Результат интеллектуальной деятельности: СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА
Вид РИД
Изобретение
В данной заявке заявлен приоритет предварительной заявки на патент США серийный номер 61/061,875, поданной 16 июня 2008 г., которая полностью включена в данную заявку путем ссылки.
Данное изобретение было создано при финансировании, полученном от Министерства обороны США по гранту DAMD 17-01-1-0830, Службы здравоохранения США по гранту СА-125623 и Национального института здоровья по основному гранту 21765. Правительство США имеет определенные права на данное изобретение.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к новым соединениям, обладающим противораковой активностью, способам получения таких соединений и их применению для лечения различных форм рака.
УРОВЕНЬ ТЕХНИКИ
Рак является второй наиболее распространенной причиной смертей в Соединенных Штатах, его превосходят только сердечные заболевания. В Соединенных Штатах 1 из каждых 4 смертей приходится на рак. Относительная пятилетняя выживаемость для всех пациентов, больных раком, которую диагностировали в 1996-2003 гг. составляла 66%, до 50% в 1975-1977 гг. (Cancer Facts & Figuras American Cancer Society: Atlanta, GA (2008)). Указанное увеличение выживаемости отображает прогресс в диагностике на ранней стадии и усовершенствования лечения. Открытие высокоэффективных средств от рака, обладающих низкой токсичностью, является основной целью исследований рака.
Амиды 2-арил-тиазолидин-4-карбоновой кислоты были описаны в качестве сильнодействующих цитотоксических агентов как для рака простаты, так и для меланомы (Li et al., "Synthesis and Antiproliferative Activity of Thiazolidine Analogs for Melanoma," Bioorg. Med. Chem. Lett. 17:4113-7 (2007); Li et al., "Structure-Activity Relationship Studies of Arylthiazolidine Amides as Selective Cytotoxic Agents for Melanoma," Anticancer Res. 27:883-888 (2007); Lu et al., "Synthesis and Biological Evaluation of 2- Arylthiazolidine-4-Carboxylic Acid Amides for Melanoma and Prostate Cancer," Abstracts of Papers, 234th ACS National Meetim, Boston, MA, United States, August 19-23, 2007, MEDI-304; Gududuru et al., "SAR Studies of 2-Arylthiazolidine-4-Carboxylic Acid Amides: A Novel Class of Cytotoxic Agents for Prostate Cancer," Bioorg. Med. Chem. Lett. 15:4010-4013 (2005); Gududuru et al., "Discovery of 2-Arylthiazolidine-4-Carboxylic Acid Amides as a New Class of Cytotoxic Agents for Prostate Cancer," J. Med. Chem. 48:2584-2588 (2005)). Такие амиды 2-арил-тиазолидин-4-карбоновой кислоты были разработаны из структуры лизофосфатидиновой кислоты (ЛФК) с липидной цепью. Такой выбор разработок был направлен на ингибирование сигналов GPCR (рецептура, сопряженного с G-белком), которые задействованы в пролиферации и выживании рака простаты (Raj et al., "Guanosine Phosphate Binding Protein Coupled Receptors in Prostate Cancer: A Review," J. Urol. 167:1458-1463 (2002); Kue et al., "Essential Role for G Proteins in Prostate Cancer Cell Growth and Signaling," J. Urol. 164:2162-7 (2000); Guo et al., "Expression and Function of Lysophosphatidic Acid LPA 1 Receptor in Prostate Cancer Cells," Endocrinology 147:4883-4892 (2006); Qi et al., "Lysophosphatidic Acid Stimulates Phospholipase D Activity and Cell Proliferation in PC-3 Human Prostate Cancer Cells," J. Cell. Physiol. 174:261-272 (1998)).
Наиболее сильнодействующие из амидов 2-арил-тиазолидин-4-карбоновой кислоты могли ингибировать раковые клетки простаты со средним значением IC50 в диапазоне от 0,7 до 1,0 мкМ, а средние значения IC50 в отношении клеток меланомы составляли 1,8-2,6 мкМ (Li et al., "Synthesis and Antiproliferative Activity of Thiazolidine Analogs for Melanoma," Bioorg. Med. Chem. Lett. 17:4113-7 (2007)). Одно преимущественное соединение, гексадециламид (2RS, 4К)-2-фенил-тиазолидин-4-карбоновой кислоты, было направлено в Национальный институт рака Соединенных Штатов Америки на скрининг лекарственного средства против рака на 60 человеческих опухолевых клеточных линиях (NCI-60). Результаты, полученные при анализе NCI-60, показали, что данное соединение может ингибировать рост всех девяти типов раковых клеток со значениями IC50 в диапазоне от 0,124 мкМ (лейкемия, CCRF-CEM) до 3,81 мкМ (немелкоклеточный рак легкого, NCI-H522). Дальнейшее увеличение противораковой активности данных соединений, в терминах их IC50 значений, будет желательным.
Данное изобретение направлено на устранение этих и других недостатков, известных из уровня техники.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
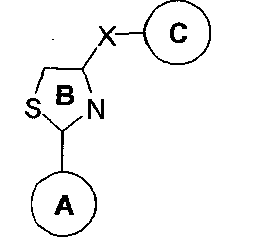
Первый аспект данного изобретения относится к соединениям формулы (I)
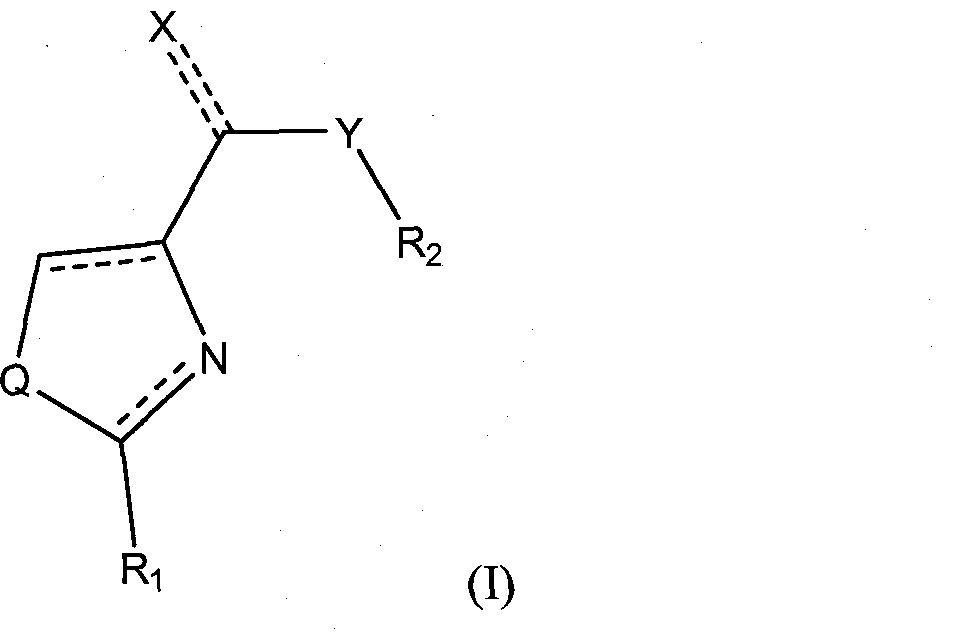
где Q представляет собой S, N, или О;
Х является необязательным и может быть O=, S=, =N-NH2, =N-OH, или -ОН;
Y является необязательным и может быть -N(H)-, О или C1-C20 углеводородом;
R1 и R2 каждый независимо представляет собой замещенные или незамещенные одинарные, конденсированные или мультициклические арильные или гетероциклические системы, включая насыщенные и ненасыщенные N-гетероциклы, насыщенные и ненасыщенные S-гетероциклы, и насыщенные и ненасыщенные O-гетероциклы, насыщенные или ненасыщенные циклические углеводороды, насыщенные или ненасыщенные смешанные гетероциклы, и алифатические неразветвленные или разветвленные C1-С30 углеводороды. Соединения могут быть представлены в виде их фармацевтически приемлемых солей, гидратов или пролекарств.
Второй аспект данного изобретения относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение в соответствии с первым аспектом данного изобретения.
Третий аспект данного изобретения относится к способу лечения рака, который включает выбор субъекта, который нуждается в лечении рака, и введение субъекту фармацевтической композиции, содержащей соединение в соответствии с первым аспектом данного изобретения в условиях, эффективных для лечения рака.
Четвертый аспект данного изобретения относится к способу разрушения раковой клетки, включающему: обеспечение соединения в соответствии с данным изобретением с последующим контактированием раковой клетки с соединением в условиях, эффективных для разрушения контактирующей раковой клетки.
Пятый аспект данного изобретения относится к способам получения соединения формулы (I).
В соответствии с одним вариантом исполнения, способ относится к стадии реакции промежуточного соединения 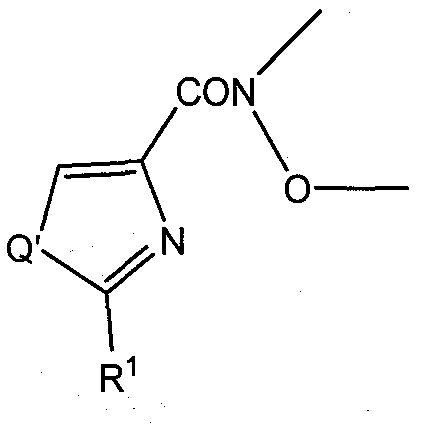 с реактивом Гриньяра, содержащим R2 или Br-R2 в условиях, эффективных для образования соединения формулы (I), содержащего метаноновую линкерную группу, где R1 и R2 определены как для формулы (I) и Q' аналогичен Q, за исключением случая, когда Q' содержит защитную группу, если Q представляет собой N, и необязательного снятия защитной группы с соединения, если Q представляет собой N. Превращение метаноновой линкерной группы в гидразоновую линкерную группу, метаноноксимную линкерную группу, и метиленовый линкер также входит в объем данного изобретения.
с реактивом Гриньяра, содержащим R2 или Br-R2 в условиях, эффективных для образования соединения формулы (I), содержащего метаноновую линкерную группу, где R1 и R2 определены как для формулы (I) и Q' аналогичен Q, за исключением случая, когда Q' содержит защитную группу, если Q представляет собой N, и необязательного снятия защитной группы с соединения, если Q представляет собой N. Превращение метаноновой линкерной группы в гидразоновую линкерную группу, метаноноксимную линкерную группу, и метиленовый линкер также входит в объем данного изобретения.
В соответствии с другим преимущественным вариантом исполнения, способ относится к стадии реакции промежуточного соединения 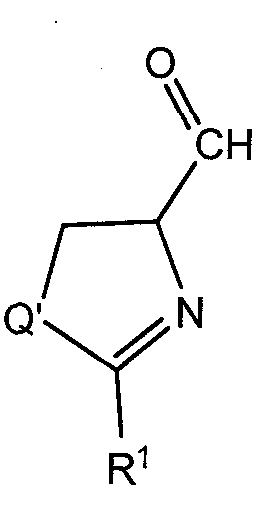 с реактивом Гриньяра R2 в условиях, эффективных для образования соединения формулы (I), содержащего -СН(ОН)- линкерную группу, где R1 и R2 определены как в формуле (I) и Q' аналогичен Q, за исключением случая, когда Q' содержит защитную группу, если Q представляет собой N, и необязательного снятия защитной группы с соединения, если Q представляет собой N. Также предусмотрена дегидрогенизация с образованием тиазольного, оксазольного или имидазольного центрального цикла.
с реактивом Гриньяра R2 в условиях, эффективных для образования соединения формулы (I), содержащего -СН(ОН)- линкерную группу, где R1 и R2 определены как в формуле (I) и Q' аналогичен Q, за исключением случая, когда Q' содержит защитную группу, если Q представляет собой N, и необязательного снятия защитной группы с соединения, если Q представляет собой N. Также предусмотрена дегидрогенизация с образованием тиазольного, оксазольного или имидазольного центрального цикла.
В соответствии с другим преимущественным вариантом исполнения, способ включает реакцию промежуточного соединения 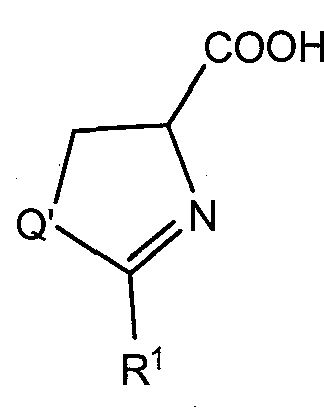 с Br-R2 в условиях, эффективных для образования соединения формулы (I), содержащего эфирную или амидную линкерную группу, где R1 и R2 определены как в формуле (I) и Q' аналогичен Q, за исключением случая, когда Q' содержит защитную группу, если Q представляет собой N, и необязательного снятия защитной группы с соединения, если Q представляет собой N. Также предусмотрена дегидрогенизация с образованием тиазольного, оксазольного или имидазольного центрального цикла.
с Br-R2 в условиях, эффективных для образования соединения формулы (I), содержащего эфирную или амидную линкерную группу, где R1 и R2 определены как в формуле (I) и Q' аналогичен Q, за исключением случая, когда Q' содержит защитную группу, если Q представляет собой N, и необязательного снятия защитной группы с соединения, если Q представляет собой N. Также предусмотрена дегидрогенизация с образованием тиазольного, оксазольного или имидазольного центрального цикла.
Данное изобретение представляет новый класс соединений, обладающих повышенной активностью и селективностью (по сравнению с предыдущими тиазолидинкарбоксамидами жирных кислот) во время исследований in vitro пo отношению к нескольким различным линиям раковых клеток, включая раковые клетки меланомы и простаты. При помощи первого преимущественного члена данного класса, также в примерах, которые приведены в данной заявке, показано, что данные соединения являются ингибиторами полимеризации тубулина. Продемонстрировано, что одно из данных соединений обладает значительной противораковой активностью во время in vivo исследований ксенотрансплантатов меланомы мышей. Исходя из этих данных и демонстрации их механизма действия, полагают, что соединения в соответствии с данным изобретением обладают значительной активностью в отношении ряда форм рака.
КРАТКОЕ ОПИСАНИЕ ФИГУР
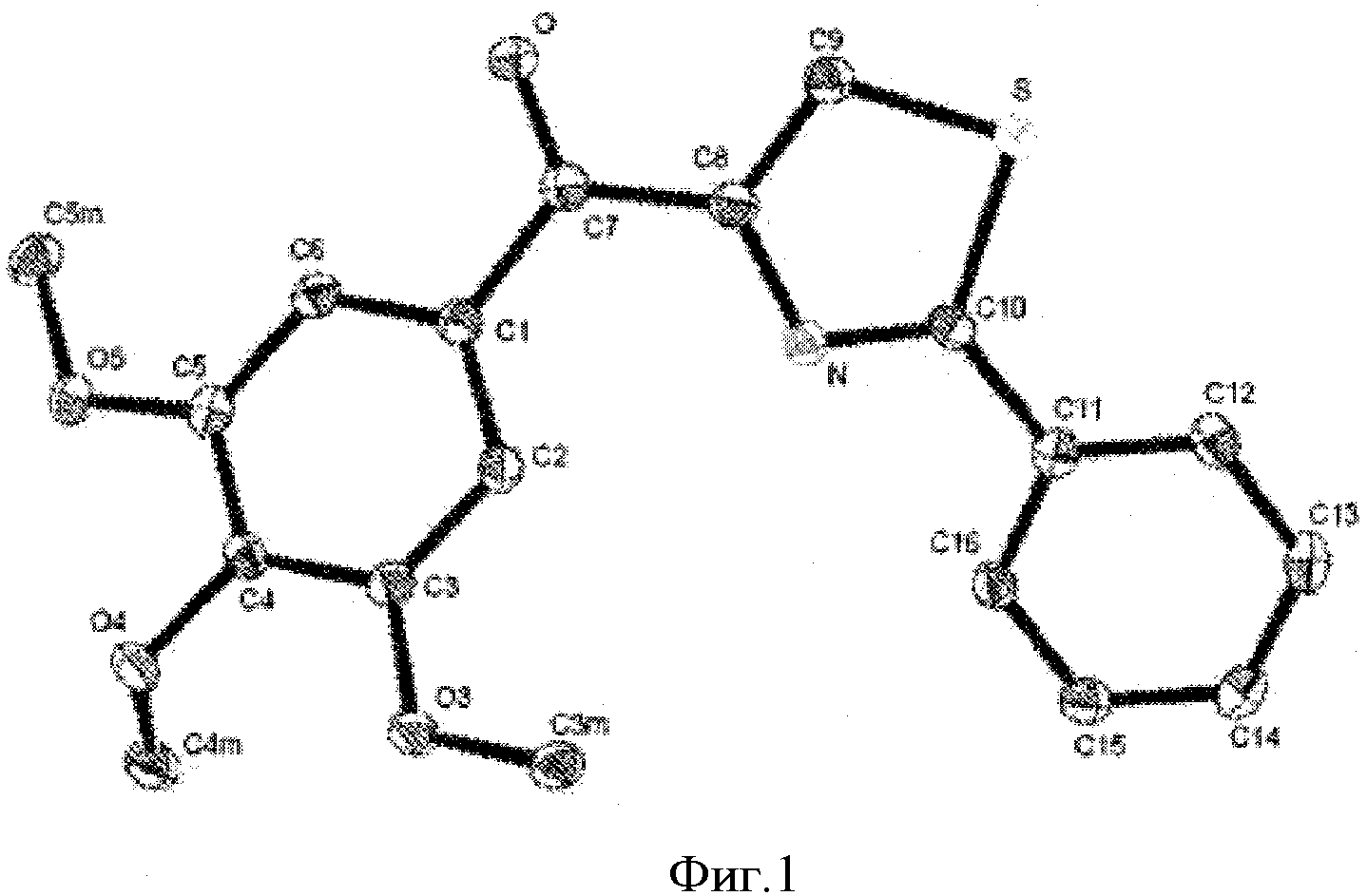
Фигура 1 представляет собой изображение ORTEP соединения 8f, где температурный эллипсоид изображен при уровне вероятности 50%. Изображение было получено в результате рентгенографических кристаллографических исследований.
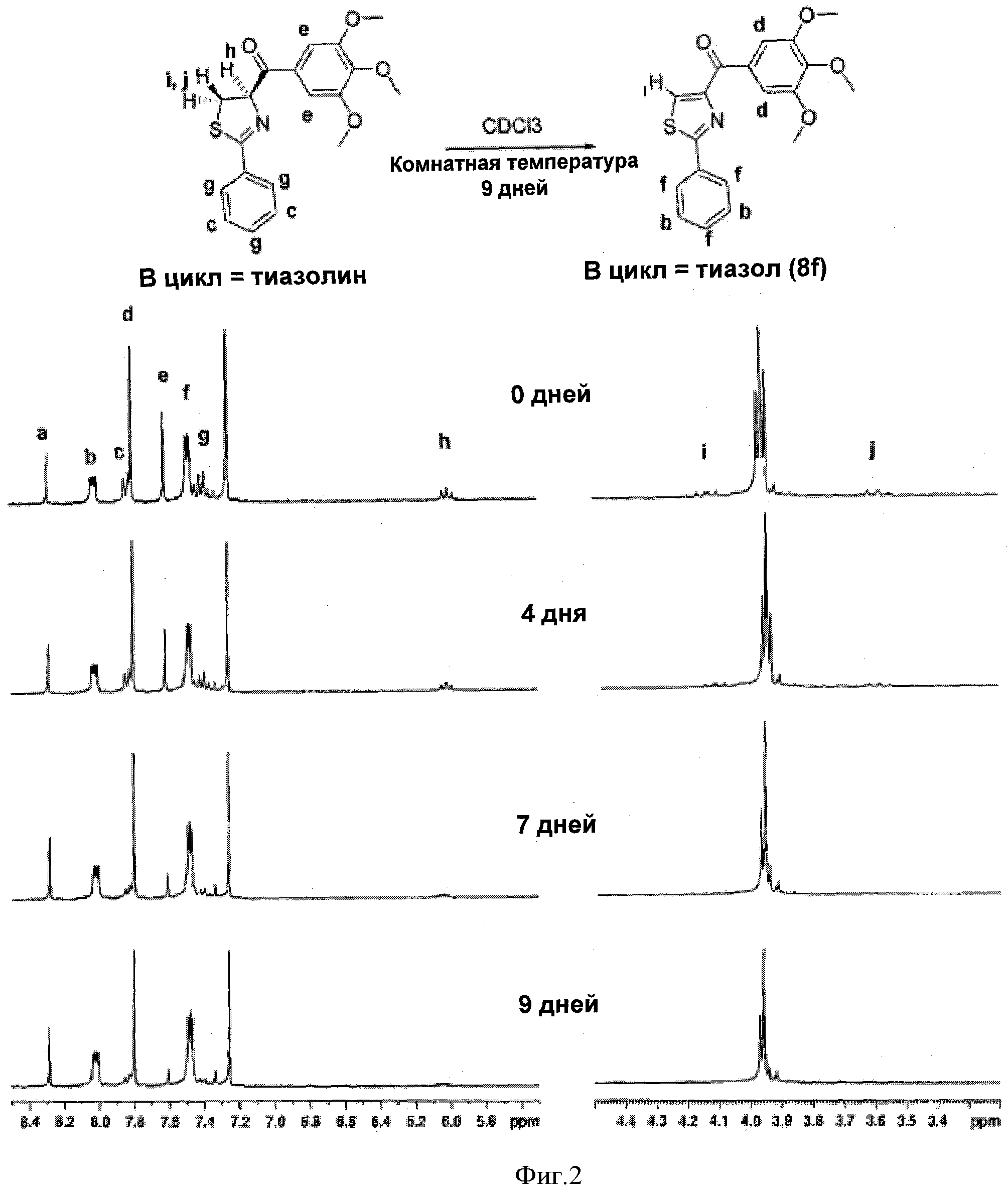
Фигура 2 иллюстрирует исследования ЯМР, где измеряли автодегидрогенизацию тиазолинового и тиазольного соединения 8f. В день 0 проба ЯМР содержала смеси тиазолина и тиазолов в CDCl3; соотношение составляло приблизительно 3:2. На 9-й день тиазолиновое соединение почти полностью превратилось в тиазольное соединение 8f.
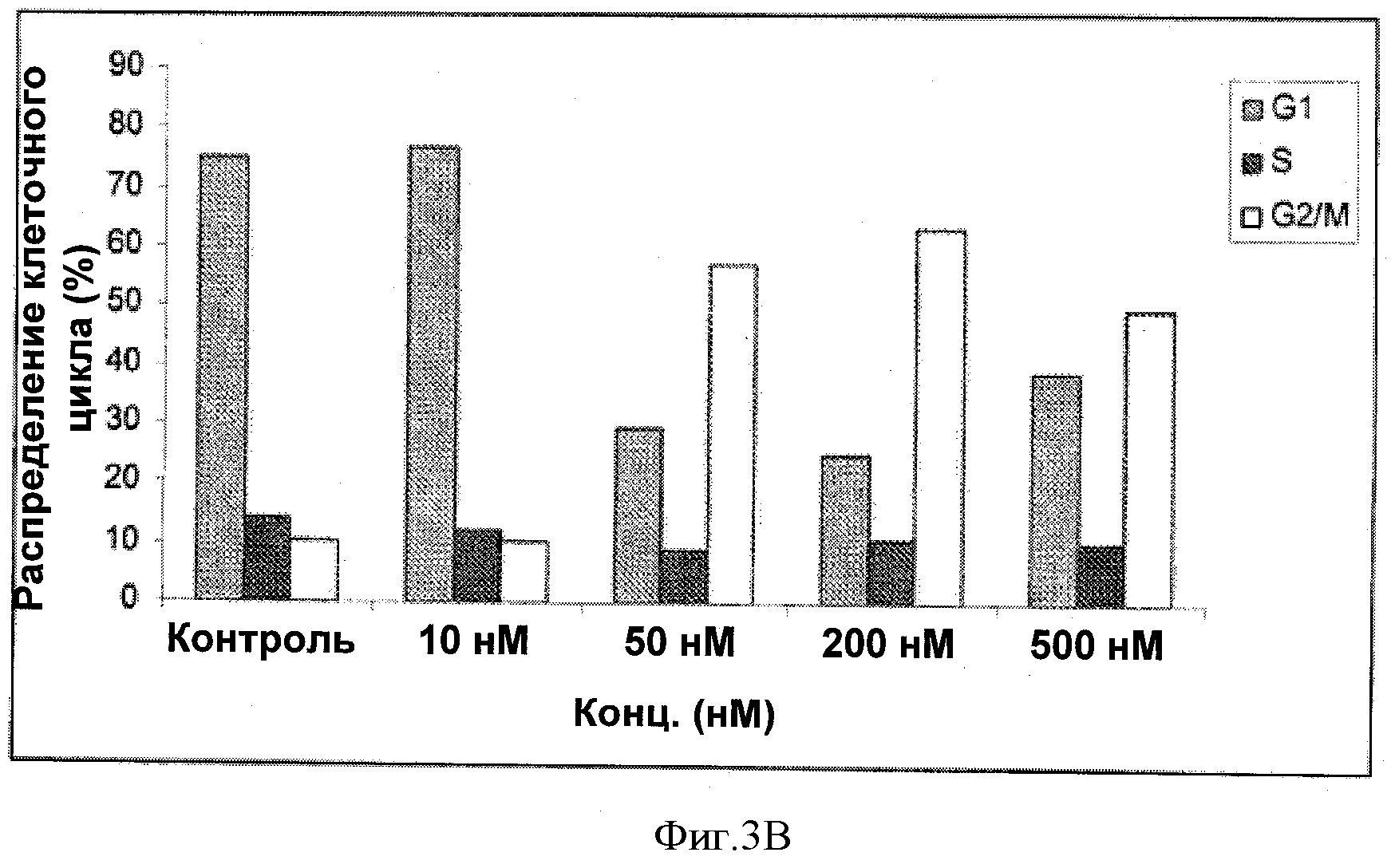
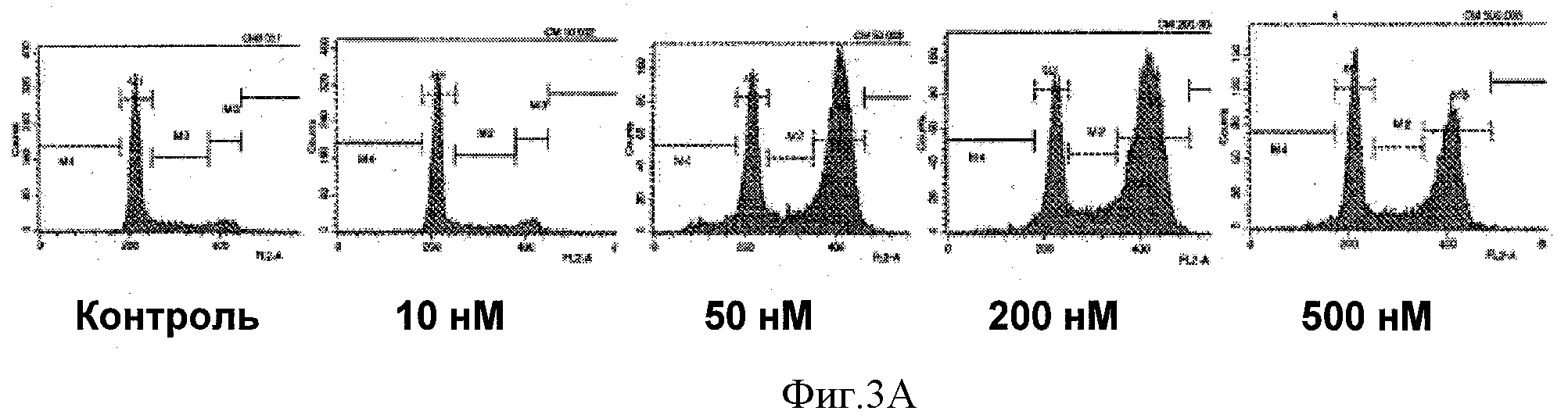
Фигуры 3А-В иллюстрируют влияние соединений 8f на распределение клеточного цикла раковых клеток простаты LNCaP. Фигура 3А иллюстрирует эффект различных дозировок (10 нМ, 50 нМ, 200 нМ, и 500 пМ) соединения 8f по сравнению с контролем. Количества, превышающие значение IC50 иллюстрируют значительное изменение распределения клеточного цикла. Фигура 3В графически иллюстрирует изменение G2/M по сравнению с распределением клеточного цикла G1.
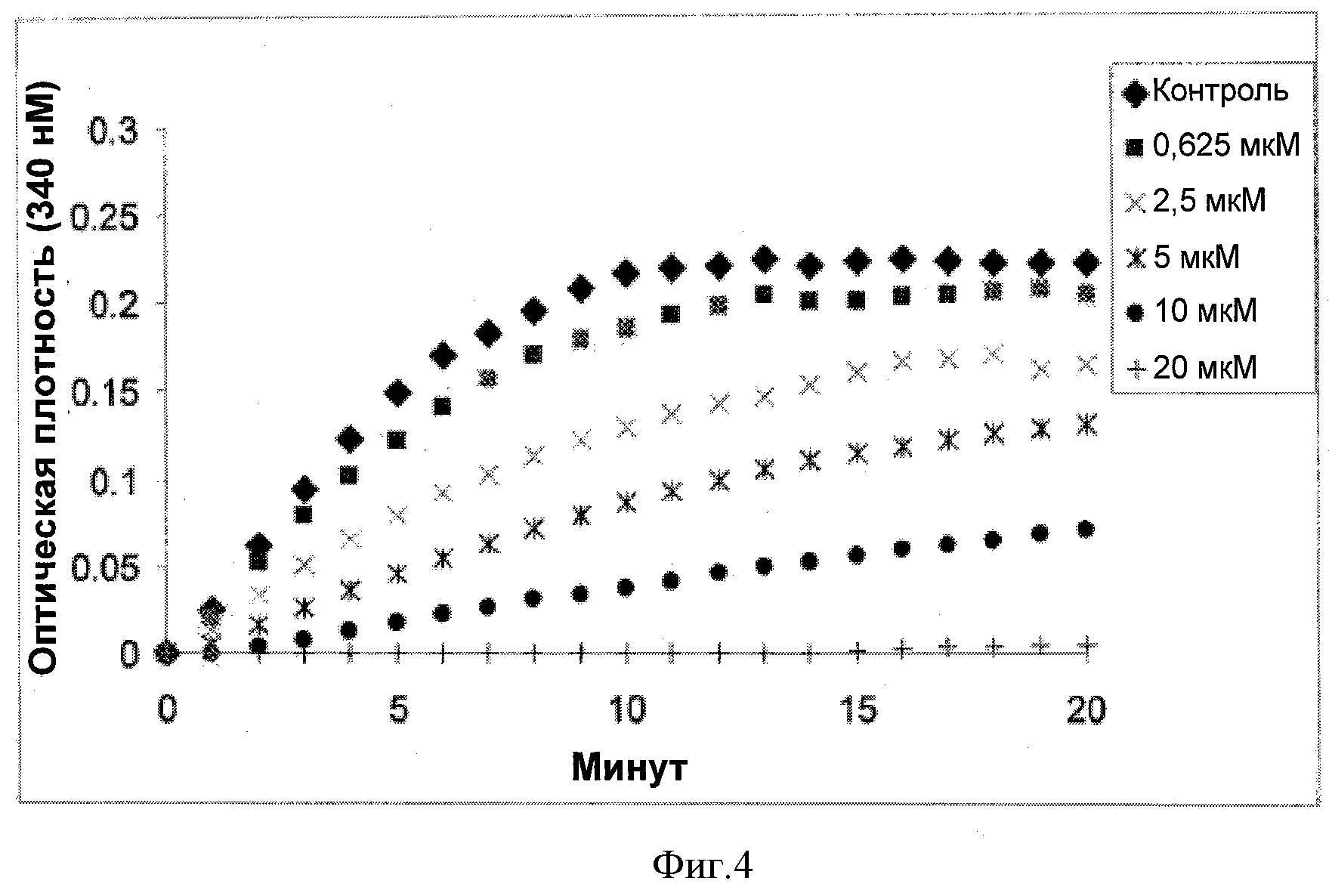
Фигура 4 представляет собой графическую иллюстрацию влияния соединения 8f на тубулиновую сборку.
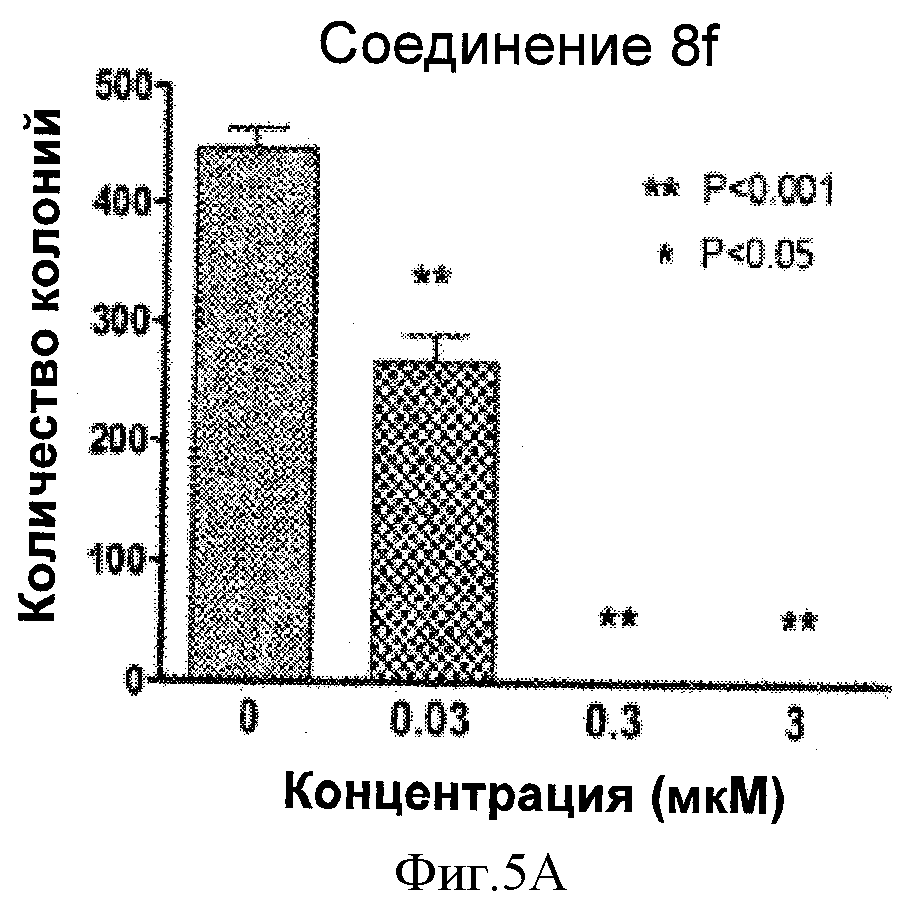
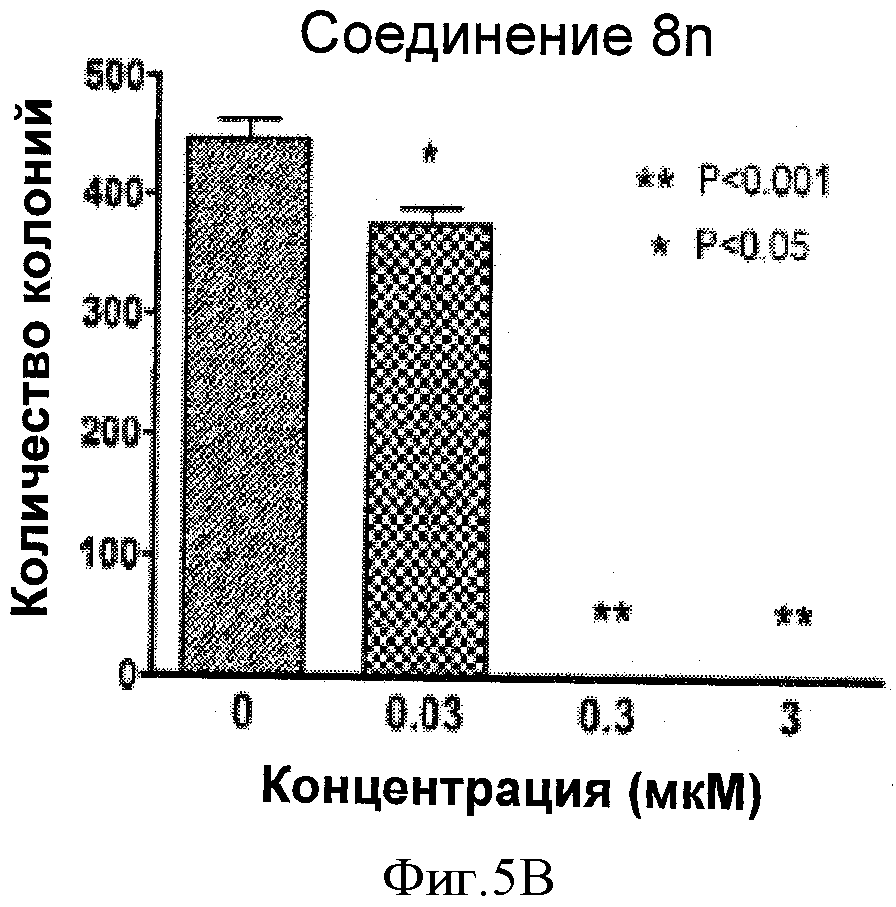
Фигуры 5А-В представляют собой графические иллюстрации способности соединений 8f и 8n в значительной степени ингибировать образование колоний меланомы А375 в анализе in vitro. При 0,3 мкМ или выше, образование колоний ингибировано полностью.
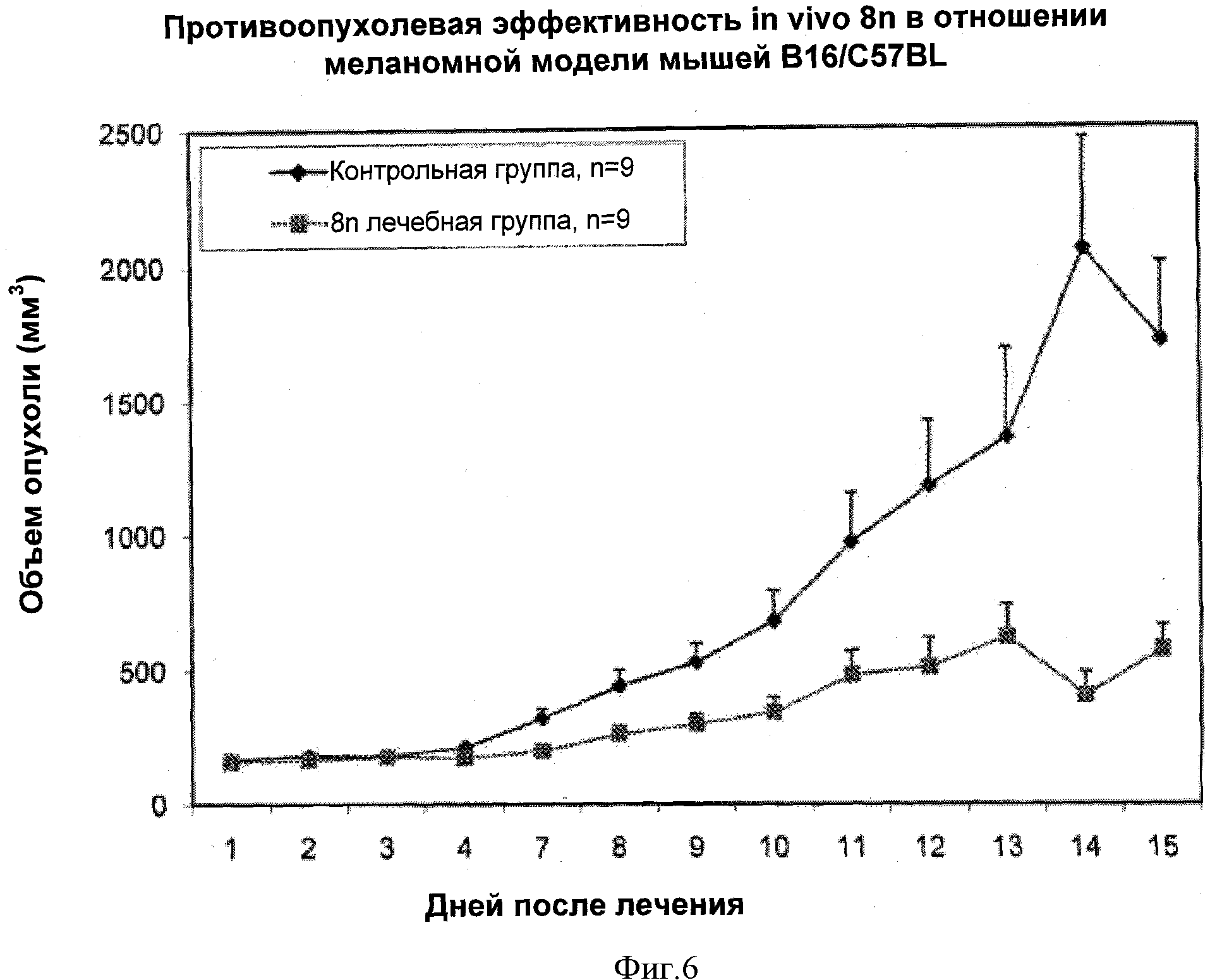
Фигура 6 представляет собой графическую иллюстрацию способности соединения 8n (6 мг/кг, IP ежедневная инъекция) ингибировать рост опухолей меланомы В16 in vivo.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Один аспект данного изобретения относится к соединениям формулы (I)

где Q представляет собой S, N, или О;
Х является необязательным и может быть S=, O=, =N-NH2, =N-OH или -ОН;
Y является необязательным и может быть -N(H)-, О или C1-C20 углеводородом; и
R1 и R2 каждый независимо представляет собой замещенные или незамещенные одинарные, конденсированные или множественные арильные или (гетеро)циклические системы, включая насыщенные и ненасыщенные N-гетероциклы, насыщенные и ненасыщенные S-гетероциклы, и насыщенные и ненасыщенные O-гетероциклы, насыщенные или ненасыщенные циклические углеводороды, насыщенные или ненасыщенные смешанные гетероциклы, алифатические неразветвленные или разветвленные C1-С30 углеводороды.
Как используют в данной заявке, "насыщенные или ненасыщенные циклические углеводороды" могут представлять собой любой такой циклический углеводород, включая, но не ограничиваясь приведенным, фенил, бифенил, трифенил, нафтил, циклоалкил, циклоалкенил, циклодиенил, флуорен, адамантан, и т.д.; "насыщенные или ненасыщенные N-гетероциклы" могут представлять собой любой такой N-содержащий гетероцикл, включая, но не ограничиваясь приведенным, аза- и диаза-циклоалкилы, такие как азиридинил, азетидинил, диазатидинил, пирролидинил, пиперидинил, пиеразинил, и азоканил, пирролил, пиразолил, имидазолил, пиридинил, пиримидинил, пиразинил, пиридазинил, триазинил, тетразинил, пирролизинил, индолил, хинолинил, изохинолинил, бензимидазолил, индазолил, хинолизинил, циннолинил, хиналолинил, фталазинил, нафтиридинил, хиноксалинил, и т.д.; "насыщенные или ненасыщенные O-гетероциклы" могут представлять собой любой такой O-содержащий гетероцикл, включая, но не ограничиваясь приведенным, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, диоксанил, фуранил, пирилий, бензофуранил, бензодиоксолил, и т.д.; "насыщенные или ненасыщенные S-гетероциклы" могут представлять собой любой такой S-содержащий гетероцикл, включая, но не ограничиваясь приведенным, тиранил, тиэтанил, тетрагидротиофенил, дитиоланил, тетрагидротиопиранил, тиофенил, тиепинил, тианафенил, и т.д.; "насыщенные или ненасыщенные смешанные гетероциклы" могут представлять собой любой гетероцикл, содержащий два или более S-, N- или O-гетероатома, включая, но не ограничиваясь приведенным, оксатиоланил, морфолинил, тиоксанил, тиазолил, изотиазолил, иадиазолил, оксазолил, изоксазолил, оксадиазолил, и т.д.
Как отмечено выше, R1 и R2 группы могут быть замещенными или незамещенными. Таким образом, несмотря на то что иллюстративные группы, указанные в предыдущем параграфе, являются незамещенными, специалист в данной области должен оценить, что такие группы могут быть замещены одним или более, двумя или более, тремя или более и даже пятью или более заместителями (но не водородом). Преимущественные R1 и R2 группы могут быть в общем представлены следующими структурами:
 ,
, 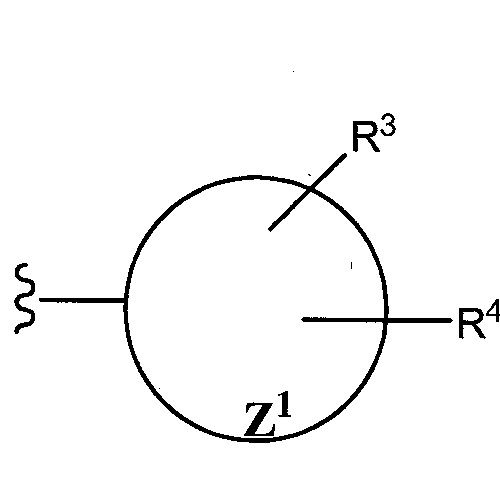 , или
, или 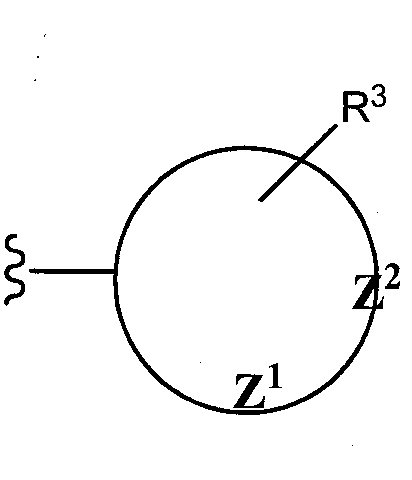
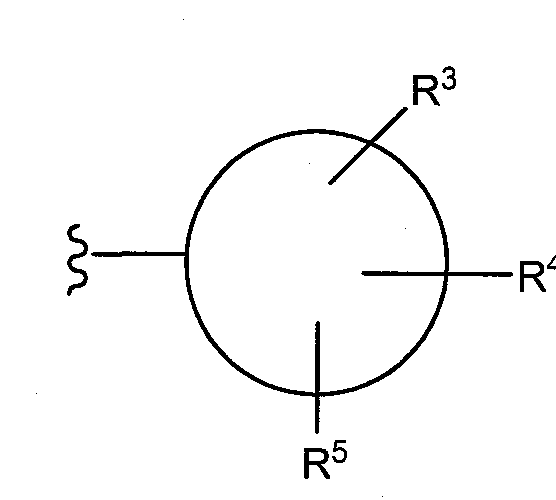
где Z1 and Z2 представляют один или более S-, N- или O-гетероатома, присутствующих в циклической структуре, а циклы являются пяти- или шестичленными циклами. В одном воплощении, R1 и R2 группы могут иметь структуру:

Заместители таких циклических членов (например, R3, R4, R5, R6, R7) независимо выбирают из группы, состоящей из водорода (например, отсутствие замещения в конкретном положении), гидроксила, алифатического неразветвленного или разветвленного C1-С10 углеводорода, алкокси, арилокси, нитро, циано, гало (например, хлоро, фторо, бромо, или йодо), галоалкило, дигалоалкило, тригалоалкило, амино, алкиламино, мезиламино, диалкиламино, ариламино, амидо, карбамида, алкил-карбамида, алкиламидо (например, ацетамида), галоалкиламида, ариламидо, арила, и C5-C1 циклоалкила, арилалкила, и их комбинаций. Одиночные заместители могут присутствовать в орто-, мета- или пара-положениях. Если присутствуют два или более заместителя, один из них преимущественно, хотя и необязательно, находится в пара-положении.
Как используют в данной заявке, "алифатический неразветвленный или разветвленный углеводород" относится как к алкиленовым группам, содержащим от одного атома углерода до определенного верхнего предела, а также к алкенильным группам и алкинильным группам, содержащим от двух атомов углерода до определенного верхнего предела, вне зависимости от того, присутствуют ли атомы углерода в одной цепи или в разветвленной цепи. Если не указано конкретно, углеводород могут содержать до приблизительно 30 атомов углерода, или до приблизительно 20 атомов углерода, или до приблизительно 10 атомов углерода. Алкенильные и алкинильные группы могут быть мононенасыщенными или полиненасыщенными.
Как используют в данной заявке, термин "алкил" может представлять собой любую неразветвленную или разветвленную алкильную группу, содержащую до приблизительно 30 атомов углерода, если не указано иное. Алкильная группа может быть единственным заместителем или может быть компонентом большего заместителя, например, входить в состав алкокси, галоалкила, арилалкила, алкиламино, диалкиламино, алкиламидо, алкилкарбамида, и т.д. Преимущественными алкильными группами являются метил, этил и пропил, и таким образом галометил, дигалометил, тригалометил, галоэтил, дигалоэтил, тригалоэтил, галопропил, дигалопропил, тригалопропил, метокси, этокси, пропокси, арилметил, арилэтил, арилпропил, метиламино, этиламино, пропиламино, диметиламино, диэтиламино, метиламидо, ацетамидо, пропиламидо, галометиламидо, галоэтиламидо, галопропиламидо, метил-карбамид, этил-карбамид, пропил-карбамид, и т.д.
Как используют в данной заявке, термин "арил" относится к любому заместителю - ароматическому циклу, который непосредственно связан с R1 или R2 членом (членами) цикла. Арильная группа может быть единственным заместителем или арильная группа может быть компонентом большего заместителя, например, входить в состав арилалкила, ариламино, ариламидо, и т.д. Иллюстративные арильные группы включают, без ограничений, фенил, толил, ксилил, фуранил, нафтил, пиридинил, пиримидинил, пиридазинил, пиразинил, триазинил, тиазолил, оксазолил, изооксазолил, пиразолил, имидазолил, тиофенил, пирролил, фенилметил, фенилэтил, фениламино, фениламидо и т.д.
Преимущественные R1 и R2 группы включают замещенные (R3-R7, как определено выше) и незамещенные фуранил, индолил, пиридинил, фенил, бифенил, трифенил, дифенилметан, адамантанил, флуоренил, и другие гетероциклические аналоги, такие, как определенные выше (например, пирролил, пиразолил, имидазолил, пиридинил, пиримидинил, пиразинил, пиридазинил, триазинил, тетразинил, пирролизинил, индолил, хинолинил, изохинолинил, бензимидазолил, индазолил, хинолизинил, циннолинил, хиналолинил, фталазинил, нафтиридинил, хиноксалинил, оксиранил, оксетанил, тетрагидрофуранил, тетрагидропиранил, диоксанил, фуранил, пирилий, бензофуранил, бензодиоксолил, тиранил, тиэтанил, тетрагидротиофен-ил, дитиоланил, тетрагидротиопиранил, тиофенил, тиепинил, тианафенил, оксатиоланил, морфолинил, тиоксанил, тиазолил, изотиазолил, иадиазолил, оксазолил, изоксазолил, оксадиазолил).
Наиболее преимущественной R2 группой является 3,4,5-триметоксифенил, а наиболее преимущественные R1 группы включают замещенные и незамещенные фенильные, замещенные и незамещенные тиофенильные, и замещенные и незамещенные индолильные группы. Преимущественными заместителями этих преимущественных R1 групп являются метил, этил, фторо, бромо, циано, нитро, трифторо и амино.
В определенных вариантах, соединение формулы (I): (Ia),
 ,
,  , или
, или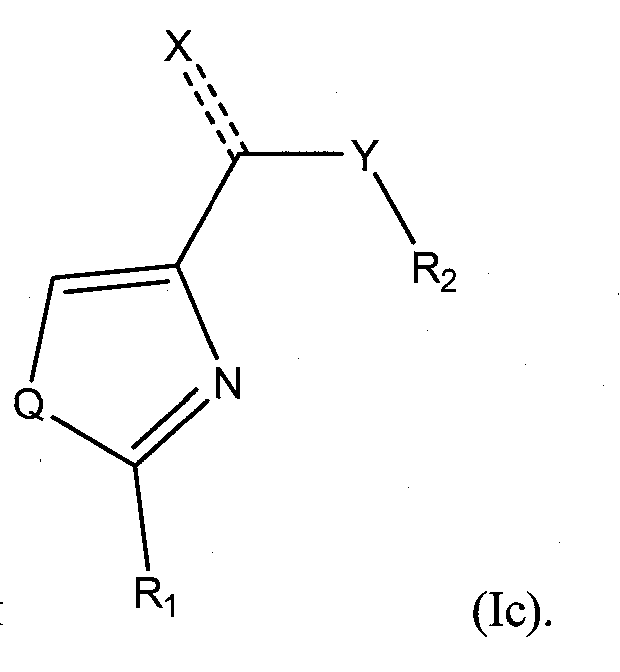
В зависимости от определения Q, поэтому, соединения в соответствии с данным изобретением включают тиазолы, дигидро-тиазолы, тиазолидины, оксазолы, дигидро-оксазолы, оксазолидины, имидазолы, дигидро-имидазолы и имидазолидины.
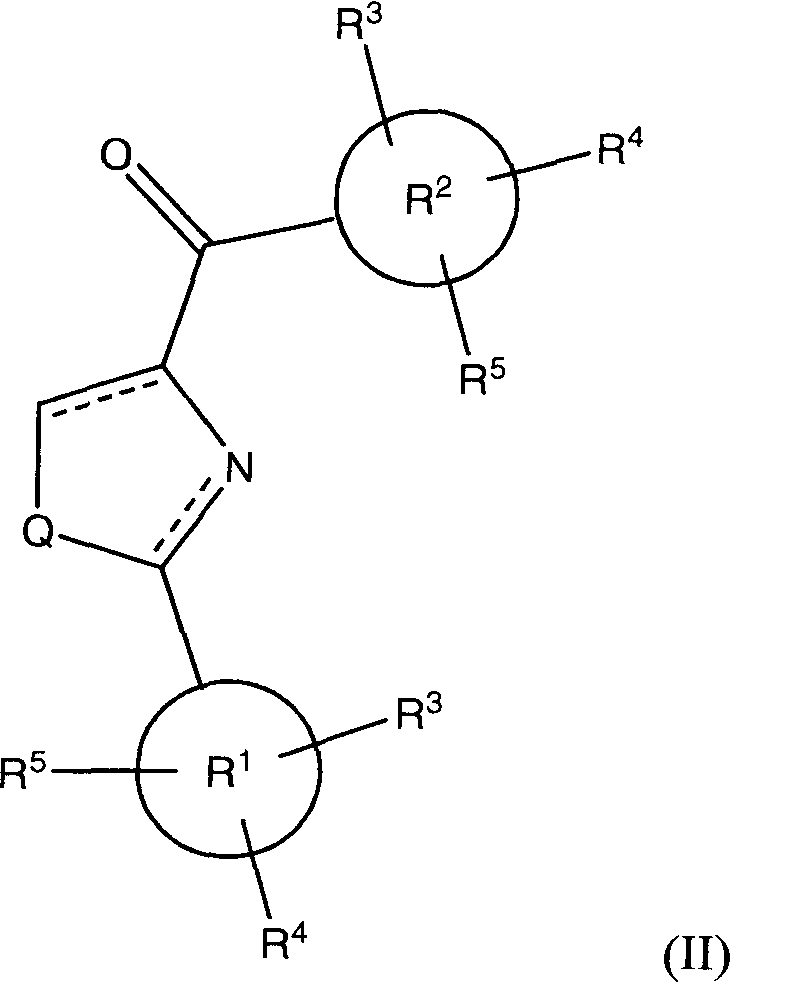
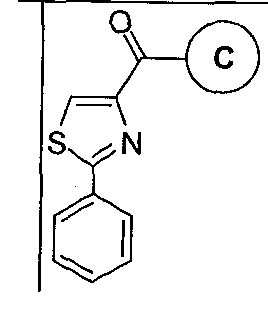
В соответствии с преимущественным вариантом исполнения, класс соединений имеет структурную формулу (II):
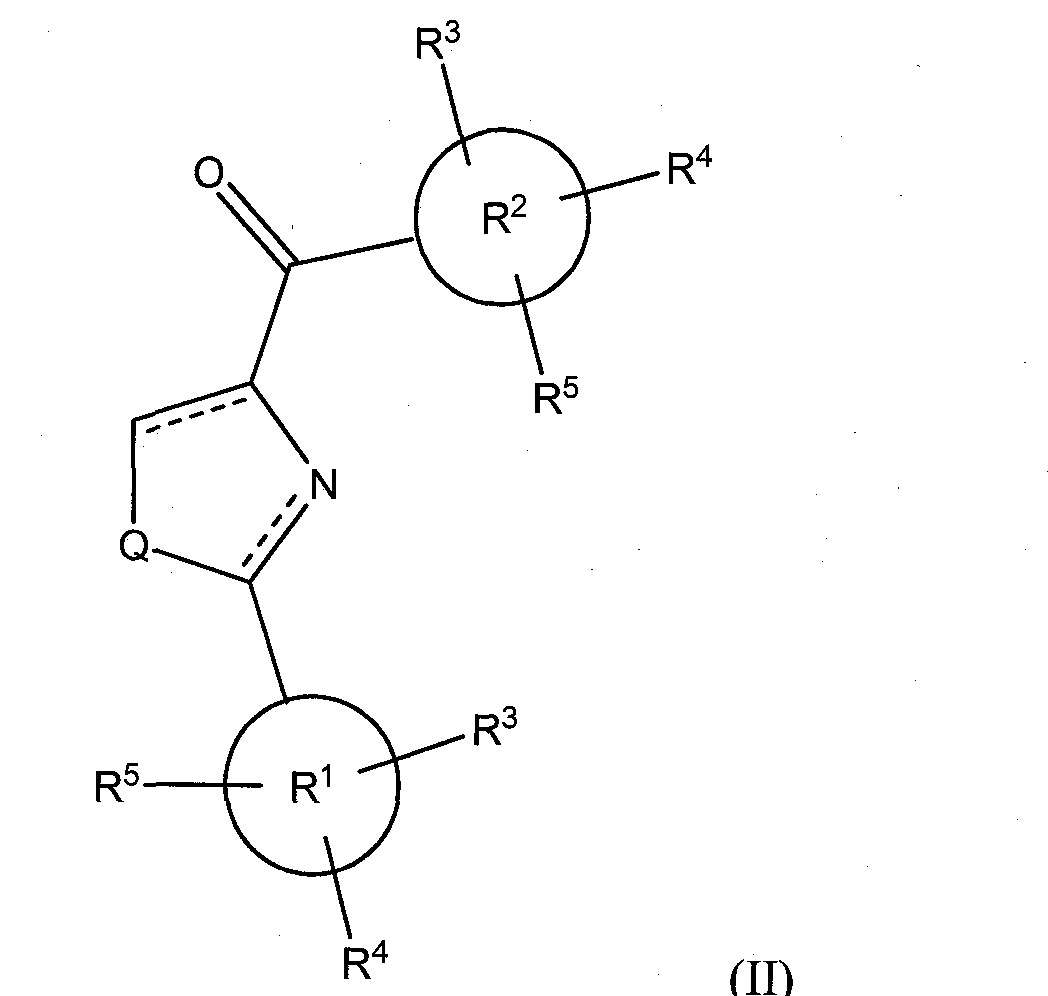
где Х представляет собой O=, Y опущено, и Q и R1-R5 такие, как определено выше для формулы (I).
Иллюстративные соединения формулы (II) включают, без ограничений: фенил(2-фенилтиазол-4-ил)метанон (соединение 8а); фенил(2-фенилтиазолидин-4-ил)метанон; фенил(2-фенилоксазолидин-4-ил)метанон; (4,5-дигидро-2-фенилоксазол-4-ил)(фенил)метанон; фенил(2-фенилоксазол-4-ил)метанон; (4-метоксифенил)(2-фенилтиазол-4-ил)метанон (соединение 8b); (4-метоксифенил)(2-фенилтиазолидин-4-ил)метанон; (4,5-дигидро-2-фенилтиазол-4-ил)(4-метоксифенил)метанон; (4-метоксифенил)(2-фенилоксазол-4-ил)метанон; (4-метоксифенил)(2-фенилоксазолидин-4-ил)метанон; (4,5-дигидро-2-фенилоксазол-4-ил)(4-метоксифенил)метанон; (4-метоксифенил)(2-фенил-1Н-имидазол-4-ил)метанон; (4-метоксифенил)(2-фенилимидазолидин-4-ил)метанон; (4,5-дигидро-2-фенил-1Н-имидазол-4-ил)(4-метоксифенил)метанон; (3-метоксифенил)(2-фенилтиазол-4-ил)метанон (соединение 8с); (3-метоксифенил)(2-фенилтиазолидин-4-ил)метанон; (4,5-дигидро-2-фенилтиазол-4-ил)(3-метоксифенил)метанон; (3-метоксифенил)(2-фенилоксазол-4-ил)метанон; (3-метоксифенил)(2-фенилоксазолидин-4-ил)метанон; (4,5-дигидро-2-фенилоксазол-4-ил)(3-метоксифенил)метанон; (3-метоксифенил)(2-фенил-1Н-имидазол-4-ил)метанон; (3-метоксифенил)(2-фенилимидазолидин-4-ил)метанон; (4,5-дигидро-2-фенил-1Н-имидазол-4-ил)(3-метоксифенил)метанон; (2-метоксифенил)(2-фенилтиазол-4-ил)метанон (соединение 8d); (2-метоксифенил)(2-фенилтиазолидин-4-ил)метанон; (4,5-дигидро-2-фенилтиазол-4-ил)(2-метоксифенил)метанон; (2-метоксифенил)(2-фенилоксазол-4-ил)метанон; (2-метоксифенил)(2-фенилоксазолидин-4-ил)метанон; (4,5-дигидро-2-фенилоксазол-4-ил)(2-метоксифенил)метанон; (2-метоксифенил)(2-фенил-1 Н-имидазол-4-ил)метанон; (2-метоксифенил)(2-фенилимидазолидин-4-ил)метанон; (4,5-дигидро-2-фенил-1 Н-имидазол-4-ил)(2-метоксифенил)метанон; (3,4-диметоксифенил)(2-фенилтиазол-4-ил)метанон (соединение 8е); (3,4-диметоксифенил)(2-фенилтиазолидин-4-ил)метанон; (4,5-дигидро-2-фенилтиазол-4-ил)(3,4-диметоксифенил)метанон; (3,4-диметоксифенил)(2-фенилоксазол-4-ил)метанон; (3,4-диметоксифенил)(2-фенилоксазолидин-4-ил)метанон; (4,5-дигидро-2-фенилоксазол-4-ил)(3,4-диметоксифенил)метанон; (3,4-диметоксифенил)(2-фенил-1Н-имидазол-4-ил)метанон; (3,4-диметоксифенил)(2-фенилимидазолидин-4-ил)метанон; (4,5-дигидро-2-фенил-1Н-имидазол-4-ил)(3,4-диметоксифенил)метанон; (3,4,5-триметоксифенил)(2-фенилтиазол-4-ил)метанон (соединение 8f); (3,4,5-триметоксифенил)(2-фенилтиазолидин-4-ил)метанон; (4,5-дигидро-2-фенилтиазол-4-ил)(3,4,5-триметоксифенил)метанон, который легко превращается в соединение 8f; (3,4,5-триметоксифенил)(2-фенилоксазолидин-4-ил)метанон; (4,5-дигидро-2-фенилоксазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-фенилоксазол-4-ил)метанон; (4,5-дигидро-2-фенил-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-фенил-1H-имидазол-4-ил)метанон; (3,4,5-триметоксифенил)(2-фенилимидазолидин-4-ил)метанон; (3,5-диметоксифенил)(2-фенилтиазол-4-ил)метанон (соединение 8g); (3,5-диметоксифенил)(2-фенилтиазолидин-4-ил)метанон; (4,5-дигидро-2-фенилтиазол-4-ил)(3,5-диметоксифенил)метанон; (3,5-диметоксифенил)(2-фенилоксазол-4-ил)метанон; (3,5-диметоксифенил)(2-фенилоксазолидин-4-ил)метанон; (4,5-дигидро-2-фенилоксазол-4-ил)(3,5-диметоксифенил)метанон; (3,5-диметоксифенил)(2-фенил-1Н-имидазол-4-ил)метанон; (3,5-диметоксифенил)(2-фенилимидазолидин-4-ил)метанон; (4,5-дигидро-2-фенил-1Н-имидазол-4-ил)(3,5-диметоксифенил)метанон; (2-фторфенил)(2-фенилтиазол-4-ил)метанон (соединение 8h); (2-фторфенил)(2-фенилтиазолидин-4-ил)метанон; (4,5-дигидро-2-фенилтиазол-4-ил)(2-фторфенил)метанон; (2-фторфенил)(2-фенилоксазол-4-ил)метанон; (2-фторфенил)(2-фенилоксазолидин-4-ил)метанон; (4,5-дигидро-2-фенилоксазол-4-ил)(2-фторфенил)метанон; (2-фторфенил)(2-фенил-1 Н-имидазол-4-ил)метанон; (2-фторфенил)(2-фенилимидазолидин-4-ил)метанон; (4,5-дигидро-2-фенил-1Н-имидазол-4-ил)(2-фторфенил)метанон; (2-фенилтиазол-4-ил)(пиридин-2-ил)метанон (соединение 8i); (4,5-дигидро-2-фенилтиазол-4-ил)(пиридин-2-ил)метанон; (2-фенилтиазолидин-4-ил)(пиридин-2-ил)метанон; (2-фенилоксазол-4-ил)(пиридин-2-ил)метанон; (4,5-дигидро-2-фенилоксазол-4-ил)(пиридин-2-ил)метанон; (2-фенилоксазолидин-4-ил)(пиридин-2-ил)метанон; (2-фенил-1H-имидазол-4-ил)(пиридин-2-ил)метанон; (4,5-дигидро-2-фенил-1H-имидазол-4-ил)(пиридин-2-ил)метанон; (2-фенилимидазолидин-4-ил)(пиридин-2-ил)метанон; (2-п-толилтиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 8k); (4,5-дигидро-2-п-толилтиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-п-толилтиазолидин-4-ил)метанон; (2-п-толилоксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-п-толилоксазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-п-толилоксазолидин-4-ил)метанон; (2-п-толил-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-п-толил-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-п-толилимидазолидин-4-ил)метанон; (2-(2-фторфенил)-тиазол-4-ил)-(3,4,5-триметоксифенил)метанон (соединение 8l); (4,5-дигидро-2-(2-фторфенил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(2-фторфенил)тиазолидин-4-ил)метанон; (2-(2-фторфенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(2-фторфенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(2-фторфенил)оксазолидин-4-ил)метанон; (2-(2-фторфенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(2-фторфенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(2-фторфенил)имидазолидин-4-ил)метанон; (2-(3-фторфенил)-тиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 8m); (4,5-дигидро-2-(3-фторфенил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(3-фторфенил)тиазолидин-4-ил)метанон; (2-(3-фторфенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(3-фторфенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(3 -фторфенил)оксазолидин-4-ил)метанон; (2-(3 -фторфенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(3-фторфенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(3-фторфенил)имидазолидин-4-ил)метанон; (2-(4-фторфенил)-тиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 8n); (4,5-дигидро-2-(4-фторфенил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-фторфенил)тиазолидин-4-ил)метанон; (2-(4-фторфенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(4-фторфенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-фторфенил)оксазолидин-4-ил)метанон; (2-(4-фторфенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(4-фторфенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-фторфенил)имидазолидин-4-ил)метанон; (2-(3,4-диметоксифенил)-тиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 8о); (4,5 -дигидро-2-(3,4-диметоксифенил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(3,4-диметоксифенил)тиазолидин-4-ил)метанон; (2-(3,4-диметоксифенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(3,4-диметоксифенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(3,4-диметоксифенил)оксазолидин-4-ил)метанон; (2-(3,4-диметоксифенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(3,4-диметоксифенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(3,4-диметоксифенил)имидазолидин-4-ил)метанон; (2-(4-нитрофенил)-тиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 8р); (4,5-дигидро-2-(4-нитрофенил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-нитрофенил)тиазолидин-4-ил)метанон; (2-(4-нитрофенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(4-нитрофенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-нитрофенил)оксазолидин-4-ил)метанон; (2-(4-нитрофенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(4-нитрофенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-нитрофенил)имидазолидин-4-ил)метанон; (2-(4-цианофенил)-тиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 8q); (4,5-дигидро-2-(4-цианофенил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-цианофенил)тиазолидин-4-ил)метанон; (2-(4-цианофенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(4-цианофенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-цианофенил)оксазолидин-4-ил)метанон; (2-(4-цианофенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(4-цианофенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-цианофенил)имидазолидин-4-ил)метанон; 4-(4-(3,4,5-триметоксибензоил)-тиазол-2-ил)-бензойную кислоту (соединение 8r); 4-(4-(3,4,5-триметоксибензоил)-(1,3-дигидро)тиазол-2-ил)-бензойную кислоту; 4-(4-(3,4,5-триметоксибензоил)-тиазолидин-2-ил)-бензойную кислоту; 4-(4-(3,4,5-триметоксибензоил)-оксазол-2-ил)-бензойную кислоту; 4-(4-(3,4,5-триметоксибензоил)-(1,3-дигидро)оксазол-2-ил)-бензойную кислоту; 4-(4-(3,4,5-триметоксибензоил)-оксазолидин-2-ил)-бензойную кислоту; 4-(4-(3,4,5-триметоксибензоил)-1H-имидазол-2-ил)-бензойную кислоту; 4-(4-(3,4,5-триметоксибензоил)-(1,3-дигидро)-1H-имидазол-2-ил)-бензойную кислоту; 4-(4-(3,4,5-триметоксибензоил)-имидазолидин-2-ил)-бензойную кислоту; метил-4-(4-(3,4,5-триметоксибензоил)-тиазол-2-ил)-бензоат (соединение 8s); метил-4-(4-(3,4,5-триметоксибензоил)-(1,3-дигидро)тиазол-2-ил)-бензоат; метил-4-(4-(3,4,5-триметоксибензоил)-тиазолидин-2-ил)-бензоат; метил-4-(4-(3,4,5-триметоксибензоил)-оксазол-2-ил)-бензоат; метил-4-(4-(3,4,5-триметоксибензоил)-(1,3-дигидро)оксазол-2-ил)-бензоат; метил-4-(4-(3,4,5 -триметоксибензоил)-оксазолидин-2-ил)-бензоат; метил-4-(4-(3,4,5-триметоксибензоил)-1H-имидазол-2-ил)-бензоат; метил-4-(4-(3,4,5-триметоксибензоил)-(1,3 -дигидро)-1H-имидазол-2-ил)-бензоат; метил-4-(4-(3,4,5-триметоксибензоил)-имидазолидин-2-ил)-бензоат; (2-(4-(трифторметил)-фенил)-тиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 8t); (4,5-дигидро-2-(4-(трифторметил)-фенил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-цианофенил)тиазолидин-4-ил)метанон; (2-(4-(трифторметил)-фенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(4-(трифторметил)-фенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-(трифторметил)-фенил)оксазолидин-4-ил)метанон; (2-(4-(трифторметил)-фенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(4-(трифторметил)-фенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-(трифторметил)-фенил)имидазолидин-4-ил)метанон; (2-(4-бромфенил)-тиазол-4-ил)-(3,4,5-триметоксифенил)метанон (соединение 8u); (4,5-дигидро-2-(4-бромфенил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-бромфенил)тиазолидин-4-ил)метанон; (2-(4-бромфенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(4-бромфенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-бромфенил)оксазолидин-4-ил)метанон; (2-(4-бромфенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(4-бромфенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-бромфенил)имидазолидин-4-ил)метанон; (2-(4-этилфенил)-тиазол-4-ил)-(3,4,5-триметокси-фенил)метанон (соединение 8v); (4,5-дигидро-2-(4-этилфенил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-этилфенил)тиазолидин-4-ил)метанон; (2-(4-этилфенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(4-этилфенил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-этилфенил)оксазолидин-4-ил)метанон; (2-(4-этилфенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(4-этилфенил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(4-этилфенил)имидазолидин-4-ил)метанон; (2-(4-аминофенил)-тиазол-4-ил)-(3,4,5-триметокси-фенил)метанон (соединение 8w); (2-(4-аминофенил)тиазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(4-аминофенил)-4,5-дигидротиазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(4-аминофенил)-оксазол-4-ил)-(3,4,5-триметокси-фенил)метанон; (2-(4-аминофенил)оксазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(4-аминофенил)-4,5-дигидрооксазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(4-аминофенил)-1H-имидазол-4-ил)-(3,4,5-триметокси-фенил)метанон; (2-(4-аминофенил)-1H-имидазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(4-аминофенил)-4,5-дигидроимидазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(4-ацетамидофенил)тиазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(4-ацетамидофенил)-4,5-дигидротиазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(4-ацетамидофенил)-тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(3,4,5-триметоксифенил)тиазол-4-ил)метанон; (4,5-дигидро-2-(3,4,5-триметоксифенил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(3,4,5-триметоксифенил)тиазолидин-4-ил)метанон; (3,4,5-триметоксифенил)(2-(3,4-диметоксифенил)тиазол-4-ил)метанон; (4,5-дигидро-2-(3,4-диметоксифенил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(3,4-диметоксифенил)тиазолидин-4-ил)метанон; (2-(4-fluornотофенил)тиазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(4-фторфенил)-4,5-дигидротиазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(4-фторфенил)-тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(2-метоксифенил)тиазол-4-ил)метанон; (4,5-дигидро-2-(2-метоксифенил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(2-метоксифенил)тиазолидин-4-ил)метанон; (2-(пиридин-4-ил)-тиазол-4-ил)-(3,4,5-триметоксифенил)метанон (соединение 8х); (4,5-дигидро-2-(пиридин-4-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(пиридин-4-ил)тиазолидин-4-ил)метанон; (2-(пиридин-4-ил)-оксазол-4-ил)-(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(пиридин-4-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(пиридин-4-ил)оксазолидин-4-ил)метанон; (2-(пиридин-4-ил)-1H-имидазол-4-ил)-(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(пиридин-4-ил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(пиридин-4-ил)имидазолидин-4-ил)метанон; (2-(пиримидин-2-ил)-тиазол-4-ил)-(3,4,5-триметоксифенил)метанон (соединение 8y); (4,5-дигидро-2-(пиримидин-4-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(пиримидин-4-ил)тиазолидин-4-ил)метанон; (2-(пиримидин-4-ил)-оксазол-4-ил)-(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(пиримидин-4-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(пиримидин-4-ил)оксазолидин-4-ил)метанон; (2-(пиримидин-4-ил)-1H-имидазол-4-ил)-(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(пиримидин-4-ил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(пиримидин-4-ил)имидазолидин-4-ил)метанон; (2-(тиофен-2-ил)-тиазол-4-ил)-(3,4,5-триметоксифенил)метанон (соединение 8z); (4,5-дигидро-2-(тиофен-2-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(тиофен-2-ил)тиазолидин-4-ил)метанон; (2-(тиофен-2-ил)-оксазол-4-ил)-(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(тиофен-2-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(тиофен-2-ил)оксазолидин-4-ил)метанон; (2-(тиофен-2-ил)-1H-имидазол-4-ил)-(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(тиофен-2-ил)-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (3,4,5-триметоксифенил)(2-(тиофен-2-ил)имидазолидин-4-ил)метанон; (2-(1H-индол-5-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 31); (2-(1H-индол-5-ил)тиазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-5-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-5-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-5-ил)оксазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-5-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-5-ил)имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-5-ил)имидазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-5-ил)имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-2-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 32); (4,5-дигидро-2-(1H-индол-2-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-2-ил)тиазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-2-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-2-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-2-ил)оксазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-2-ил)имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-2-ил)имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-2-ил)имидазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-1-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-1-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-1-ил)тиазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-1-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-1 -ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-1-ил)оксазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-1-ил)имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-1-ил)имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-1-ил)имидазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-3-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-3-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-3-ил)тиазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-3-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-3-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-3-ил)оксазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-3-ил)имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-3-ил)имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-3-ил)имидазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-4-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-4-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-4-ил)тиазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-4-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-4-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-4-ил)оксазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-4-ил)имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-4-ил)имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-4-ил)имидазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-6-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-6-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-6-ил)тиазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-6-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-6-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-6-ил)оксазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-6-ил)имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-6-ил)имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-6-ил)имидазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-7-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-7-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-7-ил)тиазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-1-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-7-ил)оксазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-7-ил)оксазолидин-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-7-ил)имидазол-4-ил)(3,4,5-триметоксифенил)метанон; (4,5-дигидро-2-(1H-индол-7-ил)имидазол-4-ил)(3,4,5-триметоксифенил)метанон; и (2-(1H-индол-7-ил)имидазолидин-4-ил)(3,4,5-триметоксифенил)метанон.
Преимущественно, R1 группа представляет собой замещенный или незамещенный фенил, замещенный или незамещенный тиофенил, или замещенный или незамещенный индолил; и R2 группа представляет собой 3,4,5-триметоксифенил. Таким образом, из вышеперечисленных соединений, (3,4,5-триметоксифенил)(2-фенилтиазол-4-ил)метанон (соединение 8f); (2-п-толилтиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 8k); (2-(4-фторфенил)-тиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 8n); (2-(4-нитрофенил)-тиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 8р); (2-(4-цианофенил)-тиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 8q); (2-(4-(трифторметил)-фенил)-тиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 8t); (2-(4-бромфенил)-тиазол-4-ил)-(3,4,5-триметоксифенил)метанон (соединение 8u); (2-(4-этилфенил)-тиазол-4-ил)-(3,4,5-триметокси-фенил)метанон (соединение 8v); (2-(4-аминофенил)-тиазол-4-ил)-(3,4,5-триметокси-фенил)метанон (соединение 8w); (2-(тиофен-2-ил)-тиазол-4-ил)-(3,4,5-триметоксифенил)метанон (соединение 8z); (2-(1H-индол-5-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 31); (2-(1H-индол-2-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон (соединение 32); (2-(1Н-индол-1-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-3-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-4-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; (2-(1H-индол-6-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон; и (2-(1H-индол-7-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон, являются преимущественными.
В соответствии с другим вариантом исполнения, класс соединений имеет структурную формулу (III):
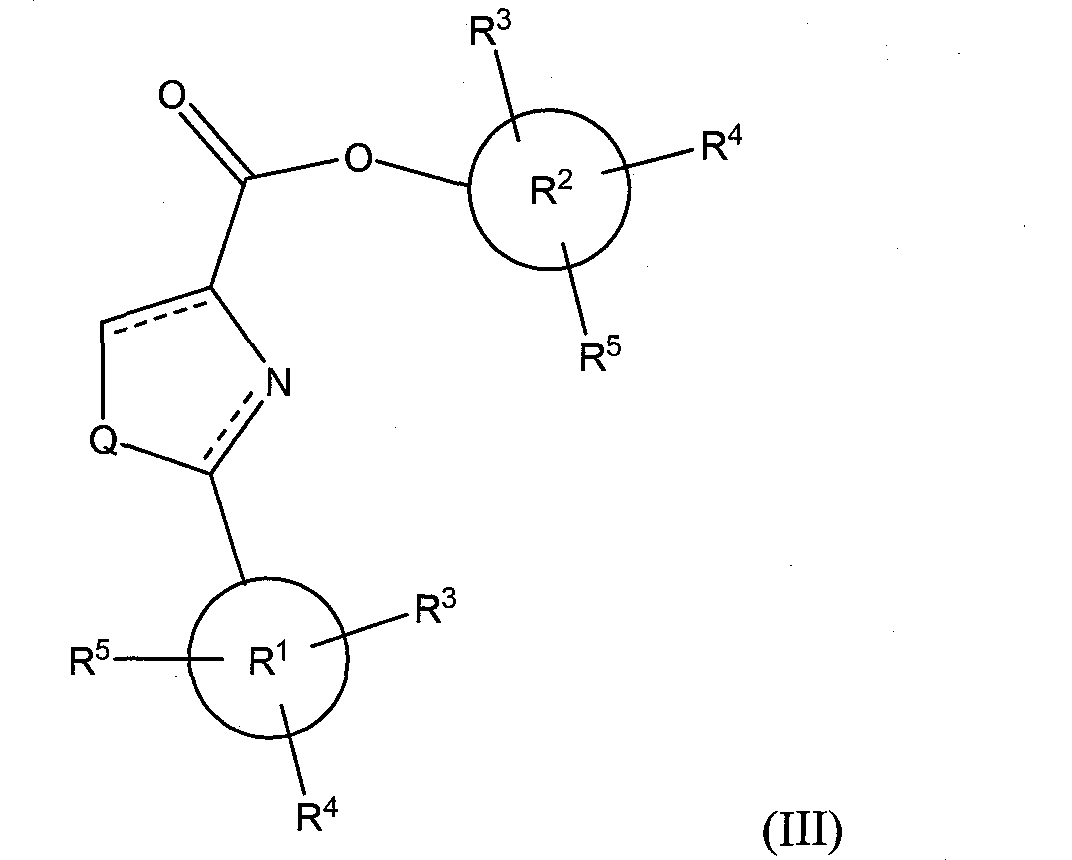
где Х представляет собой O=, Y представляет собой О, и Q и R1-R5 определены так, как приведено выше для формулы (I).
Иллюстративные соединения формулы (III) включают, без ограничений: 3,4,5-триметоксифенил 4,5-дигидро-2-фенилтиазол-4-карбоксилат; 3,4,5-триметоксифенил 2-фенилтиазол-4-карбоксилат; 3,4,5-триметоксифенил 2-фенилтиазолидин-4-карбоксилат; 3,4,5-триметоксифенил 2-фенилоксазолидин-4-карбоксилат; 3,4,5-триметоксифенил 4,5-дигидро-2-фенилоксазоле-4-карбоксилат; 3,4,5-триметоксифенил 2-фенилоксазоле-4-карбоксилат; 3,4,5-триметоксифенил 2-фенилимидазолидин-4-карбоксилат; 3,4,5-триметоксифенил 4,5-дигидро-2-фенил-1H-имидазол-4-карбоксилат; и 3,4,5-триметоксифенил 2-фенил-1H-имидазол-4-карбоксилат.
В соответствии с другим вариантом исполнения, класс соединений имеет структурную формулу (IV):
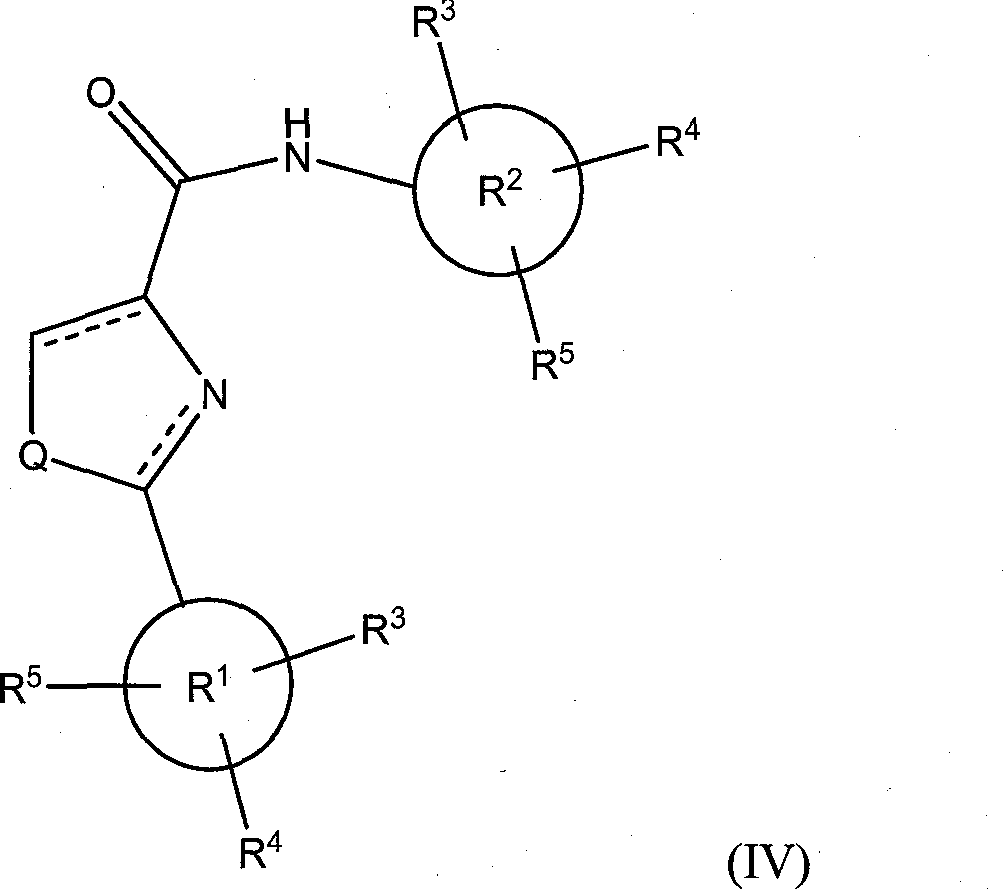
где Х представляет собой O=, Y представляет собой -NH-, и Q и R1-R5 определены так, как определено выше для формулы (I).
Иллюстративные соединения формулы (IV) включают, без ограничений:
N-(3,4,5-триметоксифенил)-2-фенилоксазолидин-4-карбоксамид; 4,5-дигидро-N-(3,4,5-триметоксифенил)-2-фенилоксазол-4-карбоксамид; N-(3,4,5-триметоксифенил)-2-фенилоксазоле-4-карбоксамид; N-(3,4,5-триметоксифенил)-2-фенил-1H-имидазол-4-карбоксамид; 4,5-дигидро-N-(3,4,5-триметоксифенил)-2-фенил-1H-имидазол-4-карбоксамид; N-(3,4,5-триметоксифенил)-2-фенилимидазолидин-4-карбоксамид; 4,5-дигидро-N-(3,4,5-триметоксифенил)-2-фенилтиазол-4-карбоксамид; N-(3,4,5-триметоксифенил)-2-фенилтиазол-4-карбоксамид; и N-(3,4,5-триметоксифенил)-2-фенилтиазолидин-4-карбоксамид.
В соответствии с другим вариантом исполнения, класс соединений имеет структурную формулу (V):
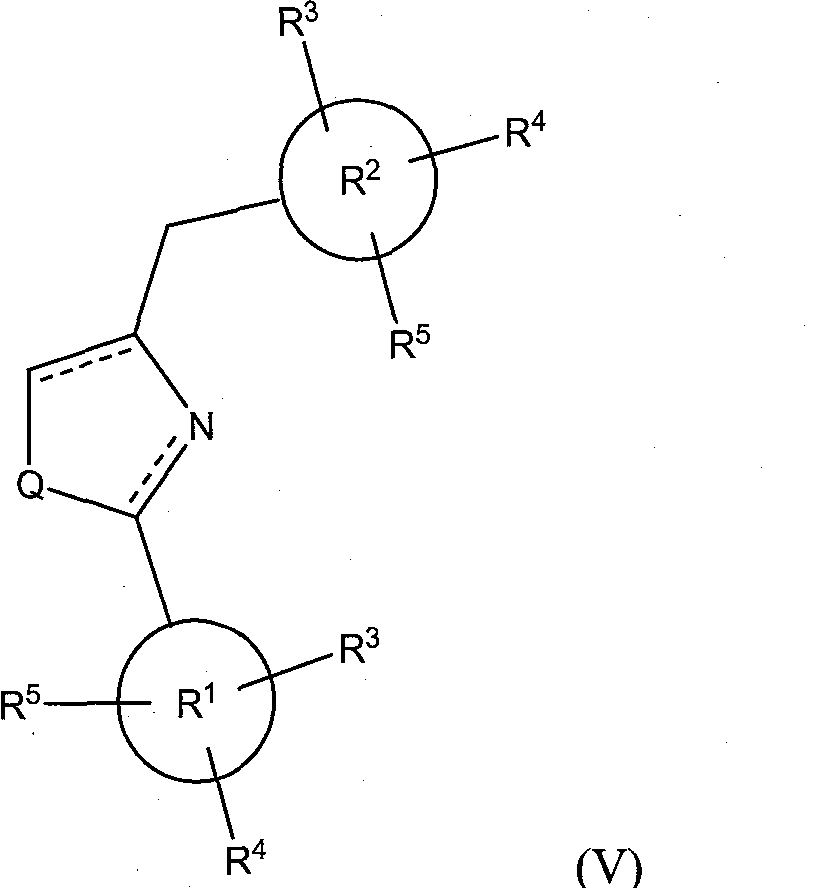
где X и Y опущены, a Q и R1-R5 определены так, как определено выше для формулы (I).
Иллюстративные соединения формулы (V) включают, без ограничений: 4-(3,4,5-триметоксибензил)-2-фенилтиазолидин; 4-(3,4,5-триметоксибензил)-4,5-дигидро-2-фенилтиазол; 4-(3,4,5-триметоксибензил)-2-фенилтиазол; 4-(3,4,5-триметоксибензил)-2-фенилоксазоле; 4-(3,4,5-триметоксибензил)-4,5-дигидро-2-фенилоксазоле; 4-(3,4,5-триметоксибензил)-2-фенилоксазолидин; 4-(3,4,5-триметоксибензил)-2-фенилимидазолидин; 4-(3,4,5-триметоксибензил)-4,5-дигидро-2-фенил-1H-имидазол; и 4-(3,4,5-триметоксибензил)-2-фенил-1H-имидазол.
В соответствии с другим вариантом исполнения, класс соединений имеет структурную формулу (VI):
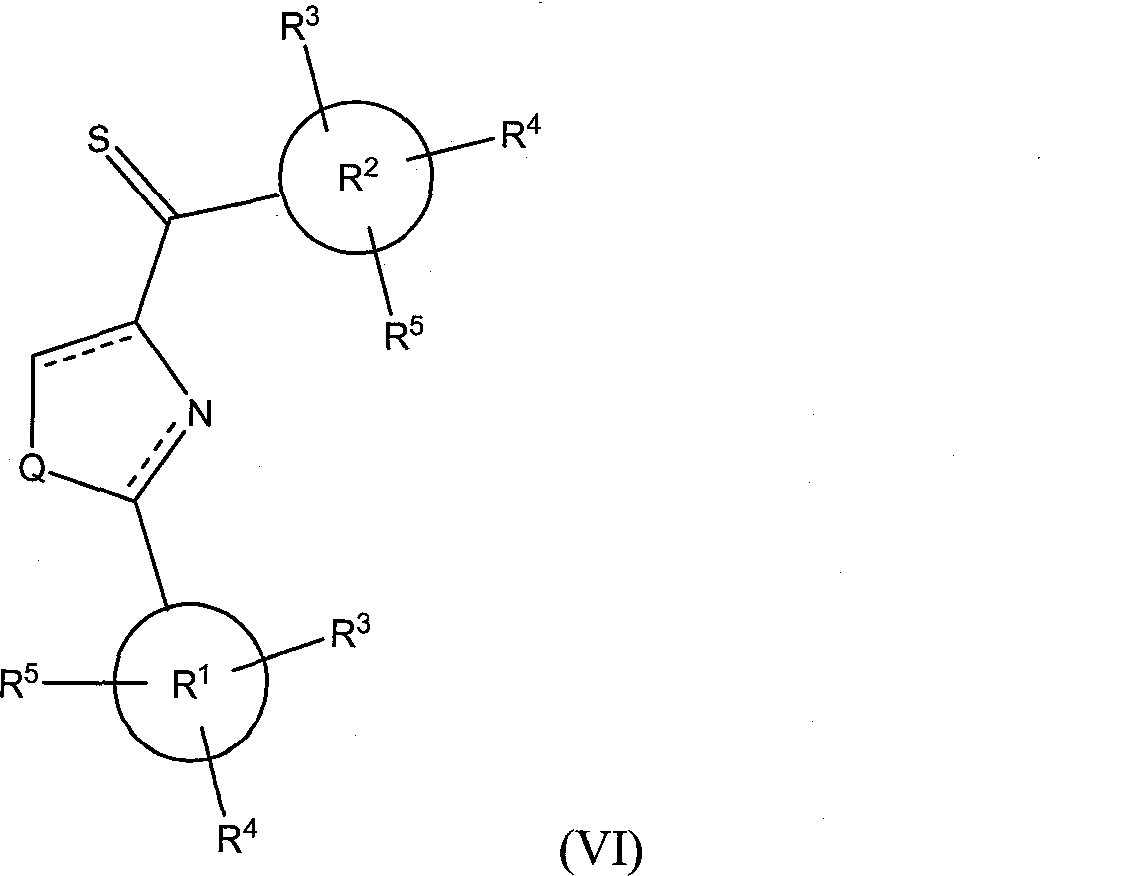
где X представляет собой S=, Y опущено, a Q и R1-R5 определены так, как определено выше для формулы (I).
Иллюстративные соединения формулы (VI) включают, без ограничений: фенил(2-фенилтиазолидин-4-ил)метантион; фенил(2-фенилоксазолидин-4-ил)метантион; (4,5-дигидро-2-фенилоксазол-4-ил)(фенил)метантион; фенил(2-фенилоксазол-4-ил)метантион; (3,4,5-триметоксифенил)(2-фенилтиазол-4-ил)метантион; (3,4,5-триметоксифенил)(2-фенилтиазолидин-4-ил)метантион; (3,4,5-триметоксифенил)(2-фенилоксазолидин-4-ил)метантион; (4,5-дигидро-2-фенилоксазол-4-ил)(3,4,5-триметоксифенил)метантион; (3,4,5-триметоксифенил)(2-фенилоксазол-4-ил)метантион; (4,5-дигидро-2-фенил-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метантион; (3,4,5-триметоксифенил)(2-фенил-1H-имидазол-4-ил)метантион; и (3,4,5-триметоксифенил)(2-фенилимидазолидин-4-ил)метантион.
В соответствии с другим преимущественным вариантом исполнения, класс соединений имеет структурную формулу (VII):
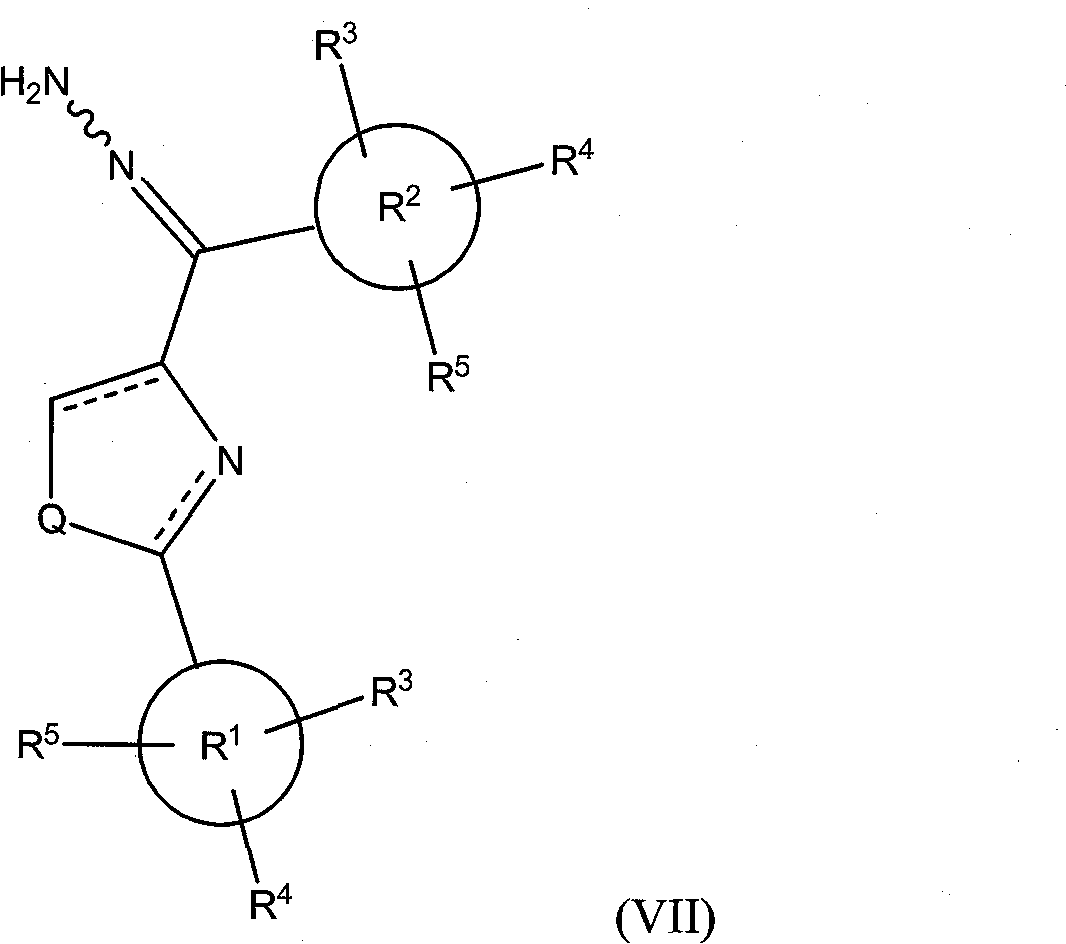
где Х представляет собой =N-NH2, Y опущено, а Q и R1-R5 определены так, как определено выше для формулы (I).
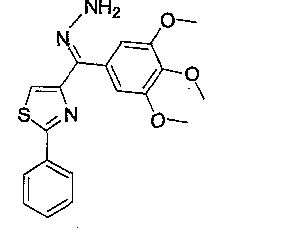
Иллюстративные соединения формулы (VII) включают, без ограничений, (Z)-1-((3,4,5-триметоксифенил)(2-фенилтиазол-4-ил)метилен)гидразин (соединение 33); (Е)-1-((3,4,5-триметоксифенил)(2-фенилтиазол-4-ил)метилен)гидразин (соединение 34); (24Z)-1-((4,5-дигидро-2-фенилтиазол-4-ил)(3,4,5-триметоксифенил)метилен)гидразин; (24Е)-1-((4,5-дигидро-2-фенилтиазол-4-ил)(3,4,5-триметоксифенил)метилен)гидразин; (Z)-1-((3,4,5-триметоксифенил)(2-фенилтиазолидин-4-ил)метилен)гидразин; (Е)-1 -((3,4,5 -триметоксифенил)(2-фенилтиазолидин-4-ил)метилен)гидразин; (Z)-1-((3,4,5-триметоксифенил)(2-фенилоксазол-4-ил)метилен)гидразин; (Е)-1-((3,4,5-триметоксифенил)(2-фенилоксазол-4-ил)метилен)гидразин; (24Z)-1-((4,5-дигидро-2-фенилоксазол-4-ил)(3,4,5-триметоксифенил)метилен)гидразин; (24Е)-1-((4,5-дигидро-2-фенилоксазол-4-ил)(3,4,5-триметоксифенил)метилен)гидразин; (Z)-1-((3,4,5-триметоксифенил)(2-фенилоксазолидин-4-ил)метилен)гидразин; (Е)-1-((3,4,5-триметоксифенил)(2-фенилоксазолидин-4-ил)метилен)гидразин; (Z)-1-((3,4,5-триметоксифенил)(2-фенил-1H-имидазол-4-ил)метилен)гидразин; (Е)-1-((3,4,5-триметоксифенил)(2-фенил-1H-имидазол-4-ил)метилен)гидразин; (24Z)-1-((4,5-дигидро-2-фенил-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метилен) гидразин; (24Е)-1-((4,5-дигидро-2-фенил-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метилен)гидразин; (Z)-1-((3,4,5-триметоксифенил)(2-фенилимидазолидин-4-ил)метилен)гидразин; и (Е)-1-((3,4,5-триметоксифенил)(2-фенилимидазолидин-4-ил)метилен)гидразин.
В соответствии с другим преимущественным вариантом исполнения, класс соединений имеет структурную формулу (VIII):
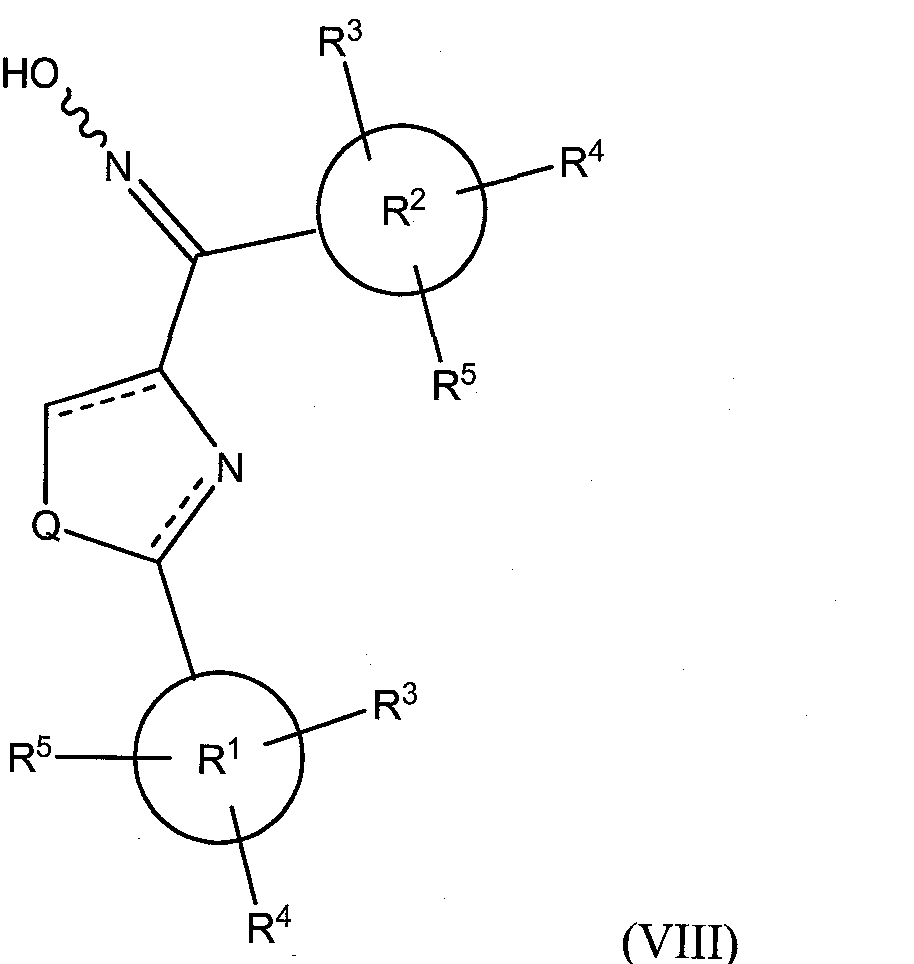
где Х представляет собой =N-OH, Y опущено, a Q и R1-R5 определены так, как определено выше для формулы (I).
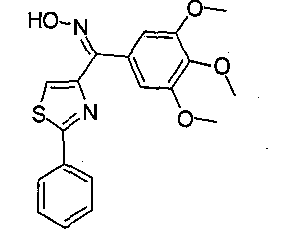
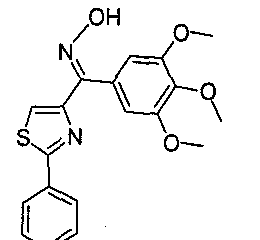
Иллюстративные соединения формулы (VIII) включают, без ограничений, (Z)-(2-фенилтиазол-4-ил)(3,4,5-триметоксифенил)метанон оксим (соединение 35); (Е)-(2-фенилтиазол-4-ил)(3,4,5-триметоксифенил)метанон оксим (соединение 36); (24Z)-1-(4,5-дигидро-2-фенилтиазол-4-ил)(3,4,5-триметоксифенил)метанон оксим; (24Е)-1-(4,5-дигидро-2-фенилтиазол-4-ил)(3,4,5-триметоксифенил)метанон оксим; (Z)-1-(3,4,5-триметоксифенил)(2-фенилтиазолидин-4-ил)метанон оксим; (Е)-1-(3,4,5-триметоксифенил)(2-фенилтиазолидин-4-ил)метанон оксим; (Z)-1-(3,4,5-триметоксифенил)(2-фенилоксазол-4-ил)метанон оксим; (Е)-1-(3,4,5-триметоксифенил)(2-фенилоксазол-4-ил)метанон оксим; (24Z)-1 -(4,5-дигидро-2-фенилоксазол-4-ил)(3,4,5-триметоксифенил)метанон оксим; (24Е)-1-(4,5-дигидро-2-фенилоксазол-4-ил)(3,4,5-триметоксифенил)метанон оксим; (Z)-1-(3,4,5-триметоксифенил)(2-фенилоксазолидин-4-ил)метанон оксим; (Е)-1-(3,4,5-триметоксифенил)(2-фенилоксазолидин-4-ил)метанон оксим; (Z)-1-(3,4,5-триметоксифенил)(2-фенил-1H-имидазол-4-ил)метанон оксим; (Е)-1-(3,4,5-триметоксифенил)(2-фенил-1H-имидазол-4-ил)метанон оксим; (24Z)-1-(4,5-дигидро-2-фенил-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон оксим;
(24Е)-1-(4,5-дигидро-2-фенил-1H-имидазол-4-ил)(3,4,5-триметоксифенил)метанон оксим; (Z)-1-(3,4,5-триметоксифенил)(2-фенилимидазолидин-4-ил)метанон оксим; и (Е)-1-(3,4,5-триметоксифенил)(2-фенилимидазолидин-4-ил)метанон оксим.
Определенные соединения, в особенности те из них, которые содержат кислотные или основные группы, могут также быть в форме соли, преимущественно фармацевтически приемлемой соли. Термин "фармацевтически приемлемая соль" относится к таким солям, которые сохраняют биологическую эффективность и свойства свободных оснований или свободных кислот, которые не являются биологически или иным образом нежелательными. Такие соли образуются с такими неорганическими кислотами, как соляная кислота, бромоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и т.п., и органическими кислотами, такими как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота, N-ацетилцистеин и т.п. Другие соли известны специалистам в данной области и могут быть легко адаптированы для применения в соответствии с данным изобретением.
Соединения в соответствии с данным изобретением могут быть также введены в виде пролекарств. Таким образом, определенные производные, которые сами по себе могут иметь небольшую фармакологическую активность или не иметь ее, могут, при введении в организм или на организм, быть превращены в соединения в соответствии с данным изобретением, имеющие желательную активность, например, путем гидролитического расщепления. Дополнительную информацию касательно применения пролекарств можно найти в работах Pro-drugs as Novel Delivery Systems, Vol.14, ACS Symposium Series (Higuchi and Stella); и Bioreversible Carriers in Drug Design, Pergamon Press (ed. E В Roche, American Pharmaceutical Association) (1987), каждая из которых полностью включена в данную заявку путем ссылки.
Пролекарства могут, например, быть получены путем замещения соответствующих функциональных групп, присутствующих в соединениях в соответствии с данным изобретением, где определенные фрагменты известны специалистам в данной области как про-фрагменты. Примеры таких пролекарств включают, без ограничений, замещение водорода в спиртовой функциональной группе (-ОН) C1-С6 алкилом с образованием простого эфира; и (ii) замещение водорода во вторичной амино функциональной группе на C1-С10 алканоил с образованием амида.
Соединения в соответствии с данным изобретением могут также быть в форме гидрата, что означает, что соединение дополнительно содержит стехиометрическое или нестехиометрическое количество воды, связанной нековалентными межмолекулярными силами.
Соединения в соответствии с данным изобретением могут также присутствовать в форме рацемической смеси, содержащей существенно эквивалентные количества стереоизомеров. В другом варианте исполнения, соединения в соответствии с данным изобретением могут быть получены или иным образом выделены при помощи известных процедур для получения стереоизомера, в существенной степени не содержащего его соответствующий стереоизомер (т.е. существенно чистого). Под существенно чистым подразумевают, что стереоизомер является как минимум приблизительно 95% чистым, более преимущественно как минимум приблизительно 98% чистым, наиболее преимущественно как минимум приблизительно 99% чистым.
Дополнительный аспект данного изобретения относится к способу получения соединений формулы (I). Дополнительно, данное изобретение описывает методологии синтеза для получения амидных, алкоксиамидных, кетонных, гидразиновых и оксимных производных тиазолидинов, тиазолинов, тиазолов, имидазолинов, имидазолов, оксазолидинов, оксазолинов и оксазолов.
Для синтеза соединений тиазолиновых и тиазольных серий, L- или D-цистеин может реагировать с замещенным или незамещенным бензонитрилом в метаноле pH 6,4 фосфатном буферном растворе при температуре окружающей среды в течение нескольких дней (см. работы Bergeron et al., "Evaluation of Desferrithiocin and its Synthetic Analogs as Orally Effective Iron Chelators," J. Med. Chem. 34:2072-8 (1991); Bergeron et al., "Desazadesmethyldesferrithiocin Analogues as Orally Effective Iron Chelators," J. Med. Chem. 42:95-108 (1999); Zamri et al., "An Improved Stereocontrolled Synthesis Pyochelin, Siderophore of Pseudomonas aeruginosa and Burkholderia cepacia," Tetrahedron 56:249-256 (2000), каждая из которых полностью включена в данную заявку путем ссылки). Полученные в результате промежуточные соединения карбоновых кислот могут быть легко превращены в соответствующие амиды Вейнреба (см. работы Nahm et al., "N-Methoxy-N-methylamides as Effective Acylating Agents," Tetrahedron Lett. 22:3815-18 (1981), которая полностью включена в данную заявку путем ссылки), используя EDCI/HOBt (Этил карбодиимид гидрохлорид)/1-гидроксибензотриазол) в качестве реагентов сочетания. Тиазольные промежуточные соединения могут быть получены путем BrCCl3/ДБУ дегидрогенизации амидов Вайнреба. Тиазольные промежуточные соединения могут реагировать с соответствующими литиевыми реактивами или реактивами Гриньяра (т.е. имеющими соответствующий "С" цикл, см. Схему 3 ниже) в безводном ТГФ с получением целевых тиазолов (Nahm et al., "N-Methoxy-N-метила mides as Effective Acylating Agents," Tetrahedron Lett. 22:3815-18 (1981), которая полностью включена в данную заявку путем ссылки). Альтернативно, тиазолиновые амиды Вейнреба могут реагировать непосредственно с соответствующими литиевыми реактивами или реактивами Гриньяра, после гашения насыщенным раствором NH4Cl, что приводит к получению смесей тиазолиновых соединений и соответствующих тиазольных соединений.
Если тиазолин/тиазольные смеси поместить в растворитель и подвергнуть воздействию воздуха в атмосфере окружающей среды в течение некоторого времени (от одной ночи до нескольких дней), тиазолиновый цикл самопроизвольно дегидрогенизирует до тиазолов. В качестве примера, в растворе с дейтерированным хлороформом, смеси тиазолиновых/тиазольных соединений могут быть медленно превращены в почти чистые тиазольные соединения приблизительно через 9 дней (см., например, Фигура 2).
Образование тиазолидиновых соединений описано в патенте США №7307093, выданном Miller et al., и патентной заявке США, номер публикации 2007/0155807, выданной Miller et al., каждая из которых полностью включена в данную заявку путем ссылки.
Оксазолиновые производные (карбоновые кислоты, карбоксамиды, метаноны) в соответствии с данным изобретением получают посредством превращения иминных производных (бензонитрила и 1-фенил-2-метокси-этанимина) с энантиомерным (L или D), или рацемическим цистеиновым, или сериновым сложным эфиром, используя триэтиламин в качестве основания (Meyer et al., Tetrahedron: Asymmetry 14:2229-2238 (2003), которая полностью включена в данную заявку путем ссылки).
Имидазольные производные получают, используя L-винную кислоту в реакции конденсации с замещенным или незамещенным арилальдегидом с образованием имидазольной циклической системы (Anderson et al., J. Med. Chem. 32(1),119-127 (1989), которая полностью включена в данную заявку путем ссылки).
Синтез тиазола, оксазола и имидазола может быть проведен путем дегидрогенизации соответствующих тиазолина, оксазолина и имидазолина. Дегидрогенизация в соответствии с данным изобретением может быть достигнута путем первоначального галогенирования таких основных циклических систем (тиазолина, имидазолина и оксазолина) с последующим элиминированием с получением целевых тиазольных, оксазольных и имидазольных производных.
Образование тиокарбонильной линкерной группы (из карбонила) может быть проведено с использованием реагента Лоуссона (Jesberger et al., Synthesis 1929-1958 (2003), которая полностью включена в данную заявку путем ссылки). Тиокетоновая структура с сопряженными ароматическими циклами является стабильной по сравнению с незатрудненными тиокетонами.
Карбонильная линкерная группа может быть также восстановлена в спирт при помощи реакции Гриньяра промежуточного альдегида с соответствующими реактивами Гриньяра. Альтернативно, карбонильная группа может быть полностью удалена путем восстановления Клемменсена с образованием соответствующего углеводорода (например, метиленовой группы). При восстановлении карбонила в спирт или метилен, сильный акцептор водорода С=O снова превращается в сильный донор водорода O-Н или углеводород, который полностью теряет эффект связывания водорода.
Сложноэфирные и карбоксамидные связи могут быть получены из таких же самых промежуточных кислот, которые использовали для образования кетоновой связи, за исключением того, что реагенты (кислоту и предшественник "С" цикла) подвергают воздействию приемлемых условий для образования соответствующих сложноэфирных (DCC, NMM) или амидных (EDCl, HOBt, Et3N) связей. Карбоксамидные связи также описаны в патенте США №7,307,093, выданном Miller et al., и патентной заявке США номер публикации 2007/0155807, выданной Miller et al., каждая из которых полностью включена в данную заявку путем ссылки.
Также оценено, что соединения и синтетические промежуточные соединения в соответствии с данным изобретением могут быть получены при помощи синтетических процессов, известных специалистам в данной области. Функциональные группы промежуточного соединения и соединения в соответствии с данным изобретением могут нуждаться в защите при помощи приемлемых защитных групп. Такие функциональные группы включают гидрокси, амино, меркапто и карбоновую кислоту. Приемлемые защитные группы для гидроксигруппы включают триалкилсиилил или диарилалкилсилил (например, t-бутилдиметилсилил, t-бутилдифенилсилил или триметилсилил), тетрагидропиранил, бензил, и т.п. Приемлемые защитные группы для амино, амидино и гуанидино включают t-бутоксикарбонил (t-Boc или Boc), бензилоксикарбонил, и т.п. Приемлемые защитные группы для меркаптогруппы включают -C(O)-R (где R представляет собой алкил, арил или аралкил), и-метоксибензил, тритил и Т.п. Приемлемые защитные группы для карбоновой кислоты включают алкильные, арильные или аралкильные сложные эфиры.
Защитные группы могут быть добавлены или удалены в соответствии со стандартными методами, которые хорошо известны специалистам в данной области и описаны в данной заявке. Использование защитной группы подробно описано в Green et al., Protective Groups in Organic Synthesis, 2nd Ed., Wiley-Interscience (1991), которая полностью включена в данную заявку путем ссылки.
Другой аспект данного изобретения относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель и соединение в соответствии с аспектами данного изобретения. Фармацевтическая композиция может содержать одно или более идентифицированных выше соединений в соответствии с данным изобретением. Как правило, фармацевтическая композиция в соответствии с данным изобретением должна содержать соединение в соответствии с данным изобретением или его фармацевтически приемлемую соль, а также фармацевтически приемлемый носитель. Термин "фармацевтически приемлемый носитель" относится к любым приемлемым адъювантам, носителям, эксципиентам или стабилизаторам, и он может быть в твердой или жидкой форме, такой как таблетки, капсулы, порошки, растворы, суспензии или эмульсии.
Обычно, композиция будет содержать приблизительно от 0,01 до 99 процентов, преимущественно приблизительно от 20 до 75 процентов активного соединения (активных соединений), вместе с адъювантами, носителями и/или эксципиентами. В то время как индивидуальные потребности могут варьироваться, определения оптимальных диапазонов эффективных количеств каждого компонента могут быть выполнены специалистом в данной области. Типичные дозировки содержат приблизительно от 0,01 до 100 мг/кг·массу тела. Преимущественные дозировки содержат приблизительно от 0.1 до 100 мг/кг·массу тела. Наиболее преимущественные дозировки содержать приблизительно от 1 до 100 мг/кг·массу тела. Режим лечения для введения соединения в соответствии с данным изобретением может быть также легко определен специалистом в данной области. То есть частота введения и размер дозы могут быть установлены путем стандартной оптимизации, преимущественно при минимизации каких-либо побочных эффектов.
Твердые стандартные лекарственные формы могут быть традиционного типа. Твердая лекарственная форма может быть капсулой и подобной формой, такой как капсула обычного желатинового типа, содержащая соединения в соответствии с данным изобретением и носитель, например скользящие вещества и инертные наполнители, такие как лактоза, сахароза или кукурузный крахмал. В другом варианте исполнения, такие соединения таблетированы с традиционными основами таблеток, такими как лактоза, сахароза или кукурузный крахмал в комбинации с такими связующими веществами, как гуммиарабик, кукурузный крахмал или желатин, агентами распада, такими как кукурузный крахмал, картофельный крахмал или альгиновая кислота, и скользящим веществом, таким как стеариновая кислота или стеарат магния.
Таблетки, капсулы и т.д. могут также содержать связующее вещество, такое как трагакантовая камедь, гуммиарабик, кукурузный крахмал или желатин; эксципиенты, такие как фосфат дикальция; агент распада, такой как кукурузный крахмал, картофельный крахмал, альгиновая кислота; скользящее вещество, такое как стеарат магния; и подсластитель, такой как лактоза, сахароза или сахарин. Если стандартная лекарственная форма представляет собой капсулу, то она может содержать, кроме веществ указанного выше типа, жидкий носитель, такой, как жирное масло.
Различные другие материалы могут присутствовать в качестве покрытий или для модификации физической формы стандартной лекарственной формы. Например, таблетки могут быть покрыты шеллаком, сахаром или ими обоими. Сироп может содержать, в дополнение к активному ингредиенту, сахарозу в качестве подсластителя, метил и пропилпарабены в качестве консервантов, краситель и ароматизатор, такой как вишневый или апельсиновый ароматизатор.
Для перорального терапевтического введения, такие активные соединения могут быть введены с эксципиентами и применены в форме таблеток, капсул, эликсиров, суспензий, сиропов и т.п. Такие композиции и препараты должны содержать как минимум 0,1% активного соединения. Процентное содержание соединения в таких композициях может, конечно, варьироваться и может традиционно составлять приблизительно от 2% до 60% от единицы массы. Количество активного соединения в таких терапевтически полезных композициях является таким, что будет получена приемлемая дозировка. Преимущественные композиции в соответствии с данным изобретением получают таким образом, что лекарственная форма для перорального применения содержит приблизительно от 1 мг до 800 мг активного соединения.
Активные соединения в соответствии с данным изобретением могут быть введены перорально, например, с инертным разжижителем, или с усвоиваемым съедобным носителем, или они могут быть заключены в капсулы с твердым или мягким покрытием, или они могут быть спрессованы в таблетки, или они могут быть включены непосредственно в диету с едой.
Фармацевтические формы, приемлемые для применения путем инъекций, включают стерильные водные растворы или дисперсии, и стерильные порошки для препаратов для немедленного приема стерильных раствором или дисперсий для инъекций. Во всех случаях, форма должна быть стерильной и должна быть текучей в той мере, в которой существует легкость введения шприцем. Она должна быть стабильной в условиях производства и хранения и должна быть сохранена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может быть растворителем или дисперсионной средой, содержащей, например, воду, этанол, полиол (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль), их приемлемые смеси и растительные масла.
Соединения или фармацевтические композиции в соответствии с данным изобретением могут быть также введены в дозировки для инъекций при помощи раствора или суспензии таких веществ в физиологически приемлемом разжижителе с фармацевтическим адъювантом, носителем или эксципиентом. Такие адъюванты, носители и/или эксципиенты включают, не ограничиваясь приведенным, стерильные жидкости, такие как вода и масла, с или без добавления поверхностно-активного вещества и других фармацевтически и физиологически приемлемых компонентов. Иллюстративные масла являются маслами нефтяного, животного, растительного или синтетического происхождения, например, арахисовым маслом, соевым маслом, или минеральным маслом. В общем, вода, солевой раствор, водная декстроза и раствор родственных сахаров, и гликоли, такие как пропиленгликоль или полиэтиленгликоль, являются преимущественными жидкими носителями, в особенности для растворов для инъекций.
Такие активные соединения могут быть также введены парентерально. Растворы или суспензии таких активных соединений могут быть получены в воде, приемлемо смешанной с таким поверхностно-активным веществом, как гидроксипропилцеллюлоза. Дисперсии могут быть также получены в глицерине, жидких полиэтиленгликолях и их смесях в масле. Иллюстративные масла являются маслами нефтяного, животного, растительного или синтетического происхождения, например, арахисовым маслом, соевым маслом, или минеральным маслом. В общем, вода, солевой раствор, водная декстроза и раствор родственных сахаров, и гликоли, такие как пропиленгликоль или полиэтиленгликоль, являются преимущественными жидкими носителями, в особенности для растворов для инъекций. В обычных условиях хранения и применения, такие препараты содержат консервант для предотвращения роста микроорганизмов.
Для применения в качестве аэрозолей, соединения в соответствии с данным изобретением в растворе или суспензии могут быть упакованы в герметизированный аэрозольный контейнер вместе с приемлемыми сжатыми жидкостями, например, углеводородными сжатыми жидкостями, такими как пропан, бутан или изобутан с традиционными адъювантами. Вещества в соответствии с данным изобретением также могут быть введены в несжатой форме, например, в небулайзере или аэрозольном аппарате.
Еще один аспект данного изобретения относится к способу лечения рака, включающему выбор субъекта, который нуждается в лечении рака, и введение субъекту фармацевтической композиции, содержащей соединение в соответствии с первым аспектом данного изобретения и фармацевтически приемлемый носитель в условиях, эффективных для лечения рака.
При введении соединений в соответствии с данным изобретением, они могут быть введены системно или, альтернативно, они могут быть введены непосредственно в конкретный участок, где присутствуют раковые клетки или предраковые клетки. Таким образом, введение может быть осуществлено любым образом, эффективным для доставки соединений или фармацевтических композиций в раковые клетки или предраковые клетки. Иллюстративные режимы введения включают, без ограничений, введение соединений или композиций перорально, местно, трансдермально, парентерально, подкожно, внутривенно, внутримышечно, интраперитонеально, путем интраназальных инстилляций, путем внутриполостных или внутрипузырных инстилляций, интраокулярно, интраартериально, внутрь пораженных тканей, или путем аппликаций на слизистые перегородки, например нос, горло и бронхиолы.
Соединения в соответствии с данным изобретением можно использовать при лечении или профилактике различных форм рака, в частности рака простаты, рака молочной железы, яичников, рака кожи (например, меланомы), рака легких, рака толстой кишки, лейкемии, рака почек, рака ЦНС (например, глиомы, глиобластомы). Лечение многих таких видов рака поддержано приведенными в данной заявке примерами. Дополнительно, исходя из их предполагаемого режима действия в качестве ингибиторов тубулина, считают, что другие формы рака будут аналогично поддаваться лечению или профилактике после введения пациенту соединений или композиций в соответствии с данным изобретением. Преимущественные соединения в соответствии с данным изобретением являются разрушительными для раковых клеток, приводя к абляции раковых клеток, но преимущественно, ненормальных клеток. Очень важно, что вред, наносимый нормальным клеткам, минимизирован, поскольку раковые клетки являются чувствительными к разрушению при гораздо более низких концентрациях соединения в соответствии с данным изобретением.
Таким образом, дополнительный аспект данного изобретения относится к способу разрушения раковой клетки, включающему: обеспечение соединения в соответствии с данным изобретением с последующим контактированием раковой клетки с соединением в условиях, эффективных для разрушения контактирующей раковой клетки. В соответствии с различными вариантами исполнения разрушения раковых клеток, клетки, которые должны быть разрушены, могут быть расположены in vivo или ex vivo (т.е. в культуре).
Еще один дополнительный аспект данного изобретения относится к способу лечения или профилактике ракового состояния, который включает: обеспечение соединения в соответствии с данным изобретением и последующее введение эффективного количества соединения пациенту способом, эффективным для лечения или профилактики ракового состояния.
В соответствии с одним вариантом исполнения, пациент, который подлежит лечению, отличается присутствием предракового состояния, и введение соединения является эффективным для предотвращения развития предракового состояния в раковое. Это может происходить путем разрушения предраковой клетки до или одновременно с ее дальнейшим развитием в раковое состояние.
В соответствии с другим вариантом исполнения, пациент, который подлежит лечению, отличается наличием в нем ракового состояния, и введение соединения является эффективным для вызывания регрессии ракового состояния или для ингибирования роста ракового состояния, т.е. остановки его роста вообще или уменьшения его скорости роста. Это преимущественно происходит путем разрушения раковых клеток, вне зависимости от их расположения в организме пациента. То есть это имеет место независимо от того, расположены ли раковые клетки в первичном участке опухоли, или имеют они метастазы и создают вторичные опухоли в организме пациента.
Как используют в данной заявке, субъект или пациент относится к любому пациенту-млекопитающему, включая, без ограничений, людей и других приматов, собак, котов, коней, коров, овец, свиней, крыс, мышей и других грызунов.
При введении соединений или фармацевтических композиций в соответствии с данным изобретением для лечения или профилактики ракового состояния, фармацевтическая композиция может также содержать, или может быть введена в сочетании с другими терапевтическими средствами или режимами лечения, которые известны на сегодняшний день, разработаны после для лечения различных типов рака. Примеры других терапевтических средств или режимов лечения включают, без ограничений, радиационную терапию, иммунотерапию, химиотерапию, хирургическое вмешательство и их комбинации.
ПРИМЕРЫ
Примеры, приведенные ниже, предназначены только для иллюстрации и не предназначены для какого-либо ограничения объема данного изобретения.
Все реагенты были приобретены от Sigma-Aldrich Chemical Co., Fisher Scientific (Pittsburgh, PA), AK Scientific (Mountain View, CA), Oakwood Products (West Columbia, SC), и т.д. и использованы без дополнительной очистки. Чувствительные к наличию влаги реакции проводили в атмосфере аргона. Обычную тонкослойную хроматографию (ТСХ) проводили на листах Uniplates с алюминиевой подложкой (Analtech, Newark, DE). Точки плавления измеряли на аппарате Фишера-Джонса для измерения температур плавления (не корректировали). ЯМР спектры получали на спектрометре Bruker ARX 300 (Billerica, MA) или спектрометре Varian Inova-500. Про химические сдвиги сообщали как про миллионные доли (ppm) по отношению к ТМС в CDCl3. Данные масс-спектров собирали на приборе электроспрей/ионная ловушка Bruker ESQUIRE в позитивном и негативном ионных режимах. Элементные анализы проводили при помощи Atlantic Microlab Inc. (Norcross, GA).
Пример 1 - Синтез тиазольных, тиазолиновых и тиазолидиновых карбоксамидов
Синтез тиазольных и тиазолидиновых карбоксамидов в общем описан в патенте США №7,307,093, выданном Miller et al., и патентной заявке США, серийный номер публикации 2007/0155807, выданной Miller et al., каждая из которых полностью включена в данную заявку путем ссылки. Синтез различных тиазольных, дигидротиазольных и тиазолидиновых карбоксамидов в соответствии с данным изобретением также проиллюстрирован на Схеме 1 ниже.
Схема 1

Реактивы и условия: (а) C2H5OH, H2O, комнатная температура; (b) Boc2O, 1 N NaOH, 1, 4-диоксан, H2O; (с) EDCI, HOBt, ТЭА, 3,4,5-триметоксианилин; (d) ТФК, CH2Cl2.
Общая процедура получения (2RS, 4R)-2-арил-тиазолидин-4-карбоновой кислоты 1: Смесь L-цистеина (3,16 г, 26,11 ммоль) и соответствующего альдегида (26,15 ммоль) в этаноле (300 мл) и воды (30 мл) перемешивали при комнатной температуре в течение 6-15 часов, а твердое вещество, которое осаждалось, собирали, промывали диэтиловым эфиром с получением соответствующей (2RS, 4R)-2-арил-тиазолидин-4-карбоновой кислоты 1 с выходами 70-99%. При 0°С, 1 (5,95 ммоль) растворяли в 1 N NaOH (6 мл) и 1,4-диоксане (15 мл), затем ди-трет-бутилдикарбонат (2,80 г, 12,80 ммоль) медленно добавляли и перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали в вакууме и промывали этилацетатом (20 мл). Водную фазу доводили до рН 4 путем добавления 1 N HCl или 5% KHSO4, затем экстрагировали этилацетатом, высушивали над сульфатом магния, фильтровали и концентрировали в вакууме с получением соответствующих ВОС-защищенных кислот в виде пенообразных твердых веществ, которые использовали для следующей стадии без дальнейшей очистки.
Общая процедура получения (2RS, 4R)-2-арил-N-(3,4,5-триметоксифенил)тиазолидин-4-карбоксамидов 2а, 2b: Смесь соответствующих ВОС-защищенных карбоновых кислот (0,3-0,5 г), EDCI (1,2 эквив.) и HOBT (1,05 эквив.) в CH2Cl2 (20 мл) перемешивали при комнатной температуре в течение 10 мин. К этому раствору, добавляли 3,4,5-триметоксианилин (1,05 эквив.) и Et3N (1.2 эквив.) и продолжали перемешивание при комнатной температуре в течение 6-8 ч. Реакционную смесь разбавляли CH2Cl2 (30 мл) и последовательно промывали водой, насыщ. NaHCO3, солевым раствором и высушивали над MgSO4. Растворитель удаляли при сниженном давлении с получением неочищенного масла, которое перемешивали с ТФК (0,6-1 мл) в 20 мл CH2Cl2 при комнатной температуре в течение 1-8 часов для расщепления ВОС группы. Реакционную смесь концентрировали, промывали насыщ. NaHCO3 и высушивали над MgSO4. Растворитель удаляли с получением неочищенного твердого вещества, и соединения 2а-2b очищали при помощи колоночной хроматографии. Выход сообщали как выход 2 стадий.
(2RS,4R)-2-Фенил-N-(3,4,5-триметоксифенил)тиазолидин-4-карбоксамид (соединение 2а): Выход: 69,5%. Т.пл. 158-159°С, 1H ЯМР (300 МГц, CDCl3) δ 9,14 (s, 0,8H), 8,61 (s, 0,2H), 7,58-7,32 (m, 5H), 6,90 (s, 1,6H), 6,71 (s, 0,4H), 5,71 (dd, 0,2H, J=9,0 Гц), 5,42 (dd, 0,8 H, J=11,7 Гц), 4,53 (dt, 0,8H), 4,19 (m, 0,2H), 3,87, 3,80 (s, s, 6H), 3,82, 3,78 (s, s, 3H), 3,80-3,78 (m, 0,4H), 3,62-3,42 (m, 1,6H), 2,96 (t, 0,2 H, J=9,0 Гц), 2,74 (dd, 0,8H, J=11,7 Гц), МС (ESI) m/z 375,1 [M+H]+, 397,1 [M+Na]+. Анал. (C19H22N2O4S) C, H, N.
(2RS,4R)-N,2-бис(3,4,5-триметоксифенил)тиазолидин-4-карбоксамид (соединение 2b): Выход: 34,5%. Т.пл. 147-149°С. 1Н ЯМР (300 МГц, CDCl3) δ 9,10 (s, 0,7H), 8,59 (s, 0,3H), 6,90 (s, 1,4H), 6,80 (s, 0,6H), 6,74 (s, 1,4H), 6,71 (s, 0,6H), 5,66 (br, 0,3H), 5,35 (d, br, 0,7H, J=7,5 Гц), 4,52 (br, 0,7H), 4,21 (br, 0,3H), 3,90, 3,87, 3,86, 3,84, 3,82, 3,81, 3,79, 3,78 (все s, 18H), 3,66-3,61, 3,54-3,38 (m, 1,6H), 2,98, 2,72 (br, 1H), МС (ESI) m/z 465,1 [M+H]+, 487,1 [M+Na]+. Анал. (C22H28N2O7S) С, H, N.
Для повышения активности и разработки более селективных агентов, данный синтез был расширен и, как обсуждено в приведенных ниже примерах, биологические исследования проводили для изучения природы заместителей, присоединенных к карбонилу в 4 положении. Синтез таких дополнительных соединений показан на Схеме 2 ниже.
Схема 2

Реактивы и условия: (а) МеОН/pH=6,4 фосфатный буфер, комнатная температура; (b) EDCI, HOBt, ТЭА, 3,4, 5-триметоксианилин; (с) CBrCl3, ДБУ.
Синтез 2-фенил-N-(3,4,5-триметоксифенил)-4,5-дигидротиазол-4-карбоксамидов 4а-4b, 5: Замещенный бензонитрил (40 ммоль) соединяли с L- или D- цистеином (45 ммоль) в 100 мл 1:1 МеОН/рН 6,4 фосфатный буферный раствор. Реакцию перемешивали при 40°С в течение 3 дней (Bergeron et al., "Evaluation of Desferrithiocin and its Synthetic Analogs as Orally Effective Iron Chelators," J. Med. Chem. 34:2072-8 (1991), которая полностью включена в данную заявку путем ссылки). Осадок удаляли путем фильтрации, а МеОН удаляли при помощи роторного испарения. В оставшийся раствор добавляли 1М HCl для доведения до рН 4 ниже 0°С. Полученный в результате осадок экстрагировали в CH2Cl2, высушивали и концентрировали (Схема 2). Карбоновые кислоты 3а, 3b реагировали с 3,4,5-триметоксианилином с использованием тех же самых процедур, которые описаны для получения соединений 2а, 2b, таким образом, образуя соединения 4а, 4b. Превращение дигидротиазолов 4а,4b в тиазолидин 5 проводили путем окисления ВгССl3/ДБУ (работа Williams et al., "Studies of Mild Dehydrogenizations in Heterocyclic Systems," Tetrahedron Lett. 38:331-334 (1997), которая полностью включена в данную заявку путем ссылки).
(4R)-2-Фенил-4,5-дигидротиазол-4-карбоновая кислота (соединение 3а): Выход: 58,3%. 1H ЯМР (300 МГц, CDCl3) δ 9,31 (br, 1H), 7,88-7,85 (m, 2H), 7,55-7,41 (m, 3H), 5,38 (t, 1 H, J=9,6 Гц), 3,75 (dt, 2 H, J=9,6 Гц, 2,7 Гц), МС (ESI) m/z 162,0 [M-COOH]+.
(4S)-2-Фенил-4,5-дигидротиазол-4-карбоновая кислота (соединение 3b): Выход: 53,9%. 1H ЯМР (300 МГц, CDCl3) δ 7,89-7,85 (m, 2H), 7,55-7,41 (m, 3H), 5,38 (t, 1H, J=9,3 Гц), 3,75 (dt, 2 H, J=9,3 Гц, 2,7 Гц), МС (ESI) m/z 162,0 [M-СООН]-.
(4R)-2-Фенил-N-(3,4,5-триметоксифенил)-4,5-дигидротиазол-4-карбоксамид (соединение 4а): Выход: 98,7%. Т.пл. 121-12°С. 1Н ЯМР (300 МГц, CDCl3) δ 8,98 (s, 1H), 8,02-7,94, 7,62-7,48 (m, 5H), 6,93 (s, 2H), 5,38 (t, 1 H, J=9,6 Гц), 3,92-3,85 (m, 2H), 3,87 (s, 6H), 3,82 (s, 3H), МС (ESI) m/z 373,1 [M+H]+, Анал. (C19H20N2O4S) C, H, N.
(4R)-2-Фенил-N-(3,4,5-триметоксифенил)-4,5-дигидротиазол-4-карбоксамид (соединение 4b): Выход: 70,7%. Т.пл. 122-123°С. 1H ЯМР (300 МГц, CDCl3)δ 8.62 (s, 1H), 7.93-7.90 (m, 2H), 7.55-7.45 (m, 3H), 6.88 (s, 2 H), 5.31 (t, 1H, J=9.6 Гц), 3.86 (s, 6H), 3.79 (s, 3H), 3.83-3.70 (m, 2H). МС (ESI) m/z 395.1 [M+Na]+, 370.9 [M-1]-. Анал. (C19H20N2O4S) C, H, N.
2-Фенил-N-(3,4,5-триметоксифенил)тиазол-4-карбоксамид (соединение 5): Выход: 89,7%. Т.пл. 157-158°С. 1H ЯМР (300 МГц, CDCl3) δ 9,30 (s, 1 H), 8,20 (s, 1H), 8,04-8,01 (m, 2H), 7,53-7,51 (m, 3H), 7,08 (s, 2H), 3,92 (s, 6H), 3,86 (s, 3H), МС (ESI) m/z 393,1 [M+Na]+. Анал. (C19H18N2O4S) C, H, N.
Пример 2 - Синтез тиазольных и тиазолидиновых производных метанона
Промежуточные соединения метоксиметиламида 2-(замещенный-фенил)-4, 5-дигидротиазол-4-карбоновой кислоты: Как показано на Схеме 3 ниже, 2-(замещенный-фенил)- и незамещенный 2-фенил-4, 5-дигидротиазол-4-карбоновые кислоты 3 получали из соответствующих нитрилов (например, бензонитрила, пиридинил-нитрила, пиримидинил-нитрила, тиофенил-нитрила) и L-цистеина, как описано выше. Полученные карбоновые кислоты использовали для синтеза метоксиметиламидных промежуточных соединений. Смесь соответствующей карбоновой кислоты 3 (5 ммоль), EDCI (6 ммоль) и HOBt (5 ммоль) в CH2Cl2 (50 мл) перемешивали в течение 10 мин. К этому раствору, добавляли NMM (5 ммоль) и HNCH3OCH3 (5 ммоль) и продолжали перемешивание при комнатной температуре в течение 6-8 часов. Реакционную смесь разбавляли CH2Cl2 (100 мл) и последовательно промывали водой, насыщ. NaHCO3, солевым раствором и высушивали над MgSO4. Растворитель удаляли при сниженном давлении с получением неочищенного продукта 2, который очищали при помощи колоночной хроматографии.
Схема 3
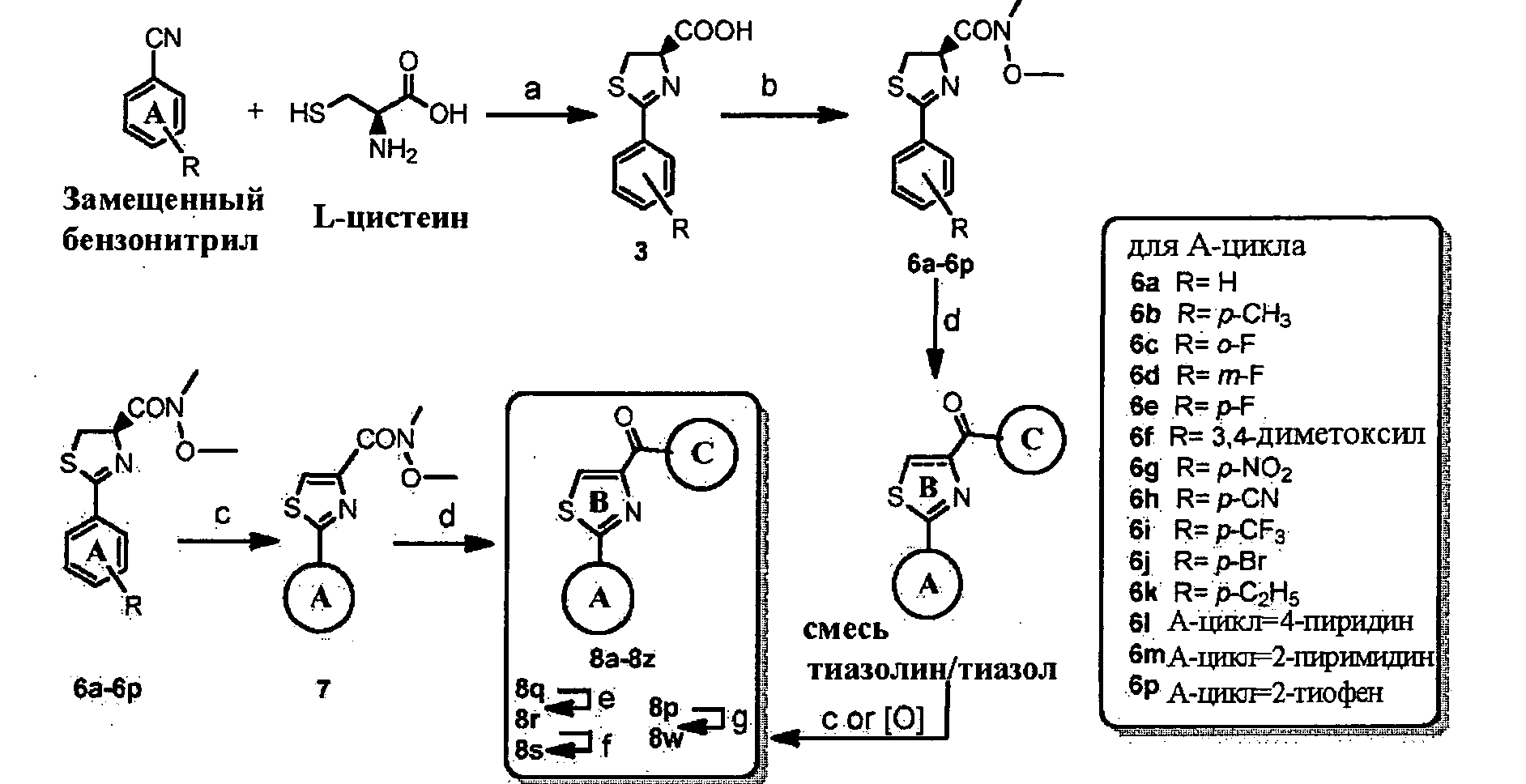

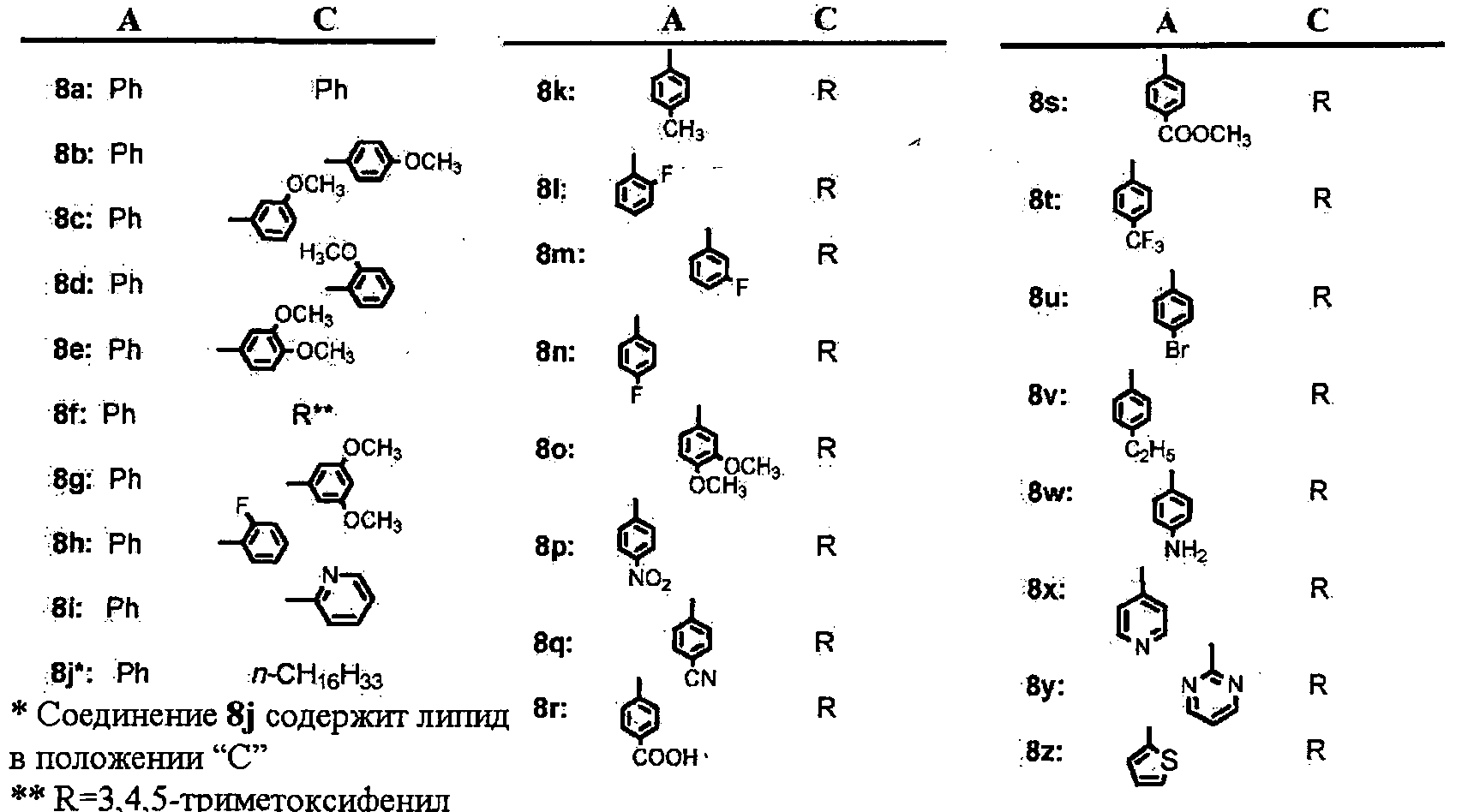
Реактивы и условия: (а) МеОН/рН 6,4 фосфатный буфер, комнатная температура; (b) EDCI, HOBt, NMM, HNCH3OCH3; (с) CBrCl3, ДБУ; (d) ArBr/BuLi или ArMgBr, ТГФ; (е) HCl/HOAc; (f) МеОН/CH3COCl; (g) Fe/HOAc; (h) BBr3, CH2Cl2.
(R)-N-Метокси-N-метил-2-фенил-4,5-дигидротиазол-4-карбоксамид (соединение 6а). Выход: 92,0%. 1Н ЯМР (300 МГц, CDCl3) δ 7,85-7,83 (m, 2H), 7,48-7,36 (m, 3H), 5,66 (t, 1H, J=9,0 Гц), 3,90 (s, 3H), 3,88-3,80 (br, 1H), 3,55-3,47 (dd, 1H, J=10,8 Гц, 9,0 Гц), 3,30 (s, 3H), MC (ESI) m/z 251,0 [M+H]+, 273,0 [M+Na]+.
(R)-Н-метокси-N-метил-2-n-толил-4,5-дигидротиазол-4-карбоксамид
(соединение 6b). Выход: 55,8%. 1Н ЯМР (300 МГц, CDCl3) δ 7,79 (d, 2H, J=7,8 Гц), 7,22 (d, 2H, J=7,8 Гц), 5,68 (t, 1H, J=8,7 Гц), 3,91 (s, 3H), 3,80 (t, 1 H, J=9,3 Гц), 3,55 (t, 1H, J=9,3 Гц), 3,30 (s, 3H), 2,93 (s, 3H), MC (ESI) m/z 265,0 [M+H]+, 287,0 [M+Na]+.
(R)-2-(2-фторфенил)-N-метокси-N-метил-4,5-дигидротиазол-4-карбоксамид (соединение 6с). Выход: 39,6%. 1H ЯМР (300 МГц, CDCl3) δ 7,91 (dt, 1H, J=7,5 Гц, 1,8 Гц), 7,43 (m, 1H), 7,19-7,09 (m, 2H), 5,63 (t, 1H), 3,88 (s, 3H), 3,83 (br, 1H), 3,48 (dd, 1H, J=11,1 Гц, 9,6 Гц), 3,30 (s, 3H), MC (ESI) m/z 291,0 [M+Na]+.
(R)-2-(3-фторфенил)-N-метокси-N-метил-4,5-дигидротиазол-4-карбоксамид (соединение 6d). Выход: 84,3%. 1Н ЯМР (300М Гц, CDCl3) δ 7,60-7,56 (m, 2H), 7,38 (dt, 1H, J=8,1 Гц, 6,0 Гц), 7,16 (dt, 1H, J=8,1 Гц, 2,4 Гц), 5,67 (t, 1H), 3,90 (s, 3H), 3,86-3,83 (br, 1H), 3,52 (dd, 1H, J=10,8 Гц, 9,3 Гц), 3,30 (s, 3H), MC (ESI) m/z 291,0 [M+Na]+.
(R)-2-(4-фторфенил)-N-метокси-N-метил-4,5-дигидротиазол-4-карбоксамид (соединение 6е). Выход: 66,0%. 1H ЯМР (300 МГц, CDCl3) δ 7,90 (d, 2H), 7,13 (d, 2H), 5,63 (t, 1H), 3,88 (s, 3H), 3,83 (br, 1H), 3,46 (dd, 1H), 3,31 (s, 3H), MC (ESI) m/z 269,0 [M+H]+.
(R)-2-(3,4-диметоксифенил)-N-метокси-N-метил-4,5-дигидротиазол-4-карбоксамид (соединение 6f). Выход: 36,7%, 1H ЯМР (300 МГц, CDCl3) δ 8,11 (d, 1H), 7,93 (s, 1H), 7,19-7,09 (d, 1H), 5,41 (t, 1H), 3,97 (s, 6H), 3,89 (s, 3H), 3,73 (br, 1H), 3,39 (dd, 1H), 3,31 (s, 3H), MC (ESI) m/z 333,1 [M+Na]+.
(R)-N-метокси-N-метил-2-(4-нитрофенил)-4,5-дигидротиазол-4-карбоксамид (соединение 6g). Выход: 53,7%. 1H ЯМР (300 МГц, CDCl3) δ 8,25(d, 2H, J=9,0 Гц), 8,01 (d, 2H, J=9,0 Гц), 5,73 (t, 1H), 3,90 (s, 3H), 3,87 (br, 1H), 3,59 (dd, 1H, J=11,1 Гц, 9,3 ц), 3,31 (s, 3H), MC (ESI) m/z 318,1 [M+Na]+.
(R)-2-(4-цианофенил)-N-метокси-N-метил-4,5-дигидротиазол-4-карбоксамид (соединение 6h). Выход: 26,7%. 1H ЯМР (300 МГц, CDCl3) δ 7,94(d, 2H, J=8,1 Гц), 7,69 (d, 2H, J=8,1 Гц), 5,71 (t, 1H, J=9,3 Гц), 3,89 (s, 3 H), 3,87 (br, 1H), 3,56 (dd, 1H, J=10,8 Гц, 9,3 Гц), 3,30 (s, 3H), MC (ESI) m/z 298,0 [M+Na]+.
(R)-N-метокси-N-метил-2-(4-трифторметилфенил)-4,5-дигидротиазол-4-карбоксамид (соединение 6i). Выход: 62,0%. 1H ЯМР (300 МГц, CDCl3) δ 7,95 (d, 2H, J=8,1 Гц), 7,65 (d, 2H, J=8,1 Гц), 5,70 (t, 1H, J=9,6 Гц), 3,89 (s, 3H), 3,85 (br, 1H), 3,55 (dd, 1H, J=10,8 Гц, 9,6 Гц), 3,30 (s, 3H), MC (ESI) m/z 341,0 [M+Na]+.
(R)-2-(4-бромфенил)-N-метокси-N-метил-4,5-дигидротиазол-4-карбоксамид (соединение 6j). Выход: 20,0%. 1H ЯМР (300 МГц, CDCl3) δ 7,71, 7,53 (d, d, 4H, J=8,4 Гц), 5,63 (t, 1H, J=9,6 Гц), 3,88 (s, 3H), 3,84 (t, 1H, J=9,6 Гц), 3,52 (dd, 1H, J=10,8 Гц, 9,6 Гц), 3,30 (s, 3H), MC (ESI) m/z 351,0 [M+Na]+.
(R)-N-метокси-N-метил-2-(4-этил)-4,5-дигидротиазол-4-карбоксамид (соединение 6k). Выход: 77,7%. 1H ЯМР (300 МГц, CDCl3) δ 7,75(d, 2H, J=8,4 Гц), 7,21 (d, 2H, J=8,4 Гц), 5,64 (t, 1H), 3,89 (s, 3H), 3,81 (m, 1H), 3,48 (dd, 1H, J=10,8 Гц, 9,3 Гц), 3,29 (s, 3H), 2,67 (q, 2H), 1,24 (t, 3H), MC (ESI) m/z 301,0 [M+Na]+.
(R)-N-метокси-N-метил-2-(пиридин-4-ил)-4,5-дигидротиазол-4-карбоксамид (соединение 6l). Выход: 66,6%. 1H ЯМР (300 МГц, CDCl3) δ 8,70 (d, 2H, J=9,0 Гц), 7,67 (d, 2H, J=9,0 Гц), 5,71 (t, 1H, J=9,6 Гц), 3,90 (s, 3H), 3,73 (t, 1H), 3,55 (dd, 1H, J=10,8 Гц, 9,6 Гц), 3,30 (s, 3H), MC (ESI) m/z 252,1 [M+H]+, 274,0 [M+Na]+.
(R)-N-метокси-N-метил-2-(пиримидин-2-ил)-4,5-дигидротиазол-4-карбоксамид (соединение 6m). Выход: 32,5%. 1Н ЯМР (300 МГц, CDCl3) δ 8,88 (d, 2H, J=4,8 Гц), 7,38 (t, 1H, J=4,8 Гц), 5,83 (t, 1H, J=9,0 Гц), 3,87 (s, 3H), 3,56 (dd, 2H, J=9,0 Гц), 3,30 (s, 3H), MC (ESI) m/z 275,0 [M+Na]+.
(R)-N-метокси-N-метил-2-(тиофен-2-ил)-4,5-дигидротиазол-4-карбоксамид (соединение 6р). Выход: 58,5%. 1H ЯМР (300 МГц, CDCl3) δ 7,57 (br, 1H), 7,49 (d, 1H, J=4,8 Гц), 7,09 (dd, 1 H, J=3,6 Гц, 4,8 Гц), 5,64 (t, 1H, J=9,0 Гц), 3,90 (s, 3H), 3,85 (br, 1H), 3,57 (dd, 1H, J=9,9, 9,0 Гц), 3,29 (s, 3H), MC (ESI) m/z 279,0 [M+Na]+.
N-метокси-N-метилтиазол-4-карбоксамид (соединение 9а): Выход: 58,7%. 1H ЯМР (300 МГц, CDCl3) δ 8,82 (d, 1Н, J=2,1 Гц), 8,10 (d, 1H, J=2,1 Гц), 3,79 (s, 3H), 3,45 (s, 3H), MC (ESI) m/z 194,9 [M+Na]+.
Метоксиметиламиды 2-(замещенный-фенил)-тиазол-4-карбоновой кислоты 7а-р: раствор полученных в результате метоксиметиламидов дигидротиазол-4-карбоновой кислоты 6а-6р (1 эквив.) в CH2Cl2 охлаждали до 0°С, и добавляли дистиллированный ДБУ (2 эквив.). Бромтрихлорометан (1,7 эквив.) затем вводили по каплям посредством шприца в течение 10 мин. Реакционные смеси оставляли нагреваться до комнатной температуры и перемешивали всю ночь. После промывания насыщенным водным NH4Cl (2×50 мл), водную фазу экстрагировали EtOAc (3×50 мл). Соединенные органические слои высушивали над MgSO4, фильтровали и концентрировали in vacua. Остаток очищали при помощи флеш-хроматографии, что требовалось для обеспечения соединений 7а-р.
Метоксиметиламид 2-фенил-тиазол-4-карбоновой кислоты (соединение 7а): Выход: 73,6%. 1H ЯМР (300 МГц, CDCl3) δ 8,01 (s, 1H), 7,99-7,96 (m, 2H), 7,47-7,44 (m, 3H), 3,88 (s, 3H), 3,49 (s, 3H), MC (ESI) m/z 271,0 [M+Na]+.
(2-(Замещенный-фенил)-тиазол-4-ил)-(замещенный-фенил)-метаноны: Как показано на Схеме 3 выше, три различных способа использовали для синтеза метанонов 8a-8z.
Способ 1: К раствору n-BuLi (1.6М, 0,713 мл) в 8 мл ТГФ добавляли раствор 3,4,5-триметоксибромбензола (1,09 ммоль) в 3 мл ТГФ при ниже -78°С. Смесь перемешивали в течение 2 часов и загружали раствор амидов 6 или 7 (1,14 ммоль) в 3 мл ТГФ. Смесь оставляли нагреваться до комнатной температуры и перемешивали всю ночь. Реакционную смесь гасили насыщенным NH4Cl, экстрагировали этиловым эфиром, высушивали над MgSO4, и оставляли на воздухе на всю ночь. Растворитель удаляли при сниженном давлении с получением сырого продукта, который очищали при помощи колоночной хроматографии с получением чистых соединений 8a-8z.
Способ 2: К раствору соответствующих реактивов Гриньяра (0,5М, 3 мл) в 2 мл ТГФ загружали раствор амидов 6 или 7 (1 ммоль) в 3 мл ТГФ при 0°С. Смеси перемешивали в течение от 30 минут до 2 часов до исчезновений амидов на ТСХ пластинках. Реакционную смесь гасили насыщ. NH4Cl, экстрагировали этиловым эфиром, высушивали над MgSO4 и оставляли на воздухе на всю ночь с получением 6 в качестве исходного вещества. Растворитель удаляли при сниженном давлении с получением сырого продукта, который очищали при помощи колоночной хроматографии с получением чистого соединения 8a-8z.
Также получали гидрохлоридные соли соединений 8i, 8x и 8w. При 0°С, к раствору 10 мл HCL в этиловом эфире (2 М) добавляли 8i, 8x или 8w (100 мг) в 5 мл CH2Cl2 (5 мл) и перемешивали всю ночь. Гидрохлоридный осадок фильтровали и промывали этиловым эфиром. Откачивание в высоком вакууме приводило к получению соответствующих солей.
Фенил (2-фенилтиазол-4-ил)-метанон (соединение 8а); Выход: 76,3%. Т.пл. 65-66°С. 1H ЯМР (300 МГц, CDCl3) δ 8,32-8,29 (m, 2H), 8,24 (s, 1H), 8,04-8,00 (m, 2H), 7,64-7,52 (m, 3H), 7,50-7,46 (m, 3H), MC (ESI) m/z 288,0 [M+Na]+. Анал. (C16H11NOS) С, H, N.
(4-Метоксифенил)(2-фенилтиазол-4-ил)-метанон (соединение 8b): Выход: 74,8%. Т.пл. 105-106°С. 1H ЯМР (300 МГц, CDCl3) δ 8,41 (d, 2 H), 8,22 (s, 1 H), 8,02 (dd, 2 H), 7,47 (m, 3 H), 7,01 (d, 2 H), 3,80 (s, 3 H), MC (ESI) m/z 318,1 [M+Na]+. Анал. (C17H13NO2S) C, H, N.
(3-Метоксифенил)(2-фенилтиазол-4-ил)-метанон (соединение 8 с): Выход: 58,8%. Т.пл. 43-44°С. 1H ЯМР (300 МГц, CDCl3) δ 8,23 (s, 1H), 8,05-8,01 (m, 2 H), 7,93 (d, 1H), 7,84 (m, 1H), 7,49-7,40 (m, 4H), 7,16-7,15 (m, 1H), 3,89 (s, 3H), MC (ESI) m/z 318,1 [M+Na]+. Анал. (C17H13NO2S) C, H, N.
(2-Метоксифенил)(2-фенилтиазол-4-ил)-метанон (соединение 8d): Выход: 57,4%. Бесцветное масло. 1H ЯМР (300 МГц, CDCl3) δ 8,03 (s, 1H), 7,98-7,95 (m, 2H), 7,57-7,47 (m, 2H), 7,47-7,42 (m, 3H), 7,08-7,01 (m, 2H), 3,78 (s, 3 H), MC (ESI) m/z 318,1 [M+Na]+. Анал. (C17H13NO2S) C, H, N.
(3,4-Диметоксифенил)(2-фенилтиазол-4-ил)-метанон (соединение 8е): Выход: 15,3%. Т.пл. 89-91°С. 1H ЯМР (500 МГц, CDCl3) δ 8,24 (s, 1H), 8,22 (dd, 1H, J=8,5 Гц, 2,0 Гц), 8,04-8,02 (m, 2H), 7,99 (d, 1H, J=2,0 Гц), 7,49-7,47 (m, 3 H), 6,98 (d, 1H, J=8,5 Гц), 3,99 (s, 6H), MC (ESI) m/z 348,0 [M+Na]+. Анал. (C18H15NO3S) C, H, N.
(2-Фенил-тиазол-4-ил)-(3,4,5-триметокси-фенил)-метанон (соединение 8f): Выход: 27,3%. Т.пл. 133-135°С. 1H ЯМР (300 МГц, CDCl3) δ 8,29 (s, 1 H), 8,03 (q, 2H), 7,80 (s, 2H), 7,49-7,47 (m, 3H), 3,96 (s, 6H), 3,97 (s, 3H), MC (ESI) m/z 378,1 [M+Na]+. Анал. (C19H17NO4S) С, Н, N.
(3,5-Диметоксифенил)(2-фенилтиазол-4-ил)-метанон (соединение 8g): Выход: 41,5%. Т.пл. 84-85°С. 1H ЯМР (300 МГц, CDCl3) δ 8,23 (s, 1H), 8,04-8,01 (m, 2H), 7,99 (d, 2H, J=2,4 Гц), 7,49-7,43 (m, 3H), 6,72 (t, 1 H, J=2,4 Гц), 3,87 (s, 6H), MC (ESI) m/z 348,3 [M+Na]+. Анал. (C18H15NO3S) C, H, N.
(2-Фторфенил)(2-фенилтиазол-4-ил)-метанон (соединение 8h): Выход: 66,4%. Т.пл. 77-79°С. 1H ЯМР (300 МГц, CDCl3) δ 8,48-8,41 (m, 2H), 8,28 (s, 2 H), 8,04-7,98 (m, 2H), 7,50-7,46 (m, 3H), 7,26-7,16 (m, 2H), MC (ESI) m/z 306,0 [M+Na]+. 283,9 [M - H]-. Анал. (C16H10FNOS) C, H, N.
(2-Фенилтиазол-4-ил)-(пиридин-2-ил)-метанон (соединение 8i): Выход: 20,7%. Т.пл. 95-97°С. 1Н ЯМР (300 МГц, CDCl3) δ 9,01 (s, 1H), 8,77 (d, 1H, J=4,8 Гц), 8,28 (d, 1H, J=7,8 Гц), 8,08-8,05 (m, 2H), 7,92 (dt, 1H, J=7,8 Гц, 1,2 Гц), 7,52 (ddd, 1H, J=7,8 Гц, 4,8 Гц, 1,2 Гц), 7,48-7,46 (m, 3H), (соединение 8i·HCl соль): Выход: 70,6%, Т.пл. 105-107°С, 1H ЯМР (300 МГц, DMCO-d6) δ 9,03 (s, 1H), 8,79 (d, 1H, J=4,8 Гц), 8,10 (br, 1H), 8,08 (br, 1H), 8,03-8,00 (m, 2 H), 7,73-7,69 (m, 1H), 7,56-7,54 (m, 3H), MC (ESI) m/z 267,0 [M+H]+. Анал. (C15H10N2OS, C15H10N2OS**HCl) C, H, N.
1-(2-Фенилтиазол-4-ил)-гептадекан-1-он (соединение 8j); Выход: 66,4%. Т.пл. 63-64°С. 1H ЯМР (300 МГц, CDCl3) δ 8,12 (s, 1H), 8,02-7,99 (m, 2H), 7,49-7,47 (m, 3H), 3,16 (t, 2H, J=7,5 Гц), 1,82-1,72 (m, 2H), 1,26 (s, 26H), 0,88 (t, 3 H, J=6,9 Гц), MC (ESI) m/z 414,4 [M+H]+. Анал. (C26H39NOS) С, Н, N.
(2-n-Толилтиазол-4-ил)-(3,4,5-триметоксифенил)-метанон (соединение 8k): Выход: 53,2%. Т.пл. 116-119°С. 1H ЯМР (300 МГц, CDCl3) δ 8,25 (s, 1H), 7,91 (d, 2H, J=8,1 Гц), 7,80 (s, 2H), 7,28 (d, 2H, J=8,1 Гц), 3,96 (s, 3H), 3,95 (s, 6H), MC (ESI) m/z 392,1 [M+Na]+. Анал. (C20H19NO4S) C, H, N.
[2-(2-Фторфенил)-тиазол-4-ил]-(3,4,5-триметоксифенил)-метанон (соединение 8l); Выход: 39,6%. Т.пл. 90-102°С. 1H ЯМР (500 МГц, CDCl3) δ 8,40 (s, 1H), 8,33 (dt, 1H, J=1,5 Гц, 8,0 Гц), 7,78 (s, 2H), 7,49-7,44 (m, 1H), 7,30-7,23 (m, 2H), 3,97 (s, 3H), 3,95 (s, 6H), MC (ESI) m/z 396,1 [M+Na]+. Анал. (C19H16FNO4S) C, H, N.
[2-(3-Фторфенил)-тиазол-4-ил] (3,4,5-триметоксифенил)-метанон (соединение 8m).- Выход: 14,1%. Т.пл. 122-124°С. 1H ЯМР (300 МГц, CDCl3) δ 8,31 (s, 1H), 7,79 (s, 2H), 7,76-7,74 (m, 2H), 7,45 (dt, 1H, J=6,0 Гц, 8,4 Гц), 7,18 (dt, 1H, J=1,8 Гц, 8,4 Гц), 3,97 (s, 3H), 3,96 (s, 6H), MC (ESI) m/z 396,1 [M+Na]+. Анал. (C19H16FNO4S) С, Н, N.
[2-(4-Фторфенил)-тиазол-4-ил]-(3,4,5-триметоксифенил)-метанон (соединение 8n): Выход: 40,2%. Т.пл. 153-155°С. 1H ЯМР (300 МГц, CDCl3) δ 8,27 (s, 1H), 8,04-8,00 (dd, 2H, J=8,4 Гц, 5,7 Гц), 7,75 (s, 2H), 7,21-7,15 (t, 3H, J=8,4 Гц), 3,97 (s, 3H), 3,95 (s, 6H), MC (ESI) m/z 396,1 [M+Na]+. Анал. (C19H16FNO4S) C, H, N.
[2-(3,4-Диметоксифенил)-тиазол-4-ил]-(3,4,5-триметоксифенил)-метанон (соединение 8о); Выход: 46,6%. Т.пл. 145-147°С. 1H ЯМР (300 МГц, CDCl3) δ 8,20 (s, 1H), 7,76 (s, 2H), 7,58-7,54 (m, 2H), 6,94 (d, 2H, J=8,1 Гц), 3,96 (s, 6H), 3,95 (s, s, 9H), MC (ESI) m/z 438,1 [M+Na]+. Анал. (C21H21NO6S·1/4H2O) C, H, N.
[2-(4-Нитрофенил)-тиазол-4-ил]-(3,4,5-триметоксифенил)-метанон (соединение 8р); Выход: 46,4%. Т.пл. 199-200°С. 1Н ЯМР (300 МГц, CDCl3) δ 8,38 (d, 2H, J=8,7 Гц), 8,34 (s, 1H), 8,20 (d, 2H, J=8,7 Гц), 7,73 (s, 2H), 3,98 (s, 3H), 3,95 (s, 6H), MC (ESI) m/z 423,1 [M+Na]+ Анал. (C19H16N2O6S) C, H, N.
4-[4-(3,4,5-Триметоксибензоил)-тиазол-2-ил]-бензонитрил (соединение 8q): Выход: 45,9%. Т.пл. 181-182°С. 1H ЯМР (300 МГц, CDCl3) δ 8,37 (s, 1H), 8,13 (d, 2H, J=8,4 Гц), 7,78 (d, 2H, J=8,4 Гц), 7,72 (s, 2H), 3,97 (s, 3H), 3,94 (s, 6H), MC (ESI) m/z 403,1 [M+Na]+. Анал. (C20H16N2O4S) C, H, N.
4-[4-(3,4,5-Триметоксибензоил)-тиазол-2-ил]-бензойную кислоту (соединение 8r); Выход: 61,9%. Т.пл. >220°С (разл.). 1H ЯМР (300 МГц, CDCl3) δ 8,65 (s, 1H), 8,00 (d, d, 4H), 7,65 (s, 2H), 3,88 (s, 6H), 3,80 (s, 3H), MC (ESI) m/z 397,9 [M-H]-, 353,9 [M-COOH]-,. Анал. (C20H17NO6S) C, H, N.
Метил-4-[4-(3,4,5-триметоксибензоил)-тиазол-2-ил]-бензоат (соединение 8s); Выход: 72,5%. Т.пл. 172-174°С. 1H ЯМР (300 МГц, CDCl3) δ 8,35 (s, 1H), 8,12 (dd, 4 H, J=8,4 Гц), 7,78 (s, 2H), 3,97 (s, 3H), 3,96 (s, 3Н), 3,95 (s, 6H), MC (ESI) m/z 436,1 [M+Na]+. Анал. (C21H19NO6S) C, H, N.
(2-(4-(Трифторметил)-фенил)-тиазол-4-ил)(3,4,5-триметоксифенил)-метанон (соединение 8t); Выход: 45,5%. Т.пл. 144-145°С. 1H ЯМР (300 МГц, CDCl3) δ 8,35 (s, 1H), 8,14, 7,65 (d, d, 4H, J=8,1 Гц), 7,76 (s, 2H), 3,97 (s, 3H), 3,95 (s, 6H), MC (ESI) m/z 446,1 [M+Na]+. Анал. (C20H16F3NO4S) С, H, N.
[2-(4-Бромфенил)-тиазол-4-ил]-(3,4,5-триметоксифенил)-метанон (соединение 8u); Выход: 51,8%. Т.пл. 149-150°С. 1H ЯМР (300 МГц, CDCl3) δ 8,28 (s, 1H), 7,89, 7,62 (d, d, 4H, J=8,1 Гц), 7,75 (s, 2H), 3,97 (s, 3H), 3,94 (s, 6H), MC (ESI) m/z 456,0, 458,0 [M+Na]+. Анал. (C19H16BrNO4S) C, H, N.
[2-(4-Этил-фенил)-тиазол-4-ил]-(3,4,5-триметокси-фенил)-метанон (соединение 8v); Выход: 40,0%. Т.пл. 86-87°С. 1H ЯМР (300 МГц, CDCl3) δ 8,25 (s, 1H), 7,93, 7,31 (d, d, 4H, J=8,4 Гц), 7,81 (s, 2H), 3,97 (s, 3H), 3,95 (s, 6H), MC (ESI) m/z 406,1 [M+Na]+. Анал. (C21H21NO4S) C, H, N.
[2-(4-Амино-фенил)-тиазол-4-ил]-(3,4,5-триметокси-фенил)-метанон (соединение 8w); Выход: 61,8%. Т.пл. 177-179°С. 1H ЯМР (300 МГц, CDCl3) δ 8,14 (s, 1H), 7,82, 7,65 (d, d, 4 H, J=8,4 Гц), 7,78 (s, 2H), 3,96 (s, 3H), 3,94 (s, 6H). (соединение 8w·HCl соль): Выход: 50.1%. Т.пл. 166-169°С. 1H ЯМР (300 МГц, DMCO-d6) δ 8,49 (s, 1H), 7,84, 6,94 (d, d, 4H, J=8,4 Гц), 7,62 (s, 2H), 3,86 (s, 3H), 3,79 (s, 6 H), MC (ESI) m/z 393,1 [M+Na]+. Анал. (C19H18N2O4S, C19H18N2O4S·HCl) C, H, N.
[2-(Пиридин-4-ил)-тиазол-4-ил]-(3,4,5-триметоксифенил)-метанон (соединение 8х); Выход: 29,3%. Т.пл. 178-180°С. 1H ЯМР (300 МГц, CDCl3) δ 8,77 (dd, 2H, J=6,0 Гц, 1,5 Гц), 8,40 (s, 1H), 7,87 (dd, 2H, J=6,0 Гц, 1,8 Гц), 7,75 (s, 2H), 3,98 (s, 3 H), 3,95 (s, 6H). (соединение 8х·НС1 соль): Выход: 92,7%. Т.пл. 182-184°С. 1H ЯМР (300 МГц, CDCl3) δ 8,85 (br, 2H), 8,52 (s, 1H), 8,22 (br, 2H), 7,66 (s, 2H), 3,98 (s, 3H), 3,94 (s, 6H), MC (ESI) m/z 379,1 [M+Na]+. Анал. (C18H16N2O4S, C18H16N2O4S·HCl) C, H, N.
[2-(Пиримидин-2-ил)-тиазол-4-ил]-(3,4,5-триметоксифенил)-метанон (соединение 8y); Выход: 51,9%. Т.пл. 190-191°С. 1H ЯМР (300 МГц, CDCl3) δ 8,88 (d, 2H, J=4,8 Гц), 8,44 (s, 1H), 7,73 (s, 2H), 7,37 (t, 1H, J=4,8 Гц), 3,95 (s, 3H), 3,94 (s, 6H), MC (ESI) m/z 380,1 [M+Na]+. Анал. (C17H15N3O4S) C, H, N.
[2-(Тиофен-2-ил)-тиазол-4-ил]-(3,4,5-триметоксифенил)-метанон (соединение 8z): Выход: 30,5%. Т.пл. 111-113°С. 1H ЯМР (300 МГц, CDCl3) δ 8,25 (s, 1H), 7,90 (s, 2H), 7,58 (dd, 1H, J=3,6, 0,9 Гц), 7,46 (dd, 1H, J=5,4, 0,9 Гц), 7,12 (dd, 1H, J=5,4, 3,6 Гц), 3,98 (s, 6H), 3,97 (s, 3H), MC (ESI) m/z 384,1 [M+Na]+. Анал. (C17H15NO4S2) С, H, N.
Тиазол-4-ил-(3,4,5-триметокси-фенил)-метанон (соединение 10а); Выход: 49,4%. Т.пл. 106-108°С. 1Н ЯМР (300 МГц, CDCl3) δ 8,92 (d, 1H, J=2,1 Гц), 8,34 (d, 1H, J=2,1 Гц), 7,61 (s, 2H), 3,94 (s, 3H), 3,93 (s, 6H), MC (ESI) m/z 302,0 [M+Na]+. Анал. (C13H13NO4S) C, H, N.
Способ 3: (2-Фенил-тиазол-4-ил)-(3,4,5-тригидрокси-фенил)-метанон (11f) синтезировали, начиная с соединения 8f. К раствору соединения 8f (123 мг, 0,35 ммоль) в 5 мл безв. CH2Cl2 добавляли BBr3 (1М раствор в CH2Cl2, 1,75 мл, 5 ммоль) при ниже -78°С. Смесь перемешивали в течение 2 часов и загружали раствор амида 7 (1,14 ммоль) в 3 мл ТГФ. Смесь оставляли медленно нагреваться до комнатной температуры и перемешивали всю ночь. Реакционную смесь гасили насыщ. NH4Cl, экстрагировали этилацетатом, высушивали над MgSO4. Растворитель удаляли при сниженном давлении с получением неочищенного продукта, который очищали при помощи колоночной хроматографии с получением чистого соединения в виде красного кристаллического твердого вещества. Выход: 50,9%. Т.пл. 175-176°С. 1Н ЯМР (300 МГц, DMCO-d6) δ 8,44 (d, 1H), 8,07-8,04 (m, 2H), 7,57-7,55 (m, 3H), 7,33 (s, 2H), MC (ESI) m/z 336,1 [M+Na]+. Анал. (C16H11NO4S) C, H, N.
Пример 3 - Рентгеноструктурное определение кристаллической структуры для соединения 8f
Соединение 8f повторно кристаллизовали из гексана и этилацетата и получали одинарные бесцветные кристаллы, приемлемые для рентгенографического исследования. Рентгеноструктурные данные для 8f получали для одинарного кристалла, смонтированного с паратоновым маслом на нейлоновой криопетле. Данные собирали при 100К на двухмерном детекторе Bruker Proteum CCD, контролируемом программным обеспечением Proteum2 (Proteum2, Bruker AXS Inc., Madison, Wisconsin, USA (2005)), с использованием генератора с вращающимся анодом и зеркалами Osmic для генерации Cu-излучения (λ=1,54178 Å). Данные преобразовывали при помощи SAINT (SAINT, Bruker AXS Inc., Madison, Wisconsin, USA. (1998)), а коррекцию поглощения применяли при помощи SADABS (SADABS, Bruker AXS Inc., Madison, Wisconsin, USA. (2000)), исходя из чрезмерных отражений; такая коррекция включала сферический компонент. Структуру решали при помощи прямых способов (SHELXSx4), которые обнаруживали все тяжелые атомы. Уточнение структуры при помощи SHELXL (SHELXL-97, G.M. Sheldrick, University of Gottingen, Germany (1997)) проводили при помощи полноматричных способов, исходя из F2, и плавно продолжали. Атомы водорода добавляли к структурной модели, допуская идеальные расстояния С-Н и изотропные ADPs, ограниченные тем, что они аналогичны ADPs связанного атома углерода. В конечной модели, анизотропные ADPs уточняли для всех тяжелых металлов, а изотропные ADPs для химически аналогичных водородов (например, Н метила) были ограничены идентичностью. Конечные параметры уточнения: wR2=0,084 для 228 параметров и 3066 независимых наблюдений, R1=0.031, S (критерий согласованности) = 1,057.
Изображение ORTEP 8f со схемой меток атомов показано на Фигуре 1. Рентгеновская структура показала, что молекула 8f содержала конъюгированную систему, состоящую из трех ароматических циклов и линкера - карбонильной группы между "В" и "С" циклом, как ожидали ("А" цикл = фенил; "В" цикл = тиазол; "С" цикл=3,4, 5-триметоксифенил). В результате, две С-С связи, примыкающие к С=O и С-С- связи между "А" фенильным и "В" тиазольным циклом отображают (С1-С7=1,496(2) Å; С7-С8=1,492(2) Å; С10-С11=1,471(2) Å) более короткие длины связей, чем нормальная С-С одинарная связь (1,54 Å), и более длинные, чем нормальная С=С двойная связь (1,34 Å) (см. Таблицу 1 ниже). Таким образом, конъюгация π системы возможна для "А", "В", "С" циклов и карбонильной группы. Карбонильная группа является практически копланарной с прилегающим "В" тиазольным циклом (O-С7-С1-С6 16.2(2)°, O-С7-С8-С9 9.7(2)°).
|
|
Пример 4 - Анализы in vitro противораковой цитотоксичности
In vitro анализы были проведены на предмет тестирования как меланомных клеточных линий, так и клеточных линий простаты. В каждом случае использовали стандартный анализ с сульфородамином В. Клетки высеивали в планшеты с 96 лунками при 1000-5000 клеток/лунка в зависимости от скоростей роста. Через 12 часов, среды поменяли и добавляли серийные разведения соединений. Клетки инкубировали для каждого из соединений в течение 48 часов. Свежие среды, содержащие тестовое соединение, меняли каждые 24 часа. После этого общий клеточный белок, соответствующий количествам клеток (как жизнеспособных, так и нежизнеспособных клеток), измеряли анализом с сульфородамином В (SRB) в соответствии с протоколом производителя (Sigma-Aldrich, Inc.) (Rubinstein et al., "Comparison of in vitro Anticancer Drug-screening Data Generated with a Tetrazolium Assay Versus a Protein Assay Against a Diverse Panel of Human Tumor Cell Lines," J. Natl. Cancer Inst. 82:1113-1118 (1990); Dothager et al., "Synthesis and Identification of Small Molecules that Potently Induce Apoptosis in Melanoma Cells Through Gl Cell Cycle Arrest," J. Am. Chem. Soc. 127:8686-8696 (2005), каждая из которых полностью включена в данную заявку путем ссылки).
Для анализов меланомы использовали одну человеческую меланомную клеточную линию (A375) и одну мышиную меланомную клеточную линию (B16-F1). Клетки A375 и клетки B16-F1 приобретали у АТСС (Американская коллекция типовых культур, Manassas, VA, USA). Фибробластные клетки применяли в качестве контрольных для определения селективности таких соединений по отношении к меланоме. Человеческие дермальные фибробластные клетки приобретали у Cascade Biologies, Inc., Portland, OR, USA. Все клеточные линии культивировали в модифицированной по способу Дульбекко среде Игла (Cellgro Mediatech, Inc., Hemdon, VA, USA), с добавлением 5% эмбриональной бычьей сыворотки (Cellgro Mediatech), смеси 1% антибиотик/антимикотик (Sigma-Aldrich, Inc., St. Louis, МО, USA) и бычьего инсулина (5 мкг/мл; Sigma-Aldrich). Культуры хранили при 37°С в увлажненной атмосфере, содержащей 5% CO2. Клетки подвергали воздействию широкого диапазона концентраций в течение 48 часов в круглодонных планшетах на 96 лунок. Клетки фиксировали 10% трихлоруксусной кислотой и пятикратно промывали водой. После высушивания клеток на воздухе в течение ночи и окрашивания раствором сульфородамина В, общее содержание белка измеряли при 560 нм при помощи планшетного ридера. Значения IC50 (т.е. концентрация, ингибирующая рост клеток на 50% от контролей без лечения) получали при помощи анализа нелинейной регрессии при помощи GraphPad Prism (GraphPad Software, San Diego, CA).
Для анализов рака простаты, отбирали четыре человеческие клеточные линии рака простаты (LNCaP, DU 145, PC-3 и РРС-1). Клетки LNCaP, PC-3 и DU 145 приобретали у АТСС (Американская коллекция типовых культур, Manassas,VA, USA). Доктор Митчелл Штайнер (Mitchell Steiner), Университет Теннеси, Центр наук о здоровье, любезно предоставил клетки РРС-1. Все клеточные линии рака простаты культивировали в RPMI 1640 (Cellgro Mediatech, Inc., Hemdon, VA, USA), с добавлением 10% эмбриональной бычьей сыворотки (Cellgro Mediatech). Культуры хранили при 37°С в увлажненной атмосфере, содержащей 5% СО2. 1000-5000 клеток высевали на планшеты в каждую лунку планшет на 96 лунок в зависимости от скорости роста и подвергали воздействию различных концентраций тестового соединения в течение 96 часов в трех-пяти репликатах. Количества клеток в конце лечения лекарственным средством измеряли при помощи анализа с сульфородамином В. Кратко, клетки фиксировали 10% трихлоруксусной кислоты и окрашивали 0,4% сульфородамина В, и поглощения при 540 нм измеряли при помощи планшетного ридера (DYNEX Technologies, Chantilly, VA). Процентные содержания выживания клеток в зависимости от концентрации лекарственного средства наносили на график и значения IC50 (концентрация, которая ингибирует рост на 50% от необработанного контроля) получали при помощи анализа нелинейной регрессии при помощи WinNonlin (Pharsight Corporation, Mountain View, CA).
Результаты данных анализов представлены в Таблицах 2-4 ниже. Модификации "В" цикла от тиазолидиновой к тиазольной системе и линкер от амида к кетону. В предыдущих соединениях АТСАА было показано, что тиазолидиновый цикл, содержавший свободную группу NH в 3-положении, являлся важным для цитотоксичности. После замещения "В" циклического тиазолидинового фрагмента на тиазолиновый цикл, антипролиферативная активность резко возросла от 0,6 мкМ до более 50 мкМ в клеточных линиях WM-164 (Li et al., "Synthesis and Antiproliferative Activity of Thiazolidine Analogs for Melanoma," Bioorg. Med. Chem. Lett. 17:4113-7 (2007), которая полностью включена в данную заявку путем ссылки). Производное АТСАА-1 жирного амиды было наиболее эффективным по отношению к клеточным линиям меланомы и рака простаты и было исследовано и показано, что оно имело значение IC50 0,4-2,2 мкМ (см. Таблицу 2). Замещение длинной жирной цепи на определенный ароматический объемный заместитель, такой как флуорен (АТСАА-2), проявлял ингибиторную активность на обе раковые клеточные линии (IC50=1,6-3,9 мкМ). Флуореновая группа в 4-карбоксилатном амидном положении также была замещена 3,4,5-триметоксилфенильной группой (2а и 2b), но эффективность по отношению к обеим раковым линиям была утеряна. Последующая модификация "В" цикла от насыщенного тиазолидинового соединения 2а в незамещенный тиазол 5 не проявила какой-либо цитотоксичности по отношению к какой-либо исследуемой раковой линии. Но тиазолиновые энантиомеры 4а и 4b (R-изомер и S-изомер, с аналогичными антипролиферативными активностями) показали повышенную активность (IC50=3,4-38,3 мкМ) по сравнению с 2а, 2b и 5. При замещении амидной CONH связи между "В" циклом и "С" циклом на карбонильный линкер, были получены смеси тиазолин/тиазольного кетона 8f вместо целевого тиазолинового кетона, поскольку происходила ауто-дегидрогенизация между тиазолином и тиазолом (превращение показано на Фигуре 2). Неожиданно, введение карбонильной линкерной группы и тиазольного "В" цикла привело к значительному повышению ингибирования роста исследуемых раковых клеточных линий с низким наномолярным уровнем (8f, IC50=0,021-0,071 мкМ), то есть сравнимо с природным противораковым агентом колхицином. Затем был разработан и синтезирован ряд родственных соединений с "В" в качестве тиазольного цикла, исходя из изобретения 8f. Также была оценена их противораковая активность по отношению к меланоме и раку простаты.
Модификации "С" цикла также имела значительный эффект. Вариация фенильных заместителей вызывала значительное изменение влияния на эффективность. Результаты анализа in vitro показаны в Таблице 3 и обеспечивают интересные результаты, но только 3,4,5-триметоксилфенил "С" цикл (8f) проявлял превосходное ингибирование по отношению ко всем раковым клеткам (IC50=21-71 нМ, среднее IC50=41 нМ). Соединение 8g, с 3,5-диметоксифенильной группой, проявило в 6 раз меньшую среднюю цитотоксичность по сравнению с 8f по отношению к шести различным клеточным линиям (IC50=170-424 нМ, рассч. Среднее IC50=261 нМ). Модификации 8f путем удаления одной метоксигруппы в мета-положении (8е) или двух метоксигрупп (8b, 8с и 8d) от 8f привело к резкому уменьшению активности (IC50>20 мкМ). Хотя орто-замещенное монометоксисоединение 8d проявляло слабую активность по отношению к определенным клеточным линиям по сравнению с мета-/пара-МеО замещенный 8с/8b и диметоксифенильное соединение 8е, никто из них не проявлял значительную активность при ингибировании по сравнению с 8f. Аналогичные тенденции также были также показаны 8h и 8j с 2-фторфенилом и гексадецилом в модификациях "С" цикла.
Модификации "А" цикла с использованием различных пара-замещенных электроноакцепторных групп (ЭАГ) и электронодонорных групп (ЭДГ) не проявляли четкого влияния на антипролиферативную активность. Введение слабых ЭАГ (4-F в 8n, IC50 значения: 6-43 нМ) или слабых ЭДГ (4-СН3 в 8k, IC50s: 5-21 нМ), усиливало эффективность по сравнению с 8f (cм. Таблицу 4). Замещение пара-положения на сильный ЭАГ, такой как NO2 (8р), CN (8q), CF3 (8t), или введение сильного ЭДГ (3, 4-диметокси) в "А" фенильный цикл (8о) проявляло сравнимую антипролиферативную активность.
Для сравнения эффектов орто-, мета- и пара-замещений, атом фтора вводили в различные положения "А" фенильного цикла (8l, 8m, и 8n). Различные о-, м-, п-заместители не проявляли одинаковой активности. n-Фтор замещенный 8n имел наибольшую активность для исследуемых клеток рака простаты (6-13 нМ), в то время как о-фтор замещенный 8l показывал наиболее низкие значения IC50 (27-30 нМ) в отношении клеток меланомы. 8n имело аналогичные средние значения IC50 (33-43 нМ) по отношению к меланоме по сравнению с 8l. Но о-фтор, замещенное 8l, имело наименьшую эффективность (IC50 значения: 52-114 нМ) среди трех замещенных соединений на клетки рака простаты. Мета-замещенное соединение 8m показало наиболее низкую активность в отношении клеток меланомы (IC50 значения: 287-304 нМ), но проявило умеренное ингибирование клеток рака простаты (IC50 значения: 23-46 нМ).
Обращаясь к эффектам стерически замещенной группы на заместители "А" фенильного цикла, было найдено, что n-бром (8u, IC50 значения: 18-44 нМ) вызывал антипролиферативную активность по сравнению с n-фтор положением (8n, IC50 значения: 6-12 нМ), но только в отношении клеток рака простаты. Пониженная активность в отношении обеих раковых клеточных линий имела место, если n-метил (8k, IC50 значения: 5-21 нМ) был замещен n-этильной группой (8v, IC50 значения: 17-70 нМ).
Для исследования того, играет ли фенильный цикл существенную роль на участке "А" цикла, фенил в 2-тиазольном положении бы удален и было получено соединение 10. Данная модификация привела к общей потере активности по сравнению с 8f. Замещение "А" цикла пиридином (соединение 8х) имело такой же эффект. Более того, замещение 2-пиримидина в "А" цикле (соединение 8y) также приводило к значительной потере активности (IC50s: 11,8-41,0 мкМ). Однако введение тиофенового замещения фенила (8z) в "А" положение улучшало расчетную эффективность в 1-3 раза во всех исследуемых клеточных линиях (IC50s: 9-38 nМ) по сравнению с 8f (IC50: 21-71 нМ).
Поскольку многие из соединений показывают плохую растворимость в воде, три водорастворимые соли получали после введения гидрофильной группы, такой как NH2 (8w) и СООН (8r), в "А" цикл с образованием HCl или натриевой соли. Другой модификацией является замещение "А"/"С" циклов в 8а на пиридиновые (8i, 8х, 8y) или пиримидиновые циклы, которые также могут быть превращены в HCl соли. Такие модификации уменьшали рассчитанные LogP значения (LogP=2,74 - 3,90) по сравнению с 8а и 8f (LogP=4,46 и 4,08; см. Таблица 5). Введение n-амино в "А" фенил (8w) является единственным случаем повышения антипролиферативной активности (HCl соль, IC50 значения: 11-29 нМ) по сравнению с 8f в отношении всех клеточных линий. Хотя замещение фенила на пиримидин (8y) сохраняло частичную активность в отношении обеих клеточных линий, диапазон эффективности был значительно снижен от нМ до мкМ по сравнению с 8f. К сожалению, введение СООН в пара-фенильный "А" цикл и пиридина в "А" или "С" циклы (8i, 8r, 8х) приводило к полной потере противораковой активности. Полная потеря эффективности наблюдалась в метиловом эфире 8s кислоты 8r в отношении обеих раковых линий. Деметилирование соединения 8f приводило к получению водорастворимого 3,4,5-тригидроксифенила в "С" циклическом соединении 11f, но такое демитилирование привело к полной потере антипролиферативной активности по отношению ко всем проанализированным раковым клеткам, что также подчеркивает важность 3,4,5-триметоксифенила в "С" положении метанонов.
Получив данные результаты, соединение 8f также подвергали анализу in vitro в NCI-60 скрининге, где измеряли способность соединения действовать на шесть клеточных линий лейкемии, восемь клеточных линий немелкоклеточного рака легких, шесть клеточных линий рака толстой кишки, шести клеточных линий рака ЦНС (например, глиома/глиобластома), восемь клеточных линий меланомы, шесть клеточных линий рака яичников, семь клеточных линий рака почек, две клеточные линии рака простаты и восемь клеточных линий рака молочной железы. Результаты анализа NCI-60 показали широкую активность в отношении всех данных типов рака, где GI50 значения находились в наномолярном диапазоне (<1,0×10-8) в отношении большинства клеточных линий, a TGI значения находились в микромолярном диапазоне в отношении большинства клеточных линий. TGI значения в наномолярном диапазоне были получены в отношении нескольких клеточных линий лейкемии, одной клеточной линии рака легких, нескольких клеточных линий рака толстой кишки, нескольких клеточных линий рака яичников и нескольких клеточных линий рака молочной железы.
|
|
|
Пример 5 - Синтез и цитотоксичность in vitro дополнительных метаноновых соединений
Индольные соединения 31 и 32 с А циклом синтезировали, используя тот же самый подход, что и 8f, описанный на Схеме 3 выше, из 1H-индол-5-карбонитрила или 1H-индол-2-карбонитрила в качестве исходного вещества. Неочищенный продукт очищали при помощи колоночной хроматографии.
(2-(1Н-индол-5-ил)тиазол-4-ил) (3,4,5-триметоксифенил)метанон (соединение 31): Выход: 36,3%, 1H ЯМР (300 МГц, CDCl3) δ 8,36 (br, 1H), 8,31 (br, 1H), 8,21 (s, 1H). 7,92-7,89 (dd, 1H), 7,83 (s, 2H), 7,47 (d, 1H), 7,29 (t, 1H), 6,64 (t, br, 1H), 3,98 (s, 3 H), 3,97 (m, 6 H), MC (ESI) m/z 417,1 [M+Na]+. 392,9 [M-H]-.
(2-(1Н-индол-2-ил)тиазол-4-ил)(3,4,5-триметоксифенил)метанон
(соединение 32): Выход: 45,8%. 1H ЯМР (500 МГц, CDCl3) δ 9,26 (br, 1H), 8,11 (s, 1H), 7,67 (d, 2H), 7,46 (s, 2H), 7,42 (d, 1H), 7,29 (t, 1H), 7,16 (t, 1H), 7,10 (s, 1H), 3,97 (s, 3 H), 3,93 (m, 6 H), MC (ESI) m/z 417,1 [M+Na]+. 392,9 [M-H]-.
Активность соединения 31 оценивали при помощи анализа на цитотоксичность in vitro, как описано в Примере 4 выше. Было определено, что соединение 31 проявляло повышенную активность по отношению к PC-3, A375 и В16 клеточным линиям.
|
Пример 6 - Определение механизма действия для соединения 8f
Для понимания мишени для таких высокоэффективных соединений был выполнен анализ клеточного цикла с использованием соединения 8f. Клетки рака простаты LNCaP были очень чувствительны к соединению 8f (IC50=29 нМ). Клетки LNCaP обрабатывали соединением 8f (10 - 500 мМ) в течение 24 часов перед окрашиванием пропидий йодидом и выполнения анализа клеточного цикла. Хотя соединение 8f не влияло на распределение клеточного цикла при 10 нМ (ниже IC50), доля клеток в G2/M фазе возросла пропорционально концентрации соединения 8f при более высоких концентрациях. Приблизительно 10% необработанных клеток наблюдали в G2/M фазе, в то время как клетки, обработанные более чем 50 нМ, показывали большую долю клеток в G2/M фазе (57, 63 и 49% соответственно для 50, 200 и 500 нМ). Данные результаты приведены на Фигурах 3А-В. Увеличение G2/M фазовых клеток сопровождалось уменьшением популяций G1, по сравнению с контролем. Эти данные указывают на то, что соединение 8f может ингибировать действие тубулина образом, аналогичным паклитакселу, алкалоидам винка и кохицину (Margolis et al., "Addition of Colchicine-Tubulin Complex to Microtubule Ends: The Mechanism of Substoichiometric Colchicine Poisoning," Proc. Nat'l Acad. Sci. USA 74:3466-70 (1977), которая полностью включена в данную заявку путем ссылки).
Исходя из данных результатов, был выполнен анализ полимеризации микроканальцев in vitro. Тубулин бычьего мозга (0,4 мг) (Cytoskeleton, Denver, СО) смешивали с различными концентрациями (0,625-20 мкМ) соединения 8f и инкубировали в 120 мкл общего тубулинового буфера (80 мМ PIPES, 2,0 мМ MgClz, 0,5 мМ этиленгликольтетрауксусной кислоты, рН 6,9 и 1 мМ GTP). Поглощение при длине волны 340 нм контролировали каждые 60 секунд в течение 20 минут при помощи микропланшетного ридера SYNERGY 4 (Bio-Tek Instruments, Winooski, VT). Спектрофотометр устанавливали при 37°C для полимеризации тубулина. Значение IC50 определяли как концентрацию, которая может ингибировать 50% полимеризации микроканальцев. Результаты приведены на Фигуре 4. По сравнению с необработанным контролем, соединение 8f ингибирует полимеризацию тубулина. Влияние 8f на тубулиновую сборку исследовали при концентрациях от 0,625 мкМ до 20 мкМ. Наблюдаемые результаты демонстрируют, что соединение 8f ингибировало полимеризацию тубулина в зависимости от дозы при значении IC50 4,23 мкМ.
Пример 7 - Цитотоксичность In vitro соединений 8f и 8n в отношении клеточной линии меланомы А375
Человеческие клетки злокачественной меланомы А375 высевали на планшеты при колониеобразующей плотности (200 клеток на лунку в планшетах на шесть лунок). Клетки выращивали в модифицированной по способу Дульбекко среде Игла (GIBCO, Invitrogen Corp., Carlsbad, CA) с добавлением эмбриональной бычьей сыворотки на полосках древесного угля (HyClone, Logan, UT) и раствора антибиотика-антимикотика (Sigma, St. Louis, МО) при 37°С в атмосфере 95% воздуха и 5% CO2. Клетки обрабатывали соединениями 8f и 8n при различных концентрациях (0, 0,03, 0,3 и 3 мкМ). Клетки выращивали в течение 10 дней и колонии фиксировали 4% параформальдегидом в ПБС при 4°С. Зафиксированные колонии промывали дистиллированной водой, окрашивали 0,1% кристаллическим голубым в течение 30 минут и промывали дистиллированной водой для удаления избытка красителя. Планшеты фотографировали и образование колоний исследовали на глаз и под микроскопом. Оба соединения 8f и 8n значительно ингибировали образование колоний меланомы при 0,03 мкМ. При двух проанализированных более высоких концентрациях (0,3 и 3 мкМ) образование колоний было полностью ингибировано, при отсутствии колоний, видимых под микроскопом (Фигуры 5А-В).
Пример 8 - Цитотоксичность In vivo соединения 8n в отношении ксенотрансплантатных опухолей меланомы
Эффективность соединения 8n оценивали при помощи мышиных меланомных клеток B16-F1, которые вводили путем инъекций черным мышам С57. Опухоли В16 будут расти в полностью иммунокомпенентном хозяине, в таком случае прогрессия опухолей может более точно реплицировать рост меланомы. Логарифмическую фазу роста B16-F1 (3,8х105) клеток вводили путем инъекций подкожно в правый задний бок мышей C57BL/6. Если опухоли могли быть пальпированы, то мышей рандомизировали в контрольную и лечебную группу (n=9). Мышам давали дозировки путем ежедневных интраперитонеальных инъекций 30 мкл основы (контрольная группа) или 8n раствора (лечебная группа, 6 мг/кг). Объем опухолей измеряли один раз в день при помощи электронного цифрового калибра Traceable® и рассчитывали при помощи формулы a×b2×0,5 где a и b представляют больший и меньший диаметры соответственно. Также регистрировали массы тела. Объем опухоли выражали в кубических миллиметрах. Данные выражали как среднее±среднеквардатичное отклонение для каждой группы и наносили на график как функцию времени. В конце лечения, всех мышей подвергали эвтаназии путем вдыхания СО2 с последующим смещением шейных позвонков. Соединение 8n показало значительное ингибирование роста опухолей при такой относительной низкой дозе (6 мг/кг), как показано на Фигуре 6. Отсутствовала значительная потеря массы тела (<5%), и все мыши имели нормальную активность в течение экспериментов.
Пример 9 - Синтез производных соединения 8f с гидразином или оксимом
Карбонильные линкерные группы модифицировали в оксимные и гидразиновые линкеры (соединения 33-36), как проиллюстрировано на Схеме 4. Соединение 8f использовали в качестве исходного материала.
Схема 4
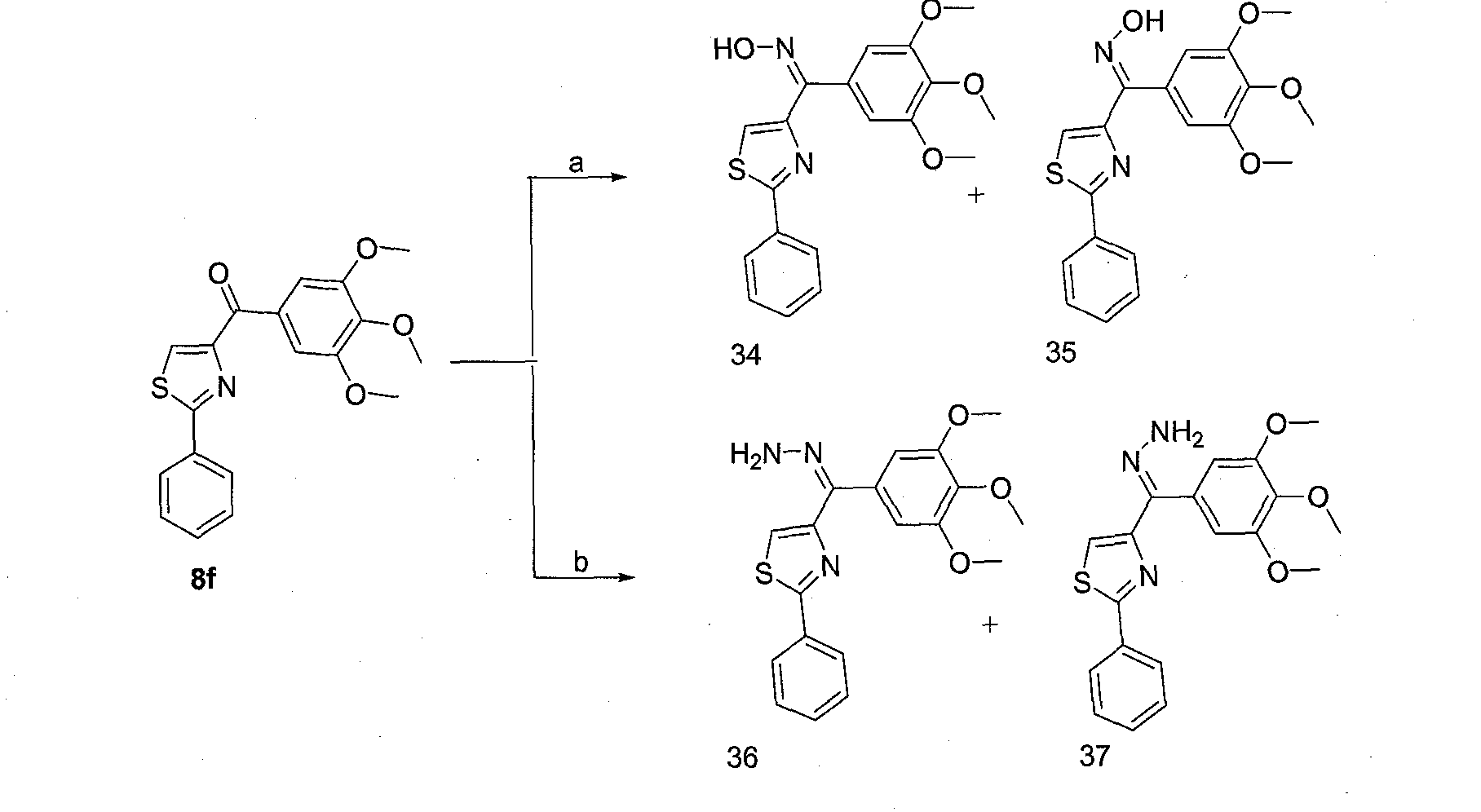
Реагенты (a) HN2O . HCl, C2H5OH, H2O, NaOH, 51%; (b) NH2NH2 xH2O, CH2Cl2, C2H5OH, 57%.
К суспензии 50 мг 8f в 2 мл этилового спирта добавляли 0,5 мл водного раствора 34 мг гидроксиламина гидрохлорида. Затем добавляли 13 мг гидроксида натрия в 0,5 мл Н2О и перемешивали при комнатной температуре в течение 10 мин. Затем нагревали до 60°С и перемешивали в течение 3 ч. Оксимные изомеры 33 и отделяли от реакционной смеси при помощи флеш-хроматографа в виде белых кристаллов с общим выходом 50%.
(Z)-(2-фенилтиазол-4-ил)(3,4,5-триметоксифенил)метанон оксим (соединение 33): Т.пл. 150-153°С. 1H ЯМР (300 МГц, CDCl3) δ 11,94 (br, 1H), 8,35 (br, 1H), 7,91-7,89 (m, 2H), 7,81-7,75 (d, 1H), 7,50-7,49 (m, 3H), 6,85 (s, 2H), 3,73 (s, 6 H), 3,71 (s, 3 H), MC (ESI) m/z 393,3 [M+Na]+, 368,9 [M-H]-.
(Е)-(2-фениллиазол-4-ш}(3,4,5-триметоксифенш)метаноп оксим (соединение 34): Т.пл. 176-177°С. 1H ЯМР (500 МГц, DMSO-d6) δ 11,48 (br, 1H), 7,92-7,90 (m, 2H), 7,64 (br, 1H), 7,52-7,48 (d, 1H), 7,52-7,48 (m, 3H), 6,75 (s, 2H), 3,75 (s, 6 H), 3,72 (s, 3 H), MC (ESI) m/z 393,1 [M+Na]+, 368,9 [M-H]-.
К раствору 2 мл гидразин в 6 мл этилового спирта добавляли раствор 230 мг 8fa 2 мл метиленхлорида. Смеси перегоняли с обратным холодильником всю ночь и адсорбировали на силикагеле. Изомеры гидразона 35 and 36 отделяли из флеш-хроматографа в виде белых кристаллов с общим выходом 56,9%.
(Z)-4-(гидразоно(3,4,5-триметоксифенил)метил)-2-фвнилтиазол (соединение 35): Т.пл. 117-119°С. 1H ЯМР (300 МГц, CDCl3) δ 8,01-7,98 (m, 2H), 7,49-7,46 (m, 5H), 7,33 (s, 1H), 6,82 (s, 2H), 3,87 (s, 3 H), 3,85 (s, 6 H), МС (ESI) m/z 370,1 [M+H]+.
(Е)-4-(гидразоно(3,4,5-триметоксифенил)метил)-2-фенштиазол
(соединение 36): Т.пл. 65-66°С. 1H ЯМР (300 МГц, CDCl3) δ 8,04-8,00 (m, 2H), 7,44-7,40 (m, ЗН), 6,95 (s, 1H), 6,62 (s, 2H), 5,62 (s, 2H), 3,93 (s, 3 H), 3,87 (s, 6 H), МС (ESI) m/z 370,1 [M+H]+.
|
Пример 10 - Разработка дополнительных производных
Соединение 8f будет дополнительно модифицировано в аналоги тиокетона 41 и 42 (Схема 5 ниже). Соединения 8a-z будут модифицированы аналогичным образом. Карбонильная группа может быть превращена в тиокарбонильную группу путем действия реагента Лоуссона (Jesberger et al., Synthesis 1929-1958 (2003), которая полностью включена в данную заявку путем ссылки). Тиокетоновая структура с конъюгированными ароматическими циклами является стабильной по сравнению с незатрудненными тиокетонами. Тиазольное соединение может быть получено после дегидрогенизации (Riedrich et al., Angewandte Chemie, International Edition, 46(15): 2701-2703 (2007), которая полностью включена в данную заявку путем ссылки). Такое превращение уменьшит акцепторную способность водородной связи от O-Н в кетоне до S--Н в тионе. Будет полезным исследование важности положения водородного акцептора в этих молекулах.
Схема 5
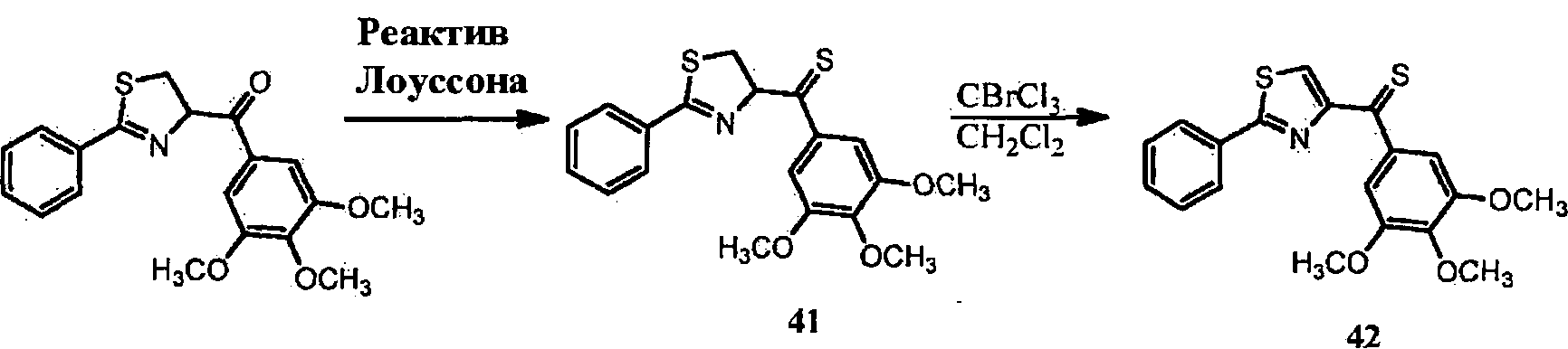
Будут синтезированы новые аналоги, в которых карбонил был восстановлен до спирта (43 и 44, Схема 6А ниже) или восстановлен до метилена (45 и 46, Схема 6В ниже). Спирт 43 и 44 может быть получен путем использования реакции Гриньяра промежуточного альдегида с соответствующими реактивами Гриньяра. Аналоги 45 и 46 могут быть получены путем восстановления по Клемменсену кетонной функциональной группы с получением соответствующего углеводорода. Если карбонил восстанавливают в спирт или метилен, то сильный акцептор водорода С=O превращается в сильный донор водорода O-Н или углеводород, который полностью теряет влияния водородных связей. Такая модификация обеспечит понимание важности карбонильной группы и того, имеет ли она конкретную функцию в противораковой активности.
Схема 6А
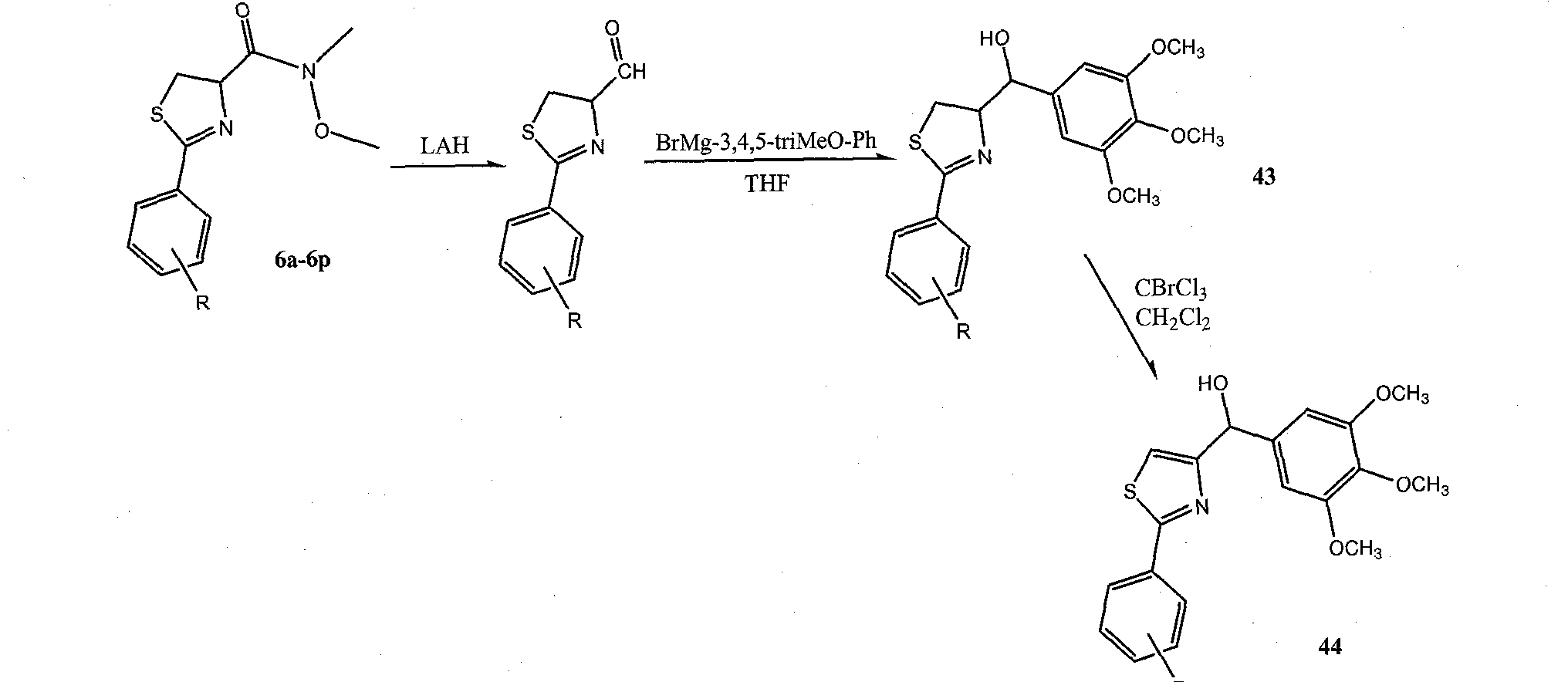
Схема 6В
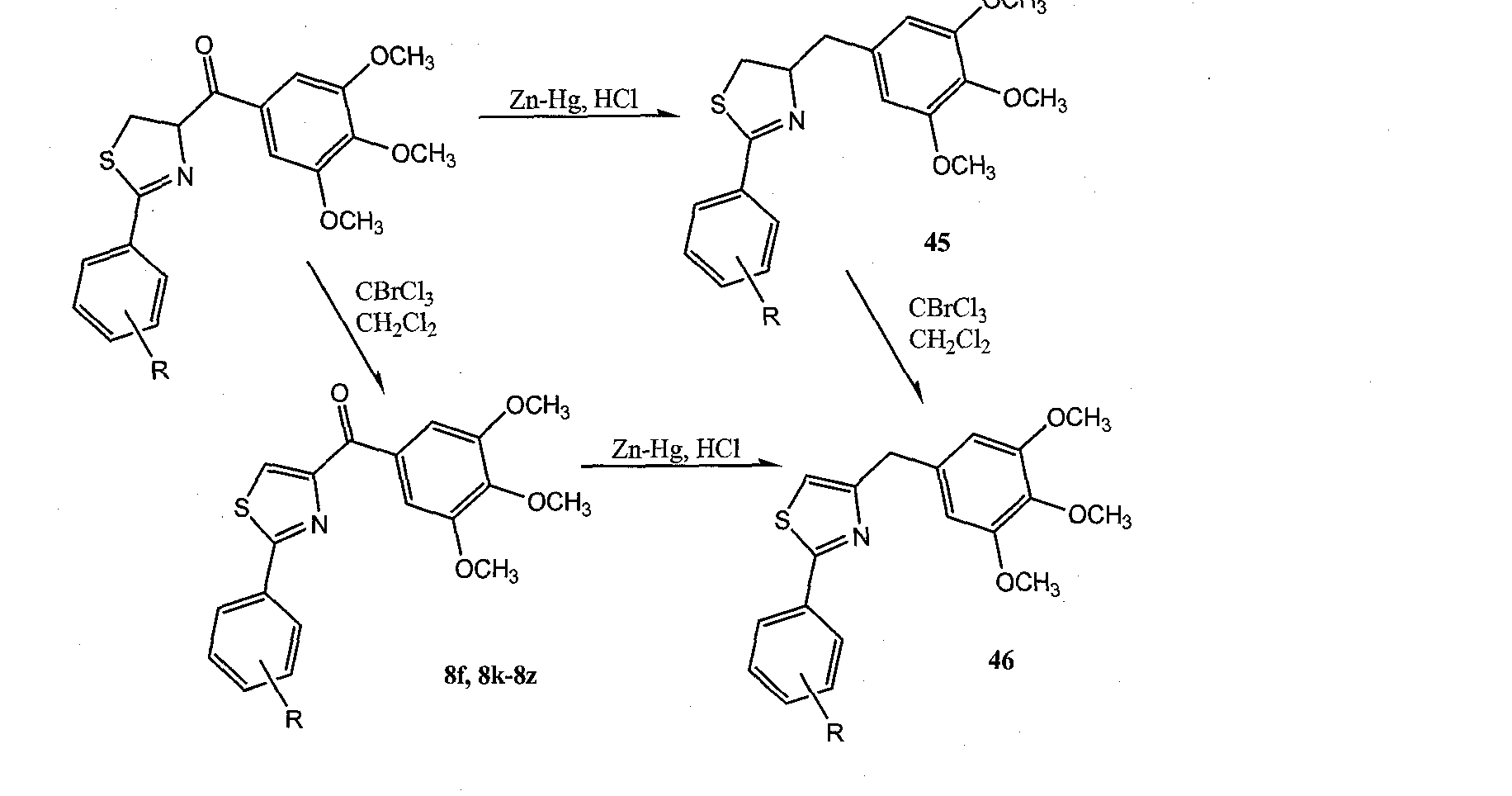
Для исследования важности кетона при антипролиферации раковых клеток, данный линкер будет превращен в амидные и сложноэфирные аналоги (47-50, Схема 7 ниже). При нахождении активности в любой из таких серий аналогов, различные связи между циклами оптимизируют для повышения активности и метаболической стабильности. Как показано на Схеме 7, в соответствии с результатами, продемонстрированными в предшествующих примерах, тиазолиновые и тиазольные циклы будут получены по реакции бензонитрила (включая замещенный бензонитрил) и цистеин (Bergeron et al., J. Med. Chem. 48:821-831 (2005), которая полностью включена в данную заявку путем ссылки). Полученные в результате кислотные промежуточные соединения будут использовать для получения сложноэфирных и амидных связей. Такие аналоги сравнивают на предмет антипролиферативной активности в отношении клеток рака простаты и/или клеток меланомы и контрольных клеток и сравнивают с соединениями 8f и 8n.
Схема 7
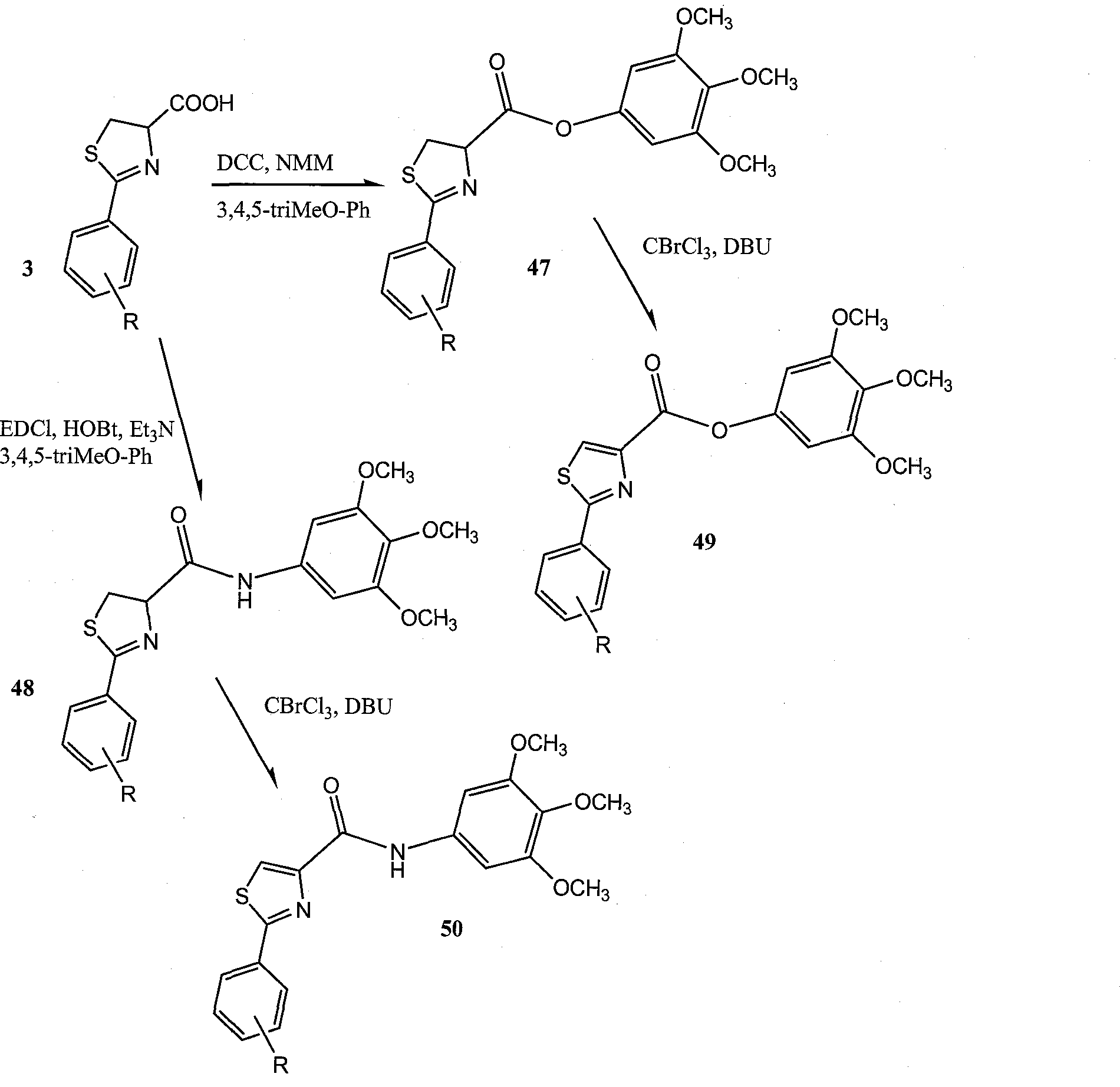
Соединения будут также получены с триметоксилфенильной группой с различными замещенными ароматическими циклами, насыщенные или ненасыщенные алкилы и различные гетероциклические группы являются такими, как определено в данной заявке. Это может быть выполнено при помощи различных реактивов Гриньяра. Такие аналоги будут подвержены оптимизации "С" цикла с наилучшей активностью, наиболее низкой токсичностью, и наилучшей метаболической стабильностью в отношении рака простаты, меланомы и других видов рака.
Также будет выполнено замещение центральных тиазолиновых и тиазольных циклов на соответствующие имидазолиновые (51), имидазольные (52), оксазолиновые (53) и оксазольные (54) циклические системы. Этилбензимидатные гидрохлоридные соли реагировали с 2,3-диаминопропаноевой кислотой с получением имидазолиновой циклической системы (см. Схема 8А ниже) (Hsu et al., J. Med. Chem. 23(11), 1232-1235 (1980), которая полностью включена в данную заявку путем ссылки). Дегидрогенизация имидазолинов приведет к получению целевых имидазольных соединений. Оксазолины могут быть получены в соответствии с классической конденсацией фенилиминового эфира с сериновым эфиром с использованием триэтиламина в качестве основания (см. Схема 8В ниже) (Меуег et al., Tetrahedron: Asymmetry 14:2229-2238 (2003), которая полностью включена в данную заявку путем ссылки). Дегидрогенизация оксазолинов приведет к получению целевых оксазольных соединений.
Схема 8А
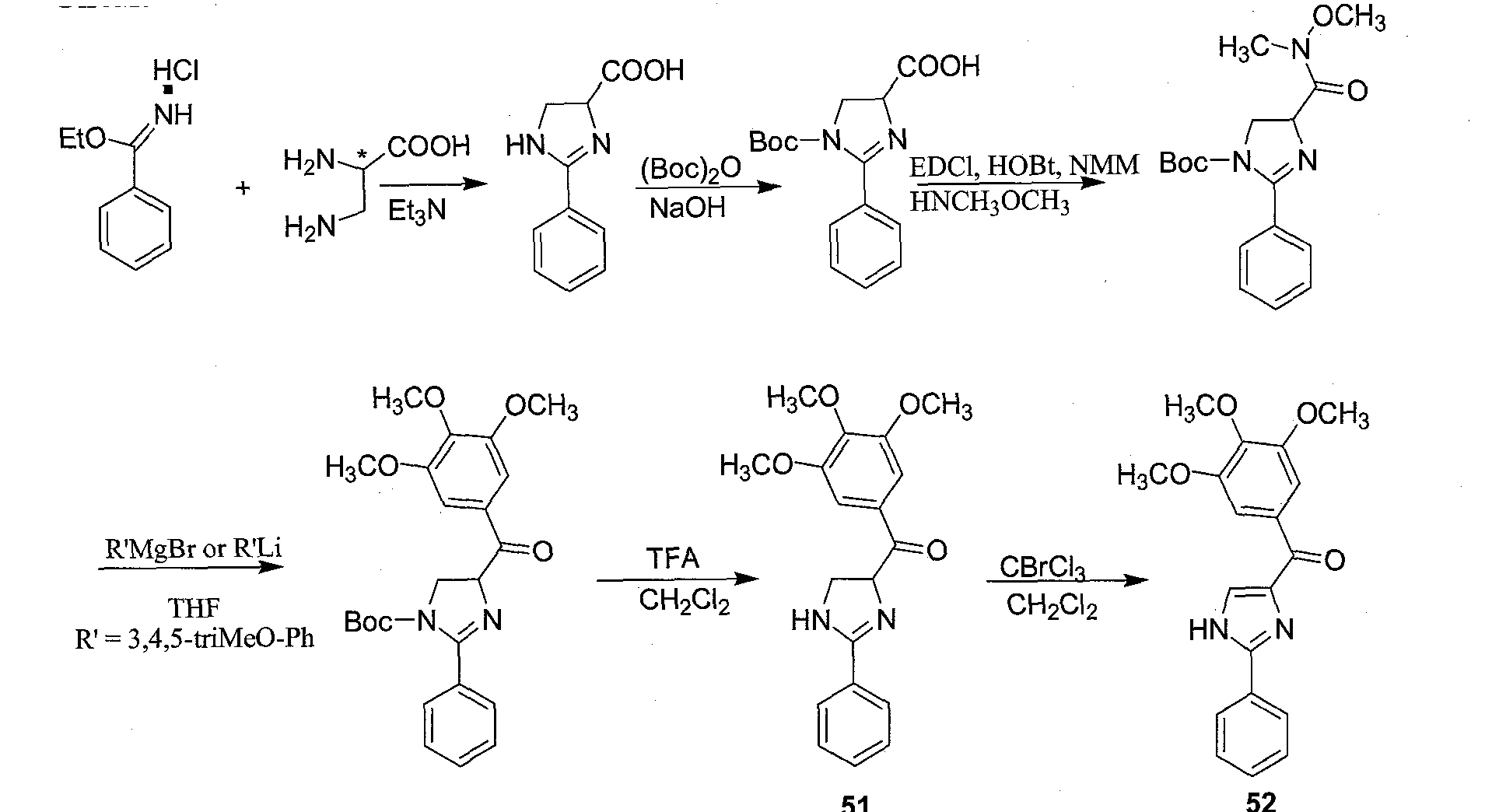
Схема 8В

Оптически чистые изомеры соединений 8a-8z будут также получены для исследования важности хиральности в 4-положении тиазолина. Это будет проведено с использованием D- или L-цистеина для синтеза хиральных промежуточных кетонов из защищенного D- или L-цистеина. Конденсация промежуточных кетонов с бензонитрилом приведет к получению R- или S-тиазолиновых изомеров. Тиазолы могут быть получены путем дегидрогенизации.
Из предыдущих исследований структурной взаимосвязи амидов тиазолидин карбоновой кислоты, обратные электронные эффекты заместителей фенила в С-2 положении тиазолидинового цикла приведут к значительно различной активности в отношении клеточных линий рака простаты. Производные с различными замещениями ароматического цикла из различных замещенных бензонитрильных реагентов также будут получены (например, 4-диметиламино-бензонитрил, 3-гидроксибензонитрил, 4-метоксибензонитрил, 3,4-диметоксибензонитрил, 3,4,5-триметоксибензонитрил, 4-ацетамидобензонитрил, 4-фторбензонитрил, 4-бромбензонитрил, 4-нитробензонитрил, 4-цианобензонитрил, 3,5-дифторбензонитрил, 4-метилбензонитрил, 3 -бром-4-фторбензонитрил, 2,6-дихлоробензонитрил, фенилбензонитрил, индоленитрил и замещенные индолилнитрилы, пиридин-нитрил и замещенные пиридинилнитрилы, фуран-нитрил и замещенные фуранилнитрилы) для индуцирования как электронодонорных, так и электроноакцепторных заместителей в циклических заместителях в С-2 положении в тиазолиновом цикле. Считают, что наилучшие заместители С-2 фенильной, индолильной, фуранильной, тиофенильной и пиридинильной групп могут быть найдены после скрининга полученных в результате аналогов.
Все отличительные признаки, описанные в данной заявке (включая любые пункты формулы, реферат и фигуры, которые прилагаются), и/или все стадии любого способа или процесса, описанного таким образом, могут быть скомбинированы с любым из приведенных выше аспектов в любом сочетании, за исключением комбинаций, где как минимум некоторые из таких отличительных признаков и/или стадий являются взаимоисключающими. Хотя преимущественные варианты исполнения были подробно обозначены и описаны в данной заявке, специалистам в релевантной области будет очевидно, что различные модификации, добавления, замещения и Т.пл. могут быть выполнены, не выходя за суть данного изобретения, и поэтому их рассматривают как такие, что входят в объем данного изобретения, как определено в формуле, приведенной ниже.