Результат интеллектуальной деятельности: НОВЫЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ ДЛЯ НАЦЕЛИВАНИЯ НА ЗЛОКАЧЕСТВЕННЫЕ СТВОЛОВЫЕ КЛЕТКИ
Вид РИД
Изобретение
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной заявки США № 61/315886, поданной 19 марта 2010 г.; предварительной заявки США № 61/315890, поданной 19 марта 2010 г., и предварительной заявки США № 61/325814, поданной 19 апреля 2010 г. Полное содержание каждой из этих заявок таким образом приведено в качестве ссылки.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение относится к нафтофурановым соединениям, полиморфам нафтофурановых соединений, нафтофурановым соединениям в форме частиц, очищенным композициям, содержащим одно или несколько нафтофурановых соединений, очищенным композициям, содержащим одно или несколько нафтофурановых соединений в форме частиц, способам получения этих нафтофурановых соединений, полиморфов, очищенных композиций и/или форм частиц и способам использования этих нафтофурановых соединений, полиморфов, очищенных композиций и/или форм частиц для лечения нуждающихся в этом субъектов.
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
Смертельные исходы вследствие злокачественных опухолей только в Соединенных Штатах насчитывают сотни тысяч ежегодно. Несмотря на успехи в лечении конкретных форм злокачественных опухолей посредством хирургии, лучевой терапии и химиотерапии, множество типов злокачественных опухолей являются по существу неизлечимыми. Даже когда эффективное лечение доступно для конкретной злокачественной опухоли, побочные эффекты такого лечения могут являться тяжелыми и приводить к значительному ухудшению качества жизни.
Большинство общепринятых химиотерапевтических средств обладают токсичностью и ограниченной эффективностью, в частности для пациентов с солидными опухолями на поздних стадиях. Химиотерапевтические средства вызывают разрушение незлокачественных клеток, так же как злокачественных клеток. Терапевтический индекс таких соединений (мера способности лечения к различению злокачественных и нормальных клеток) может являться довольно низким. Часто доза химиотерапевтического лекарственного средства, которая является эффективной для уничтожения злокачественных клеток, может уничтожать также нормальные клетки, особенно те нормальные клетки (такие как эпителиальные клетки), которые подвергаются частому делению клеток. Когда терапия действует на нормальные клетки, могут возникать такие побочные эффекты как выпадение волос, подавление гематопоэза и тошнота. В зависимости от общего состояния здоровья пациента такие побочные эффекты могут делать невозможным введение химиотерапии или по меньшей мере являться чрезвычайно неприятными и неудобными для пациента и серьезно снижать качество жизни пациентов со злокачественными опухолями. Даже для пациентов со злокачественными опухолями, отвечающих на химиотерапию с регрессией опухоли, такой ответ опухоли часто не сопровождается продлением выживаемости без прогрессирования (PFS) или продлением общей выживаемости (OS). Фактически злокачественная опухоль часто быстро прогрессирует и образует больше метастазов после исходного ответа на химиотерапию. Такие рецидивирующие злокачественные опухоли становятся высоко устойчивыми или невосприимчивыми к химиотерапевтическим средствам. Считают, что такие быстрые рецидивы и невосприимчивость после химиотерапии вызваны злокачественными стволовыми клетками.
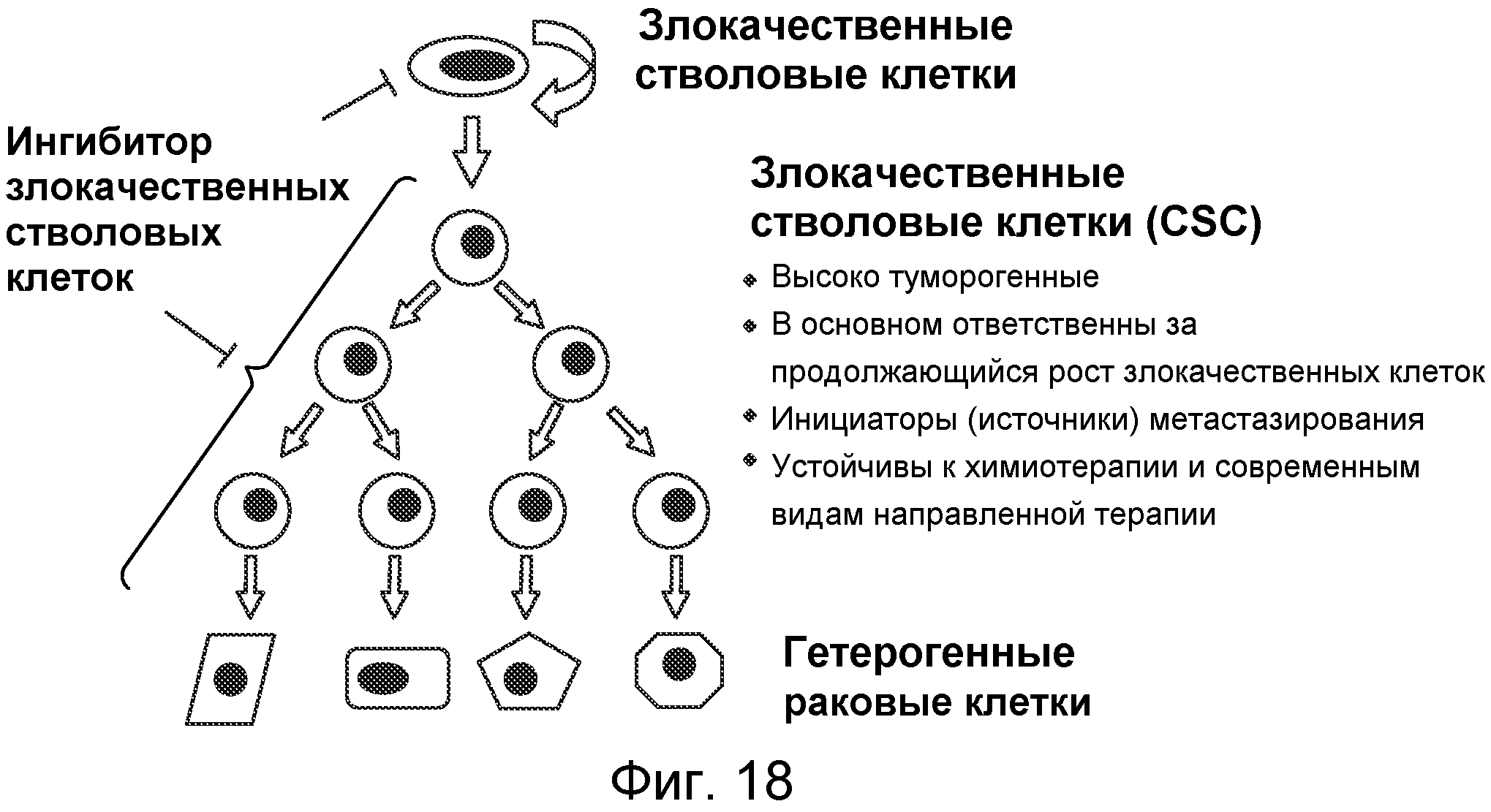
В недавних исследованиях обнаружили присутствие злокачественных стволовых клеток (CSC, называемых также инициирующими опухоли клетками или злокачественными стволоподобными клетками), которые обладают способностью к самообновлению и, как считают, в основном ответственны за рост, рецидивы и метастазирование злокачественных опухолей. Важно, что CSC по своей природе устойчивы к общепринятым лекарственным средствам. Таким образом, направленное средство с активностью против злокачественных стволовых клеток является многообещающим для пациентов со злокачественными опухолями (J. Clin. Oncol. 2008 Jun. 10; 26(17)). Таким образом, общепринятые химиотерапевтические средства могут уничтожать основную массу злокачественных клеток, но не затрагивают злокачественные стволовые клетки. Злокачественные стволовые клетки могут расти быстрее после уменьшения количества нестволовых, обычных злокачественных клеток посредством химиотерапии, что считают механизмом быстрого рецидивирования после химиотерапевтических средств.
STAT3 представляет собой онкоген, активируемый в ответ на цитокины и/или факторы роста для стимуляции пролиферации, выживаемости и других биологических процессов. STAT3 активируется фосфорилированием критического остатка тирозина, опосредованного рецепторными тирозинкиназами факторов роста, Янус-киназами или киназами семейства Src. После фосфорилирования тирозина, STAT3 образует гомодимеры и перемещается в ядро, связывается со специфическими отвечающими элементами ДНК в промоторах генов-мишеней и индуцирует экспрессию гена. STAT3 активирует гены, вовлеченные в образование, инвазию и метастазирование опухолей, включая Bcl-xl, Akt, c-Myc, циклин D1, VEGF и сурвивин. STAT3 обладает измененной активностью в широком множестве злокачественных опухолей человека, включая все основные карциномы, так же как некоторые гематологические опухоли. Постоянно активный STAT3 образуется более чем в половине видов рака груди и легких, колоректального рака, рака яичников, печеночно-клеточной карциномы и множественной миеломы и т.д.; и более чем в 95% видов рака головы/шеи. STAT3 считают одним из главных механизмов устойчивости злокачественных клеток к лекарственному средству. Однако доказано, что STAT3 является сложной мишенью для обнаружения фармацевтического ингибитора. До настоящего времени не идентифицировано прямого ингибитора STAT3 с клинически приемлемой активностью после десятилетий усилий в этой области.
Соответственно, существует необходимость обнаружения соединений и фармацевтических композиций для избирательного нацеливания на злокачественные клетки, для нацеливания на злокачественные стволовые клетки и для ингибирования STAT3, и в способах получения этих соединений и фармацевтических композиций для клинических применений.
Процитированные в настоящем документе ссылки не признаны известным уровнем техники для заявляемого изобретения.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Изобретение относится к нафтофурановым соединениям, полиморфам нафтофурановых соединений, очищенным композициям, содержащим одно или несколько нафтофурановых соединений, и нафтофурановым соединениям в форме частиц. Эти нафтофурановые соединения (включая нафтофурановые соединения в форме частиц), полиморфы и очищенные композиции являются избирательными ингибиторами злокачественных стволовых клеток и STAT3. В \l "H0 2009/036099 и \l "H1 2009/036101 описано, что нафтофурановые соединения нацелены на злокачественные стволовые клетки. Они также ингибируют нестволовые злокачественные клетки посредством ингибирования STAT3. Эти соединения способны уничтожать множество различных типов злокачественных клеток, не вызывая разрушения нормальных клеток в конкретных условиях воздействия. Соединения, таким образом, можно использовать для лечения злокачественных опухолей, особенно для лечения и предотвращения невосприимчивых, рецидивирующих, метастазирующих злокачественных опухолей или экспрессирующих STAT3 злокачественных опухолей. В публикациях описаны также способы получения нафтофурановых соединений, их производных и промежуточных соединений и фармацевтическая композиция соответствующих соединений.
Эти нафтофурановые соединения (включая нафтофурановые соединения в форме частиц), полиморфы и очищенные композиции, описанные в настоящем документе, являются пригодными при множестве показаний, включая, например, лечение, задержку прогрессирования, предотвращение рецидива или облегчение симптома нарушения пролиферации клеток. Например, нафтофурановые соединения (включая нафтофурановые соединения в форме частиц), полиморфы и очищенные композиции являются пригодными для лечения, задержки прогрессирования, предотвращения рецидива, облегчения симптома или иным образом улучшения состояния при злокачественной опухоли.
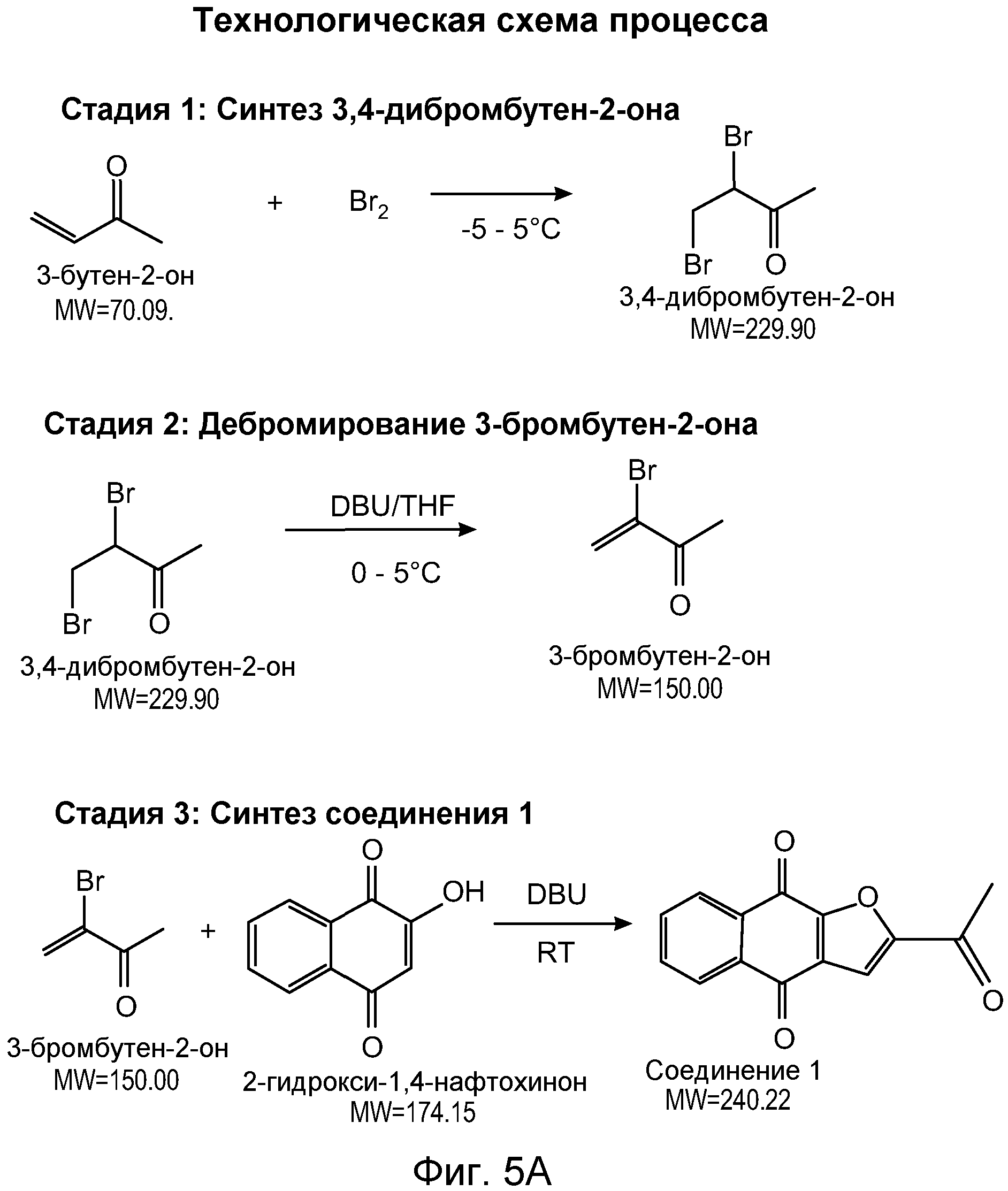
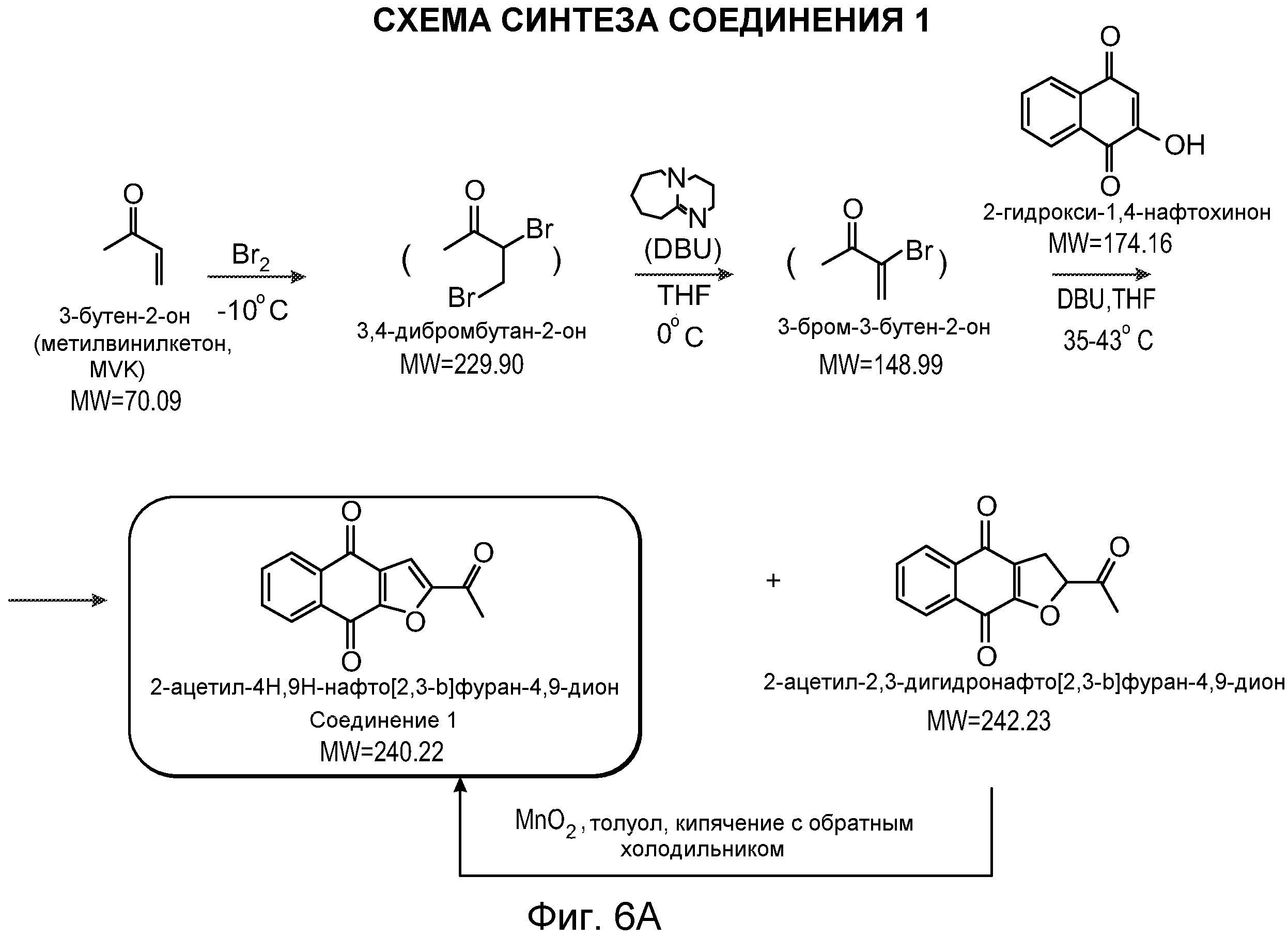
В некоторых вариантах осуществления нафтофурановое соединение представляет собой полиморф соединения, показанного ниже, обозначаемого в настоящем документе как «соединение 1»
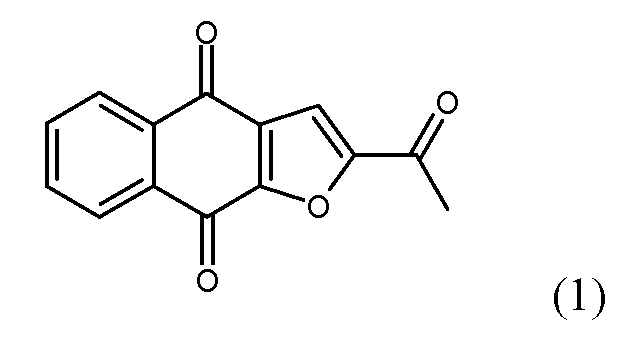
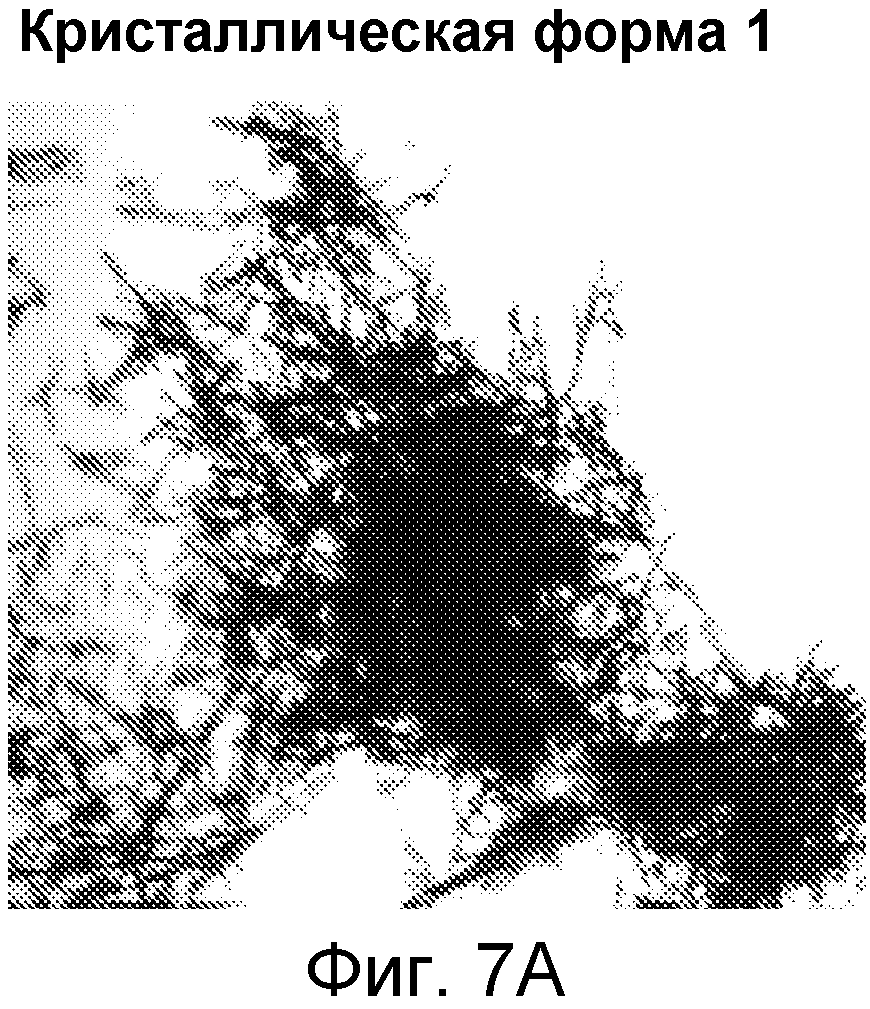
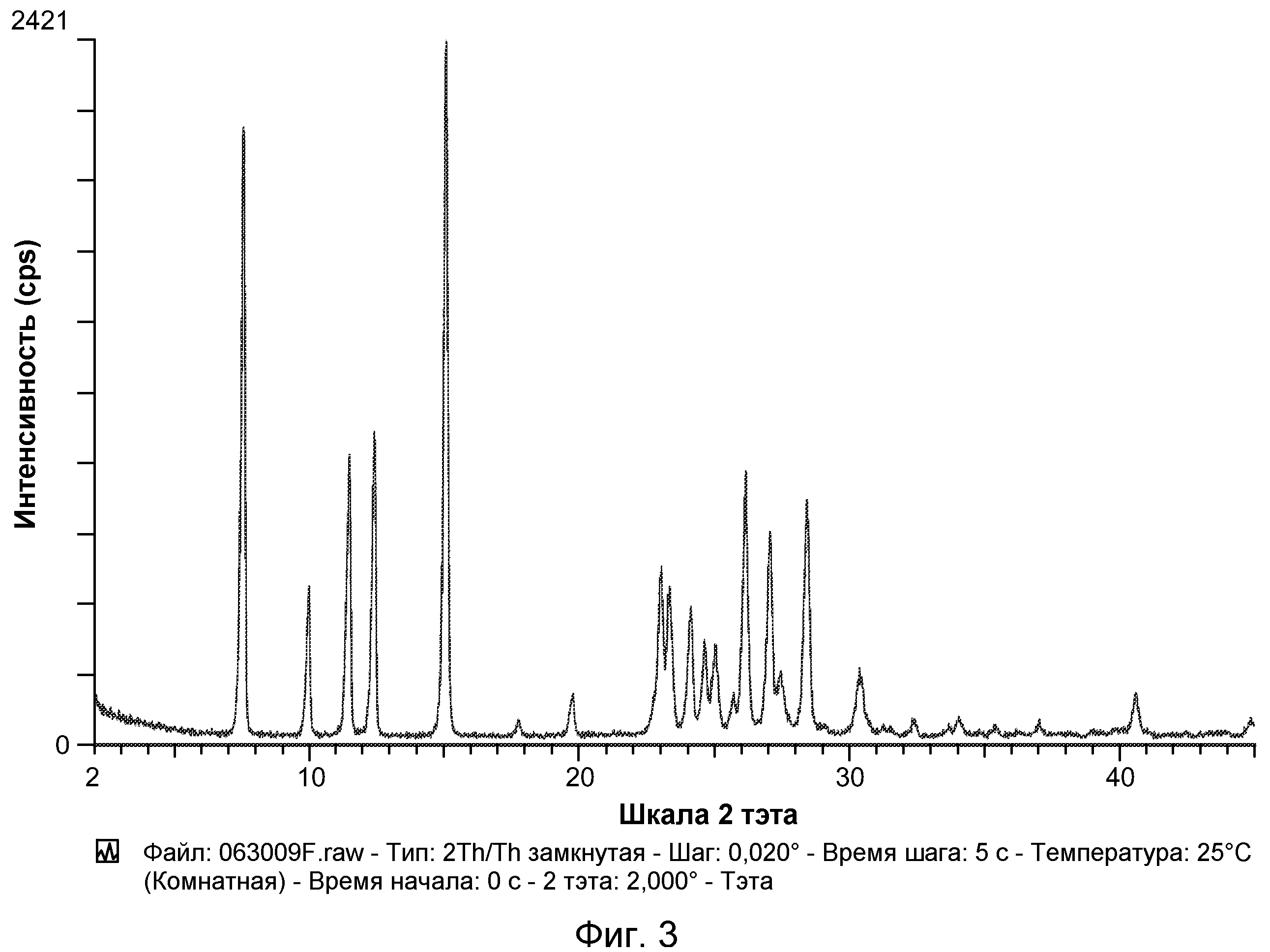
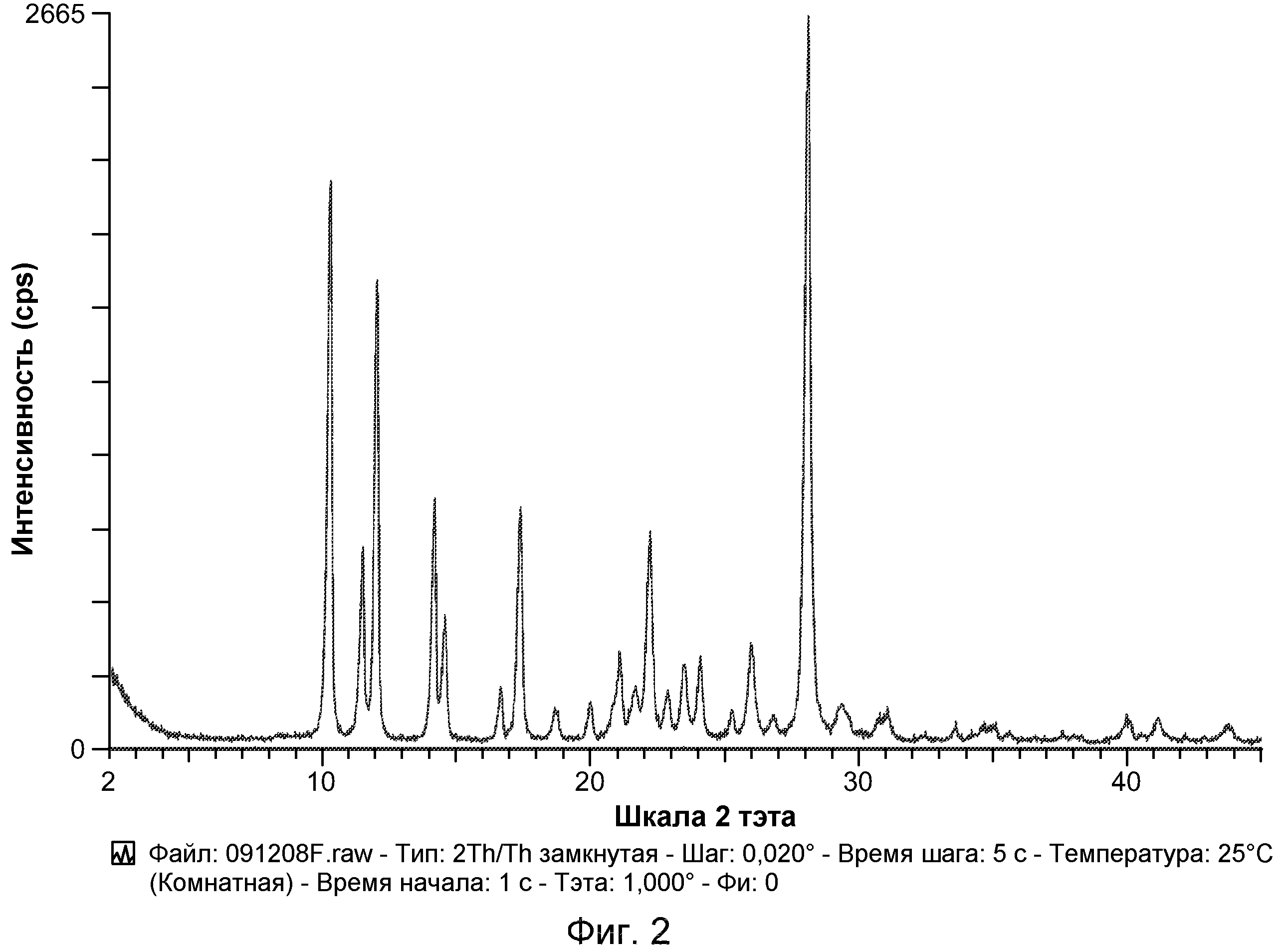
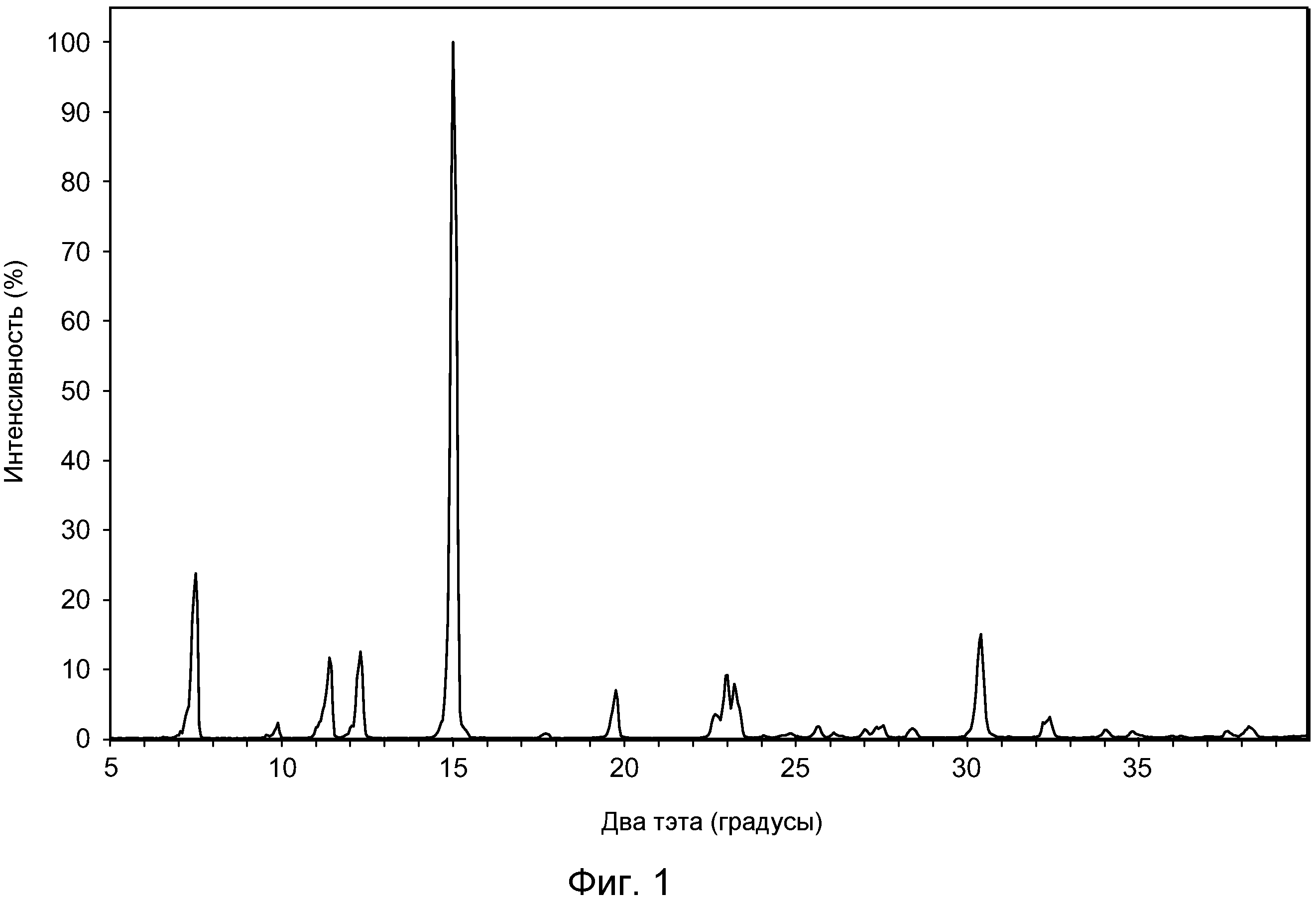
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с рентгенограммой, указанной на фиг.1. Анализ рентгеновской порошковой дифрактометрией, показанный на фиг.1, проводили с использованием дифрактометра Philips PW1800 с использованием излучения Cu при 40 кВ/30 мА в диапазоне от 5° до 70° с размером шага 0,03° и временем подсчета 3 часа. Анализ проводили от 2-тета 2-45° с использованием следующих условий: щель расходимости: 0,6 мм, антирассеивающая щель: 0,6 мм, приемная щель: 0,1 мм, щель детектора: 0,6 мм, размер шага: 0,02°, время шага: 5 секунд. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с рентгенограммой, указанной на фиг.2. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с рентгенограммой, указанной на фиг.3. Анализ рентгеновской порошковой дифрактометрией, показанный на фиг.2 и 3, проводили с использованием дифрактометра Bruker D8 Advance. Анализ проводили от 2-тета 2-45° с использованием следующих условий: щель расходимости: 0,6 мм, антирассеивающая щель: 0,6 мм, приемная щель: 0,1 мм, щель детектора: 0,6 мм, размер шага: 0,02°, время шага: 5 секунд.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0 и 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2 и/или 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 10,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 11,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,5 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 17,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 22,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 10,2 градуса, пика при 2θ по меньшей мере приблизительно 11,9 градуса, пика при 2θ по меньшей мере приблизительно 14,1 градуса, пика при 2θ по меньшей мере приблизительно 14,5 градуса, пика при 2θ по меньшей мере приблизительно 17,3 градуса, пика при 2θ по меньшей мере приблизительно 22,2 градуса и пика при 2θ по меньшей мере приблизительно 28,1 градуса, и любые их комбинации.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 7,5 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 9,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 12,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 24,6 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 7,5 градусов, пика при 2θ по меньшей мере приблизительно 9,9 градуса, пика при 2θ по меньшей мере приблизительно 15 градусов, пика при 2θ по меньшей мере приблизительно 12,3 градуса, пика при 2θ по меньшей мере приблизительно 23,0 градуса, пика при 2θ по меньшей мере приблизительно 23,3 градуса, пика при 2θ по меньшей мере приблизительно 24,6 градуса и пика при 2θ по меньшей мере приблизительно 28,4 градуса, и любых их комбинаций.
Настоящее изобретение также относится к нафтофурановым соединениям в форме частиц. Например, нафтофурановое соединение в форме частиц представляет собой частицу соединения формулы I, показанной ниже, которая является активной, т.е. обладает эффективностью и/или противоопухолевой активностью in vivo. Для эффективной частицы или частиц существуют определенные требования к размеру частиц, например, они имеют диаметр, меньший или равный приблизительно 200 мкм, приблизительно 150 мкм, приблизительно 100 мкм, приблизительно 40 мкм или приблизительно 20 мкм, приблизительно 10 мкм, приблизительно 5 мкм, приблизительно 4 мкм, приблизительно 3 мкм, приблизительно 2 мкм, приблизительно 1 мкм, приблизительно 0,5 мкм или приблизительно 0,2 мкм. Частица или частицы, превышающие определенный размер частиц, являются либо неактивными, либо менее активными.
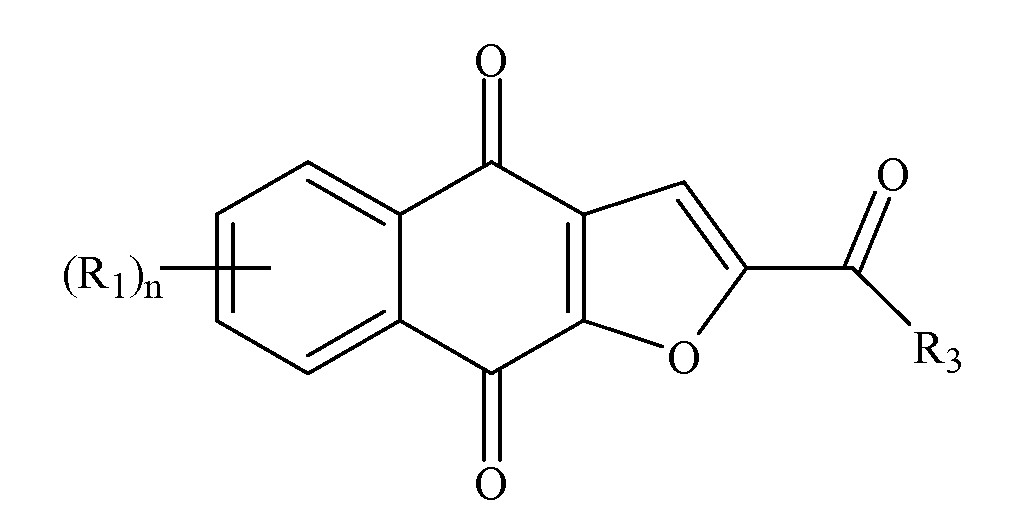
В некоторых вариантах осуществления нафтофурановое соединение в форме частиц представляет собой частицу соединения формулы I или его соли или сольвата

Формула I
где частица обладает диаметром, меньшим или равным приблизительно 200 мкм; где каждый (R1) независимо выбран из группы, состоящей из водорода, галогена, фтора, циано, нитро, CF3, OCF3, алкила, метила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила, замещенного арила, ORa, SRa и NH2; где n представляет собой 4; где R3 выбран из группы, состоящей из водорода, галогена, фтора, циано, CF3, OCF3, алкила, метила, замещенного алкила, галоген-замещенного алкила, гидроксил-замещенного алкила, амин-замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила, замещенного арила, ORa, SRa, и NRbRc; где Ra является/являются независимо выбранными из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила и замещенного арила; и где Rb и Rc независимо выбраны из группы, состоящей из водорода, алкила, замещенного алкила, циклоалкила, замещенного циклоалкила, гетероцикла, замещенного гетероцикла, арила и замещенного арила, или Rb и Rc вместе с N, с которым они связаны, формируют гетероцикл или замещенный гетероцикл.
В некоторых вариантах осуществления каждый (R1) независимо выбран из группы, состоящей из водорода, метила, F (фтора), Cl, Br, I, OH и NH2; R3 выбран из группы, состоящей из метила и C(R8)3, и каждый (R8) независимо выбран из группы, состоящей из водорода, метила, F (фтора), Cl, Br, I, OH и NH2. В некоторых вариантах осуществления не более двух из (R1) и (R8) представляют собой F (фтор), где оставшиеся представляют собой водород. В некоторых вариантах осуществления R3 представляет собой метил. В следующем варианте осуществления соединение выбрано из группы, состоящей из 2-(1-гидроксиэтил)-нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, их энантиомеров, диастереомеров, таутомеров и солей или сольватов.
В некоторых вариантах осуществления нафтофурановое соединение в форме частиц представляет собой частицу соединения 1.
В некоторых вариантах осуществления нафтофурановое соединение в форме частиц представляет собой частицу полиморфа соединения 1. Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.1. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.2. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.3.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0, и 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2 и/или 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 10,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 11,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,5 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 17,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 22,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 10,2 градуса, пика при 2θ по меньшей мере приблизительно 11,9 градуса, пика при 2θ по меньшей мере приблизительно 14,1 градуса, пика при 2θ по меньшей мере приблизительно 14,5 градуса, пика при 2θ по меньшей мере приблизительно 17,3 градуса, пика при 2θ по меньшей мере приблизительно 22,2 градуса и пика при 2θ по меньшей мере приблизительно 28,1 градуса и любых их комбинаций.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 7,5 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 9,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 12,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 24,6 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-дион, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 7,5 градуса, пика при 2θ по меньшей мере приблизительно 9,9 градуса, пика при 2θ по меньшей мере приблизительно 15 градусов, пика при 2θ по меньшей мере приблизительно 12,3 градуса, пика при 2θ по меньшей мере приблизительно 23,0 градуса, пика при 2θ по меньшей мере приблизительно 23,3 градуса, пика при 2θ по меньшей мере приблизительно 24,6 градуса и пика при 2θ по меньшей мере приблизительно 28,4 градуса, и любых их комбинаций.
В некоторых вариантах осуществления частица обладает диаметром, меньшим или равным приблизительно 160 мкм, приблизительно 150 мкм, приблизительно 120 мкм, приблизительно 100 мкм, приблизительно 50 мкм, приблизительно 40 мкм, или приблизительно 20 мкм. В следующем варианте осуществления частица обладает диаметром, меньшим или равным приблизительно 10 мкм, приблизительно 5 мкм, приблизительно 4 мкм, приблизительно 3 мкм, приблизительно 2 мкм, приблизительно 1 мкм, приблизительно 0,5 мкм, приблизительно 0,2 мкм или приблизительно 0,1 мкм.
Настоящее изобретение относится к частице или частицам нафтофуранового соединения, например, соединения формулы I, которые являются активными, т.е. обладают эффективностью и/или противоопухолевой активностью. Активная частица или частицы обладают конкретным размером, например, имеют диаметр, меньший или равный приблизительно 200 мкм, приблизительно 150 мкм, приблизительно 100 мкм, приблизительно 40 мкм или приблизительно 20 мкм, приблизительно 10 мкм, приблизительно 5 мкм, приблизительно 4 мкм, приблизительно 3 мкм, приблизительно 2 мкм, приблизительно 1 мкм, приблизительно 0,5 мкм, приблизительно 0,2 мкм или приблизительно 0,1 мкм. Частица или частицы больше определенного размера являются либо неактивными, либо менее активными, чем частицы, описанные в настоящем документе.
В некоторых вариантах осуществления изобретения фармацевтическая композиция содержит частицы соединения, например, нафтофурана формулы I или его соли или сольвата. Например, в некоторых вариантах осуществления фармацевтическая композиция содержит частицы соединения 1. Например, в некоторых вариантах осуществления фармацевтическая композиция содержит частицы полиморфа соединения 1. Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.1. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.2. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.3.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0 и 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2, и/или 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 10,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 11,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,5 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 17,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 22,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 10,2 градуса, пика при 2θ по меньшей мере приблизительно 11,9 градуса, пика при 2θ по меньшей мере приблизительно 14,1 градуса, пика при 2θ по меньшей мере приблизительно 14,5 градуса, пика при 2θ по меньшей мере приблизительно 17,3 градуса, пика при 2θ по меньшей мере приблизительно 22,2 градуса и пика при 2θ по меньшей мере приблизительно 28,1 градуса, и любых их комбинаций.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 7,5 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 9,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 12,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 24,6 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 7,5 градуса, пика при 2θ по меньшей мере приблизительно 9,9 градуса, пика при 2θ по меньшей мере приблизительно 15 градусов, пика при 2θ по меньшей мере приблизительно 12,3 градуса, пика при 2θ по меньшей мере приблизительно 23,0 градуса, пика при 2θ по меньшей мере приблизительно 23,3 градуса, пика при 2θ по меньшей мере приблизительно 24,6 градуса и пика при 2θ по меньшей мере приблизительно 28,4 градуса, и любых их комбинаций.
Фракция суммарной совокупности частиц может обладать диаметром, меньшим или равным приблизительно 200 мкм. В некоторых вариантах осуществления фракция совокупности частиц может составлять по меньшей мере приблизительно 1%, по меньшей мере приблизительно 5%, по меньшей мере приблизительно 10%, по меньшей мере приблизительно 20%, или по меньшей мере приблизительно 30% из общего количества частиц в совокупности. В некоторых вариантах осуществления фракция представляет собой значительную фракцию. Например, «значительная фракция» совокупности частиц может составлять по меньшей мере приблизительно 99%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 60%, или по меньшей мере приблизительно 50% из общего количества частиц в совокупности. Каждый (R1) может являться независимо выбранным из группы, состоящей из водорода, галогена, фтора, циано, нитро, CF3, OCF3, алкила, метила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила, замещенного арила, ORa, SRa и NH2. n может представлять собой положительное целое число; например, n может составлять 4. R3 может являться выбранным из группы, состоящей из водорода, галогена, фтора, циано, CF3, OCF3, алкила, метила, замещенного алкила, галоген-замещенного алкила, гидроксил-замещенного алкила, амин-замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила, замещенного арила, ORa, SRa и NRbRc. Ra может являться независимо выбранным из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила и замещенного арила. Rb и Rc могут являться независимо выбранными из группы, состоящей из водорода, алкила, замещенного алкила, циклоалкила, замещенного циклоалкила, гетероцикла, замещенного гетероцикла, арила и замещенного арила, или Rb и Rc вместе с N, с которым они связаны, формируют гетероцикл или замещенный гетероцикл.
В некоторых вариантах осуществления изобретения каждый (R1) может являться независимо выбранным из группы, состоящей из водорода, метила, F (фтора), Cl, Br, I, OH и NH2. R3 может являться выбранным из группы, состоящей из метила и C(R8)3. Каждый (R8) может являться независимо выбранным из группы, состоящей из водорода, метила, F (фтора), Cl, Br, I, OH и NH2. В некоторых вариантах осуществления не более двух из (R1) и R8 могут представлять собой F (фтор), где оставшиеся представляют собой водород
Формула I
В некоторых вариантах осуществления изобретения соединение формулы I выбрано из группы, состоящей из 2-(1-гидроксиэтил)-нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона и 2-этилнафто[2,3-b]фуран-4,9-диона. В некоторых вариантах осуществления соединение формулы I представляет собой соединение 1. В некоторых вариантах осуществления соединение формулы I представляет собой полиморф соединения 1. Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.1. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.2. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.3.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0 и 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2 и/или 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 10,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 11,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,5 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 17,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 22,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 10,2 градуса, пика при 2θ по меньшей мере приблизительно 11,9 градуса, пика при 2θ по меньшей мере приблизительно 14,1 градуса, пика при 2θ по меньшей мере приблизительно 14,5 градуса, пика при 2θ по меньшей мере приблизительно 17,3 градуса, пика при 2θ по меньшей мере приблизительно 22,2 градуса и пика при 2θ по меньшей мере приблизительно 28,1 градуса, и любых их комбинаций.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 7,5 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 9,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 12,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 24,6 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 7,5 градуса, пика при 2θ по меньшей мере приблизительно 9,9 градуса, пика при 2θ по меньшей мере приблизительно 15 градусов, пика при 2θ по меньшей мере приблизительно 12,3 градуса, пика при 2θ по меньшей мере приблизительно 23,0 градуса, пика при 2θ по меньшей мере приблизительно 23,3 градуса, пика при 2θ по меньшей мере приблизительно 24,6 градуса и пика при 2θ по меньшей мере приблизительно 28,4 градуса, и любых их комбинаций.
Например, фармацевтическая композиция может обладать по меньшей мере приблизительно 90% суммарной совокупности частиц с размером частиц, меньшим или равным приблизительно 160 мкм, 100 мкм, 40 мкм, 20 мкм, 10 мкм, 5 мкм, 3 мкм, или 2 мкм. Например, фармацевтическая композиция может обладать по меньшей мере приблизительно 50% суммарной совокупности частиц с размером частиц, меньшим или равным приблизительно 160 мкм, 100 мкм, 40 мкм, 20 мкм, 10 мкм, 5 мкм, 3 мкм, 2 мкм, 1 мкм или 0,5 мкм. Например, фармацевтическая композиция может обладать по меньшей мере приблизительно 10% суммарной совокупности частиц с размером частиц, меньшим или равным приблизительно 160 мкм, 100 мкм, 40 мкм, 20 мкм, 5 мкм, 2 мкм, 1 мкм, 0,5 мкм или 0,1 мкм. В фармацевтической композиции частицы могут обладать медианным диаметром, например, меньшим или равным приблизительно 160 мкм, 40 мкм, 20 мкм, 10 мкм, 5 мкм, 4 мкм, 3 мкм, 2 мкм, 1 мкм, 0,5 мкм, 0,3 мкм или 0,2 мкм. Например, частицы могут обладать медианным диаметром от приблизительно 0,2 мкм до приблизительно 50 мкм или медианным диаметром от приблизительно 0,5 мкм до приблизительно 30 мкм. Например, фармацевтическая композиция может обладать суммарной совокупностью частиц с отношением среднего диаметра к медианному диаметру не более чем приблизительно 2 мкм. Фармацевтическое изобретение может обладать частицами, содержащими соединение в кристаллическом состоянии, по меньшей мере в двух различных полиморфных состояниях.
В некоторых вариантах осуществления фармацевтическая композиция содержит соединение формулы I или его полиморф в форме частиц, где частица или частицы составляют менее 20 микрон, 10 микрон, 5 микрон, 2 микрон, 1 микрон или 0,5 микрона.
Настоящее изобретение относится к по существу чистому соединению формулы II
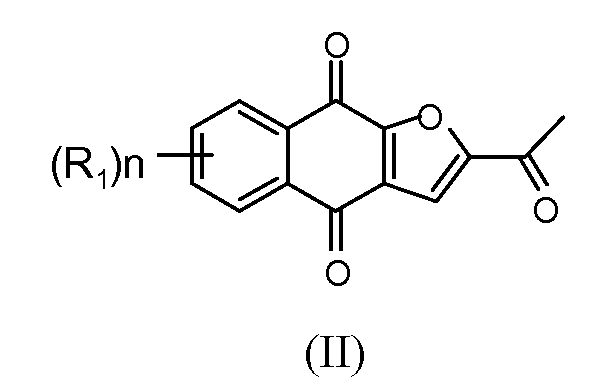
где каждый R1 независимо представляет собой H, Cl или F; и n представляет собой 0, 1, 2, 3 или 4. В некоторых вариантах осуществления соединение формулы II присутствует в форме частиц.
В некоторых вариантах осуществления по существу чистое соединение представляет собой соединение 1. В некоторых вариантах осуществления соединение 1 присутствует в форме частиц.
В некоторых вариантах осуществления по существу чистое соединение выбрано из группы, состоящей из 2-(1-гидроксиэтил)-нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] сложного эфира фосфорной кислоты, диметилового сложного эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового сложного эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов.
В некоторых вариантах осуществления по существу чистое соединение представляет собой полиморф соединения 1. Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.1. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.2. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.3.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0 и 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2 и/или 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 10,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 11,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,5 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 17,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 22,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 10,2 градуса, пика при 2θ по меньшей мере приблизительно 11,9 градуса, пика при 2θ по меньшей мере приблизительно 14,1 градуса, пика при 2θ по меньшей мере приблизительно 14,5 градуса, пика при 2θ по меньшей мере приблизительно 17,3 градуса, пика при 2θ по меньшей мере приблизительно 22,2 градуса и пика при 2θ по меньшей мере приблизительно 28,1 градуса и любых их комбинаций.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 7,5 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 9,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 12,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 24,6 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 7,5 градуса, пика при 2θ по меньшей мере приблизительно 9,9 градуса, пика при 2θ по меньшей мере приблизительно 15 градусов, пика при 2θ по меньшей мере приблизительно 12,3 градуса, пика при 2θ по меньшей мере приблизительно 23,0 градуса, пика при 2θ по меньшей мере приблизительно 23,3 градуса, пика при 2θ по меньшей мере приблизительно 24,6 градуса и пика при 2θ по меньшей мере приблизительно 28,4 градуса, и их любых комбинаций.
В некоторых вариантах осуществления полиморф соединения 1 присутствует в форме частиц.
В некоторых вариантах осуществления соединение, продукт и/или фармацевтическая композиция обладает чистотой по меньшей мере приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 95% или приблизительно 99%. В некоторых вариантах осуществления соединение, продукт и/или фармацевтическая композиция обладает чистотой по меньшей мере приблизительно 95,5%, приблизительно 96%, приблизительно 96,5%, приблизительно 97%, приблизительно 97,5%, приблизительно 98%, приблизительно 98,5%, приблизительно 99%, или приблизительно 99,5%. В некоторых вариантах осуществления соединение, продукт и/или фармацевтическая композиция обладает чистотой по меньшей мере приблизительно 99,1%, приблизительно 99,2%, приблизительно 99,3%, приблизительно 99,4%, приблизительно 99,5%, приблизительно 99,6%, приблизительно 99,7%, приблизительно 99,8% или приблизительно 99,9%.
В некоторых вариантах осуществления соединение, продукт и/или фармацевтическая композиция содержит не более приблизительно 10%, приблизительно 5%, приблизительно 1%, приблизительно 0,15%, или приблизительно 0,5% примесей. В некоторых вариантах осуществления соединение, продукт и/или фармацевтическая композиция содержит каждой отдельной примеси не более приблизительно 0,5%, приблизительно 0,2%, приблизительно 0,15%, или приблизительно 0,1%. В следующем варианте осуществления примеси представляют собой одно или несколько из группы, состоящей из 2-ацетил-2,3-дигидронафто[2,3-b]фуран-4,9-диона, 2,6-диацетилнафто[2,3-b]фуран-4,9-диона, 2,7-диацетилнафто[2,3-b]фуран-4,9-диона, 3-ацетилнафто[2,3-b]фуран-4,9-диона, нафто[2,3-b]фуран-4,9-диона, нафто[2,3-b]фуран-4,9-диона, нафто[2,3-b]фуран-4,9-диола и 1-(4,9-дигидроксинафто[2,3-b]фуран-2-ил)этанона.
В некоторых вариантах осуществления примеси включают остаточный растворитель. В некоторых вариантах осуществления растворитель выбран из группы, состоящей из этилацетата (EtOAc), толуола, этанола, метанола, хлороформа и CH2Cl2/гексана.
В некоторых вариантах осуществления чистоту определяют с помощью HPLC (высокоэффективной жидкостной хроматографии). В некоторых вариантах осуществления чистоту определяют с помощью ЯМР (ядерного магнитного резонанса). В дополнительном варианте осуществления чистоту определяют с помощью как HPLC, так и ЯМР.
Изобретение относится также к полиморфу соединения 1 в форме частиц, где соединение находится в высокоочищенной форме, продукте и/или фармацевтической композиции. Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.1. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.2. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.3.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0, и 28,1 градуса. В некоторых вариантах осуществления, полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2, и/или 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 10,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 11,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,5 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 17,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 22,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 10,2 градуса, пика при 2θ по меньшей мере приблизительно 11,9 градуса, пика при 2θ по меньшей мере приблизительно 14,1 градуса, пика при 2θ по меньшей мере приблизительно 14,5 градуса, пика при 2θ по меньшей мере приблизительно 17,3 градуса, пика при 2θ по меньшей мере приблизительно 22,2 градуса и пика при 2θ по меньшей мере приблизительно 28,1 градуса и любых их комбинаций.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 7,5 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 9,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 12,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 24,6 градуса. В некоторых вариантах осуществления, полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 7,5 градуса, пика при 2θ по меньшей мере приблизительно 9,9 градуса, пика при 2θ по меньшей мере приблизительно 15 градусов, пика при 2θ по меньшей мере приблизительно 12,3 градуса, пика при 2θ по меньшей мере приблизительно 23,0 градуса, пика при 2θ по меньшей мере приблизительно 23,3 градуса, пика при 2θ по меньшей мере приблизительно 24,6 градуса и пика при 2θ по меньшей мере приблизительно 28,4 градуса, и любых их комбинаций.
Полиморф соединения 1 присутствует в форме частиц. В некоторых вариантах осуществления полиморф соединения 1 присутствует в форме частиц, где частица обладает диаметром, меньшим или равным приблизительно 160 мкм, приблизительно 150 мкм, приблизительно 120 мкм, приблизительно 100 мкм, приблизительно 50 мкм, приблизительно 40 мкм или приблизительно 20 мкм. В некоторых вариантах осуществления полиморф соединения 1 в форме частиц представляет собой совокупность частиц, где совокупность частиц обладает D50 (т.е. медианной точкой распределения размера частиц, которая разделяет распределение на две равные части), меньшей или равной приблизительно 160 мкм, приблизительно 150 мкм, приблизительно 120 мкм, приблизительно 100 мкм, приблизительно 50 мкм, приблизительно 40 мкм или приблизительно 20 мкм. В некоторых вариантах осуществления полиморф соединения 1 присутствует в форме частиц, где частица обладает диаметром, меньшим или равным приблизительно 10 мкм, приблизительно 5 мкм, приблизительно 4 мкм, приблизительно 3 мкм, приблизительно 2 мкм, приблизительно 1 мкм, приблизительно 0,5 мкм, приблизительно 0,2 мкм или приблизительно 0,1 мкм. В некоторых вариантах осуществления полиморф соединения 1 в форме частиц представляет собой популяцию частиц, где популяция частиц обладает D50, меньшим или равным приблизительно 10 мкм, приблизительно 5 мкм, приблизительно 4 мкм, приблизительно 3 мкм, приблизительно 2 мкм, приблизительно 1 мкм, приблизительно 0,5 мкм или приблизительно 0,2 мкм.
Настоящее изобретение относится к частице или совокупности частиц полиморфа соединения 1, которые являются активными, т.е. обладают эффективностью и/или противоопухолевой активностью. Активные частица или частицы обладают конкретным размером, например, обладают диаметром или D50, меньшим или равным приблизительно 200 мкм, приблизительно 150 мкм, приблизительно 100 мкм, приблизительно 40 мкм, или приблизительно 20 мкм, приблизительно 10 мкм, приблизительно 5 мкм, приблизительно 4 мкм, приблизительно 3 мкм, приблизительно 2 мкм, приблизительно 1 мкм, приблизительно 0,5 мкм или приблизительно 0,2 мкм. Частица или частицы, превышающие конкретный размер, являются либо неактивными, либо менее активными, чем частицы, описанные в настоящем документе.
Фракция суммарной совокупности частиц полиморфа соединения 1 может обладать диаметром или D50, меньшим или равным приблизительно 200 мкм. В некоторых вариантах осуществления фракция совокупности частиц может составлять по меньшей мере приблизительно 1%, по меньшей мере приблизительно 5%, по меньшей мере приблизительно 10%, по меньшей мере приблизительно 20%, или по меньшей мере приблизительно 30% из общего количества частиц в совокупности. В некоторых вариантах осуществления фракция представляет собой значительную фракцию. Например, «значительная фракция» совокупности частиц может составлять по меньшей мере приблизительно 99%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 60% или по меньшей мере приблизительно 50% из общего количества частиц в совокупности.
В некоторых вариантах осуществления совокупность частиц полиморфа соединения 1 может составлять по меньшей мере приблизительно 90% суммарной совокупности частиц с размером частиц, меньшим или равным приблизительно 160 мкм, 100 мкм, 40 мкм, 20 мкм, 10 мкм, 5 мкм, 3 мкм или 2 мкм, 1 мкм или 0,5 мкм. Например, совокупность частиц полиморфа соединения 1 может составлять по меньшей мере приблизительно 50% суммарной совокупности частиц с размером частиц, меньшим или равным приблизительно 160 мкм, 100 мкм, 40 мкм, 20 мкм, 10 мкм, 5 мкм, 3 мкм, 2 мкм, 1 мкм или 0,5 мкм. Например, совокупность частиц полиморфа соединения 1 может составлять по меньшей мере приблизительно 10% суммарной совокупности частиц с размером частиц, меньшим или равным приблизительно 160 мкм, 100 мкм, 40 мкм, 20 мкм, 5 мкм, 2 мкм, 1 мкм, 0,5 мкм или 0,1 мкм. В совокупности частиц полиморфа соединения 1 частицы могут обладать медианным диаметром, например, меньшим или равным приблизительно 160 мкм, 40 мкм, 20 мкм, 10 мкм, 5 мкм, 4 мкм, 3 мкм, 2 мкм, 1 мкм, 0,5 мкм или 0,2 мкм. Например, частицы могут обладать медианным диаметром от приблизительно 0,002 мкм до приблизительно 50 мкм или медианным диаметром от приблизительно 0,2 мкм до приблизительно 30 мкм. Например, популяция частиц полиморфа соединения 1 может обладать суммарной совокупностью частиц с отношением среднего диаметра к медианному диаметру не более чем приблизительно 2. Популяция частиц полиморфа соединения 1 может обладать частицами, содержащими соединение в кристаллическом состоянии по меньшей мере в двух различных полиморфных состояниях.
В некоторых вариантах осуществления полиморф соединения 1 присутствует в форме частиц, где частица обладает диаметром, меньшим или равным приблизительно 20 микрон, 10 микрон, 5 микрон или 2 3 микрона, 2 микрона, 1 микрон, 0,5 микрона, 0,2 микрона или 0,1 микрона. В некоторых вариантах осуществления полиморф соединения 1 в форме частиц представляет собой совокупность частиц, где совокупность частиц обладает D50, меньшим или равным приблизительно 20 микрон, 10 микрон, 5 микрон, 4 микрона, 5 микрон, 3 микрона, 2 микрона, 1 микрон, 0,5 микрона или 0,2 микрона.
Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество по существу чистого нафтофуранового соединения и фармацевтически приемлемый носитель, наполнитель или разбавитель. Наполнитель может включать, например, глицериновый сложный эфир жирной кислоты, глицериновый сложный эфир насыщенной жирной кислоты, глицериновый сложный эфир насыщенной жирной кислоты, имеющей от 8 до 18 атомов углерода, глицериллаурат, полиэтиленгликоль, целлюлозу, микрокристаллическую целлюлозу, карбоксиметилцеллюлозу, фосфатидилхолин, липид, стерин, холестерин, поверхностно-активное вещество, полисорбат и/или полиоксиэтиленсорбитаналкилат.
В некоторых вариантах осуществления изобретения промышленное изделие может включать контейнер, содержащий терапевтически эффективное количество фармацевтической композиции и фармацевтически приемлемого наполнителя.
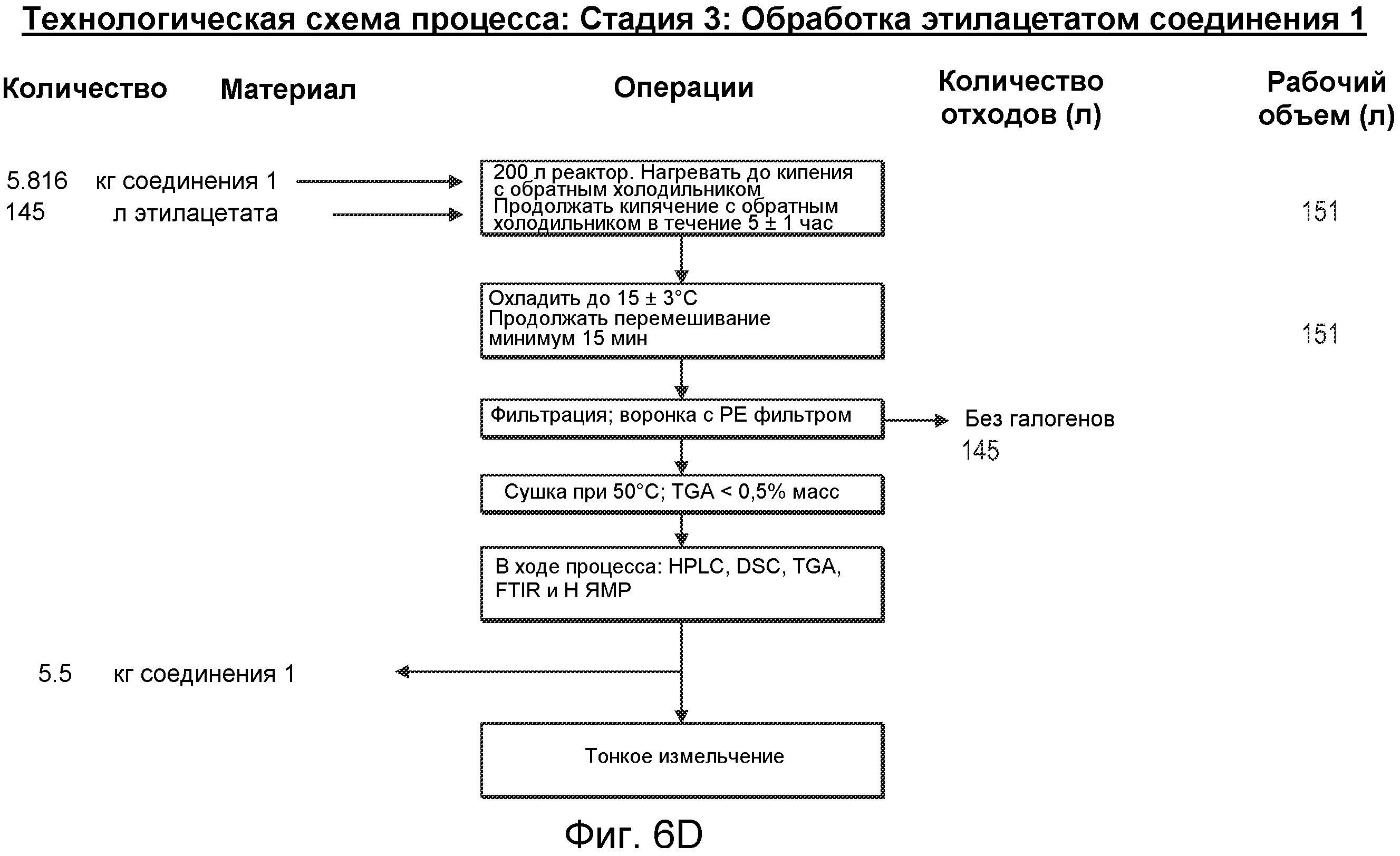
Способ получения соединения, продукта и/или фармацевтической композиции в некоторых вариантах осуществления изобретения может включать размол соединения для получения частиц. Например, соединение можно размалывать в шаровой мельнице, измельчать вальцеванием, размалывать в струйной мельнице, подвергать влажному размолу, измельчать посредством ультразвука, растирать или обрабатывать с использованием комбинации этих и/или других способов размалывания. Температуру соединения можно снижать, например, снижать до криогенной температуры, и размалывать. Такое снижение температуры может делать соединение более хрупким и более поддающимся уменьшению размера частиц при размоле.
Способ получения соединения, продукта и/или фармацевтической композиции в некоторых вариантах осуществления изобретения может включать кристаллизацию. На распределение размера частиц (PSD), полученное при кристаллизации, влияет комбинация различных механизмов, возникающих в ходе кристаллизации, таких как образование центров кристаллизации, рост, агрегация, истирание, разламывание и т.д. Когда размер частиц невозможно систематически контролировать в ходе кристаллизации для удовлетворения желаемым спецификациям, можно включать дополнительную стадию, такую как сухой размол.
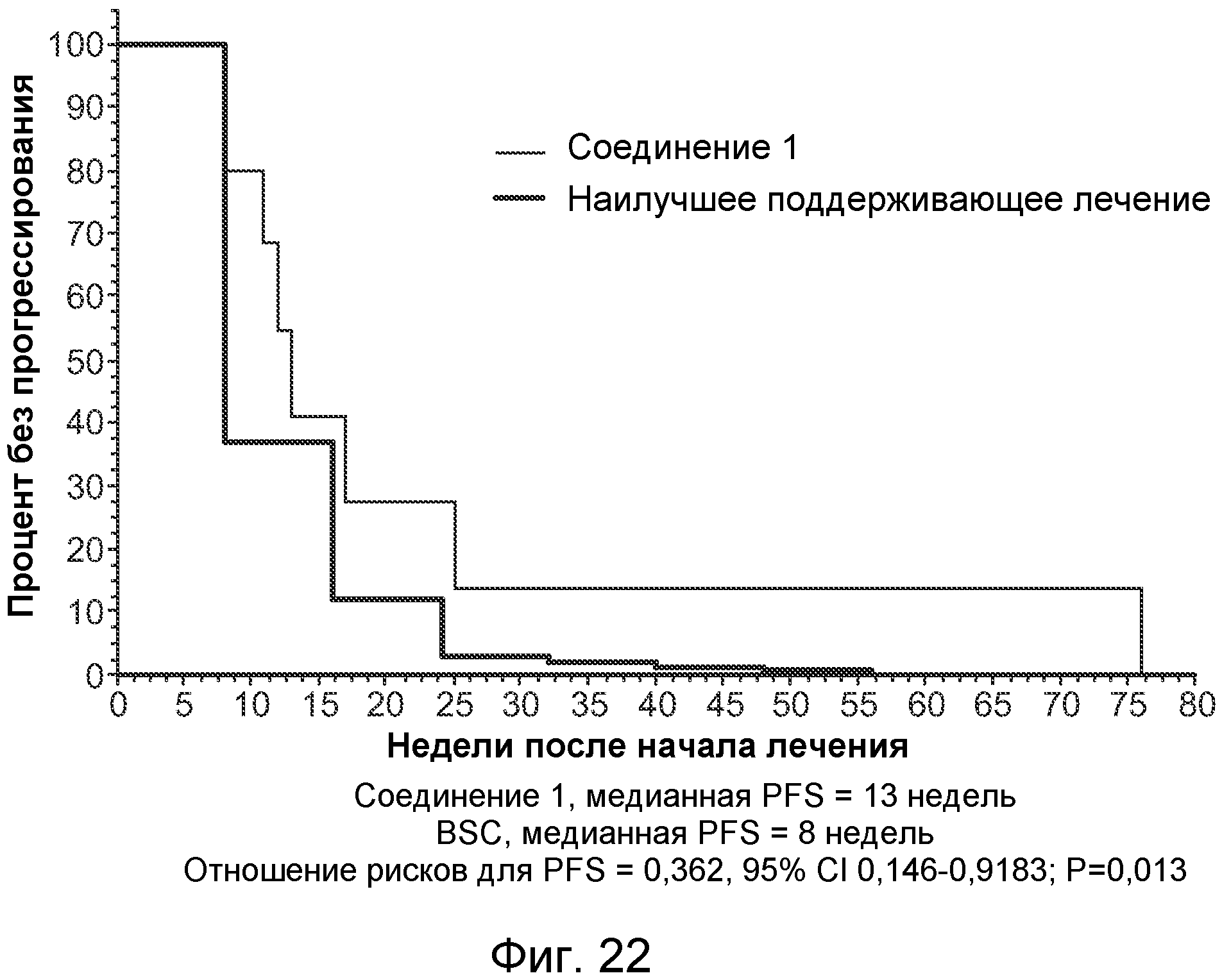
Способ лечения, задержки прогрессирования, предотвращения рецидива, облегчения симптома или иного улучшения состояния субъекта - человека, млекопитающего или животного, страдающего от неоплазии, по изобретению может включать введение терапевтически эффективного количества соединения, продукта и/или фармацевтической композиции, так что проявляется антинеопластическая активность. Например, антинеопластическая активность может представлять собой противораковую активность. Например, антинеопластическая активность может включать замедление увеличения объема неоплазии, остановку увеличения объема неоплазии или уменьшение объема неоплазии. Неоплазия может включать солидную опухоль, злокачественное новообразование, метастазирующую клетку, злокачественную стволовую клетку. Неоплазия может включать карциному, саркому, аденокарциному, лимфому или гемобластоз. Неоплазия может являться невосприимчивой к лечению посредством химиотерапии, лучевой терапии и/или гормональной терапии. Соединение, продукт и/или фармацевтическую композицию можно вводить для предотвращения рецидива неоплазии. Соединение, продукт и/или фармацевтическую композицию можно вводить в качестве вспомогательной терапии при хирургическом удалении. Соединение, продукт и/или фармацевтическую композицию можно вводить, например, перорально и/или внутривенно.
Способ по изобретению включает также лечение, задержку прогрессирования, предотвращение рецидива, облегчение симптома или иное улучшение состояния заболевания или нарушения у субъекта - человека, млекопитающего или животного, страдающего от этого заболевания или нарушения. В некоторых вариантах осуществления заболевание или нарушение выбрано из группы, состоящей из аутоиммунного заболевания, воспалительного заболевания, воспалительных заболеваний кишечника, артрита, аутоиммунного демиелинизирующего нарушения, болезни Альцгеймера, удара, ишемического реперфузионного повреждения и рассеянного склероза.
Введение соединений, продуктов и/или фармацевтических композиций пациенту, страдающему от заболевания или нарушения, считают успешным, если достигнут любой из множества лабораторных или клинических результатов. Например, введение считают успешным, если один или несколько из симптомов, связанных с заболеванием или нарушением, облегчен, уменьшен, подавлен или не прогрессирует до следующего, т.е. худшего, состояния. Введение считают успешным, если нарушение, например аутоиммунное нарушение, вступает в ремиссию или не прогрессирует до следующего, т.е. худшего, состояния.
В некоторых вариантах осуществления соединения продукты и/или фармацевтические композиции, описанные в настоящем документе, вводят в сочетании с любым из множества известных лекарственных средств, включая, например, химиотерапевтическое средство и другие антинеопластические средства, противовоспалительные соединения и/или иммуносупрессивные соединения. В некоторых вариантах осуществления соединения, продукты и/или фармацевтические композиции, описанные в настоящем документе, пригодны в сочетании с любым из множества известных лекарственных средств, включая, в качестве неограничивающего примера, хирургические лечение и способы, лучевую терапию, химиотерапию и/или гормональное или другое связанное с внутренней секрецией лечение.
Эти «совместно вводимые лекарственные средства» можно вводить последовательно или одновременно. Соединения, продукты и/или фармацевтические композиции, описанные в настоящем документе, и второе лекарственное средство можно вводить субъекту, предпочтительно человеку, в одной фармацевтической композиции. Альтернативно соединения, продукты и/или фармацевтические композиции, описанные в настоящем документе, и второе лекарственное средство можно вводить субъекту одновременно, отдельно или последовательно в отдельных фармацевтических композициях. Соединения, продукты и/или фармацевтические композиции, описанные в настоящем документе, и второе лекарственное средство можно вводить субъекту одинаковыми или различными способами введения. В некоторых вариантах осуществления совместно вводимые лекарственные средства по изобретению содержат эффективное количество соединений, продуктов и/или фармацевтических композиций, описанных в настоящем документе, и эффективное количество по меньшей мере одного другого лекарственного средства (например, профилактического или терапевтического средства), обладающего другим механизмом действия по сравнению с соединениями, продуктами и/или фармацевтическими композициями, описанными в настоящем документе. В некоторых вариантах осуществления совместно вводимые лекарственные средства по настоящему изобретению улучшают профилактический или терапевтический эффект соединений, продуктов и/или фармацевтических композиций, описанных в настоящем документе, и второго лекарственного средства посредством совместного действия с получением аддитивного или синергического эффекта. В конкретных вариантах осуществления совместно вводимые лекарственные средства по настоящему изобретению снижают побочные эффекты, связанные со вторым лекарственным средством (например, профилактическим или терапевтическим средством).
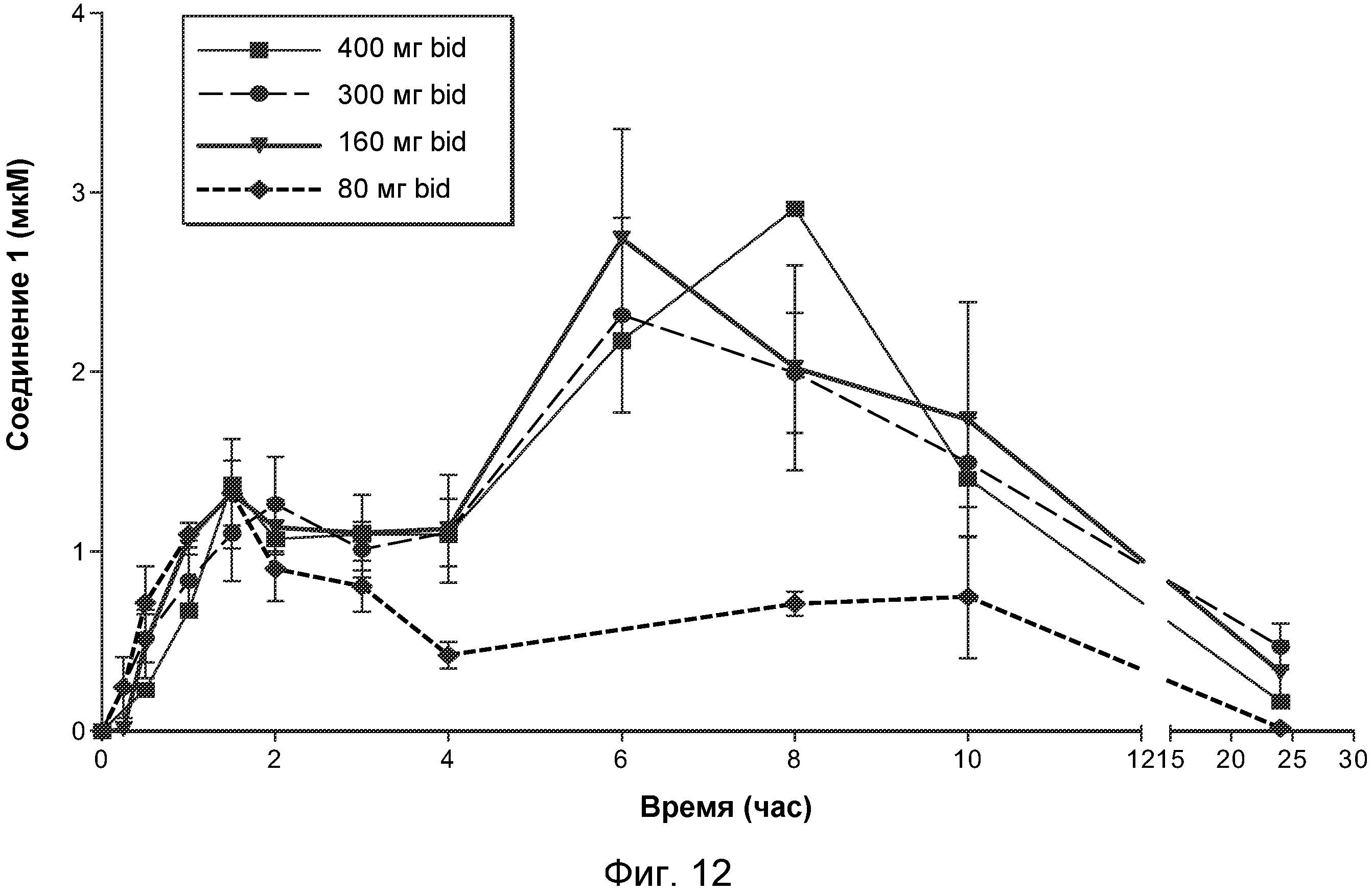
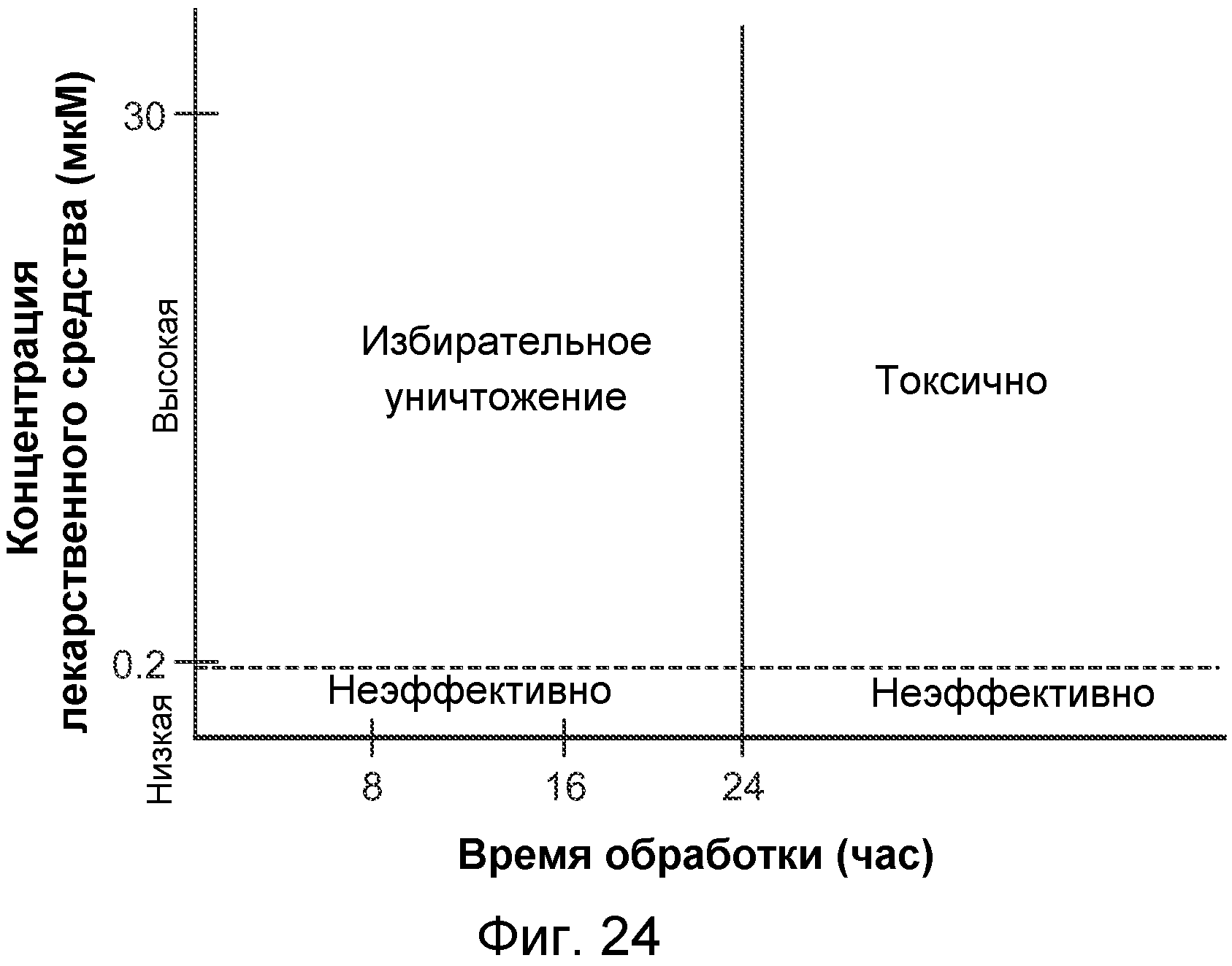
В некоторых вариантах осуществления заболевание или нарушение можно лечить посредством введения соединения, продукта и/или фармацевтической композиции следующим образом. Молярная концентрация соединения в крови может составлять по меньшей мере эффективную концентрацию и являться меньше токсичной концентрации в течение первого непрерывного периода времени, который является по меньшей мере настолько длительным, как эффективный период времени и короче опасного периода времени. Молярная концентрация в крови может являться меньшей, чем эффективная концентрация, после первого непрерывного периода времени. Например, эффективная концентрация может составлять приблизительно 0,1 мкМ, приблизительно 0,2 мкМ, приблизительно 0,5 мкМ, приблизительно 1 мкМ, приблизительно 2 мкМ, приблизительно 3 мкМ, приблизительно 4 мкМ, приблизительно 5 мкМ, приблизительно 6 мкМ, приблизительно 10 мкМ, или другую концентрацию, определенную специалистом в данной области как эффективная. Например, токсичная концентрация может составлять приблизительно 1 мкМ, приблизительно 3 мкМ, приблизительно 10 мкМ, приблизительно 15 мкМ, приблизительно 30 мкМ, приблизительно 100 мкМ или другую концентрацию, определенную специалистом в данной области как токсичная. Например, эффективный период времени может составлять приблизительно 1 час, 2 часа, приблизительно 4 часа, приблизительно 6 часов, приблизительно 8 часов, приблизительно 10 часов, приблизительно 12 часов, приблизительно 24 часа или другой период времени, определенный специалистом в данной области как эффективный. Например, опасный период времени может составлять приблизительно 12 часов, приблизительно 24 часа, приблизительно 48 часов, приблизительно 72 часа, приблизительно 144 часа или другой период времени, определенный специалистом в данной области как опасный.
В некоторых вариантах осуществления терапевтически эффективное количество соединения, продукта и/или фармацевтической композиции выбирают для получения концентрации в крови, превышающей IC50 для клеток опухоли и меньшей, чем IC50 для нормальных клеток. В некоторых вариантах осуществления терапевтически эффективное количество выбирают для получения концентрации в крови, достаточно высокой для уничтожения клеток опухоли и меньшей, чем IC50 для нормальных клеток.
В некоторых вариантах осуществления соединение, продукт и/или фармацевтическую композицию вводят перорально в лекарственной форме, например, таблетке, пилюле, капсуле (твердой или мягкой), каплете, порошке, грануле, суспензии, растворе, геле, саше, пастилке, таблетке для рассасывания, сиропе, эликсире, эмульсии, эмульсии масло-в-воде, эмульсии вода-в-масле и/или дозе жидкого лекарственного средства.
В некоторых вариантах осуществления настоящего изобретения композиция для снижения или подавления репликации или распространения неопластических клеток содержит совокупность частиц, выбранных следующим способом. Может быть предоставлено соединение формулы I или его соль или сольват
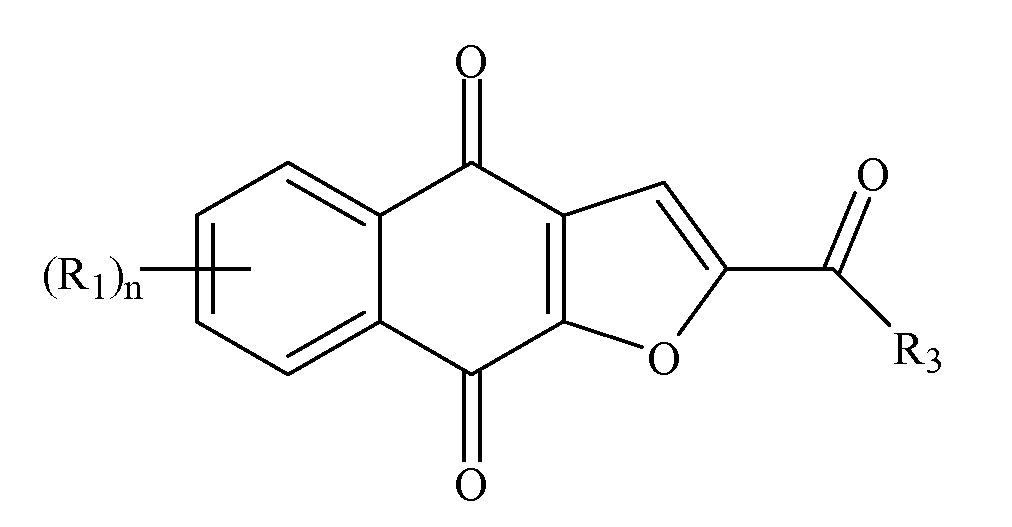
Формула I
В некоторых вариантах осуществления может быть предоставлено соединение 1 или его соль или сольват. В некоторых вариантах осуществления может быть предоставлен полиморф соединения 1. Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.1. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.2. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.3.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0 и 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2, и/или 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 10,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 11,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,5 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 17,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 22,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 10,2 градуса, пика при 2θ по меньшей мере приблизительно 11,9 градуса, пика при 2θ по меньшей мере приблизительно 14,1 градуса, пика при 2θ по меньшей мере приблизительно 14,5 градуса, пика при 2θ по меньшей мере приблизительно 17,3 градуса, пика при 2θ по меньшей мере приблизительно 22,2 градуса и пика при 2θ по меньшей мере приблизительно 28,1 градуса, и любых их комбинаций.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 7,5 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 9,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 12,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H, 9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 24,6 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 7,5 градуса, пика при 2θ по меньшей мере приблизительно 9,9 градуса, пика при 2θ по меньшей мере приблизительно 15 градусов, пика при 2θ по меньшей мере приблизительно 12,3 градуса, пика при 2θ по меньшей мере приблизительно 23,0 градуса, пика при 2θ по меньшей мере приблизительно 23,3 градуса, пика при 2θ по меньшей мере приблизительно 24,6 градуса и пика при 2θ по меньшей мере приблизительно 28,4 градуса, и любых их комбинаций.
Можно получать по меньшей мере одну совокупность частиц, содержащих соединение. Можно определять распределение размера частиц для каждой из по меньшей мере одной совокупности частиц. По меньшей мере одну совокупность частиц можно вводить в неопластические клетки и в нормальные клетки в предопределенной концентрации и в течение предопределенного периода времени. Можно наблюдать действие частиц на метаболизм и/или деление неопластических клеток и нормальных клеток. Можно оценивать индекс эффективности для каждой совокупности частиц на основании действия частиц на неопластические клетки. Можно оценивать индекс токсичности для каждой совокупности частиц на основании действия частиц на нормальные клетки. Индекс эффективности и/или индекс токсичности по меньшей мере одной совокупности частиц, обладающей первым распределением размера частиц, можно сравнивать с индексом эффективности и/или индексом токсичности по меньшей мере одной другой совокупности частиц, обладающей распределением размера частиц, отличным от первого распределения размера частиц. Совокупность частиц, обладающую большим индексом эффективности, меньшим индексом токсичности и/или большей взвешенной суммой индекса эффективности и индекса токсичности, чем по меньшей мере одна другая совокупность частиц, можно выбирать в качестве оптимальной совокупности. Например, распределение размера частиц оптимальной совокупности частиц можно идентифицировать как оптимальное распределение размера частиц. Например, оптимальную совокупность частиц можно включать в композицию. Например, индекс эффективности может являться пропорциональным противоопухолевой активности. Например, индекс эффективности может быть основан на подавлении метаболизма и/или деления неопластических клеток. Например, индекс токсичности может являться обратно пропорциональным переносимости. Например, индекс токсичности может быть основан на подавлении метаболизма и/или деления нормальных клеток. Например, по меньшей мере одну совокупность частиц можно вводить в неопластические клетки и в нормальные клетки in vitro. Например, индекс эффективности может представлять собой IC50 для неопластических клеток. Например, индекс токсичности может представлять собой IC50 для нормальных клеток. Например, по меньшей мере одну совокупность частиц можно вводить в неопластические клетки и в нормальные клетки in vivo в тестируемом животном. Тестируемое животное может представлять собой, например, млекопитающее, примата, мышь, крысу, морскую свинку, кролика или собаку. Индекс эффективности может представлять собой уменьшение объема неопластических клеток, и индекс токсичности может представлять собой уменьшение массы тестируемого животного.
В некоторых вариантах осуществления получение одной совокупности частиц, содержащих соединение, может включать выделение частиц предопределенного распределения размера частиц посредством растворения и диспергирования соединения, растворения и диспергирования соединения микроструйным способом, растворения и диспергирования соединения с помощью кавитации или распыления, размола соединения, размола соединения в шаровой мельнице, вальцевания соединения, размола соединения на струйной мельнице, влажного размола соединения, измельчения соединения посредством ультразвука, растирания соединения и/или просеивания соединения. Частицы можно суспендировать в фармацевтически приемлемом наполнителе. Определение распределения размера частиц может включать использование способа, выбранного из группы, состоящей из ситового анализа, подсчета под световым микроскопом, подсчета на электронной микрофотографии, подсчета по электрорезистентности, определения времени седиментации, лазерной дифракции, акустической спектроскопии и комбинаций.
Способ лечения неоплазии или другого нарушения пролиферации клеток может включать введение человеку, млекопитающему или животному, страдающему от неоплазии, терапевтически эффективного количества композиции, содержащей оптимальную совокупность частиц композиции с оптимальным размером и распределением размера частиц.
Настоящее изобретение также относится к способу получения соединения формулы II
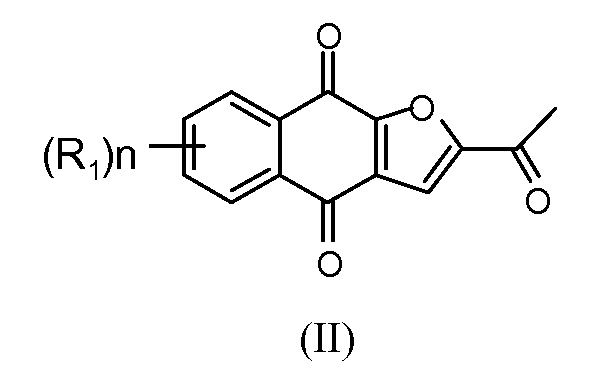
где R1 представляет собой H, Cl или F, где способ включает реакцию соединения формулы
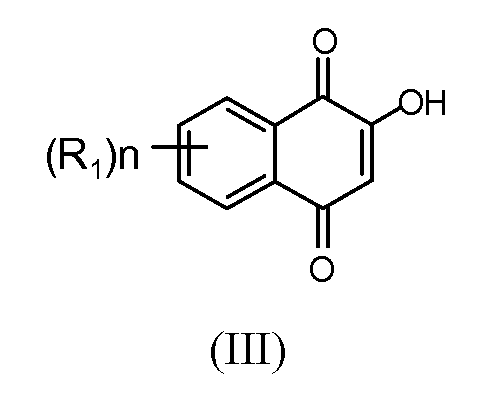
с кетоном в первом растворителе в присутствии основания, кристаллизацию неочищенного продукта из окисленной реакционной смеси и реакцию неочищенного продукта с окисляющим средством во втором растворителе.
В некоторых вариантах осуществления реакцию проводят в контейнере, открытом для атмосферного воздуха.
В некоторых вариантах осуществления кетон представляет собой соединение формулы IV
В некоторых вариантах осуществления первый растворитель выбран из группы, состоящей из тетрагидрофурана (THF), диоксана и толуола, и основание выбрано из группы, состоящей из 1,8-диазабицикло[5,4,0]ундец-7-ена (DBU), триэтиламина и диизопропилэтиламина. В некоторых вариантах осуществления окисляющее средство представляет собой диоксид марганца. В некоторых вариантах осуществления второй растворитель представляет собой толуол. В некоторых вариантах осуществления способ дополнительно включает обработку продукта окисления древесным углем.
Настоящее изобретение относится к способу получения соединения формулы II
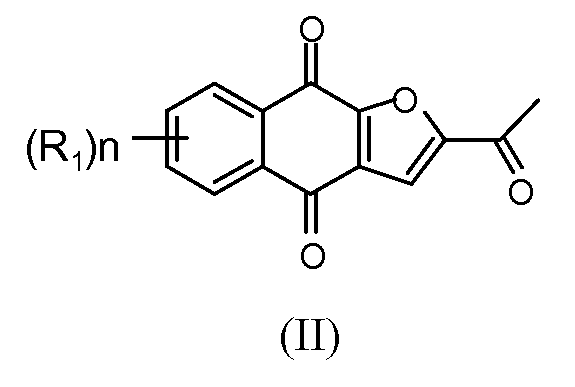
где R1 представляет собой H, Cl или F, где способ включает реакцию соединения формулы
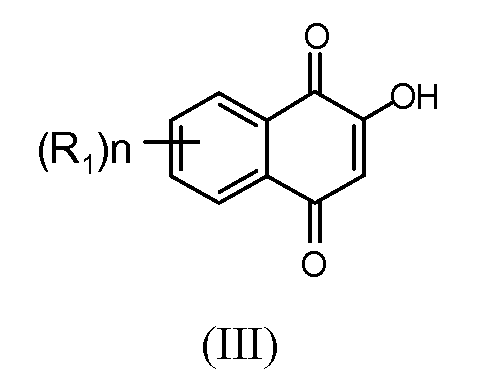
с кетоном в первом растворителе в присутствии основания, кристаллизацию неочищенного продукта из окисленной реакционной смеси, растворение неочищенного продукта во втором растворителе и обработку неочищенного продукта древесным углем.
Настоящее изобретение относится к способу получения нафтофуранового соединения. Способ включает реакцию нафтодигидрофуранового соединения или смеси, содержащей нафтодигидрофурановое соединение, с окисляющим средством в первом растворителе. В некоторых вариантах осуществления смесь дополнительно содержит нафтофурановое соединение. В некоторых вариантах осуществления нафтофурановое соединение выбрано из группы, состоящей из 2-(1-гидроксиэтил)-нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] сложного эфира фосфорной кислоты, диметилового сложного эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового сложного эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов. В некоторых вариантах осуществления окисляющее средство представляет собой диоксид марганца. В некоторых вариантах осуществления первый растворитель представляет собой толуол. В некоторых вариантах осуществления способ дополнительно включает фильтрацию продукта окисления через слой активированного угля. В некоторых вариантах осуществления способ дополнительно включает кристаллизацию нафтофуранового соединения посредством выпаривания первого растворителя. В некоторых вариантах осуществления способ дополнительно включает перекристаллизацию нафтофуранового соединения с помощью второго растворителя. В некоторых вариантах осуществления второй растворитель представляет собой этилацетат. В некоторых вариантах осуществления способ дополнительно включает суспендирование нафтофуранового соединения с помощью второго растворителя, нагревание суспензии и охлаждение суспензии.
Настоящее изобретение относится к способу получения по существу чистого нафтофуранового соединения. Способ включает кристаллизацию нафтофуранового соединения с первым растворителем и перекристаллизацию нафтофуранового соединения с помощью второго растворителя. Настоящее изобретение относится к другому способу получения по существу чистого нафтофуранового соединения. Способ включает кристаллизацию нафтофуранового соединения с помощью первого растворителя, суспендирование кристаллического нафтофуранового соединения с помощью второго растворителя, нагревание суспензии и охлаждение суспензии. В некоторых вариантах осуществления нафтофурановое соединение выбрано из группы, состоящей из 2-(1-гидроксиэтил)-нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] сложного эфира фосфорной кислоты, диметилового сложного эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового сложного эфира фосфорной кислоты, их энантиомера, диастереомера, таутомера и соли или сольвата. В некоторых вариантах осуществления первый растворитель представляет собой толуол. В некоторых вариантах осуществления второй растворитель представляет собой этилацетат.
Настоящее изобретение относится к нафтофурановому соединению, полученному любым из вышеуказанных способов. В некоторых вариантах осуществления нафтофурановое соединение выбрано из группы, состоящей из 2-(1-гидроксиэтил)-нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] сложного эфира фосфорной кислоты, диметилового сложного эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового сложного эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов. В некоторых вариантах осуществления нафтофурановое соединение обладает чистотой по меньшей мере приблизительно 80%, приблизительно 85% или приблизительно 90%, приблизительно 95% или приблизительно 99%. В некоторых вариантах осуществления соединение содержит не более, чем приблизительно 10%, приблизительно 5%, приблизительно 2%, или приблизительно 1%, приблизительно 0,5%, приблизительно 0,2%, приблизительно 0,15% или приблизительно 0,1% примесей.
Изобретение относится к способам получения частиц соединения 1, включая частицы полиморфа соединения 1, частицы высокоочищенных форм соединения 1 и частицы высокоочищенного полиморфа соединения 1. В некоторых вариантах осуществления частицы, обладающие желательным медианным размером частиц, например приблизительно 20 микрон, получают размолом кристаллов соединения 1, включая кристаллы очищенной формы соединения 1, кристаллы полиморфа соединения 1 и/или кристаллы очищенной формы полиморфа соединения 1. Например, кристаллы размалывают с использованием способа размола на струйной мельнице, где давление Вентури составляет приблизительно 40, давление измельчения составляет приблизительно 100 и скорость подачи составляет приблизительно 1304 г/час.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1 представляет собой иллюстрацию, показывающую данные XRPD кристаллической формы 1.
Фиг.2 представляет собой иллюстрацию, показывающую данные XRPD кристаллической формы 2.
Фиг.3 представляет собой иллюстрацию, показывающую данные XRPD кристаллической формы 3.
Фиг.4 представляет собой иллюстрацию, показывающую сравнение данных XRPD кристаллической формы 1 и кристаллической формы 3.
Фиг.5A и 5B представляют собой серии иллюстраций, изображающих способ синтеза кристаллической формы 2.
Фиг.6A-6D представляют собой серии иллюстраций, изображающих способ синтеза кристаллической формы 3.
Фиг.7A и 7B представляют собой фотографии, изображающие морфологию кристаллических форм 1 и 3.
Фиг.8 представляет собой график, изображающий ограниченную противоопухолевую активность кристаллической формы 1.
Фиг.9 представляет собой график, изображающий противоопухолевую активность кристаллической формы 2.
Фиг.10 представляет собой график, изображающий сравнение противоопухолевой активности кристаллической формы 1 и кристаллической формы 3.
Фиг.11 представляет собой график, изображающий данные клинической фармакокинетики (PK) для кристаллической формы 2 у пациентов со злокачественными опухолями.
Фиг.12 представляет собой график, изображающий данные клинической PK для кристаллической формы 3 у пациентов со злокачественными опухолями.
Фиг.13 представляет собой график, изображающий токсичность, наблюдаемую для кристаллической формы 2 с приблизительно 90% чистотой, полученной способом синтеза, проиллюстрированным на фиг.5A-5B.
Фиг.14 представляет собой график, изображающий безопасность кристаллической формы 2 с приблизительно 95% чистотой, полученной способом синтеза, проиллюстрированным на фиг.5A-5B.
Фиг.15 представляет собой график, изображающий противоопухолевую активность соединения 1 с различными диапазонами размера частиц.
Фиг.16 представляет собой график, изображающий данные PK соединения 1 in vivo с различными диапазонами размера частиц.
Фиг.17 представляет собой график, изображающий связь между растворением и размером частиц соединения 1.
Фиг.18 представляет собой иллюстрацию, показывающую различия между специфическими для злокачественных стволовых клеток и общепринятыми лекарственными средствами против злокачественных опухолей.
Фиг.19 представляет собой иллюстрацию, показывающую полную регрессию очага метастазирования рака толстого кишечника в почке.
Фиг.20 представляет собой график, иллюстрирующий фармакокинетику BID дозирования у пациентов, где пациентам вводили дозу 500 мг дважды в сутки (суммарная суточная доза 1000 мг).
Фиг.21 представляет собой график, иллюстрирующий фармакокинетику суточного дозирования у пациентов, где пациентам вводили дозу 20 мг один раз в сутки.
Фиг.22 представляет собой график, иллюстрирующий сравнение выживаемости без прогрессирования пациентов с колоректальным раком после лечения соединением 1. Выживаемость без прогрессирования (PFS) подлежащих оценке пациентов с колоректальным раком после лечения соединением 1 сравнивали с ретроспективными данными PFS по наилучшему поддерживающему лечению у пациентов с колоректальным раком.
Фиг.23 представляет собой график, иллюстрирующий сравнение выживаемости без прогрессирования (PFS) с фармакокинетическим действием. PFS подлежащих оценке пациентов, получающих соединение 1, сравнивали в зависимости от воздействия соединения 1 выше или ниже 1,6 мкМ в течение по меньшей мере 4 часов.
Фиг.24 представляет собой график, иллюстрирующий желаемый профиль PK с улучшенной безопасностью и эффективностью.
Фиг.25 представляет собой фотографию, иллюстрирующую, что пациенты, достигшие продолжительного стабильного заболевания (>16 недель) в ходе лечения BBI608, обладают высокими уровнями p-STAT3 в тканях опухолей до лечения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Варианты осуществления изобретения более подробно описаны ниже. При описании вариантов осуществления для ясности используют конкретную терминологию. Однако изобретение не предназначено для ограничения выбранной таким образом конкретной терминологией. Специалисту в соответствующей области известно, что можно использовать другие эквивалентные компоненты и другие разработанные способы без отклонения от содержания и объема изобретения. Содержание всех ссылок, процитированных в настоящем документе, приведено, как если бы содержание каждой было бы приведено отдельно.
В этом тексте «значительная фракция» совокупности частиц может составлять по меньшей мере приблизительно 99%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 80%, по меньшей мере приблизительно 75%, по меньшей мере приблизительно 70%, по меньшей мере приблизительно 60%, или по меньшей мере приблизительно 50% из общего количества частиц в совокупности.
Активность композиции против злокачественных стволовых клеток можно определять in vitro или in vivo. Например, противоопухолевую активность композиции можно определять in vitro посредством введения соединения и измерения самообновления и выживаемости злокачественных стволовых клеток. Например, противоопухолевую активность соединения можно оценивать in vitro посредством сравнения поведения клеток опухолей, в которые вводили соединение, с поведением клеток опухолей, в которые соединение не вводили (контроль). Например, противоопухолевую активность композиции можно определять in vivo посредством измерения, у животного, которому вводили соединение, изменения объема опухоли, посредством использования метастазирующей модели и/или посредством использования ортотопической модели. Например, противоопухолевую активность соединения можно оценивать in vivo посредством сравнения животного, которому вводили соединение, с животным, которому соединения не вводили (контроль).
Переносимость композиции можно определять in vitro или in vivo. Например, переносимость композиции можно определять in vitro посредством введения соединения и измерения скорости деления нормальных клеток, посредством измерения поглощения питательных веществ нормальными клетками, посредством измерения показателей скорости метаболизма нормальных клеток, отличных от поглощения питательных веществ, посредством измерения роста нормальных клеток и/или посредством измерения другого показателя жизнеспособности нормальных клеток. Например, переносимость соединения можно оценивать in vitro посредством сравнения поведения нормальных клеток, в которые вводили соединение, с поведением нормальных клеток, в которые соединение не вводили (контроль). Например, переносимость композиции можно определять in vivo посредством измерения у животного, которому вводили соединение, массы тела или потребления пищи или проведения клинических наблюдений, таких как сохранение или потеря шерсти, активность и/или способность отвечать на стимулы. Например, переносимость соединения можно оценивать in vivo посредством сравнения животного, которому вводили соединение, с животным, которому соединения не вводили (контроль).
Соединению, продукту и/или фармацевтической композиции можно приписать индекс эффективности и/или индекс токсичности. Например, индекс эффективности может являться пропорциональным противоопухолевой активности или может представлять собой монотонно возрастающую функцию относительно противоопухолевой активности. Например, индекс токсичности может являться обратно пропорциональным переносимости или может представлять собой монотонно убывающую функцию относительно переносимости. Опубликовано, что у нафтофуранового соединения отсутствует противоопухолевая активность in vivo. См., M.M. Rao and D.G.I. Kingston, J. Natural Products, 45(5) (1982) 600-604. Более того, опубликовано, что соединение является одинаково токсичным для злокачественных клеток и нормальных клеток. То есть, опубликовано, что соединение является одинаково уничтожающим злокачественные клетки и нормальные клетки, что позволяет заключить, что соединение не обладает потенциалом для лечения злокачественных опухолей. См., K. Hirai K. et al., Cancer Detection and Prevention, 23(6) (1999) 539-550; Takano A. et al., Anticancer Research 29:455-464, 2009.
Однако экспериментальные исследования, опубликованные в настоящем документе, указывают на то, что когда соединение вводят в виде частиц, обладающих соответствующим распределением размера частиц для достижения определенного фармакокинетического действия, как описано в этой публикации, соединение действительно обладает избирательной противоопухолевой активностью.
Для целей по настоящему изобретению «биодоступность» лекарственного средства определяют как относительное количество лекарственного средства из вводимой лекарственной формы, которое входит в системный кровоток, и скорость, с которой лекарственное средство попадает в кровоток. Биодоступность определяется по меньшей мере тремя факторами: (i) всасыванием, контролирующим биодоступность, с последующими (ii) его перераспределением в тканях и (iii) выведением (метаболическая деградация плюс почечный и другие механизмы).
«Абсолютную биодоступность» оценивают, принимая во внимание перераспределение в тканях и биотрансформацию (т.е. выведение), которые в свою очередь можно определять посредством внутривенного введения лекарственного средства. Если нет иных указаний, «HPLC» относится к высокоэффективной жидкостной хроматографии; «фармацевтически приемлемый» относится к физиологически переносимым материалам, которые, как правило, не вызывают аллергической или другой нежелательной реакции, такой как расстройство желудка, головокружение и т.п., при введении млекопитающему; «млекопитающее» относится к классу высших позвоночных, включая человека и всех других животных, вскармливающих свое потомство молоком, секретируемым молочными железами, и обладающих кожей, обычно более или менее покрытой волосами; и «лечение» предназначено, чтобы включать облегчение, ослабление или устранение по меньшей мере одного симптома заболевания(ий) у млекопитающего.
Термин «лечение», как применяют в настоящем документе, предназначено, чтобы включать введение соединений по изобретению профилактически для предотвращения или супрессии нежелательного состояния и терапевтически для устранения или уменьшения степени или симптомов состояния. Лечение также включает предотвращение рецидива нежелательного состояния, задержку прогрессирования нежелательного состояния и предотвращение или задержку начала нежелательного состояния. Лечение по изобретению проводят для человека или другого млекопитающего, страдающего от заболевания или состояния, вызывающего необходимость такого лечения. Лечение включает также введение соединения в клетки или органы in vitro. Лечение может представлять собой системное или местное введение.
Эффективное количество представляет собой количество активного ингредиента, вводимого в однократной дозе или множественных дозах, необходимое для достижения желательного фармакологического действия. Специалист в данной области может определять и оптимизировать эффективную дозу для индивидуального пациента или для лечения отдельного состояния посредством общепринятых экспериментов и титрования, хорошо известных клиническим специалистам. Фактическая доза и расписание могут меняться в зависимости от того, вводят ли композиции в комбинации с другими лекарственными средствами, или в зависимости от индивидуальных отличий в фармакокинетике, распределения лекарственного средства и метаболизма. Подобным образом, количества могут меняться для применений in vitro. В компетенцию специалиста в данной области входит регуляция дозы в соответствии с необходимостью для конкретной ситуации без излишнего экспериментирования. При описании в настоящем документе диапазоны дозирования не исключают использования более высокой или более низкой дозы компонента, чем может быть обосновано для конкретного применения.
Описания фармацевтических композиций, представленные в настоящем документе, включают фармацевтические композиции, пригодные для введения человеку. Специалисту в данной области понятно, на основании этого описания, что такие композиции в общем пригодны для введения любому млекопитающему или другому животному. Получение композиций, пригодных для введения различным животным, хорошо известно, и специалист в области ветеринарной фармакологии может разрабатывать и осуществлять такие модификации с помощью общепринятых экспериментов на основании фармацевтических композиций для введения человеку.
Структура и свойства соединений
Нафтофурановое соединение формулы I, такое как 2-(1-гидроксиэтил)-нафто[2,3-b]фуран-4,9-дион, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-дион, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-дион, 2-ацетилнафто[2,3-b]фуран-4,9-дион, 2-этилнафто[2,3-b]фуран-4,9-дион, являлось практически нерастворимым в воде и в широкой панели тестированных растворителей, включая DMSO (диметилсульфоксид), N-метилпирролидин, DMA (диметилацетамид), этанол, PEG400 (полиэтиленгликоль 400), пропиленгликоль, кремофор EL (полиэтоксилированное касторовое масло), лабразол (каприлокапроиловые макроглицериды (полиоксилглицериды), лабрафил M (сложный эфир растительного масла и PEG-6 (полиэтиленгликоля)) и каприол (каприлат пропиленгликоля). Нафтофурановое соединение может являться растворимым в ряде полярных органических растворителей, таких как конкретные галогенуглероды, например, хлоруглероды, подобные метиленхлориду, сложные эфиры, этилацетат, карбоновые кислоты, такие как уксусная кислота, кетоны, такие как ацетон, и спирты, такие как метанол. Обнаружено, что нафтофурановое соединение являлось растворимым в метиленхлориде и этилацетате.
В настоящем документе описаны экспериментальные исследования, в которых обнаружено, что избирательной противоопухолевой активности достигали посредством введения активного соединения фармацевтической композиции в форме небольших частиц для достижения конкретного фармакокинетического воздействия для избирательной противораковой активности, сфокусированной в нафтофурановом соединении. С учетом обсуждаемых в настоящее время наблюдений, сделанных для соединения, другие нафтофураны, например нафтофураны, могут сходным образом обладать преимущественными модификациями фармакокинетических профилей для достижения конкретного фармакокинетического воздействия для достижения избирательной противораковой активности при введении в форме частиц небольшого диаметра. Фармакокинетический профиль других нафтофуранов, вводимых в виде частиц с одним или несколькими различными распределениями размера, можно определить экспериментально.
Некоторые другие соединения, которые могут обладать улучшением фармакокинетического профиля и эффективностью с уменьшением размера частиц формы, в которой их вводят животному, млекопитающему или человеку, как наблюдали для соединения, тестированного в примерах, включают соединения, представленные в виде формулы I, и их соли и сольваты
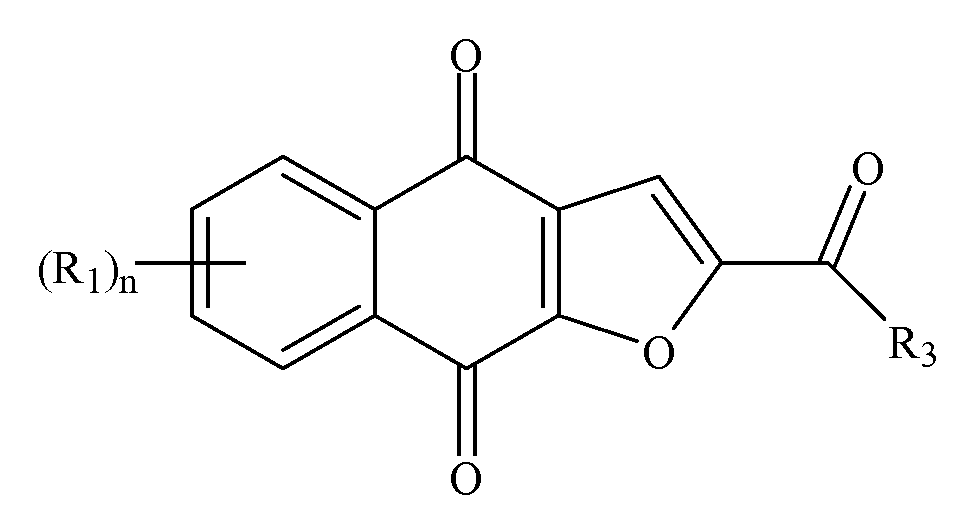
Формула I
В формуле I индекс (R1)n указывает на то, что заместитель (R1) является независимо замещенным в каждом доступном положении бензольного кольца. Например, при n равном 4, четыре заместителя R1 могут являться одинаковыми, или каждый из них может отличаться от любого другого. Например, каждый (R1) может являться независимо выбранным из группы, состоящей из водорода, галогена, фтора, циано, нитро, CF3, OCF3, алкила, метила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила, замещенного арила, ORa, SRa и NH2. Алкил может включать группы, обладающие, например, от 1 до 8 атомов углерода, соединенных одинарными связями, алкенил может включать группы, обладающие, например, от 2 до 8 атомов углерода, соединенных одной или несколькими двойными связями, и алкинил может включать группы, обладающие, например, от 2 до 8 атомов углерода, соединенных одной или несколькими тройными связями. Заместители могут содержать такие группы, как водород, галоген, циано, нитро, арил, ORa, SRa, и NH2. Например, каждый (R1) может являться независимо выбранным из группы, состоящей из водорода, метила, F (фтора), Cl (хлора), Br (брома), I (йода), OH (гидроксила) и NH2 (амина). Например, R3 может являться выбранным из группы, состоящей из водорода, галогена, фтора, циано, CF3, OCF3, алкила, метила, замещенного алкила, галоген-замещенного алкила, гидроксил-замещенного алкила, амин-замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила, замещеного арила, ORa, SRa и NRbRc. Например, R3 может являться выбранным из группы, состоящей из метила и C(R8)3. Каждый (R8) может являться независимо выбранным из группы, состоящей из водорода, метила, F (фтора), Cl, Br, I, OH и NH2. Например, самое большее два независимо выбранных заместителей (R1) и заместителей (R8) могут являться выбранными представляющими собой F (фтор), где остальные могут являться выбранными представляющими собой водород.
В некоторых вариантах осуществления соединение формулы I выбрано из группы, состоящей из 2-(1-гидроксиэтил)-нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, их энантиомеров, диастереомеров, таутомеров и солей или сольватов. Например, каждый (R1) может являться выбранным представляющим собой водород, и R3 может являться выбранным представляющим собой метил, так что соединение формулы I представляет собой 2-ацетилнафто[2,3-b]фуран-4,9-дион. Например, каждый Ra может являться независимо выбранным из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, циклоалкила, замещенного циклоалкила, циклоалкенила, замещенного циклоалкенила, гетероцикла, замещенного гетероцикла, арила и замещенного арила. Например, каждый Rb и Rc может являться независимо выбранным из группы, состоящей из водорода, алкила, замещенного алкила, циклоалкила, замещенного циклоалкила, гетероцикла, замещенного гетероцикла, арила и замещенного арила. Альтернативно, Rb и Rc вместе с N, с которым они связаны, могут формировать гетероцикл или замещенный гетероцикл.
Полиморфы
Нафтофурановые соединения по изобретению включают полиморфы. В некоторых вариантах осуществления полиморф представляет собой полиморф соединения формулы I. В некоторых вариантах осуществления полиморф представляет собой полиморф соединения 1. Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.1. Этот полиморф обозначен в настоящем документе как «кристаллическая форма 1», «форма 1» или «XRPD1» и эти термины используют взаимозаменяемо. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.2. Этот полиморф обозначен в настоящем документе как «кристаллическая форма 2», «форма 2» или «XRPD2», и эти термины используют взаимозаменяемо. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, по существу сходной с приведенной на фиг.3. Этот полиморф обозначен в настоящем документе как «кристаллическая форма 3», «форма 3» или «XRPD3», и эти термины используют взаимозаменяемо.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,4, 11,9, 14,1, 14,5, 17,3, 21,0, 22,2, 24,0, 26,0 и 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 10,2, 11,9, 14,1, 14,5, 17,3, 22,2, и/или 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 10,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 11,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 14,5 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 17,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 22,2 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,1 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 10,2 градуса, пика при 2θ по меньшей мере приблизительно 11,9 градуса, пика при 2θ по меньшей мере приблизительно 14,1 градуса, пика при 2θ по меньшей мере приблизительно 14,5 градуса, пика при 2θ по меньшей мере приблизительно 17,3 градуса, пика при 2θ по меньшей мере приблизительно 22,2 градуса, и пика при 2θ по меньшей мере приблизительно 28,1 градуса, и любых их комбинаций.
Например, в некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 11,4, 12,3, 15,0, 23,0, 23,3, 24,1, 24,6, 25,0, 26,1, 27,0 и 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей один или несколько пиков при 2θ по меньшей мере приблизительно 7,5, 9,9, 12,3, 15, 23,0, 23,3, 24,6 и/или 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 7,5 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 9,9 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 12,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 15 градусов. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 23,3 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 24,6 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей пик при 2θ по меньшей мере приблизительно 28,4 градуса. В некоторых вариантах осуществления полиморф представляет собой полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, включающей два или более пиков из пика при 2θ по меньшей мере приблизительно 7,5 градуса, пика при 2θ по меньшей мере приблизительно 9,9 градуса, пика при 2θ по меньшей мере приблизительно 15 градусов, пика при 2θ по меньшей мере приблизительно 12,3 градуса, пика при 2θ по меньшей мере приблизительно 23,0 градуса, пика при 2θ по меньшей мере приблизительно 23,3 градуса, пика при 2θ по меньшей мере приблизительно 24,6 градуса и пика при 2θ по меньшей мере приблизительно 28,4 градуса, и любых их комбинаций.
Кристаллическую форму 1 детектировали во множестве растворителей и условий, но показано, что она обладает низкой противоопухолевой активностью (фиг.8). В исследовании, показанном на фиг.8, иммуносупрессированным мышам с прижившимся подкожным раком головы и шеи человека FaDu вводили указанное количество размолотого вручную соединения 1 с кристаллической формой 1, или контроля-носителя перорально (po). Соединение 1 составляли в ГЕЛЮЦИРЕ™ (GELUCIRE™). Введение во всех режимах осуществляли ежесуточно (qd). Размеры опухолей оценивали периодически в ходе обработки.
Кристаллическую форму 2 неожиданно получили в присутствии примеси, и показано, что этот полиморф обладает сильной противоопухолевой активностью (фиг.9). В исследовании, показанном на фиг.9, иммуносупрессированным мышам с прижившимся подкожным раком головы и шеи человека FaDu вводили 100 мг/кг тонкоизмельченного соединения 1, полученного способом синтеза, описанным на фиг.5A и 5B (первый сбор), или контроля-носителя перорально (po). Соединение 1 составляли в ГЕЛЮЦИРЕ™. Все режимы введения осуществляли ежесуточно (qd). Размеры опухолей оценивали периодически в ходе обработки. Форму 2 успешно изготавливали современным способом с надлежащей практикой организации производства (cGMP) и получили одобрение от FDA и Health Canada для ее использования в клинических исследованиях. Для формы 2 показана желательная фармакокинетика (фиг.11), безопасность и убедительные признаки противоопухолевой активности для пациентов со злокачественными опухолями.
Показано, что кристаллическая форма 3 разделяет сходную, но отличающуюся порошковую дифракционную рентгенограмму (XRPD) с формой 1, и обладает характером кристаллизации, очень отличающимся от формы 1 (фиг.7A и B). Форму 3 можно получить только из формы 1 с использованием специально разработанного способа суспендирования, описанного в настоящем документе. Показано, что форма 3 обладает сильной противоопухолевой активностью (Фиг.10). В исследовании, показанном на фиг.10, иммуносупрессированным мышам с прижившимся подкожным раком головы и шеи человека FaDu вводили 200 мг/кг соединения 1 в размолотой вручную кристаллической форме 1 или форме 3 или контроль-носитель перорально (po). Соединение 1 составляли в гелюцире. Все режимы введения осуществляли ежесуточно (qd). Размеры опухолей оценивали периодически в ходе обработки. Этот полиморф успешно изготавливали способом cGMP и получили одобрение от FDA и Health Canada для его использования в клинических исследованиях. Для формы 3 также показана желательная фармакокинетика (фиг.12), безопасность и убедительные признаки противоопухолевой активности для пациентов со злокачественными опухолями.
Способ синтеза для получения кристаллической формы 2 показан на фиг.5A-5B. Кратко, заряженный 3-бутен-2-он (451,2 грамма) добавляют в 2-литровую 3-горлую круглодонную колбу, оборудованную механической мешалкой, термометром и капельной воронкой. В капельную воронку добавляют бром (936,0 граммов). После охлаждения содержимого колбы до -5°C бром добавляют по каплям в колбу при интенсивном перемешивании и поддержании температуры при -5°C в течение 30 минут. Смесь перемешивают в течение дополнительных 15 минут при -5°C и затем разделяют на 4 равные порции. Каждую порцию смеси вместе с тетрагидрофураном (2133,6 грамма) добавляют в 22-литровую 4-горлую круглодонную колбу, оборудованную механической мешалкой, термометром и капельной воронкой. В капельную воронку добавляют DBU (1,3-диазабицикло[5.4.0]ундец-7-ен, 222,9 грамма). DBU добавляют по каплям в колбу при интенсивном перемешивании и поддержании температуры при 0°C-5°C в течение 30 минут. Смесь перемешивают в течение дополнительных 15 мин при 0°C-5°C. Затем в колбу добавляют 2-гидрокси-1,4-нафтохинон (231 грамм). Дополнительный DBU (246,0 граммов) добавляют в капельную воронку и затем добавляют по каплям в смесь в колбе с такой скоростью, что температура реакционной смеси не превышает 40°C. После завершения добавления DBU полученную смесь перемешивают в течение ночи при комнатной температуре и образец реакционной смеси отбирают для анализа HPLC. В реакционную смесь добавляют воду (10,8 литра), и полученную смесь охлаждают до 0°C-3°C в течение по меньшей мере 30 минут, и затем фильтруют через вакуумный фильтр. Отфильтрованное твердое вещество промывают последовательно 5% водным бикарбонатом натрия (3 литра), водой (3 литра), 1% водной уксусной кислотой (3 литра) и этанолом дважды (2×1 литр). Промытое твердое вещество сохраняют и объединяют с веществом из других партий. Объединенный неочищенный продукт (28,73 кг) добавляют вместе с этилацетатом (811,7 кг) в сосуд на 500 галлонов (1893 л), оборудованный механической мешалкой, термометром и конденсатором. В атмосфере азота смесь нагревают до кипения с обратным холодильником (72°C) в течение 2 часов и затем фильтруют с помощью патронного фильтра 10 микрон, содержащего слой активированного угля, для удаления нерастворимых примесей. Свежий горячий этилацетат (10 кг) используют для промывки сосуда, транспортной линии и фильтра. Объединенный фильтрат охлаждают до 0-5°C и выдерживают при этой температуре 2 часа, и затем фильтруют через фильтр Бюхнера 20 дюймов (0,508 м). Отфильтрованный твердый продукт промывают при 0-5°C этилацетатом (5,7 кг) и высушивают в вакууме при 40°C до постоянной массы. Объем оставшегося фильтрата уменьшают до 63% выпариванием и процесс кристаллизации снова повторяют для получения второй порции продукта, которую также высушивают в таких же условиях, что и первый сбор продукта. Обе полученных порции представляют собой кристаллическую форму 2. Первая полученная порция (0,5 кг) обладала 99,5% чистотой по HPLC (~95% по ЯМР). Вторая полученная порция (1,09 кг) обладала 98,9% чистотой по HPLC (~90% по ЯМР).
Способ синтеза для получения кристаллической формы 3 показан на фиг.6A-6D. Стадии кратко описаны в настоящем документе. Стадия 1: 3-бутен-2-он (метилвинилкетон, MVK) бромируют с использованием брома. Дополнительного растворителя не используют. Промежуточное соединение 3,4-дибромбутан-2-он растворяют в тетрагидрофуране (THF) и проводят реакцию с 1,8-диазабицикло[5.4.0]ундец-7-еном (DBU) для образования второго промежуточного соединения, 3-бром-3-бутен-2-она. После завершения этой реакции добавляют 2-гидрокси-1,4-нафтохинон (HNQ). Добавляют вторую порцию DBU, и смесь подвергают воздействию воздуха. Реакцию останавливают водой и твердые вещества собирают фильтрацией. Эти твердые вещества промывают водным бикарбонатом натрия, водной уксусной кислотой, водой и этанолом. Продукт выделяют посредством суспендирования в этаноле и сбора твердых веществ. Стадия 2: Остаточные количества 2-ацетил-2,3-дигидронафто[2,3-b]фуран-4,9-диона, сопутствующего желаемому 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диону (соединение 1) окисляют до соединения 1 с помощью активированного диоксида марганца в толуоле. Смесь фильтруют через слой угля и целит. Фильтрат концентрируют для осаждения продукта, который фильтруют и высушивают. Стадия 3: твердые вещества суспендируют в этилацетате (25 мл/г очищенного соединения 1) при 75°C-80°C в течение приблизительно 5 час, собирают фильтрацией и высушивают. Соединение 1, полученное этим способом, представляет собой кристаллическую форму 3. Соединение 1, полученное этим способом без процесса суспендирования, дает кристаллическую форму 1.
Влияние распределения размера частиц соединения на концентрацию лекарственного средства в плазме крови и избирательную противоопухолевую активность
До настоящего изобретения микрочастиц соединения 1 не получали и/или не оценивали. Предшествующие исследования показали, что соединение 1 является одинаково токсичным для нормальных клеток и злокачественных клеток, и противоопухолевой активности не наблюдали в модели на животных. Исследования, представленные в настоящем документе, показывают, что уменьшение размера частиц соединения 1 не только улучшало биодоступность, но также приводило к увеличенной избирательной противоопухолевой активности без признаков токсичности. Это является неожиданным, поскольку улучшение биодоступности может одинаково увеличивать воздействие соединения 1 на злокачественные клетки и нормальные клетки. Механизм избирательного улучшения противораковой активности без увеличения токсичности для нормальных клеток неизвестен. В этих исследованиях улучшение биодоступности соединения 1, по-видимому, является максимальным, когда D50 (т.е. медианная точка распределения размера частиц, которая делит распределение на две равные части) составляет приблизительно 20 мкм. Однако проводили дополнительные исследования, где значение D50 составляло приблизительно 2 мкм. Микрочастицы соединения 1, обладающие D50 2 микрон, неожиданно обладали усиленной противоопухолевой активностью, даже несмотря на то, что не присутствует улучшения фармакокинетического действия по сравнению с частицами с D50 20 микрон. В дополнительных исследованиях получены наночастицы соединения 1, обладающие D50 приблизительно 100 нанометров (D50 = 110,4 нанометра), однако неожиданно, снижение противоопухолевой активности наблюдали для этого размера частиц соединения 1. Соответственно, в предпочтительном варианте осуществления композиции, содержащие частицы соединения 1, например, микрочастицы, обладают D50, равным или ниже 20 микрон и равным или выше 0,2 микрона, и обладают неожиданно сильной противоопухолевой активностью без увеличения цитотоксичности для нормальных клеток.
Противоопухолевая активность частиц соединения 1 с различными диапазонами размера частиц проиллюстрирована на фиг.15, и данные фармакокинетики для частиц соединения 1 с различными диапазонами размера частиц проиллюстрированы на фиг.16-18. В исследовании, показанном на фиг.15, иммуносупрессированным мышам с прижившимся подкожным раком головы и шеи человека FaDu вводили указанное количество соединения 1 с указанным размером частиц, или контроль-носитель перорально (po). Все режимы введения осуществляли ежесуточно (qd). Размер опухоли оценивали периодически.
Обнаружили, что введение нафтофуранового соединения в форме частиц, обладающих определенным размером частиц, например, уменьшенным размером частиц, увеличивало концентрацию лекарственного средства в плазме in vivo. В настоящем документе, если нет иных указаний, термины «размер» и «диаметр» используют взаимозаменяемо для описания частиц. Следует понимать, что использование термина «диаметр» необязательно подразумевает, что частица обладает совершенной или приблизительно сферической формой. Например, «диаметр» можно использовать в качестве приближения для размера частицы, например, диаметр сферы равного объема для несферической частицы.
Неожиданно в результате обнаружили, что введение частиц нафтофуранового соединения с определенным распределением размера частиц, например в форме небольших частиц, в фармацевтической композиции приводит к избирательной противоопухолевой активности. Например, для соединения, вводимого в форме частиц, обладающих медианным размером частиц 20 мкм (т.е. микрон, эти термины используют взаимозаменяемо в настоящем документе), показана эффективность (избирательная противоопухолевая активность), хотя относительно низкая, в моделях ксенотрансплантата на мышах. В отличие от этого, для частиц 150 мкм (микрон) не показали эффективности. Открытие, что введение нафтофуранового соединения в форме меньших частиц может приводить к избирательной противоопухолевой активности, является неожиданным и не может быть объяснено только на основании улучшения растворимости или биодоступности. То есть, как правило, улучшенная растворимость связана с увеличенной пероральной биодоступностью лекарственного средства, которая может увеличивать токсичность для нормальных клеток, так же как противоопухолевую активность. Как обсуждали выше, нафтофурановое соединение может являться одинаково токсичным для клеток опухолей и нормальных клеток, если воздействие не осуществляют в определенных условиях, как описано в WO 2009/036099 и WO 2009/036101.
Кроме того, неожиданно в результате обнаружили, что введение частиц нафтофуранового соединения с дополнительно уменьшенным размером частиц в фармацевтической композиции приводит к значительно улучшенной противоопухолевой активности, но почти неизмененному фармакокинетическому профилю, т.е. неизмененной биодоступности. Например, для соединения, вводимого в форме частиц, обладающих медианным размером частиц 2 мкм (микрон), показана значительно улучшенная эффективность в моделях ксенотрансплантата на мышах. По сравнению с частицами 20 мкм, для частиц 2 мкм показана значительно улучшенная эффективность, но очень сходный фармакокинетический профиль. Иными словами, такая улучшенная эффективность является независимой от фармакокинетического профиля, т.е. биодоступности. Результат является очень неожиданным, поскольку для такого соединения с плохой растворимостью улучшенная эффективность обычно связана с увеличенной пероральной биодоступностью лекарственного средства.
Наблюдаемое улучшение избирательной противоопухолевой активности является, таким образом, удивительным и неожиданным. Настоящее изобретение относится к частице или частицам нафтофуранового соединения, например, соединения формулы I, которые являются активными, т.е. обладают эффективностью или избирательной противоопухолевой активностью. Активная частица или частицы обладают определенным размером частиц, например, имеют диаметр, меньший или равный приблизительно 200 мкм, приблизительно 150 мкм, приблизительно 100 мкм, приблизительно 40 мкм, или приблизительно 20 мкм, приблизительно 10 мкм, приблизительно 5 мкм, приблизительно 4 мкм, приблизительно 3 мкм, приблизительно 2 мкм, приблизительно 1 мкм, приблизительно 0,5 мкм, приблизительно 0,2 мкм или приблизительно 0,1 мкм. Частица или частицы, превышающие определенный размер частиц, являются либо неактивными, либо менее активными, чем частицы, описанные в настоящем документе.
Таким образом, введение нафтофуранового соединения или другого соединения формулы I в форме меньших частиц может приводить к улучшению его избирательной противоопухолевой активности. Использование частиц соединения формулы I, обладающих определенным распределением размера частиц, при дозировании может позволять получение желательной избирательной противоопухолевой активности. Например, использование частиц нафтофуранового соединения, обладающих определенным распределением размера частиц, например являющихся небольшими частицами, может приводить к более высокой концентрации в крови в течение более короткого периода времени, и избирательной противоопухолевой активности, хотя и относительно низкой. Дальнейшее уменьшение размера частиц соединения может приводить к значительно улучшенной эффективности при неизмененной концентрации соединения в плазме крови.
В настоящем документе, если нет иных указаний, термины «концентрация в плазме крови», «молярная концентрация в крови» и «концентрация в крови» используют взаимозаменяемо. Термин «неоплазия» можно использовать для описания клеток, обладающих аномальным характером роста. Такая неоплазия может включать опухоли, как доброкачественные, так и злокачественные, например солидные опухоли, так же как другие нарушения роста клеток, такие как лейкоз, который не обладает определенной формой и не ограничен конкретной областью организма человека или животного. Таким образом, «неоплазия» включает как злокачественные, так и не злокачественные неопластические клетки и ткани. В настоящем документе, если нет иных указаний, для разъяснения или по отношению к конкретному исследованию или эксперименту, термины «опухоль» и «злокачественная опухоль» следует понимать как относящиеся к более широкому классу всех неоплазий, включая неоплазии, не ограниченные конкретной областью организма человека или животного. Однако, более ограниченный термин «солидная опухоль» следует понимать как не включающий нарушения роста клеток, такие как лейкоз, который не обладает определенной формой и не ограничен конкретной областью организма человека или животного.
Неоплазия может не обладать, обладать одной или обладать более одной из следующих характеристик: твердая форма (солидная опухоль), злокачественность, метастазирование или активность пути Stat 3. Неоплазия может включать, например, злокачественную стволовую клетку. Неоплазия может представлять собой, например, карциному, саркому, аденокарциному, лимфому или гематологическое злокачественное новообразование.
Абсорбцию определяют как процесс, посредством которого лекарственное средство поступает от участка введения к участку измерения в организме. См., M. Rowland, T.N. Tozer (1995) Clinical pharmacokinetics: Concepts and applications. Lippincott Williams & Wilkins. Пероральную абсорбцию лекарственного средства часто определяют как перенос лекарственного средства через апикальную мембрану энтероцита, поскольку считают, что апикальная мембрана является лимитирующей скорость стадией для прохождения через мембрану. См., U. Fagerholm & H. Lennernäs (1995) Experimental estimation of the effective unstirred water layer thickness in the human jejunum, and its importance in oral drug absorption, Eur J Pharm Sci 3: 247-253; M.B. Lande, J.M. Donovan & M.L. Zeidel (1995) The relationship between membrane fluidity and permeabilities to water, solutes, ammonia, and protons, J Gen Physiol 106: 67-84. Проницаемость является общим термином, описывающим, насколько легко лекарственное средство переносится через мембрану. Конкретные характеристики проницаемости лекарственного средства зависят от его физико-химических свойств, включая липофильность, заряд, размер и область полярной поверхности. См., Rowland & Tozer 1995; C.A. Lipinski, F. Lombardo, B.W. Dominy & P.J. Feeney (2001) Experimental and computational approaches to estimate solubility and permeability in drug discovery and development settings, Adv. Drug Deliv. Rev. 46: 3-26. Скорость абсорбции зависит от проницаемости лекарственного средства, площади поверхности мембраны и градиента концентрации через мембрану. Градиент концентрации является движущей силой пассивной диффузии, наиболее распространенного механизма мембранного транспорта лекарственного средства. В случае перорального введения лекарственное средство в основном абсорбируется в кишечнике. Кишечник человека составляет в длину приблизительно 5-8 метров и имеет общую площадь поверхности почти 200 квадратных метров, в то время как кишечник мыши составляет только приблизительно 10-20 см в длину. Таким образом, можно предсказать, что лекарственное средство с более крупным размером частиц может обладать более высокой или одинаковой скоростью абсорбции у человека, чем скорость абсорбции, которой лекарственное средство с меньшим размером частиц обладает у мыши, несмотря на то, что проницаемость лекарственного средства с более крупным размером частиц ниже, чем проницаемость лекарственного средства с меньшим размером частиц.
Например, можно предсказать, что распределение размеров частиц соединения формулы I, обладающих медианным диаметром, меньшим или равным приблизительно 200 мкм, 150 мкм, 100 мкм, 80 мкм, 60 мкм, 40 мкм, 20 мкм, 10 мкм, 5 мкм, 4 мкм, 3 мкм, 2 мкм, 1 мкм, 0,5 мкм или 0,2 мкм, приводит к избирательной противоопухолевой активности при введении в фармацевтическом составе, например, для лечения злокачественной опухоли или опухолей. Например, распределение размера частиц может являться таким, что частицы обладают медианным диаметром от приблизительно 0,02 мкм до приблизительно 5 мкм или от приблизительно 0,2 мкм до приблизительно 4 мкм. Например, распределение размера частиц может являться таким, что частицы обладают медианным диаметром, меньшим или равным приблизительно 5 мкм, отношением среднего диаметра к медианному диаметру не более приблизительно 2 и отношением моды диаметра к медианному диаметру по меньшей мере приблизительно 0,25.
Термин «частица» может относится к агрегату соединения формулы I. Термин «средний» может относится к сумме размеров всех частиц, разделенной на общее количество частиц. Термин «медиана» может относится, например, к диаметру, для которого половина частиц обладает большим диаметром, и половина частиц обладает меньшим диаметром. Термин «мода» может обозначать наиболее часто встречающееся значение размера частиц. Термин «суммарная совокупность» может относиться ко всем частицам.
Избирательная противоопухолевая активность, достигаемая посредством введения частиц нафтофуранового соединения, может зависеть не только от распределения размеров частиц, например, объемов частиц или диаметров, репрезентативных для этих объемов, но также от формы и распределения форм частиц. Например, совокупность частиц, обладающая игольчатой формой, может приводить к другому фармакокинетическому профилю, чем совокупность частиц, обладающих сферической формой. Таким образом, может являться желательным измерять форму и распределение формы частиц, подлежащих введению, и/или использовать способ, дающий частицы с предопределенной формой и распределением формы, например, почти одинаковой формы, например, частицы, приближенные к сферам. Например, сферичность, Ψ, частицы можно определять как
где Vp представляет собой объем частицы и Ap представляет собой площадь поверхности частицы. Сфера обладает сферичностью Ψ=1, и чем ближе сферичность частицы к единице, тем более близко форма частицы приближена к сфере. Для сравнения, тетраэдр обладает сферичностью приблизительно 0,671, куб обладает сферичностью приблизительно 0,806, октаэдр обладает сферичностью приблизительно 0,846, додекаэдр обладает сферичностью приблизительно 0,910, и икосаэдр обладает сферичностью приблизительно 0,939. Поскольку форма сферы минимизирует площадь поверхности для данного объема, можно ожидать, что частица, являющаяся почти сферической, растворяется более медленно, чем частица такого же объема, менее приближенная к сфере. Среднюю сферичность совокупности сфер можно определить как
где ∑VP представляет собой общий объем всех частиц и ∑AP представляет собой общую площадь поверхности всех частиц. Например, вводимые частицы соединения формулы I могут обладать средней сферичностью по меньшей мере приблизительно 0,8 или средней сферичностью по меньшей мере приблизительно 0,9.
Размер, распределение размера, форма, распределение формы и такие факторы, как шероховатость или неравномерность поверхности частиц, могут влиять на среднюю удельную площадь поверхности совокупности частиц соединения 1, вводимых в фармацевтическом составе. Среднюю удельную площадь поверхности можно определить как ∑Ap/∑mp, где ∑AP представляет собой общую площадь поверхности частиц и ∑mp представляет собой общую массу частиц. Чем больше средняя удельная площадь поверхности частиц, тем быстрее ожидаемое растворение частиц.
Частицы соединения формулы I в фармацевтическом составе могут содержать нафтофурановое соединение в кристаллическом состоянии в различных частицах или внутри одной и той же частицы. Кристаллическое состояние может включать один или несколько полиморфов, в различных частицах или внутри одной и той же частицы. Как понятно специалисту в данной области, ожидают, что на скорость растворения частиц может влиять агрегатное состояние в частицах соединения, например, кристаллическое, первый полиморф или второй полиморф.
Один или несколько из ряда способов можно использовать для определения размера и/или распределения размера частиц соединения формулы I в фармацевтическом составе. Например, можно использовать ситовый анализ, подсчет под световым микроскопом, подсчет на электронной микрофотографии, подсчет по электрорезистентности, определение времени седиментации, лазерную дифракцию и/или акустическую спектроскопию. Некоторые или все из этих способов или их вариантов можно использовать для определения формы, распределения формы и/или удельной площади частиц нафтофуранового соединения в фармацевтическом составе. Изотерму BET и/или способ определения удельной площади по воздухопроницаемости можно использовать для определения удельной площади частиц соединения формулы I в фармацевтическом составе.
Способы получения нафтофурановых соединений
В WO 2009/036099 и WO 2009/036101 описан способ получения нафтофуранового соединения формулы II следующим образом:
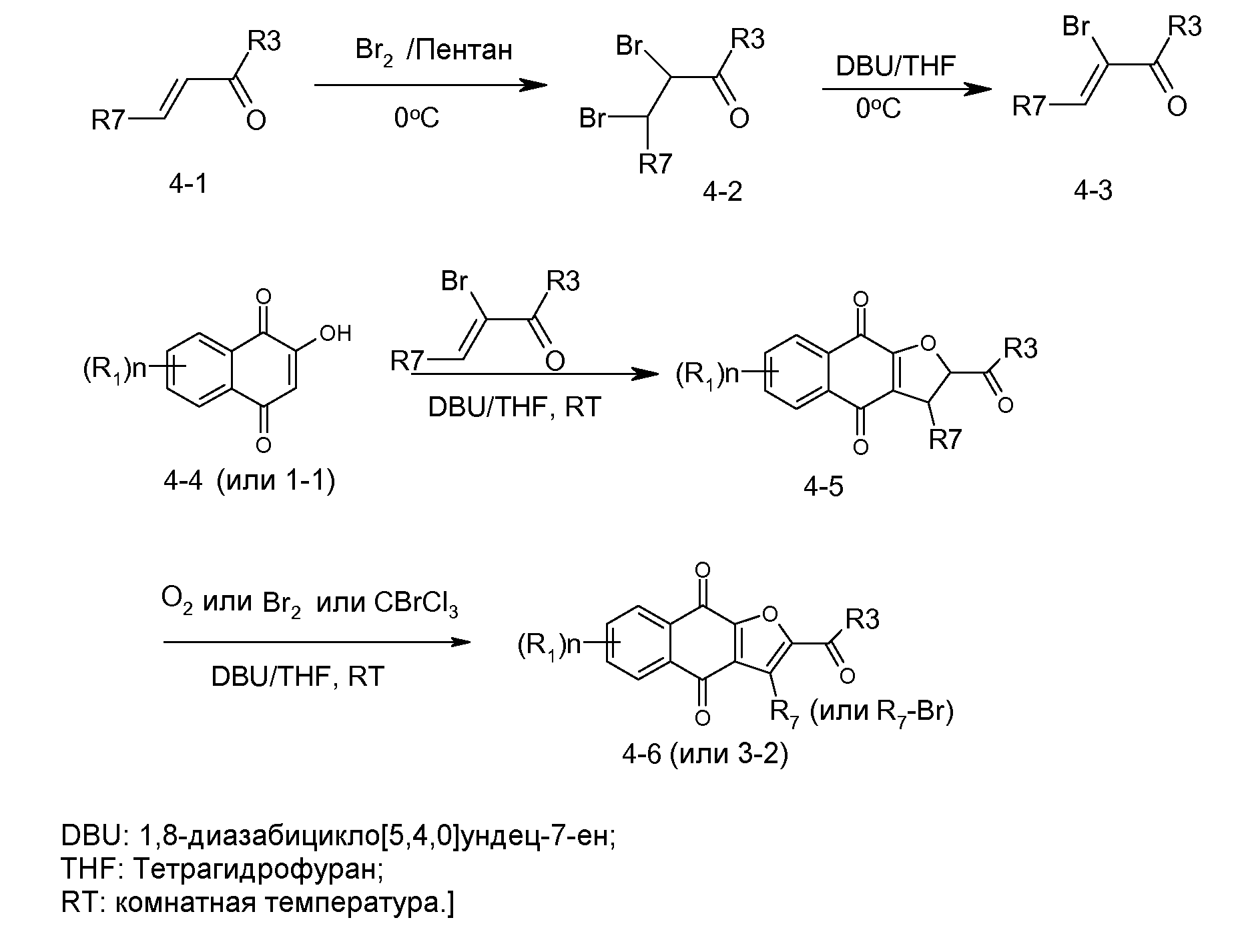
По этому способу проводят реакцию 3-бром-3-бутен-2-она (4-3) с 2-гидрокси-1,4-нафтохиноном (4-4) в контейнере, открытом для доступа воздуха, получая 2,3-дигидронафто[2,3-b]фуран-4,9-дион (4-5). 2,3-дигидронафто[2,3-b]фуран-4,9-дион (4-5) окисляется кислородом воздуха для превращения в нафто[2,3-b]фуран-4,9-дион (4-6). Этим способом получают нафто[2,3-b]фуран-4,9-дион. Однако в ходе дальнейшей разработки соединения определили, что по этому способу образуется еще значительное количество различных примесей, что препятствует потенциальным клиническим применениям этих соединений. В некоторых вариантах осуществления одной из примесей является 2,3-дигидронафто[2,3-b]фуран-4,9-дион (4-5).
В одном аспекте настоящее изобретение относится к улучшенному способу получения нафтофурана. По улучшенному способу минимизируют количество примесей и таким образом получают по существу чистый нафтофуран. Как применяют в настоящем документе, термин «по существу чистый» относится к препарату, содержащему по меньшей мере приблизительно 80% или более, как измерено по % площади при HPLC, соединения по настоящему изобретению. В некоторых вариантах осуществления нафтофуран представляет собой нафто[2,3-b]фуран-4,9-дион и родственные ему соединения (4-6).
В некоторых вариантах осуществления способ по настоящему изобретению включает окисление неочищенного продукта конденсации 3-бром-3-бутен-2-она (4-3) и 2-гидрокси-1,4-нафтохинона (4-4) с помощью окисляющего средства в первом растворителе. В следующем варианте осуществления окисляющее средство представляет собой диоксид марганца (MnO2). В дополнительном варианте осуществления неочищенный продукт выделяют перед окислением. В некоторых вариантах осуществления первый растворитель представляет собой толуол или хлороформ.
В некоторых вариантах осуществления способ по настоящему изобретению дополнительно включает обработку окисленной смеси древесным углем для избавления от конкретных примесей. В следующем варианте осуществления окисленную смесь фильтруют через слой активированного угля. В дополнительном варианте осуществления смесь фильтруют при приблизительно 100°C.
В некоторых вариантах осуществления способ по настоящему изобретению дополнительно включает кристаллизацию продукта из фильтрата. В следующем варианте осуществления продукт кристаллизуют посредством концентрации фильтрата с помощью выпаривания и охлаждения.
В некоторых вариантах осуществления способ по настоящему изобретению дополнительно включает перекристаллизацию продукта с помощью второго растворителя. В следующем варианте осуществления второй растворитель представляет собой этилацетат.
В альтернативном варианте осуществления способ по настоящему изобретению дополнительно включает суспендирование во втором растворителе продукта, кристаллизованного из первого растворителя, нагрев суспензии и охлаждение суспензии. В следующем варианте осуществления второй растворитель представляет собой этилацетат. В некоторых вариантах осуществления продукт суспендируют и нагревают только до частичного растворения. В следующем варианте осуществления объем второго растворителя, используемого для суспендирования продукта, составляет приблизительно 1/10, 1/5, 1/4, 1/3, 1/2 или 2/3 объема для полного растворения продукта в нагретом состоянии.
Настоящее изобретение также относится к нафтофурановому соединению, полученному способом по настоящему изобретению. В некоторых вариантах осуществления нафтофурановое соединение является выбранным из группы, состоящей из 2-(1-гидроксиэтил)-нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] сложного эфира фосфорной кислоты, диметилового сложного эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового сложного эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов. В следующем варианте осуществления нафтофурановое соединение получают способом, включающим реакцию выделенного неочищенного продукта конденсации 2-гидрокси-1,4-нафтохинона (4-4) и 3-бром-3-бутен-2-она (4-3) с диоксидом марганца в присутствии толуола. В дополнительном варианте осуществления способ дополнительно включает фильтрацию окисленной реакционной смеси через слой активированного угля.
В другом аспекте настоящее изобретение относится к по существу чистым нафтофурановым соединениям.
В некоторых вариантах осуществления настоящее изобретение относится к по существу чистому соединению, выбранному из группы, состоящей из 2-(1-гидроксиэтил)-нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] сложного эфира фосфорной кислоты, диметилового сложного эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового сложного эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов.
В некоторых вариантах осуществления настоящее изобретение относится к по существу чистому соединению формулы II
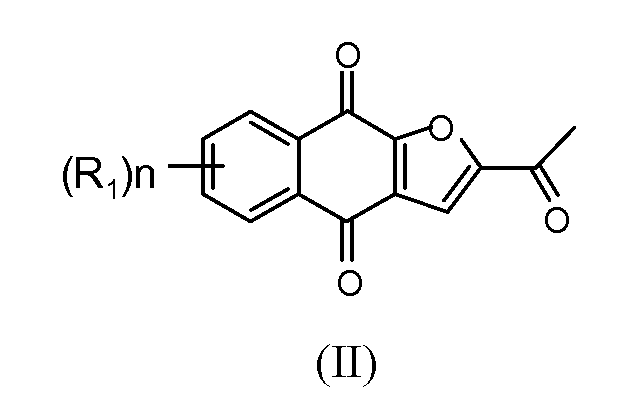
где каждый R1 независимо представляет собой H, Cl или F; и n представляет собой 0, 1, 2, 3 или 4.
Как применяют в настоящем документе, «по существу чистый» относится к чистоте по меньшей мере приблизительно 80%. В некоторых вариантах осуществления чистота соединения по настоящему изобретению составляет чистоту по меньшей мере приблизительно 85%, приблизительно 90%, приблизительно 95%, или приблизительно 99%. В следующем варианте осуществления чистота соединения по настоящему изобретению составляет чистоту по меньшей мере приблизительно 99,5%, или приблизительно 99,8%.
В дополнительном варианте осуществления чистота соединения по настоящему изобретению составляет чистоту по меньшей мере приблизительно 99,85%, приблизительно 99,90%, приблизительно 99,94%, приблизительно 99,95% или приблизительно 99,99%. В некоторых вариантах осуществления соединение по настоящему изобретению выбрано из группы, состоящей из 2-(1-гидроксиэтил)-нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] сложного эфира фосфорной кислоты, диметилового сложного эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового сложного эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов. В некоторых вариантах осуществления соединение по настоящему изобретению представляет собой полиморф. В некоторых вариантах осуществления соединение по настоящему изобретению представляет собой полиморф соединения формулы I. В некоторых вариантах осуществления соединение по настоящему изобретению представляет собой полиморф соединения 1.
Типичные примеси, которые могут присутствовать в соединении по настоящему изобретению, включают одну или несколько, выбранных из группы, состоящей из побочного продукта, изомера, промежуточного соединения и растворителя. В некоторых вариантах осуществления примеси, которые могут присутствовать в соединении по настоящему изобретению, составляют приблизительно до 10%, приблизительно до 8%, приблизительно до 5%, приблизительно до 2% или приблизительно до 1% относительно соединения формулы II. В следующем варианте осуществления примеси, которые могут присутствовать в соединении по настоящему изобретению, составляют приблизительно до 0,5%, приблизительно до 0,2%, приблизительно до 0,15% или приблизительно до 0,1% относительно соединения формулы II. В дополнительном варианте осуществления примеси, которые могут присутствовать в соединении по настоящему изобретению, составляют приблизительно до 0,05%, приблизительно до 0,02% или приблизительно до 0,01% относительно соединения формулы II. В некоторых вариантах осуществления по существу чистое соединение формулы II содержит приблизительно до 500, 200, 100, 50, 20, 10, 5, 2, 1, 0,5, 0,2, 0,15, 0,1 или 0 частей на миллион (p.p.m.) остаточного побочного продукта или побочных продуктов, относительно соединения формулы II.
В некоторых вариантах осуществления примеси включают один или несколько побочных продуктов, выбранных из группы, состоящей из 2-ацетил-2,3-дигидронафто[2,3-b]фуран-4,9-диона, 2,6-диацетилнафто[2,3-b]фуран-4,9-диона, 2,7-диацетилнафто[2,3-b]фуран-4,9-диона, 3-ацетилнафто[2,3-b]фуран-4,9-диона, нафто[2,3-b]фуран-4,9-диона, нафто[2,3-b]фуран-4,9-диона, нафто[2,3-b]фуран-4,9-диола и 1-(4,9-дигидроксинафто[2,3-b]фуран-2-ил)этанона.
В некоторых вариантах осуществления примеси включают марганец (Mn).
Чистоту соединения по настоящему изобретению можно определять с помощью различных устройств. В некоторых вариантах осуществления чистоту определяют с помощью HPLC (высокоэффективной жидкостной хроматографии). В некоторых вариантах осуществления чистоту определяют с помощью ЯМР (ядерного магнитного резонанса). В следующем варианте осуществления чистоту определяют с помощью HPLC и ЯМР.
Для этих высокочистых композиций, содержащих соединение 1, показан значительно улучшенный профиль безопасности в экспериментах на животных по сравнению с менее чистыми композициями, содержащими соединение 1. У мышей не наблюдали признаков каких-либо неблагоприятных эффектов высокочистого соединения 1. Кроме того, эти высокочистые композиции, содержащие соединение 1, тестировали на пациентах и показали их исключительную безопасность. Например, фиг.13 иллюстрирует токсичность, наблюдаемую для композиции с приблизительно 90% чистотой для соединения 1, в то время как фиг.14 иллюстрирует, что высокочистые композиции, обладающие приблизительно 95% или большей чистотой для соединения 1, являются безопасными и эффективными. В исследовании, показанном на фиг.13, иммуносупрессированным мышам с прижившимся подкожным раком головы и шеи человека FaDu (верхняя панель) или раком молочной железы человека MDA-231 (нижняя панель) вводили указанное количество соединения 1 или контроля-носителя перорально (po). Соединение 1 составляли в ГЕЛЮЦИРЕ™. Все режимы введения осуществляли ежесуточно (qd). Массы тела оценивали периодически в ходе обработки. Каждая точка представляет среднее ± SEM для восьми опухолей. Значительную токсичность наблюдали для соединения 1 с приблизительно 90% чистотой. Всего 4 мыши погибли во время обработки в первом эксперименте (верхняя панель) (одна на сутки 16, 2 на сутки 19 и 1 на сутки 23), и их массы тела, таким образом, не включали в график после их гибели. Всего 3 мыши погибли во время обработки во втором эксперименте (нижняя панель) (1 на сутки 14 и 2 на сутки 21), и их массы тела, таким образом, не включали в график после их гибели. В исследовании, показанном на фиг.14, иммуносупрессированным мышам с прижившимся подкожным раком головы и шеи человека FaDu (верхняя панель) или раком молочной железы человека MDA-231 (нижняя панель) вводили указанное количество соединения 1, или контроля-носителя перорально (po). Соединение 1 составляли в ГЕЛЮЦИРЕ™. Все режимы введения осуществляли ежесуточно (qd). Массы тела оценивали периодически в ходе обработки. Каждая точка представляет среднее ± SEM для восьми опухолей. Соединение 1 с более высокой чистотой являлось хорошо переносимым, и для него не показали признаков токсичности. Все мыши остались здоровыми на протяжении обработки в обоих экспериментах. В исследовании фазы I дозу соединения 1 увеличивали от 20 мг до 2000 мг/сутки, и максимальной переносимой дозы (MTD) не достигли. Не наблюдали ограничивающей дозу токсичности. Пациенты переносили соединение 1 очень хорошо без вызванных лекарственным средством неблагоприятных эффектов, что резко отличается от химиотерапевтических средств против рака. Клинический профиль безопасности по существу чистых композиций соединения 1 находится среди лучших в истории для онкологических лекарственных средств.
Фармацевтические составы
Обнаружили, что конкретные наполнители или усилители увеличивают пероральную биодоступность частиц соединения формулы I данного распределения размера частиц в фармацевтическом составе. Например, добавление фармацевтически совместимого наполнителя ГЕЛЮЦИРА™ 44/14 (глицериллаурат полиэтиленгликоля, производимый Gattefossé) может увеличивать биодоступность соединения 1, обладающего медианным размером частиц, меньшим или равным приблизительно 20 микрон. Примеры других наполнителей, которые можно использовать для увеличения или контроля пероральной биодоступности, включают поверхностно-активные вещества, такие как TWEEN 80™ или TWEEN 20™ (полисорбат, т.е. монолаурат полиоксиэтиленсорбитана) или конкретные липиды, такие как фосфатидилхолины, например, димиристоилфосфатидилхолин (DMPC). Поверхностно-активные вещества включают соединения, которые являются амфифильными и содержат как гидрофобные, так и гидрофильные группы. Другие наполнители могут включать, например, глицериновый сложный эфир жирной кислоты, глицериновый сложный эфир насыщенной жирной кислоты, глицериновый сложный эфир насыщенной жирной кислоты, имеющей от 8 до 18 атомов, глицериллаурат, полиэтиленгликоль, алкилат полиоксиэтиленсорбитана, целлюлозу или производные целлюлозы, такие как микрокристаллическая целлюлоза и карбоксиметилцеллюлоза (CMC), так же как липиды, такие как стерины, например, холестерин. Другие наполнители могут включать антиоксиданты, такие как витамин E. Другие наполнители и дополнительные компоненты можно включать в фармацевтический состав в соответствии с настоящим изобретением, как понятно специалисту в данной области. Например, можно включать другие активные средства, стандартные носители, носители, жидкие носители, солевой раствор, водные растворы, разбавители, поверхностно-активные средства, диспергирующие средства, инертные разбавители, гранулирующие и дезинтегрирующие средства, связующие вещества, смазывающие средства, вещества, способствующее скольжению, снимающие заряд вещества, подсластители, вкусовые добавки, окрашивающие средства, консерванты, физиологически разлагаемые композиции, такие как желатин, водные носители и растворители, масляные носители и растворители, суспендирующие средства, диспергирующие или увлажняющие средства, суспендирующие средства, эмульгаторы, смягчающие средства, буферы, соли, загустители, желатины, наполнители, эмульгаторы, антиоксиданты, антибиотики, противогрибковые средства, стабилизаторы, воду, гликоли, масла, спирты, замедляющие кристаллизацию средства (например, для замедления кристаллизации сахара), крахмалы, сахара, сахарозу, поверхностно-активные вещества, средства для увеличения растворимости любого другого ингредиента, такие как полигидроксиспирт, например, глицерин или сорбит, фармацевтически приемлемые полимерные или гидрофобные материалы и другие компоненты. Пригодное дополнительное средство или средства для добавления зависят от лекарственной формы (например, пригодный для инъекции раствор, капсула или пилюля), как понятно специалисту в данной области.
Соединение формулы I по настоящему изобретению можно составлять в «фармацевтические композиции». Варианты осуществления настоящего изобретения включают различные лекарственные формы, содержащие соединение, которые могут являться пригодными, например, для лечения пациента. Например, пероральные лекарственные формы могут включать таблетку, пилюлю, капсулу (твердую или мягкую), каплет, порошок, гранулу, суспензию (например, в водном или масляном носителе), раствор (например, в водном или масляном носителе), гель, саше, лепешку, пастилку, сироп, эликсир, эмульсию, дозу жидкого лекарственного средства, эмульсию масло-в-воде или эмульсию вода-в-масле. Из-за простоты их введения таблетки и капсулы могут представлять собой предпочтительную пероральную дозу. Твердые пероральные лекарственные формы можно покрывать сахаром или покрывать растворимой в кишечнике оболочкой общепринятыми способами. Например, составы назального спрея и спрея для других слизистых оболочек (например, формы для ингаляции) могут включать очищенные водные растворы активных соединений с консервирующими средствами и изотоническими средствами. Такие составы предпочтительно доводят до pH и изотонического состояния, совместимых со слизистыми оболочками носа или другими слизистыми оболочками. Альтернативно, они могут находиться в форме тонкоизмельченных твердых порошков, суспендированных в газообразном носителе, в форме средства для ингаляции или в форме аэрозоля. Такие составы можно вводить любыми подходящими средствами или способами, например, посредством ингалятора, распылителя, дозирующего ингалятора или т.п. Например, фармацевтическую композицию в соответствии с настоящим изобретением можно вводить местно, например, в форме мази, крема или суппозитория. Например, фармацевтическую композицию по настоящему изобретению можно вводить посредством инъекции инъекционного препарата. Таким образом, лекарственная форма по настоящему изобретению может иметь, например, твердую, полужидкую, жидкую или газообразную форму. Пригодные лекарственные формы включают, но без ограничения, формы для перорального, ректального, подъязычного введения, введения на слизистые оболочки, назального введения, введения в глаза, подкожного, внутримышечного, внутривенного, парентерального, чрескожного, спинального, интратекального, интраартикулярного, внутриартериального, субарахноидального введения, введения в бронхи, лимфу и внутриматочного введения, и другие лекарственные формы для системной доставки активных ингредиентов. Активный ингредиент, например соединение формулы I, может содержаться в составе, обеспечивающем быстрое высвобождение, замедленное высвобождение, отсроченное высвобождение или любой другой профиль высвобождения, известный специалисту в данной области, после введения субъекту (пациенту). Способ введения и лекарственная форма, выбранные для данного лечения тесно связаны с терапевтическими количествами соединений или композиций, которые являются желательными и эффективными для данного терапевтического применения, так же как с такими факторами, как психическое состояние и физическое состояние субъекта (пациента).
Фармацевтическую композицию по изобретению можно получать, упаковывать или продавать нерасфасованной, в виде единичной однократной дозы, в виде множества единичных однократных доз или в форме для множественного дозирования. Как применяют в настоящем документе, «однократная доза» представляет собой дискретное количество фармацевтической композиции, содержащей предопределенное количество активного ингредиента. Количество активного ингредиента в каждой однократной дозе, как правило, равно общему количеству активного ингредиента, который нужно ввести, или удобной части общего количества дозы, например, такой как одна вторая или одна треть такой дозы. Состав фармацевтической композиции по изобретению, пригодной для перорального введения, может находиться в форме дискретной твердой единицы дозирования. Каждая твердая единица дозирования содержит предопределенное количество активного ингредиента, например, однократную дозу или ее часть. Как применяют в настоящем документе, «масляная» жидкость представляет собой жидкость, содержащую жидкость на основе углерода или силикона, которая является менее полярной, чем вода. В таких фармацевтических лекарственных формах активное средство предпочтительно используют вместе с одним или несколькими фармацевтически приемлемым носителем(ями), таким образом, и необязательно, с любыми другими терапевтическими ингредиентами. Носитель(и) должны являться фармацевтически приемлемыми в том смысле, что являются совместимыми с другими ингредиентами состава и не являются излишне вредными для их реципиента. Композиции по настоящему изобретению можно предоставлять в единичной дозированной форме, где каждая единица дозирования, например чайная ложка, таблетка, капсула, раствор или суппозиторий, содержит предопределенное количество активного лекарственного средства или пролекарства, отдельно или в подходящей комбинации с другими фармацевтически активными средствами. Термин «единичная дозированная форма» относится к физически дискретным единицам, пригодным в качестве однократных доз для субъектов - человека и животных, где каждая единица содержит предопределенное количество композиции по настоящему изобретению, отдельно или в сочетании с другими активными средствами, рассчитанное в количестве, достаточном для получения желательного эффекта.
Лекарственные формы настоящей фармацевтической композиции можно получать способами, известными в данной области, и они содержат терапевтически эффективное количество активного соединения или ингредиента. Любой способ, известный или разработанный в дальнейшем, можно использовать для получения фармацевтических композиций или составов по изобретению. Как правило, получение включает объединение активного ингредиента с носителем или одним или несколькими другими дополнительными компонентами, и затем, если это необходимо или желательно, формование или упаковку продукта в желательную единицу однократной или множественной дозы. Порошкообразные и гранулированные составы по изобретению можно получать с использованием известных способов или способов, разработанных в дальнейшем. Такие составы можно вводить непосредственно субъекту или использовать, например, для формирования таблеток, наполнения капсул или получения водных или масляных суспензий или растворов посредством добавления к ним водного или масляного носителя. Таблетку можно получать посредством прессования или формования, или посредством влажной грануляции, необязательно, с одним или несколькими вспомогательными ингредиентами. Прессованные таблетки можно получать посредством прессования, в подходящем устройстве, активного ингредиента в свободно текучей форме, такой как порошок или гранулированный препарат. Формованные таблетки можно получать формованием, в подходящем устройстве, смеси активного ингредиента, фармацевтически приемлемого носителя и количества жидкости, по меньшей мере достаточного для увлажнения смеси. Таблетки могут являться непокрытыми или их можно покрывать с использованием способов, известных в данной области, или способов, разработанных в дальнейшем. Покрытые таблетки можно составлять для отложенной дезинтеграции в желудочно-кишечном тракте субъекта, например, посредством использования растворимого в кишечнике покрытия, таким образом обеспечивая замедленное высвобождение и абсорбцию активного ингредиента. Таблетки могут дополнительно содержать ингредиенты для обеспечения фармацевтически элегантного и привлекательного препарата. Твердые капсулы, содержащие активный ингредиент, можно получать с использованием a физиологически разлагаемой композиции, такой как желатин. Такие твердые капсулы содержат активный ингредиент. Мягкие желатиновые капсулы, содержащие активный ингредиент, можно получать с использованием физиологически разлагаемой композиции, такой как желатин. Такие мягкие капсулы содержат активный ингредиент, который может являться смешанным с водной или масляной средой. Жидкие составы фармацевтической композиции по изобретению, пригодные для введения, можно получать, упаковывать и продавать либо в жидкой форме, либо в форме сухого продукта, предназначенного для разведения водой или другим пригодным носителем перед использованием. Жидкие суспензии, в которых активный ингредиент диспергирован в водном или масляном носителе, и жидкие растворы, в которых активный ингредиент растворен в водном или масляном носителе, можно получать с использованием общепринятых способов или способов, разработанных в дальнейшем. Жидкая суспензия активного ингредиента может находиться в водном или масляном носителе. Жидкие растворы активного ингредиента могут находиться в водном или масляном носителе. Для получения таких фармацевтических лекарственных форм активный ингредиент, например нафтофуран, можно тщательно смешивать с фармацевтическим носителем общепринятыми способами составления фармацевтических смесей. Носитель может принимать широкое множество форм в зависимости от препарата, желательного для введения. Для получения композиций в пероральной лекарственной форме можно использовать любую из обычных фармацевтических сред.
В некоторых вариантах осуществления в соответствии с настоящим изобретением промышленное изделие включает контейнер, содержащий терапевтически эффективное количество фармацевтической композиции, включая соединение формулы I. Контейнер может содержать фармацевтически приемлемый наполнитель. Контейнер может содержать инструкции на печатной этикетке. Например, на печатной этикетке можно указывать дозы и частоту, с которой следует вводить фармацевтическую композицию, и следует ли вводить композицию с пищей или в пределах определенного периода времени до или после употребления пищи. Композиция может содержаться в любом пригодном контейнере, способном удерживать и распределять лекарственную форму, который в существенной степени не взаимодействует с композицией. Инструкции на этикетке могут соответствовать способом лечения, описанным в настоящем документе. Этикетка может быть связана с контейнером средствами, сохраняющими их физическую близость. В качестве неограничивающего примера, как контейнер, так и этикетка могут содержаться в упаковочном материале, таком как коробка или пластиковая упаковочная пленка, или могут быть соединены с инструкциями, являясь связанными с контейнером, например, с помощью клея, который не закрывает инструкций на этикетке, или других связывающих или удерживающих средств.
Способы получения фармацевтических составов, обладающих избранным распределением размера частиц, и идентификация оптимума распределения размера частиц
Способ размола
В способе по настоящему изобретению способ размола или растирания можно использовать для уменьшения размера частиц активного ингредиента или соединения формулы I. Например, способ размола или растирания может являться пригодным для получения частиц, обладающих медианным размером 200 мкм, 150 мкм, 100 мкм, 40 мкм, 20 мкм, 5 мкм, 2 мкм или большим, или меньшим размером. Такой способ размола или растирания может включать, например, размол в шаровой мельнице, вальцевание, размол в струйной мельнице, влажный размол, измельчение посредством ультразвука, растирание и комбинации. Например, способом можно уменьшать размер частиц посредством удара частиц о твердую поверхность или посредством подвергания частиц высокому давлению, например, раздавливания частицы между двумя поверхностями. Например, в струйной мельнице поток газа захватывает частицы и ускоряет их до высоких скоростей. Затем частицы ударяют другие частицы и стенки и разламываются на более мелкие частицы. Например, при влажном размоле частицы объединяют с жидкостью и полученную суспензию пропускают через мешалку с большим усилием сдвига для разламывания частиц. Например, при измельчении посредством ультразвука, частицы, например в суспензии, подвергают воздействию ультразвукового излучения. Кавитация, индуцируемая ультразвуком, может разламывать частицы на частицы меньшего размера.
Может являться преимущественным снижать температуру частиц перед подверганием их операции размола или растирания. Например, температуру можно снижать до криогенной температуры, например, посредством воздействия на частицы криогенной жидкости или погружения частиц в криогенную жидкость, такую как жидкий азот. Такое снижение температуры может сделать частицы более хрупкими и более подверженными уменьшению размера способом размола или растирания. После способа размола или растирания способ отбора, такой как просеивание, можно использовать для сужения диапазона размеров частиц.
Способ кристаллизации
Кристаллизация является основной стадией разделения и очистки при изготовлении лекарственных средств. Кристаллизацию можно также использовать для контроля размера частиц. На распределение размера частиц (PSD), полученное в ходе кристаллизации, влияет комбинация различных механизмов, возникающих в ходе кристаллизации, таких как образование центров кристаллизации, рост, агрегация, истирание, разламывание и т.д. Контроль PSD в ходе кристаллизации является критическим для достижения желательных свойств продукта. Когда размер частиц невозможно систематически контролировать в ходе кристаллизации для удовлетворения желаемым спецификациям, можно включать дополнительную стадию, такую как сухой размол. (Braat, et al. Crystallization: Particle Size Control, Encyclopedia of Pharmaceutical Technology: Third Edition, Published on 02 October 2006).
Способы лечения злокачественных опухолей
Способ по настоящему изобретению для лечения, задержки прогрессирования, предотвращения рецидива, ослабления симптома или иного улучшения состояния человека, млекопитающего или животного, страдающих неоплазией, включает введение терапевтически эффективного количества фармацевтической композиции, содержащей частицы с предопределенным распределением размеров, например соединения формулы I, такого как соединение 1, чистого соединения, чистого продукта и/или чистой фармацевтической композиции так, что увеличение объема неоплазии замедляется, увеличение объема неоплазии останавливается, уменьшается объем неоплазии и/или происходит уничтожение злокачественной неоплазии. Некоторые примеры типов неоплазий, которые могут поддаваться лечению этим способом, включают солидные опухоли, злокачественные опухоли, виды рака, метастазирующие опухоли, неоплазии, содержащие злокачественные стволовые клетки, неоплазии, в которые вовлечен путь STAT3, карциномы и саркомы. Неполный список видов рака, которые могут поддаваться лечению введением частиц соединения формулы I, включает следующее: рак молочной железы, рак головы и шеи, рак легких, рак яичников, рак поджелудочной железы, колоректальную карциному, рак предстательной железы, меланому, саркому, рак печени, опухоль головного мозга, лейкоз, множественную миелому, рак желудка и лимфому. В эти злокачественные опухоли может быть вовлечен путь STAT3. Неполный список видов рака, которые могут поддаваться лечению введением частиц, например, соединения формулы I, включает следующее: колоректальный рак, рак молочной железы, рак яичников, рак легких, меланому и медуллобластому. В эти злокачественные опухоли может быть вовлечен путь CSC. Неполный список других видов рака, которые могут поддаваться лечению введением частиц, например, соединения формулы I, включает следующее: рак легких, рак шейки матки, почечно-клеточную карциному, печеночно-клеточную карциному, рак пищевода, глиому, рак мочевого пузыря, колоректальный рак, рак молочной железы, рак предстательной железы, рак поджелудочной железы, рак эндометрия, рак щитовидной железы, рак желчного протока, злокачественную опухоль кости, злокачественную опухоль глаза (ретинобластома), рак желчного пузыря, рак гипофиза, рак прямой кишки, рак слюнных желез и назофарингеальный рак.
Злокачественные стволовые клетки
В последние годы широкое признание получила новая модель образования опухолей, где выдвинута гипотеза, что в пределах опухоли за онкогенную активность ответственна только небольшая часть всей массы опухоли, тогда как старая или клональная генетическая модель постулировала, что в такую онкогенную активность равный вклад вносят все мутантные опухолевые клетки. В соответствии с новой моделью эта небольшая часть онкогенных клеток представляет собой трансформированные клетки с качествами, подобными стволовым клеткам, и их называют «злокачественными стволовыми клетками» (CSC). Bonnet и Dick в 1990 годы первыми показали in vivo наличие CSC при остром миелолейкозе (AML). Их данные показали, что при трансплантации мыши с иммунодефицитом способностью переносить AML обладала только небольшая субпопуляция клеток AML человека, тогда как остальные клетки AML являлись неспособными индуцировать лейкоз. Позже было показано, что эти CSC несут такие же клеточные маркеры, CD34+/CD38-, как недифференцированные гемопоэтические стволовые клетки. (Bonnet, D., Normal and leukaemic stem cells. Br. J. Haematol., 2005. 130(4): p. 469-79). С того времени исследователи достоверно выявили CSC в различных типах опухолей, включая опухоли головного мозга, молочной железы, кожи, предстательной железы, колоректальный рак и т.д.
Модель образования опухоли с CSC смогла объяснить, почему для приживления опухолевого трансплантата экспериментальному животному необходимо инъецировать десятки или сотни тысяч опухолевых клеток. При AML человека частота этих клеток составляет менее чем 1 на 10000. (Bonnet, D. and J.E. Dick, Human acute myeloid leukemia is organized as a hierarchy that originates from a primitive hematopoietic cell. Nat. Med., 1997. 3(7): p. 730-7). Даже при том, что они являются редкими в пределах данной популяции опухолевых клеток, существует возрастающее количество доказательств, что такие клетки существуют почти во всех типах опухолей. Однако так как линии злокачественных клеток выбирают из субпопуляции злокачественных клеток, специфически адаптированных для роста в культуре тканей, биологические и функциональные свойства линий злокачественных клеток могут претерпевать значительные изменения. Таким образом, не все линии злокачественных клеток содержат CSC.
Злокачественные стволовые клетки обладают множеством признаков, сходных с нормальными стволовыми клетками. Например, CSC обладают способностью к самоподдержанию, а именно способностью служить источником дополнительных онкогенных злокачественных стволовых клеток, как правило, при более низкой скорости, чем другие делящиеся опухолевые клетки, в противовес ограниченному количеству делений. CSC также обладают способностью дифференцироваться во множество типов клеток, что может объяснять гистологический факт, что множество опухолей не только содержат множество типов клеток, свойственных органу-хозяину, но также то, что гетерогенность часто сохраняется в опухолевых метастазах. Показано, что CSC в основном ответственны за образование опухоли, метастазирование злокачественных опухолей и рецидивы злокачественных опухолей. CSC также называют инициирующими опухоль клетками, злокачественными стволовоподобными клетками, стволовоподобными злокачественными клетками, высоко онкогенными клетками, опухолевыми стволовыми клетками, стволовыми клетками солидных опухолей или суперзлокачественными клетки.
Существование злокачественных стволовых клеток имеет фундаментальные следствия для дальнейшего лечения и лекарственных средств против злокачественных опухолей. Эти следствия проявляются в идентификации заболевания, избирательного нацеливания лекарственных средств, предотвращении метастазирования и рецидива злокачественных опухолей и разработке новых стратегий борьбы против злокачественных опухолей.
Эффективность современного лечения злокачественных опухолей на начальных этапах тестирования часто измеряют по уменьшению размера опухоли, т.е. по количеству массы опухоли, которую ликвидируют. Так как CSC могут составлять очень малую долю опухоли и обладают заметно отличающимися биологическими характеристиками, чем их более дифференцированные потомки, измерение массы опухоли необязательно может отбирать лекарственные средства, специфически действующие на стволовые клетки. Фактически злокачественные стволовые клетки, по-видимому, являются более устойчивыми к лучевой терапии (XRT), а также невосприимчивы к химиотерапевтическим и направленным лекарственным средствам. (Hambardzumyan, D., M. Squatrito, and E.C. Holland, Radiation resistance and stem-like cells in brain tumors. Cancer Cell, 2006. 10(6): p. 454-6; Baumann, M., M. Krause, and R. Hill, Exploring the role of cancer stem cells in radioresistance. Nat Rev Cancer, 2008. 8(7): p. 545-54; Ailles, L.E. and I.L. Weissman, Cancer stem cells in solid tumors. Curr. Opin. Biotechnol., 2007. 18(5): p. 460-6). Нормальные соматические стволовые клетки по природе устойчивы к химиотерапевтическим средствам - они содержат различные насосы (такие как MDR), которые выводят лекарственные средства, и белки репарации ДНК. Кроме того, у них происходит замедленное обновление клеток, тогда как химиотерапевтические средства ориентированы на быстро реплицирующиеся клетки. У злокачественных стволовых клеток, являющихся мутантными аналогами нормальных стволовых клеток, также могут существовать сходные механизмы, которые позволяют им переживать терапию лекарственными средствами и лучевую терапию. Другими словами, общепринятые способы химиотерапии и лучевой терапии уничтожают дифференцированные или дифференцирующиеся клетки, которые формируют основную массу опухоли, которые не способны к образованию новых высокоонкогенных злокачественных стволовых клеток. С другой стороны, популяция злокачественных стволовых клеток, образующая дифференцированные и диффиренцирующиеся клетки, может оставаться незатронутой и вызывать рецидив заболевания. Дополнительной опасностью общепринятого лечения злокачественных опухолей является возможность того, что химиотерапевтическое лечение оставляет только устойчивые к химиотерапии злокачественные стволовые клетки, и образующаяся в результате рецидивирующая опухоль, вероятно, также будет устойчива к химиотерапии.
Так как выживающие злокачественные стволовые клетки могут обеспечивать репопуляцию опухоли и вызывать рецидив, является обязательным, чтобы способы лечения злокачественных опухолей включали стратегии против CSC (см. фиг. 18). Это сходно с уничтожением корней для предотвращения возобновления роста одуванчика, даже если срезают надземную часть сорняка (Jones, R.J., W.H. Matsui, and B.D. Smith, Cancer stem cells: are we missing the target? J. Natl. Cancer. Inst., 2004. 96(8): p. 583-5). Посредством избирательного нацеливания на злокачественные стволовые клетки становится возможным лечение пациентов с агрессивными, неоперабельными опухолями и невосприимчивыми или рецидивирующими злокачественными опухолями, а также предотвращение метастазирования и рецидивов опухолей. Разработка специфических терапевтических средств, направленно воздействующих на злокачественные стволовые клетки, может повышать выживаемость и качество жизни пациентов со злокачественными опухолями, особенно пациентов с метастазирующими злокачественными опухолями. Ключом к раскрытию этого неиспользуемого потенциала является идентификация и подтверждение путей, которые избирательно важны для самоподдержания и выживаемости злокачественных стволовых клеток. К сожалению, несмотря на то, что ранее выявлено множество путей, лежащих в основе образования опухоли при злокачественной опухоли или самоподдержания у эмбриональных стволовых клеток и стволовых клеток взрослого, для самоподдержания и выживаемости злокачественных стволовых клеток идентифицировано и подтверждено очень мало путей.
Также существует множество исследований по идентификации и выделению злокачественных стволовых клеток. В применяемых способах в основном используют способность CSC к выведению лекарственных средств, или они основаны на экспрессии поверхностных маркеров, ассоциированных со злокачественными стволовыми клетками.
Например, поскольку CSC устойчивы ко многим химиотерапевтическим средствам, неудивительно, что в CSC почти всегда сверхэкспрессированы выводящие лекарственные средства насосы, такие как ABCG2 (BCRP-1) (Ho, M.M., et al., Side population in human lung cancer cell lines and tumors is enriched with stem-like cancer cells. Cancer Res., 2007. 67(10): p. 4827-33; Wang, J., et al., Identification of cancer stem cell-like side population cells in human nasopharyngeal carcinoma cell line. Cancer Res., 2007. 67(8): p. 3716-24; Haraguchi, N., et al., Characterization of a side population of cancer cells from human gastrointestinal system. Stem Cells, 2006. 24(3): p. 506-13; Doyle, L.A. and D.D. Ross, Multidrug resistance mediated by the breast cancer resistance protein BCRP (ABCG2). Oncogene, 2003. 22(47): p. 7340-58; Alvi, A.J., et al., Functional and molecular characterisation of mammary side population cells. Breast Cancer Res., 2003. 5(1): p. R1-8), и другие представители суперсемейства связывающей АТФ кассеты (ABC) (Frank, N.Y., et al., ABCB5-mediated doxorubicin transport and chemoresistance in human malignant melanoma. Cancer Res., 2005. 65(10): p. 4320-33; Schatton, T., et al., Identification of cells initiating human melanomas. Nature, 2008. 451(7176): p. 345-9). Таким образом, для идентификации и выделения CSC также использовали способ побочной популяции (SP), исходно используемый для обогащения гемопоэтическими и лейкозными стволовыми клетками. (Kondo, T., T. Setoguchi, and T. Taga, Persistence of a small subpopulation of cancer stem-like cells in the C6 glioma cell line. Proc. Natl. Acad. Sci. USA, 2004. 101(3): p. 781-6). В этом способе, впервые описанном Goodell et al., для определения и выделения клеточной популяции, обогащенной CSC, пользуются преимуществом различного выведения флуоресцентных красителей, таких как Hoechst, зависимого от транспортера ABC 33342 (Doyle, L.A. and D.D. Ross, Multidrug resistance mediated by the breast cancer resistance protein BCRP (ABCG2). Oncogene, 2003. 22(47): p. 7340-58; Goodell, M.A., et al., Isolation and functional properties of murine hematopoietic stem cells that are replicating in vivo. J. Exp. Med., 1996. 183(4): p. 1797-806). В частности, SP выявляют, блокируя выведение лекарственного средства верапамилом, в результате чего красители больше не могут выводиться из SP.
Исследователи также сфокусированы на поиске специфических маркеров, которые позволяют отличать злокачественные стволовые клетки от основной массы опухоли. Наиболее часто экспрессируемые злокачественными стволовыми клетками поверхностные маркеры включают CD44, CD133 и CD166. (Collins, A.T., et al., Prospective identification of tumorigenic prostate cancer stem cells. Cancer Res., 2005. 65(23): p. 10946-51; Li, C., et al., Identification of pancreatic cancer stem cells. Cancer Res., 2007. 67(3): p. 1030-7; Ma, S., et al., Identification and characterization of tumorigenic liver cancer stem/progenitor cells. Gastroenterology, 2007. 132(7): p. 2542-56; Prince, M.E., et al., Identification of a subpopulation of cells with cancer stem cell properties in head and neck squamous cell carcinoma. Proc. Natl. Acad. Sci. USA, 2007. 104(3): p. 973-8; Ricci-Vitiani, L., et al., Identification and expansion of human colon-cancer-initiating cells. Nature, 2007. 445(7123): p. 111-5; Singh, S.K., et al., Identification of a cancer stem cell in human brain tumors. Cancer Res., 2003. 63(18): p. 5821-8; Dalerba, P., et al., Phenotypic characterization of human colorectal cancer stem cells. Proc. Natl. Acad. Sci. USA, 2007. 104(24): p. 10158-63). Сортировка опухолевых клеток, основанная преимущественно на дифференциальной экспрессии этого поверхностного маркера(ов), выявила большинство высокоонкогенных CSC, описанных до настоящего времени. Таким образом, эти поверхностные маркеры являются хорошо подтвержденными для идентификации и выделения злокачественных стволовых клеток из линий злокачественных клеток и из основной массы опухолевых тканей.
В недавних исследованиях выявлено наличие злокачественных стволовых клеток (CSC) с исключительной способностью к регенерации опухолей. Эти CSC существуют почти во всех типах опухолей и функционально связаны с непрерывным злокачественным ростом, метастазированием злокачественных опухолей, рецидивом и устойчивостью злокачественных опухолей к лекарственным средствам. По-видимому, CSC и их более дифференцированные потомки обладают заметно различающимися биологическими характеристиками. Общепринятые способы скрининга лекарственных средств против злокачественных опухолей зависят от измерения величины массы опухоли, таким образом, они необязательно могут отбирать лекарственные средства, специфически действующие на CSC. Фактически показано, что CSC устойчивы к стандартным способам химиотерапии и лучевой терапии, и после стандартного лечения злокачественных опухолей происходит обогащение ими, что приводит к невосприимчивости и рецидиву злокачественной опухоли. Способы выделения этих клеток в качестве неограничивающих примеров включают идентификацию их способности выведения Hoechst 33342, идентификацию по экспрессируемым этими клетками поверхностным маркерам, таким как CD133, CD44, CD166 и другие, и обогащение по их онкогенным свойствам. Возрастающее количество свидетельств связи злокачественных стволовых клеток с образованием опухолей дает большую терапевтическую возможность нацеливания на злокачественные стволовые клетки.
Данные, предоставляемые в настоящем документе, в комбинации с недавними достижениями в исследовании CSC обеспечивают предоставление в настоящем изобретении ряда способов, направленных на ингибирование CSC, способов, направленных на ингибирование CSC и гетерогенных злокачественных клеток, и способов лечения злокачественных опухолей, содержащих CSC, в частности, или злокачественных опухолей, в общем. Настоящее изобретение также относится к родственным способам (например, производство и скрининг кандидатов в лекарственные средства), веществам, композициям и наборам. Способ может предотвращать самоподдержание CSC так, что они больше не способны восстанавливать свое количество посредством деления в онкогенные клетки CSC. Или способ может индуцировать гибель клеток из числа CSC или из числа CSC и гетерогенных злокачественных клеток.
Этот способ можно использовать для лечения злокачественной опухоли субъекта. Виды рака, которые являются хорошими кандидатами для такого лечения в качестве неограничивающих примеров, включают рак молочной железы, рак головы и шеи, рак легких, рак яичников, рак поджелудочной железы, колоректальную карциному, рак предстательной железы, почечно-клеточную карциному, меланому, печеночно-клеточные карциномы, рак шейки матки, саркомы, опухоли головного мозга, различные виды рака желудка, множественную миелому, лейкоз и лимфомы. В некоторых вариантах осуществления способ применяют для лечения различных видов рака печени, различных видов рака головы и шеи, различных видов рака поджелудочной железы и/или различных видов рака желудка. В некоторых вариантах осуществления способ применяют для лечения множественной миеломы, опухолей головного мозга и сарком.
Кроме того, поскольку показано, что CSC в основном ответственны за образование опухолей, метастазирование злокачественных опухолей и рецидив злокачественных опухолей, для лечения злокачественной опухоли, которая является метастазирующей, невосприимчивой к химиотерапии или лучевой терапии, или для которой у субъекта после начального лечения произошел рецидив, практически можно применять любые способы по изобретению, направленные на ингибирование CSC или CSC и гетерогенных злокачественных клеток.
В некоторых вариантах осуществления ингибитор злокачественных стволовых клеток по настоящему изобретению представляет собой соединение формулы I, соединение 1, полиморф соединения 1, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, в значительной степени сходной с приведенной на фиг.1, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, в значительной степени сходной с приведенной на фиг.2, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, содержащей два или более пиков из пика при 2θ по меньшей мере приблизительно 10,2 градуса, пика при 2θ по меньшей мере приблизительно 11,9 градуса, пика при 2θ по меньшей мере приблизительно 14,1 градуса, пика при 2θ по меньшей мере приблизительно 14,5 градуса, пика при 2θ по меньшей мере приблизительно 17,3 градуса, пика при 2θ по меньшей мере приблизительно 22,2 градуса и пика при 2θ по меньшей мере приблизительно 28,1 градуса и любых их комбинаций, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, в значительной степени сходной с приведенной на фиг.3, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, содержащей два или более пиков из пика при 2θ по меньшей мере приблизительно 7,5 градуса, пика при 2θ по меньшей мере приблизительно 9,9 градуса, пика при 2θ по меньшей мере приблизительно 12,3 градуса, пика при 2θ по меньшей мере приблизительно 15 градусов, пика при 2θ по меньшей мере приблизительно 23 градуса, пика при 2θ по меньшей мере приблизительно 23,3 градуса, пика при 2θ по меньшей мере приблизительно 24,6 градуса и пика при 2θ по меньшей мере приблизительно 28,4 градуса, и любых их комбинаций, 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-дион, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-дион, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-дион, 2-ацетилнафто[2,3-b]фуран-4,9-дион, 2-этилнафто[2,3-b]фуран-4,9-дион, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)виниловый] сложный эфир фосфорной кислоты, диметиловый сложный эфир 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового сложного эфира фосфорной кислоты, их энантиомеры, диастереомеры, таутомеры и соли или сольваты; полиморф соединения формулы I, соединение 1, полиморф соединения 1, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, в значительной степени сходной с приведенной на фиг.1, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, в значительной степени сходной с приведенной на фиг.2, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, содержащей два или более пиков из пика при 2θ по меньшей мере приблизительно 10,2 градуса, пик при 2θ по меньшей мере приблизительно 11,9 градуса, пик при 2θ по меньшей мере приблизительно 14,1 градуса, пик при 2θ по меньшей мере приблизительно 14,5 градуса, пик при 2θ по меньшей мере приблизительно 17,3 градуса, пик при 2θ по меньшей мере приблизительно 22,2 градуса и пик при 2θ по меньшей мере приблизительно 28,1 градуса и любых их комбинаций, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, в значительной степени сходной с приведенной на фиг.3, полиморф 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующийся дифракционной рентгенограммой, содержащей два или более пиков из пика при 2θ по меньшей мере приблизительно 7,5 градуса, пика при 2θ по меньшей мере приблизительно 9,9 градуса, пика при 2θ по меньшей мере приблизительно 12,3 градуса, пика при 2θ по меньшей мере приблизительно 15 градусов, пика при 2θ по меньшей мере приблизительно 23 градуса, пика при 2θ по меньшей мере приблизительно 23,3 градуса, пика при 2θ по меньшей мере приблизительно 24,6 градуса и пика при 2θ по меньшей мере приблизительно 28,4 градуса и любых их комбинаций, 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-дион, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-дион, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-дион, 2-ацетилнафто[2,3-b]фуран-4,9-дион, 2-этилнафто[2,3-b]фуран-4,9-дион, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)виниловый] сложный эфир фосфорной кислоты, диметиловый сложный эфир 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового сложного эфира фосфорной кислоты, их энантиомеры, диастереомеры, таутомеры и соли или сольваты; или по существу чистую форму соединения формулы I, соединения 1, полиморфа соединения 1, полиморфа 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующегося дифракционной рентгенограммой, в значительной степени сходной с приведенной на фиг.1, полиморфа 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующегося дифракционной рентгенограммой, в значительной степени сходной с приведенной на фиг.2, полиморфа 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующегося дифракционной рентгенограммой, содержащей два или более пиков из пика при 2θ по меньшей мере приблизительно 10,2 градуса, пика при 2θ по меньшей мере приблизительно 11,9 градуса, пика при 2θ по меньшей мере приблизительно 14,1 градуса, пика при 2θ по меньшей мере приблизительно 14,5 градуса, пика при 2θ по меньшей мере приблизительно 17,3 градуса, пика при 2θ по меньшей мере приблизительно 22,2 градуса и пика при 2θ по меньшей мере приблизительно 28,1 градуса и любых их комбинаций, полиморфа 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующегося дифракционной рентгенограммой, в значительной степени сходной с приведенной на фиг.3, полиморфа 2-ацетил-4H,9H-нафто[2,3-b]фуран-4,9-диона, характеризующегося дифракционной рентгенограммой, содержащей два или более пиков из пика при 2θ по меньшей мере приблизительно 7,5 градусов, пика при 2θ по меньшей мере приблизительно 9,9 градуса, пика при 2θ по меньшей мере приблизительно 12,3 градуса, пика при 2θ по меньшей мере приблизительно 15 градусов, пика при 2θ по меньшей мере приблизительно 23 градуса, пика при 2θ по меньшей мере приблизительно 23,3 градуса, пика при 2θ по меньшей мере приблизительно 24,6 градуса и пика при 2θ по меньшей мере приблизительно 28,4 градуса, и любых их комбинаций, 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] сложного эфира фосфорной кислоты, диметилового сложного эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового сложного эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов; форму частиц 2-(1-гидроксиэтил)нафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-хлорнафто[2,3-b]фуран-4,9-диона, 2-ацетил-7-фторнафто[2,3-b]фуран-4,9-диона, 2-ацетилнафто[2,3-b]фуран-4,9-диона, 2-этилнафто[2,3-b]фуран-4,9-диона, моно-[1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового] сложного эфира фосфорной кислоты, диметилового сложного эфира 1-(4,9-диоксо-3a,4,9,9a-тетрагидронафто[2,3-b]фуран-2-ил)винилового сложного эфира фосфорной кислоты, их энантиомеров, диастереомеров, таутомеров и солей или сольватов (также обозначаемые в настоящем документе как «соединение по изобретению»).
Настоящее изобретение относится к способу идентификации кандидата в лекарственное средство, способного к ингибированию злокачественных стволовых клеток. В некоторых вариантах осуществления кандидат в лекарственное средство способен индуцировать гибель клеток из числа CSC или по меньшей мере ингибировать их самоподдержание. В дополнительном варианте осуществления кандидат в лекарственное средство способен индуцировать гибель клеток из числа CSC или по меньшей мере ингибировать их самоподдержание и индуцировать гибель клеток из числа гетерогенных злокачественных клеток. Для скрининга кандидата в лекарственное средство можно выбирать мишенью различные фазы пути.
Таким образом, в другом аспекте соединение по изобретению можно использовать для составления фармацевтической композиции для лечения или предотвращения нарушений или состояний. Некоторые из нарушений включают, но без ограничения, аутоиммунные заболевания, воспалительные заболевания, воспалительные заболевания кишечника, артрит, аутоиммунное демиелинизирующее нарушение, болезнь Альцгеймера, удар, ишемическое реперфузионное повреждение и рассеянный склероз. Некоторые из нарушений представляют собой злокачественные опухоли, и они включают, но без ограничения, различные виды рака молочной железы, различные виды рака головы и шеи, различные виды рака легких, различные виды рака яичников, различные виды рака поджелудочной железы, колоректальную карциному, различные виды рака предстательной железы, почечно-клеточную карциному, меланому, печеночно-клеточные карциномы, различные виды рака шейки матки, саркомы, опухоли головного мозга, различные виды рака желудка, множественную миелому, лейкоз и лимфомы.
Соответственно, в одном из аспектов настоящее изобретение относится к способу ингибирования злокачественных стволовых клеток, где в клетки вводят эффективное количество соединения по изобретению. Хорошими кандидатами на такое лечение являются злокачественные опухоли, для которых известно, что они содержат CSC, и они включают, но без ограничения, различные виды рака молочной железы, различные виды рака головы и шеи, различные виды рака легких, различные виды рака яичников, различные виды рака поджелудочной железы, колоректальную аденокарциному, различные виды рака предстательной железы, различные виды рака печени, меланому, множественную миелому, опухоли головного мозга, саркомы, медуллобластому и лейкоз.
Кроме того, поскольку показано, что CSC в основном ответственны за образование опухоли, метастазирование злокачественных опухолей и рецидивы злокачественных опухолей, для лечения злокачественной опухоли, которая является метастазирующей, невосприимчивой к химиотерапии или лучевой терапии, или для которой у субъекта после начального лечения произошел рецидив, практически можно использовать любые способы по изобретению, направленные на ингибирование CSC.
В некоторых вариантах осуществления способа злокачественную опухоль, подлежащую лечению, выбирают из следующей группы: рак печени, рак толстого кишечника, рак головы и шеи, рак поджелудочной железы, рак желудка, злокачественная опухоль почки, саркома, множественная миелома, метастазирующий рак молочной железы, метастазирующий рак предстательной железы, лейкоз, лимфома, панкреатический рак пищевода, опухоль головного мозга, глиома, рак мочевого пузыря, рак эндометрия, рак щитовидной железы, рак желчного протока, злокачественная опухоль кости, злокачественная опухоль глаза (ретинобластома), рак желчного пузыря, рак гипофиза, рак прямой кишки, рак слюнных желез и назофарингеальный рак.
В одном из аспектов настоящее изобретение относится к способу лечения злокачественной опухоли у субъекта, где субъекту вводят терапевтически эффективное количество фармацевтической композиции, содержащей соединение по изобретению. Злокачественная опухоль может являться метастазирующей. Субъект может представлять собой млекопитающее, например, человека.
Лечение посредством введения субъекту (пациенту), страдающему неоплазией, частиц, например, соединения формулы I может быть показано для приведенных ниже состояний. Неоплазия может не подлежать хирургическому удалению. Неоплазия может рецидивировать у субъекта (пациента). Злокачественные стволовые клетки вовлечены в рецидив неоплазий; уничтожение злокачественных стволовых клеток или ингибирование их самоподдержания способом по настоящему изобретению может предотвращать саморегенерацию неоплазии. Лечение посредством введения частиц нафтофурана может замедлять или останавливать увеличение объема неоплазии или уменьшать объем неоплазии, например, индуцируя гибель, ингибируя рост и/или деление, и/или избирательно уничтожая опухолевые клетки. Например, лечение по настоящему изобретению может индуцировать гибель клеток клетки неоплазии. Например, лечение может действовать, ингибируя путь STAT3 опухолевой клетки.
Лечение посредством введения субъекту (пациенту), страдающему неоплазией, частиц, например, соединения по изобретению можно использовать для предотвращения рецидива неоплазии и/или в качестве вспомогательной терапии при хирургическом удалении.
Фармацевтическую композицию, содержащую частицы, например, соединения по изобретению, можно вводить перорально, так как это является удобной формой лечения. Например, фармацевтическую композицию можно вводить перорально не более четырех раз в сутки. Альтернативно, фармацевтическую композицию можно вводить внутривенно или интраперитонеально.
В способе по настоящему изобретению терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, может представлять собой общую суточную дозу в диапазоне от приблизительно 20 мг до приблизительно 2000 мг, от приблизительно 100 мг до приблизительно 1500 мг, от приблизительно 160 мг до приблизительно 1400 мг или от приблизительно 180 мг до 1200 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, представляет собой общую суточную дозу в диапазоне от приблизительно 200 мг до приблизительно 1500 мг или от приблизительно 360 мг до 1200 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, представляет собой общую суточную дозу в диапазоне от приблизительно 400 мг до приблизительно 1000 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, представляет собой общую суточную дозу приблизительно 1000 мг.
В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят в однократной суточной дозе. Например, в некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят в однократной суточной дозе в диапазоне от приблизительно 20 мг QD до приблизительно 2000 мг QD. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят однократной суточной дозой в диапазоне от приблизительно 20 мг QD до приблизительно 1000 мг QD.
В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят в более чем одной дозе в сутки. Например, в некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят в двух дозах в сутки, где общая суточная доза лежит в диапазоне от приблизительно 160 мг до 1400 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят в двух дозах в сутки, где общая суточная доза лежит в диапазоне от приблизительно 320 мг до 1200 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят в двух дозах в сутки, где общая суточная доза лежит в диапазоне от приблизительно 400 мг до 1000 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят в двух дозах в сутки, где общая суточная доза составляет приблизительно 1000 мг.
В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят в двух дозах в сутки, где каждая доза лежит в диапазоне от приблизительно 80 мг до 1000 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят в двух дозах в сутки, где каждая доза лежит в диапазоне от приблизительно 160 мг до 600 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят в двух дозах в сутки, где каждая доза лежит в диапазоне от приблизительно 200 мг до приблизительно 500 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят в двух дозах в сутки, где каждая доза составляет приблизительно 500 мг.
В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят в трех дозах в сутки, где общая суточная доза лежит в диапазоне от приблизительно 240 мг до приблизительно 1500 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят в трех дозах в сутки, где общая суточная доза лежит в диапазоне от приблизительно 480 мг до приблизительно 1500 мг.
В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят в трех дозах в сутки, где каждая доза лежит в диапазоне от приблизительно 80 мг до 500 мг. В некоторых вариантах осуществления терапевтически эффективное количество фармацевтической композиции, содержащей частицы, полиморфы и/или очищенные формы соединения по изобретению, вводят в трех дозах в сутки, где каждая доза лежит в диапазоне от 160 мг до 500 мг.
Соединение по изобретению или его фармацевтическую композицию можно вводить посредством любого из или посредством комбинации способов, например, перорально, внутривенно или интраперитонеально. Например, в некоторых вариантах осуществления соединение по изобретению можно вводить перорально. В некоторых вариантах осуществления соединение по изобретению можно вводить перорально в составе, содержащем гелюцир и Tween 80.
Соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у субъекта, например, пациента, в диапазоне по меньшей мере от приблизительно 0,002 мкМ до приблизительно 30 мкМ в течение периода по меньшей мере от 2 часов до периода не более 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у субъекта в диапазоне по меньшей мере от приблизительно 0,2 мкМ до приблизительно 1 мкМ в течение периода по меньшей мере от 2 часов до периода не более 24 часов, равной или большей приблизительно 0,2 мкМ, 0,5 мкМ, 1,0 мкМ, 1,5 мкМ, 2,0 мкМ, 2,5 мкМ, 3,0 мкМ, 4,0 мкМ, 5,0 мкМ, 6,0 мкМ, 7,0 мкМ, 8,0 мкМ, 9,0 мкМ, 10,0 мкМ, 15,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у субъекта, равной или большей приблизительно 1,0 мкМ, 1,5 мкМ, 2,0 мкМ, 3,0 мкМ, 5,0 мкМ, 10,0 мкМ, 15,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у субъекта, равной или большей приблизительно 2,0 мкМ, 3,0 мкМ, 5,0 мкМ, 10,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у субъекта, равной или большей приблизительно 3,0 мкМ или 5,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов.
Соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у субъекта, например, пациента, в диапазоне от по меньшей мере приблизительно 0,002 мкМ∙час до приблизительно 300 мкМ∙час в течение 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать у субъекта площади под кривой за 24 часа (AUC24), равной или большей приблизительно 0,2 мкМ, 0,5 мкМ, 1,0 мкМ, 1,5 мкМ, 2,0 мкМ, 2,5 мкМ, 3,0 мкМ, 4,0 мкМ, 5,0 мкМ, 6,0 мкМ, 7,0 мкМ, 8,0 мкМ, 9,0 мкМ, 10,0 мкМ, 15,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у субъекта, равной или большей приблизительно 1,0 мкМ, 1,5 мкМ, 2,0 мкМ, 3,0 мкМ, 5,0 мкМ, 10,0 мкМ, 15,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у субъекта, равной или большей приблизительно 2,0 мкМ, 3,0 мкМ, 5,0 мкМ, 10,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать концентрации соединения в крови у субъекта, равной или большей приблизительно 3,0 мкМ или 5,0 мкМ в течение периода по меньшей мере 2 часов и менее 24 часов. В некоторых вариантах осуществления соединение по изобретению можно вводить в дозе, позволяющей достигать у субъекта площади под кривой за 24 часа (AUC0-24час), равной или большей приблизительно 2 мкМ∙час, 10 мкМ∙час, 20 мкМ∙час, 30 мкМ∙час, 40 мкМ∙час, 50 мкМ∙час, 60 мкМ∙час, 70 мкМ∙час, 80 мкМ∙час, 90 мкМ∙час, 100 мкМ∙час, 125 мкМ∙час, 150 мкМ∙час, 200 мкМ∙час, 250 мкМ∙час, 300 мкМ∙час, 400 мкМ∙час и 500 мкМ∙час.
Если требует состояние субъекта (пациента), дозы фармацевтической композиции можно вводить в виде непрерывной или пульсирующей инфузии. Длительность лечения может составлять десятилетия, годы, месяцы, недели или сутки, при условии, что польза сохраняется. Указанные выше диапазоны предоставлены только в виде руководства и являются объектом оптимизации.
В способе по изобретению клетки неоплазии избирательно уничтожают посредством введения фармацевтической композиции так, что молярная концентрация соединения в крови в течение первого непрерывного периода времени, который является по меньшей мере настолько длительным, как эффективный период времени, и короче опасного периода времени, представляет собой по меньшей мере эффективную концентрацию и является меньшей, чем токсичная концентрация. Молярная концентрация в крови после первого непрерывного периода времени может являться меньшей, чем эффективная концентрация. Эффективная концентрация может являться достаточно высокой концентрацией, чтобы уничтожить неопластические клетки, например, раковые клетки. Эффективный период времени может являться достаточно длительным, чтобы произошло уничтожение неопластических клеток, например, раковых клеток. Токсичная концентрация может представлять собой концентрацию, при которой происходит повреждение или уничтожение нормальных клеток. Опасный период времени может представлять собой период времени, достаточно длительный для повреждения или уничтожения нормальных клеток. Например, эффективная концентрация может являться равной или большей приблизительно 0,02 мкМ, приблизительно 0,05 мкМ, приблизительно 0,1 мкМ, приблизительно 0,2 мкМ, приблизительно 0,5 мкМ, приблизительно 1 мкМ, приблизительно 3 мкМ, приблизительно 10 мкМ или приблизительно 20 мкМ. Например, нетоксичная концентрация может являться равной или меньшей приблизительно 3 мкМ, приблизительно 10 мкМ, приблизительно 14 мкМ, приблизительно 30 мкМ или приблизительно 100 мкМ. Например, эффективный период времени может являться равным или более продолжительным, чем приблизительно 2 часа, приблизительно 4 часа, приблизительно 6 часов, приблизительно 12 часов, приблизительно 24 часа или приблизительно 48 часов. Например, для достижения нетоксичного для нормальных клеток воздействия необходимо, чтобы концентрация лекарственного средства, соединения 1, в крови значительно снижалась в пределах приблизительно 12 часов, приблизительно 24 часов. «Значительное снижение в крови» означает снижение концентрации лекарственного средства в крови по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 90%. Например, эффективная концентрация может представлять собой концентрацию, превосходящую IC50 для злокачественных клеток при введении соединения в течение определенного периода времени. Например, эффективный период времени может представлять собой период времени, в течение которого происходит избирательное ингибирование или уничтожение злокачественных клеток при введении соединения по меньшей мере в эффективной концентрации. Например, токсичная концентрация может представлять собой концентрацию, превосходящую IC50 для нормальных клеток при введении соединения в течение любого периода времени. Например, опасный период времени может представлять собой период времени, в течение которого происходит ингибирование или уничтожение нормальных, а также злокачественных клеток при введении соединения в эффективной концентрации.
Специалист в данной области может вводить фармацевтическую композицию, выбирая величину дозы и частоту дозирования так, чтобы достигать описанного в настоящем документе «избирательного фармакокинетического профиля» (SPP), который считают необходимым для избирательного уничтожения неопластических клеток, таких как злокачественные клетки и сохранения нормальных клеток. Такая оценка SPP также может направлять разработку фармацевтической композиции, например, распределение размера частиц и распределение формы частиц.
В способе по изобретению фармацевтическую композицию вводят перорально в такой лекарственной форме, как таблетка, пилюля, капсула (твердая или мягкая), каплет, порошок, гранула, суспензия, раствор, гель, саше, пастилка, таблетка для рассасывания, сироп, эликсир, эмульсия, эмульсия масло-в-воде, эмульсия вода-в-масле или доза жидкого лекарственного средства.
Определение оптимального распределение размера частиц
В способе по изобретению оптимальное распределение размера частиц соединения формулы I, соединения 1, полиморфа соединения 1 и/или по существу чистой формы соединения 1 для лечения человека, млекопитающего или животного, страдающих неоплазией, можно определять, как указано далее. Можно получать по меньшей мере одну совокупность частиц, содержащую соединение. Например, при получении совокупности частиц размер частиц образца твердого соединения можно уменьшать, например, растворяя соединение и распыляя раствор, растворяя соединение и диспергируя раствор с применением ультразвукового излучения, размола твердого соединения в шаровой мельнице, измельчения твердого соединения вальцеванием, растирания твердого соединения и/или просеивания твердого соединения. Распределение размера частиц по меньшей мере для одной совокупности частиц можно определять способом или комбинацией способов, известных специалисту в данной области. Например, распределение размера частиц можно определять таким способом, как ситовый анализ, подсчет под световым микроскопом, подсчет на электронной микрофотографии, подсчет по электрорезистентности, определение времени седиментации, лазерная дифракция, акустическая спектроскопия, другой способ или комбинация способов. В неопластические клетки и в нормальные клетки можно вводить по меньшей мере одну совокупность частиц при предопределенной концентрации и в течение предопределенного периода времени. Можно наблюдать действие частиц на метаболизм, деление и/или другой индикатор жизнеспособности неопластических клеток и нормальных клеток. Наблюдаемое действие частиц на неопластические клетки можно использовать для определения индекса эффективности каждой совокупности частиц. Например, для совокупности частиц, ингибирующей метаболизм и/или деление неопластических клеток, повреждающей или уничтожающей неопластические клетки или иным образом проявляющей высокую противоопухолевую активность, можно определять высокий индекс эффективности. Наблюдаемое действие частиц на нормальные клетки можно использовать для определения индекса токсичности каждой совокупности частиц. Например, для совокупности частиц, ингибирующей метаболизм и/или деление нормальных клеток или повреждающей или уничтожающей нормальные клетки или когда нормальные клетки иным образом демонстрируют низкую переносимость совокупности частиц, можно определять высокий индекс токсичности.
Например, совокупность частиц можно вводить в неопластические клетки и в нормальные клетки in vitro. Например, индекс эффективности может являться равным, пропорциональным IC50 для неопластических клеток или являться ее монотонно возрастающей функцией. Например, индекс токсичности может являться равным, пропорциональным IC50 для неопластических клеток или являться ее монотонно возрастающей функцией.
Например, совокупность частиц можно вводить в неопластические клетки и нормальные клетки тестируемого животного in vivo. Например, тестируемое животное может представлять собой млекопитающее, примата, мышь, крысу, морскую свинку, кролика или собаку. Например, индекс эффективности может являться равным, пропорциональным уменьшению объема неопластических клеток после введения совокупности частиц или являться его монотонно возрастающей функцией. Например, индекс токсичности может являться равным, пропорциональным снижению массы тестируемого животного после введения совокупности частиц или являться его монотонно возрастающей функцией. Например, совокупность частиц можно вводить человеку при клиническом исследовании. Способ лечения неоплазии может включать введение человеку, млекопитающему или животному, страдающему неоплазией, терапевтически эффективного количества совокупности частиц соединения формулы I, соединения 1, полиморфа соединения 1 и/или по существу чистой формы соединения 1. Перед введением частиц соединения, соединения формулы I, соединения 1, полиморфа соединения 1 и/или по существу чистой формы соединения 1 животному или человеку или в клетки in vitro частицы можно суспендировать в фармацевтически приемлемом наполнителе.
Индекс эффективности и/или индекс токсичности каждой совокупности частиц с первым распределением размера частиц можно сравнивать с индексом эффективности и/или индексом токсичности другой совокупности или других совокупностей частиц с распределением размера частиц, отличающимся от первого распределения размера частиц. Совокупность частиц соединения с высоким индексом эффективности и низким индексом токсичности может являться эффективной для ингибирования или уничтожения неопластических, например злокачественных, клеток, но сохранять нормальные клетки. Специалист в данной области в качестве оптимальной совокупности может выбирать совокупность частиц с большим индексом эффективности, меньшим индексом токсичности и/или большей взвешенной суммой индекса эффективности и индекса токсичности, чем по меньшей мере одна другая совокупность частиц (например, индекс эффективности можно взвешивать с положительным коэффициентом, а индекс токсичности можно взвешивать с отрицательным коэффициентом). Специалист в данной области для выбора оптимальной совокупности частиц также может использовать другие критерии, например, частицы с суммой взвешенного индекса эффективности и взвешенным отношением индекса эффективности к индексу токсичности. Распределение размера частиц оптимальной совокупности частиц можно рассматривать как оптимальное распределение размера частиц для тестируемого соединения. Оптимальное распределение размера частиц может отличаться у одного соединения, например, соединения 1, по сравнению с другим соединением, например, соединением формулы I, не являющимся соединением 1. Оптимальное распределение размера частиц для данного соединения при определении посредством введения в клетки in vitro, небольшому тестируемому животному и большому тестируемому животному может отличаться. Однако оптимальное распределение размера частиц, определяемое посредством введения данного соединения в организм in vitro или in vivo, может представлять собой обоснованную отправную точку для оптимизации распределения размера частиц для другого соединения или для введения в другой организм.
Оптимальную совокупность частиц соединения формулы I, соединения 1, полиморфа соединения 1 и/или по существу чистой формы соединения 1 можно включать в композицию для снижения или подавления репликации или распространения неопластических клеток.
ПРИМЕРЫ
Примеры представлены ниже для дополнительной иллюстрации различных признаков настоящего изобретения. Примеры также иллюстрируют пригодные способы практического осуществления изобретения. Эти примеры не ограничивают описываемое в заявке изобретение.
ПРИМЕР 1 : Получение нафтофуранового соединения
Способ получения нафтофуранового соединения (2-ацетилнафто[2,3-b]фуран-4,9-диона) кратко изложен следующим образом:
Стадия 1 : Бромирование
В 2-литровую 3-горлую круглодонную колбу, оборудованную механической мешалкой, термометром и капельной воронкой, загружают 3-бутен-2-он (451,2 грамма). В капельную воронку добавляют бром (936,0 граммов). После охлаждения содержимого колбы до -5°C бром добавляют по каплям в колбу при интенсивном перемешивании и поддержании температуры при -5°C в течение 30 минут. Смесь перемешивают в течение дополнительных 15 минут при -5°C и затем разделяют на 4 равные порции.
Стадия 2: Дебромирование
Каждую часть смеси вместе с тетрагидрофураном (2133,6 грамма) загружают в 22-литровую 4-горлую круглодонную колбу, оборудованную механической мешалкой, термометром и капельной воронкой. В капельную воронку добавляют DBU (1,3-диазабицикло[5.4.0]ундец-7-ен, 222,9 грамма). DBU добавляют по каплям в колбу при интенсивном перемешивании и поддержании температуры при 0°C-5°C в течение 30 минут. Смесь перемешивают в течение дополнительных 15 мин при 0°C-5°C.
Стадия 3: Реакция конденсации
Затем в колбу загружают 2-гидрокси-1,4-нафтофуран (231 грамм). Дополнительный DBU (246,0 граммов) добавляют в капельную воронку и затем добавляют по каплям в смесь в колбе с такой скоростью, что температура реакционной смеси не превышает 40°C. После завершения добавления DBU полученную смесь перемешивают в течение ночи при комнатной температуре, и образец реакционной смеси отбирают для анализа HPLC.
Стадия 4: Кристаллизация
В реакционную смесь добавляют воду (10,8 литра) и полученную смесь охлаждают до 0°C-3°C в течение по меньшей мере 30 минут, затем фильтруют через вакуумный фильтр. Отфильтрованное твердое вещество промывают последовательно 5% водным бикарбонатом натрия (3 литра), водой (3 литра), 1% водной уксусной кислотой (3 литра) и этанолом дважды (2×1 литр).
Промытое твердое вещество сохраняют и объединяют с веществом из других партий. Объединенный неочищенный продукт (28,73 кг) добавляют вместе с этилацетатом (811,7 кг) в сосуд на 500 галлонов (1893 л), оборудованный механической мешалкой, термометром и конденсатором. В атмосфере азота смесь нагревают до кипения с обратным холодильником (72°C) в течение 2 часов и затем фильтруют с помощью патронного фильтра 10 микрон, содержащего слой активированного угля, для удаления нерастворимых примесей.
Свежий горячий этилацетат (10 кг) используют для промывки сосуда, транспортной линии и фильтра. Объединенный фильтрат охлаждают до 0-5°C и выдерживают при этой температуре 2 часа, и затем фильтруют через фильтр Бюхнера 20 дюймов (0,508 м). Отфильтрованный твердый продукт промывают при 0-5°C этилацетатом (5,7 кг) и высушивают в вакууме при 40°C до постоянной массы. Объем оставшегося фильтрата уменьшали до 63% выпариванием и процесс кристаллизации снова повторяли для получения второй порции продукта, которую также высушивали в таких же условиях, что и первую порцию продукта.
Партия нафтофуранового соединения получена по этому способу. Чистота партии соединения составляет 95,44% площади (HPLC).
ПРИМЕР 2: Получение нафтофуранового соединения
Другой способ получения нафтофуранового соединения (2-ацетилнафто[2,3-b]фуран-4,9-диона) кратко изложен следующим образом:
Стадия 1: Бромирование
В 12 л RBF (круглодонную колбу)(защищенную от света УФ-фильтрами) добавляли MVK (2160 мл, 26,4 моль) и охлаждали до -9,6°C в бане с сухим льдом/ацетоном. Бром (1300 мл, 25,3 моль) добавляли медленно, в течение 2 час и 20 мин, поддерживая T=<-2,6°C (Tmax). Полученную желтую смесь перемешивали в течение дополнительных 28 мин.
Стадия 2: Дегидробромирование
В 72 л RBF с предварительно охлажденным THF (тетрагидрофураном) (20 л, 5 мл/г HNQ (2-гидрокси-1,4-нафтохинон)) добавляли бромированный продукт после вышеуказанной стадии и полученный раствор охлаждали до -4,8°C. DBU (4200 мл, 28,1 моль), растворенный в THF (4200 мл), добавляли медленно, в течение 2 час и 20 мин, поддерживая T<0,3°C (Tmax). Полученную суспензию перемешивали в течение 42 мин.
Стадия 3: Конденсация
2-гидрокси-1,4-нафтофуран (4003 г, 23,0 моль) добавляли, в одной порции, в реакционную смесь из вышеуказанной стадии, при -1,8°C. Охлаждающую баню добавляли во время того, как добавляли вторую порцию DBU (3780 мл, 25,3 моль) в течение 48 минут, чтобы довести реакционную температуру до 40°C. Охлаждающую баню удаляли и реакционную смесь перемешивали в течение выходных, с открытым доступом воздуха.
Стадия 4: Выделение неочищенного материала
В 200 л реактор с предварительно охлажденной водой (100 л, 25 мл/г HNQ) добавляли реакционную смесь после вышеуказанной стадии. Полученную суспензию охлаждали до 6,0°C, и затем перемешивали при T=3±3°C в течение ~1 часа. Затем полученную суспензию фильтровали и собранное твердое вещество переносили обратно в 200 л реактор.
После перемешивания в водном 5% NaHCO3 (26 л, 6,5 мл/г HNQ) в течение 1 часа, суспензию фильтровали. Собранное твердое вещество переносили обратно в 200 л реактор, перемешивали в воде (26 л) в течение 1 часа и затем фильтровали.
Влажное твердое вещество переносили обратно в 200 л реактор, перемешивали в 1% водной уксусной кислоте (26 л) в течение ~1 часа, фильтровали и затем промывали на воронке с фильтром водой (10 л). Собранное твердое вещество переносили обратно в 200 л реактор и нагревали в этаноле (17,5 л; 4,3 мл/г HNQ) со слабым кипением с обратным холодильником (77,4°C). Полученную суспензию охлаждали до 4,2°C и фильтровали.
Влажное твердое вещество переносили в 100 л реактор и нагревали в этаноле (17,5 л; 4,3 мл/г HNQ) с кипячением с обратным холодильником (77,6°C). Полученную суспензию охлаждали до 4,5°C и фильтровали. Из влажного осадка удаляли жидкость в течение ночи. Отбирали образцы для 1H ЯМР и HPLC. 1H ЯМР: Соединение 1/NDHF (2-ацетил-2,3-дигидронафто[2,3-b]фуран-4,9-дион) 42:58%; HPLC: Соединение 1/NDHF 74:11% площади.
Твердые вещества высушивали в вакуумной печи при 50°C, в течение 4 суток, получая 2268 г неочищенного соединения 1. 1H ЯМР: Соединение 1/NDHF 41:59%; HPLC: Соединение 1/NDHF 67:11% площади.
Стадия 5 : Окисление нафтодигидрофурана
Неочищенное соединение 1 (2,268 кг) суспендировали в толуоле (77 л). Добавляли MnO2 (9536 г) и смесь нагревали со слабым кипением с обратным холодильником. По TLC (1:1 EA:гексан) показали полную реакцию через 1 час.
Затем горячую реакционную смесь фильтровали через предварительно нагретый слой целита (1530 г, нижний слой), активированного угля (2230 г, средний слой) и целита (932 г, верхний слой). Собирали оранжево-желтый фильтрат.
Фильтрат концентрировали в роторном вакуумном испарителе до приблизительно 1/10 объема. Суспензию фильтровали и промывали толуолом. Затем кристаллы сушили при 50°C с получением 952 г (42%) темно-желтого твердого вещества. HPLC: 99,94%. В 1H ЯМР не выявили нафтодигидрофурана.
Кристаллы высушивали при 50°C в вакууме в течение дополнительных 46-65 часов для снижения количества остаточного толуола в материале.
Стадия 6: Обработка этилацетатом
Соединение 1 (5816 г) добавляли в 200 л реакционный сосуд. Добавляли этилацетат (145 л, 25 мл/г) и раствор нагревали до кипения с обратным холодильником в течение 2 часов 26 минут. Кипение с обратным холодильником поддерживали в течение 5 часов 30 минут, и затем смесь охлаждали и поддерживали в течение ночи при 17°C.
Суспензию фильтровали на полиэтиленовой фритте. Желтые кристаллы высушивали на воздухе, затем помещали на лотки вакуумной печи на 75 часов, получая 5532 г (выход 95,1%) желтого твердого вещества. HPLC: 99,86%. 1H ЯМР соответствует структуре соединения 1.
Стадия 7: Перекристаллизация в этилацетате
В 2 л RBF добавляли неочищенный материал (10 г) и этилацетат (900 мл). Смесь кипятили с обратным холодильником при ~77°C и затем добавляли больше этилацетата (100 мл) для достижения полного растворения. Полученный прозрачный желтоватый раствор перемешивали при кипячении с обратным холодильником в течение ~30 минут и затем нагрев убирали. Смесь перемешивали в течение ночи при комнатной температуре.
Полученную суспензию фильтровали и собранное желтое твердое вещество промывали на воронке этилацетатом (30 мл). Влажное твердое вещество сушили в вакуумной печи при 40-50°C в течение 4 часов с получением 8,53 г желтого кристаллического продукта (общий выход ~17%).
1H ЯМР: согласуется со структурой; HPLC: 99,94% площади; DSC: 228,68°C, 151 Дж/г.
Если конкретно не указано иначе, соединение 1, использованное в следующих примерах, получали как в примере 1.
ПРИМЕР 3: Тонкое измельчение нафтофуранового соединения
Например, кристаллы соединения 1 размалывали и пропускали через сито 160 микрон (мкм) (сито # 100, отверстие 150 мкм) с получением кристаллов приблизительно 160 микрон или менее.
Например, кристаллы соединения 1 размалывали (ультрацентрифужная мельница Retsch ZM 200; один проход, при 18000 об/мин с использованием сита 0,25 мм) до медианного размера частиц приблизительно 20 микрон. В таблице 3 представлено результирующее распределение размера частиц (Malvern 2000 с приставкой для влажных образцов Hydro 2000S). В столбцах представлен максимальный размер частиц с общим суммарным процентом, представленным в нижнем индексе в заголовке столбца. Например, столбец D90 представляет размер, для которого 90% частиц обладают равным или меньшим размером. Столбец D50 представляет медианный размер - половина частиц обладает большим размером, и половина частиц обладает равным или меньшим размером.
|
Например, кристаллы соединения 1 тонко измельчали с использованием способа размола на струйной мельнице (4'' струйная мельница, давление Вентури = 40, давление измельчения = 100, скорость подачи = 1304 г/час) до медианного размера частиц приблизительно 2 микрон, как представлено в таблице 4. Анализ размера частиц проводили способом сухих частиц (анализатор размеров частиц Sympatec Helos/KF).
|
Кумулятивная функция распределения, выведенная из модели логарифмически нормального распределения размера частиц, обеспечивала хорошее соответствие данным, представленным в таблице 4. Кумулятивная функция распределения представлена как
где erf представляет собой функцию распределения вероятности ошибок, d представляет собой переменную диаметра частиц, dmedian представляет собой медианный размер частиц и σ представляет собой параметр, связанный с шириной кумулятивной функции распределения. CDF(d) представляет фракцию частиц, обладающих размером, меньшим или равным d.
При установке dmedian на наблюдаемую медиану 2,07 микрон подбор модели приводил к значению σ=1,06. Модель указывает на средний диаметр 3,6 микрон и моду диаметра 0,67 микрон. Модель также позволяет предполагать удельную площадь частиц 2200 м2/кг, хотя это не принимает во внимание такие факторы, как шероховатость поверхности.
ПРИМЕР 4: Фармакокинетика составов с медианным размером частиц 2 микрона, 20 микрон, 150 микрон у мышей
В одном из экспериментов тонкоизмельченное соединение 1, полученное на стадии 6 из примера 2 со средним размером частиц 2 микрона, 20 микрон, 150 микрон, составляли в форме суспензий в 20% Гелюцире 44/14 и 1% Tween 80 и вводили перорально мышам при 100 мг/кг. Каждая временная точка представляет среднее для 3 мышей (фиг.16).
Как показано на фиг.16, в то время как для соединения 1 с размером частиц 125-150 микрон показан более низкий уровень содержания по сравнению с частицами 2 микрона и 20 микрон, при дозировании всех при 100 мг/кг, для него показан такой же профиль. Для размеров частиц соединения 1 20 микрон (d50) показано содержание в плазме крови мышей, сходное с содержанием для дозы соединения 1 с размером частиц 2 микрона (d50). Более того, если удвоить содержание соединения для соединения 1 125-150 микрон, оно будет очень сходным с графиком PK для 2 и 20 микрон.
ПРИМЕР 5: Для составов с уменьшенным размером частиц показано большее ингибирование роста опухолей
В настоящих исследованиях для соединения 1 не показано эффективности или показана низкая эффективность при введении мышам в композиции с размером частиц более 20 микрон. Однако обнаружили, что соединение 1 обладает сильной противоопухолевой активностью без наблюдаемой токсичности, если соединение вводят в композиции с размером частиц менее 5 микрон.
В одном из экспериментов состав частиц соединения 1, просеянных до 160 микрон, тестировали в модели иммуносупрессированных мышей с прижившимся подкожным ксенотрансплантатом рака головы и шеи человека FaDu. Фармацевтическую композицию составляли как 80 мг/мл в 9% Гелюцире, 20% витамине E TPGS (таблица 3). Не наблюдали эффективности при дозе 400 мг/кг ежесуточного перорального дозирования (вводили также контроль - носитель), как показано на фиг.15. Этот уровень дозирования в 4 раза превышает уровень, использованный в PK эксперименте, показанном на фиг.16. Таким образом, этим мышам вводили в 4× большее содержание, чем содержание, наблюдаемое при дозировании 100 мг/кг 2 микрона соединения 1, обладающего хорошей эффективностью. Все режимы введения осуществляли ежесуточно (qd).
В одном из экспериментов кристаллы соединения 1 размалывали до медианного размера частиц приблизительно 20 микрон. Только низкую или умеренную эффективность наблюдали, когда соединение 1, размолотое до медианного размера частиц приблизительно 20 микрон, вводили перорально ежесуточно в дозе 200 мг/кг мышам с ксенотрансплантатами рака головы и шеи человека FaDu (фиг.15) (вводили также контроль - носитель). Все режимы введения осуществляли ежесуточно (qd).
Тестировали также кристаллы соединения 1, полученные в примере 1. Кристаллы соединения 1 тонко измельчали с использованием способа размола на струйной мельнице (4'' струйная мельница, давление Вентури = 40, давление измельчения = 100, скорость подачи = 1304 г/час) до медианного размера частиц приблизительно 2 микрона, как представлено в таблице 4.
Клетки рака головы и шеи человека FaDu инокулировали подкожно самкам бестимусных голых мышей (6×l06 клеток/мышь) и позволяли формирование доступных для пальпирования опухолей. Когда опухоли достигали приблизительно 100 мм3, животных обрабатывали перорально (po) соединением 1 при 100 мг/кг или контролем-носителем ежесуточно. Соединение 1 составляли при 10 мг/мл в 20% гелюцир. Опухоли и массы тела измеряли в ходе обработки (фиг.15).
Соединение 1 также тонко измельчали с использованием способа размола на струйной мельнице (8'' дисковая мельница, давление Вентури = 40, давление измельчения = 40, скорость подачи = 1920 г/час) до медианного размера частиц приблизительно 2 микрона, как представлено в таблице 5. Анализ размера частиц проводили способом сухих частиц (анализатор размеров частиц Sympatec Helos/KF). Наблюдали противоопухолевую активность, сходную с активностью для материала 2 микрона в таблице 4.
|
Таким образом, в то время как для соединения 1 150 микрон или 20 микрон показан профиль содержания в плазме, сходный с соединением 1 2 микрона (фиг.16), для них показана различная эффективность: для соединения 1 150 микрон не показано эффективности (фиг.15); для соединения 1 20 микрон показана низкая или умеренная эффективность; и для соединения 1 2 микрона показана сильная эффективность.
Как показано на фиг.16, для размеров частиц соединения 1 20 микрон (d50) показано содержание в плазме мышей, сходное с дозой соединения 1 с размером частиц 2 микрона (d50). Однако неожиданно, для соединения 1 с размером частиц 20 микрон показана только низкая или умеренная эффективность в моделях ксенотрансплантата у мышей, в то время как для соединения 1 с размером частиц 2 микрона показана высокая эффективность. Это неожиданный результат, поскольку общим представлением является то, что эффективность лекарственного средства основана на его фармакокинетике. Таким образом, поскольку для обоих размеров частиц показана одинаковая фармакокинетика, они оба должны являться одинаково эффективными.
Более того, если удвоить содержание соединения 1 125-150 микрон, оно является очень сходным с графиком PK для 2 и 20 микрон. Интересно, что когда мышам вводят дозу соединения 1 150 микрон на уровне, настолько высоком, как 400 мг/кг, оно также не обладает эффективностью в моделях ксенотрансплантатов (фиг.15).
Эти результаты противоречат общепринятому взгляду, что уменьшение размера частиц приводит к увеличению содержания в плазме и таким образом, к лучшей эффективности.
ПРИМЕР 6: Анализ HPLC
Этот способ HPLC предназначен для оценки чистоты нафтофурана, например, 2-ацетилнафто[2,3-b]фуран-4,9-диона (соединение 1), и завершения реакций с ним посредством HPLC. Все компоненты выражают как процент площади общих пиков на хроматограмме.
1. УСТРОЙСТВО И МАТЕРИАЛЫ (таблица 6A)
|
2. ПОЛУЧЕНИЕ РАСТВОРОВ
10 мМ фосфатный буфер
Взвесить 1,74 г двухосновного фосфата калия и развести 1 л очищенной воды (довести массы и объемы до необходимых количеств). Довести pH с помощью фосфорной кислоты до pH 6,8.
Подвижная фаза A
Приготовить подвижную фазу A смешиванием 10 мМ фосфатного буфера и ацетонитрила до соотношения 80:20 буфер:ацетонитрил. Дегазировать.
Подвижная фаза B
Приготовить подвижную фазу B смешиванием 10 мМ фосфатного буфера и ацетонитрила до соотношения 20:80 буфер:ацетонитрил. Дегазировать.
Разбавитель
Подвижную фазу A можно использовать в качестве разбавителя для всех образцов и препаратов стандартов.
3. ПРЕПАРАТЫ СТАНДАРТОВ
Стандарт исходного раствора соединения 1 (Концентрация ≈1,0 мг/мл)
Его получают взвешиванием 10 мг вещества сравнения соединения 1 в 20 мл сцинтилляционном флаконе; регистрируют массу ±0,01 мг. Добавляют 10 мл DMSO и обрабатывают ультразвуком до растворения твердых веществ:
Исходные тестируемые образцы (Концентрация ≈1,0 мг/мл)
Тестовые растворы получают взвешиванием 10 мг образца в 20 мл сцинтилляционном флаконе и разбавлением 10 мл DMSO:
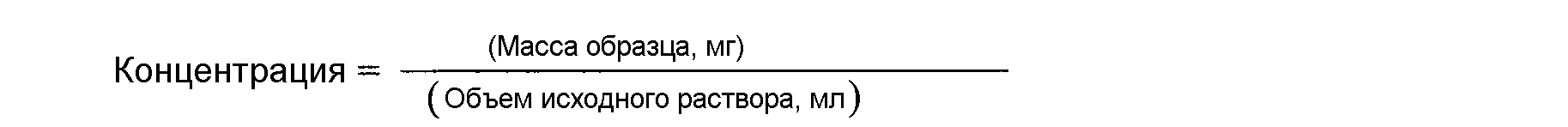
Рабочие тестовые образцы (Концентрация ≈0,01 мг/мл)
Этот раствор получали переносом 1 мл в 100 мл мерную колбу и разбавлением раствором разбавителя:

4. РАБОЧИЕ ПАРАМЕТРЫ УСТРОЙСТВА (таблица 6B)
|
5. ПОСЛЕДОВАТЕЛЬНОСТЬ ДЕЙСТВИЙ
Инъецировать растворы в следующей последовательности:
1. Пустой разбавитель (1X)
2. Рабочий стандарт соединения 1 (5X)
3. Тестовые растворы (2X каждый)
4. Рабочие стандарты (1X каждый)
6. ПРИГОДНОСТЬ СИСТЕМЫ
Система является пригодной для использования, если удовлетворяет следующим критериям.
1. Инъекция пустого разбавителя в начале последовательности не содержит интерферирующих пиков с какими-либо идентифицированными примесями.
2. Начальные инъекции рабочего стандарта соединения 1 в 5 повторах обладают (1) % RSDплощади пика <3,0%; (2) % RSDвремени удержания <3,0%; и (3) коэффициент асимметрии пика <2,0.
3. На хроматограмме для заключенного в скобки стандарта (1) время удержания составляет 97,0-103,0% среднего времени удержания начальных инъекций для определения пригодности и (2) % его площади составляет 97,0-103,0% от исходного значения.
7. РАСЧЕТЫ
Все пики регистрируют как % площади от всех пиков на хроматограмме, его можно рассчитать с помощью интегрированного программного обеспечения посредством следующей формулы:
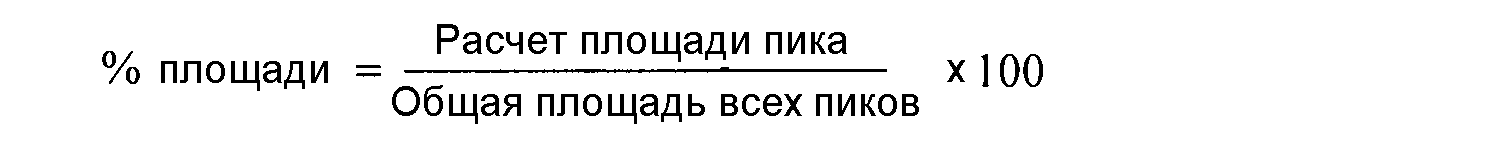
ЯМР и TLC
ЯМР (таблица 6C)
|
TLC на силикагеле (таблица 6D)
|
ПРИМЕР 7: Получение 2-ацетилнафто[2,3-b]фуран-4,9-диона
Способ получения соединения 1 представлен ниже.
Стадия 1: Бромирование
В 2-литровую 3-горлую круглодонную колбу, оборудованную механической мешалкой, термометром и капельной воронкой, добавляют 3-бутен-2-он (451,2 грамма). В капельную воронку добавляют бром (936,0 граммов). После охлаждения содержимого колбы до -5°C бром добавляют по каплям в колбу при интенсивном перемешивании и поддержании температуры при -5°C в течение 30 минут. Смесь перемешивают в течение дополнительных 15 минут при -5°C и затем разделяют на 4 равные порции.
Стадия 2: Дебромирование
Каждую порцию смеси вместе с тетрагидрофураном (2133,6 грамма) добавляют в 22-литровую 4-горлую круглодонную колбу, оборудованную механической мешалкой, термометром и капельной воронкой. В капельную воронку добавляют DBU (1,3-диазабицикло[5,4,0]ундец-7-ен, 222,9 грамм). DBU добавляют по каплям в колбу при интенсивном перемешивании и поддержании температуры при 0°C-5°C в течение 30 минут. Смесь перемешивают в течение дополнительных 15 мин при 0°C-5°C.
Стадия 3: Реакция конденсации
Затем в колбу добавляют 2-гидрокси-l,4-нафтохинон (231 грамм). Дополнительный DBU (246,0 грамм) добавляют в капельную воронку и затем добавляют по каплям в смесь в колбе с такой скоростью, что температура реакционной смеси не превышает 40°C. После завершения добавления DBU полученную смесь перемешивают в течение ночи при комнатной температуре и образец реакционной смеси отбирают для анализа HPLC.
В реакционную смесь добавляют воду (10,8 литров), и полученную смесь охлаждают до 0°C-3°C в течение по меньшей мере 30 минут, затем фильтруют через вакуумный фильтр. Отфильтрованное твердое вещество промывают последовательно 5% водным бикарбонатом натрия (3 литра), водой (3 литра), 1% водной уксусной кислотой (3 литра) и этанолом дважды (2×1 литр).
Стадия 4: Кристаллизация
Промытое твердое вещество сохраняют и объединяют с веществом из других партий. Объединенный неочищенный продукт (28,73 кг) добавляют вместе с этилацетатом (811,7 кг) в сосуд на 500 галлонов (1893 л), оборудованный механической мешалкой, термометром и конденсатором. В атмосфере азота смесь нагревают до кипения с обратным холодильником (72°C) в течение 2 часов, и затем фильтруют с помощью патронного фильтра 10 микрон, содержащего слой активированного угля, для удаления нерастворимых примесей.
Свежий горячий этилацетат (10 кг) используют для промывки сосуда, транспортной линии и фильтра. Объединенный фильтрат охлаждают до 0-5°C и выдерживают при этой температуре 2 часа, и затем фильтруют через фильтр Бюхнера 20 дюймов (0,508 м). Отфильтрованный твердый продукт промывают при 0-5°C этилацетатом (5,7 кг) и высушивают в вакууме при 40°C до постоянной массы.
Объем оставшегося фильтрата уменьшали до 63% выпариванием и процесс кристаллизации снова повторяли для получения второй порции продукта, которую также высушивали в таких же условиях, что и первую порцию продукта.
Две партии соединения 1 получены по этому способу. Одна партия обладает чистотой 91,64% площади, и другая партия обладает чистотой 95,44% площади, измеренной по HPLC.
ПРИМЕР 8: Получение неочищенного 2-ацетилнафто[2,3-b]фуран-4,9-диона
Другой способ получения соединения 1 кратко изложен следующим образом.
Стадия 1: Бромирование
В 12 л RBF (круглодонную колбу)(защищенную от света УФ-фильтрами) добавляли MVK (2,160 мл, 26,4 моль) и охлаждали до -9,6°C в бане с сухим льдом/ацетоном. Бром (1300 мл, 25,3 моль) добавляли медленно, в течение 2 час и 20 мин, поддерживая T=<-2,6°C (Tmax). Полученную желтую смесь перемешивали в течение дополнительных 28 мин.
Стадия 2: Дегидробромирование
В 72 л RBF с предварительно охлажденным THF (тетрагидрофураном) (20 л, 5 мл/г HNQ (2-гидрокси-1,4-нафтохинон)) добавляли бромированный продукт после вышеуказанной стадии и полученный раствор охлаждали до -4,8°C. DBU (4200 мл, 28,1 моль), растворенный в THF (4200 мл), добавляли медленно, в течение 2 час и 20 мин, поддерживая T<0,3°C (Tmax). Полученную суспензию перемешивали в течение 42 мин.
Стадия 3: Конденсация
2-гидрокси-1,4-нафтохинон (4,003 г, 23,0 моль) добавляли, в одной порции, в реакционную смесь из вышеуказанной стадии, при -1,8°C. Охлаждающую баню добавляли во время того, как добавляли вторую порцию DBU (3,780 мл, 25,3 моль) в течение 48 минут, чтобы довести реакционную температуру до 40°C. Охлаждающую баню удаляли и реакционную смесь перемешивали в течение выходных с открытым доступом воздуха.
Стадия 4: Выделение неочищенного материала
В 200 л реактор с предварительно охлажденной водой (100 л, 25 мл/г HNQ) добавляли реакционную смесь после вышеуказанной стадии. Полученную суспензию охлаждали до 6,0°C и затем перемешивали при T=3±3°C в течение ~1 часа. Затем полученную суспензию фильтровали и собранное твердое вещество переносили обратно в 200 л реактор.
После перемешивания в водном 5% NaHCO3 (26 л, 6,5 мл/г HNQ) в течение 1 часа, суспензию фильтровали. Собранное твердое вещество переносили обратно в 200 л реактор, перемешивали в воде (26 л) в течение 1 часа и затем фильтровали.
Влажное твердое вещество переносили обратно в 200 л реактор, перемешивали в 1% водной уксусной кислоте (26 л) в течение ~1 часа, фильтровали и затем промывали на воронке с фильтром водой (10 л). Собранное твердое вещество переносили обратно в 200 л реактор и нагревали в этаноле (17,5 л; 4,3 мл/г HNQ) со слабым кипением с обратным холодильником (77,4°C). Полученную суспензию охлаждали до 4,2°C и фильтровали.
Влажное твердое вещество переносили в 100 л реактор и нагревали в этаноле (17,5 л; 4,3 мл/г HNQ) с кипячением с обратным холодильником (77,6°C). Полученную суспензию охлаждали до 4,5°C и фильтровали. Из влажного осадка удаляли жидкость в течение ночи. Отбирали образцы для 1H ЯМР и HPLC. 1H ЯМР: Соединение 1/NDHF (2-ацетил-2,3-дигидронафто[2,3-b]фуран-4,9-дион) 42:58%; HPLC: Соединение 1/NDHF 74:11% площади.
Твердые вещества высушивали в вакуумной печи при 50°C в течение 4 суток, получая 2268 г неочищенного соединения 1. 1H ЯМР: Соединение 1/NDHF 41:59%; HPLC: Соединение 1/NDHF 67:11% площади.
ПРИМЕР 9: Окисление нафтодигидрофурана
Неочищенное соединение 1 (2,268 кг) суспендировали в толуоле (77 л). Добавляли MnO2 (9536 г) и смесь нагревали со слабым кипением с обратным холодильником. По TLC (1:1 EA:гексан) показали полную реакцию через 1 час.
Затем реакционную смесь фильтровали горячей через предварительно нагретый слой целита (1530 г, нижний слой), активированного угля (2230 г, средний слой) и целита (932 г, верхний слой). Собирали оранжево-желтый фильтрат.
Фильтрат концентрировали в роторном вакуумном испарителе до приблизительно 1/10 объема. Суспензию фильтровали и промывали толуолом. Затем кристаллы сушили при 50°C с получением 952 г (42%) темно-желтого твердого вещества. HPLC: 99,94%. В 1H ЯМР не выявили нафтодигидрофурана.
Кристаллы высушивали при 50°C в вакууме в течение дополнительных 46-65 часов для снижения количества остаточного толуола в материале.
ПРИМЕР 10: Обработка этилацетатом
Соединение 1 (5816 г) добавляли в 200 л реакционный сосуд. Добавляли этилацетат (145 л, 25 мл/г) и раствор нагревали до кипения с обратным холодильником в течение 2 часов 26 минут. Кипячение с обратным холодильником поддерживали в течение 5 часов 30 минут, и затем смесь охлаждали и поддерживали в течение ночи при 17°C.
Суспензию фильтровали на полиэтиленовой фритте. Желтые кристаллы высушивали на воздухе, затем помещали на лотки вакуумной печи на 75 часов, получая 5532 г (выход 95,1%) желтого твердого вещества. HPLC: 99,86%. 1H ЯМР соответствует структуре соединения 1.
ПРИМЕР 11: Перекристаллизация в этилацетате
В 2 л RBF добавляли неочищенный материал (10 г) и этилацетат (900 мл). Смесь кипятили с обратным холодильником при ~77°C и затем добавляли больше этилацетата (100 мл) для достижения полного растворения. Полученный прозрачный желтоватый раствор перемешивали при кипячении с обратным холодильником в течение ~30 минут и затем нагрев убирали. Смесь перемешивали в течение ночи при комнатной температуре.
Полученную суспензию фильтровали и собранное желтое твердое вещество промывали на воронке этилацетатом (30 мл). Влажное твердое вещество сушили в вакуумной печи при 40-50°C в течение 4 часов с получением 8,53 г желтого кристаллического продукта (общий выход ~17%).
1H ЯМР: согласуется со структурой; HPLC: 99,94% площади; DSC: 228,68°C, 151 Дж/г.
ПРИМЕР 12: Идентификация нафтофурановых соединений, нацеленных на злокачественные опухоли и злокачественные стволовые клетки
Способы
Прижизненные обследования: Ежесуточно проводили также обследования состояния здоровья каждого животного. Массы тела проверяли каждые трое суток. Корм и воду поставляли ежесуточно в соответствии со способами отдела содержания животных. Обработку, приводящую к >20% летальности и/или >20% потери чистой массы тела, считали токсичной. Результаты выражали как средний объем опухоли (мм3) ± SE. Значения p<0,05 считали статистически значимыми.
Содержание животных: Самцов или самок бестимусных голых мышей 4-5 недель (Charles River Laboratories, Wilmington, MA.) акклиматизировали в отделе содержания животных в течение по меньшей мере 1 недели до начала исследования. Все использованные экспериментальные способы соответствовали руководству, изложенному American Physiology Society и в Guide for the Care and Use of Laboratory Animals, а также были одобрены Institutional Animal Care and Use Committee Boston Biomedical Inc. Животных содержали в группах по четыре в клетках с подстилкой из древесной стружки в комнате с контролируемой температурой (68°F-72°F (20°C-22°C)), светом (12-час цикл света-темноты) и влажностью (45-55%). Животным обеспечивали свободный доступ к воде и пище во время эксперимента.
ПРИМЕР 13: Клинические исследования: Безопасность и эффективность
2-ацетилнафто[2,3-b]фуран-4,9-дион после получения одобрения IND US FDA и Health Canada выбран для проведения Фазы I клинических исследований, которая представляла собой исследование с повышением дозы на взрослых пациентах со злокачественными опухолями на поздних стадиях после неудачи общепринятых способов терапии. Цикл состоит из перорального введения соединения дважды в сутки в течение 4 недель. Циклы повторяли каждые 4 недели (28 суток) до прогрессирования заболевания, неприемлемой токсичности или удовлетворения другому критерию прекращения. Исследование с повышением дозы проводили как открытое и многоцентровое исследование. Модифицированную схему ускоренного титрования Саймона использовали для повышения дозы.
Первичной целью исследования являлось определение безопасности, переносимости и рекомендованной дозы фазы II (RP2D). Вторичными целями исследования являлись определение фармакодинамического профиля соединения, фармакодинамики соединения и предварительной противоопухолевой активности соединения.
Критерии включения включали гистологически или цитологически подтвержденную солидную опухоль, которая является метастазирующей, неоперабельной или рецидивирующей; возраст ≥18 лет; возможность измерения заболевания по шкале RECIST; и индекс Карновского ≥70%. Критерии исключения включали химиотерапию, лучевую терапию, иммунотерапию или прием экспериментального препарата в пределах 4 недель от первой дозы; хирургическая операция в пределах 4 недель от первой дозы; и известные метастазы в головной мозг.
На 7 февраля 2011 г. 42 пациента со злокачественными опухолями с различными солидными опухолями на поздних стадиях после неудачного лечения химиотерапевтическими средствами были включены в исследование. Демографические характеристики и исходные характеристики заболевания пациентов, выбранных при соблюдении вышеуказанных критериев, суммированы в таблице 7.
|
Для этих 42 пациентов оценивали 10 когорт при дозах от 20 мг до 2000 мг/сутки. Повышение дозы являлось хорошо переносимым и не наблюдали ограничивающей дозу токсичности. Неблагоприятные события в основном являлись умеренными с наиболее распространенными: диареей, тошнотой и утомляемостью. События степени 3 или выше включают утомляемость и диарею. Эти неблагоприятные события представляют собой регистрацию того, что эти пациенты со злокачественными опухолями на поздней стадии испытывали во время клинических исследований, что может быть связано или не связано с соединением 1. Неблагоприятные события обобщены в таблице 8.
|
До настоящего времени ни MTD, ни RP2D не достигнуты. Для доз до приблизительно 1000 мг/сутки соединения показана благоприятная фармакокинетика с кажущейся линейной фармакокинетикой и без доказательства накопления лекарственного средства при повторяемом ежесуточно дозировании каждые 28 суток. При уровне дозы 320 мг/сутки концентрация соединения в плазме являлась устойчивой в течение более 8 часов при концентрации по меньшей мере 1,5 мкМ (IC50 соединения in vitro: 30-500 нМ). Средние концентрации в плазме для различных групп доз показаны на фиг.12.
Из 42 получавших дозы пациентов 24 являлись подлежащими оценке по ответу опухолей по данным на 7 февраля 2011 г.; 16 (16/24 подлежащих оценке пациентов) достигли стабильного заболевания (8-75+ недель). Пациенты, включенные до настоящего времени, суммированы в таблице 9.
|
Для 16/24 подлежащих оценке пациентов показано SD/MR, где для 12 показано продленное SD (>12 недель) по RECIST 1.1; новые очаги метастазирования предотвращены у 83% получавших дозы пациентов.
Полная регрессия очага метастазирования рака толстого кишечника в почке у пациента 0001 показана на фиг.19. При ежесуточном введении 20 мг наблюдали высокую концентрацию соединения в моче пациента. Обогащение содержания соединения в моче (таблица 10) объясняет полную регрессию при относительно низкой дозе.
Полная регрессия очага метастазирования рака толстого кишечника в почке у пациента 0001 показана на фиг.19. При ежесуточном введении 20 мг наблюдали высокую концентрацию соединения в моче пациента. Обогащение содержания соединения в моче может помочь объяснить наблюдаемую полную регрессию при относительно низкой дозе (таблица 10).
|
Соответственно, для соединения показан отличный профиль безопасности. До настоящего времени не наблюдали ограничивающей дозу токсичности.
Наблюдали также благоприятный PK профиль для перорального bid дозирования. Концентрация в плазме достигала превышения эффективной концентрации в несколько раз (in vitro IC50). Данные AUC показаны в таблице 11.
|
Кроме того, наблюдали признаки противоопухолевой активности. Для 16 из 24 пациентов показано SD/MR по RECIST в ряде опухолей, невосприимчивым к химиотерапевтическим средствам, включая аденокарциному ободочной и прямой кишки, рак головы и шеи, рак легкого, рак молочной железы, рак желудка и рак яичника, меланому. Существовал один случай полной регрессии очага метастазирования рака толстого кишечника в почке (фиг.19). Пациенты после лечения соединением 1 показали поразительное отсутствие новых очагов метастазирования опухолей. Из 24 подлежащих оценке пациентов с невосприимчивыми злокачественными опухолями на поздних стадиях более 80% не имели метастазирующих опухолей.
У пациентов, достигших продолжительного стабильного заболевания (>16 недель) во время лечения BBI608, посредством иммуногистохимии с использованием антитела анти-p-STAT3 обнаружены высокие уровни p-STAT3 в тканях опухолей до лечения (фиг.25).
ПРИМЕР 14: Режимы дозирования
Терапевтически эффективное количество фармацевтической композиции, включая частицы, полиморфы и/или очищенные формы соединения по изобретению, может составлять общую суточною дозу в диапазоне от приблизительно 20 мг до приблизительно 2000 мг, от приблизительно 240 мг до приблизительно 1500 мг или от приблизительно 400 мг до приблизительно 1000 мг.
Пригодные режимы дозирования включают введение частиц, полиморфов и/или очищенных форм соединения по изобретению в однократной суточной дозе. Например, частицы, полиморфы и/или очищенные формы соединения по изобретению вводят в однократной суточной дозе в диапазоне от приблизительно 20 мг QD до приблизительно 1000 мг QD.
Пригодные режимы дозирования включают введение частиц, полиморфов и/или очищенных форм соединений по изобретению в более чем одной суточной дозе. Например, частицы, полиморфы и/или очищенные соединения по изобретению вводят в двух суточных дозах, где суммарная суточная доза лежит в диапазоне от приблизительно 40 мг до приблизительно 2000 мг. Например, частицы, полиморфы и/или очищенные соединения по изобретению вводят в двух суточных дозах, где каждая доза лежит в диапазоне от приблизительно 20 мг до 1000 мг. Например, частицы, полиморфы и/или очищенные формы соединения по изобретению вводят в двух суточных дозах, где каждая доза лежит в диапазоне от приблизительно 160 мг до 600 мг. Например, частицы, полиморфы и/или очищенные формы соединения по изобретению вводят в двух суточных дозах, где каждая доза лежит в диапазоне от приблизительно 200 мг до 500 мг. Например, частицы, полиморфы и/или очищенные формы соединения по изобретению вводят в двух суточных дозах, где каждая доза составляет приблизительно 500 мг.
Пригодные режимы дозирования включают введение частиц, полиморфов и/или очищенных форм соединения по изобретению в трех суточных дозах, где суммарная суточная доза лежит в диапазоне от приблизительно 60 мг до приблизительно 1500 мг. Например, частицы, полиморфы и/или очищенные формы соединения по изобретению вводят в трех суточных дозах, где каждая доза лежит в диапазоне от приблизительно 20 мг до 500 мг. Например, частицы, полиморфы и/или очищенные формы соединения по изобретению вводят в трех суточных дозах, где каждая доза лежит в диапазоне от 160 мг до 500 мг.
Для режима дозирования, при котором субъектам-людям вводили приблизительно 500 мг соединения 1 дважды в сутки (т.е. 1000 мг суммарная суточная доза), показано достижение наилучшей избирательной фармакокинетики почти для всех прошедших лечение пациентов. Для этого режима дозирования, обозначенного в настоящем документе как 500 мг BID, показаны желательные фармакокинетические свойства соединения 1 у человека (фиг.20).
В другом пригодном режиме дозирования 500 мг соединения 1 вводят трижды в сутки (TID) субъектам-людям. В то время как уровень содержания соединения 1 значительно не улучшился при дозировании трижды в сутки по сравнению с дозированием дважды в сутки, дозирование TID увеличивает время воздействия лекарственного средства на человека. Для этого режима дозирования, обозначенного в настоящем документе как 500 мг TID, показана хорошая переносимость человеком без наблюдения значительных неблагоприятных событий, связанных с лекарственным средством.
В другом пригодном режиме дозирования приблизительно 20 мг соединения 1 или более вводят один раз в сутки субъектам-людям. Для этого режима дозирования, обозначенного в настоящем документе как 20 мг QD, показаны терапевтически активные уровни у пациентов, но оно быстро выводится из крови человека (фиг.21). Для этого режима дозирования показана хорошая переносимость для человека и убедительные признаки противоопухолевой активности в очаге рака толстого кишечника в почке благодаря очень высокой концентрации лекарственного средства в моче.
В другом пригодном режиме дозирования соединение 1 вводят с молоком натощак, что обеспечивает желательную фармакокинетику (таблица 12).
|
В другом пригодном режиме дозирования соединение 1 вводят с пищей, что задерживает Tmax (таблица 13).
|
ПРИМЕР 15: Нафтофурановые соединения продлевают выживаемость без прогрессирования
Продление выживаемости без прогрессирования (PFS) показано у пациентов с колоректальным раком на поздних стадиях, невосприимчивым к химиотерапии (фиг.22). Продление выживаемости без прогрессирования наблюдали также у пациентов с раком головы и шеи, раком желудка, раком яичника, трижды негативным раком молочной железы, меланомой, адренокортикоидным раком и раком легкого.
Для соединения 1 концентрация лекарственного средства в крови выше 1 мкМ коррелировала с увеличением выживаемости без прогрессирования (фиг.23) у пациентов с различными злокачественными опухолями, включая колоректальный рак, рак желудка, головы и шеи, меланому, хондросаркому, рак легкого, предстательной железы, яичников, адренокортикоидный рак и ангиосаркому.
ПРИМЕР 16: Фармакокинетический профиль соединения 1
Обнаружили, что соединение 1 является одинаково токсичным для злокачественных клеток и нормальных клеток, и заключили, что оно не обладает потенциалом для лечения злокачественных опухолей (K. Hirai K. et al., Cancer Detection and Prevention, 23(6) (1999) 539-550; Takano A. et al., Anticancer Research 29:455-464, 2009). В исследованиях, описанных в настоящем документе, обнаружили, вопреки предположениям, что для уничтожения посредством соединения 1 для злокачественных клеток и злокачественных стволовых клеток необходимо намного более короткое воздействие, чем для нормальных клеток. Нормальные клетки могут выдерживать воздействие соединения 1 вплоть до 24 часов. Более того, в исследованиях обнаружили, что нормальные клетки могут восстанавливаться после кратковременного периода отсутствия воздействия лекарственного средства, в то время как раковые клетки не могут восстанавливаться после воздействия определенной концентрации соединения 1 в течение по меньшей мере 2 часов. На основании этих исследований, с использованием данных, показанных ниже в таблице 14, для соединения 1 для достижения избирательной противоопухолевой активности у пациентов разработано специальное фармакокинетическое воздействие [обозначенное избирательным фармакокинетическим профилем (SPP) или предпочтительным фармакокинетическим профилем (PPP), которые используют взаимозаменяемо в этой публикации] (фиг.24).
|
Пригодные SPP или PPP воздействия соединения по изобретению, такого как соединение 1, его частицы, полиморфы и/или очищенные формы, составляют по меньшей мере или выше 1,0 мкМ в течение по меньшей мере 2 часов, и концентрация лекарственного средства в крови должна быть в основном выведена в пределах 24 часов.
Например, у пациента поддерживают воздействие концентрации соединения по изобретению, такого как соединение 1, его частицы, полиморфы и/или очищенные формы, по меньшей мере 1,5 мкМ в течение определенного периода времени, предпочтительно по меньшей мере 2 часа, и лекарственное средство должно быть в основном выведено в пределах 24 часов. Более длительное воздействие соединения может приводить к токсичности и/или потере избирательности.
Для достижения этих желаемых SPP или PPP соединение по изобретению можно вводить в дозе, позволяющей достигать в крови субъекта, например пациента, концентрации соединения в диапазоне по меньшей мере от приблизительно 0,02 мкМ до приблизительно 30 мкМ. Например, соединение по изобретению можно вводить в дозе, позволяющей достигать в крови субъекта концентрации соединения по меньшей мере приблизительно выше 0,5 мкМ на время по меньшей мере 2 часа, но менее 24 часов. Например, соединение по изобретению можно вводить в дозе, позволяющей достигать в крови субъекта концентрации соединения по меньшей мере приблизительно 2 мкМ в течение по меньшей мере 2 часов, но менее 24 часов.
Предпочтительно, раковые клетки необходимо подвергать воздействию соединения по изобретению, такого как соединение 1, его частицы, полиморфы и/или очищенные формы, в течение 4 часов при концентрации более 0,2 мкМ, чтобы индуцировать гибель раковых клеток. Однако продленное воздействие не вносит значительного вклада в эффективность соединения по изобретению, такого как соединение 1, его частицы, полиморфы и/или очищенные формы, для уничтожения раковых клеток. Для соединения 1 показана избирательная активность для уничтожения раковых клеток и сохранения нормальных клеток, когда концентрацию соединения 1 поддерживали от приблизительно более 0,5 до приблизительно 3 мкМ в течение менее 24 часов. Этого предпочтительного фармакокинетического профиля и избирательной активности достигали при уменьшении размера частиц соединения 1.
Избирательная активность соединения 1 в отношении уничтожения раковых клеток и сохранения нормальных клеток представлена данными в таблице 14 и проиллюстрирована на фиг.24. Для воздействия на раковые клетки соединения 1 в концентрациях приблизительно или выше 0,2 и 30 мкМ в течение от приблизительно 4 часов вплоть до приблизительно 24 часов показано избирательное уничтожение раковых клеток и сохранение нормальных клеток. Продолжительное воздействие при этих концентрациях с продолжительностью более 24 часов приводило к потере избирательности, в том смысле, что нормальные клетки также были повреждены. Воздействие соединения 1 при концентрациях в крови менее 0,5 мкМ не приводило к уничтожению раковых клеток независимо от длительности периода воздействия.
Для режимов дозирования, описанных в настоящем документе, показан этот предпочтительный PK профиль. Например, PK, наблюдаемый для пациентов, получающих 500 мг BID для пациентов, представляет собой этот предпочтительный PK профиль воздействия (фиг.20), обладающий непрерывным воздействием соединения 1 выше терапевтических уровней с фактическим выведением лекарственного средства за 24 часа. От 80 мг BID до 200 мг BID, SPP или PPP достигали у пациентов с зависимым от дозы увеличением концентрации лекарственного средства в плазме. При 300 мг BID и 400 мг BID кажущаяся концентрация лекарственного средства в плазме, по-видимому, подвергалась ограничению дальнейшего увеличения выше 200 мг BID. Однако обнаружено, что 500 мг BID неожиданно может помочь уменьшать вариабельность между пациентами, а именно все подвергнутые лечению пациенты могут достигать SPP с достаточно высокой концентрацией лекарственного средства в плазме (фиг.12). Наконец, для пациентов, подвергнутых воздействию соединения 1 выше 1,6 мкМ в течение по меньшей мере 4 часов показано улучшение выживаемости без прогрессирования, что указывает на то, что этот профиль воздействия приводит к улучшенной эффективности для человека. PK воздействие соединения 1 выше 1 мкМ коррелирует с увеличением выживаемости без прогрессирования (фиг.23) у пациентов с различными злокачественными опухолями, включая колоректальный рак, рак желудка, головы и шеи, меланому, хондросаркому, рак легкого, предстательной железы, яичников, адренокортикоидный рак и ангиосаркому. Эти данные сильно отличаются от того, что можно было ожидать на основании доклинических экспериментов. В доклинических исследованиях показано, что соединение уничтожает раковые клетки или злокачественные стволовые клетки с IC50 приблизительно 100-200 нМ. Однако в клинике для пациентов наблюдали, что эти концентрации не ассоциированы с клинической активностью. В отличие от этого, концентрация в плазме должна достигать выше 1 мкМ для проявления признаков активности. Дополнительное увеличение концентрации лекарственного средства в плазме до приблизительно или выше 2 мкМ или 3 мкМ ассоциировано с улучшенными признаками противоопухолевой активности.
Варианты осуществления, проиллюстрированные и обсуждаемые в этом описании, предназначены только для указания специалистам в данной области известного авторам изобретения наилучшего способа осуществления и использования изобретения. Ничего в этом описании не следует рассматривать как ограничение объема настоящего изобретения. Все представленные примеры являются репрезентативными и неограничивающими. Вышеописанные варианты осуществления изобретения можно модифицировать или изменять без отклонения от изобретения, как понятно специалистам в данной области в свете вышеописанных способов. Таким образом, следует понимать, что в пределах содержания пунктов формулы изобретения и их эквивалентов изобретение можно осуществлять на практике иным образом, чем конкретно описанные.