Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ НИОСОМАЛЬНОЙ ФОРМЫ ОФЛОКСАЦИНА
Вид РИД
Изобретение
Изобретение относится к медицине и биотехнологии, а именно к способу микрокапсулирования антимикробных препаратов в ниосомы. Применение в медицинской практике антибиотиков в составе ниосом снижает степень их инактивации и позволяет оптимизировать антимикробное действие за счет концентрации микровезикул на основе неионных ПАВ, главным образом, в паренхиматозных органах (печень, селезенка, легкие). Отмечено, что иммобилизация антибиотиков в микровезикулы различного состава позволяет значительно повысить эффективность лечения некоторых инфекций в эксперименте в сравнении со свободными формами антимикробных препаратов [1, 2].
Ниосомы - это стабильные микроскопические везикулы, образованные одной или несколькими бислойными гидрофобными мембранами различного состава в присутствии неионогенных поверхностно-активных веществ (ПАВ). Включение биоактивных макромолекул в ниосомы является одним из перспективных направлений биотехнологии и медицины. Широкое применение неионных ПАВ и липидов в конструировании подобных систем обусловлено их биосовместимостью, способностью к биодеградации, низкой токсичностью [3].
Ниосомальные формы активно внедряются в медицинскую практику, и многочисленные научные исследования демонстрируют потенциальную возможность использования ниосом для дизайна новых средств адресной доставки антираковых, антимикробных и противовоспалительных препаратов [4]. Включение биологически активных веществ в ниосомы обеспечивает их эффективную дозированную и пролонгированную доставил в клетки тканей. Перспективным представляется переход от инъекционных форм отдельных лекарственных препаратов к более удобным пероральным, в том числе на основе микро- и наноконтейнеров с инкапсулированным действующим веществом.
Существует способ получения комбинированного липосомального антибактериального препарата [5]. Основу способа составляет растворение навесок фосфатидилхолина, холестерина и рифампицина в хлороформе, приготовление раствора гентамицина сульфата, создание эмульсии из хлороформенного раствора липидов с рифампицином, получение липосом выпариванием с обращением фаз, удаление невключившихся в мембрану рифампицина и внутрь везикул гентамицина сульфата центрифугированием.
Известен способ получения липосомальных форм вакцинных препаратов, основанный на растворении навесок липидов в хлороформе, формировании тонкой липидной пленки в процессе удаления растворителя при пониженном давлении, получении липосом путем интенсивного встряхивания смеси липидов с буферным раствором, содержащим включаемый антиген, и последующей лиофилизации аликвот готовой дисперсии [6].
Описан способ получения дисперсий, содержащих микровезикулы, который заключается в гомогенизации и лиофилизации эмульсии, образующейся при добавлении водной фазы к расплавленной смеси липидов. Включение действующего вещества проводят путем восстановления лиофилизата в присутствии соответствующего водного раствора. Недостатком указанного способа является низкая эффективность включения веществ в готовые микровезикулы [7].
Приведенные способы получения липосомальных препаратов, содержащих биологически активные вещества, имеют ряд общих недостатков. В частности, низкая эффективность образования микровезикул, невысокая стабильность липосомальных эмульсий при хранении вследствие окисления липидных компонентов липосом, а также агрегации и седиментации незаряженных частиц. Основными преимуществами ниосом по сравнению с липосомами являются: широкий выбор, высокая стабильность, чистота и сравнительно низкая стоимость неионных ПАВ, используемых при получении ниосом, простота методов конструирования ниосомальных препаратов и возможность крупномасштабного производства ниосом, более длительные сроки хранения, возможность варьировать размеры и, соответственно, емкость микроконтейнеров (количество включенного вещества) [8].
Известен способ получения кремнийсодержащих ниосом, заключающийся в интенсивном механическом перемешивании при комнатной температуре в течение 5 мин смеси ПЕГ-12 диметикона, масла авокадо, экстракта стволовых клеток и гиалуроновой кислоты. Полученная дисперсия содержит ниосомы размером до 100 нм [9]. Вместе с тем отсутствуют сведения об эффективности включения действующих веществ в соответствующих препаратах.
Известна модификация способа получения ниосом с использованием обращенно-фазной отгонки, предложенная Luciani с соавт. [10]. Согласно этому способу смесь Span 60, Solulan С-24, стеарилового эфира поли-100-оксиэтилена, холестерина, N-пальмитоилглюкозамина диспергируется в водном растворе включаемого вещества (гадобенат димеглюмина). Затем полученный раствор нагревают на водяной бане при 90°С в течение 30 мин и подвергают воздействию ультразвукового дезинтегратора в течение 5 мин (амплитуда 10 мкм). Среднее значение размеров частиц дисперсии при этом составило 163-268 нм в зависимости от соотношения компонентов препарата. Эффективность включения действующего вещества в микровезикулы, определенная методом спектрофотометрии, находилась в пределах 4,6-8% от общего количества гадобенат димеглюмина (в молях), содержащегося в препарате.
Наиболее близким к описываемому по технической сущности является способ получения ниосомальных препаратов, в соответствии с которым смесь сорбитана моностеарата, холестерина и дицетилфосфата (молярное соотношение 47,5:47,5:5 соответственно) растворяют в 15 мл диэтилового эфира и эмульгируют в присутствии 2 мл водной фазы, содержащей действующее вещество (диклофенак натрия) в концентрации 5 мг/мл. Органический растворитель удаляют при пониженном давлении при комнатной температуре. Полученный гель затем гидратируют в присутствии 3 мл фосфатно-солевого буфера (pH 7,4). Смесь выдерживают при пониженном давлении до завершения гидратации [11]. Эффективность включения действующего вещества составила 47,01±1,83%.
Описанный способ имеет ряд существенных недостатков. В частности, в качестве органической фазы используется диэтиловый эфир, имеющий низкую температуру кипения, а также способный образовывать взрывоопасные смеси с воздухом и при хранении - нестойкие пероксиды, которые могут быть причиной самовоспламенения при комнатной температуре. В этом способе также отсутствует описание стандартизованных параметров температуры и времени этапа гидратации ниосомального геля, что может приводить к получению серий ниосомальных препаратов с разными показателями качества.
Целью изобретения является разработка способа получения ниосомальных форм антибактериальных препаратов.
Технический результат предлагаемого изобретения достигается путем оптимизации состава и технологии конструирования ниосом, позволяющих эффективно получать ниосомальные формы как гидрофобных и амфифильных антибиотиков, локализующихся в мембране везикул, так и гидрофильных антибиотиков, локализующихся внутри везикул. Использование в качестве основного структурного компонента ниосом сорбитана моностеарата обеспечивает: высокую устойчивость к окислению дисперсии в процессе получения и хранения препарата; индукция отрицательного заряда на поверхности ниосом путем включения в состав дисперсии дицетилфосфата препятствует агрегации везикул при хранении; включение в состав ниосом полиэтиленгликоля (средняя молекулярная масса 4000) позволяет повысить эффективность включения антибактериальных препаратов в ниосомы и создает стерические препятствия для взаимодействия с белками in vivo, что способствует увеличению времени циркуляции ниосом в организме.
Основу способа составляет растворение навесок сорбитан моностеарата, холестерина, дицетилфосфата и полиэтилен гликоля в хлороформе, приготовление водного раствора включаемого антибиотика, эмульгирование смеси хлороформенного раствора сорбитан моностеарата, холестерина, дицетилфосфата и полиэтиленгликоля и водного раствора включаемого антибиотика, получение ниосом путем обращенно-фазовой отгонки. Оптимизация состава ниосомальных микровезикул и условий обращенно-фазовой отгонки позволяет получать стандартизованные ниосомальные формы антибиотиков с высокой эффективностью включения действующего вещества в ниосомы. Применение в качестве органической фазы хлороформа позволяет проводить эмульгирование смеси компонентов ниосом эффективно и безопасно.
Способ осуществляется следующим образом.
Точные навески Span 60, холестерина, полиэтиленгликоля PEG-4000 и дицетилфосфата в молярном соотношении 35:27:1:5, соответственно, растворяют в хлороформе (10 мл на 1 г смеси компонентов). К полученному раствору добавляют водную фазу, содержащую включаемый в ниосомы антибиотик. Соотношение объемов органической и водной фаз составляет 5:1. Смесь подвергают воздействию ультразвукового дезинтегратора в течение 5 мин (амплитуда 7,5 мкм, 20 кГц). Полученную эмульсию переносят в круглодонную колбу роторного испарителя и отгоняют хлороформ при пониженном давлении.
К полученному ПАВ-липидному гелю добавляют 20% от первоначального объема водной фазы и проводят гидратацию геля при интенсивном перемешивании при температуре (50±1)°С в течение 1 ч. Дисперсию ниосом выдерживают при температуре (22±2)°C в течение 12 ч.
Определение эффективности включения антибиотика в ниосомы. Эффективность включения антибиотика в ниосомы оценивают путем измерения оптической плотности образцов раствора, полученного после ультрафильтрации дисперсии ниосом. Предварительно проводят анализ серии стандартных растворов антибиотика (не менее пяти измерений для каждого раствора).
Определение концентрации антибиотика в образце препарата после ультрафильтрации дисперсии ниосом.
Аликвоту исследуемого образца ниосомальной дисперсии объемом 200 мкл вносят в патрон для ультрафильтрации (Ultrafree-MC Filters NMWL 10000 Da или аналогичный), задерживающий частицы массой более 10000 Да, и центрифугируют 20 мин при 3000 g, (4±1)°C. Раствор в нижней камере патрона используют для анализа содержания свободного антибиотика.
Количественный анализ на содержание действующего вещества проводят путем измерения оптической плотности образца при соответствующей длине волны, в качестве раствора сравнения используют соответствующий буферный раствор. Проводят не менее пяти измерений для каждого раствора.
Эффективность включения антибиотика в ниосомы рассчитывают по формуле:
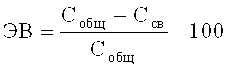 ,
,
где ЭВ - эффективность включения антибиотика в ниосомы, в %;
Собщ - общая концентрация антибиотика в препарате, в мг/мл;
Ссв - концентрация антибиотика в препарате после ультрафильтрации (отделения ниосом) в мг/мл.
В результате проведенных исследований разработан способ получения ПЭГсодержащих ниосомальных форм антибактериальных препаратов с высокой эффективностью включения действующего вещества (до 76%).
Возможность практического применения заявляемого способа иллюстрируется примерами его конкретного выполнения с использованием совокупности заявляемых признаков.
Пример 1. Получение ниосомальной формы офлоксацина.
Готовили точные навески Span 60 (0,5000 г), холестерина (0,3860 г), полиэтиленгликоля PEG-4000 (0,0140 г), дицетилфосфата (0,0710 г). Указанные компоненты растворяли при перемешивании в 25 мл хлороформа. К смеси добавляли 5 мл водной фазы (0,025 М раствор калия фосфорнокислого однозамещенного), содержащей офлоксацин (0,80 мг/мл). Смесь подвергали воздействию ультразвукового дезинтегратора в течение 5 мин (амплитуда 7,5 мкм, 20 кГц). Из полученной эмульсии удаляли хлороформ на роторном испарителе при пониженном давлении. К полученному ПАВ-липидному гелю добавляли 1 мл 0,025 М раствора калия фосфорнокислого однозамещенного и проводили гидратацию геля при интенсивном перемешивании и температуре (50±1)°С в течение 1 ч. Дисперсию ниосом выдерживали при температуре (22±2)°С в течение 12 ч.
Эффективность включения офлоксацина в ниосомы оценивали путем измерения оптической плотности образца раствора, полученного после ультрафильтрации дисперсии (отделения ниосом) при длине волны 291 нм. В качестве образца сравнения использовали 0,025 М раствор калия фосфорнокислого однозамещенного. Параллельно проводили измерение концентрации калибровочных растворов офлоксацина (растворы, содержащие 0,8, 0,6, 0,4 и 0,2 мг/мл офлоксацина в 0,025 М растворе калия фосфорнокислого однозамещенного). Проводили не менее пяти измерений для каждого раствора.
С помощью зондовой микроскопии в режиме контактной ACM (универсальная сканирующая зондовая нанолаборатория NTEGRA Prima, «NT-MDT», Россия) установлено, что среднее значение размера ниосом 250 нм (от 20 до 980 нм). Эффективность включения офлоксацина составила 76,1%.
Пример 2.Получение ниосомальной формы цефотаксима.
Получали аналогично примеру 1, используя, вместо 0,025 М раствора калия фосфорнокислого однозамещенного 0,01 М фосфатно-солевой буфер. Эффективность включения антибиотика составила 71,2%.
Используемая литература
1. Baillie A.J., Coombs G.H., Dolan T.F., Laurie J. Non-ionic surfactant vesicles, niosomes, as a delivery system for the anti-leishmanial drug, sodium stibogluconate // J. Pharm. Pharmacol. - 1986. - V. 38. - P. 502 - 505.
2. Al-Angary A., Halbert G.W. The effect of microencapsulation in colloidal targeting systems on the pharmacokinetics and metabolism of antipyrine // Microencapsulation of Drugs. Harwood Academic Publishers, 1992, Switzerland. - P. 659 - 664.
3. Uchegbu I.F., Vyas S.P. Nonionic surfactant-based vesicles (niosomes) in drug delivery // Int. J. Pharm. - 1998. - V. 172. - P. 33 - 70.
4. Sahin, N.O., Mozafari M.R. Niosomes as nanocarrier systems: Nanomaterials and nanosystems for biomedical applications [Ed.]. - Netherlands: Springer, 2007. - P. 67-81.
5. Патент РФ №2376012. Опубликован 20.12.2009 Б №36.
6. Патент США PCT/US 2012/021389, WO 2012/097347 A1.
7. Walde P., Ichikawa S. Enzymes inside lipid vesicles: preparation, reactivity and applications // Biomol. Eng. - 2001. - V. 18 (4). - P. 143-177.
8. Vora В., Khopade A.J., Jain N.K. Proniosome based transdermal delivery of levonorgestrel for effective contraception // J. Control. Release. - 1998. - V. 54 - P. 149-165.
9. Патент РФ №2320323. Опубликован 27.03.2008 Б №9.
10. Luciani A., Olivier J.-C., Clement О., Siauve N., Brillet P.-Y., Bessoud В., Gazeau F., Uchegbu I., Kahn E., Frija G., Cuenod C. Glucose-Receptor MR imaging of tumors: study in mice with PEGylated paramagnetic niosomes // Radiology - 2004. - V. 231 (l). - P. 135-142.
11. Marwa A., Omaima S., Hanaa E.-G., Mohammed A.-S. Preparation and in-vitro evaluation of diclofenac sodium niosomal formulations // IJPSR - 2013. - V. 4 (5). - P. 1757-1765.
Способ получения ниосомальной формы офлоксацина путем обращенно-фазовой отгонки, отличающийся тем, что хлороформенный раствор, содержащий сорбитан моностеарат Span 60, холестерин, полиэтиленгликоль PEG-4000 и дицетилфосфат в молярном соотношении 35:27:1:5 соответственно, смешивают с водной фазой, содержащей офлоксацин, в соотношении 5:1 по объему и эмульгируют с помощью ультразвукового дезинтегратора в течение 5 мин (амплитуда 7,5 мкм, 20 кГц), затем удаляют хлороформ путем отгонки при пониженном давлении с использованием роторного испарителя, к полученному ПАВ-липидному гелю добавляют 20% от первоначального объема водной фазы и проводят гидратацию геля в течение 1 ч при (50±1)°C, после чего дисперсию ниосом выдерживают при температуре (22±2)°C в течение 12 ч.
