Результат интеллектуальной деятельности: НАБОР СИНТЕТИЧЕСКИХ ОЛИГОДЕЗОКСИРИБОНУКЛЕОТИДОВ ДЛЯ АМПЛИФИКАЦИИ И ДЕТЕКЦИИ ЭНДОГЕННОГО ВНУТРЕННЕГО КОНТРОЛЯ ПРИ ИССЛЕДОВАНИЯХ БИОЛОГИЧЕСКОГО МАТЕРИАЛА КРУПНОГО РОГАТОГО СКОТА МЕТОДОМ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ В РЕЖИМЕ "РЕАЛЬНОГО ВРЕМЕНИ"
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, молекулярно-генетической диагностики, молекулярной биологии, в частности к набору олигодезоксирибонуклеотидов для амплификации и детекции видоспецифичного фрагмента геномной ДНК крупного рогатого скота (далее - КРС) методом полимеразной цепной реакции (ПЦР) в режиме реального времени, содержащему два олигодезоксирибонуклеотидных праймера (прямой и обратный) и один флуоресцентно-меченый ДНК-зонд.
Метод полимеразной цепной реакции (ПЦР) широко распространен при исследованиях биологического материала животных (клеток, тканей, крови и других биологических жидкостей) и используется в лабораторной практике для генотипирования, диагностики генетических патологий, установления биологического родства, выявления генетического материала возбудителей инфекционных заболеваний и др. Суть метода заключается в многократном копировании (амплификации) определенного фрагмента ДНК в исследуемой пробе биологического материала с помощью термостабильной ДНК-полимеразы и пары олигодезоксирибонуклеотидных праймеров до количества, достаточного для его детекции любым из известных способов - электрофоретическим, гибридизационно-ферментным или гибридизационно-флуоресцентным (Ребриков Д.В., Саматов Г.А., Трофимов Д.Ю. и др. ПЦР в «реальном времени»; 2-е издание - М: БИНОМ. Лаборатория знаний, 2009. - 223 с.). Для детекции накопления продуктов амплификации в режиме реального времени помимо пары праймеров необходим также флуоресцентно-меченый ДНК-зонд. Метод ПЦР отличается высокой чувствительностью и специфичностью и позволяет обнаружить целевой фрагмент ДНК, даже если он представлен в единственной копии. Другими достоинствами метода является возможность количественных измерений и небольшие затраты времени на проведение анализа.
Существует ряд проблем при исследованиях биологического материала крупного рогатого скота методом ПЦР, влияющих на получение достоверных результатов, в том числе возникающих в ходе лабораторной постановки ПЦР, которая состоит в следующем. В пробу исследуемого биологического материала вносят реакционную смесь, содержащую такие основные компоненты, как буферный раствор, смесь дезоксинуклеотидтрифосфатов (дНТФ), олигодезоксирибонуклеотидные праймеры, флуоресцентные ДНК-зонды, ДНК-полимеразу, и проводят реакцию амплификации (ДНК-Технология. Основы полимеразной цепной реакции. Методическое пособие. Москва, 2012, стр. 10-12. Сайт Интернет: http://www.dna-technology.ru/files/images/metodichki/OsnoviPCR.pdf, 2015 г.). Если в пробе анализируемого образца присутствует искомая ДНК, то в процессе реакции амплификации происходит ее денатурация (переход ДНК из двухцепочечной формы в одноцепочечную при разрыве водородных связей между комплементарными парами оснований под воздействием высоких температур), отжиг (присоединение олигодезоксирибонуклеотидных праймеров к одноцепочечной ДНК-мишени) и элонгация (после отжига праймеров ДНК-полимераза начинает синтез второй цепи ДНК с 3′-конца праймера). На протяжении всей реакции проводят регистрацию результатов ПЦР в режиме реального времени гибридизационно-флуоресцентным методом с помощью современных технологических средств, упростивших технику измерения и сделавших более точным подход к оценке результатов ПЦР.
Однако в пробе исследуемого образца биологического материала, в котором априори должна находиться ДНК, зарегистрированные результаты ПЦР могут указать на факт ее отсутствия вследствие ряда «технических» причин:
- потери ДНК во время пробоподготовки из-за несоблюдения инструкции выделения ДНК или использования некачественных реактивов;
- разрушение ДНК из-за несоблюдения правил хранения и/или транспортировки проб;
- загрязнение пробы примесями, ингибирующими ПЦР (например, такими сильными ингибиторами, как гемоглобин, гепарин).
Таким образом, в технологии ПЦР одним из важных факторов, влияющих на точность и достоверность результатов, является качество технического исполнения лабораторным персоналом всех этапов исследования, в том числе забора биологического материала и его подготовки к ПЦР (Медведева Т.В., Скворцова Р.Г., Кузьменко В.В., Огарков О.Б. ПЦР-анализ в клинической лаборатории. Учебное пособие. Иркутск. 2009. Сайт ИНТЕРНЕТ:https://www.google.ru/url?sa=t&rct=:j&q=&esrc=s&source=web&cd=28&ved=0CEk QFjAHOBQ&url=http%3A%2F%2Fasld.baikal.ru%2Fasld%2Fdocs%2FObzor%2F11%2F1.doc &ei=xBwuVe7dHMrjywOBoIGYCA&usg=AFQjCNEY4AcJAOzCysgusR78hNEFnxg8Cw&bv m=bv.90790515,d.bGQ&cad=rjt, 2015 г.).
Существует общепринятый подход, при котором в ходе лабораторной постановки ПЦР для уменьшения количества недостоверных результатов используют положительные и отрицательные, а также внутренние контроли амплификации (так называемые внутренние контрольные образцы). При этом внутренний контроль амплификации представляет собой специфический образец ДНК, который проходит все этапы испытаний, что и проба исследуемого биологического материала. Технология ПЦР в режиме реального времени позволяет регистрировать сигналы от искомой ДНК и сигналы от внутреннего контроля амплификации в одной пробирке, содержащей исследуемый биологический материал. Оценку результатов проведенного исследования биологического материала методом ПЦР осуществляют с учетом результатов анализа положительных и отрицательных контролей, а также с учетом внутреннего контроля амплификации (внутреннего контрольного образца).
Известно также, что внутренние контрольные образцы подразделяются на два типа: эндогенный и экзогенный («ПЦР «в реальном времени». 2-е издание, исправленное. Под редакцией д-ра биол. наук Д.В. Ребрикова. - М: Бином. Лаборатория знаний. 2009, стр.160-161). Экзогенный внутренний образец добавляют к пробе исследуемого биологического материала непосредственно перед началом исследования. Эндогенный внутренний образец, в отличие от экзогенного, изначально присутствует в пробе исследуемого биологического материала, являясь частью геномной ДНК исследуемого животного. Далее по тексту внутренний контрольный образец эндогенного типа именуется как «эндогенный внутренний контроль».
Эндогенным внутренним контролем (далее - ЭВК) при ПЦР служит специфический фрагмент геномной ДНК исследуемого животного, амплифицируемый с помощью олигодезоксирибонуклеотидов и детектируемый с помощью флуоресцентно-меченого ДНК-зонда. ЭВК позволяет судить об эффективности протекания ПЦР, а именно накопление фрагмента ДНК эндогенного внутреннего контроля в ходе ПЦР будет свидетельством нормального прохождения реакции амплификации. Использование ЭВК позволяет исключить получение ложноотрицательных результатов исследований вследствие отсутствия или недостаточного для детекции количества ДНК во взятом для анализа образце, неправильного приготовления реакционной смеси, присутствия ингибиторов реакции или ненадлежащего качества используемых реактивов.
Сложность выбора олигодезоксирибонуклеотидов, используемых для ампификации и детекции эндогенного внутреннего контроля, состоит в том, что они должны обладать строгой видовой специфичностью. В случае отсутствия видовой специфичности у праймеров и флуоресцентно-меченого ДНК-зонда, используемых для амплификации и детекции эндогенного внутреннего контроля, возможны ложноотрицательные результаты исследования. В случае же, если выбранные олигодезоксирибонуклеотидные праймеры и ДНК-зонд имеют сродство к нецелевым последовательностям ДНК, то возможны ложноположительные результаты исследования. Правильный выбор сочетания пары праймеров и флуоресцентно-меченого ДНК-зонда позволяет осуществить строго видоспецифическую амплификацию и детекцию целевого фрагмента ДНК методом ПЦР в режиме реального времени.
Известен эндогенный внутренний контроль, который может быть принят за прототип, используемый для снижения доли ошибочных результатов ПЦР в тест-системе «ЛЕЙКОЗ» для выявления вируса лейкоза крупного рогатого скота методом полимеразной цепной реакции (http://www.interlabservice.ru/upload/iblock/195/Leykoz.MANUAL.150413.pdf, 2015 г.). В качестве такого контроля используют фрагмент гена α-актина КРС с присутствием специфической полосы на электрофореграмме на уровне 582 п.н.
Недостатком применения фрагмента гена α-актина КРС в качестве эндогенного внутреннего контроля является то, что он не является видоспецифичным для КРС, так как встречается и у других видов животных и имеет высокий уровень структурного сходства (более 90% идентичности) у разных видов позвоночных животных. Это снижает надежность его использования в целях внутреннего контроля ПЦР при исследовании биологического материала для выявления вируса лейкоза КРС, поскольку не дает достаточных оснований утверждать, что в исследуемом образце амплифицируется именно фрагмент ДНК КРС.
Задачей изобретения является создание набора синтетических олигодезоксирибонуклеотидов для амплификации и детекции эндогенного внутреннего контроля, который можно было бы использовать при любых исследованиях биологического материала крупного рогатого скота методом полимеразной цепной реакции в режиме «реального времени».
Техническим результатом заявляемого изобретения является расширение спектра олигодезоксирибонуклеотидов, позволяющих надежно амплифицировать и детектировать эндогенный внутренний контроль при исследованиях биологического материала крупного рогатого скота методами полимеразной цепной реакции в режиме реального времени, и уменьшение частоты недостоверных результатов ПЦР.
Указанный результат достигается разработкой набора синтетических олигодезоксирибонуклеотидов для амплификации и детекции эндогенного внутреннего контроля при исследованиях биологического материала крупного рогатого скота методом полимеразной цепной реакции в режиме «реального времени», содержащего два олигодезоксирибонуклеотидных праймера и флуоресцентно-меченый ДНК-зонд, которые имеют следующую структуру:
Прямой праймер 5′→3′
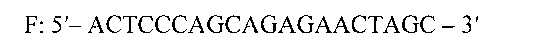
Обратный праймер 5′→3′
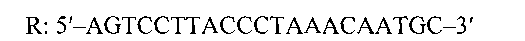
Флуоресцентно-меченый ДНК-зонд 5′→3′
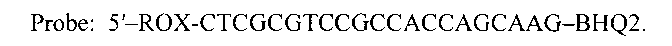
В рамках патентуемого технического решения разработанные олигодезоксирибонуклеотиды являются видоспецифичными для КРС и позволяют достоверно идентифицировать ДНК крупного рогатого скота, при этом в качестве эндогенного внутреннего контроля при исследованиях биологического материала крупного рогатого скота методом полимеразной цепной реакции в режиме «реального времени» используется фрагмент генома КРС, который кодирует видоспецифичный для КРС ретротранспозон L1-2_BT.
Апробация олигодезоксирибонуклеотидов была осуществлена с использованием пятнадцати образцов ДНК, выделенной из цельной крови коров калмыцкой, айрширской пород и черно-пестрого голштинизированного скота. Экспериментально было показано, что выбранные олигодезоксирибонуклеотиды обеспечивают надежный синтез и детекцию фрагмента ДНК КРС длиной 96 пар нуклеотидов.
Характеристика набора олигодезоксирибонуклеотидов и участка амплифицируемой ДНК КРС
Предлагаемые к патентованию олигодезоксирибонуклеотидные праймеры фланкируют участок генома КРС длиной 96 пар нуклеотидов, кодирующий последовательность ретротранспозона L1-2_ВТ. Использование в наборе с патентуемыми олигодезоксирибонуклеотидными праймерами флуоресцентно-меченого ДНК-зонда позволяет производить детекцию накопления продукта амплификации (эндогенного внутреннего контроля) в режиме «реального времени».
Важно отметить, что оптимизация условий проведения ПЦР осуществлялась с использованием наборов отечественных коммерчески доступных реагентов и ферментов, предназначенных для массового использования в лабораторной практике, что позволяет быстро и надежно применять данное изобретение в ветеринарных и научно-исследовательских лабораториях.
Перечень графических материалов
На фиг.1 представлена электрофореграмма продуктов амплификации геномной ДНК (эндогенного внутреннего контроля) КРС калмыцкой породы (1-5), айрширской породы (6-10) и черно-пестрого голштинизированного скота (11-15) с использованием патентуемых олигодезоксирибонуклеотидов. «К-» - отрицательный контроль. М - маркер длин ДНК 100-1000 п.н. (MWM-100RL, Dialat Ltd.).
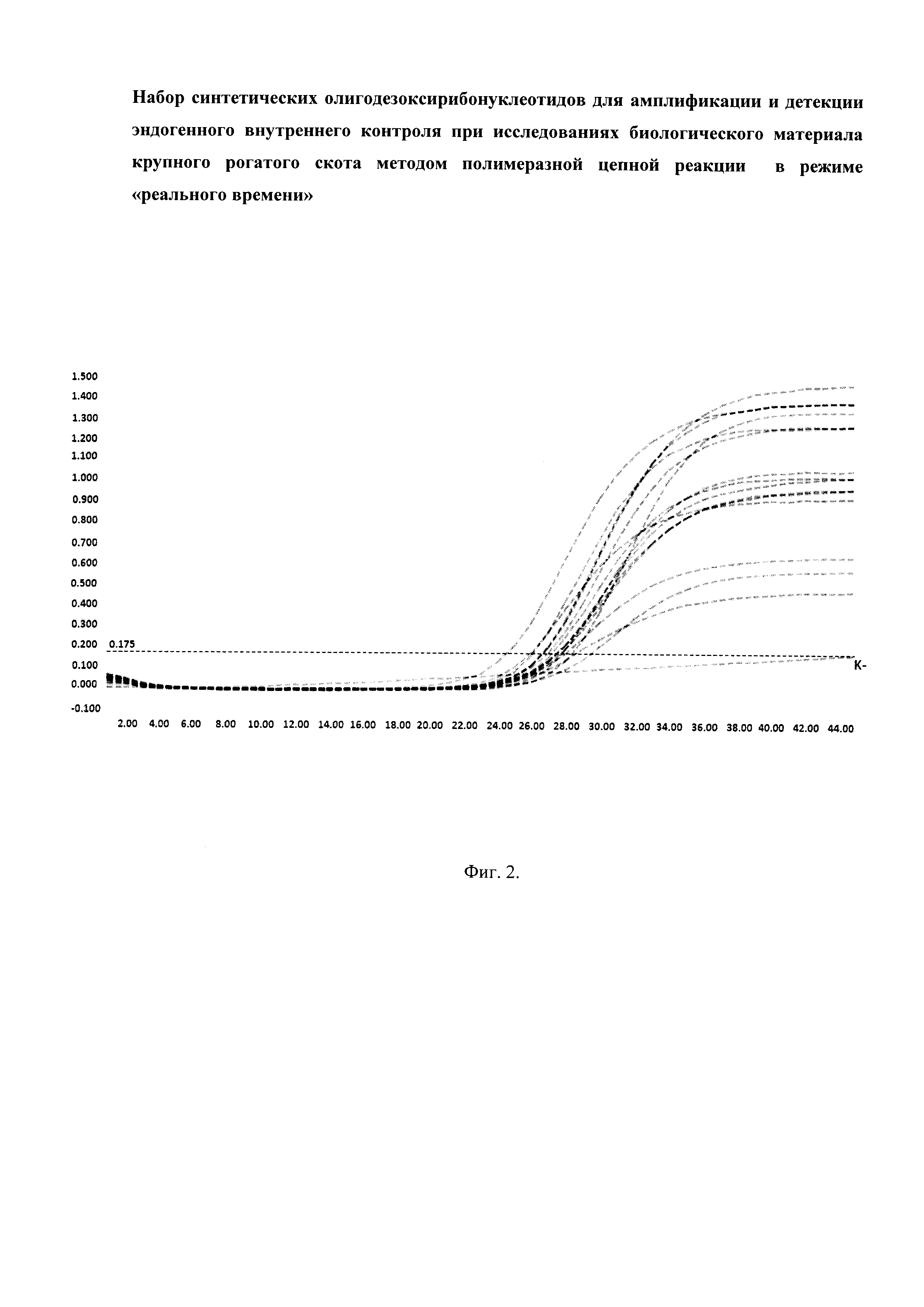
На фиг. 2. представлены графики накопления продуктов ПЦР (эндогенного внутреннего контроля) в режиме «реального времени» при анализе 15 образцов геномной ДНК калмыцкой, айрширской пород и черно-пестрого голштинизированного скота с использованием патентуемых олигодезоксирибонуклеотидов. «К-» - отрицательный контроль. По оси абсцисс отображено количество циклов ПЦР, по оси ординат - интенсивность флуоресценции.
Методика конструирования набора олигодезоксирибонуклеотидов. Выбор синтетических олигодезоксирибонуклеотидов для амплификации и детекции эндогенного внутреннего контроля при исследованиях биологического материала крупного рогатого скота методом полимеразной цепной реакции в режиме «реального времени» осуществляли на основе последовательности ретротранспозона L1-2_ВТ, полученной нами в результате секвенирования фрагментов ДНК длиной около 500 пар нуклеотидов у коров черно-пестрого голштинизированного скота (Глазко В.И., Косовский Г.Ю., Ковальчук С.Н., Архипов А.В., Петрова И.О., Дедович Г.О., Глазко Т.Т. Инвертированный повтор микросателлита (AGQ6G фланкирует районы ДНК с участками гомологии к ретротранспозонам в геноме крупного рогатого скота // Инновационные технологии в медицине - 2014. - 2(03). - С. 63-79). Выбор фрагмента ретротранспозона L1-2_BT в качестве эндогенного внутреннего контроля при исследованиях биологического материала КРС методами ПЦР в режиме реального времен обусловлен его видоспецифичностью для КРС (Jurka, J. L1 family from cow. Repbase Reports, 2009, V. 9(2), P. 598-59; Adelson D.L., Raison J.M., Edgar R.C. Characterization and distribution of retrotransposons and simple sequence repeats in the bovine genome. Proc Natl Acad Sci USA, 2009, V. 106(31), P. 2855-2860).
С помощью сервера BLAST (http://blast.ncbi.nlm.nih.gov/Blast.cgi) в международной базе данных GenBank (http://www.ncbi.nlm.nih.gov/genbank/) были найдены участки геномов КРС Bos taurus Hereford Btau_4.6.1 и Bos taurus UMD 3.1, высокогомологичные секвенированному нами фрагменту ретротранспозона L1-2_BT. С помощью сервера ClustalW2 (http://www.ebi.ac.uk/Tools/msa/clustalw2/) был проведен анализ полученных последовательностей ретротранспозона L1-2_BT и найдены их консервативные участки, на основе которых и были подобраны олигодезоксирибонуклеотидные последовательности.
Выбор олигодезоксирибонуклеотидов основывался на следующих критериях: длина 18-24 пар нуклеотидов; температура отжига олигодезоксирибонуклеотидных праймеров сходная и находится в диапазоне 60-70°C; температура отжига ДНК-зонда выше температур отжига олигодезоксирибонуклеотидных праймеров; отсутствие в последовательности олигодезоксирибонуклеотида вторичных структур с температурой плавления выше его температуры отжига; отсутствие само- и взаимокомплементарности между 3′-концами выбранных олигонуклеотидов (Ребриков Д. В., Саматов Г. А., Трофимов Д. Ю. и др. ПЦР в «реальном времени»; 2-е издание - М.: БИНОМ. Лаборатория знаний, 2009. - 27 с.).
В результате изучения структуры ретротранспозона L1-2_ВТ генома КРС были рассчитаны и синтезированы олигодезоксирибонуклеотидные праймеры и флуоресцентно-меченый ДНК-зонд для проведения полимеразной цепной реакции в режиме реального времени (табл. 1).

Экстракция ДНК КРС. Экстракцию ДНК из цельной крови пятнадцати коров калмыцкой, айрширской пород и черно-пестрого голштинизированного скота проводили с использованием набора реагентов Magna™ DNA Prep 200 (ООО «Лаборатория Изоген», Россия) согласно протоколу производителя.
Проведение полимеразной цепной реакции в режиме реального времени
Реакцию амплификации проводили в 20 мкл смеси для ПЦР (табл. 2), содержащей 1×Taq буфер для амплификации, 3 мМ MgCl2, 0.2 мМ каждого из нуклеозидтрифосфатов, 1 активных единиц HS Taq ДНК-полимеразы, 0.2 мкМ прямого и обратного олигодезоксирибонуклеотидного праймера, 0.1 мкМ олигодезоксирибонуклеотидного флуоресцентного зонда (все реактивы производства ЗАО «Евроген», Россия).

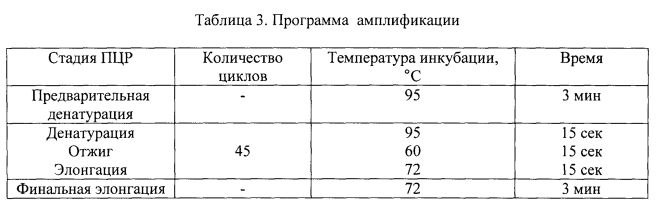
ПЦР в режиме реального времени проводили согласно программе амплификации, указанной в табл. 3. Детекцию интенсивности флуоресценции проводили по каналу ROX на приборе «LightCycler 98» (Roche, Швейцария). Результаты оценивали по наличию продукта реакции длиной 96 пар нуклеотидов (фиг. 1) и экспоненциальному росту флюоресценции (фиг. 2).
Апробация патентуемых олигодезоксирибонуклеотидов
Апробацию патентуемых олигодезоксирибонуклеотидов проводили на 15 образцах ДНК коров калмыцкой, айрширской пород и черно-пестрого голштинизированного скота. Экспериментально было показано, что выбранные олигодезоксирибонуклеотиды обеспечивают синтез и детекцию целевого фрагмента ДНК КРС длиной 96 пар нуклеотидов (фиг. 1, 2). На фиг. 1 представлена электрофореграмма продуктов амплификации геномной ДНК КРС калмыцкой породы (1-5), айширской породы (6-10) и черно-пестрого голштинизированного скота (11-15) с использованием патентуемых олигодезоксирибонуклеотидов. В результате ПЦР с использование патентуемых олигодезоксирибонуклеотидов во всех исследованных образцах был обнаружен продукт амплификации длиной 96 п.н. На фиг. 2 представлены графики накопления продукта ПЦР в режиме реального времени с использованием патентуемых олигодезоксирибонуклеотидов. Наличие продукта амплификации длиной 96 п.н. и экспоненциальное нарастание флуоресценции во всех исследованных образцах служит эндогенным внутренним контролем и является показателем того, что: 1) реакционная смесь составлена правильно; 2) в реакционной смеси отсутствуют ингибиторы ПЦР; 3) во взятых в ПЦР образцах присутствует ДНК КРС.
Таким образом, заявляемый набор синтетических олигодезоксирибонуклеотидов обеспечивает амплификацию и детекцию фрагмента геномной ДНК длиной 96 пар нуклеотидов, который может служить эндогенным внутренним контролем при исследованиях биологического материала крупного рогатого скота методом полимеразной цепной реакции в режиме реального времени.
Набор синтетических олигодезоксирибонуклеотидов для амплификации и детекции эндогенного внутреннего контроля при исследованиях биологического материала крупного рогатого скота методом полимеразной цепной реакции в режиме «реального времени», содержащий два олигодезоксирибонуклеотидных праймера и флуоресцентно-меченый ДНК-зонд, которые имеют следующую структуру:прямой праймер 5′→3′F: 5′-ACTCCCAGCAGAGAACTAGC - 3′обратный праймер 5′→3′R: 5'-AGTCCTTACCCTAAACAATGC-3′флуоресцентно-меченый зонд 5′→3′Probe: 5'-ROX-CTCGCGTCCGCCACCAGCAAG-BHQ2.