Результат интеллектуальной деятельности: РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pET40CmAP/CGL, КОДИРУЮЩАЯ ГИБРИДНЫЙ БИФУНКЦИОНАЛЬНЫЙ ПОЛИПЕПТИД CmAP/CGL СО СВОЙСТВАМИ ВЫСОКОАКТИВНОЙ ЩЕЛОЧНОЙ ФОСФАТАЗЫ CmAP И ГАЛАКТОЗОСПЕЦИФИЧНОГО ЛЕКТИНА CGL, РЕКОМБИНАНТНЫЙ ШТАММ E. coli Rosetta(DE3)/pET40CmAP/CGL - ПРОДУЦЕНТ ГИБРИДНОГО БИФУНКЦИОНАЛЬНОГО ПОЛИПЕПТИДА CmAP/CGL И СПОСОБ ЕГО ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Изобретение относится к молекулярной биотехнологии, в частности к генетической инженерии, и позволяет получать микробиологическим синтезом по оптимизированной технологии новый гибридный бифункциональный полипептид ComAP/CGL со свойствами высокоактивной щелочной фосфатазы морской бактерии и лектин-связывающей активностью галактозоспецифичного лектина мидии Crenomytilus grayanus, который может быть использован для выявления различий в гликозилировании онкофетальных антигенов.
К настоящему времени установлено, что структура углеводных цепей гликоконъюгатов, секретируемых клеткой организма, в значительной степени зависит от типа патологического процесса. Целый ряд гликопротеинов, названных онкофетальными антигенами (ОФА), используется в качестве маркеров различного типа патологий. Одним из современных методов выявления углеводного профиля клеточных гликоконъюгатов является использование углевод-связывающих белков-пектинов, способных обратимо и избирательно связываться с определенными углеводными структурами. В частности, такие гликопротеины, как трофобласт-специфический бета-1-гликопротеин (ТБГ), раково-эмбриональный антиген (РЭА), простата-специфичный антиген (ПСА), альфа-фетопротеин (АФП) являются маркерами опухолевых процессов. Однако высокий уровень этих ОФА не всегда однозначно связан с онкопатологией. Так, повышенный уровень ТБГ наблюдается как при нормально протекающей беременности, так и при онкопатологии трофобласта - пузырном заносе и хорионэпителиоме [1]. Поскольку высокий уровень ТБГ наблюдается в обоих случаях, не представляется возможным провести четкие различия между злокачественным заболеванием и беременностью, что затрудняет своевременную диагностику. РЭА секретируется как нормальными эпителиальными клетками кишечника, так и при аденокарциномах кишечника и полипах [2-3], ПСА как при раке простаты, так и при доброкачественной гиперплазии [4], АФП - при раке печени, циррозе или гепатите [5], что зачастую не позволяет поставить точный диагноз.
Ранее из морского беспозвоночного был выделен и охарактеризован галактозоспецифичный (Gal/GalNAc-специфичный) лектин из мидии Crenomytilus grayanus (CGL), а также для выявления различий в гликозилировании ОФА, были разработаны методы твердофазного лектин-ферментного анализа (ТЛФА) с использованием CGL [6-8]. Было показано, что лектины проявляют специфичность к углеводным цепям, характерным для злокачественного роста, таким как Т-антиген (Galβ1→3GalNAc-O-Ser/Thr), Tn-антиген (GalNAc-O-Ser/Thr) и биссектный GlcNAc. Для разработки на их основе методов ТЛФА были получены конъюгаты пектинов с ферментной меткой - пероксидазой хрена. С помощью одной из сконструированных тест-систем с использованием CGL были протестированы сыворотки беременных женщин (в том числе с угрозой невынашивания) и сыворотки женщин с онкопатологией. Выявлены достоверные различия между группами женщин с нормально протекающей беременностью и с угрозой невынашивания, с одной стороны, и между группами женщин с угрозой невынашивания и онкозаболеванием, с другой стороны [6]. При появлении первых признаков патологического процесса можно на ранних стадиях дифференцировать угрозу невынашивания беременности, обусловленную плацентарной недостаточностью, от начинающегося опухолевого процесса, что является крайне важным при постановке первичного диагноза.
Для выявления различий в гликозилировании еще одного ОФА - раково-эмбрионального антигена (РЭА) также был разработан метод ТЛФА на основе CGL. Методами иммуноферментного анализа (ИФА) и ТЛФА проанализированы сыворотки онкологических больных с различной этиологией и сыворотки здоровых доноров. Результаты эксперимента показали существенную разницу в связывании CGL с РЭА/РЭА-подобными антигенами из сывороток онкологических больных и здоровых доноров. Средний уровень лектин-реактивных гликоформ РЭА в образцах со всеми видами онкопатологий был в 2-3 раза выше по сравнению со средним уровнем, определенным для здоровых людей [6].
Кроме того, установлено, что CGL является высокочувствительным гистохимическим маркером. Так, показано, что он является маркером различных субпопуляций нейроцитов симпатической нервной системы. Меченный ферментной меткой CGL позволяет определять не только тела нейронов Б-типа, но и их немиелиновые аксоны [7]. Изучена также специфика локализации рецепторов муцинового типа в клетках низкодифференцированной аденокарциномы толстой кишки человека. Выявлены основные типы локализации этих рецепторов. Показано, что лектин CGL, меченный ферментной меткой, наиболее интенсивно связывается с внутриклеточными мембранами, цитоплазмой и секретом опухолевых клеток, синтезирующих муцины [8].
Определение концентрации лектин-связанных структур в эпителиальном секрете является принципиально новым подходом при выявлении злокачественных новообразований. Однако и такой анализ требует повышения эффективности наряду с простотой выполнения метода. Это возможно при использовании методов генной инженерии. Методами молекулярного клонирования была впервые установлена структура нового галактозоспецифичного пектина CGL из мидии Crenomytilus grayanus [GenBank, код доступа JQ314213], открывающего новое семейство пектинов [9]. Известен способ получения высокоактивной рекомбинантной щелочной фосфатазы морской бактерии CmAP [GenBank, код доступа ABD92772] [10].
Задача изобретения - конструирование рекомбинантного штамма-продуцента Escherichia coli, несущего такую экспрессирующую конструкцию (плазмиду), которая позволит нарабатывать целевой высокоочищенный недеградированный гибридный бифункциональный полипептид CmAP/CGL в препаративных количествах, при сохранении как иммуногенных свойств галактозоспецифичного лектина мидии CGL, так и ферментативных свойств высокоактивной щелочной фосфатазы морской бактерии CmAP, используемой для цветной визуализации лектин-связанных комплексов в лектин-ферментных методах ИФА и ТЛФА.
Поставленная задача решена путем конструирования рекомбинантной плазмидной ДНК pET40CmAP/CGL, кодирующей химерный полипептид CmAP/CGL, и рекомбинантного штамма E. coli Rosetta(DE3)/pET40CmAP/CGL, обеспечивающие индуцируемый синтез с высоким и стабильным выходом активного растворимого бифункционального белка CmAP/CGL, обладающего свойствами высокоактивной щелочной фосфатазы морской бактерии CmAP и галактозоспецифичного лектина мидии CGL.
Технический результат заявленного изобретения - получение активного гибридного бифункционального полипептида CmAP/CGL со свойствами высокоактивной щелочной фосфатазы CmAP и галактозоспецифичного лектина мидии CGL с высоким выходом и уровнем очистки.
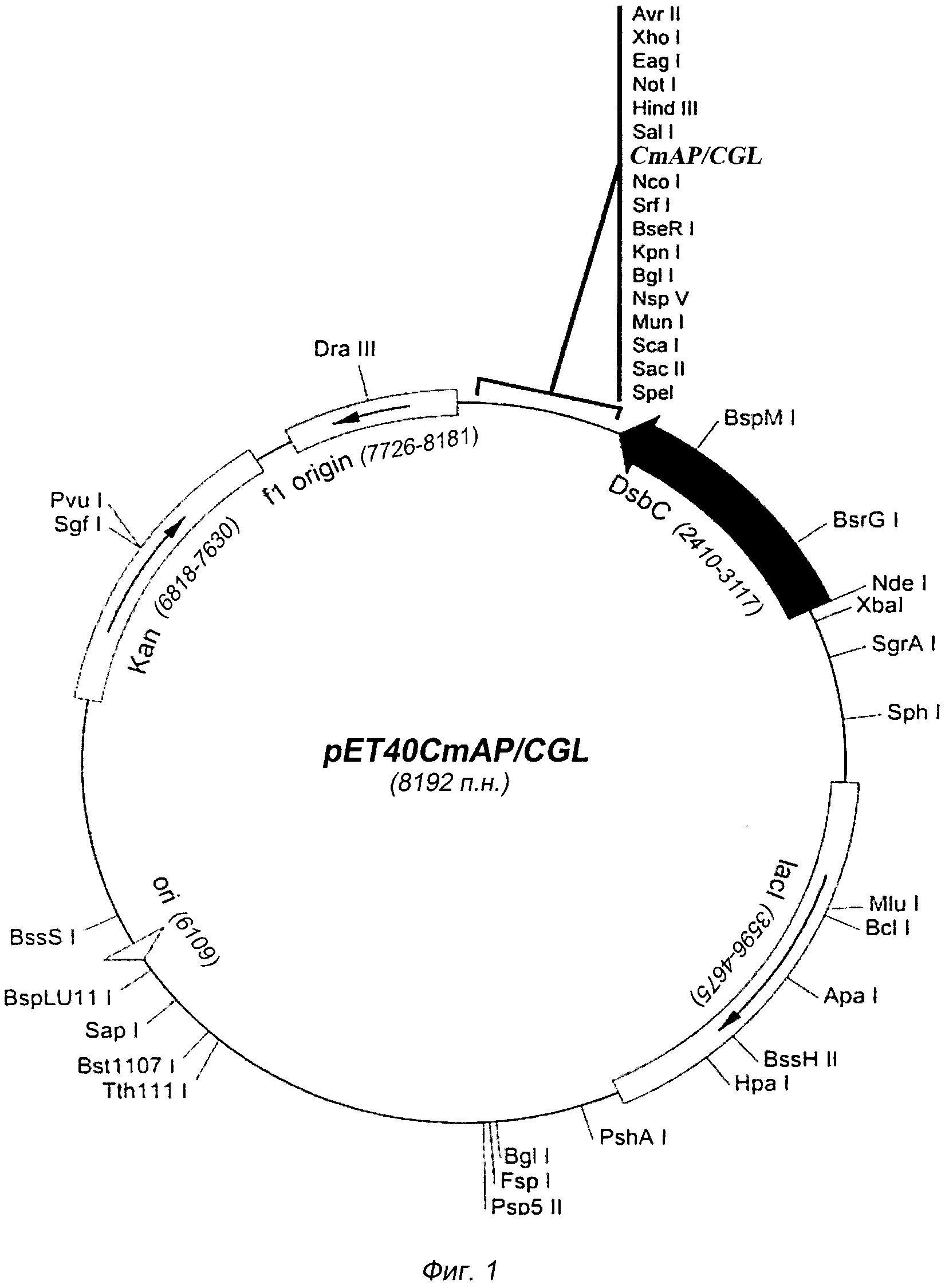
Плазмида pET40CmAP/CGL имеет 8192 пары оснований (п.о.) и характеризуется наличием NcoI/SalI-фрагмента плазмиды pET-40b(+) (Novagen) и последовательности фрагмента ДНК размером 2028 п.о., содержащего химерный ген щелочной фосфатазы CmAP (N-конец гибридной молекулы) и галактозоспецифичного лектина CGL (С-конец гибридной молекулы), соединенных между собой гибким линкером (€48)3 и сайтом энтерокиназы.
На фигуре 1 представлена физическая карта плазмиды pET40CmAP/CGL и область плазмиды, ответственная за экспрессию гибридного белка CmAP/CGL. Нуклеотидная последовательность фрагмента плазмиды pET40CmAP/CGL, фланкированная сайтами NcoI и SalI, содержит последовательность структурного гена CmAP, соответствующую открытой рамке считывания для белка CmAP, последовательности соединяющего линкера (G4S)3EL и сайта энтерокиназы D4K, последовательность структурного гена CGL, соответствующую открытой рамке считывания для белка CGL (SEQ ID N 1).
Рекомбинантный штамм E. coli Rosetta(DE3)/pET40CmAP/CGL получен трансформацией клеток E. coli Rosetta(DE3) (Novagen) плазмидой pET40CmAP/CGL с использованием традиционной генно-инженерной технологии [11].
Рекомбинантный штамм E. coli Rosetta(DE3)/pET40CmAP/CGL характеризуется следующими признаками.
Культурально-морфологические признаки.
Клетки штамма образуют крупные круглые с ровными краями, выпуклые колонии до 5 мм в диаметре, поверхность колоний гладкая, консистенция слизистая. Пигмент не накапливается. Грамотрицательны, спор не образуют, капсулы не имеют. Колонии хорошо растут на простых питательных средах (LB). При росте в жидких средах образуют интенсивную ровную муть.
Физико-биологические признаки.
Рекомбинантный штамм E. coli Rosetta(DE3)/pET40CmAP/CGL видотипичен по своим биохимическим свойствам. Штамм не обладает желатиназной активностью, не ферментирует лизин; расщепляет глюкозу, лактозу, маннит, сахарозу до кислоты и газа. Имеет мутацию в гене lac, обеспечивающую контроль уровня экспрессии, а также трансляцию редких кодонов. Оптимальной для роста является температура 37°С, а для продукции белка CmAP/CGL - 16°С.
Устойчивость к антибиотикам.
Клетки штамма характеризуются устойчивостью к хлорамфениколу (34 мкг/мл) и канамицину (25 мкг/мл).
Патогенность и токсичность.
Рекомбинантный штамм E. coli Rosetta(DE3)/pET40CmAP/CGL не патогенен и не токсичен для теплокровных животных.
Штамм хранится обычным способом в суспензии с глицерином (30%) при -20°С.
Заявляемый способ получения гибридного бифункционального белка CmAP/CGL заключается в культивировании клеток штамма E. coli Rosetta(DE3)/pET40CmAP/CGL в жидкой питательной среде LB в течение 12 ч при 16°С, затем бактериальные клетки осаждают центрифугированием, суспензию клеток дезинтегрируют в буфере, далее экстракт центрифугируют, затем надосадочную жидкость помещают на колонку с ионообменной смолой, далее элюируют белок, затем белковый элюат помещают на колонку с металлоаф инной смолой, далее активные фракции концентрируют на ионообменной смоле и выделяют целевой продукт гель-фильтрацией.
Выход рекомбинантного гибридного бифункционального белка CmAP/CGL в результате применения описанного способа составляет не менее 10 мг рекомбинантного белка с 1 л культуры с удельной активностью щелочной фосфатазы не менее 10000 ед./мг белка и иммуногенными свойствами галактозоспецифичного лектина, характерными для природного аналога CGL из мидии [6-9].
Рекомбинантный гибридный бифункциональный белок CmAP/CGL имеет относительную молекулярную массу 105,5 кДа, включая плазмидный шаперон DsbC с молекулярной массой 32,5 кДа, широкий диапазон значений температуры (25-37°С) и рН (7,5-9,5) для проявления фосфатазной активности и аффинных свойств лектина. Плазмидный шаперон Dsb не влияет на функциональность обеих частей химеры CmAP/CGL. В молекуле CmAP/CGL предусмотрено наличие сайта энтерокиназы между функциональными модулями для удаления щелочной фосфатазы из реакции при необходимости.
Использование галактозоспецифичного лектина мидии в составе гибридного бифункционального полипептида CmAP/CGL с активностью щелочной фосфатазы позволяет сократить стадии и время лектин-ферментного анализа, которые раньше требовались для получения конъюгатов лектина и фермента.
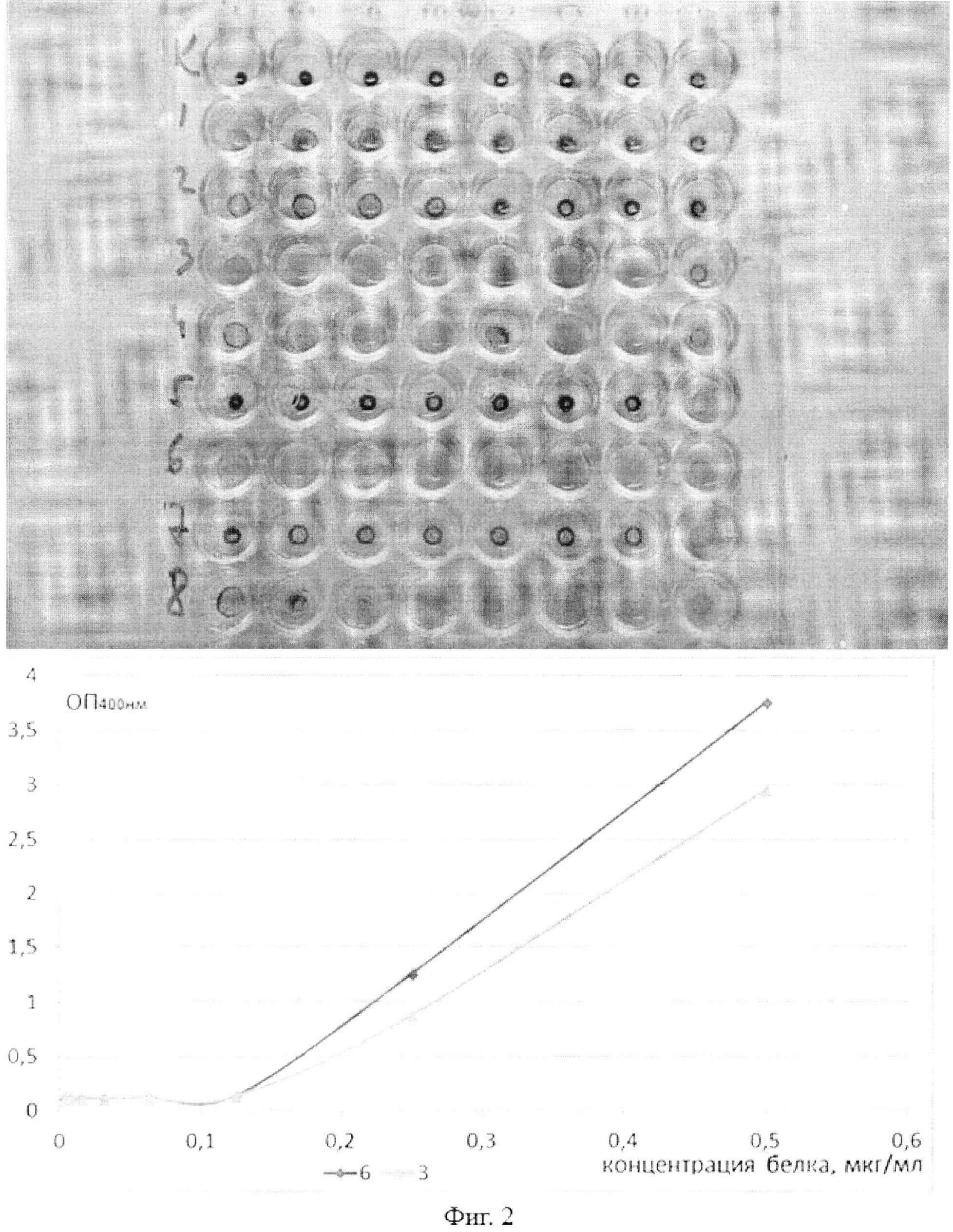
На фигуре 2 представлены результаты гемагглютинации и лектин-ферментного анализа (ИФА), проведенные с гибридным бифункциональным полипептидом CmAP/CGL, полученным от разных рекомбинантных колоний трансгенного штамма Е. coli Rosetta(DE3)/pET40CmAP/CGL.
Для гемагглютинации брали несорбирующий 96-луночный планшет с U-образными лунками. Образец, содержащий целевой белок CmAP/CGL, разводили двукратно в 100 мкл буфера, содержащего 20 мМ Tris-HCl, рН 8,2. После этого к разведениям приливали по 50 мкл 2% эритроцитов человека группы О (I). В течение часа наблюдали реакцию гемагглютинации. ИФА проводили на микропланшете, сенсибилизированном муцином, с применением гибридного бифункционального полипептида CmAP/CGL, полученного от колоний №3 и 6, отобранных по результатам геммаглютинации (фиг.2). Уровень аффинности рекомбинантного гибридного бифункционального полипептида CmAP/CGL определяли по концентрации лектин-связанных комплексов с муцином (по оси X). Визуализацию пектин-связанных комплексов осуществляли методом измерения фосфатазной активности рекомбинантного гибридного бифункционального полипептида CmAP/CGL (по оси Y).
Существенными преимуществами заявляемого способа получения гибридного бифункционального полипептида CmAP/CGL являются:
использование рекомбинантного штамма-продуцента E. coli Rosetta(DE3)/pET40CmAP/CGL, что позволяет получать при биосинтезе большое количество высокоактивного бифункционального гибридного белка CmAP/CGL;
- использование несложной трехстадийной хроматографической очистки рекомбинантного белка, что позволяет получить чистый гибридный полипептид CmAP/CGL за короткое время и с малыми потерями.
Способ получения функционально активного гибридного полипептида CmAP/CGL на основе использования химерного гена, кодирующего щелочную фосфатазу морской бактерии CmAP и галактозоспецифичный лектин мидии CGL, иллюстрируется следующими примерами.
Пример 1. Конструирование плазмиды pET40CmAP/CGL.
Рекомбинантную плазмиду pET40CmAP/CGL, содержащую химерный ген, кодирующий полноразмерную щелочную фосфатазу CmAP и полноразмерный галактозоспецифичный лектин CGL, соединяющиеся через гибкий линкер (G4S)3ELD4K, фланкированный сайтами рестрикции NcoI и SalI, конструируют на основе коммерческой плазмиды pET-40b(+) (Novagen).
Фрагмент ДНК, содержащий химерный ген гибридного полипептида CmAP/CGL, получают в два этапа. На первом этапе проводят полимеразную цепную реакцию с использованием плазмиды 40Pho в качестве матрицы для получения гена щелочной фосфатазы CmAP и праймеров X-PhoN_F и Pho40X-SacI-R, где X-PhoN_F - праймер, специфичный по отношению к N-концевой последовательности CmAP, включающий сайт для рестриктазы NcoI; Pho40X-SacI-R - обратный праймер, специфичный по отношению к С-концевой последовательности CmAP, включающий полинуклеотид, кодирующий линкер (G4S)3 и сайт рестрикции Sad:
X-PhoN_F: 5′-TATTCCATGGCAGAGATCAAGAATGTCATTCTGAT-3′
Pho40X-SacI-R: -5′-TTAAGAGCTCAGAACCACCACCACCAGAACCACCACCACCAGAACCACCACCACCCT TCGCTACCACTGTCTTCAGATACTGTCCT-3′.
Данную реакцию проводят в следующих условиях: 10× Encycio буфер, 50× смесь полимераз Encyclo ("Encyclo PCR kit", Евроген, Москва), 50× смесь dNTP (10 µM каждого), смесь праймеров (5 µМ каждого), 20 нг ДНК. Процесс амплификации состоит из следующих стадий: 30 циклов ПЦР (15 с - 95°С, 1 мин 30 с - 72°С) и инкубация 10 мин при 72°С. После амплификации ПЦР-продукт очищают электрофоретически в 1% агарозном геле. Фрагмент (1 мкг) обрабатывают рестриктазами NcoI и SacI в оптимальном буфере (Fermentas) в течение 3 часов, затем ферменты удаляют из реакционной среды по стандартной методике фенолом (1:1) [11]. В водную фракцию, содержащую фрагмент, добавляют 1/10 объема 0,3 М ацетата Na, pH 5,2, и 1/2 объема изопропанолового спирта и оставляют на -20°С в течение 30 мин. Затем центрифугируют при 14000 об/мин в течение 20 мин, осадок промывают 75% этанолом и высушивают при комнатной температуре. Осадок растворяют в 20 мкл.
2 мкг плазмидной ДНК рЕТ-40b(+) обрабатывают рестриктазами NcoI и SacI в соответствии с методикой, описанной выше, и из полученного гидролизата выделяют векторную часть плазмиды в 1% геле легкоплавкой агарозы.
Полученный фрагмент гена CmAP и векторную часть плазмиды рЕТ-40b(+) сшивают при помощи лигазной реакции в 50 мкл буфера для лигирования согласно инструкции (Fermentas). 10 мкл реакционной смеси используют для трансформации компетентных клеток E. coli Rosetta(DE3). Трансформанты высевают на LB-агар, содержащий 25 мкг/мл канамицина. После инкубирования в течение 16 ч при 37°С клоны отсевают, выделяют плазмидную ДНК и анализируют на наличие мутаций при помощи автоматического секвенирования. Отбирают плазмидную ДНК pET40CmAP, содержащую последовательность CmAP с линкером (G4S)3 на С-концевой части.
На втором этапе проводят амплификацию гена CGL с использованием к-ДНК мидии Crenomytilus grayanus и пары праймеров CGL-exp40X_dir и CGL-exp40_rev, включающих сайты для рестриктаз Sad и Sail и сайт энтерокиназы с N-конца CGL:
CGL-exp40X_dir: 5′-AGCTGAGCTCGATGACGATGACAAGATGACAACGTTTCTTATCAAACACAAGGCCAGTG-3′,
CGL-exp40_rev: 5′-AGCTGTCGACTTAGGCATAAACTAAAACGCGCTTGTCTTT-3′.
Для создания конструкции pET40CmAP/CGL полученный ген галактозоспецифического лектина CGL и 2 мкг плазмидной ДНК pET40CmAP обрабатывают рестриктазами SacI и SalI в соответствии с методикой, описанной выше, и очищают в 1% геле легкоплавкой агарозы. Очищенные ПЦР-фрагменты CGL и векторную часть плазмиды pET40CmAP сшивают при помощи лигазной реакции в 50 мкл буфера для лигирования согласно инструкции (Fermentas). 10 мкл реакционной смеси используют для трансформации компетентных клеток E. coli Rosetta(DE3). Трансформанты высевают на LB-агар, содержащий 25 мкг/мл канамицина. После инкубирования в течение 16 час при 37°С клоны отсевают, выделяют плазмидную ДНК и анализируют на наличие мутаций при помощи автоматического секвенирования. Отбирают ДНК, содержащую необходимые последовательности генов CmAP и CGL, представляющую собой плазмиду pET40CmAP/CGL размером 8192 п.о. (Фиг.1).
Пример 2. Получение рекомбинантного штамма E. coli Rosetta(DE3)/pET40CmAP/CGL - продуцента гибридного бифункционального полипептида CmAP/CGL.
Рекомбинантный штамм-продуцент E. coli Rosetta(DE3)/pET40CmAP/CGL получают путем трансформации клеток штамма E. coli Rosetta(DE3) рекомбинантной плазмидой pET40CmAP/CGL. Ночную культуру (0,5 мл LB) рекомбинантного штамма-продуцента гибридного бифункционального полипептида CmAP/CGL выращивают в литровой колбе в жидкой среде LB, содержащей на литр 10 г бакто-триптона, 5 г бакто-дрожжевого экстракта и 10 г NaCl, 25 мг/мл канамицина, рН 7,7, на шейкере при 200 об/мин при температуре 37°С в течение 2 часов до оптической плотности 0,6-0,8 (OD600), затем добавляют индуктор экспрессии IPTG до конечной концентрации 0,2 мМ и инкубируют далее при 16°С в течение 12 часов.
Для определения продуктивности штамма клеточные водные экстракты анализируют электрофорезом в 12,5% полиакриламидном геле с додецилсульфатом натрия. Гель окрашивают Кумасси R-250 по стандартной методике и определяют относительное количество белка в полосе целевого продукта. Содержание рекомбинантного белка в растворимой клеточной фракции составляет не менее 30% от всех белков этой фракции.
Пример 3. Выделение и характеристика гибридного бифункционального полипептида CmAP/CGL.
Рекомбинантный штамм-продуцент гибридного бифункционального полипептида CmAP/CGL - E. coli Rosetta(DE3)/pET40CmAP/CGL, инкубируют в литровой колбе в жидкой среде LB, содержащей на литр 10 г бакто-триптона, 5 г бакто-дрожжевого экстракта и 10 г NaCl, 0,5 мМ IPTG, 25 мг/мл канамицина, рН 7,7, на шейкере при 200 об/мин в течение 12 часов при 16°С. Бактериальные клетки осаждают на проточной центрифуге при 5000 об/мин в течение 10 мин. Суспензию клеток дезинтегрируют в 20 мл буфера А (0,05 М трис-HCl, рН 8,6, 0.01% NaN3) в течение 5×30 с, охлаждая во льду. Затем центрифугируют при 10000 об/мин в течение 30 мин. Надосадочную жидкость собирают и помещают на колонку с ДЕАЕ-52-целлюлозой (Whatman). Элюцию белка проводят градиентом концентрации NaCl (0,05 М-0,380 М) в буфере А. Активные фракции собирают и помещают на колонку с металлоафинной смолой (Qiagen), предварительно уравновешенную буфером А. Элюцию белка проводят буфером В (50 мМ Tris-HCl, рН 8,6, 50 мМ EDTA, 0,01% NaN3). Активные фракции собирают, обессоливают и концентрируют на колонке с ДЕАЕ-Toyopearl 65 ОМ (Toyo Soda), затем инкубируют с энтерокиназой (Invitrogen) при комнатной температуре в течение 12 часов. Затем раствор белка наносят на колонку для гель-фильтрации с Superdex 200 (Sigma). Выход рекомбинантного белка составляет 10 мг с 1 литра культуры.
Полученный рекомбинантный полипептид определяют по первым 10 аминокислотам на автоматическом секвенаторе. Проведенное секвенирование препарата рекомбинантного белка, выделенного из клеток штамма E. coli Rosetta(DE3)/pET40CmAP/CGL, выявило аминокислотную последовательность Ala-Glu-Ile-Lys-Asn-Val-Ile-Leu-Met-Ile, соответствующую первым 10 аминокислотам щелочной фосфатазы CmAP, являющейся N-концевой составляющей химерного белка CmAP/CGL.
Ферментативную функциональность гибридного полипептида CmAP/CGL проверяют по активности щелочной фосфатазы, которую определяют по расщеплению паранитрофенилфосфата (п-НФФ). Стандартная инкубационная смесь в объеме 500 мкл содержит 15 мМ п-НФФ, 1 М диэтаноламина (ДЭА), рН 10,3 и гибридный белок CmAP/CGL, либо 2 мМ п-НФФ, 0,1 М трис-HCl, 0,2 М KCl, рН 9,5-10,0. После 30 мин инкубации при 37°С реакцию останавливают добавлением 2 мл 0,5 М NaOH. Количество образовавшегося в процессе ферментативной реакции п-нитрофенола (п-НФ) определяют спектрофотометрически при 400 нм. За единицу активности щелочной фосфатазы принимают количество фермента, катализирующего освобождение 1 мкМ п-НФ (ε400 нм=18600) в течение 1 мин инкубации. Удельную активность выражают в единицах активности фермента на 1 мг белка. Концентрацию белка в растворе определяют по методу Брэдфорда.
Лектинную функциональность гибридного полипептида CmAP/CGL проверяют по реакции гемагглютинации и/или уровню аффинности к муцину: CmAP/CGL разводят двукратно в 100 мкл буфера, содержащем 20 мМ Tris-HCl, рН 8,2. После этого к разведениям приливают по 50 мкл 2% эритроциты человека группы О (I). В течение часа наблюдают гемагглютинацию. Либо на сенсибилизированный муцином полистирольный микропланшет вносят раствор (0,0015-0,1 мг/мл) гибридного полипептида CmAP/CGL и инкубируют 1,5 часа при комнатной температуре. Лектин-связанные комплексы отмывают буфером 10 мм трис-HCl, рН 9,0, 0,15 М NaCl, 0,05% Тритон Х-100 по 200 мкл в каждую лунку не менее 10 раз. Затем в лунки микропланшета добавляют буфер для активности щелочной фосфатазы с субстратом, как описано выше, для визуализации связавшихся комплексов.
Полученные данные по характеристике и функциональной активности продукта экспрессии искусственного химерного гена гибридного бифункционального полипептида CmAP/CGL в клетках рекомбинантного штамма E. coli Rosetta(DE3)/pET40CmAP/CGL свидетельствуют о соответствии исследуемого полипептида его природному аналогу - галактозоспецифическому лектину CGL, перспективному для использования в лектин-иммуноферментных и лектин-ферментных методах дифференциальной диагностики плацентарной недостаточности и онкопатологий трофобласта при беременности, аденокарциномы толстой кишки человека, гистопатологий нейроцитов симпатической нервной системы [6-7].
Как следует из приведенных примеров, заявляемая группа изобретений позволяет получать активный рекомбинантный гибридный бифункциональный полипептид CmAP/CGL со свойствами высокоактивной щелочной фосфатазы морской бактерии CmAP и галактозоспецифичного лектина мидии CGL с высоким выходом при относительно простой и надежной технологии.
Заявленное изобретение позволяет:
- с помощью использования рекомбинантного штамма-продуцента E. coli Rosetta(DE3)/pET40CmAP/CGL получать путем биосинтеза большое количество активного гибридного бифункционального полипептида CmAP/CGL;
- использование ионообменной, металлоаффинной и гель-фильтрационной хроматографий при очистке рекомбинантного белка из водного экстракта клеток рекомбинантного штамма-продуцента позволяет получать гибридный бифункциональный полипептид CmAP/CGL с чистотой более 98% в качестве аналога галактозоспецифичного лектина CGL, конъюгированного с ферментом, применяемого для проведения ИФА и ТЛФА.
Литература
1. Tatarinov Yu.S. Trofoblast-specific beta 1-glycoprotein as a marker for pregnancy and malignancies // Gynecol. Obster. Invest. 1978. Vol.9. P.65-97.
2. Garcia M., Seigner C., Bastid C., Choux R., Payan M.J. and Reggio H. Carcinoembryonic antigen has a different molecular weight in normal colon and cancer due to N-glycosylation differences // Cancer Res. 1991. Vol.51. P.5679-5686.
3. Fukushima K., Ohkura Т., Kanai M., Kuroki M., Matsuoka Y., Kobata A., Yamashita K. Carbohydrate structures of a normal counterpart of the carcinoembryonic antigen produced by colon epithelial cells of normal adults // Glycobiology. 1995. Vol.5. №1. P.105-115.
4. Tabares G., Radcliffe C.M., Barrabes S., Ramirez M., Aleixandre R.N, Hoesel W., Dwek R A., Rudd P.M., Peracaula R.,de Llorens R. Different glycan structures in prostate-specific antigen from prostate cancer sera in relation to seminal plasma PSA // Glycobiology. 2006. V.16. №2. Р.132-145.
5. Wu J.Т.(1990) Serum alpha-fetoprotein and its lectin reactivity in liver diseases: a review. Ann. Clin. Lab. Sci. 20, 98-105.
6. Чикаловец И.В., Молчанова В.И., Булгаков А.А., Черников О.В., Петрова И.Ю., Лукьянов П.А. Использование лектинов морских гидробионтов для диагностики ряда социально значимых заболеваний человека // Вестник ДВО РАН. - 2010. - №5. - С.1-10.
7. Фуртак В.А., Тихонов Я.Н., Чикаловец И.В., Лукьянов П.А. Гистопатология рецепторов лектина CGL в спинномозговых ганглиях крыс // Тихоокеан. мед. журн. - 2000. - №4. - С.41-43.
8. Фуртак В.А., Курика А.В., Белогорцева Н.И., Чикаловец И.В., Клещенко Ю.Е. Клеточная локализация рецепторов муцинового типа, выявляемых новым GalNac/Gal - специфичным пектином из морской мидии Crenomytilus grayanus в опухолях толстой кишки человека // Бюл. эксп.биологии и медицины. - 1999. - Т.128, №10. - С.441-444.
9. Kovalchuk S.N., Chikalovets I.V., Chernikov O.V., Molchanova V.I., Li W., Rasskazov V.A., Lukyanov P.A. cDNA cloning and structural characterization of a lectin from the mussel Crenomytilus grayanus with a unique amino acid sequence and antibacterial activity // Fish Shellfish Immunol. - 2013. - V.35. - №4. - P.1320-1324.
10. RU 2447151 C1, 10.04.2012.
11. Sambrook J., Fritsch E.F., Maniatis Т. // Molecular Cloning. A. Laboratory Manual. 2bd ed. Cold Spring Harbor, NY, 1989.