Результат интеллектуальной деятельности: СИСТЕМА И УСТРОЙСТВО (ВАРИАНТЫ) ДЛЯ КРИОКОНСЕРВАЦИИ ГРУППЫ ООЦИТОВ И ЭМБРИОНОВ МЛЕКОПИТАЮЩИХ ПО МЕТОДУ ВИТРИФИКАЦИИ ПРИ ИСПОЛЬЗОВАНИИ В КАЧЕСТВЕ НОСИТЕЛЯ ПОЛОГО ВОЛОКНА
Вид РИД
Изобретение
Область техники, к которой относится изобретение. Изобретение относится к области криоконсервации биологических объектов, то есть низкотемпературному, как правило, в условиях жидкого азота при - 196°C, хранению живых биологических объектов с возможностью восстановления их биологических функций после размораживания-отогревания. При этом для криоконсервации ооцитов, яйцеклеток и эмбрионов млекопитающих наиболее предпочтительным оказывается метод витрификации, когда при охлаждении объекта вода, как внутриклеточная, так и в окружающей объект среде, минуя процесс кристаллизации, переходит из жидкого в стеклообразное состояние. Таким образом, изобретение может найти применение для криоконсервации ооцитов, яйцеклеток и находящихся на ранних стадиях развития эмбрионов млекопитающих при проведении фундаментальных научно-исследовательских работ, для сохранения генетического фонда редких и исчезающих видов животных, в технологии трансплантации эмбрионов сельскохозяйственных животных, в области медицинских исследований.
Часть 1. Устройство для загрузки, витрификации и отогревания группы эмбрионов при использовании в качестве носителя полого волокна (УЗВО)
Уровень техники. Витрификация осуществляется путем сверхбыстрого охлаждения объекта (порядка 15000-30000°C/мин), предварительно обработанного в растворах с высокой концентрацией веществ-криопротекторов, таких как, например, диметилсульфоксид (ДМСО), этиленгликоль (ЭГ), сахароза. Технически сверхвысокая скорость охлаждения достигается при прямом погружении в жидкий азот витрифицируемого объекта, общий объем которого не превышает 0,10 мкл. Этот прием называют метод охлаждения минимального объема (ОМО). В настоящее время разработано несколько моделей носителей, которые позволяют использовать этот метод при витрификации 1 или 2 эмбрионов. К ним относятся такие носители открытого типа, как Cryotop, Cryoloop, Cryoleaf, сеточки для электронной микроскопии, полусоломинки (1). Для одновременной витрификации нескольких эмбрионов было предложено использовать в качестве носителя кусочек бумаги (2). Однако при этом эмбрионы в растворах в процессе витрификации и отогревания обрабатываются индивидуально. Известен один метод, который позволяет проводить как обработку, так и витрификацию эмбрионов группой, основанный на использовании в качестве носителя полых волокон - the hollow fiber vitrification method (HFV method; 3, 4, 5, 6). В тексте описания метод витрификации в полых волокнах обозначен как метод ВПВ.
При использовании метода ВПВ группа подлежащих витрификации эмбрионов помещается в просвет полого волокна и обрабатывается последовательно в ряде растворов как единое целое простым перемещением полого волокна из одной чашки Петри в другую при помощи пинцета. При этом расчетный объем, занимаемый, например, 10 эмбрионами свиньи в растворе эквилибрации внутри полого волокна, составляет 0,07 мкл, а затем в процессе обработки эмбрионов в растворе витрификации уменьшается примерно до 0,03 мкл, что позволяет при витрификации группы эмбрионов соблюдать требования метода ОМО. Описаны два устройства для витрификации группы эмбрионов по методу ВПВ: the hollow fiber vitrification device (HFV device) и the modified HFV device (3). HFV device, состоящее из отрезка полого волокна и инъекционной иглы, в тексте заявки обозначено как устройство для витрификации при использовании в качестве носителя полого волокна, УВПВ. The modified HFV device, состоящее из отрезка полого волокна, канюли для периферических вен, защитного чехла и криопробирки, в тексте описания обозначено как модифицированное устройство для витрификации при использовании в качестве носителя полого волокна, МУВПВ. Наиболее близким аналогом заявляемого изобретения является УВПВ.
Прототип устройства для загрузки, витрификации и отогревания группы эмбрионов при использовании в качестве носителя полого волокна (УЗВО).
Прототипом предлагаемого устройства для загрузки, витрификации и отогревания группы эмбрионов при использовании в качестве носителя полого волокна является конструкция, состоящая из отрезка полого волокна и инъекционной иглы - УВПВ. В этом устройстве в качестве носителя использовались полые волокна из триацетата целлюлозы (cellulose triacetate hollow fiber; FP-150FH, Nipro Corporation, Osaka, Japan). Внутренний диаметр волокна составлял 185 мкм, толщина стенок волокна 15 мкм, величина пор 7,5 нм. Инъекционные иглы имели длину 5,00 мм, наружный диаметр 0,15 мм, внутренний диаметр 0,10 мм (Medical Planning, Miyagi, Japan).
Отрезок полого волокна длиной около 2,5 см надевали на инъекционную иглу. Затем на канюлю иглы надевали шприц емкостью 1 мл, к которому присоединяли аспирационную трубку (3). Группу эмбрионов помещали в чашку Петри с раствором эквилибрации. Используя аспирационную трубку эмбрионы аспирировали в просвет полого волокна, после чего полое волокно отсоединяли от иглы. Полое волокно с размещенными в его просвете эмбрионами при помощи пинцета переносили в чашку Петри с раствором витрификации. Затем полое волокно, удерживаемое пинцетом в вертикальном положении, погружали в жидкий азот, в котором выдерживали его около 2 минут. После этого полое волокно извлекали из жидкого азота, незамедлительно помещали в чашку Петри с раствором отогревания эмбрионов. Затем полое волокно переносили в чашку Петри с раствором разведения и последовательно в две чашки Петри с раствором отмывания эмбрионов. Во второй чашке Петри с раствором отмывания эмбрионы высвобождали из просвета полого волокна.
Данное УВПВ было применено для витрификации эмбрионов мыши и свиньи. Не зависимо от исходной стадии развития, все витрифицированные эмбрионы мыши после отогревания были жизнеспособны. По дальнейшему развитию при культивировании и при трансплантации реципиентам эти эмбрионы не отличались от контрольной группы эмбрионов, не подвергавшихся витрификации. Кроме того, трансплантация витрифицированных при использовании УВПВ эмбрионов свиньи обеспечила рождение молодняка (3, 4). При витрификации эмбрионов крупного рогатого скота на стадии бластоцисты, через 48 часов после отогревания восстановили свой объем 86% эмбрионов (5). 80% эмбрионов крупного рогатого скота, витрифицированных на стадии морулы, после отогревания достигли стадии бластоцисты (6). Таким образом, было показано, что УВПВ пригодно для загрузки группы эмбрионов в отрезок полого волокна, проведения этапа витрификации и последующего их отогревания.
Недостатком УВПВ является использование инъекционной иглы в качестве переходного элемента между отрезком полого волокна и шприцом для присоединения аспирационной трубки. Были использованы инъекционные иглы длиной 5,00 мм, имеющие наружный диаметр 0,15 мм, внутренний диаметр 0,10 мм (Medical Planning, Miyagi, Japan). Инъекционные иглы с такими характеристиками мало распространены. Эти иглы дорогие, поэтому используются многократно. В процессе использования УВПВ инъекционные иглы контактируют с раствором эквилибрации, вследствие чего они требуют отмывания.
Задачей изобретения являлось создание устройства для загрузки, витрификации и отогревания группы эмбрионов, исключающего необходимость применения инъекционной иглы, в котором переходный элемент для соединения полого волокна с аспирационной трубкой представляет собой одну деталь, доступную, не дорогую, удобную при использовании, одноразовую.
Сущность изобретения - устройство (УЗВО), в котором отрезок полого волокна крепится непосредственно на конусообразный кончик тонкостенной трубки, наружный диаметр которого сопоставим с внутренним диаметром полого волокна, в то же время тонкостенная трубка (капилляр) представляет собой единственную деталь в качестве переходного элемента для соединения полого волокна с аспирационной трубкой (Фигура 1. Схема устройства для загрузки, витрификации и отогревания группы эмбрионов при использовании в качестве носителя полого волокна).
Для решения поставленной задачи был предложен вариант УЗВО, состоящий из стеклянного капилляра и отрезка полого волокна. В качестве носителя использовали полые волокна из триацетата целлюлозы, внутренний диаметр которых составлял 180-200 мкм, а длина отрезка около 2,0 см. В качестве переходного элемента использовали стеклянные капилляры диаметром 1,00-1,50 мм, длиной 7,00-10,00 см, имеющие конусообразный кончик с наружным диаметром 0,15-0,18 мм. Кончик стеклянного капилляра вводили в просвет полого волокна, которое удерживали при помощи пинцета. При дальнейшем продвижении стеклянного капилляра отрезок полого волокна фиксировался на нем за счет конусообразной формы кончика. При необходимости полое волокно отсоединяли от УЗВО путем обламывания кончика стеклянного капилляра при помощи пинцета.
Пример использования УЗВО. В качестве носителя использовали полые волокна из триацетата целлюлозы, внутренний диаметр которых составлял 200 мкм, толщина мембраны 15 мкм, размер пор 7 нм (Sureflux®, Nipro Corporation, Japan). Для работы готовили отрезки волокон длиной около 2,0 см. В качестве переходного элемента использовали стеклянные капилляры диаметром 1,20 мм, длиной 10,00 см. Кончик стеклянного капилляра вытягивали вручную при помощи пламени спиртовки таким образом, чтобы он имел наружный диаметр 0,15-0,18 мм. Кончик стеклянного капилляра вводили в просвет полого волокна, которое удерживали при помощи пинцета. При дальнейшем продвижении стеклянного капилляра отрезок полого волокна фиксировался на нем за счет конусообразной формы кончика капилляра капилляра (Фигура 2. Место соединения отрезка полого волокна и стеклянного капилляра). Эта конструкция, сохраняющая проходимость на всем ее протяжении, образовала УЗВО. Для загрузки эмбрионов в просвет полого волокна к свободному концу стеклянного капилляра подсоединяли аспирационную трубку.
Растворы, использованные для витрификации и отогревания эмбрионов. Состав растворов и протоколы витрификации и отогревания эмбрионов соответствовали изложенным в работе Масашиге Куваяма (7). Базовым раствором для проведения витрификации и отогревания эмбрионов являлась среда Тироде с добавлением 20,0% сыворотки крови. Раствор эквилибрации содержал 7,5% ЭГ и 7,5% ДМСО, раствор витрификации 15,0% ЭГ, 15,0% ДМСО и 0,5 М сахарозы. Раствор отогревания содержал 1,0 М сахарозы, а разбавления 0,5 М сахарозы. В качестве раствора отмывания использовался базовый раствор. Каждый из этих растворов наливали по 3,0 мл в чашки Петри диаметром 40 мм (Биомедикал, Россия). Все растворы имели комнатную температуру 23-25°C.
Вблизи стереомикроскопа ставили емкость с жидким азотом. Полученные in vitro эмбрионы крупного рогатого скота в возрасте 7 дней на стадии бластоцисты и расширенной бластоцисты по 5-10 штук помещали в базовый раствор на 10 минут, а затем переносили в раствор эквилибрации. На свободный конец стеклянного капилляра, входящего в состав УЗВО, надевали аспирационную трубку. Находящиеся в растворе эквилибрации эмбрионы аспирировали в полое волокно таким образом, чтобы столбик раствора с эмбрионами с каждой стороны отделялся от остального раствора в полом волокне двумя небольшими столбиками воздуха (Фигура 3. Эмбрионы крупного рогатого скота, загруженные в отрезок полого волокна в растворе для эквилибрации). При помощи пинцета обламывали кончик капилляра, оставляя полое волокно с загруженными эмбрионами в растворе эквилибрации, выдерживая в нем в общей сложности в течение 5 минут. При помощи пинцета полое волокно переносили в чашку Петри с раствором витрификации и выдерживали в нем 1 минуту. Удерживая полое волокно пинцетом в вертикальном положении, погружали его в жидкий азот примерно на 1 минуту. Извлекали полое волокно из жидкого азота и немедленно помещали в чашку Петри с раствором отогревания. Через 1 минуту полое волокно переносили на 5 минут в чашку с раствором разбавления, а затем помещали в первую чашку с раствором отмывания. Через 5 минут полое волокно с эмбрионами переносили во вторую чашку с раствором отмывания, в котором высвобождали эмбрионы из просвета полого волокна. Для этого при помощи пинцета удерживали полое волокно за один конец и проводили плоским шпателем вдоль полого волокна, прижимая его к дну чашки Петри. Затем эмбрионы размещали на культивирование in vitro. Оценку жизнеспособности и развития эмбрионов проводили через 24 и 72 часа после отогревания.
Результаты. В процессе использования УЗВО отрезок полого волокна надежно удерживался на конусообразном кончике стеклянного капилляра, а при необходимости легко отсоединялся путем обламывания кончика стеклянного капилляра при помощи пинцета. Через 24 часа после витрификации и отогревания смешанной группы 7-дневных эмбрионов, находящихся на стадии бластоцисты или расширенной бластоцисты, восстановили объем 89% эмбрионов (130/146, 9 повторов). Через 72 часа после отогревания в возрасте 10 суток из блестящей оболочки вышло 64% витрифицированных бластоцист (103/146). Эти результаты сопоставимы с показателями развития контрольных не подвергавшихся витрификации эмбрионов, у которых в возрасте 10 суток из блестящей оболочки вышло 70% бластоцист (94/135, 8 повторов). При отборе для витрификации только тех эмбрионов крупного рогатого скота, которые в возрасте 7 дней уже достигли стадии расширенной бластоцисты, через 24 часа после отогревания восстановили объем 96% эмбрионов (50/52, 5 повторов), через 72 часа после отогревания в возрасте 10 суток из блестящей оболочки вышло 95% бластоцист (37/40, 3 повтора).
Таким образом, полученные результаты свидетельствуют о том, что предлагаемое устройство УЗВО пригодно для осуществления загрузки, витрификации и отогревания группы эмбрионов.
Тонкостенная трубка (капилляр) нужной конфигурации может быть изготовлена промышленным способом. При использовании стеклянного капилляра кончик нужного диаметра может быть вытянут как в лабораторных условиях вручную, так и промышленным способом. Отрезок полого волокна надевается на кончик капилляра и при дальнейшем продвижении надежно фиксируется за счет конусообразной формы этого кончика. Отсоединяется полое волокно от стеклянного капилляра путем обламывания кончика капилляра при помощи пинцета. Стеклянные капилляры не дороги, поэтому используются однократно и не требуют отмывания. Отломанный кончик стеклянного капилляра длиной 3,0-5,0 мм, остающийся в просвете полого волокна на одном его конце, служит удобным местом для захвата пинцетом при переносе отрезка полого волокна с эмбрионами из одной чашки Петри в другую.
Использование капилляра в качестве единственной детали для соединения отрезка полого волокна с аспирационной трубкой является существенным признаком, характеризующим изобретение, и является отличительным признаком от прототипа.
Часть 2. Система для криоконсервации группы ооцитов и эмбрионов млекопитающих по методу витрификации при использовании в качестве носителя полого волокна (СКВПВ)
Уровень техники. В части 1 описания приведены данные, свидетельствующие о том, что при использовании в качестве носителя полых волокон из триацетата целлюлозы были успешно витрифицированы и отогреты группы эмбрионов нескольких видов млекопитающих. Однако при криоконсервации эмбрионы должны размещаться в криохранилище, а также при необходимости подвергаться транспортировке в условиях жидкого азота. Известны данные, что для продолжительного хранения в жидком азоте полые волокна с витрифицированными эмбрионами помещали в криопробирки (3, 4). Однако авторы указали, что полые волокна из триацетата целлюлозы в жидком азоте становятся очень хрупкими и при помещении в пробирку могут обламываться от соприкосновения с ее стенками (3). Вследствие этого очень велика опасность безвозвратной утраты витрифицированных эмбрионов. Поэтому для криоконсервации витрифицированных по методу ВПВ эмбрионов, при размещении на хранение в жидком азоте полые волокна должны быть защищены от возможных механических повреждений. Известна одна система для витрификации и последующего хранения группы эмбрионов в жидком азоте при использовании в качестве носителя полых волокон - the modified HFV device (3). The modified HFV device, состоящее из отрезка полого волокна, канюли для периферических вен, защитного чехла и криопробирки, в тексте заявки обозначено как модифицированное устройство для витрификации при использовании в качестве носителя полого волокна, МУВПВ. Это устройство выступает в качестве прототипа нашего изобретения - Системы для криоконсервации группы ооцитов и эмбрионов млекопитающих по методу витрификации при использовании в качестве носителя полого волокна-СКВПВ.
Итак, прототип предлагаемой СКВПВ состоял из отрезка полого волокна, канюли для периферических вен, защитного чехла и криопробирки. В качестве носителя использовались полые волокна из триацетата целлюлозы (cellulose triacetate hollow fiber; FP-150FH, Nipro Corporation, Osaka, Japan). Внутренний диаметр волокна составлял 185 мкм, толщина стенок волокна 15 мкм, величина пор 7,5 нм. Отрезок полого волокна длиной около 2,5 см приклеивали к кончику канюли для периферических вен (an ethylene-tetrafluoroethylene peripheral cannula of an indwelling needle; SR-OT1852C Surflow® I.V. catheter 18Gx2, Terumo, Tokyo, Japan) эпоксидным клеем (epoxy adhesive; 16051, Konishi, Osaka, Japan). Чехол, способный удлиняться за счет смещения одной его части относительно другой, был изготовлен из телескопических соломинок для сока (Telescopic Straw, Nippon Straw, Tokyo, Japan). Чехол крепили непосредственно на канюле для периферических вен. Затем на канюлю для периферических вен надевали шприц емкостью 1 мл, к которому для загрузки эмбрионов в полое волокно присоединяли аспирационную трубку. После загрузки эмбрионов в полое волокно аспирационную трубку отсоединяли от устройства, оставляя шприц в качестве ручки. В процессе загрузки эмбрионов в полое волокно, при проводке их через растворы эквилибрации, витрификации, а также при погружении в жидкий азот, наружная подвижная часть чехла находилась в поднятом положении, вследствие чего полое волокно находилось за пределами чехла. Затем подвижный расширенный участок чехла опускали вниз для того, чтобы закрыть с боков полое волокно, уже находящееся в жидком азоте. После этого шприц отсоединяли, а устройство, включающее отрезок полого волокна с эмбрионами, канюлю для периферических вен и защитный чехол, не вынимая из жидкого азота, помещали в криопробирку (CryoTubeзнак 337516, 4.5 ml, Thermo Fisher Scientific, MA, USA), после чего размещали в криохранилище.
Для отогревания эмбрионов криопробирку, содержащую устройство, извлекали из криохранилища и в переносном сосуде Дьюара доставляли к месту назначения. Устройство непосредственно в жидком азоте извлекали из криопробирки и вновь подсоединяли к нему шприц емкостью 1 мл, который использовался в качестве ручки. Подвижный расширенный участок чехла поднимали таким образом, чтобы полое волокно оказалось за пределами чехла, оставаясь в то же время в жидком азоте. После этого устройство полностью извлекали из жидкого азота, полое волокно немедленно помещали в чашку Петри в раствор отогревания и при помощи ножниц отрезали его от устройства. Дальнейшая обработка эмбрионов в полом волокне осуществлялась точно так же, как и при отогревании эмбрионов, витрифицированных с использованием УВПВ.
При использовании МУВПВ были витрифицированы и помещены в криохранилище эмбрионы мыши на стадии 2-х бластомеров и эмбрионы свиньи на стадии морулы. На целостность полых волокон и сохранность эмбрионов, витрифицированных с использованием МУВПВ, не влияли такие внешние факторы, как транспортировка в сосудах Дьюара или случившиеся в период хранения землетрясения. 95-96% эмбрионов мыши, витрифицированных на стадии 2-х клеток и хранившихся в жидком азоте в течение 6 или 12 месяцев, после отогревания и культивирования развивались до стадии бластоцисты. Эмбрионы свиньи, витрифицированные на стадии морулы, хранили в жидком азоте от 52 до 313 дней. После отогревания и культивирования в течение 24 часов стадии бластоцисты достигло 99% эмбрионов (72/73). В результате трансплантации этих эмбрионов, все 4 реципиента оказались супоросными и принесли потомство. До рождения молодняка развивалось в среднем 40% трансплантированных эмбрионов (3).
Недостатком технического решения МУВПВ является сложность соединения отрезка полого волокна с переходным элементом для подсоединения к шприцу. Технически трудно приклеить эпоксидным клеем (ероху adhesive; 16051, Konishi, Osaka, Japan) к кончику канюли для периферических вен (to the tip of an ethylene-tetrafluoroethylene peripheral cannula of an indwelling needle; SR-OT1852C Surflow® I.V. catheter 18Gx2, Terumo, Tokyo, Japan) отрезок полого волокна из триацетата целлюлозы диаметром 185 мкм, сохранив при этом внутренний просвет как полого волокна, так и кончика канюли для периферических вен. Использование эпоксидного клея также является недостатком, в связи с его возможными пирогенными и/или эмбриотоксическими свойствами. В то же время, именно эта конструкция использовалась для крепления защитного чехла, который служил для предотвращения возможных механических повреждений полого волокна в условиях жидкого азота.
При использовании МУВПВ детали чехла должны сдвигаться относительно друг друга в условиях жидкого азота, что также является недостатком конструкции: возможно заклинивание деталей, изготовленных из функционально непригодного материала. Авторы признают, что недостатками МУВПВ является его сложная структура, что затрудняет создание и использование устройства (3).
Использование криопробирок (CryoTubeзнак 337516, 4.5 ml, Thermo Fisher Scientific, MA, USA) является также недостатком технического решения МУВПВ. Наличие жидкого азота внутри криопробирки вызывает угрозу ее взрыва при извлечении из жидкого азота, так как криопробирка, по определению, закрывается герметично, и размещение жидкого азота в ней не предусмотрено производителем. Криопробирки очень дороги. Они достаточно громоздки, поэтому занимают много места в криохранилище.
Целью изобретения являлось создание Системы для криоконсервации группы ооцитов и эмбрионов млекопитающих по методу витрификации при использовании в качестве носителя полого волокна, в которой используются заявляемое УЗВО, чехол для предотвращения повреждений полого волокна из триацетата целлюлозы в условиях жидкого азота и контейнер, занимающий минимальный объем в криохранилище и обеспечивающий пребывание полого волокна в жидком азоте при необходимых перемещениях УЗВО с чехлом. При этом чехол должен представлять собой конструкцию из неподвижных в процессе эксплуатации друг относительно друга частей и быть совместимым с заявляемым УЗВО. Контейнер должен представлять конструкцию открытого типа, изготовленную из доступных недорогих материалов, быть компактным.
Сущность изобретения. Для решения поставленной задачи была предложена СКВПВ, состоящая из УЗВО, чехла и контейнера. Конструкция УЗВО, представляющего собой отрезок полого волокна, соединенного со стеклянным капилляром, его изготовление и использование, были изложены в части 1 заявки.
В качестве чехла была предложена тонкостенная цилиндрическая конструкция с открытыми концами длиной 5,5-6,5 см, имеющая переменный диаметр. Одна часть конструкции длиной около 2,5-3,0 см имеет внутренний диаметр 0,25-0,30 см, другая часть имеет внутренний диаметр 0,11-0,17 см. Обе части конструкции неподвижны относительно друг друга, их граница маркирована. На внешнем крае части чехла меньшего диаметра имеется суженный участок, протяженностью около 0,20 см, который обладает необходимой пластичностью для изменения величины внутреннего просвета в небольших пределах, служащий для крепления на капилляре УЗВО, при этом чехол и капилляр УЗВО сохраняют способность перемещаться друг относительно друга при сохранении взаимной ориентации, обеспечивая возможность проведения необходимых этапов витрификации и отогревания на открытом волокне и защиту отрезка полого волокна от повреждений в криохранилище.
Конструкция, состоящая из УЗВО и чехла, являющаяся частью СКВПВ, представляет собой модифицированное устройство для загрузки, витрификации и отогревания группы эмбрионов при использовании в качестве носителя полого волокна, МУЗВО.
Контейнер представляет собой цилиндрическую тонкостенную трубку длиной 12,5-13,5 см, имеющую диаметр, не превышающий 3-кратный диаметр чехла, выполненную из окрашенной пластической массы, замкнутую с одной стороны, имеющую косой срез длиной 3,0-4,0 см на другом конце, в которую помещается МУЗВО. При этом контейнер обеспечивает компактное размещение МУЗВО в криохранилище; при перемещении Системы между сосудами с жидким азотом обеспечивает постоянное нахождение отрезка полого волокна с витрифицированными эмбрионами в пределах жидкого азота, исключает возможность взрывоопасного скопления паров азота.
Комплекс МУЗВО с контейнером образуют Систему для криоконсервации группы ооцитов и эмбрионов млекопитающих по методу витрификации при использовании в качестве носителя полого волокна (СКВПВ).
Пример реализации изобретения. Конструкция УЗВО, представляющего собой отрезок полого волокна, соединенного со стеклянным капилляром, и ее использование, были изложены в части 1 заявки.
Были предложены два варианта чехла для предохранения полого волокна от механических повреждений в условиях жидкого азота, изготовленные в лабораторных условиях: чехол 1 и чехол 2.
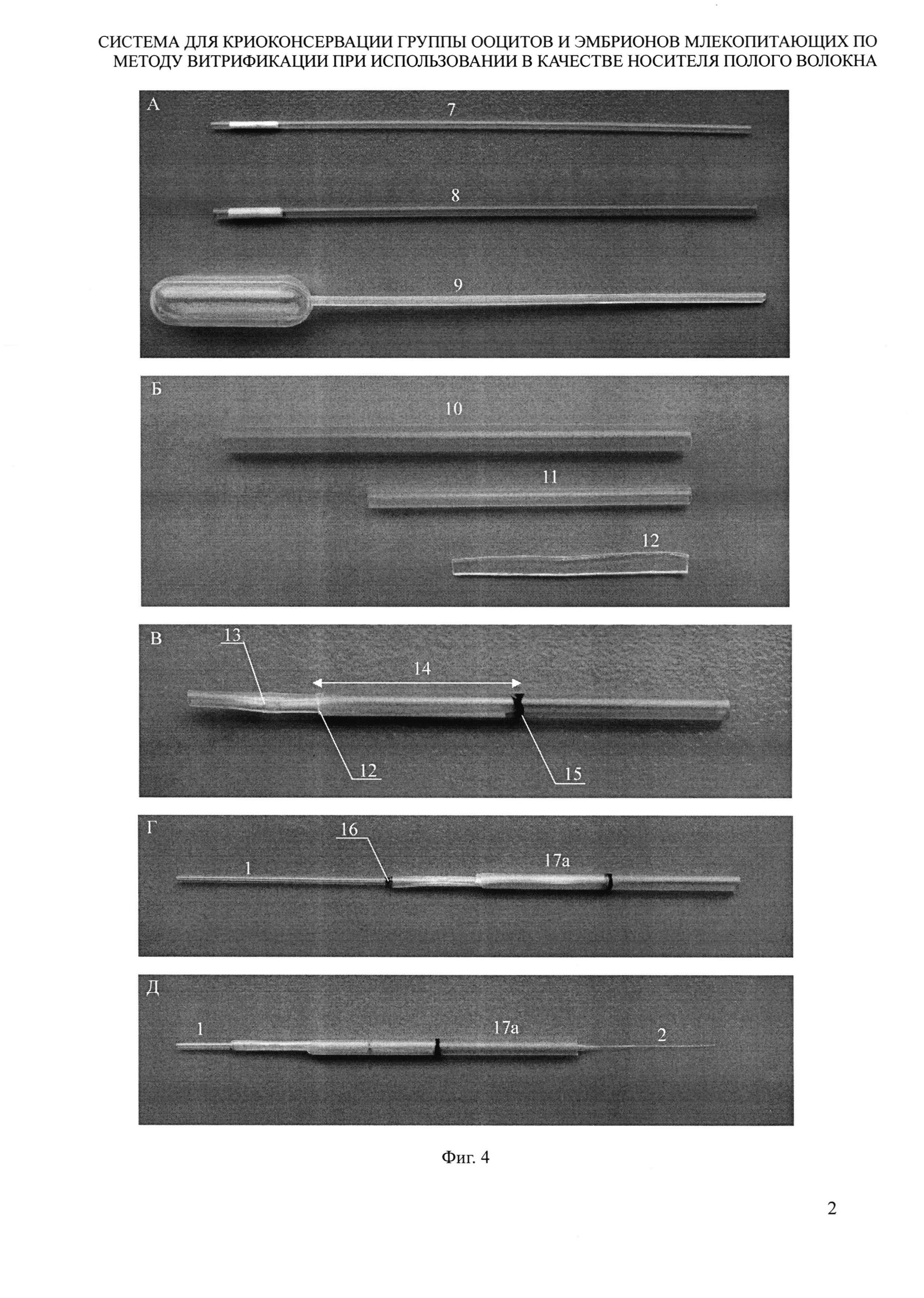
Материалом для изготовления чехла 1 являлись криосоломинки, которые используются для криоконсервации биологических материалов (Minitube, Германия). Криосоломинки объемом 0,25 мл (mini straw) имеют наружный диаметр 0,20 см, внутренний диаметр 0,17 см. Наружный диаметр криосоломинок объемом 0,50 мл (medium straw) составляет 0,30 см, внутренний диаметр 0,25 см. Кроме того, использовались серологические пипетки объемом 2,50 мл (LDPE Serum Pipette, Low Density Polyethylene; Greiner bio-one), толщина стенок груши которых составляет около 0,05 см. Готовили отрезок длиной 5,50 см криосоломинки объемом 0,50 мл, отрезок длиной 3,50 см криосоломинки объемом 0,25 мл и полиэтиленовую полоску длиной около 2,8 см и шириной 0,20 см из груши пипетки. Отрезок криосоломинки объемом 0,25 мл вставляли внутрь отрезка криосоломинки объемом 0,50 мл на глубину 2,50 см, размещая между их стенками полиэтиленовую полоску из груши пипетки. В результате полиэтиленовая полоска надежно фиксировала отрезки криосоломинок разного диаметра относительно друг друга. На наружную стенку отрезка криосоломинки объемом 0,50 мл наносили метку, обозначающую положение конца криосоломинки объемом 0,25 мл в ее просвете. Конец выступающего наружу отрезка криосоломинки объемом 0,25 мл расплющивали в поперечном направлении при помощи запаивателя пакетов Impulse Sealer AVT200, CAS Corporation, Korea, в режиме 0,5.
Свободный конец стеклянного капилляра, входящего в состав УЗВО, вставляли в чехол со стороны отрезка криосоломинки объемом 0,50.мл и продвигали далее в просвет отрезка криосоломинки объемом 0,25 мл до выхода его с другой стороны чехла. Стеклянный капилляр протягивали дальше таким образом, чтобы надетый на него отрезок полого волокна полностью скрылся в просвете чехла. После этого на стеклянном капилляре делали метку в месте его выхода наружу из чехла. Эта конструкция представляет собой модифицированное устройство для загрузки, витрификации и отогревания группы эмбрионов при использовании в качестве носителя полого волокна, МУЗВО. Для обработки эмбрионов на стадии витрификации и отогревания эмбрионов стеклянный капилляр вдвигали внутрь чехла таким образом, чтобы полое волокно оказалось за пределами чехла (Фигура 4. Модифицированное устройство для загрузки, витрификации и отогревания группы эмбрионов при использовании в качестве носителя полого волокна, на основе чехла 1).
Контейнер изготовляли из соломки питьевой разного цвета диаметром 0,5 см (ParStar, Германия). Один конец отрезка соломки длиной 13,0 см запаивали при помощи запаивателя пакетов Impulse Sealer AVT200, CAS Corporation, Korea, в режиме 8. На другом конце отрезка соломки делали косой срез длиной 3,0-4,0 см. МУЗВО помещали в подготовленный контейнер. В результате получали Систему для криоконсервации группы ооцитов и эмбрионов млекопитающих по методу витрификации при использовании в качестве носителя полого волокна, СКВПВ (Фигура 5. Система для криоконсервации группы ооцитов и эмбрионов млекопитающих по методу витрификации при использовании в качестве носителя полого волокна).
Материалом для изготовления чехла 2 являлись криосоломинки объемом 0,25 мл (mini straw; наружный диаметр 2,0 мм, внутренний диаметр 1,7 мм; Minitube, Германия) и Transfer pipette 3,5 ml (Sarstedt). Вытянутая часть Transfer pipette состояла из трех переходящих друг в друга цилиндрических участков. Первый участок (кончик пипетки) длиной около 1,5 см имел внутренний диаметр 1,5 мм, второй участок длиной около 1,0 см имел внутренний диаметр около 2,0 мм, третий участок длиной около 8,0 см имел внутренний диаметр около 3,7 мм. Готовили отрезок пипетки длиной 4,5 см, состоящий из второго участка пипетки (1,0 см) и примыкающей к нему части третьего участка (3,5 см). Отрезок криосоломинки длиной 3,0 см вставляли в просвет отрезка пипетки со стороны, имеющей внутренний диаметр около 2,0 мм, и продвигали внутрь на глубину 1,5 см. Выступающий наружу участок стенки криосоломинки расплющивали в поперечном направлении при помощи запаивателя пакетов Impulse Sealer AVT200, CAS Corporation, Korea, в режиме 0,5. Полученная конструкция представляла собой чехол 2.
Свободный конец стеклянного капилляра, входящего в состав УЗВО, вставляли в чехол 2 со стороны участка большего диаметра, продвигали в просвет отрезка соломинки и далее до выхода его с другой стороны чехла. Удерживая за свободный конец, стеклянный капилляр протягивали дальше таким образом, чтобы надетый на него с другой стороны отрезок полого волокна полностью скрылся в просвете отрезка пипетки. После этого на стеклянном капилляре делали метку в месте его выхода наружу из чехла. Для обработки эмбрионов на стадии витрификации и отогревания, стеклянный капилляр вдвигали внутрь чехла таким образом, чтобы полое волокно оказалось за пределами чехла (Фигура 6. Модифицированное устройство для загрузки, витрификации и отогревания группы эмбрионов при использовании в качестве носителя полого волокна, на основе чехла 2). Контейнер для устройства, включающего чехол 2, может быть изготовлен из соломки питьевой диаметром 0,7-0,8 см.
Пример использования СКВПВ.
Этап витрификации. Состав растворов для витрификации и отогревания полученных in vitro эмбрионов крупного рогатого скота изложен в части 1 заявки при описании примера использования УЗВО.
Вблизи стереомикроскопа ставили емкость с жидким азотом, в которую помещали контейнер для МУЗВО. Стеклянный капилляр в составе МУЗВО вдвигали внутрь чехла таким образом, чтобы волокно и кончик капилляра вышли с другой стороны за пределы чехла. К свободному концу стеклянного капилляра подсоединяли аспирационную трубку. Эмбрионы крупного рогатого скота в возрасте 7 дней, достигшие стадии бластоцисты или расширенной бластоцисты, помещали в раствор эквилибрации по 5-10 штук и загружали в полое волокно, после чего аспирационную трубку отсоединяли. Находящееся в составе МУЗВО полое волокно с эмбрионами выдерживали в растворе эквилибрации в течение 5 минут, а затем переносили в чашку Петри с раствором витрификации и выдерживали в нем 1 минуту. Удерживая МУЗВО рукой за стеклянный капилляр, полое волокно погружали в вертикальном положении в жидкий азот, а затем продолжали погружать устройство в жидкий азот до уровня метки на чехле. В этом положении МУЗВО полое волокно и широкая часть чехла оказываются ниже уровня жидкого азота. Удерживая МУЗВО пинцетом за расплющенный участок криосоломинки, перемещали стеклянный капилляр вверх до появления из чехла метки, имеющейся на капилляре. В результате полое волокно, оставаясь погруженным в жидкий азот, оказывается полностью скрытым в просвете широкого участка чехла. В таком состоянии МУЗВО с витрифицированными эмбрионами помещали в контейнер, предварительно помещенный в сосуд с жидким азотом. СКВПВ размещали в криохранилище.
Этап отогревания эмбрионов Из криохранилища СКВПВ в переносном сосуде Дьюара доставляли в емкость с жидким азотом, находящуюся вблизи стереомикроскопа. Пинцетом удерживали МУЗВО за стеклянный капилляр и извлекали его из контейнера, сохраняя при этом МУЗВО ниже уровня жидкого азота. Удерживая стеклянный капилляр пинцетом, МУЗВО поднимали в вертикальном положении таким образом, чтобы над уровнем жидкого азота показалась метка на стенке чехла. В этом положении нижняя широкая часть устройства вместе с расположенным в его просвете полым волокном оставались в толще жидкого азота. Удерживая МУЗВО за расплющенный участок соломинки, смещали стеклянный капилляр вниз вглубь чехла на 2,0-3,0 см. В результате полое волокно оказывалось за пределами чехла, еще глубже погружаясь в жидкий азот. Не торопясь поднимали МУЗВО таким образом, чтобы чехол полностью вышел из жидкого азота, а конец стеклянного капилляра с отрезком полого волокна оставался ниже уровня жидкого азота. В это время чехол освобождался от жидкого азота. Полностью вынимали МУЗВО из жидкого азота, и полое волокно немедленно помещали в чашку Петри с раствором отогревания. Отделяли полое волокно от устройства, обламывая кончик стеклянного капилляра при помощи пинцета. Дальнейшая процедура этапа отогревания эмбрионов изложена в части 1 заявки. Эмбрионы размещали на культивирование in vitro. Оценку жизнеспособности и развития эмбрионов проводили через 24 и 72 часа после отогревания.
Эмбрионы крупного рогатого скота, витрифицированные при использовании СКВПВ, помещали в криохранилище и хранили в жидком азоте в течение 1-2 месяцев. За этот период СКВПВ переносили из одного сосуда с жидким азотом в другой, некоторые СКВПВ доставляли в жидком азоте в переносном сосуде Дьюара на животноводческую ферму. При этом полые волокна в составе СКВПВ оставались целыми, эмбрионы не были утрачены.
Пример 1. После отогревания эмбрионов, хранившихся в жидком азоте в течение 52 дней, через 24 часа восстановили свой объем 93% бластоцист (14/15), через 72 часа культивирования в возрасте 10 суток из блестящей оболочки вышло 60% бластоцист (9/15).
Пример 2. При отогревании эмбрионов после 61 дня хранения в условиях жидкого азота через 24 часа культивирования восстановили свой объем 86% бластоцист (36/42), через 72 часа в возрасте 10 суток из блестящей оболочки вышло 79% бластоцист (33/42).
Пример 3. СКВПВ, находившаяся в криохранилище в течение 53 дней, была помещена в переносной сосуд Дьюара и доставлена на животноводческую ферму. После отогревания эмбрионов в условиях фермы и доставки их в лабораторию в течение 3 часов при температуре около 25°C, все 4 расширенные бластоцисты через 24 часа культивирования восстановили свой объем (100%), а через 72 часа в возрасте 10 суток вышли из блестящей оболочки (100%).
Таким образом, конструкция чехла позволяет использовать заявляемое УЗВО для образования МУЗВО, а при добавлении контейнера образовывать СКВПВ. Использованные для изготовления чехла криосоломинки широко распространены, не дороги, не токсичны и рассчитаны на использование в условиях жидкого азота, пипетки по своему назначению также готовятся из не токсичных материалов. Используется чехол однократно. Все части чехла при его использовании остаются неподвижными относительно друг друга. Это делает конструкцию простой и надежной в эксплуатации, исключая заклинивание. Расплющенный участок отрезка криосоломинки объемом 0,25 мл, входящего в состав обоих вариантов чехла, достаточно прочно удерживает стеклянный капилляр, не позволяя ему двигаться произвольно. В то же время при приложении небольшого усилия рук стеклянный капилляр может передвигаться в обоих направлениях, перемещая соединенный с ним отрезок полого волокна внутрь чехла или за его пределы. Благодаря сопоставимым величинам внутреннего диаметра криосоломинки объемом 0,25 мл и наружного диаметра стеклянного капилляра, стеклянный капилляр находится в чехле в близком к осевому положении. В результате этого отрезок полого волокна располагается примерно по оси цилиндрического чехла и оказывается закрытым с боковых сторон стенками соломинки объемом 0,50 мл, но не соприкасается с ними. При этом между стеклянным капилляром и внутренними стенками отрезка криосоломинки объемом 0,25 мл остаются зазоры на всем его протяжении, в том числе и в расплющенном участке. Это позволяет воздуху выходить из чехла, а жидкому азоту беспрепятственно заполнять чехол при вертикальном погружении МУЗВО в жидкий азот на этапе витрификации. На этапе отогревания при подъеме МУЗВО из жидкого азота благодаря этим зазорам воздух поступает в чехол, вследствие чего жидкий азот полностью и без турбулентности выходит из чехла. Полное, при отсутствии турбулентных потоков, заполнение чехла жидким азотом на этапе витрификации крайне необходимо для предотвращения повреждения полого волокна и возникновения «плавучести» МУЗВО при его размещении в жидком азоте. Полное освобождение чехла от жидкого азота на этапе отогревания также очень важно, так как после извлечения МУЗВО из жидкого азота полое волокно незамедлительно помещается в раствор отогревания эмбрионов, куда абсолютно не должны попадать даже следовые количества жидкого азота.
В промышленных масштабах чехол может быть изготовлен как цельная структура соответствующей конфигурации из пластикового материала подобно криосоломинкам для криоконсервации биологического материала.
Контейнер, изготовленный в лабораторных условиях из отрезка питьевой соломки диаметром 0,5 см (ParStar, Германия), стоит дешево. Предлагаемая конструкция позволяет при переносе контейнера из одного сосуда Дьюара в другой, с одной стороны, сохранить жидкий азот внутри контейнера, а с другой стороны избежать скопления паров азота и, следовательно, угрозы взрыва. Поэтому, при переносе СКВПВ из одной емкости с жидким азотом в другую, например, для размещения эмбрионов в криохранилище или в переносном сосуде Дьюара для доставки к месту использования, полое волокно не выходит за пределы жидкого азота, благодаря чему не нарушаются температурные условия хранения витрифицированных эмбрионов. Косой срез на открытом конце контейнера позволяет взять пинцетом конец стеклянного капилляра для извлечения МУЗВО из контейнера на этапе отогревания эмбрионов. Благодаря сопоставимым диаметрам чехла и контейнера цилиндрической формы, СКВПВ занимает минимальный объем в криохранилище. Например, в гоблете диаметром 1,3 см, то есть сопоставимом по величине диаметра с использованной в прототипе криопробиркой, одновременно может быть размещено 4 СКВПВ (Фигура 7. Размещение в гоблете Системы для криоконсервации группы ооцитов и эмбрионов млекопитающих по методу витрификации при использовании в качестве носителя полого волокна). При помощи пинцета СКВПВ легко извлекалось из гоблета, имеющего стандартную длину 12 см. Применение контейнеров и гоблетов разного цвета служило дополнительной маркировкой группы витрифицированных эмбрионов. В промышленных масштабах контейнер может быть изготовлен как структура соответствующей конфигурации из пластикового материала разного цвета, используемого при криоконсервации биологического материала. Использование предлагаемого контейнера позволяет значительно снизить затраты на криоконсервацию.
Таким образом, примеры использования СКВПВ свидетельствуют о том, что предлагаемое изобретение пригодно для осуществления криоконсервации группы эмбрионов млекопитающих по методу витрификации при использовании в качестве носителя полого волокна и обладает целым рядом преимуществ по сравнению с прототипом.
Описание чертежей
Фигура 1. Схема устройства для загрузки, витрификации и отогревания группы эмбрионов при использовании в качестве носителя полого волокна. 1 - стеклянный капилляр, 2 - отрезок полого волокна, 3 - место соединения отрезка полого волокна и стеклянного капилляра.
Фигура 2. Место соединения отрезка полого волокна и стеклянного капилляра. 1 - стеклянный капилляр, 2 - полое волокно, 3 - место соединения отрезка полого волокна и стеклянного капилляра. Фото под стереомикроскопом, длина шкалы 200 мкм.
Фигура 3. Эмбрионы крупного рогатого скота, загруженные в отрезок полого волокна в растворе для эквилибрации. 2 - полое волокно, 4 - эмбрионы, 5 - пузырьки воздуха, 6 - раствор для эквилибрации. Фото под стереомикроскопом, длина шкалы 200 мкм.
Фигура 4. Модифицированное устройство для загрузки, витрификации и отогревания группы эмбрионов при использовании в качестве носителя полого волокна, на основе чехла 1. А) Материалы для изготовления чехла: 7 - криосоломинка объемом 0,25 мл, 8 - криосоломинка объемом 0,5 мл, 9 - серологическая пипетка. Б) Детали чехла: 10 - отрезок криосоломинки объемом 0,5 мл, 11 - отрезок криосоломинки объемом 0,25 мл, 12 - полоска, вырезанная из груши серологической пипетки. В) Чехол в собранном виде: 12 - полиэтиленовая полоска, находящаяся между отрезками криосоломинок, 13 - расплющенный участок отрезка криосоломинки объемом 0,25 мл, 14 - место соединения отрезков криосоломинок, 15 - метка на чехле. Г) Положение устройства на этапах хранения и транспортировки в жидком азоте витрифицированных эмбрионов млекопитающих: 1 - стеклянный капилляр, 16 - метка на стеклянном капилляре, 17а - чехол 1. Д) Положение устройства на этапах витрификации и отогревания эмбрионов: 1 - стеклянный капилляр, 2 - отрезок полого волокна, 17а - чехол 1.
Фигура 5. Система для криоконсервации группы ооцитов и эмбрионов млекопитающих по методу витрификации при использовании в качестве носителя полого волокна. А) Составляющие части Системы. 18 - модифицированное устройство для загрузки, витрификации и отогревания группы эмбрионов при использовании в качестве носителя полого волокна, 19 - контейнер. Б) Система для криоконсервации группы ооцитов и эмбрионов млекопитающих по методу витрификации при использовании в качестве носителя полого волокна в собранном виде. 1 - стеклянный капилляр, 19 - контейнер. В) Верхняя часть Системы для криоконсервации группы ооцитов и эмбрионов млекопитающих по методу витрификации при использовании в качестве носителя полого волокна, в увеличенном виде: 1 - стеклянный капилляр, 19 - контейнер.
Фигура 6. Модифицированное устройство для загрузки, витрификации и отогревания группы эмбрионов при использовании в качестве носителя полого волокна, на основе чехла 2. А) Материалы для изготовления чехла: 7 - криосоломинка объемом 0,25 мл, 20 - пластиковая пипетка. Б) Детали чехла: 11 - отрезок криосоломинки, 13 - расплющенный участок отрезка криосоломинки, 21 - отрезок пипетки. В) Чехол в собранном виде: 13 - расплющенный участок отрезка криосоломинки, 22 - место соединения отрезков криосоломинки и пипетки. Г) Положение устройства на этапах хранения и транспортировки в жидком азоте витрифицированных эмбрионов: 1 -стеклянный капилляр, 16 - метка на стеклянном капилляре, 176 - чехол 2. Д) Положение устройства на этапах витрификации и отогревания эмбрионов: 1 - стеклянный капилляр, 2 - отрезок полого волокна, 176 - чехол 2.
Фигура 7. Размещение в гоблете Системы для криоконсервации группы ооцитов и эмбрионов млекопитающих по методу витрификации при использовании в качестве носителя полого волокна. Длина гоблета - 12 см, диаметр - 1,3 см. А) Вид сбоку. Б) Вид сверху. 23 - гоблет, 24 - выступающий из гоблета кончик Системы для криоконсервации группы ооцитов и эмбрионов млекопитающих по методу витрификации при использовании в качестве носителя полого волокна. В одном гоблете может быть размещено одновременно 4 контейнера разного цвета с МУЗВО.
Список условных обозначений:
1 - стеклянный капилляр
2 - отрезок полого волокна
3 - место соединения отрезка полого волокна и стеклянного капилляра
4 - эмбрионы
5 - пузырьки воздуха
6 - раствор для эквилибрации
7 - криосоломинка объемом 0,25 мл
8 - криосоломинка объемом 0,5 мл
9 - серологическая пипетка
10 - отрезок криосоломинки объемом 0,5 мл
11 - отрезок криосоломинки объемом 0,25 мл
12 - полоска, вырезанная из груши серологической пипетки
13 - расплющенный участок отрезка криосоломинки объемом 0,25 мл
14 - место соединения отрезков криосоломинок
15 - метка на чехле
16 - метка на стеклянном капилляре
17а - чехол 1
17б - чехол 2
18 - модифицированное устройство для загрузки, витрификации и отогревания группы эмбрионов при использовании в качестве носителя полого волокна
19 - контейнер
20 - пластиковая пипетка
21 - отрезок пипетки
22 - место соединения отрезков криосоломинки и пипетки
23 - гоблет
24 - выступающий из гоблета кончик Системы для криоконсервации группы ооцитов и эмбрионов млекопитающих по методу витрификации при использовании в качестве носителя полого волокна.
Список литературы
1. Saragusty J., Arav A. Current progress in oocyte and embryo cryopreservation by slow freezing and vitrification. Reproduction. 2011; 141: 1-19.
2. Kim et al. Successful vitrification of bovine blastocysts on paper container. Theriogenology. 2012; 78: 1085-10931.
3. Matsunari et al. Hollow fiber vitrification: A novel method for vitrifying multiple embryos in a single device. J. Reprod. Dev. 2012; 58: 599-608.
4. Maehara et al. Hollow fiber vitrification provides a novel method for cryopreserving in vitro maturation/fertilization-derived porcine embryos. Biol. Reprod. 2012; 87: 133, 1-8.
5. Beck et al. Hollow fiber vitrification of biopsied in vitro produced bovine blastocysts. Reproductive Biology. 2013; 13S: 57.
6. Wakayama et al. Practical application of the hollow fiber vitrification method for cryopreservation of mammalian embryos. Reprod. Fertil. Dev. 2013; 26: 138-139.
7. Kuwayama et al. Highly efficient vitrification method for cryopreservation of human oocytes. Reprod. Biomed. Online. 2005; 11: 300-308.