Результат интеллектуальной деятельности: СПОСОБ ВЫЯВЛЕНИЯ ВИРУСА ЛЕЙКОЗА КРС ПО НУКЛЕОТИДНЫМ ПОСЛЕДОВАТЕЛЬНОСТЯМ КОНСЕРВАТИВНЫХ ОБЛАСТЕЙ ВИРУСНОГО ГЕНОМА
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, молекулярно-генетической диагностики и ветеринарной медицины и может найти применение в ветеринарии при диагностике крупного рогатого скота на носительство вируса лейкоза. В частности, изобретение относится к способу выявления вируса лейкоза крупного рогатого скота в тканях животных, а также во внешней среде при помощи молекулярно-биологических методов, и к наборам олигонуклеотидов, пригодных для осуществления данного способа.
Уровень техники
Лейкоз крупного рогатого скота - хроническая ретровирусная пролиферативная болезнь, возбудителем которой является вирус лейкоза крупного рогатого скота (ВЛКРС) - Bovine Leukemia virus (BLV), относящийся к семейству Retroviridae. Первое сообщение о болезни было сделано в 1871 году (Leisering, 1871 по Rodriguez et al., 2011), а тремя годами позже Bollinger описал лейкоз КРС как ясно очерченную нозологическую форму (Bollinger, 1874 по Rodriguez et. al., 2011). У большинства животных, инфицированных ВЛКРС (около 70%), заболевание протекает бессимптомно, приблизительно у трети животных развивается легкая форма - персистентный лимфоцитоз (Rodriguez et al., 2011). Летальная лимфосаркома возникает менее чем у 5-10% зараженных животных, преимущественно взрослых (старше 4-5 лет).
ВЛКРС передается горизонтально, особенно при переносе инфицированных клеток (Johnson R., 1985). Поскольку свободный вирус нестабилен, чаще всего средствами передачи служат клетки, зараженные ВЛКРС (В лимфоциты, моноциты/макрофаги) и присутствующие в крови или молоке. Животные с персистентным лимфоцитозом (ПЛ) с большей вероятностью выступают в качестве источника заражения, вследствие высокого уровня зараженных клеток в крови. В стадах распространение заболевания зачастую связано с ятрогенными факторами: несоблюдение правил асептики и антисептики при проведении ветеринарных и зоотехнических процедур (таких как удаление рогов, нанесение татуировки, ректальные исследования, инъекции), что влечет за собой перемещение инфицированной крови (Kobayashi et al., 2010; Kohara et al., 2006). Длительный прямой контакт между зараженным и здоровым животным должен также рассматриваться как фактор, повышающий риск. Согласно экспериментальным данным вирус может переноситься с участием питающихся кровью насекомых (Perino L.J., 1990). Возможна передача ВЛКРС от коров телятам посредством молока (Ferrer et al., 1981a; Ferrer et al., 1981b; Meas et al., 2002). Передача ВЛКРС in utero происходит с частотой 4-18%, для коров с персистентным лимфоцитозом вероятность передачи выше (Lassauzet et al., 1991; Meas et al., 2002). Значительная часть телят, получивших материнские антитела к антигенам ВЛКРС, остаются не зараженными (Burridge et al., 1982). В сперме инфицированных быков-производителей ВЛКРС не выявлен (Dus Santos et al., 2007).
ВЛКРС широко распространен на всех континентах, за исключением Европы. Усилия, направленные на внедрение системы мер контроля и реализацию программы по искоренению ВЛКРС в ряде стран Европы, увенчались успехом (Nuotio L., 2003; Knapen et al.,1993). Программа по уничтожению ВЛКРС инфекции в молочных стадах Австралии и Новой Зеландии была запущена в середине 1990-х годов, по данным за 2005 год более 98% стад было свободно от вируса (NAHIS-AHA Enzootic Bovine Leukosis). Согласно данным National Animal Health Monitoring за 2007 год, 83,9% ферм в США имеют в своем составе зараженных животных. Доступна информация о ситуации в нескольких провинциях Канады: 89% стад и 20,8 - 37,4% животных заражено ВЛКРС (VanLeeuwen J.A. F.L., 2005; VanLeeuwen J.A. T.A., 2006). 34-50% зараженных животных в Чили, Венесуэле, Колумбии и Уругвае. В Аргентине уровень зараженности животных и ферм - 32,8% и 84% соответственно (Trono K.G., 2001). В Японии 28,6% и 68,1% (Murakami К., 2011). По информации International Organization of Epizootics ВЛКРС встречается в Китае, Монголии и Индонезии. В странах Среднего Востока за исключением Турции и Ирана распространенность ВЛКРС на уровне 20%.
Вероятность инфицирования человека ВЛКРС изучалась с применением ряда молекулярных методов (иммуноцитохимия, ПЦР, ОТ-ПЦР). Анализ выборки здоровых людей, контактирующих с коровами, (257 человек) в 74% случаев показал наличие специфических антител к ВЛКРС (Buehring et al., 2003). Опасность развития лейкоза у человека в результате инфекции ВЛКРС оценивается как маловероятная, но не исключена полностью (Calattini et al., 2006).
В течение последних десятилетий был предпринят ряд попыток по созданию вакцины против ВЛКРС. Ни одна из разработанных вакцин не обеспечивает полной и продолжительной защиты (Rodriguez S.M., 2011). Единственный подход, применяемый для борьбы с ВЛКРС, заключаются в идентификации и последующей элиминации или изоляции зараженных ВЛКРС животных.
Диагностика лейкоза может осуществляться с использованием серологических, молекулярно-генетических (ПЦР), гематологических, клинических, патоморфологических методов и метода биопробы. В настоящее время в государственных программах по борьбе с лейкозом КРС основу диагностики ВЛКРС составляют серологические методы исследования - реакция иммунодиффузии (РИД) и иммуноферментный анализ (ИФА); гематологические, клинические и патоморфологические методы служат для уточнения диагноза.
Реакция иммунной диффузии (РИД) основана на выявлении антител к вирусу и обладает, при высокой специфичности, довольно низкой чувствительностью. Характерными недостатками метода являются возможность возникновения перекрестных (неспецифических) реакций, наличие латентной стадии инфекционного процесса, низкая критическая масса возбудителя, физиологическое состояние животного, а также иммунологическая супрессия, инициированная воздействием негативных факторов внешней среды, паразитозами, сопутствующими инфекциями, многочисленными вакцинными нагрузками. На чувствительность метода влияет также специфичность сывороток (Simard, 2000).
Иммуноферментный анализ (ИФА), или enzyme-linked immunosorbent assay (ELISA), основан на иммунохимической реакции взаимодействия антиген-антитело и использовании в качестве индикатора этой реакции маркированных ферментами антител или антигенов. Обладает более высокой по сравнению с РИД чувствительностью. Кроме того, с помощью ИФА можно обнаружить антитела к ВЛКРС в молоке и моче (Carii, 1993; Carii, 1999). Несмотря на очевидные достоинства достоверность ИФА все же связана с иммунологическими реакциями, и поэтому не всегда адекватна. Еще одним недостатком ИФА является невозможность выявить антитела в сыворотке крови в течение первых 1,5-2 месяца после заражения.
Молодняк до 6-ти месячного возраста остается вне плановых исследований в связи с тем, что методы РИД и ИФА практически не пригодны для диагностики лейкоза у телят, что связано с особенностями формирования их иммунитета. Как показала практика, при использовании серологических методов оздоровление стад затягивается на годы, так как невозможно выявить всех инфицированных животных, особенно на ранних стадиях заболевания, и изолировать их от здоровых (Макаров, 2005).
Гематологическому исследованию подвергают животных, в сыворотке крови которых методами РИД или ИФА обнаружены специфические антитела к вирусу лейкоза КРС. Данным методом выявляют больных животных среди вирусоносителей.
Наиболее перспективной альтернативой серологическим методам диагностики является подход с использованием полимеразной цепной реакции (ПЦР-диагностика), позволяющий детектировать наличие провирусной ДНК в крови КРС, выявляя, таким образом, не только больных животных, но и животных-носителей; отсутствие возрастных ограничений дает возможность тестировать телят с 15-дневного возраста. Метод ПЦР позволяет выявлять вирус в материале уже через 1-2 недели после заражения. Этот метод обладает максимальной чувствительностью и высокой специфичностью (Sherman, 1992; Gonzalez, 1999), что зависит от оптимальности подбора праймеров (Marisolais, 1994; Limansky, 2002; Markiewicz, 2003). Известен способ ПЦР-диагностики ВЛКРС на основании амплификации фрагмента гена Pol (RU 2445370 Cl).
Новые возможности для быстрой количественной детекции ВЛКРС предоставляет использование ПЦР в реальном времени (Kuckleburg, 2003). Подобный подход позволяет обнаружить провирусную ДНК в геноме хозяина, даже если она представлена в одной копии (Jimba, 2010). ПЦР позволяет с высокой достоверностью выявлять животных на самых ранних стадиях заболевания (Макаров, 2005).
В настоящее время показано, что существует несколько генотипов ВЛКРС, ассоциированных с географическими изолятами (Rodriguez, 2009). На сегодняшний день секвенировано 6 геномов ВЛКРС (accretion number в базе NCBI): EF600696.1, NC_001414.1, K02120.1, AF257515.1, FJ914764.1, AF033818. Также в базах данных представлено более 700 фрагментов генома вируса из разных географических изолятов, в том числе из России. Однако ДНК-типирование ВЛКРС как в нашей стране, так и за рубежом проводится без учета полиморфизма генома вируса, что дает долю ложноотрицательных результатов. В настоящее время актуальной является задача создания способа диагностики, позволяющего выявлять BLV независимо от его разновидности.
В качестве прототипа изобретения был выбран способ диагностики ВЛКРС методом ПЦР, известный из документа WO/2012/053666. В известном способе для проведения ПЦР используют так называемые "вырожденные", или "дегенеративные" праймеры, которые фактические представляют собой смесь олигонуклеотидов различной структуры, в той или иной степени специфичных к вирусной ДНК различных генотипов. Способ позволяет выявлять различные вирусные варианты путем исследования образца вирусной ДНК в процессе одной процедуры ПЦР, таким образом облегчая проведение скрининговых исследований, однако вырожденность праймеров отрицательно сказывается на специфичности и чувствительности ПЦР.
Раскрытие изобретения
В настоящем изобретении для осуществления диагностики ВЛКРС при проведении ПЦР с подготовленным образцом вирусной нуклеиновой кислоты (ДНК или кДНК) предложено применять строго локус-специфичные праймеры и зонды, каждый из которых представляет собой олигонуклеотид, комплементарный внутренней области одной из специально подобранных нуклеотидных последовательностей генома ВЛКРС, принадлежащих локусам генов pol и gag, в которых авторы изобретения обнаружили короткие участки, представленные SEQ ID NO с 1 по 11, последовательность которых одинакова у всех известных разновидностей вируса. Данные участки нуклеотидных последовательностей идентичны у всех известных в настоящее время разновидностей ВЛКРС (всего 110 последовательностей). Настоящее изобретение раскрывает использование олигонуклеотидов, комплементарных внутренней области данных консервативных участков, в качестве праймеров и зондов для ПЦР при проведении диагностики ВЛКРС, что делает возможным детекцию в образце ДНК ВЛКРС, независимо от разновидности вируса. Перечень нуклеотидных последовательностей, ограничивающих структуру олигонуклеотидов, пригодных для создания праймеров и зондов и их использования в ПЦР-диагностике ВЛКРС, приведен в табл.1., их взаимное расположение в геноме ВЛКРС показано на рис.1.
|
|
Дополнительно, для оценки качества реакции и вирусной нагрузки (при проведении количественной ПЦР в режиме реального времени) в качестве контрольной (референсной) последовательности может быть выбрана 5′-область гена Ablim2 Bos taurus, не имеющая гомологии ни с одной из консервативных последовательностей. Для этого участка была показана уникальность в геномах млекопитающих (Klimov et al., 2005), т.е. она не имеет гомологии с другими последовательностями генома вида, а также отличается от сходных последовательностей геномов других видов.
Техническим результатом, получаемым при реализации настоящего изобретения, является расширение возможностей диагностирования ВЛКРС за счет использования в ПЦР универсальных праймеров и зондов, комплементарных консервативным областям двух локусов генома вируса - gag и pol. ДНК-диагностика по двум локусам увеличивает специфичность реакции и позволяет выявлять все известные варианты вируса, исключая возможность получения ложноотрицательных результатов. Также существенным моментом является использование референсной последовательности генома КРС, позволяющей избежать ложноположительных результатов. Проведение реакции в формате мультиплекс (все локусы тестируются в одной пробирке) позволяет существенно снизить себестоимость ДНК-диагностики без потери чувствительности. Настоящее изобретение может быть использовано при создании различных модификаций универсальных диагностических ПЦР - тест-систем, предназначенных для выявления ДНК ВЛКРС. Специалист в данной области техники на основании перечня последовательностей SEQ ID NO: 1-11 и приведенных в описании условий подбора праймеров и зондов без проведения дополнительных исследований легко выберет праймеры и зонды, пригодные для любых известных в настоящее время модификаций ПЦР, например, вложенная, или гнездовая, ПЦР (nested-PCR), инвертированная ПЦР, ПЦР с обратной транскрипцией (ОТ-ПЦР, RT-PCR), асимметричная ПЦР (single-strande PCR), ПЦР в реальном времени (real-time PCR), ступенчатая ПЦР, RAPD, ПЦР с использованием горячего старта (hot-start PCR).
В описании изобретения раскрыт весь список локусов, необходимый для выбора ПЦР-праймеров и зондов, раскрыта процедура выбора праймеров и зондов, приведены экспериментальные примеры, демонстрирующие создание различных модификаций универсальных ПЦР - тест- систем для выявления вируса ВЛКРС, таким образом, изобретение соответствует условию "промышленная применимость".
Настоящее изобретение впервые раскрывает специалисту набор локусов, которые могут быть использованы в способе диагностики ВЛКРС, предназначенном для выявления любых известных с настоящему моменту разновидностей ВЛКРС, таким образом изобретение соответствует критерию патентоспособности "новизна".
Строго ограниченный перечень последовательностей был выбран на основании проведения теоретических и экспериментальных исследований из значительного массива нуклеотидных последовательностей различных вариантов ВЛКРС, имеющегося в базе данных GenBank. Первичная структура и количество последовательностей, которые могли бы быть отобраны для создания данного перечня, как и само существование данного перечня, не является очевидным для специалиста, таким образом, изобретение отвечает условию патентоспособности "изобретательский уровень".
Краткое описание чертежей
Рис.1. Иллюстрирует расположение последовательностей SEQ ID NO: 1-11 по отношению к последовательностям генов gag и pol ВЛКРС.
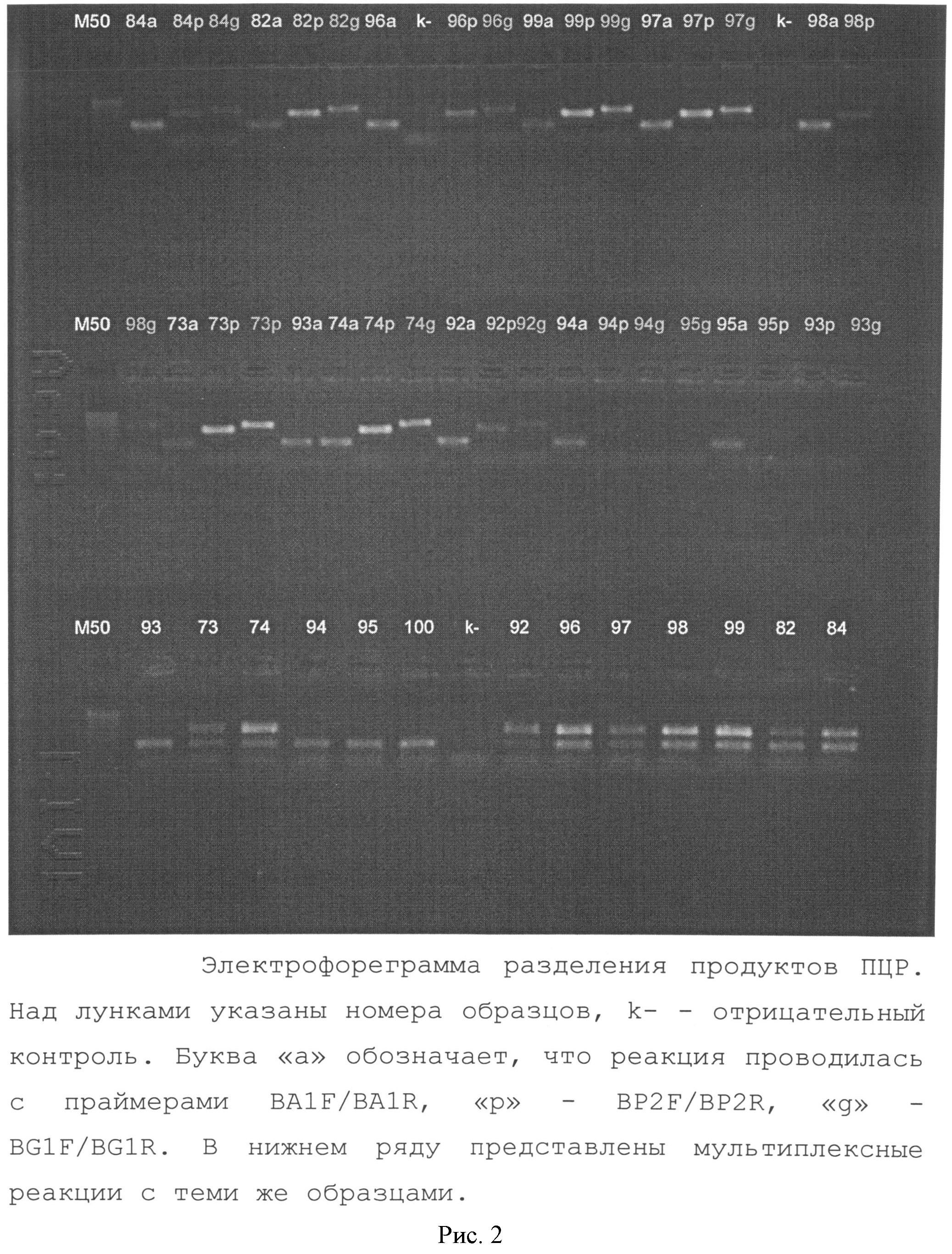
Рис.2. Иллюстрирует электрофоретическое разделение продуктов ПЦР с праймерами BA1F/BA1R.
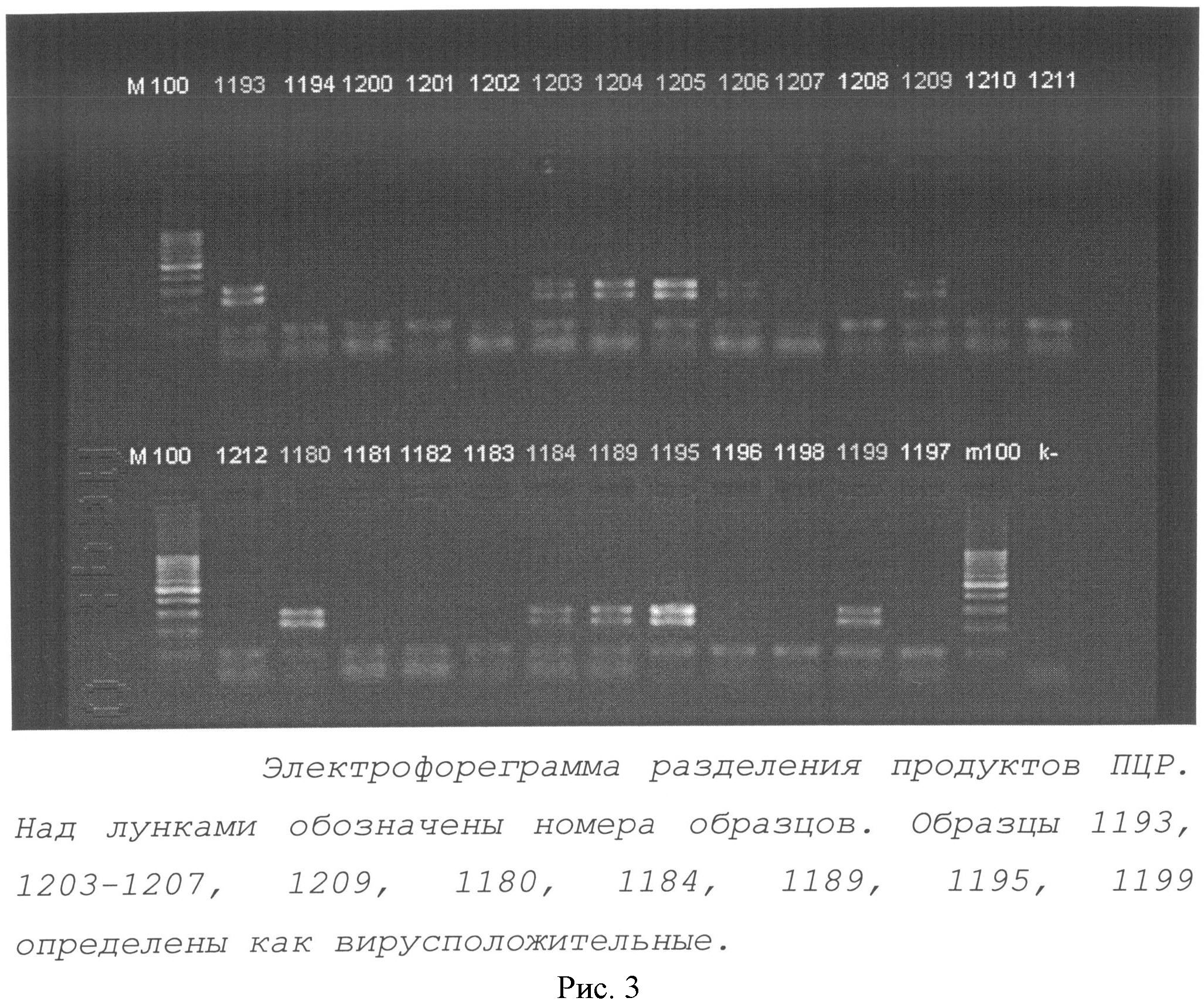
Рис.3. Иллюстрирует электрофоретическое разделение вирус-отрицательных и вирус-положительных продуктов ПЦР.
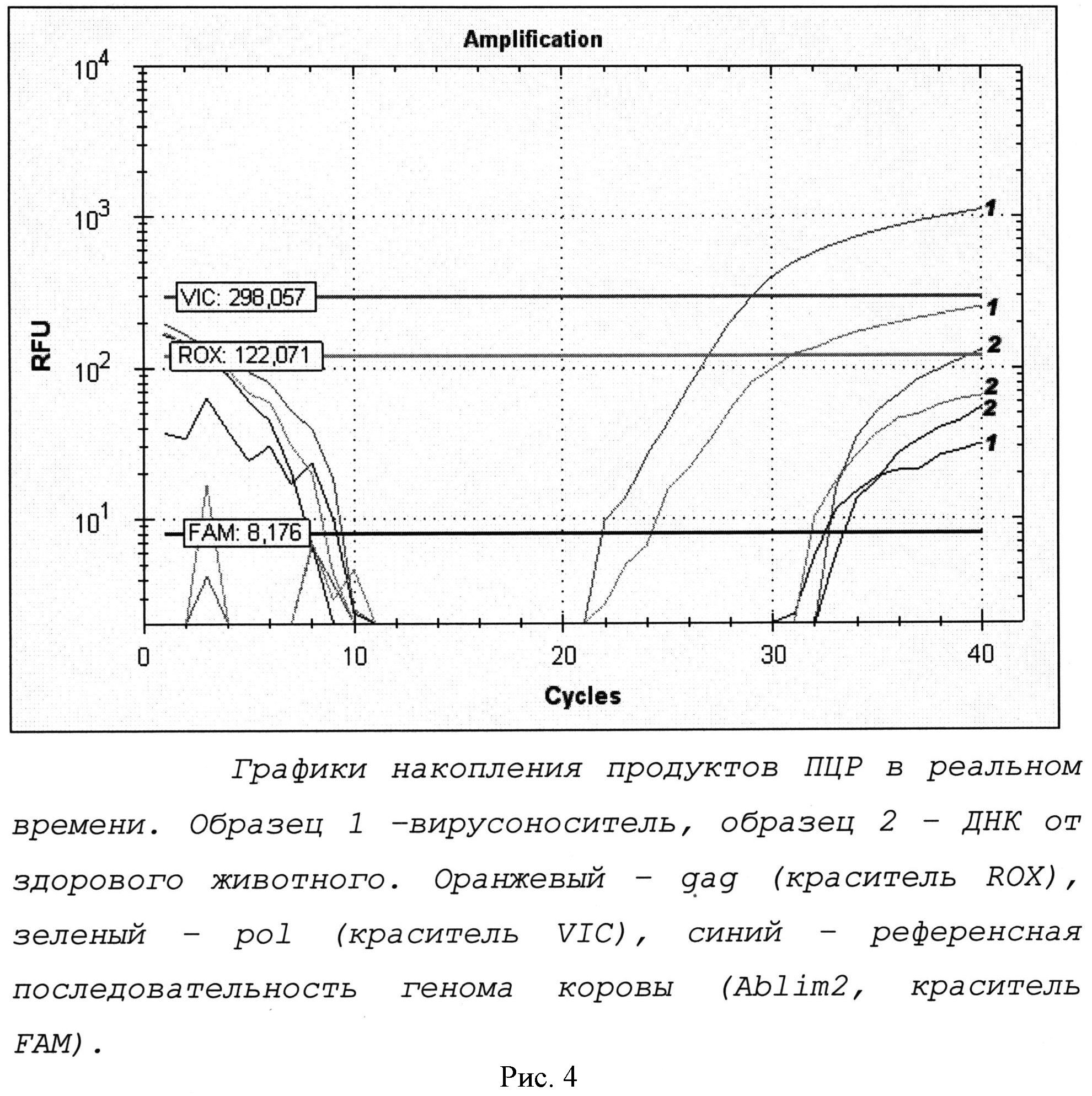
Рис.4. Иллюстрирует накопление продуктов ПЦР в реальном времени.
Осуществление изобретения
Отбор образцов, выделение и очистку вирусной нуклеиновой кислоты проводят при помощи стандартных приемов, известных специалисту в данной области.
При конструировании праймеров и зондов на основании набора олигонуклеотидов, комплементарных непрерывной последовательности внутри любого из локусов, представленных SEQ ID NO с 1 по 11, следует придерживаться следующих условий:
содержание оснований G и С в праймере должно находиться в пределах 40-60%;
длина праймера 15-25 нуклеотидов;
не допускается наличие 3 и более оснований G или С на 3′-конце праймера, т.к. это может приводить к неспецифическому отжигу;
все праймеры не должны формировать стабильных шпилек и дуплексов сами на себя или друг с другом (димеры и кросс-димеры);
температура плавления праймеров и матрицы должна быть сходной и находиться в пределах 55-65°С.
Детекцию ПЦР-фрагментов проводят в режиме реального времени или с помощью электрофоретического разделения в ПААГ или агарозном геле.
Примеры воплощения изобретения.
Пример 1.
На основании набора олигонуклеотидов, комплементарных непрерывной последовательности внутри любого из локусов, представленных SEQ ID NO: 1-11, для проведения диагностики ВЛКРС было подобрано две пары праймеров для амплификации последовательностей, входящих в состав генов gag и pol генома провируса. Еще одна пара праймеров была сконструирована для амплификации уникального фрагмента генома Bos taurus 5′-область гена Ablim2. Характеристика подобранных праймеров представлена в таблице 2. Диапазон температур отжига подобранных праймеров составил 55-57°С, что позволяет использовать для амплификации общую программу. Компьютерный анализ показал, что между выбранными последовательностями нет критических комплементарных участков (не образуют димеров и кросс-димеров), а сами праймеры не образуют шпильки, т.е. они могут быть использованы для проведения мультиплексной ПЦР. Для всех праймеров показано отсутствие в геноме Bos taurus и в геноме ВЛКРС дополнительных мест посадки.
|
|
Для постановки ПЦР были рассчитаны следующие условия, позволяющие использовать данные праймеры в мультиплексной ПЦР: денатурация 95°С - 20 с, отжиг 57°С - 15 с, элонгация цепи (синтез) 72°С - 20 с.
При этих условиях были проведены реакции с каждой парой праймеров отдельно и мультиплексная ПЦР с тремя парами праймеров. Реакция проводилась с использованием набора GenPakTM PCR Core (OOO «Лаборатория Изоген», Россия) (рисунок 2).
Для выявления дальнейшей возможности использования подобранной системы праймеров в ПЦР в режиме реального времени была поставлена реакция с набором qPCRmix-HS (ЗАО «Евроген», Россия), разработанным специально для проведения ПЦР в режиме реального времени с использованием зондов.
При проведении ПЦР с использованием смеси qPCRmix-HS были получены неспецифичные высокомолекулярные продукты. Для повышения специфичности реакции было принято решение о снижении времени синтеза до 15 секунд и повышении температуры отжига до 60°.
Оптимизированные программы выглядят следующим образом:
|
Таким образом, были подобраны оптимальные условия проведения ПЦР с праймерами, созданными на основании олигонуклеотидов, комплементарных к последовательностями SEQ ID NO 1-11 консервативных локусов генов pol и gag генома ВЛКРС. Не было обнаружено неспецифических продуктов реакции. Показана возможность проведения мультиплексной ПЦР.
Пример 2.
С использованием разработанных в примере 1 праймеров было проанализировано 1240 образцов ДНК, выделенной из крови 13 животных (в том числе из крови телят 2-4 месячного возраста, около 500, и стельных животных, около 100). На рисунке 3 представлен пример электрофоретического разделения продуктов МПЦР в 2% агарозном геле.
Всего выявлено 638 вирусположительных животных и 602 вирусотрицательных. Доля вирусоносителей составляет 51,45%.
Пример 3.
К разработанным парам праймеров были подобраны зонды для проведения ПЦР в режиме реального времени (тип TaqMan, для зондов формата Beacon за основы были взяты те же последовательности) на внутренние консервативные участки амплифицируемых фрагментов:
Р2 5′-GATACTTACTCTGGAGCTACTCATGCCTC-3′
G1 5′-ACCCAACAATCAGCTCAGCCCAACGC-3′
A1 5′-CCGCAGGGTCTACGGCAGCC-3′
С использованием разработанных праймеров и зондов была поставлена мультиплексная ПЦР в режиме реального времени с ДНК зараженного и здорового животного. На рисунке 4 представлены графики накопления продуктов реакции.
На рисунке видно, что в реакции 1 с образцом ДНК от зараженного животного кривые ПЦР с праймерами к последовательностям локусов gag и pol пересекли базовую линию, что является положительным ответом. В реакции 2 со здоровым животным - кривые не пересекли базовую линию. Синие кривые, характеризующие динамику накопления продукта внутреннего положительного контроля, пересекли базовую линию в обоих случаях.
Пример 4.
Для оценки возможности применения локусов, представленных SEQ ID NO: 4-7 и 11, для проведения диагностики ВЛКРС к ним были подобраны обратные праймеры для использования в реакции с прямым праймером к гену pol (BP2-F) и прямым праймером к гену gag (BG1-F). Последовательности праймеров представлены в таблице 4.
|
Полученные праймеры были проверены на комплементарность и специфичность отжига с помощью in silico PCR (использовалась программа FastPCR 6.4). В качестве последовательностей 6 геномов ВЛКРС (accretion number в базе NCBI): EF600696.1, NC_001414.1, K02120.1, AF257515.1, FJ914764.1, AF033818.
Результаты показали высокую степень гомологии последовательностей праймеров вариантам геномов ВЛКРС. Это подтверждает возможность использования локусов SEQ ID NO: 4-7 и 11 для ПЦР диагностики ВЛКРС.
СПИСОК ЦИТИРУЕМОЙ ЛИТЕРАТУРЫ (содержание которой полностью включено в настоящее описание посредством ссылки)
Макаров В.В., Гринишин, Д.П. Эпизоотологические перспективы лейкоза крупного рогатого скота // Вестник Российской академии сельскохозяйственных наук. 2005. Т.2, С.70-72.
Buehring G.C., Philpott S.M., Choi K.Y. Humans have antibodies reactive with Bovine leukemia virus // AIDS Res Hum Retroviruses. 2003. V.19. №12. P.1105-1113.
Burridge M.J., Thurmond M.C., Miller J.M., Schmerr M.J., Van Der Maaten M.J. Fall in antibody titer to bovine leukemia virus in the periparturient period // Canadian Journal of Comparative Medicine. 1982. V.46. №3. P.270-271.
Carli К.Т., Sen A., Batmaz H., Kennerman E. Detection of IgG antibody to bovine leukaemia virus in urine and serum by two enzyme immunoassays // Lett. Appl. Microbiol. 1999. V.28. №6. P.416-418.
Carli К.Т., Sen A., Batmaz H., Minbay A. Comparison of serum, milk and urine as samples in an enzyme immunoassay for bovine leukaemia virus infection // Res. Vet. Sci. 1993. V.55. №3. P.394-395.
Delebecque F., Suspene R., Calattini S., Casartelli N, Saib A., Froment A., Wain-Hobson S., Gessain A., Vartanian J.P., Schwartz O. Restriction of foamy viruses by APOBEC cytidine deaminases // J. Virol. 2006. V.80. №2. P.605-614.
Dus Santos M.J., Trono K., Lager I., Wigdorovitz A. Development of a PCR to diagnose BLV genome in frozen semen samples // Vet. Microbiol. 2007. V.119. P.10-18.
Ferrer J.F., Kenyon S.J., Gupta P. Milk of dairy cows frequently contains a leukemogenic virus // Science. 1981. V.213 №4511. P.1014-1016.
Ferrer J.F., Piper C.E. Role of colostrum and milk in the natural transmission of the bovine leukemia virus // Cancer Res. 1981. V.41. №12. P.4906-4909.
Gonzalez E.T., Norimine J., Valera A.R., Traveria G., Oliva G.A., Etcheverrigaray M.E. A rapid and sensitive diagnosis of bovine leukaemia virus infection using the nested shuttle polymerase chain reaction // Pesq. Vet. Bras. 1999. V.19. №2. P.63-67.
Jimba M., Takeshima S.N., Matoba K., Endoh D., Aida Y. BLV-CoCoMo-qPCR: Quantitation of bovine leukemia virus proviral load using the CoCoMo algorithm // Retrovirology. 2010. V.2. №7. P.91.
Johnson R., Gibson C.D., Kaneene J.B. Bovine leukemia virus: A herd-based control strategy // Preventive Veterinary Medicine. 1985. V.3. №4. P.339-349.
Klimov E., Rud′ko O., Rakhmanaliev E., Sulimova G. Genomic organisation and tissue specific expression of ABLIM2 gene in human, mouse and rat // BBA - Gene Structure and Expression. 2005. V.1730/1. P.1-9.
Knapen К., Kerkhofs P., Mammerickx M. Eradication of enzootic bovine leukosis in Belgium: Results of the mass detection on the national cattle population in 1989, 1990 and 1991 // Ann. Med. Vet. 1993. V.137. P.197-201.
Kobayashi S., Tsutsui Т., Yamamoto Т., Hayama Y., Kameyama K., Konishi M., Murakami K. Risk factors associated with within-herd transmission of bovine leukemia virus on dairy farms in Japan // BMC Vet. Res., 2010, 6, 1.
Kohara J., Konnai S., Onuma M.. Experimental transmission of Bovine leukemia virus in cattle via rectal palpation // Jpn. J. Vet. Res., 2006. V.54. №1. P.25-30.
Kuckleburg C.J., Chase C.C., Nelson E.A., Marras S.A., Dammen M.A., Christopher-Hennings J. Detection of bovine leukemia virus in blood and milk by nested and real-time polymerase chain reactions // J. Vet. Diagn. Invest. 2003. V.15. №1. P.72-76.
Lassauzet M.L., Thurmond M.C., Johnson W.O., Holmberg C.A. (). Factors associated with in utero or periparturient transmission of bovine leukemia virus in calves on a California dairy // Can. J. Vet. Res. 1991. V.55. №3. P.264-268.
Limansky A.P., Limanskya O. Comparison of primer sets for the detection of bovine leukemia virus by polymerase chain reaction // Bull. Vet. Inst. Pulawy. 2002. V.46. P.27-36.
Markewicz L., Rulkax J., Kamiski S. Detection of BLV provirus in different cells by Nested-PCR // Bull. Vet. Inst. Pulawy. 2003. V.47. P.325-331.
Marsolais G., Dubuc R., Bergeron J., Morrey J.D., Kelly E.J., Jackson M.K. Importance of primer selection in the application of PCR technology to the diagnosis of bovine leukemia virus // J. Vet. Diagn. Invest. 1994. V.6. №3. P.297-301.
Meas S., Usui Т., Ohashi K., Sugimoto C., Onuma M. Vertical transmission of bovine leukemia virus and bovine immunodeficiency virus in dairy cattle herds // Vet. Microbiol. 2002. V.84. №3. P.275-282.
Murakami К., Kobayashi S., Konishi M., Kameyama K., Yamamoto Т., Tsutsui T. The recent prevalence of bovine leukemia virus (BLV) infection among Japanese cattle // Vet. Microbiol. 2011. V.148. №1. P.84-88.
Nuotio L.,. Rusanen H., Sihvonen L., Neuvonen E.. Eradication of enzootic bovine leukosis from Finland // Prev. Vet. Med. 2003. V.59. №1-2. P.43-49.
Perino L.J., Wright R.E., Hoppe K.L., Fulton R.W. Bovine leukosis virus transmission with mouthparts from Tabanus abactor after interrupted feeding // Am. J. Vet. Res. 1990. V.51. №8. P.1167-1169.
Rodriguez S.M., Florins A., Gillet N., de Brogniez A., Sanchez-Alcaraz M.T., Boxus M., Boulanger F., Gutiérrez G., Trono K., Alvarez I., Vagnoni L., Willems L. Preventive and Therapeutic Strategies for Bovine Leukemia Virus: Lessons for HTLV // Viruses. 2011. V.3. P.1210-1248.
Rodriguez S.M., Golemba M.D., Campos R.H., Trono K., Jones L.R. Bovine leukemia virus can be classified into seven genotypes: evidence for the existence of two novel clades // J. Gen. Virol. 2009. V.90. Pt.ll. P.2788-2797.
Sherman M.P., Ehrlich G.D., Ferrer J.F., Sninsky J.J., Zandomeni R., Dock N.L., Poiesz B. Amplification and analysis of specific DNA and RNA sequences of bovine leukemia virus from infected cows by polymerase chain reaction // J. Clin. Microbiol. 1992. V.30. №1. P.185-191.
Simard С., Richardson S., Dixon P., Belanger C., Maxwell P. Enzyme-linked immunosorbent assay for the diagnosis of bovine leukosis: comparison with the agar gel immunodiffusion test approved by the Canadian Food Inspection Agency // Can. J. Vet. Res. 2000. V.64. №2. P.101-106.
Trono K.G., Perez-Filgueira D.M., Duffy S., Borca M.V., Carrillo C. Seroprevalence of bovine leukemia virus in dairy cattle in Argentina: comparison of sensitivity and specificity of different detection methods // Vet. Microbiol. 2001. V.83. №3. P.235-248.
Van Leeuwen J.A., Forsythe L., Tiwari A., Chartier R. Seroprevalence of antibodies against bovine leukemia virus, bovine viral diarrhea virus, Mycobacterium avium subspecies paratuberculosis, and Neospora caninum in dairy cattle in Saskatchewan // Can. Vet. J. 2005. V.46. №1. P.56-58.
Van Leeuwen J.A., Tiwari A., Plaizier J.C., Whiting T.L. Seroprevalences of antibodies against bovine leukemia virus, bovine viral diarrhea virus, Mycobacterium avium subspecies paratuberculosis, and Neospora caninum in beef and dairy cattle in Manitoba // Can. Vet. J. 2006. V.47. №8. P.783-786.
Перечень последовательностей
SEQ ID NO: 1 5′-GCAGGCCGATATAACCCATTATAAATACAAACAG-3′
SEQ ID NO: 2 5′-GTGTTTGTAGATACTTACTCTGGAGCTACTCATGCCTC-3′
SEQ ID NO: 3 5′-AACTGCTGGCAAAACCTGACAAAGGTTTT-3′
SEQ ID NO: 4 5′-GAACTTGTGGGGTTGTAGGGAAC-3′
SEQ ID NO: 5 5′-CATGGGAAGGTGGGGTTCGTCTA-3′
SEQ ID NO: 6 5′-TGAGTCCAGAGGGCTCGAGAAAGGGCCTGAG-3′
SEQ ID NO: 7 5′-CTCCCATCTGGTCTTTAGAAT-3′
SEQ ID NO: 8 5′-CTTTGCCAATATATTGCTTCCCCGGTCGA-3′
SEQ ID NO: 9 5′-ACCCAACAATCAGCTCAGCCCAACGCCGG-3′
SEQ ID NO: 10 5′-TTAGGGACTCCGTCGGGAAGGTTGTCAGCTAATGAAATTTGTAACCGGTTGACAAA-3′
SEQ ID NO: 11 5′-GGCATCTTGGGCCCTGGGGTGTGGACGAG-3′