Результат интеллектуальной деятельности: ПИТАТЕЛЬНАЯ СРЕДА ПЛОТНАЯ ДЛЯ КУЛЬТИВИРОВАНИЯ БРУЦЕЛЛ
Вид РИД
Изобретение
Изобретение относится к микробиологии и биотехнологии, а именно к получению питательных сред для выращивания бруцелл.
Известна питательная среда-заменитель «Альбими»-агара, состав которой следующий: 20 г сухого пептона, 20 мл дрожжевой воды, 5 г химически чистого хлористого натрия, 20 г агар-агара, 1 г глюкозы, 0,1 г бисульфита натрия, 1 л дистиллированной воды (МУ 3.1.7.1189-03 «Профилактика и лабораторная диагностика бруцеллеза людей»).
Недостатком данной питательной среды является ее нестандартность, в ряде случаев непрозрачность, что мешает изучению вырастающих колоний, при ее использовании отмечается замедленный и непостоянный рост бруцелл.
Известна питательная среда для выделения и культивирования бруцелл сухая (эритрит агар), выпускаемая филиалом ФГУП «Микроген», г. Махачкала, состоящая из следующих компонентов, г/л: питательный агар сухой - 35,0; тиаминбромид - 0,005; эритрит - 0,0122; глюкоза - 1,0; натрий хлористый - 5,9; агар микробиологический - 11,2; вода дистиллированная до 1 л.
Недостатками данной среды являются возможность диссоциации изучаемых культур бруцелл при пересевах на этом агаре, а также появление колоний бруцелл диаметром 0,5-1,5 мм только через 72 ч инкубации.
Наиболее близкой к предлагаемому изобретению является питательная среда для культивирования бруцелл сухая (бруцеллагар), выпускаемая ФГУН ГНЦ ПМБ (Оболенск), содержащая, г/л: панкреатический гидролизат рыбной муки - 7,5; пептон ферментативный - 7,5; панкреатический гидролизат казеина - 10,0; стимулятор роста гемофильных микроорганизмов - 5,0; глюкозу - 2,0; дрожжевой экстракт - 3,0; натрий хлористый - 3,5; тиамина хлорид - 0,005; эритрит - 0,012; агар микробиологический - 10,0±3,0; воду дистиллированную до 1 л, совокупность существенных признаков которой наиболее близка к совокупности существенных признаков плотной питательной среды предлагаемого изобретения.
Недостатком данной среды является то, что разлитая по чашкам Петри она имеет коричневый цвет, может содержать темно-коричневые вкрапления. Высокая цветность, неудовлетворительная прозрачность наряду с малым размером колоний (0,1-0,5 мм) через 48 часов инкубации затрудняют обнаружение колоний бруцелл в указанный срок.
Целью предлагаемого изобретения является создание питательной среды, имеющей незначительную опалесценцию, слабоокрашенной, обеспечивающей через 46 часов инкубации рост лабораторных штаммов бруцелл в виде колоний размером, не менее чем в 1,5 раза превышающем размер колоний, вырастающих на используемых в настоящее время средах (среде-прототипе).
Поставленная цель достигается тем, что в качестве основного источника азотистого питания в предлагаемой среде используется ферментативный гидролизат желатина в сочетании с ферментативным гидролизатом рыбной муки, в качестве стимуляторов роста - дрожжевой экстракт и глюкоза, для поддержания изотоничности среды и окислительно-восстановительного потенциала - натрий хлористый и метабисульфит натрия соответственно, для гелеобразования - агар микробиологический, а также дистиллированную воду, при следующем соотношении ингредиентов, г/л:
|
В качестве исходного сырья используют желатин ГОСТ 11293-89, марка П-11, приготовленный из костной ткани и мягкого коллагенсодержащего сырья от переработки шкур крупного рогатого скота и свиней. Желатин, в отличие от других белковых продуктов, содержит повышенное количество глицина, однако в нем почти нет серосодержащих аминокислот и триптофана (Скурихин И.М., Тутельян В.А. Таблицы химического состава и калорийности российских продуктов питания: Справочник. - М.: ДеЛи принт, 2007. - 276 с.).
Рыбную муку по ГОСТ 2116-2000 изготавливают из рыб, морских млекопитающих, ракообразных, беспозвоночных, а также из отходов, полученных при их переработке. В ней, в зависимости от вида исходного сырья, регламентировано содержание сырого протеина (не менее 36-50%), влаги (не более 10-13%), жира (не более 10-18%), фосфора (не более 5,0-5,5%), натрия хлорида (не более 5%), кальция (не более 13%). Кормовая ценность рыбной муки обусловлена высоким содержанием полноценного по аминокислотному составу белка, витаминов группы В, микроэлементов.
Дрожжевой экстракт используют в качестве полноценного и дешевого источника факторов роста микроорганизмов, что повышает ростовые свойства предлагаемой питательной среды. Дрожжи содержат до 53% белка, 25-40% углеводов и являются богатым источником витаминов группы В, витамина Д и других факторов роста - пуриновых и пиримидиновых оснований (Поляк М.С., Сухаревич В.И., Сухаревич М.Э. Питательные среды для медицинской микробиологии. - СПб.: Элби - СПб., 2002, с. 14).
Глюкоза является легкодоступным источником углерода для обеспечения роста бруцеллезного микроба. Она также выполняет роль редуцирующего вещества, связывающего токсичные перекисные соединения.
Натрий хлористый поддерживает осмотическое давление среды на уровне, необходимом для сохранения жизнедеятельности микроорганизмов.
Натрий сернистокислый пиро регулирует окислительно-восстановительный потенциала среды и является серосодержащим веществом.
Агар микробиологический обеспечивает требуемую консистенцию препарата.
Определение сухих веществ основано на удалении влаги путем выпаривания исследуемого раствора и последующего взвешивания остатка, высушенного до постоянного веса (МУК 4.2.2316-08 «Методы контроля бактериологических питательных сред»).
Дополнительное использование в предлагаемой питательной среде в качестве белковой основы гидролизата желатина и введение в ее рецептуру натрия сернистокислого пиро является отличительным признаком и позволяет улучшить качественные показатели, а также упростить и удешевить получение среды.
Технология приготовления ферментативных гидролизатов белкового сырья
Ферментативный гидролиз белкового сырья - желатина и рыбной муки, проводят однотипно. Желатин пищевой и рыбную муку взвешивают по 0,8 кг, помещают в кастрюли эмалированные емкостью 9 л, приливают по 7,0 л холодной дистиллированной воды, перемешивают и отставляют на 1 час для набухания. Затем содержимое кастрюль нагревают до температуры 40°С, устанавливают рН 8,0-8,4 20% раствором натрия гидроокиси, добавляют 0,4 кг фарша поджелудочной железы, дважды пропущенной через мясорубку, переливают в стеклянные бутыли вместимостью 10 л. В бутыли добавляют по 80 мл хлороформа, закрывают их резиновыми пробками, перемешивают, помещают в термостатную. В течение первых 2-х часов рН гидролизатов каждые 15 мин проверяют и поддерживают в пределах 7,6-8,0. Через 2 часа от начала гидролиза проверяют и при необходимости устанавливают рН в пределах 7,6-7,8 20% раствором натрия гидроокиси, перемешивают и помещают в термостатную комнату с температурой (38±1)°С. Последующие перемешивания проводят через каждые 30-60 мин. Длительность гидролиза 1-2 сут. Об окончании гидролиза судят по достижению аминного азота 0,35-0,45% в гидролизате желатина и 0,3-0,4% в гидролизате рыбной муки.
По окончании процесса гидролиза рН гидролизатов устанавливают в пределах 4,5-4,7 18% раствором соляной кислоты, гидролизаты нагревают до кипения и кипятят в течение 1 мин, охлаждают в течение 5-10 мин и фильтруют через бумажные или полотняные фильтры. Затем гидролизаты защелачивают до рН 7,8-8,0 20% раствором гидроокиси натрия, нагревают до кипения, кипятят в течение 1-2 мин, охлаждают до 60-70°С и фильтруют через бумажные или полотняные фильтры в стеклянные бутыли вместимостью 10 л. К профильтрованным гидролизатам после их охлаждения добавляют 2% хлороформа. Бутыли герметично закрывают резиновыми пробками, перемешивают и помещают в холодовую, где хранят при температуре 2-8°С.
Питательную среду на основе ферментативных гидролизатов желатина и рыбной муки для выращивания бруцелл готовят следующим способом.
Берут ферментативные гидролизаты желатина и рыбной муки из расчета содержания сухих веществ в 1 л среды 8,0 г гидролизата желатина и 4,0 г гидролизата рыбной муки, вливают их в эмалированную кастрюлю, добавляют дрожжевой экстракт 2,0 г; натрия хлорид 5,0 г; глюкозу 1,0 г; натрий сернистокислый пиро 0,1 г; агар микробиологический 8,0 г; дистиллированную воду до 1 л, устанавливают рН в пределах 7,1-7,3 20% раствором натрия гидроокиси или 18% раствором соляной кислоты. Тщательно перемешивая, нагревают до кипения и кипятят в течение 2 мин. Фильтруют через ватно-марлевый фильтр.
Профильтрованную среду разливают по 150 или 300 мл в бутылки вместимостью 250 или 450 мл соответственно, которые укупоривают ватно-марлевыми пробками, сверху закрывают пергаментной бумагой и бумагой крафт. Стерилизуют при 1,0 атм в течение 15 мин, остужают, затем разливают в стерильные чашки Петри, просушивают в течение 30 мин и используют для посева.
Оценку ростовых свойств питательной среды плотной для культивирования бруцелл проводили путем измерения диаметра и подсчета количества выросших колоний бруцелл при посеве.
Ростовые свойства полученной среды оценивали с помощью тест-культур В.abortus 19 ВА и В.melitensis Rev I. Тест-культуры выращивали на поверхности скошенного эритрит-агара при температуре 37°С в течение (46±2) ч. Двухсуточные культуры тест-штаммов бруцелл смывали с поверхности скошенного агара 0,9% раствором натрия хлорида, доводили концентрацию микробных взвесей до 10 единиц эквивалентных 1,7×109 бруцелл в 1 мл, по оптическому стандарту мутности ОСО 42-28-85П ГИСК им. Л.А. Тарасевича, полученные микробные взвеси культур разводили сначала до концентрации 1×109 м.к./мл и затем десятикратными разведениями до 1×103 м.к./мл. В процессе разведения перенос взвеси в следующую пробирку производили стерильной пипеткой объемом 1 мл, меняя пипетку для каждого разведения.
Контроль плотных питательных сред. По 0,1 мл взвеси каждого тест-штамма В.melitensis Rev I, В.abortus 19 ВА из разведений 10-6 (100 м.к./мл) высевали на 9 чашек Петри каждого варианта предлагаемой среды и среды сравнения и равномерно распределяли покачиванием по всей поверхности. Средой сравнения служил заранее проверенный агар высокого качества (Бруцеллагар). Посевы инкубировали при температуре (37±1)°С. Учет результатов посевов проводили через 46 и 72 ч инкубации.
Пример 1. Тест-штаммы выращивали на питательной среде, содержащей, г/л: ферментативного гидролизата желатина (из расчета содержания в 1 л среды сухих веществ) 7,0; ферментативного гидролизата рыбной муки (из расчета содержания в 1 л среды сухих веществ) 3,0; дрожжевого экстракта 1,0; натрия хлорида 4,0; глюкозы 0,5; натрия сернистокислого пиро 0,05; агара микробиологического 7,0; воды дистиллированной 1 л.
Пример 2. Тест-штаммы выращивали на питательной среде, содержащей, г/л: ферментативного гидролизата желатина (из расчета содержания в 1 л среды сухих веществ) 8,0; ферментативного гидролизата рыбной муки (из расчета содержания в 1 л среды сухих веществ) 4,0; дрожжевого экстракта 2,0; натрия хлорида 5,0; глюкозы 1,0; натрия сернистокислого пиро 0,1; агара микробиологического 9,0; воды дистиллированной 1 л.
Пример 3. Тест-штаммы выращивали на питательной среде, содержащей, г/л: ферментативного гидролизата желатина (из расчета содержания в 1 л среды сухих веществ) 9,0; ферментативного гидролизата рыбной муки (из расчета содержания в 1 л среды сухих веществ) 5,0; дрожжевого экстракта 2,0; натрия хлорида 6,0; глюкозы 2,0; натрия сернистокислого пиро 0,2; агара микробиологического 11,0; воды дистиллированной 1 л.
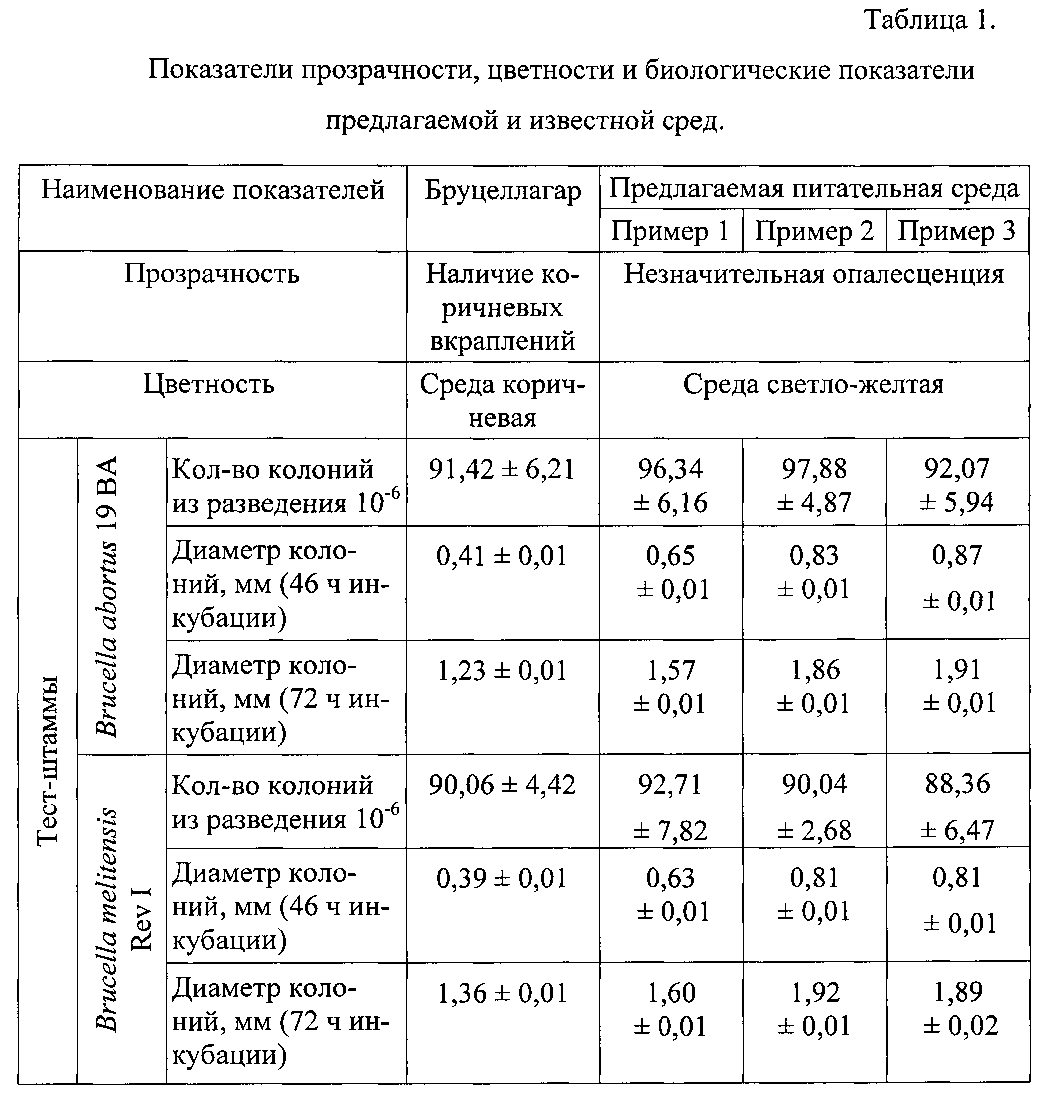
Полученные в примерах результаты обобщены в таблице 1.
Таким образом, заявленная питательная среда для культивирования бруцелл (пример №2) является оптимальной по количеству подобранных ингредиентов, что позволяет получить достаточное количество колоний максимального размера в ранние сроки (через 46±2 ч).
Предлагаемая среда обладает более оптимальными ростовыми свойствами по сравнению с известной: при приблизительно одинаковом количестве колоний их диаметр через 46 и 72 ч инкубации на предлагаемой среде в 1,5-2 раза превышал диаметр колоний, выросших на известной среде. По показателям прозрачности и цветности предлагаемая среда также превосходит известную.
Улучшенные биологические свойства предлагаемой среды наряду с ее прозрачностью и незначительной цветностью облегчают обнаружение возбудителей бруцеллеза при бактериологических исследованиях, повышают эффективность работ, связанных с культивированием бруцелл. Среда проста в приготовлении, не содержит дефицитных и дорогостоящих компонентов.
Рентабельность среды составляет 31%.