Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12
Вид РИД
Изобретение
Настоящее изобретение относится к новым производным N-[(1H-пиразол-1-ил)арил]-1H-индола или 1H-индазол-3-карбоксамида, их получению и их применению в терапевтических средствах.
Соединения согласно настоящему изобретению представляют собой обратимые антагонисты пуринегрического рецептора P2Y12. Эти соединения являются антитромбоцитарными лекарственными средствами, проявляющими сильный антитромботический эффект. Они могут применяться для лечения и профилактики сердечнососудистых нарушений, таких как тромбоэмболические заболевания или рестенозы.
В промышленно развитых странах медицинские осложнения, связанные с возникновением тромбоза, представляют собой одну из основных причин смертности. Некоторые примеры патологий, связанных с развитием тромбоза, включают острый инфаркт миокарда, нестабильную стенокардию и хроническую стабильную стенокардию, транзиторные ишемические атаки, острые нарушения мозгового кровообращения, заболевание периферических кровеносных сосудов, преэклампсию и эклампсию, тромбоз глубоких вен, эмболии (церебральная, легочная, коронарных артерий, почечная и т.д.), диссеминированное внутрисосудистое свертывание или тромботическую тромбоцитопеническую пурпуру. Также существуют риски тромботических и рестенозных осложнений в ходе и после инвазивной операции, такой как ангиопластика, каротидная эндартерэктомия, аортокоронарное шунтирование, или размещение стентов или эндоваскулярных протезов.
Артериальные тромбозы могут возникать после повреждения стенки сосуда или отрыва атеросклеротической бляшки. Тромбоциты играют основную роль в образовании этих тромбозов. Тромбоциты могут активироваться либо с помощью медиаторов, высвобождаемых в кровоток циркулирующими в периферической крови клетками или поврежденными эндотелиальными клетками, присутствующими вдоль сосудистой стенки, либо тромбогенными молекулами субэндотелиального матрикса - такими как коллаген - выходящим на поверхность в ходе повреждений сосудов. Более того, тромбоциты могут также активироваться в условиях кровотока с высоким тангенциальным напряжением, как наблюдается в стенозированных сосудах. После активации циркулирующие тромбоциты прикрепляются и накапливаются в месте повреждения сосуда, образуя тромб. В ходе этого процесса образованные тромбы могут быть достаточно массивными, чтобы заблокировать, частично или полностью, кровоток в сосуде.
В венах тромбы могут также образовываться там, где имеет место стаз или медленный кровоток. В силу их природы, эти венозные тромбы могут производить эмболы, которые перемещаются по сосудистой системе. Эти эмболы могут блокировать кровоток в сосудах, которые являются более отдаленными, такие как легочные или коронарные артерии.
Многочисленные исследования продемонстрировали, что аденозин 5′-дифосфат (ADP) представляет собой главный медиатор активации и агрегации тромбоцитов, играя ключевую роль в инициации и развитии образования тромба (Maffrand et al., Thromb. Haemostas. (1988) 59, 225-230; Herbert et al., Arterioscl. Thromb. (1993) 13, 1171-1179).
ADP высвобождается в циркуляцию поврежденными эритроцитами и эндотелиальными клетками атеросклеротической стенки и более специфически секретируется активированными тромбоцитами там, где ADP хранится в плотных гранулах при очень большой концентрации. Вызванная ADP агрегация тромбоцитов запускается его связыванием с двумя специфическими пуринегрическими рецепторами, экспрессируемыми на клеточной мембране тромбоцитов человека: P2Y1 и P2Y12. Рецептор P2Y1, наряду со стимуляцией PLCβ через Gαq, отвечает за мобилизацию внутренних пулов кальция, изменение формы тромбоцитов и временную агрегацию на ADP. Рецептор P2Y12, наряду с ингибированием аденилатциклазы через Gαi2 и активацией PI-3 киназы, отвечает за усиление ответов и стабилизацию агрегации (Gachet, Thromb. Haemost. (2001) 86, 222-232; Andre et al., J. Clin. Invest. (2003) 112, 398-406). Применение P2Y1-/-трансгенных мышей (Gachet et al., J Clin Invest (1999) 104, 1731-1737; Gachet et al., Circulation (2001) 103, 718-723; Gachet et al., Haematology (2002) 87, 23) и P2Y12-/- (Conley et al., Nature (2001) 409, 202-207) показало важность этих двух рецепторов в развитии тромбозов in vivo. У людей генетические дефекты для P2Y12 были описаны как связанные с геморрагическим фенотипом и с выраженным нарушением вызванной ADP агрегации тромбоцитов (Kanakura et al., J Thromb Haemost. (2005) 3, 2315-2323).
Применение клопидогреля в лечебной практике у людей предоставило доказательство того, что блокирование рецептора P2Y12 с помощью антагониста представляет собой ключевую терапевтическую стратегию в лечении сердечнососудистых заболеваний. Клопидогрель представляет собой пролекарственное средство семейства тиенопиридина, чей активный метаболит ковалентно связывается с рецептором P2Y12, приводя к необратимому ингибированию активности тромбоцитов in vivo. (Savi et al., Biochem Biophys Res Commun (2001) 283, 379-383; Savi et al., Proc Natl Acad Sci (2006) 103, 11069-11074). Эта молекула изначально показала свою эффективность в нескольких клинических испытаниях, снижая риск инсультов у пациентов с риском их возникновения ("A randomised, blinded, trial of clopidogrel versus aspirin in patients at risk of ischaemic events (CAPRIE)" CAPRIE steering committee Lancet (1996) 348, 1329-1339; "The Clopidogrel in Unstable Angina to Prevent Recurrent Events (CURE). Effects of Clopidogrel in Addition to Aspirin in Patients with Acute Coronary Syndromes without ST-Segment Elevation" CURE steering committee N Engl J Med (2001) 345, 7, 494-502).
Были описаны синтетические антагонисты рецептора P2Y12, которые проявляют антитромбоцитарную и антитромботическую активность. Тем не менее, все еще существует необходимость в новых антагонистах, обладающих лучшими свойствами, в частности, необходимость в обратимых антагонистах с лучшим соотношением риск/польза.
Настоящее изобретение относится к соединениям, соответствующим формуле (I):
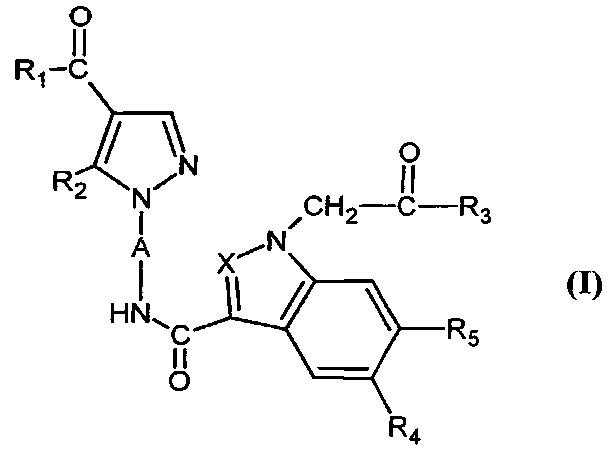
в которой
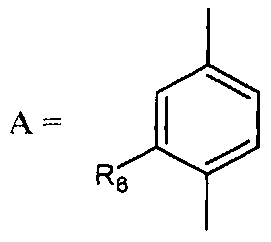
- А представляет собой двухвалентный ароматический радикал, выбранный из
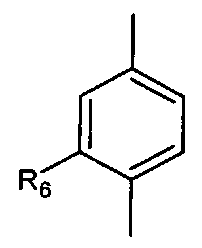 ;
; 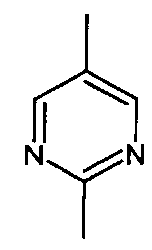 ;
; 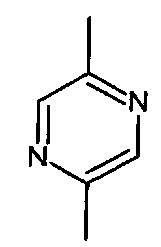 ;
; 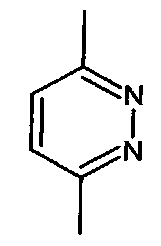 ;
;
- X представляет собой группу -CH- или атом азота;
- R1 представляет собой (C1-C4)алкил или (C1-C4)алкокси;
- R2 представляет собой группу Alk;
- R3 представляет собой гидроксил или группу -NR7R8;
- R4 представляет собой атом водорода, атом галогена, циано, фенил, группу Alk, группу OAlk или группу -NR9R10;
- R5 представляет собой атом водорода, атом галогена или группу Alk;
- R6 представляет собой атом водорода, атом галогена, циано, группу -COOAlk или группу -CONH2;
- R7 представляет собой атом водорода или (C1-C4)алкил;
- R8 представляет собой
a) атом водорода;
b) (C1-C4)алкил, не замещенный или замещенный
(i) гидроксилом;
(ii) группой OAlk;
(iii) группой -NR9R10;
(iv) (C3-C6)гетероциклоалкилом, не замещенным или замещенным (C1-C4)алкилом или группой -COOAlk;
(v) гетероарилом, не замещенным или замещенным (C1-C4)алкилом;
c) (C3-C7)циклоалкил;
d) (C3-C6)гетероциклоалкил, не замещенный или замещенный (C1-C4)алкилом, группой -COOAlk или одним или двумя оксо группами;
e) группу -SO2Alk;
- или же, R7 и R8 вместе с атомом азота, к которому они прикреплены, составляют гетероцикл, насыщенный или ненасыщенный, моно- или полициклический, конденсированный или соединенный мостиковой связью, содержащий 4-10 членов кольца и который может содержать один, два или три других атомов азота или другой гетероатом, выбранный из атома кислорода или атома серы; причем указанный гетероцикл является не замещенным или замещенным один, два или три раза заместителями, независимо выбранными из
a) атома галогена;
b) гидроксила;
c) группы -OR11;
d) оксо;
e) группы -NR9R10;
f) группы -NR12COR13;
g) группы -NR12COOR13;
h) группы -COR13;
i) группы -COOR13;
j) группы -CONR14R15;
k) (C3-C7)циклоалкила, не замещенного или замещенного гидроксилом или (C1-C4)алкилом;
l) (C3-C6)гетероциклоалкила, не замещенного или замещенного одной или двумя оксогруппами;
m) фенила, не замещенного или замещенного один или несколько раз заместителями, независимо выбранными из атома галогена, группы Alk или группы OAlk;
n) пиридинила;
o) (C1-C4)алкила, не замещенного или замещенного один или несколько раз заместителями, независимо выбранными из
(i) атома галогена;
(ii) гидроксила;
(iii) группы -OR11;
(iv) группы -NR9R10;
(v) фуппы -NR12COR13;
(vi) группы -COOR13;
(vii) группы -CONR14R15;
(viii) группы -SO2Alk;
(ix) (C3-C7)циклоалкила;
(x) (C3-C6)гетероциклоалкила;
(xi) фенила, не замещенного или замещенного один или несколько раз заместителями, независимо выбранными из атома галогена, группы Alk или группы OAlk;
(xii) гетероарила, не замещенного или замещенного (C1-C4)алкилом;
- R9 и R10 представляют, каждый независимо, атом водорода или (C1-C4)алкил;
- R11 представляет собой группу Alk, (C1-C4)алкилен-OH или (C1-C4)алкилен-OAlk;
- R12 представляет собой атом водорода или (C1-C4)алкил;
- R13 представляет собой (C1-C4)алкил;
- R14 и R15 представляют, каждый независимо, атом водорода, (C1-C4)алкил или (C3-C7)циклоалкил;
- или же, R14 и R15 вместе с атомом азота, к которому они прикреплены, составляют гетероциклический радикал, выбранный из азетидин-1-ила, пирролидин-1-ила, пиперидин-1-ила, морфолин-4-ила или пиперазин-1-ила;
- Alk представляет собой (C1-C4)алкил, не замещенный или замещенный один или несколько раз атомом фтора.
Соединения формулы (I) могут иметь один или несколько асимметричных атомов углерода. Они могут, следовательно, существовать в форме энантиомеров или диастереоизомеров. Эти энантиомеры, диастереоизомеры, а также их смеси, включая рацемические смеси, образуют часть настоящего изобретения.
Соединения формулы (I) могут существовать в форме оснований или образовывать соль с помощью кислот или оснований, в частности, фармацевтически приемлемых кислот или оснований. Указанные соли присоединения образуют часть настоящего изобретения.
Эти соли предпочтительно получают с фармацевтически приемлемыми кислотами или основаниями, но соли других кислот или оснований, которые могут применяться, например, для очищения или выделения соединений формулы (I), также образуют часть настоящего изобретения.
Атом галогена означает атом брома, хлора, фтора или йода.
(C1-C4)алкил означает линейный или разветвленный алкильный радикал с одним - четырьмя атомами углерода, такой как метильный радикал, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил.
(C1-C4)алкилен означает двухвалентный радикал с одним - четырьмя атомами углерода, такой как метильный радикален, этилен, триметилен или тетраметилен.
(C1-C4)алкокси означает линейный или разветвленный алкокси радикал с одним - четырьмя атомами углерода, такой как радикал метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, emop-бутокси, трет-бутокси.
(C3-C7)циклоапкил означает углеродсодержащий радикал циклопропил, циклобутил, циклопентил, циклогексил или циклогептил.
(C3-C6)гетероциклоалкил означает насыщенное моноциклическое кольцо, содержащее 3-6 членов кольца и один или несколько гетероатомов, таких как атомы азота, кислорода или серы. В качестве примеров гетероциклоалкил может представлять собой азиридин, азетидин, пирролидин, морфолин, пиперазин, пиперидин, имидазолин, пиразолидин, тиоморфолин, оксетан, тетрагидрофуран, тетрагидро-2H-пиран, тетрагидротиофен.
Гетероарил означает ароматическую моноциклическую систему, содержащую 5-6 членов кольца, и содержащую один или несколько гетероатомов, таких как атомы азота, кислорода или серы. Атомы азота могут быть в форме N-оксидов. В качестве примеров моноциклических гетероарилов мы можем упомянуть тиазол, тиадиазол, тиофен, имидазол, триазол, тетразол, пиридин, фуран, оксазол, изоксазол, оксадиазол, пиррол, пиразол, пиримидин, пиридазин и пиразин.
Насыщенный или ненасыщенный, моно- или пол и циклический, конденсированный или соединенный мостиковой связью гетероцикл, содержащий 4-10 членов кольца, означает гетероциклоалкил, такой как, например, азиридин, азетидин, пирролидин, пиперидин, пиперазин, морфолин, тиоморфолин, а также, например, следующие гетероциклы: октагидро-2Н-пиридо[1,2-a]пиразин, 5,6,7,8-тетрагидро[1,2,4]триазоло[4,3-a]пиразин, 2,3-дигидро-1H-пирроло[3,4-c]пиридин, октагидропирроло[1,2-a]пиразин, 1,4-диазепан, 5,6,7,8-тетрагидроимидазо[1,2-a]пиразин, 4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридин, 1,4,5,6-тетрагидропирроло[3,4-c]пиразол, 6,7-дигидро-5H-пирроло[3,4-b]пиридин, 3,8-диазабицикло[3.2.1]октан, 4,5,6,7-тетрагидро-1Н-имидазо[4,5-c]пиридин, 4,5,6,7-тетрагидро-1H-пиразоло[3,4-c]пиридин, 2,5-диазабицикло[2.2.2]октан, 2,5-диазабицикло[2.2.1]гептан, октагидропирроло[3,4-b]пиррол, октагидропирроло[3,4-c]пиррол, октагидро-2H-пиразино[1,2-a]пиразин.
Согласно настоящему изобретению проводят разграничение между
- соединениями формулы (I), в которой R3 представляет собой гидроксил (ссылка IA), а другие заместители A, X, R1, R2, R4 и R5 являются такими, как определено для соединения формулы (I);
- соединениями формулы (I), в которой R3 представляет собой группу -NR7R8 (ссылка IB), а другие заместители A, X, R1, R2, R4, R5, R7 и R8 являются такими, как определено для соединения формулы (I);
в форме основания или солей присоединения кислот или оснований.
Согласно настоящему изобретению, мы можем упомянуть соединения формулы (I), в которой:
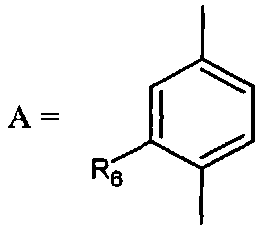
- A представляет собой двухвалентный ароматический радикал, выбранный из
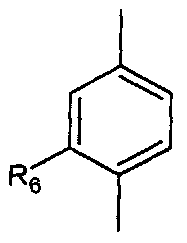 ;
; 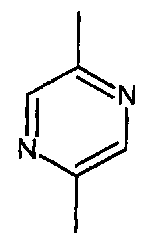 ;
; 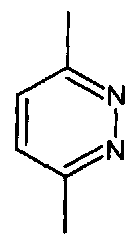 ;
;
- X представляет собой группу -CH- или атом азота;
- R1 представляет собой метильный, этильный, н-пропильный радикал или радикал этокси;
- R2 представляет собой метильный радикал;
- R3 представляет собой гидроксил или группу -NR7R8;
- R4 представляет собой атом водорода, атом брома, хлора или фтора, циано, фенил, метильный радикал, трифторметильный радикал, радикал метокси или группу диметиламино;
- R5 представляет собой атом водорода, атом брома, хлора или фтора или метильный радикал;
- R6 представляет собой атом водорода, атом брома, циано, метоксикарбонильную группу или группу -CONH2;
- R7 представляет собой атом водорода или метильный радикал;
- R8 представляет собой
a) атом водорода;
b) метильный радикал, 2-гидроксиэтил, 3-гидроксипропил, 2-метоксиэтил, 2-(метиламино)этил, 2-(диметиламино)этил, 2-(диметиламино)пропил, 2-(диметиламино)-1-метилэтил, 2-(диметиламино)-2-метилпропил, 3-(диметиламино)пропил, (1-метилпиперидин-3-ил)метил, тетрагидрофуран-3-илметил, тетрагидро-2Н-пиран-4-илметил, 2-фурилметил, (3-метил-1H-1,2,4-триазол-5-ил)метил, 1-(1Н-тетразол-5-ил)этил, 2-(1H-пиррол-1-ил)этил, 2-(1H-имидазол-1-ил)этил;
c) циклопропил;
d) 1,1-диоксидотетрагидро-3-тиенил, пирролидин-3-ил, 1-метилпирролидин-3-ил, 1-(трет-бутоксикарбонил)пирролидин-3-ил, пиперидин-3-ил, 1-метилпиперидин-3-ил, 1-(трет-бутоксикарбонил)пиперидин-3-ил, 1-метилпиперидин-4-ил;
e) метилсульфонильную группу;
- или же, R7 и R8 вместе с атомом азота, к которому они прикреплены, составляют гетероцикл, выбранный из азетидина, пирролидина, пиперидина, пиперазина, морфолина, тиоморфолина, октагидро-2Н-пиридо[1,2-a]пиразина, 5,6,7,8-тетрагидро[1,2,4]триазоло[4,3-a]пиразина, 2,3-дигидро-1H-пирроло[3,4-c]пиридина, октагидропирроло[1,2-a]пиразина, 1,4-диазепана, 5,6,7,8-тетрагидроимидазо[1,2-a]пиразина, 4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридина, 1,4,5,6-тетрагидропирроло[3,4-c]пиразола, 6,7-дигидро-5H-пирроло[3,4-b]пиридина, 3,8-диазабицикло[3.2.1]октана, 4,5,6,7-тетрагидро-1H-имидазо[4,5-c]пиридина, 4,5,6,7-тетрагидро-1H-пиразоло[3,4-c]пиридина, 2,5-диазабицикло[2.2.2]октана, 2,5-диазабицикло[2.2.1]гептана, октагидропирроло[3,4-b]пиррола, октагидропирроло[3,4-c]пиррола, октагидро-2Н-пиразино[1,2-a]пиразина; причем указанный гетероцикл является не замещенным или замещенным один, два или три раза заместителями, независимо выбранными из
a) атома фтора;
b) гидроксила;
c) радикала метокси, 2-гидроксиэтокси, 2-метоксиэтокси;
d) оксо;
e) группы амино, метиламино, диметиламино;
f) группы ацетамидо;
g) группы (трет-бутоксикарбонил)амино, (трет-бутоксикарбонил)(метил)амино;
h) ацетильной группы;
i) метоксикарбонильной группы, трет-бутоксикарбонильной группы;
j) группы диметилкарбамоил, циклопропилкарбамоил, циклобутилкарбамоил;
k) циклопропильного, циклобутильного, 2-гидроксициклопентильного радикала;
l) радикала оксетан-3-ил, 1,1-диоксидотетрагидро-3-тиенил, пиперидин-1-ил, морфолин-4-ил;
m) 4-фторфенила;
n) пиридин-2-ила;
o) метильного радикала, этила, н-пропила, изопропила, н-бутила, трифторметила, 2-фторэтила, 2,2-дифторэтила, 2,2,2-трифторэтила, 3,3,3-трифторпропила, 3,3,3-трифтор-2-гидроксипропила, гидроксиметила, 2-гидроксиэтила, 2-гидрокси-1,1-диметилэтила, метоксиметила, 2-метоксиэтила, 2-метокси-1-метилэтила, 2-метокси-1,1-диметилэтила, 2-этоксиэтила, 2-(трифторметокси)этила, 2-(2-гидроксиэтокси)этила, 2-(2-метоксиэтокси)этила, 2-(диметиламино)этила, 2-ацетамидоэтила, 2-[ацетил(метил)амино]этила, 2-метокси-2-оксоэтила, 2-этокси-2-оксоэтила, 3-этокси-3-оксопропила, 2-амино-2-оксоэтила, 2-(метиламино)-2-оксоэтила, 2-(изопропиламино)-2-оксоэтила, 2-(диметиламино)-2-оксоэтила, 2-(циклопропиламино)-2-оксоэтила, 2-оксо-2-пирролидин-1-илэтила, 2-(метилсульфонил)этила, циклопропилметила, пирролидин-1-илметила, тетрагидрофуран-2-илметила, 2-тиенилметила, 4-хлорбензила, 4-фторбензила, 2-метоксибензила, 3-фтор-4-метоксибензила, пиридин-4-илметила, (5-метил-1,2,4-оксадиазол-3-ил)метила, (5-метилизоксазол-3-ил)метила;
в форме основания или солей присоединения кислот или оснований.
Согласно настоящему изобретению мы можем упомянуть соединения формулы (I), в которой:
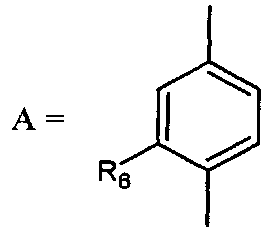
- А представляет собой двухвалентный ароматический радикал, выбранный из
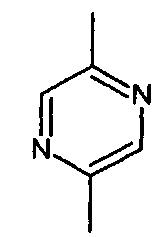 ;
; 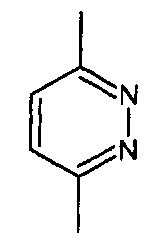 ;
;
- X представляет собой группу -CH-;
- R1 представляет собой н-пропильный радикал;
- R2 представляет собой метильный радикал;
- R3 представляет собой гидроксил или группу -NR7R8;
- R4 представляет собой атом хлора;
- R5 представляет собой атом водорода;
- R7 представляет собой атом водорода или метильный радикал;
- R8 представляет собой
b) метильный радикал, 2-гидроксиэтил, 3-гидроксипропил, 2-метоксиэтил, 2-(диметиламино)этил, 2-(диметиламино)пропил, 2-(диметиламино)-2-метилпропил, 3-(диметиламино)пропил, тетрагидрофуран-3-илметил, тетрагидро-2Н-пиран-4-илметил, 2-фурилметил, (3-метил-1H-1,2,4-триазол-5-ил)метил, 1-(1H-тетразол-5-ил)этил, 2-(1H-пиррол-1-ил)этил;
c) циклопропил;
d) 1-метилпирролидин-3-ил, 1-(трет-бутоксикарбонил)пиперидин-3-ил, 1-метилпиперидин-4-ил;
- или же, R7 и R8 вместе с атомом азота, к которому они прикреплены, составляют гетероцикл, выбранный из азетидина, пирролидина, пиперидина, пиперазина, морфолина, тиоморфолина, октагидро-2H-пиридо[1,2-a]пиразина, 5,6,7,8-тетрагидро[1,2,4]триазоло[4,3-a]пиразина, 2,3-дигидро-1H-пирроло[3,4-c]пиридина, октагидропирроло[1,2-a]пиразина, 1,4-диазепана; причем указанный гетероцикл является не замещенным или замещенным один, два или три раза заместителями, независимо выбранными из
b) гидроксила;
c) радикала метокси;
d) оксо;
h) ацетильной группа;
i) метоксикарбонильной группы;
j) диметилкарбамоильной группы;
k) циклобутильного радикала;
l) 1,1-диоксидотетрагидро-3-тиенила, пиперидин-1-ила, морфолин-4-ила;
m) 4-фторфенила;
o) метильного радикала, этила, н-пропила, изопропила, н-бутила, трифторметила, 3,3,3-трифторпропила, гидроксиметила, 2-гидроксиэтила, метоксиметила, 2-метоксиэтила, 2-этоксиэтила, 2-(трифторметокси)этила, 2-(диметиламино)этила, 2-метокси-2-оксоэтила, 2-этокси-2-оксоэтила, 2-(изопропиламино)-2-оксоэтила, 2-(диметиламино)-2-оксоэтила, 2-(циклопропиламино)-2-оксоэтила, 2-оксо-2-пирролидин-1-илэтила, тетрагидрофуран-2-илметила, 4-фторбензила, 3-фтор-4-метоксибензила, пиридин-4-илметила, (5-метил-1,2,4-оксадиазол-3-ил)метила;
в форме основания или солей присоединения кислот или оснований.
Согласно настоящему изобретению мы можем упомянуть соединения формулы (I), в которой:
- A представляет собой двухвалентный ароматический радикал
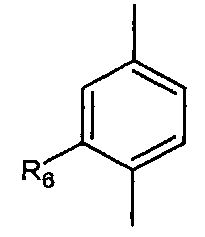 ;
;
- X представляет собой группу -CH- или атом азота;
- R1 представляет собой метильный радикал, этил, н-пропил или радикал этокси;
- R2 представляет собой метильный радикал;
- R3 представляет собой гидроксил или группу -NR7R8;
- R4 представляет собой атом водорода, атом брома, хлора или фтора, циано, фенил, метильный радикал, трифторметильный радикал, радикал метокси или группу диметиламино;
- R5 представляет собой атом водорода, атом брома, хлора или фтора или метильный радикал;
- R6 представляет собой атом водорода, атом брома, циано, группу или метоксикарбонильную группу -CONH2;
- R7 представляет собой атом водорода или метильный радикал;
- R8 представляет собой
b) метильный радикал, 2-гидроксиэтил, 2-метоксиэтил, 2-(метиламино)этил, 2-(диметиламино)этил, 2-(диметиламино)-1-метилэтил, (1-метилпиперидин-3-ил)метил, 2-(1H-имидазол-1-ил)этил;
d) 1,1-диоксидотетрагидро-3-тиенил, пирролидин-3-ил, 1-метилпирролидин-3-ил, 1-(трет-бутоксикарбонил)пирролидин-3-ил, пиперидин-3-ил, 1-метилпиперидин-3-ил, 1-(трет-бутоксикарбонил)пиперидин-3-ил;
e) метилсульфонильную группу;
- или же, R7 и R8, вместе с атомом азота, к которому они прикреплены, составляют гетероцикл, выбранный из азетидина, пирролидина, пиперидина, пиперазина, морфолина, 5,6,7,8-тетрагидро[1,2,4]триазоло[4,3-a]пиразина, октагидропирроло[1,2-a]пиразина, 1,4-диазепана, 5,6,7,8-тетрагидроимидазо[1,2-a]пиразина, 4,5,6,7-тетрагидро-1H-пиразоло[4,3-c]пиридина, 1,4,5,6-тетрагидропирроло[3,4-c]пиразола, 6,7-дигидро-5H-пирроло[3,4-b]пиридина, 3,8-диазабицикло[3.2.1]октана, 4,5,6,7-тетрагидро-1H-имидазо[4,5-c]пиридина, 4,5,6,7-тетрагидро-1H-пиразоло[3,4-c]пиридина, 2,5-диазабицикло[2.2.2]октана, 2,5-диазабицикло[2.2.1]гептана, октагидропирроло[3,4-b]пиррола, октагидропирроло[3,4-c]пиррола, октагидро-2Н-пиразино[1,2-a]пиразина; причем указанный гетероцикл является не замещенным или замещенным один, два или три раза заместителями, независимо выбранными из
a) атома фтора;
b) гидроксила;
c) 2-гидроксиэтокси, 2-метоксиэтокси;
d) оксо;
e) группы амино, метиламино, диметиламино;
f) группы ацетамидо;
g) группы (трет-бутоксикарбонил)амино, группы (трет-бутоксикарбонил)(метил)амино;
i) метоксикарбонильной группы, трет-бутоксикарбонила;
j) группы циклопропилкарбамоил, циклобутилкарбамоил;
k) циклопропильного, циклобутильного, 2-гидроксициклопентильного радикала;
l) оксетан-3-ила, морфолин-4-ила;
n) пиридин-2-ила;
о) метильного радикала, этила, н-пропила, изопропила, н-бутила, трифторметила, 2-фторэтила, 2,2-дифторэтила, 2,2,2-трифторэтила, 3,3,3-трифтор-2-гидроксипропила, гидроксиметила, 2-гидроксиэтила, 2-гидрокси-1,1-диметилэтила, метоксиметила, 2-метоксиэтила, 2-метокси-1-метилэтила, 2-метокси-1,1-диметилэтила, 2-этоксиэтила, 2-(трифторметокси)этила, 2-(2-гидроксиэтокси)этила, 2-(2-метоксиэтокси)этила, 2-(диметиламино)этила, 2-ацетамидоэтила, 2-[ацетил(метил)амино]этила, 2-этокси-2-оксоэтила, 3-этокси-3-оксопропила, 2-амино-2-оксоэтила, 2-(метиламино)-2-оксоэтила, 2-(диметиламино)-2-оксоэтила, 2-оксо-2-пирролидин-1-илэтила, 2-(метилсульфонил)этила, циклопропилметила, пирролидин-1-илметила, 2-тиенилметила, 4-хлорбензила, 4-фторбензила, 2-метоксибензила, (5-метилизоксазол-3-ил)метила;
в форме основания или солей присоединения кислот или оснований.
Согласно настоящему изобретению мы можем упомянуть соединения формулы (I), в которой:
- A представляет собой двухвалентный ароматический радикал, выбранный из
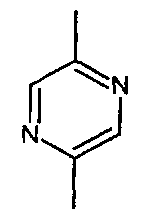 ;
; 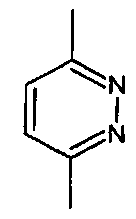 ;
;
- X представляет собой группу -CH-;
- R1 представляет собой н-пропильный радикал;
- R2 представляет собой метильный радикал;
- R3 представляет собой гидроксил или группу -NR7R8, выбранную из
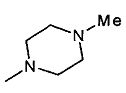 ,
, 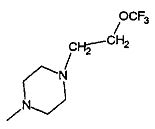 , -NHMe,
, -NHMe,
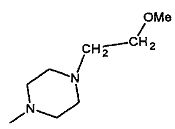 ,
, 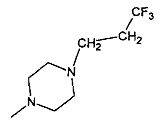 ,
, 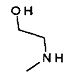 ,
,
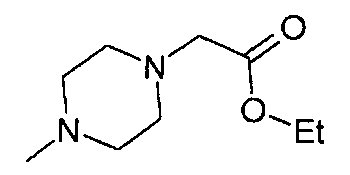 ,
, 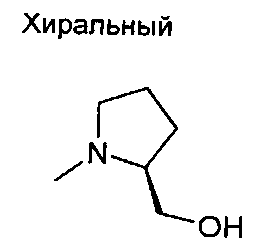 ,
, 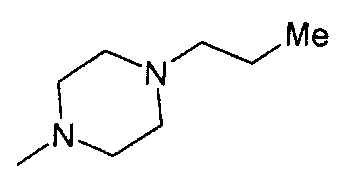 ,
,
 ,
, 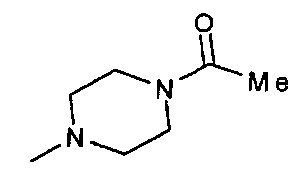 ,
, 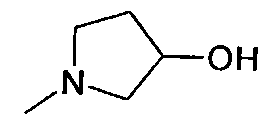 ,
,
-NMe2, 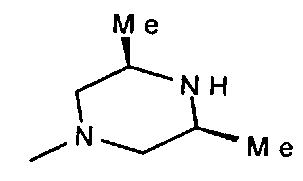 ,
,  ,
,
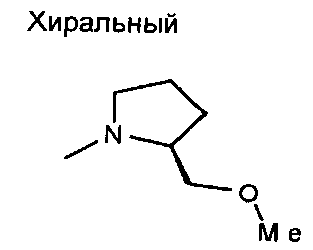 ,
, 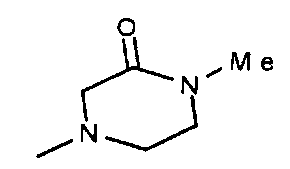 ,
, 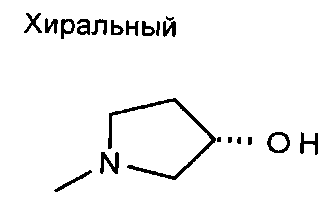 ,
,
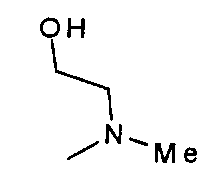 ,
, 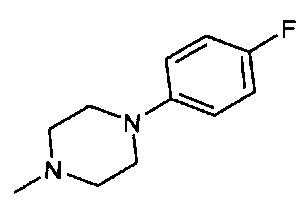 ,
, 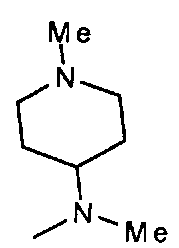 ,
,
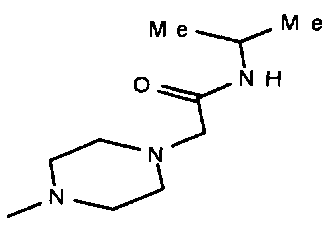 ,
, 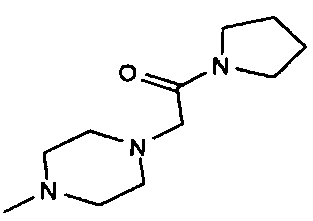 ,
, 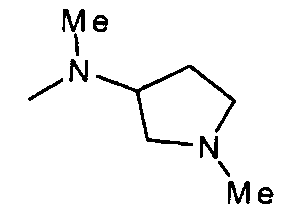 ,
,
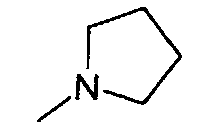 ,
, 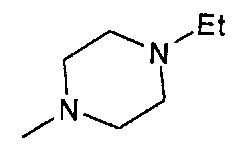 ,
, 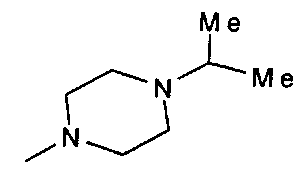 ,
,
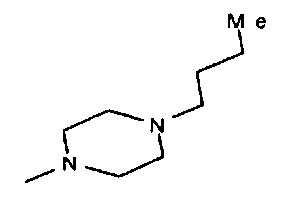 ,
, 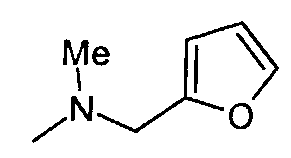 ,
, 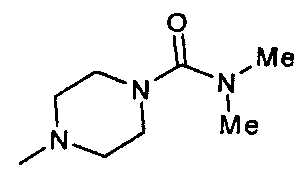 ,
,
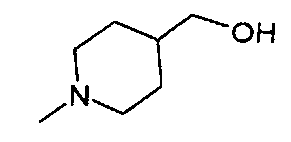 ,
, 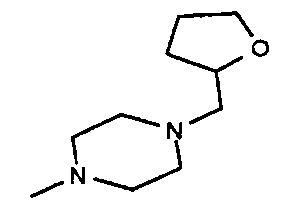 ,
, 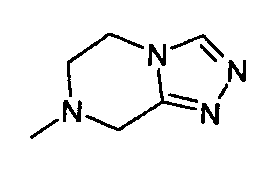 ,
,
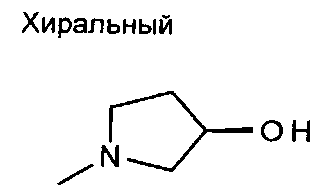 ,
, 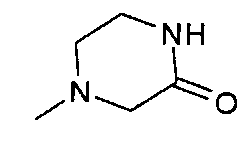 ,
, 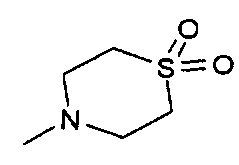 ,
,
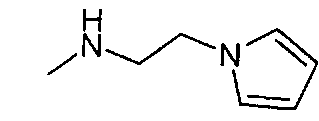 ,
,  ,
, 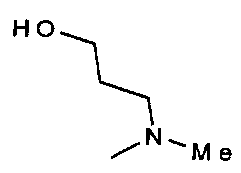 ,
,
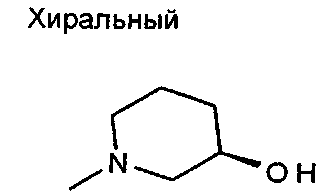 ,
, 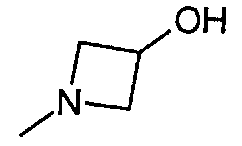 ,
, 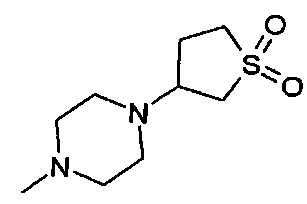 ,
,
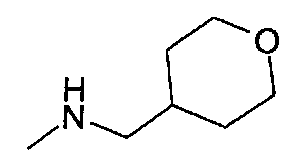 ,
, 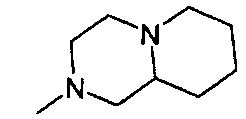 ,
, 
 ,
,  ,
,  ,
,
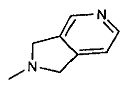 ,
, 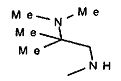 ,
, 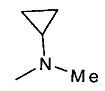 ,
,
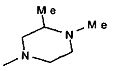 ,
, 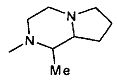 ,
, 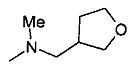 ,
,
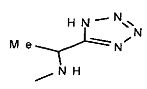 ,
, 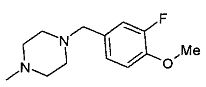 ,
, 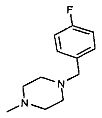 ,
,
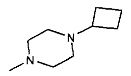 ,
, 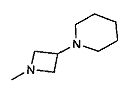 ,
, 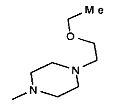 ,
,
 ,
,  ,
,  ,
,
 ,
, 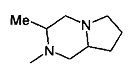 ,
, 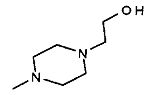 ,
,
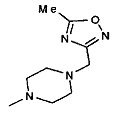 ,
, 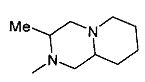 ,
, 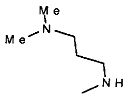 ,
,
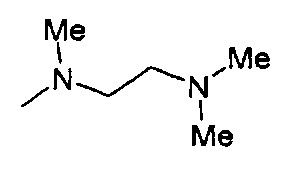 ,
, 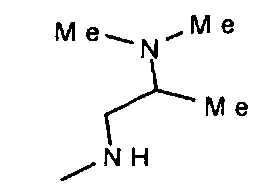 ,
, 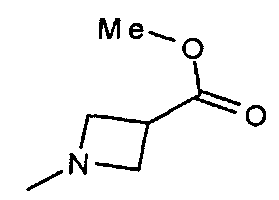 ,
,
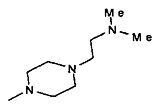 ,
, 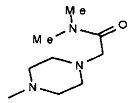 ,
, 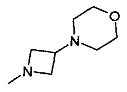 ,
,
 ,
, 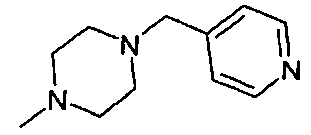 ;
;
- R4 представляет собой атом хлора;
- R5 представляет собой атом водорода; в форме основания или солей присоединения кислот или оснований.
Согласно настоящему изобретению мы можем упомянуть соединения формулы (I), в которой:
- A представляет собой двухвалентный ароматический радикал
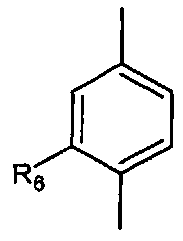 ;
;
- X представляет собой группу -CH- или атом азота;
- R1 представляет собой метильный радикал, этил, н-пропил или радикал этокси;
- R2 представляет собой метильный радикал;
- R3 представляет собой гидроксил или группу -NR7R8, выбранную из
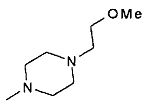 ,
,  ,
,  ,
,
 ,
, 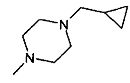 ,
,  ,
,
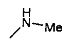 ,
,  ,
, 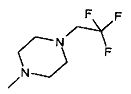 ,
,
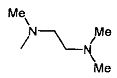 ,
, 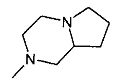 ,
, 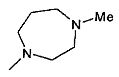 ,
,
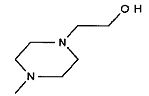 ,
, 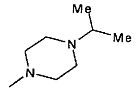 ,
, 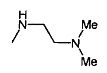 ,
,
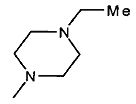 ,
, 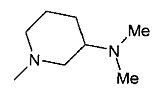 ,
, 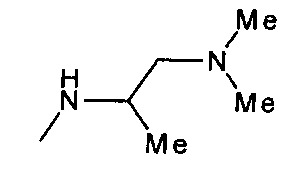 ,
,
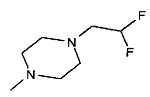 ,
, 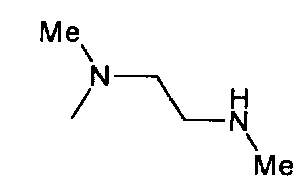 ,
, 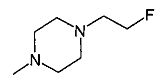 ,
,
 ,
, 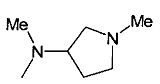 ,
, 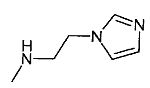 ,
,
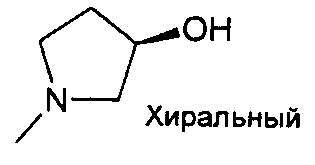 ,
, 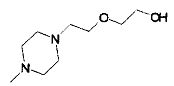 ,
, 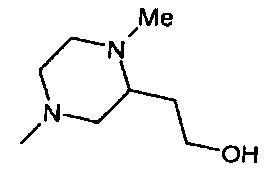 ,
,
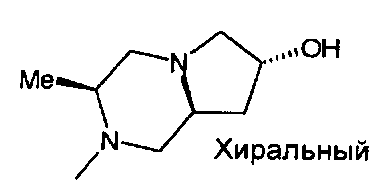 ,
, 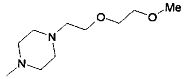 ,
, 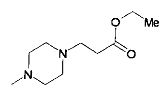 ,
,
 ,
, 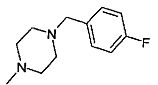 ,
, 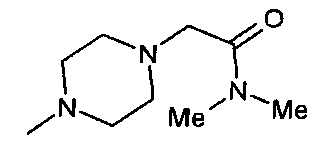 ,
,
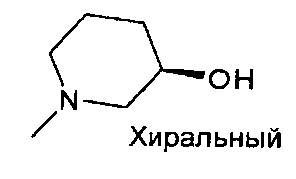 ,
, 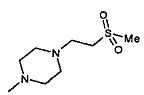 ,
, 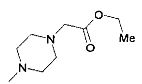 ,
,
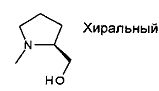 ,
, 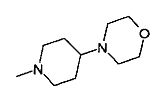 ,
, 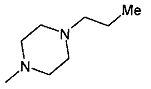 ,
,
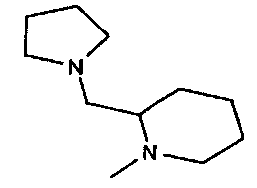 ,
, 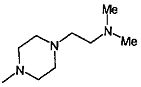 ,
, 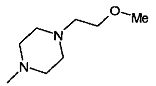 ,
,
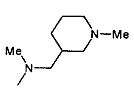 ,
, 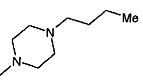 ,
, 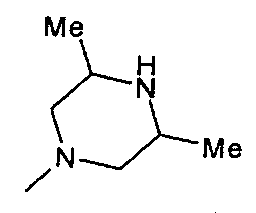 ,
,
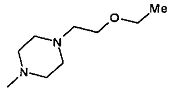 ,
, 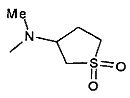 ,
, 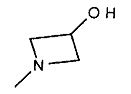 ,
,
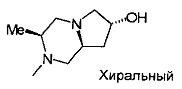 ,
, 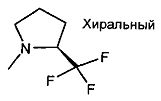 ,
, 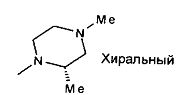 ,
,
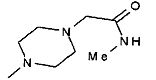 ,
, 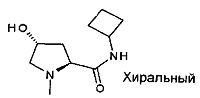 ,
, 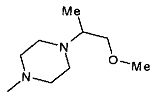 ,
,
 ,
, 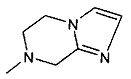 ,
, 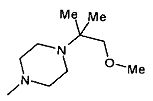 ,
,
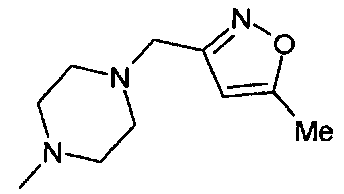 ,
, 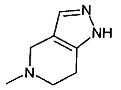 ,
, 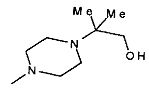 ,
,
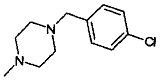 ,
, 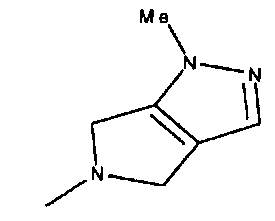 ,
, 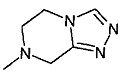 ,
,
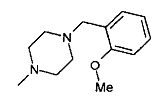 ,
, 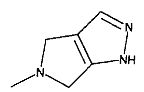 ,
, 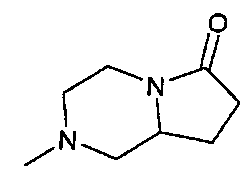 ,
,
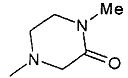 ,
, 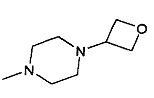 ,
, 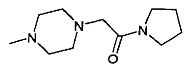 ,
,
 ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,
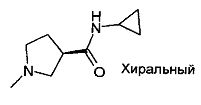 ,
, 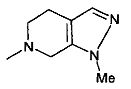 ,
, 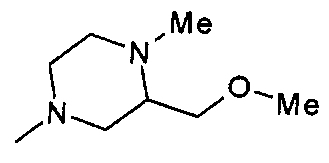 ,
,
 ,
, 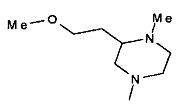 ,
, 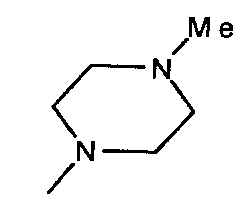 ,
,
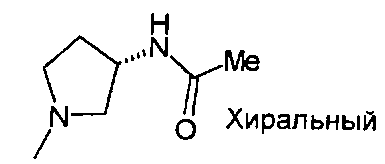 ,
, 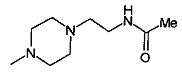 ,
, 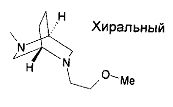 ,
,
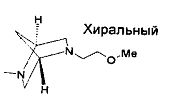 ,
, 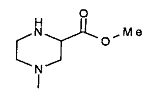 ,
, 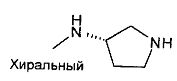 ,
,
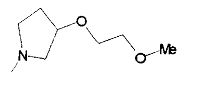 ,
, 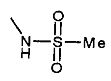 ,
, 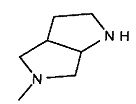 ,
,
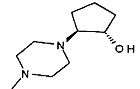 ,
, 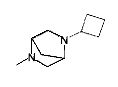 ,
, 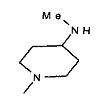 ,
,
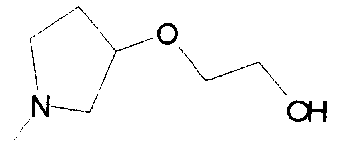 ,
, 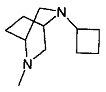 ,
, 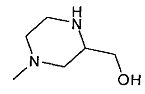 ,
,
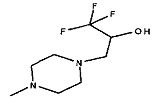 ,
, 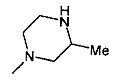 ,
, 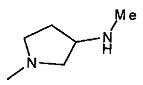 ,
,
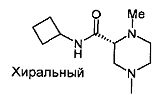 ,
, 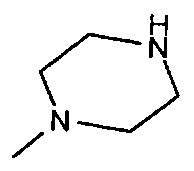 ,
, 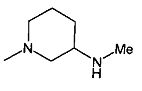 ,
,
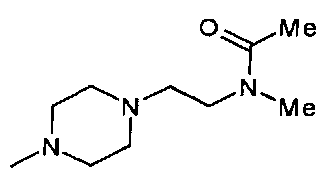 ,
, 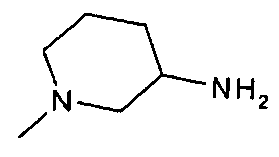 ,
, 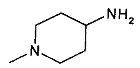 ,
,
 ,
, 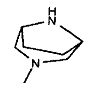 ,
, 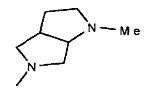 ,
,
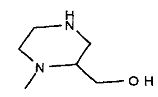 ,
, 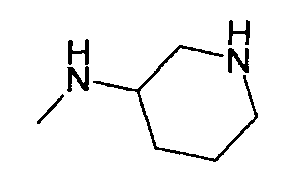 ,
, 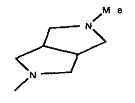 ,
,
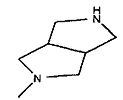 ,
, 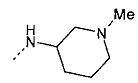 ,
, 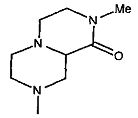 ,
,
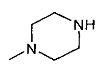 ,
, 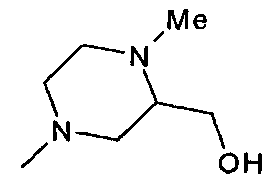 ,
, 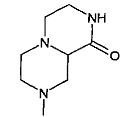 ,
,
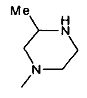 ,
, 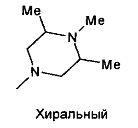 ,
, 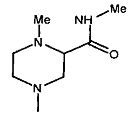 ,
,
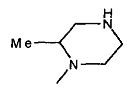 ,
,  ;
;
- R4 представляет собой атом водорода, атом брома, хлора или фтора, циано, фенил, метильный радикал, трифторметильный радикал, радикал метокси или группу диметиламино;
- R5 представляет собой атом водорода, атом брома, хлора или фтора или метильный радикал;
- R6 представляет собой атом водорода, атом брома, циано, метоксикарбонильную группу или группу -CONH2; в форме основания или солей присоединения кислот или оснований.
Согласно настоящему изобретению мы можем упомянуть соединения формулы (I) в которой:
- A представляет собой двухвалентный ароматический радикал, выбранный из:
 ;
;  ;
;
- X представляет собой группу -CH-;
- R1 представляет собой н-пропильный радикал;
- R2 представляет собой метильный радикал;
- R3 представляет собой гидроксил или группу -NR7R8, выбранную из
 ,
, 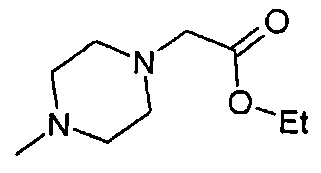 ,
, 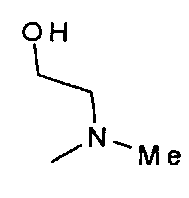 ,
,
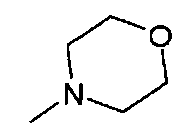 ,
, 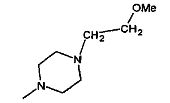 ,
, 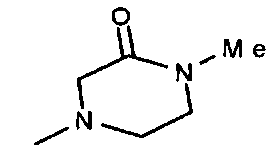 ,
,
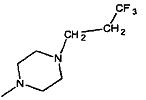 , -NMe2,
, -NMe2, 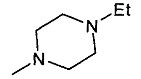 ,
,
-NHMe, 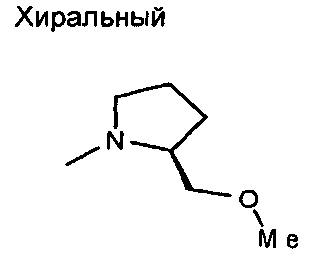 ,
, 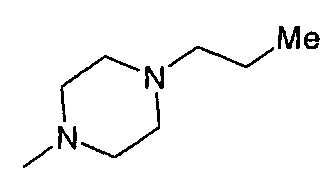 ,
,
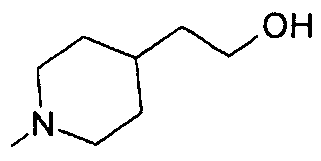 ,
, 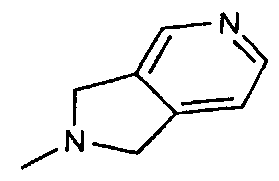 ,
, 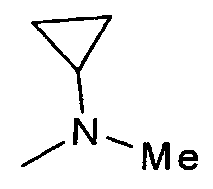 ,
,
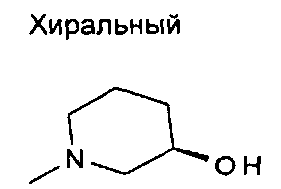 ,
, 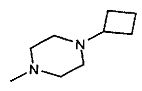 ,
, 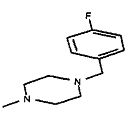 ,
,
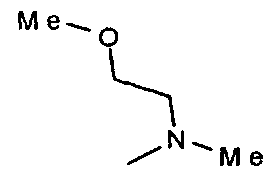 ,
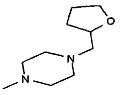
,  ,
,  ,
,
 ,
,  ,
, 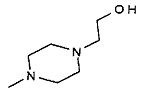 ,
,
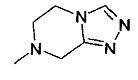 ,
, 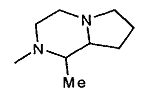 ,
, 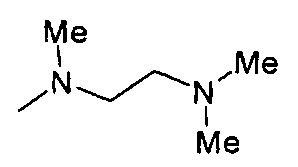 ,
,
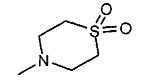 ,
,  ,
,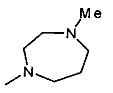 ;
;
- R4 представляет собой атом хлора;
- R5 представляет собой атом водорода;
в форме основания или солей присоединения кислот или оснований.
Согласно настоящему изобретению мы можем упомянуть соединения формулы (I), в которой:
- A представляет собой двухвалентный ароматический радикал
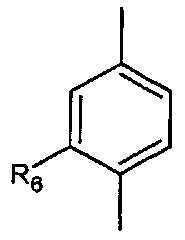 ;
;
- X представляет собой группу -CH- или атом азота;
- R1 представляет собой метильный радикал, этил, н-пропил или радикал этокси;
- R2 представляет собой метильный радикал;
- R3 представляет собой гидроксил или группу -NR7R8, выбранную из
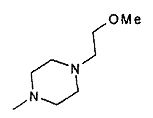 ,
, 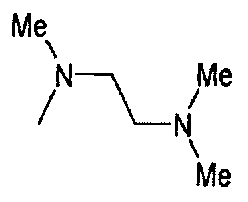 ,
, 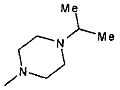 ,
,
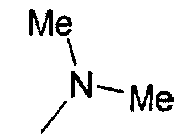 ,
, 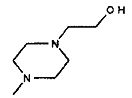 ,
, 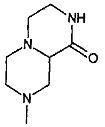 ,
,
 ,
, 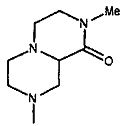 ,
, 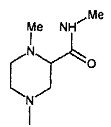 ,
,
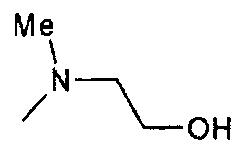 ,
, 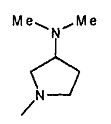 ,
, 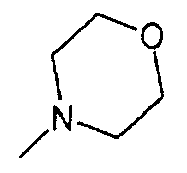 ,
,
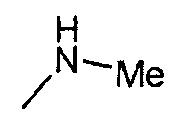 ,
, 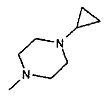 ,
, 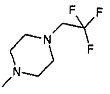 ,
,
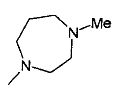 ,
, 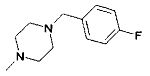 ,
, 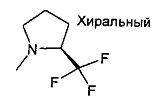 ,
,
 ,
, 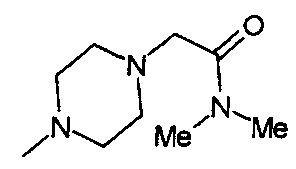 ,
, 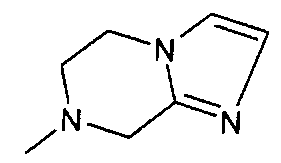 ,
,
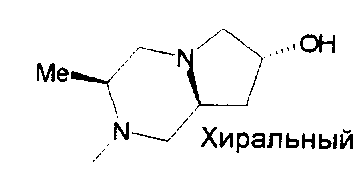 ,
, 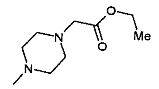 ,
, 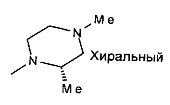 ,
,
 ,
, 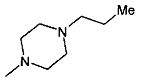 ,
, 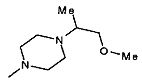 ,
,
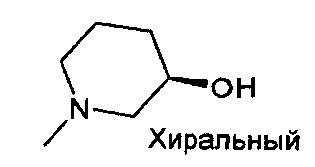 ,
, 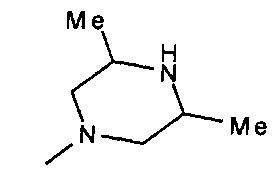 ,
, 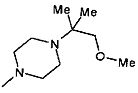 ,
,
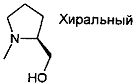 ,
, 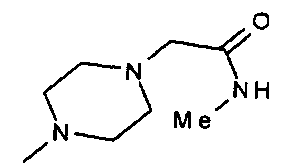 ,
,  ,
,
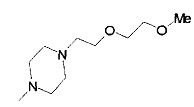 ,
, 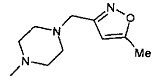 ,
, 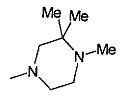 ,
,
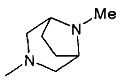 ,
, 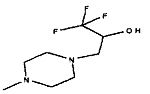 ,
, 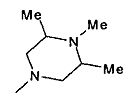 ,
,
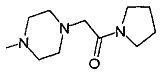 ,
, 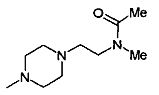 ,
,  ,
,
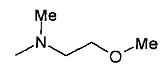 ,
, 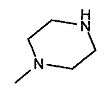 ,
, 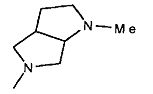 ,
,
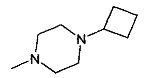 ,
, 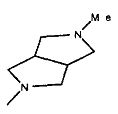 ,
,
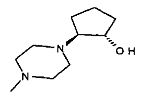 ,
, 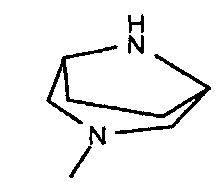 ;
;
- R4 представляет собой атом водорода, атом брома, хлора или фтора, циано, фенил, метильный радикал, трифторметильный радикал, радикал метокси или группу диметиламино;
- R5 представляет собой атом водорода, атом брома, хлора или фтора или метильный радикал;
- R6 представляет собой атом водорода, атом брома, циано, метоксикарбонильную группу или группу -CONH2;
в форме основания или солей присоединения кислот или оснований.
Среди соединений формулы (I) согласно настоящему изобретению мы можем, в частности, упомянуть следующие соединения:
- (3-{[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]карбамоил}-5-метил-1H-индол-1-ил)уксусная кислота;
- (3-{[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]карбамоил}-5,6-диметил-1H-индол-1-ил)уксусная кислота;
- (3-{[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]карбамоил}-5-хлор-1H-индол-1-ил)уксусная кислота;
- N-[5-(4-бутирил-5-метил-1H-пиразол-1-ил)пиразин-2-ил]-5-хлор-1-[2-(4-метилпиперазин-1-ил)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-[2-(4-метилпиперазин-1-ил)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-{2-[4-(2-метоксиэтил)пиперазин-1-ил]-2-оксоэтил}-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-{2-оксо-2-[4-(3,3,3-трифторпропил)пиперазин-1-ил]этил}-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-[2-(метиламино)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-(2-морфолин-4-ил-2-оксоэтил)-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-[2-(диметиламино)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-{2-[(2S)-2-(метоксиметил)пирролидин-1-ил]-2-оксоэтил}-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-[2-(4-этилпиперазин-1-ил)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-[2-(4-пропилпиперазин-1-ил)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-{2-[(2-метоксиэтил)(метил)амино]-2-оксоэтил}-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-{2-оксо-2-[4-(тетрагидрофуран-2-илметил)пиперазин-1-ил]этил}-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-[2-(5,6-дигидро[1,2,4]триазоло[4,3-a]пиразин-7 (8H)-ил)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-[2-(4-циклобутилпиперазин-1-ил)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-(2-{4-[(5-метил-1,2,4-оксадиазол-3-ил)метил]пиперазин-1-ил}-2-оксоэтил)-1H-индол-3-карбоксамид;
- {4-[(3-{[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]карбамоил}-5-хлор-1H-индол-1-ил)ацетил]пиперазин-1-ил}метилацетат;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1 -ил)пиридазин-3-ил]-5-хлор-1-{2-[циклопропил(метил)амино]-2-оксоэтил}-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-{2-[4-(4-фторбензил)пиперазин-1-ил]-2-оксоэтил}-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-{2-[4-(2-этоксиэтил)пиперазин-1-ил]-2-оксоэтил}-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-{2-[4-(2-гидроксиэтил)пиперазин-1-ил]-2-оксоэтил}-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-(2-{[2-(диметиламино)этил](метил)амино}-2-оксоэтил)-1H-индол-3-карбоксамид;
- N-[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-[2-(4-метил-1,4-диазепан-1-ил)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-[2-(8-метил-9-оксооктагидро-2Н-пиразино[1,2-a]пиразин-2-ил)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)-2-цианофенил]-5-хлор-1-[2-(4-метилпиперазин-1-ил)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-{2-[4-(4-фторбензил)пиперазин-1-ил]-2-оксоэтил}-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-{2-[4-(2-метоксиэтил)пиперазин-1-ил]-2-оксоэтил}-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-1-{2-[4-(2-метоксиэтил)пиперазин-1-ил]-2-оксоэтил}-5-метил-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-[2-(4-метилпиперазин-1-ил)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-{2-[4-(2-метокси-1-метилэтил)пиперазин-1-ил]-2-оксоэтил}-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-метил-1-[2-(4-метилпиперазин-1-ил)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-6-фтор-1-{2-[4-(2-метоксиэтил)пиперазин-1-ил]-2-оксоэтил}-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-метокси-1-[2-(4-метилпиперазин-1-ил)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-{2-[4-метил-3-(метилкарбамоил)пиперазин-1-ил]-2-оксоэтил}-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5,6-диметил-1-[2-(4-метилпиперазин-1-ил)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-метил-1-[2-(4-метилпиперазин-1-ил)-2-оксоэтил]-1H-индазол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-метил-1-(2-оксо-2-пиперазин-1-илэтил)-1H-индол-3-карбоксамид;
- N-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-6-фтор-1-[2-(4-метил пиперазин-1-ил)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-(2-{4-[(5-метилизоксазол-3-ил)метил]пиперазин-1-ил}-2-оксоэтил)-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-метил-1-(2-морфолин-4-ил-2-оксоэтил)-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-(2-оксо-2-пиперазин-1-илэтил)-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-{2-[4-(2-метокси-1,1-диметилэтил)пиперазин-1-ил]-2-оксоэтил}-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-{2-[4-(2-гидрокси-1,1-диметилэтил)пиперазин-1-ил]-2-оксоэтил}-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-[2-(8-метил-3,8-диазабицикло[3.2.1]окт-3-ил)-2-оксоэтил]-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-1-[2-(4-метилпиперазин-1-ил)-2-оксоэтил]-5-(трифторметил)-1H-индол-3-карбоксамид;
- N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-[2-оксо-2-(9-оксооктагидро-2Н-пиразино[1,2-a]пиразин-2-ил)этил]-1H-индол-3-карбоксамид; в форме основания или соли присоединения кислоты или основания.
В настоящем документе ниже, защитная группа Pg означает группу, которая делает возможным, с одной стороны, защитить реакционную функциональную группу, такую как гидроксил или амин в ходе синтеза и, с другой стороны, восстановить реакционную функциональную группу интактной в конце синтеза. Примеры защитных групп, а также способы прикрепления и снятия защитных групп представлены в "Protective Groups in Organic Synthesis", Greene et al., 4th Edition, John Wiley & Sons, Inc., New York, 2007.
Уходящая группа означает, в настоящем документе ниже, группу, которая может быть легко отщеплена от молекулы путем разрыва гетеролитической связи, с уходом электронной пары. Эта группа может, таким образом, быть легко замещена другой группой в ходе реакции замещения, например. Указанные уходящие группы представляют собой, например, галогены или активированную гидроксильную группу, такую как метансульфонат, бензолсульфонат, p-толуолсульфонат, трифлат, ацетат и т.д. Примеры уходящих групп, а также ссылки на их получение представлены в "Advanced Organic Chemistry", М.В. Smith and J. March, 6th Edition, Wiley Interscience, 2007, p.496-501.
Согласно настоящему изобретению соединения формулы (I), в которой R3=-OH (соединение IA), могут быть получены с помощью способа, который характеризуется тем, что соединение формулы (II),
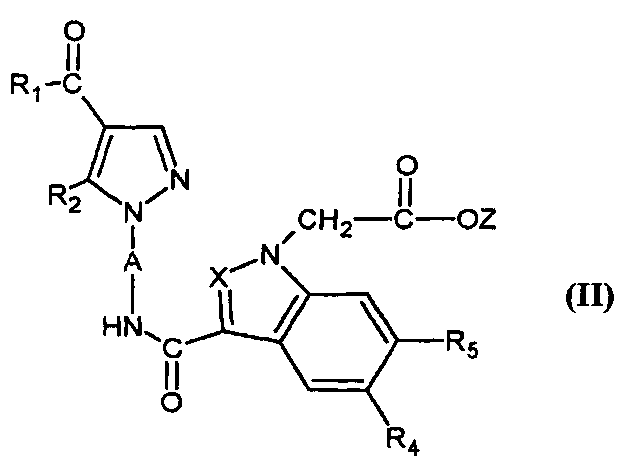 ,
,
в которой A, X, R1, R2, R4 и R5 являются такими, как определено для соединения формулы (I), и Z представляет собой (C1-C4)алкил, гидролизуют в кислой или основной среде.
Необязательно соединение формулы (I) трансформируют в одну из его солей с минеральными или органическими основаниями.
Реакцию проводят в кислой среде под действием сильной кислоты, например, соляной кислоты или серной кислотыа, в растворителе, таком как, например, диоксан или вода, и при температуре от -10°C до 110°C.
Реакцию проводят в основной среде под действием щелочного основания, например, гидроксида калия, гидроксида лития или гидроксида натрия, в растворителе, таком как, например, диоксан, тетрагидрофуран, вода, метанол, этанол или смеси этих растворителей и при температуре от -10°C до температуры флегмы растворителя.
Согласно настоящему изобретению соединения формулы (I), в которой R3=-NR7R8 (соединение IB), могут быть получены с помощью способа, который характеризуется тем, что соединение формулы (IA),
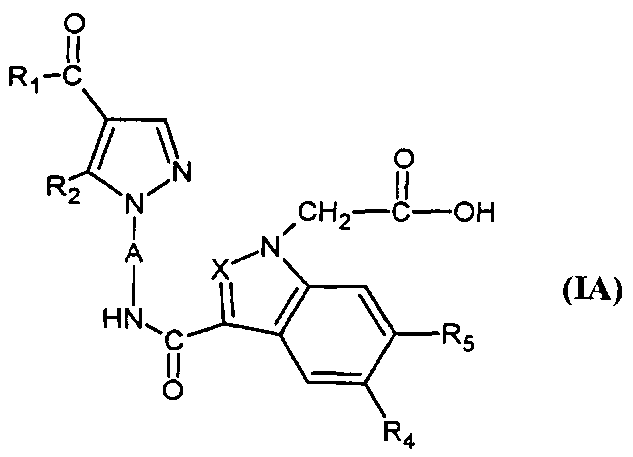 ,
,
в которой A, X, R1, R2, R4 и R5 являются такими, как определено для соединения формулы (I), вступает в реакцию с амином формулы (III),
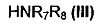 ,
,
в которой R7 и R8 являются такими, как определено для соединения формулы (I).
Необязательно соединение формулы (I) трансформируют в одну из его солей с минеральными или органическими кислотами.
Реакцию проводят в присутствии основания, например, триэтиламина, 4-диметиламинопиридина, N-метилморфолина, N-этилморфолина или пиридина и в присутствии связывающего средства, например, бис(2-оксо-1,3-оксазолидин-3-ил)фосфинового хлорида, изобутилхлорформата, 1,1′-карбонилдиимидазола, 1-(3-диметиламинопропил)-3-этил карбодиимида гидрохлорида, 2-циано-2-(гидроксиимино)этилацетата. Применяемый растворитель представляет собой, например, дихлорметан, 1,2-дихлорэтан или N,N-диметилформамид. Температура реакции составляет от -10°C до температуры флегмы растворителя.
В частности, определенные соединения формулы (I) могут быть получены из других соединений формулы (I).
Соединения формулы (I), полученные таким образом, могут быть разделены впоследствии из реакционной смеси и очищены с помощью классических способов, например, путем кристаллизации или колоночной хроматографии с силикагелем.
Соединения формулы (I), полученные таким образом, выделяют в форме свободного основания или соли с помощью классических техник.
Соединения формулы (II) могут быть получены путем реакции кислоты или активированного функционального производного указанной кислоты формулы,
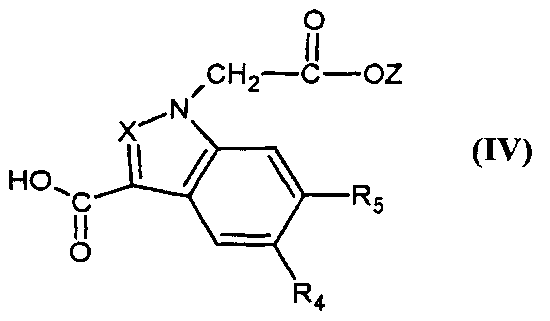 ,
,
в которой X, R4 и R5 являются такими, как определено для соединения формулы (I), и Z представляет собой (C1-C4)алкил, с соединением формулы,
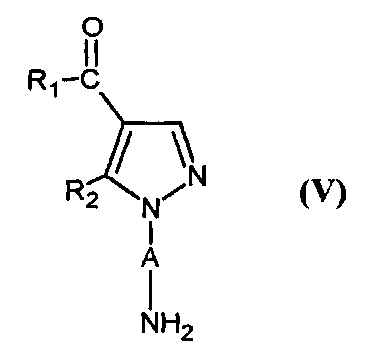 ,
,
в которой A, R1 и R2 являются такими, как определено для соединения формулы (I).
Когда соединение формулы (V) обрабатывают кислотой формулы (IV) самой по себе, это проводят в присутствии связывающего средства, применяемого в химии пептидов, такого как 1,3-дициклогексилкарбодиимид или бензотриазол-1-ил-окситрис(диметиламино)фосфонийгексафторфосфат или бензотриазол-1-ил-окситрис(пирролидино)фосфонийгексафторфосфат или 2-(1H-бензотриазол-1-ил)-1,1,3,3-тетраметилуронийтетрафторборат или 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид, в присутствии основания, такого как триэтиламин, N,N-диизопропилэтиламин или 4-диметиламинопиридин, в растворителе, таком как дихлорметан, 1,2-дихлорэтан, N-N-диметилформамид или тетрагидрофуран при температуре от -10°C до температуры флегмы растворителя.
В качестве активированного функционального производного кислоты (IV), возможно применение хлорангидрида, ангидрида, смешанного ангидрида, сложного эфира C1-C4алкила, в котором алкил является линейным или разветвленным, активированного сложного эфира, например, p-нитрофенилового сложного эфира.
Таким образом, например, хлорид кислоты, полученный с помощью реакции тионилхлорида или оксалилхлорид на кислоте формулы (IV), может вступить в реакцию с соединением формулы (V), в растворителе, таком как хлорсодержащий растворитель (дихлорметан, 1,2-дихлорэтан, хлороформ, например), эфир (тетра гидрофура н, диоксан, например), амид (N,N-диметилформамид, например) или пиридин, в инертной атмосфере, при температуре от 0°C до температуры флегмы растворителя, в присутствии третичного амина, такого как триэтиламин, N-метилморфолин, пиридин, 4-диметиламинопиридин или 1,8-диазабицикло[5.4.0]ундец-7-ен.
Соединения формулы (II) могут также быть получены путем реакции соединения формулы
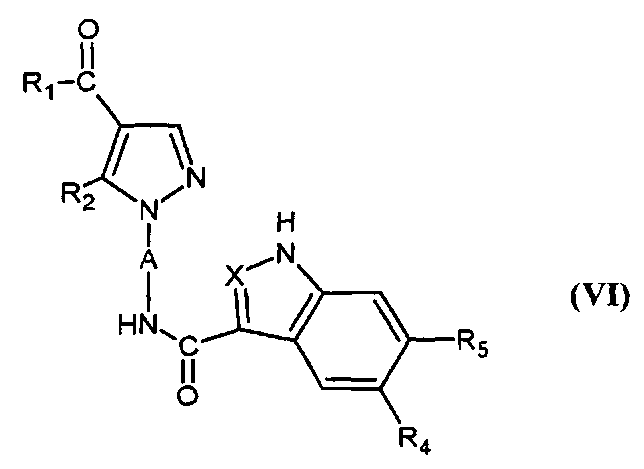 ,
,
в которой A, X, R1, R2, R4 и R5 являются такими, как определено для соединения формулы (I), с соединением формулы
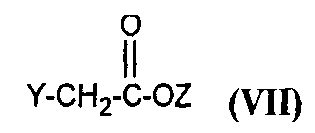 ,
,
в которой Y представляет собой уходящую группу, такую как атом галогена, метансульфонат, бензолсульфонат, p-толуолсульфонат или трифлат, и Z представляет собой (C1-C4)алкил.
Реакцию проводят в присутствии основания, такого как, например, карбонат натрия или карбонат калия, в растворителе, таком как, например N,N-диметилформамид, и при температуре от -20°C до температуры флегмы растворителя.
В частности, определенные соединения формулы (II) могут быть получены из других соединений формулы (II).
Таким образом, например, начиная с соединений формулы (II), в которой R4=Br, возможно получить соединения формулы (II):
- в которой R4=фенил, путем реакции с фенилбороновой кислотой в присутствии палладиевого катализатора, такого как тетракис(трифенилфосфин)палладий(0);
- в которой R4=-NR9R10, путем реакции с амином HNR9R10 в присутствии медного(I) катализатора, такого как йодид меди(I);
- в которой R4=CN, путем реакции с цианидом цинка(II) и в присутствии катализатора, такого как тетракис(трифенилфосфин)палладий(0).
Начиная с соединений формулы (II), в которой:
 возможно получить соединения формулы (II), в которой
возможно получить соединения формулы (II), в которой
 под действием цианида цинка (II) в присутствии Тетракис (трифенилфосфин)палладий(0).
под действием цианида цинка (II) в присутствии Тетракис (трифенилфосфин)палладий(0).
Соединения формулы (III) являются известными, коммерчески доступными или их получают с помощью способов, известных специалисту в настоящей области техники, например, те, что описаны в Публикации международной патентной заявки WO 95/18105.
Соединения формулы (IV) получают путем реакции соединения формулы
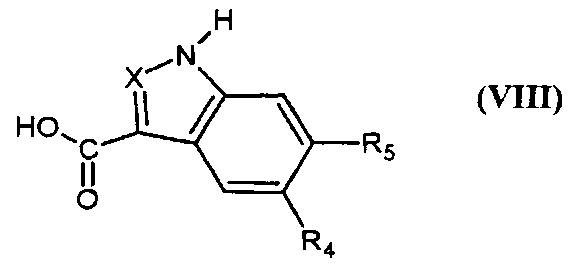 ,
,
в которой X, R4 и R5 являются такими, как определено для соединения формулы (I), с соединением формулы (VII),
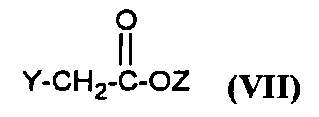 ,
,
в которой Y представляет собой уходящую группу, такую как атом галогена, метансульфонат, бензолсульфонат, p-толуолсульфонат или трифлат, и Z представляет собой (C1-C4)алкил.
Реакцию проводят в присутствии двух эквивалентов сильного основания, например, гидрида натрия, в растворителе, например, N,N-диметилформамиде и при температуре от -30°C до температуры флегмы растворителя.
Соединения формулы (V) получают путем реакции соединения формулы
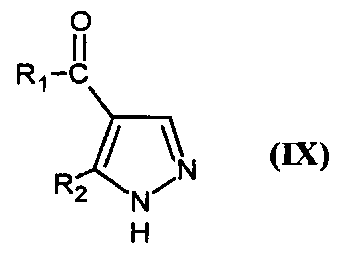 ,
,
в которой R1 и R2 являются такими, как определено для соединения формулы (I), с соединением формулы
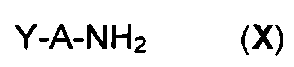 ,
,
в которой A является таким, как определено для соединения формулы (I) и Y представляет собой уходящую группу, такую как атом галогена, метансульфонат, бензолсульфонат, p-толуолсульфонат, трифлат или ацетат.
Реакцию проводят в присутствии основания, например, карбоната калия или карбоната цезия, смешанного с пролином. Реакцию проводят в присутствии металлического средства, например, йодида меди, в растворителе, таком как диметилсульфоксид, диоксан или тетрагидрофуран, например, и при температуре от 0°C до 150°C.
Соединения формулы (V) могут также быть получены путем восстановления соединения формулы
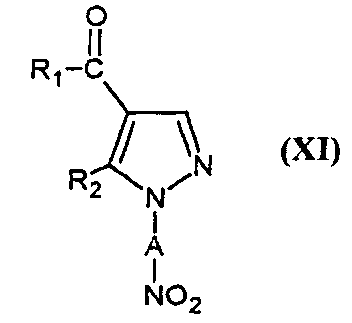 ,
,
в которой R1 и R2 являются такими, как определено для соединения формулы (I).
Реакция восстановления может быть проведена, например, в присутствии металла, такого как железо(0), цинк или олово с кислотой, такой как уксусная кислота, например, в растворителе, например, метаноле, этаноле, воде или смеси этих растворителей и при температуре от 0°C до температуры флегмы растворителя. Восстановление может также быть проведено под давлением водорода в присутствии катализатора, такого как палладий, например.
Соединения формулы (V), в которой R1 представляет собой (С1-C4)алкил, могут также быть получены с помощью кислотного гидролиза соединения формулы
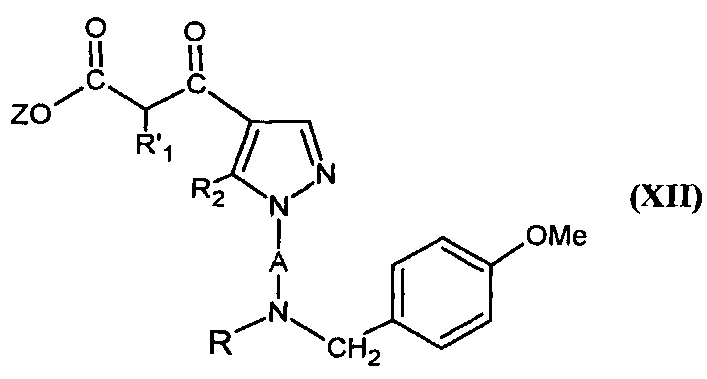 ,
,
в которой А и R2 являются такими, как определено для соединения формулы (I), Z представляет собой (C1-C4)алкил,  представляет собой атом водорода или (C1-C3)алкил и R представляет собой трет-бутоксикарбонил или атом водорода.
представляет собой атом водорода или (C1-C3)алкил и R представляет собой трет-бутоксикарбонил или атом водорода.
Реакцию осуществляют под действием сильной кислоты, например, соляной кислоты в растворителе, таком как вода и при температуре от комнатной температуры до температуры флегмы реакционной смеси.
В частности, определенные соединения формулы (V) могут быть получены из других соединений формулы (V).
Таким образом, например, начиная с соединений формулы (V), в которой A представляет собой не замещенный фенил, могут быть получены соединения формулы (V), в которой
 с R6=Br, путем реакции с N-бромсукцинимидом
с R6=Br, путем реакции с N-бромсукцинимидом
Начиная с этих соединений формулы (V, R6=Br), полученных таким образом, получают соединения формулы (V), в которой
 с R6=CN, путем реакции с цианидом цинка
с R6=CN, путем реакции с цианидом цинка
Начиная с этих соединений формулы (V, R6=CN), полученных таким образом, с помощью основного гидролиза, получают соединения формулы (V), в которой
 с R6=COOH или CONH2
с R6=COOH или CONH2
Начиная с этих соединений формулы (V, R6=COOH), полученных таким образом, получают соединения формулы (V), путем алкилирования, в которой
 c R6=COOAlk
c R6=COOAlk
Соединения формулы (VI) могут быть получены согласно СХЕМЕ I ниже, в которой A, X, R1, R2, R4 и R5 являются такими, как определено для соединения формулы (I), и Pg представляет собой N-защитную группу, предпочтительно ацетильную группу.
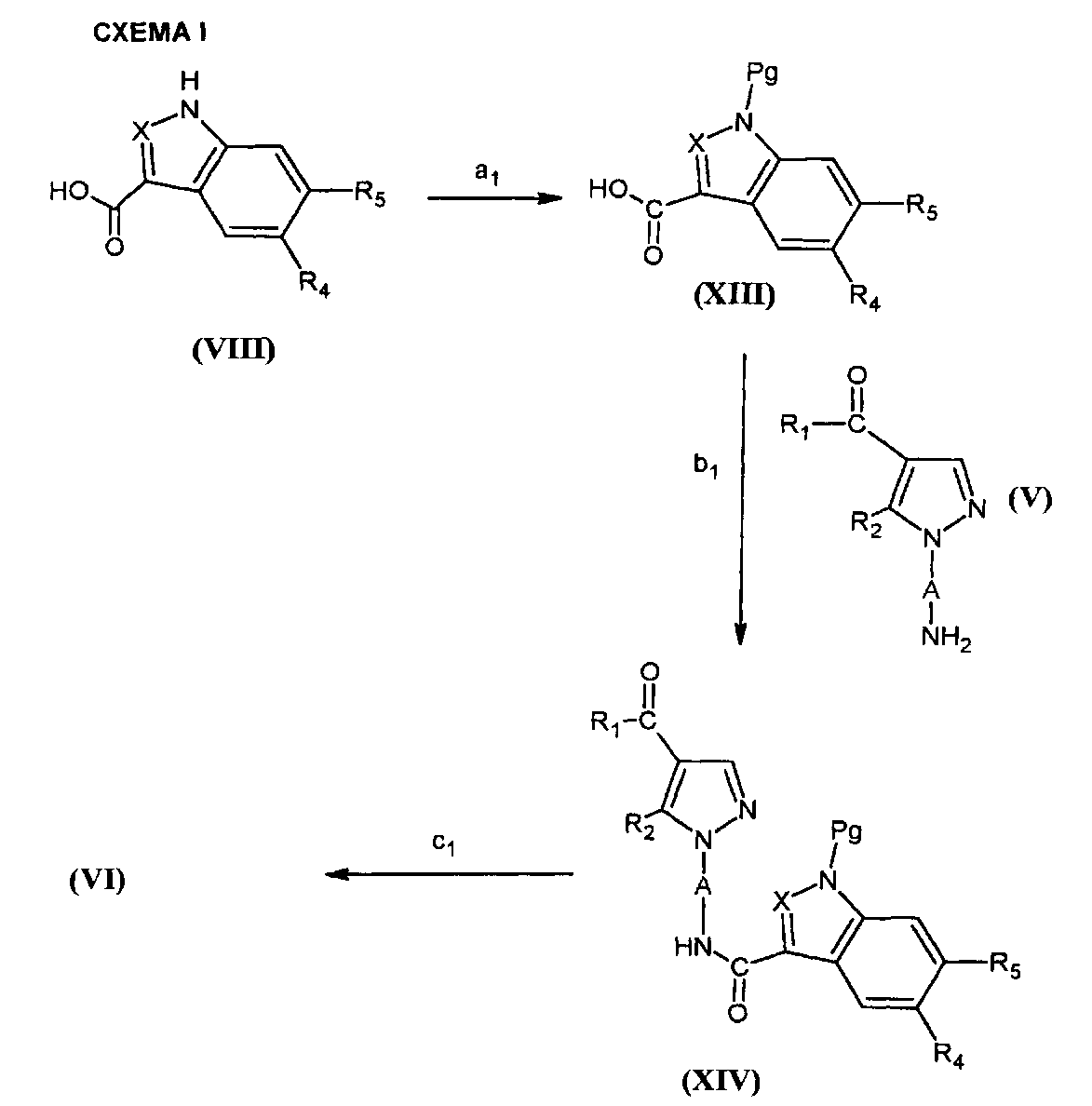
На этапе a1 СХЕМЫ I атом азота соединений формулы (VIII) селективно защищают посредством ацилирующего средства.
На этапе b1 кислота или функциональное производное указанной кислоты формулы (XIII) приводят в реакцию с соединением формулы (V) для получения соединения формулы (XIV). Реакцию проводят согласно способам, описанным выше, путем реакции соединения формулы (IV) с соединением формулы (V).
На этапе c1 с соединения формулы (XIV), полученного таким образом, снимают защитную группу с помощью классических способов.
В частности, определенные соединения формулы (VI) могут быть получены из других соединений формулы (VI). Таким образом, например, начиная с соединений формулы (VI), в которой R4=Br, могут быть получены соединения формулы (VI), в которой R4=Cl путем реакции с хлоридом никеля (II) с помощью классических способов.
Соединения формулы (VII) являются известными, коммерчески доступными или могут быть получены с помощью известных способов.
Соединения формулы (VIII), в которой X=-CH-, могут быть получены согласно адаптации способа, описанного в Journal of Fluorine Chemistry (1977) 10, 437-445 и проиллюстрированного на СХЕМЕ II ниже, в которой R4 и R5 являются такими, как определено для соединения формулы (I).
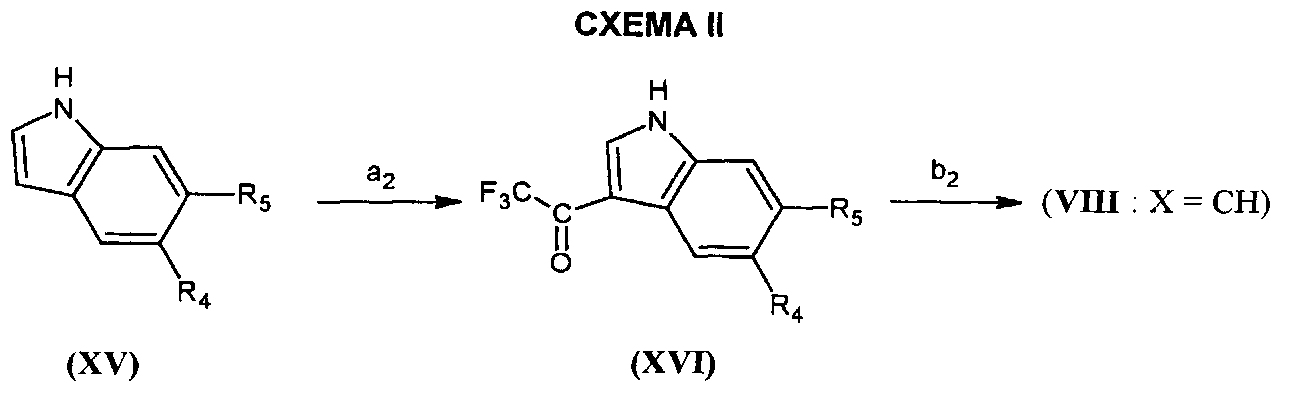
На этапе a2 СХЕМЫ II соединение формулы (XV) приводят в реакцию с трифторуксусным ангидридом в растворителе, таком как, например, диэтиловый эфир и при температуре менее чем или равной 0°C.
На этапе b2 соединение формулы (XVI), полученное таким образом, гидролизуют под действием сильного основания, такого как, например, гидроксид натрия или гидроксид калия. Реакцию проводят в растворителе, например, воде или этаноле и при температуре от комнатной температуры до температуры флегмы растворителя.
Соединения формулы (VIII), в которой X=-CH-, могут также быть получены согласно адаптации способа, описанного в Synthesis (1990) 215-218 и проиллюстрированного на СХЕМЕ III ниже, в которой R4 и R5 являются такими, как определено для соединения формулы (I), и Hal представляет собой атом галогена, предпочтительно бром или йод.
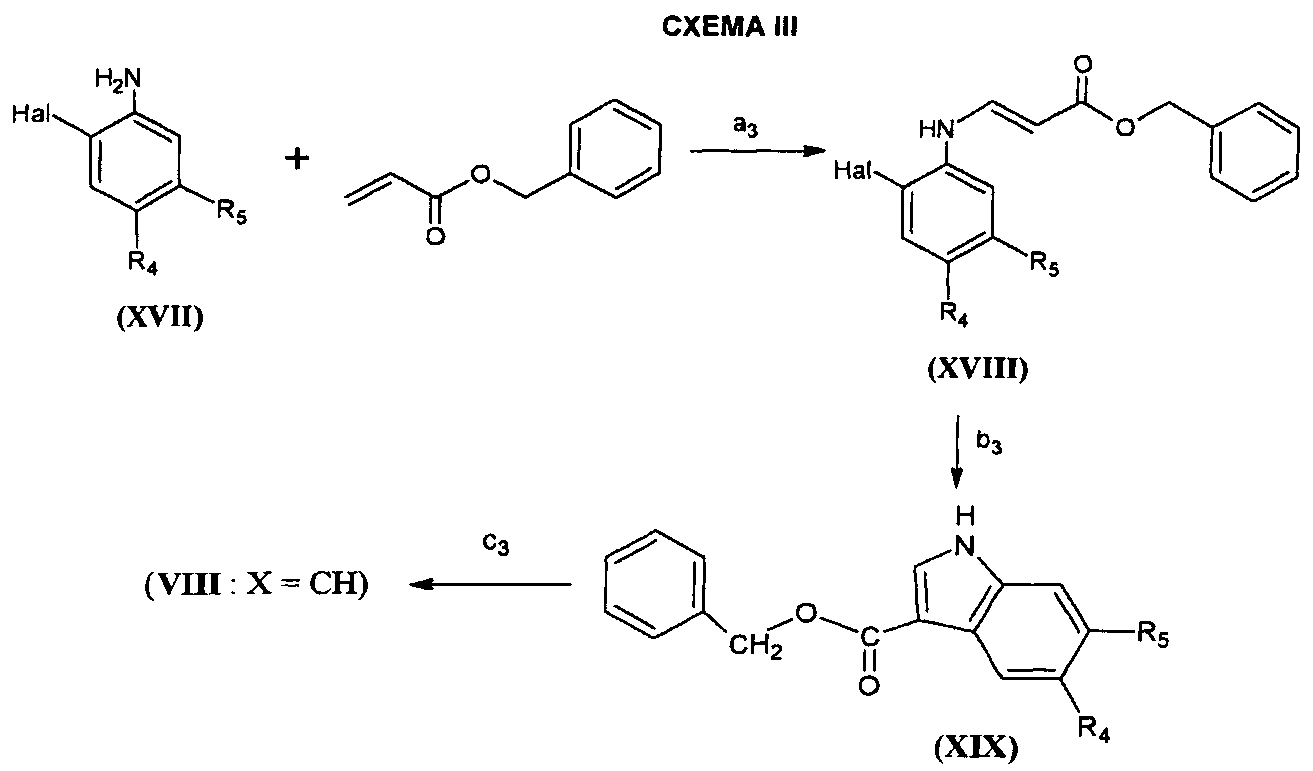
На этапе a3 СХЕМЫ III соединение формулы (XVII) приводят в реакцию с бензилакрилатом в присутствии 1,4-бензохинона, хлорида лития и ацетата палладия. Реакцию проводят в растворителе, например, тетрагидрофуране и при температуре от 0°C до температуры флегмы растворителя.
На этапе b3 соединение формулы (XVIII), полученное таким образом, циклизуют в присутствии основания, такого как, например, триэтиламин или 1,4-диазабицикло[2.2.2]октан и в присутствии палладиевого комплекса, такого как, например, ацетат палладия. Реакцию проводят в растворителе, например, N,N-диметилформамиде и при температуре от комнатной температуры до 130°C.
На этапе c3 соединение формулы (XIX), полученное таким образом, дебензилируют согласно известным способам (Protective Groups in Organic Synthesis, Greene et al., 4th Edition, John Wiley & Sons, Inc., New York, 2007) для получения предполагаемой кислоты формулы (VIII).
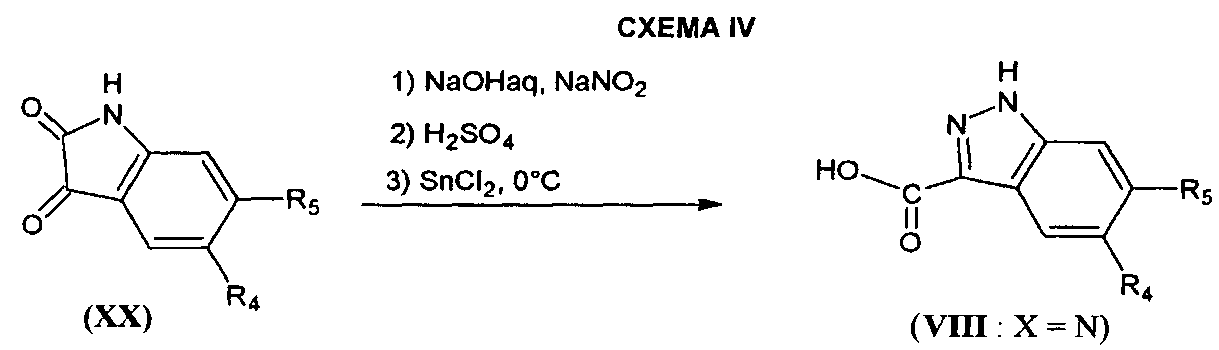
Соединения формулы (VIII), в которой X=N, могут быть получены с помощью способа, описанного в Synthetic Communications (2005) 35 (20), 2681-2684 и проиллюстрированного на СХЕМЕ IV ниже, в которой R4 и R5 являются такими, как определено для соединения формулы (I).
Соединения формулы (IX), в которой R1=(C1-C4)алкил, могут быть получены согласно СХЕМЕ V ниже, в которой R2 является таким, как определено для соединения формулы (I), Pg представляет собой защитную группу, предпочтительно группу тритила.
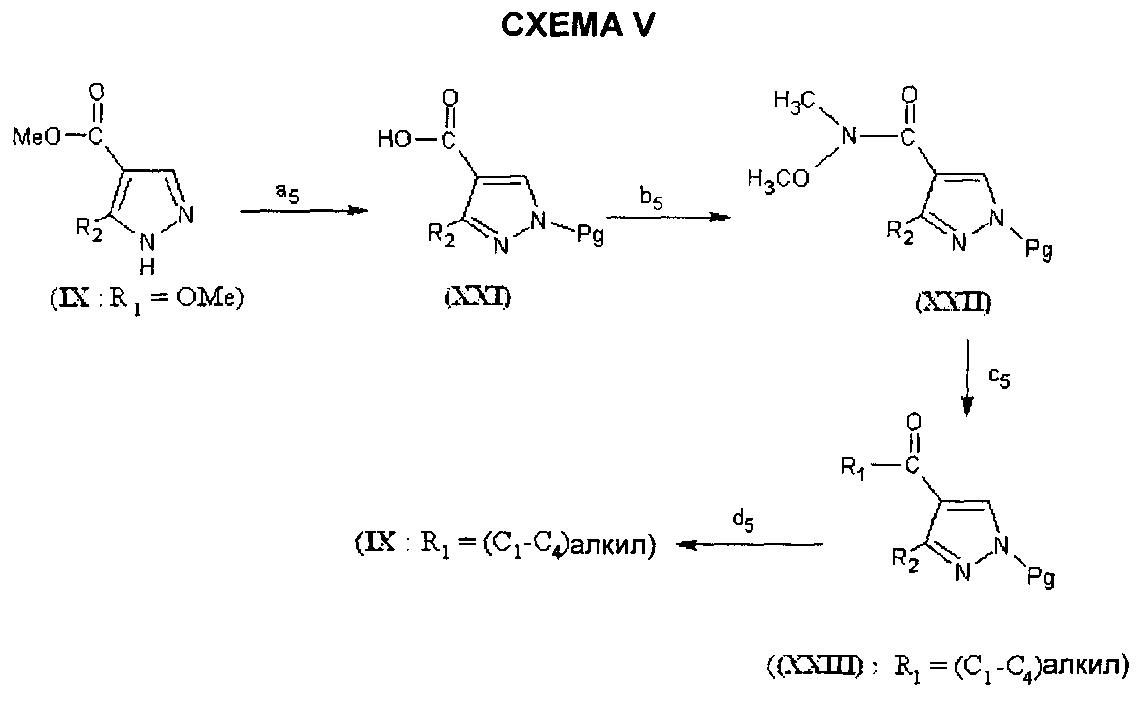
На этапе a5 СХЕМЫ V атом азота соединения формулы (IX) защищают, в частности, с помощью группы тритила, затем полученное промежуточное соединение гидролизуют в основной среде.
На этапе b5 соединение формулы (XXI), полученное таким образом, приводят в реакцию с N-метоксиметанамином в присутствии связывающего средства, такого как, например, бис(2-оксо-1,3-оксазолидин-3-ил)фосфиновый хлорид и в присутствии основания, такого как, например, 4-диметиламинопиридин. Реакцию проводят в растворителе, например, дихлорметане и при температуре от 0°C до комнатной температуры.
Соединение формулы (XXII), полученные таким образом, приводят в реакцию на этапе cs с органометаллическим соединением, таким как (C1-C4)алкилмагнийгалид, в растворителе, таком как, диэтиловый эфир или тетрагидрофуран и при температуре от -70°C до комнатной температуры.
С соединения формулы (XXIII), полученного таким образом, снимают защитную группу на этапе d5 с помощью классических способов (Protective Groups in Organic Synthesis, Greene et al., 4th Edition, John Wiley & Sons, Inc., New York, 2007).
Соединения формулы (IX), в которой R1=(C1-C4)алкил, могут также быть получены согласно СХЕМЕ VI ниже, в которой R2 является таким, как определено для соединения формулы (I), Pg представляет собой защитную группу, предпочтительно группу тритила, Z представляет собой (C1-C4)алкил и 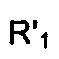 представляет собой атом водорода или (C1-C3)алкил.
представляет собой атом водорода или (C1-C3)алкил.
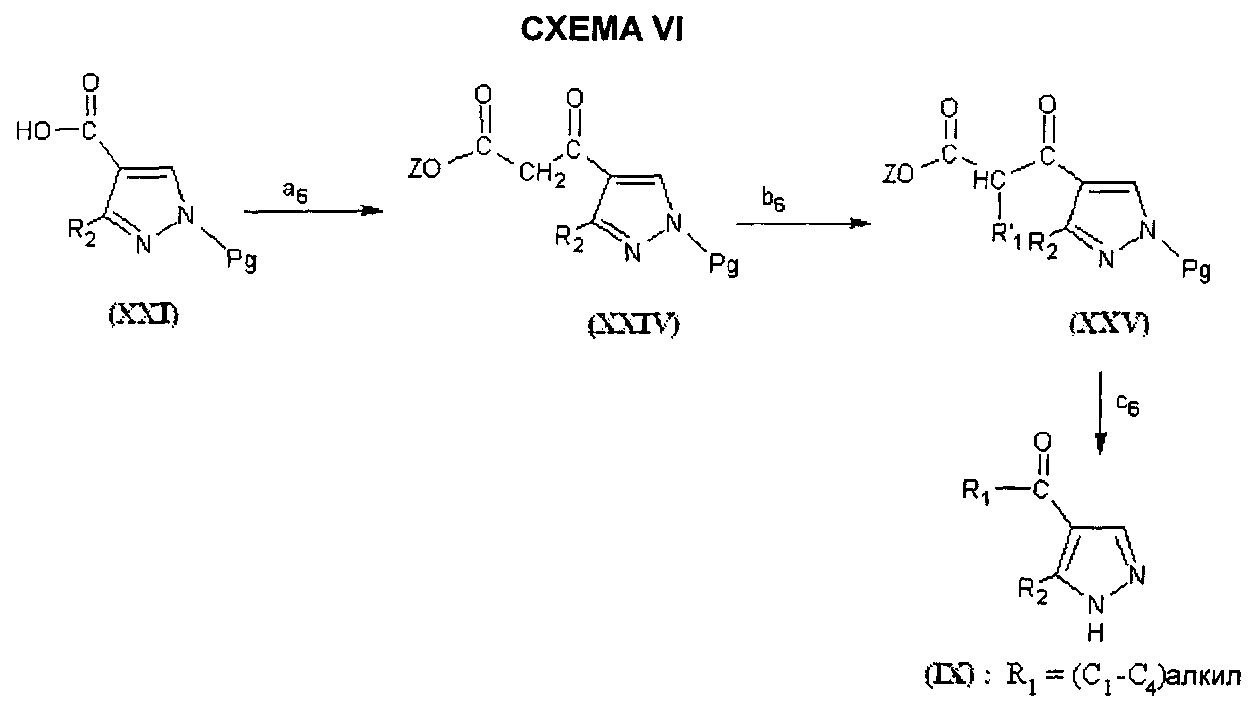
На этапе a6 СХЕМЫ VI соединение формулы (XXI) приводят в реакцию с 1,1′-карбонилдиимидазолом, затем без выделения промежуточное соединение, полученное таким образом, обрабатывают магниевой солью полуэфира малоновой кислоты согласно способу, описанному в Angew. Chem. Int. Ed. Engl (1979) 18 (1), 72-74.
На этапе b6 соединение формулы (XXIV), полученное таким образом, алкилируют путем реакции (C1-C3)алкилгалида, мезилата или тозилата в присутствии сильного основания, такого как, например, гидрид натрия, в растворителе, например, тетрагидрофуране и при температуре от 0°C до комнатной температуры.
На этапе c6 соединение формулы (XXV), полученное таким образом, гидролизуют в кислой среде. Реакцию осуществляют под действием сильной кислоты, такой как, например, соляная кислота, в растворителе, таком как, вода и при температуре от комнатной температуры до 105°C. Спонтанное декарбоксилирование, которое происходит в результате, способно создать соединение формулы (IX).
Соединения формулы (IX), в которой R1=(C1-C4)алкокси, являются известными, коммерчески доступными или их получают согласно известным способам (Synlett (2004) 4, 703-707).
Соединения формулы (X) являются известными, коммерчески доступными или их получают согласно известным способам (Tetrahedron (1988) 44 (10), 2977-2983; J. Org. Chem. (2008) 73 (23), 9326-9333).
Соединения формулы (XI), в которой R1=(C1-C4)алкил, получают согласно СХЕМЕ VII ниже, в которой A и R2 являются такими, как определено для соединения формулы (I), Z представляет собой (C1-C4)алкил и 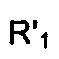 представляет собой атом водорода или (C1-C3)алкил.
представляет собой атом водорода или (C1-C3)алкил.

Этапы a7, b7 и c7 СХЕМЫ VII проводят согласно аналогичным протоколам, которые описаны для этапов a6, b6 и c6 СХЕМЫ VI.
Соединения формулы (XII) могут также быть получены согласно СХЕМЕ VIII ниже, в которой A и R2 являются такими, как определено для соединения формулы (I), Z представляет собой (C1-C4)алкил, 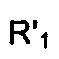 представляет собой атом водорода или (С1-C3)алкил, Y представляет собой уходящую группу, как определено ранее и Boc представляет собой ллрет-бутоксикарбонил.
представляет собой атом водорода или (С1-C3)алкил, Y представляет собой уходящую группу, как определено ранее и Boc представляет собой ллрет-бутоксикарбонил.
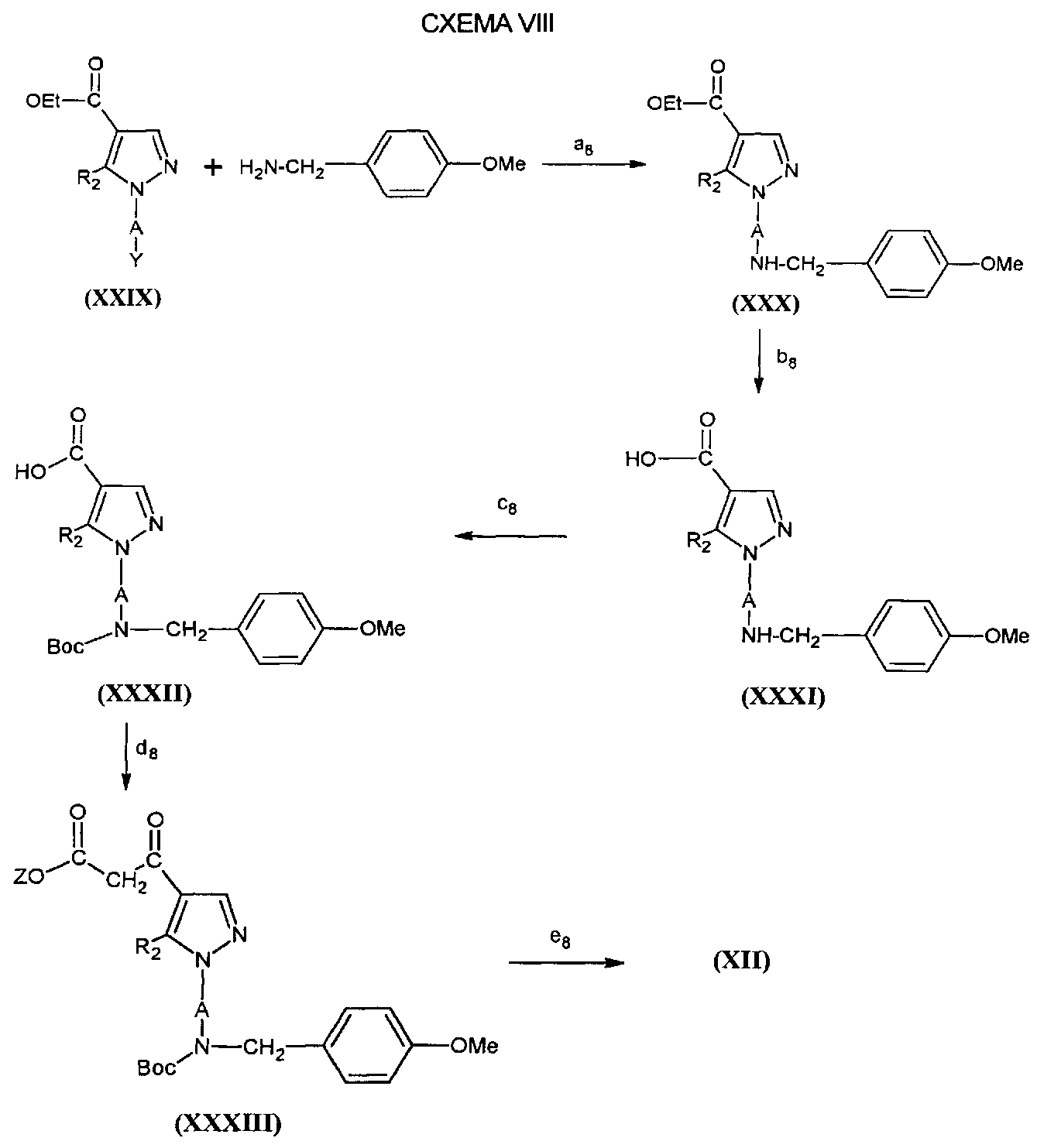
На этапе a8 СХЕМЫ VIII соединение формулы (XXIX) приводят в реакцию с 4-метоксибензиламином в растворителе, таком как диоксан и при температуре флегмы растворителя.
На этапе b8 соединение формулы (XXX), полученное таким образом, гидролизуют в основной среде с основанием, таким как гидроксид калия для получения кислоты формулы (XXXI).
На этапе c8 соединение формулы (XXXI) защищают с помощью группы Boc в присутствии оснований, таких как триэтиламин или 4-диметиламинопиридин, в растворителе, таком как DMF.
Этапы d8 и е8 проводят согласно аналогичным протоколам, как те, что описаны для этапов a6 и b6 СХЕМЫ VI.
Соединения формулы (XV), (XVII), (XX) являются известными, коммерчески доступными или могут быть получены известными способами.
Соединения формулы (XXVI) являются известными, коммерчески доступными или их получают согласно способам, описанным в Европейском патенте ЕР 1176140.
Соединения формулы (XXIX), в которой A представляет собой радикал пиридазинил получают согласно способу, описанному в J. Heterocyclic Chem. (2009) 46, 584-590.
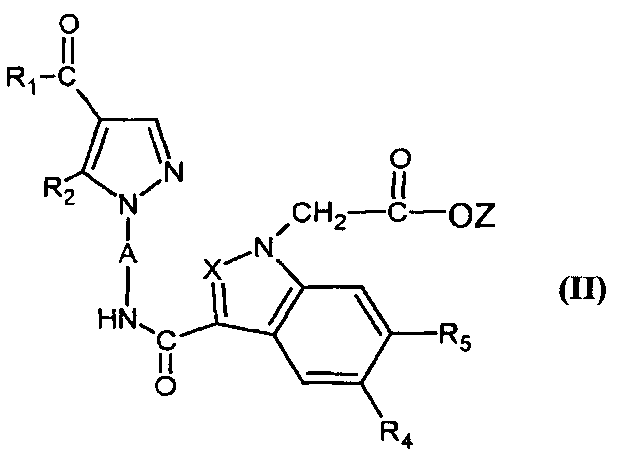
Согласно другому из его аспектов настоящее изобретение также относится к новым соединениям формулы (II). Эти соединения являются применимыми в качестве промежуточного соединения синтеза для соединений формулы (I).
Таким образом, настоящее изобретение относится к соединениям формулы,
в которой: - A представляет собой двухвалентный ароматический радикал, выбранный из:
 ;
;  ;
;  ;
;  ;
;
- X представляет собой группу -CH- или атом азота;
- R1 представляет собой (C1-C4)алкил или (C1-C4)алкокси;
- R2 представляет собой группу Alk;
- R4 представляет собой атом водорода, атом галогена, циано, фенил, группу Alk, группу OAlk или группу -NR9R10;
- R5 представляет собой атом водорода, атом галогена или группу Alk;
- R6 представляет собой атом водорода, атом галогена, циано, группу -COOAlk или группу -CONH2;
- R9 и R10 представляют, каждый независимо, атом водорода или (C1-C4)алкил;
- Z представляет собой (C1-C4)алкил;
- Alk представляет собой (C1-C4)алкил, не замещенный или замещенный один или несколько раз атомом фтора.
Согласно другому из его аспектов настоящее изобретение также относится к применению соединений формулы (I), как они есть или в радиоактивно меченой форме в качестве фармакологических инструментов для людей или животных для обнаружения и мечения пуринергического рецептора P2Y12.
В следующих примерах описывается получение некоторых соединений согласно настоящему изобретению. Эти примеры не являются ограничивающими и предусмотрены исключительно для иллюстрации настоящего изобретения. Номера соединений в примерах ссылаются на номера, представленные в ТАБЛИЦАХ X-XV ниже, которые иллюстрируют химические структуры и физические свойства некоторых соединений согласно настоящему изобретению.
Следующие сокращения применяют в получениях и в примерах:
Me: метил
Et: этил
n-Pr: н-пропил
Ph: фенил
эфир: диэтиловый эфир
изоэфир: диизопропиловый эфир
DMSO: диметилсульфоксид
DMF: N,N-диметилформамид
THF: тетрагидрофуран
DCM: дихлорметан
EtOAc: этила цетат
DMAP: 4-диметиламинопиридин
DIPEA: диизопропилэтиламин
HOAT: 1-гидрокси-7-азабензотриазол
HOBT: 1-гидроксибензотриазол
TFA: трифторуксусная кислота
BOP: бензотриазол-1-илокситрис(диметиламино)фосфонийгексафторфосфат
BOP-Cl: бис(2-оксо-1,3-оксазолидин-3-ил)фосфиновый хлорид
EDC: 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид
NaOH: гидроксид натрия
KOH: гидроксид калия
HCl: соляная кислота
NaBH4: борогидрид натрия
NaHCO3: гидрокарбонат натрия
NaH: гидрид натрия
Na2SO4; сульфат натрия
1N или 2N эфир соляной кислоты: 1N или 2N раствор соляной кислоты в диэтиловом эфире
1N (или 2N) HCl в эфире: 1N (или 2N) раствор соляной кислоты в диэтиловом эфире
4N HCl в диоксане: 4N раствор соляной кислоты в диоксане
т.п.: точка плавления
КТ: комнатная температура
т.к.: точка кипения
ВЭЖХ: высокоэффективная жидкостная хроматография
Солевой раствор: насыщенный раствор хлорида натрия в воде.
Спектры протонного ядерного магнитного резонанса (1H ЯМР) записывают на спектрометрах Bruker (250 и 400 МГц) в DMSO-d6. Химические сдвиги δ выражают в частях на миллион (ppm). Следующие сокращения применяют для интерпретации спектров: s: синглет, d: дублет, t: триплет, q: двадруплет: m: массив, mt: мультиплет, bs: широкий синглет, dd: дублет дублетов, br: широкий пик.
Соединения согласно настоящему изобретению анализируют с помощью комбинированной ВЭЖХ-УФ-МС (жидкостная хроматография/УФ-детектирование/масс-спектроскопия).
Применяемое оборудование состоит из хроматографической цепи, оснащенной диодно-матричным детектором и квадрупольным масс-спектрометром. Измеряют молекулярный пик (МН+) и время удерживания (tR) в минутах.
Способ A: WatersXBridge C18, 4,6×50 мм, 2,5 мкм
Растворитель A: вода + 0,05% TFA
Растворитель B: MeCN+0,05% TFA
1,3 мл/мин; 40°C; Waters LCT classic TOF-MS
|
Способ B: Waters XBridge C18 4,6×50 мм, 2,5 мкм,
Растворитель A: вода + 0,1% муравьиной кислоты
Растворитель B: MeCN + 0,08% муравьиной кислоты
1,3 мл/мин; 20°C; Waters Ultima Triple Quad MS
|
|
Способ C: YMC-Pack Jsphere Н80 33×2,1 мм, 4,0 мкм
Растворитель A: вода + 0,05% TFA
Растворитель B: метанол + 0,05% TFA
1,0 мл/мин; 20°C; Waters LCT classic TOF-MS, 8-канальный Mux
|
Способ D: WatersXBridge С18, 4,6×50 мм, 2,5 мкм
Растворитель A: вода + 0,05% TFA
Растворитель B: MeCN + 0,05% TFA
1,7 мл/мин, 40°C; Waters LCT classic TOF-MS
|
Способ E: Waters XBridge C18 4,6×50 мм; 2,5 мкм
Растворитель A: вода + 0,1% муравьиной кислоты
Растворитель B: MeCN + 0,1% муравьиной кислоты
1,3 мл/мин, 45°C; Waters ZQ Single Quadrupole
|
|
Способ т.п.: Merck Chromolith FastGrad. RP-18e, 50×2 мм
Растворитель A: вода + 0,05% TFA
Растворитель B: MeCN + 0,05% TFA
2,4 мл/мин, 50°C; Waters LCT classic TOF-MS
|
Способ G: серия Agilent 1100. Symmetry C18 3,5 мкм (2,1×50 мм, Waters)
Растворитель A: вода + 0,005% TFA
Растворитель B: MeCN + 0,005% TFA
0,4 мл/мин, 25°C; MSD SL (Agilent) ESI+.
|
Способ H: серия Agilent 1100. Symmetry С18 3,5 мкм (2,1×50 мм, Waters)
Растворитель A: вода + 0,005% TFA
Растворитель B: MeCN + 0,005% TFA
0,4 мл/мин, 25°C; MSD SL (Agilent) ESI+.
|
Способ I: серия Agilent 1100. X Terra C18 3,5 мкм (2,1×50 мм, Waters)
Растворитель A: аммонийацетатный буфер 10 мМ pH 7
Растворитель B: MeCN
0,4 мл/мин, 30°C; MSD SL (Agilent) ESI+.
|
Способ J: Waters UPLC ВЕН. С18 2,1×50 мм; 1,7 мкм
Растворитель A: вода + 0,05% муравьиной кислоты
Растворитель В: MeCN + 0,035% муравьиной кислоты
0,9 мл/мин; 55°C
|
Спектры масс-спектрометрии записывают в положительном режиме электрораспыления (ESI), для того чтобы наблюдать ионы, полученные от протонирования анализируемых соединений (МН+), или от образования аддуктов с другими катионами, такими как Na+, K+ и т.д.
ПОЛУЧЕНИЯ
1. Получения соединений формулы (XVI).
Получение 1.1
1-(5-бром-1H-индол-3-ил)-2,2,2-трифторэтанон.
(XVI): R4=Br; R5=H.
Раствор 21,3 мл трифторуксусного ангидрида в 70 мл эфира добавляют по каплям к раствору 20 г 5-броминдола в 250 мл эфира, охлажденного до -5°C. Его перемешивают в течение 2 часов при -5°C. Образованный осадок отфильтровывают и отмывают эфиром. 24,5 г предполагаемого соединения получают в форме белого порошка.
т.п.=254°C
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 7,50 (1H, d); 7,58 (1H, d); 8,31 (1H, s); 8,55 (1H, s); 12,85 (1H, br).
Следуя процедуре, описанной в получении 1.1, получают 3-трифторацетилиндолы формулы (XVI), представленные в ТАБЛИЦЕ I ниже:

2. Получения соединений формулы (VIII: X=CH).
Получение 2.1
5-бром-1H-индол-3-карбоновая кислота
(VIII): X=CH; R4=Br; R5=H.
24 г соединения, полученного в Получении 1.1, добавляют к раствору 46,1 г гидроксида калия в 25 мл воды, и нагревают в течение 4 часов с обратным холодильником. Реакционную смесь охлаждают и отмывают эфиром. Водную фазу охлаждают до 5°C и затем нейтрализуют с помощью раствора фосфатного буфера, предварительно нагруженного 35% соляной кислотой. Образованный осадок отфильтровывают и отмывают водой. 15,6 г предполагаемого соединения получают в форме белого порошка, т.п.=234°C.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 7,32 (1H, d); 7,46 (1H, d); 8,06 (1H, s); 8,14 (1H, s); 12,00 (2Н, br).
Следуя процедуре, описанной в получении 2.1, получают 3-карбоксииндолы формулы (VIII: X=CH), представленные в ТАБЛИЦЕ II ниже:
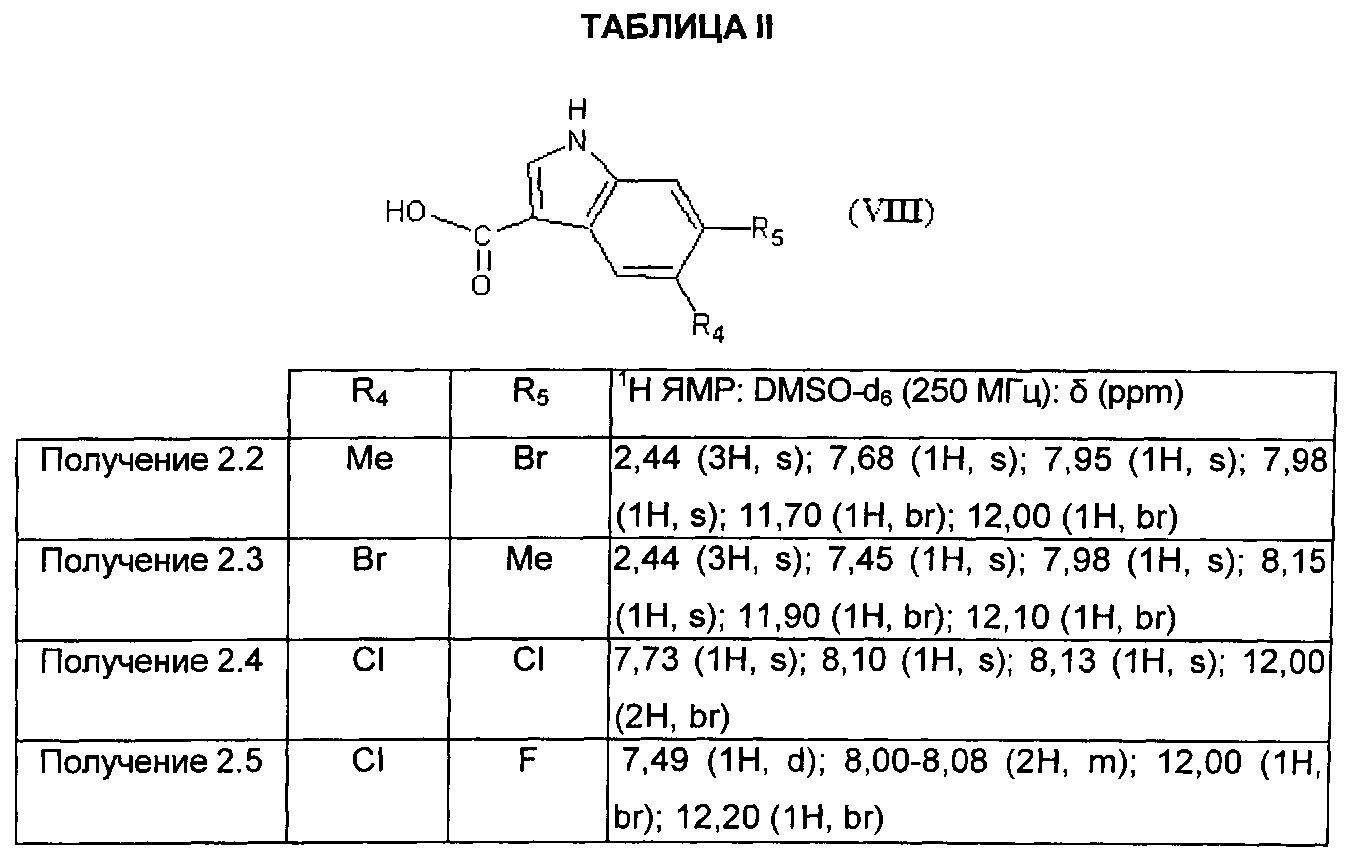
Получение 2.6
5,6-диметил-1H-индол-3-карбоновая кислота.
(VIII): X=CH; R4=Me; R5=Me.
Этап 1: 3-[(2-йод-4,5-диметилфенил)амино]бензил акрилат (XVIII)
60,8 г хлорида лития добавляют к раствору 15,5 г [1,4]-бензохинона в 350 мл THF, и полученное дегазируют с помощью азота. 3,2 г ацетата палладия и 23,7 г бензилакрилата добавляют и полученное дегазируют с помощью азота в течение приблизительно 30 минут. Затем раствор 35,1 г 2-йод-4,5-диметиланилин (полученный согласно J. Med. Chem 2001, 44, 3856-3871) в 150 мл THF добавляют и полученное перемешивают в течение ночи. Полученное фильтруют и фильтрат испаряют. Твердый остаток, полученный таким образом, растирают с эфиром. Полученное фильтруют, фильтрат отмывают раствором NaOH 0,5N и затем водой и солевым раствором. Полученное испаряют и затем твердый остаток очищают с помощью хроматографии с силикагелем, элюируя смесью циклогексан/EtOAc (8/2; объем/объем). 57,6 г предполагаемого соединения получают в форме белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 2,14 (3Н, s); 2,19 (3Н, s); 4,93 (1H, d); 5,18 (2Н, s); 7,23 (1H, s); 7,30-7,45 (5Н, m); 7,59 (1H, s); 7,72 (1H, dd); 10,05 (1H, d).
Следуя аналогичной процедуре, получают соединение формулы (XVIII), показанное ниже:
|
Этап 2: бензил 5,6-диметил-1H-индол-3-карбоксилат (XIX)
8,60 г 1,4-диазабицикло[2.2.2]октана добавляют к раствору 25,5 г соединения, полученного на этапе 1 в 120 мл DMF. Полученное дегазируют с помощью азота, затем 0,703 г ацетата палладия добавляют и реакционную смесь нагревают при 120°C в течение 7 часов. Добавляют EtOAc, затем полученное отмывают водой и солевым раствором, высушивают над Na2SO4 и испаряют. После измельчения в порошок твердого остатка с изоэфиром 12,3 г предполагаемого соединения получают в форме бежевого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 2,29 (3Н, s); 2,30 (3Н, s); 5,32 (2Н, s); 7,24 (1H, s); 7,30-7,50 (5Н, m); 7,76 (1H, s); 7,98 (1H, d); 11,70 (1H, br).
Следуя аналогичной процедуре, получают соединение формулы (XIX), представленное ниже.
|
Этап 3: 5,6-диметил-1H-индол-3-карбоновая кислота
0,54 г Pd/C в концентрации 10% и 16,9 г формата аммония добавляют к раствору 5 г соединения, полученного на этапе 2 в 120 мл МеОН. Полученное нагревают с обратным холодильником в течение 2 часов. Полученное фильтруют на тальке и фильтрат испаряют.
Твердый остаток экстрагируют с EtOAc. Полученное отмывают 0,1N раствором HCl, высушивают над Na2SO4 и испаряют до сухого состояния. 2,87 г предполагаемого соединения получают в форме белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 2,31 (6Н, s); 7,23 (1H, s); 7,77 (1H, s); 7,85 (1H, s); 11,50 (1H, br); 11,80 (1H, br).
Следуя аналогичной процедуре, получают соединение формулы (VIII: X=СН), представленное ниже:
|
3-карбоксииндазолы (соединения формулы VIII, X=N) синтезируют из коммерческого изатина согласно способу, описанному в Synthetic Communications (2005), 2681-2684.
3. Получения соединений формулы (IV).
Получение 3.1
5-хлор-1-(2-метокси-2-оксоэтил)-1H-индол-3-карбоновая кислота.
(IV): X=CH; R4=Cl; R5=Н; Z=Me.
110 мл раствора, содержащего 10 г 5-хлор-1H-индол-3-карбоновую кислоту (коммерческую) в DMF, добавляют по каплям к смеси 4,50 г NaH (60% в масле) в 400 мл DMF при -10°C. После этого полученное возвращают до КТ, перемешивают в течение 1 часа. Реакционную смесь охлаждают до -20°C. 4,86 мл метилбромацетата добавляют по каплям, полученное возвращают до КТ в течение периода, составляющего 5 часов, и перемешивают в течение 15 часов. Реакционную смесь добавляют к 1 л смеси EtOAc/1N HCl, органическую фазу собирают и водную фазу экстрагируют с EtOAc. Органические фазы комбинируют, отмывают водой и солевым раствором, затем высушивают над Na2SO4 и испаряют до сухого состояния. 8,9 г предполагаемого соединения получают в форме белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 3,70 (3Н, s); 7,26 (1H, d); 7,57 (1H, d); 7,98 (1H, s); 8,12 (1H, s); 12,3 (1H, br).
Следуя процедуре, описанной в получении 3.1, получают соединения формулы (IV), в которой X=CH и Z=Me, представленные в ТАБЛИЦЕ III ниже:
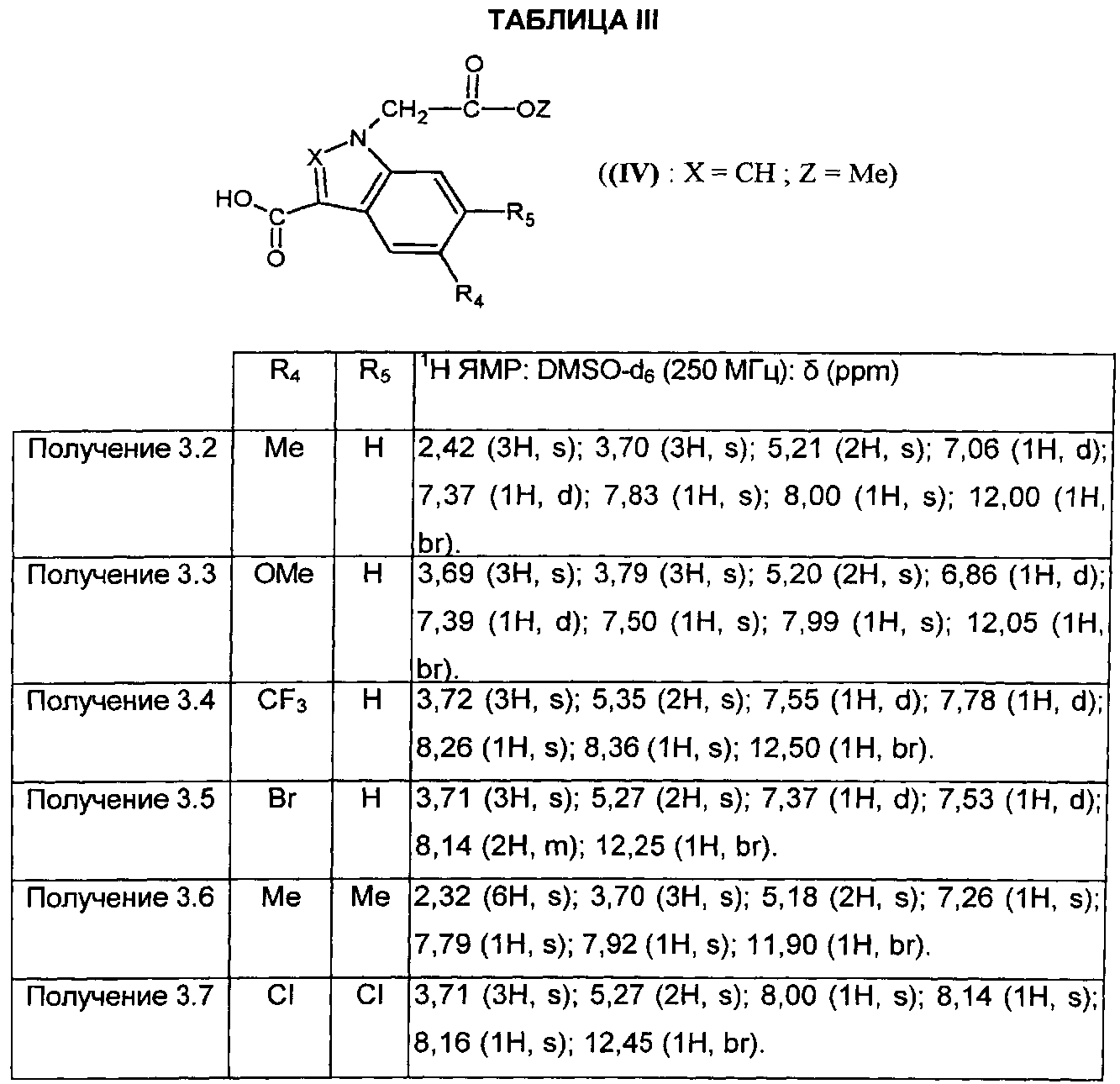
4. Получения соединений формулы (XIII).
Получение 4.1
1-ацетил-5-хлор-6-фтор-1H-индол-3-карбоновая кислота.
(XIII): X=CH; R4=Cl; R5=F; Pg=-COMe.
Раствор 4,4 г соединения из Получения 2.5 в 100 мл DCM охлаждают до 0°C, добавляют 6,28 мл триэтиламина и 0,51 г DMAP и затем, по каплям, 1,47 мл ацетилхлорида и полученное перемешивают в течение 3 часов. Реакционную смесь отмывают 1N раствором HCl и затем водой, насыщенным раствором NaCl, органическую фазу высушивают над Na2SO4 и растворитель испаряют под вакуумом. 4,82 г предполагаемого соединения получают в форме белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 2,74: s: 3Н; 8,13: d: 1H; 8,25: d: 1H; 8,52: s: 1H; 13,10: br: 1H.
Следуя процедуре, описанной в получении 4.1, получают соединения формулы (XIII), в которой Pg=-COMe, представленные в ТАБЛИЦЕ IV ниже:
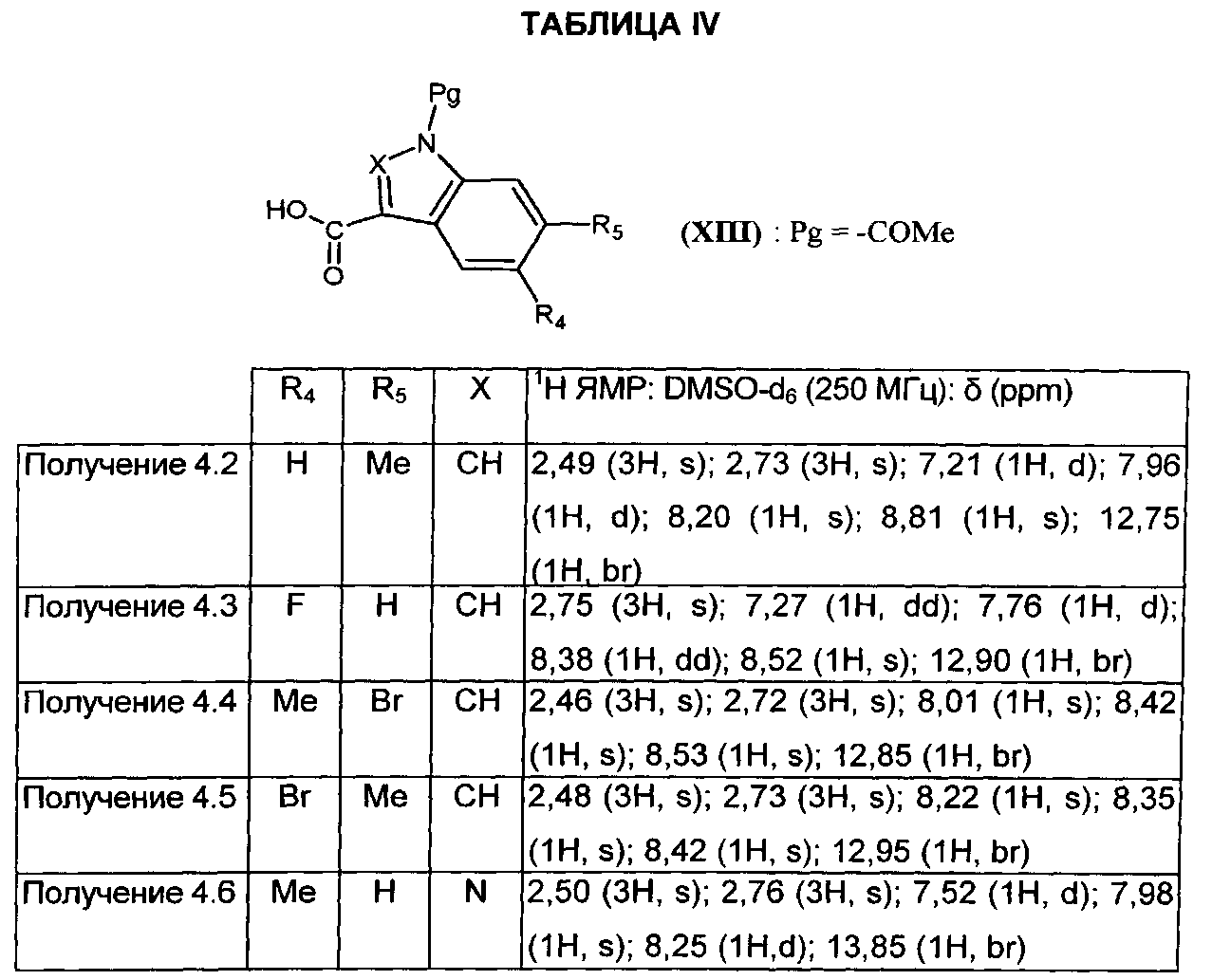
5. Получения соединений формулы (IX).
Получение 5.1
1-(5-метил-1H-пиразол-4-ил)бутан-1-он.
(IX): R1=n-Pr; R2=Me.
Этап 1: 3-метил-1-тритил-1H-пиразол-4-карбоновая кислота (XXI)
8,46 г карбоната калия и 15,8 г хлоридтритила добавляют к раствору 6,60 г метил 5-метил-1H-пиразол-4-карбоксилата в 50 мл DMF. Через 5 дней при КТ добавляют EtOAc, полученное отмывают водой, солевым раствором, высушивают над Na2SO4 и испаряют до сухого состояния. Масляный остаток, полученный таким образом, растворяют в 100 мл смеси EtOH/вода (50/50; объем/объем), 9,95 г гидроксида калия добавляют и полученное нагревают с обратным холодильником в течение 6 часов. Реакционную смесь фильтруют, пока она горячая, фильтрат концентрируют и подкисляют с помощью 1N раствора HCl. Осадок, который образовался, отфильтровывают, высушивают под вакуумом и затем отмывают смесью EtOAc/изоэфир (50/50; объем/объем) и высушивают под вакуумом. 9,70 г предполагаемого соединения получают в форме белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 2,33 (3Н, s); 7,03-7,09 (6Н, m); 7,34-7,43 (9Н, m); 7,61 (1H, s).
Этап 2: N-метокси-N,3-диметил-1-тритил-1H-пиразол-4-карбоксамид (XXII)
10,3 г DMAP и 10,3 г BOP-Cl добавляют к раствору 9,70 г соединения, полученного в предыдущем этапе, в 100 мл DCM. Затем 3,85 г N-метоксиметанамина гидрохлорида добавляют в пропорциях и перемешивают в течение 1 часа при KT. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют с EtOAc, полученное отмывают водой, солевым раствором, высушивают над Na2SO4 и затем испаряют до сухого состояния. Полученное растирают с изоэфиром, фильтруют и высушивают в вакуумной сушильной камере. 10,4 г предполагаемого соединения получают в форме белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 2,34 (3Н, s); 3,13 (3Н, s); 3,39 (3Н, s); 7,05-7,15 (6Н, m); 7,33-7,44 (9Н, m); 7,71 (1H, s).
Этап 3: 1-(3-метил-1-тритил-1H-пиразол-4-ил)бутан-1-он (XXIII)
32,7 мл 2М раствора н-пропилмагнийхлорида в эфире добавляют по каплям к раствору 10,4 г соединения, полученного в предыдущем этапе, в 130 мл THF при -30°C. Полученное возвращают до КТ и затем перемешивают в течение 4 часов. Реакционную смесь охлаждают до -30°C и затем добавляют 50 мл воды (вначале по каплям). Полученное возвращают до КТ, добавляют 250 мл 1N раствора HCl и затем полученное экстрагируют с EtOAc. Полученное отмывают водой, солевым раствором, высушивают над Na2SO4 и затем испаряют до сухого состояния. Полученное растирают в изоэфире, фильтруют и высушивают в вакуумной сушильной камере. 8,4 г предполагаемого соединения получают в форме белого порошка.
1H ЯМР: DMSO-d6 (400 МГц): δ (ppm): 0,84 (3Н, t); 1,52 (2Н, секстет); 2,34 (3Н, s); 2,62 (2Н, t); 7,04-7,12 (6Н, m); 7,33-7,45 (9Н, m); 7,93 (1H, s).
Этап 4: 1-(5-метил-1H-пиразол-4-ил)бутан-1-он
Суспензию 8,4 г соединения, полученного в предыдущем этапе, в 50 мл 4N HCl в диоксане перемешивают в течение 6 часов. Полученное испаряют до сухого состояния, растирают с изоэфиром, фильтруют и высушивают в вакуумной сушильной камере. 3,1 г предполагаемого соединения получают в форме бесцветной смолы.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,90 (3Н, t); 1,58 (2Н, секстет); 2,39 (3Н, s); 2,71 (2H,t); 8,15(1H, s).
6. Получения соединений формулы (V).
Получение 6.1
1-[1-(5-аминопиразин-2-ил)-5-метил-1H-пиразол-4-ил]бутан-1-он.
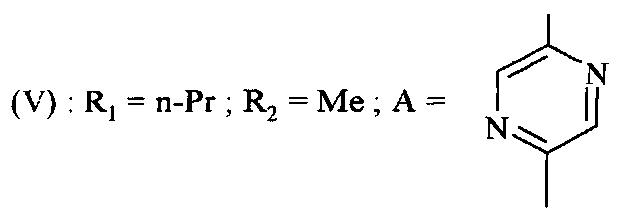
Смесь 0,60 г соединения из Получения 5,1, 1,37 г 5-бром-пиразин-2-иламина (X), 1,36 г карбоната калия, 0,38 г пролина и 0,23 г йодида меди(1) в 15 мл DMSO нагревают при 130°C в течение 20 часов. Добавляют 100 мл воды и полученное экстрагируют с DCM. Органическую фазу отмывают насыщенным раствором бикарбоната натрия и затем солевым раствором, высушивают над Na2SO4 и испаряют до сухого состояния. Полученное очищают с помощью хроматографии с силикагелем, элюируя градиентом смеси DCM/EtOAc от (80/20; объем/объем) до (40/60; объем/объем). 0,17 г предполагаемого соединения получают в форме порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,93 (3Н, t); 1,62 (2Н, секстет); 2,55 (3Н, s); 2,80 (2Н, t); 6,86 (2Н, br); 7,80 (1H, s); 8,19-8,22 (2Н, m).
Получение 6.2
1-[1-(6-аминопиридазин-3-ил)-5-метил-1H-пиразол-4-ил]бутан-1-он.
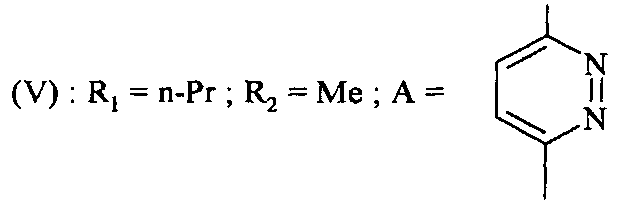
Этап 1: 1-[6-(4-метоксибензиламино)-пиридазин-3-ил]-5-метил-1H-пиразол-4-этил карбоксилат (XXX)
0,31 мл 4-метоксибензиламина добавляют к раствору 0,30 г этил 1-(6-хлорпиридазин-3-ил)-5-метил-1H-пиразол-4-карбоксилата (синтезированного с помощью способа, описанного в J. Heterocyclic Chem. 2009, 46, 584-590) в 2 мл диоксана, затем полученное нагревают при 130°C в течение 2 часов. Полученное испаряют до сухого состояния, растирают с водой, осадок отфильтровывают и высушивают под вакуумом. Осадок поглощают изоэфиром, отфильтровывают и высушивают под вакуумом. 0,30 г предполагаемого продукта получают в форме порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 1,30 (3Н, t); 2,69 (3Н, s); 3,74 (3Н, s); 4,26 (2Н, q); 4,55 (2Н, d); 6,91 (2Н, d); 7,09 (1H, d); 7,32 (2Н, d); 7,62 (1H, d); 7,67 (1H, t); 8,03 (1H, s).
Этап 2: 1-[6-(4-метоксибензиламино)-пиридазин-3-ил]-5-метил-1H-пиразол-4-карбоновая кислота (XXXI)
Раствор 5 г соединения, полученного в предыдущем этапе, в 50 мл EtOH добавляют к раствору 3,82 г KOH в 50 мл воды. Полученное нагревают при 80°C в течение 2 часов. Полученное выпаривают до сухого состояния и затем остаток поглощают 100 мл воды. 68 мл 1N раствора HCl добавляют по каплям, при перемешивании. Осадок, который образовался, отфильтровывают, полученное отмывают водой и затем высушивают в вакуумной сушильной камере. 4,5 г предполагаемого соединения получают в форме белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 2,71 (3Н, s); 3,75 (3Н, s); 4,57 (2Н, s); 6,93 (2Н, d); 7,30-7,37 (3Н, m); 7,81 (1H, d); 8,04 (1H, s); 8,42 (1H, br).
Этап 3: 1-{6-[(трет-бутоксикарбонил)-(4-метоксибензил)-амино]-пиридазин-3-ил}-5-метил-1H-пиразол-4-карбоновая кислота (XXXII)
0,17 г DMAP, 2,32 мл триэтиламина и 3 г ди-трет-бутилбикарбоната добавляют к раствору 1,87 г соединения из предыдущего этапа в 22 мл DMF, затем полученное перемешивают в течение 20 часов при KT. Добавляют 0,47 г гидроксида калия в растворе в 10 мл воды, затем полученное перемешивают в течение 20 часов. Добавляют 500 мл воды и полученное отмывают эфиром. Водную фазу забуферивают с помощью фосфатного буфера, предварительно нагруженного 1N соляной кислотой. Осадок, который образовался, отфильтровывают, полученное отмывают водой и высушивают в вакуумной сушильной камере при 50°C. 1,35 г предполагаемого соединения получают в форме порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 1,43 (9Н, s); 2,83 (3Н, s); 3,71 (3Н, s); 5,19 (2Н, br); 6,88 (1H, d); 7,25 (1H, d); 8,05-8,21 (3Н, m); 12,7 (1H, br).
Этап 4: Этил 3-(1-{6-[(трет-бутоксикарбонил)-(4-метоксибензил)амино]пиридазин-3-ил}-5-метил-1H-пиразол-4-ил)-3-оксо-пропаноат (XXXIII)
0,53 г 1,1′-карбонилдиимидазола добавляют к раствору 1,1 г соединения, полученного в предыдущем этапе, в 17 мл THF, и полученное перемешивают в течение 20 часов при KT. 0,82 г бис(3-этокси-3-оксопропаноата) магния добавляют и полученное перемешивают при 55°C в течение 20 часов. Добавляют 50 мл EtOAc, полученное отмывают 0,1 N содой, солевым раствором, высушивают над Na2SO4 и выпаривают до сухого состояния. Полученное очищают с помощью хроматографии с силикагелем, элюируя DCM и затем элюируя смесью DCM/MeOH (95/5; объем/объем). 1,18 г предполагаемого соединения получают в форме белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 1,21 (3Н, t); 1,43 (9Н, s); 2,82 (3Н, s); 3,72 (3Н, s); 4,04 (2Н, s); 4,13 (2Н, q); 5,19 (2Н, s); 6,88 (2Н, d); 7,25 (2Н, d); 8,09 (1H, d); 8,22 (1H,d); 8,41 (1H, s).
Этап 5: Этил 2-{1-[6-(4-метоксибензиламино)-пиридазин-3-ил]-5-метил-1H-пиразол-4-карбонил}бутаноат (XII)
1,25 г карбоната калия, 0,98 г тетрабутиламмонийбромида и 0,44 мл йодэтана добавляют к раствору 1,15 г соединения, полученного в предыдущем этапе, в 23 мл THF, затем полученное перемешивают при 55°C в течение 20 часов. После этого полученное возвращают до КТ, 150 мл добавляют EtOAc, полученное отмывают водой, солевым раствором, высушивают над Na2SO4 и выпаривают до сухого состояния. Полученное очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH (97/3; объем/объем). 1,18 г предполагаемого соединения получают в форме белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,92 (3Н, t); 1,15 (3Н, t); 1,43 (9Н, s); 1,88 (2Н, quint(квинтет)); 2,82 (3Н, s); 3,72 (3Н, s); 4,10 (2Н, q); 4,28 (1H, t); 5,19 (2Н, s); 6,88 (2Н, d); 7,25 (2Н, d); 8,09 (1H, d); 8,22 (1H, d); 8,49 (1H, s).
Этап 6: 1-[1-(6-амино-пиридазин-3-ил)-5-метил-1H-пиразол-4-ил]бутан-1-он
1,18 г соединения из предыдущего этапа в 5 мл 6N HCl нагревают с обратным холодильником в течение 6 часов. После этого полученное возвращают до KT, добавляют 50 мл воды, полученное отмывают с помощью EtOAc, и затем водную фазу выпаривают до сухого состояния. 50 мл 0,2N раствора NaOH добавляют и полученное экстрагируют с EtOAc. Органическую фазу отмывают солевым раствором, высушивают над Na2SO4 и выпаривают до сухого состояния. 0,42 г предполагаемого соединения получают в форме белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,93 (3Н, t); 1,62 (2Н, секстет); 2,65 (3Н, s); 2,82 (2Н, m); 6,76 (2Н, br); 7,00 (1H, d); 7,59 (1H, d); 8,27 (1H, s).
Получение 6.3
1-[1-(4-аминофенил)-5-метил-1H-пиразол-4-ил]бутан-1-он.

Этап 1: Этил 3-[5-Метил-1-(4-нитрофенил)-1H-пиразол-4-ил]-3-оксопропаноат (XXVII)
2,95 г 1,1′-карбонилдиимидазола добавляют к раствору 3 г 5-метил-1-(4-нитрофенил)-1H-пиразол-4-карбоновой кислоты (XXVI) в 120 мл THF, и перемешивают в течение 20 часов при KT. Добавляют 5,2 г бис(3-этокси-3-оксопропаноата) магния (синтезированного согласно способу, описанному в Angew. Chem. Int. Ed. Engl., 1979, 18, 72-74) и полученное нагревают при 45°C в течение 16 часов. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют с EtOAc, органическую фазу отмывают насыщенным раствором Na2CO3, водой, высушивают над MgSO4 и растворитель выпаривают под вакуумом. Остаток хроматографируют на силикагеле, элюируя DCM и затем смесью DCM/EtOH (99,5/0,5; объем/объем). Получают 2,82 г предполагаемого соединения.
1H ЯМР: CDCl3 (250 МГц): δ (ppm): 1,28 (3Н, t); 2,70 (3Н, s); 3,88 (2Н, s); 4,26 (2Н, q); 7,70 (2Н, d); 8,09 (1H, s); 8,42 (2Н, d).
Этап 2: этил 2-{[5-метил-1-(4-нитрофенил)-1H-пиразол-4-ил]карбонил}бутаноат (XXVIII)
Раствор 2,44 г соединения из предыдущего этапа в 25 мл THF охлаждают до 0°C, 0,34 г NaH (60% в масле) добавляют в пропорциях и перемешивают в течение 30 минут. Затем добавляют 0,92 мл йодэтана и перемешивают в течение 24 часов при КТ. Добавляют медленно воду, затем реакционную смесь концентрируют под вакуумом. Остаток экстрагируют с DCM, органическую фазу отмывают водой, высушивают над MgSO4 и растворитель выпаривают под вакуумом. Остаток хроматографируют на силикагеле, элюируя смесью EtOAc/циклогексан (градиент от 10 до 20% EtOAc). Получают 2,19 г предполагаемого соединения.
1H ЯМР: CDCl3 (250 МГц): δ (ppm): 1,02 (3Н, t); 1,28 (3Н, t); 2,06 (3Н, m); 2,72 (3Н, s); 3,97 (1H, t); 4,23 (2Н, q); 7,70 (2Н, d); 8,18 (1H, s); 8,42 (2Н, d).
Этап 3: 1-[5-метил-1-(4-нитрофенил)-1H-пиразол-4-ил]бутан-1-он (XI)
2,4 г соединения из предыдущего этапа в 58 мл водного раствора HCl в концентрации 37% нагревают при 105°C в течение 2 часов. Реакционную смесь охлаждают до 0°C, добавляют медленно 60 мл 35% NaOH, полученное экстрагируют с EtOAc, органическую фазу отмывают водой, высушивают над MgSO4 и растворитель выпаривают под вакуумом. Получают 1,8 г предполагаемого соединения.
1H ЯМР: CDCl3 (250 МГц): δ (ppm): 1,02 (3Н, t); 1,78 (2Н, m); 2,75 (3Н, s); 2,85 (2Н, t); 7,70 (2Н, d); 8,10 (1H, s); 8,42 (2Н, d).
Этап 4:1-[1-(4-аминофенил)-5-метил-1H-пиразол-4-ил]бутан-1-он
450 мл EtOH вливают на 5 г палладия/древесного уголя в контролируемом потоке аргона. Затем добавляют суспензию 48,7 г соединения из предыдущего этапа в 50 мл EtOH и затем 181 мл циклогексена и полученное нагревают с обратным холодильником в течение 4 часов. После охлаждения до КТ реакционную смесь фильтруют на Celite®, полученное отмывают с помощью EtOAc и фильтрат концентрируют под вакуумом. Остаток поглощают петролейным эфиром, осадок, который образовался, отфильтровывают, полученное отмывают петролейным эфиром и высушивают под вакуумом при 50°C. Получают 41,3 г предполагаемого соединения.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,93 (3Н, t); 1,60 (2Н, m); 2,41 (3Н, s); 2,77 (2Н, t); 5,6 (2Н, br); 6,66 (2Н, d); 7,10 (2Н, d); 8,14 (1H, s).
Получение 6.4
1-[1-(4-аминофенил)-5-метил-1H-пиразол-4-ил]пропане-1-он.
Этап 1: этил 2-метил-3-[5-метил-1-(4-нитрофенил)-1H-пиразол-4-ил]-3-оксо-пропаноат
0,07 г NaH (60% в масле) добавляют медленно в малых пропорциях к 0,50 г соединения, полученного на этапе 1 Получения 6.3 в 5 мл THF при 0°C. Полученное перемешивают в течение 30 минут и затем добавляют 0,15 мл йодметана. Через 24 ч при КТ добавляют медленно воду и выпаривают THF. Остаток экстрагируют с DCM и органическую фазу отмывают водой, высушивают над Na2SO4 и выпаривают до сухого состояния. Остаток рекристаллизируют из циклогексана, получая 0,5 г желтого твердого вещества.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 1,16 (3Н, t); 1,32 (1H, d); 2,61 (3Н, s); 4,09 (2Н, q); 4,44 (1H, q); 7,90 (2Н, d); 8,38-8,44 (3Н, m).
Этап 2:1-[5-метил-1-(4-нитрофенил)-1H-пиразол-4-ил]пропан-1-он
0,5 г соединения, полученного в предыдущем этапе, в 13 мл 35% HCl нагревают при 105°C в течение 2 часов. Полученное охлаждают до 0°C и добавляют медленно 14 мл 35% NaOH. Полученное экстрагируют с EtOAc, отмывают водой, солевым раствором, высушивают над Na2SO4 и выпаривают до сухого состояния. Остаток хроматографируют на силикагеле, элюируя смесью EtOAc/циклогексан (градиент от 0 до 20% EtOAc). Получают 0,39 г бежевого твердого вещества.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 1,08 (3Н, t); 2,62 (3Н, s); 2,89 (2Н, q); 7,88 (2Н, d); 8,36-8,43 (3Н, m).
Этап 3: 1-[1-(4-аминофенил)-5-метил-1H-пиразол-4-ил]пропан-1-он
0,5 г соединения из предыдущего этапа растворяют в 20 мл смеси EtOAc/МеОН (50/50; объем/объем). Полученное восстанавливают, применяя устройство непрерывной гидрогенизации H-Cube (Картридж Pd 10%, Режим полный Н2, 50°C, поток 1 мл/мин). Полученное концентрируют до сухого состояния, Твердый остаток поглощают изоэфиром, осадок, который образовался, отфильтровывают и получают 0,25 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 1,07 (3Н, t); 2,42 (3Н, s); 2,82 (2Н, q); 5,44 (2Н, br); 6,64 (2Н, d); 7,07 (2H,d); 8,12 (1H, s).
Получение 6.5
1-[1-(4-аминофенил)-5-метил-1H-пиразол-4-ил]этанон.
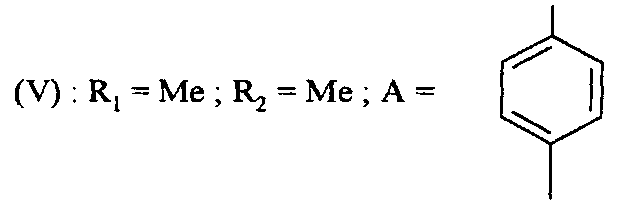
2 мл уксусной кислоты и 0,64 г железа(О) добавляют к 0,94 г 1-[5-метил-1-(4-нитрофенил)-1H-пиразол-4-ил]этанона (Journal of Chemical Research, Synopses (1986), (5), 166-7) в 60 мл смеси EtOH/вода (65/35; объем/объем). Полученное нагревают при 75°C в течение 2 часов. Полученное концентрируют, фильтруют на Celite®, фильтрат нейтрализуют насыщенным Na2CO3 и полученное экстрагируют с DCM. Органическую фазу отмывают водой, солевым раствором, полученное высушивают над Na2SO4 и выпаривают. Получают 0,70 г желтого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 2,41 (3Н, s); 5,47 (2Н, br); 6,65 (2Н, d); 7,08 (2H,d); 8,12 (1H, s).
Получение 6.6
1 -(4-аминофенил)-5-метил-1H-пиразол-4-этилкарбоксилат.
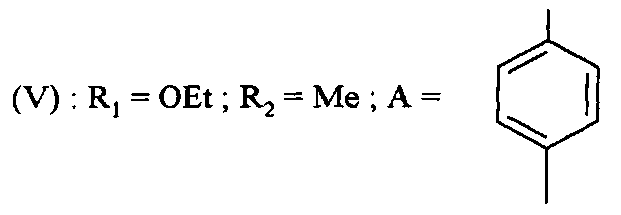
0,1 г этил-5-метил-1-(4-нитрофенил)-1H-пиразол-4-карбоксилата (Russian Journal of Organic Chemistry English (2000) 36, 2, 191-194) растворяют в 20 мл смеси EtOAc/MeOH (50/50; объем/объем). Полученное восстанавливают, применяя устройство непрерывной гидрогенизации (Картридж Pd 10%, Mode Full Н2, 50°C, поток 1 мл/мин). Полученное концентрируют до сухого состояния, твердый остаток поглощают изоэфиром и осадок, который образовался, отфильтровывают. Получают 0,08 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 1,41 (3Н, t); 4,35 (2Н, q); 6,74 (2Н, d); 7,20 (2H, d); 8,03 (1H, s).
Получение 6.7
1-[1-(4-амино-3-бромфенил)-5-метил-1H-пиразол-4-ил]бутан-1-он.
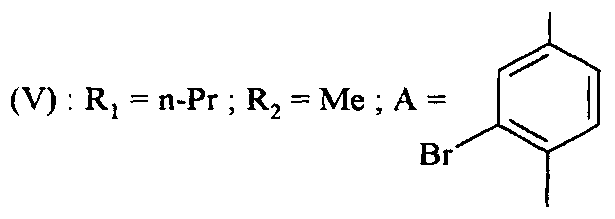
2,2 г N-бромсукцинимида добавляют к 3 г соединения из Получения 6.3 в 50 мл ацетонитрила, затем нагревают с обратным холодильником в течение 1 часа. После этого полученное возвращают до KT, добавляют 1N раствор NaHCO3, полученное экстрагируют с EtOAc, отмывают водой, солевым раствором, высушивают над Na2SO4 и выпаривают до сухого состояния. Остаток поглощают петролейным эфиром, и осадок, который образовался, отфильтровывают, получая 3,5 г бежевого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,92 (3Н, t); 1,62 (2Н, секстет); 2,44 (3Н, s); 2,78 (2Н, t); 5,69 (2Н, br); 6,89 (1H, d); 7,19 (1H, d); 7,49 (1H, s); 8,17 (1H, s).
Получение 6.8
2-амино-5-(4-бутирил-5-метил-1H-пиразол-1-ил)бензонитрил.
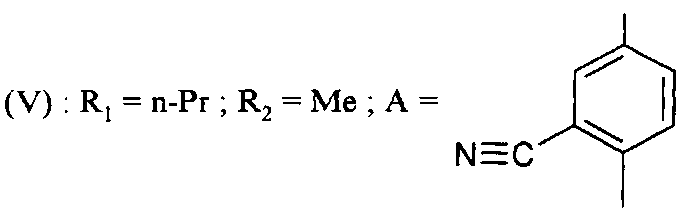
0,44 г цианида цинка и 0,18 г тетракис(трифенилфосфин)палладия добавляют к 1 г соединения из Получения 6.7 в 20 мл DMF в герметически закрытой пробирке, и полученное нагревают при 100°C в течение 7 часов. Реакционную смесь вливают в насыщенный раствор NaHCO3 и экстрагируют с EtOAc. Полученное отмывают водой, солевым раствором, высушивают над Na2SO4 и выпаривают до сухого состояния. Остаток поглощают изоэфиром и эсадок, который образовался, отфильтровывают, получая 0,71 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,92 (3Н, t); 1,61 (2Н, секстет); 2,44 (3Н, s); 2,78 (2Н, t); 6,45 (2Н, br); 6,90 (1H, d); 7,42 (1H, d); 7,58 (1H, s); 8,19 (1H, s).
Получение 6.9
Метил 2-амино-5-(4-бутирил-5-метил-1H-пиразол-1-ил)бензоат.
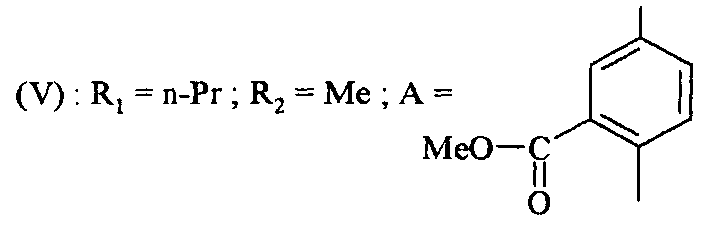
Этап 1: 2-амино-5-(4-бутирил-5-метил-1H-пиразол-1-ил)бензойная кислота
17 мл 2N NaOH добавляют к 1,5 г соединения из Получения 6.8 и полученное нагревают при 100°C в течение 8 часов. Добавляют воду, полученное отмывают с помощью DCM и затем подкисляют с помощью 2N HCl. Осадок отфильтровывают, полученное отмывают водой и высушивают в вакуумной сушильной камере. Получают 1,4 г предполагаемого соединения в форме белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,93 (3Н, t); 1,62 (2Н, секстет); 2,44 (3Н, s); 2,78 (2Н, t); 6,88 (1H, d); 7,33 (1H, d); 7,69 (1H, s); 8,17 (1H, s).
Этап 2: Метил 2-амино-5-(4-бутирил-5-метил-пиразол-1-ил)-бензоат
0,38 г бикарбоната калия и затем 0,24 мл метилйодида добавляют к 1 г соединения из предыдущего этапа в 20 мл DMF. Через 3 часов при KT добавляют воду и полученное экстрагируют с EtOAc. Органическую фазу отмывают водой, солевым раствором, высушивают над Na2SO4 и испаряют до сухого состояния, получая 0,89 г бежевого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,93 (3Н, t); 1,62 (2Н, секстет); 2,44 (3Н, s); 2,78 (2Н, t); 3,80 (3Н, s); 6,91 (1H, d); 6,97 (2Н, br); 7,38 (1H, d); 7,72 (1H, s); 8,17 (1H, s).
Получение 6.10
2-амино-5-(4-бутирил-5-метил-1H-пиразол-1-ил)бензамид
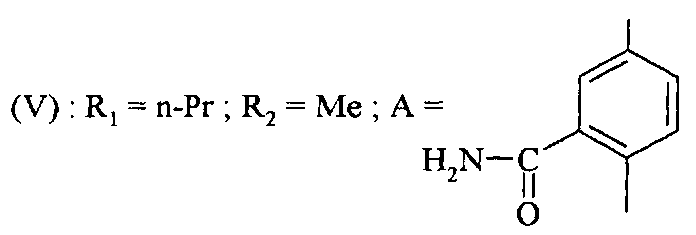
2,2 мл 2N NaOH добавляют к 0,2 г соединения из Получения 6.8 в 5 мл диоксана, затем полученное нагревают при 100°C в течение 20 ч. После этого полученное возвращают до КТ, добавляют воду и полученное экстрагируют с DCM. Полученное высушивают над Na2SO4 и испаряют до сухого состояния. Полученное очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH (до 95/5; объем/объем). Получают 0,14 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,93 (3Н, t); 1,62 (2Н, секстет); 2,44 (3Н, s); 2,78 (2Н, t); 6,81 (1H, d); 6,98 (2Н, br); 7,18 (1H, br); 7,24 (1H, d); 7,65 (1H, s); 7,81 (1H, br); 8,16 (1H, s).
7. Получения соединений формулы (III).
Получение 7.1
1-(1-метоксипропан-2-ил)пиперазина дигидрохлорид
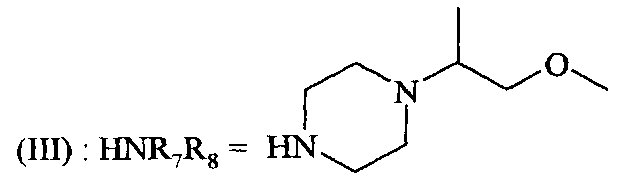
Этап 1: трет-бутил 4-(1-метокси-1-оксопропан-2-ил)пиперазин-1-карбоксилат
2,97 г карбоната калия и 1,97 г метил-2-бромпропаноатп добавляют к раствору 2 г трет-бутил-пиперазин-1-карбоксилата в 36 мл DMF, и затем полученное нагревают при 60°C в течение 1 часа. После этого полученное возвращают до KT, добавляют 150 мл EtOAc, полученное отмывают водой, солевым раствором, высушивают над Na2SO4 и затем испаряют до сухого состояния. 2,8 г предполагаемого соединения получают в форме бесцветного масла.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 1,18 (3Н, d); 1,39 (9Н, s); 2,49 (4Н, m); 3,26 (4Н, m); 3,37 (1H, q); 3,62 (3Н, s).
Этап 2: 2-[4-(трет-бутоксикарбонил)пиперазин-1-ил]пропановая кислота
6,33 мл раствора 2N NaOH добавляют к раствору 2,3 г соединения, полученного в предыдущем этапе, в 30 мл МеОН, и полученное перемешивают в течение 20 часов. Реакционную смесь добавляют к раствору хлорида аммония и затем испаряют до сухого состояния. Твердый остаток поглощают смесью DCM/MeOH (9/1; объем/объем), фильтруют и фильтрат испаряют. Остаток поглощают эфиром и отфильтровывают. 1,2 г предполагаемого соединения получают в форме белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 1,17 (3Н, d); 1,39 (9Н, s); 2,50 (m, 4Н); 3,22-3,32 (m, 5Н); 7,25 (1H, br).
Этап 3: трет-бутил 4-(1-гидроксипропан-2-ил)пиперазин-1-карбоксилат 1,10 г 1,1′-карбонилдимидазола добавляют к раствору 1,35 г соединения, полученного в предыдущем этапе, в 15 мл THF, и полученное перемешивают в течение 30 минут. Кроме того, раствор 0,33 г NaBH4 в 6 мл воды получают при 0°C и добавляют по каплям к исходному раствору активированного сложного эфира, предварительно охлажденного до -5°C. Добавляют 30 мл воды и полученное экстрагируют с EtOAc. Полученное отмывают солевым раствором, высушивают над Na2SO4 и испаряют до сухого состояния. Полученное очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH (градиент от 2 до 5% МеОН). 1 г предполагаемого соединения получают в форме бесцветного масла.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,90 (3Н, d); 1,39 (9Н, s); 2,42 (m, 4Н); 2,57 (1H, q); 3,22-3,45 (m, 6Н); 4,24 (1H, t).
Этап 4: трет-бутил 4-(1-метоксипропан-2-ил)пиперазин-1-карбоксилат
Раствор 0,49 г соединения, полученного в предыдущем этапе, в 5 мл THF добавляют к суспензии 0,17 г NaH (60% в масле) в 5 мл THF при 0°C, и полученное перемешивают в течение 30 минут. 0,27 мл подметана добавляют при 0°C, и перемешивают в течение 20 часов. Добавляют 10 мл EtOAc, полученное отмывают водой, солевым раствором, высушивают над Na2SO4 и испаряют до сухого состояния. Полученное очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH (97/3; объем/объем). 0,41 г предполагаемого соединения получают в форме бесцветного масла.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,93 (3Н, d); 1,39 (9Н, s); 2,42 (m, 4Н); 2,70 (1Н, q); 3,17-3,48 (m, 11H).
Этап 5: 1-(1-метоксипропан-2-ил)пиперазина дигидрохлорид 3,88 мл раствора 4N соляной кислоты в диоксане добавляют к раствору 0,40 г соединения, полученного в предыдущем этапе, в 7 мл DCM. Через 2 часа при KT полученное испаряют до сухого состояния, переносят в ацетон и фильтруют. 0,34 г предполагаемого соединения получают в форме белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 1,30 (3Н, d); 3,31 (3Н, s); 3,40-4,00 (m, 11H); 9,75 (2Н, br); 11,75 (1H, br).
Получение 7.2
Оксетан-3-илпиперазин
2,6 г 3-оксетанона, 1,0 г цианоборогидрида натрия и 0,16 мл уксусной кислоты добавляют к раствору 2,0 г бензилпиперазин-1-карбоксилата в 20 мл ацетонитрила и затем перемешивают в течение 16 часов при КТ. Реакционную смесь разбавляют водой и фильтруют через картридж Chem Elut®, элюируя DCM. Комбинированные органические фазы высушивают над MgSO4 и растворитель испаряют под вакуумом. Остаток очищают с помощью препаративной ВЭЖХ и получают 1,7 г белого твердого вещества. 0,5 г этого твердого вещества растворяют в 20 мл EtOH, добавляют 0,2 г Pd/C в концентрации 10% и смесь перемешивают в атмосфере водорода (4 бар) в течение 3 часов. Реакционную смесь фильтруют на Celite® и фильтрат концентрируют под вакуумом. Получают предполагаемое соединение.
Получение 7.3
N-метил-N-[2-(пиперазин-1-ил)этил]ацетамиддитрифторацетат
0,341 г 60% NaH в масле добавляют к раствору 0,748 г N-метилацетамида в 80 мл THF и перемешивают в течение 10 минут при KT. Затем 2 г трет-бутил 4-(2-бромэтил)пиперазинкарбоксилата добавляют и перемешивают в течение 16 часов при KT. Добавляют воду к реакционной смеси, полученное декантируют и органические растворитель испаряют под вакуумом. Остаток растворяют в DCM, фильтруют через картридж Chem Elut®, элюируя DCM и растворители испаряют под вакуумом. Остаток очищают с помощью препаративной ВЭЖХ и получают белое твердое вещество. Твердое вещество растворяют в 5 мл DCM, добавляют 1,2 мл TFA и полученное перемешивают в течение 16 часов при КТ. Реакционную смесь разбавляют путем добавления 100 мл толуола и растворители концентрируют под вакуумом. Получают 1,5 г предполагаемого соединения.
Получение 7.4
(1S,4S)-2-(2-метоксиэтил)-2,5-диазабицикло[2.2.1]гептандитрифторацетат 2 мл DIPEA и 0,52 мл 1-бром-2-метоксиэтана добавляют к раствору 1,0 г трет-бутил-(18,48)-2,5-диазабицикло[2.2.1]гептан-2-карбоксилата гидрохлорида в 10 мл EtOH и нагревают с обратным холодильником в течение 16 часов. После охлаждения до KT реакционную смесь разбавляют путем добавления воды и фильтруют через картридж Chem Elut®, элюируя DCM. Комбинированные органические фазы высушивают над MgSO4 и растворитель испаряют под вакуумом. Остаток растворяют в 10 мл DCM, добавляют 15 мл TFA и перемешивают в течение 2 часов при КТ. Добавляют 100 мл толуола и растворители концентрируют под вакуумом. Получают 1,45 г предполагаемого соединения.
Получение 7.5
(2R)-2-(циклобутилкарбамоил)-1-метилпиперазиндитрифторацетат
0,39 мл раствора формальдегида в концентрации 37% в воде, 0,32 г натрия цианоборогидрида и 0,994 мл уксусной кислоты добавляют к раствору 1 г трет-бутил(3R)-пиперазин-1,3-дикарбоксилата в 26 мл МеОН и перемешивают в течение 3 часов при КТ. Реакционную смесь разбавляют путем добавления насыщенного раствора K2CO3, экстрагируют с DCM, органическую фазу высушивают над MgSO4 и растворитель испаряют под вакуумом. Остаток растворяют в 4 мл DMF, добавляют 0,19 г НОАТ, 0,267 г EDC и 0,1 г циклобутиламина и полученное перемешивают в течение 16 часов при KT. Реакционную смесь разбавляют путем добавления насыщенного раствора NaHCO3, экстрагируют с DCM, органическую фазу высушивают над MgSO4 и растворитель испаряют под вакуумом. Остаток очищают с помощью препаративной ВЭЖХ, фракции, содержащие продукт, концентрируют под вакуумом и лиофилизируют, получая 0,31 г белого твердого вещества. Твердое вещество растворяют в 2 мл DCM, добавляют 2,5 мл TFA и перемешивают в течение 4 часов при KT. Полученное разбавляют путем добавления 100 мл толуола и растворители концентрируют под вакуумом. Получают 0,94 г предполагаемого соединения.
Получение 7.6
1,1,1-Трифтор-3-(пиперазин-1-ил)пропан-2-ол
Этап 1: Бензил 4-(3,3,3-трифтор-2-гидроксипропил)пиперазин-1-карбоксилат 0,47 мл 1,1,1-трифтор-2,3-эпоксипропана добавляют к раствору 1 г бензилпиперазин-1-карбоксилата в 100 мл N-метилпирролидина и полученное нагревают при 80°C в течение 12 часов. Добавляют 0,05 мл 1,1,1-трифтор-2,3-эпоксипропана и полученное нагревают при 80°C в течение 48 часов. Реакционную смесь экстрагируют с помощью DCM, органическую фазу отмывают 4% раствором LiCl в воде, полученное высушивают над MgSO4 и растворитель выпаривают под вакуумом. Остаток очищают с помощью препаративной ВЭЖХ и получают 1,7 г предполагаемого соединения.
Этап 2: 1,1,1-трифтор-3-(пиперазин-1-ил)пропан-2-ол
0,15 г Pd/C в концентрации 10% добавляют в атмосфере аргона к раствору 1,7 г соединения из предыдущего этапа в 50 мл EtOH и полученное перемешивают в течение 16 часов в атмосфере водорода (3 бар). Реакционную смесь фильтруют на Celite®, полученное отмывают EtOH и фильтрат концентрируют под вакуумом. Получают 1,2 г предполагаемого соединения.
Получение 7.7
1-(2-метоксиэтил)-4,5,6,7-тетрагидро-1H-имидазо[4,5-c]пиридин
Этап 1: Бензил-1,4,6,7-тетрагидро-5Н-имидазо[4,5-c]пиридин-5-карбоксилат
Смесь 2,0 г 4,5,6,7-тетрагидро-1H-имидазо[4,5-c]пиридина дигидрохлорида, 2,36 г NaHCO3 и 2,45 г N-(бензилоксикарбонилокси)сукцинимида в 80 мл смеси диоксан/вода (50/50; объем/объем) перемешивают в течение 16 часов при KT. Реакционную смесь экстрагируют с помощью EtOAc, органическую фазу отмывают насыщенным раствором NaHCO3, 0,1М раствором HCl, насыщенным раствором NaCl, полученное высушивают и растворитель выпаривают под вакуумом. Остаток хроматографируют на силикагеле, элюируя смесью DCM/MeOH. Получают 1,9 г предполагаемого соединения.
Этап 2: Бензил-1-(2-метоксиэтил)-1,4,6,7-тетрагидро-5H-имидазо[4,5-c]пиридин-5-карбоксилат
3,6 мл 6N NaOH, 0,051 г тетрабутиламмония бромида и 0,308 г 1-бром-2-метоксиэтана добавляют к раствору 0,475 г соединения из предыдущего этапа в 20 мл толуола и 5 мл DCM и полученное перемешивают в течение 12 часов при KT. Добавляют 0,308 г 1-бром-2-метоксиэтана и 0,05 г тетрабутиламмония йодида и перемешивают в течение 36 часов при KT. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют с помощью DCM, органическую фазу отмывают водой, полученное высушивают и растворитель выпаривают под вакуумом. Продукт, полученный таким образом, очищают с помощью препаративной ВЭЖХ и получают 0,24 г предполагаемого соединения.
Этап 3: 1-(2-метоксиэтил)-4,5,6,7-тетрагидро-1H-имидазо[4,5-c]пиридин
0,025 г Pd/C в концентрации 10% добавляют в атмосфере аргона к раствору 0,25 г соединения из предыдущего этапа в 50 мл EtOH и перемешивают в течение 16 часов в атмосфере водорода (1 бар). Полученное фильтруют на Celite®, отмывают EtOH и фильтрат концентрируют под вакуумом. Получают 0,115 г предполагаемого соединения.
Получение 7.8
Транс-2-(пиперазин-1-ил)циклопентанол
Этап 1: Бензил-4-(транс-2-гидроксициклопентил)пиперазин-1-карбоксилат
Раствор 0,524 г бензилпиперазин-1-карбоксилата охлаждают до 0°C, добавляют 0,2 г 1,2-эпоксициклопентана и полученное нагревают при 80°C в течение четырех суток. Реакционную смесь концентрируют под вакуумом и остаток очищают с помощью хроматографии с силикагелем, элюируя смесью EtOAc/МеОН. Получают 0,32 г предполагаемого соединения.
Этап 2: Транс-2-(пиперазин-1-ил)циклопентанол
0,025 г Pd/C в концентрации 10% добавляют в атмосфере аргона к раствору 0,32 г соединения из предыдущего этапа в 50 мл EtOH и полученное перемешивают в течение 16 часов в атмосфере водорода (3 бар). Реакционную смесь фильтруют на Celite, полученное отмывают EtOH и фильтрат концентрируют под вакуумом. Получают 0,19 г предполагаемого соединения.
Получение 7.9
2-(Пирролидин-3-илокси)этанол
Этап 1: Бензил-3-(2-бензилоксиэтокси)пирролидин-1-карбоксилат
Раствор 1,29 г бензил-3-гидроксипирролидин-1-карбоксилата в 80 мл THF охлаждают до 0°C, добавляют 0,245 г 60% NaH в масле и затем 1,26 г [(2-бромэтокси)метил]бензола и 0,108 г тетрабутиламмония йодида и полученное нагревают при 80°C в течение 3 часов. Добавляют 0,28 г NaH и 0,40 г [(2-бромэтокси)метил]бензола и полученное нагревают при 80°C в течение 2 часов. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют с помощью DCM, органическую фазу отмывают 0,1М раствором HCl, насыщенным раствором NaHCO3, полученное высушивают и растворитель выпаривают под вакуумом. Продукт, полученный таким образом, очищают с помощью препаративной ВЭЖХ и получают 0,46 г предполагаемого соединения.
Этап 2: 2-(пирролидин-3-илокси)этанол
0,05 г Pd/C в концентрации 10% добавляют в атмосфере аргона к раствору 0,459 г соединения из предыдущего этапа в 35 мл EtOH и полученное перемешивают в течение 16 часов в атмосфере водорода (3 бар). Реакционную смесь фильтруют на Celite, полученное отмывают EtOH и фильтрат концентрируют под вакуумом. Получают 0,205 г предполагаемого соединения.
Получение 7.10
(2S,4R)-2-(циклобутилкарбамоил)-4-гидроксипирролидинтрифторацетат
Этап 1: Трет-бутил-(2S,4R)-2-(циклобутилкарбамоил)-4-гидроксипирролидин-1-карбоксилат
1,17 г HOAT, 1,66 г 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорида и 0,615 г циклобутиламина добавляют к раствору 2,0 г (4R)-1-(трет-бутоксикарбонил)-4-гидрокси-L-пролина в 20 мл DMF. Добавляют 1,5 мл насыщенного раствора NaHCO3 и реакционную смесь фильтруют на картридже Chem Elut®, элюируя с помощью DCM. Растворители концентрируют под вакуумом и остаток очищают путем фильтрации на силикагеле, элюируя с помощью EtOAc. Получают 1,22 г предполагаемого соединения.
Этап 2: (2S,4R)-2-(циклобутилкарбамоил)-4-гидроксипирролидина трифторацетат
3,2 мл TFA добавляют к раствору 1,22 г соединения из предыдущего этапа в 31 мл DCM и полученное перемешивают в течение 12 часов при KT. Полученное концентрируют под вакуумом, остаток поглощают толуолом и растворитель выпаривают под вакуумом. Получают 1,51 г предполагаемого соединения.
Получение 7.11
2-(Метоксиметил)-1-метилпиперазина дитрифторацетат
Этап 1: Трет-бутил-3-(гидроксиметил)-4-метилпиперазин-1-карбоксилат 0,303 г ацетата натрия, 0,375 г формальдегида и 0,218 г цианоборогидрида натрия добавляют к раствору 0,5 г трет-бутил-3-(гидроксиметил)пиперазин-1-карбоксилата в 50 мл МеОН и перемешивают в течение 1 часа при KT. Добавляют насыщенный раствор (NaHCO3, полученное экстрагируют с помощью DCM, органическую фазу высушивают над Na2SO4 и растворитель выпаривают под вакуумом. Остаток хроматографируют на силикагеле, элюируя смесью DCM/MeOH. Получают 0,31 г предполагаемого соединения.
Этап 2: Трет-бутил-3-(метоксиметил)-4-метилпиперазин-1-карбоксилат
Раствор 0,125 г соединения из предыдущего этапа в 12 мл DMF охлаждают до 0°C, добавляют 0,024 г NaH (60% в масле) и 0,092 г йодметана и полученное перемешивают в течение 16 часов при КТ. Добавляют воду к реакционной смеси, полученное экстрагируют с помощью DCM, органическую фазу высушивают над Na2SO4 и растворитель выпаривают под вакуумом. Получают 0,122 г предполагаемого соединения.
Этап 3: 2-(Метоксиметил)-1-метилпиперазиндитрифторацетат
0,4 мл TFA добавляют к раствору 0,122 г соединения из предыдущего этапа в 5 мл DCM и перемешивают в течение 12 часов при КТ. Полученное концентрируют под вакуумом, остаток поглощают толуолом и растворитель выпаривают под вакуумом. Получают 0,14 г предполагаемого соединения.
Получение 7.12
3-метил-4,5,6,7-тетрагидро-3H-имидазо[4,5-c]пиридин
Этап 1: Бензил-3,4,6,7-тетрагидро-5H-имидазо[4,5-c]пиридин-5-карбоксилат
Смесь 2,0 г 4,5,6,7-тетрагидро-3Н-имидазо[4,5-c]пиридина д и гидрохлорида, 2,36 г NaHCO3 и 2,45 г N-(бензилоксикарбонилокси)сукцинимида в 80 мл смеси диоксан/вода (50/50; объем/объем) перемешивают в течение 16 часов при КТ. Реакционную смесь экстрагируют с помощью EtOAc, органическую фазу отмывают насыщенным раствором NaHCO3, 0,1М раствором HCl, насыщенным раствором NaCl, полученное высушивают над Na2SO4 и растворитель выпаривают под вакуумом. Остаток очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH. Получают 1,9 г предполагаемого соединения.
Этап 2: Бензил-3-метил-3,4,6,7-тетрагидро-5Н-имидазо[4,5-c]пиридин-5-карбоксилат
3,6 мл 6N NaOH, 0,051 г тетрабутиламмония бромида и 0,313 г йодметана добавляют к раствору 0,475 г соединения из предыдущего этапа в 20 мл толуола и 5 мл DCM и перемешивают в течение 12 часов при KT. Реакционную смесь концентрируют под вакуумом, остаток экстрагируют с помощью DCM, органическую фазу отмывают водой, полученное высушивают и растворитель выпаривают под вакуумом. Остаток очищают с помощью препаративной ВЭЖХ. Получают 0,32 г предполагаемого соединения.
Этап 3: 3-Метил-4,5,6,7-тетрагидро-3Н-имидазо[4,5-c]пиридин
0,025 г Pd/C в концентрации 10% добавляют в атмосфере аргона к раствору 0,3 г соединения из предыдущего этапа в 50 мл EtOH и перемешивают в течение 16 часов в атмосфере водорода (1 бар). Реакционную смесь фильтруют на Celite®, полученное отмывают EtOH и фильтрат концентрируют под вакуумом. Получают 0,166 г предполагаемого соединения в форме масла.
8. Получения соединений формулы (VI)
Получение 8.1
N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-6-метил-1H-индол-3-карбоксамид

Этап 1: 1-Ацетил-N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-6-метил-1H-индол-3-карбоксамид (XIV)
Смесь 1,03 г соединения из Получения 4.2 в 20 мл DCM охлаждают до 0°C, добавляют 0,81 г соединения из Получения 6.3, 0,62 г DMAP и затем 0,97 г 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорида и перемешивают в течение 2 часов, позволяя температуре вернуться к KT. Добавляют 100 мл EtOAc, органическую фазу отмывают 1N раствором HCl, 1N раствором NaOH, водой, насыщенным раствором NaCl, высушивают над Na2SO4 и растворитель выпаривают под вакуумом. Остаток поглощают изоэфиром, осадок, который образовался, отфильтровывают и высушивают под вакуумом. Получают 1,39 г предполагаемого соединения.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,95 (3Н, t); 1,65 (2Н, m); 2,47-2,52 (6Н); 2,77 (3Н, s); 2,83 (2Н, t); 7,24 (1H, d); 7,55 (2Н, d); 7,95 (2Н, d); 8,13 (1H, d); 8,24 (2Н, d); 8,75 (1H, s); 10,30 (1H, s).
Следуя процедуре, описанной в этапе 1, получают соединения формулы (XIV), представленной в ТАБЛИЦЕ V ниже.
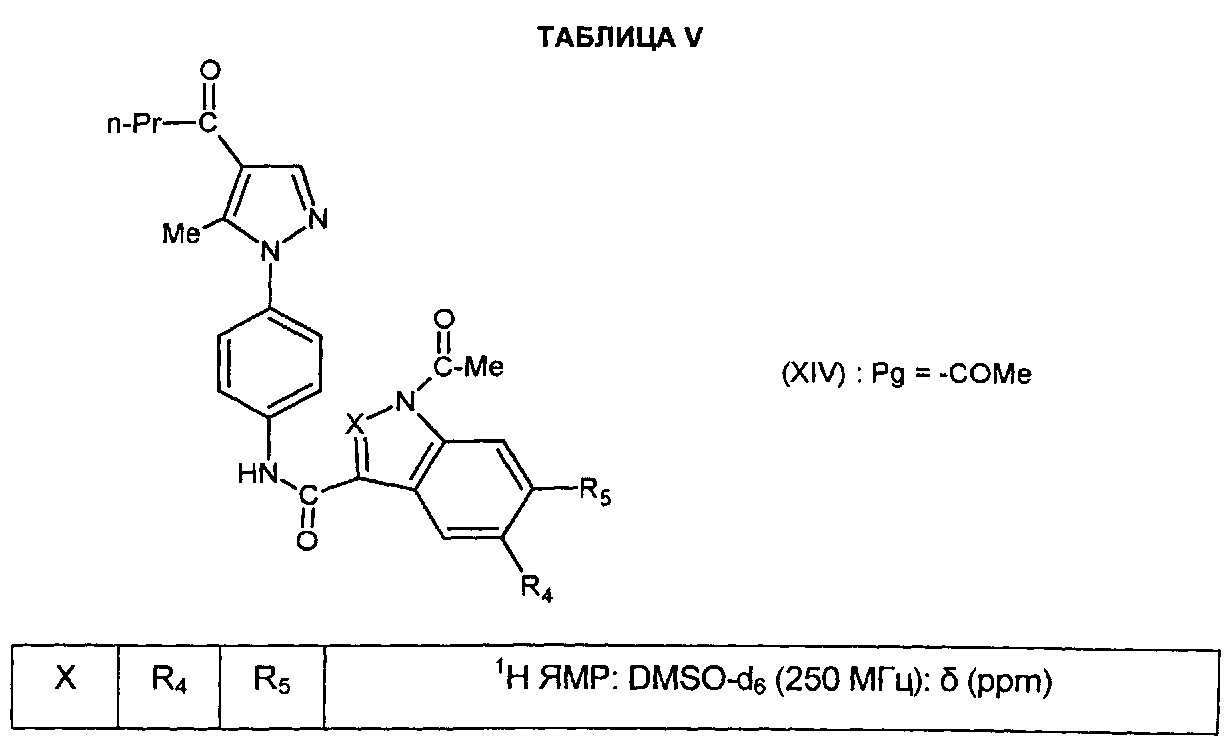
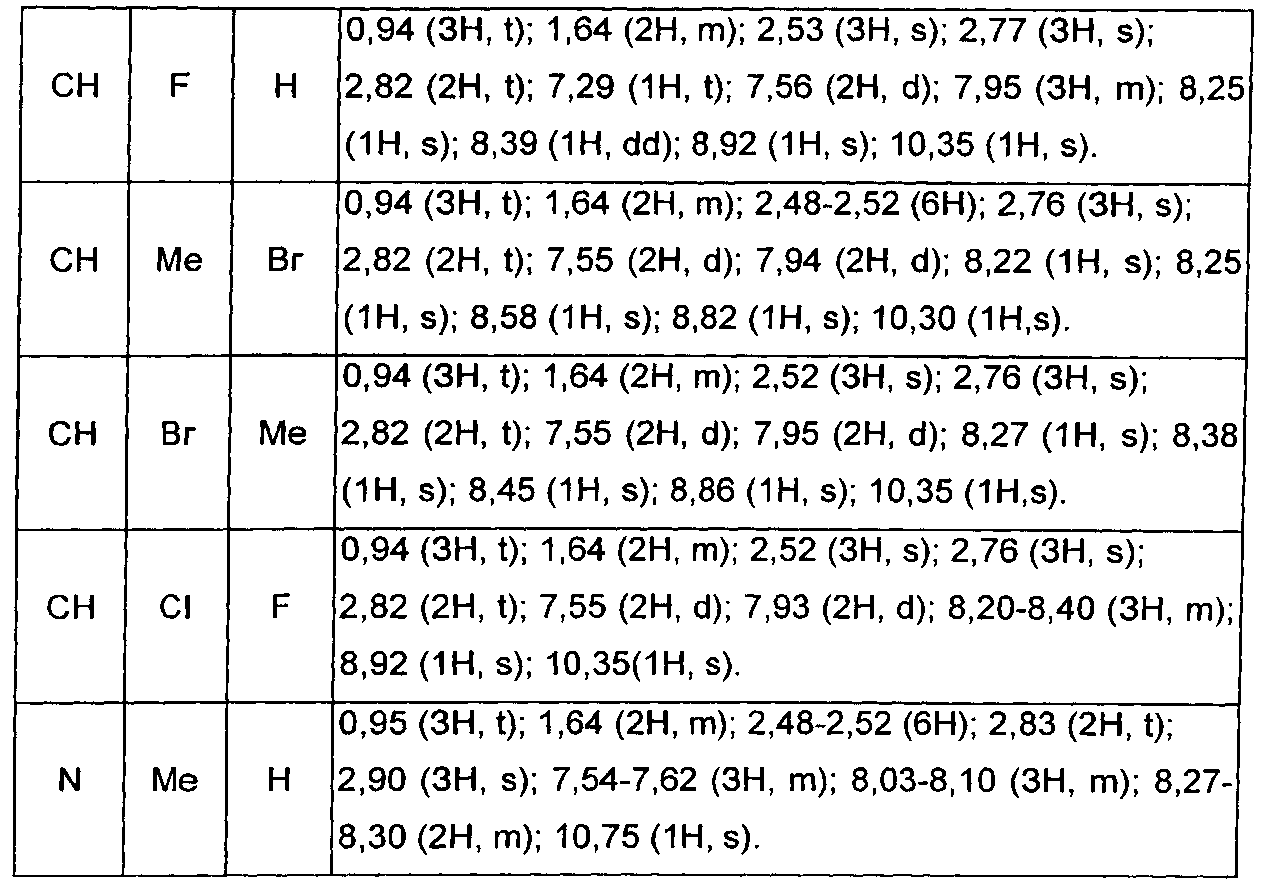
Этап 2: N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-6-метил-1H-индол-3-карбоксамид
1,5 г K2CO3 добавляют к раствору 1,15 г соединения из этапа 1 в 40 мл смеси MeOH/THF (50/50; объем/объем) и перемешивают в течение 4 часов при КТ. Реакционную смесь концентрируют под вакуумом, остаток поглощают смесью EtOAc/вода, органическую фазу отмывают водой, насыщенным раствором NaCl, высушивают над Na2SO4 и растворитель выпаривают под вакуумом. Остаток поглощают изоэфиром и осадок, который образовался, отфильтровывают. Получают 0,9 г предполагаемого соединения.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,95: t: 3Н; 1,65: m: 2Н; 2,42: s: 3H; 2,50: s: 3H; 2,82: t: 2Н; 7,00: d: 1H; 7,27: s: 1H; 7,47: d: 2Н; 7,95: d: 2Н; 8,07: d: 1H; 8,24: s: 1H; 8,25: s: 1H; 9,90: s: 1H; 11,60: s: 1H.
Следуя процедуре, описанной в этапе 2, получают соединения формулы (VI), представленной в ТАБЛИЦЕ VI ниже.

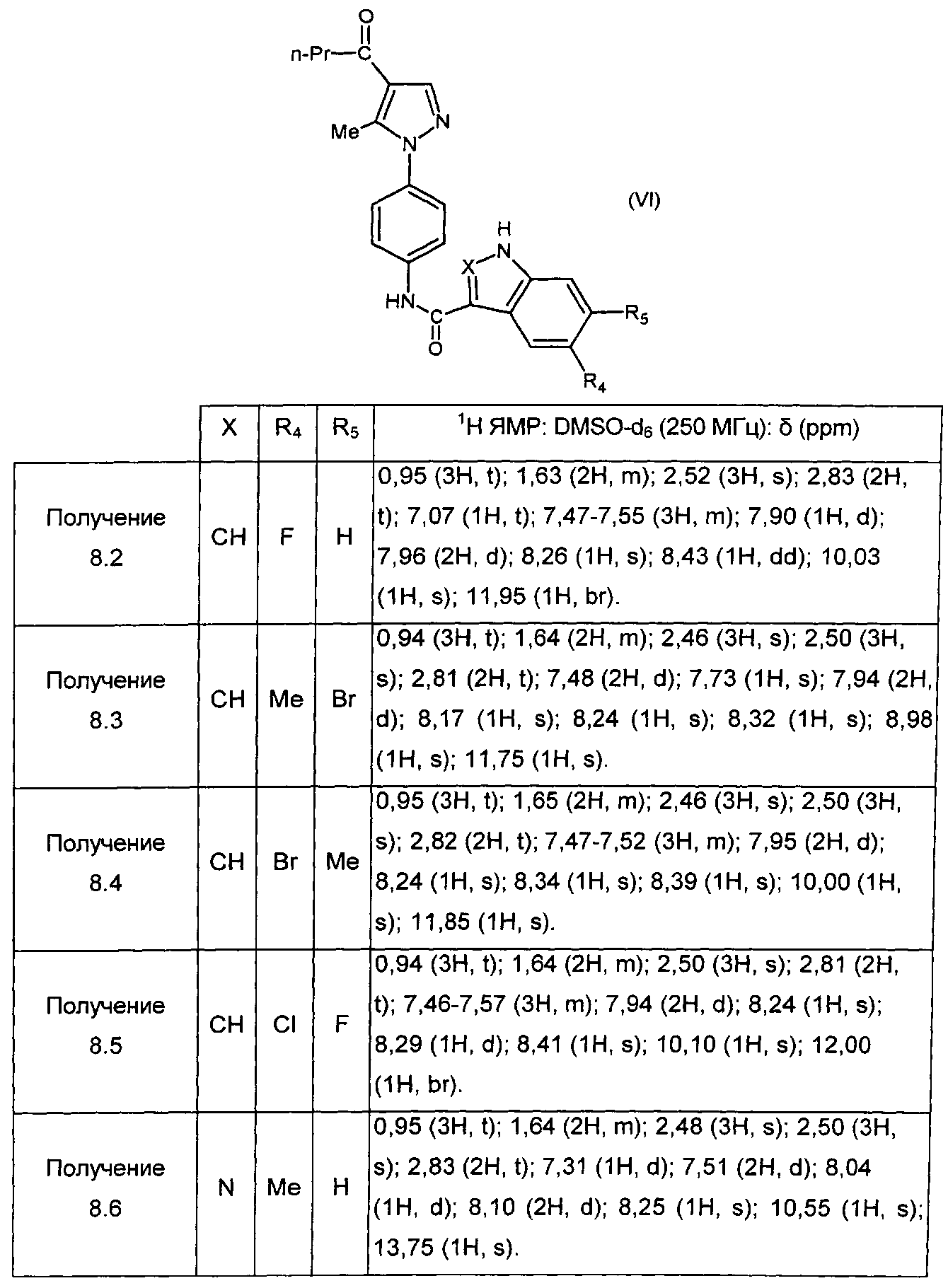
Получение 8.7
N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-6-метил-1H-индол-3-карбоксамид
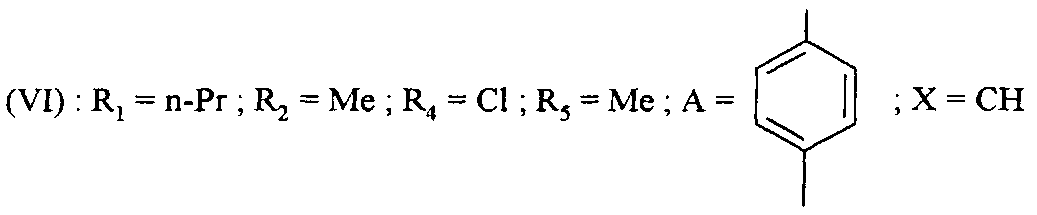
0,5 г хлорида никеля(Н) добавляют к раствору 1 г соединения из Получения 8.4 в 6 мл DMF и полученное нагревают в микроволновом приборе в течение 30 минут при 200°C. После охлаждения до КТ добавляют 60 мл воды, полученное экстрагируют с помощью EtOAc, органическую фазу отмывают насыщенным раствором NaCl, высушивают над Na2SO4 и растворитель выпаривают под вакуумом. Остаток поглощают смесью ацетон/изоэфир (50/50; объем/объем) и осадок, который образовался, отфильтровывают. Получают 0,66 г предполагаемого соединения.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,47 (3Н, s); 2,52 (3Н, s); 2,82 (2Н, t); 7,46-7,51 (3Н, m); 7,94 (2Н, d); 8,19 (1H, s); 8,24 (1H, s); 8,34 (1H, s); 9,95 (1H, s); 11,80 (1H, br).
9. Получения соединений формулы (II)
Получение 9.1
Метил(3-{[5-(4-бутирил-5-метил-1H-пиразол-1-ил)пиразин-2-ил]карбамоил}-5-хлор-1H-индол-1-ил)ацетат
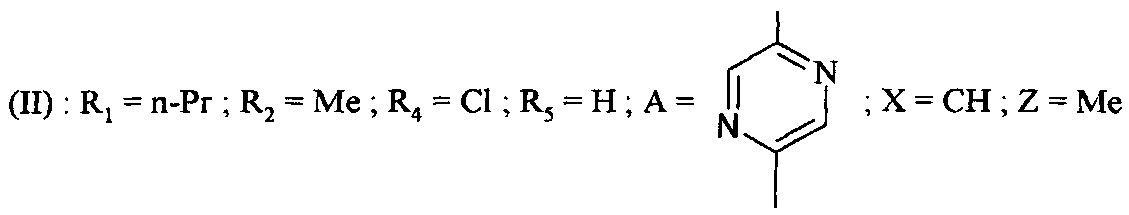
Этап 1: Метил[5-хлор-3-(хлоркарбонил)-1H-индол-1-ил] ацетат
6,6 мл тионилхлорида и несколько капель DMF добавляют к раствору 6,00 г соединения из Получения 3.1 в 200 мл DCM. Через 3 ч с обратным холодильником полученное выпаривают до сухого состояния и твердый остаток растирают с 80 мл DCM. Образованный осадок фильтруют и отмывают DCM, получая 4,5 г белого порошка.
Этап 2: Метил(3-{[5-(4-бутирил-5-метил-1H-пиразол-1-ил)пиразин-2-ил]карбамоил}-5-хлор-1H-индол-1-ил)ацетат
0,16 мл 1,8-диазабицикло[5.4.0]ундец-7-ена и 0,26 г соединения из этапа 1 добавляют к 0,17 г соединения из Получения 6.1 в 10 мл 1,2-дихлорэтана, затем полученное нагревают при 80°C в течение 2 часов. После того, как полученное возвращается к КТ, реакционную смесь отмывают водой и затем солевым раствором и высушивают над Na2SO4. Полученное выпаривают и затем твердый остаток очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH (градиент от 1 до 2% МеОН). Твердый остаток растирают с изоэфиром и затем фильтруют, получая 0,14 г желтого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,63 (2Н, m); 2,78 (3Н, s); 2.86 (2Н, t); 3,73 (3Н, s); 5,32 (2Н, s); 7,31 (1H, d); 7,61 (1H, d); 8,25 (1H, s); 8,36 (1H, s); 8,62 (1H, s); 8,86 (1H, s); 9,42 (1H, s); 11,15 (1H, s).
Получение 9.2
Метил(3-{[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]карбамоил}-5-хлор-1H-индол-1-ил)ацетат
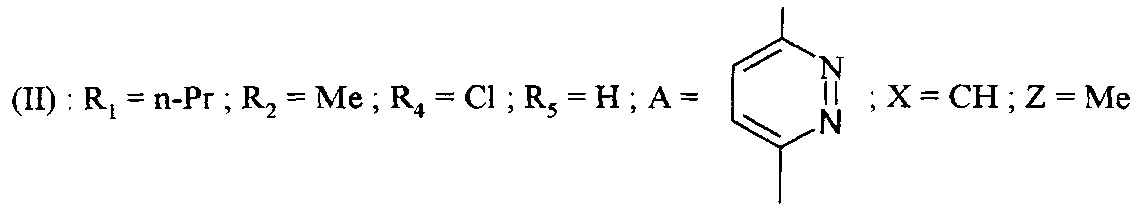
Раствор 0,35 г соединения из Получения 6.2 и 0,59 г DMAP перемешивают в течение 30 минут с присутствием 1 г молекулярного сита 4А в 20 мл 1,2-дихлорэтана. Добавляют 0,92 г соединения, полученного в этапе 1 Получения 9.1, затем полученное нагревают при 80°C в течение 6 часов. После того, как полученное возвращается к КТ, молекулярное сито удаляют путем фильтрации, реакционную смесь отмывают водой и затем солевым раствором и высушивают над Na2SO4. Полученное выпаривают и затем твердый остаток очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH (градиент от 0 до 5% МеОН), получая 0,51 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,82 (3Н, s); 2.87 (2Н, t); 3,73 (3Н, s); 5,33 (2Н, s); 7,32 (1H, d); 7,62 (1H, d); 8,13 (1H, d); 8,23 (1H, s); 8,41 (1H, s); 8,65 (1H, s); 8,71 (1H, d); 11,42 (1H, s).
Получение 9.3
Метил(3-{[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]карбамоил}-5-хлор-6-фтор-1H-индол-1-ил)ацетат
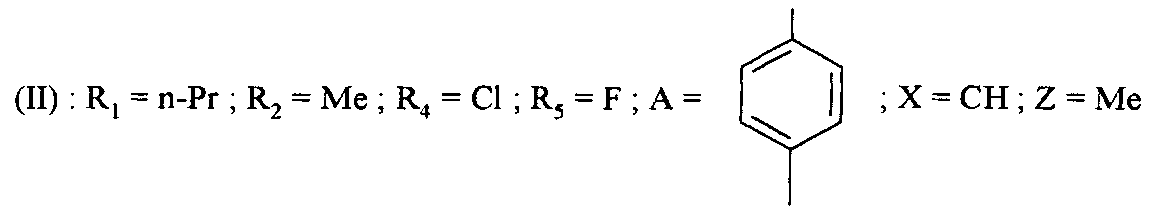
Раствор 1,25 г соединения из Получения 8.5 в 15 мл DMF охлаждают до 0°C, добавляют 0,47 г K2CO3 и затем 0,49 г метилбромацетата и полученное перемешивают в течение 3 часов при КТ. Добавляют 50 мл EtOAc и 100 мл воды, полученное декантируют, органическую фазу отмывают водой и насыщенным раствором NaCl, высушивают над Na2SO4 и растворитель выпаривают под вакуумом. Получают 1,38 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,51 (3Н, s); 2,81 (2Н, t); 3,73 (3Н, s); 5,32 (2Н, s); 7,50 (2Н, d); 7,78 (1H, d); 7,94 (2Н, d); 8,24 (1H, s); 8,30 (1H, d); 8,35 (1H, s); 10,20 (1H, s).
Следуя процедуре, описанной в Получении 9.3, получают соединения формулы (II), представленной в ТАБЛИЦЕ VII ниже. 
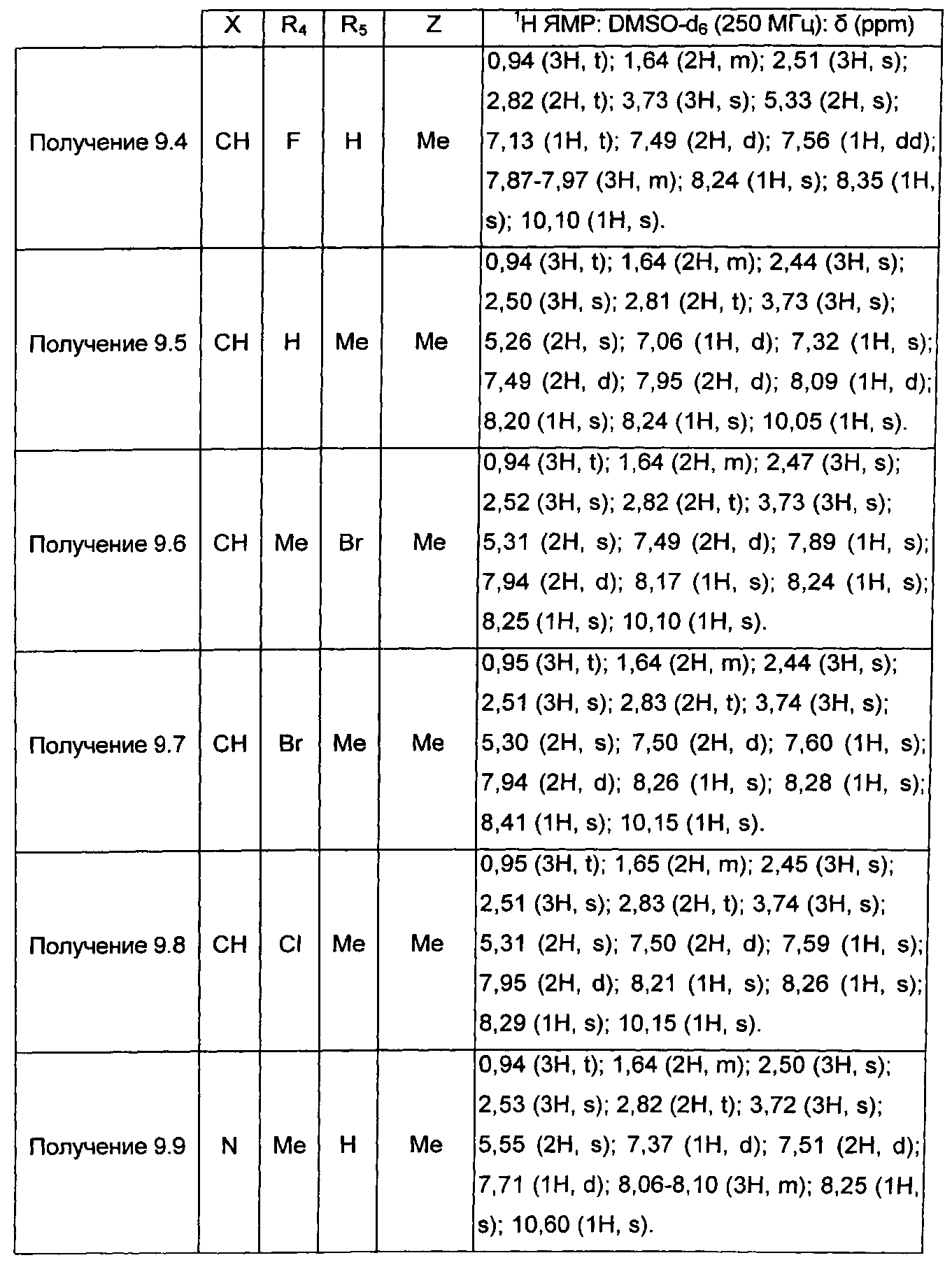
Получение 9.10
Метил(3-{[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]карбамоил}-5-хлор-1H-индол-1-ил)ацетат
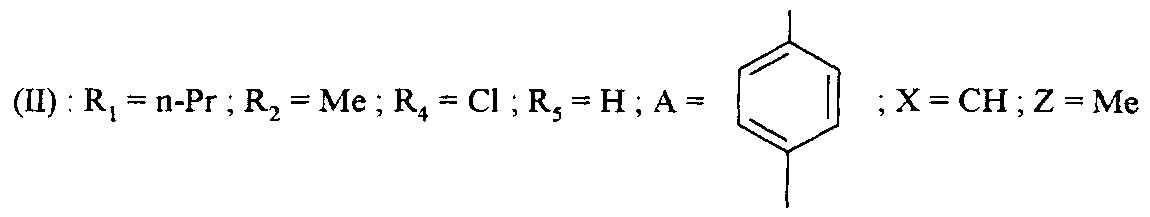
2,17 г 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорида, 2,61 г DMAP и 2,67 г соединения из Получения 6.3 добавляют к раствору 2,70 г соединения из Получения 3.1 в 50 мл 1,2-дихлорэтана и полученное перемешивают в течение 20 часов при КТ. Реакционную смесь отмывают 1N раствором HCl, насыщенным раствором NaHCO3 и водой, органическую фазу высушивают над Na2SO4 и растворитель выпаривают под вакуумом. Остаток поглощают ацетоном и осадок, который образовался, отфильтровывают. Получают 3,35 г предполагаемого соединения.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,62 (2Н, m); 2,50 (3Н, s); 2,82 (2Н, t); 3,73 (3Н, s); 5,34 (2Н, s); 7,29 (1H, d); 7,50 (2Н, d); 7,60 (1H, d); 7,94 (2Н, d); 8,21 (1H, s); 8,24 (1H, s); 8,35 (1H, s); 10,20 (1H, s).
Следуя процедуре, описанной в Получении 9.10, получают соединения формулы (II), представленной в ТАБЛИЦЕ VIII ниже. 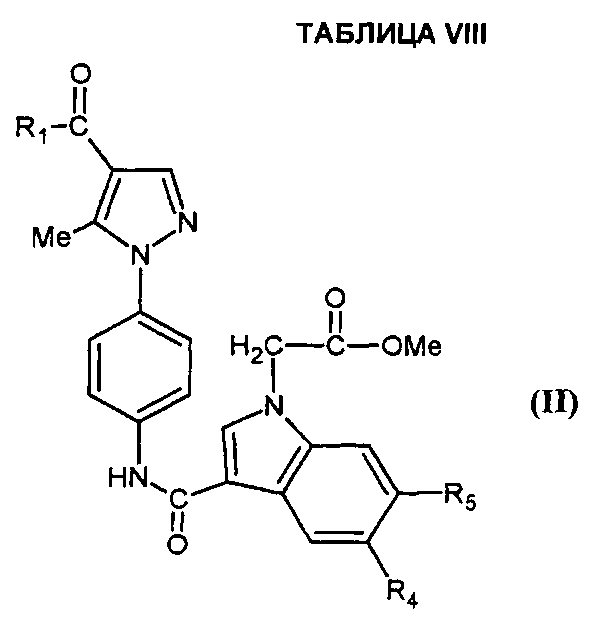
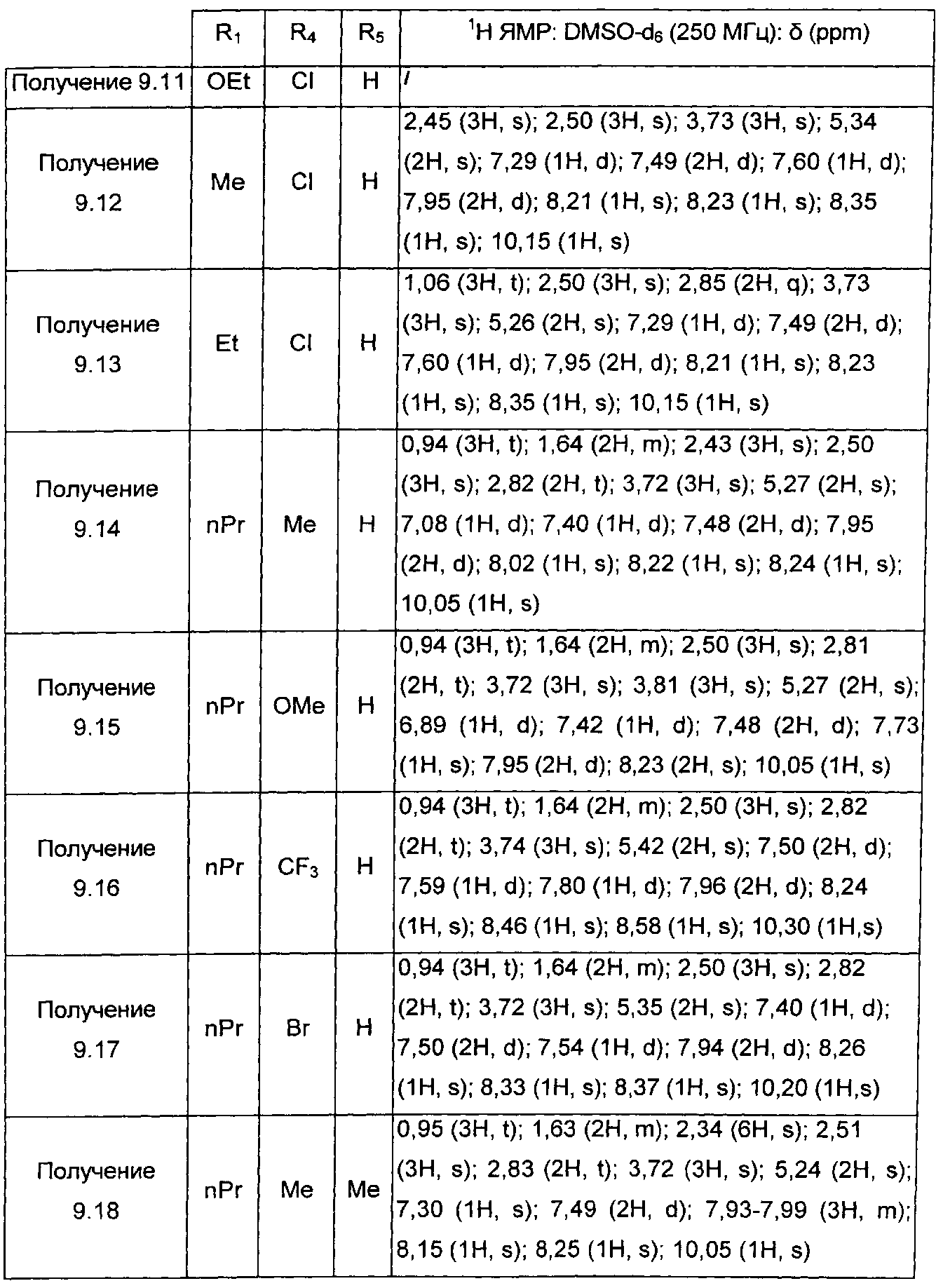

Получение 9.20
Метил(3-[[2-бром-4-(4-бутирил-5-метил-1H-пиразол-1-ил)-фенил]карбамоил]-5-хлор-1H-индол-1-ил)ацетат

0,63 мл пиридина и затем 1 г соединения из Получения 6.7 добавляют к 1,33 г соединения из этапа 1 Получения 9.1 в 25 мл 1,2-дихлорэтана. Реакционную смесь помещают в микроволновый прибор при 80°C на 30 мин (300 Вт). После того, как полученное возвращается к КТ, добавляют 50 мл воды и полученное экстрагируют с помощью DCM. Комбинированные органические фазы отмывают насыщенным бикарбонатом натрия, водой и солевым раствором, высушивают над сульфатом натрия и выпаривают до сухого состояния. Продукт растирают в ацетоне и затем фильтруют, получая 0,89 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,58 (3Н, s); 2,83 (2Н, t); 3,73 (3Н, s); 5,34 (2Н, s); 7,29 (1H, d); 7,57-7,63 (2Н, m); 7,86 (1H,d); 7,93 (1H, d); 8,18 (1H, s); 8,30 (1H, s); 8,34 (1H, s); 9,69 (1H, s).
Следуя процедуре, описанной в Получении 9.20, получают соединения формулы (II), представленной в ТАБЛИЦЕ IX ниже.
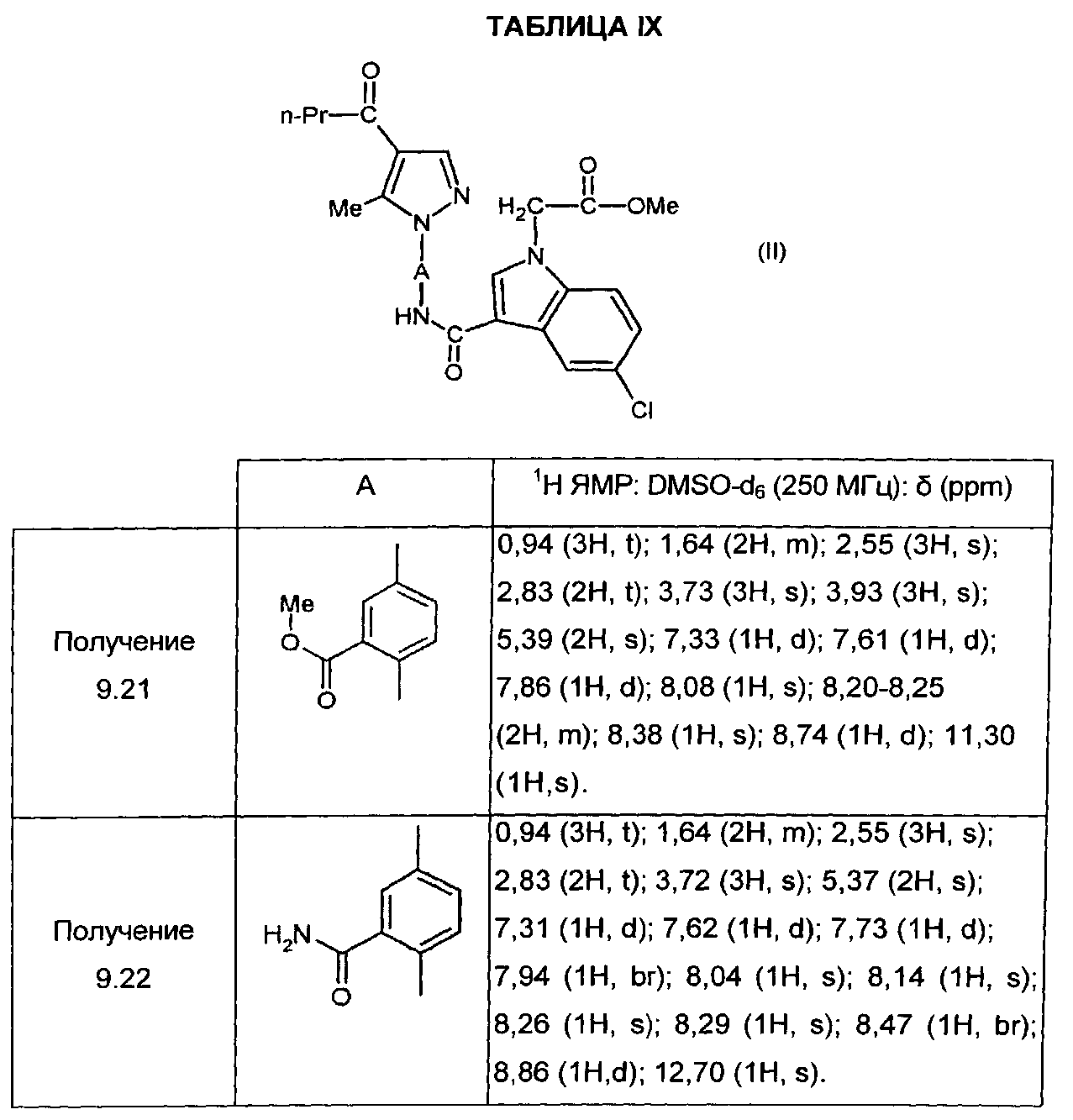
Получение 9.23
Метил-3-{[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]карбамоил}-5-фенил-1H-индол-1-ил)ацетат

0,18 г фенилбороновой кислоты и 0,36 г K3PO4.2H2O добавляют к 0,60 соединения из Получения 9.17 в 10 мл диоксана. Реакционную смесь дегазируют с помощью аргона, затем добавляют 0,06 г тетракис(трифенилфосфин)палладия(0) и полученное нагревают с обратным холодильником в течение 5 часов. Добавляют 50 мл EtOAc и 50 мл воды, выделяют органическую фазу и затем водную фазу экстрагируют еще два раза. Органические фазы комбинируют, отмывают водой и затем солевым раствором и высушивают над Na2SO4. После испарения твердый остаток очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH до (98/2; объем/объем). Получают 0,39 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,96 (3Н, t); 1,65 (2Н, m); 2,54 (3Н, s); 2,83 (2Н, t); 3,75 (3Н, s); 5,37 (2Н, s); 7,33-7,75 (9Н, m); 7,99 (2Н, d); 8,25 (1H, s); 8,33 (1H, s); 8,48 (1H, s); 10,20 (1H, s).
Получение 9.24
Метил[3-{[4-(4-бутирил-5-метил-1H-пиразол-1-ил)-фенил]карбамоил}-5-(диметиламино)-1H-индол-1-ил]ацетат
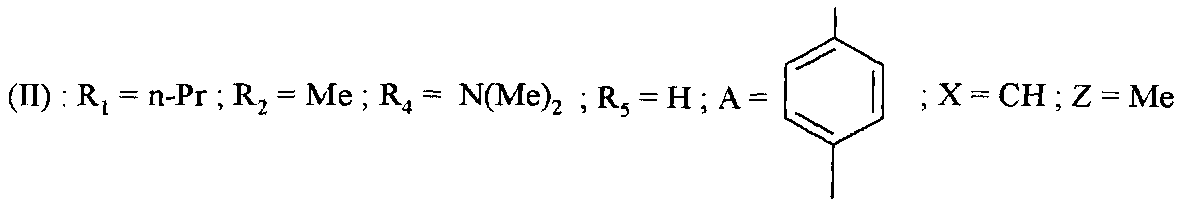
0,26 г пролина и 0,21 г йодида меди(1) добавляют к 1 г соединения из Получения 9.17 в 7 мл DMSO в пробирке с завинчивающейся крышкой. Реакционную смесь дегазируют с помощью азота, затем добавляют 7 мл 2М раствора диметиламина в THF. Пробирку закрывают и нагревают полученное при 120°C в течение 7 часов. Реакционную смесь вливают в воду и экстрагируют с помощью EtOAc, органическую фазу высушивают над Na2SO4 и выпаривают. Твердый остаток очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH до (95/5; объем/объем). Получают 0,11 г порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,52 (3Н, s); 2,83 (2Н, t); 2,91 (6Н, s); 3,71 (3Н, s); 5,22 (2Н, s); 6,88 (1H, d); 7,34 (1H, d); 7,47 (2Н, d); 7,56 (1H, s); 7,95 (2Н, d); 8,16 (1H, s); 8,24 (1H, s); 9,95 (1H, s).
Получение 9.25
Метил(3-{[4-(4-бутирил-5-метил-1H-пиразол-1-ил)-фенил]карбамоил}-5-циано-1H-индол-1-ил)ацетат
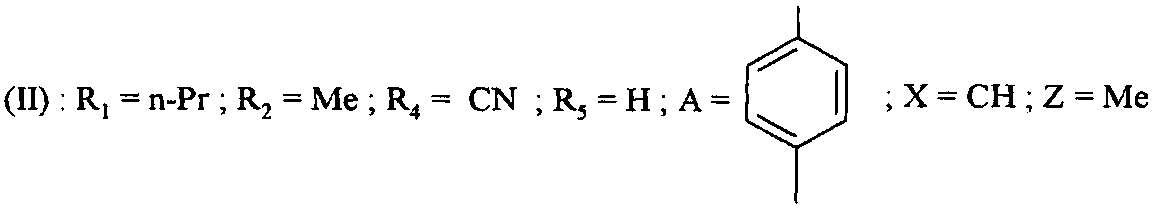
В пробирке с завинчивающейся крышкой 3 г соединения из Получения 9.17 растворяют в 40 мл DMF. Реакционную смесь дегазируют с помощью аргона, затем добавляют 0,79 г цианида цинка(II) и 0,32 г тетракис(трифенилфосфин)палладия(0). Пробирку закрывают и затем нагревают полученное при 100°C в течение 7 часов. Реакционную смесь вливают в разбавленный раствор бикарбоната натрия, обеспечивая, чтобы в конце добавления pH раствора был основным. Полученное экстрагируют с помощью EtOAc, органическую фазу высушивают над Na2SO4 и выпаривают. Твердый остаток растирают в МеОН и затем фильтруют, получая 2,2 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,52 (3Н, s); 2,82 (2Н, t); 3,73 (3Н, s); 5,42 (2Н, s); 7,52 (2Н, d); 7,66 (1H, d); 7,80 (1H, d); 7,95 (2Н, d); 8,25 (1H, s); 8,46 (1H, s); 8,61 (1H, s); 10,25 (1H, s).
Получение 9.26
Метил(3-{[4-(4-бутирил-5-метил-1H-пиразол-1-ил)-2-циано-фенил]карбамоил}-5-хлор-1H-индол-1-ил)ацетат
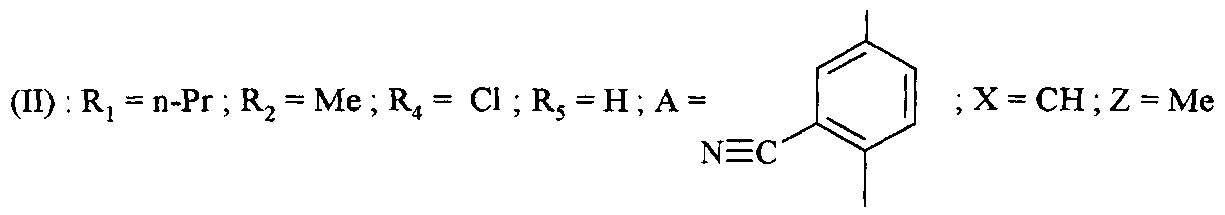
В пробирке с завинчивающейся крышкой 0,78 г соединения из Получения 9.21 растворяют в 15 мл DMF. Реакционную смесь дегазируют с помощью аргона, затем добавляют 0,21 г цианида цинка(II) и 0,08 г тетракис(трифенилфосфин)палладия(0). Пробирку закрывают и затем нагревают полученное при 100°C в течение 6 часов. Реакционную смесь вливают в разбавленный раствор бикарбоната натрия, обеспечивая, чтобы в конце добавления pH раствора был основным. Полученное экстрагируют с помощью EtOAc, отмывают водой, солевым раствором, высушивают над Na2SO4 и выпаривают. Твердый остаток растирают в изоэфире и затем фильтруют. Твердый остаток очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH до (95/5; объем/объем). Получают 0,59 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,59 (3Н, s); 2,83 (2Н, t); 3,73 (3Н, s); 5,37 (2Н, s); 7,32 (1H, d); 7,64 (1H, d); 7,80 (1H, d);7,91 (1H, d); 8,11 (1H, s); 8,17 (1H, s); 8,33 (2Н, d); 10,40 (1H, s).
ПРИМЕРЫ
ПРИМЕР 1: Соединение №1
(3-{[5-(4-бутирил-5-метил-1H-пиразол-1-ил)пиразин-2-ил]карбамоил}-5-хлор-1H-индол-1-ил)ацетат натрия
0,80 мл водного 1N раствора NaOH добавляют к 0,14 г соединения из Получения 9.1 в 6 мл смеси МеОН/диоксан (50/50; объем/объем) и перемешивают полученное в течение 3 ч. Реакционную смесь выпаривают до сухого состояния. Твердый остаток растирают с водой и затем отфильтровывают, получая 0,10 г белого порошка.
ПРИМЕР 2: Соединение №2
(3-{[6-(4-бутирил-5-метил-1H-пиразол-1-ил)пиридазин-3-ил]карбамоил}-5-хлор-1H-индол-1-ил)уксусная кислота
5,30 мл водного 1N раствора NaOH добавляют к 2,20 г соединения из Получения 9.2 в 42 мл диоксана и перемешивают полученное в течение 2 ч. Реакционную смесь выпаривают до сухого состояния. Твердый остаток повторно растворяют в 30 мл воды и затем подкисляют с помощью 7 мл 1N раствора HCl. Осадок, который образовался, отфильтровывают, его отмывают водой, получая 2,07 г бежевого порошка.
ПРИМЕР 3: Соединение №3, (3-{[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]карбамоил}-5-хлор-1H-индол-1-ил)уксусная кислота
32,9 мл водного 2N раствора NaOH добавляют к 16,2 г соединения из Получения 9.11 в 60 мл смеси МеОН/диоксан (50/50; объем/объем) и перемешивают полученное в течение 2 часов. Реакционную смесь подкисляют с помощью 1N раствора HCl и затем полученное экстрагируют с помощью EtOAc. Комбинированные органические фазы отмывают солевым раствором, высушивают над Na2SO4 и затем выпаривают. Твердый остаток растирают со смесью ацетон/изоэфир (50/50; объем/объем) и затем фильтруют, получая 11 г белого порошка. Образованный осадок в ходе концентрирования фильтрата дает дополнительные 2,95 г, т.е. в общем 13,95 г.
ПРИМЕР 4: Соединение №4
(3-{[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]карбамоил}-5-хлор-6-метил-1H-индол-1-ил)ацетат натрия
0,22 мл водного 1N раствора NaOH добавляют к 0,11 г соединения из Получения 9.8 в 5 мл смеси МеОН/диоксан (50/50; объем/объем) и затем выпаривают до сухого состояния. Твердый остаток повторно растворяют в минимальном количестве ацетона (приблизительно 1 мл) и полученное добавляют по каплям к 10 мл пентана. Образованный осадок фильтруют и высушивают в вакуумной сушильной камере, получая 0,082 г белого порошка.
Следуя процедурам, описанным в Примерах 1-4, получают соединения формулы (I), представленной в ТАБЛИЦЕ X ниже.
В данной таблице
- Me представляет собой метильный радикал;
- Et представляет собой радикал этил;
- nPr представляет собой радикал н-пропил;
- Ph представляет собой радикал фенил;
- Na представляет собой соединение в форме натриевой соли.
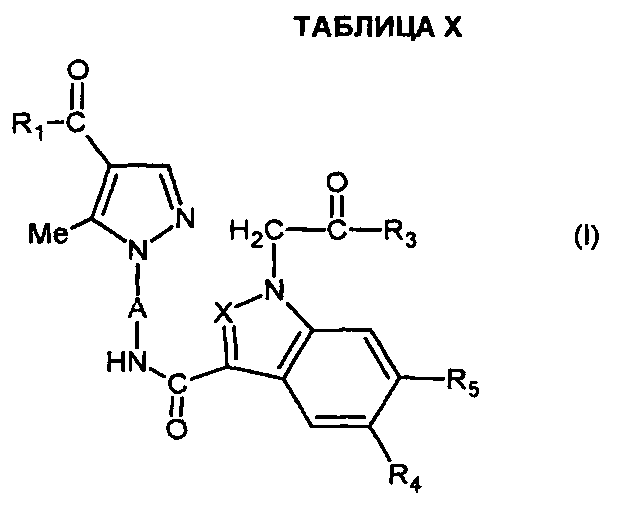
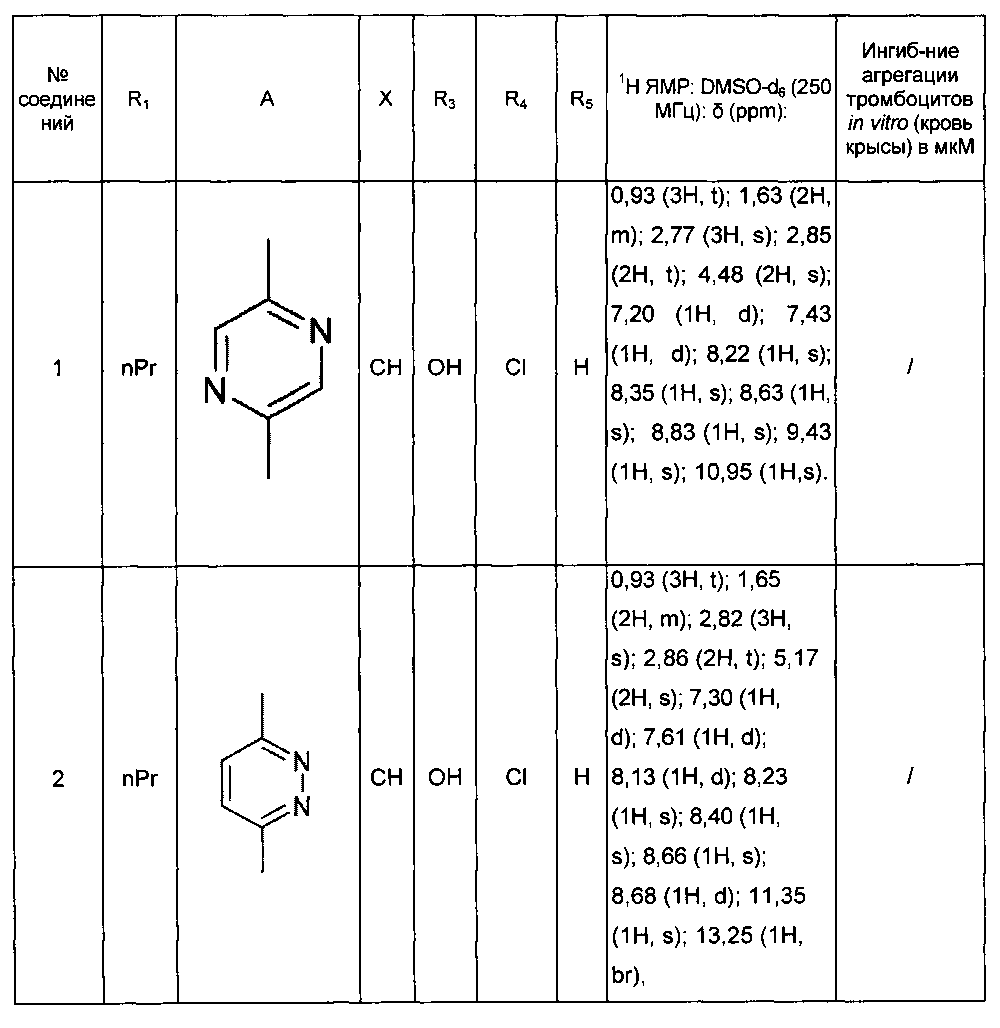
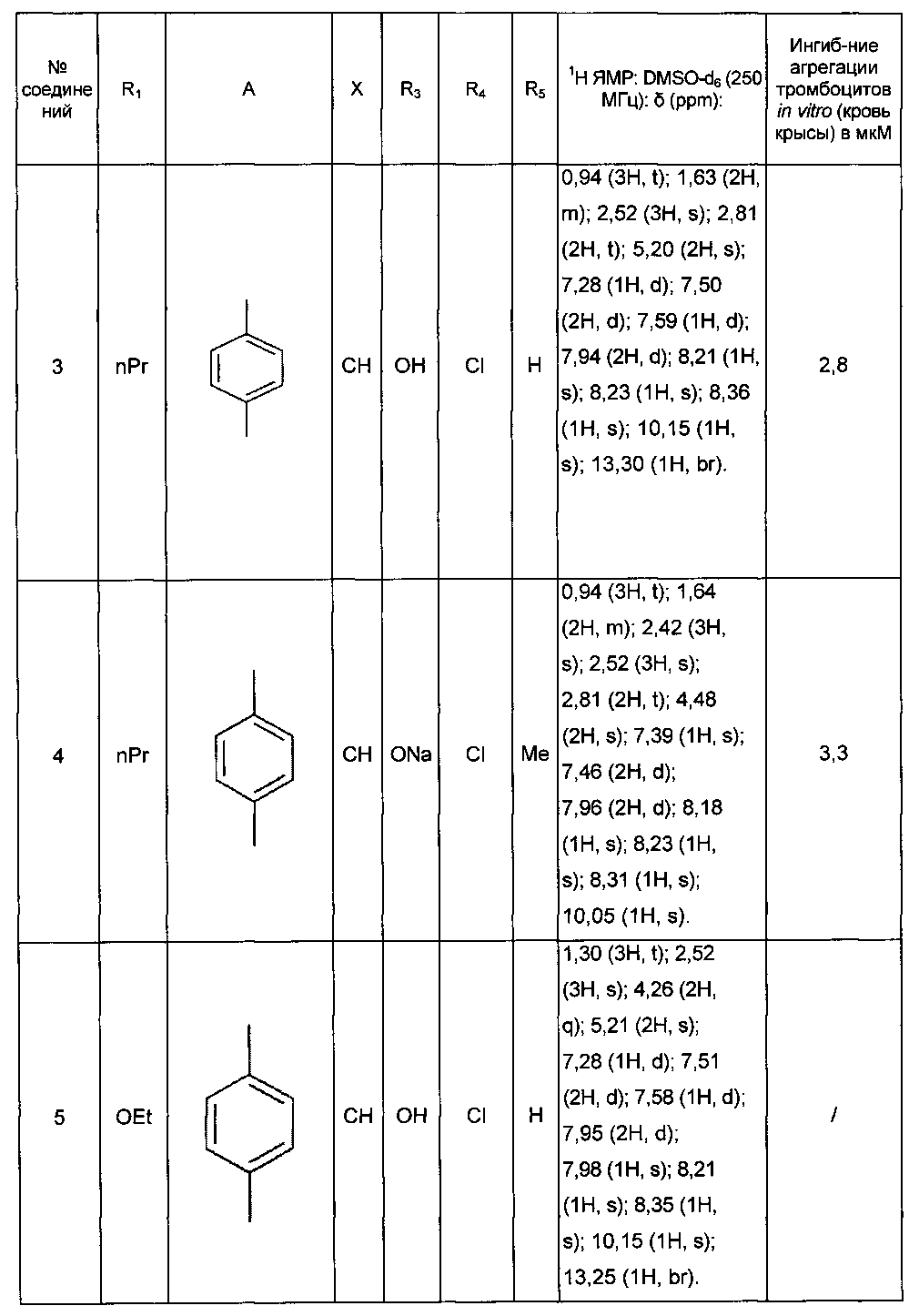
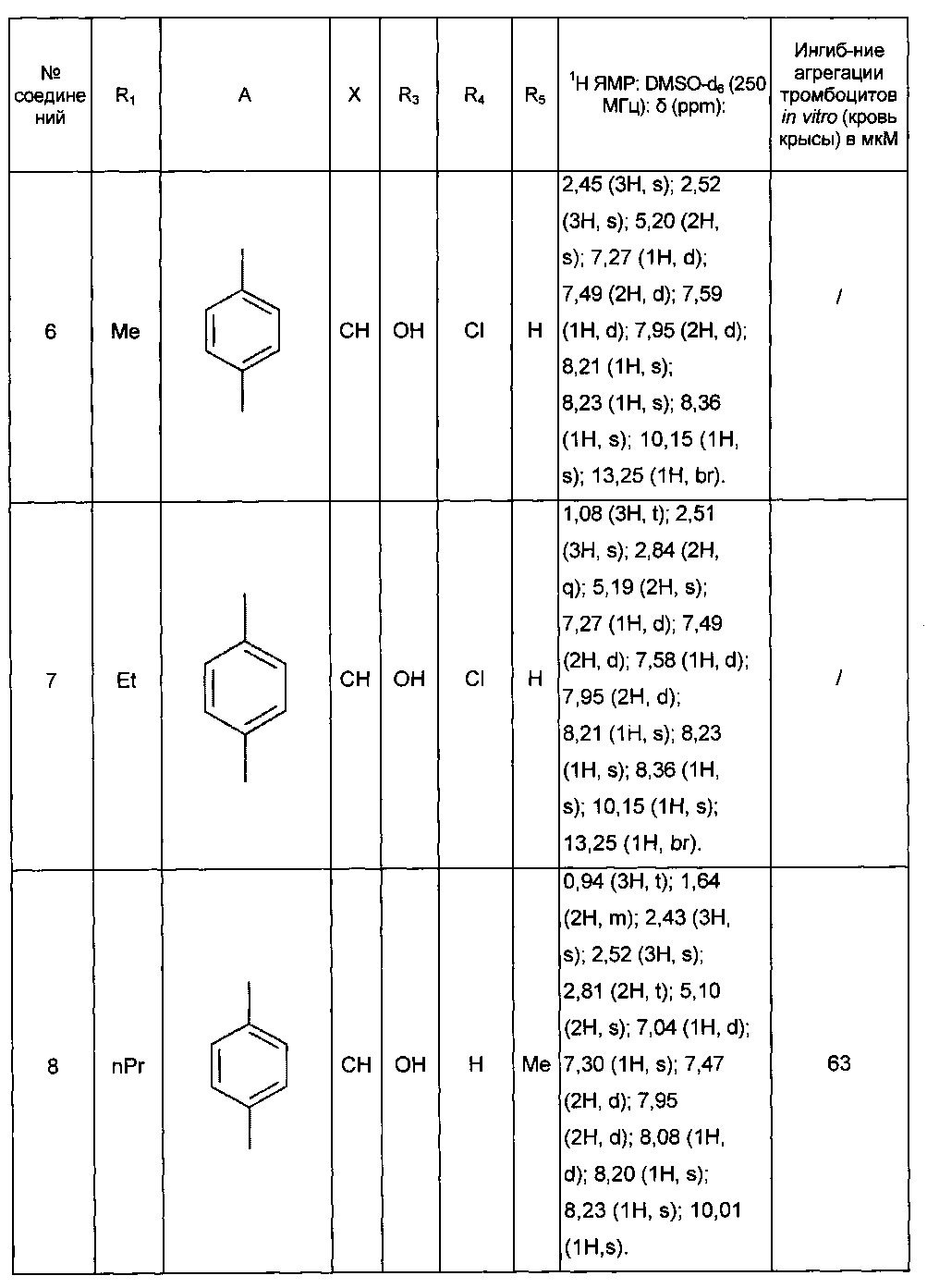
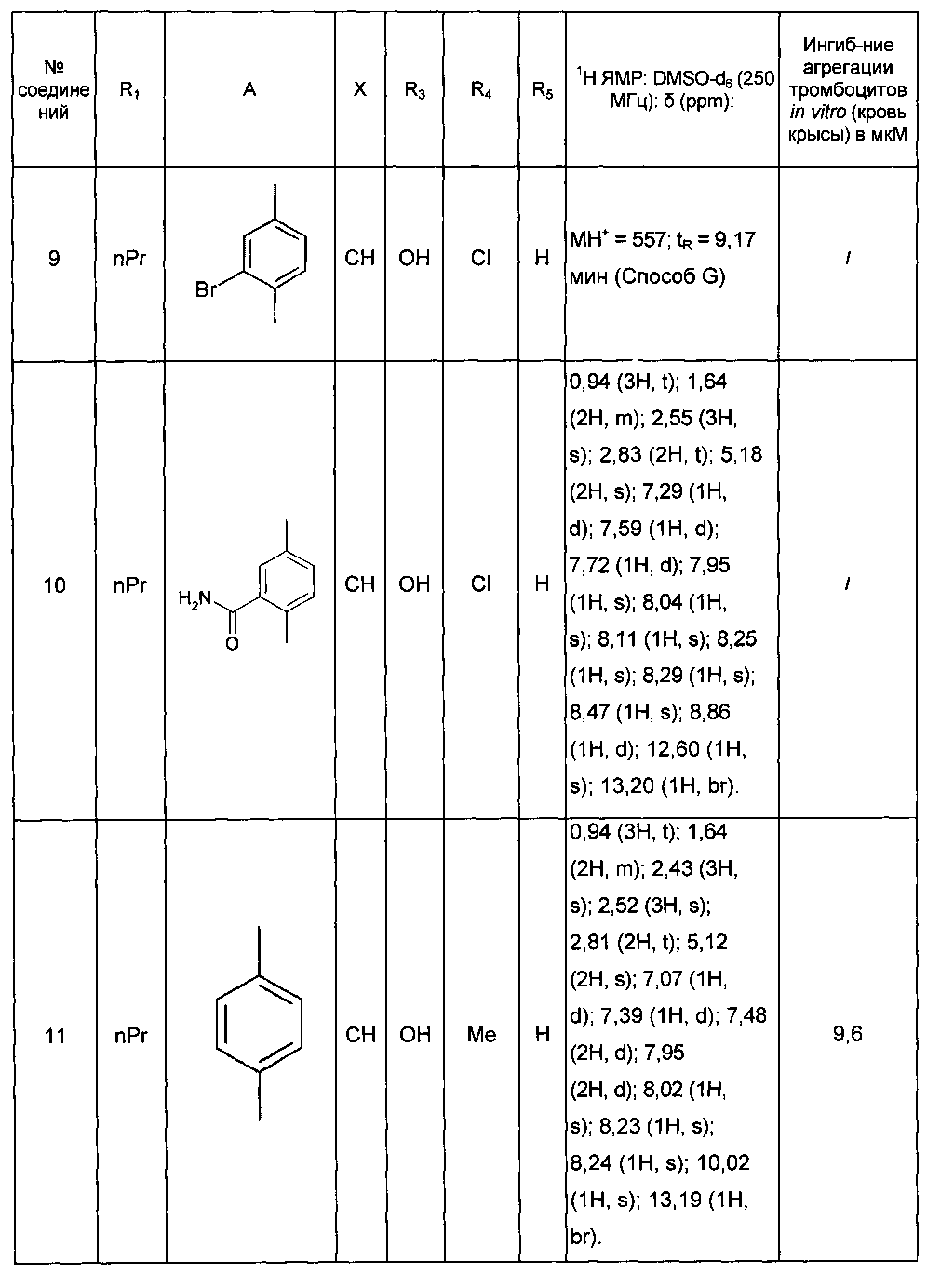
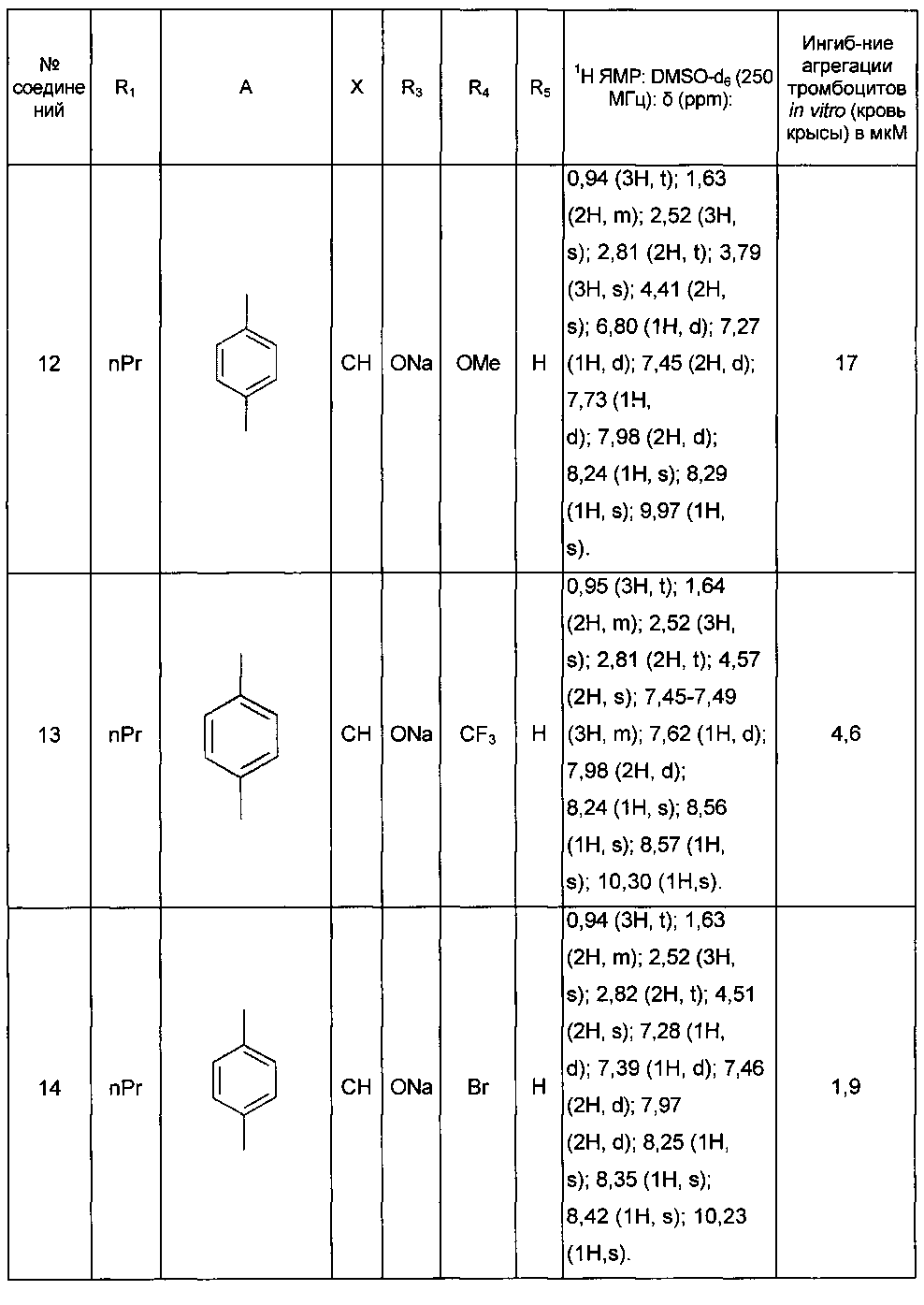

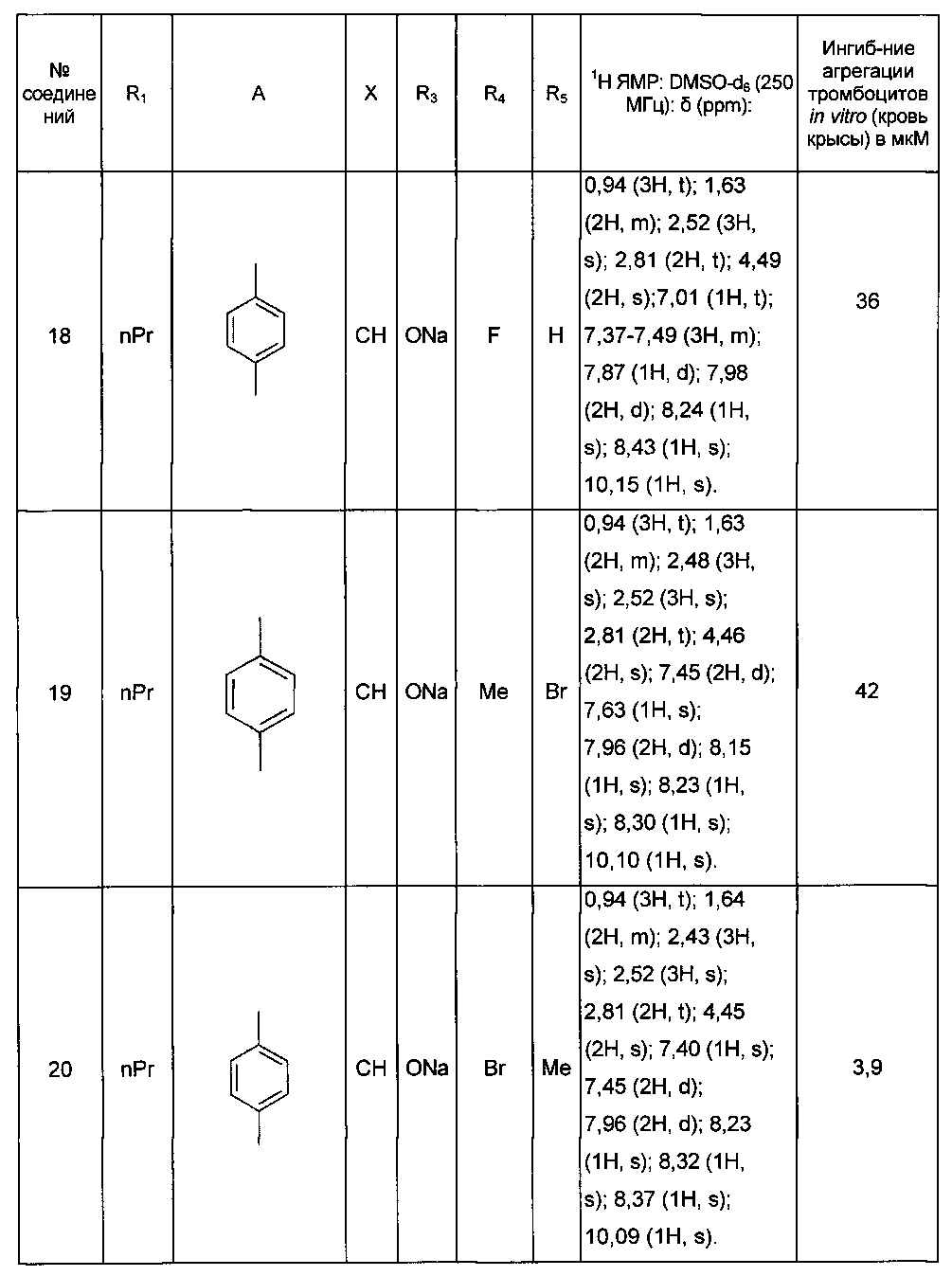
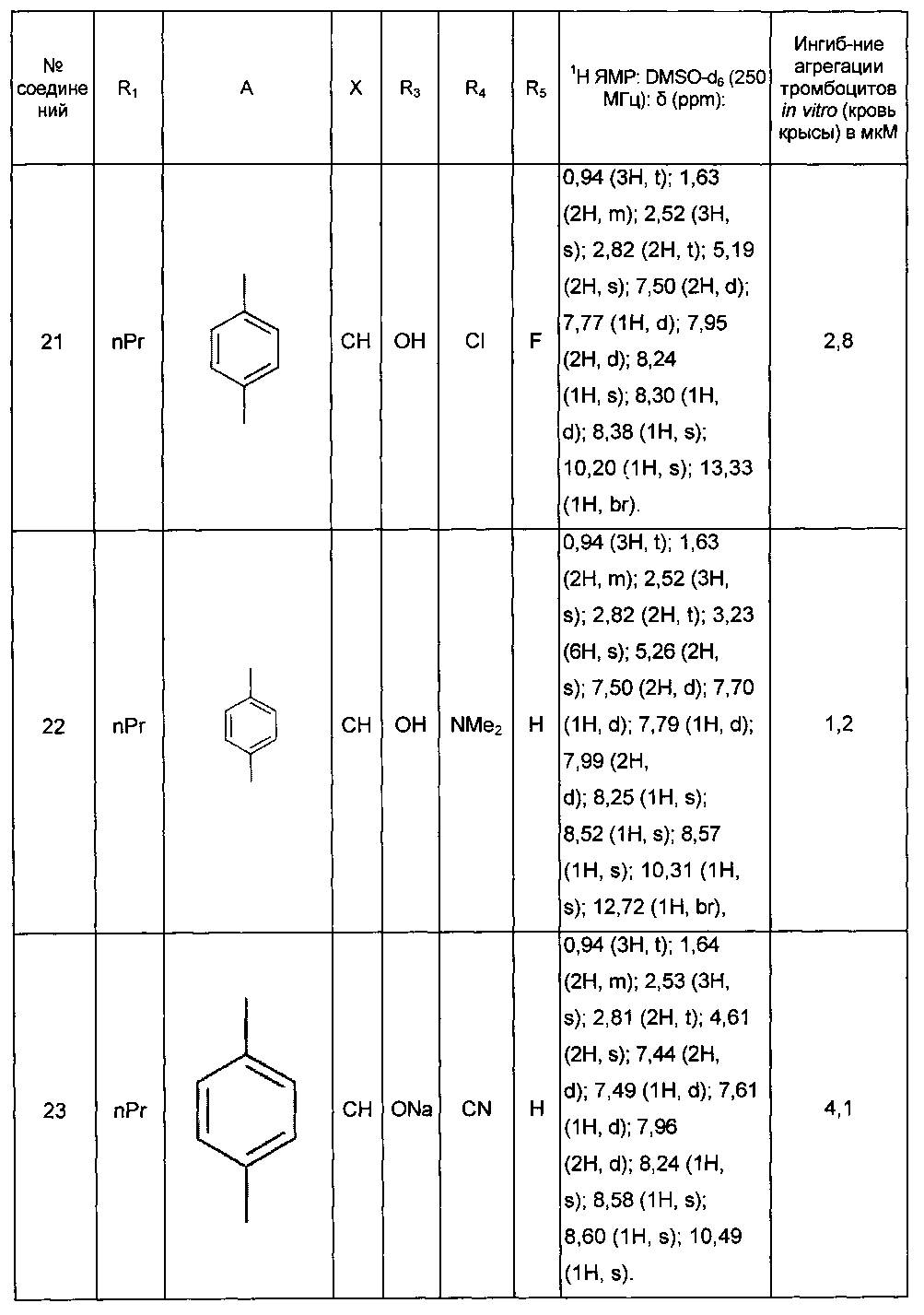
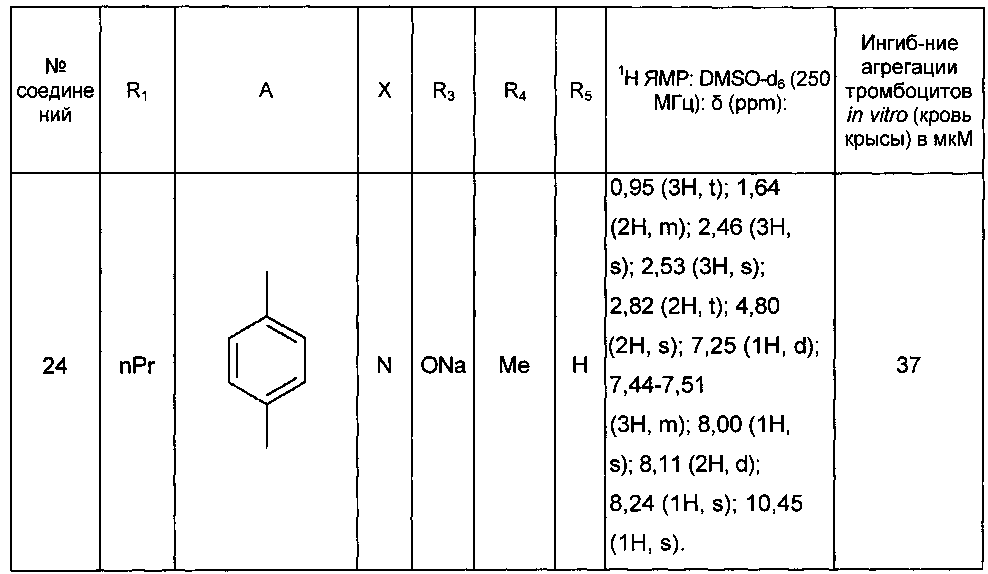
ПРИМЕР 5: Соединение №25
(3-{[4-(4-бутирил-5-метил-1Н-пиразол-1-ил)-2-(метоксикарбонил)фенил]карбамоил}-5-хлор-1Н-индол-1-ил)уксусная кислота
0,03 г гидроксида лития добавляют к 0,71 г соединения из Получения 9.22 в 20 мл THF и полученное перемешивают в течение 2 часов. Полученное выпаривают до сухого состояния, твердый остаток растирают с DCM и затем отфильтровывают. Осадок поглощают водой, подкисляют с помощью 0,175 мг KHSO4, осадок, который образовался, отфильтровывают, полученное отмывают водой и высушивают под вакуумом, получая 0,47 г бежевого порошка.
Следуя процедуре, описанной в Примере 5, получают соединения формулы (I), представленной в ТАБЛИЦЕ XI ниже.

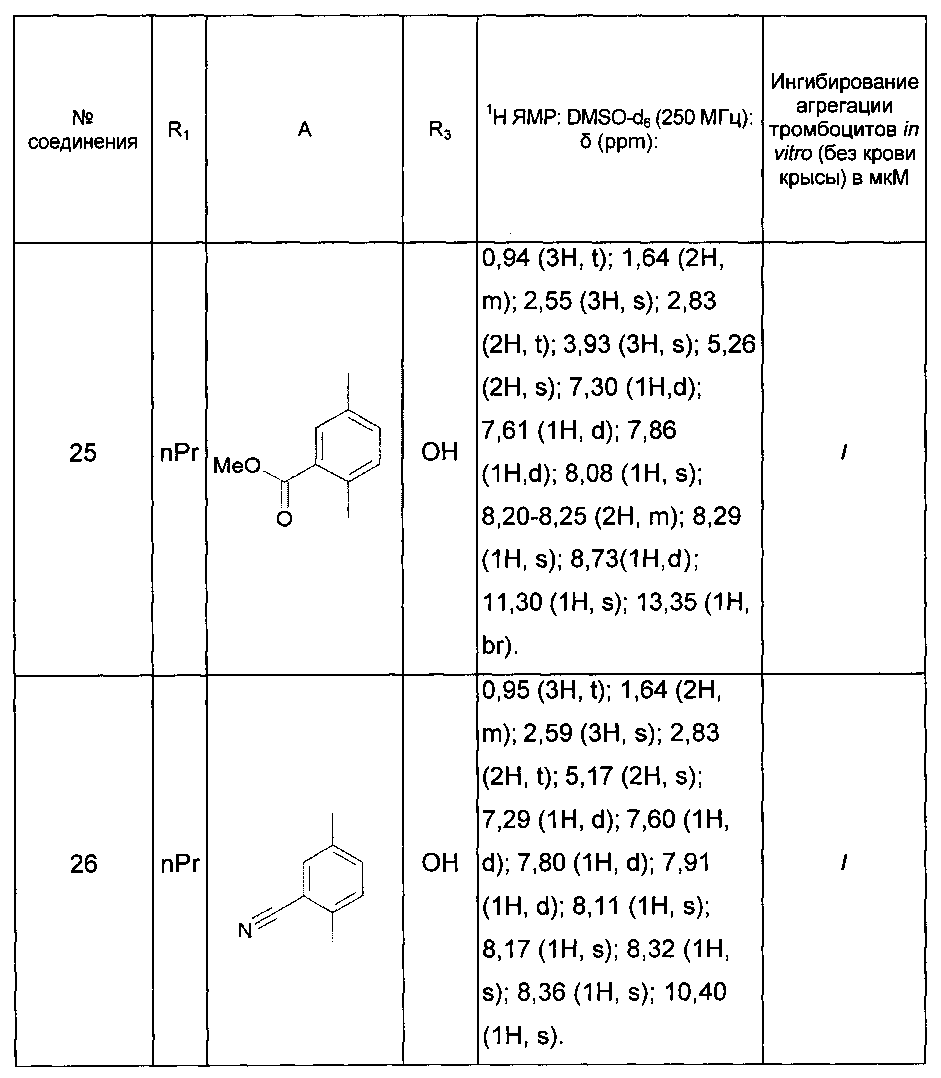
ПРИМЕР 6: Соединение №27
N-[5-(4-бутирил-5-метил-1Н-пиразол-1-ил)пиразин-2-ил]-5-хлор-1-[2-(4-метилпиперазин-1-ил)-2-оксоэтил]-1Н-индол-3-карбоксамида гидрохлорид
0,055 г 1-метилпиперазина (коммерческого) и 0,086 г BOP-Cl добавляют последовательно к 0,10 г соединения из Примера 1 в 5 мл DCM. Среда является гетерогенной. Добавляют 2 мл DMF и гомогенную реакционную смесь перемешивают в течение ночи. Полученное выпаривают до сухого состояния, добавляют 1М раствор NaHCO3 и полученное экстрагируют с помощью DCM.
Комбинированные органические фазы отмывают водой, солевым раствором, высушивают над Na2SO4 и затем выпаривают под вакуумом. Масляный остаток, полученный таким образом, очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH (градиент от 1 до 10% МеОН), получая 0,08 г белого порошка. Полученное повторно растворяют в 6 мл смеси DCM/ацетон (50/50; объем/объем) и затем добавляют 0,09 мл 2N раствора этилхлорида. Полученное выпаривают до сухого состояния, растирают с ацетоном, отфильтровывают и затем высушивают в вакуумной сушильной камере при 60°C, получая 0,06 г белого порошка.
ПРИМЕР 7: Соединение №28
N-[6-(4-бутирил-5-метил-1Н-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-[2-(4-метилпиперазин-1-ил)-2-оксоэтил]-1Н-индол-3-карбоксамида гидрохлорид
1,66 г 1-метилпиперазина (коммерческого), 2,18 г пиридина и 4,30 г ВОР-Cl добавляют последовательно к 2,65 г соединения из Примера 2 в 80 мл DMF. Полученное перемешивают в течение 48 ч, затем реакционную смесь вливают в смесь EtOAc и насыщенного раствора NaHCO3. Образованный осадок фильтруют и отмывают изоэфиром. Фильтрат переносят на делительную воронку и органическую фазу отмывают водой, солевым раствором и затем высушивают над Na2SO4. Органическую фазу концентрируют частично и образованный осадок фильтруют. Два осадка комбинируют и высушивают в вакуумной сушильной камере, получая 2,68 г белого порошка. Его суспендируют в 200 мл МеОН, затем добавляют 6,6 мл 1N раствора HCl в эфире и полученное перемешивают в течение 1 ч. Осадок, который образовался, отфильтровывают, полученное отмывают изоэфиром и затем высушивают в вакуумной сушильной камере при 40°C, получая 2,29 г светло-желтого порошка.
ПРИМЕР 8: Соединение №29
N-[6-(4-бутирил-5-метил-1Н-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-{2-[4-(2-метоксиэтил)пиперазин-1-ил]-2-оксоэтил}-1Н-индол-3-карбоксамида гидрохлорид
0,14 г DMAP, 0,10 г 1-(2-метоксиэтил)пиперазина и 0,17 г BOP-Cl добавляют последовательно к 0,11 г соединения из Примера 2 в 10 мл DMF. Полученное перемешивают в течение ночи, затем реакционную смесь вливают в смесь EtOAc и насыщенного раствора NaHCO3. Органическую фазу отмывают водой, солевым раствором, высушивают над Na2SO4 и затем выпаривают до сухого состояния. Твердый остаток, полученный таким образом, очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH (градиент от 2 до 5% МеОН). Очищенный продукт повторно растворяют в 5 мл смеси DCM/ацетон (50/50; объем/объем) и затем добавляют 0,12 мл 2N раствора этилхлорида. Полученное частично концентрируют. Медленно образуется осадок. Полученное отфильтровывают, отмывают ацетоном и затем пентаном и высушивают в вакуумной сушильной камере при 60°C, получая 0,11 г светло-желтого порошка.
ПРИМЕР 9: Соединение №30
N-[6-(4-бутирил-5-метил-1Н-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-(2-оксо-2-{4-[2-(трифторметокси)этил]пиперазин-1-ил}этил)-1Н-индол-3-карбоксамида гидрохлорид
0,11 г DMAP, 0,08 г 1-[2-(трифторметокси)этил]пиперазина, 0,13 мл пиридина и 0,24 г BOP-Cl добавляют последовательно к 0,15 г соединения из Примера 2 в 20 мл DMF, и полученное перемешивают при КТ в течение ночи. Добавляют EtOAc, полученное отмывают водой, солевым раствором, высушивают над Na2SO4 и затем выпаривают до сухого состояния. Твердый остаток, полученный таким образом, очищают с помощью колоночной хроматографии с силикагелем, элюируя смесью DCM и метанола (градиент от 1 до 10% метанола), получая 0,08 г порошка. Очищенный продукт повторно растворяют в 4 мл смеси (1:1) метанола и ацетона, затем добавляют 0,15 мл 2N раствора этилхлорида. Полученное вливают в 30 мл изоэфира, осадок, который образовался, отфильтровывают и высушивают в вакуумной сушильной камере при 60°C, получая 0,06 г белого порошка.
ПРИМЕР 10: Соединение №31
N-[6-(4-бутирил-5-метил-1Н-пиразол-1-ил)пиридазин-3-ил]-5-хлор-1-{2-оксо-2-[4-(3,3,3-трифторпропил)пиперазин-1-ил]этил}-1Н-индол-3-карбоксамида гидрохлорид
0,13 г 1-(3,3,3-трифторпропил)пиперазина, 0,04 г DMAP и 0,13 г BOP-Cl добавляют последовательно к 0,16 г соединения из Примера 2 в 5 мл DCM и полученное перемешивают при КТ в течение 48 ч. Реакционную смесь выпаривают до сухого состояния и твердый остаток растирают с 1М раствором NaHCO3. Осадок фильтруют и отмывают водой, получая 0,085 г белого порошка. Полученное повторно растворяют в 4 мл смеси (1: 1) DCM и ацетона и затем добавляют 0,28 мл 1N раствора HCl в эфире. Осадок, который образовался, отфильтровывают и высушивают в вакуумной сушильной камере при 60°C, получая 0,08 г белого порошка.
Следуя процедуре, описанной в Примерах 6-10, получают соединения формулы (I), представленной в ТАБЛИЦЕ XII ниже.
В данной таблице:
- в колонке "Соль" "-" представляет собой соединение в форме свободного основания, тогда как "HCl" представляет собой соединение в форме гидрохлорида, "TFA" представляет собой соединение в форме трифторацетата;
- Me представляет собой метильный радикал;
- Et представляет собой радикал этил;
- nPr представляет собой радикал н-пропил.
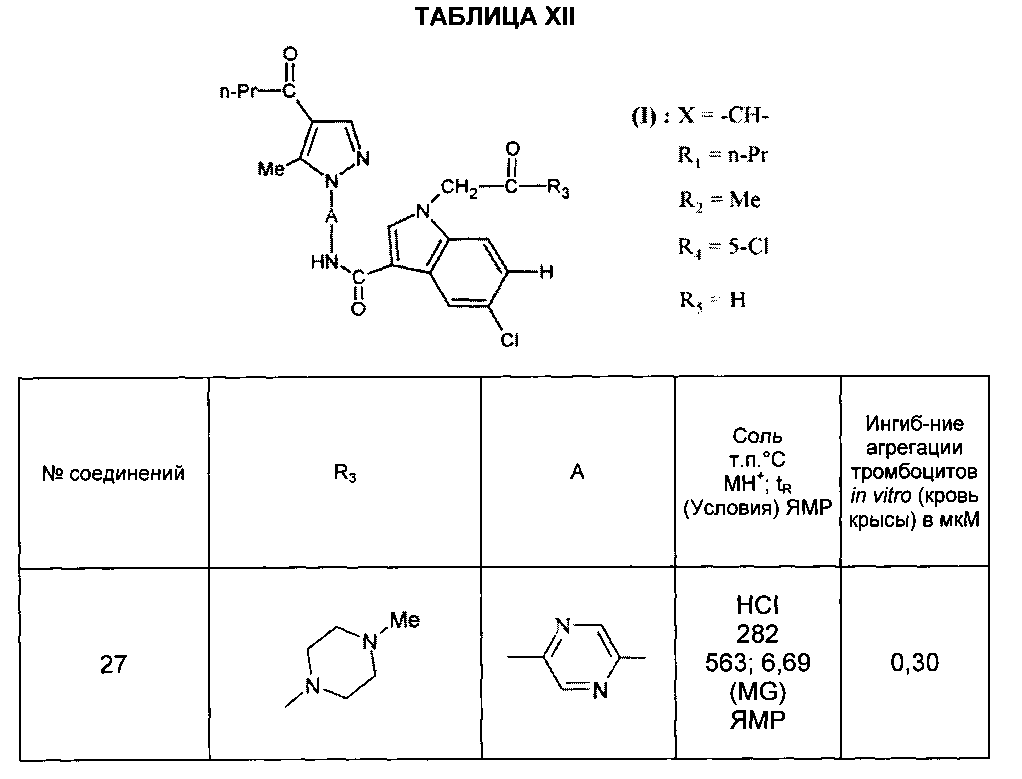
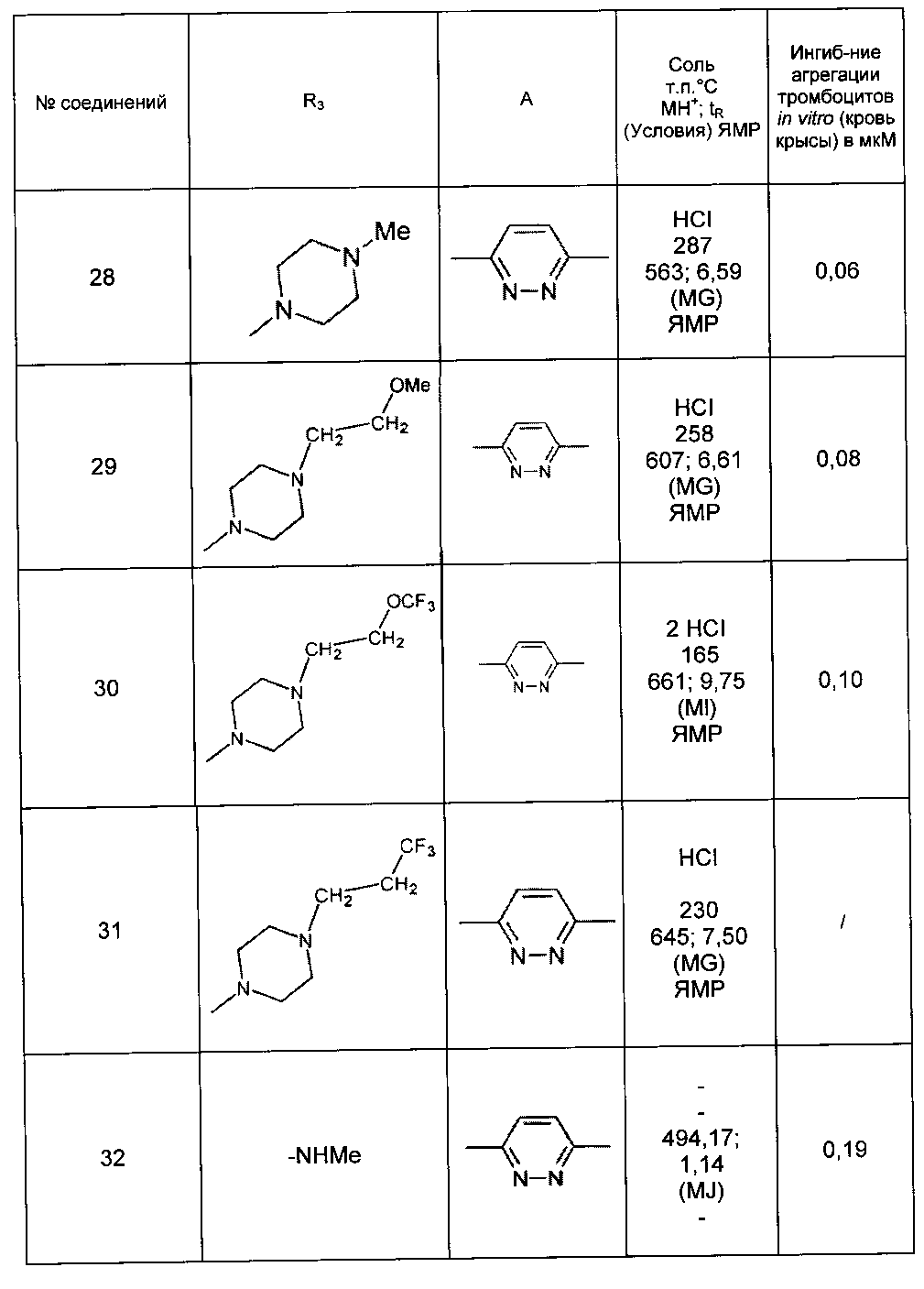
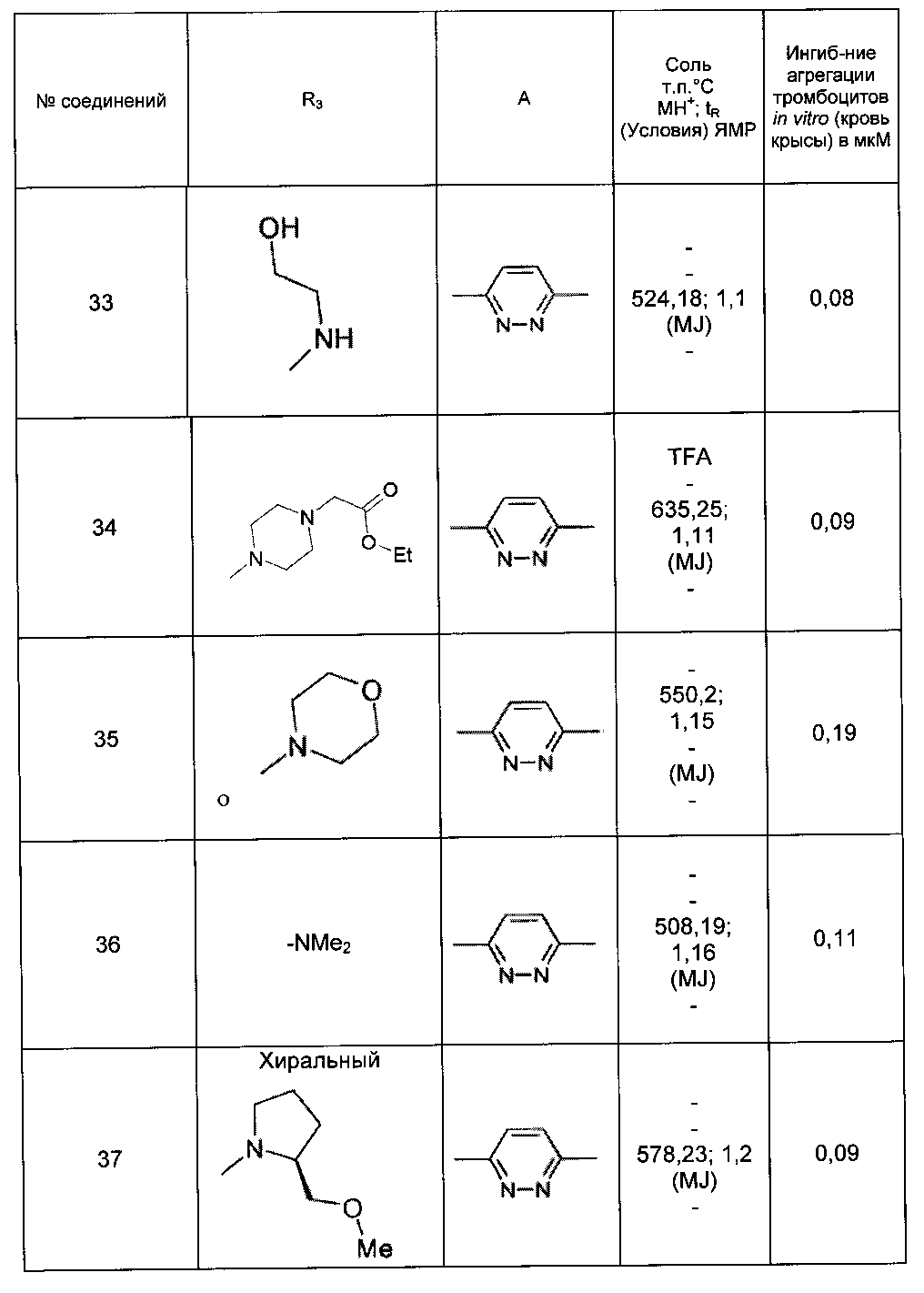
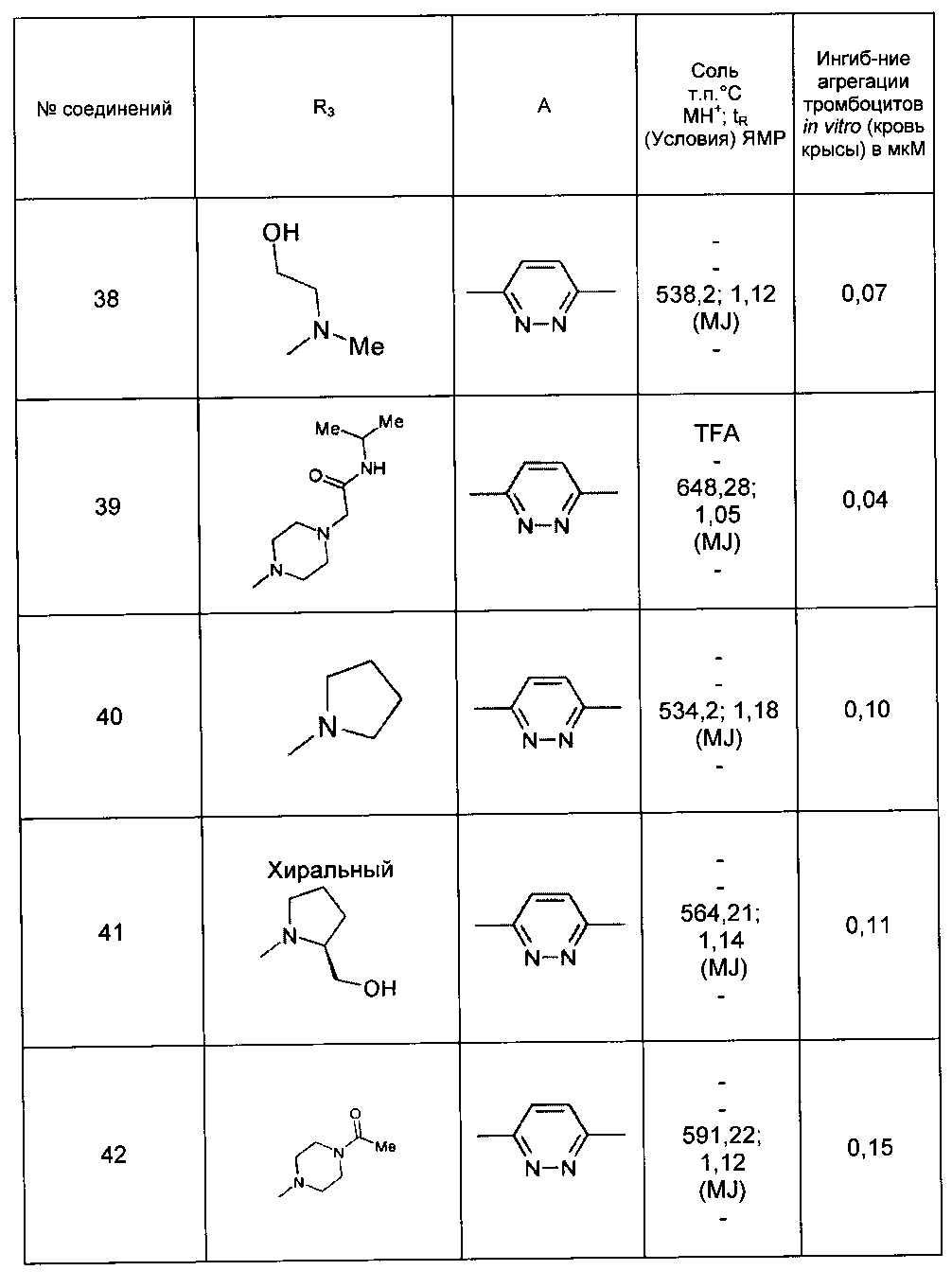
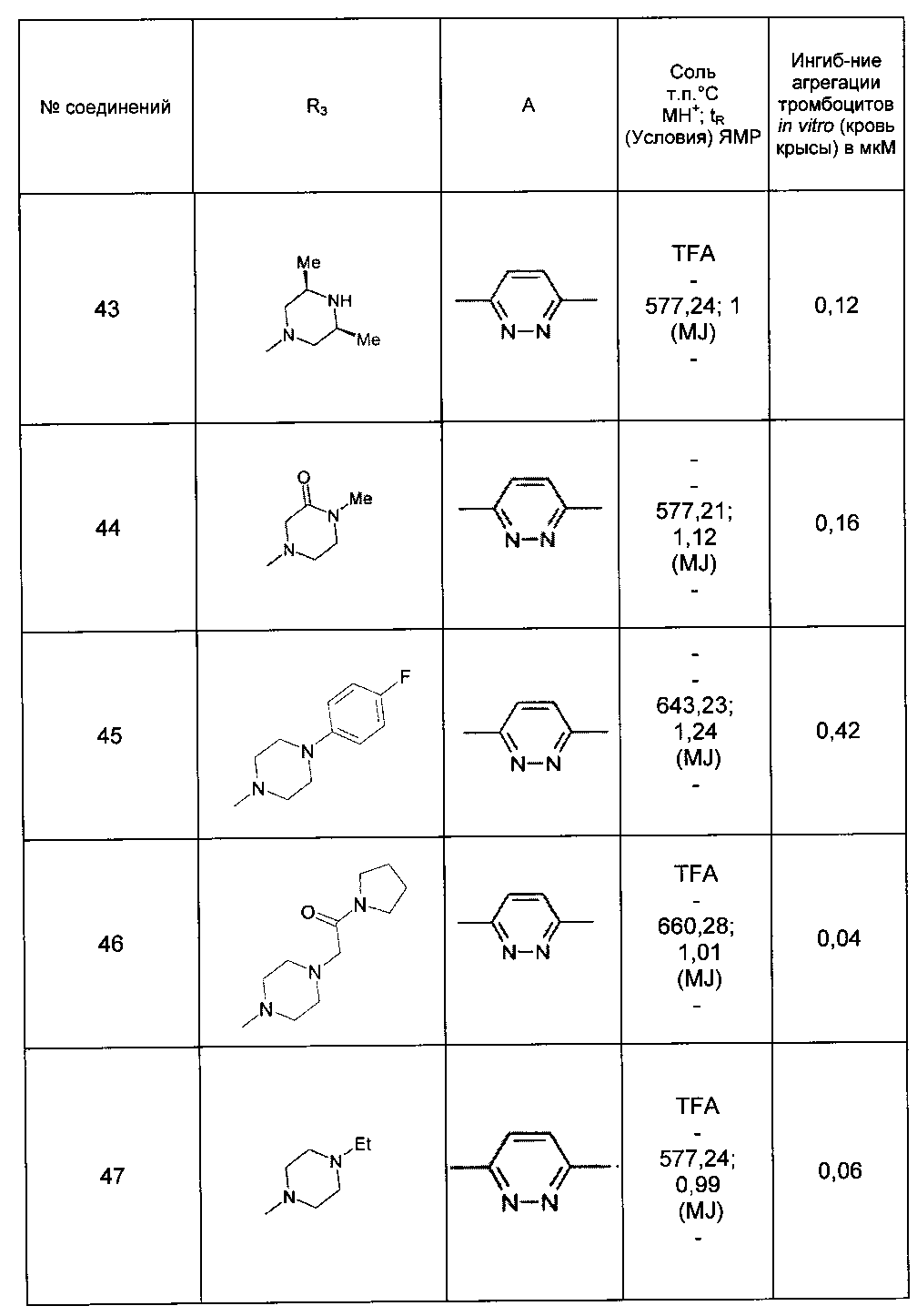
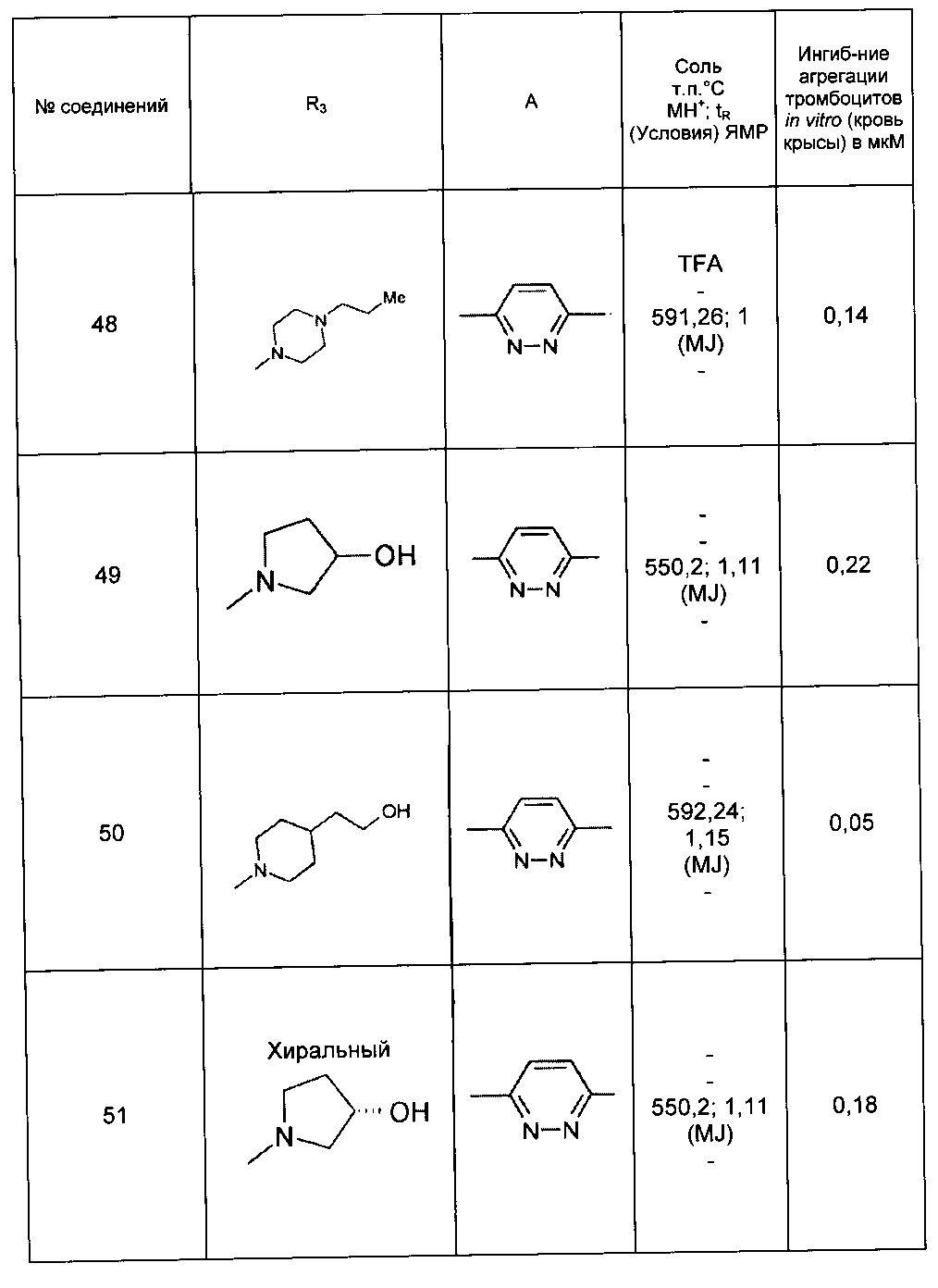
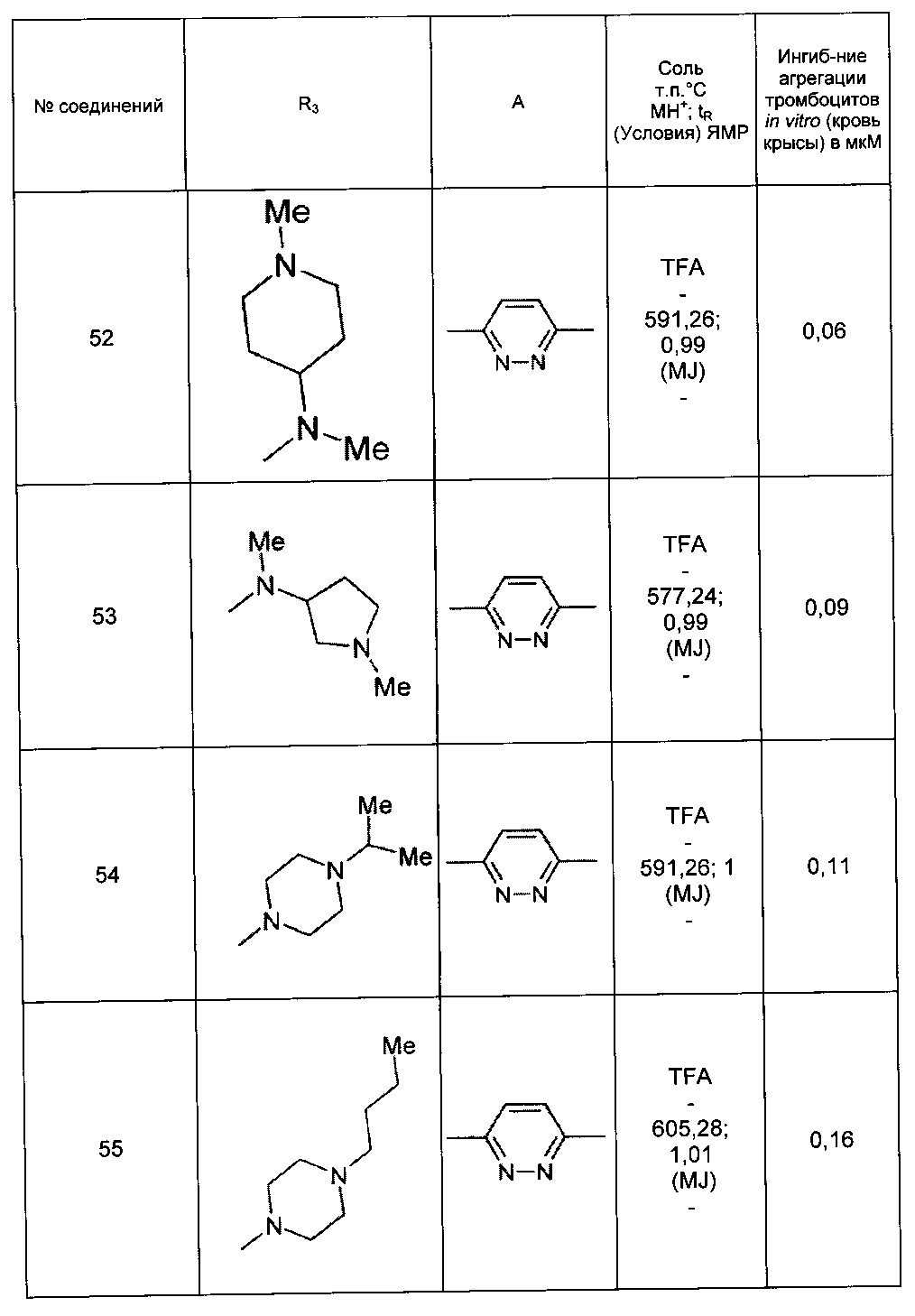
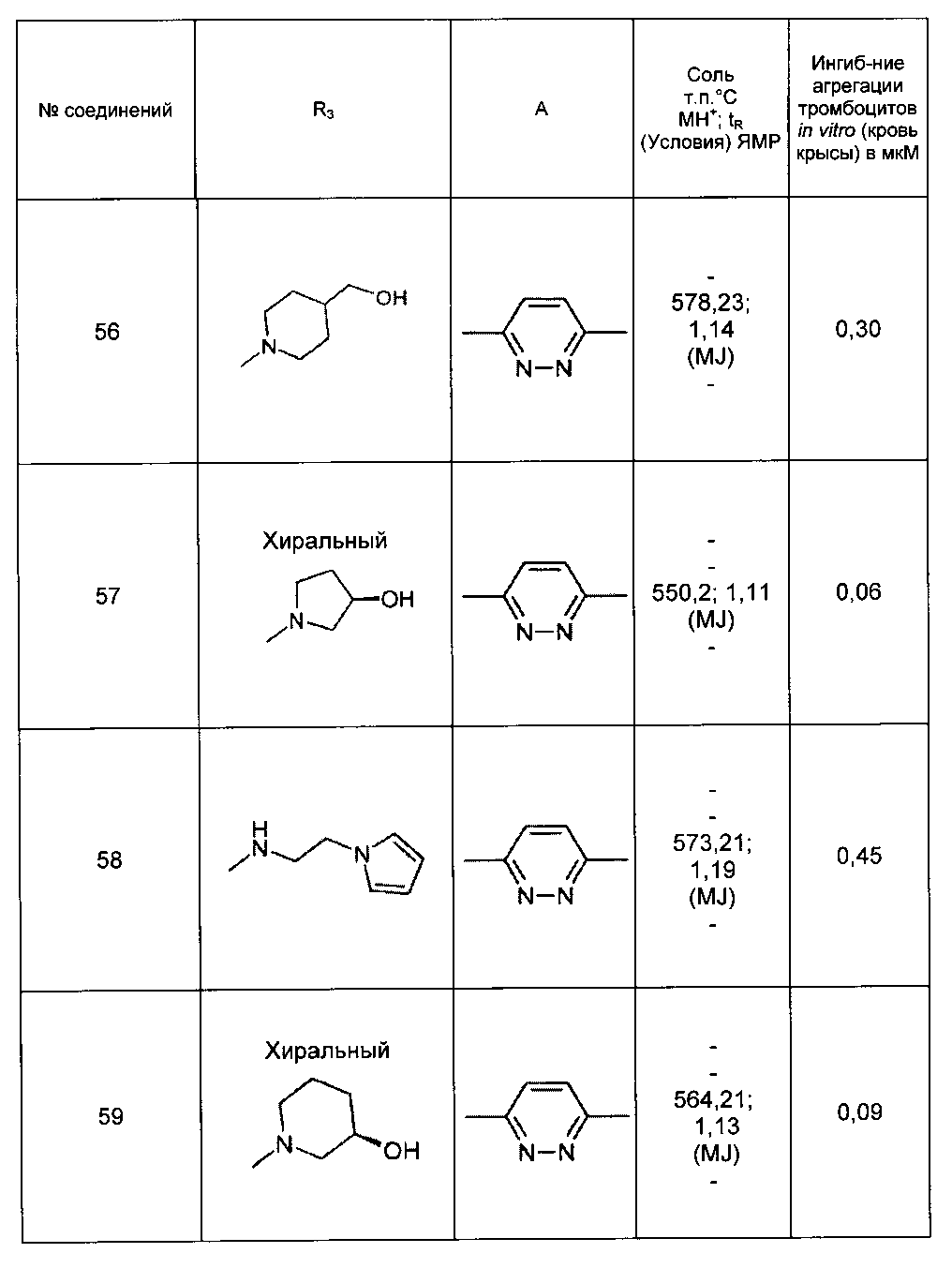
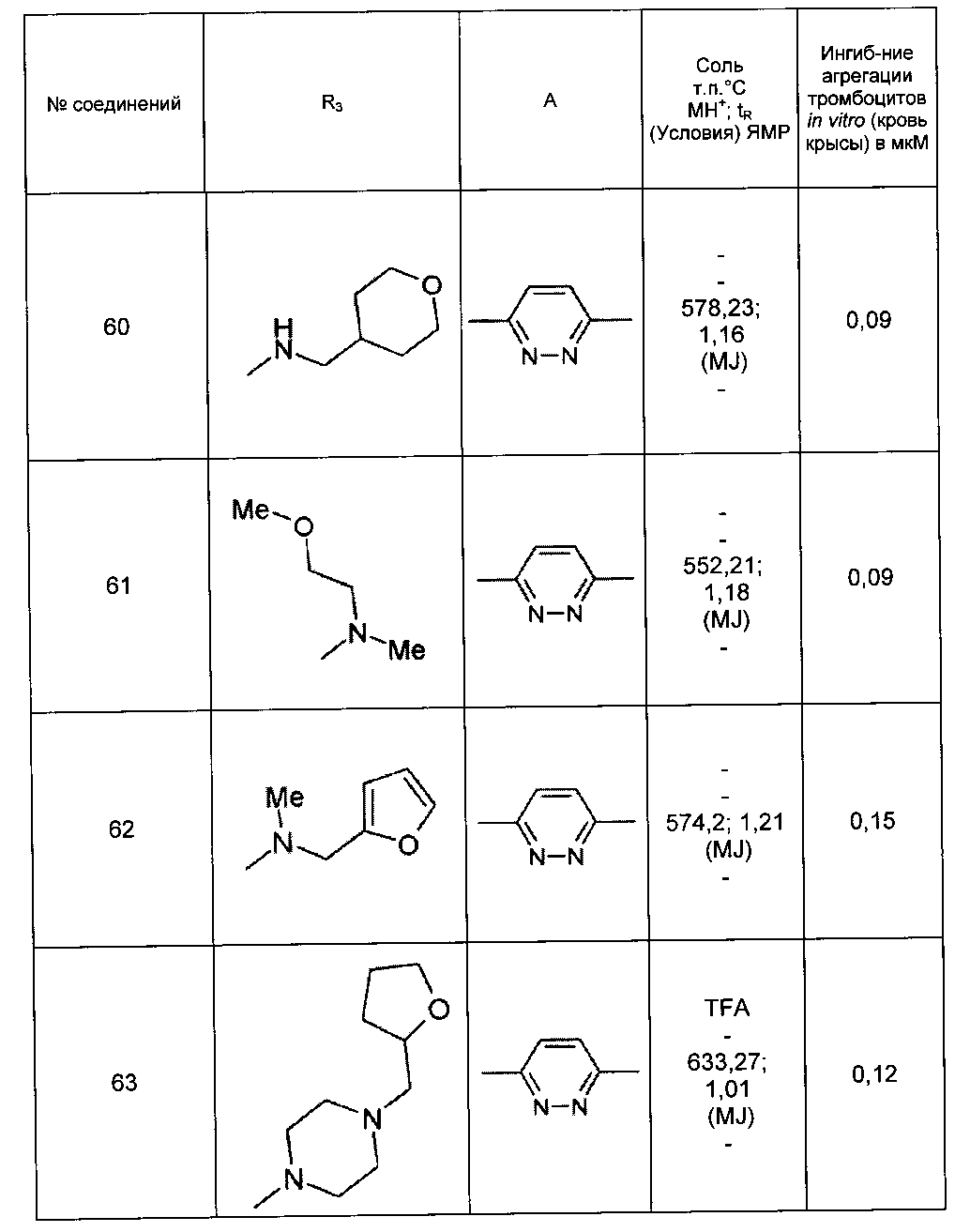
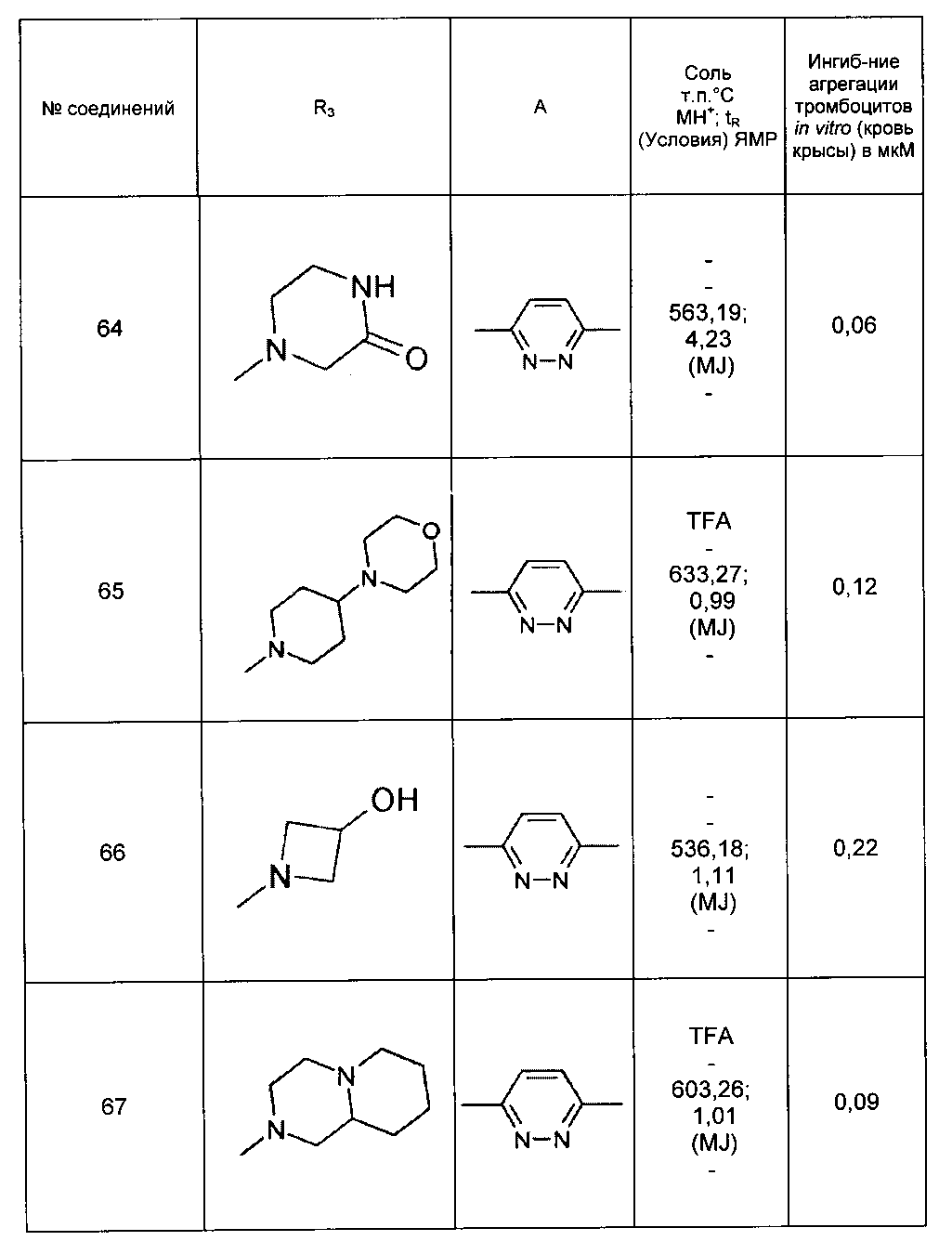
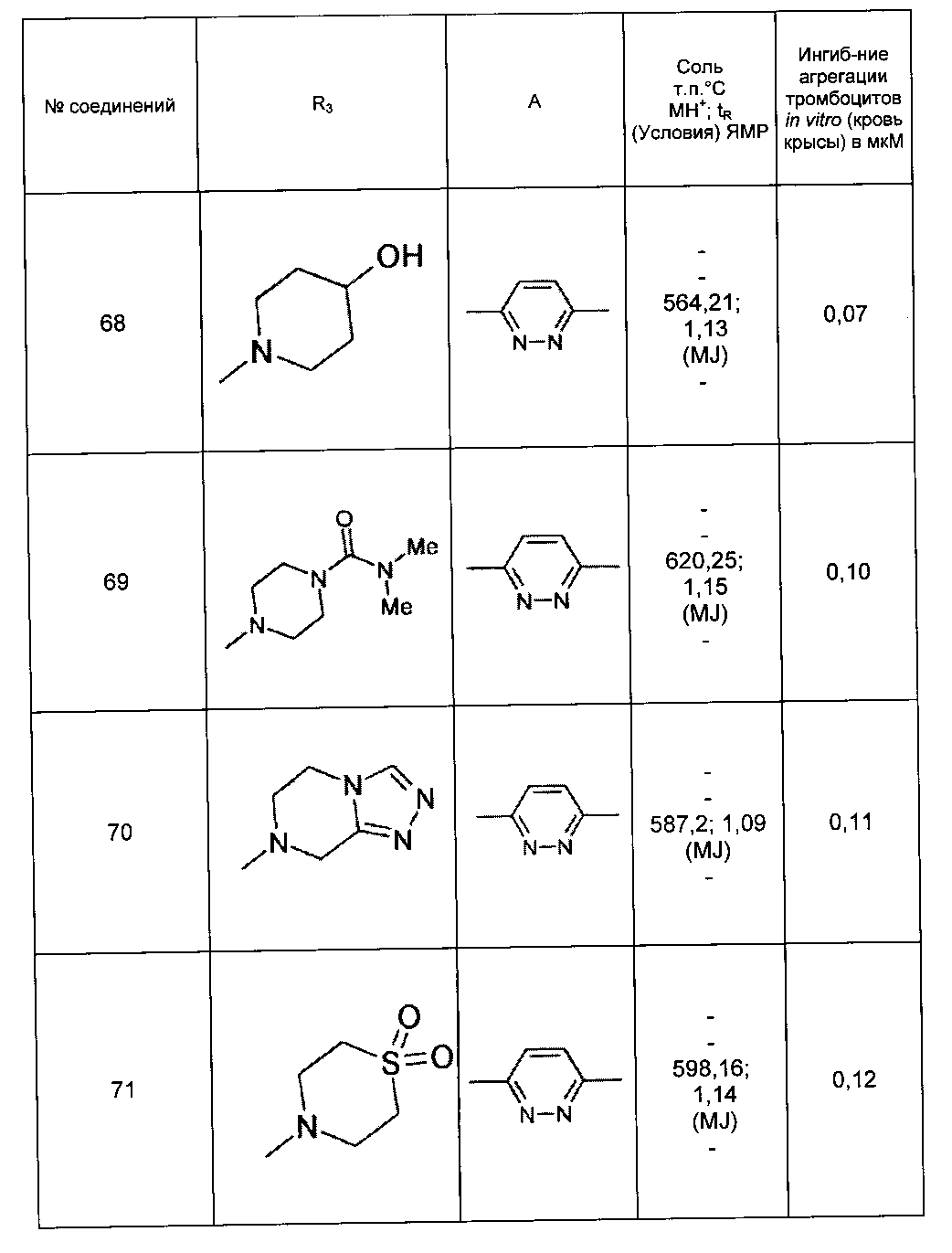

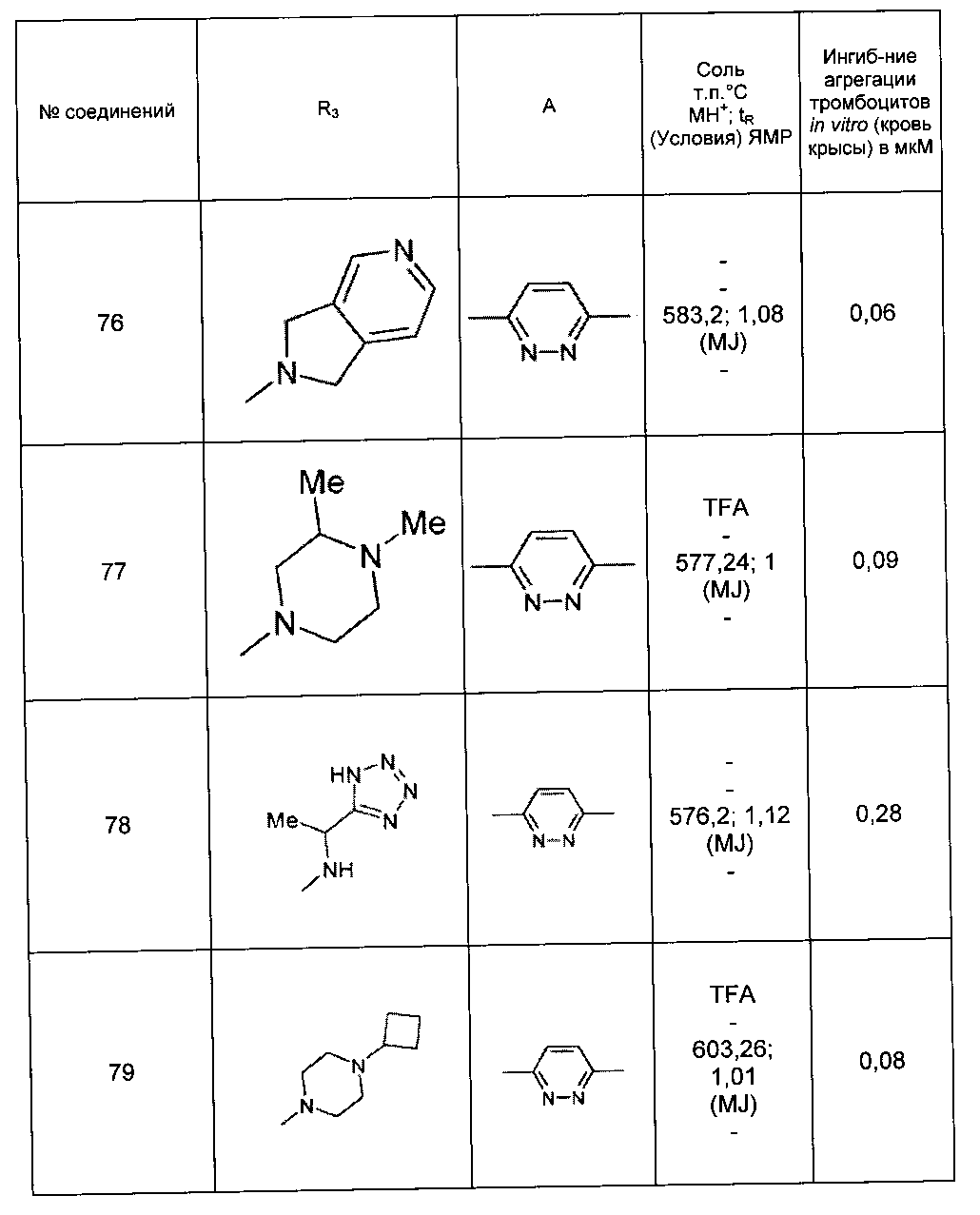
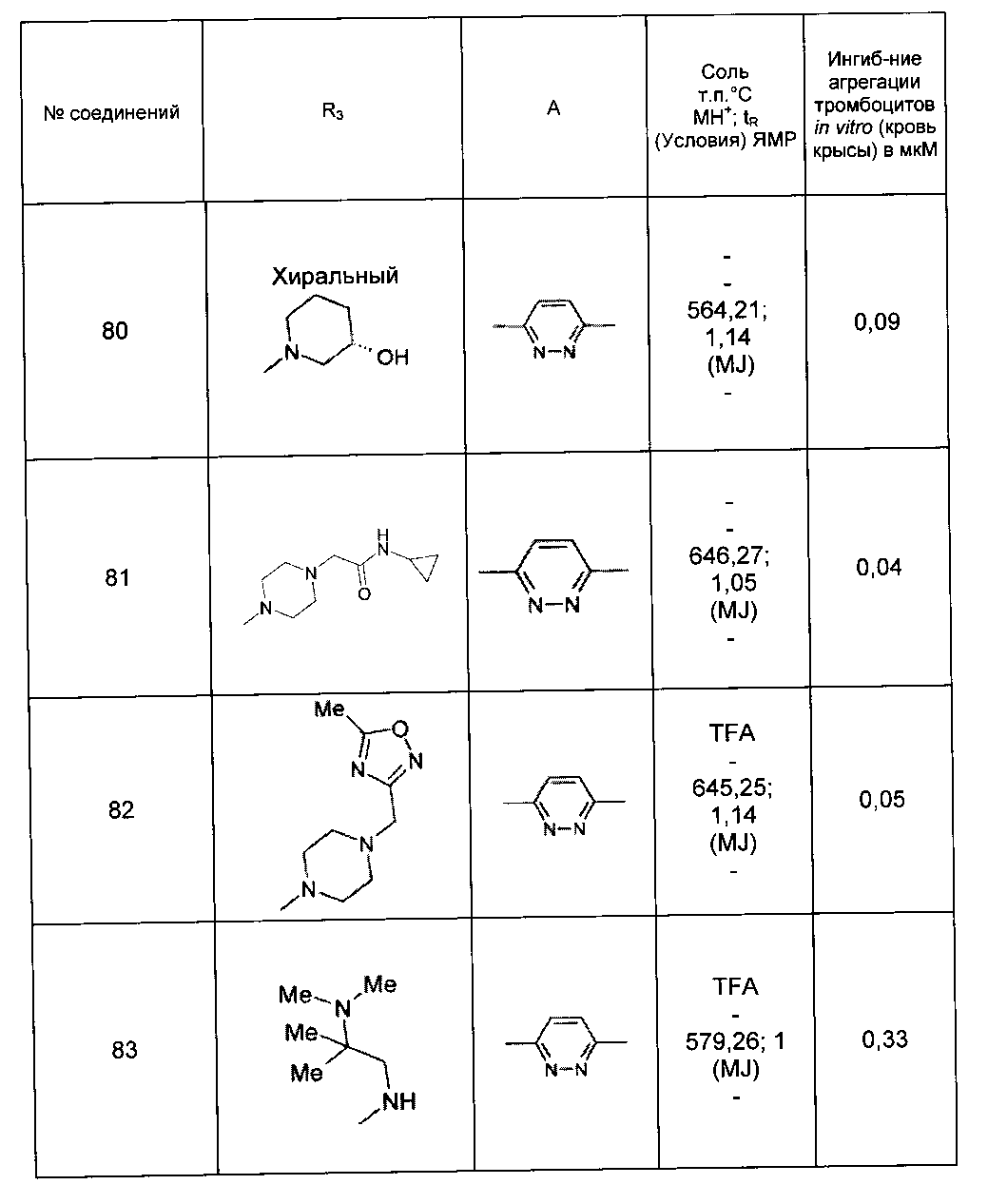

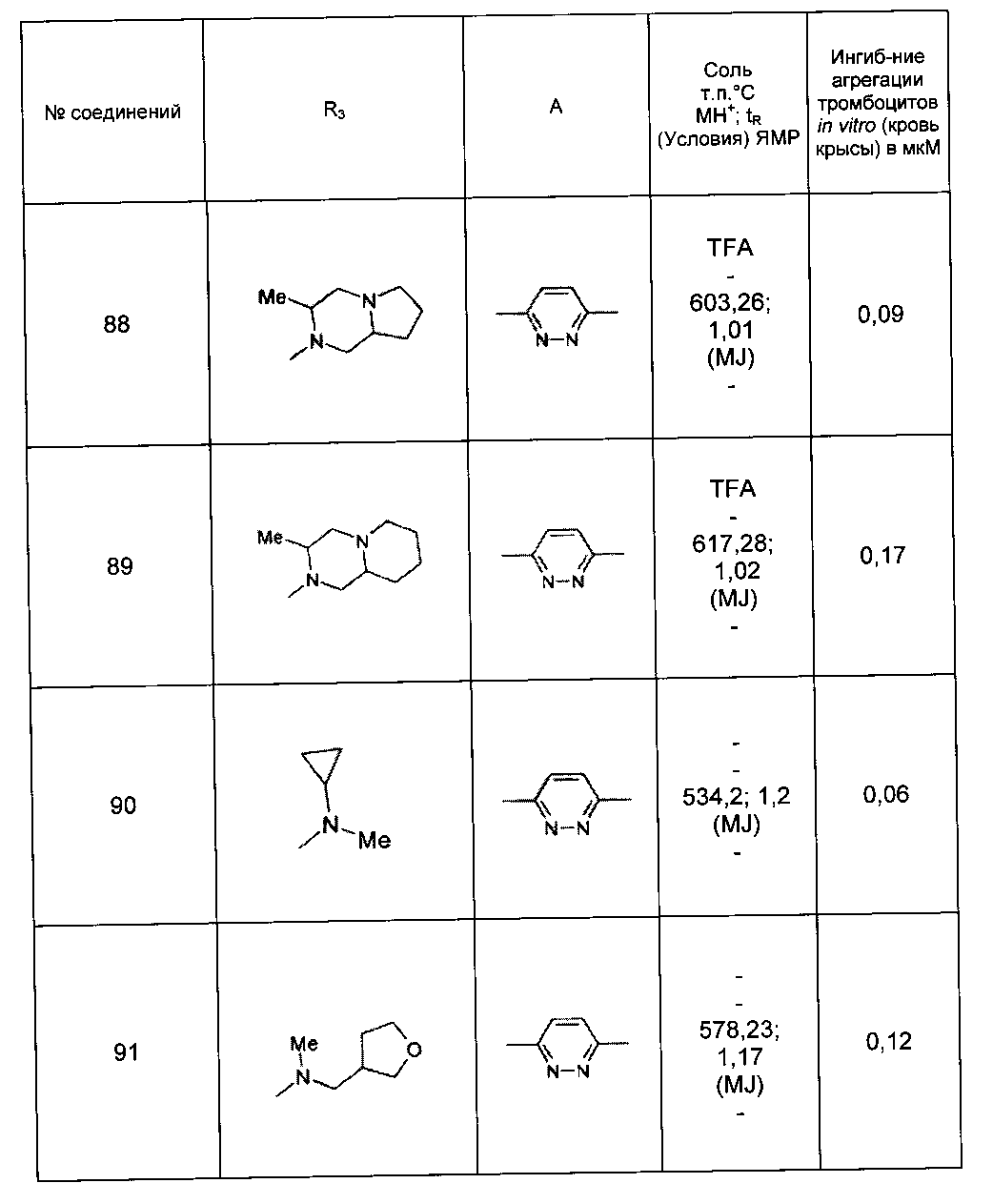
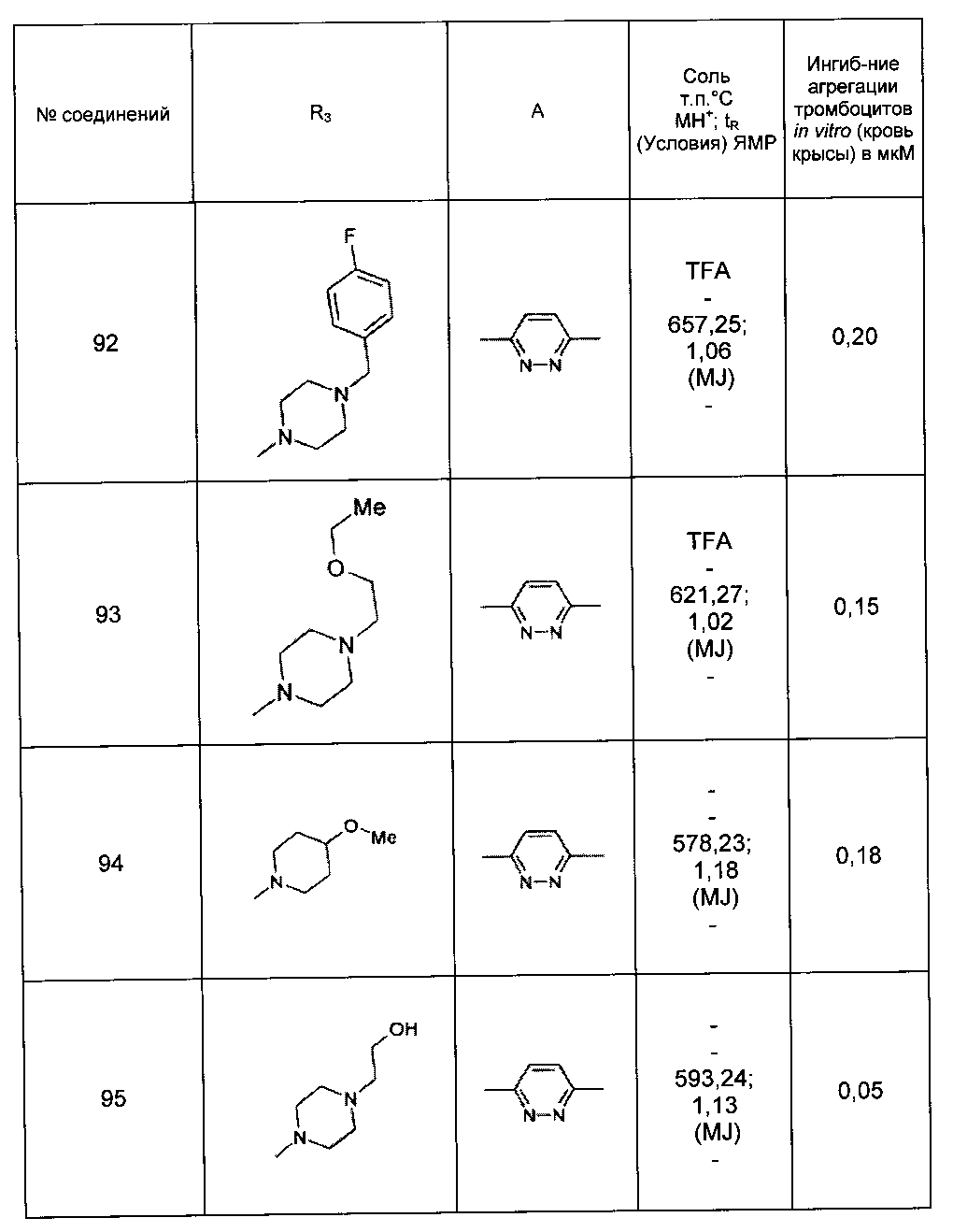
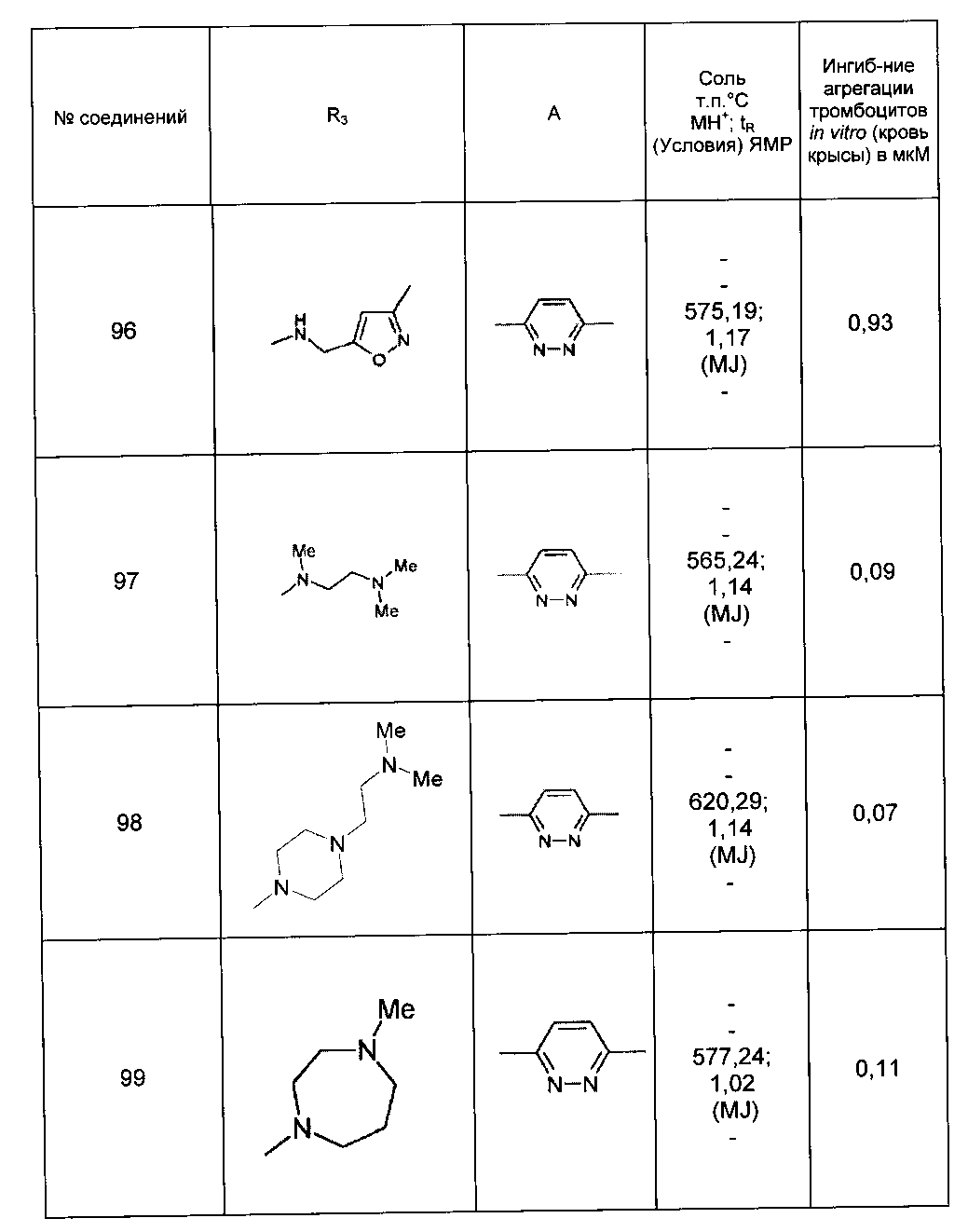
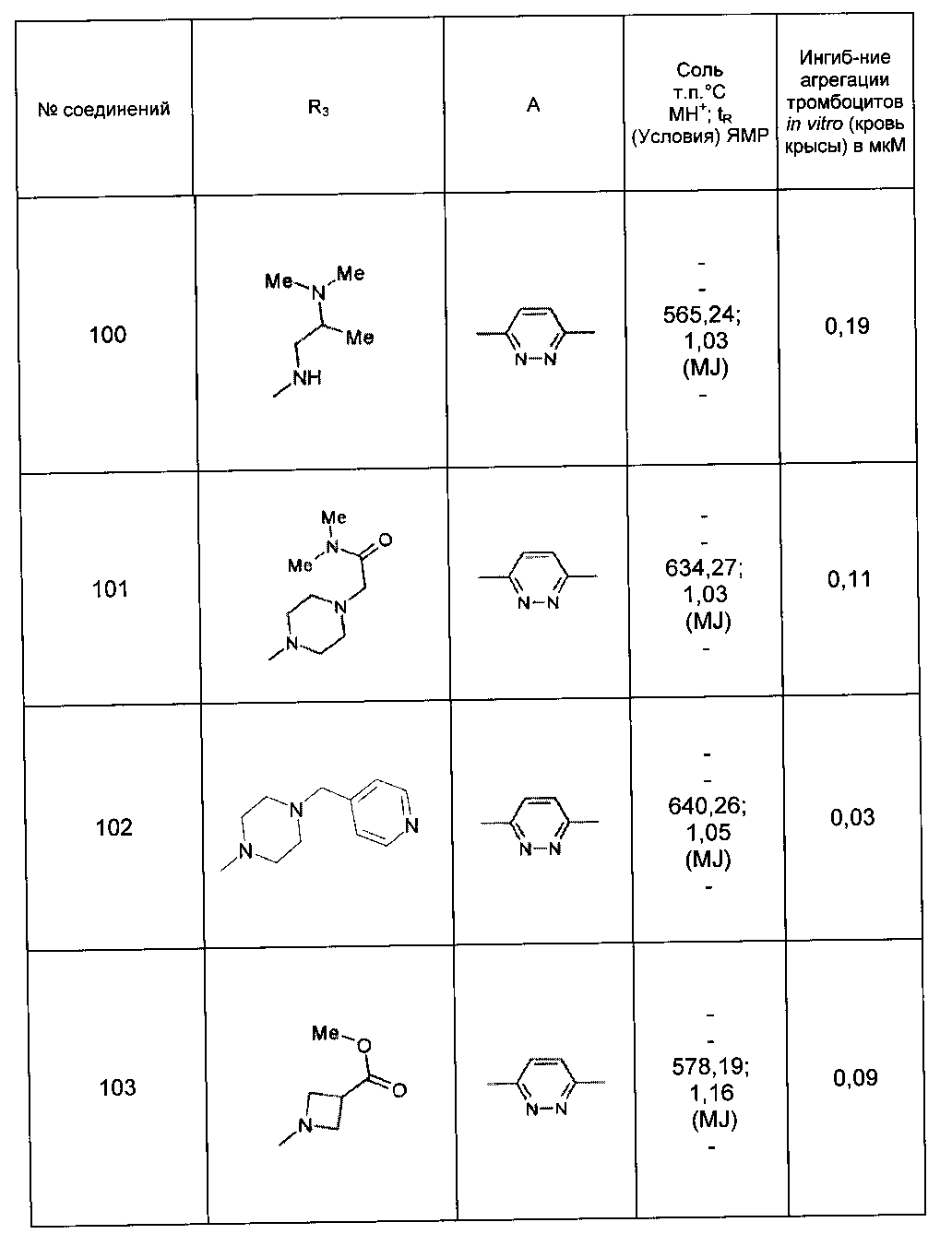
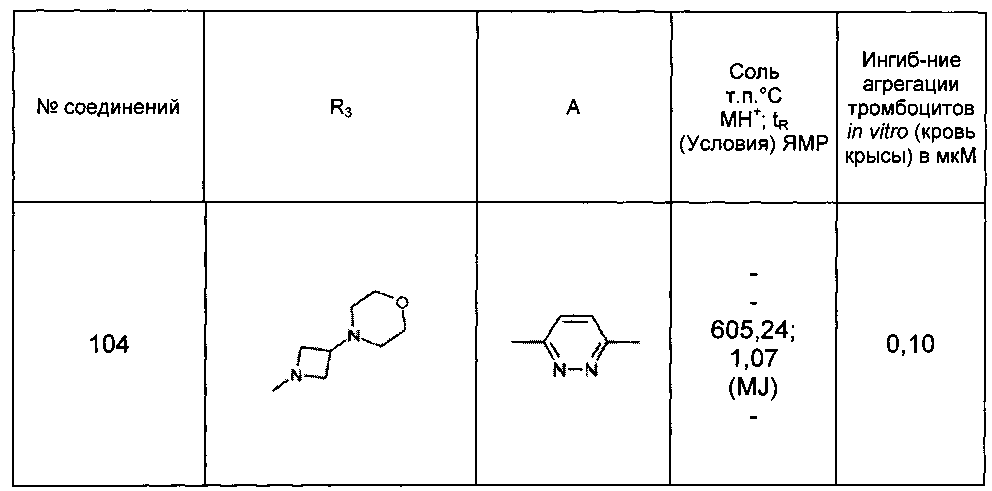
Анализы ЯМР для определенных соединений представлены ниже.
Соединение 27:
1Н ЯМР: DMSO-d6 (400 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,70-4,50 (16Н, m); 5,38 (2Н, br); 7,29 (1Н, d); 7,57 (1Н, d); 8,25 (1Н, s); 8,36 (1Н, s); 8,57 (1Н, s); 8,85 (1Н, s); 9,42 (1Н, d); 11,10 (1Н, s); 11,15 (1Н, br).
Соединение 28:
1Н ЯМР: DMSO-d6 (400 МГц): δ (ppm): 0,95 (3Н, t); 1,65 (2Н, m); 2,80-2,89 (8Н, m); 2,93-3,25 (3Н, m); 3,41-4,08 (3Н, m); 4,20 (1Н, d); 4,39 (1Н, d); 5,35 (1Н, d); 5,50 (1Н, d); 7,30 (1Н, d); 7,59 (1Н, d); 8,14 (1Н, d); 8,24 (1Н, s); 8,41 (1Н, s); 8,58 (1Н, s); 8,71 (1Н, d); 10,97 (1Н, br); 11,38 (1Н, s).
Соединение 29:
1Н ЯМР: DMSO-d6 (400 МГц): δ (ppm): 0,95 (3Н, t); 1,65 (2Н, m); 2,82 (3Н, s); 2,87 (2Н, t); 2,98-3,29 (3Н, m); 3,35 (3Н, s); 3,36-3,42 (2Н, m); 3,50-3,88 (5Н, m); 4,19 (1Н, d); 4,37 (1Н, d); 5,36 (1Н, d); 5,50 (1Н, d); 7,30 (1Н, d); 7,58 (1Н, d); 8,14 (1Н, d); 8,24 (1Н, s); 8,41 (1Н, s); 8,58 (1Н, s); 8,71 (1Н, d); 10,56 (1Н, br); 11,38 (1Н, s).
Соединение 30:
1Н ЯМР: DMSO-d6 (500 МГц): δ (ppm): 0,95 (3H, t); 1,65 (2Н, m); 2,82 (3Н, s); 2,86 (2H, t); 3,11-3,80 (9Н, m); 3,95-4,80 (3Н, m); 5,20-5,65 (2Н, m); 7,30 (1H, d); 7,57 (1H, d); 8,13 (1H,d); 8,24 (1Н, s); 8,41 (1Н, s); 8,59 (1Н, s); 8,70 (1H,d).
Соединение 31:
1H ЯМР: DMSO-d6 (400 МГц): δ (ppm): 0,95: t: 3Н; 1,65: m: 2Н; 2,82: s: 3Н; 2,86: t: 2Н; 3,00-3,90: m: 9Н; 3,95-4,70: m: 3Н; 5,25-5,55: m: 2Н; 7,30: d: 1Н; 7,57: d: 1Н; 8,13: d: 1Н; 8,24: s: 1Н; 8,41: s: 1Н; 8,59: s: 1Н; 8,70: d: 1Н.
ПРИМЕР 11: Соединение №105
N-[4-(4-бутирил-5-метил-1Н-пиразол-1-ил)фенил]-5-хлор-1-{2-[4-(2-метоксиэтил)пиперазин-1-ил]-2-оксоэтил}-1Н-индол-3-карбоксамида гидрохлорид
1,28 г 1-(2-метоксиэтил)пиперазина и 1,40 г BOP-Cl добавляют последовательно к 1,70 г соединения №3 в 35 мл DCM. Полученное перемешивают при КТ в течение 20 часов. Реакционную смесь выпаривают до сухого состояния, добавляют разбавленный раствор NaHCO3 и полученное экстрагируют с помощью EtOAc. Органическую фазу отмывают водой, солевым раствором, высушивают над Na2SO4 и выпаривают до сухого состояния. Полученное растирают в изоэфире и затем отфильтровывают. Продукт растворяют в 5 мл смеси DCM/ацетон (50/50; объем/объем) и затем добавляют 5 мл 1N раствора HCl в эфире. Гидрохлорид осаждают с помощью 10 мл эфира и затем отфильтровывают, получая 1,96 г белого порошка.
1Н ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,63 (2Н, m); 2,52 (3Н, s); 2,82 (2Н, t); 2,97-3,29 (3Н, m); 3,35-3,41 (5Н, m); 3,50-3,78 (5Н, m); 4,18 (1Н, d); 4,37 (1Н, d); 5,36 (1Н, d); 5,51 (1Н, d); 7,27 (1Н, d); 7,49 (2Н, d); 7,57 (1Н, d); 7,97 (2Н, d); 8,22 (1Н, s); 8,25 (1Н, s); 8,34 (1Н, s); 10,22 (1Н, s); 10,81 (1Н, br).
т.п. = 218°C.
Следуя процедуре, описанной в Примере 11 и начиная с соответствующих соединений формулы (IA), получают соединения формулы (I), представленные в ТАБЛИЦЕ XIII ниже.
В данной таблице
- в колонке "Соль" "Основание" представляет собой соединение в форме свободного основания, тогда как "HCl" представляет собой соединение в форме гидрохлорида, "TFA" представляет собой соединение в форме трифторацетата;
- Me представляет собой метильный радикал;
- Et представляет собой радикал этил;
- nPr представляет собой радикал н-пропил.
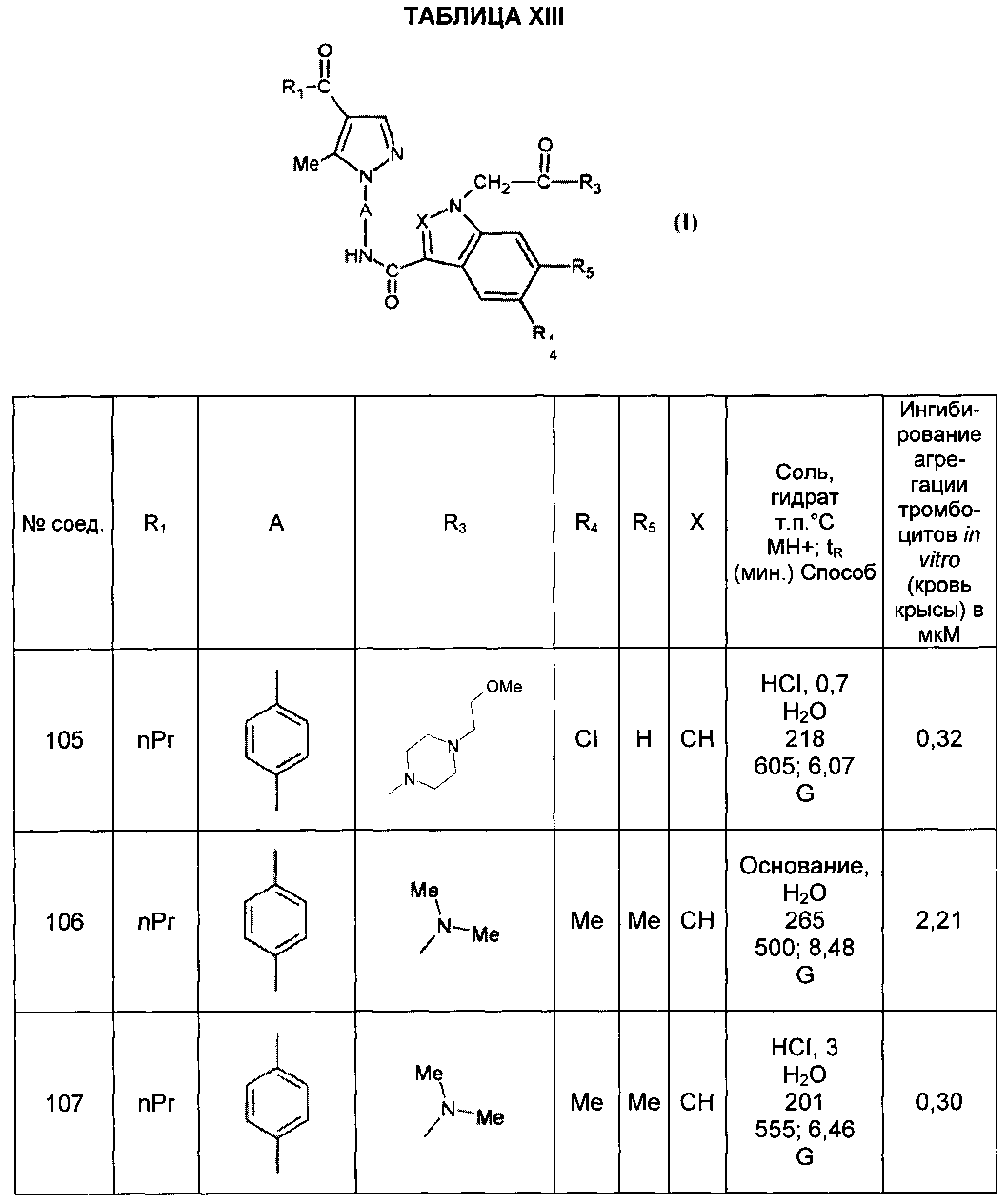
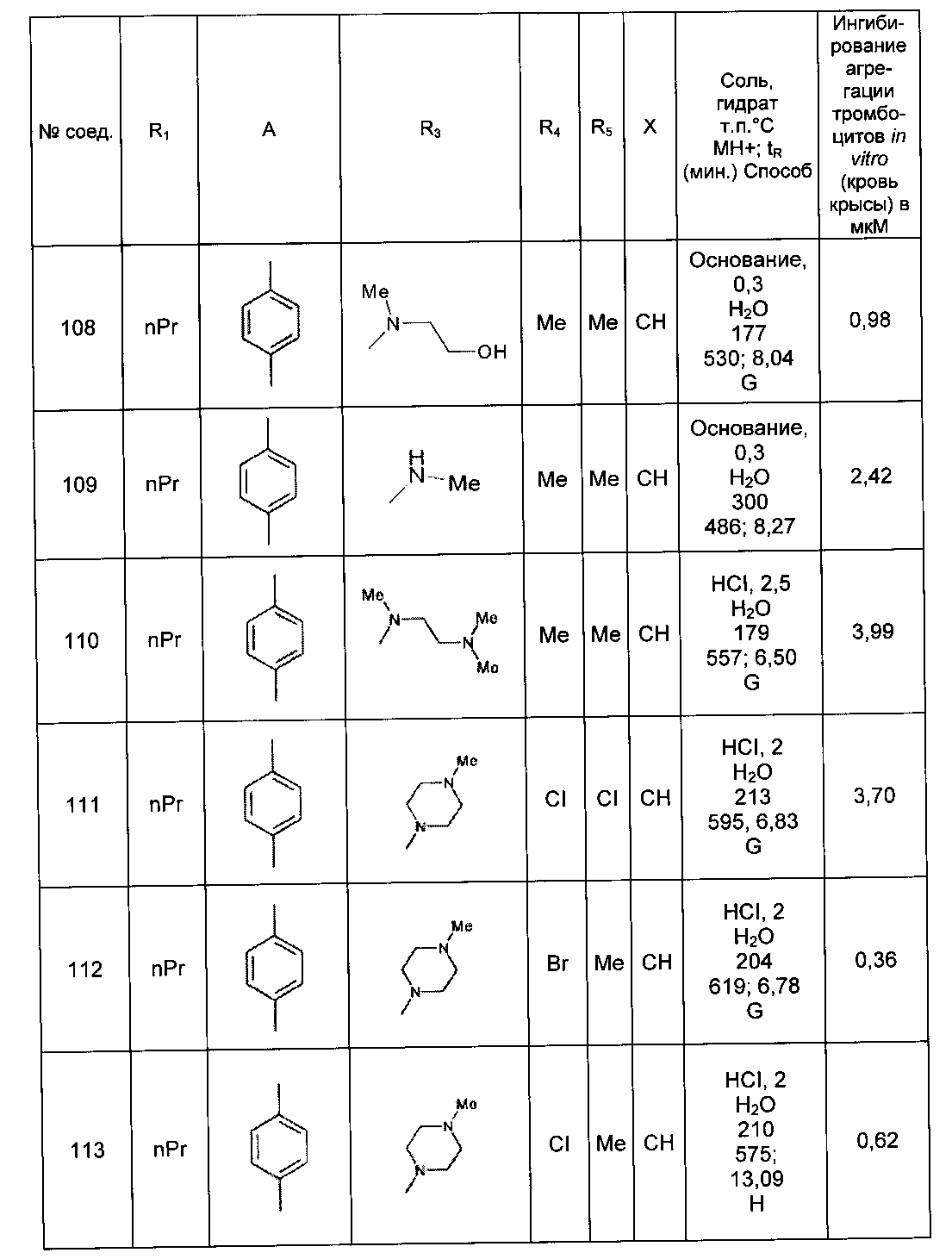
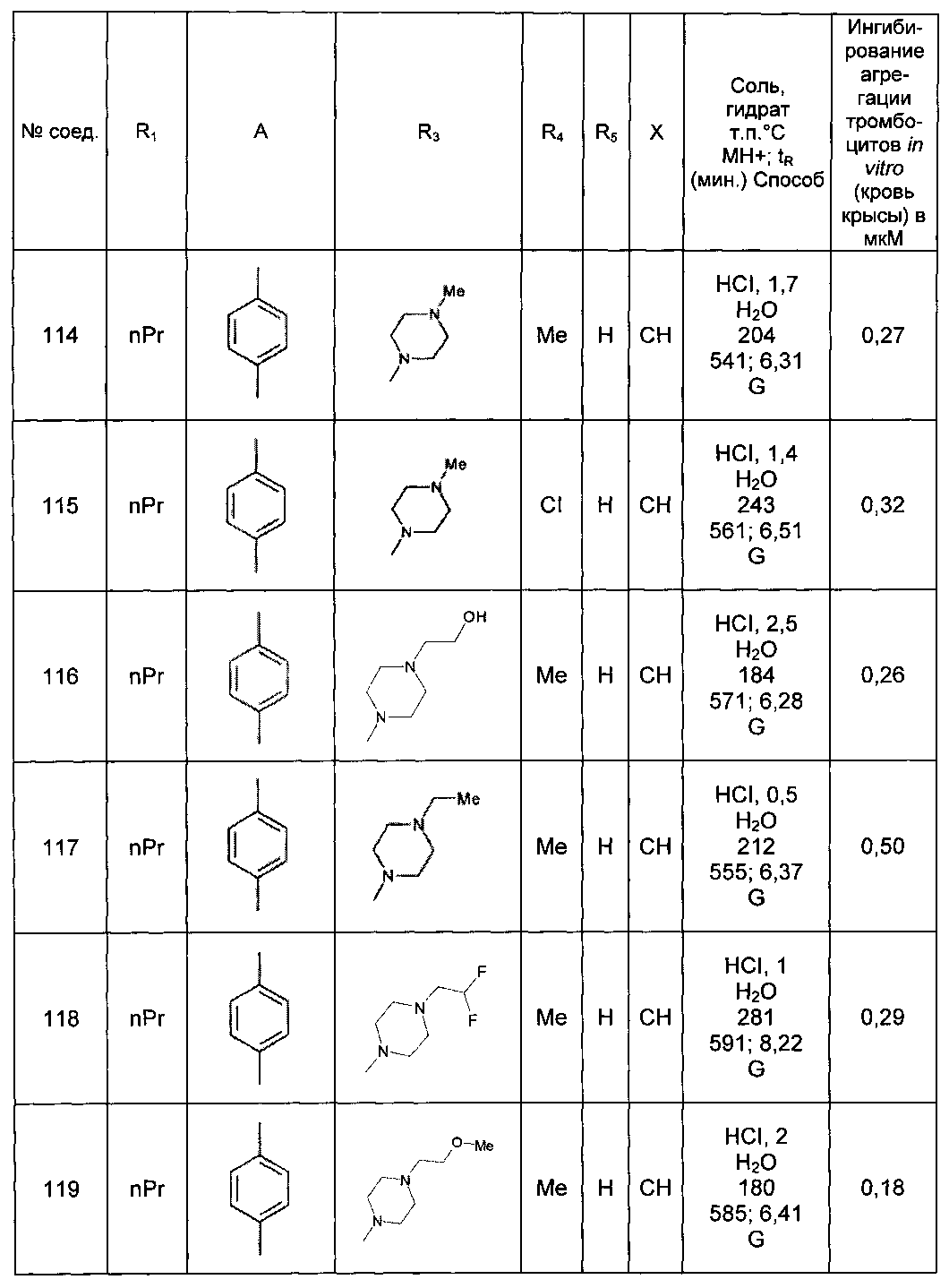

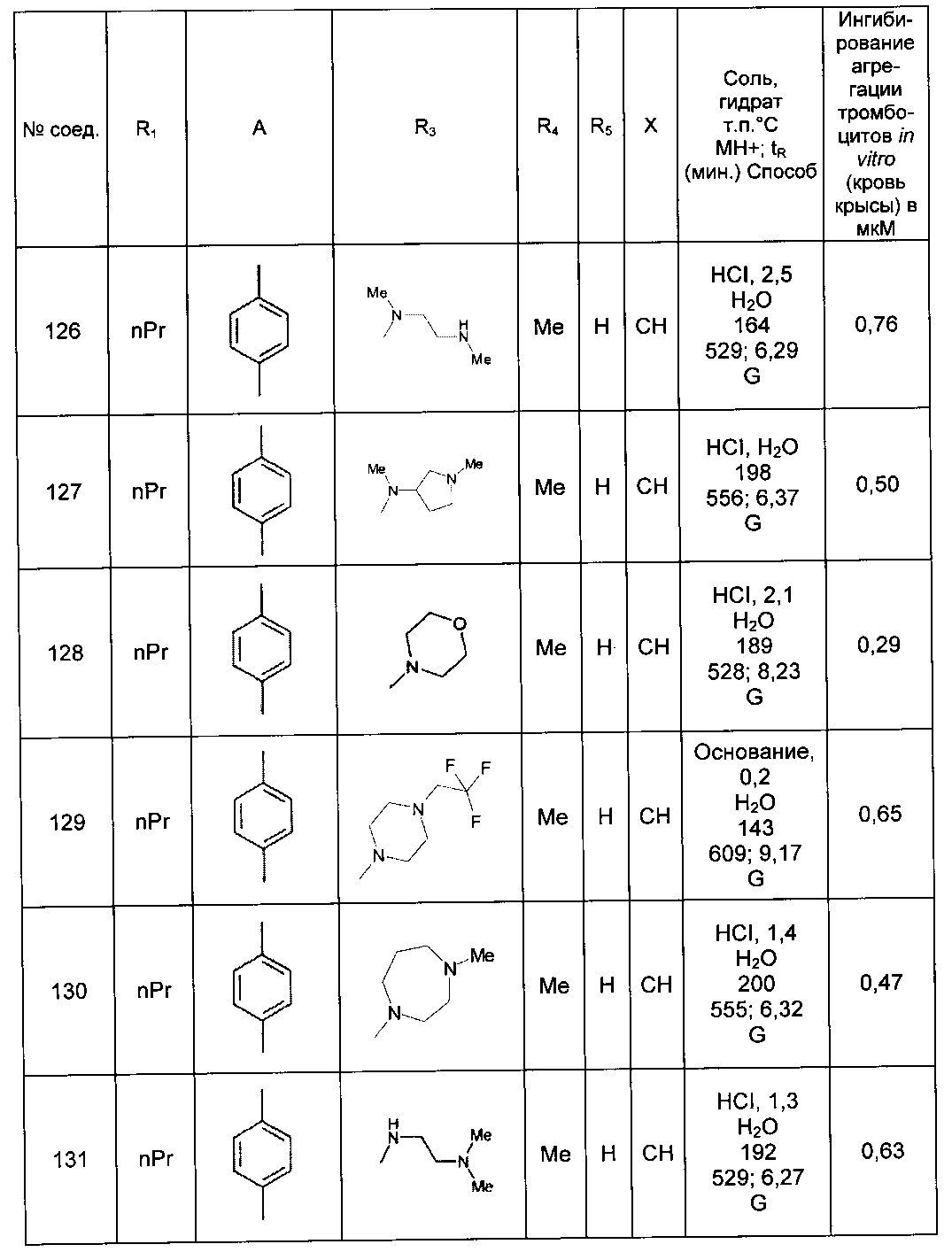
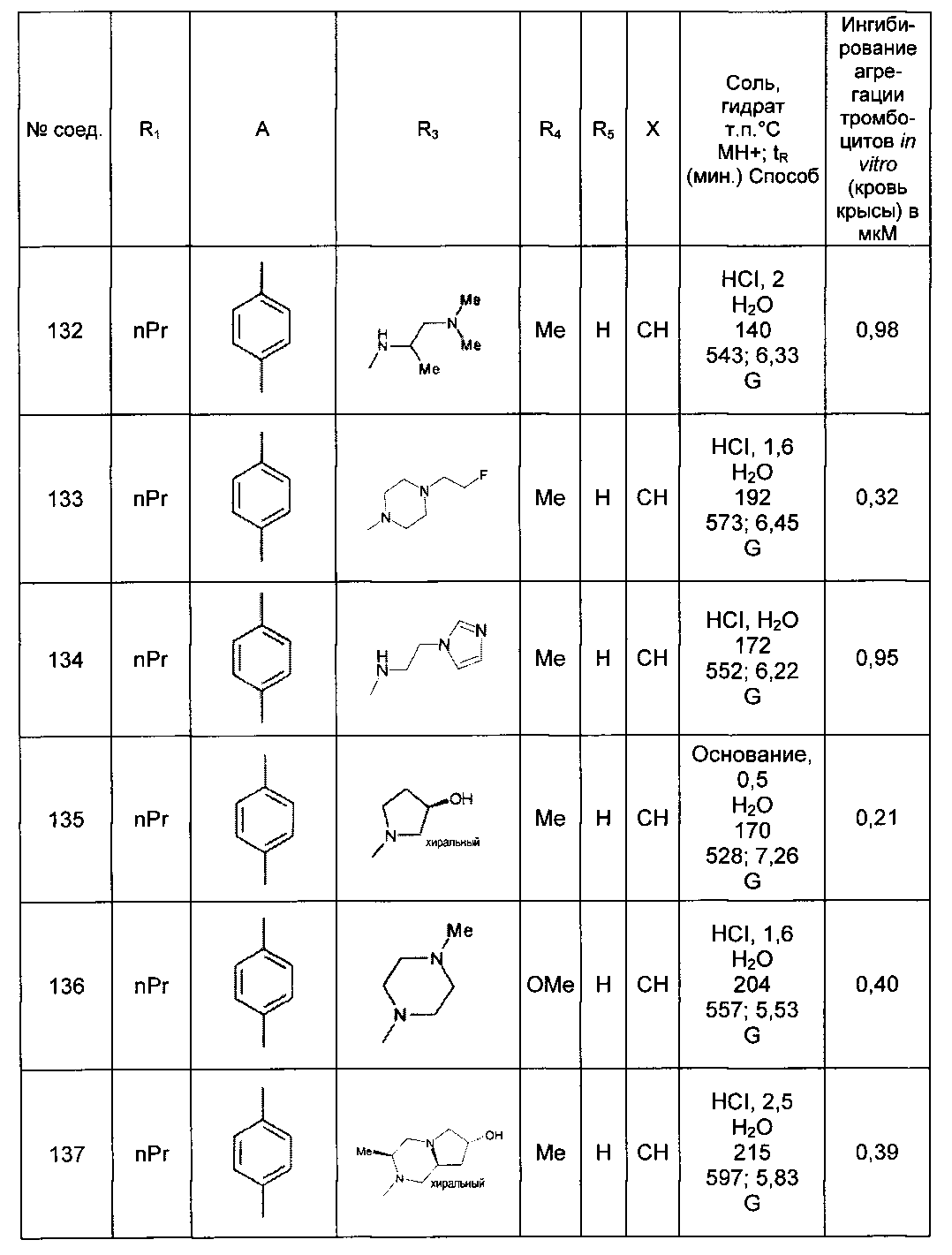
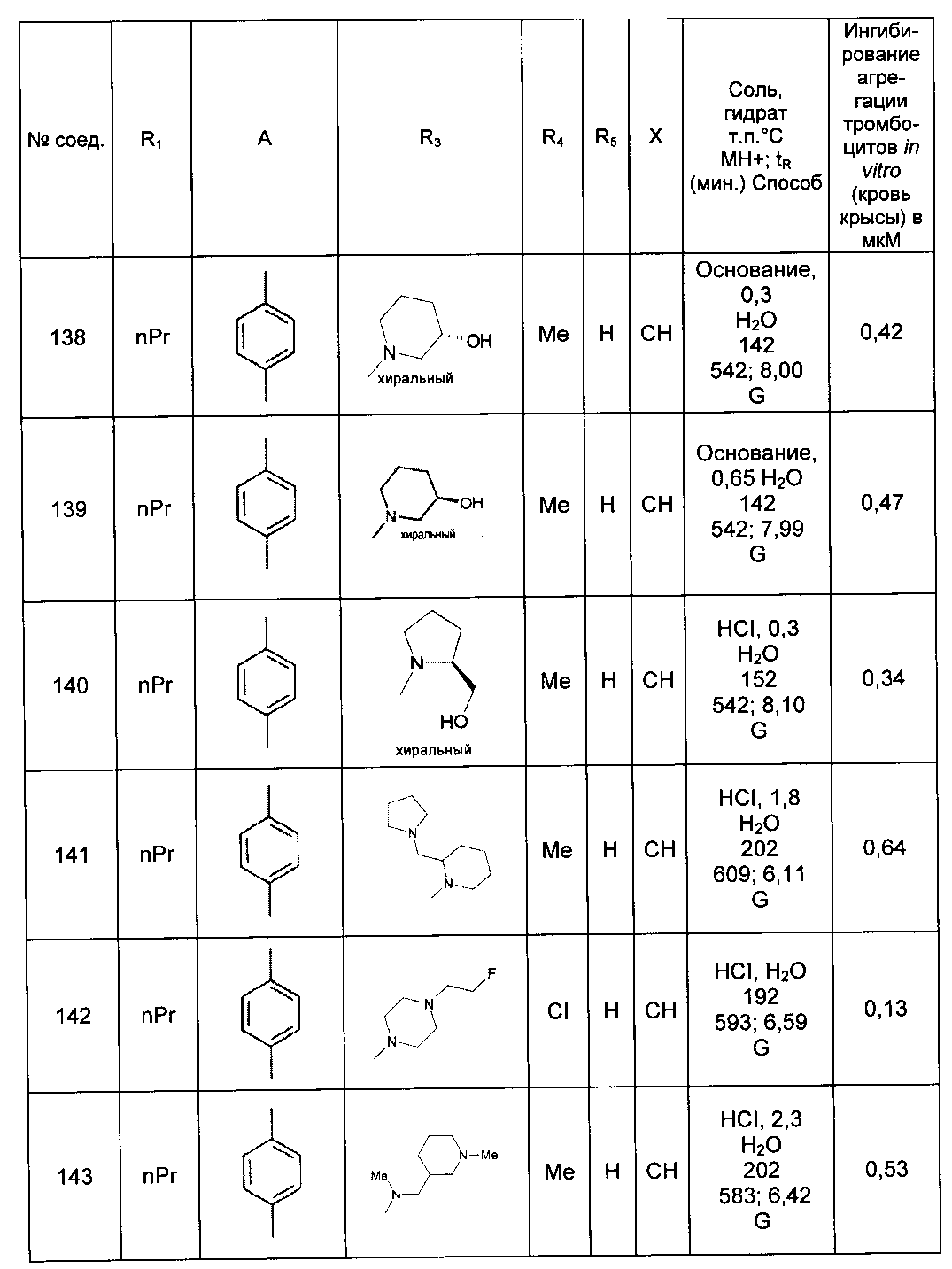
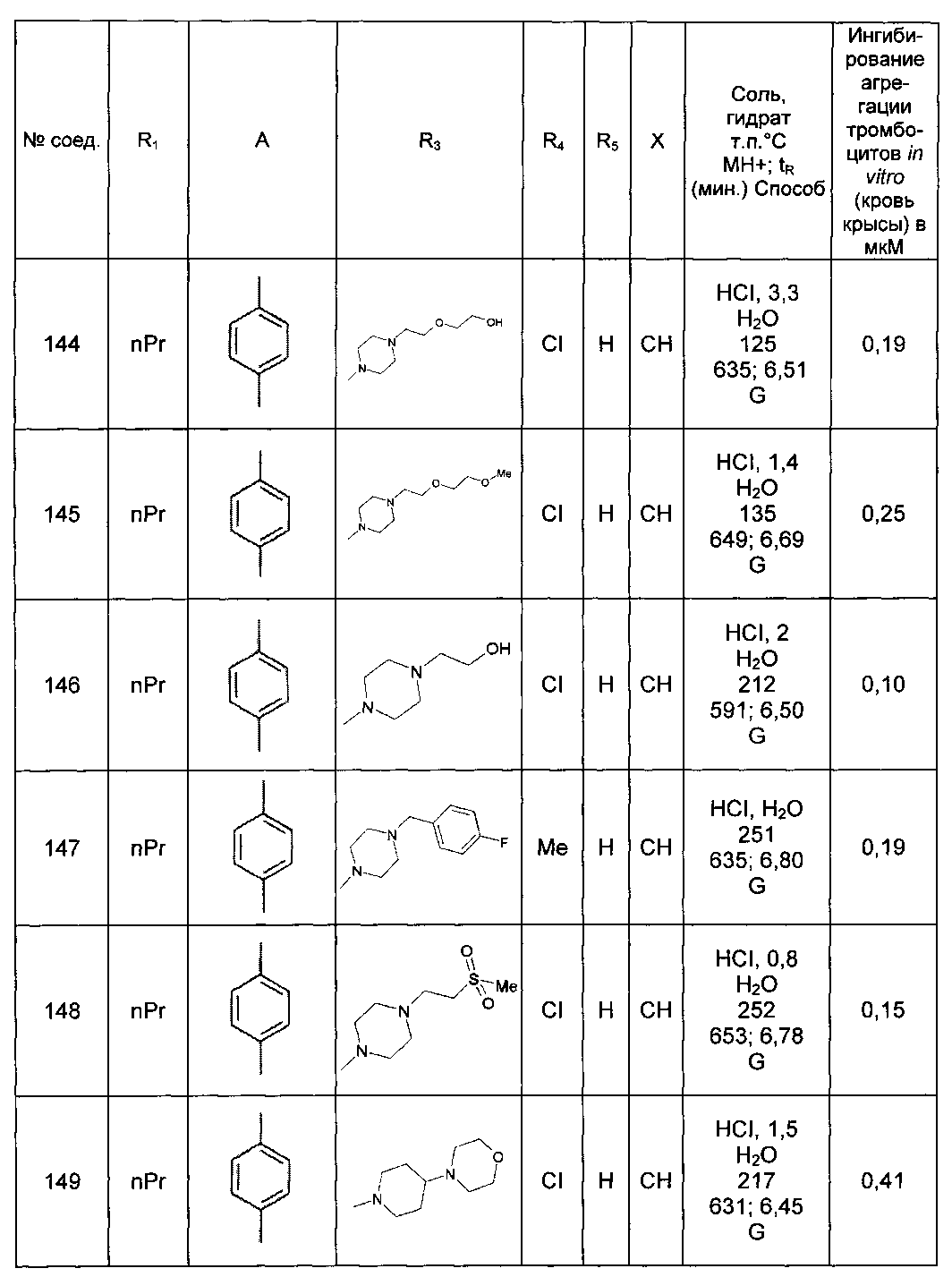
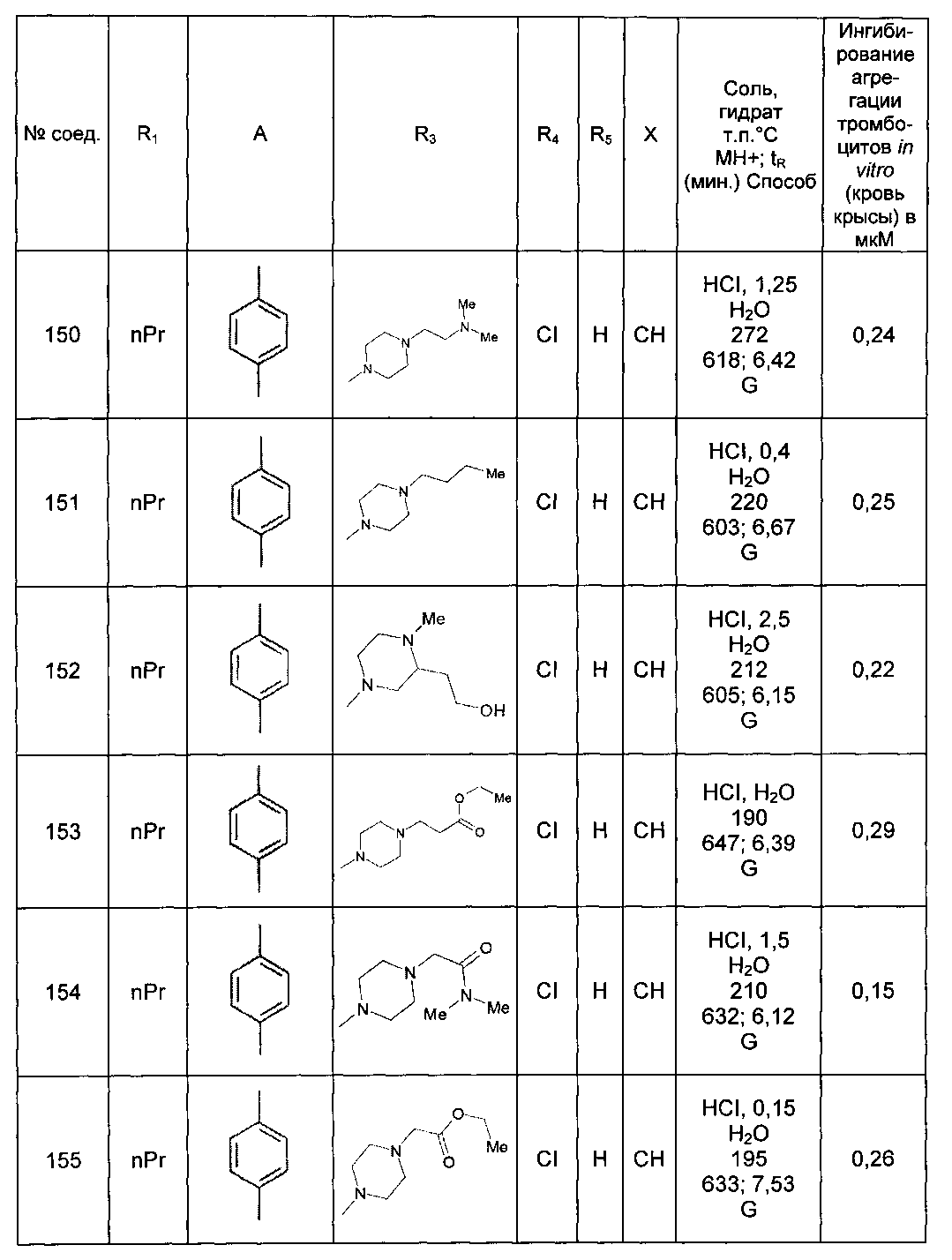
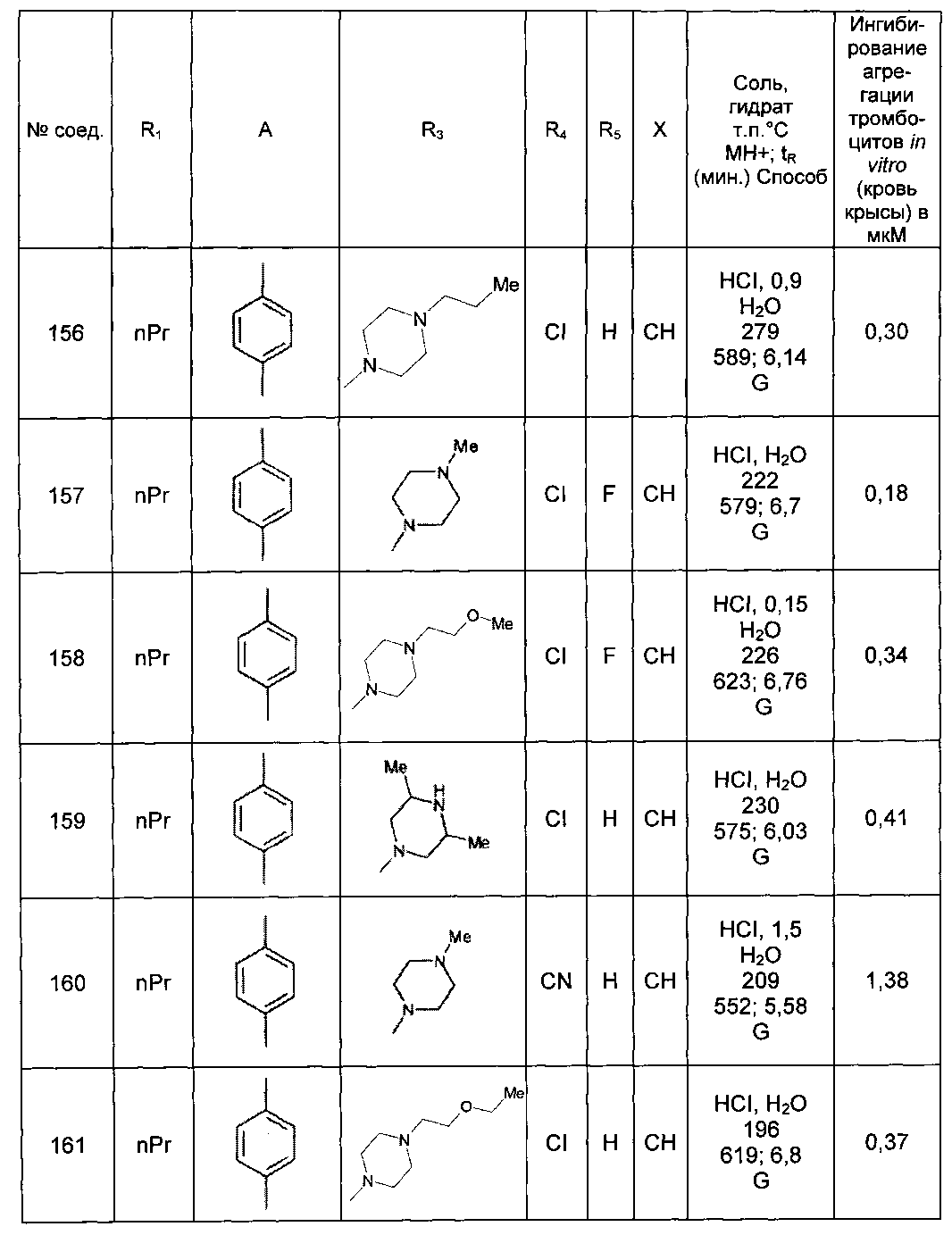
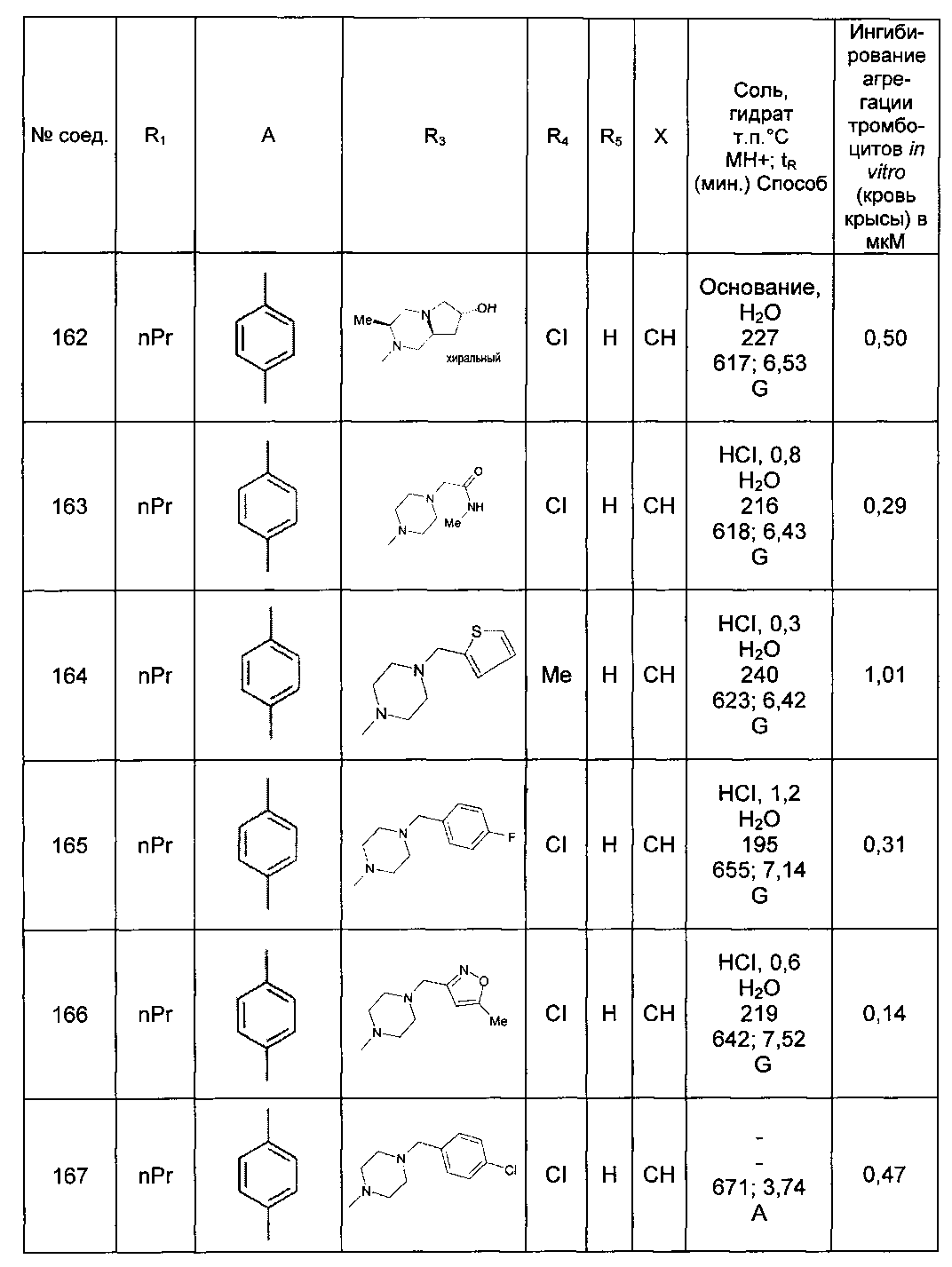
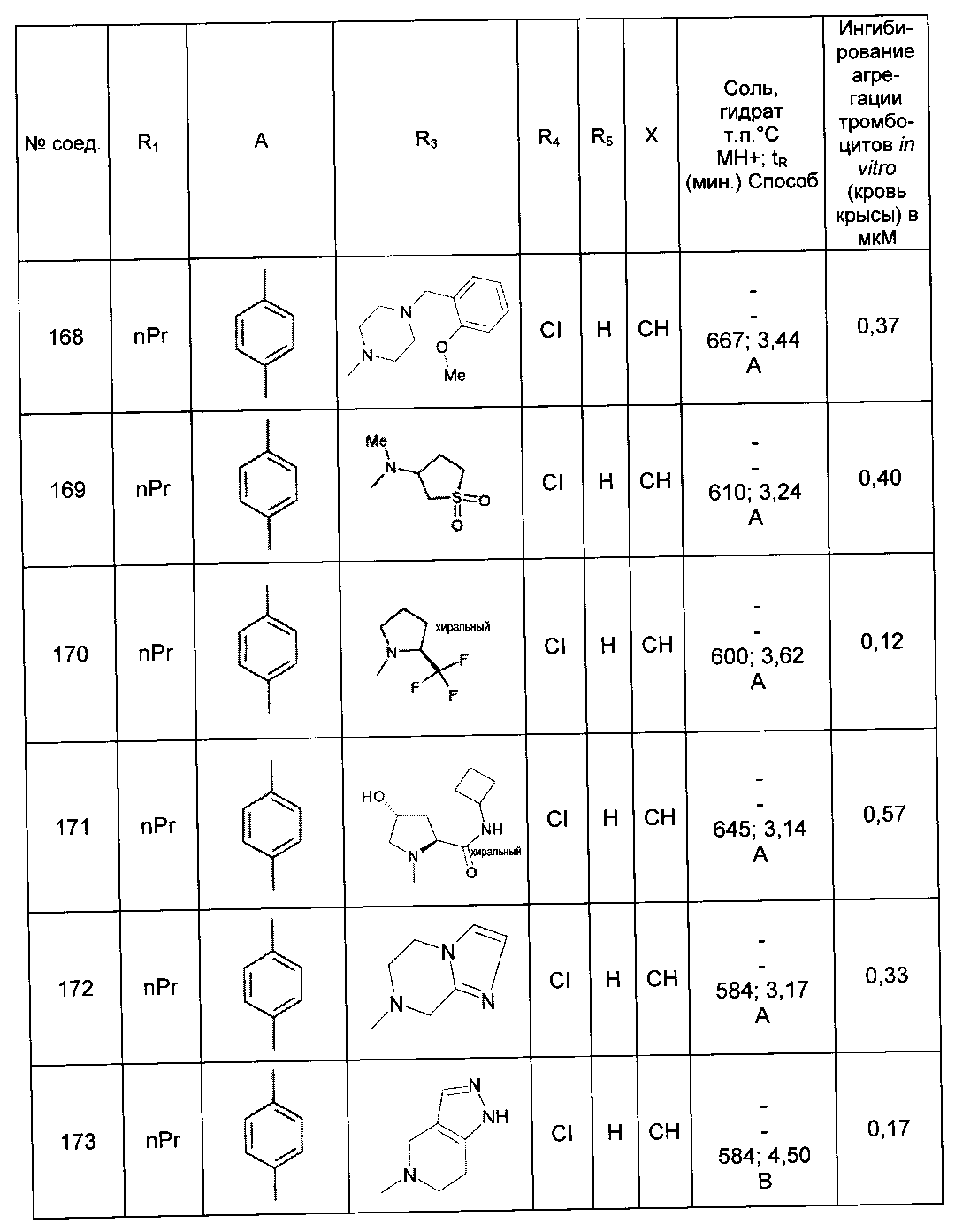
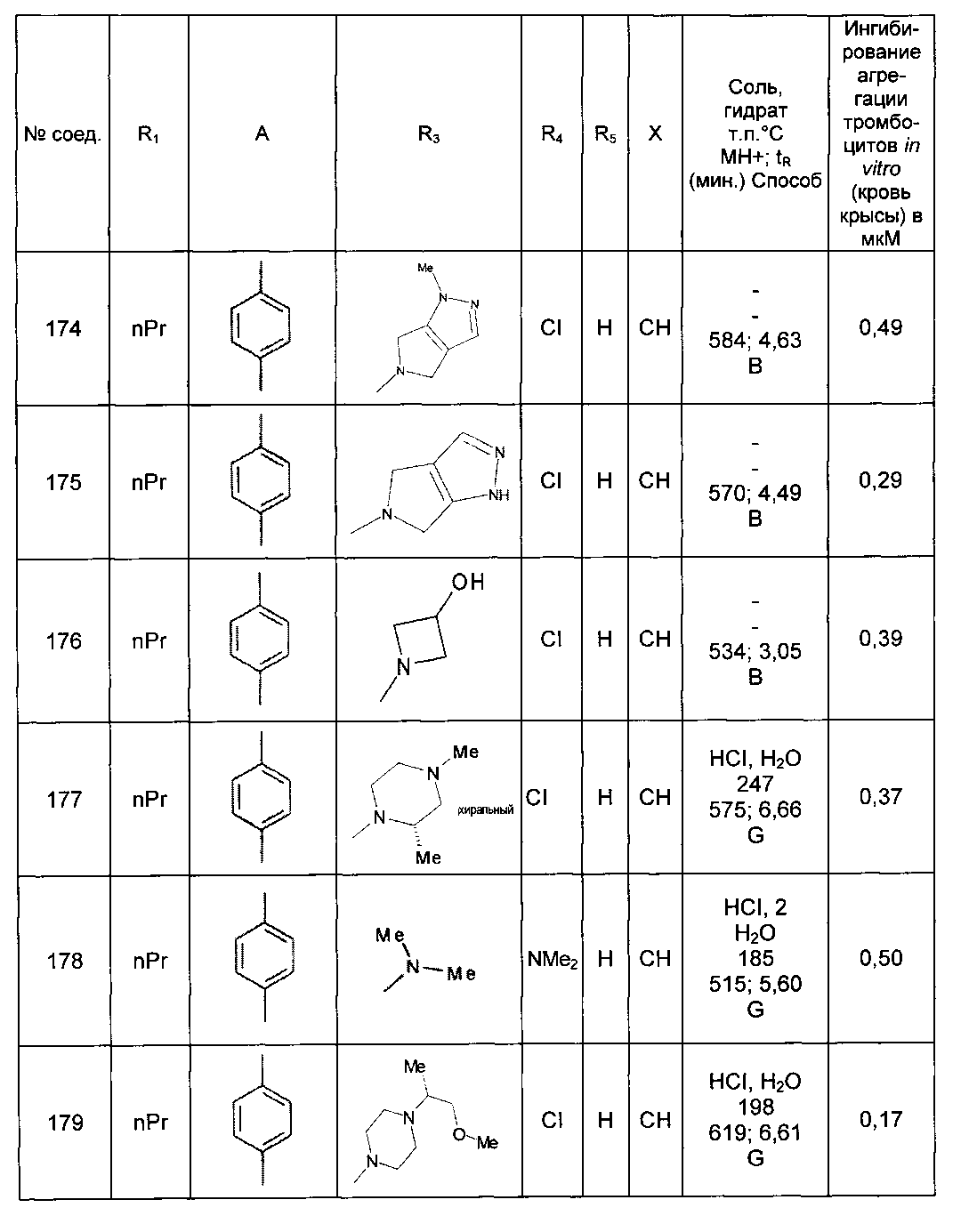
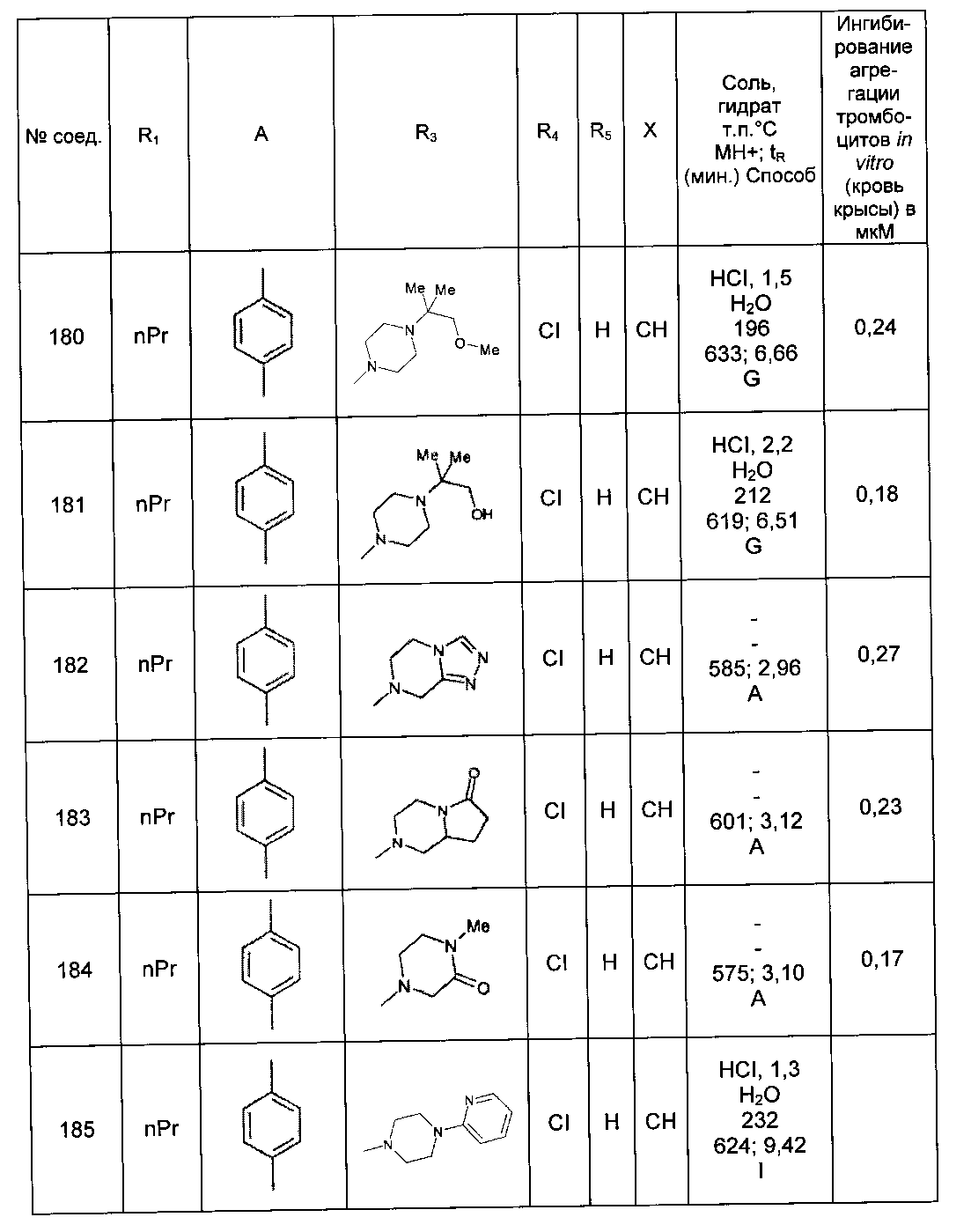
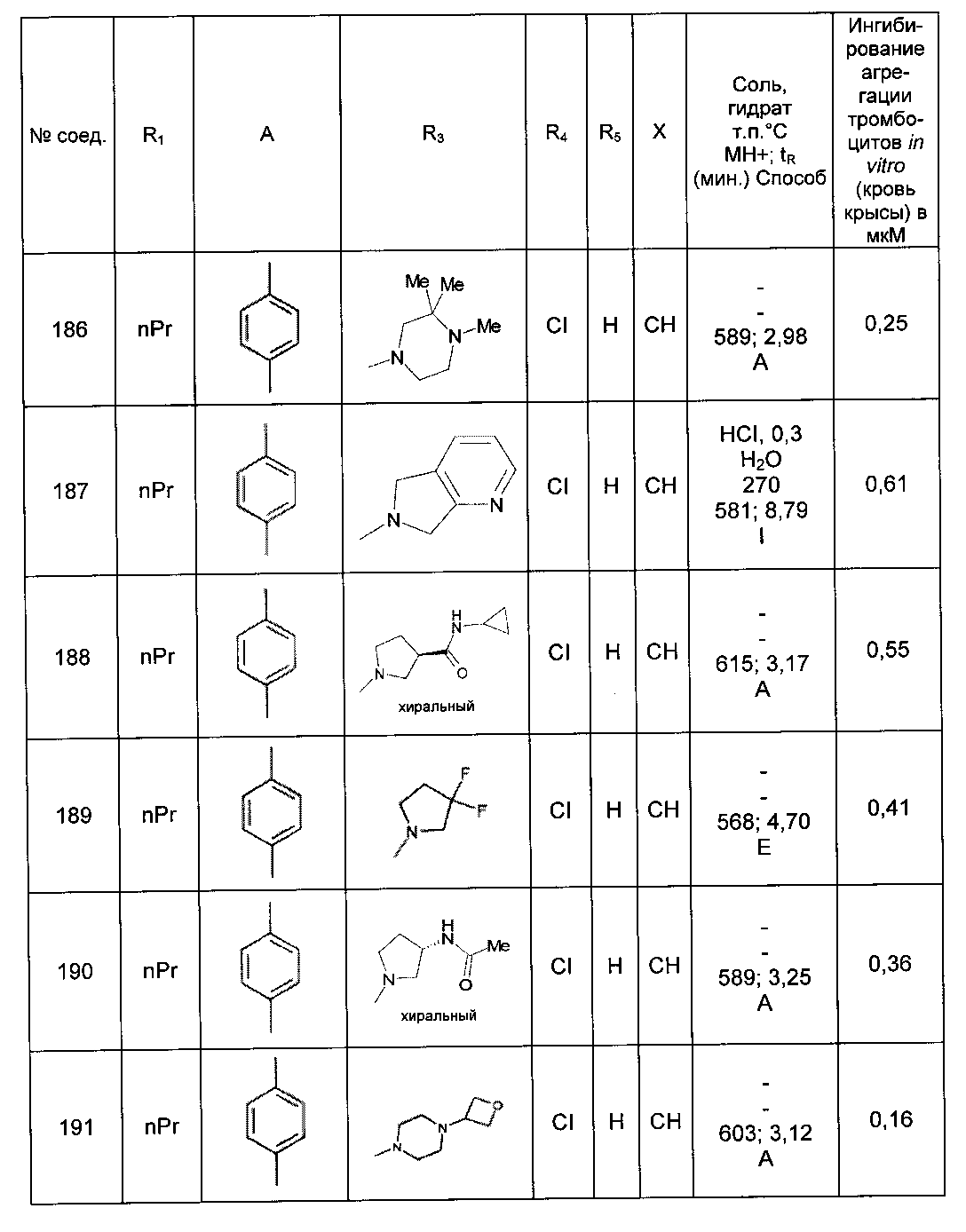
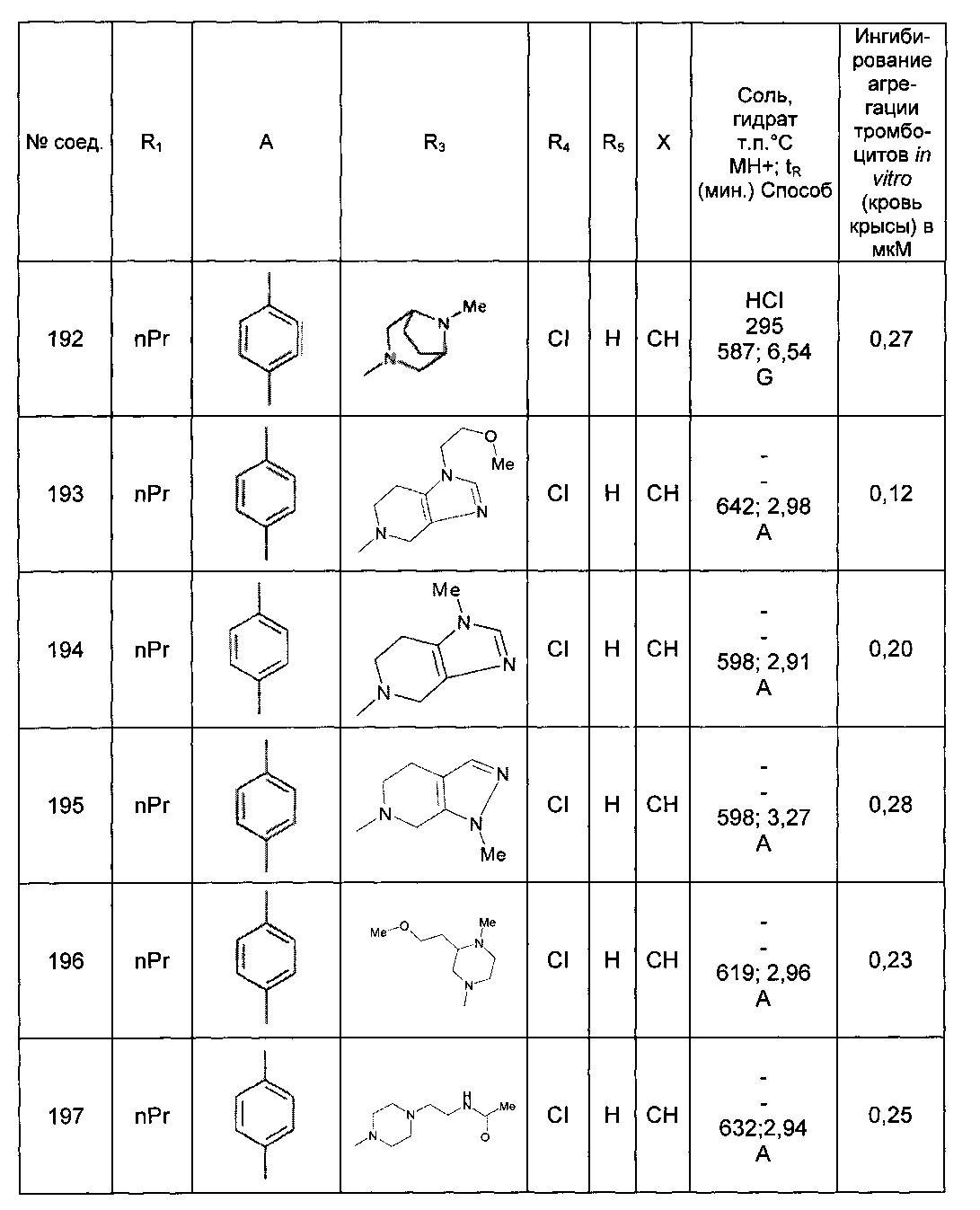
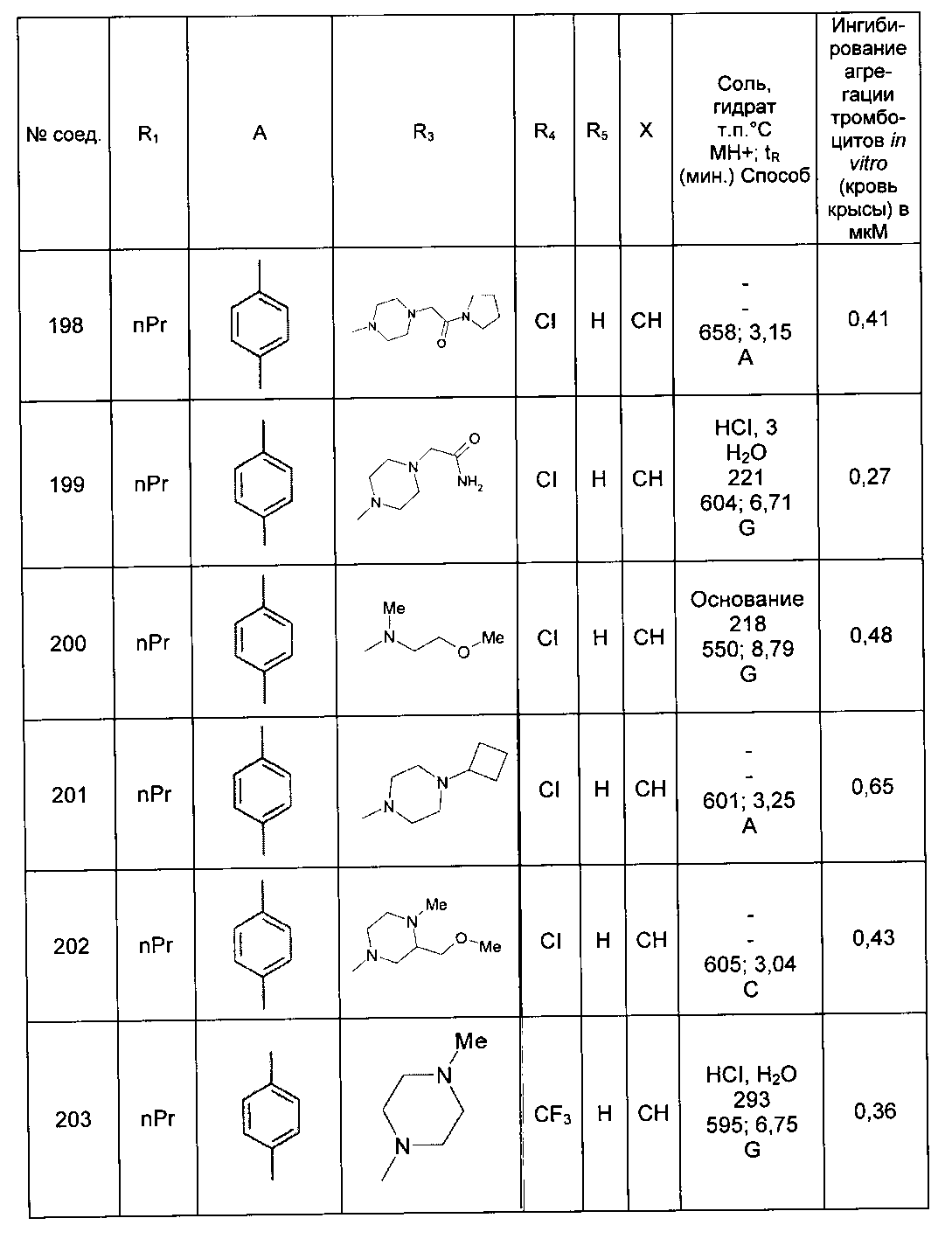
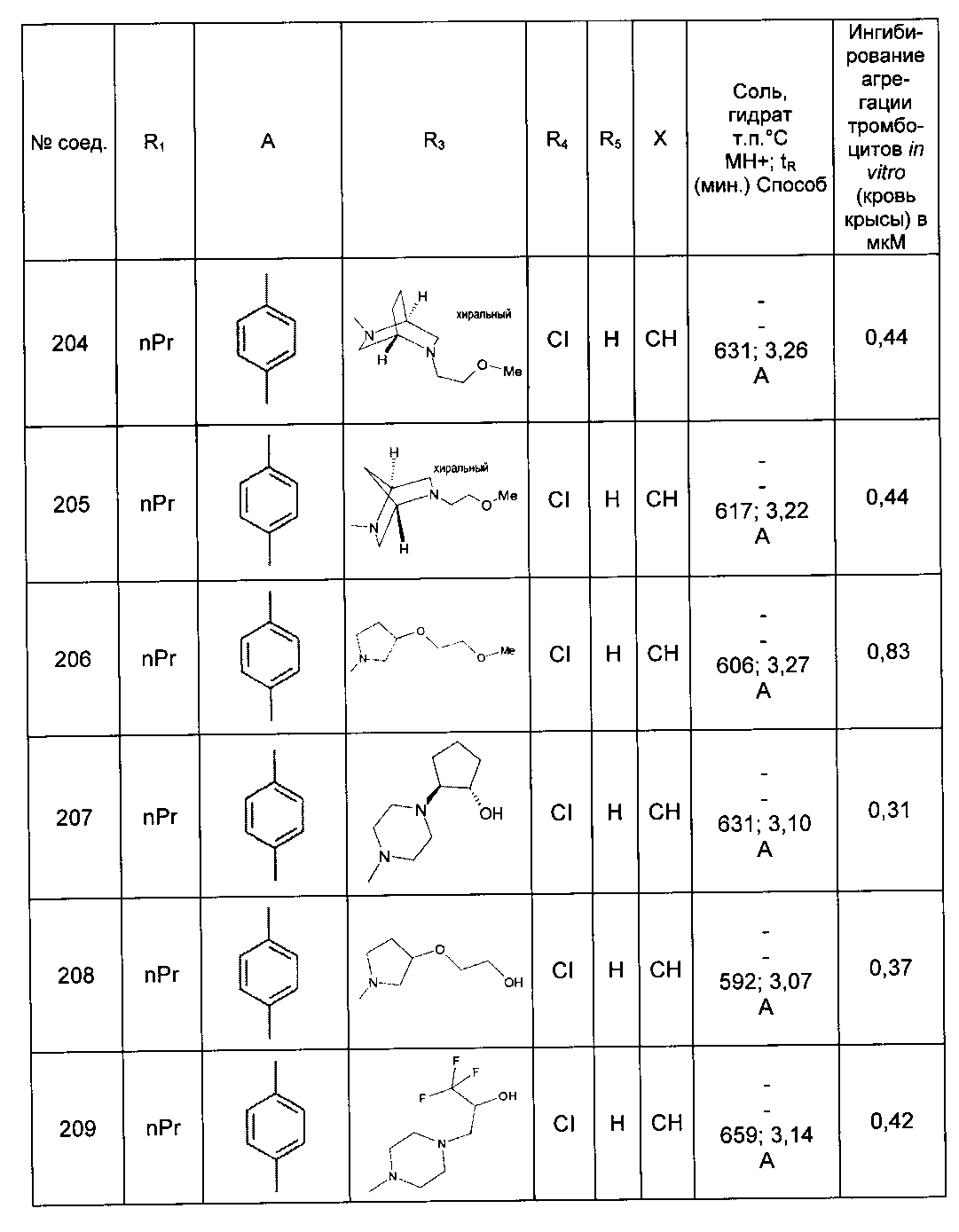
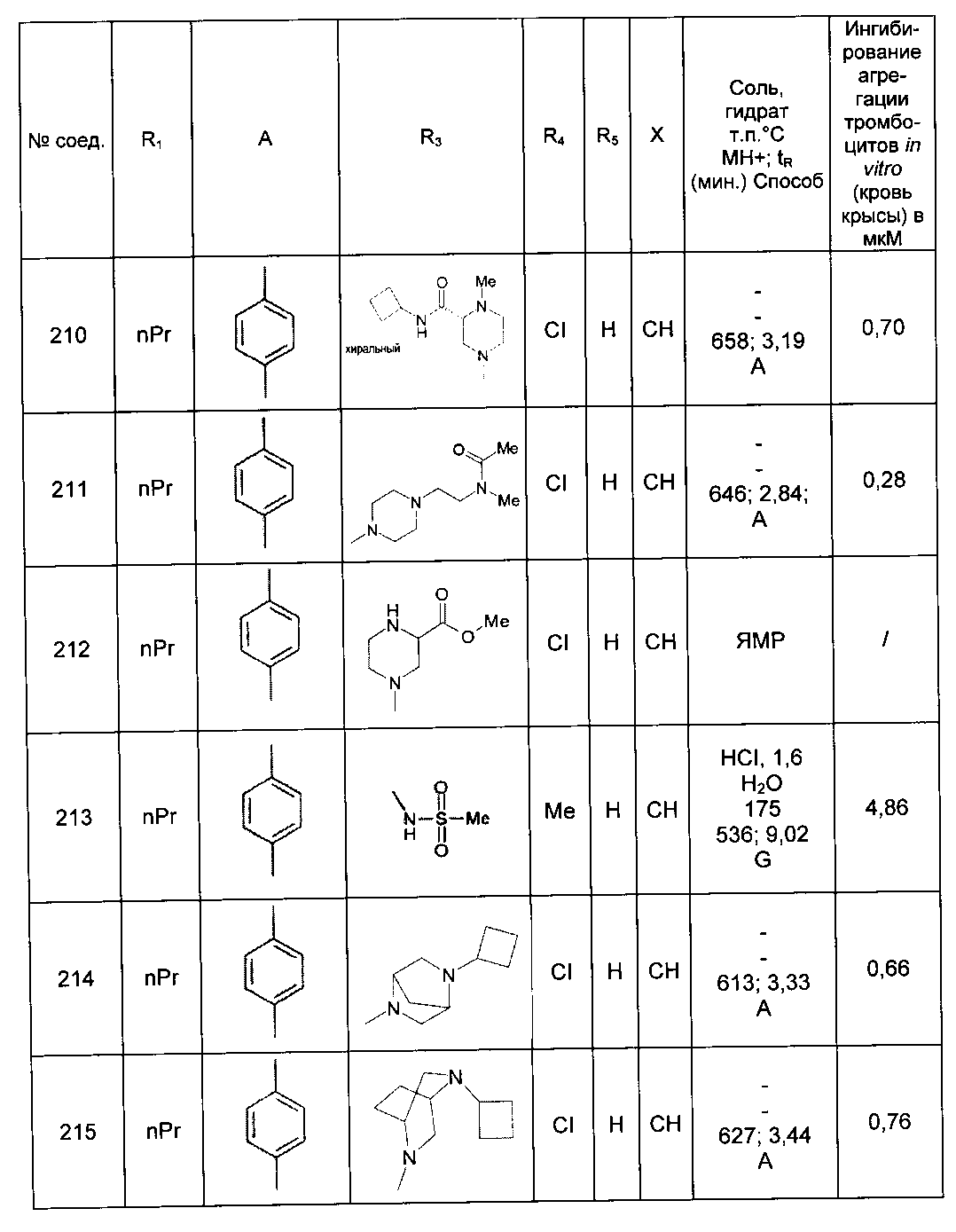
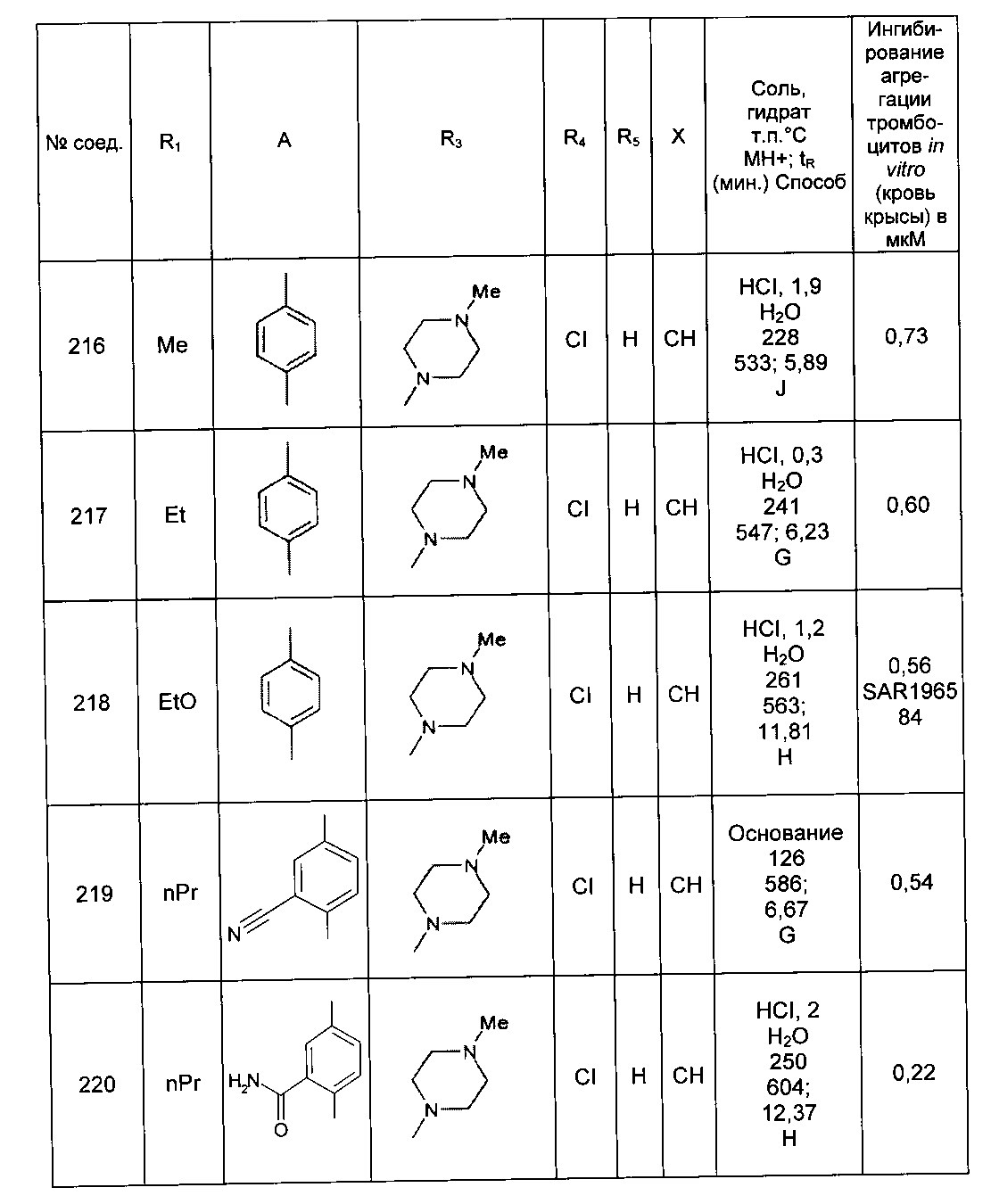
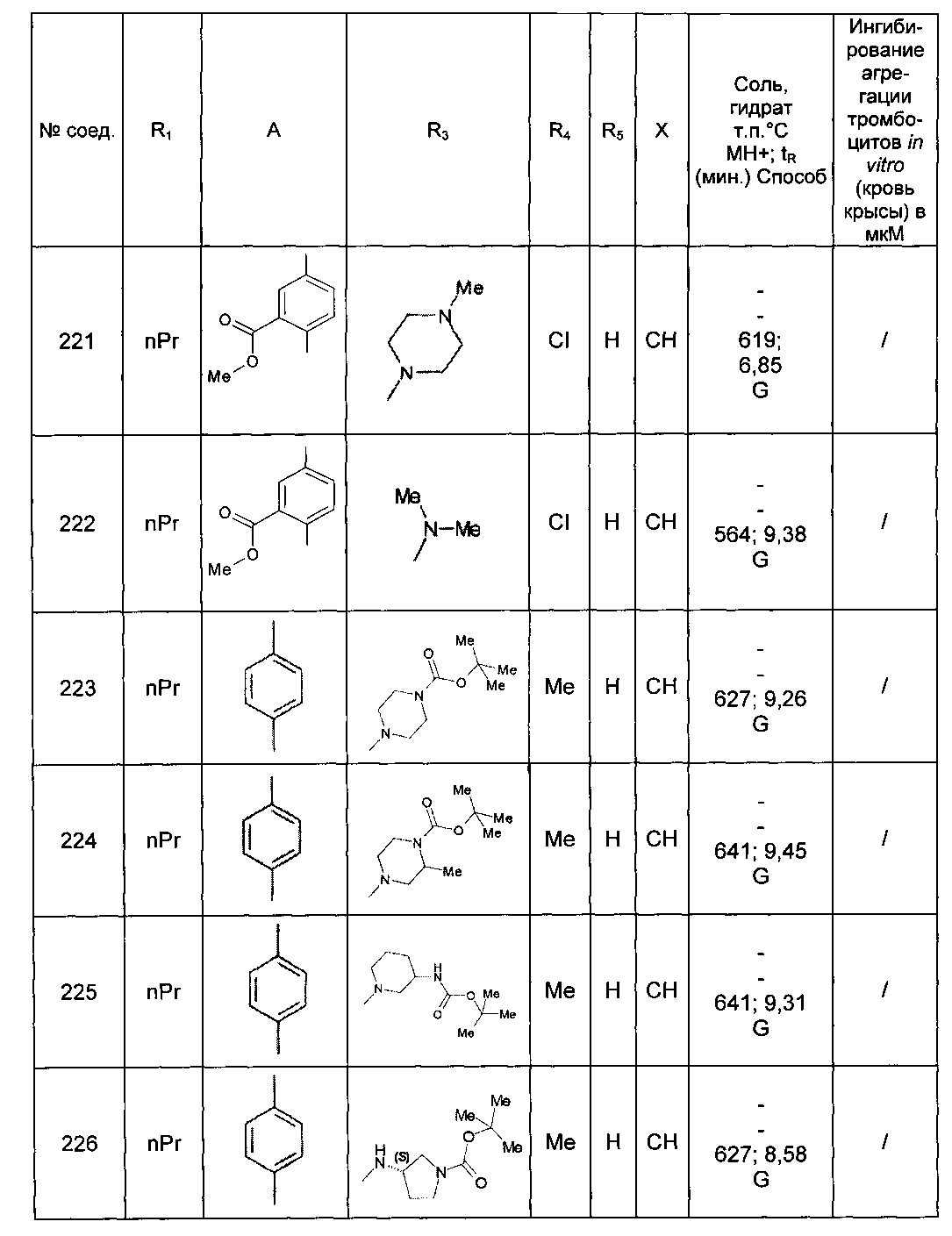
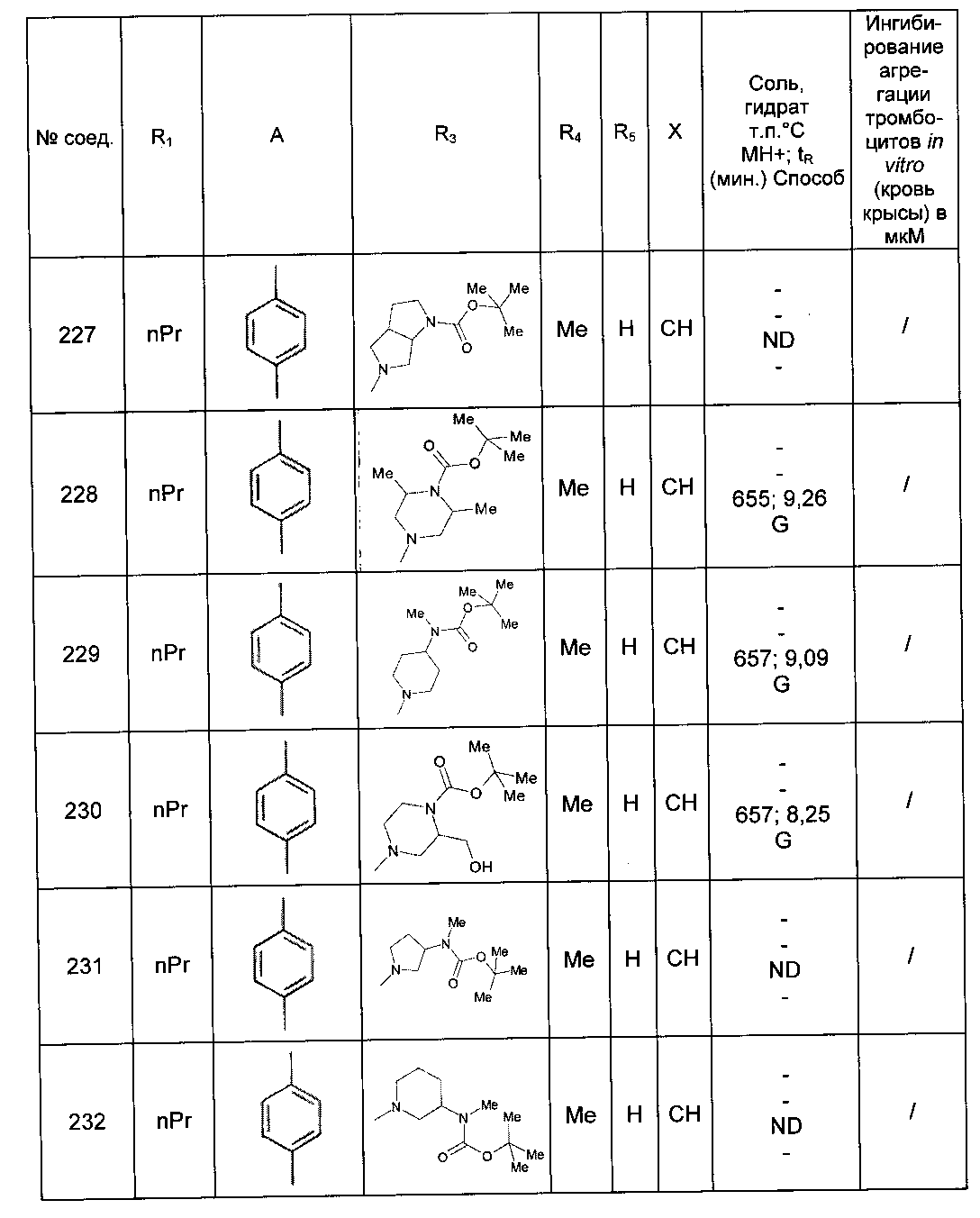
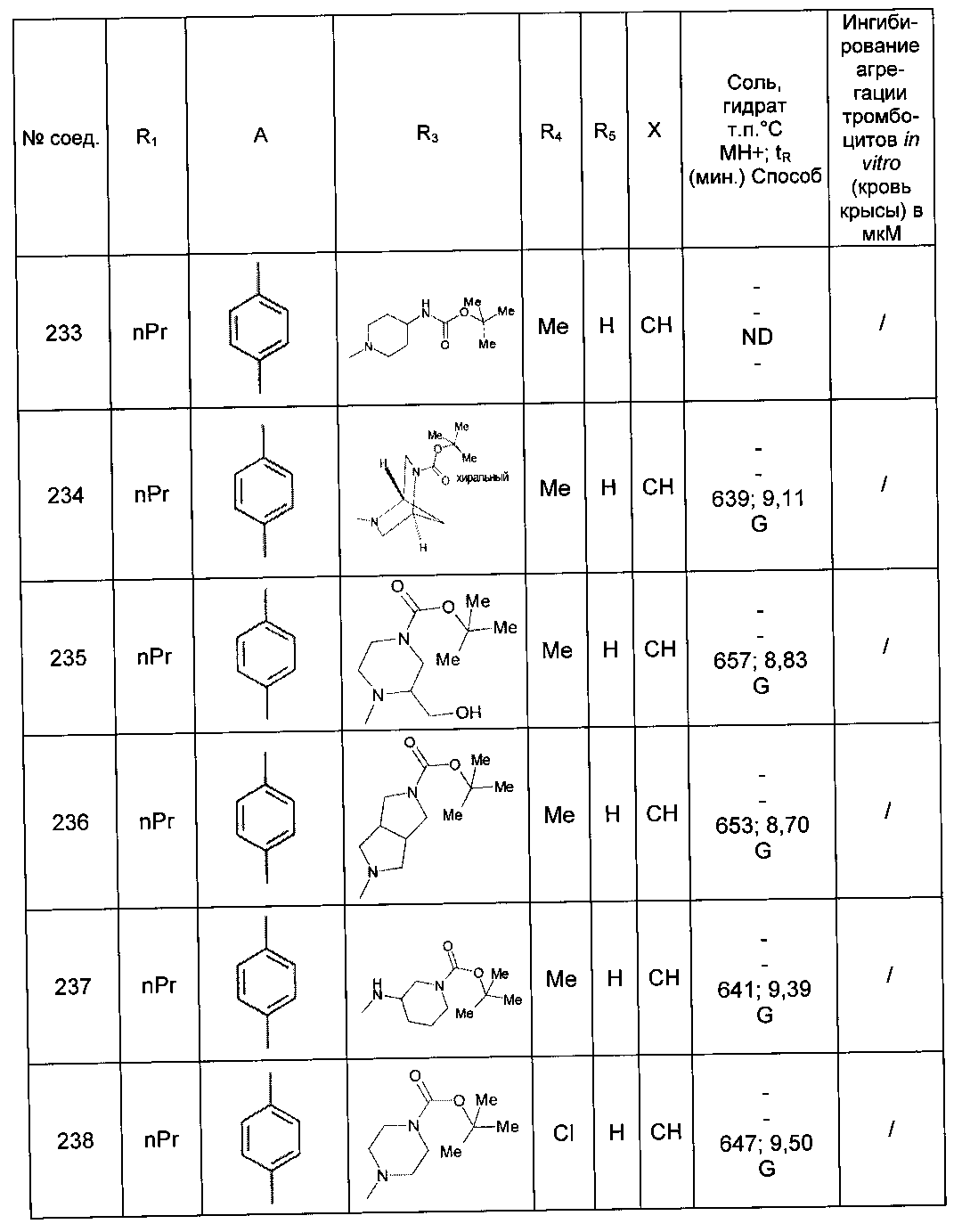
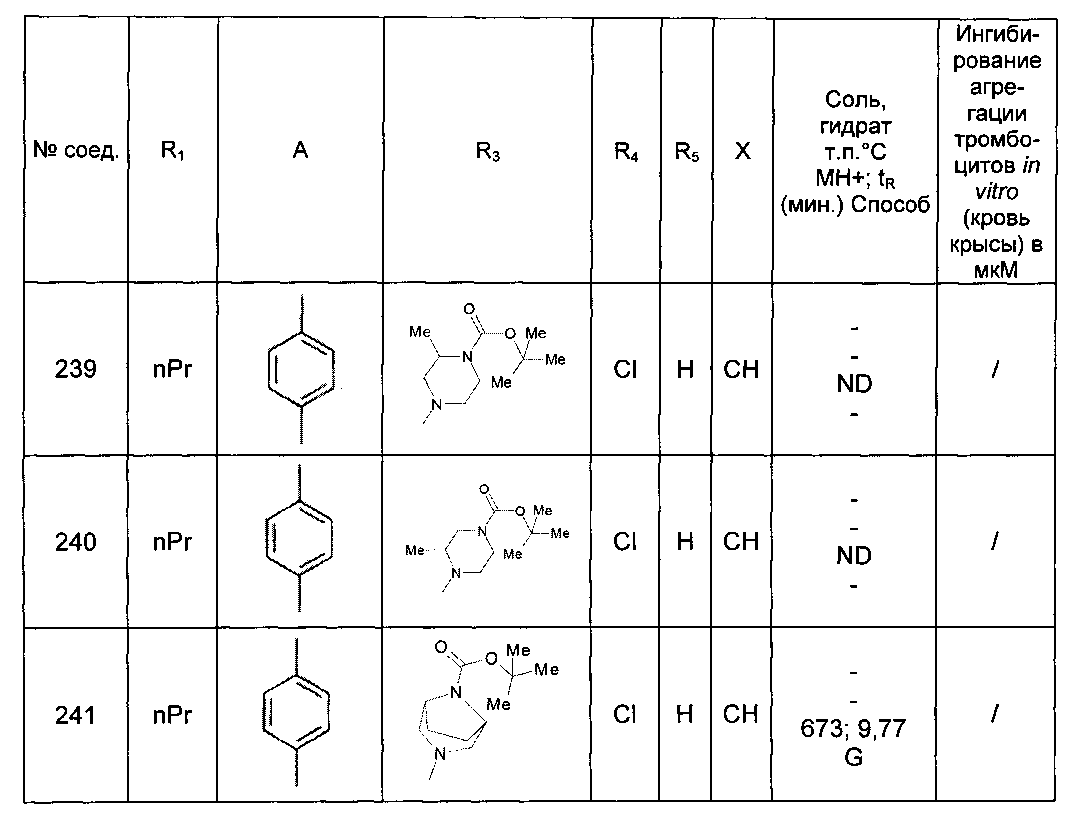
Соединения №223-241 формулы (I), несущие трет-бутилоксикарбонильную защитную группу на одном из атомов азота, не проявляют необходимую фармакологическую активность. Они представляют собой промежуточные соединения, которые можно применять для получения соединений формулы (I) №242-260.
Анализы ЯМР для определенных соединений представлены ниже.
Соединение 106:
1Н ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,63 (2Н, m); 2,33 (6Н, s); 2,52 (3Н, s); 2,81 (2Н, t); 2,89 (3Н, s); 3,14 (3Н, s); 5,22 (2Н, s); 7,25 (1Н, s); 7,47 (2Н, d); 7,93-7,99 (3Н, m); 8,09 (1Н, s); 8,24 (1Н, s); 9,97 (1Н, s).
Соединение 107:
1Н ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,63 (2Н, m); 2,33 (6Н, s); 2,52 (3Н, s); 2,78-2,84 (5Н, m); 2,91-3,24 (3Н, m); 3,39-3,75 (3Н, m); 4,11-4,45 (2Н, m); 5,20-5,45 (2Н, m); 7,27 (1H, s); 7,47 (2Н, d); 7,95-8,01 (3Н, m); 8,12 (1H, s); 8,25 (1H, s); 10,06 (1H, s); 11,18 (1H, br).
Соединение 114:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,43 (3Н, s); 2,52 (3Н, s); 2,78-2,81 (5Н, m); 2,93-3,24 (3Н, m); 3,41-3,64 (3Н, m); 4,15-4,46 (2Н, m); 5,29 (1H, d); 5,43 (1H, d); 7,06 (1H, d); 7,37 (1H, d); 7,48 (2Н, d); 7,97 (2Н, d); 8,02 (1H, s); 8,17 (1H, s); 8,24 (1H, s); 10,06 (1H, s); 10,60 (1H, br).
Соединение 115:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,52 (3Н, s); 2,78-2,89 (5Н, m); 2,93-3,24 (3Н, m); 3,39-3,69 (3Н, m); 4,20 (1H, s); 4,39 (1H, s); 5,35 (1H, d); 5,50 (1H, d); 7,28 (1H, d); 7,49 (2Н, d); 7,56 (1H, d); 7,96 (2Н, d); 8,22 (1H, s); 8,25 (1H, s); 8,31 (1H, s); 10,21 (1H, s); 10,95 (1H, br).
Соединение 119:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,43 (3Н, s); 2,52 (3Н, s); 2,82 (2Н, t); 2,97-3,28 (3Н, m); 3,34 (3Н, s); 3,35-3,41 (2Н, m); 3,50-3,77 (6Н, m); 4,20 (1H, d); 4,38 (1H, d); 5,29 (1H, d); 5,42 (1H, d); 7,06 (1H, d); 7,39 (1H, d); 7,48 (2Н, d); 7,98 (2Н, d); 8,03 (1H, s); 8,20 (1H, s); 8,24 (1H, s); 10,08 (1H, s); 10,80 (1H, br).
Соединение 128:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,43 (3Н, s); 2,52 (3Н, s); 2,82 (2Н, t); 3,48-3,70 (8Н, m); 5,31 (2Н, s); 7,06 (1H, d); 7,37 (1H, d); 7,48 (2Н, d); 7,97 (2Н, d); 8,02 (1H, s); 8,20 (1H, s); 8,24 (1H, s); 10,01 (1H, s).
Соединение 136:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,52 (3Н, s); 2,78-3,25 (8Н, m); 3,40-3,68 (3Н, m); 3,80 (3Н, s); 4,13-4,49 (2Н, m); 5,28 (1H, d); 5,43 (1H, d); 6,87 (1H, d); 7,40 (1H, d); 7,48 (2Н, d); 7,74 (1H, s); 7,97 (2Н, d); 8,20 (1H, s); 8,25 (1H, s); 10,07 (1H, s); 10,70 (1H, br).
Соединение 137:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,11 (2Н, d); 1,34 (1H, d); 1,63 (2Н, m); 1,90-2,20 (2Н, m); 2,44 (3Н, s); 2,52 (3Н, s); 2,82 (2Н, t); 3,10-4,55 (10Н, m); 5,15-5,60 (2Н, m); 7,07 (1H, d); 7,37-7,48 (3Н, m); 7,98-8,03 (3Н, m); 8,18-8,25 (2Н, m); 10,05 (1H, s); 10,30-11,50 (1H, m).
Соединение 142:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3H, t); 1,64 (2Н, m); 2,52 (3Н, s); 2,82 (2H, t); 3,01-3,77 (8Н, m); 4,13-4,48 (2Н, m); 4,81-5,03 (2Н, m); 5,36 (1H, d); 5,51 (1H, d); 7,28 (1H, d); 7,50 (2H, d); 7,56 (1H, d); 7,96 (2H, d); 8,21 (1H, s); 8,25 (1H, s); 8,30 (1H, s); 10,20 (1H, s); 10,90 (1H, br).
Соединение 145:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,52 (3Н, s); 2,82 (2Н, t); 3,06 (1H, m); 3,10-3,78 (14Н, m); 3,86 (2Н, m); 4,19 (1H, d); 4,37 (1H, d); 5,36 (1H, d); 5,51 (1H, d); 7,27 (1H, d); 7,49 (2Н, d); 7,58 (1H, d); 7,98 (2Н, d); 8,22 (1H, s); 8,25 (1H, s); 8,36 (1H, s); 10,24 (1H, s); 11,03 (1H, br).
Соединение 146:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,63 (2Н, m); 2,52 (3Н, s); 2,82 (2H, t); 2,98-3,31 (5Н, m); 3,52-3,86 (5Н, m); 4,15-4,42 (2Н, m); 5,37 (1H, d); 5,50 (1H, d); 7,28 (1H, d); 7,49 (2Н, d); 7,57 (1H, d); 7,97 (2Н, d); 8,22 (1H, s); 8,25 (1H, s); 8,34 (1H, s); 10,22 (1H, s); 10,53 (1H, br).
Соединение 147:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,43 (3Н, s); 2,52 (3Н, s); 2,81 (2Н, t); 2,90-3,70 (6Н, m); 4,21 (2Н, d); 4,40 (2Н, s); 5,27 (1H, d); 5,41 (1H, d); 7,05 (1H, d); 7,31-7,39 (3Н, m); 7,47 (2Н, d); 7,66 (1H, d); 7,96 (2Н, d); 8,02 (1H, s); 8,15 (1H, s); 8,24 (1H, s); 10,04 (1H, s); 10,90 (1H, br).
Соединение 148:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,63 (2Н, m); 2,52 (3Н, s); 2,82 (2Н, t); 2,88-4,70 (15Н, m); 5,39 (1H, br); 5,49 (1H, br); 7,28 (1H, d); 7,49 (2Н, d); 7,57 (1H, d); 7,97 (2Н, d); 8,22 (1H, s); 8,25 (1H, s); 8,36 (1H, s); 10,20 (1H, s); 11,64 (1H, br).
Соединение 154:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,52 (3Н, s); 2,82 (2Н, t); 2,95 (6Н, d); 3,01-3,29 (3Н, m); 3,47-3,80 (3Н, m); 4,10-4,46 (4Н, m); 5,38 (1H, s); 5,49 (1H, s); 7,28 (1H, d); 7,50 (2Н, d); 7,56 (1H, d); 7,96 (2Н, d); 8,22 (1H, s); 8,25 (1H, s); 8,31 (1H, s); 10,09-10,24 (2Н, m).
Соединение 157:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,63 (2Н, m); 2,52 (3Н, s); 2,80-3,70 (11H, m); 4,15 (1H, br); 4,39 (1H, br); 5,33 (1H, br); 5,48 (1H, br); 7,50 (2Н, d); 7,73 (1H, d); 7,96 (2Н, d); 8,25 (1H, s); 8,30 (1H, d); 8,34 (1H, s); 10,25 (1H, s); 10,95 (1H, br).
Соединение 158:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,63 (2Н, m); 2,52 (3Н, s); 2,82 (2Н, t); 2,91-3,84 (13Н, m); 4,15 (1H, d); 4,37 (1H, d); 5,33 (1H, d); 5,49 (1H, d); 7,49 (2Н, d); 7,74 (1H, d); 7,98 (2Н, d); 8,25 (1H, s); 8,31 (1H, d); 8,34 (1H, s); 10,29 (1H, s); 11,02 ().
Соединение 159:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,29 (3Н, d); 1,35 (3Н, d); 1,64 (2Н, m); 2,52 (3Н, s); 2,69-2,85 (3Н, m); 3,11-3,68 (3Н, m); 4,15 (1H, d); 4,42 (1H, d); 5,35 (1H, d); 5,54 (1H, d); 7,27 (1H, d); 7,49 (2Н, d); 7,58 (1H, d); 7,98 (2Н, d); 8,21 (1H, s); 8,24 (1H, s); 8,34 (1H, s); 9,22-9,46 (1H, m); 9,60-9,79 (1H, m); 10,22 (1H, br).
Соединение 165:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,52 (3Н, s); 2,82 (2Н, t); 2,90-3,23 (3Н, m); 3,44-3,73 (2Н, m); 4,19 (1H, d); 4,41 (3Н, s); 5,34 (1H, d); 5,49 (1H, d); 7,27 (1H, d); 7,36 (2Н, t); 7,49 (2Н, d); 7,55 (1H, d); 7,68 (2Н, s); 7,96 (2Н, d); 8,21 (1H, s); 8,25 (1H, s); 8,30 (1H, s); 10,19 (1H, s); 11,08 (1H, br).
Соединение 166:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,48 (3Н, s); 2,52 (3Н, s); 2,82 (2Н, t); 2,88-3,35 (4Н, m); 3,63-4,78 (6Н, m); 5,39 (1H, s); 5,44 (1H, s); 6,61 (1H, s); 7,27 (1H, d); 7,49 (2Н, d); 7,56 (1H, d); 7,97 (2Н, d); 8,21 (1H, s); 10,20 (1H, s); 11,83 (1H, br).
Соединение 177:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,34 (2Н, d); 1,56 (1H, d); 1,63 (2Н, m); 2,52 (3Н, s); 2,77-2,87 (6Н, m); 3,13 (1H, br); 3,35-3,74 (3Н, m); 4,11 (0,6Н, d); 4,41 (0,39Н, d); 4,59 (0.39Н, br); 4,74 (0,61 Н, br); 5,22-5,65 (2Н, m); 7,28 (1H, d); 7,45-7,58 (3Н, m); 7,97 (2Н, d); 8,20-8,35 (3Н, m); 10,21 (1H, s); 10,68 (1H, br).
Соединение 179:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,33 (3Н, d); 1,64 (2Н, m); 2,52 (3Н, s); 2,82 (2Н, t); 3,00-3,79 (12Н, m); 4,18 (1H, d); 4,42 (1H, d); 5,36 (1H, d); 5,49 (1H, d); 7,28 (1H, d); 7,49 (2Н, d); 7,58 (1H, d); 7,97 (2Н, d); 8,21 (1H, s); 8,24 (1H, s); 8,38 (1H, s); 10,21 (1H, s); 10,62 (1H, br).
Соединение 180:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,38 (6Н, s); 1,63 (2Н, m); 2,52 (3Н, s); 2,81 (2Н, t); 2,96-3,09 (1H, m); 3,19-3,30 (2Н, m); 3,37 (3Н, s); 3,47-3,61 (4Н, m); 3,72-3,84 (1H, m); 4,16 (1H, d); 4,42 (1H, d); 5,37 (1H, d); 5,47 (1H, d); 7,27 (1H, d); 7,49 (2Н, d); 7,59 (1H, d); 7,98 (2Н, d); 8,22 (1H, s); 8,24 (1H, s); 8,35 (1H, s); 10,22 (1H, s); 10,44 (1H, br).
Соединение 181:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,33 (6Н, s); 1,63 (2Н, m); 2,52 (3Н, s); 2,81 (2Н, t); 2,97-3,10 (1H, m); 3,20-3,30 (2Н, m); 3,50-3,64 (4Н, m); 3,73-3,84 (1H, m); 4,18 (1H, d); 4,43 (1H, d); 5,38 (1H, d); 5,48 (1H, d); 5,80 (1H, br); 7,27 (1H, d); 7,49 (2Н, d); 7,59 (1H, d); 7,98 (2Н, d); 8,22 (1H, s); 8,24 (1H, s); 8,36 (1H, s); 10,13 (1H, br); 10,24 (1H, s).
Соединение 192:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 1,88-2,30 (4Н, m); 2,52 (3Н, s); 2,76-2,85 (5Н, m); 3,08 (1H, t); 3,36-3,57 (3Н, m); 4,65 (1H, s); 4,72 (1H, s); 5,31 (1H, d); 5,42 (1H, d); 7,29 (1H, d); 7,49 (2Н, d); 7,60 (1H, d); 7,97 (2Н, d); 8,22 (1H, s); 8,25 (1H, s); 8,36 (1H, s); 10,15 (1H, br); 10,19 (1H, s).
Соединение 196:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,95 (3Н, t); 1,64 (2Н, m); 1,76 (1H, m); 1,91 (1H, m); 2,24 (1H, m); 2,55 (3Н, s); 2,85 (2Н, t); 2,88 (1H, m); 2,95 (2Н, m); 3,27 (3Н, s); 3,42-3,72 (5Н, m); 3,89-4,07 (1H, br); 4,23 (1H, br); 4,48 (1H, Ы); 5,50 (2Н, br); 7,34 (1H, br); 7,56 (2Н, d); 7,63 (1H, d); 8,02 (2Н, d); 8,28 (1H, d); 8,32 (1H, s); 8,35 (1H, s); 10,23 (2Н, s Br).
Соединение 199:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,52 (3Н, s); 2,82 (2Н, t); 2,98-4,48 (10Н, m); 5,38 (1H, s); 5,46 (1H, s); 7,28 (1H, d); 7,49 (2Н, d); 7,56 (1H, d); 7,74 (1H, s); 7,97 (2Н, d); 8,02 (1H, s); 8,21 (1H, s); 8,24 (1H, s); 8,31 (1H, s); 10,20 (1H, s); 10,31 (1H, br).
Соединение 200:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,53 (3Н, s); 2,82 (2Н, t); 2,89 (1,65Н, s); 3,18 (1,35Н, s); 3,26 (1,35Н, s); 3,41 (1,65Н, s); 3,47 (2Н, m); 3,64 (2Н, m); 5,34 (2Н, s); 7,27 (1H, m); 7,43 (0,55Н, d); 7,49 (2Н, d); 7,54 (0,45, d); 7,96 (2H, d); 8,21 (1H, s); 8.24 (1H, s); 8,30 (1H, s); 10,11 (0,55H, s); 10,13 (0,45H, s).
Соединение 203:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,53 (3Н, s); 2,79-3,25 (8Н, m); 3,40-3,69 (3Н, m); 4,10-4,50 (2Н, m); 5,43 (1H, d); 5,58 (1H, d); 7,50 (2Н, d); 7,57 (1H, d); 7,75 (1H, d); 7,98 (2Н, d); 8,25 (1H, s); 8,41 (1H, s); 8,59 (1H, s); 10,29 (1H, s); 10,49 (1H, br).
Соединение 209:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,93 (3Н, t); 1,63 (2Н, m); 2,52 (3Н, s); 2,82 (2Н, t); 3,05-3,75 (11H, m); 4,32 (1H, br); 4,83 (1H, br); 5,49 (2Н, br); 7,33 (1H, d); 7,55 (2Н, d); 7,61 (1H, d); 8,01 (2Н, d); 8,27 (1H, d); 8,31 (1H, s); 8,36 (1H, s); 10,23 (1H, s); 10,68 (1H, br).
Соединение 212: TLC.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,53 (3Н, s); 2,55-4,20 (13Н, m); 5,20-5,60 (2Н, m); 7,26 (1H, d); 7,45-7,55 (3Н, m); 7,96 (2Н, d); 8,22 (1H, s); 8,24 (1H, s); 8,32 (1H, s); 10,15 (1H, s).
Соединение 219:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,23 (3Н, s); 2,30 (2Н, m); 2,44 (2Н, m); 2,58 (3Н, s); 2,84 (2Н, t); 3,48 (2Н, m); 3,59 (2Н, m); 5,40 (2Н, s); 7,28 (1H, d); 7,56 (1H, d); 7,81 (1H, d); 7,90 (1H, d); 8,11 (1H, s); 8,16 (1H, s); 8,28 (1H, s); 8,32 (1H, s); 10,37 (1H, s).
Соединение 221:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,95 (3Н, t); 1,64 (2Н, m); 2,24 (3Н, s); 2,32 (2Н, m); 2,45 (2Н, m); 2,55 (3Н, s); 2,83 (2Н, t); 3,48 (2Н, m); 3,58 (2Н, m); 5,43 (2Н, s); 7,30 (1H, d); 7,56 (1H, d); 7,85 (1H, d); 8,08 (1H, s); 8,12 (1H, s); 8,22 (1H, s); 8,29 (1H, s); 8,76 (1H, d); 11,25 (1H, s).
ПРИМЕР 12: соединение №242:
N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-метил-1-[2-(3-метилпиперазин-1-ил)-2-оксоэтил]-1H-индол-3-карбоксамид гидрохлорид
8,19 мл раствора 4N HCl в диоксане добавляют к 1,05 г соединения №224 в 20 мл смеси EtOAc/МеОН (50/50; объем/объем). Через 20 часов при КТ осадок фильтруют, растирают с ацетоном и затем фильтруют, получая 0,77 г предполагаемого соединения.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,22-1,39 (3Н, m); 1,64 (2Н, m); 2,43 (3Н, s); 2,52 (3Н, s); 2,81 (2Н, t); 2,85-3,75 (5Н, m); 4,02-4,39 (2Н, m); 5,22-5,50 (2Н, m); 7,06 (1H, d); 7,40 (1H, d); 7,48 (2Н, d); 7,99 (2Н, d); 8,03 (1H, s); 8,22 (1H, s); 8,24 (1H, s); 9,44-9,74 (2Н, m); 10,09 (1H, s).
МН+=541; tR=6,33 мин. (способ G).
т.п.=223°C.
Следуя процедуре, описанной в примере 12 и начиная с N-защищенных соединений №224-241, получают соединения формулы (I), представленные в ТАБЛИЦЕ XIV ниже:
В данной таблице:
- в колонке "Соль" "-" представляет собой соединение в форме свободного основания, тогда как "HCl" представляет собой соединение в форме гидрохлорида, "TFA" представляет собой соединение в форме трифторацетата;
- Me представляет собой метильный радикал;
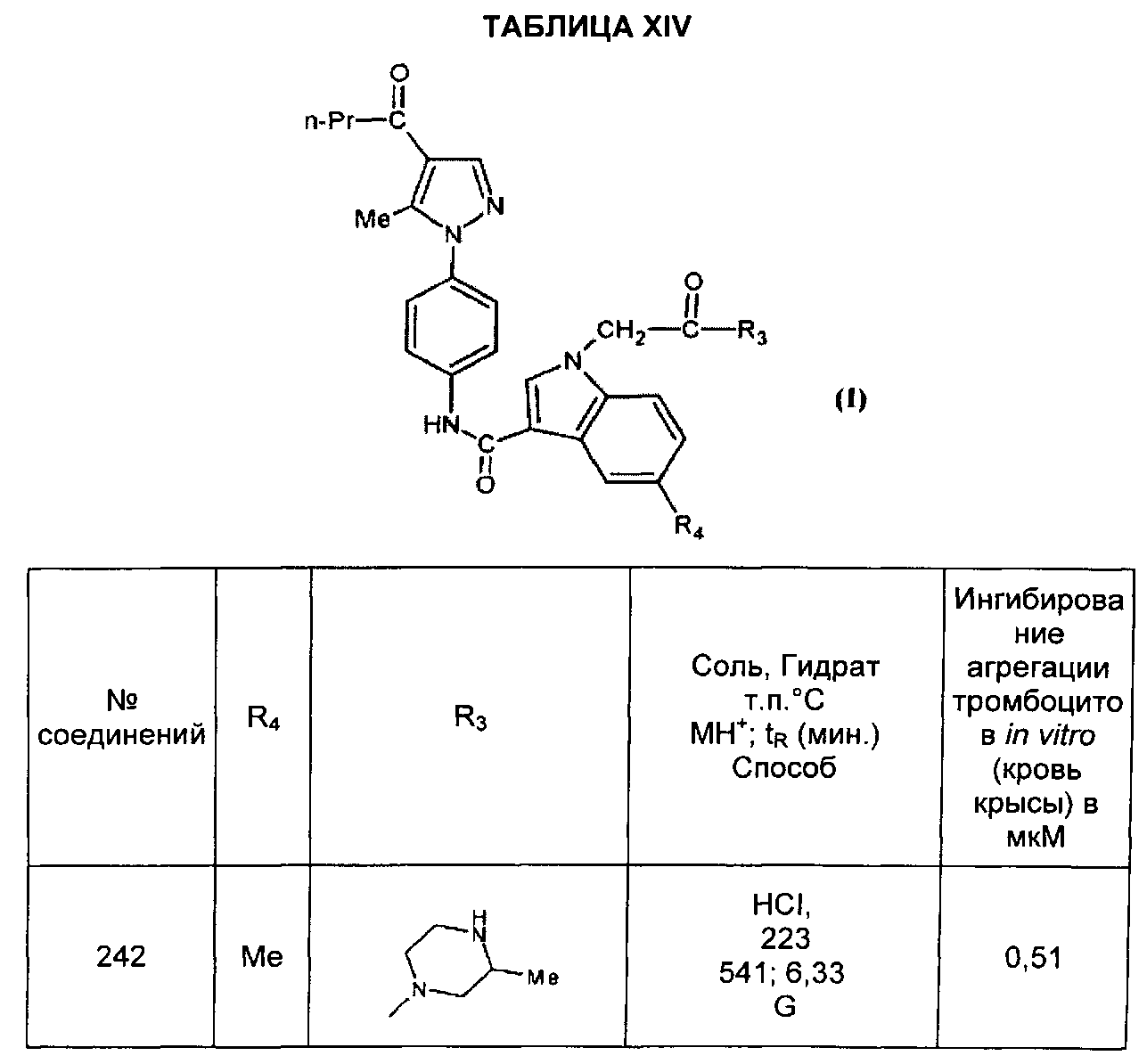
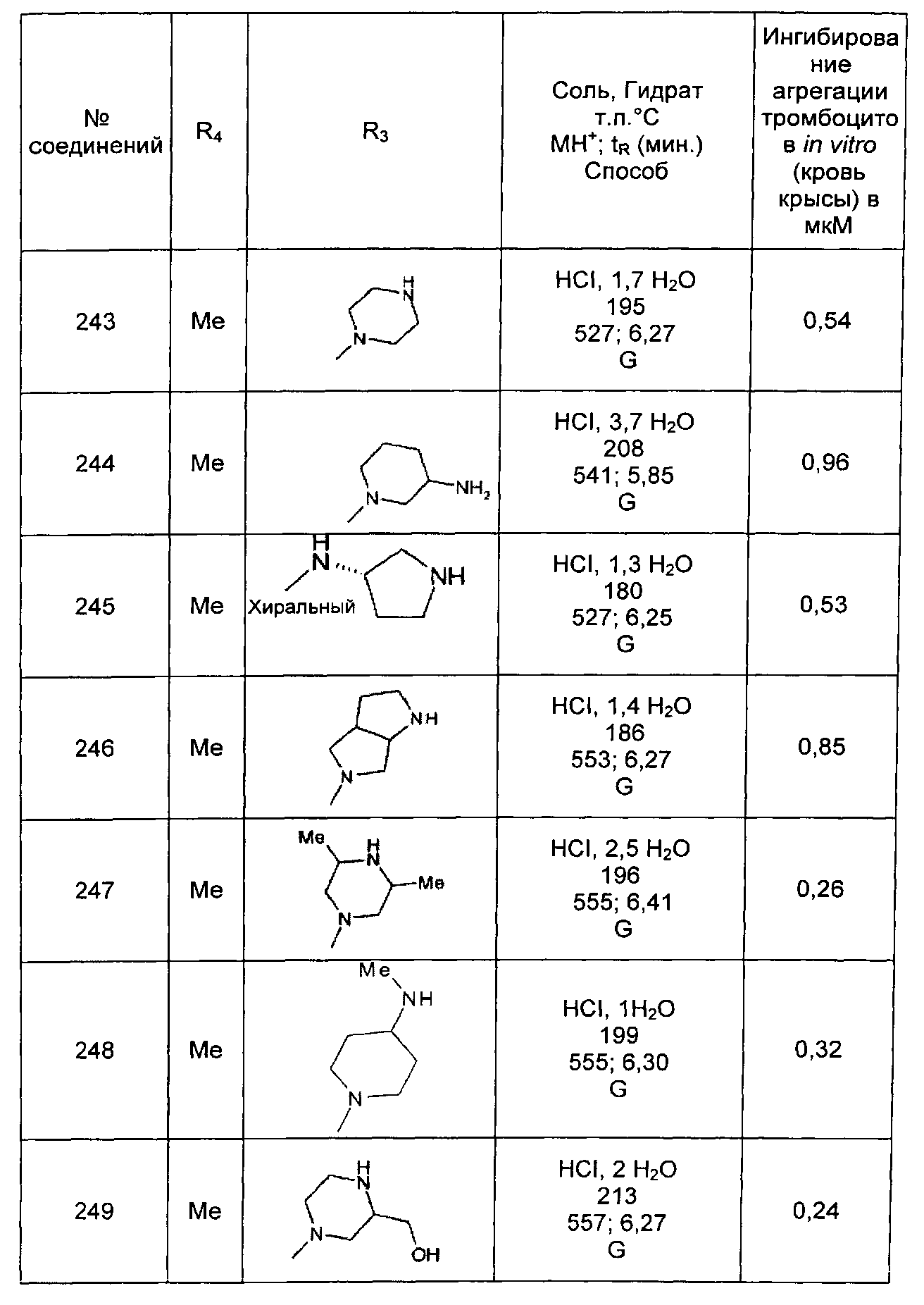
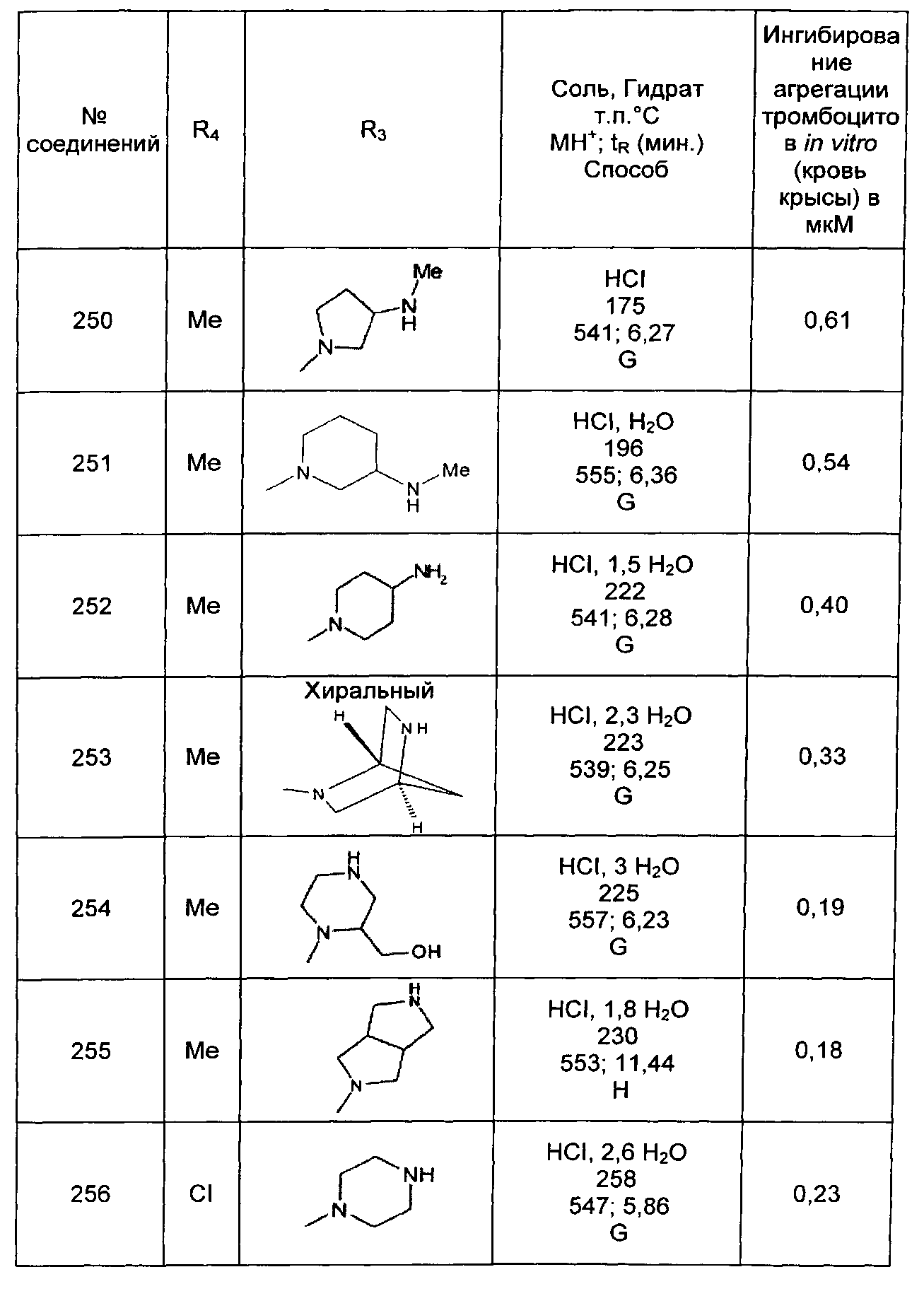
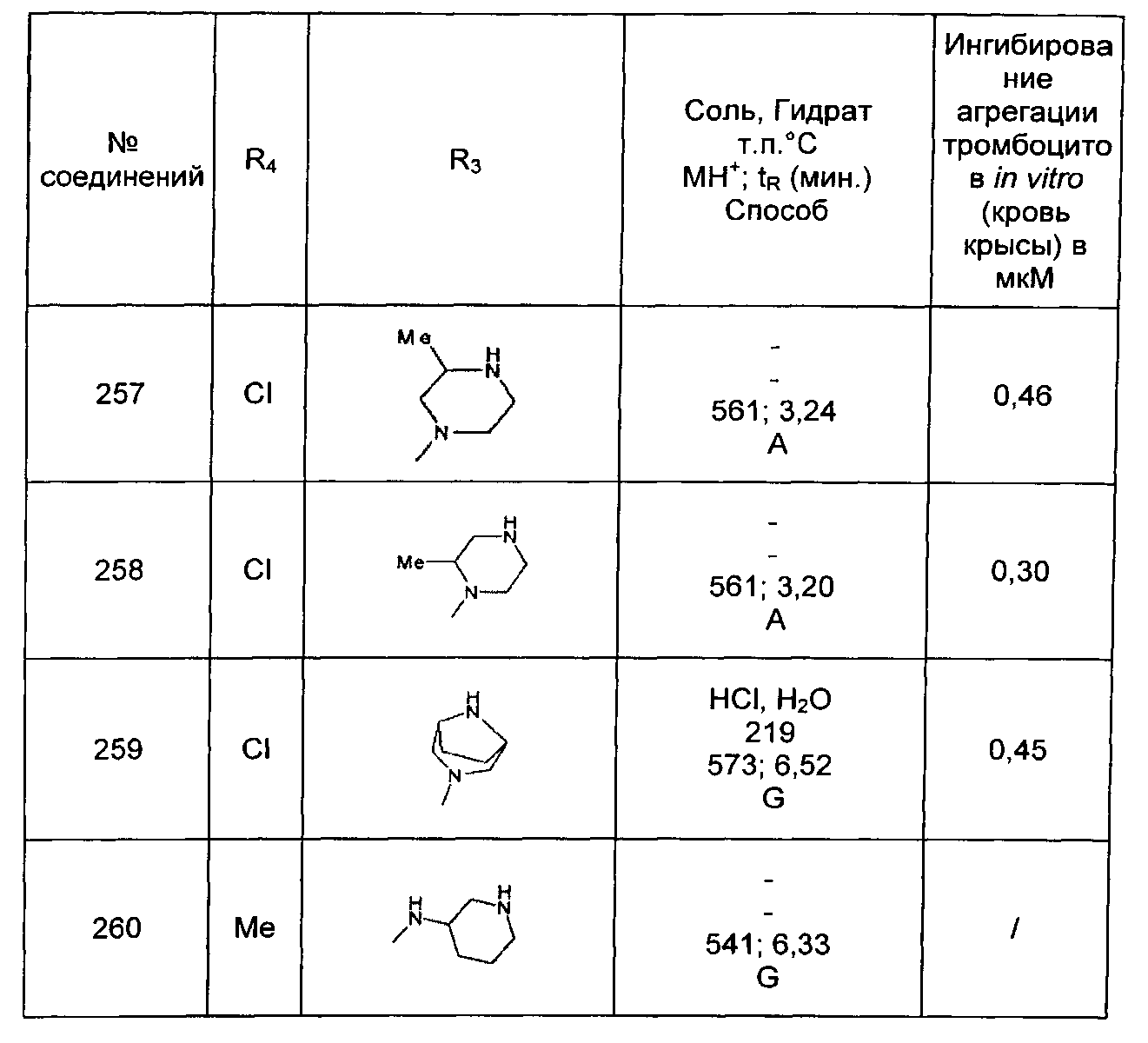
Анализы ЯМР для некоторых соединений представлены ниже: соединение 256:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,63 (2Н, m); 2,52 (3Н, s); 2,82 (2Н, t); 3,11 (2Н, br); 3,27 (2Н, br); 3,64-3,84 (4Н, m); 5,42 (2Н, s); 7,27 (1H, d); 7,49 (2Н, d); 7,58 (1H, d); 7,97 (2Н, d); 8,21 (1H, s); 8,25 (1H, s); 8,33 (1H, s); 9,32 (2Н, br); 10,21 (1H, s).
Соединение 259:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 1,86-2,17 (4Н, m); 2,52 (3Н, s); 2,82 (2Н, t); 3,10 (1H, d); 3,67 (1H, d); 3,92 (1H, d); 4,02-4,20 (3Н, m); 5,30 (2Н, d); 5,58 (2Н, d); 7,28 (1H, d); 7,49 (2Н, d); 7,56 (1H, d); 7,96 (2Н, d); 8,21 (1H, s); 8,25 (1H, s); 8,33 (1H, s); 9,18 (2Н, br); 10,16 (1H, s).
ПРИМЕР 13: соединение №261
N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-{2-[4-(2-метоксиэтил)-3,5-диметилпиперазин-1-ил]-2-оксоэтил}-1H-индол-3-карбоксамид гидрохлорид
0,12 г карбоната калия, 0,13 г йодида натрия и затем 0,080 мл 1-бром-2-метоксиэтана добавляют к 0,4 г соединения №159 в 5 мл DMF. Реакционную смесь помещают в микроволновой прибор при 160°C в течение 40 мин. (300 Вт). После ее возвращают к КТ, вливают в 50 мл воды и экстрагируют EtOAc. Комбинированные органические фазы промывают водой, высушивают над Na2SO4 и выпаривают до сухого состояния. Твердый остаток очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH (градиент от 3 до 5% МеОН), получая 0,12 г порошка. Продукт растворяют в 4 мл смеси DCM/MeOH (1/1; объем/объем) и затем добавляют 0,38 мл раствора 1М HCl в эфире. Гидрохлорид осаждают с помощью 10 мл эфира и затем фильтруют, получая 0,103 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,36 (3Н, d); 1,43 (3Н, d); 1,63 (2Н, m); 2,52 (3Н, s); 2,81 (2Н, t); 3,05 (1H, t); 3,35 (3Н, s); 3,38-3,77 (7Н, m); 4,19 (1H, d); 4,41 (1H, d); 5,33 (1H, d); 5,55 (1H, d); 7,28 (1H, d); 7,49 (2Н, d); 7,58 (1H, d); 7,97 (2Н, d); 8,22 (1H, s); 8,24 (1H, s); 8,34 (1H, s); 10,21 (1H, s); 10,97 (1H, br),
МН+=633; tR=6,25 мин. (способ G).
т.п.=187°C.
ПРИМЕР 14: соединение №262
N-[4-(4-бутирил-5-метил-7Н-пиразол-1-ил)фенил]-5-хлор-1-[2-оксо-2-(3,4,5-триметилпиперазин-1-ил)этил]-1Н-индол-3-карбоксамид гидрохлорид
0,12 г карбоната калия и затем 0,053 мл йодметана добавляют к 0,4 г соединения №159 в 5 мл DMF. Через 20 ч. при КТ добавляют воду и полученное экстрагируют EtOAc. Органическую фазу промывают водой, высушивают над Na2SO4 и затем выпаривают до сухого состояния. Твердый остаток очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH (95/5; объем/объем), получая 0,17 г порошка. Продукт растворяют в
5 мл ацетона, затем добавляют 1 мл раствора 1М HCl в эфире. Гидрохлорид осаждают с помощью 10 мл диэтилового эфира и затем фильтруют, получая 0,095 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,38 (3Н, d); 1,45 (3Н, d); 1,63 (2Н, m); 2,52 (3Н, s); 2,79-2,85 (5Н, m); 2,97 (1H, t); 3,22-3,52 (3Н, m); 4,21 (1H, d); 4,41 (1H, d); 5,33 (1H, d); 5,55 (1H, d); 7,28 (1H, d); 7,49 (2Н, d); 7,57 (1H, d); 7,97 (2Н, d); 8,22 (1H, s); 8,25 (1H, s); 8,33 (1H, s); 10,21 (1H, s); 10,85 (1H, br), МН+=589; tR=6,12 мин. (способ G).
т.п.=217°C.
Следуя процедуре, описанной в примере 14, получают соединения формулы (I), представленные в ТАБЛИЦЕ XV ниже:
В данной таблице:
- в колонке "Соль", "Основание" представляет собой соединение в форме свободного основания, тогда как "HCl" представляет собой соединение в форме гидрохлорида, "TFA" представляет собой соединение в форме трифторацетата;
- Me представляет собой метильный радикал;
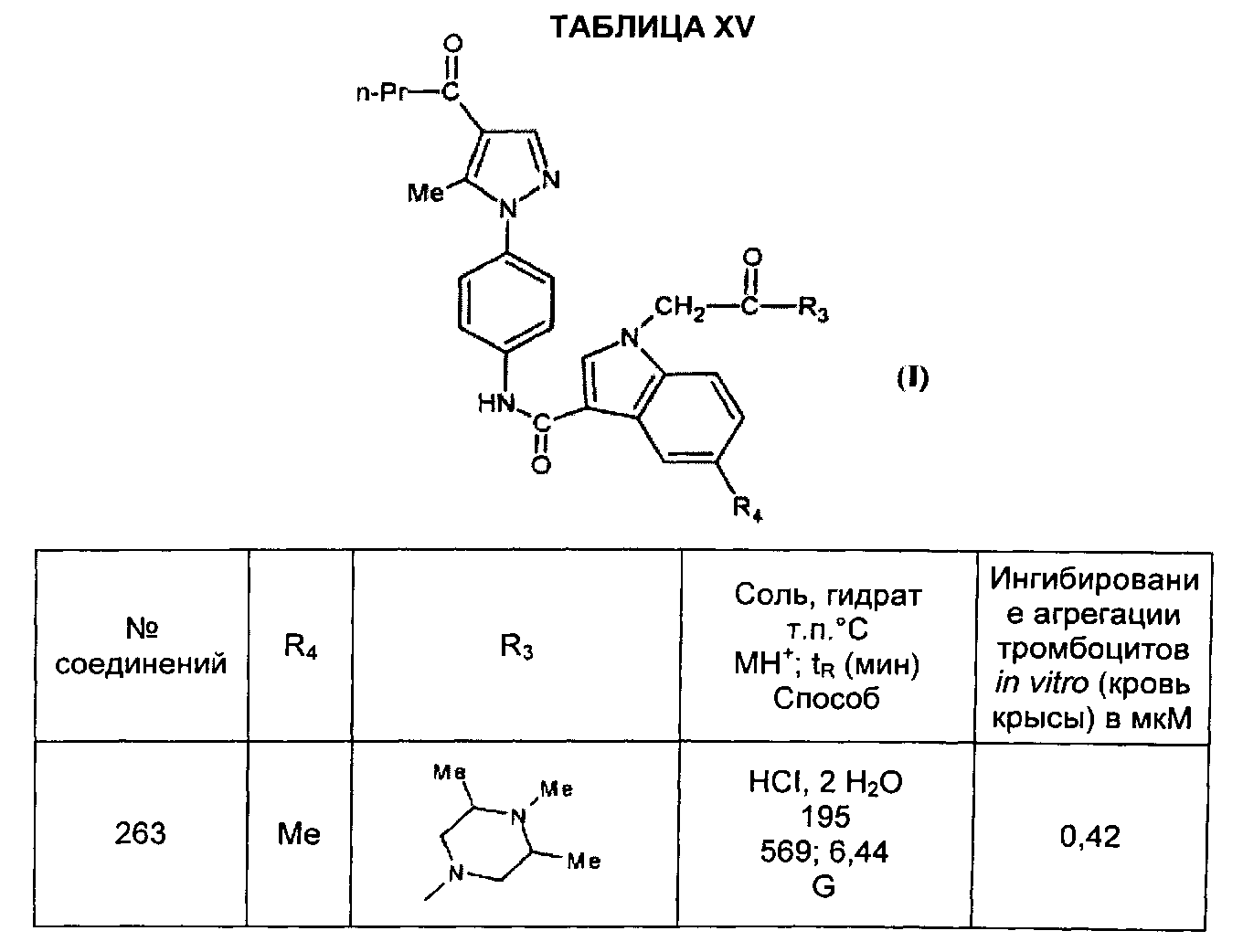
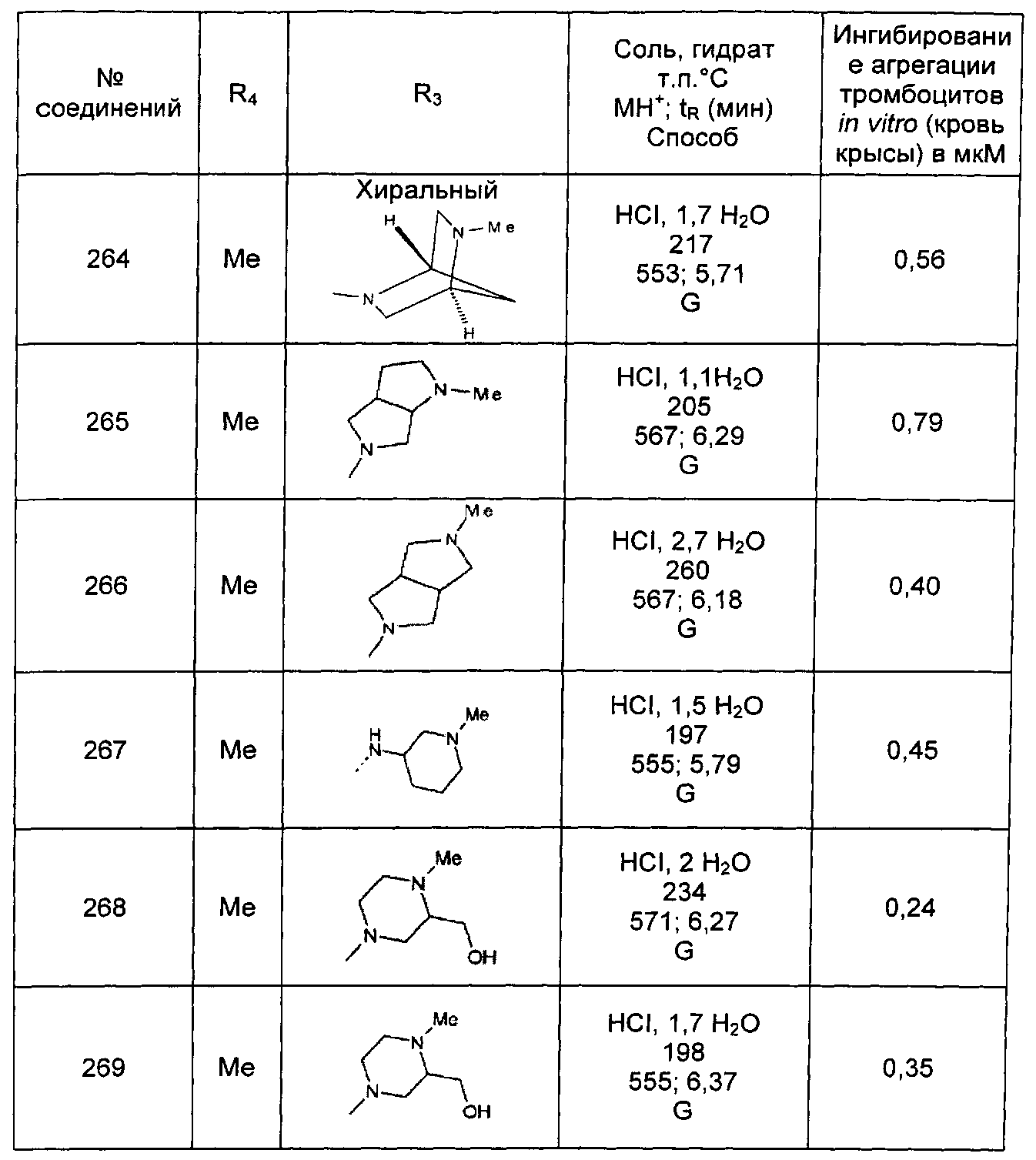
Анализы ЯМР для некоторых соединений представлены ниже:
Соединение 263:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,36 (3Н, d); 1,58-1,68 (5Н, m); 2,43 (3Н, s); 2,52 (3Н, s); 2,82 (2Н, t); 2,88 (3Н, s); 3,06-3,30 (2Н, m); 3,42-3,59 (2Н, m); 4,56-4,75 (2Н, m); 5,18 (1H, d); 5,56 (1.Н, d); 7,07 (1H, d); 7,31 (1H, d); 7,48 (2Н, d); 7,98 (2Н, d); 8,03 (1H, s); 8,25 (2Н, s); 10,07 (1H, s); 10,56 (1H, br).
Соединение 268:
1H ЯМР: DMSO-de (250 МГц): 6 (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,43 (3Н, s); 2,52 (3Н, s); 2,82 (2Н, t); 2,89 (3Н, s); 3,00-4,50 (9Н, m); 5,20-5,52 (2Н, m); 5,70 (1H, br); 7,06 (1H, d); 7,38 (1H, d); 7,48 (2Н, d); 7,97 (2Н, d); 7,99 (1H, s); 8,03 (1H, s); 8,21 (1H, s); 10,00-10,30 (2Н, m).
Соединение 269:
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,37 (3Н, d); 1,63 (2Н, m); 2,43 (3Н, s); 2,52 (3Н, s); 2,74-2,85 (5Н, m); 2,89-4,46 (7Н, m); 5,22-5,53 (2Н, m); 7,06 (1H, d); 7,38 (1H, d); 7,48 (2Н, d); 7,98 (2Н, d); 8,03 (1H, s); 8,19 (1H, s); 8,25 (1H, s); 10,08 (1H, s); 11,01 (0,8Н, br); 11,19 (0,2Н, br).
ПРИМЕР 15: соединение №270
Метил-4-[(3-{[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]карбамоил}-5-хлор-1H-индол-1-ил)ацетил]-1-метилпиперазин-2-карбоксилат
0,62 мл формальдегида в растворе в концентрации 37% в воде добавляют к 0,5 г соединения №212 в 1 мл муравьиной кислоты при 50°C и полученное нагревают при 70°C в течение 1,5 ч. Реакционную смесь добавляют к 15 мл насыщенного раствора бикарбоната натрия. Образованный осадок фильтруют, полученное промывают водой и затем высушивают в вакуумной сушильной камере при 50°C, получая 0,49 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,65 (2Н, m); 2,20-2,45 (4Н, m); 2,52 (3Н, s); 2,82 (2Н, t); 3,06-3,35 (2Н, m); 3,40-3,85 (7Н, m); 5,10-5,50 (2Н, m); 7,27 (1H, d); 7,48-7,52 (3Н, m); 7,95 (2Н, d); 8,21 (1H, s); 8,24 (1H, s); 8,29 (1H,s); 10,15 (1H, s).
МН+=619; tR=7,41 мин. (способ G)
ПРИМЕР 16: соединение №271
4-[(3-{[4-(4-Бутирил-5-метил-1H-пиразол-1-ил)фенил]карбамоил}-5-хлор-1H-индол-1-ил)ацетил]-1-метилпиперазин-2-карбоновая кислота
0,89 мл 1N раствора соды добавляют к 0,49 г соединения №270 в 5 мл метанола и полученное перемешивают в течение 18 ч. Полученное выпаривают до сухого состояния, твердый остаток поглощают водой и затем 2 мл 1N HCl добавляют по каплям. Образованный осадок фильтруют, полученное промывают водой и затем высушивают в вакуумной сушильной камере при 50°C, получая 0,40 г белого порошка. 1H ЯМР: DMSO-d6 + трифторуксусная кислота (250 МГц): δ (ppm): 0,93 (3Н, t); 1,64 (2Н, m); 2,51 (3Н, s); 2,80 (2Н, t); 2,99 (3Н, s); 3,10-4,60 (7Н, m); 5,30-5,60 (2Н, m); 7,26 (1H, d); 7,48 (2Н, d); 7,52 (1H, d); 7,96 (2Н, d); 8,21 (1H, s); 8,22 (1H, s); 8,27 (1H, s).
МН+=605; tR=6,79 мин. (способ G)
ПРИМЕР 17: соединение №272
N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-{2-[4-метил-3-(метилкарбамоил)пиперазин-1-ил]-2-оксоэтил}-1H-индол-3-карбоксамид
29 мкл N-метилморфолина и затем 25 мкл этилхлорформата добавляют к 0,20 г соединения №271 в 2 мл THF при -10°C и полученное перемешивают в течение 2 ч., поддерживая температуру при -10°C. После добавления 159 мкл раствора 2М метиламина в THF полученному позволяют медленно вернуться к КТ и затем полученное перемешивают в течение 15 ч. Реакционную смесь выпаривают и затем твердый остаток очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH (градиент от 0 до 10% МеОН). Продукт растворяют в 5 мл смеси ацетон/MeOH (1/1: объем/объем). Затем добавляют 0,4 мл раствора 1М HCl в эфире. Полученное выпаривают до сухого состояния, твердый остаток растирают с ацетоном, полученное промывают МеОН и высушивают под вакуумом, получая 0,090 г белого порошка.
1H ЯМР: DMSO-d6 + трифторуксусная кислота (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,52 (3Н, s); 2,69 (2Н, s); 2,77-2,87 (6Н, m); 2,89-4,70 (7Н, m); 5,25-5,67 (2Н, m); 7,28 (1H, d); 7,45-7,59 (3Н, m); 7,96 (2Н, d); 8,23 (2Н, s); 8,30 (1H,d).
МН+=618; tR=6,63 мин. (способ G)
т.п.=274°C.
Ингибирование агрегации тромбоцитов in vitro (кровь крысы): 0,21 мкМ.
ПРИМЕР 18: соединение №273
N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-[2-оксо-2-(9-оксооктагидро-2Н-пиразино[1,2-a]пиразин-2-ил)этил]-1H-индол-3-карбоксамид гидрохлорид
0,34 г трет-бутил(2-оксоэтил)карбамата, 0,177 г цианоборгидрида натрия и затем 0,5 мл уксусной кислоты добавляют к 1 г соединения №212 в суспензии в 15 мл МеОН. После перемешивания при КТ в течение 20 ч. полученное выпаривают до сухого состояния и затем неочищенный продукт реакции очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH (градиент от 0 до 5% метанола). Полученный порошок растворяют в 2 мл трифторуксусной кислоты и затем полученное перемешивают при KT в течение 4 ч. Реакционную смесь вливают в 30 мл 2N раствора соды. Гетерогенную среду перемешивают в течение 15 мин. и затем экстрагируют EtOAc. Органическую фазу промывают водой, солевым раствором и затем выпаривают до сухого состояния. Твердый остаток очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH (градиент от 2 до 10% метанола). Продукт растворяют в 5 мл смеси ацетон/МеОН (1/1: объем/объем) и затем добавляют 1 мл 2N раствора HCl в эфире. Полученное выпаривают до сухого состояния, рекристаллизуют из ацетона в горячем состоянии и фильтруют, получая 0,38 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,52 (3Н, s); 2,80 (2Н, t); 3,20-4,90 (11H, m); 5,20-5,65 (2Н, m); 7,20-7,35 (1H, m); 7,49 (2Н, d); 7,56 (1H, d); 7,96 (2Н, d); 8,22 (1H, s); 8,23 (1H, s); 8,28 (1H, s).
МН+=616; tR=7,74 мин. (способ G)
т.п.=230°C.
Ингибирование агрегации тромбоцитов in vitro (кровь крысы): 0,29 мкМ
ПРИМЕР 19: соединение №274 SAR164737
N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-[2-(8-метил-9-оксооктагидро-2Н-пиразино[1,2-a]пиразин-2-ил)-2-оксоэтил]-1H-индол-3-карбоксамид гидрохлорид
0,23 г трет-бутилметил(2-оксоэтил)карбамата, 0,082 г цианоборгидрида натрия и затем 0,4 мл уксусной кислоты добавляют к 0,79 г соединения №212 в суспензии в 15 мл МеОН. После перемешивания при КТ в течение 20 ч. полученное выпаривают до сухого состояния и затем неочищенный продукт реакции очищают с помощью хроматографии с силикагелем, элюируя смесью DCM/MeOH (градиент от 0 до 5% метанола). Полученный порошок растворяют в 2 мл трифторуксусной кислоты и затем полученное перемешивают при КТ в течение 4 ч. Реакционную смесь вливают в 30 мл 2N раствора соды. Гетерогенную среду перемешивают в течение 15 мин. и затем экстрагируют EtOAc. Органическую фазу промывают водой, солевым раствором и затем выпаривают до сухого состояния. Твердый остаток очищают с помощью колоночной хроматографии с силикагелем, элюируя смесью DCM/MeOH (градиент от 2 до 10% метанола). Продукт растирают с изоэфиром и затем фильтруют, получая 0,48 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,64 (2Н, m); 2,07-3,54 (18Н, m); 3,97 (0,5Н, d); 4,16 (0,5Н, d); 4,25 (0,5Н, d); 4,72 (0,5Н, d); 5,27-5,56 (2Н, m); 7,22-7,29 (1H, m); 7,49 (2Н, d); 7,52-7,61 (1H, m); 7,95 (2Н, d); 8,19-8,22 (1H, m); 8,24 (1H, s); 8,27-8,31 (1H, m).
МН+=630; tR=7,96 мин. (способ G)
т.п.=220°C.
Ингибирование агрегации тромбоцитов in vitro (кровь крысы): 0,10 мкМ
ПРИМЕР 20: соединение №275
2-{4-[(3-{[4-(4-Бутирил-5-метил-1H-пиразол-1-ил)фенил]карбамоил}-5-хлор-1H-индол-1-ил)ацетил]пиперазин-1-ил}этилацетат гидрохлорид
0,27 мл триэтиламина и затем 0,14 мл ацетилхлорида добавляют к 0,40 г соединения №146 в 5 мл DCM при 0°C. После перемешивания при КТ в течение 1 ч. реакционную смесь промывают водой, солевым раствором и затем высушивают над Na2SO4 и выпаривают до сухого состояния. Твердый остаток очищают с помощью колоночной хроматографии с силикагелем, элюируя смесью DCM/MeOH (градиент от 4 до 10% МеОН). Продукт растворяют в 2 мл смеси ацетон/МеОН (1/1: объем/объем), добавляют 1,5 мл 1N раствора HCl в эфире и затем полученное вливают в 15 мл эфира. Образованный осадок фильтруют, получая 0,32 г белого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,63 (2Н, m); 2,10 (3Н, s); 2,52 (3Н, s); 2,82 (2Н, t); 3,02-3,32 (3Н, m); 3,45-3,75 (5Н, m); 4,15-4,45 (4Н, m); 5,36 (1H, d); 5,50 (1H, d); 7,28 (1H, d); 7,49 (2Н, d); 7,57 (1H, d); 7,98 (2Н, d); 8,22 (1H, s); 8,25 (1H, s); 8,32 (1H, s); 10,15 (1H, s); 11,10 (1H, br).
МН+=633; tR=6,26 мин. (способ G)
т.п.=160°C.
Ингибирование агрегации тромбоцитов in vitro (кровь крысы): 0,20 мкМ
ПРИМЕР 21: соединение №276
N-[4-(4-бутирил-5-метил-1H-пиразол-1-ил)фенил]-5-хлор-1-{2-оксо-2-[4-(2-оксопропил)пиперазин-1-ил]этил}-1H-индол-3-карбоксамид гидрохлорид
0,21 г K2CO3 и затем 0,057 мл хлорацетона добавляют к 0,25 г соединения №256 в 11 мл DMF. После перемешивания при КТ в течение 48 ч. добавляют 100 мл EtOAc, полученное промывают водой, солевым раствором, высушивают над Na2SO4 и затем выпаривают до сухого состояния. Твердый остаток очищают с помощью колоночной хроматографии с силикагелем, элюируя смесью DCM/MeOH (градиент от 0 до 5% МеОН). Продукт растворяют в 1 мл DCM, добавляют 0,5 мл 1N раствора HCl в эфире и затем полученное вливают в 15 мл эфира. Образованный осадок фильтруют, получая 0,073 г бежевого порошка.
1H ЯМР: DMSO-d6 (250 МГц): δ (ppm): 0,94 (3Н, t); 1,63 (2Н, m); 2,23 (3Н, s); 2,52 (3Н, s); 2,82 (2Н, t); 2,93-4,64 (10Н, m); 5,38 (1H, br); 5,47 (1H, br); 7,28 (1H, d); 7,50 (2Н, d); 7,57 (1H, d); 7,97 (2Н, d); 8,22 (1H, s); 8,25 (1H, s); 8,33 (1H, s); 10,21 (1H, s); 10,50 (1H, br).
МН+=603; tR=6,11 мин. (способ G)
т.п.=248°C.
Ингибирование агрегации тромбоцитов in vitro (кровь крысы): 0,22 мкМ Соединения согласно настоящему были предоставлены для фармакологических испытаний.
Ингибирование агрегации тромбоцитов in vitro (кровь человека)
Кровь берут у здоровых добровольцев, применяя 20-мл шприцы, содержащие 2 мл забуференного цитрата натрия. Кровь переносят в полипропиленовые пробирки и центрифугируют в течение 5 минут (100 g) при комнатной температуре (без применения торможения центрифуги). Обогащенную тромбоцитами плазму супернатанта (PRP) затем удаляют, разбавляют и подсчитывают тромбоциты перед их применением при измерениях агрегации.
Измерения агрегации тромбоцитов проводят при 37°C в стеклянных пробирках (агрегометр Chrono-Log - Kordia). 4 мкл исследуемого соединения (раствор в 100 раз более концентрированный, чем необходимая конечная концентрация, в DMSO) смешивают с 392 мкл свежей PRP и инкубируют в течение 1 минуты с перемешиванием. Затем 4 мкл раствора ADP в концентрации 250 мкМ добавляют к смеси. Измерения агрегации подвергают мониторингу в течение 6-8 минут, непрерывно перемешивая, путем записи изменений оптической плотности согласно способу G.V.R. BORN (Born Nature (1962) 194, 927).
Результаты рассчитывают с применением амплитуды агрегации, выраженной как высота, и выражают как процентное отношение ингибирования.
Соединения согласно настоящему изобретению имеют Cl50 (ингибирования агрегации тромбоцитов) от 0,1 до 2 мкМ.
Ингибирование агрегации тромбоцитов in vitro (кровь крысы)
Кровь берут у самцов крыс линии Спраг-Доули массой 250-300 г. Забор образца проводят в цитрат натрия в концентрации 3,8% (1 объем к 9 объемам крови) путем прокола брюшной аорты после осуществления анестезии животному в виде пентобарбитала натрия.
Обогащенную тромбоцитами плазму (PRP) получают путем центрифугирования крови при 300 g в течение 5 минут и измерения агрегации тромбоцитов проводят, как описано выше.
Результаты рассчитывают с применением площади под кривой поглощения, измеренного в течение 6 минут, и выражают как процентное отношение ингибирования.
Соединения согласно настоящему изобретению, для которых R3=NR7R8, имеют значения CI50 (ингибирования агрегации тромбоцитов) от 0,02 до 1,5 мкМ.
Соединения согласно настоящему изобретению, для которых R3=OH, имеют значения CI50 (ингибирования агрегации тромбоцитов)>1,5 мкМ.
Результаты, полученные для каждого соединения, показаны в таблицах X-XV.
Ингибирование агрегации тромбоцитов ex vivo (кровь крысы)
Самцов крыс линии Спраг-Доули массой 250-300 г применяют с нормой 6 животных на партию. Каждое исследуемое соединение разбавляют в растворе содержащей глюкозу воды (5% глюкозы), содержащей 5% кремофора и 3% гликофурола.
Соединения согласно настоящему изобретению вводят с помощью желудочного зонда (10 мл/кг при 1 мг/мл) за два часа перед забором образца или путем инфузии (1 мл/кг при 10 мг/мл) за два часа перед забором образца.
Забор образца проводят в цитрат натрия при концентрации 3,8% (1 объема к 9 объемам крови) путем прокола брюшной аорты после осуществления анестезии животного с помощью пентобарбитала натрия.
Обогащенную тромбоцитами плазму (PRP) получают путем центрифугирования крови при 300 g в течение 5 минут и проводят измерения агрегации тромбоцитов, как описано выше.
Результаты рассчитывают, применяя площадь под кривой поглощения, измеренного в течение 6 минут, и выражают как процентное отношение (%) ингибирования.
В ТАБЛИЦЕ XVI ниже показаны результаты, полученные для соединений 11, 28, 29, 105, 107, 115, 119, 133, 142, 145, 147, 166, 170, 177, 179, 180, 219, 262, 274 и 276:
|
|
Соединения настоящего изобретения представляют собой исключительно действующие начала, совместимые с их применением в качестве медицинских продуктов и/или фармацевтических композиций.
Согласно одному из этих аспектов настоящее изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли для получения медицинских продуктов, предназначенных для предупреждения или лечения любой патологии человека и/или для ветеринарного применения. Таким образом, соединения согласно настоящему изобретению могут применяться у людей или животных (в частности, у млекопитающих, включая, без ограничения, собак, кошек, лошадей, крупный рогатый скот, овец) для предупреждения или лечения заболеваний, в которые вовлечен рецептор P2Y12.
Следовательно, их назначают в качестве ингибиторов активации, агрегации и дегрануляции тромбоцитов, в качестве промоторов дезагрегации тромбоцитов и в качестве антитромботических средств. Их также назначают при лечении или предупреждении нестабильной стенокардии, чрескожной транслюминальной коронарной ангиопластики (РТСА), инфаркта миокарда, периферического тромболиза, тромботических артериальных осложнений атеросклероза, таких как эмболические или тромботические острые нарушения мозгового кровообращения, транзиторных ишемических атак, заболевания периферических кровеносных сосудов, инфаркта миокарда с тромболизом или без него, артериальных осложнений атеросклероза вследствие хирургических вмешательств, таких как ангиопластика, эндартерэктомия, размещение стентов, трансплантаты венечных сосудов сердца и другие трансплантаты, тромботических осложнений операции или механического повреждения, такие как восстановление тканей после травмы при несчастном случае или хирургической травмы, реконструктивной хирургии (включающая кожные и мышечные лоскуты), диссеминированного внутрисосудистого свертывания, тромботической тромбоцитопенической пурпуры, гемолитического и уремического синдрома, тромботических осложнений септической лихорадки, синдрома острой дыхательной недостаточности, антифосфолипидного синдрома, вызываемой гепарином тромбоцитопении и преэклампсии/эклампсии; или венозных тромбозов, таких как тромбоз глубоких вен, веноокклюзионная болезнь, гематологических состояний, таких как миелопролиферативное заболевание (включая тромбоцитемия), серповидноклеточная анемия; или предупреждении активации тромбоцитов, вызванной механически in vivo, например, в ходе сердечно-легочного шунтирования и экстракорпоральной оксигенации (в воде с получением микротромбоэмболий), предупреждении активации тромбоцитов, вызванной механически in vitro (применение при хранении продуктов крови - например, тромбоцитарные концентраты - применение в ходе наложения шунтов, такого как почечный диализ и плазмаферез), тромбоза, вторичного по отношению к повреждению/воспалению сосуда, такому как ангиит, артериит, гломерулонефрит, воспалительного заболевания кишечника и отторжения трансплантата органа, состояний, таких как мигрень, болезнь Рейно, состояний, при которых тромбоциты могут вносить свой вклад в процесс, лежащий в основе воспалительного заболевания в стенке сосуда, такого как образование/прогрессирование атероматозных бляшек, стеноз/рестеноз, и других воспалительных заболеваний, таких как астма, в которых тромбоциты и полученные из тромбоцитов факторы вовлечены в процесс иммунологического заболевания.
Применение соединений согласно настоящему изобретению для предупреждения и/или лечения упомянутых выше заболеваний, а также для получения лекарственных продуктов, предназначенных для лечения этих заболеваний, образует неотъемлемую часть настоящего изобретения.
Описанные выше соединения формулы (I) или их фармацевтически приемлемая соль могут применяться в ежедневных дозах от 0,01 до 100 мг на килограмм веса тела млекопитающего, подлежащего лечению, предпочтительно в ежедневных дозах от 0,1 до 50 мг/кг. У людей доза может варьировать предпочтительно от 0,1 до 4000 мг в день, более конкретно от 0,5 до 1000 мг в зависимости от возраста субъекта, подлежащего лечению, или типа лечения: профилактического или лечебного.
Таким образом, согласно другому из его аспектов настоящее изобретение относится к фармацевтическим композициям, содержащим, в качестве действующего вещества, соединение формулы (I) или его фармацевтически приемлемую соль, а также один или несколько фармацевтически приемлемых наполнителей.
В фармацевтических композициях по настоящему изобретению для введения пероральным, сублингвальным, ингаляционным, подкожным, внутримышечным, внутривенным, местным, локальным, интратрахеальным, интраназальным, трансдермальным, локальным или ректальным путем, действующие вещества могут быть введены животным и людям в единичных лекарственных формах, смешанных с общепринятыми фармацевтическими носителями.
Соответствующие единичные лекарственные формы содержат пероральные лекарственные формы, такие как таблетки, мягкие или твердые капсулы, порошки, гранулы, пероральные растворы или суспензии, формы для введения сублингвальным, буккальным, интратрахеальным, интраокулярным, интраназальным путем, с помощью ингаляции, аэрозолей, местные и трансдермальные лекарственные формы, имплантаты, формы для подкожного, внутримышечного и внутривенного введения и формы для ректального введения.
Для местного применения соединения согласно настоящему изобретению могут применяться в кремах, мазях, гелях или лосьонах.
В качестве примера единичная лекарственная форма соединения согласно настоящему изобретению в форме таблетки может содержать следующие компоненты:
|
В случае перорального пути доза активного вещества, введенного в день, может достигать 0,01-100 мг/кг, в одной или нескольких отдельных дозах, предпочтительно 0,02-50 мг/кг.
Могут иметь место частные случаи, в которых уместными являются более высокие или более низкие дозировки; то такие дозировки попадают в объем настоящего изобретения. Согласно общепринятой практике соответствующая дозировка для каждого пациента определяется врачом в зависимости от способа введения и веса, а также реакции указанного пациента.
Настоящее изобретение согласно другому из его аспектов относится к способу лечения упомянутых выше нарушений, который включает введение пациенту эффективной дозы соединения согласно настоящему изобретению или его фармацевтически приемлемой соли.
Соединения согласно настоящему изобретению могут применяться для получения композиций для применения в ветеринарии.
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/2f1eed982047cfc31e968e3aafd749e7.jpg)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/d5f7d8f1d493e312f0975119899bfee9.jpg)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/c3d83a595dba8d142e218dc33ebf5267.jpg)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/99b3e3414c3a3b2b97400b42f8745a19.png)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/f6d7b239b9ec2dd56a2067c9e1b4a642.jpg)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/02cf79e752b46e7a2985d0bd5a61cfe2.png)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/5bfc3970625f7ed823e9cab2abe27df2.png)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/a7f1d34ee3744258d7f9143b19b62da2.jpg)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/ba2fc614582bc6ea178790cdb014977f.jpg)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/f59950cd2121488a1439e2d8a9f7983d.png)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/7a968c31db08f9f781f662351f5c1521.png)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/6de7a5b41f3e3c5d6ac5a2b7299df879.png)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/e951e2cebe87a913d3a9270461319c0a.jpg)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/490128f09df5ed9078dbae277c763da1.jpg)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/9e9961e55fa28dce446903b741fb5bf9.png)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/6411f1ff2d9e0efd7399c0b615c37497.png)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/d433c0b1de3092d955dffccdda7eda4b.png)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/c734768eefd935896b8647135a637f4c.jpg)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/71694185e35ccdf672be40ec7e3346ec.jpg)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/aae46e49524bd05727bf649965825b31.png)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/cc2b9a51e7794bc778e137a878d14948.png)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/5faa8d98403b019035c7c20cb34865ef.png)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/01011f1db571568730abcaf3ef36f286.jpg)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/d0c5368c8809db2d9ecb718ba1b02e4a.png)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/19f22f1a2d2e226e4f6d81af8f64ebc4.jpg)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/cabde6657bdaa99d4e50591839ad01e2.png)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/9363c04e0e5f6c926892c6b3b895ab15.jpg)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/6108214e6eef9eeb3f5ea2c3b8a9aa2d.png)
![ПРОИЗВОДНЫЕ N-[(1Н-ПИРАЗОЛ-1-ИЛ) АРИЛ]-1Н-ИНДОЛА ИЛИ 1Н-ИНДАЗОЛ-3-КАРБОКСАМИДА, ИХ ПОЛУЧЕНИЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ АНТАГОНИСТОВ P2Y12](https://fips.edrid.ru/images/rid/88/71/97/5458ee6da14adbc5ba457d1189911197.png)

