Результат интеллектуальной деятельности: КРИСТАЛЛИЧЕСКАЯ ФОРМА ОРГАНИЧЕСКОГО СОЕДИНЕНИЯ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к кристаллической форме 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1 -илметил]-бензонитрила, к способу получения указанной кристаллической формы и к применению указанной кристаллической формы для приготовления фармацевтической композиции.
УРОВЕНЬ ТЕХНИКИ
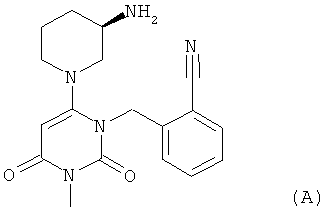
Алоглиптин, или 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрил, описывается общей формулой (А), приведенной ниже, и является ингибитором DPP-IV, в настоящее время разрабатываемым для применения для лечения патологического состояния, при котором обладает активностью ингибитор DPP-IV, например, для лечения диабета, как это описано в публикации Jun Feng, Zhiyuan Zhang, Michael В. Wallace, Stephen L. Gwaltney et al. в J.Med. Chem. 2007, 50, 2297 Пили Drugs of the Future 2008, 33,1 ff. Продающейся формой является бензоат 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, т.е. 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-илметил]-бензонитрилбензоат
Получение алоглиптина раскрыто, например, в WO 2005/095381 и WO 2007/035629. В WO 2007/035372 раскрыта аморфная форма и кристаллическая полиморфная форма алоглиптинбензоата. Согласно WO 2005/095381 из реакционной смеси получают почти белый порошок, который предположительно представляет собой соль с ТФК (трифторуксусная кислота) 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила.
Кристаллическая форма 2-[6-[3(К)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила не описана в цитированной литературе.
Полиморфизм представляет собой явление, относящееся к существованию различных кристаллических форм одной молекулы. Могут существовать несколько разных кристаллических форм одной молекулы с разными кристаллическими структурами и физическими характеристиками, такими как температура плавления, спектр ПРРГ и ИК-спектр. Таким образом, эти полиморфные формы являются разными твердыми формами, которые описываются молекулярной формулой соединения, из которого образованы кристаллы, однако они могут обладать разными полезными физическими характеристиками, которые могут оказывать прямое влияние на возможность обрабатывать и/или получать лекарственное вещество, такими как, например, сыпучесть, и на лекарственный препарат, такими как, например, сыпучесть, а также на стабильность лекарственного препарата, его характеристики растворения и биологическую доступность.
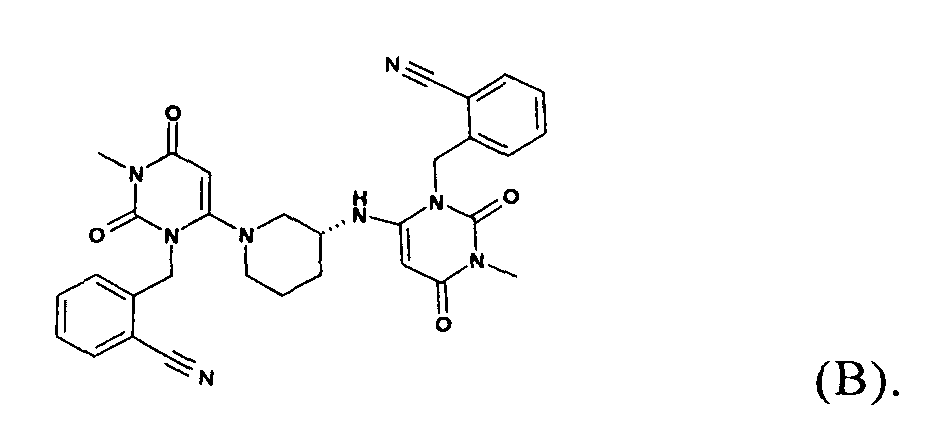
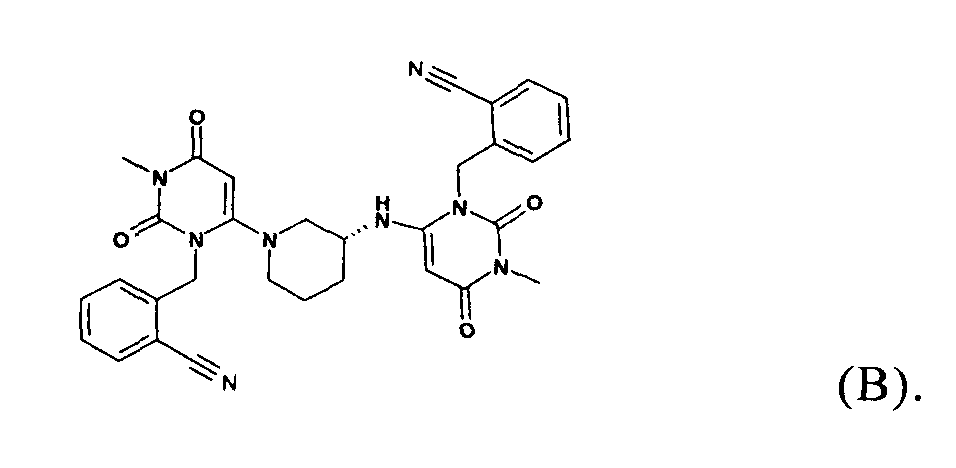
В соответствии с уровнем техники, например, по данным WO 2007/035629, 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрил предпочтительно выделяют в виде соли присоединения с кислотой после синтеза по методике, в которой в качестве исходного вещества используют 2-(6-хлор-3-метил-2,4-диоксо-3,4-дигидро-2-Н-пиримидин-1-илметил)бензонитрил и (R)-3-аминопиперидиндигидрохлорид, например, в виде гидрохлорида, бензоата, трифторацетата или тозилата. Описанные методики получения обычно приводят к образованию димерного побочного продукта общей формулы (В), который трудно удалить из искомого продукта
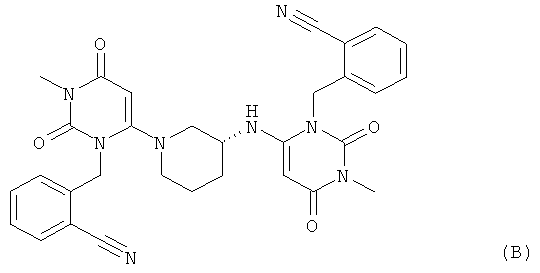
Поэтому необходимы улучшенные способы получения 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрил солей присоединения с кислотами, в частности, способы, с помощью которых эффективно удаляется димерный побочный продукт общей формулы (В) и которые одновременно пригодны для крупномасштабного производства при низкой стоимости.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к кристаллической форме алоглиптина в форме свободного основания.
В одном варианте осуществления настоящее изобретение относится к кристаллической форме 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила.
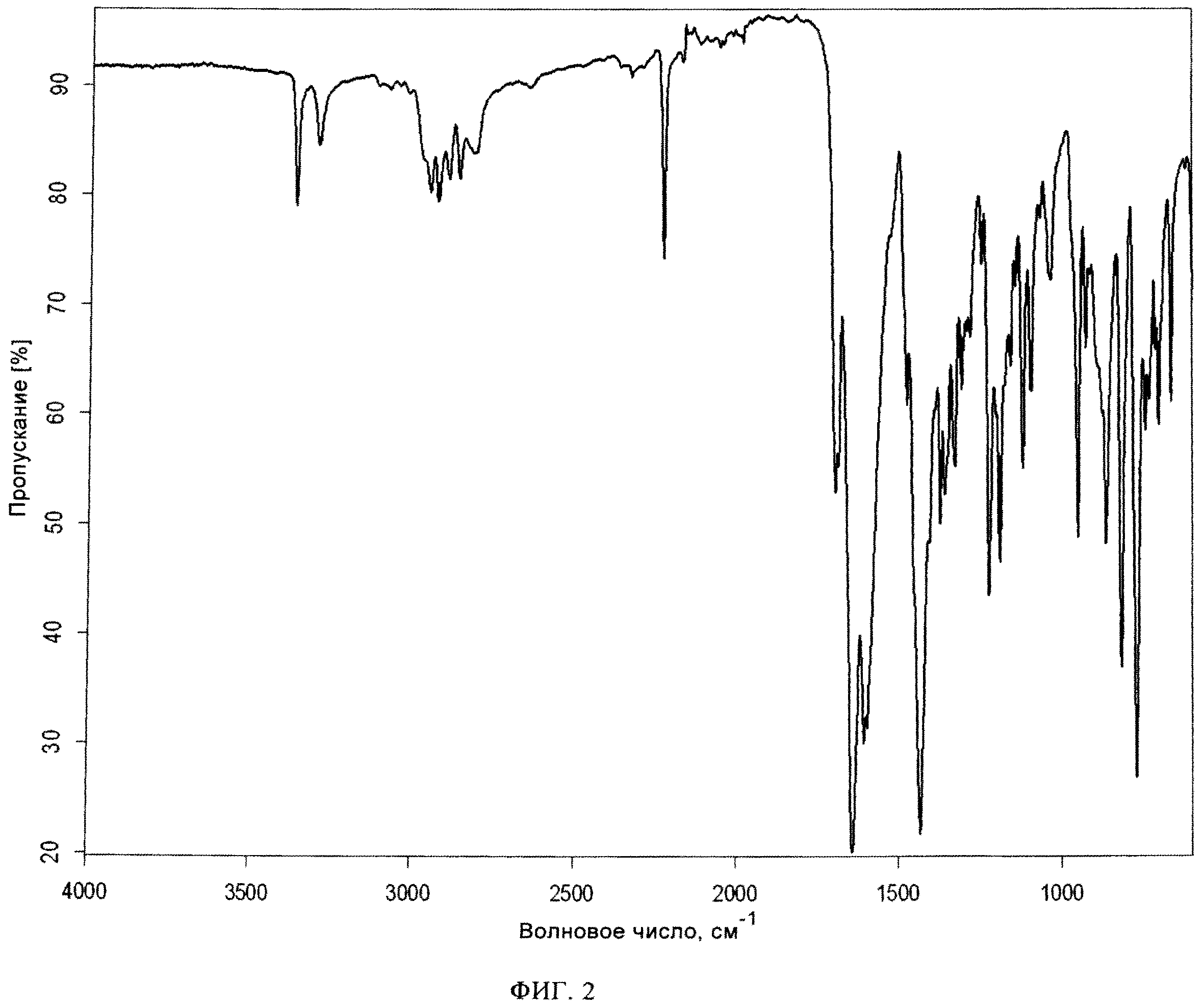
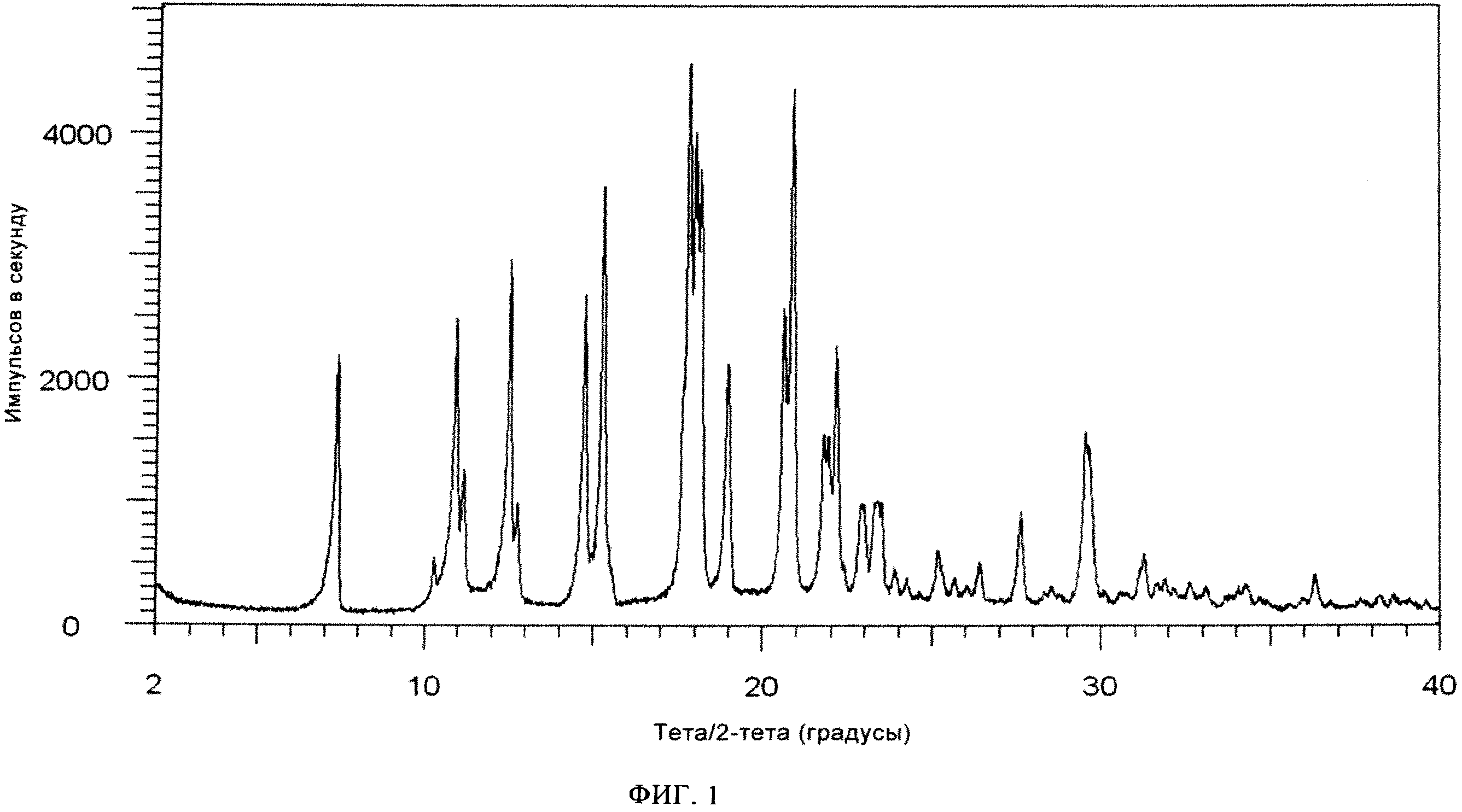
В предпочтительном варианте осуществления настоящее изобретение относится к кристаллическому 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрилу, на порошковой рентгенограмме которого содержатся пики при 2-тета, равных 10,9°±0,2°, 12,5°±0,2°, 18,0°±0,2°, 19,0°±0,2°, 21,8°±0,2° и/или в инфракрасном спектре которого содержатся пики при 3358,7 +/-2 см-1, 2223,7 +/-2 см-1, 1642,2 +/-2 см-1, 1433,4 +/-2 см-1, 818,4 +/-2 см-1 и 771,2 +/-2 см-1.
В другом варианте осуществления настоящее изобретение относится к способу получения кристаллического 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, включающему стадии:
a) приготовление раствора 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила в подходящем хлорированном углеводороде, в котором концентрация 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила является достаточно высокой, чтобы обеспечить кристаллизацию 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила;
b) добавление простого эфира, алифатического или ароматического углеводорода в качестве антирастворителя в количестве, достаточном, или со скоростью, подходящей для обеспечения кристаллизации 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила из раствора, полученного на стадии а); и
c) выделение кристаллической формы 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила.
Кроме того, настоящее изобретение относится к применению кристаллической формы 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила по любому из пунктов 1-6 формулы изобретения для приготовления соли присоединения с кислотой 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, содержащей менее чем 0,1% димерной примеси общей формулы (В).
В другом варианте осуществления настоящее изобретение относится к 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрилбензоату, содержащему менее чем 0,1% димерной примеси общей формулы (В).
Другие объекты, особенности, преимущества и аспекты настоящего изобретения станут понятными специалистам в данной области техники из последующего описания. Однако следует понимать, что описание и последующие конкретные примеры с указанием предпочтительных вариантов осуществления настоящего изобретения приведены только для иллюстрации. Их описания и других частей настоящего раскрытия для специалистов в данной области техники должны быть очевидны различные изменения и модификации, входящие в объем раскрытого изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1: Порошковая рентгенограмма кристаллического свободного основания алоглиптина, (2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила), полученного в примере 1.
Фиг. 2: Инфракрасный спектр кристаллического свободного основания алоглиптина, (2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила), полученного в примере 1.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрилу в кристаллическом виде.
Согласно изобретению неожиданно было открыто и идентифицировано кристаллическое свободное основание алоглиптина и установлено, что оно стабильно при хранении и что существует весьма подходящая методика удаления некоторых примесей из алоглиптина. Эти характеристики являются важными и благоприятными для предполагаемого применения солей присоединения свободного основания алоглиптина в фармацевтических препаратах и для их производства в промышленном масштабе.
Алоглиптин, или 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрил, описывается общей формулой (А):

Настоящее изобретение относится к кристаллическому 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1 илметил]-бензонитрилу, в частности, для которого кристаллическая форма является безводной формой.
В контексте настоящего изобретения, "безводная форма", в частности, означает форму, содержащую менее чем 1,6% воды при хранении при 25°С и 90% относительной влажности. Поэтому в другом варианте осуществления настоящее изобретение относится к кристаллической форме 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, раскрытой выше, и эта кристаллическая форма является безводной формой, содержащей менее чем 1,6% воды, при хранении при 25°С и 90% относительной влажности.
Согласно изобретению неожиданно было установлено, что кристаллическая форма 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, предлагаемая в настоящем изобретении, обладает низкой гигроскопичностью, например, является негигроскопичной и является весьма подходящей для хранения. Установлено, что при хранении можно избежать образования нежелательных побочных продуктов или продуктов разложения, которые, если не ограничиваться какой-либо теорией, предположительно частично образуются при поступлении воды.
Кристаллическая форма 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, предлагаемая в настоящем изобретении, обладает низкой гигроскопичностью, например, наблюдается поглощение воды при хранении примерно при 25°С в течение 60 мин при относительной влажности, равной 50%, составляющее лишь примерно 0,4% мас./мас., обнаружено поступление воды, составляющее лишь примерно 1,6% мас./мас. при хранении кристаллического основания примерно при 90% относительной влажности примерно при 25°С в течение 60 мин. В этих экспериментах влажность увеличивали/уменьшали ступенчато. Начиная с равной 0% относительной влажности, каждый час влажность увеличивали на 10% относительной влажности. Увеличение/уменьшение массы регистрировали непрерывно. Приведены значения, полученные в конце 1 ч хранения при указанной относительной влажности.
Эта вода легко теряется, например, при хранении при относительной влажности, равной 60% или менее. При выдерживании 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила при чрезвычайно высокой относительной влажности не наблюдали ни изменения кристаллической структуры, ни образования гидратированной формы.
Таким образом, кристаллическое свободное основание алоглиптина, предлагаемое в настоящем изобретении, дает возможность выделить соединение общей формулы (А) технически очень благоприятным образом и само является формой, подходящей для хранения и транспортировки. Поэтому настоящее изобретение также относится к применению кристаллического свободного основания алоглиптина, предлагаемого в настоящем изобретении, в качестве предназначенной для хранения и транспортировки формы алоглиптина.
Настоящее изобретение также относится к контейнеру для хранения, заполненному партиями промышленного масштаба кристаллического свободного основания алоглиптина, предлагаемого в настоящем изобретении. В контексте настоящего изобретения любой подходящий контейнер для хранения можно использовать, например коробки или мешки. Партии промышленного масштаба могут составлять от 1 г до 100 кг, предпочтительно от 5 г до 50 кг, более предпочтительно от 10 г до 20 кг кристаллического свободного основания алоглиптина, предлагаемого в настоящем изобретении. Поэтому настоящее изобретение также относится к мешкам для хранения, заполненным партиями промышленного масштаба кристаллического свободного основания алоглиптина, предлагаемого в настоящем изобретении, например пластмассовым или алюминиевым мешкам, содержащим от 5 г до 50 кг, предпочтительно от 10 г до 20 кг кристаллического свободного основания алоглиптина, предлагаемого в настоящем изобретении. Настоящее изобретение также относится к поддону для хранения, например европоддону, на который помещены контейнеры для хранения, предпочтительно мешки для хранения, предлагаемые в настоящем изобретении.
Кристаллическое свободное основание алоглиптина, предлагаемое в настоящем изобретении, является сыпучим и легко отделяется, например, фильтрованием. По данным исследования с помощью микроскопа большая часть кристаллов обладает размером, равным примерно от 4 до 30 мкм, например, примерно от 10 до 30 мкм.
Другим преимуществом настоящего изобретения является то, что выделение основного промежуточного продукта общей формулы (А) представляет собой более простой способ получения обладающего высокой чистотой 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила или его соли присоединения с кислотой, такой как бензоат, чем способ предшествующего уровня техники, в котором сначала получают соль, например гидрохлорид, обладающий корродирующей способностью, или, например трифторацетат, - химическое вещество, неприемлемое с точки зрения охраны окружающей среды, затем первую выделенную соль превращают в конечную соль, предназначенную для использования в качестве лекарственного средства, и то, что в этом способе получения не требуется использования процедур, которые являются трудоемкими для применения в промышленном масштабе, таких как колоночная хроматография.
Кроме того, кристаллический 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрил является химически стабильным, например, при температуре окружающей среды или более низкой, например, образцы, хранившиеся в течение 4 месяцев при температуре окружающей среды, по данным исследования, например с помощью ВЭЖХ (высокоэффективная жидкостная хроматография), не подвергаются разложению.
Новое кристаллическое свободное основание алоглиптина, предлагаемое в настоящем изобретении, можно охарактеризовать, например, типичной порошковой рентгенограммой, инфракрасным спектром или температурой плавления. Каждая из этих характеристик сама по себе достаточна для однозначного определения и идентификации кристаллической формы свободного основания алоглиптина, но их также можно сочетать друг с другом.
Поэтому в другом варианте осуществления настоящее изобретение относится к кристаллической форме 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, раскрытой выше, на порошковой рентгенограмме которой содержатся пики при 2-тета, равных 10,9°±0,2°, 12,5°±0,2°, 18,0°±0,2°, 19,0°±0,2°, 21,8°±0,2°.
Порошковая рентгенограмма предпочтительной кристаллической формы 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила приведена на фиг.1.
В другом варианте осуществления настоящее изобретение относится к кристаллической форме 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, раскрытой выше, в инфракрасном спектре которой содержатся пики при 3358,7 +/-2 см-1, 2223,7 +/-2 см-1, 1642,2 +/-2 см-1, 1433,4 +/-2 см-1, 818,4 +/-2 см-1 и 771,2 +/-2 см-1.
Инфракрасный спектр кристаллической формы 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила приведен на фиг.2.
Предпочтительный кристаллический 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрил можно дополнительно охарактеризовать температурой плавления, равной 127,5°С±2°С по данным измерения с помощью прибора Buchi-545 в автоматическом режиме с порогом пропускания 40% при скорости нагревания, равной 1,0°С/мин, проведенного в режиме, указанном в Фармакопее.
В предпочтительном варианте осуществления настоящее изобретение относится к кристаллическому 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрилу, обладающему степенью кристалличности, равной не менее 75%, предпочтительно не менее 80%.
Кристаллизация 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила дает возможность выделить из реакционной смеси соединение формулы (А) высокой чистоты.
Кристаллическая форма свободного основания алоглиптина, предлагаемая в настоящем изобретении, обладает тем дополнительным преимуществом, что ее можно получить с высокой чистотой. Поэтому в другом варианте осуществления настоящее изобретение относится к кристаллической форме 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, предлагаемой в настоящем изобретении, содержащей менее чем 1% общего количества примесей (% площади), предпочтительно от 0,05 до 0,5% площади общего количества примесей, предпочтительно от 0,06 до 0,2% площади общего количества примесей по данным исследования с помощью ВЭЖХ, проведенного технически обоснованным образом, предпочтительно по методике, раскрытой в экспериментальной части и раскрытой в исследовании стабильности и чистоты.
Поэтому в другом варианте осуществления настоящее изобретение относится к кристаллической форме 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, раскрытой выше, в которой соединение содержит менее чем 1% общего количества примесей.
В частности, установлено, что в контексте настоящего изобретения можно легко отделить димерные побочные продукты общей формулы (В). Таким образом, в другом варианте осуществления настоящее изобретение относится к кристаллической форме 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, раскрытой выше, в которой соединение содержит менее чем 0,5% площади димерной примеси общей формулы (В), более предпочтительно от 0,001 до 0,2% площади димерной примеси общей формулы (В), предпочтительно от 0,002 до 0,1% площади димерной примеси общей формулы (В), предпочтительно от 0,005 до 0,07% площади димерной примеси общей формулы (В) по данным исследования с помощью ВЭЖХ по методике, раскрытой в экспериментальной части (исследование стабильности и чистоты).
Поэтому в другом варианте осуществления настоящее изобретение относится к кристаллической форме 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, раскрытой выше, в которой соединение содержит менее чем 0,5% димерной примеси общей формулы (В).
В другом предпочтительном варианте осуществления кристаллическая форма свободного основания алоглиптина, предлагаемая в настоящем изобретении, в основном не содержит димерной примеси общей формулы (В).
Кроме того, кристаллическая форма свободного основания алоглиптина, предлагаемая в настоящем изобретении, обладает тем дополнительным преимуществом, что ее можно использовать для получения 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила или его соли присоединения с кислотой, такой как бензоат, содержащей менее чем 0,5% площади димерной примеси общей формулы (В), более предпочтительно от 0,001 до 0,2% площади димерной примеси общей формулы (В), предпочтительно от 0,002 до 0,1% площади димерной примеси общей формулы (В), предпочтительно от 0,005 до 0,1% площади димерной примеси общей формулы (В) по данным исследования с помощью ВЭЖХ. В другом предпочтительном варианте осуществления 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрил или его соль присоединения с кислотой, такая как бензоат, предлагаемая в настоящем изобретении, обладает указанными выше содержаниями димерной примеси общей формулы (В) и предпочтительно в основном не содержит димерной примеси общей формулы (В).
Таким образом, в одном варианте осуществления настоящее изобретение относится к применению кристаллической формы 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, предлагаемой в настоящем изобретении, для приготовления соли присоединения с кислотой 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, содержащей менее чем 0,1% димерной примеси общей формулы (В).
Настоящее изобретение также относится к способу получения кристаллической формы алоглиптина, предлагаемой в настоящем изобретении. В контексте настоящего изобретения кристаллическую форму алоглиптина можно получить способом, включающим кристаллизацию свободного основания алоглиптина из подходящего растворителя.
Таким образом, настоящее изобретение относится к способу получения кристаллического 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, включающему стадии:
а) приготовление раствора 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила в хлорированном углеводороде, предпочтительно, в котором концентрация 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила является достаточно высокой, чтобы обеспечить кристаллизацию 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила;
b) добавление простого эфира, например, симметричного или несимметричного С2-С6-алкилового эфира, предпочтительно простого эфира, выбранного из группы, включающей диизопропиловый эфир, диметиловый эфир и метил-трет-бутиловый эфир или алифатический углеводород, предпочтительно пентан, гексан или гептан в качестве антирастворителя в количестве, достаточном, или со скоростью, подходящей для обеспечения кристаллизации 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила из раствора, полученного на стадии а); и
c) выделение кристаллической формы 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила.
В частности, настоящее изобретение относится к способу получения кристаллического 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, включающему стадии:
a) приготовление раствора 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила в подходящем хлорированном углеводороде, в котором концентрация 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила является достаточно высокой, чтобы обеспечить кристаллизацию 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила;
b) добавление простого эфира, алифатического или ароматического углеводорода в качестве антирастворителя в количестве, достаточном, или со скоростью, подходящей для обеспечения кристаллизации 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила из раствора, полученного на стадии а); и
c) выделение кристаллической формы 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила.
Способ, предлагаемый в настоящем изобретении, включает стадии а), b) и с).
На стадии а) готовят раствор 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила в хлорированном углеводороде, предпочтительно дихлорметане.
В контексте настоящего изобретения в качестве растворителя можно использовать любой подходящий хлорированный углеводород, предпочтительно дихлорметан. На стадии b) добавляют подходящий антирастворитель, выбранный из числа простых эфиров и алифатических или ароматических углеводородов. В контексте настоящего изобретения можно использовать любой подходящий простой эфир или алифатический или ароматический углеводород.
Раствор 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила можно получить экстракцией водного раствора или раствора соединения общей формулы (А) в смеси воды и органического растворителя, образовавшегося, например, из реакционной смеси, например, по реакции 2-(6-хлор-3-метил-2,4-диоксо-3,4-дигидро-2-Н-пиримидин-1-илметил)бензонитрила и (R)-3-аминопиперидина или его соли с хлорированным углеводородом, предпочтительно дихлорметаном.
В предпочтительном варианте осуществления 2-(6-хлор-3-метил-2,4-диоксо-3,4-дигидро-2-Н-пиримидин-1-илметил)бензонитрил и (R)-3-аминопиперидин или его соль, например (R)-3-аминопиперидиндигидрохлорид, вводят в реакцию в смеси С1-С4-спирта и воды, предпочтительно изопропанола и воды, наиболее предпочтительно в соотношении, составляющем примерно от 10:1 (об./об.) до 2:1 (об./об.), предпочтительно в соотношении, составляющем примерно от 3:1 (об./об.) до 5:1 (об./об.), более предпочтительно составляющем примерно 4:1 (об./об.) в присутствии основания, предпочтительно карбоната щелочного металла или бикарбоната щелочного металла, например, NaHCO3 или Na2CO.
Предпочтительно, если затем реакционную смесь концентрируют в вакууме и щелочную смесь подвергают распределению в смеси воды и хлорированного углеводорода, предпочтительно дихлорметана. Затем смесь предпочтительно фильтруют и слои разделяют. Водный щелочной слой необязательно дополнительно экстрагируют хлорированным углеводородом, предпочтительно дихлорметаном. Продукт, содержащий органическую фазу, необязательно сушат с помощью осушающего агента. Органическую фазу предпочтительно фильтруют для удаления возможно содержащегося нерастворимого вещества или осушающих агентов и затем концентрируют. Стадию концентрирования проводят до обеспечения концентрации 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, которая является достаточной для обеспечения кристаллизации, например остаток, содержащий примерно не менее 50% (мас./мас.) продукта, является предпочтительным, предпочтительно, если остаток содержит от 70 до 90% (мас./мас.) продукта.
Альтернативно раствор 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила можно получить растворением маслообразного или твердого соединения общей формулы (А) в хлорированном углеводороде, предпочтительно дихлорметане.
Затем к раствору медленно добавляют антирастворитель простой эфир, предпочтительно симметричный или несимметричный С3-С6-алкиловый эфир, например диизопропиловый эфир, диметиловый эфир, метил-трет-бутиловый эфир или антирастворитель алифатический углеводород, предпочтительно линейный алифатический углеводород, например пентан, гексан или гептан или их смеси, со скоростью, обеспечивающей кристаллизацию 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, при перемешивании, предпочтительно по каплям, добавление с постоянной скоростью проводят в течение от 5 мин до нескольких часов, предпочтительно в течение примерно от 15 мин до 1 ч. Предпочтительными системами растворитель/антирастворитель являются дихлорметан в качестве растворителя и диизопропиловый эфир, метил-трет-бутиловый эфир, или гексан, или гептан, или их смеси в качестве антирастворителей. Раствор, содержащий 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрил, можно высушить перед стадией кристаллизации, однако проведение стадии сушки не является критически важным. Подходящим раствором 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила для кристаллизации с высоким выходом является, например раствор, содержащий не менее 20% (мас./мас.) продукта, например, при концентрации, равной не менее 50% (мас./мас.) продукта, например содержание от 70 до 90% продукта является предпочтительным.
В контексте настоящего изобретения подходящие растворители включают галогенированные углеводороды, такие как дихлорметан.
На стадии b) способа, предлагаемого в настоящем изобретении, 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрил кристаллизуют из раствора.
Температура кристаллизации не является критически важной, например можно использовать температуры примерно от 0°С до температуры кипения растворителя или смеси растворителей.
Затем кристаллизацию можно инициировать путем охлаждения раствора. В методике кристаллизации можно использовать затравочные кристаллы. Методику охлаждения можно провести путем охлаждения раствора или суспензии, предпочтительно до температуры, равной от примерно -20 до примерно 10°С, более предпочтительно до температуры, равной от примерно -20 до примерно 0°С. Охлаждение предпочтительно проводить медленно, например, в течение нескольких часов или, например, в течение примерно от 10 до 120 мин.
В другом варианте осуществления кристаллизацию можно инициировать путем добавления антирастворителя, раскрытого выше, например, простого эфира, например, симметричного или несимметричного С3-С6-алкилового эфира, например, диизопропилового эфира, диметилового эфира, метил-трет-бутилового эфира или гексана или гептана. Для инициирования кристаллизации необязательно можно добавить затравочные кристаллы.
Количество использующегося антирастворителя составляет примерно от 2 до 100 объемов содержащегося растворителя, предпочтительно составляет 5 до 20 объемов содержащегося растворителя.
Антирастворитель предпочтительно добавлять к концентрированному раствору при температуре от примерно температуры окружающей среды до примерно 40°С, например, от примерно 15 до 40°С при перемешивании. После добавления антирастворителя для завершения кристаллизации смесь можно охладить, например, до температуры, равной примерно от 5 до -20°С, например, примерно от 5 до 0°С в бане со льдом. К суспензии, содержащей кристаллический продукт, необязательно можно добавить дополнительный антирастворитель.
Поэтому, в одном варианте осуществления настоящее изобретение относится к способу получения кристаллического 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, раскрытого выше, в котором стадия b) включает добавление антирастворителя к раствору для осуществления кристаллизации.
В другом варианте осуществления настоящее изобретение относится к способу получения кристаллического 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, раскрытого выше, в котором антирастворитель выбран из группы, включающей простые эфиры и алифатические углеводороды.
Поэтому в другом варианте осуществления настоящее изобретение относится к способу получения кристаллического 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила, раскрытого выше, в котором простой эфир выбран из группы, включающей симметричный или несимметричный С2-С6-алкиловый эфир, и алифатический углеводород представляет собой пентан или гексан.
В контексте настоящего изобретения также можно объединить указанные выше методики инициирования кристаллизации.
На стадии с) выделяют кристаллическую форму 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрил.
В контексте настоящего изобретения кристаллический продукт можно выделить по обычным методикам, например, фильтрованием с отсасыванием. Кристаллический продукт можно высушить по обычным методикам, например, путем сушки на воздухе, сушки в токе азота или вакуумной сушки.
Способ, предлагаемый в настоящем изобретении, также может включать дополнительные стадии.
2-[6-[3(R)-Аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрил высокой чистоты по известным методикам можно легко превратить в искомую соль присоединения с кислотой, например, в искомую фармацевтически приемлемую соль, например в бензоат.
Таким образом, в другом варианте осуществления настоящее изобретение относится к применению кристаллической формы 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила для приготовления соли присоединения 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила.
В другом варианте осуществления настоящее изобретение относится к применению кристаллической формы 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрила для приготовления фармацевтической композиции.
Путем использования кристаллической формы свободного основания алоглиптина, предлагаемой в настоящем изобретении, можно получить соли присоединения, например, бензоат алоглиптина, содержащие лишь небольшие количества примесей, предпочтительно лишь небольшие количества димерных примесей общей формулы (В).
Таким образом, настоящее изобретение также относится к 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрилбензоату, по данным исследования с помощью ВЭЖХ, содержащему менее чем 0,1% площади димерной примеси общей формулы (В), например менее чем 0,05% площади, например менее чем 0,02%, предпочтительно от 0,001 до 0,2% площади димерной примеси общей формулы (В), предпочтительно от 0,002 до 0,1% площади димерной примеси общей формулы (В), предпочтительно от 0,005 до 0,1% площади, от 0,005 до 0,08% площади, от 0,005 до 0,06% площади, от 0,005 до 0,04% площади димерной примеси общей формулы (В).
Таким образом, настоящее изобретение относится к 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1 -илметил]-бензонитрилбензоату, содержащей менее чем 0,1% димерной примеси общей формулы (В).
Кроме того, настоящее изобретение относится к фармацевтической композиции, включающей кристаллическую форму 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-1-илметил]-бензонитрил, предпочтительно предназначенной для лечения диабета.
Настоящее изобретение дополнительно иллюстрируется приведенными ниже примерами.
ПРИМЕРЫ
Порошковые рентгенограммы (ПРРГ) снимали на рентгеновском порошковом дифрактометре D-8 (AXS-BRUKER):
Тета-тета-гониометр, устройство замены образцов
Мишень: медь, Kα1+Кα2λ=1,5406 А
Оптическая система с параллельными пучками (ширина приемной щели Соллера: 0,07 мм)
Сцинтилляционный счетчик, стандартный держатель образца
Накопление данных: 40 кВ, 40 мА, 2-40° тета/2-тета, шаги 0,01, 2 с
Внешние стандарты межплоскостных расстояний
NIST SRM 640A (порошкообразный кремний)
Степень кристалличности в % полученного продукта определяли по данным порошковых рентгенограмм. Степень кристалличности в % рассчитывали по формуле:
Степень кристалличности в %=100*Е/(Е+F),
где Е = площадь пика, полученная интегрированием пиков рентгенограммы, характеризующая количество кристаллического вещества;
F = площадь между пиками и фоном, характеризующая количество некристаллического вещества.
Расчеты площади проводили в диапазоне 5-40° 2-тета. Наименьшее значение интенсивности, полученное в этом диапазоне, определяли, как постоянное фоновое значение, и прямоугольник с участком "постоянное фоновое значение" *35 (1° 2-тета приведен в качестве числового значения, равного 1, для расчета площади) вычитали из площади F для диапазона от 5 до 40° 2-тета.
Инфракрасный спектр (ИК) снимали в кювете MKII Golden Gate™ Single Reflection Diamond ATR (ослабленное полное внутреннее отражение) на спектрометре Bruker Tensor 27 FTIR с разрешением 4 см-1 при нормальных условиях. Для получения спектра количество порошкообразного образца, находящегося на кончике шпателя, наносили на поверхность алмаза. Затем образец прижимали к алмазу сапфировым стержнем и снимали спектр. Спектр чистого алмаза использовали в качестве фонового спектра. Типичная точность по значениям волнового числа составляла примерно ±2 см-1. Таким образом, для большинства инфракрасных спектрометров при стандартных условиях инфракрасный пик, который находится при 1716 см-1, может находиться в диапазоне от 1714 до 1718 см-1.
Пример 1
2-[6-[3(R)-Аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-с1-илметил]-бензонитрил
Смесь (R)-3-аминопиперидин×2HCl (0,70 г, 4,0 ммоля) и NaHCO3 (1,70 г, 20,2 ммоля) и Н2О (1 мл) перемешивали в течение 5 мин. Затем к водной смеси добавляли 2-пропанол (4 мл) и 6-хлор-2-(2-цианобензил)-3-метилурацил (0,93 г, 3,4 ммоля). Затем смесь перемешивали при температуре бани, равной примерно 70°С, в течение 40 ч. Затем большую часть 2-пропанола удаляли из реакционной смеси путем отгонки в вакууме. К остатку добавляли CH2Cl2 (25 мл) и Н2О (15 мл). Слои разделяли и водный слой экстрагировали с помощью CH2Cl2 (15 мл). Объединенные органические слои дважды экстрагировали 1М хлористоводородной кислотой (25 и 10 мл). Кислую водную фазу промывали с помощью CH2Cl2 (5 мл), значение рН устанавливали равным примерно 7,5 путем добавления твердого NaHCO3 при перемешивании. Затем водный раствор дважды экстрагировали с помощью CH2Cl2 (25 и 15 мл). Органический слой сушили над безводным MgSO4, фильтровали и концентрировали до объема, равного примерно 2 мл. К остатку при перемешивании в течение примерно 30 мин добавляли диэтиловый эфир (5 мл) и смесь перемешивали при температуре окружающей среды (примерно 22°С) в течение еще 4 ч. Кристаллы выделяли фильтрованием и сушили в вакууме в течение ночи. Выход: 0,80 г.
1Н ЯМР (CDCl3, 300 МГц): δ 1,21 (m, 1Н), 1,40 (br s, 2H), 1,62 (m, 1H), 1,76 (m, 1H), 1,93 (m, 1H), 2,38 (t, 1H), 2,59 (t, 1H), 2,91 (m, 2H), 3,02 (m, 1H), 3,31 (s, 3H), 5,29 (AB, J=16 Гц, 2H), 5,37 (s, 1H), 7,13 (d, J=8 Гц, 1H), 7,37 (t, J=S Гц, 1H), 7,55 (Td, J=S Гц, J=4 Гц, 1H), 7,67 (Dd, J=8 Гц, J=1 Гц, 1H) част./млн.
Чистота по данным исследования с помощью ВЭЖХ: 99,8% димерной примеси общей формулы (В): 0,06% площади (условия проведения ВЭЖХ указаны в разделе Исследование стабильности и чистоты).
% Указывает количество % площади (площадь пика примеси, деленная на полную площадь пиков и умноженная на 100 на хроматограмме ВЭЖХ, исследованной в период от 0 до 20 мин, где видимый пик инжектирования, если он наблюдается, не учитывают).
Пример 2
2-[6-[3(R)-Аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-с1-илметил]-бензонитрил
Смесь (R)-3-аминопиперидин×2HCl (3,00 г, 17,3 ммоля) и NaHCOs (7,28 г, 86,7 ммоля) перемешивали в H2O (4 мл) при 20°С в течение 5 мин. К водной смеси добавляли 2-пропанол (16 мл) и 6-хлор-2-(2-цианобензил)-3-метилурацил (4,30 г, 15,6 ммоля). Реакционную смесь перемешивали при температуре бани, равной 70°С, в течение 89 ч. Большую часть 2-пропанола удаляли из смеси в вакууме. К остатку добавляли CH2Cl2 (100 мл) и Н2О (50 мл). Смесь фильтровали, слои разделяли и водный слой промывали с помощью CH2Cl2 (50 мл). Органические слои объединяли и дважды экстрагировали с помощью 1М HCl (100 и 50 мл). Водный раствор экстрагировали с помощью CH2Cl2 (20 мл) и нейтрализовывали твердым NaHCO3 при перемешивании. Затем раствор дважды экстрагировали с помощью CH2Cl2 (100 и 50 мл). Органический раствор фильтровали и концентрировали в вакууме. К маслообразному остатку при температуре окружающей среды (примерно 20°С) при перемешивании в течение примерно 5 мин добавляли диизопропиловый эфир (20 мл) и продукт начинал кристаллизоваться при перемешивании. Суспензию перемешивали в течение еще 2 ч, и кристаллы отделяли фильтрованием и сушили в вакууме в течение ночи. Выход: 3,55 г.
Пример 3:
2-[6-[3(R)-Аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-с1-илметил]-бензонитрил
Смесь (R)-3-аминопиперидин×2HCl (0,70 г, 4,0 ммоля) и NaHCO3 (1,70 г, 20,2 ммоля) и Н2О (1 мл) перемешивали в течение 5 мин. Затем к водной смеси добавляли 2-пропанол (4 мл) и 6-хлор-2-(2-цианобензил)-3-метилурацил (0,93 г, 3,4 ммоля). Затем смесь перемешивали при температуре бани, равной примерно 70°C, в течение 40 ч. Затем большую часть 2-пропанола удаляли из реакционной смеси путем отгонки в вакууме. К остатку добавляли CH2Cl2 (25 мл) и H2O (15 мл). Слои разделяли и водный слой экстрагировали с помощью CH2Cl2 (15 мл). Объединенные органические слои дважды экстрагировали 1М хлористоводородной кислотой (25 и 10 мл). Кислую водную фазу промывали с помощью CH2Cl2 (5 мл), значение pH устанавливали равным примерно 7,5 путем добавления твердого NaHCO3 при перемешивании. Затем водный раствор дважды экстрагировали с помощью CH2Cl2 (25 и 15 мл). Органический слой сушили над безводным MgSO4, фильтровали и концентрировали до объема, равного примерно 2 мл. К остатку при перемешивании в течение примерно 20 мин добавляли н-гексан (5 мл). Кристаллы, осадившиеся из раствора, и суспензию перемешивали при температуре окружающей среды (примерно 22°C) в течение 4 ч. Затем кристаллы отделяли фильтрованием, промывали н-гексаном (5 мл) и сушили в вакууме в течение ночи. Выход: 0,87 г.
Содержание воды (определяли по методике Карла Фишера): 0,25%.
Пример 4:
Использовали 2-[6-[3(R)-Аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-с1-илметил]-бензонитрилбензоат из примера 1-3.
Смесь 3,40 г 2-[6-[3(R)-аминопиперидин-1-ил]-3-метил-2,4-диоксо-1,2,3,4-тетрагидропиримидин-с1-илметил]-бензонитрила и 1,22 г бензойной кислоты перемешивали в 200 мл этанола при 70°C в течение 1 ч. Раствору давали охладиться до температуры окружающей среды и затем его держали в холодильнике в течение примерно 36 ч. Кристаллы выделяли фильтрованием и сушили в вакууме при 50°C в течение 8 ч.
Чистота по данным исследования с помощью ВЭЖХ: 99,9% димерная примесь общей формулы (В) не обнаружена, поскольку ее содержание составляло менее 0,05% площади.
Исследование стабильности и чистоты:
Условия проведения ВЭЖХ:
Прибор: Agilent 11 Series
Колонка: YMC-Pro C18; 150×4,6 мм, S-5 мкм, 120А
Элюент: подвижная фаза А: 3,884 г амидосульфоновой кислоты в 1000 г воды; подвижная фаза В: 3,884 г амидосульфоновой кислоты в 250 г воды и 588 г ацетонитрила.
Измерения при длине волны, равной 220 нм; инжектируемый объем 7 мкл, температура печи 40°С, скорость потока 1,0 мл/мин.
Приготовление образца: примерно 10 мг образца кристаллической формы свободного основания алоглиптина растворяют в 10 мл ацетонитрила и объем раствора доводят до 25 мл водой.
Продолжительность эксперимента 20 мин
Градиентный режим:
|