Результат интеллектуальной деятельности: СПОСОБ МОДЕЛИРОВАНИЯ ОБРАЗОВАНИЯ БИОПЛЕНОК ХОЛЕРНЫХ ВИБРИОНОВ В УСЛОВИЯХ ЭКСПЕРИМЕНТА И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ
Вид РИД
Изобретение
Предлагаемое изобретение относится к медицинской микробиологии, а именно к формированию биопленок холерных вибрионов на твердом носителе для изучения проблемы сохранения холерных вибрионов при воздействии экологических факторов в условиях эксперимента.
Известно, что бактерии, находящиеся в составе микробных сообществ и, в частности, биопленок, становятся менее доступными для действия различных внешних факторов, включая антибиотики, пестициды, металлы и др. (1). Процесс роста и формирования биопленок зависит от характеристики раствора, свойств носителя, состава популяции микроорганизмов и разнообразия адгезивных механизмов при использовании различных поверхностей (2).
Известен способ определения способности микроорганизмов формировать биопленки на поверхности твердой фазы (см. пат. RU №2461631, кл. С. 12Q 1/00, 20.09.2012 г. ), где в качестве твердой фазы используют предварительно измельченные и простерилизованные натуральные почечные камни.
В процессе культивирования бактерии адгезировались к поверхности и формировали на них биопленки разной популяции, последние окрашивают красителем и проводят оценку интенсивности окрашивания спиртового раствора на фотометре.
Однако этот способ не может быть использован для микроорганизмов II группы патогенности, так как требует соблюдения принципов биологически безопасной работы.
За прототип выбран способ получения биопленок на покровных стеклах (см. статью Романова Ю.М., Алексеева и др. «Способность к формированию биопленок в искусственных системах различных штаммов Salmonella typhimurium» журнал Микробиология, 2006 г. №4 стр. 38-42), где покровные стекла закладывают на дно чашек Петри, а культуру микроорганизмов вносят на покровные стекла и проводят культивирование с последующей отмывкой, фиксацией и окрашиванием генциан/кристалл виолетом.
Недостатком известного способа является то, что покровные стекла размещают на дне чашек Петри, что должным образом не способствует адгезии клеток в горизонтальном положении и требуется более высокая концентрация микроорганизмов при культивировании, что небезопасно при патогенности холеры. Кроме того, работа с одним покровным стеклом не дает возможности проследить динамику развития биопленки.
Техническая задача предлагаемого изобретения состояла в разработке способа и устройства для осуществления моделирования биопленок Vibrio cholerae различных серотипов с более высокой производительностью и безопасностью в работе.
Поставленная цель достигается тем, что в известном способе моделирования образования биопленок холерных вибрионов в условиях эксперимента, включающем формирование биопленок на твердом носителе, причем биопленку создают на покровных стеклах, установленных наклонно под углом (10-12)° к вертикальной оси в количестве 8-9 штук, которые помещают между витками пружинообразного приспособления, размещенного внутри емкости объемом 100 мл, затем емкость заполняют экспериментальной средой в объеме 40-50 мл до полного погружения покровных стекол, добавляют в емкость суспензию холерных вибрионов и инкубируют при конечной концентрации холерных вибрионов в n×108 КОЕ/мл с доведением до минимального порога чувствительности 0,1 КОЕ/мл при комнатной температуре.
Предложенный способ может быть реализован с помощью устройства, включающего емкость и снабженного пружинообразным приспособлением, выполненным из мягкой проволоки, закрученной в виде 10 витков, под углом не менее (10-12)° к вертикальной оси, диаметром 17 мм, причем расстояние между витками в несжатом виде составляет 3-4 мм, при этом приспособление имеет два плеча длиной 70 мм для размещения внутри емкости и его удаления из нее, пружинообразное приспособление выполнено с возможностью установки между витками покровных стекол с размером 20×20×0,6 мм, а для удерживания пружинообразного приспособления на дне помещен слой 2-3 мм крупнозернистого песка.
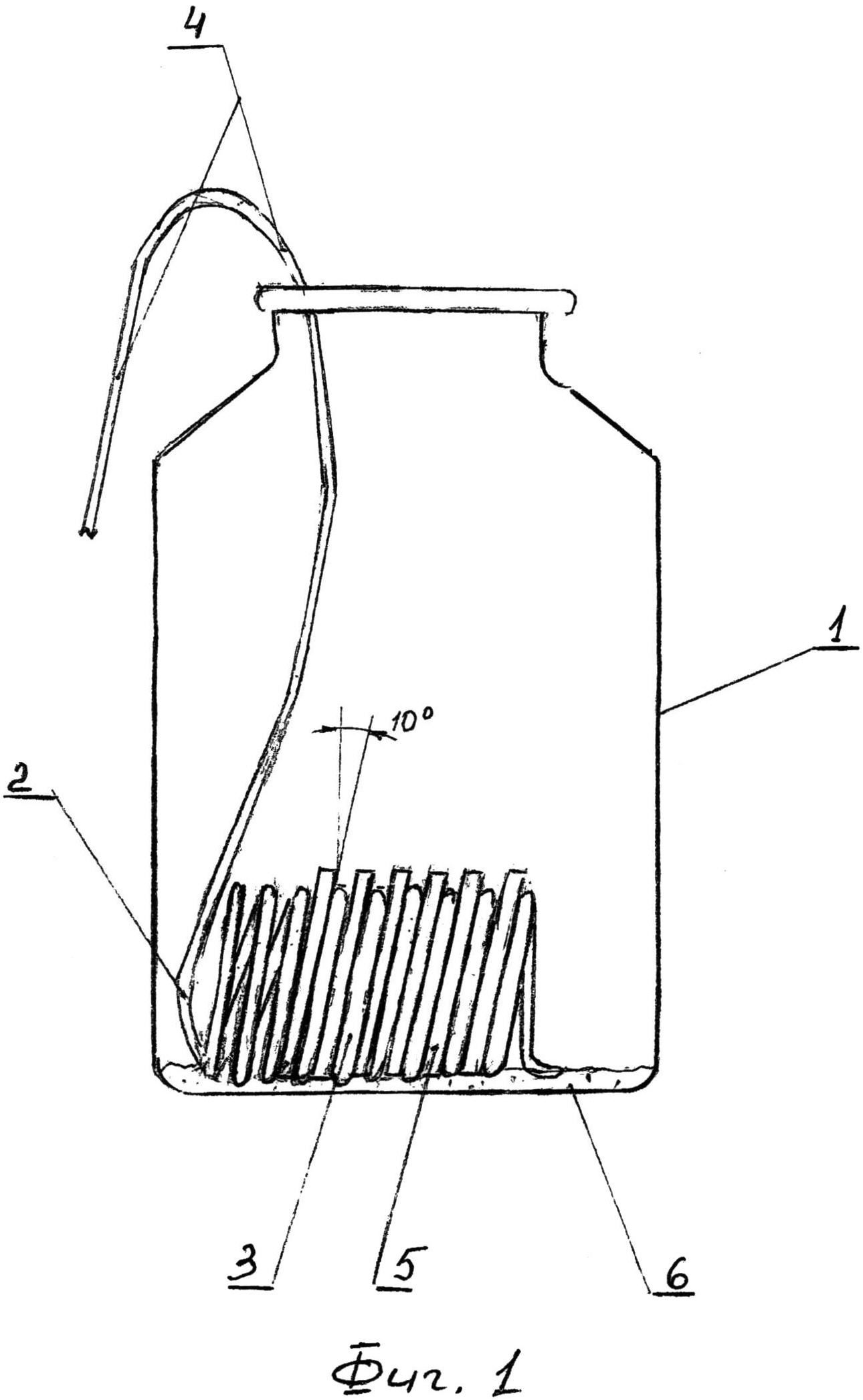
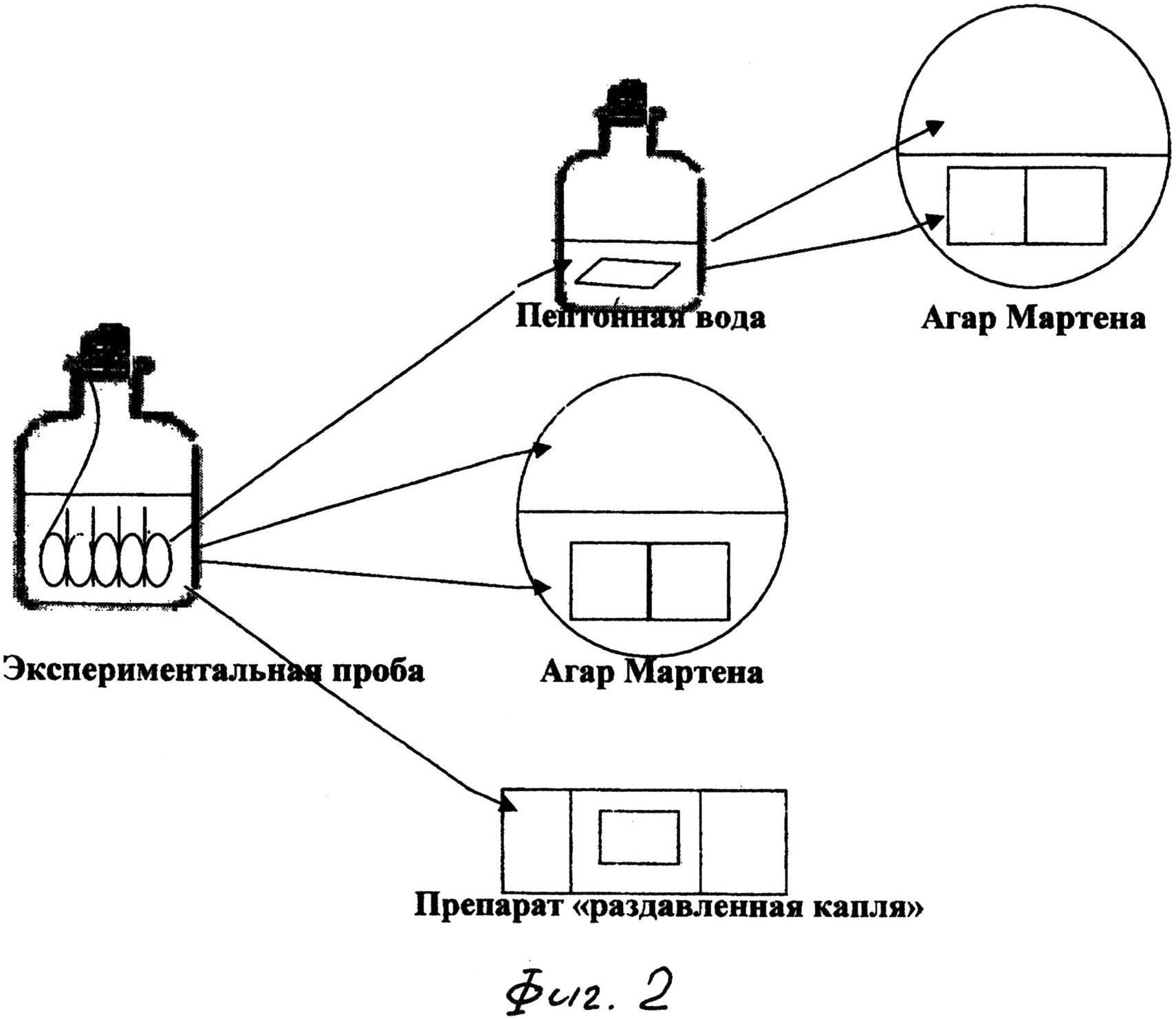
Сущность предложенного изобретения поясняется фиг. 1, 2, где на фиг. 1 изображен общий вид устройства для осуществления способа моделирования образования биопленок холерных вибрионов в условиях эксперимента; фиг. 2 - схема исследования покровных стекол на наличие холерных вибрионов.
Для реализации предложенного способа используют устройство, состоящее (см. фиг. 1) из стеклянной емкости 1 объемом 100 мл, внутри которого размещаем пружинообразное приспособление 2, выполненное из мягкой проволоки (материал - нержавеющая сталь). Последняя закручена в виде витков 3 диаметром 17 мм в количестве от 10 витков, при этом два плеча 4 проволоки имеют длину 70 мм, достаточную, чтобы витки пружины располагались на дне емкости 1. При этом длина плеча, выходящая за пределы емкости, была достаточна для захвата всего приспособления для введения и удаления из емкости. Витки пружины уложены относительно друг друга под углом не менее 10° к вертикальной оси, а расстояние между ними составляет не в сжатом состоянии (3-4) мм. Между витками 3 установлены с помощью пинцета покровные стекла 5 размером (20×20×0,6) мм, которые беспрепятственно проходят через горлышко емкости и становятся под углом (10-12)°. Для устойчивости пружинообразного приспособления предварительно перед его установкой на дне емкости размещают тонким слоем (2-3)мм крупнозернистый песок 6.
Предлагаемый способ реализуется следующим образом.
Для исследования моделирования образования биопленок холерных вибрионов в динамике используют устройство (см. фиг. 1). В каждый виток 3 приспособления 2 пинцетом вставляют одно покровное стекло 5, которых в одной емкости 1 может находиться не более 8-9 штук.
Затем в различные емкости с покровными стеклами наливают экспериментальные среды. Это может быть водопроводная вода, физиологический раствор, солевая среда (KNO3 - 0,1 г/л, К2НРО4 - 0,01 г/л2, MgSO4 - 0,01 г/л), речная, морская вода, бульон Мартена в объеме 40-50 мл (до полного погружения покровных стекол).
Для изучения образования биопленок холерных вибрионов на покровных стеклах используют суточную агаровую культуру, выращенную на пластинках с агаром Мартена, (pH 7,6-7,8) при температуре 37°C. Взвесь холерных вибрионов смывают с пластин агара Мартена, приготавливают по отраслевому стандарту мутности ГИСК им. Л.А. Тарасевича (ОСО-42-25-59-86 II), эмульсируют с помощью бактериологической петли в микробиологических пробирках с забуференными фосфатами физиологическим раствором (PBS), разводят PBS до нужного по условиям экспериментов разведения (от 109 до 102 КОЕ/мл). Суспензию холерных вибрионов с помощью 1-м3 стерильной пипетки (0,3-0,5) мл добавляют в собранные с установленными в «устройство» покровными стеклами и простерилизованные со средой культивирования емкости. Зараженные емкости инкубируют в условиях, необходимых для разных экспериментов.
Плавающие микроорганизмы, в частности холерные вибрионы, сталкиваясь во время движения с вертикально наклоненной под небольшим углом поверхностью твердого субстрата, адгезируются на ней. Хорошо известно, что любая твердая поверхность, погруженная в водную среду, покрывается слизистой биопленкой, образованной колониями микроорганизмов, защищенной полисахаридным матриксом (4).
Последовательность формирования биопленок можно представить следующим образом: адгезия клеток к поверхности, образование монослоя, движение по поверхности с образованием микроколоний, созревание биопленки и формирование трехмерной структуры.
1 стадия - твердая поверхность, погруженная в воду, покрывается первичной пленкой.
2 стадия - собственно микробная адгезия.
Микроорганизмы обратимо прикрепляются к твердой поверхности. Действуют неспецифические физико-химические силы взаимодействия между молекулами и структурами на поверхности микроорганизмов и твердого субстрата (Ван-дер-Ваальсовые, гидрофобные, электростатические, дисперсные силы Лондона) (5, 6).
Адгезия бактерий к твердым поверхностям происходит как в условиях турбулентного потока жидкости, так и при относительной неподвижности водной фазы (6). Вблизи твердой поверхности существует зона малоподвижной воды (вязкий слой). На перемещение микроорганизмов влияют капиллярные дренажные силы, обусловленные давлением жидкости, протекающей между поверхностью твердой фазы и поверхностью бактерий. Подвижные клетки бактерий перемещаются по направлению к поверхности и окончательно удерживаются притягивающими силами, действующими вблизи поверхности (7).
Адгезивы, способствующие преодолению сил отталкивания, при взаимодействии одноименно заряженных поверхностей, участвуют в переходе к необратимой стадии формирования биопленки.
3 стадия - необратимая адгезия. Состоит из нескольких самостоятельных этапов формирования.
Клетки необратимо связываются с поверхностью.
В течение некоторого времени после прикрепления к поверхности клетки могут перемещаться вдоль поверхности посредством жгутиков и пилей IV типа (8).
Затем клетки теряют подвижность, некоторые из них сливаются друг с другом, начинают выделять внеклеточные полимеры (полисахариды, липополисахариды, гликопротеины), формируется внеклеточный полимерный матрикс.
4 стадия - вторичных колонизаторов.
Микроорганизмы прикрепляются к тем, которые уже сформировали биопленку. Одновременно с увеличением биопленки формируются ее специфические структуры - полости, каналы, выросты, поры.
5 стадия - распада, дегидратации, гибели части клеток и высвобождение остальной части клеток в виде свободно падающих (планктонных), для V.cholerae, P.aeruginosa (9).
Используя в данном способе устройство, стало возможным одновременно проводить исследования нескольких покровных стекол одной пробы (см. фиг. 2) различными методами:
- Первое покровное стекло используют для исследования отпечатков биопленки на пластинках с агаром Мартина с последующим подсчетом КОЕ.
- Второе - для накопления клеток холерных вибрионов, для этого переносят покровное стекло в 1% пептонную воду (ПВ) или бульон Мартена (pH 7,8) и в течение 6 часов подращивают при температуре 37°С с последующим исследованием покровного стекла в отпечатках биопленки на пластинках с агаром Мартенами подсчетом КОЕ.
- Третье покровное стекло исследуют микроскопическим методом.
- Планктонную культуру высевают по 0,1 мл из флаконов на пластины агара Мартена с последующим подсчетом КОЕ/мл.
Пример 1.
Формирование биопленки Vibrio ElTor Р-5392 на покровных стеклах.
Для формирования биопленок использовали устройство с пружинообразным приспособлением и проводили все вышеописанные технологические приемы. Объем среды культивирования (речная вода) составлял 50 мл.
Полученные результаты почасовых исследований позволяют судить о накоплении культуры холерных вибрионов на покровных стеклах через 4 часа от начала эксперимента с начальной концентрацией холерных вибрионов 10 КОЕ/мл, через 10 часов - 1 КОЕ/мл, через 12 часов - 0,1 КОЕ/мл, с дальнейшим увеличением концентрации клеток холерных вибрионов на покровных стеклах в течение последующих часов. Микроскопический препарат через 2 часа от начала эксперимента состоит из адгезированных палочек зеленого и оранжевого цвета, цепочек и скоплений. При выдерживании покровных стекол в 1% (ПВ) на агаровых пластинках появляется полусливной или сливной рост через 10 часов (4+6) и 16 часов (10+6) от начала эксперимента при концентрациях 1,0 и 0,1 КОЕ/мл соответственно (цифра 6 в скобках - время в часах выдерживание покровных стекол в ПВ).
Наращивание концентрации холерных вибрионов в экспериментальных пробах происходит и в воде, куда были погружены стекла; так, через 8 часов от начала исследования в экспериментальной пробе с концентрацией холерных вибрионов 10 КОЕ/мл происходит увеличение на 1 порядок с дальнейшим ростом концентрации. Через 24 часа концентрация холерных вибрионов составила 104-106 КОЕ/мл. В контрольной пробе через 18 часов концентрация холерных вибрионов увеличилась на 1 порядок и составила 1×102 КОЕ/мл, без дальнейшего увеличения в течение суток. В экспериментальной пробе при концентрации холерных вибрионов 1 КОЕ/мл увеличение их концентрации начинается через 12 часов на 1 порядок и к 24 часам достигает 1×103 КОЕ/мл. В контрольной пробе за 24 часа не происходит увеличения концентрации холерных вибрионов. В экспериментальной пробе при концентрации холерных вибрионов 0,1 КОЕ/мл через 24 часа от начала исследования концентрация холерных вибрионов достигла 5×101 КОЕ/мл, в контрольной пробе холерные вибрионы к этому периоду не обнаруживались.
Такие образом, все микроскопические препараты, независимо от концентрации холерных вибрионов, состояли из адгезированных палочек оранжевого и зеленого цвета (см. фото).
Пример 2.
Формирование биопленки холерными вибрионами на покровных стеклах в динамике на различных средах культивирования.
Технология проведения способа такая же, как и в примере 1. В качестве питательных сред используют кипяченую воду, физиологический раствор, солевую среду, речную воду, морскую воду, бульон Мартена (см. таблицу). Используют культуру V.ElTor Р-5392 в начальной концентрации 106 КОЕ/мл.
Из таблицы видно, что через 6 часов от начала эксперимента микроскопический препарат состоял из неподвижных палочек зеленого и оранжевого цвета, цепочек клеток и скоплений, состоящих из 4-10 клеток. Скопления формируются через 9-24 часа в экспериментах с морской водой. Через одну неделю скопления, а также многослойность препаратов были во всех экспериментальных пробах. Начиная с третьей недели экспериментов, микроскопическая картина препаратов с морской водой изменилась в сторону уменьшения скоплений клеток и многослойности препаратов. В пробах с бульоном Мартена отмечается быстрое наращивание количества подвижных клеток, через 9 часов наблюдали скопление клеток холерных вибрионов. Через одну неделю культивирования - увеличение числа неподвижных клеток. В течение второй недели приготовленные из всех исследуемых проб микроскопические препараты выглядят многослойными: первый слой - верхний - состоит из подвижных клеток, второй - нижний - из неподвижных, скопления клеток с нижнего слоя наслаиваются вверх, между скоплениями пустые места, «в виде дорожек».
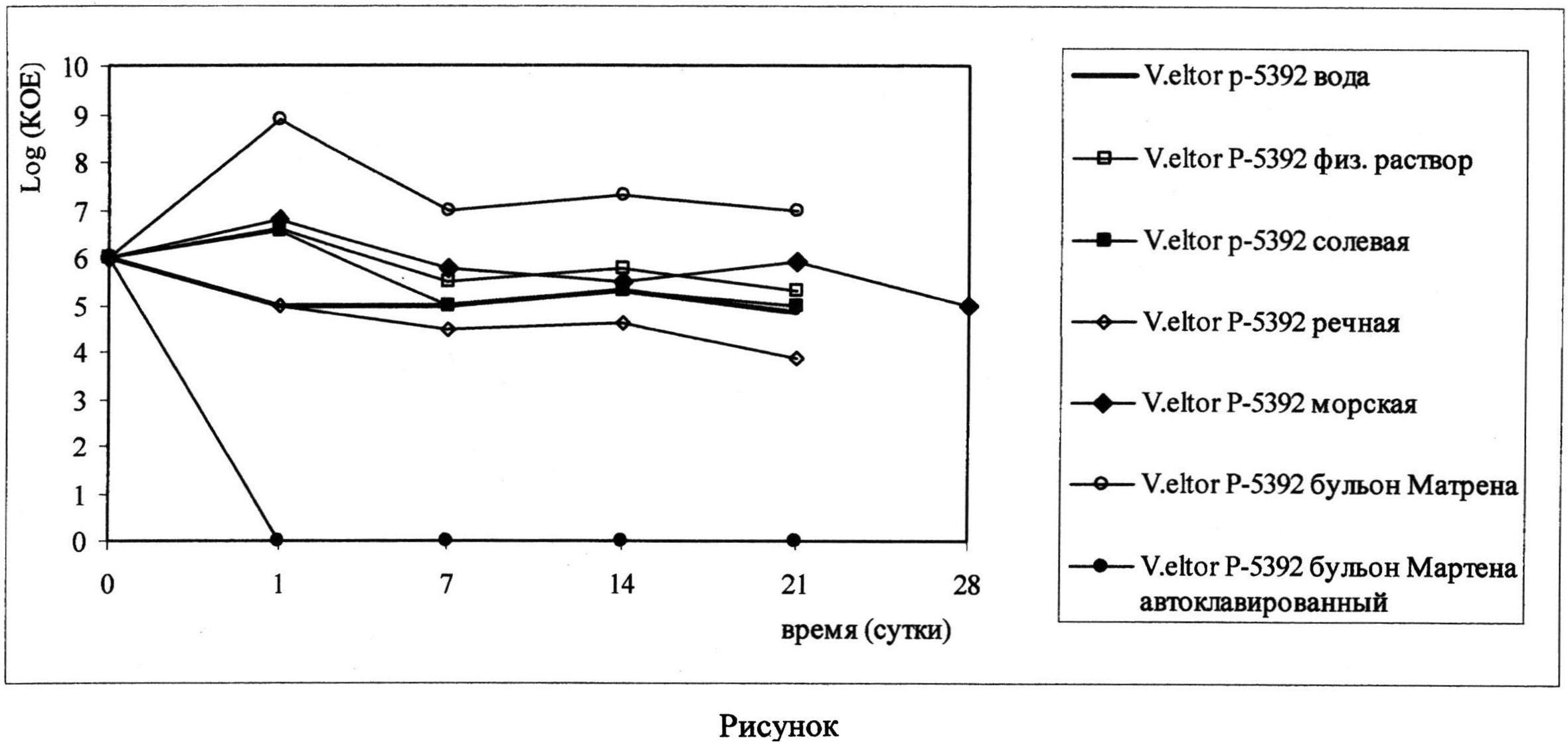
В течение срока исследования концентрация клеток холерных вибрионов в экспериментальных системах в планктоне колебалась от 104 до 107 КОЕ/мл в зависимости от среды культивирования. Соотношение КОЕ в экспериментальных пробах и контрольных было незначительным (см. рисунок).
Пример 3.
Использование способа для исследования поверхностных водоемов на холеру.
Проведенные полевые эксперименты с применением нового способа по формированию бактериальных пленок на предметах из стекла позволили выделить холерные вибрионы из воды поверхностных водоемов. За летний период 2010, 2011 гг. из рек Дон, Мертвый Донец и Темерник были выделены 46 культур V. cholerae non01/non0139 и 2 культуры V. cholerae (Ol) ElTor(ctx-,) (Инаба). Сроки обнаружения подозрительных на холерные вибрионы колоний зависели от времени нахождения проб в воде - от 2 до 24 часов обрастание биопленкой до 1 мм; подозрительных на холерные вибрионы колонии до 50% с одной пробы.
В результате при нахождении пробы в воде в течение недели пробы обрастали биопленкой до 2 мм, при этом подозрительные на холерные вибрионы колонии составляли до 10%, из которых были выделены холерные вибрионы и в том числе V. cholerae (Ol) ElTor (Инаба).
Использование предложенного способа позволяет моделировать и исследовать биопленки микроорганизмов, в том числе принадлежащих к ПБА II группы патогенности на модели холерных вибрионов разных серогрупп и токсигенности, начиная с адгезии к поверхностям покровных стекол единичных клеток и заканчивая зрелой биопленкой в интактном/нативном состоянии. Постановка покровных стекол в наклонном к вертикальной оси углом не менее 10° дает возможность более интенсивной естественной адгезии клеток холерных вибрионов при их постоянном движении сталкиваться с покровными стеклами и адгезироваться к их поверхностям.
Используя количество покровных стекол одной пробы от одного до 10, дает возможность быстрее проводить эксперимент в динамике в одинаковых условиях, что обеспечивает меньшую погрешность при учете, в частности КОЕ.
Кроме того, микробиологическая работа с ПБА II группы патогенности требует соблюдения принципов биологической безопасности, что соблюдается в данном способе моделирования, так как используемая посуда позволяет работать соблюдая все принципы биологической безопасности, в том числе работать около пламени огня, использовать стеклянные флаконы с ватно-марлевыми пробками, с диаметром, горлышка позволяющим беспрепятственно вставлять и изымать покровные стекла.
Источники информации
1. Заславская Н.В., Артеменко Н.К., Чижевская М.М., Тец В.В. Клин. микробиол. антимикроб. химиотерап. - 2000. Т.2, №2.
2. Ипполитов К.Г., Сироткин А.С., Понкратова С.А., Дюн М. Биотехнология. - 2003, №3. - С. 3-11.
3. Романова Ю.М., Алексеева Н.В., Смирнова Т.А., Андреев А.Л., Диденко Л.В., Гинцбург А.Л. Способность к формированию биопленок в искусственных системах различных штаммов Salmonella typhinimurium, Журн. микробиол., 2006. №4. С. 38-42.
4. Дебатов В.Г. Мол. биол. 1999. - Т. - 33, №6. - С. 1074-1084.
5. Van Loosdrecht М.С.Н. Bacterial Adhesion.Wagenin-gen. 1988. 200 P.
6. Раилкин А.И. / Процессы колонизации и защита от биообрастания / 1998. СПб.; Изд-во С-Петербург. Ун-та, 272 с.
7. Marshall К.С. Mechanisms of bacterial adhesion at solid-water interfaces/ Bacterial adhesion (mechanisms and physiological significance)/ Eds. Savage D.C., Fletcher M.NY-L: Plenum Press, 1985. P. 133-155.
8. Watnick P.I., Lauriano СМ., Klose K.E., Kolter R. The absence of a flagellum leads to altered colony morphology, biofilm development and virulence in Vibrio cholera 0139// Mol. Microbiol. 2001. V.39(2). P.223-35.
9. Webb J.S., Thompson L.S. James S., Charlton Т. / Cell death in Pseudomonas aeruginosa biofilm development/ Mol. Microbiol. 2003. V.185. P.4585-4592.