Результат интеллектуальной деятельности: СПОСОБ ОПРЕДЕЛЕНИЯ ГИДРОКСИБЕНЗОЛА И ЕГО МОНОМЕТИЛЬНЫХ ЗАМЕЩЕННЫХ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ
Вид РИД
Изобретение
Изобретение относится к биологии и токсикологической химии, а именно к способам определения гидроксибензола и его монометильных замещенных в биологическом материале, и может быть использовано в практике санэпидстанций, химико-токсикологических и ветеринарных лабораторий. Способ относится к числу массовых.
Известен способ определения гидроксибензола в биологическом материале путем измельчения биологического объекта, подкисления раствором виннокаменной кислоты, прибавления сульфата кадмия, проведения дистилляции с использованием парообразователя, отбора дистиллята, встряхивания дистиллята с оксидом алюминия с последующей обработкой дистиллята водно-этанольным раствором 2,6-дибромхинонхлоримида в присутствии боратного буфера с pH 10,5 и фотометрированием образующегося окрашенного раствора на фоне воды (Гадаскина И.Д., Филов В.А. Превращения и определение промышленных органических ядов в организме. - Л.: Медицина, 1970. - С.38-39).
Способ малоселективен, характеризуется недостаточно высокими точностью и чувствительностью.
Известен способ определения 4-метилгидроксибензола в моче, заключающийся в том, что анализируемую пробу подкисляют серной кислотой, перегоняют с водяным паром, полученный дистиллят обрабатывают 65% азотной кислотой, выдерживают при 37°C в течение 24 часов, нейтрализуют 20% раствором гидроксида натрия, прибавляют к реакционной смеси буферный раствор с pH 12 и проводят полярографическое определение (Гадаскина И.Д., Филов В.А. Превращения и определение промышленных органических ядов в организме. Л.: Медицина, 1970. - С.204).
Способ характеризуется длительностью выполнения, недостаточно высокой чувствительностью, не может обеспечить селективное определение гидроксибензола и его монометильных замещенных при их совместном присутствии.
Наиболее близким является способ определения гидроксибензола и его монометильных замещенных в биологическом материале, который заключается в том, что биологический объект измельчают, обрабатывают двукратно по 30 минут этилацетатом, этилацетатные вытяжки объединяют, обезвоживают, растворитель из объединенной этилацетатной вытяжки испаряют при 16-20°C, остаток растворяют в смеси растворителей гексан-диэтиловый эфир в соотношении 6:4 по объему, хроматографируют в колонке с силикагелем с использованием подвижной фазы гексан-диэтиловый эфир 6:4 по объему, фракции элюата, содержащие гидроксибензол и его монометильные замещенные, отбирают, объединяют, обезвоживают, элюент испаряют до получения остатка, анализируемые вещества в остатке переводят в соответствующие полинитропроизводные, для чего остаток разбавляют водой и обрабатывают нитрующим агентом в равном объемном соотношении, в качестве нитрующего агента применяют смесь 65%-ой азотной и 94%-ой серной кислот в соотношении 1:1 по объему, обработку ведут при кипячении на водяной бане, после чего реакционную смесь подщелачивают до pH 4 и разбавляют буферным раствором с pH 4, полученный раствор двукратно экстрагируют диэтиловым эфиром в соотношении 1:1 по объему, эфирные извлечения, содержащие полинитропроизводные 2-метилгидроксибензола и 4-метилгидроксибензола, отделяют, а водный слой подкисляют до pH 1 и разбавляют буферным раствором с pH 1, полученный раствор снова дважды обрабатывают диэтиловым эфиром в соотношении 1:1 по объему, экстракт из раствора с pH 4 упаривают до сухого остатка, остаток растворяют в системе растворителей гексан-диоксан-пропанол-2 в соотношении 40:5:1 по объему, проводят качественное и количественное определение физико-химическим методом, которым является ВЭЖХ, в колонке с неподвижной фазой «Силасорб-600» с использованием подвижной фазы гексан-диоксан-пропанол-2 в соотношении 40:5:1 по объему при скорости подачи элюента 50 мкл/мин, концентрацию соответствующих монометильных замещенных гидроксибензола вычисляют по данным хроматограммы, полученной регистрацией оптической плотности раствора, выходящего из колонки, качественное определение монометильных замещенных производят по величинам характерных объемов или времени удерживания соответствующих полинитропроизводных, экстракт из раствора с pH 1, содержащий полинитропроизводные гидроксибензола и 3-метилгидроксибензола, упаривают до сухого остатка, остаток растворяют в системе растворителей гексан-диоксан-муравьиная кислота в соотношении 5:3:0,2 по объему, проводят качественное и количественное определение физико-химическим методом, которым является ВЭЖХ, в колонке с неподвижной фазой «Силасорб-600» с использованием подвижной фазы гексан-диоксан-муравьиная кислота в соотношении 5:3:0,2 по объему при скорости подачи элюента 100 мкл/мин, концентрацию гидроксибензола и соответствующего монометильного замещенного гидроксибензола вычисляют по данным хроматограммы, полученной регистрацией оптической плотности раствора, выходящего из колонки, качественное определение гидроксибензола и монометильного замещенного производят по величинам характерных объемов или времени удерживания соответствующих полинитропроизводных (патент RU 2269137).
Способ характеризуется характеризуется недостаточно высокой чувствительностью и относительной длительностью определения гидроксибензола и его монометильных замещенных при их совместном присутствии.
Техническим результатом настоящего изобретения является повышение чувствительности и сокращение продолжительности определения.
Технический результат достигается тем, что биологический объект измельчают, обрабатывают двукратно по 30 минут этилацетатом, этилацетатные вытяжки объединяют, обрабатывают этанольным раствором гидроксида калия, растворитель из объединенной этилацетатной вытяжки испаряют при 16-20°C, остаток неоднократно обрабатывают ацетоном, содержащим хлороводородную кислоту в избытке по отношению к гидроксиду калия, находящемуся в остатке, подкисленные ацетоновые извлечения объединяют, обрабатывают водным раствором гидроксида натрия для нейтрализации остатков хлороводородной кислоты в ацетоне и создания избытка щелочной среды, ацетон испаряют из объединенного извлечения, водно-щелочной остаток разбавляют водой, образующийся раствор подкисляют до pH 2-3, насыщают сульфатом натрия, экстрагируют диэтиловым эфиром, экстракт обезвоживают, упаривают, хроматографируют в колонке с силикагелем с использованием подвижной фазы гексан-диэтиловый эфир в соотношении 6:4 по объему, фракции элюата, содержащие гидроксибензол и его монометильные замещенные, объединяют, экстрагируют буферным раствором с pH 12-13, водно-щелочной экстракт подкисляют 24% раствором хлороводородной кислоты до pH 2-3, насыщают сульфатом натрия, экстрагируют дихлорметаном, дихлорметановый экстракт обезвоживают, анализируемые вещества, содержащиеся в дихлорметановом экстракте, переводят в соответствующие триметилсилильные производные, для чего дихлорметановый экстракт обрабатывают в течение 20 минут N-метил-N-триметилсилил-трифторацетамидом в условиях нагревания при температуре 60°C, и проводят качественное и количественное определение физико-химическим методом, которым является хромато-масс-спектрометрия, в капиллярной колонке длиной 25 м и внутренним диаметром 0,2 мм с неподвижной фазой (5%-фенил)-метилполисилоксан, используя газ-носитель гелий, подаваемый со скоростью 0,6 мл/мин, и масс-селективный детектор, работающий в режиме электронного удара, начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура программируется от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 10 минут, температура инжектора составляет 250°C, температура квадруполя - 150°C, температура источника ионов - 230°C, температура интерфейса детектора - 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току, качественное определение анализируемого вещества осуществляют по времени удерживания, набору и интенсивности сигналов характеристических заряженных частиц в масс-спектре его триметилсилильного производного, а количество определяемого соединения вычисляют по площади хроматографического пика его триметилсилильного производного.
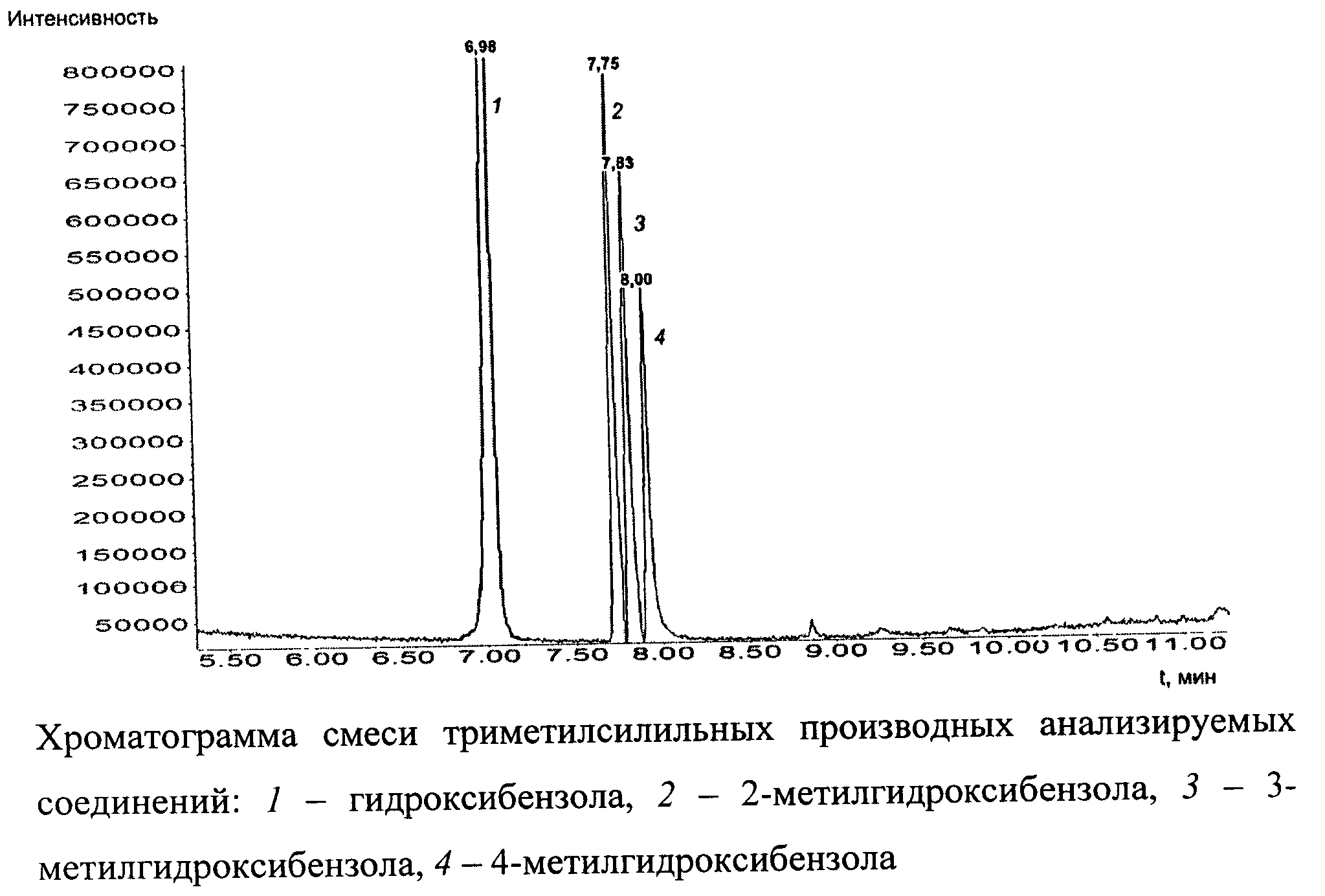
Изобретение поясняется чертежом. На фигуре представлена хроматограмма смеси триметилсилильных производных гидроксибензола и его монометильных замещенных 1 - гидроксибензола, 2 - 2-метилгидроксибензола, 3 - 3-метилгидроксибензола, 4 - 4-метилгидрокси бензола.
Способ осуществляется следующим образом: биологический объект, содержащий смесь гидроксибензола и его монометильных замещенных, измельчают, обрабатывают двукратно по 30 минут этилацетатом, этилацетатные вытяжки объединяют, обрабатывают этанольным раствором гидроксида калия, растворитель из объединенной этилацетатной вытяжки испаряют при 16-20°C, остаток неоднократно обрабатывают ацетоном, содержащим хлороводородную кислоту в избытке по отношению к гидроксиду калия, находящемуся в остатке, подкисленные ацетоновые извлечения объединяют, обрабатывают водным раствором гидроксида натрия для нейтрализации остатков хлороводородной кислоты в ацетоне и создания избытка щелочной среды, ацетон испаряют из объединенного извлечения, водно-щелочной остаток разбавляют водой, образующийся раствор подкисляют до pH 2-3, насыщают сульфатом натрия, экстрагируют диэтиловым эфиром, экстракт обезвоживают, упаривают, хроматографируют в колонке с силикагелем с использованием подвижной фазы гексан-диэтиловый эфир в соотношении 6:4 по объему, фракции элюата, содержащие гидроксибензол и его монометильные замещенные, объединяют, экстрагируют буферным раствором с pH 12-13, водно-щелочной экстракт подкисляют 24% раствором хлороводородной кислоты до pH 2-3, насыщают сульфатом натрия, экстрагируют дихлорметаном, дихлорметановый экстракт обезвоживают, анализируемые вещества, содержащиеся в дихлорметановом экстракте, переводят в соответствующие триметилсилильные производные, для чего дихлорметановый экстракт обрабатывают в течение 20 минут N-метил-N-триметилсилил-трифторацетамидом в условиях нагревания при температуре 60°C, и проводят качественное и количественное определение физико-химическим методом, которым является хромато-масс-спектрометрия, в капиллярной колонке длиной 25 м и внутренним диаметром 0,2 мм с неподвижной фазой (5%-фенил)-метилполисилоксан, используя газ-носитель гелий, подаваемый со скоростью 0,6 мл/мин, и масс-селективный детектор, работающий в режиме электронного удара, начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура программируется от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 10 минут, температура инжектора составляет 250°C, температура квадруполя - 150°C, температура источника ионов - 230°C, температура интерфейса детектора - 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току, качественное определение анализируемого вещества осуществляют по времени удерживания, набору и интенсивности сигналов характеристических заряженных частиц в масс-спектре его триметилсилильного производного, а количество определяемого соединения вычисляют по площади хроматографического пика его триметилсилильного производного.
Способ иллюстрируется следующими примерами.
Пример 1
Качественное определение гидроксибензола и его монометильных замещенных в ткани печени
Биологический объект, представляющий собой 10 г ткани печени, мелко измельчают (до размеров частиц 0,2-0,5 г), к мелкоизмельченной ткани печени прибавляют смесь гидроксибензола, 2-метилгидроксибензола, 3-метилгидроксибензола и 4-метилгидроксибензола по 5 мг каждого из веществ, тщательно перемешивают биологическую ткань с веществами и оставляют на сутки при температуре 16-20°C. По истечении указанного времени биологический объект обрабатывают двукратно по 30 минут порциями этилацетата объемом 20 мл каждая при периодическом перемешивании. Отдельные этилацетатные вытяжки отделяют, объединяют, обрабатывают 1 мл 8% этанольного раствора гидроксида калия, растворитель из объединенной этилацетатной вытяжки испаряют в токе воздуха при 16-20°C, остаток неоднократно (трижды по 3 минуты) обрабатывают при энергичном перемешивании порциями (по 15 г каждая) ацетона, содержащего концентрированную (10 М) хлороводородную кислоту в количестве 1%, что обеспечивает избыток хлороводородной кислоты по отношению к гидроксиду калия, находящемуся в остатке, подкисленные ацетоновые извлечения объединяют, обрабатывают 2 мл 10% водного раствора гидроксида натрия для нейтрализации остатков хлороводородной кислоты в ацетоне и создания избытка щелочной среды, ацетон испаряют из объединенного извлечения в токе воздуха при температуре 16-20°C, водно-щелочной остаток разбавляют водой, доводя объем раствора до 10 мл, образующийся раствор подкисляют 24% раствором хлороводородной кислоты до pH 2-3, насыщают сульфатом натрия, экстрагируют диэтиловым эфиром дважды порциями по 10 мл, эфирные экстракты объединяют, объединенный экстракт обезвоживают, пропуская через стеклянный фильтр диаметром 4 см со слоем безводного сульфата натрия толщиной 1-1,5 см, фильтр дополнительно промывают 20 мл диэтилового эфира. Отдельные фильтраты объединяют, упаривают в токе воздуха при 16-20°C до объема 4-5 мл, полученный объем смешивают с 1,5 г силикагеля L 40/100 мкм и испаряют остатки эфира из сорбента в токе воздуха при 16-20°C.
В колонку размером 240×15 мм вносят вначале 18,5 г силикагеля L 40/100 мкм, а затем, поверх образующегося слоя, - 1,5 г силикагеля L 40/100 мкм, содержащего анализируемое вещество, предварительно введенное в виде эфирного раствора.
Хроматографируют в колонке с силикагелем, используя подвижную фазу гексан-диэтиловый эфир в соотношении 6:4 по объему. Элюат собирают отдельными фракциями по 2 мл каждая. Фракции с 5 по 13 включительно, содержащие гидроксибензол и его монометильные замещенные, объединяют, элюент испаряют в токе воздуха при температуре 16-20°C до объема 6-8 мл, доводят до 10 мл смесью растворителей гексан-диэтиловый эфир в соотношении 6:4 по объему, экстрагируют дважды порциями буферного раствора с pH 12-13, отдельные экстракты отделяют, объединяют, объединенный водно-щелочной экстракт подкисляют 24% раствором хлороводородной кислоты до pH 2-3, насыщают полученный раствор сульфатом натрия и экстрагируют порциями дихлорметана трижды по 8 мл каждая. Отдельные органические экстракты отделяют, объединяют, объединенный дихлорметановый экстракт обезвоживают, пропуская через стеклянный фильтр диаметром 4 см со слоем безводного сульфата натрия толщиной 1-1,5 см, фильтр дополнительно промывают 10 мл дихлорметана. Отдельные фильтраты объединяют, упаривают в токе воздуха при температуре 16-20°C до объема 2-3 мл и доводят дихлорметаном до 5 мл (раствор А).
0,1 мл раствора А вносят в пробирку вместимостью 0,2 мл, обрабатывают в течение 20 минут 0,016 мл дериватизирующего реагента, которым является N-метил-N-триметилсилил-трифторацетамид, в условиях нагревания при 60°C, продукт реакции вместе с содержимым пробирки количественно переносят в мерную колбу вместимостью 10 мл и доводят дихлорметаном до метки (раствор Б).
4 мкл раствора Б вводят в хромато-масс-спектрометр.
Определение проводят физико-химическим методом, которым является хромато-масс-спектрометрия, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой толщиной 0,33 мкм, представляющей собой (5%-фенил)-метилполисилоксан.
Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура программируется от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 10 минут, температура инжектора составляет 250°C, температура квадруполя - 150°C, температура источника ионов - 230°C, температура интерфейса детектора - 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
Общий вид хроматограммы смеси гидроксибензола и его монометильных замещенных представлен на чертеже (фиг.). Пики на хроматограмме (в порядке возрастания времени удерживания) соответствуют триметилсилильным производным гидроксибензола (1), 2-метилгидроксибензола (2), 3-метилгидроксибензола (3), 4-метилгидроксибензола (4).
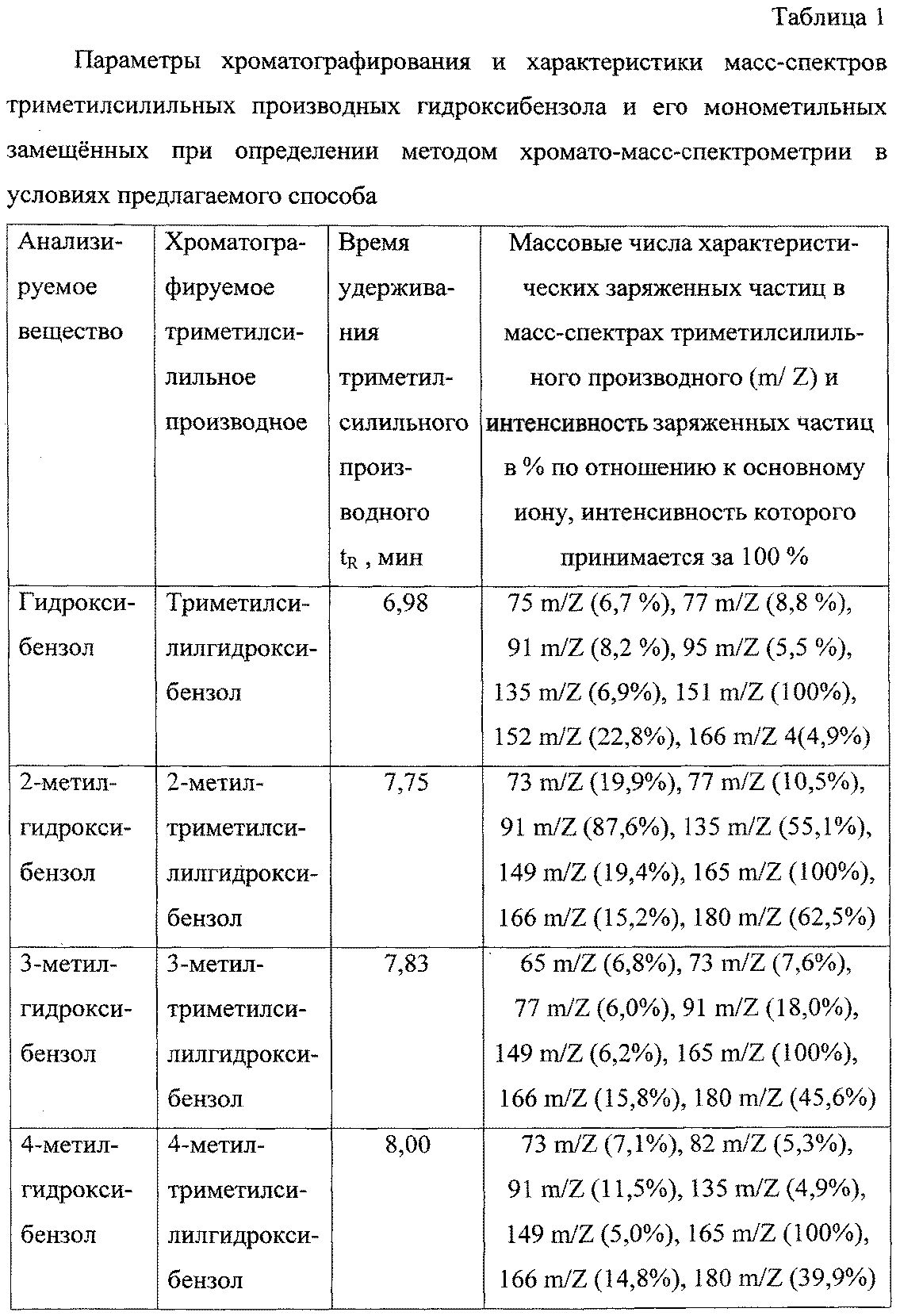
Значения времени удерживания триметилсилильных производных гидроксибензола и его монометильных замещенных представлены в таблице 1.
В масс-спектрах триметилсилильных производных анализируемых соединений, снятых по полному ионному току, обнаруживаются сигналы ряда характеристических заряженных частиц (ионов) с определенными массовыми числами. Интенсивность наиболее интенсивной частицы (основного иона) в каждом из масс-спектров принимается за 100%.
Массовые числа характеристических заряженных частиц (ионов) в масс-спектрах триметилсилильных производных анализируемых веществ и интенсивность заряженных частиц по отношению к интенсивности основного иона представлены в таблице 1.
Качественное определение анализируемых веществ (гидроксибензола и его монометильных замещенных) в виде соответствующих триметилсилильных производных осуществляют по времени удерживания соответствующих триметилсилильных производных в неподвижной фазе колонки, а также специфическому набору и интенсивности сигналов характеристических заряженных частиц в их масс-спектрах.
Пример 2
Количественное определение гидроксибензола в ткани печени в присутствии 2-метилгидроксибензола, 3-метилгидроксибензола и 4-метилгидроксибензола
Биологический объект, представляющий собой 10 г ткани печени, мелко измельчают (до размеров частиц 0,2-0,5 г), к мелкоизмельченной ткани печени прибавляют смесь гидроксибензола, 2-метилгидроксибензола, 3-метилгидроксибензола и 4-метилгидроксибензола по 5 мг каждого из веществ, тщательно перемешивают биологическую ткань с веществами и оставляют на сутки при температуре 16-20°C. По истечении указанного времени биологический объект обрабатывают двукратно по 30 минут порциями этилацетата объемом 20 мл каждая при периодическом перемешивании. Отдельные этилацетатные вытяжки отделяют, объединяют, обрабатывают 1 мл 8% этанольного раствора гидроксида калия, растворитель из объединенной этилацетатной вытяжки испаряют в токе воздуха при 16-20°C, остаток неоднократно (трижды по 3 минуты) обрабатывают при энергичном перемешивании порциями (по 15 г каждая) ацетона, содержащего концентрированную (10 М) хлороводородную кислоту в количестве 1%, что обеспечивает избыток хлороводородной кислоты по отношению к гидроксиду калия, находящемуся в остатке, подкисленные ацетоновые извлечения объединяют, обрабатывают 2 мл 10% водного раствора гидроксида натрия для нейтрализации остатков хлороводородной кислоты в ацетоне и создания избытка щелочной среды, ацетон испаряют из объединенного извлечения в токе воздуха при температуре 16-20°C, водно-щелочной остаток разбавляют водой, доводя объем раствора до 10 мл, образующийся раствор подкисляют 24% раствором хлороводородной кислоты до pH 2-3, насыщают сульфатом натрия, экстрагируют диэтиловым эфиром дважды порциями по 10 мл, эфирные экстракты объединяют, объединенный экстракт обезвоживают, пропуская через стеклянный фильтр диаметром 4 см со слоем безводного сульфата натрия толщиной 1-1,5 см, фильтр дополнительно промывают 20 мл диэтилового эфира. Отдельные фильтраты объединяют, упаривают в токе воздуха при 16-20°C до объема 4-5 мл, полученный объем смешивают с 1,5 г силикагеля L 40/100 мкм и испаряют остатки эфира из сорбента в токе воздуха при 16-20°C.
В колонку размером 240×15 мм вносят вначале 18,5 г силикагеля L 40/100 мкм, а затем, поверх образующегося слоя, - 1,5 г силикагеля L 40/100 мкм, содержащего анализируемое вещество, предварительно введенное в виде эфирного раствора.
Хроматографируют в колонке с силикагелем, используя подвижную фазу гексан-диэтиловый эфир в соотношении 6:4 по объему. Элюат собирают отдельными фракциями по 2 мл каждая. Фракции с 5 по 13 включительно, содержащие гидроксибензол и его монометильные замещенные, объединяют, элюент испаряют в токе воздуха при температуре 16-20°C до объема 6-8 мл, доводят до 10 мл смесью растворителей гексан-диэтиловый эфир в соотношении 6:4 по объему, экстрагируют дважды порциями буферного раствора с pH 12-13, отдельные экстракты отделяют, объединяют, объединенный водно-щелочной экстракт подкисляют 24% раствором хлороводородной кислоты до pH 2-3, насыщают полученный раствор сульфатом натрия и экстрагируют порциями дихлорметана трижды по 8 мл каждая. Отдельные органические экстракты отделяют, объединяют, объединенный дихлорметановый экстракт обезвоживают, пропуская через стеклянный фильтр диаметром 4 см со слоем безводного сульфата натрия толщиной 1-1,5 см, фильтр дополнительно промывают 10 мл дихлорметана. Отдельные фильтраты объединяют, упаривают в токе воздуха при температуре 16-20°C до объема 2-3 мл и доводят дихлорметаном до 5 мл (раствор А).
0,1 мл раствора А вносят в пробирку вместимостью 0,2 мл, обрабатывают в течение 20 минут 0,016 мл дериватизирующего реагента, которым является N-метил-N-триметилсилил-трифторацетамид, в условиях нагревания при 60°C, продукт реакции вместе с содержимым пробирки количественно переносят в мерную колбу вместимостью 10 мл и доводят дихлорметаном до метки (раствор Б).
4 мкл раствора Б вводят в хромато-масс-спектрометр.
Определение проводят физико-химическим методом, которым является хромато-масс-спектрометрия, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой толщиной 0,33 мкм, представляющей собой (5%-фенил)-метилполисилоксан.
Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура программируется от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 10 минут, температура инжектора составляет 250°C, температура квадруполя - 150°C, температура источника ионов - 230°C, температура интерфейса детектора - 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество гидроксибензола по площади хроматографического пика его триметилсилильного производного.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
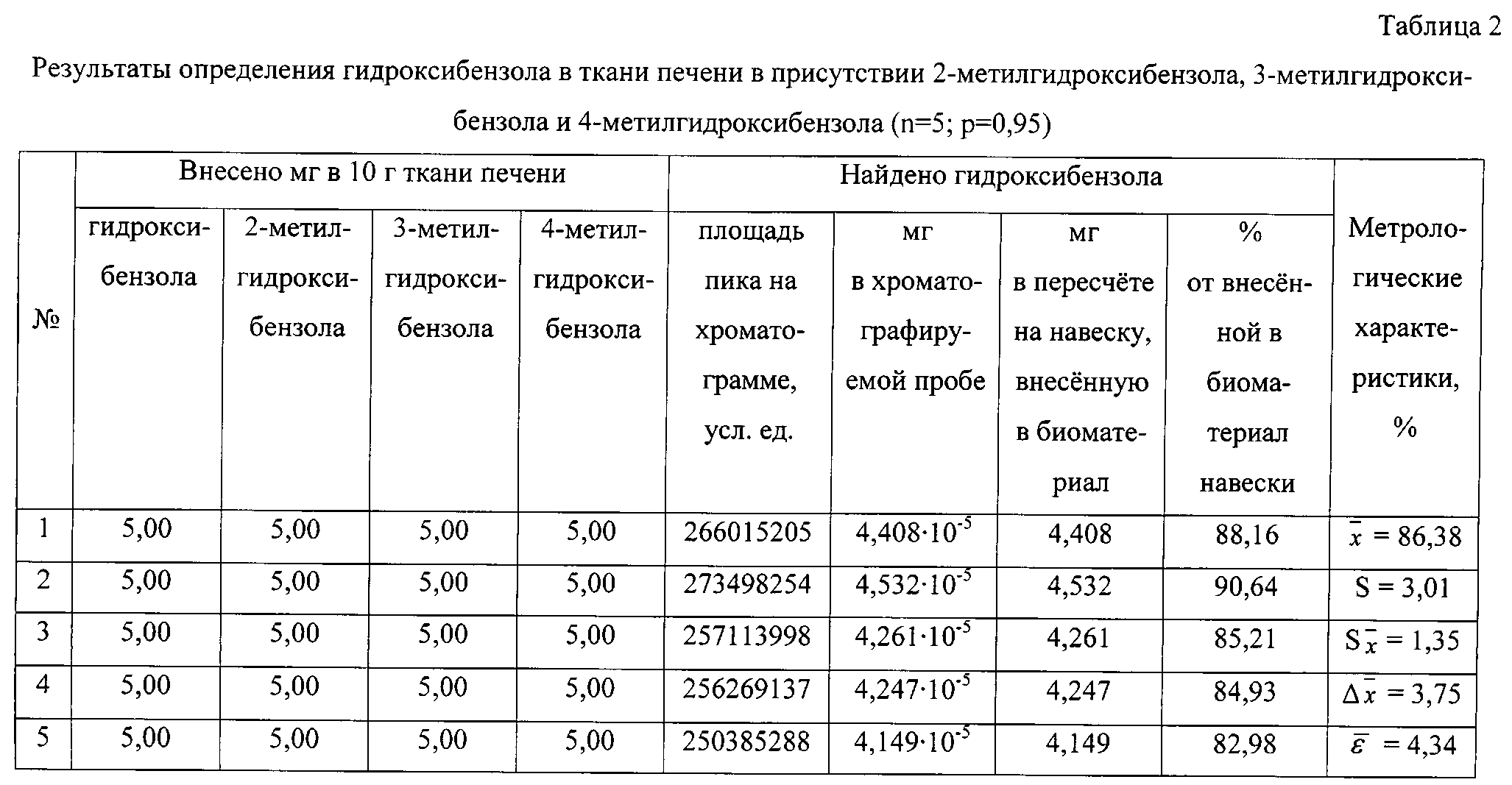
Пик на хроматограмме с временем удерживания 6,98 мин соответствует триметилсилильному производному гидроксибензола. В масс-спектре данного соединения, снятому по полному ионному току, обнаруживаются сигналы ряда характеристических заряженных частиц с массовыми числами 75, 77, 91, 95, 135, 151, 152, 166. Наиболее интенсивной является частица с массовым числом 151, интенсивность которой принимается за 100%.
По площади хроматографического пика, полученного при регистрации интенсивности по полному ионному току, определяют количественное содержание гидроксибензола, используя уравнение градуировочного графика, и пересчитывают на навеску анализируемого вещества, внесенную в биологический материал.
Построение градуировочного графика
В ряд мерных колб вместимостью 25 мл вносят 0,01, 0,1, 1,0, 2,0, 10,0 мл 0,125% раствора и 2,5, 5,0, 10,0 мл 1,25% раствора гидроксибензола в дихлорметане и доводят объем содержимого каждой колбы до метки дихлорметаном.
0,1 мл каждого из растворов вносят в пробирку вместимостью 0,2 мл, обрабатывают в течение 20 минут 0,016 мл N-метил-N-триметилсилил-трифторацетамида в условиях нагревания при 60°C, продукт реакции вместе с содержимым пробирки количественно переносят в мерную колбу вместимостью 10 мл и доводят дихлорметаном до метки.
4 мкл каждого из полученных растворов вводят в хромато-масс-спектрометр.
Определение проводят физико-химическим методом, которым является хромато-масс-спектрометрия, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой толщиной 0,33 мкм, представляющей собой (5%-фенил)-метилполисилоксан. Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура программируется от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 10 минут, температура инжектора составляет 250°C, температура квадруполя 150°C, температура источника ионов - 230°C, температура интерфейса детектора 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество гидроксибензола по площади хроматографического пика его триметилсилильного производного.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
По результатам измерений на хромато-масс-спектрометре строят график зависимости площади пика от концентрации определяемого вещества. График линеен в интервале концентраций 1·10-11-4·10-7 г. Методом наименьших квадратов рассчитывают уравнение градуировочного графика, которое имеет вид:
S=6034717·С+4880,
где S - площадь хроматографического пика триметилсилильного производного гидроксибензола, С - условная концентрация гидроксибензола в хроматографируемой пробе, нг.
Результаты количественного определения гидроксибензола в ткани печени представлены в таблице 2.
Пример 3
Количественное определение 2-метилгидрокси-бензола в ткани печени в присутствии гидрокси-бензола, 3-метилгидроксибензола и 4-метилгидр-оксибензола
Биологический объект, представляющий собой 10 г ткани печени, мелко измельчают (до размеров частиц 0,2-0,5 г), к мелкоизмельченной ткани печени прибавляют смесь гидроксибензола, 2-метилгидроксибензола, 3-метилгидроксибензола и 4-метилгидроксибензола по 5 мг каждого из веществ, тщательно перемешивают биологическую ткань с веществами и оставляют на сутки при температуре 16-20°C. По истечении указанного времени биологический объект обрабатывают двукратно по 30 минут порциями этилацетата объемом 20 мл каждая при периодическом перемешивании. Отдельные этилацетатные вытяжки отделяют, объединяют, обрабатывают 1 мл 8% этанольного раствора гидроксида калия, растворитель из объединенной этилацетатной вытяжки испаряют в токе воздуха при 16-20°C, остаток неоднократно (трижды по 3 минуты) обрабатывают при энергичном перемешивании порциями (по 15 г каждая) ацетона, содержащего концентрированную (10 М) хлороводородную кислоту в количестве 1%, что обеспечивает избыток хлороводородной кислоты по отношению к гидроксиду калия, находящемуся в остатке, подкисленные ацетоновые извлечения объединяют, обрабатывают 2 мл 10% водного раствора гидроксида натрия для нейтрализации остатков хлороводородной кислоты в ацетоне и создания избытка щелочной среды, ацетон испаряют из объединенного извлечения в токе воздуха при температуре 16-20°C, водно-щелочной остаток разбавляют водой, доводя объем раствора до 10 мл, образующийся раствор подкисляют 24% раствором хлороводородной кислоты до pH 2-3, насыщают сульфатом натрия, экстрагируют диэтиловым эфиром дважды порциями по 10 мл, эфирные экстракты объединяют, объединенный экстракт обезвоживают, пропуская через стеклянный фильтр диаметром 4 см со слоем безводного сульфата натрия толщиной 1-1,5 см, фильтр дополнительно промывают 20 мл диэтилового эфира. Отдельные фильтраты объединяют, упаривают в токе воздуха при 16-20°C до объема 4-5 мл, полученный объем смешивают с 1,5 г силикагеля L 40/100 мкм и испаряют остатки эфира из сорбента в токе воздуха при 16-20°C.
В колонку размером 240×15 мм вносят вначале 18,5 г силикагеля L 40/100 мкм, а затем, поверх образующегося слоя, - 1,5 г силикагеля L 40/100 мкм, содержащего анализируемое вещество, предварительно введенное в виде эфирного раствора.
Хроматографируют в колонке с силикагелем, используя подвижную фазу гексан-диэтиловый эфир в соотношении 6:4 по объему. Элюат собирают отдельными фракциями по 2 мл каждая. Фракции с 5 по 13 включительно, содержащие гидроксибензол и его монометильные замещенные, объединяют, элюент испаряют в токе воздуха при температуре 16-20°C до объема 6-8 мл, доводят до 10 мл смесью растворителей гексан-диэтиловый эфир в соотношении 6:4 по объему, экстрагируют дважды порциями буферного раствора с pH 12-13, отдельные экстракты отделяют, объединяют, объединенный водно-щелочной экстракт подкисляют 24% раствором хлороводородной кислоты до pH 2-3, насыщают полученный раствор сульфатом натрия и экстрагируют порциями дихлорметана трижды по 8 мл каждая. Отдельные органические экстракты отделяют, объединяют, объединенный дихлорметановый экстракт обезвоживают, пропуская через стеклянный фильтр диаметром 4 см со слоем безводного сульфата натрия толщиной 1-1,5 см, фильтр дополнительно промывают 10 мл дихлорметана. Отдельные фильтраты объединяют, упаривают в токе воздуха при температуре 16-20°C до объема 2-3 мл и доводят дихлорметаном до 5 мл (раствор А).
0,1 мл раствора А вносят в пробирку вместимостью 0,2 мл, обрабатывают в течение 20 минут 0,016 мл дериватизирующего реагента, которым является N-метил-N-триметилсилил-трифторацетамид, в условиях нагревания при 60°C, продукт реакции вместе с содержимым пробирки количественно переносят в мерную колбу вместимостью 10 мл и доводят дихлорметаном до метки (раствор Б).
4 мкл раствора Б вводят в хромато-масс-спектрометр.
Определение проводят физико-химическим методом, которым является хромато-масс-спектрометрия, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой толщиной 0,33 мкм, представляющей собой (5%-фенил)-метилполисилоксан.
Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура программируется от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 10 минут, температура инжектора составляет 250°C, температура квадруполя - 150°C, температура источника ионов - 230°C, температура интерфейса детектора - 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество 2-метилгидроксибензола по площади хроматографического пика его триметилсилильного производного.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
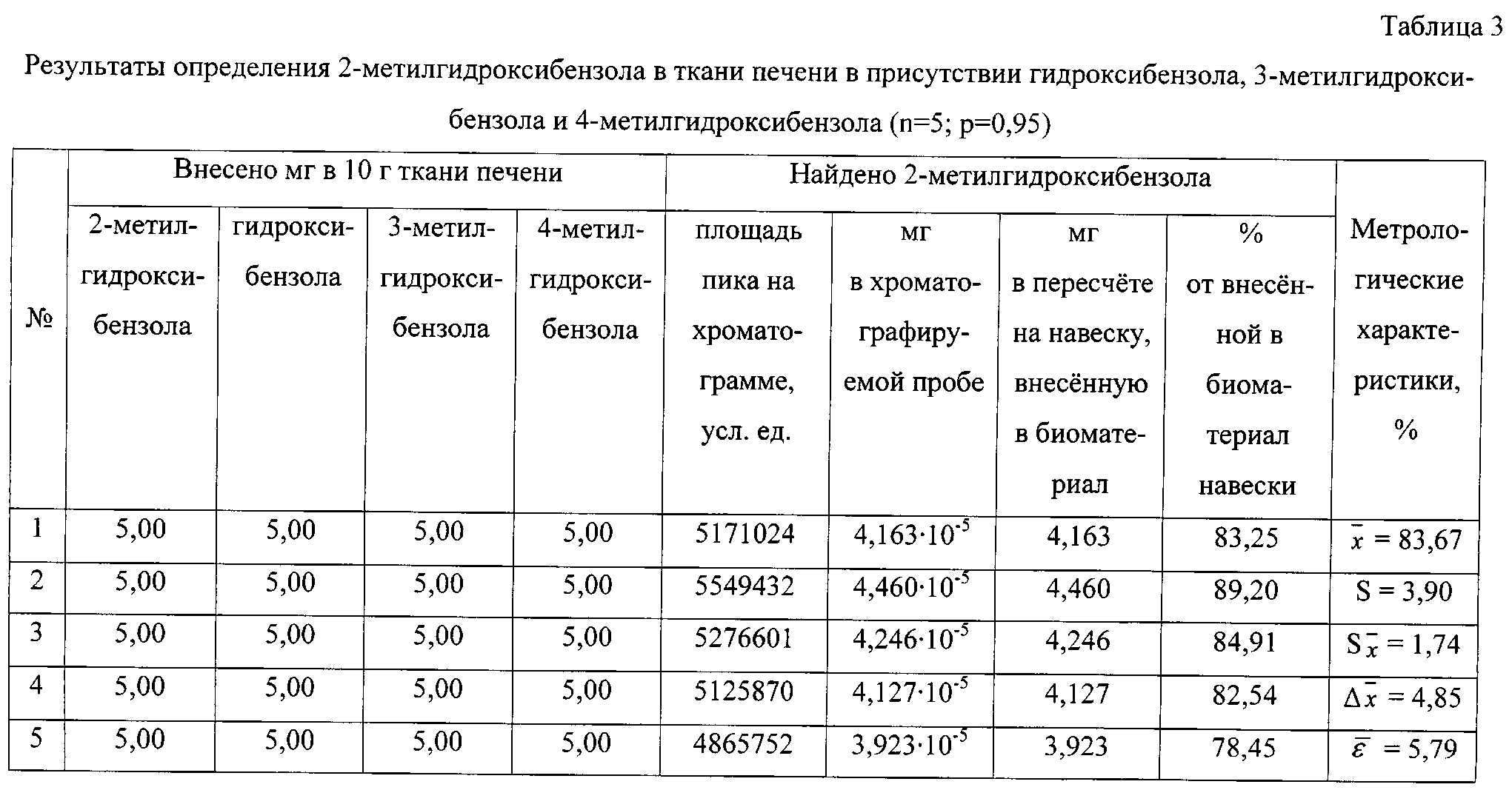
Пик на хроматограмме с временем удерживания 7,75 мин соответствует триметилсилильному производному 2-метилгидроксибензола. В масс-спектре данного соединения, снятому по полному ионному току, обнаруживаются сигналы ряда характеристических заряженных частиц с массовыми числами 73, 77, 91, 135, 149, 165, 166, 180. Наиболее интенсивной является частица с массовым числом 165, интенсивность которой принимается за 100%.
По площади хроматографического пика, полученного при регистрации интенсивности по полному ионному току, определяют количественное содержание 2-метилгидроксибензола, используя уравнение граду ировочного графика, и пересчитывают на навеску анализируемого вещества, внесенную в биологический материал.
Построение градуировочного графика
В ряд мерных колб вместимостью 25 мл вносят 0,1, 1,0, 2,0, 5,0, 10,0 мл 0,125% раствора и 5,0, 10,0, 20,0 мл 1,25% раствора 2-метилгидроксибензола в дихлорметане и доводят объем содержимого каждой колбы до метки дихлорметаном.
0,1 мл каждого из растворов вносят в пробирку вместимостью 0,2 мл, обрабатывают в течение 20 минут 0,016 мл N-метил-N-триметилсилил-трифторацетамида в условиях нагревания при 60°C, продукт реакции вместе с содержимым пробирки количественно переносят в мерную колбу вместимостью 10 мл и доводят дихлорметаном до метки.
4 мкл каждого из полученных растворов вводят в хромато-масс-спектрометр.
Определение проводят, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой толщиной 0,33 мкм, представляющей собой (5%-фенил)-метилполисилоксан.
Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура программируется от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 10 минут, температура инжектора составляет 250°C, температура квадруполя 150°C, температура источника ионов - 230°C, температура интерфейса детектора 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество 2-метилгидроксибензола по площади хроматографического пика его триметилсилильного производного.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
По результатам измерений на хромато-масс-спектрометре строят график зависимости площади пика от концентрации определяемого вещества График линеен в интервале концентраций 1·10-10-4·10-7 г. Методом наименьших квадратов рассчитывают уравнение градуировочного графика, которое имеет вид:
S=127196·C-12351,
где S - площадь хроматографического пика триметилсилильного производного 2-метилгидроксибензола, С - условная концентрация 2-метилгидроксибензола в хроматографируемой пробе, нг.
Результаты количественного определения 2-метилгидроксибензола в ткани печени представлены в таблице 3.
Пример 4
Количественное определение 3-метилгидрокси-бензола в ткани печени в присутствии гидрокси-бензола, 2-метилгидроксибензола и 4-метилгидр-оксибензола
Биологический объект, представляющий собой 10 г ткани печени, мелко измельчают (до размеров частиц 0,2-0,5 г), к мелкоизмельченной ткани печени прибавляют смесь гидроксибензола, 2-метилгидроксибензола, 3-метилгидроксибензола и 4-метилгидроксибензола по 5 мг каждого из веществ, тщательно перемешивают биологическую ткань с веществами и оставляют на сутки при температуре 16-20°C. По истечении указанного времени биологический объект обрабатывают двукратно по 30 минут порциями этилацетата объемом 20 мл каждая при периодическом перемешивании. Отдельные этилацетатные вытяжки отделяют, объединяют, обрабатывают 1 мл 8% этанольного раствора гидроксида калия, растворитель из объединенной этилацетатной вытяжки испаряют в токе воздуха при 16-20°C, остаток неоднократно (трижды по 3 минуты) обрабатывают при энергичном перемешивании порциями (по 15 г каждая) ацетона, содержащего концентрированную (10 М) хлороводородную кислоту в количестве 1%, что обеспечивает избыток хлороводородной кислоты по отношению к гидроксиду калия, находящемуся в остатке, подкисленные ацетоновые извлечения объединяют, обрабатывают 2 мл 10% водного раствора гидроксида натрия для нейтрализации остатков хлороводородной кислоты в ацетоне и создания избытка щелочной среды, ацетон испаряют из объединенного извлечения в токе воздуха при температуре 16-20°C, водно-щелочной остаток разбавляют водой, доводя объем раствора до 10 мл, образующийся раствор подкисляют 24% раствором хлороводородной кислоты до pH 2-3, насыщают сульфатом натрия, экстрагируют диэтиловым эфиром дважды порциями по 10 мл, эфирные экстракты объединяют, объединенный экстракт обезвоживают, пропуская через стеклянный фильтр диаметром 4 см со слоем безводного сульфата натрия толщиной 1-1,5 см, фильтр дополнительно промывают 20 мл диэтилового эфира. Отдельные фильтраты объединяют, упаривают в токе воздуха при 16-20°C до объема 4-5 мл, полученный объем смешивают с 1,5 г силикагеля L 40/100 мкм и испаряют остатки эфира из сорбента в токе воздуха при 16-20°C.
В колонку размером 240×15 мм вносят вначале 18,5 г силикагеля L 40/100 мкм, а затем, поверх образующегося слоя, - 1,5 г силикагеля L 40/100 мкм, содержащего анализируемое вещество, предварительно введенное в виде эфирного раствора.
Хроматографируют в колонке с силикагелем, используя подвижную фазу гексан-диэтиловый эфир в соотношении 6:4 по объему. Элюат собирают отдельными фракциями по 2 мл каждая. Фракции с 5 по 13 включительно, содержащие гидроксибензол и его монометильные замещенные, объединяют, элюент испаряют в токе воздуха при температуре 16-20°C до объема 6-8 мл, доводят до 10 мл смесью растворителей гексан-диэтиловый эфир в соотношении 6:4 по объему, экстрагируют дважды порциями буферного раствора с pH 12-13, отдельные экстракты отделяют, объединяют, объединенный водно-щелочной экстракт подкисляют 24% раствором хлороводородной кислоты до pH 2-3, насыщают полученный раствор сульфатом натрия и экстрагируют порциями дихлорметана трижды по 8 мл каждая. Отдельные органические экстракты отделяют, объединяют, объединенный дихлорметановый экстракт обезвоживают, пропуская через стеклянный фильтр диаметром 4 см со слоем безводного сульфата натрия толщиной 1-1,5 см, фильтр дополнительно промывают 10 мл дихлорметана. Отдельные фильтраты объединяют, упаривают в токе воздуха при температуре 16-20°C до объема 2-3 мл и доводят дихлорметаном до 5 мл (раствор А).
0,1 мл раствора А вносят в пробирку вместимостью 0,2 мл, обрабатывают в течение 20 минут 0,016 мл дериватизирующего реагента, которым является N-метил-N-триметилсилил-трифторацетамид, в условиях нагревания при 60°C, продукт реакции вместе с содержимым пробирки количественно переносят в мерную колбу вместимостью 10 мл и доводят дихлорметаном до метки (раствор Б).
4 мкл раствора Б вводят в хромато-масс-спектрометр.
Определение проводят физико-химическим методом, которым является хромато-масс-спектрометрия, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой толщиной 0,33 мкм, представляющей собой (5%-фенил)-метилполисилоксан.
Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура программируется от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 10 минут, температура инжектора составляет 250°C, температура квадруполя - 150°C, температура источника ионов - 230°C, температура интерфейса детектора - 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество 3-метилгидроксибензола по площади хроматографического пика его триметилсилильного производного.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
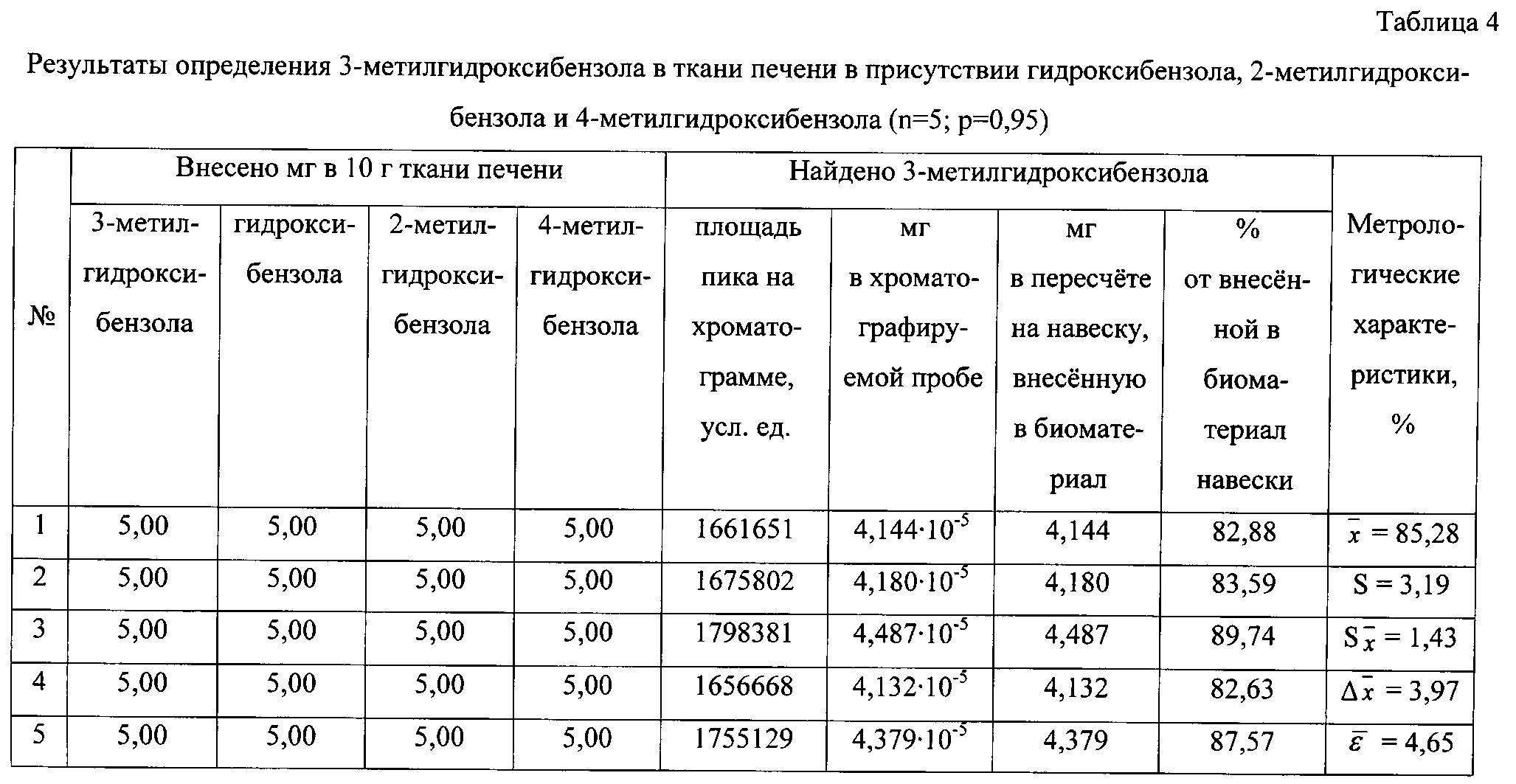
Пик на хроматограмме с временем удерживания 7,83 мин соответствует триметилсилильному производному 3-метилгидроксибензола. В масс-спектре данного соединения, снятому по полному ионному току, обнаруживаются сигналы ряда характеристических заряженных частиц с массовыми числами 65, 73, 77, 91, 149, 165, 166, 180. Наиболее интенсивной является частица с массовым числом 165, интенсивность которой принимается за 100%.
По площади хроматографического пика, полученного при регистрации интенсивности по полному ионному току, определяют количественное содержание 3-метилгидроксибензола, используя уравнение градуировочного графика, и пересчитывают на навеску анализируемого вещества, внесенную в биологический материал.
Построение градуировочного графика
В ряд мерных колб вместимостью 25 мл вносят 0,5, 1,0, 5,0, 20,0 мл 0,125% раствора и 2,5, 5,0, 10,0, 15,0 мл 2,5% раствора 3-метилгидроксибензола в дихлорметане и доводят объем содержимого каждой колбы до метки дихлорметаном.
0,1 мл каждого из растворов вносят в пробирку вместимостью 0,2 мл, обрабатывают в течение 20 минут 0,016 мл N-метил-N-триметилсилил-трифторацетамида в условиях нагревания при 60°C, продукт реакции вместе с содержимым пробирки количественно переносят в мерную колбу вместимостью 10 мл и доводят дихлорметаном до метки.
4 мкл каждого из полученных растворов вводят в хромато-масс-спектрометр.
Определение проводят, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой толщиной 0,33 мкм, представляющей собой (5%-фенил)-метилполисилоксан.
Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура программируется от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 10 минут, температура инжектора составляет 250°C, температура квадруполя 150°C, температура источника ионов - 230°C, температура интерфейса детектора 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество 3-метилгидроксибензола по площади хроматографического пика его триметилсилильного производного.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
По результатам измерений на хромато-масс-спектрометре строят график зависимости площади пика от концентрации определяемого вещества График линеен в интервале концентраций 5·10-10-6·10-7 г. Методом наименьших квадратов рассчитывают уравнение градуировочного графика, которое имеет вид:
S=39863·С+9728,
где S - площадь хроматографического пика триметилсилильного производного 3-метилгидроксибензола, С - условная концентрация 3-метилгидроксибензола в хроматографируемой пробе, нг.
Результаты количественного определения 3-метилгидроксибензола в ткани печени представлены в таблице 4.
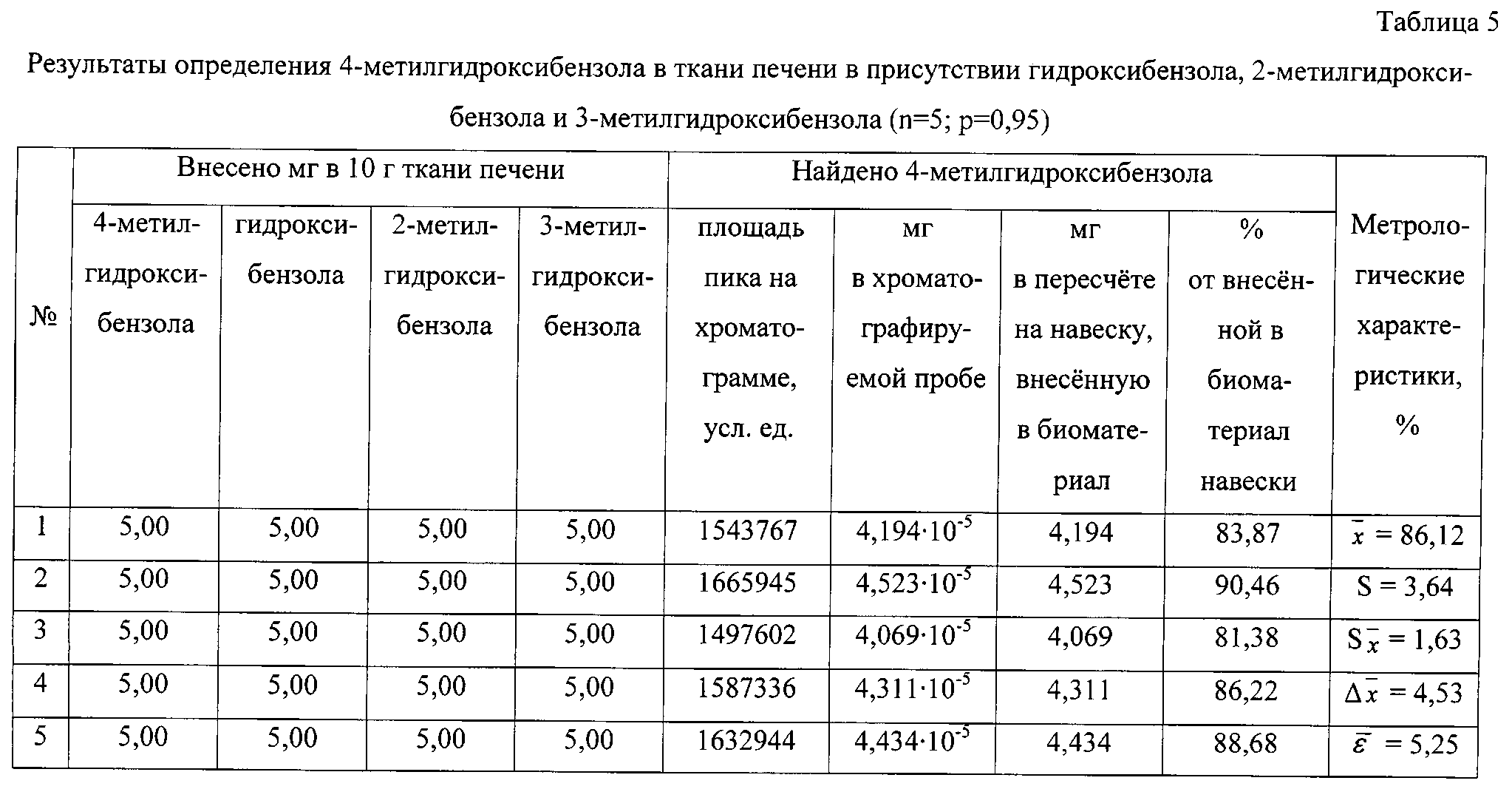
Пример 5
Количественное определение 4-метилгидрокси-бензола в ткани печени в присутствии гидрокси-бензола, 2-метилгидроксибензола и 3-метилгидр-оксибензола
Биологический объект, представляющий собой 10 г ткани печени, мелко измельчают (до размеров частиц 0,2-0,5 г), к мелкоизмельченной ткани печени прибавляют смесь гидроксибензола, 2-метилгидроксибензола, 3-метилгидроксибензола и 4-метилгидроксибензола по 5 мг каждого из веществ, тщательно перемешивают биологическую ткань с веществами и оставляют на сутки при температуре 16-20°C. По истечении указанного времени биологический объект обрабатывают двукратно по 30 минут порциями этилацетата объемом 20 мл каждая при периодическом перемешивании. Отдельные этилацетатные вытяжки отделяют, объединяют, обрабатывают 1 мл 8% этанольного раствора гидроксида калия, растворитель из объединенной этилацетатной вытяжки испаряют в токе воздуха при 16-20°C, остаток неоднократно (трижды по 3 минуты) обрабатывают при энергичном перемешивании порциями (по 15 г каждая) ацетона, содержащего концентрированную (10 М) хлороводородную кислоту в количестве 1%, что обеспечивает избыток хлороводородной кислоты по отношению к гидроксиду калия, находящемуся в остатке, подкисленные ацетоновые извлечения объединяют, обрабатывают 2 мл 10% водного раствора гидроксида натрия для нейтрализации остатков хлороводородной кислоты в ацетоне и создания избытка щелочной среды, ацетон испаряют из объединенного извлечения в токе воздуха при температуре 16-20°C, водно-щелочной остаток разбавляют водой, доводя объем раствора до 10 мл, образующийся раствор подкисляют 24% раствором хлороводородной кислоты до pH 2-3, насыщают сульфатом натрия, экстрагируют диэтиловым эфиром дважды порциями по 10 мл, эфирные экстракты объединяют, объединенный экстракт обезвоживают, пропуская через стеклянный фильтр диаметром 4 см со слоем безводного сульфата натрия толщиной 1-1,5 см, фильтр дополнительно промывают 20 мл диэтилового эфира. Отдельные фильтраты объединяют, упаривают в токе воздуха при 16-20°C до объема 4-5 мл, полученный объем смешивают с 1,5 г силикагеля L 40/100 мкм и испаряют остатки эфира из сорбента в токе воздуха при 16-20°C.
В колонку размером 240×15 мм вносят вначале 18,5 г силикагеля L 40/100 мкм, а затем, поверх образующегося слоя, - 1,5 г силикагеля L 40/100 мкм, содержащего анализируемое вещество, предварительно введенное в виде эфирного раствора.
Хроматографируют в колонке с силикагелем, используя подвижную фазу гексан-диэтиловый эфир в соотношении 6:4 по объему. Элюат собирают отдельными фракциями по 2 мл каждая. Фракции с 5 по 13 включительно, содержащие гидроксибензол и его монометильные замещенные, объединяют, элюент испаряют в токе воздуха при температуре 16-20°C до объема 6-8 мл, доводят до 10 мл смесью растворителей гексан-диэтиловый эфир в соотношении 6:4 по объему, экстрагируют дважды порциями буферного раствора с pH 12-13, отдельные экстракты отделяют, объединяют, объединенный водно-щелочной экстракт подкисляют 24% раствором хлороводородной кислоты до pH 2-3, насыщают полученный раствор сульфатом натрия и экстрагируют порциями дихлорметана трижды по 8 мл каждая. Отдельные органические экстракты отделяют, объединяют, объединенный дихлорметановый экстракт обезвоживают, пропуская через стеклянный фильтр диаметром 4 см со слоем безводного сульфата натрия толщиной 1-1,5 см, фильтр дополнительно промывают 10 мл дихлорметана. Отдельные фильтраты объединяют, упаривают в токе воздуха при температуре 16-20°C до объема 2-3 мл и доводят дихлорметаном до 5 мл (раствор А).
0,1 мл раствора А вносят в пробирку вместимостью 0,2 мл, обрабатывают в течение 20 минут 0,016 мл дериватизирующего реагента, которым является N-метил-N-триметилсилил-трифторацетамид, в условиях нагревания при 60°C, продукт реакции вместе с содержимым пробирки количественно переносят в мерную колбу вместимостью 10 мл и доводят дихлорметаном до метки (раствор Б).
4 мкл раствора Б вводят в хромато-масс-спектрометр.
Определение проводят физико-химическим методом, которым является хромато-масс-спектрометрия, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой толщиной 0,33 мкм, представляющей собой (5%-фенил)-метилполисилоксан.
Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура программируется от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 10 минут, температура инжектора составляет 250°C, температура квадруполя - 150°C, температура источника ионов - 230°C, температура интерфейса детектора - 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество 4-метилгидроксибензола по площади хроматографического пика его триметилсилильного производного.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
Пик на хроматограмме с временем удерживания 8,00 мин соответствует триметилсилильному производному 4-метилгидроксибензола. В масс-спектре данного соединения, снятому по полному ионному току, обнаруживаются сигналы ряда характеристических заряженных частиц с массовыми числами 73, 82, 91, 135, 149, 165, 166, 180. Наиболее интенсивной является частица с массовым числом 165, интенсивность которой принимается за 100%.
По площади хроматографического пика, полученного при регистрации интенсивности по полному ионному току, определяют количественное содержание 4-метилгидроксибензола, используя уравнение градуировочного графика, и пересчитывают на навеску анализируемого вещества, внесенную в биологический материал.
Построение градуировочного графика
В ряд мерных колб вместимостью 25 мл вносят 0,6, 1,0, 5,0, 20,0 мл 0,125% раствора и 2,5, 5,0, 10,0, 15,0 мл 2,5% раствора 4-метилгидроксибензола в дихлорметане и доводят объем содержимого каждой колбы до метки дихлорметаном.
0,1 мл каждого из растворов вносят в пробирку вместимостью 0,2 мл, обрабатывают в течение 20 минут 0,016 мл N-метил-N-триметилсилил-трифторацетамида в условиях нагревания при 60°C, продукт реакции вместе с содержимым пробирки количественно переносят в мерную колбу вместимостью 10 мл и доводят дихлорметаном до метки.
4 мкл каждого из полученных растворов вводят в хромато-масс-спектрометр.
Определение проводят, используя газовый хроматограф фирмы Agilent Technologies (США) модели 6850 Network GC System с квадрупольным масс-селективным детектором модели 5973 Network этой же фирмы.
Хроматографирование осуществляют в капиллярной колонке DB-5 MS EVIDEX длиной 25 м, внутренним диаметром 0,2 мм с неподвижной фазой толщиной 0,33 мкм, представляющей собой (5%-фенил)-метилполисилоксан.
Начальная температура термостата колонки составляет 70°C, данная температура выдерживается в течение 3 минут, в дальнейшем температура программируется от 70°C до 290°C со скоростью 20°C в минуту, конечная температура колонки выдерживается в течение 10 минут, температура инжектора составляет 250°C, температура квадруполя 150°C, температура источника ионов - 230°C, температура интерфейса детектора 300°C, регистрируют интенсивность сигнала, обусловленного заряженными частицами, образующимися при бомбардировке анализируемого вещества, вышедшего из капиллярной колонки и попавшего в источник ионов, ионизирующим пучком электронов с энергией 70 эВ, регистрируют масс-спектр по полному ионному току и вычисляют количество 4-метилгидроксибензола по площади хроматографического пика его триметилсилильного производного.
В качестве газа-носителя используется гелий. Подача газа-носителя производится со скоростью 0,6 мл/мин. Режим с делением потока 1:2. Масс-селективный детектор работает в режиме электронного удара (70 эВ). Регистрация масс-спектра проводится по полному ионному току с задержкой 3,5 минуты. Диапазон сканирования составляет 40-500 m/z.
По результатам измерений на хромато-масс-спектрометре строят график зависимости площади пика от концентрации определяемого вещества График линеен в интервале концентраций 6·10-10-6·10-7 г. Методом наименьших квадратов рассчитывают уравнение градуировочного графика, которое имеет вид:
S=37080·C-11183,
где S - площадь хроматографического пика триметилсилильного производного 4-метилгидроксибензола, С - условная концентрация 4-метилгидроксибензола в хроматографируемой пробе, нг.
Результаты количественного определения 4-метилгидроксибензола в ткани печени представлены в таблице 5.
Предлагаемый способ по сравнению с прототипом более чем в 100 раз повышает чувствительность определения в хроматографируемой пробе и в 33 раза - в биологическом материале, в 1,15 раза увеличивает степень извлечения гидроксибензола и его монометильных производных из ткани печени (для 4-метилоксибензола степень извлечения увеличивается с 75,05% до 86,12%), а также сокращает продолжительность процесса определения на 2 часа.
Сравнительная характеристика предлагаемого и известного способов представлена в таблице 6.