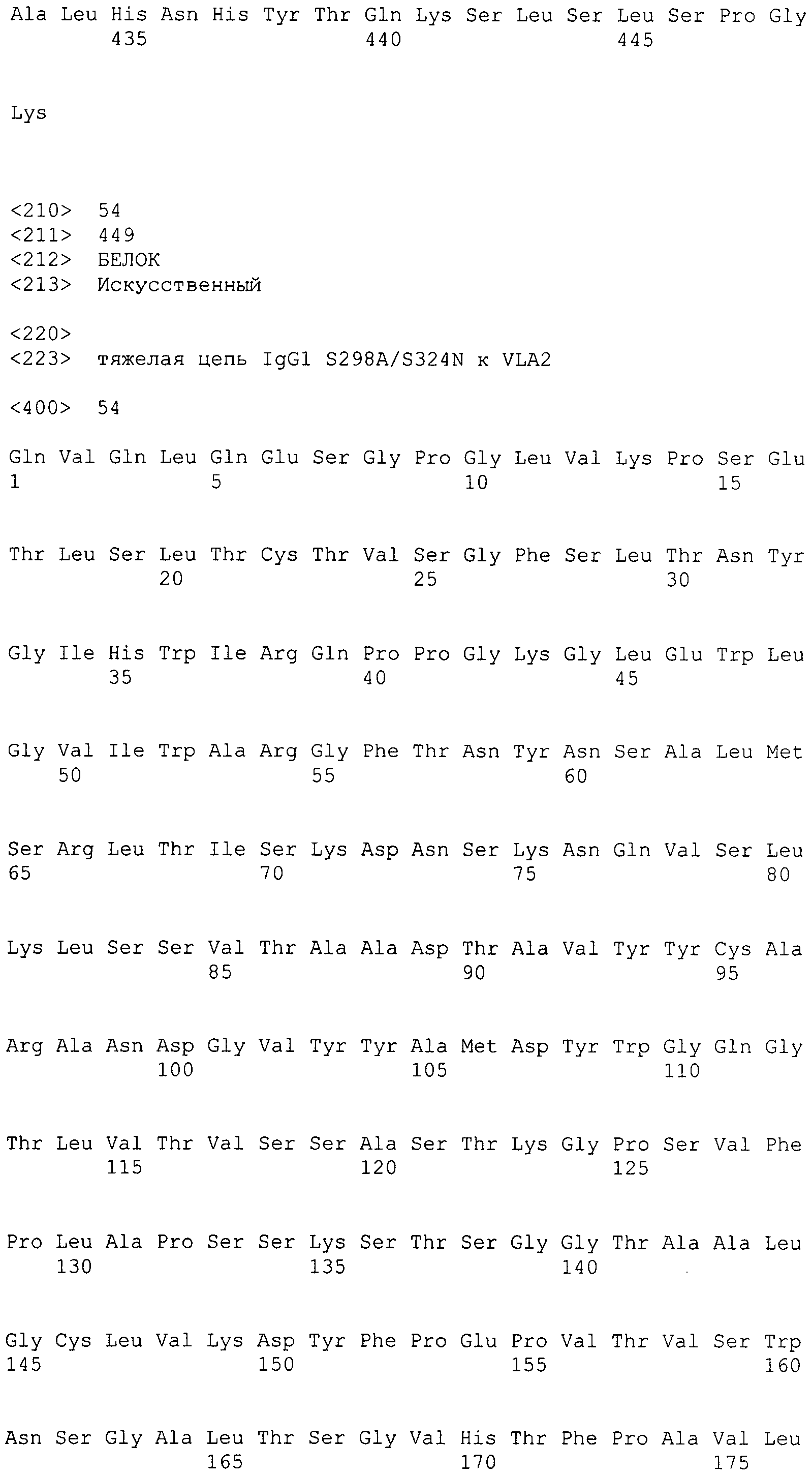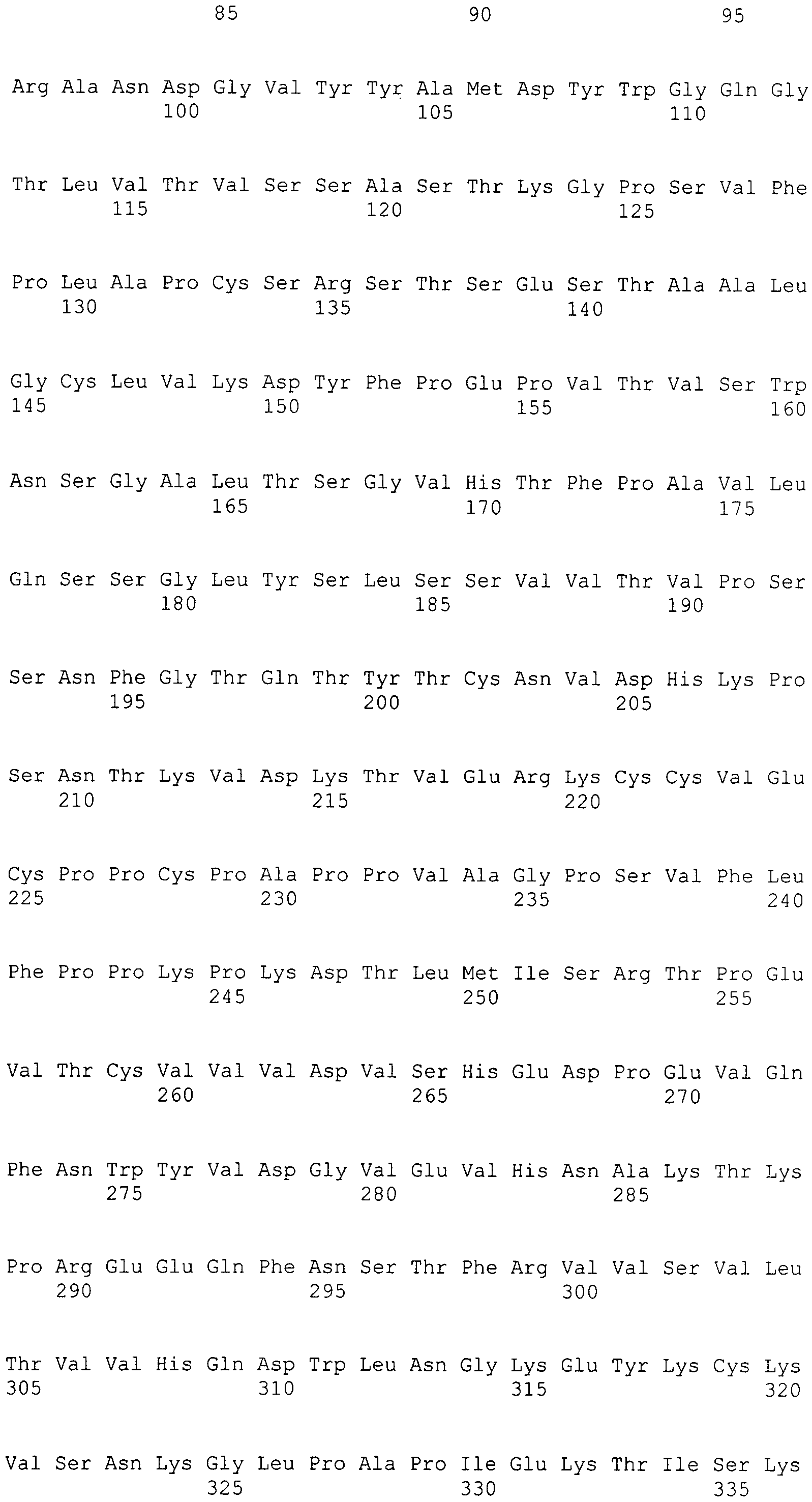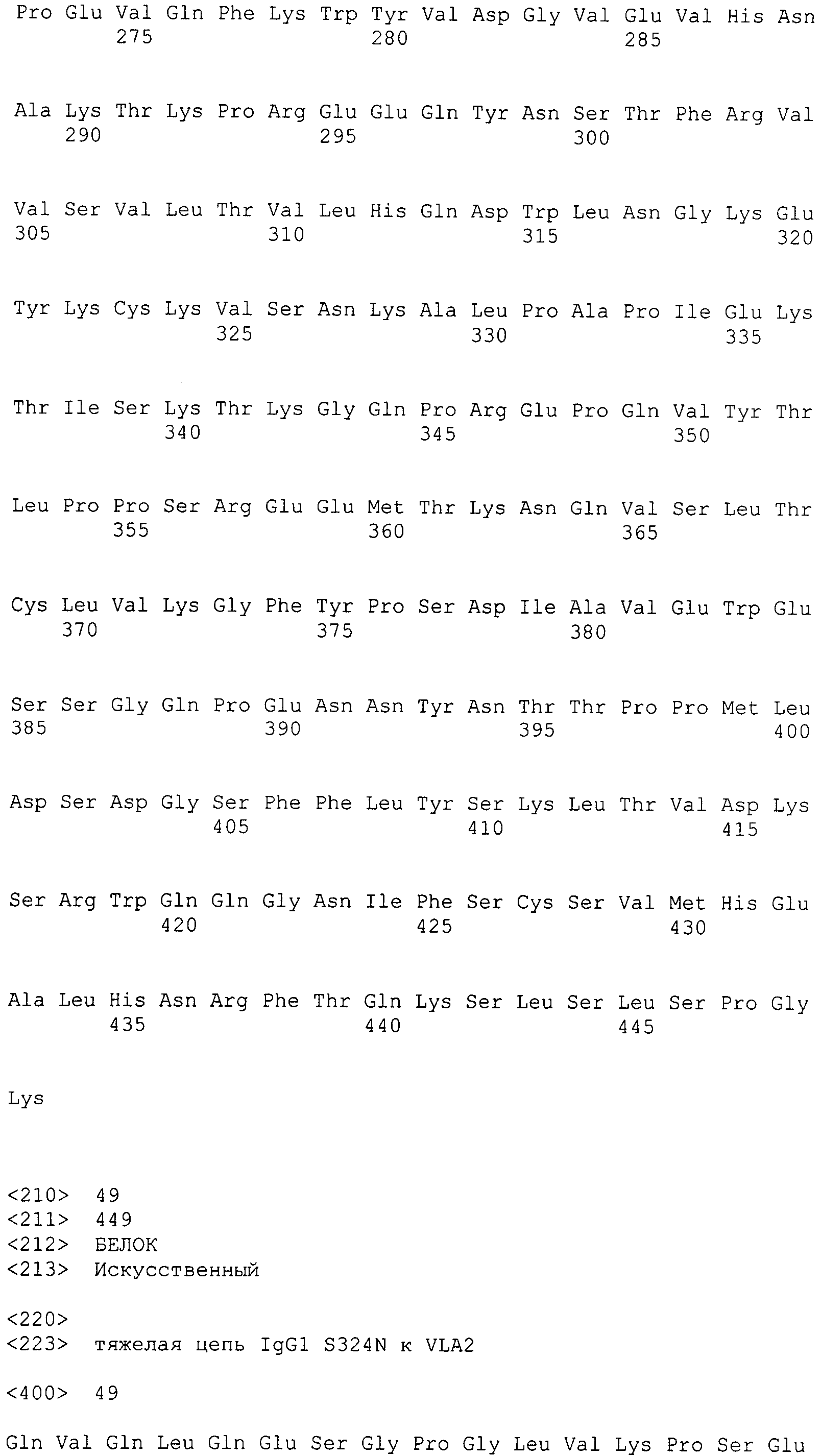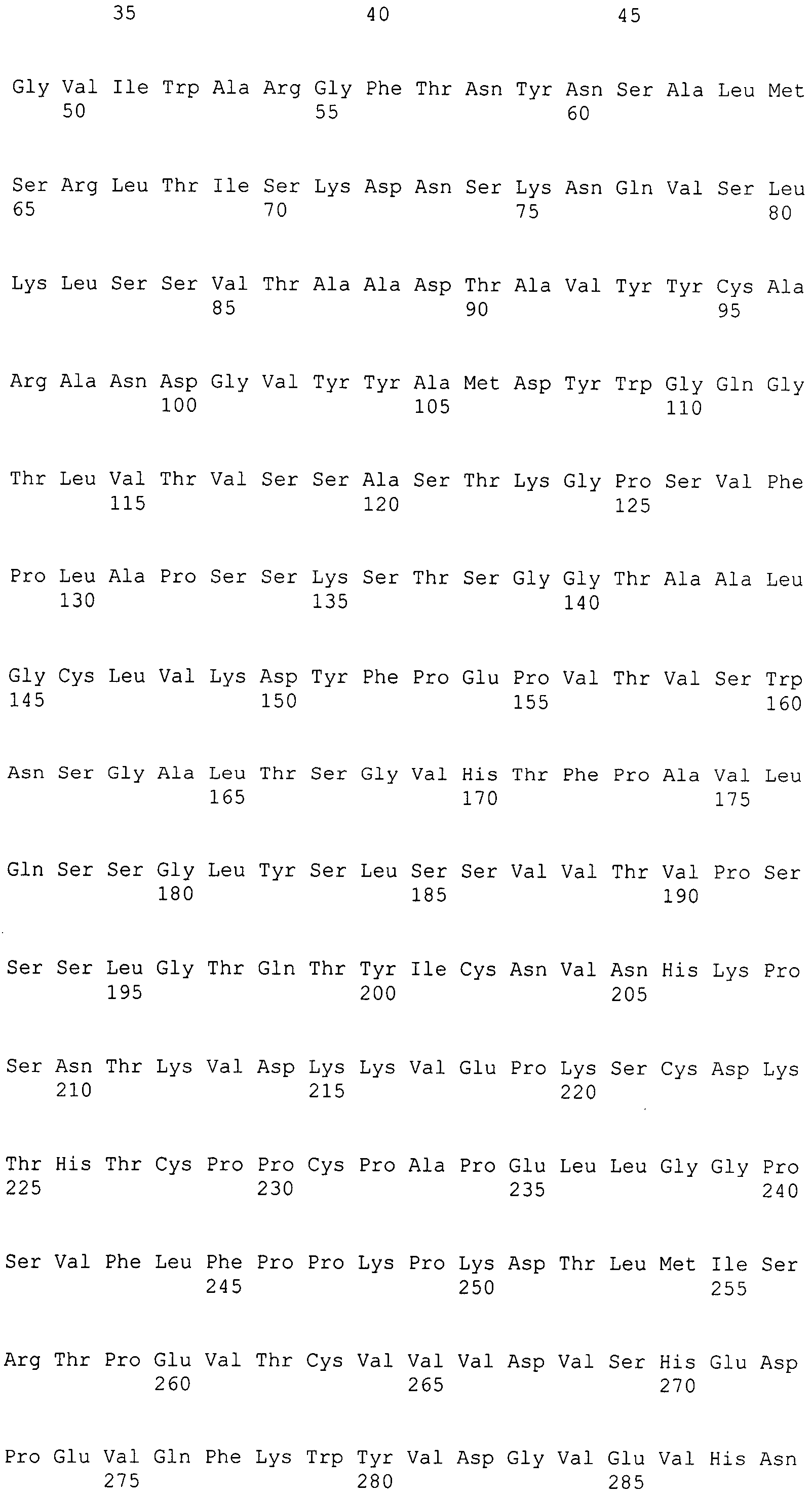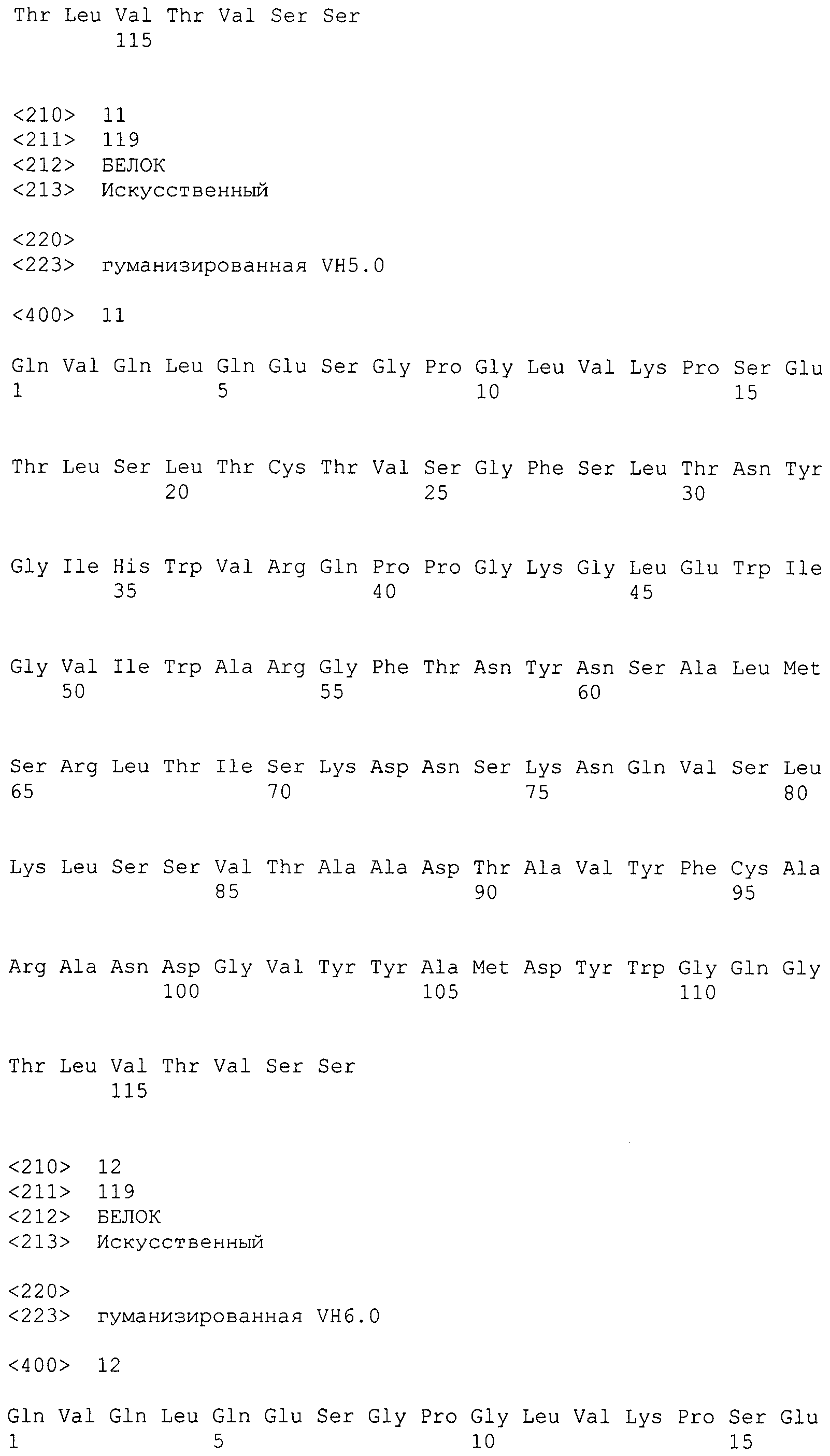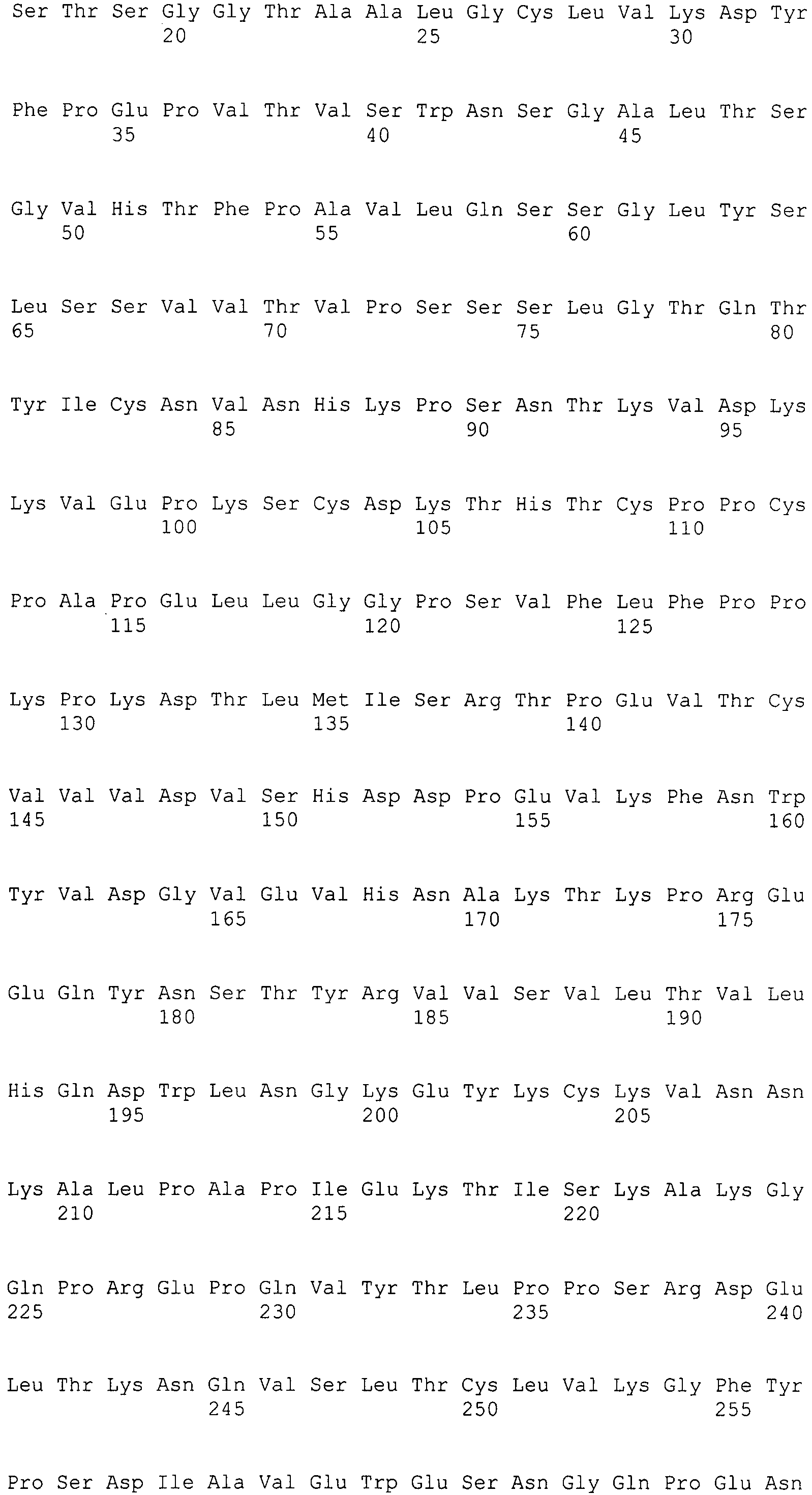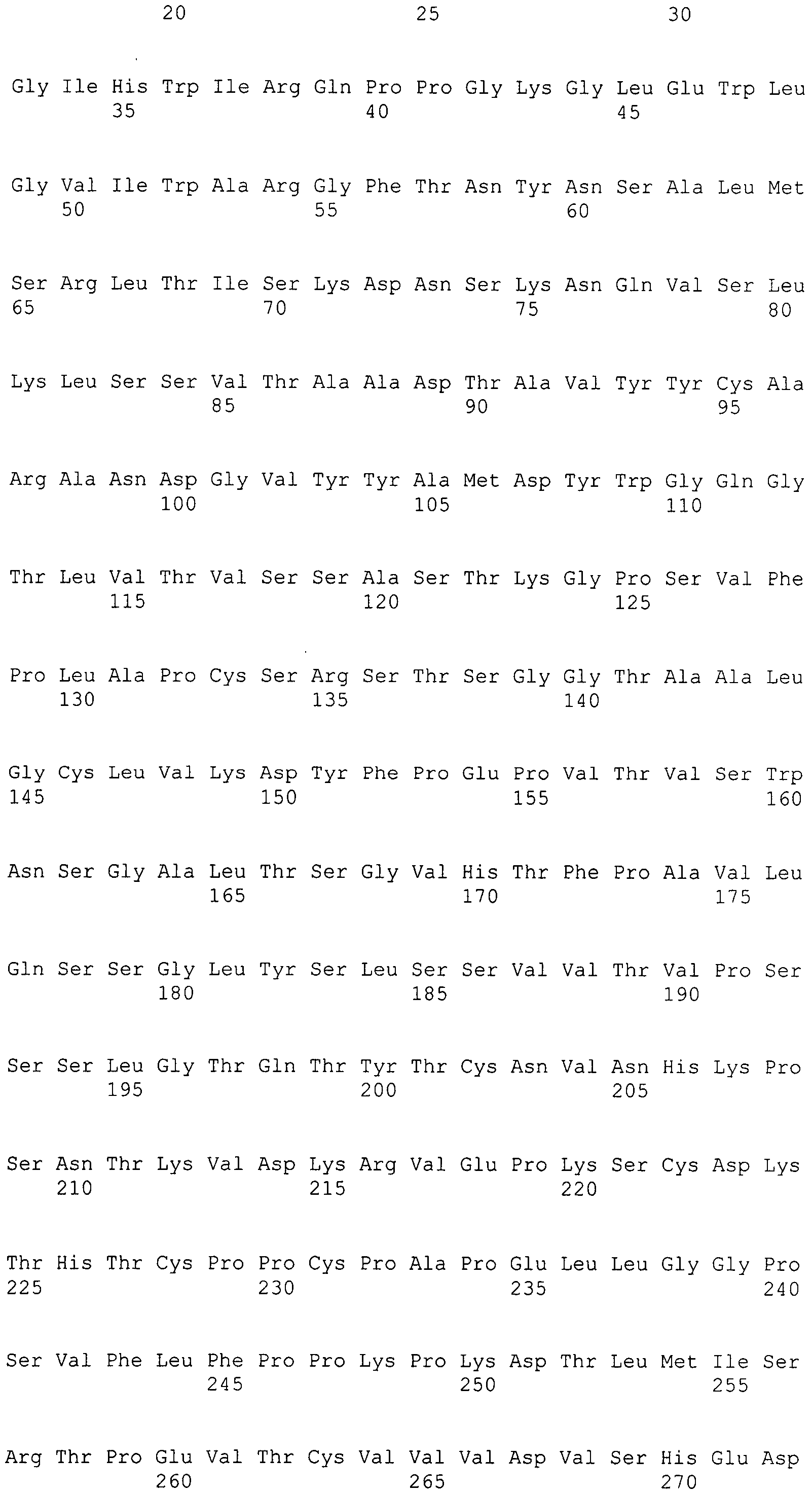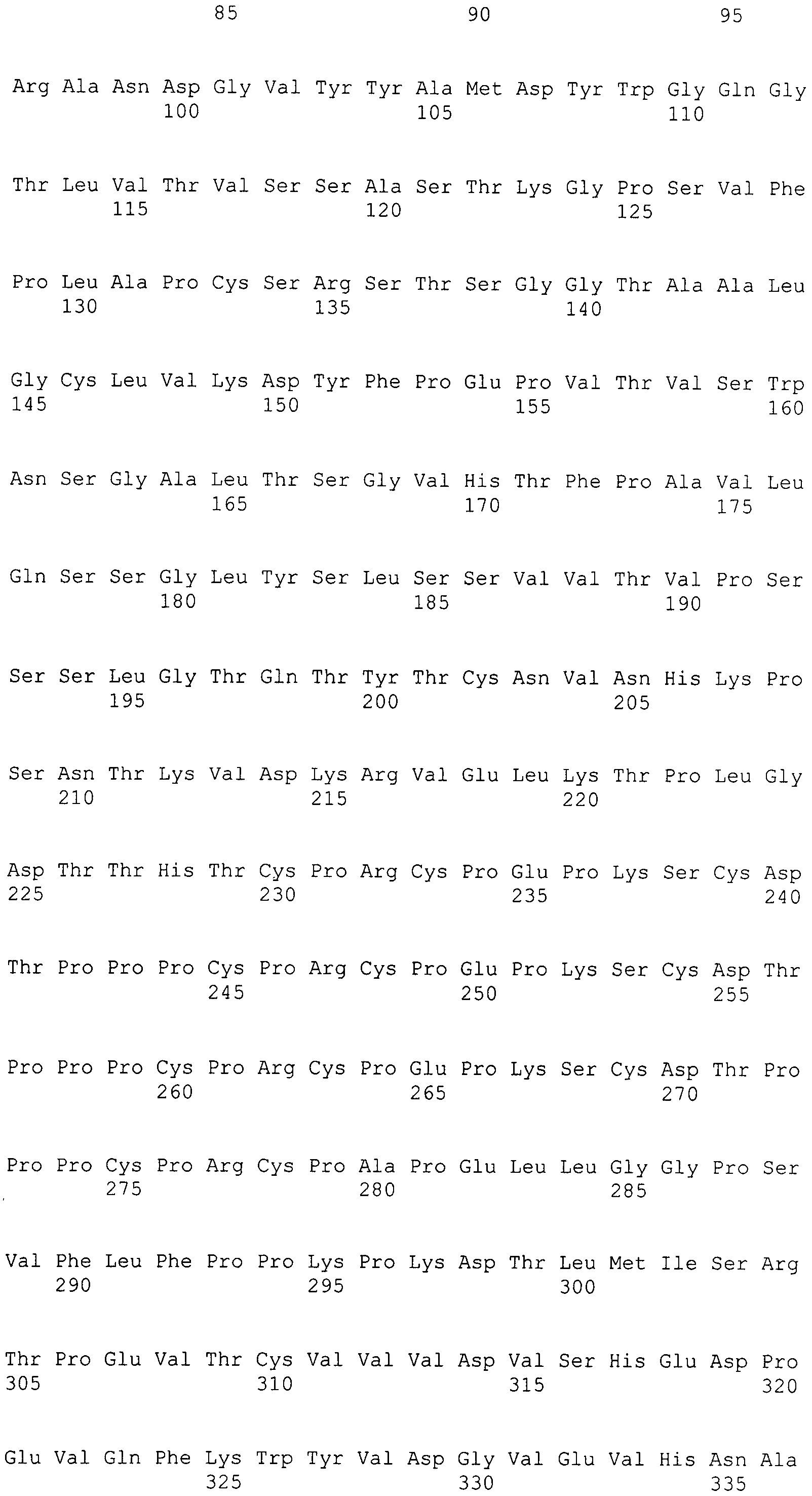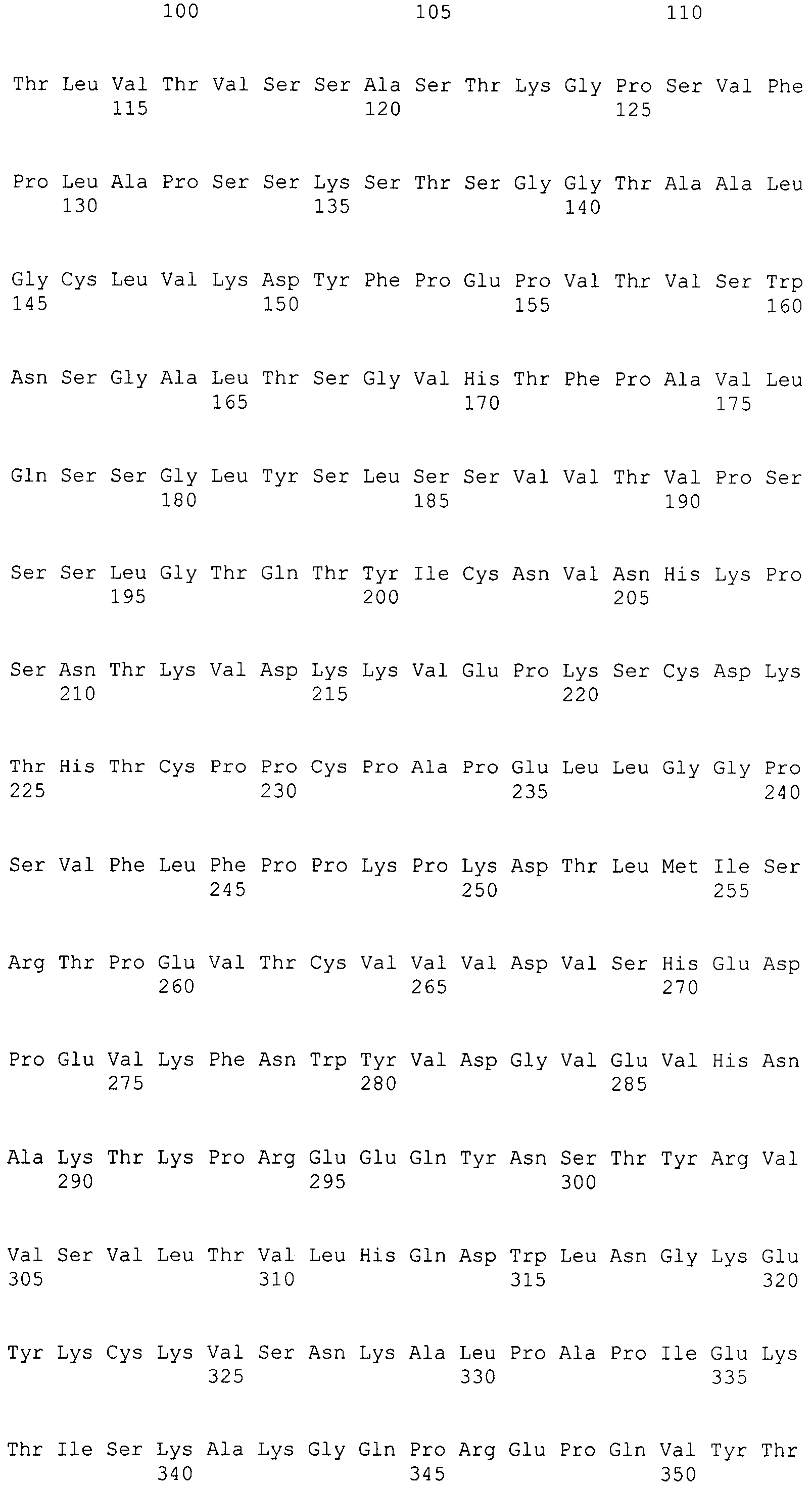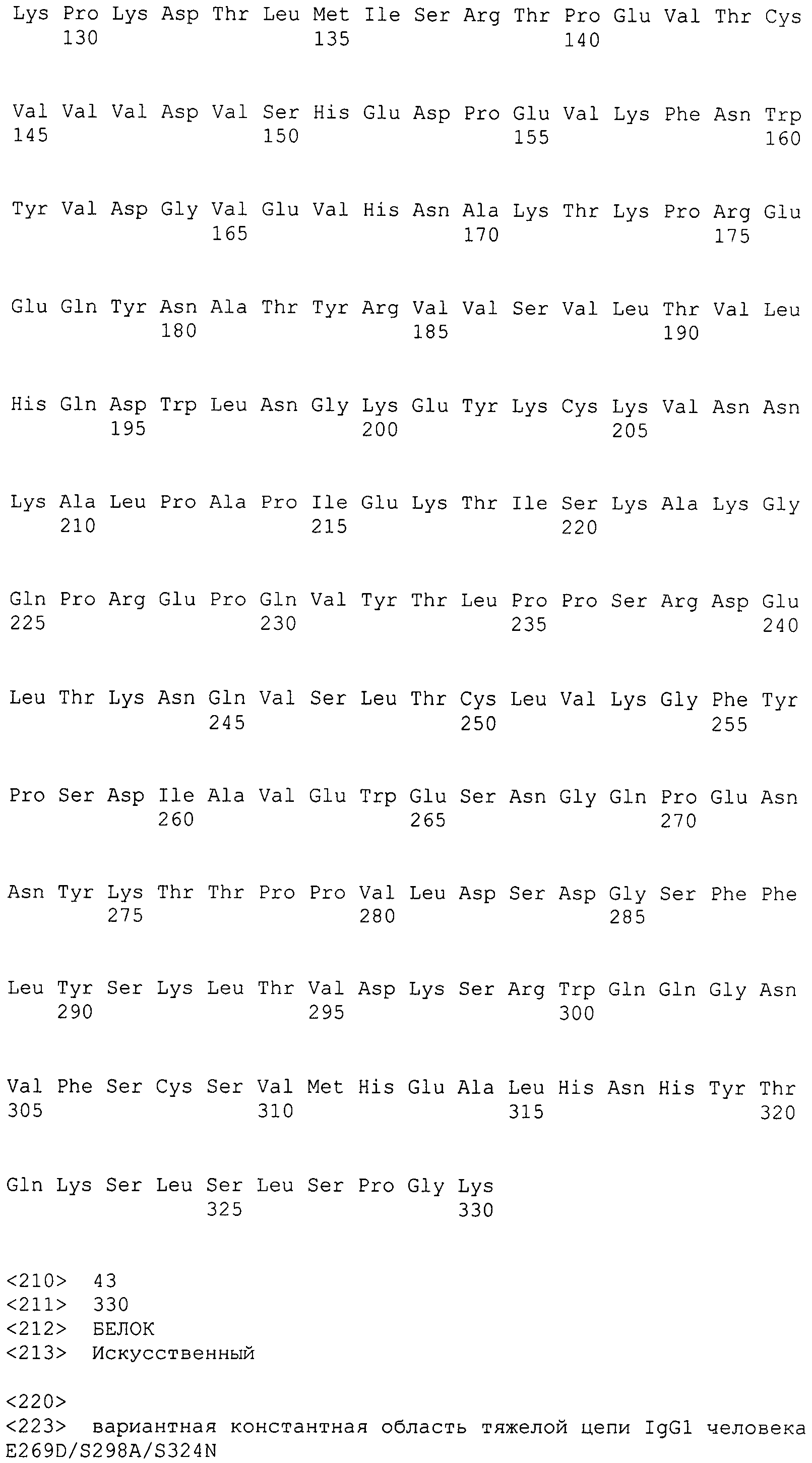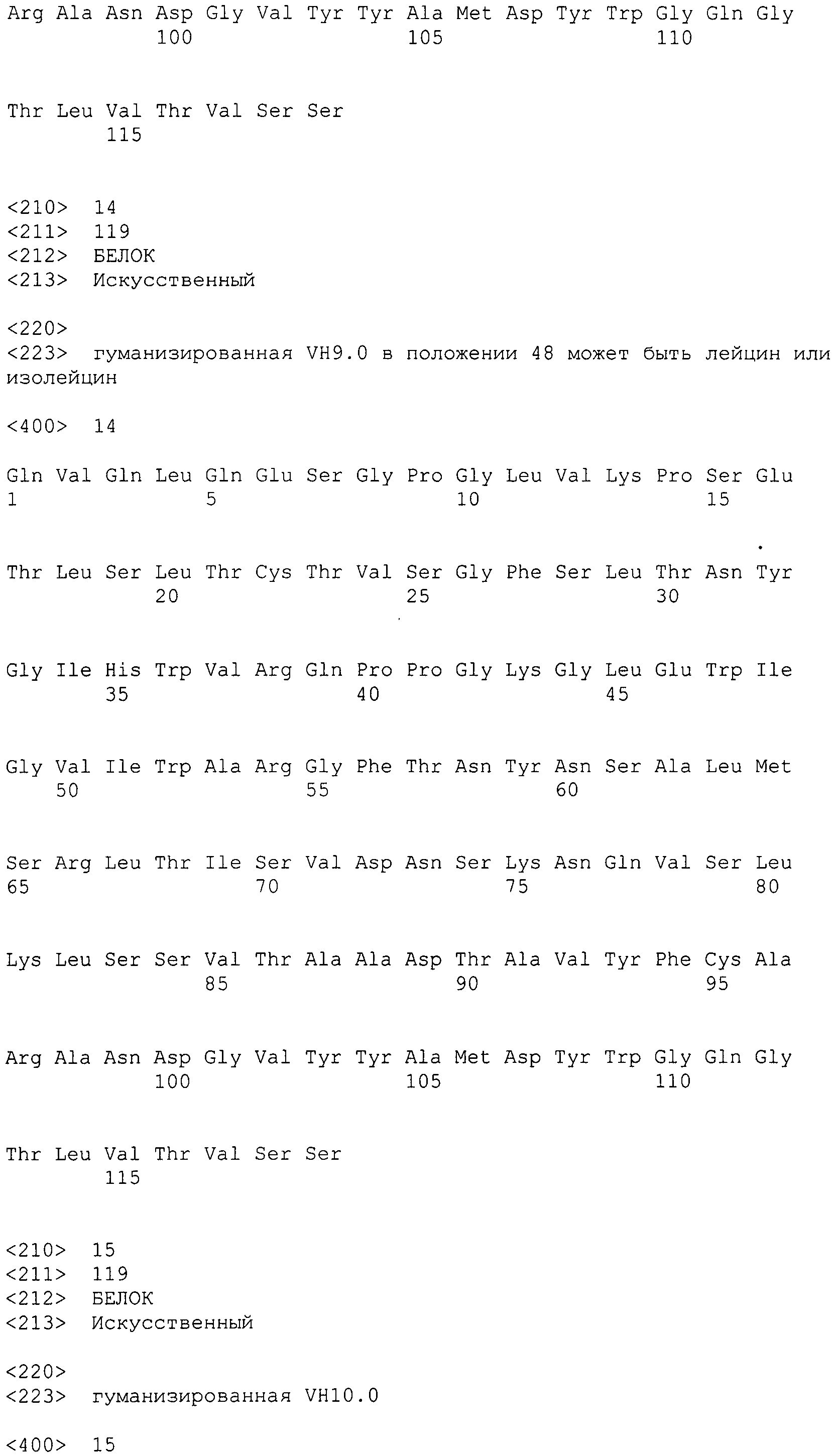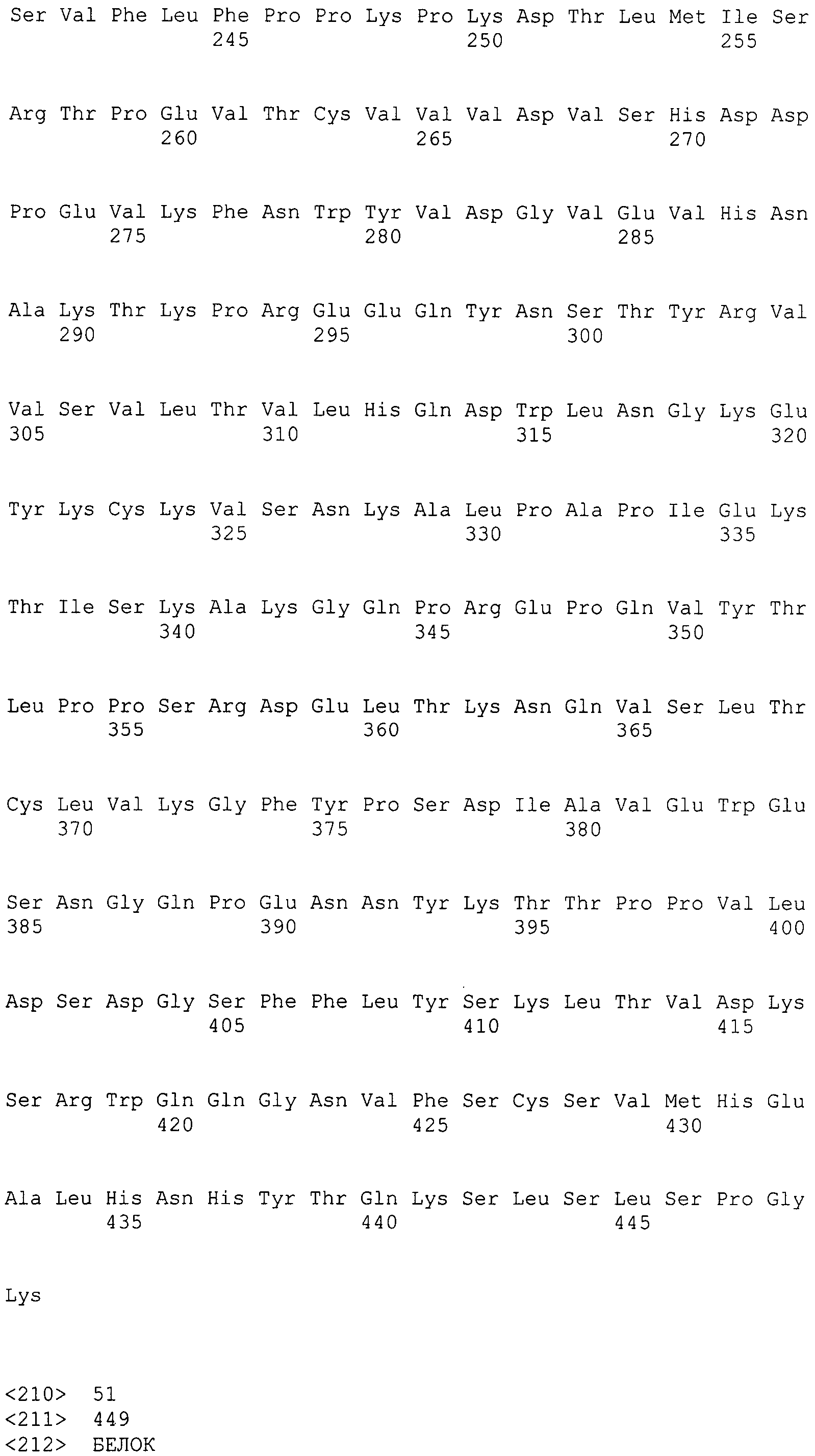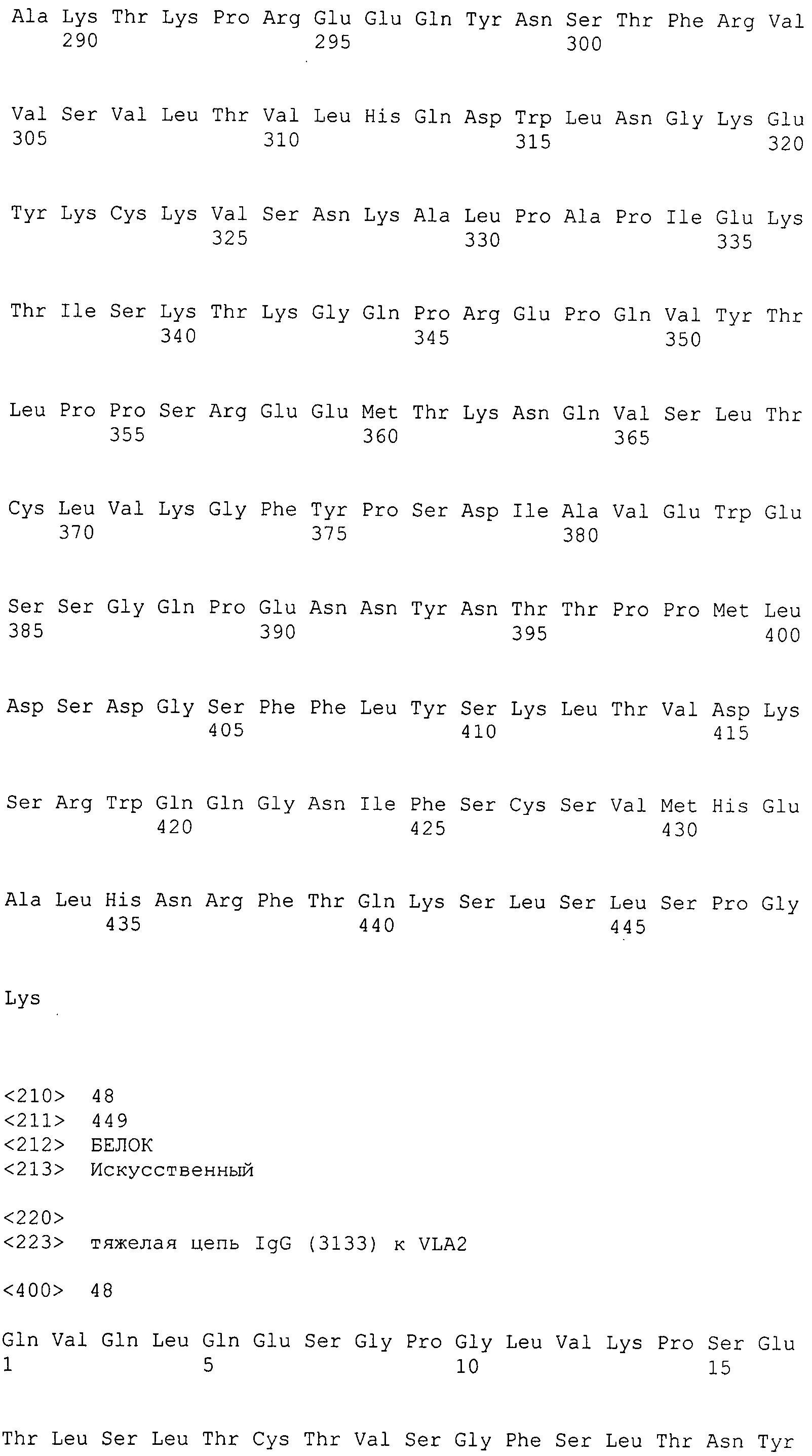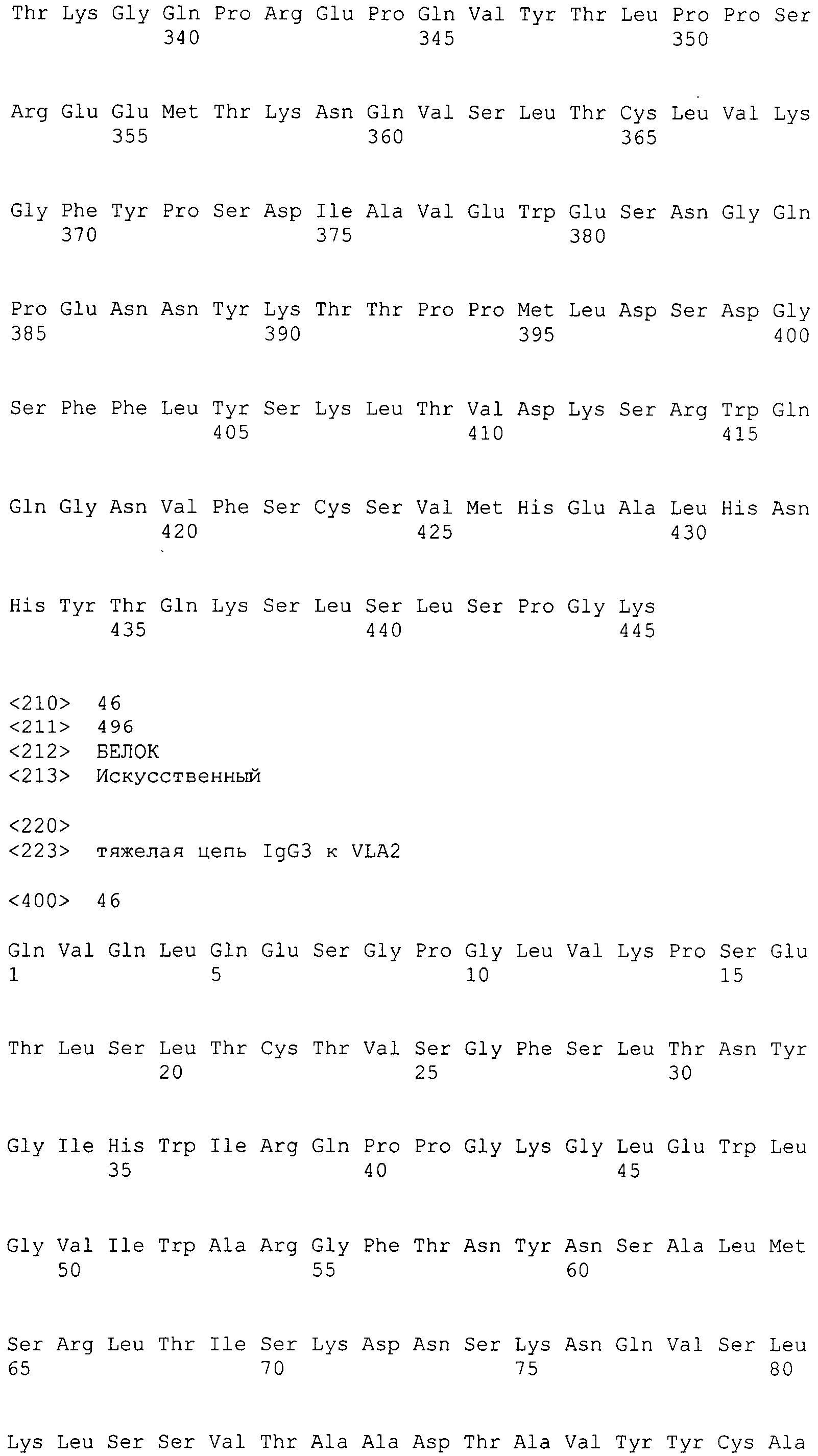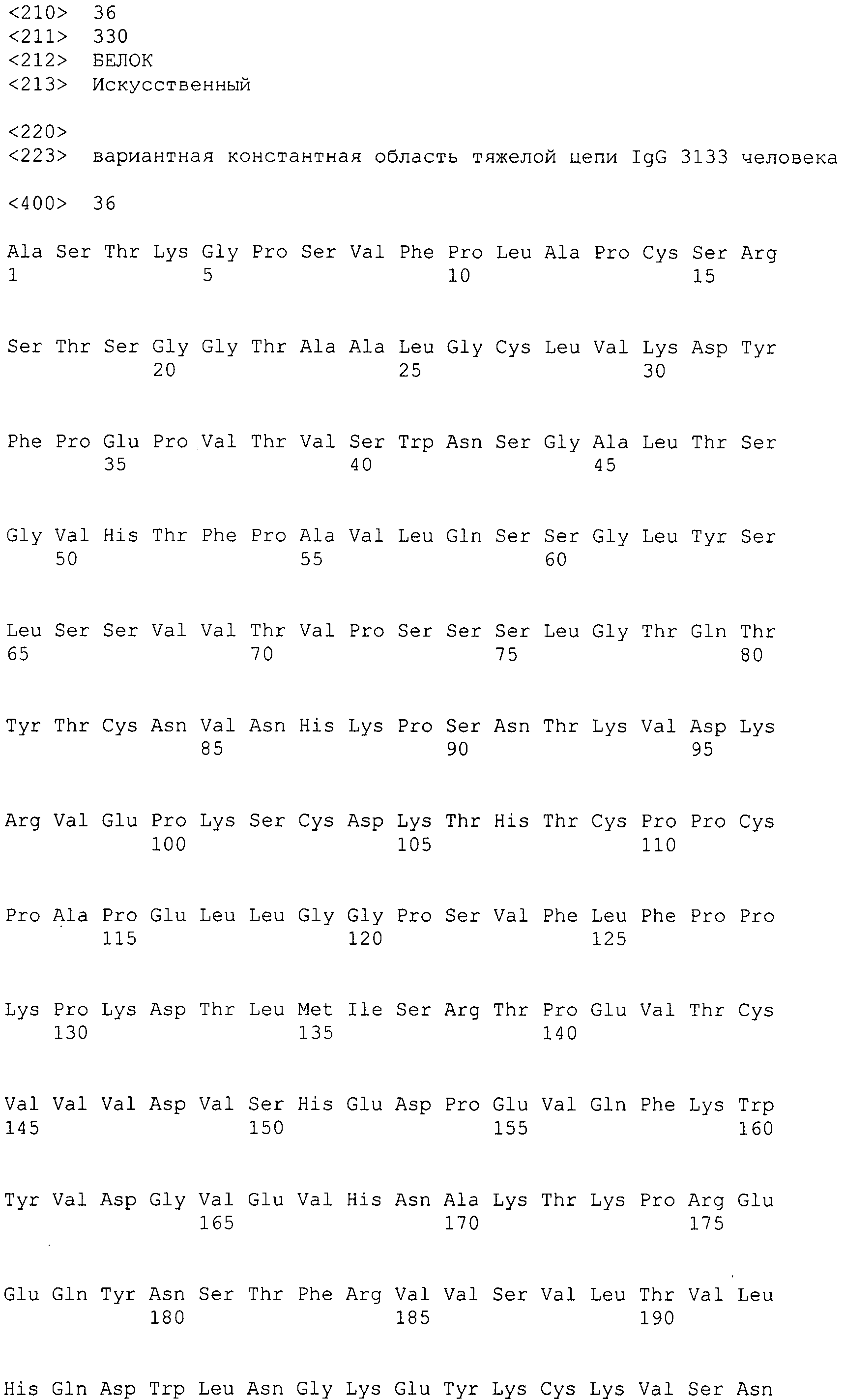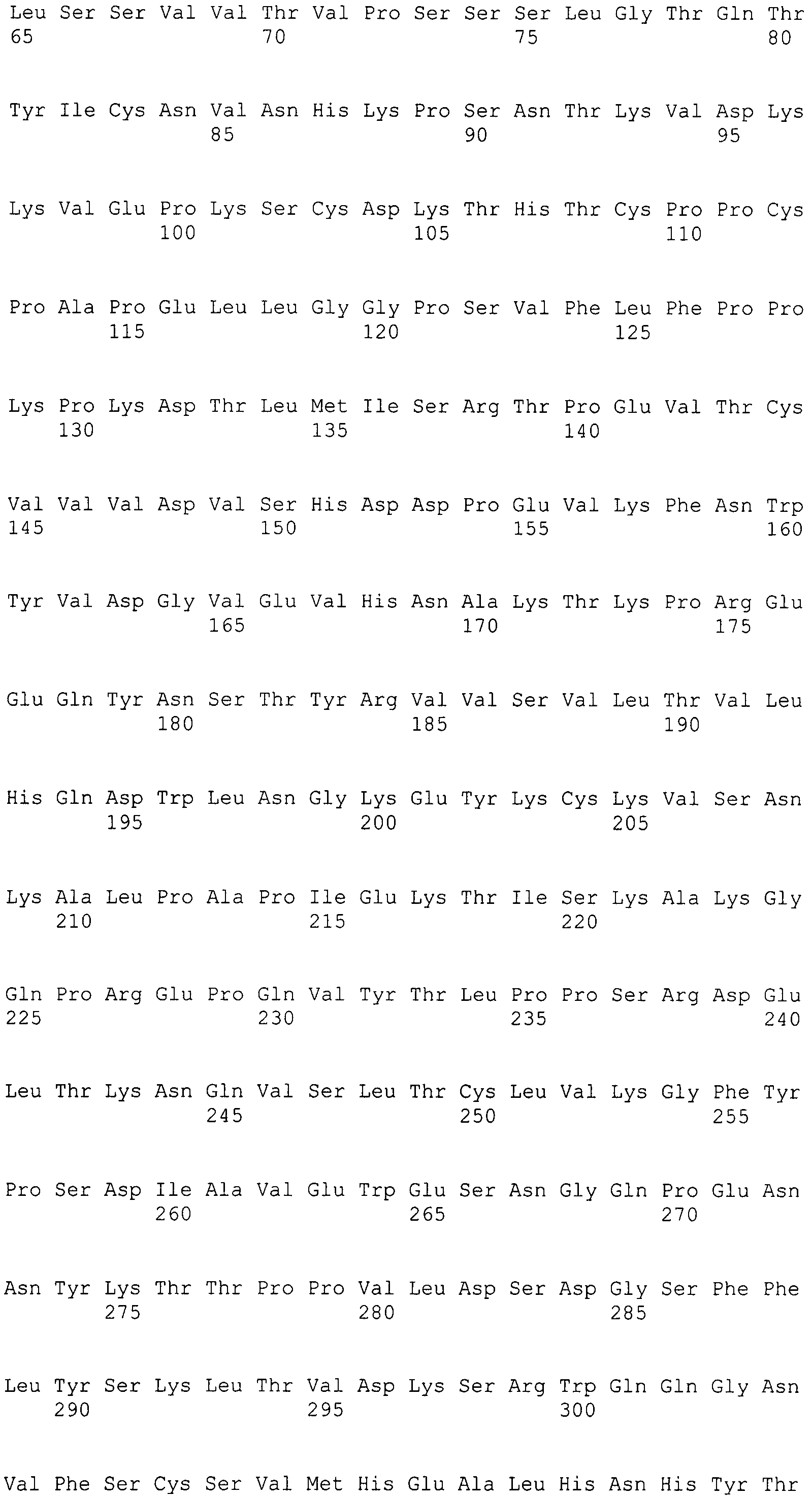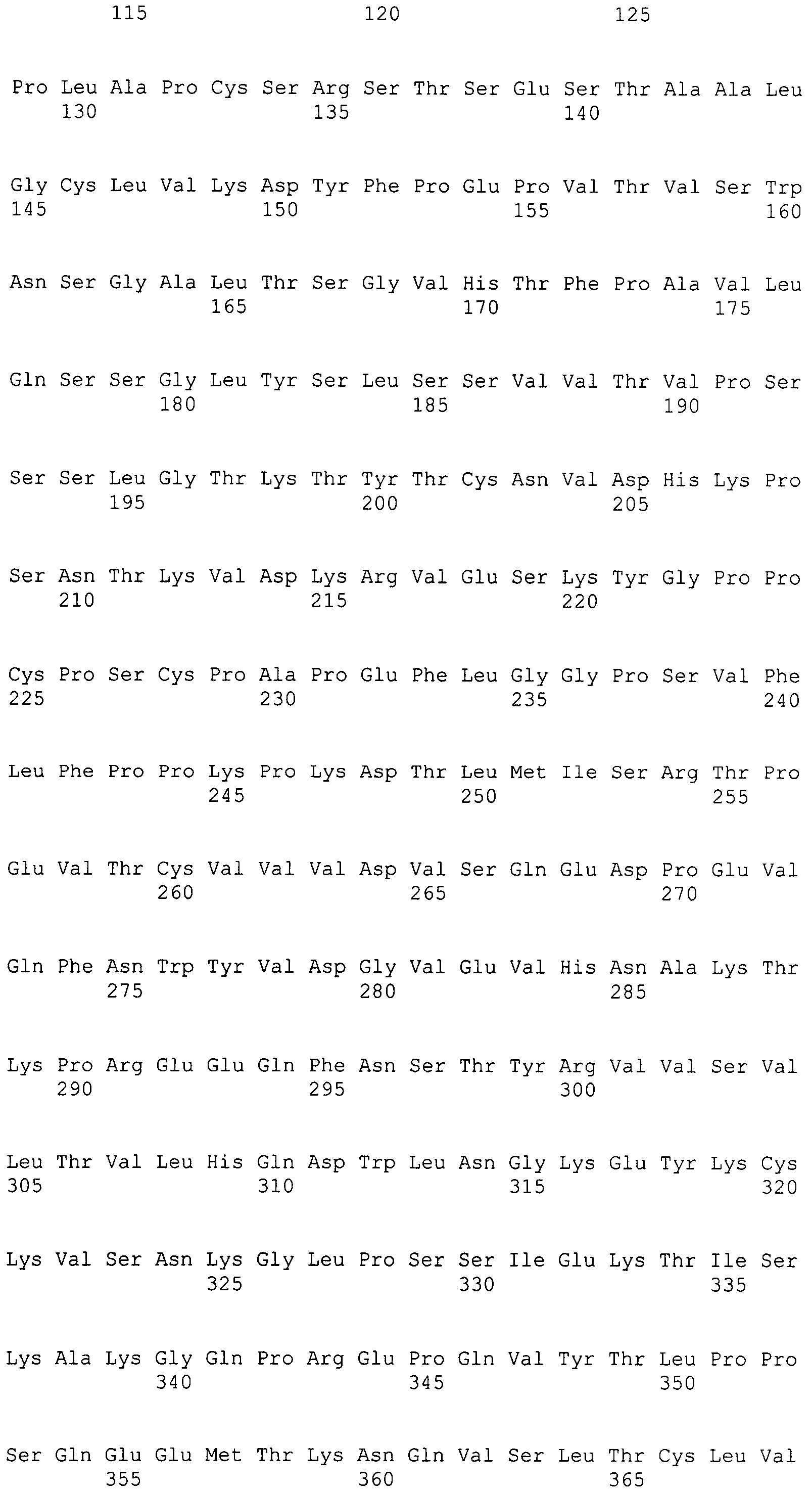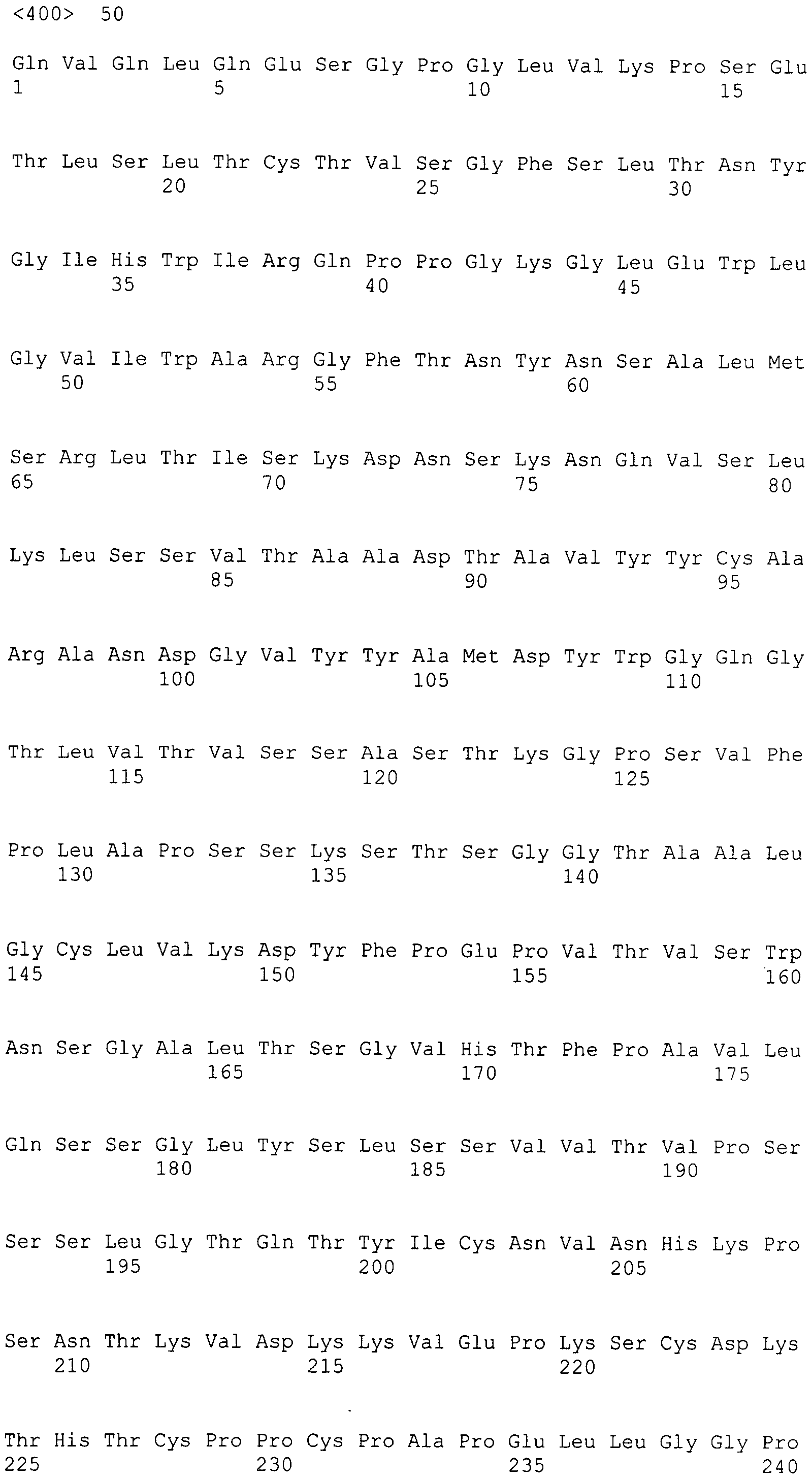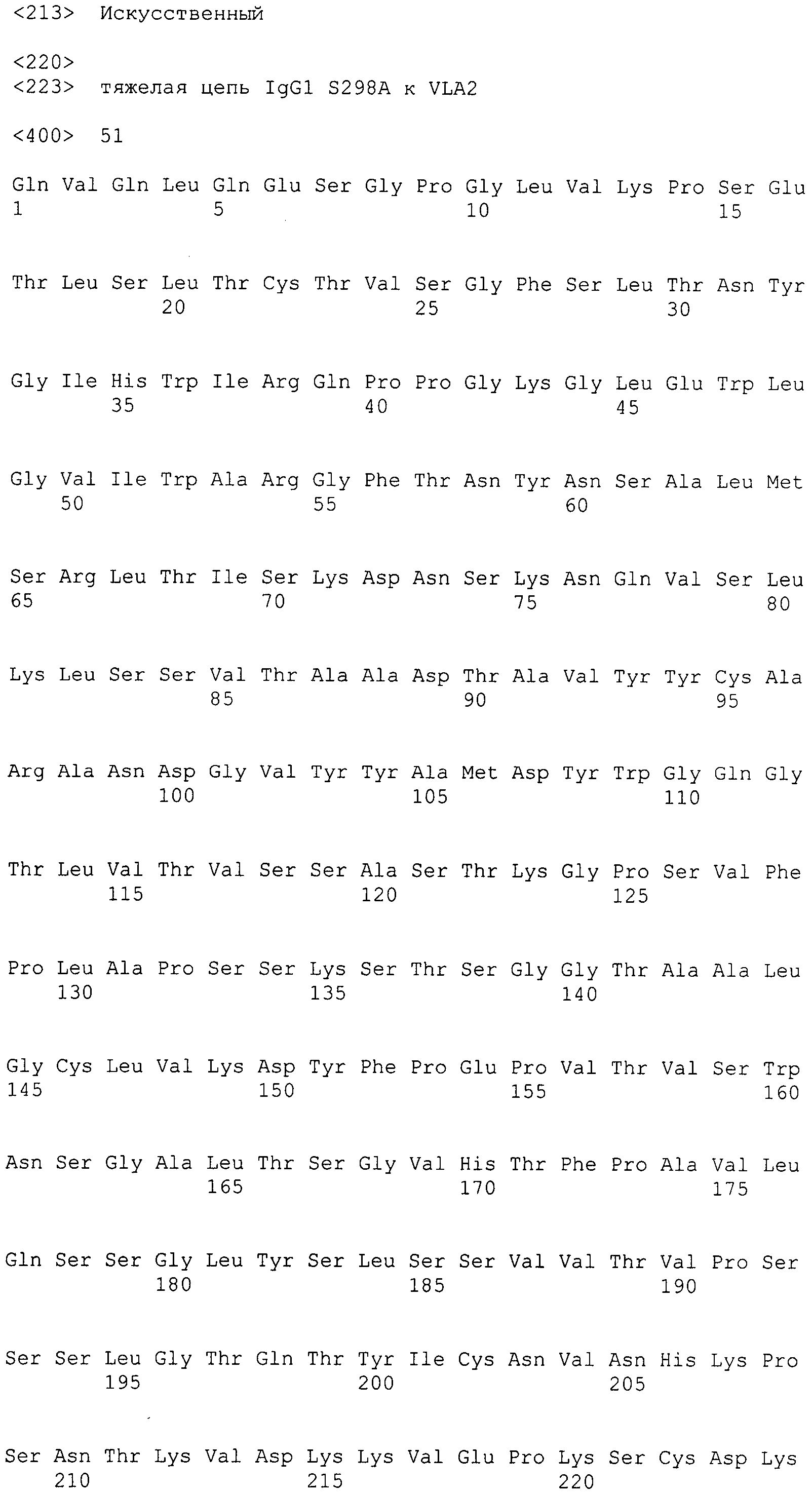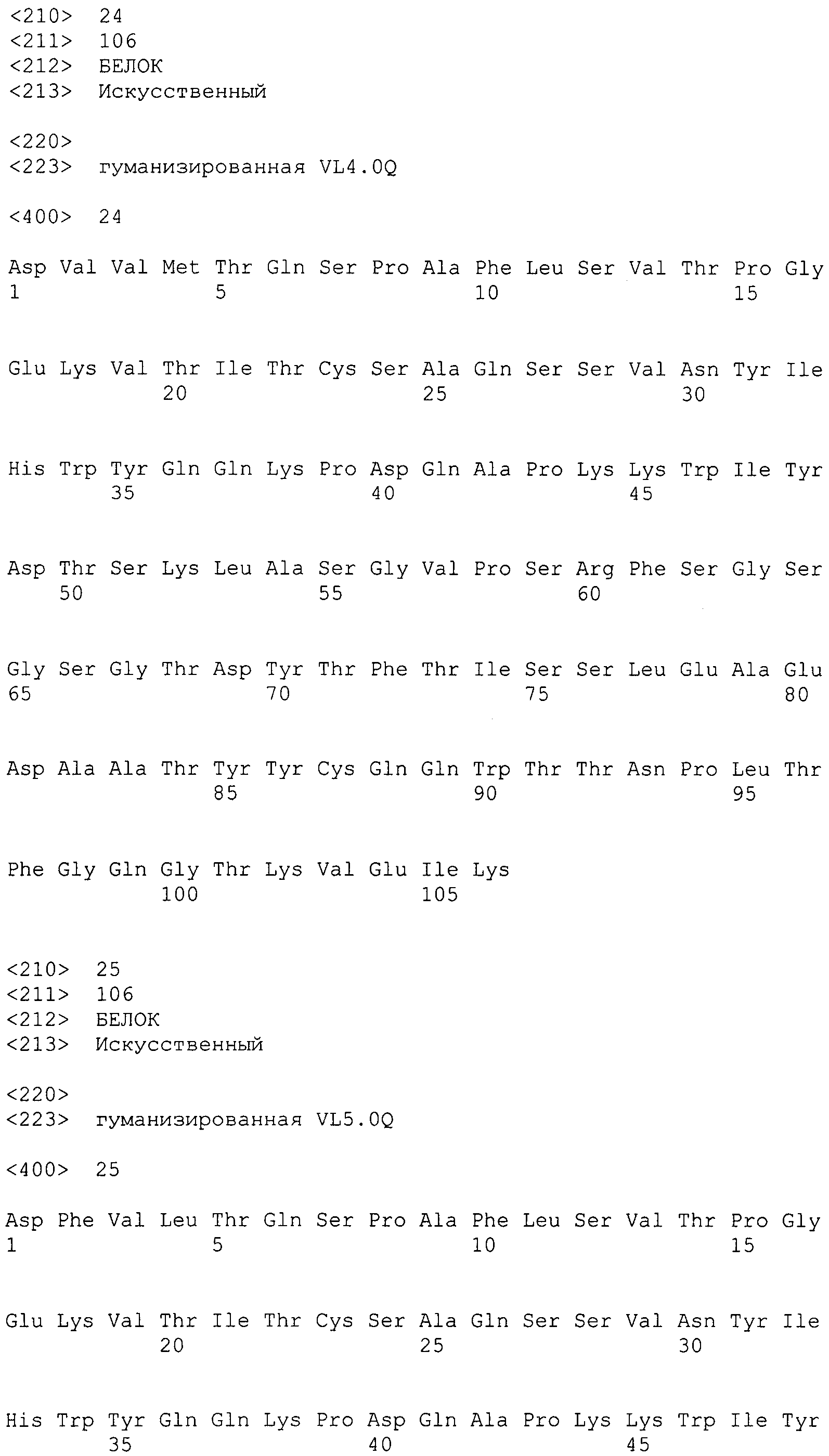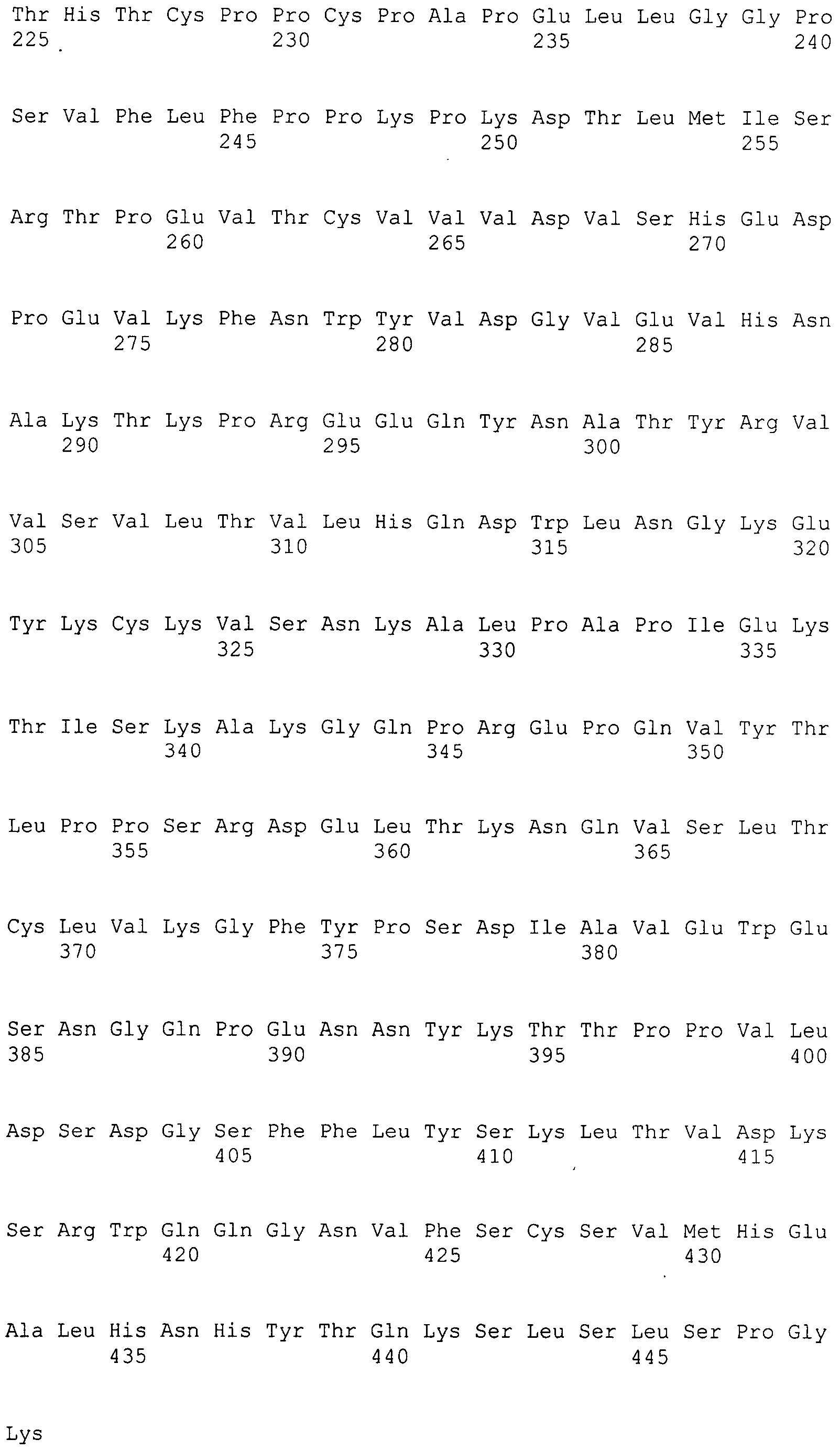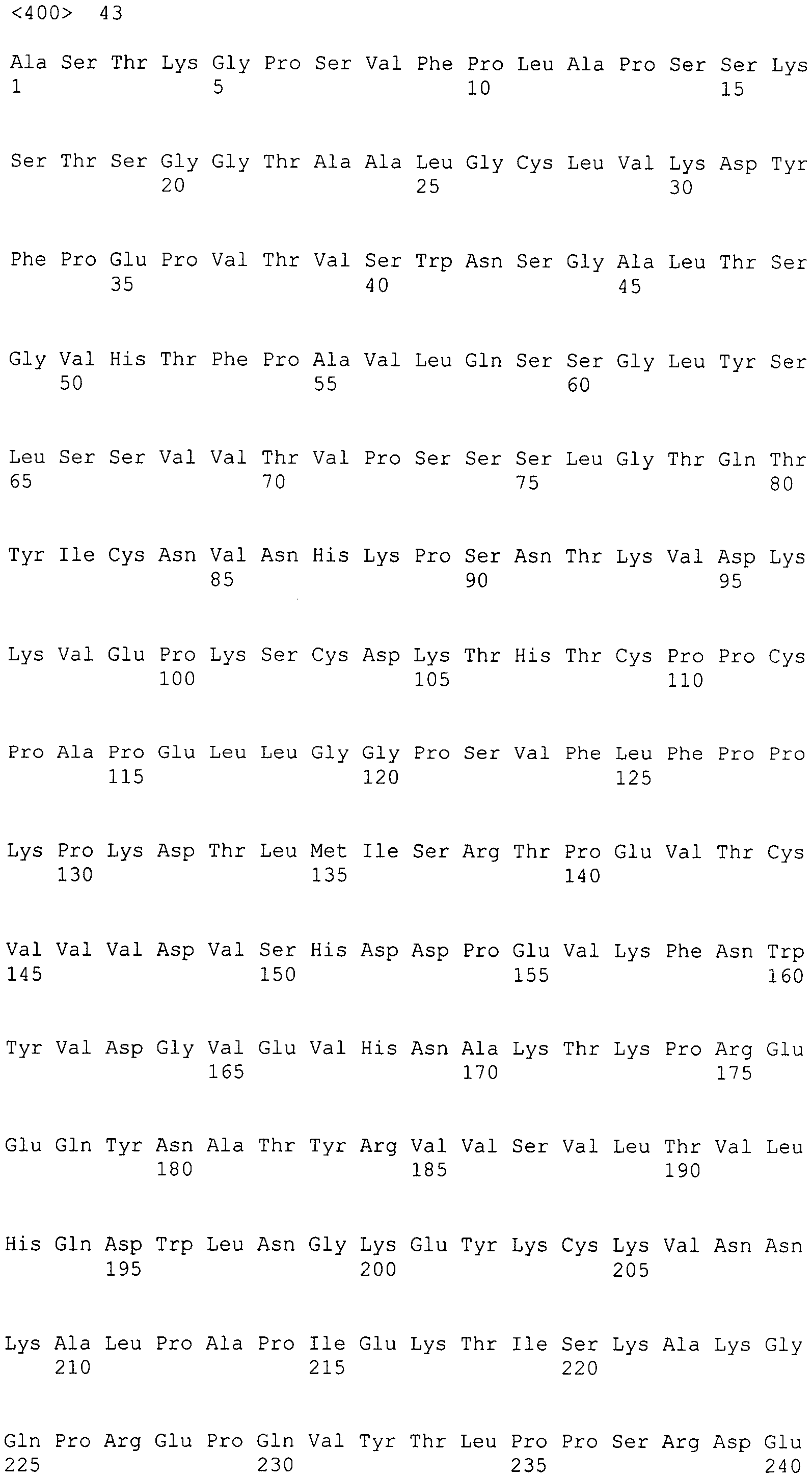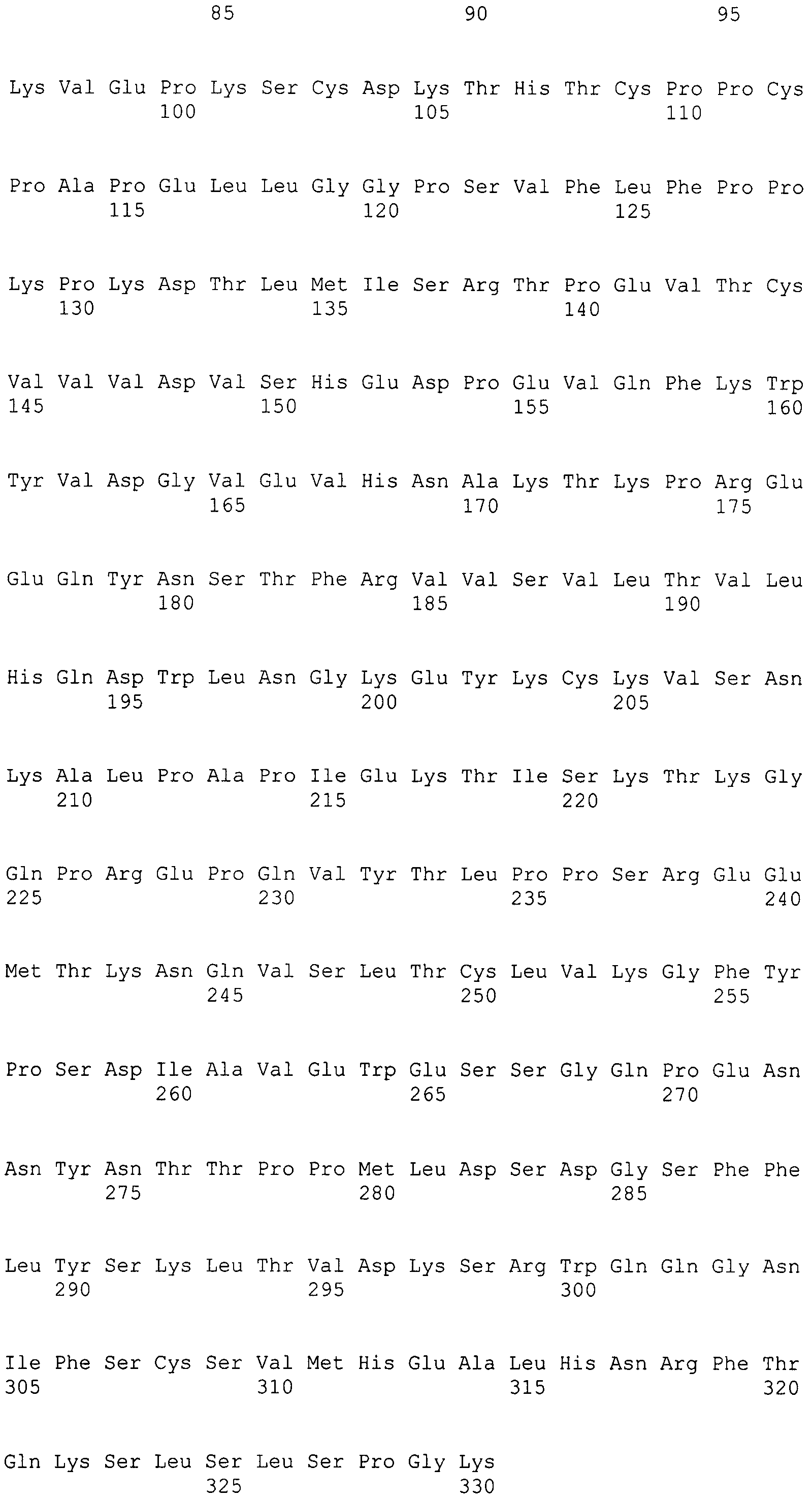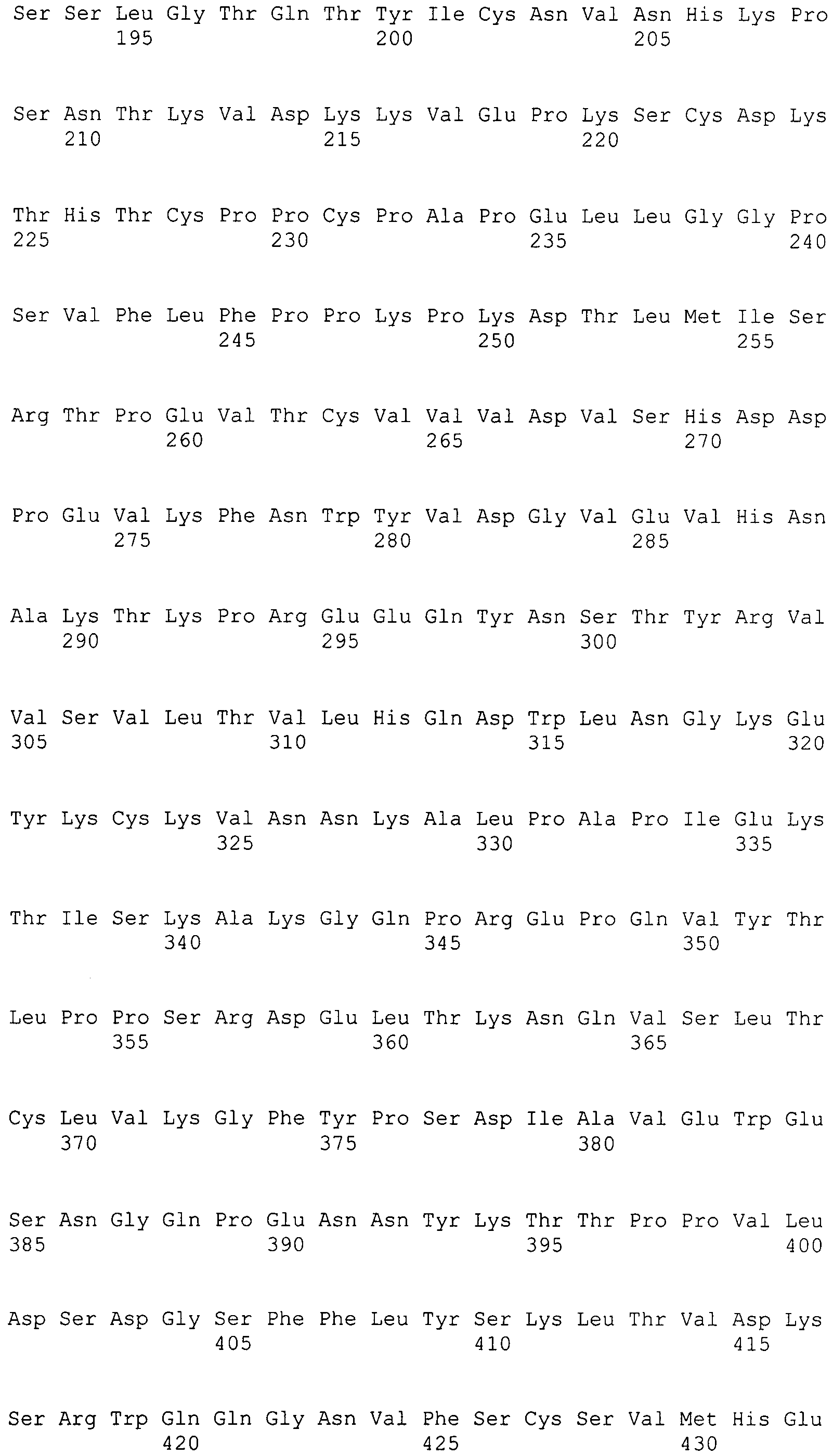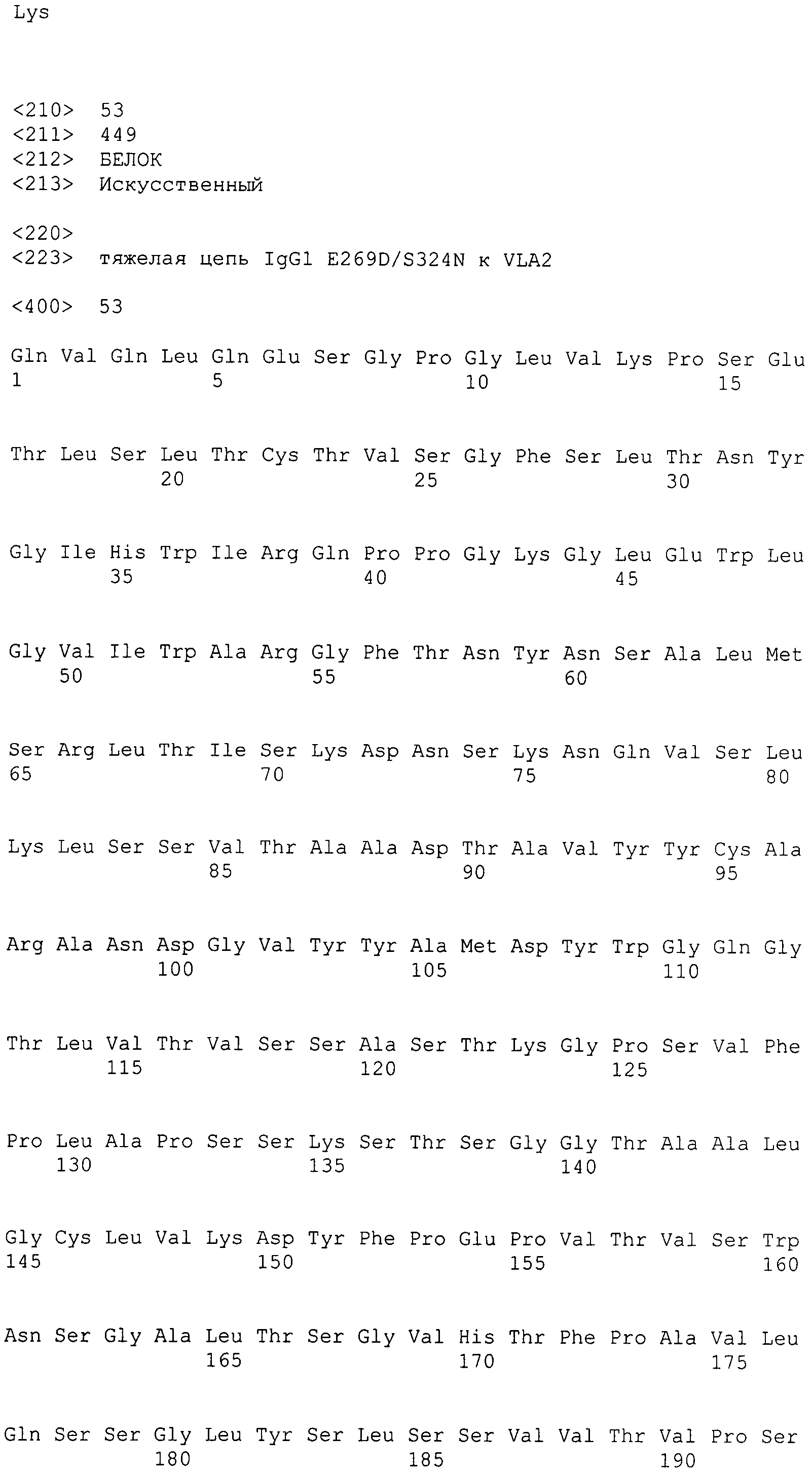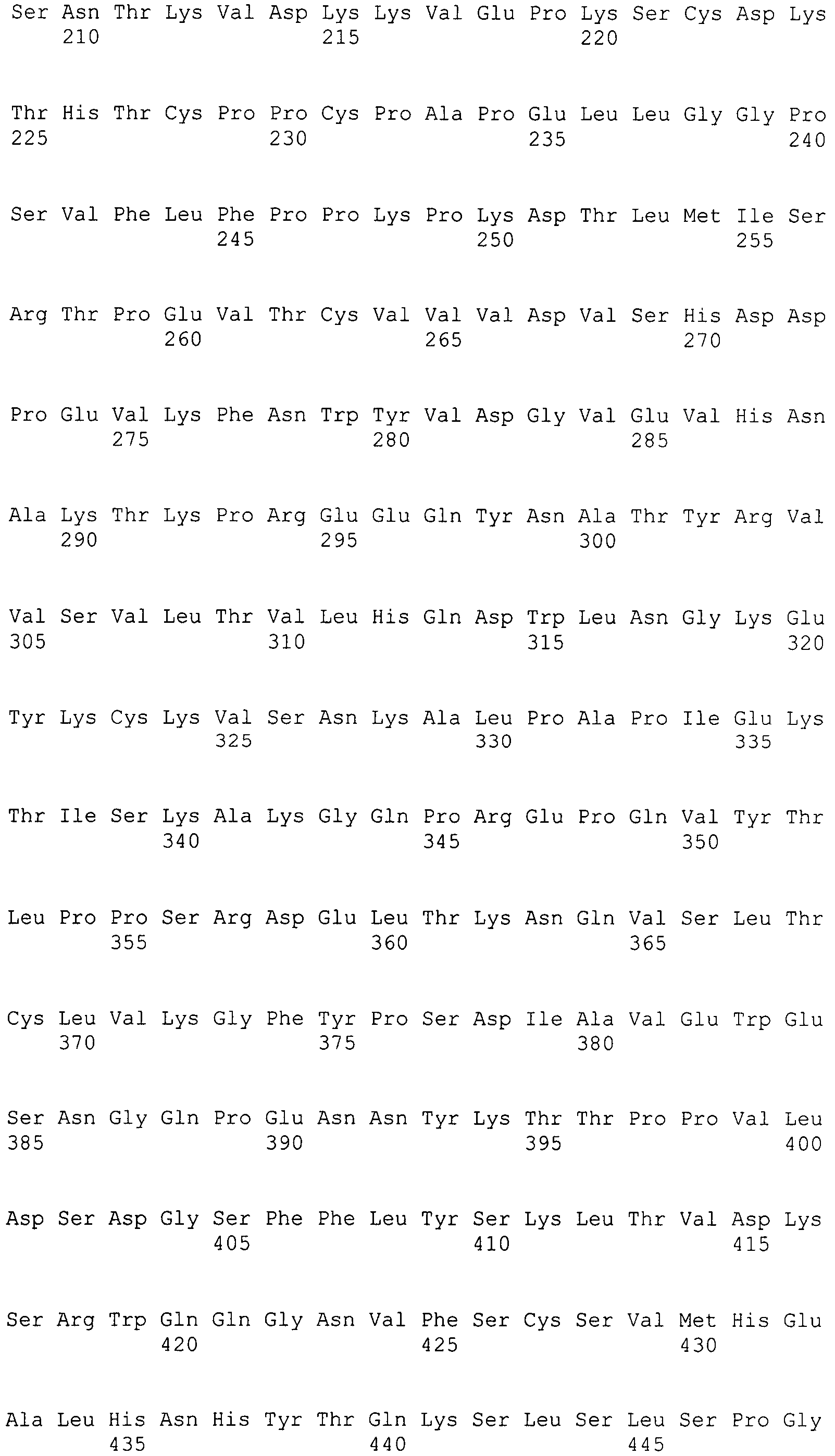Результат интеллектуальной деятельности: АНТИТЕЛА К ИНТЕГРИНУ АЛЬФА-2 И ИХ ПРИМЕНЕНИЯ
Вид РИД
Изобретение
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение в основном относится к антителам, направленным на интегрин α2β1, и их применениям, включая гуманизированные антитела к интегрину альфа-2 (α2), и способам лечения антителами к интегрину α2. Конкретнее, настоящее изобретение относится к гуманизированным антителам к интегрину α2, которые содержат вариабельную область тяжелой цепи, вариабельную область легкой цепи, константную область легкой цепи человека и вариантную константную область тяжелой цепи IgG1 человека, которые проявляют измененную эффекторную функцию.
ПРЕДПОСЫЛКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Интегрин α2β1 («очень поздний антиген 2» - Very late antigen 2; VLA-2) экспрессируется на различных типах клеток, включая тромбоциты, эндотелиальные клетки сосудов, эпителиальные клетки, активированные моноциты/макрофаги, фибробласты, лейкоциты, лимфоциты, активированные нейтрофилы и тучные клетки (Hemler, Annu Rev Immunol 8:365:365-400 (1999); Wu and Santoro, Dev. Dyn. 206:169-171 (1994); Edelson et. al., Blood. 103(6):2214-20 (2004); Dickeson et al, Cell Adhesion and Communication. 5: 273-281 (1998)). Наиболее типичные лиганды для α2β1 включают коллаген и ламинин, оба из которых обнаруживаются во внеклеточном матриксе. Обычно I-домен интегрина α2 связывается с коллагеном зависимым от наличия двухвалентных катионов образом, в то время как этот же домен связывается с ламинином посредством как зависимого от наличия двухвалентных катионов, так и независимого от наличия двухвалентных катионов механизмов (Dickeson et al, Cell Adhesion and Communication. 5: 273-281 (1998)). Специфичность интегрина α2β1 варьирует в зависимости от типа клеток, и он служит рецептором коллагена и/или ламинина для определенных типов клеток, например, интегрин α2β1 известен как рецептор коллагена для тромбоцитов и рецептор ламинина для эндотелиальных клеток (Dickeson et al, J Biol. Chem. 272: 7661-7668 (1997)). Эховирус-1, декорин, Е-кадгерин, матриксная металлопротеиназа I (MMP-I), эндорепеллин и многочисленные коллектины, а также белок комплемента C1q также являются лигандами для интегрина α2β1 (Edelson et al., Blood 107(1): 143-50 (2006)). Интегрин α2β1 вовлечен в несколько биологических и патологических процессов, включая коллаген-индуцированную агрегацию тромбоцитов, миграцию клеток по коллагену, клеткозависимую реорганизацию коллагеновых волокон, а также коллагенозависимые клеточные ответы, которые приводят к увеличению экспрессии цитокинов и пролиферации (Gendron, J. Biol. Chem. 278:48633-48643 (2003); Andreasen et al., J. Immunol. 171:2804-2811 (2003); Rao et al., J. Immunol. 165(9):4935-40 (2000)), аспекты функционирования Т-клеток, тучных клеток и нейтрофилов (Chan et. al., J. Immunol. 147:398-404 (1991); Dustin and de Fougerolles, Curr Opin Immunol 13:286-290 (2001), Edelson et. al., Blood. 103(6):2214-20 (2004), Werr et al., Blood 95:1804-1809 (2000)), аспекты гиперчувствительности замедленного типа, контактной гиперчувствительности и коллаген-индуцированного артрита (de Fougerolles et. al., J. Clin. Invest. 105:721-720 (2000); Kriegelstein et al., J. Clin. Invest. 110(12):1773-82 (2002)), морфогенез протоков молочной железы (Keely et. al., J. Cell Sci. 108:595-607 (1995); Zutter et al., Am. J. Pathol. 155(3):927-940 (1995)), заживление эпидермальных ран (Pilcher et. al., J. Biol. Chem. 272:181457-54 (1997)) и процессы, связанные с VEGF-индуцированным ангиогенезом (Senger et al., Am. J. Pathol. 160(1):195-204 (2002)).
Взаимодействия интегрин/лиганд могут способствовать выхождению лейкоцитов в воспаленные ткани (Jackson et al., J. Med. Chem. 40:3359-3368 (1997); Gadek et al., Science 295(5557):1086-9 (2002), Sircar et al., Bioorg. Med. Chem. 10:2051-2066 (2002)), а также играть важную роль в последующих событиях после первоначального выхождения лейкоцитов из кровотока в ткани в ответ на воспалительные стимулы, включая миграцию, рекрутинг и активацию провоспалительных клеток в месте воспаления (Eble J.A., Curr. Phar. Des. 11(7):867-880 (2005)). Сообщалось, что некоторые антитела, блокирующие интегрин α2β1, оказывают влияние на реакции гиперчувствительности замедленного типа и эффективность в мышиной модели ревматоидного артрита и модели воспалительного заболевания кишечника (Kriegelstein et al., J. Clin. Invest. 110(12):1773-82 (2002); de Fougerolles et. al., J. Clin. Invest. 105:721-720 (2000)) и, как сообщалось, ослабляют пролиферацию и миграцию эндотелиальных клеток in vitro (Senger et al., Am. J. Pathol. 160(1):195-204 (2002)), что позволяет предположить, что блокирование интегрина α2β1 может предотвращать/ингибировать аномальный ангиогенез или ангиогенез выше нормального, который наблюдается при различных видах рака.
Предполагается, что терапевтическое антитело, связывающее интегрин α2β1, включая интегрин α2β1 на тромбоцитах, может приводить к осложнениям с кровотечениями. Например, антитела, нацеленные на другие рецепторы тромбоцитов, такие как GPIb (Vanhoorelbeke et al., Curr. Drug Targets Cardiovasc. Haematol. Disord. 3(2):125-40 (2003)) или GP IIb/IIIa (Schell et al., Ann. Hematol. 81:76-79 (2002), Nieswandt and Watson, Blood 102(2):449-461 (2003), Merlini et al., Circulation 109:2203-2206 (2004)), связаны с тромбоцитопенией, хотя механизмы, лежащие в основе этого, до конца не ясны. Была выдвинута гипотеза, что связывание антитела с рецептором тромбоцита может изменять его трехмерную структуру и делать доступными эпитопы, которые в норме недоступны, что в дальнейшем приводит к уничтожению тромбоцитов (Merlini et al., Circulation 109:2203-2206 (2004)). В самом деле, осложнения с кровотечениями, связанные с пероральными дозами антагонистов GP IIa/IIIb, были описаны как «темная сторона» этого класса соединений (Bhatt and Topol, Nat. Rev. Drug Discov. 2(1):15-28 (2003)). Если интегрин α2β1 играет важную роль в перемещении лейкоцитов через воспаленную ткань, то было бы желательным разработать терапевтические средства, которые могли бы нацеливаться на α2β1 при болезнях, нарушениях, связанных с интегрином α2β1, и/или клеточных процессах, связанных с данными нарушениями, включая рак, воспалительные заболевания и автоиммунные заболевания, если такие средства не будут активировать тромбоциты. Гуманизированные антитела, способные нацеливаться на интегрин α2β1, как, например, интегрин α2β1 на лейкоцитах, которые не связаны с побочными осложнениями с кровотечениями, описываются в WO2007/056858. Гуманизированные антитела к интегрину α2, описанные там, представляют собой новую подгруппу антител к α2, которые характеризуются неожиданным отсутствием осложнений с кровотечениями in vivo и/или отсутствием активации интегрина α2β1 тромбоцитов. Антитела IgG4, раскрытые в WO2007/056858, однако, не несут эффекторных функций, таких как ADCC и/или CDC, которые желательны при определенных обстоятельствах, например, для лечения нарушений, связанных с интегрином α2β1, таких как рак, где эти функциональные свойства приводят к повышенной эффективности лечения. Таким образом, желательно было бы разработать антитела к интегрину α2β1, которые будут проявлять эти эффекторные функции в высокой степени.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
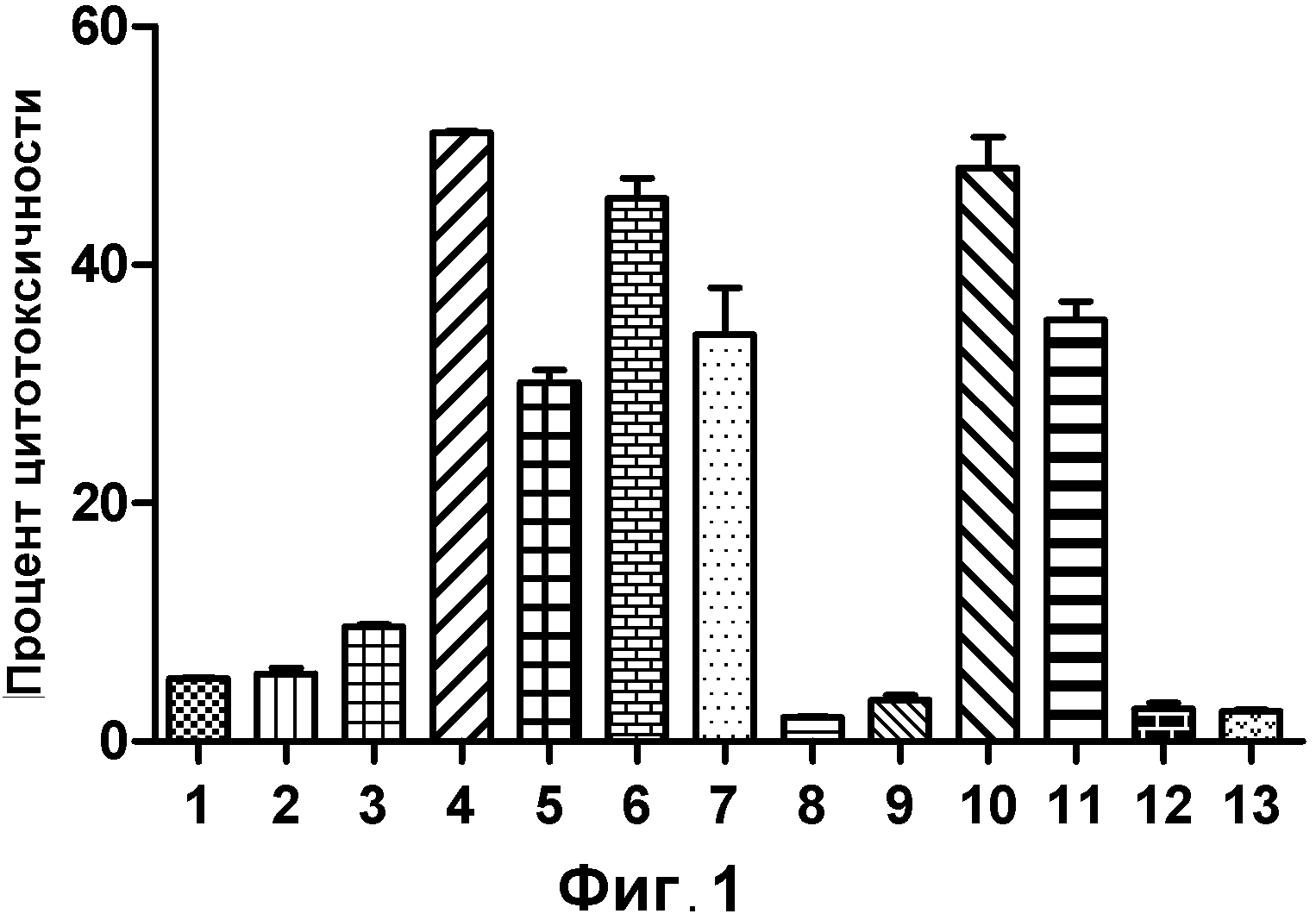
На фигуре 1 показан клеточный анализ CDC выбранных вариантов антител к VLA2: (1) IgG4 к VLA2; (2) IgG1 к VLA2; (3) IgG2 к VLA2; (4) IgG3 к VLA2; (5) IgG1133 к VLA2; (6) IgG3133 к VLA2; (7) IgG1-S324N к VLA2; (8) IgG1-S298A к VLA2; (9) IgG1-E269D к VLA2; (10) IgG1-E269D/S298A/S324N к VLA2; (11) IgG1-S298A/S324N к VLA2; (12) IgG1-контроль; (13) отрицательный контроль - без антител.
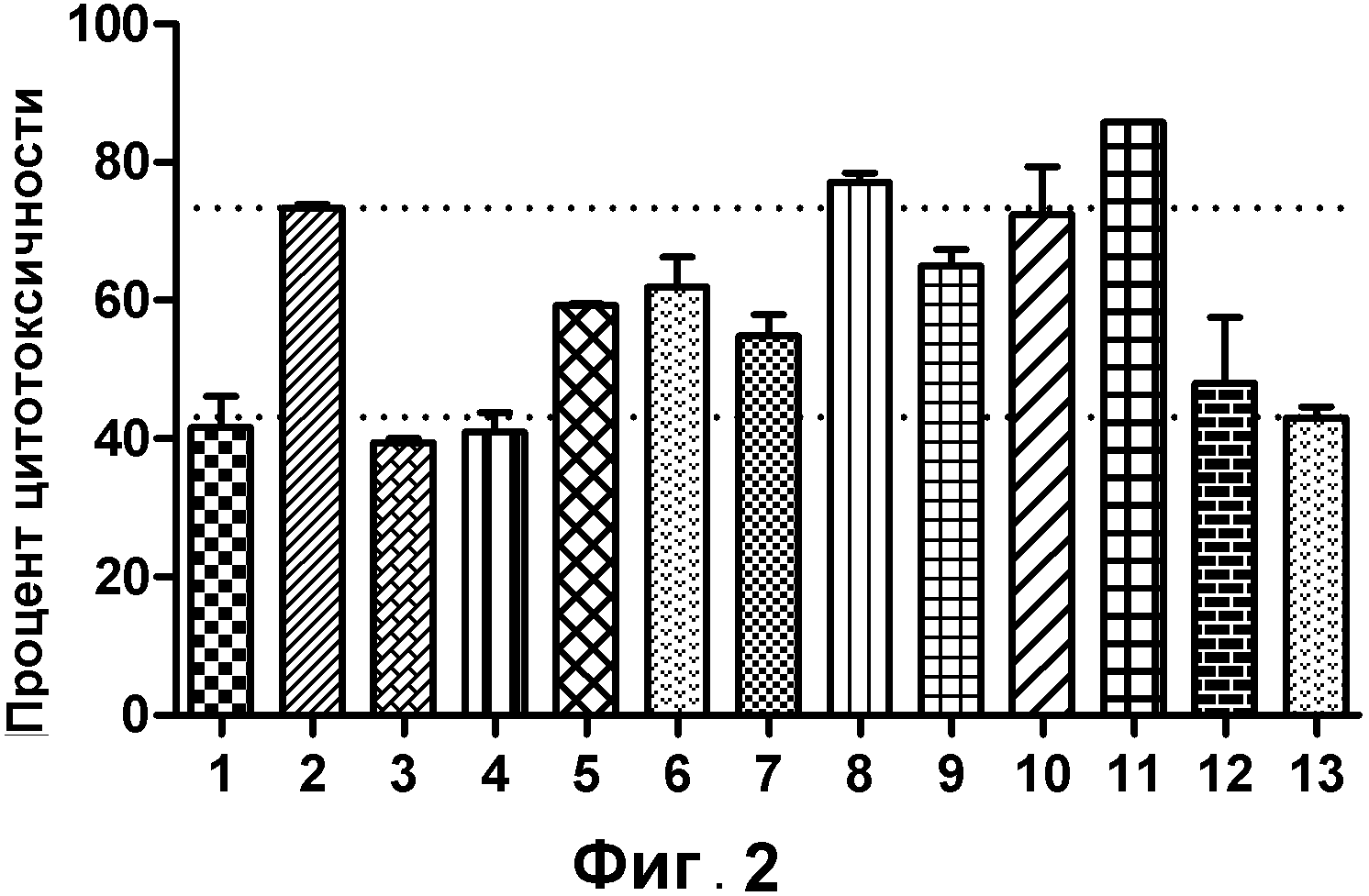
На фигуре 2 показан клеточный анализ ADCC выбранных вариантов антител к VLA2 в конечной концентрации 0,1 мкг/мл: (1) IgG4 к VLA2; (2) IgG1 к VLA2; (3) IgG2 к VLA2; (4) IgG3 к VLA2; (5) IgG1133 к VLA2; (6) IgG3133 к VLA2; (7) IgG1-S324N к VLA2; (8) IgG1-S298A к VLA2; (9) IgG1-E269D к VLA2; (10) IgG1-E269D/S298A/S324N к VLA2; (11) IgG1-S298A/S324N к VLA2; (12) IgG1-контроль; (13) отрицательный контроль - без антител.
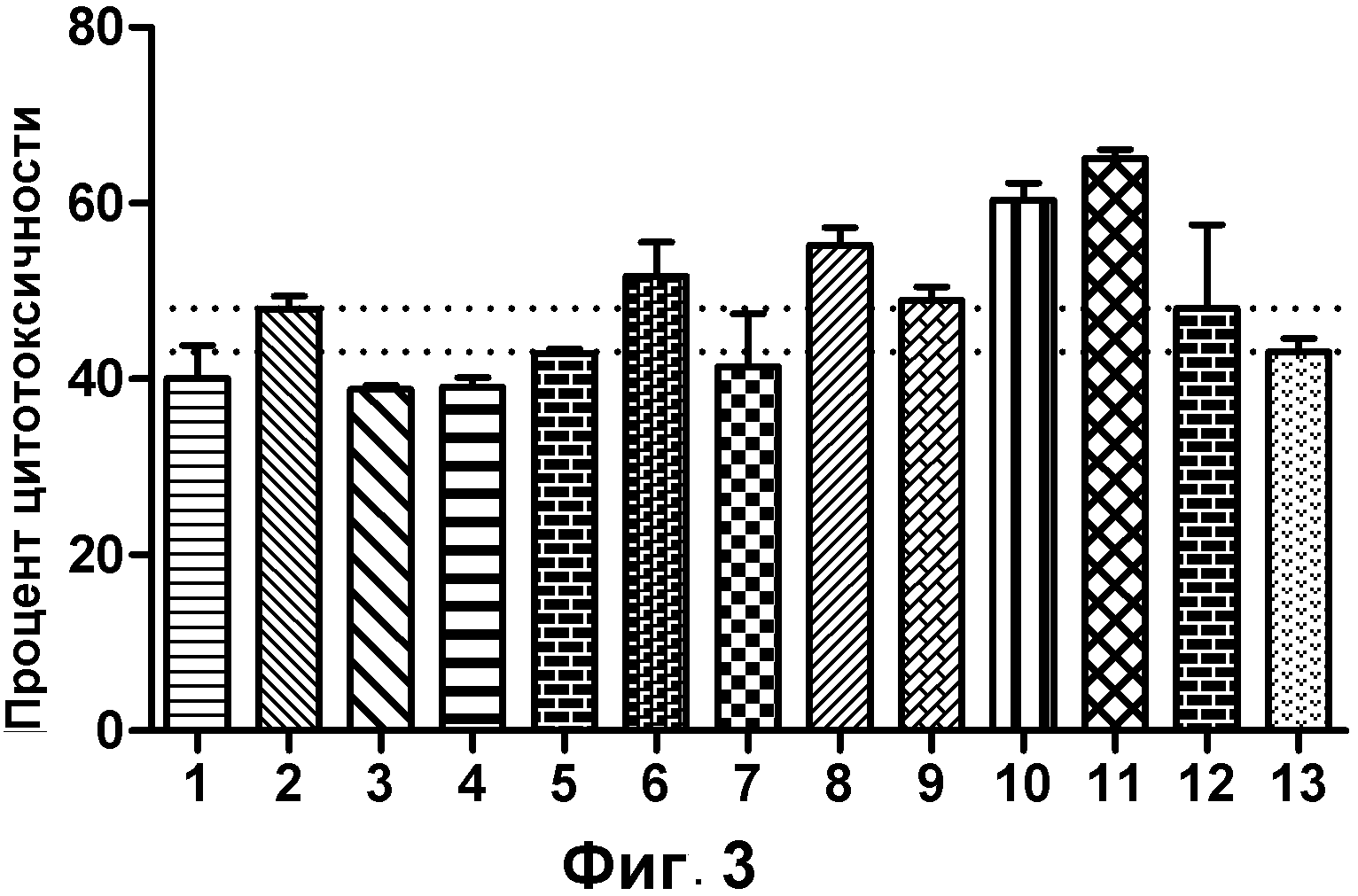
На фигуре 3 показан клеточный анализ ADCC выбранных вариантов антител к VLA2 в конечной концентрации 0,01 мкг/мл: (1) IgG4 к VLA2; (2) IgG1 к VLA2; (3) IgG2 к VLA2; (4) IgG3 к VLA2; (5) IgG1133 к VLA2; (6) IgG3133 к VLA2; (7) IgG1-S324N к VLA2; (8) IgG1-S298A к VLA2; (9) IgG1-E269D к VLA2; (10) IgG1-E269D/S298A/S324N к VLA2; (11) IgG1-S298A/S324N к VLA2; (12) IgG1-контроль; (13) отрицательный контроль - без антител.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает гуманизированное антитело к интегрину α2, содержащие вариабельную область тяжелой цепи, вариабельную область легкой цепи, константную область легкой цепи человека и вариантный константный домен тяжелой цепи IgG1 человека, при этом вариантная константная область тяжелой цепи IgG1 человека включает по меньшей мере одну аминокислотную модификацию относительно константной области тяжелой цепи IgG1 человека исходного гуманизированного антитела к интегрину α2, и при этом данное антитело проявляет измененную эффекторную функцию по сравнению с исходным гуманизированным антителом к интегрину α2.
Настоящее изобретение дополнительно обеспечивает выделенную нуклеиновую кислоту, кодирующую вышеупомянутое гуманизированное антитело к интегрину α2β1.
Настоящее изобретение дополнительно обеспечивает вектор, содержащий вышеупомянутую нуклеиновую кислоту.
Настоящее изобретение дополнительно обеспечивает клетку-хозяина, содержащую вышеупомянутую нуклеиновую кислоту или вышеупомянутый вектор.
Настоящее изобретение дополнительно обеспечивает композицию, содержащую вышеупомянутое гуманизированное антитело к интегрину α2 и фармацевтически приемлемый носитель.
Настоящее изобретение дополнительно обеспечивает набор, включающий вышеупомянутые гуманизированное антитело к интегрину α2 или вышеупомянутую композицию и инструкции для лечения нарушения, связанного с интегрином 2β1.
Настоящее изобретение дополнительно обеспечивает способ лечения нарушения, связанного с интегрином α2β1, у субъекта, при этом способ включает введение субъекту терапевтически эффективного количества вышеупомянутого антитела к интегрину α2 или вышеупомянутой композиции.
Настоящее изобретение дополнительно обеспечивает способ ингибирования связывания лейкоцитов с коллагеном, включающий введение субъекту некоторого количества вышеупомянутого антитела к интегрину α2β1 или вышеупомянутой композиции, эффективное для ингибирования связывания лейкоцитов с коллагеном.
Настоящее изобретение дополнительно обеспечивает применение вышеупомянутого гуманизированного антитела к интегрину α2 или вышеупомянутой композиции в качестве лекарственного препарата.
Настоящее изобретение дополнительно обеспечивает применение вышеупомянутого гуманизированного антитела к интегрину α2 или вышеупомянутой композиции для лечения нарушения, связанного с интегрином α2β1.
Настоящее изобретение дополнительно обеспечивает вышеупомянутое гуманизированное антитело к интегрину α2 или вышеупомянутую композицию для применения в способе лечения нарушения, связанного с интегрином α2β1.
Настоящее изобретение дополнительно обеспечивает применение вышеупомянутого гуманизированного антитела к интегрину α2 или вышеупомянутой композиции для получения лекарственного препарата для лечения нарушения, связанного с интегрином α2β1.
Настоящее изобретение дополнительно обеспечивает антитело, содержащее вариантную Fc-область IgG человека, которая содержит аминокислотную замену S324N, замещающую серин в аминокислотном положении 324 исходного антитела на аспарагин, при этом антитело демонстрирует улучшенную комплементзависимую цитотоксичность (CDC) и улучшенную антителозависимую клеточноопосредованную цитотоксичность (ADCC) по сравнению с исходным антителом.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к гуманизированным антителам к интегрину α2, которые проявляют измененную эффекторную функцию по сравнению с исходным гуманизированным антителом к интегрину α2.
Интегрин α2β1 является молекулой, состоящей из субъединицы интегрина α2 из семейства альфа-интегринов и субъединицы интегрина β1 из семейства бета-интегринов, и может происходить от любого субъекта, включая млекопитающее, но предпочтительно происходит от человека. Интегрин α2β1 может быть очищен из любого естественного источника или может быть получен синтетически (например, с помощью технологии рекомбинантных ДНК). Кодирующие последовательности нуклеиновой кислоты для интегрина α2 и интегрина β1 описываются в Takada and Hemler J. Cell Biol. 109(1):397-407 (1989; номер регистрации в GenBank - X17033; впоследствии обновлена на запись NM 002203) и Argraves, W.S, J. Cell. Biol. Sep 105(3):1183-90 (1987; номер регистрации в GenBank - X07979.1 и родственные последовательности, представляющие собой варианты, полученные в результате альтернативного сплайсинга) соответственно.
«I»-домен молекулы интегрина α2β1 относится к области данной молекулы интегрина α2β1 внутри субъединицы α2 и описывается, например, в Kamata et al., J Biol. Chem. 269:9659-9663(1994); Emsley et al., J. Biol. Chem. 272:28512 (1997) и Cell 101:47 (2000). I-домен интегрина α2 содержит лигандсвязывающий участок типа MIDAS (Metal Ion Dependent Adhesion Site - участок адгезии, зависимый от ионов металлов), который имеет потребность в данном двухвалентном катионе и специфичность к нему для поддержания связывания лигандов.
Нарушение, связанное с интегрином α2, включает нарушение, заболевание или состояние, которое вовлекает зависимые от интегрина α2 процессы/функцию (например, связывание, активность), опосредующие аберрантные клеточные реакции внутри ткани-мишени. Примеры зависимых от интегрина α2 процессов, вовлеченных в заболевание, включают коллагензависимые клеточные реакции, такие как вовлеченные в повышение экспрессии цитокинов и повышение пролиферации, аспекты функционирования Т-клеток, тучных клеток и нейтрофилов, воспалительные нарушения, морфогенез протоков молочной железы, заживление эпидермальных ран и ангиогенез. Примеры нарушений, связанных с интегрином α2, включают, но без ограничений, воспалительные заболевания или нарушения, которые включают, но без ограничений, воспалительное заболевание кишечника (такое как болезнь Крона и неспецифический язвенный колит), реакции на трансплантат (включая отторжение трансплантата), неврит зрительного нерва, травму спинного мозга, ревматоидный артрит, рассеянный склероз (включая лечение связанных с ними неврологических последствий, а также рассеянный склероз, характеризуемый рецидивами), аутоиммунные заболевания или нарушения (включая системную красную волчанку (СКВ), сахарный диабет, синдром Рейно, экспериментальный аутоиммунный энцефаломиелит, синдром Шегрена, склеродермию), юношеский сахарный диабет и нарушения, связанные с аномальным ангиогенезом или ангиогенезом выше нормального (такие как диабетическая ретинопатия, возрастная дегенерация желтого пятна, сердечно-сосудистое заболевание, псориаз, ревматоидный артрит и рак), а также инфекции, которые индуцируют воспалительную реакцию.
Лечение нарушения, связанного с интегрином α2β1, включает как терапевтическое применение, так и профилактическое или предупредительное применение антител к интегрину α2, описываемых в данном документе. Нуждающиеся в лечении включают пациентов с уже диагностированным расстройством, а также пациентов, у которых проявление нарушения необходимо предупредить или отсрочить.
Выражения «антитела к интегрину α2», или «антитело, которое связывается с α2», или «антитело, которое связывается с субъединицей интегрина α2», или «антитела к VLA-2», в настоящем документе применяются в качестве синонимов и включают антитела, предпочтительно гуманизированные IgG-антитела, которые связываются с интегрином α2 человека, например, которые связываются с иммобилизованным α2β1 с аффинностью (Kd) 50 нМ или меньше, предпочтительно 10 нМ или меньше, более предпочтительно 1 нМ или меньше, в частности 0,5 нМ или меньше.
Под выражениями «исходное гуманизированное антитело к интегрину α2», или «исходное антитело к интегрину α2», или «исходное антитело к VLA-2», которые в настоящем документе применяются в качестве синонимов, подразумевают антитело, которое связывается с интегрином α2 человека, например гуманизированное антитело IgG1 к интегрину α2, которое может быть модифицировано с тем, чтобы включать вариантную константную область тяжелой цепи IgG1 человека. Исходное гуманизированное антитело к интегрину α2 идентично антителу, которое включает вариантную константную область тяжелой цепи IgG1 человека, за исключением аминокислотной модификации в константной области тяжелой цепи IgG1 человека, и обычно является антителом с нативной константной областью тяжелой цепи IgG1 человека. Аминокислотная модификация предпочтительно не изотипна.
Выражение «антитело» или «иммуноглобулин» применяют в наиболее широком смысле, и оно охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела и полиспецифичные антитела, при условии, что они проявляют желаемую биологическую активность. Выражение антитело или иммуноглобулин включает полноразмерные антитела, а также их фрагменты, которые обладают антигенсвязывающими свойствами, т.е. которые связываются с интегрином α2. Выражение «антитело» включает гликопротеин, содержащий по меньшей мере две тяжелые (H) цепи и две легких (L) цепи, соединенные дисульфидными связями, или его антигенсвязывающий фрагмент. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (в настоящем документе имеет аббревиатуру VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов: CH1, CH2 и CH3. Каждая легкая цепь состоит из вариабельной области легкой цепи (в настоящем документе имеет аббревиатуру VL) и константной области легкой цепи (в настоящем документе имеет аббревиатуру CL). Константная область легкой цепи состоит из одного домена. VH и VL области можно дополнительно разделить на области гипервариабельности, называемые гипервариабельными участками (CDR), перемежающиеся с более консервативными областями, называемыми каркасными областями (FR или FW). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца до карбокси-конца в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Вариабельные области тяжелых и легких цепей содержат домен связывания, который взаимодействует с антигеном. Константные области антител могут опосредовать связывание иммуноглобулина с тканями или факторами хозяина, включая различные клетки иммунной системы (например, эффекторные клетки) и первый компонент (C1q) классической системы комплемента.
Выражение «полноразмерное антитело», применяемое в настоящем документе, включает структуру, которая устанавливает естественную биологическую форму антитела, включающую вариабельные и константные области. Например, у большинства млекопитающих, включая человека и мышей, полноразмерное антитело класса IgG является тетрамером и состоит из двух идентичных пар из двух иммуноглобулиновых цепей, при этом каждая пара имеет одну легкую и одну тяжелую цепь, при этом каждая легкая цепь содержит домены иммуноглобулина VL и CL, и каждая тяжелая цепь содержит домены иммуноглобулина VH, CH1 (C[гамма]1), CH2 (C[гамма]2) и CH3 (C[гамма]3). У некоторых млекопитающих, например у верблюдов и лам, антитела IgG могут состоять только из двух тяжелых цепей, при этом каждая тяжелая цепь содержит вариабельный домен, прикрепленный к Fc-области.
Выражение «химерное антитело», применяемое в настоящем документе, включает антитела, у которых последовательности вариабельной области получены от одного вида, а последовательности константной области получены от другого вида, как, например, антитело, у которого последовательности вариабельной области получены от антитела мыши, а последовательности константной области получены от антитела человека.
Выражение «гуманизированное антитело», применяемое в настоящем документе, включает антитела, в которых последовательности CDR, полученные от зародышевой линии другого вида млекопитающего, такого как мышь, были привиты на каркасные последовательности человека. Дополнительные изменения каркасной области могут быть сделаны внутри каркасных последовательностей человека, а также в последовательностях CDR, полученных от зародышевой линии другого вида млекопитающего.
Выражение «антитело человека», применяемое в настоящем документе, включает антитела с вариабельными областями, в которых как каркасные области, так и CDR, получены из последовательностей иммуноглобулина зародышевой линии человека. Кроме того, если антитело содержит константную область, константная область также получена из последовательностей иммуноглобулина зародышевой линии человека. Антитела человека настоящего изобретения могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулина зародышевой линии человека (например, мутации, внесенные случайным или сайтспецифичным мутагенезом in vitro или соматическими мутациями in vivo). Однако выражение «антитело человека», применяемое в настоящем документе, не подразумевает включение антител, в которых последовательности CDR, полученные из зародышевой линии другого вида млекопитающего, такого как мышь, привиты на каркасные последовательности человека.
Моноклональное антитело включает антитело, полученное из популяции, по существу, гомогенных антител, например, отдельные антитела, составляющие популяцию, идентичны, за исключением возможных естественных мутаций, которые могут присутствовать в небольших количествах. Моноклональные антитела высокоспецифичны и при этом направлены на один антигенный участок. Кроме того, в отличие от традиционных (например, поликлональных) препаратов антител, которые, как правило, включают различные антитела, направленные на различные детерминанты (например, эпитопы) на антигене, каждое моноклональное антитело направлено на по меньшей мере единственную детерминанту на антигене. Определение «моноклональный» указывает на характерную особенность антитела как полученного из, по существу, гомогенной популяции антител, и не должно интерпретироваться как требующее получения антитела каким-либо особенным способом. Например, моноклональные антитела можно получать гибридомным способом, впервые описанным Kohler et al., Nature 256:495 (1975), или можно получать с использованием способов рекомбинантных ДНК (см., например, патент США № 4816567). Моноклональные антитела можно также выделять из фаговых библиотек антител, например, с помощью методик, описанных в Clackson et al., Nature 352:624-628 (1991) и Marks et al., J. Mol. Biol. 222:581-597 (1991). Моноклональные антитела можно также выделять с помощью методик, описанных в патентах США №№ 6 025 155 и 6 077 677, а также в публикациях патентных заявок США №№ 2002/0160970 и 2003/0083293 (см. также, например, Lindenbaum, et al., Nucleic Acids Research 32 (21):0177 (2004)).
Гипервариабельная область включает в себя аминокислотные остатки антитела, ответственные за связывание антигена. Гипервариабельная область содержит аминокислотные остатки из гипервариабельного участка или CDR (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (H1), 50-65 (H2) и 95-102 (H3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)) и/или аминокислотные остатки из гипервариабельной петли (например, остатки 26-32 (L1), 50-52 (L2), и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2), и 96-101 (H3) в вариабельном домене тяжелой цепи; Chothia and Lesk J. Mol. Biol. 196: 901-917 (1987)). Остатки каркасной области или FR представляют собой остатки вариабельного домена, которые не являются остатками гипервариабельной области. Для антител, описанных в настоящем документе, CDR и каркасные области идентифицируются на основе системы нумерации Kabat, за исключением того, что CDR1 тяжелой цепи определяется на основе Oxford Molecular AbM как охватывающий остатки с 26 по 35. Программное обеспечение для моделирования антител Oxford Molecular AbM (http://people.cryst.cck.ac.uk/~ubc07s/) (Martin et al., Proc. Natl Acad. Sci. USA, 86, 9268-9272 (1989); Martin et al., Methods Enzymol., 203, 121-153 (1991); Pedersen et al., Immunomethods, 1, 126 (1992); и Rees et al., In Sternberg M.J.E. (ed.), Protein Structure Prediction. Oxford University Press, Oxford, 141-172. (1996)) комбинирует системы нумерации гипервариабельных областей CDR Kabat и Chothia для определения CDR.
Выражение «аминокислотная модификация» в настоящем документе включает в себя замену, вставку и/или делецию аминокислоты в полипептидной последовательности. Под «аминокислотной заменой» или «заменой» в настоящем документе подразумевают замещение аминокислоты в определенном положении в исходной полипептидной последовательности другой аминокислотой. Например, замена R94K означает вариантный полипептид, в данном случае вариант вариабельной каркасной области тяжелой цепи, в котором аргинин в положении 94 замещен на лизин. В предыдущем примере 94K указывает замену в положении 94 на лизин. Для целей настоящего документа множественные замены обычно отделяются друг от друга косой чертой. Например, R94K/L78V означает двойной вариант, включающий в себя замены R94K и L78V. Под «аминокислотной вставкой» или «вставкой», применяемыми в настоящем документе, подразумевают добавление аминокислоты в определенном положении в исходной полипептидной последовательности. Например, вставка -94 обозначает вставку в положении 94. Под «аминокислотной делецией» или «делецией», применяемыми в настоящем документе, подразумевают удаление аминокислоты в определенном положении в исходной полипептидной последовательности. Например, R94- обозначает делецию аргинина в положении 94.
Для всех положений константной области тяжелой цепи иммуноглобулина, обсуждаемых в настоящем изобретении, нумерацию осуществляют согласно EU-индексу, как описано в работе Kabat (Kabat et al., 1991, Sequences of Proteins of Immunological Interest, 5th Ed., United States Public Health Service, National Institutes of Health, Bethesda, включенной ссылкой в полном объеме). Нумерацию положений константной области тяжелой цепи иммуноглобулина в настоящем документе называют «системой нумерации, изложенной в работе Kabat» или «EU-индексом, как описано в работе Kabat», которые применяют в настоящем документе эквивалентно, и она обозначает нумерацию согласно EU-индексу, как описано в работе Kabat. «EU-индекс, как описано в работе Kabat» означает нумерацию остатков антитела человека IgGl EU, как описано в работе Edelman et al., 1969, PNAS 63:78-85.
Антитела группируют в классы, также называемые изотипами, которые определяют генетически по константной области. Константные легкие цепи человека классифицируют как каппа (CK) и лямбда (C[лямбда]) легкие цепи. Тяжелые цепи классифицируют как мю, дельта, гамма, альфа или эпсилон, и определяют изотип антитела как IgM, IgD, IgG, IgA и IgE соответственно. Класс IgG наиболее широко применяют для терапевтических целей. У людей этот класс включает подклассы IgG1, IgG2, IgG3 и IgG4. У мышей этот класс включает подклассы IgG1, IgG2a, IgG2b, IgG3. IgM имеет подклассы, включающие, но без ограничений, IgM1 и IgM2. IgA имеет несколько подклассов, включающих, но без ограничений, IgA1 и IgA2. Таким образом, «изотип», применяемый в настоящем документе, обозначает любой из классов или подклассов иммуноглобулинов, определяемый химическими и антигенными характеристиками своих константных областей. Известными изотипами иммуноглобулинов человека являются IgG1, IgG2, IgG3, IgG4, IgA1, IgA2, IgM1, IgM2, IgD и IgE.
Выражение «Fc» или «Fc-область», применяемое в настоящем документе, включает полипептид, содержащий константную область антитела за исключением первого иммуноглобулинового домена константной области. Таким образом, Fc обозначает два последних иммуноглобулиновых домена константной области IgA, IgD и IgG, и последние три иммуноглобулиновые домены константной области IgE и IgM, а также N-конец гибкого шарнирного участка к этим доменам. У IgA и IgM Fc может включать цепь J. У IgG Fc включает иммуноглобулиновые домены Cгамма2 и Cгамма3 (C[гамма]2 и C[гамма]3) и шарнирный участок между Cгамма1 (C[гамма]1) и Cгамма2 (C[гамма]2). Хотя границы Fc-области могут варьировать, Fc-область тяжелой цепи IgG человека обычно определяют как включающую остатки C226 или P230 на ее карбоксильном конце, где нумерация представляет собой согласно EU-индексу, как описано в работе Kabat. Fc может относиться к данной области в отдельности или к данной области в контексте Fc-полипептида, например антитела.
Под «вариантной константной областью тяжелой цепи IgG1 человека», применяемой в настоящем документе, подразумевают константную область тяжелой цепи IgG1 человека, которая отличается от исходной константной области тяжелой цепи IgG1 человека посредством по меньшей мере одной аминокислотной модификации. Под «Fc-вариантом» или «вариантной Fc» или «вариантной Fc-областью IgG1 человека», применяемыми в настоящем документе, подразумевают Fc-последовательность, которая отличается от таковой исходной Fc-последовательности посредством по меньшей мере одной аминокислотной модификации. Вариантная константная область тяжелой цепи IgG1 человека или Fc-вариант включает одну или несколько аминокислотных модификаций относительно исходного Fc-полипептида, где указанная аминокислотная модификация (модификации) обеспечивает (обеспечивают) одно или несколько оптимизированных свойств. Вариантная константная область тяжелой цепи IgG1 человека или Fc-вариант настоящего изобретения отличается по аминокислотной последовательности от своего исходного IgG1 посредством по меньшей мере одной аминокислотной модификации. Поэтому вариантная константная область тяжелой цепи IgG1 человека или Fc-варианты настоящего изобретения имеют по меньшей мере одну аминокислотную модификацию относительно исходной. В качестве альтернативы, вариантная константная область тяжелой цепи IgG1 человека настоящего изобретения может иметь более одной аминокислотной модификации по сравнению с исходной, например, может включать в себя преобразование всего иммуноглобулинового домена константной области или, предпочтительно, Fc-области одного изотипа в другой изотип, например, преобразование Fc-области константной области тяжелой цепи IgG1 человека в Fc-область из IgG3 человека, приводящую к изотипическому варианту, который содержит CH1 из IgG1 человека, шарнирный участок из IgG1 человека и Fc-область из IgG3 человека. Модификации можно осуществлять генетически с помощью молекулярной биологии или можно осуществлять ферментативно или химически.
Fc-варианты настоящего изобретения, по существу, могут кодироваться любым аллотипом или изоаллотипом любого иммуноглобулинового гена. В предпочтительном варианте осуществления Fc-варианты настоящего изобретения находят применение в антителах или Fc-слияниях, которые включают последовательности IgG1, классифицируемые как G1m(1), G1m(2), G1m(3), G1m(17), nG1m(1), nG1m(2) и/или nG1m(17). Поэтому, в контексте изотипа IgG1, Fc-варианты настоящего изобретения могут содержать Lys (G1m(17)) или Arg (G1m(3)) в положении 214, Asp356/Leu358 (G1m(1)) или Glu356/Met358 (nG1m(1)) и/или Glu (G1m(2)) или Ala (nG1m(2)) в положении 431.
Выражение «изотипический вариант», применяемое в настоящем документе, включает аминокислотную модификацию, которая замещает по меньшей мере одну аминокислоту одного изотипа, преимущественно по меньшей мере одну аминокислоту константной области тяжелой цепи одного изотипа, на соответствующую аминокислоту в другом выровненном изотипе. Аминокислотная модификация может включать в себя преобразование всего иммуноглобулинового домена константной области или, предпочтительно, Fc-области одного изотипа в другой изотип, например, преобразование Fc-области константной области тяжелой цепи IgG1 человека в Fc-область IgG3 человека, дающее в результате изотипический вариант, который содержит CH1 из IgG1 человека, шарнирный участок из IgG1 человека и Fc-область из IgG3 человека.
Под «шарнирным участком», или «шарнирной областью», или «шарнирной областью антитела» в настоящем документе подразумевают гибкий полипептид, включающий аминокислоты между первым и вторым константными доменами антитела. Структурно CH1-домен IgG оканчивается в EU-положении 220, и CH2-домен IgG начинается с остатка в EU-положении 237. Таким образом, для IgG шарнирный участок антитела в настоящем документе определяют как включающий положения с 221 (D221 в IgG1) по 231 (A231 в IgG1) с нумерацией согласно EU-индексу, как описано в работе Kabat.
Выражение «эффекторная функция», применяемое в настоящем документе, включает биохимическое событие, которое происходит в результате взаимодействия Fc-области антитела с Fc-рецептором или Fc-лигандом. Выражение «эффекторная функция», применяемое в настоящем документе, включает фагоцитоз, опсонизацию, клеточное связывание, возврат в исходное состояние, комплементзависимую цитотоксичность (CDC), связывание с C1q, связывающую аффинность антитела к Fc[гамма]-рецептору или антителозависимую клеточноопосредованную цитотоксичность (ADCC). Предпочтительно эффекторная функция представляет собой комплементзависимую цитотоксичность (CDC) или антителозависимую клеточноопосредованную цитотоксичность (ADCC). Эффекторную функцию измеряют при помощи стандартных анализов in vitro, которые известны в уровне техники и коммерчески доступны. Обычно ADCC измеряют при помощи анализа высвобождения лактатдегидрогеназы (LDH), как описано в примере 2 настоящей заявки, а CDC измеряют при помощи клеточного анализа, описанного в примере 1 настоящей заявки.
Выражение «изменять эффекторную функцию» или «проявление измененной эффекторной функции», применяемое в настоящем документе, включает проявление усиленной эффекторной функции антитела, например гуманизированного антитела к интегрину α2, содержащего вариантную константную область тяжелой цепи IgG1 человека, по сравнению с исходным антителом, т.е. эффекторная функция антитела, содержащего вариантную константную область тяжелой цепи IgG1 человека, более чем на 10%, предпочтительно более чем на 20%, более предпочтительно более чем на 30%, наиболее предпочтительно более чем на 50%, в частности более чем на 60%, наиболее конкретно более чем на 70% выше эффекторной функции исходного антитела.
Выражение «ADCC» или «антителозависимая клеточноопосредованная цитотоксичность», применяемое в настоящем документе, включает клеточно-опосредованную реакцию, где неспецифичные цитотоксические клетки, которые экспрессируют Fc[гамма]Rs, распознают антитела, связавшиеся на клетке-мишени, и, как следствие, вызывают лизис клетки-мишени. В различных аспектах усиленная эффекторная функция ADCC может означать усиленную активность или усиленную эффективность. Под «активностью», применяемой в экспериментальном контексте, подразумевают концентрацию антитела, при которой наблюдается определенный терапевтический эффект, EC50 (половинная максимальная эффективная концентрация). Под «эффективностью», применяемой в экспериментальном контексте, подразумевают максимальную возможную эффекторную функцию при насыщающих уровнях антитела.
Выражение «CDC» или «комплементзависимая цитотоксичность», применяемое в данном документе, включает реакцию, где один или несколько белковых компонентов комплемента распознают антитело, связавшееся на клетке-мишени, и, как следствие, вызывают лизис клетки-мишени.
Применяемое в настоящем документе выражение «субъект» включает любое животное, как человека, так и не относящееся к человеку животное. Выражение «не относящееся к человеку животное» включает всех позвоночных, например млекопитающих и не относящихся к млекопитающим, таких как приматы, кроме человека, овец, собак, кошек, лошадей, коров, кур, земноводных, рептилий и т.д. Предпочтительным субъектом является человек.
Цитотоксическое средство включает вещество, которое ингибирует или препятствует функционированию клеток и/или вызывает разрушение клеток. Они могут включать радиоактивные изотопы (например, 131I, 125I, 90Y и 186Re), химиотерапевтические средства и токсины, такие как ферментативно активные токсины бактериального, грибного, растительного или животного происхождения, или их фрагменты. Нецитотоксическое средство обозначает вещество, которое не ингибирует или не препятствует функционированию клеток, и/или не вызывает разрушение клеток. Нецитотоксическое средство может включать средство, которое может быть активировано, чтобы стать цитотоксическим. Нецитотоксическое средство может включать гранулу, липосому, матрицу или частицу (см., например, публикации патентов США 2003/0028071 и 2003/0032995, которые включены в настоящий документ ссылкой). Такие средства могут быть конъюгированы, связаны, соединены или ассоциированы с антителом к интегрину α2β1, описанном в настоящем документе.
Химиотерапевтическое средство относится к химическому соединению, пригодному при лечении рака. Примеры химиотерапевтических веществ включают, но без ограничений, адриамицин, доксорубицин, 5-фторурацил, цитозина арабинозид («Ara-C»), циклофосфамид, тиотепу, таксотер (доцетаксель), бусульфан, цитоксин, таксол, метотрексат, цисплатин, мелфалан, винбластин, блеомицин, этопозид, ифосфамид, митомицин C, митоксантрон, винкристин, винорелбин, карбоплатин, тенипозид, дауномицин, карминомицин, аминоптерин, дактиномицин, митомицины, эсперамицины (см. патент США № 4 675 187), мелфалан и другие родственные азотистые иприты.
Выделенная молекула нуклеиновой кислоты относится к молекуле нуклеиновой кислоты, которая идентифицирована и отделена по меньшей мере от одной загрязняющей молекулы нуклеиновой кислоты, с которой она обычно ассоциирована в источнике, например, в естественном источнике нуклеиновой кислоты антитела. Выделенная молекула нуклеиновой кислоты имеет иные форму и окружение, чем те, в каких она находилась в природе. Выделенные молекулы нуклеиновой кислоты, следовательно, отличаются от молекулы нуклеиновой кислоты, как она существует в природных клетках. Тем не менее, выделенная молекула нуклеиновой кислоты включает молекулу нуклеиновой кислоты, содержавшуюся в клетках, которые обыкновенно экспрессируют антитело, где, например, молекула нуклеиновой кислоты находится в хромосомном положении, отличном от такового у природных клеток.
Клетка, клеточная линия и клеточная культура часто применяются взаимозаменяемо, и все такие обозначения включают потомство. Трансформанты и трансформированные клетки (например, полученные посредством трансфекции, трансформации или трансдукции нуклеиновых кислот, векторов, вируса и т.д.) включают первичные клетки субъекта и культуры, полученные из них, без учета количества переносов. Также понятно, что все потомство может не быть точно идентичным по содержанию ДНК вследствие преднамеренных или случайных мутаций. Включают мутантное потомство, которое имеет ту же функцию или биологическую активность, по которым проводился отбор у изначально трансформированных клеток. Там, где подразумеваются различные обозначения, станет ясно из контекста.
ГУМАНИЗИРОВАННЫЕ АНТИТЕЛА К ИНТЕГРИНУ α2, СОДЕРЖАЩИЕ ВАРИАНТНЫЙ КОНСТАНТНЫЙ ДОМЕН ТЯЖЕЛОЙ ЦЕПИ IGG1 ЧЕЛОВЕКА
Настоящее изобретение обеспечивает гуманизированное антитело к интегрину α2, содержащее вариабельную область тяжелой цепи, вариабельную область легкой цепи, константную область легкой цепи человека и вариантную константную область тяжелой цепи IgG1 человека, при этом вариантная константная область тяжелой цепи IgG1 человека содержит по меньшей мере одну аминокислотную модификацию относительно константной области тяжелой цепи IgG1 человека исходного гуманизированного антитела к интегрину α2, и при этом антитело проявляет измененную эффекторную функцию по сравнению с исходным гуманизированным антителом к интегрину α2.
В одном аспекте настоящее раскрытие обеспечивает гуманизированное антитело к интегрину α2, содержащее вариабельную область тяжелой цепи, вариабельную область легкой цепи, константную область легкой цепи человека и вариантную константную область тяжелой цепи IgG1 человека, где вариантная константная область тяжелой цепи IgG1 человека представляет собой изотипический вариант, содержащий CH1 из IgG1 человека, шарнирный участок из IgG1 человека и Fc-область из IgG3 человека.
В одном варианте осуществления изотипическая вариантная константная область тяжелой цепи IgG1 человека включает SEQ ID NO: 35.
В одном аспекте настоящее раскрытие обеспечивает гуманизированное антитело к интегрину α2, содержащее вариабельную область тяжелой цепи, вариабельную область легкой цепи, константную область легкой цепи человека и вариантную константную область тяжелой цепи IgG1 человека, где вариантная константная область тяжелой цепи IgG1 человека представляет собой изотипический вариант, содержащий CH1 из IgG3 человека, шарнирный участок из IgG1 человека и Fc-область из IgG3 человека.
В одном варианте осуществления изотипическая вариантная константная область тяжелой цепи IgG1 человека включает SEQ ID NO: 36.
В одном аспекте настоящее раскрытие обеспечивает гуманизированное антитело к интегрину α2, содержащее вариабельную область тяжелой цепи, вариабельную область легкой цепи, константную область легкой цепи человека и вариантную константную область тяжелой цепи IgG1 человека, где вариантная константная область тяжелой цепи IgG1 человека содержит вариантную Fc-область IgG1 человека, которая содержит по меньшей мере одну аминокислотную модификацию относительно Fc-области IgG1 человека исходного гуманизированного антитела к интегрину α2.
В одном варианте осуществления аминокислотная модификация включает аминокислотную замену в аминокислотном положении, выбранном из группы, состоящей из 269, 298 и 324, предпочтительно аминокислотную замену в аминокислотном положении 298 и/или 324, где аминокислотное положение каждого члена группы указано с использованием системы нумерации, изложенной в работе Kabat.
В другом варианте осуществления аминокислотная модификация включает аминокислотную замену, выбранную из группы, состоящей из E269D, S298A и S324N, предпочтительно аминокислотных замен S298A и/или S324N, где аминокислотное положение каждого члена группы указано с использованием системы нумерации, изложенной в работе Kabat.
В другом варианте осуществления аминокислотная модификация включает комбинацию аминокислотных замен в аминокислотном положении, выбранном из группы, состоящей из 269/298, 269/324, 298/324 и 269/298/324, предпочтительно 298/324 или 269/298/324, где аминокислотное положение каждого члена группы указано с использованием системы нумерации, изложенной в работе Kabat.
В другом варианте осуществления аминокислотная модификация включает комбинацию аминокислотных замен, выбранных из группы, состоящей из E269D/S298A, E269D/S324N, S298A/S324N и E269D/S298A/S324N, предпочтительно S298A/S324N или E269D/S298A/S324N, где аминокислотное положение каждого члена группы указано с использованием системы нумерации, изложенной в работе Kabat.
В одном варианте осуществления вариантная Fc-область IgG1 человека включает последовательность, выбранную из группы, состоящей из SEQ ID NO: 37-43.
Измененная эффекторная функция представляет собой обычно комплементзависимую цитотоксичность (CDC), и/или связывание с C1q, и/или антителозависимую клеточноопосредованную цитотоксичность (ADCC), и/или связывающую аффинность антитела к рецептору Fc[гамма], предпочтительно комплементзависимую цитотоксичность (CDC) и/или антителозависимую клеточноопосредованную цитотоксичность (ADCC). CDC, связывание с C1q, ADCC и связывающая аффинность антитела к рецептору Fc[гамма], измеряют при помощи стандартных анализов in vitro, которые известны в уровне техники и коммерчески доступны. Обычно ADCC измеряют при помощи анализа высвобождения лактатдегидрогеназы (LDH), как описано, например, в примере 2 настоящей заявки, а CDC измеряют при помощи клеточного анализа, описанного, например, в примере 1 настоящей заявки.
Предпочтительно, гуманизированное антитело к интегрину α2 настоящего раскрытия, содержащее вариантную константную область тяжелой цепи IgG1 человека, проявляет улучшенную CDC в анализе in vitro, который описан выше, по сравнению с исходным гуманизированным антителом. «Проявление улучшенной CDC» или «представляющее улучшенную CDC», применяемое в настоящем документе, включает а) проявление улучшенной CDC по сравнению с исходным антителом, то есть исходное гуманизированное антитело к интегрину α2 уже проявляет CDC, которая улучшена посредством аминокислотной модификации константной области тяжелой цепи IgG1 человека и b) проявление de novo CDC по сравнению с исходным гуманизированным антителом к интегрину α2, то есть исходное гуманизированное антитело к интегрину α2 не проявляет CDC, поэтому CDC была введено de novo посредством аминокислотной модификации константной области тяжелой цепи IgG1 человека.
Таким образом, дополнительный аспект настоящего раскрытия обеспечивает гуманизированное антитело к интегрину α2, содержащее вариабельную область тяжелой цепи, вариабельную область легкой цепи, константную область легкой цепи человека и вариантную константную область тяжелой цепи IgG1 человека, при этом вариантная константная область тяжелой цепи IgG1 человека содержит по меньшей мере одну аминокислотную модификацию относительно константной области тяжелой цепи IgG1 человека исходного гуманизированного антитела к интегрину α2, и при этом антитело проявляет улучшенную комплементзависимую цитотоксичность (CDC) по сравнению с исходным гуманизированным антителом. Предпочтительная вариантная константная область тяжелой цепи IgG1 человека гуманизированного антитела к интегрину α2, которое проявляет улучшенную комплементзависимую цитотоксичность (CDC) по сравнению с исходным гуманизированным антителом, содержит вариантную Fc-область IgG1 человека, которая включает аминокислотную замену, выбранную из группы, состоящей из S324N, S298A/S324N и E269D/S298A/S324N, более предпочтительно вариантная Fc-область IgG1 человека включает аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 39, 42 и 43.
В одном варианте осуществления гуманизированное антитело к интегрину α2, содержащее вариантную константную область тяжелой цепи IgG1 человека, которое проявляет улучшенную комплементзависимую цитотоксичность (CDC) по сравнению с исходным гуманизированным антителом к интегрину α2, проявляет антителозависимую клеточноопосредованную цитотоксичность (ADCC), эквивалентную исходному гуманизированному антителу. Проявление ADCC, эквивалентной исходному гуманизированному антителу, включает ADCC ±50%, предпочтительно ±40%, более предпочтительно ±30%, наиболее предпочтительно ±20%, в частности ±10% от ADCC исходного гуманизированного антитела. Известно, что антитела IgG1, например, гуманизированные антитела IgG1 к интегрину α2, такие как исходные антитела, проявляют ADCC. Однако невозможно предсказать, будет ли модификация, например замена аминокислоты константной области тяжелой цепи IgG1, которая обеспечивает улучшенную комплементзависимую цитотоксичность (CDC), оказывать влияние на ADCC. Таким образом, гуманизированные антитела к интегрину α2 настоящего изобретения, содержащие вариантную константную область тяжелой цепи IgG1 человека, которые проявляют улучшенную CDC, при этом неожиданно проявляют ADCC, эквивалентную исходному гуманизированному антителу.
В дополнительном аспекте настоящее раскрытие обеспечивает гуманизированное антитело к интегрину α2, содержащее вариабельную область тяжелой цепи, вариабельную область легкой цепи, константную область легкой цепи человека и вариантную константную область тяжелой цепи IgG1 человека, где вариантная константная область тяжелой цепи IgG1 человека содержит вариантную Fc-область IgG1 человека, которая содержит по меньшей мере одну аминокислотную модификацию относительно Fc-области IgG1 человека исходного гуманизированного антитела к интегрину α2, и где антитело проявляет улучшенную антителозависимую клеточноопосредованную цитотоксичность (ADCC) по сравнению с исходным гуманизированным антителом. Предпочтительная вариантная константная область тяжелой цепи IgG1 человека гуманизированного антитела к интегрину α2, которое проявляет улучшенную антителозависимую клеточноопосредованную цитотоксичность (ADCC) по сравнению с исходным гуманизированным антителом, содержит вариантную Fc-область IgG1 человека, содержащую аминокислотную замену, выбранную из группы, состоящей из E269D, S298A, S298A/S324N и E269D/S298A/S324N, более предпочтительно, вариантную Fc-область IgG1 человека, содержащую аминокислотную замену, выбранную из группы, состоящей из SEQ ID №: 37, 38, 42 и 43.
В дополнительном аспекте настоящее раскрытие обеспечивает гуманизированное антитело к интегрину α2, содержащее вариабельную область тяжелой цепи, вариабельную область легкой цепи, константную область легкой цепи человека и вариантную константную область тяжелой цепи IgG1 человека, где вариантная константная область тяжелой цепи IgG1 человека содержит вариантную Fc-область IgG1 человека, которая содержит по меньшей мере одну аминокислотную модификацию относительно Fc-области IgG1 человека исходного гуманизированного антитела к интегрину α2, при этом аминокислотная модификация является аминокислотной заменой S298A/S324N или E269D/S298A/S324N, в то время как антитело проявляет улучшенную комплементзависимую цитотоксичность (CDC) и улучшенную антителозависимую клеточноопосредованную цитотоксичность (ADCC) по сравнению с исходным гуманизированным антителом к интегрину α2.
Антитела настоящего изобретения были сконструированы содержащими CDR как из вариабельной области тяжелой цепи, так из вариабельной области легкой цепи мышиного моноклонального антитела клона BHA2.1 (Hangan et al., Cancer Res. 56:3142-3149 (1996)). Предпочтительными исходными материалами для создания антител являются антитела к интегрину α2, такие как секретируемые гибридомой BHA2.1 (например, TMC-2206), которые являются блокирующими функцию антителами, направленными против интегрина α2 человека, и их связывание и активность зависят от присутствия интактного I-домена внутри нацеливаемого интегрина α2. Предпочтительными являются гуманизированные антитела с эпитопной специфичностью TMC-2206 (или BHA2.1), включая антитела, которые связываются с неактивной конформацией молекулы интегрина α2 и/или не действуют как миметики лиганда. Предпочтительными являются гуманизированные антитела с эпитопной специфичностью TMC-2206 (или BHA2.1), включая те, которые хотя и взаимодействуют с интегрином α2β1, присутствующим как на лейкоцитах, так и на тромбоцитах, не вызывают активацию тромбоцитов, нарушают агрегацию активированных тромбоцитов на коллагене, оказывают минимальный эффект или не воздействуют на кровотечение и/или не связаны с осложнениями с кровотечением при вводимых концентрациях, включая терапевтические дозы in vivo.
Таким образом также обеспечивается вышеупомянутое гуманизированное антитело к интегрину α2, содержащее вариабельную область тяжелой цепи, которая содержит HCDR1, содержащий аминокислотную последовательность GFSLTNYGIH (SEQ ID NO: 1), HCDR2, содержащий аминокислотную последовательность VIWARGFTNYNSALMS (SEQ ID NO: 2), и HCDR3, содержащий аминокислотную последовательность ANDGVYYAMDY (SEQ ID NO: 3).
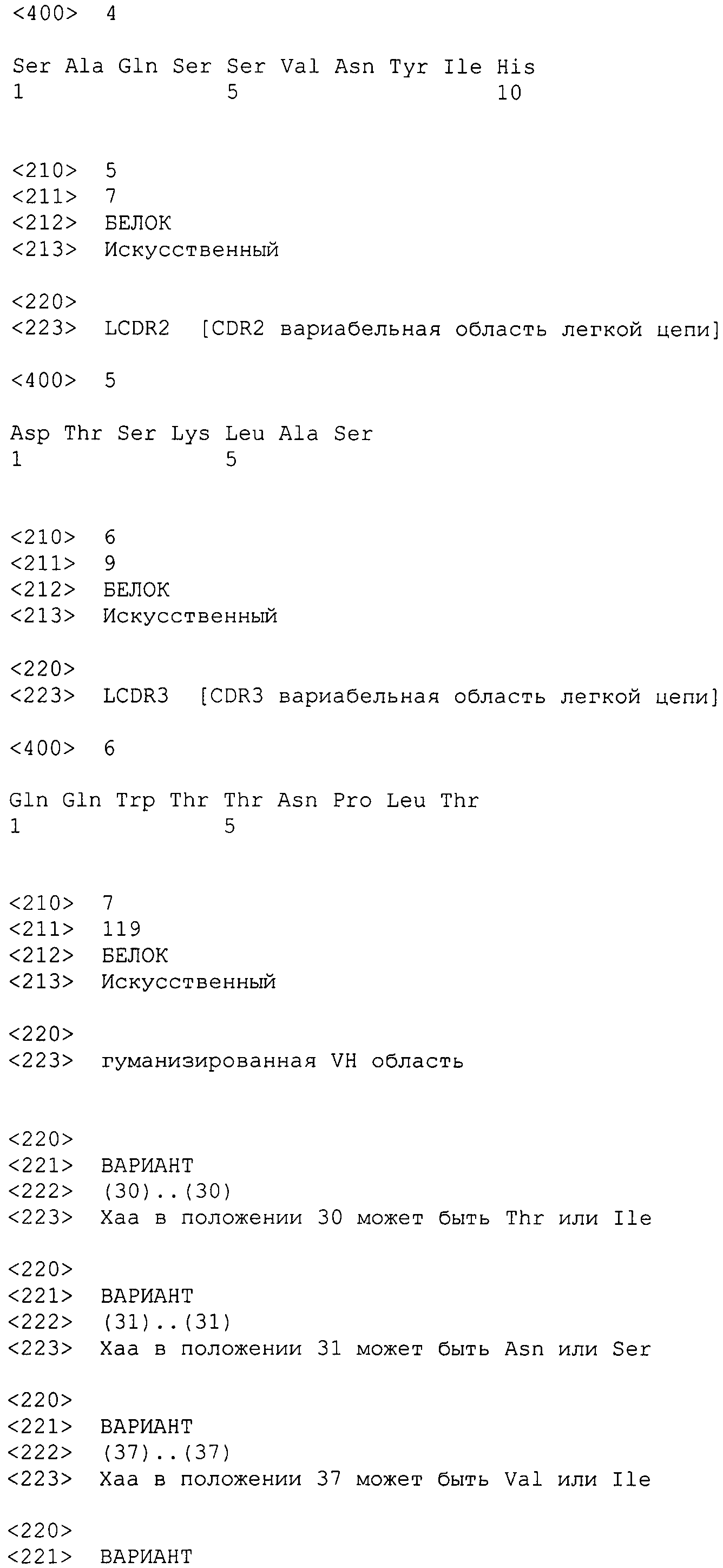
Также обеспечивается вышеупомянутое гуманизированное антитело к интегрину α2, содержащее вариабельную область легкой цепи, которая содержит LCDR1, содержащий аминокислотную последовательность SAQSSVNYIH (SEQ ID NO: 4), LCDR2, содержащий аминокислотную последовательность DTSKLAS (SEQ ID NO: 5), и LCDR3, содержащий аминокислотную последовательность QQWTTNPLT (SEQ ID NO: 6).
Также обеспечивается вышеупомянутое гуманизированное антитело к интегрину α2, содержащее вариабельную область тяжелой цепи, которая содержит HCDR1, содержащий аминокислотную последовательность GFSLTNYGIH (SEQ ID NO: 1), HCDR2, содержащий аминокислотную последовательность VIWARGFTNYNSALMS (SEQ ID NO: 2), и HCDR3, содержащий аминокислотную последовательность ANDGVYYAMDY (SEQ ID NO: 3); и/или вариабельную область легкой цепи, которая содержит LCDR1, содержащий аминокислотную последовательность SAQSSVNYIH (SEQ ID NO: 4), LCDR2, содержащий аминокислотную последовательность DTSKLAS (SEQ ID NO: 5), и LCDR3, содержащий аминокислотную последовательность QQWTTNPLT (SEQ ID NO: 6).
В варианте осуществления вышеупомянутая вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 7.
В варианте осуществления вышеупомянутая вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 7, в которой (a) в положении 71 находится Lys, (b) в положении 73 находится Asn, (c) в положении 78 находится Val или (d) любая комбинация (a)-(c).
В варианте осуществления вышеупомянутая вариабельная область тяжелой цепи содержит аминокислотную последовательность, выбранную из SEQ ID NO:8-19.
В варианте осуществления вышеупомянутая вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO: 17.
В варианте осуществления вышеупомянутая вариабельная область тяжелой цепи дополнительно содержит FW4-область, содержащую аминокислотную последовательность WGQGTLVTVSS (SEQ ID NO: 20).
В варианте осуществления вышеупомянутая вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 21.
В варианте осуществления вышеупомянутая вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 21, в которой (a) в положении 2 находится Phe, (b) в положении 45 находится Lys, (c) в положении 48 находится Tyr или (d) любая комбинация (a)-(c).
В варианте осуществления вышеупомянутая вариабельная область легкой цепи содержит аминокислотную последовательность, выбранную из SEQ ID NO: 22-33.
В варианте осуществления вышеупомянутая вариабельная область легкой цепи содержит аминокислотную последовательность SEQ ID NO: 30.
В варианте осуществления вышеупомянутая вариабельная область легкой цепи дополнительно содержит FW4-область, содержащую аминокислотную последовательность FGQGTKVEIK (SEQ ID NO: 34).
Дополнительно обеспечивается вышеупомянутое гуманизированное антитело к интегрину α2, содержащее вышеупомянутую вариантную константную область тяжелой цепи IgG1 человека, вышеупомянутые вариабельные области тяжелой и легкой цепи и константную область легкой цепи человека.
Таким образом, в дополнительном варианте осуществления антитело к интегрину α2 содержит тяжелую цепь, содержащую SEQ ID NO: 47, и легкую цепь, содержащую SEQ ID NO: 56.
В дополнительном варианте осуществления антитело к интегрину α2 содержит тяжелую цепь, содержащую SEQ ID NO: 48, и легкую цепь, содержащую SEQ ID NO: 56.
В дополнительном варианте осуществления антитело к интегрину α2 содержит тяжелую цепь, выбранную из группы, состоящей из SEQ ID NO: 49-55, и легкую цепь, содержащую SEQ ID NO: 56.
Дополнительно обеспечивается антитело, содержащее вариантную Fc-область IgG человека, которая содержит аминокислотную замену S324N, замещающую серин в аминокислотном положении 324 исходного антитела на аспарагин, при этом антитело проявляет улучшенную комплементзависимую цитотоксичность (CDC).
Дополнительно обеспечивается антитело, содержащее вариантную Fc-область IgG человека, которая содержит аминокислотную замену S324N, замещающую серин в аминокислотном положении 324 исходного антитела на аспарагин, при этом антитело проявляет улучшенную комплементзависимую цитотоксичность (CDC) и улучшенную антителозависимую клеточноопосредованную цитотоксичность (ADCC) по сравнению с исходным антителом. Антитело может дополнительно содержать аминокислотную замену E269D, замещающую глутаминовую кислоту в аминокислотном положении 269 исходного антитела на аспарагиновую кислоту, и/или замену S298A, замещающую серин в аминокислотном положении 298 исходного антитела на аланин. Антитело может быть выбрано из группы, состоящей из химерного антитела, гуманизированного антитела и полностью человеческого антитела. Антитело предпочтительно является гуманизированным антителом, более предпочтительно гуманизированным антителом к интегрину α2.
В варианте осуществления вышеупомянутое гуманизированное антитело к интегрину α2 распознает I-домен интегрина α2 человека.
В варианте осуществления вышеупомянутое гуманизированное антитело к интегрину α2 связывает интегрин α2β1.
В варианте осуществления вышеупомянутое гуманизированное антитело к интегрину α2 ингибирует связывание интегрина α2 или α2β1 с лигандом интегрина α2β1. Обычно лиганд α2β1 интегрина выбирается из коллагена, ламинина, Эховируса-1, декорина, E-кадгерина, матриксной металлопротеиназы I (MMP-I), эндорепеллина, коллектина и белка комплемента C1q, а предпочтительно является коллагеном.
Также обеспечивается выделенная нуклеиновая кислота, кодирующая вышеупомянутое гуманизированное антитело к интегрину α2, вектор, содержащий нуклеиновую кислоту, и клетка-хозяин, содержащая нуклеиновую кислоту или вектор.
Также обеспечивается композиция, содержащая вышеупомянутое гуманизированное антитело к интегрину α2 и фармацевтически приемлемый носитель.
Также обеспечивается способ лечения нарушения, связанного с интегрином α2β1, у субъекта; при этом способ содержит введение субъекту терапевтически эффективного количества вышеупомянутого гуманизированного антитела к интегрину α2 или вышеупомянутой композиции. Нарушение, связанное с интегрином α2β1, включает воспалительное заболевание, аутоиммунное заболевание и заболевание, характеризующееся аномальным или повышенным ангиогенезом, в частности воспалительное заболевание кишечника, болезнь Крона, неспецифический язвенный колит, реакцию на трансплантат, неврит зрительного нерва, травму спинного мозга, ревматоидный артрит, системную красную волчанку (СКВ), сахарный диабет, рассеянный склероз, синдром Рейно, экспериментальный аутоиммунный энцефаломиелит, синдром Шегрена, склеродермию, юношеский сахарный диабет, диабетическую ретинопатию, возрастную дегенерацию желтого пятна, сердечно-сосудистое заболевание, псориаз, рак, а также инфекции, которые индуцируют воспалительную реакцию, конкретнее, рассеянный склероз, ревматоидный артрит, неврит зрительного нерва и поражение спинного мозга.
Виды раков, которые можно лечить с помощью вышеупомянутого гуманизированного антитела к интегрину α2 или вышеупомянутой композиции, выбирают из группы, состоящей из плоскоклеточного рака, рака легкого, включающего мелкоклеточный рак легкого, немелкоклеточный рак легкого, аденокарциному легкого и плоскоклеточный рак легкого, рака брюшины, гепатоцеллюлярного рака, желудочного рака или рака желудка, включающего рак желудочно-кишечного тракта, рака поджелудочной железы, глиобластомы, рака шейки матки, рака яичников, рака печени, рака мочевого пузыря, гепатомы, рака молочной железы, рака ободочной кишки, колоректального рака, карциномы эндометрия или матки, карциномы слюнной железы, рака почки или почечного рака, рака печени, рака предстательной железы, рака вульвы, рака щитовидной железы, карциномы печени и различных видов рака головы и шеи, а также B-клеточной лимфомы, включающей неходжкинскую лимфому (НХЛ) низкой степени злокачественности/фолликулярную; мелкоклеточную лимфоцитарную (МЛ) НХЛ; НХЛ средней степени злокачественности/фолликулярную; диффузную НХЛ средней степени злокачественности; иммунобластную НХЛ высокой степени злокачественности; лимфобластную НХЛ высокой степени злокачественности; мелкоклеточную с нерасщепленным ядром НХЛ высокой степени злокачественности; массивное поражение при НХЛ; лимфому из клеток зоны мантии; СПИД-ассоциированную лимфому; макроглобулинемию Вальденстрема; хронический лимфолейкоз (ХЛЛ); острый лимфобластный лейкоз (ОЛЛ); гистиолимфоцитоз Бернарда; хронический миелобластный лейкоз и пост-трансплантационное лимфопролиферативное нарушение (ПТЛН), а также аномальной сосудистой пролиферации, связанной с факоматозами, отека, а именно связанного с опухолями головного мозга, синдрома Мейса, меланомы, мезотелиомы, множественной миеломы, фибросаркомы, остеосаркомы и эпидермоидной карциномы. Виды рака, которые предпочтительно лечить с помощью антител к интегрину α2, описанные в настоящем документе, выбирают из группы, состоящей из рака молочной железы, колоректального рака, рака прямой кишки, немелкоклеточного рака легкого, неходжкинской лимфомы (НХЛ), почечно-клеточного рака, рака предстательной железы, рака печени, рака поджелудочной железы, саркомы мягких тканей, саркомы Капоши, карциноидной опухоли, рака головы и шеи, меланомы, рака яичников, мезотелиомы и множественной миеломы. Раковые состояния, которые можно улучшить в течение лечения по настоящему изобретению, включают метастатические виды рака. Таким образом, даже более предпочтительными являются раки, выбранные из группы, состоящей из рака молочной железы, колоректального рака, рака прямой кишки, немелкоклеточного рака легкого, неходжкинской лимфомы (НХЛ), почечно-клеточного рака, рака предстательной железы, метастатического рака предстательной железы, рака печени, рака поджелудочной железы, саркомы мягких тканей, саркомы Капоши, карциноидной опухоли, рака головы и шеи, меланомы, рака яичников, мезотелиомы, множественной миеломы, метастатического колоректального рака и метастатического рака молочной железы. Особенно предпочтительными являются виды рака, выбранные из группы, состоящей из немелкоклеточного рака легкого, рака поджелудочной железы, глиобластомы, рака шейки матки, рака яичников, рака печени, рака молочной железы, рака ободочной кишки, колоректального рака, рака почки, рака предстательной железы, метастатического рака предстательной железы, мезотелиомы, фибросаркомы, остеосаркомы, эпидермоидной карциномы, метастатического колоректального рака, метастатического рака предстательной железы и метастатического рака молочной железы. Еще более предпочтительными являются виды рака, выбранные из группы, состоящей из немелкоклеточного рака легкого, рака поджелудочной железы, глиобластомы, рака печени, рака молочной железы, рака ободочной кишки, колоректального рака, рака почки, рака предстательной железы, мезотелиомы, фибросаркомы, метастатического колоректального рака, метастатического рака предстательной железы и метастатического рака молочной железы. Даже еще более предпочтительными являются виды рака, выбранные из группы, состоящей из рака поджелудочной железы, рака молочной железы, рака ободочной кишки, колоректального рака, немелкоклеточного рака легкого, фибросаркомы, метастатического колоректального рака, рака предстательной железы, метастатического рака предстательной железы и метастатического рака молочной железы. Самыми особенно предпочтительными являются виды рака, выбранные из группы, состоящей из рака поджелудочной железы, рака молочной железы, рака ободочной кишки, колоректального рака, немелкоклеточного рака легкого и фибросаркомы. Наиболее предпочтительными являются рак поджелудочной железы, рак молочной железы или метастатический рак молочной железы, с особым предпочтением рака поджелудочной железы. В равной степени самыми особенно предпочтительными являются рак предстательной железы или метастатический рак предстательной железы. «Рак молочной железы», как упоминается в настоящем документе, включают аденокарциному молочной железы. Способ настоящего изобретения особенно подходит для лечения васкуляризированных опухолей.
Предпочтительно, способ не связан с (a) активацией тромбоцитов, (b) агрегацией тромбоцитов, (c) снижением количества циркулирующих тромбоцитов, (d) осложнениями с кровотечениями или (e) любой комбинацией (a)-(d).
Также обеспечивается способ для ингибирования связывания лейкоцитов с коллагеном, включающий введение субъекту количества вышеупомянутого гуманизированного антитела к интегрину α2, эффективного для ингибирования связывания лейкоцитов с коллагеном.
Также обеспечивается набор, содержащий вышеупомянутое гуманизированное антитело к интегрину α2 или вышеупомянутую композицию, а также инструкции для лечения нарушения, связанного с интегрином α2β1.
КОНСТРУИРОВАНИЕ ГУМАНИЗИРОВАННЫХ АНТИТЕЛ К ИНТЕГРИНУ α2 И КОНЪЮГАТОВ
Антитела можно конструировать так, что акцепторная молекула человека для вариабельной области легкой цепи выбирается на основе соображений гомологии между вариабельными областями потенциальной акцепторной молекулы и вариабельной областью легкой цепи антитела мыши. Кандидатные акцепторные молекулы человека зародышевой линии являются предпочтительными для снижения потенциальной иммуногенности. Базы данных зародышевых линий составляются из последовательностей антител, которые считываются с конца FW3-области тяжелой цепи и частично до CDR3 последовательности. Для выбора FW4-области предпочтителен поиск в базах данных последовательностей зрелых антител, которые были получены из выбранной молекулы зародышевой линии, и также для применения в молекуле рекомбинантного антитела предпочтительно выбирать достаточно гомологичную FW4-область. Акцепторные молекулы человека предпочтительно выбираются из того же класса легкой цепи, что и донорская молекула мыши, и того же канонического структурного класса вариабельной области донорской молекулы мыши. Вторичные соображения для выбора акцепторной молекулы человека для вариабельной области легкой цепи включают гомологию длины CDR между донорской молекулой мыши и акцепторной молекулой человека. Акцепторные молекулы человека антитела предпочтительно выбираются посредством поисков гомологии в базе данных V-BASE, а также можно использовать и другие базы данных, такие как Kabat и публичные базы данных NCBI. Для гуманизированных антител к интегрину α2 с такой же или сходной эпитопной специфичностью и/или функциональными свойствами, как у TMC-2206, предпочтительной акцепторной молекулой человека легкой цепи является последовательность антитела зародышевой линии A14 для FW1-3-области и последовательность FGQGTKVEIK для FW4 (SEQ ID NO:34), которая представляет собой общую FW-4 зрелых легких цепей каппа 1 (например, последовательность легкой цепи AAB24132 (запись в NCBI gi/259596/gb/AAB24132)).
Антитела можно конструировать так, что акцепторная молекула человека для вариабельной области тяжелой цепи выбирается на основе соображений гомологии между вариабельными областями потенциальной акцепторной молекулы и вариабельной областью тяжелой цепи антитела мыши. Кандидатные акцепторные молекулы зародышевой линии человека являются предпочтительными для снижения потенциальной антигенности. Базы данных зародышевых линий составляются из последовательностей антител, которые считываются с конца FW3-области тяжелой цепи и частично до CDR3 последовательности. Для выбора FW4-области предпочтителен поиск в базах данных последовательностей зрелых антител, которые получены из выбранной молекулы зародышевой линии; также для применения в молекуле рекомбинантного антитела предпочтительно выбирать достаточно гомологичную FW4-область. Акцепторные молекулы человека предпочтительно выбираются из того же класса тяжелой цепи, что и донорская молекула мыши, и того же канонического структурного класса вариабельной области донорской молекулы мыши. Вторичные соображения для выбора акцепторной молекулы человека для вариабельной области тяжелой цепи включают гомологию длины CDR между донорской молекулой мыши и акцепторной молекулой человека. Акцепторные молекулы антитела человека предпочтительно выбираются посредством поиска гомологии в базе данных V-BASE, однако также можно использовать другие базы данных, такие как Kabat и публичные базы данных NCBI. Для антител к интегрину α2 с такой же или сходной эпитопной специфичностью и/или функциональными свойствами, как у TMC-2206, предпочтительной акцепторной молекулой тяжелой цепи является последовательность антитела зародышевой линии 4-59 для FW1-3-области и антитело CAA48104.1 (запись в NCBI gi/33583/emb/CAA48104.1), зрелое антитело, полученное из последовательности зародышевой линии 4-59 для FW4-области (SEQ ID NO: 20).
Моноклональные антитела можно получать с использованием гибридомного способа, впервые описанного Kohler et al., Nature, 256: 495 (1975), или можно получать способами рекомбинантных ДНК (например, патент США № 6 204 023). Моноклональные антитела также можно получать с использованием методов, описанных в патентах США №№ 6 025 155 и 6 077 677, а также в публикациях заявок на патент США №№ 2002/0160970 и 2003/0083293 (см. также, например, Lindenbaum, et al., Nucleic Acids Research 32 (21):0177 (2004)).
Варианты аминокислотных последовательностей гуманизированного антитела к интегрину α2β1 подготавливают путем введения соответствующих нуклеотидных изменений в ДНК гуманизированного антитела к интегрину α2β1, или посредством синтеза пептида. Такие варианты включают, например, делеции из, и/или вставки в, и/или замены остатков внутри аминокислотных последовательностей, показанных для антитела к интегрину α2 настоящего изобретения. Любую комбинацию аминокислотных делеции, вставки и замены осуществляют для достижения конечной конструкции, при условии, что конечная конструкция обладает желаемыми характеристиками. Аминокислотные изменения также могут менять пост-трансляционные процессы в гуманизированном антителе к интегрину α2, такие как изменение количества или положения сайтов гликозилирования.
Существует ряд способов, применяемых для того, чтобы сделать антитела человеческими или человекоподобными (например, «гуманизация»). Подходы к гуманизации антител варьировали на протяжении многих лет. Одним подходом было генерирование вариабельных областей мыши, слитых с константными областями человека, так называемые мышиные-человеческие Fc-химеры (см., например, Morrison et al, Proc. Natl. Acad. Sci. USA 81:6851-6855 (1984); патент США № 5 807 715). Другой подход использовал тот факт, что CDR можно легко идентифицировать на основе их гипервариабельной природы (Kabat et al, J. Biol. Chem. 252:6609-6616 (1977), Kabat, Adv. Protein Chem. 32:1-75 (1978)) и канонической структуры (Chothia and Lesk, J. Mol. Biol. 196(4):901-17 (1987); Lazakani et al., J. Mol. Biol. 272:929 (1997)) и гуманизировать путем прививания только CDR-областей, не принадлежащих человеку (так называемые донорские CDR), на каркасную структуру человека (так называемый акцепторный каркас), как показано, например, в Jones et al., Nature 321(6069):522-5 (1986); (см., например, патент США № 5 225 539; патент США № 6 548 640). В кластере присутствуют шесть петель CDR, и на основе кристаллографического анализа можно легко идентифицировать критические каркасные остатки внутри так называемой зоны «Вернье», фланкирующей CDR, или на поверхности контакта тяжелой и легкой цепи (см., например, Chothia and Lesk, J. Mol. Biol. 196(4):901-17 (1987); Chothia et al., J. Mol. Biol. 186(3):651-63 (1985); Chothia et al., Nature 342(6252):877-83 (1989)). Эти остатки можно мутировать к первоначальному виду остатка мыши для восстановления правильной взаимной ориентации шести CDR (см., например, Verhoyen et al., Science 239(4847):1534-6 (1988); Reichman et al., Nature 332(6162):323-7 (1988); Tempest et al., Biotechnology (NY) 9(3):266-71 (1991)). Поскольку вариабельные области могут быть классифицированы на семейства, имеющие относительно высокую гомологию между мышью и человеком (рассматривается, например, в Pascual and Capra Adv. Immunol. 49:1-74 (1991)), эти ранние исследования также указывали, что вероятность потери аффинности можно минимизировать в привитом антителе, выбирая для применения в качестве акцепторной молекулы человека последовательности зародышевой линии человека с самой высокой гомологией к интересующему антителу мыши (см., например, патент США № 5 225 539; Verhoyen et al., Science 239(4847):1534-6 (1988)).
Способы гуманизации антитела к интегрину α2, не принадлежащего человеку, описаны, например, в WO2007/056858. Для того чтобы гуманизировать антитело к интегрину α2, получают исходный материал антитела, не принадлежащего человеку, включая приготовление на основании иммунизации или путем покупки коммерчески доступных антител. Примерные методы гуманизации антител, применяемые в настоящем изобретении, например, для гуманизации TMC-2206, описаны в WO2007/056858.
Существенные изменения биологических свойств антитела достигаются путем выбора замен, которые значительно различаются по своему эффекту на поддержание (a) структуры полипептидной скелета в участке замены, например, в виде складчатой или спиральной конформации, (b) заряда или гидрофобности молекулы в сайте-мишени или (c) величины боковой цепи. Встречающиеся в природе остатки делятся на группы на основании общих свойств боковой цепи: (1) гидрофобные: норлейцин, met, ala, val, leu, ile; (2) нейтральные гидрофильные: cys, ser, thr; (3) кислотные: asp, glu; (4) основные: asn, gln, his, lys, arg; (5) остатки, которые влияют на ориентацию цепи: gly, pro; и (6) ароматические: trp, tyr, phe. Любой цистеиновый остаток, не вовлеченный в поддержание надлежащей конформации гуманизированного антитела к интегрину α2, также можно заменить, как правило, на серин, для улучшения устойчивости молекулы к окислению и предупреждения аберрантного сшивания. С другой стороны, цистеиновая связь(и) можно добавлять в антитело для улучшения его стабильности (в частности, когда антитело является фрагментом антитела, как Fv-фрагмент).
Еще один тип аминокислотного варианта антитела изменяет первоначальный характер гликозилирования антитела. Под изменением подразумевается удаление одного или нескольких углеводных фрагментов, обнаруженных в антителе, и/или добавление одного или нескольких сайтов гликозилирования, которые не присутствуют в данном антителе.
Гликозилирование антител является, как правило, N-связанным или O-связанным. N-связанное относится к присоединению углеводного фрагмента к боковой цепи остатка аспарагина. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X представляет собой любую аминокислоту, за исключением пролина, являются последовательностями распознавания для ферментативного присоединения углеводного фрагмента к боковой цепи аспарагина. Таким образом, присутствие любой из этих трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. O-связанное гликозилирование относится к присоединению одного из сахаров, N-ацетилгалактозамина, галактозы или ксилозы, к гидроксиаминокислоте, чаще всего серину или треонину, хотя также могут использоваться 5-гидроксипролин или 5-гидроксилизин.
Добавление или удаление сайтов гликозилирования в антителе удобно осуществлять путем изменения аминокислотной последовательности так, чтобы она содержала или не содержала одной или нескольких из вышеописанных трипептидных последовательностей (для N-связанных сайтов гликозилирования). Изменение можно также осуществлять путем добавления, замены на, или делеции одного или нескольких остатков серина или треонина в последовательности первоначального антитела (для O-связанных сайтов гликозилирования). Молекулы нуклеиновой кислоты, кодирующие варианты аминокислотных последовательностей гуманизированного антитела к интегрину α2, подготавливают с помощью различных способов, известных в уровне техники. Эти способы включают, но без ограничений, выделение из естественного источника (в случае вариантов аминокислотной последовательности, встречающихся в природе) или подготовку путем олигонуклеотид-опосредованного (или сайт-направленного) мутагенеза, PCR-мутагенеза или кассетного мутагенеза ранее подготовленного варианта или невариантной версии гуманизированного антитела к интегрину α2.
Обычно варианты аминокислотной последовательности гуманизированного антитела к интегрину α2 будут иметь аминокислотную последовательность с по меньшей мере 75% идентичностью аминокислотной последовательности с аминокислотными последовательностями первоначального гуманизированного антитела или тяжелой, или легкой цепи (например, последовательности вариабельной области, как в SEQ ID NO:17 или SEQ ID NO:30, соответственно), более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95%, включающей, например, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% и 100%. Идентичность или гомология в отношении этой последовательности в настоящем документе определяется как процентное содержание аминокислотных остатков в кандидатной последовательности, идентичных остаткам гуманизированного антитела к интегрину α2 после выравнивания последовательностей и введения пробелов, при необходимости, для достижения максимального процента идентичности последовательностей, и не рассматривая любые консервативные замены (описываемые выше) как часть идентичности последовательности. Ни одно из N-концевых, C-концевых или внутренних удлинений, делеций, или вставок в последовательность антитела не должно интерпретироваться как влияющее на идентичность или гомологию последовательностей. Таким образом, идентичность последовательностей может определяться стандартными способами, которые обычно применяются для сравнения сходства в положении аминокислот двух полипептидов. С помощью компьютерных программ, таких как BLAST или FASTA, два полипептида выравниваются для оптимального совмещения их соответствующих аминокислот (либо по полной длине одной или обеих последовательностей, либо по заранее определенной части одной или обеих последовательностей). Программы обеспечивают штраф за введение пробела и штраф за пробел по умолчанию, а в сочетании с компьютерной программой можно использовать матрицу замен, такую как PAM250 (стандартная матрица замен; см. Dayhoff et al., in Atlas of Protein Sequence and Structure, vol 5, supp. 3 (1978)). Например, процент идентичности можно рассчитать как общее число идентичных совмещений, умноженное на 100 и затем разделенное на сумму длины более длинной последовательности внутри совмещенного диапазона, и число пробелов, введенных в более длинную последовательность для того, чтобы выровнять две последовательности.
В некоторых вариантах осуществления может быть желательным генерирование полиспецифичных (например, биспецифичные) гуманизированных антител к интегрину α2 со связывающими специфичностями в отношении по меньшей мере двух различных эпитопов. Иллюстративные биспецифичные антитела (например, с двумя различными связывающими плечами) могут связываться с двумя различными эпитопами белка интегрина α2β1. С другой стороны, плечо к интегрину α2 можно объединять с плечом, которое связывается со стимулирующей молекулой на лейкоците, такой как рецепторная молекула Т-клетки (например, CD2 или CD3), или Fc-рецепторами для IgG (FcγR), такими как FcγR1 (CD64), FcγRII (CD32) и FcγRIII (CD16), для того чтобы сфокусировать механизмы клеточной защиты на клетке, имеющей связанный с ее поверхностью интегрин α2β1. Биспецифичные антитела могут использоваться для локализации цитотоксических средств на клетках со связанным с их поверхностью интегрином α2β1. У этих антител есть плечо, связывающее интегрин α2β1, и плечо, которое связывает цитотоксическое средство (например, гелонин, сапорин, анти-альфа-интерферон, алкалоид барвинка, A-цепь рицина или радиоизотопный гаптен).
В соответствии с другим подходом к изготовлению биспецифичных антител поверхность контакта между парой молекул антитела можно конструировать для максимального увеличения процента гетеродимеров, которые получают из рекомбинантной клеточной культуры. Предпочтительная поверхность контакта включает, по меньшей мере, часть CH3-домена константного домена антитела. В данном способе одна или несколько малых аминокислотных боковых цепей заменяются на более крупные боковые цепи (например, тирозин или триптофан). Компенсационные полости идентичного или меньшего размера для крупной боковой цепи(ей) создаются на поверхности контакта второго антитела путем замены более крупной аминокислотной боковой цепи на меньшую (например, аланин или треонин). Это обеспечивает механизм увеличения выхода гетеродимеров относительно других нежелательных конечных продуктов, таких как гомодимеры (см., например, WO96/27011).
Биспецифичные антитела включают сшитые или гетероконъюгатные антитела. Например, одно из антител в гетероконъюгате может быть связано с авидином, а другое - с биотином. Гетероконъюгатные антитела можно изготавливать с использованием любого удобного способа сшивания. Подходящие средства для сшивания хорошо известны в уровне техники и раскрываются, например, в патенте США № 4676980 наряду с рядом методов сшивания.
Предполагаются антитела с более чем двумя валентностями. Например, могут приготавливаться триспецифичные антитела (см., например, Tutt et al., J. Immunol. 147:60 (1991)).
Иммуноконъюгаты включают гуманизированное антитело к интегрину α2, конъюгированное с фрагментом, например молекулой, композицией, комплексом или средством, например, цитотоксическим средством, таким как химиотерапевтическое средство, токсин (например, ферментативно активный токсин бактериального, грибного, растительного или животного происхождения, или его фрагменты) или радиоактивный изотоп (например, радиоконъюгат), для нацеливания средства на клетку, ткань или орган, экспрессирующие α2 интегрин. Такой иммуноконъюгат может применяться в способе нацеливания фрагмента или средства на определенное место действия, характеризуемое присутствием интегрина α2 или α2β1.
Химиотерапевтические средства, пригодные для генерирования таких иммуноконъюгатов, были описаны выше. Ферментативно активные токсины и их фрагменты, которые могут применяться, включают А-цепь дифтерийного токсина, несвязывающие активные фрагменты дифтерийного токсина, А-цепь экзотоксина (из Pseudomonas aeruginosa), А-цепь рицина, А-цепь абрина, А-цепь модекцина, альфа-сарцин, белки Aleurites fordii, белки диантины, белки Phytolaca americana (PAPI, PAPII и PAP-S), ингибитор Momordica charantia, курцин, кротин, ингибитор saponaria officinalis, гелонин, митогеллин, рестриктоцин, феномицин, эномицин или трикотецены. Различные радионуклиды доступны для производства радиоконъюгированных антител к интегрину альфа 2. Примеры включают 212 Bi, 131In, 90Y или 186Re.
Конъюгаты антитела и цитотоксического средства изготавливают с помощью различных бифункциональных связывающих белки средств, таких как N-сукцинимидил-3-(2-пиридилдитиол)пропионат (SPDP), иминотиолан (IT), бифункциональные производные имидоэфиров (такие как диметиладипимидат HCl), активные сложные эфиры (такие как дисукцимидилсуберат), альдегиды (такие как глутеральдегид), бис-азидо соединения (такие как бис-(п-азидобензоил)-гександиамин), производные бис-диазония (такие как бис-(п-диазоний-бензоил)-этилендиамин), диизоцианаты (такие как толуол-2,6-диизоцианат), или соединения с двумя активными фторами (такие как 1,5-дифтор-2,4-динитробензол). Например, рициновый иммунотоксин может быть приготовлен, как описано в Vitetta et al., Science 238:1098 (1987). Меченная углеродом 14 1-изотиоцианатобензил-3-метилдиэтилентриаминпентауксусная кислота (MX-DTPA) является иллюстративным хелатообразующим средством для конъюгирования радионуклида с антителом (см., например, WO94/11026).
В другом варианте осуществления антитело может быть конъюгировано с рецептором (таким как стрептавидин) для использования в предварительном нацеливании на клетку, ткань или орган, экспрессирующие интегрин α2; при этом конъюгат антитело-рецептор вводят пациенту с последующим удалением несвязавшегося конъюгата из циркуляции с помощью очищающего средства, а затем введением лиганда (например, авидина), который конъюгируют со средством, например цитотоксическим средством (например, радионуклидом).
Антитела к интегрину α2, раскрытые в настоящем документе, также можно составлять как иммунолипосомы. Липосомы, содержащие антитело, подготавливают посредством способов, известных в уровне техники, такими как описаны в Epstein et al., Proc. Natl. Acad. Sci. USA 82: 3688 (1985); Hwang et al., Proc. Natl. Acad. Sci. USA 77: 4030 (1980); и патентах США №№ 4485045 и 4544545. Липосомы с повышенным временем циркуляции раскрываются в патенте США № 5013556.
Гуманизированные антитела к интегрину α2 также можно применять в ферментативной пролекарственной терапии, направляемой антителами (Antibody Directed Enzyme Prodrug Therapy - ADEPT), путем конъюгирования антитела с активирующим пролекарство ферментом, который превращает пролекарство (например, пептидил-химиотерапевтическое средство, см., например, WO81/01145) в активное лекарственное средство (см., например, WO88/07378 и патент США № 4975278).
Ферменты можно ковалентно связывать с антителами к интегрину α2 с помощью методов, хорошо известных в уровне техники, включая применение гетеробифункциональных сшивающих реагентов, рассмотренных выше. В качестве альтернативы можно конструировать слитые белки, содержащие, по меньшей мере, антигенсвязывающую область антитела к интегрину α2, соединенную с, по меньшей мере, функционально активной частью фермента, с помощью методов рекомбинантной ДНК, хорошо известных в уровне техники (см., например, Neuberger et al., Nature 312: 604-608 (1984)).
Ковалентные модификации гуманизированных антител к интегрину α2 можно осуществлять, например, путем химического синтеза или путем ферментативного или химического расщепления антитела. Другие типы ковалентных модификаций антитела вводят в молекулу посредством проведения реакции целевых аминокислотных остатков антитела с органическим дериватизирующим средством, которое способно реагировать с выбранными боковыми цепями или N- или C-концевыми остатками. Остатки цистеина, например, чаще всего подвергают реакции с α-галоацетатами (и соответствующими аминами), такими как хлоруксусная кислота или хлорацетамид, с образованием карбоксиметильных или карбоксиамидометильных производных. Остатки цистеина также дериватизируют путем реакции с бромтрифторацетоном, α-бром-β-(5-имидазолил)пропионовой кислотой, хлорацетилфосфатом, N-алкилмалеимидами, 3-нитро-2-пиридилдисульфидом, метил-2-пиридилдисульфидом, п-хлормеркурибензоатом, 2-хлормеркури-4-нитрофенолом или хлоро-7-нитробензо-2-окса-1,3-диазолом. Остатки гистидина, например, дериватизируют посредством реакции с диэтилпирокарбонатом при pH 5,5-7,0, поскольку это средство является относительно специфичным в отношении боковой цепи гистидина. Пара-бромофенацилбромид также является пригодным; реакцию предпочтительно выполняют в 0,1 M какодилате натрия при pH 6,0. Остатки лизина и аминоконцевые остатки, например, реагируют с ангидридами янтарной или других карбоновых кислот. Дериватизация с этими средствами оказывает эффект обращения заряда остатков лизина. Другие подходящие реагенты для дериватизации α-амино-содержащих остатков включают имидоэфиры, такие как метилпиколинимидат, пиридоксальфосфат, пиридоксаль, хлорборгидрид, тринитробензолсульфоновую кислоту, O-метилизомочевину, 2,4-пентандион, и катализируемую трансаминазой реакцию с глиоксилатом. Остатки аргинина, например, модифицируют посредством реакции с одним или несколькими общепринятыми реагентами, среди которых фенилглиоксаль, 2,3-бутандион, 1,2-циклогександион и нингидрин. При дериватизации остатков аргинина требуется, чтобы реакция выполнялась в щелочных условиях из-за высокой pKa гуанидиновой функциональной группы. Кроме того, эти реагенты могут вступать в реакцию с группами лизина, так же как и с эпсилон-аминогруппой аргинина. Остатки тирозина, например, специфически модифицируют с особой заинтересованностью во введении спектральных меток в остатки тирозина, посредством реакции с ароматическими соединениями диазония или тетранитрометаном. Чаще всего применяются N-ацетилимидазол и тетранитрометан для образования O-ацетилтирозильных соединений и 3-нитропроизводных, соответственно. Остатки тирозина йодируют с помощью 125I или 131I, чтобы подготовить меченые белки для применения в радиоиммунологическом анализе. Карбоксильные боковые группы, например остатки аспарагиновой или глутаминовой кислоты, селективно модифицируют посредством реакции с карбодиимидами (R-N=C=N-R'), где R и R' представляют собой различные алкильные группы, такие как 1-циклогексил-3-(2-морфолинил-4-этил)карбодиимид или 1-этил-3-(4-азония-4,4-диметилпентил)карбодиимид. Кроме того, остатки аспарагиновой и глутаминовой кислоты превращают в остатки аспарагина и глутамина посредством реакции с ионами аммония. Остатки аспарагина и глутамина часто дезамидируют до соответствующего остатка аспарагиновой или глутаминовой кислоты, соответственно. Эти остатки дезамидируют в нейтральных или основных условиях. Дезамидированная форма этих остатков находится в объеме настоящего изобретения. Другие модификации включают гидроксилирование пролина и лизина, фосфорилирование гидроксильных групп остатков серина и треонина, метилирование α-аминогрупп боковых цепей лизина, аргинина и гистидина (T. E. Creighton, Proteins: Structure and Molecular Properties, W.H. Freeman & Co., San Francisco, pp. 79-86 (1983)), ацетилирование N-концевого амина и амидирование любой C-концевой карбоксильной группы.
Другой тип ковалентной модификации включает в себя химическое или ферментативное связывание гликозидов с антителом. Эти процедуры дают преимущество в том, что с ними не требуется получение антител в клетке-хозяине, имеющей возможности гликозилирования в отношении N- или О-связанного гликозилирования. В зависимости от применяемого режима связывания сахар(а) можно присоединять к (a) аргинину и гистидину, (b) свободным карбоксильным группам, (c) свободным сульфгидрильным группам, как у цистеина, (d) свободным гидроксильным группам, как у серина, треонина или гидроксипролина, (e) ароматическим остаткам, как у фенилаланина, тирозина или триптофана, или (f) амидной группе глутамина (см., например, WO87/05330; Aplin and Wriston, CRC Crit. Rev. Biochem., pp. 259-306 (1981)).
Удаление любых углеводных фрагментов, присутствующих на антителе, может осуществляться, например, химически или ферментативно. Химическое дегликозилирование требует воздействия на антитела соединения трифторметансульфоновой кислоты или эквивалентного соединения. Эта обработка приводит к расщеплению большинства или всех сахаров, кроме соединяющего сахара (N-ацетилглюкозамин или N-ацетилгалактозамин), при этом не повреждая антитело (см., например, Hakimuddin, et al., Arch. Biochem. Biophys. 259: 52 (1987); Edge et al., Anal. Biochem., 118: 131 (1981)). Ферментативное расщепление углеводных фрагментов антитела может достигаться применением различных эндо- и экзогликозидаз (см., например, Thotakura et al., Meth. Enzymol. 138: 350 (1987)).
Другой тип ковалентной модификации антитела включает соединение антитела с одним из ряда небелковых полимеров, таких как полиэтиленгликоль, полипропиленгликоль или полиоксиалкилены (см., например, патенты США №№ 4640835; 4496689; 4301144; 4670417; 4791192 или 4179337).
В настоящем документе описываются выделенная нуклеиновая кислота(ы), кодирующая гуманизированное антитело к интегрину α2, а также векторы и клетки-хозяева, содержащие нуклеиновую кислоту, и методы с использованием рекомбинации для производства антитела. Для производства антитела с использованием рекомбинации нуклеиновую кислоту(ы), кодирующую антитело, выделяют и вставляют в реплицируемый вектор для дальнейшего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующая антитело, легко выделяется и секвенируется с помощью обычных процедур (например, с помощью олигонуклеотидных зондов, которые способны специфично связываться с генами, кодирующими тяжелую и легкую цепи антитела). В распоряжении имеется множество векторов. Векторные компоненты обычно включают, но без ограничений, один или несколько из следующих: сигнальную последовательность, точку начала репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции.
Антитело к интегрину α2 можно получать рекомбинантно, в том числе как слитый полипептид с гетерологичным полипептидом, который является предпочтительно сигнальной последовательностью или другим полипептидом, имеющим специфический сайт расщепления на N-конце зрелого белка или полипептида. Выбираемая гетерологичная сигнальная последовательность, предпочтительно, такова, что распознается и процессируется (например, расщепляется сигнальной пептидазой) клеткой-хозяином. Для прокариотических клеток-хозяев, которые не распознают и не процессируют эукариотическую сигнальную последовательность (например, сигнальную последовательность иммуноглобулина), сигнальную последовательность заменяют на прокариотическую сигнальную последовательность, включая, например, лидерные последовательности пектат лизазы (такой как pelB), щелочной фосфатазы, пенициллиназы, lpp (липидфосфат фосфатаза) или термостабильного энтеротоксина II. Для секреции с использованием дрожжей может применяться сигнальная последовательность дрожжей, включая, например, лидерную последовательность инвертазы дрожжей, лидерную последовательность фактора (включая лидерные последовательности α-фактора Saccharomyces и Kluyveromyces) или лидерную последовательность кислой фосфатазы, лидерную последовательность глюкоамилазы C. albicans или сигнальную последовательность, описанную в WO90/13646. Для экспрессии в клетках млекопитающих имеются в распоряжении и могут быть использованы сигнальные последовательности млекопитающих, а также вирусные секреторные лидерные последовательности, например, gD сигнальная последовательность простого герпеса. ДНК для такой области-предшественника (например, сигнальной последовательности) лигируют в рамку считывания к ДНК, кодирующей антитело к интегрину α2.
Как вектор экспрессии, так и клонирующий вектор содержат последовательность нуклеиновой кислоты, позволяющую реплицировать вектор в одной или нескольких выбранных клетках-хозяевах. В целом, в клонирующих векторах эта последовательность такова, что позволяет реплицировать вектор независимо от хромосомной ДНК хозяина и включает точки начала репликации или автономно реплицирующиеся последовательности. Такие последовательности хорошо известны для ряда бактерий, дрожжей и вирусов. Например, точка начала репликации из плазмиды pBR322 подходит для большинства грамотрицательных бактерий, точка начала репликации плазмиды 2 µ подходит для дрожжей, а различные вирусные точки начала репликации (SV40, полиома, аденовирус, VSV или BPV) пригодны для клонирующих векторов в клетках млекопитающих. В целом, компонент точки начала репликации не является необходимым для векторов экспрессии в млекопитающих (например, точку начала репликации SV40 можно, как правило, применять только потому, что она содержит ранний промотор).
Векторы экспрессии и клонирования могут содержать ген отбора, также называемый селектируемый маркер. Типичные гены отбора кодируют белки, которые (a) придают устойчивость к антибиотикам или другим токсинам, например ампициллину, неомицину, метотрексату или тетрациклину, (b) дополняют ауксотрофные недостаточности или (c) обеспечивают критические питательные вещества, не доступные из комплексной среды (например, ген, кодирующий D-аланин рацемазу для Bacilli).
Один из примеров схемы отбора использует лекарственное средство для угнетения роста клетки-хозяина. Клетки, успешно трансформированные гетерологичным геном, производят белок, предоставляющий устойчивость к лекарственному средству, и таким образом выживают в режиме отбора. Примеры такого доминантного отбора применяют лекарственные средства метотрексат, неомицин, гистидинол, пуромицин, микофенольную кислоту и гигромицин.
Другим примером подходящих селектируемых маркеров для клеток млекопитающих являются те, которые позволяют идентифицировать клетки, способные к поглощению нуклеиновой кислоты антитела к интегрину α2, такие как DHFR (дигидрофолат редуктаза), тимидинкиназа, металлотионеин-I и -II, предпочтительно гены металлотионеина приматов, аденозин деаминаза, орнитин декарбоксилаза и т.д.
Например, клетки, трансформированные геном отбора DHFR, сначала идентифицируют культивированием всех трансформантов в культуральной среде, которая содержит метотрексат (Mtx), конкурентный антагонист DHFR. Оптимальной клеткой-хозяином при использовании DHFR дикого типа является линия клеток яичника китайского хомячка (CHO), дефицитная по DHFR-активности.
В качестве альтернативы клетки-хозяева (в частности хозяева дикого типа, которые содержат эндогенный DHFR), трансформированные или совместно трансформированные последовательностями ДНК, кодирующими антитело к интегрину α2, белок DHFR дикого типа и другие селектируемые маркеры, такие как аминогликозид 3'-фосфотрансфераза (APH), могут отбираться с помощью выращивания клеток в среде, содержащей средство отбора для селектируемого маркера, включая аминогликозидный антибиотик, такой как канамицин, неомицин или G418 (см., например, патент США № 4965199).
Одним из подходящих генов отбора для применения в дрожжах является ген trp1, присутствующий в дрожжевой плазмиде YRp7 (Stinchcomb et al., Nature, 282: 39 (1979)). Ген trp1 обеспечивает маркер отбора для мутантного штамма дрожжей, не имеющего способности к росту в отсутствие триптофана, например, ATCC № 44 076 или PEP4-1 (см., например, Jones, Genetics, 85: 12 (1977)). Присутствие повреждения trp1 в геноме дрожжевой клетки-хозяина затем обеспечивает эффективные условия для обнаружения трансформации путем выращивания в отсутствие триптофана. Аналогично, штаммы дрожжей, дефицитные по Leu2 (ATCC № 20622 или 38626) дополняют известными плазмидами, несущими ген Leu2.
Кроме того, могут использоваться векторы, полученные из 1,6 µ кольцевой плазмиды pKD1, для трансформации дрожжей Kluyveromyces. В качестве альтернативы, сообщалось о системе экспрессии K. lactis для крупномасштабного производства рекомбинантного химозина теленка (Van den Berg, Bio/Technology, 8:135 (1990)). Также были раскрыты стабильные многокопийные векторы экспрессии для секреции зрелого рекомбинантного сывороточного альбумина человека с помощью промышленных штаммов Kluyveromyces (см., например, Fleer et al., Bio/Technology, 9: 968-975 (1991)).
Векторы экспрессии и клонирования обычно содержат промотор, который распознается организмом-хозяина и функционально связан с нуклеиновой кислотой антитела к интегрину α2. Промоторы, подходящие для применения с прокариотическими хозяевами, включают промотор арабинозы (например, araB), промотор phoA, промоторные системы β-лактамазы и лактозы, щелочной фосфатазы, триптофановую (trp) промоторную систему, а также гибридные промоторы, такие как промотор tac. Однако подходят и другие известные бактериальные промоторы. Промоторы для применения в бактериальных системах также будут содержать последовательность Shine-Dalgamo (S.D.), функционально связанную с ДНК, кодирующей антитело к интегрину α2.
Промоторные последовательности известны и для эукариот. Большинство генов эукариот имеют область, обогащенную АТ, расположенную приблизительно на 25-30 оснований выше сайта, где инициируется транскрипция. Другая последовательность, обнаруженная на 70-80 оснований выше от начала транскрипции у большинства генов, является областью CNCAAT, где N может быть любым нуклеотидом. На 3'-конце большинства эукариотических генов находится последовательность AATAAA, которая может служить сигналом для добавления поли-А хвоста к 3'-концу кодирующей последовательности. Такие последовательности соответственно вставляют в эукариотические векторы экспрессии.
Примеры подходящих промоторных последовательностей для применения с хозяевами-дрожжами включают, но без ограничения, промоторы для 3-фосфоглицерат киназы или других гликолитических ферментов, таких как энолаза, глицеральдегид-3-фосфат дегидрогеназа, гексокиназа, пируват декарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфат изомераза, 3-фосфоглицерат мутаза, пируваткиназа, триозофосфат изомераза, фосфоглюкозоизомераза и глюкокиназа. Другими промоторами дрожжей, которые являются индуцибельными промоторами с дополнительным преимуществом транскрипции, контролируемой условиями роста, являются промоторные области для алкогольдегидрогеназы 2, изоцитохрома С, кислой фосфатазы, деструктивных ферментов, связанных с метаболизмом азота, металлотионеина, глицеральдегид-3-фосфат дегидрогеназы и ферментов, ответственных за утилизацию мальтозы и галактозы. Подходящие векторы и промоторы для применения в дрожжевой экспрессии дополнительно описываются в EP 73657. Дрожжевые энхансеры также преимущественно используются с дрожжевыми промоторами.
Транскрипция антитела к интегрину α2 из векторов в клетках-хозяевах млекопитающих контролируется, например, промоторами, полученными из геномов вирусов, таких как вирус полиомы, вирус оспы кур, аденовирус (такой как аденовирус 2), вирус папилломы крупного рогатого скота, вирус саркомы птиц, цитомегаловирус, ретровирус, вирус гепатита В или вирус обезьян 40 (SV40), из гетерологичных промоторов млекопитающих, например, актинового промотора или иммуноглобулинового промотора, из промоторов белков теплового шока, при условии, что такие промоторы совместимы с системами клетки-хозяина. Ранний и поздний промоторы вируса SV40 в целях удобства получают как рестрикционный фрагмент SV40, который также содержит вирусную точку начала репликации SV40. Немедленно-ранний промотор цитомегаловируса человека в целях удобства получают как рестрикционный фрагмент HindIII E. Система для экспрессии ДНК в хозяевах-млекопитающих с использованием вируса папилломы крупного рогатого скота раскрывается в патенте США № 4419446, а модификация этой системы описывается в патенте США № 4601978 (см. также Reyes et al., Nature 297: 598-601 (1982) относительно экспрессии кДНК β-интерферона человека в клетках мыши под контролем промотора тимидинкиназы из вируса простого герпеса). В качестве альтернативы в качестве промотора можно применять длинный концевой повтор вируса саркомы Рауса.
Транскрипцию ДНК, кодирующей антитело к интегрину α2, у высших эукариот часто повышают путем вставки в вектор энхансерной последовательности. В настоящее время известно множество энхансерных последовательностей из генов млекопитающих (глобина, эластазы, альбумина, α-фетопротеина и инсулина). Часто, однако, применяется энхансер из вируса эукариотической клетки. Примеры включают энхансер SV40 на поздней стороне от точки начала репликации (пары основания 100-270), энхансер раннего промотора цитомегаловируса, энхансер вируса полиомы на поздней стороне от точки начала репликации и энхансеры аденовируса (см. также, например, Yaniv, Nature 297: 17-18 (1982) относительно энхансерных элементов для активации эукариотических промоторов). Энхансер можно сплайсировать в вектор в положении 5' или 3' относительно последовательности, кодирующей антитело к интегрину α2, однако предпочтительно располагать его в 5'-сайте от промотора. Другие системы регуляции генов, хорошо известные в уровне техники (например, индуцибельные системы, такие как тетрациклиновые индуцибельные системы и GeneSwitch™), могут применяться для контроля транскрипции ДНК, кодирующей антитело к интегрину α2.
Векторы экспрессии, применяемые в эукариотических клетках-хозяевах (дрожжи, грибы, насекомое, растение, животное, человек или ядерные клетки из других многоклеточных организмов), будут также содержать последовательности, необходимые для терминации транскрипции и для стабилизирования мРНК. Такие последовательности широко доступны из 5' и, иногда 3', нетранслируемых областей эукариотических или вирусных ДНК или кДНК. Эти области содержат нуклеотидные сегменты, транскрибируемые как полиаденилированные фрагменты в нетранслируемой части мРНК, кодирующей антитело к интегрину α2. Одним из полезных компонентов терминации транскрипции является полиаденилированная область гормона роста крупного рогатого скота (см., например, WO94/11026 и вектор экспрессии, раскрытый в нем).
Подходящими клетками-хозяевами для клонирования и экспрессирования ДНК в векторах настоящего документа являются клетки прокариот, дрожжей или высших эукариот, как описано выше. Подходящие прокариоты для этой цели включают эубактерий, в том числе грамотрицательные или грамположительные организмы, например, Enterobacteriaceae, такие как Escherichia, например, E. coli, Enterobacter, Erwinia, Klebsiella, Proteus, Salmonella, например, Salmonella typhimurium, Serratia, например, Serratia marcescans, и Shigella, а также Bacilli, такие как B. subtilis и B. licheniformis, Pseudomonas, такие как P. aeruginosa, и Streptomyces. Подходящие клонирующие хозяева E. coli включают E. coli 294 (ATCC 31446), E. coli B, E. coli X1776 (ATCC 31 537) и E. coli W3110 (ATCC 27 325).
В дополнение к прокариотам подходящими хозяевами для клонирования или экспрессии для векторов, кодирующих антитело к интегрину альфа 2, являются эукариотические микроорганизмы, такие как мицелиальные грибы или дрожжи. Saccharomyces cerevisiae, или обычные пекарские дрожжи, среди низших эукариотических микроорганизмов-хозяев применяются чаще всего. Однако ряд других родов, видов и штаммов широко доступны и пригодны, такие как Schizosaccharomyces pombe; хозяева из рода Kluyveromyces, включая K. lactis, K. fragilis (ATCC 12 424), K. bulgaricus (ATCC 16 045), K. wickeramii (ATCC 24 178), K. waltii (ATCC 56 500), K. drosophilarum (ATCC 36 906), K. thermotolerans, или K. marxianus; yarrowia (EP 402 226); Pichia pastoris (EP 183 070); Candida; Trichoderma reesia (EP 244 234); Neurospora crassa; Schwanniomyces, такие как Schwanniomyces occidentalis; а также мицелиальные грибы, включая Neurospora, Penicillium, Tolypocladium, или хозяева из рода Aspergillus, такие как A. nidulans или A. niger.
Подходящие клетки-хозяева для экспрессии гликозилированного антитела к интегрину α2 получают из многоклеточных организмов. Примеры клеток беспозвоночных включают клетки растений и насекомых. Были идентифицированы многочисленные штаммы и варианты бакуловирусов и соответствующие пермиссивные клетки насекомого-хозяина из хозяев, таких как Spodoptera frugiperda (гусеница), Aedes aegypti (комар), Aedes albopictus (комар), Drosophila melanogaster (плодовая мушка) и Bombyx mori. Различные вирусные штаммы для трансфекции находятся в публичном доступе, например, L-1 вариант NPV Autographa californica и штамм Bm-5 NPV Bombyx mori, а также подобные вирусы можно применять, в частности, для трансфекции клеток Spodoptera frugiperda.
В качестве хозяев также можно применять культуры растительных клеток хлопчатника, кукурузы, картофеля, сои, петунии, томатов и табака.
Однако наибольший интерес вызывают клетки позвоночных и размножение клеток позвоночных, включая различные клетки млекопитающих, стало рутинной процедурой. Примеры пригодных клеток-хозяев млекопитающих включают: линию почки обезьяны CV1, трансформированную SV40 (например, COS-7, ATCC CRL 1651); линию эмбриональной почки человека 293 или клетки 293, субклонированные для роста в суспензионной культуре (см., например, Graham et al., J. Gen Virol. 36: 59 (1977)); клетки почки детеныша хомяка (например, BHK, ATCC CCL 10); клетки яичника китайского хомячка (CHO), в том числе клетки CHO с отсутствием DHFR (см., например, DHFR Urlaub et al., Proc. Natl. Acad. Sci. USA 77: 4216 (1980)); клетки Сертоли мыши (например, TM4, Mather, Biol. Reprod. 23: 243-251 (1980)); клетки почки обезьяны (например, CV1 ATCC CCL 70); клетки почки африканской зеленой обезьяны (например, VERO-76, ATCC CRL-1587); клетки рака шейки матки человека (например, HELA, ATCC CCL 2); клетки почки собаки (например, MDCK, ATCC CCL 34); клетки печени крысы линии Buffalo (например, BRL 3A, ATCC CRL 1442); клетки легкого человека (например, W138, ATCC CCL 75); клетки печени человека (например, Hep G2, HB 8065); опухоль молочной железы мыши (например, MMT 060562, ATCC CCL51); клетки TRI (см., например, Mather et al., Annals N.Y Acad. Sci. 383: 44-68 (1982)); клетки MRC 5; клетки FS4 или линию гепатомы человека (например, Hep G2).
Клетки-хозяева трансформируют с помощью вышеописанных векторов экспрессии или клонирования для производства антитела к интегрину α2 и культивируют в традиционных питательных средах, модифицированных при необходимости для индукции промоторов, отбора трансформантов и/или амплификации генов, кодирующих желаемые последовательности.
Клетки-хозяева, применяемые для производства антитела к интегрину α2, можно культивировать в различных средах. Коммерчески доступные среды, такие как среда Ham F10 (Sigma), минимальная поддерживающая среда (Minimal Essential Medium MEM, (Sigma)), RPMI-1640 (Sigma) и среда Игла в модификации Дульбекко (Dulbecco's Modified Eagle's Medium, DMEM, (Sigma)), подходят для культивирования клеток-хозяев. Кроме того, любая из сред, описанных в Ham et al., Meth. Enz. 58: 44 (1979), Barnes et al., Anal. Biochem. 102: 255 (1980), патентах США №№ 4767704; 4657866; 4927762; 4560655 или 5 122 469; WO90103430; WO 87/00195, или патенте США № 30985 может применяться как культуральная среда для клеток-хозяев. Любая из этих сред может быть дополнена при необходимости гормонами и/или другими факторами роста (такими как инсулин, трансферрин или эпидермальный фактор роста), солями (такими как хлорид натрия, кальция, магния и фосфат), буферами (такими как HEPES), нуклеотидами (такими как аденозин и тимидин), антибиотиками (такими как лекарственное средство GENTAMYCINTM), микроэлементами (определяемыми как неорганические соединения, обычно присутствующие в конечной концентрации в микромолярном диапазоне) и глюкозой или эквивалентным источником энергии. Любые другие необходимые добавки также могут быть включены в соответствующих концентрациях, что должно быть известно специалистам в данной области. Условия культивирования, такие как температура, pH и т.п., выбираются специалистами в данной области, включая условия культивирования, ранее применяемые для клетки-хозяина, выбранной для экспрессии.
Антитела к интегрину α2 можно очищать от клеток, в том числе клеток микроорганизмов или млекопитающих, с помощью, например, хроматографии с белком А, ионообменной хроматографии, хроматографии гидрофобного взаимодействия, гель-электрофореза, диализа и/или аффинной хроматографии. Пригодность белка А в качестве аффинного лиганда зависит от вида и изотипа Fc-домена иммуноглобулина, присутствующего в антителе. Белок A может использоваться для очистки антител на основе γ1, γ2 или γ4 тяжелых цепей человека (см., например, Lindmark et al., J. Immunol. Meth. 62:1-13 (1983)). Белок G пригоден для изотипов мыши и для γ3 человека (см., например, Guss et al, EMBO J. 5:1516-1517 (1986)). Матрица, к которой присоединяется аффинный лиганд, чаще всего является агарозой, но доступны и другие матрицы. Механически стабильные матрицы, такие как стекло с контролируемым размером пор или поли(стриролдивинил)бензол, делают возможным более быстрые скорости потока и более короткое время обработки, чем те, которые могут достигаться на агарозе. Если антитело содержит CH3-домен для очистки пригоден Bakerbond ABXTM (J.T. Baker, Филлипсберг, Нью-Джерси). Очистка белка может включать один или несколько из следующих методов, таких как фракционирование на ионообменной колонке, осаждение этанолом, обращенно-фазовая ВЭЖХ, хроматография на силикагеле, хроматография на гепарине SEPHAROSETM, хроматография на анионо- или катионообменной смоле (например, колонка с полиаспарагиновой кислотой), хроматофокусирование, SDS-PAGE, осаждение сульфатом аммония и/или хроматография гидрофобного взаимодействия. Например, может быть полезно после любого этапа(ов) очистки подвергать смесь, содержащую интересующее антитело и загрязнители, хроматографии гидрофобного взаимодействия при низком рН с использованием элюирующего буфера при рН между около 2,5-4,5, предпочтительно выполняемой при низких концентрациях солей (например, от около 0-0,25 M соли).
Составы антитела к интегрину α2, в том числе для терапевтического введения, подготавливают для хранения путем смешивания антитела с желаемой степенью чистоты с факультативными физиологически приемлемыми носителями, разбавителями, наполнителями или стабилизаторами (Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)), в форме лиофилизированных составов или водных растворов. Приемлемые носители, разбавители, наполнители или стабилизаторы являются нетоксичными для реципиентов в используемых дозах и концентрациях и включают буферы, такие как фосфатный, цитратный и других органических кислот, антиоксиданты, в том числе аскорбиновую кислоту и метионин, консерванты (например, октадецилдиметилбензиламмония хлорид; гексаметония хлорид, бензалкония хлорид, бензетония хлорид, фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен, катехин, резорцин, циклогексанол, 3-пентанол и м-крезол); полипептиды с низким молекулярным весом (меньше около 10 остатков); белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды или другие углеводы, в том числе глюкозу, маннозу или декстрины; хелатообразующие средства, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, Zn-белковые комплексы) и/или неионогенные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (ПЭГ). Для терапевтических применений антитело к интегрину α2 настоящего изобретения может быть составлено, например, в фосфатном буферном растворе (PBS), содержащем 0,03% Tween-80TM.
Состав антитела может также содержать более одного активного соединения для определенного показания к лечению, предпочтительно, с комплементарными активностями, которые не оказывают отрицательного воздействия друг на друга. Может быть желательным применять антитело к интегрину α2 в дополнение к одному или нескольким средствам, применяемым в настоящее время для предупреждения или лечения рассматриваемого нарушения. Кроме того, может быть желательным дополнительно обеспечить иммуносупрессивное средство. Такие молекулы соответственно присутствуют в комбинации в количествах, которые являются эффективными для предполагаемой цели.
Активные ингредиенты могут также быть заключены в микрокапсулу, подготовленную, например, с помощью методов коацервации или посредством межфазной полимеризации, например, гидроксиметилцеллюлозную или желатиновую микрокапсулу и поли(метилметакрилатную) микрокапсулу, соответственно, в коллоидные системы доставки лекарственных средств (например, липосомы, альбуминовые микросферы, микроэмульсии, наночастицы или нанокапсулы) или в макроэмульсии. Такие методы раскрываются, например, в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Составы для применения при введении in vivo предпочтительно являются стерильными. Этого легко достигнуть, например, с помощью фильтрации через стерильные фильтрующие мембраны.
Можно подготавливать препараты с пролонгированным высвобождением. Подходящие примеры препаратов с пролонгированным высвобождением включают полупроницаемые матрицы из твердых гидрофобных полимеров, содержащих антитело, причем эти матрицы представляют собой формованные изделия, например пленки или микрокапсулы. Примеры матриц с пролонгированным высвобождением включают сложные полиэфиры, гидрогели (например, поли(2-гидроксиэтил-метакрилат) или поли(виниловый спирт)), полилактиды (патент США № 3773919), сополимеры L-глутаминовой кислоты и γ этил-L-глутамата, неразлагаемый этилен-винилацетат, разлагаемые сополимеры молочной кислоты-гликолевой кислоты, такие как Lupron DepotTM (микросферы для инъекций, составленные из сополимера молочной кислоты-гликолевой кислоты и леупролида ацетата), и поли-D-(-)-3-гидроксимасляной кислоты. В то время как полимеры, такие как этилен-винилацетат и молочная кислота-гликолевая кислота, способны высвобождать молекулы в течение свыше 100 дней, определенные гидрогели высвобождают белки в течение более коротких периодов времени. Если инкапсулированные антитела остаются в организме в течение длительного времени, они могут денатурировать или агрегировать в результате воздействия влаги при 37°C, что приводит к утрате биологической активности и возможным изменениям иммуногенности. В зависимости от вовлеченного механизма могут разрабатываться рациональные стратегии стабилизации. Например, если обнаружилось, что механизмом агрегации является образование межмолекулярных связей S-S в результате тио-дисульфидного взаимодействия, стабилизация может достигаться путем модификации сульфгидрильных остатков, лиофилизацией из кислых растворов, контролем влажности, применением соответствующих добавок и разработкой композиций специфических полимерных матриц.
ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ ГУМАНИЗИРОВАННЫХ АНТИТЕЛ К ИНТЕГРИНУ α2
Антитело к интегрину α2 можно применять для лечения различных нарушений, связанных с интегрином α2β1, как описано в настоящем документе. Антитело к интегрину α2 вводят любым подходящим способом, включая парентеральный, подкожный, внутрибрюшинный, внутрилегочный или интраназальный. При необходимости местного иммуносупрессивного лечения выполняют введение антитела внутрь поражения (включая перфузию или другой контакт трансплантата с антителом до трансплантации). Парентеральное введение включает внутримышечное, внутривенное, внутриартериальное, внутрибрюшинное или подкожное введение. Кроме того, антитело к интегрину α2 в целях удобства вводится путем импульсной инфузии, например, со снижением доз антитела. Предпочтительно, дозу дают путем инъекций, наиболее предпочтительно внутривенных или подкожных инъекций. Это может частично зависеть от того, является ли введение краткосрочным или хроническим. Более предпочтительно антитела к интегрину α2 или композиции, описываемые в настоящем документе, вводятся в способах настоящего изобретения путем внутривенной инфузии, внутривенного болюсного введения, подкожного введения, подкожной инфузии или подкожного болюса, в то время как наиболее предпочтительными являются внутривенная инфузия или внутривенное болюсное введение. Выражение «внутривенная инфузия» относится к введению лекарственного средства в вену животного или пациента-человека в течение периода времени большего, чем приблизительно 5 минут, предпочтительно от приблизительно 30 до 90 минут, хотя по настоящему изобретению внутривенную инфузию, в качестве альтернативы, вводят в течение 10 часов или менее. Выражение «внутривенное болюсное введение» или «внутривенное струйное введение» относится к введению лекарственного средства в вену животного или человека таким образом, что организм получает лекарственное средство за приблизительно 15 минут или меньше, предпочтительно 5 минут или меньше. Выражение «подкожное введение» относится к введению лекарственного средства под кожу животного или пациента-человека, предпочтительно в карман между кожей и подлежащей тканью, путем относительно медленной пролонгированной подачи из резервуара с лекарственным средством. Карман можно подготовить, сжимая и оттягивая кожу вверх и от подлежащей ткани. Выражение «подкожная инфузия» относится к введению лекарственного средства под кожу животного или пациента-человека, предпочтительно в карман между кожей и подлежащей тканью, путем относительно медленной пролонгированной подачи из резервуара с лекарственным средством в течение периода времени, включающего, но без ограничения, 30 минут или меньше, или 90 минут или меньше. Выражение «подкожное болюсное введение» относится к введению лекарственного средства под кожу животного или пациента-человека, при этом болюсная доставка лекарственного средства составляет предпочтительно меньше приблизительно 15 минут, более предпочтительно меньше 5 минут и наиболее предпочтительно меньше 60 секунд. Введение предпочтительно осуществляют в карман между кожей и подлежащей тканью, при этом карман подготавливают, например, сжимая и оттягивая кожу вверх и от подлежащей ткани. Факультативно, инфузию можно осуществлять путем подкожной имплантации помпы для доставки лекарственного средства, имплантируемой под кожу животного или пациента-человека, при этом помпа доставляет заранее определенное количество лекарственного средства в течение заранее определенного периода времени, такого как 30 минут, 90 минут, или периода времени, охватывающего продолжительность режима лечения. Прерывистое или периодическое дозирование является дозированием, которое продолжается в течение определенного периода времени и с регулярными интервалами, которые предпочтительно отделяются больше, чем одним днем.
«Терапевтически эффективное количество» или «эффективное количество» применяемые в настоящем документе в качестве синонимов, относятся к количеству антител к интегрину α2, описанных в настоящем документе, эффективному для улучшения или предупреждения симптомов, или продлению выживания субъекта, подлежащего лечению. Определение терапевтически эффективного количества находится в пределах возможностей специалистов в данной области, особенно в свете подробного раскрытия, обеспеченного в настоящем документе. Выражение «терапевтически эффективное количество» антител к интегрину α2, описанных в настоящем документе, конкретно относится к количеству, необходимому для замедления или ингибирования рака, например, роста опухоли.
Для предупреждения или лечения нарушения, связанного с интегрином α2β1, соответствующая доза антитела будет зависеть от типа заболевания, подлежащего лечению, как описано выше, тяжести и течения заболевания, вводится ли антитело к интегрину α2 в профилактических или терапевтических целях, предшествующей терапии, клинической истории пациента и реакции на антитело, а также на усмотрение лечащего врача. Антитело в целях удобства вводят пациенту однократно или в ходе серии курсов лечения.
Антитела к интегрину α2 могут таким образом вводиться субъекту, предпочтительно человеку, по способу настоящего изобретения в терапевтически эффективном количестве в диапазоне от около 0,1 до около 100 мг/кг. Предпочтительно терапевтически эффективное количество в диапазоне от около 1 до около 20 мг/кг, более предпочтительно терапевтически эффективное количество в диапазоне от около 3 до около 10 мг/кг вводится субъекту, предпочтительно человеку. Терапевтически эффективное количество гуманизированного антитела или его связывающего фрагмента можно вводить субъекту в одной или нескольких терапевтически эффективных дозах.
Для предупреждения или лечения нарушений, связанных с интегрином α2β1, подходящая доза антитела будет зависеть от типа заболевания, подлежащего лечению, как описано выше, тяжести и течения заболевания, вводится ли антитело к интегрину α2 в профилактических или терапевтических целях, предшествующей терапии, клинической истории пациента и реакции на антитело, а также на усмотрение лечащего врача. Антитело в целях удобства вводится пациенту однократно или в ходе серии курсов лечения.
В зависимости от типа и тяжести нарушения, связанного с интегрином α2β1, от около 0,1 мг/кг до около 100 мг/кг антитела является начальной кандидатной дозой для введения субъекту, например, как при однократном, так и при нескольких отдельных введениях субъекту, или при длительной инфузии. Типичная суточная доза, например, для человека может варьировать от 0,1 мг/кг до 20 мг/кг или больше, в зависимости от факторов, упомянутых выше. Для повторных введений в течение нескольких дней или дольше, в зависимости от состояния, лечение пролонгируют до наблюдения желаемого подавления симптомов заболевания. Однако могут применяться и другие режимы дозирования, например режим дозирования раз в две недели выглядит предпочтительным. Прогресс данной терапии легко контролируется специалистами в данной области.
Композиция антитела к интегрину α2 будет составляться, дозироваться и вводиться некоторым образом в соответствии с надлежащей медицинской практикой. Факторы для рассмотрения в данном контексте включают определенное заболевание, подлежащее лечению, определенное млекопитающее, подлежащее лечению, клиническое состояние индивидуального пациента, причину нарушения, место доставки средства, способ введения, график введения, результаты фармакологических и токсикологических исследований и другие факторы, известные врачам. Терапевтически эффективное количество антитела, подлежащее введению, определяется путем такого рассмотрения и является минимальным количеством, необходимым для предупреждения, улучшения или лечения нарушения, связанного с интегрином α2β1. Такое количество предпочтительно ниже количества, которое является токсичным для организма или делает организм значительно более восприимчивым к инфекциям.
Антитело к интегрину α2 не обязательно должно быть, но может факультативно составляться, совместно вводиться или применяться в качестве дополнительной терапии с одним или несколькими средствами, применяемыми в настоящее время для предупреждения или лечения рассматриваемого нарушения. Например, при ревматоидном артрите антитело может быть дано в сочетании с глюкокортикостероидом, Ремикадом® или любым утвержденным лечением для ревматоидного артрита. Для рассеянного склероза антитело может быть дано в сочетании с β-интерфероном, авонексом, копаксоном или другой утвержденной терапией лечения признаков и симптомов рассеянного склероза. Для трансплантов антитело может вводиться одновременно с или отдельно от иммуносупрессивных средств, описанных выше, таких как циклоспорин А, для модулирования иммуносупрессивного эффекта. В качестве альтернативы или дополнительно млекопитающему, страдающему от нарушения, связанного с интегрином α2β1, могут вводиться антагонисты интегрина α2β1. Эффективное количество таких других средств зависит от количества антитела к интегрину α2, присутствующего в составе, типа нарушения или лечения, а также других факторов, обсуждаемых выше. Обычно они применяются в тех же дозах и путях введения, как и применяемые в настоящем документе выше или примерно от 1 до 99% от использованных до этого доз.
Следующие примеры приводятся в качестве иллюстрации, а не в качестве ограничения. Раскрытия всех ссылок в данном описании специально включены в настоящий документ путем ссылки.
ПРИМЕРЫ
Пример 1: ВАРИАНТЫ ГУМАНИЗИРОВАННОГО АНТИТЕЛА К ИНТЕГРИНУ АЛЬФА-2 С УСИЛЕННОЙ КОМПЛЕМЕНТ-ОПОСРЕДОВАННОЙ ЭФФЕКТОРНОЙ ФУНКЦИЕЙ
Гуманизированные антитела к интегрину α2, описанные здесь, представляют новую подгруппу антител к α2 (антител к VLA2), которые характеризуются неожиданным отсутствием in vivo осложнений с кровотечениями и/или отсутствием активации тромбоцитов интегрином α2β1. Антитела IgG4, раскрытые в WO2007/056858, однако, не несут эффекторных функций, таких как ADCC и/или CDC, которые желательны при определенных обстоятельствах, например для лечения видов рака, связанных с интегрином α2β1, где эта функциональные свойства могут приводить к повышенной эффективности лечения. Таким образом, желательно было бы разработать антитела к интегрину α2β1, которые будут проявлять эти эффекторные функции в высокой степени.
Четыре изотипа IgG человека отличаются друг от друга активностями эффекторных функций и других видов активности. В целом, последовательность активности составляет IgG1≥IgG3>>IgG4≥IgG2 для ADCC и IgG3≥IgG1>>IgG2=IgG4 для CDC (Niwa R. et al., J Immunol Methods 2005; 306:151-60). В данном исследовании одно антитело IgG4 к VLA-2, раскрытое в WO2007/056858 (с тяжелой цепью SEQ ID NO: 57 и легкой цепью SEQ ID NO: 56), применили для создания новой подгруппы антител к VLA2, состоящей из встречающихся в природе изотипных вариантов антитела IgG1, IgG2 и IgG3 человека; сконструированных изотипных вариантов IgG1 человека, и химер из изотипных вариантов IgG1 человека и IgG3 человека. Все варианты создавались с помощью методов мутагенеза на основе способов перекрывающейся ПЦР-сборки.
Для генерирования вариантов полного антитела каждый вновь созданный вектор тяжелой цепи трансфицировали с одним и тем же вектором каппа легкой цепи антитела к VLA-2, несущим кДНК каппа легкой цепи антитела к VLA-2, кодирующую последовательность легкой цепи (SEQ ID NO: 56), и имеющим идентичные элементы регулирования экспрессии, как и векторы тяжелой цепи, описанные выше. Следовательно, тяжелая цепь нового варианта антитела к VLA2 определяет новый вариант полного антитела; поэтому тяжелая цепь и соответствующее полное антитело обозначают одним и тем же именем.
ВАРИАНТЫ НА ОСНОВЕ ВСТРЕЧАЮЩИХСЯ В ПРИРОДЕ ИЗОТИПОВ АНТИТЕЛА ЧЕЛОВЕКА
Для создания встречающихся в природе изотипных вариантов тяжелых цепей кДНК антитела IgG4 к VLA-2, кодирующую шарнирный и константный домены тяжелой цепи по SEQ ID NO: 57 (остаток по Kabat 119 (соответствующий остатку 121 в SEQ ID NO: 57) с ее C-конца), замещали соответствующей последовательностью кДНК, кодирующими аминокислоты для шарнирного и константного доменов IgG1 человека (№ доступа NCBI GenBank J00228.1, последовательность от остатка 1 до ее C-конца), IgG2 человека (№ доступа NCBI GenBank J00230.1, последовательность от остатка 1 до ее C-конца) и IgG3 человека (№ доступа NCBI GenBank X03604.1, последовательность от остатка 2 до ее C-конца). Эти встречающиеся в природе варианты тяжелой цепи впоследствии определяют новые антитела к VLA2, которые обозначают как тяжелую цепь IgG1 к VLA2 (SEQ ID NO: 44), тяжелую цепь IgG2 к VLA2 (SEQ ID NO: 45) и тяжелую цепь IgG3 к VLA2 (SEQ ID NO: 46), соответственно.
ВАРИАНТЫ НА ОСНОВЕ ПЕРЕТАСОВКИ ДОМЕНОВ ШАРНИРНЫХ УЧАСТКОВ-FC IGG1/IGG3 ЧЕЛОВЕКА
Антитела IgG3 человека обычно имеют усиленную CDC по сравнению с антителами IgG1 человека, что отчасти происходит потому, что Fc IgG3 имеет более высокую C1q-связывающую аффинность, чем Fc IgG1 (Schumaker VN et al., Biochemistry, 1976, 15:5175-81.). Для генерирования химер IgG4 к VLA-2 с усиленной CDC была предпринята стратегия перетасовки шарнирного участка и константных доменов IgG1 человека с шарнирным участком и константными доменами IgG3.
Были сконструированы две химеры. Первую химеру на основе IgG4 к VLA-2 сконструировали для слияния CH1 и шарнирного участка из IgG1 человека с Fc-частью IgG3 человека и назвали в настоящем документе тяжелой цепью IgG-1133 к VLA-2 (SEQ ID NO: 47); в то время как вторую конструкцию на основе IgG3 к VLA-2 сконструировали для замены шарнирного участка из IgG3 человека на шарнирный участок из IgG1 человека, эта последняя химера называется в настоящем документе как тяжелая цепь IgG-3133 к VLA-2 (SEQ ID NO: 48).
Для создания кодирующей последовательности кДНК тяжелой цепи IgG-1133 к VLA-2 (SEQ ID NO: 47) часть кДНК тяжелой цепи для IgG1 к VLA-2, кодирующую константные домены CH2 и CH3 (кодирующие остатки по Kabat 231 с ее С-конца), в векторе экспрессии для IgG1 к VLA-2 заместили соответствующей частью гена тяжелой цепи IgG3 человека (№ доступа NCBI GenBank X03604.1, остатки с 161 по 377). Для кодирующей последовательности кДНК тяжелой цепи IgG-3133 к VLA-2 (SEQ ID NO: 48) часть кДНК тяжелой цепи для IgG3 к VLA-2, кодирующую шарнирную область (ELKTPLGDTTHTCPRCPEPKSCDTPPPCPRCPEPKSCDTPPPCP RCPEPKSCDTPPPCPRCP из № доступа NCBI GenBank X03604.1), в векторе экспрессии для тяжелой цепи IgG3 к VLA-2 заместили соответствующей частью (EPKSCDKTHTCPPCP) гена тяжелой цепи IgG1 человека (№ доступа NCBI GenBank J00228.1).
МУТАНТНЫЕ ПО АМИНОКИСЛОТАМ АНТИТЕЛА К VLA2 С УСИЛЕННОЙ CDC
С целью усиления комплементзависимой цитотоксичности (CDC) разработали ряд вариантов IgG1 к VLA-2. Таким же образом, как взаимодействие Fc с Fcγ-рецепторами опосредует ADCC, взаимодействие Fc с компонентом комплемента C1q опосредует CDC. Хотя в настоящее время не доступна 3D структура для Fc/C1q комплекса, некоторые исследования картировали сайт связывания на IgG человека для C1q в области, сосредоточенной на остатках D270, K322, P329 и P331 (Idusogie et al., J Immunol Methods 2000, 164:4178-4184). Для изучения вариантов, которые могут опосредовать усиленную CDC для антитела IgG1 к VLA-2, разработали аминокислотные модификации в области D269-K334 домена CH2
Для создания этих вариантных кодирующих последовательностей кДНК, кДНК, кодирующую кДНК тяжелой цепи IgG1 к VLA-2 (SEQ ID NO: 44), мутировали для включения следующих замен: S324N (называется в настоящем документе IgG1-S324N к VLA-2; SEQ ID NO: 49), E269D (называется в настоящем документе IgG1-E269D к VLA-2; SEQ ID NO: 50) и S298A (называется в настоящем документе IgG1-S298A к VLA-2; SEQ ID NO: 51). Дополнительные варианты создавались путем комбинирования этих точечных мутаций в пары: E269D, S298A скомбинировали для генерирования варианта, названного в настоящем документе IgG1-E269D/S298A к VLA-2 (SEQ ID NO: 52); другая комбинация, названная в настоящем документе IgG1-E269D/S324N к VLA-2 (SEQ ID NO: 53), состояла из E269D и S324N; третья комбинация, названная в настоящем документе IgG1-S298A/S324N к VLA-2 (SEQ ID NO: 54) комбинировала мутации S298A и S324N. Наконец, все три мутации сложили для создания варианта, названного в настоящем документе IgG1-E269D/S298A/S324N к VLA-2 (SEQ ID NO: 55).
Эти вариантные последовательности кодирующей ДНК лигировали в вектор на основе модифицированного вектора pREP4 (Invitrogen, Калифорния, США), несущего CMV-промотор и полиаденилированную сигнальную последовательность гормона роста крупного рогатого скота. В этом векторе экспрессии секреция запускалась лидерным пептидом VJ2C мыши.
ПРОИЗВОДСТВО ВАРИАНТОВ АНТИТЕЛА К VLA2
Для временной экспрессии равные количества каждого вектора тяжелой цепи (выше) и вектора каппа легкой цепи антитела к VLA-2 совместно трансфицировали в адаптированные к суспензионному выращиванию клетки HEK-EBNA (ATCC-CRL-10852) с помощью полиэтиленимина (PEI). Как правило, 100 мл клеток в суспензии при плотности 0,8-1,2 миллиона клеток на мл трансфицировались DNA-PEI смесью, содержащей 50 мкг вектора экспрессии, кодирующего вариантную тяжелую цепь, и 50 мкг вектора экспрессии легкой цепи. Когда рекомбинантные векторы экспресии, кодирующие гены каждой сконструированной цепи, вводятся в клетки-хозяева, конструкт производится путем дальнейшего культивирования клеток в течение периода от 4 до 5 дней для обеспечения секреции в культуральную среду (EX-CELL 293, HEK293-безсывороточная среда, Sigma, Бухс, Швейцария), дополненную 0,1% плюрониловой кислоты, 4 мМ глутамина и 0,25 мкг/мл генетицина. Затем конструкт очищали из бесклеточного супернатанта с помощью рекомбинантной среды Streamline rProtein A (GE Healthcare Europe GmbH, Глаттбруг, Швейцария) и применяли для дальнейших анализов.
Уровни экспрессии некоторых из этих вариантов перечислены в Таблице 1.
|
Комплементопосредованная токсичность относительно клеток HT1080
Клеточный анализ применяли для измерения способности вариантов опосредовать CDC.
Лизис оценивали с помощью высвобождения лактатдегидрогеназы (LDH) для контроля лизиса опсонизированных вариантом клеток HT1080 комплементом крольчат (Harlan Laboratories, C-0099F, AN VENRAY, Нидерланды). Клетки-мишени (HT1080, ATTC ® No. CCL-121) промывали 2 раза полной средой (среда RPMI-1640 (Chemie Brunschwig AG, PAA, Базель, Швейцария) с добавлением 10% эмбриональной телячьей сыворотки (FBS, Chemie Brunschwig AG, PAA, Базель, Швейцария) и 1% Ultraglutamine (Lonza, Вервье, Бельгия)) путем центрифугирования и ресуспендирования. Вариантные антитела добавляли в конечной концентрации 1 мкг/мл. Сыворотку крольчат разбавляли до 7,5% полной средой и добавляли к опсонизированным антителом клеткам-мишеням. Планшеты инкубировали в течение 3 часов при 37°C.
Клеточную цитотоксичность измеряли с помощью набора Cyto Tox 96 Non-Radioactive Cytotoxity Assay (Promega, Мэдисон, США).
На фигуре 1 показаны типичные результаты этого анализа с данными, представленными в трех повторностях ± стандартное отклонение. В этом анализе наблюдается небольшой специфический лизис, обусловленный контролем IgG1 (точка данных № 12) или исходным антителом IgG4 к VLA-2 (точка данных №1) или антителом IgG2 к VLA-2 (точка данных №3). Хотя ожидался не очень низкий уровень CDC для последних встречающихся в природе изотипов, довольно удивительно, что IgG1 к VLA-2 (точка данных №2) не привел к значительному увеличению CDC, так как ожидалось, что изотип IgG1 антитела имел превосходящую CDC относительно изотипов IgG4 и IgG2. Только когда присутствует мутация S324N, CDC повышается по меньшей мере в 6,4 раза для IgG1-S324N к VLA-2 (точка данных №7), в 6,6 раза для IgG1-S298A/S324N к VLA-2 (точка данных №11) и в 9 раз для IgG1-E269D/S298A/S324N к VLA-2 (точка данных № 10). Комплемент-индуцированный лизис также значительно повышался для вариантов антитела с компонентами константной области изотипа IgG3 антитела человека, CDC повышался по меньшей мере в 5,6 раза для IgG-1133 к VLA-2 (точка данных №5) и повышался по меньшей мере в 8,6 раза для IgG-3133 к VLA-2 (точка данных №6). Самое лучшее повышение CDC наблюдалось для встречающегося в природе варианта IgG3 к VLA-2 (точка данных №4) с усилением по меньшей мере в 9,6 раза по сравнению с исходным IgG4-антителом к VLA-2. В заключение, эти результаты свидетельствуют, что мутация S324N применительно к антителу IgG1 к VLA-2 способна восстановить активный комплемент-индуцированный лизис, в то время как вариант IgG3 к VLA-2 является наиболее активным из вариантов антител к VLA2 в вызывании CDC.
Пример 2: ВАРИАНТЫ ГУМАНИЗИРОВАННОГО АНТИТЕЛА К ИНТЕГРИНУ АЛЬФА2 С УСИЛЕННОЙ АНТИТЕЛОЗАВИСИМОЙ КЛЕТОЧНОЙ ЦИТОТОКСИЧНОСТЬЮ (ADCC)
Варианты антитела к VLA2, изученные в исследовании, описанном в примере 1, оценивали по их способности вызывать ADCC.
Активности ADCC антител оценивали путем анализа высвобождения лактатдегидрогеназы (LDH) с помощью набора Cyto Tox 96 Non-Radioactive Cytotoxity Assay (Promega, Мэдисон, США). Мононуклеарные клетки периферической крови человека (PBMC) очищали из цитратной цельной крови стандартным фиколл-пак разделением, ресуспендировали в полной среде (среда RPMI-1640 (Chemie Brunschwig AG, PAA, Базель, Швейцария) с добавлением 10% эмбриональной телячьей сыворотки (FBS, Chemie Brunschwig AG, PAA, Базель, Швейцария), 2 мМ ultraglutamine 1 (Lonza, Вервье, Бельгия), 1% пенициллина/стрептомицина (Chemie Brunschwig AG, PAA, Базель, Швейцария) и 100 Ед/мл IL-2 человека (Sigma, Миссури, США)) и инкубировали в течение ночи при 37°C. На следующий день PBMC собирали центрифугированием, дважды промывали и ресуспендировали в культуральной среде при плотности 8×106 клеток/мл. В качестве клеток-мишеней применяли клеточную линию HT1080. Клетки HT1080 промывали дважды и ресуспендировали в полной среде при плотности 0,2×106 клеток/мл. Пятьдесят микролитров антитела, разведенного до 1,5 мкг/мл, с конечной концентрацией 0,1 мкг/мл (фигура 2) или 0,01 мкг/мл (фигура 3) смешивали с 50 мкл клеток-мишеней и добавляли к равному объему PBMC в U-донный 96-луночный планшет. На протяжении всего эксперимента применялось соотношение мишени к эффектору 1:40. После 4 часов инкубации при 37°C клетки центрифугировали, и образцы по 50 мкл бесклеточного супернатанта собирали, переносили в плоскодонный 96-луночный планшет и анализировали. Процент лизиса рассчитывали следующим образом: (Высвобождение образца - Спонтанное высвобождение мишени - Спонтанное высвобождение эффектора)/(Максимальное высвобождение - Спонтанное высвобождение мишени)*100; где Спонтанное высвобождение мишени представляет собой флуоресценцию от лунок, которые содержат только клетки-мишени, Спонтанное высвобождение эффектора представляет собой флуоресценцию от лунок, которые содержат только эффекторные клетки, и Максимальное высвобождение представляет собой флуоресценцию от лунок, которые содержат клетки-мишени, которые были обработаны лизирующим буфером. Фоновый процент лизиса, полученный в отсутствие антитела (Клетки-мишени + Эффекторные клетки), вычитали из процента лизиса образца; показанные данные представляют собой средний процент цитотоксичности ± стандартное отклонение лунок в трех повторностях с использованием PBMC, выделенных у одного донора.
На фигуре 2 показана небольшая специфическая ADCC, обусловленная контрольным антителом IgG1 или исходным антителом IgG4 к VLA-2 (точка данных №1 и 12, соответственно); показанные данные демонстрируют, что встречающийся в природе изотип IgG1 антитела человека к VLA2 имеет усиленную клеточную цитотоксичность к клеткам, экспрессирующим VLA-2+, и более предпочтительны точечные мутанты IgG1-антитела к VLA2 со следующим порядком активности: IgG1-S298A/S324N к VLA2 (точка данных №11; 2-кратное повышение) > IgG1-S298A к VLA2 (точка данных № 8; 1,8-кратное повышение) > IgG1 к VLA2 (точка данных №2; 1,7-кратное повышение) или IgG1-E269D/S298A/S324N к VLA2 (точка данных №10; 1,7-кратное повышение) > IgG1-E269D к VLA2 (точка данных № 9; 1,5-кратное повышение).
На фигуре 3 показано, что подобный порядок активности ADCC для вариантов антител к VLA2 сохраняется при десятикратном разведении антитела.
Перечень последовательностей приведен в конце описания.