Результат интеллектуальной деятельности: СОЛИ ФИНГОЛИМОДА
Вид РИД
Изобретение
Настоящее изобретение относится к солям, например кристаллическим солям соединения FTY720, и к их применению.
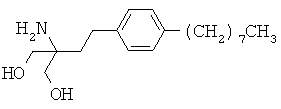
Соединения 2-амино-2-[2-(4-С2-20алкилфенил)этил]пропан-1,3-диола раскрыты в заявке ЕР-А-0627406, релевантное описание которой включено в настоящее описание посредством ссылки. Исходя из наблюдаемой активности, было установлено, что данные соединения пригодны в качестве иммунодепрессантов. Поэтому данные соединения могут быть пригодны для лечения или предотвращения различных аутоиммунных состояний, включая рассеянный склероз. Конкретным соединением данного класса является FTY720 (2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диол; финголимонд), который может быть получен в форме свободного основания или гидрохлоридной соли. FTY720 имеет следующую структуру:
Таким образом, настоящее изобретение относится к кристаллической соли FTY720, где соль выбрана из тартрата, лактата, бензоата, сукцината, малоната, ацетата и пропионата, и соль необязательно является кристаллической.
В одном из вариантов осуществления изобретения соль выбрана из тартрата, лактата, бензоата, сукцината и малоната.
В другом варианте осуществления изобретения соль выбрана из тартрата, лактата, сукцината и малоната.
В еще одном из вариантов осуществления изобретения соль представляет собой тартрат,
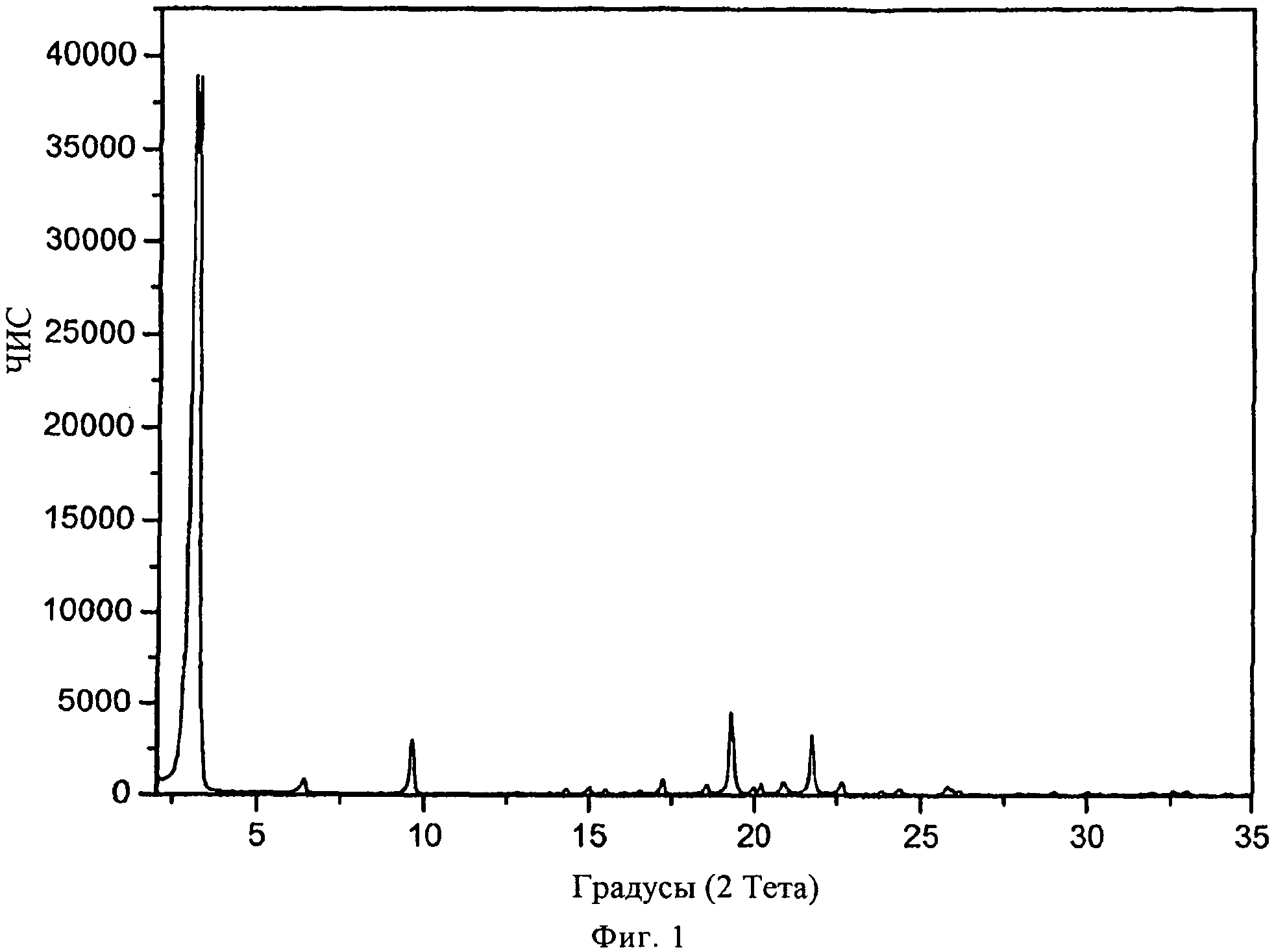
В конкретном варианте осуществления изобретения соль представляет собой тартрат, характеризующийся порошковой рентгенограммой, имеющей пики по меньшей мере у двух, предпочтительно по меньшей мере у четырех и более предпочтительно у всех, перечисленных значений 2 Тета: около 3,1, 19,3, 21,7, 9,6, 17,2, 6,4, 22,6 и 20,8 градусов 2 Тета. Пики при перечисленных значениях 2 Тета имеют следующую относительную интенсивность: 3,1 (сильная), 19,3 (слабая), 21,7 (слабая), 9,6 (слабая), 17,2 (слабая), 6,4 (слабая), 22,6 (слабая) и 20,8 (слабая). В частном варианте осуществления изобретения соль представляет собой тартрат, характеризующийся порошковой рентгенограммой, соответствующей по существу рентгенограмме, представленной на фиг.1.
В другом варианте осуществления изобретения соль представляет собой лактат.
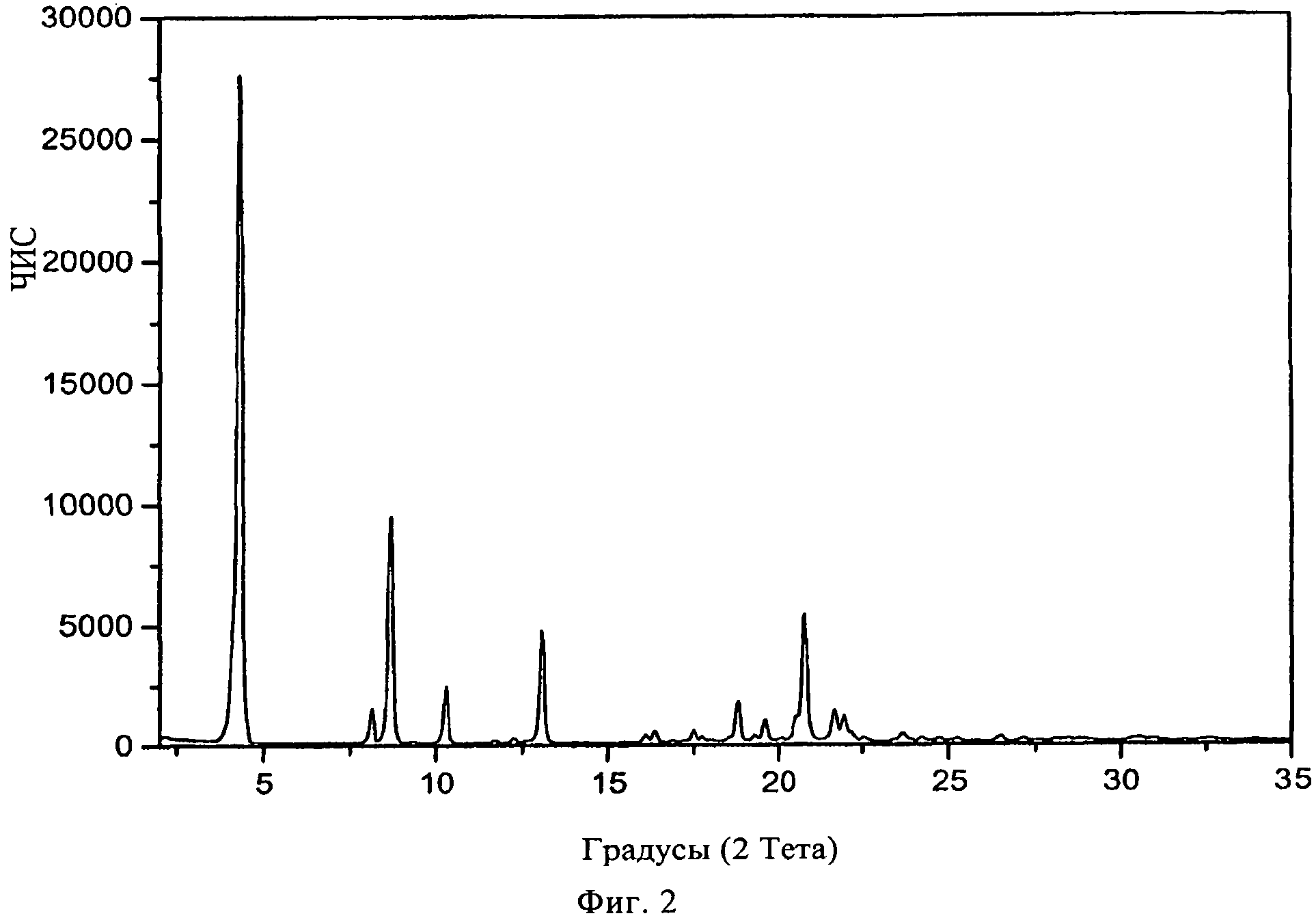
В конкретном варианте осуществления изобретения соль представляет собой лактат, характеризующийся порошковой рентгенограммой, имеющей пики по меньшей мере у двух, предпочтительно по меньшей мере у четырех и более предпочтительно у всех, перечисленных значений 2 Тета: 4,3, 8,7, 20,8, 13,1, 10,3, 18,8, 8,1, 21,6, 21,9 и 19,6 градусов 2 Тета. Пики при перечисленных значениях 2 Тета имеют следующую относительную интенсивность: 4,3 (сильная), 8,7 (средняя), 20,8 (средняя), 13,1(средняя), 10,3 (слабая), 18,8 (слабая), 8,1 (средняя), 21,6 (средняя), 21,9 (слабая) и 19,6 (слабая). В частном варианте осуществления изобретения соль представляет собой лактат, характеризующийся порошковой рентгенограммой, соответствующей по существу рентгенограмме, представленной на фиг.2.
В еще одном из вариантов осуществления изобретения соль представляет собой бензоат.
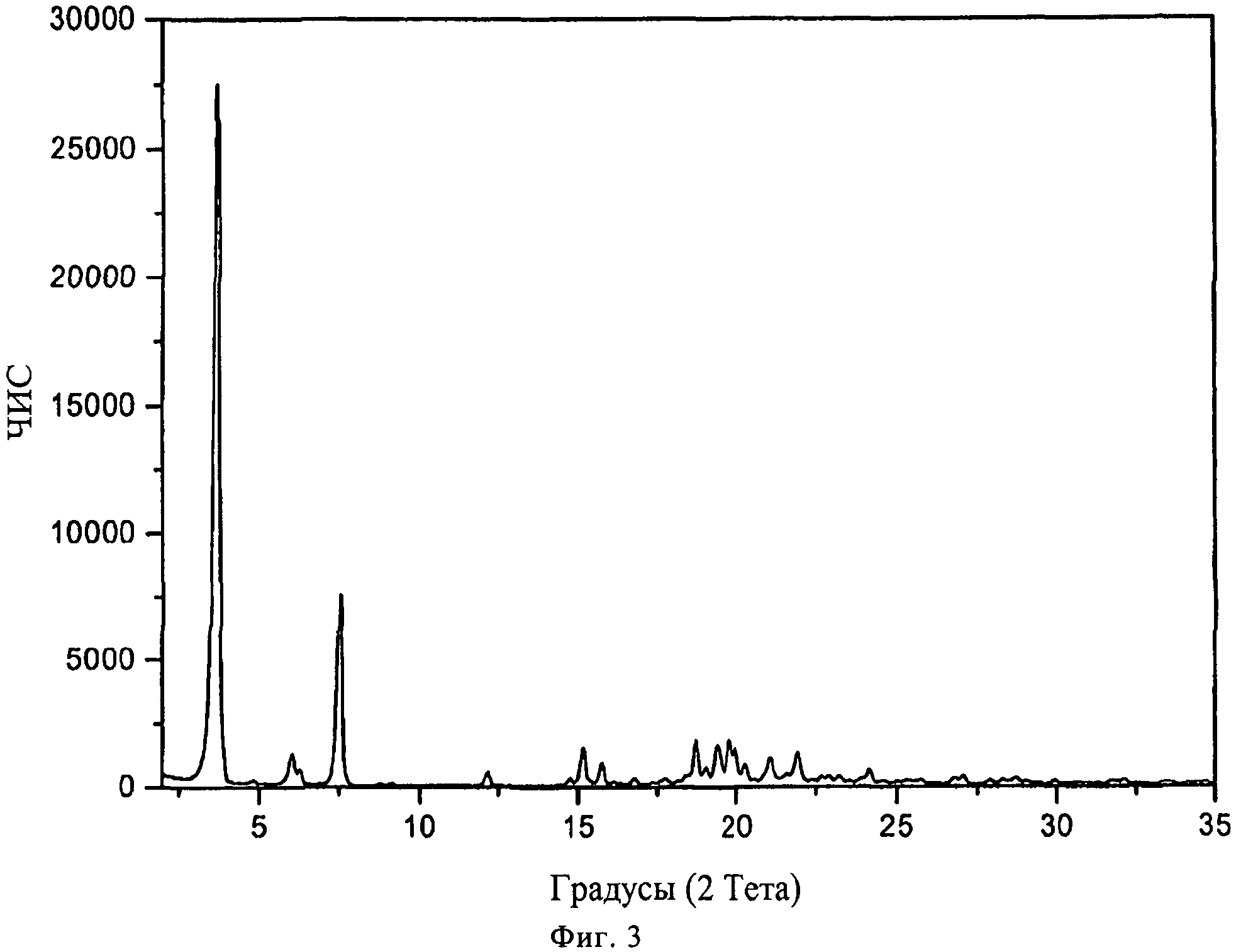
В конкретном варианте осуществления изобретения соль представляет собой бензоат, характеризующийся порошковой рентгенограммой, имеющей пики по меньшей мере у двух, предпочтительно по меньшей мере у четырех и более предпочтительно у всех, перечисленных значений 2 Тета: 3,7, 7,5, 18,7, 19,8, 15,2, 19,4, 19,9, 6,0 и 21,9 градусов 2 Тета. Пики при перечисленных значениях 2 Тета имеют следующую относительную интенсивность: 3,7 (сильная), 7,5 (средняя), 18,7 (слабая), 19,8 (слабая), 15,2 (слабая), 19,4 (слабая), 19,9 (слабая), 6,0 (слабая) и 21,9 (слабая). В частном варианте осуществления изобретения соль представляет собой бензоат, характеризующийся порошковой рентгенограммой, соответствующей по существу рентгенограмме, представленной на фиг.3.
В другом варианте осуществления изобретения соль представляет собой сукцинат.
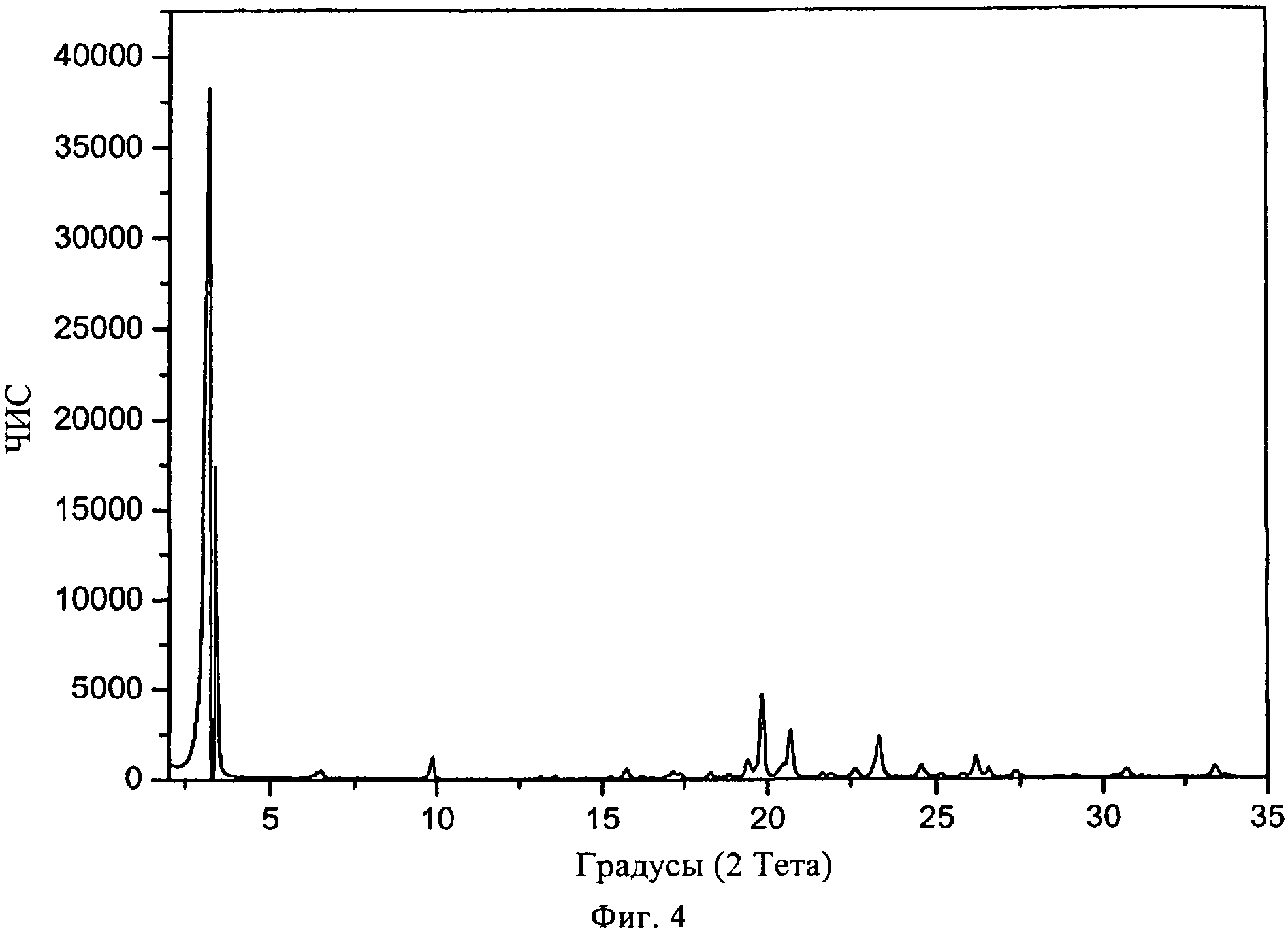
В конкретном варианте осуществления изобретения соль представляет собой сукцинат, характеризующийся порошковой рентгенограммой, имеющей пики по меньшей мере у двух, предпочтительно по меньшей мере у четырех и более предпочтительно у всех, перечисленных значений 2 Тета: 3,2, 19,8, 20,7, 23,3, 26,2, 9,8, 19,4, 24,5, 33,4, 26,6 и 22,6 градусов 2 Тета. Пики при перечисленных значениях 2 Тета имеют следующую относительную интенсивность: 3,2 (сильная), 19,8 (средняя), 20,7 (слабая), 23,3 (слабая), 26,2 (слабая), 9,8 (слабая), 19,4 (слабая), 24,5 (слабая), 33,4 (слабая), 26,6 (слабая) и 22,6 (слабая). В частном варианте осуществления изобретения соль представляет собой сукцинат, характеризующийся порошковой рентгенограммой, соответствующей по существу рентгенограмме, представленной на фиг.4.
В еще одном из вариантов осуществления изобретения соль представляет собой малонат.
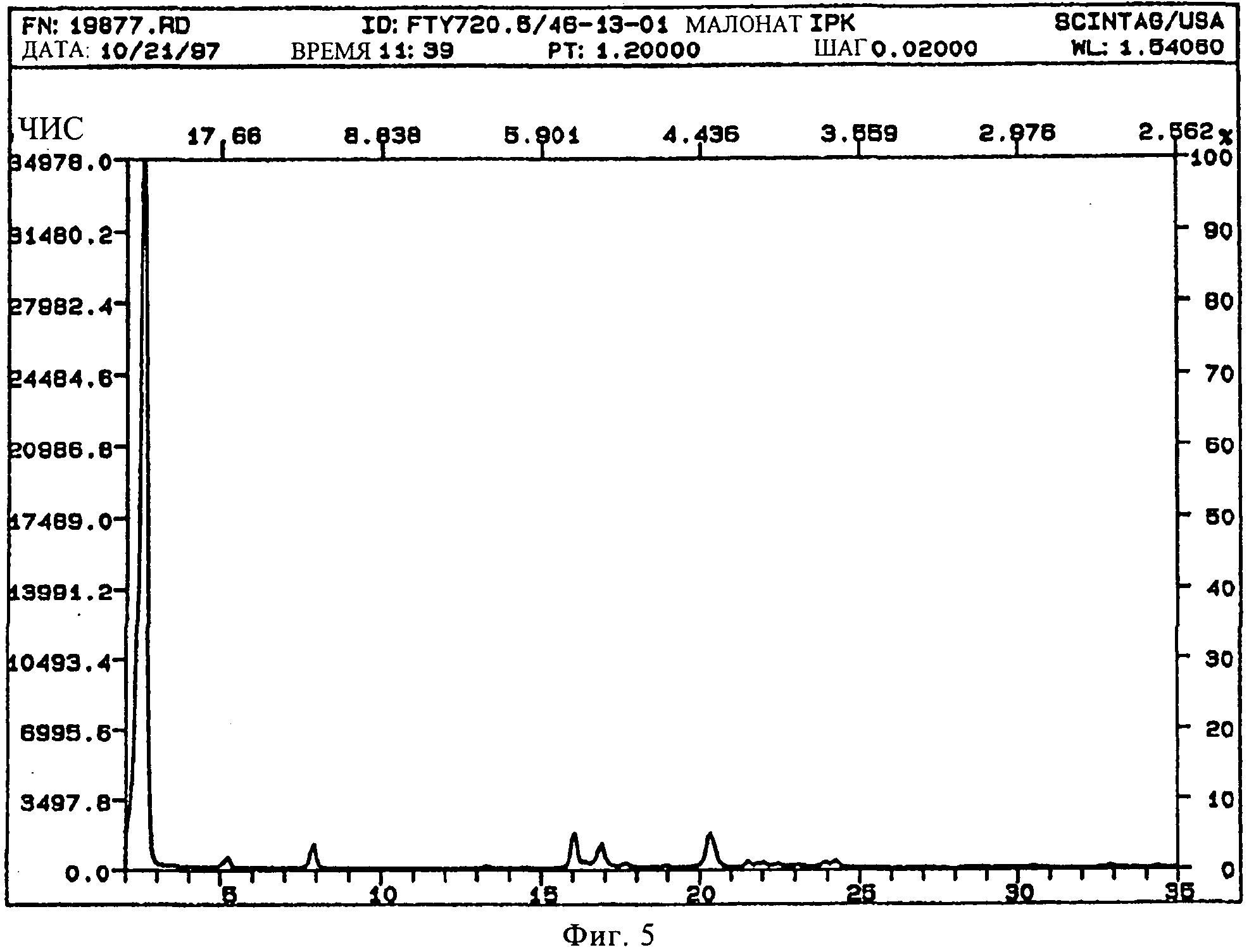
В конкретном варианте осуществления изобретения соль представляет собой малонат, характеризующийся порошковой рентгенограммой, имеющей пики по меньшей мере у двух, предпочтительно по меньшей мере у четырех и более предпочтительно у всех, перечисленных значений 2 Тета: 2,5, 5,2, 8,0, 16,2, 17,0, 20,4 градусов 2 Тета. Пики при перечисленных значениях 2 Тета имеют следующую относительную интенсивность: 2,5 (сильная), 5,2 (слабая), 8,0 (слабая), 16,2 (слабая), 17,0 (слабая), 20,4 (слабая). В частном варианте осуществления изобретения соль представляет собой малонат, характеризующийся порошковой рентгенограммой, соответствующей по существу рентгенограмме, представленной на фиг.5.
В другом варианте осуществления изобретения соль представляет собой ацетат.
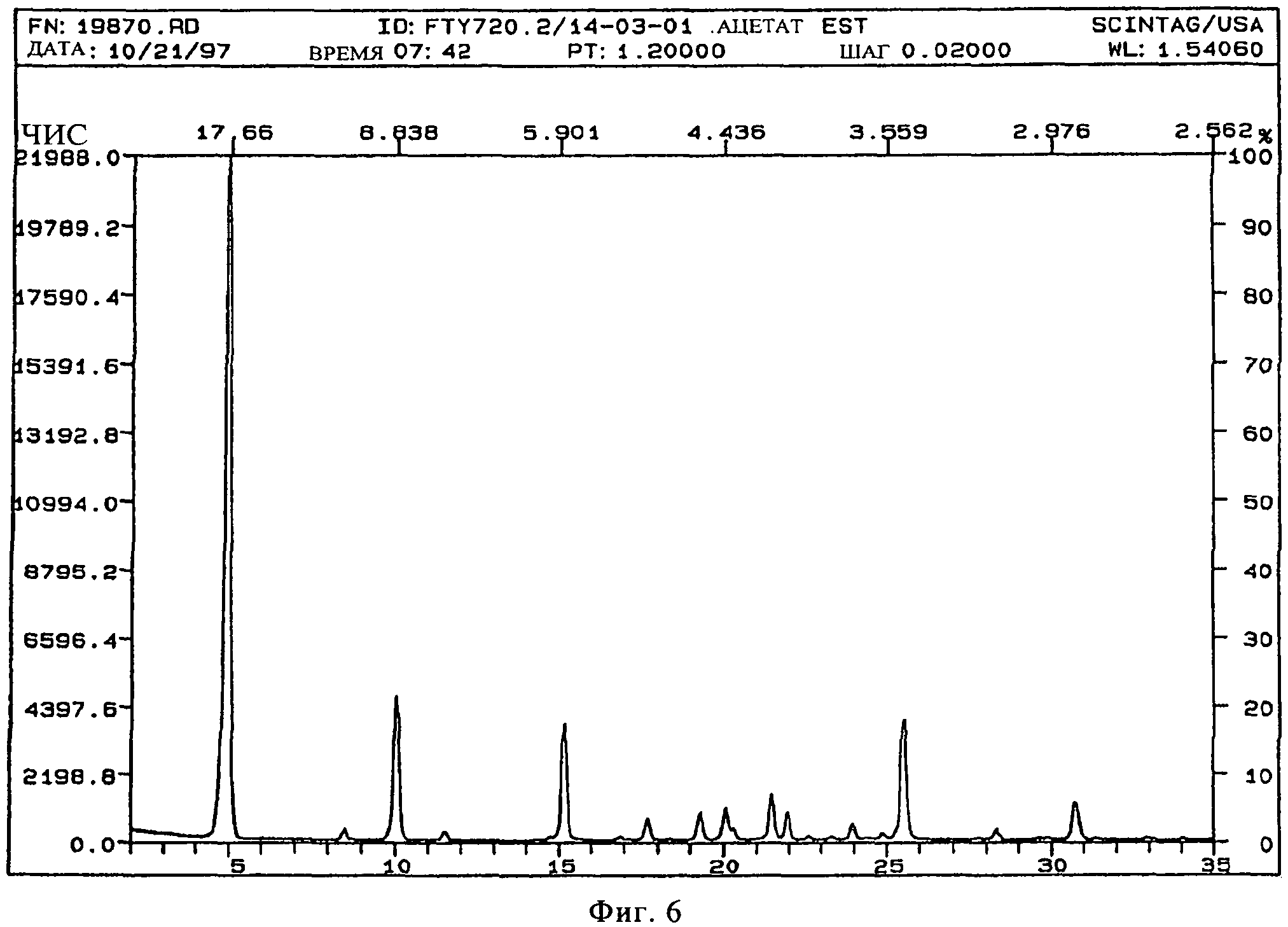
В конкретном варианте осуществления изобретения соль представляет собой ацетат, характеризующийся порошковой рентгенограммой, имеющей пики по меньшей мере у двух, предпочтительно по меньшей мере у четырех и более предпочтительно у всех, перечисленных значений 2 Тета: 4,8, 8,4, 10,1, 11,5, 15,2, 17,7, 19,3, 20,1, 21,5, 21,9, 24,0, 25,4, 30,8 градусов 2 Тета. Пики при перечисленных значениях 2 Тета имеют следующую относительную интенсивность: 4,8 (сильная), 8,4 (слабая), 10,1 (средняя), 11,5 (слабая), 15,2 (средняя), 17,7 (слабая), 19,3 (слабая), 20,1 (слабая), 21,5 (слабая), 21,9 (слабая), 24,0 (слабая), 25,4 (средняя), 30,8 (слабая). В частном варианте осуществления изобретения соль представляет собой ацетат, характеризующийся порошковой рентгенограммой, соответствующей по существу рентгенограмме, представленной на фиг.6.
В еще одном из вариантов осуществления изобретения соль представляет собой пропионат.
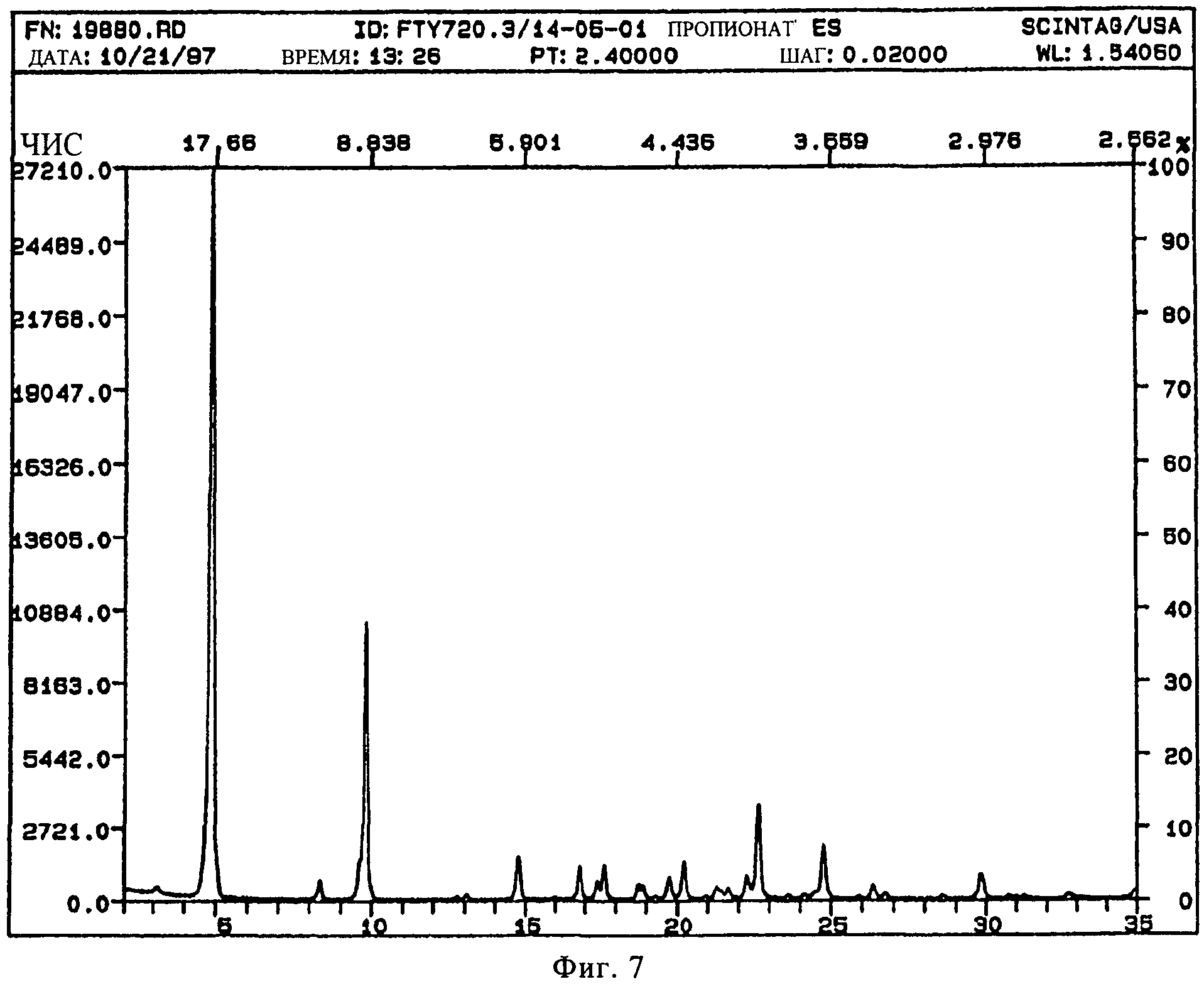
В конкретном варианте осуществления изобретения соль представляет собой пропионат, характеризующийся порошковой рентгенограммой, имеющей пики по меньшей мере у двух, предпочтительно по меньшей мере у четырех и более предпочтительно у всех, перечисленных значений 2 Тета: 4,8, 8,4, 9,8, 14,7, 16,8, 17,6, 19,7, 20,2, 22,6, 24,8, 29,8 градусов 2 Тета. Пики при перечисленных значениях 2 Тета имеют следующую относительную интенсивность: 4,8 (сильная), 8,4 (слабая), 9,8 (средняя), 14,7 (слабая), 16,8 (слабая), 17,6 (слабая), 19,7 (слабая), 20,2 (слабая), 22,6 (слабая), 24,8 (слабая), 29,8 (слабая). В частном варианте осуществления изобретения соль представляет собой пропионат, характеризующийся порошковой рентгенограммой, соответствующей по существует рентгенограмме, представленной на фиг.7.
Предпочтительно различные солевые формы настоящего изобретения могут обладать одним или несколькими требуемыми свойствами по сравнению со свободным основанием или гидрохлоридной формой FTY720. Например, соли могут быть более стабильными и иметь лучшее качество, чем свободное основание, в частности при хранении и распределении. Кроме того, соли могут иметь высокую степень диссоциации в воде и, следовательно, улучшенную растворимость в воде. Соли настоящего изобретения также могут быть предпочтительны, поскольку они демонстрируют незначительное влагопоглощение или износ.
Кристаллические формы могут быть охарактеризованы основными пиками порошковой рентгенограммы, как показано в примерах. Также кристаллические формы могут отличаться термодинамической стабильностью, физическими параметрами, такими как спектр поглощения при инфракрасной спектроскопии (ИК) или пики фазового перехода при дифференциальной сканирующей калориметрии (ДСК). Предпочтительно соли настоящего изобретения представляют собой по существу чистые кристаллические формы. Термин «по существу чистый», используемый в настоящей заявке, относится к кристаллическим формам с полиморфной чистотой более чем 90%, более предпочтительно 95%, более предпочтительно 96%, более предпочтительно 97%, более предпочтительно 98%, более предпочтительно 99%, как определено, например, порошковой рентгеновской дифракцией, рамановской спектроскопией или ИК-спектроскопией.
Соли настоящего изобретения могут находиться в форме сольватов, включая гидраты, и могут проявлять полиморфизм.
Соли настоящего изобретения могут быть получены из свободного основания традиционными химическими методами. В основном данные соли могут быть получены в результате реакции свободного основания FTY720 с подходящей кислотой в воде или в органическом растворителе, или в их смеси. Во многих случаях может быть использована неводная среда, например этилацетат, этанол или изопропанол. FTY720 и кислоту объединяют в необходимом стехиометрическом соотношении, например 1:1 или 1:2. Затем соль может кристаллизоваться, или инициируют ее кристаллизацию, или она образует аморфное твердое вещество, необязательно перед кристаллизацией. После этого твердая соль может быть высушена, например, посредством нагревания при пониженном давлении. Для целей иллюстрации, без какого-либо ограничения, различные солевые формы настоящего изобретения могут быть получены в соответствии с методиками, представленными в примерах.
Также настоящее изобретение относится к фармацевтическим составам, содержащим кристаллическую соль настоящего изобретения. Фармацевтический состав изобретения предпочтительно содержит 0,01-20% масс. соли, более предпочтительно 0,1-10% масс., например 0,5-5% масс., исходя из общей массы состава.
Фармацевтические составы могут представлять собой твердые фармацевтические композиции в форме, подходящей для орального введения, например в виде таблеток или капсул. Композиции могут быть получены традиционным способом, например смешением соли настоящего изобретения с фармацевтически приемлемым носителем или разбавителем.
В частном варианте осуществления изобретения состав представляет собой твердую фармацевтическую композицию, содержащую соль изобретения и сахарный спирт. Композиции данного вида раскрыты в заявке WO 2004/089341, содержимое которой включено в настоящее описание посредством ссылки.
Твердые композиции, раскрытые в данной публикации, особенно хорошо подходят для орального введения солей настоящего изобретения. Композиции обеспечивают удобное средство для систематического введения соединений, для которого не характерны недостатки жидких составов для инъекций или орального применения, и обладают хорошими физико-химическими свойствами и хорошо хранятся. В частности, композиции настоящего изобретения могут демонстрировать высокий уровень однородности при распределении соединения в композиции, а также высокую стабильность. Кроме того, композиции могут быть получены на высокоскоростном автоматизированном оборудовании и, таким образом, не требуется ручная инкапсуляция.
Сахарный спирт может действовать как разбавитель, носитель, наполнитель или объемообразующий агент и предпочтительно представляет собой маннит, мальтит, инозит, ксилит или лактит, предпочтительно по существу негигроскопичный сахарный спирт, например маннит (D-маннит). Может быть использован как единичный сахарный спирт, так и смесь двух или более сахарных спиртов, например, смесь маннита и ксилита, например, в соотношении от 1:1 до 4:1.
В конкретном предпочтительном варианте осуществления изобретения сахарный спирт получают из высушенной распылением композиции, например композиции маннита, имеющей высокоспецифичную площадь поверхности. Применение данного типа композиции маннита способствует промотированию однородного распределения соединения и маннита в композиции. Высокая площадь поверхности может быть достигнута путем получения сахарного спирта, например маннита, содержащего частицы, имеющие небольшой размер и/или неровную поверхность каждой частицы. Как было установлено, применение высушенного распылением сахарного спирта, например маннита, например, с размеров частиц 300 мкм или менее, улучшает сжимаемость и прочность таблеток, полученных из композиции.
Предпочтительно площадь поверхности препарата сахарного спирта, например маннита, измеренная в одной точке, составляет 1-7 м2/г, например, 2-6 м2/г или 3-5 м2/г. Предпочтительно препарат маннита может иметь размер частиц 100-300 мкм, например 150-250 мкм, и объемную плотность 0,4-0,6 г/мл, например 0,45-0,55 г/мл. Подходящим маннитом с высокой площадью поверхности является Parteck M200, коммерчески доступный от Е. Merck.
Композиция предпочтительно содержит 75-99,99% масс. сахарного спирта, более предпочтительно 85-99,9% масс., например 90-99,5% масс., исходя из общей массы композиции.
Композиция предпочтительно дополнительно содержит смазочный материал. Подходящие смазочные материалы включают стеариновую кислоту, стеарат магния, стеарат кальция, стеарат цинка, глицерила пальмитостеарат, натрия стеарилфумарат, масло канолы, гидрированное растительное масло, такое как гидрированное касторовое масло (например, Cutina® или Lubriwax® 101), минеральное масло, натрия лаурилсульфат, оксид магния, коллоидный диоксид кремния, силиконовую жидкость, полиэтиленгликоль, поливиниловый спирт, бензоат натрия, тальк, полоксамер, или смесь любого из вышеперечисленных. Предпочтительные смазочные материалы включают стеарат магния, гидрированное касторовое масло и минеральное масло. Коллоидная жидкость и полиэтиленгликоль менее предпочтительны в качестве смазочных материалов.
Предпочтительно композиция содержит 0,01-5% масс. смазочного материала, более предпочтительно 1-3% масс., например около 2% масс., исходя из общей массы композиции.
Композиция может содержать один или несколько дополнительных эксципиентов, таких как носители, связующие вещества или разбавители. В частности, композиция может содержать микрокристаллическую целлюлозу (например, Avicel®), метилцеллюлозу, гидроксисипропилцеллюлозу, крахмал (например, кукурузный крахмал) или дикальция фосфат, предпочтительно в количестве от 0,1 до 90% масс., например 1-30% масс., исходя из общей массы композиции. В случае применения связующего вещества, например микрокристаллической целлюлозы, метилцеллюлозы, гидроксисипропилцеллюлозы, его содержание составляет от 1 до 8%, например 3-6% масс., исходя из общей массы композиции. Применение связующего вещества увеличивает прочность гранул состава, которая особенно важна при тонком гранулировании. Микрокристаллическая целлюлоза и метилцеллюлоза являются наиболее предпочтительными в том случае, если требуется высокая прочность таблетки и/или более длинное время дезинтеграции. Гидроксипропилцеллюлоза предпочтительна в том случае, если требуется быстрая дезинтеграция. При необходимости в качестве дополнительного связующего вещества может быть также добавлен ксилит, например в дополнение к микрокристаллической целлюлозе, например в количестве до 20% масс. сахарного спирта, например, ксилита.
В одном из вариантов осуществления изобретения композиция дополнительно содержит стабилизатор, предпочтительно глицин·HCl или бикарбонат натрия. Количество стабилизатора может составлять от 0,1 до 30%, предпочтительно 1-20% масс.
Композиция может иметь форму порошка, гранулы, чешуек или дозированной лекарственной формы, например, в виде таблетки или капсулы.
Композиции настоящего изобретения хорошо адаптированы для инкапсулирования в оболочку капсулы для орального введения, в частности, в оболочку твердой капсулы.
Как вариант, композиции могут быть спрессованы в таблетки. Таблетки необязательно могут иметь покрытие, например покрытие тальком, или полисахаридом (например, целлюлозой), или гидроксипропилметилцеллюлозой.
В том случае если композиция представляет собой дозированную лекарственную форму, каждая лекарственная форма может содержать, например, от около 0,5 до около 10 мг соли изобретения.
Композиции настоящего изобретения демонстрируют хорошие показатели стабильности согласно стандартным исследованиям стабильности, например обладают стабильностью при хранении один, два или три года и даже больше. Показатели стабильности могут быть определены, например, посредством определения разложения продуктов методом ВЭЖХ после хранения в определенные промежутки времени, при определенной температуре, например 20, 40 или 60°С.
Фармацевтические композиции настоящего изобретения могут быть получены стандартными методами, например традиционным смешиванием, гранулированием, покрытием сахаром, растворением или лиофилизацией. Используемые методики известны из уровня техники (см., например, L. Lachman et al. The Theory and Practice of Industrial Pharmacy, 3е изд., 1986, H Sucker et al, Pharmazeutische Technologie, Thieme, 1991, Hagers Handbuch der pharmazeutischen Praxis, 4е изд. (Springer Veriag, 1971) и Remington's Pharmaceutical Sciences, 13е изд., (Mack Publ., Co., 1970) или более поздние издания).
В еще одном варианте осуществления изобретения фармацевтическую композицию получают следующим способом, включающим следующие стадии:
(а) смешивают соль настоящего изобретения и сахарный спирт;
(б) полученную на стадии (а) смесь измельчают и/или гранулируют и
(в) измельченную и/или гранулированную на стадии (б) смесь смешивают со смазочным материалом.
При использовании данного способа получают состав, обладающий хорошим уровнем содержания и однородностью смешивания (т.е. по существу однородным распределением соли в композиции), временем растворения и стабильностью.
Способ может быть осуществлен при сухом смешивании компонентов. В данном варианте осуществления изобретения стадия измельчения (б) может включать пропускание смеси, полученной на стадии (а), через сито, которое предпочтительно имеет размер ячейки 400-500 мкм. Стадия способа (а) может включать стадию смешения общего количества соли вначале с небольшим количеством сахарного спирта, например от 5 до 25% масс., исходя из общей массы сахарного спирта, для получения предварительной смеси. Затем к предварительной смеси добавляют оставшееся количество сахарного спирта. Стадия (а) также может включать стадию добавления к смеси связующего раствора, например метилцеллюлозы и/или ксилита, например в виде водного раствора. Как вариант, связующее добавляют к сухой смеси, а воду добавляют на стадии гранулирования.
Полученную на стадии (б) измельченную смесь необязательно перемешивают еще раз перед смешением со смазочным материалом. Смазочный материал, например стеарат магния, перед смешением предпочтительно предварительно просеивают, например, через 800-900 мкм сито.
Альтернативно используют метод влажного гранулирования. В данном варианте осуществления изобретения соль предпочтительно вначале в сухом виде смешивают с требуемым сахарным спиртом, например маннитом, и затем полученную смесь сахарный спирт/соль в сухом виде смешивают со связующим, таким как гидроксипропилцеллюлоза или гидроксипропилметилцеллюлоза. После этого добавляют воду и смесь гранулируют, например, с использованием автоматического гранулятора. Полученный гранулят сушат и измельчают.
При необходимости на стадии (в) к смеси, полученной на стадии (б), может быть добавлено дополнительное количество связующего.
Способ может включать дополнительную стадию таблетирования или инкапсулирования смеси, полученной на стадии (в), например, в твердые желатиновые капсулы, с использованием автоматического инкапсулирующего устройства. Капсулы могут быть окрашены или маркированы для придания индивидуального внешнего вида и мгновенного распознавания. Применение красителей улучшает внешний вид, а также используется для идентификации капсул. Красители, пригодные для использования в фармацевтике, обычно включают каротиноиды, оксиды железа и хлорофилл. Предпочтительно капсулы настоящего изобретения маркируют посредством кода.
Соли настоящего изобретения могут быть использованы:
а) для лечения или предотвращения отторжения трансплантированного органа или ткани, например для лечения реципиентов трансплантата сердца, легких, сердца и легких вместе, печени, почек, поджелудочной железы, кожи или роговицы, и для предотвращения реакций «трансплантат против хозяина», таких как изредка происходящая реакция после пересадки костного мозга; в частности, для лечения острого или хронического отторжения алло- и ксенотрансплантата, или при трансплантации клеток, продуцирующих инсулин, например клеток островков Лангерганса; и
б) для лечения или предотвращения аутоиммунных заболеваний или воспалительных состояний, например ревматоидного артрита, системной красной волчанки, тиреоидита Хашимото, рассеянного склероза, миастении гравис, диабета типа I или II и связанных с ними расстройств, васкулита, пернициозной анемии, синдрома Шегрена, увеита, псориаза, офтальмопатии Грейвса, очаговой алопеции и др., аллергических заболеваний, например аллергической астмы, атопического дерматита, аллергического ринита/конъюнктивита, аллергического контактного дерматита, воспалительных заболеваний, необязательно на основе аберрантных реакций, например воспалительного заболевания кишечника, болезни Крона или язвенного колита, внутренней астмы, воспалительных повреждений легких, воспалительных повреждений печения, воспалительных повреждений почек, атеросклероза, ирритантного контактного дерматита и других экзематозных дерматитов, себорейного дерматита, кожных проявлений иммунологически опосредованных заболеваний, воспалительных заболеваний глаз, кератоконъюнктивита, миокардита или гепатита.
Для вышеуказанных применений требуемая дозировка будет изменяться в зависимости от типа введения, конкретных состояний, подвергающихся лечению, и требуемого результата. В основном удовлетворительный результат достигается при суточной дозировке, составляющей от около 0,1 до около 100 мг/кг массы тела. Номинальная суточная дозировка для больших млекопитающих, например людей, находится в интервале от около 0,5 мг до 2000 мг, для удобства введения, например разделенная на дозы до четырех в сутки, или в форме с замедленным высвобождением.
Соли могут быть введены любыми подходящими способами, например орально, например в форме таблетки или капсулы, топически или парентерально, например внутривенно. Фармацевтические композиции, содержащие соли настоящего изобретения вместе с по меньшей мере одним фармацевтически приемлемым носителем или разбавителем, могут быть получены традиционными способами посредством смешения с фармацевтически приемлемым носителем или разбавителем. Дозированные лекарственные формы для орального введения содержат, например, от около 0,1 мг до около 500 мг активного вещества.
Соли могут быть введены в качестве единственного активного ингредиента или вместе с другими лекарственными средствами в иммуномодулирующих режимах или с другими противовоспалительными агентами, например, для лечения или предотвращения острого или хронического отторжения аллотрансплантата, воспалительных или аутоиммунных заболеваний. Например, соли могут быть использованы в комбинации с ингибиторами кальциневрина, например циклоспорином А, циклоспорином G, FK-506, ABT-281, ASM 981; ингибиторами mTOR, например рапамицином, 40-O-(2-гидрокси)этилрапамицином, CCI779, АВТ578 или АР23573 и др.; кортикостероидами; циклофосфамидом; азатиопреном; метотрексатом; другими рецепторами агониста S1P, например FTY720 или его аналогами; лефлуномидом или его аналогами; мирозибином; микофеноловой кислотой; микофенолятом мофетила; 15-деоксиспергуалином или его аналогами; иммуносупрессивными моноклональными антителами, например моноклональными антителами к рецепторам лейкоцитов; например, МНС, CD2, CD3, CD4, CD11a/CD18, CD7, CD25, CD27, В7, CD40, CD45, CD58, CD137, ICOS, CD150 (SLAM), OX40, 4-1ВВ или их лигандами, например CD 154; или с другими иммуномодуляторами, например рекомбинантной связывающей молекулой, содержащей по меньшей мере часть внеклеточного домена CTLA4 или его мутанта, например по меньшей мере внеклеточную часть CTLA4 или его мутанта, связанную с не-CTLA4 белковой последовательностью, например CTLA4Ig (например, обозначенную как АТСС 68629) или его мутантом, например LEA29Y, или с другими ингибиторами адгезионных молекул, например mAbs, или ингибиторами с небольшой молекулярной массой, включая антагонисты LFA-1, антагонисты селектина и антагонисты VLA-4.
В случае если соль вводят совместно с другим иммуномодулирующим или противовоспалительным агентом, дозировка данного агента будет изменяться в зависимости от типа совместно используемого лекарственного средства, состояния, подвергающегося лечению, и т.д.
Настоящее изобретение также относится к:
1. Способу лечения или предотвращения отторжения трансплантированного органа или ткани, включающему введение субъекту терапевтически эффективного количества кристаллической соли изобретения.
2. Способу лечения или предотвращения аутоиммунных заболеваний или воспалительных состояний, включающему введение субъекту терапевтически эффективного количества кристаллической соли изобретения.
3. Соли настоящего изобретения, например, кристаллической соли изобретения, для применения в качестве фармацевтического препарата.
4. Фармацевтической композиции, содержащей соль изобретения, например, кристаллическую соль изобретения, и фармацевтически приемлемый разбавитель или носитель.
5. Применению соли изобретения, например кристаллической соли изобретения, для получения лекарственного средства, например, в вышеописанных способах.
6. Фармацевтической композиции, содержащей (а) соль изобретения, например кристаллическую соль изобретения, и (б) второе лекарственное средство, при этом данное лекарственное средство пригодно для предотвращения или лечения вышеописанных состояний.
7. Способу, описанному выше, включающему совместное введение, например, одновременно или последовательно, (а) кристаллической соли изобретения и (б) второго лекарственного средства, при этом данное лекарственное средство пригодно для предотвращения или лечения вышеописанных состояний.
Следующие примеры иллюстрируют настоящее изобретение. В примерах 1-29 ссылки на соединение A, FTY720 или гидрохлоридную соль FTY720 также включают ссылку на любую соль настоящего изобретения.
Пример 1
Микроизмельченное соединение А, например гидрохлоридную соль 2-амино-2-[2-(4-октилфенил)этил]пропан-1,3-диола (FTY720), просеивают и 116,7 г просеянного соединения смешивают с 9683,3 г микрокристаллической целлюлозы. Затем смесь измельчают в устройстве Frewitt MGI (Key International Inc., США) с использованием сита 30 меш. Стеарат магния просеивают через сито 20 меш и 200 г просеянного соединения смешивают со смесью FTY720, получая композицию продукта.
После этого композицию продукта помещают на таблеточный пресс с использованием 7 мм пресс-формы и получают таблетки по 120 мг, при этом каждая таблетка содержит:
|
Пример 2
В данном примере используют методику примера 1, за исключением того, что стеарат магния заменяют на Cutina® (гидрированное касторовое масло).
Пример 3: FTY720 тартрат
Татрат анализируют методом порошковой рентгеновской дифракции (XRPD). В данном и последующих примерах порошковую рентгенограмму регистрируют между 2° и 35° (2 Тета) с использованием CuKα-излучения и дифракционной системы Scintag XI, снабженной регуляторами температуры и влажности.
Порошковая рентгенограмма FTY720 тартрата показана на фиг.1, характерные пики приведены ниже:
|
Пример 4: FTY720 лактат
Порошковая рентгенограмма FTY720 лактата показана на фиг.2, характерные пики приведены ниже:
|
Пример 4: FTY720 бензоат
Порошковая рентгенограмма FTY720 бензоата показана на фиг.3, характерные пики приведены ниже:
|
Пример 6: FTY720 сукцинат (2:1)
Порошковая рентгенограмма FTY720 сукцината (2:1) показана на фиг.4, характерные пики приведены ниже:
|
Свободное основание FTY720 (1,63 ммоля) растворяют в i-PrOH (6 мл) при 82°С. Затем при 82°С добавляют раствор малоновой кислоты (0,815 ммоля) в i-PrOH (1 мл). Непосредственно после добавления начинается кристаллизация продукта. Полученную суспензию охлаждают до комнатной температуры. Продукт собирают фильтрованием и промывают i-PrOH (2 мл). После сушки при 50°С получают продукт в виде белых кристаллов с выходом 92,3%.
В альтернативном способе свободное основание FTY720 (2,27 ммоля) растворяют в этилацетате (16 мл) при температуре от 88 до 90°С. Затем при 75°С добавляют раствор малоновой кислоты (1,14 ммоля) в этилацетате (3 мл), при этом непосредственно после добавления начинается кристаллизация продукта. Полученную суспензию охлаждают до комнатной температуры. Продукт собирают фильтрованием и промывают этилацетатом (2 мл). После сушки при 50°С получают продукт (788 мг) в виде белых кристаллов.
Порошковая рентгенограмма FTY720 малоната (2:1) показана на фиг.5, характерные пики приведены ниже:
|
|
Пример 8: FTY720 ацетат
Свободное основание FTY720 (1,63 ммоля) растворяют в i-PrOH (6 мл) при 82°С. Затем при 82°С добавляют раствор уксусной кислоты (1,79 экв.) в i-PrOH (1 мл). Прозрачный раствор охлаждают до комнатной температуры, в результате чего происходит кристаллизация продукта. Полученную суспензию перемешивают еще 15 мин, продукт собирают фильтрованием и промывают i-PrOH (4 мл). После сушки при 50°С получают продукт в виде белых кристаллов с выходом 83%. Затем продукт перекристаллизовывают из смеси i-PrOH/уксусная кислота и выход составляет 90,6%.
В альтернативном способе свободное основание FTY720 (2,27 ммоля) растворяют в этилацетате (16 мл) при температуре 88-90°С. Затем при 75°С добавляют раствор уксусной кислоты (2,5 экв.) в этилацетате (3 мл), при этом непосредственно после добавления начинается кристаллизация продукта. Полученную суспензию охлаждают до комнатной температуры. Продукт собирают фильтрованием и промывают этилацетатом (2 мл). После сушки при 50°С получают продукт в виде белых кристаллов с выходом 99,4%.
Порошковая рентгенограмма FTY720 ацетата показана на фиг.6, характерные пики приведены ниже:
|
|
Пример 8: FTY720 пропионат
Свободное основание FTY720 (1,63 ммоля) растворяют в i-PrOH (6 мл) при 82°С. Затем при 82°С добавляют раствор уксусной кислоты (1,79 экв.) в i-PrOH (1 мл). Прозрачный раствор охлаждают до комнатной температуры, в результате чего происходит кристаллизация продукта. Полученную суспензию перемешивают еще 15 мин, продукт собирают фильтрованием и промывают i-PrOH (2 мл). После сушки при 50°С получают продукт в виде белых кристаллов с выходом 68%. Затем продукт перекристаллизовывают из смеси i-PrOH/пропионовая кислота и выход составляет 90,6%.
В альтернативном способе свободное основание FTY720 (2,27 ммоля) растворяют в этилацетате (16 мл) при температуре 88-90°С. Затем при 75°С добавляют раствор пропионовой кислоты (2,5 экв.) в этилацетате (3 мл), при этом непосредственно после добавления начинается кристаллизация продукта. Полученную суспензию охлаждают до комнатной температуры. Продукт собирают фильтрованием и промывают этилацетатом (2 мл). После сушки при 50°С получают продукт в виде белых кристаллов с выходом 96,9%.
Порошковая рентгенограмма FTY720 пропионата показана на фиг.7, характерные пики приведены ниже:
|
Пример 10: Исследование растворимости
Определяют растворимость различных солей, и полученные данные приведены в таблице ниже (приблизительные значения при 25°С, г/100 мл %):
|