Результат интеллектуальной деятельности: КОМБИНАЦИЯ (А) ИНГИБИТОРА ФОСФОИНОЗИТ-3-КИНАЗЫ И (Б) МОДУЛЯТОРА ПУТИ Ras/Raf/Mek
Вид РИД
Изобретение
В настоящем изобретении предлагается фармацевтическая комбинация, включающая (а) ингибитор фосфоинозит-3-киназы (PI3K) и (б) соединение, которое модулирует путь Ras/Raf/Mek, и необязательно по крайней мере один фармацевтически приемлемый носитель, и указанная комбинация предназначена для одновременного, раздельного или последовательного применения, прежде всего для лечения пролиферативного заболевания, прежде всего пролиферативного заболевания, при котором наблюдаются разрегулированные пути Ras/Raf/Mek и PI3K/Akt, предлагается фармацевтическая композиция, включающая указанную комбинацию, применение указанной комбинации для получения лекарственного средства, предназначенного для лечения пролиферативного заболевания, коммерческая упаковка или продукт, включающие указанную комбинацию, в виде комбинированного препарата, предназначенного для одновременного, раздельного или последовательного применения, а также предлагается способ лечения теплокровного животного, прежде всего, человека.
В заявке WO 2006/122806 описаны производные имидазохинолина, которые ингибируют активность липидкиназ, таких как PI3-киназы. Специфические производные имидазохинолина по настоящему изобретению, их получение и пригодные фармацевтические составы, включающие указанные производные, описаны в заявке WO 2006/122806, и включают соединения формулы I
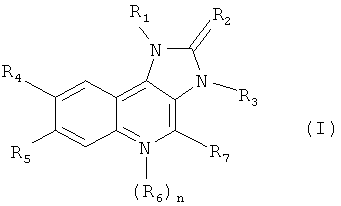 ,
,
где
R1 обозначает нафтил или фенил, при чем указанный фенил замещен одним или двумя заместителями, которые независимо выбраны из группы, включающей галоген, (низш.)алкил, незамещенный или замещенный галогеном, цианогруппой, имидазолилом или триазолилом, циклоалкил, аминогруппу, замещенную одним или двумя заместителями, независимо выбранными из группы, включающей (низш.)алкил, (низш.)алкилсульфонил, (низш.)алкоксигруппу и (низш.)алкокси(низш.)алкиламиногруппу, пиперазинил, незамещенный или замещенный одним или двумя заместителями, которые независимо выбраны из группы, включающей (низш.)алкил и (низш.)алкилсульфонил; 2-оксопирролидинил, (низш.)алкокси(низш.)алкил, имидазолил, пиразолил и триазолил,
R2 обозначает О или S,
R3 обозначает (низш.)алкил,
R4 обозначает пиридил, незамещенный или замещенный галогеном, цианогруппой, (низш.)алкилом, (низш.)алкоксигруппой, или пиперазинил, незамещенный или замещенный (низш.)алкилом, пиримидинил, незамещенный или замещенный (низш.)алкоксигруппой, хинолинил, незамещенный или замещенный галогеном, хиноксалинил или фенил, замешенный алкоксигруппой,
R5 обозначает водород или галоген,
n равно 0 или 1,
R6 обозначает оксидогруппу,
при условии, что если n равен 1, то атом азота, связанный с радикалом R6 положительно заряжен,
R7 обозначает водород или аминогруппу,
или их таутомер или фармацевтически приемлемую соль или их гидрат или сольват.
Радикалы и символы, используемые при описании соединения формулы I, имеют значения, описанные в заявке WO 2006/122806, включенной в настоящее описание в качестве ссылки.
Предпочтительным соединением по изобретению является соединение, подробно описанное в заявке WO 2006/122806. Наиболее предпочтительным соединением по настоящему изобретению является 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-с]хинолин-1-ил)фенил]пропионитрил или его монотозилат (соединение А). Синтез 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидроимидазо[4,5-с]хинолин-1-ил)фенил]пропионитрила описан, например, в заявке WO 2006/122806, см. пример 1. Другим наиболее предпочтительным соединением по настоящему изобретению является 8-(6-метоксипиридин-3-ил)-3-метил-1-(4-пиперазин-1-ил-3-трифторметилфенил)-1,3-дигидроимидазо[4,5-с]хинолин-2-он (соединение В). Синтез 8-(6-метоксипиридин-3-ил)-3-метил-1-(4-пиперазин-1-ил-3-трифторметилфенил)-1,3-дигидроимидазо[4,5-с]хинолин-2-она описан, например, в заявке WO 2006/122806, см. пример 86.
В заявке WO 07/084786 описаны производные пиримидина, проявляющие активность в отношении липидкиназ, таких как PI3-киназы. Специфические производные пиримидина по настоящему изобретению, их получение и пригодные фармацевтические составы, включающие указанные производные, описаны в заявке WO 07/084786, и включают соединения формулы II
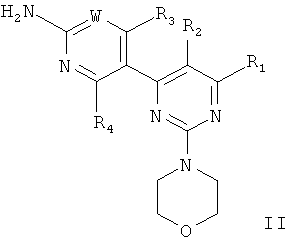
или их стереоизомер, таутомер или фармацевтически приемлемую соль, где
W обозначает CRw или N, где Rw выбран из группы, включающей
(1) водород,
(2) цианогруппу,
(3) галоген,
(4) метил,
(5) трифторметил,
(6) сульфонамидную группу,
R1 выбран из группы, включающей
(1) водород,
(2) цианогруппу,
(3) нитрогруппу,
(4) галоген,
(5) замещенный и незамещенный алкил,
(6) замещенный и незамещенный алкенил,
(7) замещенный и незамещенный алкинил,
(8) замещенный и незамещенный арил,
(9) замещенный и незамещенный гетероарил,
(10) замещенный и незамещенный гетероциклил,
(11) замещенный и незамещенный циклоалкил,
(12) -COR1a,
(13) -CO2R1a,
(14) -CONR1aR1b,
(15) -NR1aR1b,
(16) -NR1aCOR1b,
(17) -NR1aSO2R1b,
(18) -OCOR1a,
(19) -OR1a,
(20) -SR1a,
(21) -SOR1a,
(22) -SO2R1a и
(23) -SO2NR1aR1b,
где R1a и R1b независимо выбраны из группы, включающей
(а) водород,
(б) замещенный или незамещенный алкил,
(в) замещенный и незамещенный арил,
(г) замещенный и незамещенный гетероарил,
(д) замещенный и незамещенный гетероциклил и
(е) замещенный и незамещенный циклоалкил,
R2 выбран из группы, включающей
(1) водород,
(2) цианогруппу,
(3) нитрогруппу,
(4) галоген,
(5) гидроксильную группу,
(6) аминогруппу,
(7) замещенный и незамещенный алкил,
(8) -COR2a и
(9) -NR2aCOR2b,
где R2a и R2b независимо выбраны из группы, включающей
(а) водород и
(б) замещенный или незамещенный алкил,
R3 выбран из группы, включающей
(1) водород,
(2) цианогруппу,
(3) нитрогруппу,
(4) галоген,
(5) замещенный и незамещенный алкил,
(6) замещенный и незамещенный алкенил,
(7) замещенный и незамещенный алкинил,
(8) замещенный и незамещенный арил,
(9) замещенный и незамещенный гетероарил,
(10) замещенный и незамещенный гетероциклил,
(11) замещенный и незамещенный циклоалкил,
(12) -COR3a,
(13) -NR3aR3b,
(14) -NR3aCOR3b,
(15) -NR3aSO2R3b,
(16) -OR3a,
(17) -SR3a,
(18) -SOR3a,
(19) -SO2R3a и
(20) -SO2NR3aR3b,
где R3a и R3b независимо выбраны из группы, включающей
(а) водород,
(б) замещенный или незамещенный алкил,
(в) замещенный и незамещенный арил,
(г) замещенный и незамещенный гетероарил,
(д) замещенный и незамещенный гетероциклил и
(е) замещенный и незамещенный циклоалкил, и
R4 выбран из группы, включающей
(1) водород и
(2) галоген.
Радикалы и символы, используемые при описании соединения формулы I, имеют значения, описанные в заявке WO 07/084786, включенной в настоящее описание в качестве ссылки.
Предпочтительным соединением по настоящему изобретению является соединение, подробно описанное в заявке WO 07/084786. Наиболее предпочтительным соединением по изобретению является 5-(2,6-диморфолин-4-илпиримидин-4-ил)-4-трифторметилпиридин-2-иламин (соединение С). Синтез 5-(2,6-диморфолин-4-илпиримидин-4-ил)-4-трифторметилпиридин-2-иламина описан в заявке WO 07/084786, см. пример 10.
Путь передачи сигнала Ras/Raf/Mek сначала активируется при внеклеточном связывании и стимуляции рецепторных тирозинкиназ (RTK) соответствующими родственными лигандами. В результате автофосфорилирования специфических остатков тирозина в составе цитоплазматического домена RTK, комплекс Grb2-Sos перемещается к плазматической мембране и превращает неактивный Ras. ГДФ в активный Ras.ГТФ. Взаимодействие между Grb2 и активированными киназами или белками, ассоциированными с фосфорилированным рецептором, опосредуется с участием домена SH2 в составе сигнального белка, который связывается и распознает специфическую последовательность, включающую остаток фосфотирозина. После связывания с ГТФ в структуре Ras происходят конформационные изменения, что приводит к перемещению Raf-1 к цитоплазматической мембране, где происходит фосфорилирование под действием нескольких киназ и одновременное дифосфорилирование ключевых аминокислотных остатков под действием протеинфосфатазы 2В. Активированная Raf фосфорилирует Mek по двум остаткам серина в составе активирующей петли, при этом происходит активация указанной протеинкиназы. Затем Mek фосфорилирует и активирует киназу Erk, что приводит к ее перемещению в ядро, где она фосфорилирует факторы транскрипции, и в результате происходит экспрессия множества генов. Как описано в этом разделе, несколько компонентов каскада Raf/Mek/Erk могут играть исключительно важную роль при лечении рака, например, генетических изменений таких, как мутации HRAS, KRAS, NRAS или BRAF, или амплификации генов.
Сорафениб, другое название Nexavar™ или BAY 43-9006, является первым модулятором киназы Raf, который широко применяется для лечения прогрессирующей почечно-клеточной карциномы (ПКК). Сорафениб является биарильным производным мочевины и характеризуется следующей структурой:
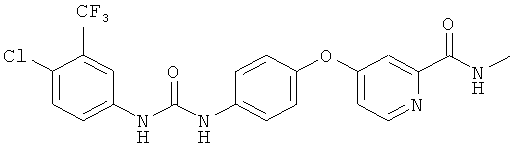
Сорафениб и способы его получения описаны, например, в патенте US 235576 или US 7351834.
RAF265 (ранее известный, как CHIR-265) является другим биодоступным модулятором Кагдля перорального введения и характеризуется следующей структурой:
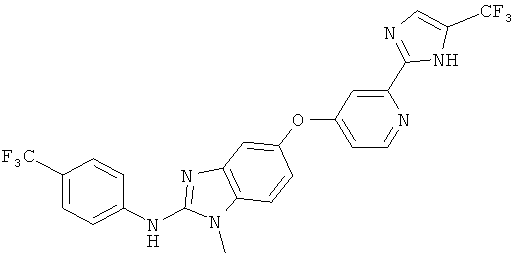
RAF265 и способы его получения описаны, например, в заявке WO 07/030377.
Другие модуляторы киназы Raf включают, например, SB 590885, XL281, PLX4032.
Модуляторы киназы Mek включают соединения, описанные в заявке WO 02/06213, прежде всего, соединение PD-0325901, которое характеризуется следующей структурой:
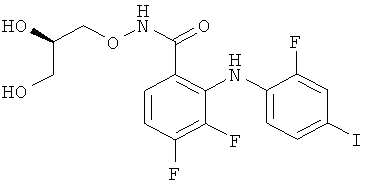
Другим родственным ингибитором киназы Mek является соединение PD-181461.
Другими модуляторами киназы Mek являются соединения, описанные в заявке WO 03/077914, прежде всего, соединение ARRY142886/AZD6244 следующей структуры:
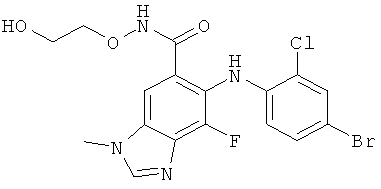
и ARRY-509, а также соединения, описанные в заявках WO 05/051906, WO 05/023251, WO 03/077855 и патенте US 20050049419, включающие N3-алкилированные бензимидазолы и другие подобные гетероциклические производные, являющиеся ингибиторами МЕК и предназначенные для лечения гиперпролиферативных заболеваний.
Другими модуляторами киназы Mek являются, например, соединения XL518, JTP-74057, AS-701255, AS-701173.
В настоящем изобретении предлагается также комбинация, такая как комбинированный препарат или фармацевтическая композиция, которые включают (а) ингибитор фосфоинозит-3-киназы (PI3K) и (б) соединение, которое модулирует путь Ras/Raf/Mek. Более подробно, первый вариант осуществления настоящего изобретения относится к комбинации, включающей (а) ингибитор фосфоинозит-3-киназы (PI3K) и (б) модулятор киназы РаГили модулятор киназы Mek.
Термин "комбинированный препарат", использованный в данном контексте, обозначает прежде всего "набор", т.е. компоненты комбинации (а) и (б), описанные выше, можно вводить независимо или в виде различных фиксированных комбинаций, содержащих различные количества компонентов комбинации (а) и (б), т.е. одновременно или в различные промежутки времени. Компоненты набора можно вводить, например, одновременно или поочередно, при этом их можно вводить в различное время, и любую часть набора можно вводить через одинаковые или различные промежутки времени. Соотношение общих количеств компонента комбинации (а) и компонента комбинации (б) в составе комбинированного препарата, в котором необходимо вводить указанные компоненты, может изменяться, например, в зависимости от состояния пациентов субпопуляции или конкретного субъекта, нуждающегося в лечении.
Неожиданно было установлено, что комбинированная терапия с использованием ингибитора PI3K и ингибитора киназы гагили киназы mek характеризуется повышенной эффективностью при лечении онкологических заболеваний. При введении ингибитора PI3K и ингибитора киназы raf или киназы mek одновременно, последовательно или в отдельности указанные ингибиторы проявляют синергизм при подавлении пролиферации клеток. Указанное неожиданное синергетическое воздействие позволяет снизить дозу каждого вводимого соединения, что способствует снижению побочных эффектов и повышению клинической эффективности соединений и курса лечения.
Синергетическое взаимодействие между одним или более компонентов, оптимальный диапазон абсолютных доз и эффективности каждого компонента можно оценивать при введении пациенту, нуждающемуся в таком лечении, указанных компонентов в различных диапазонах массовых соотношений и доз. Испытания по оценке синергетического действия с участием человека в качестве основной экспериментальной модели являются нецелесообразными в связи со сложностью и высокой стоимостью клинических испытаний. Однако, данные о синергетическом эффекте, полученные на основе фармакокинетических/фармакодинамических параметров для одного вида животного, можно использовать для прогнозирования подобного эффекта для других видов и моделей животных, как описано в данном контексте, а также использовать для прогнозирования эффективной дозы и соотношений концентраций компонентов в плазме крови и абсолютных доз, и концентраций в плазме крови для других видов. Установленная корреляция между эффектами, наблюдаемыми на моделях рака, и эффектами на опухолевое заболевание у человека, дают основания полагать, что синергизм на моделях животных можно, например, оценивать на модели опухоли BN472 или моделях рака поджелудочной железы PANCl и MiaPaCa2, как описано ниже в примерах.
В первом объекте настоящего изобретения предлагается синергетическая комбинация, предназначенная для введения человеку, включающая (а) ингибитор PI3K и (б) соединение, которое модулирует путь Ras/Raf/Mek, или их фармацевтически приемлемые соли или сольваты, в которой компоненты комбинации используют в массовых соотношениях в диапазонах, соответствующих диапазонам, которые были использованы для выявления синергетического эффекта на модели опухоли, например, как описано ниже в примерах. Пригодное соотношение компонентов комбинации, предназначенной для введения человеку, соответствует диапазону, который использовали при испытаниях на моделях животных, т.е. соотношение выбирают из следующих массовых соотношений от 50:1 до 1:50, от 50:1 до 1:20, от 50:1 до 1:10, от 50:1 до 1:1, от 20:1 до 1:50, от 20:1 до 1:20, от 20:1 до 1:10, от 20:1 до 1:1, от 10:1 до 1:50, от 10:1 до 1:20, от 10:1 до 1:10, от 10:1 до 1:1, от 1:1 до 1:50, от 1:1 до 1:20 и от 1:1 до 1:10. Более пригодное соотношение компонентов комбинации, предназначенной для введения человеку, выбирают из диапазона, который использовали при испытаниях на модели других животных, т.е. от 10:1 до 1:1 или от 5:1 до 1:1 или от 2:1 до 1:1.
В другом объекте настоящего изобретения предлагается синергетическая комбинация, предназначенная для введения человеку, включающая (а) ингибитор PI3K и (б) соединение, которое модулирует путь Ras/Raf/Mek, или их фармацевтически приемлемые соли, причем диапазон доз для каждого компонента комбинации соответствует дозам, которые были использованы для выявления синергетического эффекта на модели рака, например, моделях рака, описанных ниже в примерах. Пригодный диапазон доз ингибитора PI3K, предназначенных для введения человеку, соответствует диапазону доз, который использовали при испытаниях на пригодной модели рака, например, на модели крыс или мышей, как описано ниже в примерах, т.е. 1-50 мг/кг, более предпочтительно 1-30 мг/кг (например, 1-35 мг/кг или 1-10 мг/кг для соединения А, 1-25 мг/кг для соединения В).
Пригодный диапазон доз модулятора пути Ras/Raf/Mek для введения человеку соответствует диапазону доз, который использовали для выявления синергетического эффекта на пригодной модели рака, например, на модели крыс или мышей, как описано ниже в примерах, т.е. 1-50 мг/кг или 1-30 мг/кг (например, 1-25 мг/кг, 1-10 мг/кг или 1-2,5 мг/кг).
Пригодные дозы ингибитора PI3K, предназначенные для введения человеку, выбирают из диапазона доз 1-1200 мг, 1-500 мг, 1-100 мг, 1-50 мг, 1-25 мг, 500-1200 мг, 100-1200 мг, 100-500 мг, 50-1200 мг, 50-500 мг или 50-100 мг, предпочтительно 50-100 мг, при введении один раз в сутки или два раза в сутки или три раза в сутки, а дозы соединения, которое модулирует путь Ras/Raf/Mek, выбирают из диапазона доз 1-1000 мг, 1-500 мг, 1-200 мг, 1-100 мг, 1-50 мг, 1-25 мг, 10-100 мг, 10-200 мг, 50-200 мг или 100-500 мг при введении один раз в сутки, два раза в сутки или три раза в сутки.
В еще одном объекте настоящего изобретения предлагается синергетическая комбинация, предназначенная для введения человеку, включающая (а) ингибитор PI3K в количестве, соответствующем 10%-100%, предпочтительно 50%-100% или более предпочтительно 70%-100%, 80%-100% или 90%-100% от максимально переносимой дозы (МПД) и (б) соединение, которое модулирует путь Ras/Raf/Mek, в количестве, соответствующем 10%-100%, предпочтительно 50%-100% или более предпочтительно 70%-100%, 80%-100% или 90%-100% от МПД. В предпочтительном варианте осуществления изобретения один из компонентов, предпочтительно ингибитор PI3K, вводят в дозе, соответствующей МПД, а другой компонент, предпочтительно модулятор пути Ras/Raf/Mek, вводят в дозе, соответствующей 50%-100% МПД, предпочтительно 60%-90% МПД. Термин "МПД" обозначает самую высокую дозу лекарственного средства, при введении которой еще не наблюдаются тяжелые побочные эффекты. Величину МПД может определить специалист в данной области техники. Например, МПД можно определить в ходе фазы I испытаний, включающей введение увеличивающихся доз лекарственного средства, для оценки лимитирующей дозу токсичности и уровня биологической активности переносимых доз.
В одном варианте изобретения (а) ингибитор фосфоинозит-3-киназы (PI3K) выбран из группы, включающей соединение А, соединение В или соединение С.
В другом варианте (б) модулятор киназы Raf выбран из группы, включающей сорафениб, Raf265, SB590885, XL281 и PLX4032. В еще одном варианте (б) модулятор киназы Mek выбран из группы, включающей PD325901, PD-181461, ARRY142886/AZD6244, ARRY-509, XL518, JTP-74057, AS-701255, AS-701173, AZD8330, ARRY162, ARRY300, RDEA436, Е6201, RO4987655/R-7167, GSK1120212 и AS703026.
Термин "лечить" или "лечение", использованный в данном контексте, обозначает лечение, в результате которого достигается замедление прогрессирования заболевания. Термин "замедление прогрессирования", использованный в данном контексте, обозначает введение комбинации пациентам, которые находятся в предварительной стадии или в начальной стадии пролиферативного заболевания и которые нуждаются в таком лечении, например, пациентам, которым установлен диагноз предварительной стадии или пациентам, у которых развивается состояние, например, в результате медикаментозного лечения, или состояние, опосредованное несчастным случаем, в результате которого существует вероятность развития соответствующего заболевания.
В одном варианте осуществления настоящего изобретения пролиферативным заболеванием является меланома, рак легких, колоректальный рак, рак молочной железы, рак почек, такой как, например, почечно-клеточная карцинома, рак печени, острый миелогенный лейкоз (ОМЛ), миелодиспластический синдром, немелкоклеточный рак легких (НМКРЛ), рак щитовидной железы, рак поджелудочной железы, нейрофиброматоз или почечно-клеточный рак.
В другом варианте настоящего изобретения пролиферативным заболеванием является солидная опухоль. Термин "солидная опухоль" обозначает прежде всего рак молочной железы, рак яичников, рак ободочной кишки и желудочно-кишечного тракта, рак шейки матки, рак легких, прежде всего мелкоклеточный рак легких, а также немелкоклеточный рак легких, рак головы и шеи, рак мочевого пузыря, рак предстательной железы или саркому Капоши. Комбинация по изобретению подавляет рост солидных опухолей, а также «жидкие» опухоли. Кроме того, в зависимости от типа рака и состава конкретной комбинации возможно уменьшение объема опухоли. Комбинации, описанные в данном контексте, пригодны также для предотвращения метастазирования опухолей, а также роста и образования микрометастаз. Комбинации по изобретению пригодны прежде всего для лечения пациентов с неблагоприятным прогнозом, прежде всего, таких как пациенты с неблагоприятным прогнозом, страдающие от метастазирующих меланомы или рака поджелудочной железы.
Рак, подлежащий лечению, может развиться в результате генетических изменений пути передачи сигнала Ras/Raf/Mek, таких как, например, мутации HRAS, KRAS, NRAS или BRAF или амплификации генов. В одном варианте изобретения раком, подлежащим лечению, является рак, опосредованный мутацией KRAS, например, рак поджелудочной железы, колоректальный рак, рак легких (например, НМКРЛ) или лейкозы, опосредованные мутацией KRAS.
Структуру активных агентов определяют по кодовым номерам, общим названиям или товарным названиям, которые представлены в текущем издании справочника "The Merck Index" или в базах данных, например, Patents International (например, IMS World Publications). Соответствующие содержание указанных изданий включено в настоящее описание в качестве ссылки.
Следует понимать, что компоненты комбинации (а) и (б) можно использовать также в форме их фармацевтически приемлемых солей. Если указанные компоненты комбинации содержат, например, по крайней мере один основный центр, они могут образовывать кислотно-аддитивные соли. При наличии дополнительного основного центра также могут образовываться соответствующие кислотно-аддитивные соли. Компоненты комбинации (а) и (б), содержащие кислотную группу (например, СООН), могут образовывать также соли оснований. Компоненты комбинации (а) и (б) или их фармацевтически приемлемые соли можно также использовать в форме гидрата или сольватов, включающих другие растворители, использованные для кристаллизации.
В настоящем описании термин "комбинация по изобретению" обозначает комбинацию, в которой (а) ингибитор фосфоинозит-3-киназы и (б) соединение, которое модулирует путь Ras/Raf/Mek, каждый присутствует в свободной форме или в форме его фармацевтически приемлемой соли, и указанная комбинация необязательно включает по крайней мере один фармацевтически приемлемый носитель.
Комбинация по изобретению оказывает синергетический и аддитивный эффекты и характеризуется эффективностью и безопасностью. Указанные терапевтические преимущества комбинаций ингибитора фосфоинозит-3-киназы и соединения, которое модулирует путь Ras/Raf/Mek, позволяют использовать каждый из компонентов комбинации в более низком безопасном диапазоне доз.
Фармакологическую активность комбинации по изобретению можно, например, оценивать в ходе клинических испытаний или методами анализа, как описано ниже. Пригодными клиническими испытаниями являются, например, нерандомизированные клинические испытания с открытой этикеткой с повышающейся дозой лекарственного средства с участием пациентов, страдающих от прогрессирующих солидных опухолей. В ходе указанных испытаний можно подтвердить аддитивное или синергетическое действие активных ингредиентов в составе комбинации по изобретению. Благоприятные действия на пролиферативные заболевания можно оценивать напрямую по результатам указанных испытаний или модифицированных вариантов клинических испытаний, известных специалисту в данной области техники. Такими испытаниями являются прежде всего испытания, в которых сравнивают эффекты лечения в режиме мототерапии с использованием активных ингредиентов, и лечения комбинацией по изобретению. Предпочтительно в ходе испытаний компонент комбинации (а) вводят в фиксированной дозе, а дозу компонента комбинации (б) повышают, вплоть до максимально переносимой дозы.
В одном объекте настоящего изобретения предлагается фармацевтическая композиция, которая включает терапевтически эффективные в отношении пролиферативного заболевания количества компонентов комбинации по изобретению. В указанной композиции компоненты комбинации (а) и (б) можно вводить одновременно, один за другим или в отдельности в виде одной комбинированной лекарственной формы или в виде двух раздельных лекарственных форм. Стандартная лекарственная форма может представлять собой также фиксированную комбинацию.
Фармацевтические композиции по изобретению можно получать стандартными способами, известными специалисту в данной области техники, в формах, пригодных для энтерального, такого как пероральное или ректальное, а также парентерального введения млекопитающим (теплокровным животным), включая человека. В другом варианте, если агенты вводят в отдельности, то один агент можно вводить в виде энтерального состава, а другой компонент можно вводить парентерально.
Новая фармацевтическая композиция содержит, например, приблизительно от 10% приблизительно до 100%, предпочтительно приблизительно от 20% приблизительно до 60% активных ингредиентов. В качестве энтеральных или парентеральных фармацевтических препаратов, предназначенных для комбинированной терапии, можно использовать, например, стандартные лекарственные формы, такие как таблетки с сахарным покрытием, таблетки, капсулы или суппозитории, а также ампулы. Если не указано иное, указанные лекарственные формы получают по известным стандартным методикам, например, с использованием стандартных способов смешивания, грануляции, нанесения сахарных покрытий, растворения или лиофилизации. Предполагается, что каждая лекарственная форма, содержащая компоненты комбинации, необязательно должна содержать эффективное количество каждого компонента, поскольку необходимое эффективное количество может достигаться при введении множества стандартных лекарственных форм.
При получении композиций пероральных лекарственных средств можно использовать любые стандартные фармацевтические ингредиенты, например, такие как вода, гликоли, масла, спирты, ароматизаторы, консерванты, красители или носители, такие как крахмалы, сахара, микрокристаллическая целлюлоза, разбавители, агенты для грануляции, смазывающие вещества, связующие агенты, дезинтегрирующие агенты и т.п. в случае твердых пероральных лекарственных средств, например, таких как порошки, капсулы и таблетки, причем твердые лекарственные формы являются более предпочтительными по сравнению с жидкими формами. Таблетки и капсулы являются наиболее предпочтительными пероральными стандартными лекарственными формами в связи с простотой введения, и указанные лекарственные формы обычно содержат твердые фармацевтические носители.
Терапевтически эффективное количество каждого компонента комбинации, входящего в состав комбинации по изобретению, можно вводить прежде всего одновременно или последовательно в любом порядке, при этом компоненты можно вводить раздельно или в виде фиксированной комбинации. Например, способ замедления прогрессирования или лечения пролиферативного заболевания по изобретению заключается в том, что субъекту вводят (1) первый компонент комбинации в свободной форме или в форме фармацевтически приемлемой соли и вводят (2) второй компонент комбинации в свободной форме или в форме фармацевтически приемлемой соли, одновременно или последовательно в любом порядке, при этом указанные компоненты вводят в совместно терапевтически эффективном количестве, предпочтительно в синергетически эффективном количестве. Индивидуальные компоненты комбинации по настоящему по изобретению можно вводить в отдельности в различные промежутки времени в течение всего курса лечения или одновременно в виде раздельных лекарственных форм или в виде одной комбинированной лекарственной формы. Кроме того, термин "введение" обозначает также применение пролекарства в качестве компонента комбинации, которое in vivo превращается в компонент комбинации. Следует понимать, что изобретение включает все курсы одновременного или поочередного введения указанных соединений, и термин "введение" включает все возможные варианты.
Комбинацию по изобретению можно получать в виде комбинированного препарата или фармацевтической композиции.
Кроме того, в изобретении предлагается способ лечения теплокровного животного, страдающего от пролиферативного заболевания, который заключается в том, что указанному животному вводят терапевтически эффективное в отношении указанного пролиферативного заболевания количество комбинации по изобретению.
В настоящем изобретении предлагается также применение комбинации по изобретению для лечения пролиферативного заболевания, а также для получения лекарственного средства, предназначенного для лечения пролиферативного заболевания.
Кроме того, в настоящем изобретении предлагается коммерческая упаковка, включающая активные ингредиенты комбинации по изобретению, а также инструкцию по одновременному, раздельному или последовательному введению указанной комбинации для подавления прогрессирования или лечения пролиферативного заболевания.
Предпочтительные варианты изобретения включают комбинации следующего состава:
- соединение А, соединение В или соединение С и сорафениб,
- соединение А, соединение В или соединение С и RAF265.
В другом предпочтительном варианте предлагаются комбинации следующего состава:
- соединение А и сорафениб, Raf265, SB590885, XL281 или PLX4032,
- соединение В и сорафениб, Raf265, SB590885, XL281 или PLX4032,
- соединение С и сорафениб, Raf265, SB590885, XL281 или PLX4032,
- соединение А и PD325901, PD-181461, ARRY142886/AZD6244, ARRY-509, XL518, JTP-74057, AS-701255, AS-701173, AZD8330, ARRY162, ARRY300, RDEA436, Е6201, RO4987655/R-7167, GSK1120212 или AS703026,
- соединение В и PD325901, PD-181461, ARRY142886/AZD6244, ARRY-509, XL518, JTP-74057, AS-701255, AS-701173, AZD8330, ARRY162, ARRY300, RDEA436, Е6201, RO4987655/R-7167, GSK1120212 или AS703026,
- соединение С и PD325901, PD-181461, ARRY142886/AZD6244, ARRY-509, XL518, JTP-74057, AS-701255, AS-701173, AZD8330, ARRY162, ARRY300, RDEA436, Е6201, RO4987655/R-7167, GSK1120212 или AS703026.
В других вариантах изобретения предлагаются:
- комбинация, которая включает комбинацию по изобретению, в которой активный ингредиент присутствует в каждом случае в свободной форме или в форме фармацевтически приемлемой соли или в виде их любого гидрата, и необязательно по крайней мере один фармацевтически приемлемый носитель, и указанная комбинация предназначена для одновременного, раздельного или последовательного введения,
- фармацевтическая композиция, включающая комбинацию по изобретению в совместно терапевтически эффективном количестве в отношении пролиферативного заболевания, и по крайней мере один фармацевтически приемлемый носитель,
- применение комбинации по изобретению для лечения пролиферативного заболевания,
- применение комбинации по изобретению для получения лекарственного средства, предназначенного для лечения пролиферативного заболевания,
- применение комбинации по изобретению, в которой ингибитор PI3K выбран из соединения А, соединения В или соединения С,
- применение комбинации по изобретению, в которой соединением, которое модулирует путь Ras/Raf/Mek, является модулятор киназы Raf, например, сорафениб, RAF265, SB590885, XL281, PLX4032, и
- применение комбинации по изобретению, в которой соединением, которое модулирует путь Ras/Raf/Mek, является модулятор киназы Mek, например, PD-0325901, PD-181461, ARRY142886/AZD6244, ARRY-509, XL518, JTP-74057, AS-701255, AS-701173, AZD8330, ARRY162, ARRY300, RDEA436, Е6201, RO4987655/R-7167, GSK1120212 или AS703026.
Кроме того, в настоящем изобретении предлагается, прежде всего комбинированный препарат, включающий (а) одну или более стандартных лекарственных форм, содержащих ингибитор фосфоинозит-3-киназы и (б) соединение, которое модулирует путь Ras/Raf/Mek.
Кроме того, в настоящем изобретении предлагается, прежде всего применение комбинации, включающей (а) ингибитор фосфоинозит-3-киназы и (б) соединение, которое модулирует путь Ras/Raf/Mek, для получения лекарственного средства, предназначенного для лечения пролиферативного заболевания.
Эффективную дозу каждого компонента комбинации в составе комбинации по изобретению можно изменять в зависимости от типа используемого соединения или фармацевтической композиции, способа введения, состояния, подлежащего лечению, тяжести состояния, подлежащего лечению. Таким образом, курс введения комбинации по изобретению выбирают с учетом множества факторов, включая способ введения и функцию почек и печени пациента. Терапевт, клиницист или ветеринар могут определить и назначить количество каждого активного ингредиента, эффективное для профилактики, приостановки или подавления прогрессирования патологического состояния. Оптимальную концентрацию активных ингредиентов, присутствующих в диапазоне, в котором достигается благоприятное действие без токсичности, можно определить на основе кинетики доступности активных ингредиентов в участках-мишенях.
Если компоненты комбинации в составе комбинации по изобретению вводят в форме единых коммерческих лекарственных средств, то дозировку и способ введения указанных препаратов, если не указано иное, выбирают в соответствии с инструкциями, которые прилагаются к коммерческой упаковке соответствующего лекарственного средства, чтобы обеспечить благоприятный эффект, как описано в данном контексте.
Соединение А можно вводить человеку в дозе в диапазоне приблизительно от 50 мг/сут до 800 мг/сут.
Соединение В можно вводить человеку в дозе в диапазоне приблизительно от 25 мг/сут до 800 мг/сут.
Соединение С можно вводить человеку в дозе в диапазоне приблизительно от 25 мг/сут до 800 мг/сут.
Сорафениб можно вводить человеку в дозе в диапазоне приблизительно от 75 мг/сут до 800 мг/сут, более предпочтительно 400 мг два раза в сут.
Следует понимать, что следующие примеры приводятся только для иллюстрации изобретения и не ограничивают его объем. Кроме того, благоприятное действие комбинации по изобретению можно также оценивать с использованием других экспериментальных моделей, известных специалисту в данной области техники.
Описание фигур
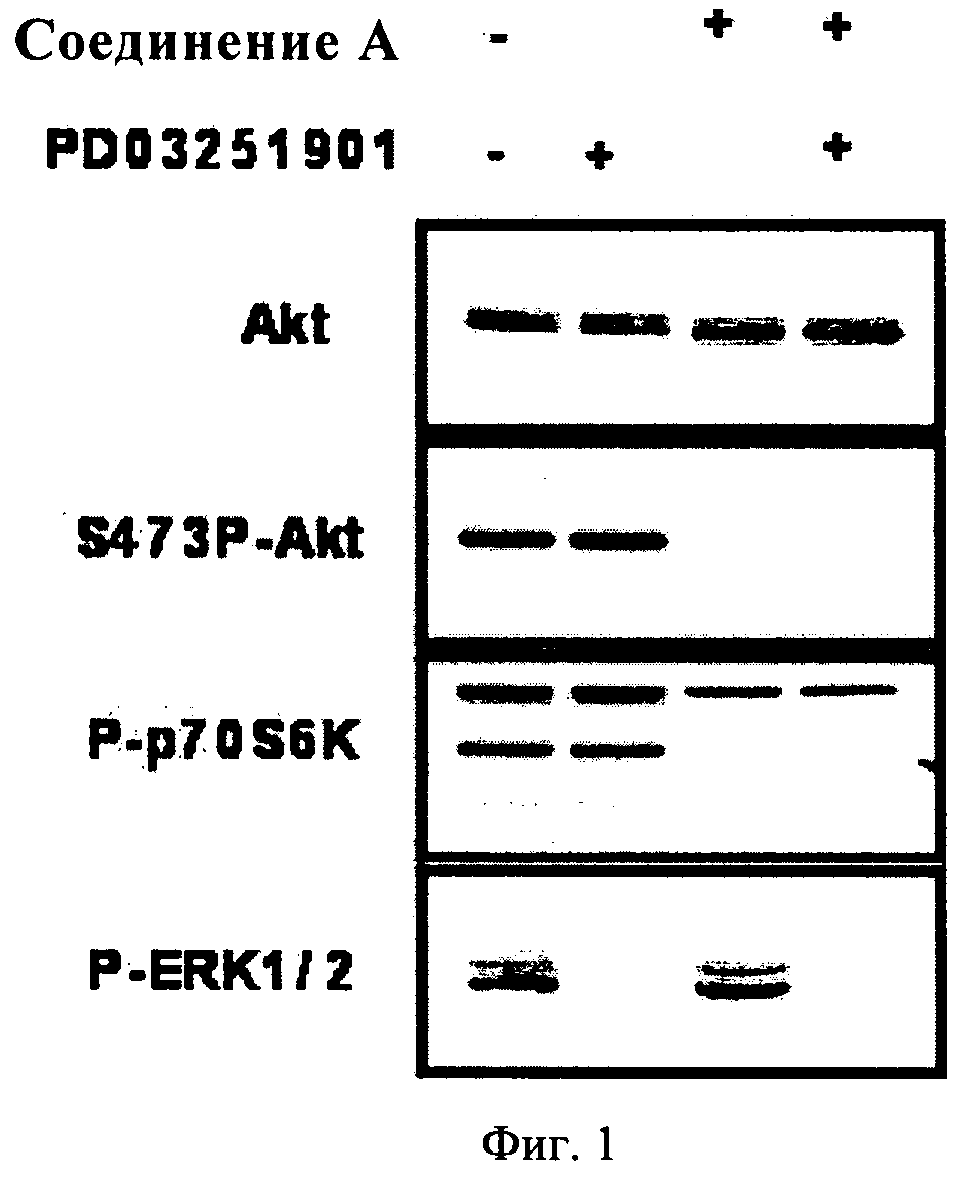
Фиг.1. Клетки А549 инкубировали в присутствии соединения А или соединения PD03251901 (250 нМ) в отдельности или в комбинации в течение 30 мин. Затем клетки собирали и оценивали уровни фосфорилирования киназ Akt, p70S6K или ERK методом вестерн-блоттинга по стандартной методике.
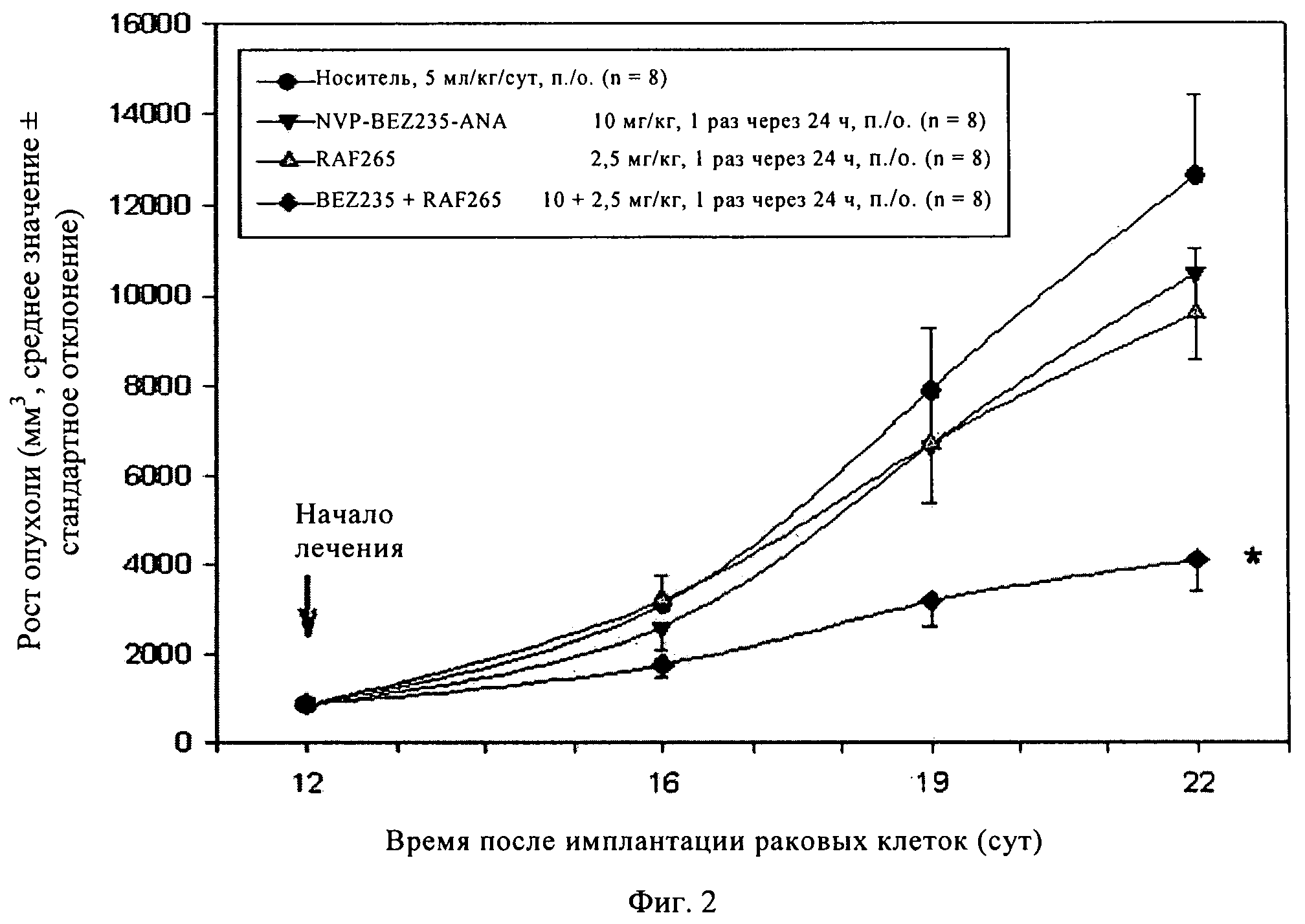
Фиг.2. Крыс с привитыми опухолями BN472 лечили указанным соединением, которое вводили в указанной дозе согласно указанному курсу лечения, при этом соединение вводили в отдельности или в комбинации. Затем в течение всего периода испытаний измеряли размер опухоли. *, Р<0,05 (критерий Дуннетта).
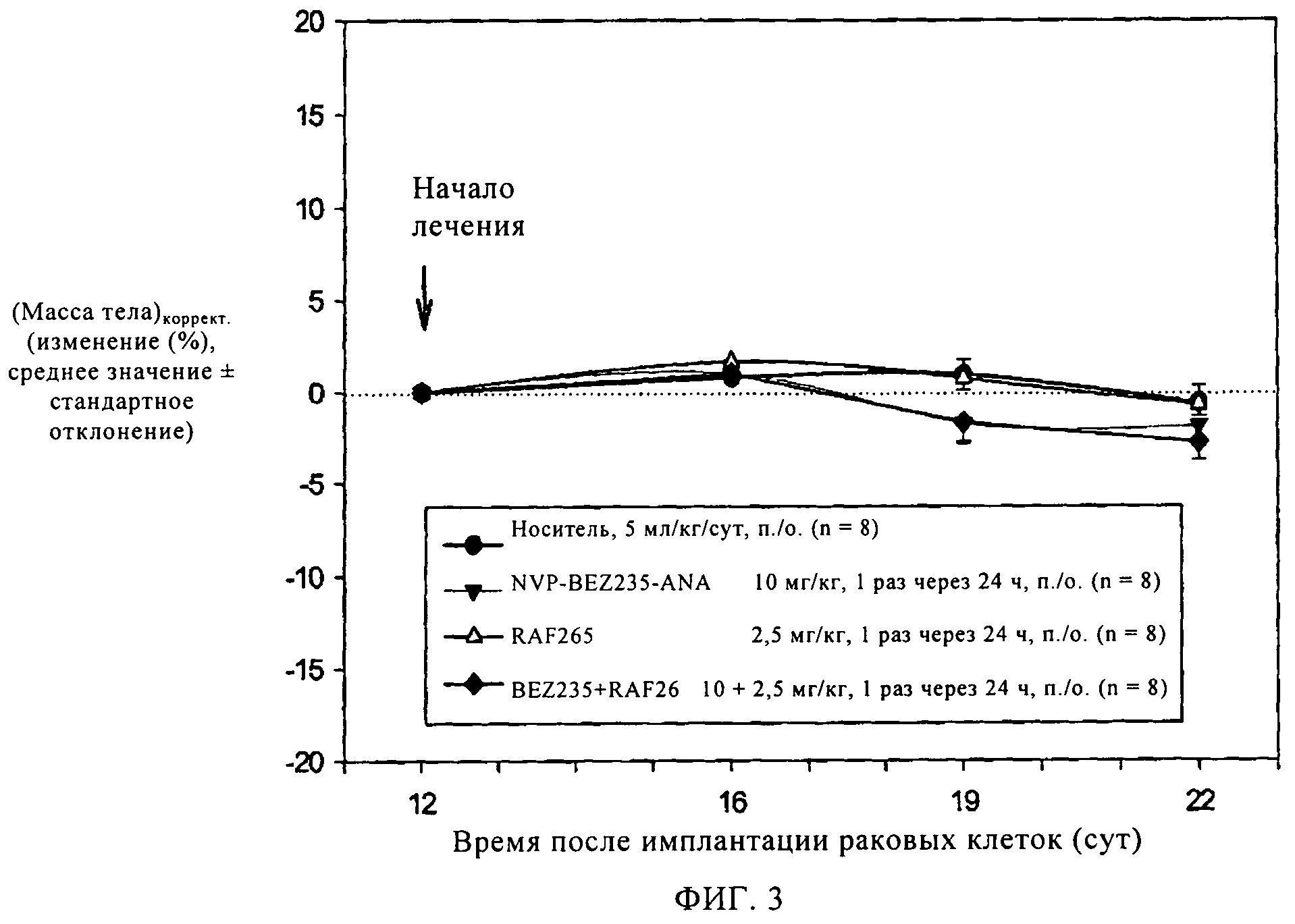
Фиг.3. Крыс с привитыми опухолями BN472 лечили указанным соединением, которое вводили в указанной дозе согласно указанному курсу лечения, при этом соединение вводили в отдельности или в комбинации. Затем в течение всего периода испытаний определяли массу тела животных. *, Р<0,05 (критерий Дуннетта).
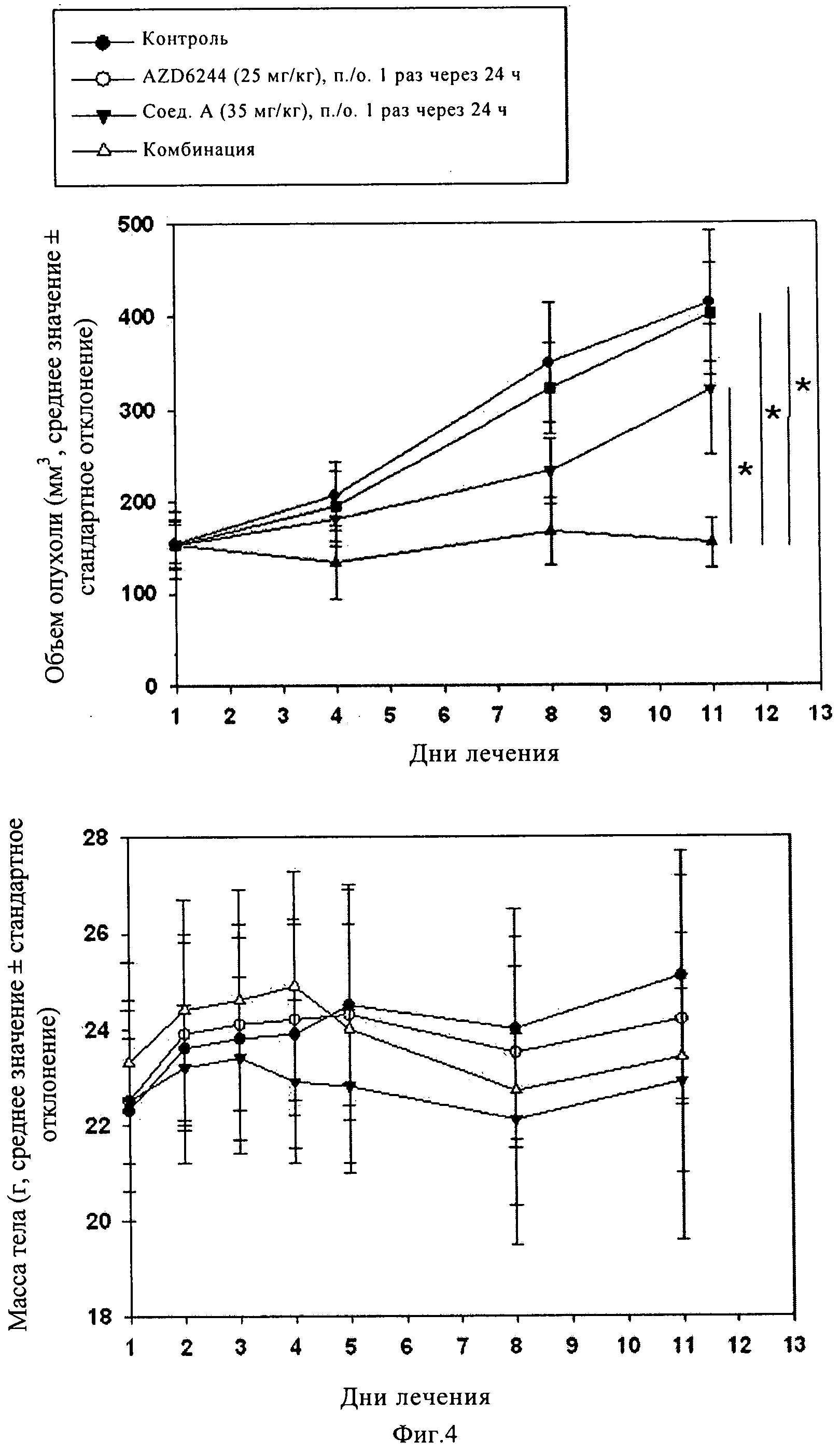
Фиг.4. KRAS мутантные клетки PANC1 имплантировали подкожно в бок голых мышей Harlan, которых затем лечили соединением А или соединением AZD6244 в отдельности или в комбинации в течение 12 сут. В течение всего периода испытаний измеряли объем опухоли (А) и массу тела животных (Б). *, р<0,05 (критерий Дуннетта).
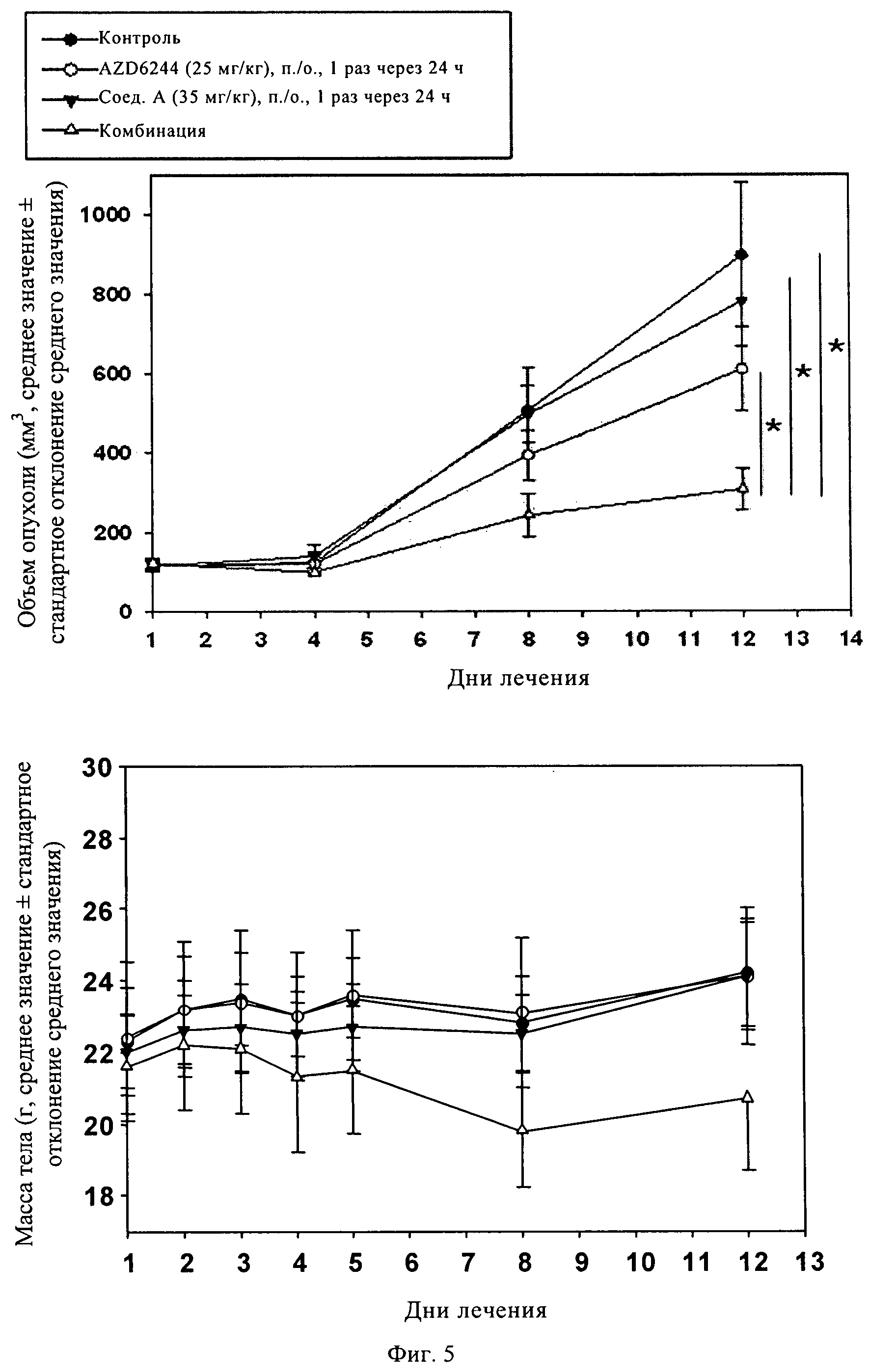
Фиг.5. KRAS мутантные клетки MiaPaCa2 имплантировали подкожно в бок голых мышей Harlan, которых затем лечили соединением А или соединением AZD6244 в отдельности или в комбинации в течение 12 сут. В течение всего периода испытаний измеряли объем опухоли (А) и массу тела животных (Б). *, р<0,05 (критерий Дуннетта).
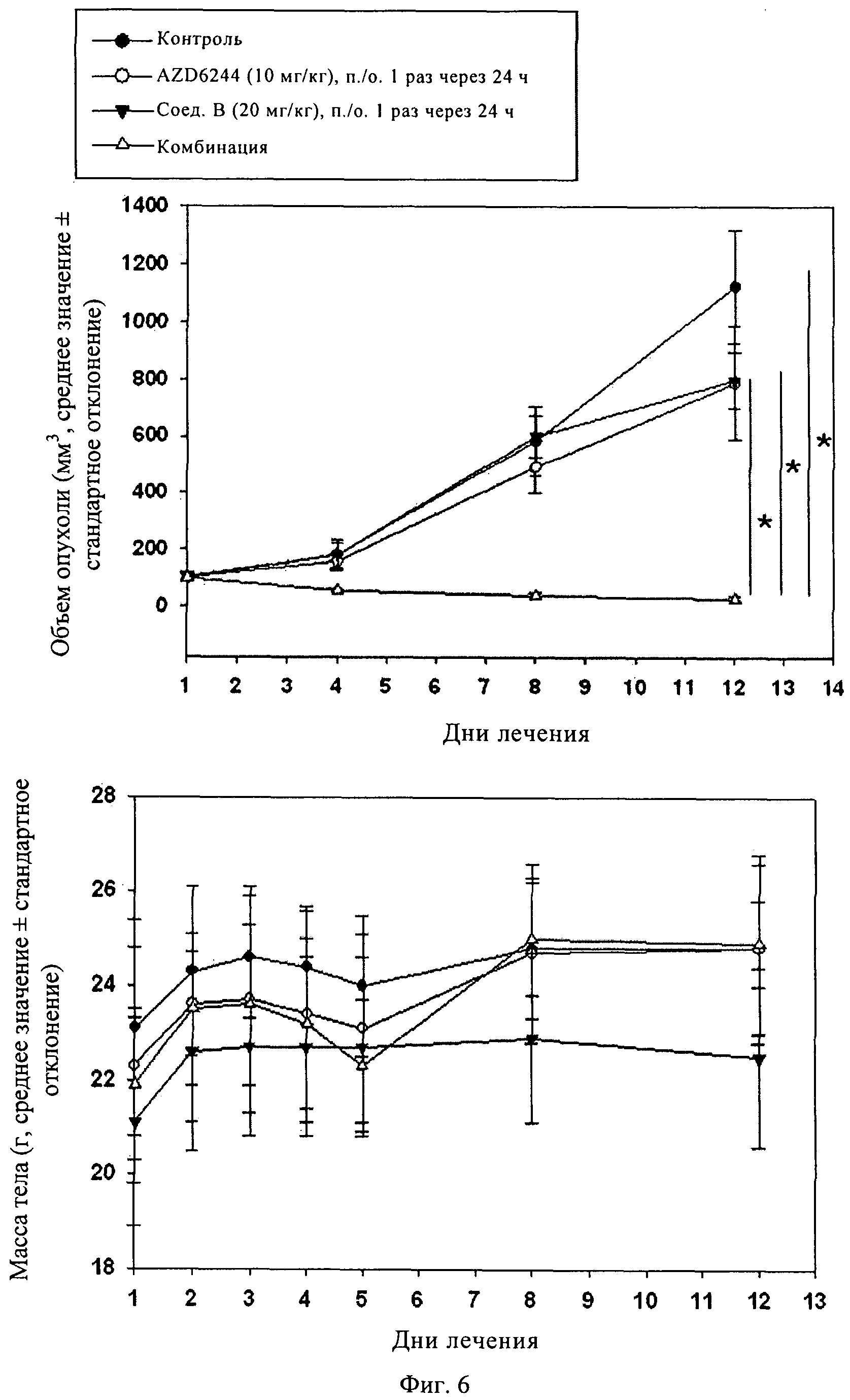
Фиг.6. KRAS мутантные клетки MiaPaCa2 имплантировали подкожно в бок голых мышей Harlan, которых затем лечили 5-(2,6-диморфолин-4-илпиримидин-4-ил)-4-трифторметилпиридин-2-иламином (в данном контексте "соединение В"), или соединением AZD6244 в отдельности или в комбинации в течение 12 сут. В течение всего периода испытаний измеряли объем опухоли (А) и массу тела животных (Б). *, р<0,05 (критерий Дуннетта).
Примеры
Пример 1
Ингибитор МЕК, PD0325901, оказывает синергетическое действие в комбинации с соединением А.по данным, полученным методом антипролиферативного анализа. Анализ проводили с использованием KRAS мутантных клеток NSCLC по стандартной методике с использованием красителя метиленового синего. Полученные результаты свидетельствуют о том, что соединение А и соединение PD0325901 подавляют пролиферацию клеток, причем величина ПР50 (т.е. концентрация, при которой наблюдается 50% подавление роста клеток) составляла 9,41 нМ и 36,8 нМ соответственно (таблица 1). В случае комбинации величина ПР50 для соединения BEZ235 снижалась до 3,2 нМ, т.е. в присутствии PD0325901 для достижения аналогичного уровня подавления пролиферации клеток требовалось в 3 раза меньшее количество BEZ235. С другой стороны в присутствии соединения А величина ПР50 для PD0325901 снижалась до 11,5 нМ. Индекс комбинации (ИК) составлял 0,718, что соответствует среднему уровню синергизма (таблица 2).
|
Клетки А549 инкубировали в присутствии соединения А или PD0325901 (NVP-LBW624) каждого в отдельности или в комбинации в повышающихся концентрациях в течение 72 ч, затем оценивали уровень пролиферации клеток по стандартной методике с использованием красителя метиленового синего, при этом определяли величину ПР50, а ИК рассчитывали с использованием программного обеспечения CalcuSyn.
|
Пример 2
Если клетки инкубировали в присутствии ингибитора МЕК. или соединения А каждого в отдельности, то указанные соединения блокировали соответствующие эффекторы (ERK. и Akt), расположенные ниже в пути передачи сигнала. Если клетки А549 инкубировали в присутствии обоих ингибиторов, то они одновременно и эффективно блокировали оба типа пути (см. фиг.1).
Пример 3
После введения животным с привитой опухолью BN472 соединения А в дозе 10 мг/кг (перорально, 1 раз в течение 24 ч) или ингибитора Raf, Raf265 (в дозе 2,5 мг/кг, перорально, 1 раз в течение 24 ч) наблюдается слабая и статистически незначимая противоопухолевая активность (оценивали по соотношению О/К (опухоль/контроль), которое составляет 83 и 76, соответственно). Однако комбинация соединения А (10 мг/кг) и RAF265 проявляет значительную и статистически достоверную противоопухолевую активность, соотношение О/К составляет 34% (см. фиг.2). Комбинация характеризуется достаточно высокой переносимостью, так как не наблюдается снижение массы тела животных (см. фиг.3).
Пример 4
KRAS мутантные клетки PANCl имплантировали подкожно в бок голых мышей Harlan. Затем животных с привитой опухолью лечили соединениями в дозах, как указано на фиг.4. Изменение объема опухоли (А) и массы тела (Б) оценивали в течение всего курса лечения, затем в день 12 животных умерщвляли. *, р<0,05, по данным анализа ANOVA, и вторичного анализа post-hoc с использованием критерия Тьюки было установлено, что противоопухолевая активность в группе, в которой животных лечили комбинацией по изобретению, существенно отличается (синергетическое действие двух соединений) от контрольной группы и групп, в которых животных лечили каждым агентом в отдельности.
Пример 5
KRAS мутантные клетки MiaPaCa2 имплантировали подкожно в бок голых мышей Harlan. Затем животных с привитой опухолью лечили соединениями в дозах, как указано на фиг.5 и фиг.6. Изменение объема опухоли (А) и массы тела (Б) оценивали в течение всего курса лечения, затем в день 12 животных умерщвляли. *, р<0,05, по данным анализа ANOVA, и вторичного анализа post-hoc с использованием критерия Тьюки было установлено, что противоопухолевая активность в группе, в которой животных лечили комбинацией по изобретению, существенно отличается (синергетическое действие двух соединений) от контрольной группы и групп, в которых животных лечили каждым агентом в отдельности.