Результат интеллектуальной деятельности: ОТАМИКСАБАН ДЛЯ ЛЕЧЕНИЯ ИНФАРКТА МИОКАРДА БЕЗ ПОДЪЕМА СЕГМЕНТА ST У ПАЦИЕНТОВ ПОЖИЛОГО ВОЗРАСТА И ПАЦИЕНТОВ С НАРУШЕННОЙ ФУНКЦИЕЙ ПОЧЕК
Вид РИД
Изобретение
Область изобретения
Настоящее изобретение относится к лечению пациентов с выявленным инфарктом миокарда без подъема сегмента ST пожилого возраста и/или пациентов с выявленной почечной недостаточностью, с простым режимом дозирования с поправкой на вес, повышающим безопасность пациента и обеспечивающим главное клиническое преимущество.
Предпосылки по изобретению
Метиловый эфир (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты, (номер CAS 193153-04-7) обладает Международным Непатентованным названием отамиксабан и установленной структурой, представленной в формуле I:
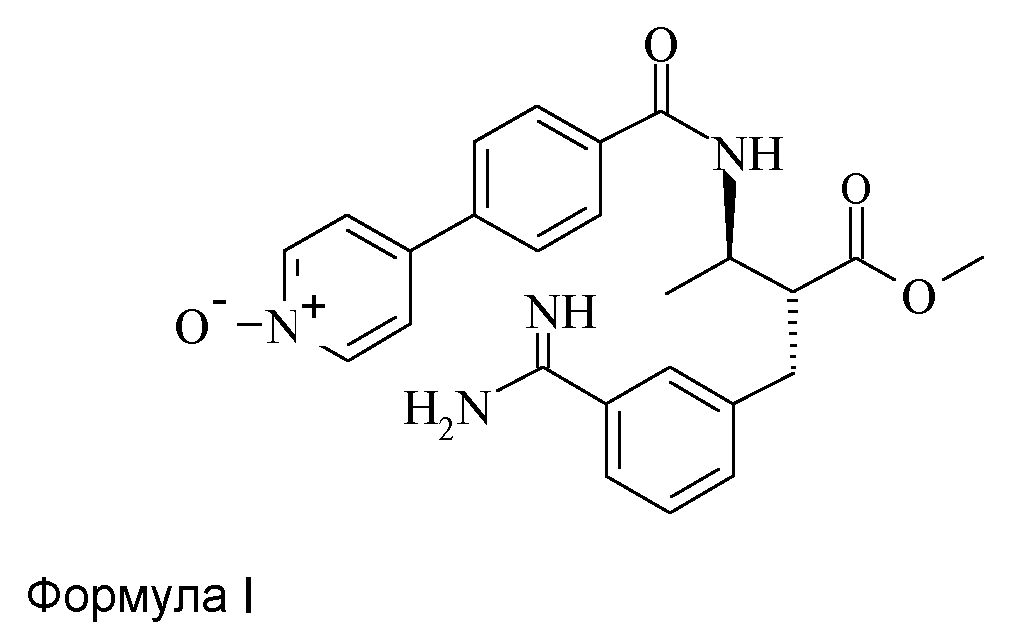
Метиловый эфир (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты (Отамиксабан, Формула I) используют в получении лекарственного средства для лечения пациентов, страдающих объектов, состояние которых улучшают посредством введения ингибитора Фактора Xa, раскрытого в WO97/24118.
Фактор Xa представляет собой предпоследний фермент в системе свертывания. Фактор Xa (фХа) является ключевой серин-протеазой, расположенной в месте слияния внешней и внутренней частей системы свертывания крови. ФХа катализирует превращение протромбина в тромбин через протромбиназный комплекс. Его исключительная роль в синтезе тромбина в совокупности с потенцирующим эффектом на образование тромба отражает его важную роль для терапевтического вмешательства.
Свободный фактор Xa и фактор Xa, связанный в протромбиназном комплексе (фактор Xa, фактор Va, кальций и фосфолипид), ингибируют посредством Отамиксабана. Ингибирования фактора Xa достигают прямым формированием комплекса между ингибитором и ферментом и, таким образом, независимо от кофактора плазмы антитромбина III. Эффективного ингибирования фактора Xa достигают посредством введения соединения либо посредством длительной внутривенной инфузии, либо болюсным внутривенным введением или любым другим парентеральным доступом, так как это приводит к желаемому эффекту предотвращения образования тромбина из протромбина, индуцированного фактором Xa. Эксперименты in vivo демонстрируют высокую эффективность Отамиксабана на моделях тромбоза у грызунов, собак и свиней. Кроме того, новейшие клинические исследования показали, что Отамиксабан эффективен, безопасен и хорошо переносится людьми и таким образом обладает множеством возможностей для лечения острого коронарного синдрома (K.R. Guertin and Yong-Mi Choi; 2007; Current Medicinal Chemistry, Vol.14, No. 23; p. 2471-2481). Клинические исследования в клинических испытаниях с целью определения оптимальной дозы показали, что Отамиксабан уменьшал фрагменты протромбина 1 + 2 достоверно больше, чем нефракционированный гепарин в режиме максимальных доз (Cohen et al., Circulation, Vol. 115, No. 20, May 2007, pages 2642-2651), но в указанных клинических исследованиях не представляли данных сравнения возраста или нарушения функции почек. Также клинические испытания показали, что Отамиксабан индуцирует быстрое прямое ингибирование фактора Xa у пациентов со стабильной ишемической болезнью сердца, принимающих их обычную терапию, с наблюдающимся у некоторых из них умеренным нарушением функции почек (Hinder et al., Clinical Pharmacology and Therapeutics, Vol. 80, No. 6, 2006, pages 691-702).
Острые коронарные синдромы (ОКС) характеризуют дисбалансом между поступлением и потреблением кислорода миокардом. Наиболее частой причиной является уменьшение перфузии миокарда в результате сужения коронарной артерии, вызванного тромбозом, развивающимся на разорванной атеросклеротической бляшке. В диагностике ОКС выделяют два основных подтипа, таких как инфаркт миокарда без подъема сегмента ST (NSTE-ACS) и инфаркт миокарда с подъемом сегмента ST (STE-MI). NSTE-ACS соответствует частичной тромботической окклюзии коронарного сосуда с более или менее выраженной ишемией. Главная цель лечения в этих условиях представляет собой предотвращение внезапной полной окклюзии артерий. STE-MI характеризуют внезапной полной тромботической окклюзией, приводящей к ишемии сердца. Это требует проведения неотложного лечения с началом в первые 6-12 часов и предпочтительно в первые 2 часа после установки диагноза. Цель представляет собой восстановление проходимости (кровотока) оклюзированного сосуда.
Для выявления пациентов с высоким риском возникновения полной окклюзии сосудов разработаны шкалы риска для перегруппировки маркеров острого тромботического процесса и других маркеров. В дополнение к оценке риска, с целью выбора предпочтительной стратегии лечения, проводят анализ сердечных биомаркеров некроза, особенно сердечных тропонинов. В течение прошлых лет было показано, что у пациентов с умеренным-высоким риском возникновения NSTE-ACS эффективна ранняя инвазивная стратегия, когда пациенты рано поступают в катетерную лабораторию (на следующие или вторые сутки) для последующего чрескожного коронарного вмешательства (ЧКВ). В новейших Американских рекомендациях по лечению пациентов с NSTE-ACS инвазивную стратегию рекомендуют пациентам с умеренным-высоким риском, тогда как у пациентов с низким риском предпочтительна консервативная стратегия. Однако своевременная доступность инвазивного лечения часто более важна для принятия решения, чем анализ риска. Кроме того, часто пожилых и слабых пациентов не лечат посредством инвазивных процедур вследствие повышенного риска кровотечения.
У всех пациентов с NSTE-ACS (с инвазивной или консервативной тактикой лечения) стандартная лекарственная терапия включает аспирин, клопидогрель и антикоагулянтную терапию. Если инвазивную тактику лечения планируют у пациентов высокого риска, представляется полезным добавление внутривенных ингибиторов GPIIb/IIIa.
Важнейшие дискуссии в медицинской литературе сегодня сфокусированы на пациентах с умеренным-высоким риском развития NSTE-ACS, которых планируют подвергнуть ранней (<48-72 час) диагностической катетеризации и коронарному вмешательству. Аспирин, клопидогрель, ингибиторы GP IIb/IIIa (включая эптифибатид и абциксимаб), нефракционированный гепарин, бивалирудин, эноксапарин, фондапаринукс рекомендованы в новейших рекомендациях, что означает их официальное признание в качестве стандарта лечения пациентов с умеренным-высоким риском развития NSTE-ACS.
Однако использование такого многоступенчатого комплексного фармакологического подхода официально не изучено и, в результате, ведет к увеличению риска развития кровотечений как осложнения, повышает сложность лечения и ведет к увеличению затрат на лечение. Также в настоящий момент эффективно использование комбинированного лечения гепарином и ингибитором GP IIb/IIIa, но это вызывает кровотечения у пациентов NSTE-ACS, получающих двойную пероральную антиагрегантную терапию аспирином и клопидогрелем. Таким образом, оптимальная антитромботическая схема лечения для пациентов с умеренным-высоким риском развития NSTE-ACS остается еще не найденной.
Также в лечении пациентов с выявленным инфарктом миокарда без подъема сегмента ST необходимо учитывать, что пациенты пожилого возраста и/или пациенты с выявленной почечной недостаточностью (в последующем пациенты с риском NSTE-ACS) нуждаются в коррекции дозы для предотвращения передозировки и кровотечения. Часто у пациентов с риском NSTE-ACS выявляют снижение совместимости при использовании лекарственных средств и повышенный риск кровотечений. Таким образом, пациентов с риском NSTE-ACS следует тщательно адаптировать к использованию антикоагулянтной терапии. Такая адаптация представляется очень опасной и легко приводит к повышению уровня смертности и повышению частоты развития инфарктов миокарда, так как нелегко предотвратить передозировку.
Целью по настоящему изобретению явилось открытие медицинского лечения, не содержащего отмеченных недостатков и обеспечивающего уменьшение количества смертей и/или инфарктов миокарда, сохраняя, по меньшей мере, одинаковое количество кровотечений в сопоставлении со стандартной терапией у пациентов с риском NSTE-ACS, которых планируют подвергнуть инвазивной терапии.
В ходе данной работы было неожиданно обнаружено, что отамиксабан обеспечивает улучшение терапии пациентов с риском NSTE-ACS. Неожиданно на терапии отамиксабаном пациенты с риском NSTE-ACS не нуждались в дополнительной адаптации режима дозирования. Пациентов с риском NSTE-ACS лечили так же, как нормальную популяцию, с режимом дозирования лишь с поправкой на вес. Также возрастала безопасность пациентов, так как не возникал риск неправильного режима дозирования. Больше не требовалось различного подхода к лечению нормальных пациентов и пациентов с риском NSTE-ACS. Это особенно полезно для пациентов пожилого возраста. Также не требовалось коррекции доз для пациентов с выявленной почечной недостаточностью (кроме коррекции с поправкой на вес, как и в нормальной популяции) и это особенно полезно у пациентов с почечной недостаточностью и тяжелой почечной недостаточностью. Также преимущество отамиксабана в коротком начальном периоде полувыведения, и, в основном, желудочно-кишечной экскреции, и прогнозируемым отношением между фармакокинетикой и фармакодинамикой.
Сущность настоящего изобретения
Настоящее изобретение относится к использованию метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли для получения лекарственного средства для применения при инфаркте миокарда без подъема сегмента ST, указанное лечение содержит введение терапевтически эффективного количества метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли человеку пациенту пожилого возраста, или с выявленной почечной недостаточностью, или с низкой массой тела, или пожилому и с выявленной почечной недостаточностью, или пожилому и с низкой массой тела, или пожилому и с выявленной почечной недостаточностью и с низкой массой тела.
Подробное описание изобретения
Таким образом, изобретение относится к использованию метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли для получения лекарственного средства для применения при инфаркте миокарда без подъема сегмента ST, указанное лечение содержит введение терапевтически эффективного количества метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли человеку пациенту старше 65 лет.
Термины, используемые в настоящем документе, обладают значениями, установленными в этой спецификации.
"Пожилой пациент (человек)" относится к пациентам в возрасте свыше 65 лет. В дополнение группа относится к пациентам в возрасте от 65 до 75 или пациентам в возрасте свыше 75 лет.
"Пациент (человек) с почечной недостаточностью" относится к пациентам с выявленным клиренсом креатинина от 30 миллилитров (мл) в минуту до 80 мл в мин; в дополнение группа пациентов с почечной недостаточностью является группой с выявленным клиренсом креатинина от 30 мл в мин до 50 мл в мин; в дополнение группа пациентов с почечной недостаточностью является группой с выявленным клиренсом креатинина от 50 мл в мин до 80 мл в мин.
"Пациент (человек) с тяжелой почечной недостаточностью" относится к пациентам с выявленным клиренсом менее чем 30 мл в мин. Однако пациенты, находящиеся на диализе, исключены из настоящего определения.
"в.в." относится к внутривенной инъекции.
"Пациенты с низкой массой тела" относится к пациентам менее чем 50 кг. В дополнение группа относится к пациентам от 30 кг до 50 кг или пациентам от 40 кг до 50 кг.
"Инфаркт миокарда без подъема сегмента ST" относится к определению инфаркта миокарда, основанного на консенсусе ACC/AHA, ESC и WHF; см. также Рекомендации для диагностики и лечения острых коронарных синдромов без подъема сегмента ST; Eur Heart J, 2007, 28(13): 1598-1660; J Am Coll Cardiol, 2007; 50:2173-2195; Eur Heart J, 2007, 28: 2525-2538.
"Отамиксабан" представляет собой международное непатентованное название метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты в качестве его хлористоводородной соли.
"Фармацевтически приемлемая соль" представляет собой любую нетоксическую неорганическую соль на основе соединения метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты. Представленные неорганические кислоты, которые образуют подходящие соли, включают такие неорганические кислоты, как соляная кислота, бромистоводородная кислота, серная кислота, фосфорная кислота и сульфаминовая кислота; и органические кислоты, такие как уксусная кислота, лимонная кислота, молочная кислота, винная кислота, малоновая кислота, метансульфоновая кислота, этансульфоновая кислота, бензолсульфоновая кислота, п-толуолсульфоновая кислота, циклогексилсульфаминовая кислота, хинная кислота и т.п. Предпочтительно соль присоединения кислоты получают из неорганической кислоты, предпочтительно из соляной кислоты.
"TIMI" представляет собой аббревиатуру для "Тромболизис при инфаркте миокарда" и относится к классификации кровотечений.
"Терапевтически эффективное количество" означает количество соединения, эффективное для лечения упомянутого нарушения или состояния.
"Лечить" или "лечение" означает любое лечение, включая в качестве неограничивающих примеров облегчение симптомов, устранение причины симптома как на временной, так и на постоянной основе, или предотвращение или замедление появления симптомов и прогрессирования названного нарушения или состояния.
Синтез метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты описали и проводили способами, хорошо известными специалистам в данной области. Например, в Международной Заявке WO97/24118 описаны способы получения.
В дополнительном варианте осуществления изобретение относится к использованию метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли для получения лекарственного средства для применения при лечении инфаркта миокарда без подъема сегмента ST, включая введение терапевтически эффективного количества метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли человеку пациенту старше 65 лет и с выявленной почечной недостаточностью.
В дополнительном варианте осуществления изобретение относится к использованию метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли для получения лекарственного средства для применения при лечении инфаркта миокарда без подъема сегмента ST, включая введение терапевтически эффективного количества метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли человеку пациенту с выявленной почечной недостаточностью.
В дополнительном варианте осуществления изобретение относится к использованию метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли для получения лекарственного средства для применения при лечении инфаркта миокарда без подъема сегмента ST, включая введение терапевтически эффективного количества метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли человеку пациенту с выявленной тяжелой почечной недостаточностью.
В дополнительном варианте осуществления изобретение относится к использованию метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли для получения лекарственного средства для применения при лечении инфаркта миокарда без подъема сегмента ST, включая введение терапевтически эффективного количества метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли человеку пациенту массой тела менее чем 50 кг.
В дополнительном варианте осуществления изобретение относится к использованию метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли для получения лекарственного средства для применения при лечении инфаркта миокарда без подъема сегмента ST, включая введение терапевтически эффективного количества метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли человеку пациенту массой тела от 30 кг до 50 кг.
В дополнительном варианте осуществления изобретение относится к использованию метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли для получения лекарственного средства для применения при лечении инфаркта миокарда без подъема сегмента ST, включая введение терапевтически эффективного количества метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли человеку пациенту массой тела от 40 кг до 50 кг.
В дополнительном варианте осуществления изобретение относится к метиловому эфиру (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли для применения в лечении инфаркта миокарда без подъема сегмента ST, указанное лечение включает введение метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли человеку пациенту старше 65 лет.
В дополнительном варианте осуществления изобретение относится к метиловому эфиру (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли для применения в лечении инфаркта миокарда без подъема сегмента ST, указанное лечение включает введение метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли человеку пациенту старше 65 лет и с выявленной почечной недостаточностью.
В дополнительном варианте осуществления изобретение относится к метиловому эфиру (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли для применения в лечении инфаркта миокарда без подъема сегмента ST, указанное лечение включает введение метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли человеку пациенту с выявленной почечной недостаточностью.
В дополнительном варианте осуществления изобретение относится к метиловому эфиру (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли для применения в лечении инфаркта миокарда без подъема сегмента ST, указанное лечение включает введение метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли человеку пациенту с выявленной тяжелой почечной недостаточностью.
В дополнительном варианте осуществления изобретение относится к метиловому эфиру (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли для применения в лечении инфаркта миокарда без подъема сегмента ST, указанное лечение включает введение метилового эфира (2R,3R)-2-(3-карбамимидоилбензил)-3-[4-(1-оксипиридин-4-ил)бензоиламино]масляной кислоты или его фармацевтически приемлемой соли человеку пациенту с низкой массой тела.
Относительное количество отамиксабана и кислоты в соли колеблется и зависит, например, от особенностей выбранной кислоты и способов приготовления соли. Предпочтительно, соли по настоящему изобретению включают приблизительно один эквивалент кислоты для приблизительно каждого эквивалента отамиксабана.
Соли присоединения кислот отамиксабана получают посредством растворения в водном или водно-спиртовом растворе, или другом подходящем растворителе, содержащем соответствующую кислоту или с добавлением соответствующей кислоты, и выделяют соль посредством испарения раствора или посредством реакции свободного основания и кислоты в органическом растворителе, когда непосредственно выделяют соль и/или получают посредством концентрации раствора.
В основном во взрослой популяции подходящие дозы находятся в пределах от 0,7 мг/кг массы тела/час до 1,4 мг/кг массы тела/час. В дополнение подходящие дозы находятся в пределах от 0,8 мг/кг массы тела/час до 1,2 мг/кг массы тела/час. Также подходящей дозой, уравновешивающей безопасность пациента и эффективность, является доза, близкая к 0,1 мг/кг массы тела/час после в./в. болюсного введения приблизительно 0,08 мг/кг массы тела.
В основном во взрослой популяции, подходящие дозы колеблются от 0,07 мг/кг массы тела/час до 0,14 мг/кг массы тела/час. В дополнение подходящие дозы находятся в пределах 0,08 мг/кг массы тела/час до 0,12 мг/кг массы тела/час.
Стерильные растворы для парентерального введения получают посредством введения отамиксабана в необходимом количестве в соответствующий растворитель с различными другими ингредиентами, перечисленными в настоящем документе, как необходимо, сопровождая использованием стерилизации посредством фильтрации. В основном дисперсии получают посредством введения стерильного активного ингредиента в стерильный носитель, содержащий деспергирующую среду и любые другие необходимые ингредиенты. В случае стерильных порошков для получения стерильных растворов для парентерального введения предпочтительные способы получения включают процедуру вакуумной сушки и лиофилизации, когда вырабатывают порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из вышеуказанного, стерильно отфильтрованного раствора.
Жидкие композиции также содержат другие компоненты, обычно используемые в разработке рецептуры фармацевтической композиции. Один пример такого компонента представляет собой лецитин. Его используют в композиции по изобретению в качестве эмульгатора в пределах приблизительно от 0,05 до приблизительно 1% по массе, а все комбинации и субкомбинации пределов и заданных количеств в вышеуказанном. Более предпочтительно использование эмульгаторов в количестве, приблизительно равном от 0,1 до приблизительно 0,5% по массе. Другими примерами компонентов, используемых в качестве антимикробных консервантов, являются: бензойная кислота или парабены; суспендирующие средства, такие как коллоидный диоксид кремния; антиоксиданты; местные пероральные анестетики; ароматизаторы; и красители.
Отбор таких необязательных компонентов и их уровень использования в композиции по изобретению представлен в пределах уровня квалификации в данной области и в более полной мере оценен в демонстрационных примерах, предоставленных далее в настоящем документе.
Подходящими носителями для парентеральных растворов являются, в основном, вода, подходящее масло, физиологический раствор, водная декстроза (глюкоза) и связанные растворы сахара и гликолей, таких как пропиленгликоль или полиэтиленгликоль. Растворы для парентеральных растворов получают посредством растворения отамиксабана в носителе и, при необходимости, добавления буферных веществ. Антиоксиданты, такие как бисульфит натрия, сульфит натрия или аскорбиновая кислота как по отдельности, так и в комбинации, являются подходящими стабилизирующими агентами. Также используют лимонную кислоту и ее соли, и натрий ЭДТА. Парентеральные растворы также содержат консерванты, такие как бензалконий хлорид, метил- или пропил-парабен и хлорбутанол.
Подходящие фармацевтические лекарственные формы для введения отамиксабана представлены следующим образом:
Суспензии
Водную суспензию получают для перорального введения таким образом, что каждые 5 мл содержат 25 мг окончательно разведенного активного ингредиента, 200 мг карбоксиметилцеллюлозы натрия, 5 мг бензоата натрия, 1,0 г раствора сорбита, U.S.P. и 0,025 мг ванилина.
Инъецируемое лекарственное средство
Парентеральную композицию, подходящую для введения посредством инъекции, получают посредством перемешивания 1,5% по массе активного ингредиента в 10% по объему пропиленгликоля и воды. Раствор стерилизуют посредством широко используемых процедур.
Следующие неограничивающие примеры представляют собой способы для приготовления и использования фармацевтической композиции по настоящему изобретению, предпочитаемые авторами.
ПРИМЕРЫ
Пример 1 - Получение соединения (III)
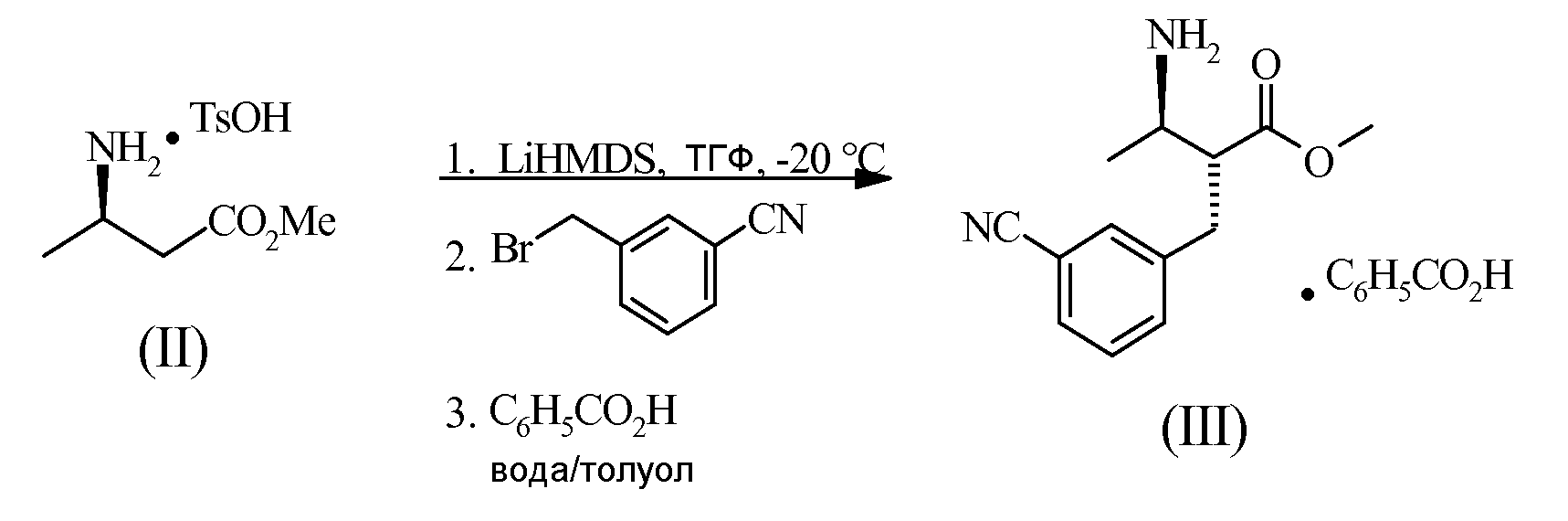
TsOH представляет собой п-толуолсульфоновую кислоту с формулой CH3CeH4SO3H. TsOH относится к моногидрату. В химический реактор помещали Соединение (II) (100,0 г) и безводный тетрагидрофуран (ТГФ) (320 г). Полученную в результате суспензию охлаждали до -20±3°C и добавляли литий гексаметилдисилазид (LiHMDS) (475,6 грамм, 1,3 M раствора в ТГФ) на 55 минут и перемешивали в течение 20 минут при температуре -20±3°C. Раствор α-бромо-м-толунитила в ТГФ (65,1 г в 181 г ТГФ) затем помещали в химический реактор на 40 минут, поддерживая на тот момент температуру, равную -20±3°C, и перемешивали последующие 30 минут. Твердую бензойную кислоту (126,6 грамм) погружали в химический реактор. Затем добавляли воду (1000 г) и смесь дистиллировали при температуре в рубашке, равной 65±3°C, и вакууме, равном 200-233 мбар. После дистилляции до постоянной температуры сосуда, равной 57°C, и постоянной температуры верхней части, равной 45°C, дистилляцию прекращали. Толуол (432 г) добавляли в горячий раствор и перемешивали до охлаждения до температуры, равной 10±2°C. Полученную в результате суспензию фильтровали, а осадок на фильтре заливали водой (250 грамм) и толуолом (432 грамма). Соединение (III) сушили при температуре, равной 45-50°C, и вакууме, равном -350 мбар, под потоком азота в течение 24 часов до получения постоянной массы. Вес выделенного твердого вещества составил 76,0 грамм (62,0% выработки продукта).
Пример 2 - Получение соединения (V)
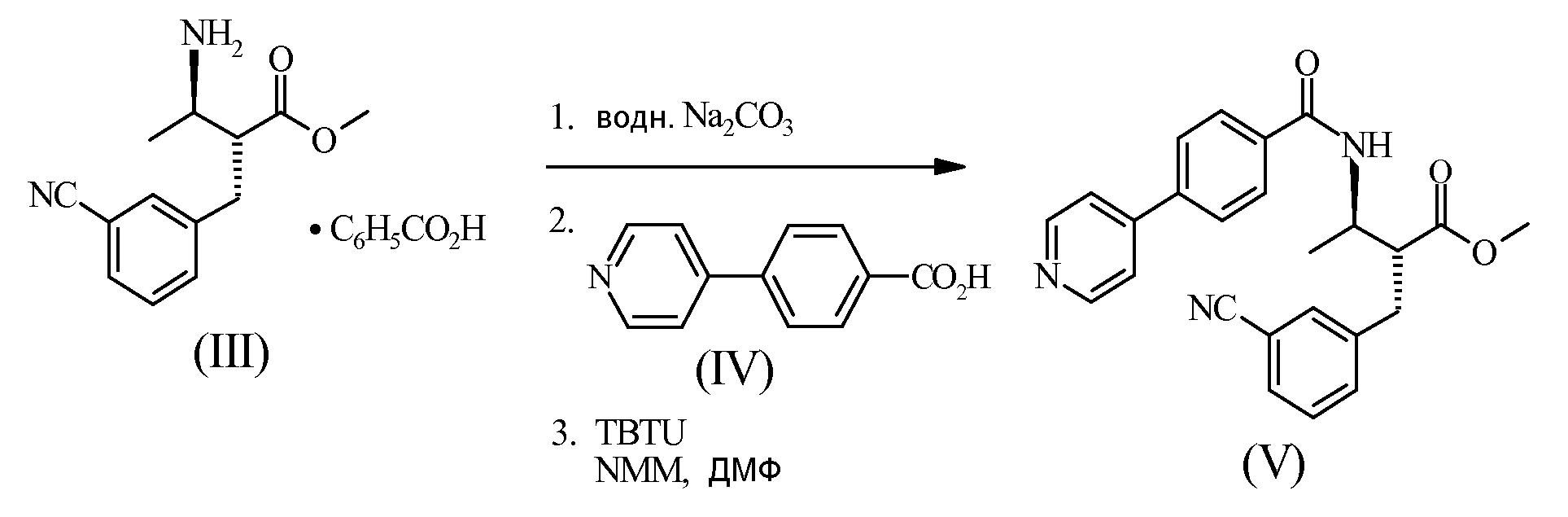
Соединение (III) разделяли между дихлорметаном и водным карбонатом натрия. Органическую фазу (содержащую свободное основание (III)) отмывали путем добавления водного карбоната натрия и дистиллировали при сниженном давлении, а растворитель заменяли диметилформамидом (ДМФ). Этот раствор анализировали на масс./масс. содержание (III). К суспензии из (IV) (1,0 эквивалентен vs. (III)) в ДМФ добавляли 2 эвивалента 4-метилморфолина и 1,1 эквивалента O-бензтриазол-1-ил-N,N,N',N'-тетраметилурониума тетрафторбората (ТБТУ). Эту смесь перемешивали при температуре окружающей среды до завершения активации сложного эфира (приблизительно 90 минут). ДМФ раствор соединения (III) (1 эквивалент) добавляли и полученный в результате раствор перемешивали в течение ночи, после чего ВЭЖХ указывал на завершение реакции. При температуре, равной 75°C, добавляли воду и охлаждали смесь до кристаллизации продукта. Смесь охлаждали до 5°C, фильтровали и осадок на фильтре отмывали водой. Продукт сушили при пониженном давлении при 70°C.
Пример 3 - Получение соединения (VI)
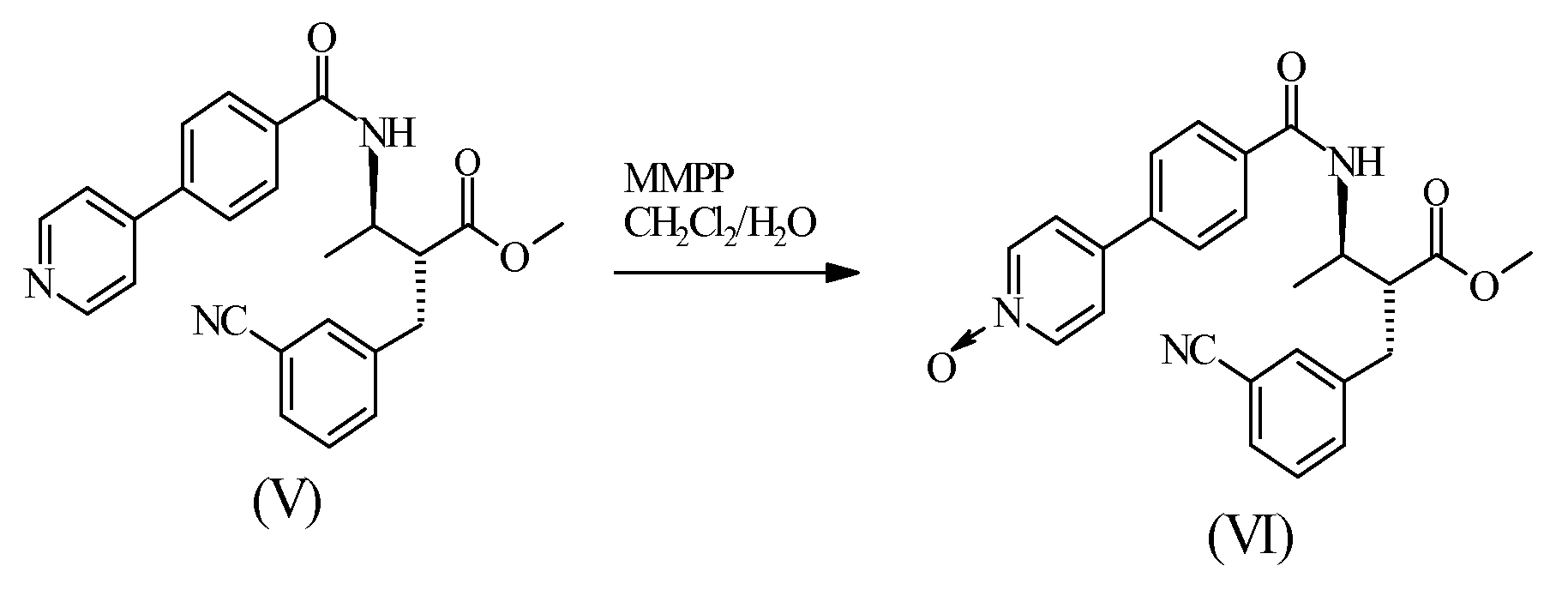
В хорошо перемешивающем химическом реакторе 45 г соединения (V) в 450 мл дихлорметана вступали в реакцию с 61 г магний монопероксифталата в течение по меньшей мере 5 часов (66,4% основан на доступном кислороде, 1,5 экв.) в 450 г воды до полного завершения реакции. Фазы разделяли и органическую фазу отмывали последовательно равными объемами воды, 5% водного раствора бикарбоната натрия и воды. Полученный в результате раствор концентрировали до приблизительно 40% массы раствора и разводили в 180 г метил изобутил кетона (МИБК). Дальнейшая дистилляция для удаления остатков дихлорметана, отбор соответствующих кристаллов и охлаждение позволили получить в качестве продукта прозрачное твердое тело. Кристаллы фильтровали, промывали 30 г МИБК и сушили при температуре, равной 50°C, при пониженном давлении для получения 41,8 г соединения (VI) (89,3% выработки продукта).
Пример 4 - Получение Соединения (I)
В медицинскую склянку с рубашкой объемом 200-мл помещали соединение (VI) (50,0 г, 116 ммоль) и метанол (50 мл). Эту смесь охлаждали до -5°C и запечатывали после установления частичного вакуума (приблизительно 100 торр). Добавляли безводную соляную кислоту (52,2 г, 1,43 моль), поддерживая на тот момент температуру реакции менее 0°C. Реакцию перемешивали при температуре 0±1°C в закрытых условиях. Через 16 часов реакция была завершена (менее чем 2 A% (VI) посредством ВЭЖХ). К промежуточному соединению произведенного раствора добавляли безводный метанол (100 мл), поддерживая на тот момент температуру менее чем 5°C. Раствор обрабатывали NH3 (27,7 г, 1,62 моль), поддерживая температуру менее чем 0°C. Перед нагреванием смеси до комнатной температуры выполняли контроль уровня pH по аликвотной пробе, растворенной в воде DI (уровень pH, равный 8-10, указывает на достаточную дозу аммиака). Реакцию перемешивали при 20°C в течение ночи до точки полного завершения реакции.
Пример 5
Следующие результаты основаны на рандомизированном, двойном слепом, контролируемом с помощью трех плацебо исследовании по сравнению отамиксабана с нефракционированным гепарином + эптифибатидом у пациентов с нестабильной стенокардией/инфарктом миокарда без подъема сегмента ST, которых планируют подвергнуть ранней инвазивной тактике лечения.
Исследуемая популяция:
Пациенты с острым коронарным синдромом без подъема сегмента ST со следующими симптомами:
Ишемический дискомфорт (т.е. ишемическая боль в груди или ее эквивалент), сохраняющийся без изменений ≥10 минут не позднее 24 часов от рандомизации
и
один из двух следующих критериев ОКС без подъема сегмента ST:
Вновь возникшая депрессия сегмента ST ≥0,1 мВ (≥1 мм), или приходящая (<30 минут) элевация сегмента ST ≥0,1 мВ (≥1 мм) в по меньшей мере 2 смежных отведениях на ЭКГ, ИЛИ повышение уровня сердечных биомаркеров не позднее 24 часов от рандомизации, оцененное как повышение уровня тропонина Т, тропонина I или КК-МВ выше верхней границы нормы
и
планируемое проведение коронарной ангиографии (далее обозначаемой как чрескожное коронарное вмешательство (ЧКВ)) в период от сутки 1 (сутки рандомизации) до сутки 3
и
полученное письменное информированное согласие
Исследуемые препараты:
Отамиксабан/плацебо;
НФГ/плацебо;
эптифибатид/плацебо
Состав: в.в. раствор
Способ(ы) введения: Внутривенно: болюсно (Бол) с последующей продолжительной инфузией (И)
Режим дозирования:
Группа отамиксабана: (Бол) 0,080 мг/кг (И) 0,035 мг/кг/час или 0,070 мг/кг/час, или 0,105 мг/кг/час, или 0,175 мг/кг/час
Если пациенту необходимо проведение аорто-коронарного шунтирования (АКШ), слепое лечение лекарственным средством (отамиксабан/плацебо) приостанавливали на неопределенный срок, и, если возможно, прием лекарственного средства B (НФГ/плацебо) приостанавливали по меньшей мере за 6 часов до хирургического вмешательства. Пациента следовало лечить в соответствии с обычными стандартами ведения пациентов.
Препараты сравнения: НФГ + эптифибатид
НФГ: 60 МЕ/кг в/в болюсно (максимально 400 МЕ) с последующей в/в инфузией в дозе 12 Ед/кг/час (максимально 1000 Ед/час), с контролем частичного тромбопластинового времени (ЧТВ) от 1,5 до 2,0 раз и добавлением болюсов во время длительной инфузии (PCI), если активное время свертывания (АВС) не находится в диапазоне 200-250 секунд. NB: Для исследования все показатели АЧТВ и АВС, представленные для подбора дозы лекарственного средства B (НФГ/плацебо), будут представлены с использованием шифровального прибора Hemochron Signature Elite (или как резервная копия, местное устройство с участием независимого, выведенного из слепого метода, работника здравоохранения).
Эптифибатид: однократно болюсно 180 мкг/кг с последующей инфузией в дозе 2 мкг/кг/мин. У пациентов с КлКр <50 мл/мин скорость инфузии снижали до 1 мкг/кг/мин.
Неотложное введение эптифибатида:
В группе отамиксабана: однократно болюсно эптифибатид (180 мкг/кг) с последующей инфузией эптифибатида без контроля плацебо.
В группе НФГ+эптифибатид: однократно болюсно введение эптифибатид с последующей инфузией эптифибатида без контроля плацебо.
В обеих группах:
- прекращали инфузию лекарственного средства C (эптифибатид/плацебо).
- скорость инфузии эптифибатида без контроля плацебо составила 2 мкг/кг/мин (у пациентов с КлКр <50 мл/мин скорость инфузии снижали до 1 мкг/кг/мин).
Первичная конечная точка: установление совокупности всех причин смерти и вновь возникшего инфаркта миокарда (ИМ) в течение 7 суток, следующих за рандомизацией
Вторичные конечные точки
- Установление совокупности всех причин смерти и вновь возникшего инфаркта миокарда (ИМ) в течение 30 суток, следующих за рандомизацией
- Установление совокупности всех причин смерти в течение 30 суток, следующих за рандомизацией
Безопасность:
- Несвязанные с АКШ значимые (крупные + небольшие) кровотечения TIMI устанавливали при помощи Комитета по клиническим исследованиям (CEAC) на 7 сутки.
- Несвязанные с АКШ крупные кровотечения устанавливали при помощи Комитета по клиническим исследованиям (CEAC) на 7 сутки.
- Связанные с АКШ кровотечения устанавливали при помощи Комитета по клиническим исследованиям (CEAC) на 7 сутки.
- Крупные кровотечения TIMI (связанные и не связанные с АКШ) устанавливали при помощи Комитета по клиническим исследованиям (CEAC) на 7 сутки.
- Небольшие кровотечения TIMI устанавливали на 7 сутки
- При обозначенных ЧКВ устанавливали тромботические и нетромботические осложнения (включая внезапное закрытите или его угрозу, вновь возникшие интракоронарные тромбозы, закрытие боковых ветвей, дистальная эмболия, феномен "невосстановленного кровотока", тромбоз катетера или присоединения к проводнику, коронарная диссекция со снижением кровотока, трудность доступа или пересеченное поражение, незапланированное использование стента, субоптимальные результаты, перфорация коронарных артерий, тампонада). Все вышеуказанные события устанавливали при помощи Независимого оценочного комитета.
Конечная точка эффективности:
События устанавливали при помощи независимого оценочного комитета. Так как целью лечения острого ОКС без постоянного подъема сегмента ST является предотвращение ассоциированной с ним заболеваемости и смертности, смерть и инфаркт миокарда считают наиболее значимой конечной точкой в терапевтических исследованиях, тогда как рецидивирующая ишемия или рефрактерная стенокардия представляют наиболее сомнительное клиническое значение (EMEA/CPCP/EWP/570/98; февраля 2008).
Первичную конечную точку определяли как двойную конечную точку клинической эффективности (все случаи смерти и инфаркта миокарда основаны на точно установленных данных), что анализировали на 7 сутки. В дальнейшем, для контроля стойкости эффекта, оценку этой конечной точки проводили на 30 сутки, 90 сутки и 180 сутки (окончание наблюдения), как рекомендовано в рекомендациях EMEA (EMEA/CPCP/EWP/570/98; Feb. 2008).
Определение первичной эффективности компонентов
Так как классификация способа смерти иногда представляет трудность, предпочтительным и более консервативным подходом к анализу смерти в клинических испытаниях является анализ всех причин смертности (например, считая все смертельные случаи, независимо от причины). В качестве компонента комбинированной эффективной конечной точки все причины смертности предоставляют очень ценную информацию о клинической значимости нового лекарственного средства.
Инфаркт миокарда
Инфаркт миокарда считают объективным компонентом конечной точки эффективности, подтверждающим клиническое испытание. Определение инфаркта миокарда основано на консенсусе ACC/AHA, ESC и WHF (J Am Coll Cardiol, 2007; 50:2173-2195; Eur Heart J, 2007, 28: 2525-2538.):
Для соответствия критериям инфаркта миокарда конечной точки, инфаркт миокарда должен отличаться от указанных событий.
Описаны четыре ситуации:
- Пациентов с отсутствием документированного повышения биомаркеров в течение по меньшей мере 12 часов после последнего эпизода ишемии или с документированной нормализацией биомаркеров после указанного события, относили к их указанной выборке,
- Пациенты со значимым повышением биомаркеров из-за указанного события во время начала возможного нового ИМ,
- Пациентов с отсутствием повышения биомаркеров, но интервалом времени с момента последнего эпизода ишемии менее чем 12 часов, относили к их указанной выборке,
- В течение 48 часов после ЧКВ
- В течение 72 часов после АКШ
Примечание: оптимальным тестом для диагностики ИМ является определение тропонина (I или T). Если проведение анализа тропонина не представляется возможным, наилучшей альтернативой является определение уровня ККМВ (определенного посредством анализа массы). Определение уровня общей КК не рекомендуют для диагностики ИМ.
Обоснование выбора группы сравнения и продолжительности лечения
Группа сравнения:
В рекомендациях пациентам с умеренным-высоким риском UA/NSTEMI с оказанным раним инвазивным вмешательством (Eur Heart J, 2007, 28(13): 1598-1660) рекомендовано лечение антикоагулянтами, и пероральными (аспирин±клопидогрель) и парентеральными (ингибиторы GPIIb/IIIa) антиагрегантными средствами.
Выбор антикоагулянта:
НФГ представляет собой единственный антикоагулянт, рекомендованный и Европейскими и Североамериканскими Рекомендациями со степенью доказательности IA, что отлично от степени доказательности эноксапарина (IIb в Европейских рекомендациях и Ia в Североамериканских рекомендациях). Доза НФГ также рекомендована в рекомендациях (Eur Heart J, 2005, 26: 804-847).
Выбор ингибитора GPIIb/IIIA основан на времени введения и на использовании ингибитора GPIIb/IIIa в текущей практике. В соответствии с рекомендациями немедленно начинают лечение ингибитором GPIIb/IIIa в случае умеренно-высокого риска по образцу эптифибатида или тирофибана (Eur Heart J, 2007, 28(13): 1598-1660).
Эптифибатид используют более широко, чем тирофибан (Агграстат®) и использовали в этом исследовании согласно апробированной до начала лечения схеме. Эптифибатид назначали в качестве апробированного маркера (режим дозирования и продолжительность лечения).
Продолжительность лечения:
Продолжительность лечения была такой же как в фазе 2 (SEPIA ACS):
- Ангиографию/ЧКВ производили по меньшей мере после 2 часов от начала исследования лекарственного средства (отамиксабан/НФГ) и максимально на Сутки 3 (Сутки 1 = суткам рандомизации)
- В соответствии с рекомендациями ACC/ESC инфузию НФГ и отамиксабана останавливали в конце ЧКВ (Eur Heart J, 2005, 26: 804-847), за исключением случаев, когда антикоагулянт являлся показанным (возвратная ишемия, фибрилляция предсердий или тромбоз левого желудочка)
- Максимальная продолжительность лечения отамиксабаном/НФГ (Лекарственное средство A/B) составило 96 часов и их не назначали после Суток 4.
- Эптифибатид (Лекарственное средство C) продолжали вводить в течение 18-24 час после ЧКВ или выписки из больницы, независимо от того, что происходило сначала (с максимумом лечения до 96 часов - в соответствии этому маркеру) и не назначали после Суток 4.
В табл.1 представлены результаты эффективности у пожилых пациентов.
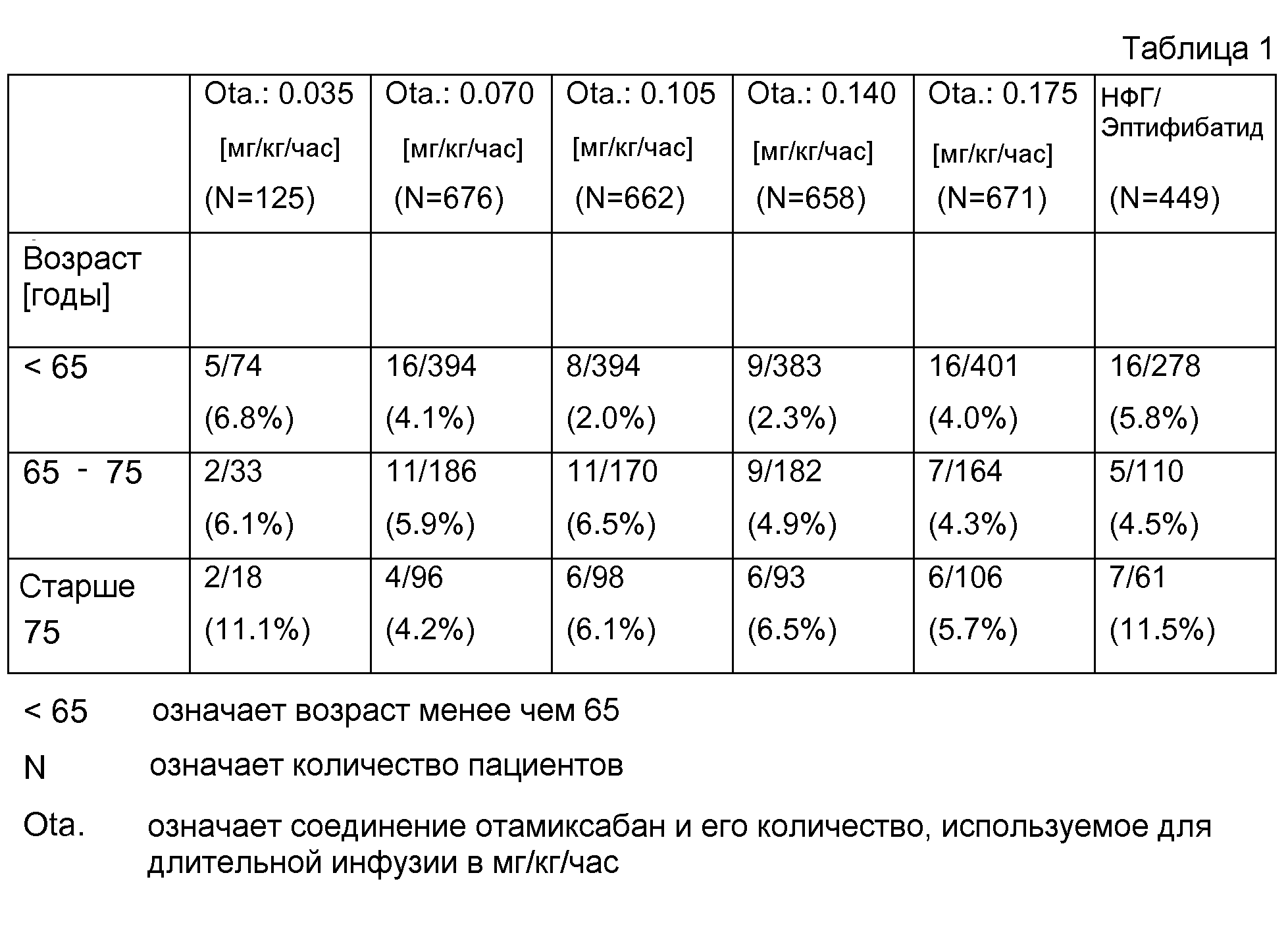
Результаты, например, в случае 5/74 (6,8 %) выявили, что в группе 74 пациента в возрасте менее чем 65 лет и что у 5 пациентов выявлена конечная точка исследования. В скобках представлено количество пациентов, достигших конечной точки в сравнении с общим количеством пациентов этой возрастной группы.
В табл.2 представлены результаты безопасности у пожилых пациентов, с выявленным в течение 7 суток кровотечением.
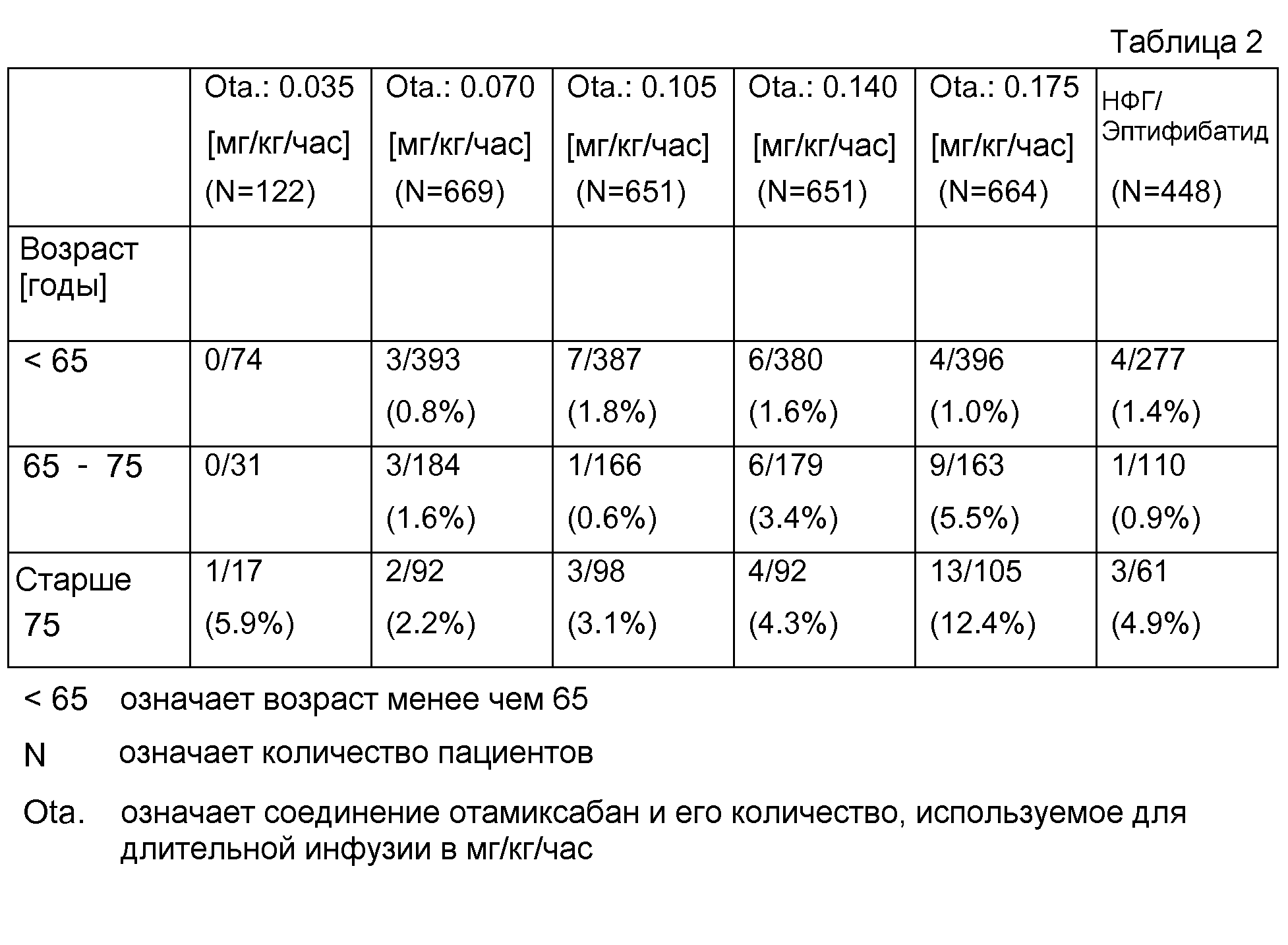
Результаты в случае, например, 3/393 (0,8 %) выявили, что в группе 393 пациента менее чем 65 лет и что у 3 пациентов выявлено кровотечение. В скобках представлено количество пациентов с кровотечением в сравнении с общим количеством пациентов этой возрастной группы.
В табл.3 представлены результаты безопасности у пациентов с почечной недостаточностью.
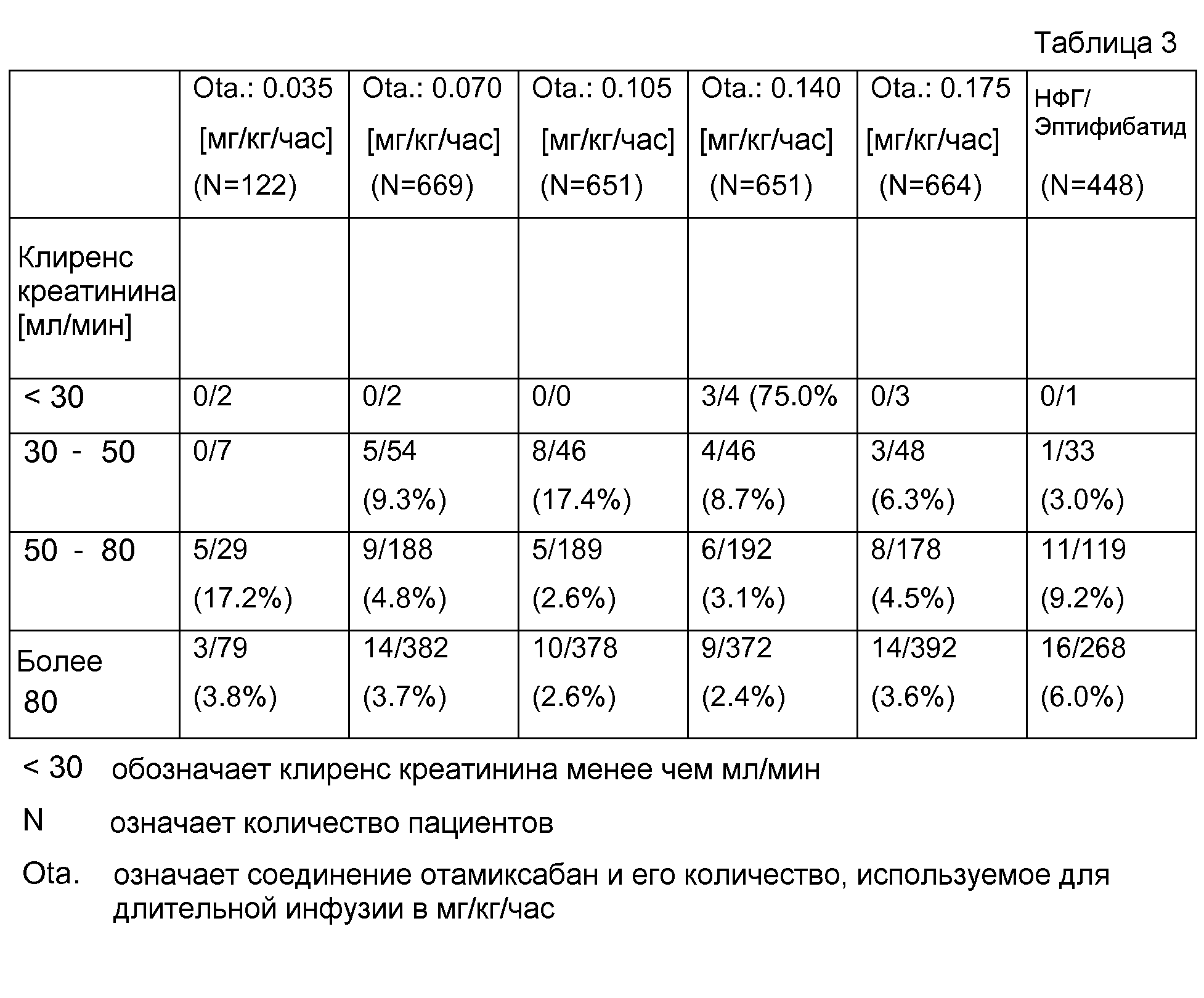
Результаты, например, в случае 5/54 (9,3 %) выявили, что в группе с клиренсом креатинина от 30 до 50 мл/мин 54 пациента и что у 5 пациентов выявлена конечная точка исследования. В скобках представлено количество пациентов, достигших конечной точки в сравнении с общим количеством пациентов этой возрастной группы.
В табл.4 представлены результаты безопасности у пациентов с почечной недостаточностью, с выявленным в течение 7 суток кровотечением.
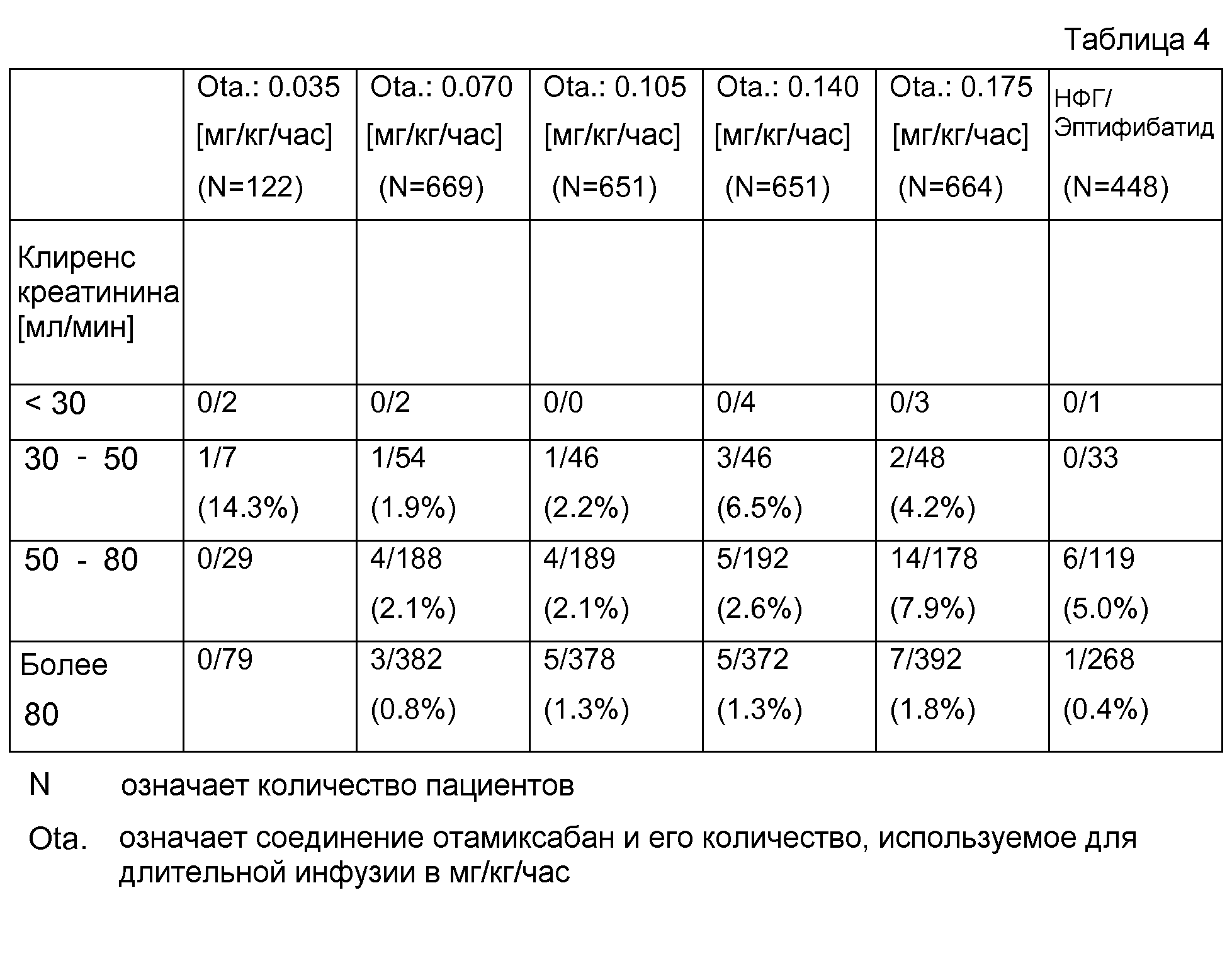
Результаты, например, в случае 4/188 (2,1 %) выявили, что в группе с клиренсом креатинина от 50 до 80 мл/мин 188 пациентов и что у 4 пациентов выявлено кровотечение. В скобках представлено количество пациентов с кровотечением в сравнении с общим количеством пациентов этой возрастной группы.
Выявленные клинические данные основаны на первичной конечной точке эффективности, первичной конечной точке безопасности и частоте тромботических осложнений:
Основываясь на частоте оказания неотложной помощи и тромботических осложнений, режим лечения отамиксабаном в дозах 0,035 мг/кг/час и 0,070 мг/кг/час (режим лечения в дозах 1 и 2) создает неадекватную антикоагуляцию.
Частота первичных конечных точек при режиме лечения отамиксабаном в дозах от 0,105 до 0,175 мг/кг/час (режим лечения в дозах от 3 до 5) проявлялась в 31-41%, ниже чем при лечении НФГ + эптифибатид. Это преимущество, главным образом, оценивали в снижении смерти и инфарктов миокарда (ИМ) (снижение от 42% до 48%), с отсутствием очевидного эффекта на снижение частоты неотложной реваскуляризации или необходимости неотложной помощи.
Режим лечения отамиксабаном в дозе 5 приводил к учащению значимых кровотечений ТИМИ.
По сравнению с UFH+эптифибатидом, риск кровотечения при режиме лечения 3 ассоциировали с количественно более высокой частотой крупных кровотечений TIMI, минимальных кровотечений TIMI, но снижением частоты небольших кровотечений TIMI (для пациентов без крупных кровотечений TIMI).
Оптимальные, сбалансированные по эффективности и безопасности дозы отамиксабана являются дозы между режимом лечения 2 (0,070 мг/кг/час) и режимом лечения 3 (0,105 мг/кг/час).
Анализ подгрупп произведен и представлен последовательностью клинических результатов в пределах демографических подгрупп (возраст, пол), согласно исходному уровню параметров (клиренс креатинина, масса тела) и способу лечения острого коронарного синдрома (инвазивный: ЧКВ или АКШ, или терапевтический).
Анализ кровотечений между подгруппами (возраст, исходный уровень клиренса креатинина, масса тела) не выявил какого-либо повышения частоты кровотечений у пожилых пациентов, пациентов с почечной недостаточностью или низкой массой тела.
Учитывая факт наличия большего количества тромботических осложнений при дозе 2, чем 3, и что тромботические осложнения вызывают серьезное беспокойство (с потенциальным воздействием на первичную конечную точку эффективности по причине смерти плюс ИМ - в фазе 3), предпочтительной дозой, по-видимому, является 0,1 мг/кг/час (ближе к дозе 3).
Для выявления возможности приспособления этой дозы в подгруппах пациентов (пожилые пациенты, пациенты с почечной недостаточностью и пациенты с низкой массой тела) в этих подгруппах произвели фармакокинетический анализ:
- в основном наблюдали отсутствие влияния возраста, клиренса креатинина или массы тела на концентрацию отамиксабана, исключая дозу 4, когда наблюдали повышение концентрации у пациентов с почечной недостаточностью и у пожилых пациентов, но подобных изменений не наблюдали в других группах доз, таким образом, вероятнее всего это обусловлено случайностью.
Заключением этого фармакокинетического анализа подгрупп привело к отбору дозы, приблизительно равной 0,1 мг/кг/час, не требующей коррекции у пожилых пациентов, пациентов с почечной недостаточностью и пациентов с низкой массой тела.

