Результат интеллектуальной деятельности: ФУРИЛИДЕНФУРАНОНОВЫЕ ПРОИЗВОДНЫЕ УСНИНОВОЙ КИСЛОТЫ КАК НОВЫЕ ПРОТИВОТУБЕРКУЛЕЗНЫЕ АГЕНТЫ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к фармацевтической химии и касается производных усниновой кислоты, содержащих фурилиденфураноновый фрагмент. Указанные соединения могут быть использованы в качестве веществ, активных в отношении Mycobacterium tuberculosis.
Уровень техники
Повышение эффективности лечения больных туберкулезом - важнейшая социальная задача в России и мире. Ежегодно эти заболевания уносят более 2 миллионов жизней. Улучшение результатов лечения туберкулеза зависит от развития современной фармацевтики, главным в котором является разработка новых технологических подходов к созданию новых лекарственных средств путем воздействия на мишени, важные для жизнедеятельности возбудителя туберкулеза - Mycobacterium tuberculosis. Одной из причин трудности лечения туберкулеза является массовое возникновение множественной лекарственной устойчивости (МЛУ или MDR - Multiple Drug Resistance) у возбудителя туберкулеза, как к традиционным противотуберкулезным лекарствам так называемого первого ряда (особенно к рифампицину и изониазиду), так и к препаратам второго ряда (фторхинолонам и аминогликозидам) (Zhang Y, Yew WW. Mechanisms of drug resistance in Mycobacterium tuberculosis. // Int J Tuberc Lung Dis. 2009 Nov; 13(11). P.1320-30; Chiang CY, Centis R, Migliori GB. Drug-resistant tuberculosis: past, present, future. Respirology. 2010 Apr; 15(3). P.413-432). Среди устойчивых штаммов особенно опасны штаммы с широкой лекарственной устойчивостью (ШЛУ или XDR - Extensively Drug-Resistant); они устойчивы к 4-9 препаратам первого и второго ряда. Поэтому преодоление проблем, стоящих перед фтизиатрией в связи с появлением MDR, является задачей первостепенной важности (Tomioka H. Prospects for the development of new antituberculous drugs putting our hopes on new drug targets. Kekkaku. 2010; 85(11):815-22, Shi R, Sugawara I. Development of new anti-tuberculosis drug candidates. Tohoku J Exp Med. 2010; 221(2):97-106; Koul A, Arnoult E, Lounis N, Guillemont J, Andries K The challenge of new drug discovery for tuberculosis. Nature. 2011. V.469(7331): P.483-90; Прозоров А.А., Зайчикова М.В., Даниленко В.Н. Мутанты Mycobacterium tuberculosis с множественной лекарственной устойчивостью: история появления, генетические и молекулярные механизмы устойчивости, возникающие проблемы / Генетика. 2012. Т.48. №1. С.5-20; Butler MS, Cooper MA. Antibiotics in the clinical pipeline in 2011. J Antibiot (Tokyo). 2011 Jun; 64(6). P.413-25).
Сформулирована необходимость разработки новых кандидатов в лекарства, в первую очередь полусинтетических, на базе природных веществ новых классов, показавших в предыдущих исследованиях новый механизм действия и прошедших исследования на безопасность для человека. Природная усниновая кислота ранее использовалась в качестве противотуберкулезного препарата, однако ее недостатками являются относительно низкая эффективность по сравнению с существующими препаратами первого ряда и низкая водорастворимость. Ранее были описаны кватернизованные производные усниновой кислоты с модификацией кольца С молекулы, проявляющие большую, чем нативные усниновые кислоты, антибактериальную активность в отношении ряда бактерий, в том числе Mycobacterium smegmatis, - модельная тест-система, используемая на первой стадии скрининга потенциальных противотуберкулезных средств (K.Е.А. Lougheed, S.A. Osborne, В. Saxty, et al. Effective inhibitors of the essential kinase PknB and their potential as anti-mycobacterial agents // Tuberculosis (Edinb). 2011. V.91(4): P.277-286). Полученные результаты могут свидетельствовать о перспективности синтетических модификаций усниновых кислот. Однако, на основании литературных данных о важной роли трикетонного фрагмента кольца С усниновой кислоты в механизме проникновения препарата в клетку (L. Guo, Q. Shi, J. Fang, et al Review of usnic acid and Usnea barbata toxicity // Journal of environmental science and health. Part C, Environmental carcinogenesis & ecotoxicology reviews. 2008. V.26. P.317-338), можно предположить, что перспективными полусинтетическими производными усниновой кислоты будут являться соединения, содержащие модифицированный фрагмент, не затрагивающий ее трикетонную систему.
Предлагаемые полусинтетические производные усниновой кислоты, содержащие фурилиденфураноновый фрагмент в цикле А усниновой кислоты, более эффективны, чем кватернизованные производные и сама усниновая кислота в отношении Mycobacterium smegmatis и Mycobacterium tuberculosis, и обладают бактерицидным действием.
Решаемая проблема: поиск противотуберкулезных средств нового механизма действия, в том числе активных в отношении штаммов с множественной лекарственной устойчивостью.
Соединения, раскрываемые в настоящем изобретении, являются производными (R)- и (S)-усниновой кислоты, содержащими фурилиденфураноновый фрагмент.
Раскрытие изобретения
Задача изобретения - использование в качестве противотуберкулезных средств полусинтетических производных усниновой кислоты, обладающих бактерицидным действием в отношении Mycobacterium tuberculosis.
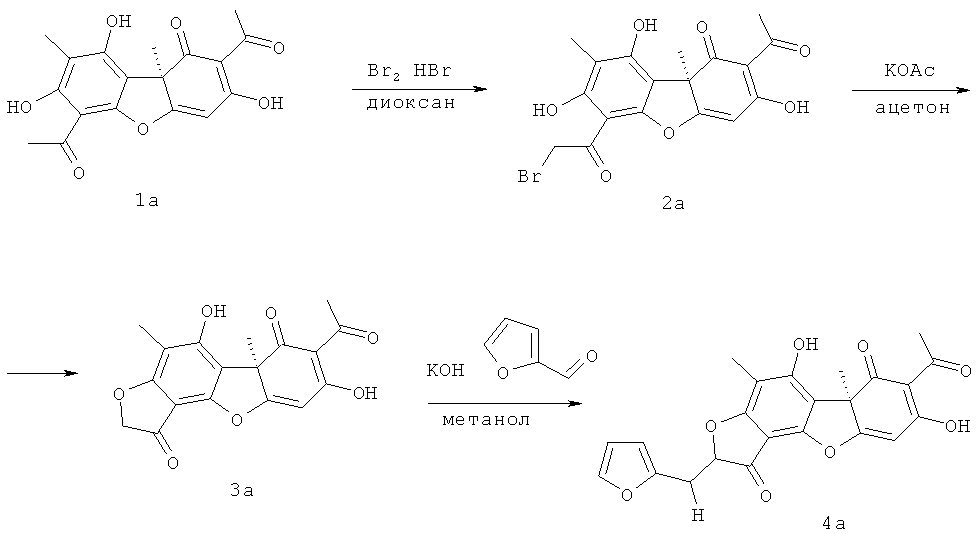
Для достижения поставленной цели мы провели ряд химических модификаций, синтез целевых соединений описан в статье (Соколов Д.Н., Лузина О.А., Шернюков А.В., Салахутдинов Н.Ф. Синтез ауронов на основе усниновой кислоты // Химия природных соединений. 2012. №3. С.350-355). В качестве исходных соединений были взяты R-(+)-усниновая кислота 1а, полученная экстракцией смеси лишайников рода Usnea, и S-(-)-усниновая кислота 1б, полученная экстракцией лишайника Cladonia Stellaris по методике (Н.Ф. Салахутдинов, М.П. Половинка, М.Ю. Панченко, патент РФ №2317076 C1; БИ 2008, №5). Бромирование усниновой кислоты 1а, б бромом в присутствии бромоводородной кислоты дает производное 2а, б, обработка которого ацетатом калия приводит к внутримолекулярной циклизации с образованием соединения с фураноновым фрагментом 3а, б. Следующим этапом было получение целевых соединений с противотуберкулезной активностью реакцией соединения 3а, б с фурфуролом.
Изобретение иллюстрируется следующими примерами.
Пример 1.
Взаимодействие усниновой кислоты 1а, б с двукратным избытком брома
К 1 ммоль усниновой кислоты 1а (либо 1б) (344 мг) добавляли комплекс бромдиоксана (2 ммоль брома (0.10 мл) растворяли в 14 мл диоксана), несколько капель HBr и оставили на 7 суток при комнатной температуре. После концентрирования реакционной смеси на ротационном испарителе хроматографировали полученный остаток на силикагеле (60-200µ), элюент - CH2Cl2.
(R)-2-ацетил-6-(2-бромацетил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1(9bH)-он 2а. Выход 283 мг (67%). Т.пл. 97-100°С. [α]D +349 (с 0.5; CHCl3). ЯМР 1Н (CDCl3, δ, м.д, J Гц): 1.75 (3H, с, Н-15), 2.08 (3H, с, H-10), 2.64 (3Н, с, Н-12), 4.52 (2H, дд, J=12.4, J=14.0, Н-14), 6.00 (1H, с, H-4), 11.17 (1H, с, OH-9), 12.68 (1H, с, OH-7), 18.81 (1H, с, OH-3). ЯМР 13С (CDCl3, δ, м.д.): 7.5 (C-10), 27.7 (C-12), 31.9 (C-15), 34.5 (C-14), 61.6 (C-9b), 98.7 (C-4), 99.0 (C-6), 104.3 (C-9a), 105.1 (C-2), 109.6 (C-8), 154.3 (C-5a), 158.4 (C-9), 164.1 (C-7), 178.5 (C-4a), 191.5 (C-3), 192.7 (C-13), 197.7 (C-1), 201.7 (C-11). ИК спектр (ν, см-1): 842, 1140, 1292, 1458, 1628, 3013, 3497. Найдено: m/z 421.9976 [M]+ C18H15O7Br. Вычислено: M=421.9996.
(S)-2-ацетил-6-(2-бромацетил)-3,7,9-тригидрокси-8,9b-диметилдибензо[b,d]фуран-1(9bH)-он 2б. [α]D -342 (с 0.5; CHCl3).
Пример 2.
Взаимодействие соединения 2а, б с ацетатом калия
К раствору 1 ммоль соединения 2а (2б) (423 мг) в 25 мл ацетона добавили 150 мг (1.5 ммоль) ацетата калия и кипятили реакционную смесь в течение 2 часов. Затем разбавили водой (до ~50-60 мл), подкислили HCl (1:4) до рН=3-4. Экстрагировали CH2Cl2 (3×10 мл), сушили над прокаленным MgSO4, удаляли растворитель и хроматографировали остаток на колонке с силикагелем, элюент - CH2Cl2.
(10R)-8,13-дигидрокси-7,10-диметил-5,16-диоксатетрациклор[7.7.0.02.6.010.15]гексадека-1,6,8,12,14-пентаен-3,11-дион 3а. Выход 308 мг (90%). Т.пл. 202-203 °С. [α]D +397 (с 0.5; CHCl3). ЯМР 1H (CDCl3, δ, м.д., J Гц): 1.73 (3Н, с, H-15), 2.13 (3H, с, H-10), 2.64 (3H, с, H-12), 4.66 (2H, с, H-14), 6.02 (1H, с, H-4), 11.27 (1H, с, OH-9), 18.82 (1H, с, OH-3). ЯМР 13C (CDCl3, δ, м.д.): 6.91 (C-10), 27.80 (C-12), 31.91 (C-15), 58.71 (C-9b), 75.70 (C-14), 99.01 (C-4), 100.61 (C-9a), 105.10 (C-6), 105.7 (C-2), 107.10 (C-8), 149.13 (C-5a), 159.80 (C-9), 173.81 (C-7), 179.61 (C-4a), 191.61 (C-3), 194.10 (C-13), 197.90 (C-1), 201.71 (C-11). Найдено: m/z 342.0736 [М]+ C18H14O7. Вычислено: М=342.0734.
(10S)-8,13-дигидрокси-7,10-диметил-5,16-диоксатетрациклор[7.7.0.02.6.010.15]гексадека-1,6,8,12,14-пентаен-3,11-дион 3б. [α]D -390 (с 0.5; CHCl3).
Пример 3.
Взаимодействие соединения 3а, б с фурфуролом
К раствору 1 ммоль соединения 3а (3б) (342 мг) в 24 мл MeOH добавили 1.1 ммоль фурфурола (105 мг), 1 мл 50% водного раствора КОН и нагревали в течение 1.5 часов. Затем реакционную смесь разбавили водой (до ~50-60 мл), подкислили HCl (1:4) до pH=3-4. Экстрагировали CH2Cl2 (3×10 мл), сушили над прокаленным MgSO4, удаляли растворитель и хроматографировали остаток на колонке с силикагелем, элюент - CH2Cl2.
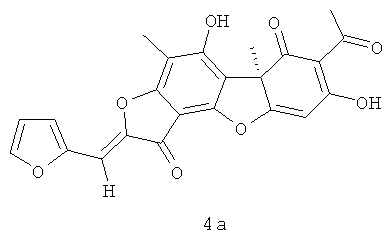
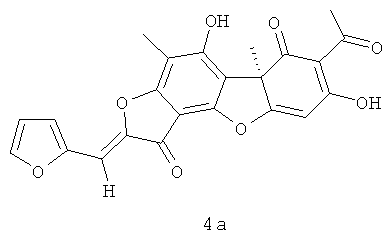
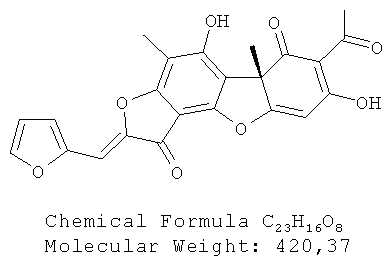
(10R,4Z)-8,13-дигидрокси-7,10-диметил-4-(2-фуранилметилиден)-5,16-диоксатетрацикло[7.7.0.02.6.010.15]гексадека-1,6,8,12,14-пентаен-3,11-дион 4а. Выход 335 мг (65%). Т.пл. 188-192°C. [α]D +365 (с 0.3; CHCl3). ЯМР 1Н (CDCl3, δ, м.д.): 1.76 (3H, с, H-15), 2.29 (3H, с, H-10), 2.65 (3H, с, H-12), 6.05 (1H, с, H-4), 6.59 (1H, с, H-16), 6.83 (1Н, м, Н-19), 7.07 (1Н, м, Н-18), 7.58 (1Н, м, Н-20), 11.38 (1Н, с, OH-9), 18.83 (1H, с, OH-3). ЯМР 13С (CDCl3, δ, м.д.): 7.41 (C-10), 27.89 (C-12), 31.96 (C-15), 58.72 (C-9b), 99.13 (C-4), 101.30 (C-6), 100.84 (C-19), 105.13 (C-2), 105.80 (C-8), 108.19 (C-9a), 113.01 (C-18), 116.69 (C-16), 145.03 (C-20), 145.70 (C-14), 148.65 (C-17), 149.67 (C-5a), 159.21 (C-9), 165.30 (C-7), 178.78 (C-4a), 179.63 (C-13), 191.64 (C-3), 197.89 (C-1), 201.81 (C-11). Найдено: m/z 420.0839 [M]+ C23H16O8. Вычислено: М=420.0840.
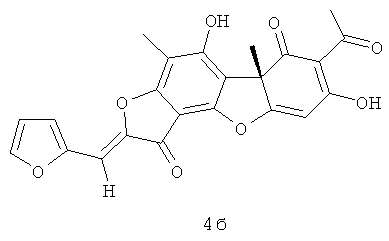
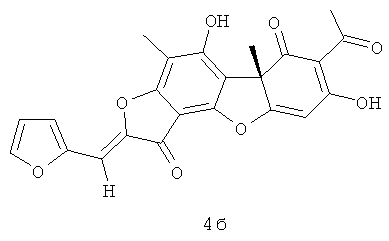
(10S,4Z)-8,13-дигидрокси-7,10-диметил-4-(2-фуранилметилиден)-5,16-диоксатетрацикло[7.7.0.02.6.010.15]гексадека-1,6,8,12,14-пентаен-3,11-дион 4б. [α]D -355 (с 0.3; CHCl3).
Пример 4.
Активность 4а и 4б на Mycobacterium smegmatis 155 mc2 и Mycobacterium tuberculosis H37Rv.
Mycobacterium smegmatis - модельная тест-система, используемая на первой стадии скрининга потенциальных противотуберкулезных средств (K.Е.А. Lougheed, S.А. Osborne, В. Saxty, et al. Effective inhibitors of the essential kinase PknB and their potential as anti-mycobacterial agents. Tuberculosis (Edinb). 2011 July; 91(4); 277-286).
Определение активности вещества проводилось методом бумажных дисков. Метод заключается в определении величины зоны подавления роста штамма, засеянного газоном на агаризованной среде, вокруг бумажных дисков, содержащих вещество в различных концентрациях.
|
Штамм M. smegmatis 155 mc2 чувствителен к 4.2 мкг/диск веществ 4а и 4б.
Штамм M. tuberculosis H37Rv чувствителен к 5 мкг/диск вещества 4б.
Пример 5.
Определение бактерицидной концентрации соединения 4б в отношении M. tuberculosis.
С целью изучения бактерицидной активности соединения 4b в отношении чувствительного лабораторного штамма M. tuberculosis H37Rv и клинического штамма с МЛУ MS-115 был проведен пересев отмытых осадков культур, инкубировавшихся с соединением 4б в концентрациях, при которых не был зарегистрирован рост культуры. Тестируемые концентрации 4б, начиная с 25 мкг/мл, оказывали бактерицидное действие на культуру M. tuberculosis, что выражалось в отсутствии роста культуры при пересеве отмытых осадков на свежую культуральную среду. Таким образом, МБК соединения 4б составила 25 мкг/мл, и 4б обладает бактерицидной активностью как в отношении чувствительного лабораторного штамма M. tuberculosis H37Rv, так и клинического штамма с МЛУ.
Пример 6.
Цитотоксическая активность: действие соединений на интактные макрофаги мыши через 5 часов после внесения
Тестировали соединения 4а и 4б в следующих концентрациях (мкг/мл):
- 50, 10, 5 (МИК100) и 2,5 (МИК90)
Контроль: макрофаги без добавления соединений представляют собой монослой хорошо распластанных веретенообразных клеток без посторонних включений в цитоплазме.
При добавлении 4а и 4б в концентрации 50 мкг/мл фиксировалось начало гибели МФ, выражавшееся в потере распластанности клеток. В концентрациях 10, 5 и 2,5 мкг/мл соединения не оказывали выраженного действия на макрофаги, и картина не отличалась от контроля.
Действие соединений на интактные МФ через 5 суток после внесения
|
4а и 4б умеренно токсичны, т.к. при инкубации с ними лизис макрофагов превышает спонтанный, в концентрациях 2,5 мкг/мл, 5 мкг/мл и 10 мкг/мл. При добавлении веществ к макрофагам в этих концентрациях их лизис превышает спонтанный приблизительно на 20%.
Пример 7.
Определение острой токсичности вещества 4б.
Исследования проведены на инбредных мышах самцах BDF1. Определение полулетальной дозы вещества (ЛД50) проводилось при помощи уравнения линейной регрессии. Вещество растирали в ступке с 1% крахмальным гелем и вводили в различных дозах перорально однократно при помощи шприца со специальным металлическим зондом. В течении 15 дней наблюдалась динамика состояния и поведения животных. На основании полученных данных было построено уравнение линейной регрессии и определена полулетальная доза вещества. Дозы, характеризующие токсичность, составили:
ЛД50=1866 (1620÷2113) мг/кг
МПД=1417 мг/кг
Таким образом, вещества 4а, 4б обладают ярко выраженным антимикобактериальным действием, что делает их перспективными для использования в качестве противотуберкулезного препарата.
Ингибиторы роста Mycobacterium tuberculosis, производные усниновой кислоты, представляющие собой (10R,4Z)-8,13-дигидрокси-7,10-диметил-4-(2-фуранилметилиден)-5,16-диоксатетрацикло[7.7.0.0.0]гексадека-1,6,8,12,14-пентаен-3,11-дион 4а и (10S,4Z)-8,13-дигидрокси-7,10-диметил-4-(2-фуранилметилиден)-5,16-диоксатетрацикло[7.7.0.0.0]гексадека-1,6,8,12,14-пентаен-3,11-дион 4б.