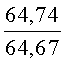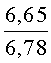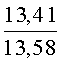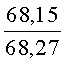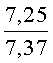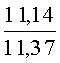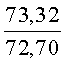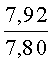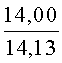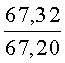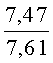Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-ДИАЛКИЛАМИНОПИРРОЛО[1,2-АЛЬФА][1,4]БЕНЗОДИАЗЕПИНА
Вид РИД
Изобретение
Изобретение относится к области органической химии - синтезу гетероциклических соединений - производных 2-диалкиламинопирроло[1,2-a][1,4]бензодиазепина.
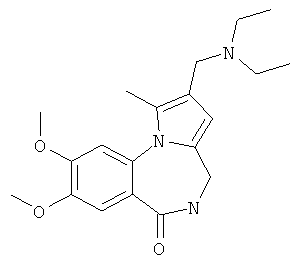
Изобретение относится к разработке способа получения оснований Манниха - производных 2-диалкиламинопирроло[1,2-a][1,4]бензодиазепина - общей формулы I,
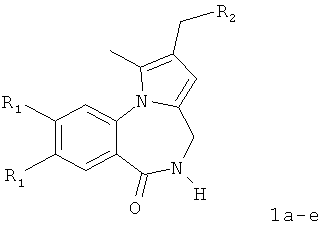
где 1a R1=OMe, R2=морфолин-4-ил; 1б R1=Н, R2=морфолин-4-ил;
1в R1=Н, R2=пиперидин-1-ил; 1г R1=OMe, R2=пиперидин-1-ил;
1д R1=Н, R2=диэтиламино; 1e R1=OMe, R2=диэтиламино,
которые могут найти применение как биологически и фармакологически активные вещества, в частности, обладающие потенциальной активностью в отношении ЦНС [Mai, A.; Di Santo, R.; Massa, S.; Artico, M.; Pantaleoni, G.C.; Giorgi, R.; Coppolino, M.F.; Barracchini, A. Eur. J. Med. Chem., 1995, 30, 593].
Способы получения подобных структур не описаны в литературе.
Аминоалкилирование по Манниху является широко известной реакцией, позволяющей ввести в молекулу органического вещества аминометильный фрагмент. Эта реакция находит применение для модификации электроноизбыточных аренов и гетероциклов, таких как тиофены [Hartough H.D., Meisel S.L. J. Am. Chem. Soc., 1948, 70, 1418; Barker J.M., Huddleston P.R., Wood M.L. Synth. Commun., 1975, 59; Dowle M.D., Hayes R., Judd D.B., Williams C.N. Synthesis, 1983, 73], индолы [Семенов Б.Б., Юровская М.А. Препаративная химия граминов. - М.: Компания Спутник+, 2005. - 184 с.], пирролы.
К недостатку методов аминоалкилирования пирролов можно отнести тот факт, что большинство известных способов пригодны для пирролов со свободным α-положением, по которому легко идут реакции электрофильного замещения [Hanck A., Kutscher, W.Z. Physiol. Chem., 1964, 338, 272], тогда как примеры протекания реакции по β-положению пиррольного кольца немногочисленны [Herz, W.; Settine, R.L. J. Org. Chem. 1959, 24, 201; Biava, М.; Fioravanti, R.; Porretta, G.C; Mencarelli, P.; Sleiter, G. Gazz. Chim. Ital. 1995, 125, 9; Biava, М.; Fioravanti, R.; Porretta, G.C; Frachey, G.; Mencarelli, P.; Sleiter, G., Perazzi, М.E.; Simonetti, N.; Villa, A. II Farmaco 1995, 50, 431].
Наиболее близким к заявляемому среди известных методов введения диалкиламинометильной группы в β-положение производных пиррола является реакция аминометилирования 2,5-диалкил-N-арилпирролов в условиях реакции Манниха, описанная в работах [Biava, М.; Fioravanti, R.; Porretta, G. С; Mencarelli, P.; Sleiter, G. Gazz. Chim. Ital. 1995, 125, 9; Biava, М.; Fioravanti, R.; Porretta, G.C; Frachey, G.; Mencarelli, P.; Sleiter, G., Perazzi, М.E.; Simonetti, N.; Villa, A. II Farmaco 1995, 50, 431]. По сообщению авторов реакция аминоалкилирования ряда N-арил-(фенил, n-хлорфенил) и N-азагетероарил-(2-пиридил, 2-пиримидинил, 2-тиазолил)пирролов действием формалина в водном растворе уксусной кислоты в присутствии морфолина, N-метилпиперазина или пиперидина гладко протекает по β-положению пиррольного кольца с образованием продуктов монозамещения.
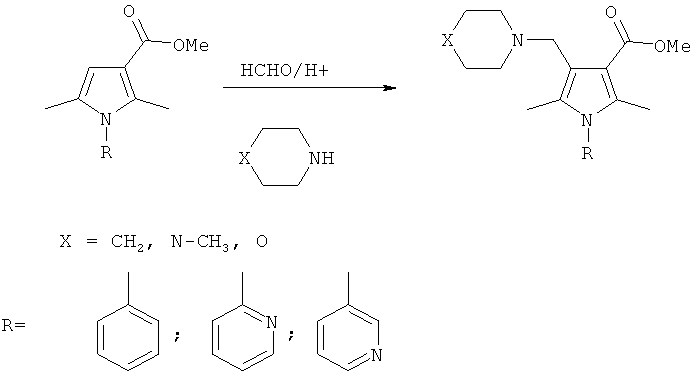
К недостаткам этого метода с точки зрения его возможного использования для аминоалкилирования пирролобензодиазепинов можно отнести довольно мягкие условия проведения процесса (взаимодействие протекает при комнатной температуре), что в случае 2,5-диметилпиррола позволяет избежать нежелательных побочных реакций, однако непригодно для конденсированных полициклических структур, содержащих сопряженный пиррольный цикл. Кроме того, для выделения продуктов реакции используется такой трудоемкий способ как колоночная хроматография, что увеличивает расход растворителей и снижает выход продуктов аминоалкилирования за счет адсорбции на силикагеле.
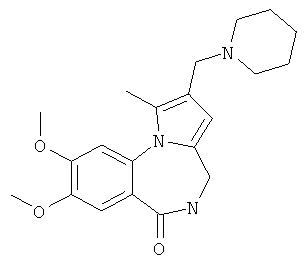
Техническим результатом является формирование новой не описанной ранее гетероциклической системы - 2-диалкиламинометилпирроло[1,2-a][1,4]бензодиазепина, содержащего в положении 4 пиррольного кольца диалкиламинометильный заместитель, в результате аминоалкилирования в условиях реакции Манниха соответствующих пирроло[1,2-a][1,4]бензодиазепинов.
Технический результат достигается тем, что в способе получения производных 2-диалкиламинометилпирроло[1,2-a][1,4]бензодиазепина общей формулы I
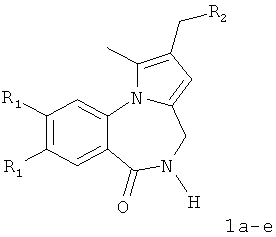
где 1а R1=ОМе, R2 = морфолин-4-ил; 1б R1=Н, R2 = морфолин-4-ил;
1в R1=Н, R2 = пиперидин-1-ил; 1г R1=ОМе, R2 = пиперидин-1-ил;
1д R1=Н, R2 = диэтиламино; 1е R1=ОМе, R2 = диэтиламино,
включающем введение диалкиламинометильной группы в β-положение пиррольного кольца производных пирроло[1,2-а][1,4]бензодиазепина в результате аминометилирования последних в условиях реакции Манниха, реакцию проводят при кипячении указанных соединений в ацетонитриле в течение 4-10 часов с добавлением смеси формалина, уксусной кислоты и вторичного амина (4,2 ммоль : 17,4 ммоль : 1,2 ммоль) на 1 ммоль пирроло[1,2-a][1,4]диазепина 2а,б.
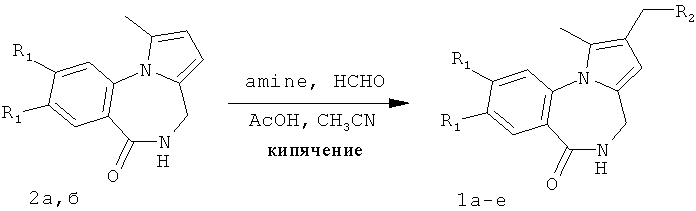
В предлагаемом способе получения 2-диалкиламинометилпирроло[1,2-a][1,4]бензодиазепина Iа-е в качестве исходных соединений использованы синтетически легко доступные производные пирроло[1,2-а][1,4]бензодиазепина 2а,б, которые получены в результате катализируемой кислотами рециклизации N-фурфуриламидов антраниловых кислот по методике, приведенной в работах [Патент РФ №2323939. Способ получения производных пирроло[1,2-а][1,4]диазепина / Т.А.Строганова, В.К.Василин, A.B.Бутин, Т.А.Неволина, Г.Д.Крапивин; Stroganova, Т.; Butin, A.; Vasilin, V.; Nevolina, Т.; Krapivin, G.Synlett, 2007, 1106].
Реакция аминоалкилирования пирроло[1,2-a][1,4]диазепинов 2а, б по Манниху проводится при кипячении реагентов, что способствует гладкому протеканию реакции. Выбор в качестве растворителя ацетонитрила объясняется хорошей растворимостью в нем исходных веществ и продуктов реакции.
Все вышесказанное способствует протеканию реакции и позволяет достичь полной конверсии исходных веществ в производные 2-диалкиламинометилпирроло[1,2-a][1,4]бензодиазепина в течение 4-10 часов без нежелательных побочных превращений исходных веществ и продуктов реакции в ходе процесса, что способствует получению высоких выходов целевых продуктов.
На стадии очистки продукты аминоалкилирования переводят в соли (гидрохлориды), обрабатывая раствор после экстракции 10%-ным раствором соляной кислоты. Последующая очистка с активированным углем и нейтрализация 10%-ным раствором гидроксида натрия приводит к выделению аналитически чистых образцов 2-диалкиламинометилпирроло[1,2-a][1,4]диазепинов. Предлагаемый метод выделения позволяет снизить потери на стадии выделения и очистки и тем самым повысить суммарный выход целевых продуктов.
На основании полученных экспериментальных данных установлено, что оптимальным является проведение реакции при кипячении реагентов, поскольку в этом случае выходы производных 2-диалкиламинометил-пирроло[1,2-a][1,4]-диазепинов достигают 51-81%, а длительность процесса составляет 4-10 часов.
Таким образом, совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь желаемого технического результата.
Индивидуальность и строение синтезированных соединений I подтверждены данными 1Н ЯМР-спектроскопии и элементного анализа.
Ниже приведены примеры осуществления заявляемого способа получения производных 2-диалкиламинометилпирроло[1,2-a][1,4]диазепина I.
Исходные пирроло[1,2-a][1,4]бензодиазепины 2а, б получены в результате рециклизации N-фурфуриламидов антраниловых кислот под действием смеси уксусной и соляной кислот при 60-70°C по методике, приведенной в [Патент РФ №2323939. Способ получения производных пирроло[1,2-a][1,4]диазепина / Т.А.Строганова, В.К.Василии, А.В.Бутин, Т.А.Неволина, Г.Д.Крапивин; Stroganova, Т.; Butin, A.; Vasilin, V.; Nevolina, Т.; Krapivin, G.Synlett, 2007, 1106].
Физико-химические характеристики пирроло[1,2-a][1,4]бензодиазепинов 1а, б соответствуют литературным данным [Stroganova, Т.; Butin, А.; Vasilin, V.; Nevolina, Т.; Krapivin, G. Synlett, 2007, 1106; Stroganova, Т.А.; Vasilin, V.K.; Zelenskaya, E.A.; Red′kin, V.M.; Krapivin, G.D.Synthesis, 2008, 19, 3088].
Пример 1.
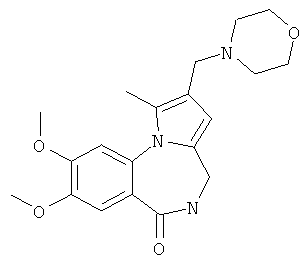
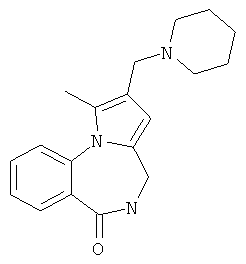
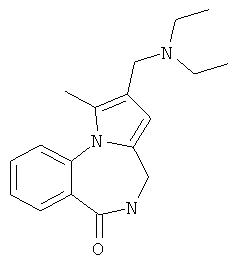
1-Метил-2-(морфолин-4-илметил)-4,5-дигидро-6Н-пирроло[1,2-a][1,4]бензодиазепин-6-он (1б)
К раствору пирроло[1,2-a][1,4]диазепина 2а (1,2 г, 5,6 ммоль) в 20 мл ацетонитрила прибавляют смесь морфолина (0,5 мл, 5,6 ммоль), формалина (0,4 мл, 5,6 ммоль) (40% водный раствор) и 5 мл уксусной кислоты. Реакционную смесь кипятят в течение 6 часов, затем выливают в 10%-ный раствор гидроксида натрия и экстрагируют этилацетатом (3×20 мл). Органические экстракты объединяют, промывают водой и выливают в 100 мл 10% раствора соляной кислоты. Органический слой отделяют, кислотный слой экстрагируют этилацетатом (15 мл), добавляют активированный уголь и кипятят в течение 3 мин. После фильтрации водный раствор охлаждают и нейтрализуют 10%-ным раствором гидроксида натрия до рН 8. Полученную смесь перемешивают до формирования осадка. Осадок отделяют фильтрацией, промывают водой и сушат. После перекристаллизации из смеси этилацетат/петролейный эфир получают белые кристаллы с выходом 76%. Тпл. 199-201°C. 1Н ЯМР (500 MHz, DMSO-d6): δ = 2,20 (с, 3Н, CH3), 2,42 (м, 4Н, N((CH2)2), 3,33 (м, 4Н, O(СН2)2), 3,86 (д.д, 1Н, Ja-b = 15,5, Ja-NH = 4,9, На), 3,99 (д.д, 1Н, Ja-b = 15,5, Jb-NH = 6,8, Hb), 5,97 (с, 1Н, 3-H), 7,39 (д, 1Н, J = 8,1, HAr), 7,41 (д.д, 1Н, J = 8,1, J = 8,0, HAr), 7,60 (д.д.д, 1Н, J = 8,1, J = 8,0, J = 1,5, HAr), 7,78 (д.д, 1Н, J = 8,1, J = 1,5, 1Н, HAr), 8,60 (д.д, 1Н, Ja-NH = 4,9, Jb-NH = 6,8, NH). 13С ЯМР (125 MHz, DMSO-d6): δ = 11,54; 36,66; 52,99; 54,26; 64,00; 106,77; 117,43; 124,89; 125,95; 126,32; 129,91; 130,71; 131,16; 142,21; 134,93; 168,54. Масс-спектр: m/z (Iотн, %) = 226 (55), 225 (100), 224 (71), 223 (13), 196 (12), 180 (18), 167 (17), 105 (27), 76 (13), 59 (26), 58 (12), 57 (21), 43 (38), 42 (23), 41 (16). Вычислено для C18H21N3O2: С 69,43; Н 6,80; N 13,49. Найдено: С 69,27; Н 6,89; N 13,58.
Пример 2.
1-Метил-2-(морфолин-4-илметил)-4,5-дигидро-6H-пирроло[1,2-a][1,4]-бензодиазепин-6-он (16) получают аналогично, проводя реакцию при комнатной температуре в течение 48 часов. Наблюдается образование только следовых количеств продукта (контроль ТСХ).
Пример 3.
1-Метил-2-(морфолин-4-илметил)-4,5-дигидро-6H-пирроло[1,2-a][1,4]-бензодиазепин-6-он (1б) получают аналогично, проводя реакцию при температуре 40°C. Продолжительность реакции составляет 28 ч (контроль ТСХ), выход продукта реакции 53%.
Как следует из приведенных примеров, понижение температуры реакции вызывает увеличение продолжительности процесса, что приводит к нежелательным побочным превращениям и, как следствие, к снижению выхода целевого продукта (Пример 3). При проведении реакции при комнатной температуре, несмотря на увеличение продолжительности реакции, образование продукта практически не идет. Таким образом, оптимальным вариантом является проведение реакции при кипячении, поскольку в этом случае выход соединения (16) достигает 76%, а длительность процесса составляет 6 ч.
Заявляемым способом получен ряд оснований Манниха производных пирроло[1,2-a][1,4]диазепина Iа-е, для которых в таблице 1 приведены длительность реакции, выходы и температуры плавления, а в таблице 2 - спектральные характеристики.
|
|
|
![СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-ДИАЛКИЛАМИНОПИРРОЛО[1,2-АЛЬФА][1,4]БЕНЗОДИАЗЕПИНА](https://fips.edrid.ru/images/rid/73/d4/6f/8bacb13550faa95992860361a2c5d0c6.png)
![СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-ДИАЛКИЛАМИНОПИРРОЛО[1,2-АЛЬФА][1,4]БЕНЗОДИАЗЕПИНА](https://fips.edrid.ru/images/rid/73/d4/6f/e6212fc9c352669b3e71931706b7bad3.png)
![СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-ДИАЛКИЛАМИНОПИРРОЛО[1,2-АЛЬФА][1,4]БЕНЗОДИАЗЕПИНА](https://fips.edrid.ru/images/rid/73/d4/6f/cdd0eb7493232f6bb3a70401466ca2be.png)