Результат интеллектуальной деятельности: СРЕДСТВО ДЛЯ СТИМУЛЯЦИИ РОСТА ВОЛОС
Вид РИД
Изобретение
Изобретение предназначено для использования в фармакологии, ветеринарной практике, косметике и касается средства, стимулирующего рост волос.
Гиалуроновая кислота (ГК) - гетерополисахарид линейного строения из класса кислых гликозаминогликанов (ГАГ) находится в соединительных тканях животных и человека и состоит из звеньев D-глюкуроновой кислоты и N-ацетил-D-глюкозамина. Молекулярная масса ГК 104-2×106Да.
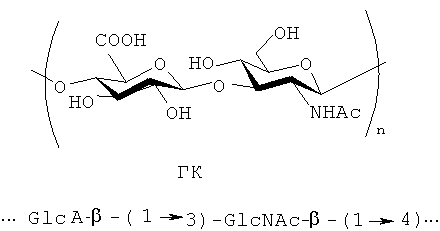
ГК широко применяется в медицине и косметике в качестве неиммуногенного биоматериала, обладающего репаративно-регенерирующими свойствами. ГК является составным компонентом косметических шампуней, кремов и тоников для стимуляции роста волос. Запатентовано также применение ГК в лечении герпеса, псориаза, а также для изготовления суппозиториев различного назначения [Понеделькина И.Ю., Лукина Е.С., Одиноков В.Н. Кислые гликозаминогликаны и их химическая модификация (обзор). // Биоорг.химия. 2008. Т.34. №1. С.5-28].
На основе ГАГ известны следующие средства, способствующие росту волос. Применяются композиции, содержащие 0.01-20% масс. низкомолекулярных ГАГ (или их солей) в сочетании с 0.05-2% масс. кальциевой соли D-(+)-(2,4-дигидрокси-3,3-диметил-1-оксобутил)аминобутановой кислоты (гопантеновой кислоты) [Пат. Японии №63215617]; составы, включающие ГАГ совместно с нуклеиновыми кислотами и пептидами [Пат. EP №378519] или в сочетании с витаминами группы В и пролином [Пат. Франции №2633829], или цинковые соли плацентарных ГАГ [Пат. EP №297455]. Также запатентованы средства, содержащие ГАГ, в основном ГК, в смесях с другими активными компонентами, способствующими укреплению и росту волос [Пат. Франции №2666740, заявка WO 2010069519, пат. Японии 2010215540, заявка Кореи KR 20100086411, пат. Японии №2008297294].
На основе модифицированных ГАГ, в частности ГК, предлагаются катионизированные по ее гидроксигруппам различными четвертичными аммонийными соединениями типа А производные ГК следующего состава:
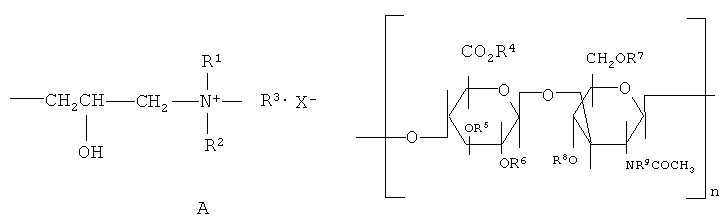
где R1-R3 - различные алкильные радикалы, X - одновалентный анион в приведенной выше четвертичной аммонийной группе, R4-R9 - Н или четвертичные аммонийные группы, n=2-5000. Они входят в состав косметических композиций в качестве агентов, улучшающих структуру волос [EP 2166022 A1, пат. Японии №2008266253].
Модифицированные по карбоксигруппе олигомеры ГК в виде метилового, этилового, бензилового или этоксикарбонилметилового эфиров входят в состав композиций для лечения алопеции различной этиологии [Заявка WO2006087392 A2].
Аналогично ГАГ, в том числе модифицированным ГАГ, никотиновая кислота (НК) и ее производные применяются для улучшения состояния эпидермиса и лечения некоторых кожных заболеваний. При местном применении НК (и никотинамид) стимулируют синтез протеинов (в том числе кератина) и образование НАД и НАДФ в клетке, тем самым способствуя росту кератиноцитов, а также обладают фотозащитными свойствами, препятствуя фотокарциногенезу (т.е. раку кожи).
Никотиновая кислота (пиридин-3-карбоновая кислота) является витамином РР, играет существенную роль в жизнедеятельности организма: представляет собой простетические группы ферментов - кодегидразы I (НАД) и кодегидразы III (НАДФ), являющихся переносчиками водорода и осуществляющих окислительно-восстановительные процессы, тканевое дыхание, углеводный и жировой обмен. НК и ее амид (никотинамид) являются специфическими противопеллагрическими средствами. НК оказывает сосудорасширяющее действие, проявляет гиполипидемическую активность: снижает общий уровень холестерина, особенно уровень триглицеридов. [Машковский М.Д. Лекарственные средства. - Москва: РИА «Новая волна», 2008. - 1206 С.].
Известны единичные примеры использования полисахаридов в качестве матрицы для конъюгации с НК. Например, взаимодействием хлорангидрида никотиновой кислоты с соответствующим полисахаридом в присутствии пиридина получены сложноэфирные конъюгаты с амилозой [Sanchez-Chaves М., Arranz F. // Die Makromolekulare Chemie. 1988. V.189, P.2269-2274] и карбоксиметилцеллюлозой, содержащий менее 1% остатков НК [J. of Pharm. Sci. 1996. V.61. P.141]. Хитозан модифицировали никотиновой кислотой через L-аланиновый спейсер по аминогруппам полимера [Y Nishiyama, Т Yoshida, Т Mori, Sh Ishii, К Kurita // Reactive and Functional Polymers. 1998. V.37, P.83-91]. Сложные эфиры ГАГ и НК не известны.
Наиболее близким к предполагаемому изобретению является средство для стимуляции роста волос, содержащее в качестве активных компонентов ацетилированную ГК (0.001-10% масс.) и НК в виде бензилового или токоферилового эфира (0.001-5% масс.) [Пат. Японии №11236319]. К недостатку такой композиции можно отнести сложность ее приготовления, смешивание двух компонентов в определенных пропорциях.
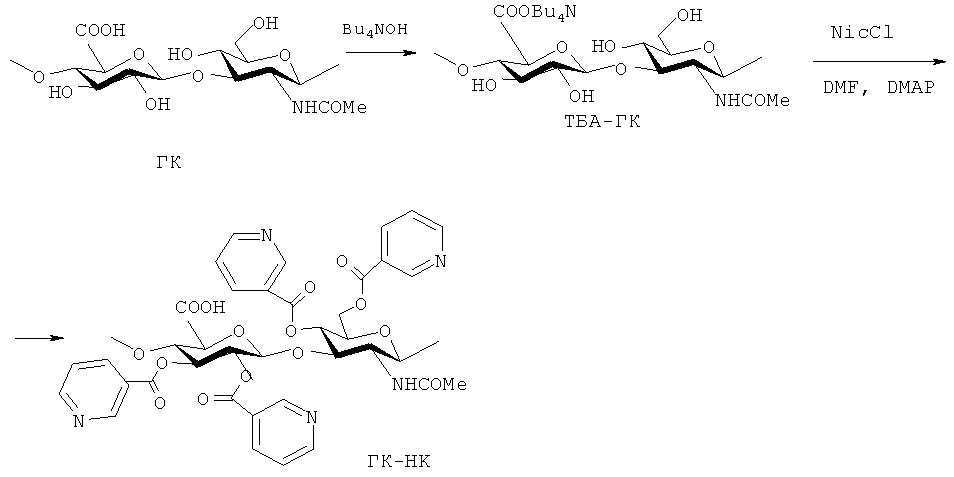
Задачей предполагаемого изобретения является получение на основе ГК и НК средства для стимуляции роста волос, которое представляет собой никотинат ГК. Никотинаты синтезируют взаимодействием третичных или четвертичных аммониевых солей ГК с хлорангидридом НК в среде диметилформамида (ДМФА) и пиридина с добавлением диметиламинопиридина (ДМАП) в качестве катализатора (20-80°C). Основными преимуществами данного средства является простота приготовления растворов никотината ГК, синергетическое действие двух активных соединений (ГК и НК) в одном, хорошая растворимость никотината ГК в воде.
Схема 1
Количество НК, ковалентно связанной с полимером, определяют на основе ЯМР-интегрирования характеристических сигналов протонов пиридинового кольца НК в области δ 7.6-9.0 м.д., в качестве внутреннего стандарта используют синглет метальных протонов MeCON-группы с δ 1.26, 1.92 м.д. ГК. Степень замещения составляет 0.23 в расчете на одну ОН-группу.
На основании оценки скорости роста шерсти на выбритой поверхности участка кожи у крыс в течение 14 дней от начала нанесения препаратов сделано заключение, что под влиянием водного раствора никотината гиалуроновой кислоты рост шерсти происходил быстрее контрольной группы и группы, которой наносили 0,5% водн. р-р гиалуроновой кислоты.
Таким образом, новое соединение - никотинат гиалуроновой кислоты - можно рассматривать как перспективное средство для стимулирования роста волос.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение тетрабутиламмониевой соли ГК (ТБА-ГК). Растворяют 300 мг (0.75 ммоль) ГК в 15-20 мл H2O, раствор наносят на колонку (300×25 мм) с Dowex 50WX4 в H+-форме, элюирют водой, фракцию с кислым pH собирают в пластиковый стакан и нейтрализуют Bu4NOH. Далее тетрабутиламмониевую соль ГК высушивают от воды при 80°C, образующуюся пленку растворяют в 5 мл МеОН и добавляют 15 мл Et2O. Осадок отделяют, промывают Et2O (2×3 мл) и сушат при пониженном давлении (60°C), получают 410 мг соли ТБА-ГК с выходом 88%.
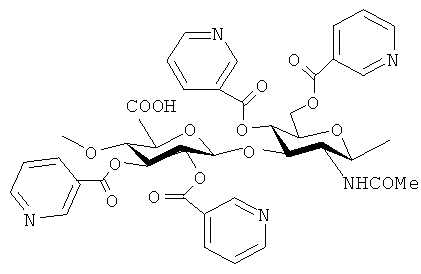
Пример 2. Получение сложного эфира ГК с НК (ГК-НК).
К 90 мг (0.145 ммоль) тетрабутиламмониевой соли ГК, растворенной в 9.5 DMF, при интенсивном перемешивании прибавляют 70 мг (0.444 ммоль) никотиноилхлорида, растворенного в 1 мл DMF. Затем добавляют каталитическое количество диметиламинопиридина DMAP (3-5 мг) и выдерживают в течение часа при нагревании (40-60°C). К реакционной массе прибавляют 5 мл воды и помещают полученный раствор в диализную ленту. Через 12 часов упаривают получившийся раствор в 2 раза, осаждают 2-х-кратным объемом метилового спирта, осадок центрифугируют, промывают этиловым спиртом, затем эфиром и высушивают в вакууме. Таким образом получают 110 мг никотината ГК (ГК-НК) (схема 4). Спектр1Н-ЯМР: δ, м.д.: 1.26, 1.92 (3Н, MeCON), 3.5-4.5 (Н1-Н6, 10Н в звеньях GlcA и GlcNAc), 7.6-9.0 (4Н, НРу в НК). Степень присоединения НК к ГК составляет 0.23 в расчете на одну ОН-группу полимера.
Пример 3. Получение водного раствора никотина ГК (ГК-НК).
0,05-0,15 г никотината ГК растворяли в 10 мл дистиллированной воды.
Пример 4. Влияние никотината ГК на рост шерсти у животных.
Эксперименты проводили на крысах массой 200-230 г линии Вистар, полученных из вивария Института цитологии и генетики СО РАН. Содержание животных соответствует условиям стандартного вивария, на стандартном гранулированном корме ПК 120-3 и ПК 120-1 (Лабораторснаб, Москва). Все манипуляции с животными осуществляли согласно Женевской конвенции 1986 г «О гуманном обращении с лабораторными животными».
Для экспериментов животных разбивали на 3 группы по 7 особей в каждой. Всем животным в области спины выбривали одинакового размера участок и на следующий день начинали наносить: 1 группе - физиологический раствор; II группе - 0,5% водн. р-р гиалуроновой кислоты; III - 0,5% водный р-р никотината гиалуроновой кислоты. Оценку роста шерсти проводили по скорости зарастания выбритой поверхности крыс в течение 14 дней от начала нанесения препаратов.
Результаты представлены в таблице 1.
На основании данных, представленных в таблице, можно сделать заключение, что под влиянием водного раствора никотината гиалуроновой кислоты рост шерсти происходил быстрее контрольной группы и группы, которой наносили 0,5% водн. р-р гиалуроновой кислоты. В частности, на 6 день исследований в группе 3 выраженное зарастание шерстью произошло у 3 из 7 крыс, а во второй у 1 из 7 крыс. Начиная с 8 дня исследований лидирующей группой являлась группа животных, которым наносили 0,5% водный р-р никотината гиалуроновой кислоты.
|