Результат интеллектуальной деятельности: СПОСОБ МОДИФИКАЦИИ МОНОЦИТОВ ПЕРИФЕРИЧЕСКОЙ КРОВИ ДЛЯ ПОВЫШЕНИЯ ИХ ПАРАКРИННОЙ АКТИВНОСТИ ПРИ АУТОЛОГИЧЕСКОЙ ТРАНСПЛАНТАЦИИ
Вид РИД
Изобретение
Изобретение относится к медицине, конкретно к экспериментальной иммунологии, и может быть использовано для модификации клеток периферической крови с целью повышения их паракринной активности при аутологической трансплантации.
В качестве модифицирующей процедуры выбрана обработка аденозином, так как показано влияние этого эндогенного нуклеозида на усиление секреции паракринных факторов некоторыми видами клеток.
В настоящее время восстановление структуры тканей после повреждений в результате острых (таких, как инфаркт миокарда) или хронических процессов (например, хроническая обструктивная болезнь легких) не обеспечивается медикаментозными средствами. Используемая терапия направлена на компенсацию нарушенных функций органа, задержку дальнейшего развития болезни, но не влияет на восстановление структуры тканей. Лидирующие позиции этих заболеваний среди причин смертности населения по всему миру указывают на недостаточную эффективность такого подхода. Поэтому ведутся поиски альтернативных терапевтических подходов. Одним из разрабатываемых методов является аутологичная клеточная терапия. В настоящее время отсутствуют достаточно эффективные способы лечения аутоиммунных, хронических и онкологических заболеваний. В связи с этим поиск методов модификации клеток периферической крови необходим для создания новых терапевтических подходов.
Группа зарубежных ученых показала, что костно-мозговые мононуклеарные клетки после трансплантации в ишемизированный миокард вырабатывают большое количество ангиогенных факторов. А с использованием МСК была продемонстрирована секреция различных ростовых факторов в культуральную среду. Кроме того, повышение экспрессии фактора роста эндотелия сосудов МСК при их генетической модификации вело к увеличению плотности сосудов после инфаркта миокарда [Matsumoto R Vascular endothelial growth factor-expressing mesenchymal stem cell transplantation for the treatment of acute myocardial infarction. / Matsumoto R, Omura T, Yoshiyama M, Hayashi T, Inamoto S, Koh KR, Ohta K, Izumi Y, Nakamura Y, Akioka K, Kitaura Y, Takeuchi K, Yoshikawa J. // Arterioscler Thromb Vase Biol. - 2005 - 25(6) - 1168-73], что позволяет рассчитывать на улучшение возможностей терапевтических клеток в области ангиогенеза после их модификации в сторону гиперэкспрессии необходимых паракринных факторов.
В то же время паракринные факторы не являются уникальными для стволовых клеток и вырабатываются также клетками периферической крови, которые при этом не обладают онкогенной активностью. Мононуклеарные клетки периферической крови также давали положительные результаты при аутологической трнасплантации, но со сниженной по сравнению со стволовым клетками эффективностью [Abdel-Latif A Adult bone marrow-derived cells for cardiac repair: a systematic review and meta-analysis / Abdel-Latif A, Bolli R, Tleyjeh IM, Montori VM, Perm EC, Hornung CA, Zuba-Surma EK, Al-Mallah M, Dawn B. // Arch Intern Med. - 2007 - 167(10) - 989-97; Burchfield et al; 2008; Role of paracrine factors in stem and progenitor cell mediated cardiac repair and tissue fibrosis // Fibrogenesis Tissue Repair. doi: 10.1186/1755-1536-1-4].
Однако благодаря относительной простоте изоляции этих клеток из периферической крови, по сравнению с получением стволовых клеток из костного мозга, мононуклеарные клетки периферического происхождения, в случае усиления их паракринной функции, могут оказаться предпочтительнее стволовых клеток для аутологической трансплантации.
В доступных для анализа источниках информации встречаются публикации, касающиеся описания различных способов получения иммунокомпетентных клеток с заданными функциональными свойствами. В частности, описан способ получения популяции CD4+CD25+foxp3+ T-лимфоцитов человека ex vivo, предусматривающий выделение и культивирование CD4+ T-клеток в ростовой среде, содержащей анти-CD28, анти-CD3, TGFβ-1 и ИЛ-2, с целью их последующего аутологичного применения [RU 2391401, опубл. 10.06.2010].
Предложен способ увеличения количества гемопоэтических недифференцированных стволовых клеток пациента ex vivo путем их выделения из крови или костного мозга пациента и культивирования в ростовой среде, содержащей смесь цитокинов, состоящей из SCF, Flt3L, ТРО, способной индуцировать очень быструю пролиферацию стволовых клеток, в то же время не вызывая их дифференцировку [RU 2360965, опубл. 27.06.2009].
Предложен метод дифференцировки моноцитов в некроветворные клетки, в частности клетки, имеющие одно или нескольких свойств эндотелиальных клеток, путем взаимодействия субстрата моноцитов с субстратом эндотелиальных клеток [РСТ 2010105285, опубл. 23.09.2010].
Показано, что культивирование моноцитов периферической крови в пробирке в ростовой среде [US 2006171928, опубл. 03.08.2006] в присутствии SDF-1 позволяет получить моноцитарные мультипотентные клетки (МОМС) для их последующего аутологичного применения [US 2010261202, опубл. 14.10.2010].
Описан метод подавления ответа иммунной системы на пересаженные ткани или клетки, заключающийся в получении дифференцированных моноцитов периферической крови в дендритные клетки [WO 2009108738, опубл. 03.0.2009, WO 2004044149, опубл. 27.05.2004, WO 2010183735, опубл. 22.07.2010].
Предложена фармацевтическая композиция, содержащая ингибитор протеазы и аденозин, и метод ее применения для предотвращения реперфузионного повреждения и ишемии органа [US 2006205671, опубл. 14.09.2006].
Наиболее близким к предлагаемому способу является способ модификации клеток путем получения недифференцированной клетки из более коммитированной клетки с целью расширения арсенала средств для лечения заболеваний иммунной системы [RU 2177996, опубл. 10.01.2002]. Известный способ позволяет получить клеточную популяцию (в культуре) с повышением числа CD34+ клеток за счет взаимодействия клеточной популяции (например, гемопоэтических клеток) с антителом, например CP3/43, при этом антитело может быть использовано в сочетании с алкилирующим агентом, например циклофосфамидом или циклическим аденозинмонофосфатом (предпочтительнее). Недифференцированные клетки способны дифференцироваться по многим линиям, т.е. они способны дифференцироваться в два или более типов специализированных клеток. Типичным примером получаемой по известному способу недифференцированной клетки является стволовая клетка.
Клеточная терапия стволовыми клетками способствует восстановлению структуры ткани. Регенерация происходит за счет образования новых функциональных клеточных элементов, взамен утраченных. По последним данным, стволовые клетки, попадая в поврежденную ткань, начинают вырабатывать большое количество паракринных факторов, которые стимулируют рост сосудов, подавляют воспаление, активизируют собственные стволовые клетки ткани и, таким образом, стимулируют внутренние резервы организма для регенерации. Однако сами стволовые клетки не замещают поврежденную ткань и достаточно быстро погибают.
Однако получение из более коммитированной клетки стволовой клетки по известному способу имеет ограничения. Несмотря на доказанный положительный эффект, клеточная терапия стволовыми клетками не является безопасной для всех пациентов, в том числе из-за риска онкологических осложнений, и ее применение на территории РФ ограничено отсутствием надлежащей законодательной базы [Пальцев М.: Медицина в свете клеточной биологии / М.Пальцев // Медицинская газета. - 2004. - №26]. Это является существенным недостатком известного способа.
В связи с широкой распространенностью и многообразием заболеваний, связанных с нарушением структуры тканей, внимание многих исследователей направлено на поиск различных методов к усилению функциональной активности трансплантированных клеток, обеспечивающих эффект терапии. Благодаря относительной простоте изоляции моноцитов из периферической крови, по сравнению с получением стволовых клеток из костного мозга, мононуклеарные клетки периферического происхождения, в случае усиления их паракринной функции, могут оказаться предпочтительнее стволовых клеток для аутологической трансплантации.
Новая техническая задача - получение функционально зрелых форм клеток, способных к генерации оптимального и достаточного количества паракринных факторов, путем их обработки аденозином - NECA (5′-N-этилкарбоксамидоаденозин).
Для решения поставленной задачи в способе модификации моноцитов периферической крови производным аденозина для повышения их паракринной активности при аутологической трансплантации, включающем выделение фракции в клеточной популяции, последующую обработку выделенной фракции производным аденозина, выделяют фракцию периферических мононуклеарных клеток (МНК) из венозной крови, после чего помещают выделенные моноциты в полную питательную культуральную среду с цитокинами и ростовыми факторами, при этом выделение моноцитов из МНК венозной крови проводят с использованием двойного градиента плотности перколла: 1,064 г/мл и 1,032 г/мл соответственно, при комнатной температуре +20°C, затем выделенные моноциты помещают в полную питательную культуральную среду для адгезии к пластику, далее, по истечении 2 часов, осуществляют замену полной питательной культуральной среды с добавлением 20 нг/мл IL4 и 20 нг/мл GM-CSF, причем модификацию моноцитов осуществляют путем стимуляции негидролизируемым аналогом аденозина NEСА(5'-N-этилкарбоксамидоаденозином) в концентрации 100 µM при инкубации клеток в CO2-инкубаторе во влажной атмосфере 5% CO2 при +37°C в течение 72 часов.
Результатом предлагаемого способа является получение функционально зрелых форм клеток, способных к генерации оптимального и достаточного количества паракринных факторов.
Способ осуществляют следующим образом.
1. Выделение фракции периферических мононуклеарных клеток (МНК)
Хэнкса («Хэнкса раствор без фенолового красного», рН 6.8-7.2, «ПанЭко», Россия). На дно пробирки с кровью наслаивают 13 мл раствора фиколла плотностью 1,077 г/см3. Центрифугируют при 400g на центрифуге «NF400R» (Турция) в течение 20 минут при комнатной температуре. Сбор клеток интерфазного кольца осуществляют с помощью пастеровской пластиковой трансфер-пипетки («Sigma-Aldrich», США). Собранные клетки переносят в стерильную пластиковую пробирку объемом 50 мл и дважды отмывают с помощью раствора Хэнкса при 165g в течение 20 минут. После второй отмывки клетки ресуспендируют в полной среде RPMI-1640, содержащей эмбриональную телячью сыворотку (ЭТС) («Sigma-Aldrich», США).
2. Процедура выделения моноцитов из МНК венозной крови.
Выделение моноцитов из МНК крови проводят с использованием двойного градиента плотности перколла (1,131 г/см3, pH=8.5-9.5, «Sigma», США). До начала процедуры выделения моноцитов готовят 10-кратный забуференный фосфатный раствор, для этого смешивают 25 г NaCl, 0.25 г Na2HPO4 и 4.2 г KH2PO4. Доводят дистиллированной водой до 400 мл, pH=7,2-7,4. Далее готовят стандартный изотонический раствор перколла (с плотностью 1,123 г/мл) путем его разведения в фосфатном буфере, для этого к 1 мл 10-кратного забуференного фосфатного раствора добавляют 9 мл перколла с плотностью 1,131 г/мл. Затем с использованием неполной среды RPMI готовят раствор перколла с плотностью 1,064 г/мл: 5226 мкл стандартного изотонического раствора перколла смешивают с 5776 мкл RPMI. Для приготовления раствора перколла с плотностью 1,032 г/мл к 750 мкл стандартного изотонического раствора перколла добавляют 4250 мкл RPMI.
Полученные после отмывки от фиколла мононуклеары ресуспендируют в 1 мл среды RPMI. Затем добавляют 1,5 мл стандартного изотонического раствора перколла (с плотностью 1,123 г/мл). Полученную смесь переносят в новые стерильные центрифужные пробирки объемом 15 мл. Сверху с помощью одноразового шприца последовательно наслаивают 5 мл раствора перколла с плотностью 1,064 г/мл и 2 мл раствора перколла с плотностью 1,032 г/мл. Полученный градиент центрифугируют в течение 50 минут с ускорением 2058g при температуре 20°C. После центрифугирования получают 2 кольца: верхнее кольцо является моноцитарным, в нижнем кольце находятся МНК, эритроциты осаждаются на дно пробирки. Моноцитарное кольцо собирают в отдельную стерильную пробирку пастеровской трансфер-пипеткой и дважды отмывают с помощью раствора Хэнкса при 659g в течение 15 минут.
Собранные моноциты используют для приготовления суспензии с концентрацией 5×105 клеток/мл. Суспензию готовят на основе среды RPMI-1640, содержащей 5 мл пирувата натрия (11 мг/мл), 146 мг глутамина, 25 мл эмбриональной телячьей сыворотки, 3 мкл β-меркаптоэтанола, Antibiotic Antimycotic Solution (10,0 units penicillin, 0,10 mg streptomycin and 0,25 µg amphotericin В per mL), 20 нг/мл IL4 и 20 нг/мл GM-CSF.
3. Культивирование моноцитов с негидрозивируемым аналогом аденозина NECA.
Выделенные моноциты с концентрацией 5×105 клеток/мл помещают в 24-луночные пластиковые культуральные планшеты («Nunclon», Дания) в объеме 1 мл на лунку. Клетки инкубируют в течение 2 часов в CO2-инкубаторе во влажной атмосфере 5% CO2 при +37°C. Далее из каждой лунки отбирают по 1 мл среды, взамен добавляя по 1 мл полной среды RPMI, содержащей негидролизуемый аналог аденозина - NECA - в концентрации 100 µМ. Клетки инкубируют в CO2-инкубаторе во влажной атмосфере 5% CO2 при +37°C в течение 72 часов.
Предложенные время инкубации (72 часа) и концентрация негидролизируемого аналога аденозина NECA (100 µM) являются оптимальными для получения функционально зрелых форм клеток, способных к генерации оптимального и достаточного количества паракринных факторов.
Фиколл - синтетический высокомолекулярный сополимер сахарозы и эпихлоргидрина - способен создавать градиент с такой плотностью, которая позволяет при центрифугировании разделить клетки периферической крови на мононуклеарную фракцию, в которую входят лимфоциты и субпопуляция моноцитов, и фракцию, содержащую гранулоциты и эритроциты. Поскольку мононуклеарная фракция обладает меньшей, чем градиентный раствор фиколла, плотностью, то располагается над градиентом. Гранулоциты и эритроциты, имеющие большую плавучую плотность, в процессе седиментации проходят через градиентный раствор и опускаются на дно пробирки. Таким образом, после центрифугирования на дне пробирки получается осадок из эритроцитов и гранулоцитов, над ним - слой фиколла, между верхней границей которого и слоем плазмы крови располагается кольцо мононуклеарных клеток (моноцитов и лимфоцитов).
Разделение фракции мононуклеаров на моноцитарную и лимфоцитарную производят с помощью градиента перколла, представляющего собой коллоидную суспензию силикагеля, частички которого покрыты поливинилпирролидоном. Это покрытие ослабляет токсическое влияние силикагеля. Основным преимуществом перколла является то, что он не проникает через биологические мембраны, а его растворы имеют низкую вязкость и низкую осмолярность. Вследствие большого размера частиц центрифугирование раствора перколла при умеренных скоростях приводит к формированию градиента плотности. Моноциты и лимфоциты образуют 2 отдельных кольца на границах раздела фаз. Верхнее кольцо содержит фракцию моноцитов, нижнее кольцо представляет собой лимфоцитарную фракцию.
Аденозин - эндогенный нуклеозид, промежуточный продукт пуринового метаболизма - играет важную роль в регуляции тканевого гомеостаза. Его количество в тканях существенно повышается при воспалении, достигая концентрации десятков и сотен микромоль. Аденозин осуществляет свои эффекты посредством активации аденозиновых рецепторов (A1, A2A, A2B и A3). Обнаружено, что аденозин влияет на выработку паракринных факторов различными клетками [Novitskiy et al.; 2008; Adenosine receptors in regulation of dendritic cell differentiation and function. / Novitskiy SV, Ryzhov SV / Blood; (ISI) Impact factor - 10.555 doi: 10.1182/blood-2008-02-136325]. Более того, после стимуляции аденозиновых рецепторов культура моноцитов увеличивает продукцию некоторых паракринных факторов, необходимых для восстановления поврежденных тканей [Novitskiy et al.; 2008; Adenosine receptors in regulation of dendritic cell differentiation and function. / Novitskiy SV, Ryzhov SV / Blood; (ISI) Impact factor - 10.555 doi: 10.1182/blood-2008-02-136325]. Оптимальная для модификации моноцитов концентрация негидролизируемого аналога аденозина NECА (100 µМ) подобрана авторами в эксперименте. Эта доза является достаточной по сравнению с использованием меньших концентраций NE A (30 µМ) для модификации моноцитов с целью усиления их паракринной функции.
Время культивации моноцитов с аденозином подобраны авторами экспериментально с целью получения максимального количества функционально активированных клеток, способных к продукции паракринных факторов. Культивирование моноцитов с аденозином в течение 72 часов в полной питательной среде с цитокинами и ростовыми факторами приводило к получению функционально зрелых клеток. При сокращении времени культивирования (24 часа) и использовании меньших концентраций NECA (30 µМ) экспрессия м-РНК паракринных факторов и их содержание в культуральной среде снижалось.
Через 72 часа после начала инкубации (в соответствии с режимом культивирования) проводят дальнейший анализ клеток.
1. Цитофлюориметрический анализ антигенного фенотипа дендритных клеток (CD1a, CD14, CD209) проводят при помощи соответствующих моноклональных антител на проточном цитометре. Осуществляют регистрацию прямого (под углами 1-100) и бокового (900) светорассеяния. Анализируют образцы клеточной суспензии по пяти параметрам: прямому светорассеянию (FSC), боковому светорассеянию (SSC) и трем показателям флюоресценции, выявляемым на FL-1, FL-2, FL-3 каналах. Учитывают не менее 5000 клеток для каждого образца.
2. Анализ жизнеспособности клеток проводят с использованием красителя 7-AAD (BD Bioscinces, США). Принцип действия 7-AAD заключается в окрашивании погибших клеток при проникновении только через поврежденную мембрану клетки и связывании с двухцепочечной ДНК.
3. Выделение тотальной РНК для дальнейшей постановки ПЦР-РВ с целью определения уровня экспрессии мРНК аденозиновых рецепторов (A1, A3, A2A, A2B).
4. Выделение тотальной РНК для дальнейшей постановки ПЦР-РВ с целью определения уровня экспрессии мРНК паракринных факторов (IL1β, IL6, IL8, IL10, IP10, βFGF, EGF, HGF, VEGF, TGFβ).
5. Иммуноферментный анализ уровня продукции целевых паракринных факторов (IL1β, IL6, IL8, IL10, IP10, βFGF, EGF, HGF, VEGF, TGFβ).
В качестве модифицирующей процедуры выбрана обработка аденозином - NECA (5'-N-этилкарбоксамидоаденозин), так как показано влияние этого эндогенного нуклеозида на усиление секреции паракринных факторов некоторыми видами клеток.
Отличием предлагаемого способа является новый методический подход, включающий осуществление последовательных этапов выделения МНК и моноцитов с использованием градиента плотности фиколла (1,077 г/см3) и двойного ступенчатого градиента плотности перколла (1,131 г/см3) соответственно, позволяющих получить достаточное количество моноцитов. Последующую модификацию клеток с целью повышения их паракринной активности осуществляют с помощью 100 µМ NECA в течение 72 часов.
Пример на выполнение способа
Материалом для исследования служила периферическая венозная кровь здорового волонтера. В ходе выполнения центрифугирования с использованием градиента плотности фиколла (1,077 г/см3) и двойного ступенчатого градиента плотности перколла (1,131 г/см3) соответственно были получены моноциты периферической крови. Далее, выделенные моноциты в концентрации 5×105 клеток/мл помещали в 24-луночные пластиковые культуральные планшеты и культивировали в полной среде RPMI, содержащей 5 мл пирувата натрия (11 мг/мл), 146 мг глутамина, 25 мл эмбриональной телячьей сыворотки, 3 мкл β-меркаптоэтанола, Antibiotic Antiniycotic Solution (10,0 units penicillin, 0,10 mg streptomycin and 0,25 µg amphotericin В per mL).
Через 2 часа культивирования проводили замену питательной среды на полную питательную среду, содержащую 5 мл пирувата натрия (11 мг/мл), 146 мг глутамина, 25 мл эмбриональной телячьей сыворотки, 3 мкл β-меркаптоэтанола, Antibiotic Antimycotic Solution (10,0 units penicillin, 0,10 mg streptomycin and 0,25 µg amphotericin В per mL), 20 нг/мл IL4, 20 нг/мл GM-CSF и негидролизуемый аналог аденозина - NECA - в концентрации 100 µМ.
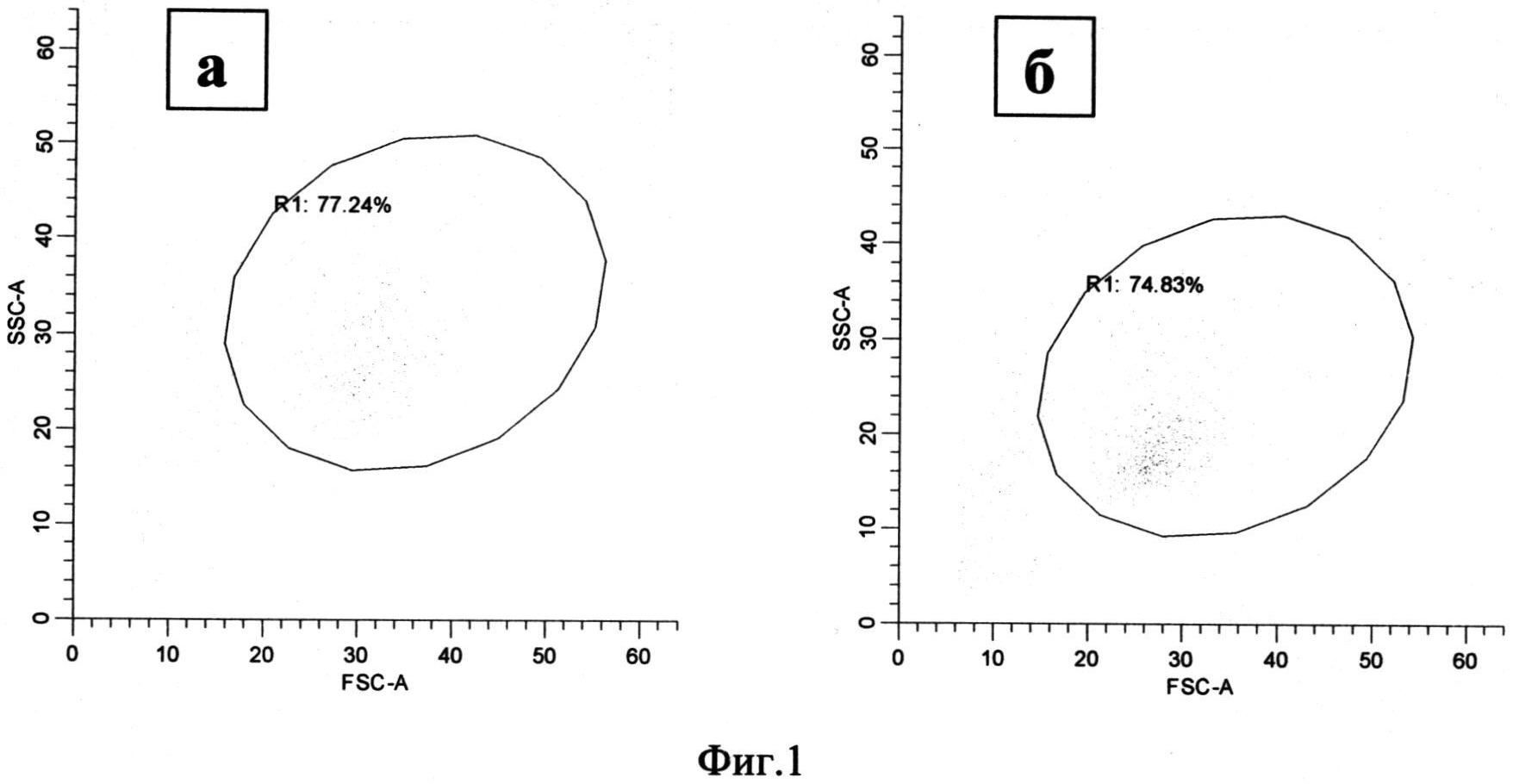
Режим стимуляции моноцитов состоял в культивировании в течение 72 часов при стимуляции аналогом аденозина NECA в концентрации 100 µM. По параметрам переднего и бокового светорассеяния анализируемые популяции составили 67.25% (58.67-79.50) и 71.18% (69.16-86.28) от общего количества событий для нестимулированной и стимулированной культур моноцитов соответственно (Фиг.1, область R1).
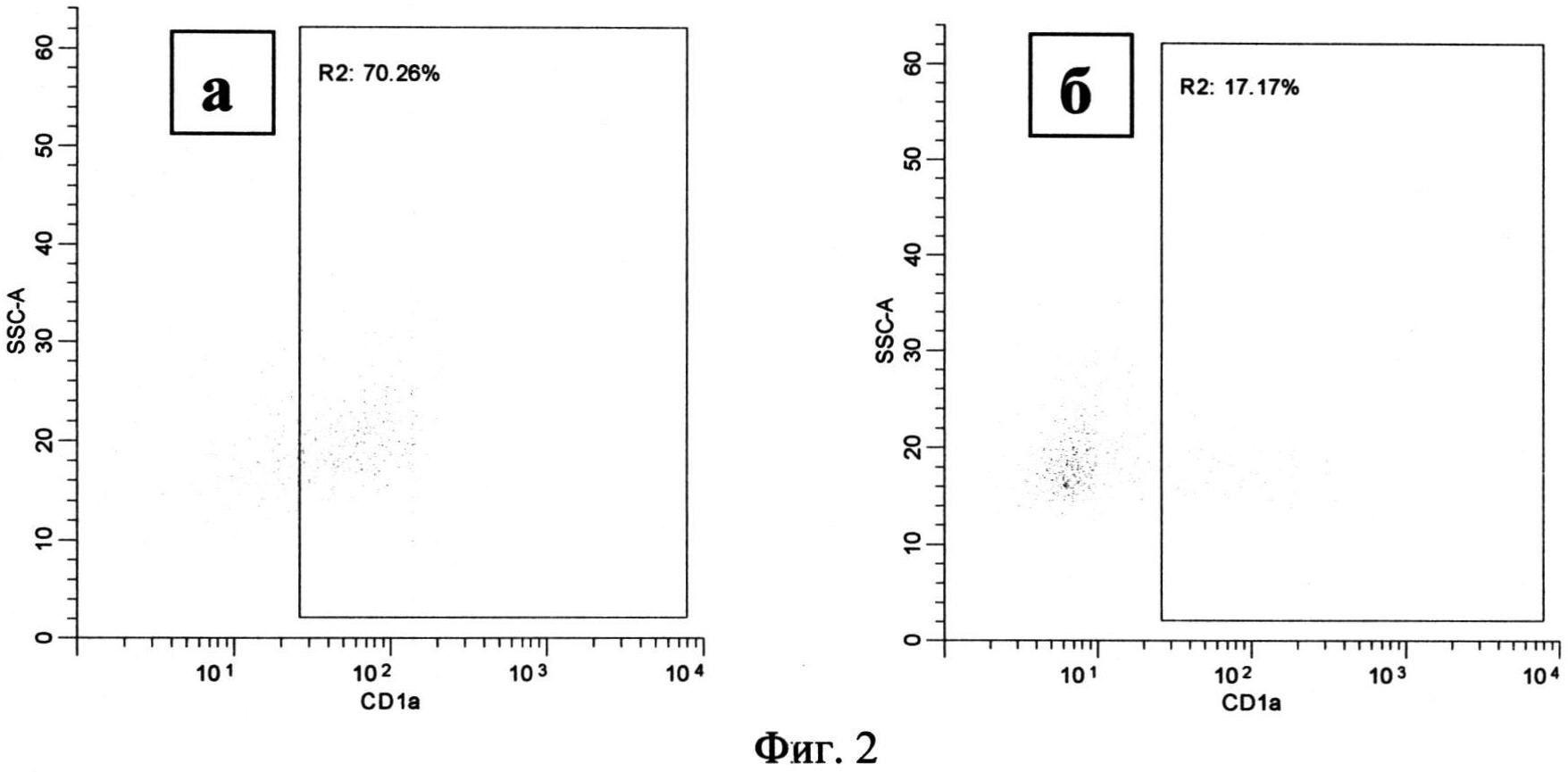
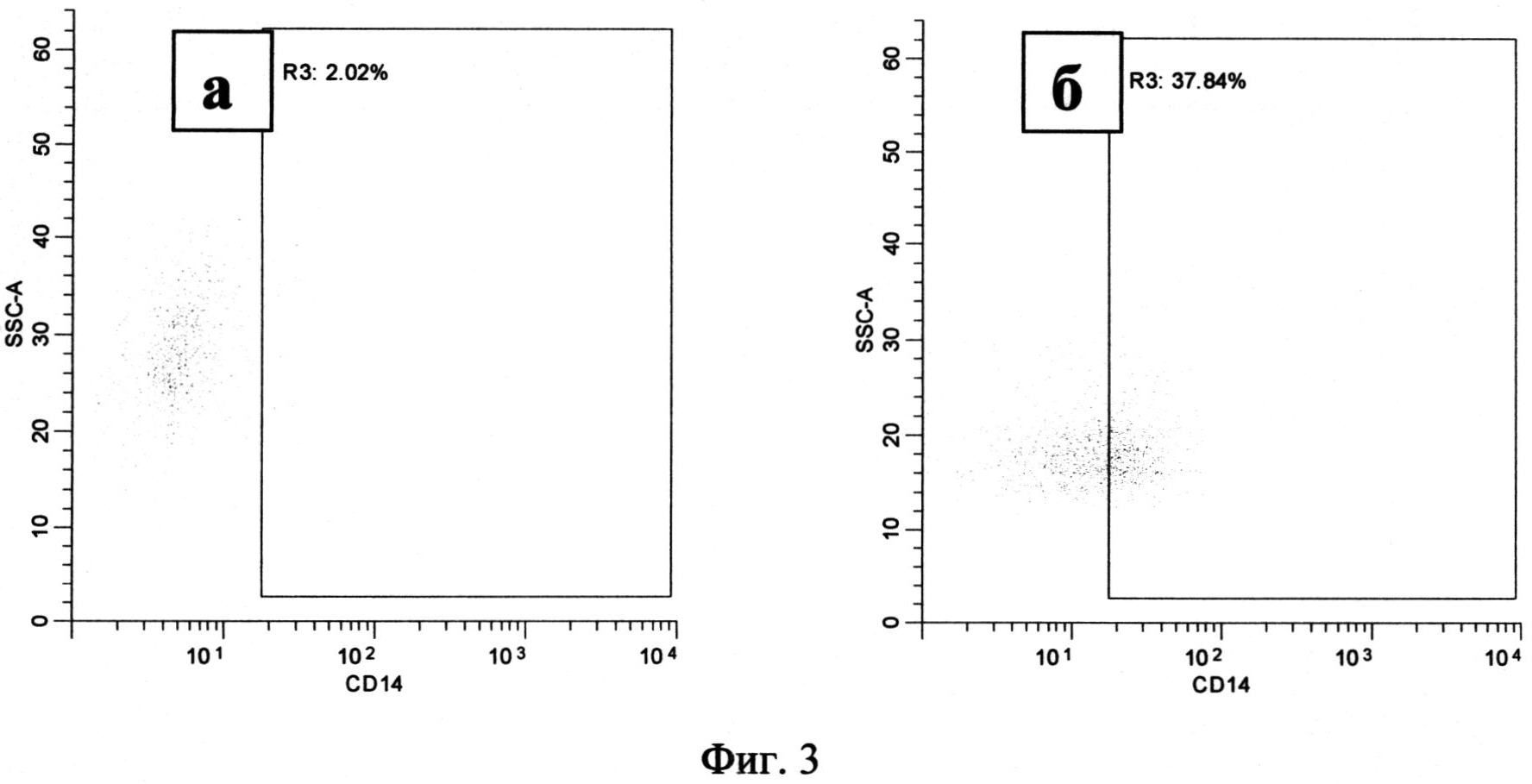
По сравнению с культивированием в течение 24 часов анализируемые популяции выросли в размере и увеличили количество гранул, что соответствует процессу дифференцировки. Процессу дифференцировки также соответствует усиление экспрессии маркера CD1a на поверхности клетки. Это наблюдалось в нестимулированной культуре моноцитов, где 44.74% клеток (36.74-58.85) несли на своей поверхности CD1a (Фиг.2, а, область R2). В то же время только 11.85% (7.283-51.17) моноцитов, стимулированных 100 µM NECA, экспрессировали этот маркер (Фиг.2, б, область R2). Дальнейшая потеря CD 14, характеризующая дифференцировку и созревание, наблюдалась в нестимулированных культурах: 5.66% (1.313-33.30) клеток несущих на своей поверхности CD14 (Фиг.3, а, область R3). В то время как при анализе стимулированных культур было обнаружено 34.87 (15.30-69.66) % клеток, несущих метку CD14 (Фиг.3, б, область R3).
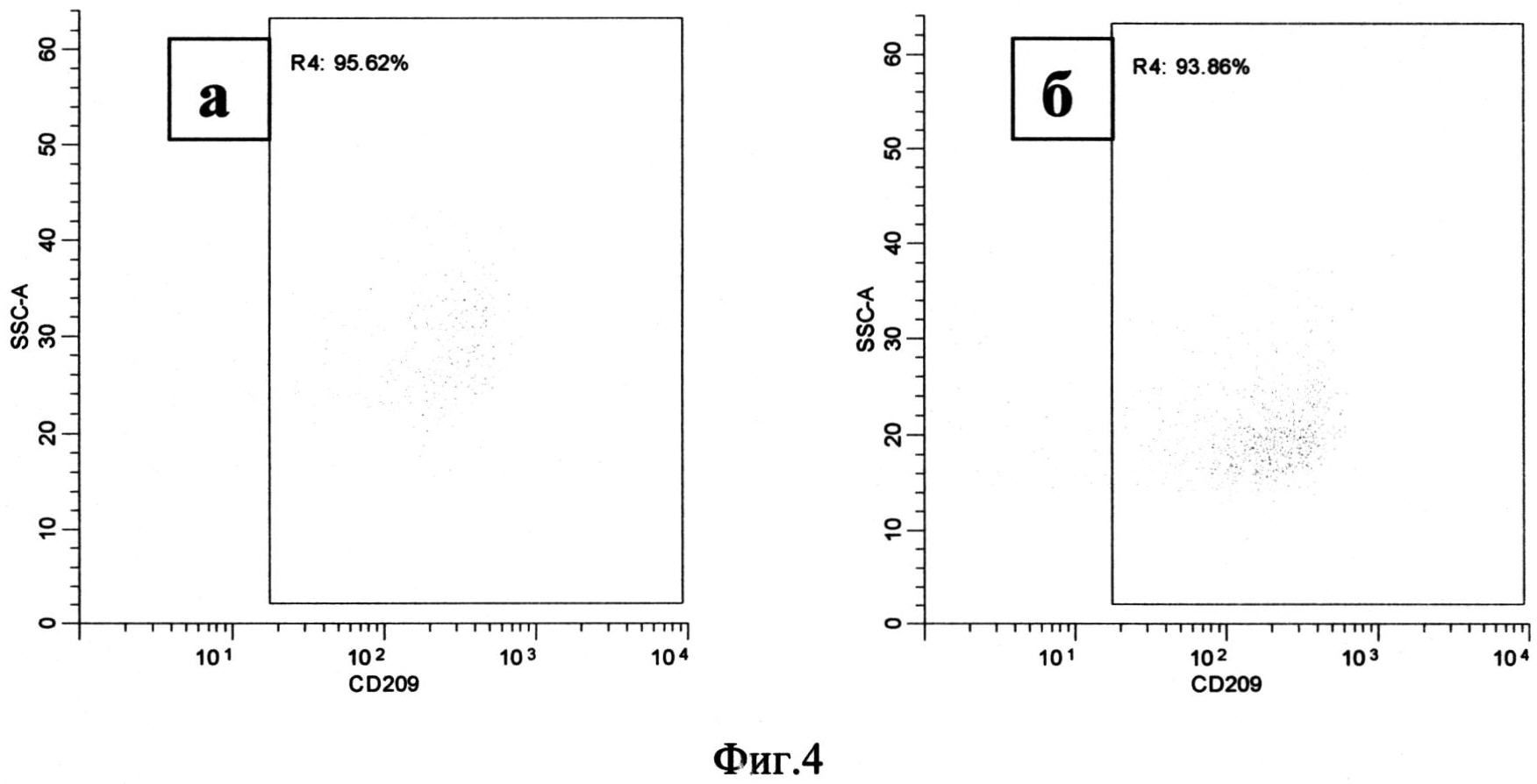
Экспрессия CD209 через 72 часа возросла и составляла 66.20 (53.66-79.00) % клеток в нестимулированной культуре и 80.03 (64.85-87.11)%) клеток в стимулированной аналогом аденозина культуре (Фиг.4, а, б).
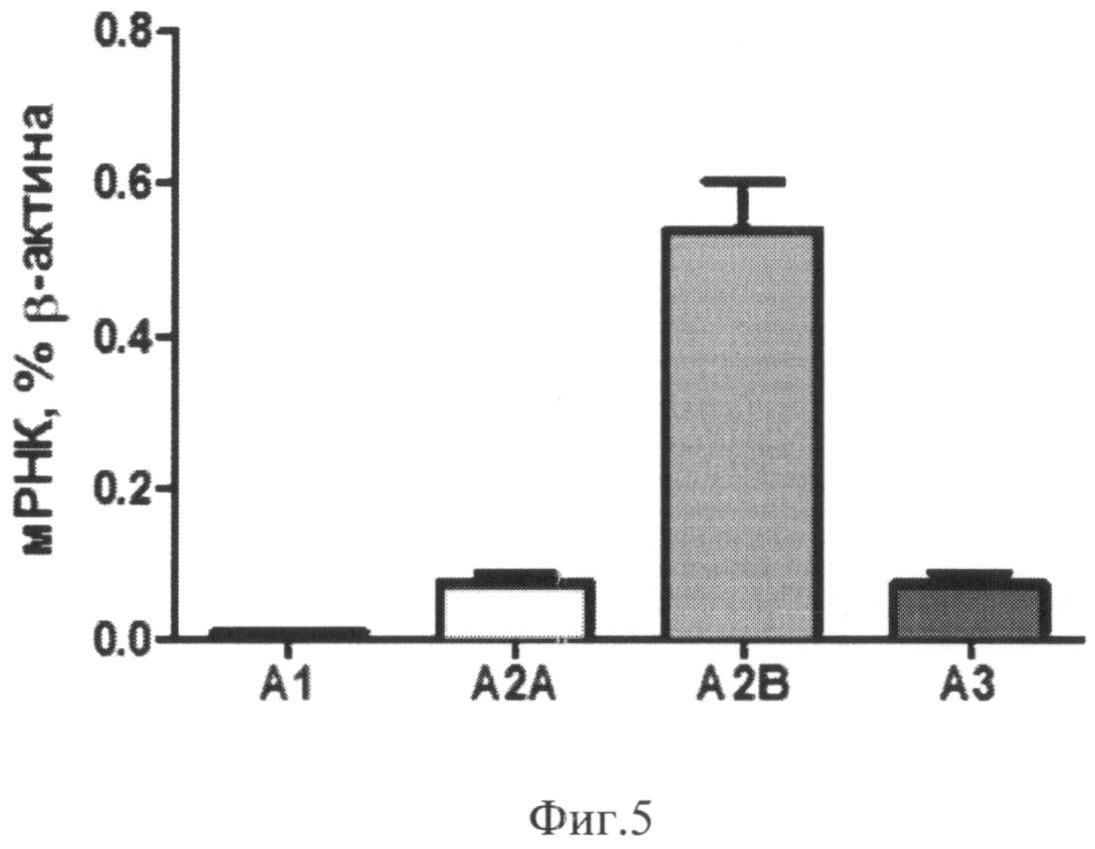
Через 72 часа после начала культивирования экспрессия мРНК аденозиновых рецепторов в клетках нестимулированной культуры возрастает по сравнению с 24-часовой культурой (Фиг.5). Экспрессия мРНК в нестимулированной культуре через 72 часа составляла:
- A1: 0,008±0,002% мРНК β-актина
- A2A: 0,074±0,011% мРНК β-актина
- A2B: 0,542±0,061% мРНК β-актина
- A3: 0,071±0,015% мРНК β-актина.
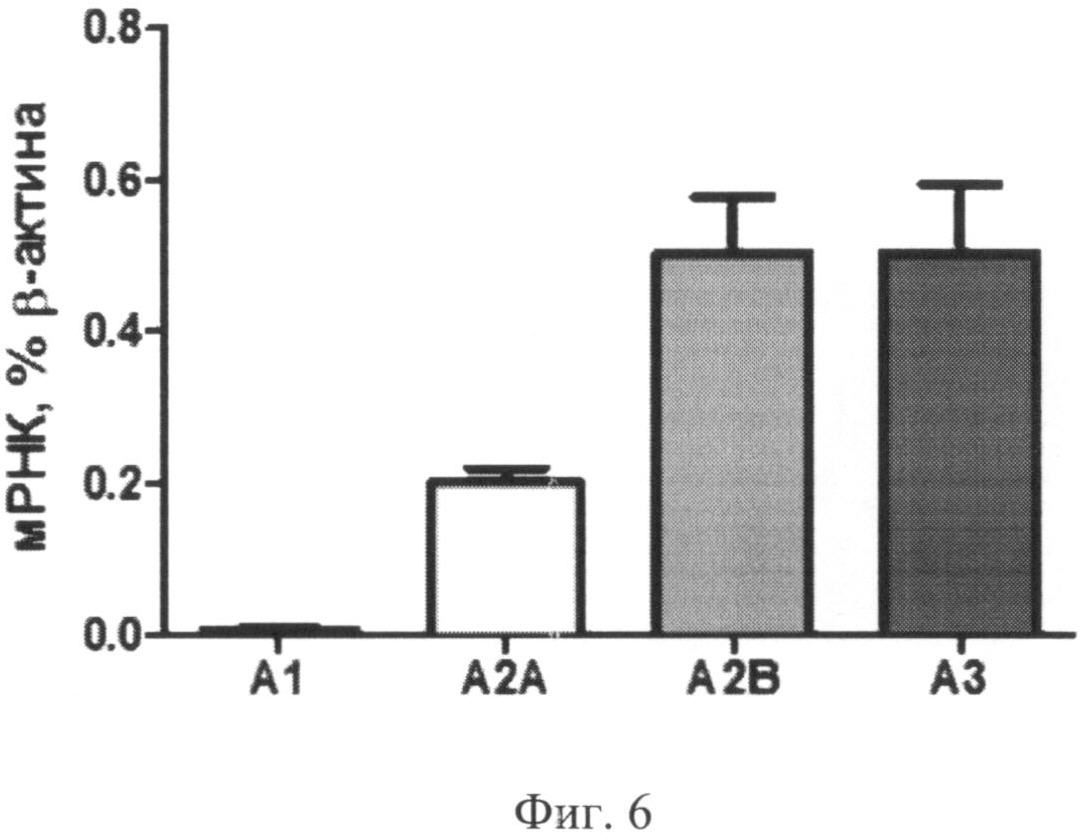
После 72 часов инкубации с 100 µМ NEC A обнаружено существенное увеличение уровня экспрессии A3 аденозинового рецептора по сравнению со всеми другими режимами стимуляции (Фиг.6).
Экспрессия мРНК в стимулированной культуре через 72 часа составляла:
- A1: 0,007±0,002% мРНК β-актина
- A2A: 0,2±0,021% мРНК β-актина
- A2B: 0,503±0,076% мРНК β-актина
- A3: 0,505±0,089% мРНК β-актина.
В качестве примера подтверждения паракринной активности модифицированных моноцитов представлены результаты определения содержания провоспалительных факторов - IL-8 и IL10 в супернатантах клеточных культур.
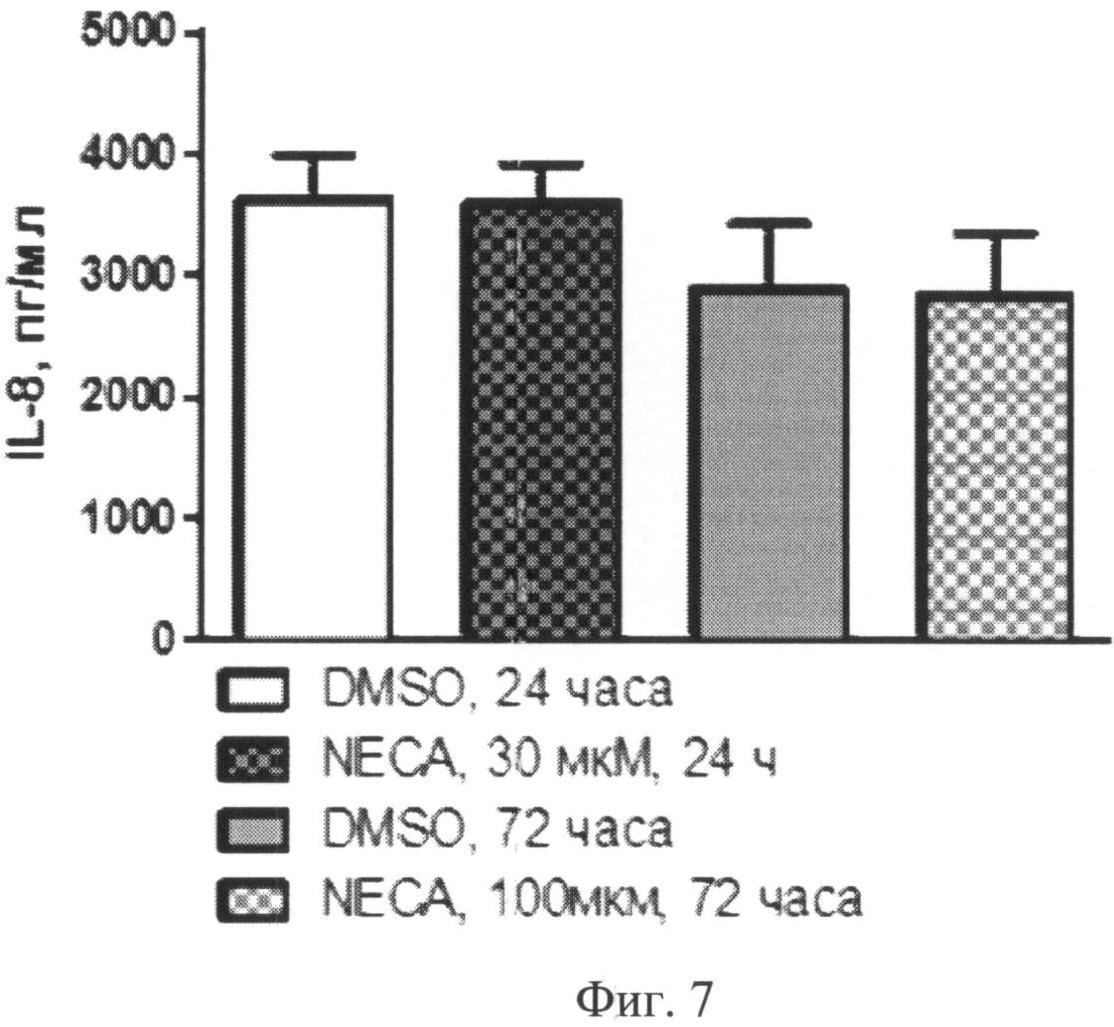
Концентрация IL-8 в супернатантах клеточных культур находилась в следующем соотношении (Фиг.7):
- без стимуляции, через 24 часа: 3268 (1991-5106) пг/мл;
- при стимуляции 30 µМ NECA, через 24 часа: 3555(2620-4806) пг/мл;
- без стимуляции, через 72 часа: 2431 (793,4-4547) пг/мл;
- при стимуляции 100 µМ NEC А, через 72 часа: 1949 (896,1-4424) пг/мл.
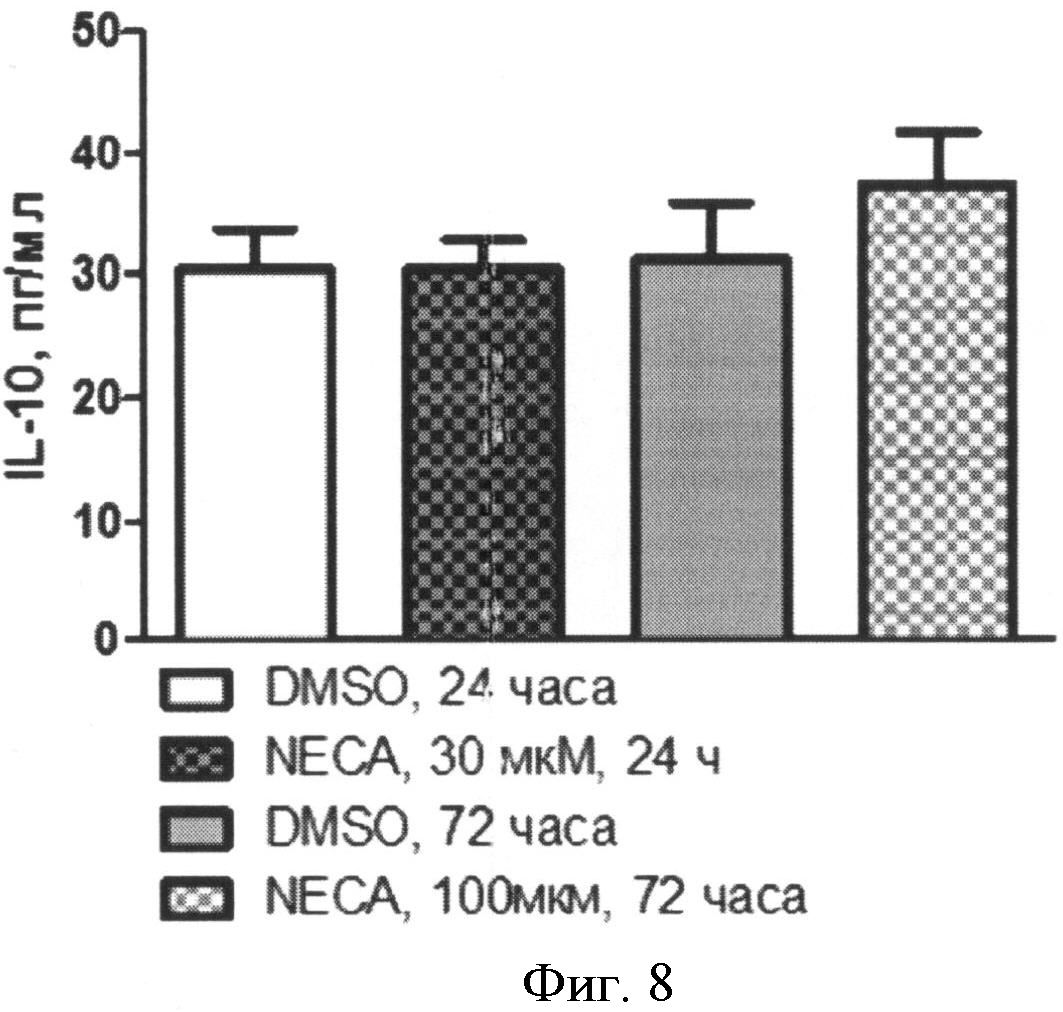
Содержание IL-10 в супернатантах клеточных культур определяли без стимуляции и после стимуляции NECА (Фиг.8). Концентрация IL-10 в супернатантах культур моноцитов составила:
- без стимуляции, через 24 часа: 23,35 (18,85-34,38) пг/мл;
- при стимуляции 30 µМ NECA, через 24 часа: 29,01 (20,15-36,01) пг/мл;
- без стимуляции, через 72 часа: 25,50 (20,40-31,82) пг/мл;
- при стимуляции 100 µМ NECA, через 72 часа: 31,11 (19,9-47,29) пг/мл.
В результате выполнения модификации моноцитов периферической крови негидролизируемым аналогом аденозина NECA для повышения их паракринной активности были обнаружены изменения в иммунофенотипе и профиле аденозиновых рецепторов моноцитов периферической крови. Выявлены различия между режимами стимуляции по эффективности модификации клеток: культивирование клеток в течение 72 часов приводило к более эффективному получению функционально активных моноцитов, способных к секреции паракринных факторов. Определены уровни экспрессии мРНК 10 паракринных факторов различной функциональной активности в культурах моноцитов периферической крови. При стимуляции аденозиновых рецепторов уровни экспрессии одних цитокинов и ростовых факторов повышались (IL-8, VEGF, bFGF, IL-10, IL-6, IP-10, IL-1β, TGF-β), у других оставались на прежнем уровне (HGF, EGF). Также были определены концентрации 10 паракринных факторов в супернатантах культур моноцитов периферической крови без стимуляции и при стимуляции 100 µМ NECA. В ответ на стимуляцию аденозиновых рецепторов 100 µM NECA в течение 72 часов выявлено существенное увеличение продукции фактора VEGF, который является основным ангиогенным фактором, оказывая влияние на рост, миграцию и пролиферацию клеток эндотелия мелких сосудов.
Фиг.1. Распределение моноцитов по размеру (FSC) и гранулярности (SSC) через 72 часа после начала культивирования.
Примечание:
а - моноциты, культивируемые без стимуляции
б - моноциты, культивируемые при добавлении 100 мкМ NECA
R1 - популяция моноцитов
Фиг.2. Распределение моноцитов по количеству CD1a на поверхности клеток, через 72 часа после начала культивирования.
Примечание:
а - моноциты, культивируемые без стимуляции
б - моноциты, культивируемые при добавлении 100 мкМ NECA
R2 - клетки, несущие на своей поверхности кластер дифференциации CD1a
Фиг.3. Распределение моноцитов по количеству CD14 на поверхности клеток, через 72 часа после начала культивирования.
Примечание:
а - моноциты, культивируемые без стимуляции
б - моноциты, культивируемые при добавлении 100 мкМ NECA
R3 - клетки, несущие на своей поверхности кластер дифференциации CD14
Фиг.4. Распределение моноцитов по количеству CD209 на поверхности клеток, через 72 часа после начала культивирования.
Примечание:
а - моноциты, культивируемые без стимуляции
б - моноциты, культивируемые при добавлении 100 мкМ NECA
R4 - клетки, несущие на своей поверхности кластер дифференциации CD209
Фиг.5. Экспрессия мРНК аденозиновых рецепторов в нестимулированной культуре моноцитов через 72 часа после начала культивирования.
Фиг.6. Экспрессия мРНК аденозиновых рецепторов в культуре моноцитов через 72 часа после начала культивирования с добавлением 100 мкМ NECA.
Фиг.7. Содержание IL-8 в супернатантах нестимулированных (DMSO) и стимулированных аналогом аденозина (NECА) культур моноцитов через 24 или 72 часа после начала культивирования.
Фиг.8. Содержание IL-10 в супернатантах нестимулированных (DMSO) и стимулированных аналогом аденозина (NECA) культур моноцитов через 24 или 72 часа после начала культивирования.
Способ модификации моноцитов периферической крови для повышения их паракринной активности при аутологической трансплантации, включающий выделение фракции в клеточной популяции, последующую обработку выделенной фракции производным аденозина, отличающийся тем, что выделяют фракцию периферических мононуклеарных клеток (МНК) из венозной крови, помещают выделенные моноциты в полную питательную культуральную среду с цитокинами и ростовыми факторами, при этом выделение моноцитов из МНК венозной крови проводят с использованием двойного градиента плотности перколла: 1,064 г/мл и 1,032 г/мл соответственно, при комнатной температуре +20°C, после чего выделенные моноциты помещают в полную питательную культуральную среду для адгезии к пластику, затем по истечении 2 часов осуществляют замену полной питательной культуральной среды с добавлением 20 нг/мл IL4 и 20 нг/мл GM-CSF, при этом модификацию моноцитов осуществляют путем стимуляции негидролизируемым аналогом аденозина NECA (5'-N-этилкарбоксамидоаденозина) в концентрации 100 µМ при инкубации клеток в CO-инкубаторе во влажной атмосфере 5% CO при +37°C в течение 72 часов.