Результат интеллектуальной деятельности: НИЗКОМОЛЕКУЛЯРНЫЕ КОНЪЮГАТЫ ПРОТИВООПУХОЛЕВЫХ АГЕНТОВ И ВЫСОКОСЕЛЕКТИВНЫХ ЛИГАНДОВ АСИАЛОГЛИКОПРОТЕИНОВОГО РЕЦЕПТОРА ДЛЯ ТЕРАПИИ ОНКОЛОГИЧЕСКИХ ПАТОЛОГИЙ ПЕЧЕНИ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к области органической и медицинской химии, а также молекулярной биологии и касается способа получения нового класса биологически активных веществ - низкомолекулярных ковалентно связанных конъюгатов противоопухолевых соединений с высокоселективными лигандами асиалогликопротеинового рецептора (ASGP-R), которые могут быть использованы в качестве лекарственных средств для лечения гепатоцеллюлярной карциномы (ГЦК).
Уровень техники
Гепатоцеллюлярная карцинома занимает 5-е по распространенности и 3-е по смертности среди злокачественных опухолей человека. Ежегодно в мире диагностируют более 600000 новых случаев заболевания [Kumar Y. et al. Transarterial therapies for hepatocellular carcinoma: a comprehensive review with current updates and future directions // Asian Рас J Cancer Prev. - 2016. - T. 17. - C. 473-478]. В связи с широким спектром побочных эффектов и высокой общей токсичностью противоопухолевых препаратов, актуальной задачей является поиск систем для их адресной доставки в пораженные ткани. Адресная доставка - перспективный метод модификации лекарственных агентов, позволяющий улучшить фармакологический профиль, локализовать терапевтические агенты в целевой ткани, органе или клетке, повысить терапевтический индекс и эффективность лекарственных препаратов за счет увеличения его действенной концентрации и снижения общего содержания в организме [Maklakova S. Yu. et al. A new approach to the synthesis of ligands of asialoglycoprotein receptor for targeted delivery of oligonucleotides to hepatocytes // Russian Chemical Bulletin. - 2015. - T. 64. - №. 7. - C. 1655-1662]. Асиалогликопротеиновый рецептор (ASGP-R) - одна из наиболее удобных мишеней для адресной доставки лекарственных агентов в клетки печени. Это обусловлено такими факторами, как: 1) высокая селективность ASGP-R по отношению к производным галактозы, 2) расположение ASGP-R только на поверхности гепатоцитов и 3) высокая концентрация (более 500000 рецепторов на каждой клетке) [Spiess М. The asialoglycoprotein receptor: a model for endocytic transport receptors // Biochemistry. - 1990. - T. 29. - №. 43. - C. 10009-10018; Stockert R.J. The asialoglycoprotein receptor: relationships between structure, function, and expression // Physiological reviews. - 1995. - T. 75. - №. 3. - C. 591-609]. Важным преимуществом ASGP-R является механизм рецептор-опосредованного эндоцитоза, за счет которого лекарственный агент попадает в гепатоцит и освобождается от молекулы-доставщика, а рецептор в течение часа возвращается на поверхность мембраны [Bareford L.М., Swaan P.W. Endocytic mechanisms for targeted drug delivery // Advanced drug delivery reviews. - 2007. - T. 59. - №. 8. - C. 748-758]. Характерной особенностью ASGP-R является его повышенная экспрессия в клетке в присутствии биотина [Collins J.С. et al. Biotin-dependent expression of the asialoglycoprotein receptor in HepG2 // J. Biol. Chem. 1988. V. 263. №. 23. P. 11280-11283]. В связи с этим возможна направленная доставка терапевтических молекул в печень с помощью адресных систем, включающих в себя тканеспецифический лиганд на основе N-ацетилгалактозамина и его производных [Maklakova S. Yu. et al. A new approach to the synthesis of ligands of asialoglycoprotein receptor for targeted delivery of oligonucleotides to hepatocytes // Russian Chemical Bulletin. - 2015. - T. 64. - №. 7. - C. 1655-1662].
Существует ряд примеров систем для направленного транспорта противоопухолевых препаратов в клетки ГЦК с помощью лигандов ASGP-R [Ivanenkov Y.A. et al. Modern approaches for treatment of liver diseases via targeted drug delivery strategies // Russ Chem Rev. - 2017. - T. 86]. В подавляющем большинстве это сополимеры, наночастицы, липосомы или мицеллы, модифицированные остатками галактозы или N-ацетилгалактозамина. Например, полимерный носитель PK2, разработанный Pfizer и исследовавшийся в фазе I/II на пациентах с первичным или метастатическим раком печени [Seymour L.W. et al. Hepatic drug targeting: phase I evaluation of polymer-bound doxorubicin // Journal of clinical oncology. - 2002. - T. 20. - №. 6. - C. 1668-1676]. Доксорубицин (Dox) связывался через расщепляемую тетрапептидную последовательность с N-(2-гидроксипропил)метакриламидным сополимером, содержащим фрагменты N-ацетилгалактозамина. Было продемонстрировано, что таким образом можно обеспечить селективный транспорт доксорубицина в клетки, и препарат был рекомендован для дальнейшего исследования (фазы II), которое тем не менее в результате было приостановлено. Основными недостатками высокомолекулярных систем направленного транспорта (мицеллы, наночастицы, липосомы и т.п.), являются: 1) низкая проницаемость через клеточную мембрану и стенки кровеносных сосудов [Ivanenkov Y.A. et al. Modern approaches for treatment of liver diseases via targeted drug delivery strategies // Russ Chem Rev. - 2017. - T. 86; Goodman Т.Т., Olive P.L., Pun S.H. Increased nanoparticle penetration in collagenase-treated multicellular spheroids // International journal of nanomedicine. - 2007. - T. 2. - №. 2. - C. 265]; 2) низкая стабильность в плазме крови [ R. et al. Assessment of the integrity of poly (caprolactone)-b-poly (ethylene oxide) micelles under biological conditions: a fluorogenic-based approach // Langmuir. - 2006. - T. 22. - №. 8. - C. 3570-3578;
R. et al. Assessment of the integrity of poly (caprolactone)-b-poly (ethylene oxide) micelles under biological conditions: a fluorogenic-based approach // Langmuir. - 2006. - T. 22. - №. 8. - C. 3570-3578;  R., Eisenberg A., Maysinger D. Block copolymer micelles as delivery vehicles of hydrophobic drugs: micelle-cell interactions // Journal of drug targeting. - 2006. - T. 14. - №. 6. - C. 343-355; Burt H.M. et al. Development of copolymers of poly (D,L-lactide) and methoxypolyethylene glycol as micellar carriers of paclitaxel // Colloids and Surfaces B: Biointerfaces. - 1999. - T. 16. - №. 1. - C. 161-171]; 3) сравнительно короткое время полувыведения [Hong М. et al. Efficient tumor targeting of hydroxycamptothecin loaded PEGylated niosomes modified with transferrin // Journal of Controlled Release. - 2009. - T. 133. - №. 2. - C. 96-102].
R., Eisenberg A., Maysinger D. Block copolymer micelles as delivery vehicles of hydrophobic drugs: micelle-cell interactions // Journal of drug targeting. - 2006. - T. 14. - №. 6. - C. 343-355; Burt H.M. et al. Development of copolymers of poly (D,L-lactide) and methoxypolyethylene glycol as micellar carriers of paclitaxel // Colloids and Surfaces B: Biointerfaces. - 1999. - T. 16. - №. 1. - C. 161-171]; 3) сравнительно короткое время полувыведения [Hong М. et al. Efficient tumor targeting of hydroxycamptothecin loaded PEGylated niosomes modified with transferrin // Journal of Controlled Release. - 2009. - T. 133. - №. 2. - C. 96-102].
В отличие от высокомолекулярных систем доставки, в литературе практически не описаны низкомолекулярные конъюгаты лигандов ASGP-R с противоопухолевыми препаратами, в которых векторный фрагмент и действующее вещество соединены с помощью сравнительно небольшого биоразлагаемого фрагмента (линкера). Хотя добавление галактозного фрагмента в структуру низкомолекулярных конъюгатов достаточно распространенно [Ma Y. et al. Galactose as Broad Ligand for Multiple Tumor Imaging and Therapy // Journal of Cancer. - 2015. - T. 6. - №.7. - C. 658-670; Melisi D. et al. D-Galactose as a vector for prodrug design // Current topics in medicinal chemistry. - 2011. - T. 11. - №. 18. - C. 2288-2298], данные работы не рассматривают его в качестве лиганда ASGP-R, а в частности предполагают увеличение растворимости в водных растворах и сродство к другому рецептору. Заявляемое изобретение представляет собой первый случай, описывающий конъюгаты противоопухолевых лекарственных соединений, связанных с ASGP-R-специфическим лигандом через относительно короткий биодеградируемый линкер. Был произведен синтез новых лигандов асиалогликопротеинового рецептора на основе производных N-ацетилгалактозамина, а также синтез их ковалентно связанных низкомолекулярных конъюгатов с противоопухолевыми лекарственными средствами и биологические испытания полученных конъюгатов на клеточных линиях HepG2, Hek293.
Раскрытие изобретения
Задачей настоящего изобретения является создание новых низкомолекулярных ковалентно связанных конъюгатов противоопухолевых лекарственных соединений с лигандами асиалогликопротеинового рецептора на основе производных N-ацетилгалактозамина для терапии онкологических заболеваний печени.
Техническим результатом является получение новых соединений, обладающих выраженной аффинностью к асиалогликопротеиновому рецептору и токсичностью по отношению к клеточным линиям гепатоцеллюлярной карциномы, низкой токсичностью по отношению к другим тканям и улучшенной биодоступностью действующего противопухолевого соединения.
Поставленная задача решается низкомолекулярными конъюгатами противоопухолевых соединений с лигандами асиалогликопротеинового рецептора на основе производных N-ацетилгалактозамина, общей структурной формулы:
где лиганд представляет собой производное N-ацетилгалактозамина структурных формул 1, 2, 3:

a «Antineoplastic agent» (противоопухолевое соединение) представляет собой соединение, содержащее свободную гидроксильную или амино группу, образующую ковалентную связь с лигандом и обладающее противоопухолевым действием для терапии онкологических заболеваний печени. При этом в качестве противоопухолевого соединения, содержащего свободную гидроксильную предпочтительно использовать паклитаксел, или гемцитабин, или цитарабин, или азацитидин, а в качестве противоопухолевого соединения, содержащего свободную амино группу предпочтительно использовать доксорубицин (Dox*HCl) или даунорубицин. Лиганды формул 1, 2 и 3 характеризуются аффинностью к асиалогликопротеиновому рецептору и предназначены для доставки противоопухолевых соединений, используемых при терапии гепатоцеллюлярной карциномы.
Способ получения низкомолекулярных конъюгатов, заключается в проведении двух последовательных реакций, сначала реакции карбодиимидного синтеза путем смешения противоопухолевого соединения и алкиниловой кислоты с терминальной тройной связью, взятых из расчета, что на 1 мольный эквивалент противоопухолевого соединения берут не менее 1.0 эквивалента алкиниловой кислоты с терминальной тройной связью, в присутствии активатора карбоксильной группы, взятом из расчета на 1 мольный эквивалент алкиниловой кислоты берут 1 эквивалент активатора карбоксильной группы, в среде, обеспечивающей протекание реакции карбодиимидного синтеза, и выделение промежуточного продукта путем колоночной хроматографии - противоопухолевого соединения, модифицированного алкинильной кислотой с теминальной тройной связью, а затем реакции [3+2] азид-алкинового циклоприсоединения посредством смешения промежуточного продукта и компонента, содержащего азидо-группу, в присутствии катализатора - соединения одновалентной меди, в среде, обеспечивающей протекание реакции циклоприсоединения, при этом на 1 мольный эквивалент промежуточного продукта используют по меньшей мере 1.0 эквивалент компонента, содержащего азидо-группу, и по меньшей мере 0.2 эквивалент катализатора, после прохождения реакции осуществляют удаление среды с последующим выделением конечного продукта при помощи колоночной хроматографии. Предпочтительно в качестве противоопухолевого соединения использовать паклитаксел, или гемцитабин, или цитарабин, или азацитидин, или доксорубицин (Dox*HCl), или даунорубицин, при этом в качестве алкиниловой кислоты с терминальной тройной связью использовать проп-2-иновую кислота, бут-3-иновую кислота, пент-4-иновую кислота, гекс-5-иновую кислота, гепт-6-иновую кислоту, а в качестве среды, обеспечивающей протекание реакции карбодиимидного синтеза, использовать ДМФА (диметилформамид), CH2Cl2 (дихлорметан), CHCl3 (хлороформ), тетрогидрофуран, ClCH2CH2Cl (1,2-дихлорэтан). В качестве активатора карбоксильной группы предпочтительно использовать растворимые в среде, обеспечивающей протекание реакции карбодиимидного синтеза, карбодиимиды, а именно 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), N,N'-диизопропилкарбодиимид (DIC), N,N'-дициклогексилкарбодиимид (DCC). Выделение промежуточного продукта предпочтительно проводить с использованием прямой колоночной хроматографии в системе с градиентом концентраций CH2Cl2:МеОН (10:1) → МеОН. Для проведения реакции [3+2] азид-алкинового циклоприсоединения в качестве компонента, содержащего азидо-группу предпочтительно использовать производное N-ацетилгалактозамина, выбранное из группы, включающей 1-Азидо-1-дезокси-2-ацетамидо-2-дезокси-β-D-галактопиранозу, 1-O-(2'-азидоэтил)-2-ацетамидо-2-дезокси-β-D-галактопиранозу, 1-О-Аллил-2-ацетамидо-2-дезокси-6-азидо-6-дезокси-β-D-галактопиранозы. При этом в качестве соединения одновалентной одновалентной меди, предпочтительно использовать одновалентные соли меди растворимые в среде, обеспечивающей прохождение реакции циклоприсоединения, а именно иодид меди (CuI), бромид меди (CuBr), хлорид меди (CuCl), а в качестве среды, обеспечивающей протекание реакции [3+2] азид-алкинового циклоприсоединения, предпочтительно использовать ДМФА, смесь вода-тетрогидрофуран в объемном соотношении 1:1, диметилсульфоксид (ДМСО). Для выделения конечного продукта - низкомолекулярного конъюгата предпочтительно использовать обращено-фазовую колоночную хроматографию в системе Н2О-MeCN.
Для получения низкомолекулярного конъюгата с противоопухолевым соединением, включающим доступную для модификации аминогруппу, в качестве которых предпочтительно использовать доксорубицин или даунорубицин, сначала получают лиганд формул 1, 2 и 3 путем проведения реакции [3+2] азид-алкинового циклоприсоединения посредством смешения соединения, содержащего терминальный алкильный фрагмент, и соединения, содержащего азидо-группу, взятых в мольном соотношении 1:1, в присутствии катализатора - соли одновалентной меди, взятой из расчета на 1 мольный эквивалент компонента, содержащего азидо-группу, по меньшей мере 0.25 эквивалента катализатора в среде обеспечивающей протекание реакции циклоприсоединения, после прохождения реакции удаляют среду и выделяют лиганд при помощи колоночной хроматографии, с последующим проведением реакции карбодиимидного синтеза между полученным лигандом и противоопухолевым соединением с доступной для модификации аминогруппой, взятых в мольном соотношении 1:1, в присутствии активатора карбоксильной группы, взятом из расчета на 1 мольный эквивалент лиганда по п. 1 не менее 1 эквивалента активатора, в ДМФА, после прохождения реакции удаляют ДМФА и выделяют конъюгат при помощи колоночной хроматографии. При этом в качестве среды, обеспечивающей протекание реакции [3+2] азид-алкинового присоединения, используют ДМФА, смесь вода-тетрогидрофуран в объемном соотношении 1:1, ДМСО. В качестве соединения, содержащего терминальный алкиновый фрагмент, предпочтительно использовать алкиниловые кислоты с терминальной тройной связью, а именно проп-2-иновую кислоту, бут-3-иновую кислоту, пент-4-иновую кислоту, гекс-5-иновую кислоту, гепт-6-иновую кислоту, а в качестве соединения, содержащего азидо-группу предпочтительно использовать производные N-ацетилгалактозамина, а именно 1-Азидо-1-дезокси-2-ацетамидо-2-дезокси-β-D-галактопиранозу, 1-O-(2'-азидоэтил)-2-ацетамидо-2-дезокси-β-D-галактопиранозу, 1-O-аллил-2-ацетамидо-2-дезокси-6-азидо-6-дезокси-β-D-галактопиранозу. Предпочтительно в качестве солей одновалентной меди использовать растворимые в среде, обеспечивающей прохождение реакции циклоприсоединения, соли меди, а именно CuI, CuBr, CuCl. Пр этом для выделения полученного лиганда предпочтительно использовать прямую колоночную хроматографию системе с градиентом концентраций CH2Cl2:МеОН (10:1) → МеОН. При проведении реакции карбодиимидного синтеза в качестве активатора карбоксильной группы предпочтительно использовать растворимые в ДМФА карбодиимиды, а именно 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), N,N'-диизопропилкарбодиимид (DIC), N,N'-дициклогексилкарбодиимид (DCC). Для выделения полученного конъюгата предпочтительно использовать две последовательные колоночные хроматографии прямую колоночную хроматографию системе с градиентом концентраций CH2Cl2:МеОН (20:1) → МеОН и обращено-фазовую колоночную хроматографию в системе Н2О-MeCN.
Краткое описание чертежей
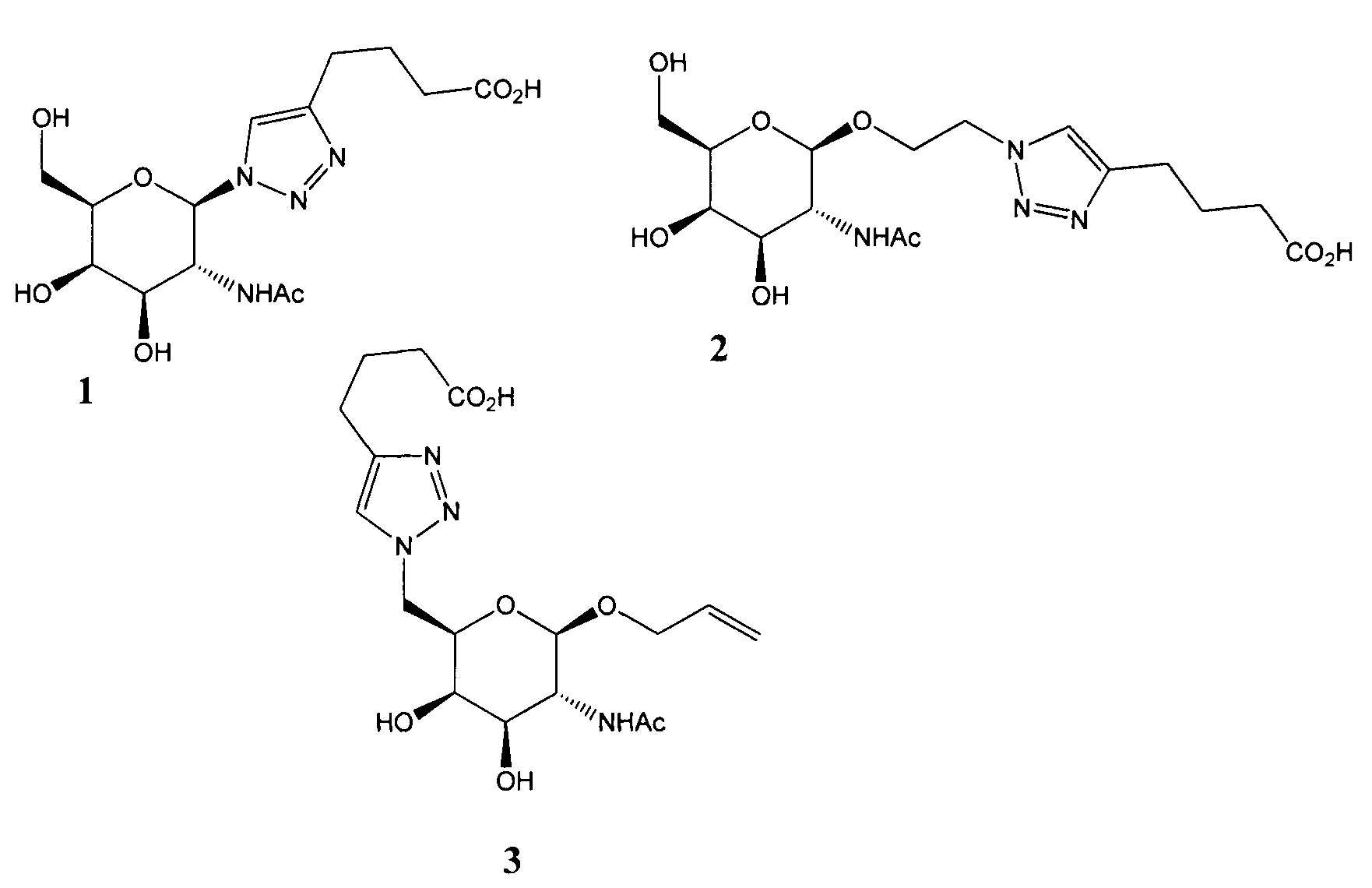
На фиг. 1 представлены снимки, сделанные при помощи микроскопа, конъюгатов (4) - А, (5) - В, (6) - С. Время инкубирования - 24 часа.
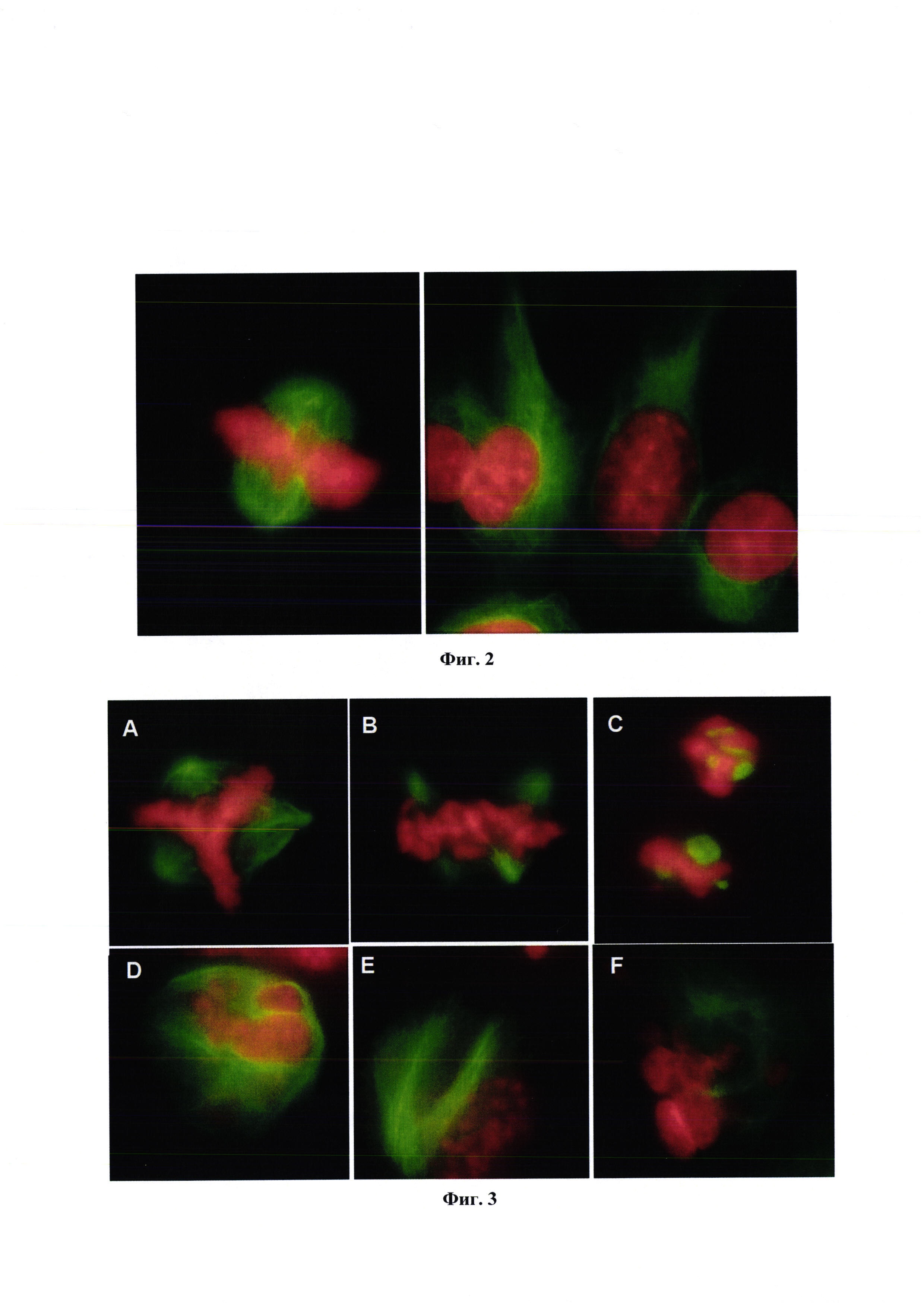
На фиг. 2 представлены снимки необработанных клеток Hepg2, которые фиксировали, пермеабилизировали и иммунизировали антителом против α-тубулина
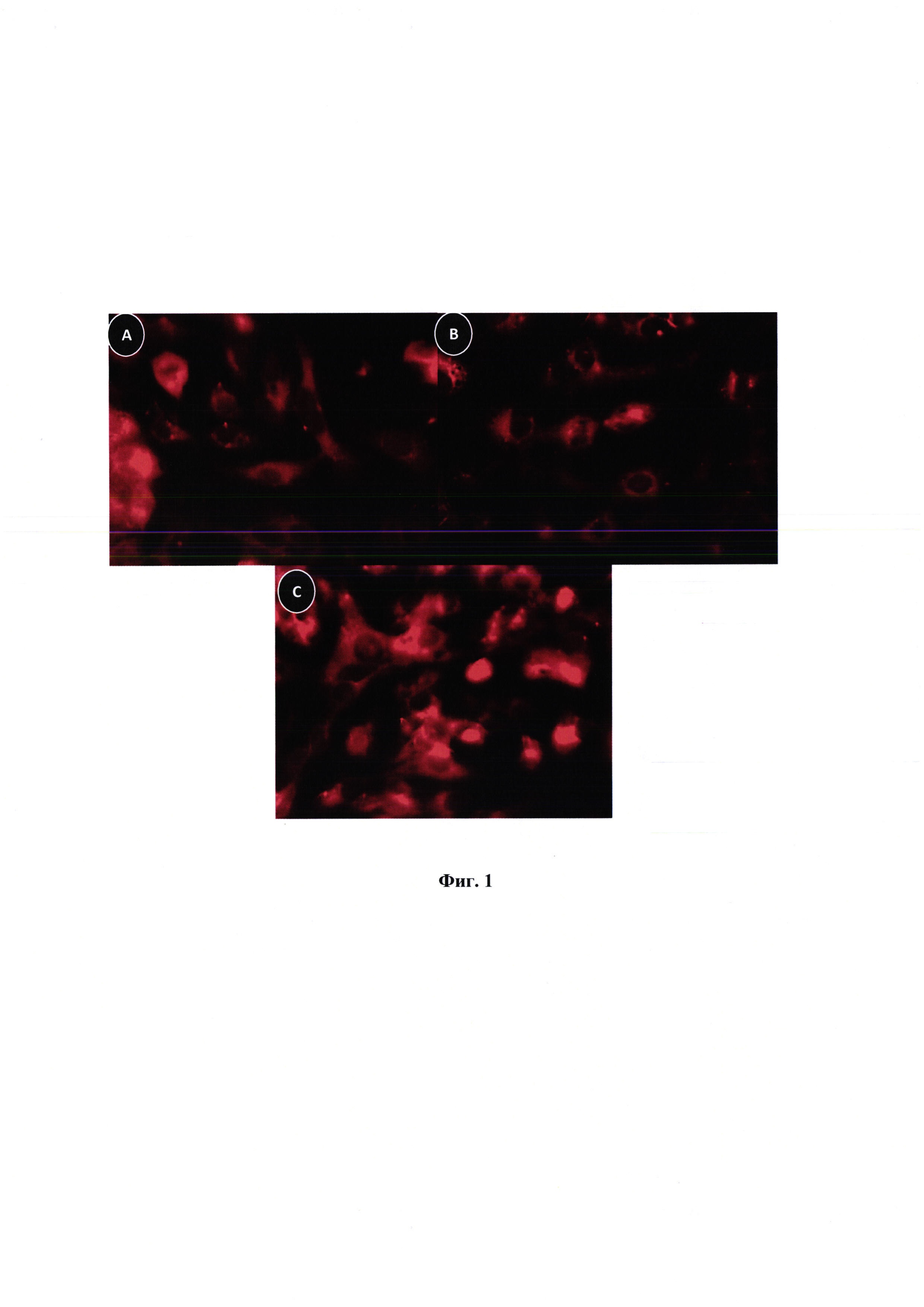
На фиг. 3 представлены снимки клеточной линии Hepg2, обработанных конъюгатами (8-10). Клетки фиксировали, пермеабилизировали и иммунизировали антителом против α-тубулина. На снимках: А - клетки после обработки конъюгатом 8 (6 часов), В - клетки после обработки конъюгатом 8 (39 часов), С - клетки после обработки конъюгатом 9 (3 часа), D - клетки после обработки конъюгатом 9 (17 часа), Е - клетки после обработки конъюгатом 10 (24 часа), F - клетки после обработки конъюгатом 9 (17 часов).
Осуществление изобретения
Ниже приведены определения терминов, которые используются в описании настоящего изобретения.
«Асиалогликопротеиновый рецептор (ASGP-R)» - трансмембранный белок, преимущественно экспрессируемый гепатоцитами, селективно распознающий производные D-галактозы и D-галактозамина и участвующий в их транспорте в клетку.
«Конъюгат» - комплекс, формирующийся при помощи ковалентных связей между противоопухолевым соединенем и его лигандом-носителем.
«Лиганд» - химическое соединение, которое образует нековалентный комплекс с той или иной биомолекулой (чаще всего белком, например клеточным рецептором, но иногда, например, с ДНК) и производит, вследствие такого связывания, те или иные биохимические, физиологические или фармакологические эффекты.
«Противоопухолевое лекарственное соединение (агент)» - вещество, используемое в качестве активного компонента в препаратах для лечения онкологических заболеваний. Примеры используемых противоопухолевых агентов и их ковалентная связь с заявляемым лигандом приведены на схеме (I)
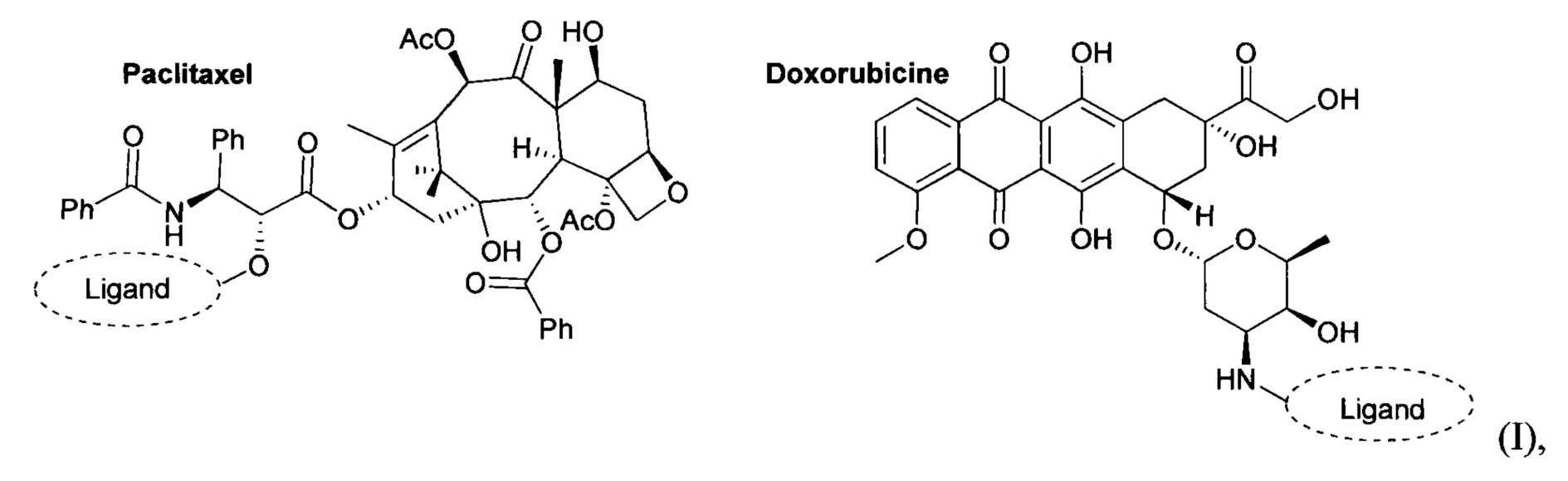
где «Ligand» (лиганд) - это выше описанные производные N-ацетилгалактозамина с структурными формулами 1, 2, 3.
Все используемые реагенты являются коммерчески доступными, выпаривание растворителя осуществляли с использованием роторного испарителя, при пониженном давлении при температуре бани примерно 50°С; контроль за ходом реакции осуществляли при помощи тонкослойной хроматографии (ТСХ), и время реакции указано только для иллюстрации; структуру и чистоту всех выделенных соединений подтверждали, по меньшей мере, одним из следующих методов: ТСХ (пластины для ТСХ с предварительно нанесенным силикагелем 60 F254 Merck), масс-спектрометрия или ядерный магнитный резонанс (ЯМР). Выход продукта приведен только для иллюстрации. Колоночную флэш-хроматографию осуществляли, используя Merck силикагель 60 (230-400 меш ASTM). Масс-спектры высокого разрешения (HRMS) зарегистрированы на спектрометре Bruker microTOF II. Спектры ЯМР регистрировали на приборах Bruker Avance-400 (рабочая частота 400.1 и 100.6 МГц для 1Н и 13С, соответственно) и Agilent 400-MR (рабочая частота 400.0 и 100.6 МГц для 1Н и 13С, соответственно), используя дейтерированный хлороформ (99,8% D) или метанол (99.9%) или ДМСО (99,9% D) в качестве растворителя, если не указано иное, относительно тетраметилсилана (TMS) в качестве внутреннего стандарта, миллионных долях (м.д.); обычные используемые сокращения следующие: с - синглет, д - дублет, т - триплет, кв - квартет, м - мультиплет, шир. - широкий и так далее.
Способ получения конъюгатов противоопухолевых лекарственных соединений с лигандами асиалогликопротеинового рецептора на основе производных N-ацетилгалактозамина для терапии онкологических заболеваний печени проводят по реакции карбодиимидного синтеза с последующей реакцией [3+2] азид-алкинового циклоприсоединения. Для противоопухолевых соединений с доступной для модификации аминогруппой возможен путь синтеза с первоначальным получением лиганда путем реакции [3+2] азид-алкинового циклоприсоединения и последующим проведением реакции карбодиимидного синтеза между лигандом и противоопухолевым соединением.
Образование конъюгата лиганда асиалогликопротеинового рецептора на основе производных N-ацетилгалактозамина с противоопухолевыми соединениями, содержащими амино и гидроксильную группы, доступные для ацилирования алкиновой кислотой с терминальной тройной связью, заключается двух последовательных реакциях. Сначала проводят модификацию противоопухолевого соединения алкиновой кислотой с терминальной тройной связью при помощи реакции карбодиимидного синтеза, которая осуществляется посредством смешения противоопухолевого соединения и алкиновой кислоты с терминальной тройной связью в присутствии активатора карбоксильной группы в среде, обеспечивающей протекание реакции карбодиимидного синтеза, при этом на 1 мольный эквивалент противоопухолевого соединения берут не менее 1 эквивалента кислоты и не менее 1.0 эквивалента активатора карбоксильной группы. После чего проводят выделение противоопухолевого соединения, модифицированного алкиновой кислотой с терминальной тройной связью, путем прямой колоночной хроматографии в системе с градиентом концентраций CH2Cl2:МеОН (10:1) → МеОН. Затем проводят реакцию [3+2] азид-алкинового циклоприсоединения посредством смешения модифицированного противоопухолевого соединения, содержащего терминальный алкильный фрагмент, и соединения, содержащего азидо-группу в мольном соотношении из расчета, что на 1 мольный эквивалент соединения, содержащего азидо-группу, используют по меньшей мере 1.0 эквивалента соединения, содержащего терминальный алкильный фрагмент. Реакцию проводят в присутствии катализатора - соединения одновалентной меди, взятого из расчета на 1 мольный эквивалент соединения, содержащего азидо-группу берут по меньшей мере 0.2 эквивалент катализатора, при этом реакцию проводят в среде, обеспечивающей растворение соединений. После прохождения реакции осуществляют удаление среды с последующим выделением продукта при помощи колоночной хроматографии.
В качестве противоопухолевого соединения используют паклитаксел, или гемцитабин, или цитарабин, или азацитидин, или доксорубицин, или даунорубицин.
В качестве алкиниловой кислоты с терминальной тройной связью используют проп-2-иновую кислота, бут-3-иновую кислота, пент-4-иновую кислота, гекс-5-иновую кислота, гепт-6-иновую кислоту.
В качестве среды, обеспечивающей протекание реакции карбодиимидного синтеза, используют диметилформамид, дихлорметан, хлороформ, тетрогидрофуран, 1,2-дихлорэтан.
В качестве активатора карбоксильной группы используют растворимые в среде, обеспечивающей протекание реакции карбодиимидного синтеза, карбодиимиды: 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), N,N'-диизопропилкарбодиимид (DIC), N,N'-дициклогексилкарбодиимид (DCC).
Для выделения промежуточного продукта используют прямую колоночную хроматографию в системе с градиентом концентраций CH2Cl2:МеОН (10:1) → МеОН.
В качестве среды, обеспечивающей протекание реакции [3+2] азид-алкинового циклоприсоединения, используют ДМФА, смесь вода-тетрогидрофуран в объемном соотношении 1:1, ДМСО или любой другой растворитель, обеспечивающий растворение и инертный к компонентам смеси.
В качестве компонента, содержащего азидо-группу - производные N-ацетилгалактозамина: 1-Азидо-1-дезокси-2-ацетамидо-2-дезокси-β-D-галактопиранозу, 1-O-(2'-азидоэтил)-2-ацетамидо-2-дезокси-β-D-галактопиранозу, 1-O-аллил-2-ацетамидо-2-дезокси-6-азидо-6-дезокси-β-D-галактопиранозу.
В качестве катализатора - соединений одновалентной меди используют любую растворимую в среде, обеспечивающей прохождение реакции циклоприсоединения, соль одновалентной меди. Например, CuI, CuBr, CuCl и т.п.
Для выделения полученного продукта используют обращено-фазовую колоночную хроматографию в системе Н2О-MeCN.
Верхняя граница содержания используемых реагентов не ограничивается, т.к. избыток какого-либо реагента не уменьшает выходов реакций, однако при большом избытке может понадобиться дополнительная очистка продуктов реакций.
Для противоопухолевых соединений с доступной для модификации аминогруппой присоединение лиганда проводят следующим образом.
На первом этапе получают заявляемые лиганды путем проведения реакции [3+2] азид-алкинового циклоприсоединения посредством смешения соединения, содержащего терминальный алкильный фрагмент, и соединения, содержащего азидо-группу, при этом на 1.0 мольный эквивалент соединения, содержащего азидо-группу, используют по меньшей мере 1.0 эквивалента соединения, содержащего терминальный алкильный фрагмент. Реакцию проводят в присутствии катализатора - соединения одновалентной меди, взятую в количестве из расчета по меньшей мере 0.25 эквивалент катализатора на 1.0 мольный эквивалент соединения, содержащего азидо-группу. Реакцию проводят в среде, обеспечивающей растворение компонентов. При этом в качестве среды, обеспечивающей растворение соединений, используют ДМФА, смесь вода-тетрогидрофуран в объемном соотношении 1:1, ДМСО или любой другой растворитель, обеспечивающий растворение и инертный к компонентам смеси. После прохождения реакции осуществляют удаление среды с последующим выделением продукта при помощи колоночной хроматографии.
В качестве соединений, содержащих терминальный алкиновый фрагмент, используют алкиниловые кислоты с терминальной тройной связью. Длина углеродного фрагмента кислоты не имеет принципиального значения, в качестве алкиниловой кислоты с терминальной тройной связью может выступать: проп-2-иновая кислота, бут-3-иновая кислота, пент-4-иновая кислота, гекс-5-иновая кислота, гепт-6-иновая и т.д.
В качестве компонента, содержащего азидо-группу, используют производные N-ацетилгалактозамина: 1-Азидо-1-дезокси-2-ацетамидо-2-дезокси-β-D-галактопиранозу, 1-O-(2'-азидоэтил)-2-ацетамидо-2-дезокси-β-D-галактопиранозу, 1-O-Аллил-2-ацетамидо-2-дезокси-6-азидо-6-дезокси-β-D-галактопиранозу.
В качестве катализатора - соединения одновалентной меди используют любую растворимую в среде, обеспечивающей прохождение реакции циклоприсоединения, соль одновалентной меди. Например, CuI, CuBr, CuCl и т.д.
Для выделения полученного продукта используют прямую колоночную хроматографию системе с градиентом концентраций CH2Cl2:МеОН (10:1) → МеОН.
Образование конъюгата полученного лиганда асиалогликопротеинового рецептора на основе производных N-ацетилгалактозамина с противоопухолевыми соединениями с доступной для модификации аминогруппой заключается в проведении реакции карбодиимидного синтеза посредством смешения соединения, содержащего карбоксильную группу - лиганда формулы 1, или 2, или 3, соответственно, и противоопухолевого соединения, включающего аминогруппу, например доксорубицина или даунорубицина, в мольном соотношении 1:1, в присутствии активатора карбоксильной группы. При этом количество активатора берут из расчета на 1,0 мольный эквивалент противоопухолевого агента по меньшей мере 1.1 эквивалент активатора. Реакцию карбодиимидного синтеза проводят в среде, обеспечивающей растворение соединений и инертной к компонентам смеси. Предпочтительно использовать ДМФА. После прохождения реакции осуществляют удаление среды с последующим выделением продукта при помощи колоночной хроматографии.
В качестве активаторов карбоксильной группы используют любой активатор карбоксильной группы карбодиимидного ряда, например: 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC), N,N'-диизопропилкарбодиимид (DIC), N,N'-дициклогексилкарбодиимид (DCC) и т.п
Для выделения полученного продукта используют две последовательные колоночные хроматографии прямую колоночную хроматографию системе с градиентом концентраций CH2Cl2:МеОН (20:1) → МеОН и обращено-фазовую колоночную хроматографию в системе Н2О-MeCN.
Представленные ниже примеры иллюстрируют, но не ограничивают настоящее изобретение.
Пример 1. Получение 4-(1-(3-ацетамидо-4,5-дигидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил)-1Н-1,2,3-триазол-4-ил)бутановой кислоты (1).
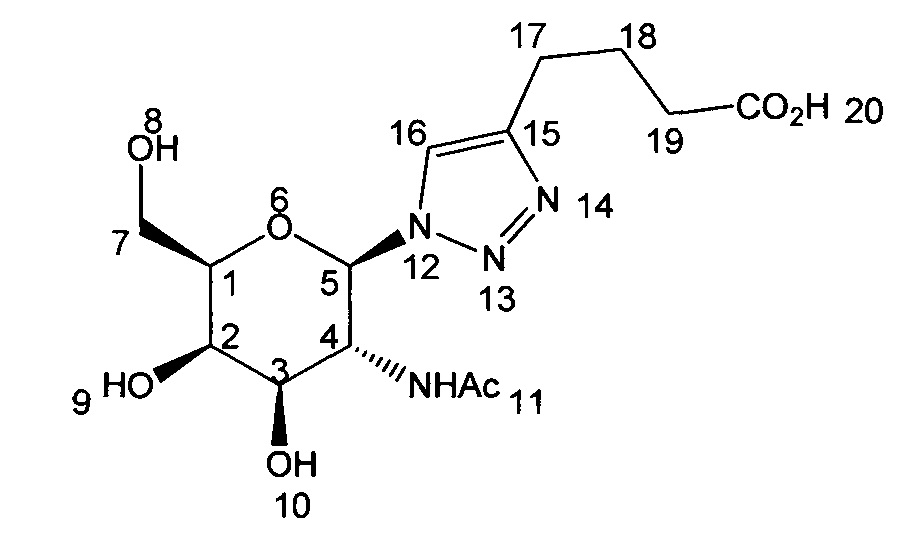
К раствору 108 мг (0,44 ммоль) 1-Азидо-1-дезокси-2-ацетамидо-2-дезокси-β-D-галактопиранозы, полученной согласно методике, описанной в работе [ N. et al. Iron (III) chloride as an efficient catalyst for stereoselective synthesis of glycosyl azides and a cocatalyst with Cu (0) for the subsequent click chemistry // Chemical Communications. - 2011. - T. 47. - №. 37. - C. 10440-10442], в 15 мл сухого ДМФА добавили 60 мг (0,528 ммоль, 1,2 экв.) гекс-5-иновой кислоты и 21 мг (0,11 ммоль, 0,25 экв.) CuI. Полученную смесь перемешивали в течение 48 часов, затем ДМФА удалили на роторном испарителе. Полученное вещество очищали методом колоночной хроматографии в системе с градиентом концентраций CH2Cl2:МеОН (10:1) → МеОН. В результате получили соединение 1 в виде светло-желтого аморфного вещества 125 мг (79%).
N. et al. Iron (III) chloride as an efficient catalyst for stereoselective synthesis of glycosyl azides and a cocatalyst with Cu (0) for the subsequent click chemistry // Chemical Communications. - 2011. - T. 47. - №. 37. - C. 10440-10442], в 15 мл сухого ДМФА добавили 60 мг (0,528 ммоль, 1,2 экв.) гекс-5-иновой кислоты и 21 мг (0,11 ммоль, 0,25 экв.) CuI. Полученную смесь перемешивали в течение 48 часов, затем ДМФА удалили на роторном испарителе. Полученное вещество очищали методом колоночной хроматографии в системе с градиентом концентраций CH2Cl2:МеОН (10:1) → МеОН. В результате получили соединение 1 в виде светло-желтого аморфного вещества 125 мг (79%).
1Н ЯМР (400 МГц, CD3OD, δ, м.д.): 8.03 (с, 1Н, Н-16); 5.75 (д, 1H, J=9.8 Гц, Н-5); 4.51-4.63 (м, 1Н, Н-1); 4.06 (д, 1Н, J=3.1 Гц, Н-2); 4.21-4.30 (м, 1Н, Н-3); 3.73-3.97 (м, 4Н, Н-3,4,7); 2.68-2.80 (м, 2Н, Н-17); 2.20-2.32 (м, 2Н, Н-19); 1.88-2.01 (м, 2Н, Н-18); 1.79 (с, 1H, -NHAc).
МСВР (m/z) для C14H22N4O7: [М+Н]+ 359.1561 (найдено), 359.1562 (рассч.); [M+Na]+ 381.1381 (найдено), 381.1381 (рассч.).
Пример 2. Получение 4-(1-(2-((3-ацетамидо-4,5-дигидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил)окси)этил)-1Н-1,2,3-триазол-4-ил)бутановой кислоты (2).

К раствору 30 мг (0,103 ммоль) 1-O-(2'-азидоэтил)-2-ацетамидо-2-дезокси-β-D-галактопиранозы, полученной согласно методике, описанной в работе [Hasegawa A. et al. Studies on the thioglycosides of N-acetylneuraminic acid 10: Synthesis of S-(α-sialosyl)-(2→6)-O-2-acetamido-2-deoxy-β-d-hexopyranosyl ceramide and its related compounds // Journal of carbohydrate chemistry. - 1992. - T. 11. - №. 3. - C. 319-331], в 15 мл сухого ДМФА добавили 13,9 мг (0,124 ммоль, 1,2 экв.) гекс-5-иновой кислоты и 4,9 мг (0,026 ммоль, 0,25 экв.) CuI. Полученную смесь перемешивали в течение 48 часов, затем ДМФА удалили на роторном испарителе. Полученное вещество очищали методом колоночной хроматографии в системе с градиентом концентраций CH2Cl2:МеОН (10:1) → МеОН. В результате получили соединение (2) в виде светло-желтого аморфного вещества 31 мг (75%).
1Н ЯМР (400 МГц, CD3OD, δ, м.д.): 8.21 (с, 1H, Н-19); 4.67-4.77 (м, 2Н, Н-1,2); 4.40 (д, 1Н, J=8.4 Гц, Н-5); 4.21-4.30 (м, 1H, Н-3); 3.90-4.03 (м, 2Н, Н-4, 13); 3.80-3.90 (м, 1Н, Н-13); 3.48-3.80 (м, 4Н, Н-7,14); 2.86 (т, 2Н, J=7.4 Гц, Н-20); 2.45 (т, 2Н, J=7.4 Гц, Н-22); 1.92-2.08 (м, 5Н, H-21, -NHAc).
МСВР (m/z) для C16H26N4O8: [М+Н]+ 403.1819 (найдено), 403.1823 (рассч.).
Пример 3. Получение 4-(1-((5-ацетамидо-6-(аллилокси)-3,4-дигидрокситетрагидро-2Н-пиран-2-ил)метил)-1Н-1,2,3-триазол-4-ил)бутановой кислоты (3).

К раствору 30 мг (0,105 ммоль) 1-O-Аллил-2-ацетамидо-2-дезокси-6-азидо-6-дезокси-β-D-галактопиранозы, полученной согласно ранее описанной методике [Wong С.Н. et al. A library approach to the discovery of small molecules that recognize RNA: use of a 1, 3-hydroxyamine motif as core // Journal of the American Chemical Society. - 1998. - T. 120. - №. 33. - C. 8319-8327] в 15 мл сухого ДМФА добавили 14,1 мг (0,125 ммоль, 1,2 экв.) гекс-5-иновой кислоты и 5 мг (0,026 ммоль, 0,25 экв.) CuI. Полученную смесь перемешивали в течение 48 часов, затем ДМФА удалили на роторном испарителе. Полученное вещество очищали методом колоночной хроматографии в системе с градиентом концентраций CH2Cl2:МеОН (10:1) → МеОН. В результате получили соединение (3) в виде светло-желтого аморфного вещества (28 мг, 67%).
1Н ЯМР (400 МГц, CD3OD, δ, м.д.): 7.99 (с, 1Н, Н-19); 5.65-5.78 (м, 1Н, Н-14); 5.04-5.19 (м, 2Н, Н-15); 4.81 (д, 1H, J=3.6 Гц, Н-2); 4.63-4.71 (м, 2Н, Н-1,5); 4.30 (дд, 1Н, J=3.5 и 11.0 Гц, Н-3); 4.19-4.24 (м, 1Н, Н-4), 3.95 (д, 1Н, J=2.6 Гц, Н-7), 3.84 (дд, 1H, J=3.1 и 11.0 Гц, Н-7), 3.63-3.75 (м, 2Н, Н-13), 2.74-2.86 (м, 2Н, Н-20), 2.32-2.42 (м, 2Н, Н-22), 1.91-2.05 (м, 5Н, Н-21, -NHAc).
МСВР (m/z) для C17H26N4O7: [М+Н]+ 399.1876 (найдено), 399.1874 (рассч.); [M+Na]+ 421.1692 (найдено), 421.1694 (рассч.).
Пример 4. Получение соединения (4).
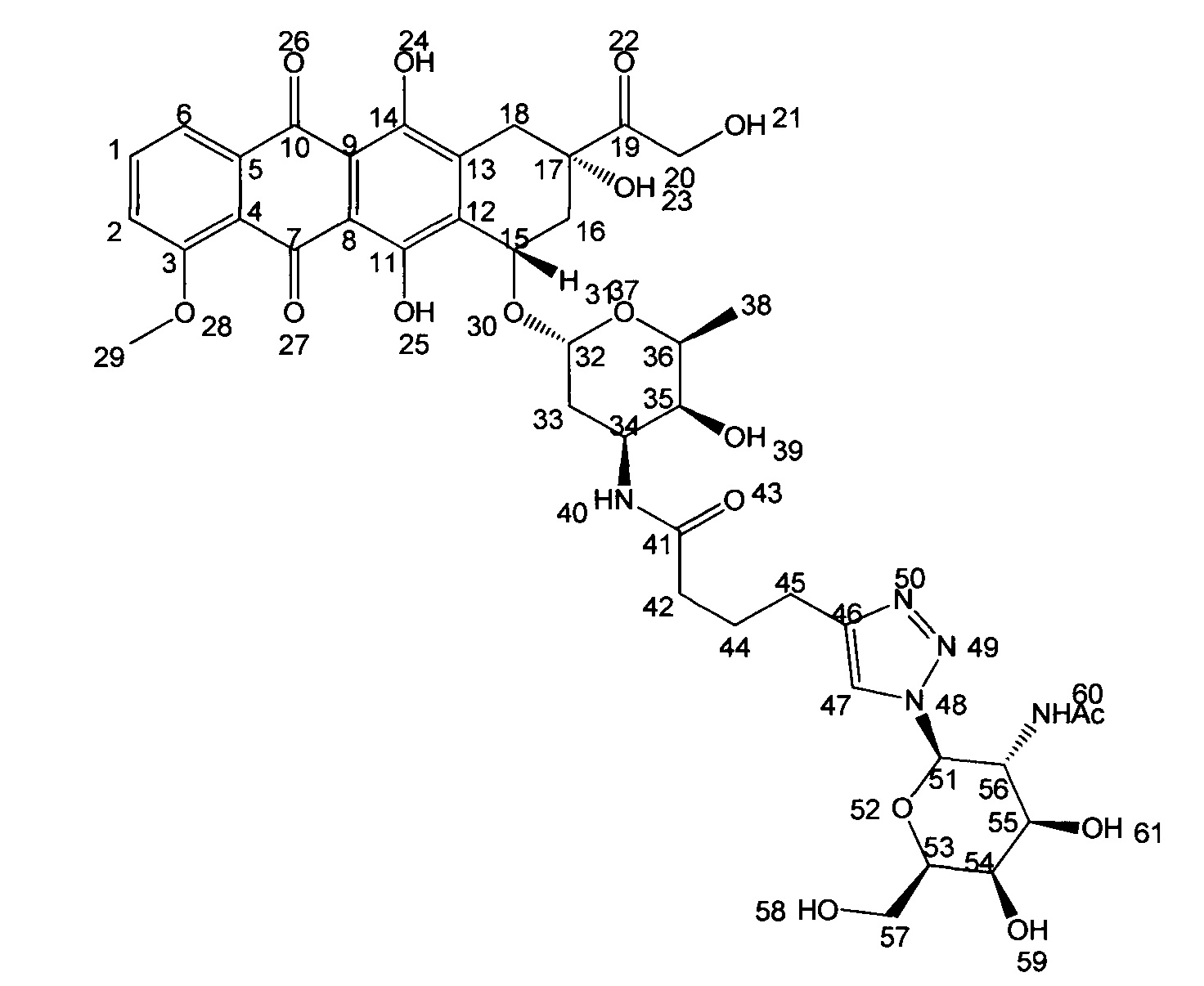
К раствору 6 мг (0,01 ммоль) доксорубицина гидрохлорида в 6 мл сухого ДМФА добавили 3,95 мг (0,01 ммоль, 1 экв.) соединения (1) в присутствии 1,15 мг (0,011 ммоль) Et3N, 1,31 мг (0,011 ммоль, 1,1 экв.) NHS, 2,11 мг (0,011 ммоль, 1,1 экв.) EDC в инертной атмосфере. Полученную смесь перемешивали в течение 24 часов, затем ДМФА удалили на роторном испарителе. Полученное вещество очищали двумя последовательными хроматографированиями: 1) колоночная хроматография на силикагеле (градиентное элюирование CH2Cl2:МеОН (20:1) → МеОН), 2) ВЭЖХ в обращено-фазовой системе (Н2О - AcCN). В результате получили конъюгат (4) в виде темно-красного порошка (7.3 мг, 80%).
1Н ЯМР (400 МГц, CD3OD, δ, м.д.): 7.72-8.04 (м, 3Н, Н-1,6, 61); 7.56 (д, 1Н, J=7.6 Гц, Н-2); 5.61 (д, 2Н, J=9.2 Гц, Н-51); 5.09-5.22 (м, 1H, Н-32); 4.65 (с, 2Н, Н-20); 4.46 (т, 1Н, J=10.0 Гц, Н-53); 4.09-4.33 (м, 3Н, Н-54,55,56); 4.04 (с, 5Н, Н-29,57); 3.69-3.87 (м, 5Н, Н-31,34,35,36, ОН); 3.62 (уш.с, 1Н, ОН); 2.91-3.18 (м, 2Н, Н-45); 2.27-2.44 (м, 2Н, Н-16); 2.06-2.22 (м, 2Н, Н-42); 1.84-2.03 (м, 4Н, Н-44,33); 1.77 (с, 3H, -NHAc); 1.20-1.34 (м, 5Н, Н-18,38).
МСВР (m/z) для C41H49N5O17: [М+Н]+ 884.3196 (найдено), 884.3196 (рассч.); [M+Na]+ 906.3025 (найдено), 906.3016 (рассч.).
Пример 5. Получение соединения (5).

К раствору 6 мг (0,01 ммоль) Dox*HCl в 6 мл сухого ДМФА добавили 4,16 мг (0,01 ммоль, 1 экв.) соединения (2) в присутствии 1,15 мг (0,011 ммоль, 1,1 экв.) Et3N, 1,31 мг (0,011 ммоль, 1,1 экв.) NHS, 2,11 мг (0,011 ммоль, 1,1 экв.) EDC в инертной атмосфере. Полученную смесь перемешивали в течение 24 часов, затем ДМФА удалили на роторном испарителе. Полученное вещество очищали двумя последовательными хроматографированиями: 1) колоночная хроматография на силикагеле (градиентное элюирование CH2Cl2:МеОН (20:1) → МеОН), 2) ВЭЖХ в обращено-фазовой системе (Н2О - AcCN). В результате получили конъюгат (5) в виде темно-красного порошка (6,7 мг, 70%).
1Н ЯМР (400 МГц, CD3OD, δ, м.д.): 8.00 (д, 1H, J=7.5 Гц, Н-6); 7.85 (т, J=7.5 Гц, Н-1); 7.74 (с, 1Н, Н-61); 7.58 (д, 1H, J=7.5 Гц, Н-2); 5.43 (м, 1Н, ОН); 5.19 (м, 1Н, Н-32); 4.74 (м, 2Н, Н-55); 4.61 (с, 2Н, Н-20); 4.51 (т, 2Н, J=6.2 Гц, Н-56); 4.33 (д, 1H, J=8.4 Гц, Н-47); 4.28 (д, 1Н, J=6.6 Гц, Н-43); 4.08-4.22 (м, 2Н, Н-44,45); 4.04 (с, 3Н, Н-29); 3.66-3.96 (м, 6Н, Н-31,34,35,36,46, ОН); 3.62 (уш.с, 1Н, ОН); 3.51-3.57 (м, 1Н, Н-49); 3.44-3.50 (м, 1Н, Н-49); 3.00-3.18 (м, 2Н, Н-62); 2.37 (м, 2Н, Н-16); 2.23 (т, 2Н, J=7.8 Гц, Н-64); 1.85-2.05 (м, 7Н, -NHAc, Н-33,63); 1.24-1.34 (м, 5Н, Н-18,38).
МСВР (m/z) для C43H53N5O18: [М+Н]+ 928,3458 (найдено), 928,3456 (рассч.); [M+Na]+ 950,3277 (найдено), 950,3270 (рассч.).
Пример 6. Получение соединения (6).

К раствору 10 мг (0,017 ммоль) Dox*HCl в 10 мл сухого ДМФА добавили 6,87 мг (0,017 ммоль, 1 экв.) соединения (3) в присутствии 1,92 мг (0,019 ммоль, 1,1 экв.) Et3N, 2,18 мг (0,019 ммоль, 1,1 экв.) NHS, 3,64 мг (0,019 ммоль, 1,1 экв.) EDC в инертной атмосфере. Полученную смесь перемешивали в течение 24 часов, затем ДМФА удалили на роторном испарителе. Полученное вещество очищали двумя последовательными хроматографированиями: 1) колоночная хроматография на силикагеле (градиентное элюирование CH2Cl2:МеОН (20:1) → МеОН), 2) ВЭЖХ в обращено-фазовой системе (Н2О - AcCN). В результате получили конъюгат (6) в виде темно-красного порошка (6 мг, 38%). 1Н ЯМР (400 МГц, CD3OD, δ, м.д.): 7.94 (д, 1Н, J=7.5 Гц, Н-6); 7.83 (т, J=7.5 Гц, Н-1); 7.73 (с, 1H, Н-59); 7.56 (д, 1H, J=7.5 Гц, Н-2); 5.56-5.72 (м, 1H, Н-54); 5.42 (м, 1H, ОН); 4.96-5.23 (м, 3Н, Н-32,55); 4.75 (м, 2Н, Н-53); 4.48-4.56 (м, 2Н, Н-20); 4.20-4.33 (м, 2Н, Н-41,45); 4.08-4.19 (м, 1H, Н-42,43); 4.02 (с, 3Н, Н-29); 3.88 (с, 1H, ОН); 3.74-3.84 (м, 1Н, Н-44) 3.46-3.70 (м, 5Н, Н-31,34,35,36,47); 2.95-3.18 (м, 2Н, Н-64); 2.11-2.42 (м, 4Н, Н-16, 61); 1.81-2.07 (м, 5Н, -NHAc, Н-63); 1.54-1.76 (м, 2Н, Н-33).
МСВР (m/z) для C44H53N5O17: [М+Н]+ 924,3509 (найдено), 924,3543 (рассч.); [M+Na]+ 946,3340 (найдено), 946,3329 (рассч.).
Пример 7. Синтез моноацилированного гекс-5-иновой кислотой паклитаксела (7). [[Pilkington-Miksa М. et al. Design, synthesis, and biological evaluation of novel cRGD-paclitaxel conjugates for integrin-assisted drug delivery // Bioconjugate chemistry. - 2012. - T. 23. - №. 8. - C. 1610-1622.]

К раствору 40,9 мг (47,87 мкмоль) паклитаксела в 20 мл сухого CH2Cl2 добавили 5,9 мг (52,66 мкмоль, 1,1 экв.) гекс-5-иновой кислоты и 8,2 мг (52,66 мкмоль, 1,1 экв.) EDC, а также каталитическое количество DMAP в инертной атмосфере. Полученную смесь перемешивали в течение 24 часов при комнатной температуре, затем CH2Cl2 удалили на роторном испарителе. Полученное вещество очищали методом обращенно-фазовой колоночной хроматографии на приборе INTERCHIM PURIFLASH 430 на обращенно-фазовой колонке PURIFLASH С18-НР 15UM F0012 в системе с градиентом концентраций H2O:MeCN (1:0) → H2O:MeCN (0:1). В результате получили соединение (7) в виде белого порошка (41,3 мг, 91%).
1Н ЯМР (400 МГц, CDCl3, δ, м.д.): 8.15 (д, 2Н, J=7.2 Гц, Н-орто-(Ar1)); 7.75 (д, 2Н, J=7.3 Гц, Н-орто-(Ar3)); 7.62 (т, 1Н, J=7.4 Гц, H-пара-(Ar1)); 7.57-7.48 (м, 3Н, Ароматика); 7.47-7.32 (м, 7Н, Ароматика); 6.90 (д, 1Н, J=9.2 Гц, NH); 6.23-6.32 (м, 2Н, Н-10, 13); 5.97 (дд, 1Н, J=2.9 и 9.2 Гц, H-3'); 5.69 (д, 1Н, J=7.1 Гц, Н-2); 5.51 (д, 1H, J=3.1 Гц, Н-2'); 4.98 (дд, 1Н, J=1.8 и 9.5 Гц, Н-5); 4.45 (дд, 1Н, J=6.7 и 10.8 Гц, Н-7); 4.33 (д, 1H, J=8.4 Гц, Н-20); 4.21 (д, 1H, J=8.6 Гц, Н-20); 3.82 (д, 1Н, J=7.1 Гц, Н-3); 2.48-2.70 (м, 3Н, Н-6, 4'',); 2.47 (с, 3Н, 4-ОАс); 2.13-2.44 (м, 8Н, Н-14, 6'', 10-ОАс, Н-2''); 2.00-1.78 (м, 6Н, Н-6,18, 3''); 1.69 (с, 3Н, Н-19); 1.24 (с, 3Н, Н-17); 1.14 (с, 3Н, Н-16).
Пример 8. Синтез конъюгата паклитаксела (8).
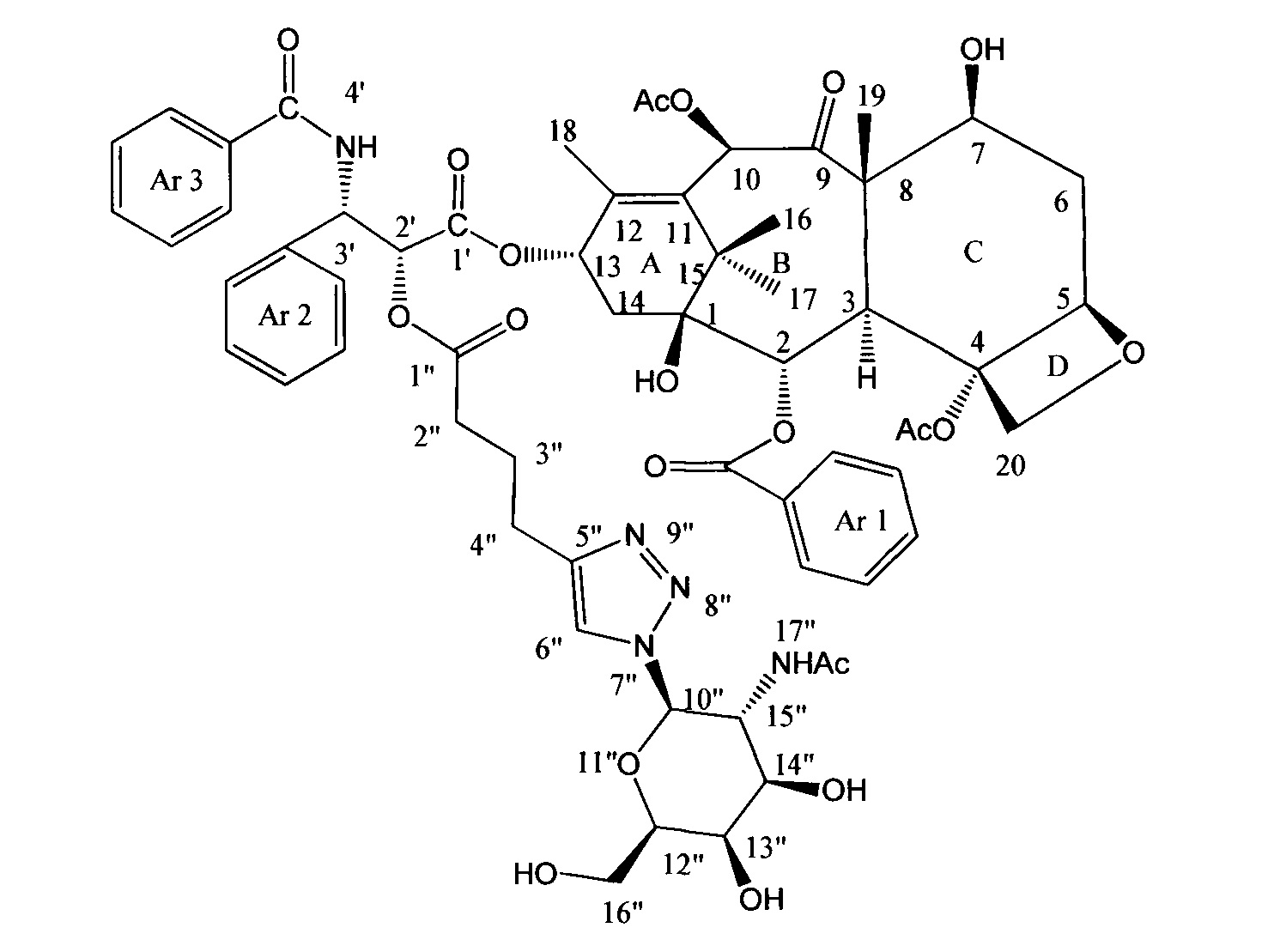
К раствору 10 мг (10,54 мкмоль) соединения (7) в 7 мл сухого ДМФА добавили 2,6 мг (10,54 мкмоль, 1 экв.) 1-Азидо-2-ацетамидо-2-дезокси-3,4,6-три-O-ацетил-β-D-галактопиранозы, полученной согласно методике, описанной в работе [ N. et al. Iron (III) chloride as an efficient catalyst for stereoselective synthesis of glycosyl azides and a cocatalyst with Cu (0) for the subsequent click chemistry // Chemical Communications. - 2011. - T. 47. - №. 37. - С. 10440-10442] в присутствии 0,4 мг (2,11 мкмоль, 0,2 экв.) CuI и 0,2 мг (2,11 мкмоль, 0,2 экв.) Et3N в инертной атмосфере. Полученную смесь перемешивали в течение 24 часов, затем ДМФА удалили на роторном испарителе. Полученное вещество очищали методом ВЭЖХ в обращено-фазовой системе (Н2О - AcCN). В результате получили конъюгат (8) в виде белого порошка (10 мг, 79%).
N. et al. Iron (III) chloride as an efficient catalyst for stereoselective synthesis of glycosyl azides and a cocatalyst with Cu (0) for the subsequent click chemistry // Chemical Communications. - 2011. - T. 47. - №. 37. - С. 10440-10442] в присутствии 0,4 мг (2,11 мкмоль, 0,2 экв.) CuI и 0,2 мг (2,11 мкмоль, 0,2 экв.) Et3N в инертной атмосфере. Полученную смесь перемешивали в течение 24 часов, затем ДМФА удалили на роторном испарителе. Полученное вещество очищали методом ВЭЖХ в обращено-фазовой системе (Н2О - AcCN). В результате получили конъюгат (8) в виде белого порошка (10 мг, 79%).
1Н ЯМР (400 МГц, CDCl3, δ, м.д.): 8.04 (д, 2Н, J=7.8 Гц, Н-орто-(Ar1)); 7.99 (м, 1H, -NH-); 7.82 (с, 1H, Н-6''); 7.69 (д, 2Н, J=6.5 Гц, Н-орто-(Ar3)); 7.29-7.57 (м, 11Н, Ароматика); 6.26 (с, 1H, Н-10); 6.08 (т, 1Н, J=8.7 Гц, Н-13); 5.84-5.91 (м, 1H, Н-3'); 5.60-5.68 (м, 2Н, Н-2, Н-10''); 5.34-5.42 (м, 1Н, Н-2'); 4.91 (д, 1Н, J=9.8 Гц, Н-5); 4.12-4.42 (м, 4Н, Н-7,20, 12''); 3.93-4.00 (м, 1Н, Н-13''); 2.53-2.73 (м, 3Н, Н-6,4''); 2.30-2.50 (м, 5Н, 4-Ас, 2''); 2.10-2.27 (м, 5Н, Н-14, 10-Ас); 1.75-2.06 (м, 6Н, Н-6,3'', -NHAc); 1.65 (с, 3Н, Н-18); 1.60 (с, 3Н, Н-19); 1.11 (с, 3Н, Н-17); 1.07 (с, 3Н, Н-16).
МСВР (m/z) для C61H71N5O20: [М+Н]+ 1194.4771 (найдено), 1194.4765 (рассч.); [M+Na]+ 1216.4585 (найдено), 1216.4585 (рассч.).
Пример 9. Синтез конъюгата паклитаксела (9).
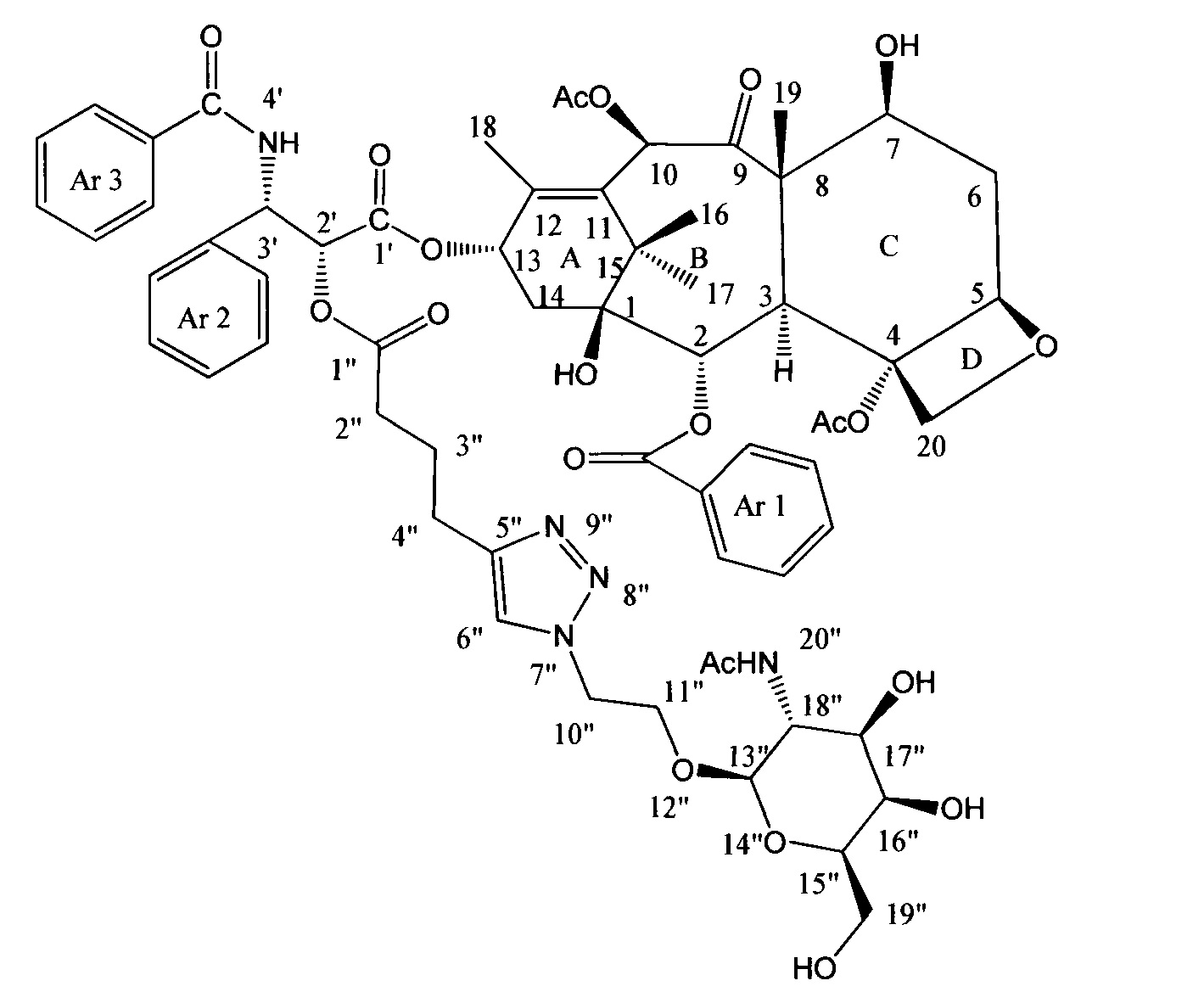
К раствору 10 мг (10,54 мкмоль) соединения (7) в 7 мл сухого ДМФА добавили 3,1 мг (10,54 мкмоль, 1 экв.) 1-O-(2'-азидоэтил)-2-ацетамидо-2-дезокси-β-D-галактопиранозы, полученной согласно методике, описанной в работе [Hasegawa A. et al. Studies on the thioglycosides of N-acetylneuraminic acid 10: Synthesis of S-(α-sialosyl)-(2→6)-O-2-acetamido-2-deoxy-β-d-hexopyranosyl ceramide and its related compounds // Journal of carbohydrate chemistry. - 1992. - T. 11. - №. 3. - C. 319-331], в присутствии 0,4 мг (2,11 мкмоль, 0,2 экв.) CuI и 0,2 мг (2,11 мкмоль, 0,2 экв.) Et3N в инертной атмосфере. Полученную смесь перемешивали в течение 24 часов, затем ДМФА удалили на роторном испарителе. Полученное вещество очищали методом ВЭЖХ в обращено-фазовой системе (Н2О - AcCN). В результате получили конъюгат (9) в виде белого порошка (7 мг, 54%).
1Н ЯМР (400 МГц, CDCl3, δ, м.д.): 8.07 (д, 2Н, J=7.5 Гц, Н-орто-(Ar1)); 8.00 (м, 2Н, -NH-, Н-6''); 7.71 (д, 2Н, J=7.0 Гц, Н-орто-(Ar3)); 7.30-7.60 (м, 12Н, Ароматика, -NH-); 6.27 (с, 1Н, Н-10); 6.09 (т, 1H, J=8.7 Гц, Н-13); 5.87 (д, 1Н, J=4.4 Гц, Н-3'); 5.63 (д, 1Н, J=7.0 Гц, Н-2); 5.33-5.42 (м, 1Н, Н-2'); 4.93 (д, 1H, J=9.3 Гц, Н-5); 4.08-4.56 (м, 9Н, Н-7,20, 11'', 13'',15'',16'', +ОН); 3.67-3.98 (м, 7Н, Н-3, 10'', 17'', 18'', 19''); 2.62-2.77 (м, 3Н, Н-6,4''); 2.31-2.52 (м, 5Н, 4-Ас, 2''); 2.09-2.26 (м, 5Н, Н-14, 10-Ас); 1.76-1.99 (м, 9Н, H-6,18,3'', NHAc); 1.62 (с, 1H, Н-19); 1.19 (с, 3Н, Н-17); 1.14 (с, 3Н, Н-16).
МСВР (m/z) для C63H75N5O21: [М+Н]+ 1238.5035 (найдено), 1238.5027 (рассч.); [M+Na]+ 1260.4848 (найдено), 1260.4847 (рассч.).
Пример 10. Синтез конъюгата паклитаксела (10).
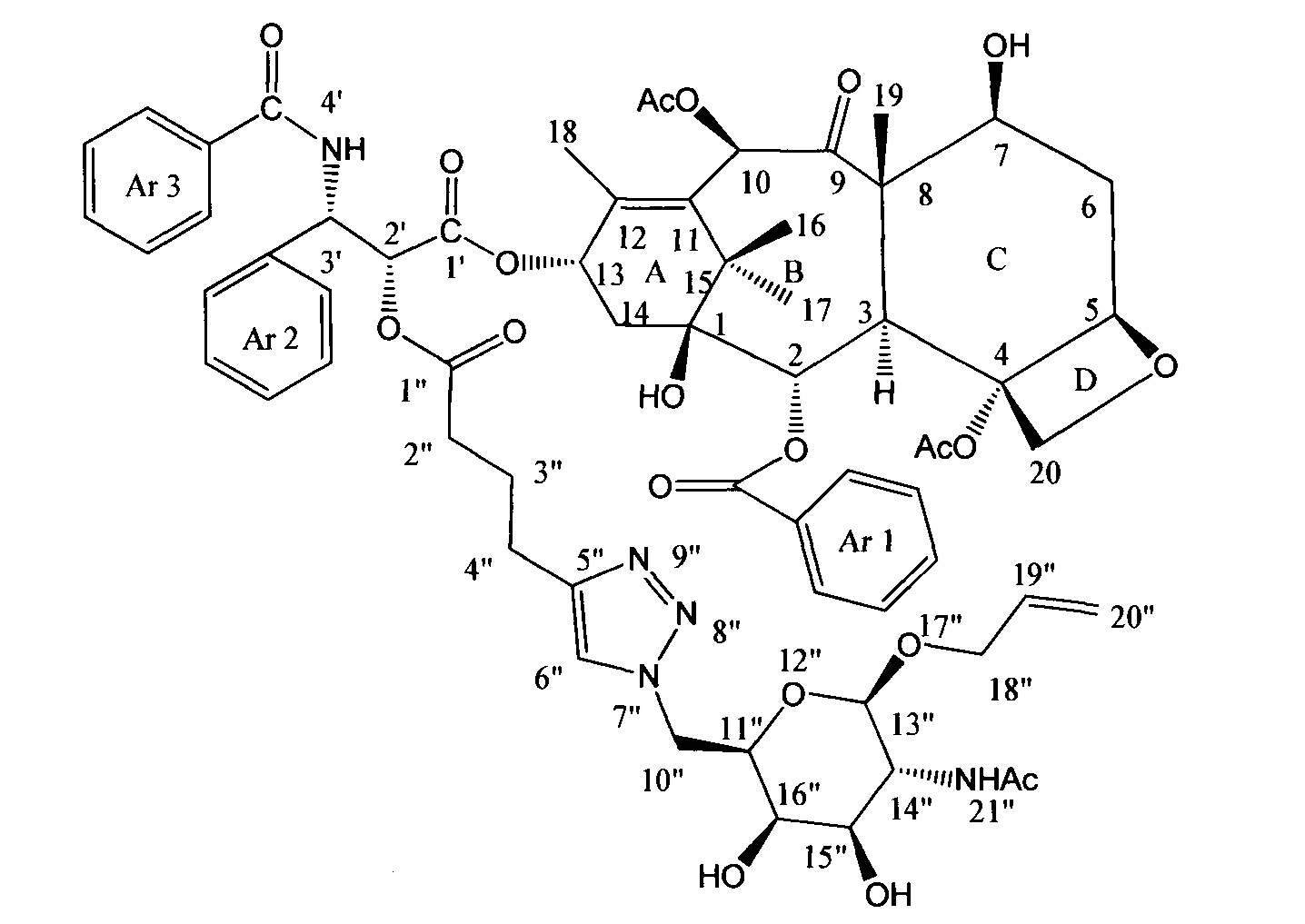
К раствору 6,5 мг (6,85 мкмоль) соединения (7) в 7 мл сухого ДМФА добавили 2,2 мг (6,85 мкмоль, 1 экв.) 1-O-Аллил-2-ацетамидо-2-дезокси-6-азидо-6-дезокси-β-D-галактопиранозы, полученной согласно ранее описанной методике [Wong С.Н. et al. А library approach to the discovery of small molecules that recognize RNA: use of a 1, 3-hydroxyamine motif as core // Journal of the American Chemical Society. - 1998. - T. 120. - №. 33. - C. 8319-8327] в присутствии 0,3 мг (1,58 мкмоль, 0,2 экв.) CuI и 0,2 мг (1,58 мкмоль, 0,2 экв.) Et3N в инертной атмосфере. Полученную смесь перемешивали в течение 24 часов, затем ДМФА удалили на роторном испарителе. Полученное вещество очищали методом ВЭЖХ в обращено-фазовой системе (Н2О - AcCN). В результате получили конъюгат (31) в виде белого порошка (6,5 мг, 77%).
1Н ЯМР (400 МГц, CD3OD, δ, м.д.): 8.11 (д, 2Н, J=7.2 Гц, Н-орто-(Ar1)); 7.80 (д, 2Н, J=7.2 Гц, Н-орто-(Ar3)); 7.77 (с, 1Н, Н-6''); 7.62-7.70 (м, 2Н, -NH-, H-пара-(Ar1)); 7.38-7.60 (м, 9Н, Ароматика); 7.27 (т, 1Н, J=7.1 Гц, Н-пара-(Ar2)); 6.43 (с, 1Н, Н-10); 6.08 (т, 1Н, J=9.1 Гц, Н-13); 5.84 (д, 1H, J=6.1 Гц, Н-3'); 5.70-5.81 (м, 1Н, Н-19''); 5.65 (д, 1Н, J=7.2 Гц, Н-2); 5.46 (д, 1H, J=6.0 Гц, Н-2'); 4.95-5.15 (м, 3Н, Н-5,20''); 4.59-4.66 (м, 1H, Н-11''); 4.17-4.39 (м, 4Н, Н-7, 13'',20); 4.09 (дд, 1Н, J=4.7, 13.3 Гц, Н-14''); 3.76-4.00 (м, 5Н, Н-3, 15'',16'',18''); 3.60 (дд, 1H, J=3.0, 10.7 Гц, Н-10''); 3.42-3.50 (м, 1H, Н-10''); 2.68-2.79 (м, 2Н, Н-4''); 2.44-2.54 (м, 3Н, Н-2'',6); 2.40 (с, 3Н, 4-ОАс); 2.11-2.23 (м, 5Н, Н-14, 10-ОАс); 1.76-2.06 (м, 7Н, Н-6,3'', 18, -NHAc); 1.66 (с, 3Н, Н-19); 1.14 (с, 6Н, Н-16, 17).
МСВР (m/z) для C64H75N5O20: [М+Н]+ 1234.5084 (найдено), 1234.5078 (рассч.); [M+Na]+ 1256.4896 (найдено), 1256.4898 (рассч.).
Пример 11. Измерение константы диссоциации комплекса лиганд-ASGP-R
Эксперимент проводился на приборе Biacore X100 (Biacore АВ, Уппсала, Швеция) с использованием чипа-носителя СМ5, состоящего из золотой пластины, покрытой слоем карбоксиметилированного декстрана. Поверхность чипа включает в себя две проточных ячейки: на одной иммобилизуется анализируемый белок, вторая ячейка - ячейка сравнения.
Использовалась буферная смесь, содержащая 150 mM NaCl, 50 mM CaCl2, 50 mM Tris, рН 7.4. Обе ячейки были активированы смесью, содержащей 0,05 М N-гидроксисукцинимид (NHS) и 0,2 М N-этил-N'-диметиламинопропил карбодиимид (EDC) в течении 7 минут, скорость потока смеси 10 мкл/мин. Поверхность ячейки 1 не модифицировалась. На поверхности ячейки 2 был иммобилизован фермент ASGRP печени кролика, растворенный в буфере: 10 mM Tris-HCl, рН 7.0. Раствор фермента подавался в течении 15 минут со скоростью 10 мкл/мин. Обе ячейки были обработаны 0.1 М раствором этаноламина (рН 8.5) для деактивации. Количество иммобилизированного белка ASGPR - 2000 RU.
Отбор и подготовка проб
Лиганды формул 1, 2, 3, исследуемые на аффинность к белку ASGP-R, были растворены в рабочей буферной смеси (150 mM NaCl, 50 mM CaCl2, 50 mM Tris, рН 7.4). К образцам с низкой растворимостью был добавлен диметилсульфоксид (ДМСО), вплоть до объема, равного половине объема использованной буферной смеси. Более высокие концентрации ДМСО не были использованы ввиду непереносимости белковой структуры экстремальных условий и опасностью необратимой денатурации.
Каждый лиганд был представлен в широком диапазоне концентраций, от 10-2 М до 5*10-11 М. Скорость потока 20 мкл/мин, лиганд подавался в течение 180 с (время связывания), и далее в течение 60 с изучалась диссоциация комплекса. Для восстановления чип-носитель обрабатывался 20 мкл 20 мМ раствором ЭДТА. Эксперименты проводились при 25°С. Все буферные растворы были дегазированы и профильтрованы.
Результаты приведены в таблице 1.


Полученные данные свидетельствуют о большей аффинности к ASGP-R полученных лигандов по отношению к нативному лиганду - N-ацетилгалактозамину.
Пример 12. Изучение токсичности конъюгатов по отношению клеточным линиям гепатоцеллюлярной карциномы.
Результаты исследования представлены в таблице 1. Экспериментальные данные цитоксичности самого паклитаксела на клеточной линии HepG2 представлены в работе Луо и соавторов [Luo D. et al. Effects of Bcl-2 and Bcl-XL protein levels on chemoresistance of hepatoblastoma HepG2 cell line // Biochemistry and Cell Biology. - 2000. - T. 78. - №. 2. - С. 119-126.], а так же получены в настоящей работе.

Для полученных конъюгатов измеренные значения цитотоксичности (СС50) на клеточной линии гепатоцеллюлярной карциномы сравнимы со значением цитотоксичности для противоопухолевого соединения.
Пример 13. Исследование устойчивости конъюгатов 8-10 в моделях биологических сред при рН 5.0 и 7.4.
Были приготовлены буферные растворы (НСООН, NH4OH) с рН 5.0 и 7.4. После растворения 200 мкг конъюгата в 2 мл буфера было отобрано по 200 мкл полученного раствора в заданные временные точки (0; 0.5; 1; 2; 4; 8; 12; 24 часа). Затем образцы подвергали заморозке при -20°С. После чего образцы были исследованы методом ВЭЖХ-МС на приборе Shimadzu Prominence LC-20 с одиночным квадрупольным масс-спектрометром Shimadzu LCMS-2020 с двойным источником ионизации DUIS-ESI-APCI. Аналитической и препаративной колонкой была Phenomenex Luna 3u C18 100A.
Для всех исследованных конъюгатов площадь пика вещества с течением времени оставалась одинаковой в пределах погрешности, из чего следует, что полученные конъюгаты не подвергаются деградации и являются устойчивыми в этих биологических средах.
Пример 14. Исследования накопления доксорубицина и конъюгатов 4-6 в клеточной культуре HepG2 методом флуоресцентной микроскопии.
Флуоресцентная микроскопия осуществлена с использованием системы для визуализации флюоресценции EVOS FL Cell Imaging System. С 40 - кратным увеличением. На фиг. 1 представлены снимки, сделанные при помощи микроскопа, конъюгатов (4) - А, (5) - В, (6) - С. Время инкубирования - 24 часа. Как свидетельствуют представленные, снимки конъюгаты накапливаются в цитоплазме и, следовательно, доставляются лигандами внутрь клетки.
Пример 15. Анализ морфологии ядра и цитоскелета клеточной культуры линии гепатоцеллюлярной карциномы (HepG2) при воздействии на них конъюгатов 8-10 при помощи иммунно-флуоресцентной микроскопии.
Клетки HepG2 выращивали на покрытых поли-L-лизином покровных стеклах в течение 24 часов с последующим воздействием паклитаксела и конъюгатов в концентрации 1 мкмоль. После 24-часового лечения клетки фиксировали в 4% параформальдегиде (Sigma-Aldrich) в PBS в течение 10 минут, три раза промывали в PBS, а затем инкубировали в течение часа с блокирующим раствором (1% бычьего сывороточного альбумина (BSA), 1% Triton Х-100 в PBS). Затем клетки инкубировали в течение ночи с альфа-тубулином Alexa Fluor 488 Mouse Monoclonal Antibody (Invitrogen # 322588) при 2 мкг/мл. Клетки дважды промывали PBS, а ядра окрашивали 4', 6-диамидино-2-фенилиндолом (DAPI) (Invitrogen). Клетки наблюдали с помощью микроскопа Zeiss Axiovert 200 М.
Необработанные клетки показали типичные ядерные и цитоскелетные структуры с образованием нормальных митотических веретен. Микротрубочки, организованные как диффузные в цитоплазме (фиг. 2).
После обработки клеток с помощью паклитаксела характерны изменения морфологии: митозы с более чем двумя полюсами; многие аномальные ядра (микроядра или многоядерные), измененная структура микротрубочек (более толстые и более плотные пучки микротрубочек). Подобные клеточные морфологические изменения наблюдались для обработанных паклитакселем конъюгатов (фиг. 3).