Результат интеллектуальной деятельности: СРЕДСТВО, ОБЛАДАЮЩЕЕ АНТИОКСИДАНТНОЙ, ПРОТИВОВОСПАЛИТЕЛЬНОЙ, НЕЙРОПРОТЕКТОРНОЙ, ГИПОЛИПИДЕМИЧЕСКОЙ, ГИПОХОЛЕСТЕРИНЕМИЧЕСКОЙ, ГИПОГЛИКЕМИЧЕСКОЙ, ГЕПАТОПРОТЕКТОРНОЙ, ИММУНОСУПРЕССОРНОЙ АКТИВНОСТЯМИ
Вид РИД
Изобретение
Изобретение относится к области медицины, конкретно к средству формулы 1:
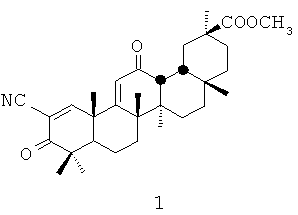
которое может быть использовано в качестве основы для разработки лекарственного средства для профилактики и лечения атеросклероза, диабета (1 и 2 типов), аутоиммунных заболеваний (таких как ревматоидный артрит, рассеянный склероз), нейродегенеративных заболеваний (таких как болезнь Паркинсона, болезнь Альцгеймера, токсический и лекарственный паркинсонизм, болезнь Гентингтона), и широкого спектра воспалительных заболеваний.
В аэробных организмах непрерывно образуется большое количество потенциально опасных молекул - свободных радикалов, основные из них - активные формы кислорода и азота, образующиеся в окислительно-восстановительных реакциях дыхательной цепи. Эти свободнорадикальные молекулы являются основным оружием клеток системы естественной резистентности организма, обеспечивая их бактерицидную активность; регулируют внутриклеточную сигнальную трансдукцию, экспрессию генов, пролиферацию клеток. При нарушении баланса между оксидантными и антиоксидантными процессами происходит повреждение клеточных мембран, ДНК, генной экспрессии, активности ферментов и т.д. [Poulsen H.E., Jensen B.R., Weimann A., Jensen S.A., Sørensen M., Loft S. Antioxidants, DNA damage and gene expression. // Free Radio Res. 2000. V.33 (Suppi). P.S33-S39]. Эти процессы лежат в патогенезе многих заболеваний (например, онкологических) и в основе старения. Многочисленными исследованиями установлено, что употребление в пищу продуктов, богатых антиоксидантами, приводит к уменьшению частоты развития онкологических и сердечно-сосудистых заболеваний, а также возрастных изменений сетчатки глаз, обструктивных заболеваний дыхательных путей и др. [Stanner S.A., Hughes J., Kelly C.N.M., Buttriss J. A review of the epidemiological evidence for the 'antioxidant hypothesis'. // Public Health Nutrition. 2003. V.7 (3). P.407-422].
В качестве объекта для развития лекарственных средств с антиоксидантной активностью внимание фармакологов привлекла группа веществ из группы синтетических олеанановых тритерпеноидов (synthetic oleanane triterpenoids - SO). Обстоятельством, повышающим привлекательность тритерпенов, является их широкое распространение в природе и во многих случаях относительная простота технологии получения из многотоннажного растительного сырья. Как показали исследования на животных, эти вещества обеспечивают защиту от повреждающего действия реактивных форм кислорода и азота на уровне организма, защищают органы и системы от нарушений, связанных с оксидативным стрессом [Sporn M.B., Liby K.T., Yore M.M., Fu L., Lopchuk J.M., Gribble G.W. New synthetic triterpenoids: potent agents for prevention and treatment of tissue injury caused by inflammatory and oxidative stress. // J Nat Prod. 2011. V.74. P.537-545]. На основе одного из соединений данной группы разработано лекарственное средство - это полусинтетическое производное олеаноловой кислоты - метиловый эфир 2-пиано-3,12-диоксоолеан-1(2),9(11)-диен-28-овой кислоты, названное «бардоксолон метил» (2). Данное соединение обладает широким спектром биологической активности (противоопухолевой, противовоспалительной и др.) [Honda Т., Janosik Т., Honda Y., Han J., Liby К.Т., Williams Ch.R., Couch R.D., Anderson A.C., Sporn M.В., Gribble G.W. // Design, synthesis, and biological evaluation of biotin conjugates of 2-cyano-3,12-dioxooleana-1,9(11)-dien-28-oic acid for the isolation of the protein targets. // J Med Chem. 2004. V.47. P.4923-4932].
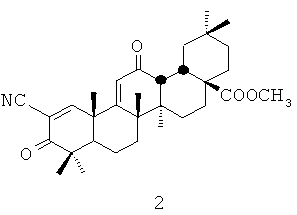
В настоящее время бардоксолон метил (2) находится на 3-й фазе клинических испытаний, проводимых компанией Reata Pharmaceuticals, Inc. в качестве антиоксиданта, противовоспалительного модулятора, используемого при лечении хронической болезни почек, вызванной сахарным диабетом 2-го типа [Bardoxolone methyl - Oral, Once Daily AIM for Renal/Cardiovascular/Metabolic Diseases. Reata Pharnaceuticals. Retrieved June 2, 2011]. Основным недостатком бардоксолон метила (2) является сравнительная труднодоступность и, соответственно, высокая цена исходного соединения для синтеза бардоксолон метила - олеаноловой кислоты. В природных источниках олеаноловая кислота присутствует совместно с другими близкими по структуре тритерпеновыми кислотами, например, с урсоловой, что затрудняет ее выделение в индивидуальном виде.
Задачей изобретения является расширение арсенала антиоксидантных, противовоспалительных, нейропротекторных, гиполипидемических, гипохолестеринемических, гипогликемических, гепатопротекторных, иммуносупрессорных средств, обладающих низкой токсичностью и полученных на основе доступного растительного сырья.
Поставленная задача решается применением метилового эфира 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты формулы (1) в качестве антиоксидантного, противовоспалительного, нейропротекторного, гиполипидемического, гипохолестеринемического, гипогликемического, гепатопротекторного, иммуносупрессорного средства, обладающего низкой токсичностью и полученного на основе доступного растительного сырья.
Новые свойства метилового эфира 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты формулы (1) установлены экспериментально.
Метиловый эфир 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты формулы (1) был получен в результате направленной комбинированной модификации колец А и С 18βН-глипирретовой кислоты формулы (3) [RU 2401273 C1, 10.10.2010].
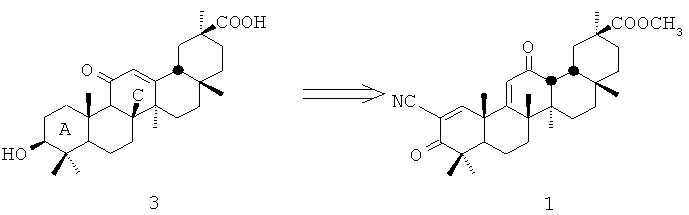
В качестве исходного продукта для синтеза был взят метиловый эфир ацетата 18βН-глипирретовой кислоты, полученный в результате уксуснокислой дегликолизации глицирризиновой кислоты с последующим метилированием диазометаном [Толстиков Г.А. и др. Солодка: биоразнообразие, химия, применение в медицине. Новосибирск: «Гео», 2007]. Первоначально была проведена модификация кольца С. Взаимодействие метилового эфира ацетата 18βН-глицирретовой кислоты с цинком и соляной кислотой приводит к восстановлению С-11 карбонильной группы до метиленовой. Окисление полученного соединения перекисью водорода в уксусной кислоте формирует карбонильную группу при С-12, последующее взаимодействие полученного кетона с бромом в уксусной кислоте (в результате реакции бромирования -дегидробромирования) приводит к 9,11-двойной связи. Дальнейшая 6-стадийная модификация кольца А (окисление гидроксильной группы в кетоннную при С-3, форматирование, конденсация с гидроксиламином, расщепление изоксазольного кольца и окисление дихлордицианхиноном) приводит к образованию 2-циано-3-оксо-1-еновый фрагмента и, соответственно, к соединению (1).
Элементный состав полученного соединения определяли из масс-спектров высокого разрешения, записанных на приборе DFS (Double Focusing Sector) фирмы Theimo Electron Corporation. Спектры ЯМР 1H и 13С регистрировали на спектрометрах АМ-400 (рабочие частоты 400.13 MHz для 1Н и 100.61 MHz для 13С) и DRX-500 (500.13 MHz и 125.76 MHz соответственно) фирмы Bruker для растворов вещества в CDCl3. В качестве внутреннего стандарта использовали сигналы растворителя (δН 7.24 и δС 76.9 м.д). Строение полученного соединения устанавливали на основании анализа спектров ЯМР 1Н с привлечением спектров двойного резонанса 1Н-1Н, и двумерных спектров гомоядерной 1Н-1Н корреляции, а также анализа спектров ЯМР 13С, записанных в режиме J-модуляции (JMOD), с внерезонансным подавлением протонов и двумерных спектров гетероядерной 13С-1Н корреляции на прямых и на дальних константах спин-спинового взаимодействия (С-Н COSY, 1JC,H 135 Гц и COLOC, 2,3JC,H 10 Гц, соответственно). В квадратных скобках приведены химические сдвиги центров мультиплетов, взятые из двумерного спектра 13С-1Н COSY.
Т. пл. 247-249°С. Найдено, m/z: 505.3025 [M]+. C32H43NO4. Вычислено M 505.3181.
Спектр ИК (хлороформ) см-1: 2238 (C≡N); 1722,1662,1663 (C=O).
Спектр ЯМР 1Н соединения (1), δ, м.д. (J, Гц): 0.90 с (С28Н3), 0.96 с (С27Н3), 1.09 с (C29H3), 1.14 с (С24Н3), 1.22 с (С23Н3), 1.44 с (С26Н3), 1.47 с (С25Н3), 0.93 д.м (H16e, J16e,16a 13.3 Гц), 1.08 м (H15e), 1.20 д.д (H19a, J19a,19e 13.2, J19a,18 13.2 Гц), 1.18.1.32 м (H21a, H22e), 1.48 д.д.д (H22a, J22a,22e 14.0, J22a,21a 14.0, J22a,21e 4.2 Гц), 1.55 д.м (H7e, J7e,7a 13.5 Гц), 1.67-1.79 м (H5a, 2Н6, H7a), 1.82 м (H15a), 1.87 м (H16a), 1.94 д.д.д.д (H21e, J21e,21a 13.3, J21e,22a 4.2, J21e,22e 3.2, J21e,19e 2.8 Гц), 2.02 д.д.д (Н18, J18,19a 13.2, J18,13 4.7, J18,19e 3.2 Гц), 2.17 д.д.д (H19e, J19e,19a 13.2, J19e,18 3.2, J19e,21e 2.8 Гц), 3.02 д (Н13, J13,18 4.7 Гц), 3.72 с (ОС31Н3), 5.97 с (Н11), 8.01 с (Н1). Спектр ЯМР 13С соединения (1), δ, м.д.: 165.65 д (С1), 114.46 с (С2), 196.42 с (С3), 44.86 с (С4), 47.57 д (С5), 18.12 т (С6), 31.58 т (С7), 45.82 с (С8), 168.18 с (С9), 42.36 с (С10), 124.17 д (С11), 199.52 с (С12), 48.04 д (С13), 42.10 с (С14), 26.03 т (С15), 26.00 т (С16), 31.88 с (С17), 37.75 д (С18), 33.61 т (С19), 43.91 с (С20), 31.11 т (С21), 38.14 т (С22), 26.88 к (С23), 21.40 к (С24), 26.61 к (С25), 24.77 к (С26), 21.81 к (С27), 26.96 к (С28), 28.46 к (С29), 177.13 с (С30), 51.48 к (С31), 114.22 с (С32).
Показано, что соединение (1) обладает противоопухолевой активностью, превышающей активность ближайшего структурного аналога - бардоксолон метила (2) в отношении всех использованных опухолевых клеточных линий, в том числе в отношении линии клеток, обладающей фенотипом множественной лекарственной устойчивости [RU 2401273 C1, 10.10.2010].
Были исследованы следующие активности (свойства) заявляемого соединения - метилового эфира 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты формулы (I): антиоксидантная, антипаркинсоническая, нейропротекторная, нейропротекторная на модели болезни Альцгеймера, противовоспалительная, противовоспалительная на модели неспецифического язвенного колита и болезни Крона, противоартритная, иммуносупрессорная, иммуносупрессорная на модели рассеянного склероза (экспериментальный аутоиммунный энцефаломиелит), гиполипидемическая, антиатеросклеротическая, гипогликемическая, антидиабетическая и гепатопротекторная.
Пример 1. Изучение токсичности метилового эфира 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты (1).
Клетки линии J-774 (перевиваемая макрофагальная мышиная линия) культивировали в среде IMDM (среда Дульбекко, модифицированная Исковым), содержащей 10%-ную эмбриональную телячью сыворотку, антибиотики (100 ед./мл пенициллина и 0.1 мг/мл стрептомицина) и антимикотик амфотерицин (0.25 мкг/мл), в атмосфере 5%-ного СО2 при 37°С. Жизнеспособность клеток после инкубации с соединением (1) определяли с помощью МТТ теста, который основан на способности живых клеток превращать соединения на основе тетразола (МТТ) в ярко окрашенные кристаллы формазана, что позволяет спектрофотометрически оценивать количество живых клеток в препарате. Для этого клетки высаживали в 96-луночные планшеты для получения монослоя. Через 24 ч, в лунках меняли среду и к клеткам добавляли раствор соединения (1) в ДМСО (диметилсульфоксид) (0.1 М) до конечной концентрации от 10-5 до 10-9 М. Клетки инкубировали в присутствии соединения еще в течение суток в тех же условиях. По окончании инкубации, без смены среды, к клеткам добавляли раствор МТТ (5 мг/мл) в фосфатно-солевом буфере до концентрации 0.5 мг/мл и инкубировали в течение 3 ч в тех же условиях. Среду удаляли, к клеткам добавляли по 100 мкл ДМСО, в котором происходит растворение образовавшихся в клетках кристаллов формазана, и измеряли оптическую плотность на многоканальном спектрофотометре на длинах волн 570 и 630 нм, где А570 - поглощение формазана, а А630 - фон клеток. По результатам теста определяли значение IC50, концентрацию соединения, при которой наблюдается гибель 50% клеток. Результаты исследования представлены в таблице 1.
Из таблицы 1 видно, что соединение (1) является низкотоксичным для линии клеток J-774.
Пример 2. Противовоспалительная активность метилового эфира 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты (1).
Противовоспалительную активность соединения формулы (1) подтвердили результатами экспериментов in vitro и in vivo.
Известно, что оксид азота (NO) является одним из медиаторов воспаления, маркером воспаления. Под действием индукторов воспаления инфекционной и неинфекционной природы происходит увеличение экспрессии генов провоспалительных циюкинов, рецепторов к ним, хемокинов, привлекающих в очаг воспаления клетки, обеспечивающие его протекание, ферментов, вырабатывающих медиаторы воспаления (в том числе индуцибельную NO-синтазу (iNOS)), и молекул адгезии. Для изучения противовоспалительной активности каких-либо веществ широко используется тест, оценивающий действие вещества на продукцию NO индуцибельной NO-синтазой [Nathan С. Nitric oxide as a secretory product of mammalian cells. // FASEB J. 1992. V.6 (12). P.3051-3064; Dugo L., Marzocco S., Mazzon E., Di Paola R., Genovese Т., Caputi A.P„ Cuzzocrea S. Ejects of GW274150, a novel and selective inhibitor of iNOS activity, in acute lung inflammation. // Br J Pharmacol. 2004. V.141 (6). P.979-987].
Для изучения влияния соединения формулы (1) на провоспалительные свойства макрофагов использовали клеточную линию J-774, которая представляет собой макрофагальную мышиную линию. Клетки макрофагальной мышиной линии J-774 рассаживали на 96-луночный планшет в среду RPMI с сывороткой и антибиотиками для достижения монослоя. Через 24 часа в лунках меняли среду и прибавляли соединение (1) или бардоксолон метил (2) в диапазоне от 0.01 до 5 мкМ, либо индометацин в диапазоне концентраций от 0.01 до 50 мкМ. ЛПС (липополисахарид) прибавляли до конечной концентрации 10 мкг/мл, либо совместно с исследуемыми соединениями, либо сам по себе. Клетки инкубировали в течение 24 часов. По окончании инкубации анализ количества синтезированного оксида нитрита (NO) проводили с помощью Griess Reagent System («Promega Corp.», США) согласно протоколу производителя. Оптическую плотность измеряли на многоканальном спектрофотометре на длине волны 570 нм. Количество NO, образовавшегося в течение инкубации клеток с соединением и ЛПС, определяли с помощью нитрит-стандарта, входящего в состав Griess Reagent System. Контролем являлись клетки, инкубированные в отсутствии соединений и ЛПС.
Соединение (1) эффективно ингибирует синтез NO в клетках в концентрациях, не достигающих значения IC50 (таблица 2). Степень подавления синтеза увеличивается с повышением концентрации соединения. Результаты исследования представлены в таблице 2. Доверительный интервал рассчитан с α=0.05 по стандартному отклонению от среднего значения, определенному по результату трех независимых экспериментов.
Из таблицы 2 видно, что инкубация клеток с соединением (1) в концентрации 1 мкМ в присутствии ЛПС снижает концентрацию NO практически до концентрации в контроле - клетках, инкубированных в отсутствии ЛПС. Эффективность ингибирования соединения (1) оказалась выше по сравнению с соединением прототипом (2) и индометацином.
Противовоспалительную активность соединения формулы (1) in vivo подтвердили исследованиями на модели гистамин-индуцированного отека. Для индукции отека аутбредным самцам CD-1 массой тела 25-28 г под плантарный апоневроз правой задней лапы вводили по 0.05 мл 0.1% раствора гистамина в аптечном изотоническом растворе хлорида натрия (опытная лапа), в другую заднюю лапу вводили столько же изотонического раствора хлорида натрия без гистамина (контрольная лапа). Соединение формулы (1) вводили внутрижелудочно через зонд в концентрации 50 мг/кг либо в растворе с Tween-80 либо с Cremophore-EL за 1 час до введения гистамина. О противовоспалительной активности судили по уменьшению отека в сравнении с интактной левой лапой по формуле:
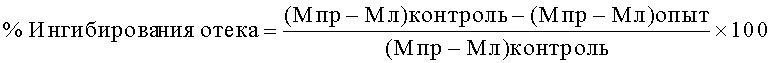
где Мпр - средная масса опытной лапы, Мл - средняя масса контрольной лапы.
Данные, полученные при исследовании противовоспалительной активности на примере снижения гистаминового отека, представлены в таблице 3.
Как видно из представленных данных, соединение формулы (1) при введении внутрь в дозе 50 мг/кг значительно снижает величину отека, а эффективность противовоспалительного действия соединения (1) выше по сравнению с широко используемым НПВС индометацином.
Учитывая, что соединение формулы (1) ингибирует продукцию NO активированными макрофагальными клетками и подавляет локальную воспалительную реакцию, вызванную введением индуктора воспаления (гистамина), можно заключить, что соединение формулы (1) обладает противовоспалительной активностью.
Пример 3. Антиоксидантная активность метилового эфира 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты (1).
Антиоксидантную активность соединения формулы (1) оценивали по развитию спонтанного и аскорбатиндуцированного перекисного окисления липидов (ПОЛ) по уровню накопления соединений, реагирующих с тиобарбитуровой кислотой - ТБК-активных продуктов в гомогенате печени мышей, перенесших гипоксию. Были использованы аутбредные мыши самцы CD-1 массой 22-24 г. Животные получали внутрижелудочно соединение формулы (1) в дозе 50 мг/кг курсом в 1% растворе Tween-80 в объеме 0.5 мл 5 дней, последний раз за 1°ч до моделирования гипоксии. Контрольная группа животных получала курсом по 0.5 мл 1% раствора Tween-80. На 5-й день животных помещали в герметическую емкость объемом 0.2°л и выдерживали до появления предсмертного судорожного припадка или агонального дыхания. Затем мышей извлекали из емкости и декапитировали. Печень промывали охлажденным до 0°С изотоническим раствором натрия хлорида через портальную вену, отделяли и гомогенизировали при 1500 об/мин в этом же растворе. Образование ТБК-активных продуктов определяли при исследовании спонтанного и аскорбатзависимого ПОЛ in vitro в гомогенате печени по принятой методике [Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. М., 1972]. Оптическую плотность регистрировали на спектрофотометре Shimadzu при 532 нм в точках, взятых с интервалом через 15 мин в течение часа.
Результаты исследования антиоксидантной активности соединения формулы (1) представлены в таблице 4.
Как видно из представленных результатов, гипоксическое воздействие приводило к увеличению уровня и скорости накопления ТБК-активных продуктов как спонтанного, так и аскорбатзависимого ПОЛ в печени мышей. Так, при спонтанном ПОЛ количество липидоперекисей превышало таковое в контроле во все сроки исследования, начиная с «нулевой» отметки времени инкубации гомогената. Профилактическое введение соединения формулы (1), как видно из таблицы 4, способствует нормализации процессов ПОЛ в печени мышей при спонтанном ПОЛ, препятствует нарастанию уровня ТБК-активных продуктов во все сроки инкубации гомогената.
Нарастание уровня ТБК-активных продуктов при гипоксии отмечалось также при аскорбатзависимом ПОЛ, начиная с 30 мин инкубации гомогената (таблица 5).
Усиление перекисного окисления липидов in vitro свидетельствует о предшествующей активации процессов ПОЛ в печени мышей в условиях гипоксии. И в этой модели курсовое введение соединения формулы (1) препятствовало нарастанию уровня индуцированных аскорбатом ТБК-активных продуктов на 30, 45 и 60 мин инкубации гомогената печени. Таким образом, соединение формулы (1) при курсовом введении животным вызывает снижение интенсивности ПОЛ в печени животных, подвергнутых гипоксии. Это позволяет заключить, что данное вещество проявляет антиоксидантную активность.
Пример 4. Нейропротекторная активность метилового эфира 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты (1).
Известно, что у антиоксидантов часто присутствует и нейропротекторная активность, т.е. способность защищать нейроны от повреждающего действия активных форм кислорода. Это свойство у соединения формулы (1) было подтверждено экспериментально на модели оксидативного стресса in vitro.
В исследованиях была использована клеточная линия IMR-32 (нейробластома человека). Клетки культивировали в пластиковых флаконах («Costar») при 37°С в атмосфере с 5% СО2 и абсолютной влажности, в среде состава (RPMI 1640,10% ЭТС, 20 мМ HEPES, 0.05 мМ 2-меркаптоэтанол, 50 мкг/мл гентамицин и 2 мМ L-глютамин). Через 2-3 пассажа содержимое флаконов сливали, центрифугировали и ресуспендировали в свежей среде, после чего оценивали количество жизнеспособных клеток. Затем клетки помещали в 96-луночные планшеты и добавляли 0.5 мМ H2O2. Через 2 часа из лунок удаляли надосадок (надосадочную жидкость) и вносили культуральную среду, содержащую различные концентрации исследуемого соединения формулы (1), культивировали в указанных выше условиях 24 часа. За 4 ч до окончания культивирования в лунки вносили бромид 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразола (МТТ, «Merck Bioscience»), (до концентрации 200 мкг/мл) концентрация которого в лунках составляла 200 мкг/мл. Затем из лунок удаляли надосадок, а осадок растворяли диметилсульфоксидом («Димексид», «Татхимфармпрепараты»). Ход реакции оценивали с помощью многоканального спектрофотометра («Пикон») по интенсивности поглощения раствора при длине волны 530 нм. Результаты представлены в таблице 6.
Как видно из таблицы, соединение формулы (1) восстанавливало поврежденные перекисью водорода клетки нейробластомы, хотя и не отменяло последствия негативного воздействия полностью. Аналогичные по качеству результаты получены и на другой модели оксидативного стресса, индуцированного сульфатом железа. Таким образом, полученные данные указывают, что соединение формулы (1) обладает нейропротекторным действием на модели оксидативного стресса.
Пример 5. Антипаркинсоническая активность метилового эфира 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты (1).
В основе патогенеза болезни Паркинсона лежит, как известно, гибель дофаминергических нейронов. Для моделирования болезни Паркинсона in vivo и in vitro в качестве повреждающего агента используется гидроксилированная форма дофамина-6-гидроксидофамин (6-OHDA), нейротоксин с селективным цитотоксическим действием в отношении дофаминергических нейронов. По молекулярной структуре 6-гидроксидофамин (6-OHDA) аналогичен дофамину, входит в клетку с помощью специфического дофаминового транспортера и генерирует образование активных форм кислорода, что и приводит к гибели нейрона. В связи с этим 6-OHDA широко используется для экспериментального моделирования поражения нейронов in vitro, характерного для болезни Паркинсона [Takata M.K., Yamaguchi F., Nakanose К., Watanabe Y., Hatano N., Tsukamoto I., Nagata M., Izumori K., Tokuda M. Neuroprotective effect of D-psicose on 6-hydroxydopamine-induced apoptosis in rat pheochromocytoma (PC12) cells. // J Biosci Bioeng. 2005. V.100 (5). P.511-516; Tiong C.X., Lu M., Bian J.S. Protective effect of hydrogen sulphide against 6-OHDA-induced cell injury in SH-SY5Y cells involves PKC/PI3K/Akt pathway. // Br J Pharm. 2010. V.161 (2). P.467-480; Wang M., Zhang Z., Cheang L.C.V., Lin Z., Lee M.Y.S. Eriocaulon buergerianum extract protects PC12 cells and neurons in zebrafish against 6-hydroxydopamine-induced damage. // Chin Med. 2011. №6. Р.16-26].
В экспериментах была использована клеточная линия IMR-32, которая представляет собой нейробластому человека. Клетки культивировали в среде следующего состава: RPMI 1640 («Sigma»), 10% ЭТС («Hyclone»), 20 мМ HEPES («Sigma»), 0.05 мМ 2-меркаптоэтанола («Sigma»), 50 мкг/мл гентамицина («Sigma») и 2 мМ L-глютамина («Sigma»). Клетки пассировали в пластиковых флаконах («Costar») при 37°С в атмосфере с 5% СО2 и абсолютной влажности. Через 2-3 пассажа содержимое флаконов сливали, центрифугировали и ресуспендировали в свежей среде, после чего оценивали количество жизнеспособных клеток. Затем клетки помещали в 96-луночные планшеты и вносили в лунки исследуемое вещество - соединение формулы (1) в различных концентрациях и культивировали в указанных выше условиях 12 часов. После этого надосадок удаляли и вносили в лунки по 0.2 mM раствора 6-OHDA («Sigma»), культивировали в указанных выше условиях еще 12 часов. За 4 ч до окончания культивирования в лунки вносили бромид 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразола (МТТ, «Merck Bioscience»), концентрация которого в лунках составляла 200 мкг/мл. Затем из лунок удаляли надосадок, а осадок растворяли диметилсульфоксидом (димексид, «Татхимфармпрепараты»). Ход реакции оценивали с помощью многоканального спектрофотометра («Пикон») по интенсивности поглощения раствора при длине волны 530 нм. Результаты представлены в таблице 7.
Предобработка клеток соединением формулы (1) дозозависимо повышала число живых клеток в культуре с токсином 6-OHDA, максимальный эффект наблюдался при концентрации исследуемого вещества 40 нМ, в этой концентрации количество живых клеток было вдвое больше, чем в контрольной культуре. Таким образом, полученные данные указывают, что исследуемое соединение формулы (1) обладает антипаркинсонической активностью.
Антипаркинсоническое действие соединения формулы (1) выявлено также и на моделях болезни Паркинсона in vivo: химически индуцированный паркинсонизм с использованием галоперидола и МРТР.
Пример 6. Нейропротекторная активность метилового эфира 2-пиано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты (1) в модели болезни Альцгеймера.
Болезнь Альцгеймера (БА) - тяжелое нейродегенеративное заболевание, приводящее к тяжелым нарушениям когнитивных функций. Ключевым маркером БА является накопление внеклеточных амилоидных бляшек и внутриклеточных нейрофибриллярных клубков [Tiraboschi P., Hansen L.A., Thal L.J, Corey-Bloom J. The importance of neuritic plaques and tangles to the development and evolution of AD. // Neurology. 2004. V.62 (11). P.1984-1989]. Амилоид-β (Аβ), основной компонент бляшек, играет ключевую роль в патогенезе БА, цитотоксическое действие олигомера Аβ 1-42 на клетки нейробластомы является широко используемой моделью БА in vitro [Kozikowski A.P., Chen Y., Subhasish Т., Lewin N.E., Blumberg P.M., Zhong Z., D'Annibale M.A., Wang W.-L., Shen Y., Langley B.C. Searching for disease modifiers - PKC activation and HDAC inhibition - a dual drug approach to Alzheimer's disease that reduces Aβ production while blocking oxidative stress. // Chem Mod Chem. 2009. V.4 (7). P.1095-1105; Liu P., Zhao L., Zhang S-L., Xiang J-Z. Modified wendan decoction can attenuate neurotoxic action associated with Alzheimer's disease. // eCAM. 2009. V.6 (3). P.325-330].
Клетки нейробластомы человека IMR-32 культивировали и готовили к эксперименту так, как описано выше. Подготовленные клетки помещали в 96-луночный планшет, добавляли исследуемое соединение формулы (1) в разных концентрациях и раствор олигомера амилоида-β 1-42 («Sigma»). Клетки культивировали 24 часа, за 4 ч до окончания культивирования в лунки вносили бромид 3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразола (МТТ, «Merck Bioscience»), концентрация которого в лунках составляла 200 мкг/мл. Затем из лунок удаляли надосадок, а осадок растворяли диметилсульфоксидом (димексид, «Татхимфармпрепараты»). Ход реакции оценивали с помощью многоканального спектрофотометра («Пикон») по интенсивности поглощения раствора при длине волны 530 нм. Результаты представлены в таблице 8. Как видно из таблицы, соединение формулы (1) в концентрациях 10 нМ и 20 нМ оказывает протекторное действие на клетки нейробластомы в присутствии олигомера амилоида-β 1-42, что указывает на возможность предупреждать развитие болезни Альцгеймера.
Соединение формулы (1) проявляло также терапевтическую эффективность на модели болезни Альцгеймера, вызванной скополамином.
Пример 7. Протгивоартритная активность метилового эфира 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты (1).
Противоартритное действие соединения формулы (1) подтвердили экспериментами на модели адьювантного артрита у крыс, воспроизведенной согласно «Методическим указаниям по изучению новых нестероидных противовоспалительных препаратов» [Методические указания по изучению новых нестероидных противовоспалительных препаратов. / Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ (под общей редакцией Р.У.Хабриева). М.: ОАО «Издательство «Медицина»», 2005. С.701].
Аутбредным крысам Sprague Dawley массой тела 250-280 г в правую заднюю лапу (опытная лапа) вводили по 0.1 мл полного адьюванта Фрейнда («Difco»), а в левую - аналогичный объем аптечного раствора хлорида натрия (контрольная лапа). Начиная с первого дня после инъекции адъюванта, ежедневно в течение 14 дней вводили соединение формулы (1) внутрижелудочно через зонд в концентрации 50 мг/кг в растворе с Tween-80. Животным контрольной группы вводили водный раствор Tween-80 без соединения формулы (1) в том же объеме. Величину отека оценивали онкометрически в динамике воспаления и выражали в разнице между объемом опытной и контрольной лап в мл. Результаты представлены в таблице 9.
Как видно из таблицы 9, профилактическое введение соединения формулы (1) привело к значительному подавлению величины отека лап при развитии артрита у крыс, что свидетельствует о наличии у соединения формулы (1) противоартритной активности.
Пример 8. Влияние метилового эфира 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты (1) на воспалительные заболевания кишечника.
К воспалительным заболеваниям кишечника относятся неспецифический язвенный колит и болезнь Крона. В основе патогенеза этих заболеваний лежит аутоиммунное воспаление в стенке кишечника. Широко используемой моделью этой группы заболеваний является индуцированный 2,4,6-тринитробензоилсульфоновой кислотой (TNBS) колит у крыс по методу Morris G.P. [Morris G.P., Beck P.L., Herridge M.S., Depew W.T., Szewczuk M.R., Wallace J.L. Hapten-induced model of chronic inflammation and ulceration in the rat colon. // Gastroenterology. 1989. V.96 (3). P.795-803]. Аутбредным крысам Sprague Dawley массой тела 250-280 г под наркозом при помощи катетера в прямую кишку через анус вводили по 0.25 мл раствора TNBS в 50%-ом этаноле (в концентрации 120 мг/мл). После этого животных держали вертикально головой вниз в течение 1 минуты. Соединение формулы (1) в дозе 50 мг/кг вводили внутрижелудочно в растворе 1% Tween-80 1 раз в день в течение 7 дней, начиная со дня введения TNBS. Клиническую оценку тяжести колита проводили по наличию у животных на 8-й день диареи, затем животных забивали, оценивали величину воспаления отрезка толстого кишечника (по массе отрезка длиной 10 см) и наличие спаек между воспаленным участком кишечника и прилежащими органами. Результаты представлены в таблице 10.
Исследуемое соединение формулы (1) снижало величину отека отрезка кишечника, значительно уменьшало клинические и морфологические проявления колита - количество животных с диареей и количество крыс, у которых наблюдались спайки. Полученные данные свидетельствуют о наличии у соединения формулы (1) свойства подавлять аутоиммунное воспаление в толстом кишечнике.
Пример 9. Влияние метилового эфира 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты (1) на экспериментальный аутоиммунный энцефаломиелит.
Экспериментальный аутоиммунный энцефаломиелит представляет собой модель рассеянного склероза - тяжелого аутоиммунного заболевания человека [Huitinga I., Bauer J., Stnjbos P.J.L.M., Rothwell N.J., Dijkstra C.D., Tilders F.J.H. Effect of annexm-1 on experimental autoimmune encephalomyelitis (EAE) in the rat. // Clin Exp Inununol. 1998. V.111 (1). P.198-204]. В экспериментах использовали аутбредных крыс Sprague Dawley массой тела 270-300 г. Миелиновый основный белок (Myelin Basic Protein bovine M1891 - MBP, «Sigma») в полном адъюванте Фрейнда («Difco») вводили в подушечку задней лапы крысы в объеме 0.06 мл (по 25 мг MBP). Соединение формулы (1) в дозе 50 мг/кг вводили 1 раз в день внутрижелудочно в растворе Tween-80 в течение 14 дней, начиная со дня иммунизации MBP. Контрольные животные получали аналогичным образом раствор Tween-80. Каждая группа состояла из 7 крыс. С появлением клинических признаков энцефаломиелита (с 7-го дня после иммунизации) проводили ежедневную оценку тяжести заболевания и оценивали ее в баллах по следующей шкале:
0 - нет симптомов;
1 - нарушение тонуса хвоста и неустойчивая походка;
2 - парез задних конечностей;
3 - полный паралич задних конечностей;
4 - паралич нижней части тела;
5 - смерть.
Результаты представлены в таблице 11.
Курсовое введение соединения формулы (1) приводило к подавлению развития энцефаломиелита, различия с контрольной (нелеченой) группой проявлялись, начиная с 13-го дня после иммунизации. Под действием соединения формулы (1) снижалась как тяжесть клинического течения, так и количество животных с тяжелыми проявлениями заболевания. Полученные данные свидетельствуют о наличии у соединения формулы (1) потенциальной способности подавлять аутоиммунное заболевание - рассеянный склероз.
Пример 10. Гиполипидемическое и антиатеросклеротическое действие метилового эфира 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты (1).
Установлено, что в развитии атеросклероза наиболее существенным является изменение соотношения в крови различных по плотности фракций липополипротеидов: увеличение атерогенных липопротеидов (липопротеидов низкой плотности (ЛПНП), липопротеидов очень низкой плотности (ЛПОНП), особого липопротеида (ЛПа)) и снижение антиатерогенных липопротеидов (липопротеидов высокой плотности (ЛПВП)).
Моделирование дисбаланса липополипротеидов осуществляли согласно методическим указаниям «Методические указания по изучению гиполипидемического и антиатеросклеротического действия фармакологических веществ» [Методические указания по изучению гиполипидемического и антиатеросклеротического действия фармакологических веществ. / Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ (под общей редакцией Р.У.Хабриева). М.: ОАО «Издательство «Медицина»», 2005. С.452], используя специальную диету. В экспериментах использовали аутбредных крыс Sprague Dawley массой тела 300-350 г, которым вводили в утренние часы внутрижелудочно ежедневно суспензию холестерина (в дозе 0.5 г/кг) в 30%-ом растворе насыщенных жиров в течение 21 дня. Для получения насыщенных жиров использовали подсолнечное масло, предварительно обработанное термически. Одновременно животные получали соединение формулы (1) в дозе 50 мг/кг внутрижелудочно в 1%-ном растворе Tween-80 в объеме 1 мл в течение 21 дня (во второй половине дня). Затем животных забивали, забирали кровь и получали сыворотку, в которой определяли содержание различных фракций липополипротеидов ферментативным способом с использованием коммерческих тест-систем согласно приложенным протоколам («Вектор-Бэст»). Результаты представлены в таблице 12.
Как видно из таблицы, холестериновая диета увеличивала содержание в крови общего холестерина и атерогенных липопротеидов (ЛПНП). У животных, получавших курс соединения формулы (1), наблюдалось снижение этих показателей. Кроме того, у животных опытной группы уменьшалось содержание триглицеридов и ЛПОНП, при этом повышалось содержание антиатерогенных липопротеидов (ЛПВП). Таким образом, соединение формулы (1) при модельной гиперлипидемии проявило антиатеросклеротическую и гиполипидемическую активность.
Пример 11. Гипогликемическое и антидиабетическое действие метилового эфира 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты.
Гипогликемическое и антидиабетическое действие соединения формулы (1) изучили на модели диабета, вызванного введением крысам аллоксана. Аллоксановый диабет является моделью инсулинзависимого сахарного диабета. Введение аллоксана приводит к гибели бета-клетки поджелудочной железы и появлению симптомов диабета (гипергликемия, глюкозурия, полифагия, полидипсия и полиурия), которые развиваются через 24-36 часов после введения аллоксана.
Моделирование диабета осуществляли, как описано [Yadav J.P., Saini S., Kalia A.N., Dangi A.S. Hypoglycemic and hypolipidemic activity of ethanolic extract of Salvadora oleoides in normal and alloxan induced diabetic rats. // Indian J Pharmacol. 2008. V.40. P.23-27]. Крысам самкам Sprague Dawley массой тела 300-350 г, лишенным пищи в течение ночи, в утренние часы внутрибрюшинно инъецировали раствор аллоксана тригидрата («La Chema») в дозе 120 мг/кг массы тела. Через 72 часа у животных забирали натощак кровь из хвостовой вены и определяли в ней содержание глюкозы при помощи глюкометра OneTouch Ultra. Животные, у которых уровень глюкозы превышал 200 мг/дл, были взяты для исследования противодиабстического действия соединения формулы (1). На другой день часть животных начинали получать ежедневно внутрь соединение формулы (1) в дозе 50 мг/кг в растворе Tween-80 в объеме 1 мл, другая часть - только по 1 мл раствора Tween-80. Длительность курса составила 21 день. Затем после забора крови и оценки уровня глюкозы животных забивали для получения сыворотки крови, в которой оценивали содержание общего холестерина, триглицеридов, ЛПВП, ЛПНП, ЛПОНП, общего белка, альбумина, креатина, для чего использовали коммерческие тест-системы («Вектор-Бэст») согласно приложенным протоколам. Результаты представлены в таблицах 13 и 14.
Как видно из таблицы 13, курсовое введение исследуемого соединения приводило к значительному снижению содержания глюкозы в сыворотке крови крыс с диабетом, что свидетельствует о наличии у соединения гипогликемической активности.
Соединение формулы (1) улучшало и ферментативную функцию поджелудочной железы, что отразилось на некоторых биохимических показателях сыворотки крови (таблица 14). Содержание общего холестерина, триглицеридов, ЛПНП, ЛПОНП и креатинина снижалось практически до интактного уровня; сниженное содержание ЛПВП, общего белка и альбумина повышалось, достигая нормальных значений.
Полученные результаты показывают, что курсовое введение соединения формулы (1) оказывает антидиабетическое действие, снижая уровень глюкозы в крови и нормализуя секреторную активность поджелудочной железы.
Пример 12. Гепатопротекторная активность метилового эфира 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты (1).
Гепатопротекторную активность соединения формулы (1) изучали на модели токсического повреждения печени, вызванного введением крысам тетрахлорметана согласно «Методическим указаниям по изучению гепатозащитной активности фармакологических веществ» [Методические указания по изучению гепатозащитной активности фармакологических веществ. / Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ (под общей редакцией Р.У.Хабриева). М.: ОАО «Издательство «Медицина»», 2005. С.683]. В экспериментах были использованы крысы самцы Sprague Dawley массой тела 200-230 г. Животные опытной группы получали ежедневно внутрижелудочно соединение формулы (1) в дозе 50 мг/кг в растворе Tween-80 в объеме 1 мл, крысы контрольной группы получали в том же объеме аналогичным образом по 1 мл раствора Tween-80. Курс введения составил 3 дня. Через 1 час после последнего введения внутрижелудочно крысам обеих групп ввели раствор тетрахлорметана (ССl4) в оливковом масле (соотношение компонентов 1:1) в дозе 5 мл/кг. Через 24 часа у животных брали кровь и определяли в сыворотке содержание ТБК-активных продуктов (малоновый диальдегид - МДА), глутатиона и активность супероксиддисмутазы, каталазы, глутатионпероксидазы. Результаты представлены в таблице 15.
На фоне развития токсического гепатита у животных повышалось содержание в сыворотке крови продукта перекисного окисления липидов - МДА, при этом снижалась активность ферментов, обеспечивающих антиоксидантную активность (таблица 15). Введение соединения формулы (1) значительно повышало активность этих ферментов и приводило к снижению содержания продукта перекисного окисления. Таким образом, полученные результаты подтверждают наличие у соединения формулы (1) гепатопротекторной активности.
Пример 13. Иммуносупрессорная активность метилового эфира 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты (1).
Иммуносупрессорную активность соединения формулы (1) изучали согласно «Методическим указаниям по изучению иммунотропной активности фармакологических веществ» [Методические указания по изучению иммунотропной активности фармакологических веществ. / Руководство по экспериментальному (поклиническому) изучению новых фармакологических веществ (под общей редакцией Р.У.Хабриева). М.: ОАО «Издательство «Медицина»», 2005. С.501]. Для оценки иммунотропного действия исследовали влияние соединения формулы (1) на гуморальный и клеточный иммунный ответ, вызванный эритроцитами барана (ЭБ). Гуморальный ответ оценивали по числу антителообразующих клеток (АОК) в селезенке, клеточный - по величине реакции гиперчувствительности замедленного типа (ГЗТ).
Эксперименты проведены на мышах линии BALB/c (масса тела 19-20 г, возраст 8 недель). Животные получали ежедневно внутрижелудочно соединение формулы (1) в дозе 50 мг/кг в растворе Tween-80 в объеме 1 мл (опытная группа) или только раствор Tween-80 (контрольная группа) в течение 3-х дней. На 4-й день мышей обеих групп иммунизировали эритроцитами барана и продолжали вводить растворитель или соединение формулы (1) в течение еще 4-х дней (курс введения составил 7 дней). Для иммунизации суспензию эритроцитов барана («ЭКОлаб») предварительно трижды отмывали, подсчитывали их количество и в объеме 0.2 мл внутрибрюшинно вводили для определения числа АОК по 5×106, при проведении реакции ГЗТ по 1×108.
Для определения числа АОК животных забивали на 5-е сутки после иммунизации ЭБ, лимфоциты получали гомогенизацией селезенок в стеклянном гомогенизаторе, после чего клеточную взвесь фильтровали через 4-слойный капрон, трижды промывали, ресуспендировали в 4 мл среды 199 и подсчитывали количество жизнеспособных клеток. В пробирки, предварительно нагретые до 49-53°С, вносили 0.9 мл среды культивирования (среда 199, 0.7% агар, «Difco»), 0.2 мл 20%-ой взвеси эритроцитов барана, 0.2 мл взвеси спленоцитов и 0.1 мл комплемента (ФГУП «НПО» «Микроген»»). После ресуспендирования данной смесью заполняли камеры Горяева, помещали их во влажную камеру, инкубировали 2 часа при 37°С, затем подсчитывали зоны гемолиза при помощи светового микроскопа.
Для оценки действия соединения формулы (1) на реакцию ГЗТ на 5-е сутки после иммунизации ЭБ животным проводили разрешающую инъекцию ЭБ в подушечку задней лапы - «опытная лапа» (108 ЭБ в 0,02 мл изотонического раствора хлорида натрия). В контрлатеральную лапу вводили 0.02 мл стерильного изотонического раствора хлорида натрия («контрольная лапа»). Местную воспалительную реакцию оценивали через 24 часа. Животных забивали, обе лапки отрезали по выступу кости ниже сочленения мало- и большеберцовой кости и выше пяточного сустава. Величину реакции оценивали по разнице массы опытной и контрольной лап и выражали в мг.
Как видно из представленных результатов (таблица 16), у животных, получавших соединение формулы (1), наблюдалось снижение вдвое величины реакции ГЗТ и уменьшение числа АОК. Эти данные свидетельствуют о наличии у соединения формулы (1) способности подавлять активность как клеточного, так и гуморального иммунного ответа, т.е. проявлять иммуносупрессорное действие.
Таким образом, экспериментально на моделях in vivo и in vitro показано, что метиловый эфир 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты - соединение формулы (1) обладает антиоксидантной, противовоспалительной, нейропротекторной, цитопротекторной, антипаркинсонической, гепатопротекторной и иммуносупрессорной активностями, способностью предотвращать развитие или облегчать течение нейродегенеративных (болезнь Паркинсона, болезнь Альцгеймера), воспалительных аутоиммунных (неспецифический язвенный колит, болезнь Крона, энцефаломиелит, ревматоидный артрит) заболеваний; оказывает гиполипидемический и гипогликемический эффект, антиатеросклеротическое и антидиабетическое действие. Благодаря таким свойствам метиловый эфир 2-циано-3,12-диоксо-18βН-олеан-1(2),11(9)-диен-30-овой кислоты (1) может быть использован для разработки лекарственных средств для профилактики и лечения атеросклероза, диабета (1 и 2 типов), аутоиммунных заболеваний (таких как ревматоидный артрит, рассеянный склероз), нейродегенеративных заболеваний (таких как болезнь Паркинсона, болезнь Альцгеймера, токсический и лекарственный паркинсонизм), воспалительных заболеваний кишечника (таких как неспецифический язвенный колит, болезнь Крона).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

