Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ДИТРИТИЙДИФТОРБЕНЗОЛА ИСТОЧНИКА ФТОРИРОВАННЫХ НУКЛЕОГЕННЫХ ФЕНИЛ-КАТИОНОВ
Вид РИД
Изобретение
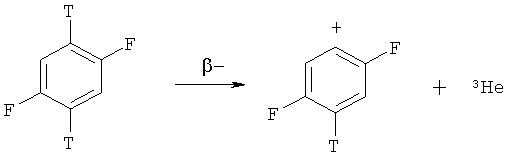
Настоящее изобретение относится к радиохимии, а именно к способу получения дитритийдифторбензола источника ядерно-химического генерирования неизвестных фторзамещенных фенил-катионов по реакции:
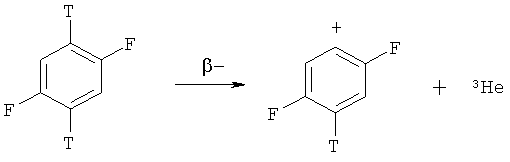
Открытый в середине 20-го века ядерно-химический метод привнес уникальную возможность генерирования свободных карбениевых ионов при процессах β-распада трития в составе углеводородов [Нефедов В.Д., Синотова Е.Н., Торопова М.А. Химические последствия β-распада. М.: Атомиздат, 1978. С.126-179; Нефедов В.Д., Синотова Е.Н., Торопова М.А. Ядерно-химический метод получения свободных карбениевых ионов и радиохимическое изучение реакций этих частиц // Изв. СО АН СССР, сер. хим. наук. 1980, №3. С.35-43; Speranza М. Tritium for generation of carbocations // Chem. Rev. 1993 / V.93, P.2933-2980].
Ранее нами был проведен цикл работ по генерированию нуклеогенных фенил-катионов, полученных в результате β-распада трития в составе как полностью тритированного бензола:
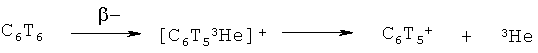
так и дитритийбензола:
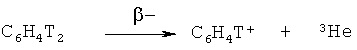
А также были изучены ион-молекулярные реакции полученных свободных нуклеогенных фенил-катионов с различными классами полицентровых нуклеофилов - органических, элементоорганических и гетероциклических соединений [Shchepina N.E., Nefedov V.D., Toropova М.А., Avrorin V.V., Lewis S.B., Mattson. Ion-molecular reactions of free phenylium ions, generated by tritium β-decay with group V-VII elements // Tetrahedron Letters, 2000, V.41. P.5303-5306; Щепина Н.Е., Аврорин В.В., Бадун Г.А., Александрова Г.А., Уханов С.Е., Федосеев В.М., Льюис С.Б., Бойко И.И. Получение меченных тритием N-фенилзамещенных производных хинолиния в результате ядерно-химического синтеза // ХГС, 2009. №7. С.1008-1014; Щепина Н.Е., Аврорин В.В., Бадун Г.А., Льюис С.Б., Федосеев В.М., Уханов С.Е. Реакция фенилирования нуклеогенными катионами как метод синтеза неизвестных и труднодоступных соединений, меченных тритием // Вестник Московского университета. 2009. Т.50, №5. С.311-316].
Одним из существенных достижений ядерно-химического метода было открытие ранее неизвестной реакции прямого фенилирования атома азота в шестичленных гетероциклических производных (особенно это касается хинолиниевых производных):
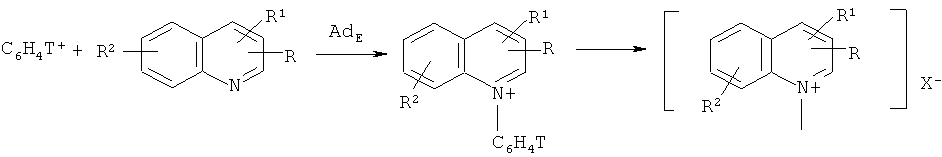
R=H, CH3, C6H5CH2, Br; X-=BF4 -;
R1=H, CH3;
R2=H, CH3,
и разработка одностадийного синтеза неизвестных и труднодоступных меченных тритием N-фенильных гетероциклических ониевых соединений, многие из которых являются важными биологически активными веществами [Щепина Н.Е., Аврорин В.В., Бадун Г.А., Федосеев В.М., Льюис С.Б. Новый метод синтеза труднодоступных стерически затрудненных пиридиниевых производных, меченных тритием // ХГС, 2010, т.46, №5, С.692-698; Щепина Н.Е., Аврорин В.В., Александрова Г.А., Бадун Г.А. Неизвестная реакция прямого фенилирования атома азота в шестичленных гетероциклических соединениях - одностадийный синтез сложных биологически активных азотистых производных, меченных тритием // Перспективные материалы. 2011. №10. С.339-344].
Широко известно, что шестичленные азотсодержащие гетероциклические соединения являются крайне важными объектами биологических исследований. Это и известные в природе производные никотиновой кислоты (компоненты коферментов, витамина В2 и В6), а также огромное число лекарственных препаратов, содержащих в своем составе гетероциклическое пиридиновое кольцо (пироксикам, обладающий противовоспалительной активностью, нифедипин и амлодипин, применяемые для лечения стенокардии, а также пинацидил - препарат для лечения гипертонической болезни) [Джилкрист Т. Химия гетероциклических соединений. М.: Мир, 1996. 463 с.; Pozharskii A.F., Soldatenkov А.Т., Katritzky A.R. Heterocycles in Life and Society. New York: Wiley, 1997. 301 p.; Heterocyclic Chemistry; 4th Ed; Joule, J. A. and Mills, K.; Blackwell Science, 2000. 589 p.]. Введение фтора в хинолиновое кольцо привело к открытию нового класса сильнодействующих антибактериальных препаратов - фторхинолонового ряда, без которых сегодня трудно представить современный арсенал антибактериальных химиотерапевтических средств [Chemistry of Organic Fluorine Compounds; II ACS Monograph 187: Washington DC, 1995. 1296 p.; Падейская Е.Н., Яковлев В.П. Фторхинолоны. М.: Биоинформ, 1995. 208 с.; Машковский М.Д. Лекарственные средства 15-е изд. М.: Новая Волна, 2005. 844 с.; Wright D.H., Brown G.H., Peterson M.L., Rotschafer J.C. Application of fluoroquinolone Pharmacodynamics // J. Antimicrob. Chemother. 2000. V.46. P.669-683; Noreddin A.M., Haynes V.L., Zhanel G.G. Pharmacokinetics and pharmacodynamics of the new quinolones // J. Pharm. Pract. 2005. V.18. P.432-443; Melhus A. Fluoroquinolones and tendon disorders // Expert Opin. Drug Saf. 2005. V.4. P.299-309; Murray T.S., Baltimore R.S. Pediatric uses of fluoroquinolone antibiotics // Pediatr. Ann. 2007. V.36. P.336-342; Boogaard J., Kibiki G.S., Kisanga E.R., Boeree M.J., Aarnoutse R.E. New drugs against tuberculosis; problems, progress, and evaluation of agents in clinical development // Antimicrob. Ag. Chemother. 2009. V.53. P.849-862].
В связи с этим представляло особый интерес осуществление ядерно-химических синтезов уже фторзамещенных гетероциклических производных.
Задачей данного изобретения является разработка простого по исполнению, доступного по реагентам, с достаточно хорошими радиохимическими выходами одностадийного метода получения дитритийдифторбензола, источника генерирования нуклеогенных реакционно-способных фторированных фенил-катионов для последующих ядерно-химических синтезов фторзамещенных гетероциклических производных.
Поставленная задача достигается признаками, указанными в формуле изобретения, а именно: способ получения дитритийдифторбензола источника неизвестных фторированных нуклеогенных фенил-катионов в результате реакции гидрирования газообразным тритием 1,4-дибром-2,5-дифторбензола на катализаторе Pd/BaSO4 при комнатной температуре, при этом в полученном дитритийдифторбензоле при самопроизвольном бета-распаде трития генерируются неизвестные свободные нуклеогенные фторзамещенные фенил-катионы:

Технический результат от вышеперечисленной совокупности существенных признаков - упрощение способа получения дитритийдифторбензола, источника генерирования нуклеогенных реакционно-способных фторированных фенил-катионов для последующих ядерно-химических синтезов фторзамещенных гетероциклических производных.
Для введения фтора в бензольное кольцо была выбрана новая реакционно-способная частица - фторированный фенил-катион, который будет генерироваться при β-распаде трития в дифтордитритийбензоле.
При этом для генерирования только одного типа катионов необходимо использовать дифтордитритийбензол, в котором оба атома трития эквивалентны. Такая ситуация реализуется при использовании двух изомеров дифтордитритийбензола - 1,4-дифтор-2,5-дитритийбензола и 1,2-дифтор-4,5-дитритийбензола.
Получение дифтордитритийбензола возможно двумя альтернативными путями, во-первых, путем гидролиза дифторфенилендилития [Талалаева Т.В., Кочешков К.А. Методы элементоорганической химии (литий, натрий, калий, рубидий, цезий). Кн. 2. М.: Наука, 1971. С.565-1192] тритийсодержащей водой, а во-вторых, путем каталитической замены галогена на тритий [Щепина Н.Е., Аврорин В.В., Бадун Г.А., Федосеев В.М., Уханов С.Е., Льюис С.Б. Ядерно-химический синтез фенилзамещенных производных пиколинов, меченных тритием // Радиохимия. 2007. Т.49. №6. С.551-553; Щепина Н.Е., Аврорин В.В., Бадун Г.А. Способ получения N-фенилзамещенных трициклических азотистых соединений, меченных тритием. Решение о выдаче патента на изобретение РФ по заявке №2010127663 от 01.08.2011 г.] в дифтордибромбензоле. Недостатками первого пути являются: а) необходимость использования при гидролизе в достаточно большом избытке тритийсодержащей воды; б) проведение реакции в диэтиловом эфире, который является сильным нуклеофилом, а следовательно, будет конкурентом хинолиновым соединениям в реакциях с дифторфенильным катионом. Удаление избытка тритийсодержащей воды и замена эфира на слабый нуклеофил - гексан - процедура нежелательная при работе с ультрамалыми количествами меченых соединений. Второй путь свободен от этих недостатков, и поэтому именно он был выбран для синтеза дифтордитритийбензола. Дифтордитритийбензол был синтезирован по видоизмененной методике с использованием реакции замещения галогена на тритий, катализируемой палладием на сульфате бария, и в присутствии амина для связывания, образующегося в реакции галогенводорода:
C6H2F2Br2+23H2+(С4Н9)3N→C6H4F2 3H2+(C4H9)3N3H Br
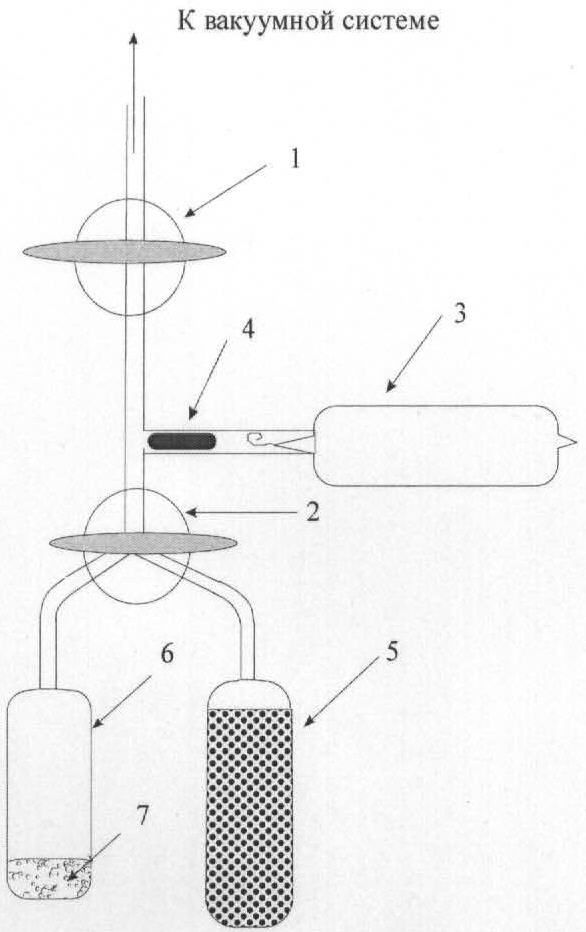
Изобретение иллюстрируется примером синтеза и схемой установки.
Синтез проводился на установке, схематично изображенной на Фиг. Установка для синтеза дитритийдифторбензола содержит: 1 - вакуумный кран; 2 - трехходовой кран; 3 - ампула с тритием; 4 - боек; 5 - ампула с молекулярными ситами; 6 - реакционная ампула; 7 - реакционная смесь и катализатор.
Пример
В качестве исходного соединения использовался 1,4-дибром-2,5-дифторбензол, а в качестве основания для связывания бромистого водорода - высококипящий трибутиламин, что обеспечивало легкость разделения дифторбензола и амина простой дистилляцией в вакууме. В реакционную ампулу помещали 5-10 мг катализатора (5% палладия на сульфате бария), а вторую ампулу заполняли молекулярными ситами СаХ и обе подсоединяли к установке для синтеза. Ампулы с молекулярными ситами и с катализатором вакуумировали, прогревая молекулярные сита до ~400°С, а ампулу с катализатором до температуры около 160°С. Вакуумирование продолжали до достижения максимального разряжения (~10-3 мм рт.ст.). После достижения предельного разряжения в ампулу с катализатором вводили водород до давления примерно 0,5 атм. Выдерживали 10-15 минут при этой температуре, охлаждали до комнатной температуры и остаточный водород и летучие продукты гидрирования удаляли в вакууме. Реакционную ампулу отсоединяли, вводили в нее 50 мкл гексанового раствора, содержащего 20 мкмолей 1,4-дибром-2,5-дифторбензола и 30 мкмолей трибутиламина. Ампулу охлаждали жидким азотом и вакуумировали. В ампулу с молекулярными ситами при охлаждении жидким азотом конденсировали 2,5 Ки трития, трехходовой кран устанавливали в такое положение, чтобы соединить реакционную ампулу и ампулу с молекулярными ситами. Реакционную ампулу охлаждали жидким азотом, а ампулу с молекулярными ситами отогревали до комнатной температуры, после чего реакционную ампулу поворотом трехходового крана герметизировали и ее содержимое перемешивали встряхиванием в течение 1 часа. К установке подсоединяли вместо ампулы с молекулярными ситами чистую пустую ампулу вместимостью ~0,5 см3. Реакционную ампулу вакуумировали при охлаждении жидким азотом и летучие продукты гидрирования вместе с гексаном перегоняли в статическом вакууме в охлаждаемую жидким азотом вновь подсоединенную ампулу. Анализ продуктов реакции осуществляли методом газовой хроматографии. На хроматограмме наблюдалось лишь два пика, принадлежащие гексану и дифторбензолу, что свидетельствовало о высокой химической чистоте полученного продукта. Его массу определяли методом внешней нормализации, она оказалась равной 14,6 мкмолей, что соответствует выходу в расчете на 1,4-дибром-2,5-дифторбензол 73%. Активность полученного продукта измеряли методом жидкостной β-радиометрии на установке Бета-2. Удельная активность синтезированного 1,4-дифтор-2,5-дитритийбензола оказалась равной 54±5 мКи/мкмоль, общая активность 788±73 мКи, кратность тритиевой метки 1,93±0,18.
Из описания и практического применения настоящего изобретения специалистам будут очевидны и другие частные формы его выполнения. Данное описание и примеры рассматриваются как материал, иллюстрирующий изобретение, сущность которого и объем патентных притязаний определены в нижеследующей формуле изобретения совокупностью существенных признаков и их эквивалентами.
Способ получения дитритийдифторбензола источника неизвестных фторированных нуклеогенных фенил-катионов в результате реакции гидрирования газообразным тритием 1,4-дибром-2,5-дифторбензола на катализаторе Pd/BaSO при комнатной температуре, при этом в полученном дитритийдифторбензоле при самопроизвольном бета-распаде трития генерируются неизвестные свободные нуклеогенные фторзамещенные фенил-катионы: