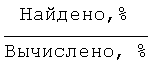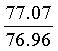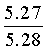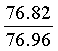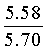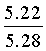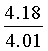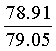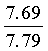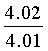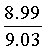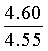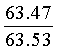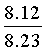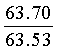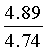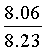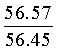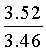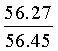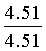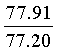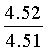Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 2-(2-АЦИЛВИНИЛ)ИНДОЛОВ
Вид РИД
Изобретение
Изобретение относится к области органической химии - синтезу гетероциклических соединений - производных 2-(2-ацилвинил)индолов, представляющих интерес в синтезе препаратов фармацевтического назначения.
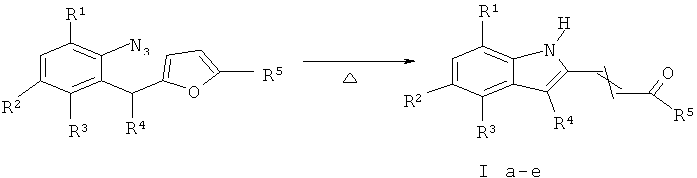
Изобретение относится к разработке способа получения производных 2-(2-ацилвинил)индолов общей формулы Ia-e (E, Z), которые могут быть использованы в синтезе аналогов алкалоидов флиндерола А-С, обладающих противомалярийной активностью [D.H.Dethe, R.D.Erande, and A.Ranjan, J. Am. Chem. Comm., 2011, 133, 2864-2867] и гиполипидемического препарата флувостатина [W. Wang and T. Ikemoto, Tetrahedron Lett., 2005, 46, 3875-3878].

|
В литературе описано несколько способов синтеза 2-ацилвинилиндолов, однако практически все они предполагают использование готового индольного каркаса. Один из методов основан на альдольной конденсации 2-формил-1H-индола и ацетона в присутствии щелочи [М.Somei and H.Ohnishi, Chem. Pharm. Bull., 1985, 33, 5147-5148]. Другим распространенным способом получения 4-(1Н-индолил-2)-бут-3-ен-2-онов является реакция Виттига между 2-формил-1H-индолом и илидами фосфора в кипящем CCl4 [V.A. Dombrovskii, Е.V. Gracheva, and P.М. Kochergin, Khim. Geterotsikl. Soed., 1986, 40-43]. Кроме того, 2-(2-ацилвинил)индолы получают палладий катализируемым кросс-сочетанием индола и алкилвинилкетонов [N.P. Grimster, С. Gauntlett, С.R.A.Godfrey, and М.J.Gaunt, Angew. Chem. Int. Ed., 2005, 44, 3125-3129], а также трехкомпонентной реакцией изохинолина, этинилфенилкетона и индола [J.S. Yadav, В.V. Subba Reddy, N.N. Yadav, and М.К. Gupta, Tetrahedron Lett., 2008, 49, 2815-2819]. Недостатками перечисленных методов являются применение труднодоступных исходных субстратов, использование дорогостоящих катализаторов и низкие выходы.
В литературе описан способ синтеза, в результате которого происходит одновременное формирование индольного каркаса и введение ацилвинильного заместителя во 2-положение индольного ядра. Метод основан на кипячении смеси 2-нитроарилдифурилметанов и избытка SnCl2·2H2O. Однако этот метод имеет несколько недостатков. Так, при введении в фурановое ядро алкильных радикалов, таких как метил и этил, реакция сопровождается побочными процессами, что снижает выход целевых индолов. Кроме того, наличие электронодонорных заместителей в пара-положении к нитрогруппе не позволяет получить целевые продукты [Uchuskin М.G., Molodtsova N.V., Abaev V.Т., Trushkov I.V., Butin A.V., Tetrahedron, 2012, 68, 4252-4258].
В основе заявляемого способа лежит описанный ранее термолиз метил 5-(2-азидофенокси)-2-фуроата с образованием производного 2-(2-метоксиаллилвинил)бензоксазола [Tanaka A. and Usui Т., Heterocycles, 1981, 16, 963-964]. Данную методологию позже использовали для синтеза 2-(2-метоксиаллилвинил)индола, однако вследствие вторичной циклизации вместо ожидаемого халкона из реакционной смеси был выделен пиридо[1,2-a]индол-1,2-дион. Недостатком данного способа низкая селективность протекающих превращений, и, как следствие, низкий выход целевых продуктов.
Задача изобретения - разработка нового эффективного способа получения производных 2-(2-ацилвинил)индолов 1а-е (Е, Z), представляющих интерес в качестве исходных соединений для синтеза биологически активных веществ.
Техническим результатом является создание простого, и эффективного способа получения 2-(2-ацилвинил)индолов, позволяющего получать целевые продукты с высоким выходом, а также варьировать заместители в индольном ядре.
Технический результат достигается в результате кипячения доступных 2-азидобензилфуранов, в высококипящих органических растворителях, например таких как бромбензол, или хлорбензол, или пара-ксилол, или орто-дихлорбензол, или дифенилоксид, или бутилацетат, или диметилсульфоксид.

|
Выходы продуктов реакции, температуры плавления, данные элементного анализа и спектральные характеристики 2-(2-ацилвинил)индолов Iа-е (E, Z) приведены в таблице 1.
Полученный технический результат позволяет расширить ряд производных 2-(2-ацилвинил)индолов Iа-е (E, Z) и тем самым номенклатуру потенциально биологически активных соединений.
Совокупность существенных признаков, изложенных в формуле изобретения, позволяет достичь вышеуказанный технический результат.
|
|
Примеры осуществления заявляемого способа получения (3E)-4-[3-(5-метил-2-фурил)-5-нитро-1H-индол-2-ил]бут-3-ен-2-она Iв (Е) и (3Z)-4-[3-(5-метил-2-фурил)-5-нитро-1H-индол-2-ил]бут-3-ен-2-она Iв (Z).
Пример 1.
2 г (5.9 ммоль) 2-азидо-5-нитрофенил-бис(5-метилфур-2-ил)метана кипятят в 10 мл бромбензола в течение 3 часов (контроль ТСХ). Затем реакционную смесь охлаждают, выпавший (3E)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Е) отфильтровывают. Раствор упаривают при пониженном давлении, (3Z)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Z) выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - бензол. Iв (Е) перекристаллизовывают из 1,4-диоксана, выход 60% (1.10 г.). Iв (Z) перекристаллизовывают из бензола, выход 15% (0.27 г.).
(3E)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Е).
Тпл.=285°C.
Найдено для C17H14N2O4, %: С, 65.68; Н 4.42; N 9.01.
Вычислено: С, 65.80; Н 4.55; N 9.03.
Спектр 1Н ЯМР (DMSO-D6), (δ, м. д. и КССВ, J, Гц): 2.38 (с, 3Н, Me), 2.42 (с, 3Н, Me), 6.32 (д, J=3.2 Гц, 1Н, НФур), 6.75 (д, J=3.2 Гц, 1Н, НФур), 6.83 (д, J=16.4 Гц, 1Н, =CH), 7.50 (д, J=8.8 Гц, 1Н, HAp), 7.85 (д, J=16.4 Гц, 1Н, =CH), 8.10 (дд, J=2.0, 8.8 Гц, 1Н, HAp), 8.64 (д, J=2.0 Гц, 1Н, HAp), 11.35 (c, 1H, NH).
Спектр 13С ЯМР (DMSO-D6), (°, м. д.): 13.4, 27.3, 108.2, 109.8, 112.1, 113.1, 117.5, 119.8, 123.9, 127.5,130.4, 132.4, 140.4, 141.4, 145.9, 152.2, 197.4.
(3Z)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Z).
Тпл=178-179°C.
Найдено для C17H14N2O4, %: С, 65.68; Н 4.42; N 9.01.
Вычислено: С, 65.56; Н 4.45; N 8.97.
Спектр 1Н ЯМР (DMSO-D6), (δ, м. д. и КССВ, J, Гц): 2.40 (с, 3Н, Me), 2.42 (с, 3Н, Me), 6.31 (д, J=3.2 Гц, 1Н, НФур), 6.51 (д, J=12.4 Гц, 1Н, =CH), 6.69 (д,.7=3.2 Гц, 1Н, НФур), 7.20 (д, J=12.4 Гц, 1Н, =CH), 7.76 (д, J=8.8 Гц, 1Н, HAp), 8.08 (дд, J=2.0, 8.8 Гц, 1Н, HAp), 8.66 (д, J=2.0 Гц, 1Н, HAp), 12.53 (c, 1H, NH).
Спектр 13С ЯМР (DMSO-D6), (δ, м. д.): 13.5, 31.7, 108.3, 110.5, 113.3, 114.1, 117.6, 119.8, 123.5, 125.0, 129.3, 132.0, 138.5, 141.6, 145.8, 152.5, 200.1.
Пример 2.
2 г (5.9 ммоль) 2-азидо-5-нитрофенил-бис(5-метилфур-2-ил)метана кипятят в 10 мл n-ксилола в течение 36 часов (контроль ТСХ). Затем реакционную смесь охлаждают, выпавший (3E)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Е) отфильтровывают. Раствор упаривают при пониженном давлении, (3Z)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Z) выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - бензол. Iв (Е) перекристаллизовывают из 1,4-диоксана, выход 65% (1.19 г.). Iв (Z) перекристаллизовывают из бензола, выход 22% (0.40 г.).
Пример 3.
2 г (5.9 ммоль) 2-азидо-5-нитрофенил-бис(5-метилфур-2-ил)метана кипятят в 10 мл хлорбензола в течение 38 часов (контроль ТСХ). Затем реакционную смесь охлаждают, выпавший (3E)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Е) отфильтровывают. Раствор упаривают при пониженном давлении, (3Z)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Z) выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - бензол. Iв (Е) перекристаллизовывают из 1,4-диоксана, выход 50% (0.92 г.). Iв (Z) перекристаллизовывают из бензола, выход 28% (0.51 г.).
Пример 4.
2 г (5.9 ммоль) 2-азидо-5-нитрофенил-бис(5-метилфур-2-ил)метана термостатируют в 10 мл дифенилоксида при температуре 190°C в течение 20 минут (контроль ТСХ). Затем к охлажденной реакционной смеси добавляют 100 мл петролейного эфира, выпавший осадок отфильтровывают. (3E)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Е) и (3Z)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Z) выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - бензол, затем ацетон. Iв (Е) перекристаллизовывают из 1,4-диоксана, выход 16% (0.29 г.). Iв (Z) перекристаллизовывают из бензола, выход 60% (1.10 г.).
Пример 5.
2 г (5.9 ммоль) 2-азидо-5-нитрофенил-бис(5-метилфур-2-ил)метана кипятят в 10 мл ДМСО в течение 7 часов (контроль ТСХ). Затем реакционную смесь охлаждают, выливают в воду (200 мл) выпавший осадок отфильтровывают. (3E)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Е) и (3Z)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Z) выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - бензол, затем ацетон. Iв (Е) перекристаллизовывают из 1,4-диоксана, выход 60% (1.10 г.). Iв (Z) перекристаллизовывают из бензола, выход 14% (0.26 г.).
Пример 6.
2 г (5.9 ммоль) 2-азидо-5-нитрофенил-бис(5-метилфур-2-ил)метана кипятят в 10 мл бутилацетата в течение 15 часов (контроль ТСХ). Затем реакционную смесь охлаждают, выпавший (3E)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Е) отфильтровывают. Раствор упаривают при пониженном давлении, (3Z)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Z) выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - бензол. Iв (Е) перекристаллизовывают из 1,4-диоксана, выход 25% (0.46 г.). Iв (Z) перекристаллизовывают из бензола, выход 50% (0.92 г.).
Пример 7.
2 г (5.9 ммоль) 2-азидо-5-нитрофенил-бис(5-метилфур-2-ил)метана кипятят в 10 мл о-дихлорбензола в течение 5 часов (контроль ТСХ). Затем реакционную смесь охлаждают, выпавший (3E)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Е) отфильтровывают. Раствор упаривают при пониженном давлении, (3Z)-4-[3-(5-метилфуран-2-ил)-5-нитро-1Н-индол-2-ил]-бут-3-ен-2-он Iв (Z) выделяют методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - бензол. Iв (Е) перекристаллизовывают из 1,4-диоксана, выход 35% (0.64 г.). Iв (Z) перекристаллизовывают из бензола, выход 40% (0.73 г.).
В таблице 2 приведены данные о влиянии реакционных условий на выходы (3Е)-4-[3-(5-метил-2-фурил)-5-нитро-1H-индол-2-ил]бут-3-ен-2-она Iв (Е) и (3Z)-4-[3-(5-метил-2-фурил)-5-нитро-1H-индол-2-ил]бут-3-ен-2-она Iв (Z) (примеры 1-7).
Как видно из таблицы 2 получение целевых продуктов (3E)-4-[3-(5-метил-2-фурил)-5-нитро-1H-индол-2-ил]бут-3-ен-2-она Iв (Е) и (3Z)-4-[3-(5-метил-2-фурил)-5-нитро-1H-индол-2-ил]бут-3-ен-2-она Iв (Z) можно достигнуть при использовании высококипящих органических растворителей, таких как бромбензол, хлорбензол, пара-ксилол, орто-дихлорбензол, дифенилоксид, бутилацетат, диметилсульфоксид при этом варьирование растворителя влияет на соотношение смеси транс/цис (E/Z) изомеров.
|
Методом 2 получен ряд производных 4-(1H-индолил-2)-бут-3-ен-2-онов I с выходами 74-88%.
Синтез исходных соединений осуществляли двумя методами
Пример. 8.
Синтез бис(5-алкил-2-фурил)(2-азидофенил)метанов осуществляли согласно методу:
Смесь 2-азидобензальдегида (20 ммоль), 4.51 мл (50 ммоль) 2-аклилфурана, 0.2 мл НСlO4 и 20 мл 1,4-диоксана перемешивают при комнатной температуре в течение 5 часов (контроль ТСХ). Затем реакционную смесь выливают в 200 мл холодной воды, нейтрализуют NaHCO3, экстрагируют бензолом (3×20 мл), объединенные органические фракции сушат Nа2SO4, упаривают при пониженном давлении. Продукт очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - дихлорметан: гексан (1:9). Выходы 71-92%.
Пример. 9
Синтез 2-азидодифенил[5-(4-хлорофенил)-2-фурил]метана осуществляли аналогично методу, описанному в работе [А.V. Butin, S.К. Smimov, Т.А. Stroganova, W. Bender, G.D. Krapivin, Tetrahedron, 2007, 63, 474-491]:
К смеси 2.25 г (10 ммоль) о-азидобензгидрола и 1.78 г (10 ммоль) 2-(4-хлорфенил)фурана в 30 мл дихлорметана при охлаждении до 5°С по каплям добавляют 4 мл эфирата трифторида бора. Реакционную смесь выдерживают при комнатной температуре 5 часов (контроль ТСХ), после чего нейтрализуют NaHCO3, отделяют органический слой, а водный экстрагируют дихлорметаном (3×20 мл), объединенные органические фракции сушат Na2SO4, упаривают при пониженном давлении. Продукт очищают методом колоночной хроматографии на силикагеле марки КСК (производства ООО Сорбполимер) фракция 5-40 мкм, элюент - бензол. Выход 79 %.
Способ получения производных 2-(2-ацилвинил)индолов общей формулы I, характеризующийся тем, что 2-азидобензилфураны кипятят в высококипящих органических растворителях, например, таких как бромбензол или хлорбензол, или параксилол, или ортодихлорбензол, или дифенилоксид, или бутилацетат, или диметилсульфоксид.