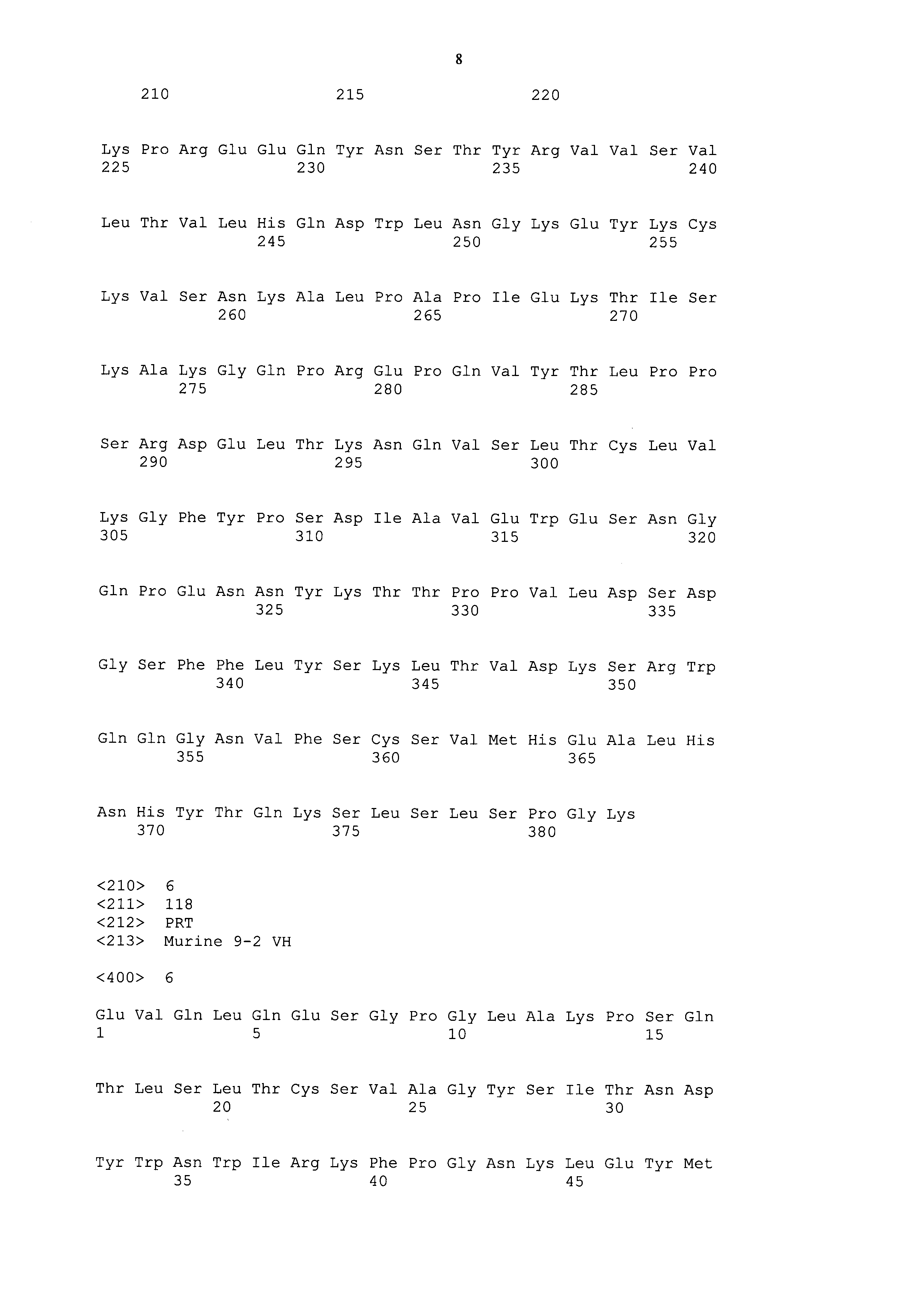Результат интеллектуальной деятельности: АНТИТЕЛО ПРОТИВ ЛИГАНДА 1 ЗАПРОГРАММИРОВАННОЙ ГИБЕЛИ КЛЕТОК (PD-L1), ЕГО АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ И ИХ МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к антителу против лиганда 1 запрограммированной гибели клеток (PD-L1, от англ. - programmed cell death ligand 1), его антигенсвязывающему фрагменту, химерному антителу и гуманизированному антителу, содержащему определяющие комплементарность участки (CDR, от англ. -complementarity-determining region) антитела против PD-L1, а также к фармацевтической композиции, содержащей антитело против PD-L1 и его антигенсвязывающий фрагмент, и к их применению в качестве противоопухолевого препарата.
Предшествующий уровень техники
Иммунотерапия опухолей в течение длительного времени представляла собой зону высокой активности в области терапии опухолей, причем одним из ее основополагающих элементов являлась связанная с Т клетками иммунотерапия опухолей. Иммунотерапия убивает опухоли за счет полного использования и мобилизации цитотоксических Т-лимфоцитов у пациентов с опухолями; она может быть наиболее эффективным и безопасным методом противоопухолевой терапии. В то же время, существенным препятствием, с которым сталкиваются при иммунотерапии опухолей, является ускользание опухоли, при котором быстрая пролиферация раковых клеток провоцируется их ингибирующеим действием на иммунную систему.
Существует чрезвычайно сложная взаимосвязь между механизмом, лежащим в основе ускользания опухоли от иммунного ответа, и иммунным ответом организма на опухоли. На ранней стадии иммунотерапии опухолей специфичные к опухоли киллерные Т-клетки обладают биологической активностью, однако утрачивают киллерную функцию по мере того, как опухоль прогрессирует к поздней стадии. Таким образом, иммунотерапия опухолей направлена на максимальное повышение ответа собственной иммунной системы пациента на опухоль. При иммунотерапии опухолей важно не только активировать ответ врожденной иммунной системы, но также поддерживать продолжительность и интенсивность ответа иммунной системы.
Т-клетка человека активируется in vivo посредством системы с двумя сигнальными путями, где антигенпрезентирующие клетки необходимы для презентирования комплекса МНС-антигенный пептид (МНС, от англ. major histocompatibility complex - главный комплекс гистосовместимости) Т-клеткам для обеспечения первого сигнала. Затем требуется серия костимулирующих молекул для обеспечения второго сигнала, позволяющего Т-клеткам демонстрировать нормальный иммунный ответ. Такая система с двойными сигнальными путями играет жизненно важную роль в балансировании иммунной системы in vivo и строго регулирует генерацию различных иммунных ответов на эндогенные и экзогенные антигены, соответственно. Отсутствие второго сигнала, обеспечиваемого костимулирующими молекулами, повлечет за собой отсутствие ответа или устойчивый специфический Т-клеточный иммунный ответ, что впоследствии приведет к толерантности. Поэтому второй сигнальный путь играет ключевую регуляторную роль в общем процессе иммунного ответа.
Белок запрограммированной гибели клеток 1 (PD-1), обнаруженный в 1992 г., представляет собой белковый рецептор, экспрессируемый на поверхности Т-клеток, и участвующий в клеточном апоптозе. PD-1 относится к семейству CD28 и демонстрирует гомологичность аминокислотной последовательности с антигеном цитотоксического Т-лимфоцита 4 (CTLA-4), соответствующую 23%. Однако он экспрессируется в основном на активированных Т-клетках, В-клетках и миелоидных клетках, чем отличается от CTLA. PD-1 имеет два лиганда, PD-L1 и PD-L2, соответственно. PD-L1 экспрессируется в основном на Т-клетках, В-клетках, макрофагах и дендритных клетках (англ. Dendritic cell, DC), и данная экспрессия повышается после активации клеток. Экспрессия PD-L2 относительно ограничена антигенпрезентирующими клетками, такими как активированные макрофаги и дендритные клетки.
PD-L1 связывается с PD-1 и В7-1 для ингибирования иммунной системы, при этом многие опухолевые клетки и иммунные клетки в микроокружении опухоли экспрессируют PD-L1. Благодаря новым исследованиям была обнаружена высокая экспрессия белка PD-L1 в опухолевых тканях человека, таких как рак молочной железы, рак легких, рак желудка, рак желудочно-кишечного тракта, рак почки, меланома, немелкоклеточный рак легкого, рак толстой кишки, рак мочевого пузыря, рак яичников, рак поджелудочной железы, рак печени и другие, а уровень экспрессии PD-L1 тесно коррелирует с клиническим состоянием и прогнозом пациентов.
Поскольку PD-L1 ингибирует пролиферацию Т-клеток по второму сигнальному пути, блокирование связывания PD-L1 с PD-1 становится весьма перспективной мишенью в области иммунотерапии опухолей.
В настоящее время существует несколько международных фармацевтических компаний, участвующих в исследовании моноклональных антител против PD-L1, которые позволяют максимально повысить собственный иммунный ответ пациентов против опухоли путем блокирования связывания PD-1 и PD-L1 и постепенного достижения цели - уничтожения опухолевых клеток. Отсылочными патентными документами являются, например, WO 0139722, WO 2013173223, WO 2014195852, WO 2013181634, WO 2015048520, WO 2015036511, US 2014335093, WO 2014100079, WO 2014055897, US 6803192B1, WO 2014022758, US 8617546B2 и WO 2010089411 А2.
Настоящее изобретение предлагает антитело против PD-L1 с высокой аффинностью, высокой селективностью и высокой биологической активностью.
Краткое описание изобретения
Настоящее изобретение предлагает антитело против PD-L1 или его антигенсвязывающий фрагмент, содержащие любую из последовательностей CDR-участка, выбранную из следующих последовательностей или их мутантной последовательности:
последовательности HCDR вариабельного участка тяжелой цепи, представленной как: SEQ ID NO 10-12, SEQ ID NO 16-18; и последовательности LCDR вариабельного участка легкой цепи, представленной как: SEQ ID NO 13-15, SEQ ID NO 19-21;
в частности, из следующих:
HCDR1, выбранной из NDYWX1 (SEQ ID NO 10) или SYWMH (SEQ ID NO 16);
HCDR2, выбранной из YISYTGSTYYNPSLKS (SEQ ID NO 11) или RI X4PNSG X5TSYNEKFKN (SEQ ID NO 17);
HCDR3, выбранной из SGGWLAPFDY (SEQ ID NO 12) или GGSSYDYFDY (SEQ ID NO 18);
LCDR1, выбранной из KSSQSLFYX2SNQKX3SLA (SEQ ID NO 13) или RASESVSIHGTHLMH (SEQ ID NO 19);
LCDR2, выбранной из GASTRES (SEQ ID NO 14) или AASNLES (SEQ ID NO 20);
LCDR3, выбранной из QQYYGYPYT (SEQ ID NO 15) или QQSFEDPLT (SEQ ID NO 21);
где X1 выбран из N или Т, Х2 выбран из R или Н, Х3 выбран из N или Н, Х4 выбран из Н или G, Х5 выбран из G или F.
Согласно предпочтительному варианту осуществления настоящего изобретения предложены антитело против PD-L1 или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением, содержащие последовательность HCDR вариабельного участка тяжелой цепи, выбранную из группы, состоящей из SEQ ID NO 10, SEQ ID NO 11, SEQ ID NO 12, SEQ ID NO 16, SEQ ID NO 17 и SEQ ID NO 18 или их мутантной последовательности.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения предложены антитело против PD-L1 или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением, содержащие последовательность LCDR вариабельного участка легкой цепи, выбранную из группы, состоящей из SEQ ID NO 13, SEQ ID NO 14, SEQ ID NO 15, SEQ ID NO 19, SEQ ID NO 20 и SEQ ID NO 21 или их мутантной последовательности.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения предложены антитело против PD-L1 или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением, где вариабельный участок легкой цепи антитела дополнительно содержит каркасный участок (FR) легкой цепи, полученный из мышиной κ -цепи, или его вариант, или FR-участок легкой цепи, полученный из мышиной λ -цепи, или его вариант; где вариабельный участок тяжелой цепи антитела дополнительно содержит FR-участок тяжелой цепи, полученный из мышиного IgG1, или его вариант, или FR-участок тяжелой цепи, полученный из мышиного IgG2, или его вариант, или FR-участок тяжелой цепи, полученный из мышиного IgG3, или его вариант.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения предложены антитело против PD-L1 или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением, где вариабельный участок тяжелой цепи антитела, содержащий FR-участок мышиного происхождения, выбран из группы, состоящей из SEQ ID NO 6, 8 или их мутантной последовательности, где вариабельный участок легкой цепи антитела, содержащий FR-участок мышиного происхождения, выбран из группы, состоящей из SEQ ID NO 7 и 9 или их мутантной последовательности.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения предложены антитело против PD-L1 или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением, где легкая цепь антитела дополнительно содержит константный участок легкой цепи, полученный из мышиной κ -цепи, или его вариант, или константный участок легкой цепи, полученный из мышиной λ -цепи, или его вариант; где тяжелая цепь антитела дополнительно содержит константный участок тяжелой цепи, полученный из мышиного IgG1, или его вариант, или константный участок тяжелой цепи, полученный из мышиного IgG2, или его вариант, или константный участок тяжелой цепи, полученный из мышиного IgG3, или его вариант.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения антитело против PD-L1 или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением представляют собой химерное антитело. Химерное антитело против PD-L1 или его фрагмент, предложенные в данном документе, дополнительно содержат константный участок тяжелой цепи, полученный из человеческого IgG1, IgG2, IgG3 или IgG4, или его вариант, предпочтительно, содержат константный участок тяжелой цепи, полученный из человеческого IgG2 или IgG4, или IgG1 без антител озависимой клеточной цитотоксичности (АЗКЦ, англ. antibody-dependent cell-mediated cytotoxicity, ADCC) посредством аминокислотной мутации.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения антитело против PD-L1 или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением представляют собой гуманизированное антитело или его фрагмент. Предпочтительно гуманизированное антитело, предложенное в данном документе, представляет собой гуманизированное антитело 9-2 или гуманизированное антитело 24D5, последовательность FR тяжелой цепи на вариабельном участке тяжелой цепи гуманизированного антитела, предложенного в данном документе, получена из тяжелой цепи зародышевой линии человека, где: последовательность FR тяжелой цепи на вариабельном участке тяжелой цепи гуманизированного антитела 9-2 получена из комбинированной последовательности IGHV4-30-4*01 тяжелой цепи зародышевой линии человека и hjh2 и содержит FR1, FR2, FR3 из IGHV4-30-4*01 тяжелой цепи зародышевой линии человека и FR4 из hjh2; последовательность FR тяжелой цепи на вариабельном участке тяжелой цепи гуманизированного антитела 24D5 получена из комбинированной последовательности IGHV1-46*01 тяжелой цепи зародышевой линии человека и hjh6.1 и содержит FR1, FR2, FR3 из IGHV1-46*01 тяжелой цепи зародышевой линии человека и FR4 из hjh6.1. Более предпочтительно, последовательность FR тяжелой цепи гуманизированного антитела 9-2, предложенная в данном документе, содержит от 0 до 10 аминокислотных обратных мутаций, предпочтительно, содержит одну или более аминокислотную обратную мутацию, выбранную из группы, состоящей из W47Y, V71R, G27Y, I48M, V67L, F78Y, S30T и Q39K, более предпочтительно, содержит аминокислотные обратные мутации W47Y и V71R; последовательность FR тяжелой цепи гуманизированного антитела 24D5, предложенная в данном документе, содержит от 0 до 10 аминокислотных обратных мутаций, предпочтительно, содержит одну или более аминокислотную обратную мутацию, выбранную из группы, состоящей из Т74K, R72V, M48I, M70L, R38Q, L83F, V68A и V79A. Дополнительно, предпочтительно, последовательность вариабельного участка тяжелой цепи гуманизированного антитела представлена следующим образом: последовательность вариабельного участка тяжелой цепи гуманизированного антитела 9-2 представлена как SEQ ID NO 22 или ее вариант; или последовательность вариабельного участка тяжелой цепи гуманизированного антитела 24D5 представлена как SEQ ID NO 24 или ее вариант.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения антитело против PD-L1 или его антигенсвязывающий фрагмент в соответствии с настоящим изобретением представляет собой гуманизированное антитело или его фрагмент. Предпочтительно гуманизированное антитело, предложенное в данном документе, представляет собой гуманизированное антитело 9-2 или гуманизированное антитело 24D5, последовательность FR легкой цепи на вариабельном участке легкой цепи гуманизированного антитела, предложенного в данном документе, получена из легкой цепи зародышевой линии человека, где: последовательность FR легкой цепи на вариабельном участке легкой цепи гуманизированного антитела 9-2 получена из комбинированной последовательности IGKV4-1*01 легкой цепи зародышевой линии человека и hjk4.1, и содержит FR1, FR2 и FR3 из IGKV4-1*01 легкой цепи зародышевой линии человека и FR4 из hjk4.1; последовательность FR легкой цепи на вариабельном участке легкой цепи гуманизированного антитела 24D5 получена из комбинированной последовательности IGKV7-3*01 легкой цепи зародышевой линии человека и hjk2.1, и содержит FR1, FR2 и FR3 из IGKV7-3*01 легкой цепи зародышевой линии человека и FR4 из hjk2.1. Предпочтительно последовательность FR легкой цепи гуманизированного антитела 9-2, предложенная в данном документе, содержит от 0 до 10 аминокислотных обратных мутаций, предпочтительно, содержит аминокислотную обратную мутацию, выбранную из P49S мутанта; последовательность FR легкой цепи гуманизированного антитела 24D5, предложенная в данном документе, содержит от 0 до 10 аминокислотных обратных мутаций, предпочтительно, содержит одну или более аминокислотную обратную мутацию, выбранную из группы, состоящей из Y91F, T22S и G72E или введение мутации дегликозилирования N85E. Дополнительно, предпочтительно, последовательность вариабельного участка легкой цепи гуманизированного антитела, предложенного в данном документе, представлена следующим образом: последовательность вариабельного участка легкой цепи гуманизированного антитела Аb-1 представлена как SEQ ID NO 23 или ее вариант; или последовательность вариабельного участка легкой цепи гуманизированного антитела Аb-2 представлена как SEQ ID NO 25 или ее вариант.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения предложено антитело против PD-L1 или его антигенсвязывающий фрагмент, где гуманизированное антитело или его антигенсвязывающий фрагмент подвергают дизайну созревания аффинности.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения предложено антитело против PD-L1 или его антигенсвязывающий фрагмент, где X1 представляет собой Т, Х2 представляет собой Н, Х3 представляет собой Н, Х4 представляет собой G, Х5 представляет собой F.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения антитело против PD-L1 или его антигенсвязывающий фрагмент содержит последовательность вариабельного участка гуманизированного антитела, представленную следующим образом:
последовательность вариабельного участка тяжелой цепи гуманизированного антитела 9-2 представленая как SEQ ID NO 26; последовательность вариабельного участка легкой цепи гуманизированного антитела 9-2 представленая как SEQ ID NO 27;
последовательность вариабельного участка тяжелой цепи гуманизированного антитела 24D5 представленая как SEQ ID NO 28; последовательность вариабельного участка легкой цепи гуманизированного антитела 24D5 представленая как SEQ ID NO 29.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения антитело против PD-L1 или антигенсвязывающий фрагмент, предложенные в данном документе, представляют собой гуманизированное антитело или его фрагмент, где тяжелая цепь гуманизированного антитела дополнительно содержит константный участок тяжелой цепи, полученный из человеческого IgG1, IgG2, IgG3 или IgG4, или его вариант, предпочтительно, содержит константный участок тяжелой цепи, полученный из человеческого IgG2 или IgG4, более предпочтительно, содержит кристаллизующийся фрагмент (Fc участок) тяжелой цепи IgG4 с мутациями F234A и L235A; гуманизированное антитело дополнительно содержит константный участок легкой цепи, полученный из человеческой κ -цепи, человеческой λ -цепи, или его вариант.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения, антитело против PD-L1 или его антигенсвязывающий фрагмент, предложенные в данном документе, представляют собой гуманизированное антитело 9-2 или гуманизированное антитело 24D5, где гуманизированное антитело 9-2 содержит последовательность антитела, состоящего из тяжелых цепей, представленную как SEQ ID NO 30, и последовательность антитела, состоящего из легких цепей, представленную как SEQ ID NO 32; где гуманизированное антитело 24D5 содержит последовательность антитела, состоящего из тяжелых цепей, представленную как SEQ ID NO 34, и последовательность антитела, состоящего из легких цепей, представленную как SEQ ID NO 36.
Настоящее изобретение дополнительно предлагает фармацевтическую композицию, содержащую терапевтически эффективное количество антитела против PD-L1 или его антигенсвязывающего фрагмента, описанных в данном документе, и один или более фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
Настоящее изобретение дополнительно предлагает молекулу ДНК, кодирующую антитело против PD-L1 или его антигенсвязывающий фрагмент, описанные выше.
Настоящее изобретение дополнительно предлагает экспрессионный вектор, содержащий молекулу ДНК, кодирующую антитело против PD-L1 или его антигенсвязывающий фрагмент, как описано выше.
Настоящее изобретение дополнительно предлагает клетку-хозяина, трансформированную экспрессионным вектором, как описано выше, где клетка-хозяин выбрана из группы, состоящей из бактерий, дрожжей и клеток млекопитающих; предпочтительно, из клеток млекопитающих.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения клетка-хозяин, описываемая в данном документе, представляет собой бактерию, предпочтительно, E.coli.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения клетка-хозяин, описываемая в данном документе, представляет собой дрожжи, предпочтительно, Pichia pastoris.
Согласно еще одному предпочтительному варианту осуществления настоящего изобретения в данном документе предложены антитело против PD-L1 или его антигенсвязывающий фрагмент, где антигенсвязывающий фрагмент представляет собой Fab, Fv, scFv или F(ab')2.
Настоящее изобретение дополнительно предлагает применение описанных выше антитела против PD-L1 или его антигенсвязывающего фрагмента или содержащей их фармацевтической композиции для приготовления лекарственного средства для лечения PD-L1- опосредуемого заболевания или расстройства, где заболевание предпочтительно представляет собой рак, более предпочтительно, представляет собой рак, экспрессирующий PD-L1; и рак предпочтительно выбран из группы, состоящей из рака молочной железы, рака легких, рака желудка, рака желудочно-кишечного тракта, рака почки, меланомы и рака мочевого пузыря; и, наиболее предпочтительно, выбран из группы, состоящей из немелкоклеточного рака легкого, меланомы, рака мочевого пузыря и рака почки.
Настоящее изобретение дополнительно предлагает способ лечения или профилактики PD-1- опосредуемого заболевания или расстройства, содержащий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества антитела против PD-L1 или его антигенсвязывающего фрагмента в соответствии с изобретением, или фармацевтической композиции, содержащей вышеуказанное; где заболевание предпочтительно представляет собой рак, более предпочтительно, PD-L1-экспрессирующий рак; рак предпочтительно выбран из группы, состоящей из рака молочной железы, рака легких, рака желудка, рака желудочно-кишечного тракта, рака почки, меланомы и рака мочевого пузыря; и, наиболее предпочтительно, выбран из группы, состоящей из немелкоклеточного рака легкого, меланомы, рака мочевого пузыря и рака почки.
Краткое описание графических материалов
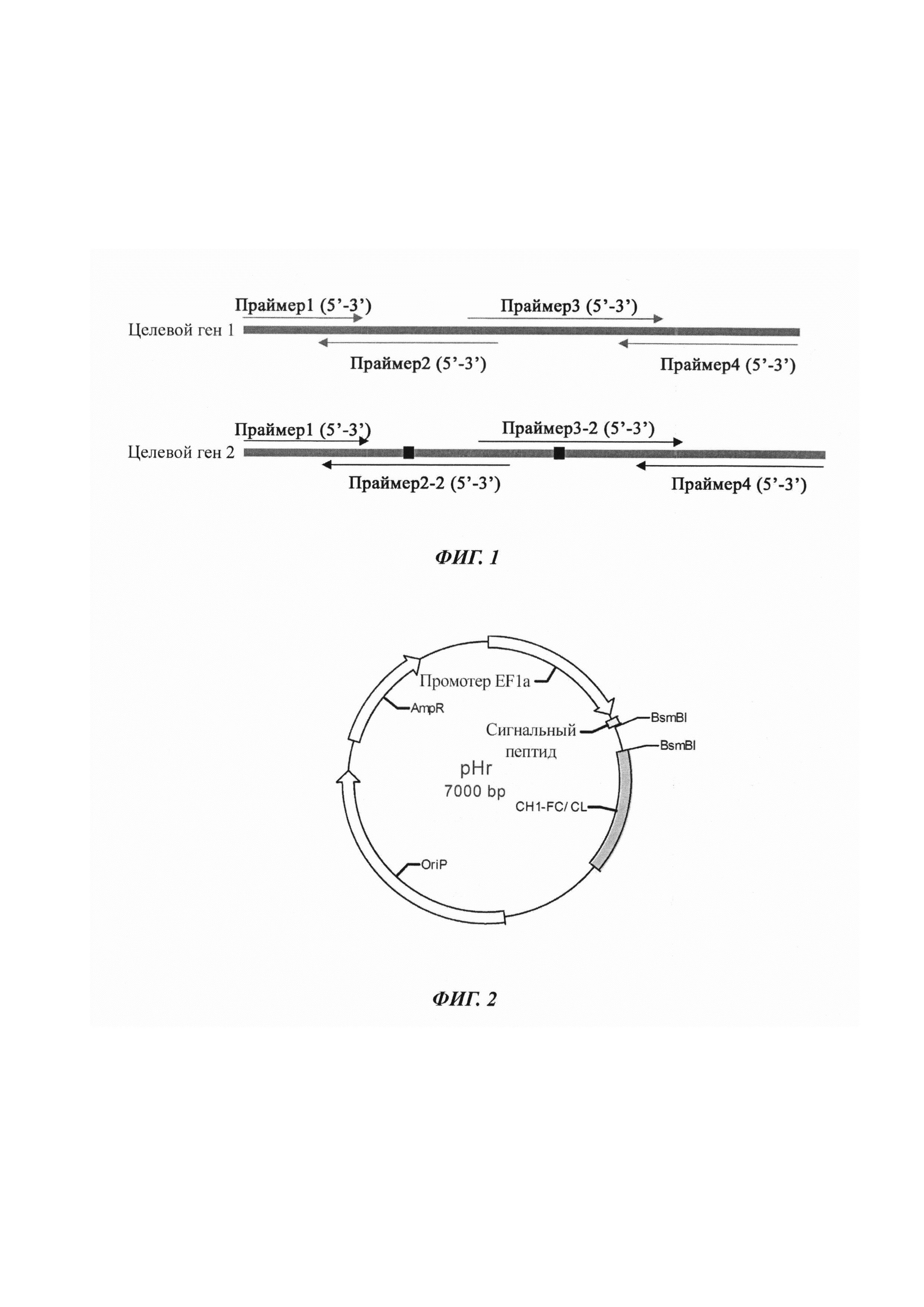
Фигура 1: Схематическая диаграмма праймеров, предназначенных для конструирования гуманизированного клона.
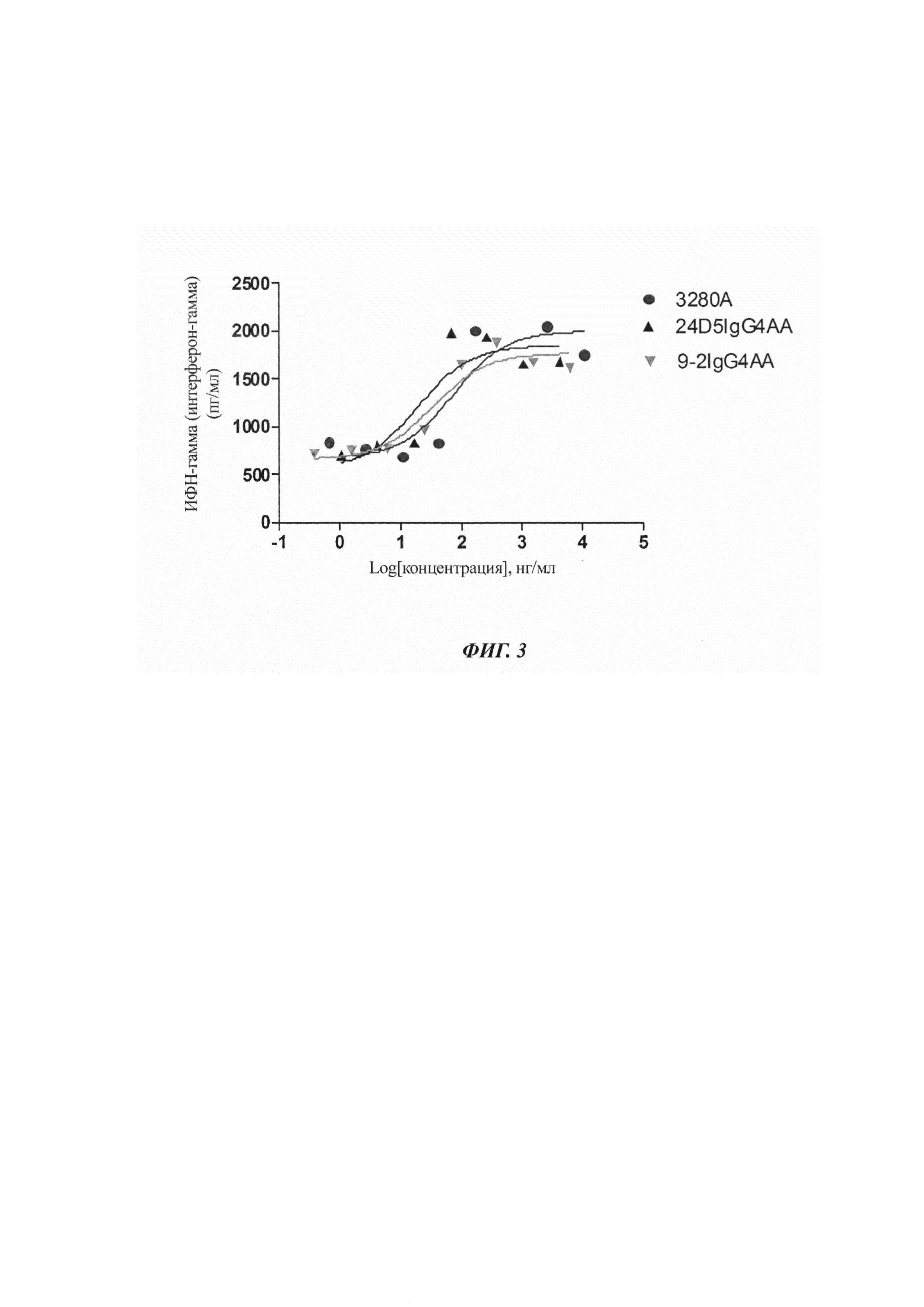
Фигура 2: Схематическая диаграмма векторов для конструирования гуманизированного клона.
Фигура 3: Стимулирование гуманизированного антитела при пролиферации мононуклеарных клеток периферической крови (МКПК, англ. peripheral blood mononuclear cells, PBMC).
Подробное описание изобретения
1.Термины
Для того чтобы сделать изобретение более понятным, соответствующие технические и научные термины конкретно определены ниже. Если где-либо в настоящем документе не оговорено специально, все другие технические и научные термины, используемые в данном документе, имеют значение, обычно понимаемое специалистом в области техники, к которой относится настоящее изобретение.
Используемые в данном документе однобуквенный код и трехбуквенный код для аминокислот описаны в работе J. Biol. Chem, 243, (1968), р3558.
Используемое в данном документе "антитело" относится к иммуноглобулину, тетрапептидной цепочечной структуре, соединенной вместе дисульфидными связями между двумя идентичными тяжелыми цепями и двумя идентичными легкими цепями. Различные константные участки тяжелой цепи иммуноглобулина демонстрируют разные аминокислотные составы и ранговый порядок, следовательно, представляют разные виды антигенности. Соответственно, иммуноглобулины можно подразделить на пять категорий или так называемых изотипов иммуноглобулинов, а именно, IgM, IgD, IgG, IgA и IgE, соответствующие тяжелые цепи представляют собой μ -цепь, δ -цепь, γ -цепь, α -цепь и ε -цепь, соответственно. В соответствии с аминокислотным составом его шарнирного участка и числом и расположением дисульфидных связей тяжелых цепей один и тот же изотип Ig можно подразделить на две разные подкатегории, например, IgG можно подразделить на IgG1, IgG2, IgG3 и IgG4. Легкую цепь можно подразделить на κ-или λ -цепь с учетом разного константного участка. Каждый из пяти изотипов Ig может содержать κ - или λ -цепь.
Согласно настоящему изобретению вариабельный участок легкой цепи антитела, упоминаемый в данном документе, дополнительно содержит константный участок легкой цепи, который содержит κ -, λ -цепь человеческого или мышиного происхождения или ее вариант.
Согласно настоящему изобретению вариабельный участок тяжелой цепи антитела, упоминаемый в данном документе, дополнительно содержит константный участок тяжелой цепи, который содержит IgG1, IgG2, IgG3, IgG4 человеческого или мышиного происхождения или его вариант.
Около 110 аминокислотных последовательностей, примыкающих к N-концу тяжелых и легких цепей антитела, являются высоковариабельными и известны как вариабельный участок (Fv-участок); остальные аминокислотные последовательности около С-конца являются относительно стабильными и известны как константный участок. Вариабельный участок содержит три гипервариабельных участка (HVR) и четыре относительно консервативных каркасных участка (FR). Три гипервариабельных участка определяют специфичность антитела, также известную как участок, определяющий комплементарность (CDR). Каждый вариабельный участок легкой цепи (LCVR) и каждый вариабельный участок тяжелой цепи (HCVR) состоит из трех CDR-участков и четырех FR-участков с последовательным порядком от аминоконца до карбоксильного конца: FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. Три CDR легкой цепи относятся к LCDR1, LCDR2 и LCDR3; а три CDR тяжелой цепи относятся к HCDR1, HCDR2 и HCDR3. Число и расположение аминокислотных остатков CDR-участка в LCVR и HCVR участках антитела или антигенсвязывающего фрагмента в данном документе соответствует известным критериям нумерации по Кабату (LCDR1-3, HCDE2-3) или соответствует критериям нумерации по Кабату и Чотиа (HCDR1).
Антитело по настоящему изобретению включает антитело мышиного происхождения, химерное антитело и гуманизированное антитело, предпочтительно, гуманизированное антитело.
Термин "антитело мышиного происхождения" согласно настоящему изобретению относится к моноклональному антителу против человеческого PD-L1, приготовленному в соответствии со знаниями и навыками в данной области техники. Во время приготовления испытуемому вводили антиген PD-L1 и затем изолировали гибридому, экспрессирующую антитело с желательными последовательностями или функциональными характеристиками. Согласно предпочтительному варианту осуществления настоящего изобретения антитело против PD-L1 мышиного происхождения или его антигенсвязывающий фрагмент дополнительно содержат константный участок легкой цепи, полученный из мышиной κ -, λ -цепи, или его вариант, или дополнительно содержат константный участок тяжелой цепи, полученный из мышиного IgG1, IgG2, IgG3 или IgG4, или его вариант.
Термин "химерное антитело" относится к антителу, образованному слиянием вариабельного участка антитела мышиного происхождения с константным участком человеческого антитела, при этом химерное антитело может смягчить иммунный ответ, индуцированный антителом мышиного происхождения. Для создания химерного антитела сначала создают гибридому, секретирующую специфическое моноклональное антитело мышиного происхождения. Ген вариабельного участка клонируют из клеток гибридомы мыши, после чего по желанию клонируют ген константного участка человеческого антитела. Мышиный ген вариабельного участка лигируют с человеческим геном константного участка для образования химерного гена, который затем будет включен в человеческий вектор и, наконец, молекула химерного антитела экспрессируется в эукариотической или прокариотической производственной системе. Согласно предпочтительному варианту осуществления настоящего изобретения вариабельный участок легкой цепи химерного антитела против PD-L1 дополнительно содержит участок Fc легкой цепи, полученный из человеческой κ -, λ -цепи, или его вариант. Вариабельный участок тяжелой цепи химерного антитела против PD-L1 дополнительно содержит константный участок тяжелой цепи, полученный из человеческого IgG1, IgG2, IgG3, IgG4, или его вариант. Константный участок человеческого антитела выбран из константного участка тяжелой цепи, полученного из человеческого IgG1, IgG2, IgG3 или IgG4, или его варианта, предпочтительно, содержит константный участок тяжелой цепи, полученный из человеческого IgG2 или IgG4, или IgG4 без АЗКЦ (антителозависимая клеточноопосредованная цитотоксичность) посредством аминокислотной мутации.
Термин "гуманизированное антитело", также известное как CDR-привитое антитело, относится к антителу, продуцируемому путем прививки мышиных CDR-последовательностей в каркасную область вариабельного участка человеческого антитела, а именно, в последовательность каркасной области человеческого антитела зародышевой линии другого типа. Гуманизированное антитело преодолевает неблагоприятный сильный иммунный ответ, индуцированный химерным антителом, несущим большое количество компонентов мышиного белка. Такие каркасные последовательности могут быть получены из публичной базы данных ДНК, содержащей последовательности генов антител зародышевой линии или из опубликованных ссылок. Например, ДНК-последовательности зародышевой линии для генов вариабельного участка тяжелой и легкой цепи человека могут быть найдены в базе данных последовательностей зародышевой линии человека "VBase" (доступной на веб-сайте www.mrccpe.com.ac.uk/vbase), а также в работе Kabat, ЕА, et al, 1991 Sequences of Proteins of Immunological Interest (Последовательности белков, представляющих иммунологический интерес), 5th Ed). Во избежание снижения активности, обусловленной уменьшением иммуногенности, каркасную последовательность вариабельного участка человеческого антитела подвергают минимальной обратной мутации или повторяющейся мутации для поддержания активности. Гуманизированное антитело по настоящему изобретению также включает гуманизированное антитело, в котором созревания аффинности CDR дополнительно достигают с помощью метода фагового дисплея.
Используемый в данном документе "антигенсвязывающий фрагмент" относится к Fab фрагменту, Fab' фрагменту, F(ab')2 фрагменту с антигенсвязывающей активностью, а также к Fv фрагменту scFv фрагмента, связывающегося с человеческим PD-L1; он содержит один или более CDR-участок антител, описанных в настоящем изобретении, выбран из группы, состоящей из последовательностей от SEQ ID NO10 до SEQ ID NO21. Fv фрагмент представляет собой минимальный фрагмент антитела, содержащий вариабельный участок тяжелой цепи, вариабельный участок легкой цепи и все антигенсвязывающие сайты без константного участка. Как правило, антитело Fv дополнительно содержит полипептидный линкер между VH и VL доменами и способно образовывать структуру, необходимую для связывания антигена. Также для соединения вариабельных участков двух антител с образованием полипептида, называемого одноцепочечным антителом или одноцепочечным Fv (scFv), могут использоваться различные линкеры. Используемый в данном документе термин "связывание с PD-L1" означает способность взаимодействовать с человеческим PD-L1. Используемый в данном документе термин "антигенсвязывающие сайты по настоящему изобретению" относится к прерывистым, трехмерным сайтам на антигене, распознаваемым антителом или антигенсвязывающим фрагментом по настоящему изобретению.
Используемый в данном документе термин "АЗКЦ", а именно, антителозависимая клеточноопосредованная цитотоксичность, относится к клеткам, экспрессирующим Fc рецепторы, непосредственно убивающим клетки-мишени, покрытые антителом, путем распознавания Fc сегмента антитела. Эффекторная функция АЗКЦ антитела может быть уменьшена или устранена за счет модификации Fc сегмента в IgG. Модификация относится к мутациям на константном участке тяжелой цепи антитела, таким как мутации, выбранные из N297A, L234A, L235A в IgG1; IgG2/4 химеры; или L234A/E235A мутации в IgG4.
Используемый в данном документе белок слияния, описанный согласно настоящему изобретению, представляет собой белковый продукт, получаемый путем коэкспрессии двух генов с помощью технологии рекомбинантных ДНК. Рекомбинантный белок слияния, содержащий Fc и внеклеточный домен PD-L1, получают путем коэкспрессии внеклеточного домена PD-L1 и Fc фрагмента человеческого антитела с помощью технологии рекомбинантных ДНК. Внеклеточный домен PD-L1 относится к части PD-L1 вне цитомембраны, последовательность которой представляет собой подчеркнутый участок SEQ ID NO 4 ниже.
Способы продуцирования и очистки антител и антигенсвязывающих фрагментов хорошо известны в данной области техники и могут быть найдены, например, в работе Antibody Experimental Technology Guide of Cold Spring Harbor (Руководство пo экспериментальной технологии антител), главы 5-8 и 15. Например, мыши могут быть иммунизированы человеческим PD-L1 или его фрагментами, и полученные в результате антитела могут быть затем ренатурированы, очищены и секвенированы с использованием общепринятых способов, хорошо известных в данной области техники. Антигенсвязывающие фрагменты также могут быть получены общепринятыми способами. Антитело или антигенсвязывающий фрагмент по настоящему изобретению генетически модифицируют для введения одного или более человеческого каркасного участка (FR) в CDR нечеловеческого происхождения. Человеческие FR последовательности зародышевой линии могут быть получены путем выравнивания вариабельного участка человеческого антитела из генетической базы данных и программного обеспечения МОЕ, от ImMunoGeneTics (IMGT) через их веб-сайт http://imgt.cines.fr, или от The Immunoglobulin FactsBook, 2001ISBN012441351.
Сконструированное антитело или антигенсвязывающий фрагмент по настоящему изобретению могут быть приготовлены и очищены с помощью общепринятых способов. Например, кДНК последовательности, кодирующие тяжелую цепь (SEQ ID NO 30) и легкую цепь (SEQ ID NO 32), могут быть клонированы и рекомбинированы в экспрессионный вектор GS. Рекомбинируемый экспрессионный вектор иммуноглобулина может затем стабильно трансфицировать овариальные клетки китайского хомячка (СНО клетки). В качестве более рекомендуемого способа, хорошо известного в данной области техники, экспрессирующая система млекопитающих будет гликозилировать антитела, как правило, на высококонсервативном N-конце в Fc участке. Стабильные клоны могут быть получены путем экспрессии антитела, специфически связывающегося с человеческим PD-L1. Позитивные клоны могут развиваться в бессывороточной культурной среде для продуцирования антител в биореакторах. Культурная среда, в которой секретировали антитело, может быть очищена с помощью общепринятых методик. Например, среда может быть удобно нанесена на колонку Protein А или G Sepharose FF, уравновешенную совместимым буфером. Колонку промывают для удаления неспецифически связывающихся компонентов. Связанное антитело элюируют с помощью градиента рН, фрагменты антитела обнаруживают с помощью анализа электрофорезом в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН-ПААГ-электрофорез, англ. SDS-PAGE - Sodium Dodecyl Sulphate-Polyacrylamide Gel Electrophoresis) и затем объединяют. Антитело может быть отфильтровано и сконцентрировано с помощью обычных методик. Растворимые агрегат и мультимеры могут эффективно удаляться с помощью обычных методик, включая гель-фильтрацию или ионный обмен. Полученный продукт может быть немедленно заморожен, например, при -70°С, либо может быть лиофилизован.
"Введение" и "лечение" применительно к животному, человеку, исследуемому субъекту, клетке, ткани, органу или биологической жидкости, относится к приведению в контакт экзогенного фармацевтического, терапевтического, диагностического агента или композиции с животным, человеком, субъектом, клеткой, тканью, органом или биологической жидкостью. "Введение" и "лечение" может относиться, например, к терапевтическим, фармакокинетическим, диагностическим, исследовательским и экспериментальным способам. Лечение клетки охватывает приведение реагента в контакт с клеткой, а также приведение реагента в контакт с жидкостью, если жидкость находится в контакте с клеткой. "Введение" и "лечение" также означает лечение in vitro и ex vivo, например, клетки реагентом, диагностическим, связующим соединением или другой клеткой. "Лечение" применительно к человеку, животным или испытуемому, относится к терапевтическому лечению, предупредительным или профилактическим мерам, к исследовательским и диагностическим применениям.
Термин "лечить" означает вводить терапевтический агент, такой как композиция, содержащая любые связывающие соединения по настоящему изобретению, изнутри или извне пациенту, имеющему один или более симптом заболевания, в отношении которого агент обладает известной терапевтической активностью. Как правило, агент вводят в количестве, эффективном для облегчения одного или более симптомов заболевания у пациента или популяции, подвергаемых лечению, либо путем индуцирования регрессии, или путем ингибирования прогрессирования такого симптома (симптомов) до любой клинически измеряемой степени. Количество терапевтического агента, эффективное для ослабления какого-либо конкретного симптома заболевания (также называемое "терапевтически эффективным количеством"), может варьироваться в соответствии с такими факторами, как стадия заболевания, возраст и вес пациента, а также способность лекарственного средства вызывать желаемый ответ у пациента. Был ли облегчен симптом заболевания, можно оценить с помощью любого клинического измерения, обычно используемого врачами или другими квалифицированными медицинскими работниками для оценки степени тяжести или состояния прогрессирования данного симптома. Хотя осуществление настоящего изобретения (например, способ лечения или изделие производства) могут быть неэффективными для ослабления исследуемого симптома (симптомов) заболевания у каждого пациента, оно должно облегчать целевой исследуемый симптом (симптомы) заболевания у статистически значимого числа пациентов, определенного любым статистическим испытанием, известным в данной области техники, таким как t-критерий Стьюдента, критерий хи-квадрат, U-критерий Манна-Уитни, критерий Краскела-Уоллиса (Н-критерий), критерий Джонкхиера-Терпстра и критерий Уилкоксона.
"Консервативная модификация" или "консервативная замещение или замена " относится к заменам аминокислот в белке другими аминокислотами, имеющими аналогичные характеристики (например, заряд, размер боковой цепи, гидрофобность/гидрофильность, конформация и жесткость остова и т.д.), таким, что изменения часто могут быть сделаны без изменения биологической активности белка. Специалисты в данной области техники признают, что, в целом, единичная аминокислотная замена в заменимых участках полипептида существенно не изменяет биологическую активность (см., например, Watson et al. (1987) Molecular Biology of the Gene, The Benjamin/Cummings Pub. Co., p. 224 (4.sup.th Ed.)). В дополнение, замены структурно или функционально аналогичных аминокислот с меньшей долей вероятности разрушают биологическую активность.
"Эффективное количество" охватывает количество, достаточное для улучшения или предотвращения симптома или признака медицинского состояния. Эффективное количество также означает количество, достаточное для обеспечения возможности или облегчения диагностики. Эффективное количество для конкретного пациента или ветеринарного субъекта может варьироваться в зависимости от таких факторов, как состояние, подлежащее лечению, общее состояние здоровья пациента, способ применения и доза для введения и тяжесть побочных эффектов. Эффективное количество может быть максимальной дозой или режимом дозирования, позволяющим избежать значительных побочных эффектов или токсических эффектов.
"Экзогенный" относится к веществам, которые продуцируются вне организма, клетки или тела человека, в зависимости от контекста. "Эндогенный" относится к веществам, которые продуцируются внутри клетки, организма или тела человека, в зависимости от контекста.
"Гомология" относится к сходству последовательностей между двумя полинуклеотидными последовательностями или между двумя полипептидами. Если положение в обеих из двух сравниваемых последовательностей занято одной и той же основной или аминокислотной мономерной субъединицей, например, если положение в каждой из двух молекул ДНК занято аденином, молекулы являются гомологичными по этому положению. Процент гомологии между двумя последовательностями является функцией от числа совпадающих или гомологичных положений, являющихся общими для двух последовательностей, разделенных на число сравниваемых положений и затем умноженных на 100. Например, если 6 из 10 положений в двух последовательностях совпадают или гомологичны, если последовательности являются оптимально выровненными, то две последовательности гомологичны на 60%. Как правило, сравнение выполняют после выравнивания двух последовательностей, чтобы обеспечить максимальную процентную гомологию.
Используемые в данном документе выражения "клетка" "клеточная линия" и "клеточная культура" используются взаимозаменяемо, а также все такие обозначения включают в себя потомство. Так, слова "трансформанты" и "трансформированные клетки" включают в себя первичную клетку субъекта и культуры, полученные из нее, без учета числа пассажей. Также следует понимать, что все потомство может и не быть в точности идентичным по составу ДНК из-за преднамеренных или непреднамеренных мутаций. В определение включено также мутантное потомство, имеющее такие же функции или биологическую активность, как показано для исходной трансформированной клетки. В случае, если имеются в виду отличающиеся обозначения, это будет ясно из контекста.
Используемая в данном документе "полимеразная цепная реакция" или "ПЦР (от англ. PCR - polymerase chain reaction)" относится к процедуре или методике, при которой малые количества специфической части нуклеиновой кислоты, РНК и/или ДНК, амплифицируют, как описано, например, в патентном документе US Pat. No. 4683195. Как правило, должна быть доступна информация о последовательности в пределах или за пределами изучаемого участка, чтобы можно было сконструировать олигонуклеотидные праймеры; такие праймеры будут идентичными или аналогичными по последовательности с соответствующими амплифицируемыми нитями матрицы. 5'-концевые нуклеотиды двух праймеров могут быть идентичны концам амплифицируемого материала. ПЦР можно использовать для амплификации специфичных последовательностей РНК, специфичных последовательностей ДНК из общей геномной ДНК и кДНК, транскрибируемой из общей клеточной РНК, последовательностей бактериофагов или плазмид и т.д. См. общие положения в работе Mullis et al. (1987) Колд Спринг Харбор Symp. Ouant. Biol. 51:263; Erlich, ed., (1989) PCR TECHNOLOGY (Stockton Press, N.Y.). Используемая в данном документе ПЦР рассматривается как один, но не единственный пример способа полимеразной реакции нуклеиновой кислоты для амплификации испытываемого образца нуклеиновой кислоты, содержащий использование известной нуклеиновой кислоты в качестве праймера и полимеразы нуклеиновой кислоты для амплификации или генерации специфической части нуклеиновой кислоты.
"Необязательный" или "необязательно" означает, что событие или ситуация, которые следуют за этим, могут, но не обязательно будут происходить, и описание включает в себя примеры, в которых событие или обстоятельство происходит или не происходит. Например, "необязательно содержит 1-3 вариабельные участки тяжелой цепи антитела" означает, что вариабельный участок тяжелой цепи антитела со специфической последовательностью может, но не обязательно будет присутствовать.
"Фармацевтическая композиция" относится к смеси, содержащей одно или более соединение в соответствии с настоящим изобретением или его физиологически/фармацевтически приемлемую соль или пролекарство с другими химическими компонентами, а также дополнительные компоненты, такие как физиологически/фармацевтически приемлемые носители и вспомогательные вещества. Фармацевтическая композиция способствует введению в организм, облегчению абсорбции активного ингредиента и тем самым оказывает влияние на биологический эффект.
Примеры и испытания
Далее настоящее изобретение будет дополнительно описано со ссылкой на примеры. Однако объем настоящего изобретения не ограничивается этим. В примерах по настоящему изобретению, в которых не описаны специфичные условия, эксперименты, как правило, проводят в обычных условиях, описанных в Руководстве по проведению лабораторных работ с использованием антител и в Руководстве по молекулярному клонированию (Molecular Cloning Manual издательства Cold Spring Harbor), или в условиях, предлагаемых изготовителями материалов или продуктов. Если источник реагентов не указан конкретно, реагенты являются обычными коммерчески доступными реагентами.
Пример 1. Приготовление антигена PD-L1 и обнаружение белкового дизайна и экспрессия белка
Полноразмерный человеческий ген PD-L1 (лиганд 1 запрограммированной гибели клеток (PD-L1) из базы данных UniProt, изоформа 1 (SEQ ID NO 1), от Sino Biological Inc., (HG10084-М)) использовали в качестве матрицы для PD-L1 по настоящему изобретению для получения последовательностей генов, кодирующих антигены, и обнаружения белков по настоящему изобретению. Необязательно, рекомбинированный с Fc фрагмента тяжелой цепи антитела (например, IgG1 человека), клонированный в вектор рTТ5 (Biovector, Cat#: 102762) или вектор pTargeT (promega, А1410) соответственно, транзиентно экспрессируемый в клетках 293F (Invitrogen, R79007) или стабильно экспрессируемый в клетках CHO-S (Invitrogen, k9000-20) и очищенный для получения антигена и обнаружения белков по настоящему изобретению. Ген PD-1 человека закупали в ORIGENE, No. SC117011, эталонная последовательность NCBI: NM_005018.1.
1. Полноразмерная аминокислотная последовательность человеческого PD-L1 
Примечание:
Часть с двойным подчеркиванием представляет собой сигнальный пептид (сигнальный пептид: от 1 до 18);
Подчеркнутая часть представляет собой внеклеточный домен PD-L1 (внеклеточный домен: от 19 до 238), где часть от 19 до 127 представляет собой иммуноглобулиноподобный домен V-типа, а от 133 до 225 - иммуноглобулиноподобный домен С2-типа;
Подчеркнутая пунктирной линией часть представляет собой трансмембранный участок (трансмембранный домен: от 239 до 259);
Часть, написанная курсивом, представляет собой цитоплазматический домен (цитоплазматический домен: от 260 до 290).
2. Иммуноген: PD-L1 с His, PADRE tag: PD-L1 (внеклеточный домен, сокращение ECD) -PADRE-His6

Примечание:
Подчеркнутая часть представляет собой внеклеточный домен PD-L1; подчеркнутая пунктирной линией часть представляет собой метку PADRE tag; часть, написанная курсивом, представляет собой метку His6-tag.
3. PD-L1 с FLAG и HIS tag (PD-L1 (ECD)-Flag-His6) получали и использовали для испытания характеристик антител по настоящему изобретению. 
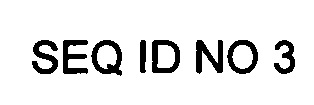
Примечание:
Подчеркнутая часть представляет собой внеклеточный домен PD-L1; подчеркнутая пунктирной линией часть представляет собой метку Flag-Tag; часть, написанная курсивом, представляет собой метку His6-tag.
4. Белок слияния PD-L1 и Fc: PD-L1 (ECD)-Fc, используют в качестве иммуноантигена или реагента для обнаружения по настоящему изобретению.
VКL-РD-L11(ЕСD)-Fс(человеческий lgG1)

Примечание:
Подчеркнутая часть представляет собой внеклеточный домен PD-L1; часть, написанная курсивом, представляет собой человеческий IgG Fc.
5. Белок слияния PD-1 и Fc: PD-1(ECD)-Fc, используют для испытания характеристик антител по настоящему изобретению. 

Примечание:
Подчеркнутая часть представляет собой внеклеточный домен PD-1; часть, написанная курсивом, представляет собой hFc (человеческий IgG1).
Пример 2. Очистка PD-L1, рекомбинантного белка PD-1, гибридомного антитела и рекомбинантного антитела
1. Стадии очистки рекомбинантного белка PD-L1 с метками His и PADRE: PD-L1 (ECD)-PADRE-His6 (SEQ ID NO 2)
Образец надосадочной жидкости, содержащей экспрессирующей клетки, центрифугировали с высокой скоростью для удаления примесей, после чего буфер заменяли на фосфатно-солевой буферный раствор (ФСБ, англ. PBS - phosphate-buffer saline), добавляли имидазол до конечной концентрации 5 мМ. Колонку для никель-хелатной хроматографии уравновешивали раствором ФСБ, содержащим 5 мМ имидазола, и промывали 2-5 объемами колонки. После этого образец надосадочной жидкости наносили на Ni колонку (GE, 17-5318-01). Колонку промывали раствором ФСБ, содержащим 5 мМ имидазола, до тех пор, пока показания А280 не возвращались к базовой линии. После этого колонку промывали ФСБ с 10 мМ имидазола для удаления неспецифически связанных белков и собирали вытекающий элюат. Целевой белок элюировали раствором ФСБ, содержащим 300 мМ имидазола, и собирали пик элюирования. Собранный элюат концентрировали и дополнительно очищали с помощью хроматографического геля Superdex200 (GE), в качестве подвижной фазы использовали ФСБ. Ошибочный пик исключали и собирали пик элюирования. Полученный белок идентифицировали с помощью электрофореза, пептидного картирования (Agilent, 6530 Q-TOF) и жидкостной хроматографии с масс-спектрометрией (ЖХ-МС, англ. LC-MS - Liquid Chromatograph Mass Spectrometer) (Agilent 6530-TOF), корректный образец разделяли на аликвоты для использования. Получали белок PD-L1 с His и PADRE метками (PD-L1 (ECD)-PADRE-His6 Е (SEQ ID NO 2)) и использовали в качестве иммуногена для антитела по настоящему изобретению.
2. Стадии очистки рекомбинантного белка PD-L1 с His и Flag метками: PD-L1 (ECD)-Flag-His6 (SEQ ID NO 3)
Образец центрифугировали с высокой скоростью для удаления примесей и концентрировали до соответствующего объема. Как было указано выше, белок, элюируемый с колонки для афинной хроматографии на иммобилизованных ионах металлов (англ. IMAC - Immobilized Metal Affinity Chromatography), загружали на flag-колонку для аффинной хроматографии (Sigma, А2220), которую уравновешивали с помощью 01×ФСБ, и колонку промывали 2-5 объемами колонки. Образцы надосадочной жидкости загружали в колонку после удаления примесей. Колонку промывали с помощью 0,5×ФСБ до тех пор, пока показание А280 не уменьшалось до базовой линии. После этого колонку промывали ФСБ, содержащим 0,3 М NaCl, примесный белок промывали и собирали. Целевой белок элюировали с помощью 0,1 М уксусной кислоты (рН 3,5-4,0) и собирали, величину рН доводили до нейтральной. Собранный элюат концентрировали и дополнительно очищали с помощью хроматографического геля Superdex200 (GE), в качестве подвижной фазы использовали ФСБ. Ошибочный пик удаляли и собирали пик элюирования. Полученный белок идентифицировали с помощью электрофореза, пептидного картирования (Agilent, 6530 Q-TOF) и ЖХ-МС (Agilent 6530-TOF), корректный образец разделяли на аликвоты для использования. Получали белок PD-L1 с His и Flag метками (PD-L1 (ECD)-Flag-His6 (SEQ ID NO 3)) и использовали его для испытаний характеристик антител в ходе настоящего изобретения.
3. Стадии очистки Fc белка слияния PD-L1 и PD-1
Образец надосадочной жидкости, содержащей экспрессирующие клетки, центрифугировали с высокой скоростью для удаления примесей и концентрировали до соответствующего объема, после этого загружали в колонку Protein A (GE, 17-5438-01). Колонку промывали с помощью 0,5×ФСБ до тех пор, пока показание А280 не уменьшалось до базовой линии. Целевой белок элюировали с помощью 100 мМ ацетата натрия (рН 3,0). Для нейтрализации целевого белка использовали 1М Трис-HCl. Затем нейтрализованный белок дополнительно очищали при помощи гель-хроматографии Superdex200 (GE), которую уравновешивали с помощью ФСБ. Ошибочный пик удаляли и собирали пик элюирования, корректный образец разделяли на аликвоты для использования. Этот способ использовали для очистки PD-L1 (ECD)-Fc (SEQ ID NO 4) и PD-1 (ECD) -Fc (SEQ ID NO 5). PD-1 (ECD) -Fc может использоваться в качестве иммуноантигена или реагента для обнаружения по настоящему изобретению, и PD-1 (ECD) -Fc используют для испытания характеристик антитела по настоящему изобретению.
Пример 3 Приготовление моноклонального антитела против человеческого PD-L1
1. Иммунизация
Моноклональное антитело против человеческого PD-L1 получали иммунизацией мышей. Были использованы экспериментальные белые мыши линии SJL, самки, в возрасте 6 недель (Beijing Vital River Laboratory Animal Technology Co., Ltd., номер лицензии на производство животных: SCXK (Пекин) 2012-0001).
Условия содержания: уровень SPF (англ. Specified Pathogen Free - свободный от патогенной флоры).
После приобретения мышей содержали в лаборатории в течение 1 недели при цикле чередования света и темноты 12/12 часов, при температуре 20-25°С, влажности 40-60%. Мышей, адаптировавшихся к среде, иммунизировали в соответствии с двумя схемами (А и В), по 6-10 в каждой группе. Иммуноантигеном был PD-L1 с His и PADRE метками ((PD-L1(ECD)-PADRE-His6 (SEQ ID NO 2).
Согласно схеме А, для эмульгирования использовали адъювант Фрейнда (Sigma Lot Num: F5881/F5506).
Первую иммунизацию проводили в полном адъюванте Фрейнда (CFA, от англ. Freund's complete adjuvant) с последующими бустер-иммунизациями в неполном адъюванте Фрейнда (IFA, от англ. Freund's incomplete adjuvant). Соотношение антигена и адъюванта составляло 1:1, 100 мкг/мышь (первая иммунизация), 50 мкг/мышь (бустер-иммунизация). В 0 день мышам внутрибрюшинно (в/б, от англ. i.p., intraperitoneal) инъецировали 100 мкг/мышь эмульгированного антигена с последующей иммунизацией один раз в две недели в течение в общей сложности 6-8 недель.
Согласно схеме В, проводили перекрестную иммунизацию поочередно с помощью Titermax (Sigma Lot Num: T2684) и Alum (Thremo Lot Num: 77161). Соотношение антигена и адъюванта (Titermax) составляло 1:1, а соотношение антигена и адъюванта (Alum) составляло 3:1, 10-20 мкг/мышь (первая иммунизация), 5 мкг/мышь (бустер-иммунизация). В 0 день мышам внутрибрюшинно (в/б) инъецировали 20/10 мкг/мышь эмульгированных антигенов с последующей иммунизацией один раз в неделю, Titermax и Alum использовали поочередно в течение в общей сложности 6-11 недель. После четырех недель иммунизации вводили антиген с помощью спинной или внутрибрюшинной инъекции в зависимости от состояния спинной папулы и отека живота.
2. Слияние клеток
Для слияния спленоцитов выбирали мышей с повышенными титрами сывороточного антитела и титрами, имеющими тенденцию к платформе (см. иммуноферментный анализ (ELISA, от англ. enzyme-linked immunosorbent assay), описанный в Испытании 1). Шоковую иммунизацию проводили с помощью в/б инъекции 10 мкг/мышь PD-L1-His за 72 часа до слияния спленоцитов. Клетки гибридомы получали путем слияния лимфоцитов селезенки с миеломными клетками Sp2/0 (АТСС® CRL-8287TM) с использованием оптимизированной опосредованной полиэтиленгликолем (ПЭГ) процедуры слияния. Клетки гибридомы ресуспендировали в полной гипоксантин-аминоптерин-тимидиновой (ГАТ, англ. HAT) среде (RPMI-1640 (англ. Roswell Park Memorial Institute medium) среда, содержащая 20% фетальной бычьей сыворотки (ФБС, от англ. FBS), 1×ГАТ и 1×хоксалоатетата-пирувата-инсулина (ОПИ, англ. OPI)) и инкубировали в 96-луночных планшетах для культуры клеток (1×105/150 мкл/лунку) при температуре 37°С, 5% СO2. На 5-й день после слияния в клетки добавляли полную среду ГАТ, 50 мкл/лунку, и затем инкубировали при 5% СO2 и 37°С. Через 7-8 дней после слияния в соответствии с плотностью растущих клеток, всю среду заменяли на полную гипоксантин-тимидиновую (ГТ, от англ. НТ) среду (RPMI-1640 среда, содержащая 20% ФБС 1×ГТ и 1×ОПИ), 200 мкл/лунку, и затем инкубировали при 5% СO2 и 37°С.
3. Скрининг клеток гибридомы
На 10-11 день после инфузии проводили ELISA анализ связывания с PD-L1 в соответствии с плотностью растущих клеток (см. Испытание 1). Для позитивных клеток, обнаруженных при анализе ELISA (Испытание 1), с помощью анализа ELISA была обнаружена блокада в PD-L1/PD-1 связывании (см. Испытание 2). Среду в позитивных лунках заменяли, и позитивные клетки развивались в 24-луночном планшете в зависимости от плотности клеток. После повторного испытания клетки, перемещенные в 24-луночный планшет, предназначались для консервирования поколения и первого субклонирования. Позитивные клетки во время первого скрининга субклонирования (см. Испытание 1) предназначались для консервирования поколения и подвергались второму субклонированию. Позитивные клетки во время второго субклонирования (см. Испытание 1) предназначались для консервирования поколения и экспрессии белка. Клетки гибридомы, имеющие блокирующий эффект на связывание PD-L1 и PD-1 (см. Испытание 2), получали путем множественного слияния клеток.
Для использования при испытании клоны 9-2 и 24D5 гибридом получали с помощью эксперимента по блокированию и эксперимента по связыванию, антитело дополнительно готовили асцитным способом или способом с использованием бессывороточной клеточной культуры, затем очищали в ходе стадий очистки, указанных в примерах.
Была выявлена следующая последовательность вариабельного участка тяжелой цепи мышиного антитела клона 9-2 гибридомы:
>9-2 mVH: последовательность вариабельного участка тяжелой цепи мышиного антитела клона 9-2 гибридомы 
>9-2 mVL: последовательность вариабельного участка легкой цепи мышиного антитела клона 9-2 гибридомы

Примечание:
Порядок является следующим: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, часть, написанная курсивом, представляет собой последовательность FR, а подчеркнутая часть представляет собой последовательность CDR.
Выявлена следующая последовательность вариабельного участка мышиного антитела клона 24D5 гибридомы:
24D5-VH: последовательность вариабельного участка тяжелой цепи мышиного антитела клона 24D5 гибридомы

24D5-VL: последовательность вариабельного участка легкой цепи мышиного антитела клона 24D5 гибридомы
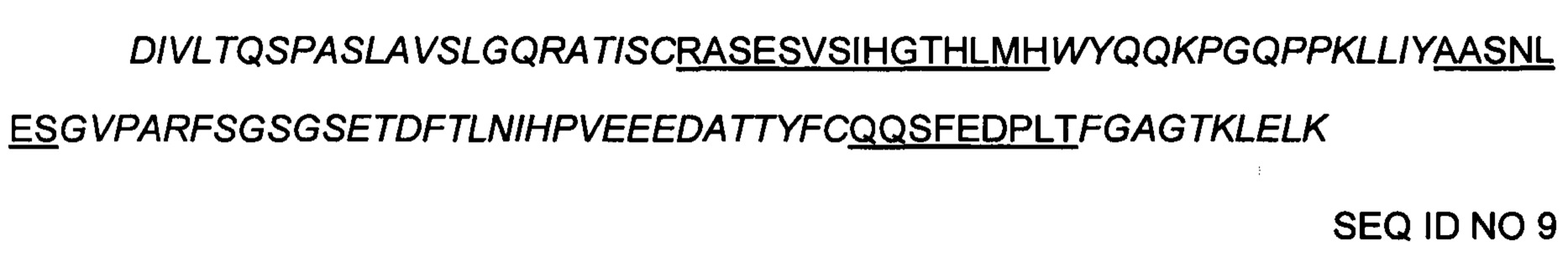
Примечание:
Порядок является следующим: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, часть, написанная курсивом, представляет собой последовательность FR, а подчеркнутая часть представляет собой последовательность CDR.
Последовательности CDR тяжелой и легкой цепи следующие:
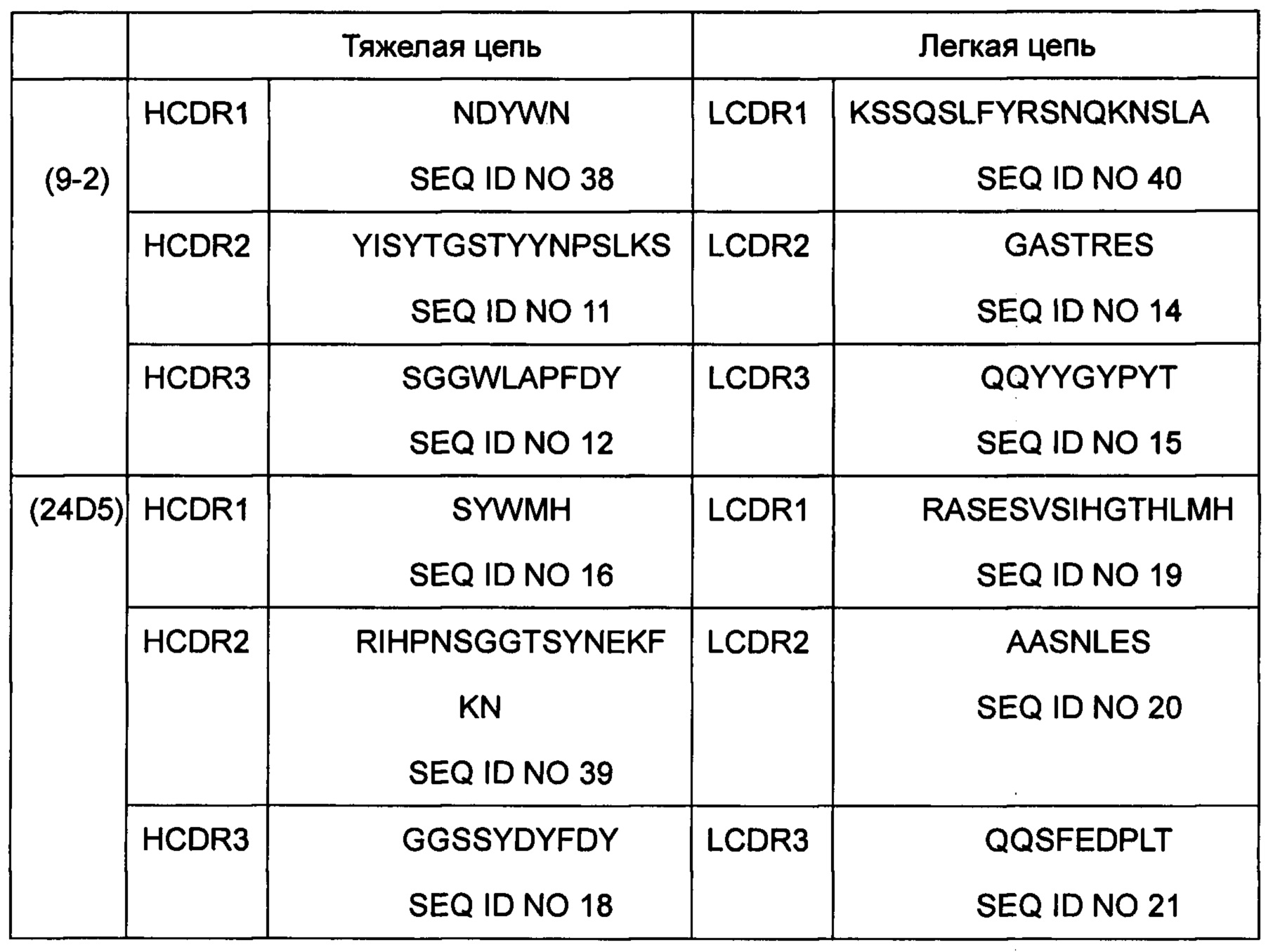
где, если Х1 в SEQ ID NO 10 является N, последовательность называется SEQ ID NO 38;
если Х4 в SEQ ID NO 17 представляет собой Н, Х5 в SEQ ID NO 17 представляет собой G, последовательность называется SEQ ID NO 39;
если Х2 в SEQ ID NO 13 является R, Х3 в SEQ ID NO 13 представляет собой N, последовательность называется SEQ ID NO 40.
Пример 4. Гуманизация человеческих гибридомных моноклональных антител против PD-L1
1. Выбор гуманизированных каркасных последовательностей для клона 9-2 гибридомы
После выравнивания с помощью базы IMGT данных генов вариабельного участка тяжелой и легкой цепи человеческого антитела и с использованием программного обеспечения МОЕ, в качестве матриц выбирали гены вариабельного участка тяжелой и легкой цепи с высокой гомологией к 9-2 и 24D5, CDR двух мышиных антител прививали на соответствующую матрицу человеческого происхождения с образованием последовательности вариабельного участка в порядке
FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4. При этом аминокислотные остатки были идентифицированы и аннотированы с помощью системы нумерации по Кабату.
Матрица гуманизированной легкой цепи антитела 9-2 мышиного происхождения представляет собой IGKV4-1*01 и hjk4.1, матрица гуманизированной тяжелой цепи представляет собой IGHV4-30-4*01 и hjh2, последовательность гуманизированного вариабельного участка следующая:
>9-2 hVH- CDR-привитый

>9-2 hVL CDR-привитый
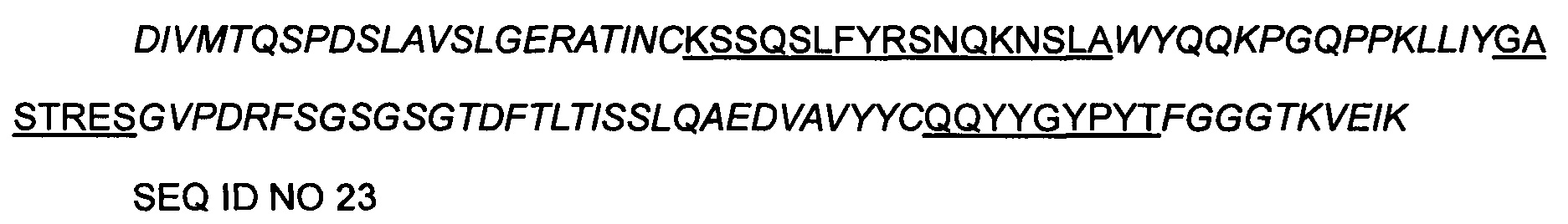
Примечание:
Порядок является следующим: FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, часть, написанная курсивом, представляет собой последовательность FR, а подчеркнутая часть представляет собой последовательность CDR.
2. Выбор матрицы и схемы обратной мутации для клона 9-2 гибридомы. См. Таблицу 1 ниже:

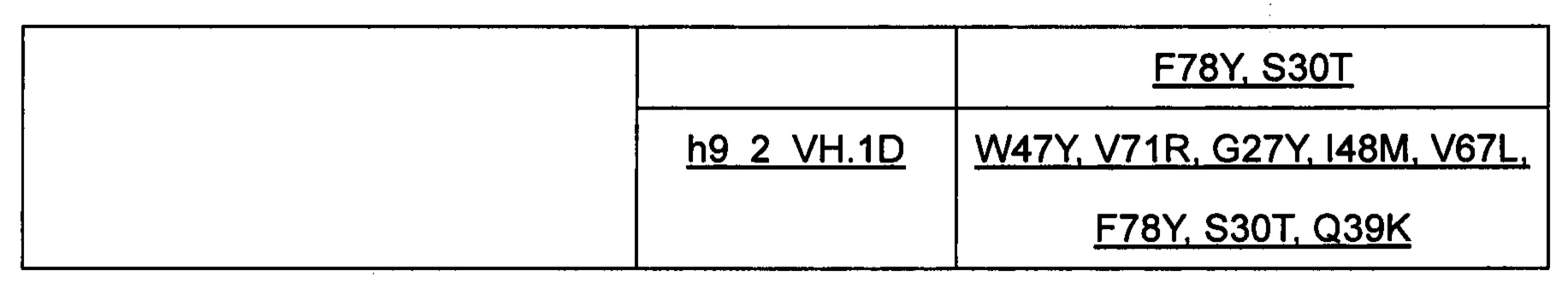
Примечание: Например, P49S указывает на обратную мутацию от Р до S в положении 49 в соответствии с системой нумерации по Кабату.
Привитый указывает на то, что CDR мышиного антитела был имплантирован в последовательности FR зародышевой линии человека.
Таблица 2: Комбинации гуманизированных последовательностей мышиного антитела 9-2

Примечание: В таблице показаны различные комбинации последовательностей разных мутаций. Например, 9_2-2 указывает на то, что на гуманизированном мышином антителе 9-2 присутствуют две мутации (легкой цепи h9_2_VL1 и тяжелой цепи h9_2-VH.1A) и т.д.
3. Выбор гуманизированной каркасной последовательности для клона 24D5 гибридомы
Серин расположен в положении 96 моноклонального антитела 24D5 против PD-L1 гибридомы, тогда как консервативный цистеин расположен на FR3 гена зародышевой линии, из него и из цистеина в положении 22 образуется внутрицепочечная дисульфидная связь. Мы сконструировали химерное антитело 24D5 и еще одно химерное антитело 24D5 с обратной мутацией от серина к цистеину в положении 96. Аффинности двух форм химерных антител согласуются с аффинностью гибридомного антитела. Гуманизированное антитело получали с помощью стратегии прививки CDR, поскольку мутация в положении 96 24D5 происходила на каркасе, это не повлияло бы на схему конструирования.
Матрица гуманизированной легкой цепи для антитела 24D5 мышиного происхождения представляет собой IGKV7-3*01 и hjk2.1, матрица гуманизированной тяжелой цепи представляет собой IGHV1-46*01 и hjh6.1, последовательность гуманизированного вариабельного участка выглядит следующим образом:
>24D5 гуманизированный вариабельный участок тяжелой цепи VH.1

>24D5 гуманизированный вариабельный участок легкой цепи VL.1

Примечание: Порядок следующий FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, часть, написанная курсивом, представляет собой последовательность FR, а подчеркнутая часть представляет собой последовательность CDR.
4. Выбор матрицы и схемы обратной мутации для клона 24D5 гибридомы. См. Таблицу 3 ниже:
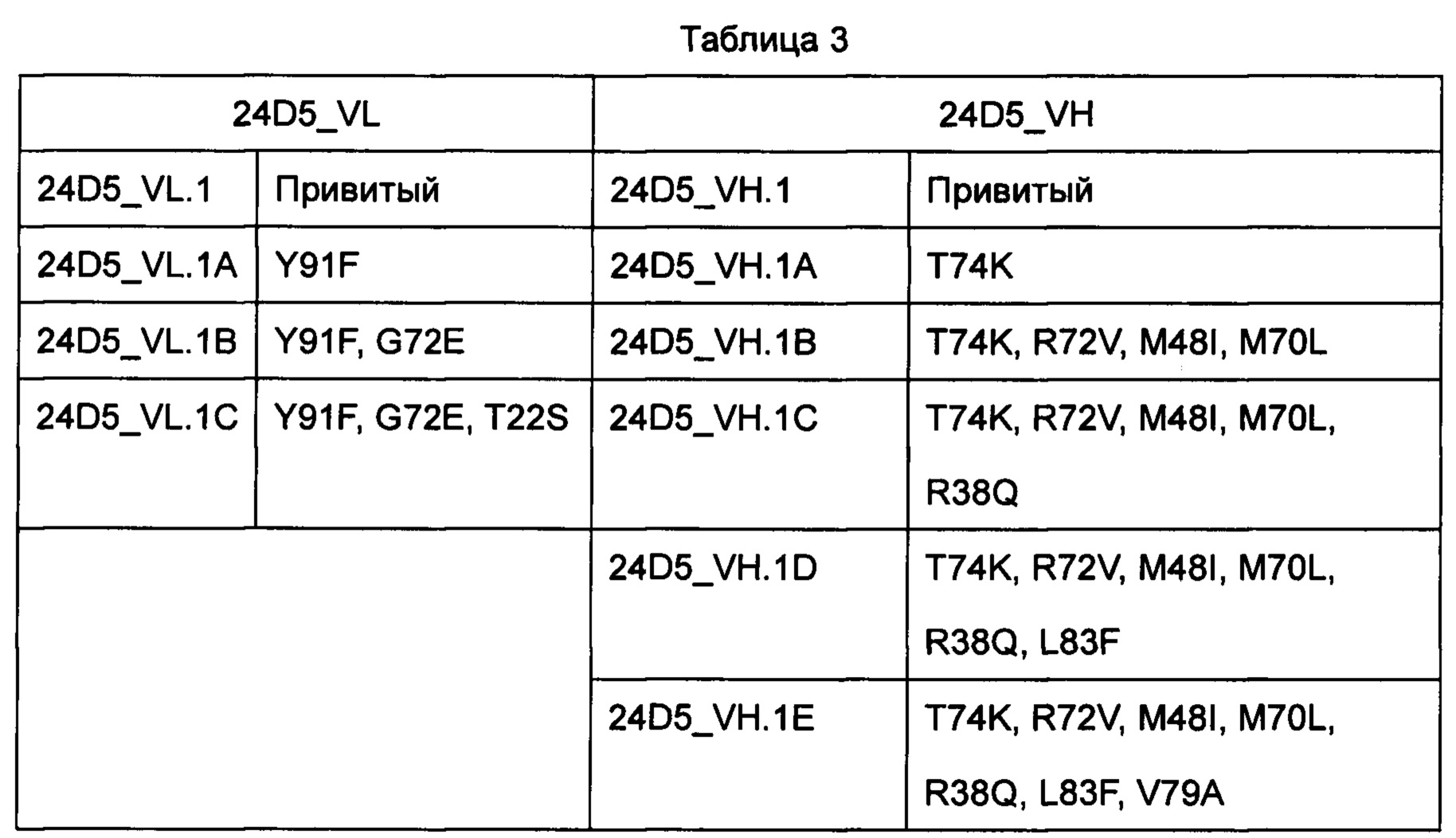
Примечание: Например, Y91F указывает на обратную мутацию от Y до F в положении 91 в соответствии с системой нумерации по Кабату.
Привитый указывает на то, что CDR мышиного антитела был имплантирован в FR последовательности зародышевой линии человека.
Таблица 4: Комбинации гуманизированных последовательностей мышиного антитела 24D5

Примечание: В таблице показаны различные комбинации последовательностей разных мутаций. Например, 5 указывает на то, что на гуманизированном мышином антителе 5 присутствуют два вида мутаций (тяжелой цепи h24D5_VH.1A и легкой цепи h24D5_VL. 1) и т.д.
Пример 5. Конструирование гуманизированного клона
Конструировали праймеры и фрагменты VH/VK генов каждого гуманизированного антитела с помощью ПЦР, затем вставляли в экспрессионный вектор рНr (с сигнальным пептидом и фрагментом гена константного участка (CH1-FC / CL)) посредством гомологической рекомбинации для конструирования полной длины экспрессионного вектора антител: VH-CH1-FC-pHr / VK-CL-pHr.
1. Дизайн праймеров
Использование онлайн-программы DNAWorks (v3.2.2)
(http://helixweb.nih.gov/dnaworks/) для дизайна множественных праймеров для синтеза фрагментов генов VH/VK, необходимых для рекомбинации: 5'-30bр сигнальный пептидплюс VH/VK плюс 30bр CH1/CL-3'. Правила дизайна праймеров: если существуют два различных аа между целевым геном 2 и целевым геном 1, создается другой праймер, содержащий сайт мутации, как показано на Фиг. 1.
2. Сплайсинг фрагментов
В соответствии с рабочими инструкциями для ДНК-полимеразы от компании TaKaRa Company Primer STAR GXL и используя праймеры, сконструированные выше, фрагмент гена VH/VK, содержащий требуемый рекомбинантный ген, был амплифицирован с помощью двухстадийной ПЦР.
3. Конструирование экспрессионного вектора рНr (с сигнальным пептидом и фрагментом гена константного участка (CH1-FC/ L)) и ферментативное расщепление
Экспрессионный вектор рНr (с сигнальным пептидом и фрагментом гена константного участка (CH1-FC/CL)) конструировали, используя некоторое количество специфической эндонуклеазы рестрикции, такой как BsmBI, чья распознающая последовательность отличается от сайта рестрикции, как показано на Фиг. 2. Эндонуклеаза BsmBI расщепляла вектор, гель извлекали и хранили для использования.
4. Рекомбинантное конструирование экспрессионного вектора VH-CH1 -FC-pHr/VK-CL-pHr
Содержащие VH/VK фрагменты генов, необходимые для рекомбинантного и экспрессионного вектора рНr (с сигнальным пептидом и фрагментом гена константного участка (CH1-FC/CL)), расщепленные с помощью BsmBI, добавляли в DH5H компетентные клетки в соотношении 3:1, инкубировали при температуре 0°С на ледяной бане в течение 30 мин, подвергали термическому шоку при температуре 42°С в течение 90 с и добавляли 5 объемов лизогенной среды (LB-среды, от англ. lysogeny broth), инкубировали при температуре 37°С в течение 45 минут, наносили на планшет LB-Amp (англ. ampicillin- ампициллин) и культивировали при температуре 37°С в течение ночи. Для секвенирования отбирали один клон и получали искомый клон.
5. Плазмиду конструировали в соответствии с дизайном данного примера, после чего очищенный белок экспрессировали в соответствии с Примером 2 и измеряли аффинность полученного белка при помощи поверхностного плазмонного резонанса (SPR, от англ. Surface Plasmon Resonance).
6. Результат:
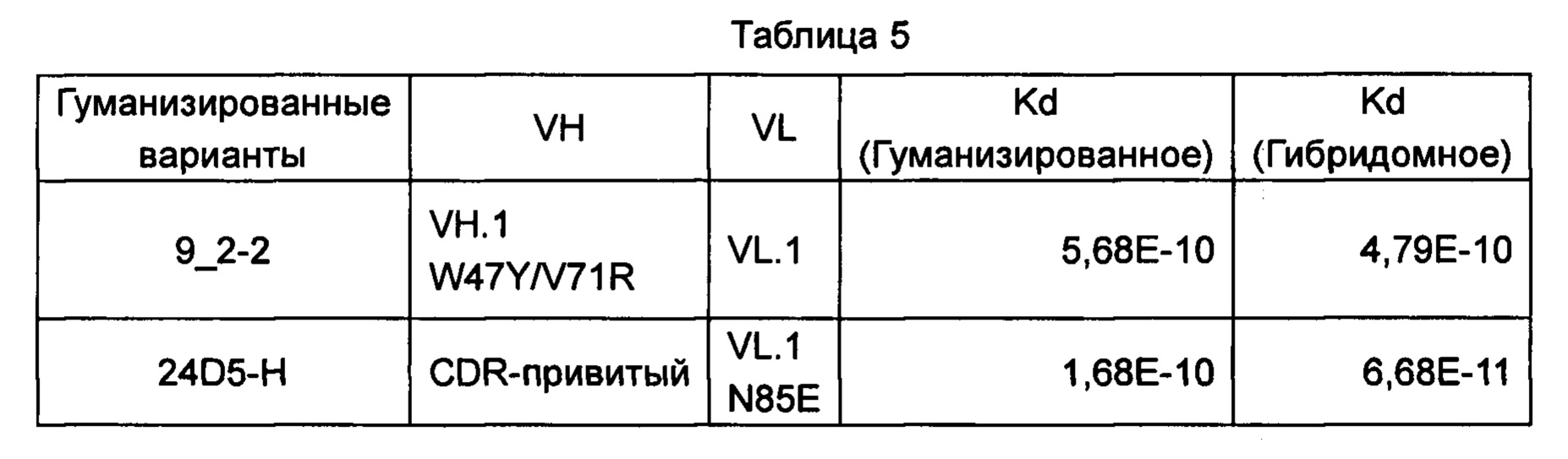
Аффинность 9_2-2 измеряли с помощью биосенсора BIACORE (Испытание 4), полученная величина была аналогична химерному антителу, и лишь небольшое увеличение аффинности наблюдалось при большем количестве обратных мутаций. Хорошая аффиность была получена путем прямого встраивания CDR антитела 24D5 в гуманизированную матрицу, но аффинность самого химерного антитела была слабее, чем в случае гибридомного антитела. Введение N85E в легкую цепь для дегликозилирования может улучшить гомогенность продукта и не повлияет на аффинность.
И, наконец, BIACORE использовали для испытания аффинности гуманизированного варианта, имеющего обратные мутации, к человеческому PD-L1-his или гибридомному антителу, гуманизированные сайты для обратных мутаций и комбинации последовательностей выбирали, как показано в Таблице 5:
Пример 6. Созревание аффинности гуманизировнного антитела против PD-L1
1. Конструирование гуманизированных фагмидных векторов 9-2-2 и 24D5
Гуманизированные 9-2-2 и 24D5 конструировали в фагмидный вектор во фрагменте scFv ((VH-3(GGGGS)-VL)), соответственно, как последовательность дикого типа (т.е. в качестве исходной или начальной последовательности, родственной мутантной последовательности, полученной в результате скрининга созревания аффинности). С помощью перекрывающейся ПЦР, VH, 3 линкер (GGGGS) и VL сплайсировали и затем лигировали во фагмидный вектор через сайты расщепления Ncol и Notl.
2. Конструирование библиотеки фаговых дисплеев
Библиотеку мутантов конструировали, используя scFv дикого типа в качестве матрицы и праймеры на основе кодонов. В процессе синтеза праймеров каждый кодон в мутантном участке имеет 50% кодонов дикого типа и 50% NNK (MNN для обратного праймера), которые вводят во все CDR-участки. ПЦР фрагмент расщепляли с помощью Ncol и Notl, лигировали во фагмидный вектор и, наконец, электрически трансформировали в E.coli TG1. Каждый праймер на основе кодонов был установлен как независимая библиотека, в которой 9-2-2 разделялся на 7 библиотек, a 24D5 разделялся на 8 библиотек.
3. Пэннинг библиотеки
Для жидкофазного пэннинга использовали биотинилированный человеческий антиген PD-L1 (ECD) и магнитные шарики, покрытые стрептавидином, в каждом раунде скрининга концентрацию антигена снижали относительно предыдущего раунда после фазы упаковки частиц, используемых при скрининге посредством высвобождения из библиотеки. После трех раундов пэннинга собирали 250 клонов антител 9-2-2 и 24D5, соответственно, и затем подвергали фаговому ELISA для обнаружения активности связывания, позитивные клоны секвенировали.
4. Поверхностный плазмонный резонанс (SPR) для обнаружения аффинности
После анализа последовательностей на секвенирующие клоны безизбыточные последовательности трансформировали в полноразмерный иммуноглобулин (ИГ, англ. IG) (γ1, κ) для экспрессии клеток млекопитающих после удаления избыточной последовательности. Полноразмерный ИГ после аффинной очистки определяли с помощью прибора BIAcore™ Х-100 (GE Life Sciences) для анализа аффинности.
Подтвержденная выбранная последовательность вариабельного участка:
>9-2 hVH(T)
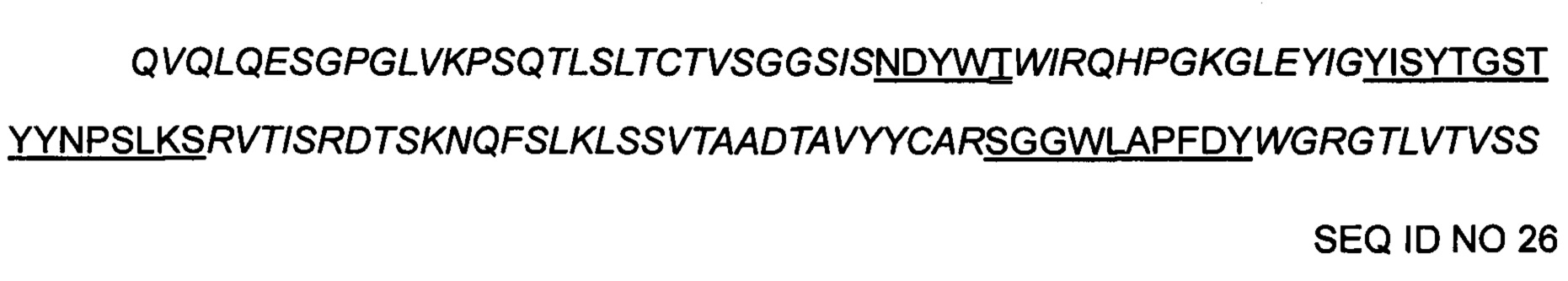
где CDR1 представляет собой SEQ ID NO 10, если X1 является Т.
>9-2 hVL(H)
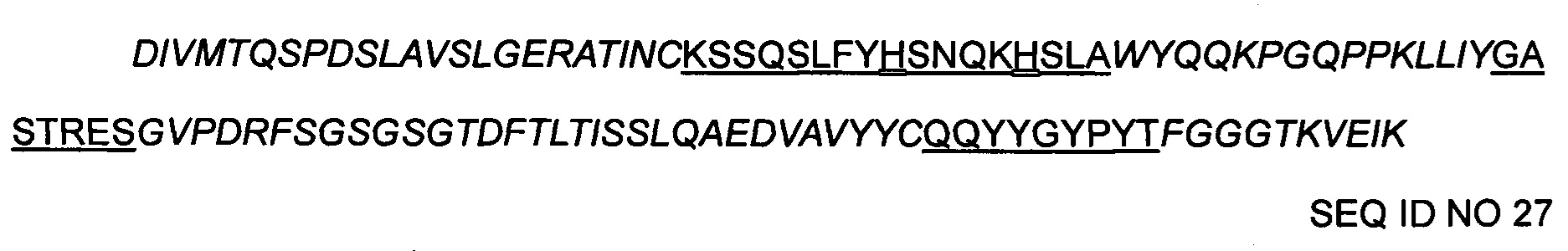
где CDR1 представляет собой SEQ ID NO 13, если Х2 является Т, а Х3 является Н.
Созревание аффинности:
>24-D5 hVH(GF)

где CDR2 представляет собой SEQ ID NO 17, если Х4 представляет собой G, а Х5 представляет собой F.
>24-D5 hVL
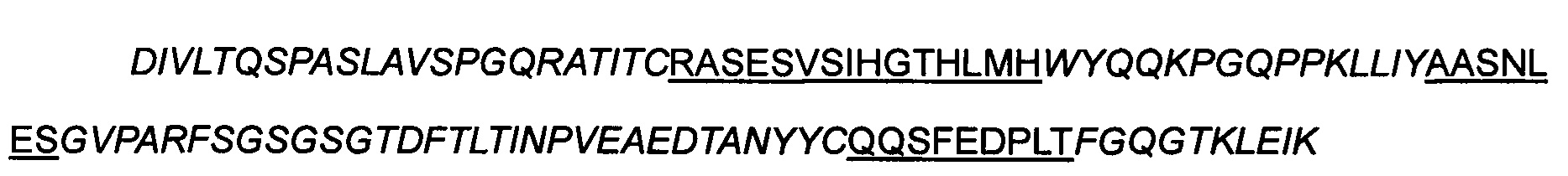

Примечание: Порядок является следующим:
FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4, часть, написанная курсивом, представляет собой последовательность FR, а подчеркнутая часть представляет собой последовательность CDR, где сайты с двойным подчеркиванием были получены путем созревания аффинности после скрининга.
Пример 7. Конструирование и экспрессия человеческого IgG4 против PD-L1
Поскольку PD-L1 также экспрессируется в активированных Т-клетках, использование константных участков IgG1 дикого типа будет индуцировать Fc-опосредуемые эффекты, такие как АЗКЦ и КЗЦ (комплементзависимая цитотоксичность, англ. complement-dependent cytotoxicity, CDC), что приводит к уменьшению активированных Т-клеток. Мутации в Fc IgG1, такие как D265A, N297A, L234A/L235A или L234F/L235A, могут уменьшать АЗКЦ, a P331S или мутации вблизи положения 331 могут уменьшать КЗЦ. Мутация в Fc гибридных антител IgG2 и IgG2/4 также может уменьшать эффекты АЗКЦ и КЗЦ. В данной работе выбирали мутантный IgG4 для получения антител без АЗКЦ и КЗЦ. Таким образом, клоны, полученные путем созревания аффинности, преобразуют в IgG4 тип, при этом центральная шарнирная область IgG4 содержит мутацию S228P, которая усиливает связывание дисульфидной связи в центральной шарнирной области, предотвращая тем самым обмен Fab-областей IgG4 и в значительной степени уменьшая образование полумолекулярных антител. Дополнительно были введены мутации F234A и L235A (mAbs 4: 3, 310-318; май/июнь 2012). Такая форма мутантного антитела IgG4 изменяет СН2 домен и уменьшает взаимодействие с Fc рецепторами для достижения эффекта уменьшения активности АЗКЦ. Очищенное 9-2 H2L10 антитело было экспрессировано в соответствии с настоящим примером и названо HRP00049, а экспрессированное 24D5 29Н1 GF получило название HRP00052. Эти белки будут дополнительно идентифицированы на этапе тестирования.
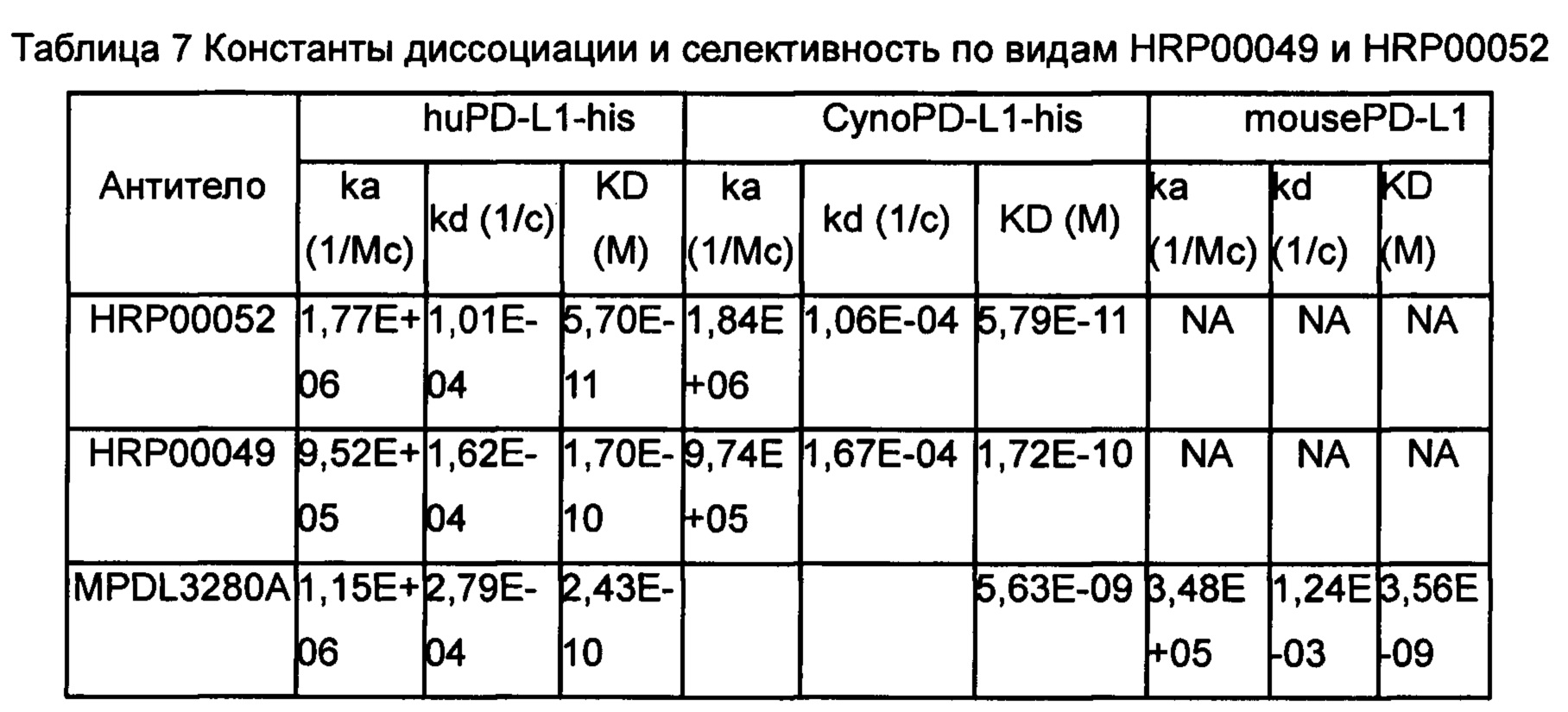
Испытание аффинности мутанта IgG4 типа с человеческим PD-L1-his или PD-L1-his макаки-резус представлено как Испытание 4, Таблица 6.
HRP00049: 9-2(H2/L10) IgG4 (AA)(S228P)
Тяжелая цепь: последовательность тяжелой цепи антитела HRP00049


Последовательность гена, кодирующая тяжелую цепь антитела HRP00049:

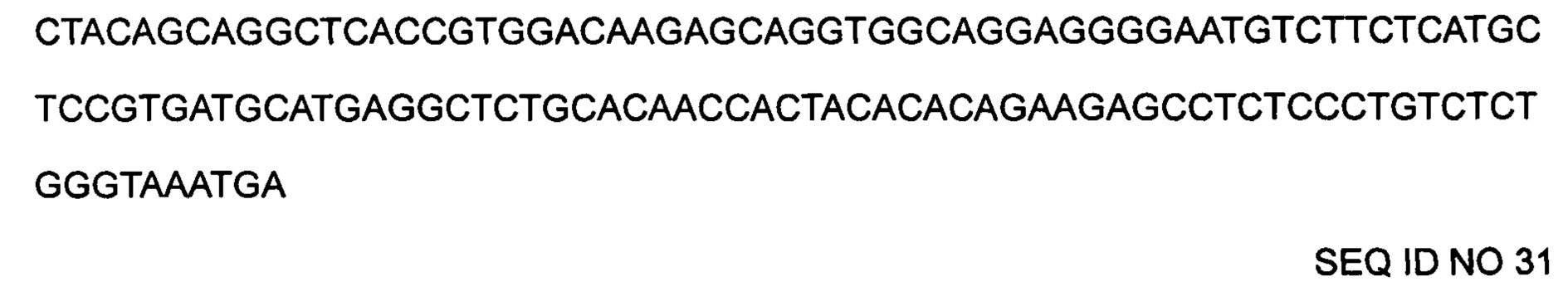
Легкая цепь: последовательность легкой цепи антитела HRP00049  Последовательность гена, кодирующая легкую цепь антитела HRP00049:
Последовательность гена, кодирующая легкую цепь антитела HRP00049:

HRP00052: 24D5(GF) IgG4 (АА) (S228P)
Тяжелая цепь: последовательность тяжелой цепи антитела HRP00052


Последовательность гена, кодирующая тяжелую цепь антитела HRP00052:

Легкая цепь: последовательность легкой цепи антитела HRP00052

Последовательность гена, кодирующая легкую цепь антитела HRP00052:

Примечание: подчеркнутая часть представляет собой последовательность вариабельного участка тяжелой или легкой цепи антитела или кодирующую ее нуклеотидную последовательность; свободная часть представляет собой последовательность константного участка антитела и соответствующую ей кодирующую нуклеотидную последовательность.
Проведение и преимущества настоящего изобретения подтверждены с помощью биохимических испытаний, как указано ниже.
Испытание 1. Связывание ELISA для PD-L1
Планшеты для микротитрования напрямую покрывали 1 мкг/мл (100 мкг/лунку) PD-L1(ECD)-Fc(SEQ ID NO 4) и инкубировали при температуре 4°С в течение ночи, затем планшеты блокировали с помощью 150 мкл/лунку ФСБ, содержащего 5% сухого молока (англ. Skim Milk)(BD, 232100), и инкубировали при температуре 4°С в течение ночи. Планшеты промывали два раза, в каждую лунку добавляли по 50 мкл/лунку клеточного супернатанта, после чего планшеты инкубировали при температуре 37°С в течение 2 ч. Планшеты промывали три раза, в каждую лунку добавляли по 50 мкл/лунку козьих антител против IgG человека Peroxidase-AffiniPure Goat Anti-Human IgG (Jackson, 115-035-003), которые разбавляли KPL Milk (KPL, 50-82-01) в соотношении 1:5000, и планшеты инкубировали при температуре 37°С в течение 1 ч. Планшеты промывали четыре раза, в каждую лунку добавляли по 50 мкл/лунку тетраметилбензидин (ТМБ, англ. ТМВ - tetramethylbenzidine), и планшеты инкубировали при температуре 37°С в течение 10 мин. Реакцию останавливали добавлением в каждую лунку по 50 мкл/лунку 1М H2SO4. Величину ОП (оптическая плотность, англ. OD - optical density,) при длине волны 450 нм считывали на микропланшетном ридере ELISA (BMG Labtech, NOVOStar).
Испытание 2. ELISA анализ блокирования связывания между PD-L1 и PD-1
Разведение биотина (Dojindo Chemical, LK03: 3 образца) и авидина (Sigma, S2438-250UG) соответствовало 6% бычьего сывороточного альбумина (БСА, от англ. BSA - bovine serum albumin) (разбавленного ФСБ, содержащим 0,1% полисорбата Твин20), в качестве раствора для нанесения жидкой фазы использовали ФСБ. Планшеты для микротитрования напрямую покрывали 1 мкг/мл (100 мкг/лунку) PD-L1(ECD)-Fc(SEQ ID NO 4) и инкубировали при температуре 4°С в течение ночи. Планшеты промывали три раза и блокировали в течение 2 ч при температуре 37°С с помощью 3% БСА (разбавленного ФСБ, содержащим 0,1% полисорбата Твин20). Планшеты промывали три раза. В каждую лунку добавляли по 50 мкл/лунку клеточного супернатанта. Затем в каждую лунку добавляли по 50 мкл/лунку био-PD-1-Fc (меченого биотином PD-1-Fc, SEQ ID NO 5, 2 мкг/мл, PD-1-FC был помечен в соответствии со способом Dojindo Chemical Kits Biotin Labeling Kit-NH2, LK03: 3 образца), хорошо перемешивали с помощью вортекса и инкубировали при температуре 37°С в течение 1 ч. Планшеты промывали 6 раз, после чего добавляли по 50 мкл/лунку полимера стрептавидин-пероксидаза (англ. Streptavidin-Peroxidase Polymer) (S2438-250UG, Sigma, который был разведен в соотношении 1:400) и инкубировали на шейкере в течение 50 мин при комнатной температуре. Планшет промывали 6 раз, затем добавляли 100 мкл/лунку ТМБ и проявляли в течение 5-10 мин при температуре 37°С. После этого реакцию останавливали добавлением 100 мкл/лунку 1М H2SO4. Величину поглощения при длине волны 450 нм считывали на микропланшетном ридере (BMG Labtech, NOVOStar) и вычисляли величину IC50 блокирования связывания антитела против PD-1 с лигандом PD-L1. Блокирующая активность гуманизированного антитела по настоящему изобретению при связывании с PD-L1/PD-1 представлена в Таблице 6 ниже.
Аналогичный одномоментный анализ блокирования также использовали для скрининга гибридомных антител.
Испытание 3. Блокада связывания PD-L1 и В7.1 антителом против PD-L1
Данный анализ был аналогичен анализу блокирования (Испытание 2) антителом против PD-L1 связывания между PD-L1 и PD-1. Био-человеческий PD-1 (ECD)-FC в Испытании 2 заменяли на био-человеческий-В7.1 (человеческий-В7.1, Sino Biological 10698-Н03Н-200), остальные стадии были теми же. В дополнение была обнаружена специфическая блокада антитела против PD-L1 в PD-L2-Fc (Q9BQ51, внеклеточный домен (аа20-аа220)) и связывание с анителом к PD-1 аналогичным образом, а также было обнаружено, что испытываемое антитело не блокирует связывание между PD-L2 и PD-1.
Аналогичный одномоментный анализ блокирования использовали для проверки гибридомных антител.
Блокирующая активность гуманизированного антитела по настоящему изобретению для PD-L1 и В7.1 связывания, PD-L2 и PD-1 связывания представлена в Таблице 6 ниже.
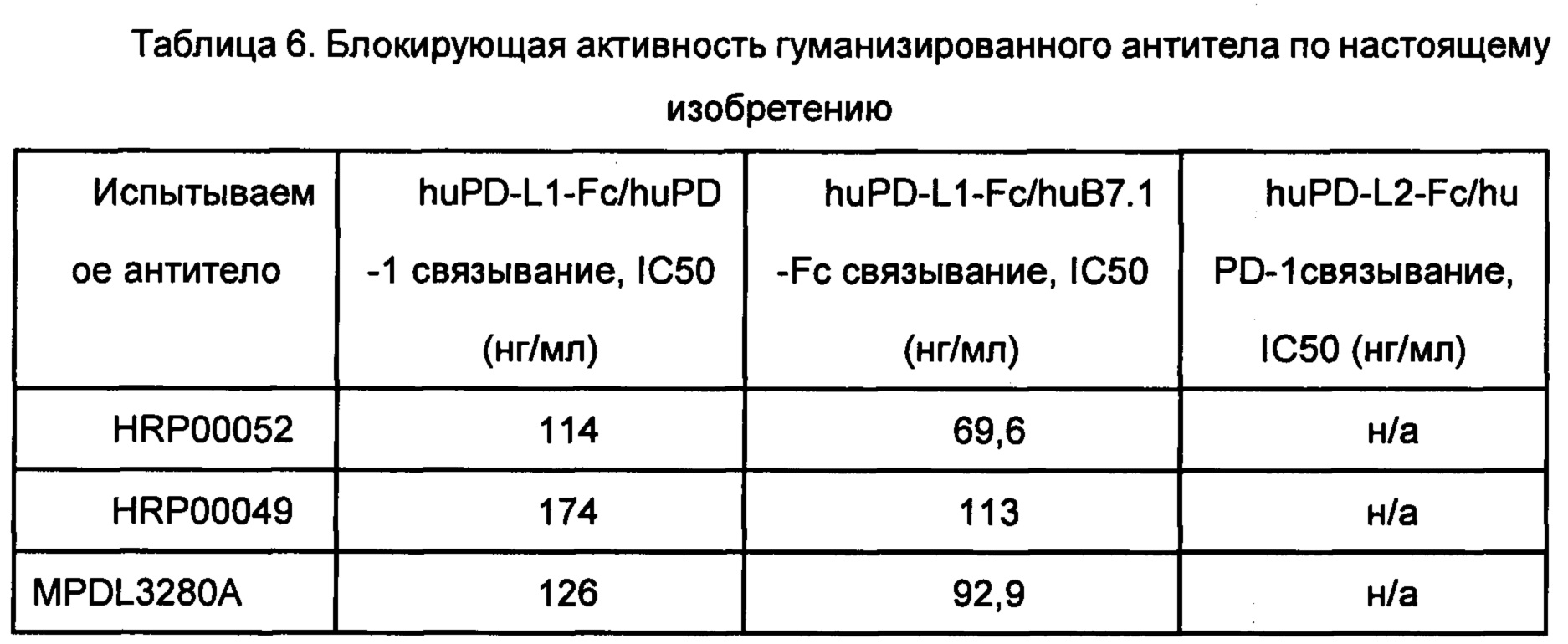
Примечание: н/а означает отсутствие блокирующей активности.
Испытание 4. Определение аффинности антитела против PD-L1 HRP00049 и HRP00052 к антигену PD-L1 при помощи анализа с использованием Biacore
Античеловеческое иммобилизованное антитело ковалентно соединяли с биочипом СМ5 (GE, BR-1000-12) в соответствии со способом, описанным в инструкциях к набору для захвата человеческих антител (GE, BR-1008-39), для аффинности, удерживающей антитело против PD-L1 по настоящему изобретению. После этого сквозь поверхность биочипа пропускали серию концентраций человеческого антигена PD-L1 (Sino biological, 10084-Н08Н-200) и реакционный сигнал обнаруживали в режиме реального времени с помощью прибора Biacore (GE, BiacoreX100) с получением кривых ассоциации и диссоциации. И наконец, при помощи обработки кривых получали величины аффинности. Во время эксперимента после завершения каждого цикла диссоциации биочип промывали и регенерировали с помощью регенерационного раствора из набора для захвата человеческих антител (GE). Полученные данные анализировали при помощи Программного обеспечения для оценки BIA (GE), используя модель связывания 1:1 (Langmuir). Величины скорости ассоциации Kа (kon), скорости диссоциации kd (koff) и константы моновалентной диссоциации KD определяли с помощью анализа. Аффинность гибридомных антител и гуманизированных антител представлена в других примерах. Приведенная ниже Таблица 7 показывает аффинности антител, подвергнутых созреванию аффинности, и контрольного антитела к человеческому антигену PD-L1 (huPD-L1-his, Sino biological, 10084-Н08Н-200), антигену яванского макака PD-L1 (Cyno PD-L1-his, Sino (90251-С08Н-100) и мышиному антигену PD-L1 (Mouse PD-L1-his, Sino biological, 50010-M08H-100).
Испытание 5. Цитологическое испытание in vitro_
Был выполнен анализ пролиферации свежей человеческой мононуклеарной клетки периферической крови (МКПК, англ. РВМС - peripheral blood mononuclear cells), вызванной антителом, для обнаружения активности клеток в отношении антитела против PD-L1.
Свежие человеческие МКПК (произвольно собранные у здоровых индивидуумов) доводили до плотности 2×106/мл, инокулпровали в 6-луночный планшет при 2 мл/лунку и инкубировали в течение 6 часов при температуре 37°С, 5% СO2. После того как суспензии клеток были отброшены, каждую лунку адгезивных клеток смешивали с 2 мл среды RPMI 1640, содержащей 100 нг/мл гранулоцитарный колониестимулирующий биологический фактор (ГМ-КСФ, от англ. GM-CSF - granulocyte colony stimulating biological factor, Peprotech, AF-300-03) и 100 нг/мл IL-4 (Peprotech, AF-200-04). Через два дня после инкубации добавляли еще 1 мл среды RPMI1640, содержащей 100 нг/мл ГМ-КСФ и 100 нг/мл интерлейкина IL-4, после чего клетки непрерывно культивировали в течение 2 дней с последующим добавлением в каждую лунку 100 нг/мл ФНО-α (фактор-α некроза опухолей, англ. TNF - tumor necrosis factor, Peprotech, AF-300-01A) и культивировали в течение еще 2 дней до получения зрелых дендритных клеток. Дендритные клетки и аллогенные Т-клетки центрифугировали и ресуспендировали при концентрации 1×106/мл и 1×105/мл, соответственно, и дозировали при помощи пипетки в 96-луночный планшет по 100 мкл/лунку с последующим добавлением 20 мкл/лунку антитела, которое последовательно разводили в различных концентрациях с помощью ФСБ, и затем культивировали в инкубаторе при температуре 37°С, 5% СO2 в течение 5 дней. После этого отбирали 100 мкл образца для определения пролиферации клеток с помощью набора для люминесцентного анализа жизнеспособности клеток CellTiter-Glo® (англ. Luminescent Cell Viability Assay kit). В это же время определяли секрецию цитокина ИФН-γ (интерферон-γ, англ. IFN -γ).
И HRP00052, и HRP00049 могут эффективно стимулировать секрецию цитокина ИФН-γ. Этот же способ использовали также для определения стимуляции при МКПК пролиферации (Фиг. 3) и секреции цитокина ИФН-у (Таблица 8) с помощью гуманизированного антитела. Как показано на Фиг. 3 и в Таблице 8, было установлено, что гуманизированное антитело по настоящему изобретению более эффективно стимулирует пролиферацию МКПК и секрецию цитокина ИФН-γ, чем положительный контроль MPDL3280A (Atezolizumab, WHO Drug Information, Vol. 28, No. 4, 2014, P488).
Таблица 8. HRP00052 и HRP00049 стимулируют МКПК с высвобождением цитокинов ИФН-γ
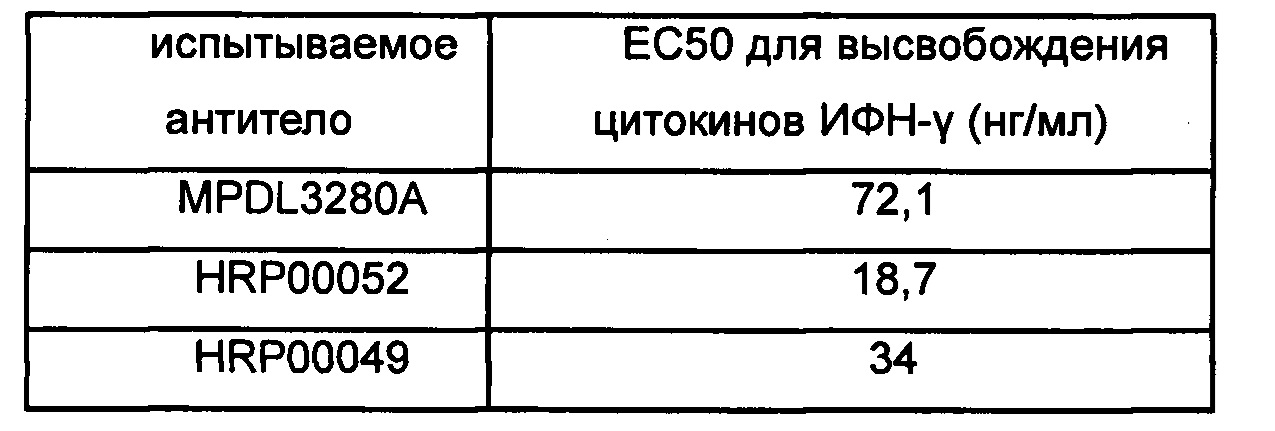
Испытание 6. Активность антитела в отношении стимулированной туберкулином
пролиферации МКПК
Определяли активность испытываемого антитела HRP00052, HRP00049 и эталонного антитела в отношении стимулированной туберкулином пролиферации МКПК in vitro.
15 мл свежих МКПК, приблизительно 3×107, добавляли в 20 мкл туберкулина (Shanghai Biyou Biotechnology, cat # 97-8800), и смесь инкубировали в инкубаторе в течение 5 дней при температуре 37°С, 5% СO2. На 6-ой день культивируемые клетки центрифугировали и ресуспендировали в свежую среду с плотностью, доведенной до 5x105 клеток/мл. 190 мкл ресуспендированных клеток добавляли в 96-луночный планшет, и 10 мкл/лунку гуманизированного антитела HRP00052 или HRP00049 добавляли в соответствующую лунку 96-луночного планшета для культуры клеток, и 10 мкл ФСБ добавляли в контрольную и холостую пробу, соответственно. После этого планшет для культуры клеток инкубировали в инкубаторе при температуре 37°С, 5% СO2, и спустя 72 часа определяли пролиферацию МКПК (Promega, cat # G7571) и секрецию ИФН-γ (Neo Bioscience, cat#EHC102g). Результаты представлены в Таблице 9 ниже.
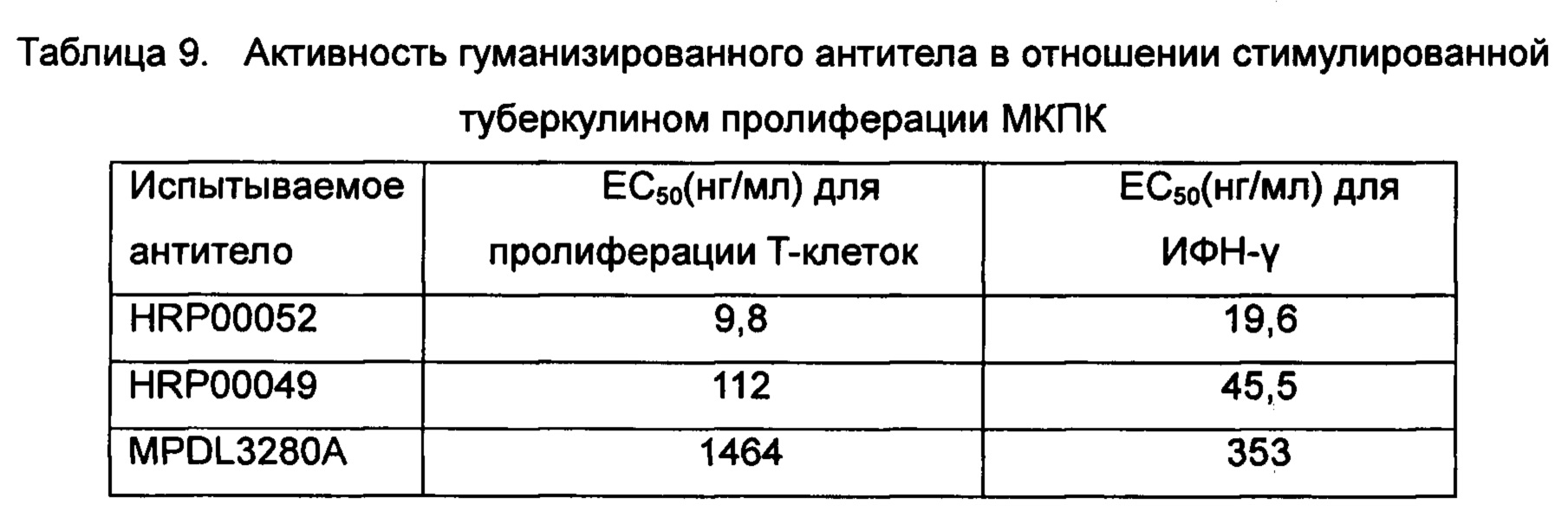
Результат: данный эксперимент демонстрирует, что гуманизированные антитела по настоящему изобретению оказывают более сильное стимулирующее действие на пролиферацию МКПК, которая ранее стимулировалась экзогенным антигеном, и данная характеристика имеет неожиданный эффект при применении для лечения опухоли.
Испытание 7. Ингибирующий эффект антитела против PD-L1 HRP00052 на рост опухолевых клеток у мышей с опухолью U87MG
В ходе исследования иммунодефицитным мышам инокулировали клетки U87MG человеческой глиобластомы. После образования опухоли человеческие МКПК, активированные с помощью анти-СD3 антитела, инъецировали в опухолевую ткань для оценки эффекта антитела против PD-L1 на лечение мышей, подкожно инъецированных опухолью глиобластомы U87 MG.
МКПК выделяли из крови, предоставленной двумя добровольцами, культивировали и активировали с помощью анти-СD3 антитела (Miltenyi Biotec, 130-093-387). U87MG клетки инокулировали подкожно в правые ребра мышей с тяжелым комбинированным иммунодефицитом (ТКИД, от англ. SCID - severe combined immunodeficiency disorder) (Vital River 11400700081219), спустя две недели, если объем опухоли был более или равен 40 мм3, мышей со слишком большой или слишком малой массой тела или размером опухоли выбраковывали. Оставшихся мышей произвольно делили на две группы в зависимости от объема опухоли. Полученные от двух добровольцев МКПК стимулировали CD3 антителами, затем смешивали в соотношении 1:1 и вводили в опухолевую ткань. Вместе с тем была начата подкожная инъекция антитела или холостого вектора (5% раствор глюкозы). Введение проводили однократно в дни 0, 7, 14 и 21, соответственно, в общей сложности 4 раза.
В Таблице 10 представлены результаты, показывающие, что доза 3 мг/кг антитела против PD-L1 HRP00052 может значительно ингибировать рост подкожной опухоли человеческой злокачественной глиомы U87MG.

*: Р меньше 0,05, против холостого вектора СО - стандартная ошибка среднего значения