Результат интеллектуальной деятельности: ЛИПОСОМЫ ИРИНОТЕКАНА ИЛИ ЕГО СОЛЕЙ, СПОСОБ ИХ ПОЛУЧЕНИЯ
Вид РИД
Изобретение
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к липосомам иринотекана или его гидрохлорида и к способу их получения, а также к инъекционной композиции, включающей данные липосомы, и способу ее получения.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Иринотекан представляет собой полусинтетическое производное камптотецина. Камптотецин может специфично связываться с топоизомеразой I, которая может индуцировать обратимые однонитевые разрывы ДНК, а затем раскручивать двунитевую структуру ДНК. Иринотекан и его активный метаболит SN-38 может связываться с комплексом топоизомераза 1-ДНК, посредством чего предотвращает воссоединение однонитевого разрыва. Доказано, что цитотоксичность иринотекана является свойством взаимодействия репликазы и тройных комплексов топоизомераза 1-ДНК-иринотекан (или SN-38), которое разрушает двойную спираль ДНК при синтезе ДНК.
Иринотекан гидрохлорид широко применяют при лечении злокачественной опухоли с преимуществами очевидных фармакологических эффектов и клинической эффективности. Однако он имеет такую же проблему, как и другие производные камптотецина: насыщенное лактоновое кольцо в структуре иринотекана является рН-зависимым и может быть обратимо преобразовано в физиологических условиях в форму его карбоксилата, для которого противоопухолевая активность ослабляется. Существующие коммерческие препараты иринотекана гидрохлорида представляют собой жидкий инъекционный препарат и лиофилизированный порошок для инъекций. После внутривенного введения в клинике свободное лекарство теряет активность, поскольку лактоновое кольцо в его структуре склонно подвергаться гидролизу до формы карбоксилата в щелочной физиологической среде, в результате чего косвенно снижается эффективность лекарства. Кроме того, эти препараты обладают серьезными побочными эффектами, которые представляют собой, в основном, нейтропению и замедленную диарею.
В последнее время липосомы широко изучены в качестве носителя лекарства. Основные признаки липосом включают защиту инкапсулированного лекарства, повышение стабильности лекарства, изменение свойств распределения лекарства in vivo и перенос лекарства в пораженную область за счет пассивного или активного направления. Как хороший носитель противораковых лекарств, липосомы могут улучшить эффективность лекарства и уменьшить токсичность лекарства.
В международной заявке WO 2005/117878 раскрыт липосомный препарат иринотекана и способ его получения. Этот препарат содержит иринотекан или иринотекан гидрохлорид, фосфолипид, выбранный из группы, состоящей из гидрогенизированного соевого фосфатидилхолина, фосфатидилэтаноламина, лецитина и кардиолипина, а также холестерина. Подобным образом, в китайской заявке на патент CN1994279A также раскрыт липосомный препарат иринотекана и способ его получения, где фосфатидилхолин используют в качестве фосфолипида для получения липосом в Примере 5.
Препараты, упомянутые в вышеуказанной патентной литературе, могут достигать хорошего эффекта. Однако при применении этих препаратов у человека стабильность, размер частиц и тому подобное все же неудовлетворительны.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены липосомы иринотекана или иринотекана гидрохлорида, которые обладают более высокой способностью к включению лекарства, высокой эффективностью инкапсуляции, хорошей стабильностью и пригодны для изготовления лекарственного препарата.
Вплоть до настоящего времени в некоторых литературных источниках (например, в международной заявке WO 2005/117878 и CN 1994279 A) описана композиция и способы получения липосом иринотекана. В некоторых их препаратах некоторые показатели дали хороший результат. Однако в них отсутствует какая-либо информация о контроле стабильности и размера частиц. После дополнительного исследования липосом авторы изобретения неожиданно обнаружили, что количество холестерина, в частности, влияло на размер частиц и стабильность липосом, когда выбранный тип неактивного ингредиента и количество, используемое в препарате, соответствовало некоторым условиям. Авторы изобретения успешно получили липосомы с малым и однородным распределением размера частиц и улучшили их стабильность путем регулирования отношения между нейтральным фосфолипидом и холестерином. По сравнению с другими препаратами липосомы по настоящему изобретению обладают высокой стабильностью при хранении, и другие показатели также значительно улучшены. Кроме того, по сравнению с технологиями, описанными в международной заявке WO 2005/117878 и CN 1994279 A, эти препараты не содержат соединение с основной функциональной группой и катионный липид. Кроме того, липосомы по настоящему изобретению обладают хорошим противоопухолевым эффектом и некоторыми преимуществами простого получения препарата, высокой способности к включению лекарства и хорошей стабильности при хранении.
Липосомы по настоящему изобретению содержат иринотекан или иринотекан гидрохлорид, нейтральный фосфолипид и холестерин, и массовое отношение холестерина к нейтральному фосфолипиду составляет 1:3-5, предпочтительно 1:3,5-4,5, наиболее предпочтительно 1:4.
Нейтральный фосфолипид, используемый в настоящем изобретении, выбран из группы, состоящей из гидрогенизированного соевого фосфатидилхолина (HSPC), фосфатидилхолина куриного яйца (ЕРС), соевого фосфатидилхолина (SPC) и тому подобного. Эффект становится лучшим, когда в качестве нейтрального фосфолипида используют гидрогенизированный соевый фосфатидилхолин. Способность к включению лекарства в липосому может быть значительно улучшена, когда массовое отношение лекарства к фосфолипиду дополнительно регулируют, как описано ниже:
|
Липосомы по настоящему изобретению могут быть получены общепринятыми способами получения липосом в данной области техники, предпочтительно способом ионного градиента. При использовании способа ионного градиента ионный градиент образован буфером между внутренней водной фазой и наружной водной фазой липосомы. Предпочтительно внутренняя водная фаза липосомы имеет более высокую концентрацию иона, чем наружная водная фаза, что может улучшить стабильность размера частиц липосом в период хранения, сохранить лучшую эффективность лекарства и обладать способностью к контролю малого и однородного среднего размера частиц липосом, обеспечить уменьшение до минимума изменения размера частиц липосом в период хранения.
В настоящем изобретении изменение размера частиц липосом в период хранения можно уменьшить до минимума путем добавления в композицию липидного производного гидрофильного полимера. Кроме того, период цикла липосом in vivo можно продлить путем добавления в композицию производного полиэтиленгликоля. Производное полиэтиленгликоля выбрано из группы, состоящей из полиэтиленгликоль 2000-дистеароилфосфатидилэтаноламина (DSPE-PEG2000), полиэтиленгликоль 5000-дистеароилфосфатидилэтаноламина, полиэтиленгликоль 2000-дипальмитоилфосфатидилэтаноламина, полиэтиленгликоль 5000-дипальмитоилфосфатидилэтаноламина. С целью улучшения долгосрочной эффективности лекарства к липосомам по настоящему изобретению предпочтительно добавлять липидное производное гидрофильного полимера. На основании этого соотношения в композиции DSPE-PEG2000 обладает наиболее очевидным эффектом. Предпочтительное массовое отношение липидного производного к иринотекану или иринотекану гидрохлориду составляет 0,2-0,4.
Липосомы могут дополнительно содержать заряженный фосфолипид, выбранный из группы, состоящей из дилауроилфосфатидилглицерина, дипальмитоилфосфатидилглицерина, дистеароилфосфатидилглицерина, димиристатфосфатидилглицерина, диолеиновой кислоты фосфатидилсерина, диолеоилфосфатидилглицерина, дилауроилфосфатидной кислоты, димиристатфосфатидной кислоты, дистеароилфосфатидной кислоты и их смеси, и массовое отношение заряженного фосфолипида к нейтральному фосфолипиду составляет 1:5-1:100.
Предпочтительно липосомы по настоящему изобретению содержат приведенные ниже массовые доли ингредиентов:
|
и отношение холестерина к гидрогенизированному соевому фосфатидилхолину составляет 1:4.
В настоящем изобретении также предложен способ получения липосом иринотекана или иринотекана гидрохлорида. Липосомы по настоящему изобретению могут быть получены общепринятым способом получения липосом. Специалист в данной области техники может выбрать ряд способов для получения липосом в соответствии с желаемой композицией согласно изобретению. Для приготовления композиции липосом в настоящем изобретении предпочтительно выбран способ получения с помощью ионного градиента. Этот способ получения включает приведенные ниже стадии:
1) Получение ненагруженных липосом любым из нижеследующих способов A-D:
А. растворение нейтрального фосфолипида и холестерина в безводном этаноле или в смешанном растворителе из безводного этанола и трет-бутилового спирта в соответствии с желаемой композицией, смешивание этой смеси с буфером с получением сырых ненагруженных липосом после удаления этанола путем перегонки при пониженном давлении, а затем получение ненагруженных липосом с желаемым размером частиц путем использования гомогенизатора высокого давления и/или экструзионного оборудования;
В. растворение нейтрального фосфолипида и холестерина в хлороформе или в смешанном растворителе хлороформ-метанол в соответствии с желаемой композицией, образование липидной пленки с помощью роторного испарителя, добавление буфера для гидратации с получением сырых ненагруженных липосом, а затем получение ненагруженных липосом с желаемым размером частиц путем использования гомогенизатора высокого давления и/или экструзионного оборудования;
С. смешивание нейтрального фосфолипида, холестерина и буфера в соответствии с желаемой композицией, затем получение ненагруженных липосом с желаемым размером частиц путем использования гомогенизатора высокого давления и/или экструзионного оборудования;
D. растворение нейтрального фосфолипида и холестерина в безводном этаноле или в смешанном растворителе из безводного этанола и трет-бутилового спирта в соответствии с желаемой композицией, смешивание этой смеси с буфером, а затем получение ненагруженных липосом с желаемым размером частиц путем использования гомогенизатора высокого давления и/или экструзионного оборудования;
2) Создание ионного градиента между внутренней водной фазой и наружной водной фазой ненагруженной липосомы: замещение наружной водной фазы ненагруженной липосомы с образованием ионного градиента между внутренней водной фазой и наружной водной фазой ненагруженной липосомы;
3) Получение липосом, нагруженных лекарством: получение водного раствора иринотекана гидрохлорида, добавление его к дисперсии ненагруженных липосом с ионным градиентом, а затем инкубация этой дисперсии с получением липосомы, нагруженной лекарством, при нагревании и перемешивании.
После стадии 3) получения липосомы, нагруженной лекарством, этот способ может также включать приведенную ниже стадию:
4) удаление свободного лекарства и концентрирование образца: добавление буферного раствора к липосомам иринотекана гидрохлорида, удаление невключенного лекарства путем использования устройства с тангенциальным потоком и концентрирование образца до соответствующего объема.
В настоящем изобретении также предложен липосомная композиция для инъекций, содержащая вышеописанные липосомы. Когда липосомы получают для инъекционной композиции, пригодной для применения человеком, полезно добавлять стабилизатор. Стабилизатор, используемый в настоящем изобретении, может представлять собой общепринятый стабилизатор, такой как витамин Е, этилендиаминтетрауксусную кислоту и т.д. Стабилизатор полезен для стабильности композиции. Для описанной композиции исследование стабилизатора показывает, что этилендиаминтетрауксусная кислота или ее соль обладает лучшим эффектом относительно других стабилизаторов. Эти стабилизаторы полезны для улучшения стабильности липосом. Таким образом, стабилизатор может представлять собой этилендиаминтетрауксусную кислоту, двунатриевую соль этилендиаминтетрауксусной кислоты и двукальциевую соль этилендиаминтетрауксусной кислоты, либо их смесь. Доля добавленного стабилизатора составляет 0-0,5% (мас./об.), и минимум составляет не 0%.
Композицию по настоящему изобретению предпочтительно содержат антиоксидант, выбранный из группы, состоящей из водорастворимого антиоксиданта и жирорастворимого антиоксиданта, где жирорастворимый антиоксидант выбран из группы, состоящей из α-токоферола, α-токоферола сукцината, α-токоферола ацетата и их смеси, где водорастворимый антиоксидант выбран из группы, состоящей из аскорбиновой кислоты, бисульфита натрия, сульфита натрия, пиросульфита натрия, L-цистеина и их смеси. Доля добавленного антиоксиданта составляет 0-0,5% (мас./об.), и минимум составляет не 0%.
Композиция для инъекций может находиться в форме жидкости или лиофилизированного порошка для инъекций. Композиция для инъекций может включать регулятор осмотического давления, выбранный из группы, состоящей из глюкозы, сахарозы, сорбита, маннита, хлорида натрия, глицерина, гистидина и его гидрохлорида, глицина и его гидрохлорида, лизина, серина, глутаминовой кислоты, аргинина, валина и их смеси. Доля добавленного регулятора осмотического давления составляет 0-0,5% (мас./об.), и минимум составляет не 0%.
Композиция в форме лиофилизированного порошка для инъекций дополнительно содержит лиопротектор, причем композицию получают в виде лиофилизированного порошка для инъекций после лиофилизации. Лиопротектор выбран из группы, состоящей из глюкозы, сахарозы, трегалозы, маннита, декстрана, лактозы и их смеси.
Предпочтительная липосомная композиция для инъекций по настоящему изобретению содержит приведенное ниже массовое отношение ингредиентов:
|
и отношение холестерина к гидрогенизированному соевому фосфатидилхолину составляет 1:4.
Способ получения вышеописанной композиции для инъекций включает приведенные ниже стадии:
1) Получение ненагруженных липосом любым из нижеследующих способов A-D:
А. растворение нейтрального фосфолипида и холестерина в безводном этаноле или в смешанном растворителе из безводного этанола и трет-бутилового спирта в соответствии с желаемой композиций, смешивание этой смеси с буфером с получением сырых ненагруженных липосом после удаления этанола путем перегонки при пониженном давлении, а затем получение ненагруженных липосом с желаемым размером частиц путем использования гомогенизатора высокого давления и/или экструзионного оборудования;
В. растворение нейтрального фосфолипида и холестерина в хлороформе или в смешанном растворителе хлороформ-метанол в соответствии с желаемой композицией, образование липидной пленки с помощью роторного испарителя, добавление буфера для гидратации с получением сырых ненагруженных липосом, а затем получение ненагруженных липосом с желаемым размером частиц путем использования гомогенизатора высокого давления и/или экструзионного оборудования;
С. смешивание нейтрального фосфолипида, холестерина и буфера в соответствии с желаемой композицией, затем получение ненагруженных липосом с желаемым размером частиц путем использования гомогенизатора высокого давления и/или экструзионного оборудования;
D. растворение нейтрального фосфолипида и холестерина в безводном этаноле или в смешанном растворителе из безводного этанола и трет-бутилового спирта в соответствии с желаемой композицией, смешивание этой смеси с буфером, а затем получение ненагруженных липосом с желаемым размером частиц путем использования гомогенизатора высокого давления и/или экструзионного оборудования;
2) Создание ионного градиента между внутренней водной фазой и наружной водной фазой ненагруженной липосомы: замещение наружной водной фазы ненагруженной липосомы с образованием ионного градиента между внутренней водной фазой и наружной водной фазой ненагруженной липосомы;
3) Получение липосомы, нагруженной лекарством: получение водного раствора иринотекана гидрохлорида, добавление его к дисперсии ненагруженных липосом с ионным градиентом, а затем инкубация этой дисперсии с получением липосомы, нагруженной лекарством, при нагревании и перемешивании.
После стадии 3) получения липосомы, нагруженной лекарством, этот способ может также включать приведенную ниже стадию:
4) удаление свободного лекарства и концентрирование образца: добавление буферного раствора к липосомам иринотекана гидрохлорида, удаление невключенного лекарства путем использования устройства с тангенциальным потоком и концентрирование образца до соответствующего объема.
После того как липосомы получены, концентрацию лекарства доводят путем их разведения до отмеренного объема; липосомы стерилизуют фильтрованием, затем заполняют и герметично закрывают с получением липосомной композиции для инъекций. Или после добавления лиопротектора к образцу липосом лекарства концентрацию лекарства доводят путем разведения до отмеренного объема, липосомы стерилизуют фильтрованием, затем заполняют, герметично закрывают и лиофилизируют с получением лиофилизированного порошка липосом для инъекций.
Полезные эффекты настоящего изобретения
Липосомная композиция иринотекана или иринотекана гидрохлорида позволяет преодолеть многие недостатки существующих препаратов и технологий. Стабильность лекарства может быть улучшена путем инкапсуляции лекарства во внутренней водной фазе липосомы. Поскольку лекарство находится в форме лактонового кольца in vivo, концентрация активного метаболита SN-38 поддерживается в плазме в течение длительного времени. Вообще говоря, липосомная композиция иринотекана или иринотекана гидрохлорида может повысить эффективность препарата и уменьшить побочные эффекты лекарств.
Липосомная композиция иринотекана или иринотекана гидрохлорида по настоящему изобретению позволяет решить проблему низкой способности к загрузке лекарства в липосому за счет контроля определенного соотношения лекарства, фосфолипида и холестерина. Отношение лекарства к липиду в липосомной композиции для инъекций выше 0,25 (мас./мас.), и эффективность инкапсуляции выше 90%, предпочтительно выше 95%. Липосомы, полученные по настоящему изобретению, обладают меньшим размером частиц и улучшают стабильность за счет оптимизации дозировки холестерина и фосфолипида. В результате скрининга стабилизатора в композицию предпочтительно добавляют определенный процент солей этилендиаминтетрауксусной кислоты, чтобы значительно улучшить стабильность липосом, распределение размера частиц липосом является однородным в интервале 10 нм - 220 нм. Результаты экспериментов по влияющему фактору композиции для инъекций липосом иринотекана или иринотекана гидрохлорида показывают, что размер частиц и эффективность инкапсуляции образца не претерпевают значительных изменений при помещении при 40°С на 10 суток и все показатели соответствуют требованиям. По сравнению с имеющимися в продаже препаратами липосомная композиция для инъекций иринотекана или иринотекана гидрохлорида характеризуется значительным повышением скорости ингибирования опухоли и значительным снижением его токсичности.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
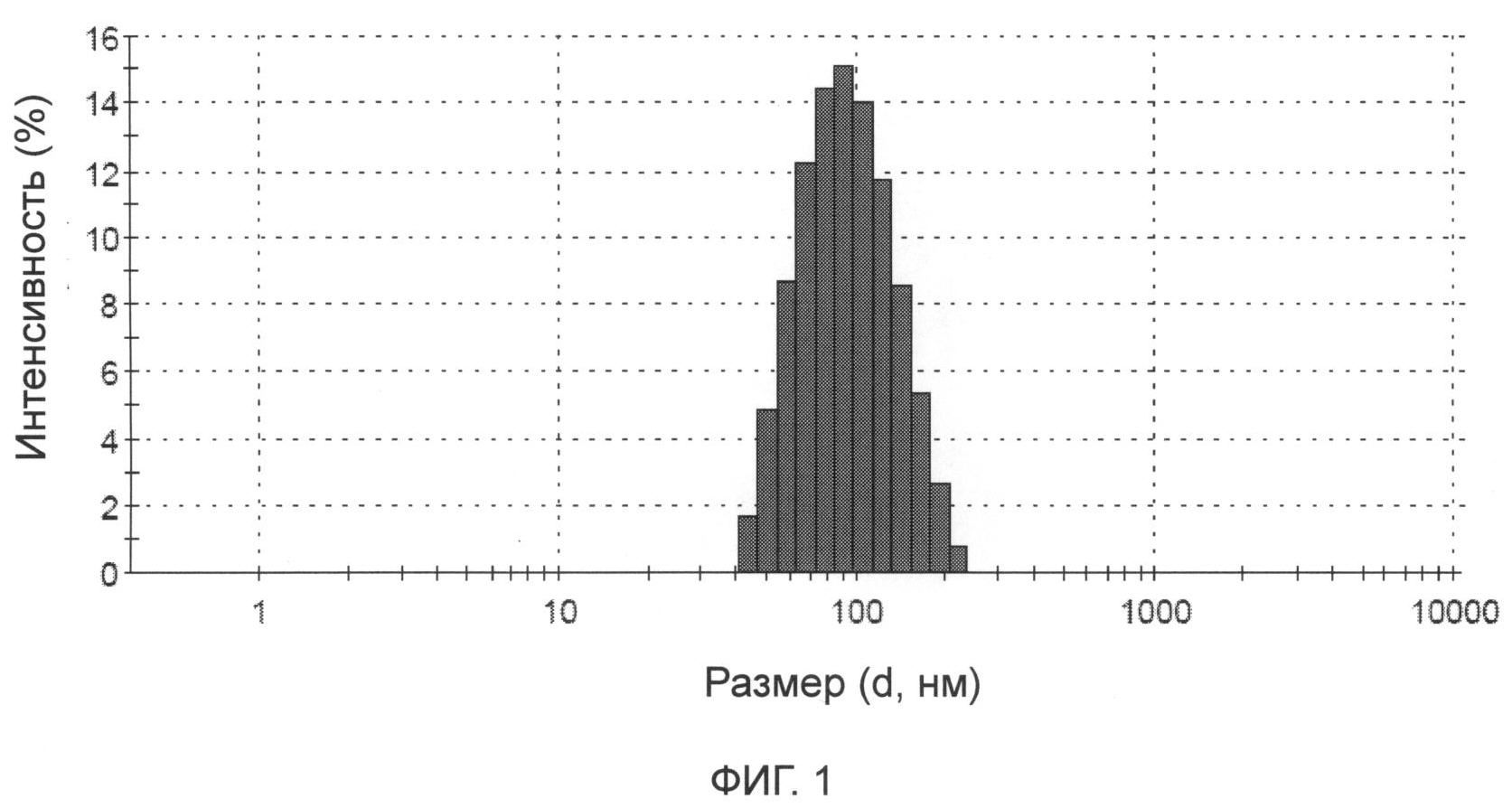
На фиг.1 показано распределение размера частиц липосомной композиции для инъекций иринотекана или иринотекана гидрохлорида в соответствии с настоящим изобретением.
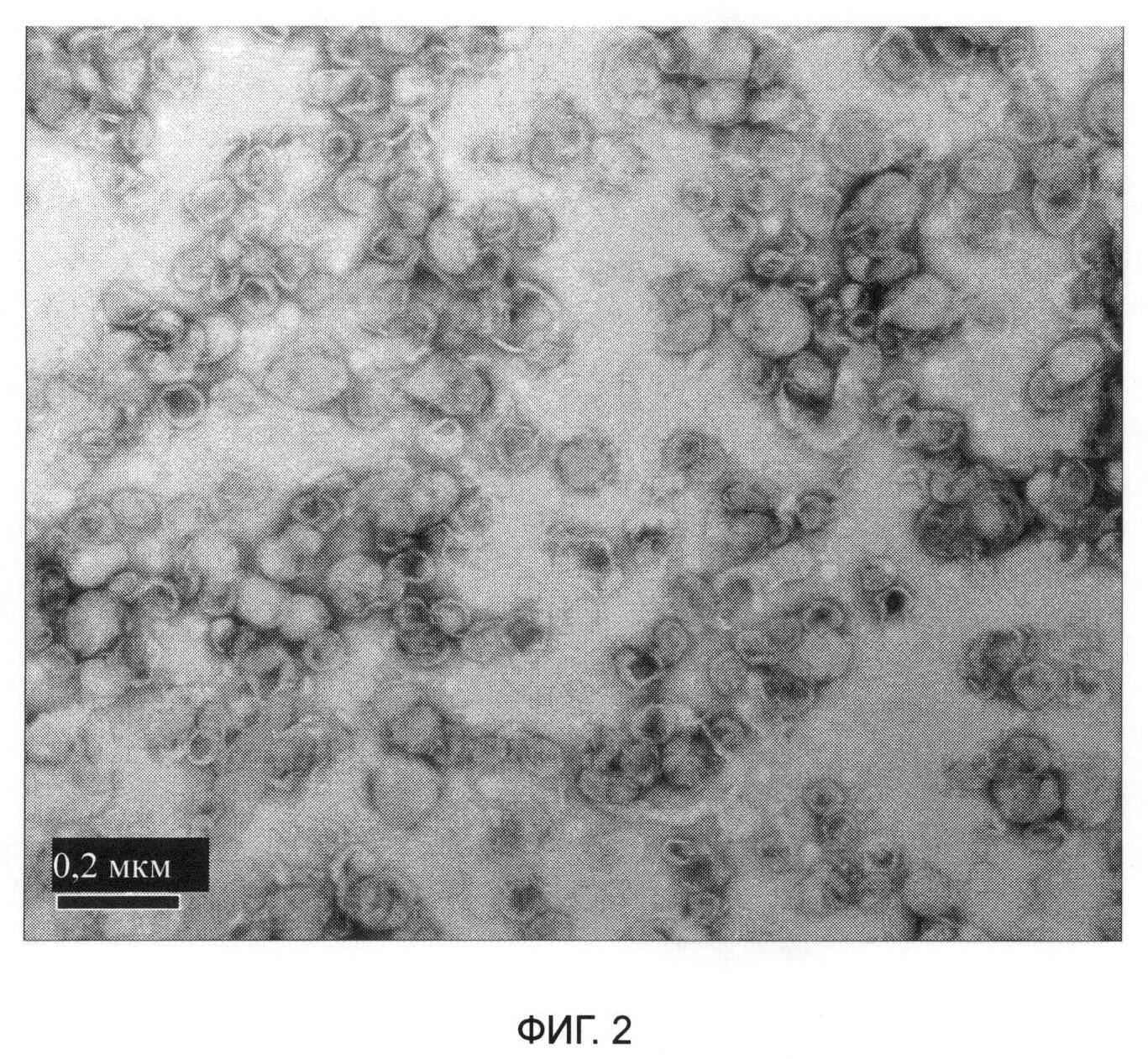
На фиг.2 показана морфология липосомной композиции для инъекций иринотекана или иринотекана гидрохлорида в соответствии с настоящим изобретением.
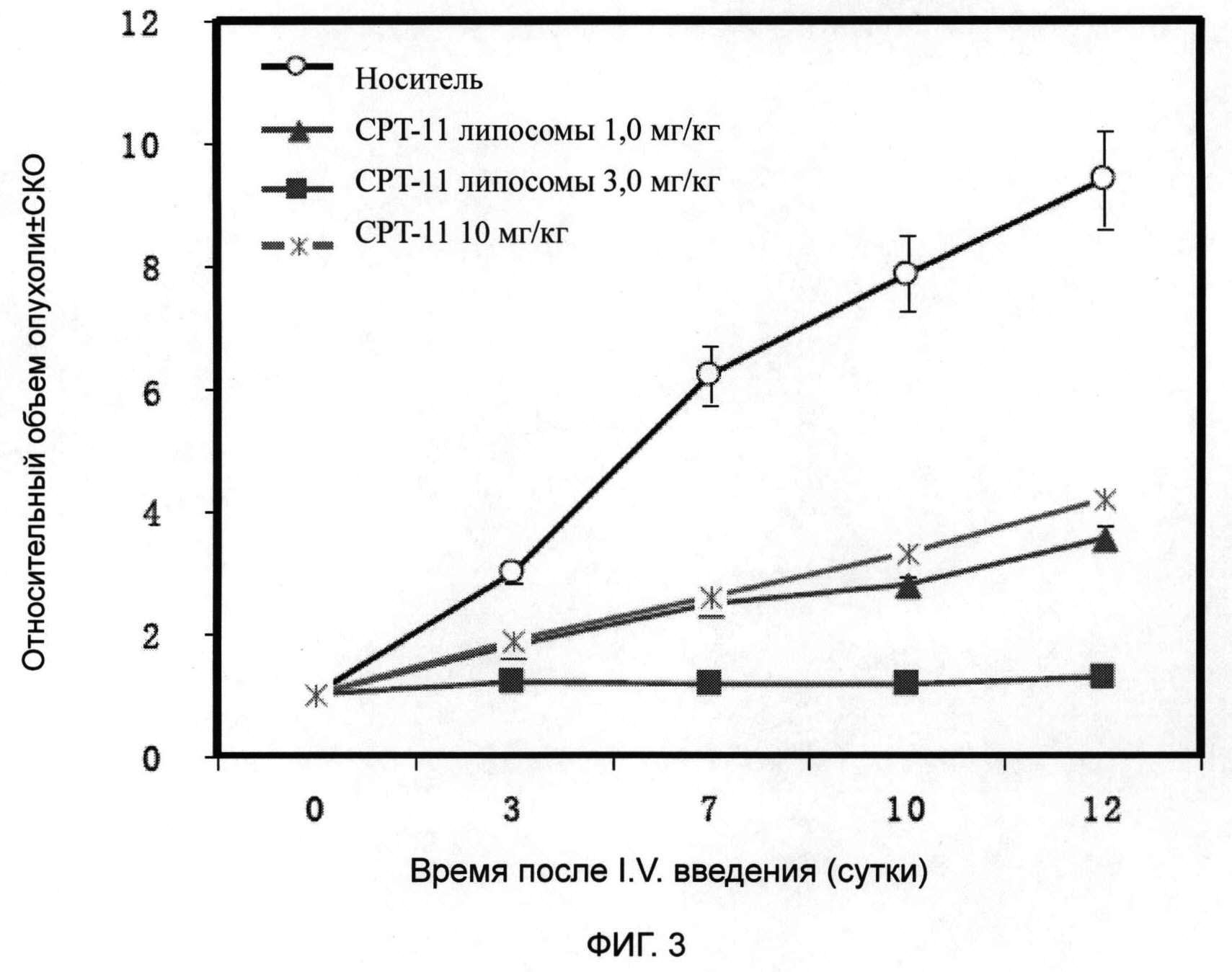
На фиг.3 показаны результаты теста на противораковый эффект in vivo липосомной композиции для инъекций иринотекана или иринотекана гидрохлорида в соответствии с настоящим изобретением.
ПРЕДПОЧТИТЕЛЬНЫЕ ФОРМЫ ОСУЩЕСТВЛЕНИЯ
Приведенные ниже примеры предназначены для дополнительной иллюстрации изобретения, но никоим образом не предназначены для ограничения его объема.
ПРИМЕР 1
Композиция:
|
Способ получения:
Гидрогенизированный соевый фосфатидилхолин (HSPC) и холестерин (CHOL) в количестве, указанном в композиции, растворяли в адекватном количестве безводного этанола, полученный в результате липидный раствор смешивали с раствором сульфата аммония (100 мл), этанол удаляли перегонкой при пониженном давлении, а затем получали сырые ненагруженные липосомы. После 5 циклов гомогенизации в гомогенизаторе высокого давления (1000 бар) размер частиц липосом регулировали путем экструзии липосом на экструзионном оборудовании (две 0,1 мкм экструзионные мембраны на экструзионном оборудовании, пятикратная экструзия), а затем добавляли водный раствор DSPE-PEG2000. При перемешивании смесь инкубировали в течение 20 минут. Ненагруженные липосомы подвергали диализу путем использования устройства для ультрафильтрации с тангенциальным потоком при непрерывном добавлении воды для инъекций в ходе диализа, затем, наконец, получили ненагруженные липосомы.
Водный раствор иринотекана гидрохлорида готовили с водой для инъекций и добавляли к дисперсии ненагруженных липосом при вышеописанном ионном градиенте, при массовом отношении иринотекана гидрохлорида к HSPC 1:3,5. При перемешивании смесь нагревали до 60°С и инкубировали в течение 20 минут, после чего получили липосомы, нагруженные лекарством. Невключенное лекарство удаляли путем использования устройства для ультрафильтрации с тангенциальным потоком. Добавляли 0,45 г хлорида натрия для доведения осмотического давления после концентрирования образца примерно до 50 мл. После доведения концентрации лекарства путем разведения до отмеренного объема липосомы стерилизовали фильтрованием с помощью 0,22 мкм фильтра, заполняли под защитой азота и герметично закрывали в маленькую бутылочку. Была получена липосомная композиция для инъекций иринотекана гидрохлорида.
Изменение размера частиц каждой композиции показано в приведенной ниже таблице. Результаты указывают на то, что размер частиц образца был наименьшим, когда массовое отношение фосфолипида к холестерину составляло 4:1.
|
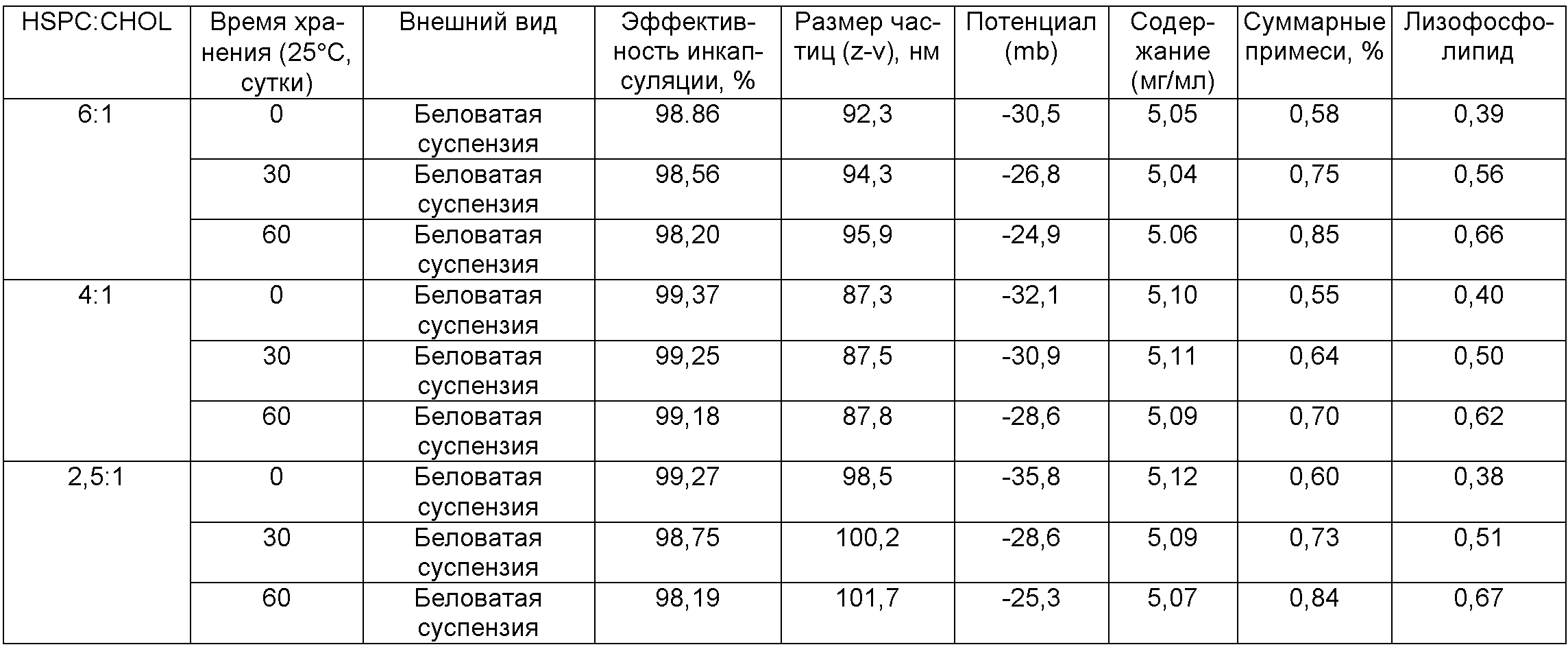
Стабильность полученного образца исследовали при 25°C при различных массовых отношениях фосфолипида к холестерину. Результаты представлены в приведенной ниже таблице. После хранения при 25°C в течение 60 суток размер частиц и эффективность инкапсуляции образца не претерпели значительных изменений, когда массовое отношение фосфолипида к холестерину составляло 4:1. Однако для образцов, имеющих другие массовые отношения фосфолипида к холестерину, размер частиц образца увеличился, а эффективность инкапсуляции снизилась. Следовательно, стабильность образца была лучшей, когда массовое отношение фосфолипида к холестерину составляло 4:1.
Выводы:
Принимая во внимание все показатели, лучшие результаты могут быть получены, когда отношение холестерина к фосфолипиду составляет 1:3-5, наиболее предпочтительно 1:4.
ПРИМЕР 2
|
Способ получения:
Гидрогенизированный соевый фосфатидилхолин и холестерин в количестве, указанном в композиции, растворяли в адекватном количестве безводного этанола, полученный в результате липидный раствор смешивали с раствором сульфата аммония (100 мл), безводный этанол удаляли перегонкой при пониженном давлении, а затем получали сырые ненагруженные липосомы. После 5 циклов гомогенизации в гомогенизаторе высокого давления (1000 бар) размер частиц липосом регулировали путем экструзии липосом на экструзионном оборудовании (две 0,1 мкм экструзионные мембраны на экструзионном оборудовании, пятикратная экструзия), а затем добавляли водный раствор DSPE-PEG2000. При перемешивании смесь инкубировали в течение 20 минут. Ненагруженные липосомы подвергали диализу путем использования устройства для ультрафильтрации с тангенциальным потоком при непрерывном добавлении воды для инъекций в ходе диализа, затем, наконец, получили ненагруженные липосомы.
Водный раствор иринотекана гидрохлорида готовили с водой для инъекций и добавляли к дисперсии ненагруженных липосом при вышеописанном ионном градиенте, при массовом отношении иринотекана гидрохлорида к HSPC 1:3,5. При перемешивании смесь нагревали до 60°C и инкубировали в течение 20 минут, после чего получили липосомы, нагруженные лекарством. Невключенное лекарство удаляли путем использования устройства для ультрафильтрации с тангенциальным потоком. Добавляли 0,45 г хлорида натрия для доведения осмотического давления после концентрирования образца примерно до 50 мл. После доведения концентрации лекарства путем разведения до отмеренного объема липосомы стерилизовали фильтрованием с помощью 0,22 мкм фильтра, заполняли под защитой азота и герметично закрывали в маленькую бутылочку. Была получена липосомная композиция для инъекций иринотекана гидрохлорида.
ПРИМЕР 3
Композиция и способ получения ненагруженных липосом были такими же, как в Примере 2, за исключением того, что массовое отношение иринотекана гидрохлорида к HSPC составляло 1:1,5, 1:2, 1:3,5, 1:4 и 1:5 в способе получения липосом. Эффективность инкапсуляции и размер частиц липосом иринотекана гидрохлорида представлены в приведенной ниже таблице:
|
Было показано, что эффективность инкапсуляции была значительно снижена, когда массовое отношение иринотекана гидрохлорида к HSPC составляло 1:1,5, и содержание включенного лекарства значительно снизилось, когда это соотношение составляло 1:5. Это непригодно для получения препаратов, используемых при клиническом применении, в обоих случаях. Эффективность инкапсуляции и содержание включенного лекарства были выше, когда соотношение составляло 1:2-1:4.
ПРИМЕР 4
Композиция и способ получения ненагруженных липосом и липосом, нагруженных лекарством, были такими же, как в Примере 2, за исключением того, что HSPC был заменен высокоочищенным фосфатидилхолином куриного яйца (ЕРС) и высокоочищенным соевым фосфатидилхолином (SPC) соответственно. Стабильность полученного в результате образца липосом исследовали при 25°C, и результаты представлены в приведенной ниже таблице. Результаты тестирования показали, что стабильность образца липосом, полученного с помощью HSPC, была лучшей, и основные показатели не претерпели заметных изменений при хранении при 25°C в течение 2 месяцев.
|
ПРИМЕР 5
|
Способ получения <1>:
Способ впрыскивания этанола: гидрогенизированный соевый фосфатидилхолин, DSPE-PEG2000 и холестерин в количестве, указанном в композиции, растворяли в адекватном количестве безводного этанола, полученный в результате липидный раствор впрыскивали в физиологический раствор иринотекана гидрохлорида. Этанол удаляли перегонкой при пониженном давлении и затем получили сырые ненагруженные липосомы. Размер частиц липосом регулировали путем экструзии липосом на экструзионном оборудовании (две 0,1 мкм экструзионные мембраны на экструзионном оборудовании, пятикратная экструзия) после 5 циклов гомогенизации в гомогенизаторе высокого давления (1000 бар). Концентрацию лекарства доводили путем разведения до отмеренного объема, липосомы стерилизовали фильтрованием с помощью 0,22 мкм фильтра, заполняли под защитой азота и герметично закрывали в маленькую бутылочку. Была получена липосомная композиция для инъекций иринотекана гидрохлорида.
Способ получения <2>:
Способ пленочной дисперсии: гидрогенизированный соевый фосфатидилхолин, DSPE-PEG2000 и холестерин в количестве, указанном в композиции, растворяли в адекватном количестве хлороформа, и из полученного в результате липидного раствора получали пленку с помощью роторного испарителя, затем хлороформ удаляли. Добавляли физиологический раствор иринотекана гидрохлорида и смесь инкубировали в течение 1 ч. Размер частиц липосом путем экструзии липосом на экструзионном оборудовании (две 0,1 мкм экструзионные мембраны на экструзионном оборудовании, пятикратная экструзия) после 5 циклов гомогенизации в гомогенизаторе высокого давления (1000 бар). Концентрацию лекарства доводили путем разведения до отмеренного объема, липосомы стерилизовали фильтрованием с помощью 0,22 мкм фильтра, заполняли под защитой азота и герметично закрывали в маленькую бутылочку. Была получена липосомная композиция для инъекций иринотекана гидрохлорида.
Определяли эффективность инкапсуляции и размер частиц липосом иринотекана гидрохлорида, полученных Способом получения <1>, <2> и Примера 2.
|
Было показано, что целевая композиция может быть получена способами пассивного включения лекарства, такими как способ впрыска этанола и способ пленочной дисперсии, при получении липосом иринотекана гидрохлорида. Но липосомы, полученные этими способами, обладают низкой эффективностью инкапсуляции, и только небольшое количество лекарства можно включить в липосомы. Напротив, образец, полученный способом активного включения лекарства (Пример 2), обладает высокой эффективностью инкапсуляции и высоким содержанием включенного лекарства. Кроме того, образец, полученный способом активного включения лекарства, имеет малый и однородный размер частиц. Таким образом, в настоящем изобретении для получения липосом использовали способ активного включения лекарства. Он дал исключительно хорошие результаты для получения липосом иринотекана гидрохлорида способом ионного градиента.
ПРИМЕР 6
|
Способ получения:
Ненагруженные липосомы: впрыскивали липидный этанольный раствор и этот раствор гомогенизировали при 1000 бар 6 раз; экструдировали 3 раза в 200 нм, 5 раз в 100 нм; добавляли PEG2000-DSPE и смесь инкубировали в течение 30 мин при 60°С. Затем смесь подвергали диализу 3 раза с помощью устройства с тангенциальным потоком, 50 мл каждый раз, где витамин E(VE) добавляли к органическому раствору фосфолипида, а ЭДТА добавляли к раствору сульфата аммония.
Липосомы, нагруженные лекарством: готовили водный раствор примерно 10 мг/мл иринотекана гидрохлорида и добавляли к ненагруженным липосомам, затем смесь инкубировали при 60°С в течение 15 мин. Образец концентрировали примерно до 50 мл путем использования устройства с тангенциальным потоком и получили 5 мг/мл образца.
Результаты стабильности представлены в приведенной ниже таблице. Все показатели образца не претерпели значительных изменений, когда добавляли одну ЭДТА. Она значительно улучшила стабильность липосом. Но другие стабилизаторы значительно не улучшили стабильность липосом.
|
ПРИМЕР 7
Препарат (1):
|
Способ получения:
Гидрогенизированный соевый фосфатидилхолин и холестерин в количестве, указанном в препарате, растворяли в адекватном количестве безводного этанола, и полученный в результате липидный раствор смешивали с раствором сульфата марганца (100 мл). После удаления безводного этанола перегонкой при пониженном давлении получали сырые ненагруженные липосомы. Размер частиц липосом регулировали путем экструзии липосом на экструзионном оборудовании (две 0,1 мкм экструзионные мембраны на экструзионном оборудовании, пятикратная экструзия). Ненагруженные липосомы подвергали диализу путем использования устройства для ультрафильтрации с тангенциальным потоком при непрерывном добавлении воды для инъекций в ходе диализа, затем получили ненагруженные липосомы. Водный раствор иринотекана гидрохлорида готовили с водой для инъекций и добавляли к дисперсии ненагруженных липосом при ионном градиенте. При перемешивании смесь нагревали до 50°C и инкубировали в течение 20 минут, после чего получили липосомы, нагруженные лекарством. Невключенное лекарство удаляли путем использования устройства для ультрафильтрации с тангенциальным потоком, а затем добавляли 2,5 г маннита для регуляции осмотического давления. После доведения концентрации лекарства путем разведения до отмеренного объема липосомы стерилизовали фильтрованием с помощью 0,22 мкм фильтра, заполняли под защитой азота и герметично закрывали в маленькую бутылочку. Наконец, был получен липосомный инъекционный препарат иринотекана гидрохлорида. Размер частиц липосом измеряли с помощью анализатора наночастиц (89,3 нм), и эффективность инкапсуляции составляла 97,5%.
Препарат (2):
|
Способ получения:
Гидрогенизированный лецитин куриного яйца и холестерин в количестве, указанном в препарате, растворяли в адекватном количестве безводного этанола, и полученный в результате липидный раствор смешивали с раствором сульфата магния (100 мл). Размер частиц липосом регулировали путем экструзии липосом на экструзионном оборудовании (две 0,1 мкм экструзионные мембраны на экструзионном оборудовании, пятикратная экструзия). Ненагруженные липосомы подвергали диализу путем использования устройства для ультрафильтрации с тангенциальным потоком при непрерывном добавлении воды для инъекций в ходе диализа, затем получили ненагруженные липосомы. Водный раствор иринотекана гидрохлорида готовили с водой для инъекций и добавляли к дисперсии ненагруженных липосом при ионном градиенте. При перемешивании смесь нагревали до 50°С и инкубировали в течение 20 минут, после чего получили липосомы, нагруженные лекарством. Невключенное лекарство удаляли путем использования устройства для ультрафильтрации с тангенциальным потоком и образец концентрировали примерно до 50 мл. Затем добавляли 2,5 г гистидина для доведения осмотического давления. После доведения концентрации лекарства путем разведения до отмеренного объема липосомы стерилизовали фильтрованием с помощью 0,22 мкм фильтра, заполняли под защитой азота и герметично закрывали в маленькую бутылочку. Наконец, был получен липосомный инъекционный препарат иринотекана гидрохлорида. Размер частиц липосом измеряли с помощью анализатора наночастиц (87,6 нм), и эффективность инкапсуляции составляла 98,1%.
Препарат (3):
|
Способ получения:
Гидрогенизированный соевый фосфатидилхолин и холестерин в количестве, указанном в препарате, растворяли в адекватном количестве безводного этанола и полученный в результате липидный раствор смешивали с раствором сульфата аммония (100 мл). После удаления безводного этанола перегонкой при пониженном давлении получили сырые ненагруженные липосомы. После 5 циклов гомогенизации в гомогенизаторе высокого давления (1000 бар) добавляли водный раствор DSPE-PEG2000. При перемешивании смесь инкубировали в течение 20 минут. Ненагруженные липосомы подвергали диализу путем использования устройства для ультрафильтрации с тангенциальным потоком при непрерывном добавлении воды для инъекций в ходе диализа, затем получили ненагруженные липосомы. Водный раствор иринотекана гидрохлорида готовили с водой для инъекций и добавляли к дисперсии ненагруженных липосом при ионном градиенте. При перемешивании смесь нагревали до 60°C и инкубировали в течение 20 минут, после чего получили липосомы, нагруженные лекарством. Невключенное лекарство удаляли путем использования устройства для ультрафильтрации с тангенциальным потоком и образец концентрировали примерно до 50 мл. Затем добавляли 0,45 г хлорида натрия для доведения осмотического давления. После доведения концентрации лекарства путем разведения до отмеренного объема липосомы стерилизовали фильтрованием с помощью 0,22 мкм фильтра, заполняли под защитой азота и герметично закрывали в маленькую бутылочку. Наконец, был получен липосомный инъекционный препарат иринотекана гидрохлорида. Размер частиц липосом измеряли с помощью анализатора наночастиц (87,3 нм), и эффективность инкапсуляции составляла 99,2%.
ПРИМЕР 8
|
Способ получения:
Гидрогенизированный соевый фосфатидилхолин, миокардиальные фосфолипиды, DSPE-PEG5000, холестерин и α-токоферол в количестве, указанном в препарате, растворяли в адекватном количестве безводного этанола и полученный в результате липидный раствор смешивали с раствором лимонной кислоты (100 мл). После удаления безводного этанола перегонкой при пониженном давлении получили сырые ненагруженные липосомы. После 5 циклов гомогенизации в гомогенизаторе высокого давления (1000 бар) ненагруженные липосомы подвергали диализу путем использования устройства для ультрафильтрации с тангенциальным потоком при непрерывном добавлении в ходе диализа раствора хлорида натрия (0,9%, 400 мл), затем получили ненагруженные липосомы. Водный раствор иринотекана гидрохлорида готовили с водой для инъекций и добавляли к дисперсии ненагруженных липосом при ионном градиенте. При перемешивании смесь нагревали до 60°C и инкубировали в течение 20 минут, после чего получили липосомы, нагруженные лекарством. Невключенное лекарство удаляли путем использования устройства для ультрафильтрации с тангенциальным потоком и образец концентрировали примерно до 50 мл. После доведения концентрации лекарства путем разведения до отмеренного объема липосомы стерилизовали фильтрованием с помощью 0,22 мкм фильтра, заполняли под защитой азота и герметично закрывали в маленькую бутылочку. Наконец, был получен липосомный инъекционный препарат иринотекана гидрохлорида. Размер частиц липосом измеряли с помощью анализатора наночастиц (85,8 нм), и эффективность инкапсуляции составляла 98,6%.
ПРИМЕР 9
|
Способ получения:
DPPC, DPPG и холестерин в количестве, указанном в препарате, растворяли в адекватном количестве безводного этанола и полученный в результате липидный раствор смешивали с раствором сульфата аммония (100 мл, содержащим этилендиаминтетрауксусной кислоты двунатриевую соль). После удаления безводного этанола перегонкой при пониженном давлении получили сырые ненагруженные липосомы. После 5 циклов гомогенизации в гомогенизаторе высокого давления (1000 бар) ненагруженные липосомы подвергали диализу путем использования устройства для ультрафильтрации с тангенциальным потоком при непрерывном добавлении в ходе диализа раствора хлорида натрия (0,9%, 400 мл), затем получили ненагруженные липосомы. Водный раствор иринотекана гидрохлорида готовили с водой для инъекций и добавляли к дисперсии ненагруженных липосом при ионном градиенте. При перемешивании смесь нагревали до 60°C и инкубировали в течение 20 минут, после чего получили липосомы, нагруженные лекарством. Невключенное лекарство удаляли путем использования устройства для ультрафильтрации с тангенциальным потоком и образец концентрировали примерно до 50 мл. После доведения концентрации лекарства путем разведения до отмеренного объема липосомы стерилизовали фильтрованием с помощью 0,22 мкм фильтра, заполняли под защитой азота и герметично закрывали в маленькую бутылочку. Наконец, был получен липосомный инъекционный препарат иринотекана гидрохлорида. Размер частиц липосом измеряли с помощью анализатора наночастиц (89,4 нм), и эффективность инкапсуляции составляла 97,2%.
ПРИМЕР 10
|
Способ получения:
Гидрогенизированный соевый фосфатидилхолин, холестерин и а-токоферол в количестве, указанном в препарате, растворяли в адекватном количестве безводного этанола, и полученный в результате липидный раствор смешивали с раствором сульфата аммония (100 мл). После удаления безводного этанола перегонкой при пониженном давлении получили сырые ненагруженные липосомы. После 5 циклов гомогенизации в гомогенизаторе высокого давления (1000 бар) липосомы экструдировали на экструзионном оборудовании (пять 100 нм экструзионных мембран на экструзионном оборудовании, пятикратная экструзия). Затем добавляли водный раствор DSPE-PEG5000 и смесь инкубировали при перемешивании в течение 20 минут. Ненагруженные липосомы подвергали диализу путем использования устройства для ультрафильтрации с тангенциальным потоком при непрерывном добавлении в ходе диализа раствора хлорида натрия (0,9%, 400 мл), затем получили ненагруженные липосомы. Водный раствор иринотекана гидрохлорида готовили с водой для инъекций и добавляли к дисперсии ненагруженных липосом при ионном градиенте. При перемешивании смесь нагревали до 60°C и инкубировали в течение 20 минут, после чего получили липосомы, нагруженные лекарством. Невключенное лекарство удаляли путем использования устройства для ультрафильтрации с тангенциальным потоком и образец концентрировали примерно до 50 мл. Затем к смеси добавляли сахарозу и маннит и гомогенно смешивали. После доведения концентрации лекарства путем разведения до постоянного объема липосомы стерилизовали фильтрованием с помощью 0,22 мм фильтра, а затем заполняли в пенициллиновый флакон и лиофилизировали. Наконец, был получен липосомный препарат иринотекана гидрохлорида в виде лиофилизированного порошка для инъекций. Размер частиц липосом измеряли (90,8 нм) после гидратации лиофилизированного порошка для инъекций, и эффективность инкапсуляции составляла 97,5%.
Эксперимент 1
Для исследования физико-химических характеристик препарата, полученного в соответствии с изобретением, в качестве примера взяли препарат примера 2.
[Распределение размера частиц]: Соответствующее количество образца разводили водой, затем измеряли способом динамического светорассеяния (ДСР). Длина волны обнаружения: λ=633 нм; угол обнаружения: 173°; температура обнаружения: 25°C. Размер частиц представлен по интенсивности. Распределение размера частиц представлено на фиг.1. Средний размер частиц составлял 85,9 нм.
[Морфология]: Отбирали соответствующее количество разведенного образца, медную сетку помещали на чистую фильтровальную бумагу, образец капали на медную сетку, окрашивали фосфорновольфрамовой кислотой и наблюдали с помощью трансмиссионного электронного микроскопа (ТЭМ, JEM2010, Japan Electronics Co., Ltd.) после высыхания. Морфология представлена на фиг.2. Внешний вид лизосом иринотекана гидрохлорида представлял собой типичную двухслойную структуру, и размер большинства частиц был ниже 200 нм. Это соответствует результату, измеренному с помощью динамического светорассеяния.
[Эффективность инкапсуляции]: Способ определения содержания лекарства: Колонка: Agilent ZORBAX Eclipse XDB-C18 (4,6×150 мм, 5 мкм), подвижная фаза: ацетонитрил - 0,05 М KH2PO4 буферный раствор (значение рН доводили до 4), содержащий 1% триэтиламин = 20:80; температура колонки: 40°C; объем впрыска: 20 мкл; скорость тока: 1,0 мл/мин.
Способ определения эффективности инкапсуляции:
Образец 1 мл раствора отбирали пипеткой в 10-мл мерную колбу и разводили водой до метки. Затем ее равномерно встряхивали и подвергали ультрафильтрации с помощью ультрафильтра 8010 (фирмы MILLIPORE). Исходный фильтрат отбрасывали, а последующий фильтрат сохраняли в качестве раствора образца. 20 мкл раствора образца и контроль наносили пипеткой на жидкостную хроматографию и записывали хроматограмму. Содержание свободного лекарства препарата вычисляли способом внешней стандартизации, обозначали как W. Суммарное количество лекарства в данном препарате вычисляли способом определения содержания, обозначали как W0. Эффективность инкапсуляции вычисляли с помощью приведенного ниже уравнения:
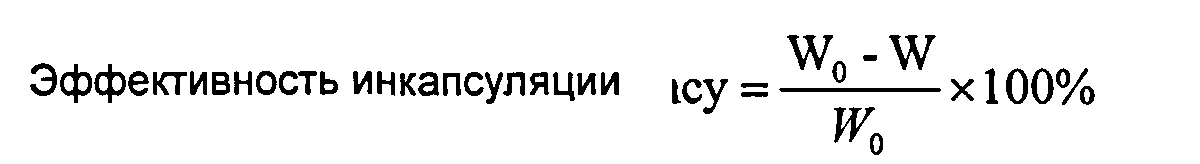
Результаты определения: Эффективность инкапсуляции препарата составляла 99,4%.
[Тест на влияющие факторы]: Влияющие факторы исследовали путем помещения препарата в различные условия. Результаты представлены в приведенной ниже таблице.
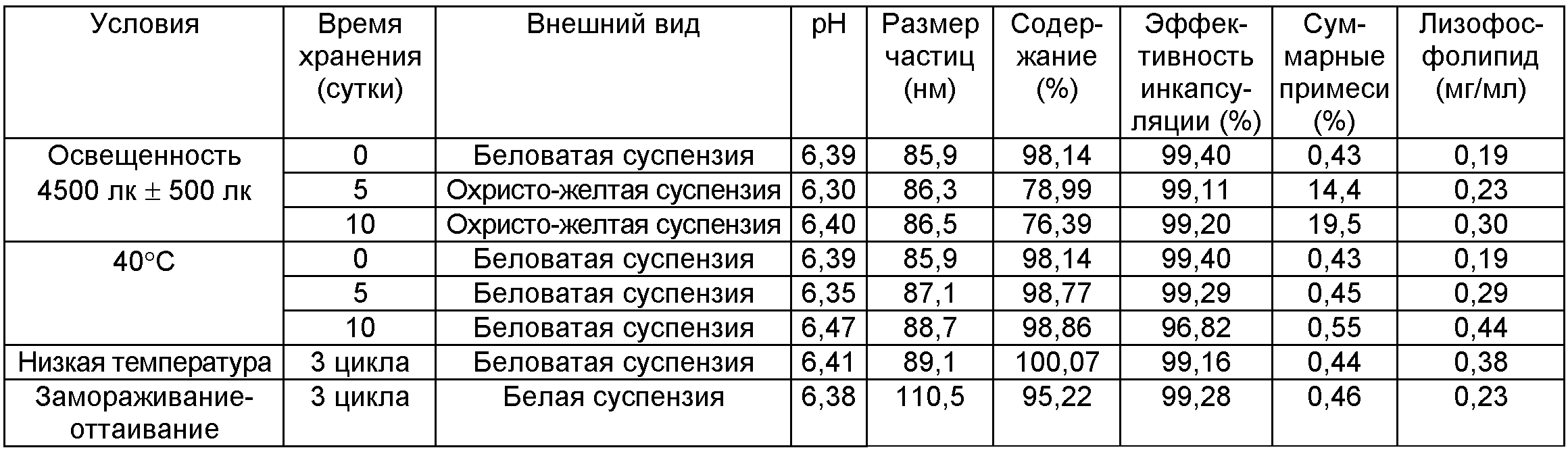
Результат показал, что образец является светочувствительным. При ярком свете внешний вид образца становился желтого цвета, содержание уменьшалось, а примеси значительно увеличивались. Эффективность инкапсуляции и размер частиц образца не подвергались заметному изменению при 40°C, при этом примеси несколько повышались. Частицы большого размера образовывались в образце в условиях низкой температуры или замораживания-оттаивания. С учетом нестабильности фосфолипида при высокой температуре и результатов теста на влияющие факторы препарат следует хранить при низкой температуре и в условиях темноты.
[Тест на противоопухолевую терапевтическую эффективность in vivo]
Название лекарства: Липосомы иринотекана гидрохлорида (СРТ-11 липосомы) (получено в соответствии с Примером 2) были предоставлены фирмой Shanghai Hengrui Pharmaceutical Co., LTD. Инъекционный препарат иринотекана гидрохлорида (СРТ-11) был предоставлен фирмой Jiangsu Hengrui Medicine Co., LTD.
Способы получения: Лекарство разводили физиологическим раствором до необходимой концентрации.
Подопытные животные: бестимусные мыши BALB/cA, 6-7 недель, самки, приобретенные у Shanghai Slac Laboratory Animal Co., LTD. № сертификата: SCXK (Шанхай) 2007-0005. Окружающая среда: уровень SPF.
Протокол эксперимента:
Бестимусных мышей подкожно инокулировали клетками рака ободочной кишки человека Ls-174t. После того как опухоли вырастали до 150-300 мм3, мышей случайным образом делили на группы (d0). Дозировка и режимы дозирования представлены в приведенной ниже таблице. Объем опухолей и массу мышей измеряли и записывали 2-3 раза в неделю. Объем опухоли (V) вычисляли с помощью приведенного ниже уравнения:
V=1/2×a×b2 где a, b представляют собой длину и ширину соответственно.
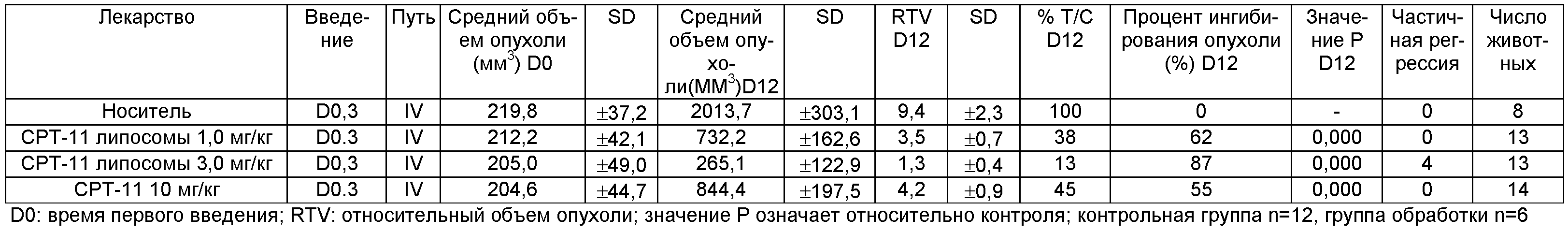
Результаты:
Как СРТ-11 липосомы, так и СРТ-11 значимо ингибировали рост рака ободочной кишки человека Ls-174ty бестимусных мышей. СРТ-11 липосомы были дозозависимыми при ингибировании роста Ls-174t. 4/14 опухолей регрессировало частично при введении СРТ-11 липосом в высокой дозе (3 мг/кг). Терапевтическая эффективность СРТ-11 липосом была эквивалента СРТ-11 (10 мг/кг) при введении СРТ-11 липосом в низкой дозе (1 мг/кг). Было показано, что терапевтическая эффективность СРТ-11 липосом подтверждена как по меньшей мере в 10 раз выше, чем инъекционный препарат СРТ-11. Подробные результаты представлены на фиг.3.