Результат интеллектуальной деятельности: ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ ДЛЯ СИНТЕЗА КАСПОФУНГИНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ
Вид РИД
Изобретение
Область техники
Настоящее изобретение относится к промежуточному соединению для синтеза каспофунгина и к способу его получения.
Предшествующий уровень техники
Каспофунгин представляет собой новый противогрибковый препарат из группы эхинокандинов, который был разработан в начале 21 века и впервые поступил на рынок в Соединенных Штатах в феврале 2001 года. Этот препарат отличается оригинальным механизмом действия, который заключается в ингибировании фермента β-D-глюкансинтазы, что приводит к нарушению целостности клеточной стенки грибов и их гибели. Каспофунгин обладает рядом преимуществ, а именно широким спектром противогрибкового действия, отсутствием перекрестной резистентности и низкой токсичностью, что позволяет использовать его для лечения системных грибковых инфекций, в том числе различных инвазивных кандидозов и аспергиллезов. Этот препарат является более эффективным, чем амфотерицин В, особенно в отношении распространенных кандидозов, устойчивых к терапии.
Каспофунгин был получен полусинтетическим методом из промежуточного соединения пневмокандина В0 (РВ0), полученного способом биологической ферментации. Различные методы синтеза каспофунгина достаточно подробно описаны в таких патентах, как US 5552521, US 5936062, US 20100168415, WO 2002083713, WO 2007057141, CN 101648994, CN 101792486 и т.д. Во всех этих методах используется ключевое промежуточное соединение формулы I′, содержащее тиол-замещенные ароматические соединения (HS-Ar), например, содержащее тиофенол в качестве уходящей группы
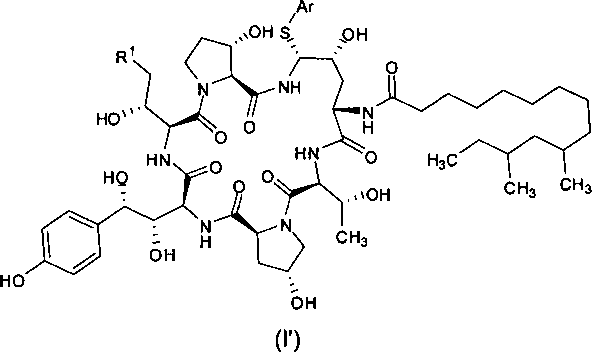
Поскольку реакция замещения тиол-содержащих ароматических соединений является региоселективной, то в ходе получения каспофунгина необходимо использовать несколько ступеней хроматографической очистки, чтобы обеспечить получение чистых промежуточных соединений и чистого конечного продукта, что приводит к снижению выхода, высокой стоимости, сложному производственному процессу и т.п. Таким образом, по-прежнему существует необходимость в разработке новых способов получения каспофунгина.
Подробное описание изобретения
Настоящее изобретение относится к промежуточному соединению для синтеза каспофунгина и к способу его получения. Способ синтеза каспофунгина можно упростить, увеличив эффективность синтеза вышеуказанного промежуточного соединения.
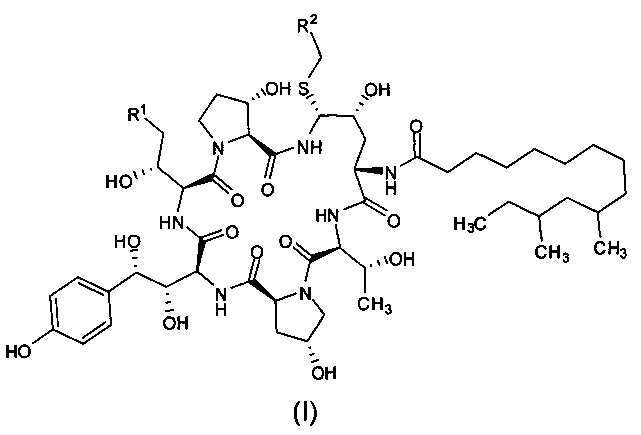
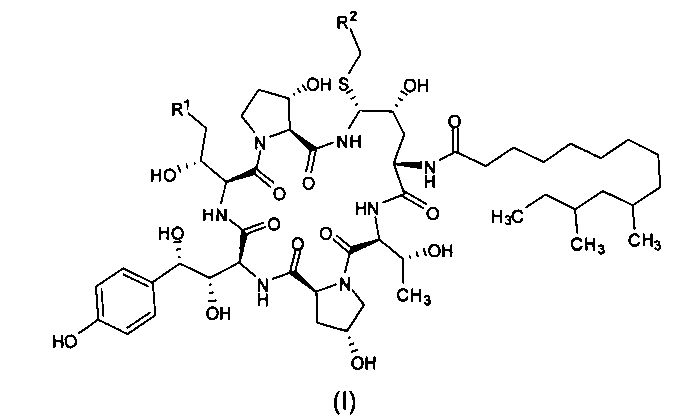
Целью настоящего изобретения является создание промежуточного соединения формулы (I) для синтеза каспофунгина
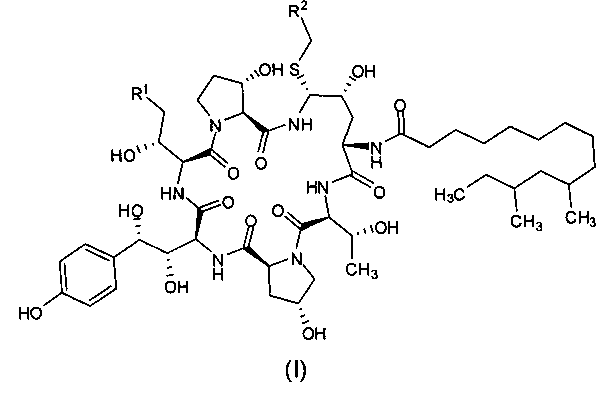
где R1 представляет собой C(=O)NH2, CN, или CH2NR3R4; R2 представляет собой CN, CO2R5, C(=O)NR6R7 или замещенный или незамещенный С6-10 арил или гетероарил; R3 и R4 независимо друг от друга являются атомами водорода или защитными группами для амино-группы, такими как BOC (tert-butoxycarbonyl - терт-бутоксикарбонил) или Cbz (carboxybenzyl - карбоксибензил); R5 представляет собой атом водорода, линейную или разветвленную C1-10 алкильную группу, линейную или разветвленную С3-10 алкенильную группу или С3-10 алкинильную группу, С3-8 циклоалкильную группу, или замещенную или незамещенную С6-10 арильную или гетероарильную группу; R6 и R7 независимо друг от друга являются атомами водорода, амино, метокси, линейными или разветвленными С1-10 алкильными группами, линейными или разветвленными С3-10 алкенильными группами или С3-10 алкинильными группами, С3-8 циклоалкильными группами, или замещенными или незамещенными С6-10 арилами или гетероарилами; или R6 и R7 вместе с атомом азота формируют гетероцикл, кольцо которого включает от пяти до восьми атомов, предпочтительно пяти- или шестиатомное кольцо; R6 и R7 не могут быть амино- или метоксигруппами одновременно.
Предпочтительно, R1 представляет собой C(=O)NH2, CN или CH2NH2; R2 представляет собой CN, CO2H, CO2Me, CO2Et, CO2Bu, CO2 tBu, CO2Ph, C(=O)NH2, C(=O)NMe2, C(=O)NHEt, C(=O)NHBu, C(=O)NHCH2CH2NH2, C(=O)NHcPr, C(=O)NHiPr, C(=O)NHcPent, C(=O)NHBu, C(=O)NHPh или фенил, более предпочтительно R2 представляет собой СО2Н, CO2Me, или C(=O)NHCH2CH2NH2.
В предпочтительном варианте реализации настоящего изобретения в формуле (I) R1 представляет собой CH2NH2; R2 представляет собой CO2Me.
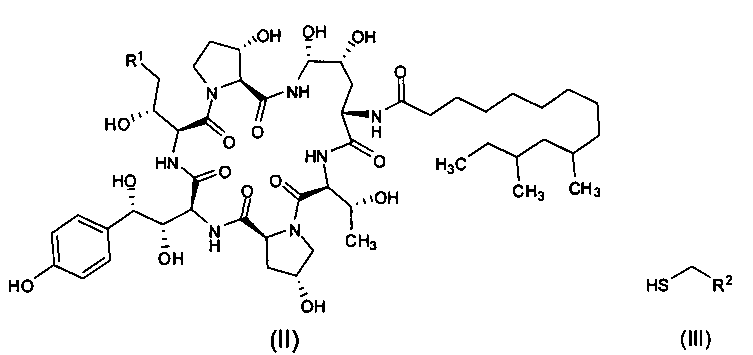
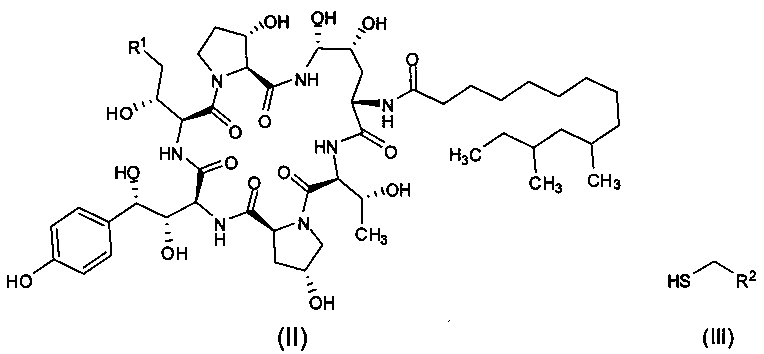
Другая цель настоящего изобретения заключается в том, чтобы предложить способ получения промежуточного соединения формулы I, который включает реакцию между промежуточным соединением формулы (II) и тиольным соединением формулы (III) в присутствии органической борной кислоты и органической сульфокислоты с получением промежуточного соединения I формулы (I);
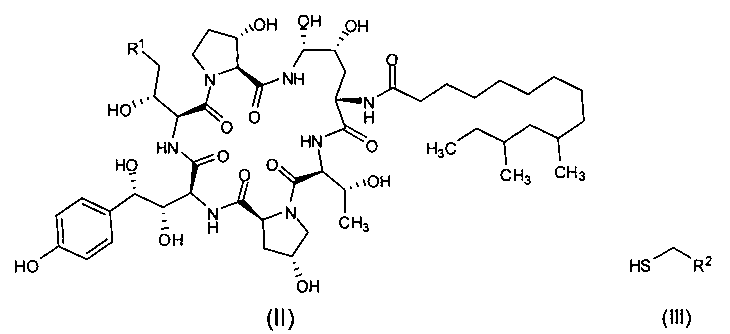
где R1 представляет собой С(=O)NH2, CN или CH2NR3R4, R2 представляет собой CN, CO2R5, С(=O)NR6R7 или замещенный или незамещенный С6-10 арил или гетероарил; R3 и R4 независимо друг от друга являются атомами водорода или защитными группами для амино-группы, такими как BOC или Cbz; R5 представляет собой атом водорода, линейную или разветвленную С1-10 алкильную группу, линейную или разветвленную С3-10 алкенильную группу, или С3-10 алкинильную группу, С3-8 циклоалкильную группу, или замещенную или незамещенную С6-10 арильную или гетероарильную группу; R6 и R7 независимо друг от друга являются атомами водорода, амино, метокси, линейными или разветвленными С1-10 алкильными группами, линейными или разветвленными С3-10 алкенильными группами или С3-10 алкинильными группами, С3-8 циклоалкильными группами, или замещенными или незамещенными С6-10 арилами или гетероарилами; или R6 и R7 вместе с атомом азота формируют гетероцикл, кольцо которого включает от пяти до восьми атомов, предпочтительно пяти или шести атомное кольцо; R6 и R7 не могут быть амино- или метоксигруппами одновременно.
Согласно настоящему изобретению также предложен способ получения каспофунгина, включающий следующие стадии:
1) Реакция промежуточного соединения формулы (II) с тиольным соединением формулы (III) в присутствии органической борной кислоты и органической сульфокислоты с получением промежуточного соединения I формулы (I);
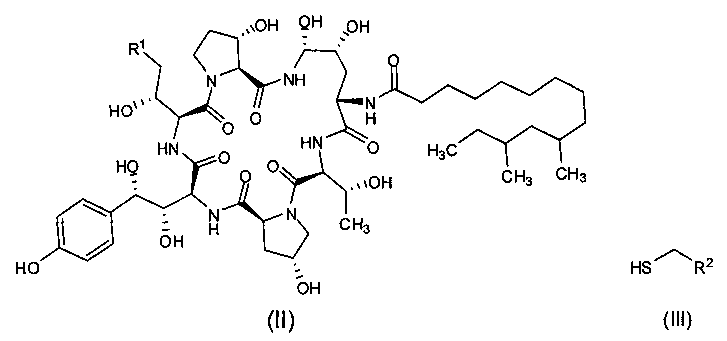
где R1 представляет собой С(=O)NH2CN или CH2NR3R4, R2 представляет собой CN, CO2R5, С(=O)NR6R7 или замещенный или незамещенный С6-10 арил или гетероарил; R3 и R4 независимо друг от друга являются атомами водорода или защитными группами для амино-группы, такими как BOC или Cbz; R5 представляет собой атом водорода, линейную или разветвленную С1-10 алкильную группу, линейную или разветвленную С3-10 алкенильную группу, или С3-10 алкинильную группу, С3-8 циклоалкильную группу, или замещенную или незамещенную С6-10 арильную или гетероарильную группу; R6 и R7 независимо друг от друга являются атомами водорода, амино, метокси, линейными или разветвленными С1-10 алкильными группами, линейными или разветвленными С3-10 алкенильными группами или С3-10 алкинильными группами, С3-8 циклоалкильными группами, или замещенными или незамещенными С6-10 арилами или гетероарилами; или R6 и R7 вместе с атомом азота формируют гетероцикл, кольцо которого включает от пяти до восьми атомов, предпочтительно, пять и шесть атомов; R6 и R7 не могут быть амино- или метоксигруппами одновременно;
2) Реакция промежуточного соединения формулы (I) с этилендиамином с получением на последнем этапе каспофунгина, в котором R1 нужно восстановить до CH2NH2 или подвергнуть аминогруппу в составе R1 деблокированию до или после реакции с этилендиамином, если R1 не является CH2NH2
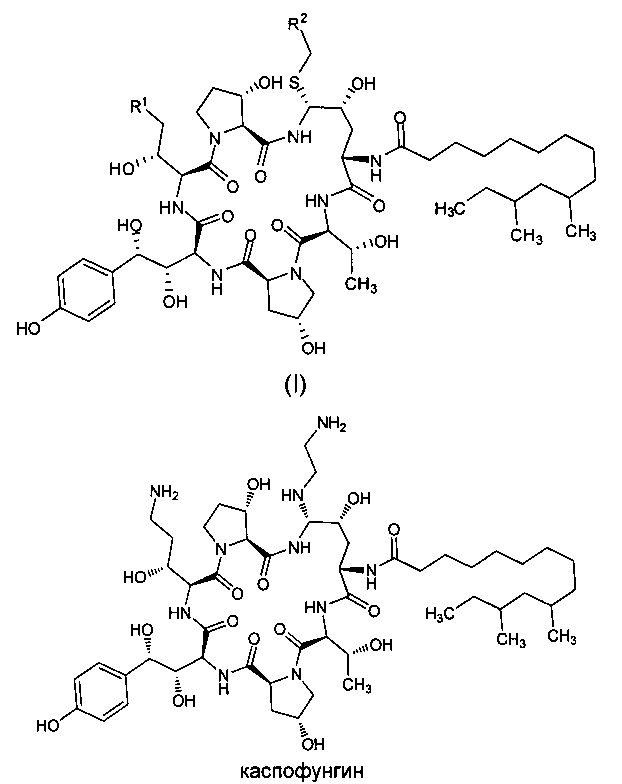
где R1 представляет собой С(=O)NH2, CN или CH2NR3R4; R2 представляет собой CN, CO2R5, С(=O)NR6R7 или замещенный или незамещенный С6-10 арил или гетероарил; R3 и R4 независимо друг от друга являются атомами водорода или защитными группами для амино-группы, такими как BOC или Cbz; R5 представляет собой атом водорода, линейную или разветвленную С1-10 алкильную группу, линейную или разветвленную С3-10 алкенильную группу, или С3-10 алкинильную группу, С3-8 циклоалкильную группу, или замещенную или незамещенную С6-10 арильную или гетероарильную группу; R6 и R7 независимо друг от друга являются атомами водорода, амино, метокси, линейными или разветвленными С1-10 алкильными группами, линейными или разветвленными С3-10 алкенильными группами или С3-10 алкинильными группами, С3-8 циклоалкильными группами, или замещенными или незамещенными С6-10 арилами или гетероарилами; или R6 и R7 вместе с атомом азота формируют гетероцикл, кольцо которого включает от пяти до восьми атомов, предпочтительно пяти- или шестиатомное кольцо; R6 и R7 не могут быть амино- или метоксигруппами одновременно.
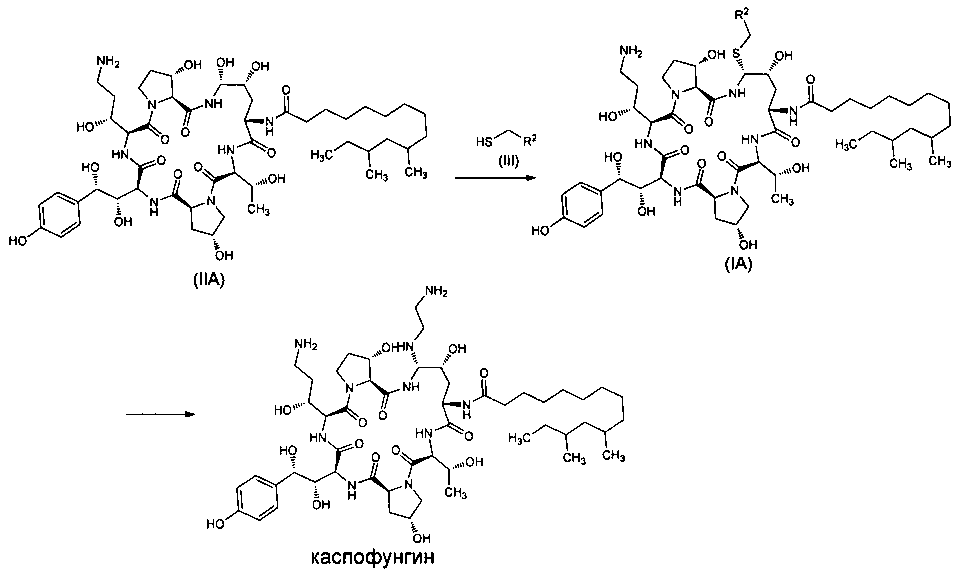
В предпочтительном варианте реализации настоящего изобретения вышеуказанный способ включает следующие стадии:
1) Реакция промежуточного соединения IIA формулы (IIA) с тиольным соединением III формулы (III) в присутствии органической бороновой кислоты и органической сульфокислоты с получением промежуточного соединения IA формулы (IA),
2) Реакция промежуточного соединения IA формулы (IA) с этилендиамином с получением каспофунгина
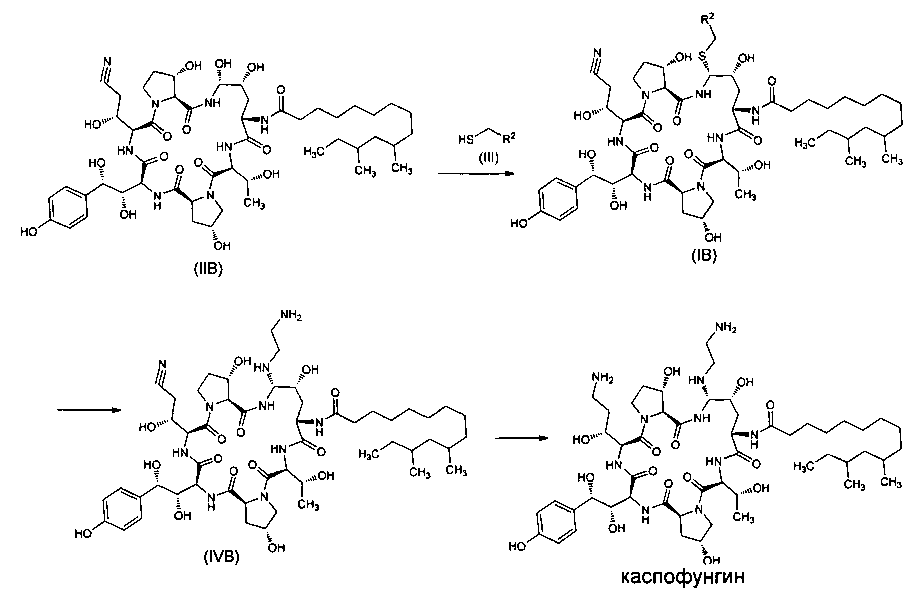
В другом предпочтительном варианте реализации настоящего изобретения вышеуказанный способ включает следующие стадии:
1) Реакция промежуточного соединения IIB формулы (IIB) с тиольным соединением III формулы (III) в присутствии органической бороновой кислоты и органической сульфокислоты с получением промежуточного соединения IB формулы (IB),
2) Реакция промежуточного соединения IB формулы (IB) с этилендиамином с получением промежуточного соединения IVB формулы (IVB),
3) Промежуточное соединение формулы (IVB) восстанавливают до каспофунгина
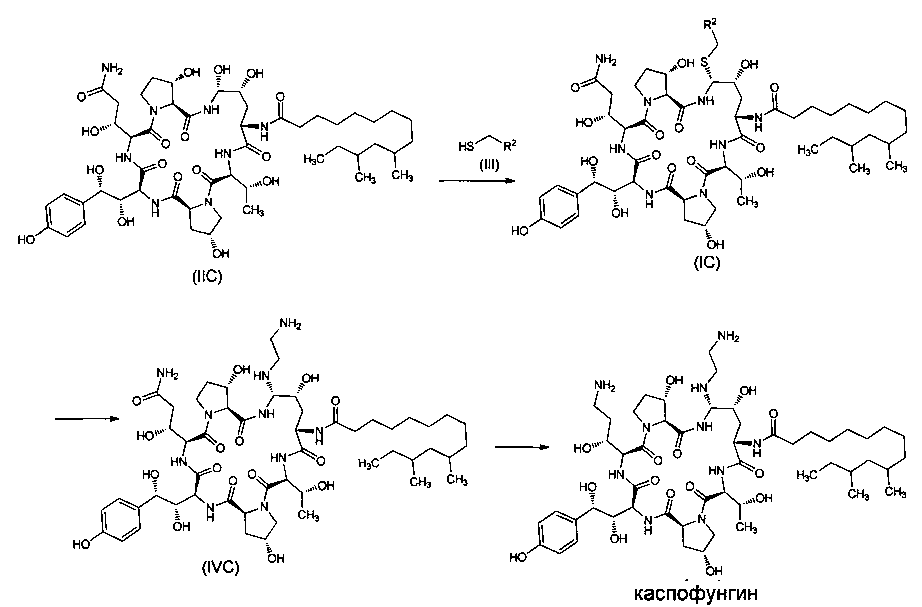
В еще одном предпочтительном варианте реализации настоящего изобретения вышеуказанный способ включает следующие стадии:
1) Реакция промежуточного соединения IIC формулы (IIC) с тиольным соединением III формулы (III) в присутствии органической борной кислоты и органической сульфокислоты с получением промежуточного соединения IC формулы (IC),
2) Реакция промежуточного соединения IC формулы (IC) с этилендиамином с получением промежуточного соединения IVC формулы (IVC),
3) Промежуточное соединение формулы (IVC) восстанавливают до каспофунгина
Группы, используемые для защиты аминогрупп в настоящем изобретении, представляют собой известные защитные группы, подходящие для защиты аминогрупп, о чем свидетельствуют способы защиты аминогрупп, описанные в литературе ("Protective Groups in Organic Synthesis", 5Th. Ed. Т.W. Greene & Р.G.М. Wuts), предпочтительно Boc или Cbz.
C6-10 ароматические группы, используемые в настоящем изобретении, могут быть одиночными, конденсированными или полициклическими, такими как фенил или нафтил. С6-10 ароматические группы могут быть незамещенными или замещенными, при этом заместители предпочтительно представляют собой одну или несколько групп, которые независимо друг от друга выбирают из алкила, алкоксила, галогена, гидроксила, нитрогруппы, цианогруппы, циклоалкила, гетероцикла, арила, гетероарила, -NR6R7, -С(O)OR8, -ОС(O)R8, -O(СН2)mC(O)OR8, -ОС(O)NR6R7, карбонила, -S(O)nR8, -OSO2R8, -SO2NR6R7, или -NHC(O)R8, где m может быть равно 0, 1 или 2; n может быть равно 0, 1 или 2; R6 и R7 определяются формулой (I); R8 может быть линейным или разветвленным С1-10 алкилом, линейным или разветвленным С3-10 алкенилом или С3-10 алкинилом, С3-8 циклоалкилом, или замещенным или незамещенным С6-10 арилом или гетероарилом; галоген может быть фтором, хлором, бромом или йодом.
Гетероарильная группа, используемая в настоящем изобретении, относится к пяти- - десятичленным гетероароматическим системам, содержащим от одного до четырех гетероатомов, которые могут быть кислородом, азотом или серой. Гетероарил представляет собой пяти- или шестичленный гетероарил. Например, фурил, тиенил, пиридил, пирролил, N-алкил пирролил, пиримидинил, пиразинил, имидазолил, тетразолил и т.д. Гетероароматические группы могут быть незамещенными или замещенными, при этом заместители предпочтительно представляют собой одну или несколько групп, независимо друг от друга выбранных из алкила, алкоксила, галогена, гидроксила, нитрогруппы, цианогруппы, циклоалкила, гетероцикла, арила, гетероарила, -NR6R7, -C(O)OR8, -OC(O)R8, -0(CH2)mC(O)OR8, -OC(O)NR6R7, карбонил, -S(O)nR8, -OSO2R8, -SO2NR6R7, или -NHC(O)R8; m может быть равно 0, 1 или 2; n может быть равно 0, 1 или 2; R6 и R7 определяются формулой (I); R8 может быть линейным или разветвленным С1-10 алкилом, линейным или разветвленным С3-10 алкенилом или С3-10 алкинилом, С3-8 циклоалкилом, или замещенным или незамещенным С6-10 арилом или гетероарилом; галоген может быть фтором, хлором, бромом, йодом.
C1-10 алкильная группа, используемая в настоящем изобретении, относится к насыщенным алифатическим углеводородным группам, например метильной, этильной, пропильной, 2-пропильной, н-бутильной, изобутильной, трет-бутильной или пентильной, и т.д. Низшие алкильные группы, содержащие от одного до четырех атомов углерода, являются более предпочтительными, например метильная, этильная, пропильная, 2-пропильная, н-бутильная, изобутильная или трет-бутильная. Алкильная группа может быть незамещенной или замещенной, при этом заместители предпочтительно представляют собой одну или несколько групп, которые независимо друг от друга выбирают из алкила, алкоксила, галогена, гидроксила, нитрогруппы, цианогруппы, циклоалкила, гетероцикла, арила, гетероарила, -NR6R7, -C(O)OR8, -OC(O)R8, -O(CH2)mC(O)OR8, -OC(O)NR6R7, карбонила, -S(O)nR8, -OSO2R8, -SO2NR6R7, или -NHC(O)R8; где m может быть равно 0, 1 или 2; n может быть равно 0, 1 или 2; R6 и R7 определяются формулой (I); R8 может быть линейным или разветвленным C1-10 алкилом, линейным или разветвленным С3-10 алкенилом или С3-10 алкинилом, С3-8 циклоалкилом, или замещенным или незамещенным С6-10 арилом или гетероарилом; галоген может быть фтором, хлором, бромом, или йодом.
С3-8 циклоалкильная группа, используемая в настоящем изобретении, относится к трех-восьмичленной углеродной моноциклической группе, которая может включать одну или несколько двойных связей, но не содержит полностью сопряженной π-электронной системы, например, циклопропильная, циклобутильная, циклопентильная, циклопентенильная, циклогексильная, циклогексадиенильная, циклогептильная, циклогептатриенильная и т.д. Циклоалкильная группа может быть незамещенной или замещенной, при этом заместители предпочтительно представляют собой одну или несколько групп, которые независимо друг от друга выбирают из алкила, алкоксила, галогена, гидроксила, нитрогруппы, цианогруппы, циклоалкила, гетероцикла, арила, гетероарила, -NR6R7, -C(O)OR8, -OC(O)R8, -O(CH2)mC(O)OR8, -OC(O)NR6R7, карбонила, -S(O)nR8, -OSO2R8, -SO2NR6R7, или -NHC(O)R8; где m может быть равно 0, 1 или 2; n может быть равно 0, 1 или 2; R6 и R7 определяются формулой (I); R8 может быть линейным или разветвленным С1-10 алкилом, линейным или разветвленным С3-10 алкенилом или С3-10 алкинилом, С3-8 циклоалкилом, или замещенным или незамещенным С6-10 арилом или гетероарилом; галоген может быть фтором, хлором, бромом, или йодом.
С3-10 алкенильная группа, используемая в настоящем изобретении, может быть незамещенной или замещенной, при этом заместители предпочтительно представляют собой одну или несколько групп, которые независимо друг от друга выбирают из алкила, алкоксила, галогена, гидроксила, нитрогруппы, цианогруппы, циклоалкила, гетероцикла, арила, гетероарила, -NR6R7, -C(O)OR8, -OC(O)R8, -O(CH2)mC(O)OR8, -OC(O)NR6R7, карбонила, -S(O)nR8, -OSO2R8, -SO2NR6R7, или -NHC(O)R8; где m может быть равно 0, 1 или 2; n может быть равно 0, 1 или 2; R6 и R7 определяются формулой (I); R8 может быть линейным или разветвленным С1-10 алкилом, линейным или разветвленным С3-10 алкенилом или С3-10 алкинилом, С3-8 циклоалкилом, или замещенным или незамещенным С6-10 арилом или гетероарилом; галоген может быть фтором, хлором, бромом, или йодом.
С3-10 алкинильная группа, используемая в настоящем изобретении, может быть незамещенной или замещенной, при этом заместители предпочтительно представляют собой одну или несколько групп, которые независимо друг от друга выбирают из алкила, алкоксила, галогена, гидроксила, нитрогруппы, цианогруппы, циклоалкила, гетероцикла, арила, гетероарила, -NR6R7, -C(O)OR8, -OC(O)R8, -O(CH2)mC(O)OR8, -OC(O)NR6R7, карбонила, -S(O)nR8, -OSO2R8, -SO2NR6R7, или -NHC(O)R8; где m может быть равно 0, 1 или 2; n может быть равно 0, 1 или 2. R6 и R7 определяются формулой (I); R8 может быть линейным или разветвленным С1-10 алкилом, линейным или разветвленным С3-10 алкенилом или С3-10 алкинилом, С3-8 циклоалкилом, или замещенным или незамещенным С6-10 арилом или гетероарилом; галоген может быть фтором, хлором, бромом, или йодом.
Органическая бороновая кислота, используемая в настоящем изобретении, представляет собой R9B(OH)2, где R9 может быть линейным или разветвленным С1-10 алкилом, линейным или разветвленным С3-10 алкенилом или С3-10 алкинилом, С3-8 циклоалкилом, или незамещенным или замещенным С6-10 арилом или гетероарилом, например метилом, этилом, пропилом, бутилом, фенилом, п-метилфенилом, п-метоксифенилом, п-хлорфенилом и т.д.
Органическая сульфокислота, используемая в настоящем изобретении, представляет собой R10SO3H, где R10 может быть замещенным или незамещенным, линейным или разветвленным С1-10 алкилом, линейным или разветвленным С3-10 алкенилом или С3-10 алкинилом, С3-8 циклоалкилом, или незамещенным или замещенным С6-10 арилом или гетероарилом, например метилом, трифторметилом, фенилом, п-метилфенилом, и т.д.
Подробное описание изобретения
Настоящее изобретение станет понятным специалистам в данной области техники после ознакомления со следующими конкретными примерами. Эти примеры приведены для иллюстрации настоящего изобретения, и никоим образом не ограничивают объем настоящего изобретения.
Обозначения промежуточных соединений формулы (I), описанных в примерах, представлены в следующей таблице:
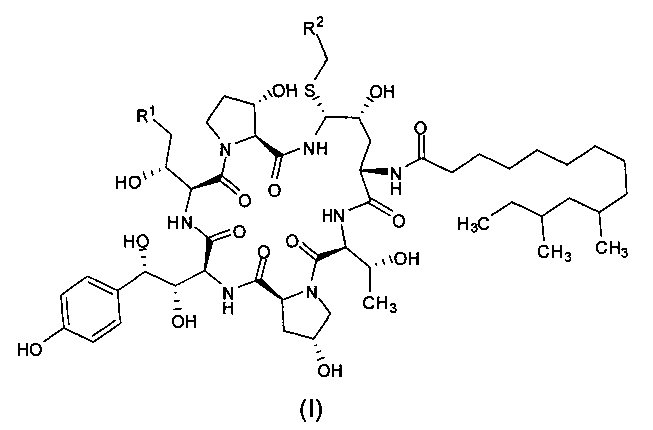
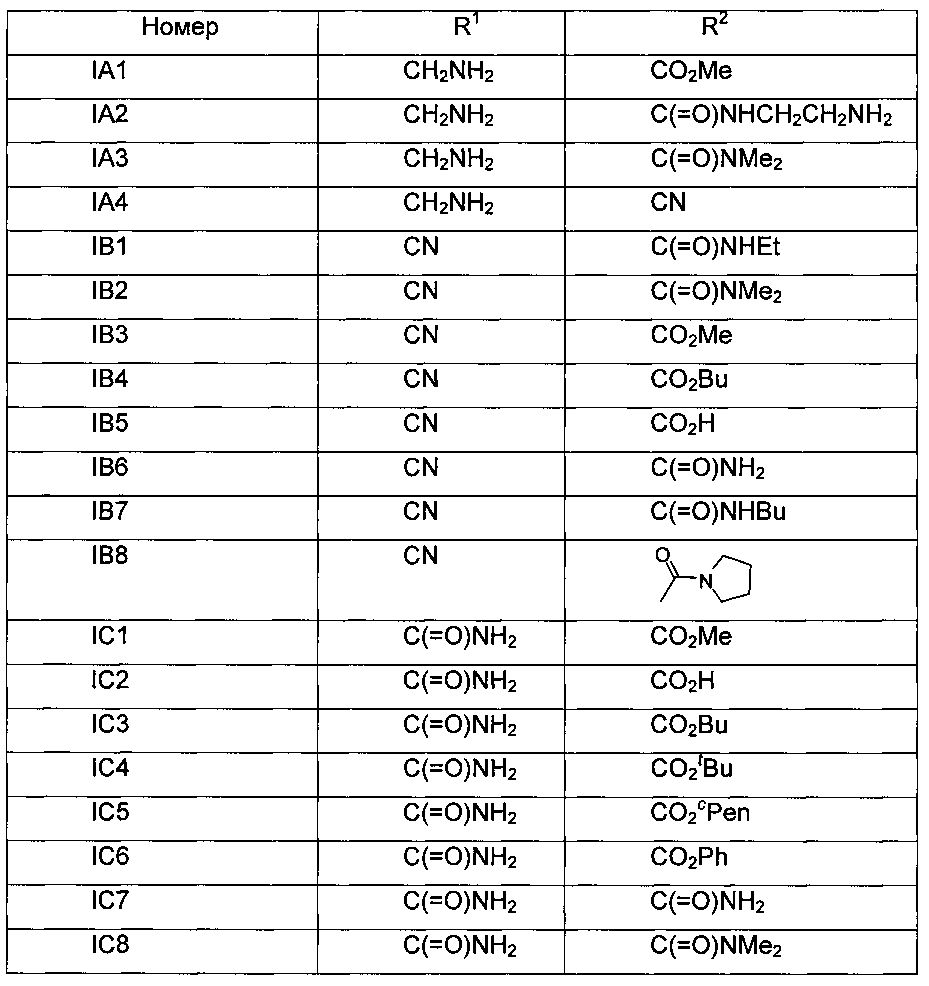
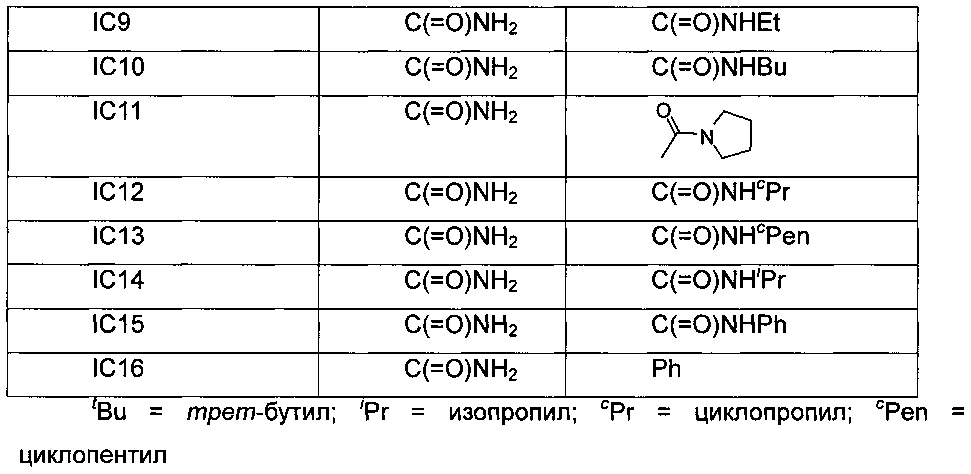
Пример 1: Получение соединения IA1
В трехгорлой стеклянной колбе готовят суспензию, содержащую соединение IIA (3,0 г) (которое было получено в соответствии с аналогичным способом, описанным в патенте US 5378804), фенилборную кислоту (0,72 г) и ацетонитрил (120 мл), затем к полученной смеси при перемешивании добавляют метилтиогликолят (1,0 г) при -20°C. Полученную смесь перемешивают в течение 30 минут при этой температуре, а затем к ней добавляют по каплям трифторметансульфокислоту (1,2 г). После этого реакционную смесь перемешивают при -20°C в течение 5-6 часов с последующим добавлением водного раствора ацетата натрия. Перемешивание продолжают еще 1-2 часа, после чего реакционную смесь фильтруют, осадок на фильтре промывают водным раствором ацетонитрила и сушат в вакууме с получением белого твердого продукта IA1 (2,8 г).
1Н ЯМР (ядерно-магнитный резонанс) (CD3OD, 400 MHz) δ 7.09 (d, 2Н), 6.74 (d, 2Н), 5.24 (d, 1Н), 5.04 (d, 1Н), 4.90 (d, 1Н) 4.56-4.47 (m), 4.39-4.35 (m, 2Н), 4.31-4.25 (m), 4.23-4.21 (m, 3Н), 3.99-3.95 (m), 3.80-3.75 (m), 3.63 (s, 3Н), 3.04 (t, 2Н), 2.42 (dd, 1Н), 2.15-1.99 (m, 7Н), 1.97-1.90 (m), 1.63-1.52 (m), 1.51-1.46 (m), 1.45-1.39 (m), 1.38-1.20 (m), 1.14 (d), 1.12-1.03 (m), 0.91 (dt, 1Н), 0.87 (d, 3Н), 0.85 (d, 6Н).
МС (масс-спекторметрия): 1139,61 (М+Н+).
Пример 2: Получение соединения IA2
В трехгорлой стеклянной колбе готовят суспензию, содержащую соединение IIA (3,0 г), фенилборную кислоту (0,72 г) и ацетонитрил (120 мл), затем к полученной смеси при перемешивании добавляют N-(2-аминоэтил)меркаптоацетамид (1,26 г) при -20°C. Полученную смесь перемешивают в течение 30 минут при этой температуре, а затем к ней добавляют по каплям трифторметансульфокислоту (1,2 г). После этого реакционную смесь перемешивают при -20°C в течение 5-6 часов с последующим добавлением водного раствора ацетата натрия. Перемешивание продолжают еще 1-2 часа, после чего реакционную смесь фильтруют, осадок на фильтре промывают водным раствором ацетонитрила и сушат в вакууме с получением белого твердого продукта IA2 (3,1 г).
МС: 1167,39 (М+Н+).
Пример 3: Получение соединения IA3
В трехгорлой стеклянной колбе готовят суспензию, содержащую соединение IIA (3,0 г), фенилборную кислоту (0,72 г) и ацетонитрил (120 мл), затем к полученной смеси при перемешивании добавляют Ν,Ν-диметил-меркаптоацетамид (1,1 г) при -20°C. Полученную смесь перемешивают в течение 30 минут при этой температуре, а затем к ней добавляют по каплям трифторметансульфокислоту (1,2 г). После этого реакционную смесь перемешивают при -20°C в течение 5-6 часов с последующим добавлением водного раствора ацетата натрия. Перемешивание продолжают еще 1-2 часа, после чего реакционную смесь фильтруют, осадок на фильтре промывают водным раствором ацетонитрила и сушат в вакууме с получением белого твердого продукта IA3 (3,1 г).
МС: 1152,81 (М+Н+).
Пример 4: Получение соединения IA4
В трехгорлой стеклянной колбе готовят суспензию, содержащую соединение IIA (3,0 г), фенилборную кислоту (0,72 г) и ацетонитрил (120 мл), затем к полученной смеси при перемешивании добавляют меркаптоацетонитрил (1,5 г) при -20°C. Полученную смесь перемешивают в течение 30 минут при этой температуре, а затем к ней добавляют по каплям трифторметансульфокислоту (1,2 г). После этого реакционную смесь перемешивают при -20°C в течение 5-6 часов с последующим добавлением водного раствора ацетата натрия. Перемешивание продолжают еще 1-2 часа, после чего реакционную смесь фильтруют, осадок на фильтре промывают водным раствором ацетонитрила и сушат в вакууме с получением белого твердого продукта IA4 (3,0 г).
1Н ЯМР (CD3OD, 400 MHz) δ 7.15 (d, 2Н), 6.79 (d, 2Н), 5.34 (d, 1Н), 5.04 (d, 1Н), 4.64 (m, 3Н), 4.53-4.42 (m, 4Н), 4.43-4.32 (m, ЗН), 4.31-4.25 (m, 5Н), 4.23-4.18 (m, 1Н), 3.99-3.95 (m, 1Н), 3.90-3.8 (m, 3Н), 3.73-3.65 (m, 2Н), 3.58-3.65 (m, 2Н), 3.05-3.18 (m, 2Н), 2.40-2.50 (m, 1Н), 2.35-2.23 (m, 4Н), 2.21-1.98 (m, 6Н), 1.97-1.80 (m, 3Н), 1.78-1.60 (m, 2Н), 1.58-1.41 (m, 2Н), 1.40-1.26 (m, 14Н), 1.21 (d, 3H), 1.20-1.13 (m, 3Н), 0.95-0.85 (m, 10Н), 0.68-0.76 (dd, 2H).
MC: 1106,54 (M+Н+).
Пример 5: Получение соединения IB1
К суспензии, состоящей из соединения IIB (100 мг, полученного в соответствии с аналогичным способом, описанным в патенте US 5378804), фенилборной кислоты (35 мг) и N-этил-2-меркаптоацетамида (68 мг) в безводном ацетонитриле (8 мл), по каплям добавляют раствор трифторметансульфокислоты (57,3 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Реакционную смесь фильтруют, осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IB1.
1Н ЯМР (CD3OD, 400 MHz) δ 7.08 (d, 2Н), 6.70 (d, 2H), 5.21 (d, 1H), 4.99 (d, 1H), 4.95 (d, 1H), 4.56-4.47 (m, 3Н), 4.39-4.21 (m, 6H), 3.99-3.95 (m, 1H), 3.87-3.83 (m, 1H), 3.80-3.75 (m, 2H), 2.95-2.90 (q, 2H), 2.80-2.64 (m, 2H), 2.46 (m, 1H), 2.42 (m, 3Н), 2.26-2.12 (m), 2.10-2.03 (m), 1.97-1.90 (m), 1.63-1.52 (m), 1.51-1.46 (m), 1.45-1.39 (m), 1.38-1.20 (m), 1.14 (d), 1.12-1.03 (m), 0.91 (dt, 1H), 0.87 (m), 0.81 (m).
MC: 1148.48 (M+H+).
Пример 6: Получение соединения IB2
К суспензии, состоящей из соединения IIB (100 мг), фенилборной кислоты (35 мг) и N,N-диметил-2-меркаптоацетамида (68 мг) в безводном ацетонитриле (8 мл), по каплям добавляют раствор трифторметансульфокислоты (57,3 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IB2.
1Н ЯМР (CD3OD, 400 MHz) δ 7.08 (d, 2Н), 6.70 (d, 2Н), 5.27 (d, 1Н), 4.99 (d, 1Н), 4.95 (d, 1Н), 4.56-4.47 (m, 3Н), 4.39-4.21 (m, 6Н), 3.99-3.95 (m, 1Н), 3.87-3.83 (m, 1Н), 3.80-3.75 (m, 2Н), 3.04 (s, 3Н), 2.89 (s, 3Н), 2.80-2.64 (m, 2Н), 2.46 (m, 1Н), 2.42 (m, 3Н), 2.26-2.12 (m), 2.10-2.03 (m), 1.97-1.90 (m), 1.63-1.52 (m), 1.51-1.46 (m), 1.45-1.39 (m), 1.38-1.20 (m), 1.14 (d), 1.12-1.03 (m), 0.91 (dt, 1H), 0.87 (m), 0.81 (m).
MC: 1148. 48 (M+H+).
Пример 7: Получение соединения IB3
К суспензии, состоящей из соединения IIB (100 мг), фенилборной кислоты (35 мг) и метил-2-меркаптоацетата (61 мг) в безводном ацетонитриле (8 мл), по каплям добавляют раствор трифторметансульфокислоты (57,3 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IB3.
1Н ЯМР (CD3OD, 400 MHz) δ 7.09 (d, 2H), 6.69 (d, 2H), 5.28 (d, 1H), 4.99 (d, 1H), 4.90 (d, 1H), 4.56-4.47 (m, 3Н), 4.39-4.21 (m, 6H), 3.99-3.95 (m, 1H), 3.87-3.83 (m, 1H), 3.80-3.75 (m, 2H), 3.66 (m, ЗН), 3.56-3.52 (dd, 1H), 3.49-3.39 (dd, 1H), 2.80-2.64 (m, 2H), 2.46 (m, 1H), 2.42 (m, 3H), 2.26-2.12 (m), 2.10-2.03 (m), 1.97-1.90 (m), 1.63-1.52 (m), 1.51-1.46 (m), 1.45-1.39 (m), 1.38-1.20 (m), 1.14 (d), 1.12-1.03 (m), 0.91 (dt, 1H), 0.87 (m), 0.81 (m).
MC: 1135,38 (M+H+).
Пример 8: Получение соединения IB4
К суспензии, состоящей из соединения IIB (100 мг), фенилборной кислоты (35 мг) и бутил-2-меркаптоацетата (85 мг) в безводном ацетонитриле (8 мл), по каплям добавляют раствор трифторметансульфокислоты (57,3 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IB4.
1Н ЯМР (CD3OD, 400 MHz) δ 7.08 (d, 2Н), 6.70 (d, 2Н), 5.29 (d, 1Н), 4.99 (d, 1Н), 4.95 (d, 1Н), 4.56-4.47 (m, 3Н), 4.39-4.21 (m, 6Н), 3.99-3.95 (m, 1Н), 3.87-3.83 (m, 1Н), 3.80-3.75 (m, 2Н), 3.58-3.56 (t, 2Н), 3.56-3.52 (dd, 1Н), 3.49-3.39 (dd, 1Н), 2.80-2.64 (m, 2Н), 2.46 (m, 1Н), 2.42 (m, 3Н), 2.26-2.12 (m), 2.10-2.03 (m), 1.97-1.90 (m), 1.63-1.52 (m), 1.51-1.46 (m), 1.45-1.39 (m), 1.38-1.20 (m), 1.14 (d), 1.12-1.03 (m), 0.91 (dt, 1H), 0.87 (m), 0.81 (m).
MC: 1178,49 (M+H+).
Пример 9: Получение соединения IB5
К суспензии, состоящей из соединения IIB (100 мг), фенилборной кислоты (35 мг), меркаптоуксусной кислоты (60 мг) в безводном ацетонитриле (8 мл), по каплям добавляют раствор трифторметансульфокислоты (57,3 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IB5.
МС: 1121,16 (М+Н+).
Пример 10: Получение соединения IB6
К суспензии, состоящей из соединения IIB (100 мг), фенилборной кислоты (35 мг) и меркаптоацетамида (62 мг) в безводном ацетонитриле (8 мл), по каплям добавляют раствор трифторметансульфокислоты (57,3 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IB6.
МС: 1120,44 (М+Н+).
Пример 11: Получение соединения IB7
К суспензии, состоящей из соединения IIB (100 мг), фенилборной кислоты (35 мг) и N-бутил-2-меркаптоацетамида (86 мг) в безводном ацетонитриле (8 мл), по каплям добавляют раствор трифторметансульфокислоты (57,3 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IB7.
МС: 1176,51 (М+Н+).
Пример 12: Получение соединения IB8
К суспензии, состоящей из соединения IIB (100 мг), фенилборной кислоты (35 мг) и N-пирролил-2-меркаптоацетамида (86 мг) в безводном ацетонитриле (8 мл), по каплям добавляют раствор трифторметансульфокислоты (57,3 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и высушивают в вакууме с получением продукта IB8.
МС: 1174,58 (М+Н+).
Пример 13: Получение соединения IC1
К суспензии, состоящей из соединения IIC (РВ0, полученного с помощью микробной ферментации) (500 мг), фенилборной кислоты (172 мг) и метилмеркаптоацетата (299 мг) в безводном ацетонитриле (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IC1.
1Н ЯМР (CD3OD, 400 MHz) δ 7.09 (d, 2Н), 6.70 (d, 2H), 5.29 (d, 1H), 5.1 (d, 1H), 4.99 (d, 1H), 4.56-4.47 (m), 4.39-4.35 (m, 2H), 4.31-4.25 (m), 4.23-4.21 (m, 3H), 3.99-3.95 (m), 3.80-3.75 (m), 3.63 (s, 3H), 3.55-3.51 (dd, 1H), 3.36-3.40 (dd, 1H), 2.88 (dd, 1H), 2.46 (dd, 1H), 2.42 (dd, 1H), 2.26-2.18 (m), 2.10-2.03 (m), 1.97-1.90 (m), 1.63-1.52 (m), 1.51-1.46 (m), 1.45-1.39 (m), 1.38-1.20 (m), 1.14 (d), 1.12-1.03 (m), 0.91 (dt, 1H), 0.87 (d, 3H), 0.85 (d, 6H).
MC: 1153,26 (M+H+).
Пример 14: Получение соединения IC2
К суспензии, состоящей из соединения IIC (500 мг), фенилборной кислоты (172 мг), меркаптоуксусной кислоты (259 мг) в безводном ацетонитриле (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IC2.
1H ЯМР (CD3OD, 400 MHz) δ 7.09 (d, 2H), 6.70 (d, 2H), 5.24 (d, 1H), 5.04 (d, 1H), 4.90 (d, 1H), 4.56-4.47 (m), 4.39-4.35 (m,2H), 4.31-4.25 (m), 4.23-4.21 (m, 3H), 3.99-3.95 (m), 3.80-3.75 (m), 2.88 (dd, 1H), 2.46 (dd, 1H), 2.42 (dd, 1H), 2.26-2.18 (m), 2.10-2.03 (m), 1.97-1.90 (m), 1.63-1.52 (m), 1.51-1.46 (m), 1.45-1.39 (m), 1.38-1.20 (m), 1.14 (d), 1.12-1.03 (m), 0.91 (dt, 1H), 0.87 (d, 3H), 0.85 (d, 6H).
MC: 1139,18 (M+H+)
Пример 15: Получение соединения IC3
К суспензии, состоящей из соединения IIC (500 мг), фенилборной кислоты (172 мг) и бутилмеркаптоацетата (417 мг) в безводном ацетонитриле (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IC3.
МС: 1195,48 (М+Н+).
Пример 16: Получение соединения IC4
К суспензии, состоящей из соединения IIC (500 мг), фенилборной кислоты (172 мг) и трет-бутилмеркаптоацетата (417 мг) в безводном ацетонитриле (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и высушивают в вакууме с получением продукта IC4.
МС: 1195,48 (М+Н+).
Пример 17: Получение соединения IC5
К суспензии, состоящей из соединения IIC (500 мг), фенилборной кислоты (172 мг) и циклопентил меркаптоацетата (431 мг) в безводном ацетонитриле (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IC5.
МС: 1207,49 (М+Н+).
Пример 18: Получение соединения IC6
К суспензии, состоящей из соединения IIC (500 мг), фенилборной кислоты (172 мг) и фенилмеркаптоацетата (431 мг) в безводном ацетонитриле (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IC6.
МС: 1215,48 (М+Н+).
Пример 19: Получение соединения IC7
К суспензии, состоящей из соединения IIC (500 мг), фенилборной кислоты (172 мг) и меркаптоацетамида (259 мг) в безводном ацетонитриле (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IC7.
1Н ЯМР (CD3OD, 400 MHz) δ 7.09 (d, 2H), 6.70 (d, 2H), 5.24 (d, 1H), 5.04 (d, 1H), 4.90 (d, 1H), 4.56-4.47 (m), 4.39- 4.35 (m,2H), 4.31-4.25 (m), 4.23-4.21 (m, 3H), 3.99-3.95 (m), 3.80-3.75 (m), 2.88 (dd, 1H), 2.46 (dd, 1H), 2.42 (dd, 1H), 2.26-2.18 (m), 2.10-2.03 (m), 1.97-1.90 (m), 1.63-1.52 (m), 1.51-1.46 (m), 1.45-1.39 (m), 1.38-1.20 (m), 1.14 (d), 1.12-1.03 (m), 0.91 (dt, 1H), 0.87 (d, 3H), 0.85 (d, 6H).
MC: 1138,45 (M+H+).
Пример 20: Получение соединения IC8
К суспензии, состоящей из соединения IIC (500 мг), фенилборной кислоты (172 мг) и N,N-диметилмеркаптоацетамида (336 мг) в безводном ацетонитриле (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IC8.
1Н ЯМР (CD3OD, 400 MHz) δ 7.09 (d, 2Н), 6.70 (d, 2Н), 5.24 (d, 1Н), 5.04 (d, 1Н), 4.90 (d, 1Н), 4.56-4.47 (m), 4.39-4.35 (m, 2H), 4.31-4.25 (m), 4.23-4.21 (m, 3Н), 3.99-3.95 (m), 3.80-3.75 (m), 3.01 (s, 1H), 2.88 (s, 1H), 2.68 (dd, 1H), 2.46 (dd, 1H), 2.42 (dd, 1H), 2.26-2.18 (m), 2.10-2.03 (m), 1.97-1.90 (m), 1.63-1.52 (m), 1.51-1.46 (m), 1.45-1.39 (m), 1.38-1.20 (m), 1.14 (d), 1.12-1.03 (m), 0.91 (dt, 1H), 0.87 (d, 3H), 0.85 (d, 6H).
MC: 1166,52 (M+H+).
Пример 21: Получение соединения IC9
К суспензии, состоящей из соединения IIC (500 мг), фенилборной кислоты (172 мг) и N,N-диметилмеркаптоацетамида (259 мг) в безводном ацетонитриле (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IC9.
1Н ЯМР (CD3OD, 400 MHz) δ 7.09 (d, 2H), 6.70 (d, 2H), 5.24 (d, 1H), 5.04 (d, 1H), 4.90 (d, 1H), 4.56-4.47 (m), 4.39-4.35 (m,2H), 4.31-4.25 (m), 4.23-4.21 (m, 3H), 3.99-3.95 (m), 3.80-3.75 (m), 2.88 (dd, 2H), 2.68 (dd, 1H), 2.46 (dd, 1H), 2.42 (dd, 1H), 2.26-2.18 (m), 2.10-2.03 (m), 1.97-1.90 (m), 1.63-1.52 (m), 1.51-1.46 (m), 1.45-1.39 (m), 1.38-1.20 (m), 1.14 (d), 1.12-1.03 (m), 0.91 (dt, 1H), 0.87 (d, 3H), 0.85 (d, 6H).
MC: 1166,52 (M+H+).
Пример 22: Получение соединения IC10
К суспензии, состоящей из соединения IIC (500 мг), фенилборной кислоты (172 мг), N,N-диметилмеркаптоацетамида (414 мг) и безводного ацетонитрила (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IC10.
1Н ЯМР (CD3OD, 400 MHz) δ 7.09 (d, 2Н), 6.70 (d, 2Н), 5.24 (d, 1Н), 5.04 (d, 1Н), 4.90 (d, 1Н), 4.56-4.47 (m), 4.39-4.35 (m, 2H), 4.31-4.25 (m), 4.23-4.21 (m, 3H), 3.99-3.95 (m), 3.80-3.75 (m), 2.94-2.91 (t, 2H), 2.68 (dd, 1H), 2.46 (dd, 1H), 2.42 (dd, 1H), 2.26-2.18 (m), 2.10-2.03 (m), 1.97-1.90 (m), 1.63-1.52 (m), 1.51-1.46 (m), 1.45-1.39 (m), 1.38-1.20 (m), 1.14 (d), 1.12-1.03 (m), 0.91 (dt, 2H), 0.87 (d, 6H), 0.85 (d, 6H).
MC: 1194,53 (M+H+).
Пример 23: Получение соединения IC11
К суспензии, состоящей из соединения IIC (500 мг), фенилборной кислоты (172 мг), N-пирролилмеркаптоацетамида (410 мг) в безводном ацетонитриле (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IC11.
1Н-ЯМР (CD3OD, 400 MHz) δ 7.09 (d, 2Н), 6.70 (d, 2Н), 5.24 (d, 1Н), 5.04 (d, 1Н), 4.90 (d, 1Н), 4.56-4.47 (m), 4.39-4.35 (m, 2H), 4.31-4.25 (m), 4.23-4.21 (m, 3Н), 3.99-3.95 (m), 3.80-3.75 (m), 3.18-3.14 (m, 4H), 2.68 (dd, 1H), 2.46 (dd, 1H), 2.42 (dd, 1H), 2.26-2.18 (m), 2.10-2.03 (m), 1.94-1.90(m, 4H), 1.87-1.85 (m), 1.63-1.52 (m), 1.51-1.46 (m), 1.45-1.39 (m), 1.38-1.20 (m), 1.14 (d), 1.12-1.03 (m), 0.91 (dt, 2H), 0.87 (d, 3H), 0.85 (d, 6H);
MC: 1192,56 (M+H+).
Пример 24: Получение соединения IC12
К суспензии, состоящей из соединения IIC (500 мг), фенилборной кислоты (172 мг) и N-циклопропилмеркаптоацетамида (370 мг) в безводном ацетонитриле (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IC12.
1Н ЯМР (CD3OD, 400 MHz) δ 7.09 (d, 2Н), 6.70 (d, 2Н), 5.24 (d, 1Н), 5.04 (d, 1Н), 4.90 (d, 1Н), 4.56-4.47 (m), 4.39-4.35 (m, 2H), 4.31-4.25 (m), 4.23-4.21 (m, 3Н), 3.99-3.95 (m), 3.80-3.75 (m), 3.21-3.09 (dd, 1H), 2.68 (dd, 1H), 2.46 (dd, 1H), 2.42 (dd, 1H), 2.26-2.18 (m), 2.10-2.03 (m), 1.87-1.85 (m), 1.63-1.52 (m), 1.51-1.46 (m), 1.45-1.39 (m), 1.38-1.20 (m), 1.14 (d), 1.12-1.03 (m), 0.91 (dt, 2H), 0.87 (d, 3H), 0.85 (d, 6H) 0.68~0.50(m,4H);
MC: 1178,46 (M+H+).
Пример 25: Получение соединения IC13
К суспензии, состоящей из соединения IIC (500 мг), фенилборной кислоты (172 мг) и N-циклопентилмеркаптоацетамида (450 мг) в безводном ацетонитриле (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IC13.
1Н ЯМР (CD3OD, 400 MHz) δ 7.09 (d, 2Н), 6.70 (d, 2Н), 5.24 (d, 1Н), 5.04 (d, 1Н), 4.90 (d, 1Н), 4.56-4.47 (m), 4.39-4.35 (m, 2H), 4.31-4.25 (m), 4.23-4.21 (m, 3H), 3.99-3.95 (m), 3.80-3.75 (m), 3.21-3.09 (dd, 1H), 2.68 (dd, 1H), 2.46 (dd, 1H), 2.42 (dd, 1H), 2.26-2.18 (m), 2.10-2.03 (m), 1.94-1.90 (m, 4H), 1.87-1.85 (m), 1.63-1.52 (m), 1.51-1.46 (m), 1.45-1.39 (m), 1.38-1.20 (m), 1.14 (d), 1.12-1.03 (m), 0.91 (dt, 2H), 0.89-0.85 (m, 15H);
MC: 1206,50 (M+H+).
Пример 26: Получение соединения IC14
К суспензии, состоящей из соединения IIC (500 мг), фенилборной кислоты (172 мг) и N-изопропилмеркаптоацетамида (370 мг) в безводном ацетонитриле (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IC14.
МС: 1180,50 (М+Н+).
Пример 27: Получение соединения IC15
К суспензии, состоящей из соединения IIC (500 мг), фенилборной кислоты (172 мг), N-фенилмеркаптоацетамида (370 мг) и безводного ацетонитрила (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IC15.
МС: 1214,65 (М+Н+).
Пример 28: Получение соединения IC16
К суспензии, состоящей из соединения IIC (500 мг), фенилборной кислоты (172 мг) и бензилмеркаптана (350 мг) в безводном ацетонитриле (30 мл), по каплям добавляют раствор трифторметансульфокислоты (282 мг) в ацетонитриле при -15°C в атмосфере азота. Реакционную смесь перемешивают при данной температуре в течение 4-6 часов до завершения реакции. После добавления водного раствора ацетата натрия и перемешивания в течение 1-2 часов к реакционной смеси добавляют воду (90 мл) и продолжают перемешивание в течение еще одного часа. Затем реакционную смесь фильтруют и осадок на фильтре промывают смесью ацетонитрил/вода, затем его собирают и сушат в вакууме с получением продукта IC16.
1Н ЯМР (CD3OD, 400 MHz) δ 7.30-7.27 (d, 2Н), 7.24-7.2 (t, 3Н), 7.17-7.15 (d, 1Н), 7.09 (d, 2Н), 6.70 (d, 2Н), 5.24 (d, 1Н), 5.04 (d, 1Н), 4.90 (d, 1Н), 4.56-4.47 (m), 4.39-4.35 (m, 2H), 4.31-4.25 (m), 4.23-4.21 (m, 3Н), 3.99-3.95 (m), 3.80-3.75 (m), 3.63 (s, 3H), 3.55-3.51 (dd, 1H), 3.36-3.40 (dd, 1H), 2.88 (dd, 1H), 2.46 (dd, 1H), 2.42 (dd, 1H), 2.26-2.18 (m), 2.10-2.03 (m), 1.97-1.90 (m), 1.63-1.52 (m), 1.51-1.46 (m), 1.45-1.39 (m), 1.38-1.20 (m), 1.14 (d), 1.12-1.03 (m), 0.91 (dt, 1H), 0.87 (d, 3H), 0.85 (d, 6H).
MC: 1171,10 (M+H+).
Пример 29: Получение каспофунгина
Соединение IA1 (70 мг) растворяют в метаноле (0,5 мл) при 15°C. Этилендиамин (0,7 мл) добавляют к раствору при 5°C и полученную смесь перемешивают при 40°C в течение 20 часов. После выпаривания метанола к остаткам смеси добавляют ацетонитрил, полученную смесь перемешивают и фильтруют в атмосфере азота с получением сырого продукта в виде твердого вещества, которое сушат в вакууме. Очистка на колонке с силикагелем С-18 позволяет получить конечный продукт - каспофунгин.
MS: 1093,21 (M+Н+).
Пример 30: Получение каспофунгина
Стадия 1):
К раствору соединения IB1 (800 мг) в метаноле (20 мл) в трехгорлой стеклянной колбе при перемешивании добавляют этилендиамин (20 мл) при 30°C и полученную реакционную смесь перемешивают в течение 18 часов при данной температуре. После концентрирования реакционного раствора к остаткам смеси добавляют ацетонитрил (40 мл), полученную смесь перемешивают в течение 20-30 минут и фильтруют. Осадок на фильтре собирают и сушат с получением продукта IVB.
MC: 1089,22 (М+Н+).
Стадия 2):
К раствору соединения IVB (100 мг) в этаноле (9 мл) и воде (1 мл) добавляют уксусную кислоту (1 мл) и Pd/C (palladium on carbon - палладиевая чернь) (10%, 50 мг). Полученную реакционную смесь перемешивают в течение 10 часов при 3 атм и 20°C в атмосфере водорода. После фильтрации для удаления катализатора и упаривания для удаления растворителя остатки смеси растворяют в воде (20 мл) и экстрагируют этилацетатом (10 мл × 2). Водную фазу собирают и лиофилизируют с получением сырого каспофунгина, который затем очищают на колонке с силикагелем С-18 с получением готового продукта - каспофунгина.
MC: 1093,21 (М+Н+).
Пример 31: Получение каспофунгина
Стадия 1):
К раствору соединения IC1 (800 мг) в метаноле (20 мл) в трехгорлой стеклянной колбе добавляют этилендиамин (20 мл) при 30°C, полученную реакционную смесь перемешивают в течение 18 часов при данной температуре. После концентрирования реакционного раствора к остаткам смеси добавляют ацетонитрил (40 мл), полученную смесь перемешивают в течение 20-30 минут и фильтруют. Осадок собирают и сушат с получением продукта IVC.
MC: 1107,29 (М+Н+).
Стадия 2):
К раствору соединения IVC (100 мг) в безводном THF (tetrahydrofuran - тетрагидрофуран) (20 мл) в трехгорлой стеклянной колбе добавляют фенилборную кислоту (33 мг) в атмосфере азота и полученную реакционную смесь перемешивают в течение ночи, а затем охлаждают до 10°C. В реакционную смесь добавляют бис(триметилсилил)трифторацетамид (140 мг) и перемешивают в течение 3 часов. Затем реакционную смесь помещают на -15°C и добавляют к ней боргидрид в растворе THF (1,0 M, 1,35 мл). Полученную смесь перемешивают в течение 6 часов при -15°C. Реакцию останавливают путем добавления 2 N соляной кислоты (2 мл), а затем добавляют воду (20 мл). Водную фазу отделяют и экстрагируют этилацетатом (10 мл × 2). Водную фазу собирают и лиофилизируют с получением сырого продукта каспофунгина, который затем очищают на колонке с силикагелем С-18 с получением готового продукта - каспофунгина.
МС: 1093,21 (М+Н+).
Основываясь на подробном описании конкретных вариантов реализации настоящего изобретения, специалист в данной области техники может вносить некоторые изменения, которые будут включены в объем настоящего изобретения.