Результат интеллектуальной деятельности: ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) ПРОТИВ CD123 ДЛЯ ИСПОЛЬЗОВАНИЯ В ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Вид РИД
Изобретение
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет заявки PCT № PCT/CN2014/084696, зарегистрированной 19 августа 2014 года, и заявки PCT № PCT/CN2014/090508, зарегистрированной 6 ноября 2014 года. Полное содержание каждой из этих заявок включено в настоящее описание посредством ссылки.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит список последовательностей, который был предоставлен в электронном виде в формате ASCII, и, таким образом, полностью включен посредством ссылки. Указанная копия ASCII, созданная 18 августа 2015 года, называется N2067-7064WO5_SL.txt и имеет размер 625588 байта.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение в основном относится к использованию эффекторных клеток иммунной системы (например, T-клеток или NK-клеток), конструируемых для экспрессии химерного антигенного рецептора (CAR) для лечения заболевания, связанного с экспрессией белка кластера дифференцировки 123 (CD123).
УРОВЕНЬ ТЕХНИКИ, ПРЕДШЕСТВУЮЩИЙ ИЗОБРЕТЕНИЮ
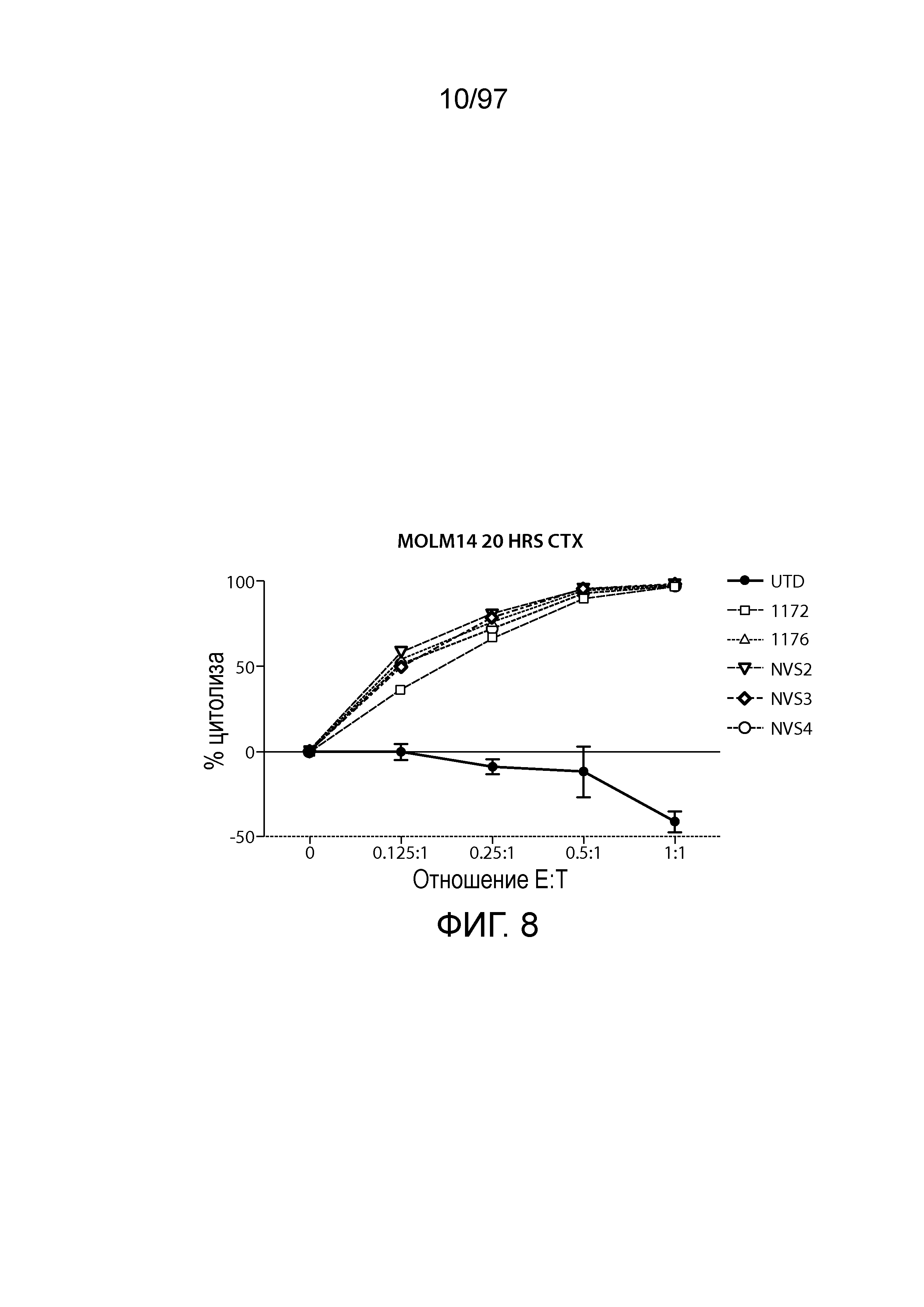
Многих пациентов с острым миелолейкозом (AML) невозможно излечить с использованием стандартной терапии (Mrozek et al., 2012, J. Clin. Oncol., 30:4515-23), и пациенты с рецидивирующим или рефрактерным AML (RR-AML) имеют особенно неблагоприятный прогноз (Kern et al., 2003, Blood, 2003, 101:64-70; Wheatley et al., 1999, Br. J. Haematol., 107:69-79).
Генетическая инженерия может придавать T-клеткам специфичность к выбранной мишени. T-клетки можно трансдуцировать генетическим материалом, кодирующим одноцепочечный вариабельный фрагмент (scFv) антитела, в сочетании с сигнальной молекулой, таким образом, используя определяющую комплементарность область (CDR) для распознавания антигена клеточной поверхности не ограниченным MHC способом. Такие клетки называют T-клетками с химерными антигенными рецепторами (CAR). Доклинические и клинические попытки направленно воздействовать по меньшей мере на 20 различных молекул поверхности при ряде злокачественных новообразований, для которых продемонстрировали некоторую активность, как правило, все еще являлись ограниченными в результате слабой устойчивости слитого продукта CAR-T-клеток (Sadelain et al., 2009, Curr. Opin. Immunol., 2009, 21:215-23). Последние достижения с направленными к CD19 T-клетками у пациентов с CLL и ALL на поздней стадии (Porter et al., 2011, N. Engl. J. Med., 365:725-33; Kalos et al., 2011, Science Transl. Med., 3:95ra73; Grupp and Kalos, 2013, N. Engl. J. Med., 368:1509-18) продемонстрировали, что такие клетки могут устранять массивную опухолевую нагрузку после однократной инфузии с ремиссией, длящейся до 3 лет на настоящий момент, указывая на значительный потенциал терапии CAR-T-клетками. Было проведено несколько доклинических попыток направленно воздействовать на AML на моделях на животных (Marin et al., 2010, Haematologica, 95:2144-52; Tettamanti et al., 2013, Br. J. Haematol., 161:389-401), хотя недавно опубликованное небольшое клиническое испытание продемонстрировало, что приемлемым является получение и инфузия T-клеток пациентам с агрессивным злокачественным новообразованием (Ritchie et al., 2013, Mol. Ther., 21:2122-9). Кроме способности химерного антигенного рецептора на генетически модифицированных T-клетках распознавать и разрушать клетки-мишени, эффективная терапия терапевтическими T-клетками должна обладать способностью пролиферировать и сохраняться в течение длительного периода времени и к дальнейшему мониторингу рецидива. T-клетки могут являться различными по эффективности вследствие толерантности, супрессии или истощения, и в настоящее время специалисты в данной области могут ограниченно контролировать эти признаки. Для того чтобы являться эффективными, трансформированные CAR T-клетки пациента должны сохранять и поддерживать способность пролиферировать в ответ на антиген. Показано, что T-клетки пациента с ALL могут сохранять это свойство с CART19, содержащими scFv мыши (см., например, Grupp et al., NEJM, 368:1509-1518 (2013).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В первом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей химерный антигенный рецептор (CAR), где CAR содержит CD123-связывающий домен (например, принадлежащий человеку или гуманизированный CD123-связывающий домен), трансмембранный домен и внутриклеточный сигнальный домен (например, внутриклеточный сигнальный домен, содержащий костимулирующий домен и/или первичный сигнальный домен). В одном из вариантов осуществления CAR содержит CD123-связывающий домен, описываемый в настоящем описании (например, принадлежащий человеку или гуманизированный CD123-связывающий домен, описываемый в настоящем описании), трансмембранный домен, описываемый в настоящем описании, и внутриклеточный сигнальный домен, описываемый в настоящем описании (например, внутриклеточный сигнальный домен, содержащий костимулирующий домен и/или первичный сигнальный домен).
В одном из вариантов осуществления кодируемый CD123-связывающий домен содержит одну или более (например, все три) определяющую комплементарность область 1 легкой цепи (CDR1 LC), определяющую комплементарность область 2 легкой цепи (CDR2 LC) и определяющую комплементарность область 3 легкой цепи (CDR3 LC) CD123-связывающего домена, описываемого в настоящем описании, и/или одну или более (например, все три) определяющую комплементарность область 1 тяжелой цепи (CDR1 HC), определяющую комплементарность область 2 тяжелой цепи (CDR2 HC) и определяющую комплементарность область 3 тяжелой цепи (CDR3 HC) CD123-связывающего домена, описываемого в настоящем описании, например, CD123-связывающего домена, содержащего одну или более, например, все три, CDR LC и одну или более, например, все три, CDR HC. В одном из вариантов осуществления кодируемый CD123-связывающий домен (например, принадлежащий человеку или гуманизированный CD123-связывающий домен) содержит вариабельную область легкой цепи, описываемую в настоящем описании (например, в таблице 2, 6 или 9), и/или вариабельную область тяжелой цепи, описываемую в настоящем описании (например, в таблице 2, 6 или 9). В одном из вариантов осуществления кодируемый CD123-связывающий домен представляет собой scFv, содержащий легкую цепь и тяжелую цепь аминокислотной последовательности из таблицы 2, 6 или 9. В одном из вариантов осуществления CD123-связывающий домен (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, приведенной в таблице 2, 6 или 9, или последовательность с 95-99% идентичностью с аминокислотной последовательностью из таблицы 2, 6 или 9; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, содержащую по меньшей мере одну, два или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, приведенной в таблице 2, 6 или 9, или последовательность с 95-99% идентичностью с аминокислотной последовательностью из таблицы 2, 6 или 9.
В других вариантах осуществления кодируемый CD123-связывающий домен содержит CDR1 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей CD123-связывающего домена тяжелой цепи, перечисленных в таблице 2, 6 или 9. В вариантах осуществления CD33-связывающий домен дополнительно содержит CDR1 LC, CDR2 LC и CDR3 LC. В вариантах осуществления CD123-связывающий домен содержит CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей CD123-связывающего домена легкой цепи, перечисленных в таблице 2, 6 или 9.
В некоторых вариантах осуществления кодируемый CD123-связывающий домен содержит одну, две или все CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей CD123-связывающего домена легкой цепи, перечисленных в таблице 2 или 9, и одну, две или все CDR1 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей CD123-связывающего домена тяжелой цепи, перечисленных в таблице 2, 6 или 9.
В одном из вариантов осуществления кодируемый CD123-связывающий домен содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:157-160, 184-215, 478, 480, 483 и 485. В одном из вариантов осуществления кодируемый CD123-связывающий домен (например, scFv) содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности 157-160, 184-215, 478, 480, 483 и 485, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 157-160, 184-215, 478, 480, 483 и 485.
В другом варианте осуществления кодируемый CD123-связывающий домен содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 216-219 или 243-274, или аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) SEQ ID NO: 216-219 или 243-274, или последовательность с 95-99% идентичностью SEQ ID NO: 216-219 или 243-274. В другом варианте осуществления кодируемый CD123-связывающий домен содержит вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, соответствующую вариабельной области тяжелой цепи SEQ ID NO:478, 480, 483 или 485, или аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) соответствующего участка SEQ ID NO: 478, 480, 483 или 485, или последовательность с 95-99% идентичностью с соответствующим участком SEQ ID NO: 478, 480, 483 или 485.
В другом варианте осуществления кодируемый CD123-связывающий домен содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 275-278 или 302-333, или аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) SEQ ID NO: 275-278 или 302-333, или последовательность с 95-99% идентичностью с SEQ ID NO: 275-278 или 302-333. В другом варианте осуществления кодируемый CD123-связывающий домен содержит вариабельную область легкой цепи, содержащую аминокислотную последовательность, соответствующую вариабельной области легкой цепи SEQ ID NO: 478, 480, 483 или 485, или аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) соответствующего участка SEQ ID NO: 478, 480, 483 или 485, или последовательность с 95-99% идентичностью с соответствующим участком SEQ ID NO: 478, 480, 483 или 485.
В одном из вариантов осуществления молекула нуклеиновой кислоты, кодирующая scFv, содержащий нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 479, 481, 482, 484, или последовательность с 95-99% идентичностью с ней. В одном из вариантов осуществления молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, где указанная нуклеотидная последовательность содержит участок нуклеотидной последовательности, выбранный из группы, состоящей из SEQ ID NO: 479, 481, 482 и 484, или последовательность с 95-99% идентичностью с ней, соответствующую вариабельной области тяжелой цепи и/или вариабельной области легкой цепи. В одном из вариантов осуществления молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, где кодируемая аминокислотная последовательность выбрана из группы, состоящей из SEQ ID NO: 157-160, или последовательность с 95-99% идентичностью с ней. В одном из вариантов осуществления молекула нуклеиновой кислоты кодирует scFv, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 184-215, или последовательность с 95-99% идентичностью с ней. В одном из вариантов осуществления молекула нуклеиновой кислоты содержит последовательность, кодирующую вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, где кодируемая аминокислотная последовательность выбрана из группы, состоящей из SEQ ID NO: 184-215, или последовательность с 95-99% идентичностью с ней.
В одном из вариантов осуществления кодируемый CD123-связывающий домен содержит линкер (Gly4-Ser)n, где n представляет собой 1, 2, 3, 4, 5 или 6, предпочтительно 3 или 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv может представлять собой, например, в любой из следующих ниже ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
В одном из вариантов осуществления кодируемый CAR содержит трансмембранный домен, который содержит трансмембранный домен белка, например, белка, описываемого в настоящем описании, например, выбранного из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном из вариантов осуществления кодируемый трансмембранный домен содержит последовательность SEQ ID NO: 6. В одном из вариантов осуществления кодируемый трансмембранный домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 6, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 6. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая трансмембранный домен, содержит нуклеотидную последовательность SEQ ID NO: 17, или последовательность с 95-99% идентичностью с ней.
В одном из вариантов осуществления кодируемый CD123-связывающий домен соединен с трансмембранным доменом шарнирной областью, например, шарнирной областью, описываемой в настоящем описании. В одном из вариантов осуществления кодируемая шарнирная область содержит SEQ ID NO: 2 или последовательность с 95-99% идентичностью с ней. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая шарнирную область содержит нуклеотидную последовательность SEQ ID NO: 13 или последовательность с 95-99% идентичностью с ней.
В одном из вариантов осуществления выделенная молекула нуклеиновой кислоты дополнительно содержит последовательность, кодирующую костимулирующий домен, например, костимулирующий домен, описываемый в настоящем описании. В вариантах осуществления внутриклеточный сигнальный домен содержит костимулирующий домен. В вариантах осуществления внутриклеточный сигнальный домен содержит первичный сигнальный домен. В вариантах осуществления внутриклеточный сигнальный домен содержит костимулирующий домен и первичный сигнальный домен.
В одном из вариантов осуществления кодируемый костимулирующий домен представляет собой функциональный сигнальный домен из белка, например, описываемого в настоящем описании, например, выбранного из группы, состоящей из молекулы MHC I класса, TNF рецепторных белков, иммуноглобулиноподобных белков, цитокиновых рецепторов, интегринов, сигнальных молекул, активирующих лимфоциты (белков SLAM), активирующих рецепторов NK-клеток, BTLA, Toll-подобного рецептора, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, который специфически связывается с CD83.
В одном из вариантов осуществления кодируемый костимулирующий домен 4-1BB содержит аминокислотную последовательность SEQ ID NO: 7. В одном из вариантов осуществления кодируемый костимулирующий домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 7, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 7. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая костимулирующий домен, содержит нуклеотидную последовательность SEQ ID NO: 18 или последовательность с 95-99% идентичностью с ней. В другом варианте осуществления кодируемый костимулирующий домен CD28 содержит аминокислотную последовательность SEQ ID NO: 43. В одном из вариантов осуществления кодируемый костимулирующий домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 43, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 43. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая костимулирующий домен CD28, содержит нуклеотидную последовательность SEQ ID NO: 44 или последовательность с 95-99% идентичностью с ней. В другом варианте осуществления кодируемый костимулирующий домен CD27 содержит аминокислотную последовательность SEQ ID NO: 8. В одном из вариантов осуществления кодируемый костимулирующий домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 8 или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 8. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая костимулирующий домен CD27, содержит нуклеотидную последовательность SEQ ID NO: 19 или последовательность с 95-99% идентичностью с ней. В другом варианте осуществления кодируемый костимулирующий домен ICOS содержит аминокислотную последовательность SEQ ID NO: 45. В одном из вариантов осуществления кодируемый костимулирующий домен ICOS содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 45 или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 45. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая костимулирующий домен ICOS, содержит нуклеотидную последовательность SEQ ID NO: 46 или последовательность с 95-99% идентичностью с ней.
В одном из вариантов осуществления выделенная молекула нуклеиновой кислоты дополнительно содержит последовательность, кодирующую внутриклеточный сигнальный домен, например, внутриклеточный сигнальный домен, описываемый в настоящем описании.
В некоторых вариантах осуществления кодируемый первичный сигнальный домен содержит функциональный сигнальный домен CD3-дзета. В вариантах осуществления функциональный сигнальный домен CD3-дзета содержит аминокислотную последовательность SEQ ID NO: 9 (мутантный CD3-дзета) или SEQ ID NO: 10 (CD3-дзета человека дикого типа) или последовательность с 95-99% идентичностью с ней.
В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и/или функциональный сигнальный домен CD3-дзета. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен 4-1BB содержит последовательность SEQ ID NO: 7 и/или аминокислотную последовательность CD3-дзета SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 7 и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 7 и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 7 и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в той же рамке считывания и в виде одной полипептидной цепи. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен, содержит нуклеотидную последовательность SEQ ID NO: 18 или последовательность с 95-99% идентичностью с ней, и/или нуклеотидную последовательность CD3-дзета SEQ ID NO: 20 или SEQ ID NO: 21, или последовательность с 95-99% идентичностью с ней.
В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит функциональный сигнальный домен CD27 и/или функциональный сигнальный домен CD3-дзета. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен CD27 содержит аминокислотную последовательность SEQ ID NO: 8 и/или аминокислотную последовательность CD3-дзета SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 8, и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10 или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 8, и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 8 и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в той же рамке считывания и в виде одной полипептидной цепи. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен CD27, содержит нуклеотидную последовательность SEQ ID NO: 19 или последовательность с 95-99% идентичностью с ней и/или нуклеотидную последовательность CD3-дзета SEQ ID NO: 20 или SEQ ID NO: 21 или последовательность с 95-99% идентичностью с ней.
В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит функциональный сигнальный домен CD28 и/или функциональный сигнальный домен CD3-дзета. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен CD28 содержит аминокислотную последовательность SEQ ID NO: 43 и/или аминокислотную последовательность CD3-дзета SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 43, и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 43, и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 43 и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в той же рамке считывания и в виде одной полипептидной цепи. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен CD28, содержит нуклеотидную последовательность SEQ ID NO: 44, или последовательность с 95-99% идентичностью с ней, и/или нуклеотидную последовательность CD3-дзета SEQ ID NO: 20 или SEQ ID NO: 21, или последовательность с 95-99% идентичностью с ней.
В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит функциональный сигнальный домен ICOS и/или функциональный сигнальный домен CD3-дзета. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен ICOS содержит аминокислотную последовательность SEQ ID NO: 45 и/или аминокислотную последовательность CD3-дзета SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 45, и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 45, и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 45 и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в той же рамке считывания и в виде одной полипептидной цепи. В одном из вариантов осуществления последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен ICOS, содержит нуклеотидную последовательность SEQ ID NO: 46 или последовательность с 95-99% идентичностью с ней, и/или нуклеотидную последовательность CD3-дзета SEQ ID NO: 20 или SEQ ID NO: 21, или последовательность с 95-99% идентичностью с ней.
В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей конструкцию CAR, содержащую лидерную последовательность, например, лидерную последовательность, описываемую в настоящем описании, например, аминокислотную последовательность SEQ ID NO: 1; CD123-связывающий домен, описываемый в настоящем описании, например, CD123-связывающий домен, содержащий CDR1 LC, CDR2 LC, CDR3 LC, CDR1 HC, CDR2 HC и CDR3 HC, описываемые в настоящем описании, например, принадлежащий человеку или гуманизированный CD123-связывающий домен, описанный в таблице 2, 6 или 9, или последовательность с 95-99% идентичностью с ней; шарнирную область, описываемую в настоящем описании, например, шарнирную область, содержащую аминокислотную последовательность SEQ ID NO: 2; трансмембранный домен, описываемый в настоящем описании, например, трансмембранный домен, содержащий аминокислотную последовательность SEQ ID NO: 6, и внутриклеточный сигнальный домен, например, внутриклеточный сигнальный домен, описываемый в настоящем описании. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит костимулирующий домен, например, костимулирующий домен, описываемый в настоящем описании (например, костимулирующий домен 4-1BB, содержащий аминокислотную последовательность SEQ ID NO: 7, или костимулирующий домен CD27, содержащий аминокислотную последовательность SEQ ID NO: 8), и/или первичный сигнальный домен, например, первичный сигнальный домен, описываемый в настоящем описании (например, стимулирующий домен CD3-дзета, содержащий последовательность SEQ ID NO: 9 или SEQ ID NO: 10). В одном из вариантов осуществления выделенная молекула нуклеиновой кислоты, кодирующая конструкцию CAR, включает лидерную последовательность, кодируемую последовательностью нуклеиновой кислоты SEQ ID NO: 12 или последовательностью с 95-99% идентичностью с ней.
В одном из вариантов осуществления выделенная молекула нуклеиновой кислоты содержит (например, состоит из) нуклеиновую кислоту, кодирующую аминокислотную последовательность CAR SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 149, SEQ ID NO: 150, SEQ ID NO: 151, SEQ ID NO: 152, SEQ ID NO: 153, SEQ ID NO: 154, SEQ ID NO: 155 или SEQ ID NO: 156, или аминокислоту, содержащую одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 149, SEQ ID NO: 150, SEQ ID NO: 151, SEQ ID NO: 152, SEQ ID NO: 153, SEQ ID NO: 154, SEQ ID NO: 155,или SEQ ID NO: 156, или аминокислотной последовательности, обладающей 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичностью с аминокислотной последовательностью SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 149, SEQ ID NO: 150, SEQ ID NO: 151, SEQ ID NO: 152, SEQ ID NO: 153, SEQ ID NO: 154, SEQ ID NO: 155 или SEQ ID NO: 156.
В одном из вариантов осуществления выделенная молекула нуклеиновой кислоты содержит (например, состоит из) последовательность нуклеиновой кислоты SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 81, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 85, SEQ ID NO: 86, SEQ ID NO: 87, SEQ ID NO: 88, SEQ ID NO: 89, SEQ ID NO: 90, SEQ ID NO: 91, SEQ ID NO: 92, SEQ ID NO: 93, SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96 или SEQ ID NO: 97, или последовательность нуклеиновой кислоты, обладающую 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичностью с последовательностью нуклеиновой кислоты SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 81, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 85, SEQ ID NO: 86, SEQ ID NO: 87, SEQ ID NO: 88, SEQ ID NO: 89, SEQ ID NO: 90, SEQ ID NO: 91, SEQ ID NO: 92, SEQ ID NO: 93, SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96 или SEQ ID NO: 97.
В одном из аспектов изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей CD123-связывающий домен, где CD123-связывающий домен содержит одну или более (например, все три) определяющую комплементарность область легкой цепи 1 (CDR1 LC), определяющую комплементарность область легкой цепи 2 (CDR2 LC) и определяющую комплементарность область легкой цепи 3 (CDR3 LC) CD123-связывающего домена, описываемого в настоящем описании, и/или одну или более (например, все три) определяющую комплементарность область тяжелой цепи 1 (CDR1 HC), определяющую комплементарность область тяжелой цепи 2 (CDR2 HC) и определяющую комплементарность область тяжелой цепи 3 (CDR3 HC) CD123-связывающего домена, описываемого в настоящем описании, например, принадлежащего человеку или гуманизированного CD123-связывающего домена, содержащего одну или более, например, все три, CDR LC, и одну или более, например, все три CDR HC.
В других вариантах осуществления кодируемый CD123-связывающий домен содержит CDR1 HC, CDR2 HC, и CDR3 HC любой аминокислотной последовательности CD123-связывающего домен тяжелой цепи, приведенной в таблице 2, 6 или 9. В вариантах осуществления CD123-связывающий домен дополнительно содержит CDR1 LC, CDR2 LC и CDR3 LC. В вариантах осуществления CD123-связывающий домен содержит CDR1 LC, CDR2 LC и CDR3 LC любой аминокислотной последовательности CD123-связывающего домена легкой цепи, приведенной в таблице 2, 6 или 9.
В некоторых вариантах осуществления кодируемый CD123-связывающий домен содержит одну, две или все из CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей CD123-связывающего домена легкой цепи, перечисленных в таблице 2, 6 или 9, и одну, две или все из CDR1 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей CD123-связывающего домена тяжелой цепи, перечисленных в таблице 2, 6 или 9.
В одном из вариантов осуществления кодируемый CD123-связывающий домен содержит вариабельную область легкой цепи, описываемую в настоящем описании (например, в SEQ ID NO: 275-278 или 302-333), и/или вариабельную область тяжелой цепи, описываемой в настоящем описании (например, в SEQ ID NO: 216-219 или 243-274). В одном из вариантов осуществления кодируемый CD123-связывающий домен представляет собой scFv, содержащий легкую цепь и тяжелую цепь аминокислотной последовательности из SEQ ID NO: 157-160, 184-215, 478, 480, 483 или 485. В одном из вариантов осуществления CD123-связывающий домен (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области легкой цепи, предоставленной в SEQ ID NO: 275-278 или 302-333, или последовательность с 95-99% идентичностью с аминокислотной последовательностью из SEQ ID NO: 275-278 или 302-333; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, предоставленной в SEQ ID NO: 216-219 или 243-274, или последовательность с 95-99% идентичностью с аминокислотной последовательностью в SEQ ID NO: 216-219 или 243-274.
В одном из вариантов осуществления кодируемый CD123-связывающий домен содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 157, SEQ ID NO: 158, SEQ ID NO: 159, SEQ ID NO: 160, SEQ ID NO: 184, SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187, SEQ ID NO: 188, SEQ ID NO: 189, SEQ ID NO: 190, SEQ ID NO: 191, SEQ ID NO: 192, SEQ ID NO: 193, SEQ ID NO: 194, SEQ ID NO: 195, SEQ ID NO: 196, SEQ ID NO: 197, SEQ ID NO: 198, SEQ ID NO: 199, SEQ ID NO: 200, SEQ ID NO: 201, SEQ ID NO: 202, SEQ ID NO: 203, SEQ ID NO: 204, SEQ ID NO: 205, SEQ ID NO: 206, SEQ ID NO: 207, SEQ ID NO: 208, SEQ ID NO: 209, SEQ ID NO: 210, SEQ ID NO: 211, SEQ ID NO: 212, SEQ ID NO: 213, SEQ ID NO: 214, SEQ ID NO: 215, SEQ ID NO: 478, SEQ ID NO: 480, SEQ ID NO: 483 и SEQ ID NO: 485, или последовательность с 95-99% идентичностью с ней. В одном из вариантов осуществления кодируемый CD123-связывающий домен представляет собой scFv, и вариабельная область легкой цепи, содержащая аминокислотную последовательность, описываемую в настоящем описании, например, в таблице 2, 6 или 9, соединена с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, описываемую в настоящем описании, например, в таблице 2, 6 или 9, через линкер, например, линкер, описываемый в настоящем описании. В одном из вариантов осуществления кодируемый CD123-связывающий домен содержит линкер (Gly4-Ser)n, где n представляет собой 1, 2, 3, 4, 5 или 6, предпочтительно 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv может находиться, например, в любой из следующих ниже ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
Полипептиды
В другом аспекте изобретение относится к выделенной полипептидной молекуле, кодируемой молекулой нуклеиновой кислоты. В одном из вариантов осуществления выделенная полипептидная молекула содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 149, SEQ ID NO: 150, SEQ ID NO: 151, SEQ ID NO: 152, SEQ ID NO: 153, SEQ ID NO: 154, SEQ ID NO: 155 и SEQ ID NO: 156, или аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) любой из указанных выше последовательностей, или последовательность с 95-99% идентичностью с любой из указанных выше последовательностей.
В другом аспекте изобретение относится к молекуле выделенного химерного антигенного рецептора (CAR) (например, полипептида), содержащего CD123-связывающий домен (например, принадлежащего человеку или гуманизированного антитела или фрагмента антитела, который специфически связывается с CD123), трансмембранный домен и внутриклеточный сигнальный домен (например, внутриклеточный сигнальный домен, содержащий костимулирующий домен и/или первичный сигнальный домен). В одном из вариантов осуществления CAR содержит антитело или фрагмент антитела, который содержит CD123-связывающий домен, описываемый в настоящем описании (например, принадлежащее человеку или гуманизированное антитело или фрагмент антитела, который специфически связывается с CD123, как описано в настоящем описании), трансмембранный домен, описываемый в настоящем описании, и внутриклеточный сигнальный домен, описываемый в настоящем описании (например, внутриклеточный сигнальный домен, содержащий костимулирующий домен и/или первичный сигнальный домен, описываемый в настоящем описании).
В одном из вариантов осуществления CD123-связывающий домен содержит одну или более (например, все три) определяющую комплементарность область 1 легкой цепи (CDR1 LC), определяющую комплементарность область 2 легкой цепи (CDR2 LC) и определяющую комплементарность область 3 легкой цепи (CDR3 LC) CD123-связывающего домена, описываемого в настоящем описании, и/или одну или более (например, все три) определяющую комплементарность 1 область тяжелой цепи (CDR1 HC), определяющую комплементарность область 2 тяжелой цепи (CDR2 HC) и определяющую комплементарность область 3 тяжелой цепи (CDR3 HC) CD123-связывающего домена, описываемого в настоящем описании, например, CD123-связывающего домена, содержащего одну или более, например, все три CDR LC и одну или более, например, все три CDR HC. В одном из вариантов осуществления CD123-связывающий домен содержит вариабельную область легкой цепи, описываемую в настоящем описании (например, в таблице 2, 6 или 9), и/или вариабельную область тяжелой цепи, описываемую в настоящем описании (например, в таблице 2, 6 или 9). В одном из вариантов осуществления CD123-связывающий домен представляет собой scFv, содержащий легкую цепь и тяжелую цепь аминокислотной последовательности, приведенной в таблице 2, 6 или 9. В одном из вариантов осуществления CD123-связывающий домен (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, предоставленной в таблице 2, 6 или 9, или последовательность с 95-99% идентичностью с аминокислотной последовательностью, предоставленной в таблице 2, 6 или 9, и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, предоставленной в таблице 2, 6 или 9, или последовательность с 95-99% идентичностью с аминокислотной последовательностью, предоставленной в таблице 2, 6 или 9.
В других вариантах осуществления CD123-связывающий домен содержит CDR1 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей CD123-связывающего домена тяжелой цепи, предоставленных в таблице 2, 6 или 9. В вариантах осуществления CD123-связывающий домен дополнительно содержит CDR1 LC, CDR2 LC и CDR3 LC. В вариантах осуществления CD123-связывающий домен содержит CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей CD123-связывающего домена легкой цепи, перечисленных в таблице 2, 6 или 9.
В некоторых вариантах осуществления CD123-связывающий домен содержит одну, две или все из CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей CD123-связывающего домена легкой цепи, перечисленных в таблице 2, 6 или 9, и одну, две или все из CDR1 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей CD123-связывающего домена тяжелой цепи, перечисленных в таблице 2, 6 или 9.
В одном из вариантов осуществления CD123-связывающий домен содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 157, SEQ ID NO: 158, SEQ ID NO: 159, SEQ ID NO: 160, SEQ ID NO: 184, SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187, SEQ ID NO: 188, SEQ ID NO: 189, SEQ ID NO: 190, SEQ ID NO: 191, SEQ ID NO: 192, SEQ ID NO: 193, SEQ ID NO: 194, SEQ ID NO: 195, SEQ ID NO: 196, SEQ ID NO: 197, SEQ ID NO: 198, SEQ ID NO: 199, SEQ ID NO: 200, SEQ ID NO: 201, SEQ ID NO: 202, SEQ ID NO: 203, SEQ ID NO: 204, SEQ ID NO: 205, SEQ ID NO: 206, SEQ ID NO: 207, SEQ ID NO: 208, SEQ ID NO: 209, SEQ ID NO: 210, SEQ ID NO: 211, SEQ ID NO: 212, SEQ ID NO: 213, SEQ ID NO: 214, SEQ ID NO: 215, SEQ ID NO: 478, SEQ ID NO: 480, SEQ ID NO: 483 и SEQ ID NO: 485, или аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) любой из указанных выше последовательностей; или последовательность с 95-99% идентичностью с любой из указанных выше последовательностей. В одном из вариантов осуществления CD123-связывающий домен представляет собой scFv, и вариабельная область легкой цепи, содержащая аминокислотную последовательность, описываемую в настоящем описании, например, в таблице 2, 6 или 9, соединена с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, описываемую в настоящем описании, например, в таблице 2, 6 или 9, через линкер, например, линкер, описываемый в настоящем описании. В одном из вариантов осуществления CD123-связывающий домен содержит линкер (Gly4-Ser)n, где n представляет собой 1, 2, 3, 4, 5 или 6, предпочтительно 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv может находиться, например, в любой из следующих ниже ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
В одном из вариантов осуществления выделенная молекула CAR содержит трансмембранный домен белка, например, белка, описываемого в настоящем описании, например, выбранного из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном из вариантов осуществления трансмембранный домен содержит последовательность SEQ ID NO: 6. В одном из вариантов осуществления трансмембранный домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 20, 10 или 5 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности SEQ ID NO: 6, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 6.
В одном из вариантов осуществления CD123-связывающий домен соединен с трансмембранным доменом шарнирной областью, например, шарнирной областью, описываемой в настоящем описании. В одном из вариантов осуществления кодируемая шарнирная область содержит SEQ ID NO: 2 или последовательность с 95-99% идентичностью с ней.
В одном из вариантов осуществления выделенная молекула CAR дополнительно содержит последовательность, кодирующую костимулирующий домен, например, костимулирующий домен, описываемый в настоящем описании.
В некоторых вариантах осуществления внутриклеточный сигнальный домен выделенной молекулы CAR содержит костимулирующий домен. В вариантах осуществления внутриклеточный сигнальный домен выделенной молекулы CAR содержит первичный сигнальный домен. В вариантах осуществления внутриклеточный сигнальный домен выделенной молекулы CAR содержит костимулирующий домен и первичный сигнальный домен.
В одном из вариантов осуществления костимулирующий домен содержит функциональный сигнальный домен белка, выбранный из группы, состоящей из молекулы MHC I класса, TNF-рецепторных белков, иммуноглобулиноподобных белков, цитокиновых рецепторов, интегринов, сигнальных молекул, активирующих лимфоциты (белков SLAM), активирующих рецепторов NK-клеток, BTLA, Toll-подобного рецептора,, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, который специфически связывается с CD83.
В одном из вариантов осуществления костимулирующий домен 4-1BB содержит последовательность SEQ ID NO: 7. В одном из вариантов осуществления костимулирующий домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 20, 10 или 5 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности SEQ ID NO: 7, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 7. В другом варианте осуществления костимулирующий домен CD28 содержит аминокислотную последовательность SEQ ID NO: 43. В одном из вариантов осуществления костимулирующий домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 43, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 43. В другом варианте осуществления костимулирующий домен CD27 содержит аминокислотную последовательность SEQ ID NO: 8. В одном из вариантов осуществления костимулирующий домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 8, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 8. В другом варианте осуществления костимулирующий домен ICOS содержит аминокислотную последовательность SEQ ID NO: 45. В одном из вариантов осуществления костимулирующий домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 45, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 45.
В вариантах осуществления первичный сигнальный домен содержит функциональный сигнальный домен CD3-дзета. В вариантах осуществления функциональный сигнальный домен CD3-дзета, содержит SEQ ID NO: 9 (мутантный CD3-дзета) или SEQ ID NO: 10 (CD3-дзета человека дикого типа) или последовательность с 95-99% идентичностью с ней.
В одном из вариантов осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и/или функциональный сигнальный домен CD3-дзета. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность SEQ ID NO: 7 и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 20, 10 или 5 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности SEQ ID NO: 7, и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 7, и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность SEQ ID NO: 7 и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в той же рамке считывания и в виде одной полипептидной цепи.
В одном из вариантов осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен CD27 и/или функциональный сигнальный домен CD3-дзета. В одном из вариантов осуществления внутриклеточный сигнальный домен CD27 содержит аминокислотную последовательность SEQ ID NO: 8 и/или аминокислотную последовательность CD3-дзета SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 8 и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 8, и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 8 и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в той же рамке считывания и в виде одной полипептидной цепи.
В одном из вариантов осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен CD28 и/или функциональный сигнальный домен CD3-дзета. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен CD28 содержит аминокислотную последовательность SEQ ID NO: 43 и/или аминокислотную последовательность CD3-дзета SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 43, и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 43, и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 43 и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в той же рамке считывания и в виде одной полипептидной цепи.
В одном из вариантов осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен ICOS и/или функциональный сигнальный домен CD3-дзета. В одном из вариантов осуществления внутриклеточный сигнальный домен ICOS содержит аминокислотную последовательность SEQ ID NO: 45 и/или аминокислотную последовательность CD3-дзета SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 45, и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 381, и/или аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления кодируемый внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 45 и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в той же рамке считывания и в виде одной полипептидной цепи.
В одном из вариантов осуществления выделенная молекула CAR дополнительно содержит лидерную последовательность, например, лидерную последовательность, описываемую в настоящем описании. В одном из вариантов осуществления лидерная последовательность содержит аминокислотную последовательность SEQ ID NO: 1 или последовательность с 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 1.
В другом аспекте изобретение относится к выделенной молекуле CAR, содержащей лидерную последовательность, например, лидерную последовательность, описываемую в настоящем описании, например, лидерную последовательность SEQ ID NO: 1 или обладающую 95-99% идентичностью с ней, CD123-связывающий домен, описываемый в настоящем описании, например, CD123-связывающий домен, содержащий CDR1 LC, CDR2 LC, CDR3 LC, CDR1 HC, CDR2 HC и CDR3 HC, описываемые в настоящем описании, например, CD123-связывающий домен, описанный в таблице 2 или 6, или последовательность с 95-99% идентичностью с ней, шарнирную область, например, шарнирную область, описываемую в настоящем описании, например, шарнирную область SEQ ID NO: 2, или обладающую 95-99% идентичностью с ней, трансмембранный домен, например, трансмембранный домен, описываемый в настоящем описании, например, трансмембранный домен, содержащий последовательность SEQ ID NO: 6 или последовательность, обладающую 95-99% идентичностью с ней, внутриклеточный сигнальный домен, например, внутриклеточный сигнальный домен, описываемый в настоящем описании (например, внутриклеточный сигнальный домен, содержащий костимулирующий домен и/или первичный сигнальный домен). В одном из вариантов осуществления внутриклеточный сигнальный домен содержит костимулирующий домен, например, костимулирующий домен, описываемый в настоящем описании, например, костимулирующий домен 4-1BB, содержащий последовательность SEQ ID NO: 7 или обладающий 95-99% идентичностью с ней, и/или первичный сигнальный домен, например, первичный сигнальный домен, описываемый в настоящем описании, например, стимулирующий домен CD3-дзета, содержащий последовательность SEQ ID NO: 9 или SEQ ID NO: 10 или обладающий 95-99% идентичностью с ней. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит костимулирующий домен, например, костимулирующий домен, описываемый в настоящем описании, например, костимулирующий домен 4-1BB, содержащий последовательность SEQ ID NO: 7, и/или первичный сигнальный домен, например, первичный сигнальный домен, описываемый в настоящем описании, например, стимулирующий домен CD3-дзета, содержащий последовательность SEQ ID NO: 9 или SEQ ID NO: 10.
В одном из вариантов осуществления выделенная молекула CAR содержит (например, состоит из) аминокислотную последовательность SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 149, SEQ ID NO: 150, SEQ ID NO: 151, SEQ ID NO: 152, SEQ ID NO: 153, SEQ ID NO: 154, SEQ ID NO: 155 и SEQ ID NO: 156 или аминокислотную последовательность, содержащую по меньшей мере одну, две, три, четыре, пять, 10, 15, 20 или 30 модификаций (например, замен, например, консервативных замен), но не более 60, 50 или 40 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 149, SEQ ID NO: 150, SEQ ID NO: 151, SEQ ID NO: 152, SEQ ID NO: 153, SEQ ID NO: 154, SEQ ID NO: 155 и SEQ ID NO: 156, или аминокислотную последовательность, обладающую 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичностью с аминокислотной последовательностью SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 125, SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 149, SEQ ID NO: 150, SEQ ID NO: 151, SEQ ID NO: 152, SEQ ID NO: 153, SEQ ID NO: 154, SEQ ID NO: 155 и SEQ ID NO: 156.
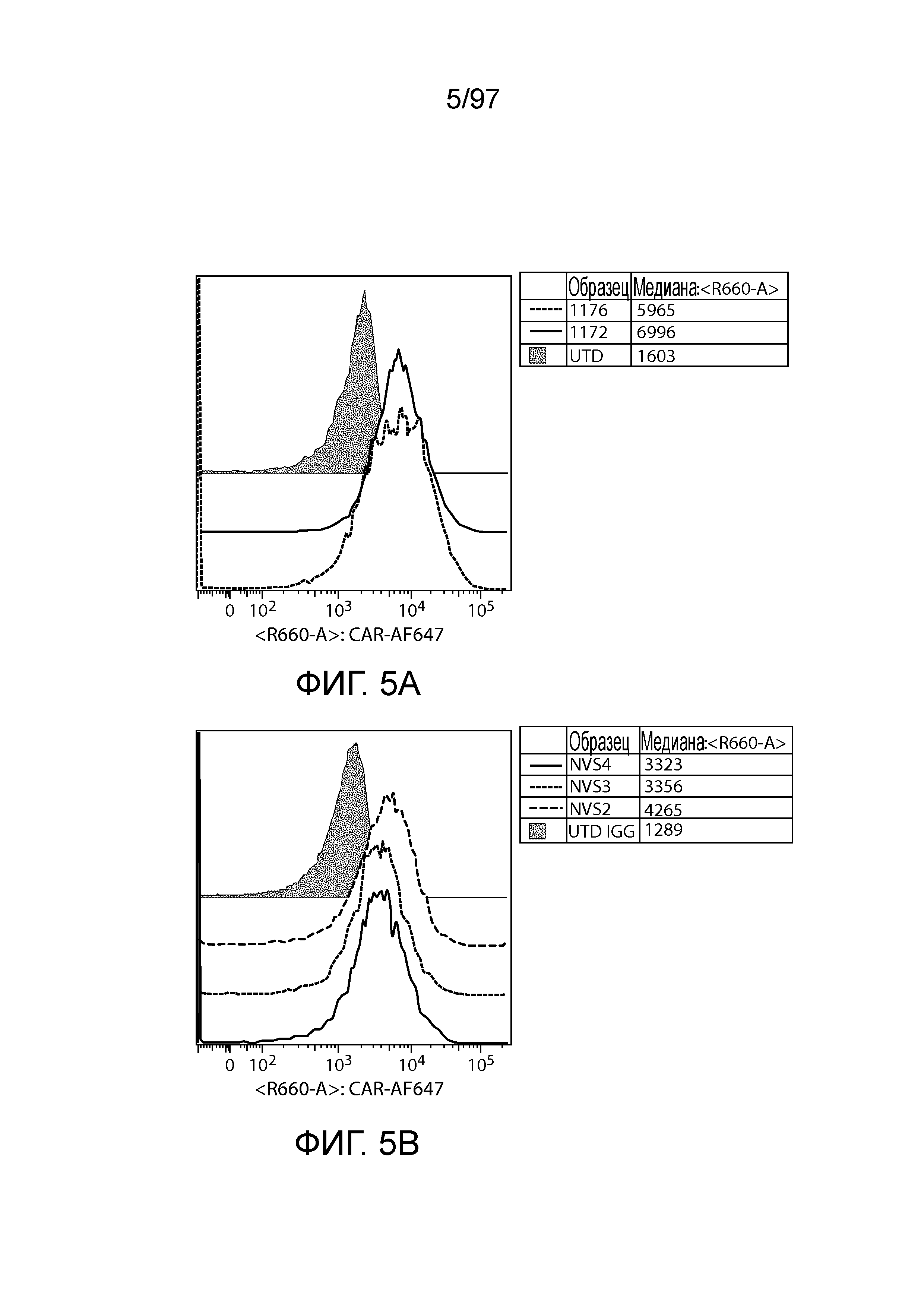
В одном из аспектов изобретение относится к CD123-связывающему домену, содержащему одну или более (например, все три) определяющую комплементарность область 1 легкой цепи (CDR1 LC), определяющую комплементарность область 2 легкой цепи (CDR2 LC) и определяющую комплементарность область 3 легкой цепи (CDR3 LC) CD123-связывающего домена, описываемого в настоящем описании, и/или одну или более (например, все три) определяющую комплементарность область 1 тяжелой цепи (CDR1 HC), определяющую комплементарность область 2 тяжелой цепи (CDR2 HC) и определяющую комплементарность область 3 тяжелой цепи (CDR3 HC) CD123-связывающего домена, описываемого в настоящем описании, например, CD123-связывающий домен, содержащего одну или более, например, все три CDR LC и одну или более, например, все три CDR HC (например, одну, две или три CDR HC в соответствии с таблицами 3, 7, 10 или 12, и/или одну, две или три CDR LC в соответствии с таблицами 4, 8, 11 или 13).
В других вариантах осуществления CD123-связывающий домен содержит CDR1 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей CD123-связывающего домена тяжелой цепи, перечисленных в таблице 2, 6 или 9. В вариантах осуществления CD123-связывающий домен дополнительно содержит CDR1 LC, CDR2 LC и CDR3 LC. В вариантах осуществления CD123-связывающий домен содержит CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей CD123-связывающего домена легкой цепи, перечисленных в таблице 2, 6 или 9.
В некоторых вариантах осуществления CD123-связывающий домен содержит одну, две или все из CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей CD123-связывающего домена легкой цепи, перечисленных в таблице 2, 6 или 9, и одну, две или все из CDR11 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей CD123-связывающего домена тяжелой цепи, перечисленных в таблице 2, 6 или 9.
В одном из вариантов осуществления CD123-связывающий домен содержит вариабельную область легкой цепи, описываемую в настоящем описании (например, в SEQ ID NO: 275-278 или 302-333), и/или вариабельную область тяжелой цепи, описываемую в настоящем описании (например, в SEQ ID NO: 216-219 или 243-274). В одном из вариантов осуществления CD123-связывающий домен представляет собой scFv, содержащий легкую цепь и тяжелую цепь аминокислотной последовательности SEQ ID NO: 157-160, 184-215, 478, 480, 483 или 485. В одном из вариантов осуществления CD123-связывающий домен (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области легкой цепи, предоставленной в SEQ ID NO: 275-278 или 302-333, или последовательность с 95-99% идентичностью с аминокислотной последовательностью в SEQ ID NO: 275-278 или 302-333; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены, например, консервативные замены), но не более 30, 20 или 10 модификаций (например, замен, например, консервативных замен) аминокислотной последовательности вариабельной области тяжелой цепи, предоставленной в SEQ ID NO: 216-219 или 243-274, или последовательность с 95-99% идентичностью с аминокислотной последовательностью в SEQ ID NO: 216-219 или 243-274.
В одном из вариантов осуществления CD123-связывающий домен содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 157, SEQ ID NO: 158, SEQ ID NO: 159, SEQ ID NO: 160, SEQ ID NO: 184, SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187, SEQ ID NO: 188, SEQ ID NO: 189, SEQ ID NO: 190, SEQ ID NO: 191, SEQ ID NO: 192, SEQ ID NO: 193, SEQ ID NO: 194, SEQ ID NO: 195, SEQ ID NO: 196, SEQ ID NO: 197, SEQ ID NO: 198, SEQ ID NO: 199, SEQ ID NO: 200, SEQ ID NO: 201, SEQ ID NO: 202, SEQ ID NO: 203, SEQ ID NO: 204, SEQ ID NO: 205, SEQ ID NO: 206, SEQ ID NO: 207, SEQ ID NO: 208, SEQ ID NO: 209, SEQ ID NO: 210, SEQ ID NO: 211, SEQ ID NO: 212, SEQ ID NO: 213, SEQ ID NO: 214, SEQ ID NO: 215, SEQ ID NO: 478, SEQ ID NO: 480, SEQ ID NO: 483 и SEQ ID NO: 485, или последовательность с 95-99% идентичностью с ней. В одном из вариантов осуществления CD123-связывающий домен представляет собой scFv, и вариабельная область легкой цепи, содержащая аминокислотную последовательность, описываемую в настоящем описании, например, в таблице 2, 6 или 9, соединена с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, описываемую в настоящем описании, например, в таблице 2, 6 или 9, через линкер, например, линкер, описываемый в настоящем описании. В одном из вариантов осуществления CD123-связывающий домен содержит линкер (Gly4-Ser)n, где n представляет собой 1, 2, 3, 4, 5 или 6, предпочтительно 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv может находиться, например, в любой из следующих ниже ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
Нуклеинов кислоты, векторы и клетки
Молекулы нуклеиновой кислоты, описываемые в настоящем описании, может представлять собой молекулу ДНК, молекулу РНК или их сочетание. В одном из вариантов осуществления молекула нуклеиновой кислоты представляет собой иРНК, кодирующую полипептид CAR, как описано в настоящем описании. В других вариантах осуществления молекула нуклеиновой кислоты представляет собой вектор, который содержит любую из указанных выше молекул нуклеиновой кислоты.
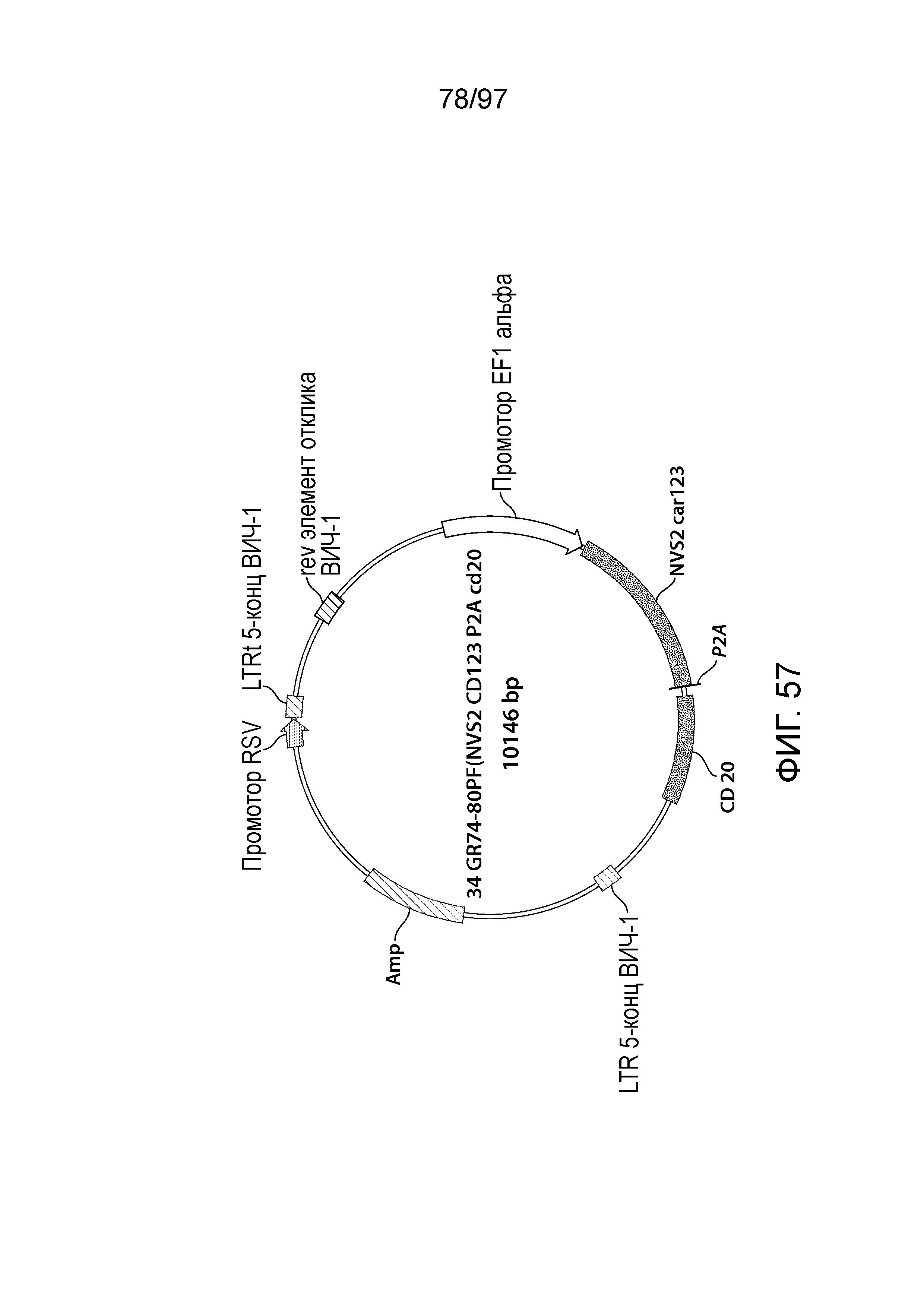
В другом аспекте изобретение относится к вектору, содержащему молекулу нуклеиновой кислоты, описываемую в настоящем описании, например, молекулу нуклеиновой кислоты, кодирующую CAR, описываемый в настоящем описании. В одном из вариантов осуществления вектор выбран из группы, состоящей из молекулы ДНК или молекулы РНК (например, плазмиды, лентивирусного вектора, аденовирусного вектора или ретровирусного вектора).
В одном из вариантов осуществления вектор представляет собой лентивирусный вектор. В одном из вариантов осуществления вектор дополнительно содержит промотор. В одном из вариантов осуществления промотор представляет собой промотор EF-1. В одном из вариантов осуществления промотор EF-1 содержит последовательность SEQ ID NO: 11. В другом варианте осуществления промотор представляет собой промотор PGK, например, усеченный промотор PGK, как описано в настоящем описании.
В одном из вариантов осуществления вектор представляет собой транскрибируемый вектор in vitro, например, вектор, который транскрибирует РНК молекулы нуклеиновой кислоты, описываемой в настоящем описании. В одном из вариантов осуществления последовательность нуклеиновой кислоты в векторе дополнительно содержит хвост поли(A), например, хвост поли-A, описываемый в настоящем описании, (например, содержащий приблизительно 150 аденозиновых оснований (SEQ ID NO: 705)). В одном из вариантов осуществления последовательность нуклеиновой кислоты в векторе дополнительно содержит 3'-UTR, например, 3'-UTR, описываемую в настоящем описании, например, содержащую по меньшей мере один повтор 3'-UTR, получаемой из бета-глобулина человека. В одном из вариантов осуществления последовательность нуклеиновой кислоты в векторе дополнительно содержит промотор, например, промотор T2A.
В другом аспекте изобретение относится к клетке, содержащей молекулу нуклеиновой кислоты или вектор, или экспрессирующей полипептид CAR, как описано в настоящем описании. В одном из вариантов осуществления клетка представляет собой клетку, описываемую в настоящем описании, например, эффекторную клетку иммунной системы (например, T-клетку человека или NK-клетку, например, T-клетку человека или NK-клетку, как описано в настоящем описании, или их популяцию клеток). В одном из вариантов осуществления T-клетка человека представляет собой T-клетку CD8+. В некоторых вариантах осуществления клетка экспрессирует нуклеиновая кислота или полипептид CAR или в какой-то момент времени экспрессировала нуклеиновую кислоту или полипептид CAR (например, транзиторно экспрессировала молекулу CAR).
В некотором варианте осуществления клетка (например, экспрессирующая CAR клетка), описываемая в настоящем описании, может дополнительно экспрессировать другое средство, например, средство, которое усиливает активность экспрессирующей CAR клетки. Например, в одном из вариантов осуществления средство может представлять собой химерную молекулу, которая содержит ингибирующую молекулу или ее домен. Примеры ингибирующих молекул включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозин и TGFR (например, TGFR бета), например, как описано в настоящем описании. В одном из вариантов осуществления химерная молекула, содержит первый полипептид, например, ингибирующую молекулу, связанную со вторым полипептидом, который обеспечивает положительный сигнал клетке, например, внутриклеточный сигнальный домен, описываемый в настоящем описании. В одном из вариантов осуществления средство содержит первый полипептид, например, ингибирующей молекулы, такой как PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозин и TGFR (например, TGFR бета), или фрагмент любых из указанных выше (например, по меньшей мере участок внеклеточного домена любых из указанных выше), и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описываемый в настоящем описании (например, содержащий костимулирующий домен (например, 41BB, CD27 или CD28, например, как описано в настоящем описании), и/или первичный сигнальный домен (например, сигнальный домен CD3-дзета, описываемый в настоящем описании). В одном из вариантов осуществления средство содержит первый полипептид PD1 или его фрагмент (например, по меньшей мере участок внеклеточного домена PD1) и второй полипептид внутриклеточного сигнального домена, описываемого в настоящем описании (например, сигнальный домен CD28, описываемый в настоящем описании, и/или сигнальный домен CD3-дзета, описываемый в настоящем описании).
В другом аспекте изобретение относится к способу получения клетки, например, эффекторной клетки иммунной системы. Способ включает введение, например, трансдукцию, эффекторной клетки иммунной системы молекулой нуклеиновой кислоты, описываемой в настоящем описании (например, молекулой РНК, например, иРНК), или вектором, содержащим молекулу нуклеиновой кислоты, кодирующую CAR, например, CAR, описываемый в настоящем описании.
Настоящее изобретение также относится к способу получения клеток (например, сконструированные с помощью РНК клетки, транзиторно экспрессирующие экзогенную РНК). Способ включает введение в клетку РНК, как описано в настоящем описании (например, транскрибируемую in vitro РНК или синтетическую РНК; последовательность иРНК, кодирующую полипептид CAR, как описано в настоящем описании). В вариантах осуществления РНК экспрессирует полипептид CAR транзиторно. В одном из вариантов осуществления клетка представляет собой клетку, как описано в настоящем описании, например, эффекторную клетку иммунной системы (например, T-клетки или NK-клетки, или популяцию клеток).
Терапевтические применения
В другом аспекте изобретение относится к способу обеспечения противоопухолевого иммунитета у млекопитающего, включающему введение млекопитающему эффективного количества клетки, экспрессирующей молекулу CAR, например, клетки, экспрессирующей молекулу CAR, описываемую в настоящем описании. В одном из вариантов осуществления клетка представляет собой аутологичную эффекторную клетку иммунной системы, например, T-клетку или NK-клетку. В одном из вариантов осуществления клетка представляет собой аллогенную эффекторную клетку иммунной системы, например, T-клетку или NK-клетку. В одном из вариантов осуществления млекопитающее представляет собой человека, например, пациента с гематологической злокачественной опухолью.
В другом аспекте изобретение относится к способу лечения млекопитающего, страдающего заболеванием, связанным с экспрессией CD123 (например, пролиферативным заболеванием, предраковым состоянием или незлокачественной опухолью, родственного показания, связанного с экспрессией CD123). Способ включает введение млекопитающему эффективного количества клеток, экспрессирующих молекулу CAR, например, молекулу CAR, описываемую в настоящем описании. В одном из вариантов осуществления млекопитающее представляет собой человека, например, пациента с гематологической злокачественной опухолью.
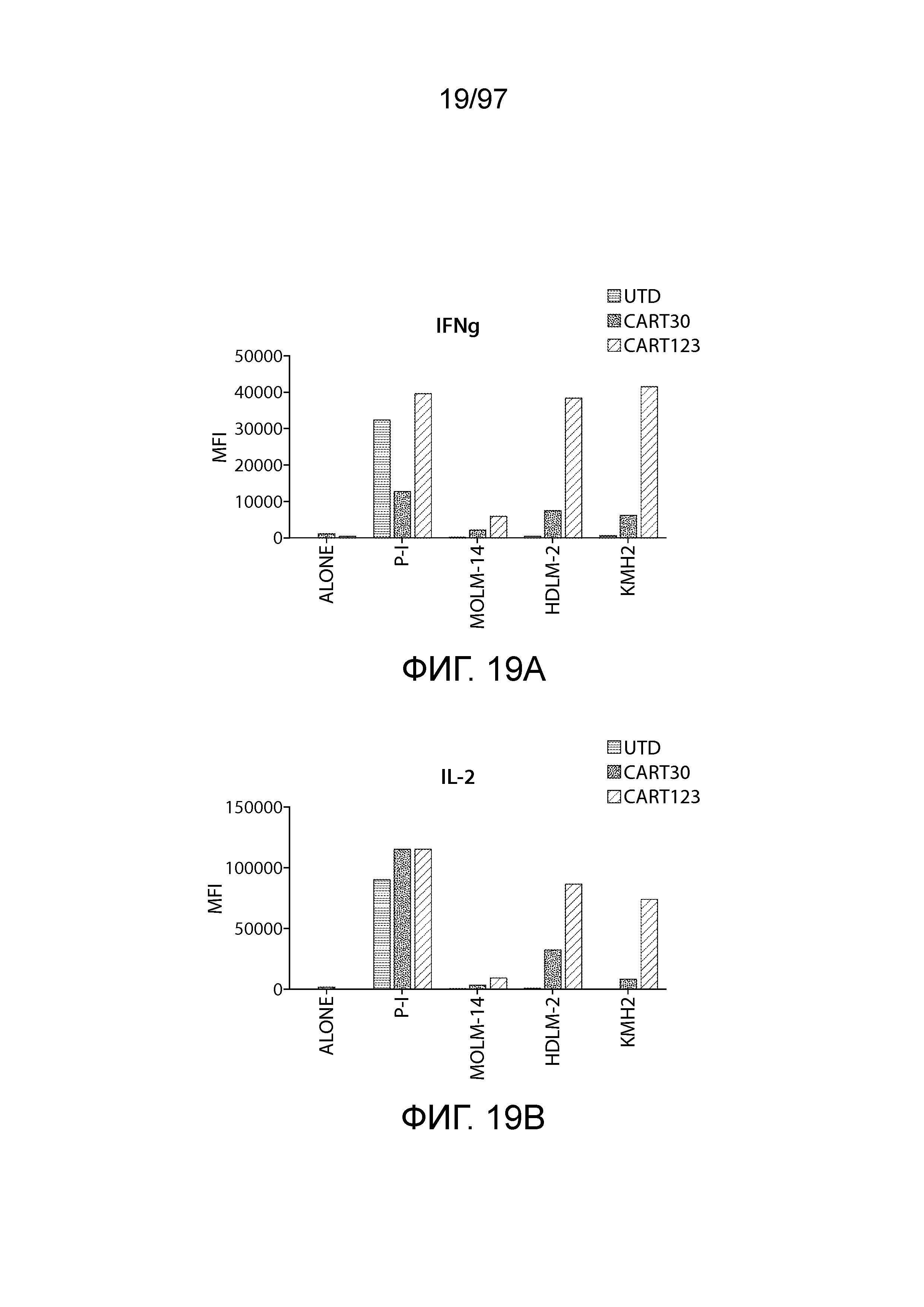
В одном из вариантов осуществления заболевание представляет собой заболевание, описываемое в настоящем описании. В одном из вариантов осуществления заболевание, ассоциированное с экспрессией CD123, выбирают из: пролиферативного заболевания, такого как злокачественная опухоль или злокачественное новообразование; предракового состояния, такого как миелодисплазия, миелодиспластический синдром или предлейкоз, или незлокачественной опухоли, родственного показания, связанного с экспрессией CD123. В одном из вариантов осуществления заболевание представляет собой гематологическую злокачественную опухоль. В других вариантах осуществления заболевание выбирают из одного или более из острых лейкозов, включая, но, не ограничиваясь ими, острый миелолейкоз (AML), острый лимфобластный лейкоз (ALL), острый лимфобластный B-клеточный лейкоз (острый лимфоидный B-клеточный лейкоз, BALL) и острый лимфобластный T-клеточный лейкоз (острый T-клеточный лимфоидный лейкоз (TALL); миелодиспластического синдрома; миелопролиферативной неоплазии; гистиоцитоза (например, мастоцитоза или новообразования из бластных плазмоцитоидных дендритных клеток); мастоцитоза, например, системного мастоцитоза или тучноклеточного лейкоза; хронического миелолейкоза (CML) и новообразования из бластных плазмоцитоидных дендритных клеток. В других вариантах осуществления заболевание, связанное с экспрессией CD123, включает, но не ограничивается ими, атипичную и/или неклассическую злокачественную опухоль, злокачественное новообразование, предраковое состояние или пролиферативное заболевание, при котором экспрессируется CD123, и их сочетаний.
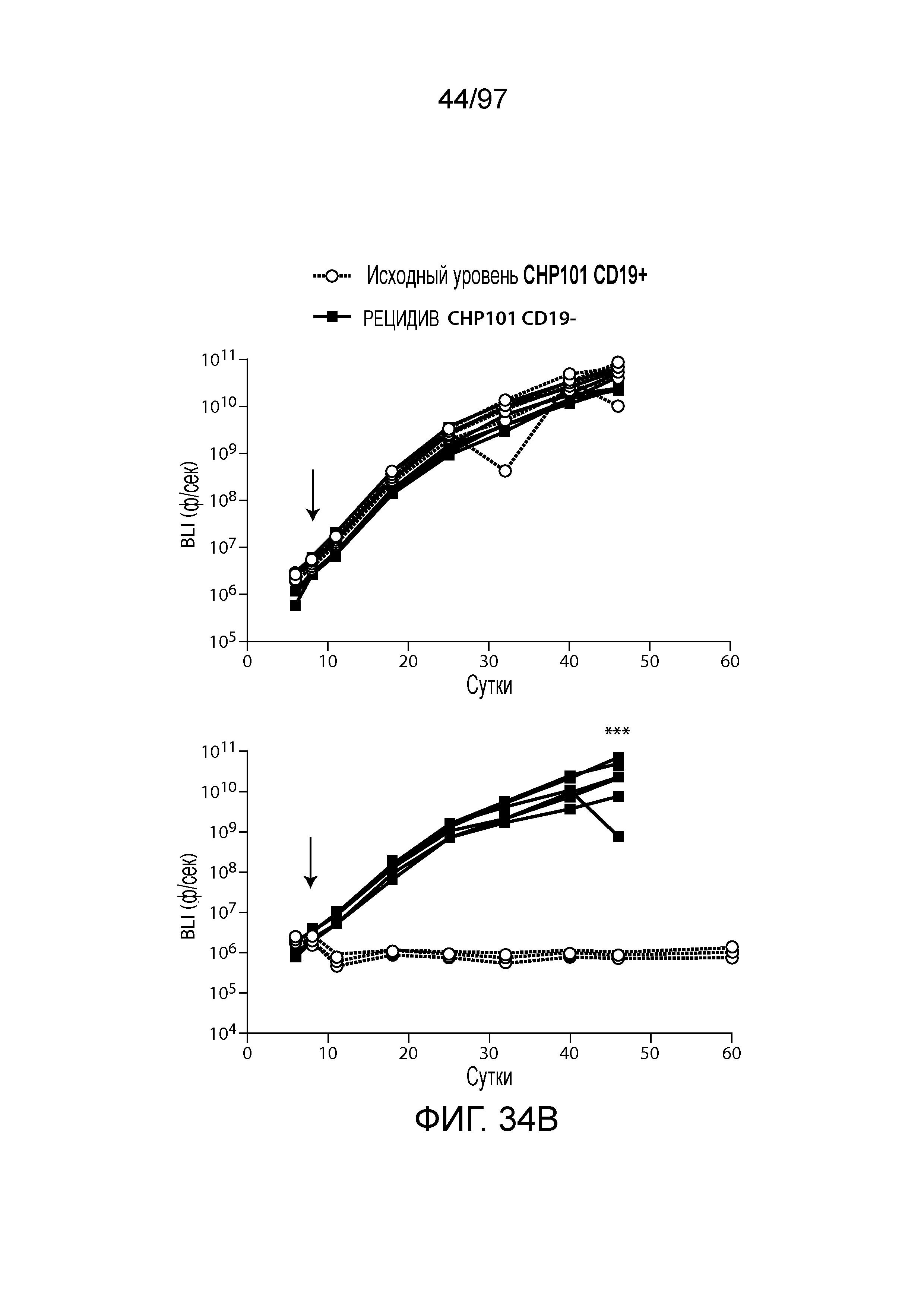
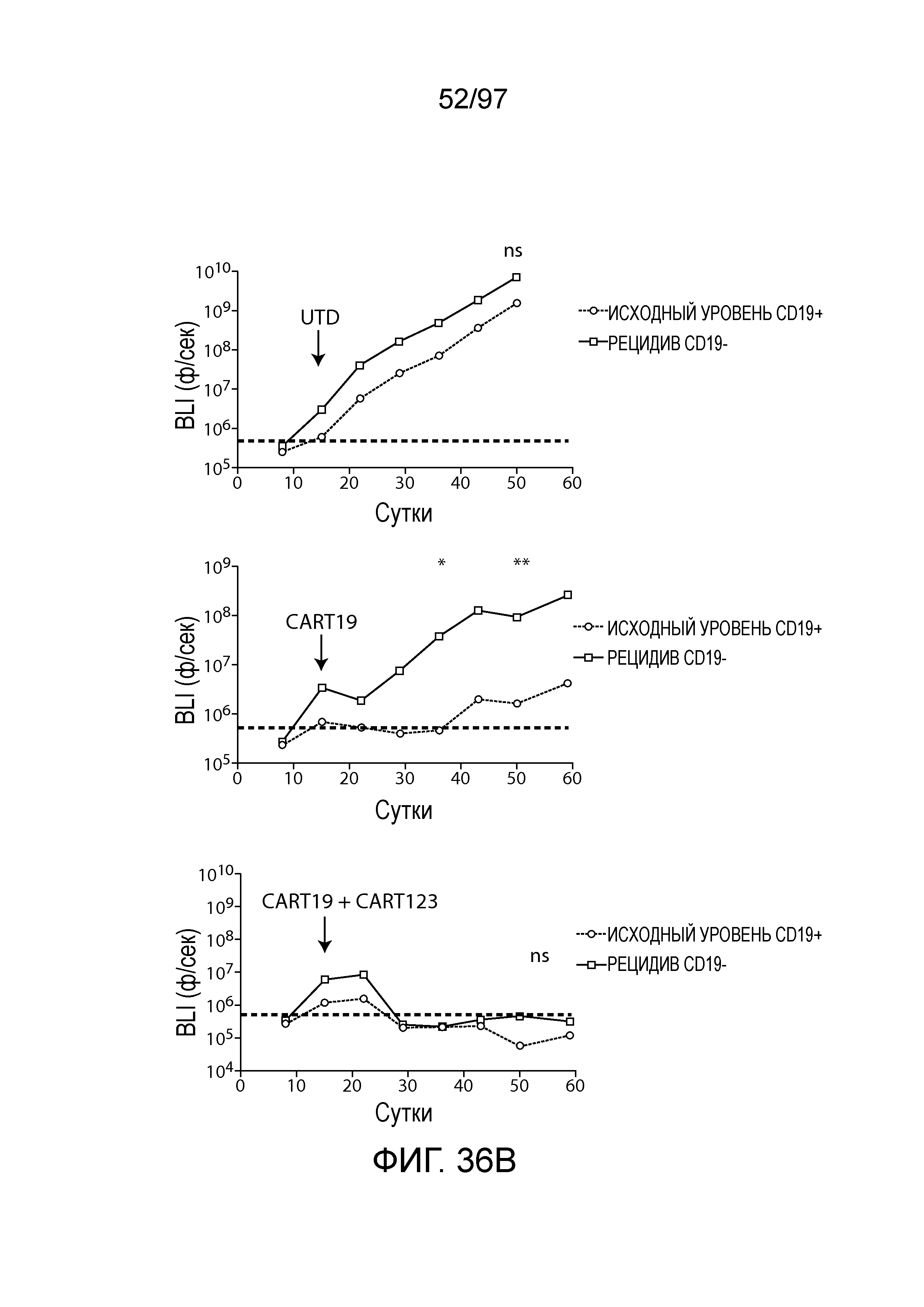
В одном из вариантов осуществления заболевание выбирают из одного или более из острого миелолейкоза (AML), острого лимфобластного лейкоза (ALL), острого лимфобластного B-клеточного лейкоза (острого лимфоидного B-клеточного лейкоза, BALL), острого лимфобластного T-клеточного лейкоза (острого лимфоидного T-клеточного лейкоза (TALL), B-клеточного пролимфоцитарного лейкоза, хронического лимфоцитарного лейкоза, хронического миелолейкоза (CML), волосатоклеточного лейкоза, лимфомы Ходжкина, мастоцитоза, гистиоцитоза, миелодиспластического синдрома, миелопролиферативной неоплазии, плазмоклеточной миеломы, новообразования из бластных плазмоцитоидных дендритных клеток или их сочетания. В одном из вариантов осуществления заболевание представляет собой лейкоз, например, ALL (например, рецидивирующий и рефрактерный ALL) или AML. В других вариантах осуществления заболевание представляет собой CD19-отрицательную злокачественную опухоль, например, CD19-отрицательную рецидивирующую злокачественную опухоль.
В некоторых вариантах осуществления любого из указанных выше способов, клетка, например, популяция эффекторных клеток иммунной системы, содержит вектор, например, лентивирусный вектор, содержащий молекулу нуклеиновой кислоты, кодирующую полипептид CAR, как описано в настоящем описании.
В других вариантах осуществления любого из указанных выше способов, клетка, например, популяция эффекторных клеток иммунной системы, содержит иРНК, кодирующую полипептид CAR, как описано в настоящем описании. В одном из вариантов осуществления клетка представляет собой экспрессирующую CAR популяцию клеток, сконструированные с помощью РНК, например, популяцию транзиторно экспрессирующих клеток.
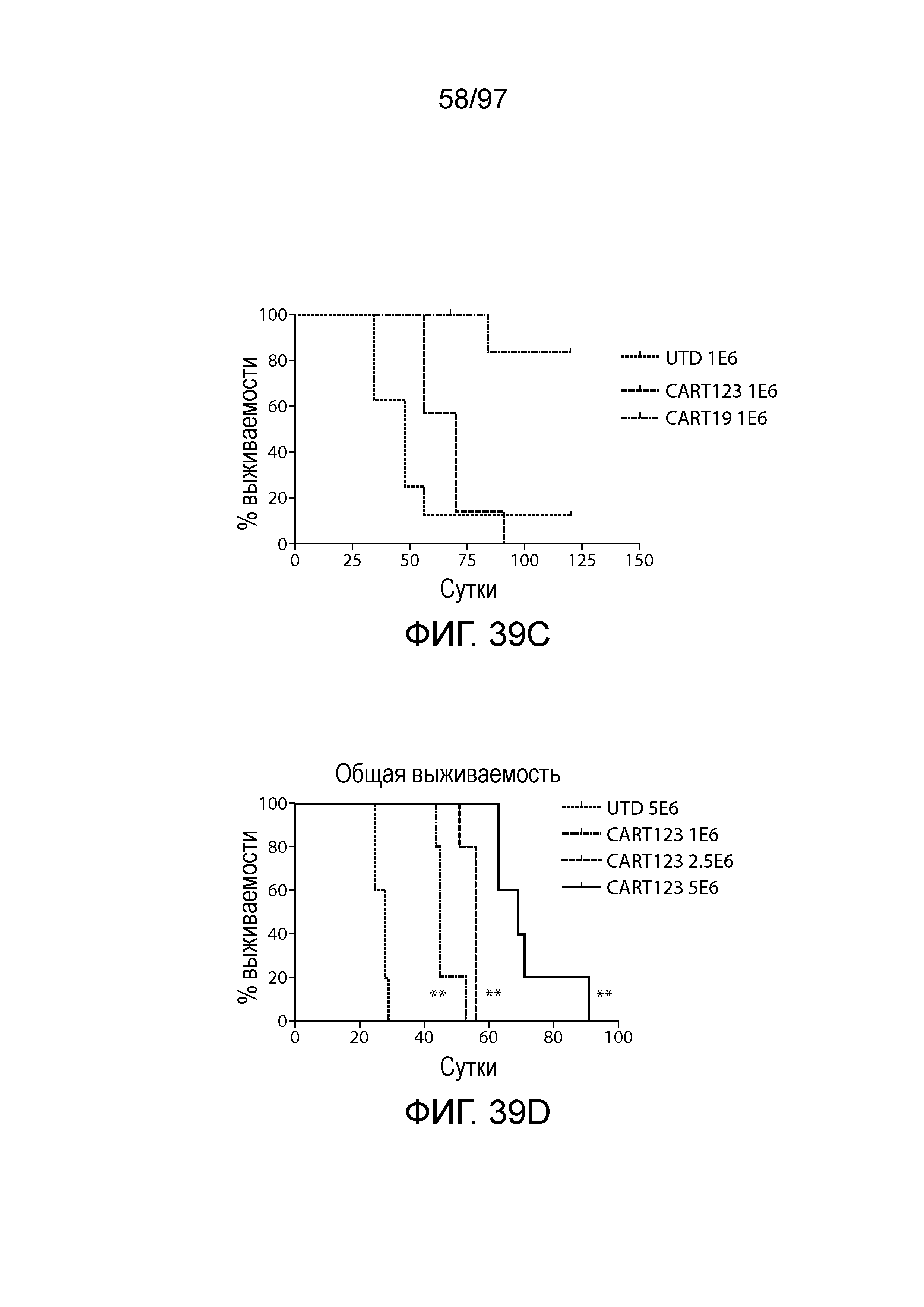
В некоторых вариантах осуществления любого из указанных выше способов способ дополнительно включает введение одной или более доз клетки (например, иммунная клетка, содержащая нуклеиновую кислоту CAR или полипептид CAR, как описано в настоящем описании) млекопитающему (например, млекопитающему, страдающему злокачественной опухолью, например, гематологической злокачественной опухолью, как описано в настоящем описании (например, AML или ALL)). В некоторых вариантах осуществления одна или более доз CAR-клеток (например, CAR-клеток CD123) содержит по меньшей мере приблизительно 1×106, 5×106, 1×107, 2×107, 5×107, 1×108, 2×108, 5×108, 1×109, 2×109 или 5×109 клеток.
В одном из вариантов осуществления вводят до 10, 9, 8, 7, 6, 5, 4, 3 или 2 доз клеток. В других вариантах осуществления вводят одну, две, три, четыре, пять или 6 доз клеток млекопитающему, например, с интервалами лечения одна, две, три, четыре или более недель. В одном из вариантов осуществления вводят до 6 доз через две недели. Дозы могут являться одинаковыми или различными. В одном из вариантов осуществления сначала вводят более низкую дозу с последующим введением одной или нескольких более высоких доз. В одном иллюстративном варианте осуществления более низкая доза составляет приблизительно от 1×105 до 1×109 клеток/кг или 1×106 до 1×108 клеток/кг, и более высокая доза составляет приблизительно от 2×105 до 2×109 клеток/кг или от 2×106 до 2×108 клеток/кг с последующими 3-6 дозами of приблизительно от 4×105 до 4×109 клеток/кг или 4×106 до 4×108 клеток/кг.
В одном из вариантов осуществления одна или более доз клеток вводят после одного или более видов противолимфомной терапии, например, противолимфомной химиотерапии. В одном из вариантов осуществления противолимфомная терапия включает химиотерапию (например, циклофосфамид).
В одном из вариантов осуществления за одной или более доз следует трансплантация клеток, например, трансплантация аллогенных гемопоэтических стволовых клеток. Например, трансплантация аллогенных гемопоэтических стволовых клеток происходит приблизительно от 20 приблизительно до 35 суток, например, приблизительно от 23 и 33 суток.
В некоторых вариантах осуществления клетка, например, популяцию эффекторных клеток иммунной системы (например, клеток, экспрессирующих молекулу CAR, описываемую в настоящем описании) вводят в комбинации с одним или более терапевтических средств или процедур, как описано в настоящем описании.
В одном из вариантов осуществления клетка, например, популяция эффекторных клеток иммунной системы (например, клеток, экспрессирующих молекулу CAR, описываемую в настоящем описании) вводят в комбинации со средством, которое повышает эффективность клетки, экспрессирующей молекулу CAR, например, средством, описываемым в настоящем описании.
В одном из вариантов осуществления клетка, например, популяция эффекторных клеток иммунной системы (например, клеток, экспрессирующих молекулу CAR, описываемую в настоящем описании) вводят в комбинации с низкой иммуностимулирующей дозой ингибитора mTOR. Без желания быть связанными теорией, полагают, что лечение низкой иммуностимулирующей дозой (например, дозой, которая является недостаточной для того, чтобы полностью подавлять иммунную систему, но достаточной для улучшения иммунной функции) сопровождается снижением PD-1-положительных T-клеток или повышением PD-1-отрицательных клеток. PD-1-положительные T-клетки, но не PD-1-отрицательные можно подвергать истощению путем введения клеток, которые экспрессируют лиганд PD-1, например, PD-L1 или PD-L2.
В одном из вариантов осуществления такой подход можно использовать для оптимизации характеристик CAR-клеток, описываемых в настоящем описании, у индивидуума. Без желания быть связанными теорией, полагают, что в одном из вариантов осуществления характеристика эндогенных немодифицированных эффекторных клеток иммунной системы, например, T-клеток, является улученной. Без желания быть связанными теорией, полагают, что в одном из вариантов осуществления характеристика экспрессирующих CD123 CAR клеток является улучшенной. В других вариантах осуществления клетки, например, T-клетки, которые экспрессируют, или которые конструировали так, чтобы они экспрессировали CAR, можно обрабатывать ex vivo путем приведения в контакт с определенным количеством ингибитора mTOR, которое увеличивает число PD1-отрицательных эффекторных клеток иммунной системы (например, T-клеток или NK-клеток) или увеличивает отношение PD1-отрицательных эффекторных клеток иммунной системы, например, T-клеток или NK-клеток/PD1-положительных эффекторных клеток иммунной системы, например, T-клеток или NK-клеток.
В одном из вариантов осуществления введение низкой иммуностимулирующей дозы ингибитора mTOR, например, аллостерического ингибитора, например, RAD001, или каталитического ингибитора начинают проводить до введения экспрессирующей CAR клетки, описываемой в настоящем описании, например, T-клеток или NK-клеток. В одном из вариантов осуществления CAR-клетки вводят через достаточный период времени или после достаточного дозирования ингибитора mTOR, таким образом, что уровень PD1-отрицательных эффекторных клеток иммунной системы, например, T-клеток или отношение PD1-отрицательных эффекторных клеток иммунной системы, например, T-клеток или NK-клеток/PD1-положительных эффекторных клетки иммунной системы, например, T-клеток или NK-клеток по меньшей временно увеличивалось.
В одном из вариантов осуществления клетка, например, эффекторная клетка иммунной системы (например, T-клетка или NK-клетка), которую конструируют так, чтобы она экспрессировала CAR, собирают через достаточный период времени или после достаточного дозирования низкой иммуностимулирующей дозы ингибитора mTOR, таким образом, что уровень PD1-отрицательных эффекторных клеток иммунной системы, например, T-клеток или NK-клеток или отношение PD1-отрицательных эффекторных клеток иммунной системы, например, T-клеток или NK-клеток/PD1-положительных эффекторных клеток иммунной системы, например, T-клеток или NK-клеток у индивидуума или получаемых от индивидуума по меньшей мере временно повышалось.
В одном из вариантов осуществления изобретение относится к ингибитору mTOR для применения для лечения индивидуума, где указанный ингибитор mTOR усиливает иммунный ответ указанного индивидуума, и где указанный индивидуум получал, получает или будет получать эффекторную клетку иммунной системы, которая экспрессирует CD123 CAR, как описано в настоящем описании.
В другом варианте осуществления клетку, например, популяцию эффекторных клеток иммунной системы (например, клеток, экспрессирующих молекулу CAR, описываемую в настоящем описании), вводят в комбинации со средством, которое улучшает один или более побочных эффектов, связанных с введением клетки, экспрессирующей молекулу CAR, например, средством, описываемым в настоящем описании.
В одном из вариантов осуществления клетку, например, популяцию эффекторных клеток иммунной системы (например, клеток, экспрессирующих молекулу CAR, описываемую в настоящем описании), вводят в комбинации со средством, которое лечит заболевание, связанное с CD123, например, средством, описываемым в настоящем описании.
В одном из вариантов осуществления клетку, например, популяцию эффекторных клеток иммунной системы (например, клеток, экспрессирующих молекулу CAR, описываемую в настоящем описании), вводят в комбинации со вторым терапевтическим средством или процедурой, выбранной из одной или более из химиотерапии, терапии против злокачественной опухоли с направленной доставкой, онколитического лекарственного средства, цитотоксического средства, цитокина, хирургической операции, радиационной терапии, агониста костимулирующей молекулы, ингибитора молекулы иммунных контрольных точек, вакцины или второй иммунотерапии на основе CAR.
В одном из вариантов осуществления клетку, например, популяцию эффекторных клеток иммунной системы (например, клеток, экспрессирующих молекулу CAR, описываемую в настоящем описании), вводят в комбинации с агонистом костимулирующей молекулы, например, агонистом костимулирующей молекулы, выбранной из одной или более из молекул MHC I класса, TNF-рецепторных белков, иммуноглобулиноподобных белков, цитокиновых рецепторов, интегринов, сигнальных молекул, активирующих лимфоциты (белков SLAM), активирующих рецепторов NK-клеток, BTLA, Toll-подобного рецептора, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, который специфически связывается с CD83.
В других вариантах осуществления клетку, например, популяцию эффекторных клеток иммунной системы (например, клеток, экспрессирующих молекулу CAR, описываемую в настоящем описании), вводят в комбинации с ингибитором молекулы иммунных контрольных точек, выбранной из одного или более из PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозина, TGFR (например, TGFR бета) или их сочетания.
В одном из вариантов осуществления ингибитор молекулы иммунных контрольных точек или агонист костимулирующей молекулы представляет собой молекулу антитела, например, молекулу моноспецифического антитела или молекулу биспецифического антитела. Например, клетку, например, популяцию эффекторных клеток иммунной системы, можно вводить в комбинации с ингибитором PD-1, ингибитором TIM-3, ингибитором CEACAM-1 или их сочетание. В одном из вариантов осуществления ингибитор PD-1 и ингибитор TIM-3 вводят в комбинации. В других вариантах осуществления ингибитор TIM-3 и ингибитор CEACAM-1 вводят в комбинации.
В некоторых вариантах осуществления ингибитор молекулы иммунных контрольных точек вводят после введения клетки, например, популяции эффекторных клеток иммунной системы, например, приблизительно через 3-7 суток после введения клетки, например, популяции эффекторных клеток иммунной системы.
Как описано в примерах в настоящем описании, было продемонстрировано, что CAR123-экспрессирующие эффекторные клетки иммунной системы представляют собой эффективное лечение CD19-отрицательных рецидивов (например, CD19-отрицательного B-ALL). Без связи с теорией, комбинаторный подход ингибирования CAR123 и CD19 (например, экспрессирующих CAR19 эффекторных клеток иммунной системы) можно использовать для лечения CD19-положительного заболевания, при этом замедляя или предотвращая возникновение рецидивов с потерей антигена.
Таким образом, в других вариантах осуществления любого из указанных выше способов клетку, например, популяцию эффекторных клеток иммунной системы, вводят в комбинации с ингибитором CD19, например, ингибитором CD19, как описано в настоящем описании.
В некоторых вариантах осуществления ингибитор CD19 представляет собой экспрессирующую CD19 CAR клетку или молекулу антитела против CD19. В одном из вариантов осуществления заболевание представляет собой лейкоз, например, ALL (например, рецидивирующий и рефрактерный ALL). В других вариантах осуществления заболевание представляет собой AML. В других вариантах осуществления заболевание представляет собой CD19-отрицательную злокачественную опухоль, например, CD19-отрицательную рецидивирующую злокачественную опухоль.
Альтернативно или в комбинации с любым из указанных выше способов, предоставлен способ профилактики CD19-отрицательного рецидива у млекопитающего, например, человека. Способ включает введение эффективного количества клеток, например, популяции эффекторных клеток иммунной системы (например, клеток, экспрессирующих молекулу CAR, описываемую в настоящем описании). В некоторых вариантах осуществления способ дополнительно включает введение ингибитора CD19, например, экспрессирующей CD19 CAR клетки. В некоторых вариантах осуществления заболевание представляет собой лейкоз, например, острый лимфобластный лейкоз (например, рецидивирующий и рефрактерный ALL) или AML.
В некоторых вариантах осуществления клетку, например, популяцию эффекторных клеток иммунной системы, вводят до, одномоментно или одновременно, или после введения ингибитора CD19. В одном из вариантов осуществления клетку, например, популяцию эффекторных клеток иммунной системы, вводят после введения CD19. В других вариантах осуществления клетку, например, популяцию эффекторных клеток иммунной системы, вводят одновременно с ингибитор CD19.
В некоторых вариантах осуществления клетка, например, популяция эффекторных клеток иммунной системы, экспрессирует CD19 CAR и CD123 CAR (например, CAR, как описано в настоящем описании).
Без желания быть связанными теорией, было выявлено, что определенные лейкозные клетки (например, бласты B-ALL) коэкспрессирует CD19 и CD123, тогда как гемопоэтические стволовые клетки (HSC), как правило, являются CD123-положительными (CD123+), но CD19-отрицательными (CD19-). Для направленного воздействия на лейкозные клетки, которые коэкспрессирует CD19 и CD123 (например, бласты B-ALL), при удержании HSC, можно использовать расщепленный CAR, когда функциональные внутриклеточные домены разделены между CAR19 и CAR123. Такие молекулы CAR вызывают полную активацию иммунной клетки, преимущественно когда клетки-мишени коэкспрессирует CD19 и CD123 (например, бласты B-ALL), в отличие от клетки, которая экспрессирует один из CD19 или CD123 (например, HSC).
Таким образом, в некоторых вариантах осуществления CD19 CAR или CD123 CAR содержит расщепленный внутриклеточный сигнальный домен, таким образом, что происходит полная активация клетки, например, популяции эффекторных клеток иммунной системы, когда CD19 CAR и CD123 CAR связываются с клеткой-мишенью, например, CD19+CD123+клеткой-мишенью (например, бластной клетки B-ALL), по сравнению с активацией, когда CD19 CAR и CD123 CAR связываются с клеткой-мишенью, которая экспрессирует один из CD19 или CD123, (например, гемопоэтическая стволовая клетка). В одном из вариантов осуществления CD123 CAR содержит костимулирующий домен, например, сигнальный домен 4-1BB, и CD19 CAR содержит первичный сигнальный домен, например, сигнальный домен CD3-дзета. В других вариантах осуществления CD123 CAR содержит первичный сигнальный домен, например, сигнальный домен CD3-дзета, и CD19 CAR содержит костимулирующий домен, например, сигнальный домен 4-1BB. CD123 CAR и CD19 CAR могут являться необязательно связанными, например, с одним или более участками расщепления пептида, такими как P2A.
В других вариантах осуществления способы, описываемые в настоящем описании, дополнительно включают введение истощающего T-клетки средства после лечения клеткой (например, эффекторной клеткой иммунной системы, как описано в настоящем описании), таким образом, снижая (например, истощая) экспрессирующие CAR клетки (например, экспрессирующие CD123 CAR клетки). Такие истощающие T-клетки средства можно использовать для эффективного истощения эффективно экспрессирующих CAR клеток (например, экспрессирующих CD123 CAR клеток) для уменьшения токсичности.
Например, альтернативно или в комбинации со способами, описываемыми в настоящем описании, описан способ снижения (например, истощения) экспрессирующей CAR клетки после терапии с использованием CAR (например, терапии с использованием CD123 CAR, описываемой в настоящем описании). Способ включает введение млекопитающему истощающего T-клетки средства в количестве для снижения (например, истощения) экспрессирующих CAR клеток. В некоторых вариантах осуществления истощающее T-клетки средство вводят после лечения млекопитающего клеткой, например, популяцией эффекторных клеток иммунной системы (например, популяцией экспрессирующих CAR клеток), таким образом, снижая уровень (например, истощая) клетки (например, экспрессирующей CAR клетки).
В некоторых вариантах осуществления способ дополнительно включает трансплантацию клетки, например, гемопоэтической стволовой клетки или костного мозга млекопитающему.
В некоторых вариантах осуществления млекопитающее страдает лейкозом, например, острым лимфобластным лейкозом.
В некоторых вариантах осуществления истощающее T-клетки средство вводят через одну, две, три, четыре или пять недель после введения клетки, например, популяции эффекторных клеток иммунной системы, описываемых в настоящем описании.
В одном из вариантов осуществления истощающее T-клетки средство представляет собой средство, которое приводит к истощению экспрессирующих CAR клеток, например, путем индукции антителозависимой клеточной цитотоксичности (ADCC) и/или индуцируемой комплементом гибели клеток. Например, экспрессирующие CAR клетки, описываемые в настоящем описании, также могут экспрессировать антиген (например, антиген-мишень), которые распознают молекулы, способные индуцировать гибель клеток, например, ADCC или индуцируемая комплементом гибель клеток. Например, экспрессирующие CAR клетки, описываемые в настоящем описании, также могут экспрессировать белок-мишень (например, рецептор), на который может направленно воздействовать антитело или фрагмент антитела. Примеры таких белков-мишеней, но не ограничиваются ими, EpCAM, VEGFR, интегрины (например, интегрины ανβ3, α4, αΙ¾β3, α4β7, α5β1, ανβ3, αν), представителей суперсемейства TNF-рецепторов (например, TRAIL-R1, TRAIL-R2), рецептор PDGF, рецептор интерферона, рецептор фолата, GPNMB, ICAM-1, HLA-DR, CEA, CA-125, MUC1, TAG-72, рецептор IL-6, 5T4, GD2, GD3, CD2, CD3, CD4, CD5, CD11, CD11a/LFA-1, CD15, CD18/ITGB2, CD19, CD20, CD22, рецептор CD23/IgE, CD25, CD28, CD30, CD33, CD38, CD40, CD41, CD44, CD51, CD52, CD62L, CD74, CD80, CD125, CD147/базиджин, CD152/CTLA-4, CD154/CD40L, CD195/CCR5, CD319/SLAMF7 и EGFR, и их усеченные варианты (например, варианты, сохраняющие один или более внеклеточных эпитопов, но не содержащие одну или более областей в цитоплазматическом домене).
В некоторых вариантах осуществления экспрессирующая CAR клетка коэкспрессирует CAR и белок-мишень, например, естественным образом экспрессирует белок-мишень или сконструирована таким образом, чтобы экспрессировать белок-мишень. Например, клетка, например, популяция эффекторных клеток иммунной системы, может содержать нуклеиновую кислоту (например, вектор), содержащую нуклеиновую кислоту CAR (например, нуклеиновую кислоту CAR, как описано в настоящем описании), и нуклеиновую кислоту, кодирующую белок-мишень.
В одном из вариантов осуществления истощающее T-клетки средство представляет собой ингибитор CD52, например, молекулу антитела против CD52, например, алемтузумаб.
В других вариантах осуществления клетка, например, популяция эффекторных клеток иммунной системы, экспрессирует молекулу CAR, как описано в настоящем описании (например, CD123 CAR), и белок-мишень, распознаваемый истощающим T-клетки средством. В одном из вариантов осуществления белок-мишень представляет собой CD20. В вариантах осуществления, когда белок-мишень представляет собой CD20, истощающее T-клетки средство представляет собой антитело против CD20, например, ритуксимаб.
В дополнительных вариантах осуществления любого из указанных выше способов способы дополнительно включают трансплантацию клетки, например, гемопоэтической стволовой клетки или костного мозга млекопитающему.
В другом аспекте изобретение относится к способу кондиционирования млекопитающего перед трансплантацией клеток. Способ включает введение млекопитающему эффективного количества клеток, содержащих нуклеиновую кислоту CAR, как описано в настоящем описании, или полипептид CAR, как описано в настоящем описании. В некоторых вариантах осуществления трансплантация клеток представляет собой трансплантацию стволовых клеток, например, трансплантацию гемопоэтических стволовых клеток или трансплантацию костного мозга. В других вариантах осуществления кондиционирование индивидуума перед трансплантацией клеток включает снижение числа экспрессирующих CD123 клеток у индивидуума, например, нормальных экспрессирующих CD123 клеток или злокачественных экспрессирующих CD123 клеток.
В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей CAR по изобретению, выделенной полипептидной молекуле CAR по изобретению, вектору, содержащему CAR по изобретению, и клетке, содержащей CAR по изобретению для применения в качестве лекарственного средства, например, как описано в настоящем описании (например, для применения для лечения заболевания, связанного с экспрессией CD123).
В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей CAR по изобретению, выделенной полипептидной молекуле CAR по изобретению, вектору, содержащему CAR по изобретению, и клетке, содержащей CAR по изобретению, для применения для лечения заболевания, при котором экспрессируется CD123, например, заболевания, при котором экспрессируется CD123, как описано в настоящем описании. В определенных вариантах осуществления заболевание представляет собой гематологическую злокачественную опухоль, например, как описано в настоящем описании. В некоторых вариантах осуществления заболевание выбирают из острого лейкоза, включая, но, не ограничиваясь ими, острый миелолейкоз (AML), острый лимфобластный лейкоз (ALL), острый лимфобластный B-клеточный лейкоз (острый лимфоидный B-клеточный лейкоз, BALL) и острый лимфобластный T-клеточный лейкоз (острый лимфоидный T-клеточный лейкоз (TALL); миелодиспластического синдрома; миелопролиферативной неоплазии; гистиоцитоза (например, мастоцитоза или новообразования из бластных плазмоцитоидных дендритных клеток); мастоцитоза, например, системного мастоцитоза или тучноклеточного лейкоза; хронического миелолейкоза (CML) или новообразования из бластных плазмоцитоидных дендритных клеток.
Дополнительные признаки и варианты осуществления указанных выше композиций и способов включают один или более из указанных ниже.
В определенных вариантах осуществления молекула CD123 CAR (например, нуклеиновая кислота CD123 CAR или полипептид CD123 CAR, как описано в настоящем описании) или CD123-связывающий домен, как описано в настоящем описании, содержит одну, две или три CDR из вариабельной области тяжелой цепи (например, CDR1 HC, CDR2 HC и/или CDR3 HC), предоставленной в таблице 3; и/или одну, две или три CDR из вариабельной области легкой цепи (например, CDR1 LC, CDR2 LC и/или CDR3 LC), предоставленной в таблице 4 (например, один, два или три CDR1 HC, CDR2 HC или CDR3 HC, и/или одну, две или три CDR1 LC, CDR2 LC или CDR3 LC CAR123-1, CAR123-2, CAR123-3, CAR123-4, предоставленных в таблице 3 или 4); или последовательность по существу идентичную (например, 95-99% идентичную или содержащую до 5, 4, 3, 2 или 1 изменения аминокислот, например, замены (например, консервативных замен)) с любой из указанных выше последовательностей.
В определенных вариантах осуществления молекула CD123 CAR (например, нуклеиновая кислота CD123 CAR или полипептид CD123 CAR, как описано в настоящем описании) или антигенсвязывающий домен к CD123, как описано в настоящем описании, содержит одну, две или три CDR из вариабельной области тяжелой цепи (например, CDR1 HC, CDR2 HC и/или CDR3 HC), предоставленной в таблице 10; и/или одну, две или три CDR из вариабельной области легкой цепи, предоставленной в таблице 11 (например, одну, две или три CDR1 HC, CDR2 HC или CDR3 HC, и/или одну, две или три CDR1 LC, CDR2 LC или CDR3 LC CAR123-1, CAR123-2, CAR123-3, CAR123-4, предоставленных в таблице 10 или 11), или последовательность по существу идентичную (например, 95-99% идентичную или содержащую до 5, 4, 3, 2 или 1 изменения аминокислот, например, замены (например, консервативных замен)) с любой из указанных выше последовательностей.
В определенных вариантах осуществления молекула CD123 CAR или антигенсвязывающий домен к CD123 содержит одну, две или три CDR из вариабельной области тяжелой цепи (например, HCDR1, HCDR2 и/или HCDR3), представленной в таблице 12, и/или одну, два или три CDR из вариабельной области легкой цепи, предоставленной в таблице 13 (например, одну, две или три CDR1 HC, CDR2 HC или CDR3 HC, и/или одну, две или три CDR1 LC, CDR2 LC или CDR3 LC CAR123-1, CAR123-2, CAR123-3, CAR123-4, предоставленных в таблице 12 или 13), или последовательность по существу идентичную (например, 95-99% идентичную или содержащую до 5, 4, 3, 2 или 1 изменения аминокислоты, например, замены (например, консервативных замен)) с любой из указанных выше последовательностей.
В определенных вариантах осуществления молекула CD123 CAR или антигенсвязывающий домен к CD123 содержит:
(i) CDR1 LC, CDR2 LC и CDR3 LC любых аминокислотных последовательностей CD123-связывающего домена легкой цепи, приведенной в таблице 2, 6 или 9, или CDR LC в таблице 4, 8, 11 или 13, и/или
(ii) CDR1 HC, CDR2 HC и CDR3 HC любых аминокислотных последовательностей CD123-связывающего домена тяжелой цепи, приведенной в таблице 2, 6 или 9, или CDR HC в таблице 3, 7, 10 или 12.
В определенных вариантах осуществления молекула CD123 CAR (например, нуклеиновая кислота CD123 CAR или полипептид CD123 CAR, как описано в настоящем описании) или антигенсвязывающий домен к CD123, как описано в настоящем описании, содержит:
(1) одну, две или три CDR легкой цепи (LC), выбранных из одной из следующих ниже:
(i) CDR1 LC SEQ ID NO: 418, CDR2 LC SEQ ID NO: 446 и CDR3 LC SEQ ID NO: 474 CAR123-1;
(ii) CDR1 LC SEQ ID NO: 419, CDR2 LC SEQ ID NO: 447 и CDR3 LC SEQ ID NO: 475 CAR123-2;
(iii) CDR1 LC SEQ ID NO: 420, CDR2 LC SEQ ID NO: 448 и CDR3 LC SEQ ID NO: 476 CAR123-3;
(iv) CDR1 LC SEQ ID NO: 421, CDR2 LC SEQ ID NO: 449 и CDR3 LC SEQ ID NO: 477 CAR123-4, и/или
(2) одну, две или три CDR тяжелой цепи (HC), выбранных из одной из следующих ниже:
(i) CDR1 HC SEQ ID NO: 334, CDR2 HC SEQ ID NO: 362 и CDR3 HC SEQ ID NO: 390 CAR123-1;
(ii) CDR1 HC SEQ ID NO: 335, CDR2 HC SEQ ID NO: 363 и CDR3 HC SEQ ID NO: 391 CAR123-2;
(iii) CDR1 HC SEQ ID NO: 336, CDR2 HC SEQ ID NO: 364 и CDR3 HC SEQ ID NO: 392 CAR123-3;
(iv) CDR1 HC SEQ ID NO: 337, CDR2 HC SEQ ID NO: 365 и CDR3 HC SEQ ID NO: 393 CAR123-4.
В определенных вариантах осуществления молекула CD123 CAR (например, нуклеиновая кислота CD123 CAR или полипептид CD123 CAR, как описано в настоящем описании) или антигенсвязывающий домен к CD123, как описано в настоящем описании, содержит:
(1) одну, две или три CDR легкой цепи (LC), выбранных из одной из следующих ниже:
(i) CDR1 LC SEQ ID NO: 501, CDR2 LC SEQ ID NO: 506 и CDR3 LC SEQ ID NO: 511 CAR123-1;
(ii) CDR1 LC SEQ ID NO: 502, CDR2 LC SEQ ID NO: 507 и CDR3 LC SEQ ID NO: 512 CAR123-2;
(iii) CDR1 LC SEQ ID NO: 503, CDR2 LC SEQ ID NO: 508 и CDR3 LC SEQ ID NO: 513 CAR123-3;
(iv) CDR1 LC SEQ ID NO: 504, CDR2 LC SEQ ID NO: 509 и CDR3 LC SEQ ID NO: 514 CAR123-4, и/или
(2) одну, две или три CDR тяжелой цепи (HC), выбранных из одной из следующих ниже:
(i) CDR1 HC SEQ ID NO: 486, CDR2 HC SEQ ID NO: 491 и CDR3 HC SEQ ID NO: 496 CAR123-1;
(ii) CDR1 HC SEQ ID NO: 487, CDR2 HC SEQ ID NO: 492 и CDR3 HC SEQ ID NO: 497 CAR123-2;
(iii) CDR1 HC SEQ ID NO: 488, CDR2 HC SEQ ID NO: 493 и CDR3 HC SEQ ID NO: 498 CAR123-3;
(iv) CDR1 HC SEQ ID NO: 489, CDR2 HC SEQ ID NO: 494 и CDR3 HC SEQ ID NO: 499 CAR123-4.
В определенных вариантах осуществления молекула CD123 CAR (например, нуклеиновая кислота CD123 CAR или полипептид CD123 CAR, как описано в настоящем описании) или антигенсвязывающий домен к CD123, как описано в настоящем описании, содержит:
(1) одну, две или три CDR легкой цепи (LC), выбранных из одной из следующих ниже:
(i) CDR1 LC SEQ ID NO: 531, CDR2 LC SEQ ID NO: 536 и CDR3 LC SEQ ID NO: 541 CAR123-1;
(ii) CDR1 LC SEQ ID NO: 532, CDR2 LC SEQ ID NO: 537 и CDR3 LC SEQ ID NO: 542 CAR123-2;
(iii) CDR1 LC SEQ ID NO: 533, CDR2 LC SEQ ID NO: 538 и CDR3 LC SEQ ID NO: 543 CAR123-3;
(iv) CDR1 LC SEQ ID NO: 534, CDR2 LC SEQ ID NO: 539 и CDR3 LC SEQ ID NO: 544 CAR123-4, и/или
(2) одну, две или три CDR тяжелой цепи (HC), выбранных из одной из следующих ниже:
(i) CDR1 HC SEQ ID NO: 516, CDR2 HC SEQ ID NO: 521 и CDR3 HC SEQ ID NO: 526 CAR123-1;
(ii) CDR1 HC SEQ ID NO: 517, CDR2 HC SEQ ID NO: 522 и CDR3 HC SEQ ID NO: 527 CAR123-2;
(iii) CDR1 HC SEQ ID NO: 518, CDR2 HC SEQ ID NO: 523 и CDR3 HC SEQ ID NO: 528 CAR123-3;
(iv) CDR1 HC SEQ ID NO: 519, CDR2 HC SEQ ID NO: 524 и CDR3 HC SEQ ID NO: 529 CAR123-4.
Если не определено иное, все технические и научные термины, используемые в настоящем описании, имеют то же значение, как общепринято понимает специалист в данной области, к которой принадлежит данное изобретение. Хотя в практическом осуществлении или тестировании настоящего изобретения можно использовать способы и материалы, аналогичные или эквивалентные способам и материалам, описываемым в настоящем описании, ниже описаны подходящие способы и материалы. Все публикации, патентные заявки, патенты и другие ссылки, указанные в настоящем описании, полностью включены посредством ссылки. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены быть ограничивающими. Заголовки, подзаголовки или пронумерованные или обозначенные буквами элементы, например, (a), (b), (i) и т.д. предоставлены только для простоты чтения. Использование заголовков или пронумерованных или обозначенных буквами элементов в этом документе не требует проведение этапов или элементов в алфавитном порядке, или того, чтобы этапы или элементы обязательно являются отделенными друг от друга. Другие признаки, задачи и преимущества изобретения станут понятны из описания и чертежей, и из формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Следующее ниже подробное описание предпочтительных вариантов осуществления изобретения будет лучше понятно при прочтении в сочетании с прилагаемыми чертежами. С целью иллюстрации изобретение на чертежах продемонстрированы варианты осуществления, которые являются в настоящее время предпочтительными. Однако следует понимать, что изобретение не ограничено точными расстановками и средствами вариантов осуществления, продемонстрированных на чертежах.
На фигуре 1 приведено графическое представление экспрессии CAR в клетках JNL, трансдуцированных конструкциями CAR к CD123, как оценивают FACS, и приводят в виде процента клеток с сигналом выше уровня сигнала в нетрансдуцированных (CAR-отрицательных) клетках, с использованием белка L в качестве реагента для детекции.
На фигуре 2, содержащей фигуры 2A, 2B и 2C, представлены графические представления активности CD123 CAR в клетках JNL. Конструкции CAR к CD123 оценивали в отношении активности с использованием линии клеток Jurkat, содержащих репортерный ген люциферазы под контролем промотора NFAT (называемых клетками JNL). Активность CAR измеряют как активацию такого репортера под контролем NFAT.
На фигуре 3 приведено графическое представление экспрессии CD123 CAR в первичных T-клетках. Процентное содержание трансдуцированных клеток (экспрессирующих CAR к CD123 на клеточной поверхности) и их относительную интенсивность флуоресценции экспрессии определяли проточным цитометрическим анализом на BD LSRFortessa или BD-FACSCanto с использованием белка L в качестве реагента для детекции. Графики гистограмм установки дискриминационного окна интенсивности относительной флуоресценции такого FACS для сигнала выше неокрашенных клеток демонстрируют процентное содержание трансдуцированных T-клеток. Трансдукция приводила к ряду CAR-положительных клеток 12-42%.
На фигуре 4 приведено графическое представление опосредованного CD123-CART цитолиза клеток. T-клетрочный цитолиз являлся направленным на экспрессирующие CD123 клетки острого миелогенного лейкоза MOLM13, стабильно экспрессирующие люциферазу. Нетрансдуцированные T-клетки использовали для определения неспецифических фоновых уровней цитолиза. Цитолитическую активность CART-CD123 измеряли в диапазоне отношений эффектор:клетка-мишень 4:1 и 2-кратных разведений T-клеток, где эффекторы определяли как T-клетки, экспрессирующие химерный рецептор к CD123. Анализы начинали проводить смешиванием подходящего числа T-клеток с постоянным числом клеток-мишеней. Через 20 часов измеряли сигнал люциферазы с использованием Bright-Glo™ Luciferase Assay на устройстве EnVision.
На фигурах 5A и 5B представлена эффективность трансдукции T-клеток CD123-CAR. На фигуре 5A представлена эффективность трансдукции T-клеток 1172 и 1176. На фигуре 5B представлена эффективность трансдукции T-клеток CD123 CAR 2-4.
На фигуре 6 представлена проточная цитометрия CD123 CAR 2-4 и 1172 и 1176 для определения отношения CD4:CD8.
На фигуре 7 (предоставленной на фигурех 7-1, 7-2 и 7-3) представлена дегрануляция CD123 CAR 2-4 и 1172 и 1176 под воздействием CD123+опухолевых клеток.
На фигуре 8 приведено графическое представление анализ люциферазы для оценки цитотоксичности T-клеток с CAR (NVS 2-4, клоны 1172 и 1176) по отношению к опухолевым клеткам-мишеням (MOLM14).
На фигуре 9 представлено сравнение опухолевой нагрузки у мышей NSG, которым инъецировали клетки MOLM14, экспрессирующие люциферазу, на С6 (до инъекции CART) и на сутки 13 (6 суток после инъекции NVS 2-4, клоны 1172 или 1176) или на сутки 20.
На фигуре 10 представлена экспрессия CD30 и CD123 в линии клеток лимфома Ходжкина HDLM-2.
На фигурах 11A и 11B представлена экспрессия CD123 CAR в T-клетках, трансдуцированных pELNS anti-CD123-41BB-CD3ζ, посредством детекции dsRed, суррогатного маркера CD123 в результате коэкспрессии T2A. dsRed детектировали посредством проточной цитометрии.
На фигуре 12 представлена кПЦР экспрессии CD123 в 4 линиях клеток лимфома Ходжкина (HDLM2, KMH2, L428, SUPHD1), CD123+MOLM14 (положительный контроль) и A375 (отрицательный контроль). В качестве гена домашнего хозяйства использовали GUSB. Порог Ct составлял 40.
На фигуре 13 представлен эффект антитела против IL3 на модели in vivo лимфомы Ходжкина. Мышам KO NOD-SCID-γ-цепь, у которых экспрессируются на повышенном уровне цитокины человека, включая IL-3 (мыши NSG-S), пересаживали линию клеток HDLM-2, экспрессирующую люциферазу. После в/в инъекции неопластические клетки постепенно образовывали рассеянные массы мягкой ткани. Серийные инъекции нейтрализующего антитела против IL3 замедляли рост опухоли.
На фигуре 14 представлен анализ дегрануляции CD107a. Нетрансдуцированные T-клетки (UTD) или CART123 инкубировали с HDLM-2 (CD123+ линией клеток HL) в течение 4 часов в отношении 5 клеток-мишеней к 1 T-клетке в присутствии антител против D28, антител против CD49d и монензина. T-клетки с CAR к CD30 использовали в качестве дополнительных контролей. Для CART123, но не для UTD, демонстрировали увеличение дегрануляции CD107a, как детектировали проточной цитометрией.
На фигуре 15 приведено графическое представление анализа дегрануляции, представленного на фигуре 20.
На фигуре 16 продемонстрировано, что экспрессирующие CD123 CAR T-клетки характеризуются значительным увеличением внутрицитоплазматической продукции цитокинов (IL-2, TNF).
На фигуре 17 продемонстрировано, что для CART123, но не для UTD, выявляли зависимый от дозозависимый цитолиз, как можно видеть по снижению испускания биолюминесценции люциферазы на основании анализа цитолиза в течение 24 часов. T-клетки инкубировали совместно к клетками люцифераза+HDML-2 в различных отношениях (0,3:1-10:1).
На фигуре 18 представлены клетки CART123 и CART30, но не UTD, для которых демонстрировали устойчивую пролиферацию при культивировании совместно с линиями клеток лимфомы Ходжкина в анализе пролиферации. T-клетки инкубировали с линиями клеток HL (CD123+) или контролями (Jurkat CD123-, MOLM-14 CD123+) или PMA/иономицин (положительный контроль) или средой для культивирования клеток (отрицательный контроль) в анализе пролиферации продолжительностью 5 суток.
На фигуре 19, содержащей фигуры 19A, 19B, 19C и 19D, представлен CART123, индуцирующий устойчивую продукцию IFNg (фиг. 19A), IL-2 (фиг. 19B), TNFa (фиг. 19C) и представлен MFI MIP1b (фиг. 19D) Luminex.
На фигуре 20 приведено схематическое представление модели in vivo лимфомы Ходжкина. 1 миллион клеток люцифераза+HDLM-2 инъецировали в/в на сутки 0. Затем проводили серийную биолюминесцентную визуализацию (BLI) для наблюдения за уровнем опухоли. Наблюдали низкий уровень опухоли на сутки 7, за которым следовало постепенное увеличение опухолевой нагрузки в течение приблизительно 6 недель, что воспроизводит медленно развивающийся характер заболевания человека. На сутки 43, когда опухолевая нагрузка являлась в 20 раз выше от исходного уровня, мыши обрабатывали 1,5 миллионами CART123-клеток или контрольными T-клетками.
На фигуре 21 представлена BLI для детекции HDLM-2 на сутки после инъекции у мышей, которых обрабатывали CART123-клетками, контрольными T-клетками или не обрабатывали в соответствии со схемой на фигуре 28.
На фигуре 22 представлена выживаемость мышей, которых обрабатывали в соответствии со схемой, представленной на фигуре 28, CART123 индуцировал полную и устойчивую эрадикацию диссеминированной опухоли в течение 14 суток, что приводит к 100% выживаемости без рецидивов и 100% общей выживаемости через 6 месяцев.
На фигуре 23 представлена взаимосвязь между устранением опухоли и активной экспансией T-клеток с CAR, как детектируют проточной цитометрией при серийных отборах проб периферической крови. Размноженные T-клетки составляли приблизительно 50% клеток CD8 и 50% клеток CD4. Число T-клеток уменьшалось в течение времени по мере того, как снижалась опухолевая нагрузка.
Фигура 24, содержащая фигуры 24A, 24B и 24C, представляет собой столбчатые диаграммы, на которых продемонстрирована продукция цитокинов T-клетками, экспрессирующими конструкции CAR123 (CD123-2, CD123-3 и CD123-4) при культивировании с клетками-мишенями MOLM13, PL21 и U87 в указанных отношениях. На фигуре 24A продемонстрирована продукция IL-2; на фигуре 24B продемонстрирована продукция IFN-гамма, и на фигуре 24C продемонстрирована продукция TNF-альфа.
Фигура 25 представляет собой столбчатую диаграмму, демонстрирующую пролиферативную способность трансдуцированных лентивирусом T-клеток, экспрессирующих CAR123-2, (CAR123-2 LV) или контроля антитело против GH при культивировании в присутствии клеток-мишеней MOLM13 (которые экспрессируют CD123), K562-CD123 человека (которые экспрессируют CD123 человека) или K562 (которые не экспрессируют CD123).
На фигуре 26, содержащей фигуры 26A, 26B и 26C, продемонстрирована способность трансдуцированных лентивирусом T-клеток, экспрессирующих CAR123 CAR, (CAR123-2 LV) или контроля (антитело против GH), или нетрансдуцированных клеток (UTD) уничтожать клетки-мишени в различных отношениях клетка-мишень:эффекторная клетка, где клетки-мишени представляют собой экспрессирующие CD123 клетки MOLM13 (фиг. 26A) или клетки PL21 (фиг. 26B), или CD123-отрицательные клетки U87 (фиг. 26C).
Фигура 27, содержащая фигуры 27A и 27B, представляет собой графики, демонстрирующие продукцию цитокинов трансдуцированных лентивирусом T-клеток, экспрессирующих CAR123, (LV CAR123-2) или контроля (антитело против GH) при культивировании в присутствии клеток-мишеней MOLM13 (которые экспрессируют CD123) и U87 (которые не экспрессируют CD123). На фигуре 27A представлена продукция цитокинов IFNγ и TNFα; на фигуре 27B представлена продукция цитокинов IL-2.
На фигуре 28 представлен опухолевая нагрузка на модели лимфомы Ходжкина in vivo на мышах, где мышам, несущим опухоли, вводили T-клетки, экспрессирующие различные конструкции CAR123: 1172, 1176, NVS2 (также обозначаемые в настоящем описании как CAR123-2), NVS3 (также обозначаемые в настоящем описании как CAR123-3) и NVS4 (также обозначаемые в настоящем описании как CAR123-4). Измеряли опухолевую нагрузку на сутки 6, сутки 14, сутки 20 и сутки 27 и предоставляли посредством биолюминесцентной визуализации (BLI).
На фигуре 29 представлена опухолевая нагрузка на модели in vivo на мышах, где мышам, несущим опухоли вводили T-клетки, экспрессирующие CAR123-2, внесенный из лентивирусного вектора (LV CART123), CAR123-2, внесенный как РНК (РНК CART123 (NVS)), и средство CAR123, внесенное как РНК (РНК CART123 (Penn)). Нетрансдуцированные T-клетки использовали в качестве контроля (UTD). Опухолевая нагрузка представлена в виде единиц биолюминесцентной визуализации (BLI).
На фигуре 30, содержащей фигуры 30A, 30B, 3°C и 30D, продемонстрирована биолюминесцентная визуализация опухолей на модели in vivo на мышах. На фигуре 30A продемонстрированы мыши, которым вводили нетрансдуцированные клетки; на фигуре 30B продемонстрированы мыши, которым вводили T-клетки, экспрессирующие РНК CAR123-2; на фигуре 3°C продемонстрированы мыши, которым вводили трансдуцированные лентивирусом T-клетки, экспрессирующие CAR123-2; на фигуре 30D продемонстрированы мыши, которым вводили T-клетки, экспрессирующие РНК средства CAR123.
На фигуре 31, содержащей фигуры 31A, 31B, 31C, 31D, 31E и 31F, продемонстрировано, что CD123 экспрессируются на высоком уровне при рецидивах CD19-отрицательного B-клеточного острого лимфобластного лейкоза, происходящих после обработки CART19. На фигуре 31A продемонстрирована экспрессия CD123 по сравнению с CD19 в 42 образцах рецидивирующего/рефрактерного ALL. На фигуре 31B продемонстрирована коэкспрессия CD123 и CD19 в бластах B-ALL. Дискриминационное окно установлено на бластах (низкие параметры SSC, синглет, живые, CD45dim). На фигуре 31C продемонстрирована стратегия установки дискриминационного окна для лейкозной стволовой клетки (LSC). CD123 экспрессируется на высоком уровне в этой подпопуляции. На фигуре 32D продемонстрирована коэкспрессия CD123 и CD19 и результаты анализа FISH. На фигурах 31E и 31F представлено сравнение экспрессии CD19 и CD123 на исходном уровне или после рецидива.
На фигуре 32, содержащей фигуры 32A, 32B, 32C, 32D, 32E и 32F, продемонстрированы результаты различных анализов in vitro с использованием T-клеток, экспрессирующих CD19 CAR (CAR19) или CD123 CAR (CAR123). На фигуре 32A продемонстрирована экспрессия CD19 и CD123; на фигуре 32B представлен анализ дегрануляция CD107a; на фигуре 32C представлена способность цитолиза клетки-мишени; на фигурах 32D и E продемонстрирована пролиферативная способность; на фигуре 32F продемонстрирована продукция цитокинов для указанных цитокинов.
На фигуре 33, содержащей фигуры 33A, 33B и 33C, продемонстрировано, что CART-клетки, экспрессирующие CD19 CAR (CAR19) или CD123 CAR (CAR123), обладали противоопухолевым действием на модели in vivo на мышах. На фигуре 33A продемонстрирована опухолевая нагрузка, предоставленная биолюминесцентной визуализацией; на фигуре 33B продемонстрирована кривая общей выживаемости мышей, получающих терапию CART, и на фигуре 33C продемонстрирована экспансия CART123-клеток в периферической крови.
На фигуре 34, содержащей фигуры 34A, 34B, 34C, 34D, 34E и 34F, продемонстрировано, что CART123 являются активными на модели in vivo на мышах рецидива с потерей антигена. На фигуре 34A представлена экспериментальная схема; на фигуре 34B продемонстрировано прогрессирование заболевания как представлено посредством биолюминесцентной визуализации на исходном уровне и при рецидиве заболевания в отношении экспрессии CD19 (верхний график) и в ответ на лечение терапией CART19 (нижний график); на фигуре 34C продемонстрированы биолюминесцентные изображения мышей, которым вводили нетрансдуцированные T-клетки или CART19-клетки; на фигуре 34D представлена экспериментальная схема обработки CART19 или CART123; на фигуре 34E продемонстрировано прогрессирование заболевания, и на фигуре 34F продемонстрирована общая выживаемость мышей, которые получали лечение.
На фигуре 35, содержащей фигуры 35A, 35B и 35C, продемонстрированы взаимодействия ALL-CART в костном мозге черепа мышей с ксенотрансплантатами. на фигуре 35A представлена экспериментальная схема; на фигуре 35B продемонстрированы характерные многофотонные изображения в плоскости XY CART19-клеток и CART123-клеток, взаимодействующих с опухолями ALL, сконструированными для экспрессии CD19 и CD123 или CD123 отдельно (подвижные клетки указаны в пунктирных окружностях, неподвижные клетки указаны стрелками), и фигура 35C представляет собой графическое представление изображений, полученных при помощи микроскопа.
На фигуре 36, содержащей фигуры 36A, 36B и 36C, продемонстрирована профилактика CD19-отрицательных рецидивов с использованием CART19 и CART123. на фигуре 36A представлена экспериментальная схема; на фигуре 36B продемонстрировано прогрессирование заболевания (опухолевая нагрузка, как представлено BLI) мышей, которых обрабатывали нетрансдуцированными T-клетками (верхний график), CART19 (средний график) или комбинацией CART19 и CART123 (нижний график), и на фигуре 36C продемонстрирована общая выживаемость в этом эксперименте.
На фигуре 37, содержащей фигуры 37A и 37B, продемонстрированы T-клетки, экспрессирующие CAR19 и CAR123, (фигура 37A) и результаты анализа дегрануляции (фигура 37B).
На фигуре 38, содержащей фигуры 38A и 38B, приведена характеристика бластов ALL. На фигуре 38A продемонстрирована экспрессия различных маркеров CD19, CD123, CD10, CD34 и CD20; и на фигуре 38B продемонстрирована стратегия установки дискриминационного окна сортировки CD19-CD123+клеток.
На фигуре 39, содержащей фигуры 39A, 39B, 39C и 39D, продемонстрирована противолейкозная активность CART123. На фигуре 39A продемонстрирована экспрессия CD19 и CD123 клетками NALM6; на фигуре 39B продемонстрирована опухолевая нагрузка (как представлено BLI) в ответ на терапию CART19 или CART123; на фигуре 39C продемонстрирована общая выживаемость мышей, которым вводили CART19 или CART123, и на фигуре 39D продемонстрирована общая выживаемость мышей, которым вводили различные дозы CART123.
На фигуре 40, содержащей фигуры 40A и 40B, приведена характеристика модели in vivo рецидива с потерей антигена. На фигуре 40A продемонстрирована экспрессия CD123 при CD19-отрицательном рецидивирующем заболевании, и на фигуре 40B продемонстрирован анализ дегрануляции CART19- или CART123-клеток при культивировании с исходными клетками или клетками после рецидива in vitro.
На фигуре 41, содержащей фигуры 41A, 41B и 41C, продемонстрирована экспрессия L1 PD1 или клетками первичного AML (фиг. 41A) и PD1 (фиг. 41B) и TIM3 (фиг. 41C) T-клетками.
На фигуре 42, содержащей фигуры 42A, 42B, 42C, и 42D, продемонстрирована экспрессия PD1 иммунных контрольных точек (фиг. 42A), TIM3 (фиг. 42B), LAG3 (фиг. 42C) и CTLA4 (фиг. 42D) CD8+T-клетками.
На фигуре 43 представлен анализ проточной цитометрии экспрессии TIM3 в образцах первичного AML (слева) и рецидивирующего AML (справа).
На фигуре 44 продемонстрирована опухолевая нагрузка (представленная биолюминесцентной визуализацией, фотонов/сек) после обработки CART123 по сравнению с обработкой нетрансдуцированными (UTD) клетками.
На фигуре 45 представлена экспрессия TIM3 и PD1 T-клетками в ксенотрансплантатах после обработки CD123 в период ремиссии или после рецидива.
На фигуре 46, содержащей фигуры 46A и 46B, приведена характеристика костного мозга у рецидивирующих мышей после культивирования совместно с ингибиторами иммунных контрольных точек, например, ингибиторами PD1, TIM3, комбинацией ингибиторов PD1 и TIM3 или комбинацией ингибиторов TIM3 и CEACAM-1. Процентное содержание T-клеток, экспрессирующих GMCSF, IFNg, Ki67 и MIP1b, детектировали в отсутствие (фиг. 46A) или в присутствии PMA/IONO (фиг. 46B).
На фигуре 47 представлена экспериментальная схема обработки ксенотрансплантатов AML нетрансдуцированными клетками и ингибиторами PD1 или ингибиторами TIM3.
На фигуре 48 продемонстрирована опухолевая нагрузка (представленная BLI, фотонов/сек) для эксперимента, проиллюстрированного на фигуре 47.
На фигуре 49 представлена экспериментальная схема обработки ксенотрансплантатов AML CART123 в комбинации с ингибиторами TIM3 и/или PD1.
На фигуре 50, содержащей фигуры 50A, 50B, 5°C и 50D, продемонстрирована опухолевая нагрузка (представленная BLI, фотонов/сек) для эксперимента, проиллюстрированного на фигуре 49. На фиг. 50A сравнивают CART123 с комбинацией CART123 и ингибитором PD1; на фиг. 50B сравнивают CART123 с комбинацией CART123 и ингибитора PD1 и ингибитором TIM3; на фиг. 5°C сравнивают CART123 с комбинацией CART123 и ингибитора TIM3, и на фиг. 50D представлен характерный график для данных, приведенных на фиг. 50A-C.
На фигуре 51, содержащей фигуры 51A, 51B, 51C, 51D и 51E, представлены различные конфигурации одного вектора, например, где кшРНК под контролем U6 находится выше или ниже кодирующие CAR элементы под контролем EF1-альфа. В иллюстративных структурах, представленных на фиг. 51A и 51B, транскрипция опосредована промоторами U6 и EF1-альфа в одном и том же направлении. В иллюстративных структурах, представленных на фиг. 51C и 51D, транскрипция опосредована промоторами U6 и EF1-альфа в различных направлениях. На фигуре 51E кшРНК (и соответствующий промотор U6) находится в первом векторе и CAR (и соответствующий промотор EF1-альфа) находится во втором векторе.
На фигуре 52 проиллюстрированы структуры двух иллюстративных конфигураций RCAR. Антигенсвязывающие элементы включают антигенсвязывающий домен, трансмембранный домен и переключающий домен. Внутриклеточные связывающие элементы включают переключающий домен, костимуляторный сигнальный домен и первичный сигнальный домен. Две конфигурации демонстрируют, что первый и второй переключающие домены, описываемые в настоящем описании, могут находиться в различных ориентациях по отношению к антигенсвязывающему элементу и внутриклеточному связывающему элементу. Другие конфигурации RCAR дополнительно описаны в настоящем описании.
На фигуре 53 продемонстрировано, что пролиферацию экспрессирующих CAR трансдуцированных T-клеток повышают низкие дозы RAD001 в системе клеточных культур. CART культивируют совместно с клетками Nalm-6 в присутствии различных концентраций RAD001. Число CAR-положительных, CD3-положительных T-клеток (черные) и общих T-клеток (серые) оценивали через 4 суток совместного культивирования.
На фигуре 54 проиллюстрированы измерения роста опухоли клеток NALM6-luc при ежесуточном дозировании RAD001 при 0,3, 1, 3 и 10 мг/кг (мг на кг массы) или дозировании носителя. Кружки означают носитель; квадраты означают дозу 10 мг/кг RAD001; треугольники означают дозу 3 мг/кг RAD001, перевернутые треугольники означают дозу 1 мг/кг RAD001, и ромбы означают дозу 0,3 мг/кг RAD001.
На фигуре 55, содержащей фигуры 55A и 55B, представлены фармакокинетические кривые, демонстрирующие количество RAD001 в крови мышей NSG с опухолями NALM6. На фиг. 55A представлены PK на сутки 0 после первой дозы RAD001. На фиг. 55B представлены PK на сутки 14 после последней дозы RAD001. Ромбы означают дозу 10 мг/кг RAD001; квадраты означают дозу 1 мг/кг RAD001; треугольники означают дозу 3 мг/кг RAD001, и x означают дозу 10 мг/кг RAD001.
На фигуре 56, содержащей фигуры 56A и 56B, представлена пролиферация in vivo гуманизированных клеток CD19 CART при дозировании RAD001 и без него. Низкие дозы RAD001 (0,003 мг/кг) каждые сутки приводят к повышению пролиферации T-клеток с CAR, выше нормального уровня пролиферации huCAR19. На фиг. 56A представлены CD4+CAR T-клетки; на фиг. 56B представлены CD8+CAR T-клетки. Кружки означают PBS; квадраты означают huCTL019; треугольники означают huCTL019 с 3 мг/кг RAD001; перевернутые треугольники означают huCTL019 с 0,3 мг/кг RAD001; ромбы означают huCTL019 с 0,03 мг/кг RAD001, и кружки означают huCTL019 с 0,003 мг/кг RAD001.
Фигура 57 представляет собой карту вектора лентивирусного вектора для экспрессии CAR123 и CD20 в стратегии по блокированию активности CART123, где последовательность CAR123 и последовательность CD20 являются связанными посредством последовательности P2A.
На фигуре 58 представлены результаты анализа дегрануляции CD107, в котором сравнивают CART123-клетки с клетками CART123 P2A CD20.
На фигуре 59, содержащей фигуры 59A, 59B, 59C и 59D, продемонстрирована продукция GM-CSF (фиг. 59A), TNF альфа (фиг. 59B), IFN гамма (фиг. 59C) и IL-2 (фиг. 59D) CART123-клетками по сравнению с клетками с CART123 P2A CD20.
На фигуре 60 представлена цитотоксическая способность (как предоставлено % специфического лизиса) CART123-клеток по сравнению с клетками CART123 P2A CD20, при инкубации в указанных отношениях эффектор:клетка-мишень.
На фигуре 61, содержащей фигуры 61A и 61B, представлено истощение T-клеток после обработки указанными дозами ритуксимаба на CART123-клетках (фиг. 61A) и клетках CART123 P2A CD20 (фиг. 61B).
На фигуре 62 представлено истощение T-клеток после обработки указанными дозами ритуксимаба на клетках CART123 P2A CD20 в присутствии 15% комплемента.
На фигуре 63, содержащей фигуры 63A и 63B, продемонстрирована стратегия двойной CART-клетки, экспрессирующей CAR19 и CAR123. Фигура 63A представляет собой карту вектора, содержащего CAR19 и CAR123, связанных последовательностью P2A. На фигуре 63B представлено процентное содержание клеток, экспрессирующих CAR19, CAR123 (Q3) и как CAR19 (Q1), так и CAR123 (Q2).
На фигуре 64, содержащей фигуры 64A и 64B, продемонстрирована стратегия расщепленной CART-клетки, которая экспрессирует CAR19 и CAR123. Фигура 64A представляет собой карта вектора, содержащего CAR19 и CAR123, связанных последовательностью P2A. CAR19 содержит домен CD3-дзета, тогда как CAR123 содержит домен 4-1BB. На фигуре 64B продемонстрировано процентное содержание клеток, экспрессирующих CAR19, CAR123 (Q3) и как CAR19 (Q1), так и CAR123 (Q2).
На фигуре 65 представлена экспрессия CD123 в образцах первичных HSC, AML и BPDCN.
На фигуре 66, содержащей фигуры 66A и 66B, представлен анализ цитотоксичности для клонов 32716 CART123 (фиг. 66A) и 26292 (фиг. 66A) при инкубации в присутствии экспрессирующих CD123 клеток-мишеней в указанных отношениях эффектор:мишень.
На фигуре 67 представлен анализ дегрануляции CD107 для CART123-клеток при инкубации с HSCs по сравнению с BPDCN.
На фигуре 68, содержащей фигуры 68A и 68B, продемонстрирована экспрессия CD123 мононуклеарными клетками из крови пациента с тучноклеточным лейкозом/системным мастоцитозом, как детектируют окрашиванием изотипическим антителом (фиг. 68A) в качестве контроля или антителом против CD123 (фиг. 68B).
На фигуре 69, содержащей фигуры 69A и 69B, представлен анализ дегрануляции CD107, где CART123-клетки культивировали наряду с PMA и иономицином (фиг. 69A) или с мононуклеарными клетками из крови пациента с тучноклеточным лейкозом/системным мастоцитозом (фиг. 69B).
На фигуре 70 представлена экспериментальная схема для когорты 1 индивидуумов в клиническом исследовании введения РНК CART123 индивидуумам с рефрактерным или рецидивирующим AML.
На фигуре 71 представлена экспериментальная схема для когорты 2 индивидуумов в клиническом исследовании введения РНК CART123 индивидуумам с рефрактерным или рецидивирующим AML. Эти пациенты получают дозы противолимфомной химиотерапии в дополнение к терапии CART.
На фигуре 72, содержащей фигуры 72A, 72B и 72C, продемонстрированы результаты абляции T-клеток с использованием антитела против CD52 алемтузумаба после обработки трансдуцированными лентивирусом CART123-клетками на модели ксенотрансплантата MOLM14. CART123-клетки или нетрансдуцированные (UTD) клетки вводили мышам на неделе 1. Алемтузумаб вводили на неделе 2, неделе 3 или неделе 4 мышам, которые получали CART123-клетки, и опухолевую нагрузку оценивали в течение 24 недель. Повторное введение "MOLM14" проводили на неделе12. На фигуре 72A продемонстрирована опухолевая нагрузка, как детектируют посредством биолюминесцентной визуализации (фотонов/сек); на фигуре 72B продемонстрирован процент CART-клеток, детектируемых в периферической крови; и на фигуре 72C приведена общая выживаемость.
На фигуре 73, содержащей фигуры 73A и 73B, представлены результаты абляции T-клеток с использованием алемтузумаба после обработки трансдуцированными лентивирусом CART123-клетками на педиатрической модели ксенотрансплантата AML. CART123-клетки или нетрансдуцированные (UTD) клетки вводили мышам через 6 недель после приживления клеток первичного AML (неделя 0). Алемтузумаб вводили мышам на неделе 4, которые получали обработку CART123. На фигуре 73A продемонстрирована опухолевая нагрузка, как детектируют посредством биолюминесцентной визуализации (фотонов/сек); на фигуре 73B продемонстрирован процент CART-клеток, детектируемых в периферической крови.
На фигуре 74, содержащей фигуры 74A и 74B, представлен анализ клеток AML в селезенке (фиг. 74A) и костном мозге (фиг. 74B) после обработки CART123 и алемтузумабом, как проведено на фигуре 73.
На фигуре 75 представлено сравнение трех конечных стадий: (1) абляция CART-клетка обработкой алемтузумабом; (2) коэкспрессия CAR/CD20 в T-клетках и абляция ритуксимабом, и (3) эклеткропорация РНК CART-клеток при опухолевой нагрузке (представлено посредством биолюминесцентной визуализации; фотонов/сек) на модели ксенотрансплантатов AML.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
Если не определено иное, все технические и научные термины, используемые в настоящем описании, имеют тоже значение, как общепринято понимает специалист в данной области, к которой принадлежит изобретение.
Термин в единственном числе относится к одному или к более чем одному (т.е. по меньшей мере к одному) объекту. В качестве примера, "элемент" означает один элемент или более чем один элемент.
Термин "приблизительно" при указании измеряемой величины, такой как количество, продолжительность времени и т.п., предназначен включать изменения ±20% или в некоторых случаях ±10%, или в некоторых случаях ±5%, или в некоторых случаях ±1%, или в некоторых случаях ±0,1% от заданной величины, таким образом, такие изменения являются подходящими для проведения описываемых способов.
Термин "химерный антигенный рецептор" или альтернативно "CAR" относится к конструкции рекомбинантного полипептида, содержащей по меньшей мере внеклеточный антигенсвязывающий домен, трансмембранный домен и цитоплазматический сигнальный домен (также обозначаемый в настоящем описании как "внутриклеточный сигнальный домен"), содержащий функциональный сигнальный домен, получаемый из стимулирующей молекулы, как определено ниже. В некоторых вариантах осуществления домены в конструкции полипептида CAR находится в той же полипептидной цепи, например, содержит химерный слитый белок. В некоторых вариантах осуществления домены в конструкции полипептида CAR не являются смежными друг с другом, например, находятся в различных полипептидных цепях, например, как предоставлено в RCAR, как описано в настоящем описании.
В одном из аспектов стимулирующая молекула CAR представляет собой дзета-цепь, связанную с комплексом T-клеточного рецептора. В одном из аспектов цитоплазматический сигнальный домен содержит первичный сигнальный домен (например, первичный сигнальный домен CD3-дзета). В одном из аспектов цитоплазматический сигнальный домен дополнительно содержит один или более функциональных сигнальных доменов, получаемых по меньшей мере из одной костимулирующей молекулы, как определено ниже. В одном из аспектов костимулирующую молекулу выбирают из 4-1BB (т.е. CD137), CD27, ICOS и/или CD28. В одном из аспектов CAR содержит химерный слитый белок, содержащий внеклеточный антигенраспознающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий функциональный сигнальный домен, получаемый из стимулирующей молекулы. В одном из аспектов CAR содержит химерный слитый белок, содержащий внеклеточный антигенраспознающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий функциональный сигнальный домен, получаемый из костимулирующей молекулы, и функциональный сигнальный домен, получаемый из стимулирующей молекуле. В одном из аспектов CAR содержит химерный слитый белок, содержащий внеклеточный антигенраспознающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий два функциональных сигнальных домена, получаемых из одной или более костимулирующих молекул, и функциональный сигнальный домен, получаемый из стимулирующей молекулы. В одном из аспектов CAR содержит химерный слитый белок, содержащий внеклеточный антигенраспознающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий по меньшей мере два функциональных сигнальных домена, получаемых из одной или более костимулирующих молекул, и функциональный сигнальный домен, получаемый из стимулирующей молекулы. В одном из аспектов CAR содержит необязательную лидерную последовательность на N-конце (N-ter) слитого белка CAR. В одном из аспектов CAR дополнительно содержит лидерную последовательность на N-конце внеклеточного антигенраспознающего домена, где лидерная последовательность необязательно является отщепленной от антигенраспознающего домена (например, aa scFv) во время клеточного процессинга и локализации CAR в клеточной мембране.
CAR, который содержит антигенсвязывающий домен (например, scFv, однодоменное антитело или TCR (например, связывающий домен TCR-альфа или связывающий домен TCR-бета)), который специфически связывается с конкретным опухолевым маркером X, где X может представлять собой опухолевый маркер, как описано в настоящем описании, также обозначают как XCAR. Например, CAR, который содержит антигенсвязывающий домен, который специфически связывается CD123, обозначают как CD123 CAR. CAR может экспрессироваться любой клеткой, например, эффекторной клеткой иммунной системы, как описано в настоящем описании (например, T-клеткой или NK-клеткой).
Термин "сигнальный домен" относится к функциональному участку белка, который действует путем передачи информации в клетку для регуляции клеточной активности через определенные пути передачи сигнала посредством образования вторичных мессенджеров или функционирования как эффекторы посредством ответа на такие мессенджеры.
Как используют в настоящем описании, термины "альфа-субъединица рецептора IL-3", "IL3Rα", "CD123", "α-цепь IL3R" и "α-субъединица IL3R" взаимозаменяемо относятся к антигенной детерминанте, которую, как известно, можно детектировать на лейкозных клетках-предшественниках. Аминокислотные последовательности и последовательности нуклеиновой кислоты человека и мыши можно найти в общедоступной базе данных, такой как GenBank, UniProt и Swiss-Prot. Например, аминокислотную последовательность IL3Rα человека можно найти по номеру доступа NP 002174 и нуклеотидную последовательность, кодирующую IL3Rα человека, можно найти по номеру доступа NM 005191. В одном из аспектов антигенсвязывающий участок CAR распознает и связывается с эпитопом во внеклеточном домене белка CD123. В одном из аспектов белок CD123 экспрессируется злокачественной клеткой. Как используют в настоящем описании, "CD123" включает белки, содержащие мутации, например, точечные мутации, фрагменты, вставки, делеции и варианты сплайсинга полноразмерного CD123 дикого типа.
Термин "антитело", как используют в настоящем описании, относится к белку или полипептидной последовательности, получаемой из молекулы иммуноглобулина, которая специфически связывается с антигеном. Антитела могут являться поликлональными или моноклональными, состоять из нескольких цепей или являться одноцепочными, или интактными иммуноглобулинами, и их можно получать из природных источников или из рекомбинантных источников. Антитела могут представлять собой тетрамеры молекул иммуноглобулина.
Термин "фрагмент антитела" относится по меньшей мере к одному участку интактного антитела или его рекомбинантным вариантам и относится к антигенсвязывающему домену, например, определяющей комплементарность к антигену вариабельной области интактного антитела, которая является достаточной для обеспечения распознавания и специфического связывания фрагмента антитела с мишенью, такой как антиген. Примеры фрагментов антител включают, но не ограничиваются ими, фрагменты Fab, Fab', F(ab')2 и Fv, фрагменты scFv антител, линейные антитела, однодоменные антитела, такие как sdAb (VL или VH), домены VHH верблюдовых, и полиспецифические антитела, состоящие из фрагментов антител, таких как бивалентный фрагмент, содержащий два фрагмента Fab, связанных дисульфидным мостиком в шарнирной области, и выделенную CDR или другие связывающие эпитоп фрагменты антитела. Антигенсвязывающий фрагмент также можно вводить в однодоменные антитела, максиантитела, миниантитела, нанотела, интраантитела, диатела, триотела, тетратела, v-NAR и bis-scFv (см., например, Hollinger and Hudson, Nature Biotechnology, 23:1126-1136, 2005). Антигенсвязывающие фрагменты также можно прививать в каркасные области на основе полипептидов, таких как фибронектин III типа (Fn3)(см. патент США № 6703199, в котором описаны миниантитела на основе полипептида фибронектина).
Термин "scFv" относится к слитому белку, содержащему по меньшей мере один фрагмент антитела, содержащий вариабельную область легкой цепи и по меньшей мере один фрагмент антитела, содержащий вариабельную область тяжелой цепи, где вариабельные области легкой и тяжелой цепи являются смежно связанными посредством короткого гибкого полипептидного линкера, и способному экспрессироваться в виде одноцепочечного полипептида, и где scFv сохраняет специфичность интактного антитела, из которого его получают. Если не казано иное, как используют в настоящем описании, scFv может содержать вариабельные области VL и VH в любом порядке, например, по отношению к N-концам и C-концам полипептида, scFv может содержать VL-линкер-VH или может содержать VH-линкер-VL.
Термин "определяющую комплементарность область" или "CDR", как используют в настоящем описании, относится к последовательностям аминокислот в вариабельных областях антитела, которые обеспечивают антигенную специфичность и аффинность связывания. Например, в основном существует три CDR в каждой вариабельной области тяжелой цепи (например, HCDR1, HCDR2 и HCDR3) и три CDR в каждой вариабельной области легкой цепи (LCDR1, LCDR2 и LCDR3). Точные границы аминокислотной последовательности данной CDR можно определять с использованием любой из ряда хорошо известных схем, включая схемы, описанные Kabat et al., (1991), "Sequences of Proteins of Immunological Interest", 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (система нумерации по "Kabat"), Al-Lazikani et al., (1997) JMB 273,927-948 (система нумерации по "Chothia") или их сочетания. Под системой нумерации по Kabat в некоторых вариантах осуществления аминокислотные остатки CDR в вариабельном домене тяжелой цепи (VH) пронумерованы 31-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3) и аминокислотные остатки CDR в вариабельном домене легкой цепи (VL) нумеруют 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3). Под системой нумерации по Chothia в некоторых вариантах осуществления аминокислоты CDR в VH пронумерованы 26-32 (HCDR1), 52-56 (HCDR2) и 95-102 (HCDR3) и Аминокислотные остатки CDR в VL пронумерованы 26-32 (LCDR1), 50-52 (LCDR2) и 91-96 (LCDR3). В комбинированной системе нумерации по Kabat и Chothia в некоторых вариантах осуществления CDR соответствуют аминокислотным остаткам, которые являются частью CDR по Kabat, CDR по Chothia или обеих. Например, в некоторых вариантах осуществления CDR соответствуют аминокислотным остаткам 26-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3) в VH, например, VH млекопитающего, например, VH человека, и аминокислотные остатки 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3) в VL, например, VL млекопитающего, например, VL человека.
Участки композиции CAR по изобретению, содержащие антитело или фрагмент антитела могут находиться в различных формах, где антигенсвязывающий домен экспрессируется в виде части непрерывной полипептидной цепи, включая, например, фрагмент однодоменного антитела (sdAb), одноцепочечное антитело (scFv) и гуманизированное антитело или антитело человека (Harlow et al., 1999, In: Using Антитела: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, в Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, в Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; Bird et al., 1988, Science, 242:423-426). В одном из аспектов антигенсвязывающий домен композиции CAR по изобретению содержит фрагмент антитела. В дополнительном аспекте CAR содержит фрагмент антитела, который содержит scFv.
Как используют в настоящем описании, термин "связывающий домен" или "молекула антитела" (также обозначаемая в настоящем описании как "связывающий домен к мишени (например, CD123)") относится к белку, например, цепи иммуноглобулина или ее фрагменту, содержащему по меньшей мере одну последовательность вариабельного домена иммуноглобулина. Термин "связывающий домен" или "молекула антитела" включает антитела и фрагменты антител. В одном из вариантов осуществления молекула антитела представляет собой молекулу полиспецифического антитела, например, она содержит совокупность последовательностей вариабельных доменов иммуноглобулинов, где первая последовательность вариабельного домена иммуноглобулина совокупности обладает специфичностью связывания к первому эпитопу, а вторая последовательность вариабельного домена иммуноглобулина совокупности обладает специфичностью связывания ко второму эпитопу. В одном из вариантов осуществления молекула полиспецифического антитела представляет собой биспецифическую молекулу антитела. Биспецифическое антитело обладает специфичностью не более чем к двум антигенам. Биспецифическая молекула антитела характеризуется первой последовательностью вариабельного домена иммуноглобулина, которая обладает специфичностью связывания к первому эпитопу, и второй последовательностью вариабельного домена иммуноглобулина, которая обладает специфичностью связывания ко второму эпитопу.
Термин "тяжелая цепь антитела" относится к большей из двух типов полипептидных цепей, содержащихся в молекулах антител в их природных конформациях, и которая обычно определяет класс, к которому принадлежит антитело.
Термин "легкая цепь антитела" относится к меньшей из двух типов полипептидных цепей, содержащихся в молекулах антител в их природных конформациях. Каппа- (κ) и лямбда- (λ) легкие цепи относится к двум основным изотипам легкой цепи антитела.
Термин "рекомбинантное антитело" относится к антителу, которое получают с использованием технологии рекомбинантных ДНК, такому как, например, антитело, экспрессируемое бактериофагом или дрожжевой экспрессирующей системой. Также следует истолковывать, что термин означает антитело, которое получили синтезом молекулы ДНК, кодирующей антитело, и где молекула ДНК экспрессирует белок-антитело или аминокислотную последовательность, определяющую антитело, где ДНК или аминокислотную последовательность получали с использованием технологии рекомбинантной ДНК или аминокислотной последовательности, которая является доступной и хорошо известной в данной области.
Термин "антиген" или "Ag" относится к молекуле, которая вызывает иммунный ответ. Такой иммунный ответ может включать образование антител или активацию специфических иммунокомпетентных клеток, или то и другое. Специалисту в данной области будет понятно, что любая макромолекула, включая практически все белки или пептиды, может служить в качестве антигена. Кроме того, антигены можно получать из рекомбинантной или геномной ДНК. Специалисту в данной области будет понятно, что любая ДНК, которая содержит нуклеотидные последовательности или неполную нуклеотидную последовательность, кодирующую белок, который вызывает иммунный ответ, таким образом, кодирует "антиген", как этот термин используют в настоящем описании. Кроме того, специалисту в данной области будет понятно, что антиген, не должен кодироваться только полноразмерной нуклеотидной последовательностью гена. Легко понять, что настоящее изобретение относится, но не ограничивается ими, к использованию неполных нуклеотидных последовательностей более одного гена, и что эти нуклеотидные последовательности располагаются в различных комбинациях, кодируя полипептиды, которые вызывают желаемый иммунный ответ. Кроме того, специалисту в данной области будет понятно, что антиген, не должен полностью кодироваться "геном". Легко понять, что антиген можно синтезировать или можно выделять из биологического образца, или он может представлять собой макромолекулу кроме полипептида. Такой биологический образец может включать, но не ограничивается ими, образец ткани, образец опухоли, клетку или жидкость с другими биологическими компонентами.
Термин "противоопухолевый эффект" относится к биологическому действию, которое может проявляться различными способами, включая, но, не ограничиваясь ими, например, уменьшение объема опухоли, уменьшение числа опухолевых клеток, уменьшение числа метастазов, увеличение продолжительности жизни, снижение пролиферации опухолевых клеток, уменьшение выживаемости опухолевых клеток или улучшение состояния различных физиологических симптомов, связанных со злокачественным состоянием. "Противоопухолевый эффект" также может проявляться в способности пептидов, полинуклеотидов, клеток и антител по изобретению предотвращать возникновение опухоли в первом месте.
Термин "противораковый эффект" относится к биологическому действию, которое может проявляться различными способами, включая, но, не ограничиваясь ими, например, уменьшение объема опухоли, уменьшение числа злокачественных клеток, уменьшение числа метастазов, увеличение продолжительности жизни, снижение пролиферации злокачественных клеток, уменьшение выживаемости злокачественных клеток или улучшение состояния различных физиологических симптомов, связанных со злокачественным состоянием. "Противораковый эффект" также может проявляться в способности пептидов, полинуклеотидов, клеток и антител предотвращать возникновение злокачественной опухоли в первом месте.
Термин "противоопухолевый эффект" относится к биологическому действию, которое может проявляться различными способами, включая, но, не ограничиваясь ими, например, уменьшение объема опухоли, уменьшение числа опухолевых клеток, снижение пролиферации опухолевых клеток или уменьшение выживаемости опухолевых клеток.
Термин "аутологичное" относится к любому веществу, получаемому от одного и того же индивидуума, которому в дальнейшем можно его повторно вводить.
Термин "аллогенный" относится к любому веществу, получаемому от другого животного того же вида, которому повторно вводят вещество. Считают, что два или более индивидуума являются аллогенными по отношению друг к другу, когда гены в одном или более локусов не являются идентичными. В некоторых аспектах аллогенное вещество от индивидуумов одного и того же вида может являться достаточно генетически различной, чтобы взаимодействовать антигенно.
Термин "ксеногенный" относится к трансплантату, получаемому от животного другого вида.
Как используют в настоящем описании, термин "аферез" относится к принятому в данной области экстракорпоральному способу, которым кровь донора или пациента удаляют у донора или пациента и пропускают через устройство, которое отделяет выбранный конкретный компонент(ы) и возвращает оставшуюся часть в кровообращение донора или пациента, например, посредством ретрансфузии. Таким образом, в отношении "аферезного образца" относится к образцу, получаемому с использованием афереза.
Термин "комбинация" относится к установленной комбинации в одной стандартной лекарственной форме или к комбинированному введению, где соединение по настоящему изобретению и партнер по комбинации (например, другое лекарственное средство, как объясняют ниже, также обозначаемое как "терапевтическое средство" или "средство для совместного введения") можно вводить независимо одновременно или раздельно в течение определенных интервалов времени, особенно когда такие интервалы времени обеспечивают возможность того, что партнеры по комбинации суммарное, например, синергическое действие. Отдельные компоненты можно упаковывать в набор или раздельно. Один или оба компонента (например, порошки или жидкости) можно восстанавливать или разбавлять до желаемой дозы перед введением. Термины "совместное введение" или "комбинированное введение", или т.п., как используют в настоящем описании, предназначен включать введение выбранного партнера по комбинации c одному нуждающемуся в этом индивидууму (например, пациенту) и предназначены включать схемы лечения, в которых средства необязательно вводят одним и тем же путем введения или одновременно. Как используют в настоящем описании, термин "фармацевтическая комбинация" означает продукт, который является результатом смешивания или объединения более одного активного ингредиента, и включает установленные и неустановленные комбинации активных ингредиентов. Термин "установленная комбинация" означает, что активные ингредиенты, например, соединение по настоящему изобретению и партнер по комбинации вводят пациенту одномоментно в форме единого целого или дозы. Термин "неустановленная комбинация" означает, что активные ингредиенты, например, соединение по настоящему изобретению и партнер по комбинации вводят пациенту в виде отдельных единиц одномоментно, одновременно или последовательно без каких-либо конкретных ограничений по времени, где такое введение обеспечивает терапевтически эффективные уровни двух соединений в организме пациента. Последнее также применяют для "коктейльной" терапии, например, введение трех или более активных ингредиентов.
Термин "злокачественная опухоль" относится к заболеванию, характеризующемуся быстрым и неконтролируемым ростом аберрантных клеток. Злокачественные клетки могут распространяться локально или через кровоток и лимфатическую систему в другие части организма. Примеры различных злокачественных опухолей описаны в настоящем описании и включают, но не ограничиваются ими, рак молочной железы, рак предстательной железы, рак яичника, рак шейки матки, рак кожи, рак поджелудочной железы, колоректальный рак, злокачественную опухоль почки, рак печени, злокачественную опухоль головного мозга, лимфому, лейкоз, рак легких и т.п. Термины "опухоль" и "злокачественная опухоль" в настоящем описании используют взаимозаменяемо, например, оба термина включают солидные и жидкие, например, диффузные или циркулирующие опухоли. Как используют в настоящем описании, термин "злокачественная опухоль" или "опухоль" включает предраковые, а также злокачественные опухоли и опухоли.
"Получаемый из", как этот термин используют в настоящем описании, указывает на взаимосвязь между первой и второй молекулой. Как правило, он относится к структурному сходству первой молекулы и второй молекулы и не означает или не включает способ или источник ограничения первой молекулы, которую получают из второй молекулы. Например, в случае внутриклеточного сигнального домена, который получают из молекулы CD3-дзета, внутриклеточный сигнальный домен сохраняет достаточно структуры CD3-дзета, таким образом, чтобы обладать необходимой функцией, а именно, способностью образовывать сигнал в подходящих условиях. Термин не означает или не включает ограничение конкретного способа получения внутриклеточного сигнального домена, например, он не означает, что для предоставления внутриклеточного сигнального домена, необходимо начинать с последовательности CD3-дзета и удаляют нежелаемую последовательность, или вводят мутации для получения внутриклеточного сигнального домена.
Как используют в настоящем описании, фраза "заболевание, связанное с экспрессией CD123," включает, но не ограничивается им, заболевание, связанное с экспрессией CD123, или состояние, связанное с клеткой, которая экспрессирует CD123 (например, CD123 дикого типа или мутантный CD123), включая, например, пролиферативное заболевание, такое как злокачественная опухоль или злокачественное новообразование; предраковое состояние, такое как миелодисплазия, миелодиспластический синдром или предлейкоз, или не связанное со злокачественной опухолью показание, ассоциированное с клеткой, которая экспрессирует CD123 (например, CD123 дикого типа или мутантный CD123). В одном из аспектов злокачественная опухоль, связанная с экспрессией CD123 (например, CD123 дикого типа или мутантного CD123), представляет собой гематологическую злокачественную опухоль. В одном из аспектов заболевание включает AML, ALL, волосатоклеточный лейкоз, пролимфоцитарный лейкоз, хронический миелолейкоз (CML), лимфому Ходжкина, неоплазию из бластных плазмоцитоидных дендритных клеток, лимфобластный B-клеточный лейкоз (B-клеточный острый лимфоидный лейкоз, BALL), острый лимфобластный T-клеточный лейкоз (T-клеточный острый лимфоидный лейкоз (TALL); миелодиспластический синдром; миелопролиферативную неоплазию; гистиоцитоз (например, мастоцитоз или новообразование из бластных плазмоцитоидных дендритных клеток); мастоцитоз, например, системный мастоцитоз или тучноклеточный лейкоз и т.п. Дополнительное заболевание, связанное с экспрессией CD123, включают, но не ограничиваются ими, например, атипичные и/или неклассические злокачественные опухоли, злокачественные новообразования, предраковые состояния или пролиферативные заболевания, связанные с экспрессией CD123. Также включают несвязанные со злокачественной опухолью, показания, ассоциированные с экспрессией CD123.
В некоторых вариантах осуществления экспрессирующая опухолевый антиген (например, CD123 или CD19) клетка экспрессирует или экспрессировала в любой момент времени иРНК, кодирующую опухолевый антиген. В одном из вариантов осуществления экспрессирующая опухолевый антиген (например, CD123- или CD19-) клетка продуцирует опухолевый антигенный белок (например, дикого типа или мутант), и опухолевый антигенный белок может содержаться на нормальных уровнях или на сниженных уровнях. В одном из вариантов осуществления экспрессирующая опухолевый антиген (например, CD123 или CD19) клетка продуцировала детектируемые уровни опухолевого антигенного белка в один из моментов времени, и затем продуцировала по существу не детектируемый опухолевый антигенный белок.
Термин "консервативные модификации последовательности" относится к модификациям аминокислот, которые не оказывают значительного влияния или не изменяют характеристики связывания антитела или фрагмента антитела, содержащего аминокислотную последовательность. Такие консервативные модификации включают замены, добавления и делеции аминокислот. Модификации можно вводить в антитело или фрагмент антитела по изобретению стандартными способами, известными в данной области, такими как сайт-специфический мутагенез и опосредованный ПЦР мутагенез. Консервативные замены представляют собой замены, в которых аминокислотный остаток заменяют аминокислотным остатком с аналогичной боковой цепью. Семейства аминокислотных остатков с аналогичными боковыми цепями определены в данной области. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или более аминокислотных остатков с CAR по изобретению можно заменять другими аминокислотными остатками из того же семейства боковых цепей и измененные CAR можно тестировать с использованием функциональных анализов, описываемых в настоящем описании.
Термин "стимуляция" относится к первичному ответу, индуцируемому связыванием стимулирующей молекулы (например, комплекса TCR/CD3) со своим когнатным лигандом, таким образом, опосредуя событие передачи сигнала, такое как, но, не ограничиваясь ими, передачу сигнала через комплекс TCR/CD3. Стимуляция может опосредовать измененную экспрессию определенных молекул, такую как снижение экспрессии TGF-β, и/или распознавание цитоскелетных структур и т.п.
Термин "стимулирующая молекула" относится к молекуле, экспрессируемой T-клеткой, которая предоставляет первичную цитоплазматическую сигнальную последовательность(и), которая регулирует первичную активацию комплекса TCR по стимулирующему пути, по меньшей мере некоторый аспект передачи сигнала T-клеточного пути. В одном из аспектов первичный сигнал инициирует, например, связывание комплекса TCR/CD3 с молекулой MHC, нагруженной пептидом, и которое приводит к опосредованию T-клеточного ответа, включая, но, не ограничиваясь ими, пролиферацию, активацию, дифференцировку и т.п. Первичная цитоплазматическая сигнальная последовательность (также обозначаемая как "первичный сигнальный домен"), которая действует стимулирующим образом, может содержать сигнальный мотив, который является известным как иммунорецепторный тирозиновый активирующий мотив или ITAM. Примеры ITAM, содержащего первичную цитоплазматическую сигнальную последовательность, которая находит конкретное применение в изобретение, включает, но не ограничивается ими, ITAM, получаемые из TCR-дзета, FcR-гамма, FcR-бета, CD3-гамма, CD3-дельта, CD3 эпсилон, CD5, CD22, CD79a, CD79b, CD278 (также известного как "ICOS"), FcεRI, CD66d, DAP10 и DAP12. В конкретном CAR по изобретению, внутриклеточный сигнальный домен в любом одном или более CAR по изобретению, содержит внутриклеточную сигнальную последовательность, например, первичную сигнальную последовательность CD3-дзета. В конкретном CAR по изобретению первичная сигнальная последовательность CD3-дзета представляет собой последовательность, предоставленную как SEQ ID NO: 9, или эквивалентные остатки от не являющихся человеком виды, например, мыши, грызуна, обезьяны, примата и т.п. В конкретном CAR по изобретению первичная сигнальная последовательность CD3-дзета представляют собой последовательность, как предоставлено в SEQ ID NO: 10, или эквивалентные остатки от не являющихся человеком видов, например, мыши, грызуна, обезьяны, примата и т.п.
Термин "антигенпрезентирующая клетка" или "APC" относится к клетке иммунной системы, такой как вспомогательная клетка (например, B-клетка, дендритная клетка и т.п.), которая предоставляет чужеродный антиген, образовавший комплекс с молекулами главного комплекса гистосовместимости (MHC), на своей поверхности. T-клетки могут распознавать эти комплексы с использованием своих T-клеточных рецепторов (TCR). APC процессируют антигены и предоставляют их T-клеткам.
"Внутриклеточный сигнальный домен", как термин используют в настоящем описании, относится к внутриклеточной части молекулы. Внутриклеточный сигнальный домен может генерировать сигнал, который обеспечивает иммунной функции эффектора, содержащей CAR клетки, например, CART-клетка или экспрессирующей CAR NK-клетки. Примеры иммунной функции эффектора, например, в CART-клетке или экспрессирующей CAR NK-клетке включают цитолитическую активность и активность хелперов, включая секрецию цитокинов. В вариантах осуществления внутриклеточный сигнальный домен преобразует сигнал эффекторной функции и направляет клетку для выполнения специализированной функции. Несмотря на то, что можно применять полный внутриклеточный сигнальный домен, во многих случаях использование полной цепи не является необходимым. В тех случаях, когда используют такой усеченный участок внутриклеточного сигнального домена, такой усеченный участок можно использовать вместо интактной цепи при условии, что он преобразует сигнал эффекторной функции. Таким образом, термин внутриклеточный сигнальный домен предназначен включать любой усеченный участок внутриклеточного сигнального домена, достаточный для преобразования сигнала эффекторной функции.
В одном из вариантов осуществления внутриклеточный сигнальный домен может содержать первичный внутриклеточный сигнальный домен. Иллюстративные первичные внутриклеточные сигнальные домены включают первичные внутриклеточные сигнальные домены, получаемые из молекул, обеспечивающих первичную стимуляцию или антигензависимую стимуляцию. В одном из вариантов осуществления внутриклеточный сигнальный домен может содержать костимулирующий внутриклеточный домен. Иллюстративные костимулирующие внутриклеточные сигнальные домены включают костимулирующие внутриклеточные сигнальные домены, получаемые из молекул, обеспечивающих костимулирующие сигналы или антигензависимую стимуляцию. Например, в случае экспрессирующей CAR эффекторной клетки иммунной системы, например, T-клетки с CAR или экспрессирующей CAR NK-клетки первичный внутриклеточный сигнальный домен может содержать цитоплазматическую последовательность T-клеточного рецептора, и костимулирующий внутриклеточный сигнальный домен может содержать цитоплазматическую последовательность из корецептора или костимулирующей молекулы.
Первичный внутриклеточный сигнальный домен может содержать сигнальный мотив, который известен как иммунорецепторный тирозиновый активирующий мотив или ITAM. Примеры ITAM, содержащих первичные цитоплазматические сигнальные последовательности включают, но не ограничиваются ими, ITAM, получаемые из CD3-дзета, FcR-гамма, FcR-бета, CD3-гамма, CD3-дельта, CD3-эпсилон, CD5, CD22, CD79a, CD79b, CD278 ("ICOS"), FcεRI, CD66d, DAP10 и DAP12.
Термин "дзета" или альтернативно "дзета-цепь", "CD3-дзета" или "TCR-дзета" определяют как белок, предоставляемый как белок с номером доступа GenBan BAG36664.1 или эквивалентные остатки от не являющихся человеком видов, например, мыши, грызуна, обезьяны, примата и т.п., и "стимулирующий домен дзета" или альтернативно "стимулирующий домен CD3-дзета", или "стимулирующий домен TCR-дзета" определяют как аминокислотные остатки из цитоплазматического домена дзета-цепи, которые являются достаточными для функциональной передачи начального сигнала, необходимого для активации T-клеток. В одном из аспектов цитоплазматический домен дзета содержит остатки от 52 до 164 номера доступа GenBank BAG36664.1 или эквивалентные остатки от не являющихся человеком видов, например, мыши, грызуна, обезьяны, примата и т.п., которые являются их функциональными ортологами. В одном из аспектов "стимулирующий домен дзета" или "стимулирующий домен CD3-дзета" представляет собой последовательность, предоставленную как SEQ ID NO: 9. В одном из аспектов "стимулирующий домен дзета" или "стимулирующий домен CD3-дзета" представляет собой последовательность, предоставленную как SEQ ID NO: 10.
Термин "костимулирующая молекула" относится к когнатному партнеру по связыванию на T-клетке, который специфически связывается с костимулирующим лигандом, таким образом, опосредуя костимулирующий ответ T-клеткой, такой как, но, не ограничиваясь ими, пролиферация. Костимулирующие молекулы представляют собой молекулы клеточной поверхности, отличные от антигенных рецепторов или их лигандов, которые являются необходимыми для эффективного иммунного ответа. Костимулирующие молекулы включают, но не ограничиваются ими, молекулу MHC I класса, TNF-рецепторные белки, иммуноглобулиноподобные белки, цитокиновые рецепторы, интегрины, сигнальные молекулы, активирующие лимфоциты (белки SLAM), активирующие NK-клетки рецепторы, BTLA, Toll-подобный рецептор, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганд, который специфически связывается с CD83.
Костимулирующий внутриклеточный сигнальный домен относится к внутриклеточному участку костимулирующей молекулы. Внутриклеточный сигнальный домен может содержать полный внутриклеточный участок или полный нативный внутриклеточный сигнальный домен молекулы, из которой его получают, или его функциональный фрагмент.
Термин "4-1BB" относится к представителю суперсемейства TNFR с аминокислотной последовательностью, предоставленной как номер доступа GenBank AAA62478.2, или эквивалентные остатки от не являющихся человеком видов, например, мыши, грызуна, обезьяны, примата и т.п.; и "костимулирующий домен 4-1BB" определяют как аминокислотные остатки 214-255 номера доступа GenBank AAA62478.2 или эквивалентные остатки от не являющихся человеком видов, например, мыши, грызуна, обезьяны, примата и т.п. В одном из аспектов "костимулирующий домен 4-1BB" представляет собой последовательность, предоставленную как SEQ ID NO: 7, или эквивалентные остатки от не являющихся человеком видов, например, мыши, грызуна, обезьяны, примата и т.п.
"Эффекторная клетка иммунной системы", как этот термин используют в настоящем описании, относится к клетке, которая участвует в иммунном ответе, например, в активации ответа иммунного эффектора. Примеры эффекторных клеток иммунной системы включают T-клетки, например, альфа/бета-T-клетки и гамма/дельта-T-клетки, B-клетки, естественные киллеры (NK)-клетки, естественные киллеры T-(NKT) клетки, тучные клетки и миелоидные фагоциты.
"Функция иммунного эффектора или ответ иммунного эффектора", как этот термин используют в настоящем описании, относится к функции или ответу, например, эффекторной клетки иммунной системы, который усиливает или активирует иммунную атаку клетки-мишени. Например, функция или ответ иммунного эффектора относится к свойству T- или NK-клетки, которая способствует цитолизу или ингибированию роста или пролиферации клетки-мишени. В случае T-клетки примерами функции или ответа иммунного эффектора являются первичная стимуляция и костимуляция.
Термин "эффекторная функция" относится к специализированной функции клетки. Эффекторная функция T-клетки, например, может представлять собой цитолитическую активность или активность хелперов, включая секрецию цитокинов.
Термин "кодирующий" относится к природному свойству конкретных последовательностей нуклеотидов в полинуклеотиде, таком как ген, кДНК или иРНК, служить в качестве матриц для синтеза других полимеров и макромолекул в биологических процессах с определенной последовательностью нуклеотидов (например, рРНК, тРНК и иРНК) или определенной последовательностью аминокислот и биологическими свойствами, обусловленными ими. Таким образом, ген, кДНК или РНК кодирует белок, если транскрипция и трансляция иРНК, соответствующей такому гену, приводит к продукции белка в клетке или другой биологической системе. Кодирующая цепь, нуклеотидная последовательность, которой является идентичной последовательности иРНК и, как правило, предоставлена в списках последовательностей, и некодирующая цепь, используемая в качестве матрицы для транскрипции гена или кДНК, могут быть обозначены как кодирующие белок или другой продукт этого гена или кДНК.
Если не указано иное, "нуклеотидная последовательность, кодирующая аминокислотную последовательность" включает все нуклеотидные последовательности, которые являются вырожденными вариантами друг друга, и которые кодируют одну и ту же аминокислотную последовательность. Фраза нуклеотидная последовательность, кодирующая белок или РНК, также может включать интроны в тех случаях, когда такая нуклеотидная последовательность, кодирующая белок, может в некотором варианте содержать интрон(ы).
Термин "эффективное количество" или "терапевтически эффективное количество" используют взаимозаменяемо в настоящем описании, и он относится к количеству соединения, состава, вещества или композиции, как описано в настоящем описании, эффективному для получения конкретного биологического результата.
Термин "эндогенный" относится к любому веществу из организма, клетки, ткани или системы или продуцируемому в организме, клетки, ткани или системе.
Термин "экзогенный" относится к любому веществу, вводимому в организм, клетку, ткань или систему или получаемому вне организма, клетки, ткани или системы.
Термин "экспрессия" относится к транскрипции и/или трансляции конкретной нуклеотидной последовательности под контролем промотора.
Термин "вектор для переноса" относится к композиции вещества, которая содержит выделенную нуклеиновую кислоту, и которую можно использовать для доставки выделенной нуклеиновой кислоты во внутреннюю часть клетки. Различные векторы известны в данной области, включая, но, не ограничиваясь ими, линейные полинуклеотиды, полинуклеотиды, связанные с ионными или амфифильными соединениями, плазмидами и вирусами. Таким образом, термин "вектор для переноса" включает автономно реплицирующуюся плазмиду или вирус. Термин также следует истолковывать как дополнительно включающий не относящиеся к плазмиде и не относящиеся к вирусу соединения, которые облегчают перенос нуклеиновой кислоты в клетки, такие как, например, соединение полилизина, липосома и т.п. Примеры вирусных векторов для переноса включают, но не ограничиваются ими, аденовирусные векторы, векторы на основе аденоассоциированного вируса, ретровирусные векторы, лентивирусные векторы и т.п.
Термин "экспрессирующий вектор" относится к вектору, содержащему рекомбинантный полинуклеотид, содержащий регулирующие экспрессию последовательности, функционально связанные с нуклеотидной последовательностью, которая экспрессируется. Экспрессирующий вектор содержит достаточное количество действующих в цис-положении элементов для экспрессии; другие элементы для экспрессии могут поставляться клеткой-хозяином или в экспрессирующей системе in vitro. Экспрессирующие векторы включают все известные в данной области экспрессирующие векторы, включая космиды, плазмиды (например, голые или содержащиеся в липосомах) и вирусы (например, лентивирусы, ретровирусы, аденовирусы и аденоассоциированные вирусы), которые содержат рекомбинантный полинуклеотид.
Как используют в настоящем описании, термин "вектор" относится к любому носителю, который можно использовать для доставки и/или экспрессии молекулы нуклеиновой кислоты. Он может представлять собой вектор для переноса или экспрессирующий вектор, как описано в настоящем описании.
Термин "лентивирус" относится к роду семейства Retroviridae. Лентивирусы являются уникальными среди ретровирусов, что заключается в том, что они способны инфицировать неделящиеся клетки; они могут доставлять значительное количество генетической информации в ДНК клетки-хозяина, таким образом, они представляют собой один из наиболее эффективных способов вектора для доставки генов. HIV, SIV и FIV являются примерами лентивирусов.
Термин "лентивирусный вектор" относится к вектору, получаемому по меньшей мере из части геном лентивируса, в частности включая самоинактивирующийся лентивирусный вектор, как предоставлено у Milone et al., Mol. Ther. 17(8): 1453-1464 (2009). Другие примеры лентивирусных векторов, которые можно использовать в клинике, включают, но не ограничиваются ими, например, технологию доставки генов LENTIVECTOR® от Oxford BioMedica, векторную систему LENTIMAX™ от Lentigen и т.п. Типы лентивирусных векторов для неклинического использования также доступные и известны специалисту в данной области.
Термин "гомологичный" или "идентичность" относится к идентичности последовательности субъединицы двух полимерных молекул, например, двух молекул нуклеиновой кислоты, таких как, две молекулы ДНК или две молекулы РНК, или двух полипептидных молекул. Когда положение субъединицы в обеих из двух молекул занимает одна и та же мономерная субъединица; например, если положение, в каждой из двух молекул ДНК занимает аденин, то они являются гомологичными или идентичными в этом положении. Гомология двух последовательностей непосредственно зависит от числа совпадающих или гомологичных положений; например, если половина (например, пять положений в полимере длиной десять субъединиц) положений в двух последовательностях являются гомологичными, две последовательности являются на 50% гомологичными; если 90% последовательностей (например, 9 из 10) совпадают или являются гомологичными, две последовательности являются на 90% гомологичными.
"Гуманизированные" формы не принадлежащих человеку антител (например, мыши) представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, получаемую из не принадлежащего человеку иммуноглобулина. Преимущественно гуманизированные антитела и фрагменты антител представляют собой иммуноглобулины человека (реципиентное антитело или фрагмент антитела), в которых остатки из определяющей комплементарность области (CDR) реципиента заменяют остатками из CDR, принадлежащей не являющимся человеком видам (донорное антитело), таким как мыши, крысы или кролика, с желаемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки каркасной области (FR) Fv иммуноглобулина человека заменяют соответствующими не принадлежащими человеку остатками. Кроме того, гуманизированное антитело/фрагмент антитела может содержать остатки, которые не встречаются ни в реципиентном антителе, ни в импортируемых CDR или каркасных последовательностях. Эти модификации могут дополнительно улучшать и оптимизировать характеристики антитела или фрагмента антитела. Как правило, гуманизированное антитело или фрагмент антитела содержит по существу все из по меньшей мере одного и, как правило двух вариабельных доменов, в которых все или по существу все области CDR соответствуют областям CDR не принадлежащего человеку иммуноглобулина, и все или значительная часть областей FR представляют собой области FR последовательности иммуноглобулина человека. Гуманизированное антитело или фрагмент антитела также может содержать по меньшей мере участок константной области иммуноглобулина (Fc), как правило, участок константной области иммуноглобулина человека. Для более подробной информации см. Jones et al., Nature, 321: 522-525, 1986; Reichmann et al., Nature, 332: 323-329, 1988; Presta, Curr. Op. Struct. Biol., 2: 593-596, 1992.
"Полностью принадлежащий человеку" относится к иммуноглобулину, такому как антитело или фрагмент антитела, где целая молекула принадлежит человеку или состоит из аминокислотной последовательности, идентичной форме человека антитела или иммуноглобулина.
Термин "выделенный" означает измененный или удаленный из природного состояния. Например, нуклеиновая кислота или пептид, естественных образом присутствующий у живого животного, не является "выделенным", но та же нуклеиновая кислота или пептид, частично или полностью отделенный от сопутствующих веществ из своего природного состояния, является "выделенной". Выделенная нуклеиновая кислота или белок могут существовать в по существу очищенной форме или могут существовать в неприродном окружении, таком как, например, клетка-хозяин.
В контексте настоящего изобретения используют следующие ниже сокращенные обозначения для часто встречающихся оснований нуклеиновых кислот. "A" относится к аденозину, "C" относится к цитозину, "G" относится к гуанозину, "T" относится к тимидину, и "U" относится к уридину.
Термин "функционально связанный" или "транскрипционный контроль" относится к функциональной связи между регуляторной последовательностью и гетерологичной последовательностью нуклеиновой кислоты, приводящей к экспрессии последней. Например, первая последовательность нуклеиновой кислоты является функционально связанной со второй последовательностью нуклеиновой кислоты, когда первая последовательность нуклеиновой кислоты находится в функциональной зависимости со второй последовательностью нуклеиновой кислоты. Например, промотор является функционально связанным с кодирующей последовательностью, если промотор влияет на транскрипцию или экспрессию кодирующей последовательности. Функционально связанные последовательности ДНК могут являться смежными относительно друг друга и, например, при необходимости соединять две кодирующие области белка, могут находиться в той же рамке считывания.
Термин "парентеральное" введение иммуногенной композиции включает, например, подкожную (п/к), внутривенную (в/в), внутримышечную (в/м) или внутригрудинную инъекцию, техники внутриопухолевого или инфузионного введения.
Термин "нуклеиновая кислота", "полинуклеотид" или "молекула нуклеиновой кислоты" относится к дезоксирибонуклеиновой кислоте (ДНК) или рибонуклеиновой кислоте (РНК), или комбинации ДНК или РНК, и их полимерам в одноцепочечной или двухцепочечной форме. Термин "нуклеиновая кислота" включает ген, кДНК или иРНК. В одном из вариантов осуществления молекула нуклеиновой кислоты является синтетической (например, химически синтезированной) или рекомбинантной. Если нет конкретных ограничений, термин включает нуклеиновые кислоты, содержащие аналоги или производные природных нуклеотидов, которые обладают сходными свойствами связывания как эталонная нуклеиновая кислота и метаболизируются сходным образом до природных нуклеотидов. Если не указано иное, конкретная последовательность нуклеиновой кислоты также в неявной форме включает ее консервативно модифицированные варианты (например, замены вырожденных кодонов), аллели, ортологи, SNP и комплементарные последовательности, а также последовательность явно указанную. В частности, замены вырожденных кодонов можно проводить путем получения последовательностей, в которых третье положение одного или более выбранных (или всех) кодонов заменяют остатками смешанных оснований и/или дезоксиинозина (Batzer et al., Nucleic Acid Res., 19:5081 (1991); Ohtsuka et al., J. Biol. Chem., 260:2605-2608 (1985), и Rossolini et al., Mol. Cell. Probes, 8:91-98 (1994)).
Термины "пептид", "полипептид" и "белок" используют взаимозаменяемо, и они относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать по меньшей мере две аминокислоты, и не накладывают какого-либо ограничения на максимальное число аминокислот, которое может содержать белковая или пептидная последовательность. Полипептиды включают любой пептид или белок, содержащий две или более аминокислоты, соединенных друг с другом пептидными связями. Как используют в настоящем описании, термин относится как к более коротким цепям, которые также общепринято обозначают в данной области, например, как пептиды, олигопептиды и олигомеры, так и к более длинным цепям, которые, как правило, обозначают в данной области как белки, для которых существует много типов. "Полипептиды" включают, например, наряду с другими биологически активные фрагменты, по существу гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитые белки. Полипептид включает природный пептид, рекомбинантный пептид или их сочетание.
Термин "промотор" относится к последовательности ДНК, распознаваемой аппаратом синтеза клетки или вводимым аппаратом синтеза, необходимой для инициализации специфической транскрипции полинуклеотидной последовательности.
Термин "промоторная/регуляторная последовательность" относится к последовательности нуклеиновой кислоты, которая является необходимой для экспрессии продукта гена, функционально связанного с промоторной/регуляторной последовательностью. В некоторых случаях такая последовательность может представлять собой коровую промоторную последовательность, а в других случаях такая последовательность также может содержать энхансерную последовательность и другие регуляторные элементы, которые являются необходимыми для экспрессии продукта гена. Промоторная/регуляторная последовательность может, например, представлять собой последовательность, которая экспрессирует продукт гена тканеспецифическим образом.
Термин "конститутивный" промотор относится к нуклеотидной последовательности, которая, когда является функционально связанной с полинуклеотидом, который кодирует или устанавливает продукт гена, вызывает образование продукта гена в клетке в большей части или во всех физиологических условиях клетки.
Термин "индуцибельный" промотор относится к нуклеотидной последовательности, которая, когда является функционально связанной с полинуклеотидом, который кодирует или устанавливает продукт гена, вызывает образование продукта гена в клетке по существу только, когда в клетке присутствует промотор.
Термин "тканеспецифический" промотор относится к нуклеотидной последовательности, которая, когда является функционально связанной с полинуклеотидом, который кодирует или устанавливает продукт гена, вызывает образование продукта гена в клетке по существу только, если клетка представляет собой клетку типа ткани, соответствующего промотору.
Термин "ассоциированный со злокачественной опухолью антиген" или "опухолевый антиген" взаимозаменяемо относится к молекуле (как правило, белку, углеводу или липиду), который экспрессируется на поверхности злокачественной клетки полностью или в качестве фрагмента (например, MHC/пептида), и который является пригодным для предпочтительного направленного воздействия фармакологического средства на злокачественную клетку. В некоторых вариантах осуществления опухолевый антиген представляет собой маркер, экспрессируемый нормальными клетками и злокачественными клетками, например, линейный маркер, например, CD19 или CD123 на B-клетках. В некоторых вариантах осуществления опухолевый антиген представляет собой молекулу клеточной поверхности, которая сверхэкспрессируется в злокачественной клетке по сравнению с нормальной клеткой, например, сверхэкспрессия в 1 раз, сверхэкспрессия в 2 раза, сверхэкспрессия в 3 раза или более по сравнению с нормальной клеткой. В некоторых вариантах осуществления опухолевый антиген представляет собой молекулу клеточной поверхности, которая несоответствующим образом синтезируется в злокачественной клетке, например, молекулу, которая содержит делеции, добавления или мутации по сравнению с молекулой, экспрессируемой нормальной клеткой. В некоторых вариантах осуществления опухолевый антиген экспрессируется только на клеточной поверхности злокачественной клетки полностью или в виде фрагмента (например, MHC/пептида) и не синтезируется или не экспрессируется на поверхности нормальной клетки. В некоторых вариантах осуществления CAR по настоящему изобретению относятся к CAR, содержащим антигенсвязывающий домен (например, антитело или фрагмент антитела), который связывается с MHC, содержащимся в пептиде. Как правило, пептиды, получаемые из эндогенных белков, заполняют "карманы" молекулы главного комплекса гистосовместимости (MHC) I класса и распознаются T-клеточными рецепторами (TCR) на CD8+ T-лимфоцитах. Комплексы MHC I класса конститутивно экспрессируются всеми ядросодержащими клетками. В злокачественной опухоли комплексы вирусоспецифичный и/или опухолеспецифичный пептид/MHC представляют собой уникальный класс мишеней на клеточной поверхности для иммунотерапии. Были описаны TCR-подобные антитела, направленно воздействующие на пептиды, получаемые из антигенов вирусов или опухолевых антигенов, по отношению к лейкоцитарную антигену человека (HLA)-A1 или HLA-A2 (см., например, Sastry et al., J Virol., 2011 85(5):1935-1942; Sergeeva et al., Blood, 2011 117(16):4262-4272; Verma et al., J. Immunol., 2010 184(4):2156-2165; Willemsen et al., Gene Ther., 2001 8(21):1601-1608; Dao et al., Sci. Transl. Med., 2013 5(176):176ra33; Tassev et al., Cancer Gene Ther., 2012 19(2):84-100). Например, TCR-подобное антитело можно идентифицировать на основании скрининга библиотеки, такой как библиотека фагового дисплея scFv человека.
Термин "гибкий полипептидный линкер" или "линкер", как используют в отношении scFv, относится к пептидному линкеру, который состоит из аминокислот, таких как остатки глицина и/или серина, используемые отдельно или в комбинации для связывания вариабельных областей тяжелой цепи и вариабельных областей легкой цепи друг с другом. В одном из вариантов осуществления гибкий полипептидный линкер представляет собой линкер Gly/Ser и содержит аминокислотную последовательность (Gly-Gly-Gly-Ser)n (SEQ ID NO: 38), где n представляет собой положительное целое число, равное 1 или более. Например, n=1, n=2, n=3. n=4, n=5 и n=6, n=7, n=8, n=9 и n=10. В одном из вариантов осуществления гибкие полипептидные линкеры содержат, но не ограничиваются ими, (Gly4 Ser)4 (SEQ ID NO: 27) или (Gly4 Ser)3 (SEQ ID NO: 28). В другом варианте осуществления линкеры содержат многие повторы (Gly2Ser), (GlySer) или (Gly3Ser) (SEQ ID NO: 29). Также в объем изобретения входят линкеры, описанные в WO2012/138475, включенной в настоящее описание посредством ссылки.
Как используют в настоящем описании, 5'-кэп (также называемый кэп РНК, кэп 7-метилгуанозин РНК или m7G-кэп РНК) представляет собой модифицированный нуклеотид гуанина, который добавили к "передней стороне" или 5'-концу эукариотической информационной РНК сразу же после начала транскрипции. 5'-кэп состоит из концевой группы, которая является связанной с первым транскрибируемым нуклеотидом. Его присутствие является критическим для распознавания рибосомой и защиты от РНКаз. Добавление кэп сопряжено с транскрипцией и происходит котранскрипционно, таким образом, что одно влияет на другое. непосредственно после начала транскрипции 5'-конец синтезируемой иРНК связывается синтезирующим кэп комплексом, связанным с РНК-полимеразой. Этот ферментативный комплекс катализирует химические реакции, которые являются необходимыми для кэппирования иРНК. Синтез проходит в виде многоэтапных биохимических реакций. Кэппирующую группу можно модифицировать для модулирования функциональности иРНК, такой как ее стабильность или эффективность трансляции.
Как используют в настоящем описании, "транскрибируемая in vitro РНК" относится к РНК, предпочтительно иРНК, которую синтезировали in vitro. Как правило, транскрибируемую in vitro РНК получают на основе транскрипционного вектора in vitro. Транскрипционный вектор in vitro содержит матрицу, которую используют для получения транскрибируемой in vitro РНК.
Как используют в настоящем описании, "поли(A)" представляет собой серию аденозинов, присоединяемых посредством полиаденилирования к иРНК. В предпочтительном варианте осуществления конструкции для транзиторной экспрессии полиA составляет от 50 до 5000 (SEQ ID NO: 30), предпочтительно более 64, более предпочтительно более 100, наиболее предпочтительно более 300 или 400. Последовательности поли(A) можно модифицировать химически или ферментативно для модуляции функциональности иРНК, такой как локализация, стабильность или эффективность трансляции.
Как используют в настоящем описании, "полиаденилирование" относится к ковалентному связыванию полиаденильной группы или ее модифицированного варианта с молекулой информационной РНК. В эукариотических организмах большая часть молекул информационной РНК (иРНК) является полиаденилированной на 3'-конце. 3'-поли(A) хвост представляет собой длинную последовательность нуклеотидов аденина (как правило, несколько сотен), добавляемых к пре-иРНК под действием фермента полиаденилатполимеразы. У высших эукариотов хвост поли(A) добавляется к транскрипту, который содержит конкретную последовательность, сигнал полиаденилирования. Хвост поли(A) и белковая связь с ним помогают защищать иРНК от разрушения экзонуклеазами. Полиаденилирование также является важным для терминации транскрипции, экспорта иРНК из ядра и трансляции. Полиаденилирование происходит в ядре сразу же после транскрипции ДНК в РНК, но дополнительно также может происходить позже в цитоплазме. После того, как происходит терминация транскрипции, цепь иРНК расщепляется под действием эндонуклеазного комплекса, связанного с РНК-полимеразой. Участок расщепления, как правило, характеризуется наличием последовательности оснований AAUAAA около участка расщепления. После расщепления иРНК, остатки аденозина добавляются к свободному 3'-концу на участке расщепления.
Как используют в настоящем описании, "транзиторная" относится к экспрессии неинтегрированного трансгена в течение часов, суток или недель, где период времени экспрессии является меньше чем период времени экспрессии гена, в случае интеграции в геном или содержащегося в стабильном плазмидном репликоне в клетке-хозяине.
Как используют в настоящем описании, термины "лечить", "лечение" и "лечащий" относятся к снижению или улучшению состояния прогрессирования, тяжести и/или продолжительности пролиферативного нарушения, или улучшению состояния одного или более симптомов (предпочтительно одного или более выраженных симптомов) пролиферативного нарушения, что является результатом проведения одного или более видов терапии (например, одного или более терапевтических средств, таких как CAR по изобретению). В конкретных вариантах осуществления термины "лечить", "лечение" и "лечащий" относятся к улучшению состояния по меньшей мере одного измеряемого физического параметра пролиферативного нарушения, такого как рост опухоли, не обязательно выраженного у пациента. В других вариантах осуществления термины "лечить", "лечение" и "лечащий" относятся к ингибированию прогрессирования пролиферативного нарушения физически, например, путем стабилизации выраженного симптома, физиологически, например, путем стабилизации физического параметра или того и другого. В других вариантах осуществления термины "лечить", "лечение" и "лечащий" относятся к уменьшению или стабилизации размера опухоли или числа злокачественных клеток.
Термин "путь передачи сигнала" относится к биохимическому отношению между различным молекулами передачи сигнала, которые играют роль в передаче сигнала из одной части клетки в другую часть клетки. Фраза "рецептор клеточной поверхности" включает молекулы и комплексы молекул, способных получать сигнал и передавать сигнал через мембрану клетки.
Термин "индивидуум" предназначен включать живые организмы, у которых можно вызывать иммунный ответ (например, млекопитающие, человек).
Термин "по существу очищенная" клетка относится к клетке, которая по существу не содержит другие типы клеток. По существу очищенная клетка также относится к клетке, которую отделили от других типов клеток, с которыми она обычно связана в своем природном состоянии. В некоторых случаях популяция по существу очищенных клеток относится к гомогенной популяции клеток. В других случаях этот термин просто относится к клетке, которую отделили от клеток, с которыми она естественным образом связана в своем естественном состоянии. В некоторых аспектах клетки культивируют in vitro. В других аспектах клетки не культивируют in vitro.
Термин "терапевтический", как используют в настоящем описании, означает лечение. Терапевтический эффект получают путем снижения, подавления, ремиссии или эрадикации состояния болезни.
Как используют в настоящем описании, термин "профилактика" означает профилактическое или защитное лечение заболевания или состояния болезни.
В контексте настоящего изобретения "опухолевый антиген" или "антиген гиперпролиферативного нарушения" или "антиген, связанный с гиперпролиферативным нарушением" относится к антигенам, которые являются наиболее распространенными для конкретных гиперпролиферативных нарушений. В определенных аспектах антигены гиперпролиферативного нарушения по настоящему изобретению получают из злокачественных опухолей, включая, но, не ограничиваясь ими, первичную или метастатическую меланому, тимому, лимфому, саркому, рак легких, рак печени, неходжкинскую лимфому, неходжкинскую лимфому, лейкозы, рак матки, рак шейки матки, рак мочевого пузыря, рак почки и аденокарциномы, такие как рак молочной железы, рак предстательной железы, рак яичника, рак поджелудочной железы и т.п.
Термин "трансфицированный" или "трансформированный" или "трансдуцированный" относится к способу, которым экзогенную нуклеиновую кислоту переносят или вводят в клетку-хозяина. "Трансфицированная" или "трансформированная" или "трансдуцированная" клетка представляет собой клетку, которую трансфицировали, трансформировали или трансдуцировали экзогенной нуклеиновой кислотой. Клетка включает первичную клетку индивидуума и ее потомство.
Термин "специфически связывается" относится к антителу или лиганду, который распознает и связывается с когнатным белком-партнером по связыванию (например, стимулирующей и/или костимулирующей молекулой, присутствующей на T-клетке), содержащимся в образце, но где антитело или лиганд по существу не распознает или связывается с другими молекулами в образце.
Как используют в настоящем описании, "регулируемый химерный антигенный рецептор (RCAR)" относится к группе полипептидов, как правило, двум в наиболее простых вариантах осуществления, которые, находясь в эффекторной клетке иммунной системы, обеспечивают клетку со специфичностью к клетке-мишени, как правило, злокачественной клетке и с регулируемой генерацией внутриклеточного сигнала. В некоторых вариантах осуществления RCAR содержит по меньшей мере внеклеточный антигенсвязывающий домен, трансмембранный и цитоплазматический сигнальный домен (также обозначаемый в настоящем описании как "внутриклеточный сигнальный домен"), содержащий функциональный сигнальный домен, получаемый из стимулирующей молекулы и/или костимулирующей молекулы, как определено в настоящем описании в отношении молекула CAR. В некоторых вариантах осуществления группы полипептидов в RCAR не являются смежными друг с другом, например, находятся в разных полипептидных цепях. В некоторых вариантах осуществления RCAR содержат переключатель димеризации, который в присутствии индуцирующей димеризацию молекулы может приводить к спариванию полипептидов друг с другом, например, может приводить к спариванию антигенсвязывающего домена с внутриклеточным сигнальным доменом. В некоторых вариантах осуществления RCAR экспрессируется в клетке (например, эффекторной клетке иммунной системы), как описано в настоящем описании, например, экспрессирующей RCAR клетке (также обозначаемой в настоящем описании как "RCARX-клетка"). В одном из вариантов осуществления RCARX-клетка представляет собой T-клетку и обозначается как RCART-клетка. В одном из вариантов осуществления RCARX-клетка представляет собой NK-клетку и обозначается как RCARN-клетка. RCAR может обеспечивать экспрессирующую RCAR клетку со специфичностью к клетке-мишени, как правило, злокачественной клетке и с регулируемой генерацией внутриклеточных сигналов или пролиферацией, которая может оптимизировать свойства иммунного эффектора экспрессирующей RCAR клетки. В вариантах осуществления RCAR-клетка основана по меньшей мере частично на антигенсвязывающем домене, что обеспечивает специфичность к клетке-мишени, которая содержит антиген, связанный антигенсвязывающим доменом.
"Мембранный якорь" или "мембранный якорный домен", как этот термин используют в настоящем описании, относится к полипептиду или группе, например, миристоиловой группе, достаточной для заякоривания внеклеточного или внутриклеточного домена в плазматической мембране.
"Переключающий домен", как этот термин используют в настоящем описании, например, когда относится к RCAR, относится к структурной единице, как правило, на основе полипептида, которая в присутствии индуцирующей димеризацию молекулы, связанной с другим переключающим доменом. Ассоциация приводит к функциональному связыванию первой структурной единицы, связанной, например, слитой с первым переключающим доменом, и второй структурной единицы, связанной, например, слитой со вторым переключающим доменом. Первый и второй переключающие домены совместно обозначают как переключатель димеризации. В вариантах осуществления первый и второй переключающие домены являются аналогичными, например, они могут представлять собой полипептиды, содержащие одну и ту же первичную аминокислотную последовательность, и их совместно обозначают как переключатель гомодимеризации. В вариантах осуществления первые и второй переключающие домены являются отличными друг от друга, например, они представляют собой полипептиды, содержащие различные первичные аминокислотные последовательности, и их совместно обозначают как переключатель гетеродимеризации. В вариантах осуществления переключатель является внутриклеточным. В вариантах осуществления переключатель является внеклеточным. В вариантах осуществления переключающий домен представляет собой структурную единицу на основе полипептида, например, FKBP или на основе FRB, и индуцирующая димеризацию молекула представляет собой низкомолекулярное соединение, например, рапалог. В вариантах осуществления переключающий домен представляет собой структурную единицу на основе полипептида, например, scFv, который связывается с пептидом myc, и индуцирующая димеризацию молекула представляет собой полипептид, его фрагмент или мультимер полипептида, например, лиганд myc или мультимеры лиганда myc, которые связываются с одним или более scFv myc. В вариантах осуществления переключающий домен представляет собой структурную единицу на основе полипептида, например, рецептор myc, и индуцирующая димеризацию молекула представляет собой антитело или его фрагменты, например, антитело myc.
"Индуцирующая димеризацию молекула", как этот термин используют в настоящем описании, например, по отношению к RCAR, относится к молекуле, которая способствует образованию связи первого переключающего домена со вторым переключающим доменом. В вариантах осуществления индуцирующая димеризацию молекула естественным образом не встречается у индивидуума или не встречается в концентрациях, которые приводят к димеризации в значительной степени. В вариантах осуществления индуцирующая димеризацию молекула представляет собой низкомолекулярное соединение, например, рапамицин или рапалог, например, RAD001.
Термин "биоэквивалентный" относится к количеству средства, отличного от эталонного соединения (например, RAD001), необходимому для оказания эффекта, эквивалентного эффекту, оказываемого эталонной дозы или эталонным количеством эталонного соединения (например, RAD001). В одном из вариантов осуществления эффект представляет собой уровень ингибирования mTOR, например, как измеряют по ингибированию киназы P70S6, например, как оценивают в анализе in vivo или in vitro, например, как измеряют анализом, описываемым в настоящем описании, например, анализом Boulay, или измерением уровней фосфорилированного S6 вестерн-блоттингом. В одном из вариантов осуществления эффект представляет собой изменение отношения PD-1-положительных/PD-1-отрицательных эффекторных клетки иммунной системы, например, T-клеток или NK-клеток, как измеряют посредством сортировки клеток. В одном из вариантов осуществления биоэквивалентное количество или доза ингибитора mTOR представляет собой количество или дозу, которая обеспечивает тот же уровень ингибирования киназы P70S6 как обеспечивает эталонная доза или эталонное количество эталонного соединения. В одном из вариантов осуществления биоэквивалентное количество или доза ингибитора mTOR представляет собой количество или дозу, которая обеспечивает тот же уровень изменения отношения PD-1-положительных/PD-1-отрицательных эффекторных клеток иммунной системы, например, T-клеток или NK-клеток, как обеспечивает эталонная доза или эталонное количество эталонного соединения.
Термин "низкая усиливающая иммунитет доза" при использовании в сочетании с ингибитором mTOR, например, аллостерическим ингибитором mTOR, например, RAD001 или рапамицином, или каталитическим ингибитором mTOR относится к дозе ингибитора mTOR, который частично, но не полностью ингибирует активность mTOR, например, как измеряют по ингибированию активности киназы P70S6. Способы оценки активности mTOR, например, по ингибированию киназы P70S6 описаны в настоящем описании. Доза является недостаточной для приведения к полному подавлению иммунитета, но является достаточной для усиления иммунного ответа. В одном из вариантов осуществления низкая усиливающая иммунитет доза ингибитора mTOR приводит к уменьшению числа PD-1-положительных эффекторных клеток иммунной системы, например, T-клеток или NK-клеток и/или увеличению числа PD-1-отрицательных эффекторных клеток иммунной системы, например, T-клеток или NK-клеток, или увеличению отношения PD-1-отрицательных T-клеток/PD-1-положительных эффекторных клеток иммунной системы, например, T-клеток или NK-клеток.
В одном из вариантов осуществления низкая усиливающая иммунитет доза ингибитора mTOR приводит к увеличению числа интактных эффекторных клеток иммунной системы, например, T-клеток или NK-клеток. В одном из вариантов осуществления низкая усиливающая иммунитет доза ингибитора mTOR приводит к одному или более из следующих ниже:
- повышению экспрессии одного или более из следующих ниже маркеров: CD62Lhigh, CD127high, CD27+ и BCL2, например, на T-клетках памяти, например, предшественниках T-клеток памяти;
- снижению экспрессии KLRG1, например, на T-клетках памяти, например, предшественниках T-клеток памяти, и
- повышению числа предшественников T-клеток памяти, например, клеток с любой одной или комбинацией следующих ниже характеристик: повышенного CD62Lhigh, повышенного CD127high, повышенного CD27+, сниженного KLRG1 и повышенного BCL2;
где любое из описанных выше изменений происходит, например, по меньшей мере транзиторно, например, по сравнению с не получавшим лечение индивидуумом.
Как используют в настоящем описании, "рефрактерное" относится к заболеванию, например, злокачественной опухоли, которая не реагирует на лечение. В вариантах осуществления рефрактерная злокачественная опухоль может являться резистентной к лечению до лечения или во время его начала. В других вариантах осуществления рефрактерная злокачественная опухоль может становиться резистентной во время лечения. Рефрактерную злокачественную опухоль также называют резистентной злокачественной опухолью.
Как используют в настоящем описании, "рецидивирующий" или "рецидив" относится к возврату или повторному возникновению заболевания (например, злокачественной опухоли) или признаков и симптомов заболевания, такого как злокачественная опухоль, после периода улучшения или ответной реакции, например, после предварительного лечения терапии, например, терапии злокачественной опухоли. Начальный период ответной реакции может включать снижение уровня злокачественных клеток ниже определенного порогового значения, например, ниже 20%, 1%, 10%, 5%, 4%, 3%, 2% или 1%. Повторное появление может включать повышение уровня злокачественных клеток выше определенного порогового значения, например, выше 20%, 1%, 10%, 5%, 4%, 3%, 2% или 1%. Например, в отношении B-ALL, повторное появление может включать, например, повторное появление бластов в крови, костном мозге (>5%) или любом экстрамедуллярном участке после полного ответа. Полный ответ в этом контексте может включать <5% бластов BM. В более общем смысле в одном из вариантов осуществления ответ (например, полный ответ или частичный ответ) может включать отсутствие детектируемой MRD (минимальной резидуальной болезни). В одном из вариантов осуществления начальный период ответной реакции длится по меньшей мере 1, 2, 3, 4, 5 или 6 суток, по меньшей мере 1, 2, 3 или 4 недели, по меньшей мере 1, 2, 3, 4, 6, 8, 10 или 12 месяцев, или по меньшей мере 1, 2, 3, 4 или 5 год.
В некоторых вариантах осуществления терапия, которая предусматривает введение ингибитора CD19, например, терапия CD19 CAR, может приводить к рецидиву или к заболеванию, рефрактерному к лечению. Рецидив или резистентность может быть вызвана потерей CD19 (например, мутацией потери антигена) или другим изменением CD19, которое снижает уровень CD19 (например, вызываемым клональной селекцией CD19-отрицательных клонов). Злокачественную опухоль, которая характеризуется такой потерей CD19 или изменением, обозначают в настоящем описании как "CD19-отрицательная злокачественная опухоль" или "CD19-отрицательная рецидивирующая злокачественная опухоль". Следует понимать, что CD19-отрицательная злокачественная опухоль не обязательно характеризоваться 100% потерей CD19, а достаточным снижением для того, чтобы снижать эффективность терапии CD19, таким образом, что такая злокачественная опухоль рецидивирует или становится рефрактерной. В некоторых вариантах осуществления CD19-отрицательная злокачественная опухоль является результатом терапии CD19 CAR.
Диапазоны: на всем протяжении этого описания различные аспекты изобретения могут быть предоставлены в формате диапазонов. Следует понимать, что описание в формате диапазонов приводят только для удобства и краткости, и их не следует истолковывать как негибкое ограничение объема изобретения. Таким образом, следует рассматривать, что в описании диапазона конкретно описаны все возможные поддиапазоны, а также отдельные числовые величины в этом диапазоне. Например, следует рассматривать, что в описании диапазона, такого как от 1 до 6, конкретно описаны поддиапазоны, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д., а также отдельные числа в этом диапазоне, например, 1, 2, 2,7, 3, 4, 5, 5,3 и 6. В качестве другого примера, диапазон, такой как 95-99% идентичность, включает что-то с 95%, 96%, 97%, 98% или 99% идентичностью и включает поддиапазоны, такие как 96-99%, 96-98%, 96-97%, 97-99%, 97-98% и 98-99% идентичность. Это применяется независимо от ширины диапазона.
Описание
В настоящем описании раскрыты композиции вещества и способы использования для лечения или профилактики заболевания, такого как злокачественная опухоль, и использованием химерных антигенных рецепторов (CAR) CD123.
В одном из аспектов изобретение относится к ряду химерных антигенных рецепторов (CAR), содержащих антитело или фрагмент антитела, сконструированный для специфического связывания с белком CD123 или его фрагментами. В одном из аспектов изобретение относится к клетке (например, эффекторной клетке иммунной системы, например, T-клетке или NK-клетке), сконструированной для экспрессии CAR, где экспрессирующая CAR клетка (например, "CART" или экспрессирующая CAR NK-клетка) обладает противоопухолевым свойством. В одном из аспектов клетку трансформируют CAR, и по меньшей мере часть CAR экспрессируется на клеточной поверхности. В некоторых вариантах осуществления клетку (например, эффекторную клетку иммунной системы, например, T-клетку или NK-клетку) трансдуцируют вирусным вектором, кодирующим CAR. В некоторых вариантах осуществления вирусный вектор представляет собой ретровирусный вектор. В некоторых вариантах осуществления вирусный вектор представляет собой лентивирусный вектор. В некоторых таких вариантах осуществления клетка может стабильно экспрессировать CAR. В другом варианте осуществления клетку (например, эффекторную клетку иммунной системы, например, T-клетку или NK-клетку) трансфицируют нуклеиновой кислотой, например, иРНК, кДНК, ДНК, кодирующей CAR. В некоторых таких вариантах осуществления, клетка может транзиторно экспрессировать CAR.
В одном из аспектов CD123-связывающий домен, например, принадлежащий человеку или гуманизированный CD123-связывающий домен, CAR представляет собой фрагмент scFv антитела. В одном из аспектов такие фрагменты антител являются функциональными, что заключается в том, что они сохраняют эквивалентную аффинность связывания, например, они связывают тот же антиген со сравнимой эффективностью, как антитело IgG, содержащее такие же вариабельные области тяжелой и легкой цепей. В одном из аспектов такие фрагменты антител являются функциональными, что заключается в том, что обеспечивают биологический ответ, который может включать, но не ограничиваться ими, активацию иммунного ответа, ингибирование сигнала трансдукции, возникающего от его антигена-мишень, ингибирование активности киназы и т.п., как будет понятно специалисту в данной области.
В некоторых аспектах антитела по изобретению встраивают в химерный антигенный рецептор (CAR). В одном из аспектов CAR содержит полипептидную последовательность, предоставленную в настоящем описании как SEQ ID NO: 98-101 и 125-156.
В одном из аспектов CD123-связывающий домен, например, гуманизированный или CD123-связывающий домен человека, участок CAR по изобретению кодируется трансгеном, последовательность которого подвергалась оптимизации кодона для экспрессии в клетке млекопитающего. В одном из аспектов полная конструкция CAR по изобретению кодируется трансгеном, полная последовательность которого подвергалась оптимизации кодона для экспрессии в клетке млекопитающего. Оптимизация кодона относится к открытию того, что частота появления синонимичных кодонов (т.е. кодонов, которые кодируют те же аминокислоты) в кодировании ДНК смещена в различных видах. Такая вырожденность кодонов обеспечивает возможность кодирования идентичного полипептида различными нуклеотидными последовательностями. Ряд способов оптимизации кодона известен в данной области и включает, например, способы, описанные по меньшей мере в патентах США с номерами 5786464 и 6114148.
В одном из аспектов антигенсвязывающий домен CAR содержит антитело против CD123 человека или фрагмент антитела. В одном из аспектов антигенсвязывающий домен CAR содержит гуманизированное антитело против CD123 или фрагмент антитела. В одном из аспектов антигенсвязывающий домен CAR содержит фрагмент антитела против CD123 человека, содержащий scFv. В одном из аспектов антигенсвязывающий домен CAR представляет собой scFv CD123 человека. В одном из аспектов антигенсвязывающий домен CAR содержит фрагмент гуманизированного антитела против CD123, содержащий scFv. В одном из аспектов антигенсвязывающий домен CAR представляет собой гуманизированный scFv CD123.
В одном из аспектов CAR123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 157-160 и 184-215. В одном из аспектов участок scFv принадлежит человеку. В одном из аспектов CAR123-связывающий домен человека содержит участок scFv, предоставленный в SEQ ID NO: 157-160. В одном из аспектов CD123-связывающий домен человека содержит участок scFv, предоставленный в SEQ ID NO: 157. В одном из аспектов CD123-связывающий домен человека содержит участок scFv, предоставленный в SEQ ID NO: 158. В одном из аспектов CD123-связывающий домен человека содержит участок scFv, предоставленный в SEQ ID NO: 159. В одном из аспектов CD123-связывающий домен человека содержит участок scFv, предоставленный в SEQ ID NO: 160. В одном из аспектов CD123-связывающий домен человека содержит участок scFv, предоставленный в SEQ ID NO: 478. В одном из аспектов CD123-связывающий домен человека содержит участок scFv, предоставленный в SEQ ID NO: 480. В одном из аспектов CD123-связывающий домен человека содержит участок scFv, предоставленный в SEQ ID NO: 483. В одном из аспектов CD123-связывающий домен человека содержит участок scFv, предоставленный в SEQ ID NO: 485.
В одном из аспектов участок scFv является гуманизированным. В одном из аспектов гуманизированный CAR123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 184-215. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 184. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 185. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 186. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 187. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 188. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 189. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 190. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 191. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 192. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 193. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 194. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 195. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 196. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 197. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 198. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 199. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 200. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 201. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 202. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 203. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 204. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 205. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 206. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 207. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 208. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 209. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 210. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 211. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 212. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 213. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 214. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 215. В одном из аспектов гуманизированный CD123-связывающий домен содержит участок scFv, предоставленный в SEQ ID NO: 556-587.
Кроме того, настоящее изобретение относится к композициям CD123 CAR и их использованию в лекарственных средствах или способах лечения наряду с другими заболеваниями злокачественной опухоли или любого злокачественного новообразования, или аутоиммунных заболеваний, включающих клетки или ткани, которые экспрессируют CD123.
В одном из аспектов CAR по изобретению можно использовать для устранения экспрессирующих CD123 нормальных клеток, таким образом, applicable для применения в качестве клеточной кондиционной терапии до трансплантации клеток. В одном из аспектов экспрессирующая CD123 нормальная клетка представляет собой экспрессирующую CD123 миелоидную клетку-предшественника, и трансплантация клеток представляет собой трансплантацию стволовых клеток.
В одном из аспектов изобретение относится к клетке (например, эффекторной клетке иммунной системы, например, T-клетке или NK-клетке), сконструированной, так чтобы экспрессировать химерный антигенный рецептор (например, экспрессирующей CAR эффекторной клетке иммунной системы, например, CART или экспрессирующей CAR NK-клетке) по настоящему изобретению, где клетка (например, "CART") обладает противоопухолевым свойством. Таким образом, изобретение относится к CD123-CAR, который содержит CD123-связывающий домен и сконструирован в виде эффекторной клетки иммунной системы, например, T-клетки или NK-клетки, и способам его использования для адоптированной терапии.
В одном из аспектов CD123-CAR содержит по меньшей мере один внутриклеточный домен, например, описываемый в настоящем описании, например, выбранный из группы из сигнального домена CD137 (4-1BB), сигнального домена CD28, сигнального домена CD3-дзета и любого их сочетания. В одном из аспектов CD123-CAR содержит по меньшей мере один внутриклеточный сигнальный домен, который получают из одной или более костимулирующих молекул, отличных от CD137 (4-1BB) или CD28.
Химерный антигенный рецептор (CAR)
Настоящее изобретение относится к конструкции рекомбинантной ДНК, содержащей последовательности, кодирующие CAR, где CAR содержит антигенсвязывающий домен (например, антитело, фрагмент антитела), который специфически связывается с CD123 или его фрагментом, например, CD123 человека, где последовательность CD123-связывающего домена (например, антитела или фрагмента антитела) является, например, смежной с и находится в той же рамке считывания как и последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен. Внутриклеточный сигнальный домен может содержать костимулирующий сигнальный домен и/или первичный сигнальный домен, например, дзета-цепь. Костимулирующий сигнальный домен относится к участку CAR, содержащему по меньшей мере участок внутриклеточного домена костимулирующей молекулы.
В конкретных аспектах конструкция CAR по изобретению содержит scFV-домен, выбранный из группы, состоящей из SEQ ID NO: 157-160,184-215, 478, 480, 483, 485 и 556-587, где scFv может предшествовать необязательная лидерная последовательность, такая как предоставлено в SEQ ID NO: 1, и за scFv может следовать необязательная шарнирная последовательность, такая как предоставлено в SEQ ID NO: 2 или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5, трансмембранная область, такая как предоставлено в SEQ ID NO: 6, внутриклеточный сигнальный домен, который содержит SEQ ID NO: 7 или SEQ ID NO: 8, и последовательность CD3-дзета, которая содержит SEQ ID NO: 9 или SEQ ID NO: 10, например, где домены являются смежными и находятся в той же рамке считывания, образуя единый слитый белок. В некоторых вариантах осуществления scFV-домен представляет собой scFV-домен человека, выбранный из группы, состоящей из SEQ ID NO: 157-160, 478, 480, 483 и 485. В некоторых вариантах осуществления scFV-домен представляет собой гуманизированный scFV-домен, выбранный из группы, состоящей из SEQ ID NO: 184-215 и 556-587. Также в изобретение входит нуклеотидная последовательность, кодирующая полипептид каждого из фрагментов scFv, выбранных из группы, состоящей из SEQ ID NO: 157-160, 184-215, 478, 480, 483, 485 и 556-587. Также в изобретение входит нуклеотидная последовательность, кодирующая полипептид каждого из фрагментов scFv, выбранных из группы, состоящей из SEQ ID NO: 157-160, 184-215, 478, 480, 483, 485 и 556-587, и каждого из доменов SEQ ID NO: 1,2 и 6-9, плюс кодируемый CD123 CAR по изобретению.
В одном из аспектов иллюстративные конструкции CD123 CAR содержат необязательную лидерную последовательность, внеклеточный антигенсвязывающий домен, шарнирную область, трансмембранный домен и внутриклеточный стимулирующий домен. В одном из аспектов иллюстративная конструкция CD123 CAR содержит необязательную лидерную последовательность, внеклеточный антигенсвязывающий домен, шарнирную область, трансмембранный домен, внутриклеточный костимулирующий домен и внутриклеточный стимулирующий домен.
В некоторых вариантах осуществления полноразмерные последовательности CD123 CAR также предоставлены в настоящем описании как SEQ ID NO: 98-101 и 125-156, как представлено в таблице 2 или 6.
Иллюстративная лидерная последовательность предоставлена как SEQ ID NO: 1. Иллюстративная шарнирная/спейсерная последовательность предоставлена как SEQ ID NO: 2 или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5. Иллюстративная последовательность трансмембранного домена предоставлена как SEQ ID NO: 6. Иллюстративная последовательность внутриклеточного сигнального домена белка 4-1BB предоставлена как SEQ ID NO: 7. Иллюстративная последовательность внутриклеточного сигнального домена CD27 предоставлена как SEQ ID NO: 8. Иллюстративная домен последовательность CD3-дзета предоставлена как SEQ ID NO: 9 или SEQ ID NO: 10. Иллюстративная последовательность внутриклеточного сигнального домена CD28 предоставлена как SEQ ID NO: 43. Иллюстративная последовательность внутриклеточного сигнального домена ICOS предоставлена как SEQ ID NO: 45.
В одном из аспектов настоящее изобретение относится к конструкции рекомбинантной нуклеиновой кислоты, содержащей молекулу нуклеиновой кислоты, кодирующую CAR, где молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, кодирующую CD123-связывающий домен, например, описываемый в настоящем описании, например, который является смежным с и находится в той же рамке считывания как и последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен. В одном из аспектов CD123-связывающий домен выбран из одной или более из SEQ ID NO: 157-160, 184-215, 478, 480, 483, 485 и 556-587. В некоторых вариантах осуществления CD123-связывающий домен представляет собой CD123-связывающий домен человека, выбранный из группы, состоящей из SEQ ID NO: 157-160, 478, 480, 483 и 485. В некоторых вариантах осуществления CD123-связывающий домен представляет собой гуманизированный CD123-связывающий домен, выбранный из группы, состоящей из SEQ ID NO: 184-215 и 556-587. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 157. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 158. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 159. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 160. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 184. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 185. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 186. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 187. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 188. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 189. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 190. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 191. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 192. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 193. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 194. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 195. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 196. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 197. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 198. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 199. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 200. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 201. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 202. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 203. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 204. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 205. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 206. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 207. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 208. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 209. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 210. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 211. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 212. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 213. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 213. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 215. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 478. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 480. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 483. В одном из аспектов CD123-связывающий домен представляет собой SEQ ID NO: 485.
В одном из аспектов настоящее изобретение относится к конструкции рекомбинантной нуклеиновой кислоты, содержащей молекулу нуклеиновой кислоты, кодирующую CAR, где молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, кодирующую CD123-связывающий домен, например, где последовательность является смежной с и находится в той же рамке считывания как и последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен. Иллюстративный внутриклеточный сигнальный домен, который можно использовать в CAR, включает, но не ограничивается ими, один или более внутриклеточных сигнальных доменов, например, из CD3-дзета, CD28, 4-1BB, ICOS и т.п. В некоторых случаях CAR может содержать любую комбинацию из CD3-дзета, CD28, 4-1BB, ICOS и т.п.
В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR по изобретению выбрана из одной или более SEQ ID NO:39-42 и 66-97. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:39. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:40. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:41. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:42. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:66. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:67. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:68. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:69. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:70. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:71. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:72. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:73. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:74. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:75. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:76. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:77. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:78. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:79. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:80. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:81. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:82. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:83. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:84. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:85. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:86. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:87. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:88. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:89. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:90. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:91. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:92. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:93. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:94. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:95. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:96. В одном из аспектов последовательность нуклеиновой кислоты конструкции CAR содержит (например, состоит из) SEQ ID NO:97. Последовательности нуклеиновой кислоты, кодирующие желаемые молекулы, можно получать с использованием известных в данной области рекомбинантных способов, таких как, например, посредством скрининга библиотеки из клеток, экспрессирующих ген, посредством получения гена из вектора, который как известно, содержит такой ген, или посредством выделения непосредственно из клеток и тканей, содержащих такой ген, стандартными способами. Альтернативно, представляющую интерес нуклеиновую кислоту можно получать синтезом вместо клонирования.
Настоящее изобретение относится к конструкциям ретровирусного и лентивирусного вектора, экспрессирующим CAR, которые можно непосредственно трансдуцировать в клетку.
Настоящее изобретение также относится к конструкции РНК, которую можно непосредственно трансфицировать в клетку. Способ получения иРНК для применения в трансфекции включает транскрипцию (IVT) in vitro матрицы со специально сконструированными праймерами с последующим добавлением полиA с получением конструкции, содержащей 3'- и 5'-нетранслируемую последовательность ("UTR"), 5'-кэп и/или внутренний участок связывания рибосомы (IRES), нуклеиновую кислоту, которую следует экспрессировать, и хвост полиA длиной, как правило, 50-2000 оснований (SEQ ID NO: 35). Получаемой таким образом РНК можно эффективно трансфицировать различные виды клеток. В одном из вариантов осуществления матрица содержит последовательности для CAR. В одном из вариантов осуществления РНК-вектор CAR трансдуцируют в T-клетку электропорацией.
Антигенсвязывающий домен
В одном из аспектов CAR по изобретению содержит направленный специфический связывающий элемент, иным образом, обозначаемый как антигенсвязывающий домен. Выбор группы зависит от типа и числа лигандов, которые определяют поверхность клетки-мишень. Например, антигенсвязывающий домен можно выбирать для распознавания лиганда, который действует как маркер клеточной поверхности на клетках-мишенях, ассоциированных с конкретным состоянием болезни.
В одном из аспектов опосредованный CAR ответ T-клеток можно направлять на представляющий интерес антиген путем конструирования антигенсвязывающего домена, который специфически связывается с желаемым антигеном в CAR.
В одном из аспектов участок CAR, содержащий антигенсвязывающий домен, содержит антигенсвязывающий домен, который направлен на CD123 или его фрагмент. В одном из аспектов антигенсвязывающий домен направлен на CD123 человека или его фрагмент.
Антигенсвязывающий домен может представлять собой любой домен, который связывается с антигеном, включая, но, не ограничиваясь ими, моноклональное антитело, поликлональное антитело, рекомбинантное антитело, антитело человека, гуманизированное антитело и его функциональный фрагмент, включая, но, не ограничиваясь ими, однодоменное антитело, такое как вариабельный домен тяжелой цепи (VH), вариабельный домен легкой цепи (VL) и вариабельный домен (VHH) получаемого от верблюдовых нанотела, и альтернативную каркасную область, которая, как известно в данной области, функционирует как антигенсвязывающий домен, такой как рекомбинантный домен фибронектина, и т.п. В некоторых случаях предпочтительно антигенсвязывающий домен получают от того же вида, для которого CAR в конечном итоге будет использовать. Например, для применения у людей предпочтительно антигенсвязывающий домен CAR содержит принадлежащие человеку или гуманизированные остатки антигенсвязывающего домена антитела или фрагмента антитела.
В некоторых случаях предпочтительно антигенсвязывающий домен получают от того же вида, для которого CAR в конечном итоге будут использовать. Например, для применения у людей предпочтительно антигенсвязывающий домен CAR содержит принадлежащие человеку или гуманизированные остатки антигенсвязывающего домена антитела или фрагмента антитела. Таким образом, в одном из аспектов антигенсвязывающий домен содержит антитело человека или фрагмент антитела. В одном из вариантов осуществления CD123-связывающий домен человека содержит одну или более (например, все три) определяющую комплементарность область 1 легкой цепи (CDR1 LC), определяющую комплементарность область 2 легкой цепи (CDR2 LC) и определяющую комплементарность область 3 легкой цепи (CDR3 LC) CD123-связывающего домена человека, описываемого в настоящем описании, и/или одну или более (например, все три) определяющую комплементарность область 1 тяжелой цепи (CDR1 HC), определяющую комплементарность область 2 тяжелой цепи (CDR2 HC) и определяющую комплементарность область 3 тяжелой цепи (CDR3 HC) CD123-связывающего домена человека, описываемого в настоящем описании, например, CD123-связывающего домена человека, содержащего одну или более, например, все три CDR LC и одну или более, например, все три CDR HC. В одном из вариантов осуществления CD123-связывающий домен человека содержит одну или более (например, все три) определяющую комплементарность область 1 тяжелой цепи (CDR1 HC), определяющую комплементарность область 2 тяжелой цепи (CDR2 HC) и определяющую комплементарность область 3 тяжелой цепи (CDR3 HC) CD123-связывающего домена человека, описываемого в настоящем описании, например, CD123-связывающий домен человека содержит две вариабельные области тяжелой цепи, где каждая содержит CDR1 HC, CDR2 HC и CDR3 HC, описываемые в настоящем описании. В одном из вариантов осуществления CD123-связывающий домен человека содержит вариабельную область легкой цепи человека, описываемую в настоящем описании (например, в таблице 2 или 9), и/или вариабельную область тяжелой цепи человека, описываемую в настоящем описании (например, в таблице 2 или 9). В одном из вариантов осуществления CD123-связывающий домен человека содержит вариабельную область тяжелой цепи человека, описываемую в настоящем описании (например, в таблице 2 или 9), например, по меньшей мере две вариабельные области тяжелой цепи человека, описываемые в настоящем описании (например, в таблице 2 или 9). В одном из вариантов осуществления CD123-связывающий домен представляет собой scFv, содержащий легкую цепь и тяжелую цепь аминокислотной последовательности из таблицы 2 или 9. В одном из вариантов осуществления CD123-связывающий домен (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области легкой цепи, предоставленной в таблице 2 или 9, или последовательность с 95-99% идентичностью с аминокислотной последовательностью из таблицы 2; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области тяжелой цепи, предоставленной в таблице 2 или 9, или последовательность с 95-99% идентичностью с аминокислотной последовательностью из таблицы 2 или 9. В одном из вариантов осуществления CD123-связывающий домен человека содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 157-160, 478, 480, 483 и 485, или последовательность с 95-99% идентичностью с ней. В одном из вариантов осуществления CD123-связывающий домен человека представляет собой scFv, и вариабельная область легкой цепи, содержащая аминокислотную последовательность, описываемую в настоящем описании, например, в таблице 2 или 9, является связанной с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, описываемую в настоящем описании, например, в таблице 2, посредством линкера, например, линкера, описываемего в настоящем описании. В одном из вариантов осуществления CD123-связывающий домен человека содержит линкер (Gly4-Ser)n, где n представляет собой 1, 2, 3, 4, 5 или 6, предпочтительно 3 или 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv может находиться, например, в любой из следующих ниже ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
В некоторых аспектах не принадлежащее человеку антитело является гуманизированным, где конкретные последовательности или области антитела модифицируют для увеличения сходства с антителом, естественным образом образуемого у человека, или его фрагментом. Таким образом, в одном из аспектов антигенсвязывающий домен содержит гуманизированное антитело или фрагмент антитела. В одном из вариантов осуществления гуманизированный CD123-связывающий домен содержит одну или более (например, все три) определяющую комплементарность область 1 легкой цепи (CDR1 LC), определяющую комплементарность область 2 легкой цепи (CDR2 LC) и определяющую комплементарность область 3 легкой цепи (CDR3 LC) гуманизированного CD123-связывающего домена, описываемого в настоящем описании, и/или одну или более (например, все три) определяющую комплементарность область 1 тяжелой цепи (CDR1 HC), определяющую комплементарность область 2 тяжелой цепи (CDR2 HC) и определяющую комплементарность область 3 тяжелой цепи (CDR3 HC) гуманизированного CD123-связывающего домена, описываемого в настоящем описании, например, гуманизированного CD123-связывающего домена, содержащего одну или более, например, все три CDR LC и одну или более, например, все три CDR HC. В одном из вариантов осуществления гуманизированный CD123-связывающий домен содержит одну или более (например, все три) определяющую комплементарность область 1 тяжелой цепи (CDR1 HC), определяющую комплементарность область 2 тяжелой цепи (CDR2 HC) и определяющую комплементарность область 3 тяжелой цепи (CDR3 HC) гуманизированного CD123-связывающего домена, описываемого в настоящем описании, например, гуманизированный CD123-связывающий домен содержит две вариабельные области тяжелой цепи, каждая из которых содержит CDR1 HC, CDR2 HC и CDR3 HC, описываемые в настоящем описании. В одном из вариантов осуществления гуманизированный CD123-связывающий домен содержит гуманизированную вариабельную область легкой цепи, описываемую в настоящем описании (например, в таблице 6), и/или гуманизированную вариабельную область тяжелой цепи, описываемую в настоящем описании (например, в таблице 6). В одном из вариантов осуществления гуманизированный CD123-связывающий домен содержит гуманизированную вариабельную область тяжелой цепи, описываемую в настоящем описании (например, в таблице 6), например, по меньшей мере две гуманизированные вариабельные области тяжелой цепи, описываемые в настоящем описании (например, в таблице 6). В одном из вариантов осуществления CD123-связывающий домен представляет собой scFv, содержащий легкую цепь и тяжелую цепь аминокислотной последовательности из таблицы 6. В одном из вариантов осуществления CD123-связывающий домен (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области легкой цепи, предоставленной в таблице 4, или последовательность с 95-99% идентичностью с аминокислотной последовательностью таблицы 6, и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, содержащую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области тяжелой цепи, предоставленной в таблице 6, или последовательность с 95-99% идентичностью с аминокислотной последовательностью из таблицы 6. В одном из вариантов осуществления гуманизированный CD123-связывающий домен содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 184-215 и 302-333, или последовательность с 95-99% идентичностью с ней. В одном из вариантов осуществления гуманизированный CD123-связывающий домен представляет собой scFv, и вариабельная область легкой цепи, содержащая аминокислотную последовательность, описываемую в настоящем описании, например, в таблице 6, связана с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, описываемую в настоящем описании, например, в таблице 6, посредством линкер, например, линкера, описываемого в настоящем описании. В одном из вариантов осуществления гуманизированный CD123-связывающий домен содержит линкер (Gly4-Ser)n, где n представляет собой 1, 2, 3, 4, 5 или 6, предпочтительно 3 или 4 (SEQ ID NO: 26). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv может находиться, например, в любой из следующих ниже ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
Гуманизированное антитело можно получать и использованием различных техник, известных в данной области, включая, но, не ограничиваясь ими, пересадку CDR (см., например, патент Европы № EP 239.400; международную публикацию № WO 91/09967 и патенты США № 5225539, 5530101 и 5585089, каждый из которых полностью включен в настоящем описании посредством ссылки), винирование или изменение поверхности (см., например, патенты Европы № EP 592.106 и EP 519.596; Padlan, 1991, Molecular Immunology, 28(4/5):489-498; Studnicka et al., 1994, Protein Engineering, 7(6):805-814, и Roguska et al., 1994, PNAS, 91:969-973, каждая из которых полностью включена в настоящее описание посредством ссылки), перестановку цепей (см., например, патент США № 5565332, который полностью включен в настоящее описание посредством ссылки) и техники, описываемые, например, в публикации патентной заявки США № US2005/0042664, публикации патентной заявки США № US2005/0048617, патенте США № 6407213, патенте США № 5766886, международной публикации № WO 9317105, Tan et al., J. Immunol., 169:1119-25 (2002), Caldas et al., Protein Eng., 13(5):353-60 (2000), Morea et al., Methods, 20(3):267-79 (2000), Baca et al., J. Biol. Chem., 272(16):10678-84 (1997), Roguska et al., Protein Eng., 9(10):895-904 (1996), Couto et al., Cancer Res., 55 (23 Supp):5973s-5977s (1995), Couto et al., Cancer Res., 55(8):1717-22 (1995), Sandhu J.S., Gene, 150(2):409-10 (1994), и Pedersen et al., J. Mol. Biol., 235(3):959-73 (1994), каждая из которых полностью включена в настоящем описании посредством ссылки. Как правило, каркасные остатки в каркасных областях заменяют соответствующим остатком из CDR донорного антитела для изменения, например, улучшения связывания антигена. Такие каркасные замены идентифицируют способами, хорошо известными в данной области, например, моделированием взаимодействий CDR и каркасных остатков для идентификации каркасных остатков, важных для связывания антигена, и сравнением последовательностей для идентификации несвойственных каркасных остатков в конкретных положениях. (См., например, Queen et al., патент США № 5585089 и Riechmann et al., 1988, Nature, 332:323, которые полностью включены в настоящее описание посредством ссылки.)
Гуманизированное антитело или фрагмент антитела содержит один или более аминокислотных остатков, остающихся в нем из источника, который не принадлежит человеку. Эти не принадлежащие человеку аминокислотные остатки, как правило, обозначают как "импортированные" остатки, которые, как правило, забирают из "импортируемого" вариабельного домена. Как приведено в настоящем описании, гуманизированные антитела или фрагменты антител, содержат одну или более CDR из не принадлежащих человеку молекул иммуноглобулина и каркасные области, где аминокислотные остатки, содержащие каркас получают полностью или преимущественно из зародышевой линии человека. Многие техники гуманизации антител или фрагментов антител хорошо известны в данной области и их можно по существу проводить следующим способом Winter и соавторов (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)) заменой CDR или последовательностей CDR грызунов соответствующими последовательностями антитела человека, т.е. пересадкой CDR (EP 239.400, публикация PCT № WO 91/09967 и патенты США № 4816567, 6331415, 5225539, 5530101, 5585089, 6548640, содержание которых включено полностью в настоящее описание посредством ссылки). В таких гуманизированных антителах и фрагментах антител по существу менее чем интактный вариабельный домен человека заменяли соответствующей последовательностью от не являющихся человеком видов. Гуманизированные антитела представляют собой, как правило, антитела человека, в которых некоторые остатки CDR и, возможно, некоторые каркасные (FR) остатки заменяют остатками из аналогичных участков в антителах грызунов. Гуманизацию антител и фрагментов антител также можно проводить винированием или изменением поверхности (EP 592.106; EP 519.596; Padlan, 1991, Molecular Immunology, 28(4/5):489-498; Studnicka et al., Protein Engineering, 7(6):805-814 (1994), и Roguska et al., PNAS, 91:969-973 (1994)) или перестановкой цепей (патент США № 5565332), содержание которых включено полностью в настоящее описание посредством ссылки.
Выбор вариабельных доменов человека как легкой, так и тяжелой цепи, которые следует использовать для получения гуманизированных антител, предназначен снижать антигенность. В соответствии с так называемым способом "наилучшего соответствия" проводят скрининг последовательности вариабельного домена антитела грызуна против полной библиотеки известных последовательностей вариабельного домена человека. Затем последовательность человека, которая является наиболее близкой к последовательности грызуну, принимают как каркасную (FR) человека для гуманизированного антитела (Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987), содержание которых включено полностью в настоящее описание посредством ссылки). В другом способе используют конкретный каркас, получаемый из консенсусной последовательности полностью принадлежащих человеку антител конкретной подгруппы легких или тяжелых цепей. Тот же каркас можно использовать для нескольких различных гуманизированных антител (см., например, Nicholson et al., Mol. Immun., 34 (16-17): 1157-1165 (1997); Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993), содержание которых полностью включено в настоящее описание посредством ссылки). В некоторых вариантах осуществления каркасную область, например, все четыре каркасные области вариабельной области тяжелой цепи получают из последовательности зародышевой линии VH4_4-59e. В одном из вариантов осуществления каркасная область может содержать, один, два, три, четыре или пять модификаций, например, замен, например, из аминокислоты в соответствующей последовательности мыши. В одном из вариантов осуществления каркасная область, например, все четыре каркасные области вариабельной области легкой цепи получают из последовательности зародышевой линии VK3_1.25. В одном из вариантов осуществления каркасная область может содержать одну, две, три, четыре или пять модификаций, например, замен, например, из аминокислоты в соответствующей последовательности мыши.
В некоторых аспектах часть композиции CAR по изобретению, которая содержит фрагмент антитела, является гуманизированной при сохранении высокой аффинности к антигену-мишени и других благоприятных биологических свойств. В соответствии с одним из аспектов изобретения гуманизированные антитела и фрагменты антител получают путем анализа исходных последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей исходных и гуманизированных последовательностей. Трехмерные модели иммуноглобулина являются общедоступными и хорошо известны специалистам в данной области. Доступными являются компьютерные программы, которые иллюстрируют и отражают вероятные трехмерные конформационные структуры выбранных последовательностей иммуноглобулинов-кандидатов. Изучение таких дисплеев обеспечивает возможность анализа вероятной роли остатков в функционировании последовательности иммуноглобулина-кандидата, например, анализа остатков, которые влияют на способность иммуноглобулина-кандидата связывать антиген-мишень. Таким образом, остатки FR можно выбирать и объединять от реципиента и импортировать последовательности, таким образом, чтобы получать желаемую характеристику антитела или фрагмента антитела, такую как повышенная аффинность к антигену-мишени. Как правило, остатки CDR непосредственно и наиболее существенно оказывают влияние на связывание антигена.
Гуманизированное антитело или фрагмент антитела может сохранять аналогичную антигенную специфичность, как исходное антитело, например, в настоящем изобретении, способность связывать CD123 человека или его фрагмент. В некоторых вариантах осуществления гуманизированное антитело или фрагмент антитела может обладать улучшенной аффинностью и/или специфичностью связывания с CD123 человека или его фрагментом.
В одном из аспектов участок антигенсвязывающего домена содержит одну или более последовательностей, выбранных из SEQ ID NO: 157-160,184-215, 478, 480, 483, 485 и 556-587. В одном из аспектов CD123 CAR, который связывает CD123-связывающий домен человека, выбран из одной или более последовательностей, выбранных из SEQ ID NO: 157-160, 478, 480, 483 и 485. В одном из аспектов CD123 CAR, который содержит гуманизированный CD123-связывающий домен, выбран из одной или более последовательностей, выбранных из SEQ ID NO: 184-215 и 556-587.
В одном из аспектов CD123-связывающий домен характеризуется конкретными функциональными признаками или свойствами антитела или фрагмента антитела. Например, в одном из аспектов часть композиции CAR по изобретению, которая содержит антигенсвязывающий домен, который специфически связывается с CD123 человека или его фрагментом. В одном из аспектов изобретение относится к антигенсвязывающему домену, содержащему антитело или фрагмент антитела, где связывающий домен антитела специфически связывается с белком CD123 или его фрагментом, где антитело или фрагмент антитела содержит вариабельную область легкой цепи и/или вариабельную область тяжелой цепи, которая содержит аминокислотную последовательность SEQ ID NO: 157-160, 184-215, 478, 480, 483, 485 и 556-587. В одном из аспектов антигенсвязывающий домен содержит аминокислотную последовательность scFv, выбранную из SEQ ID NO: 157-160, 184-215, 478, 480, 483, 485 и 556-587. В определенных аспектах scFv является смежным с лидерной последовательностью и находится в той же рамке считывания с ней. В одном из аспектов лидерная последовательность представляет собой полипептидную последовательность, предоставленную как SEQ ID NO: 1.
В одном из аспектов CD123-связывающий домен представляет собой фрагмент, например, одноцепочечный вариабельный фрагмент (scFv). В одном из аспектов CD123-связывающий домен представляет собой Fv, Fab, (Fab')2 или бифункциональное (например, биспецифическое) гибридное антитело (например, Lanzavecchia et al., Eur. J. Immunol., 17, 105 (1987)). В одном из аспектов антитела и их фрагменты по изобретению связывают белок CD123 или его фрагмент с аффинностью дикого типа или повышенной аффинностью.
В некоторых случаях scFv человека можно получать из библиотеки дисплея. Библиотека дисплея представляет собой набор соединений, где каждое соединение включает доступный полипептидный компонент и возобновимый компонент, который кодирует или идентифицирует полипептидный компонент. Полипептидный компонент изменяют таким образом, чтобы были предоставлены различные аминокислотные последовательности. Полипептидный компонент может быть любой длины, например, от трех аминокислот до 300 аминокислот. Соединение библиотеки дисплея может включать более одного полипептидного компонента, например, две полипептидные цепи Fab. В одном иллюстративном варианте осуществления библиотеку дисплея можно использовать для идентификации CD123-связывающего домена человека. При селекции полипептидный компонент каждого представителя библиотеки исследует с CD123 или его фрагментом, и если полипептидный компонент связывается с CD123, представителя библиотеки дисплея идентифицируют, как правило, по удержанию на подложке.
Удерживаемых представителей библиотеки дисплея выделяют из подложки и анализируют. Анализ может включать амплификацию и последующую селекцию в сходных или несходных условиях. Например, положительную и отрицательную селекцию можно чередовать. Анализ также может включать определение аминокислотной последовательности полипептидного компонента, т.е. CD123-связывающего домена, и очистку полипептидного компонента для подробной характеристики.
Для библиотек дисплея можно использовать ряд форматов. Примеры включают фаговый дисплей. В фаговом дисплее белковый компонент, как правило, является ковалентно связанным с белком оболочки бактериофага. Связь является результатом трансляции нуклеиновой кислоты, кодирующей белковый компонент, слитый с белком оболочки. Связь может включать гибкий пептидный линкер, участок протеазы или аминокислоту, вводимую в результате подавления стоп-кодона. Фаговый дисплей описан, например, в U.S. 5223409; Smith, (1985) Science, 228:1315-1317, WO 92/18619, WO 91/17271, WO 92/20791, WO 92/15679, WO 93/01288, WO 92/01047, WO 92/09690, WO 90/02809, de Haard et al., (1999) J. Biol. Chem., 274:18218-30; Hoogenboom et al., (1998) Immunotechnology, 4:1-20; Hoogenboom et al., (2000) Immunol. Today, 2:371-8 и Hoet et al., (2005) Nat. Biotechnol., 23(3)344-8. Бактериофаг, предоставляющий белковый компонент, можно выращивать и собирать стандартными способами получения фагов, например, осаждением PEG из среды для выращивания. После селекции отдельных фагов дисплея можно выделять нуклеиновую кислоту, кодирующую выбранные белковые компоненты, из клеток, инфицированных выбранными фагами, или из самих фагов после амплификации. Индивидуальные колонии или бляшки можно накалывать, выделять и секвенировать нуклеиновую кислоту.
Другие форматы дисплея включают дисплей на основе клеток (см., например, WO 03/029456), слияний белок-нуклеиновая кислота (см., например, US 6207446), рибосомный дисплей (см., например, Mattheakis et al., (1994) Proc. Natl. Acad. Sci. USA, 91:9022 и Hanes et al., (2000) Nat. Biotechnol., 18:1287-92; Hanes et al., (2000) Methods Enzymol., 328:404-3,; и Schaffitzel et al., (1999) J. Immunol. Methods., 231(1-2):119-35), и периплазматический дисплей на основе E. coli (2005 Nov 22;PMID: 16337958).
В некоторых случаях scFvs можно получать известным в данной области способом (см., например, Bird et al., (1988) Science, 242:423-426, и Huston et al., (1988) Proc. Natl. Acad. Sci. USA, 85:5879-5883). Молекулы scFv можно получать связыванием областей VH и VL друг с другом с использованием гибких полипептидных линкеров. Молекулы scFv содержат линкер (например, линкер Ser-Gly) с оптимизированной длиной и/или композицией аминокислот. Длина линкера может в значительной степени влиять на то, как вариабельные области scFv сворачиваются и взаимодействуют. Фактически, если применяют короткий полипептидный линкер (например, 5-10 аминокислот), то предотвращают внутрицепочечное сворачивание. Межцепьевое сворачивание также является необходимым для приведения двух вариабельных областей друг к другу для образования функционального участка связывания эпитопа. Для примеров ориентации линкера и размера см., например, Hollinger et al., 1993 Proc. Natl. Acad. Sci. USA, 90:6444-6448, публикации патентных заявок США № 2005/0100543, 2005/0175606, 2007/0014794, и публикации PCT № WO2006/020258 и WO2007/024715, которые включены в настоящее описание посредством ссылки.
scFv может содержать линкер по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50 или более аминокислотных остатков между своими областями VL и VH. Линкерная последовательность может содержать любую природную аминокислоту. В некоторых вариантах осуществления линкерная последовательность содержит аминокислоты глицин и серин. В другом варианте осуществления линкерная последовательность содержит группы повторов глицина и серина, такие как (Gly4Ser)n, где n представляет собой положительное целое число, равное или более 1 (SEQ ID NO: 25). В одном из вариантов осуществления линкер может представлять собой (Gly4Ser)4 (SEQ ID NO: 27) или (Gly4Ser)3 (SEQ ID NO: 28). Изменение длины линкера может приводить к сохранению или увеличению активности, что является результатом высокой эффективности в исследованиях активности.
Иллюстративные конструкции CD123 CAR и антигенсвязывающие домены
Иллюстративные конструкции CD123 CAR, раскрытые в настоящем описании, содержат scFv (например, scFv человека, как описано в таблицах 2, 6 и 9 в настоящем описании, необязательно которому предшествует необязательная лидерная последовательность (например, SEQ ID NO: 1 и SEQ ID NO: 12 для иллюстративной лидерной аминокислотной и нуклеотидной последовательностей, соответственно). Последовательности фрагментов scFv человека (аминокислотные последовательности SEQ ID NO: 157-160) предоставлены в настоящем описании в таблице 2. Последовательности фрагментов scFv человека без лидерной последовательности предоставлены в настоящем описании в таблице 9 (SEQ ID NO: 479, 481, 482 и 484 для нуклеотидных последовательностей и SEQ ID NO: 478, 480, 483 и 485 для аминокислотных последовательностей). Конструкция CD123 CAR может дополнительно содержать необязательный шарнирный домен, например, шарнирный домен CD8 (например, содержащий аминокислотную последовательность SEQ ID NO: 2 или кодируемый последовательностью нуклеиновой кислоты SEQ ID NO: 13); трансмембранный домен, например, трансмембранный домен CD8 (например, содержащий аминокислотную последовательность SEQ ID NO: 6 или кодируемый нуклеотидной последовательностью SEQ ID NO: 17); внутриклеточный домен, например, внутриклеточный домен 4-1BB (например, содержащий аминокислотную последовательность SEQ ID NO: 7 или кодируемый нуклеотидной последовательностью SEQ ID NO: 18, и функциональный сигнальный домен, например, домен CD3-дзета (например, содержащий аминокислотную последовательность SEQ ID NO: 9 или 10 или кодируемый нуклеотидной последовательностью SEQ ID NO: 20 или 21). В определенных вариантах осуществления домены являются смежными и находятся в той же рамке считывания с образованием одного слитого белка. В других вариантах осуществления домен находится в отдельных полипептидах, например, как в молекуле RCAR, как описано в настоящем описании.
В определенных вариантах осуществления полноразмерная молекула CD123 CAR содержит аминокислотную последовательность или кодируется нуклеотидной последовательностью CD123-1, CD123-2, CD123-3, CD123-4, hzCD123-1, hzCD123-2, hzCD123-3, hzCD123-4, hzCD123-5, hzCD123-6, hzCD123-7, hzCD123-8, hzCD123-9, hzCD123-10, hzCD123-11, hzCD123-12, hzCD123-13, hzCD123-14, hzCD123-15, hzCD123-16, hzCD123-17, hzCD123-18, hzCD123-19, hzCD123-20, hzCD123-21, hzCD123-22, hzCD123-23, hzCD123-24, hzCD123-25, hzCD123-26, hzCD123-27, hzCD123-28, hzCD123-29, hzCD123-30, hzCD123-31 или hzCD123-32, предоставленной в таблице 2, 6 или 9, или последовательностью по существу (например, 95-99%) идентичной ей.
В определенных вариантах осуществления молекула CD123 CAR или антигенсвязывающий домен CD123 содержит аминокислотную последовательность scFv CD123-1, CD123-2, CD123-3, CD123-4, hzCD123-1, hzCD123-2, hzCD123-3, hzCD123-4, hzCD123-5, hzCD123-6, hzCD123-7, hzCD123-8, hzCD123-9, hzCD123-10, hzCD123-11, hzCD123-12, hzCD123-13, hzCD123-14, hzCD123-15, hzCD123-16, hzCD123-17, hzCD123-18, hzCD123-19, hzCD123-20, hzCD123-21, hzCD123-22, hzCD123-23, hzCD123-24, hzCD123-25, hzCD123-26, hzCD123-27, hzCD123-28, hzCD123-29, hzCD123-30, hzCD123-31 или hzCD123-32, предоставленную в таблице 2, 6 или 9, или содержит аминокислотную последовательность scFv или кодируется нуклеотидной последовательностью CD123-1, CD123-2, CD123-3, CD123-4, hzCD123-1, hzCD123-2, hzCD123-3, hzCD123-4, hzCD123-5, hzCD123-6, hzCD123-7, hzCD123-8, hzCD123-9, hzCD123-10, hzCD123-11, hzCD123-12, hzCD123-13, hzCD123-14, hzCD123-15, hzCD123-16, hzCD123-17, hzCD123-18, hzCD123-19, hzCD123-20, hzCD123-21, hzCD123-22, hzCD123-23, hzCD123-24, hzCD123-25, hzCD123-26, hzCD123-27, hzCD123-28, hzCD123-29, hzCD123-30, hzCD123-31 или hzCD123-32, или последовательность по существу идентичную (например, 95-99% идентичную или содержащую до 20, 15, 10, 8, 6, 5, 4, 3, 2 или 1 аминокислотных замен) с любой из указанных выше последовательностей.
В определенных вариантах осуществления молекула CD123 CAR или антигенсвязывающий домен CD123 содержит вариабельную область тяжелой цепи и/или вариабельную область легкой цепи CD123-1, CD123-2, CD123-3, CD123-4, hzCD123-1, hzCD123-2, hzCD123-3, hzCD123-4, hzCD123-5, hzCD123-6, hzCD123-7, hzCD123-8, hzCD123-9, hzCD123-10, hzCD123-11, hzCD123-12, hzCD123-13, hzCD123-14, hzCD123-15, hzCD123-16, hzCD123-17, hzCD123-18, hzCD123-19, hzCD123-20, hzCD123-21, hzCD123-22, hzCD123-23, hzCD123-24, hzCD123-25, hzCD123-26, hzCD123-27, hzCD123-28, hzCD123-29, hzCD123-30, hzCD123-31 или hzCD123-32, предоставленную в таблице 2 или 6, или последовательность по существу идентичную (например, 95-99% идентичную или содержащую до 20, 15, 10, 8, 6, 5, 4, 3, 2 или 1 аминокислотных замен) с любой из указанных выше последовательностей.
В определенных вариантах осуществления молекула CD123 CAR или антигенсвязывающий домен CD123 содержит одну, две или три CDR из вариабельной области тяжелой цепи (например, HCDR1, HCDR2 и/или HCDR3), предоставленной в таблице 3 или 7 и/или одну, две или три CDR из вариабельной области легкой цепи (например, LCDR1, LCDR2 и/или LCDR3) CD123-1, CD123-2, CD123-3, CD123-4, hzCD123-1, hzCD123-2, hzCD123-3, hzCD123-4, hzCD123-5, hzCD123-6, hzCD123-7, hzCD123-8, hzCD123-9, hzCD123-10, hzCD123-11, hzCD123-12, hzCD123-13, hzCD123-14, hzCD123-15, hzCD123-16, hzCD123-17, hzCD123-18, hzCD123-19, hzCD123-20, hzCD123-21, hzCD123-22, hzCD123-23, hzCD123-24, hzCD123-25, hzCD123-26, hzCD123-27, hzCD123-28, hzCD123-29, hzCD123-30, hzCD123-31 или hzCD123-32, предоставленную в таблице 4 или 8, или последовательность по существу идентичную (например, 95-99% идентичную или содержащую до 5, 4, 3, 2 или 1 аминокислотных замен) с любой из указанных выше последовательностей.
В определенных вариантах осуществления молекула CD123 CAR или антигенсвязывающий домен CD123 содержит одну, две или три CDR из вариабельной области тяжелой цепи (например, HCDR1, HCDR2 и/или HCDR3), предоставленные в таблице 10, и/или одну, две или три CDR из вариабельной области легкой цепи (например, LCDR1, LCDR2 и/или LCDR3) CD123-1, CD123-2, CD123-3, CD123-4, hzCD123-1, hzCD123-2, hzCD123-3, hzCD123-4, hzCD123-5, hzCD123-6, hzCD123-7, hzCD123-8, hzCD123-9, hzCD123-10, hzCD123-11, hzCD123-12, hzCD123-13, hzCD123-14, hzCD123-15, hzCD123-16, hzCD123-17, hzCD123-18, hzCD123-19, hzCD123-20, hzCD123-21, hzCD123-22, hzCD123-23, hzCD123-24, hzCD123-25, hzCD123-26, hzCD123-27, hzCD123-28, hzCD123-29, hzCD123-30, hzCD123-31 или hzCD123-32, предоставленную в таблице 11, или последовательность по существу идентичную (например, 95-99% идентичную или содержащую до 5, 4, 3, 2 или 1 аминокислотную замену) с любой из указанных выше последовательностей.
В определенных вариантах осуществления молекула CD123 или антигенсвязывающий домен CD123 содержит одну, две или три CDR из вариабельной области тяжелой цепи (например, HCDR1, HCDR2 и/или HCDR3), предоставленные в таблице 12, и/или одну, две или три CDR из вариабельной области легкой цепи (например, LCDR1, LCDR2 и/или LCDR3) CD123-1, CD123-2, CD123-3, CD123-4, hzCD123-1, hzCD123-2, hzCD123-3, hzCD123-4, hzCD123-5, hzCD123-6, hzCD123-7, hzCD123-8, hzCD123-9, hzCD123-10, hzCD123-11, hzCD123-12, hzCD123-13, hzCD123-14, hzCD123-15, hzCD123-16, hzCD123-17, hzCD123-18, hzCD123-19, hzCD123-20, hzCD123-21, hzCD123-22, hzCD123-23, hzCD123-24, hzCD123-25, hzCD123-26, hzCD123-27, hzCD123-28, hzCD123-29, hzCD123-30, hzCD123-31 или hzCD123-32, предоставленную в таблице 13, или последовательность по существу идентичную (например, 95-99% идентичную или содержащую до 5, 4, 3, 2 или 1 аминокислотных замен) с любой из указанных выше последовательностей.
Последовательности последовательностей CDR scFV-доменов приведены в таблицах 3, 7, 10 и 12 для вариабельных доменов тяжелых цепей и в таблицах 4, 8, 11 и 13 для вариабельных доменов легких цепей. "ID" обозначает характерные SEQ ID NO для каждой CDR.
CDR, предоставленные в таблицах 3, 4, 7 и 8, являются таким как в соответствии с системой нумерации по Kabat и Chothia.
Таблица 3. CDR вариабельного домена тяжелой цепи
|
Таблица 4. CDR вариабельного домена легкой цепи
|
Таблица 7. CDR вариабельного домена тяжелой цепи
|
Таблица 8. CDR вариабельного домена легкой цепи
|
Таблица 10. CDR вариабельного домена тяжелой цепи в соответствии с системой нумерации по Kabat (Kabat et al. (1991), "Sequences of Proteins of Immunological Interest", 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD)
|
Таблица 11. CDR вариабельного домена легкой цепи в соответствии с системой нумерации по Kabat (Kabat et al. (1991), "Sequences of Proteins of Immunological Interest", 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD)
|
Таблица 12. CDR вариабельного домена тяжелой цепи в соответствии с системой нумерации по Chothia (Al-Lazikani et al., (1997) JMB 273,927-948)
|
Таблица 13. CDR вариабельного домена легкой цепи в соответствии с системой нумерации по Chothia (Al-Lazikani et al., (1997) JMB 273,927-948)
|
В вариантах осуществления одноцепочечные вариабельные фрагменты CD123 получают и клонируют в лентивирусные экспрессирующие CAR векторы с внутриклеточным доменом CD3-дзета и внутриклеточный костимулирующий домен 4-1BB. Названия иллюстративных полностью принадлежащих scFv CD123 человеку проиллюстрированы в таблице 1. Названия иллюстративных гуманизированных scFv CD123 проиллюстрированы в таблице 5.
Таблица 1: Конструкции CAR-CD123
|
Таблица 5: Конструкции CAR-CD123
|
В вариантах осуществления порядок, в котором появляются домены VL и VH в scFv изменяется (т.е. ориентация VL-VH или VH-VL), и где три или четыре копии субъединицы "G4S" (SEQ ID NO: 25), в которых каждая субъединица содержит последовательность GGGGS (SEQ ID NO: 25) (например, (G4S)3 (SEQ ID NO: 28) или (G4S)4(SEQ ID NO: 27)), соединяют вариабельные домены с образованием структурной единицы scFV-домена, как представлено в таблице 2, таблице 6 и таблице 9.
Аминокислотные последовательности и последовательности нуклеиновой кислоты CD123 scFV-доменов и молекул CD123 CAR предоставлены в таблице 2, таблице 6 и таблице 9. Аминокислотные последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи для каждого scFv также предоставлены в таблице 2 и таблице 6. Следует отметить, что фрагменты scFv (SEQ ID NO: 157-160 и 184-215) с лидерной последовательностью (например, аминокислотной последовательностью SEQ ID NO: 1 или нуклеотидной последовательностью SEQ ID NO: 12) и без лидерной последовательности (SEQ ID NO: 478, 480, 483, 485 и 556-587) также входят в настоящее изобретение.
Лидерная последовательность (аминокислотная последовательность) (SEQ ID NO: 1)
MALPVTALLLPLALLLHAARP
Лидерная последовательность (последовательность нуклеиновой кислоты) (SEQ ID NO: 12)
ATGGCCCTGCCTGTGACAGCCCTGCTGCTGCCTCTGGCTCTGCTGCTGCATGCCGCTAGACCC
Шарнир CD8 (аминокислотная последовательность) (SEQ ID NO: 2)
TTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACD
Шарнир CD8 (последовательность нуклеиновой кислоты) (SEQ ID NO: 13)
ACCACGACGCCAGCGCCGCGACCACCAACACCGGCGCCCACCATCGCGTCGCAGCCCCTGTCCCTGCGCCCAGAGGCGTGCCGGCCAGCGGCGGGGGGCGCAGTGCACACGAGGGGGCTGGACTTCGCCTGTGAT
Трансмембранный CD8 (аминокислотная последовательность) (SEQ ID NO: 6)
IYIWAPLAGTCGVLLLSLVITLYC
Трансмембранный CD8 (последовательность нуклеиновой кислоты) (SEQ ID NO: 17)
ATCTACATCTGGGCGCCCTTGGCCGGGACTTGTGGGGTCCTTCTCCTGTCACTGGTTATCACCCTTTACTGC
Внутриклеточный домен 4-1BB (аминокислотная последовательность) (SEQ ID NO: 7)
KRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL
Внутриклеточный домен 4-1BB (последовательность нуклеиновой кислоты) (SEQ ID NO: 18)
AAACGGGGCAGAAAGAAACTCCTGTATATATTCAAACAACCATTTATGAGACCAGTACAAACTACTCAAGAGGAAGATGGCTGTAGCTGCCGATTTCCAGAAGAAGAAGAAGGAGGATGTGAACTG
Внутриклеточный домен CD28 (аминокислотная последовательность) (SEQ ID NO: 43)
RSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRS (SEQ ID NO: 43)
Внутриклеточный домен CD28 (нуклеотидная последовательность) (SEQ ID NO: 44)
AGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCC (SEQ ID NO: 44)
Внутриклеточный домен ICOS (аминокислотная последовательность) (SEQ ID NO: 45)
TKKKYSSSVHDPNGEYMFMRAVNTAKKSRLTDVTL (SEQ ID NO: 45)
Внутриклеточный домен ICOS (нуклеотидная последовательность) (SEQ ID NO: 46)
ACAAAAAAGAAGTATTCATCCAGTGTGCACGACCCTAACGGTGAATACATGTTCATGAGAGCAGTGAACACAGCCAAAAAATCCAGACTCACAGATGTGACCCTA (SEQ ID NO: 46)
Домен CD3-дзета (аминокислотная последовательность) (SEQ ID NO: 9)
RVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
CD3-дзета (последовательность нуклеиновой кислоты) (SEQ ID NO: 20)
AGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACAAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGC
Домен CD3-дзета (аминокислотная последовательность; эталонная последовательность NCBI NM_000734.3) (SEQ ID NO: 10)
RVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
CD3-дзета (последовательность нуклеиновой кислоты; эталонная последовательность NCBI NM_000734.3); (SEQ ID NO: 21)
agagtgaagttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgagctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccctgagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcagaaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggcaaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcccttcacatgcaggccctgccccctcgc
Шарнир IgG4 (аминокислотная последовательность) (SEQ ID NO: 36)
ESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKM
Шарнир IgG4 (нуклеотидная последовательность) (SEQ ID NO: 37)
GAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATG
В вариантах осуществления все эти клоны в таблице 2 и 6
содержали замену остатка Q/K в сигнальном домене костимулирующего домена, получаемого из CD3-дзета-цепи.
Таблица 2. Иллюстративные последовательности CD123 CAR
|
Таблица 6: Гуманизированные последовательности CD123 CAR
|
В вариантах осуществления молекула CAR, описываемая в настоящем описании, содержит scFv, который специфически связывается с CD123, и не содержит лидерную последовательность, например, аминокислотную последовательность SEQ ID NO: 1. В таблице 9 ниже приведены аминокислотные и нуклеотидные последовательности для последовательностей scFv CD123, которые не содержат лидерную последовательность SEQ ID NO: 1.
Таблица 9. Последовательности scFv CD123 CAR
|
В вариантах осуществления затем клонировали фрагменты CAR scFv в лентивирусные векторы для получения полноразмерной конструкции CAR в одной кодирующей рамке и с использованием промотора EF1-альфа для экспрессии (SEQ ID NO: 11).
Промотор EF1-альфа
CGTGAGGCTCCGGTGCCCGTCAGTGGGCAGAGCGCACATCGCCCACAGTCCCCGAGAAGTTGGGGGGAGGGGTCGGCAATTGAACCGGTGCCTAGAGAAGGTGGCGCGGGGTAAACTGGGAAAGTGATGTCGTGTACTGGCTCCGCCTTTTTCCCGAGGGTGGGGGAGAACCGTATATAAGTGCAGTAGTCGCCGTGAACGTTCTTTTTCGCAACGGGTTTGCCGCCAGAACACAGGTAAGTGCCGTGTGTGGTTCCCGCGGGCCTGGCCTCTTTACGGGTTATGGCCCTTGCGTGCCTTGAATTACTTCCACCTGGCTGCAGTACGTGATTCTTGATCCCGAGCTTCGGGTTGGAAGTGGGTGGGAGAGTTCGAGGCCTTGCGCTTAAGGAGCCCCTTCGCCTCGTGCTTGAGTTGAGGCCTGGCCTGGGCGCTGGGGCCGCCGCGTGCGAATCTGGTGGCACCTTCGCGCCTGTCTCGCTGCTTTCGATAAGTCTCTAGCCATTTAAAATTTTTGATGACCTGCTGCGACGCTTTTTTTCTGGCAAGATAGTCTTGTAAATGCGGGCCAAGATCTGCACACTGGTATTTCGGTTTTTGGGGCCGCGGGCGGCGACGGGGCCCGTGCGTCCCAGCGCACATGTTCGGCGAGGCGGGGCCTGCGAGCGCGGCCACCGAGAATCGGACGGGGGTAGTCTCAAGCTGGCCGGCCTGCTCTGGTGCCTGGCCTCGCGCCGCCGTGTATCGCCCCGCCCTGGGCGGCAAGGCTGGCCCGGTCGGCACCAGTTGCGTGAGCGGAAAGATGGCCGCTTCCCGGCCCTGCTGCAGGGAGCTCAAAATGGAGGACGCGGCGCTCGGGAGAGCGGGCGGGTGAGTCACCCACACAAAGGAAAAGGGCCTTTCCGTCCTCAGCCGTCGCTTCATGTGACTCCACGGAGTACCGGGCGCCGTCCAGGCACCTCGATTAGTTCTCGAGCTTTTGGAGTACGTCGTCTTTAGGTTGGGGGGAGGGGTTTTATGCGATGGAGTTTCCCCACACTGAGTGGGTGGAGACTGAAGTTAGGCCAGCTTGGCACTTGATGTAATTCTCCTTGGAATTTGCCCTTTTTGAGTTTGGATCTTGGTTCATTCTCAAGCCTCAGACAGTGGTTCAAAGTTTTTTTCTTCCATTTCAGGTGTCGTGA
Gly/Ser (SEQ ID NO: 25)
GGGGS
Gly/Ser (SEQ ID NO: 26): эта последовательность может содержать 1-6 повторяющихся единиц "Gly Gly Gly Gly Ser"
GGGGSGGGGS GGGGSGGGGS GGGGSGGGGS
Gly/Ser (SEQ ID NO: 27)
GGGGSGGGGS GGGGSGGGGS
Gly/Ser (SEQ ID NO: 28)
GGGGSGGGGS GGGGS
Gly/Ser (SEQ ID NO: 29)
GGGS
ПолиA: (A)5000 (SEQ ID NO: 30)
Эта последовательность может содержать 50-5000 аденинов.
ПолиA: (T)100 (SEQ ID NO: 31)
ПолиA: (T)5000 (SEQ ID NO: 32)
Эта последовательность может содержать 50-5000 тиминов.
ПолиA: (A)5000 (SEQ ID NO: 33)
Эта последовательность может содержать 100-5000 аденинов.
ПолиA: (A)400 (SEQ ID NO: 34)
Эта последовательность может содержать 100-400 аденинов.
ПолиA: (A)2000 (SEQ ID NO: 35)
Эта последовательность может содержать 50-2000 аденинов.
Gly/Ser (SEQ ID NO: 709): эта последовательность может содержать 1-10 повторяющихся единиц "Gly Gly Gly Ser"
GGGSGGGSGG GSGGGSGGGS GGGSGGGSGG GSGGGSGGGS
Фрагменты scFv CAR можно клонировать в лентивирусные векторы с получением полноразмерной конструкции CAR в одной кодирующей рамке и с использованием промотора EF1-альфа для экспрессии (SEQ ID NO: 11).
Конструкция CAR может содержать линкер Gly/Ser, содержащий одну или более из следующих ниже последовательностей: GGGGS (SEQ ID NO: 25); включающих 1-6 повторных единиц "Gly Gly Gly Gly Ser", например, GGGGSGGGGS GGGGSGGGGS GGGGSGGGGS (SEQ ID NO: 26); GGGGSGGGGS GGGGSGGGGS (SEQ ID NO: 27); GGGGSGGGGS GGGGS (SEQ ID NO: 28); GGGS (SEQ ID NO: 29); или включающих 1-10 повторных единиц "Gly Gly Gly Ser", например, GGGSGGGSGG GSGGGSGGGS GGGSGGGSGG GSGGGSGGGS (SEQ ID NO: 709).
В вариантах осуществления конструкция CAR содержит последовательность поли-A, например, последовательность, содержащую 50-5000 или 100-5000 аденинов (например, SEQ ID NO: 30, SEQ ID NO: 33, SEQ ID NO: 34 или SEQ ID NO: 35), или последовательность, содержащую 50-5000 тиминов (например, SEQ ID NO: 31, SEQ ID NO: 32). Альтернативно, конструкция CAR может содержать, например, линкер, содержащий последовательность GSTSGSGKPGSGEGSTKG (SEQ ID NO: 704).
Биспецифические CAR
В одном из вариантов осуществления молекула полиспецифического антитела представляет собой биспецифическую молекулу антитела. Биспецифическое антитело обладает специфичностью не более чем к двум антигенам. Биспецифическая молекула антител характеризуется первой последовательностью вариабельного домена иммуноглобулина, которая обладает специфичностью связывания к первому эпитопу, и второй последовательностью вариабельного домена иммуноглобулина, которая обладает специфичностью связывания ко второму эпитопу. В одном из вариантов осуществления первые и второй эпитопы находятся на одном и том же антигене, например, том же белке (или субъединице мультимерного белка). В одном из вариантов осуществления первый и второй эпитопы перекрываются. В одном из вариантов осуществления первый и второй эпитопы не перекрываются. В одном из вариантов осуществления первый и второй эпитопы находятся на различных антигенах, например, различных белках (или различных субъединицах мультимерного белка). В одном из вариантов осуществления биспецифическая молекула антитела содержит последовательность вариабельного домен тяжелой цепи и последовательность вариабельного домен легкой цепи, которые обладают специфичностью связывания с первым эпитопом, и последовательность вариабельного домен тяжелой цепи и последовательность вариабельного домен легкой цепи, которые обладают специфичностью связывания со вторым эпитопом. В одном из вариантов осуществления биспецифическая молекула антитела содержит полуантитело, обладающее специфичностью связывания с первым эпитопом, и полуантитело, обладающее специфичностью связывания со вторым эпитопом. В одном из вариантов осуществления биспецифическая молекула антитела содержит полуантитело или его фрагмент, обладающий специфичностью связывания с первым эпитопом, и полуантитело или его фрагмент, обладающий специфичностью связывания со вторым эпитопом. В одном из вариантов осуществления биспецифическая молекула антител содержит scFv или его фрагмент, который обладает специфичностью связывания с первым эпитопом, и scFv или его фрагмент, который обладает специфичностью связывания со вторым эпитопом.
В определенных вариантах осуществления молекула антител представляет собой полиспецифическую (например, биспецифическую или триспецифическую) молекулу антитела. Протоколы получения биспецифических или гетеродимерных молекул антител известны в данной области, включая, но, не ограничиваясь ими, например, подход "выступ-во-впадину", описанный, например, в US 5731168; спаривание Fc под действием электростатического взаимодействия, как описано, например, в WO 09/089004, WO 06/106905 и WO 2010/129304; образование гетеродимеров с доменами, сконструированными с помощью стандартной замены цепей (SEED), как описано, например, в WO 07/110205; замену Fab-фрагментов, как описано, например, в WO 08/119353, WO 2011/131746 и WO 2013/060867; двойной конъюгат антитела, например, посредством сшивания антител с получением биспецифической структуры с использованием гетеробифункционального реагента, содержащего реакционноспособную аминогруппу и реакционноспособную сульфгидрильную группу, как описано, например, в US 4433059; биспецифические детерминанты антитела, получаемые рекомбинацией полуантител (пар тяжелой-легкой цепей или Fab) из различных антител с использованием цикла восстановления и окисления дисульфидных связей между двумя тяжелыми цепями, как описано, например, в US 4444878; трифункциональные антитела, например, три фрагмента Fab', сшитые посредством реакционноспособных сульфгидрильных групп, как описано, например, в US5273743; биосинтетические связывающие белки, например, пару scFv, сшитых посредством хвостов на C-конце предпочтительно посредством химического перекрестного сшивания дисульфидными или аминогруппами, как описано, например, в US5534254; бифункциональные антитела, например, фрагменты Fab с различной специфичностью связывания, димеризованные посредством лейциновых застежек (например, c-fos и c-jun), которые содержат замещенный константный домен, как описано, например, в US5582996; биспецифические и олигоспецифические моно- и олиговалентные рецепторы, например, области VH-CH1 двух антител (двух фрагментов Fab), связанных через полипептидный спейсер между областью CH1 одного антитела и областью VH другого антитела, как правило, со связанными легкими цепями, как описано, например, в US5591828; биспецифические конъюгаты ДНК-антитело, например, сшивание антител или фрагментов Fab посредством двухцепочечного участка ДНК, как описано, например, в US5635602; биспецифические слитые белки, например, экспрессирующую конструкцию, содержащую два scFv с гидрофильным спиральным пептидным линкером между ними и полной константной областью, как описано, например, в US5637481; поливалентные и связывающие белки, например, димер полипептидов, содержащих первый домен со связывающей областью вариабельной области тяжелой цепи Ig и второй домен со связывающей областью вариабельной области легкой цепи Ig, как правило, называемых диателами (также предусматривают структуры высшего порядка для получения биспецифических, триспецифических или тетраспецифических молекул, как описано, например, в US5837242; конструкции миниантител со связанными VL и VH цепями, дополнительно соединенными пептидными спейсерами с шарнирной областью антитела и областью CH3, которые можно подвергать димеризации с образованием биспецифических/поливалентных молекул, как описано, например, в US5837821; домены VH и VL, связанные с коротким пептидным линкером (например, 5 или 10 аминокислотами) или без линкера в любой ориентации, которые могут образовывать димеры с образованием биспецифических диател; тримеры и тетрамеры, как описано, например, в US5844094; нить доменов VH (или доменов VL в представителях семейства), соединенных пептидными связями с сшивающими группами на C-конце, дополнительно связанным с доменами VL с образованием серии FV (или нескольких scFv), как описано, например, в US5864019, и одноцепочечные связывающие полипептиды с доменами VH и VL, связанными через пептидный линкер, объединяют в поливалентные структуры посредством нековалентного или химического связывания с образованием, например, гомобивалентных, гетеробивалентных, трехвалентных и четырехвалентных структур с использованием формата типа scFV или диатело, как описано, например, в US5869620. Дополнительные иллюстративные полиспецифические и биспецифические молекулы и способы их получения можно найти, например, в US5910573, US5932448, US5959083, US5989830, US6005079, US6239259, US6294353, US6333396, US6476198, US6511663, US6670453, US6743896, US6809185, US6833441, US7129330, US7183076, US7521056, US7527787, US7534866, US7612181, US2002004587A1, US2002076406A1, US2002103345A1, US2003207346A1, US2003211078A1, US2004219643A1, US2004220388A1, US2004242847A1, US2005003403A1, US2005004352A1, US2005069552A1, US2005079170A1, US2005100543A1, US2005136049A1, US2005136051A1, US2005163782A1, US2005266425A1, US2006083747A1, US2006120960A1, US2006204493A1, US2006263367A1, US2007004909A1, US2007087381A1, US2007128150A1, US2007141049A1, US2007154901A1, US2007274985A1, US2008050370A1, US2008069820A1, US2008152645A1, US2008171855A1, US2008241884A1, US2008254512A1, US2008260738A1, US2009130106A1, US2009148905A1, US2009155275A1, US2009162359A1, US2009162360A1, US2009175851A1, US2009175867A1, US2009232811A1, US2009234105A1, US2009263392A1, US2009274649A1, EP346087A2, WO0006605A2, WO02072635A2, WO04081051A1, WO06020258A2, WO2007044887A2, WO2007095338A2, WO2007137760A2, WO2008119353A1, WO2009021754A2, WO2009068630A1, WO9103493A1, WO9323537A1, WO9409131A1, WO9412625A2, WO9509917A1, WO9637621A2, WO9964460A1. Содержание указанных выше заявок полностью включено в настоящее описание посредством ссылки.
В каждом антителе или фрагменте антитела (например, scFv) биспецифической молекулы антитела VH может находиться выше или ниже VL. В некоторых вариантах осуществления в расположенном выше антителе или фрагменте антитела (например, scFv) VH (VH1) располагается выше VL (VL1), и в расположенном ниже антителе или фрагменте антитела (например, scFv) VL (VL2) располагается выше VH (VH2), таким образом, что полная биспецифическая молекула антитела характеризуется порядком расположения VH1-VL1-VL2-VH2. В других вариантах осуществления в расположенном выше антителе или фрагменте антитела (например, scFv) VL (VL1) располагается выше VH (VH1), и в расположенном ниже антителе или фрагменте антитела (например, scFv) VH (VH2) располагается выше VL (VL2), таким образом, что полная биспецифическая молекула антител характеризуется порядком расположения VL1-VH1-VH2-VL2. Необязательно линкер размещают между двумя антителами или фрагментами антител (например, scFvs), например, между VL1 и VL2, если конструкцию располагают как VH1-VL1-VL2-VH2, или между VH1 и VH2, если конструкцию располагают как VL1-VH1-VH2-VL2. Линкер может представлять собой линкер, как описано в настоящем описании, например, линкер (Gly4-Ser)n, где n представляет собой 1, 2, 3, 4, 5 или 6, предпочтительно 4 (SEQ ID NO: 64). Как правило, линкер между двумя scFv должен быть достаточной длины, чтобы устранять возможность ошибочное спаривание между доменами двух scFv. Необязательно, линкер размещают между VL и VH первого scFv. Необязательно, линкер размещают между VL и VH второго scFv. В конструкциях, которые содержат многие линкеры, любые два или более линкеров могут являться одинаковыми или различными. Таким образом, в некоторых вариантах осуществления биспецифический CAR содержит VL, VH и необязательно один или более линкеров в порядке расположения, как описано в настоящем описании.
В одном из аспектов биспецифическая молекула антител характеризуется первой последовательностью вариабельного домена иммуноглобулина, например, scFv, которая обладает специфичностью связывания с CD123, например, содержит scFv, как описано в настоящем описании, например, как описано в таблице 2, таблице 6 или таблице 9, или содержит CDR легкой цепи и/или CDR тяжелой цепи из scFv CD123, описываемого в настоящем описании, и второй последовательностью вариабельного домена иммуноглобулина, которая обладает специфичностью связывания со вторым эпитопом на другом антигене. В некоторых аспектах вторая последовательность вариабельного домена иммуноглобулина обладает специфичностью связывания с антигеном, экспрессируемым на клетках AML, например, антигеном, отличным от CD123. Например, вторая последовательность вариабельного домена иммуноглобулина обладает специфичностью связывания с CLL-1. В качестве другого примера, вторая последовательность вариабельного домена иммуноглобулина обладает специфичностью связывания с CD33. В качестве другого примера, вторая последовательность вариабельного домена иммуноглобулина обладает специфичностью связывания с CD34. В качестве другого примера, вторая последовательность вариабельного домена иммуноглобулина обладает специфичностью связывания с FLT3. Например, вторая последовательность вариабельного домена иммуноглобулина обладает специфичностью связывания с рецептором фолата бета. В некоторых аспектах вторая последовательность вариабельного домена иммуноглобулина обладает специфичностью связывания с антигеном, экспрессируемым B-клетками, например, CD19, CD20, CD22 или ROR1.
Химерный TCR
В одном из аспектов антитела и фрагменты антител против CD123 по настоящему изобретению (например, такие, как описанные в таблицах 2, 6 или 9) можно трансплантировать в один или более константных доменом цепи T-клеточного рецептора ("TCR"), например, альфа-цепи TCR или бета-цепи TCR с получением химерного TCR, который специфически связывается с CD123. Без связи с теорией, полагают, что химерные TCR передают сигнал через комплекс TCR при связывании антигена. Например, scFv CD123, как описано в настоящем описании, можно трансплантировать в константный домен, например, по меньшей мере участок внеклеточного константного домена, трансмембранного домена и цитоплазматического домена цепи TCR, например, альфа-цепи TCR и/или бета-цепи TCR. В качестве другого примера, фрагмент антитела против CD123, например, домен VL, как описано в настоящем описании, можно трансплантировать в константный домен альфа-цепи TCR, и фрагмент антитела против CD123, например, домен VH, как описано в настоящем описании, можно трансплантировать в константный домен бета-цепи TCR (или альтернативно, домен VL можно трансплантировать в константный домен бет-цепи TCR и домен VH можно трансплантировать в альфа-цепь TCR). В качестве другого примера, CDR антитела или фрагмента антитела против CD123, например, CDR антитела или фрагмента антитела против CD123, как описано в таблицах 3, 4, 5, 6, 7, 8, 10, 11, 12 или 13, можно трансплантировать в альфа-цепь и/или бета-цепь TCR с получением химерного TCR, который специфически связывается с CD123. Например, LCDR, описываемые в настоящем описании, можно трансплантировать в вариабельный домен альфа-цепи TCR и HCDR, описываемые в настоящем описании, можно трансплантировать в вариабельный домен бета-цепи TCR или наоборот. Такие химерные TCR можно получать известными в данной области способами (например, Willemsen R.A. et al., Gene Therapy, 2000; 7: 1369-1377; Zhang T. et al., Cancer Gene Ther., 2004; 11: 487-496; Aggen et al., Gene Ther. 2012 Apr;19(4):365-74).
Стабильность и мутации
Стабильность CD123-связывающего домена, например, молекулы scFv (например, растворимого scFv) можно оценивать по отношению к биофизическим свойствам (например, термостабильности) общепринятой контрольной молекулы scFv или полноразмерного антитела. В одном из вариантов осуществления scFv человека обладает термостабильностью, которая является больше чем приблизительно 0,1, приблизительно 0,25, приблизительно 0,5, приблизительно 0,75, приблизительно 1, приблизительно 1,25, приблизительно 1,5, приблизительно 1,75, приблизительно 2, приблизительно 2,5, приблизительно 3, приблизительно 3,5, приблизительно 4, приблизительно 4,5, приблизительно 5, приблизительно 5,5, приблизительно 6, приблизительно 6,5, приблизительно 7, приблизительно 7,5, приблизительно 8, приблизительно 8,5, приблизительно 9, приблизительно 9,5, приблизительно 10 градусов, приблизительно 11 градусов, приблизительно 12 градусов, приблизительно 13 градусов, приблизительно 14 градусов или приблизительно 15 градусов Цельсия, чем у контрольной связывающей молекулы (например, общепринятой молекулы scFv) в описываемых анализах.
Улучшенную термостабильность CD123-связывающего домена, например, scFv впоследствии придают всей контракции CART123, что приводит к улучшенным терапевтическим свойствам конструкции CART123. Термостабильность CD123-связывающего домена, например, scFv можно улучшать по меньшей мере приблизительно на 2°C или 3°C по сравнению с общепринятым антителом. В одном из вариантов осуществления CD123-связывающий домен, например, scFv характеризуется улучшенной на 1°C термостабильностью по сравнению с общепринятым антителом. В другом варианте осуществления CD123-связывающий домен, например, scFv характеризуется улучшенной на 2°C термостабильностью по сравнению с общепринятым антителом. В другом варианте осуществления scFv характеризуется улучшенной на 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15°C термостабильностью по сравнению с общепринятым антителом. Сравнения можно проводить, например, между молекулами scFv, описываемыми в настоящем описании, и полноразмерными антителами. Термостабильность можно измерять известными в данной области способами. Например, в одном из вариантов осуществления можно измерять Tm. Способы измерения Tm и другие способы определения стабильности белка более подробно описаны ниже.
Мутации в scFv изменяют стабильность scFv и улучшают общую стабильность scFv и конструкции CART123. Стабильность гуманизированного scFv или scFv человека определяют с использованием измерений, таких как Tm, температура денатурации и температура агрегация
Связывающая способность мутантных scFv можно определять с использованием анализов, описанных в примерах.
В одном из вариантов осуществления CD123-связывающий домен, например, scFv содержит по меньшей мере одну мутацию, таким образом, что мутантный scFv придает улучшенную стабильность конструкции CART123. В другом варианте осуществления CD123-связывающий домен, например, scFv содержит по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 мутаций, появляющихся в результате процесса гуманизации, таким образом, что мутантный scFv придает улучшенную стабильность конструкции CART123.
Способы оценки стабильности белка
Стабильность антигенсвязывающего домена можно оценивать, например, способами, описанными ниже. Такие способы обеспечивают возможность определения множественных термических конформационных переходов с уничтожением складок, где наименее стабильный домен разворачивается первым или ограничивает общий порог стабильности многодоменной единицы, которая разворачивается совместно (например, многодоменный белок, для которого демонстрируют единичный конформационный переход с уничтожением складок). Наименее стабильный домен можно идентифицировать несколькими дополнительными способами. Можно проводить мутагенез для исследования, какой домен ограничивает общую стабильность. Кроме того, можно проводить оценку устойчивости к протеазе многодоменного белка в условиях, когда известно, что наименее стабильный домен является по существу развернутым, посредством DSC или другими спектроскопическими способами (Fontana et al., (1997) Fold. Des., 2: R17-26; Dimasi et al., (2009) J. Mol. Biol., 393: 672-692). После того как идентифицируют наименее стабильный домен, последовательность, кодирующую этот домен (или его участок), можно применять в качестве тестируемой последовательности в способах.
a) Термостабильность
Термостабильность композиций можно анализировать с использованием различных неограничивающих биофизических или биохимических техник, известных в данной области. В определенных вариантах осуществления термостабильность оценивают аналитической спектроскопией.
Иллюстративный аналитический спектроскопический способ представляет собой дифференциальную сканирующую калориметрию (DSC). В DSC применяют калориметр, который является чувствительным к поглощению тепла, которое сопровождает разворачивание большинства белков или доменов белка (см., например, Sanchez-Ruiz et al., Biochemistry, 27: 1648-52, 1988). Для определения термостабильности белка образец белка помещают в калориметр и повышают температуру до тех пор, пока не разворачивается Fab или scFv. Температура, при которой белок разворачивается, является показателем общей стабильности белка.
Другой иллюстративный аналитический спектроскопический способ представляет собой спектроскопию кругового дихроизма (CD). Спектрометрией CD измеряют оптическую активность композиции в зависимости от повышения температуры. Спектроскопией кругового дихроизма (CD) измеряют разницу поглощения левополяризованного света по сравнению с правополяризованным светом, которая увеличивается вследствие структурной асимметрии. Разупорядоченная или утратившая складки структура приводит к спектру CD очень сильно отличному от спектра CD упорядоченной или свернутой структуры. Спектр CD отражает чувствительность белков к денатурирующему действию повышения температуры, и, таким образом, является показателем термостабильности белка (см. van Mierlo and Steemsma, J. Biotechnol., 79(3):281-98, 2000).
Другой иллюстративный аналитический спектроскопический способ измерения термостабильности представляет собой флуоресцентную спектроскопию (см. van Mierlo and Steemsma, выше). Еще один другой иллюстративный аналитический спектроскопический способ измерения термостабильности представляет собой ядерную магнитно-резонансную (ЯМР) спектроскопию (см., например, van Mierlo and Steemsma, выше).
Термостабильность композиции можно измерять биохимически. Иллюстративный биохимический способ оценки термостабильности представляет собой анализ тепловой пробы. В "анализе тепловой пробы" композицию подвергают действию диапазона повышенных температур в течение заданного периода времени. Например, в одном из вариантов осуществления тестируемые молекулы scFv или молекулы, содержащие молекулы scFv, подвергают действию диапазона повышающихся температур, например, в течение 1-1,5 часов. Затем анализируют активность белка соответствующим биохимическим анализом. Например, если белок представляет собой связывающий белок (например, scFv или содержащий scFv полипептид) активность связывания связывающего белка можно определять функциональным или количественным ELISA.
Такой анализ можно проводить в высокопроизводительном формате, и он может представлять собой анализы, описанные в примерах с использованием E. coli и высокопроизводительного скрининга. Библиотеку CD123-связывающих доменов, например, вариантов scFv, можно создавать известными в данной области способами. Можно индуцировать экспрессию CD123-связывающих доменов, например, scFv, и CD123-связывающие домены, например, scFv можно подвергать тепловой пробе. Подвергаемые анализу тестируемые образцы можно оценивать на связывание, и такие CD123-связывающие домены, например, scFvs, которые являются стабильными можно получать в увеличенном масштабе и дополнительно характеризовать.
Термостабильность оценивают посредством измерения температуры плавления (Tm) композиции с использованием любой из указанных выше техник (например, аналитических спектроскопических техник). Температура плавления представляет собой температуру в срединной точке кривой теплового перехода, где 50% молекул композиции находятся в свернутом состоянии (см., например, Dimasi et al., (2009) J. Mol Biol., 393: 672-692). В одном из вариантов осуществления значения Tm для CD123-связывающего домена, например, scFv составляют приблизительно 40°C, 41°C, 42°C, 43°C, 44°C, 45°C, 46°C, 47°C, 48°C, 49°C, 50°C, 51°C, 52°C, 53°C, 54°C, 55°C, 56°C, 57°C, 58°C, 59°C, 60°C, 61°C, 62°C, 63°C, 64°C, 65°C, 66°C, 67°C, 68°C, 69°C, 70°C, 71°C, 72°C, 73°C, 74°C, 75°C, 76°C, 77°C, 78°C, 79°C, 80°C, 81°C, 82°C, 83°C, 84°C, 85°C, 86°C, 87°C, 88°C, 89°C, 90°C, 91°C, 92°C, 93°C, 94°C, 95°C, 96°C, 97°C, 98°C, 99°C, 100°C. В одном из вариантов осуществления значения Tm для IgG составляют приблизительно 40°C, 41°C, 42°C, 43°C, 44°C, 45°C, 46°C, 47°C, 48°C, 49°C, 50°C, 51°C, 52°C, 53°C, 54°C, 55°C, 56°C, 57°C, 58°C, 59°C, 60°C, 61°C, 62°C, 63°C, 64°C, 65°C, 66°C, 67°C, 68°C, 69°C, 70°C, 71°C, 72°C, 73°C, 74°C, 75°C, 76°C, 77°C, 78°C, 79°C, 80°C, 81°C, 82°C, 83°C, 84°C, 85°C, 86°C, 87°C, 88°C, 89°C, 90°C, 91°C, 92°C, 93°C, 94°C, 95°C, 96°C, 97°C, 98°C, 99°C, 100°C. В одном из вариантов осуществления значения Tm для поливалентного антитела составляют приблизительно 40°C, 41°C, 42°C, 43°C, 44°C, 45°C, 46°C, 47°C, 48°C, 49°C, 50°C, 51°C, 52°C, 53°C, 54°C, 55°C, 56°C, 57°C, 58°C, 59°C, 60°C, 61°C, 62°C, 63°C, 64°C, 65°C, 66°C, 67°C, 68°C, 69°C, 70°C, 71°C, 72°C, 73°C, 74°C, 75°C, 76°C, 77°C, 78°C, 79°C, 80°C, 81°C, 82°C, 83°C, 84°C, 85°C, 86°C, 87°C, 88°C, 89°C, 90°C, 91°C, 92°C, 93°C, 94°C, 95°C, 96°C, 97°C, 98°C, 99°C, 100°C.
Термостабильность также оценивают измерением удельной теплоты или теплоемкость (Cp) композиции аналитическим калориметрическим способом (например, DSC). Удельная теплота композиции представляет собой энергию (например, в ккал/моль), которая является необходимой для повышения на 1°C температуры 1 моль воды. Таким образом, большая Cp является признаком денатурированной или инактивированной белковой композиции. Изменение теплоемкости (ΔCp) композиции измеряют посредством определения удельной теплоты композиции до и после ее теплового перехода. Термостабильность также можно оценивать посредством измерения или определения других параметров термодинамической стабильности, включая свободную энергия Гиббса разворачивания (ΔG), энтальпию разворачивания (ΔH) или энтропию разворачивания (ΔS). Один или более указанных выше биохимических анализов (например, анализ тепловой пробы) используют для определения температуры (т.е. значения TC), при котором 50% композиции сохраняет свою активность (например, активность связывания).
Кроме того, мутации CD123-связывающего домена, например, scFv изменяют термостабильность CD123-связывающего домена, например, scFv по сравнению с немутантным CD123-связывающим доменом, например, scFv. Когда гуманизированный CD123-связывающий домен или CD123-связывающий домен человека, например, scFv вводят в конструкцию CART123, CD123-связывающий домен, например, гуманизированный scFv или scFv человека придает термостабильность всей конструкции CD123 CART. В одном из вариантов осуществления CD123-связывающий домен, например, scFv содержит одну мутацию, которая придает термостабильность CD123-связывающему домену, например, scFv. В другом варианте осуществления CD123-связывающий домен, например, scFv содержит множественные мутации, которые придают термостабильность CD123-связывающему домену, например, scFv. В одном из вариантов осуществления множественные мутации в CD123-связывающем домене, например, scFv обладают аддитивным эффектом в отношении термостабильности CD123-связывающего домена, например, scFv.
b)% агрегации
Стабильность композиции можно определять измерением ее подверженности агрегации. Агрегацию можно измерять различными неограничивающими биохимическими или биофизическими способами. Например, агрегацию композиции можно оценивать с использованием хроматографии, например, эксклюзионной хроматографии (SEC). SEC разделяют молекулы в зависимости от размера. Колонку заполняют полутвердыми гранулами полимерного геля, который пропускает ионы и низкомолекулярные соединения в свое внутренне пространство, но не большие ионы и низкомолекулярные соединения. Когда белковую композицию вносят в верхнюю часть колонки, компактно свернутые белки (т.е. неагрегированные белки) распределяются в большом объеме растворителя по сравнению с объемом, который является доступным для больших агрегатов белков. Таким образом, большие агрегаты двигаются быстрее через колонку, и, таким образом, смесь можно разделять или фракционировать на ее компоненты. Для каждой фракции можно отдельно количественно определять (например, посредством светорассеяния), как она элюирует из геля. Таким образом, % агрегации композиции можно определять сравнением концентраций фракции с общей концентрацией белка, вносимого в гель. Стабильные композиции элюируют из колонки как по существу одна фракция и в профиле элюирования или хроматограмме выходят как по существу один пик.
c) Аффинность связывания
Стабильность композиции можно оценивать посредством определения ее аффинности связывания с мишенью. В данной области известен широкий спектр способов определения аффинности связывания. В иллюстративном способе определения аффинности связывания используют поверхностный плазмонный резонанс. Поверхностный плазмонный резонанс представляет собой оптическое явление, которое обеспечивает возможность анализа биоспецифических взаимодействий в режиме реального времени посредством детекции изменений концентрации белков в биосенсорной матрице, например, с использованием системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, N.J.). Для дополнительных описаний см. Jonsson U., et al., (1993) Ann. Biol. Clin., 51:19-26; Jonsson U., i (1991) Biotechniques, 11:620-627; Johnsson B. et al., (1995) J. Mol. Recognit., 8:125-131, и Johnnson B. et al., (1991) Anal. Biochem. 198:268-277.
В одном из аспектов антигенсвязывающий домен CAR содержит аминокислотную последовательность, которая является гомологичной антигенсвязывающему домену аминокислотной последовательности, описываемой в настоящем описании, и антигенсвязывающий домен сохраняет желаемые функциональные свойства фрагментов антител против CD123, описываемых в настоящем описании. В одном конкретном аспекте композиция CAR по изобретению содержит фрагмент антитела. В дополнительном аспекте такой фрагмент антитела содержит scFv.
В различных аспектах антигенсвязывающий домен CAR конструируют путем модификации одной или более аминокислот в одной или обеих вариабельных областях (например, VH и/или VL), например, в одной или более областей CDR и/или в одной или более каркасных областей. В одном конкретном аспекте композиция CAR по изобретению содержит фрагмент антитела. В дополнительном аспекте такой фрагмент антитела содержит scFv.
Специалисту в данной области должно быть понятно, что антитело или фрагмент антитела по изобретению можно дополнительно модифицировать таким образом, что их аминокислотная последовательность отличается (например, от дикого типа), но не изменяется желаемая активность. Например, в белке можно проводить дополнительные нуклеотидные замены, приводящие к заменам аминокислот по "заменимым" аминокислотным остаткам. Например, заменимый аминокислотный остаток в молекуле можно заменять другим аминокислотным остатком из того же семейства боковых цепей. В другом варианте осуществления нить аминокислот можно заменять структурно сходной нитью, которая отличается порядком и/или композицией представителей семейства боковой цепи, например, можно проводить консервативную замену, в которой аминокислотные остаток заменяют аминокислотным остатком, содержащим сходную боковую цепь.
В данной области были определены семейства аминокислотных остатков, содержащие аналогичные боковые цепи, включая основные боков цепи (например, лизин, аргинин, гистидин), кислые боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин).
Процент идентичности в отношении двух или более последовательностей нуклеиновых кислоты или полипептидных последовательностей, относится к двум или более последовательностям, которые являются идентичными. Две последовательности являются "по существу идентичными", если две последовательности имеют определенное процентное содержание аминокислотных остатков или нуклеотидов, которые являются аналогичными (например, с 60% идентичностью, необязательно 70%, 71%. 72%. 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%,81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичностью на определенной области, или, в случае, когда не определено, на всей последовательности), при сравнении и выравнивании для максимального соответствия в окне сравнения или конструируемой области, как измеряют с использованием одного из следующих ниже алгоритмов сравнения последовательностей или посредством ручного выравнивания и визуальной проверки. Необязательно существует идентичность в области, длина которой составляет по меньшей мере приблизительно 50 нуклеотидов (или 10 аминокислот), или более предпочтительно в области, длина которой составляет от 100 до 500 или 1000, или более нуклеотидов (или 20, 50, 200 или более аминокислот).
Для сравнения последовательностей, как правило, одна последовательность выступает как эталонная последовательность, с которой сравнивают тестируемые последовательности. При использовании алгоритма сравнения последовательностей, тестируемые и эталонные последовательности вводят в компьютер, при необходимости устанавливают координаты подпоследовательностей и устанавливают параметры программы алгоритма последовательностей. Можно использовать параметры программы по умолчанию или можно устанавливать альтернативные параметры. Затем алгоритм сравнения последовательностей вычисляет процент идентичности последовательностей для тестируемых последовательностей относительно эталонной последовательности на основании параметров программы. Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Можно проводить оптимальное выравнивание последовательностей для сравнения, например, посредством алгоритма локальной гомологии Smith and Waterman, (1970) Adv. Appl. Math., 2:482c, посредством алгоритма выравнивания гомологии Needleman and Wunsch, (1970) J. Mol. Biol., 48:443, поиском способа подобия Pearson and Lipman, (1988) Proc. Nat'l. Acad. Sci. USA, 85:2444, посредством компьютеризированных реализаций этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в пакете программного обеспечения Wisconsin Genetics, Genetics Computer Group, 575 Science Dr., Madison, WI) или посредством ручного выравнивания и визуальной проверки (см., например, Brent et al., (2003) Current Protocols in Molecular Biology).
Двумя примерами алгоритмов, которые являются подходящими для определения процента идентичности последовательности и сходства последовательности, являются алгоритмы BLAST и BLAST 2.0, которые описаны у Altschul et al., (1977) Nuc. Acids Res., 25:3389-3402, и Altschul et al., (1990) J. Mol. Biol., 215:403-410, соответственно. Программное обеспечение для проведения анализа BLAST является общедоступным в Национальном центре биотехнологической информации.
Процент идентичности двух аминокислотных последовательностей также можно определять с использованием алгоритма E. Meyers and W. Miller, (1988) Comput. Appl. Biosci., 4:11-17, который встроен в программу ALIGN (версия 2.0), с использованием таблицы весов замен остатков PAM120, штраф за продление пропуска 12 и штраф за пропуск 4. Кроме того, процент идентичности двух аминокислотных последовательностей можно определять с использованием алгоритма Needleman and Wunsch, (1970) J. Mol. Biol., 48:444-453), который встроен в программу GAP в пакете программного обеспечения GCG (доступного на www.gcg.com), с использованием матрицы Blossom 62 или матрицы PAM250 и штраф за пропуск 16, 14, 12, 10, 8, 6 или 4 и штраф за удлинение пропуска 1, 2, 3, 4, 5 или 6.
В одном из аспектов настоящее изобретение предусматривает модификации аминокислотной последовательности исходного антитела или фрагмента (например, scFv), которые приводят к образованию функционально эквивалентных молекул. Например, VH или VL CD123-связывающего домена, например, scFv, содержащихся в CAR, можно модифицировать с сохранением по меньшей мере приблизительно 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%,81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичности исходной каркасной области VH или VL CD123-связывающего домена, например, scFv. Настоящее изобретение предусматривает модификации всей конструкции CAR, например, модификации одной или более аминокислотных последовательностей различных доменов конструкции CAR с получением функционально эквивалентных молекул. Конструкцию CAR можно модифицировать с сохранением по меньшей мере приблизительно 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичности исходной конструкции CAR.
Трансмембранный домен
Касательно трансмембранного домена в различных вариантах осуществления CAR можно конструировать таким образом, чтобы он содержал трансмембранный домен, который является связанным с внеклеточным доменом CAR. Трансмембранный домен может содержать одну или более дополнительных аминокислот, смежных с трансмембранной областью, например, одну или более аминокислот, ассоциированных с внеклеточной областью белка, из которого получали трансмембранный домен (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 до 15 аминокислот внеклеточной области) и/или одну или более дополнительных аминокислот, ассоциированных с внутриклеточной областью белка, из которого получали трансмембранный белок (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 до 15 аминокислот внутриклеточной области). В одном из аспектов трансмембранный домен представляет собой трансмембранный домен, который является связанным с одним из других доменов используемого CAR. В некоторых случаях трансмембранный домен можно выбирать или модифицировать заменой аминокислоты для устранения связывания таких доменов с трансмембранным доменом тех же или отличных белков мембранной поверхности, например, для сведения к минимуму взаимодействий с другими участниками рецепторного комплекса. В одном из аспектов трансмембранный домен может подвергаться гомодимеризации с другим CAR на экспрессирующей CAR клетке, например, CART-клетке, клеточной поверхности. В другом аспекте аминокислотную последовательность трансмембранного домена можно модифицировать или замещать таким образом, чтобы сводить к минимуму взаимодействия со связывающими доменами нативного партнера по связыванию, содержащегося в той же экспрессирующей CAR клетке, например, CART-клетке.
Трансмембранный домен можно получать из природного или рекомбинантного источника. В случае, когда источник является природным, домен можно получать из любого мембраносвязанного или трансмембранного белка. В одном из аспектов трансмембранный домен способен передавать сигнал во внутриклеточный домен(ы), когда CAR связался с мишенью. Трансмембранный домен конкретного использования в настоящем изобретении может содержать по меньшей мере трансмембранную область(и), например, альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8 (например, CD8 альфа, CD8 бета), CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154. В некоторых вариантах осуществления трансмембранный домен может содержать по меньшей мере трансмембранную область(и), например, KIRDS2, OX40, CD2, CD27, LFA-1 (CD11a, CD18), ICOS (CD278), 4-1BB (CD137), GITR, CD40, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, IL2R бета, IL2R гамма, IL7Rα, ITGA1, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, TNFR2, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, PAG/Cbp, NKG2D, NKG2C и CD19.
В некоторых случаях трансмембранный домен может являться связанным с внеклеточной областью CAR, например, антигенсвязывающим доменом CAR через шарнир, например, шарнир из белка человека. Например, в одном из вариантов осуществления шарнир может представлять собой шарнир Ig (иммуноглобулина) человека, например, шарнир IgG4 или шарнир CD8a. В одном из вариантов осуществления шарнир или спейсер содержит (например, состоит из) аминокислотную последовательность SEQ ID NO: 2. В одном из аспектов трансмембранный домен содержит (например, состоит из) трансмембранный домен SEQ ID NO: 6.
В одном из аспектов шарнир или спейсер содержит шарнир IgG4. Например, в одном из вариантов осуществления шарнир или спейсер содержит шарнир аминокислотной последовательности ESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKM (SEQ ID NO: 3). В некоторых вариантах осуществления шарнир или спейсер содержит шарнир, кодируемый нуклеотидной последовательностью GAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATG (SEQ ID NO: 14).
В одном из аспектов шарнир или спейсер содержит шарнир IgD. Например, в одном из вариантов осуществления шарнир или спейсер содержит шарнир аминокислотной последовательности RWPESPKAQASSVPTAQPQAEGSLAKATTAPATTRNTGRGGEEKKKEKEKEEQEERETKTPECPSHTQPLGVYLLTPAVQDLWLRDKATFTCFVVGSDLKDAHLTWEVAGKVPTGGVEEGLLERHSNGSQSQHSRLTLPRSLWNAGTSVTCTLNHPSLPPQRLMALREPAAQAPVKLSLNLLASSDPPEAASWLLCEVSGFSPPNILLMWLEDQREVNTSGFAPARPPPQPGSTTFWAWSVLRVPAPPSPQPATYTCVVSHEDSRTLLNASRSLEVSYVTDH (SEQ ID NO: 4). В некоторых вариантах осуществления шарнир или спейсер содержит шарнир, кодируемый нуклеотидной последовательностью AGGTGGCCCGAAAGTCCCAAGGCCCAGGCATCTAGTGTTCCTACTGCACAGCCCCAGGCAGAAGGCAGCCTAGCCAAAGCTACTACTGCACCTGCCACTACGCGCAATACTGGCCGTGGCGGGGAGGAGAAGAAAAAGGAGAAAGAGAAAGAAGAACAGGAAGAGAGGGAGACCAAGACCCCTGAATGTCCATCCCATACCCAGCCGCTGGGCGTCTATCTCTTGACTCCCGCAGTACAGGACTTGTGGCTTAGAGATAAGGCCACCTTTACATGTTTCGTCGTGGGCTCTGACCTGAAGGATGCCCATTTGACTTGGGAGGTTGCCGGAAAGGTACCCACAGGGGGGGTTGAGGAAGGGTTGCTGGAGCGCCATTCCAATGGCTCTCAGAGCCAGCACTCAAGACTCACCCTTCCGAGATCCCTGTGGAACGCCGGGACCTCTGTCACATGTACTCTAAATCATCCTAGCCTGCCCCCACAGCGTCTGATGGCCCTTAGAGAGCCAGCCGCCCAGGCACCAGTTAAGCTTAGCCTGAATCTGCTCGCCAGTAGTGATCCCCCAGAGGCCGCCAGCTGGCTCTTATGCGAAGTGTCCGGCTTTAGCCCGCCCAACATCTTGCTCATGTGGCTGGAGGACCAGCGAGAAGTGAACACCAGCGGCTTCGCTCCAGCCCGGCCCCCACCCCAGCCGGGTTCTACCACATTCTGGGCCTGGAGTGTCTTAAGGGTCCCAGCACCACCTAGCCCCCAGCCAGCCACATACACCTGTGTTGTGTCCCATGAAGATAGCAGGACCCTGCTAAATGCTTCTAGGAGTCTGGAGGTTTCCTACGTGACTGACCATT (SEQ ID NO: 15).
В одном из аспектов трансмембранный домен может являться рекомбинантным, в случае чего он содержит преимущественно гидрофобные остатки, такие как лейцин и валин. В одном из аспектов триплет фенилаланина, триптофана и валина можно найти на каждом конце рекомбинантного трансмембранного домена.
Необязательно короткий олиго- или полипептидный линкер длиной от 2 до 10 аминокислот может образовывать связь между трансмембранным доменом и цитоплазматической областью CAR. Дублет глицин-серин обеспечивает особенно подходящий линкер. Например, в одном из аспектов линкер содержит аминокислотную последовательность GGGGSGGGGS (SEQ ID NO: 5). В некоторых вариантах осуществления линкер кодируется нуклеотидной последовательностью GGTGGCGGAGGTTCTGGAGGTGGAGGTTCC (SEQ ID NO: 16).
В одном из аспектов шарнир или спейсер содержит шарнир KIR2DS2.
Цитоплазматический домен
Цитоплазматический домен или цитоплазматическая область настоящего CAR содержит внутриклеточный сигнальный домен. Внутриклеточный сигнальный домен может активировать по меньшей мере одну из нормальных эффекторных функций иммунной клетки, в которую ввели CAR.
Примеры внутриклеточных сигнальных доменов для применения в CAR по изобретению включают цитоплазматические последовательности T-клеточного рецептора (TCR) и корецепторов, которые действуют совместно для инициации передачи сигнала после задействования антигенного рецептора, а также любое производное или вариант этих последовательностей и любую рекомбинантную последовательность, которая обладает такой же функциональной способностью.
Известно, что сигналы, генерируемые только TCR, являются недостаточными для полной активации T-клетки, и что также необходимым является вторичный и/или костимулирующий сигнал. Таким образом, можно сказать, что активация T-клеток опосредована двумя отдельными классами цитоплазматических сигнальных последовательностей: цитоплазматическими сигнальными последовательностями, которые инициируют антигензависимую первичную активацию через TCR (первичные внутриклеточные сигнальные домены), и цитоплазматическими сигнальными последовательностями, которые действуют антигензависимым образом для обеспечения вторичного или костимулирующего сигнала (вторичный цитоплазматический домен, например, костимулирующий домен).
Первичный сигнальный домен регулирует первичную активацию комплекса TCR по стимулирующему пути или по ингибирующему пути. Первичные внутриклеточные сигнальные домены, которые действуют стимулирующим образом, могут содержать сигнальные мотивы, которые известны как иммунорецепторные тирозиновые активирующие мотивы или ITAM.
Примеры ITAM, содержащего первичные внутриклеточные сигнальные домены, которые находят конкретное применение в изобретении, включают ITAM TCR- дзета, FcR-гамма, FcR-бета, CD3 гамма, CD3 дельта, CD3 эпсилон, CD5, CD22, CD79a, CD79b, CD278 (также известный как "ICOS"), FcεRI, DAP10, DAP12 и CD66d. В одном из вариантов осуществления CAR по изобретению содержит внутриклеточный сигнальный домен, например, первичный сигнальный домен CD3-дзета.
В одном из вариантов осуществления первичный сигнальный домен содержит модифицированный домен ITAM, например, мутантный домен ITAM, который обладает измененной (например, повышенной или сниженной) активностью по сравнению с нативным доменом ITAM. В одном из вариантов осуществления первичный сигнальный домен содержит модифицированный содержащий ITAM первичный внутриклеточный сигнальный домен, например, оптимизированный и/или усеченный ITAM-содержащий первичный внутриклеточный сигнальный домен. В одном из вариантов осуществления первичный сигнальный домен содержит один, два, три, четыре или более мотивов ITAM.
Дополнительные примеры молекул, содержащих первичный внутриклеточный сигнальный домен, которые находят конкретное применение в изобретении, включают молекулы DAP10, DAP12 и CD32.
Внутриклеточный сигнальный домен CAR может содержать первичный сигнальный домен, например, сигнальный домен CD3-дзета, сам по себе, или его можно комбинировать с любым другим желаемым внутриклеточный сигнальным доменом(ами), пригодным в отношении CAR по изобретению. Например, внутриклеточный сигнальный домен CAR может содержать первичный сигнальный домен, например, участок CD3-дзета-цепи и костимулирующий сигнальный домен. Костимулирующий сигнальный домен относится к участку CAR, содержащему внутриклеточный домен костимулирующей молекулы. Костимулирующая молекула представляет собой молекулу клеточной поверхности, отличную от антигенного рецептора или ее лиганды, которая является необходимой для эффективного ответа лимфоцитов на антиген. Примеры таких молекул включают молекулу MHC I класса, TNF-рецепторные белки, иммуноглобулиноподобные белки, цитокиновые рецепторы, интегрины, сигнальные молекулы, активирующие лимфоциты (белки SLAM), активирующие рецепторы NK-клетки, BTLA, Toll-подобный рецептор, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганд, который специфически связывается с CD83. Например, было продемонстрировано, что костимуляция CD27 увеличивает размножение, эффекторную функцию и выживаемость CART-клеток человека in vitro и повышает устойчивость T-клеток человека и противоопухолевую активность in vivo (Song et al., Blood. 2012; 119(3):696-706).
Внутриклеточные сигнальные последовательности в цитоплазматическом участке CAR по изобретению могут являться связанными друг с другом в случайном или определенном порядке. Необязательно, короткий олиго- или полипептидный линкер, например, длиной от 2 до 10 аминокислот (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот) может образовывать связь с внутриклеточной сигнальной последовательностью. В одном из вариантов осуществления в качестве подходящего линкера можно использовать дублет глицин-серин. В одном из вариантов осуществления в качестве подходящего линкера можно использовать одну аминокислоту, например, аланин, глицин.
В одном из аспектов внутриклеточный сигнальный домен конструируют так, чтобы он содержал два или более, например, 2, 3, 4, 5 или более, костимулирующих сигнальных домена. В одном из вариантов осуществления два или более, например, 2, 3, 4, 5 или более костимулирующих сигнальных домена разделены линкерной молекулой, например, линкерной молекулой, описываемой в настоящем описании. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит два костимулирующих сигнальных домена. В некоторых вариантах осуществления линкер молекула представляет собой остаток глицина. В некоторых вариантах осуществления линкер представляет собой остаток аланина.
В одном из аспектов внутриклеточный сигнальный домен конструируют так, чтобы он содержал сигнальный домен CD3-дзета и сигнальный домен CD28. В одном из аспектов внутриклеточный сигнальный домен конструируют так, чтобы он содержал сигнальный домен CD3-дзета и сигнальный домен 4-1BB. В одном из аспектов сигнальный домен 4-1BB представляет собой сигнальный домен SEQ ID NO: 7. В одном из аспектов сигнальный домен CD3-дзета представляет собой сигнальный домен SEQ ID NO: 9 (мутантный CD3-дзета) или SEQ ID NO: 10 (CD3-дзета человека дикого типа).
В одном из аспектов внутриклеточный сигнальный домен конструируют так, чтобы он содержал сигнальный домен CD3-дзета и сигнальный домен CD27. В одном из аспектов сигнальный домен CD27 содержит аминокислотную последовательность QRRKYRSNKGESPVEPAEPCRYSCPREEEGSTIPIQEDYRKPEPACSP (SEQ ID NO: 8). В одном из аспектов сигнальный домен CD27 кодируется последовательностью нуклеиновой кислоты AGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCC (SEQ ID NO: 19).
В одном из аспектов сигнальный домен CD27 содержит аминокислотную последовательность QRRKYRSNKGESPVEPAEPCRYSCPREEEGSTIPIQEDYRKPEPACSP (SEQ ID NO: 8).
В одном из аспектов сигнальный домен CD27 кодируется последовательностью нуклеиновой кислоты AGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCC (SEQ ID NO: 19).
В одном из аспектов внутриклеточный домен конструируют так, чтобы он содержал сигнальный домен CD3-дзета и сигнальный домен CD28. В одном из аспектов сигнальный домен CD28 содержит аминокислотную последовательность SEQ ID NO: 379. В одном из аспектов сигнальный домен CD28 кодируется последовательностью нуклеиновой кислоты SEQ ID NO: 380.
В одном из аспектов внутриклеточный домен конструируют так, чтобы он содержал сигнальный домен CD3-дзета и сигнальный домен ICOS. В одном из аспектов сигнальный домен CD28 содержит аминокислотную последовательность SEQ ID NO: 381. В одном из аспектов сигнальный домен ICOS кодируется последовательностью нуклеиновой кислоты SEQ ID NO: 382.
В одном из аспектов экспрессирующая CAR клетка, описываемая в настоящем описании, может дополнительно содержать второй CAR, например, второй CAR, который содержит другой антигенсвязывающий домен, например, к той же мишени (CD123) или к другой мишени (например, CD19, CD33, CLL-1, CD34, FLT3 или рецептор фолата бета). В одном из вариантов осуществления второй CAR содержит антигенсвязывающий домен к мишени, экспрессируемой на клетках острого миелолейкоза, такой как, например, CD19, CD33, CLL-1, CD34, FLT3 или рецептор фолата бета. В одном из вариантов осуществления экспрессирующая CAR клетка содержит первый CAR, который направлен на первый антиген и содержит внутриклеточный сигнальный домен, содержащий костимулирующий сигнальный домен, но не первичный сигнальный домен, и второй CAR, который направлен на второй отличный антиген и содержит внутриклеточный сигнальный домен, содержащий первичный сигнальный домен, но не костимулирующий сигнальный домен. Без желания быть связанными теорией, размещение костимулирующего сигнального домена, например, 4-1BB, CD28, CD27, ICOS или OX-40 в первом CAR и первичного сигнального домена, например, CD3-дзета во втором CAR может ограничивать активность CAR по отношению к клеткам, в которых экспрессируются обе мишени. В одном из вариантов осуществления экспрессирующая CAR клетка содержит первый CD123 CAR, который содержит CD123-связывающий домен, трансмембранный домен и костимулирующий домен, и второй CAR, который направлен на антиген отличный от CD123 (например, антиген, экспрессируемый клетками AML, например, CD19, CD33, CLL-1, CD34, FLT3 или рецептор фолата бета) и содержит антигенсвязывающий домен, трансмембранный домен и первичный сигнальный домен. В другом варианте осуществления экспрессирующая CAR клетка содержит первый CD123 CAR, который содержит CD123-связывающий домен, трансмембранный домен и первичный сигнальный домен, и второй CAR, который направлен на антиген, отличный от CD123 (например, антиген, экспрессируемый клетками AML, например, CD19, CD33, CLL-1, CD34, FLT3 или рецептор фолата бета) и содержит антигенсвязывающий домен к антигену, трансмембранный домен и костимулирующий сигнальный домен.
В одном из вариантов осуществления экспрессирующая CAR клетка содержит CD123 CAR, описываемый в настоящем описании, и ингибирующий CAR. В одном из вариантов осуществления ингибирующий CAR содержит антигенсвязывающий домен, который связывает антиген, встречающийся в нормальных клетках, но не в злокачественных клетках, например, нормальных клетках, которые также экспрессируют CD123. В одном из вариантов осуществления ингибирующий CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен ингибирующей молекулы. Например, внутриклеточный домен ингибирующего CAR может представлять собой внутриклеточный домен PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозин и TGFR (например, TGFR бета).
В одном из вариантов осуществления, где экспрессирующая CAR клетка содержит два или более различных CAR, антигенсвязывающие домены различных CAR могут являться такими, что антигенсвязывающие домены не взаимодействуют друг с другом. Например, клетка, экспрессирующая первый и втор CAR, может содержать антигенсвязывающий домен первого CAR, например, в виде фрагмента, например, scFv, который не образует ассоциации с антигенсвязывающим доменом второго CAR, например, антигенсвязывающий домен второго CAR представляет собой VHH.
В некоторых вариантах осуществления антигенсвязывающий домен содержит однодоменные связывающие антиген (SDAB) молекулы, включая молекулы, определяющие комплементарность области которых являются частью однодоменного полипептида. Примеры включают, но не ограничиваются ими, вариабельный домены тяжелых цепей, связывавшие молекулы естественным образом, не содержащие легкие цепи, одиночные домены, получаемые из общепринятых 4-цепочечных антител, конструируемые домены и однодоменные каркасы, отличные от тех, которые получают из антител. Молекулы SDAB могу принадлежать любому уровню техники или могут представлять собой любые однодоменные молекулы, которые откроют в будущем. Молекулы SDAB можно получать от любого вида, включая, но, не ограничиваясь ими мышь, человека, верблюда, ламу, миногу, рыбу, акулу, козу, кролика и жвачное животное. Этот термин также включает молекулы природных однодоменных антител от видов, отличных от Camelidae и акул.
В одном из аспектов молекулу SDAB можно получать из вариабельной области иммуноглобулина, встречающегося у рыб, такой как, например, вариабельная область, которую получают из изотипа иммуноглобулина, известного как новый антигенный рецептор (NAR), встречающийся в сыворотке акулы. Способы получения однодоменных молекул, получаемых из вариабельной области NAR ("IgNAR"), описаны в WO 03/014161 и у Streltsov, (2005) Protein Sci., 14:2901-2909.
По другому аспекту молекула SDAB представляет собой природную однодоменную связывающую антиген молекулу, известную как тяжелая цепь, лишенная легких цепей. Такие однодоменные молекулы описаны, например, в WO 9404678 и у Hamers-Casterman C. et al., (1993) Nature, 363:446-448. Для ясности, такой вариабельный домен, получаемый из молекулы тяжелой цепи, естественным образом не содержащей легкой цепи, в настоящем описании обозначают как VHH или нанотело для отличия его от общепринятой VH четырехцепочечных иммуноглобулинов. Такую молекулу VHH можно получать от видов Camelidae, например, у верблюда, ламы, дромадера, альпаки и гуанако. Наряду с Camelidae у других видов могут образовываться молекулы с тяжелой цепь, естественным образом не содержащие легкой цепи; таким образом, VHH входит в объем изобретения.
Молекулы SDAB могут являться рекомбинантными, с трансплантированной CDR, гуманизированные, камелизированные, лишенные иммуногенных свойств и/или получаемые in vitro (например, отобранные посредством фагового дисплея).
Также было сделано открытие, что клетки, содержащие совокупность химерных погруженных в мембрану рецепторов, содержащих антигенсвязывающий домен, который взаимодействует с антигенсвязывающим доменом рецепторов, могут являться нежелательными, например, вследствие того, то он ингибирует способность одного или более антигенсвязывающих доменов связывать свой когнатный антиген. Таким образом, в настоящем описании описаны клетки, содержащие первый и второй неприродный химерный погруженный в мембрану рецептор, содержащий антигенсвязывающие домены, которые сводят к минимуму такие взаимодействия. Также в настоящем описании описаны нуклеиновые кислоты, кодирующие первый и второй неприродный химерный погруженный в мембрану рецептор, содержащий антигенсвязывающие домены, которые сводят к минимуму такие взаимодействия, а также способы получения и использования таких клеток и нуклеиновых кислот. В одном из вариантов осуществления антигенсвязывающий домен одного из указанного первого, указанного второго неприродного химерного погруженного в мембрану рецептора, содержит scFv, а другой содержит один домен VH, например, один домен VH верблюда, акулы или миноги, или один домен VH, получаемый из последовательности человека или мыши.
В некоторых вариантах осуществления описываемое в заявке изобретение содержит первый и второй CAR, где антигенсвязывающий домен одного из указанного первого CAR, указанного второго CAR не содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи. В некоторых вариантах осуществления антигенсвязывающий домен одного из указанного первого CAR, указанного второго CAR представляет собой scFv, а другой не является scFv. В некоторых вариантах осуществления антигенсвязывающий домен одного из указанного первого CAR, указанного второго CAR содержит один домен VH, например, один домен VH верблюда, акулы или миноги, или один домен VH, получаемый из последовательности человека или мыши. В некоторых вариантах осуществления антигенсвязывающий домен одного из указанного первого CAR, указанного второго CAR содержит нанотело. В некоторых вариантах осуществления антигенсвязывающий домен одного из указанного первого CAR, указанного второго CAR содержит домен VHH верблюда.
В некоторых вариантах осуществления антигенсвязывающий домен одного из указанного первого CAR, указанного второго CAR содержит scFv, а другой содержит один домен VH, например, один домен VH верблюда, акулы или миноги, или один домен VH, получаемый из последовательности человека или мыши. В некоторых вариантах осуществления антигенсвязывающий домен одного из указанного первого CAR, указанного второго CAR содержит scFv, а другой содержит нанотело. В некоторых вариантах осуществления антигенсвязывающий домен одного из указанного первого CAR, указанного второго CAR содержит scFv, а другой содержит домен VHH верблюда.
В некоторых вариантах осуществления в случае присутствия на поверхности клетки связывание антигенсвязывающего домена указанным первым CAR со своим когнатным антигеном по существу не снижается в результате присутствия указанного второго CAR. В некоторых вариантах осуществления связывание антигенсвязывающего домена указанного первого CAR со своим когнатным антигеном в присутствии указанного второго CAR составляет 85%, 90%, 95%, 96%, 97%, 98% или 99% от связывания антигенсвязывающего домена указанного первого CAR со своим когнатным антигеном в отсутствие указанного второго CAR.
В некоторых вариантах осуществления в случае присутствия на поверхности клетки, антигенсвязывающие домены указанного первого CAR, указанного второго CAR ассоциируют друг с другом меньше, если они представляли собой антигенсвязывающие домены scFv. В некоторых вариантах осуществления антигенсвязывающие домены указанного первого CAR, указанного второго CAR ассоциируют друг с другом на 85%, 90%, 95%, 96%, 97%, 98% или 99% меньше, если оба представляли собой антигенсвязывающие домены scFv.
В другом аспекте экспрессирующая CAR клетка, описываемая в настоящем описании, может дополнительно экспрессировать другой антиген, например, средство, которое усиливает активность экспрессирующей CAR клетки. Например, в одном из вариантов осуществления средство может представлять собой средство, которое ингибирует ингибирующую молекулу. Ингибирующие молекулы, например, PD1, в некоторых вариантах осуществления могут снижать способность экспрессирующей CAR клетки развивать ответ иммунного эффектора. Примеры ингибирующих молекул включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозин и TGFR (например, TGFR бета). В одном из вариантов осуществления средство, которое ингибирует ингибирующую молекулу, например, представляет собой молекулу, описываемую в настоящем описании, например, средство, которое содержит первый полипептид, например, ингибирующую молекулу, связанную со вторым полипептидом, который передает положительный сигнал в клетку, например, внутриклеточный сигнальный домен, описываемый в настоящем описании. В одном из вариантов осуществления средство содержит первый полипептид, например, ингибирующей молекулы, такой как PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозин и TGFR (например, TGFR бета), или фрагмент любого из них (например, по меньшей мере участок внеклеточного домена любого из них), и второй полипептид, который является внутриклеточным сигнальным доменом, описываемым в настоящем описании (например, содержащим костимулирующий домен (например, 41BB, CD27 или CD28, например, как описано в настоящем описании), и/или первичный сигнальный домен (например, сигнальный домен CD3-дзета, описываемый в настоящем описании). В одном из вариантов осуществления средство содержит первый полипептид PD1 или его фрагмент (например, по меньшей мере часть внеклеточного домена PD1), и второй полипептид внутриклеточного сигнального домена, описываемого в настоящем описании (например, сигнальный домен CD28, описываемый в настоящем описании и/или сигнальный домен CD3-дзета, описываемый в настоящем описании). В вариантах осуществления экспрессирующая CAR клетка, описываемая в настоящем описании, содержит переключающий костимулирующий рецептор, например, как описано в WO 2013/019615, полностью включенной в настоящее описание посредством ссылки. PD1 представляет собой ингибирующий представитель семейства CD28 рецепторов, которое также включает CD28, CTLA-4, ICOS и BTLA. PD-1 экспрессируется активированными B-клетками, T-клетками и миелоидными клетками (Agata et al., 1996 Int. Immunol., 8:765-75). Было продемонстрировано, что два лиганда к PD1, PD-L1 и PD-L2 подавляют активацию T-клеток при связывании с PD1 (Freeman et al., 2000 J. Exp. Med., 192:1027-34; Latchman et al., 2001 Nat. Immunol., 2:261-8; Carter et al., 2002 Eur. J. Immunol., 32:634-43). PD-L1 содержится в большом количестве в злокачественных опухолях человека (Dong et al., 2003 J. Mol. Med., 81:281-7; Blank et al., 2005 Cancer Immunol. Immunother., 54:307-314; Konishi et al., 2004 Clin. Cancer Res., 10:5094). Подавление иммунитета можно отменять ингибированием локального взаимодействия PD1 с PD-L1.
В одном из вариантов осуществления средство содержит внеклеточный домен (ECD) ингибирующей молекулы, например, Programmed Death 1 (PD1), можно сливать с трансмембранным доменом и внутриклеточными сигнальными доменами, такими как 41BB и CD3-дзета (также обозначаемый в настоящем описании как PD1 CAR). В одном из вариантов осуществления PD1 CAR при использовании в комбинациях с CD123 CAR, описываемыми в настоящем описании, улучшает устойчивость экспрессирующей CAR клетки, например, T-клетки или NK-клетки. В одном из вариантов осуществления CAR представляет собой PD1 CAR, содержащий внеклеточный домен PD1, указанный в виде подчеркивания в SEQ ID NO: 24. В одном из вариантов осуществления PD1 CAR содержит аминокислотную последовательность SEQ ID NO: 24.
Malpvtalllplalllhaarppgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvtttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr (SEQ ID NO: 24).
В одном из вариантов осуществления PD1 CAR содержит аминокислотную последовательность, предоставленную ниже (SEQ ID NO: 22).
pgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvtttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr (SEQ ID NO: 22).
В одном из вариантов осуществления средство содержит последовательность нуклеиновой кислоты, кодирующую PD1 CAR, например, PD1 CAR, описываемый в настоящем описании. В одном из вариантов осуществления последовательность нуклеиновой кислоты PD1 CAR представлена ниже с подчеркнутым ECD PD1 ниже в SEQ ID NO: 23
atggccctccctgtcactgccctgcttctccccctcgcactcctgctccacgccgctagaccacccggatggtttctggactctccggatcgcccgtggaatcccccaaccttctcaccggcactcttggttgtgactgagggcgataatgcgaccttcacgtgctcgttctccaacacctccgaatcattcgtgctgaactggtaccgcatgagcccgtcaaaccagaccgacaagctcgccgcgtttccggaagatcggtcgcaaccgggacaggattgtcggttccgcgtgactcaactgccgaatggcagagacttccacatgagcgtggtccgcgctaggcgaaacgactccgggacctacctgtgcggagccatctcgctggcgcctaaggcccaaatcaaagagagcttgagggccgaactgagagtgaccgagcgcagagctgaggtgccaactgcacatccatccccatcgcctcggcctgcggggcagtttcagaccctggtcacgaccactccggcgccgcgcccaccgactccggccccaactatcgcgagccagcccctgtcgctgaggccggaagcatgccgccctgccgccggaggtgctgtgcatacccggggattggacttcgcatgcgacatctacatttgggctcctctcgccggaacttgtggcgtgctccttctgtccctggtcatcaccctgtactgcaagcggggtcggaaaaagcttctgtacattttcaagcagcccttcatgaggcccgtgcaaaccacccaggaggaggacggttgctcctgccggttccccgaagaggaagaaggaggttgcgagctgcgcgtgaagttctcccggagcgccgacgcccccgcctataagcagggccagaaccagctgtacaacgaactgaacctgggacggcgggaagagtacgatgtgctggacaagcggcgcggccgggaccccgaaatgggcgggaagcctagaagaaagaaccctcaggaaggcctgtataacgagctgcagaaggacaagatggccgaggcctactccgaaattgggatgaagggagagcggcggaggggaaaggggcacgacggcctgtaccaaggactgtccaccgccaccaaggacacatacgatgccctgcacatgcaggcccttccccctcgc (SEQ ID NO: 23).
В другом аспекте настоящее изобретение относится к популяции экспрессирующих CAR клеток, например, CART-клеток или экспрессирующих CAR NK-клеток. В некоторых вариантах осуществления популяция экспрессирующих CAR клеток содержит смесь клеток, экспрессирующих различные CAR. Например, в одном из вариантов осуществления популяция экспрессирующих CAR клеток (например, CART-клеток или экспрессирующих CAR NK-клеток) может содержать первую клетку, экспрессирующую CAR с CD123-связывающем доменом, описываемым в настоящем описании, и вторую клетку, экспрессирующую CAR с другим CD123-связывающим доменом, например, CD123-связывающим доменом, описываемый в настоящем описании, который отличается от CD123-связывающего домена в CAR, экспрессируемым первой клеткой. В качестве другого примера, популяция экспрессирующих CAR клеток может содержать первую клетку, экспрессирующую CAR, который содержит CD123-связывающий домен, например, как описано в настоящем описании, и вторую клетку, экспрессирующую CAR, который содержит антигенсвязывающий домен к мишени, отличной от CD123 (например, CD33, CD34, CLL-1, FLT3 или рецептору фолата бета). В одном из вариантов осуществления популяция экспрессирующих CAR клеток содержит, например, первую клетку, экспрессирующую CAR, который содержит первичный внутриклеточный сигнальный домен, и вторую клетку, экспрессирующую CAR, который содержит вторичный сигнальный домен, например, костимулирующий сигнальный домен.
В другом аспекте настоящее изобретение относится к популяция клеток, где по меньшей мере одна клетка в популяции экспрессирует CAR, содержащий домен CD123, описываемый в настоящем описании, а вторая клетка, экспрессирует другой антиген, например, средство, которое усиливает активность экспрессирующей CAR клетки. Например, в одном из вариантов осуществления средство может представлять собой средство, которое ингибирует ингибирующую молекулу. Ингибирующие молекулы, например, в некоторых вариантах осуществления могут снижать способность экспрессирующей CAR клетки повышать ответ иммунного эффектора. Примеры ингибирующих молекул включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозин и TGFR (например, TGFR бета). В одном из вариантов осуществления средство, которое ингибирует ингибирующую молекулу, например, представляет собой молекулу, описываемую в настоящем описании, например, средство, которое содержит первый полипептид, например, ингибирующую молекулу, связанную со вторым полипептидом, который передает положительный сигнал в клетку, например, внутриклеточный сигнальный домен, описываемый в настоящем описании. В одном из вариантов осуществления средство содержит первый полипептид, например, ингибирующей молекулы, такой как PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозин и TGFR (например, TGFR бета) или фрагмент любого из них эти (например, по меньшей мере участок внеклеточного домена любого из них), и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описываемый в настоящем описании (например, содержащий костимулирующий домен (например, 41BB, CD27 или CD28, например, как описано в настоящем описании) и/или первичный сигнальный домен (например, сигнальный домен CD3-дзета, описываемый в настоящем описании). В одном из вариантов осуществления средство содержит первый полипептид PD1 или его фрагмент (например, по меньшей мере участок внеклеточного домена PD1), и второй полипептид внутриклеточного сигнального домена, описываемого в настоящем описании (например, сигнальный домен CD28, описываемый в настоящем описании, и/или сигнальный домен CD3-дзета, описываемый в настоящем описании).
В одном из аспектов настоящее изобретение относится к способам, предусматривающим введение популяции экспрессирующих CAR клеток, например, CART-клеток или экспрессирующих CAR NK-клеток, например, смеси клеток, экспрессирующих различные CAR, в комбинации с другим антигеном, например, ингибитором киназы, таким как ингибитор киназы, описываемый в настоящем описании. В другом аспекте настоящее изобретение относится к способам, предусматривающим введение популяции клеток, где по меньшей мере одна клетка в популяции экспрессирует CAR, содержащий связанный с антителом против злокачественной опухоли антигенсвязывающий домен, как описано в настоящем описании, и вторая клетка экспрессирует другой антиген, например, средство, которое усиливает активность экспрессирующей CAR клетки, в комбинации с другим антигеном, например, ингибитором киназы, таким как ингибитор киназы, описываемый в настоящем описании.
CAR рецепторов (NKR) естественных киллерных клеток
В одном из вариантов осуществления молекула CAR, описываемая в настоящем описании, содержит один или более компонентов рецептора естественной киллерой клетки (NKR), таким образом, образуя NKR-CAR. Компонент NKR может представлять собой трансмембранный домен, шарнирный домен или цитоплазматический домен из любого из следующих ниже рецепторов естественных киллерных клеток: иммуноглобулиноподобный рецептор киллерной клетки (KIR), например, KIR2DL1, KIR2DL2/L3, KIR2DL4, KIR2DL5A, KIR2DL5B, KIR2DS1, KIR2DS2, KIR2DS3, KIR2DS4, DIR2DS5, KIR3DL1/S1, KIR3DL2, KIR3DL3, KIR2DP1 и KIR3DP1; естественный цитотоксический рецептор (NCR), например, NKp30, NKp44, NKp46; семейство сигнальных молекул, активирующих лимфоциты (SLAM), рецепторов иммунных клеток, например, CD48, CD229, 2B4, CD84, NTB-A, CRACC, BLAME и CD2F-10; Fc-рецептор (FcR), например, CD16 и CD64, и рецепторы Ly49, например, LY49A, LY49C. Молекулы NKR-CAR, описываемые в настоящем описании, могут взаимодействовать с адапторной молекулой или внутриклеточным сигнальным доменом, например, DAP12. Иллюстративные конфигурации и последовательности молекул CAR, содержащих компоненты NKR, описаны в международной публикации № WO2014/145252, содержание которой, таким образом, включено посредством ссылки.
Расщепленный CAR
В некоторых вариантах осуществления в экспрессирующей CAR клетке используют расщепленный CAR. Подход расщепленного CAR более подробно описан в публикациях WO2014/055442 и WO2014/055657, включенных в настоящее описание посредством ссылки. В кратком изложении, система расщепленного CAR содержит клетку, экспрессирующую первый CAR, содержащий первый антигенсвязывающий домен и костимулирующий домен (например, 41BB), и клетка также экспрессирует второй CAR, содержащий второй антигенсвязывающий домен и внутриклеточный сигнальный домен (например, CD3-дзета). Когда клетка сталкивается с первым антигеном, костимулирующий домен активируется, и клетка пролиферирует. Когда клетка сталкивается со вторым антигеном, внутриклеточный сигнальный домен активируется, и начинает проявляться цитолитическое действие. Таким образом, экспрессирующая CAR клетка полностью активируется только в присутствии обоих антигенов. В вариантах осуществления первый антигенсвязывающий домен распознает CD123, например, содержит антигенсвязывающий домен, описываемый в настоящем описании, а второй антигенсвязывающий домен распознает антиген, экспрессируемый в клетках миелолейкоза, например, CLL-1, CD33, CD34, FLT3 или рецепторе фолата бета. В вариантах осуществления первый антигенсвязывающий домен распознает CD123, например, содержит антигенсвязывающий домен, описываемый в настоящем описании, а второй антигенсвязывающий домен распознает антиген, экспрессируемый B-клетками, например, CD19, CD20, CD22 или ROR1.
Стратегии регуляции химерных антигенных рецепторов
Существует много путей регуляции видов активности CAR. В некоторых вариантах осуществления для оптимизации безопасности и эффективности терапии CAR желаемым является регулируемый CAR (RCAR), где активность CAR можно контролировать. Например, индуцирование апоптоза с использованием, например, каспазы, слитой с доменом димеризации (см., например, Di et al., N. Engl. J. Med., 2011 Nov. 3; 365(18):1673-1683), можно использовать в качестве безопасного переключателя в терапии CAR по настоящему изобретению. В другом примере, экспрессирующие CAR клетки также могут экспрессировать индуцибельную молекулу каспазы 9 (и-каспазу 9), которая при введении способствующего димеризации лекарственного средства (например, римидуцида (также называемого AP1903 (Bellicum Pharmaceuticals) или AP20187 (Ariad)), приводит к активации каспазы 9 и апоптозу клеток. Молекула и-каспазы 9 содержит связывающий домен химического индуктора димеризации (CID), который опосредует димеризацию в присутствии CID. Это приводит к индуцибельному и селективному истощению экспрессирующих CAR клеток. В некоторых случаях молекула и-каспаза 9 кодируется молекулой нуклеиновой кислотой, отличной от кодирующего CAR вектора(ов). В некоторых случаях молекула и-каспазы 9 кодируется той же молекулой нуклеиновой кислоты что и кодирующий вектор CAR. И-каспаза 9 может обеспечивать безопасный переключатель, устраняя любую токсичность экспрессирующих CAR клеток. См., например, Song et al., Cancer Gene Ther., 2008; 15(10):667-75; клиническое испытание там же № NCT02107963 и Di Stasi et al., N. Engl. J. Med., 2011; 365:1673-83.
Альтернативные стратегии регуляции терапии CAR по настоящему изобретению включают использование низкомолекулярных соединений или антител, которые инактивируют или выключают активность CAR, например, посредством удаления экспрессирующих CAR клеток, например, индицированием антителозависимой клеточной цитотоксичности (ADCC). Например, экспрессирующие CAR клетки, описываемые в настоящем описании, также могут экспрессировать антиген, который распознают молекулы, способные индуцировать гибель клеток, например, ADCC или индуцируемую комплементом гибель клеток. Например, экспрессирующие CAR клетки, описываемые в настоящем описании, также могут экспрессировать рецептор, на который может направленно воздействовать антитело или фрагмент антитела. Примеры таких рецепторов включают EpCAM, VEGFR, интегрины (например, интегрины ανβ3, α4, αΙ¾β3, α4β7, α5β1, ανβ3, αν), представителей суперсемейства рецепторов TNF (например, TRAIL-R1, TRAIL-R2), рецептор PDGF, рецептор интерферона, рецептор фолата, GPNMB, ICAM-1, HLA-DR, CEA, CA-125, MUC1, TAG-72, рецептор IL-6, 5T4, GD2, GD3, CD2, CD3, CD4, CD5, CD1 1, CD1 1 a/LFA-1, CD15, CD18/ITGB2, CD19, CD20, CD22, рецептор CD23/IgE, CD25, CD28, CD30, CD33, CD38, CD40, CD41, CD44, CD51, CD52, CD62L, CD74, CD80, CD125, CD147/базиджин, CD152/CTLA-4, CD154/CD40L, CD195/CCR5, CD319/SLAMF7 и EGFR, и их усеченные варианты (например, варианты, сохраняющие один или более внеклеточных эпитопов, но не содержащие одну или более областей в цитоплазматическом домене).
Например, экспрессирующая CAR клетка, описываемая в настоящем описании, также может экспрессировать усеченный рецептор эпидермального фактора роста (EGFR), который не обладает способностью передачи сигнала, но сохраняет эпитоп, который распознают молекулы, способные индуцировать ADCC, например, цетуксимаб (ERBITUX®), таким образом, введение цетуксимаба индуцирует ADCC и последующее истощение экспрессирующих CAR клеток (см., например, WO2011/056894 и Jonnalagadda et al., Gene Ther., 2013; 20(8)853-860). Другая стратегия включает экспрессию очень компактного маркера/суицидального гена, который объединяет эпитопы-мишени из антигенов CD32 и CD20 в экспрессирующих CAR клетках, описываемых в настоящем описании, который связывается с ритуксимабом, что приводит к селективному истощению экспрессирующих CAR клеток, например, посредством ADCC (см., например, Philip et al., Blood. 2014; 124(8)1277-1287). Другие способы истощения экспрессирующих CAR клеток, описываемых в настоящем описании, включают введение CAMPATH, моноклонального антитела против CD52, которое селективно связывается и направляет зрелые лимфоциты, например, экспрессирующие CAR клетки, по пути разрушения, например, посредством индукции ADCC. В других вариантах осуществления на экспрессирующую CAR клетку можно направленно воздействовать с использованием лиганда CAR, например, антиидиотипического антитела. В некоторых вариантах осуществления антиидиотипическое антитело может вызывать активность эффекторных клеток, например, активности ADCC или ADC, таким образом, снижая число экспрессирующих CAR клеток. В других вариантах осуществления CAR лиганд, например, антиидиотипическое антитело, можно связывать со средством, которое индуцирует цитолиз клетки, например, токсином, таким образом, снижая число экспрессирующих CAR клеток. Альтернативно, сами молекулы CAR можно конфигурировать таким образом, что можно регулировать активность, например, включать и выключать, как описано ниже.
В других вариантах осуществления экспрессирующая CAR клетка, описываемая в настоящем описании, также может экспрессировать белок-мишень, распознаваемый истощающим T-клетки средством. В одном из вариантов осуществления белок-мишень представляет собой CD20, и истощающее T-клетки средство представляет собой антитело против CD20, например, ритуксимаб. В таком варианте осуществления истощающее T-клетки средство вводят однократно, если желательным является снижение или элиминация экспрессирующей CAR клетки, например, для ослабления индуцированной CAR токсичностью. В других вариантах осуществления истощающее T-клетки средство представляет собой антитело против CD52, например, алемтузумаб, как описано в примерах в настоящем описании.
В других вариантах осуществления RCAR содержит набор полипептидов, как правило, два в наиболее простых вариантах осуществления, в которых компоненты стандартного CAR, описываемого в настоящем описании, например, антигенсвязывающий домен и внутриклеточный сигнальный домен, распределены на отдельных полипептидах или представителях. В некоторых вариантах осуществления набор полипептидов включает переключатель димеризации, который при наличии индуцирующей димеризацию молекулы может связывать полипептиды друг с другом, например, может связывать антигенсвязывающий домен с внутриклеточным сигнальным доменом. Дополнительное описание и иллюстративные конфигурации таких регулируемых CAR приведены в настоящем описании и в международной публикации № WO 2015/090229, полностью включенной, таким образом, посредством ссылки.
В одном из аспектов RCAR содержит два полипептида или компонента: 1) внутриклеточный сигнальный компонент, содержащий внутриклеточный сигнальный домен, например, первичный внутриклеточный сигнальный домен, описываемый в настоящем описании, и первый переключающий домен; 2) антигенсвязывающий компонент, содержащий антигенсвязывающий домен, например, который специфически связывается с опухолевым антигеном, описываемым в настоящем описании, как описано в настоящем описании, и второй переключающий домен. Необязательно, RCAR содержит трансмембранный домен, описываемый в настоящем описании. В одном из вариантов осуществления трансмембранный домен может располагаться на внутриклеточном сигнальном компоненте, на антигенсвязывающем компоненте или на обоих. (Если не указано иное, когда компоненты или элементы RCAR описывают в настоящем описании, порядок может быть таким, как предоставлено, но другие виды порядка также включены. Другими словами, в одном из вариантов осуществления порядок является таким, как указано в тексте, но в других вариантах осуществления порядок может отличаться. Например, порядок элементов на одной стороне трансмембранной области может отличаться от примера, например, расположение переключающего домена относительно внутриклеточного сигнального домена может отличаться, например, являться обратным).
В одном из вариантов осуществления первый и второй переключающие домены могут образовывать внутриклеточный или внеклеточный переключатель димеризации. В одном из вариантов осуществления переключатель димеризации может представлять собой переключатель гомодимеризации, например, когда первый и второй переключающий домен являются одинаковыми, или переключатель гетеродимеризации, например, когда первый и второй переключающий домен отличаются друг от друга.
В вариантах осуществления RCAR может содержать "множественный переключатель". Множественный переключатель может содержать переключающие домены гетеродимеризации или переключающие домены гомодимеризации. Множественный переключатель содержит совокупность, например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 переключающих доменов, независимо от первого компонента, например, антигенсвязывающего компонента, и второго компонента, например, внутриклеточного сигнального компонента. В одном из вариантов осуществления первый компонент может содержать совокупность первых переключающих доменов, например, переключающих доменов на основе FKBP, а второй компонент может содержать совокупность вторых переключающих доменов, например, переключающих доменов на основе FRB. В одном из вариантов осуществления первый компонент может содержать первый и второй переключающий домен, например, переключающий домен на основе FKBP и переключающий домен на основе FRB, а второй компонент может содержать первый и второй переключающий домен, например, переключающий домен на основе FKBP и переключающий домен на основе FRB.
В одном из вариантов осуществления внутриклеточный сигнальный компонент содержит один или более внутриклеточных сигнальных доменов, например, первичный внутриклеточный сигнальный домен и один или более костимулирующих сигнальных доменов.
В одном из вариантов осуществления антигенсвязывающий компонент может содержать один или более внутриклеточных сигнальных доменов, например, один или более костимулирующих сигнальных доменов. В одном из вариантов осуществления антигенсвязывающий компонент содержит совокупность, например, 2 или 3 костимулирующих сигнальных домена, описываемых в настоящем описании, например, выбранных из 4-1BB, CD28, CD27, ICOS и OX40, и в вариантах осуществления не содержится первичный внутриклеточный сигнальный домен. В одном из вариантов осуществления антигенсвязывающий компонент содержит следующие костимулирующие сигнальные домены в направлении от внеклеточного к внутриклеточному: 4-1BB-CD27; 4-1BB-CD27; CD27-4-1BB; 4-1BB-CD28; CD28-4-1BB; OX40-CD28; CD28-OX40; CD28-4-1BB или 4-1BB-CD28. В таких вариантах осуществления внутриклеточный связывающий компонент содержит домен CD3-дзета. В одном из таких вариантов осуществления RCAR содержит (1) антигенсвязывающий компонент, содержащий антигенсвязывающий домен, трансмембранный домен и два костимулирующих домена, и первый переключающий домен, и (2) внутриклеточный сигнальный домен, содержащий трансмембранный домен или домен мембранного заякоривания и по меньшей мере один первичный внутриклеточный сигнальный домен, и второй переключающий домен.
Вариант осуществления предоставляет CAR, где антигенсвязывающий компонент не является заякоренным на поверхности CAR-клетки. Это обеспечивает возможность того, что клетка содержит внутриклеточный сигнальный компонент, который подходящим способом спаривают с одним или более антигенсвязывающих доменов без трансформации клетки последовательностью, кодирующей антигенсвязывающий компонент. В таких вариантах осуществления RCAR содержит: 1) внутриклеточный сигнальный компонент, содержащий: первый переключающий домен, трансмембранный домен, внутриклеточный сигнальный домен, например, первичный внутриклеточный сигнальный домен и первый переключающий домен, и 2) антигенсвязывающий компонент, содержащий: антигенсвязывающий домен и второй переключающий домен, где антигенсвязывающий компонент не содержит трансмембранный домен или домен мембранного заякоривания, и, необязательно, не содержит внутриклеточный сигнальный домен. В некоторых вариантах осуществления RCAR может дополнительно содержать 3) второй антигенсвязывающий компонент, содержащий: втор антигенсвязывающий домен, например, второй антигенсвязывающий домен, который связывает антиген, отличный от антигена, который связывает антигенсвязывающий домен, и второй переключающий домен.
В настоящем описании также раскрыты RCAR, где антигенсвязывающий компонент обладает биспецифической активацией и способностью направленно воздействовать. В этом варианте осуществления антигенсвязывающий компонент может содержать совокупность, например, 2, 3, 4 или 5 антигенсвязывающих доменов, например, scFvs, где каждый антигенсвязывающий домен связывается с антигеном-мишенью, например, различными антигенами или тем же антигеном, например, одинаковыми или отличными эпитопами на том же антигене. В одном из вариантов осуществления совокупность антигенсвязывающих доменов располагаются последовательно, и необязательно линкер или шарнирная область располагается между каждым из антигенсвязывающих доменов. Подходящие линкеры и шарнирные области описаны в настоящем описании.
Вариант осуществления относится к RCAR с конфигурацией, которая обеспечивает возможность переключения пролиферации. В этом варианте осуществления RCAR содержит: 1) внутриклеточный сигнальный компонент, содержащий: необязательно трансмембранный домен или домен мембранного заякоривания; один или более костимулирующих сигнальных доменом, например, выбранных из 4-1BB, CD28, CD27, ICOS и OX40, и переключающий домен, и 2) антигенсвязывающий компонент, содержащий: антигенсвязывающий домен, трансмембранный домен и первичный внутриклеточный сигнальный домен, например, домен CD3-дзета, где антигенсвязывающий компонент не содержит переключающий домен, или не содержит переключающий домен, который димеризуется с переключающим доменом на внутриклеточном сигнальном компоненте. В одном из вариантов осуществления антигенсвязывающий компонент не содержит костимулирующий сигнальный домен. В одном из вариантов осуществления внутриклеточный сигнальный компонент содержит переключающий домен из переключателя гомодимеризации. В одном из вариантов осуществления внутриклеточный сигнальный компонент содержит первый переключающий домен переключателя гетеродимеризации, и RCAR содержит второй внутриклеточный сигнальный компонент, который содержит второй переключающий домен переключателя гетеродимеризации. В таких вариантах осуществления второй внутриклеточный сигнальный компонент содержит те же внутриклеточные сигнальные домены как и внутриклеточный сигнальный компонент. В одном из вариантов осуществления переключатель димеризации является внутриклеточным. В одном из вариантов осуществления переключатель димеризации является внеклеточным.
В любой из конфигураций RCAR, описываемых в настоящем описании, первый и второй переключающие домены содержат переключатель на основе FKBP-FRB, как описано в настоящем описании.
В настоящем описании также раскрыты клетки, содержащие RCAR, описываемый в настоящем описании. Любую клетку, которую конструируют для экспрессии RCAR, можно использовать в качестве RCARX-клетки. В одном из вариантов осуществления RCARX-клетка представляет собой T-клетку и обозначается как RCART-клетка. В одном из вариантов осуществления RCARX-клетка представляет собой NK-клетку и обозначается как RCARN-клетка.
В настоящем описании также раскрыты нуклеиновые кислоты и векторы, содержащие кодирующие RCAR последовательности. Последовательность, кодирующую различные элементы RCAR, можно располагать на той же молекуле нуклеиновой кислоты, например, той же плазмиде или том же векторе, например, вирусном векторе, например, лентивирусном векторе. В одном из вариантов осуществления (i) последовательность, кодирующая антигенсвязывающий компонент, и (ii) последовательность, кодирующая внутриклеточный сигнальный компонент, могут содержаться на одной той же нуклеиновой кислоте, например, векторе. Продукцию соответствующих белков можно получать, например, с использованием отдельных промоторов или с использованием бицистронного продукта транскрипции (что может приводить к продукции двух белков в результате расщепления одного продукта трансляции или посредством трансляции двух отдельных белковых продуктов). В одном из вариантов осуществления последовательность, кодирующая расщепляемый пептид, например, последовательность P2A или F2A располагается между (i) и (ii). В одном из вариантов осуществления последовательность, кодирующая IRES, например, EMCV или EV71 IRES, располагается между (i) и (ii). В этих вариантах осуществления (i) и (ii) транскрибируются в виде одной РНК. В одном из вариантов осуществления первый промотор является функционально связанным с (i), а второй промотор является функционально связанным с (ii), таким образом, что (i) и (ii) транскрибируются как отдельные иРНК.
Альтернативно, последовательность, кодирующая различные элементы RCAR, может располагаться на разных молекулах нуклеиновой кислоты, например, разных плазмидах или векторах, например, вирусном векторе, например, лентивирусном векторе. Например, (i) последовательность, кодирующая антигенсвязывающий компонент, может содержаться в первой нуклеиновой кислоте, например, первом векторе, а (ii) последовательность, кодирующая внутриклеточный сигнальный компонент, может содержаться во второй нуклеиновой кислоте, например, втором векторе.
Переключатели димеризации
Переключатели димеризации могут являться нековалентными или ковалентными. В нековалентном переключателе димеризации индуцирующая димеризацию молекула способствует нековалентному взаимодействию между переключающими доменами. В ковалентном переключателе димеризации индуцирующая димеризацию молекула способствует ковалентному взаимодействию между переключающими доменами.
В одном из вариантов осуществления RCAR содержит переключатель димеризации на основе FKBP/FRAP или FKBP/FRB. FKBP12 (FKBP или FK506-связывающий белок) представляет собой широко распространенный цитоплазматический белок, который служит в качестве первичной внутриклеточной мишени для натурального продукта иммуносупрессивного лекарственного средства, рапамицина. Рапамицин связывается с FKBP и с большим гомологом PI3K FRAP (RAFT, mTOR). FRB представляет собой участок FRAP длиной 93 аминокислота, который является достаточным для связывания с комплексом FKBP-рапамицина (Chen J., Zheng X.F., Brown E.J. and Schreiber S.L., (1995) Identification of an 11-kDa FKBP12-rapamycin-binding domain within the 289-kDa FKBP12-rapamycin-associated protein and characterization of a critical serine residue. Proc. Natl. Acad. Sci. USA 92: 4947-51.)
В вариантах осуществления в переключателе на основе FKBP/FRAP, например, FKBP/FRB можно использовать индуцирующую димеризацию молекулу, например, рапамицин или аналог рапамицина.
Аминокислотная последовательность FKBP является такой, как указано ниже:
DVPDYASLGGPSSPKKKRKVSRGVQVETISPGDGRTFPKRGQTCVVHYTGMLEDGKKFDSSRDRNKPFKFMLGKQEVIRGWEEGVAQMSVGQRAKLTISPDYAYGATGHPGIIPPHATLVFDVELLKLETSY (SEQ ID NO: 588).
В вариантах осуществления переключающий домен FKBP может содержать фрагмент FKBP, обладающий способностью связываться с FRB, или его фрагмент или аналог в присутствии рапамицина или рапалога, например, подчеркнутый участок SEQ ID NO: 588, который представляет собой:
VQVETISPGDGRTFPKRGQTCVVHYTGMLEDGKKFDSSRDRNKPFKFMLGKQEVIRGWEEGVAQMSVGQRAKLTISPDYAYGATGHPGIIPPHATLVFDVELLKLETS (SEQ ID NO: 589).
Аминокислотная последовательность FRB является такой, как указано ниже:
ILWHEMWHEG LEEASRLYFG ERNVKGMFEV LEPLHAMMER GPQTLKETSF NQAYGRDLME AQEWCRKYMK SGNVKDLTQA WDLYYHVFRR ISK (SEQ ID NO: 590).
"Переключатель на основе FKBP/FRAP, например, FKBP/FRB", как этот термин используют в настоящем описании, относится к переключателю димеризации, содержащему: первый переключающий домен, который содержит фрагмент FKBP или его аналог, обладающий способностью связываться с FRB или его фрагментом, или аналогом в присутствии рапамицина или рапалога, например, RAD001, и обладает по меньшей мере 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентичностью с последовательностью FKBP SEQ ID NO: 54 или 55 или отличается не более чем на 30, 25, 20, 15, 10, 5, 4, 3, 2 или 1 аминокислотный остаток от нее; и второй переключающий домен, который содержит фрагмент FRB или его аналог, обладающий способностью связываться с FRB или его фрагментом, или аналогом в присутствии рапамицина или рапалога, и обладает по меньшей мере 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентичностью с последовательностью FRB SEQ ID NO: 56 или отличается не более чем на 30, 25, 20, 15, 10, 5, 4, 3, 2 или 1 аминокислотный остаток от нее. В одном из вариантов осуществления RCAR, описываемый в настоящем описании, содержит один переключающий домен, который содержит аминокислотные остатки, описанные в SEQ ID NO: 588 (или SEQ ID NO: 589), и один переключающий домен, который содержит аминокислотные остатки, описанные в SEQ ID NO: 590.
В вариантах осуществления переключатель димеризации FKBP/FRB содержит модифицированный переключающий домен FRB, для которого выявляют измененное, например, повышенное комплексообразование между переключающим доменом на основе FRB, например, модифицированным переключающим доменом FRB, переключающий домен на основе FKBP, и индуцирующей димеризацию молекулой, например, рапамицином или рапалогом, например, RAD001. В одном из вариантов осуществления модифицирующий переключающий домен FRB содержит одну или более мутаций, например, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более, выбранных из мутаций в положении(ях) аминокислоты L2031, E2032, S2035, R2036, F2039, G2040, T2098, W2101, D2102, Y2105 и F2108, где аминокислоту дикого типа подвергают мутации до любой другой природной аминокислоты. В одном из вариантов осуществления мутантный FRB содержит мутацию в E2032, где E2032 мутирует до фенилаланина (E2032F), метионина (E2032M), аргинина (E2032R), валина (E2032V), тирозина (E2032Y), изолейцина (E2032I), например, SEQ ID NO: 591 или лейцина (E2032L), например, SEQ ID NO: 592. В одном из вариантов осуществления мутантный FRB содержит мутацию в T2098, где T2098 мутирует до фенилаланина (T2098F) или лейцина (T2098L), например, SEQ ID NO: 593. В одном из вариантов осуществления мутантный FRB содержит мутацию в E2032 и в T2098, где E2032 мутирует до любой аминокислоты, и где T2098 мутирует до любой аминокислоты, например, SEQ ID NO: 594. В одном из вариантов осуществления мутантный FRB содержит мутацию E2032I и T2098L, например, SEQ ID NO: 595. В одном из вариантов осуществления мутантный FRB содержит мутацию E2032L и T2098L, например, SEQ ID NO: 596.
Таблица 14. Иллюстративный мутантный FRB, обладающий повышенной аффинностью к индуцирующей димеризацию молекуле.
|
Другие подходящие переключатели димеризации включают переключатель димеризации на основе GyrB-GyrB, переключатель димеризации на основе гиббереллина, переключатель димеризации метка/связывающее средство и переключатель димеризации гало-метка/замок-метка (snap-tag). С учетом рекомендаций, предоставленных в настоящем описании, специалисту в данной области будут понятны такие переключатели и соответствующие способствующие димеризации молекулы.
Индуцирующая димеризацию молекула
Образованию ассоциации между переключающими доменами способствует индуцирующая димеризацию молекула. В присутствии индуцирующей димеризацию молекулы взаимодействие или ассоциация между переключающими доменами обеспечивает передачу сигнала между полипептидом, связанным, например, слитым с первым переключающим доменом и полипептидом, связанным, например, слитым со вторым переключающим доменом. В присутствии неограничивающих уровней индуцирующей димеризацию молекулы передача сигнала увеличивается в 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 5, 10, 50, 100 раз, например, как измеряют в системе, описываемой в настоящем описании.
Рапамицин и аналоги рапамицина (в некоторых случаях обозначаемые как рапалоги), например, RAD001, можно использовать в качестве индуцирующих димеризацию молекул в переключателе димеризации на основе FKBP/FRB, описываемом в настоящем описании. В одном из вариантов осуществления индуцирующую димеризацию молекулу можно выбирать из рапамицина (сиролимуса), RAD001 (эверолимуса), зотаролимуса, темсиролимуса, AP-23573 (ридафоролимуса), биолимуса и AP21967. Дополнительные аналоги рапамицина пригодные для использования с переключателями димеризации на основе FKBP/FRB дополнительно описаны в разделе, озаглавленном "Способы комбинированного лечения", или в подразделе, озаглавленном "Комбинация с ингибитором mTOR в низкой дозе".
Коэкспрессия CAR с рецептором хемокина
В вариантах осуществления экспрессирующая CAR клетка, описываемая в настоящем описании, дополнительно содержит молекулу рецептор хемокина. Трансгенная экспрессия рецепторов хемокина CCR2b или CXCR2 в T-клетках повышает миграцию в секретирующие CCL2 или CXCL1 солидные опухоли, включая меланому и нейробластому (Craddock et al., J. Immunother., 2010 Oct; 33(8):780-8 и Kershaw et al., Hum. Gene Ther., 2002 Nov 1; 13(16):1971-80). Таким образом, без желания быть связанными теорией, полагают, что рецепторы хемокина, экспрессируемые в экспрессирующих CAR клетках, которые распознают хемокины, секретируемые опухолями, например, солидными опухолями, могут улучшать хоминг экспрессирующей CAR клетки к опухоли, облегчать инфильтрацию экспрессирующей CAR клетки в опухоли и повышать противоопухолевую эффективность экспрессирующей CAR клетки. Молекула рецептора хемокина может содержать природный или рекомбинантный рецептор хемокина или его фрагмент, связывающий хемокин. Молекула рецептора хемокина, подходящая для экспрессии в экспрессирующей CAR клетке, описываемой в настоящем описании, включает рецептор хемокина CXC (например, CXCR1, CXCR2, CXCR3, CXCR4, CXCR5, CXCR6 или CXCR7), рецептор хемокина CC (например, CCR1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CCR9, CCR10 или CCR11), рецептор хемокина CX3C (например, CX3CR1), рецептор хемокина XC (например, XCR1) или его фрагмент, связывающий хемокин. В одном из вариантов осуществления молекула рецептора хемокина, которая должна экспрессироваться с CAR, описываемым в настоящем описании, выбрана на основании хемокина(ов), секретируемого опухолью. В одном из вариантов осуществления экспрессирующая CAR клетка, описываемая в настоящем описании, дополнительно содержит, например, экспрессирует рецептор CCR2b или рецептор CXCR2. В одном из вариантов осуществления CAR, описываемый в настоящем описании, и молекула рецептора хемокина находятся на том же векторе или находятся на двух различных векторах. В вариантах осуществления, где CAR, описываемый в настоящем описании, и молекула рецептор хемокина находятся на одном и том же векторе, каждый из CAR и молекулы рецептора хемокина находится под контролем двух различных промоторов или находятся под контролем одного и того же промотора.
Трансфекция РНК
В настоящем описании раскрыты способы получения транскрибируемой РНК CAR in vitro. Настоящее изобретение также относится к кодирующей CAR конструкции РНК, которую можно непосредственно трансфицировать в клетку. Способ получения иРНК для применения в трансфекции может включать транскрипцию (IVT) in vitro матрицы со специально конструируемыми праймерами после добавления полиA с получением конструкции, содержащей 3'- и 5'-нетранслируемую последовательность ("UTR"), 5'-кэп и/или внутренний участок связывания рибосомы (IRES), нуклеиновой кислоты, которую необходимо экспрессировать, и хвоста полиA длиной, как правило, 50-2000 оснований (SEQ ID NO: 35). Получаемая таким образом РНК может эффективно трансфицировать различные виды клеток. В одном из аспектов матрица содержит последовательности CAR.
В одном из аспектов CD123 CAR кодируется информационной РНК (иРНК). В одном из аспектов иРНК, кодирующую CD123 CAR, вводят в T-клетку для получения CART-клетки.
В одном из вариантов осуществления транскрибируемую РНК CAR in vitro можно вводить в клетку в формате транзиторной трансфекции. РНК получают транскрипцией in vitro с использованием матрицы, получаемой полимеразной цепной реакцией (ПЦР). Представляющую интерес ДНК от любого вида можно непосредственно преобразовывать ПЦР в матрицу для синтеза иРНК in vitro с использованием подходящих праймеров и РНК-полимеразы. Источником ДНК может являться, например, геномная ДНК, плазмидная ДНК, фаговая ДНК, кДНК, синтетическая последовательность ДНК или любой подходящий источник ДНК. Желаемая матрица для транскрипции in vitro представляет собой CAR по настоящему изобретению. Например, матрица для РНК CAR содержит внеклеточную область, содержащую одноцепочечный вариабельный домен антитела к опухоли; шарнирную область, трансмембранный домен (например, трансмембранный домен CD8a) и цитоплазматическую область, которая содержит внутриклеточный сигнальный домен, например, содержащий сигнальный домен CD3-дзета и сигнальный домен 4-1BB.
В одном из вариантов осуществления ДНК, которую необходимо использовать для ПЦР, содержит открытую рамку считывания. ДНК может являться из природной последовательности ДНК из генома организма. В одном из вариантов осуществления нуклеиновая кислота может содержать некоторые или все 5'- и/или 3'-нетранслируем области (UTR). Нуклеиновая кислота может содержать экзоны и интроны. В одном из вариантов осуществления ДНК, которую необходимо использовать для ПЦР, представляет собой последовательность нуклеиновой кислоты человека. В другом варианте осуществления ДНК, которую необходимо использовать в для ПЦР, представляет собой последовательность нуклеиновой кислоты человека, содержащую 5'- и 3'-UTR. Альтернативно, ДНК может представлять собой искусственную последовательность ДНК, которая обычно не экспрессируется в природном организме. Иллюстративная искусственная последовательность ДНК представляет собой последовательность ДНК, которая содержит участки генов, которые являются легированными друг с другом с образованием открытой рамки считывания, кодирующей слитый белок. Участки ДНК, которые являются легированными друг с другом могут происходить от одного организма или от более чем одного организма.
ПЦР используют для получения матрицы для транскрипция in vitro иРНК, которую используют для трансфекции. Способы проведения ПЦР хорошо известны в данной области. Праймеры для применения в ПЦР конструируют так, чтобы они содержали области, которые являются по существу комплементарными областям ДНК, которую необходимо использовать в качестве матрицы для ПЦР. "По существу комплементарная", как используют в настоящем описании, относится к последовательности нуклеотидов, где большая часть или все основания в последовательности праймера являются комплементарными, или одно или более оснований не являются комплементарными или несовпадающими. По существу комплементарные последовательности способны отжигаться или гибридизоваться с предполагаемой ДНК-мишенью в условиях отжига, используемых для ПЦР. Праймеры можно конструировать так, чтобы они являлись по существу комплементарными к любому участку ДНК-матрицы. Например, праймеры можно конструировать для амплификации участка нуклеиновой кислоты, который обычно транскрибируется в клетках (открытая рамка считывания), включая 5'- и 3'-UTR. Праймеры также можно конструировать для амплификации участка нуклеиновой кислоты, кодирующего конкретный представляющий интерес домен. В одном из вариантов осуществления праймеры конструируют для амплификации кодирующей области кДНК человека, включая полностью или участки 5'- и 3'-UTR. Праймеры, пригодные для ПЦР, можно получать способами синтеза, которые хорошо известны в данной области. "Прямые праймеры" представляют собой праймеры, которые содержат область нуклеотидов, которые являются по существу комплементарными нуклеотидам на ДНК-матрице, которые располагаются в 3'-5' направлении последовательности ДНК, которую необходимо амплифицировать. "3'-5' направление" применяют в настоящем описании для обозначения участка 5 к последовательности ДНК, которую необходимо амплифицировать, относительно кодирующей нити. "Обратные праймеры" представляют собой праймеры, которые содержат область нуклеотидов, которые являются по существу комплементарными матрице двухцепочечной ДНК, которая располагается в 3'-5' направлении от последовательности ДНК, которую необходимо амплифицировать. "3'-5' направление" применяют в настоящем описании для обозначения участка 3' к последовательности ДНК, которую необходимо амплифицировать, относительно кодирующей нити.
В способах, описываемых в настоящем описании, можно использовать любую ДНК-полимеразу, пригодную для ПЦР. Реагенты и полимераза являются коммерчески доступными из ряда источников.
Также можно использовать химические структуры со способностью обеспечивать стабильность и/или эффективность трансляции. Предпочтительно РНК содержит 5'- и 3'-UTR. В одном из вариантов осуществления длина 5'-UTR составляет от одного до 3000 нуклеотидов. Длину последовательностей 5'- и 3'-UTR, которые необходимо добавлять к кодирующей области, можно изменять различными способами, включая, но, не ограничиваясь ими, конструирование праймеров для ПЦР, которые отжигаются на различных областях UTR. С использованием этого подхода, специалист в данной области может модифицировать длины 5'- и 3'-UTR, необходимые для получения оптимальной эффективности трансляции после трансфекции нетранскрибируемой РНК.
5'- и 3'-UTR могут представлять собой природные, эндогенные 5'- и 3'-UTR для представляющих интерес нуклеиновых кислот. Альтернативно, последовательности UTR, которые не являются эндогенными по отношению к представляющей интерес нуклеиновой кислоте, можно добавлять введением последовательностей UTR в прямые и обратные праймеры или любой другой модификацией матрицы. Использование последовательностей UTR, которые не являются эндогенными по отношению к представляющей интерес нуклеиновой кислоте, могут являться пригодными для модификации стабильности и/или эффективности трансляции РНК. Например, известно, что богатые AU элементы в последовательностях 3'-UTR могут снижать стабильность иРНК. Таким образом, можно выбирать или конструировать 3'-UTR для повышения стабильности транскрибируемой РНК на основании свойств UTR, которые хорошо известны в данной области.
В одном из вариантов осуществления 5'-UTR могут содержать Последовательность Козак эндогенной нуклеиновой кислоты. Альтернативно, когда 5'-UTR, которая не является эндогенной по отношению к представляющей интерес нуклеиновой кислоте, добавляют в ПЦР, как описано выше, консенсусную последовательность Козак можно реконструировать добавлением последовательности 5'-UTR. Последовательности Козак могут увеличивать эффективность трансляции некоторых транскриптов РНК, но, по-видимому, не являются необходимыми для всех РНК для обеспечения эффективной трансляции. Требование к последовательности Козак для многих иРНК известны в данной области. В других вариантах осуществления 5'-UTR может представлять собой 5'-UTR РНК-вируса, РНК-геном которого является стабильным в клетках. В других вариантах осуществления можно использовать различные аналоги нуклеотидов в 3'- или 5'-UTR для блокирования эндонуклеазного разрушения иРНК.
Для обеспечения синтеза РНК из ДНК-матрицы без необходимости клонирования генов, промотор транскрипции необходимо присоединять к ДНК-матрице выше последовательностей, которые необходимо транскрибировать. Когда последовательность, которая функционирует как промотор для РНК-полимеразы, добавляют к 5'-концу прямого праймера, промотор РНК-полимеразы становится включенным в продукт ПЦР выше открытой рамки считывания, которая должна транскрибироваться. В одном предпочтительном варианте осуществления промотор представляет собой промотор полимеразы T7, как описано в другом месте в настоящем описании. Другие пригодные промоторы включают, но не ограничиваются ими, промоторы РНК-полимеразы T3 и SP6. Консенсусные нуклеотидные последовательности для промоторов T7, T3 и SP6 известны в данной области.
В предпочтительном варианте осуществления иРНК содержит кэп на 5'-конце и 3'-хвост поли(A), которые определяет связывание рибосом, начало трансляции и стабильность иРНК в клетке. На циркулирующей ДНК-матрице, например, плазмидной ДНК РНК-полимераза продуцирует большой конкатамерный продукт, который не является подходящим для экспрессии в эукариотических клетках. Транскрипция плазмидной ДНК, линеризованной на конце 3'-UTR приводит к иРНК нормального размера, которая не является эффективной в эукариотической трансфекции, даже если она является полиаденилированной после транскрипции.
На линейной ДНК-матрице фаговая РНК-полимераза T7 может удлинять 3'-конец транскрипта после последнего основания матрицы (Schenborn and Mierendorf, Nuc. Acids Res., 13:6223-36 (1985); Nacheva and Berzal-Herranz, Eur. J. Biochem., 270:1485-65 (2003).
Общепринятым способом исследования удлинений поли-A/T в ДНК-матрице является молекулярное клонирование. Однако последовательность поли-A/T, интегрированная в плазмидную ДНК, может вызывать нестабильность плазмиды, именно поэтому плазмидные ДНК-матрицы, получаемые из бактериальных клеток часто являются сильно загрязненными делециями и другими аберрациями. Это приводит к тому, что способы клонирования являются не только трудоемкими и времязатратными, но часто и ненадежными. Поэтому способ, который обеспечивает возможность конструирования ДНК-матриц без 3'-удлинения поли-A/T без клонирования является очень желаемым.
Сегмент поли-A/T транскрипционной ДНК-матрицы можно получать во время ПЦР с использованием обратного праймера, содержащего хвост поли-T, такой как хвост 100T (SEQ ID NO: 31) (размер может составлять 50-5000T (SEQ ID NO: 32)), или после ПЦР любым другим способом, включая, но, не ограничиваясь ими, лигирование ДНК или рекомбинацию in vitro. Хвосты поли(A) также обеспечивают стабильность РНК и снижают ее разрушение. Как правило, длина хвоста поли(A) положительно коррелирует со стабильностью транскрибируемой РНК. В одном из вариантов осуществления хвост поли(A) составляет от 100 до 5000 аденозинов (SEQ ID NO: 33).
Хвост поли(A) РНК можно дополнительно удлинять после транскрипции in vitro с использованием поли(A)-полимеразы, такой как поли(A)-полимеразы E. coli (E-PAP). В одном из вариантов осуществления увеличение длины хвоста поли(A) из 100 нуклеотидов до от 300 до 400 нуклеотидов (SEQ ID NO: 34) приводит приблизительно к двукратному увеличению эффективности трансляции РНК. Кроме того, присоединение различных химических групп к 3'-концу может увеличивать стабильность иРНК. Такое присоединение может содержать модифицированные/искусственные нуклеотиды, аптамеры и другие соединения. Например, в хвост поли(A) можно вводит аналоги ATP с использованием поли(A)-полимеразы. Аналоги ATP могут дополнительно повышать стабильность РНК.
5'-кэпы также обеспечивают стабильность молекул РНК. В предпочтительном варианте осуществления РНК, получаемая способами, описываемыми в настоящем описании, содержит 5'-кэп. 5'-кэп получают известными в данной области и описываемыми в настоящем описании способами (Cougot et al., Trends in Biochem. Sci., 29:436-444 (2001); Stepinski et al., RNA, 7:1468-95 (2001); Elango et al., Biochim. Biophys. Res. Commun., 330:958-966 (2005)).
РНК, получаемая способами, описываемыми в настоящем описании, также может содержать последовательность внутреннего участка связывания рибосомы (IRES). Последовательность IRES может представлять собой любую вирусную, хромосомную или искусственную последовательность, которая инициирует независимое от кэп связывание рибосомы с иРНК и облегчает начало трансляции. Можно включать любые растворенные вещества, подходящие для электропорации клетки, которые могут содержать факторы, облегчающие клеточную проницаемость и жизнеспособность, такие как сахара, пептиды, липиды, белки, антиоксиданты и поверхностно-активные вещества.
РНК можно вводить в клетки-мишени любым из ряда различных способов, например, коммерчески доступных способов, которые включают, но не ограничиваются ими, электропорацию (Amaxa Nucleofector-II (Amaxa Biosystems, Cologne, Germany)), (ECM 830 (BTX) (Harvard Instruments, Boston, Mass.) или Gene Pulser II (BioRad, Denver, Colo.), Multiporator (Eppendort, Hamburg Germany), опосредованную катионными липосомами трансфекцию с использованием липофекции, полимерного инкапсулирования, модифицированной пептидами трансфекции или систем доставки на основе биолистических частиц, такие как "генная пушка" (см., например, Nishikawa et al., Hum Gene Ther., 12(8):861-70 (2001).
Способы доставки не на основе вирусов
В некоторых аспектах для доставки нуклеиновой кислоты, кодирующей CAR, описываемый в настоящем описании, в клетку или ткань, или индивидууму можно использовать способы не на основе вирусов.
В некоторых вариантах осуществления способ не на основе вирусов включает использование транспозона (также называемого транспозируемого элемента). В некоторых вариантах осуществления транспозон представляет собой часть ДНК, которая может встраиваться сама по себе в участок в геноме, например, часть ДНК, которая способна самореплицироваться и встраивать свою копию в геном, или часть ДНК, которая может вырезаться из более длинной нуклеиновой кислоты и встраиваться в другое место в геноме. Например, транспозон содержит последовательность ДНК, состоящую из инвертированных повторов, фланкирующих гены для транспозиции.
Иллюстративные способы доставки нуклеиновой кислоты с использованием транспозон включают система транспозонов "Спящая красавица" (Sleeping Beauty) (SBTS) и систему транспозонов PiggyBac (PB). См., например, Aronovich et al., Hum. Mol. Genet., 20.R1(2011):R14-20; Singh et al., Cancer Res., 15(2008):2961-2971; Huang et al., Mol. Ther., 16(2008):580-589; Grabundzija et al., Mol. Ther., 18(2010):1200-1209; Kebriaei et al., Blood. 122.21(2013):166; Williams, Molecular Therapy, 16.9(2008):1515-16; Bell et al., Nat. Protoc., 2.12(2007):3153-65 и Ding et al., Cell, 122.3(2005):473-83, которые все включены в настоящее описание посредством ссылки.
SBTS включает два компонента: 1) транспозон, содержащий трансген, и 2) источник фермента транспозазы. Транспозаза может перемещать транспозон из плазмиды носителя (или другой донорной ДНК) в ДНК-мишень, такую как хромосома/геном клетки-хозяина. Например, транспозаза связывается с плазмидой носителем/донорной ДНК, вырезает транспозон (содержащий трансген(ы)) из плазмиды и вводит его в геном клетки-хозяин. См., например, Aronovich et al. выше.
Иллюстративные транспозоны включают транспозон на основе pT2. См., например, Grabundzija et al., Nucleic Acids Res., 41,3(2013):1829-47 и Singh et al., Cancer Res. 68,8(2008): 2961-2971, которые все включены в настоящее описание посредством ссылки. Иллюстративные транспозазы включают транспозазу типа Tc1/mariner, например, транспозазу SB10 или транспозазу SB11 (высокоактивную транспозазу, которую можно экспрессировать, например, из промотор цитомегаловируса). См., например, Aronovich et al.; Kebriaei et al. и Grabundzija et al., которые все включены в настоящее описание посредством ссылки.
Использование SBTS обеспечивает эффективную интеграцию и экспрессию трансгена, например, нуклеиновой кислоты, кодирующей CAR, описываемый в настоящем описании. В настоящем описании раскрыты способы получения клетки, например, T-клетки или NK-клетки, которая стабильно экспрессирует CAR, описываемую в настоящем описании, например, с использованием системы транспозонов, такой как SBTS.
В соответствии со способами, описываемыми в настоящем описании, в некоторых вариантах осуществления одна или более нуклеиновых кислот, например, плазмид, содержащих компоненты SBTS, поставляют в клетку (например, T- или NK-клетку). Например, нуклеиновая кислота(ы) доставляют стандартными способами доставки нуклеиновой кислоты (например, плазмидной ДНК), например, способами, описываемыми в настоящем описании, например, электропорацией, трансфекцией или липофекцией. В некоторых вариантах осуществления нуклеиновая кислота содержит транспозон, содержащий трансген, например, нуклеиновую кислоту, кодирующую CAR, описываемый в настоящем описании. В некоторых вариантах осуществления нуклеиновая кислота сдержит транспозон, содержащий трансген (например, нуклеиновую кислоту, кодирующую CAR, описываемый в настоящем описании), а также последовательность нуклеиновой кислоты, кодирующую фермент транспозазу. Другие варианты осуществления относятся к системе с двумя нуклеиновыми кислотами, например, систему на основе двойных плазмид, например, где первая плазмида содержит транспозон, содержащий трансген, и вторая плазмида содержит последовательность нуклеиновой кислоты, кодирующую фермент транспозазу. Например, первая и вторая нуклеиновые кислоты доставляют совместно в клетку-хозяин.
В некоторых вариантах осуществления получают клетки, например, T- или NK-клетки, которые экспрессируют CAR, описываемый в настоящем описании, с использованием комбинации вставки гена с использованием SBTS и генного редактирования с использованием нуклеазы (например, нуклеаз цинковые пальцы (ZFN), эффекторных нуклеаз, подобных активаторам транскрипции (TALEN), системы CRISPR/Cas или сконструированных мегануклеаз реконструированных хоминг-эндонуклеаз).
В некоторых вариантах осуществления использование способа доставки не на основе вирусов позволяет репрограммировать клетки, например, T- или NK-клетки, и непосредственно вводить клетки индивидууму. Преимущества невирусных векторов включают, но не ограничиваются ими, простоту и относительно низкую стоимость получения достаточных количеств, необходимых для соответствия популяции пациентов, стабильность во время хранения и отсутствие иммуногенности.
Конструкции нуклеиновой кислоты, кодирующие CAR
Настоящее изобретение также относится к молекулам нуклеиновой кислоты, кодирующим одну или более конструкций CAR, описываемых в настоящем описании. В одном из аспектов молекула нуклеиновой кислоты предоставлена как транскрипт информационной РНК. В одном из аспектов молекула нуклеиновой кислоты предоставлена как конструкция ДНК.
Таким образом, в одном из аспектов изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей химерный антигенный рецептор (CAR), где CAR содержит CD123-связывающий домен (например, гуманизированный CD123-связывающий домен или CD123-связывающий домен человека), трансмембранный домен и внутриклеточный сигнальный домен, содержащий стимулирующий домен, например, костимулирующий сигнальный домен и/или первичный сигнальный домен, например, дзета-цепь. В одном из вариантов осуществления CD123-связывающий домен представляет собой CD123-связывающий домен, описываемый в настоящем описании, например, CD123-связывающий домен, который содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 157-160, 184-215, 478, 480, 483, 485 и 556-587, или последовательность с 95-99% идентичностью с ней. В одном из вариантов осуществления CD123-связывающий домен содержит CD123-связывающий домен человека, который содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 157-160, 478, 480, 483 и 485. В одном из вариантов осуществления CD123-связывающий домен содержит гуманизированный CD123-связывающий домен, который содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 184-215 и 556-587. В одном из вариантов осуществления трансмембранный домен представляет собой трансмембранный домен белка, например, описываемый в настоящем описании, например, выбранный из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном из вариантов осуществления трансмембранный домен содержит последовательность SEQ ID NO: 6 или последовательность с 95-99% идентичностью с ней. В одном из вариантов осуществления CD123-связывающий домен соединен с трансмембранным доменом шарнирной областью, например, шарниром, описываемым в настоящем описании. В одном из вариантов осуществления шарнирная область содержит SEQ ID NO: 2 или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5, или последовательность с 95-99% идентичностью с ней. В одном из вариантов осуществления выделенная молекула нуклеиновой кислоты дополнительно содержит последовательность, кодирующую костимулирующий домен. В одном из вариантов осуществления костимулирующий домен представляет собой функциональный сигнальный домен белка, например, описываемый в настоящем описании, например, выбранный из группы, состоящей из молекулы MHC I класса, TNF рецепторного белка, иммуноглобулиноподобного белка, цитокинового рецептора, интегрина, сигнальной молекулы, активирующей лимфоциты (белка SLAM), активирующего рецептора NK-клеток, BTLA, Toll-подобного рецептора, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, который специфически связывается с CD83.
В одном из вариантов осуществления костимулирующий домен содержит последовательность SEQ ID NO: 7 или последовательность с 95-99% идентичностью с ней. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и функциональный сигнальный домен CD3-дзета. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 7 или SEQ ID NO: 8, или последовательность с 95-99% идентичностью с ней, и последовательность SEQ ID NO: 9 или SEQ ID NO: 10, или последовательность с 95-99% идентичностью с ней, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в той же рамке считывания и в виде одной полипептидной цепи
В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей конструкцию CAR, содержащую лидерную последовательность SEQ ID NO: 1, scFV-домен с последовательностью, выбранной из группы, состоящей из SEQ ID NO: 157-160, 184-215, 478, 480, 483, 485 и 556-587 (или с последовательностью с 95-99% идентичностью с ней), шарнирную область SEQ ID NO: 2 или SEQ ID NO: 3, или SEQ ID NO: 4, или SEQ ID NO: 5 (или последовательность с 95-99% идентичностью с ней), трансмембранный домен с последовательностью SEQ ID NO: 6 (или с последовательностью с 95-99% идентичностью с ней), костимулирующий домен 4-1BB с последовательностью SEQ ID NO: 7 или костимулирующий домен CD27 с последовательностью SEQ ID NO: 8 (или с последовательностью с 95-99% идентичностью с ней), или костимулирующий домен CD28 с последовательностью SEQ ID NO: 43 (или с последовательностью с 95-99% идентичностью с ней), или костимулирующий домен ICOS с последовательностью SEQ ID NO: 45 (или с последовательностью с 95-99% идентичностью с ней) и стимулирующий домен CD3-дзета с последовательностью SEQ ID NO: 9 или SEQ ID NO: 10 (или с последовательностью с 95-99% идентичностью с ней).
В другом аспекте изобретение относится к выделенной полипептидной молекуле, кодируемой молекулой нуклеиновой кислоты. В одном из вариантов осуществления выделенная полипептидная молекула содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 98-101 и 125-156, или последовательность с 95-99% идентичностью с ней.
В другом аспекте изобретение относится к молекуле нуклеиновой кислоты, кодирующей молекулу химерного антигенного рецептора (CAR), которая содержит CD123-связывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий стимулирующий домен, и где указанный связывающий домен CD123 содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 157-160, 184-215, 478, 480, 483, 485 и 556-587, или последовательность с 95-99% идентичностью с ней. В одном из вариантов осуществления CD123-связывающий домен содержит CD123-связывающий домен человека, содержащий последовательность, выбранную из группы, состоящей из SEQ ID NO: 157-160, 478, 480, 483 и 485, или последовательность с 95-99% идентичностью с ней. В одном из вариантов осуществления CD123-связывающий домен содержит гуманизированный CD123-связывающий домен, содержащий последовательность, выбранную из группы, состоящей из SEQ ID NO: 184-215 и 556-587, или последовательность с 95-99% идентичностью с ней.
В одном из вариантов осуществления кодируемая молекула CAR дополнительно содержит последовательность, кодирующую костимулирующий домен. В одном из вариантов осуществления костимулирующий домен представляет собой функциональный сигнальный домен белка, выбранный из группы, состоящей из молекулы MHC I класса, TNF рецепторного белка, иммуноглобулиноподобного белка, цитокинового рецептора, интегрина, сигнальной молекулы, активирующей лимфоциты (белка SLAM), активирующего рецептора NK-клеток, BTLA, Toll-подобного рецептора, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, который специфически связывается с CD83. В одном из вариантов осуществления костимулирующий домен содержит последовательность SEQ ID NO: 7.
В одном из вариантов осуществления трансмембранный домен представляет собой трансмембранный домен белка, выбранных из группы, состоящей из альфа-, бета- или дзета-цепи T-клеточного рецептора, CD28, CD3 эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154, молекулы MHC I класса, TNF рецепторного белка, иммуноглобулиноподобный белок, цитокиновый рецептор, интегрин, сигнальной молекулы, активирующей лимфоциты (белка SLAM), активирующий рецептор NK-клеток, BTLA, Toll-подобного рецептора, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CDS, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CDS, ICAM-1, ICOS (CD278), GITR, BAFFR, LIGHT, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганда, который специфически связывается с CD83.
В одном из вариантов осуществления трансмембранный домен содержит последовательность SEQ ID NO: 6. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и функциональный сигнальный домен дзета. В одном из вариантов осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 7 и последовательность SEQ ID NO: 9, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в той же рамке считывания и в виде одной полипептидной цепи. В одном из вариантов осуществления CD123-связывающий домен соединен с трансмембранным доменом шарнирной областью. В одном из вариантов осуществления шарнирная область содержит SEQ ID NO: 2. В одном из вариантов осуществления шарнирная область содержит SEQ ID NO: 3 или SEQ ID NO: 4, или SEQ ID NO: 5.
В другом аспекте изобретение относится к кодируемой молекуле CAR, содержащей лидерную последовательность SEQ ID NO: 1, scFV-домен с последовательностью, выбранной из группы, состоящей из SEQ ID NO: 157-160,184-215, 478, 480, 483, 485, 556-587, или последовательностью с 95-99% идентичностью с ней, шарнирная область SEQ ID NO: 2 или SEQ ID NO: 3, или SEQ ID NO: 4. или SEQ ID NO: 5, трансмембранный домен с последовательностью SEQ ID NO: 6, костимулирующий домен 4-1BB с последовательностью SEQ ID NO: 7 или костимулирующий домен CD27 с последовательностью SEQ ID NO: 8, или костимулирующий домен CD28 с последовательностью SEQ ID NO: 43, или костимулирующий домен ICOS с последовательностью SEQ ID NO: 45 и стимулирующий домен CD3-дзета с последовательностью SEQ ID NO: 9 или SEQ ID NO: 10. В одном из вариантов осуществления кодируемая молекула CAR содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 98-101 и 125-156, или последовательность с 95-99% идентичностью с ней.
Последовательности нуклеиновой кислоты, кодирующие желаемые молекулы можно получать известными в данной области рекомбинантными способами, такими как, например, скринингом библиотеки клеток, экспрессирующих ген, получением гена из вектора, который, как известно, содержит ген, или выделением непосредственно из клеток и тканей, содержащих ген, стандартными способами. Альтернативно, представляющий интерес ген можно получать синтезом, а не клонировать.
Настоящее изобретение также относится к векторам, в которые вводят ДНК по настоящему изобретению. Векторы, получаемые из ретровирусов, таких как лентивирус, представляют собой подходящие средства для получения длительного переноса генов, т.к. они обеспечивают длительную, стабильную интеграцию трансгена и его размножение в дочерних клетках. Лентивирусные векторы обладают дополнительным преимуществом по сравнению с векторами, получаемыми из онкоретровирусов, таких как вирусы лейкозов мышей, которое заключается в том, что они могут трансдуцировать непролиферирующие клетки, такие как гепатоциты. Они также обладают дополнительным преимуществом низкой иммуногенности. Ретровирусный вектор также может представлять собой, например, гамма-ретровирусный вектор. Гамма-ретровирусный вектор может содержать, например, промотор, сигнал упаковки (ψ), участок связывания праймера (PBS), один или более (например, два) длинных концевых повтора (LTR) и представляющий интерес трансген, например, ген, кодирующий CAR. Гамма-ретровирусный вектор может не содержать структурные гены вируса, такие как gag, pol и env. Иллюстративные гамма-ретровирусные векторы включают вирус лейкоза мышей (MLV), вирус некроза селезенки (SFFV) и миелопролиферативный вирус саркомы (MPSV), и векторы, получаемые из них. Другие гамма-ретровирусные векторы описаны, например, у Tobias Maetzig et al., "Gammaretroviral Vectors: Biology, Technology and Application" Viruses. 2011 Jun; 3(6): 677-713.
В другом варианте осуществления вектор, содержащий нуклеиновую кислоту, кодирующую желаемый CAR по изобретению, представляет собой аденовирусный вектор (A5/35). В другом варианте осуществления экспрессию нуклеиновых кислот, кодирующих CAR, можно проводить с использованием транспозон, таких как спящая красавица, crisper, CAS9 и нуклеазы цинковые пальцы. См. ниже June et al., 2009 Nature Reviews Immunology, 9.10: 704-716, включенную в настоящее описание посредством ссылки.
В кратком изложении экспрессию природных или синтетических нуклеиновых кислот, кодирующих CAR, как правило, получают посредством функционального связывания нуклеиновой кислоты, кодирующей полипептид CAR или его участок, с промотором и введения конструкции в экспрессирующий вектор. Векторы могут являться подходящими для репликации и интеграции у эукариот. Характерные клонирующие векторы содержат терминаторы транскрипции и трансляции, инициирующие последовательности и промоторы, пригодные для регуляции экспрессии желаемой последовательности нуклеиновой кислоты.
Экспрессирующие конструкции по настоящему изобретению также можно использовать для иммунизации и генотерапии нуклеиновыми кислотами с использованием стандартных протоколов доставки генов. Способы доставки генов известны в данной области. См., например, патенты США № 5399346, 5580859, 5589466, полностью включенные посредством ссылки в настоящее описание. В другом варианте осуществления изобретение относится к генотерапевтическому вектору.
Нуклеиновую кислоту можно клонировать в различные типы векторов. Например, нуклеиновую кислоту можно клонировать в вектор, включая, но, не ограничиваясь ими плазмиду, фагмиду, производное фага, вирус животных и космиду. Представляющие особый интерес векторы включают экспрессирующие векторы, репликационные векторы, образующие зонд векторы и векторы секвенирования.
Кроме того, экспрессирующий вектор можно доставлять в клетку в форме вирусного вектора. Технология вирусного вектора хорошо известна в данной области и описана, например, у Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1-4, Cold Spring Harbor Press, NY) и в других учебниках по вирусологии и молекулярной биологии. Вирусы, которые являются пригодными в качестве векторов, включают, но не ограничиваются ими, ретровирусы, аденовирусы, аденоассоциированные вирусы, вирусы герпеса и лентивирусы. В основном подходящий вектор содержит участок начала репликации, функциональный по меньшей мере в одном организме, промоторную последовательность, подходящие участки узнавания рестрикционных эндонуклеаз и один или более селектируемых маркеров, (например, WO 01/96584, WO 01/29058 и патент США № 6326193).
Был разработан ряд систем на основе вирусов для переноса генов в клетки млекопитающих. Например, ретровирусы представляют собой подходящую платформу для системы доставки генов. Выбранный ген можно вводить в вектор и упаковывать в ретровирусные частицы с применением известных в данной области способов. Затем рекомбинантный вирус можно выделять и доставлять в клетки индивидуума in vivo или ex vivo. В данной области известен ряд ретровирусных систем. В некоторых вариантах осуществления используют аденовирусные векторы. В данной области известен ряд аденовирусных векторов are. В одном из вариантов осуществления используют лентивирусные векторы.
Дополнительные промоторные элементы, например, энхансеры регулируют частоту начала транскрипции. Как правило, они располагаются в области 30-110 п.н. выше участка начала, хотя было показано, что ряд промоторов также содержит функциональные элементы ниже участка начала. Расстояние между промоторными элементами часто можно измененять, таким образом, что функция промотора сохраняется, когда элементы располагают в обратном порядке или перемещают относительно друг друга. В промоторе тимидинкиназы (tk) расстояние между промоторными элементами можно увеличивать до 50 п.н. в разные стороны до того, как активность начинает снижаться. Видимо, в зависимости от промотора индивидуальные элементы могут функционировать совместно или независимо для активации транскрипции.
Примером промотора, который способен экспрессировать трансген CAR в T-клетке у млекопитающего, является промотор EF1a. Нативный промотор EF1a направляет экспрессию альфа-субъединицы комплекса фактора элонгации 1, который обеспечивает ферментативную доставку аминоацил-тРНК в рибосому. Промотор EF1a широко использовался в плазмидах экспрессии млекопитающих, и было продемонстрировано, что он является эффективным для направления экспрессии CAR из трансгенов, клонированных в лентивирусный вектор. См., например, Milone et al., Mol. Ther., 17(8): 1453-1464 (2009). В одном из аспектов промотор EF1a содержит последовательность, предоставленную как SEQ ID NO: 11.
Другой пример промотора представляет собой последовательность предраннего промотора цитомегаловируса (CMV). Такая последовательность промотора представляет собой последовательность сильного конститутивного промотора, способную направлять высокие уровни экспрессии любой полинуклеотидной последовательности, функционально связанной с ней. Однако также можно использовать другие последовательности конститутивных промоторов, включая, но, не ограничиваясь ими, ранний промотор вируса обезьян 40 (SV40), вирус опухоли молочной железы мышей (MMTV), промотор длинного концевого повтора (LTR) вируса иммунодефицита человека (ВИЧ), промотор MoMuLV, промотор вируса лейкоза птиц, предранний промотор вируса Эпштейна-Барр, промотор вируса саркомы Рауса, а также промоторы генов человека, такие как, но, не ограничиваясь ими, промотор актина, промотор миозина, промотор фактора элонгации 1α, промотор гемоглобина и промотор креатинкиназы. Кроме того, изобретение не должно быть ограничено использованием конститутивных промоторов. Также предусматривают индуцибельные промоторы как часть изобретения. Использование индуцибельного промотора обеспечивает молекулярный переключатель, способный включать экспрессию полинуклеотидной последовательности, которая является функционально связанной, когда такая экспрессия является желательной, или выключение экспрессии, когда экспрессия не является желательной. Примеры индуцибельных промоторов включают, но не ограничиваются ими, промотор металлотионеина, промотор глюкокортикоидов, промотор прогестерона и промотор тетрациклина.
Другим примером промотора является промотор фосфоглицераткиназы (PGK). В вариантах осуществления желательным может являться усеченный промотор PGK (например, промотор PGK с одной или более, например, 1, 2, 5, 10, 100, 200, 300 или 400 делециями нуклеотидов по сравнению с последовательностью промотора PGK дикого типа). Нуклеотидные последовательности иллюстративных промоторов PGK приведены ниже.
Промотор PGK WT
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACGAGGGACCGCGACAGGCAGACGCTCCCATGATCACTCTGCACGCCGAAGGCAAATAGTGCAGGCCGTGCGGCGCTTGGCGTTCCTTGGAAGGGCTGAATCCCCGCCTCGTCCTTCGCAGCGGCCCCCCGGGTGTTCCCATCGCCGCTTCTAGGCCCACTGCGACGCTTGCCTGCACTTCTTACACGCTCTGGGTCCCAGCCGCGGCGACGCAAAGGGCCTTGGTGCGGGTCTCGTCGGCGCAGGGACGCGTTTGGGTCCCGACGGAACCTTTTCCGCGTTGGGGTTGGGGCACCATAAGCT
(SEQ ID NO: 597)
Иллюстративные усеченные промоторы PGK
PGK100:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTG
(SEQ ID NO: 598)
PGK200:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACG
(SEQ ID NO: 599)
PGK300:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACGAGGGACCGCGACAGGCAGACGCTCCCATGATCACTCTGCACGCCGAAGGCAAATAGTGCAGGCCGTGCGGCGCTTGGCGTTCCTTGGAAGGGCTGAATCCCCG
(SEQ ID NO: 600)
PGK400:
ACCCCTCTCTCCAGCCACTAAGCCAGTTGCTCCCTCGGCTGACGGCTGCACGCGAGGCCTCCGAACGTCTTACGCCTTGTGGCGCGCCCGTCCTTGTCCCGGGTGTGATGGCGGGGTGTGGGGCGGAGGGCGTGGCGGGGAAGGGCCGGCGACGAGAGCCGCGCGGGACGACTCGTCGGCGATAACCGGTGTCGGGTAGCGCCAGCCGCGCGACGGTAACGAGGGACCGCGACAGGCAGACGCTCCCATGATCACTCTGCACGCCGAAGGCAAATAGTGCAGGCCGTGCGGCGCTTGGCGTTCCTTGGAAGGGCTGAATCCCCGCCTCGTCCTTCGCAGCGGCCCCCCGGGTGTTCCCATCGCCGCTTCTAGGCCCACTGCGACGCTTGCCTGCACTTCTTACACGCTCTGGGTCCCAGCCG
(SEQ ID NO: 601)
Вектор также может содержать, например, сигнальную последовательность для облегчения секреции, сигнал полиаденилирования и терминатор транскрипции (например, из гена бычьего гормона роста (BGH)), элемент, обеспечивающий эписомальную репликацию и репликацию у прокариот (например, ориджин SV40 и ColE1 или другие известные в данной области), и/или элементы для обеспечения селекции (например, ген устойчивости к ампициллину и/или маркер зеоцин).
Для оценки экспрессии полипептида CAR или его участков экспрессирующий вектор, который необходимо вводить в клетку, также может содержать ген селективного маркера или репортерный ген, или оба для облегчения идентификации и селекции экспрессирующих клеток из популяции клеток, которую пытались трансфицировать или инфицировать вирусными векторами. В других аспектах селектируемый маркер может переноситься на отдельном участке ДНК, и его используют в процедуре совместной трансфекции. Селектируемые маркеры и репортерные гены можно фланкировать подходящими регуляторными последовательностями для обеспечения экспрессии в клетках-хозяевах. Пригодные селектируемые маркеры включают, например, гены устойчивости к антибиотику, такие как neo и т.п.
Репортерные гены используют для идентификации вероятно трансфицированных клеток и для оценки функциональности регуляторных последовательностей. В основном, репортерный ген представляет собой ген, который не содержится или не экспрессируется реципиентным организмом или тканью и который кодирует полипептид, экспрессия которого проявляется посредством любого легко детектируемого свойства, например, ферментативной активности. Экспрессию репортерного гена оценивают в подходящий момент времени после введения ДНК в клетки-реципиенты. Подходящие репортерные гены могут включать гены, кодирующие ген люциферазы, бета-галактозидазы, хлорамфеникол-ацетилтрансферазы, секретируемой щелочной фосфатазы или зеленого флуоресцентного белка (например, Ui-Tei et al., 2000 FEBS Letters, 479: 79-82). Подходящие экспрессирующие системы хорошо известны, и их можно получать известными способами или получать коммерчески. В основном, конструкцию с минимальной 5'-фланкирующей областью, для которой демонстрируют наиболее высокий уровень экспрессии репортерного гена, идентифицируют как промотор. Такие области промотора можно связывать с репортерным геном и использовать для оценки средств на способность модулировать направляемую промотором транскрипцию.
В одном из вариантов осуществления вектор может дополнительно содержат нуклеиновую кислоту, кодирующую второй CAR. В одном из вариантов осуществления второй CAR содержит антигенсвязывающий домен к мишени, экспрессируемой клетками острого миелолейкоза, такой как, например, CD33, CD34, CLL-1, FLT3 или рецептор фолата бета. В одном из вариантов осуществления вектор содержит последовательность нуклеиновой кислоты, кодирующую первый CAR, который направлен на первый антиген и содержит внутриклеточный сигнальный домен, содержащий костимулирующий сигнальный домен, но не первичный сигнальный домен, и нуклеиновую кислоту, кодирующую второй CAR, который направлен на второй отличный антиген и содержит внутриклеточный сигнальный домен, содержащий первичный сигнальный домен, но не костимулирующий сигнальный домен. В одном из вариантов осуществления вектор содержит нуклеиновую кислоту, кодирующую первый CD123 CAR, который содержит CD123-связывающий домен, трансмембранный домен и костимулирующий домен, и нуклеиновую кислоту, кодирующую второй CAR, который направлен на антиген, отличный от CD123 (например, антиген, экспрессируемый клетками AML, например, CD33, CD34, CLL-1, FLT3 или рецептор фолата бета) и содержит антигенсвязывающий домен, трансмембранный домен и первичный сигнальный домен. В другом варианте осуществления вектор содержит нуклеиновую кислоту, кодирующую первый CD123 CAR, который содержит CD123-связывающий домен, трансмембранный домен и первичный сигнальный домен, и нуклеиновую кислоту, кодирующую второй CAR, который направлен на антиген, отличный от CD123 (например, антиген, экспрессируемый клетками AML, например, CD33, CLL-1, CD34, FLT3 или рецептор фолата бета) и содержит антигенсвязывающий домен к антигену, трансмембранный домен и костимулирующий сигнальный домен.
В одном из вариантов осуществления вектор содержит нуклеиновую кислоту, кодирующую CD123 CAR, описываемый в настоящем описании, и нуклеиновую кислоту, кодирующую ингибирующий CAR. В одном из вариантов осуществления ингибирующий CAR содержит антигенсвязывающий домен, который связывает антиген, встречающийся на нормальных клетках, но не злокачественных клетках, например, нормальных клетках, которые также экспрессируют CD123. В одном из вариантов осуществления ингибирующий CAR содержит антигенсвязывающий домен, трансмембранный домен и внутриклеточный домен ингибирующей молекулы. Например, внутриклеточный домен ингибирующего CAR может представлять собой внутриклеточный домен PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозин и TGFR бета.
В вариантах осуществления вектор может содержать две или более последовательностей нуклеиновой кислоты, кодирующей CAR, например, CD123 CAR, описываемый в настоящем описании, и второй CAR, например, ингибирующий CAR или CAR, который специфически связывается с антигеном, отличным от CD123 (например, антигеном, экспрессируемым клетками AML, например, CLL-1, CD33, CD34, FLT3 или рецептор фолата бета). В таких вариантах осуществления две или более последовательностей нуклеиновой кислоты, кодирующие CAR, кодируются одной нуклеиновой молекулой в той же рамке считывания и в виде одной полипептидной цепи. В этом аспекте два или более CAR могу, например, являться разделенными одним или более участками расщепления пептида. (Например, участок ауторасщепления или субстрат для внутриклеточной протеазы). Примеры участков расщепления пептида включают следующие ниже, где остатки GSG являются необязательными:
T2A: (GSG) EGRGSLLTCGDVEENPGP (SEQ ID NO: 602)
P2A: (GSG) ATNFSLLKQAGDVEENPGP (SEQ ID NO: 603)
E2A: (GSG) QCTNYALLKLAGDVESNPGP(SEQ ID NO:604)
F2A: (GSG) VKQTLNFDLLKLAGDVESNPGP (SEQ ID NO:605)
Способы введения и экспрессии генов в клетке известны в данной области. В отношении экспрессирующего вектора вектор можно легко вводить в клетку-хозяин, например, клетку млекопитающего, бактериальную клетку, дрожжевую клетку или клетку насекомого любым способом в данной области. Например, экспрессирующий вектор можно переносить в клетку-хозяина физическими, химическими или биологическими средствами.
Физические способы введения полинуклеотида в клетку-хозяина включают осаждение фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию и т.п. Способы получения клетки, содержащей векторы и/или экзогенные нуклеиновые кислоты, хорошо известны в данной области. См., например, Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1-4, Cold Spring Harbor Press, NY). Предпочтительный способ введения of полинуклеотида в клетку-хозяина представляет собой трансфекцию с использованием фосфата кальция.
Биологические способы введения представляющего интерес полинуклеотида в клетку-хозяина включают использование ДНК- и РНК-векторов. Вирусные векторы и особенно ретровирусные векторы стали наиболее широко используемым способом вставки генов в клетки млекопитающих, например, клетки человека. Другие вирусные векторы можно получать из лентивируса, поксвирусы, вирус простого герпеса I, аденовирусы и аденоассоциированные вирусы и т.п. См., например, патенты США № 5350674 и 5585362.
Химические средства введения полинуклеотида в клетку-хозяина включают коллоидные дисперсные системы, такие как макромолекулярные комплексы, нанокапсулы, микросферы, гранулы и системы на основе липидов, включая эмульсии "масло-в-воде", мицеллы, смешанные мицеллы и липосомы. Иллюстративная коллоидная система для применения в качестве носителя для доставки in vitro и in vivo представляет собой липосому (например, искусственную мембранную везикулу). Доступными являются другие способы современного уровня техники направленной доставки нуклеиновых кислот, такие как доставка полинуклеотидов направленными наночастицами или с использованием другой подходящей системы доставки субмикронного размера.
В случае, когда используют систему доставки не на основе вируса, иллюстративный носитель для доставки представляет собой липосому. Для введения нуклеиновых кислот в клетку-хозяина (in vitro, ex vivo или in vivo) предусматривают использование липидных составов. В другом аспекте нуклеиновая кислота может являться связанной с липидом. Нуклеиновую кислоту, связанную с липидом, можно инкапсулировать в водном содержимом липосомы, рассеянном в липидном бислое липосомы, связанном с липосомой посредством связывающей молекулы, которая является связанной с липосомой и олигонуклеотидом, заключенном в липосоме, в комплексе, образуемым с липосомой, диспергированном в растворе, содержащем липид, смешанном с липидом, объединенным с липидом, содержащемся в виде суспензии в липиде, содержащемся или образующим комплекс с мицеллой, или иным образом связанным с липидом. Связанные с липидом, липидом/ДНК или липидом/экспрессирующим вектором композиции не ограничены какой-либо конкретной структурой в растворе. Например, они могут содержаться в бислойной структуре в виде мицелл или со "свернутой" структурой. Они также могут просто являться диспергированными в растворе, возможно, образуя агрегаты, которые не являются однородными по размеру или форме. Липиды представляют собой жировые вещества, которые могут являться природными или синтетическими липидами. Например, липиды включают жировые капли, которые естественным образом возникают в цитоплазме, а также класс соединений, которые содержат длинноцепочечные алифатические углеводороды и их производные, такие как жирные кислоты, спирты, амины, амино спирты и альдегиды.
Пригодные для использования липиды можно получать из коммерческих источников. Например, димиристилфосфатидилхолин ("DMPC") можно получать от Sigma, St. Louis, MO; дицетилфосфат ("DCP") можно получать от K and K Laboratories (Plainview, NY); холестерин ("Choi") можно получать от Calbiochem-Behring; димиристилфосфатидилглицерин ("DMPG") и другие липиды можно получать от Avanti Polar Lipids, Inc. (Birmingham, AL.). Исходные растворы липидов в хлороформе или хлороформе/метаноле можно хранить приблизительно при -20°C. В качестве растворителя используют только хлороформ, т.к. он намного быстрее испаряется, чем метанол. "Липосома" представляет собой общий термин, включающий ряд однослойных и многослойных липидных носителей, образованных поколением закрытых липидных бислойных структур или агрегатов. Липосомы можно характеризовать как имеющие везикулярные структуры с фосфолипидной бислойной мембраной и внутренней водной средой. Многослойные липосомы содержат множественные липидные слои, разделенные водной средой. Они формируются спонтанно, когда фосфолипиды суспендируют в избытке водного раствора. Липидные компоненты претерпевают перегруппировку перед тем, как образовывать закрытые структуры и захватывать воду и растворенные вещества между липидными бислоями (Ghosh et al., 1991 Glycobiology, 5: 505-10). Однако также предусмотрены композиции, которые содержат различные структуры в растворе, отличные от обычной везикулярной структуры. Например, липиды могут допускать мицеллярную структуру или существовать только в виде неоднородных агрегатов липидных молекул. Также предусматривают комплексы липофектамин-нуклеиновая кислота.
Независимо от способа, используемого для введения экзогенных нуклеиновых кислот в клетку-хозяина или иным образом подвергание клетки действию ингибитора по настоящему изобретению, для подтверждения присутствия последовательности рекомбинантной ДНК в клетке-хозяине можно проводить ряд анализов. Такие анализы включают, например, "молекулярные биологические" анализы, хорошо известные специалистам в данной области, такие как "саузерн"- и "нозерн"-блоттинг, ОТ-ПЦР и ПЦР; "биохимические" анализы, такие как детектирование присутствия или отсутствия конкретного пептида, например, иммунологическими способами (виды ELISA и вестерн-блоттинг) или анализами, описываемыми в настоящем описании для идентификации средств, входящих в объем изобретения.
Настоящее изобретение дополнительно относится к вектору, содержащему кодирующую CAR молекулу нуклеиновой кислоты. В одном из аспектов вектор CAR можно непосредственно трансдуцировать в клетку, например, эффекторную клетку иммунной системы, например, T-клетку или NK-клетку. В одном из аспектов вектор представляет собой клонирующий или экспрессирующий вектор, например, вектор, включая, но, не ограничиваясь ими, одну или более плазмидных (например, экспрессионных плазмид, клонирующих векторов, миниколец, минивекторов, двойных микрохромосом), ректровирусных и лентивирусных векторных конструкций. В одном из аспектов вектор способен экспрессировать конструкцию CAR в эффекторных клетках иммунной системы млекопитающих, например, T-клетках млекопитающих или NK-клетках млекопитающих. В одном из аспектов T-клетка млекопитающего представляет собой T-клетку человека.
Источники клеток
Перед размножением и генетической модификацией получают источник клеток (например, эффекторных клеток иммунной системы, например, T-клеток или NK-клеток) от индивидуума. Термин "индивидуум" предназначен включать живые организмы, у которых можно вызывать иммунный ответ, (например, млекопитающих). Примеры индивидуумов включают людей, собак, кошек, мышей, крыс и их трансгенные виды.
T-клетки можно получать из ряда источников, включая мононуклеарные клетки периферической крови, костный мозг, ткань лимфоузла, пуповинную кровь, ткань тимуса, ткань из участка инфекции, асцит, плевральный выпот, ткань селезенки и опухоли.
В определенных аспектах настоящего изобретения можно использовать любое число линий эффекторных клеток иммунной системы (например, T-клеток или NK-клеток), доступных в данной области. В определенных аспектах настоящего изобретения T-клетки можно получать из единицы крови, собираемой у индивидуума с использованием любого количества техник, известных специалисту в данной области, таких как разделение Ficoll™. В одном из предпочтительных аспектов клетки из циркулирующей крови индивидуума получают посредством афереза. Продукт афереза, как правило, содержит лимфоциты, включая T-клетки, моноциты, гранулоциты, B-клетки, другие ядросодержащие лейкоциты, эритроциты и тромбоциты. В одном из аспектов клетки, собираемые аферезом, можно промывать для удаления фракции плазмы и помещать клетки в подходящий буфер или среду для последующих этапов обработки. В одном из аспектов изобретения клетки промывают фосфатно-солевым буфером (PBS). В альтернативном аспекте промывной раствор не содержит кальций и может не содержать магний, или может не содержать многие, если не все двухвалентные катионы. Начальные этапы активации при отсутствии кальция могут приводить к увеличенной активации. Как будет легко понять специалистам в данной области этап промывания можно проводить способами, известными специалистам в данной области, такими как с использованием полуавтоматический "проточной" центрифуги (например, устройства для обработки клеток Cobe 2991, Baxter CytoMate или Haemonetics Cell Saver 5) по инструкциям производителя. После промывания клетки можно ресуспендировать в различных биосовместимых буферах, таких как, например, не содержащих Ca, не содержащих Mg PBS, PlasmaLyte A или другой физиологический раствор с буфером или без него. Альтернативно, можно удалять нежелательные компоненты образца афереза и непосредственно ресуспендировать клетки в средах для культивирования.
Установлено, что в способах применения можно использовать условия среды для культивирования, предусматривающие 5% или менее, например, 2%, сыворотки AB человека и применять известные условия среды для культивирования и композиции, например, такие, как описанные у Smith et al., "Ex vivo expansion of human T cells for adoptive immunotherapy using the novel Xeno-free CTS Immune Cell Serum Replacement", Clinical and Translational Immunology (2015) 4, e31; doi:10.1038/cti.2014.31.
В одном из аспектов T-клетки выделяют из лимфоцитов периферической крови посредством лизиса эритроцитов и истощения моноцитов, например, центрифугированием в градиенте PERCOLLTM или проточным элютриационным центрифугированием. Можно дополнительно выделять конкретную подпопуляцию T-клеток, таких как CD3+, CD28+, CD4+, CD8+, CD45RA+ и CD45RO+ T-клетки, способами положительной или отрицательной секлекции. Например, в одном из аспектов T-клетки выделяют посредством инкубации с конъюгированными с антителом против CD3/против CD28 (например, 3×28) гранулами, такими как DYNABEADS® M-450 CD3/CD28T, в течение периода времени, достаточного для положительной селекции желаемых T-клеток. В одном из аспектов период времени составляет приблизительно 30 минут. В дополнительном аспекте период времени находится в диапазоне от 30 минут до 36 часов или больше и всех целочисленных значений в этом диапазоне. В дополнительном аспекте период времени составляет по меньшей мере 1, 2, 3, 4, 5 или 6 часов. В еще одном другом предпочтительном аспекте период времени составляет от 10 до 24 часов. В одном из аспектов период времени инкубации составляет 24 часа. Можно использовать большее время инкубации для выделения T-клеток в любой ситуации, когда существует несколько T-клеток по сравнению с другими типами клеток, как при выделении проникающих в опухоль лимфоцитов (TIL) из опухолевой ткани или у индивидуумов с ослабленным иммунитетом. Кроме того, использование большего времени инкубации может увеличивать эффективность захвата CD8+T-клеток. Таким образом, простым сокращением или увеличением времени можно обеспечивать связывание T-клеток с гранулами CD3/CD28 и/или увеличением или уменьшением отношения гранул к T-клеткам (как описано дополнительно в настоящем описании) подпопуляции T-клеток можно предпочтительно отбирать на или против в момент начала культивирования или в любые другие моменты времени во время процесса. Кроме того, увеличением или уменьшением отношения антитела против CD3 и/или антитела против CD28 на гранулах или другой поверхности подпопуляции T-клеток можно предпочтительно отбирать на или против в момент начала культивирования или в другие желаемые моменты времени. Специалисту в данной области будет понятно, что в контексте настоящего изобретения также можно использовать многие этапы селекции. В определенных аспектах желательным может являться проведение способа селекции и использование "неотобранных" клеток в способе активации и размножении. "Неотобранные" клетки также можно подвергать дополнительным этапам селекции.
Обогащение популяции T-клеток отрицательной селекцией можно проводить с использованием комбинации антител, направленных на поверхностные маркеры, уникальные для отрицательно селектируемых клеток. Один из способов представляет собой сортировку и/или селекцию клеток посредством отрицательной магнитной иммунной адгезии или проточной цитометрии, в которой используют смесь моноклональных антител, направленных на маркеры клеточной поверхности, присутствующие на клетках, подвергаемых отрицательной селекции. Например, для обогащения CD4+-клетками отрицательной селекцией смесь моноклональных антител, как правило, содержит антитела против CD14, CD20, CD11b, CD16, HLA-DR и CD8. В определенных аспектах желательным может являться обогащение или положительная селекция регуляторных T-клеток, которые, как правило, экспрессируют CD4+, CD25+, CD62Lhi, GITR+ и FoxP3+. Альтернативно, в определенных аспектах регуляторные T-клетки истощают посредством гранул, конъюгированных с антителами против C25, или другим аналогичным способом селекции.
Способы, описываемые в настоящем описании, могут включать, например, селекцию конкретной подпопуляции эффекторных клеток иммунной системы, например, T-клеток, которые представляют собой популяция истощенных T-регуляторных клеток, CD25+ истощенных клеток, с использованием, например, способа отрицательной селекции, например, описываемого в настоящем описании. Предпочтительно популяция истощенных регуляторных T-клеток содержит менее 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток.
В одном из вариантов осуществления регуляторные T-клетки, например, CD25+ T-клетки удаляют из популяции с использованием антитела против CD25 или его фрагмента, или CD25-связывающего лиганда, IL-2. В одном из вариантов осуществления антитело против CD25 или его фрагмент, или CD25-связывающий лиганд является конъюгированным с субстратом, например, гранулой, или иным образом нанесен на субстрат, например, гранулу. В одном из вариантов осуществления антитело против CD25 или его фрагмент является конъюгированным с субстратом, как описано в настоящем описании.
В одном из вариантов осуществления регуляторные T-клетки, например, CD25+ T-клетки удаляют из популяции с использованием реагент для истощения для истощения CD25 от Miltenyi™. В одном из вариантов осуществления отношение клеток к реагенту для истощения CD25 составляет от 1e7 клеток до 20 мкл, или от 1e7 клеток до 15 мкл, или от 1e7 клеток до 10 мкл, или от 1e7 клеток до 5 мкл, или от 1e7 клеток до 2,5 мкл, или от 1e7 клеток до 1,25 мкл. В одном из вариантов осуществления, например, для регуляторных T-клеток, например, используют истощение CD25+ более 500 миллионов клеток/мл. В дополнительном аспекте используют концентрацию клеток 600, 700, 800 или 900 миллионов клеток/мл.
В одном из вариантов осуществления популяция эффекторных клеток иммунной системы, которую необходимо подвергать истощению, содержит приблизительно 6×109 CD25+ T-клеток. В других аспектах популяция эффекторных клеток иммунной системы, которую необходимо подвергать истощению, содержит приблизительно от 1×109 до 1×1010 CD25+ T-клеток и любое целочисленное значение в этом диапазоне. В одном из вариантов осуществления получаемая популяция истощенных регуляторных T-клеток содержит 2×109 регуляторных T-клеток, например, CD25+ клеток или менее (например, 1×109, 5×108, 1×108, 5×107, 1×107 или менее CD25+ клеток).
В одном из вариантов осуществления регуляторные T-клетки, например, CD25+ клетки, удаляют из популяции с использованием системы CliniMAC с набором трубок для истощения, таком как, например, трубка 162-01. В одном из вариантов осуществления система CliniMAC работает с установленным параметром для истощения, таким как, например, DEPLETION2.1.
Без желания быть связанными конкретной теорией, снижение уровня отрицательных регуляторов иммунных клеток (например, снижение числа нежелательных иммунных клеток, например, TREG-клеток) у индивидуума до афереза или во время получения продукта экспрессирующей CAR клетки может снижать риск рецидива у индивидуума. Например, способы истощения TREG-клеток известны в данной области. Способы снижения уровня TREG-клеток включают, но не ограничиваются ими, циклофосфамид, антитело против GITR (антитело против GITR, описываемое в настоящем описании), истощение CD25 и их сочетания.
В некоторых вариантах осуществления способы получения включают снижение числа (например, истощение) TREG-клеток до получения экспрессирующей CAR клетки. Например, способы получения включают приведение образца, например, образец после афереза в контакт с антителом против GITR и/или антителом против CD25 (или его фрагментом, или CD25-связывающим лигандом), например, для истощения TREG-клеток до получения продукта экспрессирующей CAR клетки (например, T-клетки, NK-клетки).
В одном из вариантов осуществления индивидуум получает предварительное лечение одним или более видами терапии, которая снижает TREG-клетки до сбора клеток для получения продукта экспрессирующей CAR клетки, таким образом, снижая риск рецидива у индивидуума при лечении экспрессирующими CAR клетками. В одном из вариантов осуществления способы снижения TREG-клеток включают, но не ограничиваются ими, введение индивидууму одного или более из циклофосфамида, антитела против GITR, истощения CD25 или их сочетания. Введение одного или более из циклофосфамида, антитела против GITR, истощения CD25 или их сочетания может происходить во время или после инфузии продукта экспрессирующей CAR клетки.
В одном из вариантов осуществления индивидуум получает предварительное лечение циклофосфамидом до сбора клеток для получения продукта экспрессирующей CAR клетки, таким образом, снижая риск рецидива у индивидуума при лечении экспрессирующим CAR клетками. В одном из вариантов осуществления индивидуум получает предварительное лечение антителом против GITR до сбора клеток для получения продукта экспрессирующей CAR клетки, таким образом, снижая риск рецидива у индивидуума при лечении экспрессирующим CAR клетками.
В одном из вариантов осуществления популяция клеток, которую следует удалять, не представляет собой регуляторные T-клетки или опухолевые клетки, а клетки, которые иным образом отрицательно влияют на размножение и/или функцию CART-клеток, например, клетки, экспрессирующие CD14, CD11b, CD33, CD15 или другие маркеры, экспрессируемые возможными иммуносупрессивными клетками. В одном из вариантов осуществления предусматривают удалять такие клетки одновременно с регуляторными T-клетками и/или опухолевыми клетки или после указанного истощения или в другом порядке.
Способы, описываемые в настоящем описании, могут включают более одного этапа селекции, например, более одного этапа истощения. Обогащение популяции T-клеток посредством отрицательной селекции можно проводить, например, комбинацией антител, направленных на поверхностные маркеры, уникальные для подвергаемых отрицательной селекции клеток. Один из способов представляет собой сортировка и/или селекция клеток посредством отрицательной магнитной иммунной адгезии или проточной цитометрии, в которой используют смесь моноклональных антител, направленных на маркеры клеточной поверхности, присутствующие на клетках, подвергаемых отрицательной селекции. Например, для обогащения CD4+-клеток посредством отрицательной селекции смесь моноклональных антител может содержать антитела против CD14, CD20, CD11b, CD16, HLA-DR и CD8.
Описываемые в настоящем описании способы могут дополнительно включают удаление клеток из популяции, которая экспрессирует опухолевый антиген, например, опухолевый антиген, которые не содержит CD25, например, CD19, CD30, CD38, CD123, CD20, CD14 или CD11b, таким образом, обеспечивая популяцию истощенных регуляторных T-клеток, например, истощенных по CD25+ и истощенных по опухолевому антигену клеток, которые являются подходящими для экспрессии CAR, например, CAR, описываемого в настоящем описании. В одном из вариантов осуществления экспрессирующие опухолевый антиген клетки удаляют одновременно с регуляторными T-клетками, например, CD25+ клетками. Например, антитело против CD25 или его фрагмент, и антитело против опухолевого антигена, или его фрагмент можно присоединять к тому же субстрату, например, грануле, которую можно использовать для удаления клеток, или антитело против CD25 или его фрагмент, или антитело против опухолевого антигена, или его фрагмент можно присоединять к отдельным гранулам, смесь которых можно использовать для удаления клеток. В других вариантах осуществления удаление регуляторных T-клеток, например, CD25+ клеток и удаление экспрессирующих опухолевый антиген клеток является последовательным и может происходить, например, в любом порядке.
Также раскрыты способы, которые включают удаление клеток из популяции, которые экспрессируют ингибитор контрольных точек, например, ингибитор контрольных точек, описываемых в настоящем описании, например, одной или более PD1+ клеток, LAG3+ клеток и TIM3+ клеток, чтобы таким образом обеспечивать популяцию истощенных регуляторных T-клеток, например, истощенных CD25+ клеток и истощенных по ингибитору контрольных точек клеток, например, истощенных PD1+, LAG3+ и/или TIM3+ клеток. Иллюстративные ингибиторы контрольных точек включают B7-H1, B7-1, CD160, P1H, 2B4, PD1, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, TIGIT, CTLA-4, BTLA и LAIR1. В одном из вариантов осуществления экспрессирующие ингибитор контрольных точек клетки удаляют одновременно с регуляторными T-клетками, например, CD25+ клетками. Например, антитело против CD25 или его фрагмент, и антитело против ингибитора контрольных точек или его фрагмент можно связывать с одной и той же гранулой, которую можно использовать для удаления клеток, или антитело против CD25 или его фрагмент и антитело против ингибитора контрольных точек или его фрагмент можно связывать с отдельными гранулами, смесь которых можно использовать для удаления клеток. В других вариантах осуществления удаление регуляторных T-клеток, например, CD25+ клеток и удаление экспрессирующих ингибитор контрольных точек клеток является последовательным и может происходить, например, в любом порядке.
В одном из вариантов осуществления можно выбирать популяцию T-клеток, которая экспрессирует один или более из IFN-γ, TNFα, IL-17A, IL-2, IL-3, IL-4, GM-CSF, IL-10, IL-13, гранзим B и перфорин или других подходящих молекул, например, других цитокинов. Можно определять способы скрининга экспрессии клеток, например, способами, описанными в публикации PCT № WO 2013/126712.
Для выделения желаемой популяции клеток положительной или отрицательной селекцией концентрацию клеток и поверхность (например, частиц, таких как гранулы) можно изменять. В определенных аспектах желательным может являться значительное уменьшение объема, в котором гранулы и клетки смешивают друг с другом (например, увеличение концентрации клеток), для обеспечения максимального контактирования клеток и гранул. Например, в одном из аспектов используют концентрацию 2 миллиарда клеток/мл. В одном из аспектов концентрация используют 1 миллиард клеток/мл. В дополнительном аспекте используют более 100 миллионов клеток/мл. В дополнительном аспекте используют концентрацию клеток 10, 15, 20, 25, 30, 35, 40, 45 или 50 миллионов клеток/мл. В еще одном другом аспекте используют концентрацию клеток 75, 80, 85, 90, 95 или 100 миллионов клеток/мл. В дополнительных аспектах можно использовать концентрации 125 или 150 миллионов клеток/мл. Использование высоких концентраций может приводить к увеличенному выходу клеток, активации клеток и размножению клеток. Кроме того, использование высоких концентраций клеток обеспечивает более эффективный захват клеток, которые могут слабо экспрессировать представляющие интерес антигены-мишени, такие как CD28-отрицательные T-клетки, или из образцов, в которых содержится много опухолевых клеток (например, лейкозная кровь, опухолевая ткань и т.д.). Такие популяции клеток могут иметь терапевтическую ценность, и их получение является желательным. Например, использование высокой концентрации клеток обеспечивает более эффективную селекцию CD8+ T-клеток, которые обычно характеризуются более слабой экспрессией CD28.
В родственном аспекте желательным может являться использование более низких концентраций клеток. Путем значительного разбавления смеси T-клеток и поверхности (например, частиц, таких как гранулы) можно сводить к минимуму взаимодействия между частицами и клетками. Это приводит к селекции клеток, которые экспрессируют высокие количества желаемых антигенов, которые должны связываться с частицами. Например, CD4+ T-клетки экспрессируют более высокие уровни CD28 и более эффективно захватываются по сравнению с CD8+ T-клетками в разбавленных концентрациях. В одном из аспектов используемая концентрация клеток составляет 5×10e6/мл. В других аспектах используемая концентрация может составлять приблизительно от 1×105/мл до 1×106/мл и любое целочисленное значение в этом диапазоне.
В других аспектах клетки можно инкубировать на шейкере в течение различных периодов времени при различных скоростях при 2-10°C или при комнатной температуре.
T-клетки для стимуляции также можно замораживать после этапа промывания. Без желания быть связанными теорией, этап замораживания последующего размораживания обеспечивает более однородный продукт в результате удаления гранулоцитов и в некоторой степени моноцитов в популяции клеток. После этапа промывания, который удаляет плазму и тромбоциты, клетки можно суспендировать в замораживающем растворе. Несмотря на то, что многие замораживающие растворы и параметры известны в данной области и являются пригодными в этом контексте, один из способов включает использование PBS, содержащего 20% DMSO и 8% сывороточного альбумина человека, или среды для культивирования, содержащей 10% декстрана 40 и 5% декстрозы, 20% сывороточного альбумина человека и 7,5% DMSO или 31,25% Plasmalyte A, 31,25% декстрозы 5%, 0,45% NaCl, 10% декстрана 40 и 5% декстрозы, 20% сывороточного альбумина человека и 7,5% DMSO или других подходящих замораживающих сред для культивирования клеток, содержащих например, Hespan и PlasmaLyte A, затем клетки замораживают до -80°C со скоростью 1° в минуту и хранят в газовой фазе в резервуаре для хранения с жидким азотом. Можно использовать другие способы контролируемого замораживания, а также неконтролируемое моментальное замораживание при -20°C или в жидком азоте.
В определенных аспектах криоконсервированные клетки размораживают и промывают, как описано в настоящем описании, и оставляют уравновешиваться в течение одного часа при комнатной температуре перед активацией способами по настоящему изобретению.
Также в контексте изобретения предусматривают сбор образцов крови или аферез у индивидуума в момент времени до того, как размноженные клетки, как описано в настоящем описании, могут понадобиться. Таким образом, источник клеток, которые необходимо размножать, можно собирать в любой необходимый момент времени и желаемые клетки, такие как эффекторные клетки иммунной системы, например, T-клетки или NK-клетки, выделять и замораживать для дальнейшего использования в T-клеточной терапии для любых возможных заболеваний или состояний, для которых клеточная терапия будет являться эффективной, например, T-клеточная терапия, такая как T-клеточная терапия, описываемая в настоящем описании. В одном из аспектов отбирают образец крови или проводят аферез у в основном здорового индивидуума. В определенных аспектах отбирают образец крови или проводят аферез у в основном здорового индивидуума, который подвергается риску развития заболевания, но у которого заболевание еще не развилось, и представляющие интерес клетки выделяют и замораживают для дальнейшего использования. В определенных аспектах эффекторные клетки иммунной системы, например, T-клетки или NK-клетки можно размножать, замораживать и использовать позже. В определенных аспектах образцы собирают у пациента сразу же после диагностики конкурентного заболевания, как описано в настоящем описании, но до любых видов лечения. В дополнительном аспекте клетки выделяют из образца крови или в результате афереза у индивидуума до любых возможных соответствующих способов лечения, включая, но, не ограничиваясь ими лечение средствами, такими как натализумаб, эфализумаб, противовирусные средства, химиотерапия, радиация, иммуносупрессирующие средства, такие как циклоспорин, азатиоприн, метотрексат, микофенолат и FK506, антитела или другие иммунодеструктивные средства, такие как CAMPATH, антитела против CD3, цитоксан, флударабин, циклоспорин, FK506, рапамицин, микофеноловая кислота, стероиды, FR901228 и облучение.
В дополнительном аспекте настоящего изобретения T-клетки получают от пациента непосредственно после лечения, которое оставляет у индивидуума функциональные T-клетки. В отношении этого наблюдали, что после определенных видов лечения злокачественных опухолей, в частности видов лечения лекарственными средствами, которые повреждают иммунную систему, сразу же после лечения во время периода, когда пациенты, как правило, восстанавливаются после лечения, качество получаемых T-клеток может являться оптимальным или улучшенным в отношении их способности размножаться ex vivo. Аналогично, после манипуляции ex vivo способами, описываемыми в настоящем описании, эти клетки могут находиться в предпочтительном состоянии для повышенного приживления и размножения in vivo. Таким образом, в контексте настоящего изобретения предусматривают сбор клеток крови, включая T-клетки, дендритные клетки или другие клетки ростка кроветворения во время фазы восстановления. Кроме того, в определенных аспектах можно использовать режим мобилизации (например, мобилизации GM-CSF) и кондиционирования для создания условий у индивидуума, при которых благоприятной является репопуляция, рециркуляция, регенерация и/или размножение конкретных типов клеток, особенно в течение определенного временного окна после терапии. Иллюстративные типы клеток включают T-клетки, B-клетки, дендритные клетки и другие клетки иммунной системы.
В одном из вариантов осуществления эффекторные клетки иммунной системы, экспрессирующие молекулу CAR, например, молекулу CAR, описываемую в настоящем описании, получают от индивидуума, который получал низкую иммуностимулирующую дозу ингибитора mTOR. В одном из вариантов осуществления популяцию эффекторных клеток иммунной системы, например, T-клетки, которые необходимо конструировать для экспрессии CAR, собирают через достаточный период времени или после достаточного дозирования низкой иммуностимулирующей дозой ингибитора mTOR, таким образом, что уровень PD1-отрицательных эффекторных клеток иммунной системы, например, T-клеток или отношение PD1-отрицательных эффекторных клеток иммунной системы, например, T-клеток/PD1-положительных эффекторных клеток иммунной системы, например, T-клеток, у индивидуума или в собираемых от индивидуума по меньшей мере временно увеличивалось.
В других вариантах осуществления популяция эффекторных клеток иммунной системы, например, T-клеток, которые конструировали или будут конструировать для экспрессии CAR, можно обрабатывать ex vivo посредством приведения в контакт с определенным количеством ингибитора mTOR, который увеличивает число PD1-отрицательных эффекторных клеток иммунной системы, например, T-клеток или увеличивает отношение PD1-отрицательных эффекторных клеток иммунной системы, например, T-клеток/PD1-положительных эффекторных клетки иммунной системы, например, T-клеток.
В одном из вариантов осуществления популяция T-клеток является дефицитной по диаглицеролкиназе (DGK). DGK-дефицитные клетки включают клетки, которые не экспрессируют РНК DGK или белок DGK или обладают сниженной или ингибированной активностью DGK. DGK-дефицитные клетки можно получать посредством генетических подходов, например, введением РНК-интерферирующих средств, например, миРНК, кшРНК, мкРНК для снижения или предотвращения экспрессии DGK. Альтернативно, DGK-дефицитные клетки можно получать обработкой ингибиторами DGK, описываемыми в настоящем описании.
В одном из вариантов осуществления популяция T-клеток является Ikaros-дефицитной. Ikaros-дефицитные клетки включают клетки, которые не экспрессируют РНК Ikaros РНК или белок Ikaros или обладают сниженной или ингибированной активностью Ikaros, Ikaros-дефицитные клетки можно получать посредством генетических подходов, например, введением РНК- интерферирующих средств, например, миРНК, кшРНК, мкРНК для снижения или предотвращения экспрессии Ikaros. Альтернативно, Ikaros-дефицитные клетки можно получать обработкой ингибиторами Ikaros, например, леналидомидом.
В вариантах осуществления популяция T-клеток является DGK-дефицитной и Ikaros-дефицитной, например, не экспрессирует DGK и Ikaros или обладает сниженной или ингибированной активностью DGK и Ikaros. Такие DGK- и Ikaros-дефицитные клетки можно получать любым способом, описываемым в настоящем описании.
В одном из вариантов осуществления NK-клетки получают от индивидуума. В другом варианте осуществления NK-клетки представляют собой линию NK-клеток, например, линию клеток NK-92 (Conkwest).
Аллогенные эффекторные клетки иммунной системы с CAR
В вариантах осуществления, описываемых в настоящем описании, эффекторная клетка иммунной системы может представлять собой аллогенную эффекторную клетку иммунной системы, например, T-клетку или NK-клетку. Например, клетка может представлять собой аллогенную T-клетку, например, аллогенную T-клетку, в которой отсутствует экспрессия функционального T-клеточного рецептора (TCR) и/или лейкоцитарного антигена человека (HLA), например, HLA I класса и/или HLA II класса.
T-клетку, не содержащую функциональный TCR, можно, например, конструировать таким образом, чтобы она не экспрессировала какой-либо функциональный TCR на своей поверхности, конструировать таким образом, чтобы она не экспрессировала одну или более субъединиц, которые содержат функциональный TCR (например, конструировать таким образом, что она не экспрессирует (или обладает сниженной экспрессией) TCR-альфа, TCR-бета, TCR-гамма, TCR-дельта, TCR-эпсилон и/или TCR-дзета), или конструировать таким образом, что она продуцирует очень мало функционального TCR на своей поверхности. Альтернативно, T-клетка может экспрессировать по существу поврежденный TCR, например, в результате экспрессии мутантных или усеченных форм одной или более из субъединиц TCR. Термин "по существу поврежденный TCR" означает, что такой TCR не вызывает неблагоприятный иммунный ответ у хозяина.
T-клетку, описываемую в настоящем описании, можно, например, конструировать таким образом, чтобы она не экспрессировала функциональный HLA на своей поверхности. Например, T-клетку, описываемую в настоящем описании, можно конструировать таким образом, чтобы экспрессия HLA на клеточной поверхности, например, HLA I класса и/или HLA II класса являлась сниженной. В некоторых аспектах подавление HLA можно проводить путем снижения или устранения экспрессии бета-2-микроглобулина (B2M).
В некоторых вариантах осуществления T-клетка может не содержать функциональный TCR и функциональный HLA, например, HLA I класса и/или HLA II класса.
Модифицированные T-клетки, в которых отсутствует экспрессия функционального TCR и/или HLA, можно получать любыми подходящими способами, включая нокаут или нокдаун одной или более субъединиц TCR или HLA. Например, T-клетка может включают нокдаун TCR и/или HLA с использованием миРНК, кшРНК, коротких палиндромных повторов, расположенных группами, равномерно удаленными друг от друга (CRISPR), эффекторной нуклеазы, подобной активаторам транскрипции (TALEN) или эндонуклеазы цинковые пальцы (ZFN).
В некоторых вариантах осуществления аллогенная клетка может представлять собой клетку, которая не экспрессирует или экспрессирует ингибирующую молекулу на низких уровнях, например, любым методом, описываемым в настоящем описании. Например, клетка может представлять собой клетку, которая не экспрессирует или экспрессирует ингибирующую молекулу на низких уровнях, например, которая может снижать способность экспрессирующей CAR клетки повышать ответ иммунного эффектора. Примеры ингибирующих молекул включают PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозин и TGFR бета. Ингибирование ингибирующей молекулы, например, путем ингибирования уровня ДНК, РНК или белка может оптимизировать характеристики экспрессирующей CAR клетки. В вариантах осуществления можно использовать ингибирующую нуклеиновую кислоту, например, ингибирующую нуклеиновую кислоту, например, дцРНК, например, миРНК или кшРНК, короткие палиндромные повторы, расположенные группами, равномерно удаленными друг от друга (CRISPR), эффекторную нуклеазу, подобную активаторам транскрипции (TALEN) или эндонуклеазу цинковые пальцы (ZFN), например, как описано в настоящем описании.
миРНК и кшРНК для ингибирования TCR или HLA
В некоторых вариантах осуществления экспрессию TCR и/или экспрессию HLA можно ингибировать с использованием миРНК или кшРНК, которые направленно воздействуют на нуклеиновую кислоту, кодирующую TCR и/или HLA, и/или ингибирующей молекулы, описываемой в настоящем описании (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозина и TGFR бета) в клетке.
Экспрессию миРНК и кшРНК в T-клетках можно получать с использованием любой общепринятой экспрессирующей система, например, такой как экспрессирующая система на основе лентивируса.
Иллюстративные кшРНК, которые подавляют экспрессию одного или более компонентов TCR, описаны, например, в публикации US № 2012/0321667. Иллюстративные миРНК и кшРНК, которые подавляют экспрессию генов HLA I класса и/или HLA II класса, описаны, например, в публикации US № 2007/0036773.
CRISPR для ингибирования TCR или HLA
"CRISPR" или "CRISPR к TCR и/или HLA" или "CRISPR для ингибирования TCR и/или HLA", как используют в настоящем описании, относится к группе короткие палиндромные повторы, расположенные группами, равномерно удаленными друг от друга, или системе, содержащей такую группу повторов. Как используют в настоящем описании, "Cas" относится к CRISPR-ассоциированному белку. Система "CRISPR/Cas" относится к системе, получаемой из CRISPR и Cas, которые можно использовать для сайленсинга или мутации гена TCR и/или HLA, и/или ингибирующей молекуле, описываемой в настоящем описании, (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозину и TGFR бета).
Природные системы CRISPR/Cas встречаются приблизительно в 40% секвенированных геномах эубактерий и 90% секвенированных архебактерий. Grissa et al., (2007) BMC Bioinformatics, 8: 172. Эта система представляет собой тип прокариотической иммунной системы, которая обеспечивает устойчивость к чужеродным генетическим элементам, таким как плазмиды и фаги, и обеспечивает форму приобретенного иммунитета. Barrangou et al., (2007) Science, 315: 1709-1712; Marragini et al., ( 2008) Science, 322: 1843-1845.
Система CRISPR/Cas была модифицирована для применения в редактировании генома (сайленсинге, усилении или изменении конкретных генов) у эукариот, таких как мыши или приматы. Wiedenheft et al., (2012) Nature, 482: 331-8. Это проводят введением в эукариотическую клетку плазмиды, содержащей конкретным образом сконструированные CRISPR и один или более подходящих Cas.
Последовательность CRISPR, в некоторых случаях называемая локусом CRISPR, содержит чередующиеся повторы и спейсеры. В природных CRISPR спейсеры, как правило, содержат последовательности, чужеродные для бактерий, такие как плазмидная или фаговая последовательность; в TCR и/или системе HLA CRISPR/Cas спейсеры получают из последовательности гена TCR или HLA.
РНК из локуса CRISPR конститутивно экспрессируется и процессируется белками Cas до малых РНК. Они содержат спейсер, фланкированный последовательностью повтора. РНК направляет другие белки Cas на сайленсинг экзогенных генетических элементов на уровне РНК или ДНК. Horvath et al., (2010) Science, 327: 167-170; Makarova et al., (2006) Biology Direct, 1:7. Таким образом, спейсеры служат в качестве матриц для молекул РНК, аналогично миРНК. Pennisi, (2013) Science, 341: 833-836.
Вследствие того, что они естественным образом встречаются во многих различных типах бактерий, точные расположения CRISPR и структура, функция и число генов Cas и их продукт немного отличаются у разных видов. Haft et al., (2005) PLoS Comput. Biol., 1: e60; Kunin et al., (2007) Genome Biol., 8: R61; Mojica et al., (2005) J. Mol. Evol., 60: 174-182; Bolotin et al., (2005) Microbiol., 151: 2551-2561; Pourcel et al., (2005) Microbiol., 151: 653-663 и Stern et al., (2010) Trends. Genet., 28: 335-340. Например, белки Cse (подтип Cas, E. coli) (например, CasA) образуют функциональный комплекс, Cascade, который процессирует транскрипты РНК CRISPR в единицах спейсер-повтор, которые содержит Cascade. Brouns et al., (2008) Science, 321: 960-964. У других прокариот Cas6 процессирует транскрипт CRISPR. Для инактивации фага на основе CRISPR у E. coli необходимыми являются Cascade и Cas3, но не Cas1 или Cas2. Белки Cmr (модуль Cas RAMP) у Pyrococcus furiosus и других прокариот образуют функциональный комплекс с малыми РНК CRISPR, который распознает и расщепляет комплементарные РНК-мишени. Простейшая система CRISPR основана на белке Cas9, который представляет собой нуклеазу с двумя активными участками рестрикции, один для каждой цепи двойной спирали. Комбинацию Cas9 и модифицированной РНК локуса CRISPR можно использовать в системе для редактирования генома. Pennisi, (2013) Science, 341: 833-836.
Таким образом, систему CRISPR/Cas можно использовать для редактирования гена TCR и/или HLA (добавления или удаления пары нуклеотидов) или введения преждевременного стоп-кодона, что, таким образом, снижает экспрессию TCR и/или HLA. Систему CRISPR/Cas можно альтернативно использовать как РНК-интерференцию, выключение гена TCR и/или HLA обратимым способом. В клетке млекопитающего, например, РНК может направлять белок Cas к промотору TCR и/или HLA, стерически блокируя РНК-полимеразы.
Можно получать искусственные системы CRISPR/Cas, которые ингибируют TCR и/или HLA, с использованием технологии, известной в данной области, например, которая описана в публикации U.S. № 20140068797 и у Cong (2013), Science, 339: 819-823. Также можно получать другие искусственные системы CRISPR/Cas, которые известны в данной области, которые ингибируют TCR и/или HLA, например, которые описаны у Tsai (2014), Nature Biotechnol., 32:6 569-576, в патенте США № 8871445, 8865406, 8795965, 8771945 и 8697359.
TALEN для ингибирования TCR и/или HLA
"TALEN" или "TALEN к HLA и/или TCR" или "TALEN для ингибирования HLA и/или TCR" относится к эффекторной нуклеазе, подобной активатору транскрипции, искусственной нуклеазе, которую можно использовать для редактирования гена HLA и/или TCR, и/или ингибирующей молекулы, описываемой в настоящем описании (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозина и TGFR бета).
TALEN получают искусственным образом слиянием связывающего домена ДНК эффектора TAL с расщепляющим ДНК доменом. Эффекторы, подобные активаторам транскрипции (TALE), можно конструировать для связывания с любой желаемой последовательностью ДНК, включая участок гена HLA или TCR. Объединением сконструированного TALE с расщепляющим ДНК доменом можно получать рестрикционный фермент, который является специфическим для любой желаемой последовательности ДНК, включая последовательность HLA или TCR. Затем их можно вводить в клетку, где их можно использовать для редактирования генома. Boch (2011), Nature Biotech., 29: 135-6 и Boch et al., (2009) Science, 326: 1509-12; Moscou et al., (2009) Science, 326: 3501.
TALE представляют собой белки, секретируемые бактериями Xanthomonas. ДНК-связывающий домен содержит повторяющуюся высококонсервативную последовательность длиной 33-34 аминокислоты за исключением 12-й и 13-й аминокислот. Эти два положения являются высоко вариабельными, демонстрируя сильную корреляцию с распознаванием конкретного нуклеотида. Таким образом, их можно конструировать для связывания с желаемой последовательностью ДНК.
Для получения TALEN белок TALE сливают с нуклеазой (N), которая представляет собой эндонуклеазу дикого типа или мутантную по FokI эндонуклеазу. Несколько мутаций было сделано в FokI для их использования в TALEN; например, они улучшают специфичность или активность расщепления. Cermak et al., (2011) Nucl. Acids Res., 39: e82; Miller et al., (2011) Nature Biotech., 29: 143-8; Hockemeyer et al., (2011) Nature Biotech., 29: 731-734; Wood et al., (2011) Science, 333: 307; Doyon et al., (2010) Nature Methods, 8: 74-79; Szczepek et al., (2007) Nature Biotech.? 25: 786-793? и Guo et al., (2010) J. Mol. Biol., 200: 96.
Домен FokI функционирует как димер, для которого необходимыми являются две конструкции с уникальными ДНК-связывающими доменами к участкам в геноме-мишени с правильной ориентацией и расстоянием. Число аминокислотных остатков между ДНК-связывающим доменом TALE и расщепляющим доменом FokI и число оснований между двумя отдельными участками связывания TALEN, по-видимому, являются важными параметрами для получения высоких уровней активности. Miller et al., (2011) Nature Biotech., 29: 143-8.
TALEN HLA или TCR можно использовать внутри клетки для получения двухцепочечного разрыва (DSB). Мутация может возникать на участке разрыва, если механизмы репарации ошибочно препарируют разрыв посредством присоединения негомологичных концов. Например, ошибочная репарация может вводить мутацию сдвига рамки считывания. Альтернативно, в клетку можно вводить чужеродную ДНК наряду с TALEN; в зависимости от последовательностей чужеродной ДНК и хромосомной последовательности, этот процесс можно использовать для создания дефекта в гене HLA или TCR или вводить такой дефект в ген HLA или TCR дикого типа, таким образом, понижая экспрессию HLA или TCR.
Можно конструировать TALEN, специфичные к последовательностям в HLA или TCR любым известным в данной области способом, включая различные схемы с использованием модульных компонентов. Zhang et al., (2011) Nature Biotech.. 29: 149-53; Geibler et al., (2011) PLoS ONE 6: e19509.
Нуклеаза цинковые пальцы для ингибирования HLA и/или TCR
"ZFN" или "нуклеаза цинковые пальцы" или "ZFN к HLA и/или TCR" или "ZFN для ингибирования HLA и/или TCR" относится к нуклеазе цинковые пальцы, искусственной нуклеазе, которую можно использовать для редактирования гена HLA и/или TCR и/или ингибирующей молекулы, описываемой в настоящем описании (например, PD1, PD-L1, PD-L2, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CD80, CD86, B7-H3 (CD276), B7-H4 (VTCN1), HVEM (TNFRSF14 или CD270), KIR, A2aR, MHC I класса, MHC II класса, GAL9, аденозина и TGFR бета).
Аналогично TALEN, ZFN содержит нуклеазный домен FokI (или его производное), слитый с ДНК-связывающим доменом. В случае ZFN ДНК-связывающий домен содержит один или более цинковых пальцев. Carroll et al., (2011) Genetics Society of America, 188: 773-782, и Kim et al., (1996) Proc. Natl. Acad. Sci. USA, 93: 1156-1160.
Цинковый палец представляет собой небольшой белковый структурный мотив, стабилизированный одним или более цинковыми ионами. Цинковый палец может содержать, например, Cys2His2 и может распознавать приблизительно последовательность 3 п.н. Можно комбинировать различные цинковые пальцы известной специфичности для получения много пальцевых полипептидов, которые распознают последовательности длиной приблизительно 6, 9, 12, 15 или 18 п.н. Доступны различные способы селекции и сборки модулей для получения цинковых пальцев (и их сочетаний), распознающих конкретные последовательности, включая фаговый дисплей, дрожжевые одногибридные системы, бактериальные одногибридные и двугибридные системы и клетки млекопитающих.
Аналогично TALEN, ZFN должен димеризоваться для расщепления ДНК. Таким образом, необходимо, чтобы пара ZFN направленно воздействовала на непалиндромные участки ДНК. Два индивидуальных ZFN должны связывать противоположные цепи ДНК с их нуклеазами, находящимися на правильном расстоянии друг от друга. Bitinaite et al., (1998) Proc. Natl. Acad. Sci. USA, 95: 10570-5.
Также аналогично TALEN ZFN может создавать двухцепочечный разрыв в ДНК, что может создавать мутацию сдвига рамки считывания, при ошибочной репарации, что приводит к понижению экспрессии и количества HLA и/или TCR в клетке. ZFN также можно использовать с гомологичной рекомбинацией для мутации в гене HLA или TCR.
ZFN, специфичные к последовательностям в HLA и/или TCR можно конструировать любым известным в данной области способом. Cathomen et al., (2008) Mol. Ther., 16: 1200-7; Guo et al., (2010) J. Mol. Biol., 400: 96; патентная публикация U.S. 2011/0158957 и патентная публикация U.S. 2012/0060230.
Экспрессия теломеразы
Не желая быть связанными какой-либо конкретной теорией, в некоторых вариантах осуществления терапевтическая T-клетка характеризуется коротким сроком сохранения у пациента, вследствие укороченных теломераз в T-клетке; таким образом, трансфекция геном теломеразы может удлинять теломеры T-клетки и улучшать сохранение T-клетки у пациента. См. Carl June, "Adoptive T cell therapy for cancer in the clinic", Journal of Clinical Investigation, 117:1466-1476 (2007). Таким образом, в одном из вариантов осуществления эффекторная клетка иммунной системы, например, T-клетка, эктопически экспрессирует субъединицу теломеразы, например, каталитическую субъединицу теломеразы, например, TERT, например, hTERT. В некоторых аспектах настоящее изобретение относится к способу получения экспрессирующей CAR клетки, включающему приведение клетки в контакт с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, каталитическую субъединицу теломеразы, например, TERT, например, hTERT. Клетку можно приводить в контакт с нуклеиновой кислотой до, одномоментно или после контактирования с конструкцией, кодирующей CAR.
В одном из аспектов изобретение относится к способу получения популяции эффекторных клеток иммунной системы (например, T-клеток, NK-клеток). В одном из вариантов осуществления способ включает: предоставление популяции эффекторных клеток иммунной системы (например, T-клеток или NK-клеток), приведение популяции эффекторных клеток иммунной системы в контакт с нуклеиновой кислотой, кодирующей CAR, и приведение популяции эффекторных клеток иммунной системы в контакт с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, hTERT в условиях, которые обеспечивают экспрессию CAR и теломеразы.
В одном из вариантов осуществления нуклеиновая кислота, кодирующая субъединицу теломеразы, представляет собой ДНК. В одном из вариантов осуществления нуклеиновая кислота, кодирующая субъединицу теломеразы, содержит промотор, способный направлять экспрессию субъединицы теломеразы.
В одном из вариантов осуществления hTERT содержит аминокислотную последовательность белка ID GenBank AAC51724.1 (Meyerson et al., " hEST2, the Putative Human Telomerase Catalytic Subunit Gene, Is Up-Regulated in Tumor Cells and during Immortalization", Cell Volume 90, Issue 4, 22 August 1997, Pages 785-795), как указано ниже:
MPRAPRCRAVRSLLRSHYREVLPLATFVRRLGPQGWRLVQRGDPAAFRALVAQCLVCVPWDARPPPAAPSFRQVSCLKELVARVLQRLCERGAKNVLAFGFALLDGARGGPPEAFTTSVRSYLPNTVTDALRGSGAWGLLLRRVGDDVLVHLLARCALFVLVAPSCAYQVCGPPLYQLGAATQARPPPHASGPRRRLGCERAWNHSVREAGVPLGLPAPGARRRGGSASRSLPLPKRPRRGAAPEPERTPVGQGSWAHPGRTRGPSDRGFCVVSPARPAEEATSLEGALSGTRHSHPSVGRQHHAGPPSTSRPPRPWDTPCPPVYAETKHFLYSSGDKEQLRPSFLLSSLRPSLTGARRLVETIFLGSRPWMPGTPRRLPRLPQRYWQMRPLFLELLGNHAQCPYGVLLKTHCPLRAAVTPAAGVCAREKPQGSVAAPEEEDTDPRRLVQLLRQHSSPWQVYGFVRACLRRLVPPGLWGSRHNERRFLRNTKKFISLGKHAKLSLQELTWKMSVRGCAWLRRSPGVGCVPAAEHRLREEILAKFLHWLMSVYVVELLRSFFYVTETTFQKNRLFFYRKSVWSKLQSIGIRQHLKRVQLRELSEAEVRQHREARPALLTSRLRFIPKPDGLRPIVNMDYVVGARTFRREKRAERLTSRVKALFSVLNYERARRPGLLGASVLGLDDIHRAWRTFVLRVRAQDPPPELYFVKVDVTGAYDTIPQDRLTEVIASIIKPQNTYCVRRYAVVQKAAHGHVRKAFKSHVSTLTDLQPYMRQFVAHLQETSPLRDAVVIEQSSSLNEASSGLFDVFLRFMCHHAVRIRGKSYVQCQGIPQGSILSTLLCSLCYGDMENKLFAGIRRDGLLLRLVDDFLLVTPHLTHAKTFLRTLVRGVPEYGCVVNLRKTVVNFPVEDEALGGTAFVQMPAHGLFPWCGLLLDTRTLEVQSDYSSYARTSIRASLTFNRGFKAGRNMRRKLFGVLRLKCHSLFLDLQVNSLQTVCTNIYKILLLQAYRFHACVLQLPFHQQVWKNPTFFLRVISDTASLCYSILKAKNAGMSLGAKGAAGPLPSEAVQWLCHQAFLLKLTRHRVTYVPLLGSLRTAQTQLSRKLPGTTLTALEAAANPALPSDFKTILD (SEQ ID NO: 606)
В одном из вариантов осуществления hTERT содержит последовательность по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичную последовательности SEQ ID NO: 606. В одном из вариантов осуществления hTERT содержит последовательность SEQ ID NO: 606. В одном из вариантов осуществления hTERT содержит делецию (например, не более чем 5, 10, 15, 20 или 30 аминокислот) на N-конце, C-конце или обоих. В одном из вариантов осуществления hTERT содержит трансгенную аминокислотную последовательность (например, не более чем 5, 10, 15, 20 или 30 аминокислот) на N-конце, C-конце или обоих.
В одном из вариантов осуществления hTERT кодируется последовательностью нуклеиновой кислоты с номером доступа GeneBank AF018167 (Meyerson et al., "hEST2, the Putative Human Telomerase Catalytic Subunit Gene, Is Up-Regulated in Tumor Cells and during Immortalization", Cell Volume 90, Issue 4, 22 August 1997, Pages 785-795):
1 caggcagcgt ggtcctgctg cgcacgtggg aagccctggc cccggccacc cccgcgatgc
61 cgcgcgctcc ccgctgccga gccgtgcgct ccctgctgcg cagccactac cgcgaggtgc
121 tgccgctggc cacgttcgtg cggcgcctgg ggccccaggg ctggcggctg gtgcagcgcg
181 gggacccggc ggctttccgc gcgctggtgg cccagtgcct ggtgtgcgtg ccctgggacg
241 cacggccgcc ccccgccgcc ccctccttcc gccaggtgtc ctgcctgaag gagctggtgg
301 cccgagtgct gcagaggctg tgcgagcgcg gcgcgaagaa cgtgctggcc ttcggcttcg
361 cgctgctgga cggggcccgc gggggccccc ccgaggcctt caccaccagc gtgcgcagct
421 acctgcccaa cacggtgacc gacgcactgc gggggagcgg ggcgtggggg ctgctgttgc
481 gccgcgtggg cgacgacgtg ctggttcacc tgctggcacg ctgcgcgctc tttgtgctgg
541 tggctcccag ctgcgcctac caggtgtgcg ggccgccgct gtaccagctc ggcgctgcca
601 ctcaggcccg gcccccgcca cacgctagtg gaccccgaag gcgtctggga tgcgaacggg
661 cctggaacca tagcgtcagg gaggccgggg tccccctggg cctgccagcc ccgggtgcga
721 ggaggcgcgg gggcagtgcc agccgaagtc tgccgttgcc caagaggccc aggcgtggcg
781 ctgcccctga gccggagcgg acgcccgttg ggcaggggtc ctgggcccac ccgggcagga
841 cgcgtggacc gagtgaccgt ggtttctgtg tggtgtcacc tgccagaccc gccgaagaag
901 ccacctcttt ggagggtgcg ctctctggca cgcgccactc ccacccatcc gtgggccgcc
961 agcaccacgc gggcccccca tccacatcgc ggccaccacg tccctgggac acgccttgtc
1021 ccccggtgta cgccgagacc aagcacttcc tctactcctc aggcgacaag gagcagctgc
1081 ggccctcctt cctactcagc tctctgaggc ccagcctgac tggcgctcgg aggctcgtgg
1141 agaccatctt tctgggttcc aggccctgga tgccagggac tccccgcagg ttgccccgcc
1201 tgccccagcg ctactggcaa atgcggcccc tgtttctgga gctgcttggg aaccacgcgc
1261 agtgccccta cggggtgctc ctcaagacgc actgcccgct gcgagctgcg gtcaccccag
1321 cagccggtgt ctgtgcccgg gagaagcccc agggctctgt ggcggccccc gaggaggagg
1381 acacagaccc ccgtcgcctg gtgcagctgc tccgccagca cagcagcccc tggcaggtgt
1441 acggcttcgt gcgggcctgc ctgcgccggc tggtgccccc aggcctctgg ggctccaggc
1501 acaacgaacg ccgcttcctc aggaacacca agaagttcat ctccctgggg aagcatgcca
1561 agctctcgct gcaggagctg acgtggaaga tgagcgtgcg gggctgcgct tggctgcgca
1621 ggagcccagg ggttggctgt gttccggccg cagagcaccg tctgcgtgag gagatcctgg
1681 ccaagttcct gcactggctg atgagtgtgt acgtcgtcga gctgctcagg tctttctttt
1741 atgtcacgga gaccacgttt caaaagaaca ggctcttttt ctaccggaag agtgtctgga
1801 gcaagttgca aagcattgga atcagacagc acttgaagag ggtgcagctg cgggagctgt
1861 cggaagcaga ggtcaggcag catcgggaag ccaggcccgc cctgctgacg tccagactcc
1921 gcttcatccc caagcctgac gggctgcggc cgattgtgaa catggactac gtcgtgggag
1981 ccagaacgtt ccgcagagaa aagagggccg agcgtctcac ctcgagggtg aaggcactgt
2041 tcagcgtgct caactacgag cgggcgcggc gccccggcct cctgggcgcc tctgtgctgg
2101 gcctggacga tatccacagg gcctggcgca ccttcgtgct gcgtgtgcgg gcccaggacc
2161 cgccgcctga gctgtacttt gtcaaggtgg atgtgacggg cgcgtacgac accatccccc
2221 aggacaggct cacggaggtc atcgccagca tcatcaaacc ccagaacacg tactgcgtgc
2281 gtcggtatgc cgtggtccag aaggccgccc atgggcacgt ccgcaaggcc ttcaagagcc
2341 acgtctctac cttgacagac ctccagccgt acatgcgaca gttcgtggct cacctgcagg
2401 agaccagccc gctgagggat gccgtcgtca tcgagcagag ctcctccctg aatgaggcca
2461 gcagtggcct cttcgacgtc ttcctacgct tcatgtgcca ccacgccgtg cgcatcaggg
2521 gcaagtccta cgtccagtgc caggggatcc cgcagggctc catcctctcc acgctgctct
2581 gcagcctgtg ctacggcgac atggagaaca agctgtttgc ggggattcgg cgggacgggc
2641 tgctcctgcg tttggtggat gatttcttgt tggtgacacc tcacctcacc cacgcgaaaa
2701 ccttcctcag gaccctggtc cgaggtgtcc ctgagtatgg ctgcgtggtg aacttgcgga
2761 agacagtggt gaacttccct gtagaagacg aggccctggg tggcacggct tttgttcaga
2821 tgccggccca cggcctattc ccctggtgcg gcctgctgct ggatacccgg accctggagg
2881 tgcagagcga ctactccagc tatgcccgga cctccatcag agccagtctc accttcaacc
2941 gcggcttcaa ggctgggagg aacatgcgtc gcaaactctt tggggtcttg cggctgaagt
3001 gtcacagcct gtttctggat ttgcaggtga acagcctcca gacggtgtgc accaacatct
3061 acaagatcct cctgctgcag gcgtacaggt ttcacgcatg tgtgctgcag ctcccatttc
3121 atcagcaagt ttggaagaac cccacatttt tcctgcgcgt catctctgac acggcctccc
3181 tctgctactc catcctgaaa gccaagaacg cagggatgtc gctgggggcc aagggcgccg
3241 ccggccctct gccctccgag gccgtgcagt ggctgtgcca ccaagcattc ctgctcaagc
3301 tgactcgaca ccgtgtcacc tacgtgccac tcctggggtc actcaggaca gcccagacgc
3361 agctgagtcg gaagctcccg gggacgacgc tgactgccct ggaggccgca gccaacccgg
3421 cactgccctc agacttcaag accatcctgg actgatggcc acccgcccac agccaggccg
3481 agagcagaca ccagcagccc tgtcacgccg ggctctacgt cccagggagg gaggggcggc
3541 ccacacccag gcccgcaccg ctgggagtct gaggcctgag tgagtgtttg gccgaggcct
3601 gcatgtccgg ctgaaggctg agtgtccggc tgaggcctga gcgagtgtcc agccaagggc
3661 tgagtgtcca gcacacctgc cgtcttcact tccccacagg ctggcgctcg gctccacccc
3721 agggccagct tttcctcacc aggagcccgg cttccactcc ccacatagga atagtccatc
3781 cccagattcg ccattgttca cccctcgccc tgccctcctt tgccttccac ccccaccatc
3841 caggtggaga ccctgagaag gaccctggga gctctgggaa tttggagtga ccaaaggtgt
3901 gccctgtaca caggcgagga ccctgcacct ggatgggggt ccctgtgggt caaattgggg
3961 ggaggtgctg tgggagtaaa atactgaata tatgagtttt tcagttttga aaaaaaaaaa
4021 aaaaaaa (SEQ ID NO: 607)
В одном из вариантов осуществления hTERT кодируется нуклеиновой кислотой с последовательностью по меньшей мере на 80%, 85%, 90%, 95%, 96, 97%, 98% или 99% идентичной последовательности SEQ ID NO: 607. В одном из вариантов осуществления hTERT кодируется нуклеиновой кислотой SEQ ID NO: 607.
Активация и размножение клеток
Клетки можно активировать и размножать, как правило, способами, как описано, например, в патентах США 6352694, 6534055, 6905680, 6692964, 5858358, 6887466, 6905681, 7144575, 7067318, 7172869, 7232566, 7175843, 5883223, 6905874, 6797514, 6867041 и в публикации патентной заявки США № 20060121005.
Как правило, T-клетки по изобретению можно размножать приведением в контакт с поверхностью с прикрепленном к ней средством, которое стимулирует ассоциированный с комплексом CD3/TCR сигнал, и лигандом, который стимулирует костимулирующую молекулу на поверхности T-клеток. В частности, популяции T-клеток можно стимулировать, как описано в настоящем описании, таким способом как приведением в контакт с антителом против CD3 или его антигенсвязывающим фрагментом, или антителом против CD2, иммобилизованным на поверхности, или приведением в контакт с активатором протеинкиназы C (например, бриостатином) в сочетании с ионофором кальция. Для костимуляции вспомогательной молекулы на поверхности T-клеток, используют лиганд, который связывается с вспомогательной молекулой. Например, популяцию T-клеток можно приводить в контакт с антителом против CD3 и антителом против CD28 в условиях, подходящих для стимуляции пролиферации T-клеток. Для стимуляции пролиферации CD4+ T-клеток или CD8+ T-клеток можно использовать антитело против CD3 и антитело против CD28. Примеры антитела против CD28 включают 9.3, B-T3, XR-CD28 (Diaclone, Besançon, France), которые можно использовать как и другие способы, широко известные в данной области (Berg et al., Transplant Proc., 30(8):3975-3977, 1998; Haanen et al., J. Exp. Med., 190(9):13191328, 1999; Garland et al., J. Immunol Meth., 227(1-2):53-63, 1999).
В определенных аспектах первичный стимулирующий сигнал и костимулирующий сигнал для T-клетки можно обеспечивать различными протоколами. Например, средства, обеспечивающие каждый сигнал, могут находиться в растворе или являться связанными с поверхностью. В случае связывания с поверхностью средства можно связывать с одной и той же поверхностью (т.е. в "цис"-конфигурации) или с отдельными поверхностями (т.е. в "транс"-конформации). Альтернативно, одно средство можно связывать с поверхностью и другим средством в растворе. В одном из аспектов средство, обеспечивающее костимулирующий сигнал, является связанным с клеточной поверхностью, а средство, обеспечивающее первичный сигнал активации, находится в растворе или является связанным с поверхностью. В определенных аспектах оба средства могут находиться в растворе. В одном из аспектов средства могут находиться в растворимой форме, а затем их можно сшивать с поверхностью, такой как клетка, экспрессирующая Fc-рецепторы, или антитело, или другое связывающее средство, которое будет связываться со средствами. В этом отношении см. например, публикации патентных заявок США № 20040101519 и 20060034810 для искусственных антигенпрезентирующих клеток (aAPC), которые предусматривают для применения в активации и размножении T-клеток в настоящем изобретении.
В одном из аспектов два средства иммобилизуют на гранулах, на одной и той же грануле, т.е. "цис" или на отдельных гранулах, т.е. "транс". В качестве примера средство, обеспечивающее первичный сигнал активации, представляет собой антитело против CD3 или его антигенсвязывающий фрагмент, и средство, обеспечивающее костимулирующий сигнал, представляет собой антитело против CD28 или его антигенсвязывающий фрагмент; и оба средства являются совместно иммобилизованными на одной и той же грануле в эквимолярных количествах. В одном из аспектов для размножения CD4+ T-клеток и роста T-клеток используют отношение 1:1 каждого антитела, связанного с гранулами. В определенных аспектах настоящего изобретения используют отношение антител против CD3:CD28, связанных с гранулами, таким образом, что наблюдают увеличение размножения T-клеток по сравнению с размножением, наблюдаемым с использованием отношения 1:1. В одном из конкретных аспектов наблюдают увеличение приблизительно от 1 приблизительно до 3 раз по сравнению с размножением, наблюдаемым с использованием отношения 1:1. В одном из аспектов отношение антитела CD3:CD28, связанного с гранулами, находится в диапазоне от 100:1 до 1:100 и всех целочисленных значений в этом диапазоне. В одном из аспектов настоящего изобретения больше антитела против CD28 связано с частицами по сравнению с антителом против CD3, т.е. отношение CD3:CD28 является меньше одного. В определенных аспектах изобретения отношение антитела против CD28 к антителу против CD3, связанному с гранулами, составляет более 2:1. В одном из конкретных аспектов используют отношение 1:100 CD3:CD28 антитела, связанного с гранулами. В одном из аспектов используют отношение CD3:CD28 1:75 антитела, связанного с гранулами. В дополнительном аспекте используют отношение CD3:CD28 1:50 антитела, связанного с гранулами. В одном из аспектов используют отношение CD3:CD28 1:30 антитела, связанного с гранулами. В одном из предпочтительных аспектов, используют отношение CD3:CD28 1:10 антитела, связанного с гранулами. В одном из аспектов используют отношение CD3:CD28 1:3 антитела, связанного с гранулами. В еще одном другом аспекте используют отношение CD3:CD28 3:1 антитела, связанного с гранулами.
Для стимуляции T-клеток или других клеток-мишеней можно использовать отношения частиц к клеткам от 1:500 до 500:1 и любые целочисленные значения в этом диапазоне. Как специалисты в данной области могут легко понять, отношение частиц к клеткам может зависеть от размера частиц относительно клетки-мишени. Например, гранулы небольшого размера могут связывать только несколько клеток, тогда как гранулы большего размера могут связывать много клеток. В определенных аспектах для стимуляции T-клеток также можно использовать отношение клеток к частицам находится в диапазоне от 1:100 до 100:1 и любых целочисленных значений в данном диапазоне, и в дополнительных аспектах отношение составляет от 1:9 до 9:1 и любые целочисленные значения в этом диапазоне. Отношение частиц, связанных с антителом против CD3 и антитело против CD2, к T-клеткам, которое приводит к стимуляция T-клетки, может изменяться, как указано выше, однако определенные предпочтительные значения включают 1:100, 1:50, 1:40, 1:30, 1:20, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1 и 15:1, где одно из предпочтительных отношений составляет по меньшей мере 1:1 частиц на T-клетку. В одном из аспектов используют отношение частиц к клеткам 1:1 или менее. В одном из конкретных аспектов предпочтительное отношение частица:клетка составляет 1:5. В дополнительных аспектах отношение частиц к клеткам может изменяться в зависимости от суток стимуляции. Например, в одном из аспектов отношение частиц к клеткам составляет от 1:1 до 10:1 на первые сутки, и к клеткам добавляют дополнительные частицы каждые сутки или через сутки в дальнейшем в течение периода до 10 суток в конечных отношениях от 1:1 до 1:10 (на основании подсчетов клеток на сутки добавления). В одном из конкретных аспектов отношение частиц к клеткам составляет 1:1 на первые сутки стимуляции, и его доводят до 1:5 на третьи и пятые сутки стимуляции. В одном из аспектов частицы добавляют каждые сутки или через сутки до конечного отношения 1:1 на первые сутки и 1:5 на третьи и пятые сутки стимуляции. В одном из аспектов отношение частиц к клеткам составляет 2:1 на первые сутки стимуляции, и его доводят до 1:10 на третьи и пятые сутки стимуляции. В одном из аспектов частицы добавляют каждые сутки или через сутки до конечного отношения 1:1 на первые сутки, и 1:10 на третьи и пятые сутки стимуляции. Специалисту в данной области понятно, что ряд других отношений может являться пригодным для использования в настоящем изобретении. В частности, отношения изменяются в зависимости от размера частиц и размера и типа клетки. В одном из аспектов наиболее характерные отношения для использования составляют приблизительно 1:1, 2:1 и 3:1 на первые сутки.
В дополнительных аспектах по настоящему изобретению клетки, такие как T-клетки, объединяют с покрытыми средством гранулами, затем гранулы и клетки разделяют, а затем культивируют клетки. В альтернативном аспекте перед культивированием покрытые средством гранулы и клетки не разделяют, а культивируют совместно. В дополнительном аспекте гранулы и клетки сначала концентрируют путем применения силы, такой как сила магнитного поля, что приводит к увеличенному лигированию маркеров клеточной поверхности, таким образом, индуцируя стимуляцию клеток.
В качестве примера, белки клеточной поверхности можно лигировать приведением парамагнитных гранул, к которыми присоединены антитела против CD3 и антитела против CD28 (3×28 гранул), в контакт с T-клетками. В одном из аспектов клетки (например, от 104 до 109 T-клеток) и гранулы (например, DYNABEADS® M-450 CD3/CD28 T парамагнитные гранулы в отношении 1:1) объединяют в буфере, например, PBS (без двухвалентных катионов, таких как, кальций и магний). Вновь специалисты в данной области смогут легко понять, что можно использовать любую концентрацию клеток. Например, клетка-мишень может очень редко встречаться в образце и составлять только 0,01% образца, или весь образец (т.е. 100%) может представлять собой клетку-мишень, представляющую интерес. Таким образом, в контексте настоящего изобретения предусматривается любое число клеток. В определенных аспектах желательным может являться значительное уменьшение объема, в котором частицы и клетки смешивают друг с другом, (т.е. увеличение концентрации клеток) для обеспечения максимального контакта клеток и частиц. Например, в одном из аспектов используют концентрацию приблизительно 10 миллиардов клеток/мл, 9 миллиардов/мл, 8 миллиардов/мл, 7 миллиардов/мл, 6 миллиардов/мл, 5 миллиардов/мл или 2 миллиарда клеток/мл. В одном из аспектов используют более 100 миллионов клеток/мл. В дополнительном аспекте используют концентрацию клеток 10, 15, 20, 25, 30, 35, 40, 45 или 50 миллионов клеток/мл. В еще одном другом аспекте используют концентрацию клеток от 75, 80, 85, 90, 95 или 100 миллионов клеток/мл. В дополнительных аспектах можно использовать концентрации 125 или 150 миллионов клеток/мл. Использование высоких концентраций может приводить к повышенным выходу клеток, активации клеток и размножению клеток. Кроме того, использование высоких концентраций клеток обеспечивает более эффективный захват клеток, которые могут слабо экспрессировать представляющие интерес антигены-мишени, такие как CD28-отрицательн T-клетки. Такие популяции клеток могут иметь терапевтическую ценность, и в определенных аспектах их получение является желательным. Например, использование высокой концентрации клеток обеспечивает более эффективную селекцию CD8+ T-клеток, которые обычно характеризуются более слабой экспрессией CD28.
В одном из вариантов осуществления клетки, трансдуцированные нуклеиновой кислотой, кодирующей CAR, например, CAR, описываемым в настоящем описании, размножают, например, способом, описываемым в настоящем описании. В одном из вариантов осуществления клетки размножают в культуре в течение периода от нескольких часов (например, приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 18, 21 час) приблизительно до 14 суток (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 суток). В одном из вариантов осуществления клетки размножают в течение периода от 4 до 9 суток. В одном из вариантов осуществления клетки размножают в течение периода продолжительностью 8 суток или менее, например, 7, 6 или 5 суток. В одном из вариантов осуществления клетки, например, CD123 CAR клетку, описываемую в настоящем описании, размножают в культуре в течение 5 суток, и получаемые клетки являются более активными по сравнению с теми же клетками, размножаемыми в культуре в течение 9 суток в тех же условиях культивирования. Активность можно определять, например, по различным функциям T-клеток, например, пролиферации, цитолизу клетки-мишени, продукции цитокинов, активации, миграции или их сочетаниям. В одном из вариантов осуществления для клеток, например, CD123 CAR клетки, описываемой в настоящем описании, которые размножали в течение 5 суток, демонстрируют по меньшей мере увеличение в один, два, три или четыре раза удвоения клеток при стимуляции антигеном по сравнению с теми же клетками, которые размножали в культуре в течение 9 суток в тех же условиях культивирования. В одном из вариантов осуществления клетки, например, клетки, экспрессирующие CD123 CAR, описываемый в настоящем описании, размножают в культуре в течение 5 суток, и получаемые клетки характеризуются более высокой продукцией провоспалительных цитокинов, например, уровнями IFN-γ и/или GM-CSF по сравнению с такими же клетками, которые размножали в культуре в течение 9 суток в тех же условиях культивирования. В одном из вариантов осуществления для клеток, например, CD123 CAR клетки, описываемой в настоящем описании, которые размножали в течение 5 суток, демонстрируют увеличение по меньшей мере в один, два, три, четыре, пять, десять раз или более пг/мл продукции провоспалительных цитокинов, например, уровней IFN-γ и/или GM-CSF по сравнению с такими же клетками, которые размножали в культуре в течение 9 суток в тех же условиях культивирования.
В одном из аспектов настоящего изобретения смесь можно культивировать в течение нескольких часов (приблизительно от 3 часов) приблизительно до 14 суток или любой целочисленное значение времени в данном интервале. В одном из аспектов смесь можно культивировать в течение 21 суток. В одном из аспектов изобретения гранулы и T-клетки культивируют совместно в течение приблизительно восьми суток. В одном из аспектов гранулы и T-клетки культивируют совместно в течение 2-3 суток. Также желательными могут являться несколько циклов стимуляции, таким образом, что время культивирования T-клеток может составлять 60 суток или более. Условия, подходящие для культивирования T-клеток включают подходящую среду (например, минимальные питательные среды или среда RPMI 1640 или X-vivo 15, (Lonza)), которые могут содержать факторы, необходимые для пролиферации и жизнеспособности, включая сыворотку (например, эмбриональную телячью сыворотку или сыворотку человека), интерлейкин 2 (IL-2), инсулин, IFN-γ, IL-4, IL-7, GM-CSF, IL-10, IL-12, IL-15, TGFβ и TNF-α или любые другие добавки для роста клеток, известные специалисту в данной области. Другие добавки для роста клеток включают, но не ограничиваются ими, поверхностно-активное вещество, плазманат и восстановители, такие как N-ацетилцистеин и 2-меркаптоэтанол. Среды могут включают RPMI 1640, AIM-V, DMEM, MEM, α-MEM, F-12, X-Vivo 15 и X-Vivo 20, Optimizer с добавленными аминокислотами, пируватом натрия и витаминами, или не содержащие сыворотку, или дополненные подходящим количеством сыворотки (или плазмы), или определенным набором гормонов и/или количеством цитокина(ов), достаточным для роста и размножения T-клеток. Антибиотики, например, пенициллин и стрептомицин вводят только в экспериментальные культуры, а не в культуры клеток, которые следует вливать индивидууму. Клетки-мишени поддерживают в условиях, необходимых для поддержания роста, например, при определенной температуре (например, 37°C) и атмосфере (например, воздух плюс 5% CO2).
В одном из вариантов осуществления клетки размножают в подходящей среде (например, среде, описываемой в настоящем описании), которая содержит один или более интерлейкинов, что приводит по меньшей мере к увеличению в 200 раз (например, 200 раз, 250 раз, 300 раз, 350 раз) клеток в течение периода размножения 14 суток, например, как измеряют способом, описываемым в настоящем описании, таким как проточная цитометрия. В одном из вариантов осуществления клетки размножают в присутствии IL-15 и/или IL-7 (например, IL-15 и IL-7).
В вариантах осуществления способы, описываемые в настоящем описании, например, способы получения экспрессирующей CAR клетки, включают удаление регуляторных T-клеток, например, CD25+ T-клеток из популяции клеток, например, с использованием антитела против CD25 или его фрагмента, или CD25-связывающего лиганда, IL-2. Способы удаления регуляторных T-клеток, например, CD25+ T-клеток из популяции клеток описаны в настоящем описании. В вариантах осуществления способы, например, способы получения дополнительно включают приведение популяции клеток (например, популяции клеток, в которой регуляторные T-клетки, такие как CD25+ T-клетки, были истощены, или популяции клеток, которую ранее приводили в контакт с антителом против CD25, его фрагментом или CD25-связывающим лигандом) в контакт с IL-15 и/или IL-7. Например, популяцию клеток (например, которую ранее приводили в контакт с антителом против CD25, его фрагментом или CD25-связывающим лигандом) размножают в присутствии IL-15 и/или IL-7.
В некоторых вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, приводят в контакт с композицией, содержащей полипептид интерлейкина 15 (IL-15), полипептид рецептора альфа интерлейкина 15 (IL-15Ra) или комбинацией полипептида IL-15 и полипептида IL-15Ra, например, hetIL-15, во время получения экспрессирующей CAR клетки, например, ex vivo. В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, приводят в контакт с композицией, содержащей полипептид IL-15, во время получения экспрессирующей CAR клетки, например, ex vivo. В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, приводят в контакт с композицией, содержащей комбинацию полипептида IL-15 и полипептида IL-15 Ra, во время получения экспрессирующей CAR клетки, например, ex vivo. В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, приводят в контакт с композицией, содержащей hetIL-15, во время получения экспрессирующей CAR клетки, например, ex vivo.
В одном из вариантов осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, приводят в контакт с композицией, содержащей hetIL-15, во время размножение ex vivo. В одном из вариантов осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, приводят в контакт с композицией, содержащей an IL-15 полипептид, во время размножение ex vivo. В одном из вариантов осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, приводят в контакт с композицией, содержащей полипептид IL-15 и полипептид IL-15Ra, во время размножение ex vivo. В одном из вариантов осуществления приведение в контакт приводит к выживаемости и пролиферации популяции лимфоцитов, например, CD8+ T-клеток.
T-клетки, которые подвергали стимуляции в течение различного времени, могут обладать различными характеристиками. Например, характерные продукты мононуклеарных клеток крови или периферической крови после афереза содержат популяцию хелперных T-клеток (TH, CD4+), которая представляет собой популяцию более цитотоксических или супрессорных T-клеток (TC, CD8+). Размножение ex vivo T-клеток путем стимуляции рецепторов CD3 и CD28 приводит к популяции T-клеток, которая приблизительно до суток 8-9 состоит преимущественно из TH-клеток, при этом приблизительно через 8-9 суток, популяция T-клеток содержит все больше увеличивающуюся популяцию TC-клеток. Таким образом, в зависимости от цели лечения преимущественным может являться инфузия индивидууму популяции T-клеток, содержащей преимущественно TH-клетки. Аналогично, если выделяли подпопуляцию TC-клеток, специфичных к антигену, предпочтительным может являться размножение этой подпопуляции в большей степени.
Кроме того, в дополнение к маркерам CD4 и CD8 значительно изменяются другие фенотипические маркеры, но в значительной степени воспроизводимо во время процесса размножения клеток клетки expansion process. Таким образом, такая воспроизводимость обеспечивает способность подбирать продукт активированных T-клеток для конкретных целей.
После того, как конструируют CD123 CAR, можно использовать различные анализы для оценки активности молекулы, такие как, но, не ограничиваясь ими, способность размножать T-клетки после стимуляции антигеном, поддержания размножения T-клеток в отсутствие повторной стимуляции и виды активности против злокачественной опухоли на соответствующих моделях in vitro и моделях на животных. Анализы для оценки эффектов CD123 CAR более подробно описаны ниже.
Для детекции наличия мономеров и димеров можно использовать анализ вестерн-блоттинга экспрессии CAR в первичных T-клетках. См., например, Milone et al., Molecular Therapy, 17(8): 1453-1464 (2009). В очень кратком изложении, T-клетки (смесь CD4+ и CD8+ T-клеток 1:1), экспрессирующие CAR, размножают in vitro в течение более 10 суток с последующим лизисом и SDS-PAGE в восстановительных условиях. CAR, содержащие полноразмерный цитоплазматический домен TCR-ζ и эндогенную цепь TCR-ζ, детектируют вестерн-блоттингом с использованием антитела к цепи TCR-ζ. Те же подпопуляции T-клеток используют для анализа SDS-PAGE в невосстановительных условиях для обеспечения оценки ковалентного образования димеров.
Размножение in vitro CAR+ T-клеток после стимуляции антигеном можно измерять проточной цитометрией. Например, смесь CD4+ и CD8+ T-клеток стимулируют aAPC αCD3/αCD28 с последующей трансдукцией лентивирусными векторами, экспрессирующими GFP под контролем промоторов, который необходимо анализировать. Иллюстративные промоторы включают промоторы гена CMV IE, EF-1α, убиквитина C или фосфоглицерокиназы (PGK). Флуоресценцию GFP оценивают на сутки 6 культивирования в подпопуляциях CD4+ и/или CD8+ T-клеток проточной цитометрией. См., например, Milone et al., Molecular Therapy, 17(8): 1453-1464 (2009). Альтернативно, смесь CD4+ и CD8+ T-клеток стимулируют покрытыми αCD3/αCD28 магнитными гранулами на сутки 0 и трансдуцируют CAR на сутки 1 с использованием бицистронного лентивирусного вектора, экспрессирующего CAR наряду с eGFP, с использованием последовательности, вызывающей пропуски рибосомой, 2A. Культуры повторно стимулируют CD19+ K562 клетками (K562-CD19), K562 клетками дикого типа (K562 дикого типа) или K562 клетками, экспрессирующими hCD32 и 4-1BBL, в присутствии антитела против CD3 и антитела против CD28 (K562-BBL-3/28) после промывания. Через сутки в культуры добавляют экзогенный IL-2 при 100 МЕд./мл. GFP+ T-клетки подсчитывают проточной цитометрией с использованием подсчета на основе гранул. См., например, Milone et al., Molecular Therapy, 17(8): 1453-1464 (2009). Аналогичные анализы можно проводить с использованием T-клеток против CD123 (см., например, Gill et al., Blood, 2014;123:2343) или T-клеток против CD123 CAR.
Также можно измерять размножение окрашенных CAR+ T-клеток при отсутствии повторной стимуляции. См., например, Milone et al., Molecular Therapy, 17(8): 1453-1464 (2009). В кратком изложении, средний объем T-клеток (fl) измеряют на сутки 8 культивирования с использованием счетчика частиц Coulter Multisizer III, Nexcelom Cellometer Vision или Millipore Scepter после стимуляции покрытыми αCD3/αCD28 магнитными гранулами на сутки 0, и трансдукции указанным CAR на сутки 1.
Для измерения активности CART также можно использовать модели на животных. Например, можно использовать модель ксенотрансплантата с использованием CD19-специфических CAR+ T-клеток человека для лечения первичного пре-B ALL человека на иммунодефицитных мышах. См., например, Milone et al., Molecular Therapy, 17(8): 1453-1464 (2009). В очень кратком изложении, после установления ALL мышей случайным образом распределяют на группы лечения. Различные количества сконструированных αCD19-ζ и αCD19-BB-ζ T-клеток совместно инъецируют в отношении 1:1 NOD-SCID-γ-/- мышам, несущим B-ALL. В различные моменты времени после инъекции T-клеток оценивают число копий вектора αCD19-ζ и αCD19-BB-ζ в ДНК селезенки мышей. Животных оценивают на лейкоз с интервалами продолжительностью неделя. Проводят подсчеты бластных клеток CD19+ B-ALL в периферической крови у мышей, которым инъецируют αCD19-ζ CAR+ T-клетки или ложно-трансдуцированные T-клетки. Кривые выживаемости для групп сравнивают с использованием логарифмического рангового критерия. Кроме того, также можно анализировать абсолютные подсчеты CD4+ и CD8+ T-клеток периферической крови через 4 недели после инъекции T-клеток мышам NOD-SCID-γ-/-. Мышам инъецируют лейкозные клетки и через 3 недели инъецируют T-клетки, сконструированные, чтобы экспрессировать CAR, посредством бицистронного лентивирусного вектора, кодирующего CAR, связанный с eGFP. T-клетки нормализуют на 45-50% входящих GFP+ T-клеток смешиваем с ложно-трансдуцированными клетками до инъекции и подтверждают проточной цитометрией. Животных оценивают на лейкоз с интервалами в 1 неделю. Кривые выживаемости для групп CAR+ T-клеток сравнивают с использованием логарифмического рангового критерия. Аналогичные эксперименты можно проводить с CD123S CART.
Можно оценивать дозозависимую реакцию на обработку CAR. См., например, Milone et al., Molecular Therapy, 17(8): 1453-1464 (2009). Например, периферическую кровь получают через 35-70 суток после установления лейкоза у мышей, которых инъецировали на сутки 21 CAR T-клетками, эквивалентным числом ложно-трансдуцированных T-клеток или не T-клетками. У мышей из каждой группы случайным образом брали образец крови для определения количеств бластов CD19+ ALL в периферической крови, а затем умерщвляли на сутки 35 и 49. Оставшихся животных оценивают на сутки 57 и 70. Аналогичные эксперименты можно проводить с CD123S CART.
Оценка клеточной пролиферации и продукции цитокинов ранее была описана, например, у Milone et al., Molecular Therapy. 17(8): 1453-1464 (2009). В кратком изложении, оценку опосредованной CAR пролиферации проводят на планшетах для микротитрования смешиванием промытых T-клеток с клетками K562, экспрессирующим CD19 (K19) или CD32 и CD137 (KT32-BBL) до конечного отношения T-клетка:K562 2:1. Перед использованием клетки K562 облучают гамма-излучением. Моноклональные антитела против CD3 (клон OKT3) и против CD28 (клон 9.3) добавляют к культурам с клетками KT32-BBL для того, чтобы служить в качестве положительного контроля стимуляции пролиферации T-клеток, т.к. эти сигналы поддерживают длительное размножение CD8+ T-клеток ex vivo. T-клетки подсчитывают в культурах с использованием флуоресцентных гранул CountBright™ (Invitrogen, Carlsbad, CA) и проточной цитометрии, как описано производителем. CAR+ T-клетки идентифицируют по экспрессии GFP с использованием T-клеток, которые конструируют с использованием лентивирусных векторов, экспрессирующих CAR, связанный с eGFP-2A. Для CAR+ T-клеток, не экспрессирующих GFP, CAR+ T-клетки детектируют с использованием биотинилированного рекомбинантного белка CD123 и вторичного конъюгата авидин-PE. Также можно одновременно детектировать экспрессию CD4+ и CD8+ на T-клетках специфическими моноклональными антителами (BD Biosciences). Измерения цитокинов проводят в супернатантах, собираемых через 24 часа после повторной стимуляции с использованием набора human TH1/TH2 cytokine cytometric bead array (BD Biosciences, San Diego, CA) по инструкциям производителей или с использованием набора Luminex 30-plex (Invitrogen). Флуоресценцию оценивают с использованием проточного цитометра BD Fortessa и нализируют данные по инструкциям производителя. Аналогичные эксперименты можно проводить с CD123S CART.
Цитотоксичность можно оценивать стандартным анализом высвобождения 51Cr. См., например, Milone et al., Molecular Therapy., 17(8): 1453-1464 (2009). В кратком изложении, клетки-мишени (линии K562 и клетки первичного про-B-ALL) нагружают 51Cr (в виде NaCrO4, New England Nuclear, Boston, MA) при 37°C в течение 2 часов при частом перемешивании, промывают дважды в полной RPMI и высаживали на планшеты для микротитрования. Эффекторные T-клетки смешивают с клетками-мишени в лунках в полной RPMI в различных отношениях эффекторная клетка:клетка-мишень (E:T). Также подготавливают дополнительные лунки, содержащие только среду (спонтанное высвобождение, SR) или 1% раствор детергента Triton-X 100 (полное высвобождение, TR). Через 4 часа инкубации при 37°C собирают супернатант из каждой лунки. Затем измеряют высвобождаемый 51Cr с использованием счетчика гамма-частиц (Packard Instrument Co., Waltham, MA). Каждое условие проводят по меньшей мере в тех повторениях и рассчитывают процент лизиса с использованием формулы: % лизиса=(ER-SR)/(TR-SR), где ER представляет собой средний 51Cr, высвобождаемый при каждом экспериментальном условии.
Для оценки специфической миграция и пролиферации CAR на модели на животных, несущих опухоль, можно использовать способы визуализации. Такие анализы были описаны, например, у Barrett et al., Human Gene Therapy, 22:1575-1586 (2011). В кратком изложении, мышей NOD/SCID/γc-/- (NSG) инъецируют в/в клетками Nalm-6 с последующей инъекцией через 7 суток T-клетками через 4 часа после электропорации конструкциями CAR. T-клетки стабильно трансфицируют лентивирусной конструкцией для экспрессии люциферазы светляков и проводят визуализацию биолюминесценции у мышей. Альтернативно, можно измерять терапевтическую эффективность и специфичность однократной инъекции CAR+ T-клеток на модели ксенотрансплантата Nalm-6 так, как указано ниже: мышей NSG инъецируют Nalm-6, трансдуцированными для стабильной экспрессии люциферазы светляков с последующей однократной инъекцией в хвостовую вену T-клеток, электропорированных CD123 CAR через 7 суток. Визуализацию у животных проводили в различные моменты времени после инъекции. Например, можно получать тепловые карты плотности фотонов лейкоза положительного по люциферазе светляков у репрезентативных мышей на сутки 5 (за 2 суток до обработки) и сутки 8 (через 24 часа после CAR+ PBL).
Для оценки конструкции CD123 CAR по изобретению также можно использовать другие анализы, включая анализы, описанные в разделе примеры в настоящем описании, а также анализы, которые известны в данной области.
Альтернативно или в комбинации со способами, описываемыми в настоящем описании, описаны способы и композиции для одного один или более из: детекции и/или количественного определения экспрессирующих CAR клеток (например, in vitro или in vivo (например, клинический мониторинг)); размножения и/или активации иммунных клеток и/или направленной на CAR селекции, которые включают использование лиганда CAR. В одном иллюстративном варианте осуществления лиганд CAR представляет собой антитело, которое связывается с молекулой CAR, например, связывается с внеклеточным антигенсвязывающим доменом CAR (например, антитело, которое связывается с антигенсвязывающим доменом, например, антиидиотипическое антитело, или антитело, которое связывается с константной областью внеклеточного связывающего домена). В других вариантах осуществления лиганд CAR представляет собой антигенную молекула CAR (например, антигенную молекулу CAR, как описано в настоящем описании).
В одном из аспектов описан способ детекции и/или количественного определения экспрессирующих CAR клеток. Например, лиганд CAR можно использовать для детекции и/или количественного определения экспрессирующих CAR клеток in vitro или in vivo (например, клинический мониторинг экспрессирующих CAR клеток у пациента или режим дозирования пациента). Способ включает:
- предоставление CAR лиганда (необязательно меченого лиганда CAR, например, лиганда CAR, который содержит метку, гранулу, радиоактивную или флуоресцентную метку);
- приобретение экспрессирующей CAR клетки (например, приобретение образца, содержащего экспрессирующие CAR клетки, такого как промышленный образец или клинический образец);
- приведение экспрессирующей CAR клетка в контакт лигандом CAR в условиях, когда связывание происходит, таким образом, детектируя уровень (например, количество) присутствующих экспрессирующих CAR клеток. Связывание экспрессирующей CAR клетки с лигандом CAR можно детектировать стандартными способами, такими как FACS, ELISA и т.п.
В другом аспекте описан способ размножения и/или активации клеток (например, эффекторных клеток иммунной системы). Способ включает:
- предоставление экспрессирующей CAR клетки (например, первой экспрессирующей CAR клетки или транзиторно экспрессирующей CAR клетки);
- приведение указанной экспрессирующей CAR клетка в контакт с лигандом CAR, например, лигандом CAR, как описано в настоящем описании) в условиях, когда происходит размножение и/или пролиферация иммунных клеток, таким образом, получая активированную и/или размноженную популяцию клеток.
В определенных вариантах осуществления присутствует лиганд CAR (например, является иммобилизованным или прикрепленным к субстрату, например, неприродному субстрату). В некоторых вариантах осуществления субстрат представляет собой неклеточный субстрат. Неклеточный субстрат может представлять собой твердую подложку, выбираемую, например, из планшета (например, планшета для микротитрования), мембраны (например, нитроцеллюлозной мембраны), матрицы, чипа или гранулы. В вариантах осуществления лиганд CAR содержится в субстрате (например, на поверхности субстрата). Лиганд CAR можно иммобилизовать, присоединять или связывать ковалентно или нековалентно (например, сшивать) с субстратом. В одном из вариантов осуществления лиганд CAR является присоединенным (например, ковалентно) к грануле. В указанных выше вариантах осуществления популяцию иммунных клеток можно размножать in vitro или ex vivo. Способ может дополнительно включают культивирование популяции иммунных клеток в присутствии лиганда молекулы CAR, например, любым из способов, описываемых в настоящем описании.
В других вариантах осуществления способ размножения и/или активации клетки дополнительно включает добавление второй стимулирующей молекулы, например, CD28. Например, лиганд CAR и вторую стимулирующую молекулу можно иммобилизовать на субстрате, например, одной или более гранул, таким образом, обеспечивая повышенное размножение и/или активацию клеток.
В еще одном аспекте предоставлен способ отбора или обогащения экспрессирующей CAR клетки. Способ включает приведение экспрессирующей CAR клетка в контакт с лигандом CAR, как описано в настоящем описании, и отбор клетки на основании связывания лиганда CAR.
Другие варианты осуществления относятся к способу истощения, снижения и/или цитолиза экспрессирующей CAR клетки. Способ включает приведение экспрессирующей CAR клетка в контакт с лигандом CAR, как описано в настоящем описании, и направленное воздействие на клетку на основании связывания лиганда CAR, таким образом, снижая число и/или уничтожая экспрессирующую CAR клетку. В одном из вариантов осуществления лиганд CAR связывают с токсическим средством (например, токсином или разрушающим клетку лекарственным средством). В другом варианте осуществления антиидиотипическое антитело может вызывать активность эффекторной клетки, например, виды активности ADCC или ADC.
Иллюстративные антитела к CAR, которые можно использовать в способах, описываемых в настоящем описании, описаны, например, в WO 2014/190273 и Jena et al., "Chimeric Antigen Receptor (CAR)-Specific Monoclonal Antibody to Detect CD19-Specific T cells in Clinical Trials", PLOS March 2013 8:3 e57838, содержание которых включено посредством ссылки. В одном из вариантов осуществления молекула антиидиотипического антитела распознает молекулу антитела против CD19, например, scFv против CD19. Например, молекула антиидиотипического антитела может конкурировать за связывание с клоном №136.20.1 mAb CAR, специфического к CD19, описанным в Jena et al., PLOS March 2013 8:3 e57838; может содержать такие же CDR (например, один или более, например, все из CDR1 VH, CDR2 VH, CDR3 CH, CDR1 VL, CDR2 VL и CDR3 VL с использованием определения по Kabat, определения по Chothia или комбинации определений по Kabat и Chothia) как клон №136.20.1 mAb CAR, специфического к CD19; может содержать одну или более (например, 2) вариабельных областей как клон №136.20.1 mAb CAR, специфического к CD19, или может содержать клон №136.20.1 mAb CAR, специфического к CD19. В некоторых вариантах осуществления антиидиотипическое антитело получали способом, описанным у Jena et al. В другом варианте осуществления молекула антиидиотипического антитела представляет собой молекулу антиидиотипического антитела, описанную в WO 2014/190273. В некоторых вариантах осуществления молекула антиидиотипического антитела содержит такие же CDR (например, одну или более, например, все из CDR1 VH, CDR2 VH, CDR3 CH, CDR1 VL, CDR2 VL и CDR3 VL) как молекула антитела из WO 2014/190273, такая как 136.20.1; может содержать одну или более (например, 2) вариабельных областей молекулы антитела из WO 2014/190273, или может содержать молекулу антитела из WO 2014/190273, такую как 136.20.1. В других вариантах осуществления антитело к CAR связывается с константной областью внеклеточного связывающего домена молекулы CAR, например, как описано в WO 2014/190273. В некоторых вариантах осуществления антитело к CAR связывается с константной областью внеклеточного связывающего домена молекулы CAR, например, константной областью тяжелой цепи (например, шарнирной областью CH2-CH3) или константной областью легкой цепи. Например, в некоторых вариантах осуществления антитело к CAR конкурирует за связывание с моноклональным антителом 2D3, описанным в WO 2014/190273, содержит такие же CDR (например, одну или более, например, все из CDR1 VH, CDR2 VH, CDR3 CH, CDR1 VL, CDR2 VL и CDR3 VL) как 2D3, или содержит одну или более (например, 2) вариабельных областей 2D3, или содержит 2D3, как описано в WO 2014/190273.
В некоторых аспектах и вариантах осуществления композиции и способы в настоящем описании являются оптимизированными для конкретной подпопуляции T-клеток, например, как описано в US серийный № 62/031699, зарегистрированной 31 июля 2014 года, содержание которой полностью включено в настоящее описание посредством ссылки. В некоторых вариантах осуществления оптимизированные подпопуляции T-клеток характеризуются повышенной устойчивостью по сравнению с контрольной T-клеткой, например, T-клеткой другого типа (например, CD8+ или CD4+), экспрессирующей ту же конструкцию.
В некоторых вариантах осуществления CD4+ T-клетка содержит CAR, описываемый в настоящем описании, где CAR содержит внутриклеточный сигнальный домен, подходящих для (например, оптимизированный для, например, приводящий к повышенной устойчивости) CD4+ T-клетки, например, домен ICOS. В некоторых вариантах осуществления CD8+ T-клетка содержит CAR, описываемый в настоящем описании, где CAR содержит внутриклеточный сигнальный домен, подходящий для (например, оптимизированный для, например, приводящий к повышенной устойчивости) CD8+ T-клетки, например, домен 4-1BB, домен CD28 или другой костимулирующий домен, отличный от домена ICOS. В некоторых вариантах осуществления CAR, описываемый в настоящем описании, содержит антигенсвязывающий домен, описываемый в настоящем описании, например, CAR, содержащий антигенсвязывающий домен, который специфически связывается с CD123, например, CAR из таблицы 2 или таблицы 6.
В одном из аспектов в настоящем описании описан способ лечения индивидуума, например, индивидуума, страдающего злокачественной опухолью. Способ включает введение указанному индивидууму эффективного количества:
1) CD4+ T-клетки, содержащей CAR (CARCD4+)
содержащей:
антигенсвязывающий домен, например, антигенсвязывающий домен, описываемый в настоящем описании, например, антигенсвязывающий домен, который специфически связывается с CD123, например, антигенсвязывающий домен из таблицы 2, таблицы 6 или таблицы 9;
трансмембранный домен, и
внутриклеточный сигнальный домен, например, первый костимулирующий домен, например, домен ICOS; и
2) CD8+ T-клетки, содержащей CAR (CARCD8+), содержащий:
антигенсвязывающий домен, например, антигенсвязывающий домен, описываемый в настоящем описании, например, антигенсвязывающий домен, который специфически связывается с CD123, например, антигенсвязывающий домен из таблицы 2, таблицы 6 или таблицы 9;
трансмембранный домен, и
внутриклеточный сигнальный домен, например, второй костимулирующий домен, например, домен 4-1BB, домен CD28 или другой костимулирующий домен, отличный от домена ICOS;
где CARCD4+ и CARCD8+ отличаются друга от друга.
Необязательно способ дополнительно включает введение:
3) второй CD8+ T-клетки, содержащей CAR (второй CARCD8+), содержащий:
антигенсвязывающий домен, например, антигенсвязывающий домен, описываемый в настоящем описании, например, антигенсвязывающий домен, который специфически связывается с CD123, например, антигенсвязывающий домен из таблицы 2, таблицы 6 или таблицы 9;
трансмембранный домен, и
внутриклеточный сигнальный домен, где второй CARCD8+ содержит внутриклеточный сигнальный домен, например, костимулирующий сигнальный домен, не содержащийся на CARCD8+, и, необязательно, не содержит сигнальный домен ICOS.
Терапевтическое применение
Связанные с CD123 заболевания и/или нарушения
Настоящее изобретение относится в частности к композициям и способам лечения заболевания, связанного с экспрессией CD123, или состояния, связанного с клетками, которые экспрессируют CD123, включая, например, пролиферативное заболевание, такое как злокачественная опухоль или злокачественное новообразование, или предраковое состояние, такое как миелодисплазия, миелодиспластический синдром или предлейкоз; или не связанное со злокачественной опухолью показание, ассоциированное с клетками, которые экспрессируют CD123. В одном из аспектов злокачественная опухоль, связанная с экспрессией CD123, представляет собой гематологическую злокачественную опухоль. В одном из аспектов гематологическая злокачественная опухоль включает, но не ограничивается ими, AML, миелодиспластический синдром, ALL, хронический миелолейкоз, новообразование из бластных плазмоцитоидных дендритных клеток, миелопролиферативные неоплазии, лимфому Ходжкина и т.п. Дополнительное заболевание, связанное с экспрессией CD123, включает, но не ограничиваются ими, например, атипичные и/или неклассические злокачественные опухоли, злокачественные новообразования, предраковые состояния или пролиферативные заболевания, связанные с экспрессией CD123. Также можно включать не связанные со злокачественной опухолью показания, ассоциированные с экспрессией CD123.
В одном из аспектов изобретение относится к способам лечения заболевания, связанного с экспрессией CD123. В одном из аспектов изобретение относится к способам лечения заболевания, где часть опухоли является отрицательной по CD123, а часть опухоли является положительной по CD123. Например, CAR по изобретению является пригодным для лечения индивидуумов, которые получали лечение заболевания, связанного с повышенной экспрессией CD123, где индивидуум, который получал лечение против повышенных уровней CD123, страдает заболеванием, связанным с повышенными уровнями CD123. В вариантах осуществления CAR по изобретению является пригодным для лечения индивидуумов, которые получали лечение заболевания, связанного с экспрессией CD123, где индивидуум, который получал лечение, связанное с экспрессией CD123, страдает заболеванием, связанным с экспрессией CD123.
В одном из аспектов изобретение относится к вектору, содержащему CD123 CAR, функционально связанный с промотором, для экспрессии в эффекторных клетках иммунной системы млекопитающих, например, T-клетках или NK-клетках. В одном из аспектов изобретение относится к рекомбинантной T-клетке, экспрессирующей CD123 CAR, для применения для лечения экспрессирующих CD123 опухолей, где рекомбинантные эффекторные клетки иммунной системы, например, T-клетки или NK-клетки, экспрессирующие CD123 CAR, называют экспрессирующей CD123 CAR клеткой (например, CD123 CART или экспрессирующей CD123 CAR NK-клеткой). В одном из аспектов CD123 CART по изобретению может контактировать с опухолевой клеткой по меньшей мере с одним CD123 CAR по изобретению, экспрессируемым на ее поверхности, таким образом, что экспрессирующая CD123 CAR клетка (например, CD123 CART или экспрессирующая CD123 CAR NK-клетка) направленно воздействует на опухолевую клетку и ингибируют рост опухоли.
В одном из аспектов изобретение относится к способу ингибирования роста экспрессирующей CD123 опухолевой клетки, включающему приведение опухолевой клетке в контакт с экспрессирующей CD123 CAR клеткой (например, CD123 CART или экспрессирующейся CD123 CAR NK-клеткой) по настоящему изобретению, таким образом, что экспрессирующая CD123 CAR клетка (например, CD123 CART или экспрессирующая CD123 CAR NK-клетка) активируется в ответ на антиген и направленно воздействует на злокачественную клетку, где ингибируют рост опухоли.
В одном из аспектов изобретение относится к способу лечения злокачественной опухоли у индивидуума. Способ включает введение индивидууму экспрессирующей CD123 CAR клетки (например, CD123 CART или экспрессирующей CD123 CAR NK-клетки) по настоящему изобретению, таким образом, что проводят лечение злокачественной опухоли у индивидуума. Пример злокачественной опухоли, которую можно лечить экспрессирующей CD123 CAR клеткой (например, CD123 CART или экспрессирующей CD123 CAR NK-клеткой) по изобретению представляет собой злокачественную опухоль, связанную с экспрессией CD123. Пример злокачественной опухоли, которую можно лечить экспрессирующей CD123 CAR клеткой (например, CD123 CART или экспрессирующей CD123 CAR NK-клеткой) по изобретению включает, но не ограничивается ими, AML, лимфому Ходжкина, миелодиспластический синдром, хронический миелолейкоз и другие миелопролиферативные неоплазии или неоплазию из бластных плазмоцитоидных дендритных клеток и т.п.
Изобретение включает тип клеточной терапии, где эффекторные клетки иммунной системы, например, T-клетки или NK-клетки, генетически модифицирую для экспрессии химерного антигенного рецептора (CAR) и экспрессирующую CD123 CAR клетку (например, CD123 CART или экспрессирующую CD123 CAR NK-клетку) вводят посредством инфузии нуждающемуся в этом реципиенту. Вводимая инфузией клетка способна вызывать цитолиз опухолевых клеток у реципиента. В отличие от видов терапии антителом модифицированные CAR эффекторные клетки иммунной системы, например, модифицированные CAR T-клетки или модифицированные CAR NK-клетки) способны реплицировать in vivo, что приводит к длительному сохранению, которое может приводить к длительному подавлению опухоли. В различных аспектах эффекторные клетки иммунной системы, например, T-клетки или NK-клетки, вводят пациенту или их потомство сохраняются у пациента по меньшей мере в течение четырех месяцев, пяти месяцев, шести месяцев, семи месяцев, восьми месяцев, девяти месяцев, десяти месяце, одиннадцати месяцев, двенадцати месяцев, тринадцати месяцев, четырнадцати месяцев, пятнадцати месяцев, шестнадцати месяцев, семнадцати месяцев, восемнадцати месяцев, девятнадцати месяцев, двадцати месяцев, двадцати одного месяца, двадцати двух месяцев, двадцати трех месяцев, двух лет, трех лет, четырех лет или пяти лет после введения пациенту эффекторной клетка иммунной системы, например, T-клетки или NK-клетки
Изобретение также относится к типу клеточной терапии, где эффекторные клетки иммунной системы, например, T-клетки или NK-клетки модифицируют, например, транскрибируемой in vitro РНК для транзиторной экспрессии химерного антигенного рецептора (CAR) и экспрессирующую CAR клетку (например, CAR T-клетку или CAR NK-клетку) вводят инфузией нуждающемуся в этом реципиенту. Вводимая инфузией клетка способна вызывать цитолиз опухолевых клеток у реципиента. Таким образом, в различных аспектах эффекторные клетки иммунной системы, например, T-клетки или NK-клетки, вводимые пациенту, присутствуют в течение менее чем один месяц, например, три недели, две недели, одну неделю после введения эффекторной клетки иммунной системы, например, T-клетки или NK-клетки пациенту.
Без желания быть связанным какой-либо конкретной теорией, противоопухолевый иммунный ответ, вызываемый модифицированными CAR эффекторными клетками иммунной системы, например, T-клетками или NK-клеткам, может представлять собой активный или пассивный иммунный ответ или альтернативно может быть обусловлен прямым или непрямым иммунным ответом. В одном из аспектов трансдуцированные CAR эффекторные клетки иммунной системы, например, T-клетки или NK-клетки характеризуются секрецией конкретных провоспалительных цитокинов и сильной цитолитической активностью в ответ на злокачественные клетки человека, экспрессирующие CD123, устойчивы к ингибированию растворимого CD123, опосредуют неспецифический цитолиз и опосредуют регрессию установившейся опухоли человека. Например, содержащие меньшее количество антигена опухолевые клетки в гетерогенном поле экспрессирующей CD123 опухоли могут являться чувствительными для непрямого разрушения перенаправленной CD123 эффекторной клеткой иммунной системы, например, T-клетками или NK-клетками, которые ранее реагировали против смежных антиген-положительных злокачественных клеток.
В одном из аспектов полностью принадлежащие человеку модифицированные CAR эффекторные клетки иммунной системы (например, T-клетки или NK-клетки) по изобретению могут представлять собой тип вакцины для иммунизации ex vivo и/или терапии in vivo для млекопитающего. В одном из аспектов млекопитающее представляет собой человека.
В отношении иммунизации ex vivo по меньшей мере одно из перечисленного ниже проводят in vitro перед введением клетки, например, T-клетки или NK-клетки млекопитающему: i) размножение клеток, ii) введение нуклеиновой кислоты, кодирующей CAR, в клетки или iii) криоконсервацию клеток.
Способы ex vivo хорошо известны в данной области и более подробно описаны ниже. В кратком изложении, клетки выделяют у млекопитающего (например, человека) и генетически модифицируют (т.е. трансдуцируют или трансфицируют in vitro) вектором, экспрессирующим CAR, описываемый в настоящем описании. Модифицированную CAR клетку можно вводить являющемуся млекопитающим реципиенту для обеспечения терапевтической пользы. Являющейся млекопитающим реципиент может представлять собой человека, и модифицированная CAR клетка может являться аутологичной по отношению к реципиенту. Альтернативно, клетки могут являться аллогенными, изогенными или ксеногенными по отношению к реципиенту.
К клеткам по настоящему изобретению можно применять способ размножения ex vivo гемопоэтических стволовых клеток и клеток-предшественников, описанный в патенте США № 5199942, включенном в настоящее описание посредством ссылки. Другие подходящие способы известны в данной области, таким образом, настоящее изобретение не ограничено каким-либо конкретным способом размножения клеток ex vivo. В кратком изложении, культивирование и размножение ex vivo T-клеток включает: (1) сбор CD34+ гемопоэтических стволовых клеток и клеток-предшественников у млекопитающего из образца периферической крови или эксплантатов костного мозга и (2) размножение таких клеток ex vivo. Для культивирования и размножения клеток в дополнение к факторам роста клеток, описанным в патенте США № 5199942, можно использовать другие факторы, такие как flt3-L, IL-1, IL-3 и лиганд c-Kit.
В дополнение к использованию вакцины на основе клеток в отношении иммунизации ex vivo, настоящее изобретение также относится к композициям и способам иммунизации in vivo для индукции иммунного ответа, направленного против антигена у пациента.
Как правило, клетки, активированные и размноженные, как описано в настоящем описании, можно использовать в лечении и профилактике заболеваний, которые возникают у индивидуумов, у которых ослаблен иммунитет. В частности, модифицированные CAR эффекторные клетки иммунной системы (например, T-клетки или NK-клетки) по изобретению используют для лечения заболеваний, нарушений и состояний, связанных с экспрессией CD123. В определенных аспектах клетки по изобретению используют для лечения пациентов, подвергающихся риску развития заболеваний, нарушений и состояний, связанных с экспрессией CD123. Таким образом, настоящее изобретение относится к способам лечения или профилактики заболеваний, нарушений и состояний, связанных с экспрессией CD123, включающим введение нуждающемуся в этом индивидууму терапевтически эффективного количества модифицированных CAR эффекторных клеток иммунной системы (например, T-клеток или NK-клеток) по изобретению.
В одном из аспектов экспрессирующие CAR клетки (CART-клетки или экспрессирующие CAR NK-клетки) по изобретению можно использовать для лечения пролиферативного заболевания, такого как злокачественная опухоль или злокачественное новообразование, или предраковое состояние, такое как миелодисплазия, миелодиспластический синдром или предлейкоз. В одном из аспектов злокачественная опухоль, связанная с экспрессией CD123, представляет собой гематологическую злокачественную опухоль, предлейкоз, гиперпролиферативное нарушение, гиперплазию или дисплазию, которая характеризуется аномальным ростом клеток.
В одном из аспектов экспрессирующие CAR клетки (CART-клетки или экспрессирующие CAR NK-клетки) по изобретению используют для лечения злокачественной опухоли, где злокачественная опухоль представляет собой гематологическую злокачественную опухоль. Состояния гематологической злокачественной опухоли представляют собой типы злокачественной опухоли, такой как лейкоз и злокачественные лимфопролиферативные состояния, которые поражают кровь, костный мозг и лимфатическую систему.
В одном из аспектов композиции и экспрессирующие CAR клетки (CART-клетки или экспрессирующие CAR NK-клетки) по настоящему изобретению являются особенно пригодными для лечения миелолейкозов, AML и его подтипов, хронического миелолейкоза (CML), миелодиспластического синдрома (MDS), миелопролиферативной неоплазии (MPN), гистологических нарушений и нарушений, связанных с тучными клетками.
Лейкоз можно классифицировать как острый лейкоз и хронический лейкоз. Острый лейкоз можно дополнительно классифицировать как острый миелогенный лейкоз (AML) и острый лимфоидный лейкоз (ALL). Хронический лейкоз включает хронический миелогенный лейкоз (CML) и хронический лимфоидный лейкоз (CLL). другие родственные состояния включают миелодиспластические синдромы (MDS, ранее называемые как "предлейкоз"), которые представляют собой разнообразную группу гематологических состояний, объединяемых неэффективной продукцией (или дисплазией) миелоидных клеток крови и риском трансформации в AML.
Лимфома представляет собой группу опухолей клеток крови, которые развиваются из лимфоцитов. Иллюстративные лимфомы включают неходжкинскую лимфому и лимфому Ходжкина.
При AML злокачественная трансформация и неконтролируемая пролиферация аномально дифференцированной долгоживущей миелоидной клетки-предшественника приводит к высоким циркулирующим количествам незрелых форм крови и замене нормального костного мозга злокачественными клетками. Симптомы включают усталость, бледность, простоту образования гематом и кровотечения, лихорадку и инфекцию; симптомы лейкозного инфильтрата встречаются только приблизительно у 5% пациентов (часто как кожные проявления). Анализ мазка периферической крови и костного мозга являете диагностическим. Существующее лечение включает индукционную химиотерапию до достижения ремиссии и терапию после ремиссии (с трансплантацией стволовых клеток или без нее) для устранения рецидива.
AML имеет различные подтипы, которые отличаются друг от друга морфологически, иммунофенотипически и цитохимически. Описано пять классов на основе преобладающего типа клеток, включая миелоидные, миелоидно-моноцитарные, моноцитарные, эритроидные и мегакариоцитарные.
Показатели индукции ремиссии находятся в диапазоне от 50 до 85%. По имеющимся данным выживаемость в течение длительного времени без заболевания происходит у 20-40% пациентов и увеличивается от 40 до 50% у более молодых пациентов, которые получали лечение трансплантацией стволовых клеток.
Прогностические факторы помогают определять протокол лечения и интенсивность; пациентам с очень отрицательными прогностическими признаками, как правило, дают более интенсивные формы терапии, т.к. полагают, что потенциальная польза оправдывает повышенную токсичность лечения. Наиболее важным прогностическим фактором является кариотип лейкозной клетки; благоприятные кариотипы включают t(15;17), t(8;21) и inv16 (p13;q22). Отрицательные факторы включают увеличение возраста, предшествующую миелодиспластическую фазу, вторичный лейкоз, большое число WBC и отсутствие палочек Ауэра.
Начальная терапия направлена на попытку индукции ремиссии и значительно отличается от ALL, тем что AML реагирует на меньшее число лекарственных средств. Основная схема индукции включает цитарабин путем непрерывной в/в инфузии или высокие дозы в течение 5-7 суток; в это время дают даунорубицин или идарубицин в/в в течение 3 суток. Некоторые схемы лечения включают 6-тиогуанин, этопозид, винкристин и преднизон, ни их вклад остается неясным. Лечение, как правило, приводит к значительной миелосупрессии с инфекцией или кровотечением; существует значительная задержка перед восстановлением костного мозга. В течение этого времени жизненно необходимой является тщательная профилактическая и поддерживающая терапия.
Хронический миелогенный (или миелоидный) лейкоз (CML) также известен как хронический гранулоцитарный лейкоз и характеризуется как злокачественная опухоль из лейкоцитов. Общие схемы лечения CML включают ингибиторы тирозинкиназ Bcr-Abl, иматиниб (Gleevec®), дазатиниб и нилотиниб. Ингибиторы тирозинкиназ Bcr-Abl являются конкурентно пригодными для пациентов с CML с транслокацией хромосомы Philadelphia.
Миелодиспластические синдромы (MDS) представляют собой гематологические медицинские состояния, характеризуемые беспорядочным и неэффективным гемопоэзом или продукцией крови. Таким образом, число и качество образующих кровь клеток необратимо снижается. У некоторых пациентов с MDS может развиваться тяжелая анемия, тогда как у других симптомы отсутствуют. Схема классификации MDS известна в данной области, с критериями отличия отношения или частоты конкретных типов клеток крови, например, миелобластов, моноцитов и предшественников эритроцитов. MDS включает рефрактерную анемию, рефрактерную анемию с кольцевидными сидеробластами, рефрактерную анемию с избытком бластов, рефрактерную анемию с избытком бластов в трансформации, хронический миеломоноцитарный лейкоз (CML).
Лечение MDS изменяется в зависимости от тяжести симптомов. Агрессивные формы лечения пациентов с тяжелыми симптомами включают трансплантации костного мозга и поддерживающую терапию с поддержкой продукции крови (например, переливания крови), и гематопоэтические факторы роста (например, эритропоэтин). Для лечения MDS часто используют другие средства: 5-азацитидин, децитабин и леналидомид. В некоторых случаях также можно вводить хелаторы железа дефероксамин (Desferal®) и деферазирокс (Exjade®).
В другом варианте осуществления экспрессирующие CAR клетки (например, CART-клетки или экспрессирующие CAR NK-клетки) по настоящему изобретению используют для лечения злокачественных опухолей или лейкозов с лейкозными стволовыми клетками. Например, лейкозные стволовые клетки представляют собой CD34+/CD38- лейкозные клетки.
В частности, настоящее изобретение относится к композициям и способам лечения злокачественной опухоли. В одном из аспектов злокачественная опухоль представляет собой гематологическую злокачественную опухоль, включая, но, не ограничиваясь ими, лейкоз (такой как острый миелогенный лейкоз, хронический миелогенный лейкоз, острый лимфоидный лейкоз, хронический лимфоидный лейкоз и миелодиспластический синдром) и злокачественные лимфопролиферативные состояния, включая лимфому (такую как множественная миелома, лимфому Ходжкина, неходжкинскую лимфому, лимфому Беркитта и мелкоклеточную и крупноклеточную фолликулярную лимфому).
В одном из аспектов экспрессирующие CAR клетки (например, CART-клетки или экспрессирующие CAR NK-клетки) по изобретению можно использовать для лечения других злокачественных опухолей и злокачественных новообразований, такие как, но, не ограничиваясь ими, например, острые лейкозы, включая, но, не ограничиваясь ими, например, B-клеточный острый лимфоидный лейкоз ("B-ALL"), T-клеточный острый лимфоидный лейкоз ("T-ALL"), острый лимфоидный лейкоз (ALL); один или более хронических лейкозов, включая, но, не ограничиваясь ими, например, хронический миелогенный лейкоз (CML), хронический лимфоцитарный лейкоз (CLL); дополнительные гематологические злокачественные опухоли или гематологические состояния, включая, но, не ограничиваясь ими, например, B-клеточный пролимфоцитарный лейкоз, новообразование из бластных плазмоцитоидных дендритных клеток, лимфому Беркитта, диффузную крупноклеточную B-клеточную лимфому, фолликулярную лимфому, волосатоклеточный лейкоз, мелкоклеточную или крупноклеточную фолликулярную лимфому, злокачественные лимфопролиферативные состояния, лимфому MALT, лимфому мантийных клеток, лимфому маргинальной зоны, множественную миелому, миелодисплазию и миелодиспластический синдром, лимфому Ходжкина, неходжкинскую лимфому, плазмобластную лимфому, неоплазию из плазмацитоидных дендритных клеток, макроглобулинемию Вальденстрема и "предлейкоз", который представляет собой разнообразную группу гематологических состояний, объединяемых неэффективной продукцией (или дисплазией) миелоидных клеток крови и т.п. Модифицированные CAR эффекторные клетки иммунной системы, например, T-клетки или NK-клетки по настоящему изобретению можно вводить отдельно или в виде фармацевтической композиции в комбинации с разбавителями и/или с другими компонентами, такими как IL-2 или другие цитокины, или популяции клеток.
Настоящее изобретение также относится к способам ингибирования пролиферации или уменьшения популяции экспрессирующих CD123 клеток, где способы включают приведение популяции клеток, содержащей экспрессирующую CD123 клетку, в контакт с экспрессирующей CAR клеткой (например, CD123 CART-клеткой или экспрессирующей CD123 CAR NK-клеткой) по изобретению, которая связывается с экспрессирующей CD123 клеткой. В конкретном аспекте настоящее изобретение относится к способам ингибирования пролиферации или уменьшения популяции злокачественных клеток, экспрессирующих CD123, где способы включают приведение популяции экспрессирующих CD123 злокачественных клеток в контакт с экспрессирующей CAR клеткой (например, CD123 CART клеткой или экспрессирующей CD123 CAR NK-клеткой) по изобретению, которая связывается с экспрессирующей CD123 клеткой. В одном из аспектов настоящее изобретение относится к способам ингибирования пролиферации или уменьшения популяции злокачественных клеток, экспрессирующих CD123, где способы включают приведение популяции экспрессирующих CD123 злокачественных клеток в контакт с экспрессирующей CAR клеткой (например, CD123 CART клеткой или экспрессирующей CD123 CAR NK-клеткой) по изобретению, которая связывается с экспрессирующей CD123 клеткой. В определенных аспектах экспрессирующая CAR клетка (например, CD123 CART клетка или экспрессирующая CD123 CAR NK-клетка) по изобретению снижает количество, число или процент клеток и/или злокачественных клеток по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 65%, по меньшей мере на 75%, по меньшей мере на 85%, по меньшей мере на 95%, или по меньшей мере на 99% у индивидуума c миелолейкозом или на модели миелолейкоза на животных или другой злокачественной опухоли, связанной с экспрессирующими CD123 клетками, относительно отрицательного контроля. В одном из аспектов индивидуум представляет собой человека.
Настоящее изобретение также относится к способам профилактики, лечения и/или ведения заболевания, связанного с экспрессирующими CD123 клетками (например, гематологической злокачественной опухоли или атипической злокачественной опухоли, экспрессирующей CD123), где способы включают введение нуждающемуся в этом индивидууму экспрессирующей CAR клетка (например, CD123 CART клетки или экспрессирующей CD123 CAR NK-клетки) по изобретению, которая связывается с экспрессирующей CD123 клеткой. В одном из аспектов индивидуум представляет собой человека. Неограничивающие примеры нарушений, связанных с экспрессирующими CD123 клетками, включают аутоиммунные нарушения (такие как волчанка), воспалительные нарушения (такие как аллергии и астма) и злокачественные опухоли (такие как гематологические злокачественные опухоли или атипичные злокачественные опухоли, экспрессирующие CD123).
Настоящее изобретение также относится к способам профилактики, лечения и/или ведения заболевания, связанного с экспрессирующими CD123 клетками, где способы включают введение нуждающемуся в этом индивидууму экспрессирующей CAR клетки (например, CD123 CART клетки или экспрессирующей CD123 CAR NK-клетки) по изобретению, которая связывается с экспрессирующей CD123 клеткой. В одном из аспектов индивидуум представляет собой человека.
Настоящее изобретение относится к способам профилактики рецидива злокачественной опухоли, связанной с экспрессирующими CD123 клетками, где способы включают введение нуждающемуся в этом индивидууму экспрессирующей CAR клетки (например, CD123 CART клетки или экспрессирующей CD123 CAR NK-клетки) по изобретению, которая связывается с экспрессирующей CD123 клеткой. В одном из аспектов способы включают введение нуждающемуся в этом индивидууму эффективного количества экспрессирующей CAR клетки (например, CD123 CART клетки или экспрессирующей CD123 CAR NK-клетки), описываемой в настоящем описании, которая связывается с экспрессирующей CD123 клеткой, в комбинации с эффективным количеством другой терапии.
Абляция костного мозга
В одном из аспектов настоящее изобретение относится к композициям и способам абляции костного мозга. Например, в одном из аспектов изобретение относится к композициям и способы эрадикации по меньшей мере части существующего костного мозга у индивидуума. В настоящем описании описано, что в некоторых случаях CART123-клетки, содержащие CD123 CAR по настоящему изобретению, устраняют CD123-положительные миелоидные клетки-предшественники костного мозга.
В одном из аспектов изобретение относится к способу абляции костного мозга, включающему введение экспрессирующей CAR клетки (например, CD123 CART клетки или экспрессирующей CD123 CAR NK-клетки) по изобретению индивидууму, нуждающемуся в абляции костного мозга. Например, настоящий способ можно использовать для эрадикации некоторой части или полностью существующего костного мозга индивидуума, страдающего заболеванием или нарушением, при котором трансплантация костного мозга или восстановление костного мозга является эффективной стратегией лечения. В одном из аспектов способ абляции костного мозга по изобретению, включающий введение экспрессирующей CAR клетки (например, CD123 CART клетки или экспрессирующей CD123 CAR NK-клетки), описываемой в другом месте в настоящем описании, проводят у индивидуума до трансплантации костного мозга. Таким образом, в одном из аспектов способ по изобретению относится к клеточному кондиционирующему режиму до трансплантации костного мозга или стволовых клеток. В одном из аспектов трансплантация костного мозга включает трансплантацию стволовой клетки. Трансплантация костного мозга может включать трансплантацию аутологичных или аллогенных клеток.
Настоящее изобретение относится к способу лечения заболевания или нарушения, включающему введение экспрессирующей CAR клетки (например, CD123 CART клетки или экспрессирующей CD123 CAR NK-клетки) по изобретению для эрадикации по меньшей мере части существующего костного мозга. Способ можно использовать в качестве по меньшей мере части схемы лечения любого заболевания или нарушения, где эффективной является трансплантация костного мозга. Другими словами, настоящий способ можно использовать у любого индивидуума, нуждающегося в трансплантации костного мозга. В одном из аспектов абляция костного мозга, включающая введение экспрессирующей CAR клетки (например, CD123 CART клетки или экспрессирующей CD123 CAR NK-клетки), является пригодной для лечения AML. В определенных аспектах абляция костного мозга настоящим способом является пригодной для лечения гематологической злокачественной опухоли, солидной опухоли, гематологического заболевания, нарушения обмена веществ, ВИЧ, HTLV, болезни лизосомального накопления и иммунодефицита.
Композиции и способы, описываемые в настоящем описании, можно использовать для эрадикации по меньшей мере части существующего костного мозга для лечения гематологических злокачественных опухолей, включая, но, не ограничиваясь ими, лейкоз, лимфому, миелому, ALL, AML, CLL, CML, лимфому Ходжкина, неходжкинскую лимфому и множественную миелому.
Композиции и способы, описываемые в настоящем описании, можно использовать для лечения гематологических заболеваний включая наряду с другими, но, не ограничиваясь ими, миелодисплазию, анемию, пароксизмальную ночную гемоглобинурию, апластическую анемию, приобретенную апластическую анемию, анемию Даймонда-Блэкфана, Фанкони, цитопению, амегакариоцитарную тромбоцитопению, миелопролиферативные нарушения, истинную полицитемию, эссенциальную тромбоцитемию, миелофиброз, гемоглобинопатии, серповидно-клеточную анемию, большую β талассемию.
Композиции и способы, описываемые в настоящем описании, можно использовать для лечения лизосомальных болезней накопления, включая, но, не ограничиваясь ими липидозы, сфинголипидозы, лейкодистрофии, мукополисахаридозы, гликопротеинозы, детский нейрональный цероидный липофусциноз, болезнь Янского-Бильшовского, болезнь Ниманна-Пика, заболевание Гоше, адренолейкодистрофию, метахроматическую лейкодистрофию, заболевание Краббе, синдром Гурлера, синдром Шейе, синдром Гурлера-Шейе, синдром Гунтера, синдром Санфилиппо, синдром Моркио, синдром Марото-Лами, синдром Слая, муколипидоз, фуколипидоз, аспартилглюкозаминурию, альфа-маннозидоз и болезнь Вольмана.
Композиции и способы, описываемые в настоящем описании, можно использовать для лечения иммунодефицитных состояний, включая, но, не ограничиваясь ими, T-клеточные недостаточности, комбинированные T-клеточные и B-клеточные недостаточности, фагоцитарные расстройства, болезни иммунной дисрегуляции, врожденные иммунодефицитные состояния, атаксия телеангиэктазия, синдром Ди Георге, тяжелый комбинированный иммунодефицит (SCID), синдром Вискотта-Олдрича, синдром Костманна, синдром Швахмана-Даймонда, синдром Грисцелли и недостаточность основного модулятора NF-каппа-B (NEMO).
В одном из аспектов настоящее изобретение относится к способу лечения злокачественной опухоли, включающему кондиционирование костного мозга, где по меньшей мере часть костного мозга индивидуума подвергают эрадикации экспрессирующей CAR клеткой (например, CD123 CART клеткой или экспрессирующей CD123 CAR NK-клеткой) по изобретению. Например, в некоторых случаях костный мозг индивидуума содержит злокачественную клетку-предшественник, на которую можно направленно воздействовать и которую можно устранять действием экспрессирующей CAR клетки (например, CD123 CART клетки или экспрессирующей CD123 CAR NK-клетки). В одном из аспектов терапия кондиционирования костного мозга включает введение костного мозга или трансплантацию стволовых клеток индивидууму после эрадикации нативного костного мозга. В одном из аспектов терапию рекондиционирования костного мозга комбинируют с одним или более других видов терапии против злокачественной опухоли, включая, но, не ограничиваясь ими виды противоопухолевой терапии на основе CAR, химиотерапию, облучение и т.п.
В одном из аспектов необходимой может являться эрадикация вводимой экспрессирующей CAR клетки (например, CD123 CART клетки или экспрессирующей CD123 CAR NK-клетки) после инфузии костного мозга или трансплантации стволовых клеток. Эрадикацию экспрессирующей CAR клетки (например, CD123 CART клетки или экспрессирующей CD123 CAR NK-клетки) можно проводить с использованием любой подходящей стратегии или лечения, включая, но, не ограничиваясь ими, использование суицидального гена, ограниченное сохранение CAR с использованием кодируемых РНК CAR или способы, направленные против T-клеток, включая антитела или химиотерапию.
Способы комбинированного лечения
Экспрессирующую CAR клетку, описываемую в настоящем описании, можно использовать в комбинации с другими известными средствами и видами терапии. Вводимый "в комбинации", как используют в настоящем описании, означает, что два (или более) различных лекарственных препаратов доставляют индивидууму во время течения заболевания у индивидуума, например, два или более лекарственных препаратов доставляют после того, как у индивидуума диагностировали нарушение и до того, как прошло или было устранено нарушение, или было прекращено лечение по другим причинам. В некоторых вариантах осуществления доставку одного лекарственного препарата все еще сохраняют, когда начинают проводить доставку второго лекарственного препарата, таким образом, существует перекрытие введения. В некоторых случаях это обозначают в настоящем описании как "одномоментная" или "сопутствующая доставка". В других вариантах осуществления доставка одного лекарственного препарата заканчивается до того, как начинается доставка другого лекарственного препарата. В некоторых вариантах осуществления этого случая лекарственный препарат является более эффективным вследствие комбинированного введения. Например, второй лекарственный препарат является более эффективным, например, эквивалентный эффект наблюдают при меньшей количестве второго лекарственного препарата, или второй лекарственный препарат уменьшает симптомы в большей степени, чем в том, случае, когда второй лекарственный препарат вводят в отсутствие первого лекарственного препарата, или аналогичную ситуацию наблюдают для первого лекарственного препарата. В некоторых вариантах осуществления доставка является такой, что уменьшение симптома или другого параметра, связанного с нарушением, является больше, чем можно было бы наблюдать для одного лекарственного препарата, доставляемого при отсутствии другого. Эффект двух лекарственных препаратов может являться частично аддитивным, полностью аддитивным или больше чем аддитивным. Доставка может являться такой, что эффект первого доставляемого лекарственного препарата являлся все еще детектируемым, когда доставляют второй лекарственный препарат.
Экспрессирующая CAR клетка, описываемая в настоящем описании, и по меньшей мере одно дополнительное терапевтическое средство можно вводить одномоментно в той же или раздельных композициях или последовательно. Для последовательного введения экспрессирующую CAR клетку, описываемую в настоящем описании, можно вводить первой, а дополнительное средство можно вводить вторым или можно изменять порядок введения.
Терапию CAR и/или другие терапевтические средства, процедуры или способы можно проводить во время периода активного нарушения или во время периода ремиссии или менее активного заболевания. Терапию CAR можно проводить до другого лечения, одновременно с лечением, после лечения или во время ремиссии нарушения.
При введении в комбинации терапию CAR и дополнительное средство (например, второе или третье средство) или все можно вводить в количестве или дозе, которая является выше, ниже или такой же как количество или доза каждого средства, используемого отдельно, например, в виде монотерапии. В определенных вариантах осуществления вводимое количество или доза терапии CAR, дополнительного средства (например, второго или третьего средства) или всех является ниже (например, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50%) по сравнению с количеством или дозой каждого средства, используемого отдельно, например, в виде монотерапии. В других вариантах осуществления количество или доза терапии CAR, дополнительного средства (например, второго или третьего средства) или всех, которая приводит к желаемому действию (например, лечению злокачественной опухоли) является ниже (например, ниже по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50%) по сравнению с количеством или дозой каждого средства, используемого отдельно, например, в виде монотерапии, необходимой для получения того же терапевтического эффекта.
В дополнительных аспектах экспрессирующую CAR клетка, описываемую в настоящем описании, можно использовать в схеме лечения в комбинации с хирургической операцией, цитокинами, облучением или химиотерапией, такой как цитоксан, флударабин, ингибиторы гистондеацетилазы, деметилирующие средства или пептидная вакцина, такой как вакцина, описанная у Izumoto et al., 2008 J. Neurosurg., 108:963-971.
В некоторых случаях соединения по настоящему изобретению комбинируют с другими терапевтическими средствами, такими как другие средства против злокачественных опухолей, противоаллергические средства, средства против тошноты (или противорвотные средства), обезболивающие, цитопротекторные средства и их сочетания.
В одном из вариантов осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, можно использовать в комбинации с химиотерапевтическим средством. Иллюстративные химиотерапевтические средства включают антрациклин (например, доксорубицин (например, липосомальный доксорубицин)), алкалоид барвинка (например, винбластин, винкристин, виндезин, винорелбин), алкилирующее средство (например, циклофосфамид, декарбазин, мелфалан, ифосфамид, темозоломид), антитело против иммунной клетки (например, алемтузамаб, гемтузумаб, ритуксимаб, офатумумаб, тозитумомаб, брентуксимаб), антиметаболит (включая, например, антагонисты фолиевой кислоты, аналоги пиримидина, аналоги пурина и ингибиторы аденозиндеаминазы (например, флударабин)), ингибитор mTOR, агонист индуцируемого TNFR глюкокортикоидом родственного TNFR белка (GITR), ингибитор протеасомы (например, аклациномицин A, глиотоксин или бортезомиб), иммуномодулятор, такой как талидомид или производное талидомида (например, леналидомид).
Основные химиотерапевтические средства, предусматриваемые для применения в способах комбинированного лечения, включают анастрозол (Arimidex®), бикалутамид (Casodex®), блеомицина сульфат (Blenoxane®), бусульфан (Myleran®), инъекцию бусульфана (Busulfex®), капецитабин (Xeloda®), N4-пентоксикарбонил-5-дезокси-5-фторцитидин, карбоплатин (Paraplatin®), кармустин (BiCNU®), хлорамбуцил (Leukeran®), цисплатин (Platinol®), кладрибин (Leustatin®), циклофосфамид (Cytoxan® или Neosar®), цитарабин, цитозинарабинозид (Цитозар-U®), липосомальную инъекцию цитарабина (DepoCyt®), дакарбазин (DTIC-Dome®), дактиномицин (актиномицин D, космеген), даунорубицина гидрохлорид (Cerubidine®), липосомальную инъекцию даунорубицина цитрата (DaunoXome®), дексаметазон, доцетаксел (Taxotere®), доксорубицина гидрохлорид (Adriamycin®, Rubex®), этопозид (Vepesid®), флударабина фосфат (Fludara®), 5-фторурацил (Adrucil®, Efudex®), флутамид (Eulexin®), тезацитибин, гемцитабин (дифтордезоксицитидин), гидроксимочевину (Hydrea®), идарубицин (Idamycin®), ифосфамид (IFEX®), иринотекан (Camptosar®), L-аспарагиназу (ELSPAR®), лейковорин кальция, мелфалан (Alkeran®), 6-меркаптопурин (Purinethol®), метотрексат (Folex®), митоксантрон (Novantrone®), милотарг, паклитаксел (Taxol®), феникс (Yttrium90/MX-DTPA), пентостатин, полифепросан 20 с имплантатом кармустина (Gliadel®), тамоксифена цитрат (Nolvadex®), тенипозид (Vumon®), 6-тиогуанин, тиотепу, тирапазамин (Tirazone®), топотекана гидрохлорид для инъекции (Hycamptin®), винбластин (Velban®), винкристин (Oncovin®) и винорелбин (Navelbine®).
Средства против злокачественной опухоли, представляющие особый интерес для комбинаций с соединениями по настоящему изобретению, включают: антрациклины; алкилирующие средства; антиметаболиты; лекарственные средства, которые ингибируют кальций-зависимую фосфатазу кальциневрин или киназу p70S6 (FK506) или ингибируют киназу p70S6; ингибиторы mTOR; иммуномодуляторы; антрациклины; алкалоиды барвинка; ингибиторы протеасомы; агонисты GITR; ингибиторы белковой тирозинфосфатазы; ингибитор киназы CDK4; ингибитор BTK; ингибитор киназы MKN; ингибитор киназы DGK или онколитический вирус.
Иллюстративные антиметаболиты включают, но не ограничиваются ими, аналоги пиримидина, аналоги пурина и ингибиторы аденозиндеаминазы: метотрексат (Rheumatrex®, Trexall®), 5-фторурацил (Adrucil®, Efudex®, Fluoroplex®), флоксуридин (FUDF®), цитарабин (Cytosar-U®, Tarabine PFS), 6-меркаптопурин (Puri-Nethol®)), 6-тиогуанин (тиогуанин Tabloid®), фосфат флударабина (Fludara®), пентостатин (Nipent®), пеметрексед (Alimta®), ралтитрексед (Tomudex®), кладрибин (Leustatin®), клофарабин (Clofarex®, Clolar®), азацитидин (Vidaza®), децитабин и гемцитабин (Gemzar®). Предпочтительные антиметаболиты включают, цитарабин, клофарабин и флударабин.
Иллюстративные алкилирующие средства включают, но не ограничиваются ими, азотистые иприты, производные этиленимина, алкилсульфонаты, нитрозомочевины и триазены): урамустин (Aminouracil Mustard®, Chlorethaminacil®, Demethyldopan®, Desmethyldopan®, Haemanthamine®, Nordopan®, Uracil nitrogen mustard®, Uracillost®, Uracilmostaza®, Uramustin®, Uramustine®), хлорметин (Mustargen®), циклофосфамид (Cytoxan®, Neosar®, Clafen®, Endoxan®, Procytox®, Revimmune™), ифосфамид (Mitoxana®), мелфалан (Alkeran®), хлорамбуцил (Leukeran®), пипоброман (Amedel®, Vercyte®), триэтиленмеламин (Hemel®, Hexalen®, Hexastat®), триэтилентиофосфорамин, темозоломид (Temodar®), тиотепа (Thioplex®), бусульфан (Busilvex®, Myleran®), кармустин (BiCNU®), ломустин (CeeNU®), стрептозоцин (Zanosar®) и дакарбазин (DTIC-Dome®). Дополнительные иллюстративные алкилирующие средства включают, но не ограничиваются ими, оксалиплатин (Eloxatin®); темозоломид (Temodar® и Temodal®); дактиномицин (также известный как актиномицин-D, Cosmegen®); мелфалан (также известный как L-PAM, L-сарколизин и фенилаланина мустин, Alkeran®); алтретамин (также известный как гексаметилмеламин (HMM), Hexalen®); кармустин (BiCNU®); бендамустин (Treanda®); бусульфан (Busulfex® и Myleran®); карбоплатин (Paraplatin®); ломустин (также известный как CCNU, CeeNU®); цисплатин (также известный как CDDP, Platinol® и Platinol®-AQ); хлорамбуцил (Leukeran®); циклофосфамид (Cytoxan® и Neosar®); дакарбазин (также известный как DTIC, DIC и имидазола карбоксамид, DTIC-Dome®); алтретамин (также известный как гексаметилмеламин (HMM), Hexalen®); ифосфамид (Ifex®); преднумустин; прокарбазин (Matulane®); мехлоретамин (также известный как азотистый иприт, мустин и мехлорэтамина гидрохлорид, Mustargen®); стрептозоцин (Zanosar®); тиотепа (также известный как тиофосфоамид, TESPA и TSPA, Thioplex®); циклофосфамид (Endoxan®, Cytoxan®, Neosar®, Procytox®, Revimmune®) и бендамустин HCl (Treanda®).
В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с флударабином, циклофосфамидом и/или ритуксимабом. В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с флударабином, циклофосфамидом и ритуксимабом (FCR). В вариантах осуществления индивидуум страдает CLL. Например, индивидуум имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах индивидуум не имеет del(17p). В вариантах осуществления у индивидуума содержится лейкозная клетка, содержащая мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В других вариантах осуществления у индивидуума не содержится лейкозная клетка, содержащая мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH ). В вариантах осуществления флударабин вводят в дозе приблизительно 10-50 мг/м2 (например, приблизительно 10-15, 15-20, 20-25, 25-30, 30-35, 35-40, 40-45 или 45-50 мг/м2), например, внутривенно. В вариантах осуществления циклофосфамид вводят в дозе приблизительно 200-300 мг/м2 (например, приблизительно 200-225, 225-250, 250-275 или 275-300 мг/м2), например, внутривенно. В вариантах осуществления ритуксимаб вводят в дозе приблизительно 400-600 мг/м2 (например, 400-450, 450-500, 500-550 или 550-600 мг/м2), например, внутривенно.
В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с бендамустином и ритуксимабом. В вариантах осуществления индивидуум страдает CLL. Например, индивидуум имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах индивидуум не имеет делецию del(17p). В вариантах осуществления у индивидуума содержится лейкозная клетка, содержащая мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH ). В других вариантах осуществления у индивидуума не содержится лейкозная клетка, содержащая мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH ). В вариантах осуществления бендамустин вводят в дозе приблизительно 70-110 мг/м2 (например, 70-80, 80-90, 90-100 или 100-110 мг/м2), например, внутривенно. В вариантах осуществления ритуксимаб вводят в дозе приблизительно 400-600 мг/м2 (например, 400-450, 450-500, 500-550 или 550-600 мг/м2), например, внутривенно.
В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ритуксимабом, циклофосфамидом, доксорубицином, винкристином и/или кортикостероидом (например, преднизоном). В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ритуксимабом, циклофосфамидом, доксорубицином, винкристином и преднизоном (R-CHOP). В вариантах осуществления индивидуум страдает диффузной крупноклеточной B-клеточной лимфомой (DLBCL). В вариантах осуществления индивидуум страдает негенрализованной DLBCL с локализованной стадией (например, имеет опухоль с размером/диаметром менее 7 см). В вариантах осуществления индивидуум получает лечение облучением в комбинации с R-CHOP. Например, индивидууму вводят R-CHOP (например, 1-6 циклов, например, 1, 2, 3, 4, 5 или 6 циклов R-CHOP) с последующим облучением. В некоторых случаях индивидууму вводят R-CHOP (например, 1-6 циклов, например, 1, 2, 3, 4, 5 или 6 циклов R-CHOP) после облучения.
В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с этопозидом, преднизоном, винкристином, циклофосфамидом, доксорубицином и/или ритуксимабом. В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с этопозидом, преднизоном, винкристином, циклофосфамидом, доксорубицином и ритуксимабом (EPOCH-R). В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с EPOCH-R со скорректированной дозой(DA-EPOCH-R). В вариантах осуществления индивидуум страдает B-клеточной лимфомой, например, агрессивной B-клеточной лимфомой с перестройкой Myc.
В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ритуксимабом и/или леналидомидом. Леналидомид ((RS)-3-(4-амино-1-оксо-1,3-дигидро-2H-изоиндол-2-ил)пиперидин-2,6-дион) представляет собой иммуномодулятор. В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ритуксимабом и леналидомидом. В вариантах осуществления индивидуум страдает фолликулярной лимфомой (FL) или лимфомой мантийных клеток (MCL). В вариантах осуществления индивидуум страдает FL и ранее не получал лечение терапией против злокачественной опухоли. В вариантах осуществления леналидомид вводят в дозе приблизительно 10-20 мг (например, 10-15 или 15-20 мг), например, каждые сутки. В вариантах осуществления ритуксимаб вводят в дозе приблизительно 350-550 мг/м2 (например, 350-375, 375-400, 400-425, 425-450, 450-475 или 475-500 мг/м2), например, внутривенно.
Иллюстративные ингибиторы mTOR включают, например, темсиролимус; ридафоролимус (ранее известный как деферолимус, (1R,2R,4S)-4-[(2R)-2 [(1R,9S,12S,15R,16E,18R,19R,21R, 23S,24E,26E,28Z,30S,32S,35R)-1,18-дигидрокси-19,30-диметокси-15,17,21,23,29,35-гексаметил-2,3,10,14,20-пентаоксо-11,36-диокса-4-азатрицикло[30.3.1.04,9]-гексатриаконта-16,24,26,28-тетраен-12-ил]пропил]-2-метоксициклогексилдиметилфосфинат, также известный как AP23573 и MK8669 и описанный в публикация PCT № WO 03/064383); эверолимус (Afinitor® или RAD001); рапамицин (AY22989, Sirolimus®); симапимод (CAS 164301-51-3); емсиролимус, (5-{2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил}-2-метоксифенил)метанол (AZD8055); 2-амино-8-[транс--4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метил-пиридо[2,3-d]пиримидин-7(8H)-он (PF04691502, CAS 1013101-36-4) и N2-[1,4-диоксо-4-[[4-(4-оксо-8-фенил-4H-1-бензопиран-2-ил)морфолиний-4-ил]метокси]бутил]-L-аргинилглицил-L-α-аспартил-L-серин- (SEQ ID NO: 706), внутренняя соль (SF1126, CAS 936487-67-1) и XL765.
Иллюстративные иммуномодуляторы включают, например, афутузумаб (доступный от Roche®); пэгфилграстим (Neulasta®); леналидомид (CC-5013, Revlimid®); талидомид (Thalomid®), актимид (CC4047) и IRX-2 (смесь цитокинов человека, включая интерлейкин 1, интерлейкин 2 и интерферон γ, CAS 951209-71-5, доступный от IRX Therapeutics).
Иллюстративные антрациклины включают, например, доксорубицин (Adriamycin® и Rubex®); блеомицин (Lenoxane®); даунорубицин (даунорубицина гидрохлорид, дауномицин и рубидомицина гидрохлорид, Cerubidine®); липосомальный даунорубицин (липосомальный даунорубицина цитрат, DaunoXome®); митоксантрон (DHAD, Novantrone®); эпирубицин (Ellence™); идарубицин (Idamycin®, Idamycin PFS®); митомицин C (Mutamycin®); гелданамицин; гербимицин; равидомицин и дезацетилравидомицин.
Иллюстративные алкалоиды барвинка включают, например, винорелбин тартрат (Navelbine®), винкристин (Oncovin®) и виндезин (Eldisine®)); винбластин (также известный как винбластина сульфат, винкалейкобластин и VLB, Alkaban-AQ® и Velban®) и винорелбин (Navelbine®).
Иллюстративные ингибиторы протеасомы включают бортезомиб (Velcade®); карфилзомиб (PX-171-007, (S)-4-метил-N-((S)-1-(((S)-4-метил-1-((R)-2-метилоксиран-2-ил)-1-оксопентан-2-ил)амино)-1-оксо-3-фенилпропан-2-ил)-2-((S)-2-(2-морфолиноацетамидо)-4-фенилбутанамидо)пентанамид); маризомиб (NPI-0052); иксазомиба цитрат (MLN-9708); деланзомиб (CEP-18770) и O-метил-N-[(2-метил-5-тиазолил)карбонил]-L-серил-O-метил-N-[(1S)-2-[(2R)-2-метил-2-оксиранмл]-2-оксо-1-(фенилметил)этил]-L-серинамид (ONX-0912).
В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с брентуксимабом. Брентуксимаб представляет собой конъюгат антитело-лекарственное средство антитела против CD30 и монометилауристатина E. В вариантах осуществления индивидуум страдает лимфомой Ходжкина (HL), например, рецидивирующей или рефрактерной HL. В вариантах осуществления индивидуум страдает CD30+ HL. В вариантах осуществления индивидуум подвергался аутологичной трансплантации стволовых клеток (ASCT). В вариантах осуществления индивидуум не подвергался ASCT. В вариантах осуществления брентуксимаб вводят в дозе приблизительно 1-3 мг/кг (например, приблизительно 1-1,5, 1,5-2, 2-2,5 или 2,5-3 мг/кг), например, внутривенно, например, каждые 3 недели.
В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с брентуксимабом и дакарбазином или в комбинации с брентуксимабом и бендамустином. Дакарбазин представляет собой алкилирующее средство с химическим названием 5-(3,3-диметил-1-триазенил)имидазол-4-карбоксамид. Бендамустин представляет собой алкилирующее средство с химическим названием 4-[5-[бис(2-хлорэтил)амино]-1-метилбензимидазол-2-ил]бутановая кислота. В вариантах осуществления индивидуум страдает лимфомой Ходжкина (HL). В вариантах осуществления индивидуум ранее не получал лечение терапией против злокачественной опухоли. В вариантах осуществления возраст индивидуума составляет по меньшей мере 60 лет, например, 60, 65, 70, 75, 80, 85 или более. В вариантах осуществления дакарбазин вводят в дозе приблизительно 300-450 мг/м2 (например, приблизительно 300-325, 325-350, 350-375, 375-400, 400-425 или 425-450 мг/м2), например, внутривенно. В вариантах осуществления бендамустин вводят в дозе приблизительно 75-125 мг/м2 (например, 75-100 или 100-125 мг/м2, например, приблизительно 90 мг/м2), например, внутривенно. В вариантах осуществления брентуксимаб вводят в дозе приблизительно 1-3 мг/кг (например, приблизительно 1-1,5, 1,5-2, 2-2,5 или 2,5-3 мг/кг), например, внутривенно, например, каждые 3 недели.
В некоторых вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ингибитором CD20, например, антителом против CD20 (например, моно- или биспецифическим антителом против CD20) или его фрагментом. Иллюстративные антитела к CD20 включают, но не ограничиваются ими, ритуксимаб, офатумумаб, окрелизумаб, велтузумаб, обинутузумаб, TRU-015 (Trubion Pharmaceuticals), окаратузумаб и Pro131921 (Genentech). См., например, Lim et al., Haematologica., 95,1(2010):135-43.
В некоторых вариантах осуществления антитело против CD20 включает ритуксимаб. Ритуксимаб представляет собой IgG1 каппа химерного моноклонального антитела мыши/человека, который связывается с CD20 и вызывает цитолиз экспрессирующей CD20 клетки, например, как описано в www.accessdata.fda.gov/drugsatfda_docs/label/2010/103705s5311lbl.pdf. В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ритуксимабом. В вариантах осуществления индивидуум страдает CLL или SLL.
В некоторых вариантах осуществления ритуксимаб вводят внутривенно, например, в виде внутривенной инфузии. Например, каждая инфузия обеспечивает приблизительно 500-2000 мг (например, приблизительно 500-550, 550-600, 600-650, 650-700, 700-750, 750-800, 800-850, 850-900, 900-950, 950-1000, 1000-1100, 1100-1200, 1200-1300, 1300-1400, 1400-1500, 1500-1600, 1600-1700, 1700-1800, 1800-1900 или 1900-2000 мг) ритуксимаба. В некоторых вариантах осуществления ритуксимаб вводят в дозе от 150 мг/м2 до 750 мг/м2, например, приблизительно 150-175 мг/м2, 175-200 мг/м2, 200-225 мг/м2, 225-250 мг/м2, 250-300 мг/м2, 300-325 мг/м2, 325-350 мг/м2, 350-375 мг/м2, 375-400 мг/м2, 400-425 мг/м2, 425-450 мг/м2, 450-475 мг/м2, 475-500 мг/м2, 500-525 мг/м2, 525-550 мг/м2, 550-575 мг/м2, 575-600 мг/м2, 600-625 мг/м2, 625-650 мг/м2, 650-675 мг/м2 или 675-700 мг/м2, где м2 означает площадь поверхности тела индивидуума. В некоторых вариантах осуществления ритуксимаб вводят с интервалом дозирования по меньшей мере 4 суток, например, 4, 7, 14, 21, 28, 35 суток или более. Например, ритуксимаб вводят с интервалом дозирования по меньшей мере 0,5 недель, например, 0,5, 1, 2, 3, 4, 5, 6, 7, 8 недель или более. В некоторых вариантах осуществления ритуксимаб вводят в дозе и с интервалом дозирования, описываемым в настоящем описании, в течение периода времени, например, по меньшей мере 2 недель, например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 недель или более. Например, ритуксимаб вводят в дозе и с интервалом дозирования, описываемым в настоящем описании, в общей сложности по меньшей мере 4 дозы на цикл лечения (например, по меньшей мере 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 или более доз на цикл лечения).
В некоторых вариантах осуществления антитело против CD20 ввключате офатумумаб. Офатумумаб представляет собой моноклональное антитело человека IgG1κ против CD20 с молекулярной массой приблизительно 149 кДа. Например, офатумумаб получают с использованием трансгенной мыши и гибридомной технологии и экспрессируют, и выделяют из рекомбинантной линии клеток мыши (NS0). См., например, www.accessdata.fda.gov/drugsatfda_docs/label/2009/125326lbl.pdf и клиническое испытание с идентификационным номером NCT01363128, NCT01515176, NCT01626352 и NCT01397591. В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с офатумумабом. В вариантах осуществления индивидуум страдает CLL или SLL.
В некоторых вариантах осуществления офатумумаб вводят в виде внутривенной инфузии. Например, каждая инфузия обеспечивает приблизительно 150-3000 мг (например, приблизительно 150-200, 200-250, 250-300, 300-350, 350-400, 400-450, 450-500, 500-550, 550-600, 600-650, 650-700, 700-750, 750-800, 800-850, 850-900, 900-950, 950-1000, 1000-1200, 1200-1400, 1400-1600, 1600-1800, 1800-2000, 2000-2200, 2200-2400, 2400-2600, 2600-2800 или 2800-3000 мг) офатумумаба. В вариантах осуществления офатумумаб вводят в начальной дозе приблизительно 300 мг с последующим введением 2000 мг, например, приблизительно для 11 доз, например, в течение 24 недель. В некоторых вариантах осуществления офатумумаб вводят с интервалом дозирования по меньшей мере 4 суток, например, 4, 7, 14, 21, 28, 35 суток или более. Например, офатумумаб вводят с интервалом дозирования по меньшей мере 1 неделя, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 24, 26, 28, 20, 22, 24, 26, 28, 30 недель или более. В некоторых вариантах осуществления офатумумаб вводят в дозе и с интервалом дозирования, описываемым в настоящем описании, в течение периода времени, например, по меньшей мере 1 недели, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 40, 50, 60 недель или более или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев или более или 1, 2, 3, 4, 5 лет или более. Например, офатумумаб вводят в дозе и с интервалом дозирования, описываемым в настоящем описании, в общей сложности по меньшей мере 2 дозы на цикл лечения (например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 18, 20 или более доз на цикл лечения).
В некоторых случаях антитело против CD20 включает окрелизумаб. Окрелизумаб представляет собой гуманизированное моноклональное антитело против CD20, например, как описано в клинических испытаниях с идентификационными номерами NCT00077870, NCT01412333, NCT00779220, NCT00673920, NCT01194570 и у Kappos et al., Lancet., 19.378(2011):1779-87.
В некоторых случаях антитело против CD20 включает велтузумаб. Велтузумаб представляет собой гуманизированное моноклональное антитело против CD20. См., например, клиническое испытание с идентификационным № NCT00547066, NCT00546793, NCT01101581 и Goldenberg et al., Leuk. Lymphoma., 51(5)(2010):747-55.
В некоторых случаях антитело против CD20 включает GA101. GA101 (также называемое обинутузумабом или RO5072759) представляет собой гуманизированное моноклональное антитело против CD20 с модифицированной схемой гликозилирования. См., например, Robak., Curr. Opin. Investig. Drugs., 10.6(2009):588-96; клинические испытания с идентификационным номером: NCT01995669, NCT01889797, NCT02229422 и NCT01414205; и www.accessdata.fda.gov/drugsatfda_docs/label/2013/125486s000lbl.pdf.
В некоторых случаях антитело против CD20 включает AME-133v. AME-133v (также называемое LY2469298 или окаратузумабом) представляет собой гуманизированное моноклональное антитело IgG1 против CD20 с повышенной аффинностью к рецептору FcγRIIIa и повышенным антителозависимым клеточным цитотоксическим (ADCC) действием по сравнению с ритуксимабом. См., например, Robak et al., BioDrugs, 25,1(2011):13-25 и Forero-Torres et al., Clin. Cancer Res., 18,5(2012):1395-403.
В некоторых случаях антитело против CD20 включает PRO131921. PRO131921 представляет собой гуманизированное моноклональное антитело против CD20, сконструированное так, чтобы лучше связываться с FcγRIIIa и иметь повышенную ADCC по сравнению с ритуксимабом. См., например, Robak et al., BioDrugs, 25.1(2011):13-25 и Casulo et al., Clin Immunol., 154.1(2014):37-46; и клиническое испытание с идентификационным № NCT00452127.
В некоторых случаях антитело против CD20 включает TRU-015. TRU-015 представляет собой слитый белок против CD20, получаемый из доменов антитела против CD20. TRU-015 является меньше чем моноклональные антитела, но сохраняет Fc-опосредованные эффекторные функции. См., например, Robak et al., BioDrugs, 25,1(2011):13-25. TRU-015 содержит одноцепочечный вариабельный фрагмент (scFv) антитела CD20 против, связанный с шарнирным доменом, доменами CH2 и CH3 IgG1 человека, но не содержащий домены CH1 и CL.
В некоторых вариантах осуществления антитело против CD20, описываемое в настоящем описании, конъюгировано или иным образом связано с терапевтическим средством, например, химиотерапевтическим средством (например, цитоксаном, флударабином, ингибитором гистондеацетилазы, деметилирующим средством, пептидной вакциной, противоопухолевым антибиотиком, ингибитором тирозинкиназы, алкилирующим средством, средством, оказывающим действие на микротрубочки или антимитотическим средством), противоаллергическим средством, средством против тошноты (или противорвотным средством), обезболивающим средством или цитопротекторным средством, описываемым в настоящем описании.
В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ингибитором B-клеточной лимфомы 2 (BCL-2) (например, венетоклаксом, также называемым ABT-199 или GDC-0199) и/или ритуксимабом. В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с венетоклаксом и ритуксимабом. Венетоклакс представляет собой низкомолекулярное соединение, которое ингибирует антиапоптотический белок BCL-2. Структура венетоклакса (4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2H-пиран-4-илметил)амино]фенил}сульфонил)-2-(1H-пирроло[2,3-b]пиридин-5-илокси)бензамид) представлена ниже.
В вариантах осуществления индивидуум страдает CLL. В вариантах осуществления индивидуум страдает рецидивирующим CLL, например, индивидуум ранее получал терапию против злокачественной опухоли. В вариантах осуществления венетоклакс вводят в дозе приблизительно 15-600 мг (например, 15-20, 20-50, 50-75, 75-100, 100-200, 200-300, 300-400, 400-500 или 500-600 мг), например, каждые сутки. В вариантах осуществления ритуксимаб вводят в дозе приблизительно 350-550 мг/м2 (например, 350-375, 375-400, 400-425, 425-450, 450-475 или 475-500 мг/м2), например, внутривенно, например, каждый месяц.
В некоторых вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят в комбинации с онколитическим вирусом. В вариантах осуществления онколитические вирусы способны селективно реплицироваться и активировать гибель или замедление роста злокачественной клетки. В некоторых случаях онколитические вирусы не оказывают эффект или оказывают минимальный эффект на незлокачественные клетки. Онколитичие вирус включает, но не ограничивается им, онколитический аденовирус, онколитические вирусы простого герпеса, онколитический ретровирус, онколитический парвовирус, онколитический вирус осповакцины, онколитический вирус Синдбис, онколитический вирус гриппа или онколитический РНК-вирус (например, онколитический реовирус, онколитический Вирус болезни Ньюкасла (NDV), онколитический вирус кори или онколитический вирус везикулярного стоматита (VSV)).
В некоторых вариантах осуществления онколитический вирус представляет собой вирус, например, рекомбинантный онколитический вирус, описанный в US2010/0178684 A1, полностью включенном в настоящее описание посредством ссылки. В некоторых вариантах осуществления рекомбинантный онколитический вирус содержит последовательность нуклеиновой кислоты (например, гетерологичную последовательность нуклеиновой кислоты), кодирующую ингибитор иммунного или воспалительного ответа, например, как описано в US2010/0178684 A1, полностью включенном в настоящее описание посредством ссылки. В вариантах осуществления рекомбинантный онколитический вирус, например, онколитический NDV содержит проапоптотический белок (например, апоптин), цитокин (например, GM-CSF, интерферон-гамма, интерлейкин 2 (IL-2), фактор некроза опухоли альфа), иммуноглобулин (например, антитело против ED-B фибронектина), опухолеассоциированный антиген, биспецифический адаптерный белок (например, биспецифическое антитело или фрагмент антитела, направленный против белка NDV HN и T-клеточного костимуляторного рецептора, такого как CD3 или CD28; или слитый белок между IL-2 человека и одноцепочечным антителом, направленным против белка NDV HN). См., например, Zamarin et al., Future Microbiol., 7,3(2012):347-67, полностью включенной в настоящее описание посредством ссылки. В некоторых вариантах осуществления онколитический вирус представляет собой химерный онколитический NDV, описанный в US 8591881 B2, US 2012/0122185 A1 или US 2014/0271677 A1, каждый из которых полностью включен в настоящее описание посредством ссылки.
В некоторых вариантах осуществления онколитический вирус включает условно реплицирующийся аденовирус (CRAd), который конструируют, чтобы он реплицировался только в злокачественных клетках. См., например, Alemany et al., Nature Biotechnol., 18(2000):723-27. В некоторых вариантах осуществления онколитический аденовирус включает вирус, описанный в таблице 1 на стр. 725 Alemany et al., полностью включенной в настоящее описание посредством ссылки.
Иллюстративные онколитические вирусы включают, но не ограничиваются ими, следующие ниже:
Онколитический аденовирус группы B (ColoAd1) (PsiOxus Therapeutics Ltd.) (см., например, клиническое испытание с идентификатором: NCT02053220);
ONCOS-102 (ранее называемый CGTG-102), которые представляет собой аденовирус, содержащий гранулоцитарно-моноцитарный колониестимулирующий фактор (GM-CSF) (Oncos Therapeutics) (см., например, клиническое испытание с идентификатором: NCT01598129);
VCN-01, который представляет собой генетически модифицированный онколитический аденовирус человека, кодирующий гиалуронидазу PH20 человека (VCN Biosciences, S.L.) (см., например, клиническое испытание с идентификаторами: NCT02045602 и NCT02045589);
Условно реплицирующийся аденовирус ICOVIR-5, который представляет собой вирус, получаемый из аденовируса человека дикого типа серотипа 5 (Had5), который модифицировали селективно реплицироваться в злокачественных клетках с дерегулированный путь ретинобластомы/E2F (Institut Català d'Oncologia) (см., например, клиническое испытание с идентификатором: NCT01864759);
Селивир (celyvir), который содержит получаемые из костного мозга аутологичные мезенхимальные стволовые клетки (MSC), инфицированные ICOVIR5, онколитическим аденовирусом (Hospital Infantil Universitario Niño Jesús, Madrid, Spain/Ramon Alemany) (см., например, клиническое испытание с идентификатором: NCT01844661);
CG0070, который представляет собой условно реплицирующийся онколитический аденовирус серотипа 5 (Ad5), в котором промотор E2F-1 человека направляет экспрессию основных генов вируса E1a, таким образом ограничивая вирусную репликацию и цитотоксичность в отношении опухолевых клеток с дефектным путем Rb (Cold Genesys, Inc.) (см., например, клиническое испытание с идентификатором: NCT02143804); или
DNX-2401 (ранее называемый Delta-24-RGD), который представляет собой аденовирус, который конструировали так, чтобы он селективно экспрессировался в клетках ретинобластомы с недостаточностью пути (Rb) и инфицировал клетки, которые экспрессируют определенные связывающие RGD интегрины более эффективно (Clinica Universidad de Navarra, Universidad de Navarra/DNAtrix, Inc.) (см., например, клиническое испытание с идентификатором: NCT01956734).
В некоторых вариантах осуществления онколитический вирус, описываемый в настоящем описании, вводят посредством инъекции, например, подкожной, внутриартериальной, внутривенной, внутримышечной, интратекальной или интраперитонеальной инъекции. В вариантах осуществления онколитический вирус, описываемый в настоящем описании, вводят внутриопухолевым путем, трансдермально, трансмукозально, перорально, интраназально или посредством легочного введения.
В одном из вариантов осуществления клетки, экспрессирующие CAR, описываемые в настоящем описании, вводят индивидууму в комбинации с молекулой, которая уменьшает популяция Treg-клеток. Способы, которые приводят к уменьшению числа (например, истощению) Treg-клеток известны в данной области и включают, например, истощение CD25, введение циклофосфамида, модулирующую функцию GITR. Без желания быть связанными теорией, полагают, что уменьшение числа Treg-клеток у индивидуума до проведения афереза или перед введением экспрессирующей CAR клетки, описываемой в настоящем описании, уменьшает число нежелательных иммунных клеток (например, Treg) в микроокружении опухоли и снижает риск рецидива у индивидуума.
В одном из вариантов осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с молекулой, направленной на GITR и/или модулирующей функции GITR, такой как агонист GITR и/или антитело против GITR, которое истощает регуляторные T-клетки (Treg). В вариантах осуществления клетки, экспрессирующие CAR, описываемый в настоящем описании, вводят индивидууму в комбинации с циклофосфамидом. В одном из вариантов осуществления связывающие GITR молекулы и/или молекулы, модулирующие функции GITR, (например, агонист GITR и/или истощающие Treg антитела против GITR) вводят перед введением экспрессирующей CAR клетки. Например, в одном из вариантов осуществления агонист GITR можно вводить до афереза клеток. В вариантах осуществления циклофосфамид вводят индивидууму перед введением (например, инфузией или реинфузией) экспрессирующей CAR клетки или до афереза клеток. В вариантах осуществления циклофосфамид и антитело против GITR вводят индивидууму перед введением (например, инфузией или реинфузией) экспрессирующей CAR клетки или до афереза клеток. В одном из вариантов осуществления индивидуум страдает злокачественной опухолью (например, солидной злокачественной опухолью или гематологической злокачественной опухолью, такой как ALL или CLL). В одном из вариантов осуществления индивидуум страдает CLL. В вариантах осуществления индивидуум страдает ALL. В вариантах осуществления индивидуум страдает солидной злокачественной опухолью, например, солидной злокачественной опухолью, описываемой в настоящем описании. Иллюстративные агонисты GITR включают, например, слитые белки GITR и антитела против GITR (например, бивалентные антитела против GITR), такие как, например, слитый белок GITR, описанный в патенте США №: 6111090, патенте Европы №: 090505B1, патенте U.S. №: 8586023, публикациях PCT №: WO 2010/003118 и 2011/090754, или антитело против GITR, описанное, например, в патенте США №: 7025962, патенте Европы №: 1947183B1, патенте США №: 7812135, патенте США №: 8388967 и патенте США №: 8591886, патенте Европы №: EP 1866339, публикации PCT №: WO 2011/028683, публикации PCT №:WO 2013/039954, публикации PCT №: WO2005/007190, публикации PCT №: WO 2007/133822, публикации PCT №: WO2005/055808, публикации PCT №: WO 99/40196, публикации PCT №: WO 2001/03720, публикации PCT №: WO99/20758, публикации PCT №: WO2006/083289, публикации PCT №: WO 2005/115451, патенте США №: 7618632 и публикации PCT №: WO 2011/051726.
В одном из вариантов осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с агонистом GITR, например, агонистом GITR, описываемым в настоящем описании. В одном из вариантов осуществления агонист GITR вводят до экспрессирующей CAR клетки. Например, в одном из вариантов осуществления агонист GITR можно вводить до афереза клеток.
В одном из вариантов осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ингибитором mTOR, например, ингибитором mTOR, описываемым в настоящем описании, например, рапалогом, таким как эверолимус. В одном из вариантов осуществления ингибитор mTOR вводят до экспрессирующей CAR клетки. Например, в одном из вариантов осуществления ингибитор mTOR можно вводить до афереза клеток.
В одном из вариантов осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ингибитором белковой тирозинфосфатазы, например, ингибитором белковой тирозинфосфатазы, описываемым в настоящем описании. В одном из вариантов осуществления ингибитор белковой тирозинфосфатазы представляют собой ингибитор SHP-1, например, ингибитор SHP-1, описываемый в настоящем описании, такой как, например, стибоглюконат натрия. В одном из вариантов осуществления ингибитор белковой тирозинфосфатазы представляет собой ингибитор SHP-2.
В одном из вариантов осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, можно использовать в комбинации с ингибитором киназы. В одном из вариантов осуществления ингибитор киназы представляет собой ингибитор CDK4, например, ингибитор CDK4, описываемый в настоящем описании, например, ингибитор CD4/6, такой как, например, гидрохлорид 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-ил-пиридин-2-иламино)-8H-пиридо[2,3-d]пиримидин-7-она (также обозначаемый как палбоциклиб или PD0332991). В одном из вариантов осуществления ингибитор киназы представляет собой ингибитор BTK, например, ингибитор BTK, описываемый в настоящем описании, такой как, например, ибрутиниб. В одном из вариантов осуществления ингибитор киназы представляет собой ингибитор mTOR, например, ингибитор mTOR, описываемый в настоящем описании, такой как, например, рапамицин, аналог рапамицина, OSI-027. Ингибитор mTOR может представлять собой, например, ингибитор mTORC1 и/или ингибитор mTORC2, например, ингибитор mTORC1 и/или ингибитор mTORC2, описываемый в настоящем описании. В одном из вариантов осуществления ингибитор киназы представляет собой ингибитор MNK, например, ингибитор MNK, описываемый в настоящем описании, такой как, например, 4-амино-5-(4-фторанилино)пиразоло-[3,4-d]пиримидин. Ингибитор MNK может представлять собой, например, ингибитор MNK1a, MNK1b, MNK2a и/или MNK2b. В одном из вариантов осуществления ингибитор киназы представляет собой ингибитор DGK, например, ингибитор DGK, описываемый в настоящем описании, такой как, например, DGKinh1 (D5919) или DGKinh2 (D5794). В одном из вариантов осуществления ингибитор киназы представляет собой ингибитор CDK4, выбранный из алоизина A; флавопиридола или HMR-1275, 2-(2-хлорфенил)-5,7-дигидрокси-8-[(3S,4R)-3-гидрокси-1-метил-4-пиперидинил]-4-хроменона; кризотиниба (PF-02341066; гидрохлорида 2-(2-хлорфенил)-5,7-дигидрокси-8-[(2R,3S)-2-(гидроксиметил)-1-метил-3-пирролидинил]-4H-1-бензопиран-4-она (P276-00); 1-метил-5-[[2-[5-(трифторметил)-1H-имидазол-2-ил]-4-пиридинил]окси]-N-[4-(трифторметил)фенил]-1H-бензимидазол-2-амина (RAF265); индисулама (E7070); росковитина (CYC202); палбоциклиба (PD0332991); динациклиба (SCH727965); N-[5-[[(5-трет-бутилоксазол-2-ил)метил]тио]тиазол-2-ил]пиперидин-4-карбоксамида (BMS 387032); 4-[[9-хлор-7-(2,6-дифторфенил)-5H-пиримидо[5,4-d][2]бензазепин-2-ил]амино]бензойной кислоты (MLN8054); 5-[3-(4,6-дифтор-1H-бензимидазол-2-ил)-1H-индазол-5-ил]-N-этил-4-метил-3-пиридинметанамина (AG-024322); N-(пиперидин-4-ил)амида 4-(2,6-дихлорбензоиламино)-1H-пиразол-3-карбоновой кислоты (AT7519); 4-[2-метил-1-(1-метилэтил)-1H-имидазол-5-ил]-N-[4-(метилсульфонил)фенил]-2-пиримидинамина (AZD5438) и XL281 (BMS908662).
В одном из вариантов осуществления ингибитор киназы представляет собой ингибитор CDK4, например, палбоциклиб (PD0332991), и палбоциклиб вводят в дозе приблизительно 50 мг, 60 мг, 70 мг, 75 мг, 80 мг, 90 мг, 100 мг, 105 мг, 110 мг, 115 мг, 120 мг, 125 мг, 130 мг, 135 мг (например, 75 мг, 100 мг или 125 мг) каждые сутки в течение определенного периода времени, например, каждые сутки в течение 14-21 суток в цикле продолжительностью 28 суток или каждые сутки в течение 7-12 суток в цикле продолжительностью 21 сутки. В одном из вариантов осуществления палбоциклиб вводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более циклов.
В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ингибитором циклинзависимой киназы (CDK) 4 или 6, например, ингибитором CDK4 или ингибитором CDK6, описываемым в настоящем описании. В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ингибитором CDK4/6 (например, ингибитором, который направленно воздействует на CDK4 и CDK6), например, ингибитором CDK4/6, описываемым в настоящем описании. В одном из вариантов осуществления индивидуум страдает MCL. MCL представляет собой агрессивную злокачественную опухоль, которая слабо реагирует на доступные в настоящее время виды терапии, т.е. по существу неизлечимую. Во многих случаях MCL циклин D1 (регулятор CDK4/6) экспрессируется (например, вследствие хромосомной транслокации, включающей гены иммуноглобулина и циклина D1) в клетках MCL. Таким образом, без связи с теорией полагают, что клетки MCL являются высокочувствительными к ингибированию CDK4/6 с высокой специфичностью (т.е. минимальным эффектом на нормальные клетки иммунной системы). Ингибиторы CDK4/6 отдельно обладали некоторой эффективностью при лечении MCL, но с ними достигали только частичной ремиссии с высокой частотой рецидива. Иллюстративный ингибитор CDK4/6 представляет собой LEE011 (также называемый рибоциклибом), структура которого представлена ниже.
Без связи с теорией, полагают, что введением экспрессирующей CAR клетки, описываемой в настоящем описании, с ингибитором CDK4/6 (например, LEE011 или другим ингибитором CDK4/6, описываемым в настоящем описании) можно получать более высокую реакцию на лечение, например, с более высокой частотой ремиссии и/или более низкой частотой рецидива, например, по сравнению с одним ингибитором CDK4/6.
В одном из вариантов осуществления ингибитор киназы представляет собой ингибитор BTK, выбранный из ибрутиниба (PCI-32765); GDC-0834; RN-486; CGI-560; CGI-1764; HM-71224; CC-292; ONO-4059; CNX-774 и LFM-A13. В предпочтительном варианте осуществления ингибитор BTK не снижает или не ингибирует киназную активность индуцируемой интерлейкином 2 киназы (ITK) и выбран из GDC-0834; RN-486; CGI-560; CGI-1764; HM-71224; CC-292; ONO-4059; CNX-774 и LFM-A13.
В одном из вариантов осуществления ингибитор киназы представляет собой ингибитор BTK, например, ибрутиниб (PCI-32765). В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ингибитором BTK (например, ибрутинибом). В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ибрутинибом (также называемой PCI-32765). Структура ибрутиниба (1-[(3R)-3-[4-амино-3-(4-феноксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил]пиперидин-1-ил]проп-2-ен-1-она) представлена ниже.
В вариантах осуществления индивидуум страдает CLL, лимфомой мантийных клеток (MCL) или мелкоклеточной лимфомой (SLL). Например, индивидуум имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах, индивидуум не имеет del(17p). В вариантах осуществления индивидуум страдает рецидивирующим CLL или SLL, например, индивидуум ранее получал терапию против злокачественной опухоли (например, ранее получал один, два, три или четыре вида терапии против злокачественной опухоли). В вариантах осуществления индивидуум страдает рефрактерным CLL или SLL. В других вариантах осуществления индивидуум страдает фолликулярной лимфомой, например, рецидивирующей или рефрактерной фолликулярной лимфомой. В некоторых вариантах осуществления ибрутиниб вводят в дозе приблизительно 300-600 мг/сутки (например, приблизительно 300-350, 350-400, 400-450, 450-500, 500-550 или 550-600 мг/сутки, например, приблизительно 420 мг/сутки или приблизительно 560 мг/сутки), например, перорально. В вариантах осуществления ибрутиниб вводят в дозе приблизительно 250 мг, 300 мг, 350 мг, 400 мг, 420 мг, 440 мг, 460 мг, 480 мг, 500 мг, 520 мг, 540 мг, 560 мг, 580 мг, 600 мг (например, 250 мг, 420 мг или 560 мг) каждые сутки в течение периода времени, например, каждые сутки в течение цикла продолжительностью 21 сутки или каждые сутки в течение цикла продолжительностью 28 суток. В одном из вариантов осуществления ибрутиниб вводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более циклов.
В некоторых вариантах осуществления ибрутиниб вводят в комбинации с ритуксимабом. См., например, Burger et al., (2013) Ibrutinib In Combination With Rituximab (iR) Is Well Tolerated and Induces a High Rate Of Durable Remissions In Patients With High-Risk Chronic Lymphocytic Leukemia (CLL): New, Updated Results Of a Phase II Trial In 40 Patients, Abstract 675 presented at 55th ASH Annual Meeting and Exposition, New Orleans, LA 7-10 Dec. Без связи с теорией, полагают, что добавление ибрутиниба усиливает пролиферативный ответ T-клетки и может сдвигать T-клетки от фенотипа T-хелпера 2 (Th2) к T-хелперу 1 (Th1). Th1 и Th2 представляют собой фенотипы хелперных T-клеток, где Th1 по сравнению с Th2 направляют различные пути иммунного ответа. Фенотип Th1 ассоциирован с провоспалительными ответами, например, для уничтожения клеток, таких как внутриклеточные патогены/вирусы или злокачественные клетки или закреплению аутоиммунных ответов. Фенотип Th2 ассоциирован с накоплением эозинофила и противовоспалительными ответами.
В некоторых вариантах осуществления способов, применений и композиций в настоящем описании ингибитор BTK представляет собой ингибитор BTK, описанный в международной заявке WO/2015/079417, которая полностью включена. Например, в некоторых вариантах осуществления ингибитор BTK представляет собой соединение формулы (I) или его фармацевтически приемлемую соль:
где,
R1 представляет собой водород, C1-C6алкил необязательно замещенный гидрокси;
R2 представляет собой водород или галоген;
R3 представляет собой водород или галоген;
R4 представляет собой водород;
R5 представляет собой водород или галоген;
или R4 и R5 соединены друг с другом и обозначают связь -CH2-, -CH2-CH2-, -CH=CH-, -CH=CH-CH2-; -CH2-CH=CH- или -CH2-CH2-CH2-;
R6 и R7 означают независимо друг от друга H, C1-C6алкил необязательно замещенный гидроксил, C3-C6циклоалкил, необязательно замещенный галогеном или гидрокси, или галоген;
R8, R9, R, R', R10 и R11 независимо друг от друга обозначают H или C1-C6алкил, необязательно замещенный C1-C6алкокси; или любые два из R8, R9, R, R', R10 и R11 совместно с атомом углерода, с которым они связаны, могут образовывать 3-6-членное насыщенное карбоциклическое кольцо;
R12 представляет собой водород или C1-C6алкил, необязательно замещенный галогеном или C1-C6алкокси;
или R12 и любой из R8, R9, R, R', R10 или R11 совместно с атомами, с которыми они связаны, могут образовывать 4-, 5-, 6- или 7-членное азациклическое кольцо, где кольцо необязательно может являться замещенным галогеном, циано, гидроксил, C1-C6алкилом или C1-C6алкокси;
n представляет собой 0 или 1, и
R13 представляет собой C2-C6алкенил, необязательно замещенный C1-C6алкилом, C1-C6алкокси или N,N-ди-C1-C6алкиламино; C2-C6алкинил, необязательно замещенный C1-C6алкилом или C1-C6алкокси, или C2-C6алкиленилоксид, необязательно замещенным C1-C6алкилом.
В некоторых вариантах осуществления ингибитор BTK формулы I выбирают из: N-(3-(5-((1-акрилоилазетидин-3-ил)окси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (E)-N-(3-(6-амино-5-((1-(бут-2-еноил)азетидин-3-ил)окси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-((1-пропиолоилазетидин-3-ил)окси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-((1-(бут-2-иноил)азетидин-3-ил)окси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(5-((1-акрилоилпиперидин-4-ил)окси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(2-(N-метилакриламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (E)-N-(3-(6-амино-5-(2-(N-метилбут-2-енамидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(2-(N-метилпропиоламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (E)-N-(3-(6-амино-5-(2-(4-метокси-N-метилбут-2-енамидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(2-(N-метилбут-2-инамидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(2-((4-амино-6-(3-(4-циклопропил-2-фторбензамидо)-5-фтор-2-метилфенил)пиримидин-5-ил)окси)этил)-N-метилоксиран-2-карбоксамида; N-(2-((4-амино-6-(3-(6-циклопропил-8-фтор-1-оксоизохинолин-2(1H)-ил)фенил)пиримидин-5-ил)окси)этил)-N-метилакриламида; N-(3-(5-(2-акриламидоэтокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(2-(N-этилакриламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(2-(N-(2-фторэтил)акриламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(5-((1-акриламидоциклопропил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(5-(2-акриламидопропокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(6-амино-5-(2-(бут-2-инамидо)пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(6-амино-5-(2-(N-метилакриламидо)пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(6-амино-5-(2-(N-метилбут-2-инамидо)пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(3-(N-метилакриламидо)пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(5-((1-акрилоилпирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(6-амино-5-((1-(бут-2-иноил)пирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-2-(3-(5-((1-акрилоилпирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-(гидроксиметил)фенил)-6-циклопропил-3,4-дигидроизохинолин-1(2H)-она; N-(2-((4-амино-6-(3-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-5-фтор-2-(гидроксиметил)фенил)пиримидин-5-ил)окси)этил)-N-метилакриламида; N-(3-(5-(((2S,4R)-1-акрилоил-4-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(((2S,4R)-1-(бут-2-иноил)-4-метоксипирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; 2-(3-(5-(((2S,4R)-1-акрилоил-4-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-(гидроксиметил)фенил)-6-циклопропил-3,4-дигидроизохинолин-1(2H)-она; N-(3-(5-(((2S,4S)-1-акрилоил-4-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(((2S,4S)-1-(бут-2-иноил)-4-метоксипирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(5-(((2S,4R)-1-акрилоил-4-фторпирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(6-амино-5-(((2S,4R)-1-(бут-2-иноил)-4-фторпирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(5-((1-акрилоилазетидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-N-(3-(6-амино-5-((1-пропиолоилазетидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (S)-2-(3-(5-((1-акрилоилазетидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-(гидроксиметил)фенил)-6-циклопропил-3,4-дигидроизохинолин-1(2H)-она; (R)-N-(3-(5-((1-акрилоилазетидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; (R)-N-(3-(5-((1-акрилоилпиперидин-3-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(5-(((2R,3S)-1-акрилоил-3-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида; N-(3-(5-(((2S,4R)-1-акрилоил-4-цианопирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида или N-(3-(5-(((2S,4S)-1-акрилоил-4-цианопирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамида.
Если не предусмотрено иное, химические термины, используемые выше в описании ингибитора BTK формулы I, используют в соответствии с их значениями как установлено в международной заявке WO/2015/079417, которая полностью включена в настоящее описание.
В одном из вариантов осуществления ингибитор киназы представляет собой ингибитор mTOR, выбранный из темсиролимуса; ридафоролимуса (1R,2R,4S)-4-[(2R)-2[(1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28Z,30S,32S,35R)-1,18-дигидрокси-19,30-диметокси-15,17,21,23,29,35-гексаметил-2,3,10,14,20-пентаоксо-11,36-диокса-4-азатрицикло[30.3.1.04,9]гексатриаконт-16,24,26,28-тетраен-12-ил]пропил]-2-метоксициклогексилдиметилфосфината, также известного как AP23573 и MK8669; эверолимуса (RAD001); рапамицина (AY22989); симапимода; (5-{2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил}-2-метоксифенил)метанола (AZD8055); 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метил-пиридо[2,3-d]пиримидин-7(8H)-она (PF04691502) и N2-[1,4-диоксо-4-[[4-(4-оксо-8-фенил-4H-1-бензопиран-2-ил)морфолиний-4-ил]метокси]бутил]-L-аргинилглицил-L-α-аспартил-L-серина (SEQ ID NO: 706) внутренней соли (SF1126) и XL765.
В одном из вариантов осуществления ингибитор киназы представляет собой ингибитор mTOR, например, рапамицин, и рапамицин вводят в дозе приблизительно 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг (например, 6 мг) каждые сутки в течение определенного периода времени, например, каждые сутки в течение цикла продолжительностью 21 сутки или каждые сутки в течение цикла продолжительностью 28 суток. В одном из вариантов осуществления рапамицин вводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более циклов. В одном из вариантов осуществления ингибитор киназы представляет собой ингибитор mTOR, например, эверолимус, и эверолимус вводят в дозе приблизительно 2 мг, 2,5 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг (например, 10 мг) каждые сутки в течение определенного периода времени, например, каждые сутки в течение цикла продолжительностью 28 суток. В одном из вариантов осуществления эверолимус вводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более циклов.
В одном из вариантов осуществления ингибитор киназы представляет собой ингибитор MNK, выбранный из CGP052088; 4-амино-3-(пара-фторфениламино)пиразоло[3,4-d]пиримидина (CGP57380); церкоспорамида; ETC-1780445-2 и 4-амино-5-(4-фторанилино)пиразоло[3,4-d]пиримидина.
В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ингибитором фосфоинозитид-3-киназы (PI3K) (например, ингибитором PI3K, описываемым в настоящем описании, например, иделалисибом или дувелисибом) и/или ритуксимабом. В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с иделалисибом и ритуксимабом. В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с дувелисибом и ритуксимабом. Иделалисиб (также называемый GS-1101 или CAL-101; Gilead) представляет собой низкомолекулярное соединение, которое блокирует дельта-изоформу PI3K. Структура иделалисиба (5-фтор-3-фенил-2-[(1S)-1-(7H-пурин-6-иламино)пропил]-4(3H)-хиназолинона) представлена ниже.
Дувелисиб (также называемый IPI-145; Infinity Pharmaceuticals и Abbvie) представляет собой низкомолекулярное соединение, которое блокирует PI3K-δ,γ. Структура дувелисиба (8-хлор-2-фенил-3-[(1S)-1-(9H-пурин-6-иламино)этил]-1(2H)-изохинолинона) представлена ниже.
В вариантах осуществления индивидуум страдает CLL. В вариантах осуществления индивидуум страдает рецидивирующим CLL, например, индивидуум ранее получал терапию против злокачественной опухоли (например, ранее вводили антитело против CD20 или ранее вводили ибрутиниба). Например, индивидуум имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах индивидуум не имеет del(17p). В вариантах осуществления у индивидуума содержится лейкозная клетка, содержащая мутация в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В других вариантах осуществления индивидуум не содержит лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В вариантах осуществления индивидуум имеет делецию в длинном плече хромосомы 11 (del(11q)). В других вариантах осуществления индивидуум не имеет del(11q). В вариантах осуществления иделалисиб вводят в дозе приблизительно 100-400 мг (например, 100-125, 125-150, 150-175, 175-200, 200-225, 225-250, 250-275, 275-300, 325-350, 350-375 или 375-400 мг), например, два раза в сутки. В вариантах осуществления дувелисиб вводят в дозе приблизительно 15-100 мг (например, приблизительно 15-25, 25-50, 50-75 или 75-100 мг), например, дважды в сутки. В вариантах осуществления ритуксимаб вводят в дозе приблизительно 350-550 мг/м2 (например, 350-375, 375-400, 400-425, 425-450, 450-475 или 475-500 мг/м2), например, внутривенно.
В одном из вариантов осуществления ингибитор киназы представляет собой двойной ингибитор фосфатидилинозитол-3-киназы (PI3K) и mTOR, выбранный из 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метил-пиридо[2,3-d]пиримидин-7(8H)-она (PF-04691502); N-[4-[[4-(диметиламино)-1-пиперидинил]карбонил]фенил]-N'-[4-(4,6-di-4-морфолинил-1,3,5-триазин-2-ил)фенил]мочевины (PF-05212384, PKI-587); 2-метил-2-{4-[3-метил-2-оксо-8-(хинолин-3-ил)-2,3-дигидро-1H-имидазо[4,5-c]хинолин-1-ил]фенил}пропаннитрила (BEZ-235); апитолисиба (GDC-0980, RG7422); 2,4-дифтор-N-{2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамида (GSK2126458); малеиновой кислоты 8-(6-метоксипиридин-3-ил)-3-метил-1-(4-(пиперазин-1-ил)-3-(трифторметил)фенил)-1H-имидазо[4,5-c]хинолин-2(3H)-она (NVP-BGT226); 3-[4-(4-морфолинилпиридо[3',2':4,5]фуро[3,2-d]пиримидин-2-ил]фенола (PI-103); 5-(9-изопропил-8-метил-2-морфолино-9H-пурин-6-ил)пиримидин-2-амина (VS-5584, SB2343) и N-[2-[(3,5-диметоксифенил)амино]хиноксалин-3-ил]-4-[(4-метил-3-метоксифенил)карбонил]аминофенилсульфонамида (XL765).
В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ингибитором киназы анапластической лимфомы (ALK). Иллюстративные киназы ALK включают, но не ограничиваются ими, кризотиниб (Pfizer), церитиниб (Novartis), алектиниб (Chugai), бригатиниб (также называемый AP26113; Ariad), энтректиниб (Ignyta), PF-06463922 (Pfizer), TSR-011 (Tesaro) (см., например, клиническое испытание с идентификационным № NCT02048488), CEP-37440 (Teva) и X-396 (Xcovery). В некоторых вариантах осуществления индивидуум страдает солидной злокачественной опухолью, например, солидной злокачественной опухолью, описываемой в настоящем описании, например, раком легких.
Химическое название кризотиниба представляет собой 3-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-(1-пиперидин-4-илпиразоло-4-ил)пиридин-2-амин. Химическое название церитиниба представляет собой 5-хлор-N2-[2-изопропокси-5-метил-4-(4-пиперидинил)фенил]-N4-[2-(изопропилсульфонил)фенил]-2,4-пиримидиндиамин. Химическое название алектиниба представляет собой 9-этил-6,6-диметил-8-(4-морфолинопиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил. Химическое название бригатиниба представляет собой 5-хлор-N2-{4-[4-(диметиламино)-1-пиперидинил]-2-метоксифенил}-N4-[2-(диметилфосфорил)фенил]-2,4-пиримидиндиамин. Химическое название энтректиниба представляет собой N-(5-(3,5-дифторбензил)-1H-индазол-3-ил)-4-(4-метилпиперазин-1-ил)-2-((тетрагидро-2H-пиран-4-ил)амино)бензамид. Химическое название PF-06463922 представляет собой (10R)-7-амино-12-фтор-2,10,16-триметил-15-оксо-10,15,16,17-тетрагидро-2H-8,4-(метено)пиразоло[4,3-h][2,5,11]-бензоксадиазациклотетрадецин-3-карбонитрил. Химическая структура CEP-37440 представляет собой (S)-2-((5-хлор-2-((6-(4-(2-гидроксиэтил)пиперазин-1-ил)-1-метокси-6,7,8,9-тетрагидро-5H-бензо[7]аннулен-2-ил)амино)пиримидин-4-ил)амино)-N-метилбензамид. Химическое название X-396 представляет собой (R)-6-амино-5-(1-(2,6-дихлор-3-фторфенил)этокси)-N-(4-(4-метилпиперазин-1-карбонил)фенил)пиридазин-3-карбоксамид.
Также можно использовать лекарственные средства, которые ингибируют кальций-зависимую фосфатазу кальциневрин (циклоспорин и FK506) или ингибируют киназу p70S6, которая является важной для индуцируемого фактором роста сигнального каскада (рапамицин) (Liu et al., Cell, 66:807-815, 1991; Henderson et al., Immun. 73:316-321, 1991; Bierer et al., Curr. Opin. Immun., 5:763-773, 1993). В дополнительном аспекте клеточные композиции по настоящему изобретению можно вводить пациенту в сочетании (например, до, одномоментно или после) с трансплантацией костного мозга, T-клеточной аблятивной терапией с использованием химиотерапевтических средств, таких как, флударабин, дистанционной лучевой терапией (XRT), циклофосфамидом, и/или антителами, такими как OKT3 или CAMPATH. В одном из аспектов клеточные композиции по настоящему изобретению вводят после B-клеточной аблятивной терапии, такой как средствами, которые взаимодействуют с CD20, например, ритуксаном. Например, в одном из вариантов осуществления индивидуумы могут получать стандартное лечение высокими дозами химиотерапии с последующей трансплантацией стволовых клеток периферической крови. В определенных вариантах осуществления после трансплантации индивидуумы получают инфузию размноженных иммунных клеток по настоящему изобретению. В дополнительном варианте осуществления размноженные клетки вводят до хирургической операции или после нее.
В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с ингибитором индоламин-2,3-диоксигеназой (IDO). IDO представляет собой фермент, который катализирует разрушение аминокислоты L-триптофана до кинуренина. Многие злокачественные опухоли сверхэкспрессируют IDO, например, рак простаты, колоректальный рак, рак поджелудочной железы, рак шейки матки, рак желудка, рак яичника, рак головы и рак легких. pDC, макрофаги и дендритные клетки (DCs) могут экспрессировать IDO. Без связи с теорией полагают, что снижение уровня L-триптофана (например, катализируемое IDO) приводит к иммуносупрессорному окружению в результате индукции толерантности и апоптоза T-клеток. Таким образом, без связи с теорией полагают, что ингибитор IDO может усиливать эффективность экспрессирующей CAR клетки, описываемой в настоящем описании, например, посредством снижения подавления или гибели экспрессирующих CAR иммунных клеток. В вариантах осуществления индивидуум страдает солидной опухолью, например, солидной опухолью, описываемой в настоящем описании, например, раком простаты, колоректальным раком, раком поджелудочной железы, раком шейки матки, раком желудка, раком яичника, раком головы и раком легких. Иллюстративные ингибиторы IDO включают, но не ограничиваются ими, 1-метилтриптофан, индоксимод (NewLink Genetics) (см., например, клинические испытания с идентификационными № NCT01191216; NCT01792050 и INCB024360 (Incyte Corp.) (см., например, клинические испытания с идентификационным № NCT01604889; NCT01685255).
В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с модулятором миелоидными супрессорными клетками (MDSC). MDSC аккумулируются на периферии и в очагах опухоли многих солидных опухолей. Эти клетки подавляют T-клеточные ответы, таким образом, препятствуя эффективности терапии на основе экспрессирующих CAR клеток. Без связи с теорией полагают, что введение модулятора MDSC повысит эффективность экспрессирующей CAR клетки, описываемой в настоящем описании. В одном из вариантов осуществления индивидуум страдает солидной опухолью, например, солидной опухолью описываемой в настоящем описании, например, глиобластомой. Иллюстративные модуляторы MDSC включают, но не ограничиваются ими, MCS110 и BLZ945. MCS110 представляет собой моноклональное антитело (mAb) против макрофагального колониестимулирующего фактора (M-CSF). См., например, клиническое испытание с идентификационным № NCT00757757. BLZ945 представляет собой низкомолекулярный ингибитор рецептора колониестимулирующего фактора 1 (CSF1R). См., например, Pyonteck et al., Nat. Med., 19(2013):1264-72. Структура BLZ945 представлена ниже.
В вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации со средством, которое ингибирует или снижает активность иммуносупрессивных плазматических клеток. Было продемонстрировано, что иммуносупрессивные плазматические клетки препятствуют зависимой от T-клеток иммуногенной химиотерапии, такой как оксалиплатин (Shalapour et al., Nature, 2015, 521:94- 101). В одном из вариантов осуществления иммуносупрессивные плазматические клетки могут экспрессировать один или более из IgA, интерлейкина (IL)-10 и PD-L1. В одном из вариантов осуществления средство представляет собой экспрессирующую CD19 CAR клетку или экспрессирующую CAR BCMA клетку.
В некоторых вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с полипептидом интерлейкина 15 (IL-15), полипептидом рецептора альфа интерлейкина 15 (IL-15Ra) или в комбинации с полипептидом IL-15 и полипептидом IL-15Ra например, hetIL-15 (Admune Therapeutics, LLC). hetIL-15 представляет собой гетеродимерный нековалентный комплекс IL-15 и IL-15Ra. hetIL-15 описан, например, в U.S. 8124084, U.S. 2012/0177598, U.S. 2009/0082299, U.S. 2012/0141413 и U.S. 2011/0081311, включенных в настоящее описание посредством ссылки. В вариантах осуществления het-IL-15 вводят подкожно. В вариантах осуществления индивидуум страдает злокачественной опухолью, например, солидной злокачественной опухолью, например, меланомой или раком толстого кишечника. В вариантах осуществления индивидуум страдает метастатической злокачественной опухолью.
В вариантах осуществления индивидууму, страдающему заболеванием, описываемым в настоящем описании, например, гематологическим нарушением, например, AML или MDS, вводят экспрессирующую CAR клетку, описываемую в настоящем описании, в комбинации со средством, например, цитотоксическим или химиотерапевтическим средством, биологической терапией (например, антителом, например, моноклональным антителом или клеточной терапией) или ингибитором (например, ингибитором киназы). В вариантах осуществления индивидууму вводят экспрессирующую CAR клетку, описываемую в настоящем описании, в комбинации с цитотоксическим средством, например, CPX-351 (Celator Pharmaceuticals), цитарабином, даунорубицином, возароксином (Sunesis Pharmaceuticals), сапацитабином (Cyclacel Pharmaceuticals), идарубицином или митоксантроном. CPX-351 представляет собой липосомальный состав, содержащий цитарабин и даунорубицин в молярном отношении 5:1. В вариантах осуществления индивидууму вводят экспрессирующую CAR клетку, описываемую в настоящем описании, в комбинации с гипометилирующим средством, например, ингибитором ДНК-метилтрансферазы, например, азацитидином или децитабином. В вариантах осуществления индивидууму вводят экспрессирующую CAR клетку, описываемую в настоящем описании, в комбинации с биологической терапией, например, терапией антителом или клеточной терапией, например, 225Ac-линтузумабом (актимаб-A; Actinium Pharmaceuticals), IPH2102 (Innate Pharma/Bristol Myers Squibb), SGN-CD33A (Seattle Genetics) или гемтузумабом озогамицином (милотарг; Pfizer). SGN-CD33A представляет собой конъюгат антитело-лекарственное средство (ADC), содержащий димер пирролобензодиазепина, который связан с антителом против CD33. Актимаб-A представляет собой антитело против CD33 (линтузумаб), меченное актинием. IPH2102 представляет собой моноклональное антитело, которое направленно воздействует на иммуноглобулиноподобные рецепторы киллерных клеток (KIR). В вариантах осуществления индивидууму вводят экспрессирующую CAR клетку, описываемую в настоящем описании, в комбинации с ингибитором FLT3, например, сорафенибом (Bayer), мидостаурином (Novartis), квизартинибом (Daiichi Sankyo), креноланибом (Arog Pharmaceuticals), PLX3397 (Daiichi Sankyo), AKN-028 (Akinion Pharmaceuticals) или ASP2215 (Astellas). В вариантах осуществления индивидууму вводят экспрессирующую CAR клетку, описываемую в настоящем описании, в комбинации с ингибитором изоцитратдегидрогеназы (IDH), например, AG-221 (Celgene/Agios) или AG-120 (Agios/Celgene). В вариантах осуществления индивидууму вводят экспрессирующую CAR клетку, описываемую в настоящем описании, в комбинации с регулятором клеточного цикла, например, ингибитором polo-подобной киназы 1 (Plk1), например, воласертибом (Boehringer Ingelheim), или ингибитором циклинзависимой киназы 9 (Cdk9), например, алвоцидибом (Tolero Pharmaceuticals/Sanofi Aventis). В вариантах осуществления индивидууму вводят экспрессирующую CAR клетку, описываемую в настоящем описании, в комбинации с ингибитором сети передачи сигнала B-клеточного рецептора, например, ингибитором B-клеточной лимфомы 2 (Bcl-2), например, венетоклаксом (Abbvie/Roche), или ингибитором тирозинкиназы Брутона (Btk), например, ибрутинибом (Pharmacyclics/Johnson and Johnson Janssen Pharmaceuticals). В вариантах осуществления индивидууму вводят экспрессирующую CAR клетку, описываемую в настоящем описании, в комбинации с ингибитором аминопептидазы M1, например, тоседостатом (CTI BioPharma/Vernalis); ингибитором гистондеацетилазы (HDAC), например, прациностатом (MEI Pharma); мультикиназным ингибитором, например, ригосертибом (Onconova Pharmaceuticals/Baxter/SymBio) или обратимым агонистом пептидногой CXCR4, например, BL-8040 (BioLineRx). В вариантах осуществления индивидуум вводят направленную на CD123 экспрессирующую CAR клетку в комбинации с экспрессирующей CAR клеткой, которая направленно воздействует на антиген, отличны от CD123, например, CLL-1, BCMA, CD33, CD19, FLT-3 или рецептор фолата бета.
В другом варианте осуществления индивидуумы получают инфузию композиций экспрессирующих CD123 CAR клеток по настоящему изобретению до трансплантации клеток, например, трансплантации аллогенных стволовых клеток. В предпочтительном варианте осуществления CD123-экспрессирующие CAR клетки транзиторно экспрессируют CD123 CAR, например, в результате электропорации иРНК CD123 CAR, таким образом, экспрессия CD123 заканчивается до инфузии донорных стволовых клеток для предотвращения недостаточности трансплантата.
Некоторые пациенты могут испытывать аллергические реакции на соединения по настоящему изобретению и/или другое средство(а) против злокачественной опухоли во время или после введения; таким образом, часто вводят противоаллергические средства для сведения к минимуму риска аллергической реакции. Подходящие противоаллергические средства включают кортикостероиды, такие как дексаметазон (например, Decadron®), беклометазон (например, Beclovent®), гидрокортизон (также известный как кортизон, гидрокортизон сукцината натрия, гидрокортизон фосфата натрия и продаваемый под товарными наименованиями Ala-Cort®, гидрокортизона фосфат, Solu-Cortef®, Hydrocort Acetate® и Lanacort®), преднизолон (продаваемый под товарными наименованиями Delta-Cortel®, Orapred®, Pediapred® и Prelone®), преднизон (продаваемый под товарными наименованиями Deltasone®, Liquid Red®, Meticorten® и Orasone®), метилпреднизолон (также известный как 6-метилпреднизолон, метилпреднизолона ацетат, метилпреднизолона сукцинат натрия, продаваемый под товарными наименованиями Duralone®, Medralone®, Medrol®, M-Prednisol® и Solu-Medrol®); антигистамины, такие как дифенгидрамин (например, Benadryl®), гидроксизин и ципрогептадин, и бронхолитики, такие как агонисты бета-адренергических рецепторов, альбутерол (например, Proventil®) и тербуталин (Brethine®).
Некоторые пациенты могут испытывать тошноту во время и после введения соединения по настоящему изобретению и/или другого средства(в) против злокачественной опухоли; таким образом, используют противорвотные средства для профилактики тошноты (верхний желудок) и рвоты. Подходящие противорвотные средства включают апрепитант (Emend®), ондансетрон (Zofran®), гранисетрон HCl (Kytril®), лоразепам (Ativan®), дексаметазон (Decadron®), прохлорпемазин (Compazine®), касопитант (Rezonic® и Zunrisa®) и их сочетания.
Для того чтобы пациент чувствовал себя более комфортно часто предписывают лекарственное средство для облегчения боли, которую испытывают в течение периода лечения. Как правило, используют общие отпускаемые без рецепта анальгетики, такие как Tylenol®. Однако для умеренной и сильной боли также пригодными являются лекарственные средства на основе опиоидных аналгетиков, такие как гидрокодон/парацетамол или гидрокодон/ацетаминофен (например, Vicodin®), морфин (например, Astramorph® или Avinza®), оксикодон (например, OxyContin® или Percocet®), оксиморфон гидрохлорид (Opana®) и фентанил (например, Duragesic®).
Для защиты нормальных клеток от токсичность лекарственного средства и для ограничения органной токсичности в качестве вспомогательной терапии можно использовать цитопротекторные средства (такие как нейропротекторы, ловушки свободных радикалов, кардиопротекторы, нейтрализующие кровоизлияния средство на основе антрациклинов, питательные вещества и т.п.). Подходящие цитопротекторные средства включают амифостин (Ethyol®), глутамин, димесна (Tavocept®), месна (Mesnex®), дексразоксан (Zinecard® или Totect®), ксалипроден (Xaprila®) и лейковорин (также известные как лейковорин кальция, цитроворум-фактор и фолиновая кислота).
Структуру активных соединений, которые можно идентифицировать по кодовым номерам, непатентованным или торговым наименованиям, можно получать из текущего издания стандартного справочника "The Merck Index" или из баз данных, например, Patents International (например, публикаций IMS World).
Указанные выше соединения, которые можно использовать в комбинации с соединением по настоящему изобретению, можно получать и вводить, как описано в данной области, такой как в цитируемых выше документах.
В одном из вариантов осуществления настоящее изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одно соединение по настоящему изобретению (например, соединение по настоящему изобретению) или его фармацевтически приемлемую соль совместно с фармацевтически приемлемым носителем, подходящим для введение являющемуся человеком или животным индивидууму, отдельно или совместно с другими средствами против злокачественной опухоли.
В одном из вариантов осуществления настоящее изобретение относится к способам лечения являющихся человеком или животным индивидуумов, страдающих от клеточного пролиферативного заболевания, такого как злокачественная опухоль. Настоящее изобретение относится к способам лечения являющегося человеком или животным индивидуума, нуждающегося в таком лечении, включающим введение индивидууму терапевтически эффективного количества соединения по настоящему изобретению (например, соединения по настоящему изобретению) или его фармацевтически приемлемой соли отдельно или в комбинации с другими средствами против злокачественной опухоли.
В частности, композиции формулируют совместно в виде терапевтической или вводимой раздельно комбинации.
В комбинированном лечении соединение по настоящему изобретению и другое средство(а) против злокачественной опухоли можно вводить одномоментно, одновременно или последовательно без каких-либо конкретных ограничений по времени, где такое введение обеспечивает терапевтически эффективные уровни двух соединений в организме пациента.
В предпочтительном варианте осуществления соединение по настоящему изобретению и другое средство(а) против злокачественной опухоли, как правило, вводят последовательно в любом порядке посредством инфузии или перорально. Режим дозирования может изменяться в зависимости от стадии заболевания, физической подготовленности пациента, показателей безопасности отдельных лекарственных средств и от переносимости индивидуальных лекарственных средств, а также других критериев, хорошо известных лечащему врачу(ам) и врачу(ам)-терапевту(ам), вводящим комбинацию. Соединение по настоящему изобретению и другое средство(а) против злокачественной опухоли можно вводить через несколько минут друг от друга, часов, суток или даже недель друг от друга в зависимости от конкретного цикла, используемого для лечения. Кроме того, цикл может включать введение одного лекарственного средства более часто по сравнению с другим во время цикла лечения и в различных дозах на введение лекарственного средства.
Другой аспект настоящего изобретения относится к наборам, которые содержат одно или более соединений по настоящему изобретению и партнер по комбинации, как описано в настоящем описании. Характерные наборы содержат (a) соединение по настоящему изобретению или его фармацевтически приемлемую соль, (b) по меньшей мере один партнер по комбинации, например, как указано выше, таким образом, такой набор может содержать вкладыш в упаковку или другую этикетку, включая инструкции по введению.
Соединение по настоящему изобретению также можно использовать с целью преимущества в комбинации с известными терапевтическими способами, например, введение гормонов или в частности облучения. Соединение по настоящему изобретению можно в частности использовать в качестве радиосенсибилизирующего средства, особенно для лечения опухолей, которые характеризуются слабой чувствительностью к лучевой терапии.
В одном из вариантов осуществления индивидууму можно вводить средство, которое снижает или улучшает побочный эффект, связанный с введением экспрессирующей CAR клетки. Побочные эффекты, связанные с введением экспрессирующей CAR клетки, включают, но не ограничиваются ими, CRS и гемофагоцитарный лимфогистиоцитоз (HLH), также называемый синдромом активации макрофагов (MAS). Симптомы CRS включают высокие температуры, тошноту, преходящую гипотензию, гипоксию и т.п. CRS может включать клинические конституциональные признаки и симптомы, такие как лихорадка, усталость, анорексия, миалгии, артралгии, тошноту, рвоту и головную боль. CRS может включать клинические кожные признаки и симптомы, такие как высыпание. CRS может включать клинические желудочно-кишечные признаки и симптомы, такие как тошнота, рвота и диарея. CRS может включать клинические респираторные признаки и симптомы, такие как тахипноэ и гипоксемия. CRS может включать клинические сердечно-сосудистые признаки и симптомы, такие как тахикардия, увеличенное пульсовое давление, гипотензия, увеличенный сердечный выброс (ранний) и потенциально сниженный сердечный выброс (поздний). CRS может включать клинические признаки и симптомы свертывания крови, такие как повышенный уровень d-димера, гипофибриногенемия с кровотечением или без него. CRS может включать клинические почечные признаки и симптомы, такие как азотемия. CRS может включать клинические печеночные признаки и симптомы, такие как повышение активности трансаминаз и гипербилирубинемия. CRS может включать клинические неврологические признаки и симптомы, такие как головная боль, изменения психического состояния, спутанность сознания, делирий, затруднения с подбором слов или выраженная афазия, галлюцинации, тремор, дисметрия, измененная походка и судороги.
Таким образом, способы, описываемые в настоящем описании, могут включать введение экспрессирующей CAR клетки, описываемой в настоящем описании, индивидууму и дополнительно введение одного или более средств для ведения повышенных уровней растворимого фактора, возникающего в результате лечения экспрессирующей CAR клеткой. В одном из вариантов осуществления растворимый фактор, повышенный у индивидуума, представляет собой один или более из IFN-γ, TNFα, IL-2 и IL-6. В одном из вариантов осуществления фактор, повышенный у индивидуума, представляет собой один или более из IL-1, GM-CSF, IL-10, IL-8, IL-5 и фракталкин. Таким образом, средство, вводимое для лечения такого побочного эффекта, может представлять собой средство, которое нейтрализует один или более таких растворимых факторов. В одном из вариантов осуществления средство, которое нейтрализует одну или более таких растворимых форм, представляет собой антитело или его антигенсвязывающий фрагмент. Примеры таких средств включают, но не ограничиваются ими, стероид (например, кортикостероид), ингибитор TNFα и ингибитор IL-6. Примером ингибитора TNFα является молекула антитела против TNFα, такая как, инфликсимаб, адалимумаб, цертолизумаб пегол и голимумаб. Другой пример ингибитора TNFα представляет собой слитый белок, такой как энтанерцепт. Низкомолекулярный ингибитор TNFα включает, но не ограничиваются ими, производные ксантина (например, пентоксифиллин) и бупропиона. Пример ингибитора IL-6 представляет собой молекулу антитела против IL-6, такую как тоцилизумаб (toc), сарилумаб, элсилимомуб, CNTO 328, ALD518/BMS-945429, CNTO 136, CPSI-2364, CDP6038, VX30, ARGX-109, FE301 и FM101. В одном из вариантов осуществления молекула антитела против IL-6 представляет собой тоцилизумаб. Пример ингибитора на основе IL-1R представляет собой анакинру.
В определенном варианте осуществления индивидууму вводят кортикостероид, такой как, например, наряду с другими метилпреднизолон, гидрокортизон.
В некоторых вариантах осуществления индивидууму вводят сосудосуживающее средство, такое как, например, норадреналин, дофамин, фенилэфрин, эпинефрин, вазопрессин или их сочетание.
В одном из вариантов осуществления индивидууму можно вводить жаропонижающее средство. В одном из вариантов осуществления индивидууму можно вводить анальгетическое средство.
В одном из вариантов осуществления индивидууму можно вводить средство, которое усиливает активность экспрессирующей CAR клетки. Например, в одном из вариантов осуществления средство может представлять собой средство, которое ингибирует ингибирующую молекулу, например, средство представляет собой ингибитор контрольных точек. Ингибирующие молекулы, например, Programmed Death 1 (PD1), в некоторых вариантах осуществления могут снижать способность экспрессирующей CAR клетки повышать ответ иммунного эффектора. Примеры ингибирующих молекул включают PD1, PD-L1, CTLA4, TIM3, LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR бета. Ингибирование ингибирующей молекулы, например, посредством ингибирования на уровне ДНК, РНК или белка может оптимизировать характеристики экспрессирующей CAR клетки. В вариантах осуществления для ингибирования экспрессии ингибирующей молекулы в экспрессирующей CAR клетке можно использовать ингибирующую нуклеиновую кислоту, например, ингибирующую нуклеиновую кислоту, например, дцРНК, например, миРНК или кшРНК, короткие палиндромные повторы, регулярно расположенные группами (CRISPR), эффекторную нуклеазу, подобную активаторам транскрипции (TALEN), или эндонуклеазу цинкового пальца (ZFN), например, как описано в настоящем описании. В одном из вариантов осуществления ингибитор представляет собой кшРНК. В одном из вариантов осуществления ингибирующую молекулу ингибируют в экспрессирующей CAR клетке. В этих вариантах осуществления молекула дцРНК, которая ингибирует экспрессию ингибирующей молекулы, является связанной с нуклеиновой кислотой, кодирующим компонентом, например, всеми компонентами CAR.
В одном из вариантов осуществления молекула нуклеиновой кислоты, кодирующая молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует, функцию T-клетки, является функционально связанной с промотором, например, получаемым из H1 или U6 промотором, таким образом, что экспрессируется молекула дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует функцию T-клетки, например, экспрессируется в экспрессирующей CAR клетке. См. например, Tiscornia G., "Development of Lentiviral Vectors Expressing siRNA", Chapter 3, in Gene Transfer: Delivery and Expression of DNA and RNA (eds. Friedmann and Rossi). Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, USA, 2007; Brummelkamp T.R. et al. (2002) Science, 296: 550-553; Miyagishi M. et al., (2002) Nat. Biotechnol., 19: 497-500. В одном из вариантов осуществления молекула нуклеиновой кислоты, кодирующая молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует функцию T-клетки, содержится в том же векторе, например, лентивирусном векторе, который содержит молекулу нуклеиновой кислоты, кодирующую компонент, например, все компоненты CAR. В таком варианте осуществления молекула нуклеиновой кислоты, кодирующая молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует функцию T-клетки, располагается в векторе, например, лентивирусном векторе, 5'- или 3'-конце по отношению к нуклеиновой кислоте, кодирующей компонент, например, все компоненты CAR. Молекула нуклеиновой кислоты, кодирующая молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует функцию T-клетки, может транскрибироваться в том же или другом направлении, что и нуклеиновая кислота, кодирующая компонент, например, все компоненты CAR.
В одном из вариантов осуществления молекула нуклеиновой кислоты, кодирующая молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует функцию T-клетки, содержится в векторе, отличном от вектора, который содержит молекулу нуклеиновой кислоты, кодирующую компонент, например, все компоненты CAR. В одном из вариантов осуществления молекула нуклеиновой кислоты, кодирующая молекула дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует функцию T-клетки, транзиторно экспрессируется в экспрессирующей CAR клетке. В одном из вариантов осуществления молекула нуклеиновой кислоты, кодирующая молекулу дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует функцию T-клетки, стабильно интегрирована в геном экспрессирующей CAR клетки. На фигурах 51A-51E проиллюстрированы примеры векторов для экспрессии компонента, например, всех компонентов CAR с молекулой дцРНК, которая ингибирует экспрессию молекулы, которая модулирует или регулирует, например, ингибирует функцию T-клетки.
Ниже приведены примеры молекул дцРНК, пригодных для ингибирования экспрессии молекулы, которая модулирует или регулирует, например, ингибирует функцию T-клетки, где молекула которая модулирует или регулирует, например, ингибирует функцию T-клетки, представляет собой PD-1.
В таблице 16 ниже приведены названия средств РНКи PDCD1 (PD1) (получаемых из их положений в последовательности гена PDCD1 мыши NM_008798.2) вместе с SEQ ID NO: 216-263. представляющей последовательность ДНК. Смысловая (S) и антисмысловая (AS) последовательности предоставлены как содержащие 19 мономеров и 21 мономер последовательности в этой таблице. Также указано, что положение (PoS, например, 176) получают из номера положения в последовательности гена PDCD1 мыши NM_008798.2. SEQ ID NO указаны в группах из 12, которые соответствуют "смысловой 19" SEQ ID NO: 608-619; "смысловой 21" SEQ ID NO: 620-631; "антисмысловой 21" SEQ ID NO: 632-643; "антисмысловой 19" SEQ ID NO: 644-655.
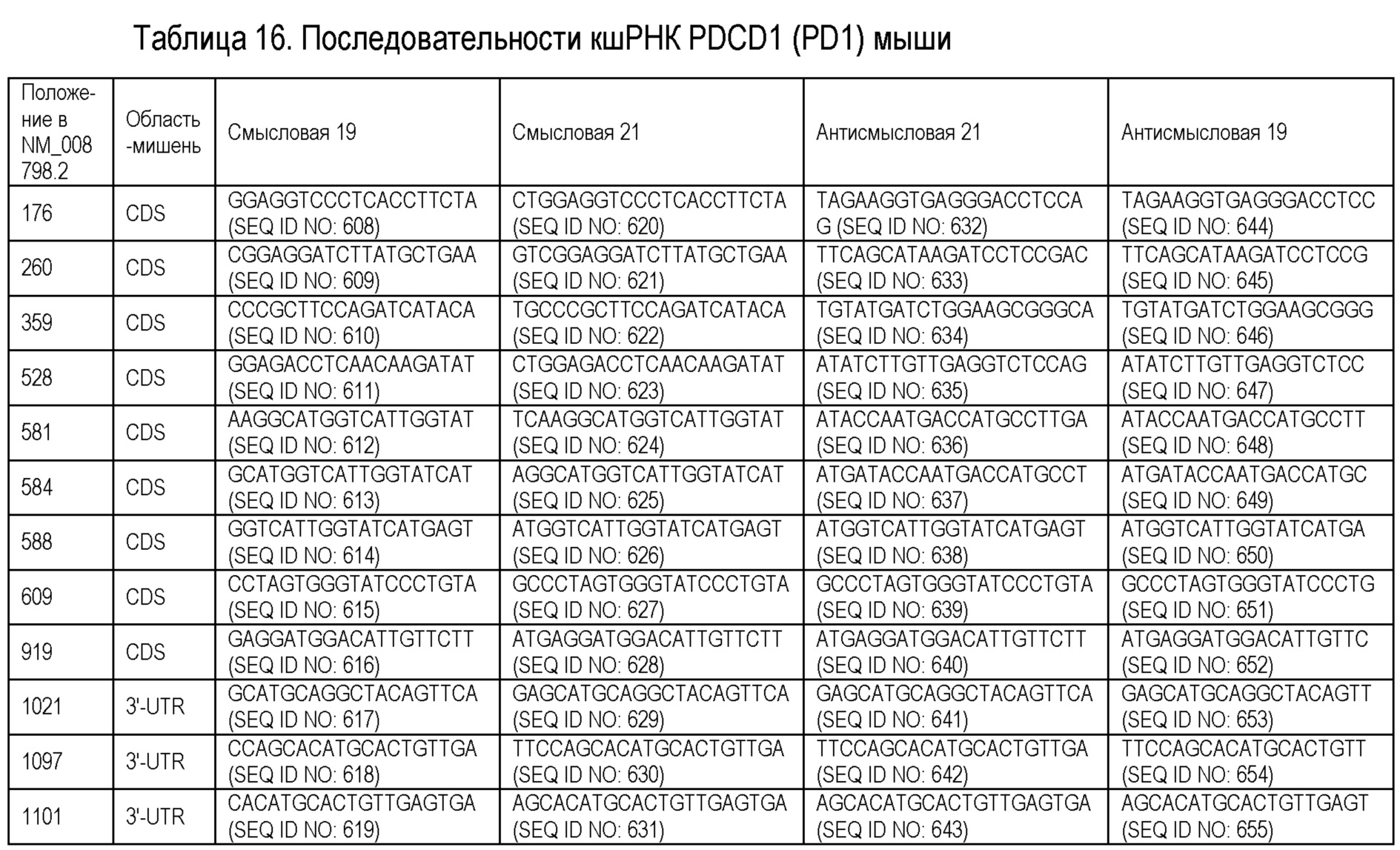
В таблице 17 ниже приведены названия средств РНКи на основе PDCD1 (PD1) (получаемых из их положения в последовательности гена PDCD1 человека, вместе с SEQ ID NO. 264-311, представляющими последовательность ДНК. Смысловая (S) и антисмысловая (AS) последовательности предоставлены как содержащие 19 мономеров и 21 мономер последовательности. SEQ ID NO указаны в группах из 12, которые соответствуют "смысловой 19" SEQ ID NO: 656-667; "смысловой 21" SEQ ID NO: 668-679; "антисмысловой 21" SEQ ID NO: 680-691; "антисмысловой 19" SEQ ID NO: 692-703.
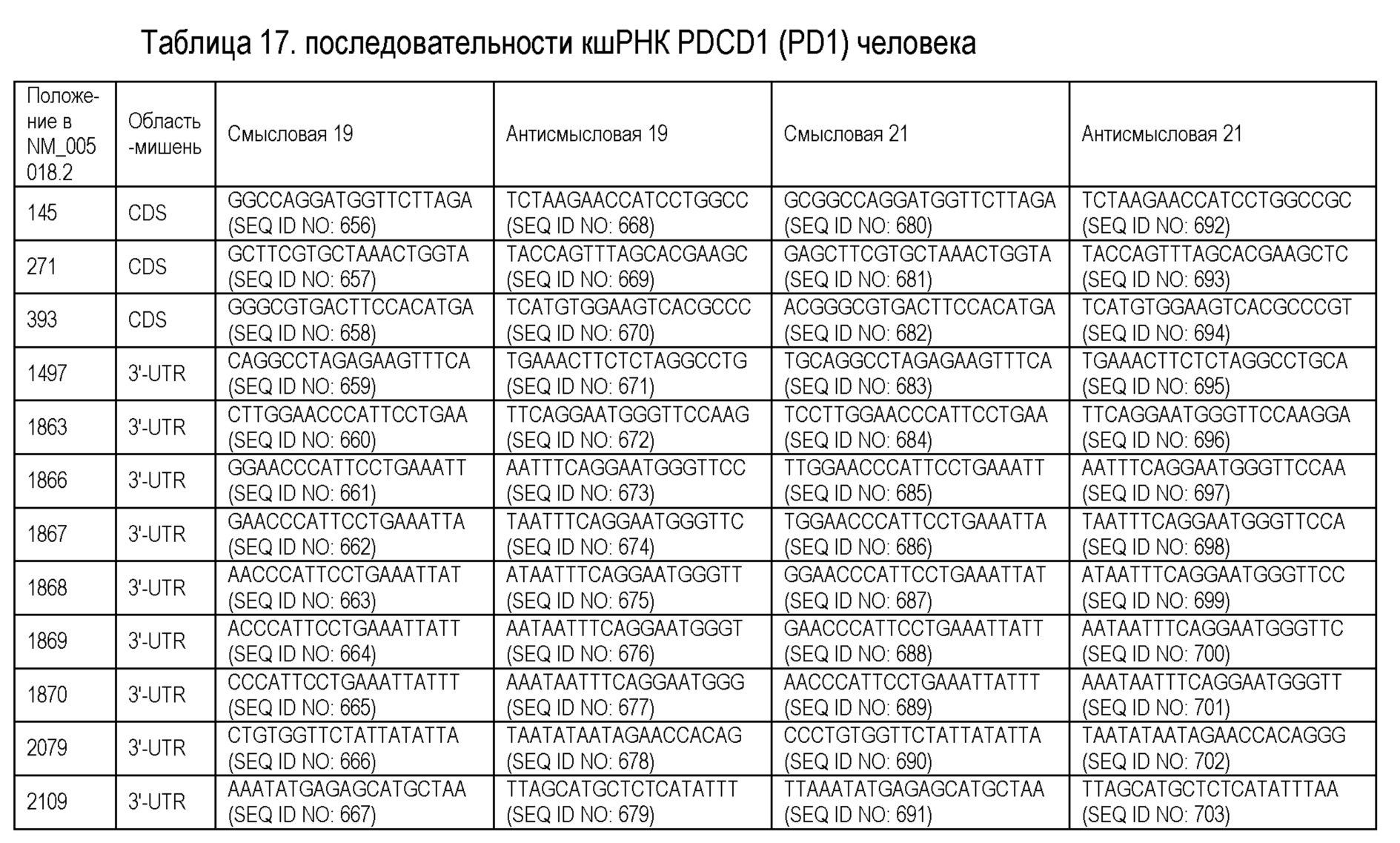
В одном из вариантов осуществления ингибитор ингибирующего сигнала может представлять собой, например, антитело или фрагмент антитела, который связывается с ингибирующей молекулой. Например, средство может представлять собой антитело или фрагмент антитела, который связывается с PD1, PD-L1, PD-L2 или CTLA4 (например, ипилимумаб (также обозначаемый как MDX-010 и MDX-101, и доступный на рынке как Yervoy®; Bristol-Myers Squibb; тремелимумаб (моноклональное антитело IgG2, доступное от Pfizer, ранее известное как тицилимумаб CP-675,206).). В одном из вариантов осуществления средство представляет собой антитело или фрагмент антитела, который связывается с TIM3. В одном из вариантов осуществления средство представляет собой антитело или фрагмент антитела, который связывается с LAG3. В вариантах осуществления средство, которое усиливает активность экспрессирующей CAR клетки, например, ингибитор ингибирующей молекулы, вводят в комбинации с аллогенным CAR, например, аллогенным CAR, описываемой в настоящем описании (например, описанной в разделе аллогенный CAR в настоящем описании).
PD-1 представляет собой ингибирующий представитель семейства CD28 рецепторов, которое также включает CD28, CTLA-4, ICOS и BTLA. PD-1 экспрессируется на активированных B-клетках, T-клетках и миелоидных клетках (Agata et al., 1996, Int. Immunol., 8:765-75). Было продемонстрировано, что два лиганда к PD-1, PD-L1 и PD-L2 подавляют активацию T-клеток при связывании с PD-1 (Freeman et al., 2000 J. Exp. Med., 192:1027-34; Latchman et al., 2001 Nat. Immunol., 2:261-8; Carter et al., 2002 Eur. J. Immunol., 32:634-43). PD-L1 содержится в большом количестве в злокачественных опухолях человека (Dong et al., 2003 J. Mol. Med., 81:281-7; Blank et al., 2005 Cancer Immunol. Immunother., 54:307-314; Konishi et al., 2004 Clin. Cancer Res., 10:5094). Иммунная супрессия можно отменять ингибированием локального взаимодействия PD-1 с PD-L1.
Антитела, фрагменты антител и другие ингибиторы PD-1, PD-L1 и PD-L2 являются доступными в данной области и можно использовать комбинацию с CAR по настоящему изобретению, описываемым в настоящем описании. Например, ниволумаб (также обозначаемый как BMS-936558 или MDX1106; Bristol-Myers Squibb) представляет собой полностью принадлежащее человеку моноклональное антитело IgG4, которое специфически блокирует PD-1. Ниволумаб (клон 5C4) и другие моноклональные антитела человека, которые специфически связываются с PD-1, описаны в US 8008449 и WO2006/121168. Пидилизумаб (CT-011; Cure Tech) представляет собой гуманизированное моноклональное антитело IgG1k, которое связывается с PD-1. Пидилизумаб и другие гуманизированные моноклональные антитела против PD-1 описаны в WO2009/101611. Пембролизумаб (ранее известный как ламбролизумаб, а также обозначаемый как MK03475; Merck) представляет собой гуманизированной моноклональное антитело IgG4, которое связывается с PD-1. Пембролизумаб и другие уманизированные антитела против PD-1 описаны в US 8354509 и WO2009/114335. MEDI4736 (медиммун) представляет собой моноклональное антитело человека, которое связывается с PDL1 и ингибирует взаимодействие лиганда с PD1. MDPL3280A (Genentech/Roche) представляет собой моноклональное антитело IgG1 с оптимизированной Fc человека, которое связывается с PD-L1. MDPL3280A и другие моноклональные антитела человека к PD-L1 описаны в патенте США №: 7943743 и публикации US № 20120039906. Другие связывающие средства против PD-L1 включают YW243.55.S70 (вариабельные области тяжелых и легких цепей представлены в SEQ ID NO 20 и 21 в WO2010/077634) и MDX-1 105 (также обозначаемый как BMS-936559 и, например, связывающие средства против PD-L1, описанные в WO2007/005874). AMP-224 (B7-DCIg; Amplimmune; например, описанный в WO2010/027827 и WO2011/066342), представляет собой слитый с Fc PD-L2 растворимый рецептор, который блокирует взаимодействие PD-1 и B7-H1. Другие антитела против PD-1 включают наряду с другими AMP 514 (Amplimmune), например, антитела против PD-1, описанные в US 8609089, US 2010028330 и/или US 20120114649.
В одном из вариантов осуществления антитело против PD-1 или его фрагмент представляет собой молекулу антитела против PD-1, как описано в US 2015/0210769, озаглавленном "Antibody Molecules to PD-1 and Uses Thereof", полностью включенном посредством ссылки. В одном из вариантов осуществления молекула антитела против PD-1 содержит по меньшей мере одну, два, три, четыре, пять или шесть CDR (или в совокупности все CDR) из вариабельной области тяжелой и легкой цепи из антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или как описано в таблице 1 US 2015/0210769, или кодируемых нуклеотидной последовательностью в таблице 1 или последовательностью по существу идентичной (например, по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или более идентичной) любой из указанных выше последовательностей; или близкородственные CDR, например, CDR, которые являются идентичными или которые содержат по меньшей мере одно изменение аминокислоты, но не более двух, трех или четырех изменений (например, замены, делеций или вставок, например, консервативных замен).
В еще одном варианте осуществления молекула антитела против PD-1 содержит по меньшей мере одну, две, три или четыре вариабельные области из антитела, описываемого в настоящем описании, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или как описано в таблице 1 US 2015/0210769, или кодируемые нуклеотидной последовательностью в таблице 1; или последовательностью по существу идентичной (например, по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или более идентичной) любой из указанных выше последовательностей.
TIM3 (T-клеточный иммуноглобулин 3) также отрицательно регулирует функцию T-клетки, в частности в секретирующих IFN-γ CD4+ хелперных T-клетках 1 и CD8+ цитотоксических T-клетках 1 и играет критическую роль в истощении T-клеток. Ингибирование взаимодействия TIM3 и его лигандов, например, галектина 9 (Gal9), фосфатидилсерина (PS) и HMGB1 может повышать иммунный ответ. Антитела, фрагменты антител и другие ингибиторы TIM3 и его лигандов являются доступными в данной области, и их можно использовать в комбинации с CD19 CAR, описываемым в настоящем описании. Например, антитела, фрагменты антител, низкомолекулярные соединения или пептидные ингибиторы, которые направленно воздействуют на TIM3, связываются с доменом IgV TIM3, ингибируя взаимодействие с его лигандами. Антитела и пептиды, которые ингибируют TIM3, описаны в WO2013/006490 и US20100247521. Другие антитела против TIM3 включают гуманизированные варианты RMT3-23 (описанные у Ngiow et al., 2011, Cancer Res., 71:3540-3551) и клон 8B.2C12 (описанный у Monney et al., 2002, Nature, 415:536-541). Биспецифические антитела, которые ингибируют TIM3 и PD-1 описаны в US20130156774.
В одном из вариантов осуществления антитело против TIM3 или его фрагмент представляет собой молекулу антитела против TIM3, как описано в US 2015/0218274, озаглавленном "Antibody Molecules to TIM3 and Uses Thereof", полностью включенном посредством ссылки. В одном из вариантов осуществления молекула антитела против TIM3 содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR (или в совокупности все CDR) из вариабельной области тяжелой и легкой цепи из антитела, выбранного из любого из ABTIM3, ABTIM3-hum01, ABTIM3-hum02, ABTIM3-hum03, ABTIM3-hum04, ABTIM3-hum05, ABTIM3-hum06, ABTIM3-hum07, ABTIM3-hum08, ABTIM3-hum09, ABTIM3-hum10, ABTIM3-hum11, ABTIM3-hum12, ABTIM3-hum13, ABTIM3-hum14, ABTIM3-hum15, ABTIM3-hum16, ABTIM3-hum17, ABTIM3-hum18, ABTIM3-hum19, ABTIM3-hum20, ABTIM3-hum21, ABTIM3-hum22, ABTIM3-hum23; или как описано в таблицах 1-4 US 2015/0218274; или кодируемые нуклеотидной последовательностью в таблицах 1-4; или последовательностью по существу идентичной (например, по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или более идентичной) любой из указанных выше последовательностей, или близкородственные CDR, например, CDR, которые являются идентичными, или которые содержат по меньшей мере одно изменение аминокислоты, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен).
В еще одном варианте осуществления молекула антитела против TIM3 содержит по меньшей мере одну, две, три или четыре вариабельные области из антитела, описываемого в настоящем описании, например, антитела, выбранного из любого из ABTIM3, ABTIM3-hum01, ABTIM3-hum02, ABTIM3-hum03, ABTIM3-hum04, ABTIM3-hum05, ABTIM3-hum06, ABTIM3-hum07, ABTIM3-hum08, ABTIM3-hum09, ABTIM3-hum10, ABTIM3-hum11, ABTIM3-hum12, ABTIM3-hum13, ABTIM3-hum14, ABTIM3-hum15, ABTIM3-hum16, ABTIM3-hum17, ABTIM3-hum18, ABTIM3-hum19, ABTIM3-hum20, ABTIM3-hum21, ABTIM3-hum22, ABTIM3-hum23; или как описано в таблицах 1-4 US 2015/0218274; или кодируемых нуклеотидной последовательностью в таблицах 1-4; или последовательностью по существу идентичной (например, по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или более идентичной) любой из указанных выше последовательностей.
В других вариантах осуществления средство, которое повышает активность экспрессирующей CAR клетки представляет собой ингибитор CEACAM (например, ингибитор CEACAM-1, CEACAM-3 и/или CEACAM-5). В одном из вариантов осуществления ингибитор CEACAM представляет собой молекулу антитела против CEACAM. Иллюстративные антитела против CEACAM-1 описаны в WO 2010/125571, WO 2013/082366 WO 2014/059251 и WO 2014/022332, например, моноклональное антитело 34B1, 26H7 и 5F4 или его рекомбинантная форма, как описано, например, в US 2004/0047858, US 7132255 и WO 99/052552. В других вариантах осуществления антитело против CEACAM связывает CEACAM-5, как описано, например, у Zheng et al., PLoS ONE. 2010 Sep 2;5(9).pii: e12529 (DOI:10:1371/journal.pone.0021146), или перекрестно реагирует с CEACAM-1 и CEACAM-5. как описано, например, в WO 2013/054331 и US 2014/0271618.
Без желания быть связанными теорией, полагают, что раково-эмбриональный антиген, связанный с молекулами клеточной адгезии (CEACAM), такой как CEACAM-1 и CEACAM-5, опосредует по меньшей мере частично ингибирование противоопухолевого иммунного ответа (см. например, Markel et al., J. Immunol., 2002 Mar 15;168(6):2803-10; Markel et al., J. Immunol., 2006 Nov 1;177(9):6062-71; Markel et al., Immunology, 2009 Feb;126(2):186-200; Markel et al., Cancer Immunol Immunother., 2010 Feb;59(2):215-30; Ortenberg et al., Mol. Cancer Ther., 2012 Jun;11(6):1300-10; Stern et al., J. Immunol., 2005 Jun 1;174(11):6692-701; Zheng et al., PLoS ONE, 2010 Sep 2;5(9). pii: e12529). Например, CEACAM-1 описан как гетерофильный лиганд TIM-3 и как играющий роль в опосредованной TIM-3 толерантности и истощении T-клеток (см. например, WO 2014/022332; Huang, et al., (2014) Nature, doi:10,1038/nature13848). В вариантах осуществления было продемонстрировано, что совместная блокада CEACAM-1 и TIM-3 усиливает противоопухолевый иммунный ответ на моделях ксенотрансплантата колоректального рака (см. например, WO 2014/022332; Huang, et al. (2014), выше). В других вариантах осуществления совместная блокада CEACAM-1 и PD-1 снижает толерантность T-клеток, как описано, например, в WO 2014/059251. Таким образом, ингибиторы CEACAM можно использовать с другими иммуномодуляторами, описываемыми в настоящем описании (например, ингибиторы PD-1 и/или TIM-3), для усиления иммунного ответ против злокачественной опухоли, например, меланомы, рака легких (например, NSCLC), рака мочевого пузыря, рака толстого кишечника, рака яичника и других злокачественных опухолей, как описано в настоящем описании.
LAG3 (ген активации лимфоцитов 3 или CD223) представляет собой молекулу клеточной поверхности, экспрессируемую активированными T-клетками и B-клетками, для которых было продемонстрировано, что они играют роль в истощении CD8+ T-клеток. Антитела, фрагменты антител и другие ингибиторы LAG3 и его лиганды являются доступными в данной области, и их можно использовать в комбинации с CD19 CAR, описываемым в настоящем описании. Например, BMS-986016 (Bristol-Myers Squib) представляет собой моноклональное антитело, которое направленно воздействует на t LAG3. IMP701 (Immutep) представляет собой антагонистическое антитело против LAG3, и IMP731 (Immutep и GlaxoSmithKline) представляет собой истощающее антитело против LAG3. Другие ингибиторы LAG3 включают IMP321 (Immutep), который представляет собой рекомбинантный слитый белок растворимой части LAG3 и Ig, который связывается с молекулами MHC II класса и активирует антигенпрезентирующие клетки (APC). Другие антитела описаны, например, в WO2010/019570.
В некоторых вариантах осуществления средство, которое повышает активность экспрессирующей CAR клетки, может представлять собой, например, слитый белок, содержащий первый домен и второй домен, где первый домен представляет собой ингибирующую молекулу или ее фрагмент, и второй домен представляет собой полипептид, который является связанным с положительным сигналом, например, полипептид, содержащий внутриклеточный сигнальный домен, как описано в настоящем описании. В некоторых вариантах осуществления полипептид, который связан с положительным сигналом, может содержать костимулирующий домен CD28, CD27, ICOS, например, внутриклеточный сигнальный домен CD28, CD27 и/или ICOS, и/или первичный сигнальный домен, например, CD3-дзета, например, описываемый в настоящем описании. В одном из вариантов осуществления слитый белок экспрессируется той же клеткой, которая экспрессирует CAR. В другом варианте осуществления слитый белок экспрессируется клеткой, например, T-клеткой, которая не экспрессирует CD123 CAR.
В одном из вариантов осуществления средство, которое повышает активность экспрессирующей CAR клетки, описываемой в настоящем описании, представляет собой miR-17-92.
В одном из вариантов осуществления средство, которое повышает активность CAR, описываемого в настоящем описании, представляет собой цитокин. Цитокины обладают важными функциями, связанными с истощением, дифференцировкой, выживаемость и гомеостазом T-клеток. Цитокины, которые можно вводить индивидууму, получающему экспрессирующую CAR клетку, описываемую в настоящем описании, включают: IL-2, IL-4, IL-7, IL-9, IL-15, IL-18 и IL-21 или их сочетание. В предпочтительных вариантах осуществления вводимый цитокин представляет собой IL-7, IL-15 или IL-21, или их сочетание. Цитокин можно вводить один раз в сутки или более одного раза в сутки, например, дважды в сутки, три раза в сутки или четыре раза в сутки. Цитокин можно вводить в течение больше одних суток, например, цитокин вводят в течение 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 1 недели, 2 недель, 3 недель или 4 недель. Например, цитокин вводят один раз в сутки в течение 7 суток.
В вариантах осуществления цитокин вводят в комбинации с экспрессирующими CAR T-клетками. Цитокин можно вводить одномоментно или одновременно с экспрессирующими CAR T-клетками, например, вводить на те же сутки. Цитокин можно получать в той же фармацевтической композиции, как и экспрессирующие CAR T-клетки, или можно получать в отдельной фармацевтической композиции. Альтернативно, цитокин можно вводить непосредственно сразу после введения экспрессирующих CAR T-клеток, например, через 1 сутки, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток или 7 суток после введения экспрессирующих CAR T-клеток. В вариантах осуществления, где цитокин вводят в режиме дозирования, который включает более одних сутки, на первые сутки режим дозирования цитокина можно проводить на те же сутки, как и введение экспрессирующих CAR T-клеток, или первые сутки режима дозирования цитокина могут приходиться на 1 сутки, 2 сутки, 3 сутки, 4 сутки, 5 сутки, 6 сутки или 7 сутки после введения экспрессирующих CAR T-клеток. В одном из вариантов осуществления на первые сутки экспрессирующие CAR T-клетки вводят индивидууму, а на вторые сутки цитокин вводят один раз сутки в течение следующих 7 суток. В предпочтительном варианте осуществления цитокин, который необходимо вводить в комбинации с экспрессирующими CAR T-клетками, представляет собой IL-7, IL-15 или IL-21.
В других вариантах осуществления цитокин вводят в период времени после введения экспрессирующих CAR клеток, например, по меньшей мере через 2 недели, 3 недели, 4 недели, 6 недель, 8 недель, 10 недель, 12 недель, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев или 1 год или более после введения экспрессирующих CAR клеток. В одном из вариантов осуществления цитокин вводят после оценки реакции индивидуума на экспрессирующие CAR клетки. Например, индивидууму вводят экспрессирующие CAR клетки в соответствии с дозированием и схемами лечения, описываемыми в настоящем описании. Реакцию индивидуума на терапию клетками, экспрессирующими CAR, оценивают через 2 недели, 3 недели, 4 недели, 6 недель, 8 недель, 10 недель, 12 недель, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев или 1 год или более после введения экспрессирующих CAR клеток, любым из способов, описываемых в настоящем описании, включая ингибирование роста опухоли, уменьшение циркулирующих опухолевых клеток или регрессия опухоли. Индивидуумам, у которых не выявляют достаточную реакцию на терапию клетками, экспрессирующими CAR, можно вводить цитокин. Введение цитокина индивидууму с недостаточно оптимальной реакцией на терапию клетками, экспрессирующими CAR, улучшает эффективность или противораковую активность экспрессирующей CAR клетки. В предпочтительном варианте осуществления цитокин, вводимый после введения экспрессирующих CAR клеток, представляет собой IL-7.
Комбинация с ингибиторами CD19
Способы и композиции, описываемые в настоящем описании, можно использовать в комбинации с ингибитором CD19. В некоторых вариантах осуществления содержащие CD123 CAR клетки и ингибитор CD19 (например, одна или более клеток, которые экспрессируют молекулу CAR, которая связывается с CD19, например, молекулу CAR, которая связывается с CD19, описываемым в настоящем описании) вводят одномоментно или одновременно, или последовательно.
В некоторых вариантах осуществления содержащие CD123 CAR клетки и ингибитор CD19 вводят инфузией индивидууму одномоментно или одновременно, например, смешивают в том же объеме инфузии. Например, популяцию содержащих CD123 CAR клеток и содержащих CD19CAR клеток смешивают друг с другом. Альтернативно, вводят популяцию клеток коэкспрессирующих CD123 CAR и CD19CAR. В других вариантах осуществления одномоментное введение предусматривает отдельное введение содержащих CD123 CAR клеток и ингибитора CD19, например, в течение предопределенного интервала времени (например, в течение 15, 30 или 45 минут друг от друга).
В некоторых вариантах осуществления начало содержащих CD123 CAR клеток и начало ингибитора CD19 находятся в пределах 1, 2, 3, 4, 6, 12, 18 или 24 часов друг от друга, или в пределах 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40, 60, 80 или 100 суток друг от друга. В некоторых вариантах осуществления конец доставки содержащих CD123 CAR клеток и конец доставки ингибитора CD19 находится в пределах 1, 2, 3, 4, 6, 12, 18 или 24 часов друг от друга или в пределах 1, 2, 3, 4, 5, 10, 15, 20, 25, 30, 35, 40, 60, 80 или 100 суток друг от друга. В некоторых вариантах осуществления перекрытие в отношении доставки содержащих CD123 CAR клеток (например, инфузии) и конца доставки ингибитора CD19 (например, инфузии) составляет по меньшей мере 1, 2, 3, 4, 5, 10, 15, 20, 25, 30 минут. В одном из вариантов осуществления ингибитор CD19 вводят до содержащих CD123 CAR клеток. В других вариантах осуществления содержащие CD123 CAR клетки вводят до ингибитора CD19.
В некоторых вариантах осуществления содержащие CD123 CAR клетки вводят пока ингибитор CD19 (например, одна или более клеток, которые экспрессируют молекулу CD19 CAR) присутствуют (например, клетки в стадии размножение) у индивидуума. В других вариантах осуществления ингибитор CD19 (например, одна или более клеток, которая экспрессирует молекулу CD19 CAR) вводят пока содержащие CD123 CAR клетки присутствуют (например, клетки в стадии размножение) у индивидуума.
Ингибитор CD19 включает, но не ограничивается ими, экспрессирующую CD19 CAR клетку, например, CD19 CART-клетку или антитело против CD19 (например, моно- или биспецифическое антитело против CD19) или его фрагмент или конъюгат.
В одном из вариантов осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с CD19 CAR клеткой (например, CART-клеткой) (например, CTL019, например, как описано в WO2012/079000, включенной в настоящее описание посредством ссылки).
В других вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с CD19 CAR клеткой (например, CART-клеткой), которая содержит гуманизированный антигенсвязывающий домен, как описано в WO2014/153270 (например, таблица 3 WO2014/153270), включенной в настоящее описание посредством ссылки.
Ингибитор CD19 (например, первая экспрессирующая CD19 CAR клетка) и вторая экспрессирующая CD123 CAR клетка могут экспрессироваться тем же типом клеток или различными типами. Например, в некоторых вариантах осуществления клетка, экспрессирующая CD19 CAR, представляет собой CD4+ T-клетку, и клетка, экспрессирующая CD123 CAR, представляют собой CD8+ T-клетку, или клетка, экспрессирующая CD19 CAR представляет собой CD8+ T-клетку, и клетка, экспрессирующая CD123 CAR представляет собой CD4+ T-клетку. В других вариантах осуществления клетка, экспрессирующая CD19 CAR, представляет собой T-клетку, и клетка, экспрессирующая CD123 CAR, представляет собой NK-клетку, или клетка, экспрессирующая CD19 CAR, представляет собой NK-клетку, и клетка, экспрессирующая CD123 CAR, представляет собой T-клетку. В других вариантах осуществления клетка, экспрессирующая CD19 CAR, и клетка, экспрессирующая CD123 CAR, обе представляют собой NK-клетки, или обе представляют собой T-клетки, например, обе представляют собой CD4+ T-клетки, или обе представляют собой CD8+ T-клетки. В других вариантах осуществления одна клетка экспрессирует CD19 CAR и CD123 CAR, и эта клетка представляет собой, например, NK-клетку или T-клетку, такую как CD4+ T-клетка или CD8+ T-клетка.
Первый CAR и второй CAR могут содержать одинаковые или различные внутриклеточные сигнальные домены. Например, в некоторых вариантах осуществления CD19 CAR содержит сигнальный домен CD3-дзета, а CD123 CAR содержит костимулирующий домен, например, костимулирующий домен 41BB, CD27 или CD28, при этом в некоторых вариантах осуществления CD19 CAR содержит костимулирующий домен, например, костимулирующий домен 41BB, CD27 или CD28,и CD123 CAR содержит сигнальный домен CD3-дзета. В других вариантах осуществления каждый из CD19 CAR и CD123 CAR содержит тот же тип первичного сигнального домена, например, сигнальный домен CD3-дзета, но CD19 CAR и CD123 CAR содержат различные костимулирующие домены, например, (1) CD19 CAR содержит костимулирующий домен 41BB, и CD123 CAR содержит отличный костимулирующий домен например, костимулирующий домен CD27, (2) CD19 CAR содержит костимулирующий домен CD27, и CD123 CAR содержит отличный костимулирующий домен, например, костимулирующий домен 41BB, (3) CD19 CAR содержит костимулирующий домен 41BB, и CD123 CAR содержит костимулирующий домен CD28, (4) CD19 CAR содержит костимулирующий домен CD28, и CD123 CAR содержит отличный костимулирующий домен, например, костимулирующий домен 41BB, (5) CD19 CAR содержит костимулирующий домен CD27, и CD123 CAR содержит костимулирующий домен CD28, или (6) CD19 CAR содержит костимулирующий домен CD28, и CD123 CAR содержит костимулирующий домен CD27. В другом варианте осуществления клетка содержит CAR, который содержит CD19-антигенсвязывающий домен и CD123-антигенсвязывающий домен, например, биспецифическое антитело.
В вариантах осуществления индивидуум страдает острым миелолейкозом (AML), например, CD19-положительным AML или CD19-отрицательным AML. В вариантах осуществления индивидуум страдает CD19+ лимфомой, например, CD19+ неходжкинской лимфомой (NHL), CD19+ FL или CD19+ DLBCL. В вариантах осуществления индивидуум страдает рецидивирующей или рефрактерной CD19+ лимфомой. В вариантах осуществления противолимфомную химиотерапию вводят индивидууму до, одновременно с или после введения (например, инфузии) CD19 CART-клеток. В примере противолимфомную химиотерапию вводят индивидууму перед введением CD19 CART-клеток. Например, противолимфомная химиотерапия заканчивается за 1-4 суток (например, 1, 2, 3 или 4 суток) до инфузии CD19 CART-клетки. В вариантах осуществления многократные дозы CD19 CART-клеток вводят, например, как описано в настоящем описании. Например, однократная доза содержит приблизительно 5×108 CD19 CART-клеток. В вариантах осуществления противолимфомную химиотерапию вводят индивидууму до, одновременно или после введения (например, инфузии) экспрессирующей CAR клетки, описываемой в настоящем описании, например, экспрессирующей не-CD19 CAR клетки. В вариантах осуществления CD19 CART вводят индивидууму до, одновременно или после введения (например, инфузии) экспрессирующей не-CD19 CAR клетки, например, экспрессирующей не-CD19 CAR клетки, описываемой в настоящем описании.
В некоторых вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят индивидууму в комбинации с экспрессирующей CD19 CAR клеткой, например, CTL019, например, как описано в WO2012/079000, включенной в настоящее описание посредством ссылки, для лечения заболевания, связанного с экспрессией CD123, например, злокачественной опухоли, описываемой в настоящем описании. Без связи с теорией полагают, что введение экспрессирующей CD19 CAR клетки в комбинации с экспрессирующей CAR клеткой улучшает эффективность экспрессирующей CAR клетки, описываемой в настоящем описании, в результате направленного воздействия на злокачественные клетки раннего происхождения, например, злокачественные стволовые клетки, модулирующие иммунный ответ, истощающие регуляторные B-клетки и/или улучшающие микроокружение опухоли. Например, экспрессирующая CD19 CAR клетка направленно воздействует на злокачественные клетки, которые экспрессируют ранние линейный маркеры, например, злокачественные стволовые клетки и экспрессирующее CD19 клетки, тогда как экспрессирующая CAR клетка, описываемая в настоящем описании, направленно воздействует на злокачественные клетки, которые экспрессируют поздние линейный маркеры, например, CD123. Такой подход прекондиционирования может улучшать эффективность экспрессирующей CAR клетки, описываемой в настоящем описании. В таких вариантах осуществления экспрессирующую CD19 CAR клетку вводят до, одновременно или после введения (например, инфузии) экспрессирующей CAR клетки, описываемой в настоящем описании.
В вариантах осуществления экспрессирующая CAR клетка, описываемая в настоящем описании, также экспрессирует CAR, направленный на CD19, например, CD19 CAR. В одном из вариантов осуществления клетку, экспрессирующую CAR, описываемый в настоящем описании, и CD19 CAR, вводят индивидууму для лечения злокачественной опухоли, описываемой в настоящем описании, например, AML. В одном из вариантов осуществления конфигурации одной или обеих молекул CAR содержат первичный внутриклеточный сигнальный домен и костимулирующий сигнальный домен. В другом варианте осуществления конфигурации одной или обеих молекул CAR содержат первичный внутриклеточный сигнальный домен и два или более, например, 2, 3, 4 или 5 или более, костимулирующих сигнальных домена. В таких вариантах осуществления молекула CAR, описываемая в настоящем описании, и CD19 CAR могут содержать тот же или отличный первичный внутриклеточный сигнальный домен, те же или отличные костимулирующие сигнальные домены, или такое же количество или различное количество костимулирующих сигнальных доменов. Альтернативно, CAR, описываемый в настоящем описании, и CD19 CAR конфигурируют как расщепленный CAR, в котором одна молекул CAR содержит антигенсвязывающий домен и костимулирующий домен (например, 4-1BB), тогда как другая молекула CAR содержит антигенсвязывающий домен и первичный внутриклеточный сигнальный домен (например, CD3-дзета).
В одном из вариантов осуществления CAR, описываемый в настоящем описании, и второй CAR, например, CD19 CAR, находятся в одном и том же векторе или находятся в двух различных векторах. В вариантах осуществления, где CAR, описываемый в настоящем описании, и второй CAR, например, CD19 CAR, находятся в одном и том же векторе, последовательности нуклеиновой кислоты, кодирующие CAR, описываемый в настоящем описании, и второй CAR, например, CD19 CAR, находятся в одной и той же рамке считывания и разделены одним или более участками расщепления пептида, например, P2A.
В других вариантах осуществления экспрессирующую CAR клетку, описываемую в настоящем описании, вводят в комбинации с ингибитором антитела против CD19. В одном из вариантов осуществления антитело против CD19 представляет собой гуманизированный антигенсвязывающий домен, как описано в WO2014/153270 (например, таблице 3 WO2014/153270), включенной в настоящее описание посредством ссылки, или его конъюгат. Другие иллюстративные антитела против CD19 или их фрагменты, или конъюгаты, включают, но не ограничиваются ими, блинатумомаб, SAR3419 (Sanofi), MEDI-551 (MedImmune LLC), комботокс, DT2219ARL (Masonic Cancer Center), MOR-208 (также называемый XmAb-5574; MorphoSys), XmAb-5871 (Xencor), MDX-1342 (Bristol-Myers Squibb), SGN-CD19A (Seattle Genetics) и AFM11 (Affimed Therapeutics). См., например, Hammer, MAbs. 4,5(2012): 571-77. Блинатумомаб представляет собой биспецифическое антитело, состоящее из двух scFvs, где один связывается с CD19, а другой связывается с CD3. Блинатумомаб направляет T-клетки атаковать злокачественные клетки. См., например, Hammer et al. клиническое испытание с идентификационным № NCT00274742 и NCT01209286. MEDI-551 представляет собой гуманизированное антитело против CD19 с Fc, сконструированным так, чтобы обладать повышенной антителозависимой клеточной цитотоксичностью (ADCC). См., например, Hammer et al. и клиническое испытание с идентификационным № NCT01957579. Комботокс представляет собой смесь иммунотоксинов, которые связываются с CD19 и CD22. Иммунотоксины состоят из фрагментов scFv антител, слитых с дегликозилированной цепью A рицина. См., например, Hammer et al. и Herrera et al., J. Pediatr. Hematol. Oncol. 31,12(2009):936-41; Schindler et al., Br. J. Haematol., 154,4(2011):471-6. DT2219ARL представляет собой биспецифический иммунотоксин, направленно воздействующий на CD19 и CD22, содержащий два scFvs и усеченный дифтерийный токсин. См., например, Hammer et al. и клиническое испытание с идентификационным № NCT00889408. SGN-CD19A представляет собой конъюгат антитело-лекарственное средство (ADC), состоящий из гуманизированного моноклонального антитела против-CD19, слитого с синтетическим цитотоксическим уничтожающим клетки средством монометилауристатином F (MMAF). См., например, Hammer et al. и клинические испытания с идентификационным № NCT01786096 и NCT01786135. SAR3419 представляет собой конъюгат антитело против CD19-лекарственное средство (ADC), содержащий гуманизированное моноклональное антитело против CD19, конъюгированное с производным майтансина через расщепляемый линкер. См., например, Younes et al., J. Clin. Oncol., 30,2(2012): 2776-82; Hammer et al., клиническое испытание с идентификационным № NCT00549185 и Blanc et al., Clin. Cancer Res., 2011;17:6448-58. XmAb-5871 представляет собой гуманизированное антитело против CD19 с конструируемым Fc. См., например, Hammer et al. MDX-1342 представляет собой человек антитело против CD19 с конструируемым Fc с повышенной ADCC. См., например, Hammer et al. В вариантах осуществления молекула антитела представляет собой молекулу биспецифического антитела против CD19 и против CD3. Например, AFM11 представляет собой биспецифическое антитело, которое направленно воздействует на CD19 и CD3. См., например, Hammer et al. и клиническое испытание с идентификационным № NCT02106091. В некоторых вариантах осуществления антитело против CD19, описываемое в настоящем описании, является конъюгированным или иным образом связанным с терапевтическим средством, например, химиотерапевтическим средством, пептидной вакциной (такой как описано у Izumoto et al., 2008 J. Neurosurg., 108:963-971), иммуносупрессирующим средством или средством иммуноабляции, например, циклоспорином, азатиоприном, метотрексатом, микофенолатом, FK506, CAMPATH, антителом против CD3, цитоксином, флударабином, рапамицином, микофеноловой кислотой, стероидом, FR901228 или цитокин.
Комбинация с низкими дозами ингибитора mTOR
В способах, описываемых в настоящем описании, используют низкие иммуностимулирующие дозы ингибиторов mTOR, например, аллостерических ингибиторов mTOR, включая рапалоги, такие как RAD001. Введение низкой иммуностимулирующей дозы ингибитора mTOR (например, дозы, которая является недостаточной для полного подавления иммунной системы, но достаточной для улучшения иммунной функции) может оптимизировать характеристики эффекторных клеток иммунной системы, например, T-клеток или экспрессирующих CAR клеток у индивидуума. Способы измерения ингибирования mTOR, дозы, схемы лечения и подходящие фармацевтические композиции описаны в патентной заявке США № 2015/01240036, таким образом, включенной посредством ссылки.
В одном из вариантов осуществления введение низкой иммуностимулирующей дозы ингибитора mTOR can приводить к одному или более из указанного ниже:
i) уменьшения числа PD-1-положительных эффекторных клеток иммунной системы;
ii) увеличения числа PD-1положительных эффекторных клеток иммунной системы;
iii) увеличения отношения PD-1-отрицательных эффекторных клеток иммунной системы/PD-1-положительных эффекторных клеток иммунной системы;
iv) увеличения числа наивных T-клеток;
v) увеличения экспрессии одного или более из следующих ниже маркеров: CD62Lhigh, CD127high, CD27+ и BCL2, например, в T-клетках памяти, например, предшественниках T-клеток памяти;
vi) понижения экспрессии KLRG1, например, в T-клетках памяти, например, предшественниках T-клеток памяти; или
vii) увеличения числа предшественников T-клеток памяти, например, клеток с любой или сочетанием следующих ниже характеристик: повышенный CD62Lhigh, повышенный CD127high, повышенный CD27+, повышенный KLRG1 и повышенный BCL2;
и где любой из указанных выше, например, i), ii), iii), iv), v), vi) или vii) происходит например, по меньшей мере временно, например, по сравнению с не получавшим лечение индивидуумом.
В другом варианте осуществления введение низкой иммуностимулирующей дозы ингибитора mTOR приводит к повышенной или пролонгированной пролиферации экспрессирующих CAR клеток, например, в культуре или у индивидуума, например, по сравнению с необрабатываемыми экспрессирующими CAR клетками или не получавшим лечение индивидуумом. В вариантах осуществления повышенная пролиферация связана с увеличением числа экспрессирующих CAR клеток. Способы измерения повышенной или пролонгированной пролиферации описаны в примерах 9 и 10. В другом варианте осуществления введение низкой иммуностимулирующей дозы ингибитора mTOR приводит к повышенному цитолизу злокачественных клеток экспрессирующими CAR клетками, например, в культуре или у индивидуума, например, по сравнению с необрабатываемыми экспрессирующими CAR клетками или не получавшим лечение индивидуумом. В вариантах осуществления повышенный цитолиз злокачественных клеток ассоциирован с уменьшением объема опухоли. Способы измерения повышенного цитолиза злокачественных клеток описаны в примере 2.
В одном из вариантов осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, описываемую в настоящем описании, вводят в комбинации с низкой иммуностимулирующей дозой ингибитора mTOR, например, аллостерического ингибитора mTOR, например, RAD001 или каталитического ингибитора mTOR. Например, введение низкой иммуностимулирующей дозы ингибитора mTOR можно начинать перед введением экспрессирующей CAR клетки, описываемой в настоящем описании; завершать перед введением экспрессирующей CAR клетки, описываемой в настоящем описании; начинать одновременно с введением экспрессирующей CAR клетки, описываемой в настоящем описании; с совпадением по времени введения экспрессирующей CAR клетки, описываемой в настоящем описании; или продолжая после введения экспрессирующей CAR клетки, описываемой в настоящем описании.
Альтернативно или дополнительно, введение низкой иммуностимулирующей дозы ингибитора mTOR может оптимизировать эффекторные клетки иммунной системы, которые конструируют для экспрессии молекулы CAR, описываемой в настоящем описании. В таких вариантах осуществления введение низкой иммуностимулирующей дозы ингибитора mTOR, например, аллостерического ингибитора, например, RAD001 или каталитического ингибитора начинают или продолжают до сбора эффекторных клеток иммунной системы, например, T-клеток или NK-клеток, которые конструируют для экспрессии молекулы CAR, описываемой в настоящем описании, у индивидуума.
В другом варианте осуществления эффекторные клетки иммунной системы, например, T-клетки или NK-клетки, которые конструируют для экспрессии молекулы CAR, описываемой в настоящем описании, например, после сбора у индивидуума, или экспрессирующие CAR эффекторные клетки иммунной системы, например, T-клетки или NK-клетки, например, перед введением индивидууму можно культивировать в присутствии низкой иммуностимулирующей дозы ингибитора mTOR.
В одном из вариантов осуществления введение индивидууму низкой иммуностимулирующей дозы ингибитора mTOR включает введение, например, один раз в неделю, например, в лекарственной форме с немедленным высвобождением от 0,1 до 20, от 0,5 до 10, от 2,5 до 7,5, от 3 до 6 или приблизительно 5 мг RAD001 или его эквивалентной дозы. В одном из вариантов осуществления введение индивидууму низкой иммуностимулирующей дозы ингибитора mTOR включает введение, например, один раз в неделю, например, лекарственной форме с длительным высвобождением от 0,3 до 60, от 1,5 до 30, от 7,5 до 22,5, от 9 до 18 или приблизительно 15 мг RAD001 или его эквивалентной дозы.
В одном из вариантов осуществления доза ингибитора mTOR связана с или обеспечивает ингибирование mTOR по меньшей мере на 5, но не более чем на 90%, по меньшей мере на 10, но не более чем на 90%, по меньшей мере на 15, но не более чем на 90%, по меньшей мере на 20, но не более чем 90%, по меньшей мере на 30, но не более чем на 90%, по меньшей мере на 40, но не более чем на 90%, по меньшей мере на 50, но не более чем на 90%, по меньшей мере на 60, но не более чем на 90%, по меньшей мере на 70, но не более чем на 90%, по меньшей мере на 5, но не более чем на 80%, по меньшей мере на 10, но не более чем на 80%, по меньшей мере на 15, но не более чем на 80%, по меньшей мере на 20, но не более чем на 80%, по меньшей мере на 30, но не более чем на 80%, по меньшей мере на 40, но не более чем на 80%, по меньшей мере на 50, но не более чем на 80%, по меньшей мере на 60, но не более чем на 80%, по меньшей мере на 5, но не более чем на 70%, по меньшей мере на 10, но не более чем на 70%, по меньшей мере на 15, но не более чем на 70%, по меньшей мере на 20, но не более чем на 70%, по меньшей мере на 30, но не более чем на 70%, по меньшей мере на 40, но не более чем на 70%, по меньшей мере на 50, но не более чем на 70%, по меньшей мере на 5, но не более чем на 60%, по меньшей мере на 10, но не более чем на 60%, по меньшей мере на 15, но не более чем на 60%, по меньшей мере на 20, но не более чем на 60%, по меньшей мере на 30, но не более чем на 60%, по меньшей мере на 40, но не более чем на 60%, по меньшей мере на 5, но не более чем на 50%, по меньшей мере на 10, но не более чем на 50%, по меньшей мере на 15, но не более чем на 50%, по меньшей мере на 20, но не более чем на 50%, по меньшей мере на 30, но не более чем на 50%, по меньшей мере на 40, но не более чем на 50%, по меньшей мере на 5, но не более чем на 40%, по меньшей мере на 10, но не более чем на 40%, по меньшей мере на 15, но не более чем на 40%, по меньшей мере на 20, но не более чем на 40%, по меньшей мере на 30, но не более чем 40%, по меньшей мере на 35, но не более чем на 40%, по меньшей мере на 5, но не более чем на 30%, по меньшей мере на 10, но не более чем на 30%, по меньшей мере на 15, но не более чем на 30%, по меньшей мере на 20, но не более чем на 30% или по меньшей мере на 25, но не более чем на 30%.
Степень ингибирования mTOR можно выражать в виде степени ингибирования киназы P70S6, или она может соответствовать степени ингибирования киназы P70S6, например, степень ингибирования mTOR можно определять по уровню снижения активности киназы P70S6, например, по снижению фосфорилирования субстрата киназы P70S6. Уровень ингибирования mTOR можно оценивать различными способами, такими как измерение активности киназы P70S6 анализом Boulay, как описано в патентной заявке США № 2015/01240036, таким образом, включенной посредством ссылки, или как описано в патенте США № 7727950, таким образом, включенной посредством ссылки; измерение уровня фосфорилированного S6 вестерн-блоттингом или оценка изменения отношения PD1-отрицательных эффекторных клеток иммунной системы к PD1-положительным эффекторным клеткам иммунной системы.
Как используют в настоящем описании, термин "ингибитор mTOR" относится к соединению или лиганду, или его фармацевтически приемлемой соли, которая ингибирует киназу mTOR в клетке. В одном из вариантов осуществления ингибитор mTOR представляет собой аллостерический ингибитор. Аллостерические ингибиторы mTOR включают нейтральное трициклическое соединение рапамицина (сиролимуса), родственных рапамицину соединений, т.е. соединения со структурой и функциональным сходством с рапамицином, включая, например, производные рапамицин, аналоги рапамицина (также обозначаемые как рапалоги) и другие соединения макролидов, которые ингибируют активность mTOR. В одном из вариантов осуществления ингибитор mTOR представляет собой каталитический ингибитор.
Рапамицин является известным макролидным антибиотиком, продуцируемым Streptomyces hygroscopicus, обладающим структурой, представленной в формуле A.
См., например, McAlpine J.B. et al., J. Antibiotics, (1991) 44: 688; Schreiber S.L. et al., J. Am. Chem. Soc., (1991) 113: 7433; патент США № 3929992. Существуют различные системы нумерации, предложенные для рапамицина. Во избежание путаницы, когда в настоящем описании называют конкретные аналоги рапамицина, названия приведены со ссылкой на рапамицин с использованием системы нумерации формулы A.
Аналоги рапамицина, пригодные в изобретении, представляют собой, например, O-замещенные аналоги, в которых гидроксильная группа на циклогексильном кольце рапамицина является замещенной OR1, где R1 представляет собой гидроксиалкил, гидроксиалкоксиалкил, ациламиноалкил или аминоалкил; например, RAD001, также известный как эверолимус, как описано в US 5665772 и WO94/09010, содержание которых включено посредством ссылки. Другие подходящие аналоги рапамицина включают аналоги, замещенные в 26- или 28-положении. Аналог рапамицина может представлять собой эпимер аналога, указанного выше, в частности эпимер аналога, замещенного в положении 40, 28 или 26, и может необязательно являться дополнительно гидрогенизированным, например, как описано в US 6015815, WO95/14023 и WO99/15530, содержания которых включены посредством ссылки, например, ABT578, также известный как зотаролимус, или аналог рапамицина, описанный в US 7091213, WO98/02441 и WO01/14387, содержания которых включены посредством ссылки, например, AP23573, также известный как ридафоролимус.
Примеры аналогов рапамицина, пригодных для использования в настоящем изобретении из US 5665772, включают, но не ограничиваются ими, 40-O-бензилрапамицин, 40-O-(4'-гидроксиметил)бензилрапамицин, 40-O-[4'-(1,2-дигидроксиэтил)]бензилрапамицин, 40-O-аллилрапамицин, 40-O-[3'-(2,2-диметил-1,3-диоксолан-4(S)-ил)-проп-2'-ен-1'-ил]-рапамицин, (2'E,4'S)-40-O-(4',5'-дигидроксипент-2'-ен-1'-ил)рапамицин, 40-O-(2-гидрокси)этоксикарбонилметилрапамицин, 40-O-(2-гидрокси)этил-рапамицин, 40-O-(3-гидрокси)пропилрапамицин, 40-O-(6-гидрокси)гексилрапамицин, 40-O-[2-(2-гидрокси)этокси]этилрапамицин, 40-O-[(3S)-2,2-диметилдиоксолан-3-ил]метилрапамицин, 40-O-[(2S)-2,3-дигидроксипроп-1-ил]рапамицин, 40-O-(2-ацетокси)этилрапамицин, 40-O-(2-никотиноилокси)этилрапамицин, 40-O-[2-(N-морфолино)ацетокси]этилрапамицин, 40-O-(2-N-имидазолилацетокси)этилрапамицин, 40-O-[2-(N-метил-N'-пиперазинил)ацетокси]этилрапамицин, 39-O-десметил-39,40-O,O-этиленрапамицин, (26R)-26-дигидро-40-O-(2-гидрокси)этилрапамицин, 40-O-(2-аминоэтил)рапамицин, 40-O-(2-ацетаминоэтил)рапамицин, 40-O-(2-никотинамидоэтил)рапамицин, 40-O-(2-(N-метилимидазо-2'-илкарбоэтоксиамидо)этил)рапамицин, 40-O-(2-этоксикарбониламиноэтил)рапамицин, 40-O-(2-толилсульфонамидоэтил)рапамицин и 40-O-[2-(4',5'-дикарбоэтокси-1',2',3'-тиазол-1'-ил)этил]рапамицин.
Другие аналоги рапамицина, пригодные в настоящем изобретении, представляют собой аналоги, где гидроксильную группу на циклогексильном кольце рапамицина и/или гидроксигруппу в положении 28 замещают гидроксиэфирной группой, известны, например, аналоги рапамицина, встречающиеся в US RE44.768, например, темсиролимус.
Другие аналоги рапамицина, пригодные в настоящем изобретении, включают аналоги, где метоксигруппу в положении 16 замещают другим заместителем, предпочтительно (необязательно замещенным гидрокси) алкинилокси, бензилом, орто-метоксибензилом или хлорбензилом, и/или где метоксигруппу в положении 39 удаляют совместно с углеродом 39, таким образом, что циклогексильное кольцо рапамицина становится циклопентильным кольцом, не содержащим в положении 39 метоксигруппу; например, как описано в WO95/16691 и WO96/41807, содержания которых включены посредством ссылки. Аналоги можно дополнительно модифицировать, таким образом, что гидрокси в положении 40 рапамицина является алкилированным, и/или карбонил в положении 32 является восстановленным.
Аналоги рапамицина из WO95/16691 включают, но не ограничиваются ими, 16-диметокси-16-(пент-2-инил)оксирапамицин, 16-диметокси-16-(бут-2-инил)оксирапамицин, 16-диметокси-16-(пропаргил)оксирапамицин, 16-деметокси-16-(4-гидрокси-бут-2-инил)оксирапамицин, 16-диметокси-16-бензилокси-40-O-(2-гидроксиэтил)рапамицин, 16-диметокси-16-бензилоксирапамицин, 16-деметокси-16-орто-метоксибензилрапамицин, 16-деметокси-40-O-(2-метоксиэтил)-16-пент-2-инил)оксирапамицин, 39-деметокси-40-дезокси-39-формил-42-норрапамицин, 39-деметокси-40-дезокси-39-гидроксиметил-42-норрапамицин, 39-деметокси-40-дезокси-39-карбокси-42-норрапамицин, 39-деметокси-40-дезокси-39-(4-метил-пиперазин-1-ил)карбонил-42-норрапамицин, 39-деметокси-40-дезокси-39-(морфолин-4-ил)карбонил-42-норрапамицин, 39-деметокси-40-дезокси-39-[N-метил,N-(2-пиридин-2-ил-этил)]карбамоил-42-норрапамицин и 39-деметокси-40-дезокси-39-(п-толуолсульфонилгидразонометил)-42-норрапамицин.
Аналоги рапамицина из WO96/41807 включают, но не ограничиваются ими, 32-деоксо-рапамицин, 16-O-пент-2-инил-32-деоксо-рапамицин, 16-O-пент-2-инил-32-деоксо-40-O-(2-гидрокси-этил)рапамицин, 16-O-пент-2-инил-32-(S)-дигидро-40-O-(2-гидроксиэтил)рапамицин, 32(S)-дигидро-40-O-(2-метокси)этилрапамицин и 32(S)-дигидро-40-O-(2-гидроксиэтил)рапамицин.
Другой подходящий аналог рапамицина представляет собой миролимус, как описано в US2005/0101624, содержание которого включено посредством ссылки.
RAD001, также известный как эверолимус (Afinitor®), имеет химическое название (1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28E,30S,32S,35R)-1,18-дигидрокси-12-{(1R)-2-[(1S,3R,4R)-4-(2-гидроксиэтокси)-3-метоксициклогексил]-1-метилэтил}-19,30-диметокси-15,17,21,23,29,35-гексаметил-11,36-диокса-4-аза-трицикло[30.3.1.04.9]гексатриаконта-16,24,26,28-тетраен-2,3,10,14,20-пентa-он.
Дополнительные примеры аллостерических ингибиторов mTOR включают сиролимус (рапамицин, AY-22989), 40-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]рапамицин (также называемый темсиролимусом или CCI-779) и ридафоролимус (AP-23573/MK-8669). Другие примеры аллостерических ингибиторов mTor включают зотаролимус (ABT578) и умиролимус.
Альтернативно или дополнительно, было выявлено, что каталитические АТФ-конкурентные ингибиторы mTOR направленно воздействует непосредственно киназный домен mTOR и направленно воздействует на mTORC1 и mTORC2. Они также являются более эффективными ингибиторами mTORC1, чем такие аллостерические ингибиторы mTOR как рапамицин, вследствие того, что они модулируют устойчивые к рапамицину mTORC1 выходные сигналы, такие как фосфорилирование 4EBP1-T37/46 и кэп-зависимая трансляция.
Каталитические ингибиторы включают: BEZ235 или 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидро-имидазо[4,5-c]хинолин-1-ил)фенил]пропионитрил или форму монотозилатной соли, синтез BEZ235 описан в WO2006/122806; CCG168 (также известный как AZD-8055, Chresta C.M. et al., Cancer Res., 2010, 70(1), 288-298), химическое название которого представляет собой {5-[2,4-бис-((S)-3-метилморфолин-4-ил)пиридо[2,3d]пиримидин-7-ил]-2-метоксифенил}метанол; 3-[2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил]-N-метилбензамид (WO09104019); 3-(2-аминобензо[d]оксазол-5-ил)-1-изопропил-1H-пиразоло[3,4-d]пиримидин-4-амин (WO10051043 и WO2013023184); N-(3-(N-(3-((3,5-диметоксифенил)амино)хиноксалин-2-ил)сульфамоил)фенил)-3-метокси-4-метилбензамид (WO07044729 и WO12006552); PKI-587 (Venkatesan A.M., J. Med.Chem., 2010, 53, 2636-2645), химическое название которого представляет собой 1-[4-[4-(диметиламино)пиперидин-1-карбонил]фенил]-3-[4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил]мочевина; GSK-2126458 (ACS Med. Chem. Lett., 2010, 1, 39-43), химическое название которого представляет собой 2,4-дифтор-N-{2-метокси-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамид; 5-(9-изопропил-8-метил-2-морфолино-9H-пурин-6-ил)пиримидин-2-амин (WO10114484); (E)-N-(8-(6-амино-5-(трифторметил)пиридин-3-ил)-1-(6-(2-цианопропан-2-ил)пиридин-3-ил)-3-метил-1H-имидазо[4,5-c]хинолин-2(3H)илиден)цианамид (WO12007926).
Дополнительные примеры каталитических ингибиторов включают mTOR 8-(6-метоксипиридин-3-ил)-3-метил-1-(4-пиперазин-1-ил-3-трифторметилфенил)-1,3-дигидроимидазо[4,5-c]хинолин-2-он (WO2006/122806) и Ku-0063794 (Garcia-Martinez J.M. et al., Biochem J., 2009, 421(1), 29-42. Ku-0063794 представляет собой специфический ингибитор мишени млекопитающих рапамицина (mTOR). WYE-354 представляет собой другой пример каталитического ингибитора mTor (Yu K. et al., (2009). Biochemical, Cellular, and In vivo Activity of Novel ATP-Competitive and Selective Inhibitors of the Mammalian Target of Rapamycin. Cancer Res. 69(15): 6232-6240).
Ингибиторы mTOR, пригодные по настоящему изобретению, также включают пролекарства, производные, фармацевтически приемлемые соли или их аналоги любого из указанных выше соединений.
Ингибиторы mTOR, такие как RAD001, можно формулировать для доставки на основе хорошо установленных способы в данной области, на основе конкретных доз, описываемых в настоящем описании. В частности, в патенте США 6004973 (включенном в настоящее описание посредством ссылки) приводят примеры составов, которые можно использовать с ингибиторами mTOR, описываемыми в настоящем описании.
Способы и биомаркеры для оценки эффективности CAR или пригодности образца
В другом аспекте изобретение относится к способу оценки или мониторинга эффективности терапии клетками, экспрессирующими CAR, (например, терапии CD123 CAR) у индивидуума (например, индивидуума, страдающего злокачественной опухолью, например, гематологической злокачественной опухолью) или пригодности образца (например, образца афереза) для терапии CAR (например, терапии CD123 CAR). Способ включает получение значения эффективности терапии CAR или пригодности образца, где указанное значение является показателем эффективности или пригодности терапии клетками, экспрессирующими CAR.
В вариантах осуществления значение эффективности для терапии CAR или пригодности образца включает измерение одного, двух, трех, четыре, пяти, шести или более (всех) из следующих ниже:
(i) уровня или активности одной, двух, трех или более (например, всех) покоящихся TEFF-клеток, покоящихся TREG-клеток, незрелых T-клеток (например, незрелых CD4 или CD8 клеток, или гамма/дельта T-клетки) или незрелых T-клеток памяти, или их сочетания в образце (например, образце афереза или промышленном образце продукта экспрессирующей CAR клетки);
(ii) уровня или активности одной, двух, трех или более (например, всех) активированных TEFF-клеток, активированных TREG-клеток, более старых T-клеток (например, более старых CD4 или CD8 клеток) или поздних T-клеток памяти, или их сочетания в образце (например, образце афереза или промышленном образце продукта экспрессирующей CAR клетки);
(iii) уровня или активности маркера истощения иммунных клеток, например, одного, двух или более ингибиторов иммунных контрольных точек (например, PD-1, PD-L1, TIM-3 и/или LAG-3) в образце (например, образце афереза или промышленном образце продукта экспрессирующей CAR клетки). В одном из вариантов осуществления иммунная клетка имеет истощенный фенотип, например, коэкспрессирует по меньшей мере два маркера истощения, например, коэкспрессирует PD-1 и TIM-3. В других вариантах осуществления иммунная клетка имеет истощенный фенотип, например, коэкспрессирует по меньшей мере два маркера истощения, например, коэкспрессирует PD-1 и LAG-3;
(iv) уровня или активности CD27 и/или CD45RO- (например, CD27+ CD45RO-) эффекторных клеток иммунной системы, например, в популяции CD4+ или CD8+ T-клеток в образце (например, образце афереза или промышленном образце продукта экспрессирующей CAR клетки);
(v) уровня или активности одного, двух, трех, четырех, пяти, десяти, двадцати или более биомаркеров, выбранных из CCL20, IL-17a и/или IL-6, PD-1, PD-L1, LAG-3, TIM-3, CD57, CD27, CD122, CD62L, KLRG1;
(vi) уровня цитокинов или активности (например, качества репертуара цитокинов) в образце продукта экспрессирующей CAR клетки, например, образце продукта экспрессирующей CD123 клетки; или
(vii) эффективности трансдукции экспрессирующей CAR клетки в промышленном образце продукта экспрессирующей CAR клетки.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, терапия клетками, экспрессирующими CAR, включает совокупность (например, популяцию) экспрессирующих CAR эффекторных клеток иммунной системы, например, совокупность (например, популяцию) T-клеток или NK-клеток, или их сочетание. В одном из вариантов осуществления терапия клетками, экспрессирующими CAR, представляет собой терапию CD123 CAR.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, измерение одного или более из (i)-(vii) проводят в образце афереза, получаемом от индивидуума. Образец афереза можно оценивать до инфузии или реинфузии.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, измерение одного или более из (i)-(vii) проводят в промышленном образце продукта экспрессирующей CAR клетки, например, образце продукта экспрессирующей CD123 CAR клетки. Промышленный продукт экспрессирующей CAR клетки можно оценивать до инфузии или реинфузия.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, индивидуум оценивают до получения, во время или после получения терапии клетками, экспрессирующими CAR.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, измерением одного или более из (i)-(vii) оценивают профиль одной или более из экспрессии гена, проточной цитометрии или экспрессии белка.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, способ дополнительно включает идентификацию индивидуума как реагирующего на лечение, нереагирующего на лечение, индивидуума с рецидивами или индивидуума без рецидивов на основании измерения одного или более из (i)-(vii).
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, реагирующего на лечение индивидуума (например, полностью реагирующего) идентифицировали или идентифицируют как имеющего более высокий уровень или активность одного, двух или более (всех) из GZMK, PPF1BP2 или наивных T-клеток по сравнению с не реагирующими на лечение индивидуумом.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, не реагирующего на лечение индивидуума идентифицировали или идентифицируют как имеющего более высокий уровень или активность одного, двух, трех, четырех, пяти, шести, семи или более (например, всех) из IL22, IL-2RA, IL-21, IRF8, IL8, CCL17, CCL22, эффекторных T-клеток или регуляторных T-клеток по сравнению с реагирующими на лечение индивидуумом.
В одном из вариантов осуществления индивидуум с рецидивом представляет собой пациента с, или у которого идентифицируют повышенный уровень экспрессии одного или более из (например, 2, 3, 4 или всех) следующих ниже генов по сравнению с индивидуумом без рецидива: MIR199A1, MIR1203, uc021ovp, ITM2C и HLA-DQB1, и/или пониженные уровни экспрессии одного или более из (например, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или всех) следующих генов по сравнению с индивидуумами без рецидива: PPIAL4D, TTTY10, TXLNG2P, MIR4650-1, KDM5D, USP9Y, PRKY, RPS4Y2, RPS4Y1, NCRNA00185, SULT1E1 и EIF1AY.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, полностью реагирующий на лечение индивидуум имеет, или у него идентифицируют более высокое, например, статистически значимое более высокое процентное содержание CD8+ T-клеток по сравнению с эталонным значением, например, процентным содержанием CD8+ T-клеток у не реагирующего на лечение индивидуума.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, полностью реагирующий на лечение индивидуум имеет, или у него идентифицируют более высокое процентное содержание CD27+ CD45RO- эффекторных клеток иммунной системы, например, в популяции CD8+ по сравнению с эталонным значением, например, числом CD27+ CD45RO- эффекторных клеток иммунной системы у не реагирующего на лечение индивидуума.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, полностью реагирующий на лечение индивидуум или частично реагирующий на лечение индивидуум имеет, или у него идентифицируют более высокое, например, статистически значимое более высокое процентное содержание CD4+ T-клеток по сравнению с эталонным значением, например, процентным содержанием CD4+ T-клеток у не реагирующего на лечение индивидуума.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, полностью реагирующий на лечение индивидуум имеет, или у него идентифицируют более высокое процентное содержание одной, двух, трех или более (например, всех) покоящихся TEFF-клеток, покоящихся TREG-клеток, незрелых T-клеток (например, незрелых CD4 или CD8 клеток или гамма/дельта T-клеток) или незрелых T-клеток памяти, или их сочетания по сравнению с эталонным значением, например, числом покоящихся TEFF-клеток у не реагирующего на лечение индивидуума, покоящихся TREG-клеток, незрелых T-клеток (например, незрелых CD4 или CD8 клеток) или ранних T-клеток памяти.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, не реагирующий на лечение индивидуум имеет, или у него идентифицируют более высокое процентное содержание одной, двух, трех или более (например, всех) активированных TEFF-клеток, активированных TREG-клеток, более старых T-клеток (например, более старых CD4 или CD8 клеток) или поздних T-клеток памяти, или их сочетание по сравнению с эталонным значением, например, числом активированных TEFF-клеток, активированных TREG-клеток, более старых T-клеток (например, более старых CD4 или CD8 клеток) или поздних T-клеток памяти у реагирующего на лечение индивидуума.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, не реагирующий на лечение индивидуум имеет, или у него идентифицируют более высокое процентное содержание маркера истощения иммунных клеток, например, один, два или более ингибиторов иммунных контрольных точек (например, PD-1, PD-L1, TIM-3 и/или LAG-3). В одном из вариантов осуществления не реагирующий на лечение индивидуум имеет, или у него идентифицируют более высокое процентное содержание экспрессирующих PD-1, PD-L1 или LAG-3 эффекторных клеток иммунной системы (например, CD4+ T-клеток и/или CD8+ T-клеток) (например, экспрессирующих CAR CD4+ клеток и/или CD8+ T-клеток) по сравнению с процентным содержанием экспрессирующих PD-1 или LAG-3 эффекторных клеток иммунной системы от реагирующего на лечение индивидуума.
В одном из вариантов осуществления не реагирующий на лечение индивидуум имеет, или у него идентифицируют более высокое процентное содержание иммунных клеток с истощенным фенотипом, например, иммунных клеток, которые коэкспрессируют по меньшей мере два маркера истощения, например, коэкспрессируют PD-1, PD-L1 и/или TIM-3. В других вариантах осуществления не реагирующий на лечение индивидуум имеет, или у него идентифицируют более высокое процентное содержание иммунных клеток с истощенным фенотипом, например, иммунные клетки, которые коэкспрессируют по меньшей мере два маркера истощения, например, коэкспрессируют PD-1 и LAG-3.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, не реагирующий на лечение индивидуум имеет, или у него идентифицируют более высокое процентное содержание клеток PD-1/PD-L1+/LAG-3+ в популяции экспрессирующих CAR клеток (например, популяции CD123 CAR+ клеток) по сравнению с индивидуумом, реагирующим (например, индивидуум, полностью реагирующим) на терапию клетками, экспрессирующими CAR.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, частично реагирующий на лечение индивидуум имеет, или у него идентифицируют более высокие процентные содержания PD-1/PD-L1+/LAG-3+ клеток по сравнению с реагирующим на лечение индивидуумом в популяции экспрессирующих CAR клеток (например, популяции CD123 CAR+ клеток).
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, не реагирующий на лечение индивидуум имеет, или у него идентифицируют истощенный фенотип PD1/PD-L1+ CAR+ и коэкспрессию LAG3 в популяции экспрессирующих CAR клеток (например, популяции CD123 CAR+ клеток).
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, не реагирующий на лечение индивидуум имеет, или у него идентифицируют более высокое процентное содержание PD-1/PD-L1+/TIM-3+ клеток в популяции экспрессирующих CAR клеток (например, популяции CD123 CAR+клеток) по сравнению с реагирующим на лечение индивидуумом (например, полностью реагирующим на лечение индивидуумом).
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, частично реагирующий на лечение индивидуум имеет, или у него идентифицируют более высокое процентное содержание PD-1/PD-L1+/TIM-3+ клеток по сравнению с реагирующими на лечение индивидуума в популяции экспрессирующих CAR клеток (например, популяции CD123 CAR+ клеток).
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, наличие CD8+ CD27+ CD45RO- T-клеток в образце афереза является положительным прогностическим фактором реакции индивидуума на терапию клетками, экспрессирующими CAR (например, терапию CD123 CAR).
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, высокое процентное содержание PD1+ CAR+ и LAG3+ или TIM3+ T-клеток в образце афереза является неблагоприятным прогностическим фактором реакции индивидуума на терапию клетками, экспрессирующими CAR (например, терапию CD123 CAR).
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, реагирующий на лечение индивидуум (например, полностью реагирующий или частично реагирующий на лечение индивидуум) имеет один, два, три или более (или все) из следующего ниже профиля:
(i) имеет большее число CD27+ эффекторных клеток иммунной системы по сравнению с эталонным значением, например, числом CD27+ эффекторных клеток иммунной системы у не реагирующего на лечение индивидуума;
(ii) (i) имеет большее число CD8+ T-клеток по сравнению с эталонным значением, например, числом CD8+ T-клеток у не реагирующий на лечение индивидуума;
(iii) имеет меньшее число иммунных клеток, экспрессирующих один или более ингибиторов иммунных контрольных точек, например, ингибитора контрольных точек, выбранного из PD-1, PD-L1, LAG-3, TIM-3 или KLRG-1, или их сочетания по сравнению с эталонным значением, например, числом клеток, экспрессирующих один или более ингибиторов иммунных контрольных точек у не реагирующего на лечение индивидуума; или
(iv) имеет большее число одной, двух, трех, четырех или более (всех) покоящихся TEFF-клеток, покоящихся TREG-клеток, наивных CD4 клеток, нестимулированных клеток памяти или ранних T-клеток памяти, или их сочетания по сравнению с эталонным значением, например, числом покоящихся TEFF-клеток, покоящихся TREG-клеток, наивных CD4 клеток, нестимулированных клеток памяти или ранних T-клеток памяти у не реагирующего на лечение индивидуума.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, уровни цитокинов или активность (vi) выбирают из одного, двух, трех, четырех, пяти, шести, семи, восьми или более (или всех) цитокинов CCL20/MIP3a, IL17A, IL6, GM-CSF, IFNγ, IL10, IL13, IL2, IL21, IL4, IL5, IL9 или TNFα, или их сочетания. Цитокин можно выбирать из одного, двух, трех, четырех или более (всех) IL-17a, CCL20, IL2, IL6 или TNFα. В одном из вариантов осуществления повышенный уровень или активность цитокина выбирают из одного или обоих IL-17a и CCL20, является показателем повышенной реакции на лечение или пониженной частоты рецидива.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, эффективность трансдукции 15% или выше в (vii) является показателем повышенной реакции на лечение или пониженной частоты рецидива.
В некоторых вариантах осуществления любых способов, описываемых в настоящем описании, эффективность трансдукции менее 15% в (vii) является показателем сниженной реакции на лечение или повышенной частоты рецидива.
В вариантах осуществления реагирующего на лечение индивидуума, не реагирующего на лечение индивидуума, индивидуума с рецидивом или индивидуума без рецидива, идентифицированного способами в настоящем описании, можно дополнительно оценивать в соответствии с клиническими критериями. Например, полностью реагирующего на лечение индивидуума идентифицировали или идентифицируют как индивидуума, страдающего заболеванием, например, злокачественной опухолью, у которого выявляют полный ответ, например, полную ремиссию в ответ на лечение. Полный ответ можно идентифицировать, например, с использованием NCCN Guidelines® или Cheson et al., J. Clin. Oncol., 17:1244 (1999) и Cheson et al., "Revised Response Criteria for Malignant Lymphoma", J. Clin. Oncol., 25:579-586 (2007) (полностью включенных посредством ссылки в настоящее описание), как описано в настоящем описании. Частично реагирующего на лечение индивидуума идентифицировали или идентифицируют как индивидуума, страдающего заболеванием, например, злокачественной опухолью, у которого выявляют частичный ответ, например, частичную ремиссию в ответ на лечение. Частичный ответ можно идентифицировать, например, с использованием NCCN Guidelines® или критериев Cheson, как описано в настоящем описании. Не реагирующего на лечение индивидуума идентифицировали или идентифицируют как индивидуума, страдающего заболеванием, например, злокачественной опухолью, у которого не выявляют реакции на лечение, например, пациент имеет стабильное заболевание или прогрессирующее заболевание. Не реагирующего на лечение индивидуума можно идентифицировать, например, с использованием NCCN Guidelines® или критериев Cheson, как описано в настоящем описании.
Альтернативно или в комбинации со способами, описываемыми в настоящем описании, в ответ на указанное значение, проведение одного, двух, трех, четырех или более из:
- проведения, например, реагирующему на лечение индивидууму или не реагирующему на лечение индивидууму терапии клетками, экспрессирующими CAR;
- введения измененного дозирования терапии клетками, экспрессирующими CAR;
- изменения схемы или времени проведения терапии клетками, экспрессирующими CAR;
- введения, например, не реагирующему на лечение индивидууму или частично реагирующему на лечение индивидууму дополнительного средства в комбинации с терапией клетками, экспрессирующими CAR, например, ингибитора контрольных точек, например, ингибитора контрольных точек, описываемого в настоящем описании;
- проведения не реагирующему на лечение индивидууму или частично реагирующему на лечение индивидууму терапии, которая увеличивает число незрелых T-клеток у индивидуума до проведения лечения терапией клетками, экспрессирующими CAR;
- модификации способа получения терапии клетками, экспрессирующими CAR, например, обогащение более незрелыми T-клетками до введения нуклеиновой кислоты, кодирующей CAR, или повышение эффективности трансдукции, например, для индивидуума, идентифицированного как не реагирующего на лечение или частично реагирующего на лечение;
- проведения альтернативной терапии, например, для не реагирующего на лечение индивидуума или частично реагирующего на лечение индивидуума, или индивидуума с рецидивом; или
- если индивидуум является, или его идентифицируют как не реагирующего на лечение индивидуума или индивидуума с рецидивом, снижения популяции TREG-клеток и/или профиля генной экспрессии TREG, например, посредством одной или более делеций CD25, введения циклофосфамида, антитела против GITR или их сочетания.
В определенных вариантах осуществления индивидуум получает предварительное лечение антителом против GITR. В определенном варианте осуществления индивидуум получает лечение антителом против GITR до инфузии или реинфузия.
Способы доставки на основе биополимера
В некоторых вариантах осуществления одну или более экспрессирующих CAR клеток, как описано в настоящем описании, можно вводить или доставлять индивидууму посредством биополимерного каркаса, например, биополимерного имплантата. Биополимерные каркасы могут поддерживать или повышать доставку, размножение и/или дисперсию экспрессирующих CAR клеток, описываемых в настоящем описании. Биополимерный каркас содержит биосовместимый (например, по существу не индуцирует воспалительный или иммунный ответ) и/или биоразрушаемый полимер, который может быть природным или синтетическим.
Примеры подходящих биополимеров включают, но не ограничиваются ими, агар, агарозу, альгинат, цемент альгинат/фосфат кальция (CPC), бета-галактозидазу (β-GAL), (1,2,3,4,6-пентаацетил-a-D-галактозу), целлюлозу, хитин, хитозан, коллаген, эластин, желатин, гиалуроновую кислоту, коллаген, гидроксиапатит, поли(3-гидроксибутират-ко-3-гидроксигексаноат) (PHBHHx), поли(лактид), поли(капролактон) (PCL), сополимер лактида с гликолидом (PLG), полиэтиленоксид (PEO), поли(молочная кислота-ко-гликолевая кислота) (PLGA), полипропиленоксид (PPO), поливиниловый спирт) (PVA), шелк, соевый белок и изолят соевого белка отдельно или в комбинации с любой другой полимерной композицией в любой концентрации и в любом отношении. Биополимер может увеличивать или модифицировать способствующие адгезии или миграции молекулы, например, пептиды миметики коллагена, которые связываются с рецептором коллагена лимфоцитов, и/или стимулирующие молекулы для повышения доставки, размножения или функции, например, противораковой активности клеток, которые необходимо доставлять. Биополимерный каркас может являться инъецируемым, например, гелевой или полутвердой, или твердой композицией.
В некоторых вариантах осуществления экспрессирующие CAR клетки, описываемые в настоящем описании, высевают на биополимерный каркас до доставки индивидууму. В вариантах осуществления биополимерный каркас дополнительно содержит одно или более дополнительных терапевтических средств, описываемых в настоящем описании, (например, другую экспрессирующую CAR клетку, антитело или низкомолекулярное соединение) или средства, которые усиливают активность экспрессирующей CAR клетки, например, встроенные или конъюгированные с биополимерами каркаса. В вариантах осуществления биополимерный каркас инъецируют, например, внутрь опухоли или хирургически имплантируют в опухоль или в непосредственной близости от опухоли, достаточной для опосредования противоопухолевого эффекта. Дополнительные примеры биополимерных композиций и способов их доставки описаны у Stephan et al., Nature Biotechnology, 2015, 33:97-101; и в WO2014/110591.
Фармацевтические композиции и виды лечения
Фармацевтические композиции по настоящему изобретению могут содержать экспрессирующую CAR клетку, например, совокупность экспрессирующих CAR клеток, как описано в настоящем описании, в комбинации с одним или более фармацевтически или физиологически приемлемыми носителями, разбавителями или эксципиентами. Такие композиции могут содержать буферы, такие как нейтральный забуференный физиологический раствор, фосфатно-солевой буфер и т.п.; углеводы, такие как глюкоза, манноза, сахароза или декстраны, маннит; белки; полипептиды или аминокислоты, такие как глицин; антиоксиданты; хелатирующие средства, такие как EDTA или глутатион; адъюванты (например, гидроксид алюминия) и консерванты. В одном из аспектов композиции по настоящему изобретению формулируют для внутривенного введения.
Фармацевтические композиции по настоящему изобретению можно вводить способом, подходящим для заболевания, подлежащее лечению (или профилактике). Количество и частоту введения определяют такие факторы, как состояние пациента и тип и тяжесть заболевания пациента, хотя подходящие дозы можно определять клиническими испытаниями.
В одном из вариантов осуществления фармацевтическая композиция по существу не содержит, например, не наблюдают детектируемых уровней загрязняющего вещества, например, выбранного из группы, состоящей из эндотоксина, микоплазмы, компонента репликации лентивируса (RCL), p24, нуклеиновой кислоты VSV-G, gag ВИЧ, остаточных гранул, покрытых антителом против CD3/антителом против CD28, антител мыши, объединенной сыворотки человека, бычьего сывороточного альбумина, телячьей сыворотки, компонентов среды для культивирования, компонентов вектора, упаковывающего клетку, или плазмиды, бактерии и гриба. В одном из вариантов осуществления бактерия представляет собой по меньшей мере бактерию, выбранную из группы, состоящей из Alcaligenes faecalis, Candida albicans, Escherichia coli, Haemophilus influenza, Neisseria meningitides, Pseudomonas aeruginosa, Staphylococcus aureus, Streptococcus pneumonia и Streptococcus pyogenes группы A.
Когда указывают "иммунологически эффективное количество", "противоопухолевое эффективное количество", "ингибирующее опухоль эффективное количество" или "терапевтическое количество", точное количество композиций по настоящему изобретению, которое необходимо вводить, может определять врач, принимая во внимание индивидуальные различия возраста, массы, размера опухоли, степени инфекции или метастазирования, и состояния пациента (индивидуума). В общем случае, может быть указано, что фармацевтическую композицию, содержащую T-клетки, описываемые в настоящем описании, можно вводить в дозе от 104 до 109 клеток/кг масса тела, в некоторых случаях от 105 до 106 клеток/кг масса тела, включая все целочисленные значения в этих диапазонах. T-клеточные композиции также можно вводить много раз в этих дозах.
В некоторых вариантах осуществления доза CAR-клеток (например, CD123 CAR-клеток) составляет приблизительно 1×106, 1,1×106, 2×106, 3,6×106, 5×106, 1×107, 1,8×107, 2×107, 5×107, 1×108, 2×108 или 5×108 клеток/кг. В некоторых вариантах осуществления доза CAR-клеток (например, CD123 CAR-клеток) составляет по меньшей мере приблизительно 1×106, 1,1×106, 2×106, 3,6×106, 5×106, 1×107, 1,8×107, 2×107, 5×107, 1×108, 2×108 или 5×108 клеток/кг. В некоторых вариантах осуществления доза CAR-клеток (например, CD123 CAR-клеток) составляет приблизительно до 1×106, 1,1×106, 2×106, 3,6×106, 5×106, 1×107, 1,8×107, 2×107, 5×107, 1×108, 2×108 или 5×108 клеток/кг. В некоторых вариантах осуществления доза CAR-клеток (например, CD123 CAR-клеток) составляет приблизительно 1,1×106-1,8×107 клеток/кг. В некоторых вариантах осуществления доза CAR-клеток (например, CD123 CAR-клеток) составляет приблизительно 1×107, 2×107, 5×107, 1×108, 2×108, 5×108, 1×109, 2×109 или 5×109 клеток. В некоторых вариантах осуществления доза CAR-клеток (например, CD123 CAR-клеток) составляет по меньшей мере приблизительно 1×107, 2×107, 5×107, 1×108, 2×108, 5×108, 1×109, 2×109 или 5×109 клеток. В некоторых вариантах осуществления доза CAR-клеток (например, CD123 CAR-клеток) составляет приблизительно до 1×107, 2×107, 5×107, 1×108, 2×108, 5×108, 1×109, 2×109 или 5×109 клеток.
Клетки можно вводить с использованием техник инфузии, которые являются общеизвестными в иммунотерапии (см., например, Rosenberg et al., New Eng. J. of Med., 319:1676, 1988).
В определенных аспектах желательным может являться введение активированных T-клеток индивидууму, а затем повторный отбор крови (или проведение афереза), активирование T-клетки после этого по настоящему изобретению и реинфузия пациенту таких активированных и размноженных T-клеток. Этот процесс можно проводить много раз в течение нескольких недель. В определенных аспектах T-клетки можно активировать из отобранных образцов крови от 10cc до 400cc. В определенных аспектах T-клетки активируют из отобранных образцов крови 20cc, 30cc, 40cc, 50cc, 60cc, 70cc, 80cc, 90cc или 100cc.
Введение индивидууму композиций можно проводить любым подходящим способом, включая посредством ингаляции аэрозолей, инъекции, проглатывания, трансфузии, имплантации или трансплантаций. Композиции, описываемые в настоящем описании, можно вводить пациенту трансартериально, подкожно, интрадермально, внутрь опухоли, внутрь узла, интрамедуллярно, внутримышечно, посредством внутривенной (в/в) инъекции или интраперитонеально. В одном из аспектов композиции экспрессирующей CAR клетки (например, T-клетки или NK-клетки) по настоящему изобретению вводят пациенту посредством интрадермальной или подкожной инъекции. В одном из аспектов композиции экспрессирующей CAR клетки (например, T-клетки или NK-клетки) по настоящему изобретению вводят посредством в/в инъекции. Композиции экспрессирующей CAR клетки (например, T-клетки или NK-клетки) можно инъецировать непосредственно в опухоль, лимфоузел или участок инфекции.
В конкретном иллюстративном аспекте индивидуумы могут проходить лейкаферез, где лейкоциты собирают, обогащают или истощают ex vivo для отбора и/или выделения представляющих интерес клеток, например, эффекторных клеток иммунной системы (например, T-клеток или NK-клеток). Такие изоляты эффекторных клеток иммунной системы (например, T-клеток или NK-клеток) можно размножать известными в данной области способами и обрабатывать, таким образом, что одну или более конструкций CAR по изобретению можно вводить, таким образом, создавая экспрессирующую CAR клетку (например, CAR T-клетку или экспрессирующую CAR NK-клетку) по изобретению. Затем нуждающиеся в этом индивидуумы могут получать стандартное лечение химиотерапии в высоких дозах с последующей трансплантацией стволовых клеток периферической крови. В определенных аспектах после или совместно с трансплантацией индивидуумы получают инфузию размноженной экспрессирующей CAR клетки (например, CAR T-клетки или экспрессирующей CAR NK-клетки) по настоящему изобретению. В дополнительном аспекте размноженные клетки вводят до хирургической операции или после нее.
Дозирование указанных выше видов лечения, которое необходимо проводить пациенту, изменяется в зависимости от точной природы состояния, подлежащего лечению и реципиента лечения. Масштабирование доз для введения человеку можно проводить в соответствии с принятыми в данной области практиками. Доза CAMPATH, например, как правило, находится в диапазоне от 1 приблизительно до 100 мг для взрослого пациента, как правило, вводимая каждые сутки в течение периода от 1 до 30 суток. Предпочтительная суточная доза составляет от 1 до 10 мг в сутки, хотя в некоторых случаях можно использовать большие дозы до 40 мг в сутки (описанные в патенте США № 6120766).
В одном из вариантов осуществления CAR вводят в эффекторные клетки иммунной системы (например, T-клетки или NK-клетки), например, с использованием транскрипции in vitro, и индивидуум (например, человек) получает начальное введение экспрессирующей CAR клетки (например, CAR T-клетка или экспрессирующей CAR NK-клетки) по изобретению и одно или более последующих введений экспрессирующей CAR клетки (например, CAR T-клетки или экспрессирующей CAR NK-клетки) по изобретению, где одно или более последующих введений вводят менее чем 15 суток, например, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или через 2 суток после предыдущего введения. В одном из вариантов осуществления более одно введение экспрессирующей CAR клетки (например, CAR T-клетки или экспрессирующей CAR NK-клетки) по изобретению вводят индивидууму (например, человеку) в неделю, например, 2, 3 или 4 введения экспрессирующей CAR клетки (например, CAR T-клетки или экспрессирующей CAR NK-клетки) по изобретению вводят в неделю. В одном из вариантов осуществления индивидуум (например, являющийся человеком индивидуум) получает более одного введения экспрессирующей CAR клетки (например, CAR T-клетки или экспрессирующей CAR NK-клетки) в неделю (например, 2, 3 или 4 введения в неделю) (также обозначаемых в настоящем описании как цикл) с последующей неделей без введений экспрессирующей CAR клетки (например, CAR T-клетки или экспрессирующей CAR NK-клетки), а затем проводят одно или более дополнительных введений экспрессирующей CAR клетки (например, CAR T-клетки или экспрессирующей CAR NK-клетки) (например, более одного введения экспрессирующей CAR клетки (например, CAR T-клетки или экспрессирующей CAR NK-клетки) в неделю) индивидууму. В другом варианте осуществления индивидуум (например, являющейся человеком индивидуум) получает более одного цикла экспрессирующей CAR клетки (например, CAR T-клетки или экспрессирующей CAR NK-клетки), и период времени между циклами составляет менее 10, 9, 8, 7, 6, 5, 4 или 3 суток. В одном из вариантов осуществления экспрессирующую CAR клетку (например, CAR T-клетку или экспрессирующую CAR NK-клетку) вводят через сутки в 3 введениях в неделю. В одном из вариантов осуществления экспрессирующую CAR клетку (например, CAR T-клетку или экспрессирующую CAR NK-клетку) по изобретению вводят в течение по меньшей мере двух, трех, четырех, пяти, шести, семи, восьми или более недель.
В одном из аспектов экспрессирующую CD123 CAR клетку (например, CAR T-клетку или экспрессирующую CAR NK-клетку) получают с использованием лентивирусных векторов, таких как лентивирус. Экспрессирующая CAR клетка (например, CAR T-клетка или экспрессирующая CAR NK-клетка), получаемая таким образом, характеризуется стабильной экспрессией CAR.
В одном из аспектов экспрессирующие CAR клетки, например, CART или экспрессирующие CAR NK-клетки, получают с использованием вирусного вектора, такого как гамма-ретровирусный вектор, например, гамма-ретровирусный вектор, описываемый в настоящем описании. Экспрессирующие CAR клетки, например, CART или экспрессирующие CAR NK-клетки, получаемые с использованием этих векторов, могут характеризоваться стабильной экспрессией CAR.
В одном из аспектов экспрессирующая CAR клетка (например, CAR T-клетка или экспрессирующая CAR NK-клетка) транзиторно экспрессирует CAR-векторы в течение периода времени 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 через 15 суток после трансдукция. Транзиторную экспрессию CAR можно получать посредством доставки вектора с РНК CAR. В одном из аспектов РНК CAR трансдуцируют в клетку (например, T-клетку или NK-клетку) электропорацией.
Возможной проблемой, которая может возникать у пациентов, которым проводят лечение с использованием транзиторно экспрессирующей CAR клетки (например, CAR T-клетки или экспрессирующей CAR NK-клетки) (в частности с scFv мышей, несущих CAR), является анафилаксия после нескольких циклов лечения.
Без связи с этой теорией, полагают, что такая анафилактическая реакция может быть вызвана развивающимся гуморальным ответом против CAR у пациента, т.е. антителами против CAR с изотипом против IgE. Полагают, что продуцирующие антитела клетки пациента претерпевают переключение класса с изотипа IgG (который не вызывает анафилаксию) на изотип IgE, затем присутствует перерыв продолжительностью от десяти до четырнадцати сутки в воздействии антигеном.
Если пациент подвергается высокому риску развития ответа антител про CAR во время курса терапии транзиторно экспрессирующимися CAR (такими, как CAR, образуемые в результате трансдукций РНК), перерывы в проведении инфузии экспрессирующих CAR клеток (например, CAR T-клеток или экспрессирующих CAR NK-клеток) не должны длиться более десяти-четырнадцати суток.
ПРИМЕРЫ
Кроме того, изобретение подробно описано посредством ссылки на следующие ниже экспериментальные примеры. Эти примеры предоставлены только с целью иллюстрации и не предназначены ограничивать, если не указано иное. Таким образом, изобретение не следует каким-либо образом интерпретировать как ограниченное следующими ниже примерами, в наоборот следует интерпретировать как включающее любой и все варианты, которые станут очевидны из указаний, предоставляемых в настоящем описании.
Без дополнительного описания полагают, что специалист в данной области с использованием предшествующего описания и следующих ниже иллюстративных примеров может получать и использовать соединения по настоящему изобретению и применять на практике описываемые в заявке способы. Следующие ниже демонстрационные примеры конкретно указывают на различные аспекты настоящего изобретения, и их не следует интерпретировать как ограничивающие каким-либо образом оставшуюся часть изобретения.
Пример 1: Конструкции CAR человека
Выделяли полностью принадлежащие человеку одноцепочечные вариабельные фрагменты антитела против CD123. ScFv против CD123 клонировали в лентивирусные экспрессирующие CAR векторы с CD3-дзета-цепью и костимулирующей молекулой 4-1BB. Содержащие CAR плазмиды (таблица 1, приведенная в разделе "Подробное описание") амплифицировали посредством бактериальной трансформации в клетки STBL3 с последующим Maxiprep с использованием набора endotoxin-free Qiagen Plasmid Maki. Лентивирусный супернатант получали на клетках 293T стандартными способами.
Порядок, в котором домены VL и VH появляются в scFv изменялся (т.е. ориентация VL-VH или VH-VL), и где три или четыре копии субъединицы "G4S" (SEQ ID NO: 25), в которых каждая субъединица содержит последовательность GGGGS (SEQ ID NO: 25) (например, (G4S)3(SEQ ID NO: 28) или (G4S)4(SEQ ID NO: 27)), соединяют вариабельные домены с образованием полной структуры scFV-домен, как продемонстрировано в таблице 2 (предоставленной в разделе "Подробное описание").
Последовательности конструкций CAR и их последовательности доменов проиллюстрированы в разделе "Подробное описание". Анализ конструкций CAR человека проводили, как описано, например, в примерах 2, 3 и 6.
Пример 2: Анализ и активность in vitro CART, несущих scFv человека
Конструкции CAR против CD123 человека оценивали на активность с использованием линии клеток Jurkat, содержащих репортерный ген люциферазы под контролем промотора NFAT (называемых клетки JNL). Активность CD123 CAR измеряли для четырех конструкций CAR человека, описываемых в настоящем описании (CD123 CAR1-4), и конструкций CD123 CAR мыши 1172 и 1176. Аминокислотная последовательность для конструкций 1172 и 1176 приведена ниже и дополнительно описана и охарактеризована в PCT/US2014/017328.
Конструкция 1172: CD123 4-1BBCD3z-CAR (аминокислотная последовательность) (SEQ ID NO: 707)
MALPVTALLLPLALLLHAARPGSDIVLTQSPASLAVSLGQRATISCRASESVDNYGNTFMHWYQQKPGQPPKLLIYRASNLESGIPARFSGSGSRTDFTLTINPVEADDVATYYCQQSNEDPPTFGAGTKLELKGGGGSGGGGSSGGGSQIQLVQSGPELKKPGETVKISCKASGYIFTNYGMNWVKQAPGKSFKWMGWINTYTGESTYSADFKGRFAFSLETSASTAYLHINDLKNEDTATYFCARSGGYDPMDYWGQGTSVTVSSASSGTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
Конструкция 1176: CD123 4-1BBCD3z-CAR (26292) (аминокислотная последовательность) (SEQ ID NO: 708)
MALPVTALLLPLALLLHAARPGSDVQITQSPSYLAASPGETITINCRASKSISKDLAWYQEKPGKTNKLLIYSGSTLQSGIPSRFSGSGSGTDFTLTISSLEPEDFAMYYCQQHNKYPYTFGGGTKLEIKGGGGSGGGGSSGGGSQVQLQQPGAELVRPGASVKLSCKASGYTFTSYWMNWVKQRPDQGLEWIGRIDPYDSETHYNQKFKDKAILTVDKSSSTAYMQLSSLTSEDSAVYYCARGNWDDYWGQGTTLTVSSASSGTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
Активность CAR измеряли как активацию такого репортерного гена под контролем NFAT. К клеткам JNL добавляли лентивирусные супернатанты, содержащие конструкции CART, для трансдукции. Через 4-6 суток после трансдукции клетки JNL оценивали на экспрессию CAR посредством FACS, как описано ниже, или смешивали с мишень-положительной (MOLM3, клетки K562, сконструированные с возможностью экспрессии CD123 (CD123-K562)) или мишень-отрицательной (K562) линиями клеток в отношении эффектор (JNL) к линии клеток-мишеней (E:T) 3:1 для индукции активации (фигура 1). Через 20 часов совместной инкубации измеряли сигнал люциферазы с использованием анализ люциферазы Bright-Glo™ на устройстве EnVision, как продемонстрировано на фигуре 2.
Оптимальные конструкции CAR против CD123 выбирали на основании количества и качества ответов эффекторных T-клеток трансдуцированных CD123 CAR T-клеток ("CART-CD123" или "CART-CD123 T-клеток") в ответ на мишени, экспрессирующие CD123 ("CD123+"). Ответы эффекторных T-клеток включают, но не ограничиваются ими, размножение, пролиферацию, удвоение клеток, продукцию цитокинов и цитолиз клетки-мишени или цитолитическую активность (дегрануляцию).
Получение CART-CD123
Для получения геномного материала, упакованного в псевдотипированные лентивирусные частицы VSVg использовали кодирующие scFv человека лентивирусные векторы для переноса. Лентивирусный вектор для переноса ДНК смешивали с тремя пакующими компонентами VSVg, gag/pol и rev в комбинации с реагентом липофектамин для их совместной трансфекции в клетки Lenti-X 293T (Clontech).
Через 30 часов среду собирали, фильтровали и хранили при -80C. Терапевтические CART-CD123 получали, начиная с крови от нормального донора прошедшего аферез, от которого наивные T-клетки получали отрицательной селекцией на T-клетки, CD4+ и CD8+ лимфоциты. Эти клетки активировали гранулами CD3×28 (Dynabeads® Human T-Expander CD3/CD28, Invitrogen) в отношении 1:3 в RPMI 1640, 10% инактивированной нагреванием эмбриональной телячьей сыворотки (FCS), 2 мМ L-глутамина, 1× пенициллина/стрептомицина, 100 мкМ заменимых аминокислот, 1 мМ пирувата Na, 10 мМ Hepes и 55 мкМ 2-меркаптоэтанола при 37°C, 5% CO2. T-клетки культивировали как 1×106 T-клеток в 0,5 мл среды на лунку 24-луночного планшета. Через 24 часа T-клетки образовывали бласты, и добавляли 0,5 мл содержащего вирус супернатанта. Затем T-клетки начинали делиться по модели логарифмического роста, за которым проводили мониторинг путем измерения количества клеток на мл, и разбавляли T-клетки в свежей среде каждые двое суток. По мере того как T-клетки начинали переходить в состояние покоя приблизительно через 10 суток, логарифмический рост замедлялся. Сочетание замедления скорости роста и приближение размера T-клеток к ~300 фл определяло состояние T-клеток, подходящее для криоконсервации для дальнейшего анализа.
Перед криоконсервацией определяли процентное содержание трансдуцированных клеток (экспрессирующих CAR к CD123 на клеточной поверхности) и их относительную интенсивность флуоресценции экспрессии проточным цитометрическим анализом на устройстве BD LSRFortessa или BD-FACSCanto с использованием белка L в качестве реагента для детекции. Графики гистограмм установки дискриминационного окна интенсивности относительной флуоресценции из этого FACS для указанного выше сигнала некрашеных клеток демонстрировали процентное содержание трансдуцированных T-клеток. Трансдукция приводила к диапазону CART-положительных клеток от 12-42%, как продемонстрировано на фигуре 2.
Оценка цитолитической активности CART-CD123 перенаправленных T-клеток.
Для оценки функциональных свойств CART-CD123 T-клеток по уничтожению экспрессирующих мишень клеток клетки размораживали и оставляли восстанавливаться в течение ночи.
Вызываемый T-клетками цитолиз был направлен на экспрессирующие CD123 линии клеток острого миелогенного лейкоза MOLM13, стабильно экспрессирующие люциферазу. Для определения неспецифических фоновых уровней цитолиза использовали нетрансдуцированные T-клетки. Цитолитическую активность CART-CD123 измеряли как титрование отношений эффектор:клетка-мишень 4:1 и 2-кратное разведение T-клеток, где эффекторы определяли как T-клетки, экспрессирующие химерный рецептор против CD123. Анализы начинали смешиванием подходящего числа T-клеток с постоянным числом клеток-мишеней. Через 20 часов сигнал люциферазы измеряли с использованием анализа люциферазы Bright-Glo™ на устройстве EnVision. Вследствие того, что соотношение экспрессирующих CD123-CART клеток к нетрансфицированным T-клеткам увеличивалось, аналогично увеличивался цитолиз CD123 клеток. Данные, приведенные в настоящем описании, позволяют предположить, что такие клетки, экспрессирующие CD123, разрушаются только экспрессирующими CD123-CART клетками и не разрушаются нетрансдуцированными T-клетками. Фигура 3.
Продукция цитокинов
Для измерения продукции цитокинов CD123 CART клетками клетки, экспрессирующие CD123-2, CD123-3 или CD123-4 размораживали и оставляли восстанавливаться ночи. T-клетки, экспрессирующие изотипический контроль (обозначаемый как "изотип"), использовали в качестве неспецифического контроля для фоновых эффектов T-клеток. T-клетки были направлены к клеткам MOLM13, PL21 или U87 (обозначаемым как клетки-мишени). В анализе проверяли отношение эффектор:мишень 1,25:1 или 20:1, как указано, где эффекторы определяли как T-клетки, экспрессирующие CD123 CAR. Анализ проводили 24 часа после смешивания клеток, где среду удаляли для анализа цитокинов IL-2 (фиг. 24A), IFN-гамма (фиг. 24B) и TNF-альфа (фиг. 24C) с использованием набора CBA-Flex для детекции цитокинов человека. Когда экспрессирующие CD123 CAR T-клетки культивировали со злокачественными клетками, экспрессирующими CD123, все CD123-CART продуцировали цитокины в ответ на экспрессирующие мишень клетки.
Пример 3: CART123 в AML
Трансдукция T-клеток
Для дальнейшего исследования выбирали клоны NVS 2 (экспрессирующий CAR123-2), NVS 3 (экспрессирующий CAR123-3), NVS 4 (экспрессирующий CAR123-4) антитела человека против CD123 человека. Все эти клоны перекрестно реагировали с CD123 яванского макака. Их активность сравнивали с клонами мыши 1172 и 1176, содержащими домены VH и VL в ориентации легкая цепь-тяжелая цепь с шарнирным доменом CD8, трансмембранным доменом CD8 и костимулирующим доменом 41BB. 1176 также дает перекрестную реакцию с CD123 яванского макака. 1172 не дает перекрестной реакции.
Плазмиды трансформировали в компетентные клетки, растили в бульоне 500cc, выделяли посредством Maxiprep и трансдуцировали стандартными способами в клетки 293T. Лентивирусный супернатант собирали через 24 и 48 часов, концентрировали с использованием ультрацентрифугирования и замораживали.
Лентивирус титровали на клетках SupT1 и определяли подходящее количество вируса для трансдукции первичных T-клеток с MOI 3. Первичные нормальные донорные CD4+CD8 клетки стимулировали с использованием гранул с антителами против CD3/CD28 (Dynal, Invitrogen) и интерлейкина 2 100 Ед/мл в течение 6 суток с последующим отмыванием гранул и замораживали один раз. Клеточный объем T-клеток уменьшался до <300 фл (после приблизительно 10-12 суток).
Эффективность трансдукции T-клеток фактически составляла 100% для всех клонов (фиг. 5A и 5B). Отношения CD4:CD8 составляли приблизительно 1:1 в клонах NVS и 3:2 в клонах 1172 и 1176 (фиг. 6).
Дегрануляция
Для оценки дегрануляции CART-клетки (клоны NVS 2-4, 1172 и 1176) размораживали, уравновешивали в течение ночи в концентрации 2e6 клеток/мл в среде для T-клеток. Затем клетки подсчитывали и ресуспендировали в 1e6 клеток/мл на следующие сутки. Опухолевые клетки-мишени (TCM, PMA/iono, MOLM14 или JURKAT) ресуспендировали в 5e6 клеток/мл. Клетки высевали в отношении 1e5 T-клетка:5e5 опухолевая клетка в 48-луночные планшеты и инкубировали в течение 2 часов в присутствии антитела против CD107a PECy7, очищенного антитела против CD49d и очищенного антитела против CD28. Затем клетки собирали, окрашивали антителом против CD3 APC и регистрировали с использованием BD LSR Fortessa (фиг. 7).
Дегрануляция T-клеток указана в верхнем правом квадранте каждого графика фигуры 7. Результаты, представленные в настоящем описании, демонстрируют аналогичное распознавание T-клетки мишеней CD123+, что проявляется аналогичной дегрануляцией во время анализа in vitro продолжительностью 2 часа. C1176 имели менее выраженную дегрануляцию порядка 65% по сравнению приблизительно с 80% в других клонах.
Цитотоксичность
Для оценки цитотоксичности CART-клетки (клоны NVS 2-4, 1172 и 1176) размораживали и уравновешивали в течение ночи при 2e6 клеток/мл в среде для T-клеток. Клетки подсчитывали и ресуспендировали при 1e6 клеток/мл на следующие сутки. Опухолевые клетки-мишени (MOLM14) ресуспендировали при 1e6 клеток/мл. Клетки высевали в черный плоскодонный 96-луночный планшет в снижающихся отношениях E:T, как указано (фиг. 8), в двух повторениях. Через 20 часов инкубации добавляли люциферин и визуализировали планшет для определения потока фотонов в качестве измерения оставшихся живых клеток. Цитолиз клеток MOLM14 являлся равным для всех клонов при большей части отношений эффектор:мишень через 20 часов.
Модель in vivo на мышах
Мышам NSG инъецировали в/в 1e6 клеток MOLM14, экспрессирующих люциферазу, на С0. На С6 проводили визуализацию опухолевой нагрузки у мышей (IVIS Spectrum) и распределяли мышей случайным образом на группы обработки. Мышей с наиболее низкой опухолевой нагрузкой распределяли в группу контроля (нетрансдуцированные T-клетки, UTD). CART-клетки (клоны NVS 2-4, 1172 и 1176) или контрольные T-клетки (1e6) инъецировали в/в на С7. Данные визуализации, проводимой на С13, представлены на фигуре 9. Через шесть суток после инъекции все конструкции против CD123 обеспечивали равный противоопухолевый эффект, соответствующий с данными in vitro.
Пример 4: Гуманизированные конструкции CAR
Получали гуманизированные одноцепочечные вариабельные фрагменты (scFv) против CD123 на основе 1176 мыши, который дают перекрестную реакцию с CD123 яванского макака, и клонировали в лентивирусный экспрессирующий вектор с внутриклеточной CD3-дзета-цепью и внутриклеточным костимулирующим доменом 4-1BB, и присваивали названия, описанные в таблице 5 (приведенной в разделе "Подробное описание").
Порядок, в котором появляются домены VL и VH в scFv, изменяется (т.е. ориентация VL-VH или VH-VL), и где три или четыре копии субъединицы "G4S" (SEQ ID NO: 25), в которой каждая субъединица содержит последовательность GGGGS (SEQ ID NO: 25) (например, (G4S)3(SEQ ID NO: 28) или (G4S)4(SEQ ID NO: 27)), соединяют вариабельные домены с образованием структурной единицы scFV-домен, как продемонстрировано в таблице 6 (предоставленной в разделе "Подробное описание").
Последовательности гуманизированных фрагментов scFv CAR (SEQ ID NO: 184-215) приведены в настоящем описании в таблице 6. Все эти клоны содержали изменение остатка Q/K в сигнальном домене костимулирующего домена, получаемого из CD3-дзета-цепи. Затем клонировали фрагменты scFv CAR в лентивирусные векторы с получением полноразмерной конструкции CAR в одной кодирующей рамке и использовали промотор EF1-альфа для экспрессии (SEQ ID NO: 11).
Пример 5: CART123 при лимфоме Ходжкина
Известно, что CD123 экспрессируется приблизительно в 50% случаях классической лимфомы Ходжкина (HL), как определяют проточной цитометрией. Известно, что экзогенное введение IL3 в культуры линии клеток лимфомы Ходжкина способствует росту и способно частично спасать клетки от апоптоза путем депривации сыворотки. Известно, что ингибирование CD123 (IL-3Ra) SL-401 снижает жизнеспособность CD123++ линий клеток HL (HDLM-2, L428).
У 8 пациентов с HL проводили анализ экспрессии CD123 иммуногистохимией. Как продемонстрировано в таблице 15 для 4/8 образцов выявляли положительный результат в клетках Рид-Штернберга и/или в микроокружении иммунной клетки.
Таблица 15: Экспрессия мишеней IHC в 8 образцах HL
|
Проточной цитометрией демонстрировали экспрессию CD30 и CD123 в хорошо известной линии клеток лимфомы Ходжкина HDLM-2 (фиг. 10). Маркеры B-клеток CD19 и CD20 отсутствовали.
В экспериментах ниже используют плазмидную ДНК pELNS anti-CD123-41BB-CD3ζ (CAR123) с ориентациями легкая цепь-тяжелая цепь или тяжелая цепь-легкая цепь scFv мыши против CD123 человека. T-клетки получали от нормальных доноров (ND052, Human Immunology Core), размножали с использованием магнитных гранул CD3/CD28 (Invitrogen) и трансдуцировали на сутки 2 лентивирусом с CAR123. На сутки 6 детектировали CD123 посредством детекции dsRed, суррогатного маркера CD123 в результате коэкспрессии T2A. dsRed детектировали проточной цитометрией (фиг. 11A-B).
Затем проводили количественную ПЦР на экспрессию CD123 в 4 линиях клеток лимфома Ходжкина (HDLM2, KMH2, L428, SUPHD1), CD123+ MOLM14 (положительный контроль) и A375 (отрицательный контроль). CD123 экспрессировался во всех линиях клеток лимфома Ходжкина (фиг. 12). GUSB использовали в качестве гена домашнего хозяйства. Порог Ct составлял 40.
Роль IL-3 в стимуляции роста клеток HL
Вследствие того, что CD123 представляет собой α-цепь рецептора IL3, и IL-3 играет важные роли в росте и дифференцировке гемопоэтических клеток, исследовали, является ли сигнальный каскад IL3 важным для роста линий клеток лимфомы Ходжкина. Мышам с KO NOD-SCID-γ-цепь, у которых экспрессируются на повышенном уровне цитокины человека, включая IL-3, (мыши NSG-S) пересаживали линию клеток HDLM-2, экспрессирующих люциферазу. После в/в инъекции неопластические клетки прогрессирующе формировали рассеянные массы мягких тканей. Серийные инъекции нейтрализующего антитела против IL3 замедляли рост опухоли. Результаты, представленные в настоящем описании, позволяют предположить, что CD123 может являться особенно подходящей мишенью при лимфоме Ходжкина. Опухолевая нагрузка продемонстрирована BLI (фиг. 13).
Анализ дегрануляции CD107a
Нетрансдуцированные T-клетки (UTD) или CART123 инкубировали с HDLM-2 (линия клеток HL CD123+) в течение 4 часов в отношении 5 клеток-мишеней к 1 T-клетки в присутствии антитела против CD28, антитела против CD49d и монензина. В качестве дополнительных контролей использовали T-клетки с CAR против CD30.
Для CART123, но не для UTD демонстрировали повышенную дегрануляцию CD107a, как детектировали проточной цитометрией (фиг. 14 и 15). Кроме того для CART123 демонстрировало значительное повышение внутрицитоплазматической продукции цитокинов (IL-2, TNF) (фиг. 16).
CART123 вызывает цитолиз клеток HDLM-2
Проводили анализ цитолиз на основе люциферазы в течение 24 часов. T-клетки инкубировали совместно с люцифераза+клетками HDML-2 в различных отношениях (0,3:1-10:1). Для CART123, но не для UTD демонстрировали дозозависимый цитолиз, как продемонстрировано уменьшением испускания биолюминесценции. Следует отметить, что для специфических к CD30 CAR T-клеток демонстрировало минимальную активность (фиг. 17).
CART123 пролиферируют в присутствии линий клеток HL
T-клетки инкубировали с линиями клеток HL (CD123+) или контролями (Jurkat CD123-, MOLM-14 CD123+) или PMA/иономицином (положительный контроль), или средой для культивирования клеток (отрицательный контроль) в анализе пролиферации T-клеток продолжительностью 5 суток. Для CART123 и CART30 клеток, но не для UTD, демонстрировали устойчивую пролиферацию при совместном культивировании с линиями клеток HL (фиг. 18).
Через 72 часа собирали супернатант после анализа пролиферации и анализировали присутствие 30 цитокинов посредством анализа Luminex. Для CART123 демонстрировало устойчивую продукцию многих цитокинов (MFI люминекс IFNg, IL-2, TNFa и MIP1b представлены на фигурах 19A-19D, соответственно).
Эффективность in vivo CART123 против линии клеток лимфомы Ходжкина (HDLM-2)
Для подтверждения данных in vitro, представленных в настоящем описании, разрабатывали модель in vivo. 1 миллион люцифераза+клеток HDLM-2 инъецировали в/в на сутки 0. Затем для наблюдения уровня опухоли проводили серийную биолюминесцентную визуализацию (BLI) (фиг. 20). Низкий уровень опухоли наблюдали на сутки 7, который сопровождался постепенным увеличением опухолевой нагрузки в течение приблизительно 6 недель, воспроизводя медленно растущий характер заболевания человека. На сутки 43, когда опухолевая нагрузка являлась в 20 раз выше по сравнению с фоновым уровнем, мышей обрабатывали 1,5 миллионами клеток CART123 или контрольными T-клетками.
CART123 индуцировал полную и длительную эрадикацию диссеминированной опухоли в течение 14 суток, что приводило к 100% выживаемости без рецидива и 100% общей выживаемости через 6 месяцев (фиг. 21 и 22).
Устранение опухоли было ассоциировано с активным размножением CAR T-клеток, как детектируют проточной цитометрией в серийных образцах периферической крови (фиг. 23). Размноженные T-клетки составляли приблизительно 50% CD8 и 50% CD4 клеток. Число T-клеток снижалось со временем по мере снижения опухолевой нагрузки.
Пример 6: Дополнительная характеристика CD123-2 CAR
Проводили дополнительные анализы in vitro для оценки первичных T-клеток, которые трансдуцировали лентивирусом для экспрессии конструкции CAR123-2 (также обозначаемый в настоящем описании как LV CAR123-2). Экспрессирующие CAR T-клетки (LV CAR123-2) сравнивали с T-клетками, экспрессирующими scFv против гликопротеина H (gH) цитомегаловируса (hCMV) (обозначаемый в настоящем описании как против GH), который действовал в качестве отрицательного контроля. Ключевые анализы in vitro включали анализы продукции цитокинов, пролиферации и цитолиза клеток. Анализы пролиферация проводили путем инкубации T-клеток (LV CAR123-2 или anti-GH) с экспрессирующей CD123 (антиген+) линией клеток, например, MOLM13 или K562, экспрессирующих CD123 человека, или CD123-отрицательными (антиген-) контрольными линиями клеток, например, K562. T-клетки выращивали в течение 4 суток. Как продемонстрировано на фигуре 25, для экспрессирующих CAR клеток, демонстрировали устойчивую пролиферацию по сравнению с отрицательным контролем при культивировании в присутствии экспрессирующих CD123 клеток.
Способность экспрессирующих CAR123-2 T-клеток вызывать цитолиз клеток-мишеней измеряли как титрование отношений мишень:эффекторная клетка в диапазоне от 1:20 и двух-кратных разведений 1:0,3125. Тестируемые клетки-мишени представляли собой экспрессирующие CD123 линии клеток MOLM13, которые стабильно экспрессируют люциферазу, клетки PL21, которые стабильно экспрессируют люциферазу и клетки U87, которые стабильно экспрессируют люциферазу. Как представлено на фигурах 26A и 26B, для экспрессирующих CD123-CAR клеток демонстрируют направленный цитолиз экспрессирующих CD123 злокачественных клеток (MOLM13 и PL21), тогда как для отрицательного контроля (клетки, экспрессирующие anti-GH) и нетрансдуцированных клеток (UTD) не демонстрируют направленный цитолиз. На фигуре 26C для UTD, отрицательного контроля (anti-GH) и экспрессирующих CAR CD123 клеток не демонстрируют специфический цитолиз клеток U87 (которые не экспрессируют CD123).
Анализ продукции цитокинов проводили, анализируя супернатант из совместных культур, содержащих T-клетки (экспрессирующие CAR123-2 или anti-GH), с антиген-положительными (MOLM13) или антиген-отрицательными (U87) клетками. Для CD123-CAR T-клетки демонстрировали устойчивую продукцию цитокинов IFN-гамма (фиг. 27A) и IL-2 (фиг. 27B).
Пример 7: Комбинация T-клеток с CAR против CD123 и против D19 для лечения и профилактики рецидива с потерей антигена
Хеморезистентный или рецидивирующий (r/r) B-клеточный острый лимфобластный лейкоз (B-ALL) ассоциирован с неблагоприятным прогнозом, но как продемонстрировали недавно, остается очень чувствительным к иммунной системе. В частности, T-клетки с химерным антигенным рецептором против CD19 (CART19, CTL019) и биспецифические антитела против CD19/CD3 (блинатумомаб) приводят к беспрецедентным частотам полного ответа 45-90% в данной популяции пациентов. Оба подхода перенаправляют аутологичные T-клетки распознавать экспрессирующие CD19 клетки. Для блинатумомаба используют непрерывную длительную инфузию биспецифической конструкции, которая объединяет одноцепочечный вариабельный фрагмент (scFv) против CD19 с scFv против CD3; в случае CART19 T-клетки являются генетически модифицированными для экспрессии scFv против CD19, слитого с T-клеточным рецептором, участвующим в передаче сигнала со встроенными костимулирующими доменами. Недавние исследования продемонстрировали, что 90% пациентов с r/r B-ALL, получавшие лечение CTL019, достигали полной ремиссии (CR) с общей выживаемостью (OS) 78% через 6 месяцев. Обнадеживающие результаты с CART19 также получали у пациентов с другими B-клеточными неоплазиями, такими как хронический лимфоцитарный лейкоз и неходжкинская лимфома.
Однако рецидив развивается в популяции пациентов, получавших лечение CART19 или блинатумомабом, и значительная часть таких рецидивов характеризуется утратой CD19. При B-ALL CD19-отрицательные рецидивы описывали у 10-20% пациентов после терапии CART19 или терапии блинатумомабом и не описано при установке других видов лечения; всего приблизительно 30% рецидивов после блинатумомаба и до 50% после CART19 являются CD19-отрицательными. CD19 представляет собой классический B-клеточный маркер, который экспрессируется с самых ранних стадий развития B-клетки до зрелой B-клетки. CD19 играет важную роль в биологии B-клетки, т.к. B-клетки с дефицитом CD19 характеризуются селективной недостаточностью роста. Таким образом, отсутствие CD19 является очень необычным открытием при B-ALL, и оно было опубликовано только у редких пациентов до эпохи эффективных видов направленной на CD19 иммунотерапии. В настоящее время исследуется возможный механизм потери антигена, и, вероятнее всего, он обусловлен селективным давлением на лейкозные субклоны такими мощными средствами против CD19. Вследствие недавнего одобрения FDA блинатумомаба и инновационного статуса согласно CTL019, вероятнее всего, что возрастающее число пациентов с r/r B-ALL будет получать лечение этими средствами. Таким образом, необходимыми являются новые эффективные стратегии для возможности лечить таких пациентов, у которых появляются рецидивы с CD19-отрицательными бластами после CART19 или блинатумомаба. В идеале новый подход будет обеспечивать лечение не только пациентов с активным рецидивом с потерей антигена, но и в случае его предварительного применения может потенциально предотвращать их возникновение.
Рецептор альфа интерлейкина 3 (или CD123) участвует в гемопоэзе, и известно, что он экспрессируется несколькими гематологическими неоплазиями, включая острый миелолейкоз (AML), острый лимфоидный лейкоз (ALL), неоплазию из плазмоцитоидных дендритных клеток, волосатоклеточный лейкоз и лимфому Ходжкина. В отличие от поверхностных антигенов линии дифференцировки, таких как CD33 (миелоидный) или CD19 (B-лимфоидный), CD123 иерархически экспрессируется гемопоэтическими клетками-предшественниками, и при AML CD123 экспрессируется лейкозными стволовыми клетками, которые вовлечены в резистентность к химиотерапии и рецидив после первичного лечения. Благодаря этим характеристикам CD123 вызвал большой интерес для направленной терапии, и разрабатываются многие средства, такие как слитый белок IL3-дифтерийный токсин (SL-401, DT388IL3), голые моноклональные антитела против CD123 (CSL-360, CSL-362), конъюгаты антитело-лекарственное средство, биспецифические антитела или слитые конструкции CD3Fv-IL3 и в последнее время T-клетки с химерным антигенным рецептором против CD123. Некоторые из этих подходов в настоящее время проходят проверку в клинических испытаниях, и многие другие будут тестировать в клинике в следующие несколько лет. Направленное воздействие на CD123 T-клетками с химерным антигенным рецептором (CART123) может приводить к глубоким и длительным ответам в ксенотрансплантатах первичного AML человека и может устанавливать T-клетки памяти против лейкоза. В этом случае, CD123 экспрессируется при CD19-отрицательных рецидивах B-ALL, возникающих после направленных на CD19 видов терапии, и такие CAR-123 T-клетки, объединенные с CART19 (CTL019), являются эффективной терапией для лечения и профилактики рецидивов с потерей антигена в ксенотрансплантатах B-ALL.
Материала и способы
Линии клеток и первичные образцы. Линии клеток исходно получали от ATCC (Manassas, VA) (K-562) или DSMZ (Braunschweig, Germany) (MOLM-14 и NALM-6). Все линии клеток тестировали на наличие загрязнения микоплазмой (наблр MycoAlert™ Mycoplasma Detection, LT07-318, Lonza, Basel, Switzerland). Для этих же экспериментов линии клеток трансдуцировали люциферазой светляков/eGFP, а затем сортировали с получением >99% положительной популяции. Положительную по люциферазе линию клеток K-562 также трансдуцировали усеченным CD19 или усеченным CD123 с получением линий клеток, экспрессирующих не expressing ни один из них, только CD19 или только CD123. MOLM-14 и K562 использовали в качестве контролей, как указано на соответствующих фигурах. Линии клеток поддерживали в культуре со средой RPMI 1640 (Gibco, 11875-085, LifeTechnologies, Grand Island, NY), дополненной 10% эмбриональной телячьей сывороткой (FBS, Gemini, 100-106, West Sacramento, CA) и 50 МЕд./мл пенициллина/стрептомицина (Gibco, LifeTechnologies, 15070-063). Повторно идентифицированные образцы костного мозга (BM) первичного ALL человека и периферической крови (PB) получали в результате клинической практики Пенсильванского университета (University of Pennsylvania)/детской больницы Филадельфии (Children's Hospital of Philadelphia) в соответствии с протоколом Institutional Review Board (IRB), приобретали от Стволов клетки и Ксенотрансплантат Core of the University of Pennsylvania или из исследуемых образцов текущих клинических испытаний CTL019 (Translation and Correlative Study Laboratory, University of Pennsylvania). Для всех функциональных исследований первичные клетки размораживали по меньшей мере 12 часов перед экспериментом и уравновешивали при 37°C.
Размножение in vivo первичных бластов B-ALL. Способы, описанные у D.M. Barrett, A.E. Seif, C. Carpenito, D.T. Teachey, J.D. Fish, C. H. June, S. A. Grupp, G. S. Reid, Noninvasive bioluminescent imaging of primary patient acute lymphoblastic leukemia: a strategy for preclinical modeling. Blood 118, e112-117 (2011).
Флуоресцентная гибридизация (FISH) in situ и иммуногистохимия. Анализ FISH и иммуногистохимию проводили стандартным способом и как описано. A comparative analysis of FISH, RT-PCR, PCR, and immunohistochemistry for the diagnosis of mantle cell lymphomas. Modern pathology: an official journal of the United States and Canadian Academy of Pathology, Inc 15, 517-525 (2002)). Анализ FISH проводили стандартным способом. В кратком изложении, собранные клетки ALL суспендировали в фиксаторе (уксусной кислоте и метаноле), помещали на предметные стекла и оставляли высыхать. В гибридизационный буферный раствор вносили зонд, слитый с геном двойного окрашивания BCR/ABL (Abbott Molecular). Предметные стекла накрывали покровными стеклами, запечатывали и оставляли внутри камеры HYBrite при 37°C в течение 6 часов. После удаления герметизирующего вещества и покровных стекл предметные стекла дважды промывали, окрашивали, сушили и контрастно окрашивали DAPI. Предметные стекла анализировали под флуоресцентным микроскопом с не менее 200 ядрами, оцениваемыми в каждом образце.
Получение конструкций CAR и CAR T-клеток. Химерный антигенный рецептор против CD19 мыши (шарнир CD8, костимулирующий домен 4-1BB и сигнальный домен CD3-дзета) получали, как описано ранее. (Milone et al., Molecular therapy: the journal of the American Society of Gene Therapy, 17 1453-1464 (2009) и Imai et al., Leukemia 18, 676-684 (2004)). Это такая же конструкция, которую в настоящее время используют в клинических испытаниях CTL019 в Пенсильванском университета (University of Pennsylvania). Для CAR123 использовали scFv против CD123 (конструкция 1172 (SEQ ID NO: 707, и как описано в PCT/US2014/017328) и ту же конструкцию остова CAR19. Получение экспрессирующих CAR T-клеток проводили, как описано ранее. (Gill et al., Blood, 123, 2343-2354 (2014)). Нормальные донорные CD4 и CD8 T-клетки или мононуклеарные клетки PB (PBMC) получали от департамента Human Immunology Core Пенсильванского университета. T-клетки высевали в плотности 1×106/мл в отношении CD4:CD8 1:1 и размножали в среде X-vivo 15 (Lonza, 04-418Q), дополненной сывороткой AB человека 5% (Gemini, 100-512), пенициллином/стрептомицином (Gibco, 15070063) и Glutamax (Gibco, 35050061), с использованием Dynabead против CD3/CD28 (Life Technologies, 11161D), добавляемых на сутки 1 культивирования и удаляемых на сутки 6. T-клетки трансдуцировали лентивирусом на сутки 2. T-клетки размножали в культуре в течение 8-15 суток, а затем собирали, когда средний объем клетки составлял менее 300 фл. Затем T-клетки криоконсервировали в FBS с 10% DMSO для дальнейших экспериментов. Перед всеми экспериментами T-клетки размораживали и уравновешивали в течение ночи при 37°C.
Многопараметрическая проточная цитометрия. Проточную цитометрию проводили, как описано ранее (Kenderian et al., Leukemia, (2015)). Антитела против антител человека приобретали от Biolegend, eBioscience или Becton Dickinson. Клетки выделяли из культур in vitro или у животных, однократно промывали в PBS, дополненной 2% эмбриональной телячьей сывороткой и окрашивали в течение 15 минут при комнатной температуре. Для количественного определения клеток использовали гранулы Countbright (Invitrogen) по инструкциям производителя. Во всех анализах для представляющей интерес популяции устанавливали дискриминационное окно на основании характеристик прямого светорассеяния в сравнении с боковым светорассеянием с последующей установкой дискриминационного окна по синглету, и дискриминационное окно для живых клеток устанавливали с использованием Live Dead Fixable Aqua (Invitrogen). Для контроля качества включали время установки дискриминационного окна. Экспрессию на поверхности CAR19 детектировали, как описано ранее, с использованием антиидиотипического антитела. Детекцию CAR123 проводили с использованием антитела козы против антитела мыши (Jackson Laboratories) или CD123-Fc/His (Sino Biologicals) и anti-His-APC (R&D) или PE (AbCam). Проточную цитометрию проводили на цитометре Fortessa-LSR II с четырьмя лазерами (Becton-Dickinson) и анализировали FlowJo X 10.0.7r2 (Tree Star).
Анализы in vitro эффекторных функций T-клеток. Измерение дегрануляции, пролиферации CFSE, анализы цитотоксичности и изменения цитокинов проводили так, как описано ранее. (Gill et al., Blood, 123, 2343-2354 (2014) и Kalos et al., Science translational medicine, 3, 95ra73 (2011)).
Анализ дегрануляции. В кратком изложении T-клетки инкубировали с клетками-мишенями в отношении 1:5 в среде для T-клеток. К каждой совместной культуре добавляли антитела против CD107a-PECY7 (Biolegend), против CD28 (BD Biosciences), против CD49d (BD Biosciences) и монензин (BD Biosciences). Через 4 часа клетки собирали и окрашивали на экспрессию CAR, CD3, CD8 и приводили окрашивание Live Dead aqua (Invitrogen). Клетки фиксировали и пермеабилизировали (буферы Invitrogen Fix/Perm), а затем проводили внутриклеточное окрашивание для детекции нескольких цитокинов (IFN, TNFα, IL-2, GM-CSF, MIP1β).
Анализ пролиферации. T-клетки промывали и ресуспендировали при 1×107/мл в 100 мкл PBS и окрашивали 100 мкл CFSE 2,5 мкМ (Invitrogen) в течение 5 минут при 37°C. Затем гасили реакцию холодной средой и промывали клетки три раза. Мишени облучали в дозе 100 Гр. T-клетки инкубировали в отношение 1:1 с облученными клетками-мишенями в течение 120 часов с добавлением среды через 24 часа. Затем клетки собирали, окрашивали на CD3, CAR и Live Dead aqua (Invitrogen) и перед анализом проточной цитометрии добавляли гранулы Countbright (Invitrogen) для определения абсолютного количества.
Анализы цитотоксичности. Для анализа цитотоксичности, как описано ранее, использовали люцифераза/eGFP+ линии клеток. В кратком изложении, мишени инкубировали в указанных отношениях с эффекторными T-клетками в течение 24 часов. Цитолиз рассчитывали посредством биолюминесцентной визуализации в спектральной камере Xenogen IVIS-200.
Измерения цитокинов. Эффекторные клетки и клетки-мишени инкубировали совместно в отношении 1:1 в среде для T-клеток в течение 24 часов. Супернатант собирали и анализировали посредством панели 30-plex Luminex (Luminex Corp, FLEXMAP 3D) по протоколу производителя (Invitrogen).
Эксперименты на животных. Эксперименты in vivo проводили так, как описано ранее. (Kenderian et al., Leukemia, (2015)). Схемы используемых моделей ксенотрансплантатов подробно описаны на соответствующих фигурах, в результатах. NOD-SCID-γ-цепь -/- (NSG), первоначально получаемые Jackson Laboratories, приобретали в департаменте Stem Cell and Xenograft Core Пенсильванского университета. Все эксперименты проводили в соответствии с протоколом (№803230), одобренным Институциональным комитетом по содержанию и использованию животных (IACUC), в котором соблюдается Руководство по содержанию и использованию лабораторных животных NIH. Клетки (линии лейкозных клеток или T-клетки) инъецировали в 200 мкл PBS в указанной концентрации в хвостовые вены мышей. Биолюминесцентную визуализацию проводили с использованием спектральной камеры Xenogen IVIS-200 и анализировали с использованием программного обеспечения LivingImage v. 4.3.1 (Caliper LifeSciencies). Животных подвергали эвтаназии в конце эксперимента, или когда они соответствовали заранее определенным конечным точкам в соответствии с протоколами IACUC.
Многофотонная микроскопия. Мышей анестезировали и поддерживали при температуре тела 37°C. Проводили визуализацию костного мозга после удаления кожи головы и иммобилизации черепа. Визуализацию проводили с использованием системы для 2-фотонной микроскопии Leica SP5 (Leica Microsystems), оборудованной пикосекундным лазером (Coherent). Каждая регистрация изображения длилась 20 минут с последующей оценкой седатации мыши. CellTrace Violet, GFP и CellTrace Orange (или TRITC) возбуждали с использованием лазерного света 850 нм. Изображения получали с использованием 20× линзы с водным погружением. Получаемые изображения анализировали с использованием программного обеспечения Volocity (PerkinElmer).
Статистический анализ. Все статистические анализы проводили так, как указано, с использованием GraphPad Prism 6 для Windows, версия 6.04 (La Jolla, CA). Для сравнения двух групп использовали t-критерий Стьюдента; в анализах, где сравнивали несколько групп, проводили однофакторный дисперсионный анализ (ANOVA) с поправкой Холма-Сида на множественные сравнения. Когда сравнивали несколько групп в несколько моментов времени/отношений, использовали t-критерий Стьюдента или ANOVA для каждого из моментов времени/отношений. Кривые выживаемости сравнивали с использованием логарифмического рангового критерия. На фигурах звездочки используют для обозначения p-значения (*=<0,05, **=<0,01, ***=<0,001, ****=<0,0001) и "нз" означает "незначимый" (p>0,05). Дополнительное подробное описание статистических анализов для каждого эксперимента приведено в подписях к фигурам.
РЕЗУЛЬТАТЫ
CD123 экспрессируются B-ALL, лейкозными стволовыми клетками и при CD19-отрицательных рецидивах
Для оценки экспрессии CD123 при B-клеточном остром лимфобластном лейкозе анализировали 42 образца от взрослых пациентов и пациентов детского возраста с ALL, включая 14 индивидуумов, включенных в текущие клинические испытания CTL019 авторов изобретения. Как продемонстрировано на фигуре 31A, 31B и 38A, CD123 экспрессируется на высоком уровне и равномерно на поверхности большинства бластов ALL, что делает его идеальным кандидатом для направленной терапии. Кроме того, также выявлено, что CD123 экспрессируется в предполагаемых лейкозных стволовых клетках (LSC), идентифицируемых как CD34+ CD38- (фигура 31C). У некоторых пациентов с B-ALL можно идентифицировать небольшие подпопуляции CD19-отрицательных бластов и эти клетки могут вносить вклад в рецидивы с потерей антигена, если они содержали клетки со злокачественным фенотипом. Для оценки наличия заболевания в CD19-отрицательных подпопуляциях CD19- CD123+ клетки из общей положительной B-ALL популяции с хромосомой Philadelphia сортировали (CD45dim, стратегия установки дискриминационного окна представлена на фигуре 38B). Выявлено, что эти клетки являлись клональными для транслокации BCR-ABL, хотя и при более низкой частоте, чем CD19+ бласты (фигура 31D). Это открытие указывает на то, что нацеливание только на CD19 в некоторых случаях приводит к рецидиву из субклональной популяции, получаемой из CD19-CD123+ клеток. Кроме того, это открытие позволяют предположить, что нацеливание на CD123 может приводить к более глубоким ответам в результате элиминации LSC и вероятно CD19-отрицательных лейкозных клонов.
Наконец, экспрессию CD123 также оценивали в образцах от пациентов с B-ALL с рецидивом после CTL019 с потерей CD19. Следует отметить, что в отличие от полной потери CD19 у большей части пациентов сохранялась экспрессии CD123 при рецидиве (фигуры 31E, 31F и 38C). Эти открытия указывают на то, что CD123 является идеальным маркером для направленного воздействия на CD19-отрицательные бласты ALL, возникающих после CART19 или блинатумомаба.
T-клетки с химерным антигенным рецептором против CD123 являются активными против B-ALL человека in vitro и in vivo
Получали T-клетки с химерным антигенным рецептором против CD123 (CART123) (37), которые трансдуцировали лентивирусом и размножали с магнитными гранулами против CD3/CD28. Активность in vitro и in vivo CART123 против B-клеточного острого лимфобластного лейкоза оценивали, как описано в настоящем описании.
Использовали линию клеток B-ALL NALM-6, которая является CD19++ и CD123+ (фигуры 32A и 39A), и образцы первичного B-ALL. Сравнение "голова к голове" in vitro между CART123 и CART19 выявляло аналогичные скорости дегрануляции CD107a, когда T-клетки культивировали совместно с NALM-6 или первичной ALL (фигура 32B). CART123 также являлись способными уничтожать клетки Nalm-6 с аналогичной эффективностью как CART19 зависимыми от дозы образом (фигура 32C). В более длительных экспериментах CART123 пролиферировали (фигуры 32D и 32E) и продуцировали многие цитокины (фигура 32F) при совместном культивировании с NALM-6 или первичным ALL в течение 3-5 суток. Эти результаты указывают на то, что CART123 обладает эквивалентной активностью в отношении CART-19 против многих мишеней B-ALL.
Для подтверждения этих данных на модели in vivo использовали модель первичного ALL. В этой модели первичные бласты, получаемые от пациентов с B-ALL, прививали мышам с нокаутом NOD-SCID-γ-цепи (NSG) и трансдуцировали репортерной конструкцией, содержащей eGFP и люциферазу щелкуна (GFP/Luc). Мышам NSG инъецировали в/в GFP/Luc+первичные бласты ALL (JH331, CD19+, CD123+, фенотип add) и после трансплантации мышей случайным образом распределяли для получения CART19, CART123 или контрольных нетрансдуцированных T-клеток (UTD). Мыши, которых обрабатывали контрольными T-клетками, быстро погибали от заболевания, тогда как для мышей, которых обрабатывали CART19 или CART123, демонстрировали эрадикацию опухоли и длительную выживаемость (фигуры 33A и 33B). CAR123 T-клетки в значительной степени размножались в периферической крови (PB) мышей по сравнению с контрольными T-клетки и экспрессировали высокие уровни CAR123 (фигура 33C). Противолейкозная активность CART123 являлась специфической и основанной на распознавании CD123 на поверхности бластов, так, когда авторы прививали мышам CD123- CD19+ лейкоз (AV576), только для CART19 демонстрируют противолейкозную активность, при этом CART123 не оказывал эффекта по сравнению с контролями UTD (фигуры 39B и 39C).
Для детекции возможной корреляции дозы CART123 и противоопухолевой активности разрабатывали модель in vivo на мышах, несущих высокую лейкозную нагрузку, (с использованием линии клеток NALM-6). В этой модели стандартные дозы CART123 (2 миллионов CAR+ клеток) не являлись способными устранять опухоль. Этим мышам инъецировали различные дозы CART123 (1,25, 2 и 5 миллиона CAR+ клеток) и наблюдали дозозависимую противолейкозную активность (фигура 39D).
CART123, но не CART19 являются высоко активными на новой доклинической модели рецидива с потерей антигена
Для тестирования новых стратегий для направленного воздействия на CD19-отрицательные рецидивы разрабатывали новую модель in vivo рецидива с потерей антигена. B-клеточные бласты, получаемые от пациента (CHP101), включенного в одно из клинических испытаний CTL019 авторов исследования, собирали на исходном уровне (до терапии CTL019), когда заболевание являлось CD19++ и CD123+, и во время рецидива после CTL019, когда у пациента развивалось CD19-отрицательное заболевание (все еще с экспрессией CD123, фигура 40A). Затем бласты размножали у мышей NSG и трансдуцировали зеленой люциферазой щелкуна (CBG) для исходного заболевания (CD19+) или красной люциферазой щелкуна (CBR) для рецидива (CD19-) (см. раздел "Способы селекции"). Следует отметить, что во время размножения in vivo бласты содержали маркеры идентичности B-клеток, отличных от CD19 (данные не показаны). В первом эксперименте мышам NSG прививали исходное заболевание CD19+ (CBG, зеленый) или CD19-отрицательный (CBR, красный) лейкоз. Обе группы случайным образом распределяли для получения CART19 или контрольных T-клеток (UTD) (фигура 34A). Как продемонстрировано на фигуре 34B, в обеих группах для мышей, которых обрабатывали UTD, демонстрировали быстрое прогрессирование исходного и рецидивирующего заболевания независимо по экспрессии CD19. В противоположность этому, в группе мышей, которых обрабатывали CART19, только мыши, которым прививали исходное заболевание (CD19-положительное), реагировали на обработку CART19, тогда как для мышей, которым прививали рецидивирующее заболевание (CD19-отрицательное), демонстрировали рефрактерность, как и ожидалось. Это также воспроизводили in vitro в анализе дегрануляция CD107a (фигура 40B). Для моделирования in vivo наличия различных клонов, экспрессирующих CD19 или не содержащих их, мышам NSG прививали сочетание 1:1 исходного и рецидивирующего заболевания; на сутки 8 мышей случайным образом распределяли для получения CART19 или контрольных T-клеток. Наблюдали за опухолевой нагрузкой с использованием биолюминесцентной визуализации, которая позволяла устанавливать различие между CD19+ (CBG, зеленый)/CD19- (CBR, красный) относительного роста лейкоза in vivo. Как продемонстрировано на фигуре 43C, у мышей, получавших UTD и CD19+ (зеленый) и CD19- (красный) лейкоз, присутствующий на сутки 6, аналогично увеличивался на сутки 11, тогда как у мышей, которых обрабатывали CART19, исходное заболевание (зеленый) полностью устраняли, тогда как для рецидивирующего заболевания (красный) демонстрировали прогрессирование.
Эту уникальную модель ксенотрансплантата первичного CD19-отрицательного B-ALL и неэффективности CART19 использовали для оценки роли CART123 при лечении рецидивов с потерей антигена. Первичные CD19-отрицательные бласты (CBR-положительные) инъецировали мышам NSG (фигура 34D), и распределяли мышей случайным образом для получения CART19, CART123 или контрольных T-клеток. Для CART19 и контрольных T-клеток демонстрировали полное отсутствие противоопухолевой активности, тогда как CART123 приводил к полной эрадикации заболевания и длительной выживаемости у таких мышей (фигуры 34E и 34F). Фактически на доклинической модели первичного B-ALL, рефрактерного к CART19, новый CART123 способен приводить к эрадикации заболевания и обеспечивать длительную выживаемость.
Для понимания дифференциальных характеристик CART19 и CART123 в этой модели in vivo на уровне отдельной клетки проводили серию экспериментов путем инъекции смеси дифференциально меченых CART19 (CellTrace Violet, синий) и CART123 (CellTracker Orange или TRITC, красный) мышам, несущим CD19-положительные первичные бласты (GFP) или CD19-отрицательные рецидивирующие бласты (GFP), и отслеживали их поведение с использованием прижизненной 2-фотонной микроскопии костного мозга свода черепа приблизительно через 24 часа после инъекции (схема эксперимента, фигура 35A). Эти исследования демонстрировали, что CART19 и CART123 двигались к участкам косного мозга, содержащим лейкоз, и что распознавание CART-клетками когнатного антигена коррелирует с блокированием подвижности. В частности, у мышей, которым прививали исходный CD19+CD123+ лейкоз, было выявлено, что 62,9% +/- 3,8 CART19 и 81,1%+/-1,2 CART123 оставались с округлой морфологией, близкой к бластам, тогда как у мышей, которым прививали рецидивирующий CD19-CD123+ лейкоз, только CART123-клетки блокировали практически опухолевые клетки (CART123 80,9%+/-5,1 в сравнении с CART19 12,4%+/- 2,2) (фигуры 35B и 35C). Эти открытия указывают на то, что при D19-отрицательном рецидивирующем ALL только CART123 могли устанавливать действующие синапсы с лейкозными клетками (GFP) и, таким образом, снижать их подвижность, тогда как CART19 клетки продолжали поиск мишеней и мигрировали в окружающие ткани без распознавания лейкозных бластов.
Комбинация CART123 и CART19 может предотвращать CD19-отрицательные рецидивы
Доказано, что CART123 являлись эффективными для лечения CD19-отрицательных рецидивов, возникающих после направленных на CD19 видов терапии на доклинической модели резистентности CART19. Однако комбинаторный подход может обеспечивать лечение активного CD19-положительного заболевания, при этом одновременно предотвращая рецидивы с потерей антигена. Для проверки этой гипотезы моделировали возникающую клиническую проблему B-ALL с возможностью CD19-отрицательного ускользания посредством совместной инъекции первичного CD19- и CD19+ заболевания мышам NSG. Затем мышей случайным образом распределяли для получения контрольных T-клеток (UTD), CART19 или комбинации CART19 и CART123 с такой же суммарной дозой T-клеток (фигура 36A). Как продемонстрировано на фигуре 36B, у мышей, которых обрабатывали контрольными T-клетками, прогрессировали оба лейкозных клона, и для CART19 демонстрировали быстрое прогрессирование главным образом CD19-отрицательного заболевания (красный). С другой стороны, для мышей, которых обрабатывали комбинацией CART123 и CART19, демонстрировали устранение заболевания и улучшенную общую выживаемость, как продемонстрировано на фигуре 36C. Анализ мышей, умерщвленных в конце эксперимента, не демонстрировал признаков остаточного лейкоза в группе объединенных CAR T-клеток. В противоположность этому, мыши с прогрессирующим заболеванием после монотерапии CART19 сохраняли ожидаемый CD19-отрицательный фенотип (фигура 36D).
Наконец, T-клетки трансдуцировали 2 лентивирусами, одним, несущим CAR19, и другим, несущим CAR123, для получения CART, который можно активировать CD19 и/или CD123. Как продемонстрировано на фигуре 37A, детектировали четыре дифференциально трансдуцированные подпопуляции T-клеток: двойные негативные по CAR19 и CAR123, одиночные положительные по CAR19, одиночные положительные по CAR123 и двойные положительные CAR19/CAR123 T-клетки. Эти четыре подпопуляции сортировали и тестировали их функциональность и специфичность против K562-WT, K562 CD19+ или K562 CD123+. На фигуре 37B продемонстрированы результаты анализа дегрануляции CD107a, где одиночные положительные подпопуляции реагируют на свою специфическую мишень, тогда как только двойная положительная популяция может подвергаться дегрануляции в присутствии экспрессирующих CD19 и CD123 K562. Кроме того, для стимулированных по двум направлениям CART-клеток демонстрировали более эффективную цитотоксичность против двойной положительной мишени по сравнению с эквивалентным числом стимулированных по одному направлению CART-клеток, что подтверждает потенциальное повышение эффективности посредством использования CAR, который активируется двумя различными антигенами. (Фигура 37C)
ОБСУЖДЕНИЕ
Направленные на CD19 виды иммунотерапии меняют парадигму лечения рецидивирующего и рефрактерного острого лимфобластного лейкоза. Пациенты с прежде неблагоприятный исходом в настоящее время имеют реальную возможность достигать полного ответа и длительной ремиссии заболевания. Однако, как продемонстрировано при некоторых обстоятельствах для лейкоза, лечение которого проводят другими формами эффективной направленной терапии, лейкозные клетки могут вырабатывать мутации потери антигена, которые приводят к резистентности и рецидиву. В случае CART19 наблюдали два основных паттерна рецидивов. Пациенты с ранней потерей CART19 в результате недостаточности сохранения подвергаются риску рецидива исходного клона; фактически, анализы минимального остаточного заболевания указывают на то, что необходимым может являться 1-6 месяцев сохраняемой активности CART для полной эрадикации злокачественного новообразования. В противоположность этому, приблизительно 50% рецидивов возникает, несмотря на сохранение CART19, и характеризуется возникновением CD19-отрицательного лейкоза. Последнее наблюдение включает возможное селективное давление CART19. В частности. CD19-отрицательные рецидивы также возникают после терапии блинатумомабом, хотя они представляют меньшую часть рецидивов после такой возможно менее эффективной терапии. (5) Существует несколько возможных механизмов развития CD19-отрицательного заболевания. Один из них заключается в селекции и преимуществе относительной выживаемости CD19-отрицательных клонов, которые присутствуют на исходном уровне с очень низкой частотой, и это изначально считалось наиболее вероятным фактором, приводящим к CD19-отрицательным рецидивам. В последнее время также важными стали считать другие механизмы, такие как нарушение регуляции сплайсинга CD19. В настоящем описании впервые продемонстрировано, что редкие CD19 бласты при B-ALL могут содержать характерные цитогенетические аномалии, встречающиеся в более распространенных CD19-положительных лейкозных бластах, что подтверждает их в качестве возможного механизма CD19-отрицательного рецидива. Авторы подтвердили эти открытия, продемонстрировав, что CD123+CD19 бласты можно трансплантировать иммунодефицитным мышам, что указывает на то, что CD123 может являться маркером лейкозных стволовых клеток при B-ALL, как он является маркером при AML.
Целью этого исследования являлось определение новых стратегий для лечения пациентов с рецидивами с потерей антигена после направленных на CD19 видов терапии. CD123 экспрессировался на высоких уровнях при большей части B-ALL, и в частности экспрессия CD123 сохраняется у пациентов с рецидивом с CD19-отрицательным заболеванием. Продемонстрировали присутствие клональных лейкозных клеток в CD19- CD123+ популяциях, что указывает на то, что нацеливание на CD123 в комбинации с CART19 может повышать вероятность эрадикации подклонов, которые могли бы пролиферировать вследствие селективного преимущества под давлением CART19. Ранее CD123 подтверждали в качестве маркера лейкозной стволовой клетки при AML. В настоящем описании показано, что CD123 должен экспрессироваться в иммунофенотипически определенной лейкозной стволовой клетки (LSC) при ALL, увеличивая возможность того, что нацеливание на CD123 на LSC может способствовать эрадикации ALL.
Для исследования роли CART123 в рецидивах с потерей антигена разрабатывали новую модель ксенотрансплантатов CD19-отрицательных рецидивов из первичных бластов, получаемых от пациента с B-ALL (CHP101), включенного в одно из испытаний CTL019 Пенсильванского университета/детской больницы Филадельфии. Этот пациент на исходном уровне имел классический CD19+CD123+ фенотип, но затем перенес рецидив после лечения CART19 CD19-CD123+ заболевания. С использованием этой модели демонстрировали, что CART123 может приводить к эрадикации рецидивирующего заболевания и в комбинации с CART19 может предотвращать рецидив с потерей антигена. Это является первой демонстрацией двойной комбинации CART на клинически значимой модели, получаемой от пациента. Кроме того, с использованием прижизненной визуализации показано, что CART-клетки входят в костный мозг менее чем через 24 часа после внутривенной инъекции, проводят поиск своих мишеней и замедляются для взаимодействия с клетками, несущими когнатный антиген. Кроме того, показано, что двойной сигнальный каскад CART123/19 являлся более эффективным, чем CART отдельно или совокупность обоих CAR, что согласуется с опубликованными ранее результатами.
Ранее была продемонстрирована доклиническая эффективность химерного антигенного рецептора против CD123 для лечения острого миелолейкоза. CART123 вызывает гемопоэтическую токсичность вследствие распознавания CD123 на гемопоэтических стволовых клетках и клетках-предшественниках, потенциально серьезную проблему для перехода к клиническому применению, т.к. тяжелая токсичность стволовых клеток может приводить к постоянной миелоабляции. Было сделано предположение, что для сведения к минимуму гемопоэтической токсичности новая конструкция, которая активировала T-клетки только при совместном участии CD19 и CD123 одновременно, может устранять такую гемопоэтическую токсичность. В настоящем описании выявлено, что CART-клетки, получающие активирующий сигнал в результате распознавания CD19 и стимулирующий сигнал в результате распознавания CD123, могут вызывать цитолиз B-ALL клеток, а также устранять тяжелую гемопоэтическую токсичность, которую авторы ранее описывали. Хотя эта концепция была ранее опубликована с использованием искусственной системы распознавания CD19/PSMA, эта клинически значимая конструкция является значительным прогрессом в данной области с относительно ясным путем перехода к клиническому применению. Следует отметить, что, хотя такая двойная конструкция CAR вероятно будет ассоциирована со сниженной токсичностью, она может оставить нерешенной проблему рецидива с потерей антигена в результате большего распознавания CAR, а не менее ограниченного. Тем не менее, если нацеливание на CD123 приводит к успешной эрадикации стволовых клеток ALL, этот подход может являться безопасным и эффективным.
В итоге, в настоящем описании продемонстрирован новая и эффективная стратегия лечения B-ALL путем нацеливания на CD123. Этот подход является особенно привлекательным, т.к. вследствие того, что CD123 экспрессируются редкими CD19-отрицательными злокачественными клетки у некоторых пациентов с B-ALL и сохраняется при рецидивах с потерей антигена, возникающих после направленных на CD19 видов иммунотерапии. Кроме того, комбинация CART19 с CART123 может предотвращать возникновение CD19-отрицательных рецидивов.
Пример 8: Повышение функции CART и терапевтического индекса в комбинации с ингибиторами контрольных точек
Терапия T-клетками с химерным антигенным рецептором (CART) была разработана как мощная и возможно лечебная терапия при гемобластозах в течение последних нескольких лет. Направленные на CD19 CART-клетки приводили к впечатляющим показателям полного ответа ~90% при остром лимфобластном лейкозе, которые являются долговременными для большинства пациентов. Однако показатели общего ответа при других злокачественных новообразованиях, таких как хронический лимфоцитарный лейкоз составляют приблизительно 50%. Это может являться частично связанным с истощением и дисфункцией CART, индуцированных лейкозными клетками. В этом примере оценивали роль ингибирующих рецепторов/путей в индукции дисфункции и истощения CART-клеток при гемобластозах.
В качестве модели опухоли линию клеток острого миелолейкоза (AML) (MOLM14) и образцы первичного AML обрабатывали CD33 или направленными на CD123 CART-клетками (содержащими стимулирующий домены 41BB и CD3z и лентивирусный вектор, конструкцию 1172 (SEQ ID NO: 707)).
Инкубация образцов первичного AML или линии клеток MOLM14 с направленными на CD33 или CD123 CART приводила к значительному повышению экспрессии PDL1 на опухолевых клетках через 24 часа после инкубации (0% на сутки 0 в сравнении с 80% на сутки 1, P<0,001) и повышению экспрессии PD1 и TIM3 на T-клетках через 3-7 суток после совместного культивирования (8% T-клеток, экспрессирующих PD1 на сутки 0, в сравнении с 43% на сутки 3, P=0,03 и 13% T-клеток, экспрессирующих TIM3 на сутки 0, в сравнении с 71% на сутки 3, p=0,001, фигуры 41A, 41B и 41C). Дополнительный анализ проточной цитометрии демонстрировал повышение экспрессии ингибиторов иммунных контрольных точек PD1, TIM3 и дополнительных ингибиторов иммунных контрольных точек LAG3 и CTLA4 в CD8+ T-клетках (фигуры 42A, 42B, 42C, и 42D) и в CD4+ T-клетках. Следует отметить, что максимальную экспрессию наблюдали на сутки 3-7 после воздействия клетками-мишенями (клетки первичного AML или MOLM14).
Для экспериментов in vivo мышам NSG (NOD-SCID-γ-/-) прививали линию клеток MOLM14. Обработка таких ксенотрансплантатов AML субоптимальными дозами CD33 или CD123 CART приводила к первичным противоопухолевым ответам с последующими рецидивами заболевания у 40-60% мышей (фигура 44).
T-клетки выделяли из костного мозга таких мышей и анализировали на дифференциальную экспрессию ингибирующих рецепторов. Наблюдали значительную повышенную активацию рецепторов PD1 и TIM-3 на T-клетках, выделяемых у мышей с рецидивирующим заболеванием, по сравнению с T-клетками, выделяемыми у мышей в период ремиссии после терапия CART-клетками (фигуры 43 и 45).
Затем исследовали роль добавления ингибиторов иммунных контрольных точек в улучшении функции T-клеток ex vivo после терапии CART-клетками. T-клетки, выделяемые из костного мозга мышей, у которых развивался рецидив после терапии CART-клетками, культивировали в присутствии опухоли совместно с ингибитором PD-1 (BioXcell, каталожный № BE0193 и № клона J110), ингибитором TIM3 (Biolegend, клон F38-2E2, каталожный № 345010), ингибитором CEACAM (Sigma-Aldrich, каталожный № SAB1403604-100UG) или комбинацией ингибиторов PD1 и TIM3, или комбинацией ингибиторов PD1 и CEACAM1. Ингибиторы иммунных контрольных точек вводили в концентрации 10 мкг/мл. Наблюдали улучшение эффекторных функций CART-клеток, как измеряют по продукции цитокинов (например, IFN-гамма) и маркера пролиферации Ki-67 в присутствии ингибиторов иммунных контрольных точек. Улучшение эффекторной функции CART-клеток являлось более выраженным, когда комбинировали оба ингибитора PD1 и TIM3 (фигура 46A и 46B).
В заключении тестировали, улучшает ли комбинация ингибиторов иммунных контрольных точек с CART противоопухолевую активность, например, повышает терапевтический индекс и предотвращает рецидивы на ксенотрансплантатах AML. В этом подходе ксенотрансплантаты MOLM14 обрабатывали субоптимальными дозами направленными на CD33 или CD123 CART или контрольными нетрансдуцированными T-клетками (UTD) с различными комбинациями ингибиторов иммунных контрольных точек или без них. Мышам NSG прививали линию клеток MOLM14 AML. Приживление подтверждали биолюминесцентной визуализацией. Затем ксенотрансплантаты AML обрабатывали субоптимальными дозами (0,25-0,5×106 всего T-клеток I.V) направленных на CD33 или CD123 CART или контрольными нетрансдуцированными T-клетками (UTD). Мыши также получали блокатор PD-1, блокатор TIM3 или комбинацию обоих на сутки 3, 6, 9 и 12 после T-клеток. За мышами проводили дальнейшее наблюдение посредством серийной визуализации для оценки нагрузки заболевания. Экспериментальная схема обобщена на фигурах 47 и 49.
Добавление ингибиторов иммунных контрольных точек к нетрансдуцированным T-клеткам не приводило к противолейкозному эффекту (фигура 48). Однако добавление блокаторов PD1 или TIM3 приводило к синергической противоопухолевой активности, как продемонстрировано на фигурах 50A, 50B, 5°C и 50D. Частота устойчивого полного ответа составляла: 45% для лечения одними CART123 (фигуры 50A, 50B и 50C), 80% для лечения CART123+ингибирование PD1 (фигура 50A), 100% для лечения CART123+ингибирование TIM3 (фигура 50B) и 80% для лечения CART123+ингибирование PD1 и TIM3 (фигура 50C).
Таким образом, лечение CART123 в комбинации с ингибиторами иммунных контрольных точек приводило к большей противоопухолевой активности по сравнению с противоопухолевым эффектом, наблюдаемым при введении CART123, в сочетании с противоопухолевым эффектом, наблюдаемым при введении только ингибиторов одних иммунных контрольных точек. Эти результаты указывают на то, что пути PD1 и TIM3 участвуют в истощении и дисфункции CART при AML. Комбинация ингибиторов иммунных контрольных точек с CART-клетками может приводить к усиленным функциям при AML и других гемобластозах.
Пример 9: Низкая доза RAD001 стимулирует пролиферацию CART на модели культуры клеток
Эффект низких доз RAD001 на пролиферацию CART-клеток in vitro оценивали путем кокультвирования экспрессирующих CART клеток с клетками-мишенями в присутствии различных концентраций RAD001.
Материалы и способы
Получение трансдуцированных CAR T-клеток
Лентивирусный вектор для переноса с гуманизированный CAR против CD19 человека (huCART19) использовали для получения геномного материала. упакованного в псевдотипированные лентивирусные частицы VSVg. Аминокислотная и нуклеотидная последовательность гуманизированного CAR против CD19 человека (huCART19) представляет собой CAR 1, ID 104875, описанную в публикации PCT WO2014/153270, зарегистрированной 15 марта 2014 года, и в настоящем описании обозначается как SEQ ID NO. 85 и 31.
Лентивирусный вектор для переноса ДНК смешивают с тремя компонентами для упаковки VSVg env, gag/pol и rev в комбинации с реагентом липофектамином для трансфекции клеток Lenti-X 293T. В дальнейшем среду меняют через 24 часа и 30 часов, содержащую вирус среду собирают, фильтруют и хранят при -80°C. CART получают трансдукцией свежих или замороженных наивных T-клеток, получаемых посредством отрицательной магнитной селекции крови здорового донора или Leuko Pak. T-клетки активируют инкубацией с гранулами с антителами против CD3/против CD28 в течение 24 часов, после чего к культурам добавляют содержащий вирус супернатант или концентрированный вирус (MOI=2 или 10, соответственно). Модифицированные T-клетки оставляют размножаться приблизительно 10 суток. Процентное содержание трансдуцированных клеток (экспрессирующих CAR на клеточной поверхности) и уровень экспрессии CAR (относительная интенсивность флуоресценции, Geo Mean) определяют проточным цитометрическим анализом на сутки от 7 до 9. Сочетание замедления скорости роста и приближения размера T-клетки к ~350 фл определяет состояние T-клеток для криоконсервирования для дальнейшего анализа.
Оценка пролиферации CART
Для оценки функциональности CART T-клетки размораживают и подсчитывают и оценивают жизнеспособность посредством Cellometer. Число CAR-положительных клетки в каждой культуре нормализуют с использованием нетрансдуцированных T-клеток (UTD). Влияние RAD001 на CART тестировали в титрованиях с RAD001, начиная от 50 нМ. Линия клеток-мишеней, используемая во всех экспериментах совместного культивирования представляет собой Nalm-6, линию клеток пре-B-клеточного острого лимфобластного лейкоза (ALL) человека, экспрессирующих CD19 и трансдуцированных для экспрессии люциферазы.
Для измерения пролиферации CART, T-клетки культивируют с клетками-мишенями в отношении 1:1. Анализ проводят в течение 4 суток, когда клетки окрашивают на CD3, CD4, CD8 и экспрессию CAR. Число T-клеток оценивают проточной цитометрией с использованием подсчета гранул в качестве эталонной величины.
Результаты
Пролиферативную способность CART-клеток тестировали на 4 сутки анализа совместного культивирования. Число CAR-положительных CD3-положительных T-клеток (черные столбцы) и общее число CD3-положительных T-клеток (белые столбцы) оценивали после культивирования CAR-трансдуцированных и нетрансдуцированных T-клеток с Nalm-6 (фиг. 53). Клетки huCART19 размножались при культивировании в присутствии менее чем 0,016 нМ RAD001 и в меньшей степени при более высоких концентрациях соединения. Следует отметить, что при 0,0032 и 0,016 нМ RAD001 пролиферация являлась выше, чем наблюдаемая без добавления RAD001. Для нетрансдуцированных T-клетки (UTD) не демонстрировали детектируемого размножения.
Пример 10: Низкая доза RAD001 стимулирует размножение CART in vivo
В этом примере оценивают способность клеток huCAR19 пролиферировать in vivo при различных концентрациях RAD001.
Материалы и способы
Клетки NALM6-luc. Линию клеток острого лимфобластного лейкоза человека (ALL) NALM6 устанавливали из периферической крови пациента с рецидивирующим ALL. Затем клетки метили люциферазой светляков. Такие суспензия клетки растили в RPMI, дополненной 10% инактивированной нагреванием эмбриональной телячьей сывороткой.
Мыши. Мышей NSG (NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ) в возрасте 6 недель получали от Jackson Laboratory (складской номер 005557).
Имплантация опухоли. Клетки NALM6-luc выращивали и размножали in vitro в RPMI, дополненной 10% инактивированной нагреванием эмбриональной телячьей сывороткой. Затем клетки переносили в 15 мл коническую пробирку и промывали дважды холодным стерильным PBS. Затем подсчитывали клетки NALM6-luc и ресуспендировали в концентрации 10×106 клетки на миллилитр PBS. Клетки помещали на лед и сразу же (в течение одного часа) имплантировали мышам. Клетки NALM6-luc инъецировали внутривенно в хвостовую вену в объеме 100 мкл в целом всего 1×106 клеток на мышь.
Дозирование CAR T-клеток. Мышам вводили 5×106 CAR T-клеток через 7 суток после имплантации опухоли. Клетки частично размораживали на водяной бане при 37 градусах Цельсия, а затем полностью размораживали добавлением 1 мл холодного стерильного PBS в пробирку, содержащую клетки. Размороженные клетки переносили в 15 мл пробирку Falcon и доводили до конечного объема 10 мл PBS. Клетки дважды промывали при 1000 об./мин. в течение 10 минут каждый раз, а затем подсчитывали на гемоцитометре. Затем T-клетки ресуспендировали в концентрации 50×106 CAR T-клеток на мл холодного PBS и держали на льду до дозирования мышам. Мышам инъецировали внутривенно через хвостовую вену 100 мкл CAR T-клеток в дозе 5×106 CAR T-клеток на мышь. Восемь мышей в группе обрабатывали 100 мкл одним PBS (PBS) или гуманизированными CD19 CAR T-клетками.
Дозирование RAD001. Формулировали концентрированную микроэмульсию 50 мг эквивалентных 1 мг RAD001, а затем ресуспендировали в D5W (5% декстроза в воде) во время дозирования. Мышам перорально дозировали каждые сутки (посредством перорального принудительного кормления) 200 мкл желаемых доз RAD001.
Анализ PK. Мышам дозировали каждые сутки RAD001, начиная с 7 суток после имплантации опухоли. Группы дозирования являлись такими, как указано ниже: 0,3 мг/кг, 1 мг/кг, 3 мг/кг и 10 мг/кг. У мышей получали образцы крови на сутки 0 и 14 после первой и последней дозы RAD001 в следующие моменты времени для анализа PK: 15 минут, 30 минут, 1 час, 2 часа, 4 часа, 8 часов, 12 часов и 24 часа.
Результаты
Размножение и фармакокинетику RAD001 тестировали у мышей NSG с опухолями NALM6-luc. Ежесуточное пероральное дозирование RAD001 отдельно не оказывало влияние на рост опухолей NALM6-luc (фигура 54). Фармакокинетический анализ RAD001 демонстрирует, что он является достаточно стабильным в крови мышей, несущих опухоль (фигура 55A и 55B). Анализ PK на сутки 0 и сутки 14 демонстрировал, что концентрации RAD001 в крови являются выше 10 нм даже через 24 часа после дозирования самой маленькой тестируемой дозы (0,3 мг/кг).
На основании этих доз huCAR19 CAR T-клетки дозировали RAD001 и не дозировали RAD001 для определения пролиферативной способности этих клеток. Наиболее высокая используемая доза составляла 3 мг/кг на основании уровней RAD001 в крови через 24 часа после дозирования. Вследствие того, что концентрация RAD001 являлась выше 10 нМ через 24 часа после последней дозы RAD001, в исследовании in vivo с CAR T-клетками использовали несколько более низких доз RAD001. CAR T-клетки дозировали в/в за сутки до начала перорального дозирования RAD001 каждые сутки. За мышами наблюдали посредством FACS в отношении размножения T-клеток.
Для наиболее низких доз RAD001 демонстрируют повышенную пролиферацию CAR T-клеток (фигура 56). Такая повышенная пролиферация является наиболее выраженной и длительной с CD4+ CAR T-клетками чем с CD8+ CAR T-клетками. Однако с CD8+ CAR T-клетками повышенную пролиферацию можно наблюдать в ранние моменты времени после дозы CAR T-клеток. В вариантах осуществления можно использовать РНК CART-клетки также в комбинации с ингибиторами иммунных контрольных точек.
Пример 11: Характеристика in vitro стратегии прекращения действия CART123
Стратегии прекращения действия представляют особый интерес для сведения к минимуму токсичности терапии CART123. Одна из стратегий снижения активности CART123 включает абляцию CD123 CAR экспрессирующих T-клеток в результате коэкспрессии CAR123 с CD20 и использование антитела против CD20 ритуксимаба для направленного воздействия на CART123-клетки для разрушения. В этом примере получают CART123-клетку, которая коэкспрессирует CD20, и характеризуют ее в различных анализах in vitro, таких как дегрануляция и способность продукции цитокинов.
Конструировали экспрессирующий вектор для экспрессии CD123 CAR и CD20. Карта вектора представлена на фигуре 57. NVS2 CAR123 (также обозначаемый в настоящем описании как CAR123-2) состоит из гуманизированного одноцепочечного вариабельного фрагмента, направленного против CD123, шарнира CD8, трансмембранного домена CD8, стимулирующих доменов 41BB и CD3. CAR123 NVS2 находится под промотором EF1alpha и является функционально связанным с полной молекулой CD20 с белком P2A. Клетки, экспрессирующие только CAR123 обозначают в настоящем описании как CART123-клетки, и клетки коэкспрессирующие CAR123 и CD20, обозначают в настоящем описании как CART123P2ACD20-клетки.
Для анализа дегрануляции CD107, CART123 и CART123P2ACD20-клетки культивировали отдельно, с CD123-положительной линией клеток MOLM14, CD123-отрицательной контрольной линией клеток Jurkat и с PMA/иономицином в качестве положительного контроля в присутствии костимулирующих молекул CD28, CD49d и монензина. CD107a измеряли проточной цитометрией через 4 часа инкубации. CART123P2ACD20-клетки претерпевают устойчивую специфическую дегрануляцию CD107a в ответ на CD123-положительную мишень, аналогично CART123-клеткам (фигура 58), таким образом, демонстрируя, что введение CD20 молекулы не оказывает отрицательного влияния на дегрануляцию CART123-клеток.
Также оценивали продукцию цитокинов CART123P2ACD20-клеткам. CART123- и CART123P2ACD20-клетки культивировали отдельно, с CD123-положительной линией клеток MOLM14, CD123-отрицательной контрольной линией клеток Jurkat и с PMA/иономицином в качестве положительного контроля в присутствии костимулирующих молекул CD28, CD49d и монензина. Клетки собирали через четыре часа, фиксировали и пермеабилизовали, окрашивали на цитокины GM-CSF, TNFα, IFNγ или IL-2, и проводили анализа проточной цитометрии. Результаты этих анализов демонстрировало, что большая часть CART123P2ACD20-клеток продуцирует GM-CSF (фигура 59A), TNFα (фигура 59B), IFNγ (фигура 59C) и IL-2 (фигура 59D) в ответ на CD123-полоижтельную мишень, аналогично CART123-клеткам.
В анализе цитотоксичности, CART123- и CART123P2ACD20-клетки инкубировали с MOLM14-luc в течение 24 часов в различных отношениях E:T, как указано, а затем проводили биолюминесцентную визуализацию, как измеряют оставшиеся живые клетки. Результаты демонстрировал, что CART123P2ACD20-клетки приводят к специфическому цитолизу CD123-положительных мишеней MOLM14, который является сравнимым с CART123-клетками (фигура 60).
Затем оценивали опосредованную ритуксимабом цитотоксичность на CART123P2ACD20-клетках. CART123 и CART123P2ACD20 инкубировали с ритуксимабом в различных концентрациях 0 мкг/мл, 1 мкг/мл, 10 мкг/мл и 100 мкг/мл. Клетки собирали через 0, 4, 12 и 48 часов и окрашивали на CD3. Рассчитывают процент истощения T-клеток. Ритуксимаб приводил к направленной цитотоксичности в концентрации 100 мкг/мл и через 48 часов инкубации в CART123P2ACD20-клетках (фигура 61B), но не в CART123-клетках (фигура 61A).
Исследовали механизм, который опосредует истощение CART123P2ACD20-клеток. CART123P2ACD20-клетки инкубировали с ритуксимабом в различных концентрациях 0 мкг/мл, 1 мкг/мл, 10 мкг/мл и 100 мкг/мл в присутствии 15% комплемента кролика. Как продемонстрировано на фигуре 62, ритуксимаб в дозе 1 мкг/мл или 10 мкг/мл приводил к истощению большей части CART123P2ACD20-клеток через 12 часов инкубации. Ритуксимаб в дозе 100 мкг/мл приводил к истощению большей части CART123P2ACD20-клеток через 4 часа инкубации. Истощение CART123P2ACD20-клеток является опосредованным обусловленной комплементом цитотоксичностью.
Пример 12: Эффективные стратегии прекращения действия CD123 CART
У многих детей и взрослых с острым миелолейкозом (AML) развивается рецидив, или заболевание является неизлечимым существующими способами лечения, что указывает на необходимость альтернативных видов терапии. Для T-клеток с химерным антигенным рецептором, направленных на CD123 (CART123), демонстрировало эффективную противолейкозную активность на моделях ксенотрансплантатов AML человека на мышах. Однако обработка мышей с привитыми нормальными гематопоэтическими клетками человека CART123, приводила к глубокой миелоабляции, что вызывает беспокойство в отношении тяжелой гематологической токсичности у пациентов с AML, которых можно лечить такими видами терапии. В настоящем примере оценивали, может ли удаление T-клеток после индуцированной CART123 эрадикации AML минимизировать такую второстепенную токсичность без ухудшения контроля над лейкозом и, таким образом, увеличивая терапевтическое окно иммунотерапии CART-клетками против AML.
Способы
Анализировали три стратегии прекращения действия на моделях ксенотрансплантатов AML человека: (1) абляция T-клеток антителом против CD52 алемтузумабом после обработки 1×105-1×106 T-клетками, трансдуцированными с использованием лентивируса CD123-41BB-CD3-дзета CART123, (2) абляция T-клеток антителом против CD20 ритуксимабом после обработки 1×105-1×106 CART123, сконструированными так, чтобы коэкспрессировать CD20 (CART123/CD20), и (3) обработка "биоразрушаемыми" CART-клетками с электропорированной иРНК антитела против CD123 (РНК-CART123). Мышей, с привитыми линиями клеток AML человека, экспрессирующими люциферазу (MOLM14, MOLM13, U937), или образцы первичного AML (n=3) обрабатывали направленными на CD123 CART-клетками, как описано выше. Конструкция CD123 CAR, используемая для этого эксперимента, представляет собой конструкцию 1172 (SEQ ID NO: 707), и ее вводили мышам на неделе 1. Для исследований истощения T-клеток 1 или 5 мг/кг алемтузумаба инъецировали интраперитонеально (и/п) на неделе 2, неделе 3 или неделе 4 (например, через 1, 2 или 3 недели после CART123) для определения оптимального дозирования и времени абляции T-клеток. В последующих исследованиях 10 мг/кг ритуксимаба инъецировали и/п через 4 недели после CART123/CD20 или 1×107 РНК-CART123 инъецировали внутривенно через 5, 9 и через 16 суток после приживления AML. За мышами наблюдали посредством биолюминесцентной визуализации и/или анализов количественной проточной цитометрии крови, селезенки и/или костного мозга каждую неделю.
Результаты
Обработка CART123 ксенотрансплантатов CD123+AML индуцировала заметное размножение T-клеток и эрадикацию лейкоза in vivo, что приводило к длительному выживанию животных (p<0,0001 в сравнении с контролями, обрабатываемыми нетрансдуцированными T-клетками). Наблюдали минимальные эффекты "ксеногенный трансплантат против хозяина".
Результаты серийной абляции CART123 на модели ксенотрансплантата в результате введения алемтузумаба представлены на фигуре 72A. В соответствующие моменты времени также проводили количественное определение CART123-клеток (фиг. 72B) и демонстрируют, что однократные дозы алемтузумаба приводили к быстрой элиминации CART123-клеток. Одна доза алемтузумаба приводила к быстрой элиминации T-клеток во всех тестируемых моделях, где наилучшую эффективностью получали при дозировании 5 мг/кг на неделе 4 (например, 3 недели после CART123). Анализ общей выживаемости приведен на фигуре 72C, демонстрирующей, что для мышей, получавших алемтузумаб на неделе 3 или неделе 4, выявляли улучшенную выживаемость по сравнению с мышами, получавшими алемтузумаб на неделе 2.
CART123/CD20 приводил к эрадикации AML с кинетикой, аналогичной эрадикации CART123, и 1 доза ритуксимаба через 4 недели после инфузии CART123/CD20 быстро устраняла T-клетки при сохранении ремиссии лейкоза. Мыши с индуцированной CART123 или CART123/CD20 ремиссией AML во время введения алемтузумаба или ритуксимаба оставались без лейкоза в течение≥12 недель (фиг. 72A), и выживаемость животных не отличалась от выживаемости мышей, которых обрабатывали направленными на CD123 CART-клетками, которые не подвергались истощению T-клеток (p=1,00). В противоположность этому, мыши, которых обрабатывали CART123 с остаточным AML во время более раннего введения алемтузумаба, испытывали быстрое прогрессирование AML, соответствующее эффективности до элиминации T-клеток (фигура 72A).
Кроме того, повторное заражение AML ("рецидив") животных, у которых ранее проводили абляцию T-клеток алемтузумабом или ритуксимабом, приводило к быстрой пролиферации AML без повторного появления T-клеток, что подтверждает полное истощение T-клеток. Для мышей, у которых не проводили абляцию, демонстрировало повторное размножение CART-клеток без повторной инъекции повторной стимуляции CD123+ (p<0,0001) (фиг. 72A).
Обработку алемтузумабом также анализировали на второй модели in vivo, модели ксенотрансплантатов, получаемых от пациентов детского возраста. В этой модели мышей инъецировали клетками AML290. Чрез шесть недель приживления AML мышам вводили физиологический раствор, нетрансдуцированные T-клетки или CART123-клетки (предоставленные на неделе 0). Алемтузумаб вводили в дозе 5 мг/кг подгруппе мышей, получавших CART123-клетки на неделе 4. Было продемонстрировано, что обработка алемтузумабом полностью устраняет CART123T-клетки в периферической крови (фиг. 73B). Анализ прогрессирования опухоли выявлял, что у мышей, получавших CART123, сохранялась ремиссия до 8 недель после обработки CART123. Мыши, которые получали обработку алемтузумабом и абляцию CART123-клеток на неделе 4, оставались в состоянии ремиссии (фиг. 73A). Анализ AML, присутствующего в различных органах ксенотрансплантатов после дозирования CART123, проводили проточной цитометрией. Обработка CART123-клетками приводила к абляции клеток AML в селезенке (фиг. 74A) и костном мозге (фиг. 74B). Обработка алемтузумабом через 4 недели после дозирования CART123 сохраняла ремиссию, как продемонстрировано по сохраняемой абляции клеток AML в селезенке (фиг. 74A) и костном мозге (фиг. 74B).
РНК-CART123 быстрее всего устраняло AML и способствовало длительному выживанию животных, хотя для РНК-CART123 ожидали меньшее сохранение in vivo, чем для CART123 или CART123/CD20. Алемтузумаб или ритуксимаб отдельно не ингибировал пролиферацию AML на моделях ксенотрансплантатов, не обрабатываемых CART123, в сравнении с контролями только с AML (p=1,00).
Сравнение трех подходов прекращения действия, описанных в этом примере, продемонстрировано на фигуре 75.
Заключения
Алемтузумаб и ритуксимаб полностью устраняли направленные на CD123 CART-клетки на моделях ксенотрансплантатов AML человека. Для продолжительной ремиссии лейкоза необходимым являлось сохранение CART123 или CART123/CD20 в течение 4 недель до прекращения действия T-клеток посредством алемтузумаба 5 мг/кг или ритуксимаба 10 мг/кг после CART123 или после CART123/CD20, соответственно. В продолжающихся исследованиях изучают эффективность элиминации T-клеток на дополнительных моделях ксенотрансплантатов первичных AML и в сравнении с другими видами иммунотерапии CART-клетками против AML. Эти стратегии прекращения действия T-клеток могут повышать эффективность терапии CART-клетками у пациентов с AML особенно до возможной гемопоэтической трансплантации стволовых клеток.
Пример 13: Комбинации CAR19 и CAR123
Большая часть бластов B-острого лимфобластного лейкоза (B-ALL) коэкспрессирует CD19 и CD123. Нацеливание на оба антигена одновременно может приводить к повышенной противоопухолевой активности и снижать частоту рецидива. Как описано в примере 8, комбинация CAR19 и CAR123 обладает повышенной терапевтической эффективностью. В этом примере исследовали различные конструкции для введения комбинации CAR19 и CAR123.
Одна из стратегий введения комбинации CAR19 и CAR123 заключается во введении двойного CART, где T-клетка экспрессирует конструкции CAR19 и CAR123. Конструировали один лентивирусный вектор, несущий последовательности CAR19 и CAR123 (вместо 2 отдельных векторов) для облегчения двойной продукции CART для клинического применения (фигура 63A). Такая лентивирусная конструкция содержит CAR19 и CAR123, связанные посредством P2A домена под контролем промотора EF1. T-клетки трансдуцировали лентивирусной конструкцией, культивировали в течение 6 суток, а затем окрашивали специфическим к CD19 scFv антителом и пептидом CD123-His и антителом против His-PE для анализа проточной цитометрии. Результаты демонстрируют, что детектировали T-клетки, экспрессирующие CAR19 и CAR123 (фигура 63B).
В другой стратегии использовали стратегию расщепленного CAR для экспрессии CAR19 и CAR123. В этой стратегии конструировали вектор, где CAR123 содержащий костимулирующий домен 4-1BB являлся связанным посредством домена P2A с содержащим CAR19 первичным сигнальным доменом CD3-дзета (фигура 64A). В частности, CAR123 содержал scFv CD123, шарнир CD8 и трансмембранный домен CD8 и домен 4-1BB. CAR19 содержал scFv CD19, шарнирный домен CD8 и трансмембранный домен CD8, и CD3-дзета домен. В этой стратегии только распознавание обоих CD19 и CD123 соответствующим участком scFvs CAR приведет к активации T-клетки с расщепленным CAR. T-клетки трансдуцировали лентивирусной конструкцией, культивировали в течение 6 суток, а затем окрашивали специфическим к scFv CD19 антителом и пептидом CD123-His и антителом против His-PE для анализа проточной цитометрии. Результаты демонстрируют, что детектировали T-клетки, экспрессирующие CAR19 и CAR123 (фигура 64B).
Пример 14: Терапия CD123 CART при гистиоцитарных нарушениях
Терапия CD123 CART может являться пригодной при гистиоцитарных нарушениях, таких как BPDCN или нарушения, связанные с тучными клетками. В этом примере, проводили эксперименты для оценки функции CART123 в отношении новообразования из бластных плазмоцитоидных дендритных клеток (BPDCN) и нарушений, связанных с тучными клетками (такими как системный мастоцитоз и тучноклеточный лейкоз).
BPDCN представляет собой редкую и агрессивную гематологическую неоплазия, возникающую из предшественников pDC, классифицированную как неоплазия из гистиоцитов/дендритных клеток. Все BPDCN экспрессируют CD123. CD123, по-видимому, является критическим для выживания BPDCN, т.к. для бластов BPDCN необходимым является IL-3 для успешного размножения ex vivo. Несмотря на первичную высокую частоту ответов на химиотерапию, длительное выживание, как правило, является очень низким, и средняя продолжительность выживания составляет 9-13 месяцев независимо от первоначального проявления.
Экспрессию CD123 определяли проточной цитометрией на гемопоэтических стволовых клетках (HSC), линии клеток острого миелолейкоза (AML) или двух различных BPDCN. Регистрируют среднюю интенсивность флуоресценции. Экспрессия CD123 на AML, нормальных CD34+ клетках костного мозга и в двух случаях BPDCN представлена на фигуре 65. Эти данные указывают на то, что CD123 экспрессируется на уровнях в 10-20 раз выше на BPDCN по сравнению с нормальными клетками костного мозга.
Дополнительные конструкции CART123 получали с использованием альтернативных клонов против CD123 (32716 (также обозначаемом в настоящем описании как конструкция 1172) и 26292 (также обозначаемом в настоящем описании как конструкция 1176), обе конструкции описаны и охарактеризованы в PCT/US2014/017328. Анализы цитолиза клеток проводили аналогично анализам, описанным в примере 2 или 3. Клон 26292 приводил к пониженному цитолизу нормальных CD34 клеток по сравнению с положительным контролем AML или BPDCN, что указывает на то, что он является подходящим для получения CART-123 с ослабленной активностью, которая может образовывать увеличенное терапевтическое окно (фигура 66B). В противоположность этому для клона 32716 демонстрировали аналогичный цитолиз CD34 клеток и BPDCN (фигура 66A).
Чувствительные анализы функции T-клетки, такие как дегрануляция и продукция цитокинов, проводили аналогично анализам, описанным в примере 2 или 3. Клон 26292 CART123 инкубировали с CD34+ HSC (фигура 67, верхний ряд) или BPDCN (фигура 67, нижний ряд) в течение четырех часов. Оценивали дегрануляцию CD107. Результаты анализа дегрануляции демонстрировали, что эффекторные функции клона 26292 можно все еще активировать CD34+ HSC (фигура 67, верхний ряд).
Нарушения, связанные с тучными клетками, включая системный мастоцитоз и тучноклеточный лейкоз, представляют собой редкие гистиоцитарные злокачественные новообразования, которые ассоциированы с неблагоприятным прогнозом. Тучные клетки экспрессируют CD123 на высоких уровнях и, таким образом, нарушения, связанные с тучными клетками, можно лечить CART123.
Проводили анализ экспрессии CD123 при нарушениях, связанных с тучными клетками. Мононуклеарные клетки из крови пациента с тучноклеточным лейкозом/системным мастоцитозом окрашивали live/dead aqua (LDAQ, ось x на фигуре 68A и 68B) и изотипом (фигура 68A) или CD123 PE (фигура 68B). Большая часть клеток SM экспрессировала CD123.
Анализ дегрануляции CD107 проводили для оценки активности CART123 в присутствии клеток тучноклеточного лейкоза. CART123-клетки культивировали отдельно, с PMA и иономицином (фигура 69A) или с мононуклеарными клетками из крови пациента с тучноклеточным лейкозом/системным мастоцитозом (фигура 69B) в течение двух часов в присутствии антитела против CD107a. Установку дискриминационного окна для T-клеток проводили с использованием антитела против CD3. Установку дискриминационного окна для положительных по CD107a событий проводили с использованием отдельной пробирки CART123. Ответ CART123 на клетки SM является эквивалентным ответу, образуемому при положительном контроле PMA+иономицин.
Пример 15: Эффект CART123 на микроокружение опухоли
В этом примере проводят анализы для проверки эффекта экспрессирующих CAR CD123 клеток на микроокружение опухоли. Эти анализы можно использовать для оценки эффекта CART123 на микроокружение опухоли при лимфоме Ходжкина.
Первый анализ проводят для определения, приводят ли злокачественные клетки, например, клетки лимфомы Ходжкина (клетки HL) к иммуносупрессивному фенотипу клеток в микроокружении опухоли, например, моноцитов. Моноциты и клетки HL выращивают в планшете Transwell, содержащем верхнюю и нижнюю камеру. Моноциты и злокачественные клетки культивируют в следующих ниже конфигурациях: (1) моноцит выращивают в одной камере, например, нижней камере, и клетка HL выращивают в другой камере, например, верхней камере, (2) моноцит и клетка HL выращивают совместно на одной и той же стороне планшета Transwell, или (3) моноцит выращивают отдельно (контроль). Клетки культивируют в течение желаемого периода времени, а затем собирают клетки для анализа проточной цитометрии или количественной ПЦР в режиме реального времени для детекции фенотипа моноцитов, например, иммуносупрессивного фенотипа путем оценки уровней маркеров, таких как CD14 и HLADR.
Второй анализ проводят для определения, может ли иммуносупрессивные клетки микроокружение опухоли, например, моноциты, ингибировать противоопухолевый T-клеточный иммунитет, опосредованный CART-клетками. Этот анализ можно проводить двумя различными путями, с использованием планшета Transwell, если предполагают, что ингибирование противоопухолевого T-клеточного иммунитета опосредовано растворимым фактором, или с использованием стандартных контейнеров для культивирования клеток, если предполагают, что ингибирование противоопухолевого T-клеточного иммунитета опосредовано контактом. Для анализа, где ингибирование противоопухолевого T-клеточного иммунитета может быть опосредован растворимым фактором, клетки выращивают в планшете Transwell, содержащем верхнюю и нижнюю камеру. Клетки культивируют в следующих конфигурациях: (1) клетка HL в одной камере, например, верхней камере, и CART19-клетка и экспрессирующая CD19 опухолевая клетка, например, B-клеточная опухоль, в другой камере, например, нижней камере; (2) моноцит в одной камере, например, верхней камере, и CART19-клетка и экспрессирующая CD19 опухолевая клетка, например, B-клеточная опухоль, в другой камере, и (3) клетка HL и моноцит в одной камере, например, верхней камере, и CART19-клетка и экспрессирующая CD19 опухолевая клетка, например, B-клеточная опухоль, в другой камере. Для анализа, может ли ингибирование противоопухолевого T-клеточного иммунитета быть опосредуемым контактом, клетки культивируют в следующих конфигурациях: (1) клетка HL, CART19-клетка и экспрессирующая CD19 опухолевая клетка; (2) моноцит, CART19-клетка и экспрессирующая CD19 опухолевая клетка, и (3) клетка HL, моноцит, CART19-клетка и экспрессирующая CD19 опухолевая клетка. Клетки культивируют в течение желаемого периода времени, а затем оценивают функцию CART19. Анализы для оценки функции CART19 включают анализы пролиферации и цитолиза, например, как описано в примерах 2 и 3.
Третий анализ проводят для определения того, что CART123 направленно воздействуют на иммуносупрессивные клетки в микроокружении опухоли. Этот анализ можно проводить двумя различными путями с использованием планшета Transwell, если предполагают, что ингибирование противоопухолевого T-клеточного иммунитета опосредовано растворимым фактором, или с использованием стандартных контейнеров для культивирования клеток, если предполагают, что ингибирование противоопухолевого T-клеточного иммунитета опосредовано контактом. Для анализа, где ингибирование противоопухолевого T-клеточного иммунитета может быть опосредовано растворимым фактором, клетки выращивают в планшете Transwell, содержащем верхнюю и нижнюю камеру. Клетки культивируют в трех конфигурациях планшета Transwell для второго анализа, описанного выше, и, кроме того, культивируют в следующих конфигурациях, которые включают CART123-клетку: (4) клетка HL и CART123 клетка в одной камере, например, верхней камере и CART19-клетка и CD19+CD123- опухолевая клетка, например, B-клеточная опухоль, в другой камере, например, в нижней камере; (5) моноцит и CART123-клетка в одной камере, например, верхней камере и CART19-клетка и CD19+CD123- опухолевая клетка, например, B-клеточная опухоль в другой камере, и (6) клетка HL, моноцит и CART123-клетка в одной камере, например, верхней камере и CART19-клетка и CD19+CD123- опухолевая клетка, например, B-клеточная опухоль, в другой камере. Для анализа, может ли ингибирование противоопухолевого T-клеточного иммунитета быть опосредовано контактом, клетки культивируют в трех стандартных контейнерах для культивирования клеток для второго анализа, описанного выше, и кроме того, культивируют в следующих конфигурациях, которые включают CART123-клетку: (4) клетка HL, CART19-клетка, CART123-клетка и CD19+CD123- опухолевая клетка; (5) моноцит, CART19-клетка, CART123-клетка и CD19+CD123- опухолевая клетка, и (6) клетка HL, моноцит, CART19-клетка, CART123-клетка и CD19+CD123- опухолевая клетка. Клетки культивируют в течение желаемого периода времени, а затем оценивают функцию CART19. Анализы для оценки функции CART19 включают анализы пролиферации и цитолиза, например, как описано в примерах 2 и 3.
Пример 16: Клиническое исследование РНК CART123 при рефрактерном или рецидивирующем AML
Это исследование изучают возможность, безопасность и эффективность вводимых внутривенно электропорированных РНК аутологичных T-клеток, экспрессирующих химерные антигенные рецепторы против CD123, экспрессирующие тандемные костимулирующие домены TCRζ и 4-1BB (TCRζ/4-1BB) (обозначаемые как "РНК CART123"), у индивидуумов с острым миелолейкозом (AML). В этом исследовании оценивают 15 индивидуумов. Оцениваемые индивидуумы представляют собой индивидуумов, которые получают по меньшей мере одну дозу РНК CART123-клеток. Продолжительность протокола активного вмешательства составляет приблизительно 2 месяца от визита скрининга. За индивидуумами проводят наблюдение в течение 6 месяцев после их первой инфузии.
Первичные задачи этого исследования сводятся к оценке безопасности РНК CART123 у индивидуумов с AML путем регистрации частоты и тяжести неблагоприятных событий, включая, но, не ограничиваясь ими, оценку частоты CRS (синдрома высвобождения цитокинов) и MAS (синдрома активации макрофагов). Вторичные задачи этого исследования включают: (1) определение сохранения и миграции РНК CART123-клеток; (2) оценку эффективности по меньшей мере 1 дозы РНК CART123-клеток у индивидуумов с AML путем измерения снижения числа бластов в периферической крови и костном мозге; (3) оценку эффективности по меньшей мере 1 дозы РНК CART123-клеток у индивидуумов с AML путем измерения общей частоты ответа (ORR) на 28 +/- 5 суток с использованием (i) стандартных морфологических критериев полного ответа (злокачественные бласты <5% с восстановлением числа), (ii) злокачественные бласты <5% без восстановления числа и (iii) оценку минимального остаточного заболевания; (4) определение общей выживаемости (OS) и выживаемости без прогрессирования заболевания (PFS) и причины(н) гибели всех индивидуумов до 6 месяцев после инфузии РНК CART123-клеток; (5) определение продолжительности ответа (DOR) для реагирующих на лечение индивидуумов до 6 месяцев после инфузии РНК CART123-клеток и (6) определение процента индивидуумов, переходящих к аллогенной HCT (или второй аллогенной HCT).
Соответствующие критериям включения индивидуумы представляют собой мужчину или женщину в возрасте старше 18 лет с AML или миелодиспластическим синдромом, для которых не существует доступных вариантов лечения с использованием доступных в настоящее время видов терапии. Индивидуумы со вторым или последующим рецидивом, любым рецидивом, рефрактерным к терапии спасения, или с устойчивым заболеванием по меньшей мере после двух линий терапии. Индивидуумы должны страдать поддающимся оценке заболеванием >5% бластов в аспирате или биопсии костного мозга, или экстрамедуллярным заболеванием (вовлечение ЦНС не допускается) в течение 2 недель до скрининга.
Индивидуумы получают лечение в/в введением РНК CART-клеток против CD123 в общем до шести доз в течение 2 недель. Дозирование проводят в соответствии с массой индивидуума с повышением дозы для индивидуума. Индивидуумов разделяют на две когорты. Когорта 1 включает первых 3 индивидуумов, которые получают РНК CART123-клетки, и получает 3 дозы после повышения РНК CART123-клеток без противолимфомной химиотерапии до инфузии (фигура 70). Когорта 2 включает оставшихся 12 индивидуумов исследования, и они получают до шести в/в доз РНК CART123-клеток с повышением дозы (фигура 71). Когорта 2 может получать противолимфомную химиотерапию 4 суток (+/- 1 сутки) до первой инфузии CART123-клеток (если ALC>500/мкл). Противолимфомную химиотерапию можно повторять до четвертой дозы РНК CART123-клеток (если ALC> 500/мкл). Противолимфомная химиотерапия включает однократную дозу циклофосфамида (1 мг/м2). Доза противолимфомной химиотерапии в схеме лечения РНК CART123 подбирают так, чтобы увеличивать приживаемость последующих доз T-клеток посредством увеличения гомеостатического пространства.
Дозы CART-клеток по массе приведены в таблице ниже.
|
Масса, используемая для дозирования, может представлять собой массу, получаемую до процедуры афереза. Число клеток основано на CAR+ клетках с экспрессией CAR, определяемой проточной цитометрией. Дозирование не изменяют при изменениях массы индивидуума. Указанные дозы представляют собой +/-20% для учета изменчивости при производстве.
Образец схема дозирования РНК CART123 приведен ниже.
|
Оценки исходного уровня и последующей опухоли проводят в соответствии со стандартом лечебной практики для AML. Оценку костного мозга при AML исходного уровня можно проводить, если последнюю оценку костного мозга индивидуума проводили более 2 недели до первой дозы циклофосфамида. Индивидуумам проводят оценку костного мозга в отношении ответа на лейкоз на сутки 16+/-2 (или в течение 7 суток последней получаемой инфузии РНК CART123), на сутки 28+/-5 и на 3 и 6 месяцы (для индивидуумов, которые не переходили к аллогенной HCT). Уровни CART-клеток и цитокины определяют подходящим тестом в исследовательской лаборатории TCSL. Определения реакции на заболевание может являться стандартным для AML.
Все индивидуумы с аплазией костного мозга на D28+/-5 (или через 14 суток после последней инфузии T-клеток, в зависимости от того, что наступит раньше) подвергаются аллогенной трансплантация гематопоэтических клеток (alloHCT) как стратегии спасения. Таким образом, для всех индивидуумов существует заранее определяемый донор стволовых клеток. Аплазию костного мозга определяют как >75% снижение насыщенности клетками от нормы для данного возраста в сочетании с ANC<0,5 тыс./мкл или тромбоцитами <50 тыс./мкл.
Ограничивающую лечение токсичность (TLT) определяют как любое непредвиденное явление, которое возможно, вероятно или определенно является связанным с инфузией T-клеток, включая негематологическое неблагоприятное явление 3 степени или выше и любую реакцию гиперчувствительности 3 степени или выше и аутоиммунный ответ, как определяют в разделе 5.5. Следующие ниже явления не включают TLT: лихорадка и инфекция, цитопении любой степени, синдром лизиса опухоли, синдром высвобождения цитокинов или любые отклонения метаболических или лабораторных показателей от нормы, которые разрешаются до степени 2 или ниже в течение семи суток.
Отчет о неблагоприятных явлениях начинают с началом введения первой дозы РНК CART123-клеток и продолжают до 4 месяца или до начала кондиционирования для HCT или другой альтернативной терапии, в зависимости от того, что наступит раньше. Индивидуумы могут непрерывно получать повторную оценку на подтверждение острой и суммарной токсичности.
ЭКВИВАЛЕНТЫ
Описания каждого и любого патента, патентной заявки и публикации, цитируемой в настоящем описании, таким образом, полностью включены в настоящее описание посредством ссылки. Несмотря на то, что это изобретение было описано со ссылкой на конкретные аспекты, очевидно, что специалисты в данной области могут разрабатывать другие аспекты и варианты настоящего изобретения, не выходя за рамки сущности и объема изобретения. Прилагаемую формулу изобретения следует истолковывать как включающую все такие аспекты и эквивалентные варианты.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> NOVARTIS AG
THE TRUSTEES OF THE UNIVERSITY OF PENNSYLVANIA
<120> ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА CD123
<130> N2067-7064WO5
<140>
<141>
<150> PCT/CN2014/090508
<151> 2014-11-06
<150> PCT/CN2014/084696
<151> 2014-08-19
<160> 709
<170> PatentIn version 3.5
<210> 1
<211> 21
<212> Белок
<213> Homo sapiens
<400> 1
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 2
<211> 45
<212> Белок
<213> Homo sapiens
<400> 2
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 3
<211> 230
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 3
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys Met
225 230
<210> 4
<211> 282
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 4
Arg Trp Pro Glu Ser Pro Lys Ala Gln Ala Ser Ser Val Pro Thr Ala
1 5 10 15
Gln Pro Gln Ala Glu Gly Ser Leu Ala Lys Ala Thr Thr Ala Pro Ala
20 25 30
Thr Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys
35 40 45
Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro
50 55 60
Ser His Thr Gln Pro Leu Gly Val Tyr Leu Leu Thr Pro Ala Val Gln
65 70 75 80
Asp Leu Trp Leu Arg Asp Lys Ala Thr Phe Thr Cys Phe Val Val Gly
85 90 95
Ser Asp Leu Lys Asp Ala His Leu Thr Trp Glu Val Ala Gly Lys Val
100 105 110
Pro Thr Gly Gly Val Glu Glu Gly Leu Leu Glu Arg His Ser Asn Gly
115 120 125
Ser Gln Ser Gln His Ser Arg Leu Thr Leu Pro Arg Ser Leu Trp Asn
130 135 140
Ala Gly Thr Ser Val Thr Cys Thr Leu Asn His Pro Ser Leu Pro Pro
145 150 155 160
Gln Arg Leu Met Ala Leu Arg Glu Pro Ala Ala Gln Ala Pro Val Lys
165 170 175
Leu Ser Leu Asn Leu Leu Ala Ser Ser Asp Pro Pro Glu Ala Ala Ser
180 185 190
Trp Leu Leu Cys Glu Val Ser Gly Phe Ser Pro Pro Asn Ile Leu Leu
195 200 205
Met Trp Leu Glu Asp Gln Arg Glu Val Asn Thr Ser Gly Phe Ala Pro
210 215 220
Ala Arg Pro Pro Pro Gln Pro Gly Ser Thr Thr Phe Trp Ala Trp Ser
225 230 235 240
Val Leu Arg Val Pro Ala Pro Pro Ser Pro Gln Pro Ala Thr Tyr Thr
245 250 255
Cys Val Val Ser His Glu Asp Ser Arg Thr Leu Leu Asn Ala Ser Arg
260 265 270
Ser Leu Glu Val Ser Tyr Val Thr Asp His
275 280
<210> 5
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 5
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 6
<211> 24
<212> Белок
<213> Homo sapiens
<400> 6
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr Cys
20
<210> 7
<211> 42
<212> Белок
<213> Homo sapiens
<400> 7
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 8
<211> 48
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 8
Gln Arg Arg Lys Tyr Arg Ser Asn Lys Gly Glu Ser Pro Val Glu Pro
1 5 10 15
Ala Glu Pro Cys Arg Tyr Ser Cys Pro Arg Glu Glu Glu Gly Ser Thr
20 25 30
Ile Pro Ile Gln Glu Asp Tyr Arg Lys Pro Glu Pro Ala Cys Ser Pro
35 40 45
<210> 9
<211> 112
<212> Белок
<213> Homo sapiens
<400> 9
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 10
<211> 112
<212> Белок
<213> Homo sapiens
<400> 10
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 11
<211> 1184
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 11
cgtgaggctc cggtgcccgt cagtgggcag agcgcacatc gcccacagtc cccgagaagt 60
tggggggagg ggtcggcaat tgaaccggtg cctagagaag gtggcgcggg gtaaactggg 120
aaagtgatgt cgtgtactgg ctccgccttt ttcccgaggg tgggggagaa ccgtatataa 180
gtgcagtagt cgccgtgaac gttctttttc gcaacgggtt tgccgccaga acacaggtaa 240
gtgccgtgtg tggttcccgc gggcctggcc tctttacggg ttatggccct tgcgtgcctt 300
gaattacttc cacctggctg cagtacgtga ttcttgatcc cgagcttcgg gttggaagtg 360
ggtgggagag ttcgaggcct tgcgcttaag gagccccttc gcctcgtgct tgagttgagg 420
cctggcctgg gcgctggggc cgccgcgtgc gaatctggtg gcaccttcgc gcctgtctcg 480
ctgctttcga taagtctcta gccatttaaa atttttgatg acctgctgcg acgctttttt 540
tctggcaaga tagtcttgta aatgcgggcc aagatctgca cactggtatt tcggtttttg 600
gggccgcggg cggcgacggg gcccgtgcgt cccagcgcac atgttcggcg aggcggggcc 660
tgcgagcgcg gccaccgaga atcggacggg ggtagtctca agctggccgg cctgctctgg 720
tgcctggcct cgcgccgccg tgtatcgccc cgccctgggc ggcaaggctg gcccggtcgg 780
caccagttgc gtgagcggaa agatggccgc ttcccggccc tgctgcaggg agctcaaaat 840
ggaggacgcg gcgctcggga gagcgggcgg gtgagtcacc cacacaaagg aaaagggcct 900
ttccgtcctc agccgtcgct tcatgtgact ccacggagta ccgggcgccg tccaggcacc 960
tcgattagtt ctcgagcttt tggagtacgt cgtctttagg ttggggggag gggttttatg 1020
cgatggagtt tccccacact gagtgggtgg agactgaagt taggccagct tggcacttga 1080
tgtaattctc cttggaattt gccctttttg agtttggatc ttggttcatt ctcaagcctc 1140
agacagtggt tcaaagtttt tttcttccat ttcaggtgtc gtga 1184
<210> 12
<211> 63
<212>ДНК
<213> Homo sapiens
<400> 12
atggccctgc ctgtgacagc cctgctgctg cctctggctc tgctgctgca tgccgctaga 60
ccc 63
<210> 13
<211> 135
<212>ДНК
<213> Homo sapiens
<400> 13
accacgacgc cagcgccgcg accaccaaca ccggcgccca ccatcgcgtc gcagcccctg 60
tccctgcgcc cagaggcgtg ccggccagcg gcggggggcg cagtgcacac gagggggctg 120
gacttcgcct gtgat 135
<210> 14
<211> 690
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 14
gagagcaagt acggccctcc ctgcccccct tgccctgccc ccgagttcct gggcggaccc 60
agcgtgttcc tgttcccccc caagcccaag gacaccctga tgatcagccg gacccccgag 120
gtgacctgtg tggtggtgga cgtgtcccag gaggaccccg aggtccagtt caactggtac 180
gtggacggcg tggaggtgca caacgccaag accaagcccc gggaggagca gttcaatagc 240
acctaccggg tggtgtccgt gctgaccgtg ctgcaccagg actggctgaa cggcaaggaa 300
tacaagtgta aggtgtccaa caagggcctg cccagcagca tcgagaaaac catcagcaag 360
gccaagggcc agcctcggga gccccaggtg tacaccctgc cccctagcca agaggagatg 420
accaagaacc aggtgtccct gacctgcctg gtgaagggct tctaccccag cgacatcgcc 480
gtggagtggg agagcaacgg ccagcccgag aacaactaca agaccacccc ccctgtgctg 540
gacagcgacg gcagcttctt cctgtacagc cggctgaccg tggacaagag ccggtggcag 600
gagggcaacg tctttagctg ctccgtgatg cacgaggccc tgcacaacca ctacacccag 660
aagagcctga gcctgtccct gggcaagatg 690
<210> 15
<211> 847
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 15
aggtggcccg aaagtcccaa ggcccaggca tctagtgttc ctactgcaca gccccaggca 60
gaaggcagcc tagccaaagc tactactgca cctgccacta cgcgcaatac tggccgtggc 120
ggggaggaga agaaaaagga gaaagagaaa gaagaacagg aagagaggga gaccaagacc 180
cctgaatgtc catcccatac ccagccgctg ggcgtctatc tcttgactcc cgcagtacag 240
gacttgtggc ttagagataa ggccaccttt acatgtttcg tcgtgggctc tgacctgaag 300
gatgcccatt tgacttggga ggttgccgga aaggtaccca cagggggggt tgaggaaggg 360
ttgctggagc gccattccaa tggctctcag agccagcact caagactcac ccttccgaga 420
tccctgtgga acgccgggac ctctgtcaca tgtactctaa atcatcctag cctgccccca 480
cagcgtctga tggcccttag agagccagcc gcccaggcac cagttaagct tagcctgaat 540
ctgctcgcca gtagtgatcc cccagaggcc gccagctggc tcttatgcga agtgtccggc 600
tttagcccgc ccaacatctt gctcatgtgg ctggaggacc agcgagaagt gaacaccagc 660
ggcttcgctc cagcccggcc cccaccccag ccgggttcta ccacattctg ggcctggagt 720
gtcttaaggg tcccagcacc acctagcccc cagccagcca catacacctg tgttgtgtcc 780
catgaagata gcaggaccct gctaaatgct tctaggagtc tggaggtttc ctacgtgact 840
gaccatt 847
<210> 16
<211> 30
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
одигонуклеотид"
<400> 16
ggtggcggag gttctggagg tggaggttcc 30
<210> 17
<211> 72
<212>ДНК
<213> Homo sapiens
<400> 17
atctacatct gggcgccctt ggccgggact tgtggggtcc ttctcctgtc actggttatc 60
accctttact gc 72
<210> 18
<211> 126
<212>ДНК
<213> Homo sapiens
<400> 18
aaacggggca gaaagaaact cctgtatata ttcaaacaac catttatgag accagtacaa 60
actactcaag aggaagatgg ctgtagctgc cgatttccag aagaagaaga aggaggatgt 120
gaactg 126
<210> 19
<211> 123
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 19
aggagtaaga ggagcaggct cctgcacagt gactacatga acatgactcc ccgccgcccc 60
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc 120
tcc 123
<210> 20
<211> 336
<212>ДНК
<213> Homo sapiens
<400> 20
agagtgaagt tcagcaggag cgcagacgcc cccgcgtaca agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgc 336
<210> 21
<211> 336
<212>ДНК
<213> Homo sapiens
<400> 21
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgc 336
<210> 22
<211> 373
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 22
Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro Trp Asn Pro Pro Thr
1 5 10 15
Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly Asp Asn Ala Thr Phe
20 25 30
Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe Val Leu Asn Trp Tyr
35 40 45
Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu Ala Ala Phe Pro Glu
50 55 60
Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe Arg Val Thr Gln Leu
65 70 75 80
Pro Asn Gly Arg Asp Phe His Met Ser Val Val Arg Ala Arg Arg Asn
85 90 95
Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser Leu Ala Pro Lys Ala
100 105 110
Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg Val Thr Glu Arg Arg
115 120 125
Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser Pro Arg Pro Ala Gly
130 135 140
Gln Phe Gln Thr Leu Val Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr
145 150 155 160
Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala
165 170 175
Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe
180 185 190
Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val
195 200 205
Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys
210 215 220
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
225 230 235 240
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
245 250 255
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
260 265 270
Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
275 280 285
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
290 295 300
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
305 310 315 320
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
325 330 335
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
340 345 350
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
355 360 365
Ala Leu Pro Pro Arg
370
<210> 23
<211> 1182
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 23
atggccctcc ctgtcactgc cctgcttctc cccctcgcac tcctgctcca cgccgctaga 60
ccacccggat ggtttctgga ctctccggat cgcccgtgga atcccccaac cttctcaccg 120
gcactcttgg ttgtgactga gggcgataat gcgaccttca cgtgctcgtt ctccaacacc 180
tccgaatcat tcgtgctgaa ctggtaccgc atgagcccgt caaaccagac cgacaagctc 240
gccgcgtttc cggaagatcg gtcgcaaccg ggacaggatt gtcggttccg cgtgactcaa 300
ctgccgaatg gcagagactt ccacatgagc gtggtccgcg ctaggcgaaa cgactccggg 360
acctacctgt gcggagccat ctcgctggcg cctaaggccc aaatcaaaga gagcttgagg 420
gccgaactga gagtgaccga gcgcagagct gaggtgccaa ctgcacatcc atccccatcg 480
cctcggcctg cggggcagtt tcagaccctg gtcacgacca ctccggcgcc gcgcccaccg 540
actccggccc caactatcgc gagccagccc ctgtcgctga ggccggaagc atgccgccct 600
gccgccggag gtgctgtgca tacccgggga ttggacttcg catgcgacat ctacatttgg 660
gctcctctcg ccggaacttg tggcgtgctc cttctgtccc tggtcatcac cctgtactgc 720
aagcggggtc ggaaaaagct tctgtacatt ttcaagcagc ccttcatgag gcccgtgcaa 780
accacccagg aggaggacgg ttgctcctgc cggttccccg aagaggaaga aggaggttgc 840
gagctgcgcg tgaagttctc ccggagcgcc gacgcccccg cctataagca gggccagaac 900
cagctgtaca acgaactgaa cctgggacgg cgggaagagt acgatgtgct ggacaagcgg 960
cgcggccggg accccgaaat gggcgggaag cctagaagaa agaaccctca ggaaggcctg 1020
tataacgagc tgcagaagga caagatggcc gaggcctact ccgaaattgg gatgaaggga 1080
gagcggcgga ggggaaaggg gcacgacggc ctgtaccaag gactgtccac cgccaccaag 1140
gacacatacg atgccctgca catgcaggcc cttccccctc gc 1182
<210> 24
<211> 394
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 24
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Pro Gly Trp Phe Leu Asp Ser Pro Asp Arg Pro
20 25 30
Trp Asn Pro Pro Thr Phe Ser Pro Ala Leu Leu Val Val Thr Glu Gly
35 40 45
Asp Asn Ala Thr Phe Thr Cys Ser Phe Ser Asn Thr Ser Glu Ser Phe
50 55 60
Val Leu Asn Trp Tyr Arg Met Ser Pro Ser Asn Gln Thr Asp Lys Leu
65 70 75 80
Ala Ala Phe Pro Glu Asp Arg Ser Gln Pro Gly Gln Asp Cys Arg Phe
85 90 95
Arg Val Thr Gln Leu Pro Asn Gly Arg Asp Phe His Met Ser Val Val
100 105 110
Arg Ala Arg Arg Asn Asp Ser Gly Thr Tyr Leu Cys Gly Ala Ile Ser
115 120 125
Leu Ala Pro Lys Ala Gln Ile Lys Glu Ser Leu Arg Ala Glu Leu Arg
130 135 140
Val Thr Glu Arg Arg Ala Glu Val Pro Thr Ala His Pro Ser Pro Ser
145 150 155 160
Pro Arg Pro Ala Gly Gln Phe Gln Thr Leu Val Thr Thr Thr Pro Ala
165 170 175
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
180 185 190
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
195 200 205
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
210 215 220
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
225 230 235 240
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
245 250 255
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
260 265 270
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg
275 280 285
Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn
290 295 300
Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg
305 310 315 320
Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro
325 330 335
Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala
340 345 350
Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His
355 360 365
Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp
370 375 380
Ala Leu His Met Gln Ala Leu Pro Pro Arg
385 390
<210> 25
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> MISC_FEATURE
<222> (1)..(5)
<223> /примечание="См. описание как обалсть подробного описания
замен и предпочтительных вариантов осуществления"
<400> 25
Gly Gly Gly Gly Ser
1 5
<210> 26
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<220>
<221> MISC_FEATURE
<222> (1)..(30)
<223> /примечание="Эта последовательность может содержать 1-6 повторяющихся единиц "Gly Gly Gly Gly Ser"
<400> 26
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
<210> 27
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 27
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 28
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 28
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 29
<211> 4
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 29
Gly Gly Gly Ser
1
<210> 30
<211> 5000
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> misc_feature
<222> (1)..(5000)
<223> /примечание="Эта последовательность может содержать 50-5000 нуклеотидов"
<400> 30
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2040
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2100
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2160
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2280
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2340
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2400
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2460
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2520
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2580
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2640
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2700
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2760
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2820
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2880
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2940
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3000
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3060
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4980
aaaaaaaaaa aaaaaaaaaa 5000
<210> 31
<211> 100
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 31
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 60
tttttttttt tttttttttt tttttttttt tttttttttt 100
<210> 32
<211> 5000
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> misc_feature
<222> (1)..(5000)
<223> /примечание="Эта последовательность может содержать 50-5000 нуклеотидов"
<400> 32
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 60
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 120
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 180
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 240
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 300
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 360
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 420
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 480
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 540
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 600
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 660
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 720
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 780
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 840
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 900
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 960
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1020
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1080
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1140
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1200
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1260
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1320
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1380
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1440
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1500
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1560
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1620
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1680
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1740
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1800
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1860
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1920
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 1980
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2040
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2100
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2160
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2220
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2280
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2340
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2400
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2460
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2520
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2580
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2640
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2700
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2760
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2820
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2880
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 2940
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3000
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3060
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3120
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3180
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3240
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3300
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3360
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3420
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3480
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3540
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3600
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3660
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3720
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3780
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3840
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3900
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 3960
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4020
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4080
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4140
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4200
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4260
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4320
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4380
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4440
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4500
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4560
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4620
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4680
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4740
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4800
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4860
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4920
tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt tttttttttt 4980
tttttttttt tttttttttt 5000
<210> 33
<211> 5000
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> misc_feature
<222> (1)..(5000)
<223> /примечание="Эта последовательность может содержать 100-5000 нуклеотидов"
<400> 33
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2040
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2100
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2160
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2220
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2280
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2340
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2400
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2460
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2520
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2580
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2640
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2700
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2760
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2820
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2880
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 2940
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3000
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3060
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 3960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 4980
aaaaaaaaaa aaaaaaaaaa 5000
<210> 34
<211> 400
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> misc_feature
<222> (1)..(400)
<223> /примечание="Эта последовательность может содержать 100-400 нуклеотидов"
<400> 34
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 400
<210> 35
<211> 2000
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<220>
<221> misc_feature
<222> (1)..(2000)
<223> /примечание="Эта последовательность может содержать 50-2000 нуклеотидов"
<400> 35
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 180
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 240
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 300
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 360
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 420
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 480
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 540
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 600
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 660
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 720
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 780
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 840
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 900
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 960
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1020
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1080
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1140
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1200
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1260
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1320
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1380
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1440
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1500
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1560
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1620
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1680
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1740
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1800
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1860
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1920
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 1980
aaaaaaaaaa aaaaaaaaaa 2000
<210> 36
<211> 230
<212> Белок
<213> Homo sapiens
<400> 36
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys Met
225 230
<210> 37
<211> 690
<212>ДНК
<213> Homo sapiens
<400> 37
gagagcaagt acggccctcc ctgcccccct tgccctgccc ccgagttcct gggcggaccc 60
agcgtgttcc tgttcccccc caagcccaag gacaccctga tgatcagccg gacccccgag 120
gtgacctgtg tggtggtgga cgtgtcccag gaggaccccg aggtccagtt caactggtac 180
gtggacggcg tggaggtgca caacgccaag accaagcccc gggaggagca gttcaatagc 240
acctaccggg tggtgtccgt gctgaccgtg ctgcaccagg actggctgaa cggcaaggaa 300
tacaagtgta aggtgtccaa caagggcctg cccagcagca tcgagaaaac catcagcaag 360
gccaagggcc agcctcggga gccccaggtg tacaccctgc cccctagcca agaggagatg 420
accaagaacc aggtgtccct gacctgcctg gtgaagggct tctaccccag cgacatcgcc 480
gtggagtggg agagcaacgg ccagcccgag aacaactaca agaccacccc ccctgtgctg 540
gacagcgacg gcagcttctt cctgtacagc cggctgaccg tggacaagag ccggtggcag 600
gagggcaacg tctttagctg ctccgtgatg cacgaggccc tgcacaacca ctacacccag 660
aagagcctga gcctgtccct gggcaagatg 690
<210> 38
<211> 4
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> MISC_FEATURE
<222> (1)..(4)
<223> /примечание="См. описание как обалсть подробного описания
замен и предпочтительных вариантов осуществления"
<400> 38
Gly Gly Gly Ser
1
<210> 39
<211> 1461
<212>ДНК
<213> Homo sapiens
<400> 39
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aactcgtcca gtcaggagcg gaagtcaaga agcccggagc gtcagtcaaa 120
gtgtcatgca aagcctcggg ctacactttc actgggtact acatgcactg ggtgcgccag 180
gctccaggac agggactgga atggatggga tggatcaacc cgaactccgg tggcaccaat 240
tacgcccaga agttccaggg gagggtgacc atgactcgcg acacgtcgat cagcaccgca 300
tacatggagc tgtcaagact ccggtccgac gatactgccg tgtactactg cgcacgggac 360
atgaacattc tggccaccgt gccttttgac atctggggtc agggaactat ggttaccgtg 420
tcctctggtg gaggcggctc cggcgggggg ggaagcggag gcggtggaag cgacattcag 480
atgacccagt cgccttcatc cctttcggcg agcgtgggag atcgcgtcac tatcacttgt 540
cgggcctcgc agtccatctc cacctacctc aattggtacc agcagaagcc aggaaaagca 600
ccgaatctgc tgatctacgc cgcgttttcc ttgcaatcgg gagtgccaag cagattcagc 660
ggatcgggat caggcactga tttcaccctc accatcaact cgctgcaacc ggaggatttc 720
gctacgtact attgccaaca aggagacagc gtgccgctca ccttcggcgg agggactaag 780
ctggaaatca agaccactac cccagcaccg aggccaccca ccccggctcc taccatcgcc 840
tcccagcctc tgtccctgcg tccggaggca tgtagacccg cagctggtgg ggccgtgcat 900
acccggggtc ttgacttcgc ctgcgatatc tacatttggg cccctctggc tggtacttgc 960
ggggtcctgc tgctttcact cgtgatcact ctttactgta agcgcggtcg gaagaagctg 1020
ctgtacatct ttaagcaacc cttcatgagg cctgtgcaga ctactcaaga ggaggacggc 1080
tgttcatgcc ggttcccaga ggaggaggaa ggcggctgcg aactgcgcgt gaaattcagc 1140
cgcagcgcag atgctccagc ctacaagcag gggcagaacc agctctacaa cgaactcaat 1200
cttggtcgga gagaggagta cgacgtgctg gacaagcgga gaggacggga cccagaaatg 1260
ggcgggaagc cgcgcagaaa gaatccccaa gagggcctgt acaacgagct ccaaaaggat 1320
aagatggcag aagcctatag cgagattggt atgaaagggg aacgcagaag aggcaaaggc 1380
cacgacggac tgtaccaggg actcagcacc gccaccaagg acacctatga cgctcttcac 1440
atgcaggccc tgccgcctcg g 1461
<210> 40
<211> 1461
<212>ДНК
<213> Homo sapiens
<400> 40
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc aactcgtcca aagcggagcg gaagtcaaga aacccggagc gagcgtgaaa 120
gtgtcctgca aagcctccgg ctacaccttt acgggctact acatgcactg ggtgcgccag 180
gcaccaggac agggtcttga atggatggga tggatcaacc ctaattcggg cggaactaac 240
tacgcacaga agttccaggg gagagtgact ctgactcggg atacctccat ctcaactgtc 300
tacatggaac tctcccgctt gcggtcagat gatacggcag tgtactactg cgcccgcgac 360
atgaatatcc tggctaccgt gccgttcgac atctggggac aggggactat ggttactgtc 420
tcatcgggcg gtggaggttc aggaggaggc ggctcgggag gcggaggttc ggacattcag 480
atgacccagt ccccatcctc tctgtcggcc agcgtcggag atagggtgac cattacctgt 540
cgggcctcgc aaagcatctc ctcgtacctc aactggtatc agcaaaagcc gggaaaggcg 600
cctaagctgc tgatctacgc cgcttcgagc ttgcaaagcg gggtgccatc cagattctcg 660
ggatcaggct caggaaccga cttcaccctg accgtgaaca gcctccagcc ggaggacttt 720
gccacttact actgccagca gggagactcc gtgccgctta ctttcggggg gggtacccgc 780
ctggagatca agaccactac cccagcaccg aggccaccca ccccggctcc taccatcgcc 840
tcccagcctc tgtccctgcg tccggaggca tgtagacccg cagctggtgg ggccgtgcat 900
acccggggtc ttgacttcgc ctgcgatatc tacatttggg cccctctggc tggtacttgc 960
ggggtcctgc tgctttcact cgtgatcact ctttactgta agcgcggtcg gaagaagctg 1020
ctgtacatct ttaagcaacc cttcatgagg cctgtgcaga ctactcaaga ggaggacggc 1080
tgttcatgcc ggttcccaga ggaggaggaa ggcggctgcg aactgcgcgt gaaattcagc 1140
cgcagcgcag atgctccagc ctacaagcag gggcagaacc agctctacaa cgaactcaat 1200
cttggtcgga gagaggagta cgacgtgctg gacaagcgga gaggacggga cccagaaatg 1260
ggcgggaagc cgcgcagaaa gaatccccaa gagggcctgt acaacgagct ccaaaaggat 1320
aagatggcag aagcctatag cgagattggt atgaaagggg aacgcagaag aggcaaaggc 1380
cacgacggac tgtaccaggg actcagcacc gccaccaagg acacctatga cgctcttcac 1440
atgcaggccc tgccgcctcg g 1461
<210> 41
<211> 1461
<212>ДНК
<213> Homo sapiens
<400> 41
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aactcgttca atccggcgca gaagtcaaga agccaggagc atcagtgaaa 120
gtgtcctgca aagcctcagg ctacatcttc acgggatact acatccactg ggtgcgccag 180
gctccgggcc agggccttga gtggatgggc tggatcaacc ctaactctgg gggaaccaac 240
tacgctcaga agttccaggg gagggtcact atgactcgcg atacctccat ctccactgcg 300
tacatggaac tctcgggact gagatccgac gatcctgccg tgtactactg cgcccgggac 360
atgaacatct tggcgaccgt gccgtttgac atttggggac agggcaccct cgtcactgtg 420
tcgagcggtg gaggaggctc ggggggtggc ggatcaggag ggggaggaag cgacatccag 480
ctgactcaga gcccatcgtc gttgtccgcg tcggtggggg atagagtgac cattacttgc 540
cgcgccagcc agagcatctc atcatatctg aattggtacc agcagaagcc cggaaaggcc 600
ccaaaactgc tgatctacgc tgcaagcagc ctccaatcgg gagtgccgtc acggttctcc 660
gggtccggtt cgggaactga ctttaccctg accgtgaatt cgctgcaacc ggaggatttc 720
gccacgtact actgtcagca aggagactcc gtgccgctga ccttcggtgg aggcaccaag 780
gtcgaaatca agaccactac cccagcaccg aggccaccca ccccggctcc taccatcgcc 840
tcccagcctc tgtccctgcg tccggaggca tgtagacccg cagctggtgg ggccgtgcat 900
acccggggtc ttgacttcgc ctgcgatatc tacatttggg cccctctggc tggtacttgc 960
ggggtcctgc tgctttcact cgtgatcact ctttactgta agcgcggtcg gaagaagctg 1020
ctgtacatct ttaagcaacc cttcatgagg cctgtgcaga ctactcaaga ggaggacggc 1080
tgttcatgcc ggttcccaga ggaggaggaa ggcggctgcg aactgcgcgt gaaattcagc 1140
cgcagcgcag atgctccagc ctacaagcag gggcagaacc agctctacaa cgaactcaat 1200
cttggtcgga gagaggagta cgacgtgctg gacaagcgga gaggacggga cccagaaatg 1260
ggcgggaagc cgcgcagaaa gaatccccaa gagggcctgt acaacgagct ccaaaaggat 1320
aagatggcag aagcctatag cgagattggt atgaaagggg aacgcagaag aggcaaaggc 1380
cacgacggac tgtaccaggg actcagcacc gccaccaagg acacctatga cgctcttcac 1440
atgcaggccc tgccgcctcg g 1461
<210> 42
<211> 1467
<212>ДНК
<213> Homo sapiens
<400> 42
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtcc aactccaaca gtcaggcgca gaagtgaaaa agagcggtgc atcggtgaaa 120
gtgtcatgca aagcctcggg ctacaccttc actgactact atatgcactg gctgcggcag 180
gcaccgggac agggacttga gtggatggga tggatcaacc cgaattcagg ggacactaac 240
tacgcgcaga agttccaggg gagagtgacc ctgacgaggg acacctcaat ttcgaccgtc 300
tacatggaat tgtcgcgcct gagatcggac gatactgctg tgtactactg tgcccgcgac 360
atgaacatcc tcgcgactgt gccttttgat atctggggac aggggactat ggtcaccgtt 420
tcctccgctt ccggtggcgg aggctcggga ggccgggcct ccggtggagg aggcagcgac 480
atccagatga ctcagagccc ttcctcgctg agcgcctcag tgggagatcg cgtgaccatc 540
acttgccggg ccagccagtc catttcgtcc tacctcaatt ggtaccagca gaagccggga 600
aaggcgccca agctcttgat ctacgctgcg agctccctgc aaagcggggt gccgagccga 660
ttctcgggtt ccggctcggg aaccgacttc actctgacca tctcatccct gcaaccagag 720
gactttgcca cctactactg ccaacaagga gattctgtcc cactgacgtt cggcggagga 780
accaaggtcg aaatcaagac cactacccca gcaccgaggc cacccacccc ggctcctacc 840
atcgcctccc agcctctgtc cctgcgtccg gaggcatgta gacccgcagc tggtggggcc 900
gtgcataccc ggggtcttga cttcgcctgc gatatctaca tttgggcccc tctggctggt 960
acttgcgggg tcctgctgct ttcactcgtg atcactcttt actgtaagcg cggtcggaag 1020
aagctgctgt acatctttaa gcaacccttc atgaggcctg tgcagactac tcaagaggag 1080
gacggctgtt catgccggtt cccagaggag gaggaaggcg gctgcgaact gcgcgtgaaa 1140
ttcagccgca gcgcagatgc tccagcctac aagcaggggc agaaccagct ctacaacgaa 1200
ctcaatcttg gtcggagaga ggagtacgac gtgctggaca agcggagagg acgggaccca 1260
gaaatgggcg ggaagccgcg cagaaagaat ccccaagagg gcctgtacaa cgagctccaa 1320
aaggataaga tggcagaagc ctatagcgag attggtatga aaggggaacg cagaagaggc 1380
aaaggccacg acggactgta ccagggactc agcaccgcca ccaaggacac ctatgacgct 1440
cttcacatgc aggccctgcc gcctcgg 1467
<210> 43
<211> 41
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 43
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 44
<211> 123
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 44
aggagtaaga ggagcaggct cctgcacagt gactacatga acatgactcc ccgccgcccc 60
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc 120
tcc 123
<210> 45
<211> 35
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 45
Thr Lys Lys Lys Tyr Ser Ser Ser Val His Asp Pro Asn Gly Glu Tyr
1 5 10 15
Met Phe Met Arg Ala Val Asn Thr Ala Lys Lys Ser Arg Leu Thr Asp
20 25 30
Val Thr Leu
35
<210> 46
<211> 105
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 46
acaaaaaaga agtattcatc cagtgtgcac gaccctaacg gtgaatacat gttcatgaga 60
gcagtgaaca cagccaaaaa atccagactc acagatgtga cccta 105
<210> 47
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 47
Gln Gln His Asn Lys Tyr Pro Tyr Thr
1 5
<210> 48
<211> 134
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 48
accacgacgc cagcgccgcg accaccaaca ccggcgccca ccatcgcgtc gcagcccctg 60
tccctgcgcc cagaggcgtg ccggccagcg gcggggggcg cagtgcacac gagggggctg 120
gacttcgcct gtga 134
<210> 49
<400> 49
000
<210> 50
<400> 50
000
<210> 51
<400> 51
000
<210> 52
<400> 52
000
<210> 53
<400> 53
000
<210> 54
<400> 54
000
<210> 55
<400> 55
000
<210> 56
<400> 56
000
<210> 57
<400> 57
000
<210> 58
<400> 58
000
<210> 59
<400> 59
000
<210> 60
<400> 60
000
<210> 61
<400> 61
000
<210> 62
<400> 62
000
<210> 63
<400> 63
000
<210> 64
<211> 30
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<220>
<221> MISC_FEATURE
<222> (1)..(30)
<223> /примечание="Эта последовательность может содержать 1-6 повторяющихся единиц "Gly Gly Gly Gly Ser"
<400> 64
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
20 25 30
<210> 65
<400> 65
000
<210> 66
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 66
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc agctggtcca gtcgggagcc gaagtcaaga agcccggcgc tagcgtgaaa 120
gtgtcctgca aagcctccgg gtacacattc acctcctact ggatgaattg ggtcagacag 180
gcgcccggcc agggactcga gtggatggga aggattgatc cttacgactc cgaaacccat 240
tacaaccaga agttcaagga ccgcgtgacc atgactgtgg ataagtccac ttccaccgct 300
tacatggagc tgtccagcct gcgctccgag gataccgcag tgtactactg cgcccgggga 360
aactgggacg actattgggg acagggaact accgtgaccg tgtcaagcgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga cgtgcagctc 480
acccagtcgc cctcatttct gtcggcctca gtgggagaca gagtgaccat tacttgtcgg 540
gcctccaaga gcatctccaa ggacctggcc tggtatcagc agaagccagg aaaggcgcct 600
aagttgctca tctactcggg gtcgaccctg caatctggcg tgccgtcccg gttctccggt 660
tcgggaagcg gtaccgaatt cacccttact atctcctccc tgcaaccgga ggacttcgcc 720
acctactact gccaacagca caacaagtac ccgtacactt tcgggggtgg cacgaaggtc 780
gaaatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 67
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 67
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc agctggtcca gtcgggagcc gaagtcaaga agcccggcgc tagcgtgaaa 120
gtgtcctgca aagcctccgg gtacacattc acctcctact ggatgaattg ggtcagacag 180
gcgcccggcc agggactcga gtggatggga aggattgatc cttacgactc cgaaacccat 240
tacaaccaga agttcaagga ccgcgtgacc atgactgtgg ataagtccac ttccaccgct 300
tacatggagc tgtccagcct gcgctccgag gataccgcag tgtactactg cgcccgggga 360
aactgggacg actattgggg acagggaact accgtgaccg tgtcaagcgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga agtggtgctg 480
acccagtcgc ccgcaaccct ctctctgtcg ccgggagaac gcgccactct ttcctgtcgg 540
gcgtccaaga gcatctcaaa ggacctcgcc tggtaccagc agaagcctgg tcaagccccg 600
cggctgctga tctactccgg ctccacgctg caatcaggaa tcccagccag attttccggt 660
tcggggtcgg ggactgactt caccttgacc attagctcgc tggaacctga ggacttcgcc 720
gtgtattact gccagcagca caacaagtac ccgtacacct tcggaggcgg tactaaggtc 780
gagatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 68
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 68
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc agctggtcca gtcgggagcc gaagtcaaga agcccggcgc tagcgtgaaa 120
gtgtcctgca aagcctccgg gtacacattc acctcctact ggatgaattg ggtcagacag 180
gcgcccggcc agggactcga gtggatggga aggattgatc cttacgactc cgaaacccat 240
tacaaccaga agttcaagga ccgcgtgacc atgactgtgg ataagtccac ttccaccgct 300
tacatggagc tgtccagcct gcgctccgag gataccgcag tgtactactg cgcccgggga 360
aactgggacg actattgggg acagggaact accgtgaccg tgtcaagcgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga cgtcgtgatg 480
acccagtcac cggcattcct gtccgtgact cccggagaaa aggtcacgat tacttgccgg 540
gcgtccaaga gcatctccaa ggacctcgcc tggtaccaac agaagccgga ccaggcccct 600
aagctgttga tctactcggg gtccaccctt caatcgggag tgccatcgcg gtttagcggt 660
tcgggttctg ggaccgactt cactttcacc atctcctcac tggaagccga ggatgccgcc 720
acttactact gtcagcagca caacaagtat ccgtacacct tcggaggcgg taccaaagtg 780
gagatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 69
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 69
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc agctggtcca gtcgggagcc gaagtcaaga agcccggcgc tagcgtgaaa 120
gtgtcctgca aagcctccgg gtacacattc acctcctact ggatgaattg ggtcagacag 180
gcgcccggcc agggactcga gtggatggga aggattgatc cttacgactc cgaaacccat 240
tacaaccaga agttcaagga ccgcgtgacc atgactgtgg ataagtccac ttccaccgct 300
tacatggagc tgtccagcct gcgctccgag gataccgcag tgtactactg cgcccgggga 360
aactgggacg actattgggg acagggaact accgtgaccg tgtcaagcgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga cgtggtcatg 480
actcagtccc cggactcact cgcggtgtcg cttggagaga gagcgaccat caactgtcgg 540
gcctcaaaga gcatcagcaa ggacctggcc tggtaccagc agaagccggg acagccgcca 600
aagctgctga tctactccgg gtccaccttg caatctggtg tccctgaccg gttctccggt 660
tccgggtcgg gtaccgactt cacgctcact atttcgtcgc tgcaagccga agatgtggcc 720
gtgtactatt gccaacagca caacaagtac ccctacactt ttggcggagg caccaaggtg 780
gaaatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 70
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 70
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgacgtgc agctcaccca gtcgccctca tttctgtcgg cctcagtggg agacagagtg 120
accattactt gtcgggcctc caagagcatc tccaaggacc tggcctggta tcagcagaag 180
ccaggaaagg cgcctaagtt gctcatctac tcggggtcga ccctgcaatc tggcgtgccg 240
tcccggttct ccggttcggg aagcggtacc gaattcaccc ttactatctc ctccctgcaa 300
ccggaggact tcgccaccta ctactgccaa cagcacaaca agtacccgta cactttcggg 360
ggtggcacga aggtcgaaat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagccaagtg cagctggtcc agtcgggagc cgaagtcaag 480
aagcccggcg ctagcgtgaa agtgtcctgc aaagcctccg ggtacacatt cacctcctac 540
tggatgaatt gggtcagaca ggcgcccggc cagggactcg agtggatggg aaggattgat 600
ccttacgact ccgaaaccca ttacaaccag aagttcaagg accgcgtgac catgactgtg 660
gataagtcca cttccaccgc ttacatggag ctgtccagcc tgcgctccga ggataccgca 720
gtgtactact gcgcccgggg aaactgggac gactattggg gacagggaac taccgtgacc 780
gtgtcaagca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 71
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 71
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgg tgctgaccca gtcgcccgca accctctctc tgtcgccggg agaacgcgcc 120
actctttcct gtcgggcgtc caagagcatc tcaaaggacc tcgcctggta ccagcagaag 180
cctggtcaag ccccgcggct gctgatctac tccggctcca cgctgcaatc aggaatccca 240
gccagatttt ccggttcggg gtcggggact gacttcacct tgaccattag ctcgctggaa 300
cctgaggact tcgccgtgta ttactgccag cagcacaaca agtacccgta caccttcgga 360
ggcggtacta aggtcgagat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagccaagtg cagctggtcc agtcgggagc cgaagtcaag 480
aagcccggcg ctagcgtgaa agtgtcctgc aaagcctccg ggtacacatt cacctcctac 540
tggatgaatt gggtcagaca ggcgcccggc cagggactcg agtggatggg aaggattgat 600
ccttacgact ccgaaaccca ttacaaccag aagttcaagg accgcgtgac catgactgtg 660
gataagtcca cttccaccgc ttacatggag ctgtccagcc tgcgctccga ggataccgca 720
gtgtactact gcgcccgggg aaactgggac gactattggg gacagggaac taccgtgacc 780
gtgtcaagca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 72
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 72
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgacgtcg tgatgaccca gtcaccggca ttcctgtccg tgactcccgg agaaaaggtc 120
acgattactt gccgggcgtc caagagcatc tccaaggacc tcgcctggta ccaacagaag 180
ccggaccagg cccctaagct gttgatctac tcggggtcca cccttcaatc gggagtgcca 240
tcgcggttta gcggttcggg ttctgggacc gacttcactt tcaccatctc ctcactggaa 300
gccgaggatg ccgccactta ctactgtcag cagcacaaca agtatccgta caccttcgga 360
ggcggtacca aagtggagat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagccaagtg cagctggtcc agtcgggagc cgaagtcaag 480
aagcccggcg ctagcgtgaa agtgtcctgc aaagcctccg ggtacacatt cacctcctac 540
tggatgaatt gggtcagaca ggcgcccggc cagggactcg agtggatggg aaggattgat 600
ccttacgact ccgaaaccca ttacaaccag aagttcaagg accgcgtgac catgactgtg 660
gataagtcca cttccaccgc ttacatggag ctgtccagcc tgcgctccga ggataccgca 720
gtgtactact gcgcccgggg aaactgggac gactattggg gacagggaac taccgtgacc 780
gtgtcaagca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 73
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 73
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgacgtgg tcatgactca gtccccggac tcactcgcgg tgtcgcttgg agagagagcg 120
accatcaact gtcgggcctc aaagagcatc agcaaggacc tggcctggta ccagcagaag 180
ccgggacagc cgccaaagct gctgatctac tccgggtcca ccttgcaatc tggtgtccct 240
gaccggttct ccggttccgg gtcgggtacc gacttcacgc tcactatttc gtcgctgcaa 300
gccgaagatg tggccgtgta ctattgccaa cagcacaaca agtaccccta cacttttggc 360
ggaggcacca aggtggaaat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagccaagtg cagctggtcc agtcgggagc cgaagtcaag 480
aagcccggcg ctagcgtgaa agtgtcctgc aaagcctccg ggtacacatt cacctcctac 540
tggatgaatt gggtcagaca ggcgcccggc cagggactcg agtggatggg aaggattgat 600
ccttacgact ccgaaaccca ttacaaccag aagttcaagg accgcgtgac catgactgtg 660
gataagtcca cttccaccgc ttacatggag ctgtccagcc tgcgctccga ggataccgca 720
gtgtactact gcgcccgggg aaactgggac gactattggg gacagggaac taccgtgacc 780
gtgtcaagca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 74
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 74
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc agctggtgca gtcaggcagc gaactgaaga agcccggagc ctccgtcaaa 120
gtgtcctgca aagcctcggg atacaccttc acctcctact ggatgaactg ggtccgccag 180
gcacctggac aggggctgga gtggatggga aggatcgatc cctacgattc cgaaacccat 240
tacaatcaga agttcaagga ccggtttgtg ttctccgtgg acaagtccgt gtccaccgcc 300
tacctccaaa ttagcagcct gaaggcggag gatacagctg tctactactg cgctcgcgga 360
aactgggatg actattgggg ccagggaact accgtgactg tgtcctccgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga cgtgcagctc 480
acccagtcgc cctcatttct gtcggcctca gtgggagaca gagtgaccat tacttgtcgg 540
gcctccaaga gcatctccaa ggacctggcc tggtatcagc agaagccagg aaaggcgcct 600
aagttgctca tctactcggg gtcgaccctg caatctggcg tgccgtcccg gttctccggt 660
tcgggaagcg gtaccgaatt cacccttact atctcctccc tgcaaccgga ggacttcgcc 720
acctactact gccaacagca caacaagtac ccgtacactt tcgggggtgg cacgaaggtc 780
gaaatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 75
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 75
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc agctggtgca gtcaggcagc gaactgaaga agcccggagc ctccgtcaaa 120
gtgtcctgca aagcctcggg atacaccttc acctcctact ggatgaactg ggtccgccag 180
gcacctggac aggggctgga gtggatggga aggatcgatc cctacgattc cgaaacccat 240
tacaatcaga agttcaagga ccggtttgtg ttctccgtgg acaagtccgt gtccaccgcc 300
tacctccaaa ttagcagcct gaaggcggag gatacagctg tctactactg cgctcgcgga 360
aactgggatg actattgggg ccagggaact accgtgactg tgtcctccgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga agtggtgctg 480
acccagtcgc ccgcaaccct ctctctgtcg ccgggagaac gcgccactct ttcctgtcgg 540
gcgtccaaga gcatctcaaa ggacctcgcc tggtaccagc agaagcctgg tcaagccccg 600
cggctgctga tctactccgg ctccacgctg caatcaggaa tcccagccag attttccggt 660
tcggggtcgg ggactgactt caccttgacc attagctcgc tggaacctga ggacttcgcc 720
gtgtattact gccagcagca caacaagtac ccgtacacct tcggaggcgg tactaaggtc 780
gagatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 76
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 76
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc agctggtgca gtcaggcagc gaactgaaga agcccggagc ctccgtcaaa 120
gtgtcctgca aagcctcggg atacaccttc acctcctact ggatgaactg ggtccgccag 180
gcacctggac aggggctgga gtggatggga aggatcgatc cctacgattc cgaaacccat 240
tacaatcaga agttcaagga ccggtttgtg ttctccgtgg acaagtccgt gtccaccgcc 300
tacctccaaa ttagcagcct gaaggcggag gatacagctg tctactactg cgctcgcgga 360
aactgggatg actattgggg ccagggaact accgtgactg tgtcctccgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga cgtcgtgatg 480
acccagtcac cggcattcct gtccgtgact cccggagaaa aggtcacgat tacttgccgg 540
gcgtccaaga gcatctccaa ggacctcgcc tggtaccaac agaagccgga ccaggcccct 600
aagctgttga tctactcggg gtccaccctt caatcgggag tgccatcgcg gtttagcggt 660
tcgggttctg ggaccgactt cactttcacc atctcctcac tggaagccga ggatgccgcc 720
acttactact gtcagcagca caacaagtat ccgtacacct tcggaggcgg taccaaagtg 780
gagatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 77
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 77
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc agctggtgca gtcaggcagc gaactgaaga agcccggagc ctccgtcaaa 120
gtgtcctgca aagcctcggg atacaccttc acctcctact ggatgaactg ggtccgccag 180
gcacctggac aggggctgga gtggatggga aggatcgatc cctacgattc cgaaacccat 240
tacaatcaga agttcaagga ccggtttgtg ttctccgtgg acaagtccgt gtccaccgcc 300
tacctccaaa ttagcagcct gaaggcggag gatacagctg tctactactg cgctcgcgga 360
aactgggatg actattgggg ccagggaact accgtgactg tgtcctccgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga cgtggtcatg 480
actcagtccc cggactcact cgcggtgtcg cttggagaga gagcgaccat caactgtcgg 540
gcctcaaaga gcatcagcaa ggacctggcc tggtaccagc agaagccggg acagccgcca 600
aagctgctga tctactccgg gtccaccttg caatctggtg tccctgaccg gttctccggt 660
tccgggtcgg gtaccgactt cacgctcact atttcgtcgc tgcaagccga agatgtggcc 720
gtgtactatt gccaacagca caacaagtac ccctacactt ttggcggagg caccaaggtg 780
gaaatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 78
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 78
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgacgtgc agctcaccca gtcgccctca tttctgtcgg cctcagtggg agacagagtg 120
accattactt gtcgggcctc caagagcatc tccaaggacc tggcctggta tcagcagaag 180
ccaggaaagg cgcctaagtt gctcatctac tcggggtcga ccctgcaatc tggcgtgccg 240
tcccggttct ccggttcggg aagcggtacc gaattcaccc ttactatctc ctccctgcaa 300
ccggaggact tcgccaccta ctactgccaa cagcacaaca agtacccgta cactttcggg 360
ggtggcacga aggtcgaaat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagccaagtg cagctggtgc agtcaggcag cgaactgaag 480
aagcccggag cctccgtcaa agtgtcctgc aaagcctcgg gatacacctt cacctcctac 540
tggatgaact gggtccgcca ggcacctgga caggggctgg agtggatggg aaggatcgat 600
ccctacgatt ccgaaaccca ttacaatcag aagttcaagg accggtttgt gttctccgtg 660
gacaagtccg tgtccaccgc ctacctccaa attagcagcc tgaaggcgga ggatacagct 720
gtctactact gcgctcgcgg aaactgggat gactattggg gccagggaac taccgtgact 780
gtgtcctcca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 79
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 79
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgg tgctgaccca gtcgcccgca accctctctc tgtcgccggg agaacgcgcc 120
actctttcct gtcgggcgtc caagagcatc tcaaaggacc tcgcctggta ccagcagaag 180
cctggtcaag ccccgcggct gctgatctac tccggctcca cgctgcaatc aggaatccca 240
gccagatttt ccggttcggg gtcggggact gacttcacct tgaccattag ctcgctggaa 300
cctgaggact tcgccgtgta ttactgccag cagcacaaca agtacccgta caccttcgga 360
ggcggtacta aggtcgagat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagccaagtg cagctggtgc agtcaggcag cgaactgaag 480
aagcccggag cctccgtcaa agtgtcctgc aaagcctcgg gatacacctt cacctcctac 540
tggatgaact gggtccgcca ggcacctgga caggggctgg agtggatggg aaggatcgat 600
ccctacgatt ccgaaaccca ttacaatcag aagttcaagg accggtttgt gttctccgtg 660
gacaagtccg tgtccaccgc ctacctccaa attagcagcc tgaaggcgga ggatacagct 720
gtctactact gcgctcgcgg aaactgggat gactattggg gccagggaac taccgtgact 780
gtgtcctcca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 80
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 80
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgacgtcg tgatgaccca gtcaccggca ttcctgtccg tgactcccgg agaaaaggtc 120
acgattactt gccgggcgtc caagagcatc tccaaggacc tcgcctggta ccaacagaag 180
ccggaccagg cccctaagct gttgatctac tcggggtcca cccttcaatc gggagtgcca 240
tcgcggttta gcggttcggg ttctgggacc gacttcactt tcaccatctc ctcactggaa 300
gccgaggatg ccgccactta ctactgtcag cagcacaaca agtatccgta caccttcgga 360
ggcggtacca aagtggagat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagccaagtg cagctggtgc agtcaggcag cgaactgaag 480
aagcccggag cctccgtcaa agtgtcctgc aaagcctcgg gatacacctt cacctcctac 540
tggatgaact gggtccgcca ggcacctgga caggggctgg agtggatggg aaggatcgat 600
ccctacgatt ccgaaaccca ttacaatcag aagttcaagg accggtttgt gttctccgtg 660
gacaagtccg tgtccaccgc ctacctccaa attagcagcc tgaaggcgga ggatacagct 720
gtctactact gcgctcgcgg aaactgggat gactattggg gccagggaac taccgtgact 780
gtgtcctcca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 81
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 81
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgacgtgg tcatgactca gtccccggac tcactcgcgg tgtcgcttgg agagagagcg 120
accatcaact gtcgggcctc aaagagcatc agcaaggacc tggcctggta ccagcagaag 180
ccgggacagc cgccaaagct gctgatctac tccgggtcca ccttgcaatc tggtgtccct 240
gaccggttct ccggttccgg gtcgggtacc gacttcacgc tcactatttc gtcgctgcaa 300
gccgaagatg tggccgtgta ctattgccaa cagcacaaca agtaccccta cacttttggc 360
ggaggcacca aggtggaaat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagccaagtg cagctggtgc agtcaggcag cgaactgaag 480
aagcccggag cctccgtcaa agtgtcctgc aaagcctcgg gatacacctt cacctcctac 540
tggatgaact gggtccgcca ggcacctgga caggggctgg agtggatggg aaggatcgat 600
ccctacgatt ccgaaaccca ttacaatcag aagttcaagg accggtttgt gttctccgtg 660
gacaagtccg tgtccaccgc ctacctccaa attagcagcc tgaaggcgga ggatacagct 720
gtctactact gcgctcgcgg aaactgggat gactattggg gccagggaac taccgtgact 780
gtgtcctcca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 82
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 82
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaggtgc agctggtgca gagcggagcc gaggtcaaga agcctggaga atccctgagg 120
atcagctgca aaggcagcgg gtataccttc acctcctact ggatgaattg ggtccgccag 180
atgcccggaa aaggcctgga gtggatggga cggattgacc cctacgactc ggaaacccat 240
tacaaccaga agttcaagga tcacgtgacc atctccgtgg acaagtccat ttccactgcg 300
tacctccagt ggtcaagcct gaaggcctcc gacactgcta tgtactactg cgcacgcgga 360
aactgggatg attactgggg acagggaaca accgtgactg tgtcctccgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga cgtgcagctc 480
acccagtcgc cctcatttct gtcggcctca gtgggagaca gagtgaccat tacttgtcgg 540
gcctccaaga gcatctccaa ggacctggcc tggtatcagc agaagccagg aaaggcgcct 600
aagttgctca tctactcggg gtcgaccctg caatctggcg tgccgtcccg gttctccggt 660
tcgggaagcg gtaccgaatt cacccttact atctcctccc tgcaaccgga ggacttcgcc 720
acctactact gccaacagca caacaagtac ccgtacactt tcgggggtgg cacgaaggtc 780
gaaatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 83
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 83
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaggtgc agctggtgca gagcggagcc gaggtcaaga agcctggaga atccctgagg 120
atcagctgca aaggcagcgg gtataccttc acctcctact ggatgaattg ggtccgccag 180
atgcccggaa aaggcctgga gtggatggga cggattgacc cctacgactc ggaaacccat 240
tacaaccaga agttcaagga tcacgtgacc atctccgtgg acaagtccat ttccactgcg 300
tacctccagt ggtcaagcct gaaggcctcc gacactgcta tgtactactg cgcacgcgga 360
aactgggatg attactgggg acagggaaca accgtgactg tgtcctccgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga agtggtgctg 480
acccagtcgc ccgcaaccct ctctctgtcg ccgggagaac gcgccactct ttcctgtcgg 540
gcgtccaaga gcatctcaaa ggacctcgcc tggtaccagc agaagcctgg tcaagccccg 600
cggctgctga tctactccgg ctccacgctg caatcaggaa tcccagccag attttccggt 660
tcggggtcgg ggactgactt caccttgacc attagctcgc tggaacctga ggacttcgcc 720
gtgtattact gccagcagca caacaagtac ccgtacacct tcggaggcgg tactaaggtc 780
gagatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 84
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 84
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaggtgc agctggtgca gagcggagcc gaggtcaaga agcctggaga atccctgagg 120
atcagctgca aaggcagcgg gtataccttc acctcctact ggatgaattg ggtccgccag 180
atgcccggaa aaggcctgga gtggatggga cggattgacc cctacgactc ggaaacccat 240
tacaaccaga agttcaagga tcacgtgacc atctccgtgg acaagtccat ttccactgcg 300
tacctccagt ggtcaagcct gaaggcctcc gacactgcta tgtactactg cgcacgcgga 360
aactgggatg attactgggg acagggaaca accgtgactg tgtcctccgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga cgtcgtgatg 480
acccagtcac cggcattcct gtccgtgact cccggagaaa aggtcacgat tacttgccgg 540
gcgtccaaga gcatctccaa ggacctcgcc tggtaccaac agaagccgga ccaggcccct 600
aagctgttga tctactcggg gtccaccctt caatcgggag tgccatcgcg gtttagcggt 660
tcgggttctg ggaccgactt cactttcacc atctcctcac tggaagccga ggatgccgcc 720
acttactact gtcagcagca caacaagtat ccgtacacct tcggaggcgg taccaaagtg 780
gagatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 85
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 85
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaggtgc agctggtgca gagcggagcc gaggtcaaga agcctggaga atccctgagg 120
atcagctgca aaggcagcgg gtataccttc acctcctact ggatgaattg ggtccgccag 180
atgcccggaa aaggcctgga gtggatggga cggattgacc cctacgactc ggaaacccat 240
tacaaccaga agttcaagga tcacgtgacc atctccgtgg acaagtccat ttccactgcg 300
tacctccagt ggtcaagcct gaaggcctcc gacactgcta tgtactactg cgcacgcgga 360
aactgggatg attactgggg acagggaaca accgtgactg tgtcctccgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga cgtggtcatg 480
actcagtccc cggactcact cgcggtgtcg cttggagaga gagcgaccat caactgtcgg 540
gcctcaaaga gcatcagcaa ggacctggcc tggtaccagc agaagccggg acagccgcca 600
aagctgctga tctactccgg gtccaccttg caatctggtg tccctgaccg gttctccggt 660
tccgggtcgg gtaccgactt cacgctcact atttcgtcgc tgcaagccga agatgtggcc 720
gtgtactatt gccaacagca caacaagtac ccctacactt ttggcggagg caccaaggtg 780
gaaatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 86
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 86
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgacgtgc agctcaccca gtcgccctca tttctgtcgg cctcagtggg agacagagtg 120
accattactt gtcgggcctc caagagcatc tccaaggacc tggcctggta tcagcagaag 180
ccaggaaagg cgcctaagtt gctcatctac tcggggtcga ccctgcaatc tggcgtgccg 240
tcccggttct ccggttcggg aagcggtacc gaattcaccc ttactatctc ctccctgcaa 300
ccggaggact tcgccaccta ctactgccaa cagcacaaca agtacccgta cactttcggg 360
ggtggcacga aggtcgaaat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagcgaggtg cagctggtgc agagcggagc cgaggtcaag 480
aagcctggag aatccctgag gatcagctgc aaaggcagcg ggtatacctt cacctcctac 540
tggatgaatt gggtccgcca gatgcccgga aaaggcctgg agtggatggg acggattgac 600
ccctacgact cggaaaccca ttacaaccag aagttcaagg atcacgtgac catctccgtg 660
gacaagtcca tttccactgc gtacctccag tggtcaagcc tgaaggcctc cgacactgct 720
atgtactact gcgcacgcgg aaactgggat gattactggg gacagggaac aaccgtgact 780
gtgtcctcca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 87
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 87
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgg tgctgaccca gtcgcccgca accctctctc tgtcgccggg agaacgcgcc 120
actctttcct gtcgggcgtc caagagcatc tcaaaggacc tcgcctggta ccagcagaag 180
cctggtcaag ccccgcggct gctgatctac tccggctcca cgctgcaatc aggaatccca 240
gccagatttt ccggttcggg gtcggggact gacttcacct tgaccattag ctcgctggaa 300
cctgaggact tcgccgtgta ttactgccag cagcacaaca agtacccgta caccttcgga 360
ggcggtacta aggtcgagat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagcgaggtg cagctggtgc agagcggagc cgaggtcaag 480
aagcctggag aatccctgag gatcagctgc aaaggcagcg ggtatacctt cacctcctac 540
tggatgaatt gggtccgcca gatgcccgga aaaggcctgg agtggatggg acggattgac 600
ccctacgact cggaaaccca ttacaaccag aagttcaagg atcacgtgac catctccgtg 660
gacaagtcca tttccactgc gtacctccag tggtcaagcc tgaaggcctc cgacactgct 720
atgtactact gcgcacgcgg aaactgggat gattactggg gacagggaac aaccgtgact 780
gtgtcctcca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 88
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 88
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgacgtcg tgatgaccca gtcaccggca ttcctgtccg tgactcccgg agaaaaggtc 120
acgattactt gccgggcgtc caagagcatc tccaaggacc tcgcctggta ccaacagaag 180
ccggaccagg cccctaagct gttgatctac tcggggtcca cccttcaatc gggagtgcca 240
tcgcggttta gcggttcggg ttctgggacc gacttcactt tcaccatctc ctcactggaa 300
gccgaggatg ccgccactta ctactgtcag cagcacaaca agtatccgta caccttcgga 360
ggcggtacca aagtggagat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagcgaggtg cagctggtgc agagcggagc cgaggtcaag 480
aagcctggag aatccctgag gatcagctgc aaaggcagcg ggtatacctt cacctcctac 540
tggatgaatt gggtccgcca gatgcccgga aaaggcctgg agtggatggg acggattgac 600
ccctacgact cggaaaccca ttacaaccag aagttcaagg atcacgtgac catctccgtg 660
gacaagtcca tttccactgc gtacctccag tggtcaagcc tgaaggcctc cgacactgct 720
atgtactact gcgcacgcgg aaactgggat gattactggg gacagggaac aaccgtgact 780
gtgtcctcca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 89
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 89
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgacgtgg tcatgactca gtccccggac tcactcgcgg tgtcgcttgg agagagagcg 120
accatcaact gtcgggcctc aaagagcatc agcaaggacc tggcctggta ccagcagaag 180
ccgggacagc cgccaaagct gctgatctac tccgggtcca ccttgcaatc tggtgtccct 240
gaccggttct ccggttccgg gtcgggtacc gacttcacgc tcactatttc gtcgctgcaa 300
gccgaagatg tggccgtgta ctattgccaa cagcacaaca agtaccccta cacttttggc 360
ggaggcacca aggtggaaat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagcgaggtg cagctggtgc agagcggagc cgaggtcaag 480
aagcctggag aatccctgag gatcagctgc aaaggcagcg ggtatacctt cacctcctac 540
tggatgaatt gggtccgcca gatgcccgga aaaggcctgg agtggatggg acggattgac 600
ccctacgact cggaaaccca ttacaaccag aagttcaagg atcacgtgac catctccgtg 660
gacaagtcca tttccactgc gtacctccag tggtcaagcc tgaaggcctc cgacactgct 720
atgtactact gcgcacgcgg aaactgggat gattactggg gacagggaac aaccgtgact 780
gtgtcctcca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 90
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 90
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc agctcgtcga gagcggaggg ggactggtgc agcccggagg aagcctgagg 120
ctgtcctgcg ctgcctccgg ctacaccttc acctcctact ggatgaactg ggtcagacag 180
gcacctggaa agggactggt ctgggtgtcg cgcattgacc cctacgactc cgaaacccat 240
tacaatcaga aattcaagga ccgcttcacc atctccgtgg acaaagccaa gagcaccgcg 300
tacctccaaa tgaactccct gcgcgctgag gatacagcag tgtactattg cgcccgggga 360
aactgggatg attactgggg ccagggaact actgtgactg tgtcatccgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga cgtgcagctc 480
acccagtcgc cctcatttct gtcggcctca gtgggagaca gagtgaccat tacttgtcgg 540
gcctccaaga gcatctccaa ggacctggcc tggtatcagc agaagccagg aaaggcgcct 600
aagttgctca tctactcggg gtcgaccctg caatctggcg tgccgtcccg gttctccggt 660
tcgggaagcg gtaccgaatt cacccttact atctcctccc tgcaaccgga ggacttcgcc 720
acctactact gccaacagca caacaagtac ccgtacactt tcgggggtgg cacgaaggtc 780
gaaatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 91
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 91
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc agctcgtcga gagcggaggg ggactggtgc agcccggagg aagcctgagg 120
ctgtcctgcg ctgcctccgg ctacaccttc acctcctact ggatgaactg ggtcagacag 180
gcacctggaa agggactggt ctgggtgtcg cgcattgacc cctacgactc cgaaacccat 240
tacaatcaga aattcaagga ccgcttcacc atctccgtgg acaaagccaa gagcaccgcg 300
tacctccaaa tgaactccct gcgcgctgag gatacagcag tgtactattg cgcccgggga 360
aactgggatg attactgggg ccagggaact actgtgactg tgtcatccgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga agtggtgctg 480
acccagtcgc ccgcaaccct ctctctgtcg ccgggagaac gcgccactct ttcctgtcgg 540
gcgtccaaga gcatctcaaa ggacctcgcc tggtaccagc agaagcctgg tcaagccccg 600
cggctgctga tctactccgg ctccacgctg caatcaggaa tcccagccag attttccggt 660
tcggggtcgg ggactgactt caccttgacc attagctcgc tggaacctga ggacttcgcc 720
gtgtattact gccagcagca caacaagtac ccgtacacct tcggaggcgg tactaaggtc 780
gagatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 92
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 92
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc agctcgtcga gagcggaggg ggactggtgc agcccggagg aagcctgagg 120
ctgtcctgcg ctgcctccgg ctacaccttc acctcctact ggatgaactg ggtcagacag 180
gcacctggaa agggactggt ctgggtgtcg cgcattgacc cctacgactc cgaaacccat 240
tacaatcaga aattcaagga ccgcttcacc atctccgtgg acaaagccaa gagcaccgcg 300
tacctccaaa tgaactccct gcgcgctgag gatacagcag tgtactattg cgcccgggga 360
aactgggatg attactgggg ccagggaact actgtgactg tgtcatccgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga cgtcgtgatg 480
acccagtcac cggcattcct gtccgtgact cccggagaaa aggtcacgat tacttgccgg 540
gcgtccaaga gcatctccaa ggacctcgcc tggtaccaac agaagccgga ccaggcccct 600
aagctgttga tctactcggg gtccaccctt caatcgggag tgccatcgcg gtttagcggt 660
tcgggttctg ggaccgactt cactttcacc atctcctcac tggaagccga ggatgccgcc 720
acttactact gtcagcagca caacaagtat ccgtacacct tcggaggcgg taccaaagtg 780
gagatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 93
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 93
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgc agctcgtcga gagcggaggg ggactggtgc agcccggagg aagcctgagg 120
ctgtcctgcg ctgcctccgg ctacaccttc acctcctact ggatgaactg ggtcagacag 180
gcacctggaa agggactggt ctgggtgtcg cgcattgacc cctacgactc cgaaacccat 240
tacaatcaga aattcaagga ccgcttcacc atctccgtgg acaaagccaa gagcaccgcg 300
tacctccaaa tgaactccct gcgcgctgag gatacagcag tgtactattg cgcccgggga 360
aactgggatg attactgggg ccagggaact actgtgactg tgtcatccgg gggtggcggt 420
agcggaggag ggggctccgg cggcggcggc tcagggggcg gaggaagcga cgtggtcatg 480
actcagtccc cggactcact cgcggtgtcg cttggagaga gagcgaccat caactgtcgg 540
gcctcaaaga gcatcagcaa ggacctggcc tggtaccagc agaagccggg acagccgcca 600
aagctgctga tctactccgg gtccaccttg caatctggtg tccctgaccg gttctccggt 660
tccgggtcgg gtaccgactt cacgctcact atttcgtcgc tgcaagccga agatgtggcc 720
gtgtactatt gccaacagca caacaagtac ccctacactt ttggcggagg caccaaggtg 780
gaaatcaaga ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 94
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 94
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgacgtgc agctcaccca gtcgccctca tttctgtcgg cctcagtggg agacagagtg 120
accattactt gtcgggcctc caagagcatc tccaaggacc tggcctggta tcagcagaag 180
ccaggaaagg cgcctaagtt gctcatctac tcggggtcga ccctgcaatc tggcgtgccg 240
tcccggttct ccggttcggg aagcggtacc gaattcaccc ttactatctc ctccctgcaa 300
ccggaggact tcgccaccta ctactgccaa cagcacaaca agtacccgta cactttcggg 360
ggtggcacga aggtcgaaat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagcgaagtg cagctcgtcg agagcggagg gggactggtg 480
cagcccggag gaagcctgag gctgtcctgc gctgcctccg gctacacctt cacctcctac 540
tggatgaact gggtcagaca ggcacctgga aagggactgg tctgggtgtc gcgcattgac 600
ccctacgact ccgaaaccca ttacaatcag aaattcaagg accgcttcac catctccgtg 660
gacaaagcca agagcaccgc gtacctccaa atgaactccc tgcgcgctga ggatacagca 720
gtgtactatt gcgcccgggg aaactgggat gattactggg gccagggaac tactgtgact 780
gtgtcatcca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 95
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 95
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgaagtgg tgctgaccca gtcgcccgca accctctctc tgtcgccggg agaacgcgcc 120
actctttcct gtcgggcgtc caagagcatc tcaaaggacc tcgcctggta ccagcagaag 180
cctggtcaag ccccgcggct gctgatctac tccggctcca cgctgcaatc aggaatccca 240
gccagatttt ccggttcggg gtcggggact gacttcacct tgaccattag ctcgctggaa 300
cctgaggact tcgccgtgta ttactgccag cagcacaaca agtacccgta caccttcgga 360
ggcggtacta aggtcgagat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagcgaagtg cagctcgtcg agagcggagg gggactggtg 480
cagcccggag gaagcctgag gctgtcctgc gctgcctccg gctacacctt cacctcctac 540
tggatgaact gggtcagaca ggcacctgga aagggactgg tctgggtgtc gcgcattgac 600
ccctacgact ccgaaaccca ttacaatcag aaattcaagg accgcttcac catctccgtg 660
gacaaagcca agagcaccgc gtacctccaa atgaactccc tgcgcgctga ggatacagca 720
gtgtactatt gcgcccgggg aaactgggat gattactggg gccagggaac tactgtgact 780
gtgtcatcca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 96
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 96
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgacgtcg tgatgaccca gtcaccggca ttcctgtccg tgactcccgg agaaaaggtc 120
acgattactt gccgggcgtc caagagcatc tccaaggacc tcgcctggta ccaacagaag 180
ccggaccagg cccctaagct gttgatctac tcggggtcca cccttcaatc gggagtgcca 240
tcgcggttta gcggttcggg ttctgggacc gacttcactt tcaccatctc ctcactggaa 300
gccgaggatg ccgccactta ctactgtcag cagcacaaca agtatccgta caccttcgga 360
ggcggtacca aagtggagat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagcgaagtg cagctcgtcg agagcggagg gggactggtg 480
cagcccggag gaagcctgag gctgtcctgc gctgcctccg gctacacctt cacctcctac 540
tggatgaact gggtcagaca ggcacctgga aagggactgg tctgggtgtc gcgcattgac 600
ccctacgact ccgaaaccca ttacaatcag aaattcaagg accgcttcac catctccgtg 660
gacaaagcca agagcaccgc gtacctccaa atgaactccc tgcgcgctga ggatacagca 720
gtgtactatt gcgcccgggg aaactgggat gattactggg gccagggaac tactgtgact 780
gtgtcatcca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 97
<211> 1458
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 97
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
cccgacgtgg tcatgactca gtccccggac tcactcgcgg tgtcgcttgg agagagagcg 120
accatcaact gtcgggcctc aaagagcatc agcaaggacc tggcctggta ccagcagaag 180
ccgggacagc cgccaaagct gctgatctac tccgggtcca ccttgcaatc tggtgtccct 240
gaccggttct ccggttccgg gtcgggtacc gacttcacgc tcactatttc gtcgctgcaa 300
gccgaagatg tggccgtgta ctattgccaa cagcacaaca agtaccccta cacttttggc 360
ggaggcacca aggtggaaat caaggggggt ggcggtagcg gaggaggggg ctccggcggc 420
ggcggctcag ggggcggagg aagcgaagtg cagctcgtcg agagcggagg gggactggtg 480
cagcccggag gaagcctgag gctgtcctgc gctgcctccg gctacacctt cacctcctac 540
tggatgaact gggtcagaca ggcacctgga aagggactgg tctgggtgtc gcgcattgac 600
ccctacgact ccgaaaccca ttacaatcag aaattcaagg accgcttcac catctccgtg 660
gacaaagcca agagcaccgc gtacctccaa atgaactccc tgcgcgctga ggatacagca 720
gtgtactatt gcgcccgggg aaactgggat gattactggg gccagggaac tactgtgact 780
gtgtcatcca ccactacccc agcaccgagg ccacccaccc cggctcctac catcgcctcc 840
cagcctctgt ccctgcgtcc ggaggcatgt agacccgcag ctggtggggc cgtgcatacc 900
cggggtcttg acttcgcctg cgatatctac atttgggccc ctctggctgg tacttgcggg 960
gtcctgctgc tttcactcgt gatcactctt tactgtaagc gcggtcggaa gaagctgctg 1020
tacatcttta agcaaccctt catgaggcct gtgcagacta ctcaagagga ggacggctgt 1080
tcatgccggt tcccagagga ggaggaaggc ggctgcgaac tgcgcgtgaa attcagccgc 1140
agcgcagatg ctccagccta caagcagggg cagaaccagc tctacaacga actcaatctt 1200
ggtcggagag aggagtacga cgtgctggac aagcggagag gacgggaccc agaaatgggc 1260
gggaagccgc gcagaaagaa tccccaagag ggcctgtaca acgagctcca aaaggataag 1320
atggcagaag cctatagcga gattggtatg aaaggggaac gcagaagagg caaaggccac 1380
gacggactgt accagggact cagcaccgcc accaaggaca cctatgacgc tcttcacatg 1440
caggccctgc cgcctcgg 1458
<210> 98
<211> 487
<212> Белок
<213> Homo sapiens
<400> 98
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Gly Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser
85 90 95
Ile Ser Thr Ala Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro
115 120 125
Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln
145 150 155 160
Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val
165 170 175
Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Thr Tyr Leu Asn Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Lys Ala Pro Asn Leu Leu Ile Tyr Ala Ala
195 200 205
Phe Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
210 215 220
Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro Glu Asp Phe
225 230 235 240
Ala Thr Tyr Tyr Cys Gln Gln Gly Asp Ser Val Pro Leu Thr Phe Gly
245 250 255
Gly Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro
260 265 270
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
275 280 285
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
290 295 300
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
305 310 315 320
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
325 330 335
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
340 345 350
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
355 360 365
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
370 375 380
Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
385 390 395 400
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
405 410 415
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
420 425 430
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
435 440 445
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
450 455 460
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
465 470 475 480
Met Gln Ala Leu Pro Pro Arg
485
<210> 99
<211> 487
<212> Белок
<213> Homo sapiens
<400> 99
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Gly Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Leu Thr Arg Asp Thr Ser
85 90 95
Ile Ser Thr Val Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro
115 120 125
Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln
145 150 155 160
Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val
165 170 175
Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala
195 200 205
Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
210 215 220
Gly Thr Asp Phe Thr Leu Thr Val Asn Ser Leu Gln Pro Glu Asp Phe
225 230 235 240
Ala Thr Tyr Tyr Cys Gln Gln Gly Asp Ser Val Pro Leu Thr Phe Gly
245 250 255
Gly Gly Thr Arg Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro
260 265 270
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
275 280 285
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
290 295 300
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
305 310 315 320
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
325 330 335
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
340 345 350
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
355 360 365
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
370 375 380
Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
385 390 395 400
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
405 410 415
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
420 425 430
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
435 440 445
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
450 455 460
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
465 470 475 480
Met Gln Ala Leu Pro Pro Arg
485
<210> 100
<211> 487
<212> Белок
<213> Homo sapiens
<400> 100
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Ile Phe Thr Gly Tyr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser
85 90 95
Ile Ser Thr Ala Tyr Met Glu Leu Ser Gly Leu Arg Ser Asp Asp Pro
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro
115 120 125
Phe Asp Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln
145 150 155 160
Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val
165 170 175
Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala
195 200 205
Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
210 215 220
Gly Thr Asp Phe Thr Leu Thr Val Asn Ser Leu Gln Pro Glu Asp Phe
225 230 235 240
Ala Thr Tyr Tyr Cys Gln Gln Gly Asp Ser Val Pro Leu Thr Phe Gly
245 250 255
Gly Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro
260 265 270
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
275 280 285
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
290 295 300
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
305 310 315 320
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
325 330 335
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
340 345 350
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
355 360 365
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
370 375 380
Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
385 390 395 400
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
405 410 415
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
420 425 430
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
435 440 445
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
450 455 460
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
465 470 475 480
Met Gln Ala Leu Pro Pro Arg
485
<210> 101
<211> 336
<212> Белок
<213> Homo sapiens
<400> 101
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Ser Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Asp Tyr Tyr Met His Trp Leu Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Asp Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Leu Thr Arg Asp Thr Ser
85 90 95
Ile Ser Thr Val Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro
115 120 125
Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp
145 150 155 160
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
165 170 175
Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu
180 185 190
Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
195 200 205
Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
210 215 220
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
225 230 235 240
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asp Ser Val Pro Leu Thr
245 250 255
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro
260 265 270
Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu
275 280 285
Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg
290 295 300
Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly
305 310 315 320
Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys
325 330 335
<210> 102
<400> 102
000
<210> 103
<400> 103
000
<210> 104
<400> 104
000
<210> 105
<400> 105
000
<210> 106
<400> 106
000
<210> 107
<400> 107
000
<210> 108
<400> 108
000
<210> 109
<400> 109
000
<210> 110
<400> 110
000
<210> 111
<400> 111
000
<210> 112
<400> 112
000
<210> 113
<400> 113
000
<210> 114
<400> 114
000
<210> 115
<400> 115
000
<210> 116
<400> 116
000
<210> 117
<400> 117
000
<210> 118
<400> 118
000
<210> 119
<400> 119
000
<210> 120
<400> 120
000
<210> 121
<400> 121
000
<210> 122
<400> 122
000
<210> 123
<400> 123
000
<210> 124
<400> 124
000
<210> 125
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 125
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser
85 90 95
Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Gln Leu
145 150 155 160
Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly Asp Arg Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 126
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 126
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser
85 90 95
Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Val Leu
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 127
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 127
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser
85 90 95
Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly Glu Lys Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 128
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 128
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser
85 90 95
Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr
165 170 175
Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 129
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 129
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu
20 25 30
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr
210 215 220
Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 130
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 130
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr
210 215 220
Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 131
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 131
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu
20 25 30
Ser Val Thr Pro Gly Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile
85 90 95
Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr
210 215 220
Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 132
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 132
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu
20 25 30
Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr
210 215 220
Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 133
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 133
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser
85 90 95
Val Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Gln Leu
145 150 155 160
Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly Asp Arg Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 134
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 134
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser
85 90 95
Val Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Val Leu
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 135
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 135
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser
85 90 95
Val Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly Glu Lys Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 136
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 136
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser
85 90 95
Val Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr
165 170 175
Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 137
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 137
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu
20 25 30
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val
210 215 220
Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 138
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 138
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val
210 215 220
Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 139
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 139
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu
20 25 30
Ser Val Thr Pro Gly Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile
85 90 95
Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val
210 215 220
Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 140
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 140
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu
20 25 30
Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val
210 215 220
Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 141
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 141
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser
85 90 95
Ile Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr
100 105 110
Ala Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Gln Leu
145 150 155 160
Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly Asp Arg Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 142
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 142
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser
85 90 95
Ile Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr
100 105 110
Ala Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Val Leu
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 143
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 143
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser
85 90 95
Ile Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr
100 105 110
Ala Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly Glu Lys Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 144
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 144
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser
85 90 95
Ile Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr
100 105 110
Ala Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr
165 170 175
Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 145
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 145
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu
20 25 30
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile
210 215 220
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
225 230 235 240
Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 146
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 146
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile
210 215 220
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
225 230 235 240
Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 147
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 147
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu
20 25 30
Ser Val Thr Pro Gly Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile
85 90 95
Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile
210 215 220
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
225 230 235 240
Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 148
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 148
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu
20 25 30
Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile
210 215 220
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
225 230 235 240
Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 149
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 149
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala
85 90 95
Lys Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Gln Leu
145 150 155 160
Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly Asp Arg Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 150
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 150
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala
85 90 95
Lys Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Val Leu
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 151
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 151
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala
85 90 95
Lys Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly Glu Lys Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 152
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 152
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala
85 90 95
Lys Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr
165 170 175
Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 153
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 153
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu
20 25 30
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
145 150 155 160
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly
180 185 190
Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys
210 215 220
Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 154
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 154
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
145 150 155 160
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly
180 185 190
Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys
210 215 220
Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 155
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 155
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu
20 25 30
Ser Val Thr Pro Gly Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile
85 90 95
Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
145 150 155 160
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly
180 185 190
Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys
210 215 220
Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 156
<211> 486
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 156
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu
20 25 30
Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
145 150 155 160
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly
180 185 190
Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys
210 215 220
Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser Thr Thr Thr Pro Ala Pro Arg Pro Pro
260 265 270
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
275 280 285
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
290 295 300
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
305 310 315 320
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
325 330 335
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
340 345 350
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
355 360 365
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
370 375 380
Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
385 390 395 400
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
405 410 415
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
420 425 430
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
435 440 445
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
450 455 460
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
465 470 475 480
Gln Ala Leu Pro Pro Arg
485
<210> 157
<211> 264
<212> Белок
<213> Homo sapiens
<400> 157
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Gly Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser
85 90 95
Ile Ser Thr Ala Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro
115 120 125
Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln
145 150 155 160
Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val
165 170 175
Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Thr Tyr Leu Asn Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Lys Ala Pro Asn Leu Leu Ile Tyr Ala Ala
195 200 205
Phe Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
210 215 220
Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro Glu Asp Phe
225 230 235 240
Ala Thr Tyr Tyr Cys Gln Gln Gly Asp Ser Val Pro Leu Thr Phe Gly
245 250 255
Gly Gly Thr Lys Leu Glu Ile Lys
260
<210> 158
<211> 264
<212> Белок
<213> Homo sapiens
<400> 158
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Gly Tyr Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Leu Thr Arg Asp Thr Ser
85 90 95
Ile Ser Thr Val Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro
115 120 125
Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln
145 150 155 160
Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val
165 170 175
Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala
195 200 205
Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
210 215 220
Gly Thr Asp Phe Thr Leu Thr Val Asn Ser Leu Gln Pro Glu Asp Phe
225 230 235 240
Ala Thr Tyr Tyr Cys Gln Gln Gly Asp Ser Val Pro Leu Thr Phe Gly
245 250 255
Gly Gly Thr Arg Leu Glu Ile Lys
260
<210> 159
<211> 264
<212> Белок
<213> Homo sapiens
<400> 159
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Ile Phe Thr Gly Tyr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser
85 90 95
Ile Ser Thr Ala Tyr Met Glu Leu Ser Gly Leu Arg Ser Asp Asp Pro
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro
115 120 125
Phe Asp Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln
145 150 155 160
Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val
165 170 175
Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp
180 185 190
Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala
195 200 205
Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
210 215 220
Gly Thr Asp Phe Thr Leu Thr Val Asn Ser Leu Gln Pro Glu Asp Phe
225 230 235 240
Ala Thr Tyr Tyr Cys Gln Gln Gly Asp Ser Val Pro Leu Thr Phe Gly
245 250 255
Gly Gly Thr Lys Val Glu Ile Lys
260
<210> 160
<211> 266
<212> Белок
<213> Homo sapiens
<400> 160
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Ser Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Asp Tyr Tyr Met His Trp Leu Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Trp Ile Asn Pro Asn Ser Gly Asp Thr Asn
65 70 75 80
Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Leu Thr Arg Asp Thr Ser
85 90 95
Ile Ser Thr Val Tyr Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro
115 120 125
Phe Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp
145 150 155 160
Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp
165 170 175
Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu
180 185 190
Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
195 200 205
Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
210 215 220
Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu
225 230 235 240
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asp Ser Val Pro Leu Thr
245 250 255
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
260 265
<210> 161
<400> 161
000
<210> 162
<400> 162
000
<210> 163
<400> 163
000
<210> 164
<400> 164
000
<210> 165
<400> 165
000
<210> 166
<400> 166
000
<210> 167
<400> 167
000
<210> 168
<400> 168
000
<210> 169
<400> 169
000
<210> 170
<400> 170
000
<210> 171
<400> 171
000
<210> 172
<400> 172
000
<210> 173
<400> 173
000
<210> 174
<400> 174
000
<210> 175
<400> 175
000
<210> 176
<400> 176
000
<210> 177
<400> 177
000
<210> 178
<400> 178
000
<210> 179
<400> 179
000
<210> 180
<400> 180
000
<210> 181
<400> 181
000
<210> 182
<400> 182
000
<210> 183
<400> 183
000
<210> 184
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 184
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser
85 90 95
Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Gln Leu
145 150 155 160
Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly Asp Arg Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 185
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 185
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser
85 90 95
Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Val Leu
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 186
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 186
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser
85 90 95
Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly Glu Lys Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 187
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 187
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser
85 90 95
Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr
165 170 175
Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 188
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 188
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu
20 25 30
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr
210 215 220
Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 189
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 189
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr
210 215 220
Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 190
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 190
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu
20 25 30
Ser Val Thr Pro Gly Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile
85 90 95
Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr
210 215 220
Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 191
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 191
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu
20 25 30
Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr
210 215 220
Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 192
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 192
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser
85 90 95
Val Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Gln Leu
145 150 155 160
Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly Asp Arg Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 193
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 193
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser
85 90 95
Val Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Val Leu
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 194
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 194
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser
85 90 95
Val Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly Glu Lys Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 195
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 195
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu
20 25 30
Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser
85 90 95
Val Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr
165 170 175
Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 196
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 196
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu
20 25 30
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val
210 215 220
Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 197
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 197
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val
210 215 220
Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 198
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 198
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu
20 25 30
Ser Val Thr Pro Gly Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile
85 90 95
Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val
210 215 220
Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 199
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 199
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu
20 25 30
Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys
145 150 155 160
Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val
210 215 220
Ser Thr Ala Tyr Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 200
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 200
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser
85 90 95
Ile Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr
100 105 110
Ala Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Gln Leu
145 150 155 160
Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly Asp Arg Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 201
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 201
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser
85 90 95
Ile Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr
100 105 110
Ala Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Val Leu
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 202
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 202
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser
85 90 95
Ile Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr
100 105 110
Ala Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly Glu Lys Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 203
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 203
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val
20 25 30
Lys Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys
50 55 60
Gly Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser
85 90 95
Ile Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr
100 105 110
Ala Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr
165 170 175
Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 204
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 204
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu
20 25 30
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile
210 215 220
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
225 230 235 240
Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 205
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 205
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile
210 215 220
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
225 230 235 240
Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 206
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 206
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu
20 25 30
Ser Val Thr Pro Gly Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile
85 90 95
Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile
210 215 220
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
225 230 235 240
Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 207
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 207
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu
20 25 30
Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys
145 150 155 160
Lys Pro Gly Glu Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly
180 185 190
Leu Glu Trp Met Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile
210 215 220
Ser Thr Ala Tyr Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala
225 230 235 240
Met Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 208
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 208
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala
85 90 95
Lys Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Gln Leu
145 150 155 160
Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly Asp Arg Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 209
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 209
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala
85 90 95
Lys Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Val Leu
145 150 155 160
Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
165 170 175
Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 210
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 210
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala
85 90 95
Lys Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly Glu Lys Val Thr
165 170 175
Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala
225 230 235 240
Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 211
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 211
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr
35 40 45
Thr Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys
50 55 60
Gly Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His
65 70 75 80
Tyr Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala
85 90 95
Lys Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Ala Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln
115 120 125
Gly Thr Thr Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met
145 150 155 160
Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr
165 170 175
Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr
180 185 190
Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Ser Gly Ser
195 200 205
Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
210 215 220
Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala
225 230 235 240
Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly
245 250 255
Gly Thr Lys Val Glu Ile Lys
260
<210> 212
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 212
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu
20 25 30
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
145 150 155 160
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly
180 185 190
Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys
210 215 220
Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 213
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 213
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu
20 25 30
Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala
50 55 60
Pro Arg Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro
65 70 75 80
Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
145 150 155 160
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly
180 185 190
Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys
210 215 220
Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 214
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 214
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu
20 25 30
Ser Val Thr Pro Gly Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile
85 90 95
Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
145 150 155 160
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly
180 185 190
Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys
210 215 220
Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 215
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 215
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu
20 25 30
Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys
35 40 45
Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro
50 55 60
Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro
65 70 75 80
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
85 90 95
Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His
100 105 110
Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val
145 150 155 160
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr
165 170 175
Phe Thr Ser Tyr Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly
180 185 190
Leu Val Trp Val Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr
195 200 205
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys
210 215 220
Ser Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala
225 230 235 240
Val Tyr Tyr Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly
245 250 255
Thr Thr Val Thr Val Ser Ser
260
<210> 216
<211> 121
<212> Белок
<213> Homo sapiens
<400> 216
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 217
<211> 121
<212> Белок
<213> Homo sapiens
<400> 217
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Arg Asp Thr Ser Ile Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 218
<211> 121
<212> Белок
<213> Homo sapiens
<400> 218
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Gly Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Gly Leu Arg Ser Asp Asp Pro Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 219
<211> 121
<212> Белок
<213> Homo sapiens
<400> 219
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Ser Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met His Trp Leu Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Asp Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Arg Asp Thr Ser Ile Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 220
<400> 220
000
<210> 221
<400> 221
000
<210> 222
<400> 222
000
<210> 223
<400> 223
000
<210> 224
<400> 224
000
<210> 225
<400> 225
000
<210> 226
<400> 226
000
<210> 227
<400> 227
000
<210> 228
<400> 228
000
<210> 229
<400> 229
000
<210> 230
<400> 230
000
<210> 231
<400> 231
000
<210> 232
<400> 232
000
<210> 233
<400> 233
000
<210> 234
<400> 234
000
<210> 235
<400> 235
000
<210> 236
<400> 236
000
<210> 237
<400> 237
000
<210> 238
<400> 238
000
<210> 239
<400> 239
000
<210> 240
<400> 240
000
<210> 241
<400> 241
000
<210> 242
<400> 242
000
<210> 243
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 243
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 244
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 244
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 245
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 245
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 246
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 246
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 247
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 247
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 248
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 248
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 249
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 249
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 250
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 250
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 251
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 251
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 252
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 252
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 253
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 253
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 254
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 254
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 255
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 255
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 256
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 256
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 257
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 257
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 258
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 258
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 259
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 259
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 260
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 260
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 261
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 261
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 262
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 262
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 263
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 263
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 264
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 264
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 265
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 265
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 266
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 266
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 267
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 267
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 268
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 268
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 269
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 269
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 270
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 270
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 271
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 271
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 272
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 272
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 273
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 273
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 274
<211> 115
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 274
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser
115
<210> 275
<211> 107
<212> Белок
<213> Homo sapiens
<400> 275
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Thr Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Asn Leu Leu Ile
35 40 45
Tyr Ala Ala Phe Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asp Ser Val Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 276
<211> 107
<212> Белок
<213> Homo sapiens
<400> 276
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Val Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asp Ser Val Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Arg Leu Glu Ile Lys
100 105
<210> 277
<211> 107
<212> Белок
<213> Homo sapiens
<400> 277
Asp Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Val Asn Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asp Ser Val Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 278
<211> 107
<212> Белок
<213> Homo sapiens
<400> 278
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asp Ser Val Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 279
<400> 279
000
<210> 280
<400> 280
000
<210> 281
<400> 281
000
<210> 282
<400> 282
000
<210> 283
<400> 283
000
<210> 284
<400> 284
000
<210> 285
<400> 285
000
<210> 286
<400> 286
000
<210> 287
<400> 287
000
<210> 288
<400> 288
000
<210> 289
<400> 289
000
<210> 290
<400> 290
000
<210> 291
<400> 291
000
<210> 292
<400> 292
000
<210> 293
<400> 293
000
<210> 294
<400> 294
000
<210> 295
<400> 295
000
<210> 296
<400> 296
000
<210> 297
<400> 297
000
<210> 298
<400> 298
000
<210> 299
<400> 299
000
<210> 300
<400> 300
000
<210> 301
<400> 301
000
<210> 302
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 302
Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 303
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 303
Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 304
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 304
Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 305
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 305
Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 306
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 306
Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 307
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 307
Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 308
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 308
Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 309
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 309
Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 310
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 310
Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 311
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 311
Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 312
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 312
Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 313
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 313
Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 314
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 314
Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 315
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 315
Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 316
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 316
Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 317
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 317
Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 318
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 318
Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 319
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 319
Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 320
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 320
Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 321
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 321
Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 322
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 322
Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 323
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 323
Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 324
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 324
Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 325
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 325
Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 326
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 326
Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 327
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 327
Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 328
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 328
Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 329
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 329
Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 330
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 330
Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 331
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 331
Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 332
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 332
Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 333
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 333
Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 334
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 334
Gly Tyr Thr Phe Thr Asp Tyr Tyr Met His
1 5 10
<210> 335
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 335
Gly Tyr Thr Phe Thr Gly Tyr Tyr Met His
1 5 10
<210> 336
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 336
Gly Tyr Thr Phe Thr Gly Tyr Tyr Met His
1 5 10
<210> 337
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 337
Gly Tyr Ile Phe Thr Gly Tyr Tyr Ile His
1 5 10
<210> 338
<400> 338
000
<210> 339
<400> 339
000
<210> 340
<400> 340
000
<210> 341
<400> 341
000
<210> 342
<400> 342
000
<210> 343
<400> 343
000
<210> 344
<400> 344
000
<210> 345
<400> 345
000
<210> 346
<400> 346
000
<210> 347
<400> 347
000
<210> 348
<400> 348
000
<210> 349
<400> 349
000
<210> 350
<400> 350
000
<210> 351
<400> 351
000
<210> 352
<400> 352
000
<210> 353
<400> 353
000
<210> 354
<400> 354
000
<210> 355
<400> 355
000
<210> 356
<400> 356
000
<210> 357
<400> 357
000
<210> 358
<400> 358
000
<210> 359
<400> 359
000
<210> 360
<400> 360
000
<210> 361
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 361
Gly Tyr Thr Phe Thr Ser Tyr Trp Met Asn
1 5 10
<210> 362
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 362
Trp Ile Asn Pro Asn Ser Gly Asp Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 363
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 363
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 364
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 364
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 365
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 365
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 366
<400> 366
000
<210> 367
<400> 367
000
<210> 368
<400> 368
000
<210> 369
<400> 369
000
<210> 370
<400> 370
000
<210> 371
<400> 371
000
<210> 372
<400> 372
000
<210> 373
<400> 373
000
<210> 374
<400> 374
000
<210> 375
<400> 375
000
<210> 376
<400> 376
000
<210> 377
<400> 377
000
<210> 378
<400> 378
000
<210> 379
<400> 379
000
<210> 380
<400> 380
000
<210> 381
<400> 381
000
<210> 382
<400> 382
000
<210> 383
<400> 383
000
<210> 384
<400> 384
000
<210> 385
<400> 385
000
<210> 386
<400> 386
000
<210> 387
<400> 387
000
<210> 388
<400> 388
000
<210> 389
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 389
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 390
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 390
Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile
1 5 10
<210> 391
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 391
Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile
1 5 10
<210> 392
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 392
Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile
1 5 10
<210> 393
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 393
Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile
1 5 10
<210> 394
<400> 394
000
<210> 395
<400> 395
000
<210> 396
<400> 396
000
<210> 397
<400> 397
000
<210> 398
<400> 398
000
<210> 399
<400> 399
000
<210> 400
<400> 400
000
<210> 401
<400> 401
000
<210> 402
<400> 402
000
<210> 403
<400> 403
000
<210> 404
<400> 404
000
<210> 405
<400> 405
000
<210> 406
<400> 406
000
<210> 407
<400> 407
000
<210> 408
<400> 408
000
<210> 409
<400> 409
000
<210> 410
<400> 410
000
<210> 411
<400> 411
000
<210> 412
<400> 412
000
<210> 413
<400> 413
000
<210> 414
<400> 414
000
<210> 415
<400> 415
000
<210> 416
<400> 416
000
<210> 417
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 417
Gly Asn Trp Asp Asp Tyr
1 5
<210> 418
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 418
Arg Ala Ser Gln Ser Ile Ser Thr Tyr Leu Asn
1 5 10
<210> 419
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 419
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 420
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 420
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 421
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 421
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 422
<400> 422
000
<210> 423
<400> 423
000
<210> 424
<400> 424
000
<210> 425
<400> 425
000
<210> 426
<400> 426
000
<210> 427
<400> 427
000
<210> 428
<400> 428
000
<210> 429
<400> 429
000
<210> 430
<400> 430
000
<210> 431
<400> 431
000
<210> 432
<400> 432
000
<210> 433
<400> 433
000
<210> 434
<400> 434
000
<210> 435
<400> 435
000
<210> 436
<400> 436
000
<210> 437
<400> 437
000
<210> 438
<400> 438
000
<210> 439
<400> 439
000
<210> 440
<400> 440
000
<210> 441
<400> 441
000
<210> 442
<400> 442
000
<210> 443
<400> 443
000
<210> 444
<400> 444
000
<210> 445
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 445
Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala
1 5 10
<210> 446
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 446
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 447
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 447
Ala Ala Phe Ser Leu Gln Ser
1 5
<210> 448
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 448
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 449
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 449
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 450
<400> 450
000
<210> 451
<400> 451
000
<210> 452
<400> 452
000
<210> 453
<400> 453
000
<210> 454
<400> 454
000
<210> 455
<400> 455
000
<210> 456
<400> 456
000
<210> 457
<400> 457
000
<210> 458
<400> 458
000
<210> 459
<400> 459
000
<210> 460
<400> 460
000
<210> 461
<400> 461
000
<210> 462
<400> 462
000
<210> 463
<400> 463
000
<210> 464
<400> 464
000
<210> 465
<400> 465
000
<210> 466
<400> 466
000
<210> 467
<400> 467
000
<210> 468
<400> 468
000
<210> 469
<400> 469
000
<210> 470
<400> 470
000
<210> 471
<400> 471
000
<210> 472
<400> 472
000
<210> 473
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 473
Ser Gly Ser Thr Leu Gln Ser
1 5
<210> 474
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 474
Gln Gln Gly Asp Ser Val Pro Leu Thr
1 5
<210> 475
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 475
Gln Gln Gly Asp Ser Val Pro Leu Thr
1 5
<210> 476
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 476
Gln Gln Gly Asp Ser Val Pro Leu Thr
1 5
<210> 477
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 477
Gln Gln Gly Asp Ser Val Pro Leu Thr
1 5
<210> 478
<211> 243
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 478
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro
130 135 140
Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg
145 150 155 160
Ala Ser Gln Ser Ile Ser Thr Tyr Leu Asn Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Lys Ala Pro Asn Leu Leu Ile Tyr Ala Ala Phe Ser Leu Gln Ser
180 185 190
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
195 200 205
Leu Thr Ile Asn Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
210 215 220
Gln Gln Gly Asp Ser Val Pro Leu Thr Phe Gly Gly Gly Thr Lys Leu
225 230 235 240
Glu Ile Lys
<210> 479
<211> 729
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 479
caagtgcaac tcgtccaaag cggagcggaa gtcaagaaac ccggagcgag cgtgaaagtg 60
tcctgcaaag cctccggcta cacctttacg ggctactaca tgcactgggt gcgccaggca 120
ccaggacagg gtcttgaatg gatgggatgg atcaacccta attcgggcgg aactaactac 180
gcacagaagt tccaggggag agtgactctg actcgggata cctccatctc aactgtctac 240
atggaactct cccgcttgcg gtcagatgat acggcagtgt actactgcgc ccgcgacatg 300
aatatcctgg ctaccgtgcc gttcgacatc tggggacagg ggactatggt tactgtctca 360
tcgggcggtg gaggttcagg aggaggcggc tcgggaggcg gaggttcgga cattcagatg 420
acccagtccc catcctctct gtcggccagc gtcggagata gggtgaccat tacctgtcgg 480
gcctcgcaaa gcatctcctc gtacctcaac tggtatcagc aaaagccggg aaaggcgcct 540
aagctgctga tctacgccgc ttcgagcttg caaagcgggg tgccatccag attctcggga 600
tcaggctcag gaaccgactt caccctgacc gtgaacagcc tccagccgga ggactttgcc 660
acttactact gccagcaggg agactccgtg ccgcttactt tcgggggggg tacccgcctg 720
gagatcaag 729
<210> 480
<211> 243
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 480
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Gly Tyr
20 25 30
Tyr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Arg Asp Thr Ser Ile Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro
130 135 140
Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg
145 150 155 160
Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln Ser
180 185 190
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
195 200 205
Leu Thr Val Asn Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
210 215 220
Gln Gln Gly Asp Ser Val Pro Leu Thr Phe Gly Gly Gly Thr Arg Leu
225 230 235 240
Glu Ile Lys
<210> 481
<211> 1760
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 481
atggccctcc ctgtcaccgc cctgctgctt ccgctggctc ttctgctcca cgccgctcgg 60
ccccaagtgc aactcgtcca aagcggagcg gaagtcaaga aacccggagc gagcgtgaaa 120
gtgtcctgca aagcctccgg ctacaccttt acgggctact acatgcactg ggtgcgccag 180
gcaccaggac agggtcttga atggatggga tggatcaacc ctaattcggg cggaactaac 240
tacgcacaga agttccaggg gagagtgact ctgactcggg atacctccat ctcaactgtc 300
tacatggaac tctcccgctt gcggtcagat gatacggcag tgtactactg cgcccgcgac 360
atgaatatcc tggctaccgt gccgttcgac atctggggac aggggactat ggttactgtc 420
tcatcgggcg gtggaggttc aggaggaggc ggctcgggag gcggaggttc ggacattcag 480
atgacccagt ccccatcctc tctgtcggcc agcgtcggag atagggtgac cattacctgt 540
cgggcctcgc aaagcatctc ctcgtacctc aactggtatc agcaaaagcc gggaaaggcg 600
cctaagctgc tgatctacgc cgcttcgagc ttgcaaagcg gggtgccatc cagattctcg 660
ggatcaggct caggaaccga cttcaccctg accgtgaaca gcctccagcc ggaggacttt 720
gccacttact actgccagca gggagactcc gtgccgctta ctttcggggg gggtacccgc 780
ctggagatca agaccactac cccagcaccg aggccaccca ccccggctcc taccatcgcc 840
tcccagcctc tgtccctgcg tccggaggca tgtagacccg cagctggtgg ggccgtgcat 900
acccggggtc ttgacttcgc ctgcgatatc tacatttggg cccctctggc tggtacttgc 960
ggggtcctgc tgctttcact cgtgatcact ctttactgta agcgcggtcg gaagaagctg 1020
ctgtacatct ttaagcaacc cttcatgagg cctgtgcaga ctactcaaga ggaggacggc 1080
tgttcttgcc ggttcccaga ggaggaggaa ggcggctgcg aactgcgcgt gaaattcagc 1140
cgcagcgcag acgctccagc ctacaagcag gggcagaacc agctctacaa cgaactcaat 1200
cttggtcgga gagaggagta cgacgtgctg gacaagcgga gaggacggga cccagaaatg 1260
ggcgggaagc cgcgcagaaa gaatccccaa gagggcctgt acaacgagct ccaaaaggat 1320
aagatggcag aagcctatag cgagattggt atgaaagggg aacgcagaag aggcaaaggc 1380
cacgacggac tgtaccaggg actcagcacc gccaccaagg acacctatga cgctcttcac 1440
atgcaggccc tgccgcctcg gtaagtcgac agctcgcttt cttgctgtcc aatttctatt 1500
aaaggttcct ttgttcccta agtccaacta ctaaactggg ggatattatg aagggccttg 1560
agcatctgga ttctgcctaa taaaaaacat ttattttcat tgctgcgtcg agagctcgct 1620
ttcttgctgt ccaatttcta ttaaaggttc ctttgttccc taagtccaac tactaaactg 1680
ggggatatta tgaagggcct tgagcatctg gattctgcct aataaaaaac atttattttc 1740
attgctgcct cgacgaattc 1760
<210> 482
<211> 729
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 482
caagtccaac tcgttcaatc cggcgcagaa gtcaagaagc caggagcatc agtgaaagtg 60
tcctgcaaag cctcaggcta catcttcacg ggatactaca tccactgggt gcgccaggct 120
ccgggccagg gccttgagtg gatgggctgg atcaacccta actctggggg aaccaactac 180
gctcagaagt tccaggggag ggtcactatg actcgcgata cctccatctc cactgcgtac 240
atggaactct cgggactgag atccgacgat cctgccgtgt actactgcgc ccgggacatg 300
aacatcttgg cgaccgtgcc gtttgacatt tggggacagg gcaccctcgt cactgtgtcg 360
agcggtggag gaggctcggg gggtggcgga tcaggagggg gaggaagcga catccagctg 420
actcagagcc catcgtcgtt gtccgcgtcg gtgggggata gagtgaccat tacttgccgc 480
gccagccaga gcatctcatc atatctgaat tggtaccagc agaagcccgg aaaggcccca 540
aaactgctga tctacgctgc aagcagcctc caatcgggag tgccgtcacg gttctccggg 600
tccggttcgg gaactgactt taccctgacc gtgaattcgc tgcaaccgga ggatttcgcc 660
acgtactact gtcagcaagg agactccgtg ccgctgacct tcggtggagg caccaaggtc 720
gaaatcaag 729
<210> 483
<211> 243
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 483
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Gly Tyr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Gly Leu Arg Ser Asp Asp Pro Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Leu Thr Gln Ser Pro
130 135 140
Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg
145 150 155 160
Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln Lys Pro
165 170 175
Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu Gln Ser
180 185 190
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
195 200 205
Leu Thr Val Asn Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
210 215 220
Gln Gln Gly Asp Ser Val Pro Leu Thr Phe Gly Gly Gly Thr Lys Val
225 230 235 240
Glu Ile Lys
<210> 484
<211> 735
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 484
caagtccaac tccaacagtc aggcgcagaa gtgaaaaaga gcggtgcatc ggtgaaagtg 60
tcatgcaaag cctcgggcta caccttcact gactactata tgcactggct gcggcaggca 120
ccgggacagg gacttgagtg gatgggatgg atcaacccga attcagggga cactaactac 180
gcgcagaagt tccaggggag agtgaccctg acgagggaca cctcaatttc gaccgtctac 240
atggaattgt cgcgcctgag atcggacgat actgctgtgt actactgtgc ccgcgacatg 300
aacatcctcg cgactgtgcc ttttgatatc tggggacagg ggactatggt caccgtttcc 360
tccgcttccg gtggcggagg ctcgggaggc cgggcctccg gtggaggagg cagcgacatc 420
cagatgactc agagcccttc ctcgctgagc gcctcagtgg gagatcgcgt gaccatcact 480
tgccgggcca gccagtccat ttcgtcctac ctcaattggt accagcagaa gccgggaaag 540
gcgcccaagc tcttgatcta cgctgcgagc tccctgcaaa gcggggtgcc gagccgattc 600
tcgggttccg gctcgggaac cgacttcact ctgaccatct catccctgca accagaggac 660
tttgccacct actactgcca acaaggagat tctgtcccac tgacgttcgg cggaggaacc 720
aaggtcgaaa tcaag 735
<210> 485
<211> 245
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 485
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Ser Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Tyr Met His Trp Leu Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Pro Asn Ser Gly Asp Thr Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Arg Asp Thr Ser Ile Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile Trp Gly
100 105 110
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Arg Ala Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
130 135 140
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
145 150 155 160
Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn Trp Tyr Gln Gln
165 170 175
Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Ser Leu
180 185 190
Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr
210 215 220
Tyr Cys Gln Gln Gly Asp Ser Val Pro Leu Thr Phe Gly Gly Gly Thr
225 230 235 240
Lys Val Glu Ile Lys
245
<210> 486
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 486
Gly Tyr Tyr Met His
1 5
<210> 487
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 487
Gly Tyr Tyr Met His
1 5
<210> 488
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 488
Gly Tyr Tyr Ile His
1 5
<210> 489
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 489
Asp Tyr Tyr Met His
1 5
<210> 490
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 490
Ser Tyr Trp Met Asn
1 5
<210> 491
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 491
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 492
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 492
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 493
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 493
Trp Ile Asn Pro Asn Ser Gly Gly Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 494
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 494
Trp Ile Asn Pro Asn Ser Gly Asp Thr Asn Tyr Ala Gln Lys Phe Gln
1 5 10 15
Gly
<210> 495
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 495
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 496
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 496
Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile
1 5 10
<210> 497
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 497
Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile
1 5 10
<210> 498
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 498
Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile
1 5 10
<210> 499
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 499
Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile
1 5 10
<210> 500
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 500
Gly Asn Trp Asp Asp Tyr
1 5
<210> 501
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 501
Arg Ala Ser Gln Ser Ile Ser Thr Tyr Leu Asn
1 5 10
<210> 502
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 502
Arg Ala Ser Gln Ser Ile Ser Thr Tyr Leu Asn
1 5 10
<210> 503
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 503
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 504
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 504
Arg Ala Ser Gln Ser Ile Ser Ser Tyr Leu Asn
1 5 10
<210> 505
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 505
Arg Ala Ser Lys Ser Ile Ser Lys Asp Leu Ala
1 5 10
<210> 506
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 506
Ala Ala Phe Ser Leu Gln Ser
1 5
<210> 507
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 507
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 508
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 508
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 509
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 509
Ala Ala Ser Ser Leu Gln Ser
1 5
<210> 510
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 510
Ser Gly Ser Thr Leu Gln Ser
1 5
<210> 511
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 511
Gln Gln Gly Asp Ser Val Pro Leu Thr
1 5
<210> 512
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 512
Gln Gln Gly Asp Ser Val Pro Leu Thr
1 5
<210> 513
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 513
Gln Gln Gly Asp Ser Val Pro Leu Thr
1 5
<210> 514
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 514
Gln Gln Gly Asp Ser Val Pro Leu Thr
1 5
<210> 515
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 515
Gln Gln His Asn Lys Tyr Pro Tyr Thr
1 5
<210> 516
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 516
Gly Tyr Thr Phe Thr Gly Tyr
1 5
<210> 517
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 517
Gly Tyr Thr Phe Thr Gly Tyr
1 5
<210> 518
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 518
Gly Tyr Ile Phe Thr Gly Tyr
1 5
<210> 519
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 519
Gly Tyr Thr Phe Thr Asp Tyr
1 5
<210> 520
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 520
Gly Tyr Thr Phe Thr Ser Tyr
1 5
<210> 521
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 521
Asn Pro Asn Ser Gly Gly
1 5
<210> 522
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 522
Asn Pro Asn Ser Gly Gly
1 5
<210> 523
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 523
Asn Pro Asn Ser Gly Gly
1 5
<210> 524
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 524
Asn Pro Asn Ser Gly Asp
1 5
<210> 525
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 525
Asp Pro Tyr Asp Ser Glu
1 5
<210> 526
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 526
Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile
1 5 10
<210> 527
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 527
Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile
1 5 10
<210> 528
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 528
Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile
1 5 10
<210> 529
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 529
Asp Met Asn Ile Leu Ala Thr Val Pro Phe Asp Ile
1 5 10
<210> 530
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 530
Gly Asn Trp Asp Asp Tyr
1 5
<210> 531
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 531
Ser Gln Ser Ile Ser Thr Tyr
1 5
<210> 532
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 532
Ser Gln Ser Ile Ser Ser Tyr
1 5
<210> 533
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 533
Ser Gln Ser Ile Ser Ser Tyr
1 5
<210> 534
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 534
Ser Gln Ser Ile Ser Ser Tyr
1 5
<210> 535
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 535
Ser Lys Ser Ile Ser Lys Asp
1 5
<210> 536
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 536
Ala Ala Phe
1
<210> 537
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 537
Ala Ala Ser
1
<210> 538
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 538
Ala Ala Ser
1
<210> 539
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 539
Ala Ala Ser
1
<210> 540
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 540
Ser Gly Ser
1
<210> 541
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 541
Gly Asp Ser Val Pro Leu
1 5
<210> 542
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 542
Gly Asp Ser Val Pro Leu
1 5
<210> 543
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 543
Gly Asp Ser Val Pro Leu
1 5
<210> 544
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 544
Gly Asp Ser Val Pro Leu
1 5
<210> 545
<400> 545
000
<210> 546
<400> 546
000
<210> 547
<400> 547
000
<210> 548
<400> 548
000
<210> 549
<400> 549
000
<210> 550
<400> 550
000
<210> 551
<400> 551
000
<210> 552
<400> 552
000
<210> 553
<400> 553
000
<210> 554
<400> 554
000
<210> 555
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 555
His Asn Lys Tyr Pro Tyr
1 5
<210> 556
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 556
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Val Gln Leu Thr Gln Ser Pro Ser
130 135 140
Phe Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Lys Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 557
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 557
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Glu Val Val Leu Thr Gln Ser Pro Ala
130 135 140
Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Ala Pro Arg Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 558
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 558
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser Pro Ala
130 135 140
Phe Leu Ser Val Thr Pro Gly Glu Lys Val Thr Ile Thr Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Asp
165 170 175
Gln Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe
195 200 205
Thr Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 559
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 559
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser Pro Asp
130 135 140
Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Pro Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 560
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 560
Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser
130 135 140
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr Met
195 200 205
Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 561
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 561
Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser
130 135 140
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr Met
195 200 205
Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 562
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 562
Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser
130 135 140
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr Met
195 200 205
Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 563
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 563
Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala Ser
130 135 140
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp Arg Val Thr Met Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr Met
195 200 205
Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 564
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 564
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Val Gln Leu Thr Gln Ser Pro Ser
130 135 140
Phe Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Lys Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 565
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 565
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Glu Val Val Leu Thr Gln Ser Pro Ala
130 135 140
Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Ala Pro Arg Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 566
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 566
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser Pro Ala
130 135 140
Phe Leu Ser Val Thr Pro Gly Glu Lys Val Thr Ile Thr Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Asp
165 170 175
Gln Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe
195 200 205
Thr Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 567
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 567
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser Pro Asp
130 135 140
Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Pro Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 568
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 568
Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
115 120 125
Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala Ser
130 135 140
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr Leu
195 200 205
Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 569
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 569
Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
115 120 125
Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala Ser
130 135 140
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr Leu
195 200 205
Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 570
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 570
Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
115 120 125
Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala Ser
130 135 140
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr Leu
195 200 205
Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 571
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 571
Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln
115 120 125
Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala Ser
130 135 140
Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp Arg Phe Val Phe Ser Val Asp Lys Ser Val Ser Thr Ala Tyr Leu
195 200 205
Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 572
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 572
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Val Gln Leu Thr Gln Ser Pro Ser
130 135 140
Phe Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Lys Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 573
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 573
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Glu Val Val Leu Thr Gln Ser Pro Ala
130 135 140
Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Ala Pro Arg Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 574
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 574
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser Pro Ala
130 135 140
Phe Leu Ser Val Thr Pro Gly Glu Lys Val Thr Ile Thr Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Asp
165 170 175
Gln Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe
195 200 205
Thr Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 575
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 575
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser Pro Asp
130 135 140
Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Pro Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 576
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 576
Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser
130 135 140
Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met Gly
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr Leu
195 200 205
Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 577
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 577
Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser
130 135 140
Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met Gly
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr Leu
195 200 205
Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 578
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 578
Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser
130 135 140
Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met Gly
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr Leu
195 200 205
Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 579
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 579
Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
115 120 125
Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser
130 135 140
Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Met Pro Gly Lys Gly Leu Glu Trp Met Gly
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp His Val Thr Ile Ser Val Asp Lys Ser Ile Ser Thr Ala Tyr Leu
195 200 205
Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 580
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 580
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Val Gln Leu Thr Gln Ser Pro Ser
130 135 140
Phe Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Lys Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 581
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 581
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Glu Val Val Leu Thr Gln Ser Pro Ala
130 135 140
Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Ala Pro Arg Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 582
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 582
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser Pro Ala
130 135 140
Phe Leu Ser Val Thr Pro Gly Glu Lys Val Thr Ile Thr Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Asp
165 170 175
Gln Ala Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe
195 200 205
Thr Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 583
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 583
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val
35 40 45
Ser Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser Pro Asp
130 135 140
Ser Leu Ala Val Ser Leu Gly Glu Arg Ala Thr Ile Asn Cys Arg Ala
145 150 155 160
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly
165 170 175
Gln Pro Pro Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
180 185 190
Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
195 200 205
Thr Ile Ser Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln
210 215 220
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu
225 230 235 240
Ile Lys
<210> 584
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 584
Asp Val Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
115 120 125
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
130 135 140
Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val Ser
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr Leu
195 200 205
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 585
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 585
Glu Val Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
115 120 125
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
130 135 140
Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val Ser
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr Leu
195 200 205
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 586
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 586
Asp Val Val Met Thr Gln Ser Pro Ala Phe Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Asp Gln Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
115 120 125
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
130 135 140
Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val Ser
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr Leu
195 200 205
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 587
<211> 242
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 587
Asp Val Val Met Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Ala
65 70 75 80
Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
115 120 125
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
130 135 140
Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Trp
145 150 155 160
Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Val Trp Val Ser
165 170 175
Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe Lys
180 185 190
Asp Arg Phe Thr Ile Ser Val Asp Lys Ala Lys Ser Thr Ala Tyr Leu
195 200 205
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
210 215 220
Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val
225 230 235 240
Ser Ser
<210> 588
<211> 132
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 588
Asp Val Pro Asp Tyr Ala Ser Leu Gly Gly Pro Ser Ser Pro Lys Lys
1 5 10 15
Lys Arg Lys Val Ser Arg Gly Val Gln Val Glu Thr Ile Ser Pro Gly
20 25 30
Asp Gly Arg Thr Phe Pro Lys Arg Gly Gln Thr Cys Val Val His Tyr
35 40 45
Thr Gly Met Leu Glu Asp Gly Lys Lys Phe Asp Ser Ser Arg Asp Arg
50 55 60
Asn Lys Pro Phe Lys Phe Met Leu Gly Lys Gln Glu Val Ile Arg Gly
65 70 75 80
Trp Glu Glu Gly Val Ala Gln Met Ser Val Gly Gln Arg Ala Lys Leu
85 90 95
Thr Ile Ser Pro Asp Tyr Ala Tyr Gly Ala Thr Gly His Pro Gly Ile
100 105 110
Ile Pro Pro His Ala Thr Leu Val Phe Asp Val Glu Leu Leu Lys Leu
115 120 125
Glu Thr Ser Tyr
130
<210> 589
<211> 108
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 589
Val Gln Val Glu Thr Ile Ser Pro Gly Asp Gly Arg Thr Phe Pro Lys
1 5 10 15
Arg Gly Gln Thr Cys Val Val His Tyr Thr Gly Met Leu Glu Asp Gly
20 25 30
Lys Lys Phe Asp Ser Ser Arg Asp Arg Asn Lys Pro Phe Lys Phe Met
35 40 45
Leu Gly Lys Gln Glu Val Ile Arg Gly Trp Glu Glu Gly Val Ala Gln
50 55 60
Met Ser Val Gly Gln Arg Ala Lys Leu Thr Ile Ser Pro Asp Tyr Ala
65 70 75 80
Tyr Gly Ala Thr Gly His Pro Gly Ile Ile Pro Pro His Ala Thr Leu
85 90 95
Val Phe Asp Val Glu Leu Leu Lys Leu Glu Thr Ser
100 105
<210> 590
<211> 93
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 590
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Glu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Thr Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys
85 90
<210> 591
<211> 95
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 591
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Ile Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Thr Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 592
<211> 95
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 592
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Leu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Thr Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 593
<211> 95
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 593
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Glu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Leu Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 594
<211> 95
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<220>
<221> MOD_RES
<222> (12)..(12)
<223> Любая аминокислота
<220>
<221> MOD_RES
<222> (78)..(78)
<223> Любая аминокислота
<400> 594
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Xaa Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Xaa Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 595
<211> 95
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 595
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Ile Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Leu Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 596
<211> 95
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 596
Ile Leu Trp His Glu Met Trp His Glu Gly Leu Leu Glu Ala Ser Arg
1 5 10 15
Leu Tyr Phe Gly Glu Arg Asn Val Lys Gly Met Phe Glu Val Leu Glu
20 25 30
Pro Leu His Ala Met Met Glu Arg Gly Pro Gln Thr Leu Lys Glu Thr
35 40 45
Ser Phe Asn Gln Ala Tyr Gly Arg Asp Leu Met Glu Ala Gln Glu Trp
50 55 60
Cys Arg Lys Tyr Met Lys Ser Gly Asn Val Lys Asp Leu Leu Gln Ala
65 70 75 80
Trp Asp Leu Tyr Tyr His Val Phe Arg Arg Ile Ser Lys Thr Ser
85 90 95
<210> 597
<211> 521
<212>ДНК
<213> Homo sapiens
<400> 597
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct 60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg 120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc 180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac gagggaccgc gacaggcaga 240
cgctcccatg atcactctgc acgccgaagg caaatagtgc aggccgtgcg gcgcttggcg 300
ttccttggaa gggctgaatc cccgcctcgt ccttcgcagc ggccccccgg gtgttcccat 360
cgccgcttct aggcccactg cgacgcttgc ctgcacttct tacacgctct gggtcccagc 420
cgcggcgacg caaagggcct tggtgcgggt ctcgtcggcg cagggacgcg tttgggtccc 480
gacggaacct tttccgcgtt ggggttgggg caccataagc t 521
<210> 598
<211> 118
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 598
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct 60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtg 118
<210> 599
<211> 221
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 599
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct 60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg 120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc 180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac g 221
<210> 600
<211> 324
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 600
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct 60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg 120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc 180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac gagggaccgc gacaggcaga 240
cgctcccatg atcactctgc acgccgaagg caaatagtgc aggccgtgcg gcgcttggcg 300
ttccttggaa gggctgaatc cccg 324
<210> 601
<211> 422
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 601
acccctctct ccagccacta agccagttgc tccctcggct gacggctgca cgcgaggcct 60
ccgaacgtct tacgccttgt ggcgcgcccg tccttgtccc gggtgtgatg gcggggtgtg 120
gggcggaggg cgtggcgggg aagggccggc gacgagagcc gcgcgggacg actcgtcggc 180
gataaccggt gtcgggtagc gccagccgcg cgacggtaac gagggaccgc gacaggcaga 240
cgctcccatg atcactctgc acgccgaagg caaatagtgc aggccgtgcg gcgcttggcg 300
ttccttggaa gggctgaatc cccgcctcgt ccttcgcagc ggccccccgg gtgttcccat 360
cgccgcttct aggcccactg cgacgcttgc ctgcacttct tacacgctct gggtcccagc 420
cg 422
<210> 602
<211> 21
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> Вариант
<222> (1)..(3)
<223> /замена=" "
<220>
<221> MISC_FEATURE
<222> (1)..(21)
<223> /note="Варианты остатков, приведенные в последовательности, не имеют предпочтений по отноешнию к вараиантам остатков в аннотациях
для вариантов положений"
<400> 602
Gly Ser Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu
1 5 10 15
Glu Asn Pro Gly Pro
20
<210> 603
<211> 22
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> Вариант
<222> (1)..(3)
<223> /замена=" "
<220>
<221> MISC_FEATURE
<222> (1)..(22)
<223> /примечание="Варианты остатков, приведенные в последовательности не имеют
предпочтения по отношению к вариантам остатков в аннотациях для
вариантов положений"
<400> 603
Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val
1 5 10 15
Glu Glu Asn Pro Gly Pro
20
<210> 604
<211> 23
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> Вариант
<222> (1)..(3)
<223> /замена=" "
<220>
<221> MISC_FEATURE
<222> (1)..(23)
<223> /примечание="Варианты остатков, приведенные в последовательности не имеют
предпочтения по отношению к вариантам остатков в аннотациях для
вариантов положений"
<400> 604
Gly Ser Gly Gln Cys Thr Asn Tyr Ala Leu Leu Lys Leu Ala Gly Asp
1 5 10 15
Val Glu Ser Asn Pro Gly Pro
20
<210> 605
<211> 25
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<220>
<221> Вариант
<222> (1)..(3)
<223> /замена=" "
<220>
<221> MISC_FEATURE
<222> (1)..(25)
<223> /примечание="Варианты остатков, приведенные в последовательности, не имкют предпочтения
по отношению к вараинтам остатков в аннотациях для
вариантов положений"
<400> 605
Gly Ser Gly Val Lys Gln Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala
1 5 10 15
Gly Asp Val Glu Ser Asn Pro Gly Pro
20 25
<210> 606
<211> 1132
<212> Белок
<213> Homo sapiens
<400> 606
Met Pro Arg Ala Pro Arg Cys Arg Ala Val Arg Ser Leu Leu Arg Ser
1 5 10 15
His Tyr Arg Glu Val Leu Pro Leu Ala Thr Phe Val Arg Arg Leu Gly
20 25 30
Pro Gln Gly Trp Arg Leu Val Gln Arg Gly Asp Pro Ala Ala Phe Arg
35 40 45
Ala Leu Val Ala Gln Cys Leu Val Cys Val Pro Trp Asp Ala Arg Pro
50 55 60
Pro Pro Ala Ala Pro Ser Phe Arg Gln Val Ser Cys Leu Lys Glu Leu
65 70 75 80
Val Ala Arg Val Leu Gln Arg Leu Cys Glu Arg Gly Ala Lys Asn Val
85 90 95
Leu Ala Phe Gly Phe Ala Leu Leu Asp Gly Ala Arg Gly Gly Pro Pro
100 105 110
Glu Ala Phe Thr Thr Ser Val Arg Ser Tyr Leu Pro Asn Thr Val Thr
115 120 125
Asp Ala Leu Arg Gly Ser Gly Ala Trp Gly Leu Leu Leu Arg Arg Val
130 135 140
Gly Asp Asp Val Leu Val His Leu Leu Ala Arg Cys Ala Leu Phe Val
145 150 155 160
Leu Val Ala Pro Ser Cys Ala Tyr Gln Val Cys Gly Pro Pro Leu Tyr
165 170 175
Gln Leu Gly Ala Ala Thr Gln Ala Arg Pro Pro Pro His Ala Ser Gly
180 185 190
Pro Arg Arg Arg Leu Gly Cys Glu Arg Ala Trp Asn His Ser Val Arg
195 200 205
Glu Ala Gly Val Pro Leu Gly Leu Pro Ala Pro Gly Ala Arg Arg Arg
210 215 220
Gly Gly Ser Ala Ser Arg Ser Leu Pro Leu Pro Lys Arg Pro Arg Arg
225 230 235 240
Gly Ala Ala Pro Glu Pro Glu Arg Thr Pro Val Gly Gln Gly Ser Trp
245 250 255
Ala His Pro Gly Arg Thr Arg Gly Pro Ser Asp Arg Gly Phe Cys Val
260 265 270
Val Ser Pro Ala Arg Pro Ala Glu Glu Ala Thr Ser Leu Glu Gly Ala
275 280 285
Leu Ser Gly Thr Arg His Ser His Pro Ser Val Gly Arg Gln His His
290 295 300
Ala Gly Pro Pro Ser Thr Ser Arg Pro Pro Arg Pro Trp Asp Thr Pro
305 310 315 320
Cys Pro Pro Val Tyr Ala Glu Thr Lys His Phe Leu Tyr Ser Ser Gly
325 330 335
Asp Lys Glu Gln Leu Arg Pro Ser Phe Leu Leu Ser Ser Leu Arg Pro
340 345 350
Ser Leu Thr Gly Ala Arg Arg Leu Val Glu Thr Ile Phe Leu Gly Ser
355 360 365
Arg Pro Trp Met Pro Gly Thr Pro Arg Arg Leu Pro Arg Leu Pro Gln
370 375 380
Arg Tyr Trp Gln Met Arg Pro Leu Phe Leu Glu Leu Leu Gly Asn His
385 390 395 400
Ala Gln Cys Pro Tyr Gly Val Leu Leu Lys Thr His Cys Pro Leu Arg
405 410 415
Ala Ala Val Thr Pro Ala Ala Gly Val Cys Ala Arg Glu Lys Pro Gln
420 425 430
Gly Ser Val Ala Ala Pro Glu Glu Glu Asp Thr Asp Pro Arg Arg Leu
435 440 445
Val Gln Leu Leu Arg Gln His Ser Ser Pro Trp Gln Val Tyr Gly Phe
450 455 460
Val Arg Ala Cys Leu Arg Arg Leu Val Pro Pro Gly Leu Trp Gly Ser
465 470 475 480
Arg His Asn Glu Arg Arg Phe Leu Arg Asn Thr Lys Lys Phe Ile Ser
485 490 495
Leu Gly Lys His Ala Lys Leu Ser Leu Gln Glu Leu Thr Trp Lys Met
500 505 510
Ser Val Arg Gly Cys Ala Trp Leu Arg Arg Ser Pro Gly Val Gly Cys
515 520 525
Val Pro Ala Ala Glu His Arg Leu Arg Glu Glu Ile Leu Ala Lys Phe
530 535 540
Leu His Trp Leu Met Ser Val Tyr Val Val Glu Leu Leu Arg Ser Phe
545 550 555 560
Phe Tyr Val Thr Glu Thr Thr Phe Gln Lys Asn Arg Leu Phe Phe Tyr
565 570 575
Arg Lys Ser Val Trp Ser Lys Leu Gln Ser Ile Gly Ile Arg Gln His
580 585 590
Leu Lys Arg Val Gln Leu Arg Glu Leu Ser Glu Ala Glu Val Arg Gln
595 600 605
His Arg Glu Ala Arg Pro Ala Leu Leu Thr Ser Arg Leu Arg Phe Ile
610 615 620
Pro Lys Pro Asp Gly Leu Arg Pro Ile Val Asn Met Asp Tyr Val Val
625 630 635 640
Gly Ala Arg Thr Phe Arg Arg Glu Lys Arg Ala Glu Arg Leu Thr Ser
645 650 655
Arg Val Lys Ala Leu Phe Ser Val Leu Asn Tyr Glu Arg Ala Arg Arg
660 665 670
Pro Gly Leu Leu Gly Ala Ser Val Leu Gly Leu Asp Asp Ile His Arg
675 680 685
Ala Trp Arg Thr Phe Val Leu Arg Val Arg Ala Gln Asp Pro Pro Pro
690 695 700
Glu Leu Tyr Phe Val Lys Val Asp Val Thr Gly Ala Tyr Asp Thr Ile
705 710 715 720
Pro Gln Asp Arg Leu Thr Glu Val Ile Ala Ser Ile Ile Lys Pro Gln
725 730 735
Asn Thr Tyr Cys Val Arg Arg Tyr Ala Val Val Gln Lys Ala Ala His
740 745 750
Gly His Val Arg Lys Ala Phe Lys Ser His Val Ser Thr Leu Thr Asp
755 760 765
Leu Gln Pro Tyr Met Arg Gln Phe Val Ala His Leu Gln Glu Thr Ser
770 775 780
Pro Leu Arg Asp Ala Val Val Ile Glu Gln Ser Ser Ser Leu Asn Glu
785 790 795 800
Ala Ser Ser Gly Leu Phe Asp Val Phe Leu Arg Phe Met Cys His His
805 810 815
Ala Val Arg Ile Arg Gly Lys Ser Tyr Val Gln Cys Gln Gly Ile Pro
820 825 830
Gln Gly Ser Ile Leu Ser Thr Leu Leu Cys Ser Leu Cys Tyr Gly Asp
835 840 845
Met Glu Asn Lys Leu Phe Ala Gly Ile Arg Arg Asp Gly Leu Leu Leu
850 855 860
Arg Leu Val Asp Asp Phe Leu Leu Val Thr Pro His Leu Thr His Ala
865 870 875 880
Lys Thr Phe Leu Arg Thr Leu Val Arg Gly Val Pro Glu Tyr Gly Cys
885 890 895
Val Val Asn Leu Arg Lys Thr Val Val Asn Phe Pro Val Glu Asp Glu
900 905 910
Ala Leu Gly Gly Thr Ala Phe Val Gln Met Pro Ala His Gly Leu Phe
915 920 925
Pro Trp Cys Gly Leu Leu Leu Asp Thr Arg Thr Leu Glu Val Gln Ser
930 935 940
Asp Tyr Ser Ser Tyr Ala Arg Thr Ser Ile Arg Ala Ser Leu Thr Phe
945 950 955 960
Asn Arg Gly Phe Lys Ala Gly Arg Asn Met Arg Arg Lys Leu Phe Gly
965 970 975
Val Leu Arg Leu Lys Cys His Ser Leu Phe Leu Asp Leu Gln Val Asn
980 985 990
Ser Leu Gln Thr Val Cys Thr Asn Ile Tyr Lys Ile Leu Leu Leu Gln
995 1000 1005
Ala Tyr Arg Phe His Ala Cys Val Leu Gln Leu Pro Phe His Gln
1010 1015 1020
Gln Val Trp Lys Asn Pro Thr Phe Phe Leu Arg Val Ile Ser Asp
1025 1030 1035
Thr Ala Ser Leu Cys Tyr Ser Ile Leu Lys Ala Lys Asn Ala Gly
1040 1045 1050
Met Ser Leu Gly Ala Lys Gly Ala Ala Gly Pro Leu Pro Ser Glu
1055 1060 1065
Ala Val Gln Trp Leu Cys His Gln Ala Phe Leu Leu Lys Leu Thr
1070 1075 1080
Arg His Arg Val Thr Tyr Val Pro Leu Leu Gly Ser Leu Arg Thr
1085 1090 1095
Ala Gln Thr Gln Leu Ser Arg Lys Leu Pro Gly Thr Thr Leu Thr
1100 1105 1110
Ala Leu Glu Ala Ala Ala Asn Pro Ala Leu Pro Ser Asp Phe Lys
1115 1120 1125
Thr Ile Leu Asp
1130
<210> 607
<211> 4027
<212>ДНК
<213> Homo sapiens
<400> 607
caggcagcgt ggtcctgctg cgcacgtggg aagccctggc cccggccacc cccgcgatgc 60
cgcgcgctcc ccgctgccga gccgtgcgct ccctgctgcg cagccactac cgcgaggtgc 120
tgccgctggc cacgttcgtg cggcgcctgg ggccccaggg ctggcggctg gtgcagcgcg 180
gggacccggc ggctttccgc gcgctggtgg cccagtgcct ggtgtgcgtg ccctgggacg 240
cacggccgcc ccccgccgcc ccctccttcc gccaggtgtc ctgcctgaag gagctggtgg 300
cccgagtgct gcagaggctg tgcgagcgcg gcgcgaagaa cgtgctggcc ttcggcttcg 360
cgctgctgga cggggcccgc gggggccccc ccgaggcctt caccaccagc gtgcgcagct 420
acctgcccaa cacggtgacc gacgcactgc gggggagcgg ggcgtggggg ctgctgttgc 480
gccgcgtggg cgacgacgtg ctggttcacc tgctggcacg ctgcgcgctc tttgtgctgg 540
tggctcccag ctgcgcctac caggtgtgcg ggccgccgct gtaccagctc ggcgctgcca 600
ctcaggcccg gcccccgcca cacgctagtg gaccccgaag gcgtctggga tgcgaacggg 660
cctggaacca tagcgtcagg gaggccgggg tccccctggg cctgccagcc ccgggtgcga 720
ggaggcgcgg gggcagtgcc agccgaagtc tgccgttgcc caagaggccc aggcgtggcg 780
ctgcccctga gccggagcgg acgcccgttg ggcaggggtc ctgggcccac ccgggcagga 840
cgcgtggacc gagtgaccgt ggtttctgtg tggtgtcacc tgccagaccc gccgaagaag 900
ccacctcttt ggagggtgcg ctctctggca cgcgccactc ccacccatcc gtgggccgcc 960
agcaccacgc gggcccccca tccacatcgc ggccaccacg tccctgggac acgccttgtc 1020
ccccggtgta cgccgagacc aagcacttcc tctactcctc aggcgacaag gagcagctgc 1080
ggccctcctt cctactcagc tctctgaggc ccagcctgac tggcgctcgg aggctcgtgg 1140
agaccatctt tctgggttcc aggccctgga tgccagggac tccccgcagg ttgccccgcc 1200
tgccccagcg ctactggcaa atgcggcccc tgtttctgga gctgcttggg aaccacgcgc 1260
agtgccccta cggggtgctc ctcaagacgc actgcccgct gcgagctgcg gtcaccccag 1320
cagccggtgt ctgtgcccgg gagaagcccc agggctctgt ggcggccccc gaggaggagg 1380
acacagaccc ccgtcgcctg gtgcagctgc tccgccagca cagcagcccc tggcaggtgt 1440
acggcttcgt gcgggcctgc ctgcgccggc tggtgccccc aggcctctgg ggctccaggc 1500
acaacgaacg ccgcttcctc aggaacacca agaagttcat ctccctgggg aagcatgcca 1560
agctctcgct gcaggagctg acgtggaaga tgagcgtgcg gggctgcgct tggctgcgca 1620
ggagcccagg ggttggctgt gttccggccg cagagcaccg tctgcgtgag gagatcctgg 1680
ccaagttcct gcactggctg atgagtgtgt acgtcgtcga gctgctcagg tctttctttt 1740
atgtcacgga gaccacgttt caaaagaaca ggctcttttt ctaccggaag agtgtctgga 1800
gcaagttgca aagcattgga atcagacagc acttgaagag ggtgcagctg cgggagctgt 1860
cggaagcaga ggtcaggcag catcgggaag ccaggcccgc cctgctgacg tccagactcc 1920
gcttcatccc caagcctgac gggctgcggc cgattgtgaa catggactac gtcgtgggag 1980
ccagaacgtt ccgcagagaa aagagggccg agcgtctcac ctcgagggtg aaggcactgt 2040
tcagcgtgct caactacgag cgggcgcggc gccccggcct cctgggcgcc tctgtgctgg 2100
gcctggacga tatccacagg gcctggcgca ccttcgtgct gcgtgtgcgg gcccaggacc 2160
cgccgcctga gctgtacttt gtcaaggtgg atgtgacggg cgcgtacgac accatccccc 2220
aggacaggct cacggaggtc atcgccagca tcatcaaacc ccagaacacg tactgcgtgc 2280
gtcggtatgc cgtggtccag aaggccgccc atgggcacgt ccgcaaggcc ttcaagagcc 2340
acgtctctac cttgacagac ctccagccgt acatgcgaca gttcgtggct cacctgcagg 2400
agaccagccc gctgagggat gccgtcgtca tcgagcagag ctcctccctg aatgaggcca 2460
gcagtggcct cttcgacgtc ttcctacgct tcatgtgcca ccacgccgtg cgcatcaggg 2520
gcaagtccta cgtccagtgc caggggatcc cgcagggctc catcctctcc acgctgctct 2580
gcagcctgtg ctacggcgac atggagaaca agctgtttgc ggggattcgg cgggacgggc 2640
tgctcctgcg tttggtggat gatttcttgt tggtgacacc tcacctcacc cacgcgaaaa 2700
ccttcctcag gaccctggtc cgaggtgtcc ctgagtatgg ctgcgtggtg aacttgcgga 2760
agacagtggt gaacttccct gtagaagacg aggccctggg tggcacggct tttgttcaga 2820
tgccggccca cggcctattc ccctggtgcg gcctgctgct ggatacccgg accctggagg 2880
tgcagagcga ctactccagc tatgcccgga cctccatcag agccagtctc accttcaacc 2940
gcggcttcaa ggctgggagg aacatgcgtc gcaaactctt tggggtcttg cggctgaagt 3000
gtcacagcct gtttctggat ttgcaggtga acagcctcca gacggtgtgc accaacatct 3060
acaagatcct cctgctgcag gcgtacaggt ttcacgcatg tgtgctgcag ctcccatttc 3120
atcagcaagt ttggaagaac cccacatttt tcctgcgcgt catctctgac acggcctccc 3180
tctgctactc catcctgaaa gccaagaacg cagggatgtc gctgggggcc aagggcgccg 3240
ccggccctct gccctccgag gccgtgcagt ggctgtgcca ccaagcattc ctgctcaagc 3300
tgactcgaca ccgtgtcacc tacgtgccac tcctggggtc actcaggaca gcccagacgc 3360
agctgagtcg gaagctcccg gggacgacgc tgactgccct ggaggccgca gccaacccgg 3420
cactgccctc agacttcaag accatcctgg actgatggcc acccgcccac agccaggccg 3480
agagcagaca ccagcagccc tgtcacgccg ggctctacgt cccagggagg gaggggcggc 3540
ccacacccag gcccgcaccg ctgggagtct gaggcctgag tgagtgtttg gccgaggcct 3600
gcatgtccgg ctgaaggctg agtgtccggc tgaggcctga gcgagtgtcc agccaagggc 3660
tgagtgtcca gcacacctgc cgtcttcact tccccacagg ctggcgctcg gctccacccc 3720
agggccagct tttcctcacc aggagcccgg cttccactcc ccacatagga atagtccatc 3780
cccagattcg ccattgttca cccctcgccc tgccctcctt tgccttccac ccccaccatc 3840
caggtggaga ccctgagaag gaccctggga gctctgggaa tttggagtga ccaaaggtgt 3900
gccctgtaca caggcgagga ccctgcacct ggatgggggt ccctgtgggt caaattgggg 3960
ggaggtgctg tgggagtaaa atactgaata tatgagtttt tcagttttga aaaaaaaaaa 4020
aaaaaaa 4027
<210> 608
<211> 19
<212>ДНК
<213> Mus musculus
<400> 608
ggaggtccct caccttcta 19
<210> 609
<211> 19
<212>ДНК
<213> Mus musculus
<400> 609
cggaggatct tatgctgaa 19
<210> 610
<211> 19
<212>ДНК
<213> Mus musculus
<400> 610
cccgcttcca gatcataca 19
<210> 611
<211> 19
<212>ДНК
<213> Mus musculus
<400> 611
ggagacctca acaagatat 19
<210> 612
<211> 19
<212>ДНК
<213> Mus musculus
<400> 612
aaggcatggt cattggtat 19
<210> 613
<211> 19
<212>ДНК
<213> Mus musculus
<400> 613
gcatggtcat tggtatcat 19
<210> 614
<211> 19
<212>ДНК
<213> Mus musculus
<400> 614
ggtcattggt atcatgagt 19
<210> 615
<211> 19
<212>ДНК
<213> Mus musculus
<400> 615
cctagtgggt atccctgta 19
<210> 616
<211> 19
<212>ДНК
<213> Mus musculus
<400> 616
gaggatggac attgttctt 19
<210> 617
<211> 19
<212>ДНК
<213> Mus musculus
<400> 617
gcatgcaggc tacagttca 19
<210> 618
<211> 19
<212>ДНК
<213> Mus musculus
<400> 618
ccagcacatg cactgttga 19
<210> 619
<211> 19
<212>ДНК
<213> Mus musculus
<400> 619
cacatgcact gttgagtga 19
<210> 620
<211> 21
<212>ДНК
<213> Mus musculus
<400> 620
ctggaggtcc ctcaccttct a 21
<210> 621
<211> 21
<212>ДНК
<213> Mus musculus
<400> 621
gtcggaggat cttatgctga a 21
<210> 622
<211> 21
<212>ДНК
<213> Mus musculus
<400> 622
tgcccgcttc cagatcatac a 21
<210> 623
<211> 21
<212>ДНК
<213> Mus musculus
<400> 623
ctggagacct caacaagata t 21
<210> 624
<211> 21
<212>ДНК
<213> Mus musculus
<400> 624
tcaaggcatg gtcattggta t 21
<210> 625
<211> 21
<212>ДНК
<213> Mus musculus
<400> 625
aggcatggtc attggtatca t 21
<210> 626
<211> 21
<212>ДНК
<213> Mus musculus
<400> 626
atggtcattg gtatcatgag t 21
<210> 627
<211> 21
<212>ДНК
<213> Mus musculus
<400> 627
gccctagtgg gtatccctgt a 21
<210> 628
<211> 21
<212>ДНК
<213> Mus musculus
<400> 628
atgaggatgg acattgttct t 21
<210> 629
<211> 21
<212>ДНК
<213> Mus musculus
<400> 629
gagcatgcag gctacagttc a 21
<210> 630
<211> 21
<212>ДНК
<213> Mus musculus
<400> 630
ttccagcaca tgcactgttg a 21
<210> 631
<211> 21
<212>ДНК
<213> Mus musculus
<400> 631
agcacatgca ctgttgagtg a 21
<210> 632
<211> 21
<212>ДНК
<213> Mus musculus
<400> 632
tagaaggtga gggacctcca g 21
<210> 633
<211> 21
<212>ДНК
<213> Mus musculus
<400> 633
ttcagcataa gatcctccga c 21
<210> 634
<211> 21
<212>ДНК
<213> Mus musculus
<400> 634
tgtatgatct ggaagcgggc a 21
<210> 635
<211> 21
<212>ДНК
<213> Mus musculus
<400> 635
atatcttgtt gaggtctcca g 21
<210> 636
<211> 21
<212>ДНК
<213> Mus musculus
<400> 636
ataccaatga ccatgccttg a 21
<210> 637
<211> 21
<212>ДНК
<213> Mus musculus
<400> 637
atgataccaa tgaccatgcc t 21
<210> 638
<211> 21
<212>ДНК
<213> Mus musculus
<400> 638
atggtcattg gtatcatgag t 21
<210> 639
<211> 21
<212>ДНК
<213> Mus musculus
<400> 639
gccctagtgg gtatccctgt a 21
<210> 640
<211> 21
<212>ДНК
<213> Mus musculus
<400> 640
atgaggatgg acattgttct t 21
<210> 641
<211> 21
<212>ДНК
<213> Mus musculus
<400> 641
gagcatgcag gctacagttc a 21
<210> 642
<211> 21
<212>ДНК
<213> Mus musculus
<400> 642
ttccagcaca tgcactgttg a 21
<210> 643
<211> 21
<212>ДНК
<213> Mus musculus
<400> 643
agcacatgca ctgttgagtg a 21
<210> 644
<211> 19
<212>ДНК
<213> Mus musculus
<400> 644
tagaaggtga gggacctcc 19
<210> 645
<211> 19
<212>ДНК
<213> Mus musculus
<400> 645
ttcagcataa gatcctccg 19
<210> 646
<211> 19
<212>ДНК
<213> Mus musculus
<400> 646
tgtatgatct ggaagcggg 19
<210> 647
<211> 19
<212>ДНК
<213> Mus musculus
<400> 647
atatcttgtt gaggtctcc 19
<210> 648
<211> 19
<212>ДНК
<213> Mus musculus
<400> 648
ataccaatga ccatgcctt 19
<210> 649
<211> 19
<212>ДНК
<213> Mus musculus
<400> 649
atgataccaa tgaccatgc 19
<210> 650
<211> 19
<212>ДНК
<213> Mus musculus
<400> 650
atggtcattg gtatcatga 19
<210> 651
<211> 19
<212>ДНК
<213> Mus musculus
<400> 651
gccctagtgg gtatccctg 19
<210> 652
<211> 19
<212>ДНК
<213> Mus musculus
<400> 652
atgaggatgg acattgttc 19
<210> 653
<211> 19
<212>ДНК
<213> Mus musculus
<400> 653
gagcatgcag gctacagtt 19
<210> 654
<211> 19
<212>ДНК
<213> Mus musculus
<400> 654
ttccagcaca tgcactgtt 19
<210> 655
<211> 19
<212>ДНК
<213> Mus musculus
<400> 655
agcacatgca ctgttgagt 19
<210> 656
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 656
ggccaggatg gttcttaga 19
<210> 657
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 657
gcttcgtgct aaactggta 19
<210> 658
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 658
gggcgtgact tccacatga 19
<210> 659
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 659
caggcctaga gaagtttca 19
<210> 660
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 660
cttggaaccc attcctgaa 19
<210> 661
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 661
ggaacccatt cctgaaatt 19
<210> 662
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 662
gaacccattc ctgaaatta 19
<210> 663
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 663
aacccattcc tgaaattat 19
<210> 664
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 664
acccattcct gaaattatt 19
<210> 665
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 665
cccattcctg aaattattt 19
<210> 666
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 666
ctgtggttct attatatta 19
<210> 667
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 667
aaatatgaga gcatgctaa 19
<210> 668
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 668
tctaagaacc atcctggcc 19
<210> 669
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 669
taccagttta gcacgaagc 19
<210> 670
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 670
tcatgtggaa gtcacgccc 19
<210> 671
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 671
tgaaacttct ctaggcctg 19
<210> 672
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 672
ttcaggaatg ggttccaag 19
<210> 673
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 673
aatttcagga atgggttcc 19
<210> 674
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 674
taatttcagg aatgggttc 19
<210> 675
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 675
ataatttcag gaatgggtt 19
<210> 676
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 676
aataatttca ggaatgggt 19
<210> 677
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 677
aaataatttc aggaatggg 19
<210> 678
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 678
taatataata gaaccacag 19
<210> 679
<211> 19
<212>ДНК
<213> Homo sapiens
<400> 679
ttagcatgct ctcatattt 19
<210> 680
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 680
gcggccagga tggttcttag a 21
<210> 681
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 681
gagcttcgtg ctaaactggt a 21
<210> 682
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 682
acgggcgtga cttccacatg a 21
<210> 683
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 683
tgcaggccta gagaagtttc a 21
<210> 684
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 684
tccttggaac ccattcctga a 21
<210> 685
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 685
ttggaaccca ttcctgaaat t 21
<210> 686
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 686
tggaacccat tcctgaaatt a 21
<210> 687
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 687
ggaacccatt cctgaaatta t 21
<210> 688
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 688
gaacccattc ctgaaattat t 21
<210> 689
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 689
aacccattcc tgaaattatt t 21
<210> 690
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 690
ccctgtggtt ctattatatt a 21
<210> 691
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 691
ttaaatatga gagcatgcta a 21
<210> 692
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 692
tctaagaacc atcctggccg c 21
<210> 693
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 693
taccagttta gcacgaagct c 21
<210> 694
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 694
tcatgtggaa gtcacgcccg t 21
<210> 695
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 695
tgaaacttct ctaggcctgc a 21
<210> 696
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 696
ttcaggaatg ggttccaagg a 21
<210> 697
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 697
aatttcagga atgggttcca a 21
<210> 698
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 698
taatttcagg aatgggttcc a 21
<210> 699
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 699
ataatttcag gaatgggttc c 21
<210> 700
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 700
aataatttca ggaatgggtt c 21
<210> 701
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 701
aaataatttc aggaatgggt t 21
<210> 702
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 702
taatataata gaaccacagg g 21
<210> 703
<211> 21
<212>ДНК
<213> Homo sapiens
<400> 703
ttagcatgct ctcatattta a 21
<210> 704
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 704
Gly Ser Thr Ser Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr
1 5 10 15
Lys Gly
<210> 705
<211> 150
<212>ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 705
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 60
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 120
aaaaaaaaaa aaaaaaaaaa aaaaaaaaaa 150
<210> 706
<211> 4
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 706
Arg Gly Asp Ser
1
<210> 707
<211> 494
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 707
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Ala
20 25 30
Ser Leu Ala Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala
35 40 45
Ser Glu Ser Val Asp Asn Tyr Gly Asn Thr Phe Met His Trp Tyr Gln
50 55 60
Gln Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Arg Ala Ser Asn
65 70 75 80
Leu Glu Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr
85 90 95
Asp Phe Thr Leu Thr Ile Asn Pro Val Glu Ala Asp Asp Val Ala Thr
100 105 110
Tyr Tyr Cys Gln Gln Ser Asn Glu Asp Pro Pro Thr Phe Gly Ala Gly
115 120 125
Thr Lys Leu Glu Leu Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
130 135 140
Ser Gly Gly Gly Ser Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu
145 150 155 160
Lys Lys Pro Gly Glu Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr
165 170 175
Ile Phe Thr Asn Tyr Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys
180 185 190
Ser Phe Lys Trp Met Gly Trp Ile Asn Thr Tyr Thr Gly Glu Ser Thr
195 200 205
Tyr Ser Ala Asp Phe Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser
210 215 220
Ala Ser Thr Ala Tyr Leu His Ile Asn Asp Leu Lys Asn Glu Asp Thr
225 230 235 240
Ala Thr Tyr Phe Cys Ala Arg Ser Gly Gly Tyr Asp Pro Met Asp Tyr
245 250 255
Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Ala Ser Ser Gly Thr
260 265 270
Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser
275 280 285
Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly
290 295 300
Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp
305 310 315 320
Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile
325 330 335
Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
340 345 350
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
355 360 365
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val
370 375 380
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly Gln Asn
385 390 395 400
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
405 410 415
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
420 425 430
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
435 440 445
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
450 455 460
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
465 470 475 480
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 708
<211> 487
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 708
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Gly Ser Asp Val Gln Ile Thr Gln Ser Pro Ser
20 25 30
Tyr Leu Ala Ala Ser Pro Gly Glu Thr Ile Thr Ile Asn Cys Arg Ala
35 40 45
Ser Lys Ser Ile Ser Lys Asp Leu Ala Trp Tyr Gln Glu Lys Pro Gly
50 55 60
Lys Thr Asn Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly
65 70 75 80
Ile Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu
85 90 95
Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala Met Tyr Tyr Cys Gln
100 105 110
Gln His Asn Lys Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu
115 120 125
Ile Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Gly Gly Gly
130 135 140
Ser Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly
145 150 155 160
Ala Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser
165 170 175
Tyr Trp Met Asn Trp Val Lys Gln Arg Pro Asp Gln Gly Leu Glu Trp
180 185 190
Ile Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys
195 200 205
Phe Lys Asp Lys Ala Ile Leu Thr Val Asp Lys Ser Ser Ser Thr Ala
210 215 220
Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr
225 230 235 240
Cys Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Leu
245 250 255
Thr Val Ser Ser Ala Ser Ser Gly Thr Thr Thr Pro Ala Pro Arg Pro
260 265 270
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
275 280 285
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
290 295 300
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
305 310 315 320
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
325 330 335
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
340 345 350
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
355 360 365
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
370 375 380
Ala Pro Ala Tyr Lys Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
385 390 395 400
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
405 410 415
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
420 425 430
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
435 440 445
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
450 455 460
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
465 470 475 480
Met Gln Ala Leu Pro Pro Arg
485
<210> 709
<211> 40
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<220>
<221> MISC_FEATURE
<222> (1)..(40)
<223> /примечание="Эта последовательность может содержать 1-10 повторяющихся единиц "Gly Gly Gly Ser"
<400> 709
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
20 25 30
Gly Gly Gly Ser Gly Gly Gly Ser
35 40
<---