Результат интеллектуальной деятельности: ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО РЕЦЕПТОРА АНТИГЕНА ПРОТИВ CD19
Вид РИД
Изобретение
[001] По настоящей заявке испрашивается приоритет заявки США с серийным номером № 61/976396, поданной 7 апреля 2014 года, заявке США с серийным номером № 62/007309, поданной 3 июня 2014 года, заявки США с серийным номером № 62/036493, поданной 12 августа 2014 года, заявки США с серийным номером № 62/076238, поданной 6 ноября 2014 года, заявки США с серийным номером № 62/087888, поданной 5 декабря 2014 года, и заявки США с серийным номером № 62/097278, поданной 29 декабря 2014 года, содержание которых включено в настоящее описание в качестве ссылки в полном объеме.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[002] Настоящая заявка содержит список последовательностей, который был предоставлен в электронной форме в формате ASCII и, таким образом, включен в настоящее описание в качестве ссылки в полном объеме. Указанная копия ASCII, созданная 6 апреля 2015 года, названа N2067-7051WO_SL.txt и имеет размер 252236 байт.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[003] Настоящее изобретение относится, главным образом, к применению T-клеток, модифицированных способами инженерии для экспрессии химерного рецептора антигена (CAR), например, в комбинации с другим средством, например, таким как ингибитор киназы и/или цитокин, для лечения заболевания, ассоциированного с экспрессией белка кластера дифференцировки 19 (CD19).
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[004] Многие пациенты с B-клеточными злокачественными опухолями не могут быть вылечены с использованием стандартной терапии. Кроме того, традиционные варианты лечения часто имеют серьезные побочные эффекты. Были предприняты попытки иммунотерапии злокачественной опухоли, однако некоторые препятствия делают ее клиническую эффективность очень труднодостижимой целью. Хотя были идентифицированы сотни так называемых опухолевых антигенов, они, как правило, являются собственными по происхождению и, таким образом, слабоиммуногенными. Более того, опухоли используют несколько механизмов, которые делают их противодействующими началу и усилению иммунной атаки.
[005] Последние разработки с использованием терапии аутологичными модифицированными химерным рецептором антигена (CAR) T-клетками (CART), которая основана на перенацеливании T-клеток на подходящую молекулу клеточной поверхности на злокачественных клетках, таких как B-клеточные злокачественные опухоли, демонстрируют перспективные результаты в отношении приспособления сил иммунной системы к лечению B-клеточных новообразований и других злокачественных опухолей (см., например, Sadelain et al., Cancer Discovery 3:388-398 (2013)). Клинические результаты для происходящих из мыши CART19 (т.е. "CTL019") показали перспективность в отношении установления полных ремиссий у пациентов, страдающих CLL, а также детского ALL (см., например, Kalos et al., Sci Transl Med 3:95ra73 (2011), Porter et al., NEJM 365:725-733 (2011), Grupp et al., NEJM 368:1509-1518 (2013)). Помимо способности химерного рецептора антигена на генетически модифицированных T-клетках распознавать и разрушать клетки-мишени, успешная терапия терапевтическими T-клетками должна быть способна к пролиферации и персистированию с течением времени, и к дальнейшему мониторингу ускользнувших лейкозных клеток. Изменчивое качество T-клеток, являющееся результатом анергии, подавления или истощения, будет оказывать эффекты на эффективность трансформированных CAR T-клеток, контроль над которой специалистами в данной области в настоящее время ограничен. Чтобы быть эффективными, трансформированные CAR T-клетки пациента должны персистировать и сохранять способность к пролиферации в ответ на антиген CAR. Было показано, что T-клетки пациента с ALL могут достигать этого при использовании CART19, содержащих scFv мыши (см., например, Grupp et al., NEJM 368:1509-1518 (2013)).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[006] Настоящее изобретение относится, по меньшей мере частично, к композициями и способам для лечения нарушений, таких как злокачественная опухоль (например, гематологические злокачественные опухоли или другие B-клеточные злокачественные опухоли) с использованием иммунных эффекторных клеток (например, T-клетки или NK-клетки), которые экспрессируют молекулу химерного рецептора антигена (CAR) (например, CAR, которая связывается с B-клеточным антигеном, например, белком кластера дифференцировки 19 (CD19) (например, номер доступа OMIM № 107265, номер доступа Swiss Prot. Acc № P15391). Композиции включают иммунные эффекторные клетки (например, T-клетки или NK-клетки), экспрессирующие CAR, нацеливающие на B-клетки, в комбинации с ингибитором киназы (например, один или несколько из ингибитора CDK4/6, ингибитора BTK, ингибитора mTOR, ингибитора MNK, двойного ингибитора PI3K/mTOR или их комбинации), и способы включают их введение. В некоторых вариантах осуществления комбинация сохраняет, или имеет улучшенную, клиническую эффективность по сравнению с любым из терапевтических средств отдельно. Кроме того, изобретение относится к применению модифицированных способами инженерии клеток, например, иммунных эффекторных клеток (например, T-клеток или NK-клеток), для экспрессии молекулы CAR, которая связывается с B-клеточным антигеном, например CD19, в комбинации с ингибитором киназы (например, ингибитор киназы, выбранный из одного или нескольких из ингибитора циклин-зависимой киназы 4 (CDK4), ингибитор тирозинкиназы Брутона (BTK), ингибитор mTOR, ингибитор киназы, взаимодействующей с активируемой митогенами протеинкиназой (MNK), двойной ингибитор фосфатидилинозитол-3-киназы (PI3K)/mTOR или их комбинация) для лечения нарушения, ассоциированного с экспрессией B-клеточного антигена, например, CD19 (например, злокачественная опухоль, например, гематологическая злокачественная опухоль).
[007] Таким образом, в одном аспекте изобретение относится к способу лечения индивидуума, например, млекопитающего, имеющего заболевание, ассоциированное с экспрессией B-клеточного антигена, например, CD19. Способ включает введение млекопитающему эффективного количества клетки, например, иммунной эффекторной клетки (например, T-клетках или NK-клетка), которая экспрессирует молекулу CAR, которая связывает B-клеточный антиген, в комбинации с ингибитором киназы, например, ингибитором киназы, описанным в настоящем описании. В одном варианте осуществления, молекула CAR связывается с CD19, как например, молекула CAR, которая связывает CD19, описанная в настоящем описании. В других вариантах осуществления молекула CAR связывается с одним или несколькими из CD20, CD22 или ROR1.
[008] В одном варианте осуществления заболевание, ассоциированное с экспрессией B-клеточного антигена (например, экспрессией одного или нескольких из CD19, CD20, CD22 или ROR1) выбрано из пролиферативного заболевания, такого как злокачественная опухоль, новообразование или предзлокачественное состояние, такое как миелодисплазия, миелодиспластический синдром или предлейкоз, или представляет собой не связанное со злокачественной опухолью состояние, ассоциированное с экспрессией B-клеточного антигена, например, одного или нескольких из CD19, CD20, CD22 или ROR1. В одном варианте осуществления заболевание представляет собой солидную опухоль или жидкостную опухоль. В одном варианте осуществления злокачественная опухоль представляет собой рак поджелудочной железы. В одном варианте осуществления заболевание представляет собой гематологическую злокачественную опухоль. В одном варианте осуществления гематологическая злокачественная опухоль представляет собой лейкоз. В одном варианте осуществления злокачественная опухоль выбрана из группы, состоящей из одного или нескольких острых лейкозов, включая, но не ограничиваясь ими B-клеточный острый лимфоидный лейкоз (BALL), T-клеточный острый лимфоидный лейкоз (TALL), мелкоклеточный лимфобластный лейкоз (SLL), острый лимфоидный лейкоз (ALL); один или несколько хронических лейкозов, включая, но не ограничиваясь ими, хронический миелогенный лейкоз (CML), хронический лимфоцитарный лейкоз (CLL). Дополнительные гематологические злокачественные опухоли или гематологические состояния включают, но не ограничиваются ими, лимфому из клеток мантийной зоны (MCL), B-клеточный пролимфоцитарный лейкоз, новообразование из бластных плазмацитоидных дендритных клеток, лимфому Беркитта, диффузную крупноклеточную B-клеточную лимфому (DLBCL), фолликулярную лимфому, волосатоклеточный лейкоз, мелкоклеточную или крупноклеточную фолликулярную лимфому, злокачественные лимфопролиферативные состояния, лимфому MALT, лимфому маргинальной зоны, множественную миелому, миелодисплазию и миелодиспластический синдром, неходжкинскую лимфому, лимфому Ходжкина, плазмабластную лимфому, новообразование из плазмацитоидных дендритных клеток и макроглобулинемию Валденстрема. В определенных вариантах осуществления заболевание, ассоциированное с экспрессией B-клеточного антигена (например, например, одного или нескольких из CD19, CD20, CD22 или ROR1), представляет собой "предлейкоз", который представляет собой многообразную совокупность гематологических состояний, объединенных неэффективной продукцией (или дисплазией) миелоидных клеток крови. В некоторых вариантах осуществления заболевание, ассоциированное с экспрессией B-клеточного антигена (например, одного или нескольких из CD19, CD20, CD22 или ROR1), включает, но не ограничивается ими, атипичные и/или неклассические злокачественные опухоли, новообразования, предзлокачественные состояния или пролиферативные заболевания, экспрессирующие B-клеточный антиген (например, один или несколько из CD19, CD20, CD22 или ROR1). Любую комбинацию заболеваний, ассоциированных с экспрессией B-клеточного антигена (например, одного или нескольких из CD19, CD20, CD22 или ROR1), описанных в настоящем описании, можно лечить способами и композициями, описанными в настоящем описании.
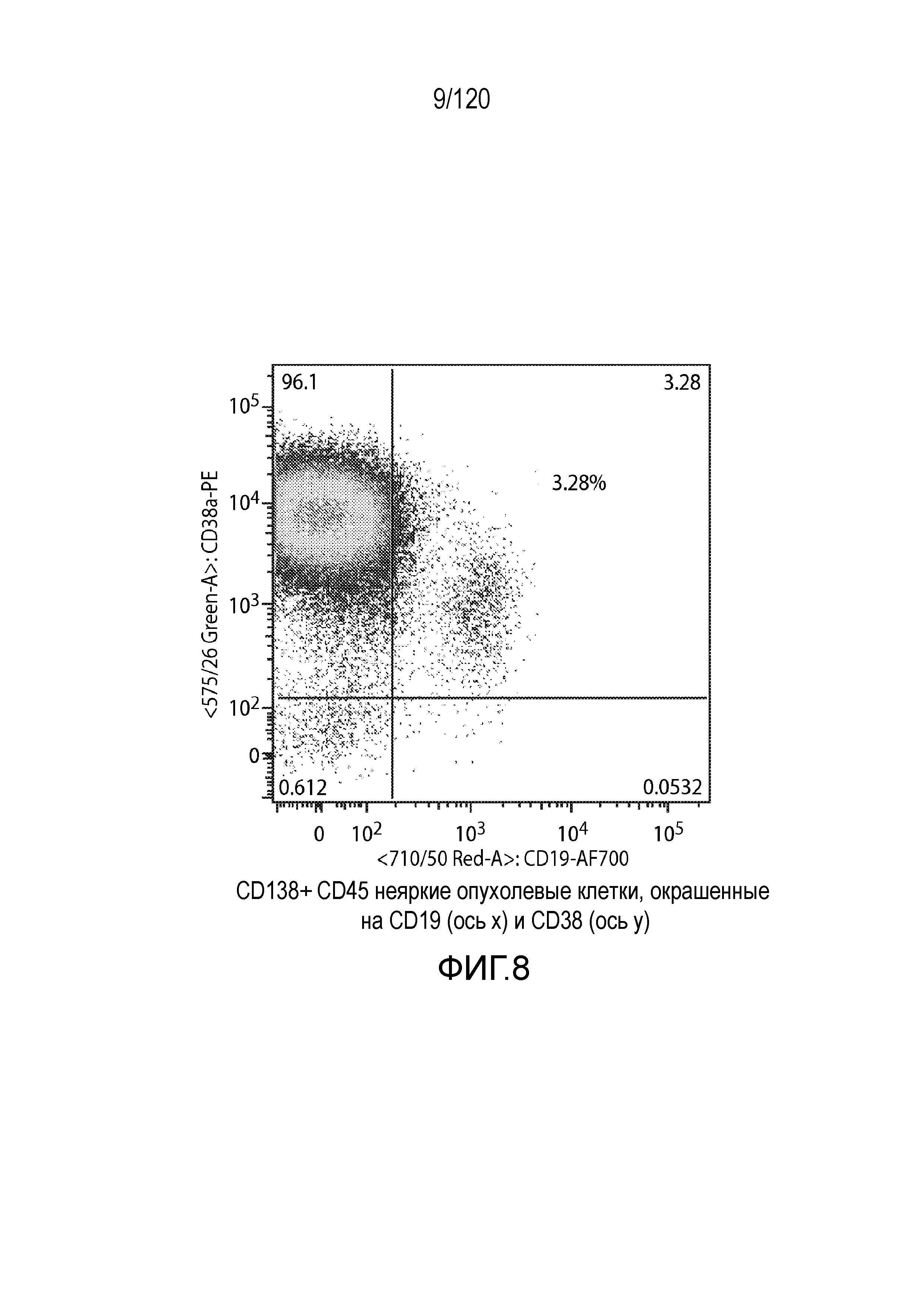
[009] В одном варианте осуществления заболевание, ассоциированное с экспрессией B-клеточного антигена (например, один или несколько из CD19, CD20, CD22 или ROR1), представляет собой лимфому, например, MCL, лимфому Ходжкина или DLBCL. В одном варианте осуществления заболевание, ассоциированное с экспрессией B-клеточного антигена (например, одного или нескольких из CD19, CD20, CD22 или ROR1) представляет собой лейкоз, например, SLL, CLL и/или ALL. В одном варианте осуществления заболевание, ассоциированное с экспрессией B-клеточного антигена, представляет собой множественную миелому (например, множественная миелома, которая является отрицательной по CD19, например, имеющая значительное большинство (99,95%) неопластических плазмацитов с отрицательным по CD19 фенотипом, например, как обнаруживают посредством проточной цитометрии и ОТ-ПЦР.
[0010] В одном варианте осуществления ингибитор киназы представляет собой ингибитор CDK4, например, ингибитор CDK4, описанный в настоящем описании, например, ингибитор CD4/6, например, такой как 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-илпиридин-2-иламино)-8H-пиридо[2,3-d]пиримидин-7-она гидрохлорид (также называемый палбоциклибом или PD0332991). В одном варианте осуществления ингибитор киназы представляет собой ингибитор BTK, например, ингибитор BTK, описанный в настоящем описании, например, такой как ибрутиниб. В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, например, ингибитор mTOR, описанный в настоящем описании, например, такой как рапамицин, аналоги рапамицина, OSI-027. Ингибитор mTOR может представлять собой, например, ингибитор mTORC1 и/или ингибитор mTORC2, например, ингибитор mTORC1 и/или ингибитор mTORC2, описанный в настоящем описании. В одном варианте осуществления ингибитор киназы представляет собой ингибитор MNK, например, ингибитор MNK, описанный в настоящем описании, например, такой как 4-амино-5-(4-фторанилино)пиразолo[3,4-d]пиримидин. Ингибитор MNK может представлять собой, например, ингибитор MNK1a, MNK1b, MNK2a и/или MNK2b. В одном варианте осуществления ингибитор может представлять собой двойной ингибитор PI3K/mTOR, например, PF-04695102.
[0011] В одном варианте осуществления ингибитор киназы представляет собой ингибитор CDK4, выбранный из алоизина A; флавопиридола или HMR-1275, 2-(2-хлорфенил)-5,7-дигидрокси-8-[(3S,4R)-3-гидрокси-1-метил-4-пиперидинил]-4-хроменона; кризотиниба (PF-02341066); 2-(2-хлорфенил)-5,7-дигидрокси-8-[(2R,3S)-2-(гидроксиметил)-1-метил-3-пирролидинил]-4H-1-бензопиран-4-она гидрохлорида (P276-00); 1-метил-5-[[2-[5-(трифторметил)-1H-имидазол-2-ил]-4-пиридинил]окси]-N-[4-(трифторметил)фенил]-1H-бензимидазол-2-амина (RAF265); индисулама (E7070); росковитина (CYC202); палбоциклиба (PD0332991); динациклиба (SCH727965); N-[5-[[(5-трет-бутилоксазол-2-ил)метил]тио]тиазол-2-ил]пиперидин-4-карбоксамида (BMS 387032); 4-[[9-хлор-7-(2,6-дифторфенил)-5H-пиримидо[5,4-d][2]бензазепин-2-ил]амино]бензойной кислоты (MLN8054); 5-[3-(4,6-дифтор-1H-бензимидазол-2-ил)-1H-индазол-5-ил]-N-этил-4-метил-3-пиридинметанамина (AG-024322); 4-(2,6-дихлорбензоиламино)-1H-пиразол-3-карбоновой кислоты N-(пиперидин-4-ил)амида (AT7519); 4-[2-метил-1-(1-метилэтил)-1H-имидазол-5-ил]-N-[4-(метилсульфонил)фенил]-2-пиримидинамина (AZD5438); XL281 (BMS908662) и рибоциклиба.
[0012] В одном варианте осуществления ингибитор киназы представляет собой ингибитор CDK4, например, палбоциклиб (PD0332991), и палбоциклиб вводят в дозе приблизительно 50 мг, 60 мг, 70 мг, 75 мг, 80 мг, 90 мг, 100 мг, 105 мг, 110 мг, 115 мг, 120 мг, 125 мг, 130 мг, 135 мг (например, 75 мг, 100 мг или 125 мг) каждые сутки в течение периода времени, например, каждые сутки в течение 14-21 суток курса из 28 суток, или каждые сутки в течение 7-12 суток курса из 21 суток. В одном варианте осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более курсов введения палбоциклиба.
[0013] В одном варианте осуществления ингибитор киназы представляет собой ингибитор BTK, выбранный из ибрутиниба (PCI-32765); GDC-0834; RN-486; CGI-560; CGI-1764; HM-71224; CC-292; ONO-4059; CNX-774 и LFM-A13. В предпочтительном варианте осуществления ингибитор BTK не снижает или не ингибирует киназную активность индуцируемой интерлейкином-2 киназы (ITK), и выбран из GDC-0834; RN-486; CGI-560; CGI-1764; HM-71224; CC-292; ONO-4059; CNX-774 и LFM-A13.
[0014] В одном варианте осуществления ингибитор киназы представляет собой ингибитор BTK, например, ибрутиниб (PCI-32765), и ибрутиниб вводят в дозе приблизительно 250 мг, 300 мг, 350 мг, 400 мг, 420 мг, 440 мг, 460 мг, 480 мг, 500 мг, 520 мг, 540 мг, 560 мг, 580 мг, 600 мг (например, 250 мг, 420 мг или 560 мг) каждые сутки в течение периода времени, например, каждые сутки в течение курса из 21 суток или каждые сутки в течение курса из 28 суток. В одном варианте осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более курсов введения ибрутиниба.
[0015] В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, выбранный из темсиролимуса; ридафоролимуса (1R,2R,4S)-4-[(2R)-2 [(1R,9S,12S,15R,16E,18R,19R,21R, 23S,24E,26E,28Z,30S,32S,35R)-1,18-дигидрокси-19,30-диметокси-15,17,21,23, 29,35-гексаметил-2,3,10,14,20-пентаоксо-11,36-диокса-4-азатрицикло[30,3,1,04,9]гексатриаконта-16,24,26,28-тетраен-12-ил]пропил]-2-метоксициклогексилдиметилфосфината, также известного как AP23573 и MK8669; эверолимуса (RAD001); рапамицина (AY22989); семапимода; (5-{2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил}-2-метоксифенил)метанола (AZD8055); 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метил-пиридо[2,3-d]пиримидин-7(8H)-она (PF04691502); и N2-[1,4-диоксо-4-[[4-(4-оксо-8-фенил-4H-1-бензопиран-2-ил)морфолиний-4-ил]метокси]бутил]-L-аргинилглицил-L-α-аспартил-L-серина, внутренней соли (SF1126) и XL765.
[0016] В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, например рапамицин, и рапамицин вводят в дозе приблизительно 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг (например, 6 мг) каждые сутки в течение периода времени, например, каждые сутки в течение курса из 21 суток или каждые сутки в течение курса из 28 суток. В одном варианте осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более курсов введения рапамицина. В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, например, эверолимус, и эверолимус вводят в дозе приблизительно 2 мг, 2,5 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг (например, 10 мг) каждые сутки в течение периода времени, например, каждые сутки в течение курса из 28 суток. В одном варианте осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более курсов введения эверолимуса.
[0017] В одном варианте осуществления ингибитор киназы представляет собой ингибитор MNK, выбранный из CGP052088; 4-амино-3-(п-фторфениламино)пиразолo[3,4-d]пиримидина (CGP57380); церкоспорамида; ETC-1780445-2 и 4-амино-5-(4-фторанилино)пиразолo[3,4-d]пиримидина.
[0018] В одном варианте осуществления ингибитор киназы представляет собой двойной ингибитор фосфатидилинозитол-3-киназы (PI3K) и mTOR, выбранный из 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метилпиридо[2,3-d]пиримидин-7(8H)-она (PF-04691502); N-[4-[[4-(диметиламино)-1-пиперидинил]карбонил]фенил]-N'-[4-(4,6-ди-4-морфолинил-1,3,5-триазин-2-ил)фенил]мочевины (PF-05212384, PKI-587); 2-метил-2-{4-[3-метил-2-оксо-8-(хинолин-3-ил)-2,3-дигидро-1H-имидазо[4,5-c]хинолин-1-ил]фенил}пропаннитрила (BEZ-235); апитолисиба (GDC-0980, RG7422); 2,4-дифтор-N-{2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамида (GSK2126458); 8-(6-метоксипиридин-3-ил)-3-метил-1-(4-(пиперазин-1-ил)-3-(трифторметил)фенил)-1H-имидазо[4,5-c]хинолин-2(3H)-она, малеиновой кислоты (NVP-BGT226); 3-[4-(4-морфолинилпиридо[3',2':4,5]фуро[3,2-d]пиримидин-2-ил]фенола (PI-103); 5-(9-изопропил-8-метил-2-морфолино-9H-пурин-6-ил)пиримидин-2-амина (VS-5584, SB2343) и N-[2-[(3,5-диметоксифенил)амино]хиноксалин-3-ил]-4-[(4-метил-3-метоксифенил)карбонил]аминофенилсульфонамида (XL765).
[0019] В одном варианте осуществления клетка экспрессирует молекулу CAR, содержащую связывающий CD19 домен (например, антитело мыши или гуманизированное антитело, или фрагмент антитела, которые специфически связываются с CD19), трансмембранный домен и внутриклеточный сигнальный домен (например, внутриклеточный сигнальный домен, содержащий костимулирующий домен и/или первичный сигнальный домен). В одном варианте осуществления CAR содержит антитело или антитела, которые включают связывающий CD19 домен, описанный в настоящем описании (например, антитело мыши или гуманизированное антитело, или фрагмент антитела, которые специфически связываются с CD19, как описано в настоящем описании), трансмембранный домен, описанный в настоящем описании, и внутриклеточный сигнальный домен, описанный в настоящем описании (например, внутриклеточный сигнальный домен, содержащий костимулирующий домен и/или первичный сигнальный домен, описанный в настоящем описании).
[0020] В одном варианте осуществления молекула CAR способна связывать CD19 (например, CD19 дикого типа или мутантный CD19 человека). В одном варианте осуществления молекула CAR содержит связывающий CD19 домен, содержащий одну или несколько (например, все три) из определяющей комплементарность области 1 легкой цепи (CDR1 LC), определяющей комплементарность области 2 легкой цепи (CDR2 LC) и определяющей комплементарность области 3 легкой цепи (CDR3 LC) связывающего CD19 домена, описанного в настоящем описании, и одну или несколько (например, все три) из определяющей комплементарность области 1 тяжелой цепи (CDR1 HC), определяющей комплементарность области 2 тяжелой цепи (CDR2 HC) и определяющей комплементарность области 3 тяжелой цепи (CDR3 HC) связывающего CD19 домена, описанного в настоящем описании, например, связывающего CD19 домена, содержащего одну или несколько, например все три, LC CDR и одну или несколько, например все три, HC CDR. В одном варианте осуществления связывающий CD19 домен содержит одну или несколько (например, все три) из определяющей комплементарность области 1 тяжелой цепи (CDR1 HC), определяющей комплементарность области 2 тяжелой цепи (CDR2 HC) и определяющей комплементарность области 3 тяжелой цепи (CDR3 HC) связывающего CD19 домена, описанного в настоящем описании, например, связывающий CD19 домен имеет две вариабельных области тяжелой цепи, каждая из которых содержит CDR1 HC, CDR2 HC и CDR3 HC, описанные в настоящем описании. В одном варианте осуществления связывающий CD19 домен содержит вариабельную область легкой цепи мыши, описанную в настоящем описании (например, в таблице 7) и/или вариабельную область тяжелой цепи мыши, описанную в настоящем описании (например, в таблице 7). В одном варианте осуществления связывающий CD19 домен представляет собой scFv, содержащий легкую цепь мыши и тяжелую цепь мыши, имеющие аминокислотную последовательность, представленную в таблице 7. В одном варианте осуществления связывающий CD19 домен (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области легкой цепи, представленной в таблице 7, или последовательность, обладающую 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 7; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области тяжелой цепи, представленной в таблице 7, или последовательность, обладающую 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 7. В одном варианте осуществления связывающий CD19 домен содержит последовательность SEQ ID NO: 59, или последовательность, обладающую 95-99% идентичностью с ней. В одном варианте осуществления связывающий CD19 домен представляет собой scFv, и вариабельная область легкой цепи, содержащая аминокислотную последовательность, описанную в настоящем описании, например, в таблице 7, связана с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, описанную в настоящем описании, например, в таблице 7, через линкер, например, линкер, описанный в настоящем описании. В одном варианте осуществления связывающий CD19 домен включает линкер (Gly4-Ser)n, где n равно 1, 2, 3, 4, 5 или 6, предпочтительно 3 или 4 (SEQ ID NO: 53). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
[0021] В одном варианте осуществления молекула CAR содержит гуманизированный связывающий CD19 домен, который включает одну или несколько (например, все три) из определяющей комплементарность области 1 легкой цепи (CDR1 LC), определяющей комплементарность области 2 легкой цепи (CDR2 LC) и определяющей комплементарность области 3 легкой цепи (CDR3 LC) гуманизированного связывающего CD19 домена, описанного в настоящем описании, и одну или несколько (например, все три) из определяющей комплементарность области 1 тяжелой цепи (CDR1 HC), определяющей комплементарность области 2 тяжелой цепи (CDR2 HC) и определяющей комплементарность области 3 тяжелой цепи (CDR3 HC) гуманизированного связывающего CD19 домена, описанного в настоящем описании, например, гуманизированного связывающего CD19 домена, содержащего одну или несколько, например, все три, LC CDR, и одну или несколько, например, все три, HC CDR. В одном варианте осуществления гуманизированный связывающий CD19 домен содержит по меньшей мере CDR2 HC. В одном варианте осуществления гуманизированный связывающий CD19 домен содержит одну или несколько (например, все три) из определяющей комплементарность области 1 тяжелой цепи (CDR1 HC), определяющей комплементарность области 2 тяжелой цепи (CDR2 HC) и определяющей комплементарность области 3 тяжелой цепи (CDR3 HC) гуманизированного связывающего CD19 домена, описанного в настоящем описании, например, гуманизированный связывающий CD19 домен имеет две вариабельных области тяжелой цепи, каждая из которых содержит CDR1 HC, CDR2 HC и CDR3 HC, описанные в настоящем описании. В одном варианте осуществления гуманизированный связывающий CD19 домен содержит по меньшей мере CDR2 HC. В одном варианте осуществления вариабельная область легкой цепи содержит один, два, три или все четыре каркасных области последовательности эмбрионального типа VK3_L25. В одном варианте осуществления вариабельная область легкой цепи имеет модификацию (например, замену, например, замену одного или нескольких аминокислотных остатков, находящихся в соответствующем положении вариабельной области легкой цепи мыши SEQ ID NO: 58, например, замену в одном или нескольких из положений 71 и 87). В одном варианте осуществления вариабельная область тяжелой цепи содержит одну, две, три или все четыре каркасных области последовательности эмбрионального типа VH4_4-59. В одном варианте осуществления вариабельная область тяжелой цепи имеет модификацию (например, замену, например, замену одной или нескольких аминокислот, находящихся в соответствующем положении в вариабельной области тяжелой цепи мыши SEQ ID NO: 58, например, замену в одном или нескольких из положений 71, 73 и 78). В одном варианте осуществления гуманизированный связывающий CD19 домен содержит вариабельную область легкой цепи, описанную в настоящем описании (например, в таблице 3) и/или вариабельную область тяжелой цепи, описанную в настоящем описании (например, в таблице 3). В одном варианте осуществления гуманизированный связывающий CD19 домен представляет собой scFv, содержащий легкую цепь и тяжелую цепь аминокислотной последовательности, представленной в таблице 3. В одном варианте осуществления гуманизированный связывающий CD19 домен (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области легкой цепи, представленной в таблице 3, или последовательности, обладающей 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 3; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области тяжелой цепи, представленной в таблице 3, или последовательность, обладающую 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 3. В одном варианте осуществления гуманизированный связывающий CD19 домен содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 12, или последовательность, обладающую 95-99% идентичностью с ними. В одном варианте осуществления гуманизированный связывающий CD19 домен представляет собой scFv, и вариабельная область легкой цепи, содержащая аминокислотную последовательность, описанную в настоящем описании, например, в таблице 3, связана с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, описанную в настоящем описании, например, в таблице 3, через линкер, например, линкер, описанный в настоящем описании. В одном варианте осуществления гуманизированный связывающий CD19 домен включает линкер (Gly4-Ser)n, где n равно 1, 2, 3, 4, 5 или 6, предпочтительно 3 или 4 (SEQ ID NO: 53). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv может находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
[0022] В одном варианте осуществления молекула CAR содержит трансмембранный домен белка, выбранного из группы, состоящей из альфа-, бета- или зета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном варианте осуществления трансмембранный домен содержит последовательность SEQ ID NO: 15. В одном варианте осуществления трансмембранный домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 20, 10 или 5 модификаций (например, замен) аминокислотной последовательности SEQ ID NO: 15 или последовательность, обладающей 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 15.
[0023] В одном варианте осуществления связывающий CD19 домен связан с трансмембранным доменом через шарнирную область, например, шарнирную область, описанную в настоящем описании. В одном варианте осуществления кодируемая шарнирная область содержит SEQ ID NO: 14 или SEQ ID NO: 45, или последовательность, обладающую 95-99% идентичностью с ними.
[0024] В одном варианте осуществления молекула CAR, кроме того, содержит последовательность, кодирующую костимулирующий домен, например, костимулирующий домен, описанный в настоящем описании. В одном варианте осуществления костимулирующий домен содержит функциональный сигнальный домен белка, выбранного из группы, состоящей из OX40, CD2, CD27, CD28, CDS, ICAM-1, LFA-1 (CD11a/CD18) и 4-1BB (CD137). В одном варианте осуществления костимулирующий домен содержит последовательность SEQ ID NO: 16. В одном варианте осуществления костимулирующий домен содержит последовательность SEQ ID NO: 51. В одном варианте осуществления костимулирующий домен содержит аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 20, 10 или 5 модификаций (например, замен) аминокислотной последовательности SEQ ID NO: 16 или SEQ ID NO: 51, или последовательность, обладающую 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 16 или SEQ ID NO: 51.
[0025] В одном варианте осуществления молекула CAR, кроме того, содержит последовательность, кодирующую внутриклеточный сигнальный домен, например, внутриклеточный сигнальный домен, описанный в настоящем описании. В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и/или функциональный сигнальный домен CD3-зета. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 16 и/или последовательность SEQ ID NO: 17. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 16 и/или последовательность SEQ ID NO: 43. В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен CD27 и/или функциональный сигнальный домен CD3-зета. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 51 и/или последовательность SEQ ID NO: 17. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 51 и/или последовательность SEQ ID NO: 43. В одном варианте осуществления внутриклеточный сигнальный домен содержит аминокислотную последовательность, обладающую по меньшей мере одной, двумя или тремя модификациями (например, заменами), но не более чем 20, 10 или 5 модификациями (например, заменами) аминокислотной последовательности SEQ ID NO: 16 или SEQ ID NO: 51 и/или аминокислотной последовательности SEQ ID NO: 17 или SEQ ID NO: 43, или последовательности, обладающей 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 16 или SEQ ID NO: 51 и/или аминокислотной последовательностью SEQ ID NO: 17 или SEQ ID NO: 43. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 16 или SEQ ID NO: 51 и последовательность SEQ ID NO: 17 или SEQ ID NO: 43, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке считывания и в качестве единой полипептидной цепи.
[0026] В одном варианте осуществления молекула CAR, кроме того, содержит лидерную последовательность, например, лидерную последовательность, описанную в настоящем описании. В одном варианте осуществления лидерная последовательность содержит аминокислотную последовательность SEQ ID NO: 13 или последовательность, обладающую 95-99% идентичностью с аминокислотной последовательностью SEQ ID NO: 13.
[0027] В одном варианте осуществления молекула CAR содержит лидерную последовательность, например, лидерную последовательность, описанную в настоящем описании, например, лидерную последовательность SEQ ID NO: 13, или обладающую 95-99% идентичностью с ней; связывающий CD19 домен, описанный в настоящем описании, например, связывающий CD19 домен, содержащий CDR1 LC, CDR2 LC, CDR3 LC, CDR1 HC, CDR2 HC и CDR3 HC, описанные в настоящем описании, например, связывающий CD19 домен мыши, описанный в таблице 7, гуманизированный связывающий CD19 домен, описанный в таблице 3, или последовательность, обладающую 95-99% идентичностью с ним; шарнирную область, например, шарнирную область, описанную в настоящем описании, например, шарнирную область SEQ ID NO: 14 или обладающую 95-99% идентичностью с ней; трансмембранный домен, например, трансмембранный домен, описанный в настоящем описании, например, трансмембранный домен, имеющий последовательность SEQ ID NO: 15 или последовательность, обладающую 95-99% идентичностью с ней; внутриклеточный сигнальный домен, например, внутриклеточный сигнальный домен, описанный в настоящем описании (например, внутриклеточный сигнальный домен, содержащий костимулирующий домен и/или первичный сигнальный домен). В одном варианте осуществления внутриклеточный сигнальный домен содержит костимулирующий домен, например, костимулирующий домен, описанный в настоящем описании, например, костимулирующий домен 4-1BB, имеющий последовательность SEQ ID NO: 16 или SEQ ID NO: 51, или обладающий 95-99% идентичностью с ним, и/или первичный сигнальный домен, например, первичный сигнальный домен, описанный в настоящем описании, например, костимулирующий домен CD3-зета, имеющий последовательность SEQ ID NO: 17 или SEQ ID NO: 43, или обладающий 95-99% идентичностью с ним.
[0028] В одном варианте осуществления молекула CAR содержит (например, состоит из) аминокислотную последовательность SEQ ID NO: 58, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41 или SEQ ID NO: 42, или аминокислотную последовательность, имеющую по меньшей мере одну, две, три, четыре, пять 10, 15, 20 или 30 модификаций (например, замен), но не более чем 60, 50 или 40 модификаций (например, замен) аминокислотной последовательности SEQ ID NO: 58, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41 или SEQ ID NO: 42, или аминокислотной последовательности, обладающей 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичностью с аминокислотной последовательностью SEQ ID NO: 58, SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41 или SEQ ID NO: 42.
[0029] В одном варианте осуществления клетка, экспрессирующая молекулу CAR, содержит вектор, который включает последовательность нуклеиновой кислоты, кодирующую молекулу CAR. В одном варианте осуществления вектор выбран из группы, состоящей из ДНК, РНК, плазмиды, лентивирусного вектора, аденовирусного вектора или ретровирусного вектора. В одном варианте осуществления вектор представляет собой лентивирусный вектор. В одном варианте осуществления вектор, кроме того, содержит промотор. В одном варианте осуществления промотор представляет собой промотор EF-1. В одном варианте осуществления промотор EF-1 содержит последовательность SEQ ID NO: 100. В одном варианте осуществления вектор представляет собой транскрибируемый in vitro вектор, например, вектор, который транскрибирует РНК молекулы нуклеиновой кислоты, описанной в настоящем описании. В одном варианте осуществления последовательность нуклеиновой кислоты в векторе in vitro, кроме того, содержит поли(A)-хвостовую часть, например, поли-A-хвостовую часть, описанную в настоящем описании, например, содержащую приблизительно 150 аденозиновых оснований (SEQ ID NO: 104). В одном варианте осуществления последовательность нуклеиновой кислоты в векторе in vitro, кроме того, содержит 3ʹ-UTR, например, 3ʹ-UTR, описанную в настоящем описании, например, содержащую по меньшей мере один повтор 3ʹ-UTR, происходящий из бета-глобулина человека. В одном варианте осуществления последовательность нуклеиновой кислоты в векторе in vitro, кроме того, содержит промотор, например, промотор T2A.
[0030] В определенных вариантах осуществления композиций и способов, описанных в настоящем описании, клетка, экспрессирующая молекулу CAR (также называемая в настоящем описании "CAR-экспрессирующей клеткой"), представляет собой клетку или популяцию клеток, как описано в настоящем описании, например, иммунную эффекторную клетку человека или популяцию клеток (например, T-клетка человека или NK-клетка человека, например, T-клетка человека, описанная в настоящем описании, или NK-клетка человека, описанная в настоящем описании). В одном варианте осуществления T-клетка человека представляет собой CD8+ T-клетку. В одном варианте осуществления клетка представляет собой аутологичную T-клетку. В одном варианте осуществления клетка представляет собой аллогенную T-клетку. В одном варианте осуществления клетка представляет собой T-клетку, и T-клетка имеет дефицит диаглицеринкиназы (DGK). В одном варианте осуществления клетка представляет собой T-клетку, и T-клетка имеет дефицит Ikaros. В одном варианте осуществления клетка представляет собой T-клетку, и T-клетка имеет дефицит как DGK, так и Ikaros. Следует понимать, что композиции и способы, описанные в настоящем описании, для которых упоминается термин "клетка", охватывают композиции и способы, содержащие одну или несколько клеток, например, популяцию клеток.
[0031] В другом варианте осуществления клетка, экспрессирующая молекулу CAR, например, как описано в настоящем описании, кроме того, может экспрессировать другое средство, например, средство, которое усиливает активность CAR-экспрессирующей клетки.
[0032] В одном варианте осуществления способ, кроме того, включает введение клетки, экспрессирующей молекулы CAR, как описано в настоящем описании, необязательно в комбинации с ингибитором киназы, например, ингибитором BTK, таким как ибрутиниб, в комбинации со средством, которое усиливает активность CAR-экспрессирующей клетки. В определенных вариантах осуществления средство представляет собой цитокин, например, IL-7, IL-15, IL-21, или их комбинацию. В одном варианте осуществления способ включает введение IL-7 индивидууму. Цитокин можно доставлять в комбинации, например, одновременно или вскоре после, с введением CAR-экспрессирующей клетки. Альтернативно цитокин можно доставлять после более длительного периода времени после введения CAR-экспрессирующей клетки, например, после оценки ответа индивидуума на CAR-экспрессирующую клетку.
[0033] В других вариантах осуществления средство, которое усиливает активность CAR-экспрессирующей клетки, может представлять собой средство, которое ингибирует иммунную ингибиторную молекулу. Примеры иммунных ингибиторных молекул включают PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета. В одном варианте осуществления средство, которое ингибирует иммунную ингибиторную молекулу, содержит первый полипептид, например, иммунную ингибиторную молекулу, связанный со вторым полипептидом, который предоставляет положительный сигнал клетке, например, внутриклеточный сигнальный домен, описанный в настоящем описании. В одном варианте осуществления средство содержит первый полипептид, например, из ингибиторной молекулы, такой как PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 или TGFR-бета, или фрагмент любого из них (например, по меньшей мере часть внеклеточного домена любого из них), и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описанный в настоящем описании (например, содержащий костимулирующий домен (например, 41BB, CD27 или CD28, например, как описано в настоящем описании) и/или первичный сигнальный домен (например, сигнальный домен CD3-зета, описанный в настоящем описании). В одном варианте осуществления средство содержит первый полипептид PD1 или его фрагмент (например, по меньшей мере часть внеклеточного домена PD1), и второй полипептид внутриклеточного сигнального домена, описанного в настоящем описании (например, сигнальный домен CD28, описанный в настоящем описании, и/или сигнальный домен CD3-зета, описанный в настоящем описании).
[0034] В одном варианте осуществления для лечения злокачественной опухоли используют инфузию лимфоцитов, например, инфузию аллогенных лимфоцитов, где инфузия лимфоцитов включает по меньшей мере одну CAR-экспрессирующую клетку, которая связывается с B-клеточным антигеном (например, CD19) (также обозначаемая в настоящем описании как клетка, экспрессирующая CAR против CD19), как описано в настоящем описании. В одном варианте осуществления для лечения злокачественной опухоли используют инфузию аутологичных лимфоцитов, где инфузия аутологичных лимфоцитов включает по меньшей мере одну CD19-экспрессирующую клетку.
[0035] В одном варианте осуществления клетку, экспрессирующую CAR против CD19, например, T-клетку, вводят индивидууму, которому проводили предшествующую трансплантацию стволовых клеток, например, трансплантацию аутологичных стволовых клеток.
[0036] В одном варианте осуществления клетку, экспрессирующую CAR против CD19, например, T-клетку, вводят индивидууму, которому вводили предшествующую дозу мелфалана.
[0037] В одном варианте осуществления клетку, экспрессирующую молекулу CAR, например, молекулу CAR, описанную в настоящем описании, вводят в комбинации со средством, которое смягчает один или несколько побочных эффектов, ассоциированных с введением клетки, экспрессирующей молекулу CAR, например, средством, описанным в настоящем описании.
[0038] В одном варианте осуществления ингибитор киназы вводят в комбинации со средством, которое смягчает один или несколько побочных эффектов, ассоциированных с введением ингибитора киназы, например, средством, описанным в настоящем описании.
[0039] В одном варианте осуществления клетку, экспрессирующую молекулу CAR, например, молекулу CAR, описанную в настоящем описании, и ингибитор киназы вводят в комбинации с дополнительным средством, которое осуществляет лечение заболевания, ассоциированного с CD19, например, дополнительным средством, описанным в настоящем описании.
[0040] В одном варианте осуществления клетки, экпрессирующие молекулу CAR, например, молекулу CAR, описанную в настоящем описании, вводят в дозе и/или по схеме дозирования, которые описаны в настоящем описании.
[0041] В одном варианте осуществления молекулу CAR вводят в T-клетки, например, с использованием транскрипции in vitro, и индивидууму (например, человеку) проводят первоначальное введение клеток, содержащих молекулу CAR, и одно или несколько последующих введений клеток, содержащих молекулу CAR, где одно или несколько последующих введений проводят менее чем через 15 суток, например, через 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 суток, после предшествующего введения. В одном варианте осуществления более одного введения клеток, содержащих молекулу CAR, проводят у индивидуума (например, человека) в неделю, например, проводят 2, 3 или 4 введения клеток, содержащих молекулу CAR, в неделю. В одном варианте осуществления индивидууму (например, человеку) проводят более одного введения клеток, содержащих молекулу CAR, в неделю (например, 2, 3 или 4 введения в неделю) (также называемые в настоящем описании курсом), а затем следует одна неделя без введения клеток, содержащих молекулу CAR, а затем проводят одно или несколько дополнительных введений индивидууму клеток, содержащих молекулу CAR (например, более одного введения клеток, содержащих молекулу CAR, в неделю). В другом варианте осуществления у индивидуума (например, человеку) проводят более одного курса введения клеток, содержащих молекулу CAR, и время между курсами составляет менее 10, 9, 8, 7, 6, 5, 4 или 3 суток. В одном варианте осуществления клетки, содержащие молекулу CAR, вводят раз в двое суток с 3 введениями в неделю. В одном варианте осуществления клетки, содержащие молекулу CAR, вводят в течение по меньшей мере двух, трех, четырех, пяти, шести, семи, восьми или более недель.
[0042] В одном варианте осуществления комбинацию ингибитора киназы и клеток, экспрессирующих молекулу CAR, например, молекулу CAR, описанную в настоящем описании, вводят в качестве терапии первой линии от заболевания, например, злокачественной опухоли, например, злокачественной опухоли, описанной в настоящем описании. В другом варианте осуществления комбинацию ингибитора киназы и клеток, экспрессирующих молекулу CAR, например, молекулу CAR, описанную в настоящем описании, вводят в качестве терапии второй, третьей, четвертой линии от заболевания, например, злокачественной опухоли, например, злокачественной опухоли, описанной в настоящем описании.
[0043] В одном варианте осуществления индивидууму вводят клетку (например, популяцию клеток), описанную в настоящем описании.
[0044] В одном варианте осуществления способ включает введение популяции клеток, множество из которых содержат молекулу CAR, описанную в настоящем описании. В некоторых вариантах осуществления популяция CAR-экспрессирующих клеток содержит смесь клеток, экспрессирующих различные CAR. Например, в одном варианте осуществления популяция CAR-экспрессирующих клеток может включать первую клетку, экспрессирующую CAR, имеющий связывающий CD19 домен, описанный в настоящем описании, и вторую клетку, экспрессирующую CAR, имеющий другой связывающий CD19 домен, например, связывающий CD19 домен, описанный в настоящем описании, который отличается от связывающего CD19 домена в CAR, экспрессируемом первой клеткой. В качестве другого примера, популяция CAR-экспрессирующих клеток может включать первую клетку, экспрессирующую CAR, который включает связывающий CD19 домен, например, как описано в настоящем описании, и вторую клетку, экспрессирующую CAR, который включает антигенсвязывающий домен к мишени, отличной от CD19 (например, CD123 или мезотелин). В одном варианте осуществления популяция CAR-экспрессирующих клеток включает, например, первую клетку, экспрессирующую CAR, который включает первичный внутриклеточный сигнальный домен, и вторую клетку, экспрессирующую CAR, который включает вторичный сигнальный домен.
[0045] В одном варианте осуществления способ включает введение популяции клеток, где по меньшей мере одна клетка в популяции экспрессирует CAR, имеющий связывающий CD19 домен, описанный в настоящем описании, и средства, которое усиливает активность CAR-экспрессирующей клетки, например, второй клетки, экспрессирующей средство, которое усиливает активность CAR-экспрессирующей клетки. Например, в одном варианте осуществления средство может представлять собой средство, которое ингибирует иммунную ингибиторную молекулу. Примеры иммунных ингибиторных молекул включают PD1, PD-L1, CTLA-4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета. В одном варианте осуществления средство, которое ингибирует иммунную ингибирующую молекулу, содержит первый полипептид, например, ингибиторную молекулу, связанный со вторым полипептидом, который предоставляет положительный сигнал клетке, например, внутриклеточный сигнальный домен, описанный в настоящем описании. В одном варианте осуществления средство содержит первый полипептид, например, из ингибиторной молекулы, такой как PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 или TGFR-бета, или фрагмент любого из них (например, по меньшей мере часть внеклеточного домена любого из них) и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описанный в настоящем описании (например, содержащий костимулирующий домен (например, 41BB, CD27 или CD28, например, как описано в настоящем описании) и/или первичный сигнальный домен (например, сигнальный домен CD3-зета, описанный в настоящем описании). В одном варианте осуществления средство содержит первый полипептид PD1 или его фрагмент (например, по меньшей мере часть внеклеточного домена PD1), и второй полипептид внутриклеточного сигнального домена, описанного в настоящем описании (например, сигнальный домен CD28, описанный в настоящем описании, и/или сигнальный домен CD3-зета, описанный в настоящем описании).
[0046] В другом аспекте изобретение относится к клетке, экспрессирующей молекулу CAR, описанную в настоящем описании, для применения в качестве лекарственного средства в комбинации с ингибитором киназы, например, ингибитором киназы, описанным в настоящем описании (например, ингибитор BTK, такой как ибрутиниб). В другом аспекте изобретение относится к ингибитору киназы, описанному в настоящем описании (например, ингибитор BTK, такой как ибрутиниб) для применения в качестве лекарственного средства в комбинации с клеткой, экспрессирующей молекулу CAR, описанную в настоящем описании.
[0047] В другом аспекте изобретение относится к клетке, экспрессирующей молекулу CAR, описанную в настоящем описании, для применения в комбинации с ингибитором киназы, например, ингибитором киназы, описанным в настоящем описании (например, ингибитор BTK, такой как ибрутиниб), для лечения заболевания, при котором экспрессируется B-клеточный антиген (например, CD19). В другом аспекте изобретение относится к ингибитору киназы, описанному в настоящем описании (например, ингибитор BTK, такой как ибрутиниб), для применения в комбинации с клеткой, экспрессирующей молекулу CAR, описанную в настоящем описании, для лечения заболевания, при котором экспрессируется B-клеточный антиген (например, CD19). Заболевание может представлять собой, например, злокачественную опухоль, такую как гематологическая злокачественная опухоль. Злокачественная опухоль может представлять собой, например, лимфому, CLL, MCL, ALL, DLBCL, множественную миелому или другую злокачественную опухоль, описанную в настоящем описании.
[0048] В другом аспекте изобретение относится к клетке, экспрессирующей молекулу CAR, описанную в настоящем описании, для применения в качестве лекарственного средства в комбинации с цитокином, например, IL-7, IL-15 и/или IL-21, как описано в настоящем описании. В другом аспекте изобретение относится к цитокину, описанному в настоящем описании, для применения в качестве лекарственного средства в комбинации с клеткой, экспрессирующей молекулу CAR, описанную в настоящем описании.
[0049] В другом аспекте изобретение относится к клетке, экспрессирующей молекулу CAR, описанную в настоящем описании, для применения в комбинации с цитокином, например, IL-7, IL-15 и/или IL-21, как описано в настоящем описании, для лечения заболевания, при котором экспрессируется CD19. В другом аспекте изобретение относится к цитокину, описанному в настоящем описании, для применения в комбинации с клеткой, экспрессирующей молекулу CAR, описанную в настоящем описании, для лечения заболевания, при котором экспрессируется CD19.
[0050] В другом аспекте изобретение относится к способу лечения млекопитающего, имеющего лимфому Ходжкина, включающему введение млекопитающему эффективного количества клетки (например, клеток), экспрессирующей молекулу CAR, например, молекулу CAR, описанную в настоящем описании.
[0051] В одном варианте осуществления клетку, экспрессирующую молекулу CAR, например, молекулу CAR, описанную в настоящем описании, вводят в комбинации со средством, которое повышает эффективность клетки, экспрессирующей молекулу CAR, например, средством, описанным в настоящем описании.
[0052] В одном варианте осуществления клетку, экспрессирующую молекулу CAR, например, молекулу CAR, описанную в настоящем описании, вводят в комбинации со средством, которое смягчает один или несколько побочных эффектов, ассоциированных с введением клетки, экспрессирующей молекулу CAR, например, средством, описанным в настоящем описании.
[0053] В одном варианте осуществления клетку, экспрессирующую молекулу CAR, например, молекулу CAR, описанную в настоящем описании, вводят в комбинации со средством, которое осуществляет лечение лимфомы Ходжкина, например, средством, описанным в настоящем описании.
[0054] В одном варианте осуществления клетку, экспрессирующую молекулу CAR, например, молекулу CAR, описанную в настоящем описании, вводят в комбинации с низкой усиливающей иммунитет дозой ингибитора mTOR, например, ингибитора mTOR, описанного в настоящем описании. Без связи с теорией, полагают, что лечение низкой усиливающей иммунитет дозой (например, доза, которая является недостаточной для полного подавления иммунной системы, но является достаточной для улучшения иммунной функции) сопровождается снижением уровня положительных по PD-1 T-клеток или повышением уровня отрицательных по PD-1 T-клеток. Положительные по PD-1 T-клетки, но не отрицательные по PD-1 T-клетки, можно устранять посредством контакта с клетками, которые экспрессируют лиганд PD-1, например, PD-L1 или PD-L2.
[0055] В одном варианте осуществления этот подход можно использовать для оптимизации эффективности клетки CAR, описанной в настоящем описании, у индивидуума. Без связи с теорией полагают, что в одном варианте осуществления эффективность эндогенных немодифицированных иммунных эффекторных клеток, например, T-клеток, повышается. Без связи с теорией полагают, что в одном варианте осуществления эффективность клеток, экспрессирующих CAR против CD19, повышается. В других вариантах осуществления клетки, например, T-клетки, которые модифицированы или будут модифицированы для экспрессии CAR, можно обрабатывать ex vivo путем контакта с количеством ингибитора mTOR, которое повышает количество отрицательных по PD1 иммунных эффекторных клеток, например, T-клеток, или увеличивает соотношение отрицательные по PD1 иммунные эффекторные клетки, например T-клетки/положительные по PD1 иммунные эффекторные клетки, например T-клетки.
[0056] В одном варианте осуществления введение низкой повышающей иммунитет дозы ингибитора mTOR, например аллостерического ингибитора, например RAD001, или каталитического ингибитора, начинают до введения экспрессирующих CAR клеток, описанных в настоящем описании, например T-клеток. В одном варианте осуществления ингибитор mTOR представляет собой RAD001 или рапамицин. В одном варианте осуществления клетки с CAR вводят после достаточного периода времени или достаточного дозирования ингибитора mTOR, чтобы уровень отрицательных по PD1 иммунных эффекторных клеток, например, T-клеток, или соотношение отрицательные по PD1 иммунные эффекторные клетки, например T-клетки/положительные по PD1 иммунные эффекторные клетки, например T-клетки, по меньшей мере временно увеличивались.
[0057] В одном варианте осуществления клетку, например, иммунную эффекторную клетку (например, T-клетку или NK-клетку), подлежащую модификации способами инженерии для экспрессии CAR, собирают после достаточного периода времени или после достаточного дозирования низкой усиливающей иммунитет дозы ингибитора mTOR, чтобы уровень отрицательных по PD1 иммунных эффекторных клеток, например, T-клеток, или соотношение отрицательные по PD1 иммунные эффекторные клетки, например T-клетки/положительные по PD1 иммунные эффекторные клетки, например T-клетки, у индивидуума или взятые от индивидуума, по меньшей мере временно увеличивались.
[0058] В вариантах осуществления любые из способов, описанных в настоящем описании, кроме того, включают проведение элиминации лимфоцитов у индивидуума перед введением одной или нескольких клеток, которые экспрессируют молекулу CAR, описанную в настоящем описании, например, молекулу CAR, которая связывает CD19. Элиминация лимфоцитов может включать, например, введение одного или нескольких из мелфалана, цитоксана, циклофосфамида и флударабина.
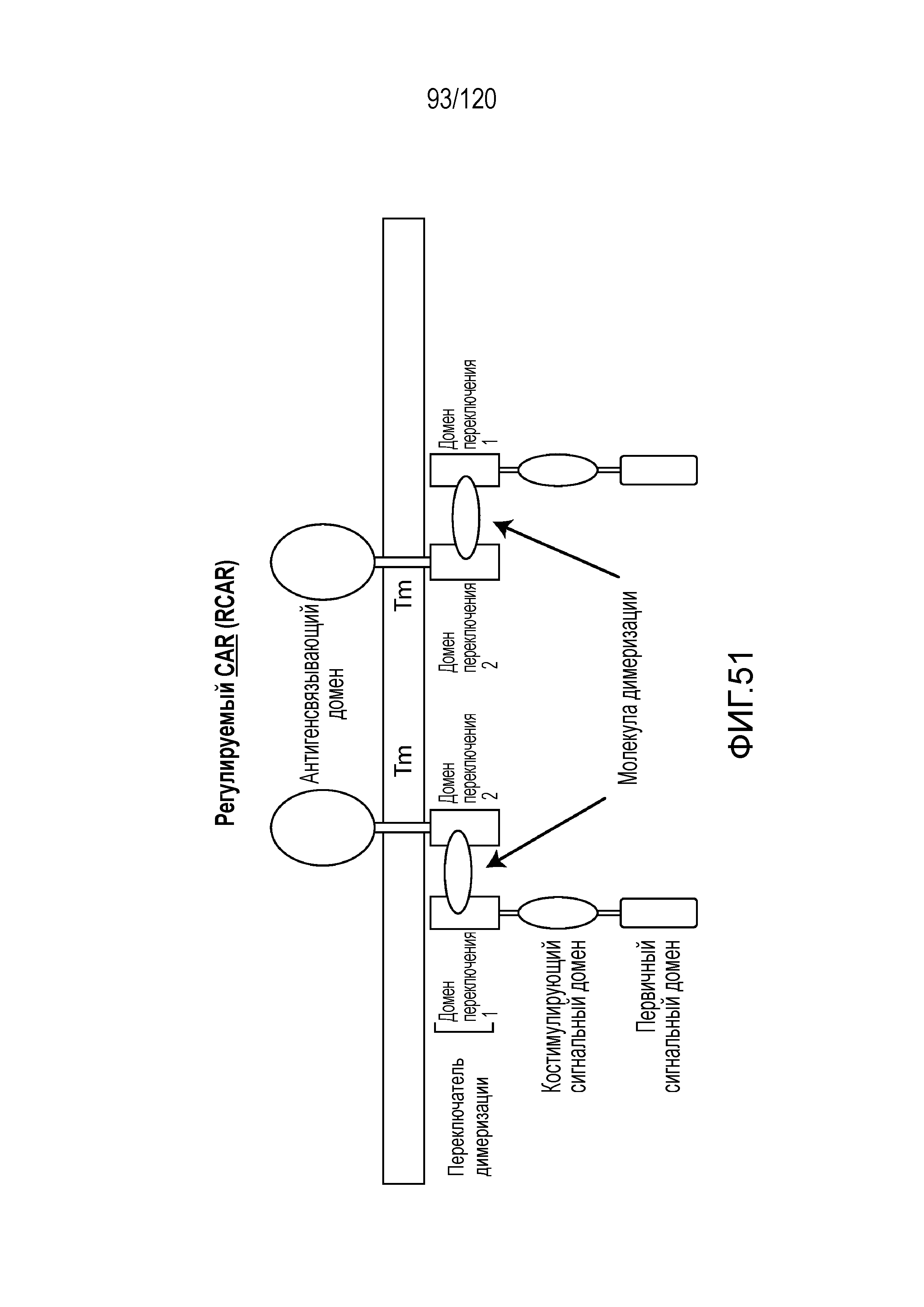
[0059] В некоторых вариантах осуществления CAR-экспрессирующая клетка, которую вводят, содержит регулируемый CAR (RCAR), например, RCAR, как описано в настоящем описании. RCAR может содержать, например, внутриклеточный сигнальный член, содержащий внутриклеточный сигнальный домен и первый домен переключения, антигенсвязывающий член, содержащий антигенсвязывающий домен, который связывает CD19, и второй домен переключения; и трансмембранный домен. Кроме того, способ может включать введение молекулы димеризации, например, в количестве, достаточном для обеспечения димеризации первого и второго доменов переключения.
[0060] В некоторых вариантах осуществления CAR-экспрессирующая клетка и ингибитор киназы вводят одновременно или по существу одновременно, например, в качестве терапии первой линии. В некоторых вариантах осуществления способ включает введение комбинации ингибитора BTK (например, ибрутиниб) и CAR-экспрессирующей клетки (например, CAR19-экспрессирующей клетки) индивидууму, в качестве терапии первой линии.
[0061] В других вариантах осуществления CAR-экспрессирующую клетку и ингибитор киназы вводят последовательно. Например, ингибитор киназы вводят до CAR-экспрессирующей клетки, или CAR-экспрессирующую клетку вводят до ингибитора киназы.
[0062] В некоторых вариантах осуществления заболевание, ассоциированное с экспрессией CD19, представляет собой гематологическую злокачественную опухоль (например, гематологическая злокачественная опухоль, описанная в настоящем описании, такая как CLL, MCL или ALL) и индивидуум является или идентифицирован как являющийся частично отвечающим, не отвечающим или рецидивирующим в отношении одного или нескольких способов терапии гематологической злокачественной опухоли, например, к ингибитору BTK, такому как ибрутиниб. В некоторых вариантах осуществления индивидуум имеет или идентифицирован как имеющий мутацию BTK. Мутация может представлять собой, например, точковую мутацию, инсерцию или делецию. Мутация может представлять собой, например, мутацию в участке связывания ингибитора BTK, например, в или вблизи ATP-связывающего кармана. Мутация может сообщать сниженный ответ (например, устойчивость) на ингибитор BTK.
[0063] В некоторых вариантах осуществления любого из способов, описанных в настоящем описании, способ включает введение ингибитора BTK (например, ибрутиниба) индивидууму, уменьшение количества (например, прекращение введения) ингибитора BTK, и затем введение CAR-экспрессирующей клетки (например, CAR19-экспрессирующей клетки) индивидууму.
[0064] В некоторых вариантах осуществления способ включает введение ингибитора BTK ингибитор (например, ибрутиниба) индивидууму, а затем введение комбинации ингибитора BTK и CAR-экспрессирующей клетки (например, CAR19-экспрессирующей клетки) индивидууму.
[0065] В некоторых вариантах осуществления способ включает введение ингибитора BTK (например, ибрутиниба) индивидууму, уменьшение количества (например, прекращение или прерывание введения) ингибитора BTK, и затем введение комбинации CAR-экспрессирующей клетки (например, CAR19-экспрессирующей клетки) и второго ингибитора BTK (например, ингибитор BTK, отличный от первого ингибитора BTK, например, отличный от ибрутиниба) индивидууму. В некоторых вариантах осуществления второй ингибитор BTK выбран из одного или нескольких из GDC-0834, RN-486, CGI-560, CGI-1764, HM-71224, CC-292, ONO-4059, CNX-774 или LFM-A13, или их комбинации.
[0066] В некоторых вариантах осуществления заболевание, ассоциированное с экспрессией B-клеточного антигена (например, CD19) представляет собой гематологическую злокачественную опухоль (например, гематологическая злокачественная опухоль, описанная в настоящем описании, например, CLL, MCL или ALL), и способ отсрочивает или снижает резистентность к ингибитору киназы (например, ингибитор BTK, такой как ибрутиниб), к CAR-экспрессирующей клетке (например, CAR19-экспрессирующая клетка) у индивидуума, или к обоим из них. В некоторых вариантах осуществления заболевание, ассоциированное с экспрессией CD19, представляет собой гематологическую злокачественную опухоль (например, гематологическая злокачественная опухоль, описанная в настоящем описании, например, CLL, MCL или ALL), и где способ продлевает ремиссию или отсрочивает рецидив гематологической злокачественной опухоли. Например, ремиссия может быть продлена, рецидив может быть отсрочен, резистентность может быть отсрочена, или резистентность может быть снижена, по сравнению с ожидаемым ходом течения заболевания при лечении монотерапией из ингибитора киназы или CAR-экспрессирующей клетки.
[0067] Иллюстративные режимы лечения, которые можно использовать в любом из вышеуказанных способов, включают один или несколько из следующих режимов.
[0068] В одном варианте осуществления ингибитор киназы и CAR-экспрессирующую клетку (например, CAR19-экспрессирующая клетка) вводят индивидууму, например млекопитающему, в качестве терапии первой линии.
[0069] В другом варианте осуществления CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку) вводят индивидууму, например, млекопитающему, после введения ингибитора киназы.
[0070] В других вариантах осуществления CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку) вводят после прекращения введения ингибитора киназы.
[0071] В других вариантах осуществления введение ингибитора киназы начинают перед введением CAR19-экспрессирующей клетки, и CAR19-экспрессирующую клетку вводят в комбинации с продолжающимся введением ингибитора киназы.
[0072] В одном варианте осуществления индивидууму вводят ингибитор киназы (например, ингибитор BTK, такой как ибрутиниб), например, в качестве терапии первой линии. После заданного интервала времени (например, 1 или 2 месяца, но также 2 недели, 3 недели, 1 месяц, 1,5 месяца, 2 месяца, 3 месяца, 4 месяца, 6 месяцев, 9 месяцев, 12 месяцев, 15 месяцев или 18 месяцев), CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку) вводят индивидууму отдельно или в комбинации с ингибитором киназы. В некоторых вариантах осуществления ответ индивидуума на лечение оценивают в заданные временные интервалы, например, до или в процессе лечения ингибитором киназы и/или CAR-экспрессирующей клеткой. Если оценка показывает, что индивидуум является полностью отвечающим, CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку) не вводят. Если оценка показывает, что индивидуум является частично отвечающим или имеет стабильное заболевание в ответ на ингибитор киназы, CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку) вводят в комбинации с ингибитором киназы, например, как описано в настоящем описании. Если оценка показывает, что индивидуум является неотвечающим или рецидивирующим, CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку) вводят в комбинации с ингибитором киназы или вторым ингибитором киназы, например, вторым ингибитором киназы, как описано в настоящем описании.
[0073] В других вариантах осуществления индивидуум, например млекопитающее, является или идентифицирован как являющийся полностью или частично отвечающим на ингибитор BTK (например, ибрутиниб), или полностью или частично отвечающим на CAR19-экспрессирующую клетку.
[0074] В некоторых вариантах осуществления, когда индивидуум является (или идентифицирован как являющийся) полностью отвечающим на ингибитор киназы (например, ингибитор BTK, такой как ибрутиниб), индивидууму не вводят CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку) в период полного ответа. В других вариантах осуществления, когда индивидуум является (или идентифицирован как являющийся) полностью отвечающим (например, полностью отвечающим на ибрутиниб) на ингибитор киназы, индивидууму вводят CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку) в период полного ответа. В одном варианте осуществления после введения CAR-экспрессирующей клетки (например, CAR19-экспрессирующей клетки), индивидуум имеет пролонгированный ответ или отсроченный рецидив (например, по сравнению с течением заболевания при лечении без терапии CAR).
[0075] В некоторых вариантах осуществления, когда индивидуум является (или идентифицирован как являющийся) частично отвечающим на ингибитор киназы (например, ингибитор BTK, такой как ибрутиниб), индивидууму не вводят CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку) в период частичного ответа. В других вариантах осуществления, когда индивидуум является (или идентифицирован как являющийся) частично отвечающим на ингибитор киназы, индивидууму вводят CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку) (отдельно или в комбинации с ингибитором BTK) в период частичного ответа. В одном варианте осуществления после терапии CAR, индивидуум имеет полный ответ и/или пролонгированный ответ или отсроченный рецидив (например, по сравнению с ожидаемым течением заболевания при лечении без терапии CAR).
[0076] В некоторых вариантах осуществления, когда индивидуум имеет (или идентифицирован как имеющий) стабильное заболевание после лечения ингибитором киназы (например, ингибитором BTK, таким как ибрутиниб), индивидууму не проводят терапию CAR в период стабильного заболевания. В других вариантах осуществления, когда индивидуум имеет (или идентифицирован как имеющий) стабильное заболевание после лечения ингибитором киназы, индивидууму проводят терапию CAR в период стабильного заболевания. В одном варианте осуществления после терапии CAR индивидуум имеет частичный ответ, полный ответ и/или пролонгированный ответ или отсроченный рецидив (например, по сравнению с ожидаемым течением заболевания при лечении без терапии CAR).
[0077] В некоторых вариантах осуществления, когда индивидуум имеет (или идентифицирован как имеющий) прогрессирующее заболевание после лечения ингибитором киназы (например, ингибитор BTK, такой как ибрутиниб), индивидууму не вводят CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку) в период прогрессирующего заболевания. В других вариантах осуществления, когда индивидуум имеет (или идентифицирован как имеющий) прогрессирующее заболевание после лечения ингибитором киназы, индивидууму вводят CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку) в период прогрессирующего заболевания. В одном варианте осуществления после терапии CAR, индивидуум имеет стабильное заболевание, частичный ответ, полный ответ и/или пролонгированный ответ или отсроченный рецидив (например, по сравнению с ожидаемым течением заболевания при лечении без терапии CAR).
[0078] В других вариантах осуществления CAR-экспрессирующую клетку вводят в комбинации со вторым ингибитором киназы, где второй ингибитор киназы отличается от ибрутиниба, когда млекопитающее является или идентифицировано как являющееся не отвечающим или рецидивирующим в отношении ибрутиниба. Второй ингибитор киназы может быть выбран из одного или нескольких из GDC-0834, RN-486, CGI-560, CGI-1764, HM-71224, CC-292, ONO-4059, CNX-774 или LFM-A13, или их комбинации.
[0079] В других вариантах осуществления индивидуум, например, млекопитающее, является (или идентифицирован как являющийся) частично отвечающим на ингибитор киназы, и индивидууму вводят CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку), отдельно или в комбинации с ингибитором BTK в период частичного ответа.
[0080] В других вариантах осуществления индивидуум, например млекопитающее, является (или идентифицирован как являющийся) не отвечающим индивидуумом, имеющим прогрессирующее или стабильное заболевание после лечения ибрутинибом, и индивидууму вводят CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку), отдельно или в комбинации со вторым ингибитором BTK, в период прогрессирующего или стабильного заболевания, где второй ингибитор киназы отличается от ибрутиниба.
[0081] В другом аспекте в рамках настоящего изобретения предусматривается способ лечения индивидуума, например, млекопитающего, имеющего заболевание, ассоциированное с экспрессией B-клеточного антигена (например, CD19). Способ включает введение индивидууму эффективного количества ингибитора киназы, как описано в настоящем описании (например, ингибитор киназы BTK, описанный в настоящем описании, например, ибрутиниб), и CAR-экспрессирующей клетки (например, CAR19-экспрессирующей клетки) в комбинации (например, одновременно (или по существу одновременно), или последовательно).
[0082] В некоторых вариантах осуществления ингибитор киназы и CAR-экспрессирующую клетку (например, CAR19-клетку) вводят в комбинации, например, в качестве терапии первой линии.
[0083] В некоторых вариантах осуществления первоначально вводят ингибитор киназы, например, в качестве монотерапии или терапии первой линии; после снижения количества (например, прекращения или прерывания введения) ингибитора киназы, индивидууму вводят CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку).
[0084] В других вариантах осуществления первоначально вводя тингибитор киназы, например, в качестве монотерапии или терапии первой линии; а затем индивидууму вводят комбинацию ингибитора киназы и CAR-экспрессирующей клетки (например, CAR19-экспрессирующей клетки).
[0085] В других вариантах осуществления первоначально вводят ингибитор киназы, например, в качестве монотерпии или терапии первой линии; после снижения количества (например, прекращения или прерывания введения) ингибитора киназы, вводят комбинацию второго ингибитора киназы и CAR-экспрессирующей клетки (например, CAR19-экспрессирующей клетки).
[0086] В некоторых вариантах осуществления ответ индивидуума на лечение оценивают в заданные временные интервалы, например, до или во время лечения ингибитором киназы и/или CAR-экспрессирующей клеткой. Если оценка показывает, что индивидуум является полностью отвечающим, CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку) не вводят. Если оценка показывает, что индивидуум является частично отвечающим или имеет стабильное заболевание в ответ на ингибитор киназы, то CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку) вводят в комбинации с ингибитором киназы, например, как описано в настоящем описании. Если оценка показывает, что индивидуум является неотвечающим или рецидивирующим, CAR-экспрессирующую клетку (например, CAR19-экспрессирующую клетку) вводят в комбинации с ингибитором киназы или вторым ингибитором киназы, например, вторым ингибитором киназы, как описано в настоящем описании.
[0087] В некоторых вариантах осуществления заболевание, ассоциированное с экспрессией B-клеточного антигена (например, CD19), представляет собой гематологическую злокачественную опухоль, лейкоз, лимфому, MCL, CLL, ALL, лимфому Ходжкина или множественную миелому.
[0088] В некоторых вариантах осуществления ингибитор киназы представляет собой ингибитор BTK, выбранный из ибрутиниба, GDC-0834, RN-486, CGI-560, CGI-1764, HM-71224, CC-292, ONO-4059, CNX-774 или LFM-A13; ингибитор CDK4, выбранный из палбоциклиба, алоизина A, флавопиридола, 2-(2-хлорфенил)-5,7-дигидрокси-8-[(3S,4R)-3-гидрокси-1-метил-4-пиперидинил]-4-хроменона; кризотиниба (PF-02341066, P276-00, RAF265, индисулама, росковитина, динациклиба, BMS 387032, MLN8054, AG-024322, AT7519, AZD5438, BMS908662; или рибоциклиба; ингибитор mTOR, выбранный из рапамицина, аналога рапамицина, такого как эверолимус, темсиролимус, ридафоролимус, семапимод, AZD8055, PF04691502, SF1126, XL765 или OSI-027; или ингибитор MNK, выбранный из: CGP052088, CGP57380, церкоспорамида или ETC-1780445-2, или 4-амино-5-(4-фторанилино)пиразолo[3,4-d]пиримидина.
[0089] В некоторых аспектах изобретение относится к способу лечения индивидуума или обеспечения у индивидуума противоопухолевого иммунитета, например, у млекопитающего, имеющего лимфому Ходжкина. Способ включает введение индивидууму эффективного количества клеток, которые экспрессируют молекулу CAR, которая связывает CD19, отдельно или в комбинации со второй терапией.
[0090] В другом аспекте изобретение относится к способу лечения или обеспечения противоопухолевого иммунитета у индивидуума, например, млекопитающего, имеющего множественную миелому (например, CD19-положительную множественную миелому или CD19-отрицательную миелому). В одном варианте осуществления множественная миелома является CD19-отрицательной, например, имеет значительное большинство (99,95%) неопластических плазматических клеток с CD19-отрицательным фенотипом, например, как обнаруживают посредством как проточной цитометрии, так и ОТ-ПЦР. Способ включает введение индивидууму эффективного количества клеток, которые экспрессируют молекулу CAR, которая связывает CD19, отдельно или в комбинации со второй терапией (например, стандартной терапией множественной миеломы). Кроме того, способ может включать введение ингибитора киназы, как описано в настоящем описании.
[0091] В вариантах осуществления способов, касающихся лимфомы Ходжкина или множественной миеломы, молекула CAR представляет собой гуманизированную молекулу CAR, например, как описано в настоящем описании. В вариантах осуществления молекула CAR представляет собой молекулу CAR, как описано в настоящем описании. Например, в вариантах осуществления молекула CAR содержит связывающий CD19 домен, который содержит одну или несколько из (например, 2, 3, 4, 5 или все из) CDR1 LC SEQ ID NO: 5, CDR2 LC SEQ ID NO: 26 и CDR3 LC SEQ ID NO: 27; CDR1 HC SEQ ID NO: 19, CDR2 LC любой из SEQ ID NO: 20-23, и CDR3 HC SEQ ID NO: 24.
[0092] В некоторых вариантах осуществления способов, касающихся лимфомы Ходжкина или множественной миеломы, молекулу CAR (например, CART19 или CTL019) вводят в качестве монотерапии. В некоторых вариантах осуществления способ дополнительно включает введение ингибитора киназы, например, ингибитора BTK (такого как ибрутиниб), ингибитора CDK4, ингибитора mTOR или ингибитора MNK.
[0093] В некоторых вариантах осуществления способов, касающихся множественной миеломы, молекулу CAR (например, CART19 или CTL019) вводят в комбинации со стандартной терапией множественной миеломы, например, с химиотерапией, устраняющей клетки миелоцитарного ростка, и/или восстановлением посредством трансплантации аутологичных стволовых клеток (например, после введения мелфалана (например, высокой дозы мелфалана)).
[0094] В другом аспекте изобретение относится к композиции, содержащей клетку, которая экспрессирует молекулу CAR, которая связывает B-клеточный антиген (например, один или несколько из CD19, CD20. CD22 или ROR1), и один или несколько ингибиторов киназ, где ингибитор киназы выбран из ингибитора тирозинкиназы Брутона (BTK), ингибитора циклин-зависимой киназы 4 (CDK4), ингибитора mTOR, или киназы, взаимодействующей с активируемой митогеном протеинкиназой (MNK). CAR-экспрессирующая клетка и один или несколько ингибиторов киназ могут присутствовать в одной дозированной форме или в качестве двух или более дозированных форм.
[0095] В вариантах осуществления композиции, описанные в настоящем описании, предназначены для применения в качестве лекарственного средства.
[0096] В вариантах осуществления композиции, описанные в настоящем описании, предназначены для лечения заболевания, ассоциированного с экспрессией B-клеточного антигена (например, CD19).
Способы и композиции для получения CAR-экспрессирующих клеток
[0097] В некоторых аспектах настоящее изобретение также относится к способу получения популяции иммунных эффекторных клеток (например, T-клеток или NK-клеток), которые могут быть модифицированы способами инженерии для экспрессии CAR (например, CAR, описанного в настоящем описании), причем способ включает: предоставление популяции иммунных эффекторных клеток; и приведение иммунных эффекторных клеток в контакт c ингибитором киназы (например, ингибитором BTK, таким как ибрутиниб) в условиях, достаточных для ингибирования мишени ингибиторных киназ (например, BTK и/или ITK). Кроме того, способ может включать приведение в контакт, например, трансдукцию, иммунных эффекторных клеток c нуклеиновой кислотой, кодирующей молекулу CAR.
[0098] В некоторых аспектах изобретение относится к способу получения CAR-экспрессирующей клетки (например, CAR-экспрессирующей иммунной эффекторной клетки или популяции клеток), включающему: приведение клетки или популяции клеток в контакт с ингибитором киназы, например, ингибитором BTK, таким как ибрутиниб; и введение (например, трансдукцию) нуклеиновой кислоты, кодирующей молекулу CAR, в клетку или популяцию клеток в таких условиях, чтобы экспрессировалась молекула CAR.
[0099] В определенных вариантах осуществления способов получения CAR-экспрессирующих клеток, молекула CAR, кодируемая нуклеиновой кислотой, представляет собой молекулу CAR, которая связывает CD19. В вариантах осуществления способ дополнительно включает культивирование клетки или клеток в условиях, которые позволяют клетке или по меньшей мере субпопуляции клеток экспрессировать молекулу CAR. В вариантах осуществления клетка представляет собой T-клетку или NK-клетку, или популяция клеток включает T-клетки, NK-клетки, или и те, и другие. В вариантах осуществления способ включает приведение клетки или клеток в контакт с ингибитором киназы (например, в течение 10-20, 20-30, 30-40, 40-60 или 60-120 минут), а затем удаление большей части или всего ингибитора киназы из клетки или клеток. В вариантах осуществления ингибитор киназы добавляют после сбора клетки или клеток, или до стимуляции клетки или клеток. В вариантах осуществления ингибитор киназы представляет собой ингибитор BTK, ингибитор CDK4, ингибитор mTOR или ингибитор MNK. В вариантах осуществления ингибитор киназы представляет собой ибрутиниб. В вариантах осуществления популяция клеток также включает злокачественные клетки, например, клетки лейкоза или лимфомы. Злокачественные клетки могут представлять собой, например, клетки CLL, MCL или ALL. В вариантах осуществления ингибитор киназы ингибирует мишень (например, BTK) в злокачественных клетках, например, снижает ее активность по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 99%. В вариантах осуществления ингибитор киназы ингибирует мишень (например, ITK) в иммунных эффекторных клетках, например, снижает ее активность по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 99%.
[00100] В некоторых аспектах настоящее изобретение также относится к реакционной смеси, содержащей ингибитор киназы (например, ингибитор BTK) и молекулу CAR или нуклеиновую кислоту, кодирующую CAR молекула. В некоторых вариантах осуществления реакционная смесь, кроме того, содержит популяцию иммунных эффекторных клеток.
[00101] В некоторых вариантах осуществления она или несколько из иммунных эффекторных клеток экспрессируют молекулу CAR или содержат нуклеиновую кислоту, кодирующую молекулу CAR. В некоторых вариантах осуществления ингибитор киназы выбран из ингибитора BTK, ингибитора CDK4, ингибитора mTOR или ингибитора MNK. В некоторых вариантах осуществления ингибитор BTK выбран из: ибрутиниба, GDC-0834, RN-486, CGI-560, CGI-1764, HM-71224, CC-292, ONO-4059, CNX-774 или LFM-A13. В вариантах осуществления реакционная смесь содержит злокачественные клетки, например, гематологические злокачественные клетки. Злокачественные клетки могут представлять собой, например, клетки, которые собраны от индивидуума при сборе иммунных эффекторных клеток от индивидуума.
[00102] В некоторых аспектах, настоящее изобретение также относится к реакционной смеси, содержащей популяцию иммунных эффекторных клеток, и молекулу CAR или нуклеиновую кислоту, кодирующую молекулу CAR, где иммунные эффекторные клетки содержат ковалентно инактивированную ITK. В вариантах осуществления по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 99% ITK являются ковалентно инактивированными. В некоторых вариантах осуществления реакционная смесь, кроме того, содержит злокачественные клетки. В вариантах осуществления злокачественная клетка содержит ковалентно инактивированную BTK. В вариантах осуществления по меньшей мере 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95% или 99% BTK являются ковалентно инактивированными. В вариантах осуществления BTK или ITK образуют ковалентную связь в или вблизи их ATP-связывающего домена с низкомолекулярным соединением, таким как ибрутиниб. В вариантах осуществления BTK образует ковалентную связь на или вблизи ее цистеина-481 с низкомолекулярным соединением, таким как ибрутиниб.
[00103] В вариантах осуществления реакционная смесь, как описано в настоящем описании, кроме того, содержит буфер или другой реагент, например, содержащий PBS раствор. В вариантах осуществления реакционная смесь, кроме того, содержит средство, которое активирует и/или увеличивает в количестве клетки в популяции, например, средство, которое стимулирует ассоциированный с комплексом CD3/TCR сигнал, и/или лиганд, который стимулирует костимулирующую молекулу на поверхности клеток. В вариантах осуществления средство представляет собой гранулы, конъюгированные с антителом против CD3 или его фрагментом, и/или антителом против CD28 или его фрагментом. В вариантах осуществления реакционная смесь, кроме того, содержит один или несколько факторов для пролиферации и/или жизнеспособности, включая сыворотку (например, эмбриональную бычью сыворотку или сыворотку человека), интерлейкин-2 (IL-2), инсулин, IFN-γ, IL-4, IL-7, GM-CSF, IL-10, IL-12, IL-15, TGFβ и TNF-α или любые другие добавки для роста клеток. В вариантах осуществления реакционная смесь, кроме того, содержит IL-15 и/или IL-7. В вариантах осуществления множество клеток в популяции в реакционной смеси содержат молекулу нуклеиновой кислоты, например, молекулу нуклеиновой кислоты, описанную в настоящем описании, которая содержит кодирующую CAR последовательность, например, последовательность, кодирующую CAR против CD19, например, как описано в настоящем описании. В вариантах осуществления множество клеток популяции в реакционной смеси содержат вектор, содержащий последовательность нуклеиновой кислоты, кодирующую CAR, например, CAR, описанный в настоящем описании, например, CAR против CD19, описанный в настоящем описании. В вариантах осуществления вектор представляет собой вектор, описанный в настоящем описании, например, вектор, выбранный из группы, состоящей из ДНК, РНК, плазмиды, лентивирусного вектора, аденовирусного вектора или ретровирусного вектора. В вариантах осуществления реакционная смесь, кроме того, содержит криопротектор или стабилизатор, например, такой как сахарид, олигосахарид, полисахарид и полиол (например, трегалоза, маннит, сорбит, лактоза, сахароза, глюкоза и декстран), соли и краун-эфиры. В одном варианте осуществления криопротектор представляет собой декстран.
[00104] В некоторых вариантах осуществления способ получения, описанный в настоящем описании, кроме того, включает приведение популяции иммунных эффекторных клеток в контакт с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, hTERT. Нуклеиновая кислота, кодирующая субъединицу теломеразы, может представлять собой ДНК.
[00105] В некоторых вариантах осуществления способ получения, описанный в настоящем описании, кроме того, включает культивирование популяции иммунных эффекторных клеток в сыворотке, содержащей 2% сыворотку hAB.
[00106] Заголовки, подзаголовки или пронумерованные или обозначенные буквами элементы, например, (a), (b), (i) и т.д., предоставлены только для простоты прочтения. Использование заголовков или пронумерованных или обозначенных буквами элементов в настоящем документе не требует, чтобы проведение стадий или элементы были в алфавитном порядке, или чтобы стадии или элементы обязательно были отдельными друг от друга.
[00107] Все публикации, патентные заявки, патенты и другие ссылки, упомянутые в настоящем описании, включены в настоящее описание в качестве ссылок в полном объеме.
[00108] Другие признаки, объекты и преимущества изобретения станут очевидными из описания и чертежей, и из формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[00109] На фиг.1A, 1B и 1C показано графическое представление цитотоксичности при анализе в T-клетках ND317 (нормальный донор), трансдуцированных CAR мыши против CD19 или гуманизированными CAR против CD19 по изобретению и культивированных либо с контрольными клетками K562, которые не экспрессируют CD19 (K562cc), как показано на фиг.1A, либо с клетками K562, трансформированными CD19 (K562.CD19), как показано на фиг.1B, либо со злокачественными B-клетками, выделенными от пациента с CLL (изолят B-клеток Pt 14), как показано на фиг.1C.
[00110] На фиг.2A и 2B представлены графики, демонстрирующие пролиферативный ответ клеток, экспрессирующих гуманизированный CAR против CD19 и CAR мыши против CD19, на CD19+ клетки, где более высокое количество жизнеспособных CAR+ T-клеток коррелирует с популяциями, демонстрирующими максимальную пролиферацию CD4+ и CD8+ T-клеток в ответ на клетки первичного CLL.
[00111] На фиг.3 показано графическое представление подвергнутых обратной свертке спектров масс ВЭЖХ для scFv по изобретению, где верхний ряд отображает не обработанный scFv и нижний ряд отображает родственный дегликозилированный scFv.
[00112] На фиг.4 показано графическое представление конформационной стабильности при измерении с использование дифференциальной сканирующей флуориметрии. Tm scFv мыши составляла 57°C (жирная линия). Все гуманизированные варианты scFv демонстрируют более высокую Tm на уровне приблизительно 70°C по сравнению с родительским scFv мыши. Остатки, внесенные посредством гуманизации, имеют Tm, увеличенную более чем на 10°C.
[00113] На фиг.5 показано графическое представление пролиферации T-клеток, трансдуцированных CAR против CD19, где клетки CART19 направлены против (a) клеточной линии хронического миелогенного лейкоза ("CML"), которая является отрицательной по экспрессии CD19, и, таким образом, использовалась в качестве отрицательного контроля; (b) рекомбинантных клеток K562, положительных по экспрессии CD19, и, таким образом, использованных в качестве положительного контроля; или (c) B-клеток Pt14, полученных от пациента CLL, которые экспрессируют CD19 на клеточной поверхности.
[00114] На фиг.6A и 6B представлено схематическое изображение репрезентативных CAR.
[00115] На фиг.7 представлено прогрессирование первичного ALL HALLX5447 у мышей NSG после лечения трансдуцированными CAR против CD19 T-клетками. Рост клеток первичного ALL человека у мышей NSG после лечения CAR T-клетками, специфичными к CD19, продемонстрировал контроль прогрессирования заболевания. Средний процент CD19+ клеток ALL человека был индикатором тяжести заболевания в периферической крови у мышей NSG до 65 суток после имплантации опухоли. Черные круги: мыши, которым вводили 100 мкл PBS через хвостовую вену; красные квадраты: мыши, которым вводили T-клетки, трансдуцированные имитирующей конструкцией; синие треугольники: мыши, которых лечили T-клетками, трансдуцированными CAR мыши против CD19; и перевернутые фиолетовые треугольники: мыши, которым вводили T-клетки, трансдуцированные гуманизированным CAR против CD19. Значимость вычисляли посредством ANOVA; * обозначает P < 0,01.
[00116] На фиг.8 представлена экспрессия CD19 в опухолевых клетках пациента. CD138+ CD45dim опухолевые клетки окрашивали на CD19 (ось x) и CD38 (ось y). Приблизительно 1-2% опухолевых клеток экспрессировали антиген CD19.
[00117] На фиг.9 представлены два графика, демонстрирующих пролиферацию клеток и размер CART19-клеток при обработке возрастающими концентрациями ибрутиниба (10 нМ, 100 нМ и 1000 нМ).
[00118] На фиг.10A и 10B представлена пролиферация CART19-клеток, стимулированных клеточными линиями MCL в присутствии или в отсутствие ибрутиниба. На фиг.10A представлена серия гистограмм, демонстрирующих пролиферацию CART19-клеток, стимулированных опухолевыми клеточными линями MOLM14, JEKO-1 и RL, в присутствии или в отсутствие возрастающих концентраций ибрутиниба (10 нМ, 100нМ и 1000 нМ). Клетки окрашивали посредством CFSE и анализировали проточной цитометрией для определения процента пролиферирующих клеток, обозначаемого столбиком на каждой гистограмме. На фиг.10B показано количественное представление для репрезентативных гистограмм, представленных на фиг.10A.
[00119] На фиг.11A и 11B представлена дегрануляция CD107a из CART19-клеток, стимулированных клеточными линиями MCL в присутствии или в отсутствие ибрутиниба. На фиг.11A представлена серия профилей проточной циотометрии, демонстрирующих дегрануляцию CD107a из CART19-клеток, стимулированных опухолевыми клеточными линиями (MOLM14, JEKO-1 и RL) в присутствии или в отсутствие возрастающих концентраций ибрутиниба (10 нМ, 100нМ и 1000 нМ). Измерение экспрессии CD107a представлено на оси y. На фиг.11B показано количественное представление результатов, показанных на фиг.11A.
[00120] На фиг.12 представлена серия профилей проточной цитометрии, демонстрирующих внутрицитоплазматическую продукцию IL-2 CART19-клетками, стимулированными опухолевыми клеточными линиями (MOLM14, JEKO-1 и RL) в присутствии или в отсутствие возрастающих концентраций ибрутиниба (10 нМ, 100нМ и 1000 нМ). На оси y представлена экспрессия IL-2.
[00121] На фиг.13 представлена серия профилей проточной цитометрии, демонстрирующих внутрицитоплазматическую продукцию TNF-a CART19-клетками, стимулированными опухолевыми клеточными линиями (MOLM14, JEKO-1 и RL) в присутствии или в отсутствие возрастающих концентраций ибрутиниба (10 нМ, 100нМ и 1000 нМ). На оси y представлена экспрессия TNF-a.
[00122] На фиг.14 представлена серия профилей проточной цитометрии, демонстрирующих внутрицитоплазматическую продукцию IFN-g CART19-клетками, стимулированными опухолевыми клеточными линиями (MOLM14, JEKO-1 и RL) в присутствии или в отсутствие возрастающих концентраций ибрутиниба (10 нМ, 100нМ и 1000 нМ). На оси y представлена экспрессия IFN-g.
[00123] На фиг.15 представлена серия графиков, демонстрирующих секрецию цитокинов из CART19-клеток, стимулированных опухолевыми клеточными линиями (MOLM14, JEKO-1 и RL) в присутствии или в отсутствие возрастающих концентраций ибрутиниба (10 нМ, 100нМ и 1000 нМ).
[00124] На фиг.16A, 16B, 16C, 16D, 16E и 16F представлены графики, демонстрирующие уничтожение посредством CART19 опухолевых клеток, MOLM14 (фиг.16A и 16D), JEKO (фиг.16B и 16E) и RL (фиг.16C и 16F), отдельно или в присутствии возрастающих концентраций ибрутиниба. Нетрансдуцированные (UTD) или CART19-клетки инкубировали с опухолевыми клетками в различных соотношениях и оценивали общий поток клеток (фиг.16A, 16B и 16C) и процент погибших клеток (16D, 16E и 16F).
[00125] На фиг.17A, 17B и 17C показано графическое представление уничтожения посредством CART19 опухолевых клеток через 24 часа при измерении посредством проточной цитометрии для подсчета общего количества клеток. Опухолевые клеточные линии MOLM14 (фиг.17A), JEKO (фиг.17B) и RL (фиг.17C) инкубировали с нетрансдуцированными (UTD) клетками или CART19-клетками отдельно (ОТДЕЛЬНО), или в комбинации с различными концентрациями ибрутиниба.
[00126] На фиг.18A, 18B, 18C и 18D показаны графические представления определения дозы CART19 в моделях на мышах RL MCL. Мониторинг опухолевой нагрузки проводили посредством визуализации биолюминесценции (BLI) с течением времени (фиг.18A и 18B). Проводили мониторинг общей выживаемости с течением времени (фиг.18C).
[00127] На фиг.19A и 19B показаны графические представления определения дозы CART19 в модели на мышах JEKO-1 MCL. Мониторинг размера опухоли проводили посредством визуализации биолюминесценции (BLI) с течением времени (фиг.19A) и также проводили мониторинг общей выживаемости с течением времени (фиг.19B).
[00128] На фиг.20 представлена схема, демонстрирующая протокол введения и оценки комбинированной терапии CART19 и ибрутинибом в моделях на мышах in vivo.
[00129] На фиг.21A, 21B, 21C и 21D показано графическое представление, демонстрирующее эффективность трансдукции PBMC для получения CART19 T-клеток, когда клетки обрабатывали ибрутинибом перед трансдукцией. Необработанные PBMC анализировали в отношении экспрессии CAR19 до трансдукции (фиг.21A) и после трансдукции (фиг.21C). Обработанные ибрутинибом PBMC анализировали в отношении экспрессии CAR19 до трансдукции (фиг.21B) и после трансдукции (фиг.21D).
[00130] На фиг.22A, 22B, 22C, 22D и 22E показано графическое представление эффекта обработки ибрутинибом на пролиферацию стимулированных CD3/CD28 T-клеток. Оценивали увеличение концентрации ибрутиниба: без обработки (фиг.22A); 0,1 мкМ ибрутиниб (фиг.22B); 0,5 мкМ ибрутиниб (фиг.22C), 1 мкМ ибрутиниб (фиг.22D) и 5 мкМ ибрутиниб (фиг.22E).
[00131] На фиг.23 показано графическое представление, демонстрирующее, что ибрутиниб не влияет на цитотоксичность CART19.
[00132] На фиг.24 представлена серия графических представлений, которые демонстрируют, что обработка ибрутинибом не индуцирует смещение TH1/TH2-цитокинов в CART19-клетках.
[00133] На фиг.25A и 25B показано графическое представление, показывающее, что непрерывное введение ибрутиниба не влияет на функцию CART19 в отношении устранения опухолевых клеток in vivo. На фиг.25A показаны клетки Nalm/6, обнаруженные в периферической крови в ходе каждого режима введения. На фиг.25B показана кривая Каплана-Мейера для выживаемости мышей, которым вводили CART19 с дозированием ибрутиниба или без него.
[00134] На фиг.26A, 26B, 26C, 26D, 26E и 26F показано графическое представление, демонстрирующее эффективность трансдукции CAR19 в клетках пациента с CLL в указанные моменты времени в ходе обработки ибрутинибом. Клетки были нетрансдуцированными (фиг.26A, 26B и 26C) или трансдуцированными посредством CAR19 (фиг.26D, 26E и 26F). Клетки, окрашенные GAM, экспрессируют CAR19, и они представлены в рамках на каждом профиле.
[00135] На фиг.27 показана серия графических представлений, показывающих скорость пролиферации нетрансдуцированных клеток по сравнению с клетками, которые были трансдуцированы посредством CAR19, от группы пациентов в указанные моменты времени в ходе обработки ибрутинибом.
[00136] На фиг.28A, 28B и 28C показано графическое представление, демонстрирующее, что лечение ибрутинибом пациентов с CLL индуцирует лимфоцитоз. Взятие клеток пациента проводили в указанные моменты времени: исходный уровень (фиг.28A); курс 2, 1 сутки (фиг. 28B), и курс 12, 1 сутки (фиг.28C).
[00137] На фиг.29A, 29B и 29C показано графическое представление, демонстрирующее, что лечение ибрутинибом трех пациентов с CLL снижало экспрессию CD200 на опухолевых клетках CLL с течением времени. Каждый профиль содержит наложение гистограмм экспрессии CD200 в клетках, выделенных в указанные моменты времени: исходный уровень (скрининг); курс 2, 1 сутки; и курс 12, 1 сутки.
[00138] На фиг.30A, 30B и 3°C показано графическое представление, демонстрирующее, что лечение ибрутинибом пациентов с CLL снижает частоту PD1+ T-клеток с течением времени. Взятие клеток пациента проводили в указанные моменты времени: исходный уровень (фиг.30A); курс 2, 1 сутки (фиг.30B); и курс 12, 1 сутки (фиг.30C).
[00139] На фиг.31A и 31B показано графическое представление, демонстрирующее чувствительность клеточных линий MCL: RL (фиг.31A) и JEKO-1 (фиг.31B) к обработке ибрутинибом.
[00140] На фиг.32 показано графическое представление, демонстрирующее эффект введения ибрутиниба в модели MCL in vivo.
[00141] На фиг.33A и B показаны изображения результатов иммуногистохимического анализа при лимфоме Ходжина, демонстрирующие, что в опухоли присутствуют CD19-экспрессирующие клетки. Фиг.33A имеет увеличение 1X и фиг.33B имеет увеличение 20X.
[00142] На фиг.34 показана схематическая диаграмма схемы эксперимента для оценки терапевтической эффективности лечения посредством CART19 у пациентов с лимфомой Ходжкина.
[00143] На фиг.35A, 35B, 35C и 35D представлены результаты проточно-цитометрического анализа экспрессии PD1 и CAR19 на T-клетках. Фиг.35A и 35B являются репрезентативными профилями проточной цитометрии, демонстрирующими распределение экспрессии PD-1 и CAR19 на CD4+ T-клетках от индивидуумов, которые являются полностью отвечающими (CR) или не отвечающими (NR) на терапию CART. На фиг.35C представлен график, на котором показан процент клеток PD1 в популяции CD4+ T-клеток от групп индивидуумов с различными ответами на терапию CART. На фиг.35D показан график, демонстрирующий процент клеток PD1 в популяции CD8+ T-клеток от групп индивидуумов с различными ответами на терапию CART.
[00144] На фиг.36A и 36B показано распределение экспрессии PD1 в клетках, экспрессирующих CD4 и CAR19 (фиг.36A) или клетках, экспрессирующих CD8 и CAR19 (фиг.36B) от групп индивидуумов с различными ответами на терапию CART.
[00145] На фиг.37 показаны результаты анализа с использованием проточной цитометрии экспрессии PD1, CAR 19, LAG3 и TIM3 на T-клетках от индивидуума, которые являются полностью отвечающими (CR) или не отвечающими (NR) на терапию CART.
[00146] На фиг.38A и 38B показано распределение экспрессии PD1 и LAG3 (фиг.38A) или экспрессии PD1 и TIM3 (фиг.38B) в группах индивидуумов с различными ответами на терапию CART.
[00147] На фиг.39 показаны результаты IgA-иммунофенотипирования плазматических клеток от пациента с миеломой, которому вводили CART19, демонстрирующее ответ на терапию CART19.
[00148] На фиг.40A и 40B представлены графики, демонстрирующие увеличение титров вакцинных штаммов гриппа по сравнению с плацебо. На фиг.40A увеличение выше исходного уровня среднего геометрического значения титров вируса гриппа в отношении каждого из 3 вакцинных штаммов гриппа (H1N1 A/California/ 07/2009, H3N2 A/Victoria/210/2009, B/Brisbane/60/ 2008) относительно увеличения в группе плацебо через 4 недели после вакцинации показано для каждой из групп дозирования RAD001 в выборке пациентов с намерением лечиться. Жирной черной линией указано увеличение титров в 1,2 раза относительно плацебо, для которого требовалось, чтобы для 2 из 3 вакцинных штаммов гриппа удовлетворялся первичный результат исследования. Звездочкой "*" указано, что увеличение титра GMT относительно плацебо превышает 1 с апостериорной вероятностью по меньшей мере 80%. На фиг.40B представлен график для тех же данных, что и на фиг.40A для подгруппы индивидуумов с исходными титрами вируса гриппа <= 1:40.
[00149] На фиг.41 показан график рассеяния для концентрации RAD001 против кратности увеличения геометрического среднего значения титра для каждого вакцинного штамма гриппа через 4 недели после вакцинации. Концентрации RAD001 (через 1 час после введения дозы) измеряли после дозирования индивидуумам в течение 4 недель. Все индивидуумы, для которых были проведены фармакокинетические измерения, были включены в анализируемую группу. Кратность увеличения геометрического среднего значения титров через 4 недели после вакцинации относительно исходного уровня показан на оси y.
[00150] На фиг.42 показано графическое представление, демонстрирующее увеличение титров в отношении гетерологичных штаммов вируса гриппа по сравнению с плацебо. Увеличение геометрического среднего значения титров вируса гриппа для 2 гетерологичных штаммов вируса (A/H1N1 штамм A/New Jersey/8/76 и A/H3N2 штамм A/Victoria/361/11), не содержавшихся в вакцине против вируса гриппа относительно увеличения в группе плацебо через 4 недели после вакцинации показано для каждой из групп дозирования RAD001 в выборке пациентов с намерением лечиться. * указывает на увеличение титра относительно плацебо, превышающее 1, с апостериорной вероятностью по меньшей мере 80%.
[00151] На фиг.43A и 43B показаны графические представления уровней IgG и IgM до и после вакцинации против гриппа. Уровни IgG и IgM против гриппа A/H1N1/California/07/2009 измеряли в сыворотке, полученной от индивидуумов до и через 4 недели после вакцинации против гриппа. Не было обнаружено значительных отличий в изменении от исходного уровня до 4 недель после вакцинации уровней IgG и IgM против гриппа H1N1 между группами RAD001 и плацебо (все значения p > 0,05 согласно критерию суммы рангов Крускала-Уоллиса).
[00152] На фиг.44A, 44B и 44C показаны графические представления снижения процента положительных по PD-1 CD4 и CD8 и увеличения отрицательных по PD-1 CD4 T-клеток после лечения RAD001. Процент положительных по PD-1 CD4, CD8 и отрицательных по PD-1 CD4 T-клеток определяли с использованием FACS-анализа образцов PBMC на исходном уровне, после введения лекарственного средства в течение 6 недель (6 недель) и через 6 после прекращения введения исследуемого лекарственного средства и через 4 недели после вакцинации против гриппа (12 неделя). На фиг.44A показано, что происходило значительное снижение (-37,1 - -28,5%) уровня положительных по PD-1 CD4 T-клеток на 12 неделе в группах, в которых вводили RAD001 при уровнях дозы 0,5 мг/сутки (n=25), 5 мг/неделя (n=29) и 20 мг/неделя (n=30) по сравнению с группой плацебо (n=25) с p=0,002 (0,02), p=0,003 (q=0,03) и p=0,01 (q=0,05) соответственно. На фиг.44B показано, что происходило значительное снижение (-43,3 - -38,5%) уровня положительных по PD-1 CD8 T-клеток на 12 неделе в группах, в которых вводили RAD001 (n=109), при уровнях доз 0,5 мг/сутки (n=25), 5 мг/неделя (n=29) и 20 мг/неделя (n=30) по сравнению с группой плацебо (n=25) с p=0,01 (0,05), p=0,007 (q=0,04) и p= 0,01 (q=0,05), соответственно. На фиг.44C показано значительное увеличение (3,0 - 4,9%) уровня отрицательных по PD-1 CD4 T-клеток на 12 неделе в группах, в которых вводили RAD001 (n=109), при уровнях доз 0,5 мг/сутки (n=25), 5 мг/неделя (n=29) и 20 мг/неделя (n=30) по сравнению с группой плацебо (n=25) с p=0,0007 (0,02), p=0,03 (q=0,07), и p=0,03 (q=0,08), соответственно.
[00153] На фиг.45A и 45B показаны графические представления снижения процента положительных по PD-1 CD4 и CD8 T-клеток и увеличения отрицательных по PD-1 CD4 T-клеток после введения RAD001 с поправкой на различия в исходной экспрессии PD-1. Процент положительных по PD-1 CD4, CD8 и отрицательных по PD-1 CD4 T-клеток определяли с использованием FACS-анализа образцов PBMC на исходном уровне, после 6 недель введения исследуемого лекарственного средства (6 неделя), и через 6 недель после прекращения введения исследуемого лекарственного средства, и через 4 недели после вакцинации против гриппа (12 неделя). На фиг.45A показано значительное снижение, составляющее 30,2%, PD-1+ CD4 T-клеток на 6 неделе в объединенной группе RAD (n=84) по сравнению с группой плацебо (n=25) с p=0,03 (q=0,13). Снижение положительных по PD-1 CD4 T-клеток на 12 неделе в объединенной группе RAD по сравнению с группой плацебо составляет 32,7% с p=0,05 (q=0,19). На фиг.45B показано значительное снижение уровня положительных по PD-1 CD8 T-клеток, составляющее 37,4%, на 6 неделе в объединенной группе RAD001 (n=84) по сравнению с группой плацебо (n=25) с p=0,008 (q=0,07). Снижение положительных по PD-1 CD8 T-клеток на 12 неделе в объединенной группе RAD001 по сравнению с группой плацебо составляет 41,4% с p=0,066 (q=0,21). На фиг.45A и 45B представлены данные с фиг.45A, 45B и 45C, но для других групп дозирования RAD001, чем на фиг.45A, 45B и 45C, объединенных в одну группу введения RAD001 на фиг.45A и 45B.
[00154] На фиг.46 представлено увеличение физической нагрузки и энергии у пожилых индивидуумов в ответ на RAD001.
[00155] На фиг.47A и 47B представлен спрогнозированный эффект RAD001 на активность P70 S6K в клетках. На фиг.47A представлено ингибирование киназы P70 S6 более высокими дозами RAD001, водимого раз в неделю и раз в сутки; на фиг.47B представлено ингибирование киназы P70 S6 более низкими дозами RAD001, вводимого раз в неделю.
[00156] На фиг.48A и 48B показана экспрессия IL-7 (CD127) на линиях злокачественных клеток и CART-клетках. Экспрессию CD127 измеряли проточно-цитометрическим анализом трех линий злокачественных клеток: RL (лимфома из клеток мантийной зоны), JEKO (также известная как Jeko-1, лимфома из клеток мантийной зоны) и Nalm-6 (B-ALL) (фиг.48A). Экспрессию CD127 измеряли проточно-цитометрическим анализом на CD3-положительных (CART) клетках, которые были инфузированы и циркулировали у мышей NSG (фиг.48B).
[00157] На фиг.49A, 49B и 49C показан противоопухолевый ответ после введения CART19 и последующего введения IL-7. Мышам NSG с трансплантированной экспрессирующей люциферазу клеточной линии лимфомы из клеток мантийной зоны (RL-luc) на 0 сутки вводили различные дозировки CART19-клеток на 6 сутки и проводили мониторинг опухолевой нагрузки. Мышей подразделяли на 4 групы и не вводили CART19-клетки, вводили 0,5×106 CART19-клеток (CART19 0,5E6), вводили 1×106 CART19-клеток (CART19 1E6) или вводили 2×106 CART19-клеток (CART19 2E6). Опухолевую нагрузку после введения CART измеряли путем выявления биолюминесценции (среднее значение BLI) (фиг.49A). Мышей, которым вводили 0,5×106 CART19-клеток (CART19 0,5E6) или 1×106 CART19-клеток (CART19 1E6), случайным образом распределяли на группы введения рекомбинантного IL-7 человека (rhIL-7) или без его введения. Мониторинг опухолевой нагрузки, показанной в данном случае посредством средней биолюминесценции (BLI), проводили для трех мышей (#3827, #3829 и #3815, которым вводили указанную первоначальную дозу CART19), представленных на фиг.49A, которым вводили IL-7, начиная на 85 сутки (фиг.49B). IL-7 вводили посредством в/б инъекции 3 раза в неделю. Опухолевую нагрузку, представленную здесь посредством средней биолюминесценции (BLI) до 85 суток (ДО) и после 115 суток (ПОСЛЕ) сравнивали между мышами, которым не вводили IL-7 (КОНРОЛЬ) и мышами, которым проводили введение IL-7 (IL-7) (фиг.49C).
[00158] На фиг.50A и 50B показана динамика T-клеток после введения IL-7. Мониторинг уровня T-клеток человека, обнаруженного в крови, проводили для каждой из мышей, которым вводили IL-7, или для контрольных мышей (фиг.50A). Уровень CART19-клеток (CD3+ клеток), обнаруженных в крови, измеряли до (ДО) и через 14 суток после (14 сутки) начала введения IL-7 (фиг.50B).
[00159] На фиг.51 представлены структуры двух иллюстративных конфигураций RCAR. Связывающие антиген члены содержат антигенсвязывающий домен, трансмембранный домен и домен переключения. Внутриклеточные связывающие члены содержат домен переключения, костимулирующий сигнальный домен и первичный сигнальный домен. Две конфигурации демонстрируют, что первый и второй домены переключения, описанные в настоящем описании, могут находиться в различных конфигурациях относительно связывающего антиген члена и внутриклеточного связывающего члена. Другие конфигурации RCAR дополнительно описаны в настоящем описании.
[00160] На фиг.52A представлено изображение клеточной линии RL.
[00161] На фиг.52B представлена группа графиков рассеяния проточной цитометрии, демонстрирующих экспрессию CD19 и CD5 первичных клеточных линиях RL и в клеточных линиях RL.
[00162] На фиг.52C представлено изображение, демонстрирующее транслокацию t(11;14) посредством флуоресцентной гибридизации in situ (FISH).
[00163] На фиг.52D представлен график, демонстрирующий IC50 (по процентному конвертированию MTT) для ингибирования ибрутинибом в различных клеточных линиях.
[00164] На фиг.52E представлена группа изображений и графиков, демонстрирующих приживление клеток RL у мышей NOD-SCID с нокаутом гамма-цепи (NSG) и итоговую опухолевую нагрузку.
[00165] На фиг.52F представлена группа гистологических изображений, демонстрирующих локализацию клеток MCL в различных органах у мышей.
[00166] На фиг.52G показана группа гистологических изображений мышей, которым инъецировали клетки MCL-RL.
[00167] На фиг.53A представлен набор графиков, демонстрирующих количество CD107a+ CART19-клеток под воздействием различных клеточных линий MCL.
[00168] На фиг.53B представлена группа графиков, демонстрирующих количество IL-2 и TNF-альфа, продуцированных CART19-клетками под воздействием различных клеточных линий MCL.
[00169] На фиг.53C представлен график, демонстрирующий процентное уничтожение различных клеточных линий MCL CART19-клетками при различных соотношениях клеток эффектор:мишень.
[00170] На фиг.53D представлен график, демонстрирующий количество сукцинимидилового эфира карбоксифлуоресцеина (CFSE), являющееся мерой пролиферации, в CART19-клетках, подвергнутых воздействию различных клеточных линий MCL.
[00171] На фиг.53E представлена группа графиков, демонстрирующих процент T-клеток до и после увеличения в количестве.
[00172] На фиг.53F представлена группа графиков, демонстрирующих процент нетрансдуцированных или трансдуцированных CAR-19 T-клеток, которые экспрессируют или продуцируют различные биомолекулы (например, цитокины).
[00173] На фиг.54A представлена группа изображений, демонстрирующих активацию индуцируемой интерлейкином-2 T-клеточной киназы (ITK), когда CART19-клетки стимулировали специфически или неспецифически.
[00174] На фиг.54B представлена группа графиков, демонстрирующих поверхностную экспрессию CD107a (мера дегрануляции), продукцию IL-2 и продукцию TNF-альфа CART19-клетками при различных концентрациях ибрутиниба.
[00175] На фиг.54C представлена группа гистограмм, демонстрирующих количество CFSE в CART19-клетках при различных концентрациях ибрутиниба и подвергнутых воздействию различных клеточных линий MCL.
[00176] На фиг.54D представлена группа графиков, демонстрирующих экспрессию или продукцию различных цитокинов и биомаркеров в качестве индикаторов статуса Th1 или Th2 CART19-клеток при комбинировании с различными концентрациями ибрутиниба.
[00177] На фиг.54E представлен набор графиков, демонстрирующих процентное уничтожение CART19-клетками различных клеточных линий MCL при комбинировании с различными концентрациями ибрутиниба.
[00178] На фиг.54F представлена столбиковая диаграмма, демонстрирующая экспрессию различных маркеров собственной цитотоксической функции CART19-клеток при комбинировании с различными концентрациями ибрутиниба.
[00179] На фиг.55 представлено схематическое изображение экспериментальной схемы модели на мышах in vivo для исследования эффекта CART19 и/или ибрутиниба на мышей, которым инъецировали MCL-RL, с использованием люминесценции в качестве получаемых данных (мера количества опухолевых клеток).
[00180] На фиг.56 представлено схематическое изображение эксперимантельной схемы модели на мышах in vivo для исследования эффекта CART19 и/или ибрутиниба на мышей, которым инъецировали MCL-RL, с использованием люминесценции в качестве получаемых данных (мера количества опухолевых клеток).
[00181] На фиг.57 представлена группа графиков, демонстрирующих люминесценцию (мера количества опухолевых клеток) у мышей, которым вводили ибрутиниб в различных концентрациях, и их общую выживаемость после лечения.
[00182] На фиг.58 представлена группа графиков, демонстрирующих люминесценцию (мера количества опухолевых клеток) у мышей, которым вводили ибрутиниб или CART19-клетки, а также их общую выживаемость после лечения.
[00183] На фиг.59 представлен график, нa котором показана люминесценция (мера количества опухолевых клеток) у мышей после ведения ибрутиниба, нетрансдуцированных T-клеток, ибрутиниба с нетрансдуцированными T-клетками, CART19-клетками и CART19-клетками с ибрутинибом.
[00183] На фиг.59 представлена график, демонстрирующий люминесценцию (мера количества опухолевых клеток) у мышей после введения ибрутиниба, нетрансдуцированных T-клеток, ибрутиниба с нетрансдуцированными T-клетками, CART19-клеток и CART19-клеток с ибрутинибом.
[00184] На фиг.60 представлен график, демонстрирующий люминесценцию (мера количества опухолевых клеток) у мышей после введения ибрутиниба отдельно, CART19-клеток отдельно или комбинации ибрутиниба с CART19-клетками.
[00185] На фиг.61A представлена группа графиков, демонстрирующих уровень Th1-цитокинов, продуцированных у мышей, которым вводили ибрутиниб и/или CART19-клетки. На фиг.61B представлена группа графиков, демонстрирующих уровень Th2-цитокинов, продуцированных у мышей, которым вводили ибрутиниб и/или CART19-клетки.
[00186] На фиг.61C представлен график, демонстрирующий процент клеток, экспресирующих маркер пролиферации Ki67 у мышей, которым вводили CART19-клетки или CART19-клетки плюс ибрутиниб.
[00187] На фиг.61D представлен график, демонстрирующий процент клеток, экспрессирующих антиапоптотический маркер BCL-2, у мышей, которым вводили CART19-клетки или CART19-летки плюс ибрутиниб.
ПОДРОБНОЕ ОПИСАНИЕ
Определения
[00188] Если не определено иначе, все технические и научные термины, используемые в настоящем описании, обладают тем же значением, которое обычно подразумевает специалист в области, к которой относится изобретение.
[00189] Форма единственного числа относится к одному или более чем к одному (т.е. по меньшей мере к одному) грамматическому объекту в форме единственного числа. В качестве примера "элемент" означает один элемент или более одного элемента.
[00190] Термин "приблизительно", когда он относится к поддающейся измерению величине, такой как количество, период времени и т.п., охватывает отклонения±20%, или в некоторых случаях±10%, или в некоторых случаях±5%, или в некоторых случаях±1%, или в некоторых случаях±0,1% от указанной величины, поскольку такие отклонения являются пригодными для выполнения описанных способов.
[00191] Термин "химерный рецептор антигена" или альтернативно "CAR" относится к набору полипептидов, как правило, двум в наиболее простых вариантах осуществления, который, когда находится в иммунной эффекторной клетке, обеспечивает специфичность клетки к клетке-мишени, как правило, злокачественной клетке, и индукцию внутриклеточного сигнала. В некоторых вариантах осуществления CAR содержит по меньшей мере внутриклеточный антигенсвязывающий домен, трансмембранный домен и цитоплазматический сигнальный домен (также обозначаемый в настоящем описании как "внутриклеточный сигнальный домен"), содержащий функциональный сигнальный домен, происходящий из стимулирующей молекулы и/или костимулирующей молекулы, как определено ниже. В некоторых аспектах полипептиды в наборе являются соседними друг с другом, например, находятся в одной полипептидной цепи (например, содержат химерный слитый белок). В некоторых вариантах осуществления, полипептиды в наборе не являются соседними друг с другом, например, они находятся в различных полипептидных цепях. В некоторых вариантах осуществления набор полипептидов включает переключатель димеризации, который в присутствии молекулы димеризации может связывать полипептиды друг с другом, например, может связывать антигенсвязывающий домен с внутриклеточным сигнальным доменом. В одном аспекте стимулирующая молекула представляет собой зета-цепь, связанную с T-клеточный рецепторным комплексом. В одном аспекте цитоплазматический сигнальный домен дополнительно содержит один или несколько функциональных сигнальных доменов, происходящих из по меньшей мере одной костимулирующей молекулы, как определено ниже. В одном аспекте костимулирующая молекула выбрана из костимулирующих молекул, описанных в настоящем описании, например, 4-1BB (т.е. CD137), CD27 и/или CD28. В одном аспекте CAR содержит химерный слитый белок, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий функциональный сигнальный домен, происходящий из стимулирующей молекулы. В одном аспекте CAR содержит химерный слитый белок, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий функциональный сигнальный домен, происходящий из костимулирующей молекулы, и функциональный сигнальный домен, происходящий из стимулирующей молекулы. В одном аспекте CAR содержит химерный слитый белок, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий два функциональных сигнальных домена, происходящих из одной или нескольких костсимулирующей молекулы(молекул), и функциональный сигнальный домен, происходящий из стимулирующей молекулы. В одном аспекте CAR содержит химерный слитый белок, содержащий внеклеточный антигенсвязывающий домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий по меньшей мере два функциональных сигнальных домена, происходящих из одной или нескольких костимулирующей молекулы(молекул), и функциональный сигнальный домен, происходящий из стимулирующей молекулы. В одном аспекте CAR содержит необязательную лидерную последовательность на N-конце (N-ter) слитого белка CAR. В одном аспекте CAR дополнительно содержит лидерную последовательность на N-конце внеклеточного антигенсвязывающего домена, где лидерная последовательность необязательно отщепляется от антигенсвязывающего домена (например, scFv) в ходе клеточного процессинга и локализации CAR на клеточной мембране.
[00192] Термин "сигнальный домен" относится к функциональной части белка, которая действует, передавая информацию в клетке для регуляции клеточной активности через определенные пути передачи сигнала путем образования вторичных посредников или функционирования в качестве эффекторов посредством ответа на таких посредников.
[00193] Как используют в рамках изобретения, термин "CD19" относится к белку кластера дифференцировки 19, который является антигенной детерминантной, поддающейся обнаружению на лейкозных клетках-предшественниках. Аминокислотные последовательности и последовательности нуклеиновых кислот человека и мыши могут быть найдены в общественной базе данных, такой как GenBank, UniProt и Swiss-Prot. Например, аминокислотная последовательность CD19 человека может быть найдена в качестве номера доступа UniProt/Swiss-Prot № P15391, и нуклеотидная последовательность, кодирующая CD19 человека, может быть найдена под номером доступа № NM_001178098. Как используют в рамках изобретения, "CD19" включает белки, содержащие мутации, например, точковые мутации, фрагменты, инсерции, делеции и варианты по сплайсингу полноразмерного CD19 дикого типа. CD19 экспрессируется большинством злокачественных опухолей B-ростка, включая, например, острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз и неходжкинскую лимфому. Другие клетки, которые экспрессируют CD19, представлены ниже в определении "заболевания, ассоциированного с экспрессией CD19". Также он является ранним маркером предшественников B-клеток. См., например, Nicholson et al. Mol. Immun. 34 (16-17): 1157-1165 (1997). В одном аспекте антигенсвязывающая часть CART распознает и связывает антиген во внеклеточном домене белка CD19. В одном аспекте белок CD19 экспрессируется на злокачественной клетке.
[00194] Как используют в рамках изобретения, термин "CD20" относится к антигенной детерминанте, о которой известно, что она поддается обнаружению на B-клетках. CD20 человека также называется трансмембранный 4-доменный представитель 1 подсемейства A (MS4A1). Аминокислотные последовательности и последовательности нуклеиновых кислот человека и мыши могут быть найдены в общедоступной базе данных, такой как GenBank, UniProt и Swiss-Prot. Например, аминокислотная последовательность CD20 человека может быть найдена под номерами доступа № NP_690605.1 и NP_068769.2, и нуклеотидная последовательность, кодирующая варианты транскриптов 1 и 3 CD20 человека, может быть найдена под номерами доступа № NM_152866.2 и NM_021950.3, соответственно. В одном аспекте антигенсвязывающая часть CAR распознает и связывает антиген во внеклеточном домене белка CD20. В одном аспекте белок CD20 экспрессируется на злокачественной клетке.
[00195] Как используют в рамках изобретения, термин "CD22" относится к антигенной детерминанте, о которой известно, что она поддается обнаружению на лейкозных клетках-предшественниках. Аминокислотные последовательности и последовательности нуклеиновых кислот человека и мыши могут быть найдены в общедоступной базе данных, такой как GenBank, UniProt и Swiss-Prot. Например, аминокислотные последовательности изоформ 1-5 CD22 человека могут быть найдены под номерами доступа № NP 001762.2, NP 001172028.1, NP 001172029.1, NP 001172030.1 и NP 001265346.1, соответственно, и нуклеотидная последовательность, кодирующая варианты 1-5 CD22 человека, может быть найдена под номерами доступа № NM 001771.3, NM 001185099.1, NM 001185100.1, NM 001185101.1 и NM 001278417.1, соответственно. В одном аспекте антигенсвязывающая часть CAR распознает и связывает антиген во внеклеточном домене белка CD22. В одном аспекте белок CD22 экспрессируется на злокачественной клетке.
[00196] Как используют в рамках изобретения, термин "ROR1" относится к антигенной детерминанте, о которой известно, что она поддается обнаружению на лейкозных клетках-предшественниках. Аминокислотные последовательности и последовательности нуклеиновых кислот человека и мыши могут быть найдены в общедоступной базе данных, такой как GenBank, UniProt и Swiss-Prot. Например, аминокислотные последовательности предшественников изоформ 1 и 2 ROR1 человека могут быть найдены под номерами доступа № NP_005003.2 и NP_001077061.1, соответственно, и последовательности мРНК, кодирующие их, могут быть найдены под номерами доступа № NM_005012.3 и NM_001083592.1, соответственно. В одном аспекте антигенсвязывающая часть CAR распознает и связывает антиген во внеклеточном домене белка ROR1. В одном аспекте белок ROR1 экспрессируется на злокачественной клетке.
[00197] Термин "антитело", как используют в рамках изобретения, относится к белку, или полипептидной последовательности, происходящим из молекулы иммуноглобулина, которая специфически связывается с антигеном. Антитела могут быть поликлональными или моноклональными, имеющими множество цепей или одноцепочечными, или интактными иммуноглобулинами, и они могут происходить из природных источников или из рекомбинантных источников. Антитела могут представлять собой тетрамеры молекул иммуноглобулинов.
[00198] Термин "фрагмент антитела" относится по меньшей мере к одной части антитела, которая сохраняет способность специфически взаимодействовать (например, путем связывания, пространственного препятствования, стабилизации/дестабилизации, пространственного распределения) с эпитопом антигена. Примеры фрагментов антител включают, но не ограничиваются ими, Fab, Fab', F(ab')2, Fv-фрагменты, фрагменты антител scFv, связанные дисульфидной связью Fv (sdFv), Fd-фрагмент, состоящий из доменов VH и CH1, линейные антитела, однодоменные антитела, такие как sdAb (либо VL, либо VH), домены VHH животных семейства верблюжьих, мультиспецифические антитела, образованные фрагментами антител, такими как двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области, и выделенные CDR или другие связывающие эпитоп фрагменты антитела. Антигенсвязывающий фрагмент также может быть включен в однодоменные антитела, максиантитела, миниантитела, наноантитела, интраантитела, диантитела, триантитела, тетраантитела, v-NAR и бис-scFv (см., например, Hollinger and Hudson, Nature Biotechnology 23:1126-1136, 2005). Антигенсвязывающие фрагменты также могут быть пересажены в каркасы на основе полипептидов, таких как фибронектин типа III (Fn3)(см. патент США №: 6703199, в котором описаны миниантитела на основе полипептида фибронектина).
[00199] Термин "scFv" относится к слитому белку, содержащему по меньшей мере один фрагмент антитела, содержащий вариабельную область легкой цепи, и по меньшей мере один фрагмент антитела, содержащий вариабельную область тяжелой цепи, где вариабельные области легкой и тяжелой цепей связаны друг с другом, например, через синтетический линкер, например, короткий гибкий полипептидный линкер, и способному экспрессироваться в качестве одноцепочечного полипептида, и где scFv сохраняет специфичность интактного антитела, из которого он происходит. Если не указано, как используют в рамках изобретения, scFv может иметь вариабельные области VL и VH в любом порядке, например, относительно N-конца и C-конца полипептида scFv может содержать VL-линкер-VH или может содержать VH-линкер-VL.
[00200] Часть CAR по изобретению, содержащая антитело или фрагмент антитела, может существовать в различных формах, где антигенсвязывающий домен экспрессируется в качестве части непрерывной полипептидной цепи, включая, например, однодоменный фрагмент антитела (sdAb), одноцепочечное антитело (scFv), гуманизированное антитело или биспецифическое антитело (Harlow et al., 1999: Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989: Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; Bird et al., 1988, Science 242:423-426). В одном аспекте антигенсвязывающий домен композиции CAR по изобретению содержит фрагмент антитела. В следующем аспекте CAR содержит фрагмент антитела, который содержит scFv. Точные границы аминокислотных последовательностей данной CDR могут быть определены с использованием любой из ряда хорошо известных схем, включая схемы, описанные Kabat et al. (1991), "Sequences of Proteins of Immunological Interest", 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (схема нумерации "Kabat"), Al-Lazikani et al., (1997) JMB 273,927-948 (схема нумерации "Chothia"), или их комбинации.
[00201] Как используют в рамках изобретения, термин "связывающий домен" или "молекула антитела" относится к белку, например, цепи иммуноглобулина или ее фрагменту, содержащему по меньшей мере одну последовательность вариабельного домена иммуноглобулина. Термины "связывающий домен" или "молекула антитела" охватывают антитела и фрагменты антитела. В одном варианте осуществления молекула антитела представляет собой мультиспецифическую молекулу антитела, например, она содержит множество последовательностей вариабельных доменов иммуноглобулинов, где первая последовательность вариабельного домена иммуноглобулина из множества обладает специфичностью связывания в отношении первого эпитопа, а вторая последовательность вариабельного домена иммуноглобулина из множества обладает специфичностью связывания в отношении второго эпитопа. В одном варианте осуществления мультиспецифическая молекула антитела представляет собой биспецифическую молекулу антитела. Биспецифическое антитело обладает специфичностью в отношении не более чем двух антигенов. Биспецифическая молекула антитела характеризуется первой последовательностью вариабельного домена иммуноглобулина, которая обладает специфичностью связывания в отношении первого эпитопа, и второй последовательностью вариабельного домена иммуноглобулина, которая обладает специфичностью связывания в отношении второго эпитопа.
[00202] Часть CAR по изобретению, содержащая антитело или фрагмент антитела, может принимать множество форм, где антигенсвязывающий домен экспрессируется в качестве части непрерывной полипептидной цепи, включая, например, однодоменный фрагмент антитела (sdAb), одноцепочечное антитело (scFv), гуманизированное антитело или биспецифическое антитело (Harlow et al., 1999, Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; Bird et al., 1988, Science 242:423-426). В одном аспекте антигенсвязывающий домен композиции CAR по изобретению содержит фрагмент антитела. В следующем аспекте CAR содержит фрагмент антитела, который содержит scFv.
[00203] Термин "тяжелая цепь антитела" относится к более крупной из двух типов полипептидных цепей, присутствующих в молекулах антитела в их встречающихся в природе конформациях, и обычно определяющему класс, к которому относится антитело.
[00204] Термин "легкая цепь антитела" относится к меньшей из двух типов полипептидных цепей, присутствующих в молекулах антител в их встречающихся в природе конформациях. Легкие цепи каппа (κ) и лямбда (λ)относятся к двум основным изотипам легких цепей антител.
[00205] Термин "рекомбинантное антитело" относится к антителу, которое получают с использованием технологии рекомбинантных ДНК, например, такому как антитело, экспрессируемое бактериофагом или дрожжевой экспрессирующей системой. Термин также следует истолковывать как антитело, полученное посредством синтеза молекулы ДНК, кодирующей антитело, причем эта молекула ДНК экспрессирует белок антитела или аминокислотную последовательность, характеризующую антитело, где ДНК или аминокислотная последовательность получены с использованием технологии рекомбинантных ДНК или аминокислотных последовательностей, которая доступна и хорошо известна в данной области.
[00206] Термин "антиген" или "Ag" относится к молекуле, которая индуцирует иммунный ответ. Иммунный ответ может вовлекать либо продукцию антител, либо активацию специфических иммунокомпетентных клеток, или оба из этих вариантов. Квалифицированному специалисту будет понятно, что любая макромолекула, включая практические все белки или пептиды, может выступать в качестве антигена. Более того, антигены могут происходить из рекомбинантной или геномной ДНК. Квалифицированному специалисту будет понятно, что любая ДНК, которая содержит нуклеотидные последовательности или частичную нуклеотидную последовательность, кодирующую белок, который индуцирует иммунный ответ, таким образом, кодирует "антиген", как этот термин используют в настоящем описании. Более того, квалифицированному специалисту будет понятно, что антиген не должен кодироваться исключительно полноразмерной нуклеотидной последовательностью гена. Хорошо понятно, что настоящее изобретение включает, но не ограничивается ими, применение частичных нуклеотидных последовательностей из более чем одного гена, и что эти нуклеотидные последовательности располагаются в различных комбинациях для кодирования полипептидов, которые индуцируют желаемый иммунный ответ. Более того, квалифицированному специалисту будет понятно, что антиген вовсе не должен кодироваться "геном". Хорошо понятно, что антиген можно получать путем синтеза, или он может происходить из биологического образца, или может представлять собой макромолекулу помимо полипептида. Такой биологический образец может включать, но не ограничиваться ими, образец ткани, образец опухоли, клетку или жидкость с другими биологическими компонентами.
[00207] Термин "противораковый эффект" относится к биологическому эффекту, который может проявляться различными путями, включая, но не ограничиваясь ими, например, снижение объема опухоли, уменьшение количества злокачественных клеток, уменьшение количества метастазов, увеличение продолжительности жизни, снижение пролиферации злокачественных клеток, снижение выживаемости злокачественных клеток или смягчение различных физиологических симптомов, ассоциированных со злокачественным состоянием. "Противораковый эффект" также может проявляться способностью пептидов, полинуклеотидов, клеток и антител к предупреждению возникновения злокачественной опухоли изначально. Термин "противоопухолевый эффект" относится к биологическому эффекту, который может проявляться различными путями, включая, но не ограничиваясь ими, например, снижение объема опухоли, уменьшение количества опухолевых клеток, снижение пролиферации опухолевых клеток или снижение выживаемости опухолевых клеток.
[00208] Термин "аутологичный" относится к любому материалу, происходящему из того же индивидуума, которому его впоследствии обратно вводят.
[00209] Термин "аллогенный" относится к любому материалу, происходящему из другого животного того же вида относительно индивидуума, которому материал вводят. Два или более индивидуумов называют аллогенными друг другу, когда гены в одном или нескольких локусов не являются идентичными. В некоторых аспектах аллогенный материал от индивидуумов того же вида может быть достаточно генетически отличающимся, чтобы происходило антигенное взаимодействие.
[00210] Термин "ксеногенный" относится к трансплантату, происходящему из животного другого вида.
[00211] Термин "злокачественная опухоль" относится к заболеванию, характеризующемуся неконтролируемым ростом аберрантных клеток. Злокачественные клетки могут распространяться локально или через кровоток и лимфатическую систему в другие части организма. Примеры различных злокачественных опухолей описаны в настоящем описании и включают, но не ограничиваются ими, рак молочной железы, рак предстательной железы, рак яичника, рак шейки матки, рак кожи, рак поджелудочной железы, рак ободочной и прямой кишки, рак почки, рак печени, злокачественную опухоль головного мозга, лимфому, лейкоз, рак легкого и т.п. Термины "опухоль" и "злокачественная опухоль" используют в настоящем описании взаимозаменяемо, например, оба термины охватывают солидные и жидкостные, например, диффузные или циркулирующие, опухоли. Как используют в рамках изобретения, термин "злокачественная опухоль" или "опухоль" включает предзлокачественные, а также злокачественные новообразования и опухоли.
[00212] Выражение "заболевание, ассоциированное с экспрессией CD19," включает, но не ограничивается ими, заболевание, ассоциированное с экспрессией CD19, или состояние, ассоциированное с клетками, которые экспрессируют или в какой-либо момент времени экспрессировали CD19, включая, например, пролиферативные заболевания, такие как злокачественная опухоль или новообразование, или предзлокачественное состояние, такое как миелодисплазия, миелодиспластический синдром или предлейкоз; или не связанные со злокачественной опухолью состояния, ассоциированные с клетками, которые экспрессируют CD19. Во избежание неопределенности, заболевание, ассоциированное с экспрессией CD19, может включать состояние, ассоциированное с клетками, которые в настоящее время не экспрессируют CD19, например, поскольку экспрессия CD19 подавлена, например, вследствие лечения молекулой, нацеленной на CD19, например, CAR против CD19, но которая когда-то экспрессировала CD19. В одном аспекте злокачественная опухоль, ассоциированная с экспрессией CD19, представляет собой гематологическую злокачественную опухоль. В одном аспекте гематологическая злокачественная опухоль представляет собой лейкоз или лимфому. В одном аспекте злокачественная опухоль, ассоциированная с экспрессией CD19, включает злокачественные опухоли и новообразования, включающие, но не ограничивающиеся ими, например, один или несколько из острых лейкозов, включая, но не ограничиваясь ими, например, B-клеточный острый лимфоидный лейкоз (BALL), T-клеточный острый лимфоидный лейкоз (TALL), острый лимфоидный лейкоз (ALL); один или несколько из хронических лейкозов, включая, но не ограничиваясь ими, например, хронический миелогенный лейкоз (CML), хронический лимфоидный лейкоз (CLL). Дополнительные злокачественные опухоли или гематологические состояния, ассоциированные с экспрессией CD19, включают, но не ограничиваются ими, например, B-клеточный пролимфоцитарный лейкоз, новообразование из бластных плазмацитоидных дендритных клеток, лимфому Беркитта, диффузную крупноклеточную B-клеточную лимфому, фолликулярную лимфому, волосатоклеточный лейкоз, мелкоклеточную или крупноклеточную фолликулярную лимфому, злокачественные лимфопролиферативные состояния, лимфому MALT, лимфому из клеток мантийной зоны (MCL), лимфому из клеток маргинальной зоны, множественную миелому, миелодисплазию и миелодиспластический синдром, неходжкинскую лимфому, лимфому Ходжкина, плазмабластную лимфому, новообразование из плазмацитоидных дендритных клеток, макроглобулинемию Вальденстрема и "предлейкоз", который представляет собой многообразную совокупность гематологических состояний, объединенных неэффективной продукцией (или дисплазия) миелоидных клеток крови, и т.п. Кроме того, заболевания, ассоциированные с экспрессией CD19, включают, но не ограничиваясь ими, например, атипичные и/или неклассические злокачественные опухоли, новообразования, предзлокачественные состояния или пролиферативные заболевания, ассоциированные с экспрессией CD19. Не связанные со злокачественной опухолью состояния, ассоциированные с экспрессией CD19, включают, но не ограничиваются ими, например, аутоиммунное заболевание (например, волчанка), воспалительные нарушения (аллергия и астма) и трансплантацию. В некоторых вариантах осуществления клетки, экспрессирующие опухолевый антиген, экспрессируют или в какой-либо момент экспрессировали мРНК, кодирующую опухолевый антиген. В одном варианте осуществления клетки, экспрессирующие опухолевый антиген, продуцируют белок опухолевого антигена (например, дикого типа или мутантный), и белок опухолевого антигена может присутствовать на нормальных уровнях или сниженных уровнях. В одном варианте осуществления экспрессирующие опухолевый антиген клетки продуцируют поддающиеся обнаружению уровни белка опухолевого антигена в один момент времени, а затем по существу не продуцируют поддающийся обнаружению белок опухолевого антигена.
[00213] Выражение "заболевание, ассоциированное с экспрессией B-клеточного антигена," включает, но не ограничивается ими, заболевание, ассоциированное с экспрессией одного или нескольких из CD19, CD20, CD22 или ROR1, или состояние, ассоциированное с клетками, которые экспрессирут или в какой-либо момент экспрессировали, один или несколько из CD19, CD20, CD22 или ROR1, включая, например, пролиферативные заболевания, такие как злокачественная опухоль, или новообразование, или предзлокачественное состояние, такое как миелодисплазия, миелодиспластический синдром или предлейкоз; или не связанное со злокачественной опухолью состояние, ассоциированное с клетками, которые экспрессируют один или несколько из CD19, CD20, CD22 или ROR1. Во избежание неопределенности, заболевание, ассоциированное с экспрессией B-клеточного антигена, может включать состояние, ассоциированное с клетками, которые в настоящее время не экспрессируют B-клеточный антиген, например, поскольку экспрессия антигена подавлена, например, вследствие лечения молекулой, нацеленной на B-клеточный антиген, например, CAR, нацеленным на B-клетку, но которые когда-то экспрессировали антиген. Выражение "заболевание, ассоциированное с экспрессией B-клеточного антигена," включает заболевание, ассоциированное с экспрессией CD19, как описано в настоящем описании.
[00214] Термин "консервативные модификации последовательности" относится к модификациям аминокислот, которые не влияют или не изменяют в значительной степени характеристики связывания антитела или фрагмента антитела, содержащих аминокислотную последовательность. Такие консервативные модификации включают аминокислотные замены, вставки или делеции. Модификации можно вносить в антитело или фрагмент антитела по изобретению стандартными способами, известными в данной области, такими как сайт-направленный мутагенез и ПЦР-опосредуемый мутагенез. Консервативные аминокислотные замены представляют собой замены, в которых аминокислотный остаток заменен аминокислотным остатком, имеющим сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, определены в данной области. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или несколько аминокислотных остатков в CAR по изобретению могут быть заменены другими аминокислотными остатками из того же семейства боковых цепей, и измененный CAR можно исследовать с использованием функциональных анализов, описанных в настоящем описании.
[00215] Термин "стимуляция" относится к первичному ответу, индуцированному посредством связывания стимулирующей молекулы (например, комплекс TCR/CD3 или CAR) с ее собственным лигандом (или опухолевым антигеном в случае CAR), что, тем самым, опосредует событие передачи сигнала, такое как, но не ограничиваясь ими, передача сигнала через комплекс TCR/CD3 или передача сигнала через соответствующий рецептор NK или сигнальные домены CAR. Стимуляция может опосредовать измененную экспрессию определенных молекул.
[00216] Термин "стимулирующая молекула" относится к молекуле, экспрессируемой иммунной клеткой (например, T-клеткой, NK-клеткой, B-клеткой), которая предоставляет сигнальную последовательность(и), которая регулирует активацию иммунной клетки стимулирующим образом для по меньшей мере некоторого аспекта каскада передачи сигнала иммунными клетками. В одном аспекте сигнал представляет собой первичный сигнал, который инициируется, например, связыванием комплекса TCR/CD3 с молекулой MHC, нагруженной пептидом, и который приводит к опосредованию T-клеточного ответа, включая, но не ограничиваясь ими, пролиферацию, активацию, дифференцировку и т.п. Первичная цитоплазматическая сигнальная последовательность (также обозначаемая как "первичный сигнальный домен"), которая действует стимулирующим образом, может содержать сигнальный мотив, который известен как иммунорецепторный тирозиновый активирующий мотив или ITAM. Примеры содержащей ITAM цитоплазматической сигнальной последовательности, которая является особенно пригодной в рамках изобретения, включают, но не ограничиваются ими, последовательности, происходящие из CD3-зета, общего FcR-гамма (FCER1G), Fc-гамма RIIa, FcR-бета (Fc-эпсилон R1b), CD3-гамма, CD3-дельта, CD3-эпсилон, CD79a, CD79b, DAP10 и DAP12. В конкретном CAR по изобретению внутриклеточный сигнальный домен в любом одном или нескольких CAR по изобретению содержит внутриклеточную сигнальную последовательность, например, первичную сигнальную последовательность CD3-зета. В конкретном CAR по изобретению первичная сигнальная последовательность CD3-зета представляет собой последовательность, представленную в SEQ ID NO: 17, или эквивалентные остатки из не являющегося человеком вида, например, мыши, грызуна, мартышки, человекообразной обезьяны и т.п. В конкретном CAR по изобретению первичная сигнальная последовательность CD3-зета представляет собой последовательность, представленную в SEQ ID NO: 43, или эквивалентные остатки из не являющегося человеком вида, например, мыши, грызуна, мартышки, человекообразной обезьяны и т.п.
[00217] Термин "антигенпредставляющая клетка" или "APC" относится к клетке иммунной системы, такой как вспомогательная клетка (например, B-клетка, дендритная клетка и т.п.), которая экспонирует чужеродный антиген в комплексе с основным комплексом гистосовместимости (MHC) на ее поверхности. T-клетки могут распознавать эти комплексы с использованием их T-клеточных рецепторов (TCR). APC процессируют антигены и презентируют их T-клеткам.
[00218] "Внутриклеточный сигнальный домен", как используют в настоящем описании, относится к внутриклеточной части молекулы. Внутриклеточный сигнальный домен генерирует сигнал, который стимулирует иммунную эффекторную функцию содержащей CAR клетки, например, CART-клетки. Примеры иммунной эффекторной функции, например, в CART-клетке, включают цитолитическую активность и хелперную активность, включая секрецию цитокинов.
[00219] В одном варианте осуществления внутриклеточный сигнальный домен может содержать первичный внутриклеточный сигнальный домен. Иллюстративные первичные внутриклеточные сигнальные домены включают домены, происходящие из молекул, ответственных за первичную стимуляцию или антигензависимую стимуляцию. В одном варианте осуществления внутриклеточный сигнальный домен может содержать костисмулирующий внутриклеточный домен. Иллюстративные костимулирующие внутриклеточные сигнальные домены включают домены, происходящие из молекул, ответственных за костисмулирующие сигналы или антиген-независимую стимуляцию. Например, в случае CART первичный внутриклеточный сигнальный домен может содержать цитоплазматическую последовательность T-клеточного рецептора, и костимулирующий внутриклеточный сигнальный домен может содержать цитоплазматическую последовательность из корецептора или костимулирующей молекулы.
[00220] Первичный внутриклеточный сигнальный домен может содержать сигнальный мотив, который известен как иммунорецепторный тирозиновый активирующий мотив или ITAM. Примеры содержащих ITAM первичных цитоплазматических сигнальных последовательностей включают, но не ограничиваются ими, последовательности, происходящие из CD3-зета, общего FcR-гамма (FCER1G), Fc-гамма RIIa, FcR-бета (Fc-эпсилон R1b), CD3-гамма, CD3-дельта, CD3-эпсилон, CD79a, CD79b, DAP10 и DAP12.
[00221] Термин "зета" или альтернативно "зета-цепь", "CD3-зета" или "TCR-зета" определяют как белок, представленный под номером доступа GenBan № BAG36664.1, или эквивалентные остатки из не являющегося человеком вида, например, мыши, грызуна, обезьяны, и т.п., и "зета-стимулирующий домен" или альтернативно "стимулирующий домен CD3-зета" или "стимулирующий домен TCR-зета" определяют как аминокислотные остатки из цитоплазматического домена зета-цепи или их функциональные производные, которые являются достаточными для функциональной передачи первоначального сигнала, необходимого для активации T-клеток. В одном аспекте цитоплазматический домен зета-цепи содержит остатки с 52 по 164 последовательности с номером доступа GenBank № BAG36664.1 или эквивалентные остатки из не являющегося человеком вида, например, мыши, грызуна, мартышки, человекообразной обезьяны и т.п., которые являются их функциональными ортологами. В одном аспекте "зета-стимулирующий домен" или "стимулирующий домен CD3-зета" представляет собой последовательность, предоставленную в качестве SEQ ID NO: 17. В одном аспекте "зета-стимулирующий домен" или "стимулирующий домен CD3-зета" представляет собой последовательность, предоставленную в качестве SEQ ID NO: 43.
[00222] Термин "костимулирующая молекула" относится к распознающему связывающему партнеру на T-клетке, который специфически связывается с костимулирующим лигандом, тем самым, опосредуя костимулирующий ответ T-клеткой, такой как, но не ограничиваясь ими, пролиферация. Костимулирующие молекулы представляют собой молекулы клеточной поверхности, отличные от рецепторов антигенов или их лигандов, которые вносят вклад в эффективный иммунный ответ. Костимулирующие молекулы включают, но не ограничиваются ими, молекулу MHC класса I, BTLA и рецептор Toll-лиганда, а также OX40, CD27, CD28, CDS, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278) и 4-1BB (CD137). Следующие примеры таких костимулирующих молекул включают CDS, ICAM-1, GITR, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганд, который специфически связывается с CD83.
[00223] Костимулирующий внутриклеточный сигнальный домен может представлять собой внутриклеточную часть костимулирующей молекулы. Костимулирующая молекула может принадлежать одному из следующих семейств белков: белки-рецепторы TNF, иммуноглобулин-подобные белки, рецепторы цитокинов, интегрины, сигнальные молекулы активации лимфоцитов (белки SLAM) и активирующие рецепторы NK-клеток. Примеры таких молекул включают CD27, CD28, 4-1BB (CD137), OX40, GITR, CD30, CD40, ICOS, BAFFR, HVEM, ICAM-1, ассоциированный с функцией лимфоцитов антиген 1 (LFA-1), CD2, CDS, CD7, CD287, LIGHT, NKG2C, NKG2D, SLAMF7, NKp80, NKp30, NKp44, NKp46, CD160, B7-H3 и лиганд, который специфически связывается с CD83, и т.п.
[00224] Внутриклеточный сигнальный домен может содержать всю внутриклеточную часть или весь нативный внутриклеточный сигнальный домен молекулы, из которой он происходит, или его функциональный фрагмент или производное.
[00225] Термин "4-1BB" относится к представителю суперсемейства TNFR с аминокислотной последовательностью, представленной в качестве последовательности с номером доступа GenBank № AAA62478.2, или эквивалентными остатками из не являющегося человеком вида, например, мыши, грызуна, мартышки, человекообразной обезьяны и т.п; и "костимулирующий домен 4-1BB" определяют как аминокислотные остатки 214-255 последовательности с номером доступа GenBank № AAA62478.2, или эквивалентные остатки из не являющегося человеком вида, например, мыши, грызуна, мартышки, человекообразной обезьяны и т.п. В одном аспекте "костимулирующий домен 4-1BB" представляет собой последовательность, представленную в качестве SEQ ID NO: 7, или эквивалентные остатки из не являющегося человеком вида, например, мыши, грызуна, мартышки, человекообразной обезьяны и т.п.
[00226] "Иммунная эффекторная клетка", как этот термин используют в настоящем описании, относится к клетке, которая вовлечена в иммунный ответ, например, в стимуляцию ответа иммунных эффекторных клеток. Примеры иммунных эффекторных клеток включают T-клетки, например, альфа/бета T-клетки и гамма/дельта T-клетки, B-клетки, натуральные киллеры (NK), натуральные киллерные T-клетки (NKT), тучные клетки и фагоциты миелоидного происхождения.
[00227] "Иммунная эффекторная функция или иммунный эффекторный ответ", как этот термин используют в настоящем описании, относится к функции или ответу, например, иммунной эффекторной клетки, которые усиливают или стимулируют иммунную атаку на клетку-мишень. Например, иммунная эффекторная функция или ответ относятся к свойству T-клеток или NK-клеток, которое стимулирует уничтожение или ингибирование роста или пролиферации клетки-мишени. В случае T-клетки, первичная стимуляция и костимуляция являются примерами иммунной эффекторной функции или ответа.
[00228] Термин "кодирующий" относится к свойству, присущему конкретным последовательностям нуклеотидов в полинуклеотиде, таком как ген, кДНК или мРНК, выступать в качестве матрицы для синтеза других полимеров и макромолекул в биологических процессах, имеющих либо определенную последовательность нуклеотидов (например, рРНК, тРНК и мРНК), либо определенную последовательность аминокислот, и к биологическим свойствам, являющимся следствием этого свойства. Таким образом, ген, кДНК или РНК, кодирует белок, если транскрипция и трансляция мРНК, соответствующей этому гену, продуцирует белок в клетке или другой биологической системе. Как кодирующая цепь, нуклеотидная последовательность которой идентична последовательности мРНК и обычно предоставляется в списках последовательностей, так и некодирующая цепь, используемая в качестве матрицы для транскрипции гена или кДНК, могут упоминаться как кодирующие белок или другой продукт этого гена или кДНК.
[00229] Если нет иных указаний, "нуклеотидная последовательность, кодирующая аминокислотную последовательность," включает все нуклеотидные последовательности, которые являются вырожденными версиями друг друга и которые кодируют одну и ту же аминокислотную последовательность. Выражение нуклеотидная последовательность, которая кодирует белок или РНК, также может включать интроны, поскольку нуклеотидная последовательность, кодирующая белок, может в некоторой версии содержать интрон(ы).
[00230] Термины "эффективное количество" или "терапевтически эффективное количество" используют в настоящем описании взаимозаменяемо, и они относятся к количеству соединения, состава, материала или композиции, как описано в настоящем описании, эффективному для достижения конкретного биологического результата.
[00231] Термин "эндогенный" относится к любому материалу из или продуцируемому внутри организма, клетки, ткани или системы.
[00232] Термин "экзогенный" относится к любому материалу, внесенному извне или продуцированному вне организма, клетки, ткани или системы.
[00233] Термин "экспрессия" относится к транскрипции и/или трансляции конкретной нуклеотидной последовательности, запускаемой промотором.
[00234] Термин "вектор для переноса" относится к композиции, которая содержит выделенную нуклеиновую кислоту и которую можно использовать для доставки выделенной нуклеиновой кислоты внутрь клетки. В данной области известны многочисленные векторы, включая, но не ограничиваясь ими, линейные полинуклеотиды, полинуклеотиды, ассоциированные с ионными или амфифильными соединениями, плазмиды и вирусы. Таким образом, термин "вектор для переноса" включает автономно реплицирующуюся плазмиду или вирус. Термин также следует истолковывать как дополнительно включающий неплазмидные и невирусные соединения, которые облегчают перенос нуклеиновой кислоты в клетки, такие как, например, соединение полилизина, липосома и т.п. Примеры вирусных векторов для переноса включают, но не ограничиваются ими, аденовирусные векторы, векторы на основе аденоассоциированного вируса, ретровирусные векторы, лентивирусные векторы и т.п.
[00235] Термин "экспрессирующий вектор" относится к вектору, содержащему рекомбинантный полинуклеотид, содержащий последовательности контроля экспрессии, функционально связанные с нуклеотидной последовательностью, подлежащей экспрессии. Экспрессирующий вектор содержит достаточное количество цис-регуляторных элементов для экспрессии; другие элементы для экспрессии могут быть предоставлены клеткой-хозяином или экспрессирующей системой in vitro. Экспрессирующие векторы включают векторы, известные в данной области, включая космиды, плазмиды (например, голые или содержащиеся в липосомах) и вирусы (например, лентивирусы, ретровирусы, аденовирусы и аденоассоциированные вирусы), которые включают рекомбинантный полинуклеотид.
[00236] Термин "лентивирус" относится к роду семейства Retroviridae. Лентивирусы являются уникальными среди ретровирусов, поскольку они способны инфицировать неделящиеся клетки; они могут доставлять значительное количество генетической информации в ДНК клетки-хозяина, так что они являются одним из наиболее эффективных способов доставки вектора с геном. Примерами лентивирусов являются ВИЧ, SIV и FIV.
[00237] Термин "лентивирусный вектор" относится к вектору, происходящему по меньшей мере из части генома лентивируса, включая, а частности, самоинактивирующийся лентивирусный вектор, представленный в Milone et al., Mol. Ther. 17(8): 1453-1464 (2009). Другие примеры лентивирусных векторов, которые можно использовать в клинике, включают, но не ограничиваются ими, например, технологию доставки генов LENTIVECTOR® от Oxford BioMedica, векторную систему LENTIMAXTM от Lentigen и т.п. Также доступны неклинические типы лентивирусных векторов, и они известны специалисту в данной области.
[00238] Термин "гомологичный" или "идентичность" относится к идентичности последовательности субъединиц между двумя полимерными молекулами, например, между двумя молекулами нуклеиновых кислот, таких как две молекулы ДНК или две молекулы РНК, или между двумя полипептидными молекулами. Если положение субъединицы в обеих из двух молекул занимает одна та же мономерная субъединица, например, если положение в каждой из двух молекул ДНК занимает аденин, тогда они являются гомологичными или идентичными в этом положении. Гомология между двумя последовательностями является прямой функцией количества совпадающих или гомологичных положений; например, если половина (например, пять положений в полимере длиной десять субъединиц) из положений в двух последовательностях являются гомологичными, тогда две последовательности являются на 50% гомологичными; если 90% положений (например, 9 из 10) совпадают или гомологичны, тогда две последовательности являются на 90% гомологичными.
[00239] "Гуманизированные" формы не являющихся человеческими антител (например, мыши) представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие связывающие антиген подпоследовательности антител), которые содержат минимальную последовательность, происходящую из не являющегося человеческим иммуноглобулина. В основном гуманизированные антитела и их фрагменты представляют собой иммуноглобулины человека (реципиентное антитело или фрагмент антитела), в которых остатки из определяющей комплементарность области (CDR) реципиента заменены остатками из CDR не являющегося человеком вида (донорное антитело), такого как мышь, крыса или кролик, имеющими желаемую специфичность, аффинность и емкость. В некоторых случаях остатки каркасной области Fv (FR) иммуноглобулина человека заменены соответствующими не являющимися человеческими остатками. Более того, гуманизированное антитело/фрагмент антитела может содержать остатки, которые не встречаются ни в реципиентном антителе, ни в импортированных последовательностях CDR или каркасной области. Эти модификации могут далее усовершенствовать и оптимизировать эффективность антитела или фрагмента антитела. Как правило, гуманизированное антитело или его фрагмент содержат по существу весь по меньшей мере один, и, как правило, два, вариабельных домена, в которых все или по существу все из областей CDR соответствуют областям CDR не являющегося человеческим иммуноглобулина и все или значительная часть областей FR представляют собой области FR из последовательности иммуноглобулина человека. Гуманизированное антитело или фрагмент антитела также могут содержать по меньшей мере часть константной области (Fc) иммуноглобулина, как правило, иммуноглобулина человека. Для более подробного описания, см. Jones et al., Nature, 321: 522-525, 1986; Reichmann et al., Nature, 332: 323-329, 1988; Presta, Curr. Op. Struct. Biol., 2: 593-596, 1992.
[00240] "Полностью человеческий" относится к иммуноглобулину, такому как антитело или фрагмент антитела, где вся молекула происходит из человека и состоит из аминокислотной последовательности, идентичной человеческой форме антитела или иммуноглобулина.
[00241] Термин "выделенный" означает измененный или извлеченный относительно природного состояния. Например, нуклеиновая кислота или пептид, естественным образом присутствующие в живом животном, не являются "выделенными", но те же нуклеиновая кислота или пептид, частично или полностью отделенные от сосуществующих с ними материалов природного состояния, являются "выделенными". Выделенная нуклеиновая кислота или белок могут существовать в по существу очищенной форме или могут существовать в ненативной среде, например, такой как клетка-хозяин.
[00242] В контексте настоящего изобретения используют следующие сокращения для обычно встречающихся оснований нуклеиновой кислоты. "A" относится к аденозину, "C" относится к цитозину, "G" относится к гуанозину, "T" относится к тимидину и "U" относится к уридину.
[00243] Термин "функционально связанный" или "контроль транскрипции" относится к функциональной связи между регуляторной последовательностью и гетерологичной последовательностью нуклеиновой кислоты, приводящей к экспрессии последней. Например, первая последовательность нуклеиновой кислоты функционально связана со второй последовательностью нуклеиновой кислоты, когда первая последовательность нуклеиновой кислоты находится в функциональной взаимосвязи со второй последовательностью нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью, если промотор влияет на транскрипцию или экспрессию кодирующей последовательности. Функционально связанные последовательности ДНК могут быть смежными друг с другом и, например, когда необходимо связать две кодирующих белок области, находится в одной рамке считывания.
[00244] Термин "парентеральное" введение иммуногенной композиции включает, например, подкожную (п/к), внутривенную (в/в), внутримышечную (в/м) или проводимую внутрь очага повреждения инъекцию, внутриопухолевое введение или способы инфузии.
[00245] Термины "нуклеиновая кислота" или "полинуклеотид" относятся к дезоксирибонуклеиновым кислотам (ДНК) или рибонуклеиновым кислотам (РНК) и их полимерам либо в одноцепочечной, либо в двухцепочечной форме. Если конкретно не ограничено, термин охватывает нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, которые имеют сходные свойства связывания с эталонной нуклеиновой кислотой и метаболизируются аналогично встречающимся в природе нуклеотидам. Если нет иных указаний, конкретная последовательность нуклеиновой кислоты также косвенно охватывает ее консервативно модифицированные варианты (например, вырожденные замены кодонов), аллели, ортологи, SNP и комплементарные последовательности, а также последовательность, прямо указанную. В частности, вырожденные замены кодонов можно осуществлять путем получения последовательностей, в которых третье положение одного или нескольких выбранных (или всех) кодонов замещено смешанными остатками и/или остатками дезоксиинозина (Batzer et al., Нуклеиновая кислота Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605-2608 (1985); и Rossolini et al., Mol. Cell. Probes 8:91-98 (1994)).
[00246] Термины "пептид," "полипептид" и "белок" используют взаимозаменяемо, и они относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должны содержать по меньшей мере две аминокислоты, и отсутствует ограничение на максимальное количество аминокислот, которые могут содержаться в последовательности белка или пептида. Полипептиды включают любой пептид или белок, содержащие две или более аминокислот, связанных друг с другом пептидными связями. Как используют в рамках изобретения, термин относится к как коротким цепям, которые также обычно называют в данной области, например, пептидами, олигопептидами и олигомерами, так и к более длинным цепям, которые обычно называют в данной области белками, для которых существует множество типов. "Полипептиды" включают, например, биологически активные фрагменты, по существу гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитые белки, среди прочих. Полипептид включает природный пептид, рекомбинантный пептид или их комбинацию.
[00247] Термин "промотор" относится к последовательности ДНК, распознаваемой синтетическим аппаратом клетки или введенным синтетическим аппаратом, которая требуется для инициации транскрипции полинуклеотидной последовательности.
[00248] Термин "промоторная/регуляторная последовательность" относится к последовательности нуклеиновой кислоты, которая требуется для экспрессии продукта гена, функционально связанного с промоторной/регуляторной последовательностью. В некоторых случаях эта последовательность может представлять собой основную промоторную последовательность и в других случаях эта последовательность также может включать энхансерную последовательность и другие регуляторные элементы, которые требуются для экспрессии продукта гена. Промоторная/регуляторная последовательность, например, может представлять собой последовательность, которая экспрессирует продукт гена тканеспецифическим образом.
[00249] Термин "конститутивный" промотор относится к нуклеотидной последовательности, которая, когда она функционально связана с полинуклеотидом, который кодирует или определяет продукт гена, вызывает продукцию продукта гена в клетке при большинстве или всех физиологических условиях в клетке.
[00250] Термин "индуцибельный" промотор относится к нуклеотидной последовательности, которая, когда она функционально связана с полинуклеотидом, который кодирует или определяет продукт гена, обеспечивает продукцию продукта гена в клетке, по существу только когда индуктор, который соответствует промотору, присутствует в клетке.
[00251] Термин "тканеспецифический" промотор относится к нуклеотидной последовательности, которая, когда она функционально связана с полинуклеотидом, который кодирует или определяет продукт гена, обеспечивает продукцию продукта гена в клетке, по существу только если клетка представляет собой клетку типа ткани, соответствующего промотору.
[00252] Термины "гибкий полипептидный линкер" или "линкер", как используют в контексте scFv, относится к пептидному линкеру, который состоит из аминокислот, таких как остатки глицина и/или серина, используемых отдельно или в комбинации, для связывания вариабельной области тяжелой цепи и вариабельной области легкой цепи вместе. В одном варианте осуществления гибкий полипептидный линкер представляет собой линкер Gly/Ser, и он содержит аминокислотную последовательность (Gly-Gly-Gly-Ser)n, где n представляет собой положительное целое число, равное или превышающее 1. Например, n=1, n=2, n=3, n=4, n=5 и n=6, n=7, n=8, n=9 и n=10 (SEQ ID NO: 105). В одном варианте осуществления гибкие полипептидные линкеры включают, но не ограничиваются ими, (Gly4 Ser)4 (SEQ ID NO: 106) или (Gly4 Ser)3 (SEQ ID NO: 107). В другом варианте осуществления линкеры включают множество повторов (Gly2Ser), (GlySer) или (Gly3Ser) (SEQ ID NO: 108). Также в объем изобретения входят линкеры, описанные в WO2012/138475, включенной в настоящее описание в качестве ссылки).
[00253] Как используют в рамках изобретения, 5'-кэп (также называемый РНК-кэпом, 7-метилгуанозиновым кэпом РНК или m7G-кэпом РНК) представляет собой модифицированный гуаниновый нуклеотид, который добавляется "спереди" или на 5'-конце эукариотической матричной РНК вскоре после начала транскрипции. 5'-кэп состоит из концевой группы, которая связана с первым транскрибируемым нуклеотидом. Его присутствие является важным для распознавания рибосомой и защиты от РНКаз. Присоединение кэпа сопряжено с транскрипцией и происходит котранскрипционно, так что каждое из этих событий влияет на другое из них. Вскоре после начала транскрипции 5'-конец синтезируемой мРНК связывается синтезирующим кэп комплексом, ассоциированным с РНК-полимеразой. Этот ферментативный комплекс катализирует химические реакции, которые требуются для кэпирования мРНК. Синтез протекает в качестве многостадийной биохимической реакции. Кэпирующую часть можно модифицировать для модулирования функциональности мРНК, такой как ее стабильность или эффективность трансляции.
[00254] Как используют в рамках изобретения, "транскрибированная in vitro РНК" относится к РНК, предпочтительно мРНК, синтезированной in vitro. Как правило, транскрибированную in vitro РНК получают с помощью вектора для транскрипции in vitro. Вектор для транскрипции in vitro содержит матрицу, которую используют для получения транскрибированной РНК in vitro.
[00255] Как используют в рамках изобретения, "поли(A)" представляет собой последовательность остатков аденозина, присоединенную путем полиаденилирования мРНК. В предпочтительном варианте осуществления конструкции для временной экспрессии поли-A имеют от 50 до 5000 (SEQ ID NO: 109), предпочтительно более 64, более предпочтительно более 100, наиболее предпочтительно более 300 или 400 оснований. Последовательности поли(A) можно модифицировать химически или ферментативно для модулирования функциональности мРНК, такой как локализация, стабильность или эффективность трансляции.
[00256] Как используют в рамках изобретения, "полиаденилирование" относится к ковалентному присоединению полиаденилильной части или ее модифицированного варианта к молекуле матричной РНК. В эукариотических организмах большинство молекул матричной РНК (мРНК) являются полиаденилированными на 3'-конце. 3'-поли(A)-хвостовая часть представляет собой длинную последовательность адениновых нуклеотидов (часто несколько сотен), присоединяемую к пре-мРНК под действием фермента полиаденилатполимеразы. У высших эукариот поли(A)-хвостовая часть присоединяется к транскриптам, которые содержат конкретную последовательность - сигнал полиаденилирования. Поли(A)-хвостовая часть и белок, связывающийся с ней, способствуют защите мРНК от деградации экзонуклеазами. Полиаденилирование также является важным для терминации транскрипции, экспорта мРНК из ядра и трансляции. Полиаденилирование происходит в ядре непосредственно после транскрипции ДНК в РНК, но, кроме того, также оно происходит позднее в цитоплазме. После завершения транскриции цепь мРНК отщепляется под действием эндонуклеазного комплекса, ассоциированного с РНК-полимеразой. Участок расщепления обычно характеризуется последовательностью оснований AAUAAA вблизи участка расщепления. После отщепления мРНК остатки аденозина являются связанными со свободным 3'-концом участка расщепления.
[00257] Как используют в рамках изобретения, "временный" относится к экспрессии невстроенного трансгена в течение периода, составляющего несколько часов, суток или недель, где период экспрессии является меньшим, чем период экспрессии гена, если он встроен в геном или содержится в стабильном плазмидном репликоне в клетке-хозяине.
[00258] Термин "каскад передачи сигнала" относится к биохимической взаимосвязи между различными молекулами передачи сигнала, которые играют роль в передачи сигнала из одной части клетки в другую часть клетки. Выражение "рецептор клеточной поверхности" включает молекулы и комплексы молекул, способные получать сигнал и передавать сигнал через мембрану клетки.
[00259] Термин "индивидуум" включает живые организмы, у которых может быть индуцирован иммунный ответ (например, млекопитающие, человек).
[00260] Термин "по существу очищенная" клетка относится к клетке, которая по существу свободна от других типов клеток. По существу очищенная клетка также относится к клетке, которая отделена от других типов клеток, с которыми она обычно ассоциирована в ее природном состоянии. В некоторых случаях популяция по существу очищенных клеток относится к гомогенной популяции клеток. В других случаях этот термин относится просто к клетке, которая отделена от клеток, с которыми она ассоциирована в ее природном состоянии. В некоторых аспектах клетки культивируют in vitro. В других аспектах клетки не культивируют in vitro.
[00261] Термин "терапевтический", как используют в рамках изобретения, означает лечение. Терапевтический эффект достигают путем снижения, подавления, обеспечения ремиссии или устранения болезненного состояния.
[00262] Термин "профилактика", как используют в рамках изобретения, означает предупреждение или защитное лечение от заболевания или болезненного состояния.
[00263] В контексте настоящего изобретения "опухолевый антиген", или "антиген гиперпролиферативного нарушения", или "антиген, ассоциированный с гиперпролиферативным нарушением", относится к антигенам, которые являются общими для конкретных гиперпролиферативных нарушений. В некоторых аспектах антигены гиперпролиферативного нарушения по настоящему изобретению происходят из злокачественных опухолей, включая, но не ограничиваясь ими первичную или метастазирующую меланомe, тимому, лимфому, саркому, рак легкого, рак печени, неходжкинскую лимфому, лимфому Ходжкина, лейкозы, рак тела матки, рак шейки матки, рак мочевого пузыря, рак почки и аденокарциномы, такие как рак молочной железы, рак предстательной железы, рак яичника, рак поджелудочной железы и т.п.
[00264] Термины "трансфицированный", или "трансформированный", или "трансдуцированный" относятся к процессу, посредством которого экзогенная нуклеиновая кислота переносится или вводится в клетку-хозяина. "Трансфицированная", или "трансформированная", или "трансдуцированная" клетка представляет собой клетку, которая трансфицирована, трансформирована или трансдуцирована экзогенной нуклеиновой кислотой. Клетка включает первичную клетку индивидуума и ее потомство.
[00265] Термин "специфически связывается" относится к антителу или лиганду, которые распознают и связываются с белком-партнером по связыванию (например, стимулирующим опухолевым антигеном), присутствующем в образце, но при этом эти антитело или лиганд по существу не распознают или не связывают другие молекулы в образце.
[00266] "Регулируемый химерный рецептор антигена (RCAR)" как этот термин используют в настоящем описании, относится к набору полипептидов, как правило, двум в наиболее простых вариантах осуществления, которые, когда он находится в клетке RCARX, обеспечивает специфичность клетке RCARX в отношении клетки-мишени, как правило, злокачественной клетке, и регулируемое генерирование внутриклеточного сигнала или пролиферацию, которые могут оптимизировать иммунное эффекторное свойство клетки RCARX. Клетка RCARX основана по меньшей мере частично, на антигенсвязывающем домене для обеспечения специфичности в отношении клетки-мишени, которая содержит антиген, связываемый антигенсвязывающим доменом. В одном варианте осуществления RCAR включает переключатель димеризации, который в присутствии молекулы димеризации может связывать внутриклеточный сигнальный домен с антигенсвязывающим доменом.
[00267] "Мембранный якорь" или "связывающий с мембраной домен", как этот термин используют в настоящем описании, относится к полипептиду или части, например, миристоильной группе, достаточным для заякоривания внеклеточного или внутриклеточного домена на плазматической мембране.
[00268] "Домен переключения", как этот термин используют в настоящем описании, например, при указании на RCAR, относится к структуре, как правило, структуре на основе полипептида, которая в присутствии молекулы димеризации ассоциирует с другим доменом переключения. Эта ассоциация приводит к функциональному связыванию первой структуры, связанной, например, слитой, с первым доменом переключения, и второй структуры, связанной, например слитой, со вторым доменом переключения. Первый и второй домены переключения в совокупности называют в настоящем описании переключателями димеризации. В вариантах осуществления первый и второй домены переключения являются одинаковыми, например, они представляют собой полипептиды, имеющие одинаковую первичную аминокислотную последовательность, и их в совокупности называют переключателями гомодимеризации. В вариантах осуществления первый и второй домены переключения отличаются друг от друга, например, они представляют собой полипептиды, имеющие отличающиеся первичные аминокислотные последовательности, и их в совокупности называют переключателями гетеродимеризации. В вариантах осуществления переключение является внутриклеточным. В вариантах осуществления переключение является внеклеточным. В вариантах осуществления домен переключения представляет собой структуру на основе полипептида, например, на основе FKBP или FRB, и молекула димеризации представляет собой низкомолекулярное соединение, например, рапалог. В вариантах осуществления домен переключения представляет собой структуру на основе полипептида, например, scFv, который связывает пептид myc, и молекула димеризации представляет собой полипептид, его фрагмент или мультимер полипептида, например, myc-лиганд или мультимеры myc-лиганда, которые связываются с одним или несколькими scFv к myc. В вариантах осуществления домен переключения представляет собой структуру на основе полипептида, например, рецептор myc, и молекула димеризации представляет собой антитело или его фрагменты, например, антитело против myc.
[00269] "Молекула димеризации", как этот термин используют в настоящем описании, например, при указании на RCAR, относится к молекуле, которая обеспечивает ассоциацию первого домена переключения со вторым доменом переключения. В вариантах осуществления молекула димеризации не является встречающейся в природе у индивидуума или не встречается в концентрациях, которые привели бы к значительной димеризации. В вариантах осуществления молекула димеризации представляет собой низкомолекулярное соединение, например, рапамицин или рапалог, например, RAD001.
[00270] Термин "биоэквивалент" относится к количеству средства, отличного от эталонного соединения (например, RAD001), требуемому для обеспечения эффекта, эквивалентного эффекту, обеспечиваемому эталонной дозой или эталонным количеством эталонного соединения (например, RAD001). В одном варианте осуществления эффект представляет собой уровень ингибирования mTOR, например, при измерении по ингибированию киназы P70 S6, например, при оценке в анализе in vivo или in vitro, например, при измерении с использованием анализа, описанного в настоящем описании, например, анализа Boulay или измерения уровней фосфорилированной S6 с использованием вестер-блоттинга. В одном варианте осуществления эффект представляет собой изменение соотношения положительные по PD-1/отрицательные по PD-1 T-клетки при измерении посредством сортировки клеток. В одном варианте осуществления биоэквивалентное количество или доза ингибитора mTOR представляют собой количество или дозу, которые достигают того же уровня ингибирования киназы P70 S6, что и эталонная доза или эталонное количество эталонного соединения. В одном варианте осуществления биоэквивалентное количество или доза ингибитора mTOR представляют собой количество или дозу, которые достигают того же уровня изменения соотношения положительные по PD-1/отрицательные по PD-1 T-клетки, как и эталонная доза или эталонное количество эталонного соединения.
[00271] Термин "низкая усиливающая иммунитет доза", когда его используют применительно к ингибитору mTOR, например, аллостерическому ингибитору mTOR, например, RAD001 или рапамицину, или каталитическому ингибитору mTOR, относится к дозе ингибитора mTOR, которая частично, но не полностью ингибирует активность mTOR, например, при измерении по ингибированию активности киназы P70 S6. Способы оценки активности mTOR, например, по ингибированию киназы P70 S6, описаны в настоящем описании. Доза является недостаточной для обеспечения полного подавления иммунного ответа, но является достаточной для усиления иммунного ответа. В одном варианте осуществления низкая усиливающая иммунитет доза ингибитора mTOR приводит к уменьшению количества положительных по PD-1 T-клеток и/или увеличению количества отрицательных по PD-1 T-клеток, или к увеличению соотношения отрицательные по PD-1 T-клетки/положительные по PD-1 T-клетки. В одном варианте осуществления низкая усиливающая иммунитет доза ингибитора mTOR приводит к увеличению количества наивных T-клеток. В одном варианте осуществления низкая усиливающая иммунитет доза ингибитора mTOR приводит к одному или нескольким из следующих:
увеличение экспрессии одного или нескольких из следующих маркеров: CD62Lhigh, CD127high, CD27+ и BCL2, например, на T-клетках памяти, например, предшественниках T-клеток памяти;
снижение экспрессии KLRG1, например, на T-клетках памяти, например, предшественниках T-клеток памяти; и
увеличение количества предшественников T-клеток памяти, например, клеток с любой или комбинацией из следующих характеристик: увеличенный уровень CD62Lhigh, увеличенный уровень CD127high, увеличенный уровень CD27+, сниженный уровень KLRG1 и увеличенный уровень BCL2;
где любое из описанных выше изменений происходит, например, по меньшей мере временно, например, по сравнению с индивидуумом без лечения.
[00272] "Рефрактерный", как используют в рамках изобретения, относится к заболеванию, например, злокачественной опухоли, которое не отвечает на лечение. В вариантах осуществления рефрактерная злокачественная опухоль может быть устойчивой к лечению до или в начале лечения. В других вариантах осуществления рефрактерная злокачественная опухоль может стать рефрактерной в процессе лечения.
[00273] "Полностью отвечающий", как используют в рамках изобретения, относится к индивидууму, имеющему заболевание, например, злокачественную опухоль, который проявляет полный ответ на лечение, например, полную ремиссию. Полный ответ можно идентифицировать, например, с использованием критериев Cheson, как описано в настоящем описании.
[00274] "Частично отвечающий", как используют в рамках изобретения, относится к индивидууму, имеющему заболевание, например, злокачественную опухоль, который проявляет частичный ответ на лечение, например, частичную ремиссию. Частичный ответ можно идентифицировать, например, с использованием критериев Cheson.
[00275] "Неотвечающий", как используют в рамках изобретения, относится к индивидууму, имеющему заболевание, например, злокачественную опухоль, который не проявляет ответ на лечение, например, пациент имеет стабильное заболевание или прогрессирующее заболевание. Неотвечающего индивидуума можно идентифицировать, например, с использованием критериев Cheson, как описано в настоящем описании.
[00276] Термин "рецидив", как используют в рамках изобретения, относится к повторному возникновению заболевания (например, злокачественной опухоли) после первоначального периода ответа (например, полного ответа или частичного ответа). Первоначальный период ответа может вовлекать уровень злокачественных клеток, падающий ниже определенного порога, например, ниже 20%, 1%, 10%, 5%, 4%, 3%, 2% или 1%. Повторное возникновение может вовлекать уровень злокачественных клеток, достигающий величины выше определенного порогового уровня, например, выше 20%, 1%, 10%, 5%, 4%, 3%, 2% или 1%. Рецидив можно идентифицировать, например, с использованием критериев Cheson, как описано в настоящем описании.
[00277] Диапазоны: на протяжении настоящего описания различные аспекты изобретения могут быть представлены в формате диапазонов. Следует понимать, что описание в формате диапазонов предоставлено только для удобства и краткости, и его не следует истолковывать как строгое ограничение объема изобретения. Таким образом, описание диапазона следует считать имеющим конкретно описанные все возможные числовые поддиапазоны, а также индивидуальные числовые величины в этом диапазоне. Например, описание диапазона, такого как от 1 до 6, следует истолковывать как диапазон, имеющий конкретно описанные поддиапазоны, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д., а также индивидуальные числа в этом диапазоне, например, 1, 2, 2,7, 3, 4, 5, 5,3 и 6. В качестве другого примера диапазон, такой как идентичность 95-99%, включает что-либо с 95%, 96%, 97%, 98% или 99% идентичностью и включает поддиапазоны, такие как идентичность 96-99%, 96-98%, 96-97%, 97-99%, 97-98% и 98-99%. Это применимо независимо от ширины диапазона.
Описание
[00278] В рамках настоящего изобретения предусматриваются композиции и способы применения для лечения заболевания, такого как злокачественная опухоль (например, гематологические злокачественные опухоли и другие B-клеточные злокачественные опухоли) с использованием иммунных эффекторных клеток (например, T-клеток или NK-клеток), которые экспрессируют химерный рецептор антигена (CAR) (например, CAR, который нацелен на B-клеточный маркер, такой как CD19). Способы включают, среди прочих, введение иммунных эффекторных клеток (например, T-клеток или NK-клеток), экспрессирующих нацеленный на B-клетки CAR, описанный в настоящем описании, в комбинации с другие средством, таким как ингибитор киназы, например, ингибитор киназы, описанный в настоящем описании.
[00279] Настоящее изобретение относится, по меньшей мере частично, к экспериментам, подтверждающим высокую эффективность комбинации терапии CAR (например, нацеленная на B-клетки терапия CAR) и ингибитора киназы, например, ингибитора BTK, такого как ибрутиниб. Комбинация ингибитора киназы, например, ингибитора BTK, такого как ибрутиниб, с терапией CAR может увеличить эффективность комбинированной терапии относительно монотерапии ингибитором киназы, или дозой CAR-экспрессирующих клеток, или и тем, и другим. Эти благоприятные эффекты могут, например, обеспечить более низкую дозу ингибитора киназы или CAR-экспрессирующих клеток, или и тех, и других, при сохранении эффективности. Результаты, описанные в настоящем описании, применимы к широкому диапазону злокачественных опухолей, например, к гематологическим злокачественным опухолям и другим B-клеточным новообразованиям. Например, ибрутиниб ингибирует BTK, уровень которой повышен при большинстве лимфом. Иммунная эффекторная клетка (например, T-клетка или NK-клетка), которая экспрессирует CAR19, нацелена на злокачественные опухоли с поверхностной экспрессией CD19, который экспрессируется при большинстве B-клеточных новообразований. Альтернативно или в комбинации с CAR19, любой другой нацеленный на B-клетки CAR (например, CAR, нацеленный на один или несколько из: CD20, CD22 или ROR1) можно использовать в комбинированных способах терапии, описанных в настоящем описании. Таким образом, комбинация терапии CAR (например, одна или несколько из терапии CAR против CD19, CAR против CD20, CAR против CD22 или CAR против ROR1) с ингибитором BTK (например, ибрутиниб) пригодна для лечения широкого диапазона злокачественных опухолей, вовлекающих сверхпролиферацию B-клеток, включая лимфомы (например, лимфому Ходжкина), MCL, CLL, DLBCL и множественную миелому.
[00280] В соответствии с настоящим изобретением, ибрутиниб может уменьшать опухолевые массы и мобилизировать неопластические B-клетки в периферической крови (см., например, пример 8 настоящего описания). Без связи с теорией, определенные лимфомы, такие как MCL, характеризуются массами злокачественных клеток в пролиферативных центрах лимфатических узлов. Для CAR-экспрессирующих иммунных эффекторных клеток иногда может быть трудным проникновение через эти плотно упакованные массы. Таким образом, ингибитор BTK, такой как ибрутиниб, может уменьшать опухолевые массы и мобилизировать неопластические B-клетки в периферической крови, делая клетки лимфомы более уязвимыми для CAR-экспрессирующих клеток.
[00281] Альтернативно или в комбинации, ингибиторы BTK, такие как ибрутиниб, также могут влиять на CAR-экспрессирующие клетки. Настоящее изобретение демонстрирует, что лечение ибрутинибом увеличивает уровень циркулирующих CART19-клеток (см., например, данные, показанные в примере 8). Без связи с теорией, увеличение уровня циркулирующих CART19-клеток может быть результатом, например, увеличенной пролиферации, изменения T-клеточного фенотипа или других факторов. Например, ибрутиниб может ингибировать ITK, киназу, обладающую гомологией с BTK. ITK экспрессируется в T-клетках, и ее ингибирование может изменять фенотип T-клеток. Лечение ингибитором киназы, таким как ибрутиниб, может изменять фенотип T-клеток с фенотипа Th2 на фенотип Th1, и, таким образом, увеличивать пролиферативную способность T-клеток. Предварительное лечение или совместное ведение индивидууму ингибитора BTK может увеличить пролиферативную способность T-клеток у индивидуума, таким образом, повышая уровень циркулирующих CAR-экспрессирующих клеток. Кроме того, индивидуум, которого предварительно лечили ингибитором BTK, например, ибрутинибом, может иметь популяцию T-клеток с более высокой пролиферативной способностью при их аферезе для получения CAR.
[00282] В одном аспекте изобретение относится к ряду химерных рецепторов антигенов (CAR), содержащих антитело или фрагмент антитела, сконструированные для специфического связывания с B-клеточным антигеном (например, выбранным из одного или нескольких из белков CD19, CD20, CD22 или ROR1). В одном аспекте изобретение относится к клетке (например, T-клетке), модифицированной способами инженерии для экспрессии CAR, где CAR T-клетка ("CART") проявляет противораковое свойство. В одном аспекте клетка трансформирована CAR и CAR экспрессируется на поверхности клетки. В некоторых вариантах осуществления клетка (например, T-клетка) трансдуцирована вирусным вектором, кодирующим CAR. В некоторых вариантах осуществления вирусный вектор представляет собой ретровирусный вектор. В некоторых вариантах осуществления вирусный вектор представляет собой лентивирусный вектор. В некоторых таких вариантах осуществления клетка может стабильно экспрессировать CAR. В другом варианте осуществления клетка (например, T-клетка) трансфицирована нуклеиновой кислотой, например, мРНК, кДНК, ДНК, кодирующей CAR. В некоторых таких вариантах осуществления клетка может временно экспрессировать CAR.
[00283] В одном аспекте связывающая белок CD19 часть CAR представляет собой scFv-фрагмент антитела. В одном аспекте такие фрагменты антител являются функциональными, поскольку они сохраняют эквивалентную аффинность связывания, например, они связывают тот же антиген с аффинностью, сравнимой с IgG-антителом, из которого они происходят. В одном аспекте такие фрагменты антител являются функциональными, поскольку они обеспечивают биологический ответ, который может включать, но не ограничивается ими, активацию иммунного ответа, ингибирование индукции передачи сигнала от их антигена-мишени, ингибирование киназной активности и т.п., как будет понятно специалисту в данной области. В одном аспекте домен CAR, связывающий антиген CD19, представляет собой scFv-фрагмент антитела, который является человеческим или гуманизированным по сравнению с последовательностью мыши для scFv, из которого он происходит. В одном аспекте родительская последовательность scFv мыши представляет собой конструкцию CAR19, представленную в публикации PCT WO2012/079000 (включенной в настоящее описание в качестве ссылки) и она представлена в настоящем описании в качестве SEQ ID NO: 59. В одном варианте осуществления связывающий CD19 домен представляет собой scFv, описанный в WO2012/079000 и представленный в SEQ ID NO: 59.
[00284] В некоторых аспектах антитела по изобретению включены в химерный рецептор антигена (CAR). В одном аспекте CAR содержит полипептидную последовательность, представленную в качестве SEQ ID NO: 12 в публикации PCT WO2012/079000, и представленную в настоящем описании в качестве SEQ ID NO: 58, где scFv-домен заменен одной или несколькими последовательностями, выбранными из SEQ ID NO: 1-12. В одном аспекте scFv-домены SEQ ID NO: 1-12 представляют собой гуманизированные варианты scFv-домена SEQ ID NO: 59, который является фрагментом scFv, происходящим из мыши, который специфически связывается с CD19 человека. Гуманизация этого scFv мыши может быть желательной для клинических условий, где специфические остатки мыши могут индуцировать ответ человека против антигена мыши (HAMA) у пациентов, которым проводят лечение CART19, например, лечение T-клетками, трансдуцированными конструкцией CAR19.
[00285] В одном аспекте часть связывающего CD19 домена, например, гуманизированного scFv, в CAR по изобретению кодируется трансгеном, последовательность которого подвергнута оптимизации кодонов для экспрессии в клетке млекопитающего. В одном аспекте вся конструкция CAR по изобретению кодируется трансгеном, полная последовательность которого подвергнута оптимизации кодонов для экспрессии в клетке млекопитающего. Оптимизация кодонов относится к открытию, что частота встречаемости синонимичных кодонов (т.е. кодонов, которые кодируют одну и ту же аминокислоту) в кодирующей ДНК является смещенной в различных видах. Такая вырожденность кодонов позволяет кодирование идентичных полипептидов различными нуклеотидными последовательностями. Различные способы оптимизации кодонов известны в данной области и включают, например, способы, описанные по меньшей мере в патентах США под номерами 5786464 и 6114148.
[00286] В одном аспекте гуманизированный CAR19 содержит scFv-часть, представленную в SEQ ID NO: 1. В одном аспекте гуманизированный CAR19 содержит scFv-часть, представленную в SEQ ID NO: 2. В одном аспекте гуманизированный CAR19 содержит scFv-часть, представленную в SEQ ID NO: 3. В одном аспекте гуманизированный CAR19 содержит scFv-часть, представленную в SEQ ID NO: 4. В одном аспекте гуманизированный CAR19 содержит scFv-часть, представленную в SEQ ID NO: 5. В одном аспекте гуманизированный CAR19 содержит scFv-часть, представленную в SEQ ID NO: 6. В одном аспекте гуманизированный CAR19 содержит scFv-часть, представленную в SEQ ID NO: 7. В одном аспекте гуманизированный CAR19 содержит scFv-часть, представленную в SEQ ID NO: 8. В одном аспекте гуманизированный CAR19 содержит scFv-часть, представленную в SEQ ID NO: 9. В одном аспекте гуманизированный CAR19 содержит scFv-часть, представленную в SEQ ID NO: 10. В одном аспекте гуманизированный CAR19 содержит scFv-часть, представленную в SEQ ID NO: 11. В одном аспекте гуманизированный CAR19 содержит scFv-часть, представленную в SEQ ID NO: 12.
[00287] В одном аспекте в CAR по изобретению антигенсвязывающий домен специфического антитела комбинирован с внутриклеточной сигнальной молекулой. Например, в некоторых аспектах внутриклеточная сигнальная молекула включает, но не ограничивается ими, сигнальные модули цепи CD3-зета, 4-1BB и CD28 и их комбинации. В одном аспекте CAR против CD19 содержит CAR, выбранный из последовательности, представленной в качестве одной или нескольких из SEQ ID NO: 31 42. В одном аспекте CAR против CD19 содержит последовательность, представленную в SEQ ID NO: 31. В одном аспекте CAR против CD19 содержит последовательность, представленную в SEQ ID NO: 32. В одном аспекте CAR против CD19 содержит последовательность, представленную в SEQ ID NO: 33. В одном аспекте CAR против CD19 содержит последовательность, представленную в SEQ ID NO: 34. В одном аспекте CAR против CD19 содержит последовательность, представленную в SEQ ID NO: 35. В одном аспекте CAR против CD19 содержит последовательность, представленную в SEQ ID NO: 36. В одном аспекте CAR против CD19 содержит последовательность, представленную в SEQ ID NO: 37. В одном аспекте CAR против CD19 содержит последовательность, представленную в SEQ ID NO: 38. В одном аспекте CAR против CD19 содержит последовательность, представленную в SEQ ID NO: 39. В одном аспекте CAR против CD19 содержит последовательность, представленную в SEQ ID NO: 40. В одном аспекте CAR против CD19 содержит последовательность, представленную в SEQ ID NO: 41. В одном аспекте CAR против CD19 содержит последовательность, представленную в SEQ ID NO: 42.
[00288] Более того, настоящее изобретение относится к композициям CAR против CD19 и к их применению в лекарственных средствах или способах лечения, среди прочих заболеваний, злокачественной опухоли или любого новообразования, или аутоиммунных заболеваний, вовлекающих клетки или ткани, которые экспрессируют CD19.
[00289] В одном аспекте CAR по изобретению можно использовать для устранения экспрессирующих CD19 нормальных клеток, таким образом, он пригоден для применения в качестве терапии клеточного кондиционирования перед трансплантаций клеток. В одном аспекте экспрессирующая CD19 нормальная клетка представляет собой экспрессирующую CD19 нормальную стволовую клетку, и трансплантация клеток представляет собой трансплантацию стволовых клеток.
[00290] В одном аспекте изобретение относится к клетке (например, T-клетке), модифицированной способами инженерии для экспрессии химерного рецептора антигена (CAR), где CAR-экспрессирующая клетка, например, CAR T-клетка ("CART"), проявляется противораковое свойство. Предпочтительным антигеном является CD19. В одном аспекте антигенсвязывающий домен CAR содержит частично гуманизированный фрагмент антитела против CD19. В одном аспекте антигенсвязывающий домен CAR содержит частично гуманизированный фрагмент антитела против CD19, содержащий scFv. Таким образом, изобретение относится к CAR против CD19, который содержит гуманизированный связывающий CD19 домен и встроен способами инженерии в иммунную эффекторную клетку, например, T-клетку или NK-клетку, и к способам их применения для адоптивной терапии.
[00291] В одном аспекте CAR против CD19 содержит по меньшей мере один внутриклеточный домен, выбранный из группы из сигнального домена CD137 (4-1BB), сигнального домена CD28, сигнального домена CD3-зета, и любой их комбинации. В одном аспекте CAR против CD19 содержит по меньшей мере один внутриклеточный сигнальный домен из одной или нескольких костимулирующей молекулы(молекул), отличной от CD137 (4-1BB) или CD28.
Химерный рецептор антигена (CAR)
[00292] Настоящее изобретение относится к рекомбинантной конструкции ДНК, содержащей последовательности, кодирующие CAR, где CAR содержит антитело или фрагмент антитела, которые специфически связываются с B-клеточным антигеном (например, CD19, например, CD19 человека), где последовательность фрагмента антитела является соседней с последовательностью нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен, и находящейся в одной рамке считывания с ней. Внутриклеточный сигнальный домен может содержать костимулирующий сигнальный домен и/или первичный сигнальный домен, например, зета-цепь. Костимулирующий сигнальный домен относится к части CAR, содержащей по меньшей мере часть внутриклеточного домена костимулирующей молекулы. В одном варианте осуществления антигенсвязывающий домен представляет собой антитело или фрагмент антитела мыши, описанный в настоящем описании. В одном варианте осуществления антигенсвязывающий домен представляет собой гуманизированное антитело или фрагмент антитела.
[00293] В конкретных аспектах конструкция CAR по изобретению содержит scFv-домен, выбранный из группы, состоящей из SEQ ID NO: 1-12, или scFV-домен SEQ ID NO: 59, где scFv может предшествовать необязательная лидерная последовательность, такая как последовательность, представленная в SEQ ID NO: 13, и а ним может следовать необязательная шарнирная последовательность, такая как последовательность, представленная в SEQ ID NO: 14, или SEQ ID NO: 45, или SEQ ID NO: 47, или SEQ ID NO: 49, трансмембранная область, такая как последовательность, представленная в SEQ ID NO: 15, внутриклеточный сигнальный домен, который включает SEQ ID NO: 16 или SEQ ID NO: 51, и последовательность CD3-зета, которая включает SEQ ID NO: 17 или SEQ ID NO: 43, где домены являются соседними и находятся в одной рамке считывания для формирования слитого белка. Также изобретение относится к нуклеотидной последовательности, которая кодирует полипептид каждого из фрагментов scFv, выбранных из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 59. Также изобретение относится к нуклеотидной последовательности, которая кодирует полипептид каждого из фрагментов scFv, выбранных из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 59, и каждого из доменов SEQ ID NO: 13-17, вместе с кодируемым слитым белком CAR против CD19 по изобретению. В одном аспекте иллюстративные конструкции CAR против CD19 содержат необязательную лидерную последовательность, внеклеточный антигенсвязывающий домен, шарнирную область, трансмембранный домен и внутриклеточный стимулирующий домен. В одном аспекте иллюстративная конструкция CAR против CD19 содержит необязательную лидерную последовательность, внеклеточный антигенсвязывающий домен, шарнирную область, трансмембранный домен, внутриклеточный костимулирующий домен и внутриклеточный стимулирующий домен. Конкретные конструкции CAR против CD19, содержащие гуманизированные домены scFv по изобретению, представлены в качестве SEQ ID NO: 31-42, или конструкции, содержащие scFv-домен мыши, представлены в качестве SEQ ID NO: 59.
[00294] Полноразмерные последовательности CAR также представлены в настоящем описании в качестве SEQ ID NO: 31-42 и 58, как показано в таблице 7 и в таблице 3.
[00295] Иллюстративная лидерная последовательность предоставлена в качестве SEQ ID NO: 13. Иллюстративная шарнирная/спейсерная последовательность предоставлена в качестве SEQ ID NO: 14, или SEQ ID NO: 45, или SEQ ID NO: 47, или SEQ ID NO: 49. Иллюстративная последовательность трансмембранного домена представлена в качестве SEQ ID NO: 15. Иллюстративная последовательность внутриклеточного сигнального домена белка 4-1BB представлена в качестве SEQ ID NO: 16. Иллюстративная последовательность внутриклеточного сигнального домена CD27 представлена в качестве SEQ ID NO: 51. Иллюстративная последовательность домена CD3-зета представлена в качестве SEQ ID NO: 17 или SEQ ID NO: 43.
[00296] В одном аспекте настоящее изобретение относится к рекомбинантной конструкции нуклеиновой кислоты, содержащей молекулу нуклеиновой кислоты, кодирующую CAR, где молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, кодирующую связывающий CD19 домен, например, описанный в настоящем описании, который является соседним с последовательностью нуклеиновой кислоты, кодирующей внутриклеточный сигнальный домен, и находится в одной рамке считывания с ней. В одном аспекте связывающий CD19 домен выбран из одной или нескольких из SEQ ID NO: 1-12 и 58. В одном аспекте связывающий CD19 домен кодируется нуклеотидными остатками 64-813 последовательности, представленной в одной или нескольких из SEQ ID NO: 61-72 и 59. В одном аспекте связывающий CD19 домен кодируется нуклеотидными остатками 64-813 SEQ ID NO: 61. В одном аспекте связывающий CD19 домен кодируется нуклеотидными остатками 64-813 SEQ ID NO: 62. В одном аспекте связывающий CD19 домен кодируется нуклеотидными остатками 64 to 813 SEQ ID NO: 63. В одном аспекте связывающий CD19 домен кодируется нуклеотидными остатками 64-813 SEQ ID NO: 64. В одном аспекте связывающий CD19 домен кодируется нуклеотидными остатками 64-813 SEQ ID NO: 65. В одном аспекте связывающий CD19 домен кодируется нуклеотидными остатками 64-813 SEQ ID NO: 66. В одном аспекте связывающий CD19 домен кодируется нуклеотидными остатками 64-813 SEQ ID NO: 67. В одном аспекте связывающий CD19 домен кодируется нуклеотидными остатками 64-813 SEQ ID NO: 68. В одном аспекте связывающий CD19 домен кодируется нуклеотидными остатками 64-813 SEQ ID NO: 69. В одном аспекте связывающий CD19 домен кодируется нуклеотидными остатками 64-813 SEQ ID NO: 70. В одном аспекте связывающий CD19 домен кодируется нуклеотидными остатками 64-813 SEQ ID NO: 71. В одном аспекте связывающий CD19 домен кодируется нуклеотидными остатками 64-813 SEQ ID NO: 72.
[00297] В одном аспекте настоящее изобретение относится к рекомбинантной конструкции нуклеиновой кислоты, содержащей трансген, кодирующий CAR, где молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты, кодирующую связывающий CD19 домен, выбранную из одной или нескольких из SEQ ID NO: 61-72, где последовательность является соседней с последовательностью нуклеиновой кислоты, кодирующей внутриклеточный сигнальный домен, и находится в одной рамке считывания с ней. Иллюстративный внутриклеточный сигнальный домен, который можно использовать в CAR, включает, но не ограничивается ими, один или несколько внутриклеточных сигнальных доменов из, например, CD3-зета, CD28, 4-1BB и т.п. В некоторых случаях CAR может содержать любую комбинацию CD3-зета, CD28, 4-1BB и т.п. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR по изобретению выбрана из одной или нескольких из SEQ ID NO: 85-96. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 85. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 86. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 87. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 88. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 89. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 90. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 91. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 92. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 93. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 94. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 95. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 96. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 97. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 98. В одном аспекте последовательность нуклеиновой кислоты конструкции CAR представляет собой SEQ ID NO: 99.
[00298] Последовательности нуклеиновых кислот, кодирующие желаемые молекулы, можно получать с использованием рекомбинантных способов, известных в данной области, например, таких как скрининг библиотек клеток, экспрессирующих ген, получение гена из вектора, о котором известно, что он включает его, или выделение непосредственно из клеток и тканей, содержащих его, с использованием стандартных способов. Альтернативно представляющую интерес нуклеиновую кислоту можно получать синтетически, а не клонировать.
[00299] Настоящее изобретение включает конструкции ретровирусных и лентивирусных векторов, экспресирующие CAR, которые можно прямо трансдуцировать в клетку.
[00300] Настоящее изобретение также включает конструкцию РНК, которая может быть прямо трансфицирована в клетку. Способ получения мРНК для применения в трансфекции вовлекает транскрипцию in vitro (IVT) матрицы с использованием специально сконструированных праймеров, с последующим присоединением поли-A, с получением конструкции, содержащей 3ʹ- и 5ʹ-нетранслируемую последовательность ("UTR"), 5ʹ-кэп и/или участок внутренней посадки рибосомы (IRES), нуклеиновую кислоту, подлежащую экспрессии, и поли-A хвостовую часть, как правило, длиной 50-2000 оснований (SEQ ID NO: 118). РНК, полученную таким образом, можно эффективно трансфицировать в различные типы клеток. В одном варианте осуществления матрица включает последовательности CAR. В одном варианте осуществления РНК-вектор CAR трансдуцируют в T-клетку способом электропорации.
Антигенсвязывающий домен
[00301] В одном аспекте CAR по изобретению содержит специфичный к мишени связывающий элемент, иначе называемый антигенсвязывающим доменом. Выбор части зависит от типа и количества лигандов, которые определяют поверхность клетки-мишени. Например, антигенсвязывающий домен может быть выбран так, чтобы он распознавал лиганд, который выступает в качестве маркера клеточной поверхности на клетках-мишенях, ассоциированных с конкретным болезненным состоянием. Таким образом примеры маркеров клеточной поверхности, которые могут выступать в качестве лигандов для антигенсвязывающего домена в CAR по изобретению, включают маркеры, ассоциированные с вирусными, бактериальными и паразитарными инфекциями, аутоиммунным заболеванием и злокачественными клетками.
[00302] В одном аспекте опосредуемый CAR T-клеточный ответ может быть направлен на представляющий интерес антиген посредством встраивания способами инженерии антигенсвязывающего домена, который специфически связывает желаемый антиген, в CAR.
[00303] В одном аспекте часть CAR, содержащая антигенсвязывающий домен, содержит антигенсвязывающий домен, который нацелен на CD19. В одном аспекте антигенсвязывающий домен нацелен на CD19 человека. В одном аспекте антигенсвязывающий домен CAR имеет такую же или сходную специфичностью связывания с фрагментом scFv FMC63, описанного в Nicholson et al. Mol. Immun. 34 (16-17): 1157-1165 (1997). В одном варианте осуществления антигенсвязывающий домен CAR включает фрагмент scFv, описанный в Nicholson et al. Mol. Immun. 34 (16-17): 1157-1165 (1997).
[00304] Антигенсвязывающий домен может представлять собой любой домен, который связывается с антигеном, включая, но не ограничиваясь ими, моноклональное антитело, поликлональное антитело, рекомбинантное антитело, антитело мыши, антитело человека, гуманизированное антитело и его функциональный фрагмент, включая, но не ограничиваясь ими, однодоменное антитело, такое как вариабельный домен тяжелой цепи (VH), вариабельный домен легкой цепи (VL) и вариабельный домен (VHH) наноантитела, происходящего из животного семейства верблюжьих, и альтернативный каркас, о котором в данной области известно, что он функционирует в качестве антигенсвязывающего домена, такой как рекомбинантный домен фибронектина и т.п.
[00305] В одном варианте осуществления молекула CAR содержит связывающий CD19 домен, содержащий одну или несколько (например, все три) из определяющей комплементарность области 1 легкой цепи (CDR1 LC), определяющей комплементарность области 2 легкой цепи (CDR2 LC) и определяющей комплементарность область 3 легкой цепи (CDR3 LC) связывающего CD19 домена, описанного в настоящем описании, и одну или несколько (например, все три) из определяющей комплементарность области 1 тяжелой цепи (CDR1 HC), определяющей комплементарность области 2 тяжелой цепи (CDR2 HC) и определяющей комплементарность области 3 тяжелой цепи (CDR3 HC) связывающего CD19 домена, описанного в настоящем описании, например, связывающего CD19 домена, содержащего одну или несколько, например, все три, CDR LC, и одну или несколько, например, все три, CDR HC. В одном варианте осуществления связывающий CD19 домен содержит одну или несколько (например, все три) из определяющей комплементарность области 1 тяжелой цепи (CDR1 HC), определяющей комплементарность области 2 тяжелой цепи (CDR2 HC) и определяющей комплементарность области 3 тяжелой цепи (CDR3 HC) связывающего CD19 домена, описанного в настоящем описании, например, связывающий CD19 домен имеет две вариабельных области тяжелой цепи, каждая из которых содержит CDR1 HC, CDR2 HC и CDR3 HC, описанные в настоящем описании. В одном варианте осуществления связывающий CD19 домен содержит вариабельную область легкой цепи мыши, описанную в настоящем описании (например, в таблице 7), и/или вариабельную область тяжелой цепи мыши, описанную в настоящем описании (например, в таблице 7). В одном варианте осуществления связывающий CD19 домен представляет собой scFv, содержащий легкую цепь мыши и тяжелую цепь мыши, имеющие аминокислотную последовательность, приведенную в таблице 7. В одном варианте осуществления связывающий CD19 домен (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области легкой цепи, представленной в таблице 7, или последовательности, обладающей 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 7; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области тяжелой цепи, представленной в таблице 7, или последовательности, обладающей 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 7. В одном варианте осуществления связывающий CD19 домен содержит последовательность SEQ ID NO: 59, или последовательность, обладающую 95-99% идентичностью с ней. В одном варианте осуществления связывающий CD19 домен представляет собой scFv, и вариабельная область легкой цепи, содержащая аминокислотную последовательность, описанную в настоящем описании, например, в таблице 7, связана с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, описанную в настоящем описании, например, в таблице 7, через линкер, например, линкер, описанный в настоящем описании. В одном варианте осуществления связывающий CD19 домен включает линкер (Gly4-Ser)n, где n равно 1, 2, 3, 4, 5 или 6, предпочтительно 3 или 4 (SEQ ID NO: 53). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут быть, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
[00306] В некоторых случаях является полезным, чтобы антигенсвязывающий домен доставлялся тому же виду, в котором в конечном итоге будет использоваться CAR. Например, для применения у человека может быть полезным, чтобы антигенсвязывающий домен CAR содержал человеческие или гуманизированные остатки антигенсвязывающего домена антитела или фрагмента антитела.
[00307] Таким образом, в одном аспекте антигенсвязывающий домен содержит гуманизированное антитело или фрагмент антитела. В одном варианте осуществления гуманизированный связывающий CD19 домен содержит одну или несколько (например, все три) из определяющей комплементарность области 1 легкой цепи (CDR1 LC), определяющей комплементарность области 2 легкой цепи (CDR2 LC) и определяющей комплементарность области 3 легкой цепи (CDR3 LC) мышиного или гуманизированного связывающего CD19 домена, описанного в настоящем описании, и/или одну или несколько (например, все три) из определяющей комплементарность области 1 тяжелой цепи (CDR1 HC), определяющей комплементарность области 2 тяжелой цепи 2 (CDR2 HC) и определяющей комплементарность области 3 тяжелой цепи (CDR3 HC) мышиного или гуманизированного связывающего CD19 домена, описанного в настоящем описании, например, гуманизированного связывающего CD19 домена, содержащего одну или несколько, например, все три, CDR LC и одну или несколько, например, все три, CDR HC. В одном варианте осуществления гуманизированный связывающий CD19 домен содержит одну или несколько (например, все три) из определяющей комплементарность области 1 тяжелой цепи (CDR1 HC), определяющей комплементарность области 2 тяжелой цепи (CDR2 HC) и определяющей комплементарность области 3 тяжелой цепи (CDR3 HC) мышиного или гуманизированного связывающего CD19 домена, описанного в настоящем описании, например, гуманизированный связывающий CD19 домен имеет две вариабельных области тяжелой цепи, каждая из которых содержит CDR1 HC, CDR2 HC и CDR3 HC, описанные в настоящем описании. В одном варианте осуществления гуманизированный связывающий CD19 домен содержит гуманизированную вариабельную область легкой цепи, описанную в настоящем описании (например, в таблице 3) и/или гуманизированную вариабельную область тяжелой цепи, описанную в настоящем описании (например, в таблице 3). В одном варианте осуществления гуманизированный связывающий CD19 домен содержит гуманизированную вариабельную область тяжелой цепи, описанную в настоящем описании (например, в таблице 3), например, по меньшей мере две гуманизированных вариабельных области тяжелой цепи, описанные в настоящем описании (например, в таблице 3). В одном варианте осуществления связывающий CD19 домен представляет собой scFv, содержащий легкую цепь и тяжелую цепь аминокислотной последовательности, представленной в таблице 3. В одном варианте осуществления связывающий CD19 домен (например, scFv) содержит: вариабельную область легкой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области легкой цепи, представленной в таблице 3, или последовательности, обладающей 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 3; и/или вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, имеющую по меньшей мере одну, две или три модификации (например, замены), но не более 30, 20 или 10 модификаций (например, замен) аминокислотной последовательности вариабельной области тяжелой цепи, представленной в таблице 3, или последовательности, обладающей 95-99% идентичностью с аминокислотной последовательностью, представленной в таблице 3. В одном варианте осуществления гуманизированный связывающий CD19 домен содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 12, или последовательность, обладающую 95-99% идентичностью с ней. В одном варианте осуществления последовательность нуклеиновой кислоты, кодирующая гуманизированный связывающий CD19 домен, содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 70, SEQ ID NO: 71 и SEQ ID NO: 72, или последовательность, обладающую 95-99% идентичностью с ней. В одном варианте осуществления гуманизированный связывающий CD19 домен представляет собой scFv, и вариабельная область легкой цепи, содержащая аминокислотную последовательность, описанную в настоящем описании, например, в таблице 3, связана с вариабельной областью тяжелой цепи, содержащей аминокислотную последовательность, описанную в настоящем описании, например, в таблице 3, через линкер, например, линкер, описанный в настоящем описании. В одном варианте осуществления гуманизированный связывающий CD19 домен включает линкер (Gly4-Ser)n, где n равно 1, 2, 3, 4, 5 или 6, предпочтительно 3 или 4 (SEQ ID NO: 53). Вариабельная область легкой цепи и вариабельная область тяжелой цепи scFv могут находиться, например, в любой из следующих ориентаций: вариабельная область легкой цепи-линкер-вариабельная область тяжелой цепи или вариабельная область тяжелой цепи-линкер-вариабельная область легкой цепи.
[00308] В одном аспекте часть антигенсвязывающего домена содержит одну или несколько последовательностей, выбранных из SEQ ID NO: 1-12. В одном аспекте гуманизированный CAR выбран из одной или нескольких последовательностей, выбранных из SEQ ID NO: 31-42. В некоторых аспектах не являющееся человеческим антителом является гуманизирвоанным, где определенные последовательности или области антитела являются модифицированными для повышения сходства с антителом, естественным образом продуцируемым у человека, или его фрагментом.
[00309] Гуманизированное антитело можно получать с использованием различных способов, известных в данной области, включая, но не ограничиваясь ими, пересадку CDR (см., например, патент Европы № EP 239400; международную публикацию № WO 91/09967 и патенты США № 5225539, 5530101 и 5585089, каждый из которых включен в настоящее описание в качестве ссылки в полном объеме), венирование или изменение поверхности см., например, патенты Европы № EP 592106 и EP 519596; Padlan, 1991, Molecular Immunology, 28(4/5):489-498; Studnicka et al., 1994, Protein Engineering, 7(6):805-814; и Roguska et al., 1994, PNAS, 91:969-973, каждый из которых включен в настоящее описание в качестве ссылки в полном объеме), шаффлинг цепей (см., например, патент США № 5565332, который включен в настоящее описание в качестве ссылки в полном объеме) и способы, описанные, например, в публикации патентной заявки США № US2005/0042664, публикации патентной заявки США № US2005/0048617, патенте США № 6407213, патенте США № 5766886, международной публикации № WO 9317105, Tan et al., J. Immunol., 169:1119-25 (2002), Caldas et al., Protein Eng., 13(5):353-60 (2000), Morea et al., Methods, 20(3):267-79 (2000), Baca et al., J. Biol. Chem., 272(16):10678-84 (1997), Roguska et al., Protein Eng., 9(10):895-904 (1996), Couto et al., Cancer Res., 55 (23 Supp):5973s-5977s (1995), Couto et al., Cancer Res., 55(8):1717-22 (1995), Sandhu J S, Gene, 150(2):409-10 (1994), и Pedersen et al., J. Mol. Biol., 235(3):959-73 (1994), каждый из которых включен в настоящее описание в качестве ссылки в полном объеме. Часто, каркасные остатки в каркасных областях заменяют соответствующим остатком из антитела, являющегося донором CDR, для изменения, например, повышения, связывания антигена. Эти замены каркасной области идентифицируют способами, хорошо известными в данной области, например, посредством моделирования взаимодействий CDR и каркасных остатков для идентификации каркасных остатков, важных для связывания антигена, сравнения последовательностей для идентификации необычных каркасных остатков в конкретных положениях (См., например, Queen et al., патент США № 5585089; и Riechmann et al., 1988, Nature, 332:323, которые включены в настоящее описание в качестве ссылок в полном объеме).
[00310] Гуманизированное антитело или фрагмент антитела имеют один или несколько аминокислотных остатков, оставшихся в них из источника, не являющегося человеческим. Эти не являющиеся человеческими аминокислотные остатки часто называют "импортными" остатками, которые, как правило, взяты из "импортного" вариабельного домена. Как описано в настоящем описании, гуманизированные антитела или фрагменты антитела содержат одну или несколько CDR из не являющихся человеческими молекул иммуноглобулинов и каркасных областей, где аминокислотные остатки, содержащие каркасную область, происходят полностью или по большей части из последовательности человека эмбирионального типа. Множество способов гуманизации антител или фрагментов антител хорошо известны в данной области, и ее можно проводить по существу согласно способу Winter и коллег (Jones et al., Nature, 321:522-525 (1986); Riechmann et al., Nature, 332:323-327 (1988); Verhoeyen et al., Science, 239:1534-1536 (1988)), путем замены CDR или последовательностями CDR грызунов соответствующих последовательностей антитела человека, т.е. пересадки CDR (EP 239400; публикация PCT № WO 91/09967; и патенты США № 4816567; 6331415; 5225539; 5530101; 5585089; 6548640, содержание которых включено в настоящее описание в качестве ссылок в полном объеме). В таких гуманизированных антителах и фрагментах по существу менее чем интактный вариабельный домен человека заменен соответствующей последовательностью из не являющегося человеком вида. Гуманизированные антитела часто представляют собой антитела человека, в которых некоторые остатки CDR и, возможно, некоторые каркасные (FR) остатки заменены остатками из аналогичных участков антител грызунов. Гуманизацию антител и фрагментов антител также можно осуществлять посредством венирования или изменения поверхности (EP 592,106; EP 519,596; Padlan, 1991, Molecular Immunology, 28(4/5):489-498; Studnicka et al., Protein Engineering, 7(6):805-814 (1994); и Roguska et al., PNAS, 91:969-973 (1994)) или шаффлинга цепей (патент США № 5565332), содержание которых включено в настоящее описание в качестве ссылки в полном объеме.
[00311] Выбор вариабельных доменов человека, как легких, так и тяжелых, для применения для получения гуманизированных антител, проводят так, чтобы снизить антигенность. Согласно так называемому способу "наилучшего соответствия", последовательность вариабельного домена антитела грызуна подвергают скринингу против целой библиотеки известных последовательностей вариабельного домена человека. Последовательность человека, которая является наиболее сходной с последовательностью грызуна, затем принимают в качестве каркасной области человека (FR) для гуманизированного антитела (Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol. Biol., 196:901 (1987), содержание которой включено в настоящее описание в качестве ссылки в полном объеме). В другом способе используют конкретную каркасную область, происходящую из консенсусной последовательности всех антител человека конкретной подгруппы легких или тяжелых цепей. Для нескольких различных гуманизированных антител можно использовано одну и ту же каркасную область (см., например, Nicholson et al. Mol. Immun. 34 (16-17): 1157-1165 (1997); Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993), содержание которых включены в настоящее описание в качестве ссылок в полном объеме). В некоторых вариантах осуществления каркасная область, например, все четыре каркасных области, вариабельной области тяжелой цепи происходит из последовательности эмбрионального типа VH4_4-59. В одном варианте осуществления каркасная область может содержать одну, две, три, четыре или пять модификаций, например, замен, например, на аминокислоту соответствующей последовательности мыши (например, SEQ ID NO: 59). В одном варианте осуществления каркасная область, например, все четыре каркасных области вариабельной области легкой цепи, происходит из последовательности эмбрионального типа VK3_1.25. В одном варианте осуществления каркасная область может содержать одну, две, три, четыре или пять модификаций, например, замен, на аминокислоту соответствующей последовательности мыши (например, SEQ ID NO: 59).
[00312] В некоторых аспектах часть композиции CAR по изобретению, которая содержит фрагмент антитела, является гуманизированной с сохранением высокой аффинности в отношении антигена-мишени и других благоприятных биологических свойств. Согласно одному аспекту изобретения гуманизированные антитела и фрагменты антител получают посредством процесса анализа родительских последовательностей и различных концептуальных гуманизированных продуктов с использованием трехмерных моделей родительских и гуманизированных последовательностей. Трехмерные модели иммуноглобулинов являются общедоступными и известны специалистам в данной области. Доступны компьютерные программы, которые иллюстрируют и проявляют возможные трехмерные конформационные структуры выбранных последовательностей иммуноглобулинов, являющихся кандидатами. Исследование этих изображений позволяют анализ вероятной роли остатков в функционировании последовательности иммуноглобулина, являющейся кандидатом, например, анализ остатков, которые влияют на способность иммуноглобулина, являющегося кандидатом, связывать антиген-мишень. Таким образом, остатки FR можно выбирать и комбинировать из реципиентных и импортных последовательностей, так чтобы достигать желаемых характеристик антитело или фрагмент антитела, таких как увеличенная аффинность в отношении антигена-мишени. Как правило, остатки CDR прямо и наиболее существенно вовлечены во влияние на связывание антигена.
[00313] Гуманизированное антитело или фрагмент антитела могут сохранять антигенную специфичность, сходную с исходным антителом, например, в рамках настоящего изобретения, способность связывать CD19 человека. В некоторых вариантах осуществления гуманизированное антитело или фрагмент антитела могут иметь увеличенную аффинность и/или специфичность связывания с CD19 человека.
[00314] В одном аспекте связывающий CD19 домен характеризуется конкретными функциональными признаками или свойствами антитела или фрагмента антитела. Например, в одном аспекте часть композиции CAR по изобретению, которая содержит антигенсвязывающий домен, специфически связывает CD19 человека. В одном аспекте антигенсвязывающий домен имеет такую же или сходную специфичность связывания CD19 человека с scFv FMC63, описанным в Nicholson et al. Mol. Immun. 34 (16-17): 1157-1165 (1997). В одном аспекте изобретение относится к антигенсвязывающему домену, содержащему антитело или фрагмент антитела, где связывающий домен антитела специфически связывается с белком CD19 или его фрагментом, где антитело или фрагмент антитела содержит вариабельную область легкой цепи и/или вариабельную область тяжелой цепи, которая включает аминокислотную последовательность SEQ ID NO: 1-12 или SEQ ID NO: 59. В одном аспекте антигенсвязывающий домен содержит аминокислотную последовательность scFv, выбранную из SEQ ID NO: 1-12 или SEQ ID NO: 59. В некоторых аспектах scFv является непрерывной и находится в той же рамке считывания, что и лидерная последовательность. В одном аспекте лидерная последовательность представляет собой полипептидную последовательность, представленную в качестве SEQ ID NO: 13.
[00315] В одном аспекте связывающий CD19 домен представляет собой фрагмент, например, одноцепочечный вариабельный фрагмент (scFv). В одном аспекте связывающий CD19 домен представляет собой Fv, Fab, (Fab')2 или бифункциональное (например, биспецифическое) гибридное антитело (например, Lanzavecchia et al., Eur. J. Immunol. 17, 105 (1987)). В одном аспекте антитела и их фрагменты по изобретению связывают белок CD19 с аффинностью дикого типа или усиленной аффинностью.
[00316] В некоторых случаях scFv можно получать в соответствии со способом, известным в данной области (см., например, Bird et al., (1988) Science 242:423-426 и Huston et al., (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883). Молекулы ScFv можно получать путем связывания областей VH и VL вместе с использованием гибких полипептидных линкеров. Молекулы scFv содержат линкер (например, линкер Ser-Gly) с оптимизированной длиной и/или аминокислотным составом. Длина линкера может в значительной степени влиять на то, как вариабельные области scFv будут сворачиваться и взаимодействовать. В действительности, если используют короткий полипептидный линкер (например, 5-10 аминокислот), это препятствует внутрицепочечному фолдингу. Внутрицепочечный фолдинг также требуется для сближения двух вариабельных областей для формирования функционального участка связывания эпитопа. Для примера ориентации и размера линкера см., например, Hollinger et al. 1993 Proc Natl Acad. Sci. U.S.A. 90:6444-6448, публикации патентных заявок США № 2005/0100543, 2005/0175606, 2007/0014794, и публикации PCT № WO2006/020258 и WO2007/024715, которые включены в настоящее описание в качестве ссылок.
[00317] scFv может содержать линкер по меньшей мере из 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 45, 50 или более аминокислотных остатков между его областями VL и VH. Линкерная последовательность может содержать любую встречающуюся в природе аминокислоту. В некоторых вариантах осуществления линкерная последовательность содержит аминокислоты глицин и серин. В другом варианте осуществления линкерная последовательность содержит наборы глициновых и сериновых повторов, такие как (Gly4Ser)n, где n представляет собой положительное целое число, равное или превышающее 1 (SEQ ID NO: 18). В одном варианте осуществления линкер может представлять собой (Gly4Ser)4 (SEQ ID NO: 106) или (Gly4Ser)3 (SEQ ID NO: 107). Варьирование длины линкера может сохранять или повышать активность, обеспечивая улучшенную эффективность в исследованиях активности.
[00318] В некоторых вариантах осуществления аминокислотная последовательность антигенсвязывающего домена (или других частей или всего CAR) может быть модифицирована, например, аминокислотная последовательность, описанная в настоящем описании, может быть модифицирована, например, посредством консервативной замены. Семейства аминокислотных остатков, имеющих сходные боковые цепи, определены в данной области, включая основные боковые цепи (например, лизин, аргинин, гистидин), кислотные боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин).
[00319] Процентная идентичность в контексте двух или более последовательностей нуклеиновых кислот или полипептидных последовательностей относится к двум или более последовательностям, которые являются одинаковыми. Две последовательности являются "по существу идентичными", если две последовательности имеют конкретный процент аминокислотных остатков или нуклеотидов, которые являются одинаковыми (например, 60% идентичность, необязательно 70%, 71%. 72%. 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%,81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичность на протяжении указанной области или, когда не уточняется, на протяжении всей последовательности), при сравнении и выравнивании на максимальное соответствие на протяжении окна сравнения или указанной области, как измеряют с использованием одного из следующих алгоритмов сравнения последовательностей или путем выравнивания вручную или визуального исследования. Необязательно, идентичность существует на протяжении области, которая имеет длину по меньшей мере приблизительно 50 нуклеотидов (или 10 аминокислот), или более предпочтительно на протяжении области, которая имеет длину от 100 до 500 или 1000 или более нуклеотидов (или 20, 50, 200 или более аминокислот).
[00320] Для сравнения последовательностей, как правило, одна последовательность выступает в качестве эталонной последовательности, с которой сравнивают исследуемые последовательности. При использовании алгоритма сравнения последовательностей, исследуемую и эталонную последовательности вводят в компьютер, координаты подпоследовательностей указывают, если необходимо, и назначают параметры программы с алгоритмом сравнения последовательностей. Можно использовать параметры программы по умолчанию или альтернативно параметры можно назначать. Затем алгоритм сравнения последовательностей вычисляет процентную идентичность последовательностей для исследуемых последовательностей относительно эталонной последовательности, исходя из параметров программы. Способы выравнивания последовательностей для сравнения хорошо известны в данной области. Оптимальное выравнивание последовательностей для сравнения можно проводить, например, с использованием алгоритма локальной гомологии Smith and Waterman, (1970) Adv. Appl. Math. 2:482c, с использованием алгоритма выравнивания по гомологии Needleman and Wunsch, (1970) J. Mol. Biol. 48:443, с использованием способа поиска сходства Pearson and Lipman, (1988) Proc. Natʹl. Acad. Sci. USA 85:2444, с использованием компьютерных воплощений этих алгоритмов (GAP, BESTFIT, FASTA и TFASTA в Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI), или путем выравнивания вручную и визуального исследования (см., например, Brent et al., (2003) Current Protocols in Molecular Biology).
[00321] Двумя примерами алгоритмов, которые пригодны для определения процентной идентичности последовательностей и сходства последовательностей, являются алгоритмы BLAST и BLAST 2.0, которые описаны в Altschul et al., (1977) Nuc. Acids Res. 25:3389-3402; и Altschul et al., (1990) J. Mol. Biol. 215:403-410, соответственно. Программное обеспечение для осуществления анализов BLAST является общедоступным через National Center for Biotechnology Information.
[00322] Процентную идентичность между двумя аминокислотными последовательностями также можно определять с использованием алгоритма E. Meyers и W. Miller (Comput. Appl. Biosci., 4:11-17, 1988), который включен в программу ALIGN (версии 2.0), с использованием таблицы веса остатков PAM120, штрафа за продолжение пропуска 12 и штрафа за пропуск 4. Кроме того, процентную идентичность между двумя аминокислотными последовательностями можно определять с использованием алгоритма Needleman и Wunsch (J. Mol, Biol. 48:444-453, 1970), который включен с программу GAP в пакете программ GCG (доступном на http://www.gcg.com), с использованием либо матрицы Blossum 62, либо матрицы PAM250, и штрафа за пропуск 16, 14, 12, 10, 8, 6 или 4 и штрафа за продолжение пропуска 1, 2, 3, 4, 5 или 6.
[00323] В одном аспекте настоящее изобретение предусматривает модификации исходной аминокислотной последовательности антитела или фрагмента (например, scFv), которые приводят к функционально эквивалентным молекулам. Например, VH или VL CD19-связывающего домена, например, scFv, содержащегося в CAR, можно модифицировать для сохранения по меньшей мере приблизительно 70%, 71%, 72%. 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичности с исходной каркасной области VH или VL CD19-связывающего домена, например, scFv. Настоящее изобретение предусматривает модификации всей конструкции CAR, например, модификации одной или нескольких аминокислотных последовательностей различных доменов конструкции CAR для получения функционально эквивалентных молекул. Конструкцию CAR можно модифицировать, чтобы она сохраняла по меньшей мере приблизительно 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% идентичность с исходной конструкцией CAR.
[00324] Биспецифические CAR
[00325] В одном варианте осуществления мультиспецифическая молекула антитела представляет собой биспецифическую молекулу антитела. Биспецифическое антитело обладает специфичностью в отношении не более чем двух антигенов. Биспецифическая молекула антитела характеризуется первой последовательностью вариабельного домена иммуноглобулина, которая обладает аффинностью связывания в отношении первого эпитопа, и второй последовательностью вариабельного домена иммуноглобулина, которая обладает специфичностью связывания в отношении второго эпитопа. В одном варианте осуществления первый и второй эпитопы находятся на одном и том же антигене, например, на одном и том же белке (или субъединице мультимерного белка). В одном варианте осуществления первый и второй эпитопы перекрываются. В одном варианте осуществления первый и второй эпитопы не перекрываются. В одном варианте осуществления первый и второй эпитопы находятся на различных антигенах, например, различных белках (или различных субъединицах мультимерного белка). В одном варианте осуществления биспецифическая молекула антитела содержит последовательность вариабельного домена тяжелой цепи и последовательность вариабельного домена легкой цепи, которые обладают специфичностью связывания в отношении первого эпитопа, и последовательность вариабельного домена тяжелой цепи, и последовательность вариабельного домена легкой цепи, которые обладают специфичностью связывания в отношении второго эпитопа. В одном варианте осуществления биспецифическая молекула антитела содержит половинное антитело, обладающее специфичностью связывания в отношении первого эпитопа, и половинное антитело, обладающее специфичностью связывания в отношении второго эпитопа. В одном варианте осуществления биспецифическая молекула антитела содержит половинное антитело или его фрагмент, обладающие специфичностью связывания в отношении первого эпитопа, и половинное антитело или его фрагмент, обладающие специфичностью связывания в отношении второго эпитопа. В одном варианте осуществления биспецифическая молекула антитела содержит scFv или его фрагмент, которые обладают специфичностью связывания в отношении первого эпитопа, и scFv или фрагмент, которые обладают специфичностью связывания в отношении второго эпитопа.
Трансмембранный домен
[00326] Что касается трансмембранного домена, в различных вариантах осуществления CAR можно конструировать так, чтобы он содержал трансмембранный домен, который связан с внеклеточным доменом CAR. Трансмембранный домен может включать одну или несколько дополнительных аминокислот, соседних с трансмембранной областью, например, одну или несколько аминокислот, ассоциированных с внеклеточной областью белка, из которого происходит трансмембранный домен (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 вплоть до 15 аминокислот внеклеточной области) и/или одну или несколько дополнительных аминокислот, ассоциированных с внутриклеточной областью белка, из которой происходит трансмембранный белок (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 вплоть до 15 аминокислот внутриклеточной области). В одном аспекте трансмембранный домен представляет собой домен, который ассоциирован с одним из других доменов, используемых в CAR, например, в одном варианте осуществления трансмембранный домен может происходить из того же белка, что и сигнальный домен, костимулирующий домен или шарнирный домен. В другом аспекте трансмембранный домен не происходит из того же белка, что и любой другой домен CAR. В некоторых случаях трансмембранный домен можно выбирать или модифицировать посредством аминокислотной замены, чтобы избежать связывания таких доменов с трансмембранными доменами тех же или отличающихся поверхностных мембранных белков, например, для минимизации взаимодействий с другими представителями рецепторного комплекса. В одном аспекте трансмембранный домен способен к гомодимеризации с другим CAR на клеточной поверхности CAR-экспрессирующей клетки. В другом аспекте аминокислотная последовательность трансмембранного домена может быть модифицирована или замещена, чтобы минимизировать взаимодействия со связывающими доменами нативного связывающего партнера, присутствующего в той же CAR-экспрессирующей клетке.
[00327] Трансмембранный домен может происходить либо из природного, либо из рекомбинантного источника. Когда источник является природным, домен может происходить из любого мембраносвязанного или трансмембранного белка. В одном аспекте трансмембранный домен способен передавать сигнал на внутриклеточный домен(ы), когда CAR связывается с мишенью. Особенно пригодный в рамках настоящего изобретения трансмембранный домен может включать по меньшей мере трансмембранную область(и), например, альфа-, бета- или зета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154. В некоторых вариантах осуществления трансмембранный домен может включать по меньшей мере трансмембранную область(и), например, из KIRDS2, OX40, CD2, CD27, LFA-1 (CD11a, CD18), ICOS (CD278), 4-1BB (CD137), GITR, CD40, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, IL2R-бета, IL2R-гамма, IL7Rα, ITGA1, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, TNFR2, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, PAG/Cbp, NKG2D, NKG2C.
[00328] В некоторых случаях трансмембранный домен может быть связан с внеклеточной областью CAR, например, антигенсвязывающим доменом CAR, через шарнирную область, например, шарнирную область из белка человека. Например, в одном варианте осуществления шарнирная область может представлять собой шарнирную область Ig (иммуноглобулина) человека (например, шарнирная область IgG4, шарнирная область IgD), линкер GS (например, линкер GS, описанный в настоящем описании), шарнирную область KIR2DS2 или шарнирную область CD8a. В одном варианте осуществления шарнирная область или спейсер содержат (например, состоят из) аминокислотную последовательности SEQ ID NO: 14. В одном аспекте трансмембранный домен содержит (например, состоит из) трансмембранный домен SEQ ID NO: 15.
[00329] В одном аспекте шарнирная область или спейсер содержат шарнирную область IgG4. Например, в одном варианте осуществления шарнирная область или спейсер содержат шарнирную область с аминокислотной последовательностью: ESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKM (SEQ ID NO: 45).
[00330] В некоторых вариантах осуществления шарнирная область или спейсер содержат шарнирную область, кодируемую нуклеотидной последовательностью: GAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATG (SEQ ID NO: 46).
[00331] В одном аспекте шарнирная область или спейсер содержат шарнирную область IgD. Например, в одном варианте осуществления шарнирная область или спейсер содержат шарнирную область с аминокислотной последовательностью RWPESPKAQASSVPTAQPQAEGSLAKATTAPATTRNTGRGGEEKKKEKEKEEQEERETKTPECPSHTQPLGVYLLTPAVQDLWLRDKATFTCFVVGSDLKDAHLTWEVAGKVPTGGVEEGLLERHSNGSQSQHSRLTLPRSLWNAGTSVTCTLNHPSLPPQRLMALREPAAQAPVKLSLNLLASSDPPEAASWLLCEVSGFSPPNILLMWLEDQREVNTSGFAPARPPPQPGSTTFWAWSVLRVPAPPSPQPATYTCVVSHEDSRTLLNASRSLEVSYVTDH (SEQ ID NO: 47).
[00332] В некоторых вариантах осуществления шарнирная область или спейсер содержат шарнирную область, кодируемую нуклеотидной последовательностью AGGTGGCCCGAAAGTCCCAAGGCCCAGGCATCTAGTGTTCCTACTGCACAGCCCCAGGCAGAAGGCAGCCTAGCCAAAGCTACTACTGCACCTGCCACTACGCGCAATACTGGCCGTGGCGGGGAGGAGAAGAAAAAGGAGAAAGAGAAAGAAGAACAGGAAGAGAGGGAGACCAAGACCCCTGAATGTCCATCCCATACCCAGCCGCTGGGCGTCTATCTCTTGACTCCCGCAGTACAGGACTTGTGGCTTAGAGATAAGGCCACCTTTACATGTTTCGTCGTGGGCTCTGACCTGAAGGATGCCCATTTGACTTGGGAGGTTGCCGGAAAGGTACCCACAGGGGGGGTTGAGGAAGGGTTGCTGGAGCGCCATTCCAATGGCTCTCAGAGCCAGCACTCAAGACTCACCCTTCCGAGATCCCTGTGGAACGCCGGGACCTCTGTCACATGTACTCTAAATCATCCTAGCCTGCCCCCACAGCGTCTGATGGCCCTTAGAGAGCCAGCCGCCCAGGCACCAGTTAAGCTTAGCCTGAATCTGCTCGCCAGTAGTGATCCCCCAGAGGCCGCCAGCTGGCTCTTATGCGAAGTGTCCGGCTTTAGCCCGCCCAACATCTTGCTCATGTGGCTGGAGGACCAGCGAGAAGTGAACACCAGCGGCTTCGCTCCAGCCCGGCCCCCACCCCAGCCGGGTTCTACCACATTCTGGGCCTGGAGTGTCTTAAGGGTCCCAGCACCACCTAGCCCCCAGCCAGCCACATACACCTGTGTTGTGTCCCATGAAGATAGCAGGACCCTGCTAAATGCTTCTAGGAGTCTGGAGGTTTCCTACGTGACTGACCATT (SEQ ID NO: 48).
[00333] В одном аспекте трансмембранный домен может быть рекомбинантным, и в этом случае он содержит в основном гидрофобные остатки, такие как лейцин и валин. В одном аспекте на каждом конце рекомбинантного трансмембранного домена может находиться триплет из фенилаланина, триптофана и валина.
[00334] Необязательно, короткий олиго- или полипептидный линкер длиной от 2 до 10 аминокислот может образовывать связь между трансмембранным доменом и цитоплазматической областью CAR. Глицин-сериновый дублет обеспечивает особенно подходящий линкер. Например, в одном аспекте линкер содержит аминокислотную последовательность GGGGSGGGGS (SEQ ID NO: 49). В некоторых вариантах осуществления линкер кодируется нуклеотидной последовательностью GGTGGCGGAGGTTCTGGAGGTGGAGGTTCC (SEQ ID NO: 50).
[00335] В одном аспекте шарнирная область или спейсер содержат шарнирную область KIR2DS2.
Цитоплазматический домен
[00336] Цитоплазматический домен или область CAR включает внутриклеточный сигнальный домен. Внутриклеточный сигнальный домен обычно ответственен за активацию по меньшей мере одной из нормальных эффекторных функций иммунной клетки, в которую введен CAR. Термин "эффекторная функция" относится к специализированной функции клетки. Эффекторная функция T-клетки, например, может представлять собой цитолитическую активность или хелперную активность, включая секрецию цитокинов. Таким образом, термин "внутриклеточный сигнальный домен" относится к части белка, которая передает сигнал эффекторной функции и направляет клетку на выполнение специализированной функции. Хотя обычно можно использовать весь внутриклеточный сигнальный домен, во многих случаях не является обязательным использование всей цепи. Когда используют укороченную часть внутриклеточного сигнального домена, такую укороченную часть можно использовать вместо интактной цепи при условии, что она передает сигнал эффекторной функции. Таким образом, подразумевают, что термин "внутриклеточный сигнальный домен" включает любую укороченную часть внутриклеточного сигнального домена, достаточную для передачи сигнала эффекторной функции.
[00337] Примеры внутриклеточных сигнальных доменов для применения в CAR по изобретению включают цитоплазматические последовательности T-клеточного рецептора (TCR) и корецепторов, которые действуют совместно для инициации передачи сигнала после связывания рецептором антигена, а также любое производное или вариант этих последовательностей и любую рекомбинантную последовательность, которая имеет ту же функциональную способность.
[00338] Известно, что сигналы, индуцируемые TCR отдельно, являются недостаточными для полной активации T-клеток, и что также требуется вторичный и/или костимулирующий сигнал. Таким образом, можно считать, что активация T-клеток опосредуется двумя различными классами цитоплазматических сигнальных последовательностей: последовательности, которые инициируют антигензависимую первичную активацию через TCR (первичные внутриклеточные сигнальные домены), и последовательности, которые действуют независимым от антигена образом, обеспечивая вторичный или костимулирующий (вторичный цитоплазматический домен, например, костимулирующий домен).
[00339] Первичный сигнальный домен регулирует первичную активацию комплекса TCR либо стимулирующим путем, либо ингибиторным путем. Первичные внутриклеточные сигнальные домены, которые действуют стимулирующим образом, могут содержать сигнальные мотивы, которые известны как иммунорецепторные тирозиновые активирующие мотивы, или ITAM.
[00340] Примеры содержащих ITAM первичных внутриклеточных сигнальных доменов, которые особенно применимы в рамках изобретения, включают сигнальные домены CD3-зета, общего FcR-гамма (FCER1G), Fc-гамма RIIa, FcR-бета (Fc-эпсилон R1b), CD3-гамма, CD3-дельта, CD3-эпсилон, CD79a, CD79b, DAP10 и DAP12. В одном варианте осуществления CAR по изобретению содержит внутриклеточный сигнальный домен, например, первичный сигнальный домен CD3-зета.
[00341] В одном варианте осуществления первичный сигнальный домен содержит модифицированный домен ITAM, например, мутантный домен ITAM, который имеет измененную (например, увеличенную или сниженную) активность по сравнению с нативным доменом ITAM. В одном варианте осуществления первичный сигнальный домен содержит модифицированный ITAM-содержащий первичный внутриклеточный сигнальный домен, например, оптимизированный и/или укороченный ITAM-содержащий первичный внутриклеточный сигнальный домен. В одном варианте осуществления первичный сигнальный домен содержит один, два, три, четыре или более мотивов ITAM.
[00342] Следующие примеры молекул, содержащих первичный внутриклеточный сигнальный домен, которые являются особенно применимыми в рамках изобретения, включают DAP10, DAP12, и CD32.
[00343] Внутриклеточный сигнальный домен CAR может содержать сигнальный домен CD3-зета сам по себе или в комбинации с любым другим желаемым внутриклеточным сигнальным доменом(ами), пригодным в контексте CAR по изобретению. Например, внутриклеточный сигнальный домен CAR может содержать часть в виде цепи CD3-зета и костимулирующий сигнальный домен. Костсимулирующий сигнальный домен относится к части CAR, содержащей внутриклеточный домен костимулирующей молекулы. Костимулирующая молекула представляет собой молекулу клеточной поверхности, отличную от рецептора антигена или его лигандов, которая требуется для эффективного ответа лимфоцитов на антиген. Примеры таких молекул включают CD27, CD28, 4-1BB (CD137), OX40, CD30, CD40, PD1, ICOS, ассоциированный с функцией лимфоцитов антиген 1 (LFA-1), CD2, CD7, LIGHT, NKG2C, B7-H3, и лиганд, который специфически связывается с CD83, и т.п. Например, было продемонстрировано, что костимуляция CD27 повышает экспансию, эффекторную функцию и выживаемость клеток CART человека in vitro и усиливает живучесть и противоопухолевую активность T-клеток человека in vivo (Song et al. Blood. 2012; 119(3):696-706). Следующие примеры таких костимулирующих молекул включают CDS, ICAM-1, GITR, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160, CD19, CD4, CD8-альфа, CD8-бета, IL2R-бета, IL2R-гамма, IL7R-альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), NKG2D, CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp и CD19.
[00344] Внутриклеточные сигнальные последовательности в цитоплазматической части CAR по изобретению могут быть связаны друг с другом в случайном или определенном порядке. Необязательно короткий олиго- или полипептидный линкер, например, длиной от 2 до 10 аминокислот (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот), может образовывать связь между внутриклеточными сигнальными последовательностями. В одном варианте осуществления в качестве подходящего линкера можно использовать глицин-сериновый дублет. В одном варианте осуществления в качестве подходящего линкера можно использовать одну аминокислоту, например, аланин, глицин.
[00345] В одном аспекте внутриклеточный сигнальный домен сконструирован, чтобы он содержал два или более, например, 2, 3, 4, 5 или более, костимулирующих сигнальных доменов. В одном варианте осуществления два или более, например, 2, 3, 4, 5 или более, костимулирующих сигнальных доменов, разделены линкерной молекулой, например, линкерной молекулой, описанной в настоящем описании. В одном варианте осуществления внутриклеточный сигнальный домен содержит два костимулирующих сигнальных домена. В некоторых вариантах осуществления линкерная молекула представляет собой остаток глицина. В некоторых вариантах осуществления линкер представляет собой остаток аланина.
[0346] В одном аспекте внутриклеточный сигнальный домен сконструирован так, чтобы он содержал сигнальный домен CD3-зета и сигнальный домен CD28. В одном аспекте внутриклеточный сигнальный домен сконструирован, чтобы он содержал сигнальный домен CD3-зета и сигнальный домен 4-1BB. В одном аспекте сигнальный домен 4-1BB представляет собой сигнальный домен SEQ ID NO: 16. В одном аспекте сигнальный домен CD3-зета представляет собой сигнальный домен SEQ ID NO: 17.
[00347] В одном аспекте внутриклеточный сигнальный домен сконструирован так, чтобы он содержал сигнальный домен CD3-зета и сигнальный домен CD27. В одном аспекте сигнальный домен CD27 содержит аминокислотную последовательность QRRKYRSNKGESPVEPAEPCRYSCPREEEGSTIPIQEDYRKPEPACSP (SEQ ID NO: 51). В одном аспекте сигнальный домен CD27 кодируется последовательностью нуклеиновой кислоты AGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCC (SEQ ID NO: 52).
[00348] В одном аспекте экспрессирующая CAR клетка, описанная в настоящем описании, может дополнительно содержать второй CAR, например, второй CAR, который включает другой антигенсвязывающий домен, например, для той же мишени (CD19) или другой мишени (например, CD123 или мезотелин). В одном варианте осуществления, когда экспрессирующая CAR клетка содержит два или более различных CAR, антигенсвязывающие домены различных CAR могут быть такими, что антигенсвязывающие домены не взаимодействуют друг с другом. Например, клетка, экспрессирующая первый и второй CAR, может иметь антигенсвязывающий домен первого CAR, например, в качестве фрагмента, например scFv, который не образует связи с антигенсвязывающим доменом второго CAR, например, антигенсвязывающий домен второго CAR представляет собой VHH.
[00347] В другом аспекте экспрессирующая CAR клетка, описанная в настоящем описании, может дополнительно экспрессировать другое средство, например, средство, которое повышает активность экспрессирующей CAR клетки. Например, в одном варианте осуществления средство может представлять собой средство, которое ингибирует ингибиторную молекулу. Ингибиторные молекулы, например, PD1, в некоторых вариантах осуществления могут снижать способность экспрессирующей CAR клетки индуцировать иммунный эффекторный ответ. Примеры ингибиторных молекул включают PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета. В одном варианте осуществления средство, которое ингибирует ингибирующую молекулу, содержит первый полипептид, например, ингибиторную молекулу, связанный со вторым полипептидом, который дает положительный сигнал клетке, например, внутриклеточным сигнальным доменом, описанным в настоящем описании. В одном варианте осуществления средство содержит первый полипептид, например, из ингибиторной молекулы, такой как PD1, PD-L1, CTLA4, TIM3, CEACAM (e.g., CEACAM-1, CEACAM-3 and/or CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 или TGFR-бета, или фрагмент любой из них (например, меньшей мере часть внеклеточного домена любой из них), и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описанный в настоящем описании (например, содержащий костимулирующий домен (например, 41BB, CD27 или CD28, например, как описано в настоящем описании) и/или первичный сигнальный домен (например, сигнальный домен CD3-зета, описанный в настоящем описании)). В одном варианте осуществления средство содержит первый полипептид из PD1 или его фрагмента (например, по меньшей мере часть внеклеточного домена PD1), и второй полипептид внутриклеточного сигнального домена, описанный в настоящем описании (например, сигнальный домен CD28, описанный в настоящем описании, и/или сигнальный домен CD3-зета, описанный в настоящем описании). PD1 представляет собой ингибиторный представитель семейства рецепторов CD28, которое также включает CD28, CTLA-4, ICOS и BTLA. PD-1 экспрессируется на активированных B-клетках, T-клетках и миелоидных клетках (Agata et al. 1996 Int. Immunol 8:765-75). Было показано, что два лиганда для PD1, PD-L1 и PD-L2, подавляют активацию T-клеток при связывании с PD1 (Freeman et a. 2000 J Exp Med 192:1027-34; Latchman et al. 2001 Nat Immunol 2:261-8; Carter et al. 2002 Eur J Immunol 32:634-43). PD-L1 распространен в злокачественных опухолях человека (Dong et al. 2003 J Mol Med 81:281-7; Blank et al. 2005 Cancer Immunol. Immunother 54:307-314; Konishi et al. 2004 Clin Cancer Res 10:5094). Иммунную супрессию можно обращать вспять путем ингибирования локального взаимодействия PD1 с PD-L1.
[00348] В одном варианте осуществления средство содержит внеклеточный домен (ECD) ингибиторной молекулы, например, Programmed Death 1 (PD1), который может быть слит с трансмембранным доменом и внутриклеточными сигнальными доменами, такими как 41BB и CD3-зета (также обозначаемый в настоящем описании как PD1 CAR). В одном варианте осуществления PD1 CAR, когда его используют в комбинациях с CAR против CD19, описанным в настоящем описании, повышает живучесть T-клетки. В одном варианте осуществления CAR представляет собой PD1 CAR, содержащий внеклеточный домен PD1, указанный подчеркиванием в SEQ ID NO: 121. В одном варианте осуществления PD1 CAR содержит аминокислотную последовательность SEQ ID NO: 121.
[00349] Malpvtalllplalllhaarppgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvtttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr (SEQ ID NO: 121).
[00350] В одном варианте осуществления PD1 CAR содержит аминокислотную последовательность, представленную ниже (SEQ ID NO: 119).
[00351] pgwfldspdrpwnpptfspallvvtegdnatftcsfsntsesfvlnwyrmspsnqtdklaafpedrsqpgqdcrfrvtqlpngrdfhmsvvrarrndsgtylcgaislapkaqikeslraelrvterraevptahpspsprpagqfqtlvtttpaprpptpaptiasqplslrpeacrpaaggavhtrgldfacdiyiwaplagtcgvlllslvitlyckrgrkkllyifkqpfmrpvqttqeedgcscrfpeeeeggcelrvkfsrsadapaykqgqnqlynelnlgrreeydvldkrrgrdpemggkprrknpqeglynelqkdkmaeayseigmkgerrrgkghdglyqglstatkdtydalhmqalppr (SEQ ID NO: 119).
[00352] В одном варианте осуществления средство содержит последовательность нуклеиновой кислоты, кодирующую PD1 CAR, например, PD1 CAR, описанный в настоящем описании. В одном варианте осуществления последовательность нуклеиновой кислоты для PD1 CAR представлена ниже с PD1 ECD, подчеркнутым в SEQ ID NO: 120
[00353] atggccctccctgtcactgccctgcttctccccctcgcactcctgctccacgccgctagaccacccggatggtttctggactctccggatcgcccgtggaatcccccaaccttctcaccggcactcttggttgtgactgagggcgataatgcgaccttcacgtgctcgttctccaacacctccgaatcattcgtgctgaactggtaccgcatgagcccgtcaaaccagaccgacaagctcgccgcgtttccggaagatcggtcgcaaccgggacaggattgtcggttccgcgtgactcaactgccgaatggcagagacttccacatgagcgtggtccgcgctaggcgaaacgactccgggacctacctgtgcggagccatctcgctggcgcctaaggcccaaatcaaagagagcttgagggccgaactgagagtgaccgagcgcagagctgaggtgccaactgcacatccatccccatcgcctcggcctgcggggcagtttcagaccctggtcacgaccactccggcgccgcgcccaccgactccggccccaactatcgcgagccagcccctgtcgctgaggccggaagcatgccgccctgccgccggaggtgctgtgcatacccggggattggacttcgcatgcgacatctacatttgggctcctctcgccggaacttgtggcgtgctccttctgtccctggtcatcaccctgtactgcaagcggggtcggaaaaagcttctgtacattttcaagcagcccttcatgaggcccgtgcaaaccacccaggaggaggacggttgctcctgccggttccccgaagaggaagaaggaggttgcgagctgcgcgtgaagttctcccggagcgccgacgcccccgcctataagcagggccagaaccagctgtacaacgaactgaacctgggacggcgggaagagtacgatgtgctggacaagcggcgcggccgggaccccgaaatgggcgggaagcctagaagaaagaaccctcaggaaggcctgtataacgagctgcagaaggacaagatggccgaggcctactccgaaattgggatgaagggagagcggcggaggggaaaggggcacgacggcctgtaccaaggactgtccaccgccaccaaggacacatacgatgccctgcacatgcaggcccttccccctcgc (SEQ ID NO: 120).
[00354] В другом аспекте настоящее изобретение относится к популяции экспрессирующих CAR клеток, например, клеток CART. В некоторых вариантах осуществления популяция экспрессирующих CAR клеток содержит смесь клеток, экспрессирующих различные CAR. Например, в одном варианте осуществления популяция CAR-экспрессирующих клеток может включать первую клетку, экспрессирующую CAR, имеющую связывающий домен против CD19, описанный в настоящем описании, и вторую клетку, экспрессирующую CAR, имеющую другой связывающий CD19 домен, например, CD19-связывающий домен, описанный в настоящем описании, который отличается от CD19-связывающего домена в CAR, экспрессируемом первой клеткой. В качестве другого примера популяция экспрессирующих CAR клеток может включать первую клетку, экспрессирующую CAR, которая включает CD19-связывающий домен, например, как описано в настоящем описании, и вторую клетку, экспрессирующую CAR, которая включает антигенсвязывающий домен, для мишени, отличной от CD19 (например, CD123). В одном варианте осуществления популяция CAR-экспрессирующих клеток включает, например, первую клетку, экспрессирующую CAR, которая включает первичный внутриклеточный сигнальный домен, и вторую клетку, экспрессирующую CAR, которая включает вторичный сигнальный домен.
[00355] В другом аспекте настоящее изобретение относится популяции клеток, где по меньшей мере одна клетка в популяции экспрессирует CAR, имеющий CD19-связывающий домен, описанный в настоящем описании, а вторая клетка экспрессирует другое средство, например, средство, которое повышает активность или функцию экспрессирующей CAR клетки. Например, в одном варианте осуществления средство может представлять собой средство, которое ингибирует ингибиторную молекулу. В некоторых вариантах осуществления ингибиторные молекулы, например, могут снижать способность экспрессирующей CAR клетки индуцировать иммунный эффекторный ответ. Примеры ингибиторных молекул включают PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 или TGFR-бета. В одном варианте осуществления средство, которое ингибирует ингибиторную молекулу, содержит первый полипептид, например, ингибиторную молекулу, ассоциированную со вторым полипептидом, которая дает сигнал клетке, например, внутриклеточный сигнальный домен, описанный в настоящем описании. В одном варианте осуществления средство содержит первый полипептид, например, из ингибиторной молекулы, такой как PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 или TGFR-бета, или фрагмент любого из них (например, по меньшей мере часть внеклеточного домена любого из них), и второй полипептид, который представляет собой внутриклеточный сигнальный домен, описанный в настоящем описании (например, содержащий костимулирующий домен (например, 41BB, CD27 или CD28, например, как описано в настоящем описании) и/или первичный сигнальный домен (например, сигнальный домен CD3-зета, описанный в настоящем описании). В одном варианте осуществления средство содержит первый полипептид PD1 или его фрагмент (например, по меньшей мере часть внеклеточного домена PD1), и второй полипептид внутриклеточного сигнального домена, описанного в настоящем описании (например, сигнальный домен CD28, описанный в настоящем описании, и/или сигнальный домен CD3-зета, описанный в настоящем описании).
Регулируемые химерные рецепторы антигенов
[00356] В некоторых вариантах осуществления является желательным регулируемый CAR (RCAR), где активность CAR можно контролировать, для оптимизации безопасности и эффективности терапии CAR. Существует много путей регуляции активности CAR. Например, индуцибельный апоптоз с использованием, например, каспазы, слитой с доменом димеризации (см., например, Di Stasa et al., N Engl. J. Med. 2011 Nov. 3; 365(18):1673-1683), можно использовать в качестве переключателя безопасности при терапии CAR по настоящему изобретению. В одном варианте осуществления клетки (например, T-клетки или NK-клетки), экспрессирующие CAR по настоящему изобретению, кроме того, содержат индуцибельный переключатель апоптоза, в котором каспаза человека (например, каспаза 9) или ее модифицированная версия является слитой с модификацией белка FKB человека, которая позволяет зависимую от условий димеризацию. В присутствии низкомолекулярного соединения, такого как рапалог (например, AP 1903, AP20187), индуцибельная каспаза (например, каспаза 9) активирует и приводит к быстрому апоптозу и гибели клеток (например, T-клеток или NK-клеток), экспрессирующих CAR по настоящему изобретению. Примеры индуцибельного переключателя апоптоза на основе каспазы (или один или несколько аспектов такого переключателя) описаны, например, в US2004040047; US20110286980; US20140255360; WO1997031899; WO2014151960; WO2014164348; WO2014197638; WO2014197638; все из которых включены в настоящее описание в качестве ссылок.
[00357] В одном аспекте RCAR содержит набор полипептидов, как правило, два в наиболее простых вариантах осуществления, в которых компоненты стандартного CAR, описанного в настоящем описании, например, антигенсвязывающий домен и внутриклеточный сигнальный домен, разделены на отдельные полипептиды или представители. В некоторых вариантах осуществления набор полипептидов включает переключатель димеризации, который в присутствии молекулы димеризации может связывать полипептиды друг с другом, например, может связывать антигенсвязывающий домен с внутриклеточным сигнальным доменом. В одном варианте осуществления в CAR по настоящему изобретению используется переключатель димеризации, такой как переключатели димеризации, описанные, например, в WO2014127261, которая включена в настоящем описании в качестве ссылки.
[00358] В одном аспекте RCAR содержит два полипептида или представителя: 1) внутриклеточный сигнальный представитель, содержащий внутриклеточный сигнальный домен, например, первичный внутриклеточный сигнальный домен, описанный в настоящем описании, и первый домен переключения; 2) антигенсвязывавющий представитель, содержащий антигенсвязывающий домен, например, который нацелен на CD19, как описано в настоящем описании, и второй домен переключения. Необязательно, RCAR содержит трансмембранный домен, описанный в настоящем описании. В одном варианте осуществления трансмембранный домен может быть расположен на внутриклеточном сигнальном представителе, на антигенсвязывающем представителе, или на обоих из них. (Если нет иных указаний, когда представители или элементы RCAR описаны в настоящем описании, порядок может быть таким, как представлено, однако также включены другие порядки. Иными словами, в одном варианте осуществления порядок является таким, как указано в тексте, а в других вариантах осуществления порядок может отличаться. Например, порядок элементов на одной стороне трансмембранной области может отличаться от приведенного в качестве примера, например, расположение домена переключения относительно внутриклеточного сигнального домена может отличаться (например, может быть обратным).
[00359] В одном варианте осуществления первый и второй домены переключения могут образовывать внутриклеточный или внеклеточный переключатель димеризации. В одном варианте осуществления переключатель димеризации может представлять собой переключатель гомодимеризации, например, где первый и второй домены переключения являются одинаковыми, или переключатель гетеродимеризации, например, где первый и второй домены переключения отличаются друг от друга.
[00360] В вариантах осуществления RCAR может содержать "множественный переключатель". Множественный переключатель может содержать домены-переключатели гетеродимеризации или домены-переключатели гомодимеризации. Множественный переключатель содержит множество, например, 2, 3, 4, 5, 6, 7, 8, 9 или 10, доменов переключения, независимо, на первом представителе, например, на антигенсвязывающем представителе, и на втором представителе, например, на внутриклеточном сигнальном представителе. В одном варианте осуществления первый представитель может содержать множество первых доменов переключения, например, доменов переключения на основе FKBP, и второй представитель может содержать множество вторых доменов переключения, например, доменов переключения на основе FRB. В одном варианте осуществления первый представитель может содержать первый и второй домены переключения, например, домен переключения на основе FKBP и домен переключения на основе FRB, и второй представитель может содержать первый и второй домены переключения, например, домен переключения на основе FKBP и домен переключения на основе FRB.
[00361] В одном варианте осуществления внутриклеточный сигнальный представитель содержит один или несколько внутриклеточных сигнальных доменов, например, первичный внутриклеточный сигнальный домен и один или несколько костимулирующих сигнальных доменов.
[00362] В одном варианте осуществления антигенсвязывающий представитель может содержать один или несколько внутриклеточных сигнальных доменов, например, один или несколько костимулирующих сигнальных доменов. В одном варианте осуществления антигенсвязывающий представитель содержит множество, например, 2 или 3, костимулирующих сигнальных доменов, описанных в настоящем описании, например, выбранных из 41BB, CD28, CD27, ICOS и OX40, и в вариантах осуществления не содержит первичного внутриклеточного сигнального домена. В одном варианте осуществления антигенсвязывающий представитель содержит следующие костимулирующие сигнальные домены от внеклеточного к внутриклеточному: 41BB-CD27; 41BB-CD27; CD27-41BB; 41BB-CD28; CD28-41BB; OX40-CD28; CD28-OX40; CD28-41BB или 41BB-CD28. В таких вариантах осуществления внутриклеточный связывающий представитель содержит домен CD3-зета. В одном таком варианте осуществления RCAR содержит (1) антигенсвязывающий представитель, содержащий антигенсвязывающий домен, трансмембранный домен, и два костимулирующих домена и первый домен переключения; и (2) внутриклеточный сигнальный домен, содержащий трансмембранный домен или связывающий с мембраной домен, и по меньшей мере один первичный внутриклеточный сигнальный домен, и второй домен переключения.
[00363] Вариант осуществления относится к RCAR, где антигенсвязывающий представитель не связан с поверхностью клетки CAR. Это позволяет клетке, имеющей внутриклеточный сигнальный представитель, удобным образом образовывать пару с одним или несколькими антигенсвязывающими доменами без трансформации клетки последовательностью, которая кодирует антигенсвязывающий представитель. В таких вариантах осуществления RCAR содержит: 1) внутриклеточный сигнальный представитель, содержащий: первый домен переключения, трансмембранный домен, внутриклеточный сигнальный домен, например, первичный внутриклеточный сигнальный домен, и первый домен переключения; и 2) антигенсвязывающий представитель, содержащий: антигенсвязывающий домен и второй домен переключения, где антигенсвязывающий представитель не содержит трансмембранный домен или связывающий с мембраной домен, и необязательно не содержит внутриклеточный сигнальный домен. В некоторых вариантах осуществления RCAR может дополнительно содержать 3) второй антигенсвязывающий представитель, содержащий: второй антигенсвязывающий домен, например, второй антигенсвязывающий домен, который связывает отличающийся антиген, чем у антигенсвязывающего домена; и второй домен переключения.
[00364] Также в рамках настоящего изобретения предусматриваются RCAR, где антигенсвязывающий представитель обладает способностью биспецифической активации и нацеливания. В этом варианте осуществления антигенсвязывающий представитель может содержать множество, например, 2, 3, 4 или 5 антигенсвязывающих доменов, например, scFv, где каждый антигенсвязывающий домен связывается с антигеном-мишенью, например, различными антигенами или одним антигеном, например, одним и тем же или различными эпитопами на одном антигене. В одном варианте осуществления множество антигенсвязывающих доменов располагаются тандемно, и необязательно между антигенсвязывающими доменами находится линкер или шарнирная область. Пригодные линкеры и шарнирные области описаны в настоящем описании.
[00365] Вариант осуществления относится к RCAR, имеющим конфигурацию, которая позволяет переключение пролиферации. В этом варианте осуществления RCAR содержит: 1) внутриклеточный сигнальный представитель, содержащий: необязательно трансмембранный домен или связывающий с мембраной домен; один или несколько костимулирующих сигнальных доменов, например, выбранных из 41BB, CD28, CD27, ICOS и OX40, и домен переключения; и 2) антигенсвязывающий представитель, содержащий: антигенсвязывающий домен, трансмембранный домен, и первичный внутриклеточный сигнальный домен, например, домен CD3-зета, где антигенсвязывающий представитель не содержит домен переключения или не содержит домен переключения, который димеризуется с доменом переключения на внутриклеточном сигнальном представителе. В одном варианте осуществления антигенсвязывающий представитель не содержит костимулирующий сигнальный домен. В одном варианте осуществления внутриклеточный сигнальный представитель содержит домен переключения из переключателя гомодимеризации. В одном варианте осуществления внутриклеточный сигнальный представитель содержит первый домен переключения переключателя гетеродимеризации и RCAR содержит второй внутриклеточный сигнальный представитель, который содержит второй домен переключения переключателя гетеродимеризации. В таких вариантах осуществления второй внутриклеточный сигнальный представитель содержит те же внутриклеточные сигнальные домены, что и внутриклеточный сигнальный представитель. В одном варианте осуществления переключатель димеризации является внутриклеточным. В одном варианте осуществления переключатель димеризации является внеклеточным.
[00366] В любой из конфигураций RCAR, описанных в настоящем описании, первый и второй домены переключения содержат переключатель на основе FKBP/FRB, как описано в настоящем описании.
[00367] Также в настоящем описании описаны клетки, содержащие RCAR, описанный в настоящем описании. Любую клетку, которая модифицирована способами инженерии для экспрессии RCAR, можно использовать в качестве клетки RCARX. В одном варианте осуществления клетка RCARX представляет собой T-клетку и ее обозначают как RCART-клетка. В одном варианте осуществления RCARX-клетка представляет собой NK-клетку и ее обозначают как RCARN-клетка.
[00368] Также в рамках настоящего изобретения предусматриваются нуклеиновые кислоты и векторы, содержащие кодирующие RCAR последовательности. Последовательность, кодирующая различные элементы RCAR, может располагаться на одной молекуле нуклеиновой кислоты, например, на одной плазмиде или векторе, например, вирусном векторе, например, лентивирусном векторе. В одном варианте осуществления (i) последовательность, кодирующая антигенсвязывающий представитель, и (ii) последовательность, кодирующая внутриклеточный сигнальный представитель, может присутствовать на одной нуклеиновой кислоте, например, векторе. Продукции соответствующих белков можно достигать, например, с использованием отдельных промоторов или с использованием бицистронного продукта транскрипции (который может обеспечить продукцию двух белков посредством расщепления единого продукта трансляции или посредством трансляции двух отдельных белковых продуктов). В одном варианте осуществления между (i) и (ii) расположена последовательность, кодирующая расщепляемый пептид, например, последовательность P2A или F2A. В одном варианте осуществления между (i) и (ii) расположена последовательность, кодирующая IRES, например, IRES EMCV или EV71. В этих вариантах осуществления (i) и (ii) транскрибируются в качестве единой РНК. В одном варианте осуществления с (i) функционально связан первый промотор и с (ii) функционально связан второй промотор, так что (i) и (ii) транскрибируются в качестве отдельных мРНК.
[00369] Альтернативно последовательность, кодирующая различные элементы RCAR, может быть расположена на различных молекулах нуклеиновых кислот, например, различных плазмидах или векторах, например, вирусных векторах, например, лентивирусных векторах. Например, последовательность (i), кодирующая антигенсвязывающий представитель, может присутствовать на первой нуклеиновой кислоте, например, первом векторе, и последовательность (ii), кодирующая внутриклеточный сигнальный представитель, может присутствовать на второй нуклеиновой кислоте, например, втором векторе.
Переключатели димеризации
[00370] Переключатели димеризациии могут быть нековалентными или ковалентными. В нековалентном переключателе димеризации молекула димеризации обеспечивает нековалентное взаимодействие между доменами переключения. В ковалентном переключателе димеризации молекула димеризации обеспечивает ковалентное взаимодействие между доменами переключения.
[00371] В одном варианте осуществления RCAR содержит переключатель димеризации на основе FKBP/FRAP или FKBP/FRB. FKBP12 (FKBP, или связывающий FK506 белок) представляет собой распространенный цитоплазматический белок, который служит в качестве первоначальной внутриклеточной мишени для природного иммунодепрессивного лекарственного средства рапамицина. Рапамицин связывается с FKBP и с большим гомологом PI3K FRAP (RAFT, mTOR). FRB представляет собой часть FRAP из 93 аминокислот, которая является достаточной для связывания комплекса FKBP-рапамицин (Chen, J., Zheng, X. F., Brown, E. J. & Schreiber, S. L. (1995) Identification of an 11-kDa FKBP12- rapamycin-binding domain within the 289-kDa FKBP12- rapamycin-associated protein and characterization of a critical serine residue. Proc Natl Acad Sci U S A 92: 4947-51.)
[00372] В вариантах осуществления в переключателе на основе FKBP/FRAP, например, FKBP/FRB может использоваться молекула димеризации, например, рапамицин или аналог рапамицина.
[00373] Аминокислотная последовательность FKBP является следующей:
D V P D Y A S L G G P S S P K K K R K V S R G V Q V E T I S P G D G R T F P K R G Q T C V V H Y T G M L E D G K K F D S S R D R N K P F K F M L G K Q E V I R G W E E G V A Q M S V G Q R A K L T I S P D Y A Y G A T G H P G I I P P H A T L V F D V E L L K L E T S Y (SEQ ID NO: 122)
[00374] В вариантах осуществления домен переключения FKBP может содержать фрагмент FKBP, обладающий способностью связывать FRB, или его фрагмент или аналог в присутствии рапамицина или аналога, например, подчеркнутую часть SEQ ID NO: 122, которая представляет собой:
V Q V E T I S P G D G R T F P K R G Q T C V V H Y T G M L E D G K K F D S S R D R N K P F K F M L G K Q E V I R G W E E G V A Q M S V G Q R A K L T I S P D Y A Y G A T G H P G I I P P H A T L V F D V E L L K L E T S (SEQ ID NO: 122)
[00375] Аминокислотная последовательность FRB является следующей:
ILWHEMWHEG LEEASRLYFG ERNVKGMFEV LEPLHAMMER GPQTLKETSF NQAYGRDLME AQEWCRKYMK SGNVKDLTQA WDLYYHVFRR ISK (SEQ ID NO: 124)
[00376] "Переключатель на основе FKBP/FRAP, например, FKBP/FRB", как этот термин используют в настоящем описании, относится к переключателю димеризации, содержащему: первый домен переключения, который содержит фрагмент FKBP или его аналог, обладающие способностью связываться с FRB, или его фрагментом или аналогом, в присутствии рапамицина или рапалога, например RAD001, и обладает по меньшей мере 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентичностью с или отличается не более чем на 30, 25, 20, 15, 10, 5, 4, 3, 2 или 1 аминокислотный остаток от последовательности FKBP SEQ ID NO: 122 или 123; и второй домен переключения, который содержит фрагмент FRB или его аналоги, обладающие способностью связываться с FRB, или его фрагментом или аналогом, в присутствии рапамицина или рапалога, и обладает по меньшей мере 70, 75, 80, 85, 90, 95, 96, 97, 98 или 99% идентичностью с или отличается не более чем на 30, 25, 20, 15, 10, 5, 4, 3, 2 или 1 аминокислотный остаток от последовательности FRB SEQ ID NO: 124. В одном варианте осуществления RCAR, описанный в настоящем описании, содержит один домен переключения, который содержит аминокислотные остатки, описанные в SEQ ID NO: 122 (или SEQ ID NO: 123), и один домен переключения, который содержит аминокислотные остатки, описанные в SEQ ID NO: 124.
[00377] В вариантах осуществления переключатель димеризации FKBP/FRB содержит модифицированный домен переключения FRB, который проявляет измененное, например усиленное, образование комплекса между доменом переключения на основе FRB, например, модифицированным доменом переключения FRB, доменом переключения на основе FKBP и молекулой димеризации, например, рапамицином или рапалогом, например RAD001. В одном варианте осуществления модифицированный домен переключения FRB содержит одну или несколько мутаций, например, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более, выбранных из мутаций в положении(ях) аминокислот L2031, E2032, S2035, R2036, F2039, G2040, T2098, W2101, D2102, Y2105 и F2108, где аминокислота дикого типа заменена любой другой встречающейся в природе аминокислотой. В одном варианте осуществления мутантный FRB содержит мутацию в положении E2032, где E2032 заменен на фенилаланин (E2032F), метионин (E2032M), аргинин (E2032R), валин (E2032V), тирозин (E2032Y), изолейцин (E2032I), например, SEQ ID NO: 125, или лейцин (E2032L), например SEQ ID NO: 126. В одном варианте осуществления мутантный FRB содержит мутацию T2098, где T2098 заменен на фенилаланин (T2098F) или лейцин (T2098L), например, SEQ ID NO: 127. В одном варианте осуществления мутантный FRB содержит мутацию в E2032 и в T2098, где E2032 заменен на любую аминокислоту и где T2098 заменен на любую аминокислоту, например, SEQ ID NO: 128. В одном варианте осуществления мутантный FRB содержит мутацию E2032I и T2098L, например, SEQ ID NO: 129. В одном варианте осуществления мутантный FRB содержит мутацию E2032L и T2098L, например, SEQ ID NO: 130.
[00378] Таблица 13. Иллюстративный мутантный FRB, обладающий увеличенной аффинностью в отношении молекулы димеризации.
|
[00379] Другие пригодные переключатели димеризации включают переключатель димеризации на основе GyrB-GyrB, переключатель димеризации на основе гибберелина, переключатель димеризации метка/связывающий элемент, переключатель димеризации halo-метка/snap-метка. Согласно руководству, представленному в настоящем описании, такие переключатели и соответствующие молекулы димеризации будут очевидны специалисту в данной области.
Молекула димеризации
[00380] Ассоциацию между доменами переключения обеспечивает молекула димеризации. В присутствии молекулы димеризации взаимодействие или ассоциация между такими доменами обеспечивает передачу сигнала между полипептидом, связанным, например, слитым, с первым доменом переключения, и полипептидом, связанным, например, слитым, со вторым доменом переключения. В присутствии неограничивающих уровней молекулы димеризации передача сигнала возрастает в 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 5, 10, 50, 100 раз, например, при измерении в системе, описанной в настоящем описании.
[00381] Рапамицин и аналоги рапамицина (иногда называемые рапалогами), например, RAD001, можно использовать в качестве молекул димеризации в переключателе димеризации на основе FKBP/FRB, описанном в настоящем описании. В одном варианте осуществления молекула димеризации может быть выбрана из рапамицина (сиролимус), RAD001 (эверолимус), зотапролимуса, темсиролимуса, AP-23573 (ридафоролимус), биолимуса и AP21967. Дополнительные аналоги рапамицина, пригодные для применения с переключателями димеризации на основе FKBP/FRB, описаны ниже в разделе "Комбинированная терапия", или в подразделе под названием "Иллюстративные ингибиторы mTOR".
Расщепленные CAR
[00382] В некоторых вариантах осуществления в CAR-экспрессирующих клетках используется расщепленный CAR. Подход расщепленных CAR более подробно описан в публикациях WO2014/055442 и WO2014/055657. В кратком изложении, система расщепленного CAR включает клетку, экспрессирующую первый CAR, обладающий первым антигенсвязывающим доменом и костимулирующим доменом (например, 41BB), и клетка также экспрессирует второй CAR, обладающий вторым антигенсвязывающим доменом и внутриклеточным сигнальным доменом (например, CD3-зета). Когда клетка встречает первый антиген, костимулирующий домен активируется, и клетка пролиферирует. Когда клетка встречает второй антиген, внутриклеточный сигнальный домен активируется и начинается активность уничтожения клеток. Таким образом, CAR-экспрессирующая клетка полностью активируется в присутствии обоих антигенов.
Трансфекция РНК
[00383] В настоящем описании описаны способы получения транскрибируемой in vitro РНК CAR. Настоящее изобретение также включает кодирующую CAR конструкцию РНК, которая может быть прямо трансфицирована в клетку. Способ получения мРНК для применения в трансфекции может вовлекать транскрипцию in vitro (IVT) матрицы с использованием специально сконструированных праймеров с последующим присоединением поли-A, с получением конструкции, содержащей 3'- и 5'-нетранслируемую последовательность ("UTR"), 5'-кэп и/или участок внутренней посадки рибосомы (IRES), нуклеиновую кислоту, подлежащую экспрессии, и поли-A хвостовую часть, как правило, длиной 50-2000 оснований (SEQ ID NO: 118). РНК, полученной таким образом, можно эффективно трансфицировать различные типы клеток. В одном аспекте матрица включает последовательности для CAR.
[00384] В одном аспекте CAR против CD19 кодируется матричной РНК (мРНК). В одном аспекте мРНК, кодирующую CAR против CD19, вводят в иммунную эффекторную клетку, например, T-клетку или NK-клетку, для получения CAR-экспрессирующей клетки, например, CART-клетки или CAR NK-клетки.
[00385] В одном варианте осуществления транскрибируемую in vitro РНК CAR можно вводить в клетку посредством временной трансфекции. РНК продуцируют путем транскрипции in vitro с использованием матрицы, полученной посредством полимеразной цепной реакции (ПЦР). Представляющую интерес ДНК из любого источника можно прямо конвертировать способом ПЦР в матрицу для синтеза мРНК in vitro с использованием подходящих праймеров и РНК-полимеразы. Источником ДНК может быть, например, геномная ДНК, плазмидная ДНК, фаговая ДНК, кДНК, синтетическая последовательность ДНК или любой другой подходящий источник ДНК. Желаемой матрицей для транскрипции in vitro является CAR по настоящему изобретению. Например, матрица для РНК CAR содержит внеклеточную область, содержащую одноцепочечный вариабельный домен противоопухолевого антитела; шарнирную область, трансмембранный домен (например, трансмембранный домен CD8a); и цитоплазматическую область, которая включает внутриклеточный сигнальный домен, например, содержащий сигнальный домен CD3-зета и сигнальный домен 4-1BB.
[00386] В одном варианте осуществления ДНК для применения в ПЦР содержит открытую рамку считывания. ДНК может происходить из встречающейся в природе последовательности ДНК генома организма. В одном варианте осуществления нуклеиновая кислота может включать некоторые или все из 5'- и/или 3'-нетранслируемых областей (UTR). Нуклеиновая кислота может включать экзоны и интроны. В одном варианте осуществления ДНК для применения в ПЦР представляет собой последовательность нуклеиновой кислоты человека. В другом варианте осуществления ДНК для применения в ПЦР представляет собой последовательность нуклеиновой кислоты человека, включающую 5'- и 3'-UTR. Альтернативно ДНК может представлять собой искусственную последовательность ДНК, которая в норме не экспрессируется во встречающемся в природе организме. Иллюстративная искусственная последовательность ДНК представляет собой последовательность ДНК, которая содержит части генов, которые лигированы с образованием открытой рамки считывания, которая кодирует слитый белок. Части ДНК, которые лигированы вместе, могут быть из одного организма или из более чем одного организма.
[00387] ПЦР используют для получения матрицы для транскрипции in vitro мРНК, которую используют для трансфекции. Способы проведения ПЦР хорошо известны в данной области. Праймеры для применения в ПЦР конструируют так, чтобы они имели области, которые по существу комплементарны областям ДНК, используемым в качестве матрицы для ПЦР. "По существу комплементарный", как используют в настоящем описании, относится к последовательностям нуклеотидов, где большинство или все из оснований в последовательности праймеров являются комплементарными, или одно или несколько оснований являются некомплементарными или несоответствующими друг другу. По существу комплементарные последовательности способны к отжигу или гибридизации с предполагаемой ДНК-мишенью в условиях отжига, используемых для ПЦР. Праймеры можно конструировать, чтобы они были по существу комплементарными любой части ДНК-матрицы. Например, праймеры можно конструировать, чтобы они амплифицировали часть нуклеиновой кислоты, которая обычно транскрибируется в клетках (открытая рамка считывания), включая 5'- и 3'-UTR. Праймеры также можно конструировать для амплификации части нуклеиновой кислоты, которая кодирует конкретный представляющий интерес домен. В одном варианте осуществления праймеры конструируют для амплификации кодирующей области кДНК человека, включая все или части 5'- и 3'-UTR. Праймеры, пригодные для ПЦР, можно получать способами синтеза, которые хорошо известны в данной области. "Прямые праймеры" представляют собой праймеры, которые содержат область нуклеотидов, которая по существу комплементарна нуклеотидам на ДНК-матрице, являющейся вышележащей относительно последовательности ДНК, подлежащей амплификации. "Вышележащий" используют в настоящем описании для обозначения положения с 5ʹ-стороны от последовательности ДНК, подлежащей амплификации, относительно кодирующей цепи. "Обратные праймеры" представляют собой праймеры, которые содержат область нуклеотидов, по существу комплементарную двухцепочечной ДНК-матрице, которая является нижележащей относительно последовательности ДНК, подлежащей амплификации. "Нижележащий" используют в настоящем описании для обозначения положения с 3'-стороны от последовательности ДНК, подлежащей амплификации, относительно кодирующей цепи.
[00388] В способах, описанных в настоящем описании, можно использовать любую ДНК-полимеразу, пригодную для ПЦР. Реагенты и полимераза являются коммерчески доступными из ряда источников.
[00389] Также можно использовать химические структуры, обладающие способностью повышать стабильность и/или эффективность трансляции. Предпочтительно РНК имеет 5'- и 3'-UTR. В одном варианте осуществления 5'-UTR имеет длину от одного до 3000 нуклеотидов. Длину последовательностей 5'- и 3'-UTR для присоединения к кодирующей области можно изменять различными способами, включая, но не ограничиваясь ими, конструирование праймеров для ПЦР которые гибридизуются с различными областями UTR. С использованием этого подхода специалист в данной области может модифицировать длину 5'- и 3'-UTR, требуемую для достижения оптимальной эффективности трансляции после трансфекции транскрибированной РНК.
[00390] 5' и 3'-UTR могут быть представлять собой встречающиеся в природе эндогенные 5'- и 3'-UTR для представляющей интерес нуклеиновой кислоты. Альтернативно последовательности UTR, которые являются эндогенными для представляющей интерес нуклеиновой кислоты, можно добавлять путем включения последовательностей UTR в прямые и обратные праймеры или посредством любых других модификаций матрицы. Использование последовательностей UTR, которые не являются эндогенными для представляющей интерес нуклеиновой кислоты, может быть полезным для модификации стабильности и/или эффективности трансляции РНК. Например, известно, что AU-богатые элементы в последовательностях 3'-UTR могут снижать стабильность мРНК. Таким образом, 3'-UTR можно выбирать или конструировать для повышения стабильности транскрибируемой РНК, исходя из свойств UTR, которые хорошо известны в данной области.
[00391] В одном варианте осуществления 5'-UTR может содержать последовательность Козака из эндогенной нуклеиновой кислоты. Альтернативно, когда 5'-UTR, которая не является эндогенной для представляющей интерес нуклеиновой кислоты, добавляют способом ПЦР, как описано выше, консенсусную последовательность Козака можно переконструировать путем добавления последовательности 5'-UTR. Последовательности Козака могут повышать эффективность трансляции некоторых РНК-транскриптов, но, по-видимому, не требуются для обеспечения эффективной трансляции всех РНК. Требование наличия последовательностей Козака для многих мРНК известно в данной области. В других вариантах осуществления 5'-UTR может представлять собой 5ʹ-UTR РНК-вируса, РНК-геном которого стабилен в клетках. В других вариантах осуществления в 3'- или 5'-UTR можно использовать различные нуклеотидные аналоги для препятствования деградации мРНК экзонуклеазами.
[00392] Для обеспечения синтеза РНК с ДНК-матрицы без необходимости в клонировании генов промотор транскрипции должен быть связан с ДНК-матрицей выше последовательности, подлежащей транскрипции. Когда последовательность, которая функционирует в качестве промотора РНК-полимеразы, добавляют к 5'-концу прямого праймера, промотор РНК-полимеразы включается в продукт ПЦР выше открытой рамки считывания, подлежащей транскрипции. В одном предпочтительном варианте осуществления промотор представляет собой промотор полимеразы T7, как описано в настоящем описании. Другие пригодные промоторы включают, но не ограничиваются ими, промоторы РНК-полимеразы T3 и SP6. Консенсусные нуклеотидные последовательности для промоторов T7, T3 и SP6, известны в данной области.
[00393] В предпочтительном варианте осуществления мРНК имеет как кэп на 5'-конце, так и 3'-поли(A)-хвостовую часть, которая определяет связывание рибосом, инициацию трансляции и стабильность мРНК в клетке. На кольцевой ДНК-матрице, например, плазмидной ДНК, РНК-полимераза продуцирует длинный конкатемерный продукт, который не пригоден для экспрессии в эукариотических клетках. Транскрипция плазмидной ДНК, линеаризованной на конце 3'-UTR, приводит к мРНК нормального размера, которая не является эффективной при эукариотической трансфекции, даже если она полиаденилируется после транскрипции.
[00394] На линейной ДНК-матрице РНК-полимераза фага T7 может удлинять 3'-конец транскрипта за пределы последнего основания матрицы (Schenborn and Mierendorf, Nuc Acids Res., 13:6223-36 (1985); Nacheva and Berzal-Herranz, Eur. J. Biochem., 270:1485-65 (2003).
[00395] Общепринятым способом встраивания участков поли-A/T в ДНК-матрицу является молекулярное клонирование. Однако последовательность поли-A/T, встроенная в плазмидную ДНК, может приводить к нестабильности плазмиды, поэтому плазмидные ДНК-матрицы, полученные из бактериальных клеток, часто в высокой степени контаминированы делециями и другими аберрациями. Это делает процедуру клонирования не только трудоемкой и времязатратной, но часто и ненадежной. Поэтому является в высокой степени желаемым способ, который позволит конструирование ДНК-матриц с 3'-участками поли-A/T без клонирования.
[00396] Сегмент поли-A/T в транскрипционной ДНК-матрице можно продуцировать в процессе ПЦР с использованием обратного праймера, содержащего поли-T-хвостовую часть, такую как 100T-хвостовая часть (SEQ ID NO: 110) (размер может составлять 50-5000 T (SEQ ID NO: 111)), или после ПЦР любым другим способом, включая, но не ограничиваясь ими, лигирование ДНК или рекомбинацию in vitro. Поли-(A)-хвостовые части также обеспечивают стабильность РНК и снижают их деградацию. Как правило, длина поли-(A)-хвостовой части положительно коррелирует со стабильностью транскрибированной РНК. В одном варианте осуществления поли(A)-хвостовая часть имеет от 100 до 5000 остатков аденозина (SEQ ID NO: 112).
[00397] Поли(A)-хвостовые части РНК, кроме того, можно удлинять после транскрипции in vitro с использованием поли(A)-полимеразы, такой как поли-A-полимераза E. coli (E-PAP). В одном варианте осуществления увеличение длины поли(A)-хвостовой части от 100 нуклеотидов до 300-400 нуклеотидов (SEQ ID NO: 113) приводит приблизительно к двукратному повышению эффективности трансляции РНК. Кроме того, присоединение различных химических групп к 3'-концу может повышать стабильность мРНК. Такое присоединение может включать модифицированные/искусственные нуклеотиды, аптамеры и другие соединения. Например, ATP аналоги можно встраивать в поли(A)-хвостовую часть с использованием поли(A)-полимеразы. Кроме того, стабильность РНК могут повышать аналоги ATP.
[00398] 5'-кэпы также обеспечивают стабильность молекул РНК. В предпочтительном варианте осуществления РНК, продуцируемые способами, описанными в настоящем описании, включают 5'-кэп. 5'-кэп предоставляют с использованием способов, известных в данной области и описанных в настоящем описании (Cougot, et al., Trends in Biochem. Sci., 29:436-444 (2001); Stepinski, et al., RNA, 7:1468-95 (2001); Elango, et al., Biochim. Biophys. Res. Commun., 330:958-966 (2005)).
[00399] РНК, продуцируемые способами, описанными в настоящем описании, также могут содержать последовательность участка внутренней посадки рибосомы (IRES). Последовательность IRES может представлять собой любую вирусную, хромосомную или искусственно сконструированную последовательность, которая инициирует кэп-независимое связывание рибосомы с мРНК и способствует инициации трансляции. Могут быть включены любые растворенные вещества, пригодные для электропорации клеток, которые могут содержать факторы, способствующие клеточной проницаемости и жизнеспособности, такие как сахара, пептиды, липиды, белки, антиоксиданты и поверхностно-активные вещества.
[00400] РНК можно включать в клетки-мишени с использованием любого из ряда различных способов, например коммерчески доступными способами, которые включают, но не ограничиваются ими, электропорацию (Amaxa Nucleofector-II (Amaxa Biosystems, Cologne, Германия)), (ECM 830 (BTX) (Harvard Instruments, Boston, Mass.) или Gene Pulser II (BioRad, Denver, Colo.), Multiporator (Eppendort, Hamburg, Германия), катионную опосредуемую липосомами трансфекцию с использованием липофекции, инкапсулирование в полимер, опосредуемую пептидом трансфекцию, или системы биолистической доставки частиц, такие как "генные пушки" (см., например, Nishikawa, et al. Hum Gene Ther., 12(8):861-70 (2001).
Невирусные способы доставки
[00401] В некоторых аспектах, невирусные способы можно использовать для доставки нуклеиновой кислоты, кодирующей CAR, описанный в настоящем описании, в клетку, или ткань, или индивидууму.
[00402] В некоторых вариантах осуществления невирусный способ включает применение транспозона (также называемого мобильным генетическим элементом). В некоторых вариантах осуществления транспозон представляет собой фрагмент ДНК, который может встраиваться в некотором положении в геноме, например, фрагмент ДНК, который способен самореплицироваться и встраивать его копию в геном, или фрагмент ДНК, который может вырезаться посредством сплайсинга из более длинной нуклеиновой кислоты и встраиваться в другое положение в геноме. Например, транспозон содержит последовательность ДНК, состоящую из инвертированных повторов, фланкирующих гены, для транспозинции.
[00403] Иллюстративные способы доставки нуклеиновых кислот с использованием транспозона включают транспозонную систему Sleeping Beauty (SBTS) и транспозонную систему piggyBac (PB). См., например, Aronovich et al. Hum. Mol. Genet. 20.R1(2011):R14-20; Singh et al. Cancer Res. 15(2008):2961-2971; Huang et al. Mol. Ther. 16(2008):580-589; Grabundzija et al. Mol. Ther. 18(2010):1200-1209; Kebriaei et al. Blood. 122,21(2013):166; Williams. Molecular Therapy 16,9(2008):1515-16; Bell et al. Nat. Protoc. 2,12(2007):3153-65; и Ding et al. Cell. 122,3(2005):473-83, все из которых включены в настоящее описание в качестве ссылок.
[00404] SBTS включает два компонента: 1) транспозон, содержащий трансген, и 2) источник фермента транспозазы. Транспозаза может переносить транспозон из плазмиды-носителя (или другой донорной ДНК) в ДНК-мишень, такую как хромосома/геном клетки-хозяина. Например, транспозаза связывается с ДНК плазмиды-носителя/донора, вырезает транспозон (включая трансген(ы)) из плазмиды, и встраивает его в геном клетки-хозяина. См., например, Aronovich et al., выше.
[00405] Иллюстративные транспозоны включают транспозон на основе pT2. См., например, Grabundzija et al. Nucleic Acids Res. 41,3(2013):1829-47; и Singh et al. Cancer Res. 68,8(2008): 2961-2971, все из которых включены в настоящее описание в качестве ссылок. Иллюстративные транспозазы включают транспозазу Tc1/mariner-типа, например, транспозазу SB10 или транспозазу SB11 (сверхактивная транспозаза, которая может экспрессироваться, например, из промотора цитомегаловируса). См., например, Aronovich et al.; Kebriaei et al.; и Grabundzija et al., все из которых включены в настоящее описание в качестве ссылок.
[00406] Применение SBTS позволяет эффективное встраивание и экспрессию трансгена, например, нуклеиновой кислоты, кодирующей CAR, описанный в настоящем описании. В рамках настоящего изобретения предусматривается получение клетки, например, T-клетки или NK-клетки, которая стабильной экспрессирует CAR, описанный в настоящем описании, например, с использованием системы транспозона, такой как SBTS.
[00407] В соответствии со способами, описанными в настоящем описании, в некоторых вариантах осуществления одну или несколько нуклеиновых кислот, например, плазмид, содержащих компоненты SBTS, доставляют в клетку (например, T- или NK-клетку). Например, нуклеиновую кислоту(ы) доставляют стандартными способами доставки нуклеиновых кислот (например, плазмидной ДНК), например, способами, описанными в настоящем описании, например, электропорацией, трансфекцией или липофекцией. В некоторых вариантах осуществления нуклеиновая кислота содержит транспозон, содержащий трансген, например, нуклеиновую кислоту, кодирующую CAR, описанный в настоящем описании. В некоторых вариантах осуществления нуклеиновая кислота содержит транспозон, содержащий трансген (например, нуклеиновую кислоту, кодирующую CAR, описанный в настоящем описании), а также последовательность нуклеиновой кислоты, кодирующую фермента транспозазу. В других вариантах осуществления предусматривается система с двумя нуклеиновыми кислотами, например, система с двумя плазмидами, например, где первая плазмида содержит транспозон, содержащий трансген, а вторая плазмида содержит последовательность нуклеиновой кислоты, кодирующую фермент транспозазу. Например, первую и вторую нуклеиновые кислоты доставляют в клетку совместно.
[00408] В некоторых вариантах осуществления получают клетки, например, T- или NK-клетки, которые экспрессируют CAR, описанный в настоящем описании, с использованием комбинации встраивания гена с использованием SBTS и генетического редактирования с использованием нуклеазы (например, нуклеазы с цинковыми пальцами (ZFN), эффекторные нуклеазы, подобные активаторам транскрипции (TALEN), система CRISPR/Cas или сконструированные мегануклеазы - переконструированные хоминг-эндонуклеазы).
[00409] В некоторых вариантах осуществления применение невирусного способа доставки позволяет перепрограммирование клеток, например, T- или NK-клеток, и прямую инфузию клеток индивидууму. Преимущества невирусных векторов включают, но не ограничиваются ими, простоту и относительно низкую стоимость получения достаточных количеств, требуемых для удовлетворения потребностей популяции пациентов, стабильность при хранении и отсутствие иммуногенности.
Конструкции нуклеиновых кислот, кодирующие CAR
[00410] Настоящее изобретение также относится к молекулам нуклеиновых кислот, кодирующим одну или несколько конструкций CAR, описанных в настоящем описании. В одном аспекте молекулу нуклеиновой кислоты предоставляют в качестве матричной РНК-транскрипта. В одном аспекте молекулу нуклеиновой кислоты предоставляют в качестве конструкции ДНК.
[00411] Таким образом, в одном аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей химерный рецептор антигена (CAR), где CAR содержит связывающий CD19 домен (например, гуманизированный связывающий CD19 домен), трансмембранный домен и внутриклеточный сигнальный домен, содержащий стимулирующий домен, например, костимулирующий сигнальный домен и/или первичный сигнальный домен, например, зета-цепь. В одном варианте осуществления связывающий CD19 домен представляет собой связывающий CD19 домен, описанный в настоящем описании, например, связывающий CD19 домен, который содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 59, или последовательности, обладающей 95-99% идентичностью с ними. В одном варианте осуществления трансмембранный домен представляет собой трансмембранный домен белка, выбранный из группы, состоящей из альфа-, бета- или зета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном варианте осуществления трансмембранный домен содержит последовательность SEQ ID NO: 15 или последовательность, обладающую 95-99% идентичностью с ней. В одном варианте осуществления связывающий CD19 домен связан с трансмембранным доменом посредством шарнирной области, например, шарнирной области, описанной в настоящем описании. В одном варианте осуществления шарнирная область содержит SEQ ID NO: 14 или SEQ ID NO: 45 или SEQ ID NO: 47 или SEQ ID NO: 49, или последовательность, обладающую 95-99% идентичностью с ними. В одном варианте осуществления выделенная молекула нуклеиновой кислоты, кроме того, содержит последовательность, кодирующую костимулирующий домен. В одном варианте осуществления костимулирующий домен представляет собой функциональный сигнальный домен белка, выбранного из группы, состоящей из OX40, CD27, CD28, CDS, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278) и 4-1BB (CD137). В одном варианте осуществления костимулирующий домен содержит последовательность SEQ ID NO: 16, или последовательность, обладающую 95-99% идентичностью с ней. В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и функциональный сигнальный домен CD3-зета. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 16 или SEQ ID NO: 51, или последовательность, обладающую 95-99% идентичностью с ней, и последовательность SEQ ID NO: 17 или SEQ ID NO: 43, или последовательность, обладающую 95-99% идентичностью с ней, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке считывания и в качестве одной полипептидной цепи.
[00412] В другом аспекте изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей конструкцию CAR, содержащую лидерную последовательность SEQ ID NO: 13, scFv-домен, обладающий последовательностью, выбранной из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 59 (или последовательности, обладающей 95-99% идентичностью с ними), шарнирную область SEQ ID NO: 14, или SEQ ID NO: 45, или SEQ ID NO: 47, или SEQ ID NO: 49 (или последовательность, обладающую 95-99% идентичностью с ней), трансмембранный домен, обладающий последовательностью SEQ ID NO: 15 (или последовательностью, обладающей 95-99% идентичностью с ней), костимулирующий домен 4-1BB, имеющий последовательность SEQ ID NO: 16, или костимулирующий домен CD27, имеющий последовательность SEQ ID NO: 51 (или последовательность, обладающую 95-99% идентичностью с ней) и стимулирующий домен CD3-зета, обладающий последовательностью SEQ ID NO: 17 или SEQ ID NO: 43 (или последовательностью, обладающей 95-99% идентичностью с ней).
[00413] В другом аспекте изобретение относится к выделенной полипептидной молекуле, кодируемой молекулой нуклеиновой кислоты. В одном варианте осуществления выделенная полипептидная молекула содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 59 или последовательности, обладающей 95-99% идентичностью с ними.
[00414] В другом аспекте изобретение относится к молекуле нуклеиновой кислоты, кодирующей молекулу химерного рецептора антигена (CAR), которая содержит связывающий CD19 домен, трансмембранный домен и внутриклеточный сигнальный домен, содержащий стимулирующий домен, и где указанный связывающий CD19 домен содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 59, или последовательности, обладающей 95-99% идентичностью с ними.
[00415] В одном варианте осуществления кодируемая молекула CAR, кроме того, содержит последовательность, кодирующую костимулирующий домен. В одном варианте осуществления костимулирующий домен представляет собой функциональный сигнальный домен белка, выбранного из группы, состоящей из OX40, CD27, CD28, CDS, ICAM-1, LFA-1 (CD11a/CD18) и 4-1BB (CD137). В одном варианте осуществления костимулирующий домен содержит последовательность SEQ ID NO: 16. В одном варианте осуществления трансмембранный домен представляет собой трансмембранный домен белка, выбранного из группы, состоящей из альфа-, бета- или зета-цепи T-клеточного рецептора, CD28, CD3-эпсилон, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137 и CD154. В одном варианте осуществления трансмембранный домен содержит последовательность SEQ ID NO: 15. В одном варианте осуществления внутриклеточный сигнальный домен содержит функциональный сигнальный домен 4-1BB и функциональный сигнальный домен зета. В одном варианте осуществления внутриклеточный сигнальный домен содержит последовательность SEQ ID NO: 16 и последовательность SEQ ID NO: 17, где последовательности, содержащие внутриклеточный сигнальный домен, экспрессируются в одной рамке считывания и в качестве единой полипептидной цепи. В одном варианте осуществления CD19-связывающий домен связан с трансмембранным доменом шарнирной областью. В одном варианте осуществления шарнирная область содержит SEQ ID NO: 14. В одном варианте осуществления шарнирная область содержит SEQ ID NO: 45, SEQ ID NO: 47 или SEQ ID NO: 49.
[00416] В другом аспекте изобретение относится к кодируемой молекуле CAR, содержащей лидерную последовательность SEQ ID NO: 13, scFv-домен, имеющий последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8, SEQ ID NO: 9, SEQ ID NO: 10, SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 59, или последовательность, обладающую 95-99% идентичностью с ними, шарнирную область SEQ ID NO: 14, или SEQ ID NO: 45, или SEQ ID NO: 47, или SEQ ID NO: 49, трансмембранный домен, имеющий последовательность SEQ ID NO: 15, костимулирующий домен 4-1BB, имеющий последовательность SEQ ID NO: 16, или костимулирующий домен CD27, имеющий последовательность SEQ ID NO: 51, и стимулирующий домен CD3-зета, имеющий последовательность SEQ ID NO: 17 или SEQ ID NO: 43. В одном варианте осуществления кодируемая молекула CAR содержит последовательность, выбранную из группы, состоящей из SEQ ID NO: 31, SEQ ID NO: 32, SEQ ID NO: 33, SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, и SEQ ID NO: 59, или последовательность, обладающую 95-99% идентичностью с ними.
[00417] Последовательности нуклеиновых кислот, кодирующие желаемые молекулы, можно получать с использованием рекомбинантных способов, известных в данной области, например, таких как скрининг библиотек клеток, экспрессирующих ген, получение гена из вектора, о котором известно, что он его включает, или выделение непосредственно из клеток или тканей, содержащих его, с использованием стандартных способов. Альтернативно представляющий интерес ген может получать способами синтеза, а не клонировать.
[00418] Настоящее изобретение также относится к векторам, в которые встроена ДНК по настоящему изобретению. Векторы, происходящие из ретровирусов, таких как лентивирус, являются подходящими инструментами для достижения долговременного переноса генов, поскольку они обеспечивают долговременное стабильное встраивание трансгена и его увеличение в количестве в дочерних клетках. Лентивирусные векторы имеют дополнительное преимущество над векторами, происходящими из онкоретровирусов, таких как вирусы лейкоза мыши, поскольку они могут трансдуцировать непролиферирующие клетки, такие как гепатоциты. Также они имеют дополнительное преимущество, состоящее в низкой иммуногенности. Ретровирусный вектор также может представлять собой, например, гамма-ретровирусный вектор. Гамма-ретровирусный вектор может включать, например, промотор, сигнал упаковывания (ψ), участок связывания праймера (PBS), один или несколько (например, два) длинных концевых повторов (LTR) и представляющий интерес трансген, например, ген, кодирующий CAR. Гамма-ретровирусный вектор может быть лишен структурных генов вируса, таких как gag, pol и env. Иллюстративные гамма-ретровирусные векторы включают вирус лейкоза мышей (MLV), вирус некроза селезенки (SFFV) и вирус миелопролиферативной саркомы (MPSV), и векторы, происходящие из них. Другие гамма-ретровирусные векторы описаны, например, в Tobias Maetzig et al., "Gammaretroviral Vectors: Biology, Technology and Application" Viruses. 2011 Jun; 3(6): 677-713.
[00419] В другом варианте осуществления вектор, содержащий нуклеиновую кислоту, кодирующую желаемый CAR по изобретению, представляет собой аденовирусный вектор (A5/35). В другом варианте осуществления экспрессию нуклеиновых кислот, кодирующих CAR, можно проводить с использованием транспозонов, таких как sleeping beauty, crisper, CAS9 и нуклеазы с цинковыми пальцами цинк. См. ниже June et al. 2009 Nature Reviews Immunology 9,10: 704-716, включенную в настоящее описание в качестве ссылки.
[00420] В кратком изложении, экспрессии природных или синтетических нуклеиновых кислот, кодирующих CAR, обычно достигают путем функционального связывания нуклеиновой кислоты, кодирующей полипептид CAR или его части, с промотором, и встраивания конструкции в экспрессирующий вектор. Векторы могут быть пригодными для репликации и встраивания для эукариот. Типичные клонирующие векторы содержат терминаторы транскрипции и трансляции, последовательности инициации и промотор, пригодные для регуляции экспрессии желаемой последовательности нуклеиновой кислоты.
[00421] Экспрессирующие конструкции по настоящему изобретению также можно использовать для иммунизации нуклеиновыми кислотами и генной терапии с использованием стандартных протоколов доставки генов. Способы доставки генов известны в данной области. См., например, патенты США № 5399346, 5580859, 5589466, включенные в настоящее описание в качестве ссылок в полном объеме. В другом варианте осуществления изобретение относится к вектору для генной терапии.
[00422] Нуклеиновую кислоту можно клонировать в множество типов векторов. Например, нуклеиновую кислоту можно клонировать в вектор, включающий, но не ограничивающийся ими, плазмиду, фагмиду, производное фага, вирус животных и космиду. Векторы, представляющие особый интерес, включают экспрессирующие векторы, реплицирующиеся векторы, векторы для получения зондов и векторы для секвенирования.
[00423] Кроме того, экспрессирующий вектор может быть предоставлен клетке в форме вирусного вектора. Технология вирусных векторов хорошо известна в данной области и описана, например, в Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1-4, Cold Spring Harbor Press, NY), и в других справочниках по вирусологии и молекулярной биологии. Вирусы, которые пригодны в качестве векторов, включают, но не ограничиваются ими, ретровирусы, аденовирусы, аденоассоциированные вирусы, вирусы герпеса и лентивирусы. Как правило, подходящий вектор содержит ориджин репликации, функциональный по меньшей мере в одном организме, промоторную последовательность, удобные участки для эндонуклеаз рестрикции, и один или несколько селективных маркеров (например, WO 01/96584; WO 01/29058 и патент США № 6326193).
[00424] Был разработан ряд систем на основе вирусов для переноса генов в клетки млекопитающих. Например, ретровирусы обеспечивают удобную платформу для систем доставки генов. Выбранный ген можно встраивать в вектор и упаковывать ретровирусные частицы с использованием способов, известных в данной области. Затем рекомбинантный вирус можно выделять и доставлять в клетки индивидуума либо in vivo, либо ex vivo. В данной области известен ряд ретровирусных систем. В некоторых вариантах осуществления используют аденовирусные векторы. В данной области известен ряд аденовирусных векторов. В одном варианте осуществления используют лентивирусные векторы.
[00425] Дополнительные промоторные элементы, например, энхансеры, регулируют частоту инициаций транскрипции. Как правило, они расположены в области на 30-110 п.о. выше участка инициации, хотя было показано, что ряд промоторов также содержат функциональные элементы ниже участка инициации. Спейсер между промоторными элементами часто является гибким, так что промоторная функция сохраняется, когда элементы инвертируются или смещаются друг относительно друга. В промоторе тимидинкиназы (tk) спейсер между промоторными элементами может быть увеличен до 50 п.о. до того, когда активность начнет снижаться. Оказалось, что в зависимости от промотора индивидуальные элементы могут функционировать либо совместно, либо независимо, активируя транскрипцию. Иллюстративные промоторы включают промоторы гена IE CMV, EF-1α, убиквитина C или фосфоглицерокиназы (PGK).
[00426] Примером промотора, который способен экпрессировать трансген CAR в T-клетке млекопитающего, является промотор EF1a. Нативный промотор EF1a контролирует экспрессию альфа-субъединицы комплекса фактора элонгации 1, который ответственен за ферментативную доставку аминоацил-тРНК в рибосому. Промотор EF1a широко используют в экспрессирующих плазмидах млекопитающих, и было показано, что он является эффективным для запуска экспрессии CAR с трансгенов, клонированных в лентивирусный вектор. См., например, Milone et al., Mol. Ther. 17(8): 1453-1464 (2009). В одном аспекте промотор EF1a содержит последовательность, представленную в качестве SEQ ID NO: 100.
[00427] Другим примером промотора является последовательность предраннего промотора цитомегаловируса (CMV). Эта промоторная последовательность представляет собой последовательность мощного конститутивного промотора, способного обеспечивать высокие уровни экспрессии любой полинуклеотидной последовательности, функционально связанной с ним. Однако также можно использовать другие конститутивные промоторные последовательности, включая, но не ограничиваясь ими, ранний промотор вируса 40 обезьян (SV40), промотор вируса опухоли молочной железы мыши (MMTV), промотор длинного концевого повтора (LTR) вируса иммунодефицита человека (ВИЧ), промотор MoMuLV, промотор вируса лейкоза птиц, предранний промотор вируса Эпштейна-Барр, промотор вируса саркомы Рауса, а также промоторы генов человека, такие как, но не ограничиваясь ими, промотор актина, промотор миозина, промотор фактора элонгации 1α, промотор гемоглобина и промотор креатинкиназы. Кроме того, изобретение не ограничивается применением конститутивных промоторов. Также в качестве части изобретения предусматриваются индуцибельные промоторы. Применение индуцибельных промоторов обеспечивает молекулярный переключатель, способный запускать экспрессию полинуклеотидной последовательности, с которой он функционально связан, когда такая экспрессия желательна, или выключать экспрессию, когда экспрессия является нежелательной. Примеры индуцибельных промоторов включают, но не ограничиваются ими металлотиониновый промотор, гликокортикоидный промотор, прогестероновый промотор и тетрациклиновый промотор.
[00428] Также вектор может включать, например, сигнальную последовательность для облегчения секреции, сигнал полиаденилирования и терминатор транскрипции (например, из гена бычьего гормона роста (BGH)), элемент, позволяющий эписомальную репликацию и репликацию у прокариот (например, ориджин SV40 и ColE1 или другие, известные в данной области) и/или элемент, позволяющие селекцию (например, ген устойчивости к ампициллину и/или зеоциновый).
[00429] Для оценки экспрессии полипептида CAR или его частей экспрессирующий вектор, подлежащий введению в клетку, также может содержать либо ген селективного маркера, либо репортерный ген, или оба из них, для облегчения идентификации и селекции экспрессирующих клеток из популяции клеток, которые намереваются трансфицировать или инфицировать вирусными векторами. В других аспектах селективный маркер может содержаться на отдельном фрагменте ДНК и использоваться в методике котрансфекции. Как селективные маркеры, так и репортерные гены, могут фланкироваться соответствующими регуляторными последовательностями для обеспечения экспрессии в клетках-хозяевах. Пригодные селективные маркеры включают, например, гены устойчивости к антибиотикам, такие как neo и т.п.
[00430] Репортерные гены используют для идентификации потенциально трансфицированных клеток и для оценки функциональности регуляторных последовательностей. Как правило, репортерный ген представляет собой ген, который не присутствует или не экспрессируется в организме или ткани реципиента и который кодирует полипептид, экспрессия которого проявляется некоторым легко поддающимся обнаружению свойством, например, ферментативной активностью. Экспрессию репортерного гена анализируют в подходящий период времени после встраивания ДНК в реципиентные клетки. Подходящие репортерные гены могут включать гены, кодирующие люциферазу, бета-галактозидазу, хлорамфениколацетилтрансферазу, секретируемую щелочную фосфатазу, или ген зеленого флуоресцентного белка (например, Ui-Tei et al., 2000 FEBS Letters 479: 79-82). Подходящие экспрессирующие системы хорошо известны, и их можно получать с использованием известных способов или приобретать от коммерческих поставщиков. Как правило, в качестве промотора идентифицируют конструкцию с минимальной 5'-фланкирующей областью, демонстрирующей наиболее высокий уровень экспрессии репортерного гена. Такие промоторные области можно связать с репортерным геном и использовать для оценки средств в отношении способности модулировать запускаемую промотором транскрипцию.
[00431] Способы введения и экспрессии генов в клетках известны в данной области. В контексте экспрессирующего вектора вектор может быть легко введен в клетку-хозяина, например, клетку млекопитающих, бактерий, дрожжей или насекомых, любым способом, известным в данной области. Например, экспрессирующий вектор можно переносить в клетку-хозяина физическим, химическим или биологическим способами.
[00432] Физические способы введения полинуклеотида в клетку-хозяина включают преципитацию с фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию и т.п. Способы получения клеток, содержащих векторы и/или экзогенные нуклеиновые кислоты, хорошо известны в данной области. См., например, Sambrook et al., 2012, MOLECULAR CLONING: A LABORATORY MANUAL, volumes 1-4, Cold Spring Harbor Press, NY). Предпочтительным способом введения полинуклеотида в клетку-хозяина является трансфекция с фосфатом кальция.
[00433] Биологические способы введения представляющего интерес полинуклеотида в клетку-хозяина включают применение ДНК- и РНК-векторов. Вирусные векторы, и, особенно ретровирусные векторы, стали наиболее широко используемым способом введения генов в клетки млекопитающих, например, человека. Другие вирусные векторы могут происходить из лентивирусов, поксвирусов, вируса простого герпеса I, аденовирусов и аденоассоциированных вирусов и т.п. См., например, патенты США № 5350674 и 5585362.
[00434] Химические средства для введения полинуклеотида в клетку-хозяина включают коллоидные дисперсные системы, такие как макромолекулярные комплексы, нанокапсулы, микросферы, гранулы и системы на основе липидов, включая эмульсии типа "масло в воде", мицеллы, смешанные мицеллы и липосомы. Иллюстративной колллоидной системой для применения в качестве носителя для доставки in vitro и in vivo является липосома (например, искусственная мембранная везикула). Доступны другие способы уровня техники для направленной доставки нуклеиновых кислот, такие как доставка полинуклеотидов с использованием нацеленных наночастиц или другой подходящей субмикронной системы доставки.
[00435] В случае, когда используют невирусную систему доставки, иллюстративным носителем для доставки является липосома. Для введения нуклеиновых кислот в клетку (in vitro, ex vivo или in vivo) предусматривается применение липидных составов. В другом аспекте нуклеиновую кислоту можно связывать с липидом. Нуклеиновая кислота, связанная с липидом, может быть инкапсулирована в водное содержимое липосомы, распределена в липидном бислое липосомы, связана с липосомой через линкерную молекулу, которая связана как с липосомой, так и с олигонуклеотидом, заключена в липосому, быть в комплексе с липосомой, диспергирована в растворе, содержащем липид, смешана с липидом, объединена с липидом, содержаться в качестве суспензии в липиде, содержаться или быть в комплексе с мицеллой, или может быть иным образом ассоциирована с липидом. Композиции, ассоциированные с липидами, липидами/ДНК или липидами/экспрессирующими векторами не ограничиваются какой-либо конкретной структурой в растворе. Например, они могут находиться в бислойной структуре в качестве мицелл или могут быть со "спавшейся" структурой. Они также могут быть просто распределены в растворе, возможно формируя агрегаты, которые не являются однородными по размеру или форме. Липиды представляют собой жирные вещества, которые могут представлять собой встречающиеся в природе или синтетические липиды. Например, липиды включают жировые капли, которые встречаются в природе в цитоплазме, а также класс соединений, который содержит алифатические углеводороды длинной цепи и их производные, такие как жирные кислоты, спирты, амины, аминоспирты и альдегиды.
[00436] Липиды, пригодные для применения, можно получать из коммерческих источников. Например, димиристилфосфатидилхолин ("DMPC") можно получать от Sigma, St. Louis, MO; дицетилфосфат ("DCP") можно получать от K & K Laboratories (Plainview, NY); холестерин ("Choi") можно получать от Calbiochem-Behring; димиристилфосфатидилглицерин ("DMPG") и другие липиды можно получать от Avanti Polar Lipids, Inc. (Birmingham, AL.). Исходные растворы липидов в хлороформе или смеси хлороформ/метанол можно хранить при приблизительно -20°C. Хлороформ используют в качестве единственного растворителя, поскольку он легче испаряется, чем метанол. "Липосома" является общим термином, охватывающим множество однослойных и многослойных липидных везикул, образованных путем формирования заключенных друг в друга липидных бислоев или агрегатов. Липосомы могут быть охарактеризованы как имеющие везикулярные структуры с фосфолипидной бислойной мембраной и внутренней водной средой. Многослойные липосомы имеют множество липидных слоев, разделенных водной средой. Они образуются самопроизвольно, когда фосфолипиды суспендируют в избытке водного раствора. Липидные компоненты претерпевают самоперестройку перед формированием замкнутых структур и заключением воды и растворенных веществ между липидными слоями (Ghosh et al., 1991 Glycobiology 5: 505-10). Однако также предусматриваются композиции, которые имеют в растворе структуры, отличающиеся от нормальной везикулярной структуры. Например, липиды могут принимать мицеллярную структуру или существовать только в качестве неоднородных агрегатов липидных молекул. Также предусматриваются комплексы липофектамин-нуклеиновая кислота.
[00437] Независимо от способа, использованного для введения экзогенных нуклеиновых кислот в клетку-хозяина или иного воздействия на клетку ингибитора по настоящему изобретению, для подтверждения присутствия последовательности рекомбинантной ДНК в клетке-хозяине можно проводить различные анализы. Такие анализы включают, например, "молекулярно-биологические" анализы, хорошо известные специалистам в данной области, такие как саузерн- и нозерн-блоттинг, ОТ-ПЦР и ПЦР; "биохимические" анализы, такие как обнаружение присутствия или отсутствия конкретного пептида, например, иммунологическими способами (ELISA и вестерн-блоттинг) или анализами, описанными в настоящем описании, для идентификации средств, входящих в объем изобретения.
[00438] Кроме того, настоящее изобретение относится к вектору, содержащему молекулу нуклеиновой кислоты, кодирующую CAR. В одном аспекте вектор CAR можно прямо трансдуцировать в клетку, например, T-клетку. В одном аспекте вектор представляет собой клонирующий или экспрессирующий вектор, например, вектор, включающий, но не ограничивающийся ими, одну или несколько плазмид (например, экспрессирующих плазмид, клонирующих векторов, миниколец, минивекторов, двойных микрохромосом), ретровирусных и лентивирусных векторных конструкций. В одном аспекте вектор способен экспрессировать конструкцию CAR в T-клетках млекопитающих. В одном аспекте T-клетка млекопитающего представляет собой T-клетку человека.
Источники клеток
[00439] Перед увеличением в количестве и генетической модификации или другой модификации источник клеток, например, T-клеток или натуральных киллерных (NK) клеток) можно получать от индивидуума. Подразумевают, что термин "индивидуум" включает живые организмы, в которых можно индуцировать иммунный ответ (например, млекопитающие). Примеры индивидуумов включают человека, мартышек, шимпанзе, собак, кошек, мышей, крыс и их трансгенные виды. T-клетки можно получать из ряда источников, включая мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из области инфекции, асцитную жидкость, плевральный выпот, ткань селезенки и опухоли.
[00440] В некоторых аспектах по настоящему изобретению иммунные эффекторные клетки, например, T-клетки, можно получать из единицы крови, взятой от индивидуума, с использованием любого из множества способов, известных квалифицированному специалисту, таких как разделение в FicollTM. В одном предпочтительном аспекте клетки из циркулирующей крови индивидуума получают аферезом. Продукт афереза, как правило, содержит лимфоциты, в том числе T-клетки, моноциты, гранулоциты, B-клетки, другие ядросодержащие лейкоциты, эритроциты и тромбоциты. В одном аспекте клетки, полученные аферезом, можно промывать для удаления фракции плазмы и, необязательно, для помещения клеток в соответствующий буфер или среды для последующих стадий обработки. В одном варианте осуществления клетки промывают фосфатно-солевым буфером (PBS). В альтернативном варианте осуществления промывочный раствор лишен кальция и может быть лишен магния или может быть лишен многих, или даже всех, двухвалентных катионов.
[00441] Первоначальные стадии активации в отсутствие кальция могут приводить к усиленной активации. Как будет хорошо понятно специалистам в данной области, стадию промывания можно проводить способами, известными в данной области, как например, с использованием полуавтоматической "проточной" центрифуги (например, устройство для обработки клеток Cobe 2991, Baxter CytoMate, или Haemonetics Cell Saver 5) в соответствии с инструкциями изготовителя. После промывания клетки можно ресуспендировать в различных биосовместимых буферах, например, таких как не содержащий Ca, не содержащий Mg PBS, PlasmaLyte A, или другой солевой раствор с буфером или без него. Альтернативно нежелательные компоненты образца для афереза можно удалять и клетки прямо ресуспендировать в культуральной среде.
[00442] В одном аспекте T-клетки выделяют из лимфоцитов периферической крови человека посредством лизиса эритроцитов и устранения моноцитов, например, посредством центрифугирования в градиенте PERCOLLTM или посредством центрифужной элютриации в противотоке.
[00443] Способы, описанные в настоящем описании, могут включать, например, селекцию конкретной субпопуляции иммунных эффекторных клеток, например, T-клеток, которые представляют собой популяцию с истощением регуляторных T-клеток, популяцию с истощением CD25+ клеток, с использованием, например, способа отрицательной селекции, например, описанного в настоящем описании. Предпочтительно, популяция клеток с истощением регуляторных T-клеток содержит менее 30%, 25%, 20%, 15%, 10%, 5%, 4%, 3%, 2%, 1% CD25+ клеток.
[00444] В одном варианте осуществления регуляторные T-клетки, например, CD25+ T-клетки, устраняют из популяции с использованием антитела против CD25 или его фрагмента, или CD25-связывающего лиганда, IL-2. В одном варианте осуществления антитело против CD25 или его фрагмент, или CD25-связывающий лиганд конъюгированы с подложкой, например, гранулами, или в другом случае нанесены на субстрат, например, гранулы. В одном варианте осуществления антитело против CD25 или его фрагмент конъюгированы с подложкой, как описано в настоящем описании.
[00445] В одном варианте осуществления регуляторные T-клетки, например, CD25+ T-клетки, удаляют из популяции с использованием реагента для истощения CD25 от MiltenyiTM. В одном варианте осуществления соотношение клеток и реагента для истощения CD25 составляет 1e7 клеток на 20 мкл, или 1e7 клеток на 15 мкл, или 1e7 клеток на 10 мкл, или 1e7 клеток на 5 мкл, или 1e7 клеток на 2,5 мкл, или 1e7 клеток на 1,25 мкл. В одном варианте осуществления, например, для регуляторных T-клеток, например, используют истощение CD25+ клеток, превышающих 500 миллионов клеток/мл. В следующем аспекте, используют концентрацию клеток, составляющую 600, 700, 800 или 900 миллионов клеток/мл.
[00446] В одном варианте осуществления популяция иммунных эффекторных клеток, подлежащих истощению, включает приблизительно 6×109 CD25+ T-клеток. В других аспектах популяция иммунных эффекторных клеток, подлежащая истощению, включает приблизительно от 1×109 до 1×1010 CD25+ T-клеток и любое целое число между ними. В одном варианте осуществления полученная популяция с истощением регуляторных T-клеток имеет 2×109 регуляторных T-клеток, например, CD25+ клеток, или менее (например, 1×109, 5×108, 1×108, 5×107, 1×107 или менее CD25+ клеток).
[00447] В одном варианте осуществления регуляторные T-клетки, например, CD25+ клетки, удаляют из популяции с использованием системы CliniMAC с набором трубок для истощения, например, таких как трубки 162-01. В одном варианте осуществления систему CliniMAC используют в настройках для истощения, например, таких как DEPLETION2.1.
[00448] Без связи с конкретной теорией, снижение уровня отрицательных регуляторов иммунных клеток (например, снижение количества нежелательных иммунных клеток, например, клеток TREG) у индивидуума перед аферезом или в процессе изготовления продукта с CAR-экспрессирующими клетками, может снизить риск рецидива у индивидуума. Например, способы истощения клеток TREG известны в данной области. Способы уменьшения количества клеток TREG включают, но не ограничиваются ими, циклофосфамид, антитело против GITR (антитело против GITR, описанное в настоящем описании), истощение CD25 и их комбинации.
[00449] В некоторых вариантах осуществления способы получения включают уменьшение количества (например, истощение) клеток TREG перед получением CAR-экспрессирующих клеток. Например, способы получения включают приведение в контакт образца, например, образца для афереза, с антителом против GITR и/или антителом против CD25 (или его фрагментом или CD25-связывающим лигандом), например, для истощения клеток TREG перед изготовлением продукта с CAR-экспрессирующими клетками (например, T-клетки, NK-клетки).
[00450] В одном варианте осуществления индивидуума предварительно лечат одним или несколькими способами терапии, которые снижают уровень клеток TREG, перед сбором клеток для изготовления продукта с CAR-экспрессирующими клетками, тем самым, снижая у индивидуума риск рецидива после лечения CAR-экспрессирующими клетками. В одном варианте осуществления способы снижения уровня клеток TREG включают, но не ограничиваются ими, введение индивидууму одного или нескольких из циклофосфамида, антитела против GITR, средства для истощения CD25, или их комбинацию. Введение одного или нескольких из циклофосфамида, антитела против GITR, средства для истощения CD25, или их комбинации может происходить до, в процессе или после инфузии продукта с CAR-экспрессирующими клетками.
[00451] В одном варианте осуществления индивидуума предварительно лечат циклофосфамидом перед сбором клеток для изготовления продукта с CAR-экспрессирующими клетками, тем самым, снижая риск рецидива у индивидуума после лечения CAR-экспрессирующими клетками. В одном варианте осуществления индивидуума предварительно лечат антителом против GITR перед сбором клеток для изготовления продукта с CAR-экспрессирующими клетками, тем самым, снижая риск рецидива у индивидуума после лечения CAR-экспрессирующими клетками.
[00452] В одном варианте осуществления популяцией клеток, подлежащей истощению, не являются ни регуляторные T-клетки, не опухолевые клетки, а клетки, которые иным образом отрицательно влияют на экспансию и/или функцию CART-клеток, например, клеток, экспрессирующих CD14, CD11b, CD33, CD15 или другие маркеры, экспрессируемые потенциально иммуносупрессорными клетками. В одном варианте осуществления предусматривается удаление таких клеток одновременно с регуляторными T-клетками и/или опухолевыми клетками, или после указанного истощения, или в другом порядке.
[00453] Способы, описанные в настоящем описании, могут включать более одной стадии селекции, на пример, более одной стадии истощения. Увеличение в количестве популяции T-клеток посредством отрицательной селекции можно проводить, например, с использованием комбинации антител, направленных на поверхностные маркеры, уникальные для клеток, подвергнутых отрицательной селекции. Одним способом является сортировка и/или селекция клеток посредством отрицательной магнитной иммунной адгезии или проточной цитометрии, в которых используется смесь моноклональных антител, направленных на маркеры клеточной поверхности, присутствующие на клетках, подвергаемых отрицательной селекции. Например, для увеличения в количестве CD4+ клеток посредством отрицательной селекции, смесь моноклональных антител может включать антитела к CD14, CD20, CD11b, CD16, HLA-DR и CD8.
[00454] Способы, описанные в настоящем описании, кроме того, могут включать удаление клеток из популяции, которые экспрессируют опухолевый антиген, например, опухолевый антиген, который не содержит CD25, например, CD19, CD30, CD38, CD123, CD20, CD14 или CD11b, тем самым, получая популяцию с истощенными регуляторными T-клетками, например, истощенными по CD25+ клетками, и истощенными по опухолевому антигену клетками, которая пригодна для экспрессии CAR, например, CAR, описанного в настоящем описании. В одном варианте осуществления клетки, экспрессирующие опухолевый антиген, удаляют одновременно с регуляторными T-клетками, например, CD25+ клетками. Например, антитело против CD25 или его фрагмент и антитело против опухолевого антитела, или его фрагмент, можно связывать с одним и тем же субстратом, например, гранулами, которые можно использовать для удаления клеток, или антитело против CD25 или его фрагмент, или антитело против опухолевого антигена или его фрагмент, можно связывать с отдельными гранулами, смесь которых можно использовать для удаления клеток. В других вариантах осуществления удаление T-регуляторных клеток, например, CD25+ клеток, и удаление клеток, экспрессирующих опухолевый антиген, является последовательным и может происходить, например, в любом порядке.
[00455] Также предусматриваются способы, которые включают устранение клеток из популяции, которые экспрессируют ингибитор точки контроля, например, ингибитор точки контроля, описанный в настоящем описании, например, одного или нескольких типов из PD1+ клеток, LAG3+ клеток и TIM3+ клеток, тем самым, обеспечивая популяцию с истощенными регуляторными T-клетками, например, с истощенными CD25+ клетками, и клетками, истощенными по ингибитору точки контроля, например, истощенными PD1+, LAG3+ и/или TIM3+ клетками. Иллюстративные ингибиторы точки контроля включают B7-H1, B7-1, CD160, P1H, 2B4, PD1, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, TIGIT, CTLA-4, BTLA и LAIR1. В одном варианте осуществления клетки, экспрессирующие ингибитор точки контроля, удаляют одновременно с регуляторными T-клетками, например, CD25+ клетками. Например, антитело против CD25 или его фрагмент и антитело против ингибитора точки контроля или его фрагмент можно связывать с одними и теми же гранулами, которые можно использовать для удаления клеток, или антитело против CD25 или его фрагмент, или антитело против ингибитора точки контроля или его фрагмент, можно связывать с отдельными гранулами, смесь которых можно использовать для удаления клеток. В других вариантах осуществления удаление T-регуляторных клеток, например, CD25+ клеток, и удаление клеток, экспрессирующих ингибитор точки контроля, является последовательным и может происходить, например, в любом порядке.
[00456] Способы, описанные в настоящем описании, могут включать стадию положительной селекции. Например, T-клетки можно выделять посредством инкубации с гранулами, конъюгированными с антителом против CD3/против CD28 (например, 3×28), такими как DYNABEAD® M-450 CD3/CD28 T, в течение периода времени, достаточного для положительной селекции желаемых T-клеток. В одном варианте осуществления период времени составляет приблизительно 30 минут. В следующем варианте осуществления период времени находится в диапазоне от 30 минут до 36 часов или более, включая все целые числа между ними. В следующем варианте осуществления, период времени составляет по меньшей мере 1, 2, 3, 4, 5 или 6 часов. В другом предпочтительном варианте осуществления период времени составляет от 10 до 24 часов, например, 24 часа. Более длительное время инкубации можно использовать для выделения T-клеток в любой ситуации, где T-клеток мало по сравнению с другими типами клеток, как например, в случае выделения инфильтрирующих опухоль лимфоцитов (TIL) из ткани опухоли или из индивидуумов с иммунодефицитом. Кроме того, использование более длительного времени инкубации может повышать эффективность улавливания CD8+ T-клеток. Таким образом, посредством простого укорочения или удлинения времени T-клеткам позволяют связываться с гранулами CD3/CD28 и/или путем увеличения или снижения соотношения гранул и T-клеток (как дополнительно описано в настоящем описании), можно предпочтительно проводить отбирать в отношении или против субпопуляции T-клеток при инициации культуры или в другие моменты времени процесса. Кроме того, путем увеличения или снижения соотношения антител против CD3 и/или антител против CD28 на гранулах или другой поверхности, можно предпочтительно проводить отбор в отношении или против субпопуляции T-клеток при инициации культуры или в другие желаемые моменты времени.
[00457] В одном варианте осуществления можно отбирать популяцию T-клеток, которые экспрессируют один или несколько из IFN-γ, TNFα, IL-17A, IL-2, IL-3, IL-4, GM-CSF, IL-10, IL-13, гранзима B и перфорина, или другие подходящие молекулы, например, другие цитокины. Способы скрининга экспрессии клеток можно определять, например, способами, описанными в публикации PCT № WO 2013/126712.
[00458] Для выделения желаемой популяции клеток посредством положительной или отрицательной селекции концентрацию клеток и поверхности (например, частиц, таких как гранулы) можно варьировать. В некоторых аспектах, может быть желательным значительное снижение объема, в котором гранулы и клетки смешивают друг с другом (например, увеличение концентрации клеток), для обеспечения максимального контакта клеток и гранул. Например, в одном аспекте используют концентрацию 10 миллиардов клеток/мл, 9 миллиардов клеток/мл, 8 миллиардов клеток/мл, 7 миллиардов клеток/мл, 6 миллиардов клеток/мл или 5 миллиардов клеток/мл. В одном аспекте используют концентрацию 1 миллиарда клеток/мл. В следующем аспекте используют концентрацию клеток 75, 80, 85, 90, 95 или 100 миллионов клеток/мл. В следующих аспектах можно использовать концентрации, составляющие 125 или 150 миллионов клеток/мл.
[00459] Использование высоких концентраций может приводить к увеличению выхода клеток, активации клеток и экспансии клеток. Кроме того, применение высоких концентраций клеток позволяет более эффективное улавливание клеток, которые могут слабо экспрессировать представляющие интерес антигены-мишени, таких как CD28-отрицательные T-клетки, или улавливание из образцов, где присутствует множество опухолевых клеток (например, кровь при лейкозе, опухолевая ткань и т.д.). Такие популяции клеток могут иметь терапевтическую ценность, и их получение может быть желательным. Например, использование высокой концентрации клеток обеспечивает более эффективную селекцию CD8+ T-клеток, которые обычно имеют более слабую экспрессию CD28.
[00460] В сходном аспекте может быть желательным снижение концентрации клеток. Путем значительного разбавления смеси T-клеток и поверхности (например, частиц, таких как гранулы), взаимодействия между частицами и клетками минимизируют. Это приводит к селекции клеток, которые экспрессируют высокие количества желаемых антигенов, подлежащих связыванию с частицами. Например, CD4+ T-клетки экспрессируют более высокие уровни CD28 и более эффективно улавливаются, чем CD8+ T-клетки в разбавленных концентрациях. В одном аспекте концентрация используемых клеток составляет 5×10 e6/мл. В других аспектах, используемая концентрация может составлять от приблизительно 1×105/мл до 1×106/мл, включая любое целое число между ними.
[00461] В других аспектах клетки можно инкубировать на вращающем устройстве в течение разных периодов времени при различных скоростях либо при 2-10°C, либо при комнатной температуре.
[00462] T-клетки, предназначенные для стимуляции, также можно замораживать после стадии промывания. Без связи с теорией полагают, что замораживание и последующее оттаивание обеспечивает более однородный продукт вследствие устранения гранулоцитов и в некоторой степени моноцитов в популяции клеток. После стадии промывания, которая устраняет плазму и тромбоциты, клетки можно суспендировать в растворе для замораживания. Хотя множество растворов и параметров для замораживания известно в данной области и пригодно в этом контексте, один способ вовлекает использование PBS, содержащего 20% DMSO и 8% сывороточный альбумин человека, или культуральной среды, содержащей 10% декстран 40 и 5% декстроза, 20% сывороточный альбумин человека и 7,5% DMSO, или 31,25% Plasmalyte-A, 31,25% декстрозу 5%, 0,45% NaCl, 10% декстран 40 и 5% декстрозу, 20% сывороточный альбумин человека, и 7,5% DMSO или другие походящие среды для замораживания клеток, содержащие, например, Hespan и PlasmaLyte A, затем клетки замораживают до -80°C со скоростью 1° в минуту и хранят в парообразной фазе емкости для хранения с жидком азоте. Можно использовать другие способы контролируемого замораживания, а также неконтролируемого замораживания сразу до -20°C или в жидком азоте.
[00463] В некоторых аспектах криосохраненные клетки размораживают и промывают, как описано в настоящем описании, и им позволяют покоиться в течение одного часа при комнатной температуре перед активацией с использованием способов по настоящему изобретению.
[00464] Также в контексте изобретения предусматривается получение образцов крови или продукта афереза от индивидуума в период до того, как клетки, описанные в настоящем описании, могут потребоваться. По существу, источник клеток, подлежащих увеличению в количестве, можно собирать в любой требуемый момент времени и желаемые клетки, такие как T-клетки, можно выделять и замораживать для последующего применения в терапии иммунными эффекторными клетками от любого множества заболеваний и состояний, при которых является полезной терапия иммунными эффекторными клетками, таких как заболевания и состояния, описанные в настоящем описании. В одном аспекте получение образца крови или продукта афереза проводят от здорового в основном индивидуума. В некоторых аспектах получение образца крови или продукта афереза проводят от здорового в основном индивидуума, который имеет риск развития заболевания, но у которого заболевание еще не развилось, и представляющие интерес клетки выделяют и замораживают для последующего применения. В некоторых аспектах T-клетки можно увеличивать в количестве, замораживать и использовать позднее. В некоторых аспектах взятие образцов проводят сразу после постановки диагноза конкретного заболевания, как описано в настоящем описании, но перед каким-либо из способов лечения. В следующем аспекте клетки выделяют из образца крови или продукта афереза от индивидуума перед любым из множества соответствующих способов лечения, включая, но не ограничиваясь ими, лечение средствами, такими как натализумаб, эфализумаб, противовирусные средства, химиотерапия, лучевая терапия, иммунодепрессивные средства, такие как циклоспорин, азатиоприн, метотрексат, микофенолат и FK506, антитела или другие иммунодепрессивные средства, такие как CAMPATH, антитела против CD3, цитоксан, флударабин, циклоспорин, FK506, рапамицин, микофеноловая кислота, стероиды, FR901228 и лучевая терапия.
[00465] В следующем аспекте настоящего изобретения T-клетки получают от пациента непосредственно после лечения, которое сохраняет у индивидуума функциональные T-клетки. В этом отношении было обнаружено, что в случае определенных способов лечения злокачественной опухоли, в частности, лечения лекарственными средствами, которые повреждают иммунную систему, вскоре после лечения в течение периода, когда пациенты в норме восстанавливаются после лечения, качество полученных T-клеток может быть оптимальным или улучшенным в отношении их способности увеличиваться в количестве ex vivo. Аналогично, после манипулирования ex vivo с использованием способов, описанных в настоящем описании, эти клетки могут быть в предпочтительном состоянии для повышения приживаемости и экспансии in vivo. Таким образом, в контексте изобретения предусматривается сбор клеток крови, в том числе T-клеток, дендритных клеток или других клеток гемопоэтического роста в процессе этой стадии восстановления. Кроме того, в некоторых аспектах, можно использовать режимы мобилизации (например, мобилизация посредством GM-CSF) и кондиционирования у индивидуума, которые способствуют репопуляции, рециркуляции, регенерации и/или экспансии конкретных типов клеток, особенно в течение определенного периода времени после терапии. Иллюстративные типы клеток включают T-клетки, B-клетки, дендритные клетки и другие клетки иммунной системы.
[00466] В одном варианте осуществления иммунные эффекторные клетки, экспрессирующие молекулу CAR, например, молекулу CAR, описанную в настоящем описании, получают от индивидуума, которому вводили низкую усиливающую иммунитет дозу ингибитора mTOR. В одном варианте осуществления популяцию иммунных эффекторных клеток, например, T-клеток, подлежащих модификации способами инженерии для экспрессии CAR, собирают после достаточного периода времени или после достаточного дозирования низкой усиливающей иммунитет дозы ингибитора mTOR, так что уровень отрицательных по PD1 иммунных эффекторных клеток, например, T-клеток, или соотношение отрицательные по PD-1 иммунные эффекторные клетки, например, T-клетки/положительные по PD-1 иммунные эффекторные клетки, например, T-клетки, у индивидуума или после взятия у индивидуума по меньшей мере временно увеличивается.
[00467] В других вариантах осуществления популяцию иммунных эффекторных клеток, например, T-клеток, которые модифицированы или будут модифицированы способами инженерии для экспрессии CAR, можно обрабатывать ex vivo путем приведения в контакт с количеством ингибитора mTOR, который увеличивает количество отрицательных по PD1 иммунных эффекторных клеток, например, T клеток, или увеличивает соотношение отрицательные по PD-1 иммунные эффекторные клетки, например, T-клетки/положительные по PD-1 иммунные эффекторные клетки, например, T-клетки.
[00468] В одном варианте осуществления популяция T-клеток является дефицитной по диаглицеринкиназе (DGK). Клетки с дефицитом DGK включают клетки, которые не экспрессируют РНК или белок DGK, или имеет сниженную или ингибированную активность DGK. Клетки с дефицитом DGK можно получать посредством генетических подходов, например, введения агентов РНК-интерференции, например, миРНК, кшРНК, микроРНК, для снижения или предотвращения экспрессии DGK. Альтернативно клетки с дефицитом DGK можно получать путем обработки ингибиторами DGK, описанными в настоящем описании.
[00469] В одном варианте осуществления популяция T-клеток имеет дефицит Ikaros. Клетки с дефицитом Ikaros включают клетки, которые не экспрессируют РНК или белок Ikaros, или обладают сниженной или ингибированной активностью Ikaros. Клетки с дефицитом Ikaros можно получать с использованием генетических подходов, например, введения агентов РНК-интерференции, например, миРНК, кшРНК, микроРНК, для снижения или предотвращения экспрессии Ikaros. Альтернативно клетки с дефицитом Ikaros можно получать путем обработки ингибиторами Ikaros, например, леналидомидом.
[00470] В вариантах осуществления популяция T-клеток является дефицитной по DGK и дефицитной по Ikaros, например, не экспрессирует DGK и Ikaros, или имеет сниженную или ингибированную активность DGK и Ikaros. Такие клетки с дефицитом DGK и Ikaros можно получать любыми способами, описанными в настоящем описании.
[00471] В одном варианте осуществления NK-клетки получают от индивидуума. В другом варианте осуществления NK-клетки представляют собой линию NK-клеток, например, линию клеток NK-92 (Conkwest).
Аллогенный CAR
[00472] В вариантах осуществления, описанных в настоящем описании, иммунная эффекторная клетка может представлять собой аллогенную эффекторную клетку, например T-клетку или NK-клетку. Например, клетка может представлять собой аллогенную T-клетку, например, аллогенную T-клетку, лишенную экспрессии функционального T-клеточного рецептора (TCR) и/или лейкоцитарного антигена человека (HLA), например, HLA класса I и/или HLA класса II.
[00473] Например, T-клетку, лишенную функционального TCR, можно конструировать так, чтобы она не экспрессировала какой-либо функциональный TCR на ее поверхности, можно конструировать так, что она не экспрессировала одной или нескольких субъединиц, которые содержат функциональный TCR, или конструировать так, чтобы она продуцировала очень мало функционального TCR на ее поверхности. Альтернативно T-клетка может экспрессировать по существу нарушенный TCR, например, посредством экспрессии мутантных или укороченных форм одной или нескольких субъединиц TCR. Термин "по существу нарушенный TCR" означает, что этот TCR не индуцирует неблагоприятную иммунную реакцию у хозяина.
[00474] T-клетку, описанную в настоящем описании, можно конструировать, например, чтобы она не экспрессировала функциональный HLA на ее поверхности. Например, T-клетку, описанную в настоящем описании, можно модифицировать способами инженерии, чтобы подавлялась экспрессия на клеточной поверхности HLA, например, HLA класса 1 и/или HLA класса II.
[00475] В некоторых вариантах осуществления T-клетка может быть лишена функционального TCR и функционального HLA, например, HLA класса I и/или HLA класса II.
[00476] Модифицированные T-клетки, которые лишены экспрессии функционального TCR и/или HLA, можно получать любыми подходящими способами, включая нокаут или нокдаун одной или нескольких субъединиц TCR или HLA. Например, T-клетка может включать нокдаун TCR и/или HLA с использованием миРНК, кшРНК, коротких палиндромных повторов, регулярно расположенных кластерами (CRISPR), нуклеазы, подобной активатору транскрипции (TALEN), или эндонуклеазы с цинковыми пальцами (ZFN).
[00477] В некоторых вариантах осуществления аллогенная клетка может представлять собой клетку, которая не экспрессирует или экспрессирует на низких уровнях ингибиторную молекулу, например, посредством любого способа, описанного в настоящем описании. Например, клетка может представлять собой клетку, которая не экспрессирует или экспрессирует на низких уровнях ингибиторную молекулу, например, которая может снижать способность экспрессирующей CAR клетки индуцировать иммунный эффекторный ответ. Примеры ингибиторных молекул включают PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета. Ингибирование ингибиторной молекулы, например, посредством ингибирования на уровне ДНК, РНК или белка, может оптимизировать эффективность экспрессирующей CAR клетки. В вариантах осуществления можно использовать ингибиторную нуклеиновую кислоту, например, дцРНК, например, миРНК или кшРНК, короткие палиндромные повторы, регулярно расположенные кластерами (CRISPR), нуклеазу, подобную активатору транскрипции (TALEN) или эндонуклеазу с цинковыми пальцами (ZFN), например, как описано в настоящем описании.
миРНК и кшРНК для ингибирования TCR или HLA
[00478] В некоторых вариантах осуществления экспрессию TCR и/или экспрессию HLA можно ингибировать с использованием миРНК или кшРНК, которые нацелены на нуклеиновую кислоту, кодирующую TCR и/или HLA, в T-клетке.
[00479] Экспрессии миРНК или кшРНК в T-клетках можно достигать с использованием любой общепринятой экспрессирующей системы, например, такой как лентивирусная экспрессирующая система.
[00480] Иллюстративные кшРНК, которые подавляют экспрессию компонентов TCR, описаны, например, в публикации США № 2012/0321667. Иллюстративные миРНК и кшРНК, которые подавляют экспрессию генов HLA класса I и/или HLA класса II, описаны, например, в публикации США № US 2007/0036773.
CRISPR для ингибирования TCR или HLA
[00481] "CRISPR" или "CRISPR против TCR и/или HLA" или "CRISPR для ингибирования TCR и/или HLA", как используют в рамках изобретения, относится к набору коротких палиндромных повторов, регулярно расположенных кластерами, или к системе, содержащей такой набор повторов. "Cas", как используют в рамках изобретения, относится к ассоциированному с CRISPR белку. Система "CRISPR/Cas" относится к системе, происходящей из CRISPR и Cas, которую можно использовать для сайленсинга или мутации генов TCR и/или HLA.
[00482] Встречающиеся в природе системы CRISPR/Cas найдены приблизительно в 40% отсеквенированных геномов эубактерий и 90% отсеквенированных геномов архей. Grissa et al. (2007) BMC Bioinformatics 8: 172. Эта система представляет собой тип прокариотической иммунной системы, который сообщает устойчивость к чужеродным генетическим элементам, таким как плазмиды и фаги, и обеспечивает форму приобретенного иммунитета. Barrangou et al. (2007) Science 315: 1709-1712; Marragini et al. (2008) Science 322: 1843-1845.
[00483] Система CRISPR/Cas была модифицирована для применения в редактировании генов (сайленсинг, усиление или изменение конкретных генов) у эукариот, таких как мыши или приматы. Wiedenheft et al. (2012) Nature 482: 331-8. Это осуществили путем введения в эукариотическую клетку плазмиды, содержащей специально сконструированный CRISPR и один или несколько соответствующих Cas.
[00484] Последовательность CRISPR, иногда называемая локусом CRISPR, содержит чередующиеся повторы и спейсеры. Во встречающемся в природе CRISPR спейсеры обычно содержат последовательности, чужеродные для бактерии, такие как последовательность плазмиды или фага; в системе CRISPR/Cas против TCR и/или HLA спейсеры происходят из последовательностей генов TCR или HLA.
[00485] РНК из локуса CRISPR конститутивно экспрессируется и процессируется белками Cas в малые РНК. Они содержат спейсер, фланкированный последовательностями повтора. РНК направляют другие белки Cas на подавление экзогенных генетических элементов на уровне РНК или ДНК. Horvath et al. (2010) Science 327: 167-170; Makarova et al. (2006) Biology Direct 1: 7. Таким образом, спейсеры выступают в качестве матриц для молекул РНК, аналогично миРНК. Pennisi (2013) Science 341: 833-836.
[00486] Поскольку они встречаются в природе во многих различных типах бактерий, точная организация и структура CRISPR, функция и количество генов Cas и их продуктов отличаются в некоторой степени от вида к виду. Haft et al. (2005) PLoS Comput. Biol. 1: e60; Kunin et al. (2007) Genome Biol. 8: R61; Mojica et al. (2005) J. Mol. Evol. 60: 174-182; Bolotin et al. (2005) Microbiol. 151: 2551-2561; Pourcel et al. (2005) Microbiol. 151: 653-663; и Stern et al. (2010) Trends. Genet. 28: 335-340. Например, белки Cse (подтип Cas, E. coli) (например, CasA) формируют функциональный комплекс, Cascade, который процессирует РНК-транскрипты CRISPR в элементы спейсер-повтор, которые сохраняет Cascade. Brouns et al. (2008) Science 321: 960-964. В других прокариотах Cas6 процессирует транскрипт CRISPR. Инактивация фага на основе CRISPR в E. coli требует Cascade и Cas3, но не Cas1 или Cas2. Белки Cmr (модуль RAMP Cas) в Pyrococcus furiosus и других прокариотах формируют функциональный комплекс с малыми РНК CRISPR, который распознает и расщепляет РНК-мишени. Более простая система CRISPR основана на белке Cas9, который представляет собой нуклеазу с двумя активными участками расщепления, по одному для каждой цепи двойной спирали. Комбинирование Cas9 и модифицированного локуса РНК CRISPR можно использовать в системе редактирования генов. Pennisi (2013) Science 341: 833-836.
[00487] Таким образом, систему CRISPR/Cas можно использовать для редактирования гена TCR и/или HLA (присоединение или делеция пары оснований) или внесения преждевременного стоп-кодона, что, таким образом, снижает экспрессию TCR и/или HLA. Альтернативно систему CRISPR/Cas можно использовать подобно РНК-интерференции, выключая гены TCR и/или HLA обратимым образом. В клетке млекопитающего, например, РНК может направлять белок Cas на промотор TCR и/или HLA, пространственно блокируя РНК-полимеразы.
[00488] Искусственные системы CRISPR/Cas, которые ингибируют TCR и/или HLA, можно получать с использованием технологии, известной в данной области, например, которая описана в публикации США № 20140068797, и Cong (2013) Science 339: 819-823. Также можно получать другие искусственные системы CRISPR/Cas, известные в данной области, которые ингибируют TCR и/или HLA, например, системы, описанные в Tsai (2014) Nature Biotechnol., 32:6 569-576, патенты США № 8871445; 8865406; 8795965; 8771945 и 8697359.
TALEN для ингибирования TCR и/или HLA
[00489] "TALEN" или "TALEN против HLA и/или TCR" или "TALEN для ингибирования HLA и/или TCR" относится к эффекторной нуклеазе, подобной активатору транскрипции, которая представляет собой искусственную нуклеазу, которую можно использовать для редактирования гена HLA и/или TCR.
[00490] TALEN получают искусственным образом путем слияния эффекторного ДНК-связывающего домена TAL с доменом расщепления ДНК. Эффекты активатора транскрипции (TALE) можно модифицировать способами инженерии для связывания с любой желаемой последовательностью ДНК, включая часть гена HLA или TCR. Путем комбинирования модифицированных способами инженерии TALE с доменом расщепления ДНК можно получать фермент рестрикции, который является специфичным к любой желаемой последовательности ДНК, включая последовательность HLA или TCR. Затем их можно вводить в клетку, где их можно использовать для редактирования генома. Boch (2011) Nature Biotech. 29: 135-6; и Boch et al. (2009) Science 326: 1509-12; Moscou et al. (2009) Science 326: 3501.
[00491] TALE представляют собой белки, секретируемые бактериями Xanthomonas. ДНК-связывающий домен содержит повторяющуюся высококонсервативную последовательность из 33-34 аминокислот, за исключением 12-ой и 13-ой аминокислот. Эти два положения являются в высокой степени вариабельными, демонстрируя строгую корреляцию со специфическим распознаванием нуклеотидов. Таким образом, их можно модифицировать способами инженерии для связывания с желаемой последовательностью ДНК.
[00492] Для получения TALEN белок TALE подвергают слиянию с нуклеазой (N), которая представляет собой эндонуклеазу FokI дикого типа или мутантную эндонуклеазу FokI. В FokI было внесено несколько мутаций для ее применения в TALEN; они, например, повышают специфичность расщепления или активность. Cermak et al. (2011) Nucl. Acids Res. 39: e82; Miller et al. (2011) Nature Biotech. 29: 143-8; Hockemeyer et al. (2011) Nature Biotech. 29: 731-734; Wood et al. (2011) Science 333: 307; Doyon et al. (2010) Nature Methods 8: 74-79; Szczepek et al. (2007) Nature Biotech. 25: 786-793; и Guo et al. (2010) J. Mol. Biol. 200: 96.
[00493] Домен FokI функционирует в качестве димера, требующего две конструкции с уникальными ДНК-связывающими доменами для участков в геноме-мишени с надлежащей ориентаций и расстояниями. Как число аминокислотных остатков между ДНК-связывающим доменом TALE и доменом расщепления FokI, так и число оснований между двумя индивидуальными участками связывания TALEN, по-видимому, являются важными параметрами для достижения высоких уровней активности. Miller et al. (2011) Nature Biotech. 29: 143-8.
[00494] TALEN против HLA или TCR можно использовать внутри клетки для обеспечения двухцепочечного разрыва (DSB). Мутацию можно вносить в участке разрыва, если механизмы репарации ненадлежащим образом репарируют разрыв посредством негомологичного соединения концов. Например, ненадлежащая репарация может вносить мутацию со сдвигом рамки считывания. Альтернативно вместе с TALEN в клетку можно вводить чужеродную ДНК; в зависимости от последовательностей чужеродной ДНК и хромосомной последовательности, этот процесс можно использовать для коррекции дефекта в гене HLA или TCR или внесения такого дефекта в ген HLA или TCR wt, таким образом, снижая экспрессию HLA или TCR.
[00495] TALEN, специфичные к последовательностям в HLA или TCR можно конструировать с использованием любого способа, известного в данной области, включая различные схемы с использованием модульных компонентов. Zhang et al. (2011) Nature Biotech. 29: 149-53; Geibler et al. (2011) PLoS ONE 6: e19509.
Нуклеаза с цинковыми пальцами для ингибирования HLA и/или TCR
[00496] "ZFN" или "нуклеаза с цинковыми пальцами" или "ZFN против HLA и/или TCR" или "ZFN для ингибирования HLA и/или TCR" относятся к нуклеазе с цинковыми пальцами, которая представляет собой искусственную нуклеазу, которую можно использовать для редактирования гена HLA и/или TCR.
[00497] Подобно TALEN, ZFN содержит нуклеазный домен FokI (или его производное), слитый с ДНК-связывающим доменом. В случае ZFN ДНК-связывающий домен содержит один или несколько цинковых пальцев. Carroll et al. (2011) Genetics Society of America 188: 773-782; и Kim et al. (1996) Proc. Natl. Acad. Sci. USA 93: 1156-1160.
[00498] Цинковый палец представляет собой небольшой белковый структурный мотив, стабилизированный одним или несколькими ионами цинка. Цинковый палец может содержать, например, Cys2His2, и может распознавать последовательность размером приблизительно 3 п.о. Различные цинковые пальцы известной специфичности можно комбинировать для получения полипептидов с несколькими пальцами, которые распознают последовательности размером приблизительно 6, 9, 12, 15 или 18 п.о. Для получения цинковых пальцев (и их комбинаций), распознающих конкретные последовательности, доступны различные способы селекции и модульной сборки, включая фаговый дисплей, дрожжевые моногибридные системы, бактериальные моногибридные и двухгибридные системы и клетки млекопитающих.
[00499] Подобно TALEN, ZFN должна димеризоваться для расщепления ДНК. Таким образом, для нацеливания на непалиндромные участки ДНК требуется пара ZFN. Две индивидуальных ZFN должны связывать противоположные цепи ДНК, причем между их нуклеазами должно быть надлежащее пространство. Bitinaite et al. (1998) Proc. Natl. Acad. Sci. USA 95: 10570-5.
[00500] Также подобно TALEN, ZFN может вносить двухцепочечный разрыв в ДНК, который может создавать мутацию со сдвигом рамки считывания в случае ненадлежащей репарации, что приводит к снижению экспрессии и количества HLA и/или TCR в клетке. ZFN также можно использовать с гомологичной рекомбинацией для внесения мутаций в гены HLA или TCR.
[00501] ZFN, специфичные к последовательностям в HLA и/или TCR, можно конструировать с использованием любого способа, известного в данной области. См., например, Provasi (2011) Nature Med. 18: 807-815; Torikai (2013) Blood 122: 1341-1349; Cathomen et al. (2008) Mol. Ther. 16: 1200-7; и Guo et al. (2010) J. Mol. Biol. 400: 96; публикацию патента США 2011/0158957; публикацию патента США 2012/0060230.
Экспрессия теломеразы
[00502] Без связи с какой-либо конкретной теорией, в некоторых вариантах осуществления терапевтическая T-клетка имеет кратковременное нахождение у пациента вследствие укороченных теломер в T-клетках; таким образом, трансфекция гена теломеразы может удлинить теломеры T-клеток и увеличить время существования T-клеток у пациента. См. Carl June, "Adoptive T cell therapy for cancer in the clinic", Journal of Clinical Investigation, 117:1466-1476 (2007). Таким образом, в одном варианте осуществления иммунная эффекторная клетка, например, T-клетка, эктопически экспрессирует субъединицу теломеразы, например, каталитическую субъединицу теломеразы, например, TERT, например, hTERT. В некоторых аспектах настоящее изобретение относится к способу получения CAR-экспрессирующей клетки, включающему приведение клетки в контакт с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, каталитическую субъединицу теломеразы, например, TERT, например, hTERT. Клетку можно приводить в контакт с нуклеиновой кислотой до, одновременно или после приведения в контакт с конструкцией, кодирующей CAR.
[00503] В одном аспекте настоящее изобретение относится к способу получения популяции иммунных эффекторных клеток (например, T-клеток или NK-клеток). В одном варианте осуществления способ включает: предоставление популяции иммунных эффекторных клеток (например, T-клеток или NK-клеток), приведение в контакт популяции иммунных эффекторных клеток с нуклеиновой кислотой, кодирующей CAR; и приведение в контакт популяции иммунных эффекторных клеток с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, hTERT, в условиях, которые позволяют экспрессию CAR и теломеразы.
[00504] В одном варианте осуществления нуклеиновая кислота, кодирующая субъединицу теломеразы, представляет собой ДНК. В одном варианте осуществления нуклеиновая кислота, кодирующая субъединицу теломеразы, содержит промотор, способный запускать экспрессию субъединицы теломеразы.
[00505] В одном варианте осуществления hTERT имеет аминокислотную последовательность GenBank Protein ID AAC51724.1 (Meyerson et al., "hEST2, the Putative Human Telomerase Catalytic Subunit Gene, Is Up-Regulated in Tumor Cells and during Immortalization" Cell Volume 90, Issue 4, 22 August 1997, Pages 785-795), являющуюся следующей:
MPRAPRCRAVRSLLRSHYREVLPLATFVRRLGPQGWRLVQRGDPAAFRALVAQCLVCVPWDARPPPAAPSFRQVSCLKELVARVLQRLCERGAKNVLAFGFALLDGARGGPPEAFTTSVRSYLPNTVTDALRGSGAWGLLLRRVGDDVLVHLLARCALFVLVAPSCAYQVCGPPLYQLGAATQARPPPHASGPRRRLGCERAWNHSVREAGVPLGLPAPGARRRGGSASRSLPLPKRPRRGAAPEPERTPVGQGSWAHPGRTRGPSDRGFCVVSPARPAEEATSLEGALSGTRHSHPSVGRQHHAGPPSTSRPPRPWDTPCPPVYAETKHFLYSSGDKEQLRPSFLLSSLRPSLTGARRLVETIFLGSRPWMPGTPRRLPRLPQRYWQMRPLFLELLGNHAQCPYGVLLKTHCPLRAAVTPAAGVCAREKPQGSVAAPEEEDTDPRRLVQLLRQHSSPWQVYGFVRACLRRLVPPGLWGSRHNERRFLRNTKKFISLGKHAKLSLQELTWKMSVRGCAWLRRSPGVGCVPAAEHRLREEILAKFLHWLMSVYVVELLRSFFYVTETTFQKNRLFFYRKSVWSKLQSIGIRQHLKRVQLRELSEAEVRQHREARPALLTSRLRFIPKPDGLRPIVNMDYVVGARTFRREKRAERLTSRVKALFSVLNYERARRPGLLGASVLGLDDIHRAWRTFVLRVRAQDPPPELYFVKVDVTGAYDTIPQDRLTEVIASIIKPQNTYCVRRYAVVQKAAHGHVRKAFKSHVSTLTDLQPYMRQFVAHLQETSPLRDAVVIEQSSSLNEASSGLFDVFLRFMCHHAVRIRGKSYVQCQGIPQGSILSTLLCSLCYGDMENKLFAGIRRDGLLLRLVDDFLLVTPHLTHAKTFLRTLVRGVPEYGCVVNLRKTVVNFPVEDEALGGTAFVQMPAHGLFPWCGLLLDTRTLEVQSDYSSYARTSIRASLTFNRGFKAGRNMRRKLFGVLRLKCHSLFLDLQVNSLQTVCTNIYKILLLQAYRFHACVLQLPFHQQVWKNPTFFLRVISDTASLCYSILKAKNAGMSLGAKGAAGPLPSEAVQWLCHQAFLLKLTRHRVTYVPLLGSLRTAQTQLSRKLPGTTLTALEAAANPALPSDFKTILD (SEQ ID NO: 131)
[00506] В одном варианте осуществления hTERT имеет последовательность, по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% идентичную последовательности SEQ ID NO: 131. В одном варианте осуществления hTERT имеет последовательность SEQ ID NO: 131. В одном варианте осуществления hTERT содержит делецию (например, не более чем 5, 10, 15, 20 или 30 аминокислот) на N-конце, C-конце или обоих концах. В одном варианте осуществления hTERT содержи трансгенную аминокислотную последовательность (например, не более чем из 5, 10, 15, 20 или 30 аминокислот) на N-конце, C-конце или обоих концах.
[00507] В одном варианте осуществления hTERT кодируется последовательностью нуклеиновой кислоты GenBank под номером доступа № AF018167 (Meyerson et al., "hEST2, the Putative Human Telomerase Catalytic Subunit Gene, Is Up-Regulated in Tumor Cells and during Immortalization" Cell Volume 90, Issue 4, 22 August 1997, Pages 785-795):
[00508] 1 caggcagcgt ggtcctgctg cgcacgtggg aagccctggc cccggccacc cccgcgatgc
61 cgcgcgctcc ccgctgccga gccgtgcgct ccctgctgcg cagccactac cgcgaggtgc
121 tgccgctggc cacgttcgtg cggcgcctgg ggccccaggg ctggcggctg gtgcagcgcg
181 gggacccggc ggctttccgc gcgctggtgg cccagtgcct ggtgtgcgtg ccctgggacg
241 cacggccgcc ccccgccgcc ccctccttcc gccaggtgtc ctgcctgaag gagctggtgg
301 cccgagtgct gcagaggctg tgcgagcgcg gcgcgaagaa cgtgctggcc ttcggcttcg
361 cgctgctgga cggggcccgc gggggccccc ccgaggcctt caccaccagc gtgcgcagct
н 421 acctgcccaa cacggtgacc gacgcactgc gggggagcgg ggcgtggggg ctgctgttgc
481 gccgcgtggg cgacgacgtg ctggttcacc tgctggcacg ctgcgcgctc tttgtgctgg
541 tggctcccag ctgcgcctac caggtgtgcg ggccgccgct gtaccagctc ggcgctgcca
601 ctcaggcccg gcccccgcca cacgctagtg gaccccgaag gcgtctggga tgcgaacggg
661 cctggaacca tagcgtcagg gaggccgggg tccccctggg cctgccagcc ccgggtgcga
721 ggaggcgcgg gggcagtgcc agccgaagtc tgccgttgcc caagaggccc aggcgtggcg
781 ctgcccctga gccggagcgg acgcccgttg ggcaggggtc ctgggcccac ccgggcagga
841 cgcgtggacc gagtgaccgt ggtttctgtg tggtgtcacc tgccagaccc gccgaagaag
901 ccacctcttt ggagggtgcg ctctctggca cgcgccactc ccacccatcc gtgggccgcc
961 agcaccacgc gggcccccca tccacatcgc ggccaccacg tccctgggac acgccttgtc
1021 ccccggtgta cgccgagacc aagcacttcc tctactcctc aggcgacaag gagcagctgc
1081 ggccctcctt cctactcagc tctctgaggc ccagcctgac tggcgctcgg aggctcgtgg
1141 agaccatctt tctgggttcc aggccctgga tgccagggac tccccgcagg ttgccccgcc
1201 tgccccagcg ctactggcaa atgcggcccc tgtttctgga gctgcttggg aaccacgcgc
1261 agtgccccta cggggtgctc ctcaagacgc actgcccgct gcgagctgcg gtcaccccag
1321 cagccggtgt ctgtgcccgg gagaagcccc agggctctgt ggcggccccc gaggaggagg
1381 acacagaccc ccgtcgcctg gtgcagctgc tccgccagca cagcagcccc tggcaggtgt
1441 acggcttcgt gcgggcctgc ctgcgccggc tggtgccccc aggcctctgg ggctccaggc
1501 acaacgaacg ccgcttcctc aggaacacca agaagttcat ctccctgggg aagcatgcca
1561 agctctcgct gcaggagctg acgtggaaga tgagcgtgcg gggctgcgct tggctgcgca
1621 ggagcccagg ggttggctgt gttccggccg cagagcaccg tctgcgtgag gagatcctgg
1681 ccaagttcct gcactggctg atgagtgtgt acgtcgtcga gctgctcagg tctttctttt
1741 atgtcacgga gaccacgttt caaaagaaca ggctcttttt ctaccggaag agtgtctgga
1801 gcaagttgca aagcattgga atcagacagc acttgaagag ggtgcagctg cgggagctgt
1861 cggaagcaga ggtcaggcag catcgggaag ccaggcccgc cctgctgacg tccagactcc
1921 gcttcatccc caagcctgac gggctgcggc cgattgtgaa catggactac gtcgtgggag
1981 ccagaacgtt ccgcagagaa aagagggccg agcgtctcac ctcgagggtg aaggcactgt
2041 tcagcgtgct caactacgag cgggcgcggc gccccggcct cctgggcgcc tctgtgctgg
2101 gcctggacga tatccacagg gcctggcgca ccttcgtgct gcgtgtgcgg gcccaggacc
2161 cgccgcctga gctgtacttt gtcaaggtgg atgtgacggg cgcgtacgac accatccccc
2221 aggacaggct cacggaggtc atcgccagca tcatcaaacc ccagaacacg tactgcgtgc
2281 gtcggtatgc cgtggtccag aaggccgccc atgggcacgt ccgcaaggcc ttcaagagcc
2341 acgtctctac cttgacagac ctccagccgt acatgcgaca gttcgtggct cacctgcagg
2401 agaccagccc gctgagggat gccgtcgtca tcgagcagag ctcctccctg aatgaggcca
2461 gcagtggcct cttcgacgtc ttcctacgct tcatgtgcca ccacgccgtg cgcatcaggg
2521 gcaagtccta cgtccagtgc caggggatcc cgcagggctc catcctctcc acgctgctct
2581 gcagcctgtg ctacggcgac atggagaaca agctgtttgc ggggattcgg cgggacgggc
2641 tgctcctgcg tttggtggat gatttcttgt tggtgacacc tcacctcacc cacgcgaaaa
2701 ccttcctcag gaccctggtc cgaggtgtcc ctgagtatgg ctgcgtggtg aacttgcgga
2761 agacagtggt gaacttccct gtagaagacg aggccctggg tggcacggct tttgttcaga
2821 tgccggccca cggcctattc ccctggtgcg gcctgctgct ggatacccgg accctggagg
2881 tgcagagcga ctactccagc tatgcccgga cctccatcag agccagtctc accttcaacc
2941 gcggcttcaa ggctgggagg aacatgcgtc gcaaactctt tggggtcttg cggctgaagt
3001 gtcacagcct gtttctggat ttgcaggtga acagcctcca gacggtgtgc accaacatct
3061 acaagatcct cctgctgcag gcgtacaggt ttcacgcatg tgtgctgcag ctcccatttc
3121 atcagcaagt ttggaagaac cccacatttt tcctgcgcgt catctctgac acggcctccc
3181 tctgctactc catcctgaaa gccaagaacg cagggatgtc gctgggggcc aagggcgccg
3241 ccggccctct gccctccgag gccgtgcagt ggctgtgcca ccaagcattc ctgctcaagc
3301 tgactcgaca ccgtgtcacc tacgtgccac tcctggggtc actcaggaca gcccagacgc
3361 agctgagtcg gaagctcccg gggacgacgc tgactgccct ggaggccgca gccaacccgg
3421 cactgccctc agacttcaag accatcctgg actgatggcc acccgcccac agccaggccg
3481 agagcagaca ccagcagccc tgtcacgccg ggctctacgt cccagggagg gaggggcggc
3541 ccacacccag gcccgcaccg ctgggagtct gaggcctgag tgagtgtttg gccgaggcct
3601 gcatgtccgg ctgaaggctg agtgtccggc tgaggcctga gcgagtgtcc agccaagggc
3661 tgagtgtcca gcacacctgc cgtcttcact tccccacagg ctggcgctcg gctccacccc
3721 agggccagct tttcctcacc aggagcccgg cttccactcc ccacatagga atagtccatc
3781 cccagattcg ccattgttca cccctcgccc tgccctcctt tgccttccac ccccaccatc
3841 caggtggaga ccctgagaag gaccctggga gctctgggaa tttggagtga ccaaaggtgt
3901 gccctgtaca caggcgagga ccctgcacct ggatgggggt ccctgtgggt caaattgggg
3961 ggaggtgctg tgggagtaaa atactgaata tatgagtttt tcagttttga aaaaaaaaaa
4021 aaaaaaa (SEQ ID NO: 132)
В одном варианте осуществления hTERT кодируется нуклеиновой кислотой, имеющей последовательность, по меньшей мере на 80%, 85%, 90%, 95%, 96, 97%, 98%, или 99% идентичную последовательности SEQ ID NO: 132. В одном варианте осуществления hTERT кодируется нуклеиновой кислотой SEQ ID NO: 132.
Активация и увеличение в количестве иммунных эффекторных клеток (например, T-клеток).
[00509] Иммунные эффекторные клетки, такие как T-клетки, можно активировать и увеличивать в количестве, в основном с использованием способов, описанных, например, в патентах США 6352694; 6534055; 6905680; 6692964; 5858358; 6887466; 6905681; 7144575; 7067318; 7172869; 7232566; 7175843; 5883223; 6905874; 6797514; 6867041 и публикации патентной заявки США № 20060121005.
[00510] Для клеток по настоящему изобретению можно использовать методику увеличения в количестве гемопоэтических стволовых клеток и клеток-предшественников ex vivo, описанную в патенте США № 5199942, включенном в настоящее описание в качестве ссылки. В данной области известны другие пригодные способы, таким образом, настоящее изобретение не ограничивается каким-либо конкретным способом увеличения клеток в количестве ex vivo. В кратком изложении, культивирование и увеличение в количестве T-клеток ex vivo включает: (1) сбор CD34+ гемопоэтических стволовых клеток и клеток-предшественников из взятого образца периферической крови или эксплантата костного мозга; и (2) увеличение таких клеток в количестве ex vivo. В дополнение к клеточным факторам роста, описанным в патенте США № 5199942, для культивирования и увеличения в количестве клеток можно использовать другие факторы, такие как flt3 L, IL-1, IL-3 и лиганд c-kit.
[00511] Как правило, популяцию иммунных эффекторных клеток, например, клеток с истощением регуляторных T-клеток, можно увеличивать в количестве путем контакта с поверхностью, имеющей связанное с ней средство, которое стимулирует сигнал, ассоциированный с комплексом CD3/TCR, и лиганд, который стимулирует костимулирующую молекулу на поверхности T-клеток. В частности, популяции T-клеток можно стимулировать, как описано в настоящем описании, например, путем контакта с антителом против CD3 или его антигенсвязывающим фрагментом, или антителом против CD2, иммобилизованным на поверхности, или путем контакта с активатором протеинкиназы C (например, бриостатин) совместно с ионофором кальция. Для стимуляции вспомогательной молекула на поверхности T-клеток можно использовать лиганд, который связывает вспомогательную молекулу. Например, популяцию T-клеток можно приводить в контакт с антителом против CD3 и антителом против CD28 в условиях, пригодных для стимуляции пролиферации T-клеток. Для стимуляции пролиферации либо CD4+ T-клеток, либо CD8+ T-клеток, можно использовать антитело против CD3 и антитело против CD28. Примеры антител против CD28 включают 9.3, B-T3, XR-CD28 (Diaclone, Besançon, Франция), которые можно использовать, а также можно использовать и другие способы, широко известные в данной области (Berg et al., Transplant Proc. 30(8):3975-3977, 1998; Haanen et al., J. Exp. Med. 190(9):13191328, 1999; Garland et al., J. Immunol Meth. 227(1-2):53-63, 1999).
[00512] В некоторых аспектах первичный стимулирующий сигнал и костимулирующий сигнал для T-клеток может быть предоставлен посредством различных протоколов. Например, средства, обеспечивающие каждый сигнал, могут быть в растворе или могут быть связанными с поверхностью. Когда они связаны с поверхностью, средства могут быть связаны с одной и той же поверхностью (т.е. в "цис"-форме) или с различными поверхностями (т.е. в "транс"-форме). Альтернативно одно средство может быть связано с поверхностью, а другое средство может находиться в растворе. В одном аспекте средство, обеспечивающее костимулирующий сигнал, связано с клеточной поверхностью, и средство, обеспечивающее первичный активирующий сигнал, находится в растворе или связано с поверхностью. В некоторых аспектах оба средства могут находиться в растворе. В одном аспекте средства могут быть в растворимой форме, а затем могут быть сшиты с поверхностью, такой как клетка, экспрессирующая Fc-рецепторы или антитело или другое связывающее соединение, которое будет связываться со средствами. В этом отношении, см., например, публикации патентных заявок США № 20040101519 и 20060034810 для искусственных антигенпредставляющих клеток (aAPC), которые предусматриваются для применения для активации и увеличения в количестве T-клеток в рамках настоящего изобретения.
[00513] В одном аспекте два средства иммобилизованы на гранулах, либо на одних и тех же гранулах, т.е. "цис", либо на отдельных гранулах, т.е. "транс". В качестве примера, средство, обеспечивающее первичный сигнал активации, представляет собой антитело против CD3 или его антигенсвязывающий фрагмент и средство, обеспечивающее костимулирующий сигнал, представляет собой антитело против CD28 или его антигенсвязывающий фрагмент; и оба средства совместно иммобилизованы на одних и тех же гранулах в эквивалентных молекулярных количествах. В одном аспекте используют соотношение 1:1 для каждого антитела, связанного с гранулами, для увеличения в количестве CD4+ T-клеток и роста T-клеток. В некоторых аспектах настоящего изобретения используют соотношение антител против CD3:CD28, связанных с гранулами, так чтобы наблюдалось увеличение экспансии T-клеток по сравнению с экспансией, наблюдаемой с использованием соотношения 1:1. В одном конкретном аспекте наблюдается увеличение в от приблизительно 1 до приблизительно 3 раз по сравнению с экспансией, наблюдаемой с использованием соотношения 1:1. В одном аспекте соотношение антител против CD3:CD28, связанных с гранулами, находится в диапазоне от 100:1 до 1:100, включая все целые числа между ними. В одном аспекте с частицами связано больше антитела против CD28, чем антитела против CD3, т.е. соотношение CD3:CD28 меньше единицы. В определенных аспектах соотношение антитела против CD28 и антитела против CD3, связанного с гранулами, превышает 2:1. В одном конкретном аспекте используют соотношение антител против CD3:CD28, связанных с гранулами, равное 1:100. В одном аспекте используют соотношение антител против CD3:CD28, связанных с гранулами, равное 1:75. В следующем аспекте используют соотношение антител против CD3:CD28, связанных с гранулами, равное 1:50. В одном аспекте используют соотношение антител против CD3:CD28, связанных с гранулами, равное 1:30. В одном предпочтительном аспекте используют соотношение антител против CD3:CD28, связанных с гранулами, равное 1:10. В одном аспекте используют соотношение антител против CD3:CD28, связанных с гранулами, равное 1:3. В следующем аспекте используют соотношение антител против CD3:CD28, связанных с гранулами, равное 3:1.
[00514] Для стимуляции T-клеток и других клеток-мишеней можно использовать отношения частиц к клеткам от 1:500 до 500:1, включая любые целые числа между ними. Как будет хорошо понятно специалистам в данной области, отношение частиц к клеткам может зависеть от размера частиц относительно клетки-мишени. Например, гранулы малых размеров могут связать только несколько клеток, в то время как гранулы больших размеров могут связывать множество клеток. В некоторых аспектах для стимуляции T-клеток можно использовать соотношение клеток и частиц, которое находится в диапазоне от 1:100 до 100:1, включая любые целые числа между ними, и в следующих аспектах соотношение включает от 1:9 до 9:1, включая любые целые числа между ними. Соотношение частиц с антителом против CD3 и антителом против CD28 и T-клеток, которое приводит к стимуляции T-клеток, может варьироваться, как отмечалось выше, однако определенные предпочтительные величины включают 1:100, 1:50, 1:40, 1:30, 1:20, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1 и 15:1, причем одно предпочтительное соотношение частиц на T-клетку составляет по меньшей мере 1:1. В одном аспекте используют соотношение частиц и клеток 1:1 или менее. В одном конкретном аспекте соотношение частица:клетка равно 1:5. В следующих аспектах соотношение частиц и клеток может варьироваться в зависимости от дня стимуляции. Например, в одном аспекте соотношение частиц и клеток составляет от 1:1 до 10:1 на первые сутки, и дополнительные частицы добавляют к клеткам каждые стуки или раз в двое суток после этого в течение вплоть до 10 суток, в конечных соотношениях от 1:1 до 1:10 (исходя из количества клеток в день добавления). В одном конкретном аспекте соотношение частиц и клеток составляет 1:1 в первый день стимуляции и его доводят до 1:5 не третьи и пятые сутки стимуляции. В одном аспекте частицы добавляют раз в сутки или раз в двое суток до конечного соотношения 1:1 на первые сутки и 1:5 на третьи и пятые сутки стимуляции. В одном аспекте соотношение частиц и клеток составляет 2:1 на первые сутки стимуляции и его доводят до 1:10 на третьи и пятые сутки стимуляции. В одном аспекте частицы добавляют раз в стуки или раз в двое суток до конечного соотношения 1:1 на первые сутки, и 1:10 на третьи и пятые сутки стимуляции. Специалисту в данной области будет понятно, что множество других соотношений может быть пригодным для применения в рамках настоящего изобретения. В частности, соотношения будут варьироваться в зависимости от размера частиц и от размера и типа клеток. В одном аспекте наиболее типичные соотношения для применения составляют около 1:1, 2:1 и 3:1 на первые сутки.
[00515] В следующих аспектах клетки, такие как T-клетки, комбинируют с покрытыми средством гранулами, затем гранулы и клетки разделяют, а затем клетки культивируют. В альтернативном аспекте перед культивированием покрытые средством гранулы и клетки не отделяют, а культивируют вместе. В следующем аспекте, гранулы и клетки сначала концентрируют с использованием силы, такой как магнитная сила, что приводит к увеличенному лигированию макркеров клеточной поверхности, тем самым индуцируя стимуляцию клеток.
[00516] В качестве примера, белки клеточной поверхности можно лигировать, позволяя парамагнитным гранулам, с которыми связаны антитело против CD3 и антитело против CD28 (гранулы 3×28) контактировать с T-клетками. В одном аспекте клетки (например, от 104 дo 109 T-клеток) и гранул (например, парамагнитные гранулы DYNABEAD® M-450 CD3/CD28 T в соотношении 1:1) комбинируют в буфере, например PBS (без двухвалентных катионов, таких как кальций и магний). Вновь, специалисту в данной области будет хорошо понятно, что можно использовать любую концентрацию клеток. Например, клетки-мишени могут быть очень редкими в образце и могут составлять только 0,01% образца, или весь образец (т.е. 100%) может состоять из представляющих интерес клеток-мишеней. Таким образом, в контексте настоящего изобретения предусматривается любое количество клеток. В некоторых аспектах может быть желательным значительное уменьшение объема, в котором частицы и клетки смешивают друг с другом (т.е. увеличение концентрации клеток) для обеспечения максимального контакта клеток и частиц. Например, в одном аспекте используют концентрацию приблизительно 10 миллиардов клеток/мл, 9 миллиардов клеток/мл, 8 миллиардов клеток/мл, 7 миллиардов клеток/мл, 6 миллиардов клеток/мл, 5 миллиардов клеток/мл или 2 миллиарда клеток/мл. В одном аспекте используют более 100 миллионов клеток/мл. В следующем аспекте используют концентрацию клеток, составляющую 10, 15, 20, 25, 30, 35, 40, 45 или 50 миллионов клеток/мл. В другом аспекте используют концентрацию клеток 75, 80, 85, 90, 95 или 100 миллионов клеток/мл. В следующих аспектах можно использовать концентрации 125 или 150 миллионов клеток/мл. Использование высоких концентраций может приводить к увеличению выхода клеток, активации клеток и экспансии клеток. Кроме того, применение высоких концентраций клеток позволяет более эффективное улавливание клеток, которые могут слабо экспрессировать представляющие интерес антигены-мишени, таких как отрицательные по CD28 T-клетки. Такие популяции клеток могут иметь терапевтическую ценность, и в некоторых аспектах может быть желательным их получение. Например, использование высокой концентрации клеток позволяет более эффективную селекцию CD8+ T-клеток, которые обычно имеют более слабую экспрессию CD28.
[00517] В одном варианте осуществления клетки, трансдуцированные нуклеиновой кислотой, кодирующей CAR, например, CAR, описанный в настоящем описании, увеличивают в количестве, например, способом, описанным в настоящем описании. В одном варианте осуществления клетки увеличивают в количестве в культуре в течение периода, составляющего от нескольких часов (например, приблизительно 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 18, 21 час) до приблизительно 14 суток (например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 или 14 суток). В одном варианте осуществления клетки увеличивают в количестве в течение периода от 4 до 9 суток. В одном варианте осуществления клетки увеличивают в количестве в течение периода 8 суток или менее, например, 7, 6 или 5 суток. В одном варианте осуществления клетки, например, клетки с CAR против CD19, описанные в настоящем описании, увеличивают в количестве в культуре в течение 5 суток, и полученные клетки являются более эффективными, чем те же клетки, которые увеличивали в количестве в культуре в течение 9 суток в тех же условиях культивирования. Эффективность может определяться, например, различными функциями T-клеток, например, пролиферацией, уничтожением клеток-мишеней, продукцией цитокинов, активацией, миграцией и их комбинациями. В одном варианте осуществления клетки, например, клетки с CAR против CD19, описанные в настоящем описании, которые увеличивали в количестве в течение 5 суток, демонстрируют увеличение удвоений клеток по меньшей мере в один, два, три или четыре раза при стимуляции антигеном по сравнению с теми же клетками, которые увеличивали в количестве в течение 9 суток при тех же условиях культивирования. В одном варианте осуществления клетки, например, клетки, экспрессирующие CAR против CD19, описанные в настоящем описании, увеличивают в количестве в культуре в течение 5 суток, и полученные клетки проявляют более высокую продукцию провоспалительных цитокинов, например, уровни IFN-γ и/или GM-CSF, по сравнению с теми же клетками, которые увеличивали в количестве в культуре в течение 9 суток в тех же условиях культивирования. В одном варианте осуществления клетки, например, клетки с CAR против CD19, описанные в настоящем описании, которые увеличивали в количестве в течение 5 суток, демонстрируют увеличение продукции провоспалительных цитокинов в пг/мл, например, уровни IFN-γ и/или GM-CSF, по меньшей мере в один, два, три, четыре, пять, десять раз или более по сравнению с теми же клетками, которые увеличивали в количестве в культуре в течение 9 суток при тех же условиях культивирования.
[00518] Также может быть желательным несколько циклов стимуляции, так чтобы время культивирования T-клеток составляло 60 суток или более. Условия, пригодные для культивирования T-клеток, включают соответствующие среды (например, минимальная поддерживающая среда или среда RPMI 1640 или, X-vivo 15, (Lonza)), которые могут содержать факторы, необходимые для пролиферации и жизнеспособности, включая сыворотку (например, эмбриональная сыворотка человек или сыворотка человека), интерлейкин-2 (IL-2), инсулин, IFN-γ, IL-4, IL-7, GM-CSF, IL-10, IL-12, IL-15, TGFβ и TNF-α или любые другие добавки для роста клеток, известные специалисту в данной области. Другие добавки для роста клеток включают, но не ограничиваются ими, поверхностно-активное вещество, плазманат и восстановители, такие как N-ацетилцистеин и 2-меркаптоэтанол. Среды могут включать RPMI 1640, AIM-V, DMEM, MEM, α-MEM, F-12, X-Vivo 15 и X-Vivo 20, Optimizer, с добавлением аминокислот, пирувата натрия и витаминов, либо бессывороточные, либо дополненные соответствующем количеством сыворотки (или плазмы) или определенным набором гормонов, и/или количеством цитокина(ов), достаточным для роста и экспансии T-клеток. Антибиотики, например, пенициллин и стрептомицин, включают только в экспериментальные культуры, но не в культуры клеток, которые подлежат инфузии индивидууму. Клетки-мишени поддерживают в условиях, необходимых для поддержания роста, например, при соответствующей температуре (например, 37°C) и в соответствующей атмосфере (например, воздух плюс 5% CO2).
[00519] В одном варианте осуществления клетки увеличивают в количестве в подходящей среде (например, среды, описанные в настоящем описании), которая включает один или несколько интерлейкинов, которые приводят к увеличению количества клеток по меньшей мере в 200 раз (например, в 200 раз, в 250 раз, в 300 раз, в 350раз) в период экспансии в течение 14 суток, например, при измерении способом, описанным в настоящем описании, таким как проточная цитометрия. В одном варианте осуществления клетки увеличивают в количестве в присутствии IL-15 и/или IL-7 (например, IL-15 и IL-7).
[00520] В вариантах осуществления способы, описанные в настоящем описании, например, способы получения CAR-экспрессирующих клеток, включают удаление регуляторных T-клеток, например, CD25+ T-клеток, из популяции, например, с использованием антитела против CD25 или его фрагмента, или CD25-связывающего лиганда, IL-2. Способы удаления регуляторных T-клеток, например, CD25+ T-клеток, из популяции клеток описаны в настоящем описании. В вариантах осуществления способы, например, способы получения, кроме того, включают приведение в контакт популяции клеток (например, популяции клеток с истощением регуляторных T-клеток, таких как CD25+ T-клеток; или популяции клеток, которую ранее приводили в контакт с антителом против CD25, его фрагментом, или CD25-связывающим лигандом) с IL-15 и/или IL-7. Например, популяцию клеток (например, которую ранее приводили в контакт с антителом против CD25, его фрагментом или CD25-связывающим лигандом) увеличивают в количестве в присутствии IL-15 и/или IL-7.
[00521] В некоторых вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, приводят в контакт с композицией, содержащей полипептид интерлейкина-15 (IL-15), полипептид альфа-рецептора интерлейкина-15 (IL-15Ra), или комбинацию как полипептида IL-15, так и полипептида IL-15Ra, например, hetIL-15, в процессе получения CAR-экспрессирующей клетки, например, ex vivo. В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, приводят в контакт с композицией, содержащей полипептид IL-15, в процессе получения CAR-экспрессирующей клетки, например, ex vivo. В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, приводят в контакт с композицией, содержащей комбинацию как полипептида IL-15, так и полипептида IL-15 Ra, в процессе получения CAR-экспрессирующей клетки, например, ex vivo. В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, приводят в контакт с композицией, содержащей hetIL-15, в процессе получения CAR-экспрессирующей клетки, например, ex vivo.
[00522] В одном варианте осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, приводят в контакт с композицией, содержащей hetIL-15, в процессе увеличения в количестве ex vivo. В одном варианте осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, приводят в контакт с композицией, содержащей полипептид IL-15, в процессе увеличения в количестве ex vivo. В одном варианте осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, приводят в контакт с композицией, содержащей как полипептид IL-15, так и полипептид IL-15Ra, в процессе увеличения в количестве ex vivo. В одном варианте осуществления приведение в контакт приводит к выживанию и пролиферации субпопуляции лимфоцитов, например, CD8+ T-клеток.
[00523] T-клетки, подвергнутые воздействию в течение различной длительности периодов стимуляции, могут проявлять различные характеристики. Например, типичная кровь или мононуклеарные клеточные продукты подвергнутой аферезу периферической крови имеют популяцию хелперных T-клеток (TH, CD4+), которая превышает популяцию цитотоксических или супрессорных T-клеток (TC, CD8+). Экспансия T-клеток ex vivo посредством стимуляции рецепторов CD3 и CD28 продуцирует популяцию T-клеток, которая до приблизительно 8-9 суток состоит в основном из TH-клеток, в то время как после 8-9 суток, популяция T-клеток содержит значительно более высокую популяцию TC-клеток. Таким образом, в зависимости от цели лечения, инфузия индивидууму популяции T-клеток, содержащей в основном TH-клетки, может быть преимущественной. Аналогично, если антигенспецифическая подгруппа TC-клеток является выделенной, может быть предпочтительным увеличение в количестве этой подгруппы в большей степени.
[00524] Кроме того, в дополнение к маркерам CD4 и CD8, другие фенотипические маркеры значительно варьируются, однако по большей части, являются воспроизводимыми в ходе процесса экспансии клеток. Таким образом, такая воспроизводимость обеспечивает возможность адаптации продукта в виде активированных T-клеток к конкретным целям.
[00525] В других вариантах осуществления способ получения, описанный в настоящем описании, кроме того, включает приведение в контакт популяции иммунных эффекторных клеток с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, hTERT. Нуклеиновая кислота, кодирующая субъединицу теломеразы, может представлять собой ДНК.
[00526] В некоторых вариантах осуществления в процессе получения CAR-клеток добавляют ингибитор киназы (например, ингибитор BTK, такой как ибрутиниб). Согласно неограничивающей теории, ингибитор киназы может улучшить качество популяции полученных клеток. Например, CAR-экспрессирующие клетки часто получают из образца собственной плазмы пациента со злокачественной опухолью для афереза, который может содержать злокачественные клетки, и ингибитор киназы может изменять передачу сигнала в этих злокачественных клетках (например, экспрессирующая BTK злокачественная клетка, такая как CLL или MCL), например, снижая их пролиферацию и повышая уровни апоптоза. В качестве другого примера, ингибитор киназы может изменять передачу сигнала в CAR-экспрессирующих клетках (или иммунных эффекторных клетках до экспрессии ими CAR), например, путем ингибирования ITK в T-клетках. Ингибитор киназы может сдвигать баланс T-клеток от TH2-клеток к TH1-клеткам.
[00527] Ингибитор киназы (например, ингибитор BTK, такой как ибрутиниб) можно добавлять в реакционную смесь на уровне, достаточном для ингибирования его мишени, например, BTK. В некоторых вариантах осуществления ингибитор киназы (например, ингибитор BTK, такой как ибрутиниб) добавляют в концентрации приблизительно 0,1-0,2, 0,2-0,5, 0,5-1, 1-2, 2-5 или 5-10 мкМ. В некоторых вариантах осуществления ингибитор киназы представляет собой ковалентный ингибитор (такой как ибрутиниб) и короткой импульсной обработки достаточно для необратимой инактивации мишени, одновременна избегая неспецифической токсичности. Следовательно, ингибитор киназы можно добавлять, например, на 10-20, 20-30, 30-40, 40-60 или 60-120 минут. Ингибитор киназы также можно добавлять на более длительные периоды времнеи, например, если ингибитор киназы обладает нековалентным способом действия. Таким образом, ингибитор киназы можно добавлять, например, на 2-4, 4-6, 6-8, 8-12, 12-18 или 18-24 часов, или на 1-2, 2-3, 3-4, 4-6, 6-8, 8-10 суток, или на весь период времени, в течение которого клетки культивируют. Ингибитор киназы можно добавлять в различные моменты времени в ходе процесса получения, например, после сбора клеток, до стимуляции гранулами, после стимуляции гранулами, до трансдукции, после трансдукции, или до введения клеток пациенту. В некоторых вариантах осуществления ингибитор киназы (например, ингибитор BTK, такой как ибрутиниб) добавляют после сбора клеток или до стимуляции, например, гранулами. До и после в этом контексте может относиться, например, к приблизительно 1, 5, 15, 30, 45 или 60 минутам до или после, или 1, 2, 3, 4, 5 или 6 часам до или после.
[00528] После конструирования CAR против CD19 различные анализы можно использовать для оценки активности молекулы, такой как, но не ограничиваясь ими, способность к экспансии T-клеток после стимуляции антигеном, поддержание экспансии T-клеток в отсутствие рестимуляции и активность против злокачественной опухоли в различных моделях in vitro и на животных. Анализы для оценки эффектов CAR против CD19 более подробно описаны ниже.
[00417] Анализ с использованием вестер-блоттинга экспрессии CAR в первичных T-клетках можно использовать для обнаружения присутствия мономеров и димеров. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В кратком изложении, T-клетки (смесь 1:1 CD4+ и CD8+ T-клеток), экспрессирующие CAR, увеличивают в количестве in vitro в течение более чем 10 суток с последующим лизисом и SDS-PAGE в восстанавливающих условиях. CAR, содержащие полноразмерный цитоплазматический домен TCR-ζ и эндогенную цепь TCR-ζ, выявляют с помощью вестер-блоттинга с использованием антитела к цепи TCR-ζ. Те же подгруппы T-клеток используют для анализа SDS-PAGE в невосстанавливающих условиях, чтобы иметь возможность оценки образования ковалентного димера.
[00418] Экспансию CAR+ T-клеток in vitro после антигенной стимуляции можно измерять проточной цитометрии. Например, смесь CD4+ и CD8+ T-клеток стимулируют гранулами αCD3/αCD28 с последующей трансдукцией лентивирусными векторами, экспрессирующими GFP под контролем промоторов, подлежащих анализу. Иллюстративные промоторы включают промоторы гена CMV IE, EF-1α, убиквитина C или фосфоглицерокиназы (PGK). Флуоресценцию GFP оценивают на 6 сутки культивирования в подгруппах CD4+ и/или CD8+ T-клеток с использованием проточной цитометрии. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). Альтернативно смесь CD4+ и CD8+ T-клеток стимулируют покрытыми αCD3/αCD28 магнитными гранулами на 0 сутки и трансдуцируют посредством CAR на 1 сутки с использованием бицистронного лентивирусного вектора, экспрессирующего CAR вместе с eGFP, с использованием рибосомальной последовательности пропуска 2A. После промывания культуры повторно стимулируют либо CD19+ клетками K562 (K562-CD19), либо клетками K562 дикого типа (K562 дикого типа), либо клетками K562, экспрессирующими hCD32 и 4-1BBL, в присутствии антитела против CD3 и антитела против CD28 (K562-BBL-3/28). К культурам раз в двое суток добавляют экзогенный IL-2 в количестве 100 МЕ/мл. GFP+ T-клетки подсчитывают проточной цитометрией с использованием подсчета на основе гранул. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009).
[00419] Также можно измерять длительную экспансию CAR+ T-клеток в отсутствие рестимуляции. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В кратком изложении измеряют средний объем T-клеток (фл) на 8 сутки культивирования с использованием устройства для подсчета частиц Coulter Multisizer, Nexcelom Cellometer Vision или Millipore Scepter, после стимуляции покрытыми αCD3/αCD28 магнитными гранулами на 0 сутки и трансдукции указанным CAR на 1 сутки.
[00532] Также для измерения активности CART можно использовать модели на животных. Например, можно использовать модель с ксенторансплантатом с использованием специфичных к CD19 человека CAR+ T-клеток для лечения первичного пре-B ALL человека у иммунодефицитных мышей. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В кратком изложении, после установления ALL мышей случайным образом распределяют в группы лечения. Различные количества модифицированных способами инженерии T-клеток αCD19-ζ и αCD19-BB-ζ совместно инъецируют в соотношении 1:1 мышам NOD-SCID-γ-/-, имеющим B-ALL. Количество копий вектора αCD19-ζ и αCD19-BB-ζ в ДНК селезенки от мышей оценивают в различные моменты времени после инъекции T-клеток. Животных оценивают в отношении лейкоза с интервалами раз в неделю. Количества CD19+ бластных клеток B-ALL в периферической крови измеряют у мышей, которым инъецировали αCD19-ζ CAR+ T-клетки и трансдуцированные имитирующей конструкцией T-клетки. Кривые выживаемости для групп сравнивают с использованием логарифмического рангового критерия. Кроме того, также можно анализировать абсолютное количество CD4+ и CD8+ T-клеток периферической крови через 4 недели после инъекции T-клеток мышам NOD-SCID-γ-/-. Мышам инъецируют лейкозные клетки и через 3 неделе инъецируют T-клетки, модифицированные способами инженерии для экспрессии CAR посредством бицистронного лентивирусного вектора, который кодирует CAR, связанный с eGFP. T-клетки нормализуют к 45-50% GFP+ T-клеток на входе путем смешения с трансдуцированными имитирующей конструкцией клетками перед инъекцией, и подтверждают проточной цитометрией. Животных оценивают в отношении лейкоза с интервалами, составляющими 1 неделю. Кривые выживаемости для групп CAR+ T-клеток сравнивают с использованием логарифмического рангового критерия.
[00533] Можно оценивать дозозависимый ответ на введение CAR. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). Например, периферическую кровь получают через 35-70 суток после установления лейкоза у мышей, которым инъецировали на 21 сутки CAR T-клетки, эквивалентное количество трансдуцированных имитирующей конструкцией T-клеток, или не инъецировали T-клетки. У мышей из каждой группы случайным образом проводили взятие крови для определения количеств CD19+ бластов ALL периферической крови, а затем умерщвляли на 35 и 49 сутки. Остальных животных оценивали на 57 и 70 сутки.
[00534] Оценка пролиферации клеток и продукции цитокинов была описана ранее, например, в Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В кратком изложении, оценку опосредуемой CAR пролиферации проводят на микропланшетах для титрования путем смешения промытых T-клеток с клетками-мишенями, такими как клетки K562-Meso, Ovcar3, Ovcar8, SW1990, Panc02.03, экспрессирующие мезотелин или CD32 и CD137 (KT32-BBL) в конечном соотношении T-клетки:клетки-мишени 1:1. К культурам с клетками KT32-BBL добавляют моноклональные антитела против CD3 (клон OKT3) и против CD28 (клон 9.3), чтобы они служили в качестве положительного контроля стимуляции пролиферации T-клеток, поскольку эти сигналы поддерживают длительную экспансию CD8+ T-клеток ex vivo. T-клетки подсчитывают в культурах с использованием флуоресцентных гранул CountBrightTM (Invitrogen, Carlsbad, CA) и проточной цитометрии, как описано изготовителем. CAR+ T-клетки идентифицируют по экспрессии GFP с использованием T-клеток, которые модифицированы связанными с eGFP-2A экспрессирующими CAR лентивирусными векторами. Для CAR+ T-клеток, не экспрессирующих GFP, CAR+ T-клетки выявляют с использованием биотинлированного рекомбинантного белка мезотелина и вторичного конъюгата авидин-PE. Также одновременно выявляют экспрессию CD4+ и CD8+ на T-клетках с использованием специфических моноклональных антител (BD Biosciences). Измерение цитокинов проводят в супернатантах, собранных через 24 часа после рестимуляции, с использованием набора цитометрических гранульных матриц для цитокинов TH1/TH2 (BD Biosciences, San Diego, CA) согласно инструкциям изготовителя. Флуоресценцию оценивают с использованием проточного цитометра FACScalibur, и данные анализируют в соответствии с инструкциями изготовителя.
[00535] Цитотоксичность можно оценивать способами, описанными в настоящем описании, например в примерах, или с использованием стандартного высвобождения 51Cr. См., например, Milone et al., Molecular Therapy 17(8): 1453-1464 (2009). В кратком изложении, клетки-мишени (например, клетки BHK или CHO, экспрессирующие мезотелин) нагружают 51Cr (таким как NaCrO4, New England Nuclear, Boston, MA) при 37°C в течение 2 часов при частом встряхивании, промывают дважды в полной RPMI и высевают на микропланшеты для титрования. Эффекторные T-клетки смешивают с клетками-мишенями в лунках в полной RPMI в различных соотношениях эффекторная клетк:клетка-мишень (E:T). Также подготавливают дополнительные лунки, содержащие только среду (самопроизвольное высвобождение, SR) или 1% раствор детергента triton-X 100 (полное высвобождение, TR). После инкубации в течение 4 часов при 37°C супернатант каждой лунки собирают. Затем измеряют высвобждение 51Cr с использованием счетчика гамма-частиц (Packard Instrument Co., Waltham, MA). Каждые условия выполняют по меньшей мере в трех экземплярах, и процентный лизис вычисляют с использованием формулы: % лизис=(ER-SR)/(TR-SR), где ER представляет собой среднее количество 51Cr, высвободившееся для каждых экспериментальных условий. Также можно использовать альтернативные анализы цитотоксичности, такие как проточные анализы цитотоксичности.
[00536] Для оценки специфического транспорта и пролиферации CAR в моделях на имеющих опухоль животных можно использовать технологии визуализации. Такие способы анализа описаны, например, в Barrett et al., Human Gene Therapy 22:1575-1586 (2011). В кратком изложении, мышам NOD/SCID/γc-/- (NSG) проводят в/в инъекцию клеток Nalm-6, а затем через 7 суток T-клетки через 4 часа после введения конструкций CAR электропорацией. T-клетки стабильно трансфицируют лентивирусной конструкцией для экспрессии люциферазы светлячка, и мышей визуализируют в отношении биолюминеценции. Альтернативно терапевтическую эффективность однократной инъекции CAR+ T-клеток в модели с ксенотрансплантатом Nalm-6 можно измерять следующим образом: мышам NSG инъецируют Nalm-6, трансдуцированные для стабильной экспрессии люциферазы светлячка, а затем через 7 суток проводят однократную инъекцию в хвостовую вену T-клеток, в которые посредством электропорации был введен CAR против CD19. Животных визуализируют в различные моменты времени после инъекции. Например, можно получать тепловые карты плотности фотонов положительных по люциферазе светлячка лейкозных клеток у репрезентативных мышей на 5 сутки (за 2 суток до лечения) и 8 сутки (через 24 ч после CAR+ PBL).
[00537] Также для оценки конструкций CAR против CD19 по изобретению можно использовать другие анализы, включая анализы, описанные в разделе "Примеры" настоящего писания, а также анализы, известные в данной области.
Ингибитор киназы
[00538] В одном варианте осуществления ингибитор киназы представляет собой ингибитор CDK4, например, ингибитор CDK4, описанный в настоящем описании, например, ингибитор CDK4/6, например, такой как 6-ацетил-8-циклопентил-5-метил-2-(5-пиперазин-1-ил-пиридин-2-иламино)-8H-пиридо[2,3-d]пиримидин-7-она гидрохлорид (также называемый палбоциклибом или PD0332991). В одном варианте осуществления ингибитор киназы представляет собой ингибитор BTK, например, ингибитор BTK, описанный в настоящем описании, например, такой как ибрутиниб. В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, например, ингибитор mTOR, описанный в настоящем описании, например, такой как рапамицин, аналог рапамицина, OSI-027. Ингибитор mTOR может представлять собой, например, ингибитор mTORC1 и/или ингибитор mTORC2, например, ингибитор mTORC1 и/или ингибитор mTORC2, описанный в настоящем описании. В одном варианте осуществления ингибитор киназы представляет собой ингибитор MNK, например, ингибитор MNK, описанный в настоящем описании, например, такой как 4-амино-5-(4-фторанилино)пиразолo[3,4-d]пиримидин. Ингибитор MNK может представлять собой, например, ингибитор MNK1a, MNK1b, MNK2a и/или MNK2b.
[00539] В одном варианте осуществления ингибитор киназы представляет собой ингибитор CDK4, выбранный из алоизина A; флавопиридола или HMR-1275, 2-(2-хлорфенил)-5,7-дигидрокси-8-[(3S,4R)-3-гидрокси-1-метил-4-пиперидинил]-4-хроменона; кризотиниба (PF-02341066; 2-(2-хлорфенил)-5,7-дигидрокси-8-[(2R,3S)-2-(гидроксиметил)-1-метил-3-пирролидинил]-4H-1-бензопиран-4-она гидрохлорида (P276-00); 1-метил-5-[[2-[5-(трифторметил)-1H-имидазол-2-ил]-4-пиридинил]окси]-N-[4-(трифторметил)фенил]-1H-бензимидазол-2-амина (RAF265); индисулама (E7070); росковитина (CYC202); пальбоциклиба (PD0332991); динациклиба (SCH727965); N-[5-[[(5-трет-бутилоксазол-2-ил)метил]тио]тиазол-2-ил]пиперидин-4-карбоксамида (BMS 387032); 4-[[9-хлор-7-(2,6-дифторфенил)-5H-пиримидо[5,4-d][2]бензазепин-2-ил]амино]бензойной кислоты (MLN8054); 5-[3-(4,6-дифтор-1H-бензимидазол-2-ил)-1H-индазол-5-ил]-N-этил-4-метил-3-пиридинметанамина (AG-024322); 4-(2,6-дихлорбензоиламино)-1H-пиразол-3-карбоновой кислоты N-(пиперидин-4-ил)амида (AT7519); 4-[2-метил-1-(1-метилэтил)-1H-имидазол-5-ил]-N-[4-(метилсульфонил)фенил]-2-пиримидинамина (AZD5438) и XL281 (BMS908662).
[00540] В одном варианте осуществления ингибитор киназы представляет собой ингибитор CDK4, например пальбоциклиб (PD0332991), и пальбоциклиб вводят в дозе приблизительно 50 мг, 60 мг, 70 мг, 75 мг, 80 мг, 90 мг, 100 мг, 105 мг, 110 мг, 115 мг, 120 мг, 125 мг, 130 мг, 135 мг (например, 75 мг, 100 мг или 125 мг) каждые сутки в течение периода времени, например, каждые сутки в течение 14-21 суток курса из 28 суток, или каждые сутки в течение 7-12 суток курса из 21 суток. В одном варианте осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более курсов пальбоциклиба.
[00541] Иллюстративным ингибитором CDK4/6 является LEE011 (также называемый рибоциклибом), структура которого показана ниже.
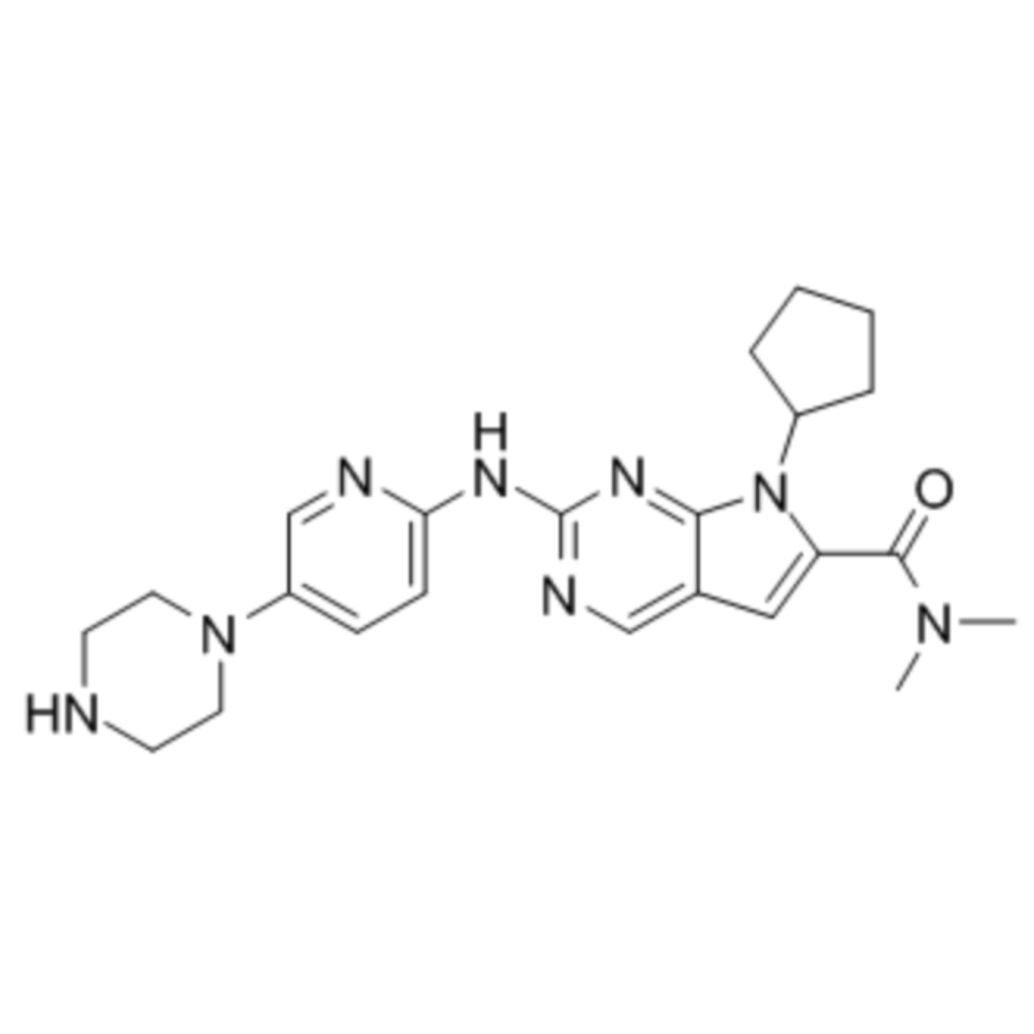
Без связи с теорией, полагают, что введение CAR-экспрессирующей клетки, описанной в настоящем описании, с ингибитором CDK4/6 (например, LEE011 или другим ингибитором CDK4/6, описанным в настоящем описании), может достигать более высокой способности к ответу, например, с более высокими показателями ремиссии и/или более низкими показателями рецидива, например, по сравнению с ингибитором CDK4/6 отдельно.
[00542] Без связи с теорией, в некоторых вариантах осуществления ингибитор CDK4/6 действует, снижая активность циклина D1 в злокачественных клетках, например, клетках MCL. Некоторые злокачественные клетки характеризуются повышенными уровнями циклина D1 вследствие транслокации. CDK4 образует комплекс с циклином D, обеспечивая прогрессирование клеточного цикла. Таким образом, в некоторых вариантах осуществления введение ингибитора CK4/6 снижает пролиферацию злокачественных клеток. См., например, Marzec et al., "Mantle cell lymphoma cells express predominantly cyclin D1a isoform and are highly sensitive to selective inhibition of CDK4 kinase activity." Blood. 2006 Sep 1;108(5):1744-50. Epub 2006 May 11.
[00543] В одном варианте осуществления ингибитор киназы представляет собой ингибитор BTK, выбранный из ибрутиниба (PCI-32765); GDC-0834; RN-486; CGI-560; CGI-1764; HM-71224; CC-292; ONO-4059; CNX-774 и LFM-A13. В одном варианте осуществления ингибитор BTK не снижает или не ингибирует киназную активность индуцируемой интерлейкином-2 киназы (ITK), и он выбран из GDC-0834; RN-486; CGI-560; CGI-1764; HM-71224; CC-292; ONO-4059; CNX-774 и LFM-A13.
[00544] В одном варианте осуществления ингибитор киназы представляет собой ингибитор BTK, например, ибрутиниб (PCI-32765), и ибрутиниб вводят в дозе приблизительно 250 мг, 300 мг, 350 мг, 400 мг, 420 мг, 440 мг, 460 мг, 480 мг, 500 мг, 520 мг, 540 мг, 560 мг, 580 мг, 600 мг (например, 250 мг, 420 мг или 560 мг) каждые сутки в течение некоторого периода времени, например, каждые сутки в течение курса из 21 суток, или каждые сутки в течение курса из 28 суток. В одном варианте осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более курсов введения ибрутиниба.
[00545] В вариантах осуществления ингибитор BTK (например, ибрутиниб) вводят индивидууму, который имеет CLL, лимфому из клеток мантийной зоны (MCL) или мелколимфоцитарную лимфому (SLL). Например, индивидуум, которому вводят ингибитор BTK, имеет делецию короткого плеча хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах индивидуум, которому вводят ингибитор BTK, не имеет del(17p). В вариантах осуществления индивидуум, которому вводят ингибитор BTK, имеет рецидивирующий CLL или SLL, например, индивидууму ранее проводили терапию злокачественной опухоли (например, ранее проводили одну, две, три или четыре предшествующих терапии злокачественной опухоли). В вариантах осуществления индивидуум, которому вводят ингибитор BTK, имеет рефрактерный или рецидивирующий CLL или SLL. В других вариантах осуществления индивидуум, которому вводят ингибитор BTK, имеет фолликулярную лимфому, например, рецидивирующую или рефрактерную фолликулярную лимфому.
[00546] Структура ибрутиниба (1-[(3R)-3-[4-амино-3-(4-феноксифенил)-1H-пиразолo[3,4-d]пиримидин-1-ил]пиперидин-1-ил]проп-2-ен-1-он) показана ниже.
[00547] Концентрации ибрутиниба, превышающие приблизительно 400 нМ не являются клинически применимыми. В исследовании Advani et al (J Clin Oncol 2012;31:88), средняя максимальная концентрация ибрутиниба в сыворотке составляла приблизительно 130 нг/мл, что эквивалентно 295 нМ (исходя из молекулярной массы ибрутиниба 440,5). Таким образом, данные, демонстрирующие эффект ибрутиниба на T-клетки при концентрации 1 мкМ, значительно превышают клинически применимую концентрацию in vivo.
[00548] В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, выбранный из темсиролимуса; ридафоролимуса (1R,2R,4S)-4-[(2R)-2 [(1R,9S,12S,15R,16E,18R,19R,21R, 23S,24E,26E,28Z,30S,32S,35R)-1,18-дигидрокси-19,30-диметокси-15,17,21,23, 29,35-гексаметил-2,3,10,14,20-пентаоксо-11,36-диокса-4-азатрицикло[30,3,1,04,9]гексатриаконта-16,24,26,28-тетраен-12-ил]пропил]-2-метоксициклогексилдиметилфосфината, также известного как AP23573 и MK8669; эверолимуса (RAD001); рапамицина (AY22989); симапимода; (5-{2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил}-2-метоксифенил)метанола (AZD8055); 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метил-пиридо[2,3-d]пиримидин-7(8H)-она (PF04691502); и N2-[1,4-диоксо-4-[[4-(4-оксо-8-фенил-4H-1-бензопиран-2-ил)морфолиний-4-ил]метокси]бутил]-L-аргинилглицил-L-α-аспартил-L-серина-, внутренней соли (SF1126); и XL765.
[00549] В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, например, рапамицин, и рапамицин вводят в дозе приблизительно 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг (например, 6 мг) каждые сутки в течение периода времени, например, каждые сутки в течение курса из 21 суток или каждые сутки в течение курса из 28 суток. В одном варианте осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более курсов введения рапамицина. В одном варианте осуществления ингибитор киназы представляет собой ингибитор mTOR, например, эверолимус, и эверолимус вводят в дозе приблизительно 2 мг, 2,5 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 11 мг, 12 мг, 13 мг, 14 мг, 15 мг (например, 10 мг) каждые сутки в течение периода времени, например, каждые сутки в течение курса из 28 суток. В одном варианте осуществления проводят 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 или более курсов введения эверолимуса.
[00550] В одном варианте осуществления ингибитор киназы представляет собой ингибитор MNK, выбранный из CGP052088; 4-амино-3-(п-фторфениламино)пиразолo[3,4-d]пиримидина (CGP57380); церкоспорамида; ETC-1780445-2 и 4-амино-5-(4-фторанилино)пиразолo[3,4-d]пиримидина.
[00551] В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, необязательно в комбинации с ингибитором киназы, например, ингибитором BTK, таким как ибрутиниб, вводят индивидууму в комбинации с ингибитором фосфоинозитид-3-киназы (PI3K) (например, ингибитор PI3K, описанный в настоящем описании, например, иделалисиб или дувелисиб) и/или ритуксимабом. В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, вводят индивидууму в комбинации с иделалисибом и ритуксимабом. В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, вводят индивидууму в комбинации с дувелисибом и ритуксимабом. Иделалисиб (также называемый GS-1101 или CAL-101; Gilead) представляет собой низкомолекулярное соединение, которое блокирует дельта-изоформу PI3K. Структура иделалисиба (5-фтор-3-фенил-2-[(1S)-1-(7H-пурин-6-иламино)пропил]-4(3H)-хиназолинона) представлена ниже.
Дувелисиб представляет собой низкомолекулярное соединение, которое блокирует PI3K-δ,γ. Структура дувелисиба (8-хлор-2-фенил-3-[(1S)-1-(9H-пурин-6-иламино)этил]-1(2H)-изохинолинон) показана ниже.
В вариантах осуществления индивидуум имеет CLL. В вариантах осуществления индивидуум имеет рецидивирующий CLL, например, индивидууму ранее проводили терапию злокачественной опухоли (например, ранее вводили антитело против CD20 или ранее вводили ибрутиниб). Например, индивидуум имеет делецию на коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах индивидуум не имеет del(17p). В вариантах осуществления индивидуум имеет лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В других вариантах осуществления индивидуум не содержит лейкозных клеток. Содержащих мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В вариантах осуществления индивидуум имеет делецию в длинном плече хромосомы 11 (del(11q)). В других вариантах осуществления индивидуум не имеет del(11q). В вариантах осуществления иделалисиб вводят в дозировке приблизительно 100-400 мг (например, 100-125, 125-150, 150-175, 175-200, 200-225, 225-250, 250-275, 275-300, 325-350, 350-375, или 375-400 мг), например, BID. В вариантах осуществления дувелисиб вводят в дозировке приблизительно 15-100 мг (например, приблизительно 15-25, 25-50, 50-75 или 75-100 мг), например, два раза в сутки. В вариантах осуществления ритуксимаб вводят в дозировке приблизительно 350-550 мг/м2 (например, 350-375, 375-400, 400-425, 425-450, 450-475 или 475-500 мг/м2), например, внутривенно.
[00552] В одном варианте осуществления ингибитор киназы представляет собой двойной ингибитор фосфатидилинозитол-3-киназы (PI3K) и ингибитор mTOR, выбранный из 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метилпиридо[2,3-d]пиримидин-7(8H)-она (PF-04691502); N-[4-[[4-(диметиламино)-1-пиперидинил]карбонил]фенил]-N'-[4-(4,6-ди-4-морфолинил-1,3,5-триазин-2-ил)фенил]мочевины (PF-05212384, PKI-587); 2-метил-2-{4-[3-метил-2-оксо-8-(хинолин-3-ил)-2,3-дигидро-1H-имидазо[4,5-c]хинолин-1-ил]фенил}пропаннитрила (BEZ-235); апитолисиба (GDC-0980, RG7422); 2,4-дифтор-N-{2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамида (GSK2126458); 8-(6-метоксипиридин-3-ил)-3-метил-1-(4-(пиперазин-1-ил)-3-(трифторметил)фенил)-1H-имидазо[4,5-c]хинолин-2(3H)-она-малеиновой кислоты (NVP-BGT226); 3-[4-(4-морфолинилпиридо[3',2':4,5]фуро[3,2-d]пиримидин-2-ил]фенола (PI-103); 5-(9-изопропил-8-метил-2-морфолино-9H-пурин-6-ил)пиримидин-2-амина (VS-5584, SB2343); и N-[2-[(3,5-диметоксифенил)амино]хиноксалин-3-ил]-4-[(4-метил-3-метоксифенил)карбонил]аминофенилсульфонамида (XL765).
[00553] В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, необязательно в комбинации с ингибитором киназы, например, ингибитором BTK, таким как ибрутиниб, вводят индивидууму в комбинации с ингибитором киназы анапластической лимфомы (ALK). Иллюстративные ингибиторы киназы ALK включают, но не ограничиваются ими, кризотиниб (Pfizer), церитиниб (Novartis), алектиниб (Chugai), бригатиниб (также называемый AP26113; Ariad), энтректиниб (Ignyta), PF-06463922 (Pfizer), TSR-011 (Tesaro) (см., например, клинические испытания под идентификационным номером № NCT02048488), CEP-37440 (Teva), и X-396 (Xcovery). В некоторых вариантах осуществления индивидуум имеет солидную злокачественную опухоль, например, солидную злокачественную опухоль, описанную в настоящем описании, например, рак легкого.
[00554] Химическое название кризотиниба представляет собой 3-[(1R)-1-(2,6-дихлор-3-фторфенил)этокси]-5-(1-пиперидин-4-илпиразол-4-ил)пиридин-2-амин. Химическое название церитиниба представляет собой 5-хлор-N2-[2-изопропокси-5-метил-4-(4-пиперидинил)фенил]-N4-[2-(изопропилсульфонил)фенил]-2,4-пиримидиндиамин. Химическое название алектиниба представляет собой 9-этил-6,6-диметил-8-(4-морфолинопиперидин-1-ил)-11-оксо-6,11-дигидро-5H-бензо[b]карбазол-3-карбонитрил. Химическое название бригатиниба представляет собой 5-хлор-N2-{4-[4-(диметиламино)-1-пиперидинил]-2-метоксифенил}-N4-[2-(диметилфосфорил)фенил]-2,4-пиримидиндиамин. Химическое название энтректиниба представляет собой N-(5-(3,5-дифторбензил)-1H-индазол-3-ил)-4-(4-метилпиперазин-1-ил)-2-((тетрагидро-2H-пиран-4-ил)амино)бензамид. Химическое название PF-06463922 представляет собой (10R)-7-амино-12-фтор-2,10,16-триметил-15-оксо-10,15,16,17-тетрагидро-2H-8,4-(метено)пиразолo[4,3-h][2,5,11]-бензоxaдиазациклотетрадецин-3-карбонитрил. Химическая структура CEP-37440 представляет собой (S)-2-((5-хлор-2-((6-(4-(2-гидроксиэтил)пиперазин-1-ил)-1-метокси-6,7,8,9-тетрагидро-5H-бензо[7]аннулен-2-ил)амино)пиримидин-4-ил)амино)-N-метилбензамид. Химическое название X-396 представляет собой (R)-6-амино-5-(1-(2,6-дихлор-3-фторфенил)этокси)-N-(4-(4-метилпиперазин-1-карбонил)фенил)пиридазин-3-карбоксамид.
[00555] В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, необязательно в комбинации с ингибитором киназы, например, ингибитором BTK, таким как ибрутиниб, вводят индивидууму в комбинации с ингибитором индоламин-2,3-диоксигеназы (IDO). IDO представляет собой фермент, который катализирует деградацию аминокислоты L-триптофана до кинуренина. Многие злокачественные опухоли сверхэкспрессируют IDO, например, рак предстательной железы, рак ободочной и прямой кишки, рак поджелудочной железы, рак шейки матки, рак желудка, рак яичника, рак головы и рак легкого. pDC, макрофаги и дендритные клетки (DC) могут экспрессировать IDO. Без связи с теорией, полагают, что снижение уровня L-триптофана (например, катализируемое IDO) приводит к иммунодепрессивной среде путем индукции анергии и апоптоза T-клеток. Таким образом, без связи с теорией, полагают, что ингибитор IDO может повышать эффективность CAR-экспрессирующей клетки, описанной в настоящем описании, например, путем уменьшения подавления или гибели CAR-экспрессирующих иммунных клеток. В вариантах осуществления индивидуум имеет солидную опухоль, например, солидную опухоль, описанную в настоящем описании, например, рак предстательной железы, рак ободочной и прямой кишки, рак поджелудочной железы, рак шейки матки, рак желудка, рак яичника, рак головы и рак легкого. Иллюстративные ингибиторы IDO включают, но не ограничиваются ими, 1-метилтриптофан, индоксимод (NewLink Genetics) (см., например, клинические испытания под идентификационными номерами № NCT01191216; NCT01792050) и INCB024360 (Incyte Corp.) (см., например, клинические испытания под идентификационными номерами № NCT01604889; NCT01685255).
[00556] В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, необязательно в комбинации с ингибитором киназы, например, ингибитором BTK, таким как ибрутиниб, вводят индивидууму в комбинации с модулятором супрессорных клеток миелоидного происхождения (MDSC). MDSC накапливаются на периферии и в области опухоли многих солидных опухолей. Эти клетки подавляют T-клеточные ответы, тем самым препятствуя эффективности CAR-экспрессирующих клеток. Без связи с теорией, полагают, что введение модулятора MDSC повышает эффективность CAR-экспрессирующих клеток описанных в настоящем описании. В одном варианте осуществления индивидуум имеет солидную опухоль, например, солидную опухоль, описанную в настоящем описании, например, глиобластому. Иллюстративные модуляторы MDSC включают, но не ограничиваются ими MCS110 и BLZ945. MCS110 представляет собой моноклональное антитело (mAb) против макрофагального колониестимулирующего фактора (M-CSF). См., например, клинические испытания под идентификационным номером № NCT00757757. BLZ945 представляет собой низкомолекулярный ингибитор рецептора колониестимулирующего фактора 1 (CSF1R). См., например, Pyonteck et al. Nat. Med. 19(2013):1264-72. Структура BLZ945 показана ниже.
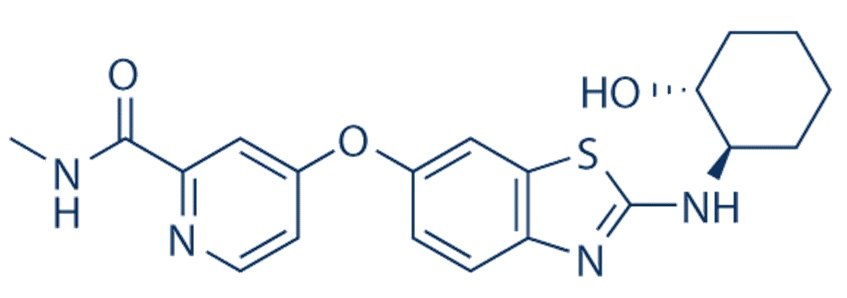
[00557] В некоторых вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, необязательно в комбинации с ингибитором киназы, например, ингибитором BTK, таким как ибрутиниб, вводят индивидууму в комбинации с полипептидом интерлейкина-15 (IL-15), полипептидом альфа-рецептора интерлейкина-15 (IL-15Ra), или с комбинацией как полипептида IL-15, так и полипептида IL-15Ra, например, hetIL-15 (Admune Therapeutics, LLC). hetIL-15 представляет собой гетеродимерный нековалентный комплекс IL-15 и IL-15Ra. hetIL-15 описан, например, в U.S. 8124084, U.S. 2012/0177598, U.S. 2009/0082299, U.S. 2012/0141413 и U.S. 2011/0081311, включенных в настоящее описание в качестве ссылок. В вариантах осуществления het-IL-15 вводят подкожно. В вариантах осуществления индивидуум имеет злокачественную опухоль, например, солидную злокачественную опухоль, например, меланому или рак толстого кишечника. В вариантах осуществления индивидуум имеет метастазирующую злокачественную опухоль.
Терапевтическое применение
Ассоциированные с CD19 заболевания и/или нарушения
[00558] В одном аспекте изобретение относится к способам лечения заболевания, ассоциированного с экспрессией CD19. В одном аспекте изобретение относится к способам лечения заболевания, где часть опухоли является отрицательной по CD19 и часть опухоли является положительной по CD19. Например, CAR по изобретению пригоден для лечения индивидуумов, которые подвергались лечению от заболевания, ассоциированного с повышенной экспрессией CD19, где индивидуум, которому проводили лечение, связанное с повышенными уровнями CD19, имеет заболевание, ассоциированное с повышенными уровнями CD19.
[00559] Способы терапии, описанные в настоящем описании, можно использовать для лечения, например, индивидуумов, которые отвечают на ингибитор киназы, такой как ибрутиниб (например, частичный ответ или полный ответ) или индивидуумов, которые не отвечают (например, не отвечающие индивидуумы или индивидуумы с рецидивом). Без связи с теорией, ряд пациентов, подвергающихся лечению ингибиторами киназы (например, ингибиторы BTK, такие как ибрутиниб) может продемонстрировать сниженный ответ на лечение (например, являются частичными отвечающими или не отвечающими на лечение или имеют рецидив в ходе лечения). Таким образом, введение терапевтических средств на основе CAR, описанных в настоящем описании, в комбинации с ингибиторами киназ может обеспечивать благоприятные эффекты.
[00560] Иллюстративные терапевтические режимы для этих индивидуумов описаны ниже.
[00561] В некоторых случаях, когда индивидуум является неотвечающим или имеет рецидив после лечения ингибитором киназы (например, ингибитором BTK, таким как ибрутиниб), ингибитор киназы отменяют и проводят терапию CAR. В других случаях, когда индивидуум не отвечает на ингибитор киназы (например ингибитор BTK, такой как ибрутиниб), введение ингибитора киназы продолжают и к режиму добавляют терапию CAR. В поддержку этого применения служат, например, эксперименты Примера 8 настоящего описания, которые указывают на то, что терапия CAR является эффективной в качестве монотерапии в резистинтных ибрутинибу клетках. Без связи с теорией, продолжение терапии ингибитором киназы может повысить эффективность терапии CAR, например, путем увеличения количества CAR-экспрессирующих клеток в кровотоке (см. Пример 8 настоящего описания).
[00562] Без связи с теорией, индивидуум, который является неотвечающим или имеет рецидив при лечении ингибитором киназы (например, ингибитором BTK, таким как ибрутиниб) может быть неотвечающим по меньшей мере по двумя причинам: индивидуум имеет мутацию в мишени лекарственного средства (например, BTK, например, мутация C481S), которая препятствует ингибированию мишени, или он может иметь изменения в других каскадах, которые могут запускать пролиферацию, даже когда мишень ингибируется в достаточной степени (например, мутация в PLCγ, такая как активирующая мутация в PLCγ, приводящая к конститутивной независимой от BTK клеточной передаче сигнала). Лечение можно изменять в зависимости от причины отсутствия ответа. Например, в первой ситуации (в некоторых вариантах осуществления), если индивидуум имеет (или идентифицирован как имеющий) мутацию, которая препятствует ингибированию ингибитором киназы его мишени, ингибитор киназы можно заменять вторым ингибитором киназы (например, направленным против той же мишени) (или их можно вводить в комбинации). Более конкретно, в некоторых вариантах осуществления, когда пациент имеет (или идентифицирован как имеющий) мутацию, которая препятствует ингибированию ибрутинибом BTK, ибрутиниб можно заменять вторым ингибитором BTK, например, ингибитором BTK, описанным в настоящем описании, таким как GDC-0834, RN-486, CGI-560, CGI-1764, HM-71224, CC-292, ONO-4059, CNX-774 или LFM-A13). Без связи с теорией, второй ингибитор киназы может действовать на область мишени, которая не нарушается мутацией, и, таким образом, индивидуум является чувствительным ко втором ингибитору киназы. В других вариантах осуществления сохраняют исходный ингибитор киназы (например ингибитор BTK, такой как). Согласно неограничивающей теории, в данном случае исходный ингибитор киназы может обладать полезной активностью в отношении CAR-экспрессирующих клеток, например, способствуя TH1-фенотипу, стимулируя пролиферацию или иным образом увеличивая уровни или активность клеток.
[00563] Как отмечалось выше, в некоторых случаях индивидуум является неотвечающим, поскольку индивидуум имеет изменение (например, мутацию) в другом каскаде, которое может запускать пролиферацию, даже когда мишень в достаточной степени ингибируется. Таким образом, если индивидуум имеет (или определен как имеющий) изменение в каскаде, которое делает активность ингибитора киназы неэффективной, терапию ингибитором киназы можно сохранять. Без связи с теорией, активность ингибитора киназы (например, ингибитора BTK, такого как ибрутиниб) может стимулировать полезные биологические изменения в злокачественных клетках, даже если ингибитор киназы отдельно не является достаточным для замедления пролиферации. Например, ингибитор киназы может быть достаточным для мобилизации злокачественных клеток из лимфатических узлов, что делает их более уязвимыми для терапии CAR.
[00564] Что касается индивидуумов, которые отвечают на ингибитор киназы (например, ингибитор BTK, такой как ибрутиниб), в настоящее время описаны различные терапевтические режимы. В некоторых вариантах осуществления, когда индивидуум является (или идентифицирован как являющийся) полностью отвечающим на ингибитор киназы, индивидууму не проводят терапию CAR в период полного ответа. В других вариантах осуществления, когда индивидуум является (или идентифицирован как являющийся) полностью отвечающим на ингибитор киназы, индивидууму проводят терапию CAR в период полного ответа. В одном варианте осуществления после терапии CAR индивидуум имеет пролонгированный ответ или отсроченный рецидив (например, по сравнению с ожидаемым течением заболевания при лечении без терапии CAR). Например, MCL при лечении монотерапией ибрутиниба имеет среднюю продолжительность ответа приблизительно 17,5 месяцев.
[00565] В некоторых вариантах осуществления когда индивидуум является (или идентифицирован как являющийся) частично отвечающим на ингибитор киназы (например, ингибитор BTK, такой как ибрутиниб), индивидууму не проводят терапию CAR в период частичного ответа. В других вариантах осуществления, когда индивидуум является (или идентифицирован как являющийся) частично отвечающим на ингибитор киназы, индивидууму проводят терапию CAR в период частичного ответа. В одном варианте осуществления после терапии CAR индивидуум имеет полный ответ и/или пролонгированный ответ или отсроченный рецидив (например, по сравнению с ожидаемым течением заболевания при лечении без терапии CAR).
[00566] В некоторых вариантах осуществления, когда индивидуум имеет (или идентифицирован как имеющий) стабильное заболевание после начале лечения ингибитором киназы (например, ингибитором BTK, таким как ибрутиниб), индивидууму не проводят терапию CAR в период стабильного заболевания. В других вариантах осуществления, когда индивидуум имеет (или идентифицирован как имеющий) стабильное заболевание после начала лечения ингибитором киназы, индивидууму проводят терапию CAR в период стабильного заболевания. В одном варианте осуществления после терапии CAR индивидуум имеет частичный ответ, полный ответ и/или пролонгированный ответ или отсроченный рецидив (например, по сравнению с ожидаемым течением заболевания при лечении без терапии CAR).
[00567] В некоторых вариантах осуществления, когда индивидуум имеет (или идентифицирован как имеющий) прогрессирующее заболевание после начала лечения ингибитором киназы (например, ингибитором BTK, таким как ибрутиниб), индивидууму не проводят терапию CAR в период прогрессирующего заболевания. В других вариантах осуществления, когда индивидуум имеет (или идентифицирован как имеющий) прогрессирующее заболевание после начала лечения ингибитором киназы, индивидууму проводят терапию CAR в период прогрессирующего заболевания. В одном варианте осуществления после терапии CAR индивидуум имеет стабильное заболевание, частичный ответ, полный ответ и/или пролонгированный ответ или отсроченный рецидив (например, по сравнению с ожидаемым течением заболевания при лечении без терапии CAR).
[00568] Таким образом, до или во время лечения можно проводить одну или несколько стадий оценки заболевания для определения того, какой курс лечения является пригодным для пациента. Например, индивидууму можно вводить ингибитор киназы (например, ингибитор BTK, такой как) в качестве терапии первой линии. Затем после некоторого периода времени (например, 1 или 2 месяца, однако также 2 недели, 3 недели, 1 месяц, 1,5 месяца, 2 месяца, 3 месяца, 4 месяца, 6 месяцев, 9 месяцев, 12 месяцев, 15 месяцев или 18 месяцев) можно оценивать ответ пациента. Если оценка показывает, что индивидуум является полностью отвечающим, в некоторых вариантах осуществления терапию CAR не проводят, например, как описано выше. Если оценка показывает, что индивидуум является частично отвечающим или имеет стабильное заболевание, в некоторых вариантах осуществления терапию CAR проводят в комбинации с ингибитором киназы, например, как описано выше. Если оценка показывает, что индивидуум является не отвечающим или имеет рецидив, в некоторых вариантах осуществления терапию CAR проводят в комбинации с ингибитором киназы или вторым ингибитором киназы, например, как описано выше. В некоторых вариантах осуществления ингибитор киназы контролирует заболевание, в то время как CAR-экспрессирующие клетки получают, например, в то время как собственные T-клетки пациента модифицируют способами инженерии для экспрессии CAR и/или других факторов.
[00569] Клинические стандарты классификации статуса ответа пациента или статуса рецидива у пациента известны в данной области. В качестве примера, для злокачественной лимфомы стандартизованные критерии ответа описаны в Cheson et al, J Clin Oncol 17:1244 (1999) и Cheson et al., "Revised Response Criteria for Malignant Lymphoma", J Clin Oncol 25:579-586 (2007) (обе из которых включены в настоящее описание в качестве ссылок в полном объеме). Таким образом, в некоторых вариантах осуществления индивидуума считают полностью отвечающим, частично отвечающим, имеющим стабильное заболевание, не отвечающим или имеющем рецидив согласно критериям Cheson или модифицированным критериям Cheson. Критерии классификации других гематологических злокачественных опухолей известны в данной области.
[00570] Согласно критериям, приведенным в таблице 2 Cheson 2007, полностью отвечающий индивидуум имеет исчезновение всех признаков заболевания; частично отвечающий индивидуум имеет регрессию поддающего определению заболевания и отсутствие новых участков; пациент со стабильным заболеванием имеет неуспех в достижении CR/PR или PD; и пациент с рецидивирующим заболеванием или прогрессирующим заболеванием имеет любой новый очаг и увеличение, превышающее или равное 50%, ранее вовлеченных участков после надира. Оценка может вовлекать определение того, является ли заболевание FDG-авидным, положительным или отрицательным в PET, присутствуют ли узелки, например, пальпируемые в печени или селезенке, и является ли костный мозг чистым или демонстрирует вовлечение.
[00571] Терапию CAR и ингибитором киназы (например, ингибитором BTK, таким как ибрутиниб) можно проводить, например, одновременно или последовательно. В некоторых вариантах осуществления терапию CAR начинают по существу в то же время, в которое начинают терапию ингибитором киназы. В некоторых вариантах осуществления терапию CAR начинают до начала терапии ингибитором киназы. В некоторых вариантах осуществления терапию CAR начинают после начала терапии ингибитором киназы. Например, терапию CAR можно начинать, например, по меньшей мере через 1, 2, 3 или 4 недели, или через 1, 2, 3, 4, 6, 9, 12, 15, 18 или 24 месяцев после начала терапии ингибитором киназы. В некоторых вариантах осуществления терапию CAR начинают, пока пациент имеет физиологически существенные уровни ингибитора киназы в его организме.
[00572] При введении в комбинации, терапию CAR и ингибитором киназы (например, ингибитором BTK, таким как ибрутиниб), или обоими из них, можно проводить в количестве или в дозе, которые превышают, являются более низкими или являются такими же, как и количество или доза каждого средства, используемого отдельно, например, в качестве монотерапии. В определенных вариантах осуществления введенное количество или дозировка терапии CAR, ингибитора киназы, или обоих из них, являются более низкими (например, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50%), чем количество или дозировка каждого средства, используемого отдельно, например, в качестве монотерапии. В других вариантах осуществления количество или дозировка терапии CAR, ингибитором киназы или обоими из них, которые приводят к желаемому эффекту (например, лечение злокачественной опухоли) являются более низкими (например, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50% более низкими), чем количество или дозировка каждого средства, используемого отдельно, например, в качестве монотерапии, требуемое для достижения того же терапевтического эффекта.
[00573] При введении в комбинации, терапию CAR и ингибитором киназы (например, ингибитором BTK, таким как ибрутиниб), или обоими из них, можно проводить в течение периода времени, который является более длительным, более коротким или таким же, как и период времени для каждого средства, используемого отдельно, например, в качестве монотерапии. В определенных вариантах осуществления продолжительность проведения терапии CAR, ингибитором киназы, или обоими из них, является более короткой (например, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, или по меньшей мере на 50%), чем продолжительность лечения каждым средством, используемым отдельно, например, в качестве монотерапии. В других вариантах осуществления продолжительность проведения терапии CAR, ингибитором киназы, или обоими из них, которая приводит к желаемому эффекту (например, лечение злокачественной опухоли) является более короткой (например, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50% более короткой), чем продолжительность для каждого средства, используемого отдельно, например, в качестве монотерапии, требуемая для достижения того же терапевтического эффекта. В некоторых вариантах осуществления пациенту проводят сокращенный курс введения ингибитора киназы (например, ингибитора BTK, такого как ибрутиниб). Например, сокращенный курс введения ингибитора киназы может длиться всего приблизительно 0-2, 2-4, 4-6, 6-8, 8-10, 10-12, 12-15, 15-18, 18-21 или 21-24 месяца или может длиться приблизительно 0-2, 2-4, 4-6, 6-8, 8-10, 10-12, 12-15, 15-18, 18-21 или 21-24 месяца после проведения терапии CAR. В вариантах осуществления сокращенный курс ингибитора киназы оканчивается до рецидива. В вариантах осуществления ингибитор киназы вводят на нормальных уровнях (например, как при монотерапии) в ходе сокращенного курса.
[00574] В вариантах осуществления однократная доза CAR-экспрессирующих клеток содержит приблизительно 5×108 CART-леток против CD19. Доза CAR-экспрессирующих клеток также может составлять приблизительно 5×106, 1×107, 2×107, 5×107, 1×108, 2×108, 5×108, 1×109, 2×109 или 5×109 клеток, например, клеток с CAR против CD19, например, CART-клеток против CD19.
[00575] В одном аспекте изобретение относится к вектору, содержащему CAR против CD19, функционально связанный с промотором для экспрессии в клетках млекопитающих, например, T-клетках. В одном аспекте изобретение относится к рекомбинантной клетке, например, T-клетке, экспрессирующей CAR против CD19, для применения для лечения экспрессирующих CD19 опухолей, где рекомбинантную T-клетку, экспрессирующую CAR против CD19, называют CART против CD19. В одном аспекте CART против CD19, описанная в настоящем описании, способна контактировать с приводить опухолевую клетку в контакт по меньшей мере с одним CAR против CD19, экспрессируемым на ее поверхности, так что CART нацеливается на опухолевую клетку и рост опухоли ингибируется.
[00576] В одном аспекте изобретение относится к способу ингибирования роста CD19-экспрессирующей опухолевой клетки, включающему приведение в контакт опухолевой клетки с клеткой, экспрессирующей CAR против CD19, например, CART-клеткой против CD19, описанной в настоящем описании, так что CART активируется в ответ на антиген и нацеливается на злокачественную клетку, где рост опухоли ингибируется. Клетку, экспрессирующую CAR против CD19, например, T-клетку, вводят в комбинации с ингибитором киназы, например, ингибитором киназы, описанным в настоящем описании.
[00577] Введение "в комбинации", как используют в рамках изобретения, означает, что два (или более) различных способа лечения осуществляют у индивидуума в процессе наличия у индивидуума нарушения, например, два или более способа лечения проводят после диагностирования у пациента нарушения и пока не произойдет излечение или устранение нарушения, или пока лечение не прекратят по другим причинам. В некоторых вариантах осуществления введение одного лекарственного средства все еще проводят, когда начинается введение второго, так что существует перекрывание с точки зрения введения. Это иногда называют в настоящем описании "одновременной" или "совместной" доставкой. В других вариантах осуществления доставка одного лекарственного средства заканчивается до начала доставки другого лекарственного средства. В некоторых вариантах осуществления в любом случае лечение является более эффективным вследствие комбинированного введения. Например, второе лекарственное средство является более эффективным, например, эквивалентный эффект наблюдают при использовании меньшего количества второго лекарственного средства, или второе лекарственное средство снижает симптомы в большей степени, чем наблюдалось бы, если бы второе лекарственное средство вводили в отсутствие первого лекарственного средства, или аналогичную ситуацию наблюдают для первого лекарственного средства. В некоторых вариантах осуществления доставка является такой, что снижение симптома или другого параметра, связанного с нарушения, является более высоким, чем наблюдалось бы при доставке одного лекарственного средства в отсутствие другого. Эффект двух способов лечения может быть частично аддитивным, полностью аддитивным или более чем аддитивным. Доставка может быть такой, что эффект первого доставляемого лекарственного средства все еще поддается обнаружению, когда доставляют второе лекарственное средство. В одном варианте осуществления CAR-экспрессирующую клетку вводят в дозе и/или по схеме дозирования, описанных в настоящем описании, и ингибитор киназы или средство, которое усиливает активность CAR-экспрессирующей клетки, вводят в дозе и/или по схеме дозирования, описанным в настоящем описании.
[00578] Изобретение относится к типу клеточной терапии, где T-клетки генетически модифицированы для экспрессии химерного рецептора антигена (CAR), и CART-клетку вводят путем инфузии реципиенту, нуждающемуся в этом. Введенная путем инфузии клетка способна уничтожать опухолевые клетки реципиента. В отличие от антительной терапии, модифицированные посредством CAR T-клетки способны реплицироваться in vivo, что приводит к длительной персистенции, которая может приводить к длительному контролю опухоли. В различных аспектах T-клетки, вводимые пациенту, или их потомство, сохраняются у пациента в течение по меньшей мере четырех месяцев, пяти месяцев, шести месяцев, семи месяцев, восьми месяцев, девяти месяцев, десяти месяцев, одиннадцати месяцев, двенадцати месяцев, тринадцати месяцев, четырнадцати месяцев, пятнадцати месяцев, шестнадцати месяцев, семнадцати месяцев, восемнадцати месяцев, девятнадцати месяцев, двадцати месяцев, двадцати одного месяца, двадцати двух месяцев, двадцати трех месяцев, двух лет, трех лет, четырех лет или пяти лет после введения T-клетки пациенту.
[00579] Также изобретение относится к типу клеточной терапии, где T-клетки модифицированы, например, транскрибированной in vitro РНК, для временной экспрессии химерного рецептора антигена (CAR), и CART-клетку вводят путем инфузии реципиенту, нуждающемуся в этом. Введенная путем инфузии клетка способна уничтожать опухолевые клетки реципиента. Таким образом, в различных аспектах T-клетки, введенные пациенту, сохраняются в течение менее чем одного месяца, например, трех недель, двух недель, одной недели после введения T-клеток пациенту.
[00580] Без связи с какой-либо конкретной теорией, иммунный ответ против опухолевых клеток, индуцируемый модифицированными посредством CAR T-клетками, может представлять собой активный или пассивный иммунный ответ или альтернативно может быть следствием прямого против непрямого иммунного ответа. В одном аспекте трансдуцированные CAR T-клетки проявляют специфическую секрецию провоспалительных цитокинов и мощную цитолитическую активность в ответ на злокачественные клетки человека, экспрессирующие CD19, выдерживают ингибирование растворимым CD19 и опосредуют неспецифический цитолиз и опосредуют регрессию развернутой опухоли человека. Например, опухолевые клетки без антигена в гетерогенной области экспрессирующей CD19 опухоли могут быть чувствительными к непрямому разрушению перенацеленных на CD19 T-клеток, которые ранее реагировали с соседними положительными по антигену злокачественными клетками.
[00581] В одном аспекте полностью человеческие модифицированные посредством CAR T-клетки по изобретению могут представлять собой тип вакцины для иммунизации ex vivo и/или терапии in vivo у млекопитающего. В одном аспекте млекопитающим является человек.
[00582] Что касается иммунизации ex vivo, по меньшей мере одно из следующих событий происходит in vitro перед введением клетку в млекопитающего: i) увеличение клеток в количестве, ii) введение нуклеиновой кислоты, кодирующей CAR, в клетки или iii) криоконсервация клеток.
[00583] Методики ex vivo хорошо известны в данной области и более подробно рассмотрены ниже. В кратком изложении, выделяют клетки млекопитающего (например, человека) и генетически модифицируют (т.е. трансдуцируют или трансфицируют in vitro) вектором, экспрессирующим CAR, описанный в настоящем описании. Модифицированную посредством CAR клетку можно вводить реципиенту-млекопитающему для обеспечения терапевтической пользы. Реципиент-млекопитающее может представлять собой человека и модифицированная посредством CAR клетка может быть аутологичной для реципиента. Альтернативно клетки могут быть аллогенными, сингенными или ксеногенными в отношении реципиента. В дополнение к использованию клеточной вакцины для иммунизации ex vivo, также в настоящее изобретение включены композиции и способы для иммунизации in vivo для индукции иммунного ответа, направленного против антигена у пациента.
[00584] Как правило, клетки активированные и увеличенные в количестве, как описано в настоящем описании, можно использовать для лечения и предупреждения заболеваний, которые возникают у индивидуумов с иммунодефицитом. В частности, CAR-экспрессирующие клетки по изобретению используют для лечения заболеваний, нарушений и состояний, ассоциированных с экспрессией CD19. В некоторых аспектах клетки используют для лечения пациентов, имеющих риск развития заболеваний, нарушений и состояний, ассоциированных с экспрессией CD19. Таким образом, изобретение относится к способам лечения или предупреждения заболеваний, нарушений и состояний, ассоциированных с экспрессией CD19, включающим введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества CAR-экспрессирующих клеток, описанных в настоящем описании, в комбинации с ингибитором киназы, например, ингибитором киназы, описанным в настоящем описании.
[00585] Настоящее изобретение также относится к способам ингибирования пролиферации или уменьшения популяции CD19-экспрессирующих клеток, причем способы включают приведение в контакт популяции клеток, содержащей CD19-экспрессирующую клетку, с клеткой, экспрессирующей CAR против CD19, описанной в настоящем описании, которая связывается с CD19-экспрессирующей клеткой, и приведение в контакт популяции CD19-экспрессирующих клеток с ингибитором киназы, например, ингибитором киназы, описанным в настоящем описании. В конкретном аспекте настоящее изобретение относится к способам ингибирования пролиферации или уменьшения популяции злокачественных клеток, экспрессирующих CD19, причем способы включают приведение в контакт популяции CD19-экспрессирующих злокачественных клеток с клеткой, экспрессирующей CAR против CD19, описанной в настоящем описании, которая связывается с CD19-экспрессирующей клеткой, и приведение в контакт CD19-экспрессирующей клетки с ингибитором киназы, например, ингибитором киназы, описанным в настоящем описании. В одном аспекте настоящее изобретение относится к способам ингибирования пролиферации или уменьшения популяции злокачественных клеток, экспрессирующих CD19, причем способы включают приведение в контакт популяции CD19-экспрессирующих злокачественных клеток с клеткой, экспрессирующей CAR против CD19, описанной в настоящем описании, которая связывается с CD19-экспрессирующей клеткой, и приведение в контакт CD19-экспрессирующей клетки с ингибитором киназы, например, ингибитором киназы, описанным в настоящем описании. В некоторых аспектах, комбинация клетки, экспрессирующей CAR против CD19, описанной в настоящем описании, и ингибитора киназы, например, ингибитора киназы, описанного в настоящем описании, снижает количество, число, величину или процент клеток и/или злокачественных клеток по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 65%, по меньшей мере на 75%, по меньшей мере на 85%, по меньшей мере на 95%, или по меньшей мере на 99% у индивидуума с гематологической злокачественной опухолью или другой злокачественной опухолью, ассоциированной с CD19-экспрессирующимт клетками, или в модели этих опухолей на животных, относительно отрицательного контроля. В одном аспекте индивидуумом является человек.
[00586] Настоящее изобретение также относится к способам предупреждения, лечения и/или управления течения заболеванием, ассоциированным с CD19-экспрессирующими клетками (например, гематологическая злокачественная опухоль или атипичная злокачественная опухоль, экспрессирующая CD19), причем способы включают введение индивидууму, нуждающемуся в этом, клетки, экспрессирующей CAR против CD19, которая связывается с CD19-экспрессирующей клеткой, и введение ингибитора киназы, например, ингибитора киназы, описанного в настоящем описании. В одном аспекте индивидуумом является человек. Неограничивающие примеры нарушений, ассоциированных с CD19-экспрессирующими клетками, включают аутоиммунные нарушения (такие как волчанка), воспалительные нарушения (такие как аллергия и астма) и злокачественные опухоли (такие как гематологические злокачественные опухоли или атипичные злокачественные опухоли, экспрессирующие CD19).
[00587] Настоящее изобретение также относится к способам предупреждения, лечения и/или управления течением заболевания, ассоциированного с CD19-экспрессирующими клетками, причем способы включают введение индивидууму, нуждающемуся в этом, CART-клетки против CD19 по изобретению, которая связывается с CD19-экспрессирующей клеткой. В одном аспекте индивидуумом является человек.
[00588] Настоящее изобретение относится к способам предупреждения рецидива злокачественной опухоли, ассоциированной с CD19-экспрессирующими клетками, причем способы включают введение индивидууму, нуждающемуся в этом, клетки, экспрессирующей CAR против CD19 (такой как CART-клетка против CD19) по изобретению, которая связывается с CD19-экспрессирующей клеткой. В одном аспекте способы включают введение индивидууму, нуждающемуся в этом, эффективного количества клеток, экспрессирующих CAR против CD19 (такой как CART-клетка против CD19), описанных в настоящем описании, которые связываются с CD19-экспрессирующей клеткой, в комбинации с эффективным количеством другой терапии.
[00589] В одном аспекте изобретение относится к способу лечения злокачественной опухоли у индивидуума. Способ включает введение индивидууму клетки (например, иммунной эффекторной клетки), экспрессирующей нацеленный на B-клетки CAR, например, T-клетки или NK-клетки, описанной в настоящем описании, в комбинации с ингибитором киназы, например, ингибитором киназы, описанным в настоящем описании, так что происходит лечение злокачественной опухоли у индивидуума. Примером злокачественной опухоли, которая поддается лечению способами, описанными в настоящем описании, является злокачественная опухоль, ассоциированная с экспрессией B-клеточного антигена, например, CD19. В одном варианте осуществления заболевание представляет собой солидную или жидкостную опухоль. В одном варианте осуществления заболевание представляет собой гематологическую злокачественную опухоль. В одном варианте осуществления гематологическая злокачественная опухоль представляет собой лейкоз. В одном варианте осуществления гематологическая злокачественная опухоль представляет собой новообразование из зрелых B-клеток, например, согласно классификации ВОЗ. В одном варианте осуществления гематологическая злокачественная опухоль представляет собой новообразование, происходящее из CD19+ B-лимфоцитов. В одном варианте осуществления злокачественная опухоль выбрана из группы, состоящей из одного или нескольких острых лейкозов, включая, но не ограничиваясь ими B-клеточный острый лимфоидный лейкоз (BALL), T-клеточный острый лимфоидный лейкоз (TALL), мелкоклеточный лимфобластный лейкоз (SLL), острый лимфоидный лейкоз (ALL); один или несколько хронических лейкозов, включая, но не ограничиваясь ими, хронический миелогенный лейкоз (CML), хронический лимфоцитарный лейкоз (CLL); дополнительные гематологические злокачественные опухоли или гематологические состояния включают, но не ограничиваются ими, лимфому из клеток мантийной зоны (MCL), B-клеточный пролимфоцитарный лейкоз, новообразование из бластных плазмацитоидных дендритных клеток, лимфому Беркитта, диффузную крупноклеточную B-клеточную лимфому (DLBCL) (например, обогащенная T-клетками/гистиоцитами крупноклеточная B-клеточная лимфома, первичная DLCBL ЦНС, первичная кожная DLBCL нижних конечностей или EBV+ DLBCL пожилых), DLBCL, ассоциированную с хроническим воспалением, фолликулярную лимфому, педиатрическую фолликуярную лимфому, волосатоклеточный лейкоз, мелкоклеточную или крупноклеточную фолликулярную лимфому, злокачественные лимфопролиферативные состояния, лимфому MALT (внеузловая лимфома маргинальной зоны ассоциированной со слизистыми оболочками лимфоидной ткани), лимфому клеток маргинальной зоны, множественную миелому, миелодисплазию и миелодиспластический синдром, неходжкинскую лимфому, лимфому Ходжкина, плазмабластную лимфому, новообразование из плазмацитоидных дендритных клеток, макроглобулинемию Валденстрема, лимфома маргинальной зоны селезенки, лимфому/лейкоз селезенки (например, неуточненный), диффузную мелкоклеточную B-клеточную лимфому красной пульпы селезенки, волосатоклеточный лейкоз-вариант, лимфоплазматическую лимфому, болезнь тяжелых цепей (например, болезнь тяжелых цепей альфа, болезнь тяжелых цепей гамма или болезнь тяжелых цепей мю), плазмацитарную миелому, одиночную плазмацитому кости, внекостную плазмацитому, лимфому маргинальной зоны лимфатического узла, педиатрическую лимфому маргинальной зоны лимфатического узла, первичную кожную фолликулярную лимфому, лимфоматоидный гранулематоз, первичную средостенную (тимическую) крупноклеточную B-клеточную лимфому, внутрисосудистую крупноклеточную B-клеточную лимфому, ALK+ крупноклеточную B-клеточную лимфому, крупноклеточную B-клеточную лимфому, возникающую на фоне ассоциированного с HHV8 мультицентрового заболевания Кастлемана, первичную выпотную лимфому, B-клеточную лимфому неуточненную (например, с промежуточными признаками между DLBCL и лимфомой Беркитта или промежуточными признаками между DLBCL и классической лимфомой Ходжкина), и "предлейкоза", который представляет собой многообразную совокупность гематологических состояний, объединенных неэффективной продукцией (или дисплазией) миелоидных клеток крови, и заболевания, ассоциированные с экспрессией с B-клеточного антигена (например, CD19) включают, но не ограничиваются ими ими атипичные и/или неклассические злокачественные опухоли, новообразования, предзлокачественные состояния или пролиферативные заболевания, экспресирующие B-клеточный антиген (например, CD19); и любую их комбинацию.
[00590] В некоторых вариантах осуществления злокачественная опухоль представляет собой лимфому Ходжкина, и пациента лечат CAR-экспрессирующими клетками, например, в качестве монотерапии или в комбинации с одним или несколькими дополнительными способами терапии. В вариантах осуществления лимфома Хджкина имеет стадию I, II, III или IV. Дополнительное терапевтическое средство может включать, например, ингибитор киназы, такой как ингибитор BTK, такой как ибрутиниб. Дополнительный способ терапии может включать средство для лечения лимфомы Ходжкина. Дополнительный способ терапии может включать, например, лучевую терапию, MOPP (мустарген, онковин, преднизон и прокарбазин), ABVD (адриамицин, блеомицин, винбластин и дакарбазин), Stanford V (режим с химиотерапией и лучевой терапией) или BEACOPP (блеомицин, этопозид, адриамицин, циклофосфамид, онковин, прокарбазин, преднизон). В некоторых вариантах осуществления индивидуума ранее лечили одним или несколькими из лучевой терапии, MOPP, Stanford V или BEACOPP, или он является резистентным к ним, или он является рефрактерным к ним.
[00591] Не связанные со злокачественной опухолью состояния, ассоциированные с экспрессией B-клеточного антигена, например, одного или нескольких из CD19, CD20, CD22 или ROR1, включают, но не ограничиваются ими, например, аутоиммунное заболевание (например, волчанку), воспалительные нарушения (аллергию и астму) и трансплантацию.
[00592] В некоторых вариантах осуществления злокачественная опухоль, которую можно лечить комбинацией, описанной в настоящем описании, представляет собой множественную миелому. Множественная миелома представляет собой злокачественную опухоль крови, характеризующуюся накоплением клона плазмацитов в костном мозге. Современные способы терапии множественной миеломы включают, но не ограничиваются ими, лечение леналидомидом, который является аналогом талидомида. Леналидомид обладает активностью, которая включает противоопухолевую активность, ингибирование ангиогенеза и иммуномодулирование. В некоторых вариантах осуществления CAR против CD19, например, как описано в настоящем описании, можно использовать для нацеливания на клетки миеломы. В некоторых вариантах осуществления комбинацию, описанную в настоящем описании, можно использовать с одним или несколькими дополнительными способами терапии, например, лечением леналидомидом.
[00593] CAR-экспрессирующие клетки, описанные в настоящем описании, можно вводить либо отдельно, либо в качестве фармацевтической композиции в комбинации с разбавителями и/или с другими компонентами, такими как IL-2 или другие цитокины или популяции клеток.
[00594] В вариантах осуществления истощающую лимфоциты химиотерапию проводят у индивидуума до, одновременно или после введения (например, инфузиии) клеток c CAR, например, CAR-экспрессирующих клеток, описанных в настоящем описании. В одном примере истощающую лимфоциты химиотерапию проводят у индивидуума до введения клеток с CAR. Например, истощающую лимфоциты химиотерапию завершают за 1-4 суток (например, 1, 2, 3 или 4 суток) до инфузии CAR-клеток. В вариантах осуществления вводят множество доз CAR-клеток, например, как описано в настоящем описании. Например, однократная доза включает приблизительно 5×108 клеток с CAR. В вариантах осуществления истощающую лимфоциты химиотерапию проводят у индивидуума до, одновременно или после введения (например, инфузии) CAR-экспрессирующей клетки, описанной в настоящем описании.
Гематологическая злокачественная опухоль
[00595] Гематологические злокачественные состояния представляют собой типы злокачественной опухоли, такие как лейкоз, лимфома и злокачественные лимфоролиферативные состояния, которые поражают кровь, костный мозг и лимфатическую систему.
[00596] Лейкоз можно подразделить на острый лейкоз и хронический лейкоз. Острый лейкоз можно далее подразделить на острый миелогенный лейкоз (AML) и острый лимфоидный лейкоз (ALL). Хронический лейкоз включает хронический миелогенный лейкоз (CML) и хронический лимфоидный лейкоз (CLL). Другие родственные состояния включают миелодиспластические синдромы (MDS, ранее известный как "предлейкоз"), которые представляют собой многообразную совокупность гематологических состояний, объединенных неэффективной продукцией (или дисплазией) миелоидных клеток крови и риском трансформации в AML.
[00597] Лимфома представляет собой группу опухолей из клеток крови, которая развивается из лимфоцитов. Иллюстративные лимфомы включают неходжкинскую лимфому и лимфому Ходжкина.
Комбинированные способы терапии
[00598] Комбинацию CAR-экспрессирующей клетки, описанной в настоящем описании (например, и ингибитора киназы, описанного в настоящем описании) можно использовать в комбинации с другими известными средствами и способами терапии.
[00599] Экспрессирующую CAR клетку, описанную в настоящем описании, и по меньшей мере одно дополнительное лекарственное средство можно вводить одновременно, в одной или в отдельных композициях, или последовательно. Для последовательного введения сначала можно вводить экспрессирующую CAR клетку, описанную в настоящем описании, а затем можно вводить дополнительное средство, или порядок введения может быть обратным.
[00600] Терапию CAR и/или проведение введения других лекарственных средств, процедур и способов лечения, можно осуществлять в ходе периодов активного нарушения или в ходе периодов ремиссии или менее активного заболевания. Терапию CAR можно проводить до другого способа лечения, одновременно с лечением, после лечения или в ходе ремиссии нарушения.
[00601] При введении в комбинации, терапию CAR и введение одного или нескольких дополнительных средств (например, ингибитора киназы и/или третьего средства), или всех из них, можно проводить в количестве или в дозе, которые превышают, являются более низкими или являются такими же, как и количество или доза каждого средства отдельно, например, в качестве монотерапии. В определенных вариантах осуществления введенное количество или доза терапии CAR, дополнительного средства (например, ингибитора киназы и/или третьего средства), или всех из них, является более низкой (например, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50%) чем количество или доза каждого средства, используемого отдельно, например, в качестве монотерапии. В других вариантах осуществления количество или доза терапии CAR, дополнительного средства (например, ингибитора киназы и/или третьего средства), или всех из них, которые приводят к желаемому эффекту (например, лечение злокачественной опухоли) являются более низкими (например, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50% более низкими), чем количество или доза каждого средства, используемого отдельно, например, в качестве монотерапии, требуемые для достижения того же терапевтического эффекта.
[00602] В следующих аспектах, комбинацию CAR-экспрессирующей клетки, описанной в настоящем описании, (например, и ингибитора киназы) можно использовать в терапевтическом режиме в комбинации с хирургической операцией, химиотерапией, лучевой терапией, иммунодепрессивными средствами, такими как циклоспорин, азатиоприн, метотрексат, микофенолат и FK506, антителами или другими иммунодеструктивными средствами, такими как CAMPATH, антитела против CD3, или другими способами терапии на основы антител, цитоксином, флударабином, циклоспорином, FK506, рапамицином, микофеноловой кислотой, стероидами, FR901228, цитокинами и лучевой терапией, пептидной вакциной, такой как пептидная вакцина, описанная в Izumoto et al. 2008 J Neurosurg 108:963-971.
[00603] В одном варианте осуществления комбинацию CAR-экспрессирующей клетки, описанной в настоящем описании, (например, и ингибитора киназы) можно использовать в комбинации с другим химиотерапевтическим средством. Иллюстративные химиотерапевтические средства включают антрациклин (например, доксорубицин (например, липосомальный доксорубицин)), алкалоид барвинка (например, винбластин, винкристин, виндезин, винорелбин), алкилирующее средство (например, циклофосфамид, декарбазин, мелфалан, ифосфамид, темозоломид), антитело против иммунных клеток (например, алемтузумаб, гемтузумаб, ритуксимаб, офатумумаб, тозитумомаб, брентуксимаб), антиметаболит (включая, например, антагонисты фолиевой кислоты, аналоги пиримидинов, аналоги пуринов и ингибиторы аденозиндезаминазы (например, флударабин)), агонист индуцируемого глюкокортикоидами TNFR-родственного белка (GITR), ингибитор протеасом (например, аклациномицин A, глиотоксин или бортезомиб), иммуномодулятор, такой как талидомид или производное талидомида (например, леналидомид).
[00604] Основные химические средства, предусматриваемые для применения в комбинированных способах терапии, включают анастрозол (Arimidex®), бикалутамид (Casodex®), блеомицин сульфат (Blenoxane®), бусульфан (Myleran®), бусульфан инъекционный (Busulfex®), капецитабин (Xeloda®), N4-пентоксикарбонил-5-дезокси-5-фторцитидин, карбоплатин (Paraplatin®), кармустин (BiCNU®), хлорамбуцил (Leukeran®), цисплатин (Platinol®), кладрибин (Leustatin®), циклофосфамид (Cytoxan® или Neosar®), цитарабин, цитозин арабинозид (Cytosar-U®), инъекционный липосомальный цитарабин (DepoCyt®), дакарбазин (DTIC-Dome®), дактиномицин (актиномицин D, космеган), даунорубицин гидрохлорид (Cerubidine®), инъекционный липосомальный даунорубицина цитрат (DaunoXome®), дексаметазон, доцетаксел (Taxotere®), доксорубицина гидрохлорид (Adriamycin®, Rubex®), этопозид (Vepesid®), флударабина фосфат (Fludara®), 5-фторурацил (Adrucil®, Efudex®), флутамид (Eulexin®), тезацитибин, гемцитабин (дифтордезоксицитидин), гидроксимочевину (Hydrea®), идарубицин (Idamycin®), ифосфамид (IFEX®), иринотекан (Camptosar®), L-аспарагиназу (ELSPAR®), лейковорин кальций, мелфалан (Alkeran®), 6-меркаптопурин (Purinethol®), метотрексат (Folex®), митоксантрон (Novantrone®), милотарг, паклитаксел (Taxol®), феникс (иттрий-90/MX-DTPA), пентостатин, имплантат полифепросана 20 с кармустином (Gliadel®), тамоксифена цитрат (Nolvadex®), тенипозид (Vumon®), 6-тиогуанин, тиотепу, тирапазамин (Tirazone®), топотекана гидрохлорид для инъекций (Hycamptin®), винбластин (Velban®), винкристин (Oncovin®) и винорелбин (Navelbine®).
[00605] Иллюстративные алкилирующие средства включают, но не ограничиваются ими, азотистые иприты, производные этиленимина, алкилсульфонаты, нитрозомочевину и триазены: урацил мустард (Aminouracil Mustard®, Chlorethaminacil®, Demethyldopan®, Desmethyldopan®, Haemanthamine®, Nordopan®, Uracil nitrogen mustard®, Uracillost®, Uracilmostaza®, Uramustin®, Uramustine®), хлорметин (Mustargen®), циклофосфамид (Cytoxan®, Neosar®, Clafen®, Endoxan®, Procytox®, RevimmuneTM), ифосфамид (Mitoxana®), мелфалан (Alkeran®), хлорамбуцил (Leukeran®), пипоброман (Amedel®, Vercyte®), триэтиленмеламин (Hemel®, Hexalen®, Hexastat®), триэтилентиофосфорамин, темозоломид (Temodar®), тиотепу (Thioplex®), бусульфан (Busilvex®, Myleran®), кармустин (BiCNU®), ломустин (CeeNU®), стрептозоцин (Zanosar®) и дакарбазин (DTIC-Dome®). Дополнительные иллюстративные алкилирующие средства включают, но не ограничиваются ими, оксалиплатин (Eloxatin®); темозоломид (Temodar® и Temodal®); дактиномицин (также известный как актиномицин-D, Cosmegen®); мелфалан (также известный как L-PAM, L-сарколизин и фенилаланин мустард, Alkeran®); алтретамин (также известный как гексаметилмеламин (HMM), Hexalen®); кармустин (BiCNU®); бендамустин (Treanda®); бусульфан (Busulfex® и Myleran®); карбоплатин (Paraplatin®); ломустин (также известный как CCNU, CeeNU®); цисплатин (также известный как CDDP, Platinol® и Platinol®-AQ); хлорамбуцил (Leukeran®); циклофосфамид (Cytoxan® и Neosar®); дакарбазин (также известный как DTIC, DIC и имидазол карбоксамид, DTIC-Dome®); алтретамин (также известный как гексаметилмеламин (HMM), Hexalen®); ифосфамид (Ifex®); преднумустин; прокарбазин (Matulane®); мехлорэтамин (также известный как азотистый иприт, мустин и мехлорэтамин гидрохлорид, Mustargen®); стрептозоцин (Zanosar®); тиотепу (также известную как тиофосфоамид, TESPA и TSPA, Thioplex®); циклофосфамид (Endoxan®, Cytoxan®, Neosar®, Procytox®, Revimmune®) и бендамустин HCl (Treanda®).
[00606] В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, необязательно в комбинации с ингибитором киназы, например, ингибитором BTK, таким как ибрутиниб, вводят индивидууму в комбинации с флударабином, циклофосфамидом и/или ритуксимабом. В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, вводят индивидууму в комбинации с флударабином, циклофосфамидом и ритуксимабом (FCR). В вариантах осуществления индивидуум имеет CLL. Например, индивидуум имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке). В других примерах индивидуум не имеет del(17p). В вариантах осуществления индивидуум имеет лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В других вариантах осуществления индивидуум не имеет лейкозной клетки, содержащей мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В вариантах осуществления флударабин вводят в дозировке приблизительно 10-50 мг/м2 (например, приблизительно 10-15, 15-20, 20-25, 25-30, 30-35, 35-40, 40-45 или 45-50 мг/м2), например, внутривенно. В вариантах осуществления циклофосфамид вводят в дозировке приблизительно 200-300 мг/м2 (например, приблизительно 200-225, 225-250, 250-275 или 275-300 мг/м2), например, внутривенно. В вариантах осуществления ритуксимаб вводят в дозировке приблизительно 400-600 мг/м2 (например, 400-450, 450-500, 500-550 или 550-600 мг/м2), например, внутривенно.
[00607] В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, необязательно в комбинации с ингибитором киназы, например, ингибитором BTK, таким как ибрутиниб, вводят индивидууму в комбинации с бендамустином и ритуксимабом. В вариантах осуществления индивидуум имеет CLL. Например, индивидуум имеет делецию в коротком плече хромосомы 17 (del(17p), например, в лейкозной клетке. В других примерах индивидуум не имеет del(17p). В вариантах осуществления индивидуум имеет лейкозную клетку, содержащую мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В других вариантах осуществления индивидуум не имеет лейкозной клетки, содержащей мутацию в гене вариабельной области тяжелой цепи иммуноглобулина (IgVH). В вариантах осуществления бендамустин вводят в дозировке приблизительно 70-110 мг/м2 (например, 70-80, 80-90, 90-100 или 100-110 мг/м2), например, внутривенно. В вариантах осуществления ритуксимаб вводят в дозировке приблизительно 400-600 мг/м2 (например, 400-450, 450-500, 500-550 или 550-600 мг/м2), например, внутривенно.
[00608] В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, необязательно в комбинации с ингибитором киназы, например, ингибитором BTK, таким как ибрутиниб, вводят индивидууму в комбинации с ритуксимабом, циклофосфамидом, доксорубицином, винкристином и/или кортикостероидом (например, преднизон). В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, вводят индивидууму в комбинации с ритуксимабом, циклофосфамидом, доксорубицином, винкристином и преднизоном (R-CHOP). В вариантах осуществления индивидуум имеет диффузную крупноклеточную B-клеточную лимфому (DLBCL). В вариантах осуществления индивидуум имеет необъемную DLBCL ограниченной стадии (например, имеет опухоль, имеющую размер/диаметр менее 7 см). В вариантах осуществления индивидуума лечат лучевой терапией в комбинации с R-CHOP. Например, индивидууму проводят терапию R-CHOP (например, 1-6 курсов, например, 1, 2, 3, 4, 5 или 6 курсов R-CHOP), а затем лучевую терапию. В некоторых случаях, индивидууму проводят терапию R-CHOP (например, 1-6 курсов, например, 1, 2, 3, 4, 5 или 6 курсов R-CHOP) после лучевой терапии.
[00609] В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, необязательно в комбинации с ингибитором киназы например, ингибитором BTK, таким как ибрутиниб, вводят индивидууму в комбинации с этопозидом, преднизоном, винкристином, циклофосфамидом, доксорубицином и/или ритуксимабом. В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, вводят индивидууму в комбинации с этопозидом, преднизоном, винкристином, циклофосфамидом, доксорубицином и ритуксимабом (EPOCH-R). В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, вводят индивидууму в комбинации со скорректированной дозой EPOCH-R (DA-EPOCH-R). В вариантах осуществления индивидуум имеет B-клеточную лимфому, например, агрессивную B-клеточную лимфому с реаранжированным Myc.
[00610] Иллюстративные иммуномодуляторы включают, например, афутузумаб (доступный 5от Roche®); пегфилграстим (Neulasta®); леналидомид (CC-5013, Revlimid®); талидомид (Thalomid®), актимид (CC4047) и IRX-2 (смесь цитокинов человека, включая интерлейкин 1, интерлейкин 2 и интерферон γ, CAS 951209-71-5, доступные от IRX Therapeutics).
[00611] Иллюстративные антрациклины включают, например, доксорубицин (Adriamycin® и Rubex®); блеомицин (lenoxane®); даунорубицин (даунорубицин гидрохлорид, дауномицин и рубидомицин гидрохлорид, Cerubidine®); липосомальный даунорубицин (липосомальный даунорубицина цитрат, DaunoXome®); митоксантрон (DHAD, Novantrone®); эпирубицин (EllenceTM); идарубицин (Idamycin®, Idamycin PFS®); митомицин C (Mutamycin®); гелданамицин; гербимицин; равидомицин; и дезацетилгавидомицин.
[00612] Иллюстративные алкалоиды барвинка включают, например, винорелбина тартрат (Navelbine®), винкристин (Oncovin®) и виндезин (Eldisine®)); винбластин (также известный как винбластина сульфат, винкалейкобластин и VLB, Alkaban-AQ® и Velban®); и винорелбин (Navelbine®).
[00613] Иллюстративные ингибиторы протеасом включают бортезомиб (Velcade®); карфилзомиб (PX-171-007, (S)-4-метил-N-((S)-1-(((S)-4-метил-1-((R)-2-метилoксиран-2-ил)-1-оксопентан-2-ил)амино)-1-оксо-3-фенилпропан-2-ил)-2-((S)-2-(2-морфолиноацетамидо)-4-фенилбутанамидо)пентанамид); маризомиб (NPI-0052); иксазомиба цитрат (MLN-9708); деланзомиб (CEP-18770); и O-метил-N-[(2-метил-5-тиазолил)карбонил]-L-серил-O-метил-N-[(1S)-2-[(2R)-2-метил-2-оксиранил]-2-оксо-1-(фенилметил)этил]-L-серинамид (ONX-0912).
[00610] В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, необязательно в комбинации с ингибитором киназы, например, ингибитором BTK, таким как ибрутиниб, вводят индивидууму в комбинации с ритуксимабом и/или леналидомидом. Леналидомид ((RS)-3-(4-амино-1-оксо-1,3-дигидро-2H-изоиндол-2-ил)пиперидин-2,6-дион) является иммуномодулятором. В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, вводят индивидууму в комбинации с ритуксимабом и леналидомидом. В вариантах осуществления индивидуум имеет фолликулярную лимфому (FL) или лимфому из клеток мантийной зоны (MCL). В вариантах осуществления индивидуум имеет FL, и его ранее не лечили терапией против злокачественной опухоли. В вариантах осуществления леналидомид вводят в дозировке приблизительно 10-20 мг (например, 10-15 или 15-20 мг), например, каждые сутки. В вариантах осуществления ритуксимаб вводят в дозировке приблизительно 350-550 мг/м2 (например, 350-375, 375-400, 400-425, 425-450, 450-475 или 475-500 мг/м2), например, внутривенно.
[00611] Иллюстративные иммуномодуляторы включают, например, афутузумаб (доступный от Roche®); пегфилграстим (Neulasta®); леналидомид (CC-5013, Revlimid®); талидомид (Thalomid®), помелидомид, актимид (CC4047) и IRX-2 (смесь цитокинов человека, включающая интерлейкин 1, интерлейкин 2 и интерферон γ, CAS 951209-71-5, доступная от IRX Therapeutics).
[00612] Иллюстративные антрациклины включают, например, доксорубицин (Adriamycin® и Rubex®); блеомицин (lenoxane®); даунорубицин (дауорубицина гидрохлорид, дауномицин и рубидомицина гидрохлорид, Cerubidine®); даунорубицин липосомальный (даунорубицина цитрат липосомальный, DaunoXome®); митоксантрон (DHAD, Novantrone®); эпирубицин (EllenceTM); идарубицин (Idamycin®, Idamycin PFS®); митомицин C (Mutamycin®); гелданамицин; гербимицин; равидомицин и десацетилравидомицин.
[00613] Иллюстративные алкалоиды барвинка включают, например, винорелбина тартрат (Navelbine®), винкристин (Oncovin®) и виндезин (Eldisine®)); винбластин (также известный как винбластина сульфат, винкалейкобластин и VLB, Alkaban-AQ® и Velban®) и винорелбин (Navelbine®).
[00614] Иллюстративные ингибиторы протеасом включают бортезомиб (Velcade®); карфилзомиб (PX-171-007, (S)-4-метил-N-((S)-1-(((S)-4-метил-1-((R)-2-метилоксиран-2-ил)-1-оксопентан-2-ил)амино)-1-оксо-3-фенилпропан-2-ил)-2-((S)-2-(2-морфолиноацетамидо)-4-фенилбутанамидо)пентанамид); маризомиб (NPI-0052); иксазомиба цитрат (MLN-9708); деланзомиб (CEP-18770) и O-метил-N-[(2-метил-5-тиазолил)карбонил]-L-серил-O-метил-N-[(1S)-2-[(2R)-2-метил-2-оксиранил]-2-оксо-1-(фенилметил)этил]-L-серинамид (ONX-0912).
[00615] В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, необязательно в комбинации с ингибитором киназы например, ингибитором BTK, таким как ибрутиниб, вводят индивидууму в комбинации с брентуксимабом. Брентуксимаб представляет собой конъюгат антитело-лекарственное средство между антителом против CD30 и монометилауристатином E. В вариантах осуществления индивидуум имеет лимфому Ходжкина (HL), например, рецидивирующую или рефрактерную HL. В вариантах осуществления индивидуум имеет CD30+ HL. В вариантах осуществления индивидуума подвергали трансплантации аутологичных стволовых клеток (ASCT). В вариантах осуществления индивидуума не подвергали ASCT. В вариантах осуществления брентуксимаб вводят в дозировке приблизительно 1-3 мг/кг (например, приблизительно 1-1,5, 1,5-2, 2-2,5 или 2,5-3 мг/кг), например, внутривенно, например, каждые 3 недели.
[00616] В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, необязательно в комбинации с ингибитором киназы например, ингибитором BTK, таким как ибрутиниб, вводят индивидууму в комбинации с брентуксимабом и дакарбазином или в комбинации с брентуксимабом и бендамустином. Дакарбазин представляет собой алкилирующее средство, имеющее химическое название 5-(3,3-диметил-1-триазенил)имидазол-4-карбоксамид. Бендамустин представляет собой алкилирующее средство c химическим названием 4-[5-[бис(2-хлорэтил)амино]-1-метилбензимидазол-2-ил]бутановая кислота. В вариантах осуществления индивидуум имеет лимфому Ходжкина (HL). В вариантах осуществления индивидуума ранее не лечили терапией против злокачественной опухоли. В вариантах осуществления индивидуум имеет возраст по меньшей мере 60 лет, например, 60, 65, 70, 75, 80, 85 или старше. В вариантах осуществления дакарбазин вводят в дозировке приблизительно 300-450 мг/м2 (например, приблизительно 300-325, 325-350, 350-375, 375-400, 400-425 или 425-450 мг/м2), например, внутривенно. В вариантах осуществления бендамустин вводят в дозировке приблизительно 75-125 мг/м2 (например, 75-100 или 100-125 мг/м2, например, приблизительно 90 мг/м2), например, внутривенно. В вариантах осуществления брентуксимаб вводят в дозировке приблизительно 1-3 мг/кг (например, приблизительно 1-1,5, 1,5-2, 2-2,5 или 2,5-3 мг/кг), например, внутривенно, например, каждые 3 недели.
[00617] В некоторых вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, вводят индивидууму в комбинации с ингибитором CD20, например, антителом против CD20 (например, моноспецифическое или биспецифическое антитело против CD20) или его фрагментом. Иллюстративные антитела против CD20 включают, но не ограничиваются ими, ритуксимаб, офатумумаб, окрелизумаб, велтузумаб, обинутузумаб, TRU-015 (Trubion Pharmaceuticals), окаратузумаб и Pro131921 (Genentech). См., например, Lim et al. Haematologica. 95.1(2010):135-43.
[00618] В некоторых вариантах осуществления антитело против CD20 содержит ритуксимаб. Ритуксимаб представляет собой химерное моноклональное антитело IgG1 каппа мыши/человека, которое связывается с CD20 и вызывает цитолиз CD20-экспрессирующей клетки, например, как описано в www.accessdata.fda.gov/drugsatfda_docs/label/2010/103705s5311lbl.pdf. В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, вводят индивидууму в комбинации с ритуксимабом. В вариантах осуществления индивидуум имеет CLL или SLL.
[00619] В некоторых вариантах осуществления ритуксимаб вводят внутривенно, например, в качестве внутривенной инфузии. Например, каждая инфузия обеспечивает приблизительно 500-2000 мг (например, приблизительно 500-550, 550-600, 600-650, 650-700, 700-750, 750-800, 800-850, 850-900, 900-950, 950-1000, 1000-1100, 1100-1200, 1200-1300, 1300-1400, 1400-1500, 1500-1600, 1600-1700, 1700-1800, 1800-1900 или 1900-2000 мг) ритуксимаба. В некоторых вариантах осуществления ритуксимаб вводят в дозе от 150 мг/м2 до 750 мг/м2, например, приблизительно 150-175 мг/м2, 175-200 мг/м2, 200-225 мг/м2, 225-250 мг/м2, 250-300 мг/м2, 300-325 мг/м2, 325-350 мг/м2, 350-375 мг/м2, 375-400 мг/м2, 400-425 мг/м2, 425-450 мг/м2, 450-475 мг/м2, 475-500 мг/м2, 500-525 мг/м2, 525-550 мг/м2, 550-575 мг/м2, 575-600 мг/м2, 600-625 мг/м2, 625-650 мг/м2, 650-675 мг/м2 или 675-700 мг/м2, где м2 указывает на площадь поверхности тела индивидуума. В некоторых вариантах осуществления ритуксимаб вводят с интервалом дозирования по меньшей мере 4 суток, например, 4, 7, 14, 21, 28, 35 суток или более. Например, ритуксимаб вводят с интервалом дозирования по меньшей мере 0,5 недели, например, 0,5, 1, 2, 3, 4, 5, 6, 7, 8 недель, или более. В некоторых вариантах осуществления ритуксимаб вводят в дозе и с интервалом дозирования, описанным в настоящем описании, в течение периода времени, например, по меньшей мере 2 недель, например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 недель или более. Например, ритуксимаб вводят в дозе и с интервалом дозирования, описанным в настоящем описании, на протяжении всего по меньшей мере 4 доз на курс лечения (например, по меньшей мере 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 или более доз на курс лечения).
[00620] В некоторых вариантах осуществления антитело против CD20 включает офатумумаб. Офатумумаб представляет собой моноклональное антитело IgG1κ человека против CD20, имеющее молекулярную массу приблизительно 149 кДа. Например, офатумумаб получают с использованием трансгенных мышей и технологии гибридом, и экспрессируют и очищают из рекомбинантной клеточной линии мыши (NS0). См., например, www.accessdata.fda.gov/drugsatfda_docs/label/2009/125326lbl.pdf; и клинические испытания под идентификационным номером NCT01363128, NCT01515176, NCT01626352 и NCT01397591. В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, вводят индивидууму в комбинации с офатумумабом. В вариантах осуществления индивидуум имеет CLL или SLL.
[00621] В некоторых вариантах осуществления офатумумаб вводят в качестве внутривенной инфузии. Например, каждая инфузия обеспечивает приблизительно 150-3000 мг (например, приблизительно 150-200, 200-250, 250-300, 300-350, 350-400, 400-450, 450-500, 500-550, 550-600, 600-650, 650-700, 700-750, 750-800, 800-850, 850-900, 900-950, 950-1000, 1000-1200, 1200-1400, 1400-1600, 1600-1800, 1800-2000, 2000-2200, 2200-2400, 2400-2600, 2600-2800 или 2800-3000 мг) офатумумаба. В вариантах осуществления офатумумаб вводят в начальной дозировке приблизительно 300 мг, а затем 2000 мг, например, в течение приблизительно 11 доз, например, в течение 24 недель. В некоторых вариантах осуществления офатумумаб вводят с интервалом дозирования по меньшей мере 4 суток, например, 4, 7, 14, 21, 28, 35 суток или более. Например, офатумумаб вводят с интервалом дозирования, составляющим по меньшей мере 1 недель, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 24, 26, 28, 20, 22, 24, 26, 28, 30 недель или более. В некоторых вариантах осуществления офатумумаб вводят в дозе и с интервалом дозирования, описанными в настоящем описании, в течение периода времени, например, в течение по меньшей мере 1 недели, например, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 22, 24, 26, 28, 30, 40, 50, 60 недель или более, или 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 месяцев или более, или 1, 2, 3, 4, 5 лет или более. Например, офатумумаб вводят в дозе и с интервалом дозирования, описанным в настоящем описании, на протяжении всего по меньшей мере 2 доз на курс лечения (например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 18, 20, или более доз на курс лечения).
[00622] В некоторых случаях, антитело против CD20 включает окрелизумаб. Окрелизумаб представляет собой гуманизированное моноклональное антитело против CD20, например, как описано в клинических испытаниях под идентификационными номерами № NCT00077870, NCT01412333, NCT00779220, NCT00673920, NCT01194570, и в Kappos et al. Lancet. 19,378(2011):1779-87.
[00623] В некоторых случаях антитело против CD20 включает велтузумаб. Велтузумаб представляет собой гуманизированное моноклональное антитело против CD20. См., например, клинические испытания под идентификационными номерами № NCT00547066, NCT00546793, NCT01101581, и Goldenberg et al. Leuk Lymphoma. 51(5)(2010):747-55.
[00624] В некоторых случаях, антитело против CD20 включает GA101. GA101 (также называемый обинутузумабом или RO5072759) представляет собой гуманизированное глико-модифицированное моноклональное антитело против CD20. См., например, Robak. Curr. Opin. Investig. Drugs. 10,6(2009):588-96; клинические испытания под идентификационными номерами: NCT01995669, NCT01889797, NCT02229422 и NCT01414205; и www.accessdata.fda.gov/drugsatfda_docs/label/2013/125486s000lbl.pdf.
[00625] В некоторых случаях антитело против CD20 включает AME-133v. AME-133v (также называемый LY2469298 или окаратузумабом) представляет собой гуманизированное моноклональное IgG1-антитело против CD20 с увеличенной аффинностью в отношении рецептора FcγRIIIa и усиленной активностью антитело-зависимой клеточной цитотоксичности (ADCC) по сравнению с ритуксимабом. См., например, Robak et al. BioDrugs 25.1(2011):13-25; и Forero-Torres et al. Clin Cancer Res. 18.5(2012):1395-403.
[00626] В некоторых случаях антитело против CD20 включает PRO131921. PRO131921 представляет собой гуманизированное моноклональные антитело против CD20, модифицированное способами инженерии, чтобы оно обладало улучшенным связыванием с FcγRIIIa и усиленной ADCC по сравнению с ритуксимабом. См., например, Robak et al. BioDrugs 25.1(2011):13-25; и Casulo et al. Clin Immunol. 154,1(2014):37-46; и клиническое испытание под идентификационным номером № NCT00452127.
[00627] В некоторых случаях, антитело против CD20 включает TRU-015. TRU-015 представляет собой слитый белок CD20, образованный доменами антитела против CD20. TRU-015 имеет меньший размер, чем моноклональные антитела, но сохраняет опосредуемые Fc эффекторные функции. См., например, Robak et al. BioDrugs 25.1(2011):13-25. TRU-015 содержит одноцепочечный вариабельный фрагмент (scFv) против CD20, связанный с шарнирной областью IgG1 человека, CH2- и CH3-доменами, но лишен доменов CH1 и CL.
[00628] В некоторых вариантах осуществления антитело против CD20, описанное в настоящем описании, конъюгировано или иным образом связано с лекарственным средством, например, химиотерапевтическим средством (например, цитоксан, флударабин, ингибитор деацетилазы гистонов, деметилирующее средство, пептидная вакцина, противоопухолевый антибиотик, ингибитор тирозинкиназы, алкилирующее средство, антитубулиновое или антимитотическое средство), средство против аллергии, средство против тошноты (или противорвотное средство), средство для смягчения боли или цитопротекторное средство, описанное в настоящем описании.
[00629] В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, вводят индивидууму в комбинации с ингибитором B-клеточной лимфомы 2 (BCL-2) (например, венетоклаксом, также называемым ABT-199 или GDC-0199) и/или ритуксимабом. В вариантах осуществления CAR-экспрессирующую клетку, описанную в настоящем описании, вводят индивидууму в комбинации с венетоклаксом и ритуксимабом. Венетоклакс представляет собой низкомолекулярное соединение, которое ингибирует антиапоптотический белок BCL-2. Структура вентоклакса (4-(4-{[2-(4-хлорфенил)-4,4-диметилциклогекс-1-ен-1-ил]метил}пиперазин-1-ил)-N-({3-нитро-4-[(тетрагидро-2H-пиран-4-илметил)амино]фенил}сульфонил)-2-(1H-пирроло[2,3-b]пиридин-5-илокси)бензамид) представлена ниже.
[00630] В вариантах осуществления индивидуум имеет CLL. В вариантах осуществления индивидуум имеет рецидивирующий CLL, например, индивидууму ранее проводили терапию злокачественной опухоли. В вариантах осуществления венетоклакс вводят в дозировке приблизительно 15-600 мг (например, 15-20, 20-50, 50-75, 75-100, 100-200, 200-300, 300-400, 400-500 или 500-600 мг), например, каждые сутки. В вариантах осуществления ритуксимаб вводят в дозировке приблизительно 350-550 мг/м2 (например, 350-375, 375-400, 400-425, 425-450, 450-475, или 475-500 мг/м2), например, внутривенно, например, каждый месяц.
[00631] В одном варианте осуществления клетки, экспрессирующие CAR, описанный в настоящем описании, необязательно в комбинации с ингибитором киназы, например, ингибитором BTK, таким как ибрутиниб, вводят индивидууму в комбинации с молекулой, которая уменьшает популяцию Treg-клеток. Способы, которые уменьшают количество (например, истощают) Treg-клетки, известны в данной области и включают, например, истощение по CD25, введение циклофосфамида, модулирование функции GITR. Без связи с теорией, полагают, что уменьшение количества Treg-клеток у индивидуума перед аферезом или перед введением CAR-экспрессирующей клетки, описанной в настоящем описании, уменьшает количество нежелательных иммунных клеток (например, Treg) в микроокружении опухоли и уменьшает риск рецидива у индивидуума. В одном варианте осуществления клетки, экспрессирующие CAR, описанный в настоящем описании, необязательно в комбинации с ингибитором киназы, например, ингибитором BTK, таким как ибрутиниб, вводят индивидууму в комбинации с молекулой, нацеленной на GITR и/или модулирующей функции GITR, такой как агонист GITR и/или антитело против GITR, которые истощают регуляторные T-клетки (Treg). В вариантах осуществления клетки, экспрессирующие CAR, описанный в настоящем описании, необязательно в комбинации с ингибитором киназы, например, ингибитором BTK, таким как ибрутиниб, вводят индивидууму в комбинации с циклофосфамидом. В одном варианте осуществления молекулы, связывающие GITR, и/или молекулы, модулирующие функции GITR (например, агонист GITR и/или истощающие Treg антитела против GITR), вводят перед введением CAR-экспрессирующей клетки. Например, в одном варианте осуществления агонист GITR можно вводить до афереза клеток. В вариантах осуществления циклофосфамид вводят индивидууму до введения (например, инфузии или реинфузии) CAR-экспрессирующей клетки или до афереза клеток. В вариантах осуществления циклофосфамид и антитело против GITR вводят индивидууму перед введением (например, инфузии или реинфузии) CAR-экспрессирующей клетки или до афереза клеток. В одном варианте осуществления индивидуум имеет злокачественную опухоль (например, солидную злокачественную опухоль или гематологическую злокачественную опухоль, такую как ALL или CLL). В одном варианте осуществления индивидуум имеет CLL. В вариантах осуществления индивидуум имеет ALL. В вариантах осуществления индивидуум имеет солидную злокачественную опухоль, например, солидную злокачественную опухоль, описанную в настоящем описании.
[00632] Иллюстративные агонисты GITR включают, например, слитые белки GITR и антитела против GITR (например, двухвалентные антитела против GITR) например, такие как слитый белок GITR, описанный в патенте США № 6111090, патенте Европы № 090505B1, патенте США № 8586023, публикации PCT № WO 2010/003118 и 2011/090754, или антитело против GITR, описанное, например, в патенте США № 7025962, патенте Европы № 1947183B1, патенте США № 7812135, патенте США № 8388967, патенте США № 8591886, патенте Европы № EP 1866339, публикации PCT № WO 2011/028683, публикации PCT № WO 2013/039954, публикации PCT № WO2005/007190, публикации PCT № WO 2007/133822, публикации PCT № WO2005/055808, публикации PCT № WO 99/40196, публикации PCT № WO 2001/03720, публикации PCT № WO99/20758, публикации PCT № WO2006/083289, публикации PCT № WO 2005/115451, патенте США № 7618632 и публикации PCT № WO 2011/051726.
[00633] В одном варианте осуществления комбинацию CAR-экспрессирующей клетки, описанной в настоящем описании, и ингибитора киназы, описанного в настоящем описании, вводят индивидууму в комбинации с агонистом GITR, например, агонистом GITR, описанным в настоящем описании. В одном варианте осуществления агонист GITR вводят до введения CAR-экспрессирующей клетки. Например, в одном варианте осуществления агонист GITR можно вводить до афереза клеток. В одном варианте осуществления индивидуум имеет CLL.
[00634] Также можно использовать лекарственные средства, которые либо ингибируют кальцийзависимую фосфатазу кальциневрин (циклоспорин и FK506), либо ингибируют киназу p70S6, которая является важной для индуцируемой факторами роста передачи сигнала (рапамицин). (Liu et al., Cell 66:807-815, 1991; Henderson et al., Immun. 73:316-321, 1991; Bierer et al., Curr. Opin. Immun. 5:763-773, 1993). В следующем аспекте композиции клеток по настоящему изобретению можно вводить пациенту совместно с (например, до, одновременно или после) трансплантации костного мозга, терапией, устраняющей T-клетки, с использованием химиотерапевтических средств, таких как флударабин, лучевая терапия внешним пучком (XRT), циклофосфамид и/или антитела, такие как OKT3 или CAMPATH. В одном аспекте композиции клеток по настоящему изобретению вводят после терапии, устраняющей B-клетки, такой как средства, которые реагируют с CD20, например, ритуксан. Например, в одном варианте осуществления индивидуумы могут подвергаться стандартному лечению химиотерапией в высокой дозе с последующей трансплантацией стволовых клеток периферической крови. В определенных вариантах осуществления после трансплантации индивидуумам проводят инфузию увеличенных в количестве иммунных клеток по настоящему изобретению. В дополнительном варианте осуществления увеличенные в количестве клетки вводят до или после хирургической операции.
[00635] В одном варианте осуществления индивидууму можно вводить средство, которое снижает или смягчает побочный эффект, ассоциированный с введением экспрессирующей CAR клетки. Побочные эффекты, ассоциированные с введением экспрессирующей CAR клетки, включают, но не ограничиваются ими CRS и гемофагоцитарный лимфогистиоцитоз (HLH), также называемый синдромом активации макрофагов (MAS). Симптомы CRS включают высокую лихорадку, тошноту, временную гипотензию, гипоксию и т.п. Таким образом, способы, описанные в настоящем описании, могут включать введение экспрессирующей CAR клетки, описанной в настоящем описании, индивидууму, и, кроме того, введение средства для контроля повышенных уровней растворимого фактора вследствие лечения экспрессирующей CAR клеткой. В одном варианте осуществления растворимый фактор, повышенный у индивидуума, представляет собой один или несколько из IFN-γ, TNFα, рецептор IL-2 и IL-6. Таким образом, средство, вводимое для лечения этого побочного эффекта, может представлять собой средство, которое нейтрализует один или несколько из этих растворимых факторов. Примеры таких средств включают, но не ограничиваются ими, стероид (например, кортикостероид), ингибитор TNFα и ингибитор IL-6. Примером ингибитора TNFα является молекула антитела против TNFα такая как инфликсимаб, адалимумаб, цертолизумаб пегол и голимумаб. Другим примером ингибитора TNFα является слитый белок, такой как этанерцепт. Низкомолекулярный ингибитор TNFα включает, но не ограничивается ими, производные ксантина (например, пентоксифиллин) и бупропион. Примером ингибитора IL-6 является молекула антитела против IL-6 или молекула антитела против рецептора IL-6, такая как тоцилизумаб (toc), тоцилизумаб (toc), сарилумаб, элсилимомаб, CNTO 328, ALD518/BMS-945429, CNTO 136, CPSI-2364, CDP6038, VX30, ARGX-109, FE301 и FM101. В одном варианте осуществления молекула антитела против рецептора IL-6 представляет собой тоцилизумаб. Примером ингибитора на основе IL-1R является анакинра.
[00636] В одном варианте осуществления индивидууму можно вводить средство, которое повышает активность экспрессирующей CAR клетки. Например, в одном варианте осуществления средство может представлять собой средство, которое ингибирует ингибиторную молекулу. Ингибиторные молекулы, например Programmed Death 1 (PD1), в некоторых вариантах осуществления могут уменьшать способность экспрессирующей CAR клетки индуцировать иммунный эффекторный ответ. Примеры ингибиторных молекул включают PD1, PD-L1, CTLA4, TIM3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), LAG3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и TGFR-бета. Ингибирование ингибиторной молекулы, например, посредством ингибирования уровня ДНК, РНК или белка, может оптимизировать эффективность экспрессирующей CAR клетки. В вариантах осуществления для ингибирования экспрессии ингибиторной молекулы в экспрессирующей CAR клетке можно использовать ингибиторную нуклеиновую кислоту, например, ингибиторную нуклеиновую кислоту, например, дцРНК, например миРНК или кшРНК; короткие палиндромные повторы, регулярно расположенные кластерами (CRISPR), нуклеазу, подобную активатору транскрипции (TALEN) или эндонуклеазу с цинковыми пальцами (ZFN). В одном варианте осуществления ингибитор представляет собой кшРНК. В одном варианте осуществления ингибиторная молекула ингибируется в экспрессирующей CAR клетке. В этих вариантах осуществления молекула дцРНК, которая ингибирует экспрессию ингибиторнй молекулы, связана с нуклеиновой кислотой, которая кодирует компонент, например, все из компонентов, CAR. В одном варианте осуществления the ингибитор of an ингибиторy signal can be, например, an антитело или антитело фрагмент that binds to an ингибиторy молекула. Например, средство может представлять собой антитело или фрагмент антитела, которые связываются с PD1, PD-L1, PD-L2 или CTLA4 (например, ипилимумаб (также называемый MDX-010 и MDX-101, и выпускаемый в продажу как Yervoy®; Bristol-Myers Squibb; тремелимумаб (моноклональное IgG2-антитело, доступное от Pfizer, ранее известное как тицилимумаб, CP-675.206)). В одном варианте осуществления средство представляет собой антитело или фрагмент антитела, которые связываются с TIM3. В одном варианте осуществления средство представляет собой антитело или фрагмент антитела, которые связываются с LAG3. В одном варианте осуществления средство представляет собой антитело или фрагмент антитела, которые связываются с CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5).
[00637] PD1 представляет собой ингибиторный представитель семейства рецепторов CD28, которое также включает CD28, CTLA-4, ICOS и BTLA. PD1 экспрессируется на активированных B-клетках, T-клетках и миелоидных клетках (Agata et al. 1996 Int. Immunol 8:765-75). Было показано, что два лиганда для PD1, PD-L1 и PD-L2, подавляют активацию T-клеток при связывании с PD1 (Freeman et al. 2000 J Exp Med 192:1027-34; Latchman et al. 2001 Nat Immunol 2:261-8; Carter et al. 2002 Eur J Immunol 32:634-43). PD-L1 распространен в злокачественных опухолях человека (Dong et al. 2003 J Mol Med 81:281-7; Blank et al. 2005 Cancer Immunol. Immunother 54:307-314; Konishi et al. 2004 Clin Cancer Res 10:5094). Иммунную супрессию можно обращать вспять путем ингибирования локального взаимодействия PD1 с PD-L1. Антитела, фрагменты антител и другие ингибиторы PD1, PD-L1 и PD-L2 известны и могут использоваться в комбинации с CAR против CD19, описанным в настоящем описании. Например, ниволумаб (также обозначаемый как BMS-936558 или MDX1106; Bristol-Myers Squibb) представляет собой полностью человеческое моноклональное IgG4-антитело, которое специфически блокирует PD1. Ниволумаб (клон 5C4) и другие моноклональные антитела человека, которые специфически связываются с PD1, описаны в US 8008449 и WO2006/121168. Пидилизумаб (CT-011; Cure Tech) представляет собой гуманизированное моноклональное IgG1k-антитело, которое связывается с PD1. Пидилизумаб и другие гуманизированные моноклональные антитела против PD1 описаны в WO2009/101611. Пембролизумаб (ранее известный как ламбролизумаб и также обозначаемый как Keytruda, MK03475; Merck) представляет собой гуманизированное моноклональное IgG4-антитело, которое связывается с PD-1. Пембролизумаб и другие гуманизированные антитела против PD-1 описаны в US 8354509 и WO2009/114335. MEDI4736 (Medimmune) представляет собой моноклональное антитело человека, которое связывается с PDL1 и ингибирует взаимодействие лиганда с PD1. MDPL3280A (Genentech/Roche) представляет собой моноклональное IgG1-антитело с оптимизированной Fc, которое связывается с PD-L1. MDPL3280A и другие моноклональные антитела человека к PD-L1 описаны в патенте США № 7943743 и публикации США № 20120039906. Другие связывающие PD-L1 средства включают YW243.55.S70 (вариабельные области тяжелой и легкой цепей представлены в SEQ ID NO: 20 и 21 в WO2010/077634) и MDX-1 105 (также обозначаемый как BMS-936559, и, например, связывающие PD-L1 средства, описанные в WO2007/005874). AMP-224 (B7-DCIg; Amplimmune; например, описанный в WO2010/027827 и WO2011/066342), представляет собой слитый растворимый рецептор PD-L2-Fc, который блокирует взаимодействие между PD1 и B7-H1. Другие антитела против PD1 включают AMP 514 (Amplimmune), среди прочих, например, антитела против PD1, описанные в US 8609089, US 2010028330 и/или US 20120114649.
[00638] TIM3 (T-клеточный иммуноглобулин 3) также подавляет T-клеточную функцию, в частности, в секретирующих IFN-γ CD4+ T-хелперных 1 и CD8+ цитотоксических T-клетках 1, и он играет важную роль в устранении T-клеток. Ингибирование взаимодействия между TIM3 и его лигандами, например галектином-9 (Gal9), фосфотидилсерином (PS) и HMGB1, может увеличить иммунный ответ. Антитела, фрагменты антител и другие ингибиторы TIM3 и его лиганды доступны в данной области и могут быть использованы в комбинации с CAR против CD19, описанным в настоящем описании. Например, антитела, фрагменты антитела, низкомолекулярные соединения или пептидные ингибиторы, которые нацелены на TIM3, связываются с IgV-доменом TIM3, ингибируя взаимодействия с его лигандами. Антитела и пептиды, которые ингибируют TIM3, описаны в WO2013/006490 и US20100247521. Другие антитела против TIM3 включают гуманизированные версии RMT3-23 (описанные в Ngiow et al., 2011, Cancer Res, 71:3540-3551) и клон 8B.2C12 (описанный в Monney et al., 2002, Nature, 415:536-541). Биспецифические антитела, которые ингибируют TIM3 и PD-1, описаны в US20130156774.
[00639] В других вариантах осуществления средство, которое повышает активность экспрессирующей CAR клетки, представляет собой ингибитор CEACAM (например, ингибитор CEACAM-1, CEACAM-3 и/или CEACAM-5). В одном варианте осуществления ингибитор CEACAM представляет собой молекулу антитела против CEACAM. Иллюстративные антитела против CEACAM-1 описаны в WO 2010/125571, WO 2013/082366 WO 2014/059251 и WO 2014/022332, например моноклональное антитело 34B1, 26H7 и 5F4; или их рекомбинантные формы, как описано, например, в US 2004/0047858, US 7132255 и WO 99/052552. В других вариантах осуществления антитело против CEACAM связывается с CEACAM-5, как описано, например, в Zheng et al. PLoS One. 2010 Sep 2;5(9). pii: e12529 (DOI:10:1371/journal.pone.0021146) или перекрестно реагирует с CEACAM-1 и CEACAM-5, как описано, например, в WO 2013/054331 и US 2014/0271618.
[00640] Без связи с теорией, полагают, что канцероэмбриональные антигенные молекулы клеточной адгезии (CEACAM), такие как CEACAM-1 и CEACAM-5, опосредуют, по меньшей мере частично, ингибирование противоопухолевого иммунного ответа (см. например, Markel et al. J Immunol. 2002 Mar 15;168(6):2803-10; Markel et al. J Immunol. 2006 Nov 1;177(9):6062-71; Markel et al. Immunology. 2009 Feb;126(2):186-200; Markel et al. Cancer Immunol Immunother. 2010 Feb;59(2):215-30; Ortenberg et al. Mol Cancer Ther. 2012 Jun;11(6):1300-10; Stern et al. J Immunol. 2005 Jun 1;174(11):6692-701; Zheng et al. PLoS One. 2010 Sep 2;5(9). pii: e12529). Например, CEACAM-1 описан в качестве гетерофильного лиганда для TIM-3, играющего роль в опосредуемой TIM-3 толерантности и устранении T-клеток (см. например, WO 2014/022332; Huang, et al. (2014) Nature doi:10.1038/nature13848). В вариантах осуществления показано, что совместная блокада CEACAM-1 и TIM-3 усиливает противоопухолевый иммунный ответ в моделях с ксенотрансплантатом рака ободочной и прямой кишки (см. например, WO 2014/022332; Huang, et al. (2014), выше). В других вариантах осуществления совместная блокада CEACAM-1 и PD-1 снижает толерантность T-клеток, как описано, например, в WO 2014/059251. Таким образом, ингибиторы CEACAM можно использовать с другими иммуномодуляторами, описанными в настоящем описании (например, ингибиторы PD-1 и/или ингибиторы TIM-3) для усиления иммунного ответа против злокачественной опухоли, например, меланомы, рака легкого (например, NSCLC), рака мочевого пузыря, рака толстого кишечника, рака яичника и других злокачественных опухолей, как описано в настоящем описании.
[00641] LAG3 (ген активации лимфоцитов 3 или CD223) представляет собой молекулу клеточной поверхности, экспрессируемую на активированных T-клетках и B-клетках, для которой было показано, что она играет роль в устранении CD8+ T-клеток. Антитела, фрагменты антитела и другие ингибиторы LAG3 и его лиганды доступны в данной области, и их можно использовать в комбинации с CAR против CD19, описанным в настоящем описании. Например, BMS-986016 (Bristol-Myers Squib) представляет собой моноклональное антитело, которое нацелено на LAG3. IMP701 (Immutep) представляет собой антитело-антагонист LAG3 и IMP731 (Immutep и GlaxoSmithKline) представляет собой истощающее антитело против LAG3. Другие ингибиторы LAG3 включают IMP321 (Immutep), который представляет собой рекомбинантный слитый белок растворимой части LAG3 и Ig, который связывается с молекулами MHC класса II и активирует антигенпредставляющие клетки (APC). Другие антитела описаны, например, в WO2010/019570.
[00642] В некоторых вариантах осуществления терапию CAR и введение ингибитора киназы проводят в комбинации с агонистом toll-подобного рецептора (TLR). Агонист TLR может представлять собой агонист TLR9. В некоторых вариантах осуществления агонист TLR представляет собой олигодезоксинуклеотид, например, CG-обогащенный олигодезоксинуклеотид, например, неметилированный CG-обогащенный олигодезоксинуклеотид. См., например, Sagiv-Barfi et al., "Ibrutinib enhances the antitumor immune response induced by intratumoral injection of a TLR9 ligand in syngeneic mouse lymphoma model". Blood. 2015 Feb 6. pii: blood-2014-08-593137, который включен в настоящее описание в качестве ссылки в полном объеме. В некоторых вариантах осуществления агонист TLR вводят в комбинации с CAR-экспрессирующей NK-клеткой. Без связи с теорией, агонист TLR может стимулировать активацию NK-клеток, таких как CAR-экспрессирующие NK-клетки. В некоторых вариантах осуществления агонист TLR вводят посредством инъекции например, внутриопухолевой инъекции.
[00643] В некоторых вариантах осуществления средство, которое повышает активность экспрессирующей CAR клетки, может представлять собой, например, слитый белок, содержащий первый домен и второй домен, где первый домен представляет собой ингибиторную молекулу или ее фрагмент, и второй домен представляет собой полипептид, который ассоциирован с положительным сигналом, например, полипептид, содержащий внутриклеточный сигнальный домен, как описано в настоящем описании. В некоторых вариантах осуществления полипептид, который ассоциирован с положительным сигналом, может включать костимулирующий домен CD28, CD27, ICOS, например, внутриклеточный сигнальный домен CD28, CD27 и/или ICOS, и/или первичный сигнальный домен, например, из CD3-зета, например, описанный в настоящем описании. В одном варианте осуществления слитый белок экспрессируется той же клеткой, которая экспрессирует CAR. В другом варианте осуществления слитый белок экспрессируется клеткой, например, T-клеткой, которая не экспрессирует CAR против CD19.
[00644] В одном варианте осуществления средство, которое повышает активность экспрессирующей CAR клетки, описанной в настоящем описании, представляет собой miR-17-92.
[00645] В одном варианте осуществления средство, которое усиливает активность CAR, описанного в настоящем описании, представляет собой цитокин. Цитокины имеют важные функции, связанные с экспансией, дифференцировкой, выживаемостью и гомеостазом T-клеток. Цитокины, которые можно вводить индивидууму, которому вводят CAR-экспрессирующую клетку, описанную в настоящем описании, включают: IL-2, IL-4, IL-7, IL-9, IL-15, IL-18, и IL-21 или их комбинацию. В предпочтительных вариантах осуществления вводимый цитокин представляет собой IL-7, IL-15 или IL-21, или их комбинацию. Цитокин можно вводить один раз в сутки или более одного раза сутки, например, два раза в сутки, три раза в сутки или четыре раза в сутки. Цитокин можно вводить в течение более чем одних суток, например, цитокин вводят в течение 2 суток, 3 суток, 4 суток, 5 суток, 6 суток, 1 недели, 2 недель, 3 недель или 4 недель. Например, цитокин один раз в сутки в течение 7 суток.
[00646] В вариантах осуществления цитокин вводят в комбинации с CAR-экспрессирующими клетками. Цитокин можно вводить одновременно или совместно с CAR-экспрессирующими клетками, например, вводить в один и тот же день. Цитокин можно составлять в ту же фармацевтическую композицию, что и CAR-экспрессирующие клетки, или его можно составлять в отдельную фармацевтическую композицию. Альтернативно цитокин можно вводить вскоре после введения CAR-экспрессирующих T-клеток, например, через 1 сутки, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток или 7 суток после введения CAR-экспрессирующих клеток. В вариантах осуществления, в которых цитокин вводят в режиме дозирования, длящемся более одних суток, первые сутки режима дозирования цитокина могут быть теми же, что и сутки введения CAR-экспрессирующих клеток, или первые сутки режима дозирования цитокина могут быть через 1 сутки, 2 суток, 3 суток, 4 суток, 5 суток, 6 суток или 7 суток после введения CAR-экспрессирующих T-клеток. В одном варианте осуществления на первые сутки CAR-экспрессирующие клетки вводят индивидууму и на вторые сутки цитокин вводят один раз в сутки в течение последующих 7 суток. В предпочтительном варианте осуществления цитокин, подлежащий введению в комбинации с CAR-экспрессирующими клетками, представляет собой IL-7, IL-15 и/или IL-21.
[00647] В других вариантах осуществления цитокин вводят после достаточного периода времени после введения CAR-экспрессирующих клеток, например, по меньшей мере через 2 недели, 3 недели, 4 недели, 6 недель, 8 недель, 10 недель, 12 недель, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев или 1 год или более после введения CAR-экспрессирующих клеток. В одном варианте осуществления цитокин вводят после оценки ответа индивидуума на CAR-экспрессирующие клетки. Например, индивидууму вводят CAR-экспрессирующие клетки в соответствии с дозировкой и режимами, описанными в настоящем описании. Ответ индивидуума на терапию CART оценивают через 2 недели, 3 недели, 4 недели, 6 недель, 8 недель, 10 недель, 12 недель, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев или 1 год или более после введения CAR-экспрессирующих клеток, с использованием любого из способов, описанных в настоящем описании, включая ингибирование роста опухоли, уменьшение количества циркулирующих опухолевых клеток или регрессию опухоли. Индивидуумам, которые не проявляют достаточного ответа на терапию CART, можно вводить цитокин. Введение цитокина индивидууму, который имеет субоптимальный ответ на терапию CART, повышает эффективность CART и/или противоопухолевую активность. В предпочтительном варианте осуществления цитокин, вводимый после введения CAR-экспрессирующих клеток, представляет собой IL-7.
Комбинирование с низкой дозой ингибитора mTOR
[00648] В одном варианте осуществления клетки, экспрессирующие молекулу CAR, например, молекулу CAR, описанную в настоящем описании, вводят в комбинации с низкой усиливающей иммунитет дозой ингибитора mTOR.
[00649] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 5, но не более 90%, по меньшей мере 10, но не более 90%, по меньшей мере 15, но не более 90%, по меньшей мере 20, но не более 90%, по меньшей мере 30, но не более 90%, по меньшей мере 40, но не более 90%, по меньшей мере 50, но не более 90%, по меньшей мере 60, но не более 90%, или по меньшей мере 70, но не более 90%.
[00650] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 5, но не более 80%, по меньшей мере 10, но не более 80%, по меньшей мере 15, но не более 80%, по меньшей мере 20, но не более 80%, по меньшей мере 30, но не более 80%, по меньшей мере 40, но не более 80%, по меньшей мере 50, но не более 80%, или по меньшей мере 60, но не более 80%.
[00651] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 5, но не более 70%, по меньшей мере 10, но не более 70%, по меньшей мере 15, но не более 70%, по меньшей мере 20, но не более 70%, по меньшей мере 30, но не более 70%, по меньшей мере 40, но не более 70%, или по меньшей мере 50, но не более 70%.
[00652] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 5, но не более 60%, по меньшей мере 10, но не более 60%, по меньшей мере 15, но не более 60%, по меньшей мере 20, но не более 60%, по меньшей мере 30, но не более 60%, или по меньшей мере 40, но не более 60%.
[00653] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 5, но не более 50%, по меньшей мере 10, но не более 50%, по меньшей мере 15, но не более 50%, по меньшей мере 20, но не более 50%, по меньшей мере 30, но не более 50%, или по меньшей мере 40, но не более 50%.
[00654] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 5, но не более 40%, по меньшей мере 10, но не более 40%, по меньшей мере 15, но не более 40%, по меньшей мере 20, но не более 40%, по меньшей мере 30, но не более 40%, или по меньшей мере 35, но не более 40%.
[00655] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 5, но не более 30%, по меньшей мере 10, но не более 30%, по меньшей мере 15, но не более 30%, по меньшей мере 20, но не более 30%, или по меньшей мере 25, но не более 30%.
[00656] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 1, 2, 3, 4 или 5, но не более чем 20%, по меньшей мере 1, 2, 3, 4 или 5, но не более чем 30%, по меньшей мере 1, 2, 3, 4 или 5, но не более чем 35, по меньшей мере 1, 2, 3, 4 или 5, но не более чем 40%, или по меньшей мере 1, 2, 3, 4 или 5, но не более чем 45%.
[00657] В одном варианте осуществления доза ингибитора mTOR ассоциирована с или обеспечивает ингибирование mTOR, составляющее по меньшей мере 1, 2, 3, 4 или 5, но не более чем 90%.
[0658] Как описано в настоящем описании, степень ингибирования mTOR можно выражать в качестве степени ингибирования P70 S6-киназы, например, степень ингибирования mTOR можно определять по уровню снижения активности P70 S6-киназы, например, по снижению фосфорилирования субстрата P70 S6-киназы. Уровень ингибирования mTOR можно оценивать способом, описанным в настоящем описании, например, с использованием анализа Boulay, или измерения уровней фосфорилированной S6 с помощью вестерн-блоттинга.
ИЛЛЮСТРАТИВНЫЕ ИНГИБИТОРЫ mTOR
[00659] Как используют в рамках изобретения, термин "ингибитор mTOR" относится к соединению или лиганду, или их фармацевтически приемлемой соли, которые ингибируют киназу mTOR в клетке. В одном варианте осуществления ингибитор mTOR представляет собой аллостерический ингибитор. В одном варианте осуществления ингибитор mTOR представляет собой каталитический ингибитор.
[00660] Аллостерические ингибиторы mTOR включают нейтральное трициклическое соединение рапамицин (сиролимус), родственные рапамицину соединения, которые представляют собой соединения, имеющие структурное и функциональное сходство с рапамицином, включая, например, производные рапамицина, аналоги рапамицина (также называемые рапалогами) и другие макролидные соединения, которые ингибируют активность mTOR.
[0661] Рапамицин представляет собой известный макролидный антибиотик, продуцируемый Streptomyces hygroscopicus, имеющий структуру, показанную в формуле A.
[00662]  (A)
(A)
[00663] См., например, McAlpine, J.B., et al., J. Antibiotics (1991) 44: 688; Schreiber, S.L., et al., J. Am. Chem. Soc. (1991) 113: 7433; патент США № 3929992. Существуют различные схемы нумерации, предложенные для рапамицина. Во избежание путаницы, когда в настоящем описании упоминаются конкретные аналоги рапамицина, названия приведены относительно рапамицина с использованием схемы нумерации формулы A.
[00664] Аналоги рапамицина, пригодные в рамках изобретения, представляют собой, например, O-замещенные аналоги, в которых гидроксильная группа на циклогексильном кольце рапамицина заменена OR1, где R1 представляет собой гидроксиалкил, гидроксиалкоксиалкил, ациламиноалкил или аминоалкил; например RAD001, также известный как эверолимус, как описано в US 5665772 и WO94/09010, содержимое которых включено в качестве ссылки. Другие пригодные аналоги рапамицина включают аналоги рапамицина, замещенные в положении 26 или 28. Аналог рапамицина может представлять собой эпимер аналога, упомянутого выше, в частности, эпимер аналога, замещенного в положении 40, 28 или 26, и он необязательно может быть далее гидрогенизирован, например, как описано в US 6015815, WO95/14023 и WO99/15530, содержание которых включено в настоящее описание в качестве ссылки, например ABT578, также известный как зотаролимус, или аналог рапамицина, описанный в US 7091213, WO98/02441 и WO01/14387, содержание которых включено в качестве ссылки, например AP23573, также известный как ридафоролимус.
[00665] Примеры аналогов рапамицина, пригодных для применения в рамках настоящего изобретения, из US 5665772 включают, но не ограничиваются ими, 40-O-бензилрапамицин, 40-O-(4ʹ-гидроксиметил)бензилрапамицин, 40-O-[4ʹ-(1,2-дигидроксиэтил)]бензилрапамицин, 40-O-аллилрапамицин, 40-O-[3ʹ-(2,2-диметил-1,3-диоксолан-4(S)-ил)-проп-2ʹ-ен-1ʹ-ил]-рапамицин, (2ʹE,4ʹS)-40-O-(4ʹ,5ʹ-дигидроксипент-2ʹ-ен-1ʹ-ил)рапамицин, 40-O-(2-гидрокси)этоксикарбонилметилрапамицин, 40-O-(2-гидрокси)этилрапамицин, 40-O-(3-гидрокси)пропилрапамицин, 40-O-(6-гидрокси)гексилрапамицин, 40-O-[2-(2-гидрокси)этокси]этилрапамицин, 40-O-[(3S)-2,2-диметилдиоксолан-3-ил]метилрапамицин, 40-O-[(2S)-2,3-дигидроксипроп-1-ил]рапамицин, 40-O-(2-ацетокси)этилрапамицин, 40-O-(2-никотиноилокси)этилрапамицин, 40-O-[2-(N-морфолино)ацетокси]этилрапамицин, 40-O-(2-N-имидазолилацетокси)этилрапамицин, 40-O-[2-(N-метил-Nʹ-пиперазинил)ацетокси]этилрапамицин, 39-O-десметил-39,40-O,O-этиленрапамицин, (26R)-26-дигидро-40-O-(2-гидрокси)этилрапамицин, 40-O-(2-аминоэтил)рапамицин, 40-O-(2-ацетаминоэтил)рапамицин, 40-O-(2-никотинамидоэтил)рапамицин, 40-O-(2-(N-метилимидазо-2ʹ-илкарбэтоксамидо)этил)рапамицин, 40-O-(2-этоксикарбониламиноэтил)рапамицин, 40-O-(2-толилсульфонамидоэтил)рапамицин и 40-O-[2-(4ʹ,5ʹ-дикарбоэтокси-1ʹ,2ʹ,3ʹ-триазол-1ʹ-ил)этил]рапамицин.
[00666] Другие аналоги рапамицина, пригодные в рамках настоящего изобретения, представляют собой аналоги, в которых гидроксильная группа на циклогексильном кольце рапамицина и/или гидроксигруппа в положении 28 заменены группой сложного гидроксиэфира, например, аналоги рапамицина, описанные в US RE44768, например темсиролимус.
[00667] Другие аналоги рапамицина, пригодные в рамках настоящего изобретения, включают аналоги, в которых метоксигруппа в положении 16 заменена другим заместителем, предпочтительно (необязательно гидрокси-замещенным) алкинилокси, бензилом, ортометоксибензил или хлорбензилом и/или где метоксигруппа в положении 39 удалена вместе с углеродом 39, так что циклогексильное кольцо рапамицина становится циклопентильным кольцом, лишенным метоксигруппы в положении 39; например, как описано в WO95/16691 и WO96/41807, содержание которых включено в качестве ссылки. Аналоги можно далее модифицировать, так что гидрокси в положении 40 рапамицина алкилирован и/или 32-карбонил восстановлен.
[00668] Аналоги рапамицина из WO95/16691 включают, но не ограничиваются ими, 16-деметокси-16-(пент-2-инил)оксирапамицин, 16-деметокси-16-(бут-2-инил)оксирапамицин, 16-деметокси-16-(пропаргил)оксирапамицин, 16-деметокси-16-(4-гидроксибут-2-инил)оксирапамицин, 16-деметокси-16-бензилокси-40-O-(2-гидроксиэтил)рапамицин, 16-деметокси-16-бензилоксирапамицин, 16-деметокси-16-ортометоксибензилрапамицин, 16-деметокси-40-O-(2-метоксиэтил)-16-пент-2-инил)оксирапамицин, 39-деметокси-40-дезокси-39-формил-42-нор-рапамицин, 39-деметокси-40-дезокси-39-гидроксиметил-42-норрапамицин, 39-деметокси-40-дезокси-39-карбокси-42-норрапамицин, 39-деметокси-40-дезокси-39-(4-метилпиперазин-1-ил)карбонил-42-норрапамицин, 39-деметокси-40-дезокси-39-(морфолин-4-ил)карбонил-42-норрапамицин, 39-деметокси-40-дезокси-39-[N-метил,N-(2-пиридин-2-илэтил)]карбамоил-42-норрапамицин и 39-деметокси-40-дезокси-39-(п-толуолсульфонилгидразонометил)-42-норрапамицин.
[00669] Аналоги рапамицина из WO96/41807 включают, но не ограничиваются ими, 32-деоксорапамицин, 16-O-пент-2-инил-32-деоксорапамицин, 16-O-пент-2-инил-32-деоксо-40-O-(2-гидроксиэтил)рапамицин, 16-O-пент-2-инил-32-(S)-дигидро-40-O-(2-гидроксиэтил)рапамицин, 32(S)-дигидро-40-O-(2-метокси)этилрапамицин и 32(S)-дигидро-40-O-(2-гидроксиэтил)рапамицин.
[00670] Другим пригодным аналогом рапамицина является умиролимус, как описано в US2005/0101624, содержание которой включено в качестве ссылки.
[00671] RAD001, иначе известный как эверолимус (Afinitor®), имеет химическое название (1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28E,30S,32S,35R)-1,18-дигидрокси-12-{(1R)-2-[(1S,3R,4R)-4-(2-гидроксиэтокси)-3-метоксициклогексил]-1-метилэтил}-19,30-диметокси-15,17,21,23,29,35-гексаметил-11,36-диокса-4-азатрицикло[30,3,1,04,9]гексатриаконта-16,24,26,28-тетраен-2,3,10,14,20-пентаон
[00672] Следующие примеры аллостерических ингибиторов mTOR включают сиролимус (рапамицин, AY-22989), 40-[3-гидрокси-2-(гидроксиметил)-2-метилпропаноат]рапамицин (также называемый темсиролимусом или CCI-779) и ридафоролимус (AP-23573/MK-8669). Другие примеры аллостерических ингибиторов mTor включают зотаролимус (ABT578) и умиролимус.
[00673] Альтернативно или дополнительно, было обнаружено, что каталитические конкурирующие с ATP ингибиторы mTOR нацелены на киназный домен mTOR прямо и нацелены как на mTORC1, так и на mTORC2. Также они являются более эффективными ингибиторами mTORC1, чем такие аллостерические ингибиторы mTOR, как рапамицин, поскольку они модулируют устойчивую к рапамицину mTORC1 активность, такую как фосфорилирование 4EBP1-T37/46 и кэп-зависимая трансляция.
[00674] Каталитические ингибиторы включают: BEZ235 или 2-метил-2-[4-(3-метил-2-оксо-8-хинолин-3-ил-2,3-дигидро-имидазо[4,5-c]хинолин-1-ил)фенил]пропионитрил, или его форму монотозилата. Синтез BEZ235 описан в WO2006/122806; CCG168 (иначе известный как AZD-8055, Chresta, C.M., et al., Cancer Res, 2010, 70(1), 288-298), который имеет химическое название {5-[2,4-бис-((S)-3-метилморфолин-4-ил)пиридо[2,3d]пиримидин-7-ил]-2-метоксифенил}метанол; 3-[2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил]-N-метилбензамид (WO09104019); 3-(2-аминобензо[d]оксазол-5-ил)-1-изопропил-1H-пиразолo[3,4-d]пиримидин-4-амин (WO10051043 и WO2013023184); N-(3-(N-(3-((3,5-диметоксифенил)амино)хиноксалин-2-ил)сульфамоил)фенил)-3-метокси-4-метилбензамид (WO07044729 и WO12006552); PKI-587 (Venkatesan, A.M., J. Med.Chem., 2010, 53, 2636-2645), который имеет химическое название 1-[4-[4-(диметиламино)пиперидин-1-карбонил]фенил]-3-[4-(4,6-диморфолино-1,3,5-триазин-2-ил)фенил]мочевина; GSK-2126458 (ACS Med. Chem. Lett., 2010, 1, 39-43), который имеет химическое название 2,4-дифтор-N-{2-метокси-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамид; 5-(9-изопропил-8-метил-2-морфолино-9H-пурин-6-ил)пиримидин-2-амин (WO10114484); (E)-N-(8-(6-амино-5-(трифторметил)пиридин-3-ил)-1-(6-(2-цианопропан-2-ил)пиридин-3-ил)-3-метил-1H-имидазо[4,5-c]хинолин-2(3H)-илиден)цианамид (WO12007926).
[00675] Следующие примеры каталитических ингибиторов mTOR включают 8-(6-метокси-пиридин-3-ил)-3-метил-1-(4-пиперазин-1-ил-3-трифторметилфенил)-1,3-дигидроимидазо[4,5-c]хинолин-2-он (WO2006/122806) и Ku-0063794 (Garcia-Martinez JM, et al.,Biochem J., 2009, 421(1), 29-42. Ku-0063794 is a specific inhibitor of the mammalian target of rapamycin (mTOR)). WYE-354 является другим примером каталитического ингибитора mTor (Yu K, et al. (2009). Biochemical, Cellular, and In vivo Activity of Novel ATP-Competitive and Selective Inhibitors of the Mammalian Target of Rapamycin. Cancer Res. 69(15): 6232-6240).
[00676] Ингибиторы mTOR, пригодные в соответствии с настоящим изобретением, также включают пролекарства, производные, фармацевтически приемлемые соли или аналоги любого из указанных выше средств.
[00677] Ингибиторы mTOR, такие как RAD001, можно составлять для доставки на основе хорошо известных в данной области способов на основе конкретных дозировок, описанных в настоящем описании. В частности, в патенте США 6004973 (включенном в настоящее описание в качестве ссылки) представлены примеры составов, которые могут использоваться с ингибиторами mTOR, описанными в настоящем описании.
ОЦЕНКА ИНГИБИРОВАНИЯ mTOR
[00678] mTOR фосфорилирует киназу P70 S6, тем самым активируя киназу P70 S6 и позволяя ей фосфорилировать субстрат. Степень ингибирования mTOR можно выражать как степень ингибирования киназы P70 S6, например, степень ингибирования mTOR можно определять по уровню снижения активности киназы P70 S6, например, по снижению фосфорилирования субстрата киназы P70 S6. Можно определить уровень ингибирования mTOR путем измерения активности киназы P70 S6 (способность киназы P70 S6 фосфорилировать субстрат), в отсутствие ингибитора, например, перед введением ингибитора, и в присутствии ингибитора, или после введения ингибитора. Уровень ингибирования киназы P70 S6 обеспечивает уровень ингибирования mTOR. Таким образом, если киназа P70 S6 ингибируется на 40%, активность mTOR при измерении по активности киназы P70 S6, ингибируется на 40%. Степень или уровень ингибирования, упоминаемые в настоящем описании, представляют собой средний уровень ингибирования на протяжении периода дозирования. В качестве примера, если ингибитор вводят один раз в неделю, уровень ингибирования приводится как средний уровень ингибирования на протяжении этого интервала, а именно, недели.
[00679] В Boulay et al., Cancer Res, 2004, 64:252-61, включенной в настоящее описание в качестве ссылки, описан анализ, который можно использовать для оценки уровня ингибирования mTOR (упоминаемый в настоящем описании как анализ Boulay). В одном варианте осуществления анализ основан на измерении активности киназы P70 S6 из биологических образцов до и после введения ингибитора mTOR, например RAD001. Взятие образцов можно проводить в заданные моменты времени после введения ингибитора mTOR, например, через 24, 48 и 72 часов после введения. Можно использовать биологические образцы, например, из кожи или мононуклеарных клеток периферической крови (PBMC). Из образцов получают экстракты общего белка. Киназу P70 S6 выделяют из белковых экстрактов иммунопреципитацией с использованием антитела, которое специфически распознает киназу P70 S6. Активность выделенной киназы P70 S6 можно измерять в анализе киназы in vitro. Выделенную киназую можно инкубировать с субстратами, представляющими собой рибосомальные субъединицы 40S (которые представляют собой эндогенный субстрат киназы P70 S6) и гамма-32P в условиях, которые обеспечивают фосфорилирование субстрата. Затем реакционную смесь можно разделять на геле SDS-PAGE, и сигнал 32P можно анализировать с использованием FluoroImager. Сигнал 32P, соответствующий размеру рибосомальной субъединицы 40S, указывает на фосфорилированный субстрат и активность киназы P70 S6. Увеличение и снижение активности киназы можно вычислять путем количественного определения площади и интенсивности сигнала 32P у фосфорилированного субстрата (например, с использованием ImageQuant, Molecular Dynamics), присвоения величин произвольных единиц количественно определенному сигналу и сравнения величин после введения с величинами до введения или с эталонной величиной. Например, процентное ингибирование киназной активности можно вычислять по следующей формуле: 1-(величина, полученная после введения/величина, полученная до ведения)×100. Как описано выше, степень или уровень ингибирования, упоминаемые в настоящем описании, представляют собой средний уровень ингибирования на протяжении интервала дозирования.
[00680] Способы оценки киназной активности, например, активности киназы P70 S6, также представлены в US 7727950, включенной в настоящее описание в качестве ссылки.
[00681] Уровень ингибирования mTOR также можно оценивать по изменению соотношения отрицательных по PD1 и положительных по PD1 T-клеток. T-клетки из периферической крови можно идентифицировать в качестве положительных или отрицательных по PD1 известными в данной области способами.
Ингибиторы mTOR в низкой дозе
[00682] В способах, описанных в настоящем описании, используются низкие усиливающие иммунитет дозы ингибиторов mTOR, например, аллостерических ингибиторов mTOR, включая рапалоги, такие как RAD001. Напротив, уровни ингибитора, которые полностью или практически полностью ингибируют каскад mTOR, являются иммунодепрессивными, и используются, например, для предупреждения отторжения трансплантата органа. Кроме того, высокие дозы рапалогов, которые полностью ингибируют mTOR, также ингибируют рост опухолевых клеток и используются для лечения различных злокачественных опухолей (см., например, Antineoplastic effects of mammalian target of rapamycine inhibitors. Salvadori M. World J Transplant. 2012 Oct 24;2(5):74-83; Current and Future Treatment Strategies for Patients with Advanced Hepatocellular Carcinoma: Role of mTOR Inhibition. Finn RS. Liver Cancer. 2012 Nov;1(3-4):247-256; Emerging Signaling Pathways in Hepatocellular Carcinoma. Moeini A, Cornellà H, Villanueva A. Liver Cancer. 2012 Sep;1(2):83-93; Targeted cancer therapy - Are the days of systemic chemotherapy numbered? Joo WD, Visintin I, Mor G. Maturitas. 2013 Sep 20.; Role of natural and adaptive immunity in renal cell carcinoma response to VEGFR-TKIs and mTOR inhibitor. Santoni M, Berardi R, Amantini C, Burattini L, Santini D, Santoni G, Cascinu S. Int J Cancer. 2013 Oct 2).
[00683] Настоящее изобретение основано, по меньшей мере частично, на неожиданном открытии, что дозы ингибиторов mTOR, являющиеся значительно более низкими, чем дозы, используемые в современных клинических условиях, имели улучшенный эффект в отношении повышения иммунного ответа у человека и увеличения соотношения отрицательные по PD-1 T-клетки/положительные по PD-1 T-клетки. Было неожиданным, что низкие дозы ингибиторов mTOR, вызывающие только частичное ингибирование активности mTOR, способны эффективно повышать иммунный ответ у человека и повышать соотношение отрицательные по PD-1 T-клетки/положительные по PD-1 T-клетки.
[00684] Альтернативно или дополнительно, без связи с какой-либо теорией полагают, что низкая усиливающая иммунитет доза ингибитора mTOR может увеличивать количества наивных T-клеток, например, по меньшей мере временно, например, по сравнению с индивидуумом без лечения. Альтернативно или дополнительно, вновь без связи с теорией полагают, что такое лечение ингибитором mTOR после достаточного периода времени или достаточного дозирования приводит к одному или нескольким из следующих:
увеличение экспрессии одного или нескольких из следующих маркеров: CD62Lhigh, CD127high, CD27+ и BCL2, например, на T-клетках памяти, например, на предшественниках T-клеток памяти;
снижение экспрессии KLRG1, например, на T-клетках памяти, например, на предшественниках T-клеток памяти; и
увеличение количества предшественников T-клеток памяти, например, клеток с одной или комбинацией следующих характеристик: увеличенный уровень CD62Lhigh, увеличенный уровень CD127high, увеличенный уровень CD27+, сниженный уровень KLRG1, и увеличенный уровень BCL2;
и где любое из описанных выше изменений происходит, например, по меньшей мере временно, например, по сравнению с индивидуумом без лечения (Araki, K et al. (2009) Nature 460:108-112). Предшественники T-клеток памяти представляют собой T-клетки памяти, которые находятся на ранней стадии программы дифференцировки. Например, T-клетки памяти имеют одну или несколько из следующих характеристику: увеличенный уровень CD62Lhigh, увеличенный уровень CD127high, увеличенный уровень CD27+, сниженный уровень KLRG1 и/или увеличенный уровень BCL2.
[00685] В одном варианте осуществления изобретение относится к композиции или дозированной форме ингибитора mTOR, например аллостерического ингибитора mTOR, например рапалога, рапамицина или RAD001, или каталитического ингибитора mTOR, которая при введении в выбранном режиме дозирования, например, один раз в сутки или один раз в неделю, ассоциирован с: уровнем ингибирования mTOR, который не ассоциирован с полной или значительной иммунной супрессией, а ассоциирован с усилением иммунного ответа.
[00686] Ингибитор mTOR, например, аллостерический ингибитор mTOR, например рапалог, рапамицин или RAD001, или каталитический ингибитор mTOR, может быть предоставлен в составе с замедленным высвобождением. Любая из композиций или единичных дозированных форм, описанных в настоящем описании, может быть предоставлена в составе с замедленным высвобождением. В некоторых вариантах осуществления состав с замедленным высвобождением имеет более низкую биодоступность, чем состав с немедленным высвобождением. Например, в вариантах осуществления для достижения сходного терапевтического эффекта с составом с немедленным высвобождением, состав с замедленным высвобождением будет иметь в от приблизительно 2 до приблизительно 5, в от приблизительно 2,5 до приблизительно 3,5, или приблизительно в 3 раза больше количества ингибитора, чем предоставлено в составе с немедленным высвобождением.
[00687] В одном варианте осуществления предусматриваются формы с немедленным высвобождением, например RAD001, как правило, используемые для одного введения в неделю, имеющие от 0,1 до 20, от 0,5 до 10, от 2,5 до 7,5, от 3 до 6 или приблизительно 5 мг на единичную дозированную форму. Для введения один раз в неделю эти составы с немедленным высвобождением соответствуют формам с замедленным высвобождением, имеющим, соответственно, от 0,3 до 60, от 1,5 до 30, от 7,5 до 22,5, от 9 до 18, или приблизительно 15 мг ингибитора mTOR, например аллостерического ингибитора mTOR, например рапамицина или RAD001. В вариантах осуществления обе формы вводят один раз в неделю.
[00688] В одном варианте осуществления предусматриваются формы с немедленным высвобождением, например формы RAD001, как правило, используемые для одного введения в сутки, имеющие от 0,005 до 1,5, от 0,01 до 1,5, от 0,1 до 1,5, от 0,2 до 1,5, от 0,3 до 1,5, от 0,4 до 1,5, от 0,5 до 1,5, от 0,6 до 1,5, от 0,7 до 1,5, от 0,8 до 1,5, от 1,0 до 1,5, от 0,3 до 0,6, или приблизительно 0,5 мг на единичную дозированную форму. Для введения один раз в сутки эти формы с немедленным высвобождением соответствуют формам с замедленным высвобождением, имеющим, соответственно, от 0,015 до 4,5, от 0,03 до 4,5, от 0,3 до 4,5, от 0,6 до 4,5, от 0,9 до 4,5, от 1,2 до 4,5, от 1,5 до 4,5, от 1,8 до 4,5, от 2,1 до 4,5, от 2,4 до 4,5, от 3,0 до 4,5, от 0,9 до 1,8, или приблизительно 1,5 мг ингибитора mTOR, например аллостерического ингибитора mTOR, например рапамицина или RAD001. Для введения один раз в неделю эти формы с немедленным высвобождением соответствуют формам с замедленным высвобождением, имеющим, соответственно, от 0,1 до 30, от 0,2 до 30, от 2 до 30, от 4 до 30, от 6 до 30, от 8 до 30, от 10 до 30, от 1,2 до 30, от 14 до 30, от 16 до 30, от 20 до 30, от 6 до 12, или приблизительно 10 мг ингибитора mTOR, например аллостерического ингибитора mTOR, например рапамицина или RAD001.
[00689] В одном варианте осуществления предусматриваются формы с немедленным высвобождением, например формы RAD001, как правило, используемые для введения один раз в сутки, имеющие от 0,01 до 1,0 мг на единичную дозированную форму. Для введения один раз в сутки эти формы с немедленным высвобождением соответствуют формам с замедленным высвобождением, имеющим, соответственно, от 0,03 до 3 мг ингибитора mTOR, например аллостерического ингибитора mTOR, например рапамицина или RAD001. Для введения один раз в неделю эти формы с немедленным высвобождением соответствуют формам с замедленным высвобождением, имеющим, соответственно, от 0,2 до 20 мг ингибитора mTOR, например аллостерического ингибитора mTOR, например рапамицина или RAD001.
[00690] В одном варианте осуществления предусматриваются формы с немедленным высвобождением, например формы RAD001, как правило, используемые для одного введения в неделю, имеющие от 0,5 до 5,0 мг на единичную дозированную форму. Для введения один раз в неделю эти формы с немедленным высвобождением соответствуют формам с замедленным высвобождением, имеющим, соответственно, от 1,5 до 15 мг ингибитора mTOR, например аллостерического ингибитора mTOR, например, рапамицина или RAD001.
[00691] Как описано выше, одной мишенью каскада mTOR является киназа P70 S6. Таким образом, дозы ингибиторов mTOR, которые являются пригодными в способах и композициях, описанных в настоящем описании, представляют собой дозы, которые являются достаточными для достижения не более чем 80% ингибирования активности киназы P70 S6 относительно активности киназы P70 S6 в отсутствие ингибитора mTOR, например, при измерении с использованием анализа, описанного в настоящем описании, например, анализа Boulay. В следующем аспекте изобретение относится к количеству ингибитора mTOR, достаточному для достижения не более чем 38% ингибирования активности киназы P70 S6 относительно активности киназы P70 S6 в отсутствие ингибитора mTOR.
[00692] В одном аспекте доза ингибитора mTOR, пригодного в способах и композициях по изобретению, является достаточной для достижения, например, при введении человеку, 90 +/- 5% (т.е., 85-95%), 89 +/- 5%, 88 +/- 5%, 87 +/- 5%, 86 +/- 5%, 85 +/- 5%, 84 +/- 5%, 83 +/- 5%, 82 +/- 5%, 81 +/- 5%, 80 +/- 5%, 79 +/- 5%, 78 +/- 5%, 77 +/- 5%, 76 +/- 5%, 75 +/- 5%, 74 +/- 5%, 73 +/- 5%, 72 +/- 5%, 71 +/- 5%, 70 +/- 5%, 69 +/- 5%, 68 +/- 5%, 67 +/- 5%, 66 +/- 5%, 65 +/- 5%, 64 +/- 5%, 63 +/- 5%, 62 +/- 5%, 61 +/- 5%, 60 +/- 5%, 59 +/- 5%, 58 +/- 5%, 57 +/- 5%, 56 +/- 5%, 55 +/- 5%, 54 +/- 5%, 54 +/- 5%, 53 +/- 5%, 52 +/- 5%, 51 +/- 5%, 50 +/- 5%, 49 +/- 5%, 48 +/- 5%, 47 +/- 5%, 46 +/- 5%, 45 +/- 5%, 44 +/- 5%, 43 +/- 5%, 42 +/- 5%, 41 +/- 5%, 40 +/- 5%, 39 +/- 5%, 38 +/- 5%, 37 +/- 5%, 36 +/- 5%, 35 +/- 5%, 34 +/- 5%, 33 +/- 5%, 32 +/- 5%, 31 +/- 5%, 30 +/- 5%, 29 +/- 5%, 28 +/- 5%, 27 +/- 5%, 26 +/- 5%, 25 +/- 5%, 24 +/- 5%, 23 +/- 5%, 22 +/- 5%, 21 +/- 5%, 20 +/- 5%, 19 +/- 5%, 18 +/- 5%, 17 +/- 5%, 16 +/- 5%, 15 +/- 5%, 14 +/- 5%, 13 +/- 5%, 12 +/- 5%, 11 +/- 5% или 10 +/- 5%, ингибирования активности киназы P70 S6, например, при измерении с использованием анализа, описанного в настоящем описании, например, анализа Boulay.
[00693] Активность киназы P70 S6 у индивидуума можно измерять с использованием способов, известных в данной области, например, согласно способам, описанным в патенте США 7727950, посредством анализа с использованием иммуноблоттинга уровней фосфо-P70 S6K и/или уровней фосфо-P70 S6 или посредством анализа киназной активности in vitro.
[00694] Как используют в рамках изобретения, термин "приблизительно" применительно к дозе ингибитора mTOR, относится к вплоть до +/-10% вариабельности количества ингибитора mTOR, однако он может включать отсутствие вариабельности указанной дозы.
[00695] В некоторых вариантах осуществления изобретение относится к способам, включающим введение индивидууму ингибитора mTOR, например аллостерического ингибитора, например RAD001, в дозировке в пределах заданного остаточного уровня. В некоторых вариантах осуществления остаточный уровень является значительно более низким, чем остаточные уровни, ассоциированные с режимами дозирования, используемыми у пациентов с трансплантатом органа и злокачественной опухолью. В одном варианте осуществления ингибитор mTOR, например RAD001 или рапамицин, вводят для достижения остаточного уровня, который составляет менее 1/2, 1/4, 1/10 или 1/20 от остаточного уровня, который приводит к иммуносупрессии или противораковому эффекту. В одном варианте осуществления ингибитор mTOR, например RAD001 или рапамицин, вводят для достижения остаточного уровня, который составляет менее 1/2, 1/4, 1/10 или 1/20 от остаточного уровня, указанного на одобренном FDA вкладыше в упаковку для применения для иммуносупрессии или противораковых показаний.
[00696] В одном варианте осуществления способ, описанный в настоящем описании, включает введение индивидууму ингибитора mTOR, например аллостерического ингибитора, например RAD001, в дозировке, которая обеспечивает заданный остаточный уровень от 0,1 до 10 нг/мл, от 0,1 до 5 нг/мл, от 0,1 до 3 нг/мл, от 0,1 до 2 нг/мл или от 0,1 до 1 нг/мл.
[00697] В одном варианте осуществления способ, описанный в настоящем описании, включает введение индивидууму ингибитора mTOR, например аллостерического ингибитора, например RAD001, в дозировке, которая обеспечивает заданный остаточный уровень от 0,2 до 10 нг/мл, от 0,2 до 5 нг/мл, от 0,2 до 3 нг/мл, от 0,2 до 2 нг/мл или от 0,2 до 1 нг/мл.
[00698] В одном варианте осуществления способ, описанный в настоящем описании, включает введение индивидууму ингибитора mTOR, например аллостерического ингибитора, например RAD001, в дозировке, которая обеспечивает заданный остаточный уровень от 0,3 до 10 нг/мл, от 0,3 до 5 нг/мл, от 0,3 до 3 нг/мл, от 0,3 до 2 нг/мл или от 0,3 до 1 нг/мл.
[00699] В одном варианте осуществления способ, описанный в настоящем описании, включает введение индивидууму ингибитора mTOR, например аллостерического ингибитора, например RAD001, в дозировке, которая обеспечивает заданный остаточный уровень от 0,4 до 10 нг/мл, от 0,4 до 5 нг/мл, от 0,4 до 3 нг/мл, от 0,4 до 2 нг/мл или от 0,4 до 1 нг/мл.
[00700] В одном варианте осуществления способ, описанный в настоящем описании, включает введение индивидууму ингибитора mTOR, например аллостерического ингибитора, например RAD001, в дозировке, которая обеспечивает заданный остаточный уровень от 0,5 до 10 нг/мл, от 0,5 до 5 нг/мл, от 0,5 до 3 нг/мл, от 0,5 до 2 нг/мл или от 0,5 до 1 нг/мл.
[00701] В одном варианте осуществления способ, описанный в настоящем описании, включает введение индивидууму ингибитора mTOR, например аллостерического ингибитора, например RAD001, в дозировке, которая обеспечивает заданный остаточный уровень от 1 до 10 нг/мл, от 1 до 5 нг/мл, от 1 до 3 нг/мл или от 1 до 2 нг/мл.
[00702] Как используют в рамках изобретения, термин "остаточный уровень" относится к концентрации лекарственного средства в плазме непосредственно перед следующей дозой или минимальную концентрацию лекарственного средства между двумя дозами.
[00703] В некоторых вариантах осуществления заданный остаточный уровень RAD001 находится в диапазоне приблизительно от 0,1 до 4,9 нг/мл. В одном варианте осуществления заданный остаточный уровень составляет менее 3 нг/мл, например, составляет менее 0,3 или менее 3 нг/мл. В одном варианте осуществления заданный остаточный уровень составляет менее 3 нг/мл, например, составляет приблизительно от 0,3 или менее до 1 нг/мл.
[00704] В следующем аспекте в рамках изобретения может использоваться ингибитор mTOR, отличный от RAD001, в количестве, которое ассоциировано с заданным остаточным уровнем, который является биологически эквивалентным указанному заданному остаточному уровню для RAD001. В одном варианте осуществления заданный остаточный уровень для ингибитора mTOR, отличного от RAD001, представляет собой уровень, который обеспечивает тот же уровень ингибирования mTOR (например, при измерении способом, описанным в настоящем описании, например, ингибирование P70 S6-киназы), что и остаточный уровень RAD001, описанный в настоящем описании.
Фармацевтические композиции: ингибиторы mTOR
[00705] В одном аспекте настоящее изобретение относится к фармацевтическим композициям, содержащим ингибитор mTOR, например ингибитор mTOR, как описано в настоящем описании, составленный для применения в комбинации с клетками CAR, описанными в настоящем описании.
[00706] В некоторых вариантах осуществления ингибитор mTOR составляют для введения в комбинации с дополнительным средством, например, как описано в настоящем описании.
[00707] Главным образом, соединения по изобретению можно вводить в терапевтически эффективных количествах, как описано выше, любыми обычными и приемлемыми способами, известными в данной области, либо по отдельности, либо в комбинации с одним или несколькими лекарственными средствами.
[00708] Фармацевтические составы можно получать с использованием общепринятых методик растворения и смешения. Например, нерасфасованное лекарственное вещество (например, ингибитор mTOR или стабилизированная форма соединения (например, комплекс с производным циклодекстрина или другим известным комплексообразующим средством)) растворяют в подходящем растворителе в присутствии одного или нескольких эксципиентов, описанных в настоящем описании. Ингибитор mTOR, как правило, составляют в виде фармацевтических дозированных форм для обеспечения легко контролирования дозирования лекарственного средства и для предоставления пациенту удобного и легко используемого продукта.
[00709] Соединения по изобретению можно вводить в качестве фармацевтических композиций обычным путем, в частности, энтерально, например перорально, например, в форме таблеток или капсул, или парентерально, например, в форме инъекционных растворов или суспензий, местно, например, в форме лосьонов, гелей, мазей или кремов, или в назальной форме или в форме суппозитория. Когда ингибитор mTOR вводят в комбинации с (либо одновременно, либо отдельно) другим средством, как описано в настоящем описании, в одном аспекте оба компонента можно вводить одним и тем же путем (например, парентерально). Альтернативно другое средство можно вводить отличающимся путем относительно пути введения ингибитора mTOR. Например, ингибитор mTOR можно вводить перорально, а другое средство можно вводить парентерально.
ЗАМЕДЛЕННОЕ ВЫСВОБОЖДЕНИЕ
[00710] Ингибиторы mTOR, например, аллостерические ингибиторы mTOR или каталитические ингибиторы mTOR, описанные в настоящем описании, могут быть предоставлены в качестве фармацевтических составов в форме пероральных твердых дозированных форм, содержащих ингибитор mTOR, описанный в настоящем описании, например рапамицин или RAD001, которые удовлетворяют требованиям стабильности продукта и/или имеют благоприятные фармакокинетические свойства относительно таблеток с немедленным высвобождением (IR), такие как сниженные средние пиковые концентрации в плазме, сниженная вариабельность между пациентами и у одного пациента в отношении степени всасывания лекарственного средства и максимальной концентрации в плазме, сниженное соотношение Cmax/Cmin и/или сниженные эффекты питания. Предоставленные фармацевтические составы могут позволить более точный подбор дозы и/или снижение частоты неблагоприятных явлений, таким образом, обеспечивая более безопасное лечение пациентов ингибитором mTOR, описанным в настоящем описании, например рапамицином или RAD001.
[00711] В некоторых вариантах осуществления настоящее изобретение относится к стабильным составам с пролонгированным высвобождением ингибитора mTOR, описанного в настоящем описании, например рапамицина или RAD001, которые представляют собой системы из множества частиц и могут иметь функциональные слои и покрытия.
[00712] Термин "состав с множеством частиц с пролонгированным высвобождением", как используют в рамках изобретения, относится к составу, который обеспечивает высвобождение ингибитора mTOR, описанного в настоящем описании, например рапамицина или RAD001, в течение пролонгированного периода времени, например, в течение по меньшей мере 1, 2, 3, 4, 5 или 6 часов. Состав с пролонгированным высвобождением может содержать матрицы и покрытия из специальных эксципиентов, например, как описано в настоящем описании, которые составлены так, чтобы активный ингредиент был доступным на протяжении пролонгированного периода времени после приема.
[00713] Термин "пролонгированное высвобождение" может быть использован взаимозаменяемо с терминами "замедленное высвобождение" (SR) или "продленное высвобождение". Термин "пролонгированное высвобождение" относится к фармацевтическому составу, который не высвобождает активное вещество сразу после перорального приема, а высвобождает его в течение пролонгированного периода времени в соответствии с определением в статье фармакопеи Ph. Eur. (7-ое издание) о таблетках и капсулах и общей главе USP <1151> о фармацевтических дозированных формах. Термин "немедленное высвобождение" (IR), как используют в рамках изобретения, относится к фармацевтическому составу, который высвобождает 85% активного лекарственного вещества в течение менее чем 60 минут в соответствии с определением "Guidance for Industry: "Dissolution Testing of Immediate Release Solid Oral Dosage Forms" (FDA CDER, 1997). В некоторых вариантах осуществления термин "немедленное высвобождение" означает высвобождение эверолимуса из таблеток в пределах 30 минут, например, при измерении в анализе растворения, описанном в настоящем описании.
[00714] Стабильные составы с пролонгированным высвобождением ингибитора mTOR, описанного в настоящем описании, например рапамицина или RAD001, могут быть охарактеризованы посредством профиля высвобождения in vitro с использованием анализов, известных в данной области, таких как анализ растворения, как описано в настоящем описании: емкость для растворения заполняют 900 мл фосфатного буфера, pH 6,8, содержащего додецилсульфат натрия 0,2% при 37°C, и растворение проводят с использованием способ с использованием лопастной мешалки при 75 об/мин в соответствии с USP согласно статье USP о тестировании 711, и статье Ph.Eur. о тестировании 2.9.3, соответственно.
[00715] В некоторых вариантах осуществления стабильные составы с пролонгированным высвобождением ингибитора mTOR, описанного в настоящем описании, например рапамицина или RAD001, высвобождают ингибитор mTOR в анализе высвобождения in vitro в соответствии со следующими характеристиками высвобождения:
0,5 ч: <45%, или <40, например <30%
1 ч: 20-80%, например 30-60%
2 ч: >50%, или >70%, например >75%
3 ч: >60%, или >65%, например >85%, например >90%.
[00716] В некоторых вариантах осуществления стабильные составы с пролонгированным высвобождением ингибитора mTOR, описанного в настоящем описании, например, рапамицина или RAD001, высвобождают 50% ингибитора mTOR не ранее чем в течение 45, 60, 75, 90, 105 мин или 120 мин в анализе растворения in vitro.
Способы доставки посредством биополимеров
[00717] В некоторых вариантах осуществления одну или несколько CAR-экспрессирующих клеток, как описано в настоящем описании, необязательно в комбинации с ингибитором киназы, например, ингибитором BTK, таким как ибрутиниб, можно вводить или доставлять индивидууму через биополимерный каркас, например, биополимерный имплантат. Биополимерные каркасы могут способствовать или усиливать доставку, экспансию и/или распределение CAR-экспрессирующих клеток, описанных в настоящем описании. Биополимерный каркас содержит биосовместимый (например, по существу не индуцирует воспалительный или иммунный ответ) и/или биодеградируемый полимер, который может быть встречающимся в природе или синтетическим.
[00718] Примеры подходящих биополимеров включают, но не ограничиваются ими, агар, агарозу, альгинат, альгинат/кальций-фосфатный цемент (CPC), бета-галактозидазу (β-GAL), (1,2,3,4,6-пентаацетил a-D-галактоза), целлюлозу, хитин, хитозан, коллаген, эластин, желатин, гиалуроновую кислоту, коллаген, гидроксиапатит, сополимер 3-гидроксибутирата и 3-гидроксигексаноата) (PHBHHx), полилактид, поликапролактон (PCL), сополимер лактида и гликолида (PLG), полиэтиленоксид (PEO), сополимер молочной и гликолевой кислот (PLGA), полипропиленоксид (PPO), поливиниловый спирт (PVA), шелк, соевый белок и изолят соевого белка, отдельно или в комбинации с любой другой полимерной композицией, в любой концентрации и в любом соотношении. Биополимер может быть усилен или модифицирован молекулами, усиливающими адгезию или миграцию, например, пептидами-миметиками коллагена, которые связываются с рецептором коллагена на лимфоцитах, и/или стимулирующие молекулы для повышения доставки, экспансии или функции, например, противоопухолевой активности, клеток, подлежащих доставке. Биополимерный каркас может быть поддающимся инъекции, например, в виде геля или полутвердого вещества, или он может представлять собой твердую композицию.
[00719] В некоторых вариантах осуществления CAR-экспрессирующие клетки, описанные в настоящем описании, высевают на биополимерный каркас перед доставкой индивидууму. В вариантах осуществления биополимерный каркас, кроме того, содержит одно или несколько дополнительных лекарственных средств, описанных в настоящем описании (например, другая CAR-экспрессирующая клетка, антитело или низкомолекулярное соединение), или средств, которые усиливают активность CAR-экспрессирующей клетки, например, включенных или конъюгированных с биополимерами каркаса. В вариантах осуществления биополимерный каркас инъецируют, например, внутрь опухоли, или хирургически имплантируют в опухоль или достаточно близко к опухоли, чтобы опосредовать противоопухолевый эффект. Дополнительные примеры биополимерных композиций и способов их доставки описаны в Stephan et al., Nature Biotechnology, 2015, 33:97-101; и WO2014/110591.
[00720]
Фармацевтические композиции и способы лечения
[00721] Фармацевтические композиции по настоящему изобретению могут содержать экспрессирующую CAR клетку, например, множество экспрессирующих CAR клеток, как описано в настоящем описании, в комбинации с одним или несколькими фармацевтически или физиологически приемлемыми носителями, разбавителями или эксципиентами. Такие композиции могут содержать буферы, такие как нейтральный забуференный физиологический раствор, фосфатно-солевой буфер и т.п.; углеводы, такие как глюкоза, манноза, сахароза или декстраны, маннит; белки; полипептиды или аминокислоты, такие как глицин; антиоксиданты; хелатирующие агенты, такие как EDTA или глутатион; адъюванты (например, гидроксид алюминия) и консерванты. В одном аспекте композиции по настоящему изобретению составляют для внутривенного введения.
[00722] Фармацевтические композиции по настоящему изобретению можно вводить способом, пригодным для заболевания, подлежащего лечению (или предупреждению). Количество и частота введений будут определяться такими факторами, как состояние пациента и тип и тяжесть заболевания пациента, хотя подходящие дозировки могут быть определены в клинических испытаниях.
[00723] В одном варианте осуществления фармацевтическая композиция по существу свободна от примесей, например, отсутствуют поддающиеся обнаружению уровни примесей, например, выбранных из группы, состоящей из эндотоксина, микоплазмы, компетентного по репликации лентивируса (RCL), p24, нуклеиновой кислоты VSV-G, gag ВИЧ, остаточных гранул, покрытых антителом против CD3/антителом против CD28, антител мыши, объединенной сыворотки человека, бычьего сывороточного альбумина, бычьей сыворотки, компонентов культуральной среды, клетки для упаковывания вектора или плазмидных компонентов, бактерий и грибов. В одном варианте осуществления бактерия представляет собой по меньшей мере одну бактерию, выбранную из группы, состоящей из Alcaligenes faecalis, Candida albicans, Escherichia coli, Haemophilus influenza, Neisseria meningitides, Pseudomonas aeruginosa, Staphylococcus aureus, Streptococcus pneumoniae и Streptococcus pyogenes группы A.
[00724] Когда указано "иммунологически эффективное количество", "эффективное против опухоли количество", "ингибирующее опухоль эффективное количество" или "терапевтическое количество" точное количество композиций по настоящему изобретению, подлежащее введению, может определять врач с учетом индивидуальных отличий возраста, массы тела, размера опухоли, степени инфекции или метастазирования, и состояния пациента (индивидуума). Как правило, можно утверждать, что фармацевтическую композицию, содержащую T-клетки, описанные в настоящем описании, можно вводить в дозировке от 104 до 109 клеток/кг массы тела, в некоторых случаях от 105 до 106 клеток/кг массы тела, включая все целые числа в этих диапазонах. Композиции T-клеток также можно вводить многократно в этих дозировках. Клетки можно вводить с использованием способов инфузии, которые хорошо известны при иммунотерапии (см., например, Rosenberg et al., New Eng. J. of Med. 319:1676, 1988).
[00725] В некоторых аспектах может быть желательным введение активированных T-клеток индивидууму, а затем впоследствии повторное взятие крови (или проведение афереза), активация T-клеток из нее в соответствии с настоящим изобретением, и повторная инфузия пациенту активированных и увеличенных в количестве T-клеток. Этот процесс можно проводить многократно каждые несколько недель. В некоторых аспектах T-клетки можно активировать из взятой крови в объеме от 10 см3 до 400 см3. В некоторых аспектах T-клетки активируют из взятой крови в объеме 20 см3, 30 см3, 40 см3, 50 см3, 60 см3, 70 см3, 80 см3, 90 см3 или 100 см3.
[00726] Введение рассматриваемых композиций можно проводить любым удобным способом, включая ингаляцию аэрозоля, инъекцию, прием внутрь, трансфузию, имплантацию или трансплантацию. Композиции, описанные в настоящем описании, можно вводить пациенту трансартериально, подкожно, внутрикожно, внутрь опухоли, внутрь лимфоузла, внутрь костного мозга, внутримышечно, посредством внутривенной (в/в) инъекции или внутрибрюшинно. В одном аспекте композиции T-клеток по настоящему изобретению вводят пациенту посредством внутрикожной или подкожной инъекции. В одном аспекте композиции T-клеток по настоящему изобретению вводят посредством в/в инъекции. Композиции иммунных T-клеток можно инъецировать прямо в опухоль, лимфатический узел или в область инфекции.
[00727] В конкретном иллюстративном аспекте индивидуумов можно подвергать лейкоаферезу, где лейкоциты собирают, увеличивают в количестве или истощают ex vivo для селекции и/или выделения представляющих интерес клеток, например, T-клеток. Эти выделенные T-клетки можно увеличивать в количестве способами, известными в данной области, и обрабатывать так, чтобы можно было вводить одну или несколько конструкций CAR, тем самым, создавая CAR T-клетку по изобретению. Индивидуумов, нуждающихся в этом, можно впоследствии подвергать стандартному лечению химиотерапией в высокой дозе с последующей трансплантацией стволовых клеток периферической крови. В некоторых аспектах после или одновременно с трансплантацией индивидуумам проводят инфузию увеличенных в количестве CAR T-клеток по настоящему изобретению. В дополнительном аспекте увеличенные в количестве клетки вводят до или после хирургической операции.
[00728] Дозировка описанных выше лекарственных средств, подлежащая введению пациенту, варьируется в зависимости от точной природы состояния, подвергаемого лечению, и реципиента лечения. Увеличение дозировок в масштабе для введения человеку можно проводить в соответствии с принятой в данной области практикой. Доза CAMPATH, например, как правило, находится в диапазоне от 1 до приблизительно 100 мг для взрослого пациента, обычно вводимых в течение периода от 1 до 30 суток. Предпочтительная суточная доза составляет от 1 до 10 мг в сутки, хотя в некоторых случаях можно использовать более высокие дозы вплоть до 40 мг в сутки (как описано в патенте США № 6120766).
[00729] В одном варианте осуществления CAR вводят в T-клетки, например, с использованием транскрипции in vitro, и индивидууму (например, человеку) проводят первоначальное введение CART-клеток по изобретению, и одно или несколько последующих введений CART-клеток по изобретению, где одно или несколько последующих введений проводят в течение менее чем 15 суток, например 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 суток, после предшествующего введения. В одном варианте осуществления индивидууму (например, человеку) проводят более одного введения CART-клеток по изобретению в неделю, например проводят 2, 3 или 4 введений CART-клеток по изобретению в неделю. В одном варианте осуществления индивидууму (например, человек) проводят более одного введения CART-клеток в неделю (например, 2, 3 или 4 введений в неделю) (также называемых в настоящем описании курсом), за которыми следует неделя без введения CART-клеток, а затем индивидууму проводят одно или несколько дополнительных введений CART-клеток (например, более одного введения CART-клеток в неделю). В другом варианте осуществления у индивидуума (например, человеку) проводят более одного курса введения CART-клеток, и время между курсами в каждом случае составляет менее 10, 9, 8, 7, 6, 5, 4 или 3 суток. В одном варианте осуществления CART-клетки вводят раз в двое суток на протяжении 3 введений в неделю. В одном варианте осуществления CART-клетки по изобретению вводят в течение по меньшей мере двух, трех, четырех, пяти, шести, семи, восьми или более недель.
[00730] В одном аспекте CAR-экспрессирующие клетки, получают с использованием вирусных векторов, таких как лентивирус. Клетки, такие как CART, полученные таким образом, будут иметь стабильную экспрессию CAR.
[00731] В одном аспекте CAR-экспрессирующие клетки, например, CART, получают с использованием вирусного вектора, такого как гамма-ретровирусный вектор, например, гамма-ретровирусный вектор, описанный в настоящем описании. CART, полученные с использованием этих векторов, могут иметь стабильную экспрессию CAR.
[00732] В одном аспекте CART временно экспрессируют векторы CAR в течение 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 суток после трансдукции. Временной экспрессии CAR можно достигать посредством доставки РНК-вектора с CAR. В одном аспекте РНК CAR трансдуцируют в T-клетку посредством электропорации.
[00733] Потенциальной проблемой, которая может возникать у пациентов, подвергаемых лечению с использованием CART-клеток с временной экспрессией (в частности, CART, содержащих scFv мыши), является анафилаксия после многократных введений.
[00734] Без связи с теорией, полагают, что такой анафилактический ответ может быть вызван развитием у пациента гуморального ответа против CAR, т.е. антител против CAR, имеющих анти-IgE изотип. Считается, что антителопродуцирующие клетки пациента претерпевают переключение класса с изотипа IgG (который не вызывает анафилаксию) на изотип IgE, когда существует период перерыва в воздействии антигена, составляющий от десяти до четырнадцати суток.
[00735] Если пациент имеет высокий риск индукции антительного ответа против CAR в ходе временной терапии с использованием CAR (такой как терапия, осуществляемая посредством трансдукции РНК), перерывы между инфузиями CART не должны длиться более чем от десяти до четырнадцати суток.
ПРИМЕРЫ
[00736] Далее изобретение подробно описано с помощью следующих экспериментальных примеров. Эти примеры предоставлены только для целей иллюстрации и не подразумевается, что они являются ограничивающими, если нет иных указаний. Таким образом, изобретение никоим образом не следует истолковывать как ограниченное следующими примерами, а скорее его следует истолковывать как охватывающее любые и все вариации, которые станут очевидными благодаря указаниям, представленным в настоящем описании.
[00737] Без дальнейшего описания полагают, что специалист в данной области может с использованием предшествующего описания и следующих ниже иллюстративных примеров получать и использовать соединения по настоящему изобретению и применять на практике заявленные способы. Представленные ниже рабочие примеры конкретно указывают на различные аспекты настоящего изобретения, и их не следует считать ограничивающими каким-либо образом остальную часть описания.
Пример 1: Гуманизация антитела мыши против CD19
[00738] Молекула антитела против CD19 может представлять собой, например, молекулу антитела (например, гуманизированная молекула антитела против CD19), описанную в WO2014/153270, которая включена в настоящее описание в качестве ссылки в полном объеме. Гуманизация антитела мыши против CD19 является желательной для клинических условий, в которых специфические остатки мыши могут индуцировать ответ человека против антигена мыши (HAMA) у пациентов, которым проводят лечение CART19, т.е. лечение T-клетками, трансдуцированными конструкцией CAR19. Последовательности VH и VL происходящего из гибридомы антитела мыши против CD19 были взяты из опубликованной литературы (Nicholson et al, 1997, выше). Гуманизацию проводили путем пересадки областей CDR из антитела мыши против CD19 в акцепторные каркасные области человека эмбрионального типа VH4_4-59 и VK3_L25 (база данных vBASE). В дополнение к областям CDR пять каркасных остатков, т.е. VH #71, #73, #78 и VL #71 #87, предположительно поддерживающих структурную целостность областей CDR, сохраняли из последовательности мыши. Кроме того, J-элементы JH4 и JK2 человека использовали для тяжелой и легкой цепей, соответственно. Полученные аминокислотные последовательности гуманизированного антитела были обозначены как FMC63_VL_hz и FMC63_VH_hz1, соответственно, и они также представлены ниже в таблице 1. Нумерация остатков соответствует Kabat (Kabat E.A. et al, 1991, выше). Для определений CDR использовали как Kabat, так и Chothia et al, 1987, выше). Остатки, происходящие из антитела мыши против CD19, представлены полужирным шрифтом/курсивом. Положения #60/61/62, заключенные в рамку, являются потенциальным участком для посттрансляционной модификации (PTM) в CDR H2, также называемой HCDR2.
Таблица 1: Аминокислотные последовательности гуманизированных вариабельных доменов антитела против CD19 (SEQ ID NO: 114-117, соответственно, в порядке встречаемости).
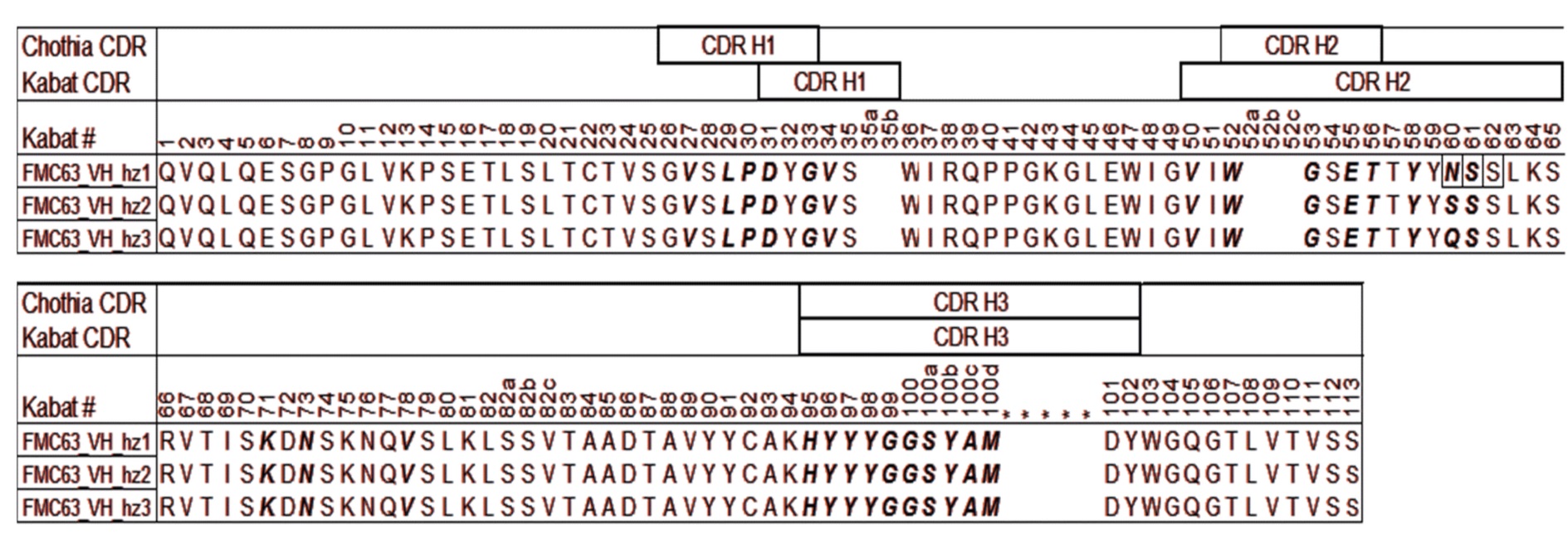
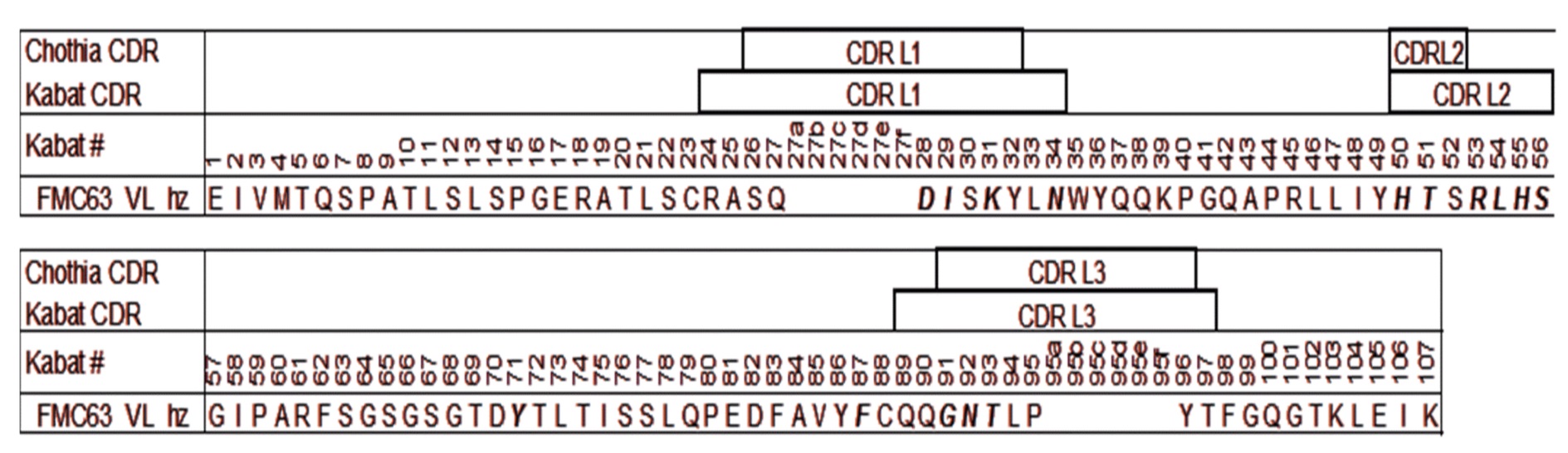
[00739] Эти гуманизированные IgG против CD19 использовали для получения растворимых scFv для исследования экспрессии и scFv для полных конструкций CART против CD19 (см. Примеры ниже). Интерес представляет то, что в ходе гуманизации в положении 62 области CDRH2 является предпочтительным остаток серина, а не остаток аланина, присутствующий в CDRH2 мыши. Последовательность мыши лишена посттрансляционной модификации (PTM) и имеет аспарагин-серин-аланин в положениях 60/61/62, соответственно, в CDRH2. Это создает потенциальные мотивы PTM (указанные в качестве заключенного в рамку участка в CDRH2) в процессе гуманизации. Проводили исследование того, действительно ли участок PTM, полученный в процессе гуманизации, является "истинным" участком PTM, или только теоретическим. Было предположено, что аминокислотный мотив аспарагина, за которым следует серин (NS), может быть подвержен посттрансляционной дезамидации, но не чему-либо, что было хорошо заметным. Было также предположено, что аспарагин, за которым следует любая аминокислота, за исключением пролина, а затем следует серин (NxS, x≠P), может быть подвержен посттрансляционному N-гликозилированию. Для проверки этой гипотезы были получены два варианта IgG, в которых в аспарагин в положении 60 (о котором известно, что он является участком гликозилирования) внесена мутация на серин или глутамин, и обозначены как FMC63_VH_hz2 (N60S) и FMC63_VH_hz2 (N60Q), соответственно. Эти конструкции получали для устранения какого-либо потенциального участка посттрансляционной модификации (PTM) и исследования сохранения активности (cм. Пример 2, ниже).
Клонирование:
[00740] Последовательности ДНК, кодирующие домены VL и VH мыши и гуманизированные домены VL и VH, получали, и кодоны конструкций оптимизировали для экспрессии в клетках Homo sapiens.
[00741] Последовательности, кодирующие домены VL и VH, субклонировали из клонирующих векторов в экспрессирующие векторы, подходящие для секреции в клетках млекопитающих. Тяжелые и легкие цепи клонировали в индивидуальные экспрессирующие векторы, чтобы обеспечить сотрансфекцию. Элементы экспрессирующего вектора включают промотор (энхансер-промотор цитомегаловируса (CMV)), сигнальную последовательность для облегчения секреции, сигнал полиаденилирования и терминатор транскрипции (ген бычьего гормона роста (BGH)), элемент, позволяющий эписомальную репликацию и репликацию у прокариот (например, ориджин SV40 и ColE1 или другие, известные в данной области), и элементы, позволяющие селекцию (ген устойчивости к ампициллину и маркер зеоцина).
Экспрессия:
[00742] Химерные и гуманизированные IgG-кандидаты экспрессировали в клетках млекопитающих HEK293F в масштабе 1 мл. Очищенные супернатанты использовали для исследований связывания FACS. Точнее, клетки HEK293F разбавляли до 5E5 клеток/мл в среде FreeStyle, дополненной Pen/Strep, и 1 мл переносили в 24-ячеечный круглодонный планшет с глубокими ячейками. 0,5 мкг плазмиды для экспрессии у млекопитающих легкой цепи и 0,5 мкг плазмиды для экспрессии у млекопитающих тяжелой цепи разбавляли одной и той же средой вместе с 4 мкл FuGENE HD (Roche REF 04709705001). После инкубации в течение 15 мин при к.т., к клеткам капельно добавляли смесь ДНК/Fugene, и помещали их в инкубатор с 5% CO2 при 250 об/мин, 37°C на пять суток. Затем супернатант отделяли от клеток центрифугированием. Для измерения содержания IgG, аликвоты объемом 200 мкл помещали в лунки 96-луночных микропланшетов для титрования. Все образцы и стандарты измеряли в двух экземплярах с использованием биосенсоров Protein A Dip and Read (Fortebio, каталожный номер № 18-5010). Планшет помещали в устройство Octet (ForteBio) и позволяли ему уравновеситься до 27°C в камере с термостатом. Данные обрабатывали автоматически с использованием программного обеспечения Octet User Software версии 3.0, и концентрацию определяли путем сравнения стандартной кривой IgG.
Анализ связывания с использованием FACS:
[00743] Гуманизированные и химерные антитела оценивали с использованием проточно-цитометрического анализа связывания с использованием клеточной линии 300.19-hsCD19FL. Эту клеточную линию получали путем трансфекции линии пре-B клеток мыши 300.19 вектором (hCD19 FL/pEF4-myc-His A), кодирующим последовательность полноразмерного CD19 человека и природный промотор, а также ген устойчивости к зеоцину. В кратком изложении, клетки 300.19 подвергали электропорации посредством линеаризованной плазмиды, а затем клетки, экспрессирующие высокие уровни hsCD19, идентифицировали с использованием конъюгированного с APC Ab против CD19 человека (клон HIB19 из BD 555415), а затем сортировали с использованием проточного цитометра FACS Aria. Отсортированные hsCD19+-клетки культивировали, и было подтверждено, что они экспрессируют высокие уровни hsCD19.
[00744] Анализ связывания можно проводить непосредственно с использованием бессывороточной культуральной среды, содержащей экспрессируемый IgG. Все оцененные IgG доводили до одинаковой концентрации (85 нМ), а затем разбавляли посредством 3-кратных серийных разведений до 1,4 пМ. Затем в 96-луночном планшете аликвоты по 5×105 клеток/лунка инкубировали в течение 30 мин при 4°C с разбавленными IgG. Клетки промывали два раза буфером для FACS (0,5% BSA в PBS) перед добавлением антитела для обнаружения, конъюгированного с APC антитела козы против hu IgG, специфичного к Fc-фрагменту (Dianova #109-136-098), разбавленного 1:1000 в буфере для FACS. Клетки инкубировали в течение дополнительных 30 мин при 4°C, а затем промывали два раза буфером для FACS и анализировали с использованием FACS Calibur (BD Bioscience). Построение кривых связывания (медиана интенсивности флуоресценции против концентрации IgG) и определение EC50 проводили с использованием программного обеспечения GraphPad PrismTM 3.0 c нелинейным регрессионным анализом, сигмовидным ответом на дозу (переменный наклон).
[00745] FACS-анализ демонстрирует, что кажущееся связывание для всех оцениваемых IgG может широко варьироваться, причем некоторые конструкции проявляют 5-10-кратный сдвиг EC50 в качестве IgG относительно scFv. Исходя из величин EC50 выбраны лидирующие кандидаты, которые обладают аффинностью связывания, имеющей коэффициент 2 или более по сравнению с химерным эталоном.
Пример 2: Охарктеризация растворимых фрагментов scFv против CD19, происходящих из гуманизированных IgG-антител против CD19
[00746] Растворимые фрагменты scFv получали из гуманизиованных IgG против CD19, описанных в примере 1, с использованием стандартных способов молекулярной биологии. Эти растворимые scFv использовали в исследованиях для охарактеризации стабильности, экспрессии на клеточной поверхности и связывающих свойств scFv. Кроме того, также проводили эксперименты для исследования влияния потенциального PTM, внесенного в процессе модификации.
Экспрессия и очистка scFv
[00747] Для трансфекции каждой конструкции scFv приблизительно 3e8 клеток 293F трансфицировали посредством 100 мкг плазмиды с использованием PEI в качестве реагента для трансфекции в соотношении 3:1 (PEI:ДНК). Клетки выращивали в 100 мл среды для экспрессии EXPi293 (Invitrogen) во вращающихся флаконах при 37°C, 125 об./мин., 8% CO2. Культуру собирали через шесть суток и использовали для очистки белка.
[00748] Клетки 293F собирали посредством центрифугирования при 3500g в течение 20 минут. Супернатант собирали и фильтровали через фильтрационный элемент VacuCap90 PF (с 0,8/0,2-мкм Super Мембрана, PALL). К супернатанту добавляли 400 мкл агарозных гранул Ni-NTA (Qiagen). Смесь центрифугировали и инкубировали в течение 4 ч при 4°C. Также ее наносили на колонку для очистки и промывали промывочным буфером с 20 мМ гистидином. Белок элюировали 500 мкл буфера для элюирования с 300 мМ гистидином. Образцы подвергали диализу против буфера PBS при 4C в течение ночи. Количественное определение в образцах белка проводили с использованием Nanodrop 2000c.
Анализ конформации и коллоидной стабильности scFv
[00749] Термостабильность scFv определяли с использованием DSF: 10-20 мкл образца белка смешать с красителем Sypro Orange (Invitrogen, каталожный номер № #S6650) в конечном разведении 1:1000 в общем объеме 25 мкл в PBS, анализировать на BioRad CFX1000 (25°C в течение 2 мин, затем увеличение на 0,5°C в течение 30 секунд, от 25 до 95°C).
[00750] Для аналитического эксперимента SEC, приблизительно 15-20 мкг образца белка scFv в 20 мкл PBS инжектировали в TSKgel Super SW2000 при скорости потока 0,3 мл/мин на Agilent серии 1100.
EC50 с использованием связывания в FACS
[00751] Линию клеток мыши 300.CD19 выращивали в RPMI 1640 с 0,5 мг/мл зеоцина. Приблизительно 5e5 клеток/лунка переносили в 96-луночный планшет BD Falcon. Клетки осаждали центрифугированием при 900 об/мин (центрифуга Sorval Legend XT) в течение 3 минут. Супернатант удаляли. Образцы белка scFv против CD19 разбавляли DPBS с 5% FBS. Образцы добавляли в лунки, смешивали с клетками и инкубировали в течение 1 часа. Клетки промывали два раза в DPBS с 5% FBS. Клетки инкубировали с антителом против поли-His PE (R&D) в течение 1 часа, промывали два раза перед анализом FACS (LSRII от BD Biosciences).
Анализ кинетики с использованием Proteon
[00752] Кинетику определяли с использованием Bio-Rad Proteon. Иммобилизацию проводили с использованием стандартного присоединения аминов на сенсорном чипе GLC. Образцы scFv разбавляли до 0,03 мг/мл в ацетате, pH 4,5, и наносили на чип при скорости потока 30 мкл/мин в течение 300 секунд. Затем лиганд CD19 подвергали серийному разведению в PBS-Tween и инжектировали при скорости потока 50 мкл/мин в течение 120 секунд с временем диссоциации 480 секунд. Поверхность чипа регенерировали глицином, pH 2,5. Данные аппроксимировали с использованием модели Ленгмюра 1:1.
Поверхностная экспрессия конструкций CART19 и окрашивание с использованием FACS
[00753] Суспензионные клетки HEK293F, временно трансфицированные различными CART против hCD19, собирали через 2 суток после трансфекции. Приблизительно 1e6 клеток помещали в каждую лунку V-образного 96-луночного планшета (Greiner Bio-One, Германия) и промывали три раза 0,2 мл буфера для FACS (1×PBS, содержащий 4% бычий сывороточный альбумин (BSA) (фракция V BSA, Roche Diagnostics, Indianapolis, IN). Клетки ресуспендировали в 0,2 мл буфера для FCAS либо с 0,2 мкг биотинилированного белка L (GenScript, Piscataway, NJ), либо с 100 нМ hCD19(а.к. 1-29)-hIgG1 Fc (изготовлен в NIBRI) и инкубировали при 4°C в течение 30 минут. Затем клетки промывали 0,2 мл буфера FACS три раза и инкубировали с 1 мкл стрептавидина-Alexa Fluor 488 (Life Technologies, Grand Island, NY) в 0,2 мл буфера FACS для образцов с белком L, или 2 мкл антител против Fcγ человека с PE (Jackson ImmunoResearch Laboratories, West Grove, PA) в 0,2 мл буфера FACS для образцов с hCD19-hIgG1 Fc в течение 30 минут при 4°C в темноте. После промывания 0,2 мл буфера FACS три раза клетки анализировали на устройстве LSRII (BD Biosciences, San Jose, CA) с использованием программного обеспечения FACSDiva software (BD Biosciences, San Jose, CA). Иммунофлуоресцентное окрашивание анализировали в качестве относительной логарифмической флуоресценции живых клеток, и измеряли процент положительных по Alexa Fluor 488 или положительных по PE клеток.
Анализ потенциальных PMT, полученных в процессе гуманизации
[00754] Интерес представляло то, что в процессе гуманизации в положении 62 области CDRH2 предпочтительным является остаток серина, а не остаток аланина, присутствующий в CDRH2 мыши, как описано в примере 1. Проводили исследование того, действительно ли участок PTM, полученный в ходе процесса гуманизации, является "истинным" участком PTM, или только теоретическим. Получали два варианта IgG, в которых аспарагин в положении 60 (о котором известно, что он является участком гликозилирования) заменяли на серин или глутамин, и они были обозначены как FMC63_VH_hz2 (N60S) и FMC63_VH_hz2 (N60Q), соответственно. Эти конструкции получали для устранения потенциального участка посттрансляционной модификации (PTM) и исследования сохранения активности.
Результаты
[00755] Гуманизированные scFv и scFv мыши против CD19 экспрессировали в клетках 293F и очищали с использованием His-метки. Экспрессия и выход всех гуманизированных scFv были значительно более высокими, чем экспрессия и выход исходного scFv мыши (данные не представлены).
[00756] Для подтверждения идентичности и оценки целостности конструкции scFV анализируют после инкубации с N-гликаназой F (PNG-аза F) или без нее, посредством высокоэффективной жидкостной хроматографии масс-спектрометрии (ВЭЖХ-MS) (см. фиг.3) и SDS-PAGE (данные не представлены). PNG-аза F является специфическим ферментом для удаления N-связанных структур гликанов из консенсусной последовательности N-X-S/T/C, где X представляет собой любую аминокислоту, за исключением пролина. В кратком изложении, образцы разбавляют водой до 0,1 мкг/мкл и либо оставляют необработанными, либо инкубируют с PNG-азой F в соотношении PNG-аза F:scFV 1:2 (об./об.) в течение 3 часов при 37°C.
[00757] Анализ SDS-PAGE проводят с использованием 4-12% геля Bis-Tris NuPAGE от Novex. Приблизительно 2 мкг scFV наносят на каждую дорожку, и проводят электрофорез при постоянном напряжении 200 В в течение 40 минут. После электрофореза, гель окрашивают с использованием красителя PhastGel Blue R 250 (Amersham Pharmacia) и обесцвечивают с использованием 10% уксусной кислоты, 30% метанолом.
[00758] Анализ ВЭЖХ-MS проводят на системе Waterʹs Acquity UPLC, подсоединенной к масс-спектрометру Xevo-Tof. Приблизительно 1 мкг каждого образца наносят на колонку R 1/10 2,1×100 мм 10 мкм POROS (Applied Biosciences), установленную на 60°C, при скорости потока 0,5 мл/мин. Подвижные фазы состоят из 0,1% муравьиной кислоты (A) и 0,1% муравьиной кислоты, 75% изопропанола, 25% ацетонитрила (B). Белок элюируют с колонки с использованием обращено-фазового градиента 25%-90% B за 12 минут. Получение данных проводят с использованием сканирования с электрораспылением положительных ионов при диапазоне m/z 600-4000 Да с линейным изменением напряжения на конусе источника 20-50 В. Полученные спектры подвергают обратной свертке с использованием MaxEnt1.
[00759] В процессе гуманизации вносили участок гликозилирования. Варианты без PTM (VH: N60S или N60Q) не имели этой дополнительной формы. Эта конструкция была единственной конструкцией с консенсусным участком N-связанного гликозилирования в CDR2 HC. В анализе SDS-PAGE необработанные образцы мигрировали в качестве отдельных полос, что согласуется с приблизительной молекулярной массой последовательностей для всех конструкций за исключением 103101-WT (S/N), для которой наблюдали дублет. Эта конструкция является единственной с консенсусным участком N-связанного гликозилирования в H-CDR2. После обработки PNG-азой F полоса дублета с более высокой молекулярной массой более не присутствовала, что указывает на частичную занятость участка. Аналогично, наблюдаемые молекулярные массы подвергнутых обратной свертке спектров масс согласуются с молекулярными массами, предсказанными, исходя из аминокислотных последовательностей. Однако, хотя другие конструкции продемонстрировали один основной тип молекул, 103101-WT (S/N) также имела популяцию с массой на 1217 Дальтон выше, чем было предсказано, исходя из последовательности, которая более не присутствовала после обработки PNG-азой F. Это согласуется с присутствием одной преобладающей N-связанной гликоформы, вероятно, олигоманнозы 5, исходя из массы. Присутствие гликозилированной формы было подтверждено с использованием MS-анализа, как показано на фиг.3.
[00760] Конформационную стабильность измеряли с использованием дифференциальной сканирующей флуориметрии (DSF). Как показано на фиг.4, Tm scFv мыши составляла 57°C, в то время как варианты конструкции человека продемонстрировали более высокую Tm, составляющую приблизительно 70°C. Tm для всех гуманизированных scFv является значительно более высокой, чем для scFv мыши, что отчетливо демонстрирует, что все гуманизированные scFv являются более стабильными, чем scFv мыши. Эта стабильность, вероятно, будет переходить в конструкцию CART19, что, вероятно, приведет к улучшенным терапевтическим свойствам.
[00761] Активность очищенного scFv измеряли по связыванию с hCD19-экспрессирующими клетками, а также по связыванию с антигеном hCD19, с использованием способа обнаружения на основе SPR. Для определения связывания scFv использовали линию клеток мыши 300. EC50 scFv мыши в отношении hCD19 составляла приблизительно 06-1,6 нМ. Гуманизированные варианты продемонстрировали EC50 в том же низком или суб-нМ диапазоне EC50.
Пример 3: Констуркции CAR против CD19
[00762] ScFv для применения в конечной конструкции CAR получали на основе гуманизированного IgG, описанного в примере 1. Порядок, в котором домены VL и VH находились в scFv, варьировали (т.е. ориентация VL-VH или VH-VL), и либо три, либо четыре копии субъединицы "G4S" (SEQ ID NO: 18), в которых каждая субъединица содержит последовательность GGGGS (SEQ ID NO: 18) (например, (G4S)3 (SEQ ID NO: 107) или (G4S)4(SEQ ID NO: 106)), связывали вариабельные домены в целый scFv-домен, как показано в таблице 2.
[00763] Таблица 2. Гуманизированные конструкции scFv CD19, демонстрирующие ориентацию VH и VL и длину линкера ("3G4S" описан в качестве SEQ ID NO: 107 и "4G4S" описан в качестве SEQ ID NO: 106).
|
[00764] Последовательности гуманизированных фрагментов scFv (SEQ ID NO: 1-12) представлены ниже в таблице 3. Полные конструкции CAR получали с использованием SEQ ID NO: 1-12 c дополнительными последовательностями SEQ ID NO: 13-17, показанными ниже, для получения полных конструкций CAR с SEQ ID NO: 31-42.
- лидерная последовательность (аминокислотная последовательность) (SEQ ID NO: 13)
MALPVTALLLPLALLLHAARP
- лидерная последовательность (последовательность нуклеиновой кислоты) (SEQ ID NO: 54)
ATGGCCCTGCCTGTGACAGCCCTGCTGCTGCCTCTGGCTCTGCTGCTGCATGCCGCTAGACCC
- шарнирная область CD8 (аминокислотная последовательность) (SEQ ID NO: 14)
TTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACD
- шарнирная область CD8 (последовательность нуклеиновой кислоты) (SEQ ID NO: 55)
ACCACGACGCCAGCGCCGCGACCACCAACACCGGCGCCCACCATCGCGTCGCAGCCCCTGTCCCTGCGCCCAGAGGCGTGCCGGCCAGCGGCGGGGGGCGCAGTGCACACGAGGGGGCTGGACTTCGCCTGTGAT
- трансмембранный домен CD8 (аминокислотная последовательность) (SEQ ID NO: 15)
IYIWAPLAGTCGVLLLSLVITLYC
- трансмембранный домен (последовательность нуклеиновой кислоты) (SEQ ID NO: 56)
ATCTACATCTGGGCGCCCTTGGCCGGGACTTGTGGGGTCCTTCTCCTGTCACTGGTTATCACCCTTTACTGC
- внутриклеточный домен 4-1BB (аминокислотная последовательность) (SEQ ID NO: 16)
KRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL
- внутриклеточный домен 4-1BB (последовательность нуклеиновой кислоты) (SEQ ID NO: 60)
AAACGGGGCAGAAAGAAACTCCTGTATATATTCAAACAACCATTTATGAGACCAGTACAAACTACTCAAGAGGAAGATGGCTGTAGCTGCCGATTTCCAGAAGAAGAAGAAGGAGGATGTGAACTG
- домен CD3-зета (аминокислотная последовательность) (SEQ ID NO: 17)
RVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
- домен CD3-зета (последовательность нуклеиновой кислоты) (SEQ ID NO: 101)
AGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACAAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGC
- домен CD3-зета (аминокислотная последовательность; эталонная последовательность NCBI NM_000734.3) (SEQ ID NO: 43)
RVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
- домен CD3-зета (последовательность нуклеиновой кислоты; эталонная последовательность NCBI NM_000734.3); (SEQ ID NO: 44)
AGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACCAGCAGGGCCAG
AACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTT
TGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGA
AGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGG
AGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGC
ACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGC
CCTTCACATGCAGGCCCTGCCCCCTCGC
- Шарнирная область IgG4 (аминокислотная последовательность) (SEQ ID NO: 102)
ESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKM
- Шарнирная область IgG4 (нуклеотидная последовательность) (SEQ ID NO: 103)
GAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATG
[00765] Все эти клоны содержали замену остатков Q/K в сигнальном домене костимулирующего домена, происходящего из 4-1BB.
Таблица 3: Конструкции гуманизированного CAR против CD19
|
Таблица 7: Конструкции CAR мыши против CD19
|
[00766] Последовательности гуманизированных последовательностей CDR scFv-доменов представлены в таблице 4 для вариабельных доменов тяжелой цепи и в таблице 5 для вариабельных доменов легкой цепи. "ID" означает соответствующий SEQ ID NO для каждой CDR.
Таблица 4. CDR вариабельных доменов тяжелой цепи (Kabat)
|
Таблица 5 CDR вариабельного домена легкой цепи
|
[00767] Таблица 6 представляет собой идентифицирующий ключ, сопоставляющий числовые названия конструкций CD19 с конкретной ориентацией легкой и тяжелой цепей scFv, количеством линкерных элементов (т.е., (G4S)3 (SEQ ID NO: 107) или (G4S)4 (SEQ ID NO: 106)), разделяющих тяжелую и легкую цепи, и отличием аминокислотных последовательностей в CDR2 тяжелой цепи.
Таблица 6: Обозначения CAR против CD1
|
[00768] Затем фрагменты scFv CAR клонировали в лентивирусные векторы для получения полноразмерной конструкции CAR в одной кодирующей рамке и использующей промотора EF1-альфа для экспрессии (SEQ ID NO: 100).
Промотор EF1-альфа
CGTGAGGCTCCGGTGCCCGTCAGTGGGCAGAGCGCACATCGCCCACAGTCCCCGAGAAGTTGGGGGGAGGGGTCGGCAATTGAACCGGTGCCTAGAGAAGGTGGCGCGGGGTAAACTGGGAAAGTGATGTCGTGTACTGGCTCCGCCTTTTTCCCGAGGGTGGGGGAGAACCGTATATAAGTGCAGTAGTCGCCGTGAACGTTCTTTTTCGCAACGGGTTTGCCGCCAGAACACAGGTAAGTGCCGTGTGTGGTTCCCGCGGGCCTGGCCTCTTTACGGGTTATGGCCCTTGCGTGCCTTGAATTACTTCCACCTGGCTGCAGTACGTGATTCTTGATCCCGAGCTTCGGGTTGGAAGTGGGTGGGAGAGTTCGAGGCCTTGCGCTTAAGGAGCCCCTTCGCCTCGTGCTTGAGTTGAGGCCTGGCCTGGGCGCTGGGGCCGCCGCGTGCGAATCTGGTGGCACCTTCGCGCCTGTCTCGCTGCTTTCGATAAGTCTCTAGCCATTTAAAATTTTTGATGACCTGCTGCGACGCTTTTTTTCTGGCAAGATAGTCTTGTAAATGCGGGCCAAGATCTGCACACTGGTATTTCGGTTTTTGGGGCCGCGGGCGGCGACGGGGCCCGTGCGTCCCAGCGCACATGTTCGGCGAGGCGGGGCCTGCGAGCGCGGCCACCGAGAATCGGACGGGGGTAGTCTCAAGCTGGCCGGCCTGCTCTGGTGCCTGGCCTCGCGCCGCCGTGTATCGCCCCGCCCTGGGCGGCAAGGCTGGCCCGGTCGGCACCAGTTGCGTGAGCGGAAAGATGGCCGCTTCCCGGCCCTGCTGCAGGGAGCTCAAAATGGAGGACGCGGCGCTCGGGAGAGCGGGCGGGTGAGTCACCCACACAAAGGAAAAGGGCCTTTCCGTCCTCAGCCGTCGCTTCATGTGACTCCACGGAGTACCGGGCGCCGTCCAGGCACCTCGATTAGTTCTCGAGCTTTTGGAGTACGTCGTCTTTAGGTTGGGGGGAGGGGTTTTATGCGATGGAGTTTCCCCACACTGAGTGGGTGGAGACTGAAGTTAGGCCAGCTTGGCACTTGATGTAATTCTCCTTGGAATTTGCCCTTTTTGAGTTTGGATCTTGGTTCATTCTCAAGCCTCAGACAGTGGTTCAAAGTTTTTTTCTTCCATTTCAGGTGTCGTGA (SEQ ID NO: 100).
Анализ гуманизированных конструкций CAR проводили, как описано в примере 4.
Пример 4: Анализ гуманизированных конструкций CD19 в CART
[00769] Для оценки осуществимости нацеливания на CD19 посредством технологии CAR одноцепочечные вариабельные фрагменты антитела против CD19 клонируют в лентивирусный CAR-экспрессирующий вектор с зета-цепью CD3 и костимулирующей молекулой 4-1BB в четырех различных конфигурациях, и выбирают оптимальную конструкцию, исходя из количества и качества ответа эффекторных T-клеток, трансдуцированных CAR против CD19 ("CART19" или "CART19 T-клеток") в ответ на CD19+ мишени. Ответы эффекторных T-клеток включают, но не ограничиваются ими, экспансию клеток, пролиферацию, удвоение, продукцию цитокинов, и активность уничтожения клеток-мишеней или цитолитическую активность (дегрануляция).
Материалы и способы
Получение перенацеленных гуманизированных CART19 T-клеток
[00770] Лентивирусные векторы для переноса гуманизированных CART19 используют для получения геномного материала, упакованного в псевдотипированные лентивирусные частицы VSVg. ДНК лентивирусного вектора для переноса смешивают с тремя упаковывающими компонентами VSVg, gag/pol и rev в комбинации с реагентом липофектамином для трансфекции ее в клетки Lenti-X 293T (Clontech). Через 24 и 48 ч среду собирают, фильтруют и концентрируют ультрацентрифугированием. Полученный препарат вируса хранят при -80°C. Количество трансдуцирующих элементов определяют посредством титрования на клетках SupT1. Перенацеленные CART19 T-клетки получают путем активации свежих наивных T-клеток посредством приведения в контакт с гранулами CD3×28 в течение 24 ч, а затем добавления подходящего количества трансдуцирующих элементов для получения желаемого процента трансдуцированных T-клеток. Этим модифицированным T-клеткам позволяют увеличиваться в количестве до тех пор, пока они не станут покоящимся и не уменьшатся в размере, и в этот момент времени их замораживают для последующего анализа. Количества и размеры клеток определяют с использованием Coulter multisizer III. Перед криосохранением определяют процент трансдуцированных клеток (экспрессирующих CART19 на клеточной поверхности) и их относительную интенсивность флуоресценции этой экспрессии с использованием проточно-цитометрического анализа на LSRII. С помощью гистограмм можно изучать относительные уровни экспрессии CAR путем сравнения процента трансдуцированных клеток с их относительной интенсивностью флуоресценции.
Оценка цитолитической активности, способности к пролиферации и секреции цитокинов у гуманизированных перенацеленных CART19 T-клеток.
[00771] Для оценки функциональных способностей гуманизированных CAR19 T-клеток к уничтожению, пролиферации и секреции цитокинов, клетки размораживают и позволяют им восстановиться в течение ночи. В дополнение к гуманизированному CART19, CART19 мыши использовали для сравнительных целей, в то время как SS1-BBz использовали в качестве ненацеленного экспрессируемого CAR для фонового эффекта CAR/T-клеток. "Контрольный" золотой стандарт (GS) CART19 использовали во всех анализах для сравнения варьирования в анализе. Важно, что GS CART19 являются клетками, полученными в условиях производства исследовательской категории (т.е. не клинической категории, и они включают добавление IL-2 для в среду для роста культуры. Это, вероятно, влияет на общую жизнеспособность и функциональность этих клеток, и их не следует оценивать в качестве прямого сравнения с получением других трансдуцированных популяций T-клеток исследовательской категории. Уничтожение T-клеток было направлено на K562, клеточную линию хронического миелогенного лейкоза, экспрессирующую или не экспрессирующую CD19 или Pt14, B-клетки, выделенные от пациентов CLL. Для этого проточного анализа цитотоксичности клетки-мишени окрашивают CSFE для количественного определения их присутствия. Клетки-мишени окрашивают в отношении экспрессии CD19 для подтверждения сходных уровней антигена-мишени. Цитолитическую активность CAR19 T-клеток измеряют при титровании в соотношениях эффекторная клетка:клетка-мишень 10:1, 3:1, 1:1, 0,3:1 и 0:1, где эффекторы определяют как T-клетки, экспрессирующие химерный рецептор против CD19. Анализы начинают со смешения соответствующего количества T-клеток с неизменным количеством клеток-мишеней. Через 16 ч общий объем каждой смеси удаляют и каждую лунку промывают, комбинируя соответствующим образом. T-клетки окрашивают на CD2 и все клетки окрашивают маркером живых/погибших 7AAD. После последнего промывания осажденные клетки ресуспендируют в конкретном объеме с заданным количеством гранул для подсчета. Данные окрашивания клеток получают с использованием проточной цитометрии LSRII и анализируют с помощью программного обеспечения FloJo с использованием гранул для получения количественных результатов.
[00772] Для измерения клеточной пролиферации и продукции цитокинов T-клетками с гуманизированным CAR19 клетки размораживают и позволяют им восстановиться в течение ночи. В дополнение к гуманизированному CART19, CART19 мыши использовали для сравнительных целей, в то время как SS1-BBz использовали в качестве ненацеленного экспрессируемого CAR для фонового эффекта CAR/T-клеток. "Контрольный" золотой стандарт (GS) CART19 использовали во всех анализах для сравнения варьирования в анализе. T-клетки были нацелены либо на K562, линию клеток хронического миелогенного лейкоза, экспрессирующую или не экспрессирующую CD19 или Pt14, либо на B-клетки, выделенные от пациентов с CLL. Кроме того, для оценки потенциала T-клеток к ответу на эндогенные иммунологические сигналы использовали гранулы CD3×28. Для анализа пролиферации T-клетки окрашивали CSFE. Пролиферация соответствует разведению красителя CSFE, отражающему разделение красителя родительских клеток на две дочерние клетки. В анализе исследуются только соотношения эффектор:мишень 1:1 и 1:0, где эффекторы определяют как T-клетки, экпрессирующие химерный рецептор против CD19. Анализ проводят в двух экземплярах и через 24 ч после смешения клеток 50% среды удаляют/заменяют для анализа цитокинов с использованием 10-плексной панели Luminex для обнаружения цитокинов человека. Через 5 суток T-клетки окрашивают на экспрессию CAR, фенотипируют либо как CD4-клетки, либо как CD8-клетки, и окрашивают в отношении живых/погибших посредством 7AAD. После последнего промывания осажденные клетки ресуспендируют в конкретном объеме с заданным количеством гранул для подсчета BD. Данные окрашивания клеток получают с использованием проточной цитометрии LSRII и анализируют с помощью программного обеспечения FloJo с использованием гранул для получения количественных результатов. Общее количество клеток определяют по количеству подсчитанных клеток относительно конкретного количества гранул, умноженного на долю гранул, еще подлежащих подсчету.
[00773] Для оценки возможности клеток с гуманизированным CART19 функционировать сходным образом с успешным на сегодняшний день CART19 мыши, авторы настоящего изобретения решили оценить in vitro их способность уничтожать клетки-мишени, пролиферировать в ответ на антиген-мишень и демонстрировать признаки персистирования. Путем упаковывания каждой из лентивирусных конструкций гуманизированного CART19 и титрации их на клетках SupT1 можно определить количество вируса для нормализации трансдукции приблизительно до 50%. Это позволяет более прямые сравнения активности, начиная со сходного среднего количества участков встраивания на клетку.
[00774] Терапевтические CAR19 T-клетки получают, начиная с крови нормального подвергнутого аферезу донора, наивные T-клетки которого получают отрицательной селекцией T-клеток, CD4+ и CD8+ лимфоцитов. Эти клетки активируют гранулами CD3×28 в 10% RPMI при 37°C, 5% CO2.
[00775] Через 24 ч T-клетки увеличиваются в размере, и к ним добавляют нормализованное количество вируса. T-клетки начинают делиться с логарифмическим паттерном роста, мониторинг которого проводят путем измерения количеств клеток на мл и размера клеток. По мере того, как T-клетки начинают покоиться, логарифмический рост прекращается и размер клеток уменьшается. Комбинация замедления скорости роста и размера T-клеток, приближающегося к ~300 фл, определяет состояние, при котором T-клетки криосохраняют или рестимулируют.
[00776] Существует очень сходная тенденция среди покоящихся T-клеток, исходя из их размера. Практически перекрывающийся профиль между клетками с гуманизированным CART с существующими на сегодняшний день CART19 мыши и популяцией UTD указывает на отсутствие необычного эффекта гуманизированного CAR19 на экспансию нормальных T-клеток после активации. В качестве контроля используют SS1-BBz для определения нежелательной независимой от антигена активности CAR. Профиль общего увеличения в количестве клеток демонстрирует, что различия в фактических величинах для увеличения в количестве отдельных клеток, вероятно, являются следствием в основном отличий в исходном количестве клеток. Путем нормализации исходного количества T-клеток наблюдают плотный кластер для всех CART19-клеток. Кроме того, нежелательный эффект независимой от антигена активации CAR обнаруживается на линии, проходящей ниже и отдаляющейся от группы.
[00777] Определяли уровень поверхностной экспрессии каждой из этих CAR19-экспрессирующих клеток. Титрованный вирус, нормализованный для трансдукции, демонстрирует сравнимые уровни экспрессии, коррелирующие с эффективностью трансдукции, процентом трансдуцированных клеток. Для некоторых CAR титры экстраполировали из ранее проведенных упаковок, и, хотя их проценты трансдуцированных клеток ниже, их MFI также снижены, как и ожидалось. Результаты указывают на то, что отсутствует поддающийся обнаружению отрицательный эффект гуманизированного CAR19 на жизнеспособность клеток в отношении нормальной экспансии по сравнению с UTD и CAR19 T-клетками мыши.
[00778] Анализируют способность клеток с гуманизированным CART19 селективно различать специфический эпитоп клеточной поверхности, экспрессируемый на клетках, и разрушать их. Клетки K562 дикого типа не экспрессируют CD19, но могут быть трансдуцированы для экспрессии CD19. Сравнение этих кривых уничтожения с использованием титрований количеств эффекторных клеток, демонстрирует, что эти клетки, которые экспрессируют CD19, уничтожаются. Перенацеленные T-клетки от того же донора и модифицированые либо посредством клеток с гуманизированным CART19, либо современными клиническими CART19-клетками, указывает на отсутствие различий в их способности к уничтожению. Кривые уничтожения демонстрируют, что очень сходная способность к уничтожению обнаруживается среди клеток с гуманизированным CART19, нацеленных на CD19+ клетки CLL от пациента 14. Интересно, что происходит снижение общей цитолитической активности, в частности GS CART19, что указывает на то, что эти клетки могут обладать определенными ингибиторными свойствами. Сходный уровень CD19, экспрессированного на клетках-мишенях, указывает на то, что уровень экспрессии не является причиной отличий в уничтожении клеток.
[00779] Необходимое свойство клеток с гуманизированным CART19 к пролиферации после контакта с клетками-мишенями обнаруживается для всех конструкций после стимуляции контрольными гранулами CD3×28 и экспрессирующими CD19 мишенями. Нацеливание на клетки Pt14 CLL, по-видимому, указывает на несколько более высокую скорость пролиферации с scFv с ориентацией от легкой к тяжелой цепи, причем не наблюдается изменений при наличии 3x или 4x линкера GGGGS (SEQ ID NO 107 и 106, соответственно). Результаты пролиферации отражают общее количество клеток, накопленных в течение 5 суток, что указывает на то, что гуманизированные CART19, 2146, 2144, 2136, 2141 и 2137 дают более высокий пролиферативный сигнал T-клеткам. Впечатляет, что это было обнаружено для клеток с гуманизированным CART19, нацеленных на клетки Pt14 CLL.
[00780] В целом, гуманизированные конструкции CART19 проявляют в высокой степени сходные характеристики с современным CART19 мыши в отношении цитолитической активности, пролиферативного ответа и секреции цитокинов на антиген-специфические мишенями. Потенциал клеток с гуманизированным CART19 (2146, 2144, 2136, 2141 и 2137) к обеспечению более высокого пролиферативного сигнала для T-клеток при активации мишенью, по-видимому, является дополнительным полезным фактором этих новых конструкций к потенциальному усилению терапевтического ответа.
Результаты
[00781] С использованием анализов как дегрануляции, так и продукции цитокинов, было продемонстрировано, что модифицированные способами инженерии CART19 T-клетки специфически нацелены на CD19+ клетки.
[00782] Анализировали клетки ND317, трансдуцированные гуманизированными конструкциями CD19CAR (также называемыми "huCART19") по изобретению. Существовало высокое сходство в размере T-клеток в процессе их экспансии после активации CD3×28 и трансдукции гуманизированными кандидатами CART19 относительно CART19 мыши и немодифицированных (UTD) T-клеток.
[00783] Эксперименты продемонстрировали небольшое отличие в количестве T-клеток, накопившихся в процессе их экспансии после активации CD3×28 и трансдукции различными гуманизированными CART19-кандидатами относительно CART19 мыши, и немодифицированных (UTD) T-клеток.
[00784] Экспрессия на клеточной поверхности гуманизированных CART19 является сравнимой, и их уровень экспрессии является в высокой степени сходным, с CART19 мыши. Наложение гистограмм профиля окрашивания экспрессии на клеточной поверхности каждой из трансдуцированных гуманизированным CART19 T-клеток и средней интенсивности флуоресценции (MFI), вычисленной из этих профилей, хорошо коррелирует с процентом трансдуцированных клеток.
[00785] Более того гуманизированный CART19 обладает сходной и сравнимой специфической цитотоксической активностью в отношении нацеливания на CD19-экспрессирующие клетки-мишени с CART19 мыши. См. графики проточных анализов уничтожения через 16 ч с использованием соотношений эффектора и мишени (E:T) при титровании с эффекторными гуманизированными CART19-клетками, нацеленными на меченные CSFE K562cc (фиг.1A, не экспрессирующие CD19 контроли), K562.CD19 (фиг.1B, клетки K562, трансдуцированные для экспрессии CD19) или Pt14 (фиг.1C, B-клетки от пациента с CLL). Цитолитическая активность всех клеток с гуманизированным CART19 является сходной и сравнимой с CART19 мыши. Отличия в цитолитической активности между различными мишенями являются сходными и сравнимыми, что указывает на то, что активность CART19 мыши сохраняется в гуманизированной форме CART19.
[00786] Наложение гистограмм меченных CFSE клеток с гуманизированным CART19 через 6 суток после смешения с клетками-мишенями демонстрируют их пролиферативную способность (фиг.5). Пролиферативный ответ, обеспечиваемый CAR19, представляет собой необходимый ответ после контактирования с клетками-мишенями и их уничтожения для развития положительного клинического ответа. Разведение красителя CSFE SS1-BBz, являющееся индикатором делящихся дочерних клеток, вызывающих разведение исходной клеточной линии, является результатом не покоящихся T-клеток, сохраняющих деление по независимому от нацеливания механизму.
[00787] Общую способность клеточных популяций к пролиферации оценивают с использованием гранул CD3×28, которые имитируют эндогенный контакт с TCR и костимулятором CD28. Данные указывают на то, что каждая клеточная популяция имеет сравнимый потенциал к пролиферации. Все клетки с гуманизированным CART19 и с CART19 мыши пролиферируют мощно и в сравнимой степени при контакте с клетками K562, экспрессирующими CD19. Клетки с гуманизированным CART19 также хорошо отвечали на B-клетки, полученные от пациента с CLL, хотя некоторые, по-видимому, отвечали в несколько меньшей степени. Как показано на фиг.2A и 2B, можно видеть, что гуманизированные CART19-клетки 2136, 2137, 2140, 2141, 2144 и 2146 имеют несколько более высокую пролиферацию, о чем свидетельствует более высокое разведение красителя CSFE. Все эти конструкции имеют одну и ту же вариабельную ориентацию цепей от легкой к тяжелой, что указывает на то, что эта ориентация является предпочтительной для выбора. Более детальное исследование аминокислотных изменений в участке CDR2 тяжелой цепи (таблица 1), показывает, что каждый из трех вариантов YSSSL, YQSSL и YNSSL (SEQ ID NO: 28, 29 и 30, соответственно) представлен в конструкциях, которые, по-видимому, имеют более высокую пролиферацию после контакта с мишенями. Кроме того, эти наблюдаемые конструкции имеют как линкер G4S, содержащий 3 копии субъединицы (3G4S) (SEQ ID NO: 107), так и линкер G4S, содержащий 4 копии субъединицы (4G4S) (SEQ ID NO: 106), что указывает на то, что размер линкера не влияет на функцию.
[00788] Исходя из пролиферативной экспансии, описанной выше, определяли общее количество клеток через 5 суток после контакта с опухолью. Клетки демонстрируют уменьшение количеств относительно первоначально посеянных, что указывает на то, что требуется активация для поддержания выживаемости. Эндогенный контроль активации анализируют, чтобы показать, что общее количество клеток после 6 суток является сходным. Клетки с гуманизированным CART19, нацеленные на клетки K562, сверхэкспрессирующие CD19, демонстрируют, что оба типа клеток с CART19 мыши имеют в итоге более высокие количества клеток, причем 2146 имели несколько более высокие количества относительно других конструкций со сходными величинами. Общие количества клеток также анализировали через 6 суток после воздействия B-клеток от пациента 14 (pt14), и интересно, что они показывают, что ранее исключенные путем селекции гуманизированные конструкции CART19 2146, 2144, 2136, 2141 и 2137, все из которых имеют ориентацию от легкой к тяжелой цепи и соответствуют трем аминокислотным вариантам YSSSL, YQSSL и YNSSL (SEQ ID NO: 28, 29 и 30, соответственно), приводили к более высоким общим количествам клеток, превышающим клетки с CART19 мыши. Это неожиданное отличие между различными гуманизированными клонами CD19CAR может обеспечивать лучшую клиническую эффективность CART-клеток, трансдуцированных этими конструкциями.
[00789] Анализировали фоновые уровни цитокинов, продуцированных из клеток с гуманизированным CART19 после воздействия контрольных клеток K562, не экспрессирующих CD19. Супернатанты через 24 ч анализировали с использованием 30-плексной панели luminex. Потенциальный профиль цитокинов в результате стимуляции эндогенной иммунной системы гранулами CD3×28 указывает на то, то каждая из клеточных популяций имеет сравнимый профиль цитокинов.
[00790] Данные также показывают, что гуманизированные CART19 и CART19 мыши продуцируют сходные профили цитокинов на сходных уровнях, когда они отвечают на одинаковые мишени. Профиль цитокинов был более низким, но сходным при нацеливании на клетки-мишени Pt14.
Пример 5: Лечение гуманизированными CAR T-клетками против CD19 в модели ALL in vivo.
[00791] Первичные клетки ALL человека можно выращивать у мышей с иммунодефицитом без необходимости в культивировании их in vitro. Этих мышей можно использовать для исследования эффективности T-клеток с химерным рецептором антигена (CAR) в модели, которая соответствует популяции пациентов, которая встречается в клинике. Модель, использованную в этом эксперименте, HALLX5447, пассировали дважды у мышей NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG) перед применением в исследованиях, тестирующих эффективность CAR T-клеток.
[00792] Ранее было показано, что CART-клетки мыши против CD19 нацеливаются и уничтожают лейкозные клетки в модели первичного ALL человека на мышах NSG. scFv против CD19 (одноцепочечный вариабельный фрагмент Fc) был гуманизирован, и в настоящем примере сравнивается способность T-клеток, экспрессирующих гуманизированный CAR против CD19 (CAR 2), уничтожать опухолевые клетки ALL in vivo со способностью CAR T-клеток мыши против CD19. Здесь, эффективность этих клеток прямо сравнивали у мышей с развернутым первичным ALL человека путем оценки CD19+ клеток человека с использованием FACS периферической крови. После имплантации 1,5×106 первичных клеток ALL внутривенно, нагрузка заболеванием, составляющая 2,5-4% CD19+ клеток человека в крови, была достигнута через 2 недели после имплантации опухоли. Этот процент CD19 представляет собой процент от всех клеток в крови мышей. 100% клеток человека у мышей перед введением CAR T-клеток являются опухолевыми клетками. Проценты выше 2% CD19+ клеток человека в периферической крови считаются развернутым заболеванием ALL человека. Имеющих лейкоз мышей лечили CAR T-клетками после установления лейкоза у мышей приблизительно от двух до трех недель после имплантации опухоли. Мышам в каждой группе вводили 5×106 тотальных T-клеток человека. Эффективность трансдукции донорных T-клеток человека экспрессирующим CAR человека составляла -60%. После введения T-клеток у мышей каждую неделю проводили взятие крови для анализа процента CD19+ клеток человека в крови в качестве биомаркера прогрессирования заболевания.
Материалы и способы:
[00793] Первичные клетки ALL человека: Первичные клетки не культивировали in vitro перед имплантацией. Эти клетки собирали от пациента с ALL, а затем переносили мышам для приживления и увеличения в количестве. После увеличения в количестве опухолевых клеток у мышей, костный мозг и спленоциты извлекали и замораживали живыми в отдельных партиях для реимплантации. Клетки замораживали в 90% FBS и 10% DMSO в минимальной концентрации 5×106 клеток на миллилитр. Для реимплантации замороженные клетки ALL размораживали, а затем инъецировали внутривенно мышам NSG для получения мышей с ALL для применения для сравнения противоопухолевой эффективности T-клеток с гуманизированным CAR против CD19 и T-клеток с CAR мыши против CD19.
[00794] Мыши: Мышей NSG (NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ) в возрасте 6 недель получали от Jackson Laboratory (номер партии 005557). Животным позволяли акклиматизироваться в виварии Novartis NIBRI в течение по меньшей мере 3 суток перед экспериментом. Животных содержали в соответствии с правилами и нормативами Novartis ACUC.
[00795] Имплантация опухоли: Серийно пассированные in vivo клетки первичного ALL человека, модель HALLX5447, размораживали на водяной бане при 37°C. Затем клети переносили в 15-мл коническую пробирку и промывали два раза холодным стерильным PBS. Затем клетки первичного ALL подсчитывали и ресуспендировали в концентрации 15×106 клеток на миллилитр PBS. Клетки помещали на лед и сразу (в течение одного чала) имплантировали мышам. Клетки ALL инъецировали внутривенно через хвостовую вену в объеме 100 мкл в количестве всего 1,5×106 клеток на мышь.
[00796] Дозирование CAR T-клеток: Мышам вводили 5×106 T-клеток через 16 суток после имплантации опухоли. Клетки частично размораживали на водяной бане при 37 градусах Цельсия, а затем полностью размораживали добавлением в пробирку, содержавшую клетки, 1 мл холодного стерильного PBS. Размороженные клетки переносили в 15-мл пробирку falcon и доводили до конечного объема 10 мл посредством PBS. Клетки промывали два раза при 1000 об/мин в течение 10 минут каждый раз, а затем подсчитывали на гемоцитометре. Затем T-клетки ресуспендировали в концентрации 50×106 клеток на мл холодного PBS и держали на льду до тех пор, пока не вводили мышам. Мышам инъецировали внутривенно через хвостовую вену 100 мкл CAR T-клеток в дозе 5×106 T-клеток на мышь. Пяти мышам на группу вводили либо 100 мкл PBS отдельно (PBS), либо нетрансдуцированные T-клетки (имитация), либо T-клетки мыши с CAR против CD19 (muCTL019), либо гуманизированные CAR T-клетки против CD19 (huCTL019). Все из нетрансдуцированных T-клеток, muCTL019 T-клеток и huCTL019 T-клеток получали от одного и того же донора параллельно.
[00797] Мониторинг животных: Мониторинг состояния здоровья мышей проводили каждые сутки, включая измерение массы тела два раза в неделю. Процентное изменение массы тела вычисляли как (BWтекущая - BWисходная)/(BWисходная)×100%. Мониторинг опухолевой нагрузки проводили каждую неделю посредством FACS-анализа периферической крови. У мышей раз в неделю проводили взятие крови через хвостовую вену в покрытые EDTA пробирки, которые держали на льду. 10-20 мкл крови высевали из пробирок в 96-луночные планшеты на льду. Лизис эритроцитов проводили с помощью буфера для лизиса эритроцитов ACK (Life Technologies, каталожный номер A10492-01), а затем промывали два раза холодным PBS. Клетки инкубировали Fc-блокирующей смесью человека и мыши (Miltenyi Biotec, каталожные номера 130-059-901 и 130-092-575) в течение 30 минут, а затем инкубировали с антителом против CD19 человека в течение 30 минут. Клетки фиксировали 2% раствором параформальдегида в течение 20 минут, промывали и хранили в PBS+2% FBS в течение ночи перед анализом на BD Canto или Fortessa, а затем проводили анализ с использованием программного обеспечения для анализа FlowJo FACS. Клетки анализировали для определения процента CD19+ клеток в крови мышей NSG, имеющих опухоль ALL человека HALLX5447. Проценты CD19 в крови представлены в качестве среднего значения±стандартная ошибка среднего значения (SEM).
[00798] Процентные величины лечение/контроль (T/C) вычисляли с использованием следующей формулы:
% T/C=100 × ΔT/ΔC, если ΔT > 0;
% регрессия=100 × ΔT/Tисходный, если ΔT < 0;
где T=средний процент CD19 в периферической крови группы, в которой вводили лекарственное средство, в последний день исследования; Tисходный=процент CD19 в периферической крови в группе, в которой вводили лекарственное средство, в первый день дозирования; ΔT=средний процент CD19 в периферической крови в группе, в которой вводили лекарственное средство, в последний день исследования - средний процент CD19 в периферической крови в группе, в которой вводили лекарственное средство, в первый день дозирования; C=средний процент CD19 в периферической крови контрольной группы в последний день исследования; и ΔC=средний процент CD19 в периферической крови контрольной группы в последний день исследования - средний процент CD19 в периферической крови контрольной группы в первый день дозирования.
[00799] Величины T/C в диапазоне 100% - 42% интерпретируют как не имеющие или имеющие минимальную противоопухолевую активность; величины T/C, которые составляют < 42% и > 10%, интерпретируют как наличие противоопухолевой активности или ингибирование роста опухоли. Величины T/C < 10% или величины регрессии > -10% интерпретируют как стаз опухоли. Величины регрессии < -10% описывают как регрессию.
Результаты:
[00800] Противоопухолевую активность T-клеток с гуманизированным CAR против CD19 и CAR против CD19 мыши оценивали и прямо сравнивали в модели первичного ALL человека. После имплантации опухоли на 0 сутки, мышей распределяли случайным образом в группы введения, и им вводили 5×106 T-клеток внутривенно на 16 сутки. Мониторинг нагрузки заболеванием ALL и здоровья животных проводили до достижения животными конечной точки. Мышей во всех группах умерщвляли на 65 сутки после имплантации опухоли, когда нагрузка заболеванием в контрольных группах была выше 80% CD19+ клеток человека в периферической крови.
[00801] Отчетливое отличие в нагрузке заболеванием наблюдали между контрольными группами, и группами, в которых вводили либо T-клетки с CAR мыши против CD19, либо T-клетки с гуманизированным CAR против CD19, с P < 0,01, начиная с 24 суток после имплантации и до конца исследования на 65 сутки. T-клетки CAR мыши против CD19 и T-клетки с гуманизированным CAR против CD19 продемонстрировали сходную способность контролировать рост опухолевых клеток ALL человека HALLX5447 у мышей NSG. Обе группы продемонстрировали максимальный уровень заболевания в периферической крови, составляющий 12-15% CD19+ клеток человека через 21 сутки после имплантации HALLX5447. Через 42 суток после имплантации опухоли в группе huCTL019 CD19+ клетки человека не обнаруживались, в то время как процент CD19+ клеток человека в группе muCTL019 был снижен приблизительно до 1%. Как T-клетки CAR мыши против CD19, так T-клетки с гуманизированным CAR против CD19, обеспечивали сравнимую способность контролировать увеличение в количестве клеток первичного ALL человека в этой модели (P>0,05). % величин T/C для группы T-клеток, трансдуцированных имитирующей конструкцией, составил 94,40%, что демонстрирует, что трансдуцированные имитирующей конструкцией T-клетки не обладали противоопухолевой активностью. Процентная регрессия в группе muCTL019 составила -89,75%, и в группе huCTL019 она составила -90,46%, что демонстрирует, что оба из этих способов лечения способны вызывать регрессию модельной опухоли HALLX5447. Проценты CD19+ клеток человека в периферической крови в качестве меры нагрузки заболеванием у этих мышей представлены на фиг.7. Группа введения PBS, в которой не вводили никаких T-клеток, продемонстрировала базовую кинетику роста первичной опухоли ALL у мышей NSG с внутривенной имплантацией. В группе имитирующего введения вводили нетрансдуцированные T-клетки, которые подвергались такому же процессу экспансии in vitro, что и CAR T-клетки. Эти клетки служат в качестве T-клеточного контроля, чтобы продемонстрировать неспецифический ответ T-клеток в этой модели опухоли. Группы введения как PBS, так и трансдуцированных имитирующей конструкцией T-клеток, продемонстрировали непрерывное прогрессирование опухоли в ходе эксперимента. Как T-клетки CAR мыши против CD19, так T-клетки с гуманизированным CAR против CD19, контролируют прогрессирование заболевания в течение одной недели после инъекции 5×106 T-клеток и демонстрируют сходную способность осуществлять контроль заболевания в ходе этого исследования в течение 65 суток.
[00802] Противоопухолевую активность T-клеток, трансдуцированных CAR против CD19 мыши и гуманизированным CAR против CD19, оценивали в исследовании эффективности у мышей NSG, имеющих модельный первичный ALL человека HALLX5447. Это исследование продемонстрировало, что как T-клетки с CAR мыши против CD19, так и T-клетки с гуманизированным CAR против CD19 (muCTL019 и huCTL019), способны индуцировать противоопухолевый ответ в первичной модели ALL человека. Кроме того, этот ответ, проанализированный с использованием нагрузки заболеванием в периферической крови, является таким же для клеток muCTL019 и huCTL019. Как T-клетки с CAR мыши против CD19, так и T-клетки с гуманизированным CAR против CD19, контролируют рост первичного ALL в течение недели после дозирования мышам T-клеток. Первоначально после введения нагрузка заболеванием продолжала расти, а затем снижалась до практически не поддающихся обнаружению уровней. Одно введение либо T-клеток с CAR мыши против CD19, либо T-клеток с гуманизированным CAR против CD19, приводило к длительному противоопухолевому ответу в ходе прогрессирования заболевания в течение 65 суток у мышей, которым вводили контроль. T-клетки с гуманизированным CAR против CD19 продемонстрировали сходную способность индуцировать эффективный ответ против опухоли с CD19 и контролировать нагрузку ALL, с теми, что наблюдали для T-клеток с CAR мыши против CD19.
Пример 6: CAR T-клетки против CD19 для применения для лечения множественной миеломы
[00803] Даже с использованием современных режимов химиотерапии, направленной терапии и трансплантации аутологичных стволовых клеток, миелому считают неизлечимым заболеванием. В настоящем примере описано лечение множественной миеломы (MM) с использованием аутологичных T-клеток, направленных на CD19 с использованием химерного рецептора антигена (лентивирус/CD19:4-1BB:CD3-зета; также известный как "CART19" или CTL019). В этом примере продемонстрировано, что направленные на CD19 способы терапии CAR обладают потенциалом в развитии глубоких длительных ремиссий на основе нацеливания на стволовые клетки миеломы и/или опухолевые клетки, которые экспрессируют очень низкие (не поддающиеся обнаружению большинством способов) уровни CD19.
[00804] При лечении пациентки с агрессивным вторичным плазмацитарным лейкозом авторы настоящего изобретения обнаружили, что CART19, введенные через двое суток после спасительной трансфузии аутологичных стволовых клеток, приводили к быстрому устранению плазмацитарного лейкоза и очень высокому частичному ответу у пациентки, у которой происходило прогрессирование при многих линиях химиотерапии. Эта пациентка была зависимой от трансфузии в течение месяцев перед лечением; через два месяца после лечения у нее восстановилась лейкоцитарная формула (с количеством тромбоцитов и количествами лейкоцитов в нормальном диапазоне) и ей не требовались трансфузии, в связи с чем она была освобождена от ее лечения в больнице.
[00805] Поскольку клетки миеломы в природе не экспрессируют CD19, открытие, что лечение CART19 индуцировало быстрый и значительный ответ этой опухоли, был неожиданным. Без связи с конкретной теорией, было предположено, что CART19 можно использовать для лечения миеломы, вследствие следующего: (1) хотя традиционно полагали, что клетки миеломы являются отрицательными по экспрессии CD19 при использовании проточной цитометрии, существуют данные, что клетки миеломы могут экспрессировать очень низкие уровни CD19, так что экспрессия поддается обнаружению по РНК, но не с использованием проточной цитометрии или иммуногистохимии; и (2) концепция нацеливания на клонотипическую B-клетку, которая, как полагают, является злокачественной стволовой клеткой, которая дает начало множественной миеломы и особенно резистентна к химиотерапии. Существует клональная взаимосвязь между B-клетками и миеломными опухолевыми клетками, однако традиционная терапия миеломы нацелена на злокачественные плазмациты, а не на B-клетки. CART19 для лечения миеломы, таким образом, нацелены на клеточную популяцию, отличающуюся от большинства способов терапии миеломы.
[00806] По опыту одного пациента, пациентка имела циркулирующие плазмациты, и авторы настоящего изобретения были способны исследовать ее опухолевые клетки в отношении экспрессии CD19. Приблизительно 1-2% ее опухолевых клеток экспрессировали антиген CD19 (фиг.8). Таким образом, является обоснованным, что CART19 могут иметь прямой эффект на очень небольшую популяцию ее опухолевых клеток; хотя очень высокий частичный ответ не мог быть спрогнозирован, исходя из нацеливания только на очень небольшую популяцию CD19+ опухолевых клеток.
[00807] В этом случае, CART19 вводили после трансплантации аутологичных стволовых клеток после мелфалана в высокой дозе. Хотя это является стандартной терапией при миеломе, она не является излечивающей. Более того, эта пациентка ранее подвергалась тандемным трансплантациям аутологичных стволовых клеток, и у нее быстро возникал рецидив (<6 месяцев) после трансплантации. Без связи с конкретной теорией, применение клеток CART19, как описано в настоящем описании может иметь неперекрывающийся механизм при лечении миеломы при комбинировании со спасающей трансплантацией аутологичных стволовых клеток.
[00808] Пациентку с рефрактерной множественной миеломой лечили CTL019 после миелоаблятивной химиотерапии и ASCT. Ремиссия сохранялась, несмотря на потерю поддающихся обнаружению CTL019 и восстановление нормальных CD19-положительных B-клеток, что указывает на то, что этот ответ не требовал непрерывной активности CTL019. Более того, этот ответ пациентки был достигнут, даже несмотря на то, что значительное большинство (99,95%) неопластических плазмацитов были отрицательными по CD19 как при проточной цитометрии, так и в ОТ-ПЦР.
[00809] Отсутствие поддающейся обнаружению экспрессии CD19 в этой преобладающей популяции неопластических пламацитов пациентки указывает на то, что клинически значимая мишень CTL019 находилась за пределами этой доминантной CD19-отрицательной популяции. Неопластические плазмациты у пациентов с множественной миеломой проявляют генетическую, иммунофенотипическую и функциональную гетерогенность. Для выживания клона при терапии миеломы могут потребоваться конкретные субпопуляции. У пациентки, описанной в данном примере, например, небольшая CD19-экспрессирующая подгруппа плазмацитов могла быть относительно устойчивой к мелфалану, но чувствительной к CTL019. Эти данные указывают на то, что терапевтическое нацеливание на небольшую подгруппу клона может приводить к длительной клинической пользе при совместном использовании с общепринятой терапией против миеломы.
[00810] Альтернативно клинически значимая мишень CTL019 у этой пациентки могла находиться вне популяции неопластических плазмацитов. Например, CTL019 может нацеливаться на популяцию стволовых клеток, которая является относительно небольшой, но дает начало неопластическим плазмацитам. Таким образом, множественная миелома может представлять собой заболевание множества поздних типов клеток B-ростка, но только терминально дифференцированные плазмациты, такие как способы терапии, подобные CTL019, которые нацелены на B-лимфоциты, могут быть полезными дополнительными средствами для терапии, которая прямо нацелена на плазмациты.
[00811] В испытании фазы I десять дополнительных пациентов с множественной миеломой будут лечить CART19, на сегодняшний день лечат по меньшей мере трех пациентов.
Обоснование дозы и риск/польза
[00812] Для этого протокола авторы настоящего изобретения решили использовать равномерное дозирование внутривенным путем введения. Первичной задачей этого протокола было исследование безопасности и осуществимости введения клеток CART-19 пациентам с множественной миеломой. Ожидаемыми первичными токсическими действиями являются (1) высвобождение цитокинов, когда CAR встречают их заместительный антиген CD 19 на злокачественных или нормальных B-клетках; (2) истощение нормальных B-клеток, аналогично терапии ритуксимабом; (3) отвечающие на стероиды кожные и желудочно-кишечные синдромы, напоминающие реакцию "трансплантат против хозяина", как наблюдали ранее, когда увеличенные в количестве/костимулированные аутологичные T-клетки объединяли с ASCT при MM. Теоретической проблемой было то, может ли произойти трансформация или неконтролируемая пролиферация CART-19 T-клеток в ответ на высокие уровни CD 19. Это было меньшей проблемой при этом применении по сравнению с другим исследованием пациентов с CLL, поскольку ожидается, что нагрузка клонотипическими B-клетками при MM будет значительно более низкой, чем нагрузка злокачественными B-клетками у рефрактерных пациентов с CLL, подвергаемых лечению в этом исследовании.
Обоснование дозы
[00813] Для первых 3 пациентов авторы настоящего изобретения наблюдали клиническую активность в дозах, находящихся в диапазонах от 1,4×l07 до 1,1×l09 клеток CART-19. Это наблюдение демонстрирует, по меньшей мере у первых 3 подвергаемых лечению пациентов, что отсутствует очевидная взаимосвязь доза-ответ. Полный ответ наблюдали у пациентов, которым проводили введение с отличием доз на два порядка. Таким образом, в отличие от стандартных лекарственных средств, которые метаболизируются, CAR T-клетки могут иметь широкий диапазон ответа на дозу. Наиболее вероятно, это является следствием того, что CAR T-клетки способны интенсивно пролиферировать у пациентов. Таким образом, авторы настоящего изобретения выбрали диапазон дозы l-5×108 клеток CART-19 для инфузии. В этом исследовании с одним пациентом, предложенном на основании применения из сострадания, пациенту было предложено вплоть до 5×108 CART19-клеток без нижнего предела дозы. Для испытания у десяти пациентов, пациентам будет предложено 1-5×107 клеток CART-19.
Общая схема
[00814] Это исследование представляло собой исследование с одним пациентом, предложенное на основании применения из сострадания; оно было смоделировано после испытания фазы I для определения того, является ли инфузия аутологичных T-клеток, трансдуцированных для экспрессии CART-19, безопасной. Первичными целями исследования было определение безопасности, переносимости и потенциала к приживлению CART-19 T-клеток у пациентов, подвергнутых спасительной ASCT после раннего рецидива после первой ASCT. Протокол состоит из открытого предварительного исследования.
[00815] При включении в исследование индивидуумов будут подвергать биопсии костного мозга и стандартной лабораторной и визуализирующей оценке их MM. Пригодных для включения индивидуумов будут подвергать стационарному аферезу для получения больших количеств мононуклеарных клеток периферической крови (PBMC) для получения CART-19. T-клетки будут очищать от PBMC, трансдуцировать лентивирусным вектором TCRζ/4-1BB, увеличивать в количестве in vitro, а затем замораживать для последующего введения. Количество пациентов, которые имеют недостаточные количества T-клеток, экспансию или производство по сравнению с количеством пациентов, которые имеют успешно произведенные T-клетки, будут регистрировать; ожидается, что осуществимость производства продукта не будет проблематичной у этой популяции пациентов.
[00816] Индивидуумы, как правило, будут иметь достаточно стволовых клеток периферической крови, оставшихся сохраненными после мобилизации/сбора, проведенных при подготовке для первой ASCT, для проведения двух дополнительных ASCT. Те, которые не будут их иметь, будут подвергаться второй процедуре мобилизации/сбора либо до, либо после стационарного афереза с режимом в соответствии с предпочтениями лечащего врача. Приблизительно через две недели после первоначального лейкафереза индивидуумы будут поступать больницу и им будут вводить мелфалан в высокой дозе (сутки -2) с последующей инфузией аутологичных стволовых клеток через двое суток (0 сутки), и всем индивидуумам будут проводить инфузию CART-19 клеток через от двенадцати до четырнадцати суток (сутки +12-14). В исследование будет включено вплоть до 10 пациентов.
[00817] Всем индивидуумам будут проводить анализы крови для оценки безопасности, и приживления и персистенции клеток CART-19 с регулярными интервалами вплоть до 4 недели исследования. На сутки +42 и сутки +100, индивидуумам будут проводить аспирацию/биопсию костного мозга для оценки нагрузки плазмацитами костного мозга и транспорта клеток CART-19 в костный мозг. Формальную оценку ответа будут проводить на 100 сутки в соответствии с критериями 136 Международной рабочей группы по миеломе (IMWG), и мониторинг TTP будут проводить в соответствии со стандартной клинической практикой для пациентов с множественной миеломой. Основным результатом эффективности, измеренным в этом исследовании, будет сравнение TTP после первоначальной ASCT у пациента с TTP после ASCT в этом исследовании.
[00818] Первичным результатом этого исследования является безопасность и осуществимость инфузии клеток CART-19 с ASCT, в исследовании будет использоваться правило ранней остановки. В кратком изложении, если менее 2 тяжелых неожиданных неблагоприятных явления произойдет среди первых пятерых индивидуумов, подвергаемых исследованию, то в исследование включат дополнительных пять индивидуумов для включения заданного количества, составляющего 10. Авторы настоящего изобретения будут наблюдать подвергнутых лечению индивидуумов в течение 40 суток после инфузии CART-19 (т.е. до первой официальной оценки ответа на 42 сутки) перед включением последующего индивидуума до тех пор, пока не будет включено и исследовано пять индивидуумов. Для лечения второй группы из пяти пациентов период ожидания между индивидуумами не потребуется.
[00819] После интенсивного наблюдения в течение 6 месяцев индивидуумов будут оценивать по меньшей мере раз в три месяца в течение двух лет со сбором медицинского анамнеза, физикальным обследованием и тестами крови. После этой оценки индивидуумов будут включать в дополнительное исследование для ежегодного наблюдения по телефону и с помощью опросника в течение вплоть до дополнительных тринадцати лет для оценки долговременных проблем со здоровьем, таких как развитие новой злокачественной опухоли.
Первичные результаты исследования
[00820] Это предварительное испытание предназначено для исследования безопасности и осуществимости лечения аутологичными T-клетками, трансдуцированными CD19 TCRζ/4-lBB у пациентов, подвергающихся спасающей ASCT от MM после раннего рецидива после первой ASCT.
Первичные результаты безопасности и осуществимости включают:
[00821] Возникновение связанных с исследованием неблагоприятных явлений, определяемых как NCJ CTC 2: признаки/симптомы степени 3, лабораторная токсичность и клинические явления, которые возможно, вероятно или точно связаны с исследуемым лечением в какой-либо момент времени от инфузии до 24 недели. Они будут включать токсичность вследствие инфузии и любую токсичность, возможно связанную с клетками CART-19, включая, но не ограничиваясь ими:
a. Лихорадку
b. Сыпь
c. Нейтропению, тромбоцитопению, анемию, аплазию костного мозга
d. Дисфункцию печени
e. Легочные инфильтраты или другую легочную токсичность
f. GVHD-подобные синдромы, затрагивающие желудочно-кишечный тракт или кожу.
[00822] Будут исследовать осуществимость производства клеток CART-19 из продуктов афереза. Будут определять количество произведенных продуктов, которые не удовлетворяют критериям эффективности трансдукции вектора, чистоты T-клеток, жизнеспособности, стерильности и опухолевой контаминации.
[00823] Глубину и длительность ответа после трансплантации аутологичных стволовых клеток CART19 будут сравнивать с глубиной и длительностью ответа, который каждый пациент первоначально достиг после стандартной трансплантации аутологичных стволовых клеток.
Отбор и исключение индивидуумов
Критерии включения
[00824] Индивидуумы должны быть подвергавшимися предшествующей ASCT от MM и должны иметь прогрессирование в течение 365 суток после инфузии стволовых клеток. Пригодными для включения являются индивидуумы, которые подвергались двум предшествующим ASCT в качестве части запланированного режима консолидации с использованием тандемной ASCT. Прогрессирование будут определять в соответствии с критериями IMWG для прогрессирующего заболевания или, для пациентов, которые достигли CR или sCR после первоначальной ASCT, критериями рецидива CR (Durie et al. Leukemia 2006;20(9):1467-1473). N.B.: отсутствует требование, чтобы пациенты были включены в пределах 365 суток после предшествующей ASCT, и пациенты могут подвергаться лечению другими средствами, включая экспериментальные средства, после рецидива/прогрессирования после предшествующей ASCT перед включением в это исследование.
[00825] Индивидуумы должны подписать письменное информированное согласие.
[00826] Индивидуумы должны иметь адекватную функцию жизненно-важных органов для введения мелфалана в высокой дозе, как определяют по следующим критериям, определяемым в течение 12 недель до даты инфузии мелфалана: a. Уровень креатинина в сыворотке ≤ 2,5 или оцененное выведение креатинина ≥30 мл/мин и отсутствие зависимости от диализа. b. SGOT ≤ 3-x верхних пределов нормы и общий билирубин ≤ 2,0 мг/дл (за исключением пациентов, у которых гипербилирубинемия связана с синдромом Гилберта). c. фракция выброса левого желудочка (LVEF) ≥ 45% или, если LVEF равна <45%, выполненная по установленной форме оценка кардиологом, идентифицирующим отсутствие клинически значимого нарушения сердечно-сосудистой функции. Оценка LVEF должна быть проведена в пределах шести недель до включения в исследование. d. Достаточная легочная функция с FEV1, FVC, TLC, DLCO (после соответствующей коррекции по объему легких и концентрации гемоглобина) ≥40% от спрогнозированных величин. Исследование легочной функции должно быть проведено в пределах шести недель до включения в исследование.
[00827] Индивидуумы должны иметь общий статус ECOG 0-2, если только более высокий общий статус не является следствием исключительно боли в костях.
Критерии исключения: Индивидуумы не должны:
[00828] иметь активную и неконтролируемую инфекцию.
[00829] иметь активную инфекцию вирусом гепатита B, гепатита C или ВИЧ.
[00830] какое-либо неконтролируемое медицинское нарушение, которое исключает участие, как описано.
Режим лечения
[00831] Терапия рецидивирующей/прогрессирующей множественной миеломы
[00832] Пациенты могут получать, до включения в исследования, терапию от рецидивирующей/прогрессирующей множественной миеломы согласно предпочтениям их лечащих врачей. Терапию можно продолжать после включения в исследование.
[00833] Пациенты должны прекратить любую терапию за две недели до афереза и за две недели до мелфалана в высокой дозе. Если ожидается, что более двух недель пройдет между аферезом и мелфаланом в высокой дозе, пациенты могут возобновить терапию после афереза, в соответствии с мнением лечащего врача.
[00834] Мелфалан в высокой дозе (сутки -2)
[00835] Пациенты будут поступать в больницу на сутки -3 или -2 и будут подвергаться обследованию лечащим врачом и стандартным лабораторным тестам, которые включают мониторинг параметров синдрома лизиса опухоли, перед началом протокола лечения. Взятие крови для лабораторных тестов для мониторинга MM (SPEP, количественное определение иммуноглобулинов и бессывороточный анализ свободных легких цепей) будут проводить перед началом терапии, если такие тесты не будут проведены в течение 7 суток до поступления.
[00836] Терапия высокой дозы состоит из мелфалана в дозе 200 мг/м2, вводимой внутривенно в течение приблизительно 20 минут на сутки -2. Доза мелфалана будет снижена до 140 мг/м2 для пациентов в возрасте >70 лет или для пациентов любого возраста, которые по мнению лечащего могут не перенести дозу 200 мг/м2. Всем пациентам будут проводить стандартную противорвотную профилактику, которая может включать дексаметазон, и стандартную противомикробную профилактику.
[00837] Реинфузия стволовых клеток (0 сутки)
[00838] Инфузию стволовых клеток будут проводить на 0 сутки по меньшей мере через 18 часов после введения мелфалана в высокой дозе. Стволовые клетки будут инфузировать внутривенно в течение приблизительно 20-60 минут после премедикации согласно стандартной практике учреждения. Следует проводить инфузию по меньшей мере 2×106 CD34+ предшественников/кг массы тела. Кроме того, по меньшей мере 1×106 CD34+ предшественников/кг массы тела должны быть доступными в качестве запасного продукта стволовых клеток для инфузии в случае замедленного приживления или позднего отторжения трансплантата. G-CSF следует вводить SQ, начиная на сутки +5, с дозированием согласно стандартной практике учреждения. Другие поддерживающие меры ухода, такие как трансфузионное поддержание, будут проводить в соответствии со стандартным руководством учреждения.
[00839] Инфузия клеток CART19 (сутки +12-14)
[00840] Будут вводить однократную дозу T-клеток, трансдуцированных CART-19, состоящую из вплоть до 5×107 клеток CART-19. Минимальной приемлемой дозой для инфузии клеток, трансдуцированных вектором CD19 TCRζ4-1BB, является 1×107. Клетки CART-19 будут вводить в качестве однократной дозы посредством быстрой в/в инфузии на +12-14 сутки после инфузии стволовых клеток. Если пациент не будет удовлетворять каким-либо критериям включения, описанным в настоящем описании, в пределах окна из 12-14 суток, инфузию CART-19 можно отсрочить за пределы суток +12-14 до тех пор, пока не критерии не будут удовлетворены.
[00841] Поддерживающий леналидомид
[00842] Индивидуумам, которым проводили и которые перенесли поддерживающий леналидомид после их первой ASCT, будут повторно начинать проводить поддерживающую терапию леналидомидом приблизительно на сутки +100 при условии отсутствия противопоказаний по мнению лечащего врача. Начальная доза будет составлять 10 мг каждые сутки, если только предшествующий опыт не определит альтернативную исходную дозу для конкретного пациента. Поддерживающую терапию будут проводить до прогрессирования заболевания или появления непереносимости.
[00843] Получение и введение исследуемого лекарственного средства
[00844] CART-19 T-клетки получают в CVPF, и их не выдают из CVPF до тех пор, пока не будут удовлетворены одобренные FDA критерии выдачи инфузированных клеток (например, доза клеток, чистота клеток, стерильность, среднее количество копий векторов/клетка, и т.д.). После выдачи клетки будут транспортированы к постели пациента для введения.
[00845] Размораживание клеток. Замороженные клетки будут транспортировать на сухом льду к постели индивидуума. Клетки будут размораживать у постели пациента с использованием водяной бани, поддерживаемой при от 36°C до 38°C. Мешок будут осторожно растирать до тех пор, пока клетки не станут размороженными. В контейнере не должно оставаться замороженных комков. Если продукт клеток CART-19 по внешнему виду является поврежденным или мешок протекает, или иным образом нарушен, инфузию не следует проводить, и он должен быть возвращен в CVPF, как описано ниже.
[00846] Премедикация. Побочные эффекты после инфузий T-клеток включают временную лихорадку, озноб и/или тошноту; для обзора см. Cruz et al. (Cytotherapy 2010;12(6):743-749). Рекомендуется, чтобы индивидууму проводили премедикацию ацетаминофеном и дифенгидрамина гидрохлоридом перед инфузией клеток CART-19. Это введение медикаментов может повторяться каждые шесть часов при необходимости. Может быть назначен курс введения нестероидных противовоспалительных средств, если пациент продолжает иметь лихорадку, не смягчаемую ацетаминофеном. Рекомендуется, чтобы пациентам не вводили системные кортикостероиды, такие как гидрокортизон, преднизон, метилпреднизолон или дексаметазон в любой момент времени, за исключением случая угрожающей жизни чрезвычайной ситуации, поскольку это может иметь неблагоприятный эффект на T-клетки.
[00847] Фебрильная реакция. В маловероятном случае, когда у индивидуума развивается сепсис или системная бактериемия после инфузии CAR T-клеток, следует начинать введение соответствующих культур и медикаментозный контроль. Если в качестве причины предполагается контаминированный продукт CART-19 T-клеток, продукт можно повторно протестировать в отношении стерильности с использованием сохраненных образцов, которые хранятся в CVPF.
[00848] Введение. Инфузию будут проводить в отдельном помещении в Rhoads с использованием мер предосторожности для пациентов с иммунодефицитом. Трансдуцированные T-клетки будут вводить посредством быстрой внутривенной инфузии при скорости потока приблизительно от 10 мл до 20 мл в минуту через набор для крови Y-типа без латекса калибра 18 с 3-ходовым клапаном. Длительность инфузии зависит от общего объема, подлежащего инфузии, и рекомендованной скорости инфузии. Каждый мешок для инфузий будет иметь прикрепленный к нему ярлык, содержащий следующую информацию: "ТОЛЬКО ДЛЯ АУТОЛОГИЧЕСКИХ ЦЕЛЕЙ". Кроме того, ярлык будет иметь по меньшей мере два уникальных идентификатора, таких как инициалы индивидуума, дата рождения и номер исследования. Перед инфузией два индивидуума будут независимо проверять всю это информацию в присутствии индивидуума и, таким образом, будут подтверждать, что эта информация точно соответствует участнику.
[00849] Медицинское оборудование для неотложной помощи (т.е. тележка неотложной помощи) будет доступно в процессе инфузии на случай, если у индивидуума возникнет аллергический ответ или тяжелый гипотонический криз, или любая другая реакция на инфузию. Основные показатели жизнедеятельности (температура, дыхательная частота, пульс и кровяное давление) будут определять до и после инфузии, а затем каждые 15 минут в течение по меньшей мере одного часа или до тех пор, пока эти показатели не станут удовлетворительными и стабильными. Индивидуума попросят не уходить до тех пор, пока врач не решит, что это безопасно для него или для нее.
Упаковывание
[00850] Инфузия будет содержать однократную дозу 1-5×107 клеток, трансдуцированных CART19, c минимальной приемлемой дозой 1×107 клеток CART-19 для инфузии. Каждый мешок будет содержать аликвоту (объем зависит от дозы) криосреды, содержащей следующие реагенты инфузионной категории (% об./об.): 31,25% плазмалит-A, 31,25% декстроза (5%), 0,45% NaCl, вплоть до 7,5% DMSO, 1% декстран 40, 5% сывороточный альбумин человека.
Аферез
[00851] Процедуру афереза в большом объеме (12-15 литров или 4-6 объемов крови) проводят в центре афереза. В ходе этой процедуры получают PBMC для CART-19. Посредством одного лейкафереза намереваются собрать по меньшей мере 5×109 лейкоцитов для получения CART-19 T-клеток. Также получают и сохраняют базовый уровень лейкоцитов крови для удовлетворения требований FDA в отношении ретроспективного анализа и для исследований. Ожидается, что клеточный продукт будет готов для выдачи приблизительно через 2-4 недели. Проводят проточно-цитометрическое количественное определение подгрупп лимфоцитов, включая определение CD19 и CD20 B-клеток. Проводят базовую оценку проводят в отношении антител человека против VSV-G и против антител мыши (HAMA). Если индивидуум ранее имел достаточную коллекцию, полученную путем афереза, находящуюся в банке согласно современной надлежащей производственной практике в Clinical Cell and Vaccine Production Facility, то эти клетки можно использовать в качестве источника клеток для получения CART-19. Использование продукта афереза, находящегося в банке, может предотвратить расходы, временные затраты и риск для индивидуума, подвергающегося дополнительному сбору посредством афереза.
Циторедуктивная химиотерапия
[00852] Истощающая лимфоциты химиотерапия будет представлять собой мелфалан в высокой дозе, как описано в настоящем описании.
Инфузия CART-19
[00853] Инфузию будут начинать на сутки +12-14 после реинфузии стволовых клеток.
[00854] На сутки +12-14 перед первой инфузией пациентам будут проводить анализ CBC с подсчетом лейкоцитарной формулы, и оценку количеств CD3, CD4 и CD8, поскольку химиотерапию проводят частично для индукции лимфопении.
[00855] Первую дозу будут вводить с использованием однократной дозы. Клетки размораживают у постели пациента. Размороженные клетки будут вводить при переносимой скорости инфузии, чтобы длительность инфузии составляла приблизительно 10-15 минут. Для облегчения перемешивания клетки будут вводить одновременно с использованием Y-адаптера. Индивидуумам будут проводить инфузию и премедикацию, как описано в настоящем описании. Будут оценивать основные показатели жизнедеятельности индивидуума и будут проводить пульсовую оксиметрию перед дозированием, в конце инфузии и каждые 15 минут после этого в течение 1 часа и до тех пор, пока эти показатели не будут стабильными и удовлетворительными. Образец крови для определения исходного уровня CART-19 будут получать в любой момент времени до первой инфузии и через от 20 минут до 4 часов после каждой инфузии (и отсылать в TCSL).
[00856] Пациентам, испытывающим токсичность, связанную с мелфаланом в высокой дозе, будут отсрочивать инфузию до тех пор, пока их токсичность не разрешится. Конкретные факторы токсичности, служащие основанием отсрочивания инфузий T-клеток, включают: 1) легочные: потребность в дополнительном кислороде для поддержания насыщения более 95% или присутствие радиографических аномалий на рентгенограмме грудной клетки, которые прогрессируют; 2) сердечные: новая сердечная аритмия, не контролируемая медикаментозным путем, 3) гипотензия, требующая сосудосуживающего поддержания, 4) активная инфекция: положительные культуры крови в отношении бактерий, грибов или вируса в течение 48-часов после инфузии T-клеток.
Контроль токсичности
[00857] Неконтролируемая пролиферация T-клеток. Контроль токсичности, ассоциированной с инфузией аллогенных или аутологичных T-клеток, проводят с использованием курса фармакологической иммуносупрессии. Сообщалось, что ассоциированная с T-клетками токсичность в организме отвечает на системные кортикостероиды. Если происходит неконтролируемая пролиферация T-клеток (токсичность степени 3 или 4, связанная с клетками CART-19), индивидуумов можно лечить кортикостероидами. Индивидуумов можно лечить импульсной дозой метилпреднизолона (2 мг/кг в/в, разделенная q8 ч×2 суток), а затем быстрым уменьшением дозы.
[00858] Кроме того, исходя из наблюдений индивидуумов, которых лечили по другому протоколу, существует некоторая угроза синдрома активации макрофагов (MAS), хотя ожидается, что нагрузка CD 19+ опухолью будет значительно более низкой у пациентов с миеломой, чем у пациентов с CLL. Лечение и режим лечения этой токсичности будут осуществляться в соответствии с мнением лечащего врача и исследователя. Предполагаемое управление течением может включать: если индивидуум имеет лихорадку более 101°F, которая длиться более 2 последовательных дней и отсутствуют признаки инфекции (отрицательные культуры крови, CXR или другой источник), можно рассматривать тоцилизумаб 4 мг/кг. Добавление кортикостероидов и терапии против TNF может рассматриваться врачом.
[00859] Истощение B-клеток. Является возможным, что будет происходить истощение B-клеток и гипогаммаглобулинемия. Это является общим со способами терапии, направленными против CD20. В случае клинически значимой гипогаммаглобулинемии (т.е. системных инфекций), индивидууму будут вводить внутривенный иммуноглобулин (IVIG) согласно установленным клиническим руководствам по дозированию для восстановления нормальных уровней сывороточных иммуноглобулинов, как и в случае ритуксимаба.
[00860] Первичное отторжение трансплантата. Первичное отторжение трансплантата (т.е. отсутствие приживления) может быть более частым после второй ASCT по сравнению с первой ASCT. Критерии включения в исследование предусматривают, что должно быть доступно достаточное количество стволовых клеток для спасительной реинфузии по решению лечащего врача в случае первичного отторжения трансплантата.
[00861] Результаты
[00862] В настоящее время в этом продолжающемся испытании проводится лечение посредством CTL019 трех рефрактерных к лечению пациентов с развернутой множественной миеломой. Результаты для двух из этих пациентов показывают, что оба из них имеет выраженные противоопухолевые эффекты терапии CTL019, исходя из первичной оценки эффективности в момент времени три месяца. Третий пациент еще не достиг момента времени три месяца. Результаты для двух пациентов более подробно описаны ниже.
[00863] Первая пациентка с миеломой завершила ее оценку ответа на сутки +100, и она имела очень хороший ответ на терапию CART19. Были проведены следующие тесты со следующими результатами:
- SPEP/иммунофиксация: отрицательные
- иммунофиксация в моче: слабая не поддающаяся количественному определению полоса легкой цепи каппа при иммунофиксации (также присутствовала на 38 сутки, т.е. не является новой)
В остальном, пациентка удовлетворяла критериям строгой полной ремиссии, включая:
- сывороточное соотношение свободных легких цепей: нормальное
- биопсия костного мозга: отрицательная
- IgA-иммунофенотипирование: IgA ниже предела обнаружения
[00864] Не считая слабого результата не поддающейся количественному определению легкой цепи каппа при иммунофиксации в моче, пациентка удовлетворяла всем критериям "строгой полной ремиссии". Обобщение иммунофенотипирования плазмацитов в 3 момента времени (сутки -2, сутки +38, сутки +103) представлено на фиг.39, и оно демонстрирует, что IgA пациентки находится ниже предела обнаружения. Обобщение показывает тяжелую нагрузку множественной миеломой на сутки -2 и отсутствие поддающейся обнаружению нагрузки на сутки +38 и +103, которое классифицирует пациентку как "MRD-отрицательная" посредством проточного анализа. На сутки +103, обобщение показывает восстановление нормальных поликлональных CD19+ плазмацитов и B-клеток. Пациентка не имела симптомов заболевания или терапии и осуществляла деятельность подобно здоровому индивидууму.
[00865] Вторая подвергнутая лечению пациентка еще не достигла момента времени +100 суток. Однако в настоящий момент времени она хорошо себя чувствует, но еще слишком рано определять эффект инфузии CTL019.
Пример 7: Ингибитор киназы/CAR19 T-клеточная комбинированная терапия лимфомы из клеток мантийной зоны
[00866] Адоптивная терапия T-клетками является в значительной степени перспективной для лечения лимфоидных злокачественных опухолей. Являются перспективными клинические ответы при мелколимфоцитарной лимфоме/хроническом лимфоцитарном лейкозе (SLL/CLL) и остром лимфоцитарном лейкозе (ALL) с использованием адоптивного переноса аутологичных T-клеток, трансдуцированных химерными рецепторами антигенов (CAR) против специфического антигена B-клеток CD19 (CAR19 T-клетки/клетки CART19) с использованием CTL109. Авторы настоящего изобретения ранее описали первоначальные данные для 3 пациентов с рефрактерным к химиотерапии SLL/CLL, включенных в испытание фазы I для лечения положительных по CD19 злокачественных опухолей с использованием CD19-специфического CAR (CAR19 T-клетки/клетки CART19). Использованный подход вовлекал генетическую модификацию происходящей из пациента массы T-клеток с использованием лентивируса для экспрессии нацеленного на CD19 CAR, который содержит сигнальные домены, происходящие из CD137 и TcRz. Для этого исследования клетки увеличивали в количестве с использованием технологии экспансии с использованием гранул с антителом против CD3 и CD28 авторов настоящего изобретения, и клетки подвергали инфузии вскоре после истощения лимфоцитов без поддержания цитокинами (Kalos M, et al. (2011) Sci Transl Med. 3: 95ra73; и Porter DL, et al. (2011) N Engl J Med. 365: 725-733). Эти ранние результаты были чрезвычайно перспективными: (i) после одного курса лечения 2/3 пациентов достигли полных ремиссий и оставались свободными от заболевания на протяжении 15+ месяцев после лечения, в то время как третий пациент, которого лечили кортикостероидами, вскоре после инфузии T-клеток продемонстрировал выраженный частичный ответ. (ii) У этих пациентов авторы изобретения смогли воспроизвести элементы, предположительно требуемые для конечной эффективности адоптивных стратегий терапии на основе T-клеток, а именно, устойчивую экспансию T-клеток in vivo, устранение заболевания, уменьшение количества T-клеток и длительное функциональное персистирование. На сегодняшний день 10 пациентов с SLL/CLL подвергают лечению, причем 2 из них остаются в полной клинической и молекулярной ремиссии, 5 испытывают частичную ремиссию и 3 проявляют отсутствие поддающегося измерению ответа. В другом исследовании два пациента с B-клеточным ALL достигли полной ремиссии с 1 рецидивом с лейкозными клетками, лишенными экспрессии CD19.
[00867] При лимфоме из клеток мантийной зоны (MCL), как до, так и после крупноклеточной трансформации, также, вероятно, будет полезной адоптивная терапия на основе CART19, в частности, в комбинации с ингибиторами киназы, такими как ингибиторы киназ, которые прямо воздействуют на клетки MCL.
[00868] Для дальнейшего анализа комбинации адоптивной терапии на основе CART19 в комбинации с ингибиторами киназы будут использовать высокопроизводительный скрининг для оценки нескольких ингибиторов, нацеленных на киназы, критичные для патогенеза MCL: CDK4/6, BTK и mTOR, в комбинации с клетками CART19. Наиболее перспективные комбинации будут оценивать более подробно, как in vitro, так и in vivo, в модели на мышах с ксенотрансплантатом MCL, которая в конечном итоге может позволить разработку клинического протокола для оценки комбинации низкомолекулярного ингибитора киназы и иммунотерапии CART-клетками у пациентов с MCL.
[00869] В этом исследовании будут проводить доклинические испытания для определения потенциальной клинической эффективности этого подхода при различных подтипах MCL и для оценки способности к терапевтическому нацеливанию на клетки MCL с использованием CART19-клеток либо отдельно, либо в комбинации с низкомолекулярными ингибиторами отдельных белков семейства киназ, экспрессия и активность которых являются ключевыми для выживания и роста клеток MCL.
План исследования
[00870] В доклинических условиях будут оценивать возможность терапевтического нацеливания на клетки MCL, как культивируемые, так и первичные клетки, с использованием ингибиторов киназы с документированным патогенным значением при MCL и клеток CART19. Высокопроизводительный анализ с MTT будут использовать для определения эффекта этих средств для идентификации потенциальных комбинаций, дозирования и расписания применения средств. Наиболее перспективные 2-3 комбинации будут оценивать более тщательно в отношении клеточной функции, клеточной передачи сигнала, исходя из фосфорилирования, и экспрессии генов сначала in vitro, а затем in vivo, в модели с ксенотрансплантатом MCL.
Исследования in vitro для охарактеризации способности комбинаций ингибитор киназы/клетки CART-19 к эффективному нацеливанию на клетки MCL
[00871] В соответствии с этой задачей будут проводить оценку с использованием детальных функциональных, фенотипических, биохимических и молекулярных анализов, приведенных выше, для исследования in vitro влияния низкомолекулярных ингибиторов киназ на клетки MCL, а также для исследования взаимодействий между клетками CART19 и клетками MCL и влияния ингибиторов на эти взаимодействия.
[00872] Основными способами достижения цели будет получение всестороннего набора данных для:
i. документирования того, что клетки CART19 активируются культивируемыми и первичными клетками MCL и лизируют их;
ii. демонстрации того, что выбранные ингибиторы киназы повышают способность друг друга и/или клеток CART19 устранять клетки MCL без отрицательного влияния на функцию клеток CART19, когда их соответствующим образом применяют с точки зрения дозы и, для некоторых из них, времени введения ингибитора относительно клеток CART19; и
iii. установления режима времени и дозировок ингибитора BTK для применения в экспериментах с ксенотрансплантатами MCL in vivo с использованием мышей NSG.
[00873] Целями этого исследования являются, например, идентификация терапевтических комбинаций низкомолекулярных ингибиторов, нацеленных на киназы, критичные для патобиологии MCL: CDK4, BTK и mTOR, вместе с клетками CART19, мониторинг активности CART19 и охарактеризация функциональных, биохимических и молекулярных эффектов терапии на MCL.
[00874] Эти исследования должны установить рациональный режим времени и дозы лечения ингибитором киназы BTK совместно с терапией CART19 для оценки in vivo согласно 2 задаче.
Исследования in vivo для оценки способности клеток CART19 к нацеливанию на фолликулярную лимфому отдельно и в комбинации с ингибитором BTK
[00875] В соответствии с этой задачей авторы настоящего изобретения будут исследовать в моделях на животных способность отдельной комбинации(й) ингибитор/клетки CART19 влиять на рост прижившихся и первичных клеток MCL.
[00876] Основными способами достижения цели будет получение всестороннего набора данных для:
i. демонстрации того, что выбранная комбинация ингибитор/клетка CART19 значительно повышает выживаемость животных с трансплантированным MCL по сравнению с контролями (животные, которых лечили одним средством и имитирующим средством);
ii. установление режима времени и дозировки выбранной комбинации ингибитор киназы/CART19 для применения в качестве основания для последующего клинического испытания.
[00877] Цели этого исследования включают оценку лечения и схемы дозирования, определенной в задаче 1, для идентифицированной комбинации ингибитор киназы/CART19 плюс ингибитор BTK, и для исследования того, является ли лечение BTK синергичным с CART19 в отношении нацеливания на MCL у мышей NSG с ксенотрансплантатами клеток MCL, как культивируемых, так и первичных.
[00878] Для достижения предполагаемых целей будут использовать следующие типы клеток, соединения, животных и экспериментальные методологии:
[00879] Клетки MCL:
[00880] Четыре клеточных линии MCL (Jeko-1, Mino, SP-49 и SP-53) и замороженные живыми образцы 15 первичных MCL (12 типичных и 3 бластоидных). Хотя клеточные линии хорошо растут самопроизвольно, первичные клетки будут культивировать отдельно, а также в присутствии кондиционированной среды, собранной от стромальных клеток костного мозга HS5, для повышения их жизнеспособности.
[00881] Клетки CART19:
[00882] Первичные T-клетки человека, модифицированные способами инженерии для экспрессии CAR19, будут получать с использованием трансдукции лентивирусом и с использованием общепринятых протоколов ((Kalos M, et al. (2011) Sci Transl Med. 3: 95ra73; и Porter DL, et al. (2011) N Engl J Med. 365: 725-733). После однократного события трансдукции T-клетки, как правило, экспрессируют CAR19 с частотой, превышающей 30%.
[00883] В исследованиях авторов настоящего изобретения будут использованы популяции CART 19 от пяти пациентов с SLL/CLL (50-100 флаконов/пациент с 1×107 клеток/флакон уже доступны). Клетки CART19 будут идентифицировать с использованием специфичного к CAR19 идиотипического антитела (STM). Активность CART19 будут контролировать как in vitro, так и in vivo, у мышей NSG стандартизированным образом с использованием клеточной линии CD19+ NALM-6, отрицательной по CD19 клеточной линии K562 и трансдуцированной CD19 клеточной линии K562. Хотя функция клеток CART19 не ограничена по MHC, также будут использовать клетки CART19 по меньшей мере от 5 пациентов с MCL.
[00884] Ингибиторы киназ
[00885] Будут исследовать ингибиторы следующих киназ: CDK4/6 (PD0332991), BTK (PCI-32765), mTORC1 (рапамицин), MNK (4-амино-5-(4-фторанилино)пиразолo[3,4-d]пиримидин (Marzec M, et al. PLoS One 6:e24849); и новое соединение от Eli Lilly (Gupta M, et al. (2012) Blood 119:476-487); mTOR (OSI-027) и двойной PI3K/mTOR (PF-04691502).
[00886] Соединения будут оценивать сначала с заданным спектром эффективных доз, включая нетоксичные концентрации, достигнутые в сыворотках пациента, чтобы убедиться в оптимальном ингибировании киназы.
[00887] Животные:
[00888] Эксперименты in vivo будут проводить с использованием мышей NOD-SCID-IL-2Rgc null (NSG), у которых проводят взятие крови и которые доступны от Stem Cell and Xenograft Core с использованием производителей, полученных от Jackson Laboratory (Bar Harbor). Мышей будут содержать в стерильных условиях с использованием микроизоляторов с HEPA-фильтрами и будут кормить облученной пищей и подкисленной водой.
[00889] Мышей после трансплантации будут лечить антибиотиками (неомицин и полимиксин) на протяжении эксперимента. Для всех исследований будут использовать животных в возрасте от шести до восьми недель в равных соотношениях самцов и самок, в соответствии с протоколами, одобренными Institutional Animal Care and Use Committee.
[00890] Авторы настоящего изобретения использовали животных NSG в предшествующих исследованиях по адоптивному переносу T-клеток специально для оценки дифференциальной активности клеток CART19 (Witzig TE, et al. (2010) Hematology Am Soc Hematol Educ Program. 2010:265-270, MTT-тест). Сначала будут проводить высокопроизводительный MTT-тест для оценки роста клеток MCL в ответ на ингибиторы киназы, используемые отдельно или в различных комбинациях. Этот анализ способен одновременно определить скорость пролиферации и жизнеспособность клеток, что позволяет эффективную оценку множества возможных комбинаций низкомолекулярных ингибиторов в присутствии или в отсутствие клеток CART19. Ключевыми аспектами этого анализа будут охарактеризация эффекта лекарственных средств с точки зрения потенциального синергического, аддитивного или антагонистического эффекта. Кроме того, можно оценивать эффект низкомолекулярных ингибиторов на клетки CART19. Хотя ингибирование BTK должно быть специфическим для B-клеток, ингибирование mTOR и CDK4/6 будет влиять на клетки CART19. Определение надлежащего расписания применения лекарственных средств для минимизации их потенциального эффекта на клетки CART19 будет одной из целей этих экспериментов.
[00891] Для проведения теста клетки MCL будут высевать в 96-луночные планшеты в количестве 1×104 клеток/лунка в трех экземплярах и подвергать воздействию среды или ингибиторов киназы в различных комбинациях и различных концентрациях клеток CART-19. Через 48 и 74 ч будут определять относительное количество метаболически активных клеток с использованием колориметрического анализа восстановления MTT (Promega).
[00892] Значимость отличий между средними величинами (+/- S.D.) для контролей и различных условий лечения будут оценивать с использованием t-критерия Стьюдента со значением P<0,05, считающимся статистически значимым.
[00893] Анализы пролиферации и апоптоза клеток:
[00894] Далее наиболее перспективные комбинации лекарственных средств будут оценивать в анализах мечения CFSE и метки dUTP-конца разрыва цепи (tunel) для определения как цитостатических, так и цитотоксических компонентов ингибирования роста клеток MCL, соответственно. В первом из анализов клетки MCL будут метить добавлением CFSE с ингибитором BTK и/или немеченными клетками CART-19. Через 48 ч культивируемые клетки будут анализировать способом FACS в отношении паттерна профиля мечения клеток MCL-типа посредством CFSE. Анализ tunel будут проводить с использованием набора ApoAlert DNA Fragmentation Assay Kit от BD Biosciences в соответствии с протоколом изготовителя.
[00895] В кратком изложении, клетки MCL будут культивировать с ингибиторами и/или клетками CART19 в течение 48 или 72 часов. После промывания клетки будут окрашивать меченым антителом против CD20 и будут повышать их проницаемость, промывать и инкубировать в буфере с TdT в течение 1 часа при 37°C. Реакцию будут останавливать, клетки промывать, ресуспендировать и анализировать проточной цитометрией с использованием программного обеспечения CellQuest PRO.
[00896] Функциональные анализы CART19:
[00897] Авторы настоящего изобретения будут измерять эффекторную активность клеток CART19 против клеточных линий MCL с использованием дегрануляции CD107, анализов внутриклеточной секреции цитокинов (ICS), анализов пролиферации, цитолиза и мультиплексных анализов для обнаружения цитокинов (32). Для анализов дегрануляции и ICS, эффектор (T-клетки) и мишень (опухолевые клетки) будут совместно инкубировать в присутствии антитела против CD107 в течение 4 часов при E:T 0,2:1, а затем будут проводить окрашивание поверхности (CAR19, CD3, CD8, CD4) и внутриклеточных маркерных цитокинов в соответствии с общепринятыми протоколами. Цитолиз клеток MCL будут оценивать с использованием анализа цитолиза на основе проточной цитометрии. Для анализов пролиферации эффекторные клетки будут предварительно нагружать CFSE (флуоресцеин-сукцинилэстераза карбоксифлуоресцеинсукцинимидилового сложного эфира), смешанной с клетками-мишенями при E:T 0,2:1, совместно инкубировать при 37°C в течение 4 суток, окрашивать в отношении поверхностных маркеров (CAR19, CD3, CD8, CD4) и анализировать в отношении разведения CFSE проточной цитометрией.
[00898] Мультиплексные анализы цитокинов
[00899] Авторы настоящего изобретения будут измерять продукцию цитокинов клетками CART19 в ответ на мишени MCL с использованием анализов с гранулами на основе Luminex, как описано в (STM32). Для этих анализов авторы настоящего изобретения будут использовать 30-плексный набор Invitrogen, который одновременно измеряет IL-1β, IL-1RA, IL-2, IL-2R, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-12 (p40⁄p70), IL-13, IL-15, IL-17, TNF-α, IFN-α, IFN-γ, GM-CSF, MIP-1α, MIP-1β, IP-10, MIG, эотаксин, RANTES, MCP-1, VEGF, G-CSF, EGF, FGF-основный и HGF в сыворотке, плазме или супернатанте культуры ткани.
[00900] Мультипараметрический проточно-цитометрический анализ клеток CART19T:
[00901] Авторы настоящего изобретения будут измерять модулирование поверхностных маркеров, ассоциированных с функциональной активацией и супрессией клеток CART19, после совместной инкубации с опухолевыми клетками с использованием четырехцветной проточной цитометрии и специализированного BD LSR II, оборудованного 4 лазерами (синий (488 нм), фиолетовый (405 нм), зеленый (532 нм) и красный (633 нм), доступного от University of Pennsylvania Abramson Cancer Center Flow Cytometry Core. Все данные проточной цитометрии будут анализировать с использованием программного обеспечения FlowJo (TreeStar, San Carlos, CA). Эти анализы будут проводить по существу как описано в (STM42), с использованием выводного канала для исключения погибших клеток и клеток-мишеней (CD19+), и идиотип-специфического реагента CAR19 для обнаружения клеток CART19 (STM). Авторы настоящего изобретения будут оценивать следующие маркеры положительных и отрицательных по CART19 клеток (CD3+/CD8+ и CD3+/CD4+) после совместной инкубации с опухолевыми клетками, либо на интактных клетках, либо на клетках, у которых повысили проницаемость. Авторы настоящего изобретения создали мультипараметрические панели для этих маркеров:
- активация/эффекторная функция: CD25, CD154, CD134, CD137, CD69, CD57, CD28, T-bet
- ингибирование: CD152 (CTLA4), PD1, LAG3, CD200
- супрессия (Treg) CD4+/CD25++/CD127-, Fox-P3+
[00902] Одновременно клетки MCL, идентифицированные окрашиванием на CD19 и CD5, будут исследовать в отношении экспрессии иммунодепрессивных белков: CD174 (PD-L1) CD173 (PD-L2) и CD152.
[00903] Влияние ингибитора на клеточную передачу сигнала:
[00904] Эта часть исследования будет сфокусирована только на отдельных соединениях, которые оказались наиболее эффективными в функциональных анализах (рост, пролиферация и апоптоз клеток), описанных выше. Эффект будут исследовать отдельно для каждого лекарственного средства и для выбранных комбинаций, и исследование будут корректировать в зависимости от конкретных соединений. Например, в то время как с использованием комбинации ингибиторов mTORC1 и MNK будут оценивать передачу сигнала mTORC1, в частности фосфорилирование eIF-4E, ингибирование BTK будет сфокусировано на каскадах PI3K-AKT и MEK-ERK, и ингибирование CDK4/6 будет сфокусировано на фосфорилировании Rb. Эти исследования будут проводить путем вестерн-блоттинга с использованием фосфо-специфических антител, как описано (Marzec M, et al. (2006) Blood. 108:1744-1750; Marzec M, et al. (2008) Blood 111: 2181-2189; Zhang Q, et al. (2011) Proc Natl Acad Sci USA 108: 11977-11982). В кратком изложении, клетки MCL будут лизировать и белковые экстракты будут анализировать с использованием метода Лоури (Bio-Rad) и наносить на полиакриламидный гель. Для исследования фосфорилирования белков подвергнутые блоттингу мембраны будут инкубировать с фосфор-специфическими антителами, например, антителами, специфичными в отношении S6rp S235/236, eIF4E S209, 4E-BP1 T37/46, 4E-BP1 T70 (Cell Signaling), для оценки активности mTORC1 и MNK и их ингибирования. Далее, мембраны будут инкубировать с соответствующими вторичными конъюгированными с пероксидазой антителами. Блоты будут проявлять с использованием системы ECL Plus System от Amersham.
[00905] Анализ экспрессии генов геномного масштаба:
[00906] Ингибирование передачи сигнала в клетках, как правило, приводит к изменениям транскрипции генов. Для определения эффектов отдельного ингибитора или нескольких ингибиторов на транскрипцию генов при MCL будут проводить анализ экспрессии генов геномного масштаба, который проводили, как описано в Marzec M, et al. (2008) Blood 111: 2181-2189; Zhang Q, et al. (2011) Proc Natl Acad Sci USA 108: 11977-11982. В кратком изложении, клетки будут обрабатывать в культурах в трех экземплярах выбранным ингибитором или его разбавителем в течение 0, 4 и 8 часов. Далее будут очищать тотальную РНК для увеличения в количестве мРНК, которую будет подвергать обратной транскрипции, мечению и исследованию путем гибридизации с микрочипом Affimetrix против всех известных экзонов генов. Данные микрочипа будут нормализовывать и суммировать с использованием RMA, как выполнено в алгоритме GeneSpring и MAS5. В полученные значения p будут вносить поправку на множественное тестирование с использованием средней доли ложных отклонений гипотезы (FDR) способом возрастания Benjamini-Hochberg. Дифференциальное тестирование экспрессии будут проводить с использованием различных инструментов, включая SAM и PartekPro. Затем выявленные представляющие интерес гены будут кластеризовать, исходя из профилей экспрессии (GeneSpring или Spotfire), и кластеры будут анализировать в отношении функциональных групп и каскадов в базах данных KEGG, Ingenuity Pathway Analysis и Gene Ontology с использованием NIH-David в качестве инструмента поиска. Для генов, идентифицированных на основе этих данных, будут проводить независимое подтверждение экспрессии посредством количественной ОТ-ПЦР на большем наборе образцов (по меньшей мере 20) различных типов MCL (стандартный против бластоидного и положительный по SOX11 против отрицательного по SOX11).
[00907] Полноэкзомный анализ последовательности ДНК:
[00908] Для лучшей охарактеризации случаев MCL в отношении их патогенеза и, в возможной степени, ответа на предлагаемые здесь комбинированные способы терапии, будут исследовать последовательность экзомной ДНК. Полноэкзомное улавливание и секвенирование нового поколения для образцов ДНК MCL и нормальной периферической крови будут проводить с использованием NimbleGen SequenceCapture 2.1M Human Exome Array и устройства HiSeq 2000/1000 Illumina.
[00909] Оценка эффекта лечения на ксенотрансплантированных опухолях:
[00910] Мыши NSG будут иметь опухоли MCL (происходящие как из клеточных линий MCL: Jeko и Mino, так и из первичных клеток, имплантированных в качестве либо фрагментов тканей, либо, менее предпочтительно, клеточных суспензий). Опухоли будут развивать путем подкожной имплантации небольших фрагментов опухоли. Терапию будут начинать после достижения опухолями 0,2-0,3 см. Ингибитор(ы) киназы будут вводить через зонд с дозой и во время, которые будут предварительно определены in vitro (например, авторы настоящего изобретения планировали применять ингибитор BTK одновременно с клетками CART19, учитывая его специфичность в отношении B-клеток и ожидаемое отсутствие какого-либо ингибиторного эффекта на клетки CART19). Клетки CART-19 будут инъецировать в хвостовую вену имеющих опухоль мышей в дозе 1×107/животное, ингибитор(ы) киназы будут вводить через зонд в дозе и во время, предварительно выбранным in vitro. Доза была определена авторами настоящего изобретения как достаточная для воспроизводимого устранения злокачественных клеток, и в то же время недостаточная для индукции реакции "ксенотрансплантат против хозяина". Большой исходный клеточный материал CART19 (1×1010) будут получать и замораживать для минимизации вариабельности, ассоциированной с отличиями в эффекторных клетках. Первичным показателем в этих экспериментах будет выживаемость, которую авторы настоящего изобретения будут оценивать с использованием кривых Каплана-Мейера. В качестве второго показателя авторы настоящего изобретения будут оценивать дифференциальную экспансию клеток CART19 у животных после инфузии T-клеток. Это станет возможным вследствие того факта, что продукт с инфузируемыми T-клетками будет состоять из положительных и отрицательных по CART19 клеток в определенном соотношении. Для этих анализов у животных будут отбирать кровь каждую неделю через хвостовую вену (каждый раз по 25 микролитров), а затем будут проводить лизис эритроцитов и окрашивание на CD3, CD4, CD8 и CART19 человека. Предпочтительная экспансия CART19-клеток (по меньшей мере 2-кратное увеличение соотношения CART19+/CART19-) будет признаком селективной индуцируемой MCL экспансии клеток CART19. Для оценки результатов лечения объемы имплантированных подкожных опухолей будут измерять следующим образом по формуле: объем=0,4ab2, где a и b обозначают, соответственно, длинный и короткий диаметры опухоли. Отличия в объеме опухолей между группами с лечением и без лечения будут статистически анализировать с использованием стандартного t-критерия. Мышей будут умерщвлять в конечный момент экспериментов (>30 суток), или, если опухоли достигнут > 1,2 см в диаметре, или когда будут отмечаться какие-либо признаки страдания животного. Отличия в объемах опухоли между группами мышей с лечением и без лечения будут статистически анализировать с использованием стандартного t-критерия. Опухоли, а также внутренние органы, будут извлекать, обрабатывать и анализировать посредством гистологическго анализа и для отдельных опухолей посредством иммуногистохимии с использованием набора антител против B-клеток (CD20, CD79a, Pax-5, CD10, BCL-6) и T-клеток (CD2, CD3, CD4, CD5, CD7, CD8, TIA-1), и маркера пролиферации Ki-67.
[00911] Статистический анализ:
[00912] В функциональных исследованиях in vitro значимость отличий между средними величинами (+/- S.D.) для контролей и различных условий лечения будут оценивать с использованием t-критерия Стьюдента со значением P < 0,05, считающимся статистически значимым. Исходя из предшествующего опыта авторов изобретения, ожидается, что различия между экспериментальными группами мышей будут большими. Таким образом, для каждой группы лечения будут использовать 10 мышей NSG, что обеспечить мощность по меньшей мере 90% при уровне ошибки 1 типа 0,05 с двухсторонним критерием для двух выборок, учитывая, что ожидаемое соотношение между различием в средних значениях для лечения и стандартных отклонениях равно по меньшей мере 3. Данные будут представлены в качестве среднего значения±SEM. Сравнение между группами будут проводить t-критерия для двух выборок. Значимой будут считать величину p < 0,05. Для исследований с выживаемостью без опухоли будут использовать группы по 10 мышей для сравнения выживаемости, и будут регистрировать статус заболевания (опухоль против отсутствия опухоли) и время без опухоли для каждой мыши. Будут строить кривую выживаемости Каплана-Мейера и для сравнения кривых выживаемости будут использовать логарифмический ранговый критерий. Уровень значимости контролируют на уровне 0,05.
Пример 8: Комбинированная терапия ибрутинибом/CAR19 T-клетками лимфомы из клеток мантийной зоны
[00913] Эксперименты, описанные в этом примере, охарактеризовывают активность CART19 в комбинации с лечением ибрутинибом для лечения лимфомы из клеток мантийной зоны in vitro и in vivo. Ибрутиниб представляет собой низкомолекулярный ингибитор BTK, часто используемый для лечения некоторых гематологических злокачественных опухолей. Эксперименты in vitro, описанные в настоящем описании, включают оценку пролиферации, продукции цитокинов, дегрануляции, CD107a и цитотоксичности. Модели с ксенотрансплантатами на мышах использовали для исследования эффективности и оптимальной дозировки лечения CART19 с ибрутинибом in vivo. Хотя ибрутиниб проявляет значительную активность при MCL, приблизительно 30% пациентов не отвечают, и среди отвечающих только от 21% до приблизительно одной трети имеют полную ремиссию (Wang et al. NEJM 369,6 (2013):507-16). Достижение полной ремиссии ассоциировано с увеличением выживаемости без прогрессирования. Более того, терапия может приводить к резистентности к лекарственному средству со срединной продолжительностью ответа 17,5 месяцев. В некоторых случаях мутации в участке связывания BTK или непосредственно ниже наблюдали после терапии ибрутинибом, что указывает на механизм резистентности к лекарственному средству, который может становиться все более частым. См., например, Woyach et al. NEJM. 370,24(2014):2286-94. Также блокада функции BTK приводит к ингибированию передачи сигнала B-клеточного рецептора (BCR) и не является непосредственно цитотоксической. См., например, Ponader et al. Blood. 119,5(2012):1182-89. Отсутствие цитотоксичности и неуспех в устранении злокачественных клонов предрасполагают к клональной эволюции под давлением отбора. Также, предварительные данные об увеличенной трансформации в агрессивное заболевание у пациентов, которых лечили ибрутинибом от CLL, являются вызывающими опасения. См., например, Byrd et al. NEJM. 369,1(2013):32-42; и Parikh et al. Blood. 123,11(2014):1647-57.
[00914] Инфузия аутологичных T-клеток, трансдуцированных химерными рецепторами антигенов (CAR) против специфического антигена B-клеток CD19 (CTL019, CART19) приводит к значительным клиническим ответам у большинства пациентов с различными B-клеточными новообразованиями, прежде всего, острым лимфобластным лейкозом (ALL). См., например, Maude et al. NEJM. 371,16(2014):1507-17; и Ruella et al. Expert Opin. Biol. Ther. (2015):1-6. Присутствие масс в лимфатических узлах или объемного заболевания может приводить к снижению инфильтрации T-клеток и последующему уменьшению противоопухолевой активности. Объемная лимфоаденопатия, как оказалось, не ухудшает ответ на ибрутиниб. Wang et al. NEJM. 369,6(2013):507-16. Также ибрутиниб показан конкретную эффективность в отношении снижения опухолевых масс и мобилизации неопластических B-клеток в периферической крови.
Способы
Клеточные линии и первичные образцы. Клеточные линии MCL получали в ATCC (Mino, Jeko-1, SP-49), в то время как MCL-RL получали из прогрессирующего плеврального выпота пациента с MCL. Для экспериментов in vitro клеточные линии поддерживали в культуре со средой RPMI, дополненной 10% эмбриональной телячьей сывороткой, пенициллином и стрептомицином. Для некоторых экспериментов клетки MCL-RL и Jeko-1 трансдуцировали зеленой люциферазой жука-щелкуна/eGFP, а затем сортировали с получением популяции, положительной >99%. В качестве контролей использовали линии клеток острого лейкоза MOLM-14, K562 или NALM-6 и клеточную линию T-ALL JURKAT. Эти клеточные линии первоначально получали от ATCC. Деидентифицированные образцы костного мозга человека с первичным MCL (BM) и периферической крови (PB) были получены из клинической практики University of Pennsylvania. Для всех функциональных исследований первичные клетки размораживали по меньшей мере за 12 часов до эксперимента и держали в покое при 37° C.
Получение конструкций CAR и CAR T-клеток. Химерный рецептор антигена мыши против CD19 (содержащий шарнирную область CD8, костимулирующий домен 41BB и сигнальный домен CD3-зета) получали, как описано ранее. См., например, Milone et al. Molecular Therapy: the Journal of the American Society of Gene Therapy. 17,8(2009):1453-64. Получение CAR-экспрессирующих T-клеток проводили, как описано ранее. См., например, Gill et al. Blood. 123,15(2014):2343-54. Нормальные донорные CD4 и CD8 T-клетки или мононуклеарные клетки PB (PBMC) получали от Human Immunology Core of the University of Pennsylvania. T-клетки высевали в количестве 1×106/мл с соотношением CD4:CD8 1:1 и увеличивали в количестве в среде X-vivo 15 (Lonza, 04-418Q), с сывороткой человека AB 5% (Gemini, 100-512), пенициллином/стрептомицином (Gibco, 15070063) и Glutamax (Gibco, 35050061) с использованием Dynabeads против CD3/CD28 (Life Technologies, 11161D), добавленных на 1 сутки культивирования и удаленных на 6 сутки. T-клетки трансдуцировали лентивирусом на 2 сутки. T-клетки увеличивали в количестве в культуре в течение 8-15 суток и собирали, когда средний объем клеток был ниже 300 фл. Затем T-клетки криосохраняли в FBS 10% DMSO для последующих экспериментов. Перед всеми экспериментами, T-клетки размораживали и держали в покое в течение ночи при 37°C.
Ибрутиниб. Ибрутиниб (PCI-32765) приобретали от MedKoo (#202171) или Selleck Biochemicals (#S2680) в качестве порошка или раствора в DMSO. Для экспериментов in vitro ибрутиниб разбавляли до концентраций 10, 100 и 1000 нМ. Для экспериментов in vivo, порошковый ибрутиниб растворяли в 10% растворе HP-бета-циклодекстрина (1,6 мг/мл) и вводили мышам в питьевой воде.
Мультипараметрический проточно-цитометрический анализ. Антитела против антител человека приобретали от Biolegend, eBioscience или Becton Dickinson. Клетки выделяли из культуры in vitro или от животных, промывали один раз в PBS, дополненном 2% эмбриональной телячьей сывороткой, и окрашивали в течение 15 минут при комнатной температуре. Для количественного определения клеток использовали гранулы Countbright (Invitrogen) в соответствии с инструкциями производителя. Во всех анализах представляющую интерес популяцию гейтировали, исходя из характеристик прямого против бокового рассеяния с последующим синглетным гейтированием, и живые клетки гейтировали с использованием Live Dead Aqua (Invitrogen). Для контроля качестве было включено временное гейтирование. Поверхностную экспрессию CAR19 выявляли, как описано ранее. См., например, Kalos et al. Science Translational Medicine. 3,95(2011):95ra73. Проточную цитометрию проводили на цитометре с четырьмя лазерами Fortessa-LSR (Becton-Dickinson) и анализ проводили с использованием FlowJo X 10.0.7r2 (Tree Star).
Анализ дегрануляции. Анализ дегрануляции проводили, как описано ранее. См., например, Kalos et al. Science Translational Medicine. 3,95(2011):95ra73. T-клетки инкубировали с клетками-мишенями в соотношении 1:5 в среде для T-клеток. К сокультуре добавляли антитело против CD107a-PECY7 (Biolegend), антитело против CD28 (BD Biosciences), антитело против CD49d (BD Biosciences) и моненсин (BD Biosciences). Через 4 часа клетки собирали и окрашивали в отношении экспрессии CAR, CD3, CD8 и окрашивали Live Dead aqua (Invitrogen). Клетки фиксировали и увеличивали их проницаемость (Invitrogen Fix/Perm buffers), а затем проводили внутриклеточное окрашивание для обнаружения множества цитокинов (IFN, TNFa, IL-2, GM-CSF, MIP1b).
Анализ пролиферации. T-клетки промывали и ресуспендировали в количестве 1×107/мл в 100 мкл PBS и окрашивали 100 мкл CFSE 2.5 мкМ (Invitrogen) в течение 5 минут при 37°C. Затем реакцию гасили холодной средой и клетки промывали три раза. Мишени облучали в дозе 100 Гр. T-клетки инкубировали в соотношении 1:1 с облученными клетками-мишенями в течение 120 часов с добавлением среды через 24 часа. Затем клетки собирали, окрашивали на CD3, CAR и посредством Live Dead aqua (Invitrogen), перед проточно-цитометрическим анализом добавляли гранулы Countbright beads (Invitrogen) для абсолютного количественного определения.
Анализы цитотоксичности. Люциферазу/eGFP+ клетки NALM-6 или RL использовали для анализа цитотоксичности, как описано ранее. См., например, Gill et al. Blood. 123,15(2014):2343-54. Мишени инкубировали в указанных соотношениях с эффекторными T-клетками в течение 4 или 16 часов. Уничтожение вычисляли посредством биолюминесцентной визуализации на камере Xenogen IVIS-200 Spectrum.
Измерения цитокинов. Эффекторные клетки и клетки-мишени соинкубировали в соотношении 1:1 в среде для T-клеток в течение 24 ч. Супернатант собирали и анализировали посредством 30-плексного чипа Luminex (Luminex Corp, FLEXMAP 3D) в соответствии с протоколом изготовителя (Invitrogen). См., например, Kalos et al. Science Translational Medicine. 3,95(2011):95ra73.
Эксперименты in vivo. Мышей NOD-SCID-γ-цепь-/- (NSG), первоначально полученных из Jackson Laboratories, приобретали у Stem Cell and Xenograft Core of the University of Pennsylvania. Все эксперименты проводили про протоколам, одобренным Institutional Animal Care and Use Committee (IACUC). Схема использованных моделей с ксенотрансплантатами обсуждается в настоящем описании. Клетки (клеточные линии MCL или T-клетки) инъецировали в 200 мкл PBS в указанной концентрации в хвостовую вену мышей. Биолюминесцентную визуализацию проводили с использованием камеры Xenogen IVIS-200 Spectrum и анализировали с использованием программного обеспечения LivingImage v. 4.3.1 (Caliper LifeSciencies). Животных умерщвляли в конце эксперимента, или когда они удовлетворяли заданным конечным результатам согласно протоколам IACUC.
Иммуногистохимия. Иммуногистохимическое окрашивание (IHC) фиксированных в формалине заключенных в парафин тканей проводили на устройстве Leica Bond-III с использованием Bond Polymer Refine Detection System. Антитела против CD3, CD4, CD8, Pax5 и циклина D1 использовали неразбавленными. Индуцированное нагреванием извлечение эпитопа проводили в течение 20 минут с использованием раствора ER2 (Leica Microsystems AR9640). Изображения получали в цифровой форме с использованием Aperio ScanScopeTM.
Статистический анализ. Весь статистический анализ проводили с использованием GraphPad Prism 6 для windows версии 6.04.
Клеточные линии лимфомы из клеток мантийной зоны
[00915] Большинство существующих линий лимфомы из клеток мантийной зоны (MCL) были иммортализованы, и их увеличивали в количестве на протяжении многих поколений in vitro, таким образом, они утратили их зависимость от передачи сигнала через B-клеточный рецептор. Следовательно, они являются малочувствительными к ибрутинибу. Проводили эксперименты in vitro для определения чувствительности клеточных линий MCL к лечению ибрутинибом. Эти клеточные линии также использовали для оценки эффективности комбинированного лечения ибрутинибом/CART19 в экспериментах, рассмотренных далее в этом примере. Клетки MCL собирали из плеврального выпота пациента с многократно рецидивировавшим MCL. Как исходные клетки (RLпервичные), так и клеточная линия, происходящая из них (RL), имели бластоидную морфологию, типичный иммунофенотип MCL и были положительными по классической транслокации t(11;14) согласно флуоресцентной гибридизации in situ (FISH) (фиг.52A, 52B, 52C).
[00916] Клетки RL и JEKO-1 культивировали с различными дозами ибрутиниба (0,1 нМ, 1 нМ, 10 нМ, 100 нМ, 1 мкМ и 10 мкМ) и чувствительность к ибрутинибу определяли путем измерения уменьшения биолюминесценции (BLI). Как показано на фиг.31A, клетки RL были чувствительными к лечению ибрутинибом дозозависимым образом. Однако клетки JEKO-1 были устойчивыми к лечению ибрутинибом (без демонстрации сниженной биолюминесценции в качестве функции увеличенной дозировки ибрутиниба).
[00917] Чувствительность клеток RL, Jeko-1 и Mino к ибрутинибу также анализировали с использованием анализа MTT. Воздействие на RL возрастающих концентраций ибрутиниба in vitro приводило к дозозависимому ингибированию пролиферации и последующему фосфорилированию медиатора, что указывает на эффект ибрутиниба, направленный на мишень, с IC50 10 нМ. Напротив, установившиеся клеточные линии MCL Jeko-1 и Mino были относительно резистентными к ибрутинибу с результатами IC50 вплоть до10 мкМ (фиг.52D). Для подтверждения RL в качестве эффективной модели для экспериментов in vivo, иммунодифицитным мышам NOD-SCID с нокатом γ-цепи (NSG) трансплантировали 1×106 экспрессирущих люциферазу клеток RL (фиг.52E). Оценивали их опухолевую нагрузку и выживаемость. После внутривенной инъекции MCL приживался у всех мышей и локализовывался в селезенке и печени с последующим диссеминированием в костный мозг, кровь и лимфатические узлы (фиг.52F). Гистология пораженной селезенки и печени согласуется с паренхиматозной инфильтрацией MCL (фиг.52G).
[00918] Эти результаты показали, что эти различные клеточные линии, таким образом, можно использовать для моделирования чувствительного к ибрутинибу и резистентного к ибрутинибу MCL.
Клетки лимфомы из клеток мантийной зоны являются чувствительными к уничтожению посредством CART19
[00919] Основную доклиническую работу, демонстрирующую эффективность CART19, проводили с использованием клеточных линий B-ALL, которые являются не чувствительными к ибрутинибу. Более того, наилучшие клинические ответы на сегодняшний день были описаны у пациентов с B-ALL, в то время как пациенты с вялотекущими B-клеточными злокачественными опухолями, согласно сообщениям, имеют более низкие ответы.
[00920] Для демонстрации того, что MCL является чувствительной к уничтожению посредством CART19 в этой модели T-клетки здорового донора трансдуцировали конструкцией CAR против CD19, которую использовали в клинических испытаниях. См., например, Porter, NEJM 2011. Проводили серию экспериментов in vitro, чтобы показать, что чувствительная к ибрутинибу клеточная линия RL и устойчивая к ибрутинибу клеточная линия Jeko-1 обеспечивали эквивалентную дегрануляцию CART-19, продукцию цитокинов, уничтожение и пролиферацию (фиг.53A, 53B, 53C, 53D). Кроме того, периферическую кровь и костный мозг получали от двух пациентов с MCL на лейкозной фазе, что позволило увеличение в количестве и трансдукцию аутологичных T-клеток посредством CAR против CD19. Аутологичные происходящие от пациента CART19-клетки были реактивными в отношении MCL, в то время как нетрансдуцированные T-клетки были нереактивными в отношении их соответствующих аутологичных MCL (фиг.53E, 53F). Эти результаты указывают на то, что MCL являются чувствительной к эффекторным функциям CART19.
Оценка лечения ибрутинибом/CART19 in vitro
[00921] Эффект ибрутиниба на T-клетки ранее игнорировали, исходя из кратковременных анализов активности, как описано в Honigberg et al. Proc. Natl. Acad. Sci. USA. 107(2010):13075-80. Позднее был описан анализ эффекта ибрутиниба на T-клеточную киназу ITK для подтверждения иммуномодулирующей роли ибрутиниба в отношении CD4 T-клеток путем ингибирования поляризации Th2-типа. См. Dubovsky et al. Blood 122,15(2013):2539-49. Анализ цитокинов у пациентов, которых лечили CART19, несколькими группами показал, что терапия CART19 ассоциирована как с Th1 (IL2, IFNγ, TNF), Th2 (IL-4, IL-5, IL-10), так и с другими цитокинами (см., например, Kalos et al. Science Translational Medicine 3,95(2011):95ra73). В этом примере оценивали эффект функции CART19 с ибрутинибом при концентрациях ибрутиниба, равных, превышающих или являющихся более низкими, чем концентрации ибрутиниба, которые ожидались бы для пациентов (средняя пиковая концентрация в сыворотке 100-150 нг/мл). См. Advani et al. J. Clin. Oncol. 2013;31:88.
[00922] Было обнаружено, что клетки CART19 содержат ITK. Неспецифическая стимуляция клеток CART19 через TCR в присутствии ибрутиниба приводила к снижению уровня фосфорилированной ITK (pITK-Y180), как ранее было описано для CD4+ T-клеток. См. Dubovsky et al. Blood 122,15(2013):2539-49. Напротив, специфическая стимуляция клеток CART19 через CAR не приводила к сниженной активации ITK (фиг.54A). Это наблюдение показало, что воздействие ибрутиниба, вероятно, не оказывало неблагоприятного влияния на функцию CART19.
[00923] Кроме того, определяли кратковременную и долговременную функцию клеток CART19 in vitro в присутствии ибрутиниба. Ибрутиниб в клинически значимых концентрациях не нарушал пролиферацию, дегрануляцию или продукцию цитокинов в клетках CART19; хотя при сверхфизиологических концентрациях происходило ингибирование функций клеток CART19, вероятно, отражающее неспецифическую токсичность (фиг.54B, 54C, 10B).
[00924] В частности, PBMC, выделенные от нормального здорового донора, трансдуцировали лентивирусной конструкцией CAR против CD19, как описано выше. Полученные CAR19-экспрессирующие T-клетки (CART19) культивировали и пассировали для определения способности к пролиферации и экспансии. T-клетки в соотношении 1:1 CD4:CD8 культивировали с различными концентрациями ибрутиниба (10 нМ, 100 нМ и 1000 нМ ибрутиниб) или без него. Ибрутиниб добавляли при каждом пассировании клеток. Количество клеток подсчитывали на 0 сутки, 5 сутки, 6 сутки, 7 сутки, 9 сутки и 10 сутки (фиг.9A). Также проводили мониторинг объема клеток (фиг.9B).
[00925] Также использовали окрашивание CFSE и проточно-цитометрический анализ для оценки пролиферации клеток CART19 в присутствии ибрутиниба после стимуляции опухолевыми клеточными линями MOLM14, JEKO-1 и RL. MOLM14 представляет собой клеточную линию AML, и JEKO-1 и RL представляют собой клеточные линии лимфомы из клеток мантийной зоны. В частности, клетки RL представляют собой новую клеточную линию MCL, происходящую из неопластических B-клеток, полученных из плеврального выпота пациента с рецидивирующим MCL. Клетки CART19 и опухолевые клетки смешивали в соотношении 1:1 и оценивали пролиферацию в течение 5 суток. Процент пролиферирующих клеток указан на каждой гистограмме на фиг.10A. Количественное определение пролиферации, как показано на фиг.10B, демонстрируют. Что высокие дозы ибрутиниба могут ингибировать пролиферацию клеток CART19 в процессе сокультивирования с клеточными линиями MCL.
[00926] Дегрануляция T-клеток указывает на активацию цитолитических T-клеток и способность инициировать антигенспецифическую цитотоксичность. CD107a является функциональным маркером дегрануляции T-клеток, временно экспрессируемым на клеточной поверхности после стимуляции T-клеток. Проточно-цитометрический анализ использовали для количественного определения CD107a-экспрессирующих CART19 T-клеток после стимуляции опухолевыми клеточными линиями MOLM14, JEKO-1 и RL. CD107a-экспрессирующие клетки присутствовали в Q2 (квадрант 2) клеточных профилей, показанных на фиг.11A. Количественное определение результатов, полученных из профилей, представленных на фиг.11A, представлено на фиг.11B. Эти результаты указывают на то, что сокультивирование клеток CART19 либо с MCL-RL, либо с JEKO-1, приводило к массивной CAR-специфической дегрануляции CD107a.
[00927] Продукцию цитокинов CART19 T-клетками в присутствии ибрутиниба также количественно определяли после стимуляции различными опухолевыми клеточными линиями. Продукцию IL-2, TNF-α и IFN-γ оценивали проточной цитометрией. Клетки, продуцирующие цитокины, находятся в квадранте 2 профилей, показанных на фиг.12, фиг.13 и фиг.14. CART19 T-клетки, стимулированные JEKO-1 и RL, продемонстрировали увеличение экспрессии цитокинов. Также возрастающие концентрации ибрутиниба не влияли на процент продуцирующих цитокины клеток CART19.
[00928] Секрецию цитокинов из клеток CART19 после стимуляции опухолевыми клетками и в присутствии варьирующей концентрации ибрутиниба анализировали с использованием 30-плексного анализа LUMINEX. Анализировали цитокины, секретируемые TH1-клетками, такие как IL-2, IFN-γ и TNF-α. Анализировали цитокины, секретируемые TH2-клетками, включая IL-4, IL-5, IL-6, IL-10, IL-13, IL-15, IL-17, MIP1a, GM-CSF, MIP-1b, CP-1, IL-1Ra, IL-7, IP-10, IL-1b, VEGF, G-CSF, EGF, HGF, IFNa, IL-12, RANTES, эотаксин, IL-2R, MIG и IL-8. Как показано на фиг.15, TH1- и TH2-цитокины секретировались CART19 T-клетками.
[00929] Также эксперименты с использованием двух различных способов показали, что отсутствовали отличия в поляризации Th1/Th2 между подвергнутыми воздействию ибрутиниба и не подвергнутыми воздействию ибрутиниба клетками CART19 (фиг.54D).
[00930] Уничтожение клеток MCL клетками CART19 усиливалось в присутствии ибрутиниба, что указывает по меньшей мере на аддитивный эффект комбинации (фиг.54E). Однако, собственная цитотоксическая функция клеток CART19 не усиливалась в присутствии ибрутиниба (фиг.54F).
[00931] Дополнительные анализы биолюминесценции проводили для оценки уничтожения клетками CART19 опухолевых клеток. Клетки CART19 высевали с опухолевыми клетками MOLM14, JEKO-1 и RL, содержащими люциферазный репортер, в различных соотношениях, таких как 1:1; 1:0,5; 1:0,25 и 1:0 в 96-луночном планшете в двух экземплярах. Через 24 часа биолюминесценцию выявляли и количественно определяли. Результаты показали, что биолюминесценция в образцах MOLM14 не снижалась после инкубации с клетками CART19. Однако для клеток JEKO-1 и RL биолюминесценция снижалась в присутствии клеток CART19, что указывает на то, что CART19-клетки опосредовали уничтожение клеток JEKO-1 и RL (фиг.16A, 16B, 16C, 16D, 16E и 16F). При обработке ибрутинибом происходило дальнейшее снижение биолюминесценции, что указывает на то, что комбинация ибрутиниба и CART19 вызывала усиленное уничтожение клеток JEKO-1 и RL относительно обработки CART19 отдельно. В соответствии с этими результатами, подсчет общего количества клеток после каждой обработки показал, что обработка посредством CART19 клеток JEKO-1 и RL вызывала снижение количества клеток и еще большее снижение при обработке CART19 и ибрутинибом (фиг.17B и 17C), что указывает на то, что комбинированная терапия была не только эффективной в отношении уничтожения клеток MCL, но и приводила к эффективному уничтожению клеточных линий MCL.
Оценка лечения ибрутинибом/CART19 in vivo
[00932] В этих экспериментах модели лимфомы из клеток мантийной зоны на мышах использовали для оценки комбинированной терапии CART19 и ибрутинибом in vivo.
[00933] В этом примере использовали схемы, такие как схемы, показанные на фиг.20, 55 и 5A. На фиг.20 показана схема тестирования комбинированной терапии CART19/ибрутинибом в моделях MCL на мышах in vivo. 1×106 клеток из линий клеток RL (MCL-3), JEKO-1 (MCL-4) и NALM6 (MCL-5) инъецируют мышам NSG (20 мышей для каждого эксперимента). После одной недели 1 для обеспечения приживления начинают лечение на 0 сутки, и это лечение представляет собой: 0,5-1×106 клеток CART19 (посредством инъекции), 25 мг/кг/сутки ибрутиниба (оральный зонд) или лечение CART19+ибрутиниб. На 7 сутки, 14 сутки, 21 сутки и 28 сутки визуализируют биолюминесценцию для мониторинга размера опухоли. Мышей, которым вводят ибрутиниб, непрерывно лечат ибрутинибом. Также проводят мониторинг выживаемости мышей. На фиг.55 и 56 показаны дополнительные схемы тестирования комбинированной терапии CART19/ибрутинибом в моделях MCL на мышах in vivo. 2×106 клеток MCL-RL инъецируют мышам NSG. После одной недели для обеспечения приживления (приживление подтверждали путем визуализации биолюминесценции), начинали лечение на 7 сутки (после инъекции клеток MCL-RL), и это лечение представляет собой: контроль в виде носителя, клетки CART19 (2×106 клеток) и/или ибрутиниб (125 мг/кг/сутки). На 14, 21, 28 и 35 сутки (после инъекции клеток MCL-RL) проводят визуализацию биолюминесценции для мониторинга размера опухоли.
[00934] Исследовали эффект лечения ибрутинибом отдельно в модели MCL на мышах in vivo. Клетки RL, трансфицированные геном GFP/люциферазы, внутривенно инъецировали иммунодефицитным мышам NSG что приводило к 100% приживлению MCL в печени и селезенке с распространением в итоге в лимфатические узлы и костный мозг. Мышей лечили различными дозами ибрутиниба: 25 мг/кг/сутки и 250 мг/кг/сутки. Среднюю биолюминесценцию, соответствующую росту опухоли, оценивали в различные моменты времени. Как показано на фиг.32, происходящие из RL опухоли продемонстрировали связанную с дозой чувствительность. Проводили дополнительные эксперименты с титрованием доз ибрутиниба у мышей, содержащих клетки RL, и они показаны на фиг.57. Более высокая доза приводила к лучшей противоопухолевой активности без повышения токсичности, что согласуется с более высокой дозой ибрутиниба, используемой в клинике при MCL (Wang et al. NEJM 369,6(2013):507-16).
[00935] Также проводили определение дозы CART19. Две линии клеток MCL, RL (MCL-1) и JEKO-1 (MCL-2), содержащие репортер GFP-люцифераза, инъецировали мышам NSG на 0 сутки. CART19 T-клетки инъецировали на 7 сутки в различных дозировках, например, в количестве 0,5×e6 клеток, 1×e6 клеток или 2×e6 клеток. Мониторинг мышей проводили, например, в течение 100 суток. В различные моменты времени проводили мониторинг мышей в отношении размера опухоли (например, биолюминесцентная визуализация) (фиг.18A и 18B, и фиг.19A), и в отношении общей выживаемости (например, кривая выживаемости Каплана-Мейера) (фиг.18C и фиг.19B). Различные дозы клеток CART19 продемонстрировали дозозависимую противоопухолевую эффективность, причем доза 2×106 клеток CART19/мышь была наиболее эффективной дозой (фиг.19A).
[00936] Эти исследования обеспечили возможность проведения прямого сравнения двух способов терапии MCL. Как показано на фиг.58, у мышей, которым вводили клетки CART-19, была достигнута длительная выживаемость. Отсутствовали отличия в противоопухолевом эффекте при сравнении нетрансдуцированных T-клеток плюс ибрутиниб с ибрутинибом отдельно. Таким образом, во всех последующих экспериментах контрольные группы представляли собой носитель и ибрутиниб отдельно (фиг.59).
[00937] Также исследовали добавление CART19 к ибрутинибу, как подробно представлено на схеме на фиг.56. Оценка эффекта ибрутиниба на опухолевую нагрузку продемонстрировала умеренно замедленный рост опухоли в ранние моменты времени. Напротив, терапия клетками CART19 привела к отчетливому снижению опухолевой нагрузки в течение нескольких недель. У мышей, которым вводили клетки CART19 отдельно, после этого следовало начало вялотекущего рецидива на 40 сутки, в то время как мыши, которых лечили клетками CART19, а также ибрутинибом, не имели поддающегося обнаружению заболевания до 80 суток (фиг.60). Гистопатология органов, извлеченных в конце эксперимента, продемонстрировала персистирование заболевания у всех контрольных и подвергнутых лечению ибрутинибом мышей с очагами некроза опухоли у подвергнутых лечению ибрутинибом мышей. Большинство мышей, которых лечили CART19 отдельно, демонстрировали вялотекущий рецидив в течение длительного периода времени, который сопровождался персистированием клеток CART19, в то время как мыши, которых лечили CART19-ибрутинибом, продемонстрировали избавление от опухоли и исчезновение CART19 из вовлеченных органов (данные не представлены).
Механизм комбинированного эффекта CART19 и ибрутиниба
[00938] Эксперименты in vitro, описанные в настоящем описании, показали, что ибрутиниб ни нарушал, ни отчетливо усиливал кратковременные эффекторные функции CART19. Исследования in vivo продемонстрировал, что монотерапия ибрутинибом имела умеренный противоопухолевый эффект. Результаты показали, что ибрутиниб мог значительно усиливать противоопухолевую функцию клеток CART19 (фиг.60). Таким образом, проводили эксперименты для определения механизма этого эффекта.
[00939] Было показано, что ITK ингибирует поляризацию Th2 и смещение в сторону фенотипа Th1 (Dubovsky et al. Blood 122,15(2013):2539-49). У мышей, которых лечили клетками CART19 и ибрутинибом, с использованием этого анализа не наблюдали увеличения Th1-клеток по сравнению с монотерапией клетками CART19 (фиг.61A, 61B). Однако воздействие на мышей ибрутиниба привело к увеличению уровня периферических клеток CART19. Отсутствовали отличия в маркере пролиферации Ki67 между группой лечения и контрольной группой (фиг.61C), так что этот анализ не обнаруживал отличий в пролиферации. Аналогично, не было отличий в антиапоптотическом маркере Bcl2 или маркере апоптоза фосфотидилсерине, что указывает на то, что отличия в количествах CART-клеток не были связаны с нарушением апоптоза (фиг.61D). Поскольку ибрутиниб ассоциирован с периферическим лимфоцитозом у пациентов, проводили эксперименты для определения того, встречается ли это также у мышей, которых лечили ибрутинибом отдельно. Через одну неделю после начала введения ибрутиниба у мышей, которых лечили ибрутинибом, было больше циркулирующих клеток MCL и меньше клеток MCL в лимфатических узлах/органах. Интересно, что это увеличение наблюдали как в чувствительной к ибрутинибу, так и резистентной к ибрутинибу модели in vivo, также как также его наблюдали у мышей NSG с трансплантированной клеточной линией острого лейкоза NALM-6 (данные не представлены).
[00940] Чтобы понять роль ибрутиниба в экспансии T-клеток in vivo, авторы настоящего изобретения трансплантировали мышам NSG клетки MCL-RL WT, а затем лечили их положительными по люциферазе T-клетками. Мыши, которых лечили как CTL019, так и CTL019-ибрутинибом, продемонстрировали интенсивную экспансию T-клеток по сравнению с UTD или UTD-ибрутинибом (данные не представлены). Затем авторы настоящего изобретения исследовали частоту различных подгрупп T-клеток in vivo и не выявили отличий в T-клетках PB через 1 неделю после инфузии T-клеток (данные не представлены). Поскольку CXCR4 вовлечен в запускаемую ибрутинибом мобилизацию B-клеток у человека, авторы настоящего изобретения проверили экспансию CXCR4 in vivo в T-клетках PB мышей, которых лечили CTL019 или CTL019-ибрутинибом: уровень CXCR4 был сходным в 2 группах (данные не представлены). Наконец, анализировали экспрессию ингибиторного/костимулирующего рецептора на T-клетках PB мышей, которых лечили CART19 и CART19-ибрутинибом. Не наблюдали отличий в экспрессии TIM3, LAG3, CD137 или CTLA4, однако у мышей, которых лечили CTL019 и UTD в комбинации с ибрутинибом, наблюдали сниженную экспрессию PD-1.
Заключения
[00941] Способы терапии B-клеточных злокачественных опухолей включают низкомолекулярные ингибиторы передачи сигнала BCR и способы терапии с использованием направленных на CD19 T-клеток. В случае рецидивирующего MCL, ингибитор BTK ибрутиниб в настоящее время одобрен FDA и обеспечивает высокие первоначальные показатели ответа. К сожалению эти ответы имеют тенденцию тому, чтобы быть временными, и требуют более высоких доз лекарственного средства, чем дозы, используемые в случае CLL. CART-19 приводят к длительным ответам у пациентов с B-ALL высокого риска, и они также могут быть эффективными при других B-клеточных злокачественных опухолях. Предварительные данные указывают на то, что ответы зрелых B-клеточных злокачественных опухолей на CART-19 могут быть более низкими, чем у B-ALL, однако механизм этого расхождения еще предстоит установить. В этом примере исследовали влияние добавления ибрутиниба к CART19 при лечении MCL.
[00942] Различные линии клеток MCL с переменной чувствительностью к ибрутинибу (IC50 в диапазоне от 10 нМ до 10 мкМ) использовали для экспериментов in vitro. Эти различные клеточные линии использовали для моделирования как чувствительной к ибрутинибу, так и резистентной к ибрутинибу MCL. При всех кроме наиболее высоких доз ибрутиниба клеточная функция CART19 оставалась ненарушенной, с интактной кинетикой экспансии T-клеток, распознаванием опухоли и уничтожением, и продукцией цитокинов. Более того, результаты не выявили поляризации T-хелперных клеток при воздействии ибрутиниба. Эти данные могут быть следствием комбинации факторов, включая применение смешанной культуры клеток CD4 и CD8 в противоположность модели с экспериментированием только с CD4, выполненной Dubovksy et al. Blood 122,15(2013):2539-49. Как чувствительные к ибрутинибу, так и резистентные к ибрутинибу клеточные линии в высокой степени активировали клетки CART19 и индуцировали уничтожение, продукцию цитокинов и пролиферацию. Комбинация CART19 и ибрутиниба in vitro привела по меньшей мере к адаптивному уничтожению опухоли. Результаты, представленные в этом примере, демонстрируют превосходство CART19 над ибрутинибом, когда каждый из них использовали в качестве монотерапии в клинически значимых дозах и схемах введения (однократная доза для CART19, непрерывное введение для ибрутиниба).
[00943] Также в этом примере выполняли системную модель с ксенотрансплантатом MCL с использованием клеточной линии MCL-RL, полученной в лаборатории. Лечение этих мышей различными дозами аллогенных CAR19 T-клеток приводило к зависимому от дозы противоопухолевому эффекту. Сходный ответ на дозу CART-19 также наблюдали в резистентной к ибрутинибу клеточной линии JEKO-1. Лечение MCL-RL in vivo проводили различными дозами (например, 0, 25 и 125 мг/кг/сутки) ибрутиниба, что приводило к срединной общей выживаемости, соответственно, 70, 81 и 100 суток (p < 0,001). Прямое сравнение in vivo ибрутиниба 125 мг/кг и CART19 продемонстрировало значительно улучшенный контроль опухоли для мышей, которых лечили CART19. Также мышей с трансплантированными MCL-RL лечили носителем, ибрутинибом, CART19 или комбинацией CART19 и ибрутиниба (iCART19). При клинических значимых дозах монотерапия MCL посредством CART19 была лучшей, чем монотерапия ибрутинибом, и комбинация ибрутиниба с CART19 приводила к усиленному противоопухолевому эффекту. В частности, комбинация iCART19 in vivo приводила к первоначально более высоким циркулирующим уровням клеток CART19, за которыми следовали глубокие ответы опухоли, и рецидивы были значительно отсрочены, когда к CART19 добавляли ибрутиниб. Комбинация iCART19 приводила к улучшенному контролю опухоли, причем 80% мышей достигали полной ремиссии длительного выживания без заболевания. Механистически, мыши, которых лечили ибрутинибом, имели более высокие количества циркулирующих клеток CART19 без изменений в фенотипе Th1/Th2 или памяти. Таким образом, результаты, представленные в настоящем описании, демонстрируют, что ибрутиниб можно комбинировать с CART19 рациональным образом, и указывают на то, что свойства каждого из этих способов терапии могут компенсировать отличия от других, что, таким образом, приводит к усиленному долговременному противоопухолевому эффекту. Эксперименты и результаты комбинирования ингибирования передачи сигнала BCR с направленной на CD19 T-клеточной терапией создали условия для рационального комбинирования способов терапии B-клеточных злокачественных опухолей, не имеющих перекрестной резистентности.
[00944] Кинетика ответа опухоли и рецидива указывает на то, что ибрутиниб служит либо для углубления первоначального ответа, достигнутого посредством CTL019 отдельно, либо для усиления долговременной способности CTL019-клеток к иммунному надзору.
Пример 9: Комбинированная терапия ибрутинибом/CAR19 T-клетками хронического лимфоцитарного лейкоза
[00945] Ибрутиниб также используют для лечения хронического лимфоцитарного лейкоза (CLL). Ибрутиниб не продемонстрировал цитотоксических эффектов на T-клетки или NK-клетки. Однако, в клетках CLL ибрутиниб стимулирует запрограммированную клеточную гибель и ингибирует миграцию и адгезию опухолевых клеток. В этом примере проводили эксперименты для исследования: 1) эффекта ибрутиниба на получение CART19 от пациентов, которых подвергали терапии ибрутинибом; и 2) оптимальное время лечения ибрутинибом в комбинации с CART19 для оптимальной функции in vivo.
Эффект ибрутиниба на продукцию и функцию CART19
[00946] PBMC здорового донора получали с использованием афереза, как описано в настоящем описании, например, в примере 6. PBMC инкубировали с 5 мкМ ибрутиниба в течение 30 минут или оставляли необработанными (для контроля), а затем клетки промывали два раза. Затем клетки трансдуцировали лентивирусными конструкциями, содержвашими CAR19, для получения CART19 T-клеток с использованием способов, описанных в настоящем описании, например, в Примере 4. FACS-анализ количества CART19 T-клеток, полученных из обработанных ибрутинибом PBMC, проводили для определения количества CART19 T-клеток, полученных из обработанных ибрутинибом PBMC по сравнению с необработанными PBMC. Как показано на фиг.21, 15% трансдуцированных обработанных ибрутинибом PBMC экспрессировали CAR19 и 12% трансдуцированных необработанных PBMC экспрессировали CAR19. Эти результаты демонстрируют, что обработка ибрутинибом не влияла на эффективность лентивирусной трансдукции или продукцию CART19 T-клеток. Таким образом, CART19 T-клетки можно получать от пациентов с CLL, подвергающихся лечению ибрутинибом.
[00947] Кроме того, проводили анализ in vitro для определения эффекта ибрутиниба на пролиферацию CART19 T-клеток, цитотоксичность CART19 и соотношение продукции цитокинов TH1:TH2.
[00948] Для измерения клеточной пролиферации клетки окрашивали CFSE для обнаружения пролиферирующих клеток и анализировали посредством FACS, как описано в примере 4. CART19 T-клетки инкубировали с различными концентрациями ибрутиниба (0,1 мкМ, 0,5 мкМ, 1 мкМ и 5 мкМ), и либо стимулировали гранулами против CD3/CD28, либо оставляли нестимулированными. На фиг.22 наложены гистограммы для сравнения нестимулированных со стимулированными посредством CD3/CD28 CART19 T-клетками при каждой концентрации ибрутиниба. Для каждой концентрации ибрутиниба наблюдали пролиферацию CD3/CD28-стимулированных T-клеток, что, тем самым, демонстрирует, что обработка ибрутинибом не влияла на пролиферацию клеток CART19.
[00949] Также оценивали эффект ибрутиниба на цитотоксичность CART19 T-клеток с использованием способов, описанных в примере 4. Нетрансдуцированые и трансдуцированные посредством CAR19 T-клетки обрабатывали средой, DMSO или 1 мкМ ибрутинибом. Проточный анализ уничтожения проводили с использованием титрования соотношений эффектора и мишени (E;T) с эффекторными клетками CART19 (обработанные средой, DMSO или ибрутинибом) для определения специфической цитотоксической активности против CD19-экспрессирующих клеток-мишеней. Как показано на фиг.23, CART19 T-клетки, обработанные ибрутинибом, продемонстрировали тот же процент специфической цитотоксической активности против экспрессирующих CD19 клеток-мишеней, что и контроли (CART19 T-клетки, обработанные средой или DMSO). Таким образом, лечение ибрутинибом не влияло на цитотоксичность CART19.
[00950] Обработка ибрутинибом может ограничить активацию TН2, и, таким образом, может обеспечить давление отбора в сторону TH1 в T-клетках и смещению цитокинов TH1/TH2 у пациентов-людей с CLL. Проводили анализы для измерения продукции цитокинов TH1 и TH2 в присутствии или в отсутствие ибрутиниба или DMSO (контроль). Как показано на фиг.24, ибрутиниб не стимулирует смещение цитокинов TH1 и TH2 в клетках CART 19.
Эффективность комбинированного лечения ибрутинибом/CART19 in vivo
[00951] Функцию CART19 оценивали в модели на мышах in vivo. Клетки Nalm/6 (клеточная линия острого лимфобластного лейкоза человека) имплантировали мышам NSG и мониторинг мышей проводили каждые сутки в течение по меньшей мере 50 суток. Модель опухоли Nalm/6 обеспечивает опухоли, которые не являются чувствительными к ибрутинибу, и, таким образом, позволяют анализ функции CART19 in vivo и эффективности уменьшения объема опухоли/лечения рака. Начиная на 7 сутки, мышам вводили либо DMSO (контроль), либо ибрутиниб каждые сутки через оральный зонд. CART19 вводили на 7 сутки или 9 сутки, или мышей оставляли без введения (контроль). На сутки 4, 11, 18, 25 и 32 измеряли количество клеток Nalm/6, циркулирующих у мышей, например, посредством FACS-анализа периферической крови, для определения эффективности CART19 в отношении устранения клеток Nalm/6 в присутствии или в отсутствие ибрутиниба. Например, клетки окрашивали антителом против CD19 человека для определения процента CD19+ клеток (Nalm/6) человека в крови мышей, имеющих опухоль NSG.
[00952] как показано на фиг.25A, мыши, которым не проводили инъекций CART19, проявляли увеличение количества опухолевых клеток Nalm/6. Однако мыши, которым проводили инъекции CART19 в комбинации с ежесуточным введением DMSO, продемонстрировали успешное устранение (уменьшение количества) клеток Nalm/6. Мыши, которым проводили инъекции CART19 в комбинации с ежесуточным введением ибрутиниба, также продемонстрировали успешное устранение клеток Nalm/6 с той же кинетикой и эффективностью, что и мыши, которым проводили введение DMSO. Таким образом, эти результаты указывают на то, что лечение ибрутиниба не нарушает функцию CART19 в отношении уничтожения клеток Nalm/6 в этой модели опухоли.
[00953] Мониторинг состояния здоровья мышей проводили в течение по меньшей мере 50 суток после инъекции клеток Nalm/6. Кривая выживаемости Каплана-Мейера на фиг.25B показывает, что ни одна из мышей, которых не подвергали лечению (не вводили CART19 T-клетки) и которым вводили либо DMSO, либо ибрутиниб, не выжила в течение более чем 30 суток после инъекции клеток Nalm/6. Однако лечение CART19 T-клетками с DMSO или с ибрутинибом повышало выживаемость мышей. Таким образом, эти результаты, взятые вместе с результатами опухолевой нагрузки, представленными на фиг.13A, демонстрируют, что лечение ибрутинибом не нарушает функцию CART19 в отношении выведения опухолевых клеток в модели опухоли NSG-Nalm/6 in vivo.
Оптимальный режим лечения комбинацией ибрутиниба/CART19 у пациентов с CLL
[00954] Оптимальное время для введения CART19 в процессе лечения ибрутинибом CLL оценивали с использованием образцов от пациентов CLL, которые подвергались лечению ибрутинибом в течение одного года. Образцы PBMC от 9 пациентов с CLL (пациент 111330026, пациент 111330030, пациент 111330039, пациент 111330056, пациент 111330073, пациент 111330074, пациент 111330081, пациент 111330086 и пациент 111330111) выделяли в различные курсы лечения ибрутиниба и использовали для получения CART19 T-клеток. Образцы PBMC собирали до и после лечения ибрутиниба для установления исходного уровня, а затем собирали в процессе лечения ибрутинибом на курсе 2, сутки 1 и 12 курсе, 1 сутки. Оценивали несколько различных параметров производства CART19, таких как трансдукция, пролиферация, цитотоксичность и продукция цитокинов. Другая оценка может включать иммунофенотипирование ex vivo, такое как оценка памяти, ингибиторных молекул и истощения.
[00955] На фиг.26 представлены результаты проточно-цитометрического анализа трансдукции CAR19 T-клеток от пациента 111330030, которые были репрезентативными результатами для результатов, полученных для других 8 пациентов после трансдукции CAR. PBMC собирали от пациентов в указанные моменты времени (исходный уровень, например, до лечения; 2 курс на 1 сутки; и 12 курс на 1 сутки) и трансдуцировали лентивирусными векторами, содержащими CAR19, с использованием способов, как описано, например, в Примере 4. Затем трансдуцированные PBMC окрашивали на аннексин, CD3, CD4 и GAM (для обнаружения CAR), а затем анализировали с использованием FACS-анализа. Заключенная в рамку область на графиках на фиг.14 демонстрирует процент клеток, которые были положительными по GAM и которые были успешно трансдуцированы с получением CART19 T-клеток. Нижние три графика демонстрируют, что CAR19 были успешно трансдуцированы приблизительно в 23% от клеток на исходном уровне, в 28% от клеток на 2 курсе, 1 сутки, и в 44% от клеток на 12 курсе, 1 сутки.
[00956] Далее оценивали скорость пролиферации (или удвоений популяций) клеток CART19 или нетрансдуцированных клеток (контроль) в каждый момент времени (исходный уровень, 2 курс на 1 сутки и 12 курс на 1 сутки) в течение 12 суток. На фиг.27 показано графическое представление удвоений популяции на протяжении 12 суток для трех пациентов: пациента 111330039 (#39), пациента 111330026 (#26) и пациента 111330030 (#30). Эти результаты указывают на то, что с точки зрения скорости пролиферации, PBMC, выделенные между или на 2 курсе, сутки 1, и 12 курсе, сутки 1, являются предпочтительными для трансдукции CAR.
Потенциальные механизмы влияния лечения ибрутинибом на функцию CART19
[00957] Различные механизмы лечения ибрутинибом, которые могут влиять на функцию CART19, оценивали в образцах пациента с CLL.
[00958] Анализ CD19-экспрессирующих (CD19+) клеток проводили с использованием FACS-анализа. PBMC от пациента CLL, подвергавшегося лечению ибрутинибом, выделяли на исходном уровне (до лечения ибрутинибом), на 2 курсе, сутки 1, и на 12 курсе, сутки 1, а затем окрашивали на CD19. FACS-анализ продемонстрировал, что ибрутиниб вызывает снижение уровня CD19-экспрессирующих клеток (фиг.28A, фиг.28B и фиг.28C). Таким образом, эти результаты указывают на то, что лечение ибрутинибом индуцирует лимфоцитоз.
[00959] Дополнительный анализ проводили для исследования экспрессии CD200 на опухолевых клетках с течением времени в процессе лечения ибрутинибом. Иммунодепрессивная молекула CD200 активирована на опухолевых клетках первичного B-клеточного CLL. CD200 связывается с его рецептором, CD200R, который экспрессируется на клетках моноцитарного/макрофагального ростка и на T-лимфоцитах. Взаимодействие CD200 с его рецептором доставляет ингибиторный сигнал макрофагальному ростку, изменяя профиль цитокинов с TH1 на TH2, и приводит к индукции регуляторных T-клеток. Образцы от пациентов 111330030, 111330026 и 111330039 на исходном уровне (скрининг), 2 курсе, сутки 1, и 12 курсе, сутки 1, окрашивали на аннексин, CD19 (для сортировки по CD19-экспрессирующим опухолевым клеткам) и CD200, и анализировали с использованием FACS. Гистограммы, выявляющие экспрессию CD200 на опухолевых клетках в каждый момент времени, накладывали друг на друга для каждого пациента (фиг.29A, 29B и 29C). Как правило, экспрессия CD200 на опухолевых клетках снижалась с течением времени в ходе лечения ибрутинибом.
[00960] Также оценивали частоту PD1-экспрессирующих T-клеток в процессе лечения ибрутинибом. Образцы от пациентов получали на исходном уровне, 2 курсе, сутки 1, и 12 курсе, сутки 1, и окрашивали аннексином, CD3, CD8 и PD1. Клетки, которые были отрицательными по аннексину и положительными по CD3, анализировали в отношении экспрессии CD8 и PD1. Клетки, которые экспрессируют CD8 и PD1, обозначены рамкой на фиг.30A, 30B и 30C. Сравнение профилей FACS для клеток на исходном уровне (фиг.30A), 2 курсе, сутки 1 (фиг.30B), и 12 курсе, сутки 1 (фиг.30C), указывает на то, что лечение ибрутинибом снижает частоту PD1-экспрессирующих клеток с течением времени.
[00961] Данные, полученные в экспериментах, описанных выше, указывают на то, что оптимальное время для проведения терапии CART19 у пациентов с CLL, которым вводят ибрутиниб, представляет собой период между 2 курсом и 12 курсом, или на 12 курсе.
Пример 10: Терапия CAR19 T-клетками лимфомы Ходжкина
[00962] Терапию CAR19 T-клетками также можно использовать для лечения лимфомы Ходжкина (HL). Лимфома Ходжкина характеризуется присутствием злокачественных клеток Ходжкина-Рида-Штенберга (HRS), которые происходят из клональных B-клеток герминативного центра. Существует несколько факторов, которые указывают на терапевтическую эффективность терапии HL CAR19 T-клетками. Окрашивание на CD19 опухолей HL демонстрирует CD19-сверхэкспрессирующие (CD19+) клетки в опухоли и микроокружении опухоли (фиг.33). Исследование показало, что популяция клональных B-клеток (CD20+CD27+ALDH+), которые экспрессируют CD19, является ответственной за получение и поддержание клеточных линий лимфомы Ходжкина, и также циркулирует в крови большинства пациентов с HL (Jones et al., Blood, 2009, 113(23):5920-5926). Было предположено, что эта популяция клональных B-клеток дает начало или вносит вклад в образование злокачественных клеток HRS. Таким образом, терапия CART19 может истощать эту популяцию B-клеток, которые вносят вклад в образование опухоли или поддержание опухолевых клеток. Другое исследование показало, что истощение B-клеток замедляет рост солидной опухоли в множестве моделей на мышах (Kim et al., J Immunotherapy, 2008, 31(5):446-57). В поддержку идеи, что истощение B-клеток в микроокружении опухоли HL приводит к некоторому противоопухолевому эффекту, современные способы терапии, такие как ритуксан, в настоящее время клинически тестируют для нацеливания на и истощение опухолевых B-клеток при HL (Younes et al., Blood, 2012, 119(18):4123-8). Также было показано, что канцерогенез de novo, связанный с хроническим воспалением, является зависимым от B-клеток (de Visser, et al., Cancer Cell, 2005, 7(5):411-23). Результаты этих исследований указывают на то, что нацеливание на популяцию B-клеток, в частности, в микроокружении опухоли HL, может быть полезным для лечения HL, путем снижения или ингибирования прогрессирования заболевания или роста опухоли.
[00963] Кроме того, нормальные CD19-экспрессирующие B-клетки также инфильтрируют микроокружение опухоли при HL. Предшествующие исследования с терапией CART19 при CLL и ALL (например, описанные в примерах 4 и 5) показывает, что воздействие CD19+ мишеней на CART19 приводит к продукции цитокинов и образованию макрофагов. Таким образом, модулирование микроокружения опухоли HL из проопухолевого микроокружения в антиопухолевое микроокружение может быть достигнуто путем инфузии CART19 для взаимодействия с нормальными CD19+ B-клетками, присутствующими при HL. Например, воздействие на CART19 CD19-экспрессирующих мишеней вызывает продукцию цитокинов, например, воспалительных цитокинов, которые стимулируют противоопухолевую активность через экспансию цитотоксических T-клеток, активацию макрофагов и привлечение других иммунных эффекторных клеток с различными функциями, которые ингибируют рост опухоли, таких как лейкоциты, макрофаги и антигенпредставляющие клетки. Поскольку CD19+ B-клетки-мишени могут не быть злокачественными (например, нормальные циркулирующие B-клетки), для модулирования микроокружения опухоли может быть предпочтительным временный, а не длительный эффект CART19.
[00964] Исследование для изучения терапевтической эффективности терапии CART19 у пациентов с HL можно проводить, как описано ниже (фиг.34). В исследовании также будет оцениваться безопасность и переносимость CART19 у индивидуумов с HL, и будет определяться эффект CART19-клеток на микроокружение опухоли HL.
[00965] В этом исследовании лечат 8 пациентов с классической HL. Пациенты представляют собой пациентов любых возрастов, хотя могут быть разработаны отдельные протоколы для доставки лекарственного средства педиатрическим и взрослым пациентам. Пациенты в этом исследовании не имеют доступных потенциально излечивающих вариантов лечения (таких как трансплантация аутологичных (ASCT) или аллогенных стволовых клеток) или они не подходят для таких излечивающих вариантов лечения. Например, пациенты могут быть любыми из следующих: PET+ после спасительной химиотерапии, PET+ после лечения брентуксимабом или PET+ после ASCT с или без предшествующего воздействия брентуксимаба. Пациенты будут иметь ограниченный прогноз (ожидаемое выживание от нескольких месяцев до менее или равно 2 лет) с доступными в настоящее время способами терапии. Наконец, пациенты не будут иметь проводимую терапию антителом против CD20. Пациентов исключают вследствие невозможности выполнения, например, если пациент имеет недостаточные количества T-клеток для 6 инфузий CART19.
[00966] мРНК CAR19 получают путем транскрипции in vitro. мРНК CAR19 вводят путем электропорации в донорные T-клетки, и полученные клетки увеличивают в количестве и стимулируют путем инкубации с CD3/CD28-гранулами. Дозировки, содержащие 1×108-5×108 T-клеток с веденной посредством электропорации РНК CAR19, доставляют пациенту три раза в неделю в течение двух недель (например, на 0, 2, 4, 7, 9 и 11 сутки). Общую частоту ответа будут оценивать клинически, посредством сканирования CT и PET через 1 после введения. Мониторинг ответа и выживания будут проводить каждый месяц в течение первых 6 месяцев, затем каждые 3 месяца до 2 лет после первой инфузии CART19 (0 сутки). Способы мониторинга включают биопсию опухоли или лимфатических узлов (например, для иммуногистохимического анализа и/или выделения РНК для определения профиля экспрессии) и сканирование PET до и после лечения CART19. Например, эффект клеток CART19 на микроокружение опухоли HL анализируют путем сравнения результатов определения профиля экспрессии генов, проведенного на доступных биоптатах лимфатических узлов от выбранных пациентов до лечения и приблизительно через одну неделю после лечения (или после подходящего периода времени для возможности изменения клеточного фенотипа). Для оценки безопасности и переносимости лечения CART19, описана частота и тяжесть неблагоприятных явлений, включая частоту синдрома высвобождения цитокинов (CRS) и синдрома активации макрофагов (MAS).
[00967] Химиотерапию можно проводить одновременно с лечением CART19. Первой дозе CART19 может предшествовать истощающая лимфоциты химиотерапия, например, цитоксаном.
Пример 11: Подгруппа неотвечающих пациентов с CLL имеет увеличенную экспрессию молекул ингибиторов иммунной точки контроля
[00968] В этом исследовании клетки CART19, произведенные в клинических условиях, от 34 пациентов с CLL оценивали в отношении экспрессии молекул ингибиторов иммунной точки контроля, таких как PD-1, LAG3 и TIM3. Ответ этой группы на CART19 был известен и, таким образом, можно оценивать корреляцию между ответом и профилями экспрессии биомаркеров.
[00969] Произведенные клетки CART19 от пациентов с CLL с различными ответами на терапию CART анализировали проточной цитометрией для определения экспрессии CAR и ингибиторных молекул иммунной точки контроля PD-1, LAG3 и TIM3. Клетки CART19 были от: здоровых доноров (HD) (n=2); пациентов с CLL, которые отвечали на терапию CART (CR) (n=5); пациентов с CLL, которые частично отвечали на терапию CART (PR) (n=8); пациентов с CLL, которые не отвечали на терапию CART (NR) (n=21). Клетки окрашивали флуоресцентно мечеными антителами, которые специфически распознают молекулу CD3, CD4, CD8, CD27, CD45RO, CAR19 и молекулами иммунной точки контроля PD-1, LAG3 и TIM3, в соответствии со стандартными способами проточно-цитометрического анализа, известными в данной области. Экспрессию каждого маркера, например, CD4+, CD8+ и т.д., определяли с использованием программного обеспечения для проточно-цитометрического анализа, и субпопуляции (например, CD4+ T-клетки, CD8+ T-клетки или CAR19-экспрессирующие T-клетки) далее анализировали в отношении экспрессии молекул иммунной точки контроля PD-1, LAG3 и TIM3.
[00970] Пример проточно-цитометрического анализа профилей для определения поверхностных маркеров представлен на фиг.35A и 35B. T-клетки, экспрессирующие CD4, определяли с использованием проточной цитометрии и далее анализировали в отношении экспрессии CAR19 и PD-1, так что ось x профилей указывает на экспрессию CAR19 (верхний левый (Q5) и нижний левый (Q8) квадранты демонстрируют CAR19-отрицательные CD4+ клетки, в то время как верхний правый (Q6) и нижний правый (Q7) квадранты демонстрируют CAR19-экспрессирующие CD4+ клетки) и ось y демонстрирует экспрессию PD-1 (нижние левый (Q8) и правый (Q7) квадранты демонстрируют отрицательные по PD-1 CD4+ клетки и верхние левый (Q5) и правый (Q6) квадранты демонстрируют экспрессирующие PD-1 CD4+ клетки). В популяции CD4+ от отвечающего на CART пациента, 44,7% CD4+ клеток в целом экспрессировали PD-1, и приблизительно 22,3% CAR19-экспрессирующих клеток были положительными по PD-1, в то время как 27,2% CAR19-экспрессирующих клеток были отрицательными по PD-1 (фиг.35A). Напротив, в популяции CD4+ от неотвечающего пациента было значительное уменьшение CAR19-экспрессирующих клеток в целом (приблизительно 15,3% по сравнению с 49,5% у CR), причем 14,7% CAR19-экспрессирующих клеток были положительными по PD-1, в то время как только 0,64% были отрицательными по PD-1 (фиг.35B). Сравнение между профилями на фиг.35A и фиг.35B показывает, что значительно более высокий процент CD4+ клеток от неотвечающего пациента экспрессируют PD-1 (приблизительно 92,9%) по сравнению с отвечающим на CART пациентом (приблизительно 44,7%).
[00971] С использованием способов и анализа, описанных выше, определяли процент экспрессирущих PD-1 (PD-1+) клеток в CD4+ популяции и CD8+ популяции для каждого пациента в каждой группе ответа. Было показано, что неотвечающие пациенты имеют более высокий процент PD-1+ клеток как в популяции CD4+ (фиг.35C), так и в популяции CD8+ (фиг.35D) по сравнению с пациентами, которые отвечали на терапию CAR (CR); увеличение среднего процента PD-1 было статистически значимым как для CD4+ популяции, так и для CD8+ популяции. Частично отвечающие пациенты (PR) проявляли более высокие проценты PD-1+ клеток, чем отвечающие пациенты CR) как в CD4+ популяции (фиг.35C), так и в CD8+ популяциях (фиг.35D).
[00972] Далее определяли процент экспрессирующих PD-1 (PD-1+) клеток в CAR19-экспрессирующей CD4+ популяции и CAR19-экспрессирующей CD8+ популяции для каждого пациента в каждой группе ответа. Проводили анализ, сходный с описанным выше анализом, с дополнительной стадией анализа CD4+ и CD8+ клеток для экспрессии CAR19, и после идентификации экспрессирующих CAR19 клеток, определением процента клеток с экспрессией PD-1 в популяциях CAR19-экспрессирующих клетках. Сходную тенденцию с тенденцией, которую наблюдали в общих CD4+ и CD8+ популяциях, наблюдали для CAR19-экспрессирующих CD4+ и CD8+ популяций: было показано, что не отвечающие пациенты имеют более высокий процент PD-1+ клеток как в CD4+ популяции (фиг.36A), так и в CD8+ популяции (фиг.36B) по сравнению с пациентами, которые отвечали на терапию CAR (CR); увеличение среднего процента PD-1 было статистически значимым как для CD4+ популяции, так и для CD8+ популяции. Частично отвечающие (PR) пациенты имели более высокий процент клеток PD-1+, чем отвечающие пациенты (CR) как в CD4+ популяции (фиг.36A), так и в CD8+ популяции (фиг.36B).
[00973] Дальнейший анализ проводили для определения распределения клеток, экспрессирующих PD-1, LAG3 и TIM3, от пациентов с различными ответами на терапию CAR. Репрезентативный анализ профиля клеток для экспрессии PD-1, LAG3 и TIM3 в CD4+ популяции показан на фиг.37. Популяции клеток сначала анализировали в отношении экспрессии CD4+ и CD8+. Затем CD4+ популяцию (или CD8+ популяцию, не показано) анализировали в отношении экспрессии PD-1 и CAR19 (фиг.37, левые профили). Как описано ранее, неотвечающие пациенты (NR) имели значимо увеличенный процент клеток, которые в целом были PD-1+, по сравнению с отвечающими на CART пациентами (CR) (приблизительно 92,9% положительных по PD-1 для NR по сравнению с 44,7% положительных по PD-1 для CR). Более того, у неотвечающих пациентов CAR19-экспрессирующие клетки были по большей части положительными по PD-1 (14,7% положительных по PD-1 и CAR+ по сравнению с 0,64% отрицательных по PD-1 и CAR+). Затем популяции анализировали в отношении соэкспрессии PD-1 и LAG3 (фиг.37, средние профили). Клетки, которые экспрессировали как PD-1, так и LAG3, показаны в верхнем правом квадранте (Q2). Не отвечающие пациенты имели значительно увеличенный процент клеток, которые экспрессировали оба ингибитора иммунной точки контроля: PD-1 и LAG3, по сравнению с отвечающими на CART пациентами (67,3% по сравнению с 7,31%). Экспрессию PD-1 также анализировали с экспрессией TIM3. На фиг.37, правые профили, в рамке указаны клетки, которые экспрессируют как PD-1, так и TIM3. Аналогично результатам, полученным для PD-1 и LAG3, неотвечающие пациенты имели значительно более высокий процент клеток, которые экспрессировали оба ингибитора иммунной точки контроля: PD-1 и TIM3, по сравнению с отвечающими на CART пациентами (83,3% по сравнению с 28,5%). Процент экспрессирующих PD-1 клеток (PD1+), экспрессирующих PD-1 и LAG3 клеток (PD1+LAG3+), и экспрессирующих PD-1 и TIM3 клеток (PD1+TIM3+) определяли для каждого пациента в каждой группе ответа с использованием проточно-цитометрического анализа, как описано выше. Было показано, что неотвечающие пациенты имеют увеличенный процент PD1+ LAG3+ клеток (фиг.38A) и PD1+TIM3+ клеток (фиг.38B) по сравнению с отвечающими на CART пациентами, который был статистически значимым для обеих клеточных популяций. Частично отвечающие пациенты также продемонстрировали увеличенный процент обеих клеточных популяций по сравнению с отвечающими на CART пациентами, причем средние значения для них были сниженными по сравнению с неотвечающими пациентами.
[00974] Эти результаты указывают на то, что пациенты, которые не отвечают на терапию CAR, проявляют увеличенную экспрессию ингибиторов иммунной точки контроля (например, PD-1, LAG3 и TIM3) по сравнению с пациентами, которые отвечают или частично отвечают на терапию CAR. Таким образом, эти результаты показывают, что средства, которые ингибируют или снижают экспрессию ингибиторов иммунной точки контроля, например, PD-1, LAG3 или TIM3, могут быть пригодными для введения пациентам, которым проводят терапию CAR, для предупреждения иммунного подавления через каскады иммунных точек контроля (например, опосредуемые PD-1, LAG3 или TIM3), тем самым повышая эффективность CAR-экспрессирующих клеток.
Пример 12: Эффекты ингибирования mTOR на старение иммунной системы у пожилых людей
[00975] Одним из каскадов, наиболее явно связанных со старением, является каскад mTOR. Было показано, что ингибитор mTOR увеличивает продолжительность жизни у мышей и вызывает улучшение при различных связанных со старением состояний у пожилых мышей (Harrison, DE et al. (2009) Nature 460:392-395; Wilkinson JE et al. (2012) Aging Cell 11:675-682; и Flynn, JM et al. (2013) Aging Cell 12:851-862). Таким образом, эти данные указывают на то, что ингибиторы mTOR могут иметь благоприятные эффекты на старение или связанные со старением состояния у человека.
[00976] Связанным со старением фенотипом, который можно исследовать в клинических испытаниях с короткими временными рамками, является старение иммунной системы. Старение иммунной системы представляет собой снижение иммунной функции, которое происходит у пожилых, что приводит к повышенной чувствительности к инфекциям и сниженному ответу на вакцинацию, в том числе вакцинацию против гриппа. Снижение иммунной функции с возрастом является следствием накопления иммунных дефектов, включающих снижение способности гемопоэтических стволовых клеток (HSC) образовывать наивные лимфоциты, и увеличение количества истощенных положительных по PD-1 лимфоцитов, которые имеют дефектный ответ на антигенную стимуляцию (Boraschi, D et al. (2013) Sci. Transl. Med.5:185ps8; Lages, CS et al. (2010) Aging Cell 9:785-798; и Shimatani, K et al., (2009) Proc. Natl. Acad. Sci. USA 106:15807-15812). Исследования на пожилых мышах показали, что введение в течение 6 недель ингибитора mTOR рапамицина восстанавливало функцию HSC, что приводило к увеличенной продукции наивных лимфоцитов, улучшенному ответу на вакцинацию против гриппа и увеличенной продолжительности жизни (Chen, C et al. (2009) Sci. Signal. 2:ra75).
[00977] Для оценки эффектов ингибирования mTOR на связанные со старением человека фенотипы, и оценки того, смягчает ли ингибитор mTOR RAD001 старение иммунной системы, оценивали ответ вакцины против гриппа у пожилых добровольцев, которым вводили RAD001 или плацебо. Данные, представленные в настоящем описании, указывают на то, что RAD001 усиливал ответ на вакцину против гриппа у пожилых добровольцев в дозах, которые хорошо переносились. RAD001 также снижал процент положительных по programmed death (PD)-1 CD4 и CD8 T-лимфоцитов, которые накапливаются с возрастом. Эти результаты показывают, что ингибирование mTOR могло иметь благоприятные эффекты на старение иммунной системы у пожилых добровольцев.
[00978] Как описано в настоящем описании, лечение в течение 6 недель ингибитором mTOR RAD001, являющимся аналогом рапамицина, улучило ответ на вакцинацию против гриппа у пожилых людей-добровольцев.
Способы
Исследуемая выборка
[00979] Пожилых добровольцев в возрасте ≥ 65 лет без нестабильных основных медицинских заболеваний включали в исследование в 9 областях Новой Зеландии и Австралии. Критерии исключения при скрининге включали гемоглобин < 9,0 г/дл, количество лейкоцитов <3500/мм3, количество нейтрофилов <2000/мм3, или количество тромбоцитов <125000/мм3, неконтролируемый диабет, нестабильную ишемическую болезнь сердца, клинически значимое основное легочное заболевание, иммунодефицит в анамнезе или проведение иммуносупрессивной терапии, коагулопатию в анамнезе или медицинское состояние, требующее длительного противосвертывающего лечения, оцененную скорость гломерулярной фильтрации < 30 мл/мин, присутствие тяжелой неконтролируемой гиперхолестеринемии (>350 мг/дл, 9,1 ммоль/л) или гипертриглицеридемию (>500 мг/дл, 5,6 ммоль/л).
[00980] Исходные демографические данные между группами лечения были сходными (таблица 7). Из 218 включенных в исследование индивидуумов 211 завершили исследование. Семь индивидуумов были исключены от исследования. Пять индивидуумов отказались вследствие неблагоприятных явлений (AE), один индивидуум отменил согласие и один индивидуум покинул исследование в результате нарушения протокола.
Таблица 7: Демографические и исходные характеристики исследуемых пациентов
|
*Индекс массы тела представляет собой массу в килограммах, деленую на квадрат роста в метрах
Схема и проведение исследования
[00981] С декабря 2011 года по апрель 2012 года 218 пожилых добровольцев были включены в рандомизированное слепое для наблюдателя плацебо-контролируемое испытание. Индивидуумов случайным образом распределяли на группу лечения с использованием валидированной автоматизированной системы рандомизации с соотношением RAD001 и плацебо 5:2 в каждой группе лечения. Группы лечения представляли собой:
RAD001, 0,5 мг каждые сутки, или плацебо
RAD001, 5 мг раз в неделю, или плацебо
RAD001, 20 мг раз в неделю, или плацебо
[00982] Испытание было слепым для наблюдателя, поскольку плацебо в группах RAD001, 0,5 мг каждые сутки и 20 мг раз в неделю, незначительно отличалось от таблеток RAD001 в этих группах. Исследующий персонал, оценивающий индивидуумов, не знал об исследуемом лечении и, таким образом, был полностью слепым. Длительность лечения для всех групп составляла 6 недель, в ходе которых индивидуум подвергался оценкам безопасности в клинике каждые 2 недели. После дозирования индивидуумам в течение 4 недель измеряли стационарные уровни RAD001 до введения дозы и через один час после введения дозы. После завершения курса исследуемого лекарственного средства из 6 недель индивидуумам давали 2-недельный перерыв без лекарственных средств для реверсии какой-либо возможной индуцированной RAD001 иммуносупрессии, а затем проводили вакцинацию против гриппа сезона 2012 (Agrippal®, Novartis Vaccines and Diagnostics, Siena, Италия), включавшую штаммы H1N1 A/California/ 07/2009, H3N2 A/Victoria/210/2009, B/Brisbane/60/ 2008. Через четыре недели после вакцинации против гриппа проводили взятие сыворотки индивидуумов для измерения титров вируса гриппа. Титры антител к 3 вакцинным штаммам вируса гриппа, а также к 2 гетерологичным штаммам (A/штамм H1N1 A/New Jersy/8/76 и A/штамм H3N2 A/Victoria/361/11) измеряли с использованием стандартного анализа ингибирования гемагглютинации (Kendal, AP et al. (1982) Concepts and procedures for laboratory-based influenza surveillance. Atlanta: Centers for Disease Control and Prevention B17-B35). Уровни IgG и IgM, специфичных к A/H1N1/California/07/2009, измеряли в образцах сыворотки, взятых до и через 4 недели после вакцинации против гриппа, как описано ранее (Spensieri, F. et al. (2013) Proc. Natl. Acad. Sci. USA 110:14330-14335). Результаты выражали в качестве интенсивности флуоресценции.
[00983] Все индивидуумы предоставляли письменное информированное согласие. Исследование проводили в соответствии с Good Clinical Practice и было одобрено соответствующими этическими комитетами и регулирующими органами.
Безопасность
[00984] Во время посещений для исследования проводили оценку неблагоприятных явлений и сбор крови для гематологической и биохимической оценки безопасности. Информацию о неблагоприятных явлениях также получали из дневников, которые индивидуумы заполняли дома в течение 6 недель, когда они принимали исследуемое лекарственное средство. Данные обо всех неблагоприятных явлениях получали от времени информированного согласия до 30 суток после последнего посещения для исследования. События классифицировались исследователями как мягкие, умеренные и тяжелые.
Статистический анализ
[00985] Первичный анализ геометрических средних значений соотношений титров проводили с использованием нормальной байесовский регрессионной модели с неинформативной априорной вероятностью. Эту модель аппроксимировали к каждому титру антител на логарифмической шкале. Первичным результатом в каждой модели был результат измерения на 84 сутки. Результат измерения на 63 сутки был включен в вектор исхода. Модель аппроксимировали с использованием SAS 9.2 Proc Mixed с Prior Statement. Ковариационную структуру матрицы считали неструктурированной (тип опции=UN). Использовали Flat Prior. Для вторичного анализа уровней сероконверсии использовали логистическую регрессию.
[00986] Выборку пациентов с намерением лечиться определяли как все индивидуумы, которым вводили по меньшей мере одну полную дозу исследуемого лекарственного средства и которые не имели существенных отклонений от протокола, влияющих на данные эффективности. 199 из всего 218 индивидуумов, включенных в исследование, входили в выборку пациентов с намерением лечиться.
Иммунофенотипирование
[00987] Мононуклеарные клетки периферической крови выделяли из цельной крови, взятой в 3 момента времени: исходный уровень; через 6 недель после лечения исследуемым лекарственным средством; и в конце исследования, когда индивидуумы не принимали лекарственное средство в течение 6 недель и 4 недель после вакцинации против вируса гриппа. Семьдесят шесть субпопуляций PBMC анализировали проточной цитометрией с использованием 8-цветных панелей иммунофенотипирования в Human Immune Monitoring Center в Stanford University, CA, США, как описано ранее (Maecker, HT et al. (2012) Nat Rev Immunol. 12:191-200). Семьдесят шесть субпопуляций PBMC анализировали проточной цитометрией с использованием 8-цветных лиофилизированных панелей для иммунофенотипирования (BD Lyoplate, BD Biosciences, San Diego, CA). Образцы PBMC с жизнеспособностью >80% и выходом 2×106 клеток или более включали в анализ.
[00988] Относительные изменения иммунофенотипов от исходного уровня до 6 недели лечения лекарственным средством и от исходного уровня до конца исследования (Week 12) вычисляли для каждой из групп дозирования RAD001. T-критерий Стьюдента вычисляли, чтобы исследовать, отличалось ли относительное изменение иммунофенотипов от исходного уровня до двух моментов времени взятия образцов значимо от нуля, соответственно, в каждой группе дозирования после внесения поправки на эффект плацебо. Условную подстановку отсутствующих данных в анализе эффекта лечения не проводили. Таким образом, если пациент имел отсутствующие данные о фенотипе на исходном уровне, этого пациента не включали в анализ по этому фенотипу. Если пациент имел отсутствующие данные о фенотипе на 6 или 12 неделях, тогда этот пациент не участвовал в анализе этого фенотипа для этого момента времени с отсутствующими данными.
[00989] Проводили 608 тестов в 76 фенотипах в 3 группах дозирования для сравнения эффекта лечения против эффекта плацебо. Для контроля возникновения ложноположительных результатов, ассоциированных с множественным тестированием, и обеспечения еще большей мощности, использовали методологию стратифицированного контроля уровня ложноположительных результатов (FDR). Группу типа клеток принимали как факто стратификации и проводили вычисление FDR (величина q) в каждой группе соответственно. Все нулевые гипотезы отклоняли при уровне значимости 0,05 с соответствующим значением q ≤ 0,1. Стратегия внесения поправки на множественное тестирование с отклонением при уровне значимости 0,05 и соответствующем q<0,1 гарантировали, что менее 10% данных были ложными.
[00990] Во втором анализе исследовали изменения иммунофенотипа между объединенными группами лечения и плацебо, где все три группы дозирования RAD001 объединяли. Для определения того, какие изменения иммунофенотипа отличались между группой введения и группой плацебо, вычисляли соотношения количеств клеток по пациентам для каждого измеренного фенотип между исходным уровнем и 6 неделей лечения исследуемым лекарственным средством и между исходным уровнем и концом исследования (12 неделя). Соотношения подвергали логарифмическому преобразованию и анализировали с использованием ковариационного анализа в каждый момент времени для обнаружения отличий между объединенными группами лечения и плацебо. Проводили 152 тестов 76 фенотипов для сравнения объединенного эффекта лечения против эффекта плацебо. Для контроля возникновения ложноположительных результатов, ассоциированных с множественным тестированием, и обеспечения еще большей мощности, использовали методологию стратифицированного контроля уровня ложноположительных результатов (FDR) (Benjamini, Y. et al. (1995) J. Roy. Statist. 57:289-300; и Sun, L. et al. (2006) Genet. Epidemiol. 30:519-530). Группу типа клеток принимали как факто стратификации и проводили вычисление FDR (величина q) в каждой группе соответственно. Все нулевые гипотезы при уровне значимости 0,05 и значении q менее 20% отклоняли. Это можно интерпретировать как отклонение только тех гипотез со значениями P менее 0,05 и вероятностью менее 20%, в которых каждый наблюдаемый значимый результат был следствием множественного тестирования.
Результаты
[00991] Главным образом, RAD001 хорошо переносился, в частности, в режимах дозирования 0,5 мг каждые сутки и 5 мг раз в неделю. В ходе исследования не произошло смертей. Три индивидуума испытали серьезные неблагоприятные явления (SAE), которые были оценены как несвязанные с RAD001. 4 SAE представляли собой кровоизлияния в сетчатку левого глаза с последующей слепотой у индивидуума с нормальным количеством тромбоцитов, которые завершили курс из 6 недель по 5 мг каждую недель RAD001 за 6 недель до этого; тяжелую боль в спине у индивидуума, которому давали плацебо, и тяжелый гастроэнтерит у индивидуума, которому давали плацебо. Перечень обусловленных лечением неблагоприятных явлений (AE) со встречаемостью >2% в любых группах введения представлен в таблице 8. Большинство распространенных связанных с RAD001 AE представляли собой язву рта, которая в большинстве случаев имела мягкую тяжесть. В целом, индивидуумы, которым вводили RAD001, имели сходную встречаемость тяжелых AE с индивидуумами, которым давали плацебо. Только одно тяжелое AE было оценено как связанные с RAD001 язвы рта у индивидуума, которому вводили 20 мг RAD001 раз в неделю.
Таблица 8: Встречаемость связанных с лечением AE >2% в любой группе лечения согласно предпочтительному термину
|
[00992] Способность RAD001 улучшать иммунную функцию у пожилых добровольцев оценивали путем измерения серологического ответа на вакцину против гриппа сезона 2012. Геометрические средине титры (GMT) ингибирования гемагглютинации (HI) для каждого из 3 вакцинных штаммов гриппа на исходном уровне и через 4 недели после вакцинации против гриппа представлены в таблице 9. Первичной переменной анализа было соотношение HI GMT (4 недели после вакцинации/исходный уровень). Исследование было начато для возможности продемонстрировать, что по меньшей мере для 2 из 3 вакцинных штаммов происходило 1) ≥ 1,2-кратное увеличение GMT относительно плацебо; и 2) апостериорная вероятность не ниже 80%, что соотношение GMT с поправкой на плацебо превышало 1. Этот конечный результат был выбран, поскольку увеличение соотношения GMT для вируса гриппа в 1,2 раза, индуцированное вакцинным адъювантом MF-59, было ассоциировано со снижением заболеваемости гриппом (Iob, A et al. (2005) Epidemiol Infect 133:687-693).
Таблица 9. HI GMT для каждого вакцинного штамма вируса гриппа на исходном уровне и через 4 недели после вакцинации против гриппа
|
Исходный уровень указывает на 2 недели до вакцинации против вируса гриппа
4 недели указывает на 4 недели после вакцинации против вируса гриппа
N представляет собой количество индивидуумов на группу
GMT представляет собой геометрического среднее значение титра
Соотношение GMT представляет собой GMT через 4 недели после вакцинации/GMT на исходном уровне
CV% указывает на коэффициент вариаций
[00993] В выборке с намерением лечиться (ITT) группы низкой усиливающей иммунитет дозы RAD001 (0,5 мг каждые сутки или 5 мг раз в неделю), но не группа более высокой дозы (20 мг раз в неделю) удовлетворили первичному результату исследования (фиг.40A). Это демонстрирует, что существует явный иммуномодулирующий механизм RAD001 при более низких дозах, и что при более высоких дозах могут вовлекаться известные иммунодепрессивные эффекты ингибирования mTOR. Более того, результаты указывают на тенденцию в направлении улучшения иммунной функции у пожилых людей после лечения низкой усиливающей иммунитет дозой RAD001.
[00994] В анализе подгрупп подгруппа пациентов с низкими исходными титрами вируса гриппа (≤ 1:40) имела большее ассоциированное с RAD001 увеличение титров, чем популяция ITT (фиг.40B). Эти данные показывают, что RAD001 является особенно эффективным в отношении усиления ответа на вакцину против гриппа у индивидуумов, которые не имели защитных титров (>1:40) на исходном уровне, и, таким образом, имели наиболее высокий риск заболевания гриппом.
[00995] Графики рассеяния концентрации RAD001 против повышения титров к каждому вакцинному штамму гриппа демонстрируют обратную взаимосвязь воздействие/ответ (фиг.41). Моделирование и имитация на основе опосредуемого mTOR фосфорилирования продуктов киназы S6 (S6K) прогнозируют, что режим дозирования 20 мг раз в неделю ингибирует опосредуемую mTOR активность S6K практически полностью, режим дозирования 5 мг раз в неделю ингибирует активность S6K более чем на 50%, и режим дозирования 0,5 мг каждые сутки ингибирует фосфорилирование S6K приблизительно на 38% в ходе интервала дозирования (Tanaka, C et al. (2008) J. Clin. Oncol 26:1596-1602). Таким образом, частичное ингибирование mTOR, например, опосредуемого mTOR фосфорилирования S6K низкой усиливающей иммунитет дозой RAD001 может быть настолько же, если не более, эффективным, чем практически полное ингибирование mTOR высокой дозой RAD001, в отношении усиления иммунного ответа у пожилых людей.
[00996] Также оценивали уровни сероконверсии через 4 недели после вакцинации против гриппа. Сероконверсию определяли как изменение от отрицательного титра до вакцинации (т.е. титр HI <1:10) до титра HI после вакцинации ≥ 1:40 или по меньшей мере 4-кратное увеличение относительно неотрицательного (≥ 1:10) титра HI до вакцинации. В выборке пациентов с намерением лечиться уровни сероконверсии для штаммов H3N2 и B были увеличенными в группах RAD001 по сравнению группой плацебо, хотя увеличение не удовлетворяло статистической значимости (таблица 10). В субпопуляции индивидуумов с исходными титрами вируса гриппа <= 1:40, введение RAD001 также повышало уровни сероконверсии в отношении штаммов H3N2 и B, и эти результаты достигали статистической значимости для штамма B в группе дозирования 0,5 мг каждые сутки. Эти данные далее демонстрируют, что RAD001 повышал серологический ответ на вакцинацию против гриппа у пожилых людей.
Таблица 10: Процент индивидуумов с сероконверсией в отношении гриппа через 4 недели после вакцинации
|
* Отношение шансов для сероконверсии между RAD001 и плацебо значимо отличалось от 1 (двухстороннее значение p < 0,05, полученное посредством логистической регрессией с лечением в качестве фиксированного эффекта)
[00997] Современные сезонные вакцины против гриппа часто обеспечивают недостаточную защиту против постоянно появляющихся штаммов гриппа, которые существуют в качестве вариантов ранее циркулировавших вирусов. Однако у мышей, вакцинированных против вируса гриппа в присутствии ингибитора mTOR рапамицина по сравнению с плацебо, развивался более широкий серологический ответ на вирус гриппа. Более широкий серологический ответ включал антитела к консервативным эпитопам, экспрессируемым множеством подтипов вируса гриппа, которые обеспечили защиту от инфекции гетерологичными штаммами вируса гриппа, не содержащимися в вакцине (Keating, R et al. (2013) Nat Immunology 14:2166-2178). Для определения того, расширял ли RAD001 серологический ответ на вирус гриппа у пожилых добровольцев измеряли титры HI к 2 гетерологичным штаммам вируса гриппа, не содержащимся в вакцине против гриппа (A/штамм H1N1 A/New Jersey/8/76 и A/штамм H3N2 A/Victoria/361/11). Увеличение соотношений HI GMT для гетерологичных штаммов было более высоким в группе RAD001 по сравнению с группой плацебо (фиг.42). Кроме того, уровни сероконверсии для гетерологичных штаммов были более высокими в группе RAD001 по сравнению с группой плацебо. Увеличение сероконверсии в группах дозирования 5 и 20 мг RAD001 раз в неделю было статистически значимым для гетерологичного штамма H3N2 (Таблица 11). Уровень сероконверсии в отношении H3N2 для объединенных групп RAD001 составил 39% против 20% для группы плацебо (p=0,007). Результаты, описанные в настоящем описании, указывают на то, что ингибирование mTOR расширяет серологический ответ пожилых добровольцев на вакцинацию против гриппа и повышает титры антител к гетерологичным штаммам вируса гриппа, не содержащимся в сезонной вакцине против гриппа.
[00998] Расширенный серологический ответ на гетерологичные штаммы вируса гриппа у мышей, которым вводили рапамицин, были ассоциированы с ингибированием переключения классов B-клеток и увеличением уровней IgM против вируса гриппа (Keating, R. et al. (2013) Nat Immunol 14:2166-2178). Однако ингибирование переключения классов может быть не вовлечено в расширенный серологический ответ у людей, которым вводили RAD001, поскольку уровни IgM и IgG против вируса гриппа после вакцинации не различались между группами введения RAD001 и плацебо (фиг.43).
Таблица 11: Процент индивидуумов с сероконверсией к гетерологичным штаммам вируса гриппа через 4 недели после сезонной вакцинации против гриппа
|
* Отношение шансов для сероконверсии между RAD001 и плацебо значимо отличалось от 1 (двухстороннее значение p < 0,05, полученное посредством логистической регрессии с лечением в качестве фиксированного эффекта)
[00999] Для определения механизма, посредством которого RAD001 повышал иммунную функцию у пожилых добровольцев, проводили иммунофенотипирование на образцах PBMC, полученных от индивидуумов на исходном уровне, после 6 недель лечения исследуемым лекарственным средством и через 4 недели после вакцинации против гриппа (6 после прекращения введения исследуемого лекарственного средства). Хотя процент большинства подгрупп PBMC не отличался между группами RAD001 и плацебо, процент положительных по PD-1 CD4 и CD8 клеток был боле низким в группе RAD001 по сравнению с группой плацебо (фиг.44). Положительные по PD-1 CD4 и CD8 клетки накапливаются с возрастом и имеют дефектные ответы на стимуляцию антигеном, поскольку PD-1 ингибирует индуцируемую T-клеточным рецептором пролиферацию T-клеток, продукцию цитокинов и цитолитическую функцию (Lages, CS et al. (2010) Aging Cell 9:785-798). Происходило увеличение процента положительных по PD-1 T-клеток с течением времени в группе плацебо. На 12 неделе (4 недели после вакцинации) это увеличение могло быть следствием вакцинации против гриппа, поскольку было показано, что вирус гриппа повышает уровень положительных по PD-1 T-клеток (Erikson, JJ et al. (2012) JCI 122:2967-2982). Однако процент CD4 положительных по PD-1 T-клеток снижался от исходного уровня на 6 и 12 неделях во всех группах RAD001 (фиг.44A). Процент CD8 положительных по PD-1 клеток также снижался от исходного уровня как на 6, так и 12 неделях в двух группах более низкой дозы RAD001 (фиг.44B). Процент отрицательных по PD-1 CD4 T-клеток оценивали, и он был увеличен в группах RAD001 по сравнению с плацебо (фиг.44C).
[001000] При более строгом статистическом анализе, когда результаты групп RAD001 объединяли и вносили поправку на отличия в исходной экспрессии PD-1, существовало статистически значимое снижение 30,2% уровня положительных по PD-1 CD4 T-клеток на 6 неделе в объединенной группе RAD (n=84) по сравнению с группой плацебо (n=25) с p=0,03 (q=0,13) (фиг.45A). Снижение уровня положительных по PD-1 CD4 T-клеток на 12 неделе в объединенной группе RAD по сравнению с группой плацебо составляет 32,7% с p=0,05 (q=0,19). На фиг.45B показано статистически значимое снижение, составляющее 37,4%, положительных по PD-1 CD8 T-клеток на 6 неделе в объединенной группе RAD001 (n=84) по сравнению с группой плацебо (n=25) с p=0,008 (q=0,07). Снижение положительных по PD-1 CD8 T-клеток на 12 неделе в объединенной группе RAD001 по сравнению с группой плацебо составляет 41,4% с p=0,066 (q=0,21). Таким образом, результаты, представленные на фиг.44 и 45, взятые вместе, указывают на то, что ассоциированное с RAD001 снижение процента положительных по PD-1 CD4 и CD8 T-клеток может вносить вклад в усиленную иммунную функцию.
Заключение
[001001] В заключение, данные, представленные в настоящем описании, демонстрируют, что ингибитор mTOR RAD001 смягчает связанное со старением снижение иммунологической функции у пожилого человека, как оценивают по ответу на вакцинацию против гриппа, и что это смягчение достигается с приемлемым соотношением риск/польза. В исследовании пожилых мышей введение в течение 6 недель ингибитора mTOR рапамицина не только усиливало ответ на вакцинацию против гриппа, но также увеличивало продолжительность жизни, что указывает на то, что ослабление старения иммунной системы может быть маркером более широкого эффекта на связанные со старением фенотипы.
[001002] Поскольку дозирование RAD001 прекращали за 2 недели до вакцинации эффекты RAD001 в отношении усиления иммунитета могут опосредоваться изменениями соответствующей популяции клеток, которая сохраняется после прекращения введения лекарственного средства. Результаты, представленные в настоящем описании, показывают, что RAD001 снижал процент истощенных положительных по PD-1 CD4 и CD8 T-клеток по сравнению с плацебо. Экспрессия PD-1 индуцируется передачей сигнала TCR и остается высокой в условиях длительной антигенной стимуляции, включающей хроническую вирусную инфекцию. Без связи с теорией, возможно, что RAD001 снижал хроническую активацию иммунной системы у пожилых добровольцев и, тем самым, приводил к снижению экспрессии PD-1. RAD001 также может прямо ингибировать экспрессию PD-1, как описано для иммунофилина циклоспорина A (Oestreich, KJ et al. (2008) J Immunol. 181:4832-4839). Индуцированное RAD001 снижение процента положительных по PD-1 T-клеток, вероятно, повышало качество T-клеточных ответов. Это согласуется с предшествующим исследованиями, демонстрирующими, что ингибирование mTOR повышало качество CD8 T-клеток памяти в ответ на вакцинацию у мышей и приматов (Araki, K et al. (2009) Nature 460:108-112). Также было показано, что у пожилых мышей ингибирование mTOR увеличивает количество гемопоэтических стволовых клеток, что приводи к увеличению продукции наивных лимфоцитов (Chen, C et al. (2009) Sci Signal 2:ra75). Хотя значимые отличия в процентах наивных лимфоцитов в группах RAD001 против плацебо не были выявлены в этом примере, этот возможный можно далее исследовать.
[001003] Механизм, посредством которого RAD001 расширял серологический ответ на гетерологичные штаммы вируса гриппа, можно исследовать далее. Также было показано, что рапамицин ингибирует переключение классов в B-клетках после вакцинации против гриппа. В результате был получен уникальный репертуар антител против гриппа, которые стимулировали перекрестную защиту против летальной инфекции подтипами гриппа, не содержащимися в вакцине против гриппа (Keating, R et al. (2013) Nat Immunol. 14:2166-2178). Результаты, описанные в настоящем описании, не показали, что RAD001 изменял переключение класса B-клеток у пожилых индивидуумов, которые прекращали введение RAD001 за 2 недели до вакцинации против гриппа. Хотя основной механизм требует дальнейшего прояснения, увеличенный серологический ответ на гетерологичные штаммы вируса гриппа, описанные в настоящем описании, могут сообщать усиленную защиту от заболевания гриппом в те годы, когда соответствие между сезонной вакциной и циркулирующими штаммами гриппа в обществе является низким.
[001004] Эффект RAD001 на титры антител против вируса гриппа был сравним с эффектом вакцинного адъюванта MF59, который одобрен для повышения ответа у пожилых людей на вакцинацию против гриппа (Podda, A (2001) Vaccine 19:2673-2680). Таким образом, обеспечиваемое RAD001 усиление антительного ответа на вакцинацию против гриппа может быть переведено в клиническую пользу, как продемонстрировано для вакцины против гриппа с MF59 в качестве адъюванта у пожилых людей (Iob, A et al. (2005) Epidemiol Infect. 133:687-693). Однако RAD001 также используют для подавления иммунного ответа у пациентов с трансплантатами органов. Эти вроде бы парадоксальные открытия предполагают вероятность, что иммуномодулирующие эффекты ингибиторов mTOR могут быть зависимыми от дозы и/или антигена (Ferrer, IR et al. (2010) J Immunol. 185:2004-2008). В настоящем примере показана тенденция к обратной взаимосвязи воздействие RAD001/ответ на вакцинацию. Является возможным, что полное ингибирование mTOR подавляет иммунную функцию через нормальный механизм циклофилин-рапамицин, где частичное ингибирование mTOR, по меньшей мере у пожилых людей, усиливает иммунную функцию вследствие явного ингибирования связанного со старением фенотипа. Интересно, что активность mTOR возрастает в различных тканях, включая гемопоэтические стволовые клетки в моделях на стареющих животных (Chen C. et al. (2009) Sci Signal 2:ra75 и Barns, M. et al. (2014) Int J Biochem Cell Biol. 53:174-185). Таким образом, подавление активности mTOR до уровней, наблюдаемых в молодых тканях, в противоположность полному подавлению активности mTOR, может иметь клиническую пользу при связанных со старением показаниях.
[001005] Профиль безопасности ингибиторов mTOR, таких как RAD001, при лечении связанных со старением показаний, представляет интерес. Токсичность RAD001 в дозах, используемых в онкологии и при трансплантации органов, включает уровни стоматита, диареи, тошноты, цитопении, гиперлипидемии и гипергликемии, которые были бы неприемлемы для многих связанных со старением показаний. Однако эти AE связаны с остаточными уровнями RAD001 в крови. Таким образом, режимы дозирования RAD001, использованные в этом исследовании, были выбраны так, чтобы минимизировать остаточные уровни. Средние остаточные уровни RAD001 в группах дозирования 0,5 мг каждые сутки, 5 мг раз в неделю и 20 мг раз неделю составляли 0,9 нг/мл, ниже 0,3 нг/мл (нижняя граница количественного определения) и 0,7 нг/мл, соответственно. Эти остаточные уровни являются значительно более низкими, чем остаточные уровни, ассоциированные с режимами дозирования, используемыми у пациентов с трансплантацией органов и злокачественной опухолью. Кроме того, ограниченный курс лечения в течение 6 недель снижал риск неблагоприятных явлений. Эти данные указывают на то, что режимы дозирования, используемые в этом исследовании, могут иметь приемлемое соотношение риск/польза для некоторых состояний у пожилых людей. Тем не менее, у значительных количеств индивидуумов в экспериментах, описанных в настоящем описании, развивались язвы рта, даже при дозировании только 0,5 мг каждые сутки. Таким образом, профиль безопасности низкой усиливающей иммунитет дозы RAD001 требует дальнейшего исследования. Разработка ингибиторов mTOR с улучшенными профилями безопасности, чем доступные в настоящее время рапалоги, может обеспечить лучшие терапевтические режимы в будущем для связанны со старением состояний.
Пример 13: Усиление иммунного ответа на вакцину у пожилых индивидуумов
[001006] Иммунная функция снижается у пожилых людей, что приводит к увеличению встречаемости инфекции снижению ответа на вакцинацию. В качестве первой стадии при определении того, имеет ли ингибирование mTOR эффекты, направленные против старения, у человека, проводили испытание для определения того, вызывает ли ингибитор mTOR RAD001 реверсию связанного со старением снижений иммунной функции при оценке по ответу на вакцинацию у пожилых добровольцев. Во всех случаях получали соответствующие согласия от пациентов и исследования были одобрены органами общественного здравоохранения.
[001007] В исследовании использовали следующие 3 режима дозирования RAD001:
20 мг раз в неделю (остаточный уровень: 0,7 нг/мл)
5 мг раз в неделю (остаточный уровень был ниже пределов обнаружения)
0,5 мг каждые сутки (остаточный уровень: 0,9 нг/мл)
[001008] Эти режимы дозирования были выбраны, поскольку они имеют более низкие остаточные уровни, чем дозы RAD001, одобренные при трансплантации и онкологи. Остаточный уровень представляет собой наиболее низкий уровень лекарственного средства в организме. Остаточный уровень RAD001, ассоциированный с режимом дозирования при онкологии 10 мг каждые сутки, составляет приблизительно 20 нг/мл. Остаточный уровень, ассоциированный с режимом дозирования при трансплантации 0,75-1,5 мг bid, составляет приблизительно 3 нг/мл. Напротив, остаточный уровень, ассоциированный с режимами дозирования, использованными в исследованиях авторов настоящего изобретения, является в 3-20 раз более низким.
[001009] Поскольку связанные с RAD001 AE ассоциированы с остаточными уровнями, было спрогнозировано, что 3 режима дозирования будут иметь надлежащую безопасность для здоровых добровольцев. Кроме того, было спрогнозировано, что 3 дозы будут обеспечивать диапазон ингибирования mTOR. Киназа P70 S6 (P70 S6K) представляет собой нижерасположенную мишень, которая фосфорилируется посредством mTOR. Уровни фосфорилирования P70 S6K служат в качестве меры активности mTOR. Исходя из моделирования и имитации данных фосфорилирования P70 S6K, полученных в доклинических и клинических испытаниях RAD001, было спрогнозировано, что доза 20 мг раз в неделю будет практически полностью ингибировать активность mTOR в течение полной н недели, в то время как доза 5 мг раз в неделю и 0,5 мг каждые сутки будут частично ингибировать активность mTOR.
[001010] Пожилых добровольцев в возрасте ≥ 65 лет случайным образом распределяли в одну из 3 групп лечения RAD001 (50 индивидуумов на группу) или плацебо (20 индивидуумов на группу). Индивидуумов лечили исследуемым лекарственным средством в течение 6 недель, затем давали 2-недельный перерыв, а затем проводили вакцинацию против гриппа (Aggrippal, Novartis) и пневмококка (Pneumovax 23, Merck). Ответ на вакцинацию против гриппа оценивали путем измерения геометрических средних титров (GMT) посредством анализа ингибирования гемагглютинации в отношении 3 штаммов вируса гриппа (подтипы вируса гриппа H1N1, H3N2 и B) в вакцине против гриппа через 4 недели после вакцинации. Первичные результаты исследования представляли собой (1) безопасность и переносимость и (2) увеличение в 1,2 раза титров против вируса гриппа по сравнению с плацебо для 2/3 из трех вакцинных штаммов вируса гриппа через 4 недели после вакцинации. Этот конечный результат был выбран, поскольку увеличение титров против вируса гриппа в 1,2 раза ассоциировано с со снижением заболеваемости гриппом после вакцинации, и, таким образом, он является клинически значимым. Дозы 5 мг раз в неделю и 0,5 мг каждые сутки хорошо переносились и в отличие от дозы 20 мг раз в неделю удовлетворяли первичному результату GMT (фиг.40A). RAD001 не только улучшал ответ на вакцинацию против гриппа, он также улучшал ответ у пожилых добровольцев на пневмококковую вакцинацию по сравнению с плацебо. Пневмококковая вакцина содержит антигены из 23 серотипов пневмококка. У исследуемых индивидуумов измеряли титры антител к 7 из этих серотипов. Титры антител к 6/7 серотипов были увеличены во всех 3 группах RAD по сравнению с плацебо.
[001011] Комбинированные данные для вируса гриппа и пневмококка указывают на то, что частичное (менее чем 80-100%) ингибирование mTOR является более эффективным в отношении реверсии связанного со старением снижения иммунной функции, чем полное ингибирование mTOR.
Пример 14: Ингибирование mTOR в низкой дозе увеличивает энергию и выносливость
[001012] В доклинических моделях ингибирование mTOR рапалогом рапамицином повышает самопроизвольную физическую активность у пожилых мышей (Wilkinson et al. Rapamycin slows aging in mice. (2012) Aging Cell; 11:675-82). Интерес представляет то, что для индивидуумов в группе дозирования 0,5 мг каждые сутки, описанные в примере 13, также описаны увеличение энергии и увеличение выносливости к физической нагрузке по сравнению с плацебо в опросниках, которые давали через один год после дозирования (фиг.46). Эти данные указывают на то, что частичное ингибирование mTOR рапалогами может иметь благоприятные эффекты на связанную с со старением заболеваемость, помимо только иммунной функции.
Пример 15: Ингибирование киназы P70 S6 посредством RAD001
[001013] Моделирование и имитацию проводили для прогнозирования суточных и недельных диапазонов доз RAD001, которые частично ингибируют активность mTOR. Как отмечалось выше, P70 S6K фосфорилируется посредством mTOR и она является нижерасположенной мишенью mTOR, которая наиболее тесно связана со старением, поскольку нокаут P70 S6K увеличивает продолжительность жизни. Таким образом, проводили моделирование доз RAD001, которые частично ингибируют активность P70 S6K. Спрогнозировано, что дозирование каждую неделю в диапазоне ≥ 0,1 мг и < 20 мг обеспечивает частичное ингибирование активности P70 S6K (фиг.47).
[001014] Для дозирования каждые сутки концентрации RAD001 от 30 пМ до 4 нМ частично ингибировали активность P70 S6K в клеточных линиях (таблица 12). Спрогнозировано, что эти сывороточные концентрации достигаются с использованием доз RAD001 от ≥ 0,005 мг до < 1,5 мг каждые сутки.
Таблица 12: Процентное ингибирование активности P70 S6K в клетках HeLa in vitro
|
Заключение
[001015] Разрабатывали способы лечения связанных со старением заболеваний или общего усиления иммунного ответа с использованием доз ингибиторов mTOR, которые только частично ингибируют P70 S6K. Эффективность частичного ингибирования mTOR низкими дозами RAD001 при связанных со старением показаниях является неожиданным открытием. Доза RAD001, находящаяся в диапазоне от ≥ 0,1 мг до < 20 мг раз в неделю и от ≥ 0,005 мг до < 1,5 мг каждые сутки будет обеспечивать частичное ингибирование mTOR, таким образом, ожидается, что она будет иметь эффективность при связанных со старением заболеваниях или для усиления иммунного ответа.
Пример 16: Экзогенный IL-7 усиливает функцию CAR T-клеток
[001016] После адоптивного переноса CAR T-клеток некоторые пациенты имеют ограниченную персистенцию CAR T-клеток, что может приводить к субоптимальным уровням противоопухолевой активности. В этом примере оценивают эффекты введения экзогенного IL-7 человека в моделях на мышах с ксенотрансплантатами, в которых наблюдали изначальный субоптимальный ответ на CAR T-клетки.
[001017] Экспрессию рецептора IL-7 CD127 сначала оценивали в различных клеточных линиях злокачественной опухоли и в CAR-экспрессирующих клетках. Две клеточных линии лимфомы из клеток мантийной зоны (RL и Jeko-1) и одну клеточную линию B-ALL (Nalm-6) анализировали проточной цитометрией в отношении экспрессии CD127. Как показано на фиг.48A, из трех исследованных линий злокачественных клеток RL продемонстрировала наиболее высокую экспрессию CD127, а за гей следовали Jeko-1 и Nalm-6. Клетки CART19 вводили путем инфузии мышам NSG и оценивали экспрессию CD127 на циркулирующих клетках CART19 посредством проточной цитометрии. Как показано на фиг.48B, CD127 однородно экспрессировался на всех циркулирующих клетках CART19.
[001018] Далее, эффект экзогенного введения IL-7 на противоопухолевую активность клеток CART19 оценивали в модели лимфомы на животных. Мышам NSG трансплантировали экспрессирующую люциферазу линию клеток мантийной зоны (RL luc) на 0 сутки (D0), а затем проводили введение клеток CART19 на 6 сутки. Мышей NSG разделяли на группы, где в одной группе не вводили клетки CART19, во второй группе вводили 0,5×106 клеток CART19, в третьей группе вводили 1×106 клеток CART19 и в четвертой группе вводили 2×106 клеток CART19. Мониторинг размера опухоли проводили посредством измерения средней биолюминесценции трансплантированных опухолей в течение более чем 80 суток. Только мыши, которым вводили 2×106 клеток CART19, продемонстрировали отторжение опухоли и ингибирование роста опухоли (фиг.49A). Было показано, что мыши из двух групп, в которых вводили 0,5×106 клеток CART19 или 1×106 клеток CART19 имеют субоптимальный противоопухолевый ответ. Затем мышей из этих двух групп распределяли случайным образом, где трем мышам (мыши #3827 и #3829, которым вводили 0,5×106 клеток CART19, и мышь #3815, которой вводили 1×106 клеток CART19) вводили экзогенный рекомбинантный IL-7 человека в дозировке 200 нг/мышь посредством внутрибрюшинной инъекции три раза в неделю, начиная на 85 сутки, и двум мышам не вводили. Опухолевая нагрузка мышей, которым вводили экзогенный IL-7 на 85-125 сутки, при определении по средней биолюминесценции, представлена на фиг.49B. Все мыши, которым вводили IL-7, продемонстрировали выраженный ответ, состоящий в снижении опухолевой нагрузки на 1-3 log. Мыши, которым первоначально вводили более высокую дозу клеток CART19 (мышь #3815, которой вводили 1×106 клеток CART19) продемонстрировали более глубокий ответ. При сравнении опухолевой нагрузки у мышей, которым проводили введение IL-7, с контролем, до и после введения IL-7, снижение опухолевой нагрузки наблюдали только у мышей, которым проводили введение IL-7 (фиг.49C).
[001019] Также исследовали динамику T-клеток после введения IL-7 в модели лимфомы на животных. Клетки CART19 человека не поддавались обнаружению в крови перед введением IL-7. После введения IL-7 происходило быстрое, но вариабельное, увеличение количеств T-клеток у подвергаемых лечению мышей (фиг.50A). Степень экспансии T-клеток, наблюдаемая у мышей, которым вводили IL-7, также коррелировала с ответом опухоли. Мышь с наиболее высоким количеством обнаруженных в крови T-клеток на пике экспансии в процессе введения IL-7 (мышь #3815) имела наиболее высокое снижение опухолевой нагрузки (см. фиг.49B). Более того, момент максимальной экспансии коррелировал с дозой T-клеток, инъецированной на исходном уровне. Количество/уровень CD3-экспрессирующих клеток в крови также измеряли до и после лечения IL-7. У контрольных мышей было обнаружено очень мало CD3-экспрессирующих клеток, в то время как у мышей, которых лечили IL-7, было продемонстрировано значительное увеличение количества CD3+ клеток после лечения IL-7 (фиг.50B).
[001020] Взятые вместе, результаты этого примера демонстрируют, что лечение экзогенным IL-7 увеличивает пролиферацию T-клеток и противоопухолевую активность in vivo, что указывает на то, что применение IL-7 у пациентов с субоптимальными результатами после терапии CAR может повысить противоопухолевый ответ у этих пациентов.
ЭКВИВАЛЕНТЫ
[001021] Содержание каждого патента, патентной заявки и публикации, цитированных в настоящем описании, включено в настоящее описание в качестве ссылки в полном объеме. Хотя это изобретение описано в отношении конкретных аспектов, очевидно, что другие аспекты и вариации настоящего изобретения могут быть установлены другими специалистами без отклонения от истинной сущности и объема изобретения. Подразумевают, что прилагаемую формулу изобретения следует истолковывать как включающую все такие аспекты и эквивалентные вариации.