Результат интеллектуальной деятельности: Способ получения четырехкомпонентной культуральной живой вакцины против кори, ветряной оспы, эпидемического паротита, краснухи
Вид РИД
Изобретение
Область техники
Изобретение относится к медицине, а именно, к медицинской вирусологии и биотехнологии и может быть использовано при разработке средств специфической профилактики и в, частности, для получения 4-х компонентной вакцины для профилактики кори, ветряной оспы, эпидемического паротита и краснухи.
Уровень техники
Создание четырехкомпонентной вакцины на основе вирусов кори, ветряной оспы, эпидемического паротита и краснухи с эпидемической точки зрения является весьма перспективной, поскольку эти детские заболевания, как правило, встречаются в один эпидемический период, нанося ущерб здоровью детского населения страны.
Многокомпонентные вакцины обладают рядом преимуществ перед моновалентными вакцинами. Одномоментная вакцинация, не сопровождающаяся потенцированием реактогенности и угнетением иммунного ответа к какому либо из антигенов, позволяет сократить число вакцинаций без уменьшения вводимых антигенов, уменьшает стрессовую нагрузку на прививаемых и позволяет более успешно реализовать проведение прививок в сроки, определенные календарем прививок, снизить загруженность медицинских работников и, соответственно, снизить стоимость программ иммунизации.
Отечественного способа получения четырехкомпонентной живой культуральной вакцины, аттенуированной для профилактики кори, эпидемического паротита, краснухи и ветряной оспы нет, также как нет и моновакцины для профилактики ветряной оспы.
Известны зарубежные способы получения вакцины PRIORIX-TETRA (GlaxoSmithKline, Бельгия) и ProQuad (США) для профилактики кори, эпидемического паротита, краснухи и ветряной оспы.
Наиболее близким аналогом заявляемого изобретения является способ получения тетравакцины PRIORIX-TETRA, включающий приготовление вируссодержащих материалов из аттенуированного штамма Schwarz вируса кори, из штамма RIT 4385 вируса паротита (получен из штамма Jeryl Lynn), из штамма RA27/3 вируса краснухи и из штамма vOKA вируса ветряной оспы. Из каждого вирусного штамма раздельно на клетках куриного эмбриона произведены моновакцины против кори и эпидемического паротита, а на диплоидных клетках человека MRC-5 (легкие эмбриона человека) - моновакцины против краснухи и ветряной оспы [PRIORIX-TETRAR PRODUCT INFORMATION, GlaxoSmthKline, 28.11.2014].
Недостатками известного технического решения является использование различных видов клеток для приготовления вируссодержащих материалов, применение трипсина в качестве диспергирующего агента для всех клеточных субстратов, как для получения первичной клеточной культуры из тканей куриных эмбрионов, так и для пассирования диплоидных клеточных штаммов, использование для приготовления вакцины внеклеточного вируса ветряной оспы, полученного из внутриклеточно-ассоциированного вируса путем сложной методики извлечения. Как известно, трипсин, обладая высокой диссоциирующей активностью, вызывает частичный протеолиз белков клеточной мембраны и тем самым снижает исходную потенцию клеток к делению. Повреждение клеточной мембраны влечет за собой повреждение и ингибирование рецепторов, расположенных на ее поверхности, что несомненно, искажает достоверность информации при взаимодействии клеточных рецепторов и вирусов.
Задачей предлагаемого способа является получение целевого продукта высокого качества и экономически выгодным способом за счет использования единого клеточного субстрата для вирусов кори, эпидемического паротита, краснухи и ветряной оспы и тем самым возможности снижения содержания белков птичьего эмбриона в комбинированной живой культуральной вакцине аттенуированной для профилактики кори, эпидемического паротита, краснухи и ветряной оспы.
Научная новизна и оригинальность исследования заключаются также в создании холодоадаптированных штаммов всех 4-х вирусов, входящих в состав комбинированной вакцины, что позволяет снизить до минимума реактогенность вирусных штаммов, не снижая при этом иммуногенности. Созданная комбинированная вакцина будет обладать высоким специфическим иммунным ответом, поскольку три вирусных штамма из 4-х (корь, эпидемический паротит и ветряная оспа), входящих в состав 4-х компонентной вакцины, являются отечественными, циркулирующими на территории России.
Раскрытие сущности изобретения.
Поставленная цель достигается тем, что заявленный способ предусматривает заражение вирусами кори (штамм Ленинград-16 - холодоадаптированный), эпидемического паротита (штамм Л-3 - холодоадаптированный), краснухи (штамм RA27/3 холодоадаптированный), ветряной оспы (штамм vFiraVax холодоадаптированный) (депонирован под №2891 в Государственной коллекции вирусов Института вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России 12 декабря 2018 года) отечественного штамма диплоидных клеток: ЛЭЧ-3, пассируемых с помощью 0,4% раствора тринатрийцитрата в питательной среде ДМЕМ/F12 с 0,13% NaHCO3 и 10 мМ HEPES, обогащенной оксалоацетатом (0,15 мг/мл), пируватом (0,05 мг/мл), инсулином бычьим (0,2 U/мл) и ростстимулирующим фактором 0,08% ТНЦ в конечной концентрации, с 5% эмбриональной телячьей сывороткой (ЭТС), инактивированной прогреванием и выходом вирусов в культуральную среду, его осветлением низкоскоростным центрифугированием, фильтрацией через миллипоровые фильтры, внесением стабилизатора и лиофильным высушиванием.
На стадии репродукции осуществляют сборы вируссодержащей жидкости с инфицированных диплоидных клеток ЛЭЧ-3 для вируса кори, эпидемического паротита, краснухи и ветряной оспы не менее 5-15 индивидуальных сливов с интервалами 2-3 суток с момента выхода вирусов в культуральную среду (начиная с 4-6 суток с момента инфицирования).
Техническим результатом изобретения является улучшение качества вакцины за счет введения в нее нового вирусного штамма vFiraVax, который обеспечивает высокий иммуный ответ на ветряночный компонент 4- х валентной вакцины.
Заявленное техническое решение позволяет упростить технологию получения комбинированной вакцины, улучшить ее качество и обеспечить защиту от биологических контаминантов (вирусов, микоплазм, бактерий):
а) за счет использования единого клеточного субстрата, а именно штаммов диплоидных клеток для всех 4-х вирусных штаммов
Выбор и перспективность клеточного субстрата определяется его доступностью и стабильностью биологических свойств, технологичностью в производстве и возможностью длительного хранениятжидком азоте, а также высокой чувствительностью к модельным вирусам и отсутствием контаминации (Л.Д. Дьяконов, Животная клетка в культуре (методы и применение в биотехнологии), Москва 2009, Из-во Спутник).
Применение первичных культур клеток не оправдано по экономическим и биологическим показателям и, в особенности, по безопасности.
Экспертный комитет по биологической стандартизации ВОЗ в качестве альтернативы к первичным клеточным субстратам для производства вирусных вакцин рекомендует человеческие диплоидные клетки (human diploid cells - HDCs). Использование HDCs основано на способности клеточных культур: а) сохраняться при низких температурах на ранних уровнях пассажей; б) в результате этого появляется возможность охарактеризовать криогенные банки клеток, количество которых позднее можно увеличивать, для того чтобы обеспечить производство стандартизованным источником клеток в течение многих десятилетий; с) экстенсивно проверять восстановленные клетки из криобанка (working cell bank - WCB) перед использованием в производстве вакцины; д) появляется возможность доказать, что клетки не содержат посторонних агентов и что они неспособны формировать опухоли при введении иммуносупрессивным животным. HDCs в качестве субстрата для производства вирусных вакцин была принята и имеет долгую историю изучения безопасности и эффективности. В практику также введена концепция клеточного мастер банка (master cell bank - МСВ): рабочий клеточный банк).
б) использование для штамма диплоидных клеток ростовой питательной среды ДМЕМ/F12 с 0,13% NaHCO3 и 10 мМ HEPES, обогащенной ростовыми добавками ОПИ (оксалолацетат - 0,15 мг/мл, пируват натрия - 0,05 мг/мл, бычий-инсулин 0,2 U/мл) и добавление ростстимулирующего фактора ТНЦ в конечной концентрации 0,001-0,01%, с 5% ЭТС, инактивированной прогреванием, позволяет получить плотный клеточный монослой диплоидных клеток на 3-4 сутки без дополнительной замены ростовой питательной среды на свежую.
Введение ростовых добавок и ростстимулирующего фактора дает возможность получить высококачественный целевой продукт за более низкую конечную стоимость.
Введение в ростовую среду двух буферных растворов в оптимальном сочетании (0,13% бикарбоната натрия и 10 мМ HEPES) обеспечивает наиболее физиологические условия для роста диплоидных клеток в самые критические моменты роста, т.е. на 1 и 2 сутки.
в) использование ТНЦ в концентрации 0,2-0,6% на изотоническом растворе моновалентных солей и глюкозы для пассирования штаммов диплоидных клеток при температуре 35-37°С увеличивает пролиферативную активность диплоидных клеточных культур по сравнению с трипсинизированными клеточными культурами.
Преимуществом перед трипсином имеет использование в качестве диссоциирующего агента для пассирования клеточных линий тринатрийцитрат (ТНЦ) - это диссоциирующий агент химической природы, связывающий двухвалентные ионы Са2+. Диссоциация с помощью ТНЦ происходит по клеточному контакту и клеточная мембрана остается неповрежденной.
Изучение нами диссоциирующей способности ТНЦ для клеточных культур показало отсутствие необходимости применения смесей различных диссоциирующих агентов для усиления их специфического действия.
Показано, что пролиферативный индекс клеточных линий, культивируемых с помощью ТНЦ всегда выше по сравнению с трипсином на 30-50% в зависимости от типа клеточных культур. Эти данные хорошо согласуются с результатами измерения активности ключевых ферментов гликолиза после 48 часов роста культур клеток. Общий уровень гликолитической активности у культур клеток, пассируемых с помощью ТНЦ, возрастает незначительно, в то же время образовавшийся пул глюкозо-6-фосфата в большей степени утилизируется за счет активации глюкозо-6-фосфатдегидрогеназы (возрастает более чем на 70% по сравнению при пассировании с трипсином) и подавления в 2,5 раза фосфофруктокиназы. Очевидно, активация пентозофосфатного шунта необходима быстрорастущим клеткам для поддержания синтеза ДНК на высоком уровне при интенсивном расходовании предшественников. Параллельно возрастает и активность лизосомальных ферментов, что указывает на увеличение транспорта веществ и повышенную метаболическую активность клеток, пассируемых посредством ТНЦ.
Таким образом, предотвращение разрушения плазматических мембран протеолитическими ферментами за счет использования ТНЦ приводит к быстрому восстановлению нормального физиологического состояния клеток и увеличению их пролиферативных потенций. При пассировании клеточных культур с использованием ТНЦ количество патологических митозов снижается на 30-54%, что является результатом более физиологических условий культивирования клеток.
Нами было установлено, что спектр чувствительности клеточных культур, пассируемых с помощью ТНЦ к некоторым ДНК- и РНК-содержащим вирусам увеличивается. Так, величина инфекционной активности вакцинных штамма вируса кори (Ленинград-16), эпидемического паротита (Ленинград-3), вируса краснухи (штамм RA27/3), вируса ветряной оспы (штамм «vFiraVax») выше на 0,75-1,5 lgГАДЕ50 в сравнении с таковыми показателями при пассировании с трипсином.
Таким образом, наши исследования некоторых культуральных, цитогенетических, вирусологических и биохимических свойств клеточных культур, пассируемых с ТНЦ, отчетливо выявили ряд преимуществ по сравнению с трипсином. И, в первую очередь, обращает внимание повышенная потенция клеточных культур к пролиферации на протяжении всего периода культивирования и на всех пассажных уровнях. Наиболее важной информацией по определению активности ключевых ферментов гликолиза является активация глюкозо-6-фосфатдегидрогеназы более чем на 70% и подавление в 2,5 раза активности фосфатфруктокиназы. Эти результаты указывают, что процесс гликолиза в клетках, пассируемых с ТНЦ идет по пентозофосфатному пути, основному пути гликолиза в нормальной ткани человека, включая диплоидные клетки, культивируемые in vitro.
Осуществление изобретения.
Предложенный способ осуществляют следующим образом.
Вирусные сборы (вируссодержащую жидкость - ВСЖ) вакцинного штамма вируса кори (штамм Ленинград-16),вируса эпидемического паротита (штамм Л-3), вакцинного штамма вируса краснухи (штамм RA27/3), вакцинного штамма ветряной оспы (штамм vFiraVax) получают путем репродукции вирусов в монослойной культуре диплоидных клеток ЛЭЧ-3. Для увеличения репродукции вышеперечисленных вирусов штамм диплоидных клеток ЛЭЧ-3 выращивают в питательной- среде ДМЕМ/F12 с 0,13% NaHCO3 и 10 мМ HEPES, обогащенной ростовыми добавками (оксалоацетат, пируват, инсулин - ОПИ и ростстимулирующим фактором ТНЦ (0,001-0,01%) с 5% ЭТС (эмбриональной телячьей сывороткой), инактивированной прогреванием, 2 мМ тлутамина глутамина, 40 мкг/мл гентамицина. Культуру диплоидных клеток пассируют с помощью 0,4% раствора тринатрийцитрата на изотоническом растворе моновалентных солей и глюкозы (6,0 г/л). По достижении плотного монослоя диплоидных клеток, как правило, на 3-4 сутки роста, ростовую среду удаляют, клеточный монослой осторожно 2-х кратно промывают фосфатно-буферным раствором, содержащим ионы Са2+ и Mg2+ и на монослой клеток ЛЭЧ-3 вносят ВСЖ кори, эпидемического паротита, краснухи, ветряной оспы с множественностью инфицирования 0,02. Контакт вирусов с клетками продолжается 2 часа при температуре 30°С, при этом, через каждые 15 минут культуральные флаконы с инфицированными клетками покачивают для равномерного распределения ВСЖ. Через 2 часа, не удаляя неадсорбировавшийся вирус, в культуральные флаконы вносят поддерживающую среду ДМЕМ без сыворотки с 2 мМ глутамина и 40 мкг/мл гентамицина в объеме в 2 раза меньшем, чем ростовая среда. Вирусные индивидуальные сборы собирают, как указано выше.
Определение инфекционной активности индивидуальных вирусных сборов проводят на чувствительной для всех 4-х вакцинных штаммов клеточной линии Vero или КМ-27 (кожно-мышечная ткань эмбриона человека или ФЭМС (штамм диплоидных клеток фибробластов эмбриона морской свинки) или Mewo (меланома человека), выращенных на 24-луночных планшетах. Посевная доза клеток составляет 70×103 клеток в ростовой среде ДМЕМ с 5% ЭТС, 2 мМ глутамина и 40 мкг/мл гентамицина. На 2-е сутки после формирования сплошного монослоя, ростовую питательную среду из лунок планшет удаляют, клеточный монослой в лунках однократно промывают ФБР и в лунки каждой планшеты вносят по 0,5 мл десятикратных разведений ВСЖ кори, эпидемического паротита, краснухи и ветряной оспы.
Инфекционную активность 4-х вирусов титруют с разведения 10-1 до разведения 10-8 и оценивают инфекционную активность вируса кори по характерному цитопатическому действию (образование симпластов), и выражают в lgТЦД50/0,5 мл. Инфекционную активность вирусов эпидемического паротита, краснухи и ветряной оспы титруют с разведения 10-1 до разведения 10-9, оценивают в реакции гемадсорбции с 0,25% взвесью эритроцитов морской свинки и выражают в гемадсорбирующих единицах в 0,5 мл (lgГАДЕ50/0,5 мл). Гемадсорбирующую активность вирусов краснухи и ветряной оспы подтверждают в реакции иммунофлуоресценции со специфическими антивирусными иммуноглобулинами.
Титр вируса кори штамм Ленинград-16 достигает во всех сливах инфекционной активности 5,0-6,5 lgТЦД50/0,5 мл, титр вируса эпидемического паротита штамм Ленинград-3 достигает во всех сливах инфекционной активности 6,5-7,0 lgГАДЕ50/0,5 мл, титр вируса краснухи штамм RA27/3 достигает во всех сливах инфекционной активности 7,0-8,0 lgГАДЕ50/0,5 мл. Титр вируса ветряной оспы достигает во всех сливах инфекционной активности 7,0-8,0 lgГАДЕ50/0,5 мл.
После определения инфекционной активности индивидуальных сборов, их объединяют каждый в отдельности с добавлением стабилизатора, а затем готовят комбинированную четырехкомпонентную комбинированную вакцину из аттенуированных штаммов вируса кори (штамм Ленинград-16), вируса эпидемического паротита (штамм Ленинград-3), вируса краснухи (штамм RA27/3) вируса ветряной оспы (штамм vFiraVax), при этом титр вируса кори штамм Ленинград-16 достигает инфекционной активности 5,0-6,5 lg lgГАДЕ50/0,5 мл, титр вируса эпидемического паротита штамм Ленинград-3 имеет инфекционную активность 6,5-7,0 lgГАДЕ50/0,5 мл, титр вируса краснухи штамм RA27/3 достигает инфекционной активности 7,0-8,0 lgГАДЕ50/0,5 мл, титр вируса ветряной оспы достигает во всех сливах инфекционной активности 7,0-8,0 lgГАДЕ50/0,5 мл. В вакцине данные штаммы находятся в следующем соотношении: вакцинный штамм вируса кори (штамм Ленинград 16) не менее 3,0 lgГАДЕ50/0,5 мл; вакцинный штамм вируса эпидемического паротита (штамм Ленинград 3) не менее 4,5 lgГАДЕ50/0,5 мл; вакцинный штамм вируса краснухи (штамм Wistar RA27/3) не менее 4,5 lgГАДЕ50/0,5 мл; вакцинный штамм ветряной оспы (штамм vFiraVax) не менее 5,5 lgГАДЕ50/0,5/0,5 мл.
Краткое описание поясняющих материалов
Таблица 1 - Титры в ИФА кроличьих иммунных сывороток, иммунизированных вирусными антигенами, входящих в состав комбинированной вакцины.
Таблица 2 - Нейтрализующая активность кроличьих сывороток, иммунизированных вакцинными штаммами вирусов.
Таблица 3 - Пролиферативная активность перевиваемой клеточной линии Vero на 3-b сутки роста, культивируемые с использованием тринатрийцитратана различных пассажных уровнях.
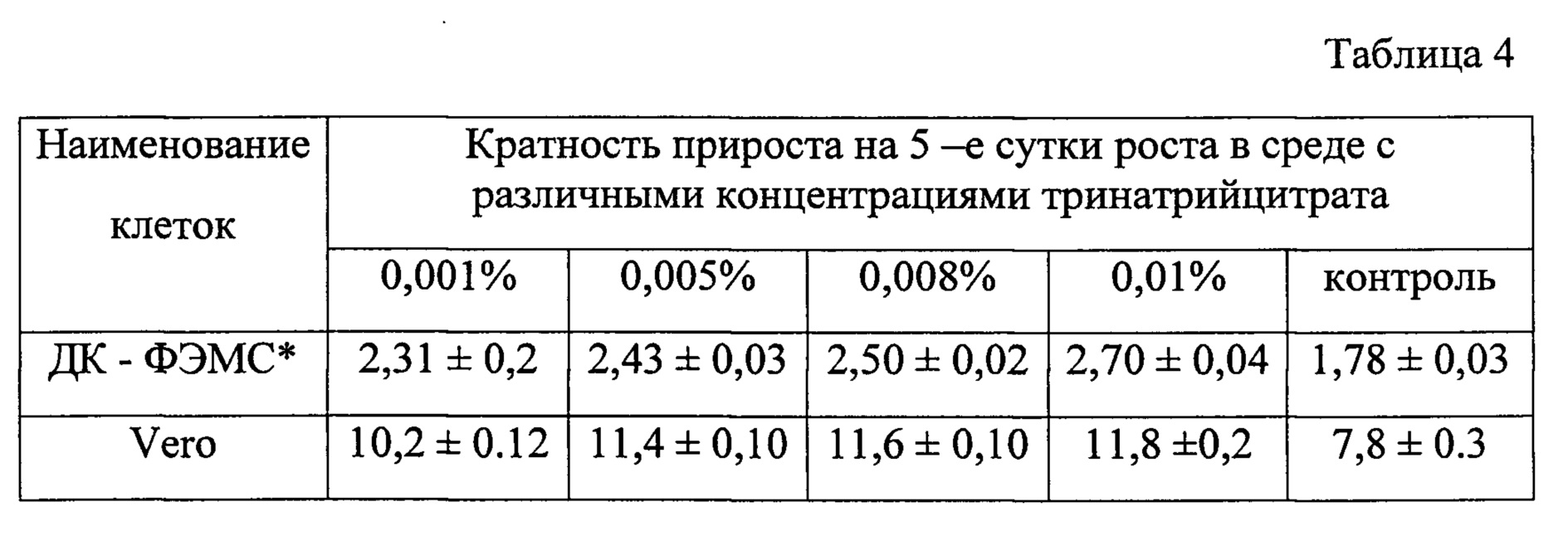
Таблица 4 - Кратность прироста клеточных культур на 5-е сутки роста при выращивании в питательной среде с различными концентрациями тринатрийцитрата. * - диплоидные клетки - фибробласты эмбрионов морской свинки
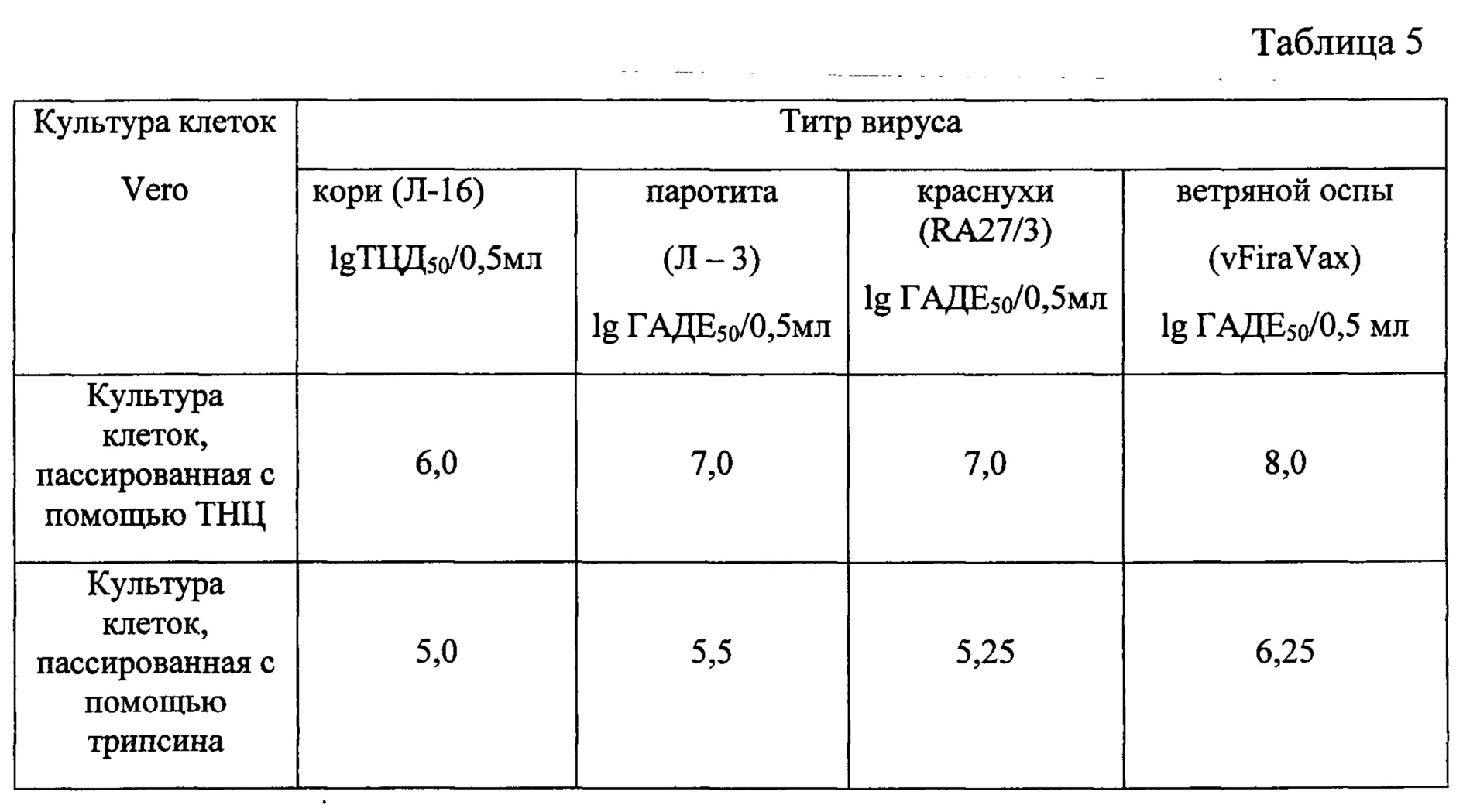
Таблица 5 - Накопление вакцинных штаммов вирусов в перевиваемой клеточной культуре Vero пассируемых с помощью тринатрийцитрата и трипсина.
Пример 1. Определение иммунизирующих свойств вакцины.
Иммунизирующие свойства 4-х компонентной вакцины определяли путем оценки иммунизирующих свойств моновакцин, входящих в состав комбинированной вакцины, а именно, иммунного ответа вакцинного штамма вирусов кори, ветряной оспы, эпидемического паротита и краснухи. С этой целью проводили подкожную иммунизацию кроликов породы «Шиншилла», весом 2,5 кг. Через 30 дней после иммунизации из ушной вены животного забирали образцы крови, получали иммунные кроличьи сыворотки и проводили их серологический анализ. Титры иммунных сывороток в иммуноферментном анализе (ИФА) представлены в таблице 1.
Пример 2. Реакцию нейтрализации ставили на чувствительной культуре клеток Vero. Культуру клеток Vero выращивали в 24 - луночных планшетах в ростовой среде ДМЕМ /F12 5% эмбриональной телячьей сыворотки с 2 мМ глутамина и 40 мкг/мл гентамицина. Посевная концентрация клеток составляла 70×103 леток на лунку. Через 24-48 часов культивирования при 36,5°С в атмосфере с 5% CO2 после формирования монослоя поставили реакцию нейтрализации для всех 4-х компонентов вирусов. С этой целью равные объемы двухкратных разведений иммунных сывороток и 100 доз вакцинных вирусов объединяли, тщательно перемешивали, оставляли на контакт при комнатной температуре на 2 часа, при этом каждые 15 минут объединенные смеси встряхивали. После завершения контакта смесь иммунных сывороток со 100 дозами вирусов наносили в лунки 24-луночных пластин с монослоем клеток, которые предварительно были промыты фосфатно-буферным раствором, содержащим ионы магния и кальция. В таблице 2 представлены результаты.
Полученные результаты убедительно демонстрируют высокие иммунизирующие свойства моновакцин кори, ветряной оспы, эпидемического паротита и краснухи, входящие в состав комбинированной 4-х валентной вакцины.
Пример 3. Определение ростстимулирующего эффекта ТНЦ
3.1 Пассирование перевиваемых клеточных культур и штаммов диплоидных клеток с использованием ТНЦ.
Для пассирования перевиваемых клеточных культур и штаммов диплоидных клеток при температуре 35°С-37°С используется ТНЦ в концентрации 0,2-0,6% на изотоническом растворе моновалентных солей и глюкозы (оптимальная концентрация ТНЦ 0,4%). Оценивают эффективность роста клеточных культур по пролиферативной активности или что то же, по индексу пролиферации (ИД). ИД - это отношение числа выросших клеток к числу посеянных клеток. В табл. 3 представлены результаты пролиферативной активности клеточной линии Vero на 3-й сутки роста с использованием ТНЦ на различных пассажных уровнях.
Пролиферативную активность штаммов диплоидных клеточных культур КМ-27 и ФЭМС пассируемые при температуре 35°С-37°С увеличивается 20-30% по сравнению с трипсинизированными клеточными культурами. Субкультивирование производят через каждые 4-5 суток с коэффициентом рассева 1:2-1:3. Длительное культивирование штаммов диплоидных клеток прослежена до 30 пассажа. Во всех случаях в данной культуре наблюдалось удвоение популяции на 3 сутки роста, в сравнении с трипсинизированными культурами, которые дают удвоение на 5 сутки.
3.2 Ростстимулирующая активность ТНЦ.
Клеточные культуры Vero и диплоидные клетки - фибробласты эмбрионов морской свинки (ДК - ФЭМС) выращивали в ростовой среде, содержащей различные концентрации ТНЦ: 0,001, 0,005, 0,008 и 0,01%. Контрольные культуры выращивали в ростовой среде без добавления ТНЦ. На 5-е сутки роста клетки снимали с ростовой поверхности культурального флакона и определяли индекс пролиферации. В таблице 4 представлены результаты исследования.
Как видно из таблицы 4, ростстимулирующая активность ТНЦ проявляется при всех испытанных концентрациях и степень стимуляции зависит от вида клеточных культур и от конечной концентрации препарата в ростовой среде. Так, при концентрации ТНЦ 0,001% пролиферативная активность диплоидных клеток увеличивается на 30%, а при концентрации 0,01% - на 50%.
Выявленная ростстимулирующая активность ТНЦ для клеточных культур статистически достоверна при уровнях значимости р<0,05 - р<0,001.
Пример 4. Накопление вирусов кори (штамм Л-16), эпидемического паротита (штамм Л-3), краснухи (штамм - RA2/3), ветряной оспы (штамм vFiravax).
В культуре клеток Vero, пассируемых с помощью ТНЦ, изучали накопление вакцинных штаммов вируса кори, эпидемического паротита, краснухи и ветряной оспы. Монослойные культуры клеток Vero, пассируемые с помощью ТНЦ и трипсина инфицировали указанными вирусами. Множественность инфицирования, условия культивирования были одинаковыми для 2-х сравниваемых культур клеток. В таблице 5 представлены результаты накопления вакцинных штаммов вирусов в клеточных культурах Vero.
Как видно из таблицы, титры вакцинных штаммов вирусов в перевиваемых клеточных культурах Vero, пассируемых с помощью ТНЦ, на 0,75-1.5 lg выше, чем в трипсинизированных.
Учитывая вышеперечисленные экспериментальные данные, целесообразно рекомендовать использование ТНЦ для культивирования клеточных линий, используемых в качестве клеточного субстрата для получения противовирусных вакцин для медицинской практики.