Результат интеллектуальной деятельности: Рекомбинантный белок, содержащий антигенно-значимые фрагменты белков вируса гепатита Е, используемый в тест-системах для серодиагностики гепатита Е (варианты)
Вид РИД
Изобретение
Изобретение относится к биотехнологии и иммунологии и представляет собой способ получения рекомбинатных белков путем синтеза в бактериальных клетках, обладающих антигенной активностью к вирусу гепатита Е, и набор белков, полученных этим способом и позволяющих проводить серодиагностику гепатита Е.
Гепатит Е представляет значимую проблему для здравоохранения, и неоспоримо важным является совершенствование его лабораторной диагностики. Основным лабораторным показателем инфицирования вирусом гепатита Е (ВГЕ) является выявление в сыворотке крови больных специфических антител методом иммуноферментного анализа (ИФА). Из-за трудностей, связанных с культивированием ВГЕ известные к настоящему времени диагностические тест-системы основаны главным образом на использовании рекомбинантных антигенов.
Многочисленные исследования молекулярно-биологических основ иммунного ответа на вирус гепатита Е позволили определить структуру вирусного генома и локализовать основные вирусные антигенные детерминанты. Благодаря определению нуклеотидных последовательностей геномов вирусных изолятов различного географического происхождения и успехам в изучении антигенной структуры вирусных белков доказано существование двух основных серовариантов вируса: серотипа Бирма, к которому относят вирусные изоляты азиатского происхождения, и серотипа Мексика, объединяющего американские изоляты.
Первоначально диагностика гепатита Е основывалась на серологическом исключении вирусных гепатитов другой этиологии. Большинство разработаных к настоящему времени методов диагностики гепатита Е основано на определении антител к белкам-продуктам второй и третьей открытых рамок считывания генома вируса гепатита Е в сыворотках крови (серодиагностика). Для этих целей используются различные подходы, в которых применяется принцип иммуноферментного анализа (ИФА), метода иммунофлюоресценции, иммуноблотинга. Применение этой группы методов базируется на использовании синтетических пептидов-фрагментов вирусных белков или рекомбинантных полипептидов, содержащих фрагменты вирусных антигенов. Одним из наиболее перспективных путей совершенствования диагностических тест-систем является применение в качестве антителосвязывающего субстрата рекомбинантных белков вируса гепатита Е, синтезированных в различных экспрессирующих системах. Такие рекомбинантные белки, сохраняющие антигенные детерминанты вируса гепатит Е, используются в серодиагностике заболевания, обеспечивая высокие показатели чувствительности и специфичности используемых тестов (патент US 5563032, кл. 435/5, 08.10.96).
Геном ВГЕ представляет собой одноцепочечную полиаденилированную РНК положительной полярности размером 7,3 тысяч нуклеотидных остатков (т.н.о.), содержит три открытых рамки считывания orf1, orf2 и orf3, а также недавно обнаруженную четвертую открытую рамку считывания orf4 [18], трансляция которой происходит через внутренний сайт связывания рибосом. В процессе репликации синтезируется кодирующая основные антигенно значимые белки ORF2 и ORF3 субгеномная бицистронная РНК размером 2,2 т.н.о. [10]. Одним из диагностически значимых антигенов является продукт гена orf3 - белок ORF3, или VP13, с молекулярной массой 13 kDa и протяженностью 113-114 аминокислотных остатков (а.о.). ORF3 - мультифункциональный регуляторный белок, отвечающий за уклонение вируса от иммунного ответа хозяина, регуляцию репликации вируса, сборку и созревание вирионов, выход вируса из инфицированной клетки [24]. Установлено, что в составе белка ORF3 имеется 3 антигенных домена в области 31-40 а.о., 63-76 а.о. и С-концевого участка, который содержит основные иммунодоминантные эпитопы [12, 22]. Известно также, что в положении 63-76 а.о. присутствует обогащенный пролином мотив «РХХР», содержащий линейные и поверхностно-ориентированные генотип-специфические антигенные сайты [23]. Диагностически важная особенность белка ORF3 - его способность взаимодействовать с сыворотками крови больных на поздних сроках острой фазы инфекции и в ранней фазе реконвалесценции [17].
Применение антигенов, в полной мере содержащих иммунодоминантные участки данного белка, представляется перспективным не только с точки зрения возможности выявления генотип-специфических антител, но и для определения давности инфицирования и стадии заболевания гепатитом Е (ГЕ). Заболевание, вызываемое ВГЕ 1 генотипа, является строгим антропонозом и распространено на территории стран постсоветского пространства Центральной Азии. В данной работе была поставлена задача получения рекомбинантного аналога полноразмерного белка VP13 ВГЕ 1-го генотипа штамма, циркулирующего в странах СНГ и имеющего эпидемиологическую значимость с точки зрения возможного завоза в Россию в связи с усилением международной трудовой миграции.
Праймеры и пробы для ПЦР и секвенирования синтезировали в ЦКП ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН. Получение фекальных экстрактов, выделение из них нуклеиновых кислот и подтверждение наличия РНК ВГЕ методом вложенной ПЦР проводили по ранее разработанным методикам [7].
ДНК-копию вирусной РНК (кДНК) получали на матрице очищенной из фекальных экстрактов РНК, содержащих РНК ВГЕ 1 генотипа, с использованием 18-членных олиго-dT-праймеров и обратной транскриптазы Superscript III («Life Technologies)), США). Вирусную кДНК амплифицировали с помощью высокоточной ДНК-полимеразы «Phusion» («Finnzymes», Финляндия) в соответствии с рекомендациями производителя. Реакции проводили на термоциклере «TProfessional Gradient» («Biometra», Германия).
ПЦР-продукты необходимого размера выделяли из агарозных гелей после электрофоретического разделения ампликонов, затем проводили еще один цикл ПЦР-амплификации с Taq-полимеразой, полученные ПЦР-продукты очищали на спин-колонках «Micro Bio-SpinBio-Gel Р-30» («BioRad», США) и использовали в А/Т-клонировании. Лигирование полученных ДНК-вставок в плазмидные векторы pGEM-Teasy («Promega», США) и pEL5a [1] и трансформацию компетентных клеток E.coli СС001 генотипа XL-Blue (ООО «Евроген», Россия) и штамма E.coli PLT90 (F-, lon::Tn10(TetR), endA1, malPpa::[PR, C1857](Mal- λimm) thi, hsdR17) [2] лигазной смесью осуществляли по общепринятому методу [6].
Определение нуклеотидной последовательности ДНК после очистки проводили в ЦКП ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН. Для анализа и обработки нуклеотидных и аминокислотных последовательностей, дизайна праймеров использовали пакеты программ «Vector NTI», AS [20] и MEGA [15]. Потенциальные иммунодоминантные участки вирусных белков определяли по результатам расчета гидрофильных и гидрофобных профилей [16]. Анализ коротких пептидных гомологий между ВГЕ 1 генотипа и герпес-вирусами человека 1-8 типов проводили, используя ранее описанные алгоритмы [14].
Получение биомасс культур клеток E.coli PLT90, трансформированных векторной или рекомбинантными плазмидами, выделение и очистку рекомбинантных полипептидов проводили по ранее опубликованным методикам [4, 5].
В работе использовали сыворотки крови и фекалии больных гепатитом из инфекционных больниц г. Ош (Республика Киргизия) и сыворотки крови больных гепатитом, предоставленные Белорусским государственным медицинским университетом (г. Минск, Республика Беларусь). Сыворотки крови условно здоровых лиц и контрольной группы (содержащие серологические маркеры инфицирования вирусами гепатитов А, В, С и инфекционных патологий печени иной этиологии: инфекционный мононуклеоз, цитомегаловирусная инфекция, ВИЧ-инфекция) были получены из Московского областного научно-исследовательского клинического института им. М. Ф. Владимирского и Клинико-диагностического центра ФГБНУ НИИВС им. И.И. Мечникова, г. Москва. В качестве положительного контрольного образца использовали рекомбинантный полипептид ORF3 ВГЕ штамма Бирма из коллекции Лаборатории клонирования вирусных геномов ФГБНУ НИИВС им. И.И. Мечникова [3]. IgG-антитела к ВГЕ в образцах сывороток крови выявляли с помощью иммуноферментной тест-системы «ДС-ИФА-АНТИ-HEV-G» (НПО «Диагностические системы», Россия). Серологические маркеры инфицирования вирусами гепатитов А, В, С и возбудителями инфекционной патологии печени иной этиологии определяли с помощью коммерческих иммуноферментных тест-систем «ДС-ИФА-АНТИ-НАУ-С-РЕКОМБ», «ДС-ИФА-HBsAg - подтверждающий тест», «ДС-ИФА-ВИЧ-АГ/АТ Скрин» (НПО «Диагностические системы», Россия), «Вектогеп В-HBs-антиген-2», «ГепаБест анти-HBc-IgG», «Бест анти-ВГС-авто», «Бест анти-ВГС-подтверждающий тест», «Бест анти-ВГС-подтверждающий тест», «ВектоЦМВ-IgG-авидность», «ВектоВЭБ-EA-IgG», «ВектоВЭБ-NA-IgG» (ЗАО «Вектор-Бест», Россия), «БЛОТ ВИЧ  +0» (ЗАО БТК «Биосервис», Россия). Иммуноферментный анализ выполняли в соответствии с инструкциями производителей соответствующих тест-систем.
+0» (ЗАО БТК «Биосервис», Россия). Иммуноферментный анализ выполняли в соответствии с инструкциями производителей соответствующих тест-систем.
Вестерн-блоттинг и твердофазный непрямой иммуноферментный анализ проводили с помощью ранее описанных методик [21,4].
Наиболее близким аналогом является решение по патенту RU 2172346, опубл.: 20.08.2001. В нем описан способ получения полипептида, обладающего антигенной активностью вируса гепатита Е, предусматривающий создание участка ДНК, кодирующего полипептид, клонирование в векторной экспрессии с получением рекомбинантной ДНК, трансформацию полученной рекомбинантной ДНК штамма-хозяина, культивирование трансформантов и выделение целевого продукта, отличающийся тем, что создают участок ДНК, кодирующий полипептид, содержащий фрагмент белков - продуктов второй или третьей открытых рамок считывания вирусного генома. Создают участок ДНК, кодирующий полипептид, содержащий фрагмент белков - продуктов второй открытой рамки считывания вирусного генома с аминокислотной последовательностью (см. графическую часть формулы). Создают участок ДНК, кодирующий полипептид, содержащий фрагмент белков-продуктов второй открытой рамки считывания вирусного генома с аминокислотной последовательностью (см. графическую часть формулы). Создают участок ДНК, кодирующий полипептид, содержащий фрагмент белков-продуктов третьей открытой рамки считывания вирусного генома с аминокислотной последовательностью (см. графическую часть формулы).
Также в прототипе описан набор для определения антител к возбудителю гепатита Е-вирусу гепатита Е, включающий иммуносорбент, на основе антигенов вируса гепатита Е, реагенты для определения присутствия антител, отличающийся тем, что в качестве антигена вируса гепатита Е он содержит фрагменты белков - продуктов второй и/или третьей открытых рамок считывания вирусного генома, имеющие аминокислотные последовательности, охарактеризованные в пп. 2-4 соответственно, иммобилизованные на твердом носителе в смеси и/или по отдельности.
Пример 1
Получение фрагмента ДНК НЕ40,
Для полученая фрагмента ДНК были использованы олигонуклеотиды:

Пример 4
Получение фрагмента ДНК НЕ60.
Для получения фрагмента ДНК были использованы олигонуклеотиды:

Пример 7,
Получение фрагмента ДНК НЕ70.
Для получения фрагмента ДНК были использованы олигонуклеотиды.


К пункту 2 формулы

К пункту 3 формулы

К пункту 4 формулы

Технической проблемой прототипа является то, что белок не обладает достаточной степенью чувствительности в связи с тем, что не полностью представлены иммунодоминантные эпитопы, белок короткий, содержит только С-концевой фрагмент, имеет невысокую оптическую плотность.
Таким образом, возможны ложноположительные результаты.
Задачей изобретения является получение рекомбинантного аналога полноразмерного белков ORF2 и ORF3 вируса гепатита Е 1-го и 3-го генотипов.
Техническим результатом является рекомбинантный антиген, обладающий возможностью его применения в диагностических тестах, которые обеспечивают повышение точности путем снижения ложноположительных результатов.
Указанный технический результат достигается за счет того, что заявлен рекомбинантный белок, содержащих антигенно-значимые фрагменты белков вируса гепатита Е, используемый в тест-системах для серодиагностики гепатита Е, включающий иммуносорбент, на основе антигенов вируса гепатита Е, реагенты для определения присутствия антител, отличающийся тем, что в качестве антигена вируса гепатита Е он содержит фрагменты белков - продуктов третьей открытых рамок считывания вирусного генома, имеющие аминокислотные последовательности ORF3_HE1 - гепатит Е, генотип 1, клонирована в pEL3a по сайту BamHI, выраженные:


причем, последовательность без учета бета-галактозидазы, С-концевой фрагмент, почти полноразмерный белковый продукт ORF3 (жирный шрифт) - без одного Arg на С-конце (канонически Gln-Leu-Gly-Pro-Arg-Arg), показаны последние 8 ако от плазмиды плюс стоп-кодон.
По второму варианту заявлен рекомбинантный белок, содержащих антигенно-значимые фрагменты белков вируса гепатита Е, используемый в тест-системах для серодиагностики гепатита Е, включающий иммуносорбент, на основе антигенов вируса гепатита Е, реагенты для определения присутствия антител, отличающийся тем, что в качестве антигена вируса гепатита Е он содержит фрагменты белков - продуктов третьей открытых рамок считывания вирусного генома, имеющие аминокислотные последовательности ORF3_HE3 - гепатит Е, генотип 3, клонирована в pEL3c по сайтам XmaI - PstI, выраженные:


причем, последовательность без учета бета-галактозидазы, С-концевой фрагмент, полноразмерный белковый продукт ORF3 (жирный шрифт), показаны последние ако от плазмиды плюс стоп-кодон.
По третьему варианту заявлен рекомбинантный белок, содержащих антигенно-значимые фрагменты белков вируса гепатита Е, используемый в тест-системах для серодиагностики гепатита Е, включающий иммуносорбент, на основе антигенов вируса гепатита Е, реагенты для определения присутствия антител, отличающийся тем, что в качестве антигена вируса гепатита Е он содержит фрагменты белков - продуктов третьей открытых рамок считывания вирусного генома, имеющие аминокислотные последовательности ORF2_HE3 - гепатит Е, генотип 3, клонирована в pEL3a по сайтам сайту BamHI, выраженные:


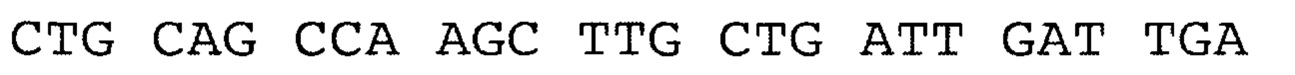
причем, последовательность без учета бета галактозидазы, только С-концевой фрагмент (проведена оптимизация кодонов), последние 12 ако на С-конце относятся к вектору (не выделены жирным шрифтом), 405-660 ако фрагмент белка ORF2 (полноразмерный 660 ако).
По четвертому варианту заявлен рекомбинантный белок, содержащих антигенно-значимые фрагменты белков вируса гепатита Е, используемый в тест-системах для серодиагностики гепатита Е, включающий иммуносорбент, на основе антигенов вируса гепатита Е, реагенты для определения присутствия антител, отличающийся тем, что в качестве антигена вируса гепатита Е он содержит фрагменты белков - продуктов третьей открытых рамок считывания вирусного генома, имеющие аминокислотные последовательности ORF2_HE1 - гепатит Е, генотип 3, клонирована в pEL3c, клонирована в pEL3c (ПЦР продукт размером 810 п.н. из клона N4_2) по сайтам сайту BamHI - PstI, выраженные:


причем, последовательность без учета бета галактозидазы, только С-концевой фрагмент (оптимизации кодонов не было) 405-660 ако фрагмент белка ORF2 {полноразмерный 660 ако).
Способ получения любого из вышеуказанных рекомбинантных белков, обладающего антигенной активностью вируса гепатита Е, предусматривающий создание участка ДНК, кодирующего полипептид, клонирование в векторной экспрессии с получением рекомбинантной ДНК, трансформацию полученной рекомбинантной ДНК штамма-хозяина, культивирование трансформантов и выделение целевого продукта, при этом создают участок ДНК, кодирующий полипептид, содержащий фрагмент белков -продуктов третьей открытых рамок считывания вирусного генома, отличающийся тем, что из препарата РНК ВГЕ 1-го генотипа, выделяют от больного рекомбинантную плазмиду, содержащую ДНК-копию субгеномной вирусной РНК, с использованием данной плазмиды получают штаммы E.coli - продуценты рекомбинантного антигена ORF3 ВГЕ 1-го генотипа в виде слитного с В-галактозидазой E.coli полипептида, содержащего полноразмерную копию белка ORF3.
Для повышения уровня экспрессии рекомбинантного белка проводят оптимизацию кодонов клонированного фрагмента кДНК.
Рекомбинантный белок ORF3 выделяют из телец-включений биомассы штамма-продуцента и очищен методом эксклюзионной хроматографии.
Краткое описание чертежей
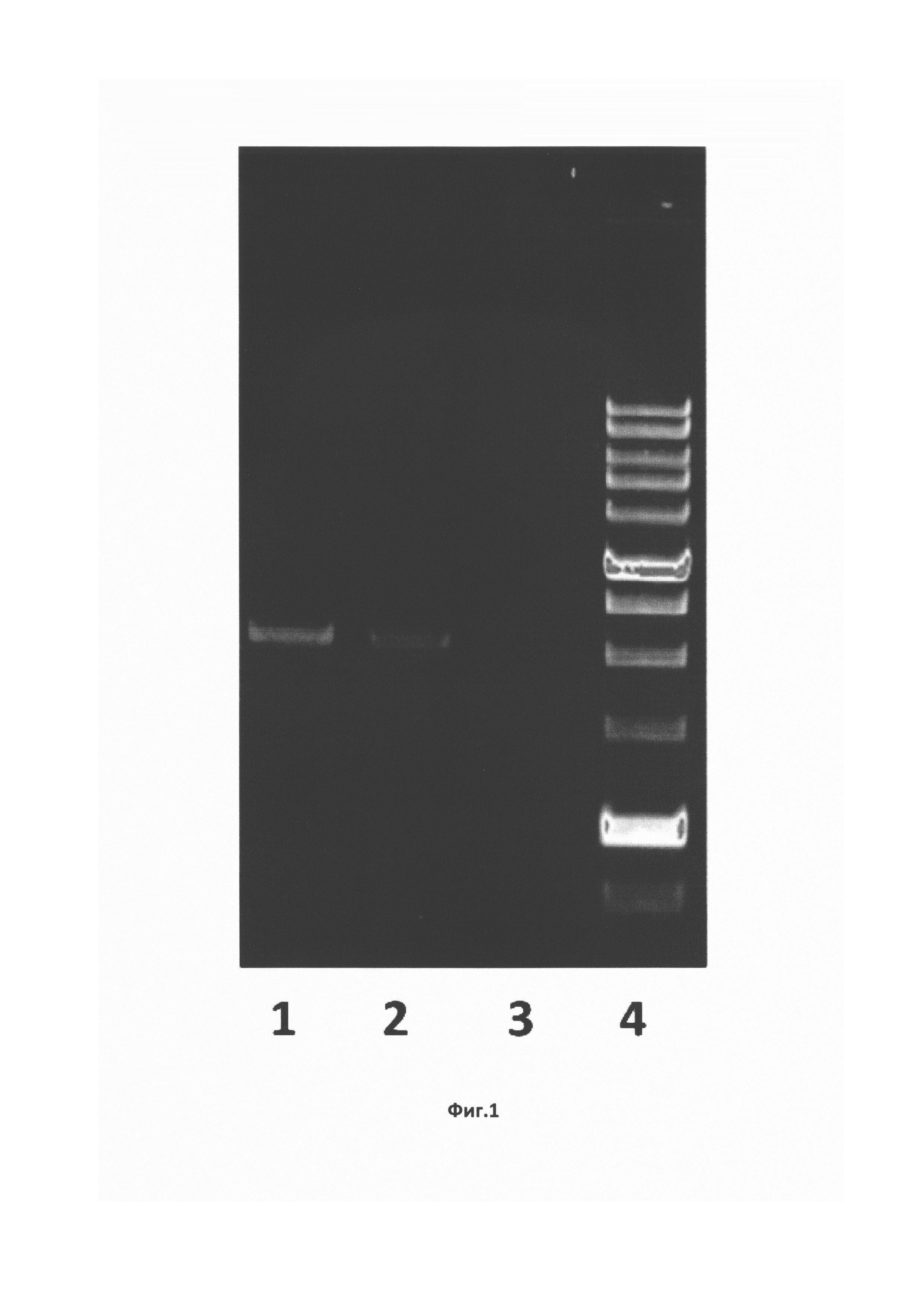
На Фиг. 1 показан электрофорез ПЦР-продуктов в 0,8%-ном агарозном геле в присутствии бромистого этидия. Дорожки: 1,2 - ПЦР-продукты; 3 - отрицательный контроль (ПЦР без ДНК), 4 - маркеры молекулярных масс (сверху вниз: 100000, 8000, 6000, 5000, 4000, 3000, 2500, 2000, 1500, 1000, 500 пар нуклеотидных остатков).
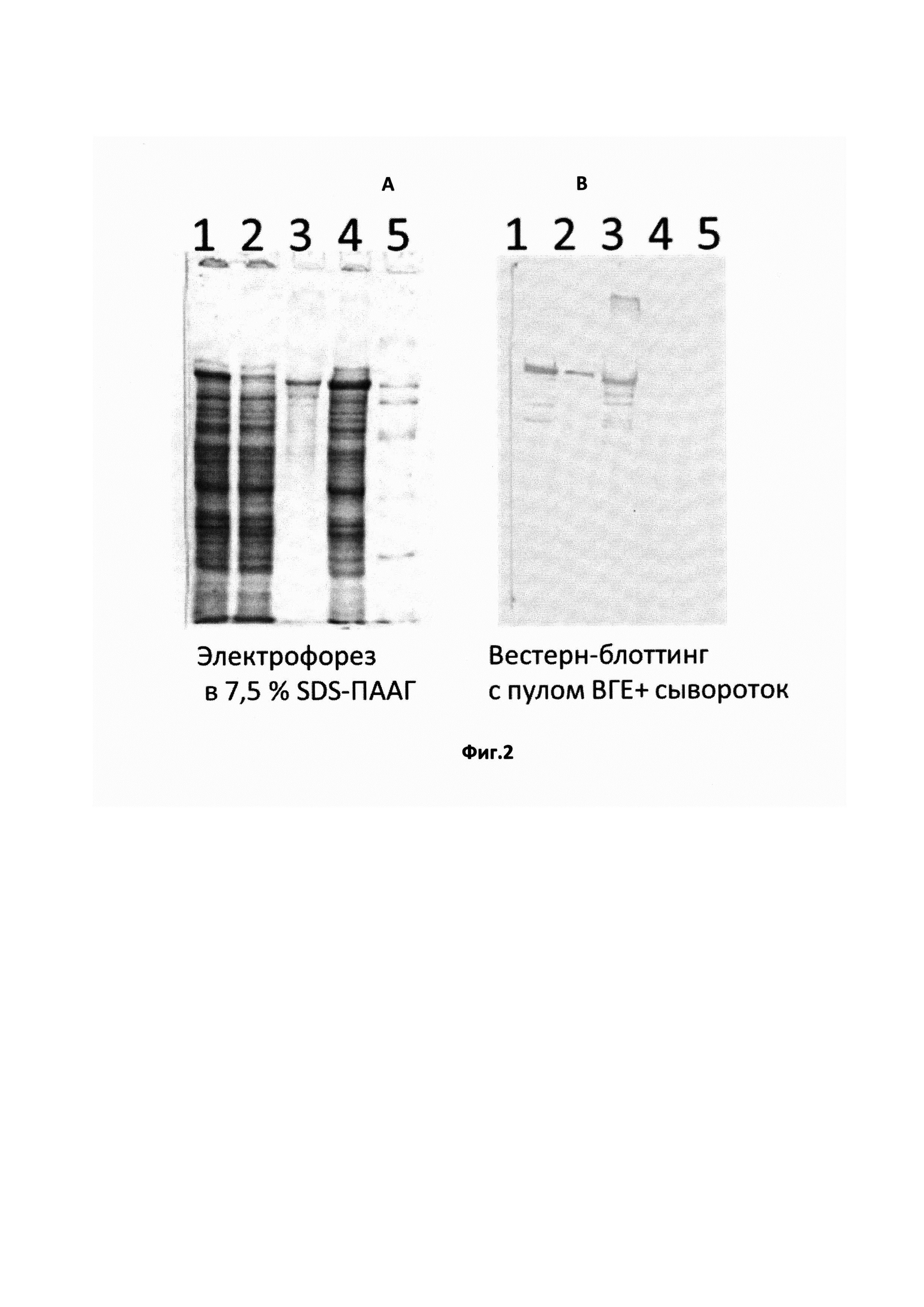
На Фиг. 1 показан электрофорез в 10% SDS-полиакриламидном геле (А) и Вестерн-блоттинг с пулом сывороток крови больных ГЕ (В):
1, 2 - лизаты культур клонов E.coli РОР2136, экспрессирующих рекомбинантный полипептид ORF3 после (1) и до (2) оптимизации кодонов;
3 - ранее полученный рекомбинантный полипептид ORF3 ВГЕ штамма Бирма (92-123 а.о.);
4 - лизат клеток E.coli РОР2136, трансформированных плазмидой рЕХ1 без вставки;
5 - маркеры молекулярных масс (193 кД, 112 кД, 64 кД, 30 кД, 26 кД, 12,8 кД, 6,5 кД).
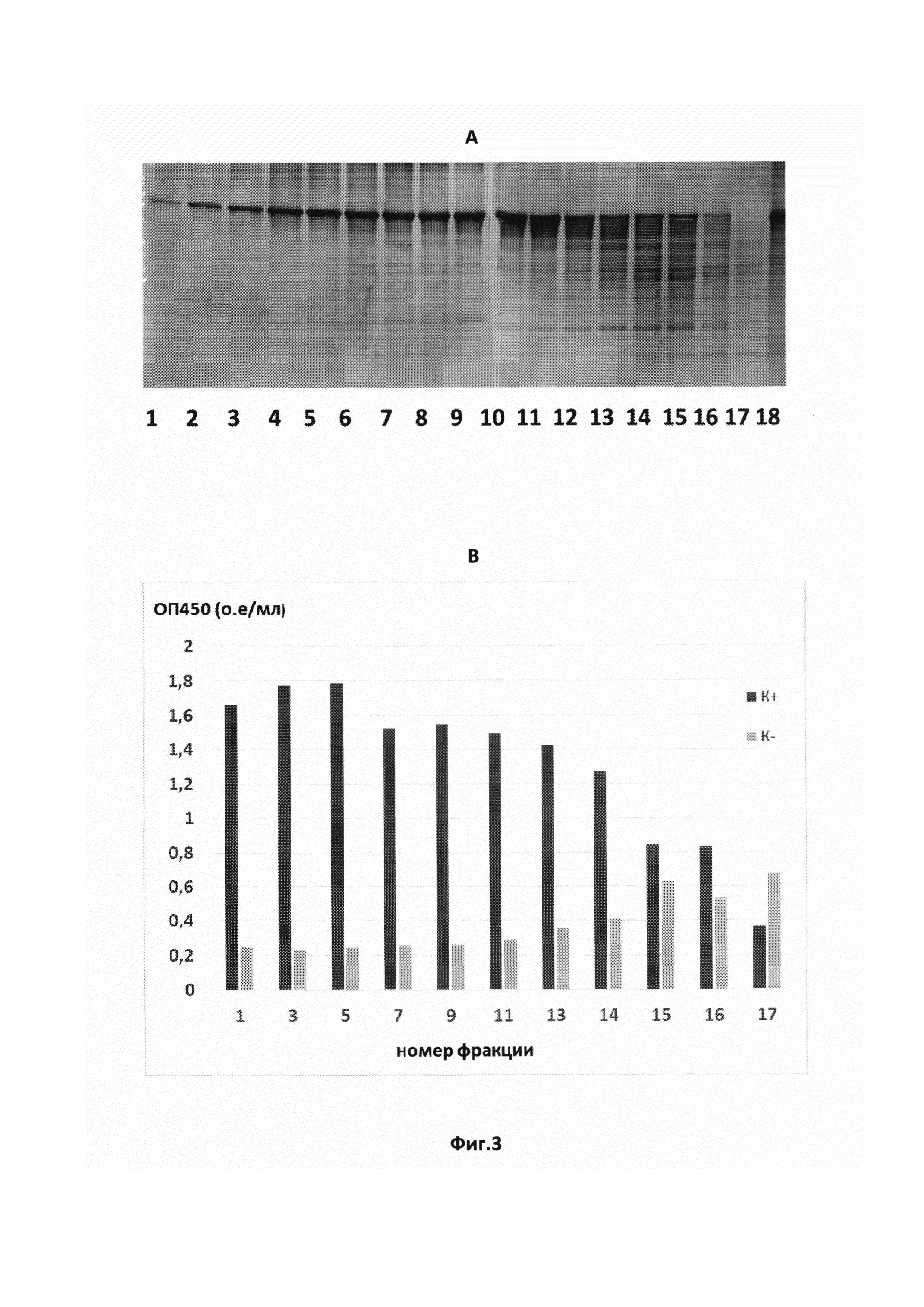
На Фиг. 3 показаны результаты тестирования методами электрофореза в SDS-полиакриламидном геле (А) и иммуноферментного анализа (В) фракций рекомбинантного белка ORF3 ВГЕ 1-го генотипа после хроматографической очистки. К+ - пул сывороток крови больных ГЕ; К- - пул сывороток крови здоровых доноров.
Осуществление изобретения
Из образцов фекалий пациентов из Киргизии с клиническими признаками гепатита, содержащих РНК ВГЕ 1 генотипа, выделили тотальную РНК, которую использовали для получения кДНК в реакциях обратной транскрипции с применением олиго-dT-праймеров. Для клонирования фрагментов субгеномной РНК использовали 5 полученных образцов кДНК и 5 пар специфических праймеров, рассчитанных на основе последовательности генома вируса ВГЕ 1 генотипа (NCBI АВ369689), выбранного в качестве консенсуса по данным биоинформационного анализа. С целью получения необходимого ПЦР-продукта отработали условия проведения реакции: состав буфера, концентрация реагентов, продолжительность элонгации, температура отжига матрицы. После оптимизации условия ПЦР были следующими: 40 сек. при температуре +98°С, затем 30 циклов амплификации (денатурация в течение 5 сек при +98°С, отжиг матрицы в течение 20 сек при +67,5°С, синтез второй цепи в течение 2 мин при +72°С) и финальная элонгация - 5 мин при +72°С. В результате были получены ПЦР-продукты размером от 2200 до 2300 п.н. в количествах, достаточных для клонирования в векторе pGEM-Teasy («Promega», США) (Фиг. 1).
При последующем А/Т-клонировании получили клоны E.coli CCOOl (XL-Blue), содержащие в составе рекомбинантной плазмиды pGEMeasy-HE1 фрагменты ДНК размером 2,3 т.п.н., соответствующие субгеномной РНК вируса, что было подтверждено секвенированием. Сравнительный анализ показал совпадение аминокислотной последовательности белка, кодируемого клонированным фрагментом ДНК, с белком ORF3 референсного штамма вируса за исключением одной аминокислотной замены (Ala34 на Val34).
Последовательность белка ORF3 дополнительно проанализировали с помощью исследования профиля его гидрофобности/гидрофильности, рассчитанного по индексу гидропатичности [16], где более высокие значения индекса соответствуют более гидрофобным участкам полипептидов. Провели анализ коротких пептидных гомологий -мотивов потенциальных линейных эпитопов, - между белком ORF3 ВГЕ 1 генотипа и белками семейства герпесвирусов человека 1-8 типов с использованием доступных в базах данных аминокислотных последовательностей. В аминокислотной последовательности полученного белка ORF3 не было обнаружено совпадений с последовательностями структурных белков герпесвирусов, за исключением фрагмента Gln63-Pro69, подобного участку ядерного белка EBNA-2 вируса Эпштейн-Барр (ВЭБ), однако большая часть этой последовательности находится вне экспериментально картированной иммунодоминантной области Ser67-Gly76 [4], совпадая лишь по трем аминокислотным остаткам Ser67-Pro69-Pro69.
Фрагмент кДНК гена orf3 из рекомбинантной плазмиды pGEMeasy-HE1 переклонировали в экспрессирующий вектор pEL5a с помощью ПЦР с по сайтам рестрикции BamHI и PstI. Таким образом, были получены плазмиды, кодирующие полноразмерную копию белка ORF3 в виде слитного с  E.coli полипептида. Наличие вставки и рамки считывания слитного белка подтверждали секвенированием. Белковый состав лизатов клонов рекомбинантного штамма-продуцента E.coli PLT90 исследовали методами электрофореза в SDS-полиакриламидном геле и Вестерн-блоттинга с пулом образцов сывороток крови, содержащих IgG-антитела к ВГЕ (Фиг. 2). В качестве положительного контрольного образца использовали ранее полученный [3] рекомбинантный белок, содержащий С-концевой фрагмент белка ORF3 ВГЕ 1 генотипа (штамм Бирма), в качестве контроля специфичности реакции - лизат биомассы штамма E.coli PLT90, трансформированного векторной плазмидой без вставки вирусоспецифической ДНК. Несмотря на специфическое взаимодействие с положительными сыворотками в реакции Вестерн-блоттинга, в лизате биомассы полученного штамма-продуцента рекомбинантный антиген присутствовал в недостаточном для препаративного выделения количестве.
E.coli полипептида. Наличие вставки и рамки считывания слитного белка подтверждали секвенированием. Белковый состав лизатов клонов рекомбинантного штамма-продуцента E.coli PLT90 исследовали методами электрофореза в SDS-полиакриламидном геле и Вестерн-блоттинга с пулом образцов сывороток крови, содержащих IgG-антитела к ВГЕ (Фиг. 2). В качестве положительного контрольного образца использовали ранее полученный [3] рекомбинантный белок, содержащий С-концевой фрагмент белка ORF3 ВГЕ 1 генотипа (штамм Бирма), в качестве контроля специфичности реакции - лизат биомассы штамма E.coli PLT90, трансформированного векторной плазмидой без вставки вирусоспецифической ДНК. Несмотря на специфическое взаимодействие с положительными сыворотками в реакции Вестерн-блоттинга, в лизате биомассы полученного штамма-продуцента рекомбинантный антиген присутствовал в недостаточном для препаративного выделения количестве.
Для увеличения продукции рекомбинантных белков в бактериальных системах экспрессии в настоящее время широко применяется метод оптимизации кодонов, в котором используется подход синонимичных (без изменения кодируемой аминокислоты) замен соответствующих триплетов [8]. С целью повышения уровня синтеза слитного белка в клонированном фрагменте гена orf3 была проведена замена 51 триплета нуклеотидов на более часто встречающиеся в бактериях Е.coli синонимичные кодоны. Фрагмент ДНК с оптимизированными кодонами orf3s, синтезированный в ЦКП ФГБУН Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН, переклонировали в экспрессирующий вектор pEL5a по схеме, аналогичной примененной для клонирования фрагмента гена orf3 дикого штамма вируса. Наличие вставки и рамки считывания слитного белка было подтверждено секвенированием.
Рекомбинантные клоны E.coli, полученные после проведения оптимизации кодонов, были вновь протестированы на способность синтезировать целевой белок. На Фиг. 2 представлены результаты электрофоретического анализа белкового состава лизатов биомасс рекомбинантных штаммов E.coli до и после оптимизации кодонов и результаты исследования методом Вестерн-блоттинга взаимодействия рекомбинантного белка в составе лизатов с пулом сывороток больных ГЕ.
Степень очистки рекомбинантного антигена ORF3 и 8-галактозидазы E.coli контролировалась на отдельных стадиях процесса выделения с помощью электрофореза в 10% SDS-полиакриламидном геле. Исследование фракций белка после хроматографической очистки подтвердило отделение рекомбинантных полипептидов от основной массы примесных белков (Фиг. 3А). Тестирование антигенной активности полученных фракций белка методом ИФА показало снижение оптической плотности в лунках с иммобилизованным рекомбинантным белком ORF3 в реакциях с пулом положительных по ВГЕ сывороток и рост неспецифического сигнала с пулом отрицательных (донорских) сывороток в 11-13 фракциях (Фиг. 3В). Для дальнейшей работы использовали лучшие по показателям двух методов фракции.
Молекулярная масса полученного рекомбинантного белка, определенная по результатам электрофоретического профиля лизатов штамма-продуцента и препаратов выделяемого из них целевого продукта, составила 128,5 «Да, что соответствует расчетной величине. Продуктивность штамма составила не менее 500 мкг рекомбинантного белка на 1 мл клеточной суспензии при плотности культуры 5×108 кл/мл, степень очистки белка по данным электрофореза - 95%.
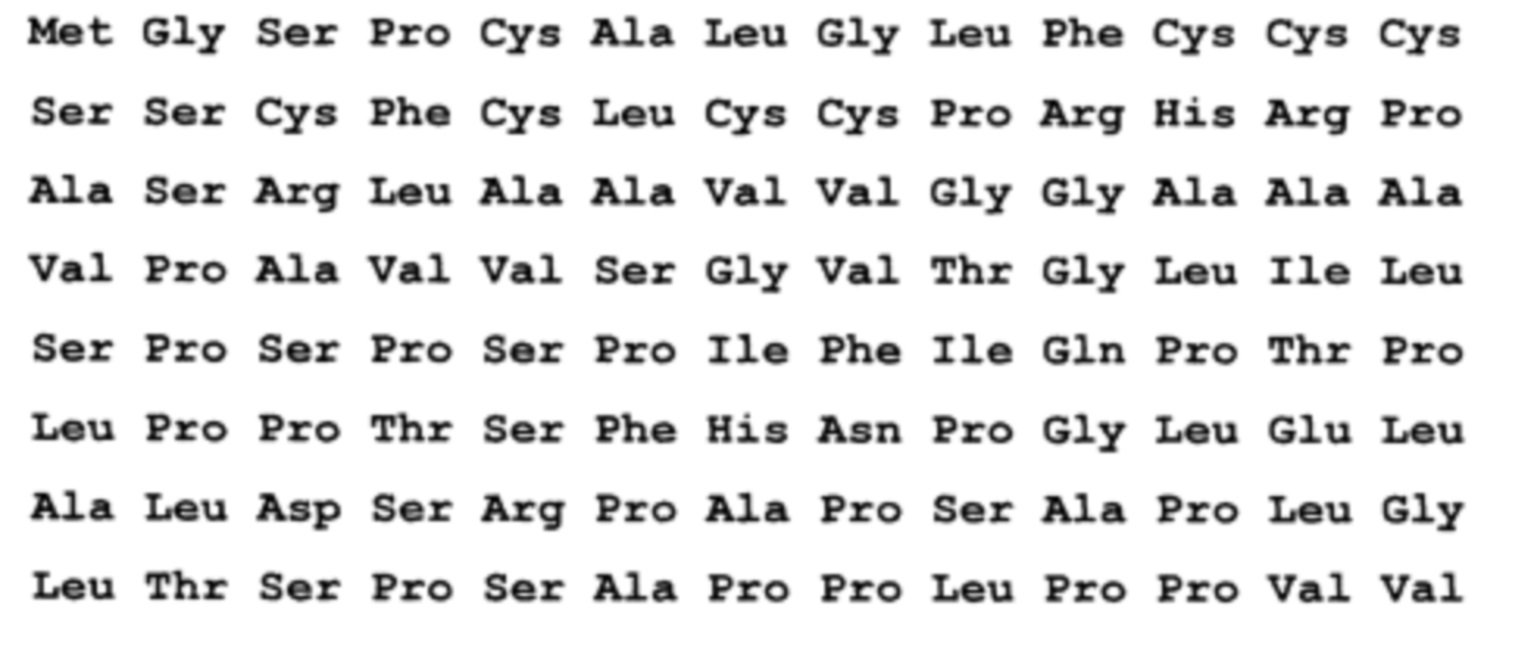
Был получен рекомбинантный белок ORF3_HE1 - гепатит Е, генотип 1, клонирована в pEL3a по сайту BamHI (ПЦР продукт, амплификация плазмиды со вставкой, полученной из Еврогена, клон НЕ21 в плазмиде pAL2-T). Последовательность без учета бета-галактозидазы, С-концевой фрагмент, почти полноразмерный белковый продукт ORF3 (жирный шрифт) - без одного Arg на С-конце (канонически Gln-Leu-Gly-Pro-Arg-Arg), показаны последние 8 ако от плазмиды плюс стоп-кодон.
По 1 варианту заявлен рекомбинантный белок, содержащих антигенно-значимые фрагменты белков вируса гепатита Е, используемый в тест-системах для серодиагностики гепатита Е, включающий иммуносорбент, на основе антигенов вируса гепатита Е, реагенты для определения присутствия антител, отличающийся тем, что в качестве антигена вируса гепатита Е он содержит фрагменты белков - продуктов третьей открытых рамок считывания вирусного генома, имеющие аминокислотные последовательности ORF3_HE1 - гепатит Е, генотип 1, клонирована в pEL3a по сайту BamHI ((ПЦР продукт, амплификация плазмиды со вставкой, полученной из Еврогена, клон НЕ21 в плазмиде pAL2-T)), выраженные:
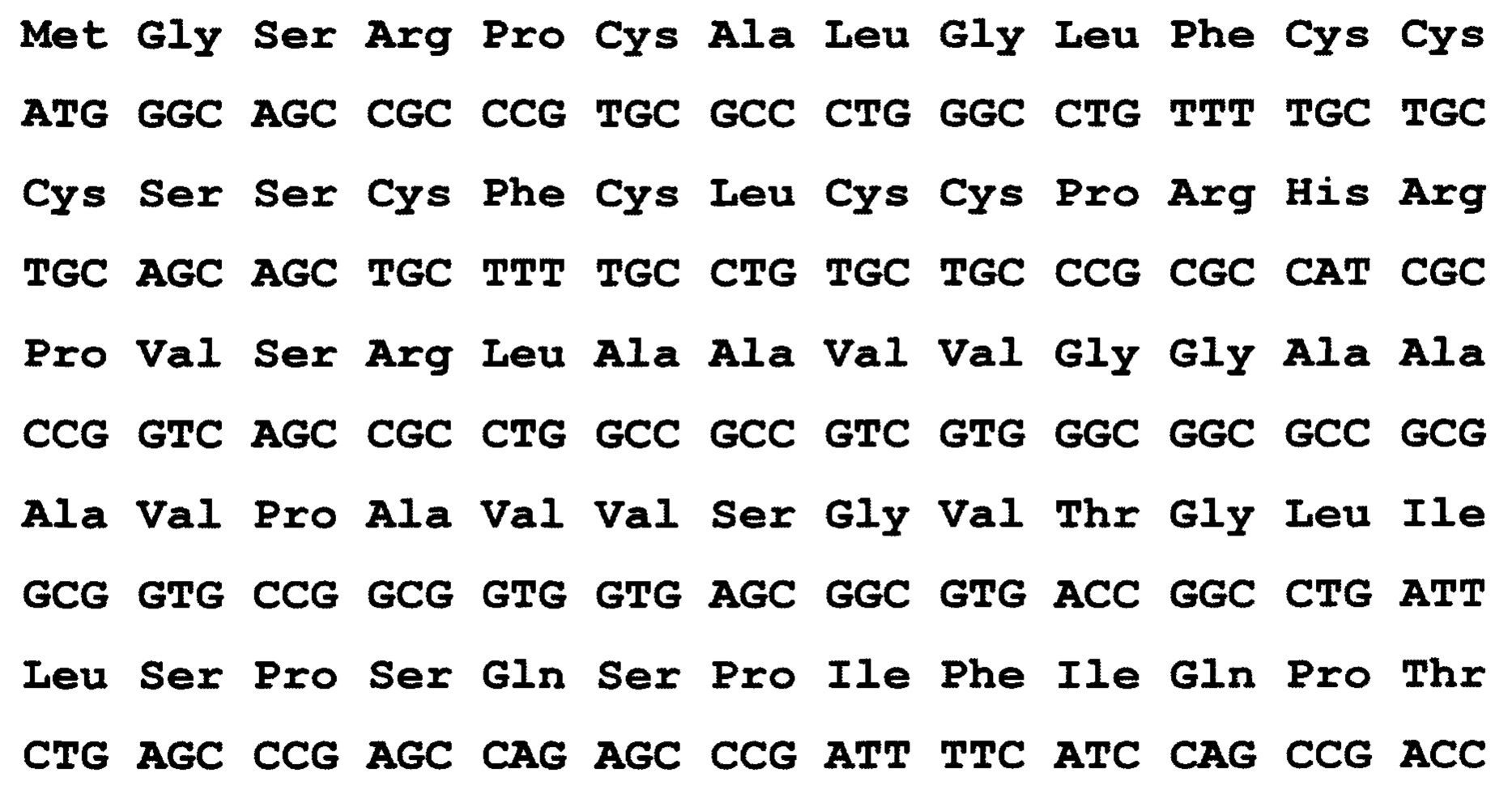

причем, последовательность без учета бета-галактозидазы, С-концевой фрагмент, почти полноразмерный белковый продукт ORF3 (жирный шрифт) - без одного Arg на С-конце (канонически Gln-Leu-Gly-Pro-Arg-Arg), показаны последние 8 ако от плазмиды плюс стоп-кодон.
По 2 варианту заявлен рекомбинантный белок, содержащих антигенно-значимые фрагменты белков вируса гепатита Е, используемый в тест-системах для серодиагностики гепатита Е, включающий иммуносорбент, на основе антигенов вируса гепатита Е, реагенты для определения присутствия антител, отличающийся тем, что в качестве антигена вируса гепатита Е он содержит фрагменты белков - продуктов третьей открытых рамок считывания вирусного генома, имеющие аминокислотные последовательности ORF3_HE3 - гепатит Е, генотип 3, клонирована в pEL3c по сайтам XmaI - PstI (прямое вырезание вставки из плазмиды, сделанной в Еврогене, клон SD35 в плазмиде pAL2-Т), выраженные:
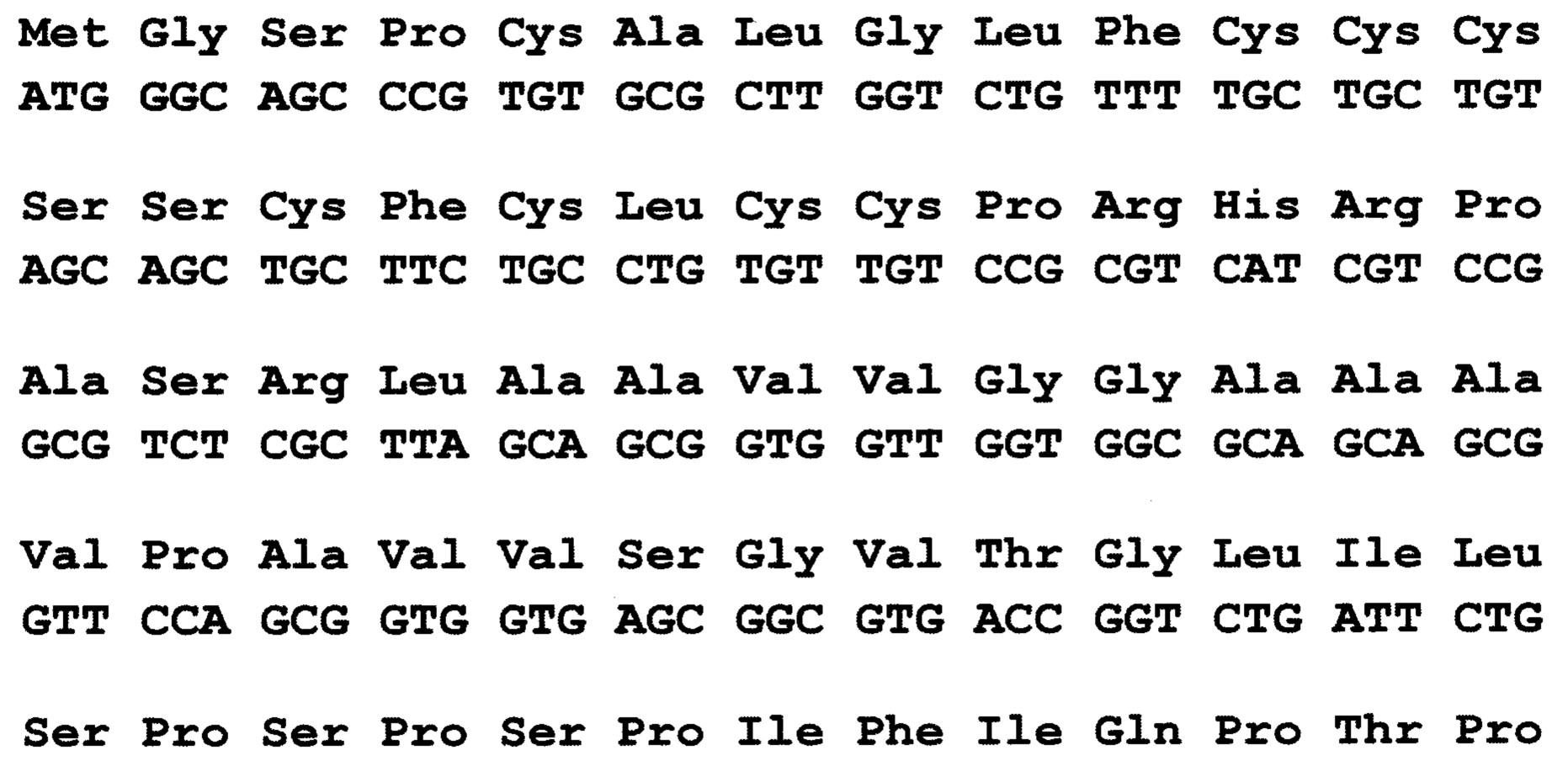

причем, последовательность без учета бета-галактозидазы, С-концевой фрагмент, полноразмерный белковый продукт ORF3 (жирный шрифт), показаны последние ако от плазмиды плюс стоп-кодон.
По 3 варианту заявлен рекомбинантный белок, содержащих антигенно-значимые фрагменты белков вируса гепатита Е, используемый в тест-системах для серодиагностики гепатита Е, включающий иммуносорбент, на основе антигенов вируса гепатита Е, реагенть для определения присутствия антител, отличающийся тем, что в качестве антигена вируса гепатита Е он содержит фрагменты белков - продуктов третьей открытых рамок считывания вирусного генома, имеющие аминокислотные последовательности ORF2_HE3 - гепатит Е, генотип 3, клонирована в pEL3a по сайтам сайту BamHI (прямое вырезание вставки из плазмиды, сделанной в Еврогене), выраженные:


причем, последовательность без учета бета галактозидазы, только С-концевой фрагмент (проведена оптимизация кодонов), последние 12 ако на С-конце относятся к вектору (не выделены жирным шрифтом), 405-660 ако фрагмент белка ORF2 (полноразмерный 660 ако).
По 4 варианту заявлен рекомбинантный белок, содержащих антигенно-значимые фрагменты белков вируса гепатита Е, используемый в тест-системах для серодиагностики гепатита Е, включающий иммуносорбент, на основе антигенов вируса гепатита Е, реагенты для определения присутствия антител, отличающийся тем, что в качестве антигена вируса гепатита Е он содержит фрагменты белков - продуктов третьей открытых рамок считывания вирусного генома, имеющие аминокислотные последовательности ORF2_HE1 - гепатит Е, генотип 3, клонирована в pEL3c, клонирована в pEL3c (ПЦР продукт размером 810 п.н. из клона N4_2) по сайтам сайту BamHI - PstI, выраженные:

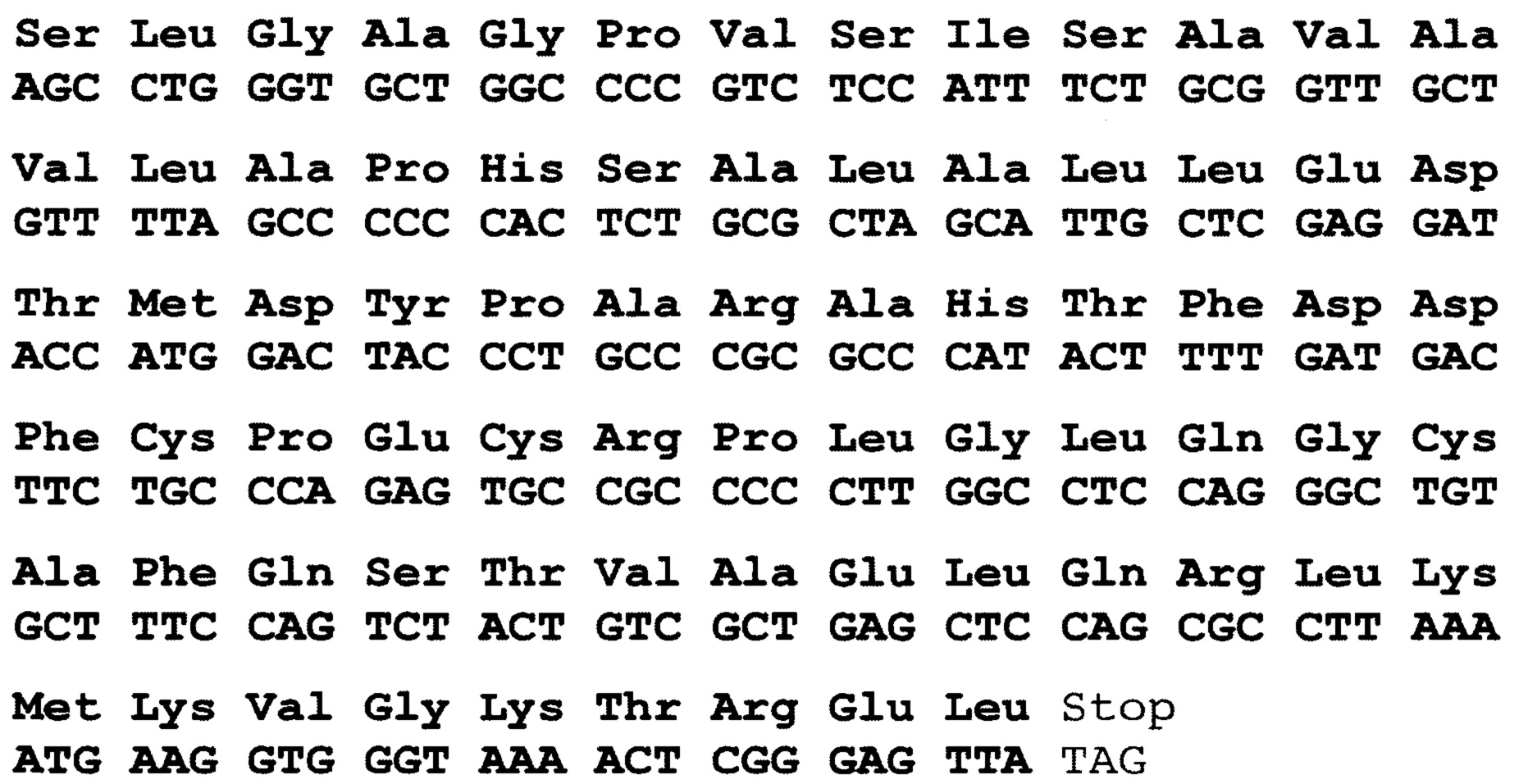
причем, последовательность без учета бета галактозидазы, только С-концевой фрагмент (оптимизации кодонов не было) 405-660 ако фрагмент белка ORF2 (полноразмерный 660 ако).
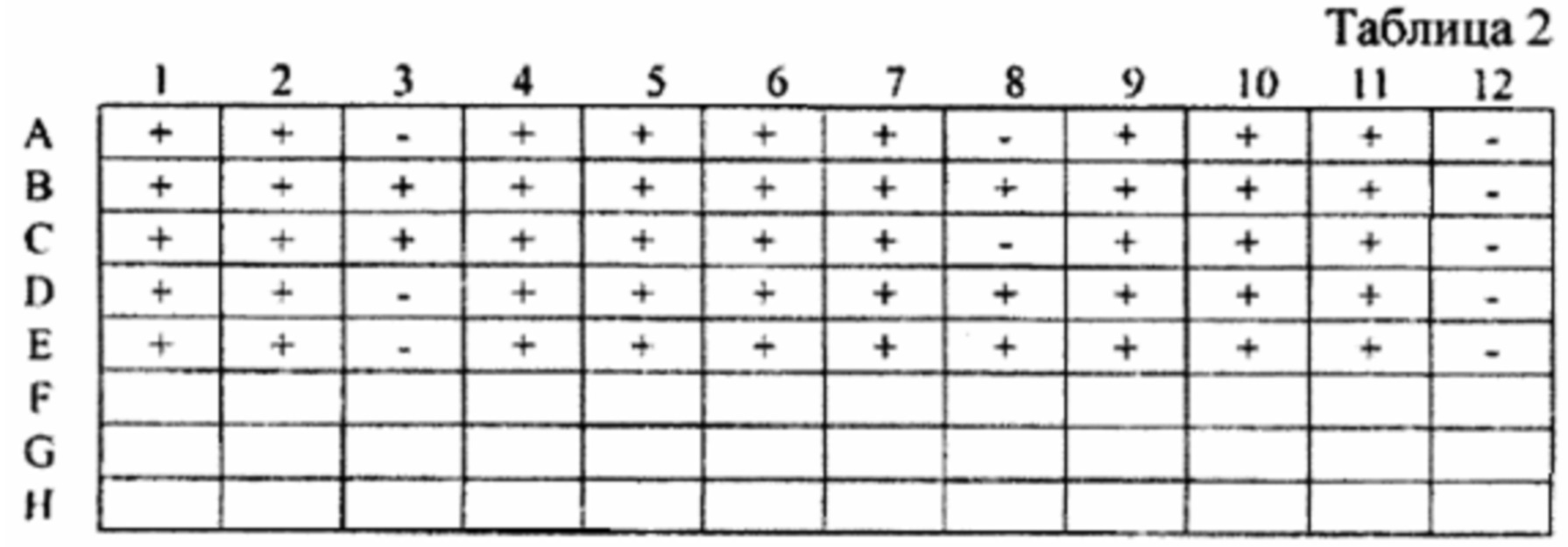
Для оценки антигенной специфичности полученного рекомбинантного белка ORF3 ВГЕ 1-го генотипа были сформированы контрольные панели образцов сывороток крови, протестированных с помощью коммерческих тест-систем на содержание серологических маркеров инфицирования вирусами гепатитов А, В, С, Е, ВЭБ, ВИЧ  и ЦМВ. Средние значения оптической плотности в обследованных методом ИФА группах образцов при использовании в качестве антигена рекомбинантного белка ORF3, иммобилизованного в лунках полистироловых планшетов, представлены в Таблице 1.
и ЦМВ. Средние значения оптической плотности в обследованных методом ИФА группах образцов при использовании в качестве антигена рекомбинантного белка ORF3, иммобилизованного в лунках полистироловых планшетов, представлены в Таблице 1.
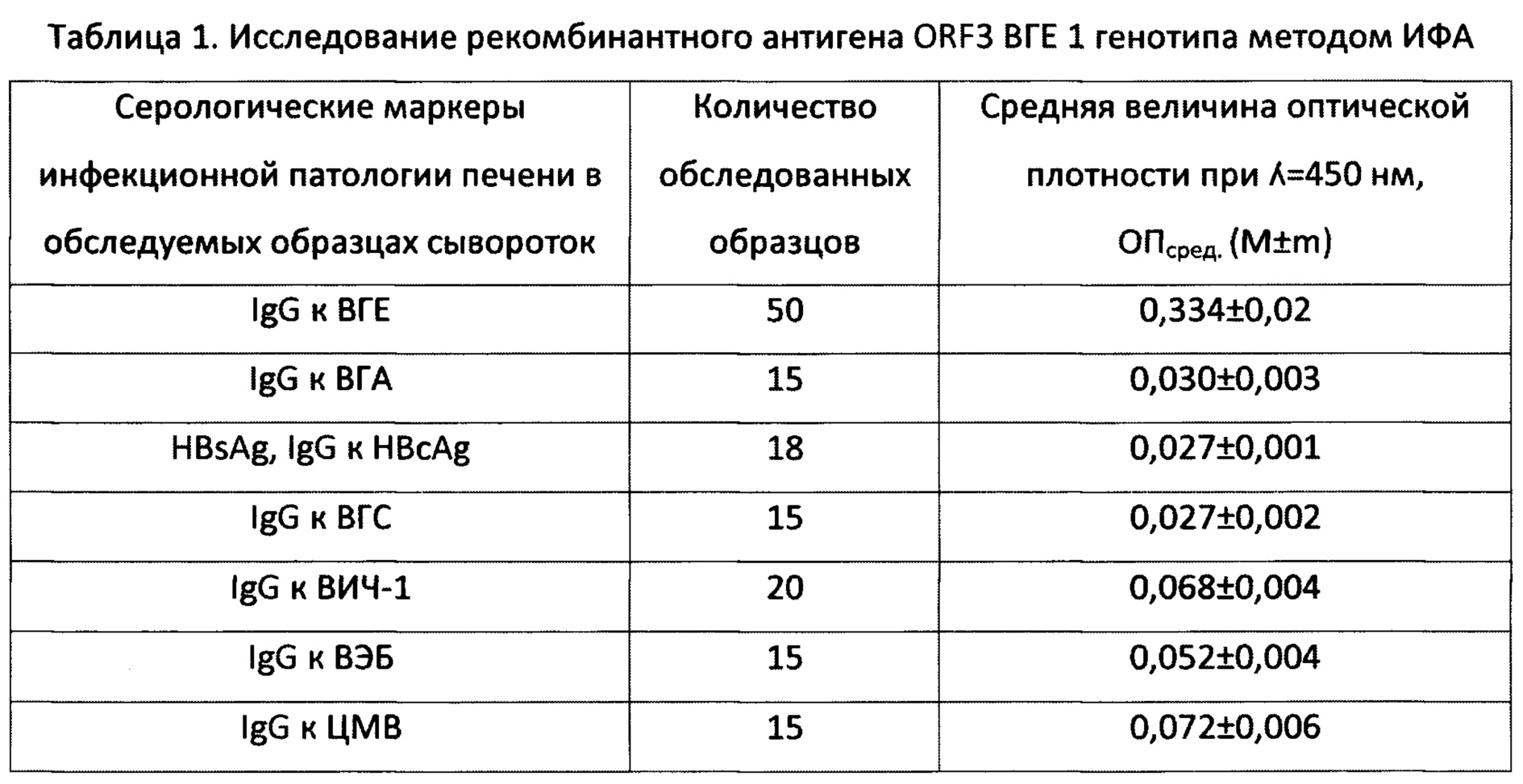
84% обследованных образцов сывороток крови, по результатам предварительного тестирования содержащих IgG-антитела к ВГЕ, положительно прореагировали с полученным рекомбинантным белком ORF3. Относительно невысокую оптическую плотность (от 0,210 до 0,763 о.е./мл) можно объяснять тем, что белок ORF3 индуцирует преимущественно образование IgM- и ранних IgG-антител, а отбор образцов опытной группы проводился на тест-системах, содержащих в составе антигенной основы белок ORF2 ВГЕ и предназначенных для выявления IgG-антител [19]. Исследование образцов от здоровых доноров (n=120) и групп сравнения не выявило ложноположительных результатов, что свидетельствует о строгой специфичности полученного рекомбинантного антигена и отсутствии перекрестной реактивности с маркерами инфицирования возбудителями других вирусных гепатитов и инфекционной патологии печени иной этиологии (ЦМВ, ВЭБ, ВИЧ). При использовании в качестве антигена препарата В-галактозидазы, выделенной из биомассы клеток штамма E.coli PLT90, трансформированных плазмидой pEL5a без вставки вирусоспецифической ДНК, положительных реакций с образцами сывороток опытной и контрольных групп не выявлено.
Источники информации:
1. Алаторцев В.Е., Алаторцева Г.И. Патент РФ. 1992. №2071501 на изобретение «Вектор pEL5a, предназначенный для экспрессии чужеродной ДНК»;
2. Алаторцев В.Е., Алаторцева Г.И. Патент РФ. 1992. №2043409 на изобретение «Штамм бактерий Escherichia coli, используемый для получения рекомбинантных белков»;
3. Алаторцева Г.И. Получение рекомбинантных белков, содержащих антигенные детерминанты вируса гепатита Е, и создание на их основе диагностических тест-систем: Автореферат, диссертации кандидата биологических наук, М., 2000, 24 с.;
4. Г.И. Алаторцева, А.В. Сидоров, Л.Н. Нестеренко, Л.Н. Лухверчик, И.И. Амиантова, В.В. Доценко, Хыу Фонг Фам, А.В. Милованова, О.Б. Выливанная, А.С.Казанова, В.В. Лавров, В.В. Зверев Получение рекомбинантного аналога гликопротеина е вируса Varicella zoster: клонирование, экспрессия и исследование антигенных свойств. Эпидемиология и вакцинопрофилактика, 2016, 15,1(86), с. 77-85;
5. Гловер Д. Новое в клонировании ДНК. Методы. Пер. с англ. Москва, 1989, с. 122-128., Практическая химия белка. Ред. Дарбре А. Пер. с англ. Москва, 1989, с. 1-621;
6. Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. Пер. с англ. Москва, Мир, 1984, 487 с.;
7. Солонин С.А., Мальцева Н.С., Троценко О.Е., Исаева О.В., Кюрегян К.К., Михайлов М.И., Попова О.Е., Кожанова Т.В., Отт В.А., Каравянская Т.Н. Циркуляция вируса гепатита Е на территории Хабаровского края. Дальневосточный журнал инфекционной патологии. 2010, №16, С. 31-36;
8. Claudia, P. Ravasi, M.E. Castelli et al. Expression of codon optimized genes in microbial systems: current industrial applications and perspectives. Front. Microbiol., 2014, V. 5, P. 2-8;
9. M. Fogeda, F. de Ory, A. Avellon et al. Differential diagnosis of hepatitis E virus, cytomegalovirus and Epstein-Barr virus infection in patients with suspected hepatitis E. J Clin. Virol., 2009, V. 45, N. 3, P. 259-261;
10. Graff, J.; Torian, U.; Nguyen et al. A bicistronic subgenomic mRNA encodes both the ORF2 and ORF3 proteins of hepatitis E virus. J. Virol. 2006, 80, 5919-5926;
11. C. Hyams, D.A. Mabayoje, R. Copping et al. Serological cross reactivity to CMV and EBV causes problems in the diagnosis of acute hepatitis E virus infection. J Med. Virol., 2014, V. 86, N. 3, P. 478-483;
12. Y.E. Khudyakov, N.S. Khudyakova, H.A. Fields et al. Epitope mapping in proteins of hepatitis E virus. Virology, 1993, V. 194, N. 1, P. 89-96.
13. Y E. Khudyakov, N.S. Khudyakova, D.L. Jue et al. Comparative characterization of antigenic epitopes in the immunodominant region of the protein encoded by open reading frame 3 in Burmese and Mexican strains of hepatitis E virus. J. Gen. Virol., 1994, V. 75 (3), P. 641-646;
14. E.V. Koonin, A.E. Gorbalenya, M.A. Purdy et al. Computer-assisted assignment of functional domains in the nonstructural polyprotein of hepatitis E virus: delineation of an additional group of positive-strand RNA plant and animal viruses. Proc. Natl. Acad. Sci. USA, 1992, V. 89, N. 17, P. 8259-8263;
15. S. Kumar, K. Tamura, M. Nei MEGA3: Integrated software for Molecular Evolutionary Genetics Analysis and sequence alignment. Briefings in Bioinformatics, 2004, V. 5, P. 150-163;
16. J. Kyte, R.F. Doolittle A simple method for displaying the hydropathic character of a protein. J. Mol. Biol, 1983, V.157, N. 1, P. 105-132;
17. H. Ma, X. Song, Z. Li et al. Varying abilities of recombinant polypeptides from different regions of hepatitis E virus ORF2 and ORF3 to detect anti-HEV immunoglobulin M. J Med. Virol., 2009, V. 81, N6, P. 1052-1061;
18. Nair, V.P. S. Anang, C. Subramani et al. Endoplastic reticulum stress induced synthesis of a novel viral factor mediates efficient replication ofgenotype-1 hepatitis E. PLOS Pathol., 2016, V. 12, N. 4, P. e1005521;
19. Obriadina A1, Meng JH, Ulanova T, Trinta K, Burkov A, Fields HA, Khudyakov YE.A new enzyme immunoassay for the detection of antibody to hepatitis E virus. J Gastroenterol Hepatol. 2002, SuppI 3: 360-364;
20. S.M. Resenchuk, V.M. Blinov ALIGNMENT SERVICE: creation and processing of alignments of sequences of unlimited length. Comput. Appl. Biosci. (CABIOS), 1995, V. 11, N. 1, P. 7-11;
21. Towbin H., Staehlin T., Gordon Y. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc. nat. Acad. Sci. USA, 1979, V. 76, N 9, P. 4350-4359;
22. P.O. Yarbough, A.W. Tarn, K.E. Fry et al. Hepatitis E virus: identification of type-common epitopes. J. Virol, 1991, V. 65, N. 11, P. 5790-5797;
23. Yonglin Yang, Shaoli Lin, Yuchen Nan et al. A Linear Surface Epitope in a Proline-Rich Region of ORF3 Product of Genotype 1 Hepatitis E Virus. Viruses. 2016 Aug 18; 8(8). pii: E227.
24. Zhou Y, Zhao C, Tian Y et al. Characteristics and Functions of HEV Proteins. Adv Exp Med Biol., 2016. N2 948, P. 17-38.