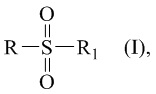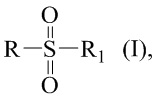Результат интеллектуальной деятельности: Сульфопроизводные на основе бета-пинена и способ их получения
Вид РИД
Изобретение
Изобретение относится к синтезу новых хиральных 10сульфопроизводных βпинена, в частности, димиртанилтиолсульфоната, миртанилсульфохлорида и миртанилсульфокислоты с (R)- и (S)-конфигурациями атома С-2.
Терпены являются природными биологически активными соединениями, обладающими бактерицидной, анальгетической и муколитической активностью, используются в качестве фунгицидов и противовирусных средств [Л.Е. Никитина, Н.П. Артемова, В.А. Старцева, Природные и тиомодифицированные производные: монография. - Germany: LAP LAMBERT, 2012, 168 с.]. Синтез новых соединений, сочетающих терпеновый фрагмент с различными серосодержащими фармакофорными группами, является перспективным направлением для получения биологически активных веществ [Nikitina L.E., Artemova N.P., Startseva V.A., Fedyunina I.V., Klochkov V.V. Chem. Nat. Comp. 2017, 53 (5), 811.]. Сульфокислоты и сульфохлориды, как известно, используются в качестве полупродуктов в органическом синтезе лекарственных препаратов [Котегов Н.А., Белогурова Н.В., Зырянов В.А., Тупикина В.Г., Петров А.Ю., Пат. 2119332 (1995). РФ. Б.И. 1998, № 27]. Тиолсульфонаты обладают бактерицидной и фунгицидной активностями [D.R. Hogg. In Comprehensive Organic Chemistry, Vol. 3, Sulphur Compounds. (Eds. D. Barton, W.D. Ollis). Pergamon Press: Oxford, 1979].
Однако в литературе недостаточно информации о терпеновых сульфокислотах и, особенно, о тиолсульфонатах и сульфохлоридах, так как получение их известными способами сульфирования затрудняется многочисленными перегруппировками и осмолением в ходе реакции. Известно некоторое количество терпеновых сульфокислот: карановой [Myslinski E., Michalek E. Roczniki Chemii, 1973, 47(2), 285], ментановой [Traynor, Kane, Betkouski, Hirshy. J. Org. Chem., 1979, 44, 1557], изоборнановой и пинановой структур [Лезина О.М., Гребенкина О.Н., Судариков Д.В., Крымская Ю.В., Рубцова С.А., Кучин А.В. ЖОрХ. 2015, 51 (10), 1391].
В работе [Agami С., Prince B., Syntet. Commun., 1990, 20 (21), 3289] (наиболее близкий аналог) описывается миртанилсульфокислота с S-конфигурацией атома С-2 и способ ее получения взаимодействием соответствующего бромида с сульфитом натрия. Недостатком данного способа является невысокий выход (~ 30%).
Иных аналогов получения заявленных монотерпеновых тиолсульфоната, сульфохлорида и сульфокислоты выявлено не было.
Задачей настоящего изобретения является синтез новых монотерпеновых тиолсульфоната, сульфохлорида и сульфокислоты, полученных эффективным способом.
Технический результат заключается в расширении арсенала новых терпеновых сульфопроизводных заданной структуры, востребованных в органическом синтезе биологически активных соединений, и в разработке метода синтеза терпеновых сульфопроизводных в одну стадию с сохранением структуры терпенового фрагмента исходного тиола и высоким выходом целевого продукта.
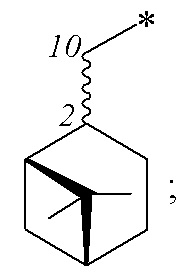
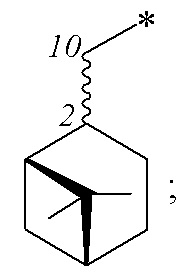
Технический результат достигается получением сульфопроизводных β-пинена с R- и S-конфигурацией атома С-2 структурной формулы (I), в частности, миртанилсульфохлоридов (RSO2Cl) с (R)- и (S)-конфигурациями атома С-2, димиртанилтиолсульфоната (RSO2SR) и миртанилсульфокислоты (RSO3H) с R-конфигурацией атома С-2, включая ее гидраты, сольваты и фармацевтически приемлемые соли:
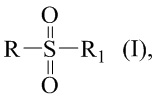
где R – радикал пинановой структуры 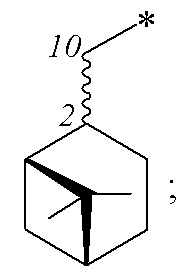
R1 - SR; Cl; ОН или  ;
;
где звездочкой обозначена связь, через которую осуществляется присоединение сульфогруппы соединений формулы (I), являющихся ценными полупродуктами в органическом синтезе биологически активных веществ.
Технический результат способа достигается тем, что синтез осуществляется окислением миртантиолов в водно-органическом растворителе диоксидом хлора (ClO2), а именно путем смешивания раствора тиола в органическом растворителе с водным или органическим раствором диоксида хлора при мольном соотношении тиол : ClO2, равном 1.0:0.5÷5.0, соответственно, в течение 0.5-4.0 ч. При этом для получения сульфокислоты используют в качестве растворителя водный пиридин или диметилформамид, для получения тиолсульфоната - дихлорметан и водный раствор диоксида хлора, для получения сульфохлорида - дихлорметан и катализатор VO(acac)2.
Синтез сульфопроизводных структурной формулы (I) осуществляется следующим образом (схема 1).
Раствор тиолов 1а,б в органическом растворителе смешивают с водным или органическим раствором диоксида хлора при мольном соотношении тиол : ClO2, равном 1.0:0.5 ÷ 1.0:5.0, соответственно, при температуре от 0 до 30°C. Продуктами реакции являются димиртанилтиолсульфонат 2а,б, миртанилсульфохлорид 3а,б и миртанилсульфокислота 4а,б.
Схема 1. Окисление миртантиола

Растворитель для приготовления раствора исходного тиола выбирают из группы спиртов, простых эфиров, алифатических углеводородов, галогенированных алифатических углеводородов, азотсодержащих растворителей; растворитель для экстракции диоксида хлора выбирают из группы галогенированных алифатических углеводородов, простых эфиров, алифатических углеводородов, азотсодержащих растворителей, спиртов или воду.
В качестве исходного субстрата брали индивидуальный тиол 1а или смесь диастереомерных тиолов 1а и 1б в соотношении 7:1 (de 75%). Диастереомерно чистый тиол 1а синтезирован в несколько стадий: из (-)-β-пинена реакцией гидроборирования-окисления был получен цис-миртанол [Кучин А.В, Фролова Л.Л. Изв. АН. Сер хим. 2000, 9, 1658], далее по модифицированной методике - йодид [Garegg P.J., Samuelsson B. J. Chem. Soc., Perkin Trans. 1. 1980, 0, 2866], а затем взаимодействием с AcSK - тиоацетат [T.-C. Zheng, M. Burkart, D. E. Richardson, Tetrahedron Lett. 1999, 40, 603], из которого по методике [Banach A., Ścianowski Ja., Ozimek P. Phosphorus, Sulfur, and Silicon and the Related Elements. 2014, 189, 274] - тиол 1а. Смесь диастереомерных тиолов 1а,б получена присоединением тиоуксусной кислоты по двойной связи (-)-β-пинена в присутствии LaCl3 и последующем восстановлении полученных диастереомерных тиоацетатов LiAlH4 до тиолов 1а,б [Banach A., Ścianowski Ja., Ozimek P. Phosphorus, Sulfur, and Silicon and the Related Elements. 2014, 189, 274].
Водный раствор диоксида хлора (ClO2) – промышленный продукт, концентрацию которого определяли титрованием по методике [Т.А.Туманова, И.Е.Флис. Физико-химические основы отбелки. М.: Лесная промышленность, 1972, 236].
Способ позволяет получить целевые продукты в одну стадию с сохранением структуры терпенового фрагмента исходного тиола с высоким выходом. Для подбора оптимальных условий синтеза соединений 2а,б-4а,б варьировались такие параметры, как растворитель, соотношение тиол : диоксид хлора, наличие катализатора VO(acac)2 и время реакции. Нами были опробованы в качестве растворителей пиридин, диметилформамид, ацетонитрил, дихлорметан, гексан. Соотношение тиол : ClO2 изменялось от 1:0.5 до 1:5, время реакции - от 0.25 до 4 ч. Было выявлено, что оптимальный растворитель для синтеза сульфокислот 4а,б - водный пиридин или диметилформамид, для тиолсульфонатов 2а,б - дихлорметан, для сульфохлоридов 3а,б - дихлорметан и наличие катализатора VO(acac)2 в количестве 5-10 мол. %. Использование данных условий приводит к повышению выхода сульфокислот до 98% (от теоретического), тиолсульфонатов - 45%, сульфохлоридов - 96%.
ИК спектры регистрировали на ИК-Фурье-спектрометре Shimadzu IR Prestige 21 в тонком слое. Спектры ЯМР 1H и 13C регистрировали на спектрометре Bruker Avance-300 (300.17 МГц для 1Н и 75.48 МГц для 13С) в растворах CDCl3 (внутренний стандарт – сигнал хлороформа) и ДМСО-d6. Полное отнесение сигналов 1Н и 13С выполняли с помощью двумерных гомо- (1H-1H COSY, 1H-1H NOESY) и гетероядерных экспериментов (1H-13C HSQC, HMBC). Масс-спектры регистрировали на высокоэффективном жидкостном хроматографе с масс-селективным детектором Thermo finnigan LCQ Fleet (растворитель - CH3OH). Детектирование проводили по отрицательным ионам. Колоночную хроматографию выполняли на силикагеле Alfa Aesar (0.06–0.2 мм).
Характеристики полученных соединений.
S-(((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)метил)-((1S,2R,5S)-6,6-диметилбицикло[3.1.1]гептан-2-ил)метансульфонотиоат (2а)
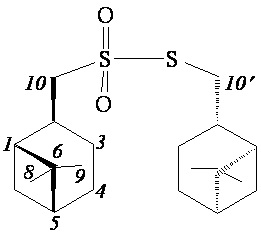
ИК спектр (KBr, ν, см–1): 1128 и 1321 см-1 (SO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.87-0.96 м (1H, H7'α), 1.00-1.09 м (1H, H7α), 1.03 c (3H, H8), 1.06 c (3H, H8'), 1.23 c (3H, H9), 1.25 c (3H, H9'), 1.47–1.59 м (1H, H3α), 1.62-1.74 м (1H, H3a'), 1.81-2.14 м (9H, H1, H1', H3β, H4, H4', H5, H5'), 2.15-2.30 м (1H, H3β'), 2.33-2.50 м (2H, H7β, H7β'), 2.75-2.98 м (2H, H2, H2'), 3.22 д (2Н, Н10', J 7.9 Гц), 3.40-3.51 м (2Н, Н10). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.70 (C3'), 21.87 (C3), 23.13 (C8, C8'), 25.80 (C4'), 25.89 (C4), 27.53 (C9'), 27.79 (C9), 32.47 (C7'), 33.18 (C7), 35.29 (C2'), 36.00 (C2), 37.07 (C6'), 37.36 (C6), 40.64 (C5'), 41.05 (C5), 42.68 (C10'), 45.14 (C1'), 46.50 (C1), 70.28 (C10). Найдено, %: С 64.91; Н 9.19; S 17.34. C20H34O2S2. Вычислено, %: С 64.82; Н 9.25; S 17.30.
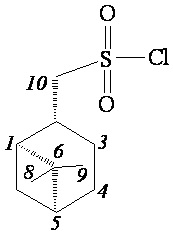
((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)метансульфохлорид (3а)

ИК спектр (KBr, ν, см–1): 1168, 1377 см-1 (SO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.01-1.12 м (1H, H7α), 1.05 c (3H, H8), 1.26 c (3H, H9), 1.64-1.81 м (1H, H3α), 1.90–2.08 м (3H, H4, H5), 2.06-2.17 м (1H, H1), 2.18-2.35 м (1H, H3β), 2.39-2.51 м (1H, H7β), 2.89–3.03 м (1H, H2), 3.85 д (2Н, Н10, J 6.5 Гц). Спектр ЯМР 13С (CDCl3, δ, м.д.): 21.37 (C3), 23.09 (C8), 25.61 (C4), 27.42 (C9), 32.31 (C7), 36.60 (C2), 38.36 (C6), 40.52 (C5), 46.09 (C1), 73.38 (C10). Найдено, %: С 50.79; Н 7.19; S 13.61. C10H17ClO2S. Вычислено, %: С 50.73; Н 7.24; S 13.54.
((1S,2R,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)метансульфоновая кислота (4а)
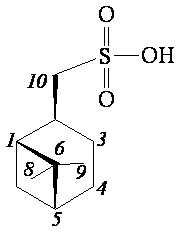
ИК спектр (KBr, ν, см–1): 1002, 1028, 1051, 1167, 1215 см-1 (SO2). Спектр ЯМР 1Н (ДМСО-d6, δ, м.д.): 0.85-0.94 м (1H, H7α), 0.94 c (3H, H8), 1.14 c (3H, H9), 1.48-1.67 м (1H, H3α), 1.75-1.95 м (3H, H4, H5), 1.91-2.01 м (2H, H3β, H1), 2.20-2.38 м (1H, H7β), 2.41-2.53 м (1H, H2), 2.75 д (2Н, Н10, J 6.6 Гц), 7.18 уш. с (1H, OH). Спектр ЯМР 13С (ДМСО-d6, δ, м.д.): 22.12 (C3), 23.34 (C8), 26.22 (C4), 28.13 (C9), 32.66 (C7), 36.83 (C2), 38.46 (C6), 40.88 (C5), 46.27 (C1), 59.51 (C10). Масс-спектр (ESI, 5 кВ), m/z (Iотн (%)): 217.29 (100) [M-H]ˉ, 97.00 (48) [C7H13].
((1S,2S,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)метансульфохлорид (3б)
Спектральные данные соединения 3б получены из спектров смеси 3а, 3б. ИК спектр (KBr, ν, см–1): 1168, 1377 см-1 (SO2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.92 c (3H, H8), 0.98-1.10 м (1H, H7α), 1.11 c (3H, H9), 1.60-1.78 м (1H, H3α), 1.80-1.91 м (2H, H4), 1.94-2.03 м (3H, H1, H3β, H5), 2.36-2.48 м (1H, H7β), 2.83-2.91 м (1H, H2), 3.70 д (2Н, Н10, J 6.6 Гц). Спектр ЯМР 13С (CDCl3, δ, м.д.): Спектр ЯМР 13С (CDCl3, δ, м.д.): 20.01 (C8), 23.20 (C3), 25.61 (C4), 26.50 (C9), 32.30 (C7), 32.62 (C2), 39.74 (C6), 40.20 (C5), 45.08 (C1), 72.53 (C10). Найдено, %: С 50.79; Н 7.19; S 13.61. C10H17ClO2S. Вычислено, %: С 50.73; Н 7.24; S 13.54.
((1S,2S,5S)-6,6-Диметилбицикло[3.1.1]гептан-2-ил)метансульфоновая кислота (4б)
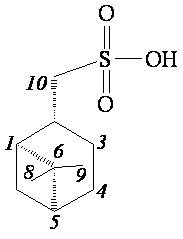
Спектральные данные соединения 4б получены вычитанием сигналов из спектров смеси 4а, 4б. ИК спектр (KBr, ν, см–1): 1002, 1028, 1051, 1167, 1215 см-1 (SO2). Спектр ЯМР 1Н (ДМСО-d6, δ, м.д.): 0.81 c (3H, H8), 0.93-1.02 м (1H, H7α), 1.16 c (3H, H9), 1.55-1.65 м (1H, H3α), 1.65–1.73 м (2H, H4), 1.76-1.85 м (1H, H3β), 1.92–1.99 м (1H, H1), 2.20-2.38 м (2H, H5, H7β), 2.35-2.41 м (1H, H2), 2.59 д (2Н, Н10, J 6.6 Гц), 7.18 уш. с (1H, OH). Спектр ЯМР 13С (ДМСО-d6, δ, м.д.): 20.45 (C8), 23.30 (C3), 24.49 (C4), 27.03 (C9), 31.94 (C2), 32.66 (C7), 38.69 (C6), 40.66 (C5), 45.15 (C1), 58.00 (C10). Масс-спектр (ESI, 5 кВ), m/z (Iотн (%)): 217.29 (100) [M-H]ˉ, 97.00 (48) [C7H13].
Получение новых соединений показано на следующих примерах.
Пример 1. Для получения S-(((1S,2R,5S)-6,6-диметилбицикло[3.1.1]гептан-2-ил)метил)-((1S,2R,5S)-6,6-диметилбицикло[3.1.1]гептан-2-ил)метансульфонотиоата (2а) к раствору 0.17 г (1 ммоль) тиола 1а в дихлорметане при перемешивании добавляли раствор 0.135 г (2 ммоль) ClO2 в дихлорметане. Время синтеза 2 ч. Водную и органическую фазы разделяли. Растворители отгоняли при пониженном давлении. Остаток органической фазы делили методом колоночной хроматографии. Выход 2а - 45%.
Пример 2. Для получения ((1S,2R,5S)-6,6-диметилбицикло[3.1.1]гептан-2-ил)метансульфохлорида (3а) к раствору 0.17 г (1 ммоль) тиола 1а в дихлорметане при перемешивании добавляли 0.027 г VO(acac)2 (0.1 ммоль), затем раствор 0.135 г (2 ммоль) ClO2 в дихлорметане. Время синтеза 2 ч. Растворитель отгоняли. Целевой продукт очищали методом колоночной хроматографии. Выход 3а - 96%.
Пример 3. Для получения ((1S,2R,5S)-6,6-диметилбицикло[3.1.1]гептан-2-ил)метансульфоновой кислоты (4а) к раствору 0.17 г (1 ммоль) тиола 1а в пиридине при перемешивании добавляли водный раствор 0.135 г (2 ммоль) ClO2. Время синтеза 2 ч. Растворитель отгоняли. Целевой продукт очищали методом колоночной хроматографии. Выход 4а - 98%.
Пример 4. Для получения ((1S,2S,5S)-6,6-диметилбицикло[3.1.1]гептан-2-ил)метансульфохлорида (3б) к раствору 0.17 г (1 ммоль) смеси тиолов 1а и 1б в дихлорметане при перемешивании добавляли 0.027 г VO(acac)2 (0.1 ммоль), затем раствор 0.135 г (2 ммоль) ClO2 в дихлорметане. Время синтеза 2 ч. Растворитель отгоняли. Целевой продукт - смесь диастереомеров 3а,б (de 75%) - очищали методом колоночной хроматографии. Выход смеси 3а,б - 96%.
Пример 5. Для получения ((1S,2S,5S)-6,6-диметилбицикло[3.1.1]гептан-2-ил)метансульфоновой кислоты (4б) к раствору 0.17 г (1 ммоль) смеси тиолов 1а и 1б в пиридине при перемешивании добавляли водный раствор 0.135 г (2 ммоль) ClO2. Время синтеза 2 ч. Растворитель отгоняли. Целевой продукт - смесь диастереомеров 4а,б (de 75%) - очищали методом колоночной хроматографии. Выход смеси диастереомеров 4а,б - 98%.
Пример 6. Для получения ((1S,2R,5S)-6,6-диметилбицикло[3.1.1]гептан-2-ил)метансульфоновой кислоты (4а) к раствору 0.17 г (1 ммоль) тиола 1а в пиридине при перемешивании добавляли водный раствор 0.034 г (0.5 ммоль) ClO2. Время синтеза 0.5 ч. Растворитель отгоняли. Целевой продукт очищали методом колоночной хроматографии. Выход 4а - 67%.
Пример 7. Для получения S-(((1S,2R,5S)-6,6-диметилбицикло[3.1.1]гептан-2-ил)метил)-((1S,2R,5S)-6,6-диметилбицикло[3.1.1]гептан-2-ил)метансульфонотиоата (2б) к раствору 0.17 г (1 ммоль) смеси тиолов 1а и 1б в дихлорметане при перемешивании добавляли раствор 0.135 г (2 ммоль) ClO2 в дихлорметане. Время синтеза 4 ч. Водную и органическую фазы разделяли. Растворители отгоняли при пониженном давлении. Остаток органической фазы делили методом колоночной хроматографии. Выход смеси диастереомеров 2а,б - 15%.
Пример 8. Для получения ((1S,2R,5S)-6,6-диметилбицикло[3.1.1]гептан-2-ил)метансульфоновой кислоты (4а) к раствору 0.17 г (1 ммоль) тиола 1а в ацетонитриле при перемешивании добавляли водный раствор 0.34 г (5 ммоль) ClO2. Время синтеза 0.5 ч. Растворитель отгоняли. Целевой продукт очищали методом колоночной хроматографии. Выход 4а - 76%.
Примеры использования сульфокислот (RSO3H) и сульфохлоридов (RSO2Cl).
1. Наличие сульфогруппы в составе лекарственного препарата увеличивает его растворимость в воде, что обуславливает снижение токсичности, а также создает предпосылки для создания инъекционных лекарственных форм.
Все терпеновые сульфокислоты формулы RSO3H, где R = терпенил, полученные в работе [Гребенкина О.Н., Лезина О.М., Изместьев Е.С., Судариков Д.В., Пестова С.В., Рубцова С.А., Кучин А.В. ЖОрХ. 2017, 53 (6), 844.] и в настоящем патенте являются хорошо растворимыми в воде.
2. Сульфокислоты RSO3H и сульфохлориды RSO2Cl используются в качестве полупродуктов в органическом синтезе лекарственных препаратов. Так, сульфокамфорная кислота используется в производстве лекарственных препаратов, обладающих коронарорасширяющей способностью, антибактериальной активностью, болеутоляющим свойством (сульфокамфокаин, полусинтетические пенициллины и цефалоспорины) [Котегов Н.А., Белогурова Н.В., Зырянов В.А., Тупикина В.Г., Петров А. Ю., Пат. 2119332 (1995). РФ. Б.И. 1998, № 27].
3. Из сульфонилхлоридов и сульфокислот в органическом синтезе можно получить широкий ряд других производных, востребованных в химии и фармацевтике (схема 2): сульфинилхлориды (RSOCl), сульфиновые кислоты (RSO2H), сульфамиды (RSO2NR2R3) и сульфинамиды (RSONR2R3), эфиры сульфокислот (RSO2R4), сульфон- (RSO2NR5) и сульфинимиды (RSONR5):
Схема 2

Примеры использования тиолсульфонатов.
1. Тиолсульфонаты (RSO2SR) обладают бактерицидной и фунгицидной активностями [D.R. Hogg. In Comprehensive Organic Chemistry, Vol. 3, Sulphur Compounds. (Eds. D. Barton, W.D. Ollis). Pergamon Press: Oxford, 1979].
2. Ранее нами показано, что пинановые гидрокситиолсульфонаты проявляют антимикробную активность в отношении Candida albicans, Staphylococcus aureus и Cryptococcus neoformans [Гребенкина О.Н., Лезина О.М., Изместьев Е.С., Судариков Д.В., Пестова С.В., Рубцова С.А., Кучин А.В. ЖОрХ. 2017, 53 (6), 844.].
Таким образом, нами получены синтезированные вещества в сочетании терпенового фрагмента с сульфогруппой, являющиеся потенциальными биологически активными соединениями, повышающими противогрибковую, противовоспалительную, антихеликобактерную, противоопухолевую и другие активности, которые могут быть использованы в качестве: антисептика, фунгицида противовирусные средства; оказывающие антигипергликемическое, противовоспалительное, противопаразитарное действие и химиопрофилактическое действие при раке.