Результат интеллектуальной деятельности: Рекомбинантный вектор для создания плазмидных генетических конструкций, обладающих повышенной длительностью экспрессии целевых генов
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области молекулярной генетики, биотехнологии и медицины и представляет собой рекомбинантный вектор, обеспечивающий эффективную и пролонгированную экспрессию встроенных в него целевых генов, как для применения при ex vivo модификации клеток в целях клеточной терапии, так и для генной терапии путем прямого введения генетических конструкций в ткани-мишени.
Уровень техники
Генная терапия с использованием вирусных векторов оказалась эффективной против ряда заболеваний (May С, Rivella S, Callegari J et al. Therapeutic haemoglobin synthesis in beta-thalassaemic mice expressing lentivirus encoded human beta-globin. Nature 2000; 406:82-86; Bainbridge JW, Smith AJ, Barker SS et al. Effect of gene therapy on visual function in Leber's congenital amaurosis. N Engl J Med 2008; 358:2231-2239; Blaese RM, Culver KW, Miller AD et al. T lymphocyte-directed gene therapy for ADA-SCID: initial trial results after 4 years. Science 1995 270:475-480; Bordignon C, Notarangelo LD, Nobili N et al. Gene therapy in peripheral blood lymphocytes and bone marrow for ADA-immunodeficient patients. Science 1995; 270:470-465). Тяжелые побочные эффекты, такие как инсерционный мутагенез (Hacein-Bey-Abina, S, Le Deist, F, Carlier et al. Sustained correction of X-linked severe combined immunodeficiency by ex vivo gene therapy. N Engl J Med 2002; 346:1185-1193; Cavazzana-Calvo, M, Fischer, A. Gene therapy for severe combined immunodeficiency: are we there yet? J Clin Invest 2007; 117:1456-1465) и сильный иммунный ответ на введение вирусных частиц (Raper SE, Chirmule N, Lee FS, et al. Fatal systemic inflammatory response syndrome in a ornithine transcarbamylase deficient patient following adenoviral gene transfer. Mol Genet Metab 2003; 80:148-158), связанные с природой вирусных векторов, повышают значительно риск использования данной технологии и могут существенно замедлить развитие этой области медицины. Генетические конструкции, полученные на основе плазмидных векторов, не встраиваются в геном и не могут стать причиной анафилактического шока. Кроме того, получение необходимых для терапии количеств плазмидных векторов более технологично и стоит намного дешевле вирусных векторов. Несмотря на то, что начальная эффективность экспрессии трансгена плазмидными конструкциями обычно выше, чем вирусными, для плазмидных векторов характерно резкое падение уровня экспрессии со временем и низкая продолжительность работы, в особенности в клетках ex vivo, в том числе и стволовых клетках, а также в ряде тканей и органов человека. Это приводит к тому, что достигаемый с применением таких конструкций терапевтический эффект оказывается весьма кратковременным.
Для повышения длительности экспрессии трансгенов плазмидными векторами используют следующие подходы: удаление бактериальных последовательностей (Chen ZY, Не CY, Ehrhardt A, Kay MA. Minicircle DNA vectors devoid of bacterial DNA result in persistent and high-level transgene expression in vivo. Mol Ther. 2003; 8:495-500; Chen ZY, He CY, Meuse L, Kay MA. Silencing of episomal transgene expression by plasmid bacterial DNA elements in vivo. Gene Ther. 2004; 11:856-864), сокращение числа CpG динуклеотидов в конструкции (Hyde SC, Pringle IA, Abdullah S et al. CpG-free plasmids confer reduced inflammation and sustained pulmonary gene expression. Nat Biotechnol. 2008; 26:549-551) и введение S/MAR элементов в состав вектора (Argyros О, Wong SP, Niceta M et al. Persistent episomal transgene expression in liver following delivery of a scaffold/matrix attachment region containing non-viral vector. Gene Ther. 2008; 15:1593-1605).
Ближайшие аналоги:
1. Плазмида pCpG. Коммерчески доступная плазмида pCpG компании Invivogen представляет собой полностью лишенную CpG динуклеотидов кольцевую молекулу ДНК с двумя длинными S/MAR элементами по обе стороны экспрессионной кассеты. Однако полная элиминация CpG динуклеотидов из бактериальной последовательности плазмиды может негативно сказаться на эффективности ее размножения в бактериях, что приведет к удорожанию производства достаточных количеств плазмид. Заявляемый вектор представляет собой разумный компромисс между снижением количества CpG динуклеотидов до уровня, когда они уже не влияют негативно на экспрессию трансгенов, и сохранением репликационных свойств плазмиды.
2. Плазмидные вектора pEPI и pEPito (Papapetrou ЕР, Ziros PG, Micheva ID et al. Gene transfer into human hematopoietic progenitor cells with an episomal vector carrying an S/MAR element. Gene Ther. 2006 13:40-51; Haase R, Magnusson T, Su В et al. Generation of a tumor-and tissue-specific episomal non-viral vector system. BMC Biotechnol. 2013; 13:49; Haase R, Argyros O, Wong SP et al. pEPito: a significantly improved non-viral episomal expression vector for mammalian cells. BMC Biotechnol. 2010; 10:20).
Плазмидный вектор, способный к эписомальному поддержанию, изначально был создан с использованием полноразмерных S/MAR элементов. Затем из него были удалены 60% CpG динуклеотидов и введены разные тканеспецифические промоторы. Несмотря на успешное эписомальное поддержание, вектор оказался способным поддерживать долговременную экспрессию трансгена только в некоторых типах клеток. В гематопоэтических стволовых клетках экспрессия оказалась непродолжительной, в клетках линии MEL полностью прекратилась.
3. Миникольца. Кей и коллеги в 2003 году (Chen ZY, Не CY, Ehrhardt A, Kay MA. Minicircle DNA vectors devoid of bacterial DNA result in persistent and high-level transgene expression in vivo. Mol Ther. 2003; 8:495-500) впервые предложили использовать в качестве эписомальных векторов миникольца. Миникольца получаются из плазмид за счет встраивания сайтов узнавания какой-либо рекомбиназы на концах экспрессионной кассеты и действия соответствующей рекомбиназы. При этом необходимые для размножения плазмиды в бактериях бактериальные последовательности присутствуют на стадии наработки плазмиды и удаляются лишь в конце процедуры наработки. Однако самим по себе миникольцам не удается полностью избежать падения уровня экспрессии со временем (Chen ZY, Riu Е, Не CY, Xu Н, Kay MA. Silencing of episomal transgene expression in liver by plasmid bacterial backbone DNA is independent of CpG methylation. Mol Ther. 2008; 16:548-556). Определенный успех в поддержании уровня экспрессии был достигнут только при получении миниколец из pEPito (Argyros О, Wong SP, Fedonidis С et al. Development of S/MAR minicircles for enhanced and persistent transgene expression in the mouse liver. J Mol Med (Berl). 2011; 89:515-529). Однако недостатком этой системы является сложная процедура рекомбинации и очистки закольцованных экспрессионных кассет, что удорожает производство плазмид.
Задачей заявляемого изобретения является разработка нового плазмидного вектора, обеспечивающего эффективную и пролонгированную экспрессию различных целевых генов ex vivo и in vivo.
Задача решается путем создания кольцевой молекулы ДНК, которая содержит точку начала репликации R6K, ген, обеспечивающий устойчивость к антибиотику зеоцину, под управлением бактериального промотора Е7, гексамер мутированного S/MAR элемента из человеческого гена IFNβ длиной 155 пар нуклеотидов, в котором произведена заменена восьми G/C нуклеотидов на А/Т нуклеотиды, комбинацию человеческого EF-1a промотора и мышиного CMV-энхансера, управляющую экспрессией целевого гена, и сигнал полиаденилирования SV40polyA.
Технический результат изобретения: разработан новый плазмидный вектор, эффективно экспрессирующий различные целевые гены ex vivo и in vivo. Нуклеотидная последовательность плазмидного вектора приведена в перечне последовательностей нуклеотидов под номером SEQ ID NO 1. Сконструированный плазмидный вектор содержит всего 13 CpG динуклеотидов, что позволяет ему в значительной степени избегать CpG метилирования и связанного с ним формирования супрессивного гетерохроматина и, следовательно, сайленсинга экспрессии трансгена. Содержащиеся в плазмиде 6 коротких S/MAR элементов способствуют ассоциации плазмиды с ядерным хроматином клетки и снижают скорость ее разведения при делении клетки. Кроме того, S/MAR элементы благодаря своим инсуляторным свойствам могут экранировать экспрессионную кассету от негативного влияния оставшихся в бактериальной области плазмиды CpG-динуклеотидов. Использованные в векторе S/MAR элементы были дополнительно модифицированы по сравнению с природным аналогом для снижения термодинамической стабильности данного функционального элемента, что способствует усилению его функции.
Разработанный вектор может быть применен в двух основных областях техники. Во-первых, после встраивания в разработанный вектор последовательностей, кодирующих необходимые для дальнейшего использования белки или функциональные генетические элементы, полученные генетические конструкции могут применяться для модификаций клеток ex vivo для обеспечения экспрессии терапевтических белков или другой модификации клеток с последующим применением модифицированных клеток в клеточной терапии. Во многих протоколах клеточной терапии может возникнуть необходимость повышения экспрессии некоторых белков, или экспрессии новых белков, не экспрессируемых самими клетками. В некоторых терапевтических протоколах может возникнуть необходимость в прекондиционировании трансплантируемых клеток, например, для обеспечения эффективного хоуминга клеток после системного введения. В других случаях может понадобиться частичная или полная дифференцировка аутологических стволовых клеток. Далее в примерах мы показываем, что разработанный нами плазмидный вектор может поддерживать экспрессию трансгена на высоком уровне в мезенхимальных стволовых клетках в течение относительно длительного времени, и значительно лучше поддерживает экспрессию трансгена, чем это возможно с обычными плазмидными векторами, содержащими большое число CpG динуклеотидов. Во-вторых, после встраивания в разработанный вектор последовательностей, кодирующих необходимые для дальнейшего использования белки или функциональные генетические элементы, полученные генетические конструкции могут применяться непосредственно для генной терапии - введения их в органы или ткани-мишени, для обеспечения экспрессии терапевтических белков в данных органах и тканях, для высвобождения терапевтических белков в кровоток, или для иных терапевтических целей.
Краткое описание фигур
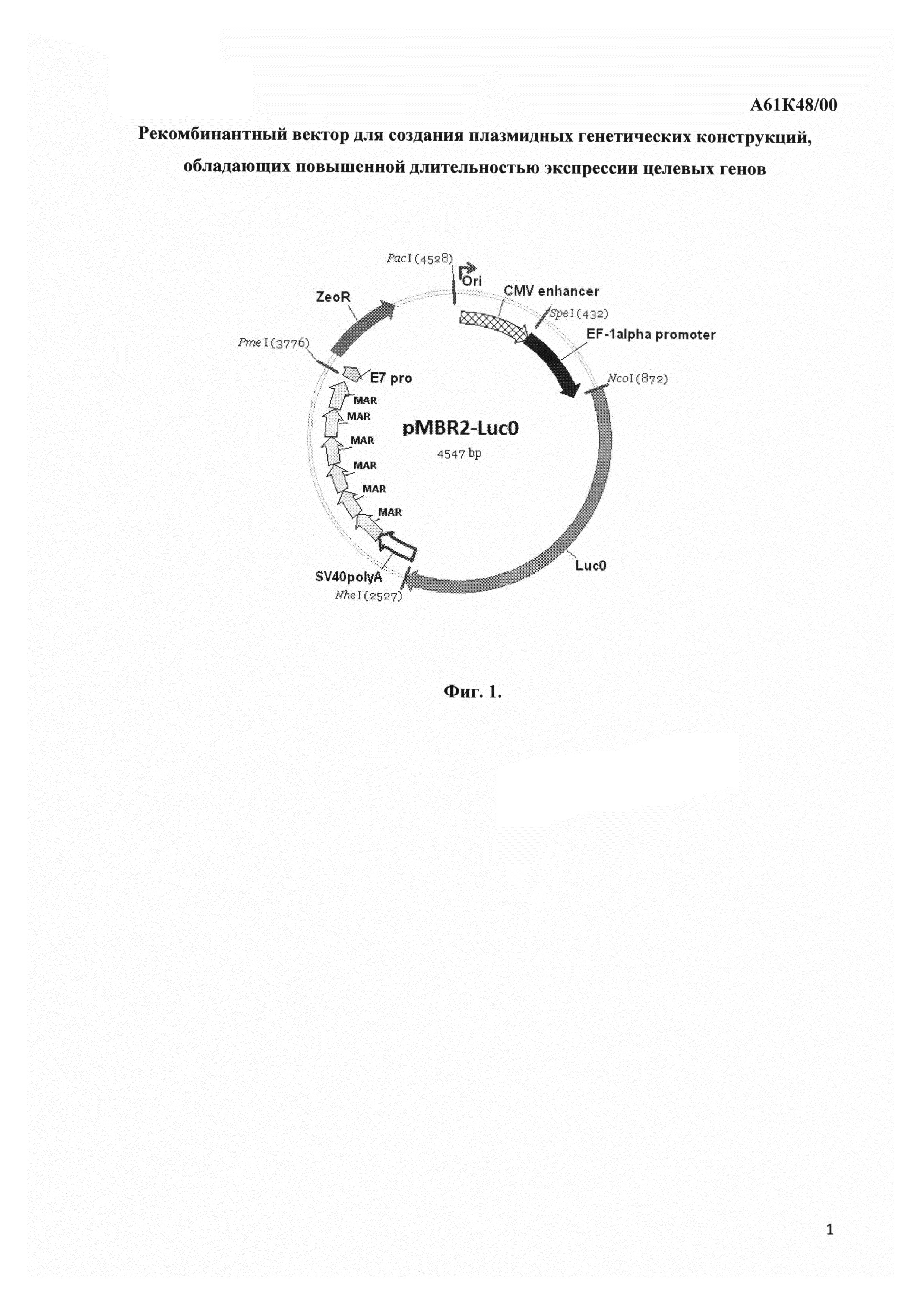
Фиг. 1 представляет карту плазмиды pMBR2-Luc0, полученной путем встраивания гена светлячковой люциферазы, не содержащего CpG динуклеотидов, в вектор pMBR2.
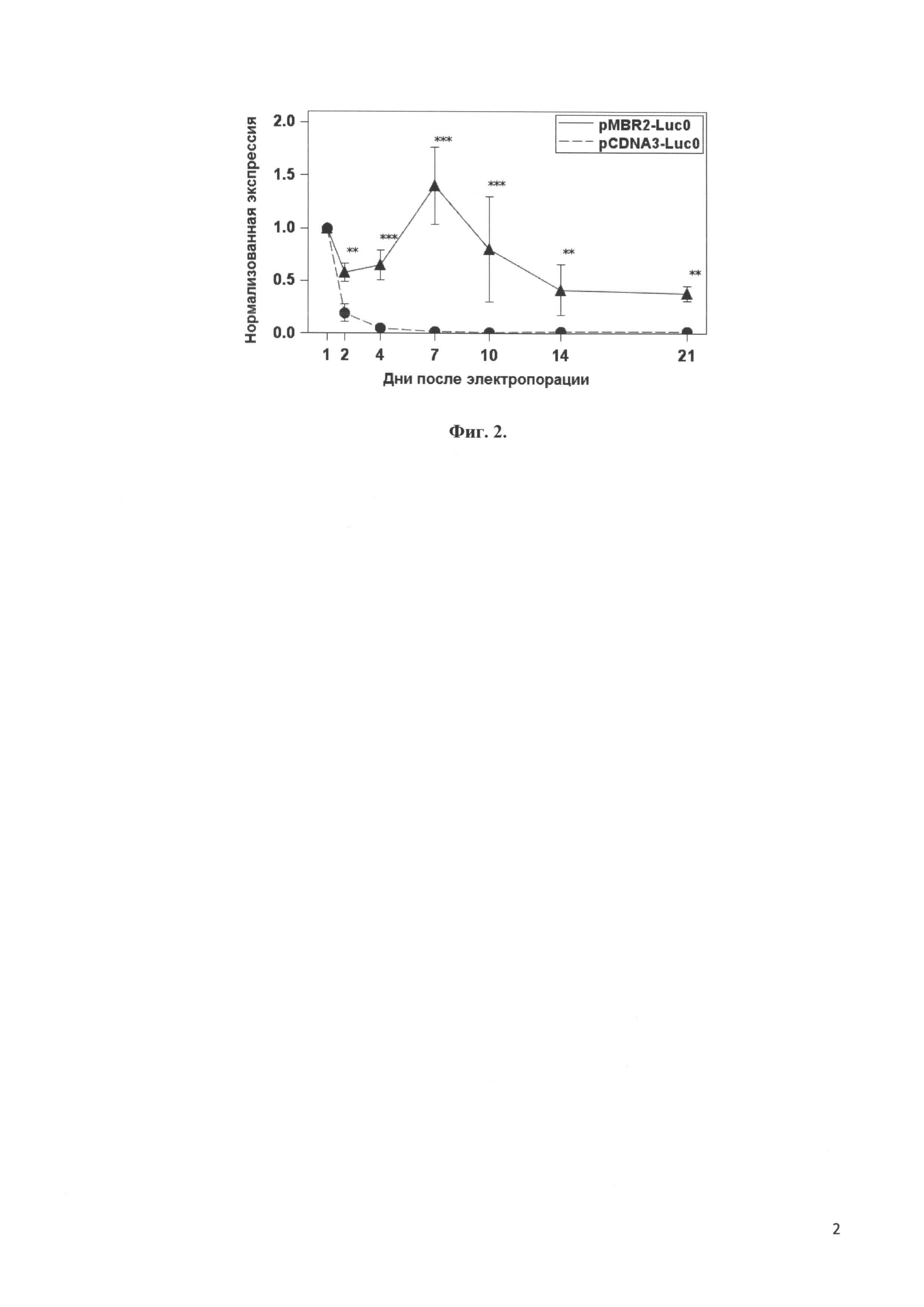
Фиг. 2 представляет сравнение динамики экспрессии гена светлячковой люциферазы, не содержащего CpG динуклеотидов, вектором pMBR2 и коммерческим вектором pCDNA3 в мезенхимальных стволовых клетках в зависимости от времени. ** - p<0.05, *** - p<0.001.
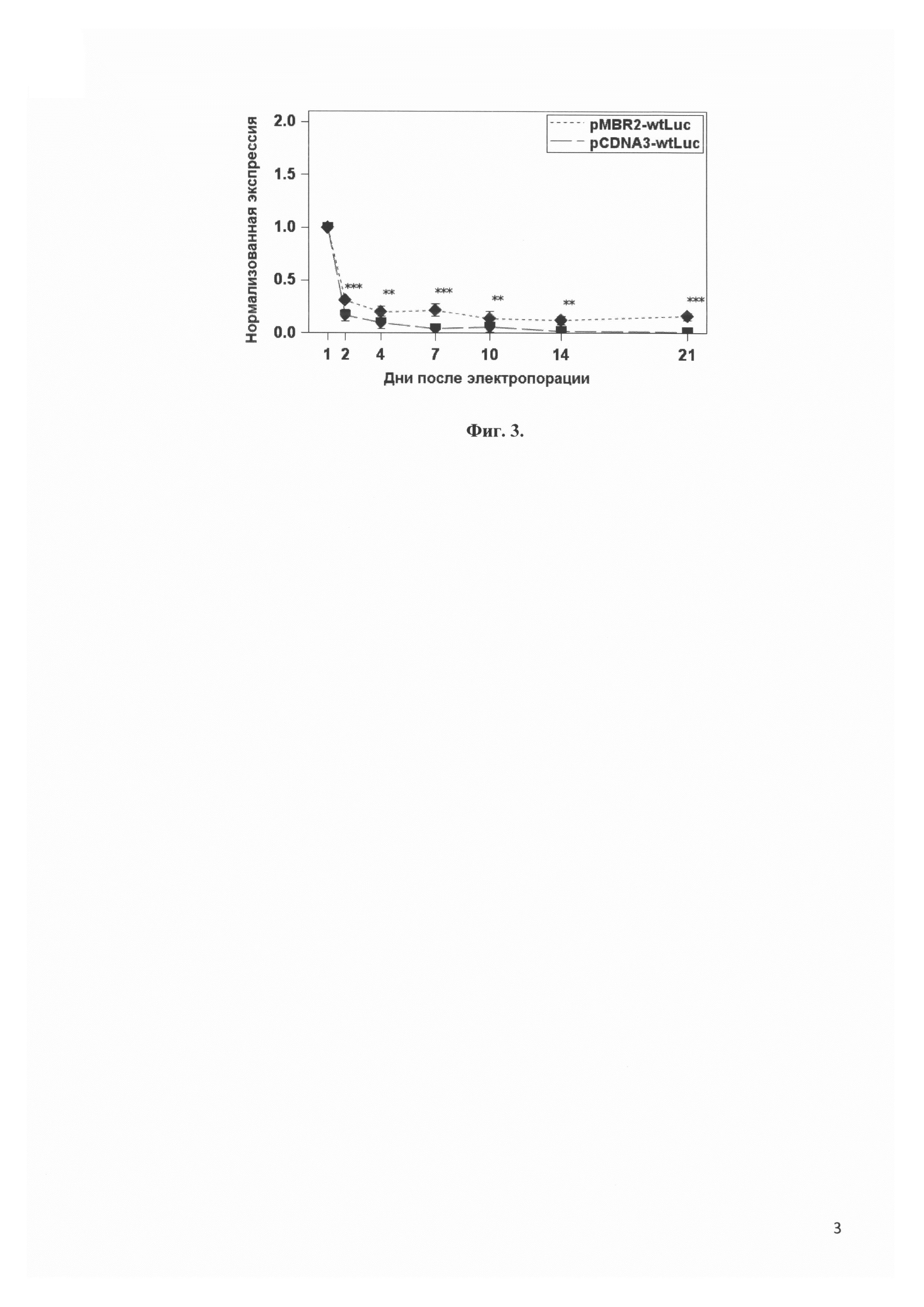
Фиг. 3 представляет сравнение динамики экспрессии гена светлячковой люциферазы дикого типа, содержащего 97 CpG динуклеотидов, вектором pMBR2 и коммерческим вектором pCDNA3 в мезенхимальных стволовых клетках в зависимости от времени. ** - p<0.05, *** - p<0.001.
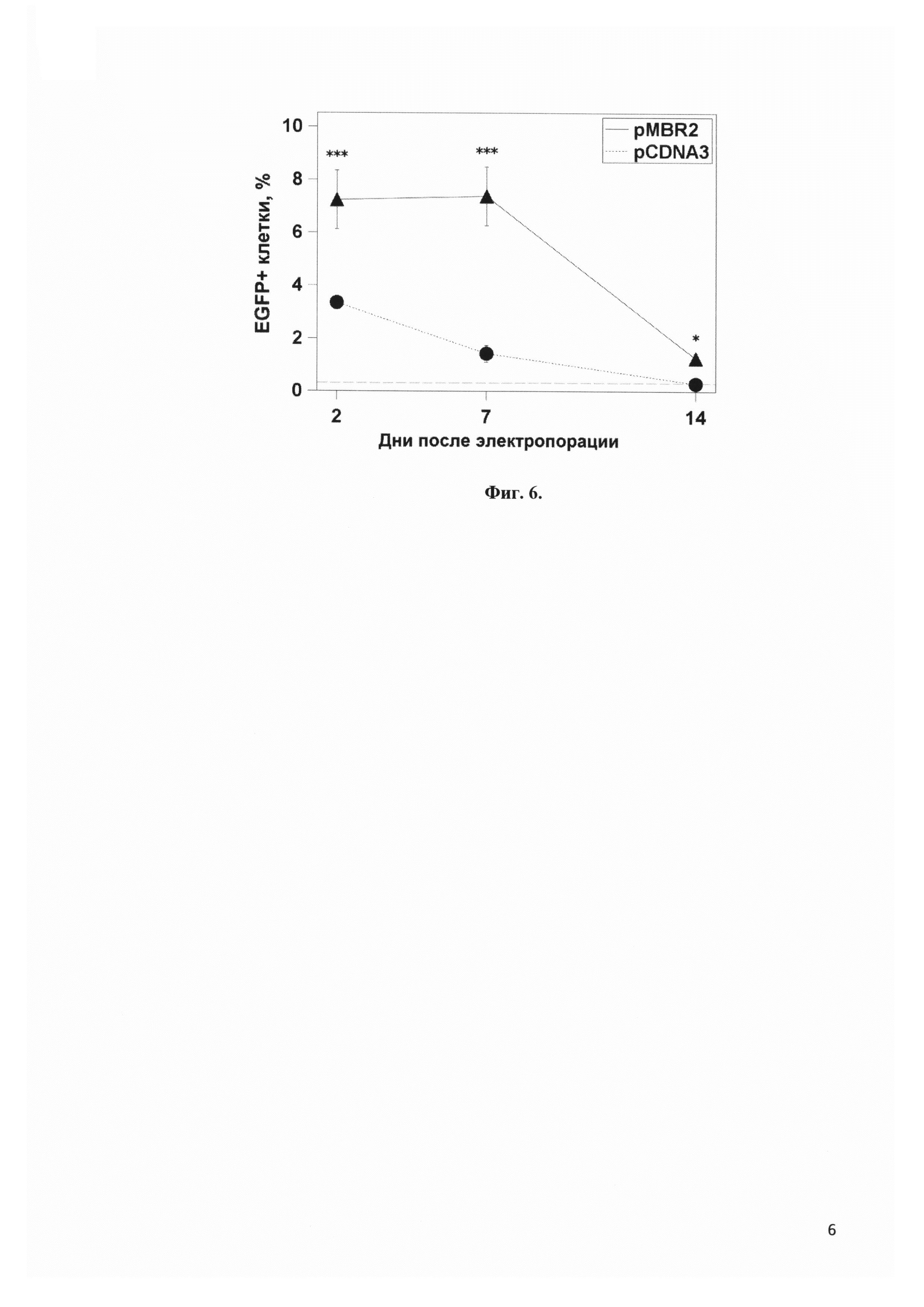
Фиг. 4 представляет примеры окрашивания МСК на β-галактозидазу после экспрессии лишеннного CpG гена β-галактозидазы вектором pMBR2 и коммерческим вектором pCDNA3. В левом столбце вектор pCDNA3, в правом - pMBR2. Верхний ряд - 2-ой день после электропорации, в средний ряд - 7-ой день после электропорации, нижний ряд - 14-ый день после электропорации.
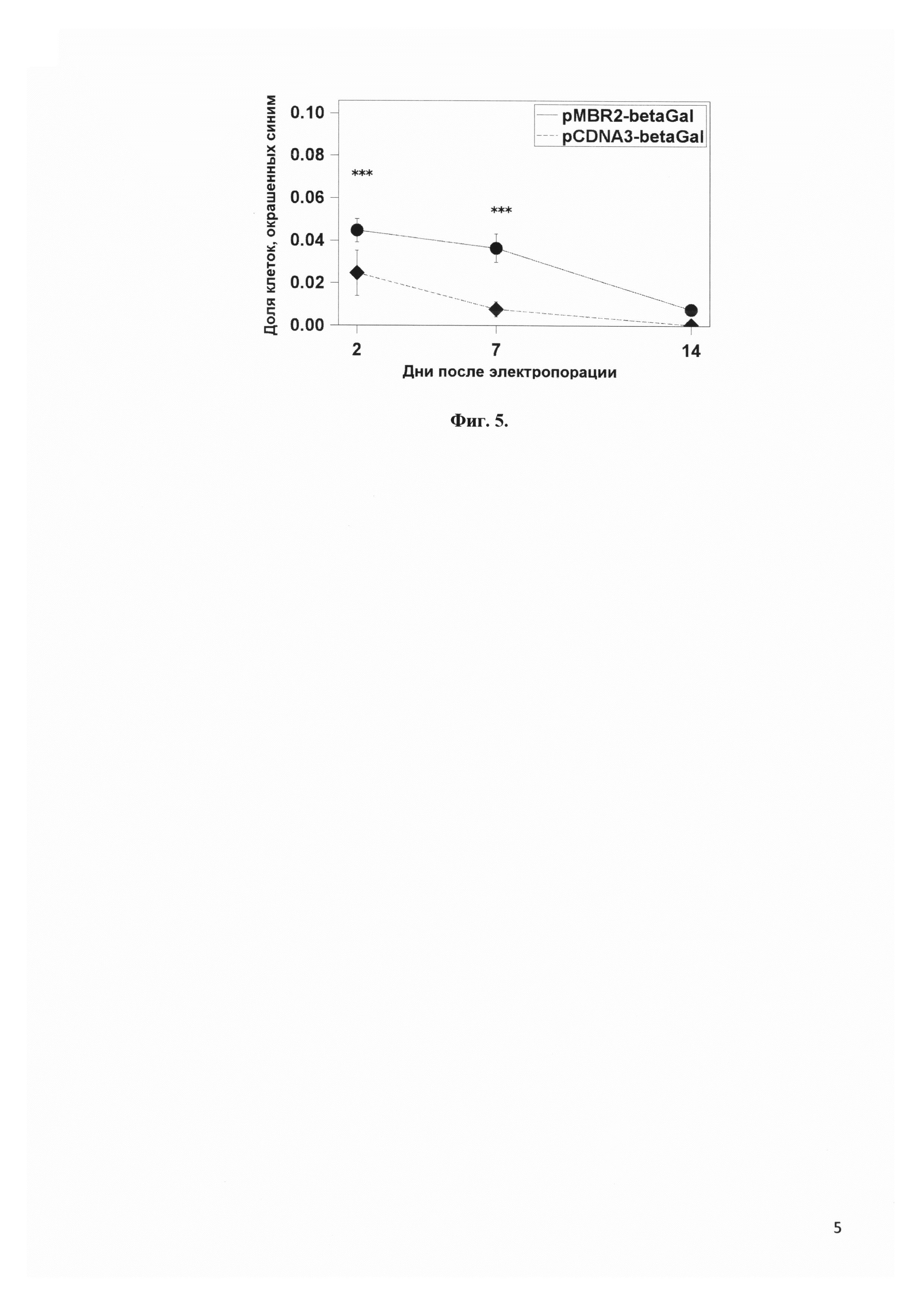
Фиг. 5 представляет сравнение количества клеток, экспрессирующих ген β-галактозидазы, лишенный CpG, вектором pMBR2 и коммерческим вектором pCDNA3 в мезенхимальных стволовых клетках. *** - p<0.001
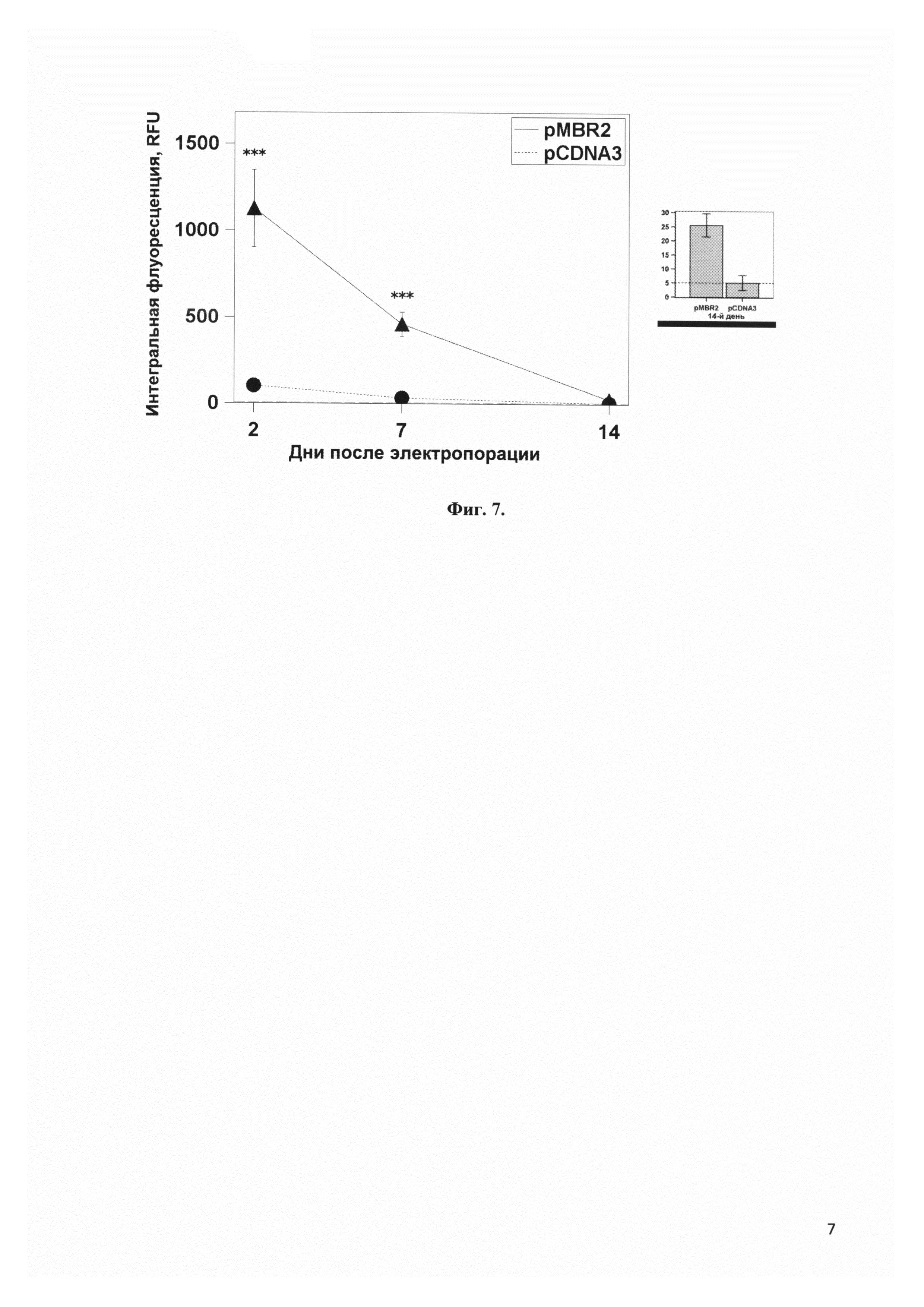
Фиг. 6 представляет сравнение доли мезенхимальных стволовых клеток, экспрессирующих флюоресцентный белок eGFP, вектором pMBR2 и коммерческим вектором pCDNA3. *** - p<0.001, * - p<0.1
Фиг. 7 представляет сравнение интегральной флуоресценции мезенхимальных стволовых клеток, экспрессирующих флюоресцентный белок eGFP, вектором pMBR2 и коммерческим вектором pCDNA3. *** - p<0.001
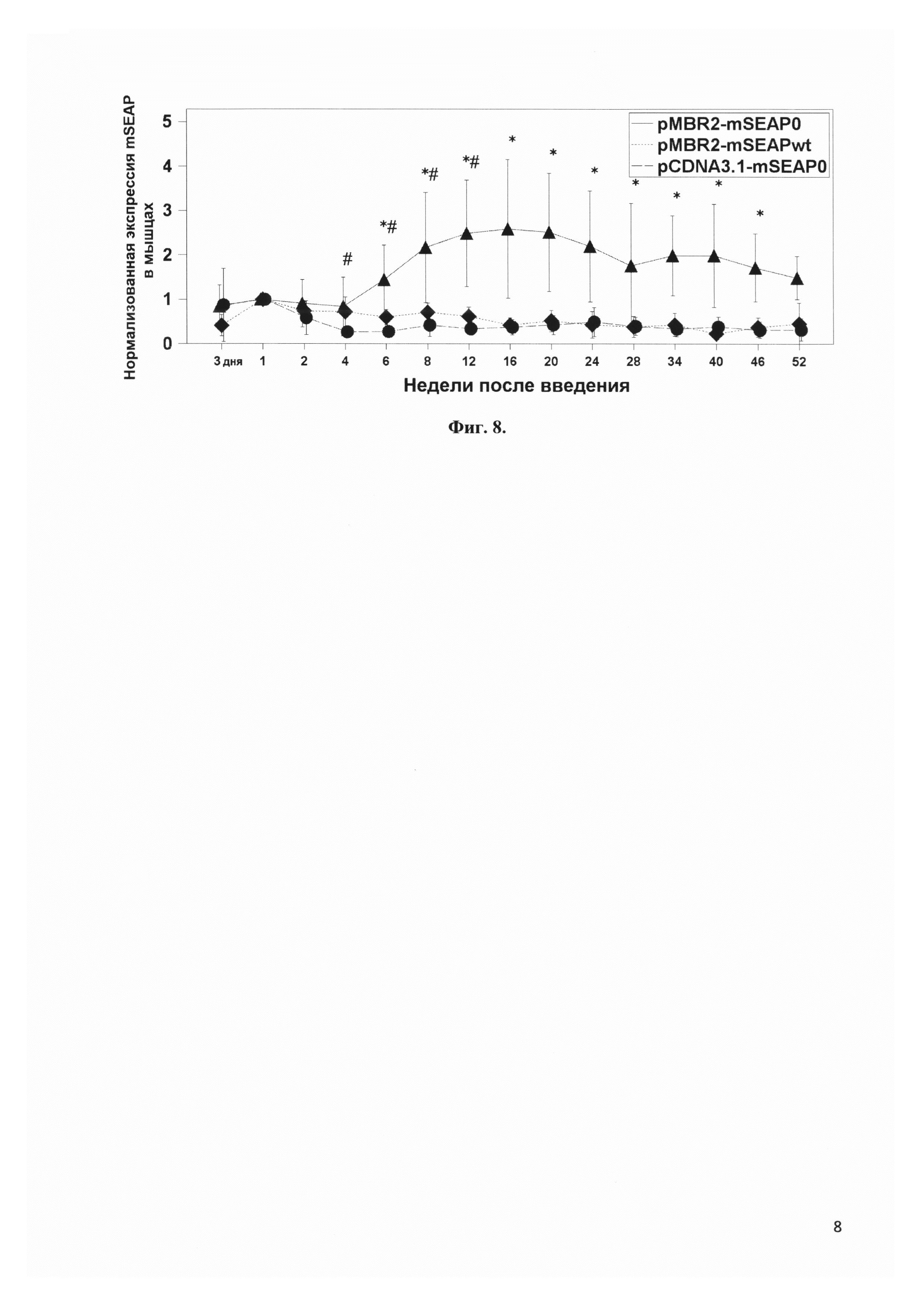
Фиг. 8 представляет сравнение динамики экспрессии в мышцах задних конечностей мышей гена секретируемой фосфатазы mSEAP, не содержащего CpG динуклеотидов вектором pMBR2 и коммерческим вектором pCDNA3, а также гена mSEAP дикого типа, содержащего CpG динуклеотиды, вектором pMBR2. * - p<0.01 при сравнении pMBR2-mSEAP0 с каждой из групп pMBR2-mSEAPwt и pCDNA3.1-mSEAP0. # - p<0.05 при сравнении групп pMBR2-mSEAPwt и pCDNA3.1-mSEAP0 между собой.
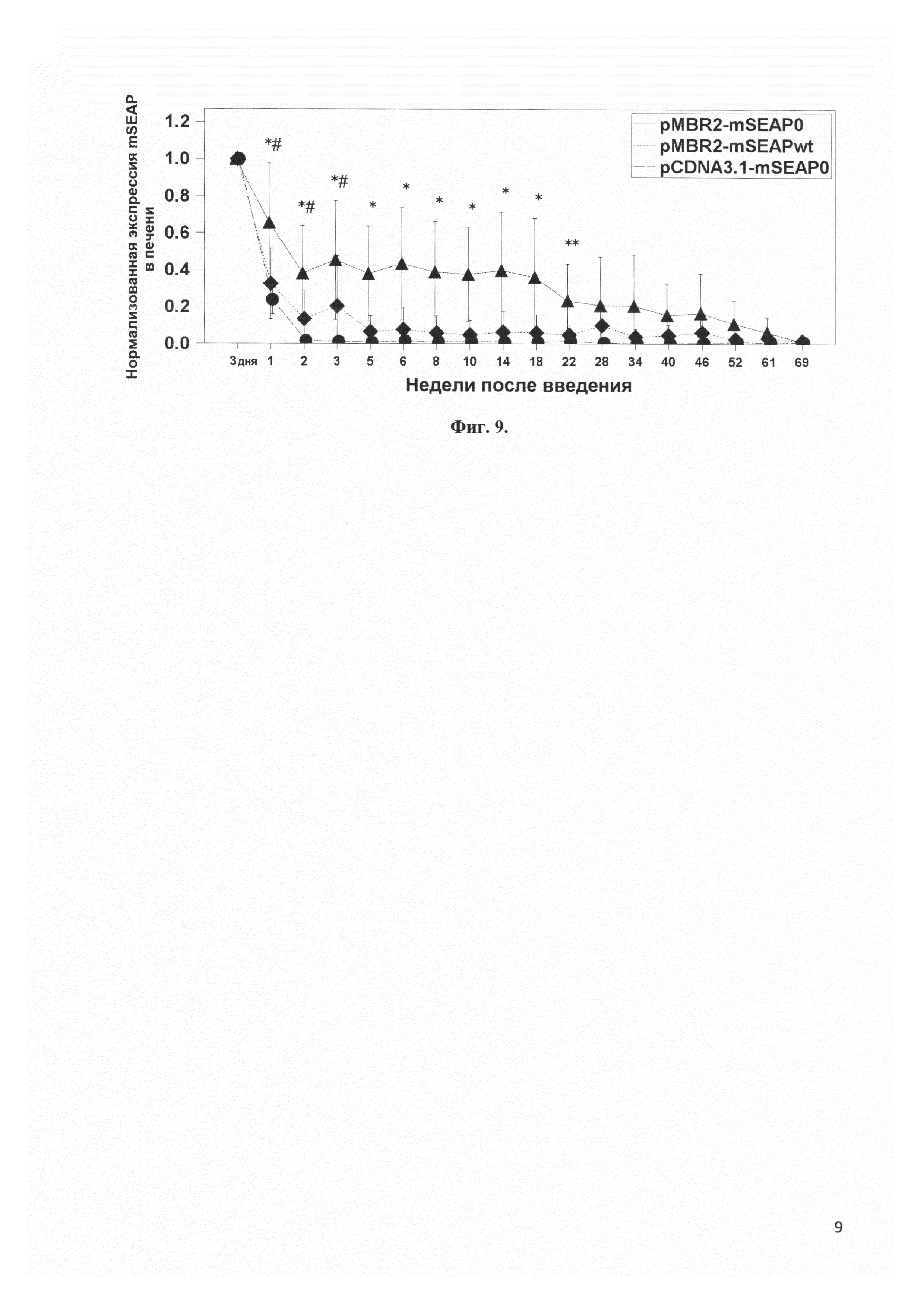
Фиг. 9 представляет сравнение динамики экспрессии в печени мышей гена секретируемой фосфатазы mSEAP, не содержащего CpG динуклеотидов вектором pMBR2 и коммерческим вектором pCDNA3, а также гена mSEAP дикого типа, содержащего CpG динуклеотиды, вектором pMBR2. * - р<0.01 при сравнении pMBR2-mSEAP0 с каждой из групп pMBR2-mSEAPwt и pCDNA3.1-mSEAP0. ** p<0.1 при сравнении pMBR2-mSEAP0 с любой из групп pMBR2-mSEAPwt и pCDNA3.1-mSEAP0. # - p<0.05 при сравнении групп pMBR2-mSEAPwt и pCDNA3.1-mSEAP0 между собой.
Осуществление изобретения
Пример 1. Создание вектора pMBR2.
Все составные части, необходимые для создания вектора, являются синтетическими (синтез проведен компанией GenScript (США)). На первом этапе были объединены вместе три фрагмента: а) бактериальный остов с рестриктными сайтами NheI и NcoI на концах, состоящий из бактериальной области начала репликации R6K, содержащей 5 CpG динуклеотидов, бактериальный Е7 промотор с 2 CpG динуклеотидами, ген, обеспечивающий устойчивость к антибиотику зеоцину с 4 CpG динуклеотидами, а также SV40 сайт полиаденилирования; б) димер мутированного S/MAR элемента из человеческого гена IFNβ длиной 155 пар нуклеотидов с рестриктными сайтами NheI и XbaI на концах, в котором мы заменили 8 G/C нуклеотидов на А/Т, чтобы снизить энергию, необходимую для расплетания цепей ДНК в этом месте и одновременно элиминировать CpG динуклеотиды; в) последовательность, кодирующую ген hTRAIL, с сайтами рестрикции NheI и NcoI на концах. Встраивание S/MAR элемента уже на первом этапе клонирования было необходимо, т.к. без него плазмида реплицировалась крайне медленно, и дальнейшие манипуляции были невозможны. На втором этапе клонирования последовательность, кодирующую hTRAIL, была заменена на последовательность, кодирующую репортерный ген светлячковую люциферазу, не содержащую CpG динуклеотидов и идентичную последовательности Luc::Sh, из плазмиды pMOD-LucSh (Invivogen).
Следующие этапы представляли собой последовательную вставку еще двух S/MAR димеров в NheI сайт конструкции до образования гексамера, а также вставку человеческого EF-1a промотора и мышиного CMV-энхансера, содержащего 2 CpG-динуклеотида. Полученная плазмида содержала 13 CpG-динуклеотидов в векторе и ни одного во вставке, кодирующей люциферазу. Конструкция получила название pMBR1-Luc0, а соответствующий вектор - pMBR1. Отличительная черта этой конструкции - нахождение гексамера S/MAR элемента внутри транскрипционной единицы, между сайтом полиаденилирования и стоп-кодоном. Согласно некоторым работам (Piechaczek С, Fetzer С, Baiker A, Bode J, Lipps HJ. A vector based on the SV40 origin of replication and chromosomal S/MARs replicates episomally in CHO cells. Nucleic Acids Res. 1999; 27:426-428), такая организация плазмиды должна способствовать ее эписомальному поддержанию в делящихся клетках.
Кроме этой конструкции была создана и другая, в которой S/MAR элемент находился вне транскрипционной единицы, сразу после нее. Для этого SV40poly(A) последовательность была вырезана из pMBR1 вектора путем разрезания по сайтам BspTI(AflII) и PmeI и заменена двухцепочечным адаптером. SV40poly(A) последовательность была амплифицирована с использованием праймеров, подобранных таким образом, чтобы на ее концах образовались рестриктные сайты XbaI и NheI, и вставлена в разрезанный по NheI вектор, приготовленный из конструкции с адаптером. Полученная конструкция получила название pMBR2-Luc0, а соответствующий вектор - pMBR2. Нуклеотидная последовательность плазмидного вектора pMBR2 приведена в перечне последовательностей нуклеотидов под номером SEQ ID NO 1, нуклеотидная последовательность pMBR2-Luc0 приведена под номером SEQ ID NO 2. На Фиг. 1 приведена графическая схема (карта) конструкции pMBR2-Luc0.
Созданный вектор был далее протестирован in vivo и in vitro, путем сравнения уровня и динамики сохранения экспрессии различных целевых генов с помощью вектора pMBR2 и коммерческого вектора pCDNA3.
Пример 2. Сравнение экспрессии светлячковой люциферазы, не содержащей CpG динуклеотидов, в мезенхимальных стволовых клетках (МСК) человека.
МСК человека выращивали в среде DMEM с глюкозой 1 г/л, содержащей 10% фетальную бычью сыворотку, 1% пенициллин-стрептомицин, 0,1% гентамицин и 0,1% амфотерицин Б, все - Gibco, USA) в гипоксических условиях (5% CO2, 5% O2, 37°С). При конфлюэнтности в 70% клетки промывали раствором Версена, затем TrypLE (Gibco), а затем ресуспендировали в полной среде. Клетки центрифугировали (5 минут, 300 g), ресуспендировали в фосфатно-солевом буфере, снова центрифугировали (5 минут, 300 g) и ресуспендировали в среде OptiMEM в концентрации 500 тысяч клеток на 100 мкл среды. Клетки смешивали с плазмидами pCDNA3-Luc0 и pMBR2-Luc0 в соотношении 500 тысяч клеток и 5 мкг плазмиды и помещали в кювету BioRad с зазором между электродами в 1 мм. Затем клетки электропорировали экспоненциальным импульсом в 90 В и продолжительностью 5,5-5,7 мс, и рассевали в лунки 24-луночных планшетов. Через заданные промежутки времени содержимое нескольких лунок лизировали и производили измерение люциферазной активности с помощью набора Luciferase Assay System (Promega, USA) на люминометре 20/20n (Promega, USA) в соответствии с инструкциями производителя.
На Фиг. 2 показаны нормированные уровни экспрессии светлячковой люциферазы, не содержащей CpG динуклеотидов, векторами pMBR2 и pCDNA3 в мезенхимальных стволовых клетках на протяжении трех недель после электропорации. Видно, что уровень экспрессии люциферазы вектором pCDNA3 стремительно падает в первые дни после электропорации, а уровень экспрессии вектором pMBR2 растет на протяжении первой недели, а через три недели после электропорации составляет около 50% от начального значения.
Пример 3. Сравнение экспрессии светлячковой люциферазы дикого типа в МСК.
Элиминация CpG-динуклеотидов из последовательности целевого гена не всегда возможна без потерь в активности или в уровне экспрессии белка. Однако созданный нами вектор pMBR2 может на относительно высоком уровне экспрессировать и содержащий CpG трансген. Для доказательства этого, был проведен эксперимент, аналогичный эксперименту из примера 1 с плазмидами pMBR2-wtLuc и pCDNA3-wtLuc. Его результаты приведены на Фиг. 3. Видно, что, хотя плазмида pMBR2-wtLuc не обеспечивает такого высокого уровня экспрессии трансгена, как pMBR-Luc0, она все же обеспечивает на всем протяжении эксперимента значительно более высокий уровень экспрессии трансгена, чем pCDNA3. В случае вектора pCDNA3 уровень экспрессии трансгена падает практически до фоновых значений после 2 недель эксперимента.
Пример 4. Сравнение экспрессии β-галактозидазы в МСК.
В этом эксперименте сравнивали экспрессию лишенной CpG β-галактозидазы векторами pMBR2 и pCDNA3. После электропорации, аналогичной примерам 1 и 2, клетки на 2-й, 7-й и 14-й дни культивирования фиксировали 4% формальдегидом в течение 5 минут, промывали фосфатно-солевым буфером и затем 16 часов окрашивали при 37°С раствором следующего состава: X-Gal 1 мг/мл, 5 мМ ферроцианида калия, 5 мМ феррицианида калия, 2 мМ MgCl2, 5% диметилформамида в фосфатно-солевом буфере. Клетки фотографировали, полученные изображения анализировали с помощью программы ImageJ, и определяли долю клеток, окрашенных синим цветом. Примеры микроскопического анализа окрашенных клеток приведены на Фиг. 4.Численные данные представлены на Фиг. 5. В течение первой недели после электропорации вектор pMBR2 обеспечивает значительно более высокий уровень экспрессии трансгена, чем pcDNA3. Более того, вектор pMBR2 лучше сохраняет экспрессию, поскольку через 2 недели после введения плазмид в клетки уровень β-галактозидазы падает до фоновых значений для pcDNA3, но остается на ощутимом уровне (10-12% от начального) для pMBR2.
Пример 5. Сравнение экспрессии зеленого флуоресцентного белка (GFP) в МСК.
Электропорация производилась аналогично примерам 1-3. На 2-й, 7-й и 14-й дни после электропорации часть клеток переводили в суспензию в фосфатно-солевом буфере и анализировали на проточном питометре Gallios (Beckman Coulter). На Фиг. 6 отображены данные о доле экспрессирующих eGFP клеток, а на Фиг. 7 - данные об интегральной флуоресценции с учетом интенсивности флуоресценции отдельных клеток. По обоим этим параметрам pMBR2 значительно опережает pCDNA3 на всем протяжении эксперимента. Интегральная флуоресценция с использованием плазмиды pCDNA3+eGFP за две недели эксперимента снижается до фоновых значений, в то время как интегральная флуоресценция с использованием плазмиды pMBR2+eGFP остается детектируемой.
Пример 6. Экспрессия секретируемой щелочной фосфатазы вектором pMBR2 в мышцах задних конечностей мышей.
В экспериментах in vivo использовали два варианта репортерного гена мышиной секретируемой щелочной фосфатазы mSEAP: форму дикого типа mSEAPwt (кДНК клон MGC 60698) и лишенную CpG динуклеотидов форму mSEAP0 (Invivogen). Этот белок секретируется синтезирующими его клетками в кровоток и может быть там детектирован. Три плазмиды pMBR2-mSEAP0, pMBR2-mSEAPwt и pCDNA3-mSEAP0 вводились в задние конечности методом множественных инъекций с последующей электропорацией с параметрами напряженность поля - 600 В/см и продолжительностью импульса - 50 мс. Забор крови у мышей осуществляли на протяжении года, измерение активности mSEAP в сыворотке крови производили с помощью набора Phospha-Light™ SEAP Reporter Gene Assay System (ThermoFisher Scientific) в соответствии с инструкцией производителя на люминометре 20/20n (Turner BioSystems). Начиная с четвертой недели и до самого конца эксперимента уровень экспрессии mSEAP0 вектором pMBR2 был значительно выше, чем вектором pCDNA3. Наличие CpG динуклеотидов в mSEAPwt негативно сказывалось на уровне экспрессии секретируемой щелочной фосфатазы. При этом с 4-ой по 12-ю неделю эксперимента конструкция pMBR2-mSEAPwt, тем не менее, показывала лучшие результаты по экспрессии щелочной фосфатазы в сравнении с pCDNA3-mSEAP0.
Пример 7. Экспрессия секретируемой щелочной фосфатазы вектором pMBR2 в печени мышей.
Аналогично примеру 6, три плазмиды pMBR2-mSEAP0, pMBR2-mSEAPwt и pCDNA3-mSEAP0 вводили в печень. Введение осуществлялось гидродинамически. Для чего плазмидную ДНК в 2 мл физраствора вводили в хвостовую вену мыши в течение 15 секунд. Забор крови и измерение активности репортерного гена проводились аналогично примеру 6. Печень - более проблемный орган с точки зрения долговременной экспрессии плазмиды, чем скелетные мышцы. В большинстве работ в первые недели после введения уровень экспрессии целевых генов падает на несколько порядков. В нашем эксперименте уровень экспрессии щелочной фосфатазы плазмидой pMBR2-mSEAP0 упал на порядок только к концу первого года эксперимента. На протяжении всего времени он оставался значительно выше, чем уровень экспрессии щелочной фосфатазы другими плазмидами. В сравнении с pMBR2, уровень экспрессии mSEAP0 вектором pCDNA3 падал намного быстрее, и уже через 3 недели практически не отличался от нуля. Уровень экспрессии трансгена mSEAPwt вектором pMBR2, хотя и был на значительно более низком уровне, чем для трансгена mSEAP0, тем не менее, в течение года в среднем превышал фоновые значения.
Полученные в приведенных выше примерах результаты показывают, что вектор pMBR2 обеспечивает как более высокие уровни экспрессии, так и более стабильную и длительную экспрессию трансгенов по сравнению с вектором pCDNA3, как в клетках ех vivo, так и в тканях in vivo. Следует отметить при этом, что использование вектора pMBR2 с целевыми генами без CpG динуклеотидов является предпочтительным, так как такие гены показывают значительно более стабильную экспрессию, чем аналогичные гены дикого типа с CpG динуклеотидами. В то же время известно, что удаление CpG динуклеотидов из последовательности целевого гена за счет использования вырожденности генетического кода может приводить к снижению его функции или уровня экспрессии. Таким образом, наиболее оптимальным способом использования pMBR2 для экспрессии целевых генов является следующий: проводится создание одного или нескольких вариантов целевого гена с полным или частичным удалением CpG динуклеотидов, после чего проводится анализ функции и уровня экспрессии продукта этого гена; в случае отсутствия значительных эффектов на функцию или экспрессию, для создания экспрессионных конструктов на основе вектора pMBR2 используется вариант с минимальным количеством CpG динуклеотидов. В случае же наличия значительных негативных эффектов на функцию или экспрессию продукта целевого гена проводится проверка динамики экспрессии различных вариантов целевого гена после введения в МСК человека, если предполагается использование конструкции для модификации клеток в целях клеточной терапии, или в печень мышей, если предполагается использование конструкции для генной терапии, и выбираются те варианты, которые обеспечивают наиболее стабильную экспрессию в течение 3-4 недель.
Рекомбинантный вектор для создания плазмидных генетических конструкций, обладающих повышенной длительностью экспрессии целевых генов, который содержит гексамер модифицированного S/MAR элемента из человеческого гена IFNβ и сниженное до 13 число CpG динуклеотидов, нуклеотидная последовательность которого представлена в перечне последовательностей нуклеотидов под номером SEQ ID NO 1.