Результат интеллектуальной деятельности: СПОСОБ ДИАГНОСТИКИ СВЕТЛОКЛЕТОЧНОЙ ПОЧЕЧНОКЛЕТОЧНОЙ КАРЦИНОМЫ И НАБОР ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицины, в частности онкологии, и молекулярной биологии и может быть использовано для ранней диагностики, светлоклеточной почечноклеточной карциномы (СПК).
Уровень техники
Рак почки широко распространен и опасен тем, что практически не поддается химио- и радиотерапии. В мире ежегодно выявляется в среднем 190000 новых случаев почечноклеточной карциномы (ПК), причем почти у 1/3 больных опухоль служит причиной смерти. Заболевание до 4% случаев имеет наследственный характер (синдром Хиппеля-Линдау) и связано с герминальными мутациями в соответствующих генах, тогда как подавляющее большинство представляют собой спорадические случаи. В настоящее время выделяют несколько типов ПК в зависимости от происхождения раковых клеток: наиболее распространенный - светлоклеточная почечноклеточная карцинома - СПК (70-75% всех опухолей почек). Папиллярная почечноклеточная карцинома находится на втором месте по встречаемости. Остальные гистологические типы встречаются крайне редко - это хромофобная почечноклеточная карцинома, онкоцитарный рак почки и др. Для диагностики рака почки используют неинвазивные методы: ультразвуковую и рентгеновскую компьютерную томографию, магнитно-резонансную томографию. Реже используют пункционную биопсию опухоли почки с последующим гистологическим исследованием. Часто рак почки выявляют на ранних стадиях только благодаря случайным обнаружениям при ультразвуковом обследовании. Около четверти пациентов на момент установления диагноза уже имеют метастазы.
Молекулярные маркеры, специфичные для ПК, в российской клинической практике практически не применяют. Только один опухолевый маркер М2-РК (изомерная форма пируваткиназы) используется для диагностики рака почки. Определение его содержания в крови применяют в качестве дополнительного диагностического теста, а также выявления метастазов и рецидивов некоторых опухолей, включая рак почки.
В литературе предлагают новые маркеры, например увеличение экспрессии гена CD70 на уровне мРНК и/или белка в опухолевых клетках. Методом иммуногистохимии показана высокая экспрессия этого гена в опухолях ПК и ее отсутствие в прилежащих к опухоли нормальных тканях [Diegmann J, Junker K, Gerstmayer В, Bosio A, Hindermann W, Rosenhahn J, von Eggeling F. 2005. Identification of CD70 as a diagnostic biomarker for clear cell renal cell carcinoma by gene expression profiling, real-time RT-PCR and immunohistochemistry. Eur J Cancer. 41(12), 1794-1801].
Развитие ПК - сложный процесс, при котором найдены изменения более чем в 20 генах, расположенных на разных хромосомах [Velickovic М., Delahunt В., Grebe S.K. 1999. Loss of heterozygosity at 3p14.2 in clear cell renal cell carcinoma is an early event and is highly localized to the FHIT gene locus. Cancer Res. 59, 1323-1326; Lam JS, Leppert JT, Figlin RA, Belldegrun AS. 2005. Role of molecular markers in the diagnosis and therapy of renal cell carcinoma. Urology. 66(5 Suppl), 1-9]. В настоящее время накоплен достаточно большой объем данных, касающихся отдельных молекулярно-генетических характеристик различных типов ПК. И хотя спектр генетических изменений в случае каждой конкретной опухоли носит индивидуальный характер, тем не менее, наблюдают определенные закономерности генетических изменений, которые дают основания связывать их с развитием и/или прогрессией той или иной патологии. Известно, что при СПК выявляют частые нарушения на коротком плече хромосомы 3. Наиболее изученным геном в этой области является ген-супрессор VHL, мутации в котором вызывают наследственную форму рака почки - синдром Хиппеля-Линдау. Выявлены также изменения в количестве копий генов VHL и FHIT, FOXP1 [Toma M.I., Grosser М., Herr A., Aust D.E., Meye А., Hoefling С., Fuessel S., Wuttig D., Wirth M.P., Baretton G.B. 2008. Loss of heterozygosity and copy number abnormality in clear cell renal cell carcinoma discovered by high-density affymetrix 10K single nucleotide polymorphism mapping array. Neoplasia. 10(7), 634-642]. При папиллярной карциноме выявлены дупликации генов на хромосомах Y, 7, 17. Практически отсутствуют данные о генах, снижение содержания мРНК которых, используют для ранней диагностики СПК и других типов почечноклеточной карциномы.
Диагностическими признаками злокачественной трансформации клеток могут служить геномные изменения в опухолевых клетках: точечные мутации, микросателлитная нестабильность, аллельные потери, эпигеномные изменения (метилирование промоторных участков генов), а также изменения функциональной активности многих генов на уровне мРНК и белка. В отличие от белковых, молекулярно-генетические маркеры обладают значительно большей чувствительностью. В числе перспективных потенциальных маркерных генов, вовлеченных в канцерогенез почки, рассматривают новые потенциальные гены-супрессоры опухолевого роста (TSG, tumor suppressor genes) на коротком плече хромосомы 3 человека [Zabarovsky ER, Lerman MI, Minna JD. 2002. Tumor suppressor genes on chromosome 3p involved in the pathogenesis of lung and other cancers. Oncogene. 21(45), 6915-6935; Molecular analysis of deletions in human chromosome 3p21 and the role of resident cancer genes in disease. Brief Funct Genomic Proteomic. 6(1), 19-39].
На коротком плече хромосомы 3 (3р21.1) идентифицирован ген ACY1 (другие обозначения aminoacylase 1; ACY-1; N-acyl-L-amino-acid amidohydrolase, ACY1D, acylase, aminoacylase-1), кодирующий белок, который представляет собой гомодимерный цинк-связывающий металлофермент. Еще в 1980 году показано, что ACY1 гидролизует ацетил-метионин и ацетил-глутамат. Этот фермент функционирует в цитозоле и экспрессируется в широком спектре тканей. Аминоацилаза-1 является наиболее распространенной среди представителей класса аминоацилаз - ферментов, вовлеченных в гидролиз N-ацетилированных белков.
Ген демонстрирует эволюционный консерватизм и экспрессируется, главным образом, в мозге, печени и почках, что позволяет предполагать роль кодируемого им фермента в метаболизме аминокислот в этих органах. Однако надо отметить, что обнаруженная фенотипическая вариабельность у пациентов, у которых выявлен дефицит ACY1 путем скрининга новорожденных, не позволяет рассматривать дефицит ACY1 в качестве заболевания. Используя дрожжевой двугибридный скрининг генов мышей, показано, что ACY1 взаимодействует с белком SPHK1 [Maceyka М., Nava V.E., Milstien S., Spiegel S. Aminoacylase 1 is a sphingosine kinase 1-interacting protein. FEBS Lett. 2004. 568(1-3):30-4]. При совместной трансфекции генов ACY1 и SPHK1 в клеточную линию HEK293 два белка, экспрессируемые этими генами, взаимодействовали между собой. Этот факт был доказан благодаря выявлению их ко-иммунопреципитации. Показано, что полноразмерный ACY1 усиливает пролиферативное и анти-апоптотическое воздействие SPHK1. ACY1, по-видимому, также индуцирует перераспределение SPHK1 на плазматической мембране. Эти данные позволяют предполагать, что ACY1 влияет на клеточную локализацию и активность SPHK1, что может иметь важное значение в процессе канцерогенеза.
Аминоацилаза-1 в норме экспрессируется во всех содержащих ядро клетках, то есть не экспрессируется в норме только в эритроцитах. Однако Миллер в 1989 году обнаружил, что этот фермент не определяется в 4- из 29-клеточных линий мелкоклеточного рака легкого [Miller YE, Minna JD, Gazdar AF. Lack of expression of aminoacylase-1 in small cell lung cancer. Evidence for inactivation of genes encoded by chromosome 3p.J Clin Invest., 1989 83(6):2120-4]. Это дало основания предполагать вовлеченность данного фермента в процесс развития этого типа рака. Кроме того, выявлено значительное снижение экспрессии гена ACY1 при раке почки у крыс, а также его ингибиторная активность в клеточных линиях рака почки [Zhong Y, Onuki J, Yamasaki T, Ogawa О, Akatsuka S, Toyokuni S. Genome-wide analysis identifies a tumor suppressor role for aminoacylase 1 in iron-induced rat renal cell carcinoma. Carcinogenesis, 2009 30(1):158-64]. Недавно показана дифференциальная экспрессия гена ACY1 в клетках нейробластомы человека [Long РМ, Stradecki НМ, Minturn JE, Wesley UV, Jaworski DM., Differential aminoacylase expression in neuroblastoma. Int J Cancer., 2011 129(6):1322-30]. Данные об определении снижения содержания мРНК гена ACY1, используемого для диагностики СПК, отсутствуют.
Изобретение, предлагающее способ диагностики различных видов рака человека, в том числе рак легкого, а также лимфом и лейкемий, основано на выявлении цитогенетических изменений и аллельных потерь для 10-ти генов-супрессоров опухолевого роста, расположенных в критичной области LUCA хромосомы 3 [Ji L., Minna J., Roth J., Lerman M. Chromosome 3p21.3 genes are tumor suppressors. 2002. Международные патенты № WO 0204511, № US 2004016006].
Изобретение, относящееся к способу диагностики рака молочной железы, толстой кишки, мочевого пузыря, основано на обнаружении методом ПЦР с радиоактивно меченными праймерами повышения уровня мРНК множественных сплайсированных форм гена поверхностного гликопротеина CD44 в опухолевых тканях, соответствующих метастазах и биоптатах по сравнению с нормальными тканями [Tarin D., Matsumura Y. Diagnostic method. 1994. Международный патент № WO 94/02633].
Изобретение, предлагающее способ диагностики лимфом, основано на сравнении относительного уровня мРНК генов легких λ- и κ- иммуноглобулинов, вовлеченных в развитие лимфом, методом ПЦР-РВ [Stalberg A., Kubista М. Method to measure gene expression ratio of key genes. 2002. международный патент № WO 02/09913].
Изобретение, предлагающее способ диагностики светлоклеточной почечноклеточной карциномы, основанный на определении содержания мРНК гена CHL1 (CALL) [Кудрявцева А.В., Анедченко Е.А., Кондратьева Т.Т., Лерман М.И., Сенченко В.Н.. ″Способ диагностики светлоклеточной почечноклеточной карциномы и набор для его осуществления″. Дата приоритета 20.02.09, Регистрационный номер 2393472, Роспатент].
Данный аналог наиболее близок по технической сущности заявленному изобретению и принят за прототип.
Проведен поиск для гена ACY1 по базам данных с учетом следующих различных обозначений и вариантов написания названия гена: ACY1; N-acyl-L-amino acid aminohydrolase; acylase; aminoacylase 1. Ни для одного из перечисленных вариантов не обнаружено охранных документов и/или патентных заявок, ограничивающих возможность использования снижения содержания мРНК гена ACY1, в том числе с использованием метода ПЦР-РВ, для диагностики СПК.
Для оценки содержания мРНК генов используют различные методы. Современный высокочувствительный метод ПЦР-РВ отличается от традиционных качественных и полуколичественных методов тем, что позволяет быстро и точно определить количество копий ДНК или кДНК в широком диапазоне концентраций [Livak K.J., Flood S.J., Marmaro J., Giusti W., Deets K. 1995. Oligonucleotides with fluorescent dyes at opposite ends provide a quenched probe system useful for detecting PCR product and nucleic acid hybridization. PCR Methods Appl. 4, 357-362]. Метод широко используют в мире как для научных, так и клинических целей, благодаря высокой производительности, обычно проводят 96 или 384 реакций. В отличие от обычной ПЦР, когда количество продуктов определяют на конечной стадии реакции, ПЦР-РВ позволяет следить за накоплением продуктов в экспоненциальной фазе реакции. В этой системе наряду с праймерами используют зонд (пробу), меченный флуоресцентным красителем. Зонд является олигонуклеотидом, который гибридизуется с последовательностью ДНК/кДНК между двумя фланкирующими праймерами. ПЦР-РВ состоит из двух основных этапов: 1) гибридизации исследуемой матрицы с зондом и 2) ПЦР, катализируемой TagДНК-полимеразой, обладающей 5′-экзонуклеазной активностью, расщепляющей зонд, что приводит к появлению и нарастанию флуоресцентного сигнала. На мировом рынке представлены различные модели приборов для ПЦР-РВ, разработанные известными фирмами-изготовителями - Applied Biosystems, Bio-Rad, Invitrogene, Eppendorf и др., а также отечественные приборы ДТ-322 (ДНК-Технология), АНК-32 (Институт Аналитического Приборостроения РАН, http://www.syntol.ru/productank.htm).
В России этот метод все больше применяется для количественной оценки содержания мРНК генов как в фундаментальных исследованиях, так и в клинике. Появление на отечественном рынке недорогих приборов, разработанных российскими фирмами, а также недорогих отечественных наборов реактивов («Синтол», «ДНК-Технологии», «Изоген» и др.), сравнимых по эффективности с зарубежными наборами обеспечит более широкое распространения этого технологичного метода [Манзенюк О.Ю., Малахо С.Г., Пехов В.М., Косорукова И.С., Полтараус А.Б. 2006. Характеристика универсальных отечественных наборов реагентов для ПЦР в реальном времени. Опыт использования в молекулярной онкодиагностике. Молекулярная биология. 40, 349-356]. Методики и протоколы, описанные в данной заявке, предполагают, в основном, использование отечественных наборов и хотя выполнены на приборе ABI Prism 7500 (Applied Biosystems, США), могут быть адаптированы для отечественных приборов. Сочетание недорогих приборов и отечественных наборов реактивов позволит сделать доступным этот технологичный метод для отечественных научных и клинических лабораторий.
Из изложенного ясно, что изменение содержания мРНК онкозначимых генов в опухолях по сравнению с нормальными тканями в качестве молекулярного маркера для диагностики большинства карцином, в том числе, рака почки, пока не нашло широкого практического применения в клиниках. В данной области существует потребность в поиске новых диагностических маркеров, позволяющих достоверно и уже на ранних стадиях диагностировать заболевания, а также в разработке на их основе, чувствительного, надежного, применимого в условиях клинических или поликлинических медицинских учреждений способа диагностики рака почки, а именно СПК - наиболее распространенного типа.
Раскрытие изобретения
Данное изобретение стало возможным в результате проведенного авторами сравнительного анализа содержания мРНК гена ACY1 в образцах СПК на разных клинических стадиях и открытия того факта, что уже на ранних стадиях этого заболевания происходит значительное и частое снижение содержания мРНК гена ACY1.
Настоящее изобретение в своем первом аспекте относится к новому способу для диагностики СПК, который представляет собой измерение содержания мРНК гена ACY1. Сниженное содержание мРНК гена в предположительно пораженных раком тканях почки человека по сравнению с его содержанием в нормальных/здоровых тканях служит диагностическим маркером СПК.
В одном из воплощений рак почки, в отношении которого снижение содержания мРНК гена ACY1 служит в качестве диагностического маркера, является СПК.
В еще одном аспекте настоящее изобретение относится к применению снижения содержания мРНК гена ACY1 в качестве маркера для диагностики СПК.
В еще одном аспекте настоящее изобретение относится к способу диагностики СПК.
Данный способ включает следующие стадии:
а) получение исходной пары образцов тканей от пациента, где один из образцов получен из предположительно пораженных раком тканей, а второй получен из прилегающих гистологически нормальных («условно-нормальных») тканей;
б) выделение и очистка препаратов РНК из исходной пары образцов;
в) синтез одноцепочечной кДНК на матрице РНК с использованием олигонуклеотидных праймеров;
г) проведение количественной реакции амплификации фрагмента гена ACY1 с использованием кДНК, полученной на стадии в), в качестве матрицы и пары геноспецифичных олигонуклеотидных праймеров и зонда;
д) сравнение количества амплифицированного фрагмента ДНК ACY1 в образце, полученном из предположительно пораженных раком тканей почки, с количеством амплифицированного фрагмента ДНК в образце, полученном из нормальных тканей, где указанные количества амплифицированного фрагмента ДНК отражают содержание мРНК гена ACY1, причем его уменьшение служит диагностическим маркером рака почки.
В отдельном предпочтительном воплощении данного изобретения последовательность праймеров и зонда представлена SEQ ID NO: 1, 2 и 3.
Еще одним аспектом настоящего изобретения является набор праймеров и зонда для осуществления полимеразной цепной реакции с целью определения содержания мРНК гена ACY1, имеющий последовательности SEQ ID NO: 1, 2 и 3.
В еще одном воплощении способа настоящего изобретения на стадии д) количественная реакция амплификации фрагмента гена ACY1 представляет собой ПЦР в реальном времени.
В следующем воплощении заявленного способа для рака почки на стадии д) в качестве контрольных генов используют гены GUSB или RPN1, кодирующие бета-глюкуронидазу и рибофорин 1 соответственно.
Перечень фигур.
Далее изобретение будет более подробно раскрыто со ссылкой на отдельные иллюстративные примеры и фигуры, где
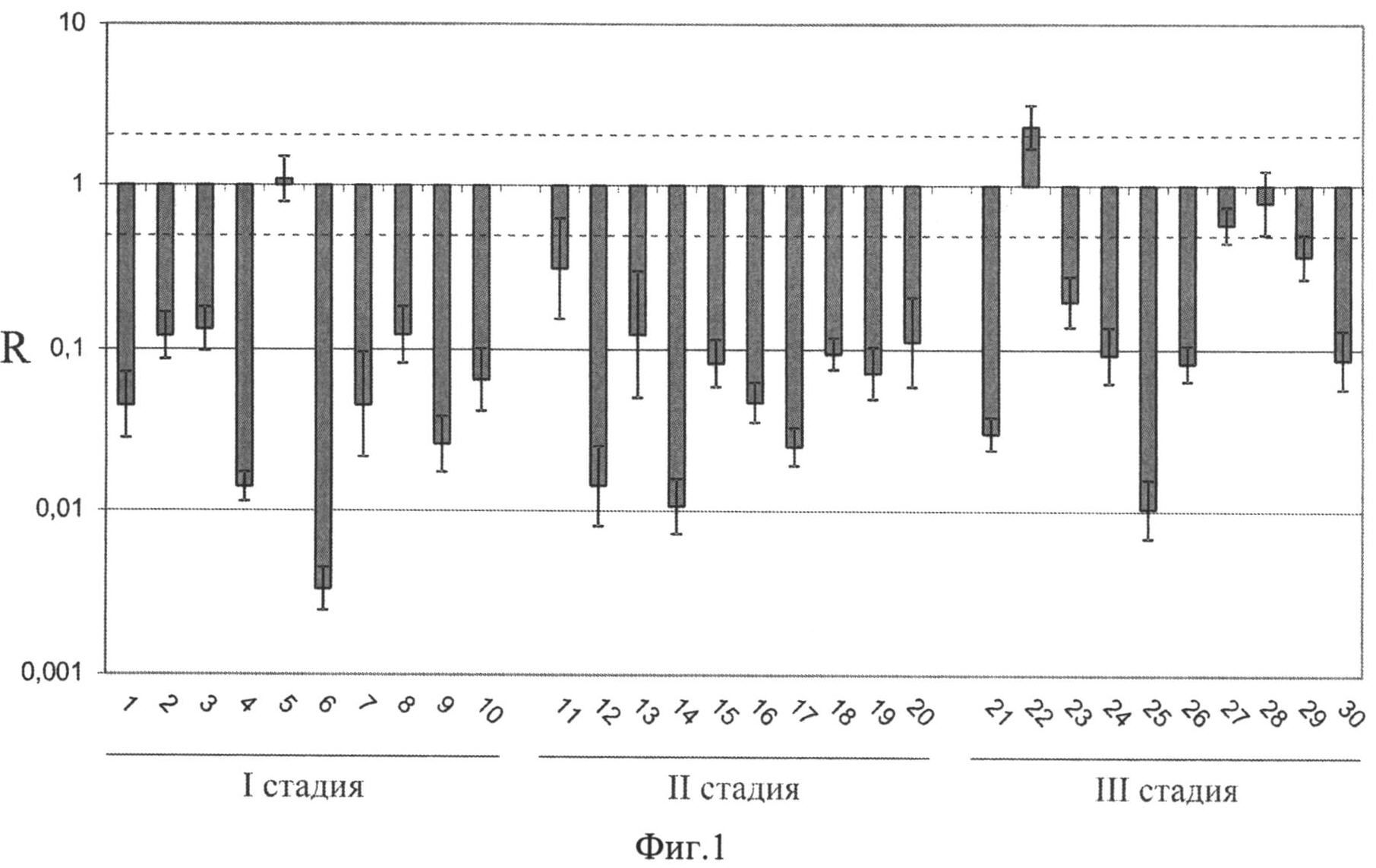
Фиг.1 Относительное содержание мРНК (R) гена ACY1 в образцах СПК. Фигура показывает, что снижение содержания мРНК гена ACY1 обнаружено в большинстве исследованных образцов СПК по сравнению с «условной нормой». Данные нормированы относительно контрольных генов RPN1 и GUSB.
Таблица 1. Клиническая характеристика исследованных образцов СПК.
Таблица 2. Частота (FD) и средний уровень снижения мРНК (LDcp) гена ACY1 при СПК.
Осуществление изобретения
Данное изобретение предлагает способ диагностики СПК на разных стадиях развития злокачественной трансформации, включая начальные, основанный на определении снижения содержания мРНК гена ACY1. Достоверно обнаруживаемое различие содержания мРНК гена ACY1 в нормальных и опухолевых тканях может быть использовано для обнаружения СПК.
Образцы тканей для анализа
В качестве образцов почки для проведения анализа могут быть использованы биоптаты или операционные образцы ткани.
Выделение РНК из образцов тканей
Способы выделения суммарной РНК из образцов тканей млекопитающих хорошо известны специалистам и, как правило, включают следующие стадии: измельчение в жидком азоте образцов опухолевых и нормальных тканей, лизис клеток, выделение РНК и ее очистку, проверку качества РНК электрофорезом в 1%-ном агарозном геле в присутствии красителя бромида этидия или в денатурирующем полиакриламидном геле, а также спектрофотометрическое определение количества РНК. Гомогенизацию кусочков тканей можно проводить вручную, растирая пестиком в керамической ступке, или с помощью механических гомогенизаторов, например, Omni Mixer или Micro-Dismembrator фирмы Sartorius (Германия). Для выделения РНК могут быть использованы различные протоколы, широко известные специалистам в данной области. В классических методах выделения РНК используют сильные хаотропные агенты, такие как гуанидинхлорид и гуанидинизотиоцианат, растворяющие белки, и последовательные экстракции фенолом и хлороформом для денатурации и удаления белков [Sambrook J., Fritsch E.F., Maniatis Т. 1989. Molecular Cloning. A laboratory Manual. 2nd Edition ed. Cold Spring Harbour: CSHL Press]. Широко используют также метод с использованием реагента Trizol [GIBCO/Life Technologies]. Для предотвращения разрушения РНК РНКазами могут быть использованы ингибиторы, такие как ингибитор RNAsin плацентарного или рекомбинантного происхождения или, например, ванадил-рибозидный комплекс - неспецифический ингибитор РНКаз широкого спектра действия.
Быстрое и качественное выделение РНК можно проводить с использованием ряда коммерчески доступных наборов (Клоноген, Санкт-Петербург; RNeasy kits (Qiagen); SV Total RNA Isolation System, Promega (США) и т.д.). Использование различных приборов, например, QuickGene-810 (Life Science, Япония), позволяет исключить работу с агрессивными агентами, ускорить и упростить выделение РНК. Для экстракции РНК в этом приборе используют 80 мкм пористую мембрану, которая в 12,5 раз тоньше обычно используемого в таких приборах стеклянного фильтра (1000 мкм), что позволяет уменьшить деградацию РНК и увеличить ее выход.
Реакция обратной транскрипции: синтез кДНК на матрице РНК, выделенной из образцов тканей
Реакция обратной транскрипции, в результате которой на РНК-матрице синтезируют одноцепочечную цепь ДНК, при необходимости, с достройкой второй цепи, позволяет перейти от нестабильных молекул РНК к более стабильным молекулам ДНК. Дальнейшая ПЦР-амплификация позволяет использовать очень малые количества исходной РНК (на уровне нескольких нанограмм), а следовательно, и количества исследуемых легочных тканей, из которых выделяют РНК.
Реакцию обратной транскрипции можно проводить с использованием коммерчески доступных препаратов обратных транскриптаз, таких как обратная транскриптаза вируса лейкоза мышей Молони (M-MLV), вируса миелобластоза птиц (AMV), PowerScript (точечная мутация M-MLV-RT), С. Therm Polymerase и др., с помощью которых можно получать продукты амплификации длиной до нескольких тысяч и даже несколько десятков тысяч пар нуклеотидов (т.п.н.). Может быть использована термостабильная ДНК-полимераза Thermus thermophilus (Tth), обладающая обратной транскриптазной активностью в присутствии ионов Mn2+.
Для обратной транскрипции могут быть использованы различные праймеры, например:
1) Олиго(dT)n-содержащие праймеры связываются с эндогенным полиА-хвостом на 3′-конце мРНК (число n обычно равно 12-18, но может достигать и большей величины). Эти праймеры наиболее часто используют для получения полноразмерных кДНК. К олиго(dT)-последовательности часто добавляют на 3′-конце нуклеотиды A, C или G, чтобы «заякорить» праймер на границу транскрипта и поли-А тракта;
2) Случайные гексануклеотидные праймеры (статистические затравки) гибридизуются с РНК в многочисленных участках. При обратной транскрипции с этими праймерами получают короткие кДНК. Случайные гексамеры используют для преодоления трудностей, связанных с вторичной структурой РНК, они более эффективны при обратной транскрипции 5′-областей мРНК;
3) Гексамеры или другие короткие олигонуклеотиды (10-12 нуклеотидов) случайного состава могут быть также использованы в комбинации с олигоdT-содержащими праймерами;
4) Специфические олигонуклеотидные праймеры используют для транскрипции участка мРНК, представляющего интерес для исследования. Эти праймеры успешно применяют для диагностических целей.
Анализ содержания мРНК гена можно проводить, используя одноцепочечную или двуцепочечную амплифицированную кДНК. Для синтеза второй цепи и ее амплификации наиболее часто используют специфичные праймеры. В продаже имеются наборы для синтеза кДНК, основанные на применении различных обратных транскриптаз и различных праймеров для затравки. Для получения кДНК разработан также SMART-метод (switching mechanism at the 5′ end of RNA templates of reverse transcriptase), в основе которого лежит свойство обратных транскриптаз добавлять на 3′-конец синтезированной первой цепи кДНК несколько нуклеотидных остатков, преимущественно dC. Эта олиго(dC)-последовательность служит местом отжига олигонуклеотидного адаптера, имеющего комплементарную олиго(dG)-последовательность на 3′-конце. Обратная транскриптаза воспринимает праймер как продолжение РНК-матрицы и продолжает синтез первой цепи [Schmidt W.M., Mueller M.W. 1999. CapSelect: a highly sensitive method for 5′ CAP-dependent enrichment of full-length cDNA in PCR-mediated analysis of mRNAs. Nucleic Acids Res. 27, е31]. Таким образом, первая цепь кДНК оказывается фланкирована с одной стороны последовательностью 3′-праймера с олиго(dT) на 3′-конце, а с другой - последовательностью, комплементарной адаптору. Эти праймеры имеют одинаковые внешние последовательности, отличаясь только на 3′-конце. Затем первую цепь амплифицируют в ПЦР с праймером, соответствующим внешней части 3′-праймера и адаптера. Нуклеотидную последовательность общей части этих праймеров подбирают в зависимости от дальнейших целей, например получения клонотек, применения вычитающей гибридизации и т.д. В результате получают двухцепочечную ДНК, обогащенную полноразмерными последовательностями. За счет использования адаптера с заблокированным 3′-концом достигается существенное снижение фоновой амплификации. При использовании модифицированного SMART-метода за короткое время происходит амплификация исходного материала более, чем в 105 раз, что позволяет работать с очень небольшими количествами РНК (меньше 1 нанограмма), а следовательно, и с небольшим количеством исследуемых тканей [Zhu Y.Y., Machleder Е.М., Chenchik А., Li R., Siebert P.D. 2001. Reverse transcriptase template switching: a SMART approach for full-length cDNA library construction. Biotechniques. 30, 892-897]. Наборы для получения кДНК этим способом выпускают различные фирмы, например, Евроген, Россия (набор MINT), Clontech, США и т.п.
Выбор специфических праймеров и зондов
Выбор специфических праймеров и зондов осуществляют способом, хорошо известным специалистам в данной области, для чего используют имеющиеся программы, многие из которых находятся в свободном доступе в Интернете. Среди таких программ можно упомянуть Oligo (версия 6.42), PrimerSelect из пакета Lasergene (www.dnastar.com), Primer Express (Applied Biosystems, (USA), Primer Designer (ИМБ PAH), FastPCR (http://www.biocenter.helsinki.fi/bi/Programs/fastpcr.htm), PrimerQuest ′(http://scitools.idtdna. com/Primerquest/) и др. С учетом сложности анализируемого генома, длина праймеров может быть выбрана в диапазоне от 18 до 25 п.н. Оптимальный размер ампликона около 150 п.н. Подбор зондов для проведения ПЦР-РВ осуществляется в соответствии со стандартными рекомендациями и требованиями метода.
В предпочтительном воплощении используют праймеры и зонд:
ACY1_F (SEQ ID NO: 1) 5′-CCATCTTGCTCAACTCCCACA-3′;
ACY1_R (SEQ ID NO: 2) 5′-CTCCTCATCAGGCACAAAGGTC-3′;
ACY1_Z (SEQ ID NO: 3) 5′-[FAM] TTGAAGACAGGCACCACATCCGTGT-[RTQ1]-3′, размер ампликона - 224 п.н.
Оценка содержания мРНК гена ACY1 методом ПЦР-РВ
Количественная оценка содержания мРНК достигается с помощью параллельного проведения ПЦР-РВ с тестируемым и контрольным образцами. Выбору подходящего контрольного гена для нормализации количественных данных посвящено много обзоров [Radonic A., Thulke S., Mackay I.M., Landt О., Siegert W., Nitsche A. 2004. Guideline to reference gene selection for quantitative real-time PCR. Biochem Biophys Res Commun. 313, 856-862; Huggett J., Dheda K., Bustin S., Zumla A. 2005. Real-time RT-PCR normalisation; strategies and considerations. Genes and Immunity. 6, 279-284; Wong M.L, Medrano J.F. 2005. Real-time PCR for mRNA quantification. BioTechniques. 39, 1-11]. Чаще всего, в качестве контрольных, выбирают гены «домашнего хозяйства», хотя для этой цели может быть использован любой ген с относительно постоянным уровнем транскрипции в исследуемых образцах. Однако вариабельность содержания мРНК необходимо проверять для каждой исследуемой выборки образцов данного типа тканей. Решение о выборе того или иного гена в качестве контрольного зависит также от степени выбранной/требуемой точности. Согласно предпочтительной форме осуществления количественной оценки содержания мРНК генов необходимо выбрать контрольный ген, имеющий незначительную вариабельность содержания мРНК в опухолевых и нормальных тканях легкого по сравнению с исследуемым геном.
В настоящем изобретении для образцов рака почки и нормальных тканей почки выбраны два контрольных гена - GUSB (глюкуронидаза) и RPN1 (рибофорин 1) ввиду отсутствия в литературе оптимального контрольного гена для этого типа ткани. Вариабельность наиболее часто используемого в качестве контроля гена GAPDH также оценена, однако оказалась более значительной, чем для генов GUSB и RPN1. Можно использовать как оба эти гена совместно, а затем усреднять результат для целевого гена относительно них. Использование двух контрольных генов особенно актуально в тех случаях, когда содержание целевого гена изменяется незначительно. Поскольку содержание мРНК гена ACY1 в опухолях почки изменяется существенно, также допустимо использование одного контрольного гена (RPN1 или GUSB).
Оценка содержания мРНК генов может быть основана на абсолютном и относительном измерении количества копий исследуемых транскриптов - абсолютный метод (метод абсолютной стандартной прямой) и относительный количественный анализ (ΔΔCt-метод). Согласно предпочтительной форме осуществления количественной оценки содержания мРНК генов, в качестве основного метода измерений выбран второй из них, позволяющий проводить двойное сравнение данных для исследуемого и контрольного генов в опухоли и норме. Данный метод не требует выравнивания концентраций опухолевых и нормальных образцов РНК/кДНК, которое необходимо при использовании других методов, например, ОТ-ПЦР.
Выбор образцов сравнения
Согласно предпочтительной форме осуществления количественной оценки содержания мРНК генов важно проверить пригодность образцов сравнения, в данном случае «условных норм».
«Условной нормой» принято считать образец ткани с отсутствующими макро- и микроскопическими признаками опухолевого роста. При «непригодности» образца условно-нормальной ткани (т.е. в случаях, когда при микроскопии обнаруживали опухолевые клетки, или материал был трудно интерпретируемый) использовали усредненные нормы нескольких имеющихся «условных норм». Поскольку не для всех опухолевых образцов имелись пригодные парные «условные нормы», расчеты относительного количества копий транскрипта гена ACY1 (RкДНК) проводили, используя разные образцы сравнения - парные «условные нормы» и/или усредненные «условные нормы» от нескольких больных.
Учет эффективностей реакций
Согласно предпочтительной форме осуществления количественной оценки изменения содержания мРНК генов необходимо учитывать значения эффективности проводимых реакций, которые могут оказать заметное влияние на конечный результат. Для этого разработана программа математической обработки экспериментальных данных ПЦР-РВ с расчетом эффективностей реакций [Программа для ЭВМ «Анализ транскрипции генов». Свидетельство о государственной регистрации №2008612585, 2008, Роспатент]. Программа совместима с файлами экспериментальных данных (Ct, ΔRn и др.) из программного обеспечения RQ, Relative Quantification (Applied Biosystems, ABI Prism SDS Software) и также позволяет проводить статистическую оценку достоверности измеряемых изменений и оценку пригодности выбранного контрольного гена.
Далее настоящее изобретение будет подробно проиллюстрировано со ссылкой на конкретные примеры, представляющие собой наиболее предпочтительные воплощения изобретения. Изобретение не ограничивается описанными воплощениями, напротив, предполагается, что оно включает любые альтернативы, модификации или эквиваленты, допустимые с учетом сущности и объема изобретения.
Пример 1. Образцы тканей
Образцы опухолевых тканей (T), прилегающие к опухолям морфологически нормальные ткани (N) (т.н. «условные нормы») собраны и охарактеризованы в НИИ КО ГУ РОНЦ им. Н.Н. Блохина РАМН. Образцы опухолевых тканей (опухоль, «условная норма») получены непосредственно после удаления опухоли. Каждый образец делили примерно на 3 равные части и хранили в жидком азоте.
Коллекция образцов тканей СПК, подлежащих исследованию, составила 30 образцов, а также 30 образцов «условной нормы». Средний возраст больных с диагнозом СПК, среди которых 14 мужчин, 16 женщин, составляет 53 года (32-76 лет). Среди больных 5 человек имели метастазы в регионарные лимфоузлы.
Пример 2. Выделение РНК из образцов тканей
РНК из нормальных и опухолевых тканей человека выделяли с использованием набора реагентов RNeasy Mini Kit («Qiagen», Германия) согласно протоколу. Основные этапы включали: 1) разрушение ткани, замороженной в жидком азоте, с использованием микродесмембратора («Sartorius» Германия) и гомогенизацию разрушенного образца в лизирующем буфере RLT в расчете 600 мкл на 30 мкг ткани; 2) центрифугирование 3 минуты при 14 000 об/мин (4°C); 2) добавление равного объема водного 70% этилового спирта к супернатанту; 3) нанесение на колонку; 4) промывание колонки после сорбции РЖ один раз буфером RW1 объемом 700 мкл и дважды буфером RPE объемом 500 мкл; 5) элюцию РНК водой, свободной от РНКаз. Концентрацию РНК определяли на спектрофотометре «NanoDrop ND1000», («NanoDrop Technologies Inc.», США) при длине волны 260 нм. Качество выделенной РНК проверяли с помощью электрофореза в 1% агарозе в присутствии бромистого этидия, а также на приборе Bioanalyser Agilent 2100 («Agilent Technologies», США).
Нуклеотидный состав ампликонов подтверждали секвенированием на автоматическом секвенаторе 3730 DNA Analyzer (″Applied Biosystems″). Секвенирование проводили отдельно с 5′ и 3′-концевого праймеров с использованием реактивов DYEnamic ЕТ Terminator Cycler Sequencing Kit (″Amersham″, США). Все праймеры и зонды были специфичны в условиях ПЦР-РВ, ампликоны имели ожидаемые нуклеотидные последовательности и размер.
Пример 3. Реакция обратной транскрипции
Для проведения реакции обратной транскрипции брали по 1 мкг РНК, полученной одним из двух вышеописанных методов с использованием наборов реагентов Trizol RNA Prep («Лаборатория Изоген») или реагентов RNeasy Mini Kit («Qiagen», Германия), предварительно обработанной не содержащей РНКаз ДНКазой I (Invitrogene), 100 нг гексануклеотидных праймеров, 1 мМ dNTP, 1х реакционный буфер («Fermentas», Литва), содержащий 250 мМ Tris-HCl (pH 8.3, 25°C), 250 мМ KCl, 20 мМ MgCl2, 50 мМ DTT, и 200 единиц обратной транскриптазы M-MuLV ((«Fermentas», Литва). Реакцию проводили в объеме 20 мкл при следующем температурном режиме: 25°C - 10 мин, 42°C - 60 мин, 50°C - 10 мин, 70°C - 10 мин.
Пример 4. Подбор условий для количественной оценки содержания мРНК гена ACY1 в опухолях почки.
Использовали специфичные праймеры и зонды для гена ACY1 (SEQ ID NO: 1, 2, 3).
Последовательности выбранных праймеров и зондов для контрольных генов:
Прямой GUSB-F5′-GATGGAAGAAGTGGTGCGTAGG-3′
Обратный GUSB-R5′-TTAGAGTTGCTCACAAAGGTTCACAG-3′
Зонд GUSB-Z-5′-[FAM]-CGTCCCACCTAGAATCTGCTGGCTACTACTT-[RTQ1]-3′.
Размер ампликона - 171 п.н.
Прямой RPN1-F5′-CACCCTCAACAGTGGCAAGAAGG-3′
Обратный RPN1-R5′-TGCATTTCGCTCACTCTGTCG-3′
Зонд RPN1-Z-5′-[FAM]-CCCTCTGTCTTCAGCCTGGACTGCA-[RTQ1]-3′.
Размер ампликона - 125 п.н.
Для проведения ПЦР-РВ подобраны оптимальные концентрации праймеров и зондов исследуемого и контрольного генов. Концентрации праймеров варьировали в диапазоне 100-500 nM при постоянной концентрации зондов, равной 100 nM, затем концентрацию зондов варьировали от 100 до 500 nM при оптимальной концентрации праймеров. Для гена ACY1 оптимальные концентрации праймеров составили 300 нМ и зонда 400 нМ, для гена GUSB - концентрация праймеров - 300 нМ, зонда - 250 нМ, для гена RPN1 - концентрация праймеров - 350 нМ, зонда - 200 нМ.
Пример 5. Количественная оценка содержания мРНК гена ACY1
Для количественных измерений использовали прибор ABI PRISM ® 7500 Sequence Detection System, Applied Biosystems, США.
Протокол определения содержания мРНК гена ACY1 методом ПЦР-РВ
1. Готовили реакционные смеси для генов ACY1, RPN1 и GUSB, осторожно смешав все компоненты реакции, кроме матрицы (кДНК), из расчета 1 реакция объемом 25 мкл для каждого образца + 1 дополнительная реакция по 25 мкл.
Состав реакционной смеси для гена ACY1:
|
Состав реакционной смеси для гена GUSB:
|
Состав реакционной смеси для гена RPN1:
|
2. В 96-луночную планшету добавляли по 20 мкл приготовленных реакционных смесей без матрицы.
3. Вносили по 5 мкл матрицы, плотно закрывали планшету пленкой.
4. Помещали планшету в приборное отделение, задавали названия ячеек, температурный режим для 40 циклов: 95°C - 10 мин - денатурация и активация фермента, 95°C - 15 с - денатурация, 60°C - 1 мин - отжиг зонда и полимеризация, затем запускали прибор.
5. Реакции проводили в режиме относительных количественных измерений (программное обеспечение RQ, Relative Quantification, Applied Biosystems).
6. Нуклеотидный состав ампликонов подтверждали секвенированием на автоматическом секвенаторе 3730 DNA Analyzer (Applied Biosystems, США). Секвенирование проводили отдельно с 5′ и 3′-концевого праймеров с использованием реактивов DYEnamic ЕТ Terminator Cycler Sequencing Kit (″Amersham″, США).
7. Проводили математическую обработку данных ПЦР-РВ и представляли результаты в графическом и/или табличном виде.
Пример 6. Математическая обработка данных ПЦР-РВ
Данные ПЦР-РВ переносили в виде текстового файла в Microsoft Excel и проводили математическую обработку данных. Относительное содержание мРНК RкДНК (далее R), представляющее отношение количества копий исследуемой последовательности кДНК к количеству копий контрольной последовательности в опухоли (Т) по сравнению с нормой (N), связана с основными параметрами ПЦР-РВ пороговым циклом Ct и эффективностью реакции Е общим выражением [Бюллетень 2, http://docs.appliedbiosystems.com/pebiodocs/04303859.pdf]
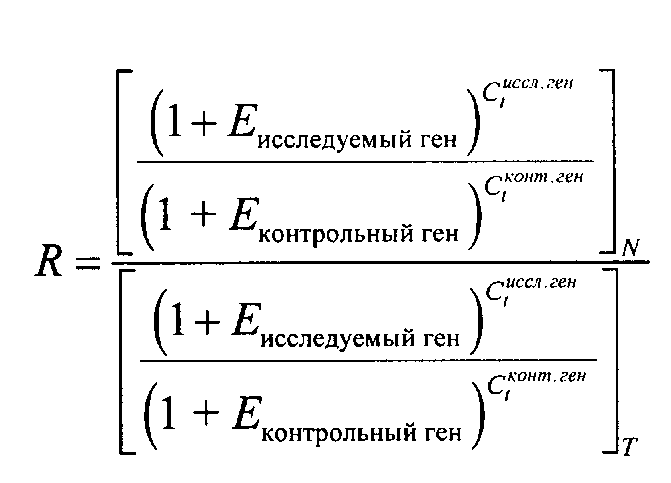
Интервал крайних значений R вычисляли с учетом рассчитанных отклонений Е для значений Ct:
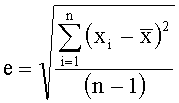 , где
, где 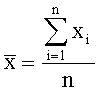 , i=1,2,…, n, где n - число повторов реакции (в нашем случае n=3). При суммировании величин отклонения вычисляют по формуле
, i=1,2,…, n, где n - число повторов реакции (в нашем случае n=3). При суммировании величин отклонения вычисляют по формуле
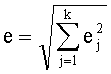 j=1,2,…, k, где k - число суммируемых величин.
j=1,2,…, k, где k - число суммируемых величин.
Сравнивали уровень снижения мРНК генов - LD, равный 1/R и показывающий во сколько раз содержание мРНК каждого гена снижено в опухоли по сравнению с нормой. Эффективность ПЦР-РВ (Е) для генов GUSB, RPN1 и ACY1 рассчитывалась с помощью программы «Анализ Транскрипции Генов». В данной программе эффективность реакции рассчитывается по тангенсу угла наклона прямой, которая аппроксимирует кинетическую кривую на ее линейном участке с помощью метода наименьших квадратов. При дальнейшей обработке данных учитывали полученные значения эффективностей, которые составили в образцах почки для гена ACY1 Еопухоль=Енорма=(87±10)%, для гена GUSB-Еопухоль=Енорма=(80±9)%, для гена RPN1-Еопухоль=Енорма=(86±9)%. Достоверность наблюдаемых изменений оценивали при помощи непараметрических тестов Уилкоксона и Манна-Уитни. Данные считали достоверными при Р<0,05, где Р - показатель статистической значимости данных.
Оценка содержания мРНК гена ACY1 в образцах СПК
В подавляющем большинстве случаев СПК (87%, 26/30, Р<0.01) обнаружено снижение содержания мРНК гена ACY1 от 3-х до 300-т раз по сравнению с «условными» нормальными тканями (фиг.1, табл.2). Значение LDcp для всей выборки составило 12 раз. В одном образце СПК отмечено незначительное (2 раза) повышение содержания мРНК гена ACY1. Значения LDcp и FD в образцах, соответствующих различным клиническим стадиям и для всей выборки близки.
Статистически значимых корреляций между степенью, частотой снижения содержания мРНК гена ACY1 и такими характеристиками, как клиническая стадия, локализация и размер первичной опухоли, возраст и пол пациента, не выявлено. В исследованной выборке всего 5 образцов СПК с метастазами, поэтому разделения образцов на группы с метастазами и без метастазов не проводили.
Представленное выше подробное описание изобретения и его конкретных воплощений, приведенных в примерах со ссылкой на фигуры, предназначено исключительно для более полного уяснения сущности заявленного изобретения, но не для его ограничения. Специалисту будет ясно, что могут быть сделаны различные изменения, которые, тем не менее, будут соответствовать сущности и объему настоящего изобретения, которые определяются прилагаемой формулой изобретения.
|
|