Результат интеллектуальной деятельности: Стандартный образец содержания анти-D антител в препаратах иммуноглобулинов человека
Вид РИД
Изобретение
Изобретение относится к биотехнологии, в частности к стандартным образцам, предназначенным для определения содержания анти-D антител в препаратах иммуноглобулинов человека.
Изобретение может быть использовано для оценки качества препаратов иммуноглобулинов человека. Изобретение позволяет определять содержание анти-D антител в препаратах иммуноглобулинов человека (кроме препаратов иммуноглобулина человека антирезус Rho(D)) для внутривенного и подкожного введения методом гемагглютинации.
А также изобретение может быть использовано для определения содержания анти-D антител в препаратах иммуноглобулинов человека (кроме препаратов иммуноглобулина человека антирезус Rho(D)) для внутривенного и подкожного введения в процессе производства для оценки качества как при выпуске, так и в ходе исследований с целью подтверждения соответствия требованиям нормативной документации.
Препараты иммуноглобулинов человека (ИГЧ) представляют собой лекарственные средства, содержащие концентрированный раствор соответствующей белковой фракции, выделенной из объединенной плазмы крови более чем 1000 доноров. Использование в технологическом процессе не только этапов спиртового фракционирования при температуре ниже 0°С, но и методов хроматографического выделения обуславливает высокую вероятность сохранения максимально полного спектра иммуноглобулинов класса G, в том числе антиэритроцитарных антител. Анти-D антитела в составе иммунологически активной белковой фракции сохраняются при изготовлении препаратов иммуноглобулинов человека.
Введение резус-положительным пациентам больших объемов препаратов ИГЧ может вызвать интраваскулярный гемолиз с резким снижением гемоглобина, гематокрита, ретикулоцитозом,
гипербилирубинемией, гемоглобинурией и сопровождаться другими симптомами, вплоть до почечной и полиорганной недостаточности. Исследования, показали, что эти осложнения могут быть связаны с содержанием в препаратах анти-D антител в количестве, соответствующем агглютинации в разведении от 1:16 до 1:32 [1, 2]. Соответственно, для исключения осложнений иммуноглобулинотерапии в международную практику производства препаратов ИГЧ с 2006 г. введено нормирование содержания анти-D антител, регламентированное содержание которых не должно превышать титр положительного стандарта [3-6]. Положительный стандарт содержит максимально допустимое количество анти-D антител, соответствующее разведению 1:8.
Показателем качества препаратов ИГЧ, характеризующим количественное содержание анти-D антител, является «Анти-D антитела». Содержание анти-D антител может быть выявлено методом гемагглютинации в сравнении с положительным стандартом. Специфичность анализа подтверждается применением отрицательного стандарта, а также D-отрицательных эритроцитов фенотипа 0 гг.Монография Европейской фармакопеи 07/2011:20626 «Test for anti-D antibodies in human immunoglobulin)) описывает метод гемагглютинации «на плоскости», ОФС.1.8.2.0004.15 «Испытание на анти-D антитела в лекарственных препаратах иммуноглобулинов человека», включенная в состав Государственной фармакопеи XIII выпуска, предусматривает метод гемагглютинации с использованием гелевой технологии и «на плоскости» [7, 8]. Эти методы оценки качества не применимы к препаратам иммуноглобулина человека антирезус Rho(D).
Ближайшими к заявляемому стандартному образцу являются: 1) Международный референс-реагент анти-D антител в препаратах иммуноглобулинов для внутривенного введения: положительный и отрицательный контроли для метода гемагглютинации, утвержденный в 2004 г. (WHO Reference Reagent, Anti-D antibodies in intravenous immunoglobulin: Positive control and Negative control for haemagglutination tests, NIBSC code: 02/228 & 02/226). Оба контроля представляют собой лиофилизированный нормальный иммуноглобулин человека для внутривенного введения с содержанием белка 5% (Вигам, Bio Products Laboratory, Elstree, UK), расфасованный по 1,0 мл. Для получения положительного контроля в 5% раствор нормального иммуноглобулина был добавлен восстановленный 2-й Международный стандарт для анти-D иммуноглобулина (NIBSC code: 01/572) до конечного разведения 1:6000, что соответствует расчетной антирезусной активности 0,0475 МЕ/мл (агглютинация в разведении 1:8). Содержание анти-D антител в стандарте определено в ходе совместных исследований 20 лабораторий Европы, Австралии и США в реакции гемагглютинации с использованием эритроцитов фенотипов 0R2R2, 0R1R1, 0rr, обработанных или не обработанных папаином, в реакции гемагглютинации. В положительном контроле определено содержание анти-D антител на уровне, соответствующем разведению 1:8, в отрицательном контроле - не более 1:2 [9].
2) Рабочий стандарт иммуноглобулин человека для внутривенного введения с содержанием анти-D антител и негативный контроль иммуноглобулина человека для внутривенного введения (Working Standard IVIG + anti-D and Negative control IVIG; panel NIBSC code: 04/132 & 04/140; panel NIBSC code: 05/242). Оба контроля представляют собой лиофилизированный нормальный иммуноглобулин человека для внутривенного введения с содержанием белка 5% (предоставлен Bio Products Laboratory, Elstree, UK), расфасованный по 1,0 мл. Для получения положительного контроля в 5% раствор нормального иммуноглобулина был добавлен восстановленный 2-й Международный стандарт для анти-D иммуноглобулина (NIBSC code: 01/572) до конечного разведения 1:6000, что соответствует расчетной антирезусной активности 0,0475 МЕ/мл (агглютинация в разведении 1:8). Содержание анти-D антител в Рабочем стандарте иммуноглобулина определено в ходе совместных исследований Национального института биологических стандартов и контроля (National Institute for Biological Standards and Control (NIBSC)), Европейского директората по качеству лекарственных средств и здравоохранения (European Directorate for the Quality of Medicines (EDQM)) и Центра биологических оценок и исследований Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration/Center for Biologies Evaluation and Research (FDA/CBER)) в реакции гемагглютинации с использованием эритроцитов фенотипов 0R2R2, 0R1R1, 0R1R2, 0rr, обработанных папаином. В положительном контроле стандартного образца определено содержание анти-D антител, соответствующее разведению 1:8, в отрицательном контроле - не более 1:2 [10]. Для применения в качестве стандарта Европейской фармакопеи части образцов стандарта присвоено наименование Immunoglobulin panel for anti-D antibodies test, Biological Reference Preparation, batch 1, Y0000540, а для применения в качестве стандарта FDA - Reference Reagent Anti-D antibodies in intravenous immunoglobulin: Positive control and Negative control for haemagglutination tests, CBER Lot 1A & 1N-a [11].
В настоящее время указанные стандарты используются при определении содержания анти-D антител в препаратах ИГЧ. Перед использованием их растворяют в заданном объеме (1,0 мл) воды для инъекций. В результате получают раствор с содержанием иммуноглобулина примерно 50 мг/мл и содержанием анти-D антител, соответствующим разведению образца 1:8. Отсутствие возможности определить точное содержание белка в восстановленном растворе иммуноглобулина ввиду малого объема в дальнейшем не позволяет получить раствор с точным содержанием белка 25 мг/мл, что в сочетании с большой кратностью разведения образцов для использования в реакции гемагглютинации и отсутствием установленной соответствующими объективными методами их антирезусной активности оказывает влияние на погрешность определения содержания в известных стандартах анти-D антител. Указанное в инструкциях по их применению содержание анти-D антител в количестве 0,0475 МЕ/мл является расчетным и обеспечивается в процессе изготовления только точностью разведения в 6000 раз Международного стандарта антирезусного иммуноглобулина с активностью 285 МЕ/мл в растворе иммуноглобулина человека нормального с содержанием белка 50 мг/мл.
Задачей изобретения является создание стандартного образца содержания анти-D антител с упрощенной пробоподготовкой, в котором с помощью объективного метода установлено количественное содержание анти-D антител (антирезусная активность) в диапазоне максимально разрешенных значений, соответствующих разведению не более 1:8, что повысит точность и улучшит воспроизводимость результатов определения содержания анти-D антител в препаратах ИГЧ.
Поставленная задача решается благодаря тому, что стандартный образец содержания анти-D антител в препаратах иммуноглобулинов человека представляет собой набор из растворов иммуноглобулинов человека, полученных из плазмы крови доноров соответствующих группы крови и резус-фактора и аттестованных по содержанию анти-D антител методом гемагглютинации с использованием гелевой технологии и «на плоскости», по антирезусной активности методом проточной цитофлюориметрии и по содержанию белка колориметрическим методом.
Стандартный образец содержания анти-D антител содержит:
1) положительный компонент с целевым значением содержания анти-D антител, соответствующим разведению не более 1:8 (в реакции гемагглютинации), и установленной методом проточной цитофлюориметрии антирезусной активностью не более 0,7 МЕ/мл, полученный из плазмы крови Rh(-) доноров IV(AB) группы крови;
2) отрицательный компонент с целевым значением содержания анти-D антител, соответствующим разведению менее 1:2 (в реакции гемагглютинации) и не выявляющий антирезусную активность при определении методом проточной цитофлюориметрии, полученный из плазмы крови Rh(+) доноров IV(AB) группы крови.
Заявляемый стандартный образец иммуноглобулина человека, используемый для определения содержания анти-D антител в препаратах ИГЧ, включает две ампулы из прозрачного нейтрального стекла, содержащие раствор иммуноглобулина человека с соответствующим содержанием анти-D антител, белка и антирезусной активностью, имеющие маркировку на внешней поверхности, отражающую информацию о названии стандартного образца, наименовании компонента с указанием содержания анти-D антител, об изготовителе, дате изготовления, сроке годности, условиях хранения; инструкцию по применению; упакован в тару для хранения и транспортирования.
Между совокупностью существенных признаков заявленного стандартного образца и достигаемым техническим результатом существует причинно-следственная связь, а именно, использование двух компонентов с аттестованным содержанием белка позволяет улучшить воспроизводимость и повысить точность результатов определения содержания анти-D антител в препаратах ИГЧ методом гемагглютинации, исключить дополнительные стадии пробоподготовки, оказывающие влияние на погрешность определения содержания в указанных стандартах анти-D антител.
Дополнительно стандартный образец содержания анти-D антител аттестован по содержанию белка. Количество белка определяется технологией получения препаратов иммуноглобулинов человека.
Благодаря решению таких задач, как создание положительного компонента из плазмы крови Rh(-) доноров IV(AB) группы крови, создание отрицательного компонента из плазмы крови крови Rh(+) доноров IV(AB) группы крови, получение аттестованных характеристик методами гемагглютинации, методом проточной цитофлюориметрии и колориметрическим, упрощение пробоподготовки, изобретение позволяет улучшить воспроизводимость и повысить точность результатов определения содержания анти-D антител в препаратах ИГЧ.
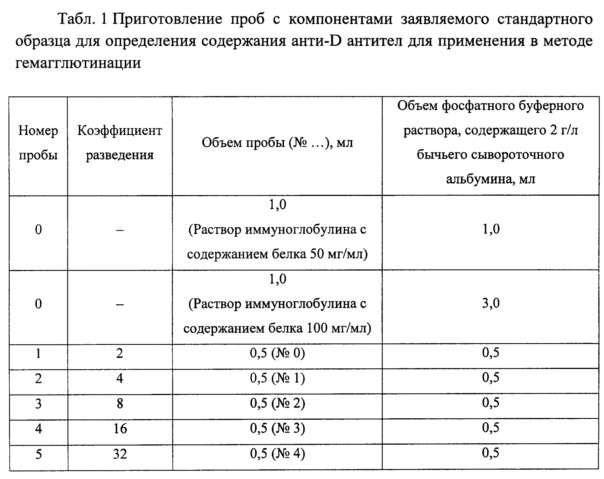
Табл. 1. Приготовление проб с компонентами заявляемого стандартного образца для определения содержания анти-D антител для применения в методе гемагглютинации.
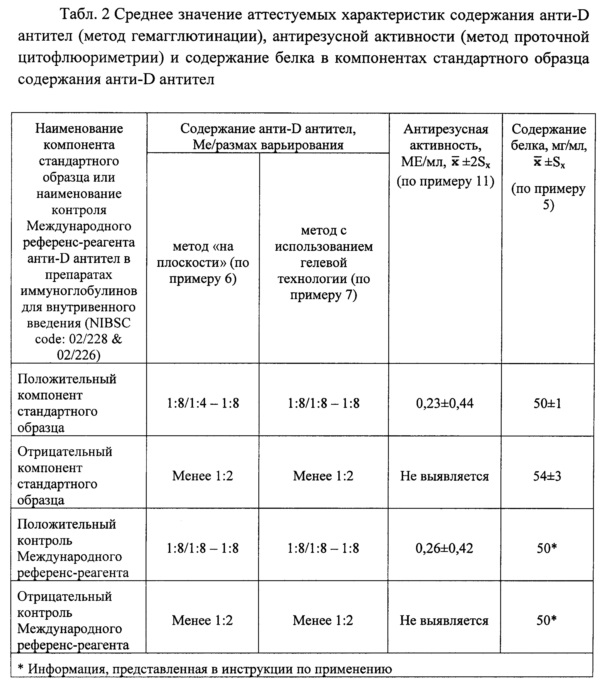
Табл. 2. Среднее значение аттестуемых характеристик содержания анти-D антител (метод гемагглютинации), антирезусной активности (метод проточной цитофлюориметрии) и содержание белка в компонентах стандартного образца содержания анти-D антител.
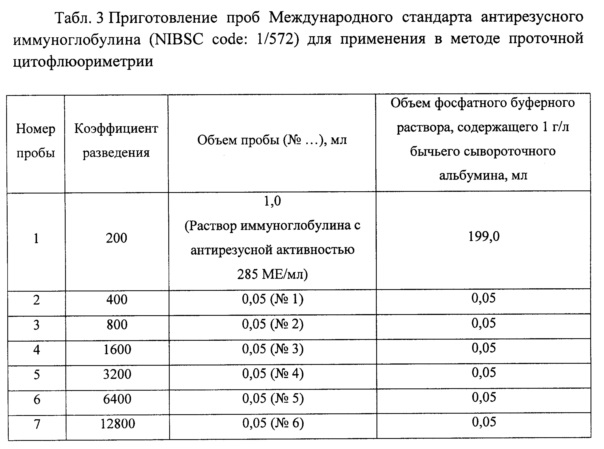
Табл. 3. Приготовление проб Международного стандарта антирезусного иммуноглобулина (NIBSC code: 1/572) для применения в методе проточной цитофлюориметрии.
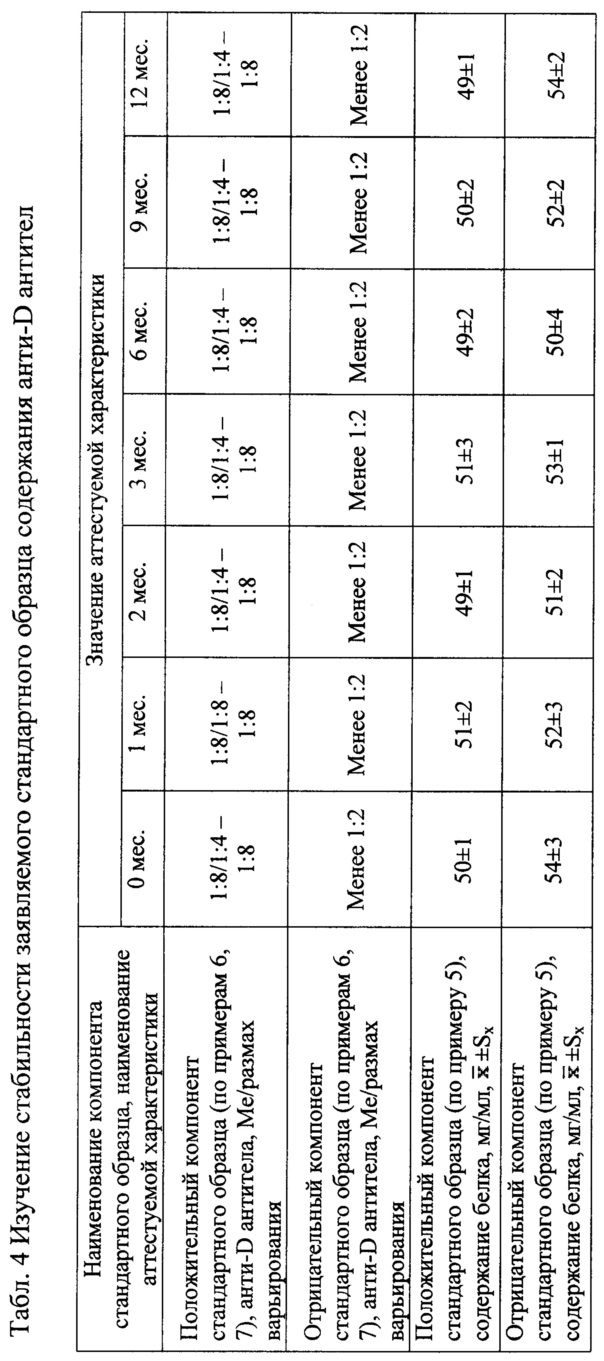
Табл. 4. Изучение стабильности заявляемого стандартного образца содержания анти-D антител.
Возможность осуществления заявляемого изобретения показана следующими примерами:
Пример 1. Приготовление фосфатного буферного раствора.
В мерную колбу вместимостью 1000 мл вносят 8,0 г натрия хлорида, 0,76 г безводного натрия гидрофосфата, 0,2 г калия хлорида, 0,2 калия дигидрофосфата. Добавляют 900 мл воды очищенной. Доводят рН до 7,4±0,1 1 М раствором натрия гироксида или 1 М раствором хлористоводородной кислоты, перемешивают и доводят объем раствора до метки водой очищенной, и вновь перемешивают. Возможно хранение раствора при температуре (5±3)°С в течение 30 сут.
Пример 2. Приготовление фосфатного буферного раствора, содержащего 2 г/л бычьего сывороточного альбумина.
К 1000 мл полученному согласно примеру 1 фосфатному буферному раствору добавляют 2,0 г бычьего сывороточного альбумина, тщательно перемешивают, избегая образования пены. Возможно хранение раствора при температуре (5±3)°С в течение 30 сут.
Пример 3. Подготовка раствора папаина.
Лиофилизат массой 25 мг растворяют в 2,5 мл полученного по примеру 1 фосфатного буферного раствора. Инкубируют при температуре (37±0,5)°С в течение 30 мин. Раствор используют свежеприготовленным. Возможно хранение раствора при температуре (6±2)°С в течение 5 сут или при температуре минус (21±1)°С в течение 6 мес. Раствор после оттаивания повторному замораживанию не подлежит.
Пример 4. Обработка стандартных эритроцитов папаином и подготовка суспензии стандартных эритроцитов.
Эритроциты человека Rh(+), фенотип 0R2R2, 0R1R1 или 0R1R2 (полученные не менее чем от трех доноров, не более 3 сут хранения) центрифугируют 10 мин при 260-470 g при комнатной температуре (20±5)°С, надосадочную жидкость сливают. Полученный осадок ресуспендируют в десятикратном объеме 0,9% раствора натрия хлорида и снова центрифугируют в течение 10 мин при g при комнатной
температуре (20±5)°С. Процедуру повторяют не менее 3 раз до получения прозрачной надосадочной жидкости.
В стеклянную пробирку вносят равные объемы промытых эритроцитов и приготовленного по примеру 3 раствора папаина, инкубируют в течение 15 мин при температуре (37±0,5) С, а затем центрифугируют при 260-470 g в течение 10 мин, после удаления надосадочной жидкости осадок ресуспендируют в десятикратном объеме полученного по примеру 1 буферного раствора и центрифугируют при тех же условиях.
Для приготовления 3% суспензии 1 объем осадка эритроцитов, обработанных папаином, ресуспендируют в 32 объемах полученного по примеру 2 фосфатного буферного раствора, содержащего 2 г/л бычьего сывороточного альбумина.
Эритроциты человека Rh(-), фенотип 0rr, (полученные не менее чем от трех доноров, не более 3 сут хранения) центрифугируют 10 мин при 260-470 g при комнатной температуре (20±5)°С, надосадочную жидкость сливают. Полученный осадок ресуспендируют в десятикратном объеме 0,9% раствора натрия хлорида и снова центрифугируют в течение 10 мин при 260-470 g при комнатной температуре (20±5)°С. Процедуру повторяют не менее 3 раз до получения прозрачной надосадочной жидкости.
В стеклянную пробирку вносят равные объемы промытых эритроцитов и полученного по примеру 3 раствора папаина, инкубируют в течение 15 мин при температуре (37±0,5) С, а затем центрифугируют при 260-470 g в течение 10 мин, после удаления надосадочной жидкости осадок ресуспендируют в десятикратном объеме полученного по примеру 1 буферного раствора и центрифугируют при тех же условиях.
Для приготовления 3% суспензии 1 объем осадка эритроцитов, обработанных папаином, ресуспендируют в 32 объемах полученного по примеру 2 фосфатного буферного раствора, содержащего 2 г/л бычьего сывороточного альбумина.
Для приготовления 0,8% суспензии 1 объем осадка эритроцитов, обработанных папаином, ресуспендируют в 125 объемах полученного по примеру 2 фосфатного буферного раствора, содержащего 2 г/л бычьего сывороточного альбумина.
Пример 5. Определение содержания белка колориметрическим методом с биуретовым реактивом.
Для приготовления раствора компонента заявляемого стандартного образца в мерную колбу вместимостью 50 мл (при содержании белка 100 мг/мл) или вместимостью 25 мл (при содержании белка 50 мг/мл) вносят 1,0 мл компонента заявляемого стандартного образца, доводят объем раствора 0,9% раствором натрия хлорида до метки и перемешивают. Для приготовления раствора стандартного образца в мерную колбу вместимостью 50 мл вносят 1,0 мл стандартного образца содержания белка в иммуноглобулине (ОСО 42-28-340 «Отраслевой стандартный образец содержания белка в иммуноглобулине»), доводят объем раствора 0,9% раствором натрия хлорида до метки и перемешивают. В пробирку вносят 5,0 мл раствора компонента заявляемого стандартного образца, в другую пробирку вносят 5,0 мл раствора стандартного образца содержания белка в иммуноглобулине. Для приготовления раствора сравнения в третью пробирку вносят 5,0 мл 0,9% раствора натрия хлорида. Во все три пробирки добавляют по 5,0 мл биуретового реактива, перемешивают и выдерживают 30 мин при комнатной температуре (20±5)°С. После инкубации измеряют оптическую плотность растворов компонента заявляемого стандартного образца и стандартного образца содержания белка в иммуноглобулине на спектрофотометре в кюветах с толщиной слоя 10 мм при длине волны 540 нм по отношению к раствору сравнения.
Содержание белка (С) в компоненте заявляемого стандартного образца вычисляют по формуле:
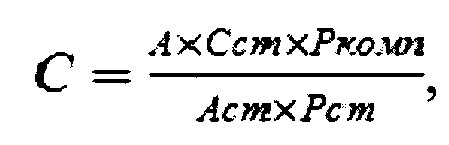 где
где
С - стандартный образец;
А - значение оптической плотности раствора компонента заявляемого стандартного образца;
Ccm - содержание белка в стандартном образце содержания белка в иммуноглобулине, мг/мл;
Ркомп - разведение компонента заявляемого стандартного образца;
Acm - значение оптической плотности раствора стандартного образца содержания белка в иммуноглобулине;
Pcm - разведение стандартного образца содержания белка в иммуноглобулине.
Результаты определения содержания белка в компонентах заявляемого стандартного образца колориметрическим методом с биуретовым реактивом представлены в Табл. 2.
Пример 6. Определение аттестуемой характеристики методом гемагглютинации «на плоскости» с использованием различных типов планшетов.
Приготовление проб с компонентами заявляемого стандартного образца приведено в Табл. 1.
В лунки V-образного 96-луночного планшета вносят равное количество соответствующей пробы с компонентами заявляемого стандартного образца и полученной по примеру 4 3% суспензии обработанных папаином эритроцитов человека Rh(+) (первый ряд) или 3% суспензии обработанных папаином эритроцитов человека Rh(-) (второй ряд). Пробы осторожно встряхивают (на шейкере) в течение 10 с, затем центрифугируют в течение 1 мин при 360-650 g. Планшеты располагают под углом 70° и оценивают визуально агглютинацию через 4-5 мин (но не более чем через 10 мин).
На поверхность плоского планшета для серологических исследований вносят 50 мкл соответствующей пробы с компонентами заявляемого стандартного образца и 25 мкл полученной по примеру 4 3% суспензии обработанных папаином эритроцитов человека Rh(+) (первый ряд) или 3% суспензии обработанных папаином эритроцитов человека Rh(-) (второй ряд). Пробы осторожно встряхивают и оценивают визуально агглютинацию через 10 мин.
Результаты определения содержания анти-D антител методом гемагглютинации («на плоскости») в стандартном образце представлены в Табл. 2.
Из данных, представленных в Табл. 1, следует, что отсутствует необходимость растворения стандартного образца, получение разведения до содержания белка 25 г/л проводится без предварительного подтверждения содержания белка, при этом наблюдается следующий положительный момент - упрощение пробоподготовки.
Из данных, представленных в Табл. 2 следует, что аттестуемое значение содержания анти-D антител в компонентах стандартного образца содержания анти-D антител соответствует заявленным требованиям: положительный компонент содержит анти-D антитела в количестве, соответствующем разведению 1:8 (Me) с размахом варьирования от 1:4 до 1:8; отрицательный компонент содержит анти-D антитела в количестве, соответствующем разведению менее 1:2.
Пример 7. Определение аттестуемой характеристики методом гемагглютинации в геле.
Приготовление проб с компонентами заявляемого стандартного образца приведено в Табл. 1.
Гелевый метод основан на использовании гелевой карты, представляющей собой пластиковый планшет с микропробирками, наполненными гелевыми колонками. Каждая микропробирка состоит из дозирующей/инкубационной камеры и колонки, содержащей полимеризованные микросферы декстрана в буферном растворе низкой ионной силы (LISS).
В дозирующую/инкубационную камеру микропробирки вносят по 50 мкл полученной по примеру 4 0,8% суспензии обработанных папаином эритроцитов человека Rh(+) (первый ряд) или 0,8% суспензии обработанных папаином эритроцитов человека Rh(-) (второй ряд) и по 25,0 мкл соответствующей пробы с компонентами заявляемого стандартного образца. Пробы центрифугируют на специальной центрифуге (для гелевых карт) в стандартных условиях (запрограммированный режим) и оценивают агглютинацию.
Содержание анти-D антител определяют как максимальное разведение пробы компонента заявляемого стандартного образца при котором наблюдают распределение агглютинированных эритроцитов в толще гелевой колонки или в ее верхней части. Неагглютинированные эритроциты оседают на дно микропробирки.
Результаты определения содержания анти-D антител методом гемагглютинации (в геле) в стандартном образце представлены в Табл. 2.
Из данных, представленных в Табл. 1, следует, что отсутствует необходимость растворения стандартного образца, получение разведения до содержания белка 25 г/л проводится без предварительного подтверждения содержания белка, при этом наблюдается следующий положительный момент - упрощение пробоподготовки.
Из данных, представленных в Табл. 2 следует, что аттестуемое значение содержания анти-D антител в компонентах стандартного образца содержания анти-D антител соответствует заявленным требованиям: положительный компонент содержит анти-D антитела в количестве, соответствующем разведению 1:8 (Me) с размахом варьирования от 1:8 до 1:8; отрицательный компонент содержит анти-D антитела в количестве, соответствующем разведению менее 1:2.
Пример 8. Приготовление фосфатного буферного раствора, содержащего 1 г/л бычьего сывороточного альбумина.
К 1000 мл полученному согласно примеру 1 фосфатному буферному раствору добавляют 1,0 г бычьего сывороточного альбумина, тщательно перемешивают, избегая образования пены. Раствор фильтруют через бумажный фильтр.
Пример 9. Подготовка суспензии стандартных эритроцитов для проточной цитофлюориметрии.
Эритроциты человека Rh(+), фенотип 0R1R1 (полученные не менее чем от трех доноров, не более 3 сут хранения) центрифугируют 5 мин при 1070-1080 g при комнатной температуре (20±5)°С (отдельно полученные от каждого донора), надосадочную жидкость сливают. Полученный осадок ресуспендируют в десятикратном объеме полученного по примеру 8 фосфатного буферного раствора, содержащего 1 г/л бычьего сывороточного альбумина, и снова центрифугируют в течение 5 мин при 1070-1080 g при комнатной температуре (20±5)°С. Процедуру повторяют не менее 3 раз до получения прозрачной надосадочной жидкости. Осадок эритроцитов от каждого из трех доноров смешивают в одной пробирке.
Для приготовления суспензии эритроцитов с концентрацией от 1×104 до 5×104 клеток/мкл 1 объем осадка эритроцитов ресуспендируют в 29-30 объемах полученного по примеру 8 фосфатного буферного раствора, содержащего 1 г/л бычьего сывороточного альбумина.
Эритроциты человека Rh(-), фенотип 0rr (полученные не менее чем от трех доноров, не более 3 сут хранения) центрифугируют 5 мин при 1070-1080 g при комнатной температуре (20±5)°С (отдельно полученные от каждого донора), надосадочную жидкость сливают. Полученный осадок ресуспендируют в десятикратном объеме полученного по примеру 8 фосфатного буферного раствора, содержащего 1 г/л бычьего сывороточного альбумина, и снова центрифугируют в течение 5 мин при 1070-1080 g при комнатной температуре (20±5)°С. Процедуру повторяют не менее 3 раз до получения прозрачной надосадочной жидкости. Осадок эритроцитов от каждого из трех доноров смешивают в одной пробирке.
Для приготовления суспензии эритроцитов с концентрацией от 1×104 до 5×104 клеток/мкл 1 объем осадка эритроцитов ресуспендируют в 29-30 объемах полученного по примеру 8 фосфатного буферного раствора, содержащего 1 г/л бычьего сывороточного альбумина.
Пример 10. Подготовка раствора вторичных антител, меченых флуоресцеином.
Восстанавливают содержимое флакона в соответствии с инструкцией по применению. К 1 объему восстановленного раствора вторичных антител, меченых флуоресцеином, добавляют 199 объемов полученного по примеру 8 фосфатного буферного раствора, содержащего 1 г/л бычьего сывороточного альбумина.
Пример 11. Определение аттестуемой характеристики методом проточной цитофлюориметрии.
Восстанавливают содержимое флаконов с Международным стандартом антирезусного иммуноглобулина (NIBSC code: 1/572), Международным референс-реагентом анти-D антител в препаратах иммуноглобулинов для внутривенного введения: положительный и отрицательный контроли (NIBSC code: 02/228 & 02/226) в соответствии с инструкциями по применению. Приготовление проб с Международным стандартом антирезусного иммуноглобулина проводят в зависимости от ожидаемой антирезусной активности. Пример приведен в Табл. 3. Пробы компонентов заявляемого стандартного образца и контролей Международного референс-реагента анти-D антител в препаратах иммуноглобулинов для внутривенного введения (NIBSC code: 02/228 & 02/226) используют без дальнейшей подготовки.
В соответствующие лунки F-образного 96-луночного планшета вносят по 50 мкл полученной по примеру 9 суспензии стандартных эритроцитов человека Rh(-), фенотип 0rr и суспензии стандартных эритроцитов человека Rh(+), фенотип 0R1R1. Добавляют по 50 мкл соответствующей пробы с компонентами заявляемого стандартного образца, соответствующей пробы Международного стандарта антирезусного иммуноглобулина и соответствующей пробы контролей Международного референс-реагента анти-D антител в препаратах иммуноглобулинов для внутривенного введения (NIBSC code: 02/228 & 02/226). Пробы осторожно встряхивают (на шейкере) в течение 15 с, затем инкубируют при температуре (37±2)°С в течение (40±4) мин. По окончании инкубации центрифугируют в течение 3 мин при 50 g. Надосадочную жидкость удаляют, вносят по 200 мкл полученного по примеру 8 фосфатного буферного раствора, содержащего 1 г/л бычьего сывороточного альбумина. Пробы осторожно встряхивают (на шейкере) в течение 15 с и центрифугируют в течение 3 мин при 50 g, надосадочную жидкость удаляют. Процедуру отмывания эритроцитов повторяют еще дважды.
Во все лунки микропланшета добавляют по 50 мкл полученного по примеру 10 раствора вторичных антител, меченых флуоресцеином, и инкубируют при комнатной температуре (20±5)°С в течение (20±2) мин.
По окончании инкубации во все лунки планшета добавляют по 150 мкл полученного по примеру 8 фосфатного буферного раствора, содержащего 1 г/л бычьего сывороточного альбумина, центрифугируют в течение 3 мин при 50 g, надосадочную жидкость удаляют. Во все лунки планшета добавляют по 200 мкл полученного по примеру 8 фосфатного буферного раствора, содержащего 1 г/л бычьего сывороточного альбумина. Пробы осторожно встряхивают (на шейкере) в течение 15 с и центрифугируют в течение 3 мин при 50 g, надосадочную жидкость удаляют. Процедуру отмывания эритроцитов повторяют еще дважды.
Во все лунки планшета добавляют по 50 мкл полученного по примеру 8 фосфатного буферного раствора, содержащего 1 г/л бычьего сывороточного альбумина. Пробы осторожно встряхивают (на шейкере) в течение 15 с и помещают в проточный цитометр. Измеряют флюоресценцию клеток при условии отбора 12 мкл суспензии клеток из каждой лунки и сравнивают значения флюоресценции 10000 клеток с использованием аргонного лазера (от 492 нм до 520 нм).
Результаты определения антирезусной активности компонентов стандартного образца представлены в Табл. 2.
Из данных, представленных в Табл. 2 следует, что антирезусная активность положительного компонента заявляемого стандартного образца содержания анти-D антител не превышает антирезусную активность положительного контроля Международного референс-реагента анти-D антител в препаратах иммуноглобулинов для внутривенного введения (NIBSC code: 02/228), антирезусная активность отрицательного компонента стандартного образца содержания анти-D антител методом проточной цитофлюориметрии не выявляется. При этом наблюдается следующий положительный момент - установленная антирезусная активность компонентов стандартного образца содержания анти-D антител повышает точность результатов определения содержания анти-D антител в препаратах ИГЧ.
Пример 12. Изучение стабильности заявляемого стандартного образца содержания анти-D антител.
Для изучения стабильности образцы полученного стандартного образца содержания анти-D антител хранят при температуре (5±3)°С и определяют контролируемые параметры в момент закладки на хранение, далее каждый месяц в течение первых трех месяцев, далее с интервалом в 3 мес.до 15 мес. Контролируемые параметры: содержание анти-D антител и содержание белка. Результаты изучения стабильности представлены в Табл. 4. Для установления окончательного срока хранения наблюдения продолжаются.
Пример 13. Набор, содержащий стандартный образец содержания анти-D антител.
Набор содержит:
1) положительный компонент (ампула 3,0 мл), представляющий собой раствор иммуноглобулина человека, полученный из плазмы крови Rh(-) доноров IV(AB) группы крови,
2) отрицательный компонент стандартного образца (ампула 3,0 мл), представляющий собой раствор иммуноглобулина человека, полученный из плазмы крови крови Rh(+) доноров IV(AB) группы крови, аттестованные по методикам, изложенным в примерах 5, 6, 7 и 11. Набор упаковывают в пачку картонную и прикладывают инструкцию по применению и паспорт на стандартный образец.
Пример 14. Хранение и транспортирование стандартного образца.
Упакованные наборы стандартного образца хранят при температуре (5±3)°С в защищенном от света месте. Транспортирование осуществляют всеми видами крытого транспорта согласно санитарно-эпидемиологическим правилам СП 3.3.2.3332-16 «Условия транспортирования и хранения иммунобиологических лекарственных препаратов» при температуре (5±3)°С.
Аналогичным образом, с учетом раскрытия изобретения в описании, специалистом в данной области могут быть получены, выполнены другие варианты изобретения, которые охватываются формулой изобретения.
СПИСОК ЛИТЕРАТУРЫ
1. Pisani G., Wirz М., Gentili G. Anti-D testing in intravenous immunoglobulins: shouldn't it be considered? Vox. Sang. 1996; 71 (2): 132.
2. Turner C.E., Thorpe S., Brasher M.D., Thorpe R. Anti-Rh D activity of commercial intravenous immunoglobulin preparations. Vox Sang. 1999; 76 (1): 55-58.
3. 01/2012:0918 «Human normal immunoglobulin for intravenous administration)) European Pharmacopoeia EDQM. 9 Ed. Доступ по подписке [Электронный ресурс]. URL: http://online6.edqm.eu/ep900/ (дата обращения: 12.12.2017).
4. 01/2013:0338 «Human normal immunoglobulin)) European Pharmacopoeia EDQM. 9th Ed. Доступ по подписке [Электронный ресурс]. URL: http://online6.edqm.eu/ep900/ (дата обращения: 12.12.2017).
5. ФС.3.3.2.0007.15 «Иммуноглобулин человека нормальный)) Государственная фармакопея Российской Федерации. XIII издание. Том II [Электронный ресурс]. URL: http://pharmacopoeia.ru/fs-3-3-2-0007-15-immunoglobulin-cheloveka-normalnyj/ (дата обращения: 12.12.2017).
6. ФС.3.3.2.0008.15 «Иммуноглобулин человека нормальный для внутривенного введения» Государственная фармакопея Российской Федерации. XIII издание. Том II [Электронный ресурс]. URL: http://pharmacopoeia.ru/fs-3-3-2-0008-15-immunoglobulin-cheloveka-normalnyj-dlya-vnutrivennogo-vvedeniya/ (дата обращения: 12.12.2017).
7. 07/2011:20626 «Test for anti-D antibodies in human immunoglobulin)) European Pharmacopoeia EDQM. 9th Ed. Доступ по подписке [Электронный ресурс]. URL: http://online6.edqm.eu/ep900/ (дата обращения: 12.12.2017).
8. ОФС.1.8.2.0004.15 «Испытание на анти-D антитела в лекарственных препаратах иммуноглобулинов человека» Государственная фармакопея Российской Федерации. XIII издание. Том III [Электронный ресурс]. URL: http://pharmacopoeia.ru/ofs-1-8-2-0004-15-ispytanie-na-anti-d-antitela-v-lekarstvennyh-preparatah-immunoglobulinah-cheloveka/ (дата обращения: 12.12.2017).
9. Лист-вкладыш к Международному референс-реагенту анти-D антител в препаратах иммуноглобулинов для внутривенного введения: положительный и отрицательный контроли для метода гемагглютинации, NIBSC code: 02/228 и 02/226 [Электронный ресурс]. URL: http://www.nibsc.org/documents/ifu/02-228.pdf (дата обращения: 12.12.2017).
10. Лист-вкладыш к Рабочему стандарту иммуноглобулин человека для внутривенного введения с содержанием анти-D антител и негативный контроль иммуноглобулина человека для внутривенного введения, NIBSC code: 04/132 и 04/140 [Электронный ресурс]. URL: http://www.nibsc.org/documents/ifu/04-132.pdf (дата обращения: 12.12.2017).
11. Thorpe S.J., Fox В., Heath A., Behr-Gross М-Е., Virata M.L., Yu M.W. International collaborative study to establish immunoglobulin (anti-D test) BRP Batch 1. Pharmeuropa Bio. 2006; 2006 (1): 49-55.