Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ МАННОЗЫ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В данном изобретении испрашивается приоритет в соответствии со статьей 35 Свода законов США, §119, согласно предварительной заявке на патент США № 61/777,398, поданной 12 марта 2013; полное содержание которой включено сюда в качестве ссылки.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Воспалительное заболевание кишечника (ВЗК) представляет собой комплекс хронического воспалительного расстройства, в котором две наиболее распространенные формы включают язвенный колит (ЯК) и болезнь Крона (БК). ВЗК является мультифакториальным заболеванием, которое возникает при сочетании предрасполагающих генетических факторов, триггерных факторов окружающей среды, дисбактериоза желудочно-кишечной микробиоты и неправильной воспалительной реакции (Man et al., 2011, Nat Rev Gastroenterol Hepatol, Mar, 8(3):152-68).
Некоторые исследования фекальных и связанных со слизистой оболочкой бактериальных сообществ показали, что микробиота пациентов, страдающих болезнью Крона (БК) отличается от микробиоты здоровых контрольных людей, а также пациентов, страдающих язвенным колитом (ЯК). Хотя описанные изменения не всегда согласовались, количество Escherichia coli обычно повышалось, а Firmicutes имелись в недостаточном количестве у пациентов с БК (Peterson et al., 2008, Cell Host Microbe, 3: 17-27; Frank et al., 2007, Proc. Natl. Acad. Sci., 104:13780-13785). Если эти изменения были причинными факторами или последствиями воспаления, они остаются спорными. В настоящее время несколько патогенов были предложены в качестве причинных агентов. В частности, было описано, что адгезивно-инвазивная E. coli (AIEC) преобладает у пациентов с БК по сравнению с контролем в нескольких странах (Соединенное Королевство, Франция и США) (Darfeuille-Michaud et al., 2004, Gastroenterology, 127:412-421; Martinez-Medina et al., 2009, Inflamm Bowel Dis., 15:872-882). Штаммы AIEC были выделены из подвздошных очагов поражения у ~35% пациентов с БК по сравнению со здоровыми людьми. Одной из характеристик AIEC является их способность прилипать и проникать в клетки эпителия. Из различных моделей известно, что связывание адгезинов, экспрессированных на поверхности бактериальной клетки, с определенными гликозилированными рецепторами на поверхности ткани хозяина считается начальной и критической стадией в патогенезе, но открывают новый путь для терапии, такой как блокирование взаимодействия между фимбриями 1 типа и CEACAM6, известным рецептором хозяина для FimH (Barnich et al., 2007, J. Clin. Invest., 117:1566-1574; Carvalho et al., 2009, JEM, vol. 206, no. 10, 2179-2189). Поэтому ингибирование и последующая внутриклеточная репликация AIEC в клетках эпителия могут предотвратить возникновение подслизистой инфекции, приводящей к воспалению слизистой оболочки и разрушению эпителиального барьера.
Также недавно было показано, что антагонисты FimH являются потенциально эффективными при лечении инфекций мочевыводящих путей (J. Med. Chem. 2010, 53, 8627-8641).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данном изобретении представлены соединения, применяемые для лечения или профилактики бактериальных инфекций, таких как инфекция мочевыводящих путей (ИМП) и воспалительные заболевания кишечника (ВЗК).
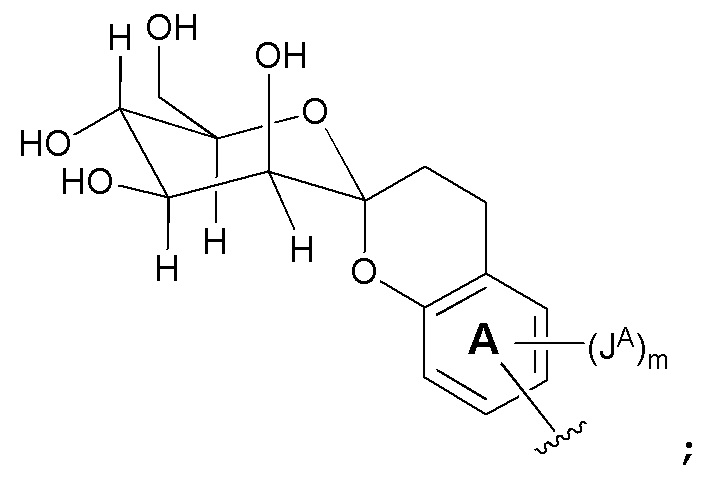
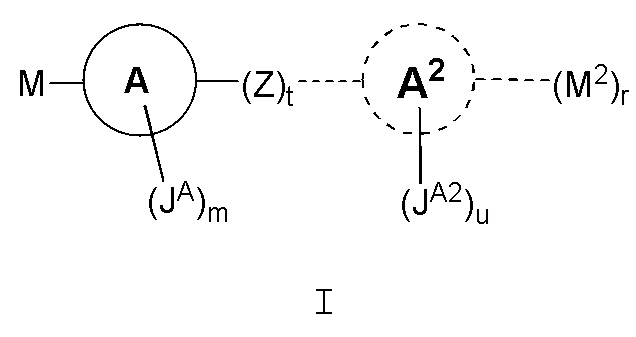
Соединения в соответствии с данным изобретением представлены следующей структурой формулы Ia или его фармацевтически приемлемой солью:

где M, M2, кольцо A, кольцо A2, Z, JA, JB, m, r, t и u такие, как описаны здесь.
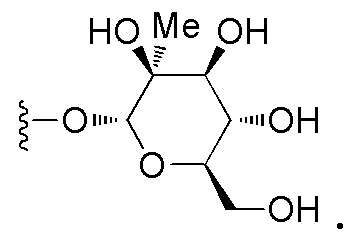
Соединения в соответствии с данным изобретением имеют модифицированные маннозные группы, которые обладают неожиданно повышенной стабильностью по сравнению с соединениями с не модифицированным маннозными группами.
В данном изобретении также представлены способы получения описанных здесь соединений. Далее, в данном изобретении представлена композиция, содержащая описанное здесь соединение и фармацевтически приемлемый носитель, адъювант или наполнитель. В данном изобретении также представлены способы лечения или профилактики бактериальной инфекции у пациента, включающие введение пациенту эффективного количества соединения или композиции в соответствии с данным изобретением.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение относится к соединениям, применяемым для лечения или профилактики бактериальных инфекций, таких как инфекция мочевыводящих путей (ИМП) и воспалительные заболевания кишечника (ВЗК).
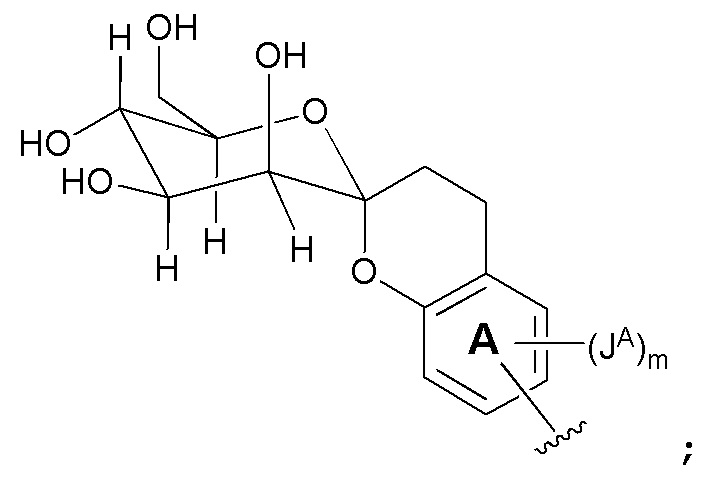
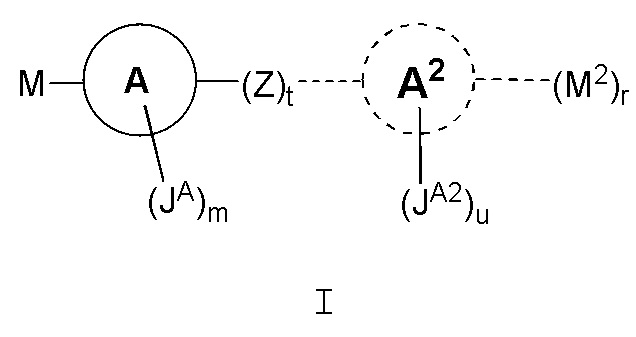
В одном варианте, соединения в соответствии с данным изобретением представлены следующей структурой формулы I:

или его фармацевтически приемлемой солью, где
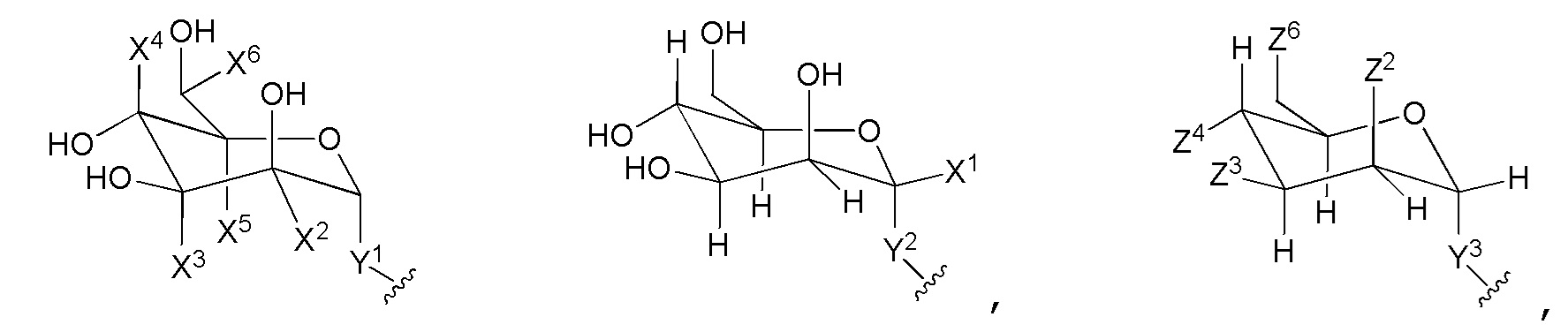
каждый M и M2 независимо является

или M вместе с кольцом A образует спиро-конденсированное трициклическое кольцо, как показано ниже:
 ;
;
или M2 вместе с кольцом A2 образует спиро-конденсированное трициклическое кольцо, как показано ниже:

где:
Y1 является -O-, -O(C1-C4 алифатической)- группой, -O(галогенC1-C4 алифатической)- группой, -S-, -S(C1-C4 алифатической)- группой, -S(O)p-, -S(O)p(C1-C4 алифатической)- группой или -(C1-C6)алифатической группой;
Y2 является -O(C1-C4 алифатической)- группой, -S(C1-C4 алифатической)- группой, -SO2(C1-C4 алифатической)- группой или -(C1-C6) алифатической группой;
Y3 является -O-, -O(C1-C4 алифатической)- группой, -O(галогенC1-C4 алифатической)- группой, -S-, -S(C1-C4 алифатической)- группой, -S(O)p-, -S(O)p(C1-C4 алифатической)- группой или -(C1-C6)алифатической группой;
каждый Z2, Z3, Z4 и Z6 независимо является OH или F; при условии, что, по крайней мере, один из Z2, Z3, Z4 и Z6 является F;
X1 является -U1-V1; X1 необязательно замещен 1-4 галогенами;
U1 является -(CH2)q- или -C(O)-;
V1 является C1-C10 алифатической группой, где вплоть до четырех метиленовых единиц могут быть необязательно заменены на -O-, -NR2-, -S-, -C(O)-, -S(O)-, -S(O)2- или P(O);
X2 является H, C1-C10 алифатической группой, -U2-V2 или -U2-V2-Q;
U2 является -(CH2)q- или -C(O)-;
V2 является C1-C10 алифатической группой, где вплоть до четырех метиленовых единиц могут быть необязательно заменены на -O-, -NR2-, -S-, -C(O)-, -S(O)-, -S(O)2- или P(O);
Q является 3-8-членным насыщенным, частично ненасыщенным или ароматическим кольцом, имеющим 0-4 гетероатома, выбранных из кислорода, азота или серы;
где X2 необязательно замещен 1-4 галогенами, CN, NO2 или C1-C10алифатической группой, где вплоть до трех метиленовых единиц C1-C10алифатической группы могут быть необязательно заменены на -NR-, -O-, -S-, -C(O)- или -S(O)- или -S(O)2-;
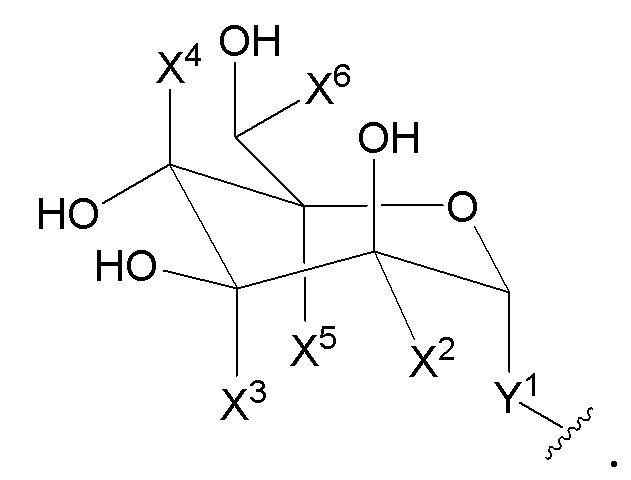
каждый X3, X4, X5 и X6 независимо является H или C1-3алкилом;
при условии, что только один из X2, X3, X4, X5 и X6 не является H;
Кольцо A является C3-C10 циклоалкилом, 3-12-членным гетероциклилом, C6-10 арилом или 5-14-членным гетероарилом; где гетероциклил или гетероарил независимо содержит 1-6 гетероатомов, выбранных из кислорода, азота или серы;
Кольцо A2 необязательно отсутствует, является C3-C10 циклоалкилом, 3-12-членным гетероциклилом, C6-10 арилом или 5-14-членным гетероарилом;
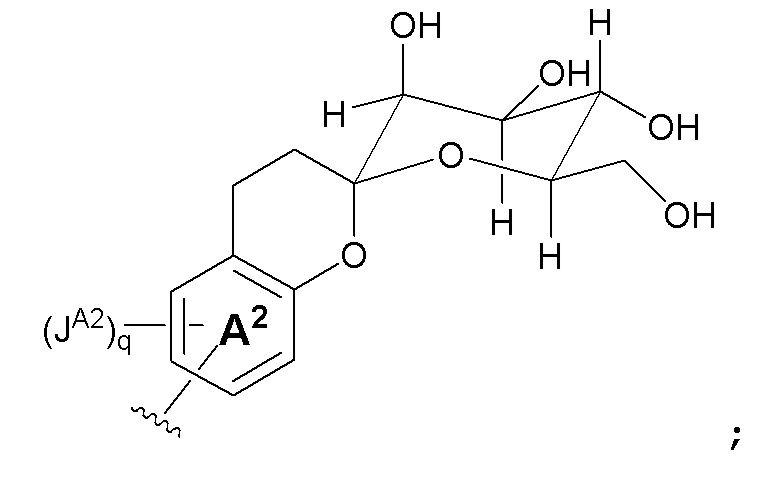
Z является -CH=CH-,  или кольцом B;
или кольцом B;
Кольцо B является C3-C10 циклоалкилом, 3-12-членным гетероциклилом, C6-10 арилом или 5-14-членным гетероарилом; где указанный гетероциклил или гетероциклил независимо содержит 1-6 гетероатомов, выбранных из кислорода, азота или серы;
каждый JA, JA2 и JB независимо является галогеном, CN, NO2, оксо, C3-8 циклоалкилом, 3-8-членным гетероциклилом, C6-10 арилом, 5-10-членным гетероарилом, (C6-10 арил)-(C1-C6алкилом)-, (5-10-членным гетероарилом)-(C1-C6алкилом)-, (C3-8 циклоалкил)-(C1-C6алкилом)-, (3-8-членный гетероциклил)-(C1-C6алкилом)- или C1-C12 алифатической группой; где вплоть до четырех метиленовых единиц C1-C12 алифатической группы или вплоть до трех метиленовых единиц C1-C6алкила могут быть необязательно заменены на -NR, -O, -S-, -C(O)-, -S(O)-, -S(O)2- или P(O); каждый JA, JA2 и JB независимо является и необязательно замещен 1-5 галогенами, CN, NO2 или C1-C10алифатической группой, где вплоть до трех метиленовых единиц C1-C10алифатической группы могут быть необязательно заменены на -NR-, -O-, -S-, -C(O)- или -S(O)- или -S(O)2-;
R и R2 каждый независимо является H, C1-C6 алифатической группой или C3-6циклоалкилом;
каждый m, n и u независимо является 0, 1, 2, 3 или 4;
каждый t и r независимо является 0 или 1; и
каждый p и q независимо является 1 или 2.
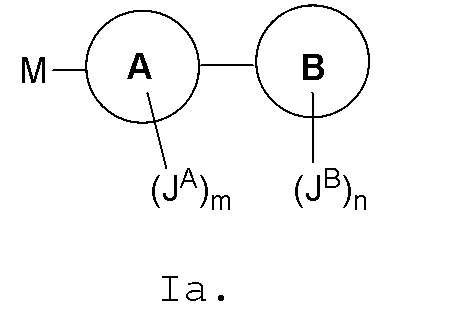
В одном варианте, соединения в соответствии с данным изобретением представлены следующей структурой формулы Ia или его фармацевтически приемлемой солью:

где
M является

или M и один из JA, вместе с кольцом A, образует спиро-конденсированное трициклическое кольцо, необязательно связанное с кольцом B как показано в формуле D:

где:
Y1 является -O-, -O(C1-C4алкилом)-, -S-, -S(C1-C4алкилом)-, -S(O)p-, -S(O)p(C1-C4алкилом)- или -(C1-C6)алкилом;
Y2 является -O(C1-C4алкилом)-, -S(C1-C4алкилом)-, -SO2(C1-C4алкилом)- или -(C1-C6)алкилом;
Y3 является -O-, -O(C1-C4алкилом)-, -S-, -S(C1-C4алкилом)-, -S(O)p-, -S(O)p(C1-C4алкилом)- или -(C1-C6)алкилом;
где каждая из алкильных групп в Y1, Y2 и Y3 необязательно и независимо замещена 1-4 галогенами;
каждый Z2, Z3, Z4 и Z6 независимо является OH или F; при условии, что, по крайней мере, один из Z2, Z3, Z4 и Z6 является F;
каждый X3, X4 и X6 является H или C1-3алкилом;
X1 является -U1-V1; X1 необязательно замещен 1-4 галогенами;
U1 является -(CH2)q- или -C(O)-;
V1 является C1-C10 алифатической группой, где вплоть до четырех метиленовых единиц могут быть необязательно заменены на -O-, -NR2-, -S-, -C(O)-, -S(O)-, -S(O)2- или P(O);
X2 является H или -U2-V2; X2 необязательно замещен 1-4 галогенами;
U2 является -(CH2)q- или -C(O)-;
V2 является C1-C10 алифатической группой, где вплоть до четырех метиленовых единиц могут быть необязательно заменены на -O-, -NR2-, -S-, -C(O)-, -S(O)-, -S(O)2- или P(O);
X5 является H или C1-3алкилом;
при условии, что, по крайней мере, один из X2, X3, X4, X5 и X6 не является H; и если X2 не является H, то X3, X4 и X6 все являются H;
Кольцо A является C3-C8 циклоалкилом, 3-8-членным гетероциклилом, C6-10 арилом или 5-10-членным гетероарилом; кольцо A необязательно связано с кольцом B;
Кольцо B отсутствует или является C3-C8 циклоалкилом, 3-8-членным гетероциклилом, C6-10 арилом, (C6-10 арил)-(C1-C6алкилом)- или 5-10-членным гетероарилом;
каждый JA и JB независимо является галогеном, CN, NO2, C3-8 циклоалкилом, 3-8-членным гетероциклилом, C6-10 арилом, 5-10-членным гетероарилом, (C6-10 арил)-(C1-C6алкилом)-, (5-10-членный гетероарил)-(C1-C6алкилом)- или C1-C12 алифатической группой, где вплоть до четырех метиленовых единиц C1-C12 алифатической группы могут быть необязательно заменены на -NR, -O, -S-, -C(O)-, -S(O)-, -SO2- или P(O); каждый JA и JB независимо является и необязательно замещен 1-5 галогенами, CN или NO2;
R и R2 каждый независимо является H, C1-C6 алифатической группой или C3-6циклоалкилом;
R1 является H или C1-3алкилом;
каждый m, n и q независимо является 0, 1, 2, 3 или 4; и
каждый p и q независимо является 1 или 2.
Должно быть понятно, что если кольцо или связь представлены пунктирной линией, это означает, что кольцо или связь необязательно присутствует. Также должно быть понятно, что кольца, описанные как C3-C10 циклоалкил, 3-12-членный гетероциклил, C6-10 арил или 5-14-членный гетероарил, включают моноциклические, бициклические и трициклические кольца. Например, C3-C10 циклоалкил включает насыщенные или частично ненасыщенные моноциклические C3-8циклоалкильные и насыщенные или частично ненасыщенные C8-12 циклоалкильные бициклические кольца. 3-12-членный гетероциклил включает моноциклические насыщенные или частично ненасыщенные 3-8-членные гетероциклильные кольца, содержащие 1-4 гетероатома, выбранных из кислорода, азота или серы; бициклические насыщенные или частично ненасыщенные 8-12-членные гетероциклильные кольца, содержащие 1-6 гетероатомов, выбранных из кислорода, азота или серы; и трициклические насыщенные или частично ненасыщенные 10-14-членные гетероциклильные кольца, содержащие 1-6 гетероатомов, выбранных из кислорода, азота или серы. C6-10 арил включает фенил и нафтил. 5-14-членный гетероарил включает моноциклический 5-6-членный гетероарил, содержащий 1-4 гетероатома, выбранных из кислорода, азота или серы; бициклический 8-10-членный гетероарил, содержащий 1-6 гетероатомов, выбранных из кислорода, азота или серы; и трициклический 10-14-членный гетероарил, содержащий 1-6 гетероатомов, выбранных из кислорода, азота или серы. Мультициклическим кольцом считается арил или гетероарил, если, по крайней мере, одно кольцо является ароматическим.
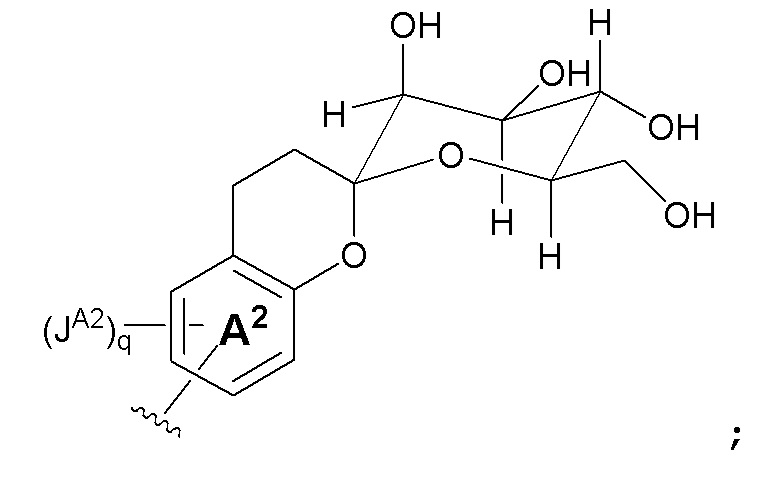
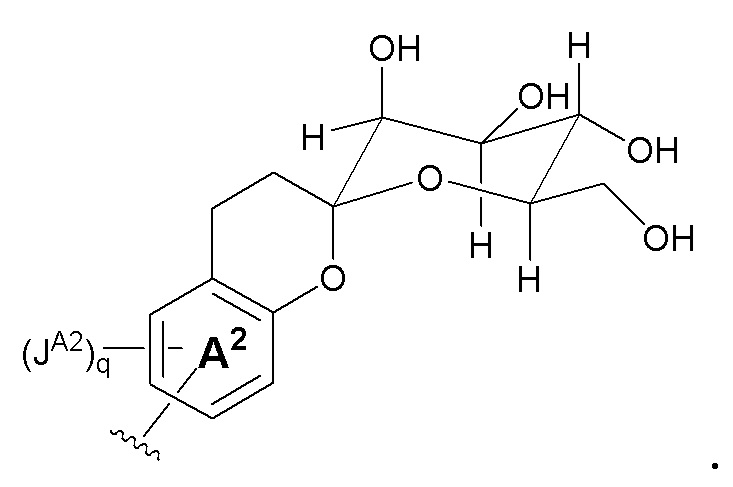
В некоторых вариантах, кольцо A2 отсутствует; r и q являются 0; t является 1; и Z является кольцом B, как показано на формуле Ia:

В некоторых вариантах, соединение не является одним из следующих:

В некоторых вариантах, кольцом A является C6-10 арил или 5-10-членный гетероарил. В некоторых вариантах, кольцом A является фенил или нафтил. В некоторых вариантах, кольцом A является фенил. В некоторых вариантах, кольцо A связано с кольцом B; и кольцом B является C6-10 арил или 5-10-членный гетероарил. В некоторых вариантах, кольцом B является фенил.
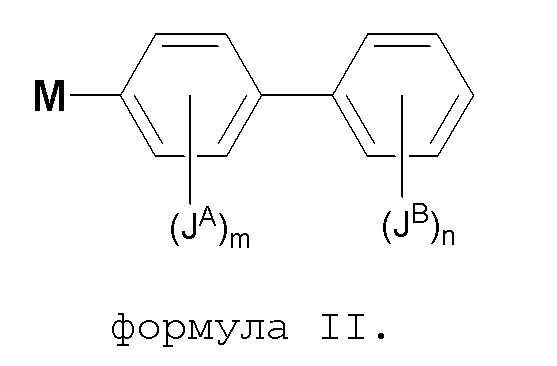
В некоторых вариантах, кольцо A связано с кольцом B, как показано в формуле II:

где кольцо M, JA, JB, m и n такие, как определены здесь.
В некоторых вариантах, JA является галогеном, галогенC1-4алифатической группой, C1-4алифатической группой, -O(C1-4алифатической) группой и JB является NO2, C(O)N(R)2, C(O)OR или CONH-(CH2)2-O-(CH2)2-O-(CH2)2-NH2.
В некоторых вариантах, Y1, Y2 и Y3 являются -O-. В некоторых вариантах, Y1, Y2 или Y3 являются C1-6алифатической группой, где алифатические группы в Y1, Y2 и Y3 необязательно и независимо замещены 1-4 галогенами. В некоторых вариантах,
В других вариантах, M является  В других вариантах, Y2 является O. В некоторых вариантах, X1 является C1-3алкилом. В определенных вариантах, X1 является метилом.
В других вариантах, Y2 является O. В некоторых вариантах, X1 является C1-3алкилом. В определенных вариантах, X1 является метилом.
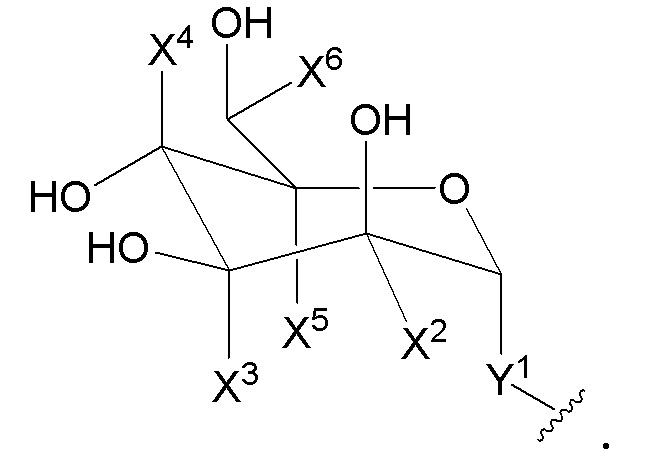
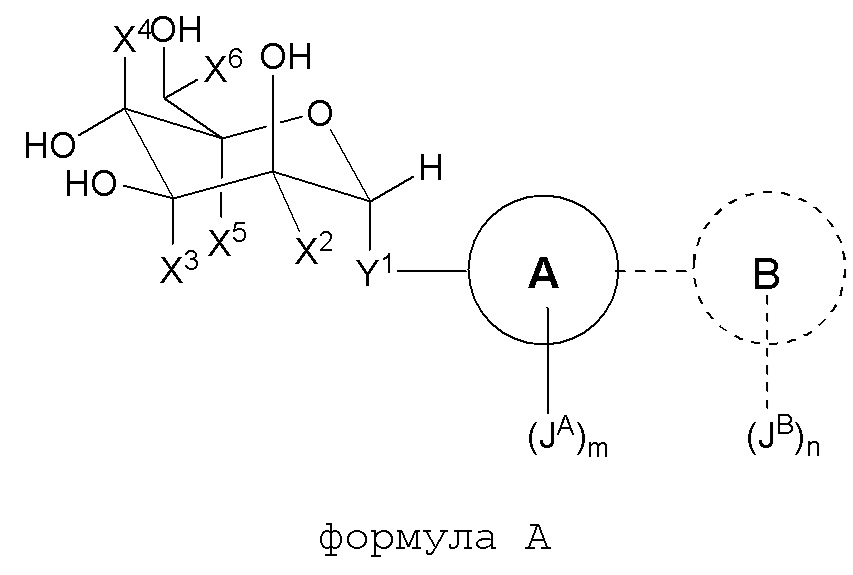
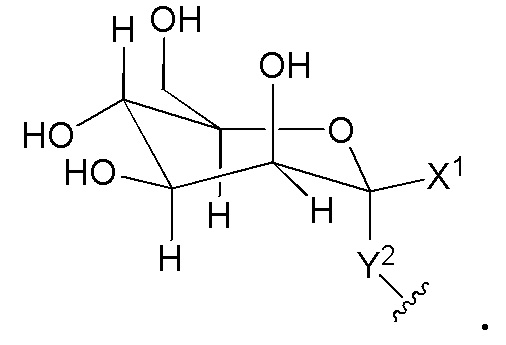
В другом варианте представлено соединение формулы A:

где
Y1 является -O-, -O(C1-C4алкилом)-, -S-, -S(C1-C4алкилом)-, -S(O)p-, -SOp(C1-C4алкилом)- или -(C1-C6)алифатической группой;
X2 является H, C1-C10 алифатической группой, -U2-V2 или -U2-V2-Q;
U2 является -(CH2)q- или -C(O)-;
V2 является C1-C10 алифатической группой, где вплоть до четырех метиленовых единиц могут быть необязательно заменены на -O-, -NR2-, -S-, -C(O)-, -S(O)-, -S(O)2- или P(O);
Q является 3-8-членным насыщенным, частично ненасыщенным или ароматическим кольцом, содержащим 0-4 гетероатома, выбранных из кислорода, азота или серы;
где X2 необязательно замещен 1-4 галогенами, CN, NO2 или C1-C10алифатической группой, где вплоть до трех метиленовых единиц C1-C10алифатической группы могут быть необязательно заменены на -NR-, -O-, -S-, -C(O)- или -S(O)- или -S(O)2-;
R2 является H, C1-C6 алифатической группой или C3-6циклоалкилом;
каждый X3, X4 и X6 независимо является H или C1-3алкилом;
X5 является H;
при условии, что только один из X2, X3, X4, X5 и X6 не является H;
Кольцом A является C3-C10 циклоалкил, 3-12-членный гетероциклил, C6-10 арил или 5-14-членный гетероарил; где гетероциклил или гетероарил независимо содержит 1-6 гетероатомов, выбранных из кислорода, азота или серы; кольцо A необязательно связано с кольцом B;
Кольцо B отсутствует, или является C3-C10 циклоалкилом, 3-12-членным гетероциклилом, C6-10 арилом или 5-14-членным гетероарилом; где указанный гетероциклил или гетероциклил независимо содержит 1-6 гетероатомов, выбранных из кислорода, азота или серы;
каждый JA и JB независимо является галогеном, CN, NO2, C3-8 циклоалкилом, 3-8-членным гетероциклилом, C6-10 арилом, 5-10-членным гетероарилом, (C6-10 арил)-(C1-C6алкилом)-, (5-10-членный гетероарил)-(C1-C6алкилом)- или C1-C12 алифатической группой, где вплоть до четырех метиленовых единиц C1-C10 алифатической группы могут быть необязательно заменены на -NR, -O-, -S-, -C(O)-, -S(O)-, -SO2- или P(O); каждый JA и JB независимо является и необязательно замещен 1-5 галогенами, CN или NO2;
R является H, C1-C6 алифатической группой, C3-6циклоалкилом, C(O)OH, C(O)O(C1-4алкилом) или C(O)(C1-4алкилом);
каждый m и n независимо является 0, 1, 2, 3 или 4; и
каждый p и q независимо является 1 или 2.
В некоторых вариантах,
Y1 является -O-, -O(C1-C4алкилом)-, -S-, -S(C1-C4алкилом)-, -S(O)p-, -S(O)p(C1-C4алкилом)- или -(C1-C6)алкилом;
X2 является H или -U2-V2; X2 необязательно замещенным 1-4 галогенами;
U2 является -(CH2)q- или -C(O)-;
V2 является C1-C10 алифатической группой, где вплоть до четырех метиленовых единиц могут быть необязательно заменены на -O-, -NR2-, -S-, -C(O)-, -S(O)-, -S(O)2- или P(O);
R2 является H, C1-C6 алифатической группой или C3-6циклоалкилом;
каждый X3, X4 и X6 независимо является H или C1-3алкилом;
X5 является H;
при условии, что, по крайней мере, один из X2, X3, X4, X5 и X6 не является H; и если X2 не является H, то X3, X4 и X6 все являются H;
Кольцом A является C3-C8 циклоалкил, 3-8-членный гетероциклил, C6-10 арил или 5-10-членный гетероарил; где гетероциклил или гетероарил независимо содержит 1-6 гетероатомов, выбранных из кислорода, азота или серы; кольцо A необязательно связано с кольцом B;
Кольцом B является C3-C8 циклоалкил, 3-8-членный гетероциклил, C6-10 арил, (C6-10 арил)-(C1-C6алкил)- или 5-10-членный гетероарил; где указанный гетероциклил или гетероциклил независимо содержит 1-6 гетероатомов, выбранных из кислорода, азота или серы;
каждый JA и JB независимо является галогеном, CN, NO2, C3-8 циклоалкилом, 3-8-членным гетероциклилом, C6-10 арилом, 5-10-членным гетероарилом, (C6-10 арил)-(C1-C6алкилом)-, (5-10-членный гетероарил)-(C1-C6алкилом)- или C1-C12 алифатической группой, где вплоть до четырех метиленовых единиц C1-C10 алифатической группы могут быть необязательно заменены на -NR, -O-, -S-, -C(O)-, -S(O)-, -SO2- или P(O); каждый JA и JB независимо является и необязательно замещен 1-5 галогенами, CN или NO2;
R является H, C1-C6 алифатической группой, C3-6циклоалкилом, C(O)OH, C(O)O(C1-4алкилом) или C(O)(C1-4алкилом);
каждый m, n и q независимо является 0, 1, 2, 3 или 4;
каждый p и q независимо является 1 или 2.
Согласно другому варианту,
X2 является H, C1-C10 алифатической группой, -U2-V2 или -U2-V2-Q;
U2 является -(CH2)q- или -C(O)-;
V2 является C1-C10 алифатической группой, где вплоть до четырех метиленовых единиц могут быть необязательно заменен на -O-, -NR2-, -S-, -C(O)-, -S(O)-, -S(O)2- или P(O);
Q является 3-8-членным насыщенным, частично ненасыщенным или ароматическим кольцом, содержащим 0-4 гетероатома, выбранных из кислорода, азота или серы;
где X2 необязательно замещен 1-4 галогенами, CN, NO2 или C1-C10алифатической группой, где вплоть до трех метиленовых единиц C1-C10алифатической группы могут быть необязательно заменены на -NR-, -O-, -S-, -C(O)- или -S(O)- или -S(O)2-;
где каждый R3 и R5 независимо является H, C1-3алкилом или -(C1-3алкил)-(фенилом).
В некоторых вариантах, Y2 является -O-.
В некоторых вариантах,
X2 является H; C1-6алкилом; или -U1-V1; где
U2 является -(CH2)q- и V2 является -OR3-; -OC(O)N(R2)2-, -N(R2)2, -N(R2)C(O)R3, -NHC(O)OR5, -NHC(O)NHR2, -NHSO2R3, -NHSO2NHR2, -C(O)OR3, C(O)N(R2)2, -SO2R3, -S(O)R3, -SO2NHR3, -SR3, -P(O)(OR3)2, -OP(O)(OR3)2;
или U2 является C(O) и V2 является -OR3 или N(R2)2;
где каждый R3 и R5 независимо является H, C1-3алкилом или -(C1-3алкил)-(фенилом).
В некоторых вариантах, U1 является -(CH2)q-. В других вариантах, U2 является -(CH2)q-. В некоторых вариантах q является 1. В других вариантах, X2 является H, C1-6алкилом или -(CH2)qOR3. В других вариантах, X2 является метилом, CH2OH, CH2N3, CH2NH2, CH2OCH2CH2OCH2Ph, CH2OCH2CH2OH,  , CH2NHC(O)CH3 или CH2OCH2Ph. В других вариантах, X2 является метилом, CH2OH или CH2OCH2Ph. В некоторых вариантах, X2 является C1-4алкилом. В других вариантах, X2 является метилом.
, CH2NHC(O)CH3 или CH2OCH2Ph. В других вариантах, X2 является метилом, CH2OH или CH2OCH2Ph. В некоторых вариантах, X2 является C1-4алкилом. В других вариантах, X2 является метилом.
В некоторых вариантах, X6 является C1-6алкилом. В других вариантах, X6 является метилом, этилом или изопропилом. В некоторых вариантах, X3 является метилом. В некоторых вариантах, один из X2, X3, X4, X5 и X6 является -U1-V1 и другие пять из X2, X3, X4, X5 и X6 являются H.
В некоторых вариантах, JA и JB каждый независимо являются галогеном, CN, C1-10алифатической группой, C(O)(C3-6циклоалкилом) или C(O)(3-8-членным гетероциклилом, содержащим 1-2 гетероатома, выбранных из O, NH, N(C1-4алкила) или S); где вплоть до трех метиленовых единиц C1-10алифатической группы необязательно заменены на O, NH, N(C1-4алкил), S, C(O), S(O) или S(O)2; каждый JA и JB независимо и необязательно замещен 1-3 галогенами.
В некоторых вариантах, JA является хлором, фтором, CN, CH3, CH2CH3, CH(CH3)2, OCH3 или OCF3. В других вариантах, JB является галогеном, CN, OCH3, C(O)NH(CH3), C(O)N(CH3)2, NO2, C(O)OH, C(O)OCH3, C(O)NH(CH2)2O(CH2)2O(CH2)2NH2, C(O)NH(CH2)2OCH3, C(O)NH(циклопропил), C(O)NH(CH2)2(4-метилпиперазинил), C(O)NHCH(CH2OH)CH(OH)CH3, C(O)NHC(CH2OH)3, C(O)NHC(CH2OH)2CH3, C(O)NHCH(CH2OH)2, C(O)NH(CH2)2(морфолинил), C(O)NHCH2(тетрагидропиранил), C(O)NH(тетрагидропиранил), C(O)NHCH2(4-BOCпиперидинил), C(O)NH(CH2)2N(CH3)2, C(O)(4-метилпиперазинил), C(O)NHCH(CH2OH)COOH, C(O)пирролидинил, N(CH2CH2OH)C(CH2OH)3, C(O)NHCH(CH2OH)CH(OH)CH3, S(O)2NH2, S(O)2NC(CH3)3, O(тетрагидропиранил), где указанный тетрагидропиранил необязательно замещен C1-4алкилом, фтором, OH или CH2OH. В некоторых вариантах, тетрагидропиранилом является молекула сахара, такая как гликозильная или маннозильная группа.
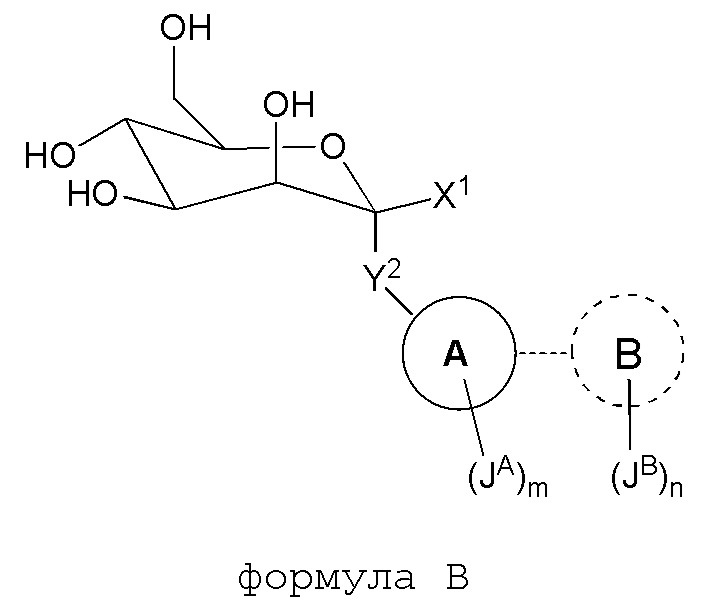
В другом варианте представлено соединение формулы B:

где
Y2 является -O(C1-C4алкилом)-, -S(C1-C4алкилом)-, -S(O)-, -SO2(C1-C4алкилом)- или -(C1-C6)алкилом;
X1 является -U1-V1; X1 необязательно замещен 1-4 галогеном;
U1 является -(CH2)q- или -C(O)-;
V1 является C1-C10 алифатической группой, где вплоть до четырех метиленовых единиц могут быть необязательно заменены на -O-, -NR2-, -S-, -C(O)-, -S(O)-, -S(O)2- или P(O);
Кольцом A является C3-C10 циклоалкил, 3-12-членный гетероциклил, C6-10 арил или 5-14-членный гетероарил; где гетероциклил или гетероарил независимо содержит 1-6 гетероатомов, выбранных из кислорода, азота или серы; кольцо A необязательно связано с кольцом B;
Кольцо B отсутствует, является C3-C10 циклоалкилом, 3-12-членным гетероциклилом, C6-10 арилом или 5-14-членным гетероарилом; где указанный гетероциклил или гетероциклил независимо содержит 1-6 гетероатомов, выбранных из кислорода, азота или серы;
каждый JA и JB независимо является галогеном, CN, NO2, C3-8 циклоалкилом, 3-8-членным гетероциклилом, C6-10 арилом, 5-10-членным гетероарилом, (C6-10 арил)-(C1-C6алкилом)-, (5-10-членный гетероарил)-(C1-C6алкилом)- или C1-C12 алифатической группой, где вплоть до четырех метиленовых единиц C1-C10 алифатической группы могут быть необязательно заменены на -NR, -O-, -S-, -C(O)-, -S(O)-, -SO2- или P(O); каждый JA и JB независимо является и необязательно замещен 1-5 галогенами, CN или NO2;
R является H, C1-C6 алифатической группой, C3-6циклоалкилом, C(O)OH, C(O)O(C1-4алкилом) или C(O)(C1-4алкилом);
каждый m и n независимо является 0, 1, 2, 3 или 4;
каждый q независимо является 1 или 2.
В некоторых вариантах,
Y2 является -O(C1-C4алкилом)-, -S(C1-C4алкилом)-, -S(O)-, -SO2(C1-C4алкилом)- или -(C1-C6)алкилом;
X1 является -U1-V1; X1 необязательно замещен 1-4 галогенами;
U1 является -(CH2)q- или -C(O)-;
V1 является C1-C10 алифатической группой, где вплоть до четырех метиленовых единиц могут быть необязательно заменены на -O-, -NR2-, -S-, -C(O)-, -S(O)-, -S(O)2- или P(O);
Кольцом A является C3-C8 циклоалкил, 3-8-членный гетероциклил, C6-10 арил или 5-10-членный гетероарил; кольцо A необязательно связано с кольцом B;
Кольцом B является C3-C8 циклоалкил, 3-8-членный гетероциклил, C6-10 арил, (C6-10 арил)-(C1-C6алкил)- или 5-10-членный гетероарил;
каждый JA и JB независимо является галогеном, CN, NO2, C3-8 циклоалкилом, 3-8-членным гетероциклилом, C6-10 арилом, 5-10-членным гетероарилом, (C6-10 арил)-(C1-C6алкилом)-, (5-10-членный гетероарил)-(C1-C6алкилом)- или C1-C12 алифатической группой, где вплоть до четырех метиленовых единиц C1-C10 алифатической группы могут быть необязательно заменены на -NR, -O-, -S-, -C(O)-, -S(O)-, -SO2- или P(O); каждый JA и JB независимо является и необязательно замещен 1-5 галогенами, CN или NO2;
R является H, C1-C6 алифатической группой, C3-6циклоалкилом, C(O)OH, C(O)O(C1-4алкилом) или C(O)(C1-4алкилом);
каждый m и n независимо является 0, 1, 2, 3 или 4.
В некоторых вариантах, X1 является C1-6алкилом; или -U1-V1; где
U2 является -(CH2)q- и V2 является -OR3-; -OC(O)N(R2)2-, -N(R2)2, -N(R2)C(O)R3, -NHC(O)OR5, -NHC(O)NHR2, -NHSO2R3, -NHSO2NHR2, -C(O)OR3, C(O)N(R2)2, -SO2R3, -S(O)R3, -SO2NHR3, -SR3, -P(O)(OR3)2, -OP(O)(OR3)2; или
U2 является C(O) и V2 является -OR3 или N(R2)2;
R является H, C1-C6 алифатической группой, C3-6циклоалкилом, C(O)OH, C(O)O(C1-4алкилом) или C(O)(C1-4алкилом);
R2 является H, C1-C6 алифатической группой или C3-6циклоалкилом; и
R3 является H, C1-3алкилом или -( C1-3алкил)-(фенилом).
В других вариантах, X1 является C1-6алкилом; или -U1-V1; где
U2 является -(CH2)q- и V2 является -OR3-; -OC(O)N(R2)2-, -N(R2)2, -N(R2)C(O)R3, -NHC(O)OR5, -NHC(O)NHR2, -NHSO2R3, -NHSO2NHR2, -C(O)OR3, C(O)N(R2)2, -SO2R3, -S(O)R3, -SO2NHR3, -SR3, -P(O)(OR3)2, -OP(O)(OR3)2; или
U2 является C(O) и V2 является -OR3 или N(R2)2;
R является H, C1-C6 алифатической группой, C3-6циклоалкилом, C(O)OH, C(O)O(C1-4алкилом) или C(O)(C1-4алкилом);
R2 является H, C1-C6 алифатической группой или C3-6циклоалкилом; и
R3 является H, C1-3алкилом или -( C1-3алкил)-(фенилом).
В некоторых вариантах, X1 является C1-6алкилом. В некоторых вариантах, X1 является метилом. В других вариантах, Y2 является -O(C1-C4алкилом)-. В других вариантах, Y2 является -O(галогенC1-C4 алкилом)-. В некоторых вариантах, Y2 является -O(C1-C4алкилом)-, кольцо A является фенилом, кольцо B отсутствует и JA является C(O)NH(C1-4алкилом).
В другом варианте представлено соединение формулы C:

где
каждый Z1, Z2, Z3 и Z4 независимо является H или F; при условии, что, по крайней мере, один из Z1, Z2, Z3 и Z4 является F;
Y3 является -O-, -O(C1-C4алкилом)-, -S-, -S(C1-C4алкилом)-, -S(O)p -, -SOp(C1-C4алкилом)- или -(C1-C6)алкилом;
Кольцом A является C3-C10 циклоалкил, 3-12-членный гетероциклил, C6-10 арил или 5-14-членный гетероарил; где гетероциклил или гетероарил независимо содержит 1-6 гетероатомов, выбранных из кислорода, азота или серы; кольцо A необязательно связано с кольцом B;
Кольцо B отсутствует, является C3-C10 циклоалкилом, 3-12-членным гетероциклилом, C6-10 арилом или 5-14-членным гетероарилом; где указанный гетероциклил или гетероциклил независимо содержит 1-6 гетероатомов, выбранных из кислорода, азота или серы;
каждый JA и JB независимо является галогеном, CN, NO2, C3-8 циклоалкилом, 3-8-членным гетероциклилом, C6-10 арилом, 5-10-членным гетероарилом, (C6-10 арил)-(C1-C6алкилом)-, (5-10-членный гетероарил)-(C1-C6алкилом)- или C1-C12 алифатической группой, где вплоть до четырех метиленовых единиц C1-C10 алифатической группы могут быть необязательно заменены на -NR-, -O-, -S-, -C(O)-, -S(O)-, -SO2- или P(O); каждый JA и JB независимо является и необязательно замещен 1-5 галогенами, CN или NO2;
R является H, C1-C6 алифатической группой, C3-6циклоалкилом, C(O)OH, C(O)O(C1-4алкилом) или C(O)(C1-4алкилом);
каждый m и n независимо является 0, 1, 2, 3 или 4;
p является 1 или 2.
В другом варианте,
каждый Z1, Z2, Z3 и Z4 независимо является H или F; при условии, что, по крайней мере, один из Z1, Z2, Z3 и Z4 является F;
Y3 является -O-, -O(C1-C4алкилом)-, -S-, -S(C1-C4алкилом)-, -S(O)p -, -SOp(C1-C4алкилом)- или -(C1-C6)алкилом;
Кольцом A является C3-C8 циклоалкил, 3-8-членный гетероциклил, C6-10 арил или 5-10-членный гетероарил; кольцо A необязательно связано с кольцом B;
Кольцом B является C3-C8 циклоалкил, 3-8-членный гетероциклил, C6-10 арил, (C6-10 арил)-(C1-C6алкил)- или 5-10-членный гетероарил;
каждый JA и JB независимо является галогеном, CN, NO2, C3-8 циклоалкилом, 3-8-членным гетероциклилом, C6-10 арилом, 5-10-членным гетероарилом, (C6-10 арил)-(C1-C6алкилом)-, (5-10-членный гетероарил)-(C1-C6алкилом)- или C1-C12 алифатической группой, где вплоть до четырех метиленовых единиц C1-C10 алифатической группы могут быть необязательно заменены на -NR, -O-, -S-, -C(O)-, -S(O)-, -SO2- или P(O); каждый JA и JB независимо является и необязательно замещен 1-5 галогенами, CN или NO2;
R является H, C1-C6 алифатической группой, C3-6циклоалкилом, C(O)OH, C(O)O(C1-4алкилом) или C(O)(C1-4алкилом);
каждый m и n независимо является 0, 1, 2, 3 или 4.
В некоторых вариантах, только один из Z1, Z2, Z3 и Z4 является F и другие три являются H. В некоторых вариантах, Z1 является F. В некоторых вариантах, Z2 является F. В некоторых вариантах, Z3 является F. В некоторых вариантах, Z4 является F.
В некоторых вариантах, Y3 является -O-.
Согласно другому варианту, кольцом A является фенил. В некоторых вариантах, JA является галоген, C1-4алифатической группой или -O(C1-4алифатической) группой; где указанный C1-4алифатическая группа или -O(C1-4алифатическая) группа необязательно замещена 1-4 галогенами.
Согласно другому варианту, кольцом B является 5-10-членный гетероарил.
В другом варианте представлено соединение формулы D:

где
Кольцо B отсутствует, является C3-C10 циклоалкилом, 3-12-членным гетероциклилом, C6-10 арилом или 5-14-членным гетероарилом; где указанный гетероциклил или гетероциклил независимо содержит 1-6 гетероатомов, выбранных из кислорода, азота или серы;
каждый JA и JB независимо является галогеном, CN, NO2, C3-8 циклоалкилом, 3-8-членным гетероциклилом, C6-10 арилом, 5-10-членным гетероарилом, (C6-10 арил)-(C1-C6алкилом)-, (5-10-членный гетероарил)-(C1-C6алкилом)- или C1-C12 алифатической группой, где вплоть до четырех метиленовых единиц C1-C10 алифатической группы могут быть необязательно заменены на -NR, -O-, -S-, -C(O)-, -S(O)-, -SO2- или P(O); каждый JA и JB независимо является и необязательно замещен 1-5 галогенами, CN или NO2;
R является H, C1-C6 алифатической группой, C3-6циклоалкилом, C(O)OH, C(O)O(C1-4алкилом) или C(O)(C1-4алкилом);
каждый m и n независимо является 0, 1, 2, 3 или 4.
Согласно другому варианту,
Кольцом B является C3-C8 циклоалкил, 3-8-членный гетероциклил, C6-10 арил, (C6-10 арил)-(C1-C6алкил)- или 5-10-членный гетероарил;
каждый JA и JB независимо является галогеном, CN, NO2, C3-8 циклоалкилом, 3-8-членным гетероциклилом, C6-10 арилом, 5-10-членным гетероарилом, (C6-10 арил)-(C1-C6алкилом)-, (5-10-членный гетероарил)-(C1-C6алкилом)- или C1-C12 алифатической группой, где вплоть до четырех метиленовых единиц C1-C10 алифатической группы могут быть необязательно заменены на -NR, -O-, -S-, -C(O)-, -S(O)-, -SO2- или P(O); каждый JA и JB независимо является и необязательно замещен 1-5 галогенами, CN или NO2;
R является H, C1-C6 алифатической группой, C3-6циклоалкилом, C(O)OH, C(O)O(C1-4алкилом) или C(O)(C1-4алкилом);
каждый m и n независимо является 0, 1, 2, 3 или 4.
В некоторых вариантах, кольцом B является фенил и JB является C(O)NHCH3, OCH3 или NO2.
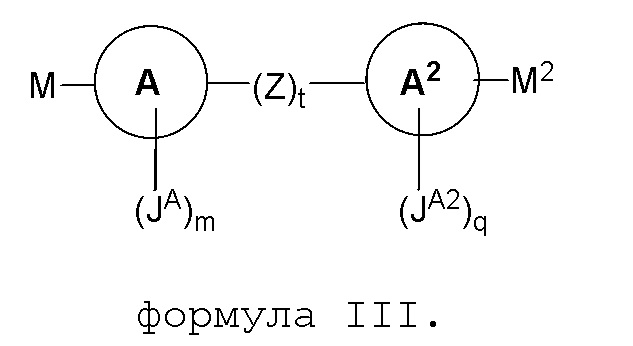
В другом варианте представлено соединение, представленное формулой III:

В некоторых вариантах, M и M2 являются одинаковыми. В других вариантах, M и M2 являются разными.
В некоторых вариантах, M является

В других вариантах, M2 является

В других вариантах, M2 вместе с кольцом A2 образует

В некоторых вариантах, Y1 является O и X2 является метилом. В других вариантах, t является 1 и Z является фенилом или пиридилом. В других вариантах t является 0.
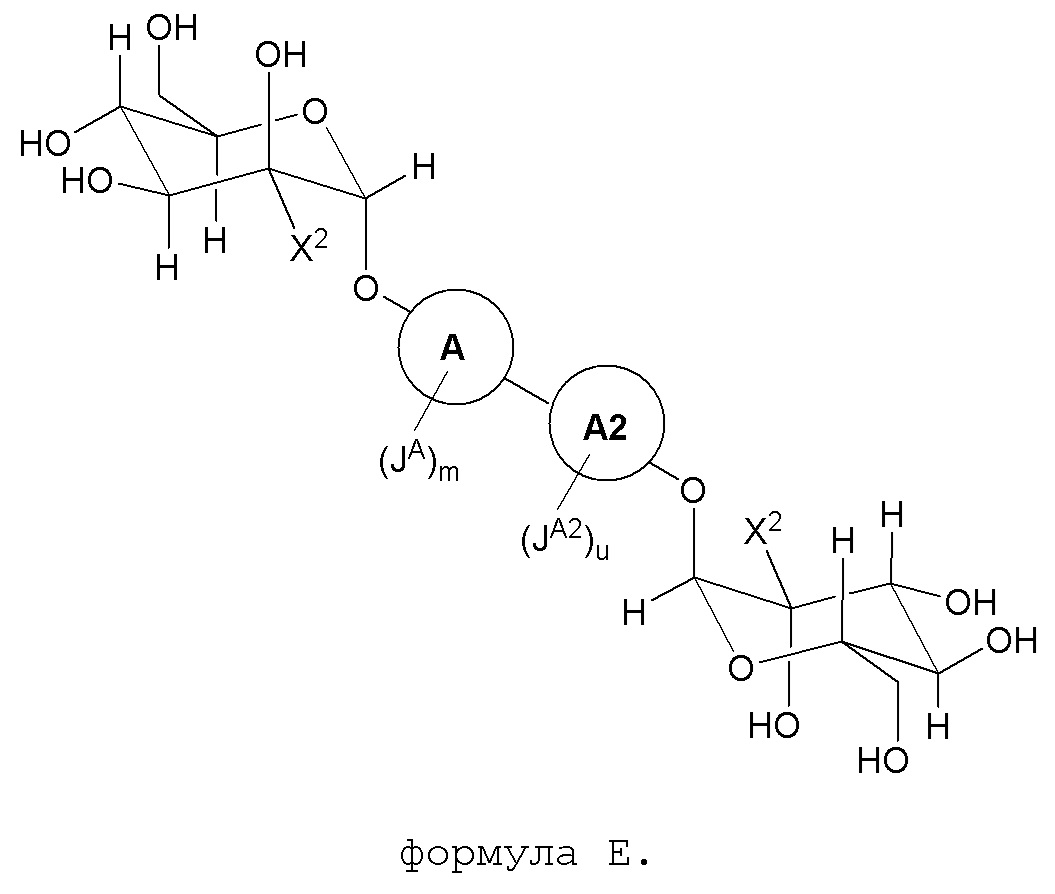
В другом варианте представлено соединение, представленное формулой E:

В некоторых вариантах, кольцо A и кольцо A2 являются фенилом. В других вариантах, X2 является C1-4алкилом. В некоторых вариантах, X2 является метилом.
В некоторых вариантах, JA и JA2 каждый независимо являются CN, галогеном, C1-6алкилом, где вплоть до одной метиленовой единицы указанного C1-6алкила необязательно заменена на O, S, NH, N(C1-6алкил), C(O), S(O) или S(O)2, замещенным 1-3 галогенами. В других вариантах, JA и JA2 каждый независимо является CN, метилом, этилом, изопропилом, фтором, хлором, OCH3 или OCF3.
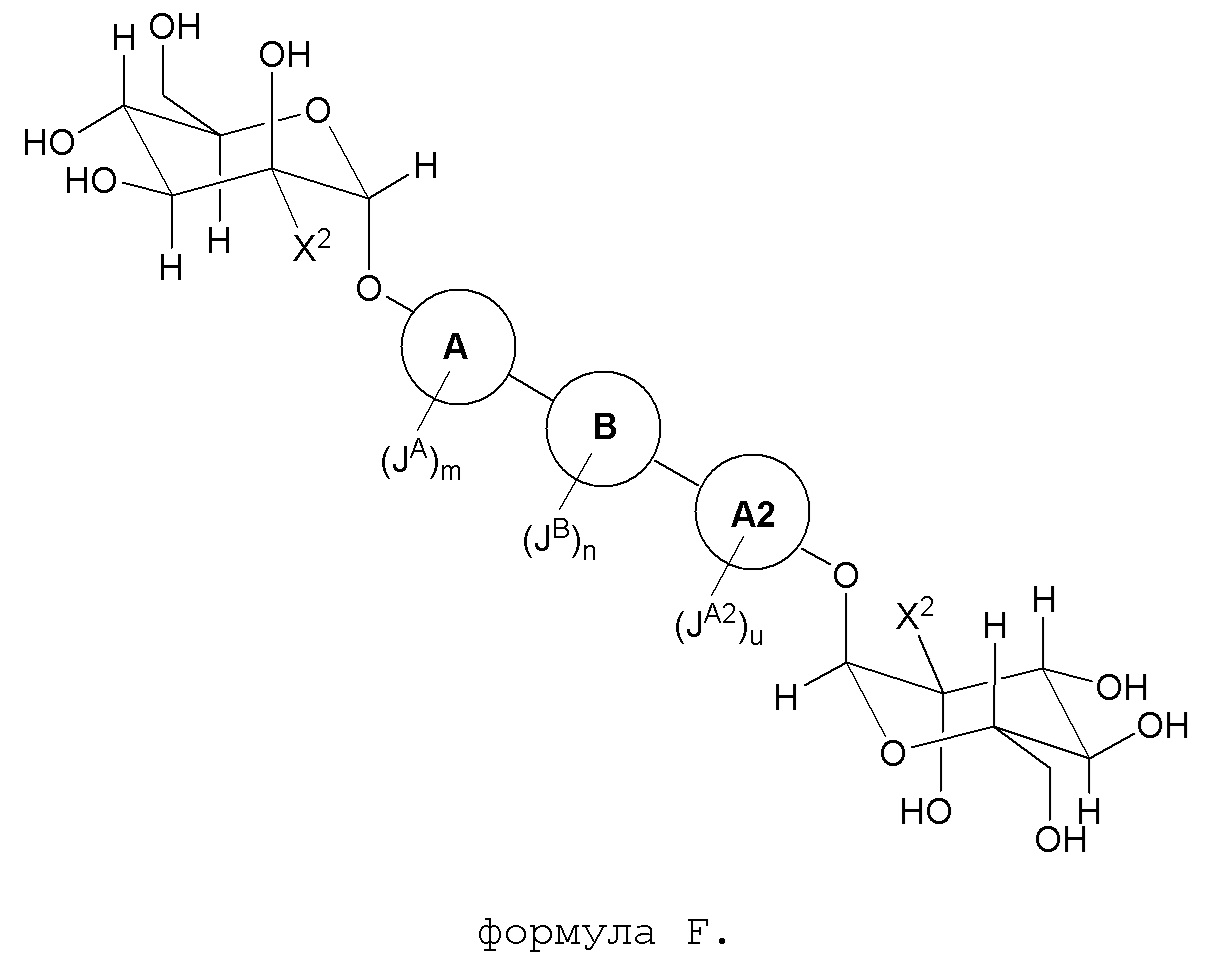
В другом варианте представлено соединение, представленное формулой F:

В некоторых вариантах, кольцо A и кольцо A2 являются фенилом. В некоторых вариантах, кольцом B является C3-6циклоалкил, фенил или пиридил. В некоторых вариантах, JA и JA2 каждый независимо являются CN, галогеном, C1-6алкилом, где вплоть до одной метиленовой единицы указанного C1-6алкила необязательно заменена на O, S, NH, N(C1-6алкил), C(O), S(O) или S(O)2, замещенным 1-3 галогенами. В других вариантах, JA и JA2 каждый независимо является метилом; m является 1; и u является 1. В других вариантах, JB является фенилом, необязательно замещенным метилом и 
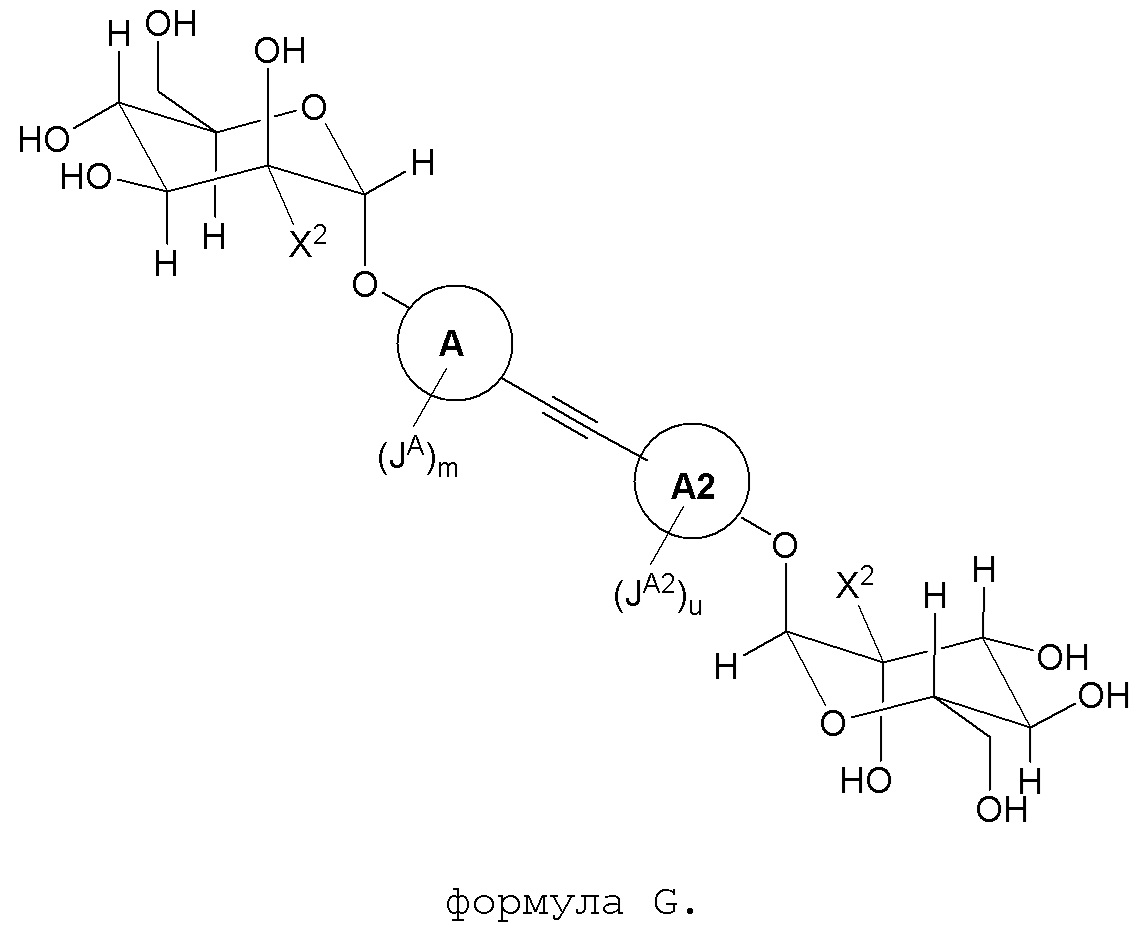
В другом варианте представлено соединение, представленное формулой G:

В некоторых вариантах, X2 является метилом, кольцо A и кольцо A2 являются фенилом; JA и JB каждый независимо являются метилом; m является 1; и n является 1.
В другом варианте представлено соединение, представленное формулой H:

В некоторых вариантах, t является 1 и Z является фенилом или пиридилом. В других вариантах, t является 0. В еще одном варианте, кольцо A и кольцо A2 являются фенилом.
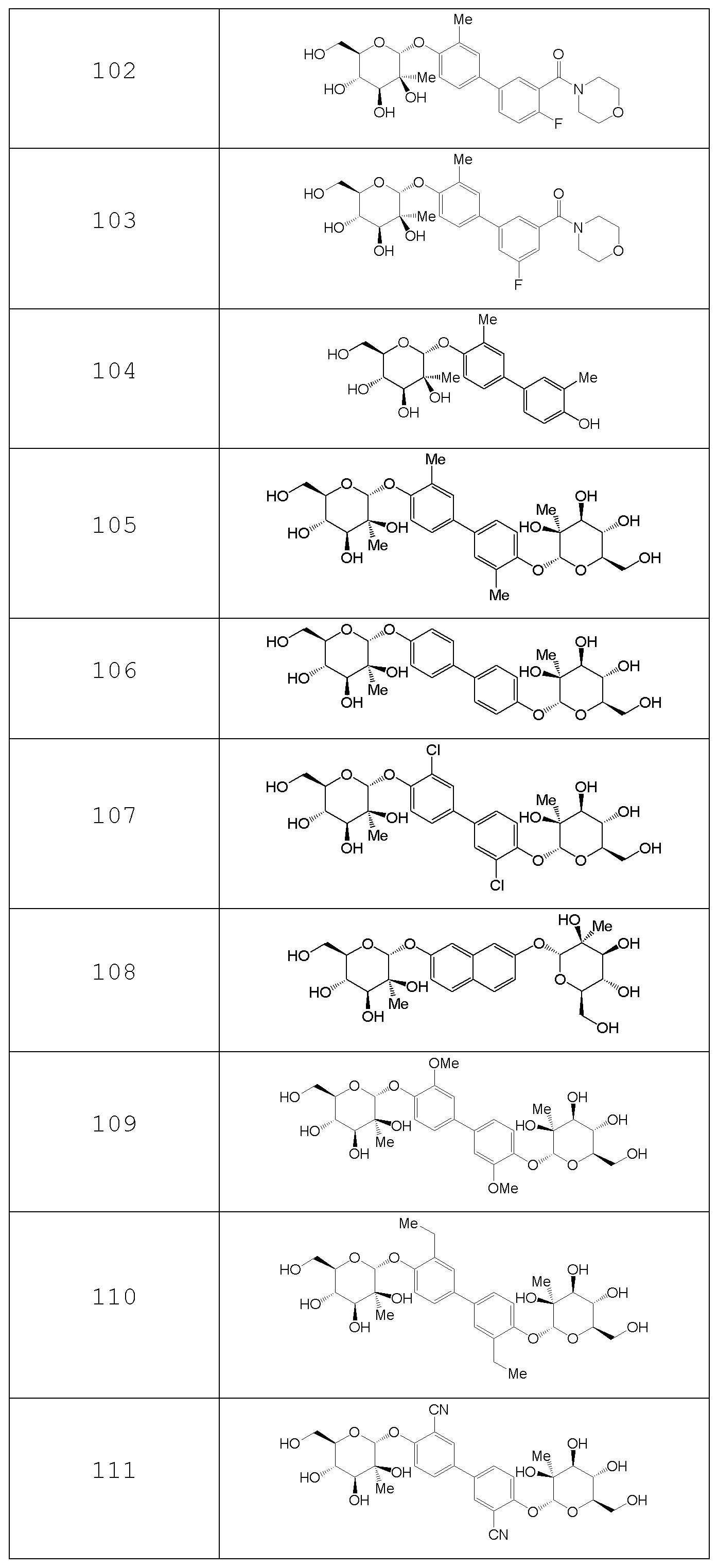
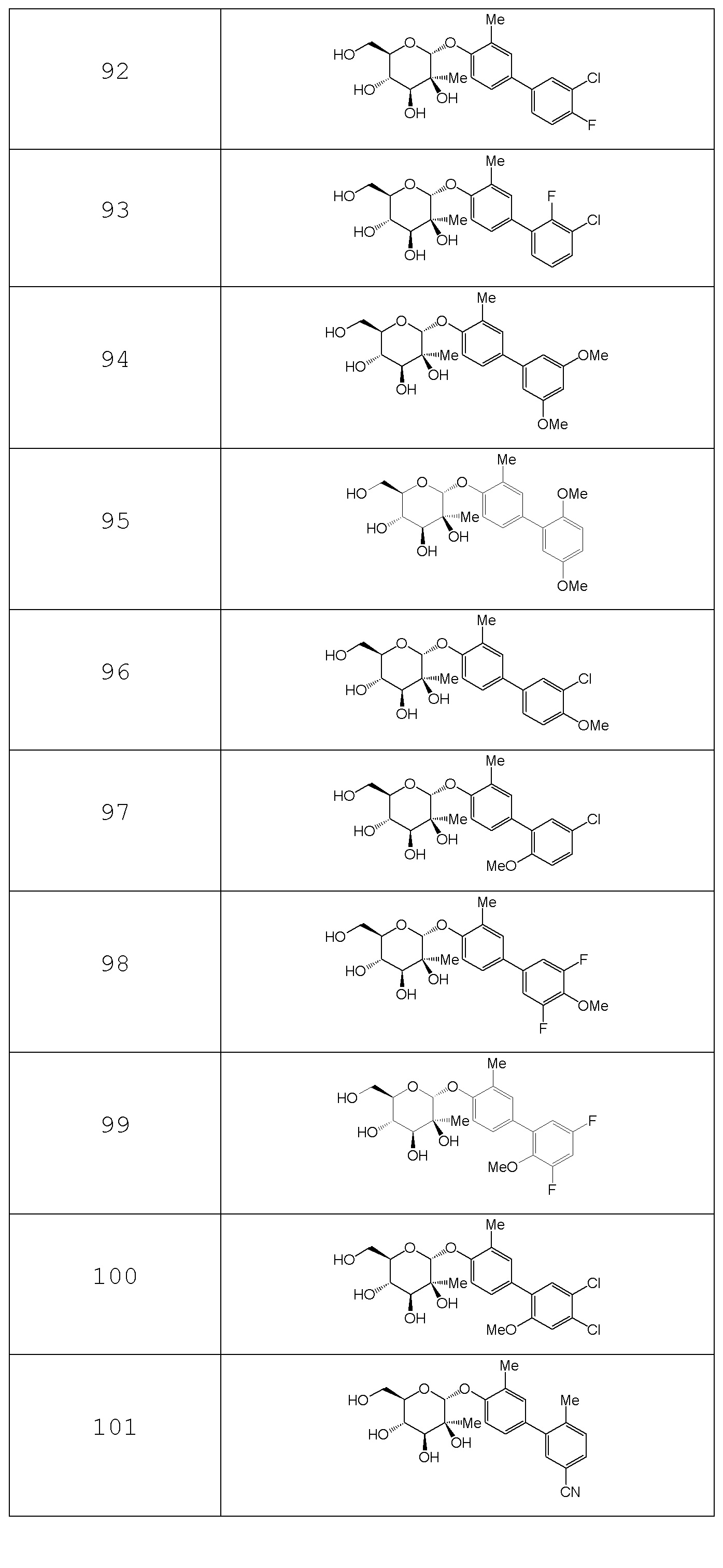
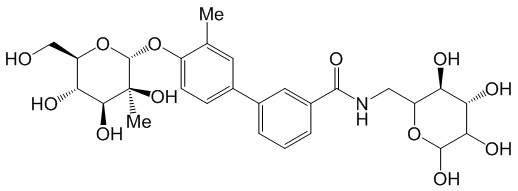
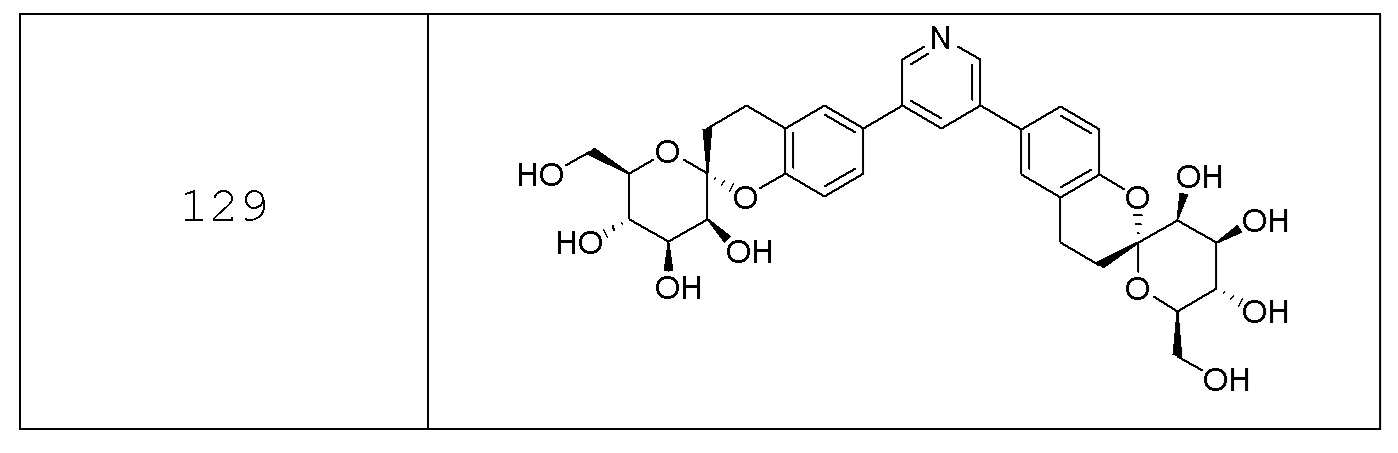
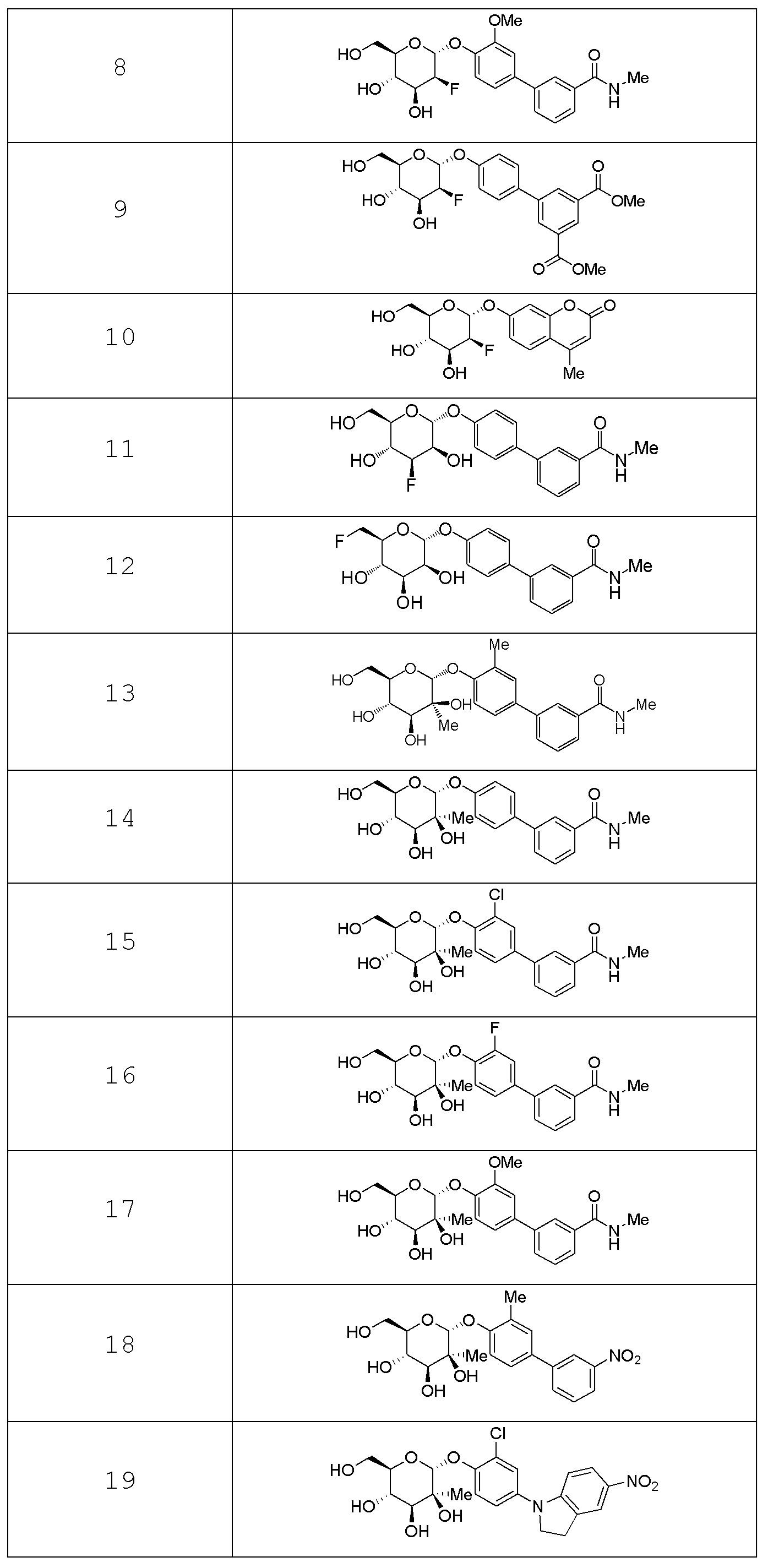
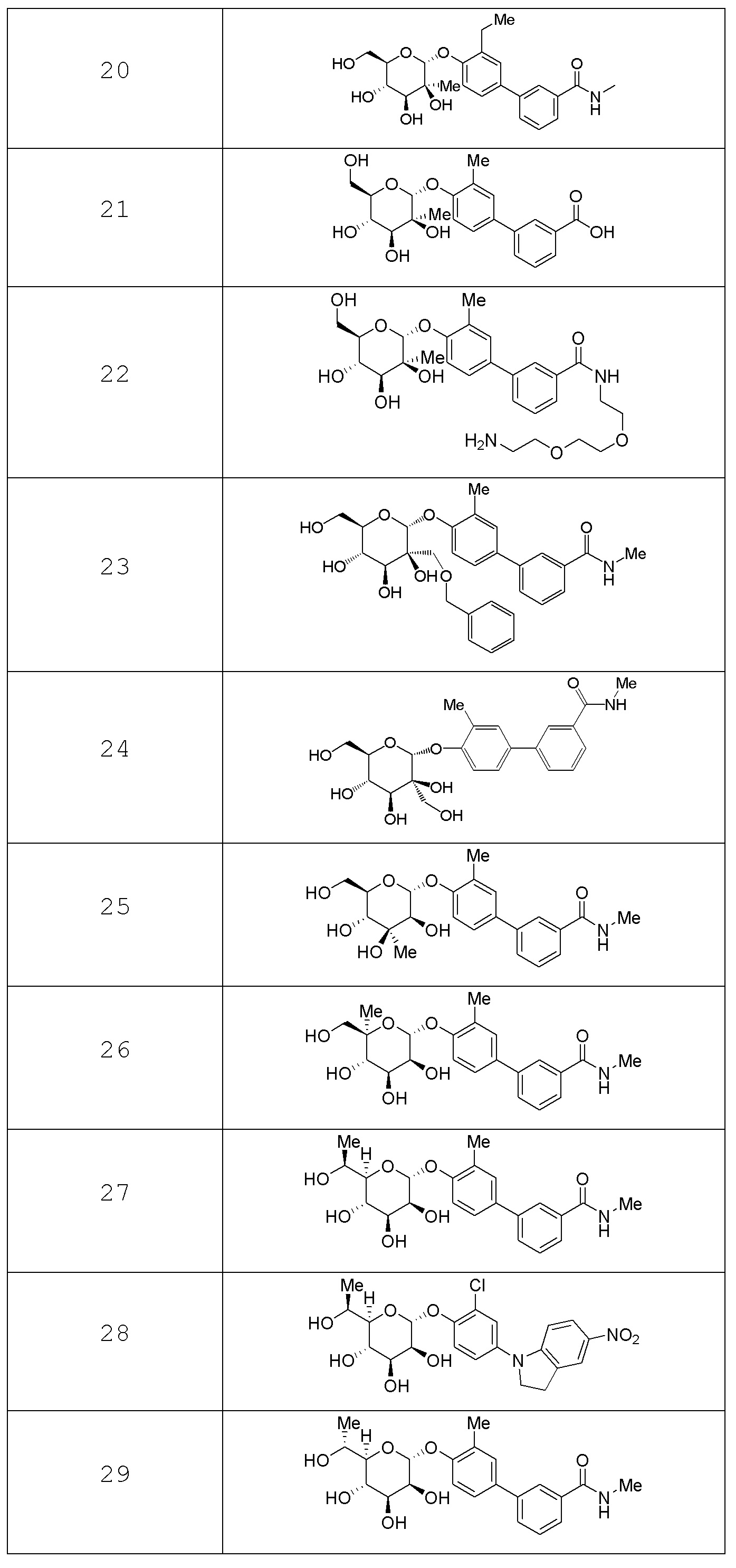
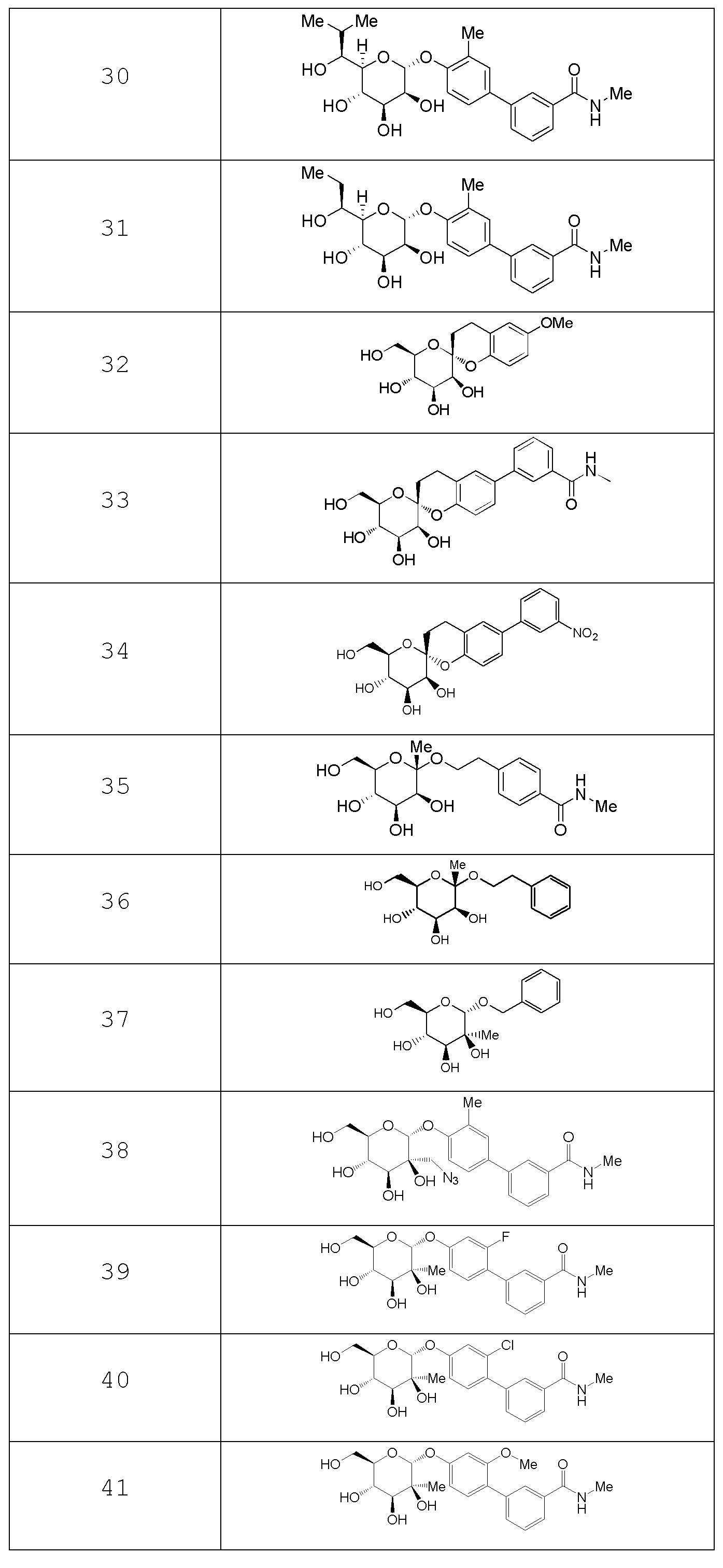
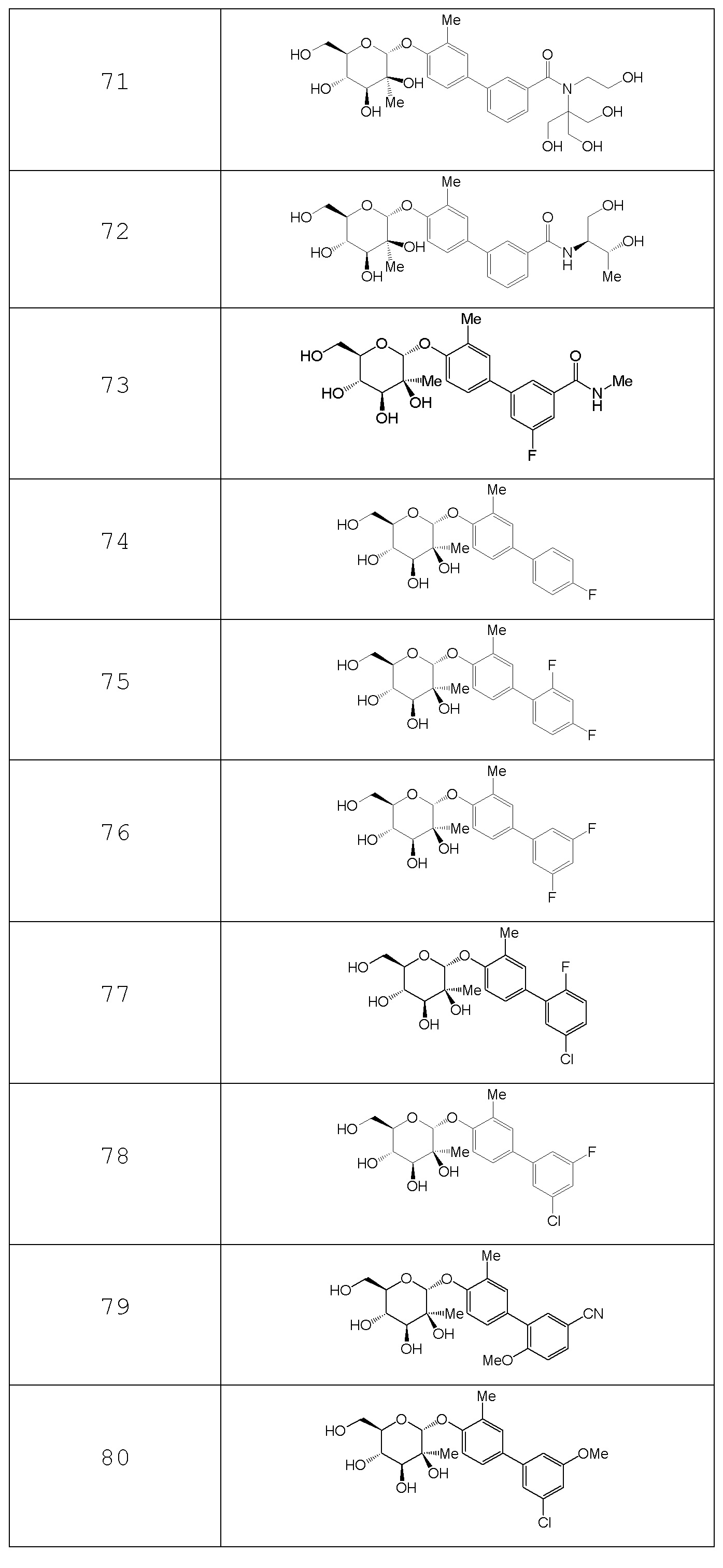
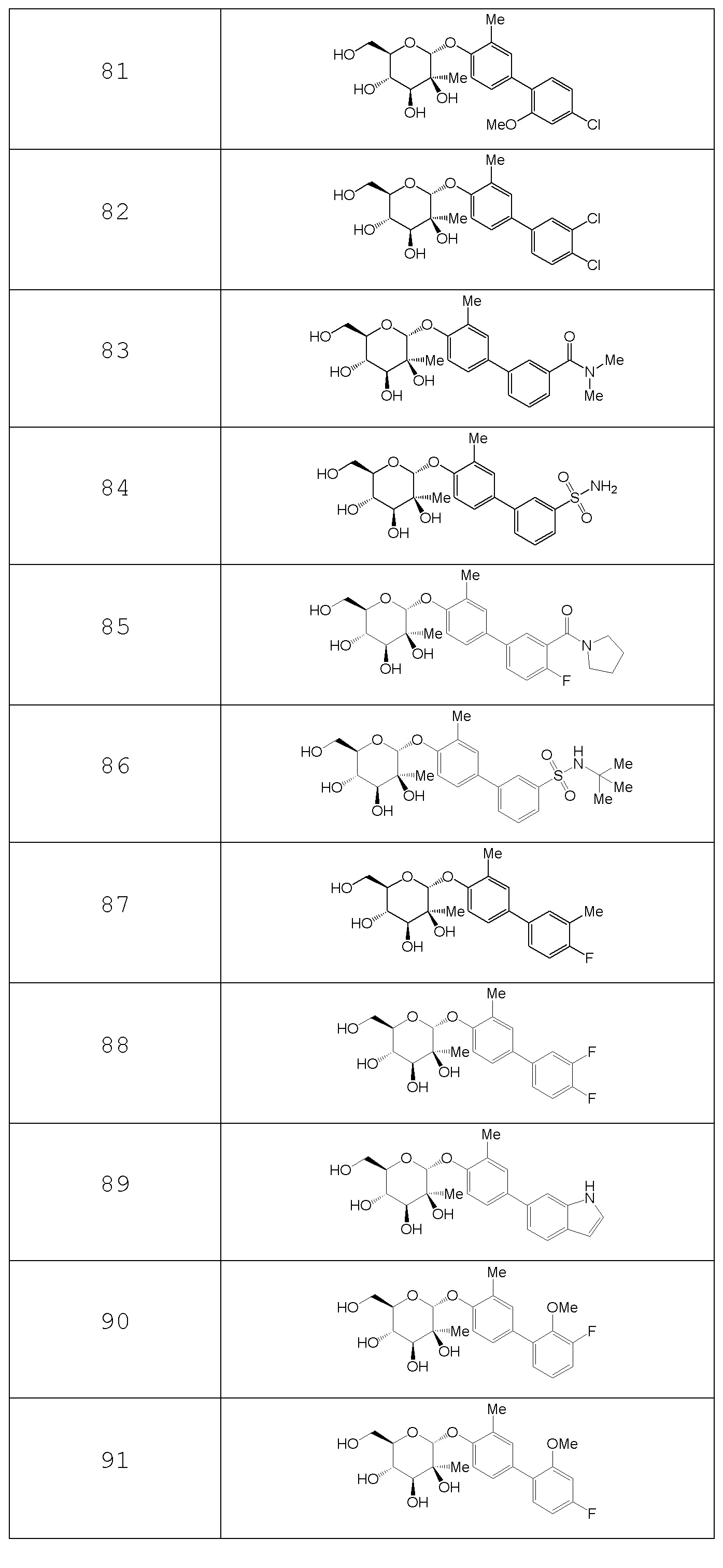
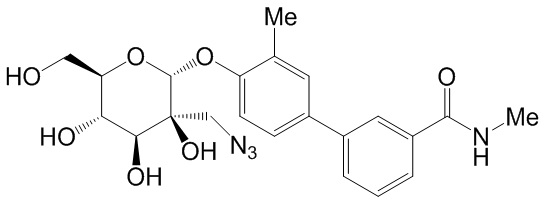
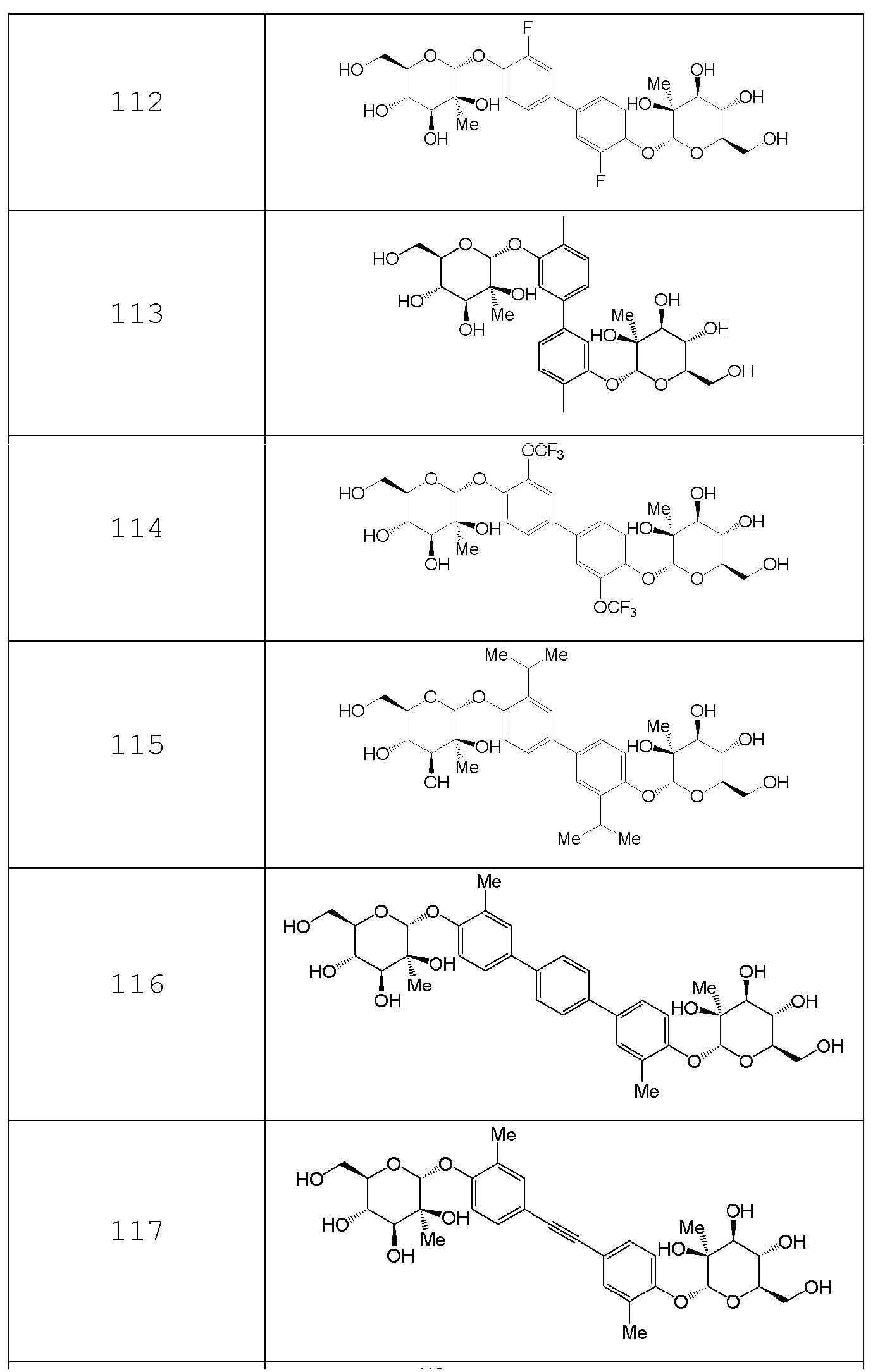
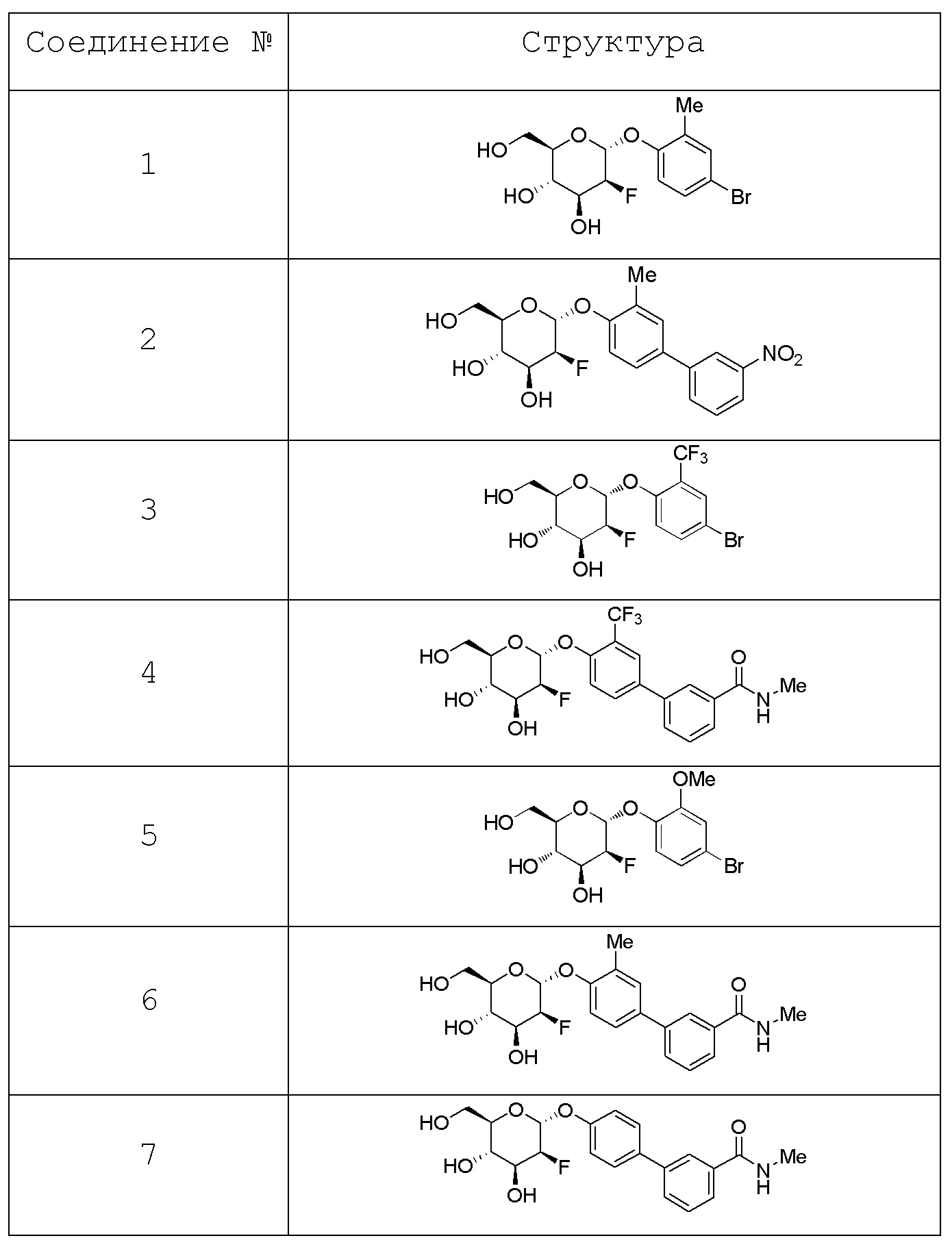
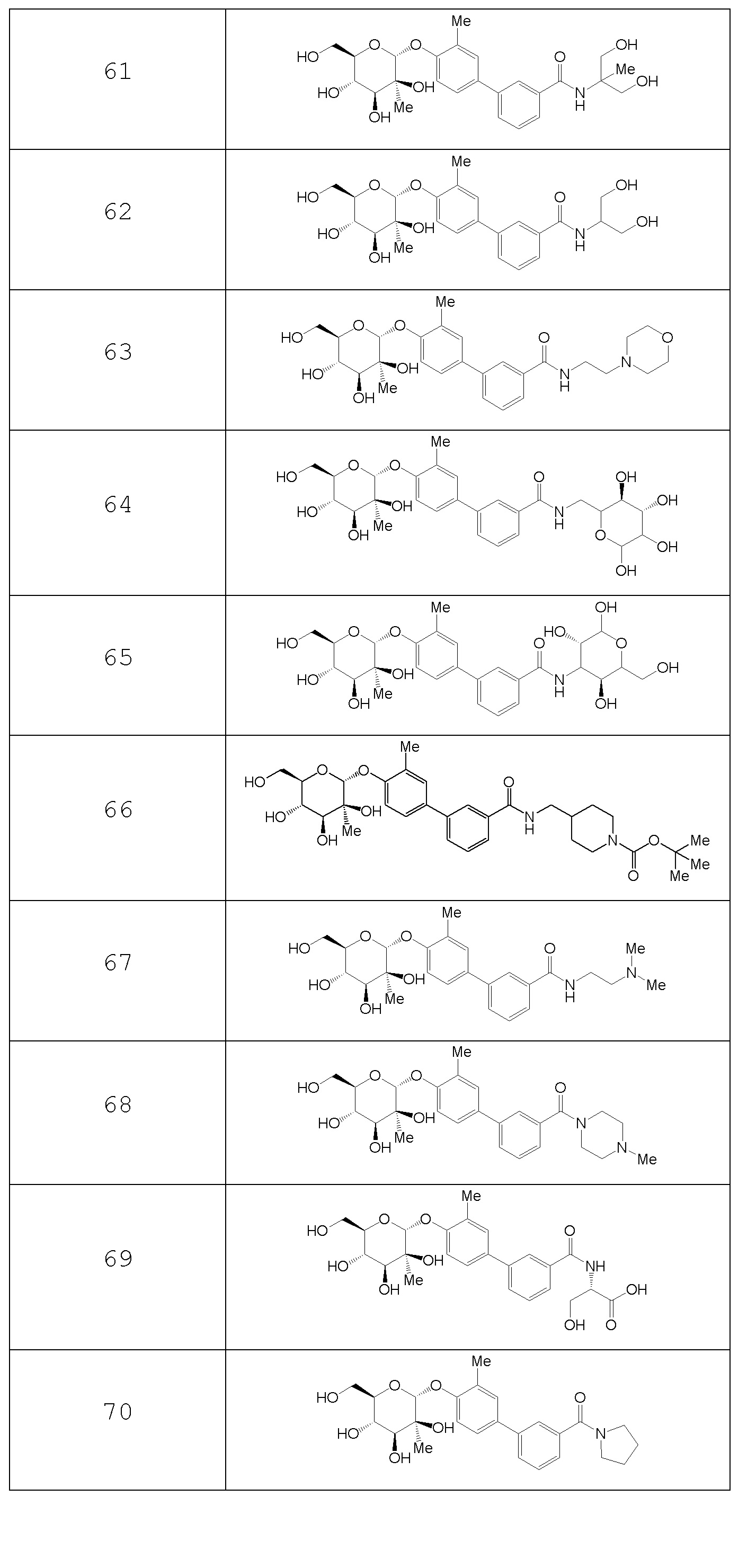
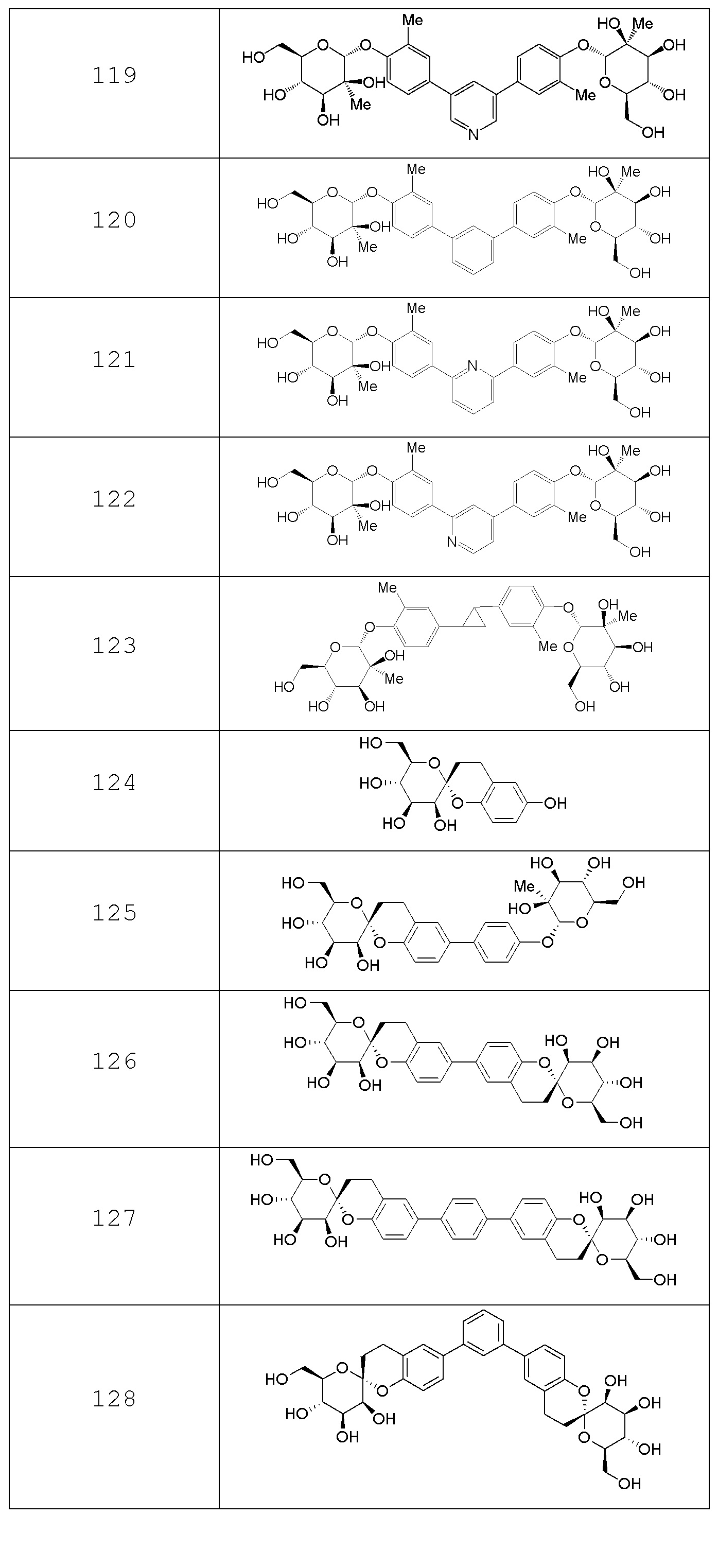
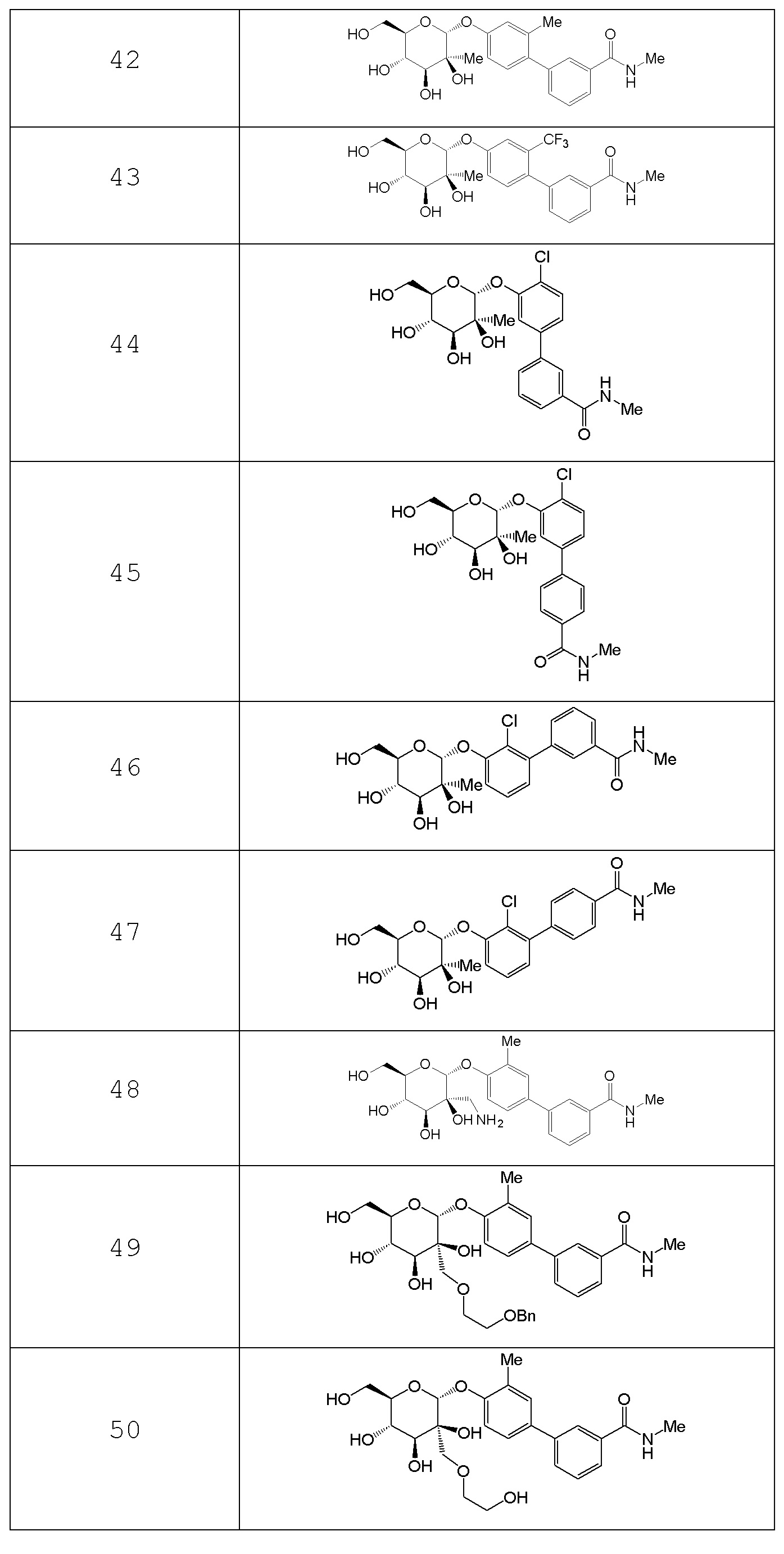
В других вариантах представлено соединение, выбранное из одного или более из следующих таблиц.

















В данном изобретении также представлены способы получения описанных здесь соединений. Эти способы в общем описаны на представленных ниже схемах.
В данном изобретении также представлена композиция, содержащая описанное здесь соединение и фармацевтически приемлемый носитель, адъювант или наполнитель.
В данном изобретении также представлен способ лечения или профилактики бактериальной инфекции у пациента, включающий веление пациенту эффективного количества соединения или композиции в соответствии с данным изобретением.
В одном варианте способа, бактериальной инфекцией является инфекция мочевыводящих путей или воспалительное заболевание кишечника.
В другом варианте представлен способ лечения или профилактики бактериальной инфекции у пациента, включающий введение пациенту эффективного количества соединения в соответствии с данным изобретением или его фармацевтически приемлемой соли или композиции, содержащей указанное соединение. В некоторых вариантах, бактериальной инфекцией является инфекция мочевыводящих путей или воспалительное заболевание кишечника. В некоторых вариантах, бактериальной инфекцией является язвенный колит. В других вариантах, бактериальной инфекцией является болезнь Крона. В некоторых вариантах, бактериальной инфекцией является причина болезни Крона или язвенного колита. В некоторых вариантах, бактериальные инфекции вызываются штаммами AIEC (адгерентно-инвазивной e. coli).
В другом варианте представлен способ лечения или профилактики воспалительного заболевания кишечника у пациента, включающий введение объекту эффективного количества соединения в соответствии с данным изобретением или его фармацевтически приемлемой соли или композиции, содержащей данное соединение. В некоторых вариантах, объектом является пациент. В других вариантах, объектом является человек. В некоторых вариантах, воспалительным заболеванием кишечника является болезнь Крона. В других вариантах, воспалительным заболеванием кишечника является язвенный колит.
В другом варианте представлен способ ингибирования FimH в бактериях из бактериального штамма e. coli, выделенного у пациентов с воспалительным заболеванием кишечника, включающий контакт бактерии с эффективным количеством соединения в соответствии с данным изобретением или его фармацевтически приемлемой соли или композиции, содержащей указанное соединение. В некоторых вариантах, бактериальным штаммом является LF-82.
В другом варианте представлен способ ингибирования FimH у пациента, включающий введение пациенту эффективного количества соединения в соответствии с данным изобретением или его фармацевтически приемлемой соли или композиции, содержащей указанное соединение.
В другом варианте представлен способ ингибирования адгезии e. coli у пациента, включающий введение пациенту эффективного количества соединения в соответствии с данным изобретением или его фармацевтически приемлемой соли или композиции, содержащей указанное соединение. В некоторых вариантах ингибирование адгезии предотвращает закрепление инфекции под слизистой оболочкой.
В другом варианте представлен способ блокирования взаимодействия между фимбрией 1 типа и CEACAM6 у пациента, включающий введение пациенту эффективного количества соединения в соответствии с данным изобретением или его фармацевтически приемлемой соли или композиции, содержащей указанное соединение.
Как описано здесь, указанный численный интервал атомов включает любое целое число в его пределах. Например, группа, содержащая 1-4 атомов, может включать 1, 2, 3 или 4 атома.
Термин “стабильный” в данном описании относится к соединениям, которые практически не изменяется при попадании в условия его получения, определения, восстановления, хранения, очистки и применения для одной или более описанных здесь целей. В некоторых вариантах, стабильным соединением или химически допустимым соединением является соединение, которое практически не изменяется при выдерживании при температуре 40°C или менее при отсутствии влаги или других условий химической реакции, в течение, по крайней мере, недели.
Термин “алифатический” или “алифатическая группа” в данном описании означает прямую (т.е., не разветвленную) или разветвленную углеводородную цепь, которая полностью насыщена или которая содержит одну или более единиц ненасыщенности, но не является ароматической.
Если не указано иначе, алифатические группы содержат 1-20 алифатических атомов углерода. В некоторых вариантах, алифатические группы содержат 1-10 алифатических атомов углерода. В других вариантах, алифатические группы содержат 1-8 алифатических атомов углерода. В других вариантах, алифатические группы содержат 1-6 алифатических атомов углерода, и в других вариантах, алифатические группы содержат 1-4 алифатических атомов углерода. Алифатические группы могут быть линейной или разветвленной, замещенной или не замещенной алкильной, алкенильной или алкинильной группами. Конкретные примеры включают, но не ограничены ими, метил, этил, изопропил, н-пропил, втор-бутил, винил, н-бутенил, этинил и трет-бутил.
Термин “алкил” в данном описании означает насыщенный прямой или разветвленный углеводород. Термин “алкенил” в данном описании означает прямой или разветвленный углеводород, содержащий одну или более двойных связей. Термин “алкинил” в данном описании означает прямой или разветвленный углеводород, содержащий одну или более тройных связей.
Термин “циклоалифатическая” группа (“карбоцикл” или “карбоциклил” или “карбоциклическая” группа) относится к не ароматическому моноциклическому углеродсодержащему кольцу, которое может быть насыщено или содержит одну или более единиц ненасыщенности, содержащему от трех до четырнадцати атомов углерода в кольце. В некоторых вариантах, кольцо содержит от трех до десяти атомов углерода; в других вариантах, кольцо содержит от трех до шести атомов углерода. Термин включает полициклические конденсированные, спиро или мостиковые карбоциклические кольцевые системы. Термин также включает полициклические кольцевые системы, в которых карбоциклическое кольцо может быть сконденсировано с одним или более не ароматическими или гетероциклическими кольцами или одним или более ароматическими кольцами или их сочетанием, где радикал или точка присоединения находится на карбоциклическом кольце. Конденсированные бициклические кольцевые системы содержат два кольца, которые имеют два общих соединяющих атомов в кольце, мостиковая бициклическая группа содержит два кольца, которые имеют три или четыре общих соседних атомов в кольце, спиро бициклические кольцевые системы имеют один общий атом в кольце. Примеры циклоалифатических групп включают, но не ограничены ими, циклоалкильную и циклоалкенильную группы. Конкретные примеры включают, но не ограничены ими, циклогексил, циклопропенил и циклобутил.
Термин “гетероцикл” (или “гетероциклил” или “гетероциклическое”) в данном описании относится к не ароматическому моноциклическому кольцу, которое может быть насыщено или содержит одну или более единиц ненасыщенности, содержащему от трех до четырнадцати атомов в кольце, где один или более атомов углерода кольца замещен гетероатомом, таким как N, S или O. В некоторых вариантах, кольцо содержит от трех до десяти атомов в кольце; в других вариантах, кольцо содержит от трех до шести атомов в кольце. В других вариантах, кольцо содержит от пяти до шести атомов в кольце. Термин включает конденсированные, спиро или мостиковые гетероциклические кольцевые системы. Термин также включает полициклические кольцевые системы, в которых гетероциклическое кольцо может быть конденсировано с одним или более не ароматическими карбоциклическими или гетероциклическими кольцами или одним или более ароматическими кольцами или их сочетанием, где радикал или место присоединения находится на гетероциклическом кольце.
Примеры гетероциклов включают, но не ограничены ими, пиперидинил, пиперизинил, пирролидинил, пиразолидинил, имидазолидинил, азепанил, диазепанил, триазепанил, азоканил, диазоканил, триазоканил, оксазолидинил, изоксазолидинил, тиазолидинил, изотиазолидинил, оксазоканил, оксазепанил, тиазепанил, триазоканил, бензимидазолонил, тетрагидрофуранил, тетрагидропиранил, тетрагидротиофенил, морфолино, в том числе, например, 3-морфолино, 4-морфолино, 2-тиоморфолино, 3-тиоморфолино, 4-тиоморфолино, 1-пирролидинил, 2-пирролидинил, 3-пирролидинил, 1-тетрагидропиперазинил, 2-тетрагидропиперазинил, 3-тетрагидропиперазинил, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 1-пиразолинил, 3-пиразолинил, 4-пиразолинил, 5-пиразолинил, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-пиперидинил, 2-тиазолидинил, 3-тиазолидинил, 4-тиазолидинил, 1-имидазолидинил, 2-имидазолидинил, 4-имидазолидинил, 5-имидазолидинил, индолинил, тетрагидрохинолинил, тетрагидроизохинолинил, тиенотиенил, тиенотиазолил, бензотиоланил, 3-(1-алкил)бензимидазол-2-онил и 1,3 дигидроимидазол-2-онил.
Циклические группы (например, циклоалифатическая и гетероциклы) могут быть линейно конденсированными, мостиковыми или спироциклическими.
Термин “гетероатом” означает один или более из кислорода, серы, азота, фосфора или кремния (включая любую окисленную форму азота, серы, фосфора или кремния; кватернизированную форму любого основного азота или; замещаемый азот гетероциклического кольца, например, N (как в 3,4-дигидро-2H-пирролиле), NH (как в пирролидиниле) или NR+ (как в N-замещенном пирролидиниле)).
Термин "ненасыщенная" в данном описании означает, что часть имеет одну или более единиц ненасыщенности. Как известно специалисту в данной области техники, не насыщенные группы могут быть частично не насыщены или полностью не насыщены. Примеры частично ненасыщенных групп включают, но не ограничены ими, бутен, циклогексен и тетрагидропиридин. Полностью не насыщенные группы могут быть ароматическими, анти-ароматическими или не ароматическими. Примеры полностью не насыщенных групп включают, но не ограничены ими, фенил, циклооктатетраен, пиридил, тиенил и 1-метилпиридин-2(1H)-он.
Термин “алкокси” или “тиоалкил” в данном описании относится к алкильной группе, как определено выше, присоединенной к молекуле через атом кислорода (“алкокси”, например, -O-алкил) или серы (“тиоалкил”, например, -S-алкил).
Термины “галоалкил”, “галоалкенил”, “галоалифатический” и “галоалкокси” означают алкил, алкенил или алкокси, в зависимости от обстоятельств, замещенный одним или более атомами галогена. Этот термин включает перфторированные алкильные группы, такие как -CF3 и -CF2CF3.
Термины “галоген”, “гало” и “гал” означают F, Cl, Br или I.
Термин “арил”, применяемый отдельно или как часть большей группы, как в “аралкиле”, “аралкокси” или “арилоксиалкиле”, относится к карбоциклическим ароматическим кольцевым системам. Термин “арил” может применяться взаимозаменяемо с термином “арильное кольцо”.
Карбоциклические ароматические кольцевые группы содержат только атомы углерода в кольце (обычно от шести до четырнадцати) и включают моноциклические ароматические кольца, такие как фенил, и конденсированные полициклические ароматические кольцевые системы, в которых два или более карбоциклических ароматических колец конденсированы друг с другом. Примеры включают 1-нафтил, 2-нафтил, 1-антрацил и 2-антрацил. Также в объем термина “карбоциклическое ароматическое кольцо” в данном описании включена группа, в которой ароматическое кольцо конденсировано с одним или более не ароматическими кольцами (карбоциклическим или гетероциклическим), такими как инданил, фталимидил, нафтимидил, фенантридинил или тетрагидронафтил, где радикал или место присоединения находится на ароматическом кольце.
Термин “гетероарил”, “гетероароматическая”, “гетероарильное кольцо”, “гетероарильная группа” и “гетероароматическая группа”, применяемый отдельно или как часть большей группы, такой как “гетероаралкил” или “гетероарилалкокси”, относится к гетероароматической кольцевой группе, содержащей от пяти до четырнадцати членов, включая моноциклические гетероароматические кольца и полициклические ароматические кольца, в которых моноциклическое ароматическое кольцо конденсировано с одним или более другим ароматическим кольцом. Гетероарильные группы содержат один или более гетероатомов в кольце. Также в объем термина “гетероарил” в данном описании включена группа, в которой ароматическое кольцо конденсировано с одним или более не ароматическими кольцами (карбоциклическим или гетероциклическим), где радикал или место присоединения находятся на ароматическом кольце. Бициклическим 6,5 гетероароматическим кольцом в данном описании, например, является шестичленное гетероароматическое кольцо, конденсированное со вторым пятичленным кольцом, где радикал или место присоединения находятся на шестичленном кольце.
Должно быть понятно, что 5-10-членный гетероарил включает и моноциклические и бициклические кольца. Например, он может включать 5-6-членные моноциклические кольца, содержащие 1-4 гетероатома, выбранных из кислорода, азота или серы, и 8-10-членные бициклические кольца, содержащие 1-6 гетероатомов, выбранных из кислорода, азота или серы.
Примеры гетероарильных групп включают пиридил, пиразинил, пиримидинил, пиридазинил, имидазолил, пирролил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил или тиадиазолил, включая, например, 2-фуранил, 3-фуранил, N-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-оксадиазолил, 5-оксадиазолил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 3-пиразолил, 4-пиразолил, 1-пирролил, 2-пирролил, 3-пирролил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 3-пиридазинил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-триазолил, 5-триазолил, тетразолил, 2-тиенил, 3-тиенил, карбазолил, бензимидазолил, бензотиенил, бензофуранил, индолил, бензотриазолил, бензотиазолил, бензоксазолил, бензимидазолил, изохинолинил, индолил, изоиндолил, акридинил, бензизоксазолил, изотиазолил, 1,2,3-оксадиазолил, 1,2,5-оксадиазолил, 1,2,4-оксадиазолил, 1,2,3-триазолил, 1,2,3-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил, пуринил, пиразинил, 1,3,5-триазинил, хинолинил (например, 2-хинолинил, 3-хинолинил, 4-хинолинил) и изохинолинил (например, 1-изохинолинил, 3-изохинолинил или 4-изохинолинил).
Термины “защищающая группа” и “защитная группа” в данном описании являются взаимозаменяющими и относятся к агенту, применяемому для временного блокирования одной или более желаемых функциональных групп в соединении с множеством реакционноспособных мест. В определенных вариантах, защитная группа имеет одну или более, или, предпочтительно, все, из следующих характеристик: a) ее добавляют селективно к функциональной группе с хорошим результатом для получения защищенного субстрата, который б) устойчив к реакциям, проходящим на одном или более реакционноспособных мест; и в) она селективно удаляется с хорошим результатом реагентами, которые не взаимодействуют с восстановленной, со снятой защитой функциональной группой. Специалисту в данной области техники понятно что, в некоторых случаях, реагенты не взаимодействуют с другими реакционноспособными группами в соединении. В других случаях, реагенты могут также взаимодействовать с другими реакционноспособными группами в соединении. Примеры защитных групп подробно представлены у Greene, T.W., Wuts, P. G в “Protective Groups in Organic Synthesis”, Third Edition, John Wiley & Sons, New York: 1999 (и другие издатели книги), полное содержание которой включено сюда в качестве ссылки. Термин “азотная защитная группа” в данном описании относится к агенту, применяемому для временного блокирования одной или более желаемых азотных реакционноспособных мест в соединении с множеством функциональных групп. Предпочтительные азотные защитные группы также обладают характеристиками, представленными для указанной выше защитной группы, и определенные типовые азотные защитные группы также подробно описаны в главе 7 у Greene, T.W., Wuts, P. G в “Protective Groups in Organic Synthesis”, Third Edition, John Wiley & Sons, New York: 1999, полное содержание которой включено сюда в качестве ссылки.
В некоторых вариантах, где это указано, метиленовая единица алифатической цепи необязательно замещена другим атомом или группой. Примеры таких атомов или групп включают, но не ограничены ими, -NR-, -O-, -C(O)-, -C(=N-CN)-, -C(=NR)-, -C(=NOR)-, -S-, -S(O)- и -S(O)2-. Эти атомы или группы могут быть объединены с получением больших групп. Примеры таких больших групп включают, но не ограничены ими, -OC(O)-, -C(O)CO-, -CO2-, -C(O)NR-, -C(=N-CN), -NRC(O)-, -NRC(O)O-, -S(O)2NR-, -NRSO2-, -NRC(O)NR-, -OC(O)NR- и -NRSO2NR-, где R является, например, H или C1-6алифатической, или другим образом определена здесь.
Должно быть понятно, что эти группы могут быть связаны с метиленовыми единицами алифатической цепи через одинарные, двойные или тройные связи. Примером необязательного замещения (атом азота в данном случае), которое связано с алифатической цепью через двойную связь, является -CH2CH=N-CH3. В некоторых случаях, особенно на концах, необязательное замещение может быть связано с алифатической группой через тройную связь. Одним из примеров этого является CH2CH2CH2C N. Должно быть понятно, что в таком случае концевой азот не связан с другим атомом.
N. Должно быть понятно, что в таком случае концевой азот не связан с другим атомом.
Также должно быть понятно, что термин “метиленовая единица” также может относиться к разветвленным или замещенным метиленовым единицам. Например, в изопропильной части [-CH(CH3)2] атом азота (например, NR), замещающий первую из перечисленных “метиленовых единиц” образует диметиламин [-N(CH3)2]. В таких случаях как этот специалист в данной области техники поймет, что атом азота не будет иметь другие дополнительные атомы, связанные с ним, и “R” из “NR” будет отсутствовать в этом случае.
Термины “углеродные единицы” и “метиленовые единицы” являются взаимозаменяемыми. Должно быть понятно, что эти термины относятся к углеродным единицам алифатической группы с различным порядком связывания, таким как четыре отдельные “метиленовые единицы”, показанные в углеводороде ниже: HC=CH-CH2C CH.
CH.
Только такое замещение и сочетание групп дает стабильную структуру, которая рассматривается. Необязательные заместители могут появляться как в самой цепи, так и на любом конце цепи; т.е. и в месте присоединения, и/или на концах. Два необязательных замещения могут быть рядом друг с другом в цепи, если это дает химически стабильное соединение. Необязательные замещения также могут полностью замещать все атомы углерода в цепи. Например, C3 алифатическая может быть необязательно замещена -NR-, -C(O)- и -NR- с получением -NRC(O)NR- (мочевины).
Если не указано иначе, если замещение имеет место на конце, замещающий атом связан с H на конце. Например, если -CH2CH2CH3 необязательно замещена -O-, полученным соединением ожжет быть -OCH2CH3, -CH2OCH3 или -CH2CH2OH. Должно быть понятно, что если концевой атом не содержит электроны со свободной валентностью, то атом водорода на конце не требуется (например, -CH2CH2CH=O или -CH2CH2C N).
N).
Если не указано иначе, изображенные здесь структуры также включают все изомерные (например, энантиомерные, диастереомерные, геометрические, конформационные и ротационные) формы структуры. Например, R и S конфигурации для каждого асимметрического центра, (Z) и (E) изомеры с двойной связью и (Z) и (E) конформационные изомеры включены в данное изобретение. Специалисту в данной области техники понятно, что заместитель может свободно вращаться вокруг любых вращающихся связей. Например, заместитель, изображенный как  , также является
, также является  .
.
Поэтому отдельные стереохимические изомеры, а также энантиомерные, диастереомерные, геометрические, конформационные и ротационные смеси соединений в соответствии с данным изобретением включены в объем данного изобретения.
Если не указано иначе, все таутомерные формы соединений в соответствии с данным изобретением включены в объем данного изобретения.
В соединениях в соответствии с данным изобретением любой атом, который отдельно не обозначен как конкретный изотоп, представляет любой стабильный изотоп этого атома. Если не указано иначе, когда положение обозначено конкретно как "H" или "водород", понимается, что положение содержит водород в его естественной, распространенной в природе изотопной композиции. Также, если не указано иначе, если положение обозначено конкретно как "D" или "дейтерий", понимается, что положение содержит дейтерий в избытке, который, по крайней мере, в 3340 раз больше, чем природная форма дейтерия, которая составляет 0,015% (т.е., по крайней мере, 50,1% введения дейтерия).
"D" и "d" оба относятся к дейтерию.
Дополнительно, если не указано иначе, изображенные здесь структуры также включают соединения, которые отличаются только присутствием одного или более насыщенного изотопами атома. Например, соединения, имеющие данные структуры, за исключением замены водорода дейтерием или тритием или замены атома углерода 13C- или 14C-обогащенным углеродом, включены в объем данного изобретения. Такие соединения применяют, например, в качестве аналитических инструментов или проб в биологических исследованиях.
Как описано здесь, где указано, соединения в соответствии с данным изобретением могут необязательно быть замещены одним или более заместителями, такими как показаны здесь или представлены конкретными классами, подклассами и видами в соответствии с данным изобретением. Должно быть понятно, что фраза “необязательно замещенный” применялась взаимозаменяемо с фразой “замещенный или незамещенный”. В общем, термин “замещенный”, с дополнительным определением “необязательно” или нет, относится к замещению водородных радикалов в данной структуре радикалом указанного заместителя. Если не указано иначе, необязательно замещенная группа может иметь заместитель в каждом замещаемом положении группы, и если более одного положения в любой данной структуре могут быть замещены более чем одним заместителем, выбранным из указанной группы, заместители могут быть одинаковыми или разными в каждом положении.
Рассматриваются только такие выборы и сочетания заместителей, которые дают стабильную структуру. Такие выборы и сочетания очевидны специалисту в данной области техники и могут быть определены без излишних экспериментов.
Термин “атом кольца” относится к атому, такому как C, N, O или S, который находится в кольце ароматической группы, циклоалкильной группы или не ароматического гетероциклического кольца.
“Замещаемым атомом кольца” в ароматической группе является атом углерода или азота кольца, связанный с атомом водорода. Водород может быть необязательно замещен подходящей замещающей группой. Таким образом, термин “замещаемый атом кольца” не включает атомы азота или углерода кольца, которые являются общими, если два кольца конденсированы. Кроме того, “замещаемый атом кольца” не включает атомы углерода или азота кольца, если изображена структура, которая уже присоединена к группе, отличной от водорода.
Арильная группа, такая как определена здесь, может содержать один или более подходящих атомов в кольце, которые могут быть связаны с подходящим заместителем. Примеры подходящих заместителей на замещаемом атоме углерода кольца арильной группы включают R'. R' является -Ra, -Br, -Cl, -I, -F, -ORa, -SRa, -O-CORa, -CORa, -CSRa, -CN, -NO2, -NCS, -SO3H, -N(RaRb), -COORa, -NRcNRcCORa, -NRcNRcCO2Ra, -CHO, -CON(RaRb), -OC(O)N(RaRb), -CSN(RaRb), -NRcCORa, -NRcCOORa, -NRcCSRa, -NRcCON(RaRb), -NRcNRcC(O)N(RaRb), -NRcCSN(RaRb), -C(=NRc)-N(RaRb), -C(=S)N(RaRb), -NRd-C(=NRc)-N(RaRb), -NRcNRaRb, -S(O)pNRaRb, -NRcSO2N(RaRb), -NRcS(O)pRa, -S(O)pRa, -OS(O)pNRaRb или -OS(O)pRa; где p является 1 или 2.
Ra-Rd каждый независимо являются -H, алифатической группой, ароматической группой, неароматической карбоциклической или гетероциклической группой, или -N(RaRb), взятые вместе, образуют неароматическую гетероциклическую группу. Алифатическая, ароматическая и неароматическая гетероциклическая группа, представленная Ra-Rd, и неароматическая гетероциклическая группа, представленная -N(RaRb), необязательно и независимо замещены одним или более группами, представленными R#. Предпочтительно, Ra-Rd не замещены.
R# является галогеном, R+, -OR+, -SR+, -NO2, -CN, -N(R+)2, -COR+, -COOR+, -NHCO2R+, -NHC(O)R+, -NHNHC(O)R+, -NHC(O)N(R+)2, -NHNHC(O)N(R+)2, -NHNHCO2R+, -C(O)N(R+)2, -OC(O)R+, -OC(O)N(R+)2, -S(O)2R+, -SO2N(R+)2, -S(O)R+, -NHSO2N(R+)2, -NHSO2R+, -C(=S)N(R+)2 или -C(=NH)-N(R+)2.
R+ является -H, C1-C4 алкильной группой, моноциклической арильной группой, неароматической карбоциклической или гетероциклической группой, каждая из которых необязательно замещена алкилом, галогеналкилом, алкокси, галогеналкокси, галогеном, -CN, -NO2, амином, алкиламином или диалкиламин. Предпочтительно, R+ не замещен.
Алифатическая или неароматическая гетероциклическая или карбоциклическая группа в данном описании может содержать один или более заместителей. Примером подходящих заместителей для алифатической группы или атома углерода кольца не ароматической гетероциклической группы является R''. R'' включает заместители, перечисленные выше для R', и =O, =S, =NNHR**, =NN(R**)2, =NNHC(O)R**, =NNHCO2(алкил), =NNHSO2(алкил), =NR**, спиро циклоалкильную группу или конденсированную циклоалкильную группу. Каждый R** независимо выбирают из водорода, незамещенной алкильной группы или замещенной алкильной группы. Примеры заместителей на алкильной группе, представленной R**, включают амино, алкиламино, диалкиламино, аминокарбонил, галоген, алкил, алкиламинокарбонил, диалкиламинокарбонил, алкиламинокарбонилокси, диалкиламинокарбонилокси, алкокси, нитро, циано, карбокси, алкоксикарбонил, алкилкарбонил, гидрокси, галогеналкокси или галогеналкил.
Если гетероциклильная, гетероарильная или гетероаралкильная группа содержит атом азота, он может быть замещен или не замещен. Если атом азота в ароматическом кольце гетероарильной группы имеет заместитель, азотом может быть четвертичный азот.
Предпочтительным положением для замещения не ароматической азотсодержащей гетероциклической группе является атом азота кольца. Подходящие заместители на азоте неароматической гетероциклической группы или гетероарильной группы включают -R^, -N(R^)2, C(O)R^, CO2R^, -C(O)C(O)R^, -SO2R^, SO2 N(R^)2, C(=S)N(R^)2, C(=NH)-N(R^)2 и -NR^SO2R^; где R^ является водородом, алифатической группой, замещенной алифатической группой, арилом, замещенным арилом, гетероциклическим или карбоциклическим кольцом или замещенным гетероциклическим или карбоциклическим кольцом. Примеры заместителей группы, представленной R^, включают алкил, галоалкокси, галоалкил, алкоксиалкил, сульфонил, алкилсульфонил, галоген, нитро, циано, гидрокси, арил, карбоциклическое или гетероциклическое кольцо, оксо, амино, алкиламино, диалкиламино, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонилокси, алкокси, карбокси, алкоксикарбонил или алкилкарбонил. Предпочтительно, R^ не замещен.
Не ароматические азотсодержащие гетероциклические кольца, которые замещены на азоте кольца и присоединены к остатку молекулы на атоме углерода кольца называют N замещенными. Например, N алкильная пиперидинильная группа присоединена к остатку молекулы в положении два, три или четыре пиперидинильного кольца и замещена на атоме азота кольца алкильной группой. Неароматические азотсодержащие гетероциклические кольца, такие как пиразинил, которые замещены на азоте кольца и присоединены к остатку молекулы через второй атом азота кольца называют N' замещенными-N-гетероциклами. Например, N' ацил N-пиразинильная группа присоединена к остатку молекулы на первом атоме азота кольца и замещена на атоме азота кольца ацильной группой.
В данном описании необязательно замещенный аралкил может быть замещен на алкильной и арильной части. Если не указано иначе, в данном описании необязательно замещенный аралкил необязательно замещен на арильной части.
Термины “связь” и “отсутствует” применяют взаимозаменяемо для обозначения того, что группа отсутствует.
Соединения в соответствии с данным изобретением определены здесь их химическими структурами и/или химическими наименованиями. Если соединение обозначено и химической структурой и химическим наименованием, и химическая структура и химическое наименование не совпадают, химическая структура является определяющей для идентификации соединения.
Соединения в соответствии с данным изобретением могут существовать в свободной форме для лечения или, где это приемлемо, в виде фармацевтически приемлемой соли.
Фармацевтически приемлемые соли
В данном описании, термин "фармацевтически приемлемая соль" относится к солям соединения, которые, с точки зрения медицинской практики, подходят для применения в контакте с тканями человека и низших животных без возникновения побочных эффектов, таких как, токсичность, раздражение, аллергическая реакция и подобные, и соизмеримы с разумным соотношением польза/риск.
Фармацевтически приемлемые соли хорошо известны в данной области техники. Например, S. M. Berge et al., подробно описывают фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 1977, 66, 1-19, включенной сюда в качестве ссылки. Фармацевтически приемлемые соли соединений в соответствии с данным изобретением включают соли, полученные из подходящих неорганических и органических кислот и оснований. Эти соли могут быть получены in situ во время конечного выделения и очистки соединений. Кислотно-аддитивные соли могут быть получены 1) взаимодействием очищенного соединения в свободной форме с подходящей органической или неорганической кислотой и 2) выделением полученной соли.
Примеры фармацевтически приемлемых нетоксичных кислотно-аддитивных солей включают соли аминогруппы, образованные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и перхлорная кислота, или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или с применением других способов, применяемых в данной области техники, таких как ионный обмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, гликолат, глюконат, гликолат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, пальмоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, салицилат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат и подобные.
Основно-аддитивные соли могут быть получены 1) взаимодействием очищенного соединения в кислой форме с подходящим органическим или неорганическим основанием и 2) выделением полученной соли. Соли, полученные из подходящих оснований, включают соли щелочного металла (например, натрия, лития и калия), щелочноземельного металла (например, магния и кальция), аммония и N+(C1-4алкила)4. Данное изобретение также рассматривает кватернизацию любых основных азотсодержащих групп соединений в соответствии с данным изобретением. Водо- или маслорастворимые или диспергируемые продукты могут быть получены такой кватернизацией.
Другие фармацевтически приемлемые соли включают, если они применимы, нетоксичные катионы аммония, четвертичного аммония и амина, полученные с применением противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрит, низший алкилсульфонат и арилсульфонат. Другие кислоты и основания, которые сами по себе не являются фармацевтически приемлемыми, могут применяться для получения солей, применяемых в качестве промежуточных соединений для получения соединений в соответствии с данным изобретением и их фармацевтически приемлемых кислотно- или основно-аддитивных солей.
Должно быть понятно, что данное изобретение включает смеси/сочетания различных фармацевтически приемлемых солей, а также смеси/сочетания соединений в свободной форме и фармацевтически приемлемых солей.
Кроме соединений в соответствии с данным изобретением, фармацевтически приемлемые производные или пролекарства соединений в соответствии с данным изобретением также могут применяться в композициях для лечения или профилактики указанных здесь расстройств.
В данном описании и если не указано иначе, термин “пролекарство” означает производное соединения, которое может гидролизоваться, окисляться или другим образом взаимодействовать в биологических условиях (in vitro или in vivo) с получением соединения в соответствии с данным изобретением. Пролекарства могут становиться активными при таком взаимодействии в биологических условиях, или они могут быть активными в непрореагировавших формах. Примеры пролекарств, рассматриваемых в данном изобретении, включают, но не ограничены ими, аналоги или производные соединений в соответствии с данным изобретением, которые включают биогидролизуемые части, такие как биогидролизуемые амидные, биогидролизуемые сложные эфирные, биогидролизуемые карбаматные, биогидролизуемые карбонатные, биогидролизуемые уреидные и биогидролизуемые фосфатные аналоги. Другие примеры пролекарств включают производные соединений в соответствии с данным изобретением, которые содержат -NO, -NO2, -ONO или -ONO2 группы. Пролекарства обычно получают с применением хорошо известных способов, таких как те, которые описаны в BURGER'S MEDICINAL CHEMISTRY AND DRUG DISCOVERY (1995) 172-178, 949-982 (Manfred E. Wolff ed., 5th ed).
“Фармацевтически приемлемое производное” является продуктом присоединения или производным, которое, при введении пациенту при необходимости, способно обеспечивать, прямо или косвенно, соединение, описанное здесь, или его метаболит или остаток. Примеры фармацевтически приемлемых производных включают, но не ограничены ими, сложные эфиры и соли таких сложных эфиров.
“Фармацевтически приемлемое производное или пролекарство” включает любой фармацевтически приемлемый сложный эфир, соли сложного эфира или другие производное или его соль соединения в соответствии с данным изобретением, которое при введении реципиенту способно обеспечивать, прямо или косвенно, соединение в соответствии с данным изобретением или его метаболит или остаток, обладающий ингибирующим действием. Особенно предпочтительные производные или пролекарства включают такие, которые повышают биодоступность соединений в соответствии с данным изобретением при введении таких соединений пациенту (например, позволяют перорально вводимому соединению более легко абсорбироваться в кровь), или которые улучшают доставку исходного соединения в биологическую область (например, мозг или лимфатическую систему) в зависимости от видов пациентов.
Фармацевтически приемлемые пролекарства соединений в соответствии с данным изобретением включают, без ограничений, сложные эфиры, сложные эфиры аминокислоты, сложные эфиры фосфата, соли металлов и сложные эфиры сульфоната.
В данном описании, фраза “побочные эффекты” охватывает нежелательные и вредные эффекты терапии (например, профилактического или терапевтического агента). Побочные эффекты всегда нежелательны, но нежелательные эффекты не обязательно являются неблагоприятными. Неблагоприятный эффект терапии (например, профилактического или терапевтического агента) может быть опасным или вызывающим дискомфорт или рисковым. Побочные эффекты включают, но не ограничены ими, лихорадку, озноб, вялость, желудочно-кишечные токсичности (в том числе язвы и эрозии желудка и кишечника), тошноту, рвоту, нейротоксичности, нефротоксичности, почечные токсичности (включая такие состояния, как папиллярный некроз и хронический интерстициальный нефрит), печеночные токсичности (в том числе повышение уровня ферментов в сыворотке печени), миелотоксичности (в том числе лейкопению, миелодепрессии, тромбоцитопению и анемию), сухость во рту, металлический привкус, перехаживание беременности, слабость, сонливость, боли (в том числе боли в мышцах, боли в костях и головную боль), выпадение волос, слабость, головокружение, экстра-пирамидальные симптомы, акатизию, сердечнососудистые нарушения и половые дисфункции.
В одном варианте данным изобретением является фармацевтическая композиция, содержащая соединение в соответствии с данным изобретением и фармацевтически приемлемый носитель, разбавитель, адъювант или наполнитель. В одном варианте, данным изобретением является фармацевтическая композиция, содержащая эффективное количество соединения в соответствии с данным изобретением и фармацевтически приемлемый носитель, разбавитель, адъювант или наполнитель. Фармацевтически приемлемые носители включают, например, фармацевтические разбавители, наполнители или носители, подходящим образом выбранные в соответствии с предполагаемой формой введения и согласующиеся с обычной фармацевтической практикой.
Фармацевтически приемлемый носитель может содержать инертные ингредиенты, которые не чрезмерно ингибирует биологическую активность соединений. Фармацевтически приемлемые носители должны быть биосовместимыми, например, не токсичными, не воспламеняющимися, не иммуногенными или должны избегать других нежелательных реакций или побочных эффектов при введении пациенту. Могут применяться стандартные методы получения фармацевтических составов.
Фармацевтически приемлемый носитель, адъювант или наполнитель, в данном описании, включает любые и все растворители, разбавители и другие жидкие наполнители, добавки для диспергирования или суспендирования, поверхностно-активные агенты, изотонические агенты, загущающие или эмульгирующие агенты, консерванты, твердые связующие агенты, смазывающие агенты и подобные, которые подходят для конкретной желаемой лекарственной формы. В Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) описаны различные носители, применяемые для составления фармацевтически приемлемых композиций, и известные методики для их получения. За исключением случаев, когда какой-либо обычный носитель несовместим с соединениями в соответствии с данным изобретением, например, вызывает нежелательные биологические эффекты или другим образом неблагоприятно взаимодействует с любыми другими компонентами фармацевтически приемлемой композиции, его применения рассматривается в объеме данного изобретения.
Некоторые примеры материалов, которые могут быть фармацевтически приемлемыми носителями, включают, но не ограничены ими, ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота или сорбат калия, смеси неполных глицеридов насыщенные растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, кислый фосфат динатрия, кислый фосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, полиакрилаты, воски, полиэтилен-полиоксипропиленовые блок-сополимеры, ланолин, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как карбоксиметилцеллюлоза натрия, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; наполнители, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло; сафлоровое масло; кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли; такие как пропиленгликоль или полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт и фосфатные буферные растворы, а также другие не токсичные совместимые смазывающие агенты, такие как лаурилсульфат натрия и стеарат магния, а также красители, высвобождающие агенты, покрывающие агенты, подсластители, вкусовые добавки и ароматизаторы, консерванты и антиоксиданты также могут присутствовать в композиции, по мнению составителя.
Соединения в соответствии с данным изобретением или их фармацевтические соли могут быть составлены в фармацевтические композиции для введения пациенту, как определено здесь. Эти фармацевтические композиции, которые содержат количество соединения, эффективное для лечения или профилактики бактериальной инфекции, такой как ВЗК, и фармацевтически приемлемый носитель, являются другим вариантом данного изобретения.
В одном варианте данным изобретением является способ лечения или профилактики бактериальной инфекции, такой как ВЗК, у пациента, нуждающегося в таковом, включающий введение пациенту эффективного количества соединения или композиции в соответствии с данным изобретением.
В данном описании, термины “субъект”, “пациент” и “млекопитающее” применяются взаимозаменяемо. Термины “субъект” и “пациент” относятся к животному (например, птице, такой как курица, перепел или индейка, или млекопитающему), предпочтительно, млекопитающему, включая не приматов (например, корову, свинью, лошадь, овцу, кролика, морскую свинку, крысу, кошку, собаку и мышь) и приматов (например, обезьяну, шимпанзе и человека) и более предпочтительно, человека. В одном варианте, пациентом является не человекообразное животное, такое как сельскохозяйственное животное (например, лошадь, корова, свинья или овца) или домашнее животное (например, собака, кошка, морская свинка или кролик). В предпочтительном варианте, субъектом является человек.
В данном описании, “эффективное количество” относится к количеству, достаточному для вызова желаемой биологической реакции. В данном изобретении делаемой биологической реакцией является снижение или облегчение тяжести, длительности, развития или наступления бактериальной инфекции, предотвращение развития бактериальной инфекции, вызывая регрессию бактериальной инфекции, предотвращение повторного наступления, развития, наступления или развития симптома, связанного с бактериальной инфекцией, или усиления или улучшения профилактического или терапевтического эффектов другой терапии. Точное количество соединения, вводимого пациенту, зависит от способа введения, типа и тяжести заболевания или состояния и от характеристик пациента, таких как общее состояние здоровья, возраст, пол, масса тела и толерантность к лекарственным средствам. Оно также зависит от степени, тяжести и типа бактериальной инфекции и способа введения. Специалист в данной области техники способен определить дозировку в зависимости от этих и других факторов. При совместном введении с другими агентами, например, при совместном введении с агентом для лечения бактериальных инфекций, “эффективное количество” второго агента будет зависеть от типа применяемого лекарственного средства. Подходящие дозировки известны для утвержденных агентов и могут быть скорректированы специалистом в данной области техники в соответствии с состоянием субъекта, типом лечимого состояния и количеством применяемого соединения в соответствии с данным изобретением. В случаях, когда количество не указано, эффективное количество может быть предположено.
В данном описании термины “лечить”, “лечение” и “лечится” относятся к снижению или облегчению развития, тяжести и/или длительности бактериальной инфекции, или облегчению одного или более симптомов (предпочтительно, одного или более заметных симптомов) бактериальной инфекции, которые получаются при введении одной или более терапий (например, одного или более терапевтических агентов, таких как соединение в соответствии с данным изобретением). В конкретных вариантах, термины “лечить”, “лечение” и “лечится” относятся к облегчению, по крайней мере, одного измеримого физического параметра бактериальной инфекции. В других вариантах термины “лечить”, “лечение” и “лечится” относятся к ингибированию развития бактериальной инфекции, либо физически, например, стабилизацией измеримого симптома, либо физиологически, например, стабилизацией физического параметра или обоих. В других вариантах, термины “лечить”, “лечение” и “лечится” относятся к снижению или стабилизации бактериальной инфекции.
В данном описании, термины “предотвращать”, “профилактика” и “предотвращение” относятся к снижению риска возникновения или развития данной бактериальной инфекции или к снижению или ингибированию повторного наступления бактериальной инфекции. В одном варианте, соединение в соответствии с данным изобретением вводят в качестве профилактической меры пациенту, предпочтительно, человеку, имеющему генетическую предрасположенность к любому из состояний, заболеваний или расстройств, описанных здесь.
Фармацевтически приемлемые композиции в соответствии с данным изобретением могут вводиться человеку и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, внутрибрюшинно, местно (в виде порошков, мазей или капель), буккально, в виде перорального или назального спрея и подобных в зависимости от тяжести лечимой инфекции.
Жидкие лекарственные формы для перорального введения включают, но не ограничены ими, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Кроме активных соединений жидкие лекарственные формы могут содержать инертный разбавитель, обычно применяемый в данной области техники, такой как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензил бензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, зародышевое, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирной кислоты сорбитана, и их смеси. Кроме инертных разбавителей, пероральные композиции могут также включать адъюванты, такие как смачивающие агенты, подсластители, вкусовые добавки и отдушки.
Препараты для инъекций, например, стерильные водные или масляные суспензии для инъекций, могут быть составлены в соответствии с известным уровнем техники с применением подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильные препараты для инъекций также могут включать стерильные растворы, суспензии или эмульсии для инъекций в не токсичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Приемлемые наполнители и растворители, которые могут применяться, включают воду, раствор Рингера, U.S.P. и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно применяют в качестве растворителя или суспендирующей среды. Для этой цели может применяться любое легкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, применяют для получения препаратов для инъекций.
Композиции для инъекций могут быть стерилизованы, например, фильтрацией через удерживающий бактерии фильтр или добавлением стерилизующих агентов в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде и другой стерильной среде для инъекций перед применением.
Для пролонгации эффекта соединения в соответствии с данным изобретением часто желательно замедлять абсорбцию соединения из подкожных или внутримышечных инъекций. Это может быть достигнуто применением жидкой суспензии кристаллического или аморфного материала с плохой растворимостью в воде. Скорость абсорбции соединения зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленная абсорбция парентерально введенного соединения достигается растворением или суспендированием соединения в масляном наполнителе. Депо формы для инъекций получают формированием микроинкапсулирующих матриц соединения в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от отношения соединения к полимеру и природы конкретного применяемого полимера, скорость выделения соединения может контролироваться. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Депо композиции для инъекций также получают улавливанием соединения в липосомы или микроэмульсии, которые совместимы с тканями тела.
Композиции для ректального или вагинального введения предпочтительно являются суппозиториями, которые могут быть получены смешиванием соединений в соответствии с данным изобретением с подходящими не раздражающими наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при температуре окружающей среды, но жидкие при температуры тела и, следовательно, плавятся в прямой кишке или вагинальной полости и выделяют активное соединение.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешивают с, по крайней мере, одним инертным фармацевтически приемлемым наполнителем или носителем, таким как цитрат натрия и фосфат дикальция и/или a) наполнителями или разбавителями, такими как крахмалы, лактоза, сахароза, глюкоза., манит и кремниевая кислота, b) связующими агентами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и аравийская камедь, c) смачивающими агентами, такими как глицерин, d) разрыхляющими агентами, такими как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, определенные силикаты и карбонат натрия, e) замедлителями раствора, такими как парафин, f) усилителями абсорбции, такими как соединения четвертичного аммония, g) смачивающими агентами, такими как, например, цетиловый спирт и моностеарат глицерина, h) абсорбентами, такими как каолин и бентонит, и i) смазывающими агентами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул и пилюль, лекарственная форма также может содержать буферные агенты.
Твердые композиции подобного типа также могут применяться в качестве наполнителей в мягких или твердых желатиновых капсулах с применением таких наполнителей, как лактоза и молочный сахар, а также высокомолекулярные полиэтиленгликоли и подобные. Твердые лекарственные формы в виде таблеток, драже, капсул и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области составления фармацевтических средств. Они могут необязательно содержать средства, придающие непрозрачность, а также могут представлять собой композицию, которая выделяет активный ингредиент(ы) только или предпочтительно в определенной части кишечного тракта, необязательно, с замедлением. Примеры заделывающих композиций, которые могут применяться, включают полимерные вещества и воски. Твердые композиции подобного типа также могут применяться в качестве наполнителей для мягких и твердых желатиновых капсул с применением таких наполнителей, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и подобные.
Активные соединения также могут быть в микроинкапсулированной форме с одним или более наполнителями, описанными выше. Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия, контролирующие выделения покрытия и другие покрытия, хорошо известные в области составления фармацевтических средств. В таких твердых лекарственных формах активное соединение может быть смешано с, по крайней мере, одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы также могут содержать, в качестве обычно практики, дополнительные вещества, отличные от инертных разбавителей, например, таблетирующие смазывающие агенты и другие таблетирующие добавки, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль, лекарственные формы также могут содержать буферные агенты. Они могут необязательно содержать агенты, придающие непрозрачность, и также могут представлять собой композицию, которая выделяет активный ингредиент(ы) только или предпочтительно в определенной части кишечного тракта, необязательно, с замедлением. Примеры заделывающих композиций, которые могут применяться, включают полимерные вещества и воски.
Лекарственные формы для местного или чрезкожного введения соединения в соответствии с данным изобретением включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, лекарственные формы для ингаляций и пластыри. Активный компонент смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, которые могут потребоваться. Офтальмологические композиции, ушные капли и глазные капли также включены в объем данного изобретения. Дополнительно, данное изобретение охватывает применение чрезкожных пластырей, которые имеют дополнительное преимущество, заключающееся в контролируемой доставке соединения в тело. Такие лекарственные формы могут быть получены растворением или диспергированием соединения в подходящей среде. Улучшители абсорбции также могут применяться для увеличения прохождения соединения через кожу. Скорость может контролироваться либо контролирующей скорость мембраной, либо диспергированием соединения в полимерную матрицу или гель.
Композиции в соответствии с данным изобретением могут вводиться перорально, парентерально, ингаляцией спрея, местно, ректально, назально, буккально, вагинально или через имплантированный резервуар. Термин "парентеральное" в данном описании включает, но не ограничено ими, подкожную, внутривенную, внутримышечную, внутрисуставную, внутрисиновиальную, интрастернальную, интратекальную, внутрипеченочную, внутриочаговую и внутричерепную инъекцию или инфузию. Предпочтительно, композиции вводят перорально, внутрибрюшинно или внутривенно.
Стерильные формы для инъекций композиций в соответствии с данным изобретением могут быть водной или масляной суспензией. Эти суспензии могут быть составлены методами, известным в данной области техники, с применением подходящих диспергирующих и смачивающих агентов и суспендирующих агентов. Стерильный препарат для инъекций также может быть стерильным раствором или суспензией для инъекций в не токсичном парентерально приемлемом разбавителе или растворителе, например, раствором в 1,3-бутандиоле. Приемлемые наполнители и растворители, которые могут применяться, включают воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные нелетучие масла обычно применяют в качестве растворителя или суспендирующей среды. Для этой цели может применяться любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, применяют для получения препаратов для инъекций, которые являются природными фармацевтически приемлемыми маслами, такими как оливковое масло или касторовое масло, особенно в их полиоксиэтилированных версиях. Такие масляные растворы или суспензии также могут содержать длинноцепный спиртовой разбавитель или диспергирующий агент, такой как карбоксиметилцеллюлоза или подобные диспергирующие агенты, которые обычно применяют для составления фармацевтически приемлемых лекарственных форм, включая эмульсии и суспензии. Другие применяемые обычно поверхностно-активные вещества, такие как Tweens, Spans и другие эмульгирующие агенты или улучшители биодоступности, применяемые обычно в производстве фармацевтически приемлемых твердых, жидких или других лекарственных форм, также могут применяться для целей составления композиций.
Фармацевтические композиции в соответствии с данным изобретением могут вводиться перорально в любой перорально приемлемой лекарственной форме включающей, но не ограниченной ими, капсулы, таблетки, водные суспензии или растворы. Для таблеток для перорального применения применяемые обычно носители включают, но не ограничены ими, лактозу и кукурузный крахмал. Также обычно применяют смазывающие агенты, такие как стеарат магния. Для перорального введения в форме капсул полезные разбавители включают лактозу и кукурузный крахмал. При необходимости перорального введения водных суспензий, активный ингредиент объединяют с эмульгирующим и суспендирующим агентами. При желании также могут быть добавлены определенные подсластители, вкусовые добавки или красители.
Альтернативно, фармацевтические композиции в соответствии с данным изобретением могут вводиться в форме суппозиториев для ректального введения. Они могут быть получены смешиванием агента с подходящим не раздражающим наполнителем, который является твердым при комнатной температуре, но жидким при температуре прямой кишки и поэтому плавится в прямой кишке с выделением лекарственного средства. Такие материалы включают, но не ограничены ими, масло какао, пчелиный воск и полиэтиленгликоли.
Фармацевтические композиции в соответствии с данным изобретением также могут вводиться местно, особенно если цель лечения включает области или органы, легко доступные местным введением, включая заболевания глаз, кожи или нижнего кишечного тракта. Подходящие местные композиции легко получают для каждой из этих областей или органов.
Местное введения для нижнего кишечного тракта может быть достигнуто композицией в виде ректального суппозитория (см. выше) или в виде подходящей клизмы. Также могут применяться местные чрескожные пластыри.
Для местного введения фармацевтические композиции могут быть составлены в виде подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или более носителях. Носители для местного введения соединений в соответствии с данным изобретением включают, но не ограничены ими, минеральное масло, жидкий вазелин, вазелин, пропиленгликоль, полиоксиэтилен, соединение полиоксипропилена, эмульгирующий воск и воду. Альтернативно, фармацевтические композиции могут быть составлены в виде подходящего лосьона или крема, содержащего активные компоненты, суспендированные или растворенные в одном или более фармацевтически приемлемых носителях. Подходящие носители включают, но не ограничены ими, минеральное масло, моностеарат сорбитана, полисорбат 60, цетиловые эфиры, воск, цетеариловый спирт, 2 октилдодеканол, бензиловый спирт и воду.
Для офтальмологического применения фармацевтические композиции могут быть составлены в виде микронизированных суспензий в изотоническом, pH скорректированном стерильном физиологическом растворе, или, предпочтительно, в виде растворов в изотоническом pH скорректированном стерильном физиологическом растворе, с или без добавления консервантов, таких как хлорид бензилалкония. Альтернативно, для офтальмологического применения фармацевтическая композиция может быть составлены в мази, такой как вазелин.
Альтернативно, для офтальмологического применения, фармацевтические композиции могут быть составлены в виде мази, такой как вазелин.
Фармацевтические композиции в соответствии с данным изобретением также могут вводиться в применением назального аэрозоля или ингалятора. Такие композиции получают методами, хорошо известными в области получения фармацевтических композиций, и могут быть получены в виде растворов в физиологическом растворе, с применением бензилового спирта или других подходящих консервантов, промоторов абсорбции для улучшения биодоступности, фторуглеродов и/или обычных солюбилизирующих или диспергирующих агентов.
Режим дозирования с применением соединений в соответствии с данным изобретением может быть выбран в соответствии с множеством факторов, включая лечимое расстройство и тяжесть расстройства; активность конкретного применяемого соединения; конкретной применяемой композиции; возраста, массы тела, общего состояния здоровья, пола и режима питания пациента; времени введения, способа введения и скорости выведения конкретного применяемого соединения; функционирования почек и печени у пациента; и конкретного применяемого соединения или соли, длительности лечения; лекарственных средств, применяемых в сочетании или одновременно с конкретными применяемыми соединениями и подобных факторов, хорошо известных в области медицины. Специалист в данной области техники легко определит и пропишет эффективное количество соединения в соответствии с данным изобретением, требуемое для лечения, например, для профилактики, ингибирования (полного или частичного) или остановки развития заболевания.
Дозы соединений в соответствии с данным изобретением могут варьироваться от около 0,01 до около 100 мг/кг массы тела/сутки, от около 0,01 до около 50 мг/кг массы тела/сутки, от около 0,1 до около 50 мг/кг массы тела/сутки или от около 1 до около 25 мг/кг массы тела/сутки. Понятно, что общее количество в сутки может вводиться одной дозой или может вводиться множеством доз, например, дважды, трижды или четыре раза в сутки.
Соединения для применения в соответствии со способом данного изобретения могут быть составлены в стандартной лекарственной форме. Термин “стандартная лекарственная форма” относится к физически отдельным единицам, подходящим в качестве единичной дозы для пациентов, проходящих лечением, где каждая единица содержит предопределенное количество активного материала, рассчитанное для получения желаемого терапевтического эффекта, необязательно в сочетании с подходящим фармацевтическим носителем. Стандартная лекарственная форма может быть для единичной суточной дозы или для множества суточных доз (например, от около 1 до 4 или более раз в сутки). Если применяют множество доз, стандартная лекарственная форма может быть одинаковой или разной для каждой дозы.
Эффективное количество может быть достигнуто в способе или фармацевтической композиции в соответствии с данным изобретением с применением соединения в соответствии с данным изобретением или его фармацевтически приемлемой соли отдельно или в сочетании с дополнительным подходящим терапевтическим агентом, например, противораковым терапевтическим агентом. Если применяется комбинированная терапия, эффективное количество может быть достигнуто с применением первого количества соединения в соответствии с данным изобретением или его фармацевтически приемлемой соли и второго количества дополнительного подходящего терапевтического агента.
В одном варианте, соединение в соответствии с данным изобретением и дополнительный терапевтический агент, каждый вводят в эффективном количестве (т.е., каждый в количестве, которое было бы терапевтически эффективным при введении по отдельности). В другом варианте, соединение в соответствии с данным изобретением и дополнительный терапевтический агент, каждый вводят в количестве, которое отдельно не обеспечивает терапевтический эффект (суб-терапевтическая доза). В еще одном варианте, соединение в соответствии с данным изобретением может вводиться в эффективном количестве, в то время как дополнительный терапевтический агент вводят в субтерапевтической дозе. В другом варианте, соединение в соответствии с данным изобретением может вводиться в субтерапевтической дозе, а дополнительный терапевтический агент, например подходящий противораковый терапевтический агент, вводят в эффективном количестве.
В данном описании, термины “в сочетании” или “совместное введение” могут применяться взаимозаменяемо для обозначения применения более одной терапии (например, одного или более профилактических и/или терапевтических агентов). Применение терминов не ограничивает порядок, в котором терапевтические средства (например, профилактические и/или терапевтические агенты) вводят пациенту.
Совместное введение охватывает введение первого и второго количеств соединений, применяемых для совместного введения, практически одновременно, например, в одной фармацевтической композиции, например, капсуле или таблетке, содержащей фиксированное соотношение первого и второго количеств, или во множестве раздельных капсул или таблеток для каждого. Кроме того, такое совместное введение также охватывает применение каждого соединения последовательно в любом порядке.
Если совместное введение включает отдельное введение первого количества соединения в соответствии с данным изобретением и второго количества дополнительного терапевтического агента, соединения вводят достаточно близко во времени для получения желаемого терапевтического эффекта. Например, период времени между каждым введением, который может дать желаемый терапевтический эффект, может варьироваться от минут до часов и может быть определен с учетом свойств каждого соединения, таких как мощность, растворимость, биодоступность, период полувыведения из плазмы и кинетический профиль. Например, соединение в соответствии с данным изобретением и второй терапевтический агент могут вводиться в любом порядке с интервалом около 24 между введениями, с интервалом около 16 часов между введениями, с интервалом около 8 часов между введениями, с интервалом около 4 часов между введениями, с интервалом около 1 часа между введениями или с интервалом около 30 минут между введениями.
Более конкретно, первый терапевтический агент (например, профилактический или терапевтический агент, такой как соединение в соответствии с данным изобретением) может вводиться до (например, за 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часа, 12 часа, 24 часа, 48 часа, 72 часа, 96 часа, 1 неделю, 2 недель, 3 недель, 4 недель, 5 недель, 6 недель, 8 недель или 12 недель), одновременно с или после (например, через 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часа, 12 часа, 24 часа, 48 часа, 72 часа, 96 часа, 1 неделю, 2 недель, 3 недель, 4 недель, 5 недель, 6 недель, 8 недель или 12 недель) введения второго терапевтического агента (например, профилактического или терапевтического агента, такого как противораковый агент) пациенту.
Понятно, что способ совместного введения первого количества соединения в соответствии с данным изобретением и второго количества дополнительного терапевтического агента может обеспечить улучшенный или синергетический терапевтический эффект, где объединенный эффект больше, чем суммарный эффект, достигаемый при раздельном введении первого количества соединения в соответствии с данным изобретением и второго количества дополнительного терапевтического агента.
В данном описании, термин “синергетический” относится к сочетанию соединения в соответствии с данным изобретением и другого терапевтического агента (например, профилактического или терапевтического агента), которое более эффективно, чем суммарные эффекты терапевтических агентов. Синергетический эффект комбинированной терапии (например, сочетания профилактического или терапевтического агента) позволяет применять более низкие дозы одного или более терапевтических агентов и/или реже вводить указанные терапевтические агенты пациенту. Возможность применять пониженные дозы терапевтического агента (например, профилактического или терапевтического агента) и/или реже вводить указанные терапевтические агенты снижает токсичность, связанную с введением такого терапевтического агента, без снижения эффективности указанного терапевтического агента в профилактике, управлении или лечении расстройства. Кроме того, синергетический эффект может улучшить эффективность терапевтических агентов в профилактике, управлении или лечении расстройства. Наконец, синергетический эффект комбинированной терапии (например, сочетания профилактического или терапевтического агента) позволяет избежать или снизить неблагоприятные или нежелательные побочные эффекты, связанные с применением каждого терапевтического агента по отдельности.
Присутствие синергетического эффекта может быть определено с применением подходящих способов для оценки взаимодействия лекарственных средств. Подходящие способы включают, например, уравнение сигмоидальной кривой-Emax (Holford, N.H.G. и Scheiner, L.B., Clin. Pharmacokinet. 6: 429-453 (1981)), уравнение аддитивности Лоу (Loewe, S. и Muischnek, H., Arch. Exp. Pathol Pharmacol. 114: 313-326 (1926)) и уравнение медианного эффекта (Chou, T.C. и Talalay, P., Adv. Enzyme Regul. 22: 27-55 (1984)). Каждое указанное выше уравнение может применяться с экспериментальными данными для создания соответствующего графика, помогающего оценить эффекты сочетания лекарственных средств. Соответствующие графики, связанные с уравнениями, указанными выше, представляют собой кривую концентрация-эффект, кривую изоболограммы и кривую показателя аддитивности, соответственно.
Активность соединений в качестве ингибиторов бактериальной инфекции может быть оценена in vitro или in vivo. Анализы In vitro включают анализы, которые определяют ингибирования активности FimH. Анализы in vitro проводят количественный анализ способности ингибитора связываться с FimH и она может быть измерена либо введением радиоактивных меток в ингибитор перед связыванием, выделением комплекса ингибитора и определением количества радиомеченых связей, либо проведением соревновательного эксперимента, в котором новые ингибиторы инкубируют с FimH, связанным с известными радиолигандами. Подробные условия анализа соединения, применяемого в соответствии с данным изобретением, представлены в примерах ниже.
ПОДРОБНОСТИ ЭКСПЕРИМЕНТОВ
Представленные ниже аббревиатуры применяют в примерах ниже:
AcOH уксусная кислота
Ac2O уксусный ангидрид
водн. водный
BF3.OEt2 диэтилоксонио-трифтор-бор
CH3CN ацетонитрил
CCl3CN трихлорацетонитрил
CDCl3 хлороформ-D
конц. концентрат
ОК объем колонки
Cs2CO3 карбонат цезия
Cu(OAc)2 диацетоксимедь
CH2Cl2 метиленхлорид или дихлорметан
ДМАП 4-диметиламинопиридин
ДМФ диметилформамид
ДМСО диметилсульфоксид
Экв. эквивалент
EtOAc этилацетат
ч. час
Гекс. гексан
LiOH.H2O моногидрат гидроксида лития
M молярный
MeOH метанол
NaOMe метоксид натрия
мин минута
МС 4Å молекулярные сита 4 ангстрема
МТБЭ метил трет-бутиловый эфир
Na2SO4 сульфат натрия
NMO N-метилморфолин-N-оксид
OsO4 тетроксид осмия
PdCl2 хлорид палладия (II)
Pd(OAc)2 ацетат палладия(II)
PdCl2(dppf).CH2Cl2 дихлорид (1,1'-Бис-(дифенилфосфино)
ферроцен)палладия (II)
Pd(OH)2 дигидроксипалладий
Pd(PPh3)4 тетракис(трифенилфосфин) палладий
Pyr пиридин
КТ комнатная температура
Siliacat DPP-Pd дифенилфосфинпалладий на кремниевой
подложке
TBABr бромид тетрабутиламмония
ТЭА триэтиламин
ТГФ тетрагидрофуран
ТСХ тонкослойная хроматография
TMSOTf триметилсилил трифторметансульфонат
Соединения в соответствии с данным изобретением могут быть получены с учетом описания с применением стадий, в общем известных специалисту в данной области техники. Соединения могут быть анализированы известными способами, включая, но не ограничиваясь ими, ЖХ-МС (жидкостную хроматографию масс спектрометрию), ВЭЖХ (высокоэффективную жидкостную хроматографию) и ЯМР (ядерный магнитный резонанс). Должно быть понятно, что конкретные состояния, описанные ниже, являются только примерами и не ограничивают объем условий, которые могут применяться для получения соединений в соответствии с данным изобретением. Вместо этого, данное изобретение также включает условия, которые очевидны специалистам в данной области техники в свете этого описания для получения соединений в соответствии с данным изобретением. Если не указано иначе, все переменные в представленных ниже схемах такие, как определены здесь.
Масс спектральные образцы анализируют на масс спектрометре Waters UPLC Acquity, работающем в одном МС режиме с ионизацией электрораспылением. Образцы помещают в масс спектрометр с применением хроматографии. Подвижная фаза для масс спектр. анализа состоит из 0,1% муравьиной кислоты и смеси ацетонитрил-вода. Условия градиента колонки включают 5%-85% ацетонитрил-вода в течение более 6 минут времени прогона Acquity HSS T3 1,8 мкм 2,1 мм ВД×50 мм. Скорость потока составляет 1,0 мл/мин. В данном описании, термин “Ву(мин)” относится к ЖХ-МС времени удержания, в минутах, относящемуся к соединению. Если не указано иначе, способ ЖХ-МС применяют для получения записанного времени удержания как подробно описано выше.
Очистку ВЭЖХ с обращенной фазой проводят в стандартных условиях с применением либо Phenomenex Gemini 21,2 мм ВД×250 мм колонки (5 мкм), Gemini 21,2 мм ВД×75 мм колонки, (5 мкм), 110Å или в большинстве случаев, Waters XSELECT CSH Prep C18 (5 мкм) ODB 19×100 мм колонки. Элюирование проводят с применением линейного градиента CH3CN-H2O (с или без 0,01% ТФК буфера или 0,1% HCOH) в качестве подвижной фазы. Система растворителей рассчитана в соответствии с полярностью соединения, скоростью потока, 20 мл/мин. Соединения собирают либо УФ, либо детектором Waters 3100 Mass Detector, ИЭР положительный режим. Фракции, содержащие желаемое соединение, объединяют, концентрируют (роторный испаритель) для удаления избытка CH3CN, и полученный водный раствор лиофилизируют с получением желаемого продукта в большинстве случаев в идее белой пены.
ВЭЖХ аналитический способ проводят на Phenomenex Gemini C18 3 мкм 110Å 4,6 мм ВД×250 мм, Phenomenex Gemini C18 3 мкм 110 Å 4,6 мм ВД×50 мм, с применением различных сочетаний CH3CN-H2O (0,01% ТФК в качестве буфера) в качестве подвижной фазы, скорость потока 1 мл/мин, PDA 210 нм. Способ A: Phenomenex Gemini C18 3 мкм 110A 4,6 мм ВД×250 мм; (10-50% ацетонитрил-вода в течение 40 мин, 0,01% ТФК). Способ B: Phenomenex Gemini C18 3 мкм 110A 4,6 мм ВД×250 мм; (50-90% ацетонитрил-вода в течение 40 мин, 0,01% ТФК). Способ C: Phenomenex Gemini C18 3 мкм 110A 4,6 мм ВД×50 мм; (20-60% ацетонитрил-вода в течение 10 мин, 0,01% ТФК). Способ D: Phenomenex Gemini C18 3 мкм 110A 4,6 мм ВД×50 мм; (10-50% ацетонитрил-вода в течение 10 мин, 0,01% ТФК).
Общие способы синтеза: описанные здесь ПРИМЕРЫ получают следующими общими СПОСОБАМИ
СПОСОБ 1: Получение биарильных ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ типа III
Биарильные промежуточные соединения типа III получают (Схема 1) катализируемым палладием поперечным сочетанием между арилбороновой кислотой или арилпинаколовым боронатом типа I (коммерчески доступным или полученным из соответствующего галогенида) и арилгалогенидами типа II. Альтернативно, сочетающиеся партнеры включают арилбороновую кислоту или арилпинаколовый боронат типа IV (коммерчески доступный или полученный из соответствующего галогенида) и арилгалогениды типа V.
Схема 1

СПОСОБ 2: Синтез ПРИМЕРОВ формулы A и C
Соединения формулы A и C могут быть получены двухстадийным синтезом (Схема 2). Гликозилирование биарилов типа III может быть достигнуто тремя разными методами синтеза (Схема 2). Во-первых, активация аномерного производного O-ацетила типа VI кислотой Льюиса (BF3OEt2) в присутствии биарила типа III дает защищенный (ЗГ является Ac) маннозид типа VII. Альтернативно, гликозилирование биарилов типа III может быть достигнуто активацией трихлоримидата типа VIII трифлатом триметилсилила. Наконец, активация аномерного фторида типа IX бромидом ртути в присутствии биарилов типа III дает полностью защищенные маннозиды типа VII. Наконец, удаление защитной группы (омыление для ацетат и гидрогенолиз для бензилового эфира) на VII дает желаемые маннозиды типа X.
Схема 2

СПОСОБ 3: Синтез ПРИМЕРОВ формулы A и C
Альтернативно, маннозиды формулы A и C могут быть получены трехстадийным синтезом (Схема 3). Гликозилирование II в условиях, ранее описанных в способе 2, могут давать промежуточные соединения типа XI, которые могут быть подвергнуты катализированному палладием поперечному сшиванию с I для получения полностью защищенных маннозидов типа VII. Снятие защиты в описанных выше условиях дает желаемый маннозид типа X.
Схема 3

СПОСОБ 4: Синтез ПРИМЕРОВ формулы A и C
Альтернативно, маннозиды типа XI могут быть превращены в их соответствующие пинаколборонаты XII с последующим катализируемым палладием поперечным сшиванием с арилбромидами типа V с получением описанных ранее маннозидов VII (Схема 4).
Схема 4

СПОСОБ 5: Синтез ПРИМЕРОВ формулы D
Маннозиды формулы D могут быть получены в две стадии (Схема 5). Кислота Льюиса (например, BF3OEt2) способствует добавлению фенолов типа XIII на ацетат (E)-2-((3S,4S,5R,6R)-3,4,5-трис(бензилокси)-6-((бензилокси)метил)тетрагидро-2H-пиран-2-илиден)этила с получением спиро-маннозида XIV(см. Tetrahedron, 2010, 66, 5229-5234). Наконец, гидролиз бензильных защитных групп дает желаемые маннозиды типа XV.
Схема 5

СПОСОБ 6: Синтез ПРИМЕРОВ формулы B
Маннозиды формулы B могут быть получены двухстадийным синтезом (Схема 6). Трифлат триметилсилила способствует добавлению спиртов типа XVII в маннозиды типа XVI с получением α-O-маннозидов типа XVIII. Гидрогенолиз последнего дает желаемые маннозиды XIX.
Схема 6

СПОСОБ 7: Синтез ПРИМЕРОВ формулы E
Бис-маннозиды формулы E могут быть получены тремя параллельными способами синтеза, каждый из которых включает две стадии. Сначала катализируемое палладием сочетание пинаколбороната XII и галогенированного арила XX дает полностью защищенный бис-маннозид XXI. Удаление защитных групп с XXI дает желаемый бис-маннозид XXII. Альтернативно, галогенированные арилы XI и XX могут сочетаться непосредственно с применением палладиевого катализатора (см. J. Org. Chem. 2003, 68, 3938-3942 если X=Br и J. Org. Chem. 2012, 77, 2971-2977 если X=I). Наконец, двойное гликозидирование бис-фенола типа XXIII активацией аномерного производного O-ацетила типа VI кислотой Льюиса (например, BF3OEt2) также может дать желаемый полностью защищенный бис-маннозид XXI.
Схема 7

СПОСОБ 8: Синтез ПРИМЕРОВ формулы F
Бис-маннозиды формулы F могут быть получены в две стадии через двойное катализируемое палладием поперечное сшивание между пинаколборонатом XII и бис-галогенированным арилом или гетероарилом. Полученный бис-маннозид XXIV может быть далее лишен защиты в стандартных условиях с получением желаемого бис-маннозида XXV.
Схема 8

X является гало и ЗГ является подходящей гидроксильной защитной группой.
СПОСОБ 9: Синтез ПРИМЕРОВ формулы G
Маннозиды формулы G могут быть получены в одну стадию через двойное катализируемое палладием/медью сочетание Соногаширы между арилбромидом XXVI, полученным удалением защитных групп на XI, и TMS-ацетиленом.
Схема 9

СПОСОБ 10: Синтез ПРИМЕРОВ формулы H
Соединения формулы H могут быть получены в две стадии. Сначала, катализируемое палладием поперечное сшивание между арилбромидом XXIX и пинаколборонатом XXVIII дает желаемый биарил XXX. Удаление защитной группы дает желаемый бис-спиро-маннозид XXXI. Промежуточные соединения XXIX и XXVIII могут быть получены сочетанием, описанным в Способе 5, с применением подходящим образом замещенных фенолов.
Схема 10

Углеводородные ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ M1-M22, изображенные на фигуре 1, применяют при получении ПРИМЕРОВ, описанных здесь.
Фигура 1

Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M1
Триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-фтортетрагидро-2H-пиран-2,4,5-тритил

Указанное в заголовке соединение получают по методике, описанной в Angew. Chem. Int. Ed. 2010, 49, 8724-8728.
Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M2
(4aR,6R,7S,8S,8aR)-7-(бензилокси)-8-фтор-2-фенил-6-(фенилтио)гексагидропиранo[3,2-d][1,3]диоксин

Указанное в заголовке соединение получают по методике, описанной в JOC, 2007, 72, 1681-1690.
Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M3

Стадия I: триацетат (2R,3R,4S,5S,6R)-2-(ацетоксиметил)-6-(4-йодфенокси)тетрагидро-2H-пиран-3,4,5-тритила

К раствору коммерчески доступного ацетата [(2R,3R,4S,5S,6R)-3,4,5,6-тетраацетокситетрагидропиран-2-ил]метила (3,814 г, 9,771 ммоль) и 4-йодфенола (2,650 г, 12,05 ммоль) в 1,2-дихлорэтане (35 мл) при 0°С добавляют BF3.OEt2 (1,810 мл, 14,66 ммоль) по каплям. Реакционную смесь нагревают до КТ и перемешивают при 40°С в течение 12 ч. Реакционную смесь охлаждают до КТ, выливают в насыщенный водный NaHCO3 и разбавляют CH2Cl2. Органический слой отделяют и водный слой повторно промывают CH2Cl2. Объединенные органические фракции сушат над Na2SO4, фильтруют и концентрируют. Желаемое соединение очищают на колонке с силикагелем (100 г) с применением гексана/EtOAc (от 20 до 60% EA) в качестве элюента на системе Biotage™ с получением указанного в заголовке соединения (4,01 г, 75% выход).
Стадия II: (2R,3S,4S,5S,6R)-2-(((трет-бутилдифенилсилил)окси)метил)-6-(4-йодфенокси)тетрагидро-2H-пиран-3,4,5-триол

К раствору ацетата [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-6-(4-йодфенокси)тетрагидропиран-2-ил]метила со Стадии I (4,014 г, 7,29 ммоль) в MeOH (100 мл) добавляют NaOMe (1,58 мл 25% масс./об., 7,29 ммоль). Реакционную смесь перемешивают в течение ночи при КТ. Реакционную смесь гасят уксусной кислотой (420 мкл, 7,386 ммоль) и концентрируют. Остаток суспендируют в 500 мл Tol и смесь концентрируют in vacuo. Остаток частично растворяют в ДМФ (100 мл), охлаждают до 0°С и добавляют трет-бутилхлордифенилсилан (4,00 мл, 15,38 ммоль), затем 4H-имидазол (2,023 г, 29,72 ммоль). Реакционную смесь перемешивают 3 ч при 0°С, затем нагревают до КТ и перемешивают в течение двух дней. Полученную смесь выливают в H2O/Et2O (1/1). Органический слой отделяют, промывают водой (2x), солевым раствором, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают над толстым слоем силикагеля, элюируя 10, 20, 50 и 100% EtOAc в Гекс. с получением желаемого продукта (3,725 г, 82% выход)
Стадия III: трет-бутилдифенил(((2R,3R,4S,5S,6R)-3,4,5-трис(бензилокси)-6-(4-йодфенокси)тетрагидро-2H-пиран-2-ил)метокси)силан

К раствору трет-бутилдифенил(((2R,3R,4S,5S,6R)-3,4,5-трис(бензилокси)-6-(4-йодфенокси)тетрагидро-2H-пиран-2-ил)метокси)силана со Стадии II (3,725 г, 6,003 ммоль) и бензилбромида (2,90 мл, 24,4 ммоль) в ДМФ (30 мл) при 0°С добавляют порциями NaH (801 мг, 20,0 ммоль). Реакционную смесь нагревают до КТ и перемешивают в течение 12 ч. Реакционную смесь выливают в насыщенный водный раствора NH4Cl и экстрагируют Et2O. Органический слой промывают водой (дважды), солевым раствором, сушат над MgSO4, фильтруют и концентрируют. Полученную неочищенную смесь очищают на слое силикагеле с применением гексана/EtOAc (0, 2, 4% EA) в качестве элюента с получением указанного в заголовке соединения (4,002 г, 73% выход) в виде бесцветного масла.
Стадия IV: ((2R,3R,4S,5S,6R)-3,4,5-трис(бензилокси)-6-(4-йодфенокси)тетрагидро-2H-пиран-2-ил)метанол

К раствору трет-бутилдифенил(((2R,3R,4S,5S,6R)-3,4,5-трис(бензилокси)-6-(4-йодфенокси)тетрагидро-2H-пиран-2-ил)метокси)силана со Стадии III (4,002 г, 4,402 ммоль) в ТГФ (75 мл) добавляют уксусную кислоту (100 мкл, 1,76 ммоль), затем фторид тетрабутиламмония (10,6 мл 1M, 10,6 ммоль). Реакционную смесь перемешивают в течение ночи при КТ. Полученную смесь концентрируют in vacuo и остаток очищают на колонке с силикагелем (100 г) с применением гексана/EtOAc (от 10 до 30% EA) в качестве элюента на системе Biotage™ с получением указанного в заголовке соединения (2,583 г, 85% выход) в виде бесцветного масла.
Стадия V: ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ M3
К раствору ((2R,3R,4S,5S,6R)-3,4,5-трис(бензилокси)-6-(4-йодфенокси)тетрагидро-2H-пиран-2-ил)метанола со Стадии IV (444 мг, 0,646 ммоль) в CH2Cl2 (5,02 мл) при 0°С добавляют 2,3,4,6,7,8,9,10-октагидропиримидо[1,2-a]азепин (193 мкл, 1,293 ммоль), затем XtalFluor-E (163 мг, 0,711 ммоль). Реакционную смесь перемешивают при 0°С в течение 2 ч, выливают в насыщенный водный раствор NaHCO3 и разбавляют CH2Cl2. Органический слой отделяют, сушат над Na2SO4, фильтруют и концентрируют. Полученную неочищенную смесь очищают на колонке с силикагелем (25 г) с применением гексана/EtOAc (от 0 до 20% EA) в качестве элюента на системе Biotage™ с получением указанного в заголовке соединения (52 мг, 12% выход).
Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M4
тетраацетат (3S,4S,5R,6R)-6-(ацетоксиметил)-3-метилтетрагидро-2H-пиран-2,3,4,5-тетраила

Стадия I: (3aS,6R,6aS)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-3a-(гидроксиметил)-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ол

К суспензии (3aS,4S,6R,6aS)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ола (коммерчески доступен) (25,00 г, 96,1 ммоль) и K2CO3 (19,92 г, 144,1 ммоль) в MeOH (250,0 мл) добавляют муравьиную кислоту (37% в воде, 178,7 мл, 2,401 ммоль). Реакционную смесь перемешивают 64 ч при 95°C, охлаждают до 0°C, нейтрализуют (pH 7) водным H2SO4 (10%). Смесь перемешивают 15 мин при 0°C, затем полученный осадок отфильтровывают и маточную жидкость концентрируют в вакууме с получением бесцветного масла. Неочищенное масло растворяют в CH2Cl2 и органическую фазу промывают водой и солевым раствором. Раствор сушат над Na2SO4, фильтруют, концентрируют в вакууме и, наконец, очищают флэш-хроматографией на колонке (220 г двуокиси кремния) с применением 40-100% EtOAc/Гексана над 15 ОК с получением указанного в заголовке соединения (19,3 г, 66,5 ммоль, 69%).
Стадия II: (3aS,6R,6aS)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-3a-(гидроксиметил)-2,2-диметилдигидрофуро[3,4-d][1,3]диоксол-4(3aH)-он

В 3-горлую круглодонную колбу (3 л), оборудованную механической мешалкой и термопарой, добавляют (3aS,6R,6aS)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-3a-(гидроксиметил)-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ол со Стадии I (38 г, 130,9 ммоль), Cs2CO3 (23,58 г, 235,6 ммоль) и воду (1,33 л). Полученную смесь охлаждают до 3°C с применением бани лед/вода, затем добавляют Br2 (31,37 г, 10,11 мл, 196,3 ммоль) в течение 5 мин. Реакционную смесь нагревают до КТ постепенно и перемешивают в течение 16 ч. Реакционную смесь промывают N2 (барбортируют в раствор) в течение 30 мин, обрабатывают 300 мл водного насыщенного Na2S2O3 в течение 15 мин и экстрагируют (3×200 мл) CH2Cl2. Объединенные органические фазы промывают водой, сушат над Na2SO4, фильтруют, концентрируют и очищают флэш-хроматографией на колонке (220 г двуокиси кремния) с применением 0-75% EtOAc/Гексан над 10 ОК с получением указанного в заголовке соединения (29,0 г, 101 ммоль, 77%).
Стадия III: (3aS,6R,6aS)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-3a-(йодметил)-2,2-диметилдигидрофуро[3,4-d][1,3]диоксол-4(3aH)-он

В 2-литровую круглодонную колбу, оборудованную механической мешалкой и конденсатором, загружают (3aS,6R,6aS)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-3a-(гидроксиметил)-2,2-диметилдигидрофуро[3,4-d][1,3]диоксол-4(3aH)-он (30,5 г, 106 ммоль), имидазол (25,93 г, 380,9 ммоль) и трифенилфосфан (72,15 г, 275,1 ммоль), толуол (915,0 мл), затем I2 (69,82 г, 275,1 ммоль). Реакционную смесь перемешивают при 85°C в течение 90 мин, охлаждают до КТ и фильтруют. Твердое вещество промывают 200 мл толуола и к объединенным фильтратам добавляют 150 мл водного насыщенного Na2S2O3 и 25 мл NaCl. Полученный раствор перемешивают в течение 15 мин. Органический слой отделяют, промывают насыщенным NaHCO3 и 25 мл солевого раствора. Органическую фазу сушат над Na2SO4, фильтруют, концентрируют и очищают с применением 320 г двуокиси кремния и 100% Гексана 4 ОК и 0-80% над 7 ОК с получением указанного в заголовке соединения (39,0 г, 97,9 ммоль, 92,6%) в виде белого твердого вещества.
Стадия IV: (3aS,6R,6aS)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2,3a-триметилдигидрофуро[3,4-d][1,3]диоксол-4(3aH)-он

(3aS,6R,6aS)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-3a-(йодметил)-2,2-диметилдигидрофуро[3,4-d][1,3]диоксол-4(3aH)-он со Стадии III (39 г, 97,94 ммоль) растворяют в EtOH (195 мл). К полученному раствору добавляют Et3N (16,4 мл, 118 ммоль) и Pd/C 10% влажный (1,04 г, 9,79 ммоль). Реакционную смесь перемешивают в атмосфере H2 (40 ф/д2) в течение 72 ч. Полученную реакционную смесь фильтруют на целите, последний промывают 600 мл EtOH. Объединенные растворы разбавляют 1,6 л CH2Cl2 и добавляют 800 мл насыщенного водного Na2S2O3. Эту смесь перемешивают в течение 15 мин. Органическую фазу отделяют, промывают 800 мл насыщенного водного Na2S2O3. После разделения органическую фазу сушат над Na2SO4, фильтруют и концентрируют. Этот неочищенный продукт перекристаллизовывают в 40 мл EtOH и 25 мл гептана при 83°C. После охлаждения полученный кристаллический продукт собирают фильтрацией с получением указанного в заголовке соединения (24,3 г, 89,3 ммоль, 91%) в виде белого твердого вещества.
Стадия V: (3aS,6R,6aS)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2,3a-триметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ол

DIBAL (24,2 мл 1,5 M, 36,4 ммоль) в толуоле добавляют по каплям в течение 10 мин к холодному (-78°C) раствору (3aS,6R,6aS)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2,3a-триметилдигидрофуро[3,4-d][1,3]диоксол-4(3aH)-она со Стадии IV (9,00 г, 33,1 ммоль) в CH2Cl2 (90 мл). Реакционную смесь перемешивают при -78°C в течение 2 ч. После завершения холодную реакционную смесь гасят 4 мл MeOH, который добавляют по каплям в течение 2 мин и затем нагревают до КТ в течение 30 мин. Добавляют 500 мл насыщенного водного тартрата натрия, и полученную суспензию энергично перемешивают в течение 1 ч при комнатной температуре. Органическую фазу отделяют, промывают водой, солевым раствором, сушат над Na2SO4, фильтруют и концентрируют с получением указанного в заголовке соединения (22,1 г, 80,7 ммоль, 98%).
Стадия VI: (3S,4S,5S,6R)-6-(гидроксиметил)-3-метилтетрагидро-2H-пиран-2,3,4,5-тетраол

К раствору (3aS,6R,6aS)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2,3a-триметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ола со Стадии V (9,00 г, 32,8 ммоль) в H2O (45 мл) и диоксане (45 мл) добавляют полимер Dowex 50WX4 (4,5 г). Реакционную смесь перемешивают при 60°C в течение 16 ч, охлаждают до КТ, фильтруют и концентрируют с получением указанного в заголовке соединения (6,25 г, 32,19 ммоль, 98%).
Стадия VII: ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ M4
К раствору (3S,4S,5S,6R)-6-(гидроксиметил)-3-метилтетрагидро-2H-пиран-2,3,4,5-тетраола со Стадии VI (7,40 г, 38,11 ммоль) в пиридине (148 мл) добавляют ДМАП (931 мг, 7,62 ммоль) и Ac2O (71,9 мл, 762 ммоль). Реакционную смесь перемешивают при 60°C в течение 16 ч, охлаждают до КТ, разбавляют CH2Cl2 (300 мл) и воду (300 мл) добавляют в течение 10 мин, и конечную смесь перемешивают в течение 15 мин. Органическую фазу отделяют, промывают дважды 250 мл HCl 1N, затем солевым раствором, сушат над Na2SO4, фильтруют и концентрируют. очистка на картридже из двуокиси кремния Biotage™ SNAP (220 г) с применением EtOAc (от 40% до 80% в 10 ОК)/Гекс. в качестве элюента дает указанное в заголовке соединение (11,1 г, 72%) смеси один к одному α и β диастереоизомеров на аномерном атоме углерода. 1H ЯМР (400 МГц, CDCl3) смесь α/β (ок. 1:1) δ 6,86 (с, 1H, H1α), 5,62 (с, 1H, H1β), 5,42-5,05 (м, 4H), 4,30-4,05 (м, 4H), 4,04-3,82 (м, 2H), 2,20-2,03 (м, 30H, 10 OAc), 1,62 (с, 3H, CH3 α или β), 1,48 (с, 3H, CH3 α или β).
Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M5
тетраацетат (3S,4S,5R,6R)-6-((S)-1-ацетоксиэтил)тетрагидро-2H-пиран-2,3,4,5-тетраила

Стадия I: (2R,3R,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-ил]метанол

Указанное в заголовке соединение получают по методике, описанной в: Daragics, K.; Fügedi, P. Tet. Lett., 2009, 50, 2914-2916.
Стадия II: (1S)-1-[(2R,3S,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-ил]этанол

К раствору (2R,3R,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-ил]метанола со Стадии I (856 мг, 1,58 ммоль) в ДМСО (4,66 мл) и Et3N (1,103 мл, 7,915 ммоль) в CH2Cl2 (4,7 мл) при 0°C добавляют комплекс SO3.пиридин (1,260 г, 7,915 ммоль) 3 порциями. Реакционную смесь перемешивают в течение 1 ч. После завершения, реакционную смесь разбавляют EtOAc и промывают последовательно водой, 10% водным бисульфатом калия, насыщенным водным NaHCO3 и солевым раствором. Органическую фазу сушат над MgSO4, фильтруют и концентрируют в вакууме. Остаток совместно выпаривают дважды с бензолом с получением неочищенного альдегида, который применяют без дальнейшей очистки на следующей стадии. MeMgBr (1,90 мл 3M, 5,68 ммоль) добавляют к раствору (2S,3S,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-карбальдегида (1,531 г, 2,842 ммоль) в ТГФ (14 мл) при 0°C. Реакционную смесь перемешивают в течение 15 мин, затем перемешивают в течение 90 минут при КТ. После завершения, насыщенный водный раствор NH4Cl добавляют к смеси, и продукт экстрагируют из водной фазы с CH2Cl2 (3 раза). Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают дважды флэш-хроматографией с применением первого градиента 0-60% EtOAc:Гекс., затем 10-20% EtOAc:Гекс. во второй раз, с получением указанного в заголовке соединения (989,7 мг, 63% выход).
ЖХ-МС: m/z=577,5 (M+Na+).
1H ЯМР соответствует описанному в литературе в: Doores, K.J.; Fulton, Z.; Hong, V.; Patel, M.K.; Scanlan, C.N., Wormald, M.R.; Finn, M.G.; Burton, D.R.; Wilson, I.A.; Davis, B.G. PNAS, 2010, 107, 17107-17112.
Стадия III: ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ M5
Указанное в заголовке соединение получают из (1S)-1-[(2R,3S,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-ил]этанола с применением методики, описанной в: Doores, K.J.; Fulton, Z.; Hong, V.; Patel, M.K.; Scanlan, C.N., Wormald, M.R.; Finn, M.G.; Burton, D.R.; Wilson, I.A.; Davis, B.G. PNAS, 2010, 107, 17107-17112.
Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M6
тетраацетат (3S,4S,5R,6R)-6-((R)-1-ацетоксиэтил)тетрагидро-2H-пиран-2,3,4,5-тетраил

Стадия I: 4-нитробензоат [(1R)-1-[(2R,3S,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-ил]этила]

Раствор (1S)-1-[(2R,3S,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-ил]этанола из ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M5, Стадия II (990 мг, 1,78 ммоль), трифенилфосфина (749 мг, 2,85 ммоль), изопропила (NE)-N-изопропоксикарбонилиминокарбамата в толуоле 40% масс./об. (1,44 мл, 2,85 ммоль) и ТГФ (17,8 мл) охлаждают до 0°C и добавляют 4-нитробензойную кислоту (477 мг, 2,85 ммоль). Реакционную смесь нагревают вплоть до КТ в течение 4 часов. После завершения, реакционную смесь концентрируют в вакууме, и неочищенную смесь очищают флэш-хроматографией с применением градиента 0-100% EtOAc:Гекс. с получением указанного в заголовке соединения (1,03 г, 82% выход). 1H ЯМР (400 МГц, CDCl3) δ 8,25-8,13 (м, 4H), 7,43-7,13 (м, 20H), 5,52 (квд, J=6,6, 1,9 Гц, 1H), 5,05-4,95 (м, 2H), 4,77-4,61 (м, 6H), 4,44 (д, J=11,8 Гц, 1H), 4,06-3,88 (м, 3H), 3,83 (дд, J=3,0, 2,0 Гц, 1H), 1,36 (д, J=6,6 Гц, 3H).
Стадия II: (1R)-1-[(2R,3S,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-ил]этанол

4-нитробензоат [(1R)-1-[(2R,3S,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-ил]этила] со Стадии I (1,03 г, 1,46 ммоль) растворяют в EtOH (6 мл), ТГФ (6 мл) и воде (2,6 мл). NaOH (293 мг, 7,32 ммоль) добавляют к смеси, и полученный раствор перемешивают при КТ в течение 2 часов. После завершения, раствор концентрируют в вакууме и неочищенный остаток разделяют между водой и CH2Cl2 3 раза. Органические слои объединяют, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Неочищенный остаток очищают флэш-хроматографией с применением градиента 10-40% EtOAc/Гекс. с получением указанного в заголовке соединения с незначительными примесями (661 мг, 81% выход). ЖХ-МС: m/z=577,7 (M+Na+)
Стадия III: (2S,3S,4S,5S,6R)-6-[(1R)-1-гидроксиэтил]тетрагидропиран-2,3,4,5-тетрол

Азот барботируют через раствор (1R)-1-[(2R,3S,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-ил]этанола со Стадии II (661 мг, 1,192 ммоль) в MeOH (12 мл). К полученному раствору добавляют Pd/C, влажный, Degussa (126,9 мг, 0,1192 ммоль). Реакционную смесь перемешивают при КТ в течение 4 дней в атмосфере водорода (1 атм.). В этот момент реакция больше не развивается. Неочищенную смесь фильтруют над целлитом и промывают MeOH и CH2Cl2. Фильтрат концентрируют в вакууме с получением неочищенной смеси нескольких продуктов. Гидроксид палладия (83,7 мг, 0,119 ммоль) загружают в дегазированный раствор указанной выше смеси и уксусной кислоты (68,0 мкл, 1,19 ммоль) в MeOH (10 мл). Реакционную смесь перемешивают в течение 2 дней в 1 атм. водорода. Раствор фильтруют над Целитом, и фильтрат концентрируют в вакууме с получением снова смеси нескольких продуктов. Наконец, гидроксид палладия (280 мг, 0,399 ммоль) загружают в дегазированный раствор указанной выше смеси и уксусной кислоты (57,0 мкл, 0,996 ммоль) в MeOH (7 мл). Реакционную смесь перемешивают в течение 2 дней под 1 атм. H2. После завершения реакции раствор фильтруют над Целитом и промывают MeOH. Маточную жидкость концентрируют в вакууме, и неочищенный продукт совместно выпаривают 3 раза с бензолом для удаления оставшегося AcOH. Неочищенный продукт применяют непосредственно на следующей стадии. ЖХ-МС: m/z=217,2 (M+Na+)
Стадия IV: ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ M6
Неочищенный (2S,3S,4S,5S,6R)-6-[(1R)-1-гидроксиэтил]тетрагидропиран-2,3,4,5-тетрол со Стадии III (193,4 мг, 0,996 ммоль) перемешивают в Ac2O (5,0 мл, 53 ммоль) и пиридине (10 мл) при КТ в течение 18 часов. После завершения, реакционную смесь концентрируют в вакууме и совместно выпаривают с бензолом. Остаток очищают флэш-хроматографией с применением первого градиента 20-50% EtOAc:Гекс. и затем вторую хроматографию проводят с применением 20-40% EtOAc:Гекс. с получением указанного в заголовке соединения (290 мг, 72% выход за 2 последних стадии). ЖХ-МС: m/z=427,3 (M+Na)+.
Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M7
ацетат [(2R,3S,4S,5S)-3,4,5,6-тетраацетокси-2-метил-тетрагидропиран-2-ил]метила

Указанное в заголовке соединение получают с применением методики, описанной в: Doores, K.J.; Fulton, Z.; Hong, V.; Patel, M.K.; Scanlan, C.N., Wormald, M.R.; Finn, M.G.; Burton, D.R.; Wilson, I.A.; Davis, B.G. PNAS, 2010, 107, 17107-17112.
Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M8
тетраацетат (3S,4S,5R,6R)-6-(ацетоксиметил)-3-((бензилокси)метил)тетрагидро-2H-пиран-2,3,4,5-тетраила

Стадия I: (3aS,6R,6aS)-3a-((бензилокси)метил)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилдигидрофуро[3,4-d][1,3]диоксол-4(3aH)-он

К холодному (0°С) раствору (3aS,6R,6aS)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-3a-(гидроксиметил)-2,2-диметилдигидрофуро[3,4-d][1,3]диоксол-4(3aH)-она из ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M4, Стадия II (1,500 г, 5,203 ммоль) в ДМФ (23 мл) добавляют NaH (250 мг, 6,24 ммоль). Реакционную смесь перемешивают в течение 15 мин, затем добавляют бензилбромид (743 мкл, 6,24 ммоль) и конечную реакционную смесь перемешивают при КТ в течение 2 ч. Реакционную смесь разделяют между EtOAc и водой. Органический слой сушат над Na2SO4, концентрируют и очищают флэш-хроматографией (0-50% EtOAC/Гексан) с получением указанного в заголовке соединения (1200 мг, 3,171 ммоль, 61%). 1H ЯМР (400 МГц, CDCl3) δ 7,48-7,08 (м, 5H), 4,75 (д, J=3,2 Гц, 1H), 4,60 (д, J=12,1 Гц, 1H), 4,53 (д, J=12,0 Гц, 1H), 4,50-4,32 (м, 2H), 4,18-4,09 (м, 1H), 4,08 (дд, J=9,1, 3,9 Гц, 1H), 3,94 (д, J=9,1 Гц, 1H), 3,72 (д, J=9,1 Гц, 1H), 1,47 (с, 6H), 1,39 (с, 6H).
Стадия II: (3aS,6R,6aS)-3a-((бензилокси)метил)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ол

Указанное в заголовке соединение получают по методике, описанной в ПРОМЕЖУТОЧНОМ СОЕДИНЕНИИ M4, Стадия V, но с применением (3aS,6R,6aS)-3a-((бензилокси)метил)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилдигидрофуро[3,4-d][1,3]диоксол-4(3aH)-она со Стадии I. ЖХ-МС: m/z=403,4 (M+Na)+.
Стадия III: (3S,4S,5S,6R)-3-((бензилокси)метил)-6-(гидроксиметил)тетрагидро-2H-пиран-2,3,4,5-тетраол

К раствору (3aS,6R,6aS)-3a-((бензилокси)метил)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ола со Стадии II (1000 мг, 2,63 ммоль) в диоксане (17 мл) и воде (8,5 мл) добавляют ТФК (2,05 мл, 26,6 ммоль). Реакционную смесь перемешивают при КТ в течение 16 ч. Полученную смесь концентрируют в вакууме, совместно выпаривают с толуолом с получением указанного в заголовке соединения (780 мг, 2,60 ммоль, 98,80%), который применяют на следующей стадии без дальнейшей очистки.
Стадия IV: ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ M8
К холодному (0°С) раствору (3S,4S,5S,6R)-3-((бензилокси)метил)-6-(гидроксиметил)тетрагидро-2H-пиран-2,3,4,5-тетраола со Стадии III (750 мг, 2,50 ммоль) в пиридине (5,1 мл) добавляют ДМАП (61 мг, 0,499 ммоль), затем добавляют Ac2O (2,36 мл, 24,9 ммоль). Реакционную смесь перемешивают в течение 16 ч при КТ. Реакционную смесь разделяют между EtOAc и водой. Органический слой отделяют, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают на картридже из двуокиси кремния Biotage™ SNAP (10 г) с применением EtOAc (от 0% до 50% в 10 ОК)/Гекс. в качестве элюента с получением указанного в заголовке соединения (300 мг, 24%) в виде бесцветного масла. 1H ЯМР (400 МГц, CDCl3) смесь α/β (ок. 1:2) δ 7,37-7,20 (м, 10H), 6,81 (с, 1H, H1α), 6,06 (с, 1H, H1β), 5,63 (д, J=8,1 Гц, 1H), 5,60 (д, J=8,1 Гц, 1H), 5,38 (т, J=9,9 Гц, 1H), 5,25 (т, J=9,8 Гц, 1H), 4,56-3,77 (м, 14H), 2,15-1,90 (м, 30H). ЖХ-МС: m/z=533,8 (M+Na)+.
Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M9
ацетат [(2E)-2-[(3S,4S,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-илиден]этила]

Стадия I: метил 2-(трибутилфосфоранилиден)ацетат

К холодному (0°С) раствору трибутилфосфана (5,00 мл, 20,0 ммоль) в толуоле (20 мл) в атмосфере N2 добавляют метил 2-бромацетат (1,90 мл, 20,1 ммоль). Полученную суспензию нагревают до КТ и перемешивают в течение ночи в атмосфере N2. Полученную смесь концентрируют в вакууме, повторно растворяют в CH2Cl2 (50 мл), последовательно промывают водным 1N NaOH (2×20 мл), H2O (20 мл), сушат над MgSO4, фильтруют и концентрируют с получением указанного в заголовке соединения (5,35 г, 97% выход) в виде бесцветного масла
Стадия II: метил (2E)-2-[(3S,4S,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-илиден]ацетат

К раствору метил 2-(трибутилфосфоранилиден)ацетата со Стадии I (2,01 г, 7,31 ммоль) в толуоле (9,0 мл), помещенному в пробирку под давлением, добавляют (3S,4S,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-он (полученный по ссылке Org Lett, 2011, 13(14), 3628-3631 (2,00 г, 3,71 ммоль). Пробирку под давлением закрывают крышкой и перемешивают при 80°C в течение 20 ч. После охлаждения до КТ, реакционную смесь очищают флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (100 г) с применением градиента EtOAc (от 0 до 20%) в Гекс. с получением указанного в заголовке соединения (2,01 г, 91% выход) в виде бесцветного масла.
Стадия III: (2E)-2-[(3S,4S,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-илиден]этанол

К холодному (-78°C) раствору метила (2E)-2-[(3S,4S,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-илиден]ацетата со Стадии II (1,98 г, 3,30 ммоль) в толуоле (20 мл) в атмосфере N2 добавляют раствор DIBAL в толуоле (5,60 мл 1,5M, 8,40 ммоль) в течение 1 ч через шприцевую помпу. Реакционную смесь перемешивают в течение еще 2 ч, затем добавляют 40 мл насыщенного раствора соли Рошель, затем 40 мл EtOAc, и смесь перемешивают при КТ в течение 3 ч. Слои разделяют; водный слой повторно экстрагируют EtOAc (2×40 мл). Объединенные органические экстракты промывают солевым раствором (40 мл), сушат над Na2SO4, фильтруют и концентрируют. Неочищенный продукт очищают флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (50 г) с применением градиента EtOAc (от 0 до 20%) в CH2Cl2 с получением указанного в заголовке соединения (1,28 г, 68% выход) в виде бесцветного масла, которое затвердевает до белого твердого вещества.
Стадия IV: ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ M9
К раствору (2E)-2-[(3S,4S,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-илиден]этанола со стадии III (1,28 г, 2,26 ммоль) в CH2Cl2 (15 мл) добавляют пиридин (550 мкл, 6,80 ммоль), ДМАП (28 мг, 0,23 ммоль), затем Ac2O (530 мкл, 5,62 ммоль). После перемешивания в течение 3 ч, реакционную смесь гасят H2O и водным раствором 1N HCl (10 мл каждый). Слои разделяют, водный слой повторно экстрагируют CH2Cl2 (2×10 мл). Объединенные органические экстракты концентрируют и совместно выпаривают с гептаном (дважды) с получением указанного в заголовке соединения (1,36 г, 99% выход) в виде бесцветного масла. 1H ЯМР (400 МГц, CDCl3) δ 7,43-7,23 (м, 18H), 7,22-7,13 (м, 2H), 5,51 (т, J=8,2 Гц, 1H), 4,94 (д, J=10,8 Гц, 1H), 4,75-4,61 (м, 4H), 4,60-4,49 (м, 3H), 4,45-4,31 (м, 2H), 4,28-4,13 (м, 2H), 3,86-3,72 (м, 2H), 3,66-3,52 (м, 2H), 2,00 (с, 3H).
Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M10
триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-2-(4-бром-2-метилфенокси)-3-метилтетрагидро-2H-пиран-3,4,5-тритила

К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M4 (2,06 г, 5,094 ммоль) в CH2Cl2 (10 мл) добавляют 4-бром-2-метилфенол (1,9 г, 10,16 ммоль), затем BF3.OEt2 (3,87 мл, 30,5 ммоль). Полученную смесь перемешивают при 40°C в течение 6 ч, охлаждают до КТ, медленно выливают в насыщенный водный раствор NaHCO3 (50 мл) при энергичном перемешивании. Смесь разбавляют CH2Cl2 (10 мл), органический слой отделяют и водный слой повторно экстрагируют CH2Cl2 (2×5 мл). Объединенные органические слои концентрируют, и остаток очищают на Biotage™ SNAP картридже на двуокиси кремния (50 г) элюируя Гекс./EtOAc (от 0% до 50%) с получением указанного в заголовке соединения (1,82 г, 67,2%) в виде белого кристаллического твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,30 (д, J=2,0 Гц, 1H), 7,28-7,22 (м, 1H), 7,04 (д, J=8,7 Гц, 1H), 6,24 (с, 1H), 5,57 (д, J=9,7 Гц, 1H), 5,39 (т, J=9,9 Гц, 1H), 4,17 (дд, J=12,2, 5,4 Гц, 1H), 4,10 (дд, J=12,2, 2,4 Гц, 1H), 4,00 (ддд, J=10,2, 5,4, 2,3 Гц, 1H), 2,26 (с, 3H), 2,15 (с, 3H), 2,14 (с, 3H), 2,04 (с, 6H), 1,63 (с, 3H).
Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M11
(2R,3S,4S,5S,6R)-2-(4-бром-2-хлорфенокси)-6-(гидроксиметил)-3-метилтетрагидро-2H-пиран-3,4,5-триол

Стадия I: триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-2-(4-бром-2-хлорфенокси)-3-метилтетрагидро-2H-пиран-3,4,5-тритила

Указанное в заголовке соединение получают по методике, описанной для ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M10, но с применением 4-бром-2-хлорфенола в качестве реагента. Указанное в заголовке соединение очищают на Biotage™ SNAP картридже на двуокиси кремния (50 г) элюируя Гекс./EtOAc (от 0% до 35%) и выделяют в виде белого твердого вещества (40%).
Стадия II: ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ M11
К раствору ацетата [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-6-(4-бром-2-хлор-фенокси)-5-метилтетрагидропиран-2-ил]метила со стадии I (1,317 г, 2,387 ммоль) в MeOH добавляют NaOMe в MeOH (4,77 мл 0,5M, 2,39 ммоль). Реакционную смесь перемешивают при КТ в течение 18 ч. Реакционную смесь нейтрализуют кислым полимером Амберлист, фильтруют и концентрируют с получением указанное в заголовке соединение (888 мг, 86,1%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,54 (с, 1H), 7,38 (д, J=8,9 Гц, 1H), 7,32 (д, J=8,9 Гц, 1H), 5,22 (с, 1H), 3,78-3,61 (м, 4H), 3,56 (дд, J=8,7, 4,4 Гц, 1H), 1,39 (с, 3H). ЖХМС (M+H)+ 384,78
Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M12
триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-2-(3-бром-2-хлорфенокси)-3-метилтетрагидро-2H-пиран-3,4,5-тритила

К смеси ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M4 (200 мг, 0,495 ммоль) и 3-бром-2-хлорфенола (154 мг, 0,742 ммоль) в дихлорэтане (2,60 мл) добавляют BF3.OEt2 (190 мкл, 1,50 ммоль). Смесь перемешивают при 60°C в течение ночи в герметично закрытой пробирке. Полученную смесь охлаждают до КТ, осторожно добавляют 2 мл насыщенного водного раствора NaHCO3, затем 2 мл CH2Cl2. Органические слои разделяют (разделение фаз), и водный слой повторно экстрагируют CH2Cl2 (2×2 мл). Объединенные органические экстракты концентрируют, и остаток очищают на Biotage™ SNAP картридже на двуокиси кремния (10 г), элюируя Гекс./EtOAc (0-50%, 12ОК, 50% 5ОК) с получением указанного в заголовке соединения (93 мг, 34%) в виде белого твердого вещества. ЖХМС (M+Na)+ 575,18
Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M13
триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-2-(5-бром-2-хлорфенокси)-3-метилтетрагидро-2H-пиран-3,4,5-тритил

Указанное в заголовке соединение получают по методике, описанной для ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M12, но с применением 5-бром-2-хлорфенола в качестве реагента. Реакционную смесь перемешивают в течение 48 ч, и указанное в заголовке соединение выделяют в виде белого твердого вещества (34%). ЖХМС (M+Na)+ 573,19
Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M14
тетраацетат (3S,4S,5R,6R)-6-(ацетоксиметил)-3-(азидометил)тетрагидро-2H-пиран-2,3,4,5-тетраила

К раствору (3S,4S,5S,6R)-3-(азидометил)-6-(гидроксиметил)тетрагидропиран-2,3,4,5-тетрола (получен по методике, описанной в Tetrahedron: Asymmetry 18 (2007) 1502-1510) (650 мг, 2,76 ммоль) в пиридине (13 мл) добавляют ДМАП (68 мг, 0,55 ммоль) и Ac2O (5,2 мл, 55,3 ммоль). Реакционную смесь перемешивают при 60°C в течение 16 ч, охлаждают до КТ, разбавляют CH2Cl2 (13 мл) и добавляют воду (13 мл) в течение 2 мин, и конечную смесь перемешивают в течение 5 мин. Органическую фазу отделяют, промывают дважды 25 мл HCl 1N, затем солевым раствором, сушат над Na2SO4, фильтруют и концентрируют. Очистка на Biotage™ SNAP картридже на двуокиси кремния (40 г) с применением EtOAc (от 0% до 80% в 10 ОК) в Гекс. в качестве элюента дает указанное в заголовке соединение (850 мг, 69%) в виде смеси два к одному α и β диастереоизомеров на аномерном атоме углерода. 1H ЯМР (400 МГц, CDCl3) смесь α/β (ок. 2:1) δ 6,72 (с, 1H, H1α), 5,91 (с, 1H, H1β), 5,33 (д, J=9,7 Гц, 1 H1α), 5,41 (д, J=9,3 Гц, 1 H1β), 5,38 (т, J=10,0 Гц, 1 H1α), 5,38 (т, J=10,0 Гц, 1 H1α), 5,24 (т, J=9,4 Гц, H1β), 4,33-3,80 (м, 5H), 2,22-2,17 (м, 6H), 2,12-2,07 (м, 6H), 2,05 (с, 3H).
Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M15
тетраацетат (3S,4S,5R,6R)-6-(ацетоксиметил)-3-((2-(бензилокси)этокси)метил)тетрагидро-2H-пиран-2,3,4,5-тетраил

Стадия I: (3aS,6R,6aS)-3a-((2-(бензилокси)этокси)метил)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилдигидрофуро[3,4-d][1,3]диоксол-4(3aH)-он

К холодному (0°С) раствору (3aS,6R,6aS)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-3a-(гидроксиметил)-2,2-диметилдигидрофуро[3,4-d][1,3]диоксол-4(3aH)-она из ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M4, стадия II (800 мг, 2,78 ммоль) в ДМФ (12,0 мл) добавляют гидрид натрия (144 мг, 3,6 ммоль). Реакционную смесь перемешивают в течение 15 мин и добавляют 2-бромэтоксиметилбензол (571 мкл, 3,61 ммоль). Реакционную смесь перемешивают при 60°C в течение 16 ч, разделяют между EtOAc и водой, органическую фазу сушат над Na2SO4, концентрируют и очищают флэш-хроматографией на двуокиси кремния (0-50% EtOAC/Гексан) с получением указанного в заголовке соединения (452 мг, 39%) в виде бесцветного масла. 1H ЯМР (400 МГц, Хлороформ-d) δ 7,41-7,21 (м, 5H), 4,80 (д, J=2,8 Гц, 1H), 4,53 (с, 2H), 4,46-4,36 (м, 2H), 4,13 (дд, J=9,1, 5,4 Гц, 1H), 4,09-4,01 (м, 1H), 3,99 (д, J=9,2 Гц,1H), 3,82 (д, J=9,2 Гц, 1H), 3,77-3,64 (м, 2H), 3,58 (тд, J=4,6, 1,5 Гц, 2H), 1,46 (с, 3H), 1,45 (с, 3H), 1,40 (с, 3H), 1,39 (с, 3H).
Стадия II: (3aS,6R,6aS)-3a-((2-(бензилокси)этокси)метил)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ол

DIBAL (1,13 мл 1,5M, 1,7 ммоль) в толуоле добавляют по каплям к холодному (-78°C) раствору (3aS,6R,6aS)-3a-((2-(бензилокси)этокси)метил)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилдигидрофуро[3,4-d][1,3]диоксол-4(3aH)-она (650 мг, 1,5 ммоль) в CH2Cl2 (6,5 мл). Реакционную смесь перемешивают при -78°C в течение 2 ч. После завершения, холодную реакционную смесь гасят 0,3 мл MeOH, добавляемым по каплям в течение 2 мин, и затем нагревают до КТ в течение 30 мин. Добавляют 50 мл насыщенного водного тартрата натрия, и полученную суспензию энергично перемешивают в течение 1 ч при комнатной температуре. Органическую фазу отделяют, промывают водой, солевым раствором, сушат над Na2SO4, фильтруют и концентрируют с получением указанного в заголовке соединения (625 мг, 96%)
Стадия III: (3S,4S,5S,6R)-3-((2-(бензилокси)этокси)метил)-6-(гидроксиметил)тетрагидро-2H-пиран-2,3,4,5-тетраол

К раствору (3aS,6R,6aS)-3a-((2-(бензилокси)этокси)метил)-6-((R)-2,2-диметил-1,3-диоксолан-4-ил)-2,2-диметилтетрагидрофуро[3,4-d][1,3]диоксол-4-ола (650 мг, 1,53 ммоль) в H2O (3,3 мл) и диоксане (3,3 мл) добавляют полимер Dowex 50WX4 (300 мг). Реакционную смесь перемешивают при 60°C в течение 16 ч, охлаждают до КТ, фильтруют и концентрируют с получением указанного в заголовке соединения (450 мг, 85%).
Стадия IV: ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ M15
К раствору (3S,4S,5S,6R)-3-((2-(бензилокси)этокси)метил)-6-(гидроксиметил)тетрагидро-2H-пиран-2,3,4,5-тетраола (450 мг, 1,31 ммоль) в пиридине (9,0 мл) добавляют ДМАП (32 мг, 0,26 ммоль) и Ac2O (2,5 мл, 26,1 ммоль). Реакционную смесь перемешивают при 60°C в течение 16 ч, охлаждают до КТ, разбавляют CH2Cl2 (18 мл) и водой (18 мл) добавляют в течение 2 мин, и конечную смесь перемешивают в течение 15 мин. Органическую фазу отделяют, промывают дважды 10 мл HCl 1N, затем солевым раствором, сушат над Na2SO4, фильтруют и концентрируют. Очистка на Biotage™ SNAP картридже на двуокиси кремния (80 г) с применением EtOAc (от 20% до 80% в 10 ОК) в Гекс. в качестве элюента дает указанное в заголовке соединение (450m г, 62%) в виде 45/55 смеси α и β диастереоизомеров на аномерном атоме углерода. 1H ЯМР (400 МГц, CDCl3) смесь α/β (ок. 45:55) δ 7,43-7,29 (м, 5H), 6,77 (с, 1H, H1α), 6,03 (с, 1H, H1β), 5,58 (дд, J=16,5, 9,7 Гц, 1H, H1α), 5,38 (т, J=10,0 Гц, 1H, H1β), 5,24 (с, 1H), 4,51 (м, 2H), 4,32-3,97 (м, 4H), 3,82 (м, 1H), 3,68-3,39 (м, 4H), 2,19-1,92 (м, 15H).
ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ M16-M22 получают по методике, описанной для ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M10 с применением подходящим образом замещенного фенола.
|
|
Биарильные ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ A1-A12, изображенные на фигуре 2, применяют для получения ПРИМЕРОВ, описанных здесь

Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A1
3-(4-гидроксифенил)-N-метилбензамид

Смесь [3-(метилкарбамоил)фенил]бороновой кислоты (3,41 г, 19,1 ммоль), 4-бромфенола (3,00 г, 17,3 ммоль), K2CO3 (3,60 г, 26,01 ммоль) и SiliaCat DPP-Pd (667 мг, 0,173 ммоль) объединяют в сосуде под давлением. Добавляют MeOH (30 мл), и реакционную смесь перемешивают 2 ч при 80°C. Реакционную смесь охлаждают до КТ, фильтруют на целите и осадок промывают порциями MeOH. Объединенные фильтраты концентрируют. Остаток разделяют между водным раствором 1N HCl и EtOAc (50 мл каждый). Слои разделяют, и водный слой повторно экстрагируют EtOAc (2×25 мл). Объединенные органические экстракты промывают солевым раствором (25 мл), сушат над Na2SO4, фильтруют и концентрируют с получением неочищенного продукта, который очищают флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (100 г) с применением EtOAc (50%) в CH2Cl2 в качестве элюента. Твердые вещества, которые кристаллизуются при концентрации смешанных фракций, собирают фильтрацией с получением первой партии указанного в заголовке соединения (814 мг, 21% выход) в виде белого твердого вещества. Концентрация чистых фракций из хроматографии дает вторую партию указанного в заголовке соединения (1,66 г, 42% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,96-7,87 (м, 2H), 7,68-7,58 (м, 2H), 7,50-7,39 (м, 3H), 6,97-6,85 (м, 2H), 6,37 (шс, 1H), 3,02 (д, J=4,8 Гц, 3H).
Получение ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A2
3-(4-гидрокси-3-метилфенил)-N-метилбензамид

Указанное в заголовке соединение получают по методике, описанной для ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A1, с применением 4-бром-2-метилфенола (6,67 г, 35,7 ммоль) в качестве исходного материала. Неочищенный продукт пропускают через слой двуокиси кремния с применением EtOAc, концентрируют, затем перекристаллизовывают с применением смеси ТГФ (80 мл) и CH2Cl2 (25 мл), с получением указанного в заголовке соединения (2,63 г, 31% выход) в виде беловатого твердого вещества. Концентрация маточных жидкостей с последующей очисткой флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (100 г) с применением градиента EtOAc (от 0 до 50%) в CH2Cl2 дает вторую партию указанного в заголовке соединения (2,53 г, 29% выход) в виде беловатого твердого вещества. 1H ЯМР (400 МГц, ДМСО-D6) δ 9,48 (с, 1H), 8,50 (д, J=4,6 Гц, 1H), 8,00 (т, J=1,6 Гц, 1H), 7,75-7,63 (м, 2H), 7,52-7,40 (м, 2H), 7,35 (дд, J=8,3, 2,3 Гц, 1H), 6,86 (д, J=8,3 Гц, 1H), 2,79 (д, J=4,5 Гц, 3H), 2,19 (с, 3H).
Общее получение ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ A3-A14 (Таблица A)

Пробирку для микроволновой печи загружают подходящим образом замещенным 4-бромфенолом и фенилбороновой кислотой (1 экв.), K2CO3 (1,5 экв.) и SiliaCat DPP-Pd (0,1 экв.) в MeOH. Пробирку закрывают крышкой и подвергают микроволновому облучению в течение 15 минут при 120°C. Реакционную смесь разделяют между водным раствором 1N HCl и CH2Cl2. Слои разделяют, и водный слой повторно экстрагируют дважды CH2Cl2. Объединенные органические экстракты сушат над Na2SO4, концентрируют и очищают флэш-хроматографией на Biotage™ SNAP силикагелевом картридже с применением градиента EtOAc в CH2Cl2 с получением указанного в заголовке соединения.
|
|
|
Получение ПРИМЕРА 1:
(2R,3S,4S,5S,6R)-6-(4-бром-2-метилфенокси)-5-фтор-2-(гидроксиметил)тетрагидропиран-3,4-диол

Стадия I: ацетат [(2R,3R,4S,5S,6R)-3,4-диацетокси-6-(4-бром-2-метилфенокси)-5-фтортетрагидропиран-2-ил]метила

В сосуде под давлением суспензию ацетата [(2R,3R,4S,5S)-3,4,6-триацетокси-5-фтортетрагидропиран-2-ил]метила (полученного по методике, описанной в Angew. Chem. Int. Ed. 2010, 49, 8724-8728) (199 мг, 0,568 ммоль) и 4-бром-2-метилфенола (217 мг, 1,160 ммоль) в CH2Cl2 (6,0 мл) обрабатывают BF3.OEt2 (215 мкл, 1,697 ммоль) по каплям. Реакционную смесь перемешивают в течение 5 мин при КТ, покрывают крышкой и перемешивают при 40°C в течение 16 ч. После охлаждения до КТ добавляют 5 мл насыщенного водного NaHCO3. Слои разделяют, и водный слой затем экстрагируют CH2Cl2 (2×2 мл). Объединенные органические экстракты концентрируют, и неочищенный продукт очищают флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (10 г) с применением градиента EtOAc (от 0 до 30%) в Гекс. Выпаривание чистых фракций дает указанное в заголовке соединение в виде белого твердого вещества (179 мг, 66% выход). 1H ЯМР (400 МГц, CDCl3) δ 7,31 (д, J=2,4 Гц, 1H), 7,29-7,24 (м, 1H), 7,02 (д, J=8,7 Гц, 1H), 5,64 (дд, J=6,4, 2,0 Гц, 1H), 5,50-5,36 (м, 2H), 4,98 (дт, J=49,5, 2,1 Гц, 1H), 4,26 (дд, J=12,4, 5,1 Гц, 1H), 4,09 (дд, J=12,4, 2,3 Гц, 1H), 4,06-3,99 (м, 1H), 2,24 (с, 3H), 2,14 (с, 3H), 2,06 (с, 3H), 2,05 (с, 3H). 19F ЯМР (376 МГц, CDCl3) δ -204,49 (ддд, J=49,4, 29,4, 6,4 Гц). ИЭР-МС m/z рассч. 476,05, найдено 499,30 (M+Na)+
Стадия II: ПРИМЕР 1
К раствору ацетата [(2R,3R,4S,5S,6R)-3,4-диацетокси-6-(4-бром-2-метилфенокси)-5-фтортетрагидропиран-2-ил]метила со стадии I (98 мг, 0,205 ммоль) в MeOH (4,0 мл) добавляют NaOMe в MeOH (205 мкл 0,5M, 0,103 ммоль). После перемешивания в течение ночи, реакционную смесь обрабатывают предварительно промытым полимером Dowex 50WX4-400, фильтруют и промывают MeOH (3×1 мл). Объединенные фильтраты концентрируют с получением указанного в заголовке соединения (70 мг, 89%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,31 (д, J=1,9 Гц, 1H), 7,27 (дд, J=8,6, 2,1 Гц, 1H), 7,16 (д, J=8,7 Гц, 1H), 5,70 (дд, J=6,7, 1,7 Гц, 1H), 4,91-4,72 (м, 1H), 3,96 (ддд, J=30,8, 9,7, 2,6 Гц, 1H), 3,78 (дд, J=12,1, 2,5 Гц, 1H), 3,75-3,66 (м, 2H), 3,62-3,53 (м, 1H), 2,21 (с, 3H). 19F ЯМР (376 МГц, CD3OD) δ -206,88 (ддд, J=49,4, 30,9, 6,9 Гц). ИЭР-МС m/z рассч. 351,17, найдено 373,20 (M+Na)+
Получение ПРИМЕРА 2:
(2R,3S,4S,5S,6R)-5-фтор-2-(гидроксиметил)-6-((3-метил-3'-нитро-[1,1'-бифенил]-4-ил)окси)тетрагидро-2H-пиран-3,4-диол

В пробирку для микроволновой печи загружают (2R,3S,4S,5S,6R)-6-(4-бром-2-метилфенокси)-5-фтор-2-(гидроксиметил)тетрагидропиран-3,4-диол (ПРИМЕР 1) (32 мг, 0,0911 ммоль), (3-нитрофенил)бороновую кислоту (18 мг, 0,107 ммоль), Cs2CO3 (89 мг, 0,273 ммоль), SiliaCat DPP-Pd (35 мг, 0,00911 ммоль) и 2мл CH3CN. Пробирку дегазируют, накрывают крышкой и подвергают микроволновому облучению в течение 10 мин при 100°C. Реакционную смесь разбавляют MeOH и CH2Cl2 (1 мл каждый) и пропускают через 500 мг isolute картридж на двуокиси кремния, промывают смесью CH2Cl2/MeOH (1:1, 4×1 мл). Объединенные фильтраты концентрируют, и неочищенный продукт очищают флэш-хроматографией с обращенной фазой на Biotage™ SNAP C18 картридже (12 г), с применением градиента MeCN (от 10 до 90%) в H2O. Чистые фракции объединяют и концентрируют с получением указанного в заголовке соединения (18 мг, 50% выход) в виде бледно-желтого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,41 (т, J=1,9 Гц, 1H), 8,17 (дд, J=8,2, 1,4 Гц, 1H), 7,99 (д, J=8,3 Гц, 1H), 7,66 (т, J=8,0 Гц, 1H), 7,57-7,47 (м, 2H), 7,37 (д, J=8,4 Гц, 1H), 5,81 (дд, J=6,7, 1,7 Гц, 1H), 4,88 (дт, J=49,4, 2,2 Гц, 1H), 4,02 (ддд, J=30,8, 9,6, 2,6 Гц, 1H), 3,86-3,77 (м, 2H), 3,73 (дд, J=12,1, 5,3 Гц, 1H), 3,63 (ддд, J=7,6, 4,9, 2,1 Гц, 1H), 2,33 (с, 3H). 19F ЯМР (376 МГц, CD3OD) δ -206,84 (ддд, J=49,3, 30,8, 6,7 Гц). ИЭР-МС m/z рассч. 393,12238, найдено 394,34 (M+1)+
Получение ПРИМЕРА 3:
(2R,3S,4S,5S,6R)-6-[4-бром-2-(трифторметил)фенокси]-5-фтор-2-(гидроксиметил)тетрагидропиран-3,4-диол

Стадия I: ацетат [(2R,3R,4S,5S,6R)-3,4-диацетокси-6-[4-бром-2-(трифторметил)фенокси]-5-фтортетрагидропиран-2-ил]метила

Указанное в заголовке соединение получают из ацетата [(2R,3R,4S,5S)-3,4,6-триацетокси-5-фтор-тетрагидропиран-2-ил]метила (106 мг, 0,303 ммоль) и 4-бром-2-(трифторметил)фенола (151 мг, 0,627 ммоль) по методике, описанной в ПРИМЕРЕ 1, стадия I. Очистка флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (10 г) с применением градиента EtOAc (от 0 до 30%) в Гекс. дает указанное в заголовке соединение (41 мг, 26% выход) в виде белого пенистого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,75 (д, J=2,4 Гц, 1H), 7,64 (дд, J=8,9, 2,4 Гц, 1H), 7,22 (д, J=9,0 Гц, 1H), 5,72 (дд, J=6,3, 2,0 Гц, 1H), 5,50-5,34 (м, 2H), 5,00 (дт, J=49,2, 2,2 Гц, 1H), 4,27 (дд, J=12,4, 4,8 Гц, 1H), 4,09 (дд, J=12,4, 2,3 Гц, 1H), 4,03 (ддд, J=9,0, 4,7, 2,3 Гц, 1H), 2,13 (с, 3H), 2,06 (с, 6H). 19F ЯМР (376 МГц, CDCl3) δ -62,52 (s), -205,28 (ддд, J=49,2, 29,4, 6,3 Гц). ИЭР-МС m/z рассч. 531,25, найдено 553,27 (M+Na)+
Стадия II: ПРИМЕР 3
Удаление ацетатных защитных групп ацетата [(2R,3R,4S,5S,6R)-3,4-диацетокси-6-[4-бром-2-(трифторметил)фенокси]-5-фтортетрагидропиран-2-ил]метила со стадии I (39 мг, 0,0734 ммоль) с применением протокола, описанного для ПРИМЕРА 1, Стадия II, дает указанное в заголовке соединение (29 мг, 93% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,77-7,70 (м, 2H), 7,46 (д, J=8,5 Гц, 1H), 5,86 (дд, J=6,5, 1,8 Гц, 1H), 4,80 (дт, J=49,1, 2,3 Гц, 1H), 3,93 (ддд, J=30,7, 9,6, 2,6 Гц, 1H), 3,80 (дд, J=12,1, 2,3 Гц, 1H), 3,77-3,65 (м, 2H), 3,61-3,52 (м, 1H), 19F ЯМР (376 МГц, CD3OD) δ -63,91 (с, 3F), -207,57 (ддд, J=49,2, 30,8, 6,7 Гц, 1F). ИЭР-МС m/z рассч. 403,98825, найдено 403,37 (M+1)+
Получение ПРИМЕРА 4
3-[4-[(2R,3S,4S,5S,6R)-3-фтор-4,5-дигидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]окси-3-(трифторметил)фенил]-N-метилбензамид

Указанное в заголовке соединение получают по методике, описанной для ПРИМЕРА 2, но с применением (2R,3S,4S,5S,6R)-6-[4-бром-2-(трифторметил)фенокси]-5-фтор-2-(гидроксиметил)тетрагидропиран-3,4-диола (ПРИМЕР 3) (21,4 мг, 0,0501 ммоль) и [3-(метилкарбамоил)фенил]бороновой кислоты (13 мг, 0,07263 ммоль). Очистка ВЭЖХ с обращенной фазой и сушка вымораживанием объединенных фракций, содержащих желаемый продукт, дает указанное в заголовке соединение (12 мг, 51% выход) в виде рыхлого белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,06 (т, J=1,7 Гц, 1H), 7,95-7,87 (м, 2H), 7,84-7,75 (м, 2H), 7,63 (д, J=8,5 Гц, 1H), 7,56 (т, J=7,8 Гц, 1H), 5,92 (дд, J=6,5, 1,8 Гц, 1H), 4,93-4,75 (м, 1H), 3,99 (ддд, J=30,7, 9,6, 2,6 Гц, 1H), 3,82 (дд, J=12,2, 2,3 Гц, 1H), 3,78-3,69 (м, 2H), 3,67-3,58 (м, 1H), 2,95 (с, 3H). 19F ЯМР (376 МГц, CD3OD) δ -63,47 (с, 3F), -207,47 (ддд, J=49,4, 30,7, 6,6 Гц, 1F). ИЭР-МС m/z рассч. 459,1305, найдено 460,38 (M+1)+
Получение ПРИМЕРА 5
(2R,3S,4S,5S,6R)-6-(4-бром-2-метоксифенокси)-5-фтор-2-(гидроксиметил)тетрагидропиран-3,4-диол

Стадия I: ацетат [(2R,3R,4S,5S,6R)-3,4-диацетокси-6-(4-бром-2-метоксифенокси)-5-фтортетрагидропиран-2-ил]метила

Указанное в заголовке соединение получают по методике, описанной для ПРИМЕРА 1, Стадия I с применением ацетата [(2R,3R,4S,5S)-3,4,6-триацетокси-5-фтортетрагидропиран-2-ил]метила (102 мг, 0,291 ммоль) и 4-бром-2-метоксифенола (116 мг, 0,571 ммоль). Очистка флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (10 г) с применением градиента EtOAc (от 0 до 40%) в Гекс. дает указанное в заголовке соединение (71 мг, 49% выход) в виде бесцветной смолы. 1H ЯМР (400 МГц, CDCl3) δ 7,07-6,88 (м, 3H), 5,58 (дд, J=6,9, 1,6 Гц, 1H), 5,49 (ддд, J=28,0, 10,1, 2,4 Гц, 1H), 5,40 (т, J=9,3 Гц, 1H), 5,03 (дт, J=49,4, 2,1 Гц, 1H), 4,26 (дд, J=14,0, 4,8 Гц, 2H), 4,16-4,06 (м, 1H), 3,84 (с, 3H), 2,13 (с, 3H), 2,07 (с, 3H), 2,04 (с, 3H). 19F ЯМР (376 МГц, CDCl3) δ -204,14 (ддд, J=49,5, 28,2, 6,9 Гц). ИЭР-МС m/z рассч. 493,27, найдено 493,28 (M+1)+
Стадия II: ПРИМЕР 5
Удаление ацетатных защитных групп ацетата [(2R,3R,4S,5S,6R)-3,4-диацетокси-6-(4-бром-2-метокси-фенокси)-5-фтортетрагидропиран-2-ил]метила со стадии I (67 мг, 0,136 ммоль) с применением протокола, описанного для ПРИМЕРА 1, Стадия II, дает указанное в заголовке соединение (50 мг, 98% выход) в виде бесцветного твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,18-7,09 (м, 2H), 7,03 (дд, J=8,6, 2,3 Гц, 1H), 5,56 (дд, J=7,1, 1,9 Гц, 1H), 4,94-4,72 (м, 1H), 3,96 (ддд, J=31,0, 9,3, 2,6 Гц, 1H), 3,84 (с, 3H), 3,82-3,67 (м, 4H). 19F ЯМР (376 МГц, CD3OD) δ -206,72 (ддд, J=49,8, 30,9, 7,2 Гц). ИЭР-МС m/z рассч. 366,01144, найдено 367,28 (M+1)+
Получение ПРИМЕРА 6
3-[4-[(2R,3S,4S,5S,6R)-3-фтор-4,5-дигидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]окси-3-метилфенил]-N-метилбензамид

Стадия I: ацетат [(2R,3R,4S,5S,6R)-3,4-диацетокси-5-фтор-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-2-ил]метила

В пробирку для микроволновой печи загружают ацетат [(2R,3R,4S,5S,6R)-3,4-диацетокси-6-(4-бром-2-метилфенокси)-5-фтортетрагидропиран-2-ил]метила из ПРИМЕРА 1, Стадия I (75 мг, 0,157 ммоль), N-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензамид (49 мг, 0,188 ммоль), Cs2CO3 (178 мг, 0,546 ммоль), SiliaCat DPP-Pd (67 мг, 0,01742 ммоль) и 2 мл CH3CN. Пробирку дегазируют, накрывают крышкой и подвергают микроволновому облучению в течение 10 мин при 100°C. Реакционную смесь разбавляют EtOAc, фильтруют на целите и промывают порциями EtOAc. Объединенные фильтраты концентрируют и неочищенный продукт очищают флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (10 г) с применением градиента EtOAc (от 50 до 80%) в Гекс. с получением указанного в заголовке соединения в виде белого пенистого твердого вещества (55 мг, 66% выход). ИЭР-МС m/z рассч. 531,19, найдено 532,62 (M+1)+
Стадия II: ПРИМЕР 6
Удаление ацетатных защитных групп ацетата [(2R,3R,4S,5S,6R)-3,4-диацетокси-5-фтор-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-2-ил]метила со стадии I (45 мг, 0,0847 ммоль) с применением протокола, описанного для ПРИМЕРА 1, Стадия II, с получением указанного в заголовке соединения (34 мг, 98% выход) в виде белого рыхлого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,02 (т, J=1,6 Гц, 1H), 7,78-7,71 (м, 2H), 7,54-7,44 (м, 3H), 7,34 (д, J=8,5 Гц, 1H), 5,78 (дд, J=6,8, 1,9 Гц, 1H), 4,87 (дт, J=49,4, 4,9 Гц, 1H), 4,02 (ддд, J=30,9, 9,6, 2,6 Гц, 1H), 3,84-3,69 (м, 3H), 3,67-3,60 (м, 1H), 2,94 (с, 3H), 2,32 (с, 3H). 19F ЯМР (376 МГц, CD3OD) δ -206,77 (ддд, J=49,6, 31,0, 6,8 Гц). ИЭР-МС m/z рассч. 405,15875, найдено 406,52 (M+1)+
Получение ПРИМЕРА 7
3-[4-[(2R,3S,4S,5S,6R)-3-фтор-4,5-дигидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]оксифенил]-N-метилбензамид

Стадия I: ацетат [(2R,3R,4S,5S,6R)-3,4-диацетокси-5-фтор-6-[4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-2-ил]метила

В сосуде подавлением раствор ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M1 (124 мг, 0,354 ммоль) и ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A1 (161 мг, 0,708 ммоль) в CH2Cl2 (3,7 мл) обрабатывают BF3.Et2O (135 мкл, 1,06 ммоль) по каплям, смесь перемешивают при КТ в течение 5 мин, затем нагревают вплоть до 40°C и перемешивают в течение ночи, затем добавляют еще BF3.OEt2 ((135 мкл, 1,06 ммоль)) и реакционную смесь перемешивают при 40°C в течение ночи. После охлаждения до КТ, добавляют 3 мл насыщенный водный раствор NaHCO3 и 1 мл смеси CHCl3-iPrOH (4:1). Слои разделяют, и водный слой экстрагируют смесью CHCl3-iPrOH (4:1, 3×2 мл). Объединенные органические экстракты концентрируют, и полученный неочищенный продукт очищают флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (25 г) с применением градиента MeOH (от 0 до 5%) в CH2Cl2. Фракции, содержащие продукт, концентрируют и очищают снова флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (10 г) с применением градиента EtOAc (50-100%) в Гекс. Чистые фракции концентрируют досуха с получением указанного в заголовке соединения в виде белого пенистого твердого вещества (18 мг, 10% выход). 1H ЯМР (400 МГц, CDCl3) δ 7,96 (с, 1H), 7,67 (дд, J=8,1, 4,3 Гц, 2H), 7,57 (д, J=8,7 Гц, 2H), 7,48 (т, J=7,7 Гц, 1H), 7,18 (д, J=8,7 Гц, 2H), 6,21 (с, 1H), 5,75 (дд, J=6,6, 1,5 Гц, 1H), 5,59-5,34 (м, 2H), 4,99 (д, J=49,5 Гц, 1H), 4,29 (дд, J=12,6, 5,1 Гц, 1H), 4,16-4,00 (м, 2H), 3,04 (д, J=4,8 Гц, 3H), 2,15 (с, 3H), 2,06 (с, 3H), 2,04 (с, 3H).
Стадия II: ПРИМЕР 7
Удаление ацетатных защитных групп ацетата [(2R,3R,4S,5S,6R)-3,4-диацетокси-5-фтор-6-[4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-2-ил]метила со стадии I (18 мг, 0,034 ммоль) с применением протокола, описанного для ПРИМЕРА 1, Стадия II, дает указанное в заголовке соединение (12 мг, 86% выход) в виде белого рыхлого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,03 (т, J=1,7 Гц, 1H), 7,80-7,72 (м, 2H), 7,67-7,58 (м, 2H), 7,52 (т, J=7,8 Гц, 1H), 7,29-7,19 (м, 2H), 5,76 (дд, J=6,9, 1,7 Гц, 1H), 4,91-4,75 (м, 1H), 3,98 (ддд, J=30,9, 9,5, 2,6 Гц, 1H), 3,80 (дд, J=12,0, 2,4 Гц, 1H), 3,77-3,70 (м, 2H), 3,69-3,61 (м, 1H), 2,94 (с, 3H). ИЭР-МС m/z рассч. 391,14313, найдено 392,31 (M+H)+
Получение ПРИМЕРА 8
3-[4-[(2R,3S,4S,5S,6R)-3-фтор-4,5-дигидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]окси-3-метоксифенил]-N-метилбензамид

Указанное в заголовке соединение получают по методике, описанной для ПРИМЕРА 2, но с применением (2R,3S,4S,5S,6R)-6-(4-бром-2-метоксифенокси)-5-фтор-2-(гидроксиметил)тетрагидропиран-3,4-диола (ПРИМЕР 5) (40 мг, 0,106 ммоль) и [3-(метилкарбамоил)фенил]бороновой кислоты (28 мг, 0,156 ммоль). Очистка ВЭЖХ с обращенной фазой и сушка вымораживанием объединенных фракций, содержащих желаемый продукт, дает указанное в заголовке соединение (18 мг, 40% выход) в виде белого рыхлого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,05 (т, J=1,7 Гц, 1H), 7,82-7,70 (м, 2H), 7,52 (т, J=7,8 Гц, 1H), 7,36-7,27 (м, 2H), 7,21 (дд, J=8,3, 2,1 Гц, 1H), 5,64 (дд, J=7,1, 1,8 Гц, 1H), 4,89 (дт, J=49,6, 2,3 Гц, 1H), 4,02 (ддд, J=31,0, 9,5, 2,5 Гц, 1H), 3,94 (с, 3H), 3,88-3,70 (м, 4H), 2,95 (с, 3H). 19F ЯМР (376 МГц, CD3OD) δ -206,65 (ддд, J=49,6, 30,8, 7,1 Гц). ИЭР-МС m/z рассч. 421,1537, найдено 422,41 (M+1)+
Получение ПРИМЕРА 9
Диметил 5-[4-[(2R,3S,4S,5S,6R)-3-фтор-4,5-дигидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]оксифенил]бензол-1,3-дикарбоксилат

Стадия I: диметил 5-[4-[(2R,3S,4S,5R,6R)-4,5-диацетокси-6-(ацетоксиметил)-3-фтортетрагидропиран-2-ил]оксифенил]бензол-1,3-дикарбоксилата

Указанное в заголовке соединение получают по методике, описанной для ПРИМЕРА 7, но с применением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M1 (207 мг, 0,591 ммоль) и ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A9 (364 мг, 1,18 ммоль). После очистки флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (10 г) с применением градиента EtOAc (от 0 до 50%) в Гекс. указанное в заголовке соединение (204 мг, 60% выход) получают в виде белого твердого вещества, которое применяют сразу на следующей стадии.
Стадия II: ПРИМЕР 9
Удаление ацетатных защитных групп диметил 5-[4-[(2R,3S,4S,5R,6R)-4,5-диацетокси-6-(ацетоксиметил)-3-фтор-тетрагидропиран-2-ил]оксифенил]бензол-1,3-дикарбоксилата со стадии I (204 мг, 0,354 ммоль) с применением протокола, описанного для ПРИМЕРА 1, Стадия II и очистка флэш-хроматографией с обращенной фазой на Biotage™ SNAP C18 картридже (30 г) с применением градиента MeCN (10-70%) в H2O с получением указанного в заголовке соединения (64 мг, 39% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,57 (т, J=1,6 Гц, 1H), 8,44 (д, J=1,6 Гц, 2H), 7,72-7,56 (м, 2H), 7,39-7,20 (м, 2H), 5,79 (дд, J=6,9, 1,8 Гц, 1H), 4,92-4,76 (м, 1H), 3,99 (ддд, J=30,9, 9,6, 2,7 Гц, 1H), 3,81 (дд, J=12,0, 2,4 Гц, 1H), 3,77-3,70 (м, 2H), 3,69-3,62 (м, 1H). ИЭР-МС m/z рассч. 450,1326, найдено 451,24 (M+1)+
Получение ПРИМЕРА 10
7-[(2R,3S,4S,5S,6R)-3-фтор-4,5-дигидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]окси-4-метилхромен-2-он

Стадия I: ацетат [(2R,3R,4S,5S,6R)-3,4-диацетокси-5-фтор-6-(4-метил-2-оксохромен-7-ил)окситетрагидропиран-2-ил]метила

Указанное в заголовке соединение получают по методике, описанной для ПРИМЕРА 7, но с применением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M1 (201 мг, 0,574 ммоль) и 4-метилумбеллиферона (201 мг, 1,14 ммоль). Очистка флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (10 г) с применением градиента EtOAc (от 0 до 20%) в CH2Cl2 дает указанное в заголовке соединение (26 мг, 10% выход) в виде белого пенистого твердого вещества, которое применяют непосредственно на следующей стадии.
Стадия II: ПРИМЕР 10
Удаление ацетатных защитных групп ацетата [(2R,3R,4S,5S,6R)-3,4-диацетокси-5-фтор-6-(4-метил-2-оксохромен-7-ил)окситетрагидропиран-2-ил]метила (25 мг, 0,054 ммоль) с применением протокола, описанного для ПРИМЕРА 1, Стадия II и очистка флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (12 г) с применением градиента MeOH (от 0 до 10%) в CH2Cl2 дает указанное в заголовке соединение (13 мг, 68% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,73 (д, J=8,8 Гц, 1H), 7,19 (д, J=2,4 Гц, 1H), 7,15 (дд, J=8,8, 2,5 Гц, 1H), 6,22 (д, J=1,2 Гц, 1H), 5,87 (дд, J=6,9, 1,9 Гц, 1H), 4,92-4,76 (м, 1H), 3,96 (ддд, J=30,8, 9,6, 2,7 Гц, 1H), 3,84-3,65 (м, 3H), 3,62-3,52 (м, 1H), 2,46 (д, J=1,2 Гц, 3H). 19F ЯМР (376 МГц, CD3OD) δ -207,48 (ддд, J=49,2, 30,8, 6,8 Гц). ИЭР-МС m/z рассч. 340,09583, найдено 341,27 (M+1)+
Получение ПРИМЕРА 11
4'-(((2R,3R,4S,5R,6R)-4-фтор-3,5-дигидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)-N-метил-[1,1'-бифенил]-3-карбоксамид

Стадия I: (4aR,7R,8S,8aR)-7-(бензилокси)-8-фтор-6-(4-йодфенокси)-2-фенилгексагидропиранo[3,2-d][1,3]диоксин

К холодному (-40°С) раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M2 (140 мг, 0,3094 ммоль) и 4-йодфенола (109 мг, 0,495 ммоль) в CH2Cl2 (4,5 мл) добавляют 1-йодпирролидин-2,5-дион (111 мг, 0,495 ммоль) и трифторметансульфоновую кислоту (4 мкл, 0,0460 ммоль). Реакционную смесь перемешивают в течение 1 ч при -40°С и 16 ч при КТ. Полученную смесь разделяют между насыщенным NaHCO3 (4 мл) и CH2Cl2 (8 мл). Органический экстракт сушат (Na2SO4), фильтруют, выпаривают досуха и очищают на Biotage™ SNAP картридже на двуокиси кремния (10 г) с применением EtOAc (от 0% до 20% в 10 ОК) в Гекс. в качестве элюента с получением указанного в заголовке соединения (100 мг, 0,178 ммоль, 57%). ЖХ-МС: m/z=563,39 (M+H)+.
Стадия II: 4'-(((4aR,6R,7R,8S,8aR)-7-(бензилокси)-8-фтор-2-фенилгексагидропиранo[3,2-d][1,3]диоксин-6-ил)окси)-N-метил-[1,1'-бифенил]-3-карбоксамид

К раствору N-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензамида (56 мг, 0,215 ммоль) и (4aR,7R,8S,8aR)-7-(бензилокси)-8-фтор-6-(4-йодфенокси)-2-фенилгексагидропиранo[3,2-d][1,3]диоксина (110 мг, 0,1960 ммоль) со стадии I в MeOH (1,65 мл) добавляют Cs2CO3 (194 мг, 0,5980 ммоль) и SiliaCat DPP-Pd (78 мг, 0,020 ммоль). Реакционную смесь перемешивают 10 мин при 100°С в микроволновой печи. Полученную смесь фильтруют через целит, последний промывают MeOH и объединенный фильтрат концентрируют. Этот продукт разделяют между водой (4 мл) и EtOAc (8 мл). Органические экстракты сушат над Na2SO4, фильтруют, выпаривают досуха и очищают на Biotage™ SNAP картридже на двуокиси кремния (12 г) с применением EtOAc (от 0% до 100% в 10 ОК) в Гекс. в качестве элюента с получением указанного в заголовке соединения (45 мг, 0,079 ммоль, 40%). ЖХ-МС: m/z=570,53 (M+H)+.
Стадия III: ПРИМЕР 11
Смесь 4'-(((4aR,7R,8S,8aR)-7-(бензилокси)-8-фтор-2-фенилгексагидропиранo[3,2-d][1,3]диоксин-6-ил)окси)-N-метил-[1,1'-бифенил]-3-карбоксамид со стадии II (45 мг, 0,079 ммоль) и 20% масс. Pd(OH)2 на угле (32 мг, 0,0082 ммоль) в сухом MeOH (675 мкл) перемешивают в течение 24 часа в атмосфере H2 при 80 ф/д2. Полученную смесь фильтруют через целит, катализатор промывают MeOH, объединенные фильтраты концентрируют и очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (8,5 мг, 0,021 ммоль, 27%). 1H ЯМР (400 МГц, CD3OD) δ 8,01 (т, J=1,8 Гц, 1H), 7,81-7,67 (м, 2H), 7,65-7,54 (м, 2H), 7,49 (т, J=7,8 Гц, 1H), 7,33-7,16 (м, 2H), 5,57 (дд, J=4,6, 2,0 Гц, 1H), 4,77 (ддд, J=49,5, 9,3, 3,4 Гц, 1H), 4,26 (ддд, J=6,5, 3,5, 2,0 Гц, 1H), 4,03 (дт, J=12,9, 9,6 Гц, 1H), 3,84-3,66 (м, 2H), 3,61 (ддд, J=10,0, 5,0, 2,7 Гц, 1H), 2,92 (с, 3H). ЖХ-МС: m/z=392,34 (M+H)+.
Получение ПРИМЕРА 12
4'-(((2R,3S,4S,5S,6S)-6-(фторметил)-3,4,5-тригидрокситетрагидро-2H-пиран-2-ил)окси)-N-метил-[1,1'-бифенил]-3-карбоксамид

Стадия I: N-метил-4'-(((2R,3S,4S,5S,6S)-3,4,5-трис(бензилокси)-6-(фторметил)тетрагидро-2H-пиран-2-ил)окси)-[1,1'-бифенил]-3-карбоксамид

К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M3 (83 мг, 0,1243 ммоль) и [3-(метилкарбамоил)фенил]бороновой кислоты (35 мг, 0,1956 ммоль) in трет-бутаноле (4 мл) добавляют Na2CO3 (300 мкл 2M, 0,6000 ммоль), затем PdCl2(PPh3)2 (6 мг, 0,03384 ммоль). Реакционную смесь дегазируют три раза (вакуум, затем азот), затем перемешивают 5 часов при 80°С. Полученную темно-коричневую смесь охлаждают до КТ, разбавляют 15 мл EtOAc и фильтруют на слое силикагеля. Последний промывают двумя порциями 15 мл EtOAc. Объединенные фракции концентрируют, и остаток очищают на колонке с силикагелем (Snap 10 г) с применением гексана/EtOAc (от 20 до 80% в 20ОК) в качестве элюента на системе Biotage™ с получением указанного в заголовке соединения (61 мг, 90% чистый, 67% выход).
Стадия II: ПРИМЕР 12
К раствору N-метил-4'-(((2R,3S,4S,5S,6S)-3,4,5-трис(бензилокси)-6-(фторметил)тетрагидро-2H-пиран-2-ил)окси)-[1,1'-бифенил]-3-карбоксамида со стадии I (61 мг, 0,083 ммоль) в MeOH (8 мл) добавляют Pd(OH)2 (19 мг, 0,1353 ммоль). Реакционную смесь перемешивают в течение ночи под 100 ф/д2 H2. Полученную смесь фильтруют на Isolut Celite 545 картридже, последний промывают MeOH (2×4 мл) и концентрируют. Полученную смесь (29 мг) растворяют в MeOH и очищают ВЭЖХ. Фракции (4×6 мл), содержащие желаемый продукт, объединяют, концентрируют и, наконец, лиофилизируют с получением указанного в заголовке соединения в виде белого рыхлого твердого вещества (20 мг, 60% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ 8,55 (д, J=4,5 Гц, 1H), 8,07 (с, 1H), 7,80-7,72 (м, 2H), 7,68 (д, J=8,8 Гц, 2H), 7,52 (т, J=7,7 Гц, 1H), 7,18 (д, J=8,8 Гц, 2H), 5,51 (д, J=1,6 Гц, 1H), 4,65-4,38 (м, 2H), 3,88 (дд, J=3,1, 1,9 Гц, 1H), 3,74 (дд, J=8,7, 3,2 Гц, 1H), 3,67-3,52 (м, 2H), 2,81 (д, J=4,5 Гц, 3H). 19F ЯМР (376 МГц, ДМСО-d6) δ -0,75 (тд, J=47,9, 25,9 Гц). ЖХ-МС: m/z=392,31(M+H)+
Получение ПРИМЕРА 13
N,3'-диметил-4'-(((2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидро-2H-пиран-2-ил)окси)-[1,1'-бифенил]-3-карбоксамид

Стадия I: триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-метил-2-((3-метил-3'-(метилкарбамоил)-[1,1'-бифенил]-4-ил)окси)тетрагидро-2H-пиран-3,4,5-тритила

К суспензии ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M4 (10,80 г, 26,71 ммоль) и ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A2 (10,31 г, 42,74 ммоль) в 1,2-дихлорэтане (162,0 мл) при 0°C добавляют BF3.Et2O (10,15 мл, 80,13 ммоль) по каплям. Полученную смесь перемешивают при 40°C в течение 48 ч, охлаждают до 3°C и гасят 30 мл насыщенного водного NaHCO3 при перемешивании. Полученную суспензию фильтруют, и органическую фазу отделяют, сушат над Na2SO4, фильтруют и концентрируют. Очистка на 220 г двуокиси кремния с 40-100% EtOAc/Гексаном над 15 ОК на системе Biotage™ с получением указанного в заголовке соединения (7,8 г, 12,70 ммоль, 48%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,02 (т, J=1,8 Гц, 1H), 7,74 (ддт, J=7,8, 4,7, 1,3 Гц, 2H), 7,58-7,34 (м, 3H), 7,21 (д, J=8,5 Гц, 1H), 6,33 (с, 1H), 5,63 (д, J=9,7 Гц, 1H), 5,40 (т, J=9,9 Гц, 1H), 4,20 (дд, J=12,3, 5,0 Гц, 1H), 4,14-3,94 (м, 2H), 2,93 (с, 3H), 2,36 (с, 3H), 2,13 (с, 3H), 2,12 (с, 3H), 2,02 (с, 3H), 1,98 (с, 3H), 1,64 (с, 3H).
Стадия II: ПРИМЕР 13
К перемешиваемому раствору ацетата [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-5-метил-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-2-ил]метила со стадии I (3,70 г, 6,32 ммоль) в сухом MeOH (93 мл) при КТ добавляют NaOMe (704 мкл 25% масс./масс., 3,16 ммоль). Полученную смесь перемешивают 2 ч, затем добавляют полимер Ambilite IR-120 до тех пор, пока pH реакционной смеси не станет 4. Полученную смесь фильтруют и концентрируют досуха с получением указанного в заголовке соединения (2,600 г, 6,141 ммоль, 97%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,00 (т, J=1,8 Гц, 1H), 7,72 (ддт, J=8,0, 5,2, 1,2 Гц, 2H), 7,52-7,38 (м, 3H), 7,31 (д, J=8,5 Гц, 1H), 5,27 (с, 1H), 3,82-3,62 (м, 4H), 3,58 (м, 1H), 2,92 (с, 3H), 2,31 (с, 3H), 1,40 (с, 3H). ЖХ-МС: m/z=418,2 (M+H)+.
Получение ПРИМЕРА 14
N-метил-3-[4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]бензамид

Указанное в заголовке соединение получают по методике, описанной в ПРИМЕРЕ 13, но с применением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A1 на Стадии I. На Стадии II реакцию гасят пропусканием реакционной смеси через предварительно промытый 1 г SCX-2 картридж, промывая порциями MeOH. Объединенные фильтраты концентрируют и очищают ВЭЖХ с обращенной фазой с получением желаемого соединения (41% выход за две стадии). 1H ЯМР (400 МГц, CD3OD) δ 8,03 (т, J=1,7 Гц, 1H), 7,80-7,69 (м, 2H), 7,67-7,57 (м, 2H), 7,51 (т, J=7,8 Гц, 1H), 7,28-7,15 (м, 2H), 5,24 (с, 1H), 3,78-3,62 (м, 6H), 2,94 (с, 3H), 1,39 (с, 3H). ИЭР-МС m/z рассч. 403,43, найдено 404,14 (M+1)+
Получение ПРИМЕРА 15
3-[3-хлор-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]-N-метилбензамид

Указанное в заголовке соединение получают по методике, описанной в ПРИМЕРЕ 13, но с применением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A6 на Стадии I. На Стадии II реакцию гасят пропусканием реакционной смеси через предварительно промытый 1 г SCX-2 картридж, промывая порциями MeOH. Объединенные фильтраты концентрируют и очищают ВЭЖХ с обращенной фазой с получением желаемого соединения (6,5% выход за две стадии). 1H ЯМР (400 МГц, CD3OD) δ 8,04 (т, J=1,7 Гц, 1H), 7,83-7,70 (м, 3H), 7,59 (дд, J=8,6, 2,3 Гц, 1H), 7,54 (д, J=7,8 Гц, 1H), 7,50 (д, J=8,7 Гц, 1H), 5,32 (с, 1H), 3,85-3,59 (м, 5H), 2,95 (с, 3H), 1,45 (с, 3H). ИЭР-МС m/z рассч. 437,87, найдено 438,09 (M+1)+
Получение ПРИМЕРА 16
3-[3-фтор-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]-N-метилбензамид

Указанное в заголовке соединение получают по методике, описанной в ПРИМЕРЕ 13, но с применением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A5 на Стадии I. На Стадии II реакцию гасят пропусканием реакционной смеси через предварительно промытый 1 г SCX-2 картридж, промывая порциями MeOH. Объединенные фильтраты концентрируют и очищают ВЭЖХ с обращенной фазой с получением желаемого соединения (27% выход за две стадии). 1H ЯМР (400 МГц, CD3OD) δ 8,04 (т, J=1,7 Гц, 1H), 7,82-7,73 (м, 2H), 7,57-7,40 (м, 4H), 5,23 (с, 1H), 3,86-3,64 (м, 5H), 2,95 (с, 3H), 1,43 (с, 3H). 19F ЯМР (376 МГц, CD3OD) δ -134,69 (дд, J=12,1, 7,7 Гц). ИЭР-МС m/z рассч. 421,42, найдено 422,37 (M+1)+
Получение ПРИМЕРА 17
3-[3-метокси-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]-N-метилбензамид

Указанное в заголовке соединение получают по методике, описанной в ПРИМЕРЕ 13, но с применением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A4 на Стадии I. На Стадии II реакцию гасят пропусканием реакционной смеси через предварительно промытый 1 г SCX-2 картридж, промывая порциями MeOH. Объединенные фильтраты концентрируют и очищают ВЭЖХ с обращенной фазой с получением желаемого соединения (21% выход за две стадии). 1H ЯМР (400 МГц, CD3OD) δ 8,05 (т, J=1,7 Гц, 1H), 7,81-7,71 (м, 2H), 7,52 (т, J=7,8 Гц, 1H), 7,34-7,25 (м, 2H), 7,20 (дд, J=8,3, 2,2 Гц, 1H), 5,17 (с, 1H), 3,92 (с, 3H), 3,89-3,82 (м, 1H), 3,81-3,66 (м, 4H), 2,95 (с, 3H), 1,45 (с, 3H). ИЭР-МС m/z рассч. 433,45, найдено 434,17 (M+1)+
Получение ПРИМЕРА 18
(2R,3S,4S,5S,6R)-6-(гидроксиметил)-3-метил-2-[2-метил-4-(3-нитрофенил)фенокси]тетрагидропиран-3,4,5-триол

Указанное в заголовке соединение получают по методике, описанной в ПРИМЕРЕ 13, но с применением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A7 на Стадии I. На Стадии II реакцию гасят пропусканием реакционной смеси через предварительно промытый 1 г SCX-2 картридж, промывая порциями MeOH. Объединенные фильтраты концентрируют и очищают ВЭЖХ с обращенной фазой с получением желаемого соединения (46% выход за две стадии). 1H ЯМР (400 МГц, CD3OD) δ 8,42 (т, J=2,0 Гц, 1H), 8,16 (ддд, J=8,2, 2,2, 0,8 Гц, 1H), 8,00 (ддд, J=7,8, 1,6, 0,9 Гц, 1H), 7,66 (т, J=8,0 Гц, 1H), 7,55-7,44 (м, 2H), 7,37 (д, J=8,4 Гц, 1H), 5,31 (с, 1H), 3,81-3,67 (м, 4H), 3,64-3,52 (м, 1H), 2,34 (с, 3H), 1,42 (с, 3H). ИЭР-МС m/z рассч. 405,40, найдено 428,18 (M+Na) +
Получение ПРИМЕРА 19
(2R,3S,4S,5S,6R)-2-(2-хлор-4-(5-нитроиндолин-1-ил)фенокси)-6-(гидроксиметил)-3-метилтетрагидро-2H-пиран-3,4,5-триол

Стадия II: триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-2-(2-хлор-4-(5-нитроиндолин-1-ил)фенокси)-3-метилтетрагидро-2H-пиран-3,4,5-тритила

В пробирку для микроволновой печи загружают триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-2-(4-бром-2-хлорфенокси)-3-метилтетрагидро-2H-пиран-3,4,5-тритила из ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M11, Стадия I (60 мг, 0,109 ммоль), 5-нитроиндолин (26,8 мг, 0,163 ммоль), Cs2CO3 (110 мг, 0,337 ммоль), X-Phos (5,2 мг, 0,011 ммоль), Pd2(dba)3 (1,5 мг, 0,0016 ммоль) и толуол (880 мкл). Смесь затем нагревают до 100ºC в течение 15 минут в микроволновой печи, фильтруют на целите, концентрируют досуха и остаток очищают флэш-хроматографией на колонке на силикагеле (от 10 до 80% EtOAc в Гекс.) с получением указанного в заголовке соединения (32 мг, 47% выход).
Стадия II: ПРИМЕР 19
Указанное в заголовке соединение получают по методике, описанной в ПРИМЕРЕ 13 на Стадии II. Реакцию гасят пропусканием реакционной смеси через предварительно промытый 1 г SCX-2 картридж, промывая порциями MeOH. Объединенные фильтраты концентрируют и очищают ВЭЖХ с обращенной фазой с получением желаемого соединения. 1H ЯМР (400 МГц, CD3OD) δ 8,00 (м, 2H), 7,45 (д, J=8,9 Гц, 1H), 7,38 (д, J=2,7 Гц, 1H), 7,26 (дд, J=8,9, 2,7 Гц, 1H), 6,84 (д, J=8,8 Гц, 1H), 5,22 (с, 1H), 4,09 (т, J=9,0 Гц, 2H), 3,72 (м, 5H), 3,21 (т, J=9,0 Гц, 2H), 1,43 (с, 3H). ЖХМС m/z (M+H)+=467,23
Получение ПРИМЕРА 20
3-[3-этил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]-N-метилбензамид

Указанное в заголовке соединение получают по методике, описанной в ПРИМЕРЕ 13, но с применением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A3 на Стадии I. На Стадии II реакцию гасят пропусканием реакционной смеси через предварительно промытый 1 г SCX-2 картридж, промывая порциями MeOH. Объединенные фильтраты концентрируют и очищают ВЭЖХ с обращенной фазой с получением желаемого соединения (37% выход за две стадии). 1H ЯМР (400 МГц, CD3OD) δ 8,03 (т, J=1,7 Гц, 1H), 7,80-7,64 (м, 2H), 7,54-7,42 (м, 3H), 7,35 (д, J=8,4 Гц, 1H), 5,31 (с, 1H), 3,80-3,68 (м, 4H), 3,66-3,52 (м, 1H), 2,95 (с, 3H), 2,83-2,67 (м, 2H), 1,42 (с, 3H), 1,27 (т, J=7,5 Гц, 3H). ИЭР-МС m/z рассч. 431,1944, найдено 432,24 (M+1)+
Получение ПРИМЕРА 21
3-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]бензойная кислота

Стадия I: Метил 3-[3-метил-4-[(2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]бензоат

Указанное в заголовке соединение получают по методике, описанной в ПРИМЕРЕ 13, но с применением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A8 на Стадии I. Очистка на Biotage™ SNAP картридже на двуокиси кремния дает указанное в заголовке соединение (21% выход) в виде бесцветного масла. 1H ЯМР (400 МГц, CDCl3) δ 8,23 (с, 1H), 7,99 (д, J=7,6 Гц, 1H), 7,74 (д, J=7,6 Гц, 1H), 7,53-7,38 (м, 3H), 7,28 (д, J=6,3 Гц, 1H), 5,51-5,35 (м, 3H), 4,31 (дд, J=12,5, 5,2 Гц, 1H), 4,14-4,06 (м, 2H), 3,96 (с, 3H), 2,38 (с, 3H), 2,26 (с, 3H), 2,16 (с, 3H), 2,05 (д, J=2,3 Гц, 6H), 1,39 (с, 3H). ЖХ-МС: m/z=609,31 (M+Na)+.
Стадия II: 3'-метил-4'-(((2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)-3-метилтетрагидро-2H-пиран-2-ил)окси)-[1,1'-бифенил]-3-карбоновая кислота
К раствору метил 3-[3-метил-4-[(2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]бензоата со стадии I (237 мг, 0,404 ммоль) в MeOH (4 мл) добавляют водный NaOH 2M (807 мкл 2M, 1,61 ммоль) и реакционную смесь перемешивают в течение 3 ч. Реакционную смесь гасят водным HCl 4M (101 мкл 4M, 0,404 ммоль) до тех пор, пока pH не достигнет 2, и полученную смесь лиофилизируют в течение ночи. Остаток растворяют в пиридине и к раствору добавляют Ac2O (305 мкл, 3,23 ммоль) и ДМАП (2,5 мг, 0,020 ммоль). Реакционную смесь перемешивают при КТ в течение 18 ч, выливают в HCl 1N, разбавляют EtOAc и перемешивают в течение 15 мин. Органическую фазу отделяют, промывают водой, солевым раствором, сушат над Na2SO4, фильтруют, концентрируют в вакууме. Остаток очищают на Biotage™ SNAP картридже на двуокиси кремния (10 г) с получением указанного в заголовке соединения (168 мг, 73% выход) в виде бесцветного масла. 1H ЯМР (400 МГц, CDCl3) δ 8,28 (т, J=1,6 Гц, 1H), 8,08-8,03 (м, 1H), 7,82-7,76 (м, 1H), 7,53 (т, J=7,8 Гц, 1H), 7,48-7,40 (м, 2H), 7,27 (с, 1H), 5,52-5,35 (м, 3H), 4,31 (дд, J=12,7, 5,4 Гц, 1H), 4,13-4,06 (м, 2H), 2,37 (с, 3H), 2,16 (с, 3H), 2,13 (с, 3H), 2,05 (д, J=1,0 Гц, 6H), 1,38 (с, 3H). ЖХ-МС: m/z=595,62 (M+Na)+.
Стадия III: ПРИМЕР 21
К раствору 3'-метил-4'-(((2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)-3-метилтетрагидро-2H-пиран-2-ил)окси)-[1,1'-бифенил]-3-карбоновой кислоты со стадии II (20 мг, 0,035 ммоль) в MeOH (300 мкл) добавляют NaOMe в MeOH (35 мкл 0,5M, 0,018 ммоль) до pH=9. Реакционную смесь перемешивают при КТ в течение 18 ч. Реакцию нейтрализуют кислым полимером Amberlyst, фильтруют и концентрируют с получением указанного в заголовке соединения (12 мг, 75%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,19 (с, 1H), 7,93 (д, J=7,7 Гц, 1H), 7,78 (д, J=7,7 Гц, 1H), 7,49 (т, J=7,7 Гц, 1H), 7,42 (д, J=9,3 Гц, 2H), 7,31 (д, J=8,3 Гц, 1H), 5,27 (с, 1H), 3,78-3,67 (м, 4H), 3,64-3,55 (м, 1H), 2,31 (с, 3H), 1,40 (с, 3H). ЖХ-МС: m/z=405,18 (M+H)+.
Получение ПРИМЕРА 22
N-[2-[2-(2-аминоэтокси)этокси]этил]-3-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метил-тетрагидропиран-2-ил]оксифенил]бензамид

Стадия I: трет-бутил N-[2-[2-[2-[[3-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метил-тетрагидропиран-2-ил]оксифенил]бензоил]амино]этокси]этокси]этил]карбамат

К раствору 3'-метил-4'-(((2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)-3-метилтетрагидро-2H-пиран-2-ил)окси)-[1,1'-бифенил]-3-карбоновой кислоты из ПРИМЕРА 21, Стадия II (148 мг, 0,259 ммоль) в ДМФ (5,2 мл) добавляют трет-бутил N-[2-[2-(2-аминоэтокси)этокси]этил]карбамат (70,6 мг, 0,284 ммоль). Раствор охлаждают при 0°C, добавляют ГАТУ (118 мг, 0,310 ммоль) и ДИПЭА (59 мкл, 0,34 ммоль). Полученную смесь нагревают до КТ и перемешивают в течение 3 ч. Реакционную смесь разбавляют EtOAc и промывают 3 раза насыщенным водным NH4Cl. Объединенные водные фазы экстрагируют 5 раз EtOAc. Объединенные органические фазы сушат над MgSO4 и концентрируют в вакууме. Остаток очищают на Biotage™ SNAP картридже на двуокиси кремния (10 г). Объединенные фракции, содержащие желаемый продукт, объединяют, концентрируют и растворяют в MeOH (5 мл). Туда добавляют NaOMe в MeOH (517 мкл 0,5M, 0,259 ммоль) до pH=9. Полученную смесь перемешивают в течение ночи. Реакционную смесь нейтрализуют кислым полимером Amberlyst и концентрируют с получением указанного в заголовке соединения (81 мг, 45%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,02 (с, 1H), 7,73 (ддд, J=7,8, 3,3, 1,5 Гц, 2H), 7,51-7,42 (м, 3H), 7,30 (д, J=8,5 Гц, 1H), 5,27 (с, 1H), 3,75-3,56 (м, 11H), 3,48 (т, J=5,6 Гц, 2H), 3,31-3,27 (м, 4H), 3,17 (т, J=5,6 Гц, 2H), 2,30 (с, 3H), 1,39 (2s, 12H). ЖХ-МС: m/z=635,43 (M+H)+
Стадия II: ПРИМЕР 22
К трет-бутил N-[2-[2-[2-[[3-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]бензоил]амино]этокси]этокси]этил]карбамату со стадии I (70,6 мг, 0,102 ммоль) добавляют ТФК в CH2Cl2 1:1 (7мл) и смесь перемешивают в течение 5 мин. Реакционную смесь концентрируют в вакууме с получением указанного в заголовке соединения в виде соли ТФК (65 мг, 91%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,02 (с, 1H), 7,77-7,70 (м, 2H), 7,48 (дд, J=18,4, 10,9 Гц, 3H), 7,31 (д, J=8,0 Гц, 1H), 5,27 (с, 1H), 3,78-3,63 (м, 12H), 3,61 (д, J=5,6 Гц, 4H), 3,04 (с, 2H), 2,31 (с, 3H), 1,40 (с, 3H). ЖХ-МС: m/z=535,75 (M+H)+
Получение ПРИМЕРА 23
4'-(((2R,3S,4S,5S,6R)-3-((бензилокси)метил)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)-N,3'-диметил-[1,1'-бифенил]-3-карбоксамид

Указанное в заголовке соединение получают по методике, описанной в ПРИМЕРЕ 13 но с применением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M8 на Стадии I. 1H ЯМР (400 МГц, CD3OD) δ 8,03 (т, J=1,8 Гц, 1H), 7,73 (ддт, J=9,3, 7,9, 1,3 Гц, 2H), 7,55-7,37 (м, 3H), 7,35-7,22 (м, 1H), 7,20-7,04 (м, 5H), 5,64 (с, 1H), 4,61 (д, J=12,2 Гц,1H), 4,36 (д, J=12,1 Гц, 1H), 3,88-3,67 (м, 5H), 3,67-3,40 (м, 2H), 2,93 (с, 3H), 2,13 (с, 3H). ЖХ-МС: m/z=524,3 (M+H)+
Получение ПРИМЕРА 24
N,3'-диметил-4'-(((2R,3S,4S,5S,6R)-3,4,5-тригидрокси-3,6-бис(гидроксиметил)тетрагидро-2H-пиран-2-ил)окси)-[1,1'-бифенил]-3-карбоксамид

Стадия I: триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-(гидроксиметил)-2-((3-метил-3'-(метилкарбамоил)-[1,1'-бифенил]-4-ил)окси)тетрагидро-2H-пиран-3,4,5-тритила

К раствору ацетата [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-5-(бензилоксиметил)-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-2-ил]метила из ПРИМЕРА 23, Стадия 1 (100 мг, 0,145 ммоль) в EtOH (3,3 мл) и AcOH (33 мкл, 0,5784 ммоль) добавляют Pd(OH)2 20% (41 мг, 0,058 ммоль). Реакционную смесь перемешивают под 1 атм. H2 в течение 16 ч. Полученную смесь фильтруют над Целитом, последний промывают MeOH и объединенные фракции MeOH концентрируют в вакууме. Остаток очищают на Biotage™ SNAP картридже на двуокиси кремния (10 г) с применением EtOAc (0-75%, 10ОК) в Гекс. в качестве элюента с получением указанного в заголовке соединения (65 мг, 75%) в виде твердого вещества. ЖХ-МС: m/z=602,6 (M+H)+.
Стадия II: ПРИМЕР 24
К перемешиваемому раствору триацетата (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-(гидроксиметил)-2-((3-метил-3'-(метилкарбамоил)-[1,1'-бифенил]-4-ил)окси)тетрагидро-2H-пиран-3,4,5-тритила со стадии I (20 мг, 0,033 ммоль) в сухом MeOH (1,2 мл) при КТ добавляют NaOMe (66 мкл 0,5M, 0,039 ммоль). Полученную смесь перемешивают 16 часов, нейтрализуют ионообменной смолой Dowex 50 WX4-400 (H+). Смесь фильтруют, концентрируют в вакууме и очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (6,0 мг, 41%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,00 (т, J=1,8 Гц, 1H), 7,71 (ддт, J=7,7, 4,9, 1,2 Гц, 2H), 7,55-7,40 (м, 3H), 7,33 (д, J=8,5 Гц, 1H), 5,56 (с, 1H), 3,95 (д, J=11,5 Гц, 1H), 3,87 (д, J=11,4 Гц, 1H), 3,82-3,65 (м, 4H), 3,58 (дт, J=6,8, 3,3 Гц, 1H), 2,92 (с, 3H), 2,28 (с, 3H).
Получение ПРИМЕРА 25
N-метил-3-[3-метил-4-[(2R,3S,4S,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-4-метилтетрагидропиран-2-ил]оксифенил]бензамид

Стадия 1: (2R,4aR,6S,7S,8R,8aR)-6-(бензилокси)-8-((трет-бутилдиметилсилил)окси)-2-фенилгексагидропиранo[3,2-d][1,3]диоксин-7-ол

К раствору коммерчески доступного (4aR,6S,7S,8R,8aS)-6-бензилокси-2-фенил-4,4a,6,7,8,8a-гексагидропиранo[5,6-d][1,3]диоксин-7,8-диола (8,00 г, 22,3 ммоль) и 4H-имидазола (2,181 г, 32,03 ммоль) в ДМФ (72 мл) добавляют трет-бутилхлордиметилсилан (4,189 г, 5,17 мл, 27,79 ммоль). Реакционную смесь перемешивают в течение 120 минут и затем разделяют между EtOAc и водой. Органические экстракты сушат над Na2SO4, фильтруют, выпаривают досуха и очищают на силикагеле с применением 0-20% EtOAc:Гекс. в качестве элюента с получением указанного в заголовке соединения (9,83 г, 88% выход). 1H ЯМР (400 МГц, ДМСО-D6) δ 7,54-7,26 (м, 10H), 5,68 (с, 1H), 5,10 (дд, J=11,8, 4,6 Гц, 1H), 4,83 (д, J=1,3 Гц, 1H), 4,74 (д, J=12,2 Гц, 1H), 4,55 (д, J=12,2 Гц, 1H), 4,16 (дт, J=12,2, 6,1 Гц, 1H), 4,03-3,92 (м, 2H), 3,87-3,76 (м, 1H), 3,75-3,57 (м, 1H), 0,87 (с, 9H), 0,07 (с, 3H), 0,02 (с, 3H).
Стадия 2: (4aR,6S,7S,8R,8aR)-6-(бензилокси)-8-((трет-бутилдиметилсилил)окси)-2-фенилгексагидропиранo[3,2-d][1,3]диоксин-7-ол

К раствору (2R,4aR,6S,7S,8R,8aR)-6-(бензилокси)-8-((трет-бутилдиметилсилил)окси)-2-фенилгексагидропиранo[3,2-d][1,3]диоксин-7-ол со стадии I (600 мг, 1,269 ммоль) в ДМФ (6,0 мл) при 0°C добавляют NaH (55 мг, 1,40 ммоль). Реакционную смесь перемешивают в течение 15 минут, затем добавляют BnBr (181 мкл, 1,52 ммоль). Реакционную смесь перемешивают 2 ч при КТ. После завершения, реакционную смесь разделяют между водой и EtOAc. Органические экстракты сушат над Na2SO4, фильтруют и выпаривают досуха. Неочищенный продукт очищают на силикагеле с применением 0-10% EtOAc:Гекс. в качестве элюента с получением указанного в заголовке соединения (530 мг, 71% выход). 1H ЯМР (400 МГц, ДМСО-d6) δ 7,55-7,22 (м, 15H), 5,75 (с, 1H), 5,03 (д, J=1,1 Гц, 1H), 4,73 (м, 3H), 4,56 (д, J=12,1 Гц, 1H), 4,21-3,88 (м, 3H), 3,82-3,52 (м, 3H), 0,82 (с, 9H), 0,05 (с, 3H), 0,01 (с, 3H).
Стадия III: (4aR,6S,7S,8S,8aS)-6,7-бис(бензилокси)-2-фенилгексагидропиранo[3,2-d][1,3]диоксин-8-ол

К раствору (4aR,6S,7S,8R,8aR)-6-(бензилокси)-8-((трет-бутилдиметилсилил)окси)-2-фенилгексагидропиранo[3,2-d][1,3]диоксин-7-ола со стадии II (7,80 г, 13,86 ммоль) в ТГФ (78 мл) в закрытом реакционном сосуде добавляют AcOH (1,18 мл, 20,8 ммоль) и фторид тетрабутиламмония (41,6 мл 1M, 41,6 ммоль). Реакционную смесь перемешивают при 60°C в течение 1 ч и охлаждают КТ. Реакционную смесь затем разделяют между водой и EtOAc и водную фазу экстрагируют EtOAc 3 раза. Объединенные органические экстракты сушат над Na2SO4, фильтруют и выпаривают досуха. Неочищенный продукт очищают на силикагеле с применением 0-25% EtOAc:Гекс. в качестве элюента с получением указанного в заголовке соединения (4,90 г, 79%). 1H ЯМР (400 МГц, ДМСО-D6) δ 7,47-7,11 (м, 15H), 5,69-5,53 (м, 1H), 5,30-5,16 (м, 1H), 4,97 (т, J=9,3 Гц, 1H), 4,77-4,56 (м, 3H), 4,54-4,36 (м, 1H), 4,17-4,05 (м, 1H), 3,94-3,78 (м, 2H), 3,78-3,47 (м, 3H).
Стадия IV: (4aR,6S,7R,8aR)-6,7-дибензилокси-2-фенил-4a,6,7,8a-тетрагидро-4H-пиранo[3,2-d][1,3]диоксин-8-он

К раствору (4aR,6S,7S,8S,8aS)-6,7-бис(бензилокси)-2-фенилгексагидропиранo[3,2-d][1,3]диоксин-8-ола со стадии III (500 мг, 1,115 ммоль) в CH2Cl2 (5,0 мл) добавляют раствор периодинана Десса-Мартина (709 мг, 1,672 ммоль) в CH2Cl2 (5,0 мл) по каплям в течение 5 минут. Смесь перемешивают в течение 3 часов. Реакционную смесь разделяют между водным насыщенным раствором NaHCO3 и CH2Cl2. Водную фазу экстрагируют 3 раза с применением CH2Cl2 Объединенные органические экстракты сушат над Na2SO4, фильтруют и выпаривают досуха. Неочищенный продукт очищают на силикагеле с применением 0-25% EtOAc:Гекс. в качестве элюента с получением указанного в заголовке соединения (320 мг, 64% выход). 1H ЯМР (400 МГц, ДМСО-D6) δ 7,44-7,21 (м, 15H), 5,79 (с, 1H), 5,32 (д, J=1,2 Гц, 1H), 5,00 (д, J=9,5 Гц, 1H), 4,70 (д, J=11,7 Гц, 1H), 4,59-4,46 (м, 3H), 4,25 (дд, J=9,6, 4,4 Гц, 1H), 4,05-3,83 (м, 3H).
Стадия V: (4aR,6S,7S,8aS)-6,7-дибензилокси-8-метилен-2-фенил-4a,6,7,8a-тетрагидро-4H-пиранo[3,2-d][1,3]диоксин

К раствору бромида метил(трифенил)фосфония (2,080 г, 5,823 ммоль) в ТГФ (22,40 мл) при 0°C добавляют трет-бутоксид калия (5,38 мл 1M, 5,38 ммоль). Смесь перемешивают при 0°C в течение 30 минут. К этой смеси добавляют через шприц раствор (4aR,6S,7R,8aR)-6,7-дибензилокси-2-фенил-4a,6,7,8a-тетрагидро-4H-пиранo[3,2-d][1,3]диоксин-8-она со стадии IV (2 г, 4,479 ммоль) в ТГФ (22,40 мл). Полученную смесь нагревают вплоть до КТ и перемешивают в течение ночи. После завершения добавляют насыщенный водный раствор NH4Cl, и реакционную смесь экстрагируют EtOAc 3 раза. Объединенные органические экстракты сушат над Na2SO4, фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией с применением градиента 5-20% EtOAc:Гекс. с получением указанного в заголовке соединения (1,31 г, 66% выход). 1H ЯМР (400 МГц, CDCl3) δ 7,62-7,50 (м, 2H), 7,46-7,23 (м, 13H), 5,68 (с, 1H), 5,46 (дт, J=2,0, 1,2 Гц, 1H), 5,18 (д, J=1,9 Гц, 1H), 4,96 (д, J=1,2 Гц, 1H), 4,74 (д, J=12,0 Гц, 1H), 4,67 (д, J=12,1 Гц, 1H), 4,59-4,49 (м, 1H), 4,41 (дд, J=15,1, 10,3 Гц, 2H), 4,22 (дд, J=5,6, 2,6 Гц, 1H), 3,98 (с, 1H), 3,95-3,83 (м, 2H). ЖХМС: m/z=467,4 (M+Na)+.
Стадия VI: (4aR,6S,7S,8S,8aR)-6,7-дибензилокси-2-фенилспиро[4a,6,7,8a-тетрагидро-4H-пиранo[3,2-d][1,3]диоксин-8,2'-оксиран]

(4aR,6S,7S,8aS)-6,7-дибензилокси-8-метилен-2-фенил-4a,6,7,8a-тетрагидро-4H-пиранo[3,2-d][1,3]диоксин со стадии V (1,23 г, 2,767 ммоль) растворяют в CH2Cl2 (28 мл) и добавляют м-ХПБК (1,116 г, 4,981 ммоль). Смесь перемешивают при КТ в течение 3 часов. Добавляют еще м-ХПБК (1,116 г, 4,981 ммоль) и полученный раствор перемешивают в течение 3 дней. Затем снова добавляют м-ХПБК (272 мг) и раствор перемешивают в течение ночи. После завершения, смесь фильтруют над Целитом и добавляют насыщенный раствор NaHCO3. Полученную смесь экстрагируют 3 раза CH2Cl2. Объединенные органические экстракты сушат над Na2SO4, фильтруют и концентрируют в вакууме. Неочищенный остаток очищают флэш-хроматографией с применением градиента 5-20% EtOAc:Гекс. Желаемые фракции объединяют и концентрируют в вакууме. Затем проводят вторую очистку с применением 5-15% EtOAc:Гекс. с получением указанного в заголовке соединения (396 мг, 31% выход). 1H ЯМР (400 МГц, CDCl3) δ 7,58-7,19 (м, 15H), 5,60 (с, 1H), 5,01-4,88 (м, 2H), 4,75 (д, J=12,1 Гц, 1H), 4,68 (д, J=12,1 Гц, 1H), 4,52 (д, J=12,0 Гц, 1H), 4,44 (д, J=9,4 Гц, 1H), 4,27 (дд, J=10,0, 4,5 Гц, 1H), 4,04 (тд, J=9,8, 4,5 Гц, 1H), 3,97-3,86 (м, 1H), 3,40-3,34 (м, 1H), 3,21 (д, J=5,1 Гц, 1H), 2,74 (д, J=5,1 Гц, 1H). ЖХМС: m/z=483,1 (M+Na)+.
Стадия VII: (4aR,6S,7S,8S,8aR)-6,7-дибензилокси-8-(йодметил)-2-фенил-4a,6,7,8a-тетрагидро-4H-пиранo[3,2-d][1,3]диоксин-8-ол

I2 (393 мг, 1,55 ммоль) добавляют к раствору PPh3 (404 мг, 1,55 ммоль) в CH2Cl2 (5,9 мл) и смесь перемешивают при КТ в течение 5 минут, в этот момент добавляют раствор (4aR,6S,7S,8S,8aR)-6,7-дибензилокси-2-фенилспиро[4a,6,7,8a-тетрагидро-4H-пиранo[3,2-d][1,3]диоксин-8,2'-оксирана] со стадии VI (396 мг, 0,8599 ммоль) в CH2Cl2 (4,887 мл). Полученный раствор перемешивают в течение 5 часов. После завершения, реакцию гасят 10% водным раствором NaHSO3, и смесь энергично перемешивают в течение 5 минут. Полученную смесь разбавляют простым эфиром и слои разделяют. Органическую фазу промывают последовательно водой и солевым раствором, сушат над Na2SO4, фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией с применением 0-20% EtOAc:Гекс. в качестве элюента с получением указанного в заголовке соединения (204 мг, 40% выход). 1H ЯМР (400 МГц, CDCl3) δ 7,53-7,28 (м, 15H), 5,54 (с, 1H), 4,94 (д, J=1,4 Гц, 1H), 4,75 (д, J=12,3 Гц, 1H), 4,72-4,62 (м, 2H), 4,54 (д, J=12,3 Гц, 1H), 4,27-4,17 (м, 1H), 4,05-3,90 (м, 3H), 3,88-3,68 (м, 3H), 3,07 (д, J=2,3 Гц, 1H).
Стадия VIII: (4aR,6S,7S,8S,8aR)-6,7-дибензилокси-8-метил-2-фенил-4a,6,7,8a-тетрагидро-4H-пиранo[3,2-d][1,3]диоксин-8-ол

К раствору (4aR,6S,7S,8S,8aR)-6,7-дибензилокси-8-(йодметил)-2-фенил-4a,6,7,8a-тетрагидро-4H-пиранo[3,2-d][1,3]диоксин-8-ола со стадии VII (204 мг, 0,3467 ммоль) в толуоле (6,932 мл) добавляют гидрид трибутилолова (15 мг, 140 мкл, 0,520 ммоль) и AIBN (3,4 мг, 0,021 ммоль). Полученный раствор перемешивают при 90°C в течение 12 часов. После завершения, реакционную смесь концентрируют в вакууме. Остаток очищают флэш-хроматографией с применением 0-30% EtOAc:Гекс. с получением указанного в заголовке соединения (121 мг, 75% выход). 1H ЯМР (400 МГц, CDCl3) δ 7,54-7,45 (м, 2H), 7,43-7,28 (м, 13H), 5,56 (с, 1H), 5,02-4,95 (м, 1H), 4,80-4,55 (м, 3H), 4,49 (д, J=12,1 Гц, 1H), 4,28-4,17 (м, 1H), 3,90-3,71 (м, 3H), 3,53-3,44 (м, 1H), 2,93 (с, 1H), 1,51 (с, 3H). ЖХМС: m/z=463,4 (M+H)+
Стадия IX: ацетат [(2R,3R,4S,5S)-3,4,5,6-тетраацетокси-4-метилтетрагидропиран-2-ил]метила

(4aR,6S,7S,8S,8aR)-6,7-дибензилокси-8-метил-2-фенил-4a,6,7,8a-тетрагидро-4H-пиранo[3,2-d][1,3]диоксин-8-ол со стадии VIII (151 мг, 0,3265 ммоль) растворяют в MeOH (3,265 мл) и смесь дегазируют азотом. Pd/C, влажный, Degussa (139 мг, 0,131 ммоль) добавляют к смеси, которую затем перемешивают при КТ под 1 атм. H2 в течение 6 дней. Реакционную смесь фильтруют над Целитом и промывают MeOH и CH2Cl2. Раствор концентрируют в вакууме.
Смесь неочищенных продуктов (смесь полностью лишенных защиты и моно-бензилированных соединений) затем перемешивают в пиридине (5 мл) с уксусным ангидридом (2,5 мл, 26,50 ммоль) при КТ в течение 18 часов. Добавляют ДМАП (7,9 мг, 0,065 ммоль) и реакционную смесь перемешивают 2 часа, затем добавляют пиридин (1 мл) и уксусный ангидрид (0,5 мл, 5,30 ммоль) и ДМАП (7,9 мг, 0,065 ммоль), и реакционную смесь перемешивают в течение ночи. После завершения, реакционную смесь концентрируют в вакууме и совместно выпаривают с бензолом 3 раза. Неочищенный продукт очищают флэш-хроматографией с применением градиента 0-50% EtOAc:Гекс. Необходима вторая очистка с применением в этот раз 10-30% EtOAc:Гекс.
Полученный продукт растворяют в MeOH (1,658 мл), и смесь дегазируют азотом в течение нескольких минут, в этот момент добавляют Pd/C, влажный, Degussa (52,93 мг, 0,04974 ммоль) и смесь перемешивают в течение недели под 1 атм. H2. Смесь фильтруют над Целитом и промывают MeOH и CH2Cl2. Фильтрат концентрируют в вакууме, и продукт растворяют в пиридине (5 мл) и Ac2O (2,5 мл, 26,50 ммоль) добавляют. Смесь перемешивают при КТ в течение 12 часов. После завершения, реакционную смесь концентрируют в вакууме и совместно выпаривают с бензолом. Неочищенный продукт очищают флэш-хроматографией с применением 0-50% EtOAc:Гекс. в качестве градиента с получением указанного в заголовке соединения (37 мг, 13% общий выход). ЖХМС: m/z=427,3 (M+Na)+.
Стадия X: ацетат [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-4-метил-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-2-ил]метила

К раствору ацетата [(2R,3R,4S,5S)-3,4,5,6-тетраацетокси-4-метилтетрагидропиран-2-ил]метила со стадии IX (37,0 мг, 0,0915 ммоль) и ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A2 (44,2 мг, 0,1830 ммоль) в 1,2-дихлорэтане (523,2 мкл) при 0°C в пробирке для микроволновой печи добавляют BF3.OEt2 (34,8 мкл, 0,275 ммоль) по каплям. Смесь нагревают вплоть до КТ и затем нагревают вплоть до 40°C и перемешивают в течение ночи. После завершения, реакционную смесь охлаждают до КТ, и реакционную смесь очищают непосредственно флэш-хроматографией с применением градиента 40-90% EtOAc:Гекс. с получением указанного в заголовке соединения (27 мг, 50% выход). ЖХМС: m/z=586,4 (M+H)+
Стадия XI: ПРИМЕР 25
К перемешиваемому раствору ацетата [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-4-метил-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-2-ил]метила со стадии×(27 мг, 0,0461 ммоль) в сухом метаноле (461 мкл) при КТ добавляют раствор NaOMe 25% масс./об. в MeOH (9,964 мкл, 0,04611 ммоль). Полученную смесь перемешивают 2 часа. ЖХМС показывает, что реакция завершена. После завершения смесь загружают в SPE, SXC картридж (1 г). Колонку промывают MeOH в эквиваленте 4 ОК. Фильтрат концентрируют в вакууме с получением неочищенного желаемого продукта. Наконец, продукт подвергают очистке с обращенной фазой с получением указанного в заголовке соединения (19 мг, 66% выход). 1H ЯМР (400 МГц, CD3OD) δ 8,02 (д, J=1,9 Гц, 1H), 7,74 (ддд, J=8,0, 5,0, 1,6 Гц, 2H), 7,54-7,42 (м, 3H), 7,31 (д, J=8,4 Гц, 1H), 5,55 (д, J=1,8 Гц, 1H), 3,86-3,63 (м, 5H), 2,94 (с, 3H), 2,32 (с, 4H), 1,50 (с, 3H). ЖХМС: m/z=418,31 (M+H)+
Получение ПРИМЕРА 26
N-метил-3-[3-метил-4-[(2S,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-6-метилтетрагидропиран-2-ил]окси-фенил]бензамид

Стадия I: ацетат [(2R,3S,4S,5S,6S)-3,4,5-триацетокси-2-метил-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-2-ил]метила

К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M7 (123 мг, 0,304 ммоль) и ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A2 (147 мг, 0,608 ммоль) в 1,2-дихлорэтане (1,73 мл) при 0°C добавляют BF3.OEt2 (116 мкл, 0,913 ммоль) по каплям. Смесь нагревают вплоть до КТ и затем нагревают вплоть до 40°C и перемешивают в течение ночи. После завершения, реакционную смесь охлаждают до КТ и загружают непосредственно в колонку для флэш-хроматографии. Очистку проводят с применением градиента 20-80% EtOAc:Гекс. Смешанные фракции собирают и очищают снова флэш-хроматографией с применением градиента 30-70% EtOAc:Гекс. Чистый продукт, собранный при первой и второй очистках, объединяют в получением желаемого указанного в заголовке соединения (150 мг, 84% выход). 1H ЯМР (400 МГц, CD3OD) δ 8,02 (т, J=1,8 Гц, 1H), 7,77-7,68 (м, 2H), 7,55-7,40 (м, 3H), 7,19 (д, J=8,5 Гц, 1H), 5,71 (д, J=2,8 Гц, 1H), 5,70 (с, 1H), 5,68-5,66 (м, 1H), 5,51 (дд, J=2,8, 2,1 Гц, 1H), 4,05-3,94 (м, 2H), 2,94 (с, 3H), 2,32 (с, 3H), 2,20 (с, 3H), 2,11 (с, 3H), 2,08 (с, 3H), 2,04 (с, 3H), 1,31 (с, 3H). ЖХ-МС: m/z=586,7 (M+H)+
Стадия II: ПРИМЕР 26
К перемешиваемому раствору ацетата [(2R,3S,4S,5S,6S)-3,4,5-триацетокси-2-метил-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-2-ил]метила (150 мг, 0,2561 ммоль) в сухом метаноле (2,561 мл) при КТ добавляют раствор метоксида натрия в метаноле 25% масс./об. (55,34 мкл, 0,2561 ммоль). Полученную смесь перемешивают 2 часа. После завершения, смесь разбавляют минимумом MeOH и загружают в SPE, SXC картридж (1 г). Колонку промывают MeOH в эквиваленте 4 ОК. Фильтрат концентрируют в вакууме с получением указанного в заголовке соединения (89 мг, 71% выход). 1H ЯМР (400 МГц, CD3OD) δ 8,00 (т, J=1,8 Гц, 1H), 7,76-7,67 (м, 2H), 7,52-7,41 (м, 3H), 7,27 (д, J=8,4 Гц, 1H), 5,58 (д, J=1,8 Гц, 1H), 4,16 (дд, J=10,1, 3,2 Гц, 1H), 4,12-4,02 (м, 2H), 3,52 (д, J=11,5 Гц, 1H), 3,43 (д, J=11,6 Гц, 1H), 2,92 (с, 3H), 2,27 (с, 3H), 1,09 (с, 3H). ЖХ-МС: m/z=418,3 (M+H)+
Получение ПРИМЕРА 27
N-метил-3-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-[(1S)-1-гидроксиэтил]тетрагидропиран-2-ил]оксифенил]бензамид

Стадия 1: [(2R,3R,4S,5S,6R)-3,5-диацетокси-2-[(1S)-1-ацетоксиэтил]-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-4-ил]ацетат

К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M5 (96,0 мг, 0,237 ммоль) и ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A2 (115 мг, 0,475 ммоль) в 1,2-дихлорэтане (1,4 мл) при 0°C добавляют BF3.OEt2 (90,3 мкл, 0,712 ммоль) по каплям. Смесь нагревают вплоть до КТ и затем нагревают вплоть до 40°C. Полученный раствор перемешивают в течение ночи. После завершения, реакционную смесь охлаждают до КТ и загружают непосредственно в колонку для флэш-хроматографии. Очистку проводят с применением градиента 30-100% EtOAc:Гекс. Проводят вторую флэш-хроматографию с применением 30-70% EtOAc:Гекс. с получением указанного в заголовке соединения (66 мг, 47% выход). ЖХ-МС: m/z=586,6 (M+H)+
Стадия II: ПРИМЕР 27
К перемешиваемому раствору [(2R,3R,4S,5S,6R)-3,5-диацетокси-2-[(1S)-1-ацетоксиэтил]-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-4-ил]ацетата со стадии I (66 мг, 0,113 ммоль) в сухом метанол (1,2 мл) при КТ добавляют раствор NaOMe в MeOH 25% масс./об. (24,35 мкл, 0,1127 ммоль). Полученную смесь перемешивают 1 час. После завершения смесь концентрируют и загружают в SPE, SXC картридж (1 г). Колонку промывают MeOH в эквиваленте 4 ОК. Фильтрат концентрируют в вакууме с получением продукта, который лиофилизируют в смеси MeOH и воды (41 мг, 82% выход). 1H ЯМР (400 МГц, CD3OD) δ 8,52 (с, 1H), 8,01 (т, J=1,8 Гц, 1H), 7,72 (ддт, J=7,9, 5,0, 1,3 Гц, 2H), 7,47 (тд, J=8,5, 8,1, 6,1 Гц, 3H), 7,24 (д, J=8,5 Гц, 1H), 5,61 (д, J=1,8 Гц, 1H), 4,12-4,01 (м, 2H), 4,00-3,82 (м, 2H), 2,98-2,86 (м, 3H), 2,29 (с, 3H), 1,08 (д, J=6,6 Гц, 3H). ЖХ-МС: m/z=418,5 (M+H)+
Получение ПРИМЕРА 28
(2R,3S,4S,5S,6R)-2-[2-хлор-4-(5-нитроиндолин-1-ил)фенокси]-6-[(1S)-1-гидроксиэтил]тетрагидропиран-3,4,5-триол

Стадия I: [(2R,3R,4S,5S,6R)-3,5-диацетокси-2-[(1S)-1-ацетоксиэтил]-6-(4-бром-2-хлорфенокси)тетрагидропиран-4-ил]ацетат

К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M5 (100 мг, 0,250 ммоль) и 4-бром-2-хлорфенола (101 мг, 0,490 ммоль) в CH2Cl2 (1,5 мл) при 0°C добавляют BF3.OEt2 (97 мкл, 0,76 ммоль) по каплям. Смесь нагревают вплоть до КТ и затем нагревают вплоть до 40°C. Полученный раствор перемешивают в течение ночи. После завершения, реакционную смесь охлаждают до КТ и загружают непосредственно в колонку для флэш-хроматографии. Очистку проводят с применением градиента 0-40% EtOAc/Гекс. с получением указанного в заголовке соединения (95 мг, 0,17 ммоль, 69,60%). ЖХ-МС: m/z=575,43 (M+Na)+
Стадия II:

В пробирку для микроволновой печи загружают [(2R,3R,4S,5S,6R)-3,5-диацетокси-2-[(1S)-1-ацетоксиэтил]-6-(4-бром-2-хлорфенокси)тетрагидропиран-4-ил]ацетат со стадии I (82,0 мг, 0,150 ммоль), 5-нитроиндолин (12,0 мг, 0,072 ммоль), Cs2CO3 (48,0 мг, 0,15 ммоль), X-Phos (2,0 мг, 0,0042 ммоль) и Pd2(DBA)3 (0,55 мг, 0,00060 ммоль). Добавляют толуол (1,2 мл), и пробирку дегазируют (вакуум, затем N2), закрывают крышкой и подвергают микроволновому облучению в течение 15 мин при 100°C. Реакционную смесь разбавляют EtOAc, пропускают на 500 мг картридже на двуокиси кремния и элюируют EtOAc. Остаточную смесь концентрируют при пониженном давлении и применяют как есть на следующей стадии без дальнейшей очистки.
Стадия III: ПРИМЕР 28
К перемешиваемому раствору [(2R,3R,4S,5S,6R)-3,5-диацетокси-2-[(1S)-1-ацетоксиэтил]-6-[2-хлор-4-(5-нитроиндолин-1-ил)фенокси]тетрагидропиран-4-ил]ацетата со стадии II (0,15 ммоль) в сухом MeOH (2 мл) при КТ добавляют NaOMe (150 мкл 0,5M, 0,0740 ммоль). Полученную смесь перемешивают в течение 4 часов при КТ. После завершения смесь концентрируют и загружают в катионообменную смолу (SXC, картридж, 1 г). Колонку промывают метанолом в эквиваленте 4 ОК. Смесь очищают с применением ВЭЖХ с обращенной фазой. Объединенные фракции, содержащие желаемый продукт, лиофилизируют с получением указанного в заголовке соединения (47 мг, 82% выход). 1H ЯМР (400 МГц, CD3OD) δ 8,53 (с, 1H), 8,11-7,94 (м, 1H), 7,49-7,18 (м, 3H), 6,84 (д, J=8,7 Гц, 1H), 5,60 (с, 1H), 4,18-4,01 (м, 2H), 3,92 (дд, J=20,5, 11,3 Гц, 2H), 3,41-3,33 (м, 1H), 3,25-3,16 (м, 1H), 1,07 (д, J=6,6 Гц, 3H). ЖХ-МС: m/z=467,35 (M+H)+
Получение ПРИМЕРА 29
N-метил-3-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-[(1R)-1-гидроксиэтил]тетрагидропиран-2-ил]окси-фенил]бензамид

Стадия I: (2R,3R,4S,5S,6R)-3,5-диацетокси-2-[(1R)-1-ацетоксиэтил]-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-4-ил]ацетат

К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M6 (145 мг, 0,359 ммоль) и ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A2 (173 мг, 0,717 ммоль) в 1,2-дихлорэтане (2,050 мл) при 0°C в пробирке для микроволновой печи добавляют BF3.OEt2 (136 мкл, 1,08 ммоль) по каплям. Смесь нагревают вплоть до КТ и затем перемешивают в течение ночи при 40°C и. После завершения, реакционную смесь охлаждают до КТ и загружают сразу в колонку для флэш-хроматографии. Очистку проводят с применением градиента 30-100% EtOAc:Гекс. Смешанные фракции собирают и очищают снова флэш-хроматографией с применением градиента 50-85% EtOAc:Гекс. Чистый продукт, собранный после первой и второй очистки, объединяют с получением желаемого соединения (210 мг, 67% выход). ЖХ-МС: m/z=586,7 (M+H)+
Стадия II: ПРИМЕР 29
К перемешиваемому раствору [(2R,3R,4S,5S,6R)-3,5-диацетокси-2-[(1R)-1-ацетоксиэтил]-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-4-ил]ацетата со стадии I (141 мг, 0,241 ммоль) в сухом MeOH (2,5 мл) при КТ добавляют раствор NaOMe в MeOH 25% масс./об. (52 мкл, 0,24 ммоль). Полученную смесь перемешивают 1 час при КТ. После завершения смесь концентрируют, и неочищенный продукт загружают в минимальное количество метанола в SPE, SXC картридж (1 г). Колонку промывают MeOH в эквиваленте 4 ОК. Фильтрат концентрируют в вакууме с получением неочищенного продукта, который подвергают ВЭЖХ с обращенной фазой. Чистые фракции объединяют и лиофилизируют сразу с получением указанного в заголовке соединения (38,9 мг, 36% выход). 1H ЯМР (400 МГц, CD3OD) δ 8,00 (т, J=1,8 Гц, 1H), 7,72 (ддт, J=7,9, 5,1, 1,3 Гц, 2H), 7,51-7,42 (м, 3H), 7,28 (д, J=8,5 Гц, 1H), 5,52 (д, J=1,8 Гц, 1H), 4,05 (дд, J=3,4, 1,8 Гц, 1H), 4,00 (квд, J =6,5, 4,6 Гц, 1H), 3,94 (дд, J=9,3, 3,4 Гц, 1H), 3,76 (т, J=9,6 Гц, 1H), 3,49 (дд, J=9,8, 4,5 Гц, 1H), 2,92 (с, 3H), 2,30 (с, 3H), 1,18 (д, J=6,4 Гц, 3H). ЖХ-МС: m/z=418,2 (M+H)+
Получение ПРИМЕРА 30
N-метил-3-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-[(1S)-1-гидрокси-2-метилпропил]тетрагидропиран-2-ил]оксифенил]бензамид

Стадия I: (1S)-2-метил-1-[(2R,3S,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-ил]пропан-1-ол

К раствору (2R,3R,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-ил]метанола (Daragics, K.; Fügedi, P. Tet. Lett., 2009, 50, 2914-2916) (1,500 г, 2,774 ммоль), ДМСО (8,159 мл) и NEt3 (1,93 мл, 13,9 ммоль) в CH2Cl2 (8,2 мл) при 0°C добавляют комплекс SO3.пиридин (2,208 г, 13,87 ммоль) 3 порциями. Реакционную смесь перемешивают в течение 1 часа. После завершения, реакционную смесь разбавляют EtOAc и промывают водой, 10% водным бисульфатом калия, насыщенным водным NaHCO3 и солевым раствором. Органический слой сушат над MgSO4 и концентрируют в вакууме. Остаток совместно выпаривают дважды с бензолом с получением неочищенного альдегида, который применяют без дальнейшей очистки.
Бромизопропилмагний (957 мкл 2,9M, 2,77 ммоль) добавляют к раствору (2S,3S,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-карбальдегида (747 мг, 1,39 ммоль) в ТГФ (7,0 мл) при 0°C. Раствор перемешивают в течение 15 мин и ледяную баню удаляют, и смесь перемешивают в течение 15 мин при КТ. После завершения, смесь гасят насыщенным водным NH4Cl. Водный слой повторно экстрагируют 3 раза EtOAc. Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией с применением градиента 0-50% EtOAc:Гекс. с получением указанного в заголовке соединения (407 мг, 50% выход за 2 стадии). 1H ЯМР (400 МГц, CD3Cl) δ 7,26 (с, 20H), 5,00-4,87 (м, 2H), 4,79-4,59 (м, 6H), 4,42 (д, J=12,0 Гц, 1H), 4,26-4,14 (м, 1H), 3,97 (дд, J=9,5, 3,1 Гц, 1H), 3,89-3,75 (м, 2H), 3,43 (дд, J=10,7, 8,8 Гц, 1H), 1,98 (д, J=10,8 Гц, 1H), 1,92 (дт, J=8,9, 6,7 Гц, 1H), 1,07 (д, J=6,7 Гц, 3H), 0,91 (д, J=6,7 Гц, 3H). ЖХ-МС: m/z=605,0 (M+Na)+.
Стадия II: (3S,4S,5S,6R)-6-[(1S)-1-гидрокси-2-метил-пропил]тетрагидропиран-2,3,4,5-тетрол

(1S)-2-метил-1-[(2R,3S,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-ил]пропан-1-ол со стадии I (407 мг, 0,698 ммоль) растворяют в MeOH (7,2 мл) и смесь дегазируют азотом. Pd/C, влажный, Degussa (446 мг, 0,419 ммоль) добавляют к смеси, которую затем перемешивают при КТ под 1 атм. H2 в течение ночи. На следующий день заполняют свежий H2 и добавляют AcOH (159 мкл, 2,794 ммоль). Реакционную смесь перемешивают в течение недели. Реакционную смесь фильтруют над Целитом, промывают MeOH и CH2Cl2 и фильтрат концентрируют в вакууме. Остаток растворяют в EtOH (6,983 мл) и AcOH (159 мкл, 2,79 ммоль) и смесь дегазируют азотом. Pd(OH)2 (294 мг, 0,419 ммоль) добавляют к смесь, которую затем перемешивают при КТ в течение 2 дней под 1 атм. H2. Реакционную смесь фильтруют над Целитом, промывают MeOH и CH2Cl2. Фильтрат концентрируют в вакууме с получением указанного в заголовке соединения, которое используют как таковое на следующей стадии. ЖХ-МС: m/z=245,2 (M+Na)+.
Стадия III: [(3S,4S,5R,6R)-2,3,5-триацетокси-6-[(1S)-1-ацетокси-2-метилпропил]тетрагидропиран-4-ил]ацетат

(3S,4S,5S,6R)-6-[(1S)-1-гидрокси-2-метил-пропил]тетрагидропиран-2,3,4,5-тетрол со стадии II (155 мг, 0,698 ммоль) растворяют в пиридине (10 мл) и Ac2O (5,0 мл, 53 ммоль) добавляют. Смесь перемешивают при КТ в течение 12 часов. Реакционную смесь концентрируют в вакууме и совместно выпаривают с бензолом 3 раза. Очистку неочищенного продукта проводят флэш-хроматографией с применением градиента 0-50% EtOAc:Гекс. с получением указанного в заголовке соединения (35,7 мг, 11% выход). ЖХ-МС: m/z=455,3 (M+Na)+.
Стадия IV: [(2R,3R,4S,5S,6R)-3,5-диацетокси-2-[(1S)-1-ацетокси-2-метилпропил]-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-4-ил]ацетат

К раствору [(3S,4S,5R,6R)-2,3,5-триацетокси-6-[(1S)-1-ацетокси-2-метилпропил]тетрагидропиран-4-ил]ацетата со стадии III (35,7 мг, 0,0826 ммоль) и ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A2 (39,8 мг, 0,165 ммоль) в 1,2-дихлорэтане (505 мкл) при 0°C добавляют BF3.OEt2 (31,4 мкл, 0,248 ммоль) по каплям. Смесь нагревают вплоть до КТ и затем нагревают вплоть до 40°C и перемешивают в течение ночи. После завершения, реакционную смесь охлаждают до КТ и очищают непосредственно флэш-хроматографией с применением градиента 40-100% EtOAc:Гекс. с получением указанного в заголовке соединения (29,3 мг, 58% выход). ЖХ-МС: m/z=614,4 (M+H)+
Стадия V: ПРИМЕР 30
К перемешиваемому раствору [(2R,3R,4S,5S,6R)-3,5-диацетокси-2-[(1S)-1-ацетокси-2-метилпропил]-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-4-ил]ацетата со стадии IV (29,3 мг, 0,04775 ммоль) в сухом MeOH (500,2 мкл) при КТ добавляют раствор NaOMe в MeOH 25% масс./об. (10,3 мкл, 0,0478 ммоль). Полученную смесь перемешивают 2 часа при КТ. После завершения смесь разбавляют минимальным количеством MeOH и загружают в SPE, SXC картридж (1 г). Колонку промывают MeOH в эквиваленте 4 ОК. Фильтрат концентрируют в вакууме с получением неочищенного продукта, который очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (10,8 мг, 51% выход). 1H ЯМР (400 МГц, CD3OD) δ 8,00 (т, J=1,8 Гц, 1H), 7,72 (ддт, J=7,1, 4,0, 1,2 Гц, 2H), 7,56-7,37 (м, 3H), 7,20 (д, J=8,5 Гц, 1H), 5,66 (д, J=1,8 Гц, 1H), 4,10-4,01 (м, 1H), 3,96 (дд, J=5,4, 2,1 Гц, 2H), 3,58 (дт, J=7,3, 1,4 Гц, 1H), 3,38-3,30 (м, 1H), 2,92 (с, 3H), 2,29 (с, 3H), 1,84-1,64 (м, 1H), 0,92 (д, J=6,7 Гц, 3H), 0,38 (д, J=6,7 Гц, 3H). ЖХ-МС: m/z=446,0 (M+H)+.
Получение ПРИМЕРА 31
N-метил-3-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-[(1S)-1-гидроксипропил]тетрагидропиран-2-ил]оксифенил]бензамид

Стадия I: (S)-1-((2R,3S,4S,5S,6S)-3,4,5,6-тетракис(бензилокси)тетрагидро-2H-пиран-2-ил)пропан-1-ол

К раствору (2R,3R,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-ил]метанола (Daragics, K.; Fügedi, P. Tet. Lett., 2009, 50, 2914-2916) (1,500 г, 2,774 ммоль), ДМСО (8,159 мл) и NEt3 (1,93 мл, 13,9 ммоль) в CH2Cl2 (8,15 мл) при 0°C добавляют комплекс SO3.пиридин (2,208 г, 13,87 ммоль) 3 порциями. Реакционную смесь перемешивают в течение 1 часа. После завершения, реакционную смесь разбавляют EtOAc и промывают водой, 10% водным бисульфатом калия, насыщенным водным NaHCO3 и солевым раствором. Органическую фазу сушат над MgSO4 и концентрируют в вакууме. Остаток совместно выпаривают дважды с бензолом с получением неочищенного альдегида, который применяют без дальнейшей очистки.
EtMgBr (924,7 мкл of 3M in Et2O, 2,774 ммоль) добавляют к раствору (2S,3S,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-карбальдегида (747 мг, 1,39 ммоль) в ТГФ (6,9 мл) при 0°C. Реакционную смесь перемешивают в течение 15 минут при этой температуре и затем ледяную баню удаляют. Смесь перемешивают при КТ в течение еще 15 минут. После завершения, смесь гасят насыщенный водный NH4Cl. Водный слой повторно экстрагируют 3 раза EtOAc. Объединенные органические слои сушат над Na2SO4, фильтруют и концентрируют в вакууме. Неочищенный продукт очищают флэш-хроматографией с применением градиента 0-50% EtOAc:Гекс. с получением указанного в заголовке соединения. (633 мг, 80% выход за 2 стадии). ЖХ-МС: m/z=591,5 (M+Na)+.
Стадия II: (3S,4S,5S,6R)-6-[(1S)-1-гидроксипропил]тетрагидропиран-2,3,4,5-тетрол

(1S)-1-[(2R,3S,4S,5S,6S)-3,4,5,6-тетрабензилокситетрагидропиран-2-ил]пропан-1-ол (633 мг, 1,113 ммоль) растворяют в MeOH (11,13 мл) и смесь дегазируют азотом. Pd на C, 10% масс./масс., влажный, Degussa (710,7 мг, 0,6678 ммоль) затем добавляют к смеси. Реакционную смесь перемешивают при КТ под 1 атм. H2. Через 1 день H2 повторно заполняют, добавляют AcOH (253 мкл, 4,45 ммоль) и реакционную смесь перемешивают в течение выходных. Смесь фильтруют над Целитом, промывают MeOH и CH2Cl2 и фильтрат концентрируют в вакууме. Эту неочищенную смесь растворяют в EtOH (11 мл) и AcOH (253 мкл, 4,45 ммоль) и смесь дегазируют азотом. К смеси добавляют гидроксид палладия 10% масс./масс. (313 мг, 0,445 ммоль). Раствор затем перемешивают при КТ под 1 атм. H2 в течение 2 дней. В этот момент реакционную смесь фильтруют над Целитом, промывают MeOH и CH2Cl2 и фильтрат концентрируют в вакууме. Неочищенный продукт применяют как таковой на следующей стадии. ЖХ-МС: m/z=231,2 (M+Na)+.
Стадия III: [(3S,4S,5R,6R)-2,3,5-триацетокси-6-[(1S)-1-ацетоксипропил]тетрагидропиран-4-ил]ацетат

(3S,4S,5S,6R)-6-[(1S)-1-гидроксипропил]тетрагидропиран-2,3,4,5-тетрол со стадии II (231 мг, 1,11 ммоль) растворяют в пиридине (10 мл) и добавляют Ac2O (5,0 мл, 53,0 ммоль). Смесь перемешивают при КТ в течение 12 часов. Реакционную смесь затем концентрируют в вакууме и совместно выпаривают с бензолом. Очистку с применением флэш-хроматографии проводят с применением градиента 0-50% EtOAc:Гекс. Указанное в заголовке соединение получают и применяют как таковое на следующей стадии. ЖХ-МС: m/z=441,2 (M+Na)+.
Стадия IV: [(2R,3R,4S,5S,6R)-3,5-диацетокси-2-[(1S)-1-ацетоксипропил]-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-4-ил]ацетат

К раствору [(3S,4S,5R,6R)-2,3,5-триацетокси-6-[(1S)-1-ацетоксипропил]тетрагидропиран-4-ил]ацетата со стадии III (51,4 мг, 0,123 ммоль) и ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A2 (59,31 мг, 0,246 ммоль) в 1,2-дихлорэтане (730 мкл) при 0°C добавляют BF3.OEt2 (46,7 мкл, 0,369 ммоль) по каплям. Смесь нагревают вплоть до КТ и затем нагревают вплоть до 40°C и перемешивают в течение ночи. После завершения, реакционную смесь охлаждают до КТ и очищают непосредственно флэш-хроматографией с применением градиента 40-100% EtOAc:Гекс. Получают указанное в заголовке соединение и его применяют как таковое на следующей стадией. ЖХ-МС: m/z=622,4 (M+Na)+.
Стадия V: ПРИМЕР 31
К перемешиваемому раствору [(2R,3R,4S,5S,6R)-3,5-диацетокси-2-[(1S)-1-ацетоксипропил]-6-[2-метил-4-[3-(метилкарбамоил)фенил]фенокси]тетрагидропиран-4-ил]ацетата со стадии IV (47,7 мг, 0,07955 ммоль) в сухом MeOH (814 мкл) при КТ добавляют раствор NaOMe в MeOH 25% масс./об. (17,19 мкл, 0,07955 ммоль). Полученную смесь перемешивают в течение 2 часов. После завершения, реакционную смесь разбавляют минимальным количеством MeOH и загружают в SPE, SXC картридж (1 г). Колонку промывают MeOH в эквиваленте 4 ОК. Фильтрат концентрируют в вакууме с получением неочищенного продукта, который очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (15,5 мг, 3% выход за 4 стадии). 1H ЯМР (400 МГц, CD3OD) δ 8,02 (т, J=1,8 Гц, 1H), 7,81-7,68 (м, 2H), 7,56-7,41 (м, 3H), 7,23 (д, J=8,5 Гц, 1H), 5,65 (д, J=1,8 Гц, 1H), 4,09-4,03 (м, 1H), 3,97 (дд, J=5,4, 1,8 Гц, 2H), 3,77-3,69 (м, 1H), 3,44-3,38 (м, 1H), 2,94 (с, 3H), 2,31 (с, 3H), 1,56 (дт, J=13,5, 7,5 Гц, 1H), 1,35 (ткв, J=14,5, 7,3 Гц, 1H), 0,66 (т, J=7,4 Гц, 3H). ЖХ-МС: m/z=432,1 (M+H)+.
Получение ПРИМЕРА 32
(2R,3'S,4'S,5'S,6'R)-6'-(гидроксиметил)-6-метоксиспиро[хроман-2,2'-тетрагидропиран]-3',4',5'-триол (

Стадия I: (2R,3'S,4'S,5'R,6'R)-3',4',5'-трибензилокси-6'-(бензилоксиметил)-6-метоксиспиро[хроман-2,2'-тетрагидропиран]

К холодному (0°C) раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M9 (87 мг, 0,143 ммоль) и 4-метоксифенола (53,0 мг, 0,430 ммоль) в CH2Cl2 (2 мл) добавляют BF3.OEt2 (18,0 мкл, 0,142 ммоль). После перемешивания в течение 30 мин при 0°C, реакционную смесь разбавляют H2O и CH2Cl2 (3 мл каждый). Слои разделяют, и водный слой повторно экстрагируют CH2Cl2 (1 мл). Объединенные органические экстракты концентрируют и очищают флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (10 г) с применением градиента EtOAc (от 0 до 20%) в Гекс. с получением указанного в заголовке соединения (43 мг, 45% выход) в виде белого пенистого твердого вещества.
Стадия II: ПРИМЕР 32
Pd(OH)2 (16,5 мг, 0,0024 ммоль) загружают в сосуд под давлением, промытый N2. Добавляют MeOH (1 мл), затем раствор (2R,3'S,4'S,5'R,6'R)-3',4',5'-трибензилокси-6'-(бензилоксиметил)-6-метоксиспиро[хроман-2,2'-тетрагидропирана] со стадии I (43 мг, 0,064 ммоль) в MeOH (2 мл) и EtOAc (2 мл). Добавляют AcOH (15,0 мкл, 0,264 ммоль), сосуд под давлением продувают H2 (3x) и затем перемешивают в течение ночи под 45 ф/д2 H2. Реакционную смесь фильтруют на целите и катализатор промывают порциями MeOH. Объединенные фильтраты концентрируют и совместно выпаривают с бензолом с получением неочищенного продукта, который очищают флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (10 г) с применением градиента MeOH (от 0 до 20%) в CH2Cl2 с получением указанного в заголовке соединения (12 мг, 57% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 6,74-6,60 (м, 3H), 4,06 (дд, J=9,5, 3,4 Гц, 1H), 3,79-3,60 (м, 7H), 3,52 (ддд, J=9,9, 4,5, 2,7 Гц, 1H), 3,00 (ддд, J=16,6, 12,9, 6,2 Гц, 1H), 2,63 (ддд, J=16,4, 5,8, 2,2 Гц, 1H), 2,35 (ддд, J=13,6, 6,2, 2,4 Гц, 1H), 1,71 (тд, J=13,2, 6,0 Гц, 1H). ИЭР-МС m/z рассч. 312,32, найдено 335,29 (M+Na)+
Получение ПРИМЕРА 33
N-метил-3-[(2R,3'S,4'S,5'S,6'R)-3',4',5'-тригидрокси-6'-(гидроксиметил)спиро[хроман-2,2'-тетрагидропиран]-6-ил]бензамид

Стадия I: N-метил-3-[(2R,3'S,4'S,5'R,6'R)-3',4',5'-трибензилокси-6'-(бензилоксиметил)спиро[хроман-2,2'-тетрагидропиран]-6-ил]бензамид

Указанное в заголовке соединение получают по методике, описанной в ПРИМЕРЕ 32 с применением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M9 (116 мг, 0,19 ммоль) и ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A1 (138 мг, 0,610 ммоль) в ТГФ (2,7 мл). Через 1 ч при 0°C добавляют другой эквивалент BF3.OEt2 и перемешивание продолжают в течение 1,5 ч при 0°C и 2,5 ч при КТ. Очистка флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (10 г) с применением градиента EtOAc (от 0 до 20%) в CH2Cl2 дает указанное в заголовке соединение (18 мг, 12% выход) в качестве бесцветной камеди.
Стадия II: ПРИМЕР 33
Применяют N-метил-3-[(2R,3'S,4'S,5'R,6'R)-3',4',5'-трибензилокси-6'-(бензилоксиметил)спиро[хроман-2,2'-тетрагидропиран]-6-ил]бензамид со стадии I (23 мг, 0,030 ммоль). Очищают неочищенный продукт препаративной тонкослойной хроматографией на силикагеле (10×20 см, 1 мм толщина) с применением 20% MeOH в CH2Cl2 в качестве элюента. Конечный продукт растворяют в смеси H2O/MeCN (20% MeCN), фильтруют и лиофилизируют с получением указанного в заголовке соединения (8,9 мг, 69% выход) в виде белого рыхлого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,01 (т, J=1,7 Гц, 1H), 7,78-7,67 (м, 2H), 7,49 (т, J=7,8 Гц, 1H), 7,45-7,35 (м, 2H), 6,96-6,83 (м, 1H), 4,11 (дд, J=9,5, 3,4 Гц, 1H), 3,81 (д, J=3,4 Гц, 1H), 3,74 (т, J=9,7 Гц, 1H), 3,70-3,66 (м, 1H), 3,58 (ддд, J=9,9, 4,2, 3,1 Гц, 1H), 3,18-3,05 (м, 1H), 2,76 (ддд, J=15,8, 5,6, 2,2 Гц, 1H), 2,43 (ддд, J=13,5, 6,0, 2,4 Гц, 1H), 1,79 (тд, J=13,3, 5,9 Гц, 1H). ИЭР-МС m/z рассч. 415,44, найдено 416,39 (M+1)+
Получение ПРИМЕРА 34
(2R,3'S,4'S,5'S,6'R)-6'-(гидроксиметил)-6-(3-нитрофенил)спиро[хроман-2,2'-тетрагидропиран]-3',4',5'-триол

Стадия I: (2R,3'S,4'S,5'R,6'R)-3',4',5'-трибензилокси-6'-(бензилоксиметил)-6-(3-нитрофенил)спиро[хроман-2,2'-тетрагидропиран]

Указанное в заголовке соединение получают по методике, описанной в ПРИМЕРЕ 32 с применением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M9 (307 мг, 0,50 ммоль) и 4-(3-нитрофенил)фенола (326 мг, 1,52 ммоль) в качестве исходного материала и времени реакции 45 минут. Очистка флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (25 г) с применением градиента EtOAc (от 0 до 30%) в Гекс., затем вторая очистка на Biotage™ SNAP картридже на двуокиси кремния (10 г) с применением градиента EtOAc (от 0 до 10%) в CH2Cl2 дают указанное в заголовке соединение (87 мг, 23% выход) в виде беловатого пенистого твердого вещества.
Стадия II: ПРИМЕР 34
К холодному (-78°C) перемешиваемому раствору (2R,3'S,4'S,5'R,6'R)-3',4',5'-трибензилокси-6'-(бензилоксиметил)-6-(3-нитрофенил)спиро[хроман-2,2'-тетрагидропирана] со стадии I (85 мг, 0,11 ммоль) и 1,2,3,4,5-пентаметилбензола (166 мг, 1,12 ммоль) в CH2Cl2 (6,8 мл) добавляют раствор BCl3 в CH2Cl2 (1,10 мл 1,0M, 1,11 ммоль). После перемешивания в течение 2 ч при -78°C, реакционную смесь гасят MeOH (6,8 мл), нагревают до КТ, концентрируют и очищают на Biotage™ SNAP картридже на двуокиси кремния (10 г) с применением градиента MeOH (от 0 до 20%) в CH2Cl2 с получением указанного в заголовке соединения (32 мг, 69% выход) в виде бледно-желтого твердого вещества. 1H ЯМР (400 МГц, CD3OD+ДМСО-D6) δ 8,42 (т, J=2,0 Гц, 1H), 8,17 (ддд, J=8,2, 2,2, 0,9 Гц, 1H), 8,01 (ддд, J=7,8, 1,6, 1,0 Гц, 1H), 7,67 (т, J=8,0 Гц, 1H), 7,53-7,40 (м, 2H), 6,96 (д, J=9,1 Гц, 1H), 4,10 (дд, J=9,5, 3,4 Гц, 1H), 3,81 (д, J=3,4 Гц, 1H), 3,77-3,66 (м, 3H), 3,57 (дт, J=9,9, 3,7 Гц, 1H), 3,20-3,05 (м, 1H), 2,79 (ддд, J=16,3, 5,7, 2,3 Гц, 1H), 2,44 (ддд, J=13,7, 6,2, 2,6 Гц, 1H), 1,80 (тд, J=13,1, 5,8 Гц, 1H). ИЭР-МС m/z рассч. 403,1267, найдено 404,23 (M+H)+
Получение ПРИМЕРА 35
N-метил-4-(2-(((2S,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-2-метилтетрагидро-2H-пиран-2-ил)окси)этил)бензамид

Стадия I: N-метил-4-(2-(((2S,3S,4S,5R,6R)-3,4,5-трис(бензилокси)-6-((бензилокси)метил)-2-метилтетрагидро-2H-пиран-2-ил)окси)этил)бензамид

К перемешиваемому раствору (2S,3S,4S,5R,6R)-3,4,5-трис(бензилокси)-6-((бензилокси)метил)-2-метилтетрагидро-2H-пиран-2-ол (получают по методике, описанной в Tetrahedron 2001, 57,4297-4309) (309 мг, 0,558 ммоль) и 4-(2-гидроксиэтил)-N-метилбензамид (100 мг, 0,558 ммоль) в CH2Cl2 (4,6 мл) добавляют триметилсилил трифторметансульфонат (20,0 мкл, 0,112 ммоль). Реакционную смесь перемешивают при КТ в течение 16 ч. Полученную смесь гасят NEt3 (39,0 мкл, 0,279 ммоль), перемешивают в течение 20 мин, концентрируют и очищают на Biotage™ SNAP картридже на двуокиси кремния (10 г) элюируя EtOAc (от 0% до 100%, в 10 ОК) в Гекс. с получением указанного в заголовке соединения (190 мг, 0,2521 ммоль, 45%) в виде камеди. ЖХ-МС: m/z=716,66 (M+H)+.
Стадия II: ПРИМЕР 35
К перемешиваемому раствору N-метил-4-(2-(((2S,3S,4S,5R,6R)-3,4,5-трис(бензилокси)-6-((бензилокси)метил)-2-метилтетрагидро-2H-пиран-2-ил)окси)этил)бензамида со стадии I (190 мг, 0,265 ммоль) в MeOH (1,9 мл) и EtOAC (1,9 мл) добавляют Pd/C 20% влажный (40,0 мг, 0,376 ммоль). Реакционную смесь перемешивают в течение 16 ч в атмосфере H2 (1 атм.). Катализатор отфильтровывают и промывают MeOH/CH2Cl2. Объединенные фильтраты концентрируют и очищают флэш-хроматографией (0-20% MeOH/CH2Cl2) с получением указанного в заголовке соединения (60 мг, 60% выход). 1H ЯМР (400 МГц, CD3OD) δ 7,70 (д, J=8,2 Гц, 2H), 7,31 (д, J=8,2 Гц, 2H), 3,77 (дд, J=9,5, 3,4 Гц, 1H), 3,75-3,66 (м, 3H), 3,57 (дд, J=11,7, 5,9 Гц, 1H), 3,53 (д, J=3,4 Гц, 1H), 3,46 (т, J=9,7 Гц, 1H), 3,08 (ддд, J=10,0, 6,0, 2,4 Гц, 1H), 2,92-2,83 (м, 5H), 1,32 (с, 3H). ЖХ-МС: m/z=356,0 (M+H)+.
Получение ПРИМЕРА 36

Указанное в заголовке соединение получают по методике, описанной для ПРИМЕРА 35, но с применением 2-фенилэтанола на Стадии I. 1H ЯМР (400 МГц, CD3OD) δ 7,32-7,07 (м, 5H), 3,87-3,54 (м, 5H), 3,54 (д, J=3,3 Гц, 1H), 3,47 (д, J=9,7 Гц, 1H), 3,19 (дддд, J=9,8, 6,0, 2,4, 0,9 Гц, 1H), 2,82 (т, J=6,9 Гц, 2H), 1,32 (с, 3H). ЖХ-МС: m/z=299,3 (M+H)+.
Получение ПРИМЕРА 37
(2S,3S,4S,5S,6R)-2-(бензилокси)-6-(гидроксиметил)-3-метилтетрагидро-2H-пиран-3,4,5-триол

Стадия I: триацетат (3S,4S,5R,6R)-6-(ацетоксиметил)-2-гидрокси-3-метилтетрагидро-2H-пиран-3,4,5-тритила

К холодному (0°C) раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M4 (505 мг, 1,25 ммоль) в ТГФ (7 мл) добавляют раствор NH3 в MeOH (3,60 мл 7M, 25,2 ммоль). Полученную смесь перемешивают в течение 2 ч при 0°C, концентрируют и очищают флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (25 г) с применением градиента EtOAc (от 0 до 60%) в Гекс. с получением указанного в заголовке соединения (273 мг, 60% выход) в виде белого пенистого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 5,98 (д, J=4,5 Гц, 1H), 5,44 (д, J=9,7 Гц, 1H), 5,33 (д, J=9,8 Гц, 1H), 4,23 (дт, J=9,9, 3,7 Гц, 1H), 4,15 (д, J=3,7 Гц, 2H), 3,12 (д, J=4,5 Гц, 1H), 2,10 (с, 6H), 2,09 (с, 3H), 2,04 (с, 3H), 1,54 (с, 3H).
Стадия II: триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-метил-2-(2,2,2-трихлор-1-иминоэтокси)тетрагидро-2H-пиран-3,4,5-тритила

К холодному (0°C) раствору триацетата (3S,4S,5R,6R)-6-(ацетоксиметил)-2-гидрокси-3-метилтетрагидро-2H-пиран-3,4,5-тритила со стадии I (273 мг, 0,754 ммоль) в CH2Cl2 (11 мл) добавляют 2,2,2-трихлорацетонитрил (765 мкл, 7,54 ммоль) затем ДБУ (12,0 мкл, 0,0754 ммоль) по каплям. Реакционную смесь перемешивают в течение 1 ч при 0°C, затем 2 ч при КТ. Полученную смесь концентрируют и очищают на Biotage™ SNAP картридже на двуокиси кремния (25 г) с применением градиента EtOAc (от 0 до 50%) в Гекс. с получением указанного в заголовке соединения (278 мг, 73% выход) в виде бесцветной камеди. 1H ЯМР (400 МГц, CDCl3) δ 8,82 (с, 1H), 7,04 (с, 1H), 5,43 (д, J=3,7 Гц, 1H), 4,27-4,04 (м, 4H), 2,14 (с, 3H), 2,12 (с, 3H), 2,06 (с, 3H), 2,05 (с, 3H), 1,59 (с, 3H).
Стадия III: триацетат (2S,3S,4S,5R,6R)-6-(ацетоксиметил)-2-(бензилокси)-3-метилтетрагидро-2H-пиран-3,4,5-тритила

К холодному (-20°C) перемешиваемому раствору триацетата (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-метил-2-(2,2,2-трихлор-1-иминоэтокси)тетрагидро-2H-пиран-3,4,5-тритила со стадии II (111 мг, 0,219 ммоль) в CH2Cl2 (2,0 мл) добавляют порошковые молекулярные сита 4Å (110 мг) и фенилметанол (23,7 мг, 0,219 ммоль) в атмосфере N2, и смесь перемешивают в течение 10 мин. Затем добавляют TMSOTf (9,0 мкл, 0,23 экв.) и полученную смесь перемешивают в течение 30 мин. Реакционную смесь гасят насыщенным водным NaHCO3, органическую фазу промывают солевым раствором, сушат над MgSO4, фильтруют и концентрируют в вакууме. Остаток очищают на Biotage™ SNAP картридже на двуокиси кремния (10 г) с применением EtOAc (от 10% до 50%) в Гекс. в качестве элюента с получением указанного в заголовке соединения (45,0 мг, 50%) в виде бесцветного масла.
Стадия IV: ПРИМЕР 37
К холодному (0°С) раствору триацетат (2S,3S,4S,5R,6R)-6-(ацетоксиметил)-2-(бензилокси)-3-метилтетрагидро-2H-пиран-3,4,5-тритила со стадии II (45,0 мг, 0,110 ммоль) в MeOH (1 мл) добавляют NaOMe (110 мл, 0,5M, 0,055 ммоль). Реакционную смесь нагревают до КТ и перемешивают в течение ночи. Реакционную смесь гасят полимером DOWEX 50WX4-400 до достижения pH 4-5, фильтруют и концентрируют. Остаток очищают на Biotage™ SNAP C18 картридже (10 г), элюируя CH3CN (20-30%) в воде с получением указанного в заголовке соединения (25 мг, 76% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,39-7,22 (м, 5H), 4,72 (д, J=11,9 Гц, 1H), 4,52 (с, 1H), 4,48 (д, J=11,9 Гц, 1H), 3,81 (дд, J=11,7, 2,2 Гц, 1H), 3,72 (дд, J=11,7, 5,4 Гц, 1H), 3,65-3,59 (м, 1H), 3,56 (т, J=9,2 Гц, 1H), 3,48 (д, J=8,7 Гц, 1H), 1,22 (с, 3H).
Получение ПРИМЕРА 38
3-[4-[(2R,3S,4S,5S,6R)-3-(азидометил)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]окси-3-метилфенил]-N-метилбензамид

Стадия I: триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-(азидометил)-2-((3-метил-3'-(метилкарбамоил)-[1,1'-бифенил]-4-ил)окси)тетрагидро-2H-пиран-3,4,5-тритила

К суспензии ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M14 (850 мг, 1,90 ммоль) и ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A2 (737 мг, 3,10 ммоль) в 1,2-дихлорэтане (13,0 мл) при 0°C добавляют BF3.Et2O (725 мкл, 5,70 ммоль) по каплям. Полученную смесь перемешивают при 40°C в течение 16 ч, охлаждают до 3°C и гасят 2 мл насыщенного водного NaHCO3 при перемешивании. Полученную суспензию фильтруют, и органическую фазу отделяют, сушат над Na2SO4, фильтруют и концентрируют. Очистка на Isco CombiFlash® силикагелевом картридже (40 г), элюируя EtOAc (40-100%) в Гекс. (15 ОК) дает указанное в заголовке соединение (192 мг, 16%) в виде белого твердого вещества. ЖХ-МС: m/z=627,5 (M+H)+.
Стадия II: ПРИМЕР 38
К перемешиваемому раствору триацетата (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-(азидометил)-2-((3-метил-3'-(метилкарбамоил)-[1,1'-бифенил]-4-ил)окси)тетрагидро-2H-пиран-3,4,5-тритила со стадии I (200 мг, 0,32 ммоль) в сухом MeOH (5,0 мл) при КТ добавляют раствор NaOMe в MeOH (36 мкл 0,50M, 0,16 ммоль). Полученную смесь перемешивают в течение 2 ч, нейтрализуют добавлением полимера Ambilite IR-120 до достижения реакционной смесью pH 4. Полученную смесь фильтруют, концентрируют и очищают на Isco CombiFlash® силикагелевом картридже (12 г), элюируя MeOH (0-10%) в CH2Cl2/(15 ОК) с получением указанного в заголовке соединения (105 мг, 68%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,01 (т, J=1,8 Гц, 1H), 7,72 (ддт, J=7,7, 6,0, 1,3 Гц, 2H), 7,53-7,40 (м, 3H), 7,34 (д, J=8,4 Гц, 1H), 5,52 (с, 1H), 3,83 (д, J=12,8 Гц, 1H), 3,78-3,70 (м, 4H), 3,62-3,65 (м, 1H), 3,51 (д, J=12,8 Гц, 1H), 2,92 (с, 3H), 2,30 (с, 3H). ЖХ-МС: m/z=459,3 (M+H)+.
Получение ПРИМЕРОВ 39-43
ПРИМЕРЫ 39-43 получают по следующей общей методике с применением ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ M4 и A10-A14, соответственно. Флаконы загружают подходящими фенолами (1,2 экв. A9-A14). Добавляют раствор ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M4 (100 мг, 0,247 ммоль) в 1,2-дихлорэтане (1,5 мл), затем добавляют (100 мкл, 0,789) в каждый флакон. Флакон закрывают крышкой и конечную смесь перемешивают при 60°C в течение ночи. Полученную неочищенную смесь охлаждают до КТ, гасят осторожным добавлением 2 мл насыщенного водного раствора NaHCO3 и разбавляют CH2Cl2 (2 мл). Органический слой отделяют, и водный слой повторно экстрагируют CH2Cl2 (2×2 мл). Объединенные органические экстракты концентрируют. Полученный неочищенный остаток растворяют в MeOH (2 мл) и обрабатывают NaOMe в MeOH (500 мкл 0,5M). Смесь перемешивают в течение 2 ч при КТ, пропускают через предварительно промытый 1 г SCX-2 картридж. Последний промывают MeOH (3×1 мл), и объединенные фракции концентрируют. Остаток наконец очищают ВЭЖХ с обращенной фазой с получением указанных в заголовке соединений.
|
|
Получение ПРИМЕРОВ 44-47
ПРИМЕРЫ 44 и 45 получают с применением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M13, ПРИМЕРЫ 46 и 47 с применением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M12 по следующей общей методике. Пробирки для микроволновой печи загружают подходящей фенилбороновой кислотой (1,5 экв.), Cs2CO3 (3,0 экв.) и SiliaCat DPP-Pd (0,1 экв.). ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ M12 или M13 (45 мг, 1,0 экв.) растворяют в MeCN (2 мл) и добавляют в каждую пробирку. Пробирки накрывают крышкой с подвергают облучению микроволнами, 15 мин при 100°C. Полученную смесь разбавляют CH2Cl2:EtOAc (1:1) и пропускают через 500 мг bondelut силикагелевый картридж, элюируя CH2Cl2-EtOAc (1:1) (около 5 мл всего). Полученные фракции объединяют и концентрируют. Остаток растворяют в MeOH (1 мл) и добавляют NaOMe в MeOH, и конечную смесь перемешивают в течение 2 ч при КТ. Полученную смесь пропускают через предварительно промытый 1 г SCX-2 картридж, промывают MeOH (3×1 мл). Объединенные фильтраты концентрируют, и остаток очищают ВЭЖХ с обращенной фазой с получением желаемого продукта.
|
Получение ПРИМЕРА 48
3-[4-[(2R,3S,4S,5S,6R)-3-(аминометил)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]окси-3-метилфенил]-N-метилбензамид

К перемешиваемому раствору ПРИМЕРА 38 (35 мг, 0,076 ммоль) в EtOH (700 мкл) и воде (700 мкл) добавляют 10% Pd/C (4 мг, 0,033 ммоль). Полученную смесь перемешивают в течение 16 часов в атмосфере H2, фильтруют на целите, концентрируют и очищают на Isco CombiFlash® C18 картридж (12 г), элюируя CH3CN (от 5 до 50%) в воде с получением указанного в заголовке соединения (8 мг, 23%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,00 (т, J=1,7 Гц, 1H), 7,72 (ддт, J=7,2, 4,1, 1,2 Гц, 2H), 7,43-7,51 (м, 3H), 7,34 (д, J=8,5 Гц, 1H), 5,47 (с, 1H), 3,86 (д, J=9,1 Гц, 1H), 3,80-3,69 (м, 3H), 3,59-3,49 (м, 1H), 3,22 (д, J=13,5 Гц, 1H), 2,98 d, (J=13,5 Гц, 1H), 2,92 (с, 3H), 2,32 (с, 3H). ЖХ-МС: m/z=433,15 (M+H)+.
Получение ПРИМЕРА 49
3-[4-[(2R,3S,4S,5S,6R)-3-(2-бензилоксиэтоксиметил)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]окси-3-метилфенил]-N-метилбензамид

Стадия I: триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-((2-(бензилокси)этокси)метил)-2-((3-метил-3'-(метилкарбамоил)-[1,1'-бифенил]-4-ил)окси)тетрагидро-2H-пиран-3,4,5-тритила

К смеси ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M15 (450 мг, 0,820 ммоль) и ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ A2 (392 мг, 1,62 ммоль) в дихлорэтане (6,3 мл) добавляют BF3.OEt2 (309 мкл, 2,43 ммоль). Смесь перемешивают при 40°C в течение ночи. Полученную смесь охлаждают до КТ; гасят добавлением 2 мл насыщенного водного NaHCO3. Полученную суспензию фильтруют, и органическую фазу отделяют, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают на Isco CombiFlash® силикагелевом картридже (40 г), элюируя EtOAc (0-100%) в Гекс. (15 ОК) с получением указанного в заголовке соединения (165 мг, 28%) в виде белого твердого вещества. ЖХ-МС: m/z=758,2 (M+Na)+.
Стадия II: ПРИМЕР 49
К перемешиваемому раствору триацетата (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-((2-(бензилокси)этокси)метил)-2-((3-метил-3'-(метилкарбамоил)-[1,1'-бифенил]-4-ил)окси)тетрагидро-2H-пиран-3,4,5-тритила со стадии I (20 мг, 0,027 ммоль) в сухом MeOH (1,0 мл) при КТ добавляют раствор MeONa в MeOH (3 мкл 25% масс./масс., 0,014 ммоль). Полученную смесь перемешивают в течение 2 часов, нейтрализуют добавлением полимера Ambilite IR-120 до достижения реакционной смесью pH 4. Полученную смесь фильтруют и концентрируют с получением указанного в заголовке соединения (14 мг, 86%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,98 (т, J=1,8 Гц, 1H), 7,73-7,64 (м, 2H), 7,52-7,40 (м, 2H), 7,38 (дд, J=8,6, 2,4 Гц, 1H), 7,31 (д, J=8,6 Гц, 1H), 7,25-7,05 (м,5H), 5,57 (с, 1H), 4,37 (с, 2H), 3,91 (д, J=9,9 Гц, 1H), 3,84 (д, J=9,9 Гц, 1H), 3,80-3,65 (м, 5H), 3,64-3,49 (м, 4H), 2,93 (с, 3H), 2,31 (с, 3H). ЖХ-МС: m/z=658,11 (M+1)+.
Получение ПРИМЕРА 50
N-метил-3-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-3-(2-гидроксиэтоксиметил)-6-(гидроксиметил)тетрагидропиран-2-ил]оксифенил]бензамид

Стадия I: триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-((2-гидроксиэтокси)метил)-2-((3-метил-3'-(метилкарбамоил)-[1,1'-бифенил]-4-ил)окси)тетрагидро-2H-пиран-3,4,5-тритила

К перемешиваемому раствору триацетата (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-((2-(бензилокси)этокси)метил)-2-((3-метил-3'-(метилкарбамоил)-[1,1'-бифенил]-4-ил)окси)тетрагидро-2H-пиран-3,4,5-тритила из ПРИМЕРА 49, Стадия I (150 мг, 0,200 ммоль) в сухом EtOH (3,8 мл) и AcOH (47 мкл, 0,82 ммоль) добавляют Pd(OH)2 (20% влажный, 57 мг, 0,082 ммоль). Полученную смесь перемешивают в течение 16 часов в атмосфере H2, фильтруют на целите и концентрируют с получением указанного в заголовке соединения (125 мг, 95%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,96 (т, J=1,8 Гц, 1H), 7,66 (дд, J=7,9, 1,8 Гц, 2H), 7,54-7,42 (м, 2H), 7,42-7,33 (м, 1H), 7,23 (д, J=8,5 Гц, 1H), 6,21 (с, 1H), 5,86 (д, J=9,7 Гц, 1H), 5,43 (т, J=10,0 Гц, 1H), 4,29-4,16 (м, 2H), 4,16-4,04 (м, 2H), 3,99 (д, J=10,0 Гц, 1H), 3,71 (м, 1H), 3,65-3,55 (м, 1H), 3,56-3,39 (м, 2H), 3,05 (д, J=4,8 Гц, 3H), 2,36 (с, 3H), 2,21 (с, 3H), 2,12 (с, 3H), 2,06 (с, 3H), 2,04 (с, 3H).
Стадия II: ПРИМЕР 50
К перемешиваемому раствору триацетата (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-((2-гидроксиэтокси)-метил)-2-((3-метил-3'-(метилкарбамоил)-[1,1'-бифенил]-4-ил)окси)тетрагидро-2H-пиран-3,4,5-тритила со стадии I (30 мг, 0,046 ммоль) в сухом MeOH (1,5 мл) при КТ добавляют раствор NaOMe в MeOH (5 мкл 25% масс./масс., 0,023 ммоль). Полученную смесь перемешивают в течение 2 часов, нейтрализуют добавлением полимера Ambilite IR-120 до достижения реакционной смесью pH 4. Полученную смесь фильтруют и концентрируют с получением указанного в заголовке соединения (19 мг, 82%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,92 (т, J=1,8 Гц, 1H), 7,64 (ддт, J=8,1, 5,3, 1,3 Гц, 2H), 7,45-7,30 (м, 4H), 7,25 (д, J=8,4 Гц, 1H), 5,48 (с, 1H), 3,85-3,73 (м, 2H), 3,73-3,58 (м, 4H), 3,58-3,33 (м, 5H), 2,84 (с, 3H), 2,24 (с, 3H). ЖХ-МС: m/z=478,3 (M+H)+.
Получение ПРИМЕРА 51
N-метил-3-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-[[4-(гидроксиметил)триазол-1-ил]метил]тетрагидропиран-2-ил]оксифенил]бензамид

К перемешиваемому раствору ПРИМЕРА 38 (25 мг, 0,054 ммоль), аскорбата натрия (29 мг, 0,16 ммоль), проп-2-ин-1-ола (174 мкл, 0,055 ммоль) в NMP (235 мкл) добавляют CuOAc (1,0 мг, 0,010 ммоль). Полученную смесь перемешивают в течение 48 часов при комнатной температуре, фильтруют и очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (15 мг, 54%) в виде белого твердого вещества. ЖХ-МС: m/z=515,16 (M+1).
Получение ПРИМЕРА 52
3-[4-[(2R,3S,4S,5S,6R)-3-(ацетамидометил)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]окси-3-метилфенил]-N-метилбензамид

К перемешиваемому раствору ПРИМЕРА 48 (70 мг, 0,16 ммоль) в ТГФ (1,6 мл) добавляют NaOAc (1,6 мл 50% масс./об., 9,8 ммоль) и ацетилхлорид (10,0 мкл, 0,16 ммоль). Полученную смесь перемешивают в течение 16 часов при КТ, фильтруют, концентрируют и очищают с применением ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (8 мг, 10%). ЖХ-МС: m/z=475,76 (M+1).
Получение ПРИМЕРА 53
3-[3-хлор-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]-N-(2-метоксиэтил)бензамид

К дегазированной (N2) смеси ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M11 (40 мг, 0,09261 ммоль), t-Bu3PH+.BF4- (5,0 мг, 0,017 ммоль) и Pd2(dba)3 (17,0 мг, 0,0186 ммоль) в ТГФ (300 мкл)/воде (300 мкл) добавляют раствор [3-(2-метоксиэтилкарбамоил)фенил]бороновой кислоты (21,0 мг, 0,0942 ммоль) в NMP (200 мкл). Затем добавляют K3PO4 (39 мг, 0,1837 ммоль) и реакционную смесь перемешивают при 75°C в течение 18 часов. Полученную смесь фильтруют, и фильтрат очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (8,5 мг, 18%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,03 (д, J=1,5 Гц, 1H), 7,81-7,69 (м, 3H), 7,54 (ддд, J=25,0, 12,9, 5,4 Гц, 3H), 5,30 (с, 1H), 3,80-3,61 (м, 6H), 3,57 (с, 4H), 3,38 (с, 3H), 1,44 (с, 3H). ЖХ-МС: m/z=482,25 (M+H)+.
Получение ПРИМЕРА 54
2-хлор-4-[3-хлор-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]-N-циклопропилбензамид

К смеси ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M11 (40,0 мг, 0,104 ммоль), Pd(OAc)2 (5,0 мг, 0,022 ммоль) и [3-(2-дициклогексилфосфанилфенил)-2,4-диметокси-фенил]сульфонилоксинатрия (23,0 мг, 0,0449 ммоль) в 500 мкл MeТГФ добавляют [3-хлор-4-(циклопропилкарбамоил)фенил]бороновую кислоту (200 мкл 0,5M, 0,100 ммоль) и K2CO3 водн. (100 мкл 4,5M, 0,450 ммоль). Реакционную смесь перемешивают при 65°C в течение 18 часов. Полученную смесь фильтруют, и фильтрат очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (3,0 мг, 5%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,62-7,57 (м, 2H), 7,47 (дд, J=15,7, 5,1 Гц, 2H), 7,39 (т, J=8,3 Гц, 2H), 5,22 (с, 1H), 3,70-3,57 (м, 3H), 3,57-3,50 (м, 2H), 2,78 (ддд, J=11,1, 7,5, 4,0 Гц, 1H), 1,34 (с, 3H), 0,77-0,68 (м, 2H), 0,58-0,50 (м, 2H). ЖХ-МС: m/z=499,15 (M+H)+.
Получение ПРИМЕРА 55
5-[3-хлор-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]-2-фтор-N-метилбензамид

ПРИМЕР 55 получают по методике, описанной для ПРИМЕРА 54 с применением 4-фтор-3-(метилкарбамоил)фенил]бороновой кислоты в качестве исходного материала. Реакционную смесь перемешивают 2 ч при 80°С. Указанное в заголовке соединение очищают ВЭЖХ с обращенной фазой и выделяют в виде белого твердого вещества (2,4 мг, 6%). ЖХ-МС: m/z=456,22 (M+H)+.
Получение ПРИМЕРА 56
3-[3-хлор-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]-5-фтор-N-метилбензамид

ПРИМЕР 56 получают по методике, описанной для ПРИМЕРА 54 с применением 3-фтор-3-(метилкарбамоил)фенил]бороновой кислоты в качестве исходного материала. Реакционную смесь перемешивают 2 ч при 80°С. Указанное в заголовке соединение очищают ВЭЖХ с обращенной фазой и выделяют в виде белого твердого вещества (0,96 мг, 2%). ЖХ-МС: m/z=455,11 (M+H)+.
Получение ПРИМЕРА 57
Метил 3-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]бензоат

К суспензии метил 3-[3-метил-4-[(2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]бензоата из ПРИМЕРА 21, Стадия I (1,62 г, 2,762 ммоль) в MeOH (6 мл) добавляют NaOMe в MeOH (5,94 мл 0,5M, 2,97 ммоль). Реакционную смесь перемешивают при КТ. Через 30 мин образуется белый осадок и туда добавляют еще MeOH (6 мл). Смесь перемешивают в течение 2 ч, гасят кислым полимером DOWEX до pH 4, перемешивают в течение 5 мин. Полимер отфильтровывают, промывают MeOH (30 мл). Объединенные фильтраты концентрируют с получением указанного в заголовке соединения (1,12 г, 67%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,18 (т, J=1,6 Гц, 1H), 7,96-7,88 (м, 1H), 7,83-7,74 (м, 1H), 7,50 (т, J=7,8 Гц, 1H), 7,46-7,39 (м, 2H), 7,31 (д, J=8,3 Гц, 1H), 5,27 (с, 1H), 3,92 (с, 4H), 3,77-3,65 (м, 3H), 3,63-3,53 (м, 1H), 2,31 (с, 2H), 1,40 (с, 3H).
Получение ПРИМЕРА 58
N-[2-(4-метилпиперазин-1-ил)этил]-3-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]бензамид

ПРИМЕР 58 получают по методике, описанной для ПРИМЕРА 22, Стадия I, с применением ПРИМЕРА 21 и 2-(4-метилпиперазин-1-ил)этан-1-амина в качестве исходного материала. Реакционную смесь перемешивают 2 ч при КТ. Полученную неочищенную смесь очищают непосредственно ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде белого твердого вещества (67% выход). 1H ЯМР (400 МГц, CD3OD) δ 8,02 (шс, 1H), 7,73 (шд, J=7,7 Гц, 2H), 7,51-7,42 (м, 3H), 7,31 (д, J=8,5 Гц, 1H), 5,27 (с, 1H), 3,77-3,67 (м, 4H), 3,62-3,51 (м, 3H), 2,71-2,39 (м, 10H), 2,31 (с, 3H), 2,28 (с, 3H), 1,40 (с, 3H). ЖХ-МС: m/z=530,52 (M+H)+.
Получение ПРИМЕРОВ 59-72
ПРИМЕРЫ 59-72 получают по методике, описанной для ПРИМЕРА 58 с применением подходящего коммерчески доступного амина.
|
|
|
|
|
Получение ПРИМЕРА 73
3-фтор-N-метил-5-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]бензамид

К смеси ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M10 (30,0 мг, 0,0565 ммоль), Pd(OAc)2 (4,0 мг, 0,018 ммоль) и [3-(2-дициклогексилфосфанилфенил)-2,4-диметокси-фенил]сульфонилоксинатрия (14,0 мг, 0,0273 ммоль) добавляют дегазированный раствор в NMP [3-фтор-5-(метилкарбамоил)фенил]бороновой кислоты (200 мкл 0,50M, 0,100 ммоль) затем дегазированный водный раствор K2CO3 (100 мкл 2,5M, 0,250 ммоль). Конечную смесь перемешивают при 65°С в течение 18 ч. Полученную реакционную смесь охлаждают до КТ и добавляют NaOMe (50 мкл 25% масс./об., 0,231 ммоль в MeOH). Полученную смесь перемешивают 4 ч при КТ и наконец нейтрализуют AcOH (50 мкл). Полученную смесь фильтруют (CHROMSPEC Syringe Filters 4 мм mm ПТФЭ, 0,45 мкм), летучие соединения концентрируют и остаточный NMP раствор очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения в виде белого твердого вещества. ЖХ-МС: m/z=436,28 (M+H)+.
Получение ПРИМЕРОВ 74-104.
ПРИМЕРЫ 74-104 получают по методике, описанной для соединения 73, с применением подходящей бороновой кислоты.
|
|
|
|
Получение ПРИМЕРА 105 (способ A)
(2R,3S,4S,5S,6R)-6-(гидроксиметил)-3-метил-2-[2-метил-4-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]фенокси]тетрагидропиран-3,4,5-триол

Стадия I: триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-метил-2-(2-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)тетрагидро-2H-пиран-3,4,5-тритила

К дегазированному (N2) раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M10 (11,00 г, 20,70 ммоль), KOAc (1,06 г, 41,1 ммоль) и бис(пинаколато)диборона (7,885 г, 31,1 ммоль) в ДМФ (110 мл) добавляют PdCl2(dppf)-ДХМ (845 мг, 1,04 ммоль). Реакционную смесь дегазируют (3x) и перемешивают при 80°C в течение 16 ч. Реакционную смесь охлаждают до КТ, гасят EtOAc и водным насыщенным NH4Cl и фильтруют на целите. Органическую фазу отделяют, сушат над Na2SO4, фильтруют, концентрируют и очищают на Isco CombiFlash® силикагелевом картридже (220 г), элюируя EtOAc (0-60%) в Гекс. (13 ОК) с получением указанного в заголовке соединения (10,6 г, 89%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,64-7,54 (м, 2H), 7,13 (д, J=8,1 Гц, 1H), 6,31 (с, 1H), 5,59 (д, J=9,7 Гц, 1H), 5,38 (т, J=9,9 Гц, 1H), 4,17 (дд, J=12,2, 5,2 Гц, 1H), 4,07-3,93 (м, 2H), 2,27 (с, 3H), 2,13 (с, 3H), 2,12 (с, 3H), 2,02 (с, 6H), 1,61 (с, 3H), 1,32 (с, 12H).
Стадия II: ацетат [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-6-[2-метил-4-[3-метил-4-[(2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]фенокси]-5-метилтетрагидропиран-2-ил]метила

К дегазированной смеси ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M10 (10,0 г, 18,8 ммоль), триацетата (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-метил-2-(2-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)тетрагидро-2H-пиран-3,4,5-тритила со стадии I (10,9 г, 18,8 ммоль) и K2CO3 (13,03 г, 94,3 ммоль) в 2-MeТГФ (217 мл) добавляют воду (43,4 мл), Pd(OAc)2 (623 мг, 2,78 ммоль) и [3-(2-дициклогексилфосфанилфенил)-2,4-диметоксифенил]сульфонилоксинатирй (2,89 г, 5,64 ммоль). Реакционную смесь дегазируют (3 раза) и нагревают при 65°C в течение 80 мин. Реакционную смесь охлаждают на ледяной бане, водную фазу отделяют, экстрагируют 200 мл EtOAc. Объединенную органическую фазу промывают 300 мл водного насыщенного NH4Cl, солевым раствором, сушат над Na2SO4, фильтруют на целите и концентрируют. Остаток очищают на Isco CombiFlash® силикагелевом картридже (330 г), элюируя ацетоном (0-35%) в Гекс. (22 ОК) с получением указанного в заголовке соединения (14,7 г, 86%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,33 (дд, J=2,4, 0,9 Гц, 2H), 7,28 (ддд, J=8,5, 2,4, 0,7 Гц, 2H), 7,19 (д, J=8,5 Гц, 2H), 6,29 (с, 2H), 5,60 (д, J=9,7 Гц, 2H), 5,40 (т, J=9,8 Гц, 2H), 4,18 (дд, J=12,2, 5,2 Гц, 2H), 4,14-4,00 (м, 4H), 2,33(с, 6H), 2,14 (с, 6H), 2,13 (с, 6H), 2,03 (с, 6H), 2,02 (с, 6H), 1,64 (с, 6H).
Стадия III: ПРИМЕР 105
К суспензии ацетата [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-6-[2-метил-4-[3-метил-4-[(2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]фенокси]-5-метилтетрагидропиран-2-ил]метила (16,0 г, 17,7 ммоль) в MeOH (910 мл) добавляют NaOMe (1,97 мл 25% масс./масс., 8,86 ммоль). Реакционную смесь перемешивают 90 мин и нейтрализуют пропусканием через 133 г полимера Dowex 50W4 H+ и 250 мл метанола применяют для промывания колонки после нейтрализации. Фильтрат концентрируют до появления белого осадка и суспензию перемешивают в течение 45 мин при 0°C, фильтруют и промывают 10 мл холодного MeOH. Твердое вещество сушат при 40°C вакууме в течение 16 ч с получением указанного в заголовке соединения (8,50 г, 85%). 1H ЯМР (400 МГц, CD3OD) δ 7,38-7,30 (м, 4H), 7,26 (д, J=8,4 Гц, 2H), 5,25 (с, 2H), 3,79-3,69 (м, 8H), 3,66-3,55 (м, 2H), 2,30 (с, 6H), 1,41 (с, 6H). ЖХ-МС: m/z=567,59 (M+H)+.
Альтернативное получение ПРИМЕРА 105 (способ B)
Стадия I: триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-2-(4-йод-2-метилфенокси)-3-метилтетрагидро-2H-пиран-3,4,5-тритила

К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M4 (5,00 г, 12,4 ммоль) в CH2Cl2 (25 мл) добавляют 4-йод-2-метилфенол (5,79 г, 24,7 ммоль) и BF3.OEt2 (9,5 мл, 74,9 ммоль). Реакционную смесь перемешивают при 40°C в течение 90 мин, охлаждают до КТ и медленно выливают в насыщенный водный NaHCO3 (100 мл) при энергичном перемешивании. Органический слой отделяют, и водный слой повторно экстрагируют CH2Cl2 (2x 25мл). Объединенные органические слои концентрируют и очищают на Biotage™ SNAP картридже на двуокиси кремния (100 г), элюируя EtOAc (0-50%) в Гекс. (14 ОК) с получением указанного в заголовке соединения (3,56 г, 50%) в виде светло-желтого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,47 (дд, J=2,2, 0,9 Гц, 1H), 7,41 (ддд, J=8,6, 2,3, 0,7 Гц, 1H), 6,91 (д, J=8,6 Гц, 1H), 6,22 (с, 1H), 5,54 (д, J=9,7 Гц, 1H), 5,37 (т, J=9,9 Гц, 1H), 4,20-4,02 (м, 2H), 4,00-3,94 (м, 1H), 2,22 (д, J=0,7 Гц, 3H), 2,13 (с, 3H), 2,12 (с, 3H), 2,02 (с, 6H), 1,60 (с, 3H).
Стадия II: ацетат [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-5-метил-6-[2-метил-4-[3-метил-4-[(2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]фенокси]тетрагидропиран-2-ил]метила

К смеси триацетата (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-2-(4-йод-2-метилфенокси)-3-метилтетрагидро-2H-пиран-3,4,5-тритила со стадии I (1,00 г, 1,73 ммоль), TBABr (557 мг, 1,73 ммоль) и Pd(OAc)2 (19 мг, 0,086 ммоль) в ДМФ (15 мл) добавляют триэтиламин (602 мкл, 4,32 ммоль). Реакционную смесь перемешивают при 110°C в течение 15 ч, охлаждают до КТ и разбавляют EtOAc (50 мл). Органический слой промывают водой (2x 25мл), солевым раствором, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают на Biotage™ SNAP картридже на двуокиси кремния (100 г), элюируя EtOAc (10-60%) в Гекс. градиенте (13 ОК) с получением указанного в заголовке соединения (303 мг, 39%) в виде желтого вещества.
Стадия III: ПРИМЕР 105
Удаление ацетатных защитных групп с получением ПРИМЕРА 105 проводят как описано выше в способе A, Стадия III.
Альтернативное получение ПРИМЕРА 105 (способ C)
Стадия I: ацетат [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-5-метил-6-[2-метил-4-[3-метил-4-[(2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]фенокси]тетрагидропиран-2-ил]метила

К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M10 (50,0 мг, 0,0940 ммоль) в ДМФ (1,25 мл) добавляют PdCl2.(CH3CN)2 (1,8 мг, 0,0047 ммоль) и N1,N1,N1',N1',N2,N2,N2',N2'-октаметилэтен-1,1,2,2-тетрамин (44 мкл, 0,19 ммоль). Реакционную смесь нагревают при 50°С в течение 16 ч, охлаждают до КТ, разбавляют водой и экстрагируют EtOAc (3×15 мл). Объединенные органические слои сушат над Na2SO4, фильтруют, концентрируют и очищают на Biotage™ SNAP картридже на двуокиси кремния (10 г), элюируя EtOAc (от 10% до 75%) в Гекс. с получением указанного в заголовке соединения (12 мг, 28%).
Стадия II: ПРИМЕР 105
Удаление ацетатных защитных групп с получением ПРИМЕРА 105 проводят как описано выше в способе A, Стадия III.
Альтернативное получение ПРИМЕРА 105 (способ D)
Стадия I: ацетат [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-5-метил-6-[2-метил-4-[3-метил-4-[(2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]фенокси]тетрагидропиран-2-ил]метила

К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M4 (100 мг, 0,25 ммоль) в CH2Cl2 (500 мкл) добавляют 4-(4-гидрокси-3-метилфенил)-2-метилфенол (26 мг, 0,12 ммоль) и BF3.OEt2 (188 мкл, 1,48 ммоль). Реакционную смесь нагревают при 40°С в течение 4,5 ч, охлаждают до КТ и медленно выливают в насыщенный водный NaHCO3 (2 мл) при энергичном перемешивании. Органическую фазу отделяют и водную фазу повторно экстрагируют CH2Cl2. Объединенные органические слои сушат над Na2SO4, фильтруют, концентрируют и очищают на Biotage™ SNAP картридже на двуокиси кремния (12 г), элюируя EtOAc (от 20% до 55%) в Гекс. с получением указанного в заголовке соединения (25 мг, 22%).
Стадия II: ПРИМЕР 105
Удаление ацетатных защитных групп с получением ПРИМЕРА 105 проводят как описано выше в способе A, Стадия III.
Получение ПРИМЕРА 106
(2R,3S,4S,5S,6R)-6-(гидроксиметил)-3-метил-2-[4-[4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]фенокси]тетрагидропиран-3,4,5-триол.

ПРИМЕР 106 получают в две стадии по методике, описанной для ПРИМЕРА 105, способ D, но с применением [1,1'-бифенил]-4,4'-диола в качестве реагента. На первой стадии (гликозидирование) реакционную смесь перемешивают 3 дня при 40°С. На второй стадии (снятие защиты) реакционную смесь перемешивают в течение ночи, и полученную смесь очищают на Biotage™ SNAP C18 картридже (12 г), элюируя CH3CN (от 10% до 25%) в воде в качестве элюента с получением указанного в заголовке соединения. 1H ЯМР (400 МГц, CD3OD) δ 7,52-7,46 (м, 2H), 7,18-7,11 (м, 2H), 5,18 (с, 1H), 3,78-3,59 (м, 5H), 1,36 (с, 3H).
Получение ПРИМЕРА 107
(2R,3S,4S,5S,6R)-2-[2-хлор-4-[3-хлор-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]фенокси]-6-(гидроксиметил)-3-метилтетрагидропиран-3,4,5-триол

ПРИМЕР 107 получают в две стадии по методике, описанной для ПРИМЕРА 105, способ C, но с применением ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M11. 1H ЯМР (400 МГц, CD3OD) δ 7,60 (м, 2H), 7,51-7,34 (м, 4H), 5,27 (с, 2H), 3,81-3,53 (м, 10H), 1,42 (с, 6H). ЖХ-МС: m/z=608,43 (M+H)+.
Получение ПРИМЕРА 108
(2R,3S,4S,5S,6R)-6-(гидроксиметил)-3-метил-2-[[7-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]окси-2-нафтил]окси]тетрагидропиран-3,4,5-триол

ПРИМЕР 108 получают в две стадии по методике, описанной для ПРИМЕРА 105, способ D, но с применением нафталин-2,7-диола в качестве реагента. На первой стадии (гликозидирование) реакционную смесь перемешивают 3 дня при 40°С. На второй стадии указанное в заголовке соединение очищают ВЭЖХ с обращенной фазой. 1H ЯМР (400 МГц, CD3OD) δ 7,70 (д, J=8,9 Гц, 1H), 7,54 (дд, J=49,6, 2,9 Гц, 1H), 7,25-6,95 (м, 1H), 5,29 (с, 1H), 3,83-3,54 (м, 5H), 1,37 (д, J=10,4 Гц, 3H).
Получение ПРИМЕРОВ 109-115
ПРИМЕРЫ 109-115 получают по методике, описанной для ПРИМЕРА 105, способ C, но с применением ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ M16-M22, соответственно, на первой стадии. Все ПРИМЕРЫ очищают ВЭЖХ с обращенной фазой с последующим конечным снятием защиты (NaOMe/MeOH).
|
|
Получение ПРИМЕРА 116
(2R,3S,4S,5S,6R)-6-(гидроксиметил)-3-метил-2-[2-метил-4-[4-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]фенил]фенокси]тетрагидропиран-3,4,5-триол

К дегазированной смеси 4,4,5,5-тетраметил-2-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]-1,3,2-диоксаборолана (30,0 мг, 0,0909 ммоль), ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M10 (96,6 мг, 0,182 ммоль) и 3-(2-дициклогексилфосфанилфенил)-2,4-диметоксибензолсульфоновой кислоты (ион натрия (1)) (18,67 мг, 0,0364 ммоль) в 2-Me ТГФ (600,0 мкл) и воде (120,0 мкл) добавляют последовательно K2CO3 (62,8 мг, 0,455 ммоль) и Pd(OAc)2 (4,1 мг, 0,018 ммоль). Полученную смесь перемешивают при 60°С в течение 16 ч, охлаждают до КТ, разбавляют водой и экстрагируют EtOAc (3×8 мл). Объединенные органические экстракты пропускают через фазовый сепаратор и концентрируют с получением неочищенной смеси, которую растворяют в MeOH (400 мл). К полученному раствору добавляют NaOMe в MeOH (400 мкл 0,5M, 0,200 ммоль) и смесь перемешивают в течение 18 ч. Реакцию гасят водородной формой полимера DOWEX 50WX4 до pH 4-5, разбавляют метанолом (25 мл), фильтруют и концентрируют. Остаток растворяют в ~0,75 мл ДМСО и раствор очищают на Biotage™ SNAP C18 (30 г), элюируя CH3CN (от 10% до 63%, 11 ОК) в воде с получением указанного в заголовке соединения (10,8 мг, 18%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,59 (с, 4H), 7,46-7,39 (м, 4H), 7,29 (д, J=8,4 Гц, 2H), 5,26 (с, 2H), 3,78-3,69 (м, 8H), 3,65-3,55 (м, 2H), 2,30 (с, 6H), 1,40 (с, 6H).
Получение ПРИМЕРА 117
(2R,3S,4S,5S,6R)-6-(гидроксиметил)-3-метил-2-[2-метил-4-[2-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]этинил]фенокси]тетрагидропиран-3,4,5-триол

Стадия I: (2R,3S,4S,5S,6R)-2-(4-бром-2-метилфенокси)-6-(гидроксиметил)-3-метилтетрагидро-2H-пиран-3,4,5-триол

К раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M10 (320 мг, 0,602 ммоль) в MeOH (4,8 мл) добавляют NaOMe (600 мкл 0,5M, 0,300 ммоль). Смесь перемешивают при КТ в течение 3 ч, фильтруют через предварительно промытый 1 г SCX-2 картридж. Последний промывают три раза MeOH. Объединенные фракции MeOH концентрируют досуха с получением указанного в заголовке соединения (215 мг, 92%). 1H ЯМР (400 МГц, CD3OD) δ 7,29 (д, J=2,0 Гц, 1H), 7,25 (дд, J=8,7, 2,4 Гц, 1H), 7,16 (д, J=8,8 Гц, 1H), 5,20 (с, 1H), 3,79-3,64 (м, 4H), 3,62-3,45 (м, 1H), 2,23 (с, 3H), 1,38 (с, 3H). ЖХМС m/z (M+Na)+=387,53.
Стадия II: ПРИМЕР 117
Смесь (2R,3S,4S,5S,6R)-2-(4-бром-2-метилфенокси)-6-(гидроксиметил)-3-метилтетрагидропиран-3,4,5-триола со стадии I (108 мг, 0,297 ммоль), PdCl2(PPh3)2 (12,5 мг, 0,0178 ммоль) и йодида меди (5,6 мг, 0,030 ммоль) в CH3CN (1,5 мл) помещают в пробирку для микроволновой печи (10 мл). Добавляют ДБУ (267 мкл, 1,78 ммоль) и воду (10 мкл, 0,55 ммоль) и смесь дегазируют с последующим добавлением ТМС-ацетилена (21 мкл, 0,15 ммоль). Пробирку герметично закрывают и энергично перемешивают при 80°С в течение 20 ч. Смесь охлаждают до КТ, концентрируют и остаток растворяют в ДМСО (0,5 мл). Полученный раствор очищают на Biotage™ SNAP C18 (30 г), элюируя CH3CN (от 0% до 50%, 15 ОК) в воде. Фракции, содержащие желаемый продукт, объединяют и концентрируют. Остаток затем очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (12,4 мг, 14%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,28-7,24 (м, 4H), 7,20 (д, J=9,2 Гц, 2H), 5,24 (с, 2H), 3,76-3,64 (м, 8H), 3,59-3,49 (м, 2H), 2,22 (с, 6H), 1,37 (с, 6H). ЖХМС m/z (M+H)+=591,47.
Получение ПРИМЕРА 118
(2R,3S,4S,5S,6R)-2-[4-[3,5-бис[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]фенил]-2-метилфенокси]-6-(гидроксиметил)-3-метилтетрагидропиран-3,4,5-триол

Стадия I: триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-метил-2-(2-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)тетрагидро-2H-пиран-3,4,5-тритила

К дегазированной смеси ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M10 (1,00 г, 1,88 ммоль), KOAc (369 мг, 3,76 ммоль) и бис(пинаколато)диборона (717 мг, 2,82 ммоль) в ДМФ (10,0 мл) добавляют PdCl2(dppf)-ДХМ (77 мг, 0,094 ммоль). Реакционную смесь перемешивают при 80°C в течение 21 ч, охлаждают до КТ и разделяют между EtOAc и насыщенным водным NH4Cl. Органический слой отделяют, фильтруют на целите, сушат над Na2SO4, фильтруют, концентрируют и остаток очищают на Biotage™ SNAP Ultra картридже на двуокиси кремния (25 г), элюируя EtOAc (10-60%) в Гекс. в качестве градиента с получением указанного в заголовке соединения (971 мг, 89%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,65-7,56 (м, 2H), 7,13 (д, J=8,2 Гц, 1H), 6,31 (с, 1H), 5,59 (д, J=9,7 Гц, 1H), 5,38 (т, J=9,9 Гц, 1H), 4,17 (дд, J=12,2, 5,2 Гц, 1H), 4,08-3,94 (м, 2H), 2,27 (с, 3H), 2,13 (с, 3H), 2,12 (с, 3H), 2,02 (с, 6H), 1,61 (с, 3H), 1,32 (с, 12H).
Стадия II: пер-ацетилированный ПРИМЕР 118

К дегазированному раствору триацетата (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-метил-2-(2-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)тетрагидро-2H-пиран-3,4,5-тритила со стадии I (100 мг, 0,17 ммоль), 1,3,5-трийодбензола (24 мг, 0,052 ммоль) в 2-Me ТГФ (3,75 мл) и воде (750 мкл) добавляют K2CO3 (36 мг, 0,26 ммоль), Pd(OAc)2 (1,0 мг, 0,0052 ммоль) и 3-(2-дициклогексилфосфанилфенил)-2,4-диметоксибензолсульфоновую кислоту (ион натрия (1)) (5 мг, 0,010 ммоль). Реакционную смесь дегазируют, перемешивают при 70°C в течение 2 ч, охлаждают до КТ и разделяют между EtOAc и водой. Органический слой отделяют, фильтруют на целите, сушат над Na2SO4, фильтруют, концентрируют и очищают на Biotage™ SNAP Ultra картридже на двуокиси кремния (12 г), элюируя EtOAc (20-80%) в Гекс. в качестве градиента с получением пер-ацилированного ПРИМЕРА 118 (50 мг, 61%) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,68 (д, J=1,4 Гц, 3H), 7,58 (д, J=2,4 Гц, 3H), 7,54 (дд, J=8,6, 2,3 Гц, 3H), 7,23 (д, J=8,6 Гц, 3H), 6,35 (с, 3H), 5,64 (д, J=9,7 Гц, 3H), 5,41 (т, J=9,9 Гц, 3H), 4,21 (дд, J=12,2, 4,9 Гц, 3H), 4,12-3,97 (м, 6H), 2,37 (с, 9H), 2,14 (с, 9H), 2,12 (с, 9H), 2,02 (с, 9H), 1,99 (с, 9H), 1,64 (с, 9H).
Стадия III: ПРИМЕР 118
К раствору пер-ацетилированного ПРИМЕРА 118 со стадии II (50 мг, 0,035 ммоль) в MeOH (1,0 мл) добавляют NaOMe (4,0 мкл 25% масс./масс., 0,018 ммоль). В полученную суспензию перемешивают 2 ч при КТ затем добавляют полимер Ambilite IR-120 до достижения реакционной смесью pH 4. Суспензию разбавляют MeOH (10 мл), фильтруют и концентрируют с получением указанного в заголовке соединения (30 мг, 88%). 1H ЯМР (400 МГц, CD3OD) δ 7,63 (с, 3H), 7,54-7,42 (м, 6H), 7,32 (д, J=8,4 Гц, 3H), 5,28 (с, 3H), 3,82-3,66 (м, 12H), 3,61 (дт, J=6,9, 3,6 Гц, 3H), 2,33 (с, 9H), 1,41 (с, 9H). ЖХМС m/z (M+H)+=925,81
Получение ПРИМЕРА 119
(2R,3S,4S,5S,6R)-6-(гидроксиметил)-3-метил-2-[2-метил-4-[5-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]-3-пиридил]фенокси]тетрагидропиран-3,4,5-триол

К дегазированному раствору триацетата (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-метил-2-(2-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси)тетрагидро-2H-пиран-3,4,5-тритила из ПРИМЕРА 118, Стадия I (204 мг, 0,35 ммоль), 3-бром-5-йод-пиридина (50,0 мг, 0,180 ммоль) в 2-MeТГФ (1,9 мл) и воде (375 мкл) добавляют K2CO3 (74,0 мг, 0,530 ммоль), Pd(OAc)2 (2,0 мг, 0,011 ммоль) и 3-(2-дициклогексилфосфанилфенил)-2,4-диметоксибензолсульфоновую кислоту (ион натрия (1)) (11 мг, 0,021 ммоль). Реакционную смесь дегазируют снова, перемешивают при 70°C в течение 16 ч и затем охлаждают до КТ. Органический слой отделяют, сушат над Na2SO4, фильтруют на целите, разбавляют MeOH (1 мл) и 2-Me ТГФ (2 мл) и обрабатывают NaOMe (352 мкл 0,5M, 0,18 ммоль) в течение 2 ч при комнатной температуре. Реакционную смесь нейтрализуют AcOH (20 мкл, 0,35 ммоль), концентрируют и очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (8 мг, 14%). 1H ЯМР (400 МГц, CD3OD) δ 8,66 (с, 2H), 8,16 (д, J=1,8 Гц, 1H), 7,62-7,42 (м, 4H), 7,36 (д, J=8,5 Гц, 2H), 5,29 (с, 2H), 3,81-3,63 (м, 8H), 3,58 (дт, J=6,8, 3,5 Гц, 2H), 2,33 (с, 6H), 1,40 (с, 6H). ЖХМС m/z (M+H)+=644,38.
Получение ПРИМЕРОВ 120, 121 и 122
ПРИМЕРЫ 120-122 получают по методике, описанной для ПРИМЕРА 119 с применением подходящим образом замещенного коммерчески доступного бис-галогенированного фенила или пиридина.
|
Получение ПРИМЕРА 123
(2R,3S,4S,5S,6R)-6-(гидроксиметил)-3-метил-2-[2-метил-4-[2-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]циклопропил]фенокси]тетрагидропиран-3,4,5-триол

Стадия I: триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-метил-2-(2-метил-4-((E)-2-(6-метил-4,8-диоксо-1,3,6,2-диоксазаборокан-2-ил)винил)фенокси)тетрагидро-2H-пиран-3,4,5-тритила

В пробирку, содержащую 2-[(E)-2-бромвинил]-6-метил-1,3,6,2-диоксазаборокан-4,8-дион (95,1 мг, 0,363 ммоль), ацетат [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-5-метил-6-[2-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]тетрагидропиран-2-ил]метила из ПРИМЕРА 118, Стадия I (175 мг, 0,303 ммоль) добавляют в атмосфере азота PdCl2(dppf). CH2Cl2 (22,1 мг, 0,0303 ммоль) и K3PO4 (192,7 мг, 0,908 ммоль) в CH3CN (1,2 мл). Пробирку герметично закрывают и перемешивают при КТ в течение 3 дней. Смесь фильтруют на слое силикагеля и фильтрат концентрируют. Остаток очищают на Biotage™ SNAP картридже на двуокиси кремния, элюируя EtOAc в Гекс. в качестве градиента с получением указанного в заголовке соединения (107,6 мг, 56%).
Стадия II: ацетат [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-5-метил-6-[2-метил-4-[(E)-2-[3-метил-4-[(2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]винил]фенокси]тетрагидропиран-2-ил]метила

В пробирку, содержащую ПРОМЕЖУТОЧНОЕ СОЕДИНЕНИЕ M10 (144,4 мг, 0,272 ммоль) и триацетат (2R,3S,4S,5R,6R)-6-(ацетоксиметил)-3-метил-2-(2-метил-4-((E)-2-(6-метил-4,8-диоксо-1,3,6,2-диоксазаборокан-2-ил)винил)фенокси)тетрагидро-2H-пиран-3,4,5-тритила (107,6 мг, 0,170 ммоль) добавляют в атмосфере азота PdCl2(dppf). CH2Cl2 (12,4 мг, 0,0170 ммоль) и K3PO4 (108,2 мг, 0,510 ммоль) в CH3CN (1,4 мл). Пробирку герметично закрывают и перемешивают при 60°C в течение ночи. Смесь фильтруют на слое силикагеля, и фильтрат концентрируют. Остаток очищают на Biotage™ SNAP картридже на двуокиси кремния, элюируя EtOAc в Гекс. с получением указанного в заголовке соединения (40 мг, 25%).
Стадия III: ацетат [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-5-метил-6-[2-метил-4-[2-[3-метил-4-[(2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]циклопропил]фенокси]тетрагидропиран-2-ил]метила

К раствору ацетата [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-5-метил-6-[2-метил-4-[(E)-2-[3-метил-4-[(2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]винил]фенокси]тетрагидропиран-2-ил]метила со стадии II (40 мг, 0,043 ммоль) и Pd(OAc)2 (4,8 мг, 0,022 ммоль) в CH2Cl2 (1,0 мл) при 0°C добавляют по каплям раствор диазометана (5,4 мл 0,8M, 4,3 ммоль) и раствор перемешивают до полного превращения в желаемый продукт (отслеживается ЖХМС). Полученную смесь фильтруют над Целитом, и фильтрат концентрируют при пониженном давлении с получением неочищенной смеси (40,6 мг) указанного в заголовке соединения. Последнее применяют на следующей стадии без дальнейшей очистки.
Стадия IV: ПРИМЕР 123
Неочищенную смесь ацетата [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-5-метил-6-[2-метил-4-[2-[3-метил-4-[(2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]циклопропил]фенокси]тетрагидропиран-2-ил]метила со стадии III (40,6 мг) растворяют в MeOH (323 мкл) и добавляют NaOMe (86 мкл 0,5 M, 0,043 ммоль). Полученную смесь перемешивают в течение ночи при КТ. Добавляют AcOH (0,9 мкл, 0,015 ммоль) и смесь концентрируют. Остаток очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (4,1 мг) в виде белого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,10 (д, J=8,2 Гц, 3H), 6,96-6,85 (м, J=9,8 Гц, 5H), 5,14 (д, J=6,5 Гц, 2H), 3,76-3,66 (м, J=10,2, 4,1 Гц, 9H), 3,65-3,55 (м, J=4,7 Гц, 3H), 2,19 (с, 6H), 1,96 (т, 2H), 1,37 (с, 6H), 1,27 (т, J=7,1 Гц, 2H). ЖХМС m/z (M+H)+=607,7.
Получение ПРИМЕРА 124
(2R,3'S,4'S,5'S,6'R)-6'-(гидроксиметил)спиро[хроман-2,2'-тетрагидропиран]-3',4',5',6-тетрол (VКТ-1178998)

Стадия I: (2R,3'S,4'S,5'R,6'R)-3',4',5',6-тетрабензилокси-6'-(бензилоксиметил)спиро[хроман-2,2'-тетрагидропиран]

К холодному (0°C) раствору ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ M9 (1,99 г, 3,27 ммоль) и 4-бензилоксифенола (1,97 г, 9,84 ммоль) в CH2Cl2 (48 мл) добавляют BF3.OEt2 (420 мкл, 3,31 ммоль). После перемешивания в течение 45 мин при 0°C, реакционную смесь гасят H2O (25 мл), перемешивают в течение 15 мин и слои разделяют. Водный слой повторно экстрагируют CH2Cl2 (2×25 мл) и объединенные органические экстракты концентрируют до около 25 мл. Выпавший в осадок непрореагировавший фенол удаляют фильтрацией. Фильтрат очищают на Biotage™ SNAP картридже на двуокиси кремния (100 г), элюируя EtOAc (от 0 до 20%) в Гекс. в качестве градиента с получением указанного в заголовке соединения (1,56 г, 64% выход) в виде бесцветной камеди. 1H ЯМР (400 МГц, CDCl3) δ 7,47-7,05 (м, 25H), 6,81-6,55 (м, 3H), 5,04 (д, J=11,6 Гц, 1H), 4,96 (с, 2H), 4,90 (д, J=10,6 Гц, 1H), 4,84 (с, 2H), 4,72 (д, J=11,6 Гц, 1H), 4,59 (д, J=10,6 Гц, 1H), 4,54 (д, J=11,7 Гц, 1H), 4,41-4,30 (м, 2H), 4,11 (т, J=9,7 Гц, 1H), 3,85 (д, J=2,8 Гц, 1H), 3,82 (ддд, J=10,0, 4,6, 1,6 Гц, 1H), 3,74 (дд, J=11,6, 4,7 Гц, 1H), 3,64 (дд, J=11,5, 1,6 Гц, 1H), 2,95 (ддд, J=16,3, 13,2, 6,4 Гц, 1H), 2,59-2,48 (м, 1H), 2,42 (ддд, J=12,8, 5,9, 1,6 Гц, 1H), 1,50 (дт, J=13,0, 5,8 Гц, 1H).
Стадия II: ПРИМЕР 124
В сосуд под давлением загружают (2R,3'S,4'S,5'R,6'R)-3',4',5',6-тетрабензилокси-6'-(бензилоксиметил)спиро[хроман-2,2'-тетрагидропиран] со стадии I (646 мг, 0,863 ммоль) в EtOAc (5 мл) и MeOH (10 мл). Добавляют Pd(OH)2 (31 мг, 0,044 ммоль) (суспензия в MeOH), затем уксусную кислоту (245 мкл, 4,31 ммоль). Реакционную смесь затем разбавляют MeOH (10 мл) и EtOAc (15 мл). Сосуд под давлением заполняют H2 и удаляют газы (3X), затем перемешивают в течение ночи под 45 ф/д2 H2 на встряхивателе Парра. Реакционную смесь вентилируют под N2, фильтруют на целите и катализатор осторожно промывают порциями MeOH. Объединенные фильтраты концентрируют и совместно выпаривают с гептаном. Анализ ЯМР показал, что реакция не завершена, поэтому неочищенную смесь повторно помещают в точные условия реакции и обрабатывают с получением, после совместного выпаривания с 1,4-диоксаном (2x), указанного в заголовке соединения (251 мг, 89% выход) в виде беловатого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 6,62 (д, J=8,4 Гц, 1H), 6,56-6,47 (м, 2H), 4,06 (дд, J=9,5, 3,4 Гц, 1H), 3,76-3,62 (м, 4H), 3,52 (ддд, J=9,9, 4,5, 2,8 Гц, 1H), 2,96 (ддд, J=16,7, 12,9, 6,2 Гц, 1H), 2,57 (ддд, J=16,4, 6,0, 2,3 Гц, 1H), 2,32 (ддд, J=13,4, 6,1, 2,4 Гц, 1H), 1,69 (тд, J=13,1, 6,0 Гц, 1H). ЖХМС m/z (M+Na)+=321,29
Получение ПРИМЕРА 125
(2R,3'S,4'S,5'S,6'R)-6'-(гидроксиметил)-6-[3-метил-4-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)-3-метилтетрагидропиран-2-ил]оксифенил]спиро[хроман-2,2'-тетрагидропиран]-3',4',5'-триол

Стадия I: [(2R,3'S,4'S,5'S,6'R)-3',4',5'-тригидрокси-6'-(гидроксиметил)спиро[хроман-2,2'-тетрагидропиран]-6-ил]трифторметансульфонат

К раствору ПРИМЕРА 124 (730 мг, 2,24 ммоль) и 1,1,1-трифтор-N-фенил-N-(трифторметилсульфонил)метансульфонамида (962 мг, 2,69 ммоль) в ДМФ (10 мл) добавляют ТЭА (625 мкл, 4,48 ммоль), и реакционную смесь перемешивают в течение 24 ч, затем концентрируют досуха. Неочищенный продукт очищают на Biotage™ SNAP картридже на двуокиси кремния (50 г), элюируя градиентом MeOH (0-20%) в CH2Cl2 с получением указанного в заголовке соединения (842 мг, 87% выход) в виде бесцветного твердого вещества с примесью ТЭА. 1H ЯМР (400 МГц, CD3OD) δ 7,14-7,02 (м, 2H), 6,93 (д, J=8,8 Гц, 1H), 4,06 (дд, J=9,5, 3,4 Гц, 1H), 3,79 (д, J=3,4 Гц, 1H), 3,74-3,60 (м, 3H), 3,52 (ддд, J=9,9, 4,6, 3,1 Гц, 1H), 3,15-2,99 (м, 1H), 2,72 (ддд, J=16,6, 5,6, 2,2 Гц, 1H), 2,42 (ддд, J=13,7, 6,1, 2,3 Гц, 1H), 1,74 (тд, J=13,3, 5,8 Гц, 1H). ЖХМС m/z (M+H)+=431,21.
Стадия II: ацетат [(2R,2'R,3'R,4'S,5'S)-3',4',5'-триацетокси-6-(трифторметилсульфонилокси)спиро[хроман-2,6'-тетрагидропиран]-2'-ил]метила

В пробирку, содержащую [(2R,3'S,4'S,5'S,6'R)-3',4',5'-тригидрокси-6'-(гидроксиметил)спиро[хроман-2,2'-тетрагидропиран]-6-ил]трифторметансульфонат со стадии I (840 мг, 1,95 ммоль) и ДМАП (49 мг, 0,401 ммоль) добавляют пиридин (2,8 мл, 34,6 ммоль), затем Ac2O (3,32 мл, 35,1 ммоль). После перемешивания в течение 2,5 ч, реакционную смесь разбавляют CH2Cl2 (30 мл) и гасят H2O и 1N HCl (15 мл каждый). Слои разделяют, и водный слой повторно экстрагируют CH2Cl2 (2×15 мл). Объединенные органические экстракты концентрируют и совместно выпаривают с CH2Cl2/гептаном (3x). Неочищенный остаток очищают флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (50 г), элюируя градиентом EtOAc (0-60%) в Гекс. с получением указанного в заголовке соединения (907 мг, 78% выход) в виде белого кристаллического твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,07 (дд, J=8,9, 2,9 Гц, 1H), 7,02 (д, J=2,8 Гц, 1H), 6,99 (д, J=8,9 Гц, 1H), 5,65 (дд, J=10,1, 3,5 Гц, 1H), 5,43 (д, J=3,5 Гц, 1H), 5,32 (т, J=10,2 Гц, 1H), 4,23 (дд, J=12,3, 5,8 Гц, 1H), 4,02-3,92 (м, 2H), 2,98 (ддд, J=16,7, 13,1, 6,4 Гц, 1H), 2,69 (ддд, J=6,5, 5,2, 0,8 Гц, 1H), 2,22 (с, 3H), 2,18 (ддд, J=13,5, 6,3, 1,9 Гц, 1H), 2,06 (с, 3H), 2,01 (с, 3H), 1,90 (с, 3H), 1,70 (тд, J=13,4, 6,1 Гц, 1H). 19F ЯМР (376 МГц, CDCl3) δ -72,88 (с). ЖХМС m/z (M+H)+=599,34
Стадия III: ацетат [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-5-метил-6-[2-метил-4-[(2R,3'S,4'S,5'R,6'R)-3',4',5'-триацетокси-6'-(ацетоксиметил)спиро[хроман-2,2'-тетрагидропиран]-6-ил]фенокси]тетрагидропиран-2-ил]метила

В пробирку под давлением загружают ацетат [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-5-метил-6-[2-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенокси]тетрагидропиран-2-ил]метила из ПРИМЕРА 118, Стадия I (71,0 мг, 0,123 ммоль), ацетат [(2R,2'R,3'R,4'S,5'S)-3',4',5'-триацетокси-6-(трифторметилсульфонилокси)спиро[хроман-2,6'-тетрагидропиран]-2'-ил]метила со стадии II (50,0 мг, 0,0835 ммоль), K2CO3 (58,0 мг, 0,420 ммоль), Pd(OAc)2 (4,9 мг, 0,022 ммоль) и [3-(2-дициклогексилфосфанилфенил)-2,4-диметоксифенил]сульфонилоксинатрий (V-Phos) (13,6 мг, 0,0265 ммоль). Пробирку закрывают крышкой и дегазируют (вакуум, затем N2, 3x) и добавляют 2-метилтетрагидрофуран (1,0 мл) и H2O (200 мкл). Пробирку дегазируют снова и переносят в предварительно нагретую (65°C) масляную баню. После перемешивания в течение 2 ч, реакционную смесь охлаждают до КТ, пропускают через небольшой слой Целита, промывают EtOAc (5 мл) и насыщенным водным раствором NH4Cl (3 мл). Слой отделяют, и водный слой повторно экстрагируют EtOAc (2×3 мл). Объединенные органические экстракты сушат над Na2SO4, фильтруют и концентрируют. Неочищенный остаток очищают флэш-хроматографией на Biotage™ SNAP картридже на двуокиси кремния (10 г), элюируя градиентом EtOAc (20-80%) в Гекс. с получением указанного в заголовке соединения (73 мг) в виде бесцветного твердого вещества с примесью пинакола. 1H ЯМР (400 МГц, CDCl3) δ 7,36-7,33 (м, 1H), 7,31 (дд, J=5,0, 2,2 Гц, 1H), 7,28 (д, J=2,3 Гц, 1H), 7,24 (д, J=1,9 Гц, 1H), 7,20 (д, J=8,5 Гц, 1H), 6,98 (д, J=8,4 Гц, 1H), 6,31 (с, 1H), 5,71 (дд, J=10,1, 3,5 Гц, 1H), 5,62 (д, J=9,7 Гц, 1H), 5,44 (д, J=3,3 Гц, 1H), 5,40 (д, J=9,8 Гц, 1H), 5,35 (т, J=10,1 Гц, 1H), 4,26 (дд, J=12,0, 5,1 Гц, 1H), 4,20 (дд, J=12,2, 5,2 Гц, 1H), 4,16-3,95 (м, 4H), 3,00 (ддд, J=16,4, 13,2, 6,1 Гц, 1H), 2,76-2,64 (м, 1H), 2,34 (с, 3H), 2,25-2,11 (м, 10H), 2,06 (с, 3H), 2,05 (с, 6H), 2,02 (с, 3H), 1,91 (с, 3H), 1,74 (тд, J=13,2, 6,0 Гц, 1H), 1,66 (с, 3H). ЖХМС m/z (M+Na)+=923,71
Стадия IV: ПРИМЕР 125
К суспензии ацетата [(2R,3R,4S,5S,6R)-3,4,5-триацетокси-5-метил-6-[2-метил-4-[(2R,3'S,4'S,5'R,6'R)-3',4',5'-триацетокси-6'-(ацетоксиметил)спиро[хроман-2,2'-тетрагидропиран]-6-ил]фенокси]тетрагидропиран-2-ил]метила со стадии III (66,5 мг, 0,0738 ммоль) в MeOH (1,3 мл) добавляют NaOMe в MeOH (300 мкл 0,5M, 0,150 ммоль. После перемешивания в течение 3 ч, реакционную смесь разбавляют MeOH (2 мл), обрабатывают предварительно промытым полимером Dowex 50WX4-400, фильтруют и промывают порциями MeOH. Объединенные фильтраты концентрируют и очищают на Biotage™ SNAP C18 картридже (12 г), элюируя градиентом CH3CN (10-90%) в H2O. Фракции, содержащие желаемый продукт, объединяют, концентрируют, повторно растворяют в смеси H2O/CH3CN (20%) и сушат вымораживанием с получением указанного в заголовке соединения (26,7 мг, 59% выход) в виде белого рыхлого твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,38-7,21 (м, 5H), 6,84 (д, J=9,1 Гц, 1H), 5,25 (с, 1H), 4,10 (дд, J=9,5, 3,4 Гц, 1H), 3,80 (д, J=3,4 Гц, 1H), 3,77-3,66 (м, 7H), 3,65-3,52 (м, 2H), 3,08 (ддд, J=16,4, 13,0, 6,2 Гц, 1H), 2,72 (ддд, J=7,3, 5,2, 1,7 Гц, 1H), 2,41 (ддд, J=13,2, 5,8, 2,2 Гц, 1H), 2,29 (с, 3H), 1,77 (тд, J=13,2, 5,9 Гц, 1H), 1,41 (с, 3H). ЖХМС m/z (M+H)+=565,49
Получение ПРИМЕР 126
(2R,3'S,4'S,5'S,6'R)-6'-(гидроксиметил)-6-[(2R,3'S,4'S,5'S,6'R)-3',4',5'-тригидрокси-6'-(гидроксиметил)спиро[хроман-2,2'-тетрагидропиран]-6-ил]спиро[хроман-2,2'-тетрагидропиран]-3',4',5'-триол

Стадия I: ацетат [(2R,2'R,3'R,4'S,5'S)-3',4',5'-триацетокси-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)спиро[хроман-2,6'-тетрагидропиран]-2'-ил]метила

В пробирку под давлением загружают ацетат [(2R,2'R,3'R,4'S,5'S)-3',4',5'-триацетокси-6-(трифторметилсульфонилокси)спиро[хроман-2,6'-тетрагидропиран]-2'-ил]метила со стадии II (501 мг, 0,837 ммоль), KOAc (170 мг, 1,73 ммоль), бис(пинаколато)диборон (321 мг, 1,26 ммоль) и PdCl2(dppf).CH2Cl2 (35 мг, 0,0429 ммоль), закрывают крышкой и дегазируют (вакуум, затем N2 3x). ДМФ (5,0 мл) добавляют, реакционную смесь снова дегазируют, затем нагревают при 80°C в течение 4 ч. Реакционную смесь разбавляют насыщенным водным раствором NH4Cl и EtOAc (15 мл каждый). Слои разделяют, и органический слой промывают насыщенным водным раствором NH4Cl (15 мл), сушат над Na2SO4, фильтруют и концентрируют. Неочищенный остаток очищают на Biotage™ SNAP картридже на двуокиси кремния (50 г) элюируя градиентом EtOAc (0-60%) в Гекс. с получением указанного в заголовке соединения (457 мг, 95% выход) в виде белого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,61 (д, J=8,0 Гц, 1H), 7,56 (с, 1H), 6,95 (д, J=8,1 Гц, 1H), 5,68 (дд, J=10,1, 3,4 Гц, 1H), 5,42 (д, J=3,4 Гц, 1H), 5,34 (т, J=10,1 Гц, 1H), 4,24 (дд, J=12,1, 4,9 Гц, 1H), 4,01 (ддд, J=9,8, 4,9, 2,3 Гц, 1H), 3,94 (дд, J=12,2, 2,4 Гц, 1H), 3,03-2,86 (м, 1H), 2,75-2,53 (м, 1H), 2,21 (с, 3H), 2,16 (ддд, J=13,2, 5,8, 1,8 Гц, 1H), 2,05 (с, 4H), 2,00 (с, 3H), 1,93 (с, 3H), 1,69 (тд, J=13,3, 5,8 Гц, 1H), 1,33 (с, 12H). ЖХМС m/z (M+Na)+=599,48.
Стадия II: ацетат [(2R,2'R,3'R,4'S,5'S)-3',4',5'-триацетокси-6-[(2R,3'S,4'S,5'R,6'R)-3',4',5'-триацетокси-6'-(ацетоксиметил)спиро[хроман-2,2'-тетрагидропиран]-6-ил]спиро[хроман-2,6'-тетрагидропиран]-2'-ил]метила

Указанное в заголовке соединение получают по методике, описанной для ПРИМЕРА 125, Стадия III, с применением ацетата [(2R,2'R,3'R,4'S,5'S)-3',4',5'-триацетокси-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)спиро[хроман-2,6'-тетрагидропиран]-2'-ил]метила со стадии I и ацетата [(2R,2'R,3'R,4'S,5'S)-3',4',5'-триацетокси-6-(трифторметилсульфонилокси)спиро[хроман-2,6'-тетрагидропиран]-2'-ил]метила из ПРИМЕРА 125, Стадия I. Указанное в заголовке соединение (79% выход) получают в виде белого твердого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,32 (дд, J=8,2, 2,1 Гц, 2H), 7,24 (широкий с, 2H), 6,98 (д, J=8,4 Гц, 2H), 5,70 (дд, J=10,1, 3,3 Гц, 2H), 5,44 (д, J=3,3 Гц, 2H), 5,35 (т, J=10,1 Гц, 2H), 4,26 (дд, J=11,9, 4,9 Гц, 2H), 4,10-3,91 (м, 4H), 3,07-2,89 (м, 2H), 2,70 (дд, J=16,9, 5,4 Гц, 2H), 2,27-2,13 (м, 8H), 2,06 (с, 6H), 2,02 (с, 6H), 1,92 (с, 6H), 1,74 (тд, J=13,0, 5,7 Гц, 2H). ЖХМС m/z (M+Na)+=899,72
Стадия III ПРИМЕР 126
Указанное в заголовке соединение получают по методике, описанной для ПРИМЕРА 125, Стадия IV, начиная с ацетата [(2R,2'R,3'R,4'S,5'S)-3',4',5'-триацетокси-6-[(2R,3'S,4'S,5'R,6'R)-3',4',5'-триацетокси-6'-(ацетоксиметил)спиро[хроман-2,2'-тетрагидропиран]-6-ил]спиро[хроман-2,6'-тетрагидропиран]-2'-ил]метила со стадии II. 1H ЯМР (400 МГц CD3OD) δ 7,33-7,22 (м, 4H), 6,89-6,78 (м, 2H), 4,10 (дд, J=9,5, 3,4 Гц, 2H), 3,79 (д, J=3,4 Гц, 2H), 3,74 (т, J=9,7 Гц, 2H), 3,71-3,65 (м, 4H), 3,57 (ддд, J=9,9, 4,2, 3,1 Гц, 2H), 3,07 (ддд, J=17,5, 13,0, 6,1 Гц, 2H), 2,77-2,67 (м, 2H), 2,40 (ддд, J=13,3, 5,8, 2,2 Гц, 2H), 1,76 (тд, J=13,2, 5,9 Гц, 2H). ЖХМС m/z (M+H)+=563,49
Получение ПРИМЕРА 127
(2R,3'S,4'S,5'S,6'R)-6'-(гидроксиметил)-6-[4-[(2R,3'S,4'S,5'S,6'R)-3',4',5'-тригидрокси-6'-(гидроксиметил)спиро[хроман-2,2'-тетрагидропиран]-6-ил]фенил]спиро[хроман-2,2'-тетрагидропиран]-3',4',5'-триол

Стадия I: ацетат [(2R,2'R,3'R,4'S,5'S)-3',4',5'-триацетокси-6-[4-[(2R,3'S,4'S,5'R,6'R)-3',4',5'-триацетокси-6'-(ацетоксиметил)спиро[хроман-2,2'-тетрагидропиран]-6-ил]фенил]спиро[хроман-2,6'-тетрагидропиран]-2'-ил]метила

В пробирку под давлением загружают ацетат [(2R,2'R,3'R,4'S,5'S)-3',4',5'-триацетокси-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)спиро[хроман-2,6'-тетрагидропиран]-2'-ил]метила из ПРИМЕРА 126, Стадия I (105 мг, 0,182 ммоль), 1,4-дибромбензол (20 мг, 0,0845 ммоль), K2CO3 (64 мг, 0,463 ммоль), Pd(OAc)2 (2,6 мг, 0,0116 ммоль) и [3-(2-дициклогексилфосфанилфенил)-2,4-диметоксифенил]сульфонилоксинатрий (V-Phos) (9 мг, 0,0176 ммоль). Пробирку накрывают крышкой и дегазируют (вакуум, затем N2, 3x) и добавляют 2-метилтетрагидрофуран (400 мкл) и H2O (80 мкл), пробирку дегазируют снова и переносят в предварительно нагретую (65°C) масляную баню. После перемешивания в течение 2 ч реакционную смесь охлаждают до КТ, разбавляют CH2Cl2 (3 мл) и H2O (2 мл). Слои разделяют, и водный слой повторно экстрагируют CH2Cl2 (2×1 мл). Объединенные органические экстракты концентрируют. Неочищенный остаток очищают на Biotage™ SNAP картридже на двуокиси кремния (10 г), элюируя градиентом EtOAc (50-100%) в Гекс. с получением указанного в заголовке соединения (71 мг) в виде белого твердого вещества с примесью пинакола. 1H ЯМР (400 МГц, CDCl3) δ 7,59 (с, 4H), 7,43 (дд, J=8,4, 2,2 Гц, 2H), 7,35 (д, J=2,1 Гц, 2H), 7,02 (д, J=8,4 Гц, 2H), 5,72 (дд, J=10,1, 3,5 Гц, 2H), 5,46 (д, J=3,5 Гц, 2H), 5,35 (т, J=10,1 Гц, 2H), 4,27 (дд, J=12,1, 5,1 Гц, 2H), 4,05 (ддд, J=10,1, 5,2, 2,5 Гц, 2H), 4,00 (дд, J=12,0, 2,5 Гц, 2H), 3,03 (ддд, J=15,9, 12,9, 5,8 Гц, 2H), 2,79-2,65 (м, 2H), 2,29-2,14 (м, 8H), 2,07 (с, 6H), 2,02 (с, 6H), 1,92 (с, 6H), 1,76 (дт, J=13,2, 5,9 Гц, 2H). ЖХМС m/z (M+H)+=975,72.
Стадия II: ПРИМЕР 127
Указанное в заголовке соединение получают по методике, описанной для ПРИМЕРА 125, Стадия IV, начиная с ацетата [(2R,2'R,3'R,4'S,5'S)-3',4',5'-триацетокси-6-[4-[(2R,3'S,4'S,5'R,6'R)-3',4',5'-триацетокси-6'-(ацетоксиметил)спиро[хроман-2,2'-тетрагидропиран]-6-ил]фенил]спиро[хроман-2,6'-тетрагидропиран]-2'-ил]метила со стадии I. 1H ЯМР (400 МГц, CD3OD) δ 7,60 (с, 4H), 7,44-7,34 (м, 4H), 6,93-6,85 (м, 2H), 4,11 (дд, J=9,5, 3,4 Гц, 2H), 3,81 (д, J=3,4 Гц, 2H), 3,79-3,67 (м, 6H), 3,59 (дт, J=9,9, 3,7 Гц, 2H), 3,11 (ддд, J=16,7, 12,9, 6,0 Гц, 2H), 2,75 (ддд, J=16,2, 5,5, 2,0 Гц, 2H), 2,43 (ддд, J=13,4, 6,0, 2,4 Гц, 2H), 1,79 (тд, J=13,3, 5,8 Гц, 2H). ЖХМС m/z (M+H)+=639,49
Получение ПРИМЕРА 128
(2R,3'S,4'S,5'S,6'R)-6'-(гидроксиметил)-6-[3-[(2R,3'S,4'S,5'S,6'R)-3',4',5'-тригидрокси-6'-(гидроксиметил)спиро[хроман-2,2'-тетрагидропиран]-6-ил]фенил]спиро[хроман-2,2'-тетрагидропиран]-3',4',5'-триол

Указанное в заголовке соединение получают в две стадии по методике, описанной для ПРИМЕРА 127, но с применением 1,3-дибромбензола на первой стадии. 1H ЯМР (400 МГц, CD3OD+ДМСО-D6) δ 7,80-7,65 (м, 1H), 7,57-7,37 (м, 7H), 6,97-6,88 (м, 2H), 4,10 (дд, J=9,5, 3,4 Гц, 2H), 3,82 (д, J=3,4 Гц, 2H), 3,78-3,67 (м, 6H), 3,58 (дт, J=9,9, 3,7 Гц, 2H), 3,11 (ддд, J=16,4, 12,9, 6,1 Гц, 2H), 2,79 (ддд, J=7,8, 5,3, 2,1 Гц, 2H), 2,43 (ддд, J=13,4, 5,9, 2,4 Гц, 2H), 1,80 (тд, J=13,2, 5,8 Гц, 2H). ЖХМС m/z (M+H)+=639,49.
Получение ПРИМЕРА 129
(2R,3'S,4'S,5'S,6'R)-6'-(гидроксиметил)-6-[5-[(2R,3'S,4'S,5'S,6'R)-3',4',5'-тригидрокси-6'-(гидроксиметил)спиро[хроман-2,2'-тетрагидропиран]-6-ил]-3-пиридил]спиро[хроман-2,2'-тетрагидропиран]-3',4',5'-триол

Указанное в заголовке соединение получают в две стадии по методике, описанной для ПРИМЕРА 127, но с применением 3,5-дибромпиридина на первой стадии. 1H ЯМР (400 МГц, CD3OD) δ 8,63 (широкий с, 2H), 8,13 (с, 1H), 7,51-7,36 (м, 4H), 7,01-6,86 (м, 2H), 4,09 (дд, J=9,5, 3,4 Гц, 2H), 3,80 (д, J=3,4 Гц, 2H), 3,76-3,63 (м, 6H), 3,56 (ддд, J=9,9, 4,2, 3,2 Гц, 2H), 3,18-2,97 (м, 2H), 2,76 (ддд, J=16,5, 5,5, 2,1 Гц, 2H), 2,42 (ддд, J=13,4, 5,9, 2,3 Гц, 2H), 1,77 (тд, J=13,3, 5,8 Гц, 2H). ЖХМС m/z (M+H)+=640,47
Анализ теплового сдвига
Домен распознавания углеводорода белка FimH (M1-T179) м не отщепляемым C-концевым 6-His концом клонируют в pET21b плазмид и экспрессируют в E. coli и очищают до гомогенности. Тепловую стабилизацию белка при связывании лиганда измеряют в 96-луночном формате на ViiA™ 7 (Life Technologies, Carlsbad, CA) КТ-ПЦР инструменте. Анализ проводят дважды в 20 мМ Трис pH 7,4 и 150 мМ NaCl в конечной концентрации 5,6 мкМ и 56 мкМ для белка и лиганда, соответственно. Чувствительный к окружающей среде краситель (Applied Biosystems Protein Thermal Shift™ Dye (P/N 4461141)) добавляют в каждую лунку до конечного соотношения 1:1000. Планшеты центрифугируют при 1000×g в течение 1 минуты и инкубируют при комнатной температуре в течение 10 минут. Тепловую стабильность белка с и без лиганда измеряют от 45°C до 85°C со скоростью сканирования 0,05°С/сек. Полученные данные анализируют с применением программы Protein Thermal Shift™ Software (версия 1,1) с ДМСО контролем, применяемым в качестве ссылки. В таблице 2 ниже представлена дельте теплового плавления для соединений 1-129 в анализе теплового сдвига.
|
Анализ бактериального связывания
Целью анализа бактериального связывания (АБС) является определение ингибирующего действия селективных антагонистов FimH на связывании бактериального штамма LF82 с гликопротеином АБС-(Манноза)3.
Ниже представлен список материалов, применяемых для проведения АБС, описанного ниже.
LB бульон: поставщик: Gibco, #10855
D-ФРФБ: поставщик: Wisent, #311-425-CL
LB агаровые планшеты
96-луночный черный планшет (высокое связывание): поставщик: Costar, #3925
TopSealTM-A герметичные клеевые пленки; поставщик: PerkinElmer, #6005185
Карбонатно-бикарбонатный буфер pH 9,6 таблетки, поставщик: Medicago, #09-8922-24
Вода, поставщик: Gibco, #15230-162
Альбумин бычьей сыворотки (АБС): поставщик: Sigma, #A-7888
(Человеческий)3-АБС (α1-3, α1-6 Маннотриоза-АБС, 1 мг), V-Labs, #NGP1336, лот # HGDX37-169-1
Tween 20: поставщик: Sigma, #P9416
Система анализа люциферазы Bright-Glo: поставщик: Promega, #E2610
Штамм LF82/люцифераза: инвазивная способность штамма Escherichia coli, выделенного из подвздошной слизистой пациента с болезнью Крона. Boudeau J, Glasser AL, Masseret E, Joly B, Darfeuille-Michaud A, Infect Immun. 1999, 67(9), 4499-509
Растворы и буферы, применяемые для проведения АБС, описаны ниже.
0,04M карбонатный-бикарбонатный буфер (покрывающий буфер)
40 мкг/мл АБС-(человеческий)3: растворяют 1 мг (человеческого)3-АБС в 25 мл воды.
4000 мкг/мл АБС
40 мкг/мл АБС
1 мкг/мл АБС-(человеческий)3: 150 мкл 40 мкг/мл АБС-(человеческий)3 + 5,85 мл 40 мкг/мл АБС
0,5 мкг/мл АБС-(человеческий)3 в 0,02M карбонатно-бикарбонатном буфере.
20 мкг/мл АБС в 0,02M карбонатно-бикарбонатном буфере
Блокирующий буфер (2% АБС/D-ФРФБ): 1 г АБС в 50 мл D-ФРФБ
2X связывающий буфер (0,2% АБС/D-ФРФБ): 5 мл блокирующего буфера + 45 мл D-ФРФБ.
Промывочный буфер (D-ФРФБ/0,01% Tween 20): 10 мкл Tween 20 в 100 мл D-ФРФБ.
1X Bright-Glo люциферазный субстрат: разведение 1:1 системы для исследования люциферазы Bright-Glo с D-ФРФБ
Протокол эксперимента проведения АБС описан ниже.
Выдержанная в течение ночи культуру штамма LF82/люцифераза: в две пробирки Falcon 50 мл добавляют 20 мл LB+20 мкл 50 мг/мл Канамицина и инокулируют с петлей из глицеринового исходного раствора штамма LF82/Люциферазы. Инкубируют в течение ночи при 37°С без встряхивания.
Гликопротеиновое покрытие 96-луночных планшетов: добавляют 100 мкл/лунку 0,5-2 мкг/мл АБС-(человек)3. 20 мкг/мл АБС применяют в качестве контрольного фона. Герметично закрывают планшет герметизирующей клеевой пленкой и инкубируют в течение ночи при комнатной температуре. Промывают 96-луночный планшет три раза 150 мкл/лунку D-ФРФБ, добавляют 170 мкл/лунку блокирующего раствора и инкубируют 45 мин (минимум) при комнатной температуре.
Получение бактериальной суспензии: смешивают две пробирки с культурой (40 мл) и осуществляют 1:10 разведение в LB (900 мкл LB+100 мкл культуры. Измеряют оптическую плотность (ОП) бактериальных культур. OD1 ~5×108 клеток/мл. Центрифугируют LF82 культуру в течение 20 мин при 3500 об/мин при комнатной температуре. Повторно суспендируют бактериальную лепешку в D-ФРФБ и центрифугируют снова в течение 20 мин при 3500 об/мин. Повторно суспендируют бактериальную лепешку в D-ФРФБ с получением бактериальной концентрации 2×109 бактерий/мл. Разводят 1/10 в D-ФРФБ с получением конечной бактериальной концентрации 2×108 бактерий/мл (=107 бактерий/50 мкл). Проводят 1/10 серийные разведения в LB каждой бактериальной суспензии, помещают 10 мкл разведения на LB агаровые планшеты (конечные разведения 10-7) и инкубируют в течение ночи при 37°C и подсчитывают КОЕ для определения актуальной плотности бактерий в анализе.
Анализ бактериального связывания: добавляют 147 мкл 2X связывающего буфера в планшет с соединением (содержащий 3 мкл соединения). Затем проводят стадию блокирования (по крайней мере, 45 мин), промывают планшеты три раза 200 мкл/лунку D-ФРФБ. С помощью 100 мкл многоканального ручного пипеттора добавляют 50 мкл/лунку соединения, разведенного в 2X связывающем буфере. С помощью 100 мкл многоканального ручного пипеттора добавляют 50 мкл/лунку бактериальной суспензии. Перемешивают с медленной скоростью в течение 1 мин и инкубируют 40-75 мин при комнатной температуре. Промывают 5 раз 150 мкл/лунку промывочным буфером и затем один раз D-ФРФБ. Добавляют 100 мкл/лунку 1X Bright-Glo люциферазного субстрата. Считывают люминесценцию с помощью планшетного ридера Analyst HT или микробета планшетного ридера Trilux 1450. В таблице 3 ниже показаны данные IC50 для соединений 1-129 в анализе бактериального связывания.
|
Конкурентно-связывающий анализ
Первые 177 аминокислот белка FimH могут быть экспрессированы в виде слитого белка с тромбином в pET21b плазмиде в бактерии. Эта последовательность FimH белка содержит домен распознавания углеводорода (ДРУ) и должен оканчиваться FimH-ДРУ. После бактериальной экспрессии белка, белок FimH-ДРУ очищают до гомогенности и тромбиновый конец удаляют протеазным отщеплением. Конкурнетно-связывающий анализ с помощью флуоресцентной поляризации проводят с применением 5 нМ Alexa 647 маннозидной пробы и 60 нМ FimH-ДРУ. Образцы исследуют в малообъемном 384-луночном микротитровальном планшете в конечном объеме 20 мкл. Условия конечного буфера для исследований следующие: 50 мМ Трис-Cl, pН 7,0, 100 мМ NaCl, 1 мМ ЭДТК, 5 мМ β-меркаптоэтанола, 0,05% АБС и 2,5% ДМСО. TДва анализа проводят для FimH, названные анализ 1 или анализ 2. Условия анализа являются одинаковыми для обоих анализов за исключением следующего: анализ 1 включает соединения, полученные ручным разведением в факторе серийного разведения с 12-точечным дозозависимым эффектом, а анализ 2 включает соединения, полученное на роботизированной системе также через фактор серийного разведения (12-точечный дозозависимый эффект) и сначала получают дважды в 384-луночных полипропиленовых круглодонных планшетах Corning. Планшеты для анализа 2 содержат соединение, которое затем замораживают и оттаивают перед применением. Сначала в буфер для исследования добавляют пробу Alexa 647 и FimH-ДРУ, затем добавляют 0,5 мкл тестируемого соединения (анализ 1 или 2) от 0,4 нМ до 75 мкМ конечной концентрации (12 точечное титрование с 3-кратным серийным разведением). Контрольные лунки для пробы Alexa 647 готовят в тех же условиях за исключением добавления FimH-ДРУ белка. Планшеты затем инкубируют в течение 5 ч при комнатной температуре в темноте и во влажных условиях для предотвращения окрашивания. Планшеты считывают с помощью мультимодального планшетного ридера SpectraMax Paradigm и подходящего картриджа для определения флуоресцентной поляризации (Alexa-647).
Alexa 647 маннозидную пробу готовят с применением методики, описанной для FAM маннозида (Han, Z. et. al., 2010, J. Med. Chem., 53, 4779), которая описана на схеме ниже.

К голубому перемешиваемому раствору (2S,3S,4S,5S,6R)-2-(4-аминобутокси)-6-(гидроксиметил)тетрагидропиран-3,4,5-триола (2,21 мг, 0,009 ммоль) и (2E)-2-[(2E,4E)-5-[3,3-диметил-5-сульфонато-1-(3-сульфонатопропил)индол-1-ий-2-ил]пента-2,4-диенилиден]-3-[6-(2,5-диоксопирролидин-1-ил)окси-6-оксогексил]-3-метил-1-(3-сульфонатопропил)индолин-5-сульфоната (ион калия (3)) (4,9 мг, 0,0044 ммоль) в ДМФ (44 мкл) добавляют Et3N (5,4 мг, 7,0 мкл, 0,053 ммоль) при КТ. Раствор перемешивают при комнатной температуре в течение ночи, концентрируют, растворяют в воде и очищают на 12 г C-18 силикагелевом картридже на системе Isolera с применением ацетонитрила в воде (от 0 до 40%, 10 ОК) и затем лиофилизацией с получением Alexa 647 маннозидной пробы (3,3 мг, 34%) в виде темно-голубого твердого вещества.
Значения Kd соединений определяют из кривых доза-реакция с применением двенадцати концентраций для соединения дважды. Кривые строят по точкам данных с применением анализа конкурентного замещения Fluorescence Polarization, и Kds интерполируют из полученных кривых с применением программы GraphPad Prism, версия 50,4 (GraphPad software Inc., San Diego, CA, USA).
Анализ стабильности фекалий мыши
Анализ стабильности фекалий мыши может применяться для измерения стабильности антагонистов FimH в окружающей среде, которая имитирует кишечник. Образцы свежих мышиных фекалий от некоторого количества животных (по крайней мере, 4) гомогенизируют с 10 объемами (масс./об.) 100 мМ буфера на основе фосфата калия (pH 6,5) с применением устройства Stomacher. Смесь фекалий затем центрифугируют 5 мин при 2000 г и надосадочную жидкость собирают для инкубирования. Тестируемые соединения вводят в количестве 100 мкМ в надосадочную жидкость фекалий и инкубируют при 37°C вплоть до 6 часов. Ферментную реакцию останавливают добавлением 9 объемов ацетонитрила, содержащих 0,1% муравьиную кислоту и внутренний стандарт. Смесь центрифугируют и надосадочные жидкости анализируют HPЖХ-МС/МС для оценки процента оставшегося исходного продукта по сравнению с контрольным образцом. Соединения в соответствии с данным изобретением неожиданно и удивительно стабильны по сравнению с подобными соединениями, в которых маннозная группа не модифицирована (см. соединение A).
|
Анализ стабильности человеческих фекалий
Анализ стабильности человеческих фекалий может применяться для измерения стабильности антагонистов FimH в среде, которая имитирует кишечник. Образцы свежих человеческих фекалий от 3 доноров гомогенизируют с 10 объемами (масс./об.) 100 мМ буфера на основе фосфата калия (pH 6,5) с помощью устройства Stomacher. Смесь фекалий затем центрифугируют в течение 5 мин при 2000g и надосадочную жидкость собирают для инкубирований. Тестируемые соединения вводят в количестве 100 мкМ в надосадочную жидкость фекалий и инкубируют при 37°C вплоть до 24 часов. Ферментную реакцию останавливают добавлением 9 объемов ацетонитрила, содержащих 0,1% муравьиную кислоту и внутренний стандарт. Смесь центрифугируют и надосадочные жидкости анализируют HPЖХ-МС/МС для оценки процента оставшегося исходного продукта по сравнению с контрольным образцом. Соединения в соответствии с данным изобретением неожиданно и удивительно стабильны по сравнению с подобными соединениями, в которых маннозная группа не модифицирована (см. соединение A).
|
Исследование экскреции мышей после перорального дозирования антагониста FimH
Мышам дают 10 мг/кг перорально (10 мл/кг; 0,5% метоцел) антагонисты FimH и собирают мочу и фекалии на лед вплоть до 72 ч в клетках для экскреции. После сбора образцы фекалий разбавляют 10 объемами воды и гомогенизируют с применением устройства Stomacher. Смесь фекалий и мочи затем гасят ацетонитрилом, содержащим внутренний стандарт, центрифугируют и надосадочные жидкости затем разбавляют 1 объемом воды с последующим анализом HPЖХ-МС/МС в режиме SRM. Соединения в соответствии с данным изобретением неожиданно и удивительно стабильны по сравнению с подобными соединениями, в которых маннозная группа не модифицирована (см. соединение A).
|
Хотя здесь описано множество вариантов данного изобретения, очевидно, что основные примеры могут быть изменены с получением других вариантов, в которых применяются соединения, способы и процессы данного изобретения. Поэтому должно быть понятно, что объем данного изобретения определен формулой изобретения, а не конкретными вариантами, которые представлены в качестве примера.