Результат интеллектуальной деятельности: СПОСОБЫ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ПОЛУЧЕНИЯ СТЕРИЧЕСКИХ СОЕДИНЕНИЙ
Вид РИД
Изобретение
Настоящая заявка устанавливает приоритет заявки США № 60/782976, поданной 16 марта 2006 года, и заявки США № 60/844771, поданной 15 сентября 2006 года.
Область изобретения
Настоящее изобретение относится к способам и промежуточным соединениям для получения ингибиторов протеазы, в частности ингибиторов серинпротеазы.
Предпосылки изобретения
Инфекция вирусом гепатита C ("HCV") является насущной медицинской проблемой для человека. HCV признан как агент, являющийся причиной большинства случаев гепатита, отличного от гепатитов A и B, который, как было определено, присутствует в сыворотке у 3% людей во всем мире [A. Alberti et al., "Natural History of Hepatitis C", J. Hepatology, 31., (Suppl. 1), p. 17-24 (1999)]. Только в США может быть инфицировано около четырех миллионов человек [M.J. Alter et al., "The Epidemiology of Viral Hepatitis in the United States, Gastroenterol. Clin. North Am., 23, p. 437-455 (1994); M.J. Alter "Hepatitis C Virus Infection in the United States", J. Hepatology, 31 (Suppl. 1), p. 88-91 (1999)].
При первоначальном воздействии вируса HCV только у около 20% инфицированных субъектов развивается острый клинический гепатит, тогда как у других наблюдается спонтанное рассасывание инфекции. Однако почти в 70% случаев вирус приводит к хронической инфекции, которая сохраняется в течение десятилетий [S. Iwarson, "The Natural Course of Chronic Hepatitis", FEMS Microbiology Reviews, 14, p. 201-204 (1994); D. Lavanchy, "Global Surveillance and Control of Hepatitis C", J. Viral Hepatitis, 6, p. 35-47 (1999)]. Сохраняющаяся в течение долгого времени хроническая инфекция обычно приводит к рецидивам и прогрессивному осложнению воспаления печени, которое часто приводит к более тяжелым заболеваниям, таким как цирроз и гепатоцеллюлярная карцинома [M.C. Kew, "Hepatitis C and Hepatocellular Carcinoma", FEMS Microbiology Reviews, 14, p. 211-220 (1994); I. Saito et. al., "Hepatitis C Virus Infection is Associated with the Development of Hepatocellular Carcinoma", Proc. Natl. Acad. Sci. USA, 87, p. 6547-6549 (1990)]. К сожалению, в настоящее время не существует никаких в широком смысле эффективных методов лечения для ослабления развития хронического HCV.
Соединения, описанные как ингибиторы протеазы и, в частности, ингибиторы серинпротеазы, полезные для лечения HCV инфекций, раскрываются в WO 02/18369. Также в указанной заявке раскрыты способы и промежуточные соединения для получения таких соединений. Однако остается потребность в экономичных способах получения этих соединений.
Краткое описание изобретения
Настоящее изобретение относится к способам и промежуточным соединениям для получения альфа-амино бета-гидроксикислоты формулы 1
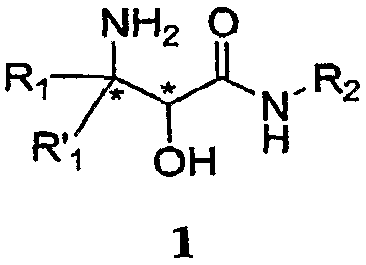
где переменные R1, R'1 и R2 определены ниже и соединение формулы 1 имеет энантиомерный избыток (эи) 55% или больше.
Способ включает стадии окисления ненасыщенного амида или сложного эфира с получением соответствующего эпоксида, образование альфа-гидрокси,бета-аминокислоты с использованием подходящего агента аминирования и разделение амида амино-спирта.
Способы и промежуточные соединения конкретно направлены на получение (2S,3S)-3-амино-N-циклопропил-2-гидроксигексанамида.
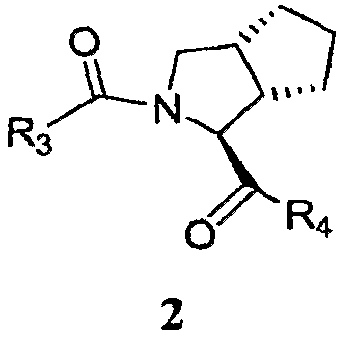
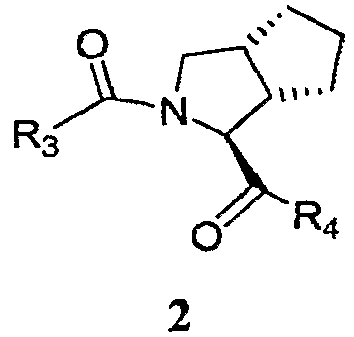
Эти способы и промежуточные соединения являются полезными для получения ингибитора протеазы формулы 2, где переменные R3 и R4 определены ниже.
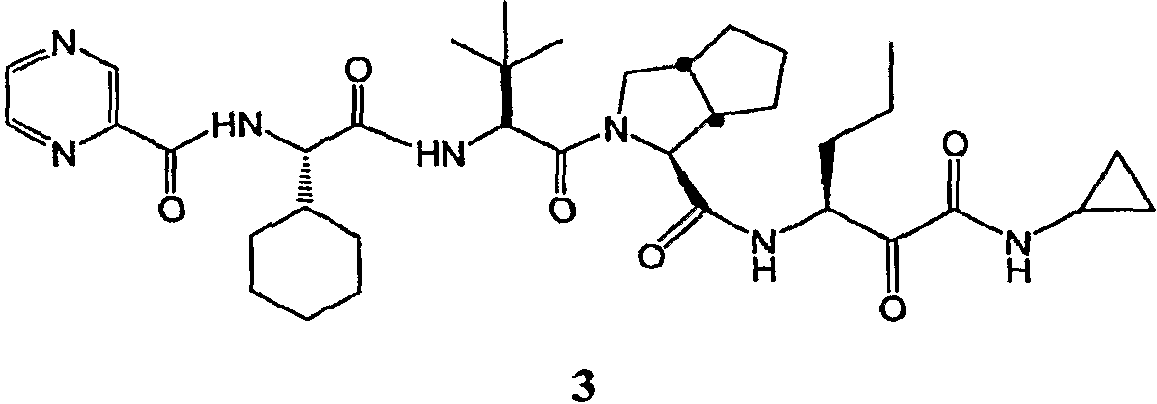
В одном аспекте настоящее изобретение раскрывает способы и промежуточные соединения, используемые для получения ингибитора серинпротеазы формулы 3.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Определения
Как это использовано в настоящем описании, термин "энантиомерный избыток (эи) 55% или больше" означает, что один энантиомер составляет 55% или больше по сравнению с другим в химическом веществе. Энантиомер может присутствовать как результат либо углеродного центра, с которым связана аминогруппа (представленный звездочкой) в формуле 1 (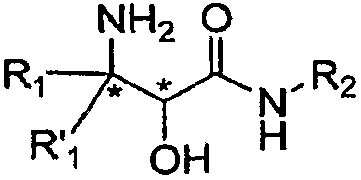 ), либо углеродного центра, с которым связана гидроксильная группа (также представлен звездочкой) в формуле 1, или обоих углеродных центров. Например, при нумерации от карбонильной группы соединения могут представлять собой (2S, 3S), (2S, 3R), (2R, 3R) или (2R, 3S) в этих двух углеродных центрах.
), либо углеродного центра, с которым связана гидроксильная группа (также представлен звездочкой) в формуле 1, или обоих углеродных центров. Например, при нумерации от карбонильной группы соединения могут представлять собой (2S, 3S), (2S, 3R), (2R, 3R) или (2R, 3S) в этих двух углеродных центрах.
Как это использовано в настоящем описании, "органические основания", которые можно использовать в способе по настоящему изобретению, включают третичные органические основания, которые включают, но не ограничиваются этим, триалкиламины, например диэтилизопропиламин, триэтиламин, N-метилморфолин и т.п., и гетероариламины, например пиридин, хинолин и т.п.
Как это использовано в настоящем описании, термин "алифатический" охватывает алкил, алкенил и алкинил.
Как это использовано в настоящем описании, "алкильная" группа относится к насыщенной алифатической углеводородной группе, содержащей 1-8 (например, 1-6 или 1-4) атомов углерода. Алкильная группа может быть линейной или разветвленной. Примеры алкильной группы включают, но не ограничиваются этим, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, н-пентил, н-гептил и 2-этилгексил. Алкильная группа необязательно может быть замещена одним или несколькими заместителями, такими как циклоалкил, гетероциклоалкил, арил, гетероарил, алкокси (две алкоксигруппы на одном атоме или смежных атомах могут образовывать кольцо вместе с атомом(атомами), с которым они связаны), ароил, гетероароил, алкоксикарбонил, алкилкарбонилокси, ацил, сульфонил (такой как алкилсульфонил или арилсульфонил), сульфинил (такой как алкилсульфинил), сульфанил (такой как алкилсульфанил), сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо, карбамоил, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероарилалкокси, амино, нитро, карбокси, циано, оксо, галоген, гидрокси, сульфо, меркапто, алкилсульфанил, алкилсульфинил, алкилсульфонил, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, циклоалкил-алкилкарбониламино, арилкарбониламино, аралкилкарбониламино, гетероциклоалкил-карбониламино, гетероциклоалкил-алкилкарбониламино, гетероарилкарбониламино или гетероаралкилкарбониламино.
Как это использовано в настоящем описании, "алкенильная" группа относится к алифатической углеродной группе, которая содержит 2-8 (например, 2-6 или 2-4) атомов углерода и, по меньшей мере, одну двойную связь. Подобно алкильной группе, алкенильная группа может быть линейной или разветвленной. Примеры алкенильной группы включают, но не ограничиваются этим, аллил, изопренил, 2-бутенил и 2-гексенил. Алкенильная группа необязательно может быть замещена одним или несколькими заместителями, такими как циклоалкил, гетероциклоалкил, арил, гетероарил, алкокси (две алкоксигруппы на одном атоме или смежных атомах могут образовывать кольцо вместе с атомом(атомами), с которым они связаны), ароил, гетероароил, алкоксикарбонил, алкилкарбонилокси, ацил, сульфонил (такой как алкилсульфонил или арилсульфонил), сульфинил (такой как алкилсульфинил), сульфанил (такой как алкилсульфанил), сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо, карбамоил, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероарилалкокси, амино, нитро, карбокси, циано, оксо, галоген, гидрокси, сульфо, меркапто, алкилсульфанил, алкилсульфинил, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, циклоалкил-алкилкарбониламино, арилкарбониламино, аралкилкарбониламино, гетероциклоалкил-карбониламино, гетероциклоалкил-алкилкарбониламино, гетероарилкарбониламино или гетероаралкилкарбониламино.
Как это использовано в настоящем описании, "алкинильная" группа относится к алифатической углеродной группе, которая содержит 2-8 (например, 2-6 или 2-4) атомов углерода и содержит, по меньшей мере, одну тройную связь. Алкинильная группа может быть линейной или разветвленной. Примеры алкинильной группы включают, но не ограничиваются этим, пропаргил и бутинил. Алкинильная группа необязательно может быть замещена одним или несколькими заместителями, такими как циклоалкил, гетероциклоалкил, арил, гетероарил, алкокси (две алкоксигруппы на одном атоме или смежных атомах могут образовывать кольцо вместе с атомом(атомами), с которым они связаны), ароил, гетероароил, алкоксикарбонил, алкилкарбонилокси, ацил, сульфонил (такой как алкилсульфонил или арилсульфонил), сульфинил (такой как алкилсульфинил), сульфанил (такой как алкилсульфанил), сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо, карбамоил, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероарилалкокси, амино, нитро, карбокси, циано, оксо, галоген, гидрокси, сульфо, меркапто, алкилсульфанил, алкилсульфинил, алкилсульфонил, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, циклоалкил-алкилкарбониламино, арилкарбониламино, аралкилкарбониламино, гетероциклоалкил-карбониламино, гетероциклоалкил-алкилкарбониламино, гетероарилкарбониламино или гетероаралкилкарбониламино.
Как это использовано в настоящем описании, "амино" группа относится к -NRxRy, где каждый из Rx и Ry независимо представляет собой водород, алкил, циклоалкил, (циклоалкил)алкил, арил, аралкил, гетероциклоалкил, (гетероциклоалкил)алкил, гетероарил или гетероаралкил, каждый из которых определен в настоящем описании и является необязательно замещенным. Когда термин "амино" не означает концевую группу (например, алкилкарбониламино), он представлен формулой -NRx-. Rx имеет значения, определенные выше.
Как это использовано в настоящем описании, "арильная" группа, используемая отдельно или как часть более крупной группы, как в "аралкиле", "аралкокси" или "арилоксиалкиле", относится к фенильной, нафтильной или бензоконденсированной группе, содержащей 2-3 кольца. Например, бензоконденсированная группа включает фенил, конденсированный с одной или двумя C4-8 карбоциклическими группами, например 1,2,3,4-тетрагидронафтил, инданил или флуоренил. Арил является необязательно замещенным одним или несколькими заместителями, такими как алкил (включая карбоксиалкил, гидроксиалкил и галогеналкил, такой как трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, амино, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкил)алкилкарбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкил)алкилкарбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидрокси, ацил, меркапто, сульфонил (такой как алкилсульфонил), сульфинил (такой как алкилсульфинил), сульфанил (такой как алкилсульфанил), сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
Как это использовано в настоящем описании, "аралкильная" группа относится к алкильной группе (например, C1-4 алкильной группе), которая замещена арильной группой. Оба "алкил" и "арил" определены выше. Примером аралкильной группы является бензил. "Гетероаралкильная" группа относится к алкильной группе, которая замещена гетероарилом. Как "алкил", так и "гетероарил" определены в настоящем описании. Как это использовано в настоящем описании, "циклоалифатическая" группа охватывает "циклоалкильную" группу и "циклоалкенильную" группу.
Как это использовано в настоящем описании, "циклоалкильная" группа относится к насыщенному карбоциклическому моно- или бициклическому (конденсированному или связанному мостиковой связью) кольцу из 3-10 (например, 5-10) атомов углерода. Примеры циклоалкильных групп включают циклопропил, циклопентил, циклогексил, циклогептил, адамантил, норборнил, кубил, октагидроинденил, декагидронафтил, бицикло[3.2.1]октил, бицикло[2.2.2]октил, бицикло[3.3.1]нонил и бицикло[3.3.2]децил и адамантил. "Циклоалкенильная" группа, как это использовано в настоящем описании, относится к неароматическому карбоциклическому кольцу из 3-10 (например, 4-8) атомов углерода, содержащему одну или несколько двойных связей. Примеры циклоалкенильных групп включают циклопентенил, 1,4-циклогексадиенил, циклогептенил, циклооктенил, гексагидроинденил, октагидронафтил, бицикло[2.2.2]октенил и бицикло[3.3.1]ноненил. Циклоалкильная или циклоалкенильная группа необязательно может быть замещена одним или несколькими заместителями, такими как алкил (включая карбоксиалкил, гидроксиалкил и галогеналкил, такой как трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, амино, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкил)алкилкарбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкил)алкилкарбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидрокси, ацил, меркапто, сульфонил (такой как алкилсульфонил или арилсульфонил), сульфинил (такой как алкилсульфинил), сульфанил (такой как алкилсульфанил), сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
Как это использовано в настоящем описании, термин "гетероциклоалифатический" охватывает гетероциклоалкильную группу и гетероциклоалкенильную группу.
Как это использовано в настоящем описании, "гетероциклоалкильная" группа относится к 3-10-членной моно- или бициклической (конденсированной или связанной мостиковой связью) (например, 5-10-членной моно- или бициклической) насыщенной кольцевой структуре, в которой один или несколько кольцевых атомов представляют собой гетероатом, например N, O или S. Примеры гетероциклоалкильной группы включают пиперидинил, пиперазинил, тетрагидропиранил, тетрагидрофурил, диоксоланил, оксазолидинил, изооксазолидинил, морфолинил, октагидробензофурил, октагидрохроменил, октагидротиохроменил, октагидроиндолил, октагидропириндинил, декагидрохинолинил, октагидробензо[b]тиофенеил, 2-оксабицикло[2.2.2]октил, 1-азабицикло[2.2.2]октил, 3-азабицикло[3.2.1]октил и 2,6-диоксатрицикло[3.3.1.03,7]нонил. Моноциклическая гетероциклоалкильная группа может быть конденсированной с фенильной группой, такой как тетрагидроизохинолин. "Гетероциклоалкенильная" группа, как это использовано в настоящем описании, относится к моно- или бициклической (например, 5-10-членной моно- или бициклической) неароматической кольцевой структуре, содержащей одну или несколько двойных связей и в которой один или несколько кольцевых атомов представляют собой гетероатом, например N, O или S. Гетероциклоалкильная или гетероциклоалкенильная группа необязательно может быть замещена одним или несколькими заместителями, такими как алкил (включая карбоксиалкил, гидроксиалкил и галогеналкил, такой как трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил (такой как бензимидазолидинил), (гетероциклоалкил)алкил, арил, гетероарил, алкокси (две алкоксигруппы на одном и том же атоме или на смежных атомах могут образовывать кольцо вместе с атомом(атомами), с которым они связаны), циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, амино, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкил)алкилкарбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкил)алкилкарбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидрокси, ацил, меркапто, сульфонил (такой как алкилсульфонил или арилсульфонил), сульфинил (такой как алкилсульфинил), сульфанил (такой как алкилсульфанил), сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил.
"Гетероарильная" группа, как это использовано в настоящем описании, относится к моноциклической, бициклической или трициклической кольцевой структуре, содержащей 4-15 кольцевых атомов, где один или несколько кольцевых атомов представляют собой гетероатом, например N, O или S, и где одно или несколько колец в бициклической или трициклической кольцевой структуре являются ароматическими. Гетероарильная группа включает бензоконденсированную кольцевую систему, содержащую 2-3 кольца. Например, бензоконденсированная группа включает фенил, конденсированный с одной или двумя C4-8 гетероциклическими группами, например индолинил и тетрагидрохинолинил. Некоторые примеры гетероарила включают азетидинил, пиридил, фурил, пирролил, тиенил, тиазолил, оксазолил, имидазолил, индолил, тетразолил, бензофурил, изохинолинил, бензтиазолил, ксантен, тиоксантен, фенотиазин, дигидроиндол и бензо[1,3]диоксол. Гетероарил необязательно замещен одним или несколькими заместителями, такими как алкил (включая карбоксиалкил, гидроксиалкил и галогеналкил, такой как трифторметил), алкенил, алкинил, циклоалкил, (циклоалкил)алкил, гетероциклоалкил, (гетероциклоалкил)алкил, арил, гетероарил, алкокси, циклоалкилокси, гетероциклоалкилокси, арилокси, гетероарилокси, аралкилокси, гетероаралкилокси, ароил, гетероароил, амино, нитро, карбокси, алкоксикарбонил, алкилкарбонилокси, аминокарбонил, алкилкарбониламино, циклоалкилкарбониламино, (циклоалкил)алкилкарбониламино, арилкарбониламино, аралкилкарбониламино, (гетероциклоалкил)карбониламино, (гетероциклоалкил)алкилкарбониламино, гетероарилкарбониламино, гетероаралкилкарбониламино, циано, галоген, гидрокси, ацил, меркапто, сульфонил (такой как алкилсульфонил или арилсульфонил), сульфинил (такой как алкилсульфинил), сульфанил (такой как алкилсульфанил), сульфокси, мочевина, тиомочевина, сульфамоил, сульфамид, оксо или карбамоил. "Гетероаралкильная" группа, как это использовано в настоящем описании, относится к алкильной группе (например, C1-4 алкильной группе), которая замещена гетероарильной группой. Как "алкил", так и "гетероарил" определены выше.
Как это использовано в настоящем описании, "циклическая группа" включает циклоалкил, гетероциклоалкил, циклоалкенил, гетероциклоалкенил, арил или гетероарил, каждый из которых определен выше.
Как это использовано в настоящем описании, "ацильная" группа относится к формильной группе или группе алкил-C(=O)-, где "алкил" определен выше. Ацетил и пивалоил являются примерами ацильных групп.
Как это использовано в настоящем описании, "карбамоильная" группа относится к группе, имеющей структуру -O-CO-NRxRy или -NRx-CO-O-Rz, где Rx и Ry определены выше, и Rz может представлять собой алкил, арил, аралкил, гетероциклоалкил, гетероарил или гетероаралкил.
Как это использовано в настоящем описании, "карбокси" и "сульфо" группа относятся к -COOH или -COORx и -SO3H или -SO3Rx соответственно.
Как это использовано в настоящем описании, "алкокси" группа относится к группе алкил-O-, где "алкил" определен выше.
Как это использовано в настоящем описании, "сульфокси" группа относится к -Q-SO-Rx или -SO-O-Rx, где Rx определен выше.
Как это использовано в настоящем описании, "сульфонильная" группа относится к -S(O)2-Rx, где Rx определен выше.
Как это использовано в настоящем описании "сульфинильная" группа относится к -S(O)-Rx, где Rx определен выше.
Как это использовано в настоящем описании "сульфанильная" группа относится к -S-Rx, где Rx определен выше.
Как это использовано в настоящем описании, группа "галоген" или "гало" относится к фтору, хлору, брому или йоду.
Как это использовано в настоящем описании, "галогеналифатическая" группа относится к алифатической группе, замещенной 1-3 атомами галогена. Например, термин галогеналкил включает группу -CF3.
Как это использовано в настоящем описании, "сульфамоильная" группа относится к структуре -S(O)2-NRxRy или -NRx-S(O)2-Rz, где Rx, Ry и Rz определены выше.
Как это использовано в настоящем описании, "сульфамидная" группа относится к структуре -NRx-S(O)2-NRyRz, где Rx, Ry и Rz определены выше.
Как это использовано в настоящем описании, "карбониламино" группа, используемая отдельно или в сочетании с другой группой, относится к амидогруппе, такой как -C(O)-NRx-, -NRx-C(O)- и -C(O)-N(Rx)2. Например, алкилкарбониламино включает алкил-C(O)-NRx- и алкил-NRx-C(O)-.
Как это использовано в настоящем описании, группа "мочевины" относится к структуре -NRx-CO-NRyRz, а группа "тиомочевины" относится к структуре -NRx-CS-NRyRz. Rx, Ry и Rz определены выше.
Фраза "необязательно замещенный" используется взаимозаменяемо с фразой "замещенный или незамещенный." Как описано в настоящей заявке, соединения по настоящему изобретению необязательно могут быть замещены одним или несколькими заместителями, такими как в общем виде проиллюстрированные выше или представленные на примере конкретных классов, подклассов и видов по настоящему изобретению. Как описано в настоящей заявке, переменные охватывают конкретные группы, такие как алкил и арил. Если не указано иное, каждая из конкретных групп для переменных необязательно может быть замещена одним или несколькими заместителями, описанными в настоящей заявке. Каждый заместитель конкретной группы необязательно дополнительно замещен одним-тремя заместителями, выбранными из галогена, циано, алкокси, гидроксила, нитро, галогеналкила и алкила. Например, алкильная группа может быть замещена алкилсульфанилом, и алкилсульфанил необязательно может быть замещен одним-тремя заместителями, выбранными из галогена, циано, алкокси, гидроксила, нитро, галогеналкила и алкила. В качестве дополнительного примера циклоалкильная часть (циклоалкил)карбониламино необязательно может быть замещена одним-тремя заместителями, выбранными из галогена, циано, алкокси, гидроксила, нитро, галогеналкила и алкила.
Как правило, термин "замещенный" независимо от того, присутствует ли перед ним термин "необязательно" или нет, относится к замещению водородных радикалов в данной структуре радикалом указанного заместителя. Конкретные заместители описаны выше в определениях и ниже в описании соединений и их примерах. Если не указано иное, необязательно замещенная группа может содержать заместитель в каждом положении группы, которое может быть замещено, и когда в какой-либо определенной структуре более одного положения могут быть замещены больше чем одним заместителем, выбранным из указанной группы, такие заместители могут быть либо одинаковыми, либо отличными друг от друга в каждом положении. Кольцевой заместитель, такой как гетероциклоалкил, может быть связан с другим кольцом, таким как циклоалкил, с образованием спиро-бициклической кольцевой системы, например оба кольца содержат один общий для этих колец атом. Как должно быть понятно специалистам в данной области, комбинации заместителей, предусматриваемые настоящим изобретением, представляют собой такие комбинации, которые обеспечивают образование стабильных или химически достижимых соединений.
Фраза "стабильный или химически достижимый", как это использовано в настоящем описании, относится к соединениям, которые, по существу, не изменяются, будучи подверженными условиям, которые делают возможным их получение, определение и предпочтительно их выделение, очистку и применение по одному или более назначениям, которые раскрываются в настоящей заявке. В некоторых вариантах воплощения стабильное соединение или химически достижимое соединение представляет собой соединение, которое, по существу, не изменяется, когда его выдерживают при температуре 40°C или ниже, в отсутствие влаги или в других химически реактивных условиях, по меньшей мере, в течение недели.
Как это использовано в настоящем описании, термин "бициклическая конденсированная кольцевая система" или "бициклическая кольцевая система" относится к двум кольцам, у которых два атома являются общими для этих колец. Любое кольцо может быть насыщенным, частично ненасыщенным или ароматическим. Каждое кольцо также может содержать 1-3 гетероатома.
Как это использовано в настоящем описании, термин "трициклическая конденсированная кольцевая система" или "трициклическая кольцевая система" относится к бициклической кольцевой системе, в которой третье кольцо является конденсированным с бициклической кольцевой системой таким образом, что третье кольцо имеет, по меньшей мере, общих два атома с бициклической кольцевой системой. В некоторых вариантах воплощения все три кольца имеют, по меньшей мере, один общий атом. Любое из колец в трициклической кольцевой системе может быть насыщенным, частично ненасыщенным или ароматическим. Каждое из колец может включать 1-3 гетероатома.
В некоторых вариантах воплощения алифатические группы, алкильные группы, арильные группы, гетероциклические группы, карбоциклические группы и бициклические или трициклические кольцевые системы содержат один или несколько заместителей. Заместители выбирают из тех, которые являются стабильными в реакционных условиях способа по настоящему изобретению, как это должно быть известно специалистам в данной области. Примеры заместителей включают галоген, -Q1, -OQ1, -OH, защищенный OH (такой как ацилокси), фенил (Ph), замещенный Ph, -OPh, замещенный -OPh, -NO2, -CN, -NHQ1, -N(Q1)2, -NHCOQ1, -NHCONHQ1, -NQ1CONHQ1, -NHCON(Q1)2, -NQ1CON(Q1)2, -NQ1COQ1, -NHCO2Q1, -NQ1CO2Q1, -CO2Q1, -COQ1, -CONHQ1, -CON(Q1)2, -S(O)2Q1, -SONH2, -S(O)Q1, -SO2NHQ1, -SO2N(Q1)2, -NHS(O)2Q1, -NQ1S(O)2Q1, =O, =S, =NNHQ1, =NN(Q1)2, =N-OQ1, =NNHCOQ1, =NNQ1СOQ1, =NNНСO2Q1, =NNQ1СO2Q1, =NNНSO2Q1, =NNQ1SO2Q1 или =NQ1, где Q1 представляет собой необязательно замещенную алифатическую группу, арильную или аралкильную группу.
Как это использовано в настоящем описании, атомы азота в гетероциклическом кольце необязательно могут быть замещены. Подходящие заместители по атому азота включают Q2, COQ2, S(O)2Q2 и CO2Q2, где Q2 представляет собой алифатическую группу или замещенную алифатическую группу.
Если не указано иное, структуры, представленные в настоящей заявке, также включают все стереохимические формы этих структур; т.е. R- и S-конфигурации для каждого асимметрического центра. Поэтому отдельные стереохимические изомеры, а также энантиомерные и диастереомерные смеси соединений по настоящему изобретению включены в объем настоящего изобретения.
Термин "по существу чистый" относится к стереохимической чистоте соединения, которая больше 90%. В некоторых вариантах воплощения стереохимическая чистота соединения больше 95%. В других вариантах воплощения стереохимическая чистота соединения составляет 99% или больше.
Термин "селективная кристаллизация" означает кристаллизацию по существу чистого изомера из растворителя, содержащего смесь изомеров.
Термин "динамическая кристаллизация" означает кристаллизацию по существу чистого изомера из растворителя, содержащего смесь изомеров, в условиях, которые вызывают изомеризацию смеси изомеров с получением изомера, который селективно кристаллизуется. Например, в случае разделения энантиомеров изомеризация более растворимого энантиомера до менее растворимого изомера в результате приводит к кристаллизации менее растворимого изомера, поскольку равновесие между изомерами регулируется кристаллизацией в сторону менее растворимого энантиомера. Конкретный пример динамической кристаллизации может включать эпимеризацию аномерного углерода в растворителе в условиях, в которых происходит селективная кристаллизация одного, по существу, чистого энантиомера.
Если не указано иное, структуры, представленные в настоящей заявке, также включают соединения, которые различаются только присутствием одного или нескольких изотопно обогащенных атомов.
Различные "защитные группы", "блокирующие группы" или "амин-блокирующие группы" можно использовать в способах по настоящему изобретению. Примеры амин-блокирующих групп или защитных групп включают, но не ограничиваются этим, -Q7, -C(O)Q7, -C(O)OQ7, -SOQ7, -SO2Q7, -SO3Q7, -SO2N(Q7)2, -C(O)C(O)Q7, -C(O)C(O)OQ7, -C(O)CH2C(O)Q7, -C(O)N(Q7)2, -(CH2)0-2NHC(O)Q7, -C(=NH)N(Q7)2, -C(O)N(OQ7)Q7, -C(=NOQ7)Q7, -P(O)(Q7)2 и -P(O)(OQ7)2; где Q7 представляет собой водород, необязательно замещенную алифатическую группу, необязательно замещенную арильную группу или необязательно замещенную гетероциклическую группу. Предпочтительно, Q7 представляет собой C1-12 алифатическую группу, C3-10 циклоалифатическую группу, (C3-10 циклоалифатическая группа)-C1-12 алифатическую группу, C6-10 арил, (C6-10 арил)-(C1-12 алифатическая группа)-, C3-10 гетероциклил, (C6-10 гетероциклил)-C1-12 алифатическую группу, C5-10 гетероарил или (C5-10 гетероарил)-(C1-12 алифатическя группа)-.
Как это использовано в настоящем описании, термин "кислота Льюиса" относится к группе, способной к обобществлению или акцептированию электронной пары. Примеры кислот Льюиса включают, но не ограничиваются этим, BF3-этераты и галогениды металлов, алкоксиды и смешанные галогениды/алкоксиды (например, Al(O-алкил)2Cl, Al(O-алкил)Cl2). Металлы могут представлять собой алюминий, титан, цирконий, магний, медь, цинк, железо, олово, бор, иттрий, лантан и самарий.
EDCI представляет собой 1-(3-диметиламинопропил)-3-этилкарбодиимид. HOBt представляет собой 1-гидроксибензотриазол. HOSuc представляет собой N-гидроксисукцинимид. ТГФ представляет собой тетрагидрофуран. TFA представляет собой трифторуксусную кислоту. DCM представляет собой дихлорметан. DMAP представляет собой 4-диметиламинопиридин. DIPEA представляет собой диизопропилэтиламин. DMF (ДМФА) представляет собой диметилформамид. TFA представляет собой трифторуксусную кислоту. CBZ представляет собой бензилоксикарбонил. 1H-ЯМР представляет собой протонный ядерный магнитный резонанс. ТСХ представляет собой тонкослойную хроматографию. TEMPO представляет собой свободный радикал 2,2,6,6-тетраметилпиперидинилокси.
II. Способы и промежуточные соединения
В основном, настоящее изобретение относится к способам и промежуточным соединениям, используемым для получения пространственно-специфических соединений.
Конкретно, способы и промежуточные соединения, описанные в настоящей заявке, являются полезными для получения ингибитора HCV протеазы формулы 2.
где
R3 представляет собой RW- или P4-L3-P3-L2-P2-;
R4 представляет собой -NH-CR1R'1-CH(OH)C(O)-NHR2;
каждый W независимо представляет собой связь, -NR4, -O- или -S-;
каждый из P2, P3 и P4 независимо представляет собой связь, H, необязательно замещенную алифатическую группу, необязательно замещенную гетероалифатическую группу, необязательно замещенный арил, необязательно замещенный гетероарил, необязательно замещенный алкокси, необязательно замещенный алкилсульфанил, необязательно замещенный аралкокси, необязательно замещенный аралкилсульфанил, необязательно замещенный моно- или диалкиламино, необязательно замещенный моно- или диариламино или необязательно замещенный моно- или дигетероариламино, при условии, что
когда L2 отсутствует и P3 представляет собой H, тогда L3 и P4 отсутствуют;
когда P2 не является концевой группой, тогда P2 связан с сердцевинной структурой формулы 3 и P2 также связан с L2, если эта группа присутствует, или с P3, если L2 отсутствует;
когда P3 не является концевой группой, тогда P3 связан с L2, если эта группа присутствует, или с P2, если L2 отсутствует, и P3 также связан с L3, если эта группа присутствует, или с P4, если L3 отсутствует;
каждый L2 или L3 независимо представляет собой связь, -C(O)- или -SO2-;
каждый R1 и R'1 независимо представляет собой H, необязательно замещенную алифатическую группу, необязательно замещенный арил, необязательно замещенный аралкил, необязательно замещенную гетероалифатическую группу или необязательно замещенный гетероаралкил, или каждый R1 и R'1 вместе с атомом, с которым они связаны, могут образовывать 3-7-членное необязательно замещенное циклоалифатическое кольцо.
В некоторых вариантах воплощения R3 представляет собой P2-, который представлен структурой:
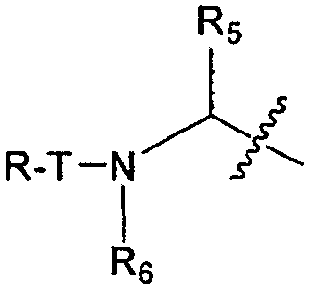
где
каждый T независимо представляет собой связь, H, -C(O)-, -O-C(O)-, -NHC(O)-, -C(O)C(O)- или -SO2-;
каждый R независимо представляет собой H, необязательно замещенную алифатическую группу, необязательно замещенную гетероалифатическую группу, необязательно замещенную циклоалифатическую группу, необязательно замещенную гетероциклическую группу, необязательно замещенный аралкил, необязательно замещенный гетероаралкил, необязательно замещенный арил или необязательно замещенный гетероарил; и
каждый R5 и R6 независимо представляет собой H, необязательно замещенную алифатическую группу, необязательно замещенную гетероалифатическую группу, необязательно замещенный гетероарил, необязательно замещенный фенил, необязательно замещенный аралкил или необязательно замещенный гетероарилалкил, или
R5 и смежный с ним R6, взятые вместе с атомами, с которыми они связаны, образуют 5-7-членный, необязательно замещенный моноциклический гетероцикл или 6-12-членный, необязательно замещенный бициклический гетероцикл, в котором каждое гетероциклическое кольцо необязательно содержит дополнительный гетероатом, выбранный из -O-, -S- или -NR4-; и каждый R7 независимо представляет собой H, необязательно замещенную алифатическую группу, необязательно замещенную гетероалифатическую группу, необязательно замещенный гетероарил или необязательно замещенный фенил.
В некоторых вариантах воплощения R1 представляет собой P3-L2-P2, который представлен структурой:
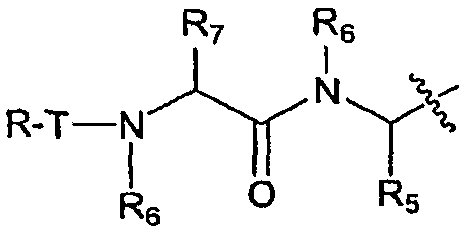
В некоторых вариантах воплощения R3 представляет собой P4-L3-P3-L2-P2, который представлен структурой:
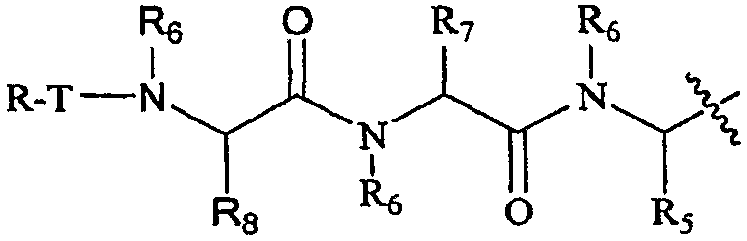
где
каждый T независимо представляет собой связь, H, -C(O)-, -O-C(O)-, -NHC(O)-, -C(O)C(O)- или -SO2-;
каждый R независимо представляет собой H, необязательно замещенную алифатическую группу, необязательно замещенную гетероалифатическую группу, необязательно замещенную циклоалифатическую группу, необязательно замещенную гетероциклическую группу, необязательно замещенный аралкил, необязательно замещенный гетероаралкил, необязательно замещенный арил или необязательно замещенный гетероарил;
каждый R5, R6, R7 и R8 независимо представляет собой H, необязательно замещенную алифатическую группу, необязательно замещенную гетероалифатическую группу, необязательно замещенный гетероарил, необязательно замещенный фенил, необязательно замещенный аралкил или необязательно замещенный гетероарилалкил, или
R5 и смежный с ним R6, взятые вместе с атомами, с которыми они связаны, образуют 5-7-членный, необязательно замещенный моноциклический гетероцикл или 6-12-членный, необязательно замещенный бициклический гетероцикл, в котором каждое гетероциклическое кольцо необязательно содержит дополнительный гетероатом, выбранный из -O-, -S- или -NR4-; и каждый R7 независимо представляет собой H, необязательно замещенную алифатическую группу, необязательно замещенную гетероалифатическую группу, необязательно замещенный гетероарил или необязательно замещенный фенил;
R7 и смежный с ним R6, взятые вместе с атомами, с которыми они связаны, могут образовывать 5-7-членный, необязательно замещенный моноциклический гетероцикл, 5-7-членный, необязательно замещенный моноциклический арил, 6-12-членный, необязательно замещенный бициклический гетероцикл или 6-12-членный, необязательно замещенный бициклический арил, где каждое гетероциклическое или арильное кольцо необязательно содержит дополнительный гетероатом, выбранный из -O-, -S- или -NR4-;
R8 и смежный с ним R6, взятые вместе с атомами, с которыми они связаны, образуют 5-7-членный, необязательно замещенный моноциклический гетероцикл, 5-7-членный, необязательно замещенный моноциклический гетероарил, 6-12-членный, необязательно замещенный бициклический гетероцикл или 6-12-членный, необязательно замещенный бициклический гетероарил, где каждое гетероциклическое или гетероарильное кольцо необязательно содержит дополнительный гетероатом, выбранный из -O-, -S- или -NR4-;
R8 и R, взятые вместе с атомами, с которыми они связаны, образуют 5-7-членный, необязательно замещенный моноциклический гетероцикл, 5-7-членный, необязательно замещенный моноциклический арил, 6-12-членный, необязательно замещенный бициклический гетероцикл или 6-12-членный, необязательно замещенный бициклический арил, где каждое гетероциклическое или арильное кольцо необязательно содержит дополнительный гетероатом, выбранный из -O-, -S- или -NR4-;
когда R5 и R6 вместе с атомами, с которыми они связаны, образуют кольцо, R7 и кольцевая система, образованная R5 и R6, могут образовывать 8-14-членную, необязательно замещенную бициклическую конденсированную кольцевую систему, где такая бициклическая конденсированная кольцевая система необязательно является также конденсированной с необязательно замещенным фенилом с получением необязательно замещенной 10-16-членной трициклической конденсированной кольцевой системы.
Примером ингибиторов HCV протеаз формулы 2 является соединение формулы 3, представленное ниже.
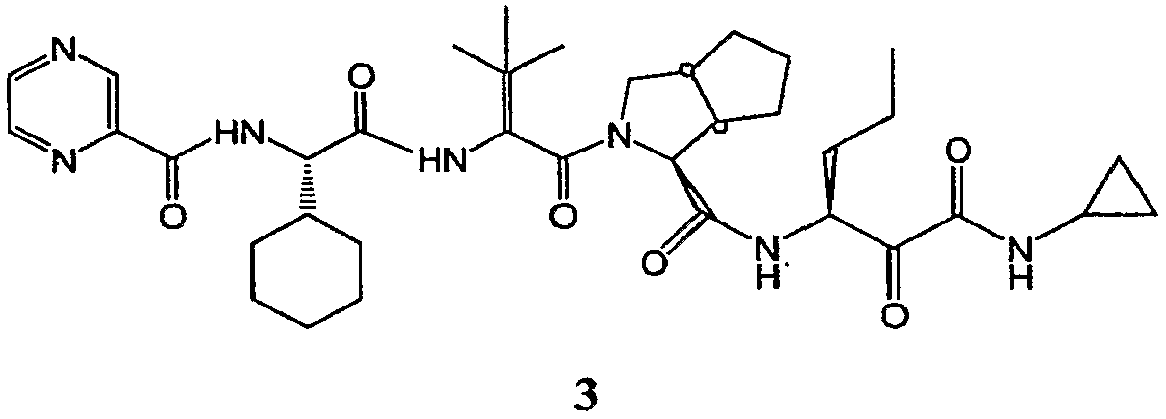
В одном аспекте настоящее изобретение обеспечивает способы и промежуточные соединения для получения α-гидрокси-β-аминокислотного производного формулы 1, которое является полезным для получения ингибиторов протеазы:
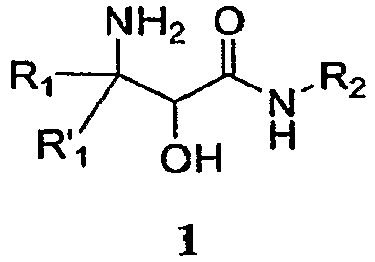
где R1 и R'1, каждый независимо, представляет собой H, необязательно замещенную алифатическую группу, необязательно замещенную циклоалифатическую группу, необязательно замещенную арилалифатическую группу, необязательно замещенную гетероалифатическую группу или необязательно замещенную гетероарилалифатическую группу, и R2 представляет собой H, необязательно замещенную алифатическую группу, необязательно замещенную циклоалифатическую группу, необязательно замещенную арилалифатическую группу, необязательно замещенную гетероалифатическую группу или необязательно замещенную гетероарилалифатическую группу, и амид аминоспирта формулы 1 имеет энантиомерный избыток (эи) больше 55% (определение эи см., например, в Jerry March, Advanced Organic Chemistry, John Wiley and Sons, Inc., 1992, p. 125).
В одном варианте воплощения настоящее изобретение обеспечивает способ и промежуточные соединения для получения соединения формулы 1, как в общем виде показано на схеме 1.
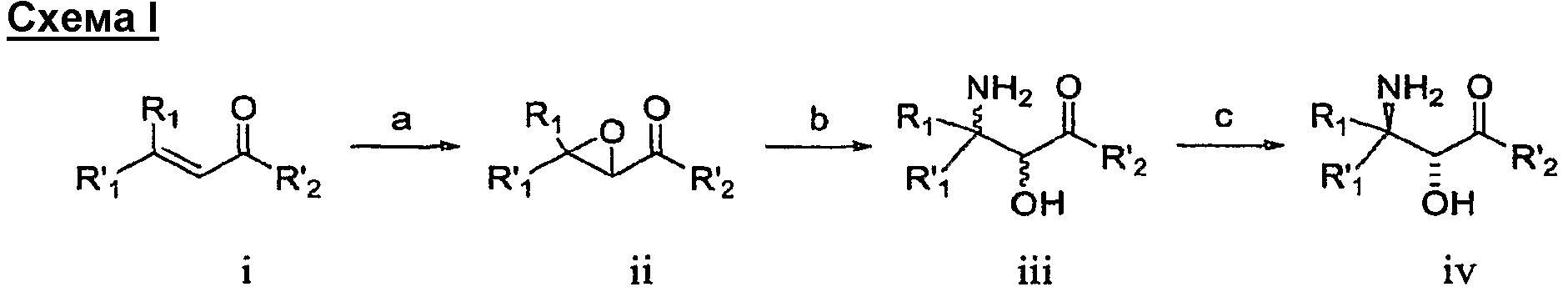
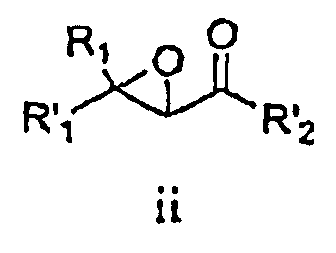
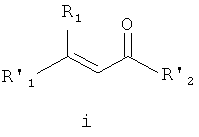
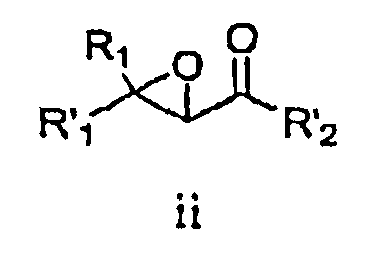
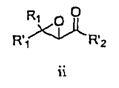
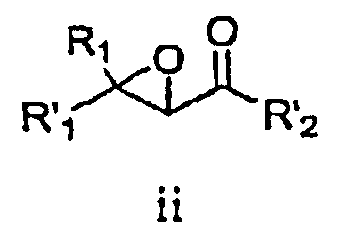
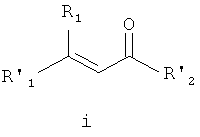
В соответствии со схемой I R1 и R'1 имеют значения, указанные выше; R'2 представляет собой -NHR2 или -OE, где R2 имеет значения, указанные выше, и E представляет собой C1-C5 алкил или необязательно замещенный бензил. Ненасыщенное соединение i преобразовывают в эпоксид ii (стадия a) с использованием известных способов, например окисление перкислотой, такой как, например, мета-хлорпербензойная кислота или перуксусная кислота (см., например, R. S. Porto, M. L. A. A. Vasconcellos, E. Ventura, F. Coelho, Synthesis, 2005, 2297-2306), пероксидом водорода (см., например, Dorothee Felix, Claude Wintner and A. Eschenmoser, Organic Synthesis, Collective Volume 6, p. 679), пероксидом мочевины-водорода (также называемым гидропероксидом мочевины) в присутствии трифторуксусного ангидрида, Oxone® (KHSO5, пероксомоносульфат калия) или органическим пероксидом, таким как, например, трет-бутилгидропероксид. Альтернативно, эпоксид ii можно получить путем конденсации с использованием глицидилового сложного эфира (см., например, M. Ballester, Chem. Revs. 55, 283-300 (1955); D. M. Burness, Organic Synthesis, Collective Volume 4, p. 649).
В некоторых вариантах воплощения эпоксидирование может быть осуществлено с получением оптически обогащенных эпоксидов (см., например, H. Kakei, R. Tsuji, T. Ohshima, M. Shibasaki, J. Am. Chem. Soc, 2005, 127, 8962-8963; M. Marigo, J. Franzen, T. B. Poulsen, W. Zhuang, K. A. Jorgensen, J. Am. Chem. Soc, 2005, 127, 6284-6289; M.Shibisaki et.al., U.S. Pat. № 6,833,442 (BINOL Ars complex); R. Kino, K. Daikai, T. Kawanami, H. Furuno, J. Inanaga, Org. Biomol. Chem., 2004, 2, 1822-1824; Y. Shi, U.S. Pat. № 6,348,608 (ОXОNE, EDTA, optically active ketone)).
Стадию эпоксидирования можно осуществить, используя либо сложный эфир (R'2=-OE), либо амид (R'2=-NHR2). Когда стадию эпоксидирования осуществляют, используя сложный эфир, этот сложный эфир затем преобразуют в амид. Настоящим изобретением предусматривается, что образование амида можно осуществлять на любой стадии способа с использованием известных способов и защитных групп, где это является подходящим.
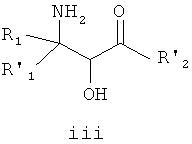
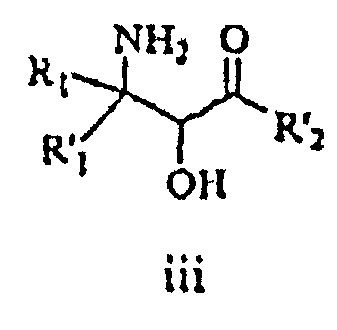
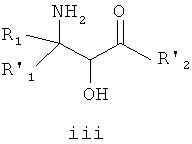
Взаимодействие эпоксида ii с подходящим агентом аминирования (стадия b) дает аминоспирт 3. Подходящие агенты аминирования представляют собой такие, которые могут быть преобразованы в аминосоединение iii. Примеры подходящих агентов аминирования включают азид, фталимид и необязательно замещенный бензиламин.
На стадии c смесь аминоспиртов формулы iii разделяют с получением оптически активного соединения формулы iv. Подходящие способы для разделения смеси iii включают, например, образование соли с подходящей оптически активной органической кислотой.
Подходящие оптически активные органические кислоты включают, но не ограничиваются этим, винную кислоту, яблочную кислоту, диизопропилиденгулоновую кислоту и дезоксихолевую кислоту.
В одном варианте воплощения R'2 формулы i представляет собой -NHR2.
В одном варианте воплощения эпоксидирование соединения i осуществляют с использованием трет-бутилгидропероксида в присутствии основания, такого как, например, гидроксид натрия или бутиллитий.
В другом варианте воплощения эпоксидирование осуществляют с использованием моноперсульфата калия, этилендиаминтетрауксусной кислоты и необязательно оптически активного кетона.
В одном варианте воплощения аминоспирт формулы iii имеет транс-конфигурацию.
В одном варианте воплощения соединение формулы iv имеет 2-(S)-, 3(S)-конфигурацию.
В одном варианте воплощения aминирование соединения ii с получением аминоспирта iii осуществляют путем взаимодействия соединения ii с азидом натрия с последующим восстановлением промежуточного азидного соединения при помощи водорода в присутствии катализатора палладия на углероде.
В другом варианте воплощения разделение iii до iv осуществляют путем образования соли с оптически активной кислотой и кристаллизации полученной таким образом соли.
В другом варианте воплощения оптически активная органическая кислота представляет собой винную кислоту.
В следующем варианте воплощения оптически активная органическая кислота представляет собой дезоксихолевую кислоту.
В одном варианте воплощения R1 представляет собой C1-C6 алкил и R'1 представляет собой H.
В другом варианте воплощения R2 представляет собой C1-C6 алкил или C1-C6 циклоалкил.
В другом варианте воплощения R2 представляет собой циклопропил.
В другом варианте воплощения аминогидроксисоединения формулы iii можно получить в соответствии со способами, описанными в патентах США № 6020518, 6087530 и 6639094, каждый из которых включен в настоящую заявку во всей его полноте посредством ссылки.
В другом варианте воплощения, как показано на схеме II, настоящее изобретение обеспечивает способ и промежуточные соединения для получения соединения формулы 3.
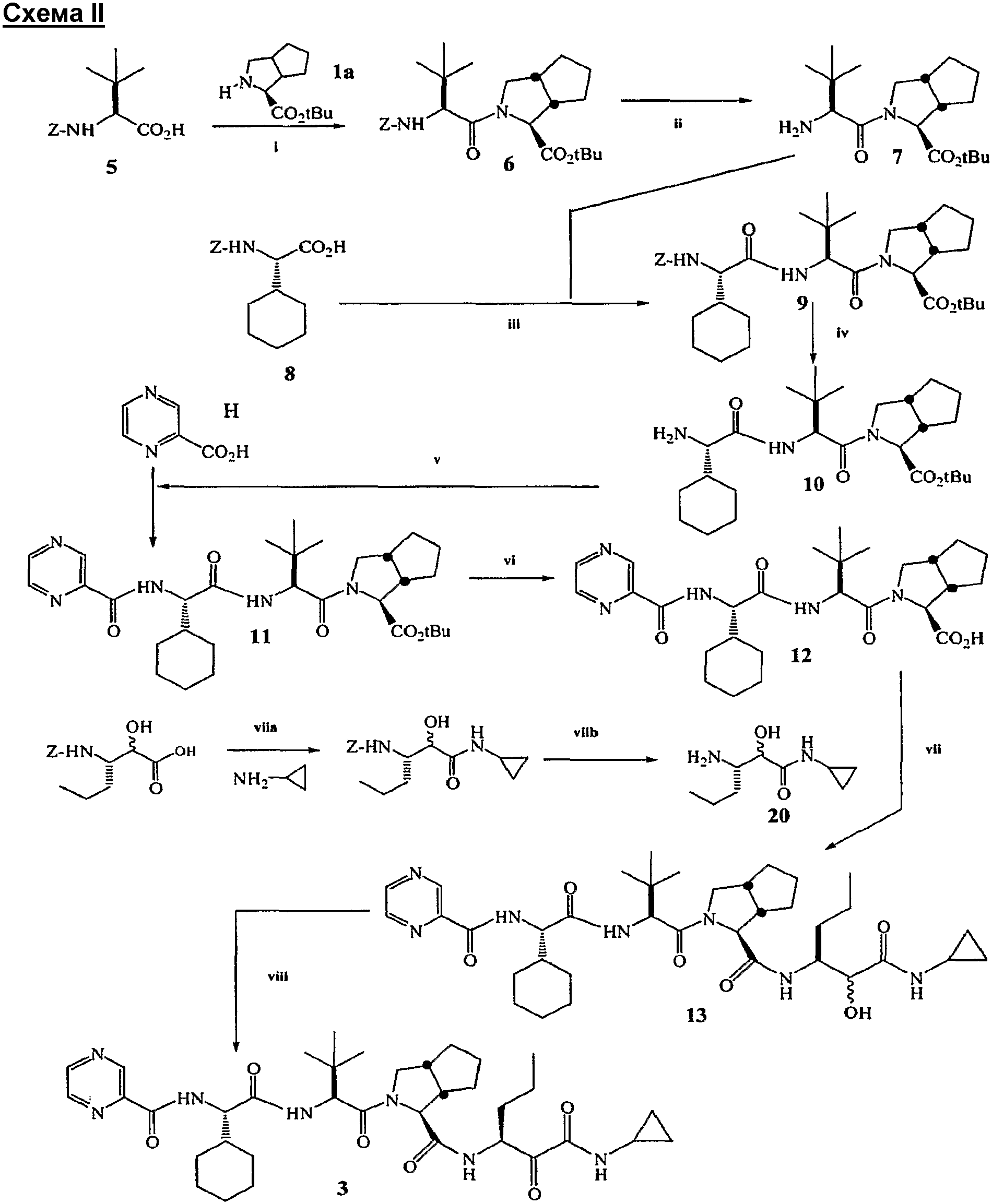
На схеме II бициклический сложный аминоэфир формулы 1a подвергают взаимодействию с защищенной аминокислотой формулы 5, где Z представляет собой амино-защитную группу, которую можно удалить в кислотных, основных условиях или условиях гидрирования, отличных от тех, которые используют для удаления R1 защитной группы, в присутствии агента сочетания с получением сложного амидо-эфира формулы 6. Защитную группу Z удаляют из соединения сложного амидо-эфира формулы 6 с получением сложного амино-эфирного соединения формулы 7.
Взаимодействие аминосоединения формулы 7 с защищенной аминокислотой 8 в присутствии агента сочетания дает трипептид формулы 9.
Удаление защитной группы Z в трипептиде формулы 9 обеспечивает свободный амино-трипептид формулы 10.
Взаимодействие амино-трипептида формулы 10 с пиразин-2-карбоновой кислотой в присутствии агента сочетания дает сложный эфир амид-трипептида формулы 11.
Гидролиз сложного эфира амид-трипептида формулы 11 обеспечивает амид-трипептидную кислоту формулы 12.
Взаимодействие амид-трипептидной кислоты формулы 12 с амино-гидроксиамидом формулы 20 в присутствии агента сочетания дает гидрокси-пептид формулы 13.
На конечной стадии окисление гидроксигруппы формулы 12 обеспечивает соединение формулы 3.
Любое из промежуточных соединений, полученных, как описано в настоящей заявке, можно использовать с или без его выделения из реакционной смеси. Желаемый ингибитор протеазы можно получить путем присоединения подходящей P2, P2-P3 или P2-P3-P4 группы. Сочетание амина с такой группой можно осуществить с использованием соответствующей карбоновой кислоты или ее реакционноспособного эквивалента, в стандартных условиях образования амидной связи или сочетания. Типичная реакция сочетания включает подходящий растворитель, амин в концентрации в пределах от около 0,01 до 10 M, предпочтительно от около 0,1 до 1,0 M, необходимую карбоновую кислоту, основание и пептидный связывающий агент.
Если амин используют без выделения, сочетание можно осуществить in situ в растворителе реакционной смеси, используемом для получения амина, или в другом растворителе. К этой реакционной смеси можно добавить необходимую карбоновую кислоту, и реакцию поддерживают при температуре в пределах от около 0 до 100°C, предпочтительно в пределах от около 20 до около 40°C. Затем основание и пептидный связывающий реагент добавляют к смеси, которую поддерживают при температуре в пределах от около 0 до около 60°C, предпочтительно в пределах от около 20 до около 40°C. Основание типично представляет собой третичное аминовое основание, такое как триэтиламин, диизопропилэтиламин, N-метилморфолин, DBU, DBN, N-метилимидазол, предпочтительно - триэтиламин или диизопропилэтиламин. Количество основания, которое используют, как правило, составляет до около 20 эквивалентов на эквивалент амина, предпочтительно, по меньшей мере, около 3 эквивалентов основания. Примеры пептидных связывающих реагентов включают DCC (дициклогексилкарбодиимид), DIC (диизопропилкарбодиимид), ди-п-толуоилкарбодиимид, BDP (1-бензотриазолдиэтилфосфат-1-циклогексил-3-(2-морфолинилэтил)карбодиимид), EDC (гидрохлорид 1-(3-диметиламинопропил-3-этилкарбодиимида), фторангидрид циануровой кислоты, хлорангидрид циануровой кислоты, TFFH (гексафторфосфат тетраметилфторформамидиния), DPPA (дифенилфосфоразидат), BOP (гексафторфосфат бензотриазол-1-илокситрис(диметиламино)фосфония), HBTU (гексафторфосфат O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония), TBTU (тетрафторборат O-бензотриазол-1-ил-N,N,N',N'-тетраметилурония), TSTU (тетрафторборат O-(N-сукцинимидил)-N,N,N',N'-тетраметилурония), HATU (гексафторфосфат N-[(диметиламино)-1-H-1,2,3-триазолo[4,5,6]-пиридин-1-илметилен]-N-метилметанaминия, N-оксид), BOP-Cl (хлорангидрид бис(2-оксо-3-оксазолидинил)фосфиновой кислоты), PyBOP (тетрафторфосфат (1-H-1,2,3-бензотриазол-1-илокси)-трис(пирролидино)фосфония), BrOP (гексафторфосфат бромтрис(диметиламино)фосфония), DEPBT (3-(диэтоксифосфорилокси)-1,2,3-бензотриазин-4(3H)-он), PyBrOP (гексафторфосфат бромтрис(пирролидино)фосфония). EDC, HOAT, BOP-Cl и PyBrOP являются предпочтительными пептидными связывающими реагентами. Количество связывающего реагента находится в пределах от около 1,0 до около 10,0 эквивалентов. Необязательные реагенты, которые можно использовать в реакции образования амидной связи, включают DMAP (4-диметиламинопиридин) или активные сложноэфирные реагенты, такие как HOBT (1-гидроксибензотриазол), HOAT (гидроксиазабензотриазол), HOSu (гидроксисукцинимид), HONB (эндо-N-гидрокси-5-норборнен-2,3-дикарбоксамид), в количестве в пределах от около 1,0 до около 10,0 эквивалентов.
Альтернативно, можно обрабатывать амин реакционноспособным эквивалентом R1 карбоновой кислоты, таким как P2-, P3-P2- или P4-P3-P2-C(=O)X1, где -C(=O)X1 представляет собой группу, которая является более реакционноспособной, чем COOH, в реакции сочетания. Примеры -C(=O)X1 групп включают группы, где X1 представляет собой Cl, F, OC(=O)R (R = алифатическая группа или арил), -SH, SR, -SAr или -SeAr. Защитные группы для кислоты и амина, используемые в настоящем изобретении, известны из уровня техники (см., например, T. W. Greene & P.G.M Wutz, Protective Groups in Organic Synthesis, 3rd Edition, John Wiley & Sons, Inc. (1999) и более ранние издания этой книги).
Известны различные химические группы, которые можно использовать в качестве P3-P2- части ингибитора протеазы. Примеры таких P3-P2- групп включены в заявку США № 60/709964, которая также включена в настоящую заявку посредством ссылки во всей ее полноте.
Другие способы, хорошо известные из уровня техники, также можно использовать для осуществления способов по настоящему изобретению и даже для получения соединений по настоящему изобретению. См., например, WO 07/022459 A2, которая включена в настоящую заявку посредством ссылки во всей ее полноте.
III. Примеры
Представленные ниже примеры предназначены исключительно для иллюстрации и не должны рассматриваться как каким-либо образом ограничивающие объем настоящего изобретения.
Пример 1: 3-пропилоксиран-2-карбоновая кислота
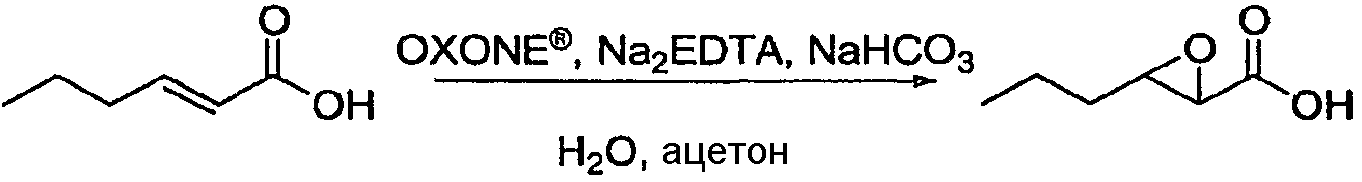
Колбу, снабженную расположенной сверху мешалкой, термометром и капельной воронкой, помещали в атмосферу азота, затем загружали транс-2-гексеновую кислоту (69,8 г, 611 ммоль), воду (420 мл) и ацетон (420 мл). Затем добавляли бикарбонат натрия (NaHCO3, 224 г, 2,66 моль) по порциям, поддерживая при этом реакционную температуру на уровне 25±5°C. После того как было добавлено все количество бикарбоната натрия, раствор OXONE® (454 г, 738 ммоль) в 4×10-4 M динатриевой соли этилендиаминтетрауксусной кислоты дегидрата (Na2EDTA; 1,32 л) загружали в капельную воронку и добавляли в течение 90 минут, поддерживая при этом реакционную температуру на уровне 25±5°C и pH в пределах 9,5-7,5. Реакционную смесь затем оставляли для перемешивания в течение 16 часов, после чего анализ ВЭЖХ показал отсутствие какой-либо (E)-гекс-2-еновой кислоты. Смесь охлаждали до 0±5°C, подкисляли до pH 2 при помощи 6 н. раствора HCl (515 мл, 2,8 моль) и экстрагировали этилацетатом (EtOAc; 3×250 мл). Объединенные органические фазы сушили над сульфатом натрия (Na2SO4), фильтровали, затем концентрировали при пониженном давлении с получением указанного в заголовке соединения (60,4 г, 76%) в виде масла желтого цвета.
1Н-ЯМР (500 МГц, d6-ДМСО) δ 12,88 (шир.с, 1Н), 3,21 (с, 1Н), 3,06-3,03 (м, 1Н), 1,58-1,36 (м, 4Н), 0,91 (т, J=7,5 Гц, 3Н).
Пример 2: N-циклопропил-3-пропилоксиран-2-карбоксамид

Колбу, снабженную расположенной сверху мешалкой, термометром и капельной воронкой, помещали в атмосферу азота, затем загружали кислоту, полученную в примере 1 (20,0 г, 154 ммоль), и изопропилацетат (IPAc; 200 мл) и затем охлаждали до 0±5°C. 4-метилморфолин (NMM, 154 мл, 17 мл) загружали в капельную воронку, затем добавляли, поддерживая при этом температуру при 0±5°C. После того как добавление было завершено, капельную воронку промывали при помощи IPAc (10 мл) и затем загружали изобутилхлорформиат (IBCF, 137 ммоль, 19,5 мл), который добавляли, поддерживая при этом температуру при 0±5°C. Реакционную смесь перемешивали при 0±5°C в течение 90 минут, после чего добавляли раствор циклопропиламина (154 ммоль, 10,7) в IPAc (80 мл), поддерживая при этом температуру при 0±5°C. По завершении добавления реакционную смесь нагревали до температуры 25±5°C и оставляли для перемешивания в течение 18 часов. Добавляли гидроксид натрия (231 мл, 1,0 н.) и фвухфазную смесь интенсивно перемешивали в течение 30 минут, затем слои разделяли. Органическую фазу затем промывали при помощи HCl (231 мл, 1,0 н.). Объединенные органические фазы сушили над сульфатом натрия (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (19,5 г, 75%) в виде масла оранжевого цвета.
1Н-ЯМР (500 МГц, d6-ДМСО) 7,97 (шир.с, 1Н), 3,10 (д, J=1,9 Гц, 1Н), 2,99-2,95 (м, 1Н), 2,67-2,61 (м, 1Н), 1,60-1,36 (м, 4Н), 0,90 (т, J=7,3 Гц, 3Н), 0,62-0,58 (м, 2Н), 0,47-0,43 (м, 2Н).
Пример 3: Альтернативное получение N-циклопропил-3-пропилоксиран-2-карбоксамида

Колбу, снабженную механической мешалкой, термометром и капельной воронкой, помещали в атмосферу азота, затем загружали кислоту примера 1 (5,0 г, 38 ммоль), гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDCI; 8,1 г, 42 ммоль), гидрат 1-гидроксибензотриазола (HOBt; 5,7 г, 42 ммоль) и N,N-диметилформамид (ДМФА; 50 мл), затем охлаждали до 0±5°C. В капельную воронку загружали NMM (5,9 мл, 54 ммоль), который затем добавляли к реакционной смеси, поддерживая при этом температуру при 0±5°C. Смесь перемешивали в течение 30 минут, затем добавляли циклопропиламин (2,9 мл, 42 ммоль) и реакционной смеси давали нагреться до 25±5°C в течение 16 часов. Добавляли соляную кислоту (50 мл, 1,0 н.) и IPAc (50 мл) и затем смесь перемешивали еще в течение 30 минут. Все содержимое переносили в делительную воронку, слои разделяли, затем органический слой промывали последовательно HCl (50 мл, 1,0 н.), насыщенным водным раствором NaHCO3 (2×50 мл) и насыщенным солевым раствором (2×50 мл). Объединенные органические фазы сушили над сульфатом натрия (Na2SO4), фильтровали, затем концентрировали при пониженном давлении с получением указанного в заголовке амида (3,2 г, 50%) в виде масла оранжевого цвета.
Пример 4. Транс-N-циклопропил-2-гексенамид

Колбу, снабженную расположенной сверху мешалкой, термометром и капельной воронкой, помещали в атмосферу азота, затем загружали (E)-гекс-2-еновую кислоту (89,8 г, 787 ммоль), EDCI (158,3 г, 826 ммоль), HOBt (112,0 г, 826 ммоль) и IPAc (890 мл), затем охлаждали до 0±5°C. В капельную воронку загружали NMM (99,1 мл, 1,6 моль), который затем добавляли к реакционной смеси, поддерживая при этом температуру при 0±5°C. Смесь перемешивали в течение 30 минут, затем добавляли циклопропиламин (60,0 мл, 866 ммоль) и реакционной смеси давали нагреться до 25±5°C в течение 16 часов. Реакционную смесь промывали добавлением соляной кислоты (500 мл, 1,0 н.) и смесь интенсивно перемешивали в течение 30 минут, затем давали отстояться в течение 30 минут; слои разделяли и повторяли процедуру промывки. Добавляли гидроксид натрия (500 мл, 1,0 н.) и затем смесь интенсивно перемешивали в течение 30 минут, затем давали отстояться в течение 30 минут; слои разделяли и повторяли процедуру промывки. Добавляли воду (500 мл) и затем смесь интенсивно перемешивали в течение 30 минут, затем давали отстояться в течение 30 минут; слои разделяли и повторяли процедуру промывки. Объединенные органические фазы концентрировали при пониженном давлении до 1/3 исходного объема, затем добавляли IPAc (600 мл); эту процедуру повторяли два раза, при этом происходило образование белого осадка. Суспензию затем концентрировали при атмосферном давлении до 2/3 исходного объема, затем охлаждали до 50±5°C. Медленно добавляли н-гептан (890 мл), при этом реакционную смесь охлаждали до -5±5°C и выдерживали при этой температуре в течение 4 часов. Твердое вещество фильтровали, промывали холодным н-гептаном (2×250 мл) и сушили с получением указанного в заголовке амида (82,4 г, 68%) в виде мелких твердых частиц белого цвета.
1Н-ЯМР (500 МГц, d6-ДМСО) 7,89 (с, 1Н), 6,58 (дт, J=15,2, 7,0 Гц, 1Н), 5,80 (дт, J=15,2, 1,3 Гц, 1Н), 2,70-2,65 (м, 1Н), 2,12-2,06 (м, 2Н), 1,44-1,37 (м, 2Н), 0,88 (т, J=7,3 Гц, 3Н), 0,64-0,60 (м, 2Н), 0,42-0,38 (м, 2Н).
Пример 5: N-циклопропил-3-пропилоксиран-2-карбоксамид
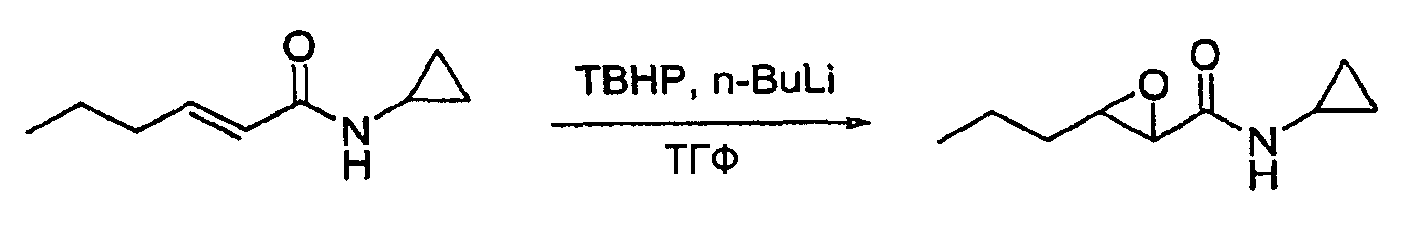
Колбу, снабженную расположенной сверху мешалкой, термометром и капельной воронкой, помещали в атмосферу азота, затем загружали трет-бутилгидропероксид (ТВНР; 95 мл, 5,5 М, 522 ммоль) и тетрагидрофуран (ТГФ; 200 мл). Реакционную смесь охлаждали до -20±5°C и загружали в капельную воронку н-бутиллитий (n-BuLi; 235 мл, 2,5 М, 587 ммоль) и медленно добавляли, поддерживая при этом реакционную температуру ниже -5±5°C. По завершении добавления реакционную смесь нагревали до температуры 0±5°C и добавляли амид примера 4 (19,80 г, 130 ммоль) в ТГФ (20 мл), поддерживая при этом температуру на уровне 0±5°C, после чего температуру повышали до 25±5°C и реакционную смесь перемешивали в течение 12 часов. После этого добавляли IPAc (200 мл) и насыщенный водный раствор гидросульфита натрия (200 мл) и реакционную смесь перемешивали в течение 60 минут. Слои разделяли и водный слой экстрагировали при помощи IPAc (два раза, каждый раз по 75 мл). Объединенные органические фазы сушили над сульфатом натрия (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (21,87 г, 99%).
Пример 6: N-циклопропил-3-пропилоксиран-2-карбоксамид
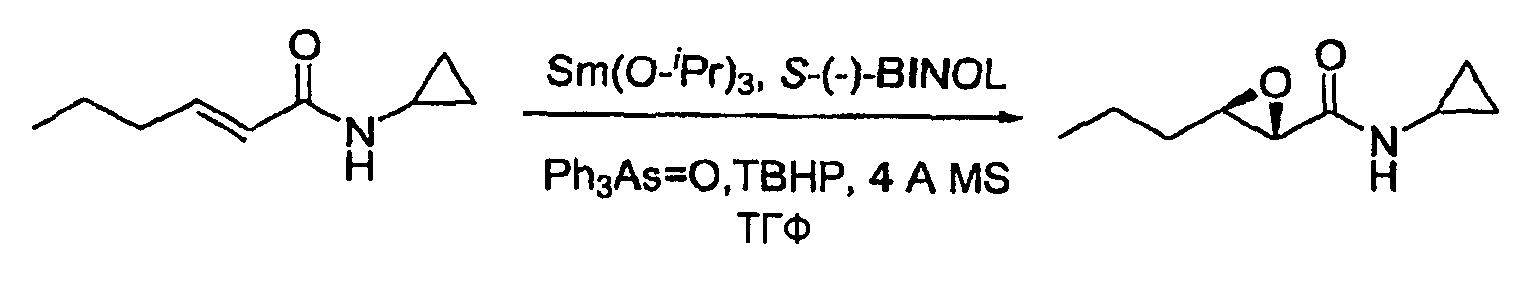
Колбу, снабженную механической мешалкой, термометром и капельной воронкой, помещали в атмосферу азота, затем загружали изопропоксид самария (III) (Sm(O-i-Pr)3, 430 мг, 1,3 ммоль), трифениларсиноксид (Ph3As=0; 420 мг, 1,3 ммоль), S-(-)1,1'-би-2-нафтол ((S)-BINOL), 370 мг, 1,3 ммоль), 4 Å молекулярные сита (13 г) и ТГФ (20 мл), затем перемешивали в течение 30 минут при температуре 25±5°C. Затем добавляли трет-бутилгидропероксид (2,8 мл, 5,5 М, 16 ммоль). Смесь перемешивали в течение 30 минут при температуре 25±5°C, затем добавляли амид примера 4 (2,0 г, 13 ммоль) в ТГФ (2,0 мл). Реакционную смесь перемешивали в течение 14 часов, после чего реакция была завершена на 95%, как было определено методом ВЭЖХ.
Пример 7: N-циклопропил-3-пропилоксиран-2-карбоксамид

В трехгорлую 250-мл круглодонную колбу, снабженную механической мешалкой и содержащую (Е)-N-циклопропилгекс-2-енамид (10,0 г, 65,3 ммоль) и пероксид мочевины-водорода (UHP) (25,0 г, 4,0 экв.) в CH2Cl2 (100 мл, 10 об.), при 0°C добавляли трифторуксусный ангидрид (41,1 г, 27,2 мл, 3,0 экв.). Реакционную смесь нагревали до температуры 35±5°C и перемешивали в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры добавляли еще одну аликвоту трифторуксусного ангидрида (13,7 г, 9,0 мл, 1,0 экв.). Реакционную смесь снова нагревали до температуры 35±5°C и перемешивали еще в течение 3 часов.
Реакционную смесь затем снова охлаждали до 0°C и гасили медленным добавлением насыщенного раствора NaHCO3 (5 об.) и перемешивания в течение 30 минут. Органический слой отделяли и водный слой экстрагировали при помощи CH2Cl2 (50 мл, 5 об.). Объединенный органический слой сушили и упаривали с получением 10,0 г (90%) неочищенного продукта, N-циклопропил-3-пропилоксиран-2-карбоксамида, в виде масла бледно-желтого цвета. Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Пример 8: 3-азидо-N-циклопропил-2-гидроксигексанамид
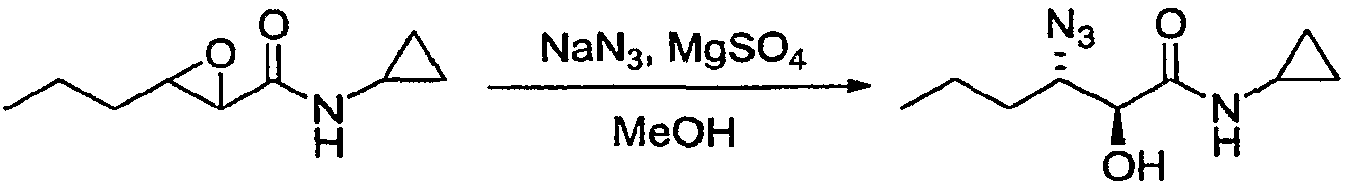
Колбу, снабженную расположенной сверху мешалкой, термометром и обратным холодильником, помещали в атмосферу азота и затем загружали эпоксид примера 5 (20,0 г, 118 ммоль), азид натрия (NaN3; 31,0 г, 473 ммоль), сульфат магния (MgSO4; 14,0 г, 118 ммоль) и метанол (MeOH; 200 мл). Смесь нагревали до температуры 65±5°C в течение 2 часов, затем охлаждали до температуры 25±5°C и фильтровали через слой Целита 545. Растворитель удаляли при пониженном давлении с получением вязкого масла, которое переносили для поглощения в IPAc (250 мл), затем промывали водой (3×250 мл). Органическую фазу сушили над сульфатом натрия (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (15,1 г, 60%) в виде твердого вещества белого цвета.
1Н-ЯМР (500 МГц, d6-ДМСО) 7,87 (с, 1Н), 5,97 (д, J=6,0 1Н), 4,02 (дт, J=6,0, 3,8 Гц, 1Н), 2,70-2,65 (м, 1Н), 1,60-1,20 (м, 4Н), 0,88 (т, J=7,0 Гц, 3Н), 0,63-0,58 (м, 2Н), 0,51-0,46 (м, 2Н).
Пример 9: 3-амино-N-циклопропил-2-гидроксигексанамид
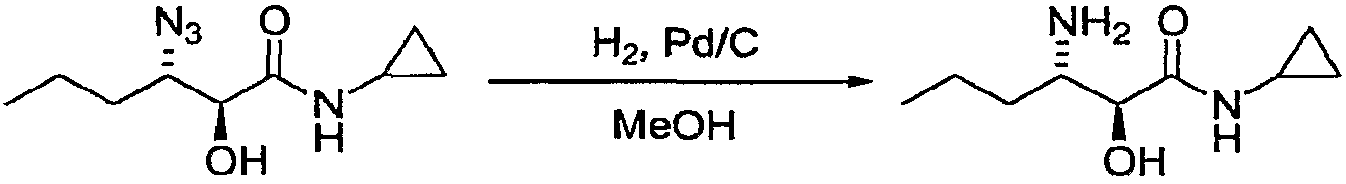
Азид примера 7 (15,1 г, 71,3 ммоль), Pd/C (1,5 г, 5% масс., содержание влаги 50%) и MeOH (150 мл) загружали в аппарат высокого давления, затем продували газообразным азотом в течение 5 минут. Сосуд герметично закрывали, создавали давление до 1 бар при помощи газообразного азота с последующим выпуском газа, три раза. Ту же процедуру повторяли с газообразным водородом. После третьей продувки водородом в сосуд загружали 3 бар водорода. Начинали перемешивание и поддерживали температуру 25±5°C. Реакционную смесь перемешивали таким образом в течение 14 часов, после чего реакционную смесь фильтровали через слой Целита 545 и растворитель удаляли с получением неочищенного аминоспирта (8,48 г) в виде твердого вещества желтого цвета. К этому веществу добавляли ацетонитрил (ACN; 150 мл) и реакционную смесь нагревали до температуры кипения с обратным холодильником, при этом все твердые частицы растворялись. Смесь затем охлаждали до температуры 25±5°C и образовавшиеся белые игольчатые кристаллы собирали, промывали холодным ACN и сушили с получением очищенного аминоспирта (4,87 г).
1Н-ЯМР (500 МГц, d6-ДМСО) 8,05 (шир.с, 3Н), 4,20 (д, J=3,2, 1Н), 3,42-3,34 (м, 1Н), 2,71-2,65 (м, 1Н), 1,51-1,20 (м, 4Н), 1,17 (д, J=6,5 Гц, 1Н), 0,83 (т, J=7,6 Гц, 3Н), 0,64-0,60 (м, 2Н), 0,54-0,49 (м, 2Н).
Пример 10: 3-амино-N-циклопропил-2-гидроксигексанамид, соль L-винной кислоты
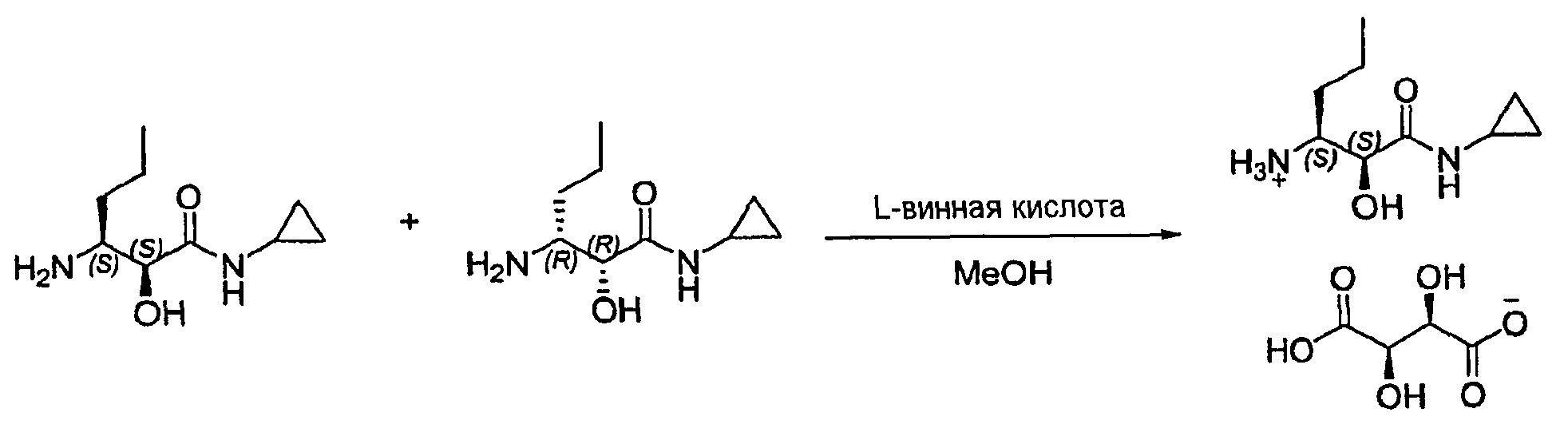
К рацемической смеси 3-амино-N-циклопропил-2-гидроксигексанамида (100 мг, 0,53 ммоль) в MeOH (1 мл) добавляли L-винную кислоту (39,7 мг, 0,26 ммоль) в MeOH (20 мкл) и смесь охлаждали до температуры 0±5°C. Через 48 часов при 0±5°C образовывался осадок белого цвета, который собирали, промывали метил трет-бутиловым эфиром (2×5 мл), затем сушили с получением указанного в заголовке соединения. Анализ методом хиральной ВЭЖХ и сравнение с аутентичным образцом хиральной гидрохлоридной соли аминоспирта показали, что указанное в заголовке соединение было получено с 62% эи.
Пример 11: 3-амино-N-циклопропил-2-гидроксигексанамид, соль деэоксихолевой кислоты

В трехгорлую 250-мл круглодонную колбу, снабженную механической мешалкой и содержащую рацемический 3-амино-N-циклопропил-2-гидроксигексанамид (10,0 г, 53,69 ммоль) в ТГФ (100 мл), загружали дезоксихолевую кислоту (15,8 г, 40,27 ммоль, 0,75 экв.). Реакционную смесь перемешивали и нагревали при температуре 65±5°C в течение 2 часов. Полученной гомогенной смеси давали охладиться до температуры в пределах 22-25°C в течение часа и поддерживали при этой температуре в течение 4 часов. Осажденные твердые частицы собирали фильтрованием, промывали при помощи ТГФ (10 мл), сушили в течение ночи с получением 12,2 г 3-амино-N-циклопропил-2-гидроксигексанамида в форме соли дезоксихолевой кислоты (41%, энантиомерное отношение(ER)=3:97) в виде твердого вещества белого цвета.
Пример 12: 3-амино-N-циклопропил-2-гидроксигексанамид, соль соляной кислоты

В трехгорлую 250-мл круглодонную колбу, снабженную механической мешалкой и содержащую смесь соли дезоксихолевой кислоты, полученной в примере 11, в 2-пропаноле (62 мл) добавляли 5-6 н. раствор HCl в изопропиловом спирте (66 мл, 3 экв.) при перемешивании. Полученный раствор нагревали при температуре 75±5°C в течение одного часа и давали охладиться до температуры в пределах 22-25°C в течение 1 часа и поддерживали при этой температуре в течение 2 часов. Осажденные твердые частицы собирали фильтрованием, промывали 2-пропанолом (12 мл, 1 об.), сушили в течение ночи с получением 7,2 г 3-амино-N-циклопропил-2-гидроксигексанамида в форме соли соляной кислоты (75%, энантиомерное отношение(ER)=0,05:99,95) в виде твердого вещества белого цвета.
Пример 13. Получение (1S,3aR,6aS)-2-((S)-2-((S)-2-циклогексил-2-(пиразин-2-карбоксамидо)ацетамидо)-3,3-диметилбутаноил)-N-((S)-1-(циклопропиламино)-1,2-диоксо-гексан-3-ил)октагидроциклопента[c]пиррол-1-карбоксамида
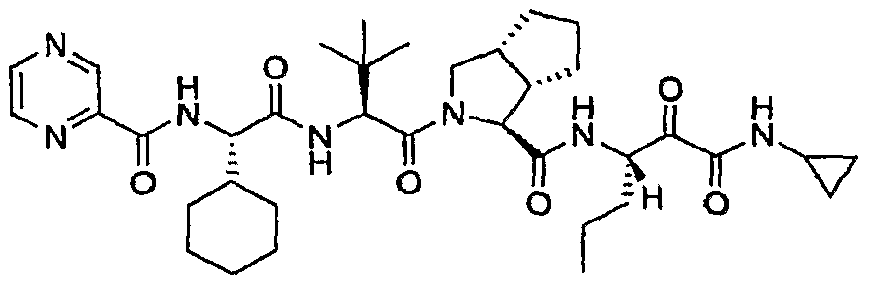
Стадия a: Получение
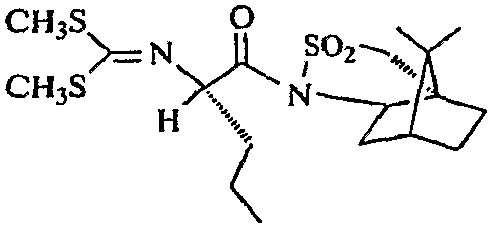 (соединение vii, представленное ниже)
(соединение vii, представленное ниже)
Представленный выше сультам vi получают известными способами, такими как способы, описанные в Y. Elemes and U. Ragnarsson, J. of Chem. Soc, Perkin 1, 1996, 6, p.537; W.Oppolzer et al., Helv. Chim. Acta., 1994, 25: 2363), с использованием соответствующего незамещенного сультама и пропилйодида.
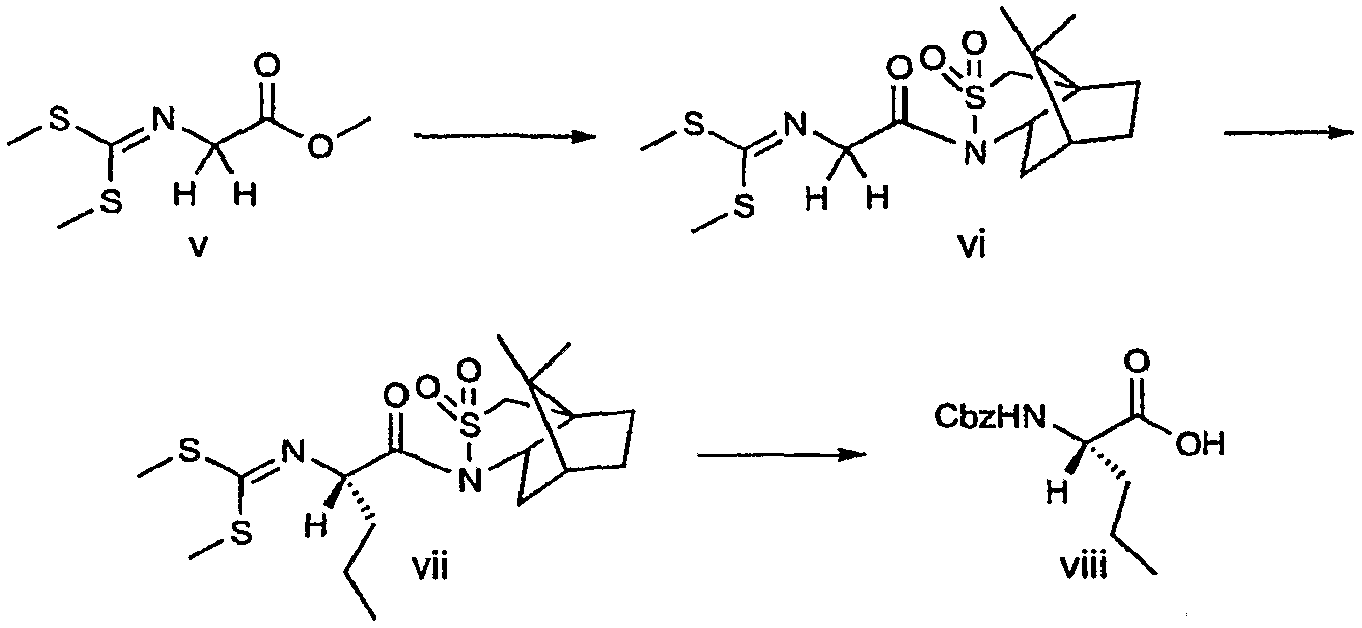
В 500-мл круглодонную колбу, снабженную магнитной мешалкой и вводом для N2, загружали соединение vi (17,32 г, 45,8 ммоль) и ТГФ (229 мл). Полученный раствор охлаждали до -78°C и добавляли n-BuLi (31,5 мл раствора 1,6 M в гексанe, 50,3 ммоль) при помощи шприцевого насоса в течение 1 часа. Полученный раствор желтого цвета подвергали старению в течение 30 минут и затем добавляли раствор HPMA (56 мл) и n-PrI (13,4 мл, 137 ммоль) в течение 30 минут. Смеси давали нагреться до комнатной температуры в течение 8 часов. Смесь охлаждали до -20°C и добавляли H2O (50 мл). Реакционную смесь экстрагировали при помощи EtOAc (400 мл) и органические фазы сушили над MgSO4 и концентрировали с получением 61,3 г неочищенного масла. Хроматография на 500 г силикагеля с элюированием смесью 2:1 гептан/EtOAc с последующим концентрированием обогащенной фракции давали 20,35 г твердого вещества белого цвета. Это вещество перекристаллизовывали из EtOH (210 мл) с получением соединения vii в виде кристаллического твердого вещества белого цвета.
Стадия b: Получение (S)-2-(бензилоксикарбониламино)-пентановой кислоты (соединение viii, представленное выше)
Соединение vii (15,39 г, 32,1 ммоль) объединяли с ТГФ (100 мл) и 1 н. раствором HCl (50 мл). Полученную эмульсию перемешивали в течение ночи при комнатной температуре и затем концентрировали при пониженном давлении с получением вязкого масла. Полученное масло растворяли в ТГФ (100 мл), добавляли воду (25 мл) и LiOH (3,08 г, 128 ммоль). Полученный раствор перемешивали в течение ночи при комнатной температуре и затем концентрировали для удаления ТГФ с получением мутной светло-желтой эмульсии. Эмульсию разбавляли водой (25 мл) и экстрагировали при помощи CH2Cl2 (3×50 мл). Водную фазу разбавляли при помощи ТГФ (200 мл) и затем охлаждали до 0°C при быстром перемешивании и добавляли CBZ-Cl (7,6 мл, 54 ммоль) по каплям в течение 15 минут. Через 1 час при 0°C ТГФ удаляли в вакууме и остаток подкисляли добавлением 50 мл 1 н. раствора HCl. Смесь экстрагировали при помощи EtOAc (3×100 мл) и органическую фазу сушили над Na2SO4 и концентрировали с получением масла. Полученный остаток растворяли в EtOAc (25 мл) и гептане (150 мл), вносили затравочный кристалл и перемешивали в течение ночи при комнатной температуре. Твердые частицы собирали на фритте, промывали гептаном (30 мл) и сушили на воздухе с получением соединения viii.
Стадия c: Получение (S)-2-(бензилоксикарбониламино)-пентановой кислоты
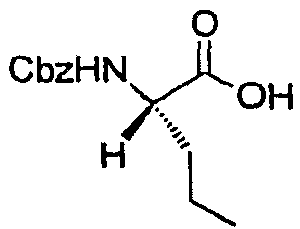
Как показано ниже, указанное в заголовке соединение получают путем гидролиза сультама, являющегося продуктом стадии a, и преобразования полученной свободной аминокислоты в ее Cbz-производное известными способами (см., например, W. Green, P. G. M. Wuts, Protective Groups in Organic Synthesis, Wiley-Interscience, New York, 1999).
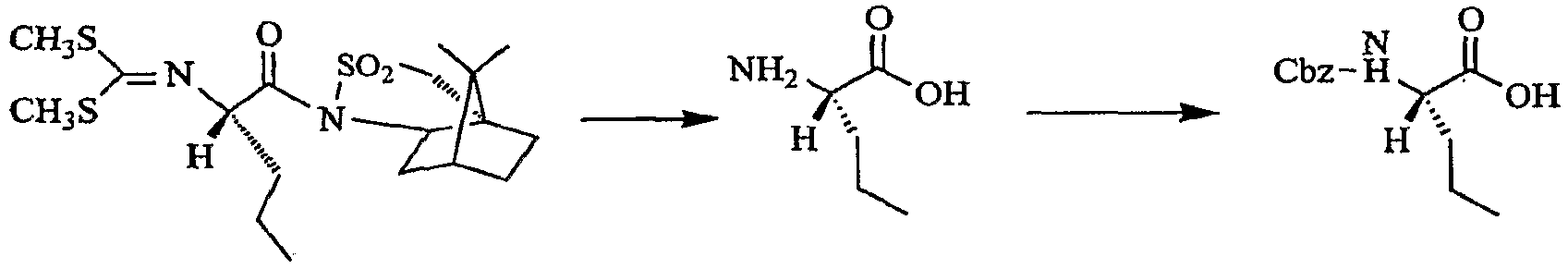
Стадия d: Получение (S)-бензил 1-(метокси(метил)амино)-1-оксо-2-пентан-2-илкарбамата
В колбу, содержащую 1,0 г (S)-2-(бензилоксикарбониламино)-пентановой кислоты (3,97 ммоль) в 20 мл дихлорметана, поддерживаемую при температуре 0оC, добавляли 3,0 экв. N-метилморфолина (700 мкл), 1,5 экв. гидрохлорида N,O-диметилгидроксиламина (581 мг) и 1,5 экв. EDCI (1,14 г). Реакционную смесь перемешивали в течение ночи при температуре от 0оC до комнатной температуры. Реакционную смесь затем разбавляли в дихлорметане и промывали раствором HCl (1 н.) и насыщенным солевым раствором. Органический слой сушили над MgSO4. Неочищенную смесь очищали флэш-хроматографией (этилацетат 15-75% в гексане) с получением указанного в заголовке соединения.
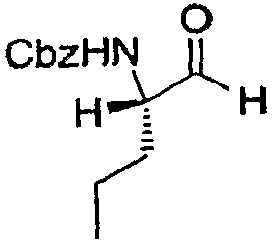
Стадия e: Получение (S)-бензил 1-оксо-2-пентан-2-илкарбамата

С использованием процедуры, описанной в WO 02/18369, Cbz-защищенную аминокислоту стадии d преобразовывали в указанное в заголовке соединение. Конкретно, в колбу, содержащую 1,0 экв. (S)-бензил 1-(метокси(метил)амино)-1-оксо-2-пентан-2-илкарбамата (810 мг, 2,75 ммоль) в 10 мл безводного ТГФ, поддерживаемую при температуре 0°C (на ледяной бане), медленно добавляли 1,7 экв. раствора боргидрида лития (1,0 M) (4,67 мл). Примерно через 10 минут ледяную баню удаляли и реакцию продолжали в течение одного часа. Реакцию гасили при 0°C добавлением 5 мл раствора KHSO4 (10%). Раствор затем разбавляли путем добавления 10 мл HCl (1 н.). Смесь перемешивали в течение 30 минут, затем экстрагировали 3 раза дихлорметаном. Органические фазы объединяли и промывали раствором HCl (1 н.), водой и насыщенным солевым раствором. Органическую фазу затем сушили над MgSO4 и летучие вещества выпаривали. Альдегид использовали как таковой на следующей стадии.
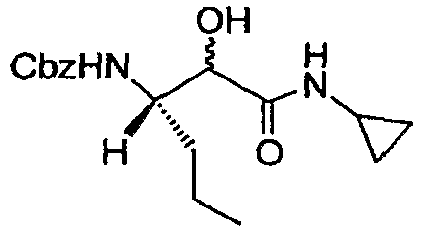
Стадия f: Получение бензил (3S)-1-(циклопропиламино)-2-гидрокси-1-оксогексан-3-илкарбамата
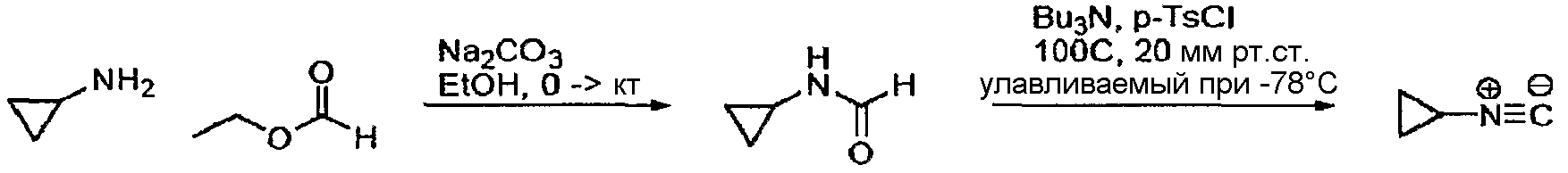
Циклопропилизоцианид получали в соответствии со схемой, представленной ниже.
Конкретно, циклопропилизонитрил подвергали сочетанию с альдегидным продуктом стадии d с получением указанного в заголовке соединения, как описано в J. E. Semple et al., Org. Lett., 2000, 2(18), p.2769; Lumma W., J. Org. Chem., 1981, 46, 3668.
Стадия g: Получение (3S)-3-амино-N-циклопропил-2-гидроксигексанамида
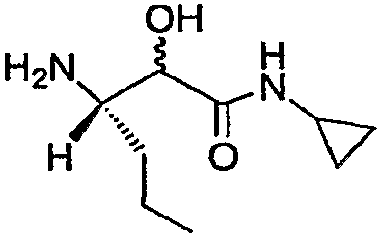
Гидрогенолиз Cbz-соединения стадии e осуществляли с использованием катализатора палладия на углероде в присутствии водорода с получением указанного в заголовке соединения. На схемах ниже представлены стадии d, e, f и g.
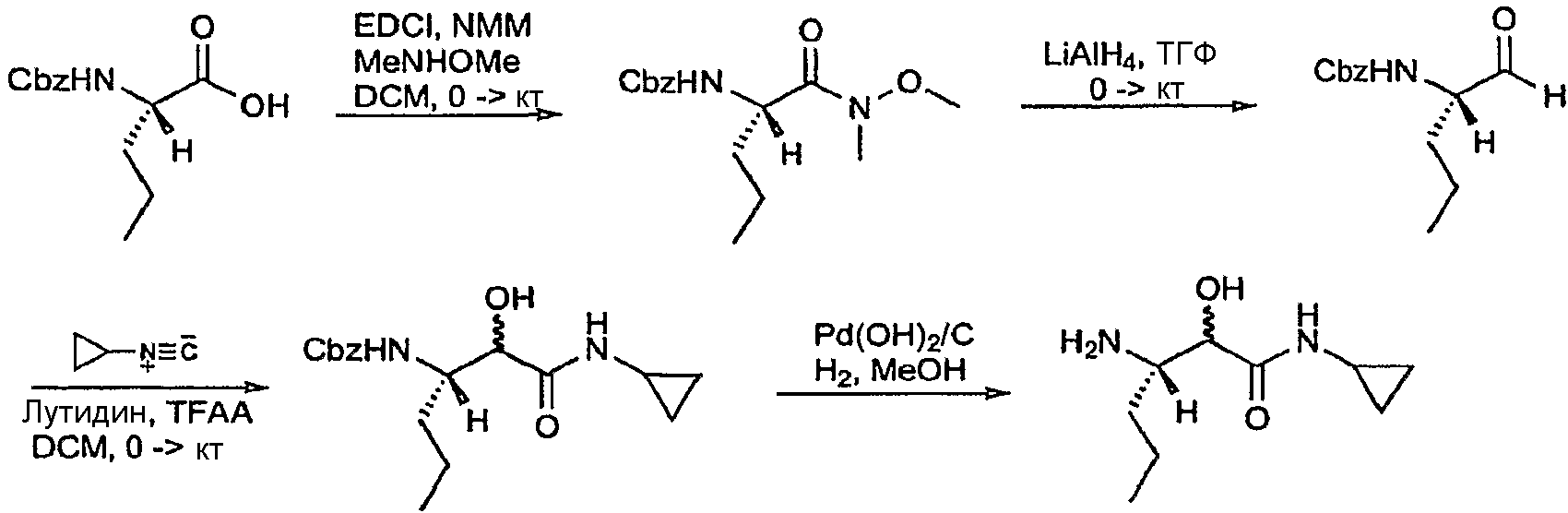
Стадия h: Получение (1S,3aR,6aS)-2-((S)-2-((S)-2-циклогексил-2-(пиразин-2-карбоксамидо)ацетамидо)-3,3-диметилбутаноил)-N-((3S)-1-(циклопропиламино)-2-гидрокси-1-оксогексан-3-ил)октагидроциклопента[c]пиррол-1-карбоксамида

Указанное в заголовке соединение получали из гидрокси-аминоамидного продукта стадии g путем конденсации с подходящей кислотой в присутствии агента сочетания, такого как, например, EDCI и HOSu. Конкретно, в колбу, содержащую 1,2 экв. (1S,3aR,6aS)-2-((S)-2-((S)-2-циклогексил-2-(пиразин-2-карбоксамидо)ацетамидо)-3,3-диметилбутаноил)октагидроциклопента[c]пиррол-1-карбоновой кислоты (1,59 г) в 20 мл ДМФА, добавляли 2,5 экв. диизопропиламина (980 мкл), 1,2 экв. гидрата N-гидроксибензотриазола (411 мг) и 1,3 экв. EDCI (558 мг). Через 15 минут перемешивания при комнатной температуре к смеси добавляли 1,0 экв. гидрохлорида (3S)-3-амино-N-циклопропил-2-гидроксигексанамида (500 мг). Еще через 24 часа реакционную смесь разбавляли в 400 мл этилацетата. Органическую фазу смеси промывали HCl (1 н.), водой, насыщенным раствором бикарбоната натрия, насыщенным солевым раствором и затем сушили над MgSO4. Неочищенный продукт очищали хроматографией на диоксиде кремния (этилацетат 70-100% в гексане) с получением указанного в заголовке соединения.
Стадия i: Получение (1S,3aR,6aS)-2-((S)-2-((S)-2-циклогексил-2-(пиразин-2-карбоксамидо)ацетамидо)-3,3-диметилбутаноил)-N-((S)-1-(циклопропиламино)-1,2-диоксогексан-3-ил)октагидроциклопента[c]пиррол-1-карбоксамида
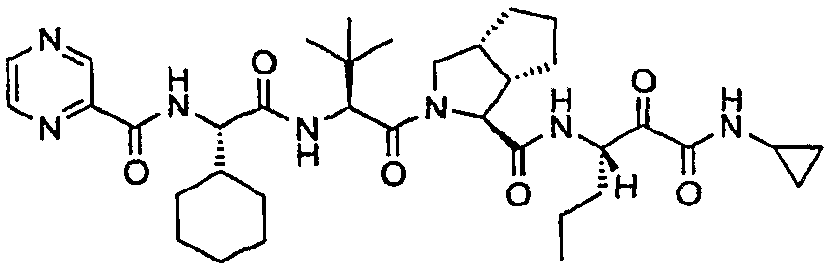
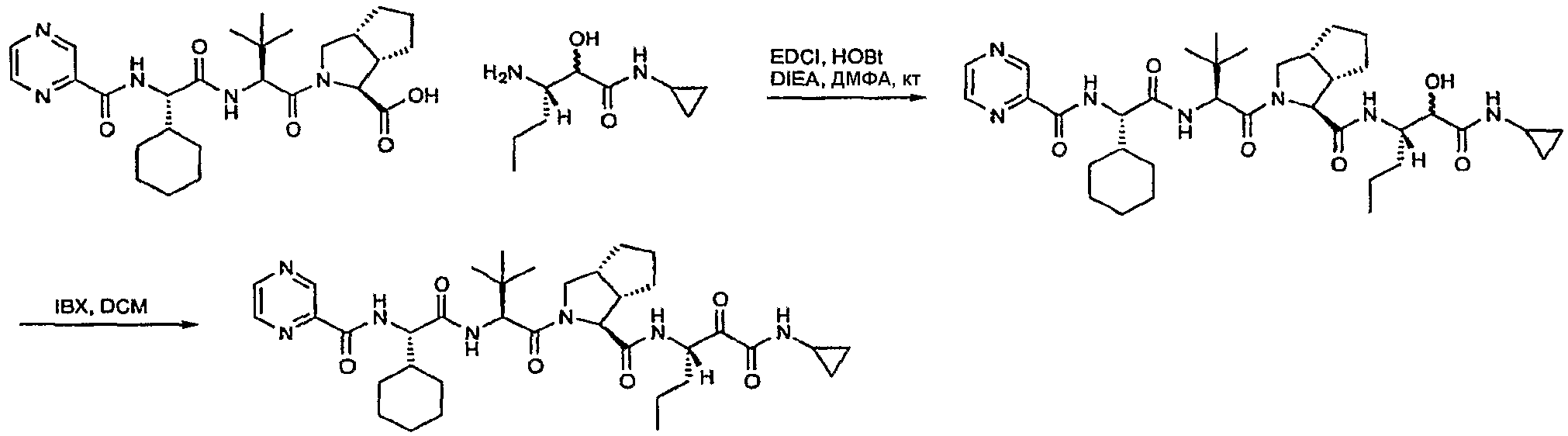
Указанное в заголовке соединение получали путем окисления продукта стадии h с использованием подходящего окислителя, такого как перйодинан Dess Martin или TEMPO, и гипохлорита натрия. Конкретно, в колбу, содержащую 1,31 г (1S,3aR,6aS)-2-((S)-2-((S)-2-циклогексил-2-(пиразин-2-карбоксамидо)ацетамидо)-3,3-диметилбутаноил)-N-((3S)-1-(циклопропиламино)-2-гидрокси-1-оксогексан-3-ил)октагидроциклопента[c]пиррол-1-карбоксамида в 40 мл дихлорметана, добавляли при комнатной температуре 1,06 г перйодинана Dess Martin. После 2 часов перемешивания добавляли 50 мл бисульфита натрия (1 н.) и смесь перемешивали в течение 30 минут. 2 фазы разделяли, органическую фазу промывали водой два раза, насыщенным солевым раствором и сушили над Na2SO4. Неочищенный продукт очищали хроматографией на диоксиде кремния (этилацетат 20-100% в гексане) с получением указанного в заголовке соединения. Диастереизомерное соотношение определяли при помощи хиральной ВЭЖХ с нормальной фазой.
На схеме ниже представлены реакции стадии g и стадии h.
Пример 14: Получение гидрохлорида (2S,3S)-3-амино-N-циклопропил-2-гидроксигексанамида
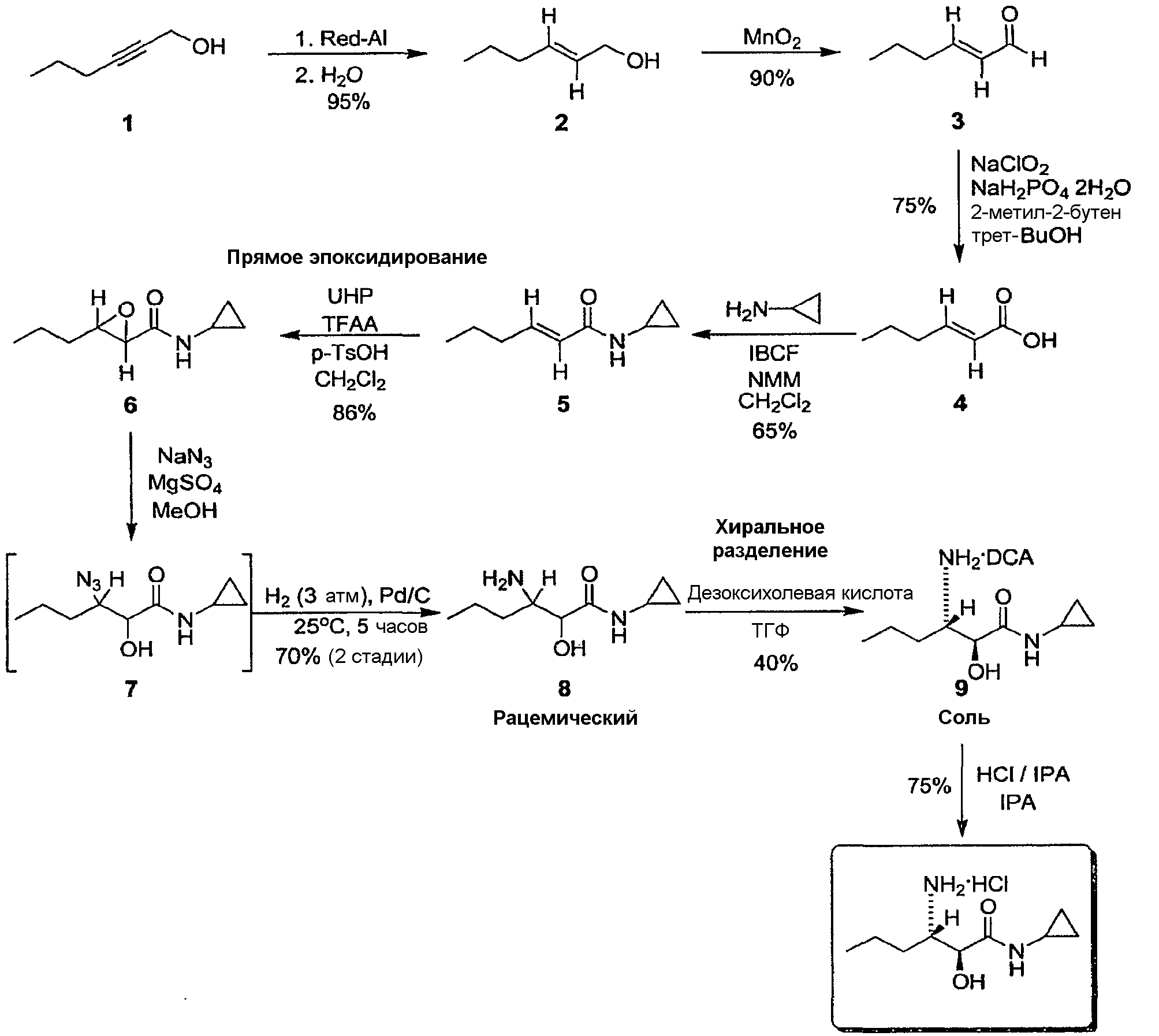
Стадия 1: Восстановление (транс-2-гексен-1-ол)
В трехгорлую 250-мл круглодонную колбу, снабженную механической мешалкой и обратным холодильником, загружали 2-гексин-1-ол (10 г, 0,1 моль) и ТГФ (100 мл, 10 об.). Полученную смесь охлаждали до 0±5°C и затем медленно добавляли Red-Al (65% в толуоле, 32 мл, 1,6 экв.) в атмосфере азота при температуре в пределах от 0°C до 20°C. Полученной смеси давали нагреться до 25°C и перемешивали в течение 5 часов. Реакционную смесь охлаждали до температуры -5±5°C и Н2O (8,2 г, 4 экв.) добавляли по каплям при температуре в пределах от 0°C до 15°C. К полученной смеси добавляли IPAC (50 мл, 5 об.) и насыщенный раствор NH4Cl (50 мл, 5 об.). После перемешивания смеси в течение 10 минут образовавшееся твердое вещество белого цвета отфильтровывали. Органический слой из фильтрата отделяли и водный слой экстрагировали при помощи IPAC (30 мл, 3 об.). Органические слои объединяли и промывали водой (30 мл, 3 об.), сушили над MgSO4 и концентрировали с получением продукта, т.е. соединения 2. Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 2: Окисление: MnO 2 (транс-2-гексен-1-аль)
В трехгорлую 250-мл круглодонную колбу, снабженную механической мешалкой, содержащую 2-гексен-1-ол-3d (10 г, 0,1 моль) в CH2Cl2 (150 мл, 15 об.), загружали активированный MnO2 (87 г, 10 экв.) при комнатной температуре. После интенсивного перемешивания в течение 1 часа добавляли еще одну порцию MnO2 (16 г, 2 экв.) и встряхивание продолжали в течение 4 часов. Реакционный раствор фильтровали через слой Цилита®. Растворитель удаляли в вакууме (25°C, 100 мм рт.ст.) с получением неочищенного альдегидного продукта (т.е. соединения 3). Неочищенный продукт использовали на следующей стадии без дополнительной очистки.
Стадия 3: Окисление: NaClO 2 (транс-2-гексененовая кислота)
В трехгорлую 500-мл круглодонную колбу, снабженную механической мешалкой и обратным холодильником, загружали 2-гексен-1-аль-3d (10 г, 0,1 моль), трет-BuOH (90 мл, 9 об.) и 2-метил-2-бутен (30 мл, 3 об.). К полученному раствору добавляли свежеприготовленный водный раствор NaClO2 (27,4 г, 3 экв.) и NaH2PO4 (62,9 г, 4 экв.) в воде (200 мл) в течение 30 минут. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор охлаждали до 0°C и добавляли к нему насыщенный водный раствор Na2SO3 до тех пор, пока реакционная смесь не становилась бесцветной. Перемешивание останавливали, органический слой отделяли и водный слой экстрагировали при помощи EtOAc (3 об. ×3). Органические слои объединяли и концентрировали в вакууме до тех пор, пока общий объем не составил 3 об. Полученный раствор экстрагировали 1 н. раствором NaOH (3 об. ×3) и оставшийся органический слой сливали. Объединенный водный раствор подкисляли 6 н. раствором HCl до тех пор, пока pH не достигал значения 1,0. Раствор экстрагировали при помощи CH2Cl2 (3 об. ×5). Объединенные органические слои сушили над MgSO4 и концентрировали с получением продукта (т.е. соединения 4).
Стадия 4: Амидирование ((E)-N-циклопропилгекс-2-енамид)
В трехгорлую 250-мл круглодонную колбу, снабженную механической мешалкой и обратным холодильником, загружали 2-гексеновую кислоту-3d (10 г, 0,09 моль), IBCF (13 г, 1,1 экв.) в CH2Cl2 (100 мл, 10 об.). Полученный раствор охлаждали до 0°C и медленно добавляли NMM (13,2 г, 1,5 экв.), контролируя при этом температуру в пределах от 0 до 20°C. Затем смеси давали нагреться до комнатной температуры и перемешивали в течение 1 часа. К полученному раствору добавляли циклопропиламин (5,9 г, 1,2 экв.) и раствор перемешивали в течение 2 часов. Реакционную смесь промывали 1 н. раствором NaOH (3 об. ×2), 1 н. раствором HCl (3 об. ×2) и насыщенным солевым раствором (3 об.) и водой (3 об.). Органический слой сушили над MgSO4 и концентрировали с получением неочищенного продукта в виде масла. Неочищенный продукт растворяли при помощи гептана (5 об.) и охлаждали до -78°C при перемешивании. Осажденное твердое вещество фильтровали и сушили с получением продукта (т.е. соединения 5).
Стадия 5: Эпоксидирование (N-циклопропил-3-пропилоксиран-2-карбоксамид)
В трехгорлую 250-мл круглодонную колбу, снабженную механической мешалкой и содержащую (E)-N-циклопропилгекс-2-енамид-3d 5 (10 г, 0,06 моль), пероксид мочевины-водорода (25 г, 4 экв.) и p-TsOH (12,3 г, 1 экв.) в CH2Cl2 (100 мл, 10 об.) при 0°C добавляли трифторуксусный ангидрид (40,9 г, 3 экв.) в CH2Cl2 (50 мл, 5 об.) в течение 30 минут. Реакционную смесь нагревали до температуры 40±5°C и перемешивали в течение 3 часов. После охлаждения до 0°C реакционную смесь гасили медленным добавлением 6 н. раствора NaOH (100 мл, 10 об.) и перемешивали в течение 30 минут. Органический слой отделяли и промывали насыщенным солевым раствором (5 об.) и водой (5 об.). Промытый органический слой сушили над MgSO4 и растворитель выпаривали с получением эпоксидного продукта (т.е. соединения 6), который использовали на следующей стадии без дополнительной очистки.
Стадия 6: Образование азида (3-азидо-N-циклопропил-2-гидроксигексанамид)
В трехгорлую 250-мл круглодонную колбу, снабженную механической мешалкой и обратным холодильником, содержащую эпоксид-3d 6 (10 г, 0,06 моль) и безводный сульфат магния (14,1 г, 2,0 экв.) в MeOH (100 мл, 10 об.), добавляли азид натрия (15,3 г, 4,0 экв.) одной порцией. Полученную смесь нагревали до температуры 65±5°C и перемешивали в течение 5 часов. Реакционную смесь охлаждали до комнатной температуры, добавляли IPAC (100 мл, 10 об.) и смесь перемешивали еще в течение 10 минут. Смесь фильтровали через слой Цилита® для удаления нерастворимых солей и полученный прозрачный раствор концентрировали до 3 об. К полученному раствору добавляли IPAC (170 мл, 17 об.) и смесь перемешивали еще в течение 10 минут. Снова раствор фильтровали через слой Целита® с получением продукта, азида-3d (т.е. соединения 7), в виде раствора в IPAC (около 200 мл), который использовали на следующей стадии без дополнительной очистки.
Стадия 7: Гидрирование (рацемический продукт)
В 500-мл реактор гидрирования, представляющий собой автоклав, снабженный механической мешалкой, содержащий азид-3d (т.е. соединение 7) (200 мл, 0,05 моль) в IPAC, полученный на предыдущей стадии, загружали Pd/C (10% Pd, содержание воды 50%, 0,8 г). В раствор вводили азот (1,0 атм) и затем выпускали, три раза, затем вводили водород (3,0 атм) и выпускали, три раза. В полученный раствор вводили водород (3 атм) и перемешивали в течение 5 часов. После высвобождения газообразного водорода раствор продували азотом в течение 5 минут. К полученному раствору добавляли MeOH (30 мл, 3 об.) и реакционную смесь нагревали до температуры 50±5°C. Реакционную смесь фильтровали через слой Цилита® с получением прозрачного раствора. Продукт выделяли концентрированием раствора при температуре 20±5°C до тех пор, пока не оставалось 3 об. раствора. Твердое вещество собирали фильтрованием, промывали (IPAC, 3 об.) и сушили с получением продукта (т.е. соединения 8).
Стадия 8: Разделение 3-амино-N-циклопропил-2-гидроксигексанамида
I. Образование соли
Дезоксихолевую кислоту (15,7 г, 0,75 экв.) загружали в трехгорлую 250-мл круглодонную колбу, снабженную механической мешалкой и содержащую рацемический 3-амино-N-циклопропил-2-гидроксигексанамид (10 г, 0,05 моль) в ТГФ (100 мл, 10 об.). Реакционную смесь нагревали до температуры 65±5°C и перемешивали в течение 1 часа при этой температуре. Полученную гомогенную смесь охлаждали до температуры 23±2°C в течение 1 часа и оставляли при температуре в указанных пределах в течение 1 часа. Осажденные твердые частицы собирали фильтрованием, промывали при помощи ТГФ (50 мл, 5 об.) и сушили с получением соли.
В трехгорлую 250-мл круглодонную колбу, снабженную механической мешалкой, загружали соль (полученную на предыдущей стадии) и 2-пропанол (62 мл, 5 об.). Раствор нагревали до температуры 75±5°C и медленно добавляли 5-6 н. раствор HCl в IPA (12 мл, 3 экв.) при интенсивном перемешивании. Полученный раствор перемешивали при указанной температуре в течение 1 часа и затем охлаждали до температуры 23±2°C. Реакционную смесь поддерживали при указанной температуре в течение 1 часа. Осажденные твердые частицы собирали фильтрованием, промывали 2-пропанолом (36 мл, 3 об.), сушили с получением гидрохлорида (2S,3S)-3-амино-N-циклопропил-2-гидроксигексанамида (энантиомерное отношение = 0:100).
Другие варианты воплощения
Должно быть понятно, что, хотя настоящее изобретение было представлено в связи с его подробным описанием, представленное выше описание изобретения предназначено для его иллюстрации и не ограничивает объем настоящего изобретения, который определяется объемом прилагаемой формулы изобретения. Другие аспекты, преимущества и модификации охватываются представленной ниже формулой изобретения.