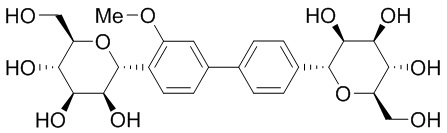
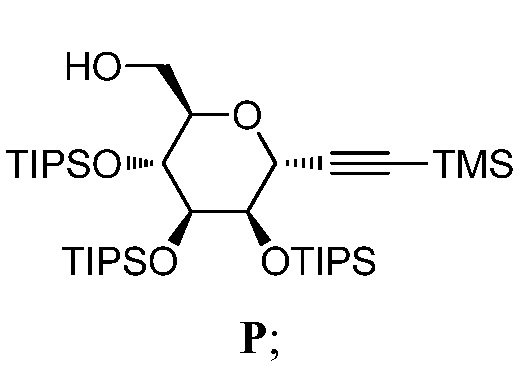
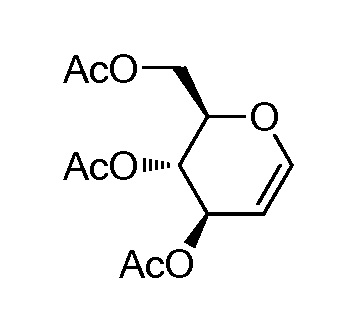
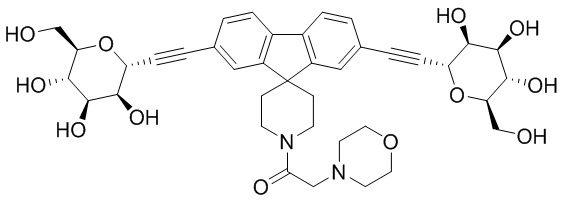
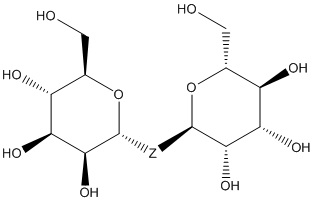
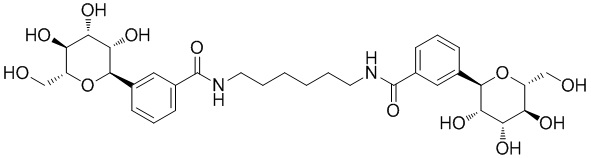
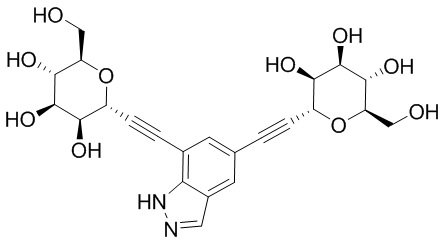
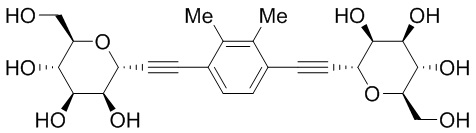
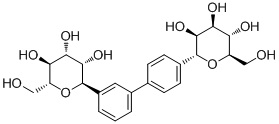
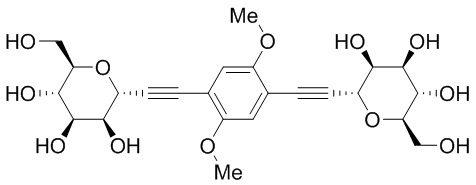
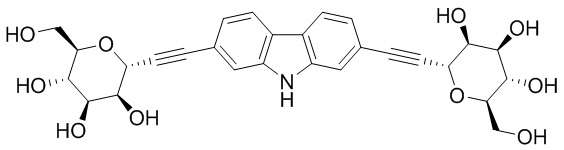
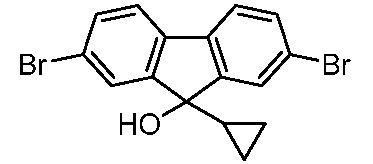
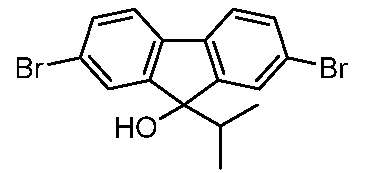
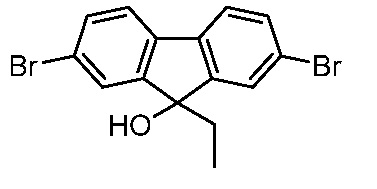
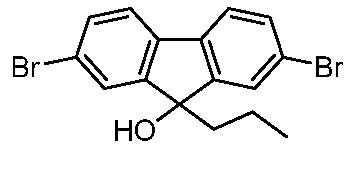
Результат интеллектуальной деятельности: ПРОИЗВОДНЫЕ МАННОЗЫ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ
Вид РИД
Изобретение
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящее изобретение, в соответствии с 35 USC § 119, заявляет приоритет предварительной заявки на патент США № 61/738620, заявленной 18 декабря 2012 года; предварительной заявки на патент США № 61/788241, заявленной 15 марта 2013 года; предварительной заявки на патент США № 61/874501, заявленной 6 сентября 2013 года; полное содержание каждой из указанных заявок введено в данное описание в виде ссылок.
ОПИСАНИЕ ФИГУР
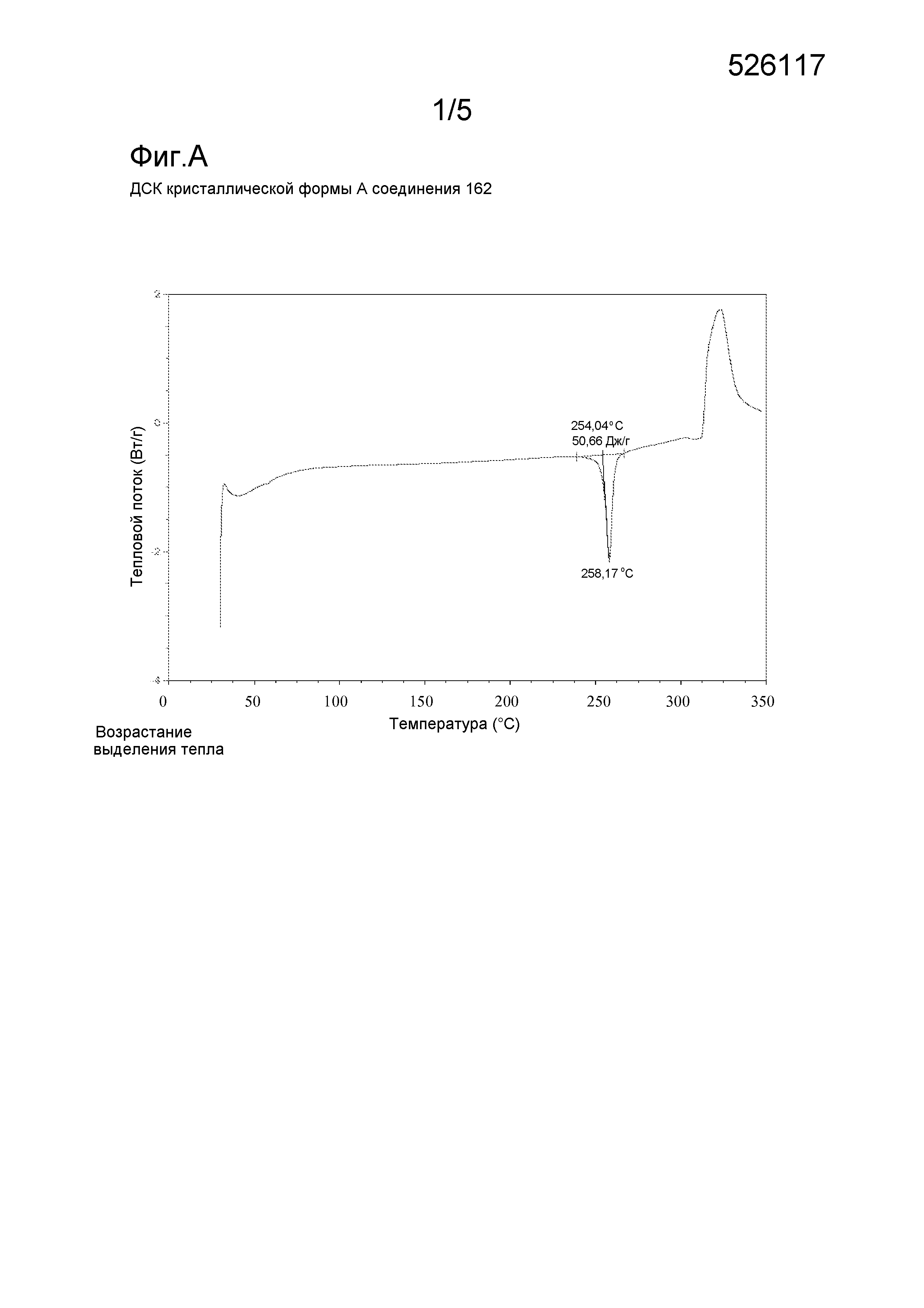
Фигура А: Дифференциальная сканирующая калориметрия (ДСК) кристаллической формы А соединения 162.
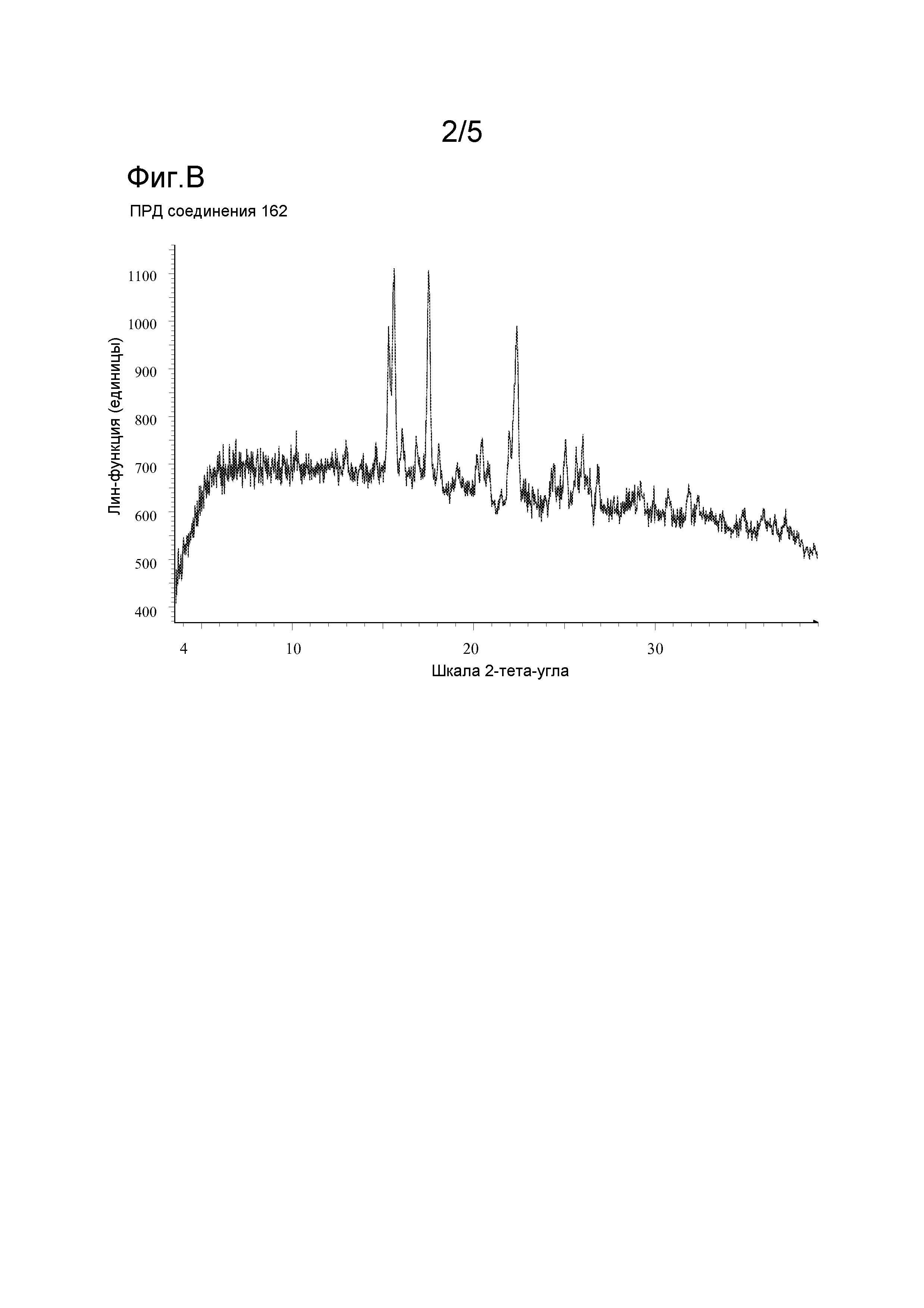
Фигура B: Порошковая рентгеновская дифрактограмма соединения 162.
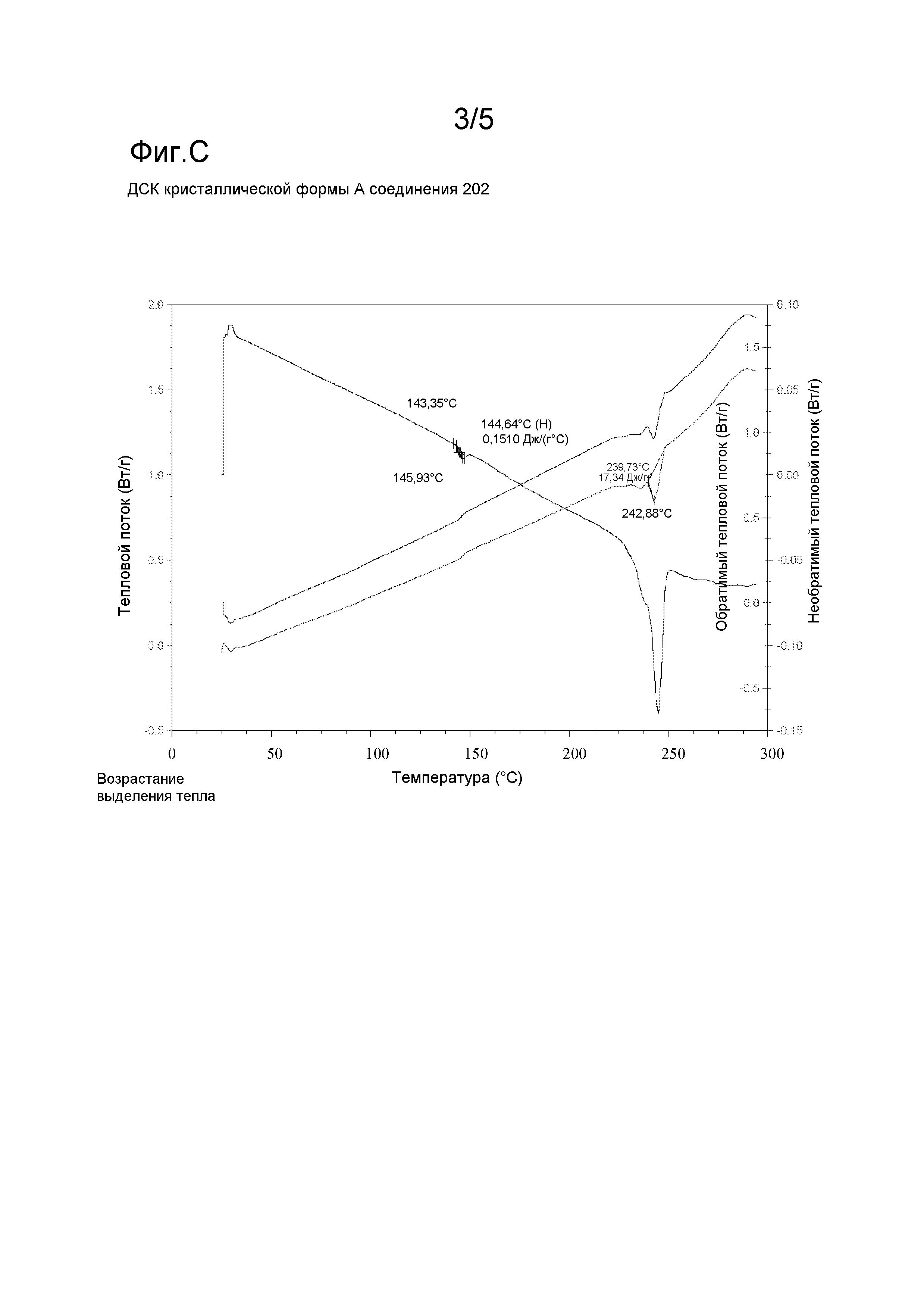
Фигура C: Дифференциальная сканирующая калориметрия (ДСК) кристалличекой формы А соединения 202.
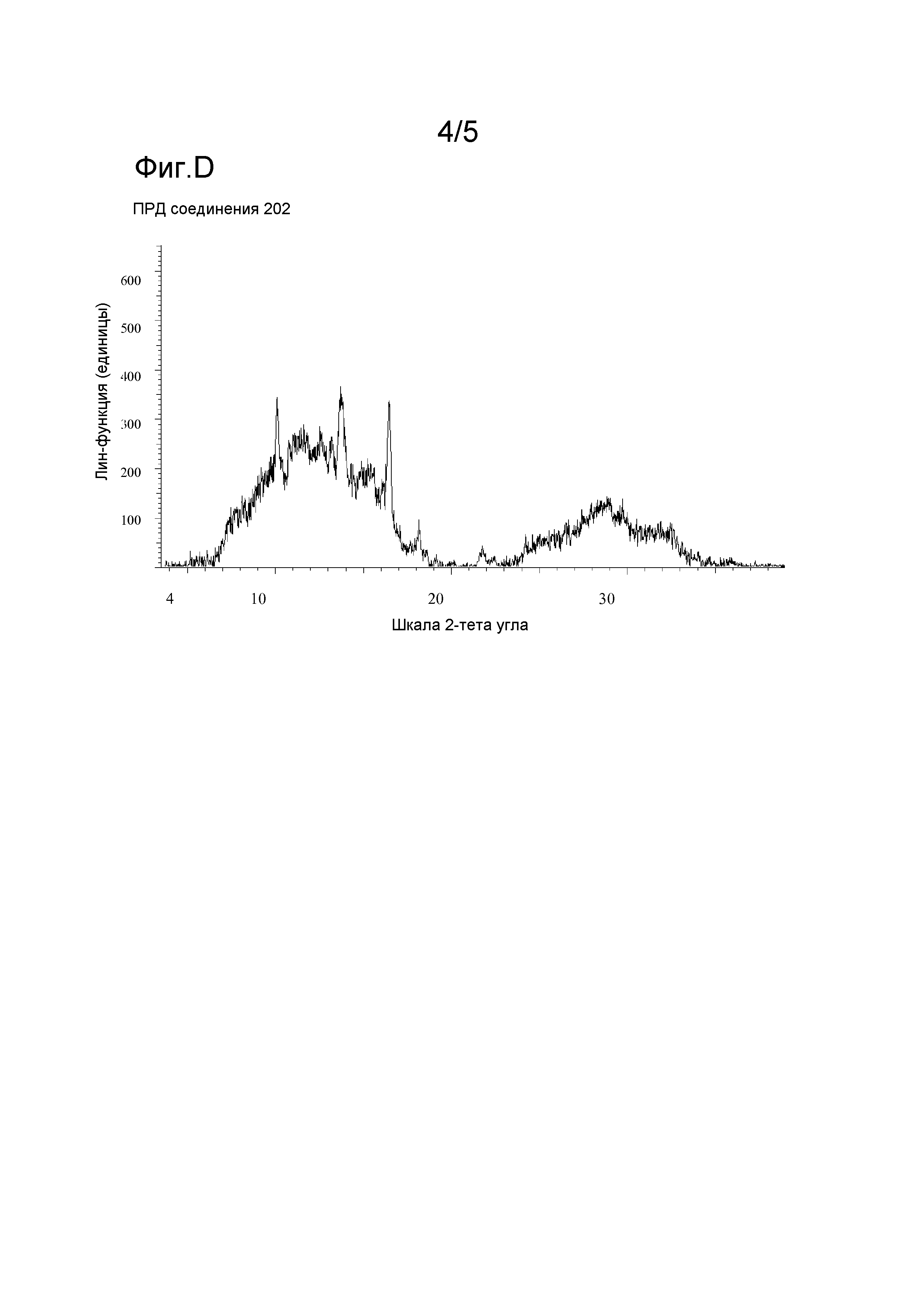
Фигура D: Порошковая рентгеновская дифрактограмма соединения 202.
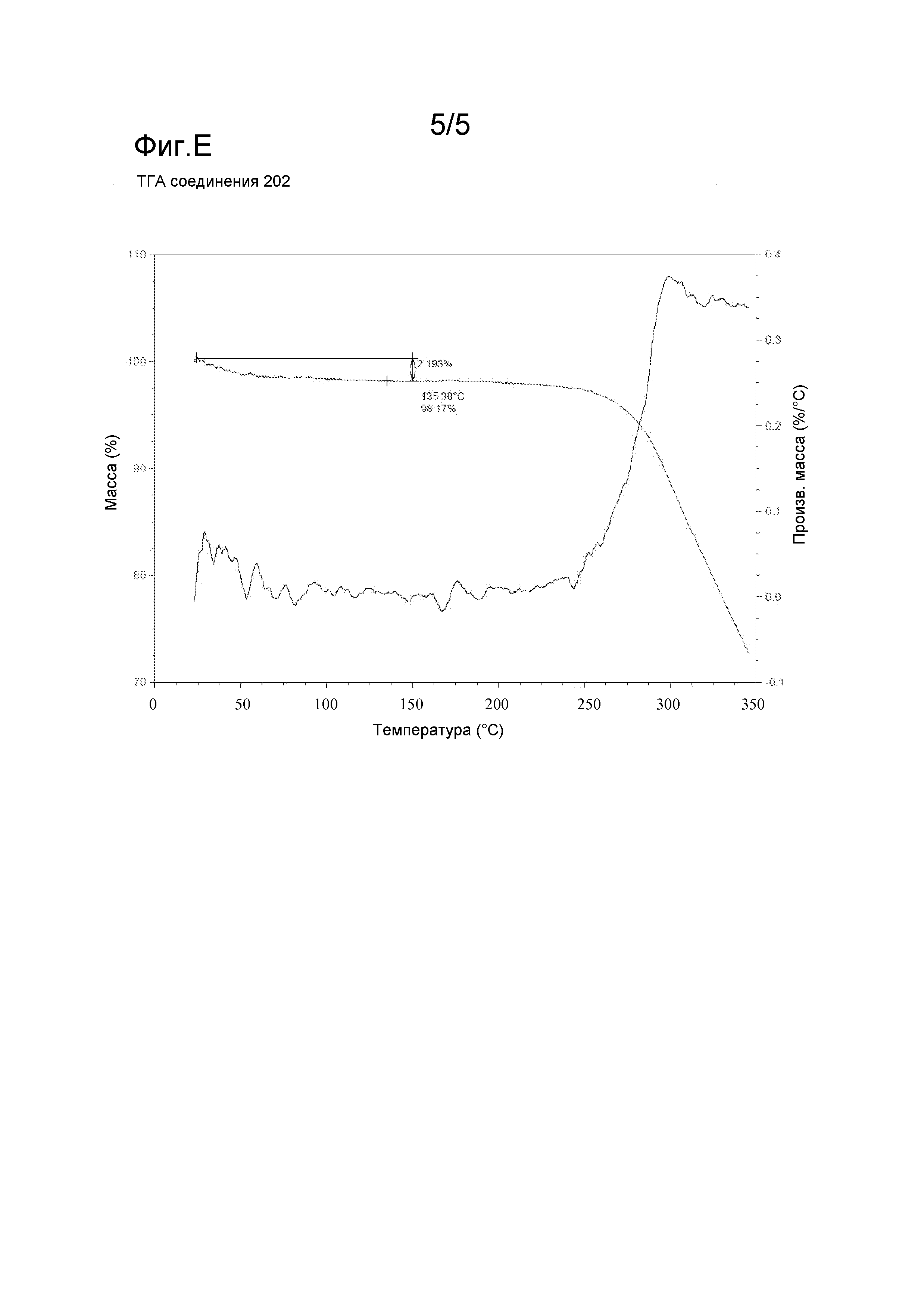
Фигура E: Термический гравиметрический анализ (ТГА) следовых количеств соединения 202.
УРОВЕНЬ ТЕХНИКИ
Воспалительная болезнь кишечника (Inflammatory bowel disease - IBD) представляет собой сложное хроническое воспалительное расстройство, двумя наиболее распространенными формами которого являются язвенный колит (ulcerative colitis - UC) и болезнь Крона (Crohn's disease - CD). IBD - многофакторное заболевание, которое является результатом сочетания факторов генетической предрасположенности, пускового механизма окружающей среды, дисбактериоза желудочно-кишечной микробиоты и патологической воспалительной реакции (Man et al. 2011, Nat. Rev. Gastroenterol Hepatol, Mar, 8(3): 152-68).
Некоторые исследования фекального биоценоза и биоценоза слизистой оболочки показали, что микробиота пациентов с болезнью Крона отличается от микробиоты здоровых контрольных пациентов, а также пациентов с язвенным колитом (UC). Хотя описанные изменения не всегда являются согласующимися, у пациентов с CD количество Escherichia coli, как правило, возрастает, в то время как содержание Firmicutes снижается (Peterson et al., 2008, Cell Host Microbe, 3: 17-27; Frank et al., 2007, Proc. Natl. Acad. Sci., 104: 13780-13785). Являются ли эти изменения причинными факторами, или они представляют последствия воспаления, остается дискуссионным вопросом. На сегодняшний день в качестве возбудителей рассматриваются несколько болезнетворных организмов. В частности сообщалось, что в некоторых странах (Великобритания, Франция и США) энтероадгезивная/инвазивная E. coli (adherent-invasive e. coli - AIEC) у пациентов с CD обнаруживается чаще, чем в контрольной группе (Darfeuille-Michaud et al., 2004, Gastroenterology, 127:412-421; Martinez-Medina et al., 2009, Inflamm Bowel Dis., 15:872-882). AIEC штаммы были выделены у ~35% пациентов с CD из поражений, связанных с непроходимостью кишечника, и лишь у ~5% здоровых пациентов. Одной из отличительных особенностей AIEC является их способность сцепляться с эпителиальными клетками и внедряться в них. Из различных моделей известно, что связывание адгезинов, экспрессированных на бактериальной клеточной поверхности, с определенными гликозилированными рецепторами на поверхности ткани хозяина считается начальным и важным шагом в патогенезе, открывающим новые возможности для терапии, такой как блокирование взаимодействия пилий 1 типа и CEACAM6, известного рецептора хозяина для FimH (Barnich et al., 2007, J. Clin. Invest., 117: 1566-1574; Carvalho et al., 2009, JEM, vol. 206, no. 10, 2179-2189). Таким образом, ингибирование адгезии и, как следствие этого, внутриклеточной репликации AIEC в эпителиальных клетках может предотвратить инфицирование подслизистой оболочки, которая приводит к воспалению слизистой оболочки и разрушению эпителиального барьера.
Кроме того, в последнее время было показано, что FimH антагонисты потенциально эффективны в лечении инфекций мочевых путей (J. Med. Chem. 2010, 53, 8627-8641).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет соединения, применимые для лечения или предотвращения бактериальных инфекций, таких как инфекции мочевых путей (urinary tract infection - UTI) и воспалительная болезнь кишечника (IBD).
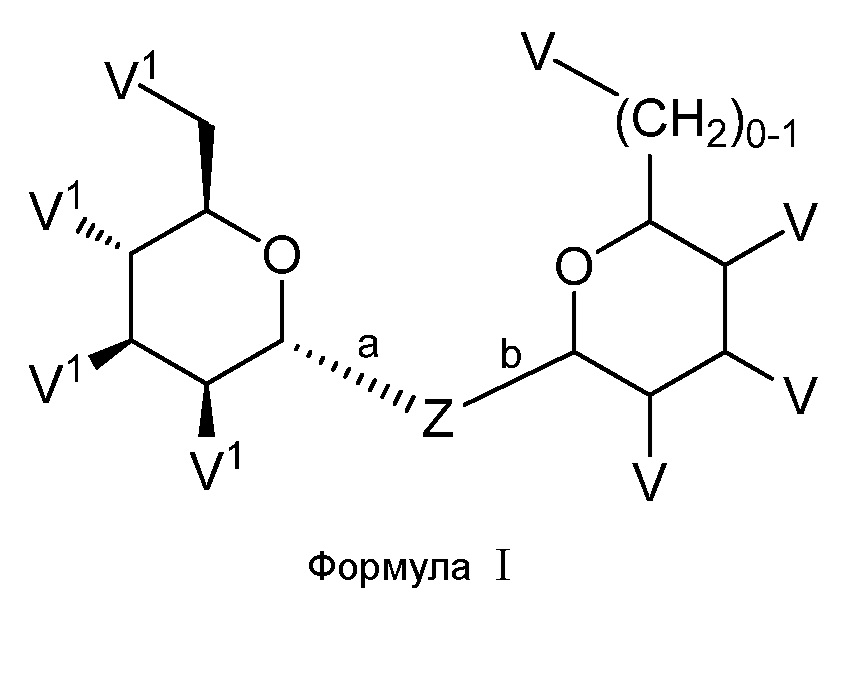
Соединения по настоящему изобретению представлены структурной формулой (I) или представляют собой их фармацевтически приемлемые соли:
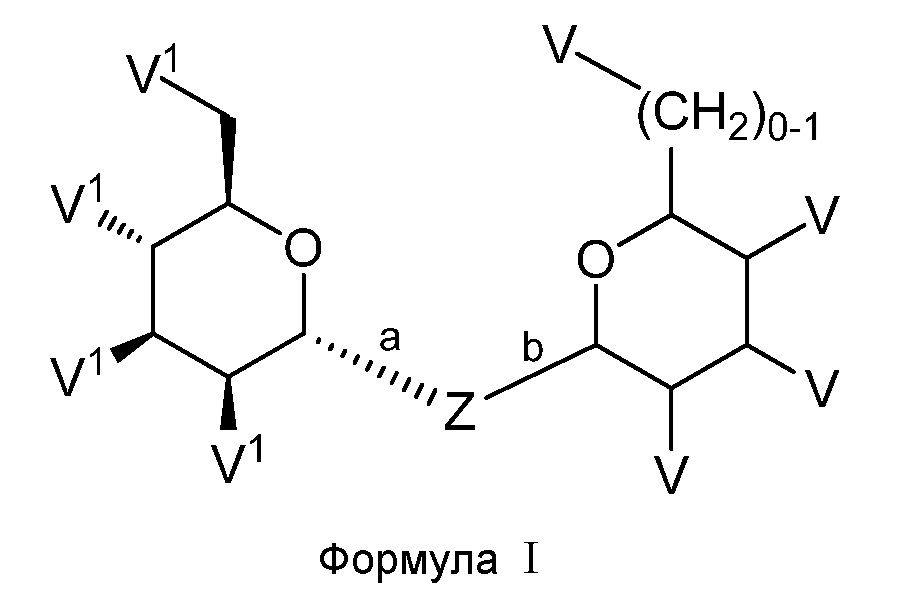 ,
,
где V1, Z и V принимают значения, определенные в данном описании.
Настоящее изобретение также относится к композиции, содержащей соединение, описанное в данном документе, и фармацевтически приемлемый носитель, адъювант или наполнитель.
Настоящее изобретение также предоставляет способ лечения или предотвращения бактериальной инфекции у субъекта, включающий введение субъекту эффективного количества соединения или композиции, описанной в данном документе. Настоящее изобретение также предоставляет способы получения соединений по настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям, применимым для лечения или предотвращения бактериальных инфекций, таких как инфекции мочевых путей (ИМП) и воспалительные заболевания кишечника (IBD).
Один аспект настоящего изобретения предоставляет соединение формулы I или его фармацевтически приемлемую соль:
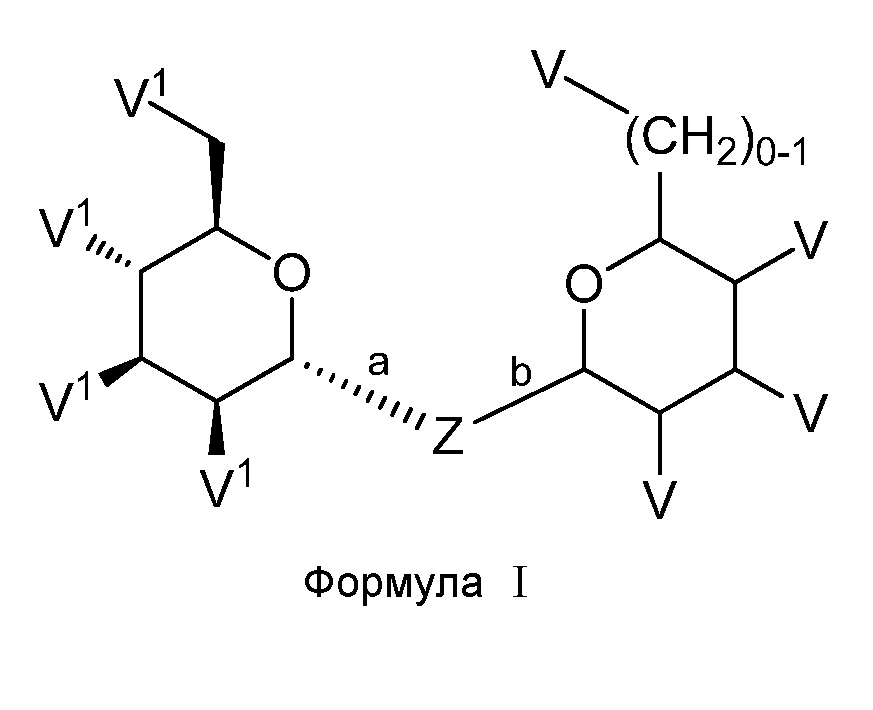 ,
,
где
V1 представляет собой галоген, NH2, ОН или SH;
V представляет собой Н, галоген, -OR7, -NR5R6, -SR7 или C1-C6 алифатическую группу;
R5 представляет собой -Н; Х5; Q5; Х5-Q5; -C(O)R9; -C(O)NHR9 или -C(O)OR 9;
R6 представляет собой -Н; Х6; Q6; Х6-Q6; -C(O)R9; -C(O)NHR9 или -C(O)OR9;
R7 представляет собой -Н; Х7; Q7; Х7-Q7; -C(O)R9 или -C(O)NHR9;
R9 представляет собой -Н; Х9; Q9 или Х9-Q9;
каждый Х5, Х6, Х7 и Х9 независимо представляет собой C1-C6 алифатическую группу, необязательно замещенную 1-3 атомами галогенов;
каждый Q5, Q6, Q7 и Q9 независимо представляет собой С6-C10 арил, 5-10-членный гетероарил, С3-С8 циклоалифатическую группу или 3-12-членный гетероциклил; где указанные Q5, Q6, Q7 и Q9 являются независимо и необязательно замещенными 1-6 заместителями J;
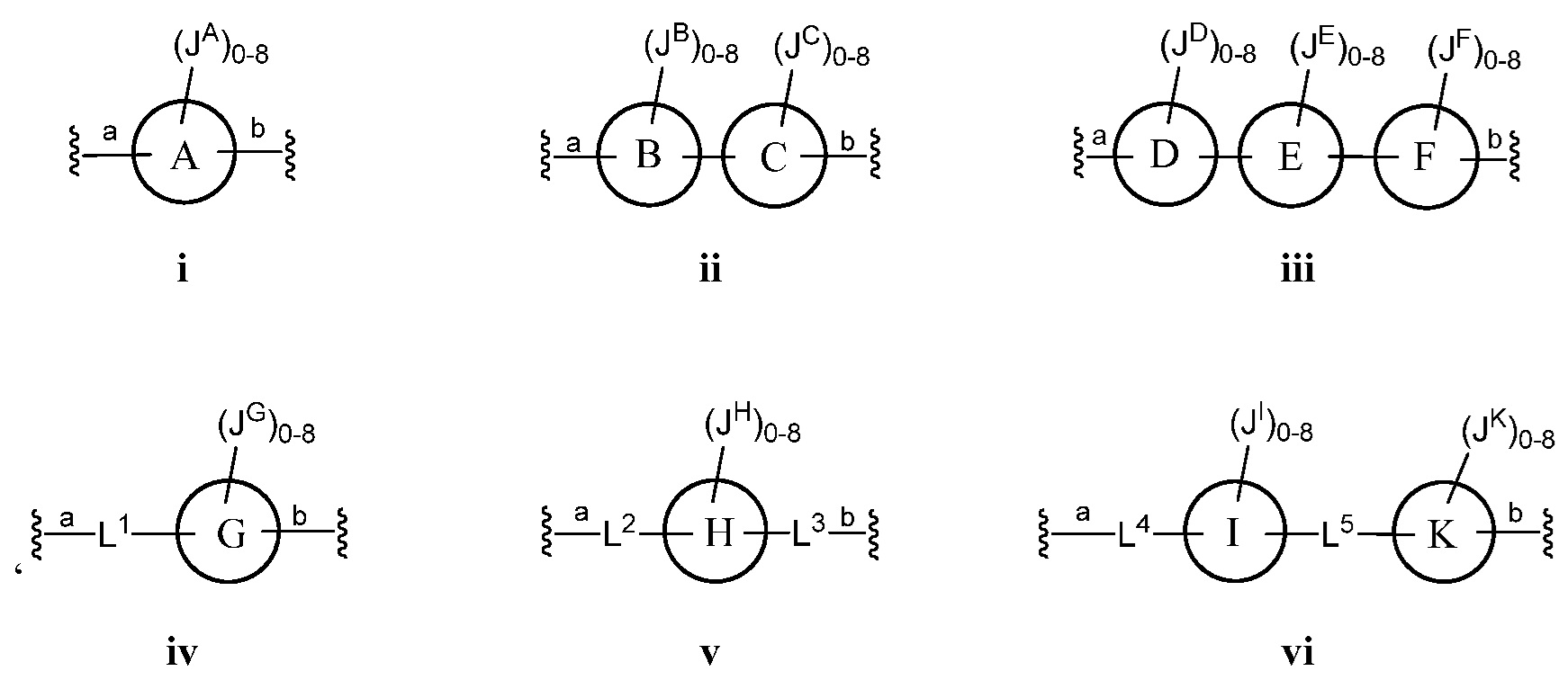
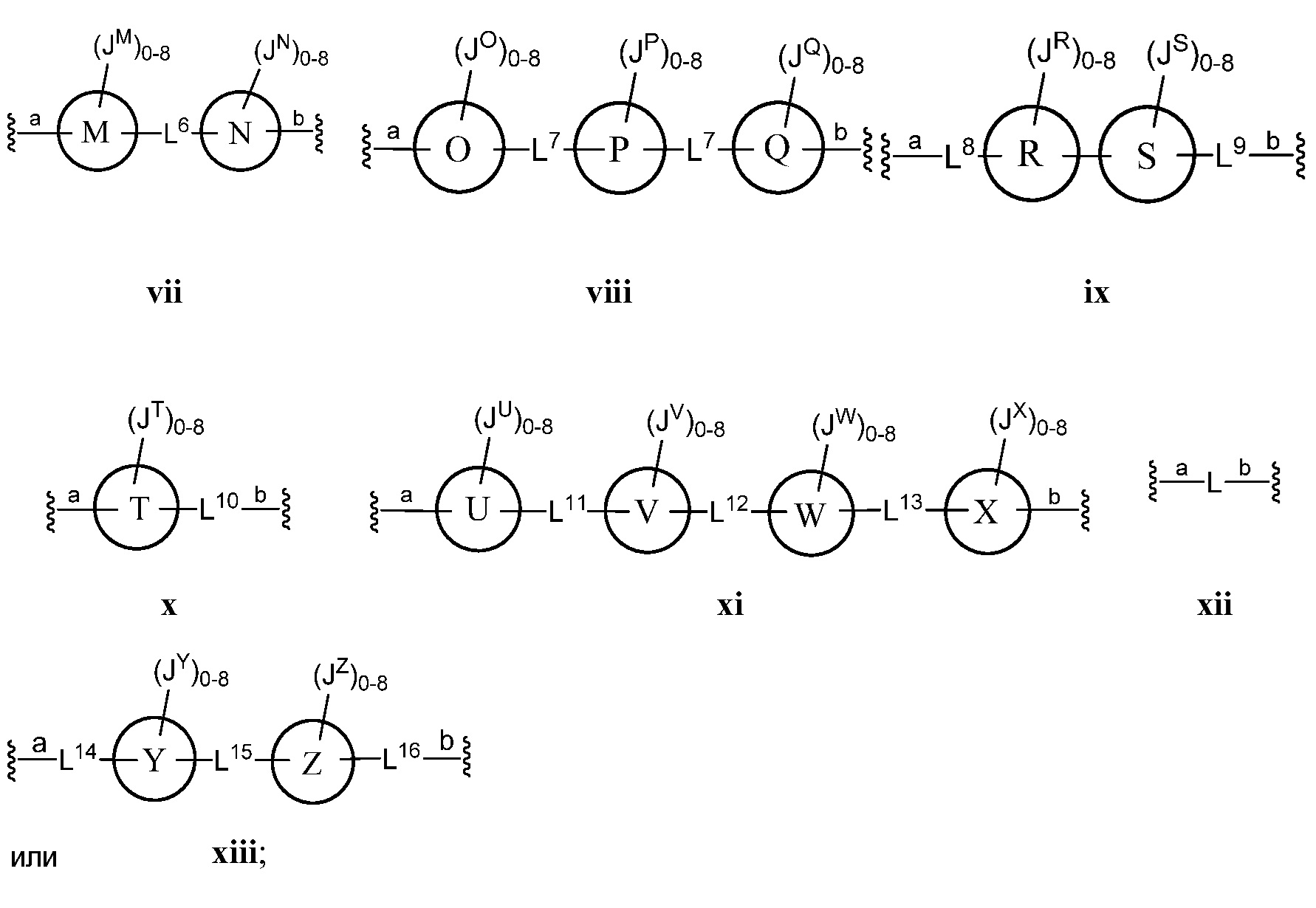
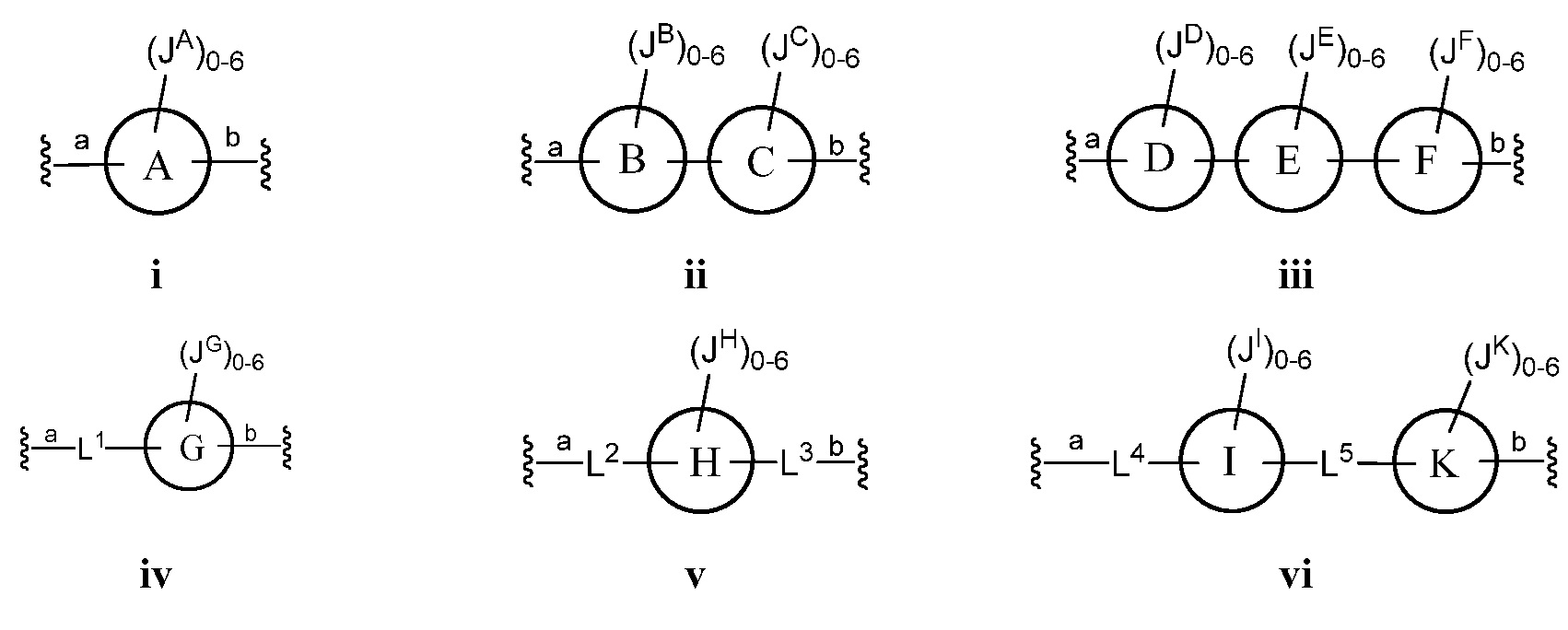
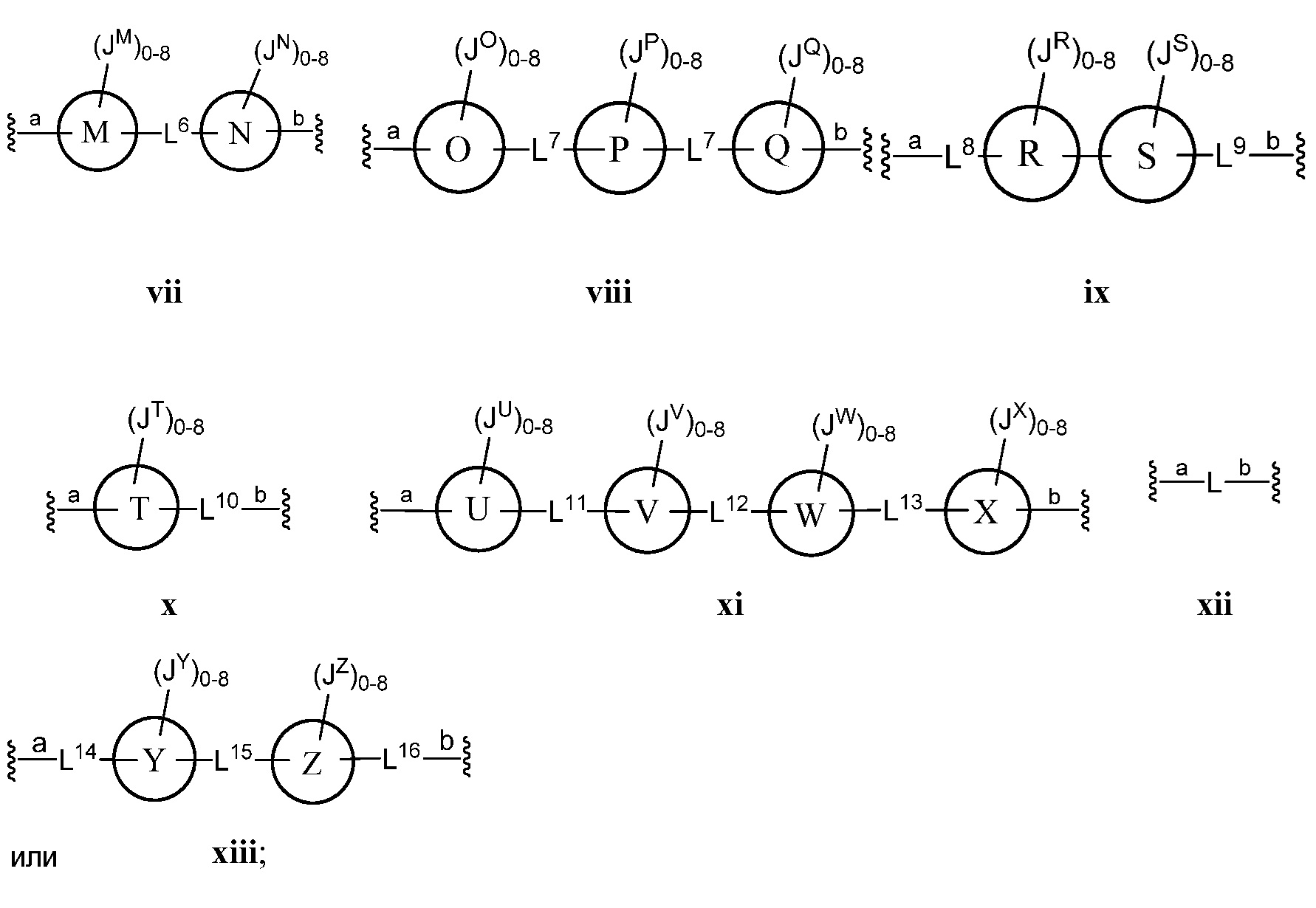
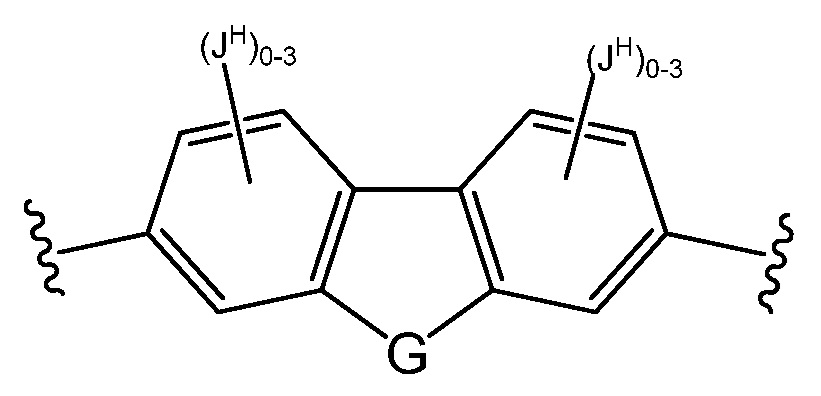
Z представляет собой
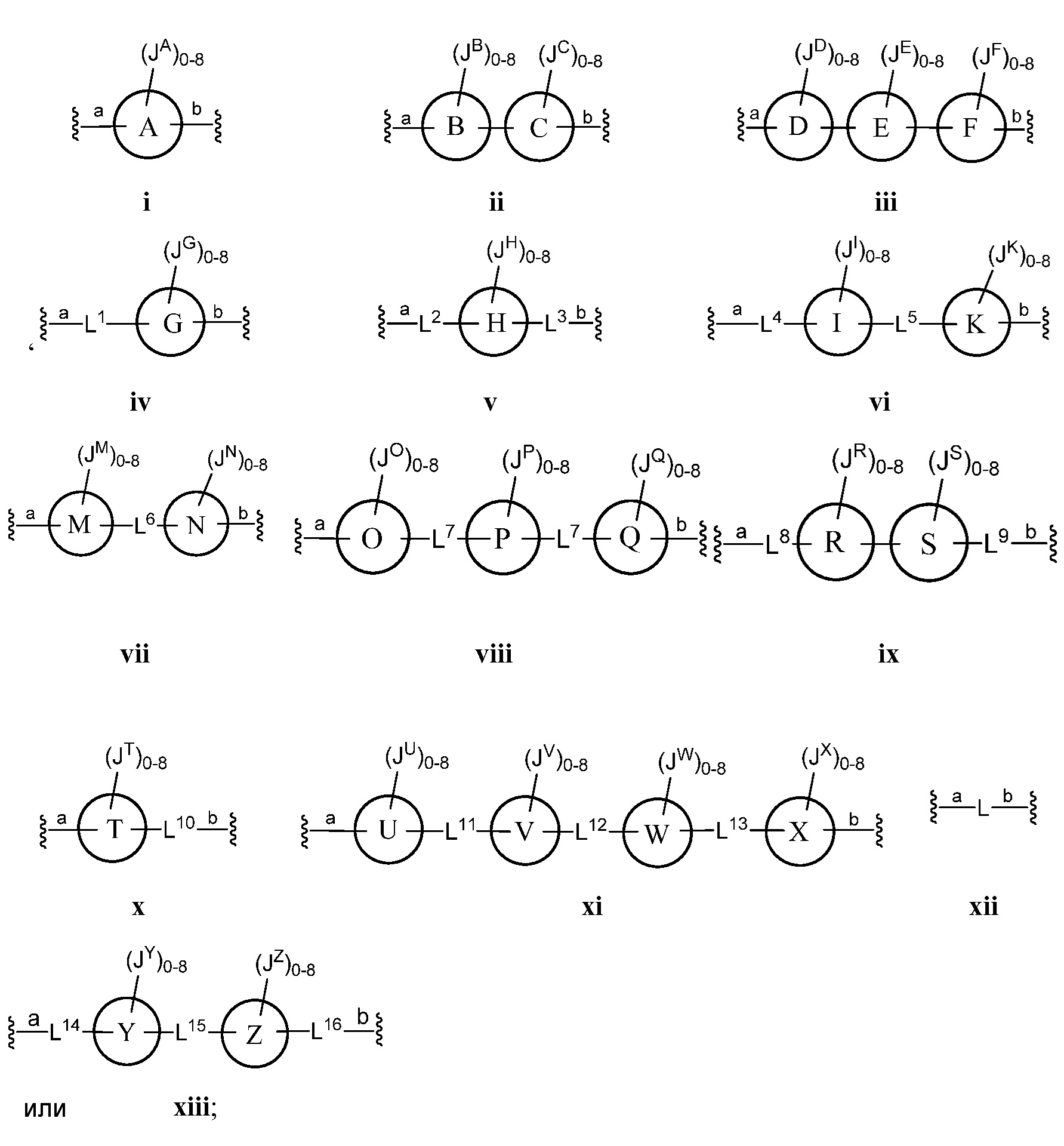
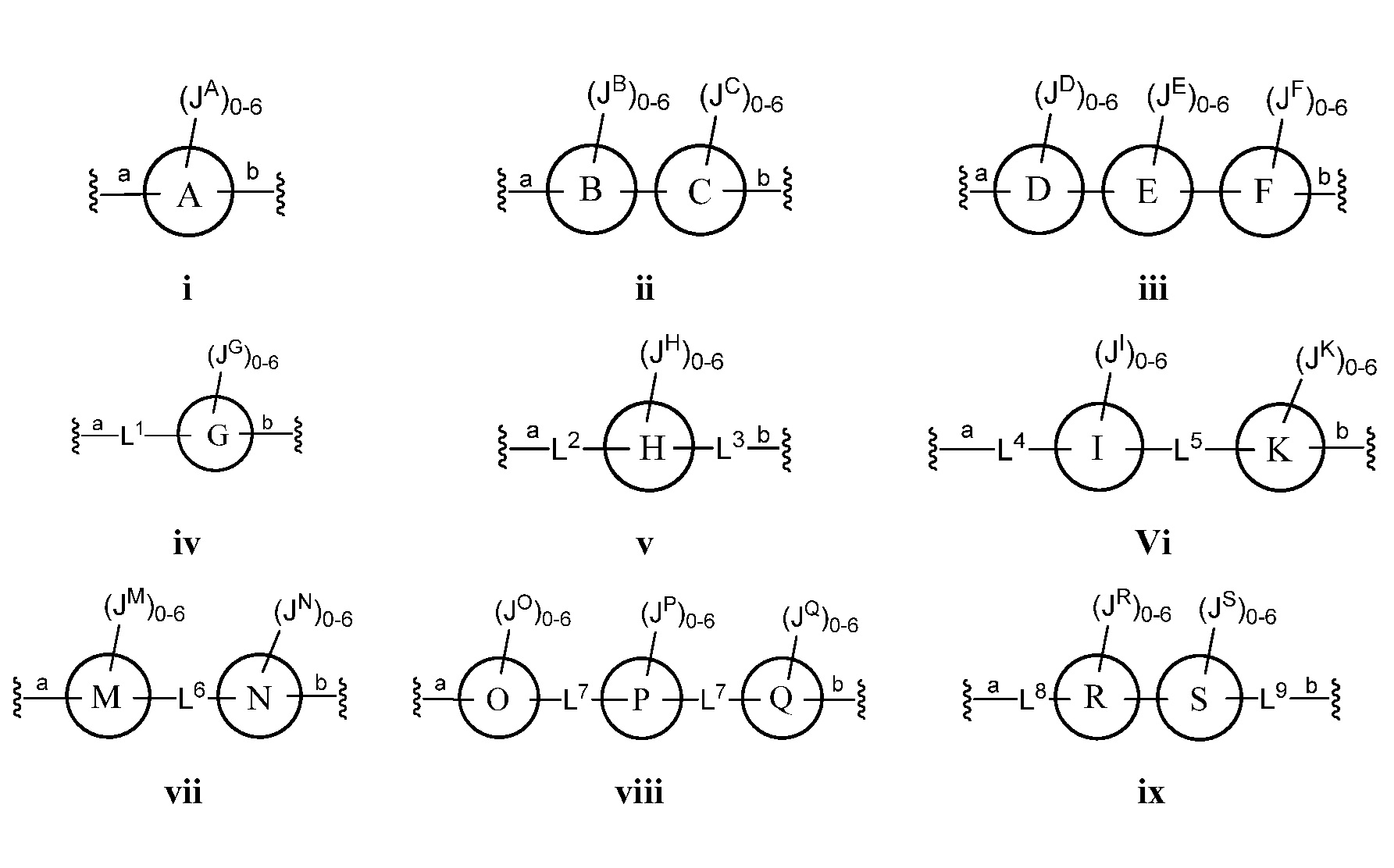
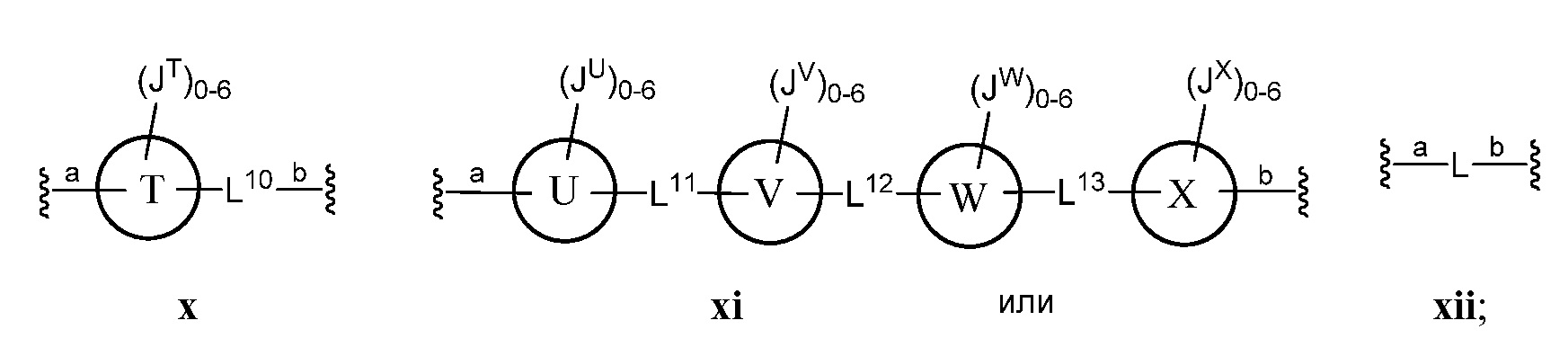
где кольца A, B, C, D, E, F, G, H, I, K, M, N, O, P, Q, R, S, Т, U, V, W, X, Y и Z, каждое независимо, представляют собой 5-6-членное насыщенное, полностью ненасыщенное, частично ненасыщенное или ароматическое моноциклическое кольцо, необязательно содержащее 1-4 гетероатома, выбранных из атомов кислорода, азота или серы; 8-12-членное насыщенное, полностью ненасыщенное, частично ненасыщенное или ароматическое бициклическое кольцо, необязательно содержащее 1-6 гетероатомов, выбранных из атомов кислорода, азота или серы; или 10-14-членное насыщенное, полностью ненасыщенное, частично ненасыщенное или ароматическое трициклическое кольцо, необязательно содержащее 1-6 гетероатомов, выбранных из атомов кислорода, азота или серы;
L представляет собой -X Y, где Х представляет собой C1 алифатическую группу или -C(O)-, и Y представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-6 алифатическая группа); L является необязательно замещенным 1-3 атомами галогенов;
Y, где Х представляет собой C1 алифатическую группу или -C(O)-, и Y представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-6 алифатическая группа); L является необязательно замещенным 1-3 атомами галогенов;
L1 представляет -X1 Y1-, где Х1 представляет собой C1 алифатическую группу или -С(O)-, и Y1 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-6 алифатическая группа); L1 является необязательно замещенным 1-3 атомами галогенов;
Y1-, где Х1 представляет собой C1 алифатическую группу или -С(O)-, и Y1 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-6 алифатическая группа); L1 является необязательно замещенным 1-3 атомами галогенов;
L2 представляет собой -X2 Y2-, где Х2 представляет собой C1 алифатическую группу или -C(O)-, и Y2 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-6 алифатическая группа); L2 является необязательно замещенным 1-3 атомами галогенов;
Y2-, где Х2 представляет собой C1 алифатическую группу или -C(O)-, и Y2 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-6 алифатическая группа); L2 является необязательно замещенным 1-3 атомами галогенов;
каждый L3, L5 и L16 независимо представляет собой C1-C12 алифатическую группу, в которой до трех метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-6 алифатическая группа); каждый L3, L5 и L16 независимо является необязательно замещенным 1-3 атомами галогенов;
L4 представляет -X4 Y4-, где Х4 представляет собой C1 алифатическую группу или -С(O)-, и Y4 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C6 алифатическая группа); L4 является необязательно замещенным 1-3 атомами галогенов;
Y4-, где Х4 представляет собой C1 алифатическую группу или -С(O)-, и Y4 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C6 алифатическая группа); L4 является необязательно замещенным 1-3 атомами галогенов;
L6 представляет собой C1-C15 алифатическую группу, в которой до шести метиленовых звеньев необязательно замещены на группы О, NH, N(C1-С6 алифатическая группа), S, -С(O)-, S(O) или S(O)2; L6 является необязательно замещенным 1-3 атомами галогенов;
каждый L7 и L9 независимо представляет собой C1-C6 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C4 алифатическая группа); каждый L7 и L9 независимо является необязательно замещенным 1-3 атомами галогенов;
L8 представляет собой -X8 Y8-, где Х8 представляет собой C1 алифатическую группу, и Y8 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C6 алифатическая группа); L8 является необязательно замещенным 1-3 атомами галогенов;
Y8-, где Х8 представляет собой C1 алифатическую группу, и Y8 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C6 алифатическая группа); L8 является необязательно замещенным 1-3 атомами галогенов;
L10 представляет собой C1-C6 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы О, NH, N(C1-C6 алифатическая группа), S или -C(O)-; L10 является необязательно замещенным 1-3 атомами галогенов;
L11 представляет собой C1-C6 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы О, NH, N(C1-C10 алифатическая группа), S или -C(O)-; L11 является необязательно замещенным 1-3 атомами галогенов;
L12 представляет собой C1-C6 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы О, NH, N(C1-C6 алифатическая группа), S или -C(O)-; L12 является необязательно замещенным 1-3 атомами галогенов;
L13 представляет собой C1-C6 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы О, NH, N(C1-C6 алифатическая группа), S или -C(O)-; L13 является необязательно замещенным 1-3 атомами галогенов;
L14 представляет собой -X14 Y14-, где Х14 представляет собой C1 алифатическую группу, и Y14 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C6 алифатическая группа); L14 является необязательно замещенным 1-3 атомами галогенов;
Y14-, где Х14 представляет собой C1 алифатическую группу, и Y14 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C6 алифатическая группа); L14 является необязательно замещенным 1-3 атомами галогенов;
L15 представляет собой C1-C6 алифатическую группу;
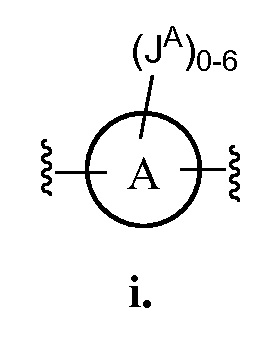
каждый J, JA, JB, JC, JD, JE, JF, JG, JH, JI, JK, JM, JN, JO, JP, JQ, JR, JS, JT, JU, JV, JX, JY и JZ независимо представляет собой галоген, -CN, -NO2, XJ, QJ или XJ-QJ; или две группы из J, JA, JB, JC, JD, JE, JF, JG, JH, JI, JK, JM, JN, JO, JP, JQ, JR, JS, JT, JU, JV, JW, JX, JY или JZ, присоединенные к одному и тому же атому углерода, вместе с атомом углерода, к которому они присоединены, необязательно образуют -C=N-OH, -C(O)- или кольцо HH;
кольцо НН представляет собой 3-8-членное насыщенное моноциклическое кольцо, содержащее 0-2 гетероатома, выбранных из атомов кислорода, азота или серы; необязательно замещенное 1-4 заместителями JHH;
JHH представляет собой галоген, CN, оксо, XJ, QJ или XJ-QJ;
XJ представляет собой C1-C10 алифатическую группу, в которой до 4 метиленовых звеньев необязательно замещены на группы -O-, -NH, N(C1-C6 алифатическая группа), -S-, -С(O)-, -C(=NOH)-, -S(O)-, -S(O)2-, P или P(O); XJ является необязательно замещенным 0-6 заместителями, выбранными из атомов галогенов, ОН или C1-C4 алкила; или является необязательно замещенным 0-1 группой CN;
QJ представляет собой 3-7-членное моноциклическое насыщенное, полностью ненасыщенное, частично ненасыщенное или ароматическое кольцо, необязательно содержащее 1-4 гетероатома, выбранных из атомов кислорода, азота или серы; или 8-12-членное насыщенное, полностью ненасыщенное, частично ненасыщенное или ароматическое кольцо, необязательно содержащее 1-6 гетероатомов, выбранных из атомов кислорода, азота или серы; где каждый QJ необязательно замещен 1-6 группами, выбранными из атомов галогенов, оксо, CN или C1-6 алкила, в котором до 2 метиленовых звеньев необязательно замещены на группы -O-, -NH, N(C1-6 алифатическая группа), -S-, -C(O)-, -S(O)- или -S(O)2-;
при условии, что в некоторых вариантах осуществления настоящего изобретения Z не является группой СН2СН2,
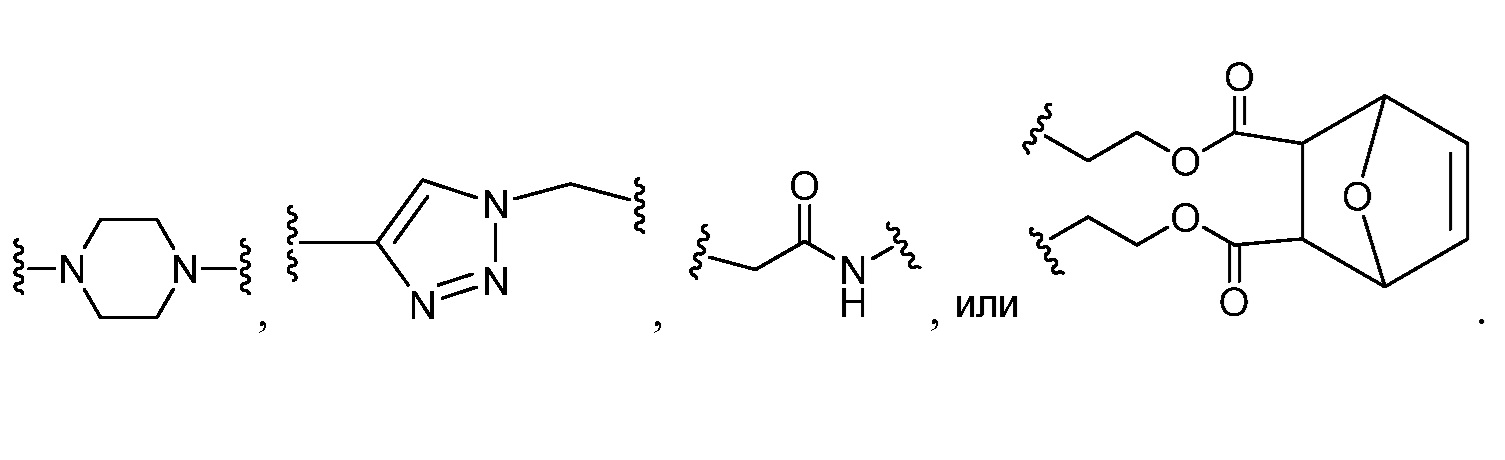
Следует представлять, что а и b обозначают связи и указывают на специфическую связь и стереохимию связи, присоединяющей кольцо сахара к группе Z. Следует также представлять, что если X, X1, X2, X4, X8 и Х14 представляют собой С(O), то связь между X и Y; Х1 и Y1; Х2 и Y2; Х4 и Y4; Х8 и Y8 и Х14 и Y14, соответственно, представляет собой одинарную связь. Когда X, X1, X2, X4, X8 и X14 представляет собой C1 алифатическую группу, тогда связь между X и Y; Х1 и Y1; Х2 и Y2; Х4 и Y4; Х8 и Y8 и Х14 и Y14, соответственно, будет изменяться в зависимости от природы X, X1, X2, X4, X8 и X14. Например, если Х представляет собой «CH», то связь между X и Y является двойной связью с образованием группы -СН=Y.
Другой аспект настоящего изобретения предоставляет соединение формулы I или его фармацевтически приемлемую соль:
 ,
,
где
V1 представляет собой галоген, NH2, ОН или SH;
V представляет собой Н, галоген, -OR7, -NR5R6, -SR7 или C1-C6 алифатическую группу;
R5 представляет собой -Н; Х5; Q5; Х5-Q5; -C(O)R9; -C(O)NHR9 или -C(O)OR9;
R6 представляет собой -Н; Х6; Q6; Х6-Q6; -C(O)R9; -C(O)NHR9 или -C(O)OR9;
R7 представляет собой -Н; Х7; Q7; Х7-Q7; -C(O)R9 или -C(O)NHR9;
R9 представляет собой -Н; Х9; Q9 или Х9-Q9;
каждый Х5, Х6, Х7 и Х9 независимо представляет собой C1-C6 алифатическую группу, необязательно замещенную 1-3 атомами галогенов;
каждый Q5, Q6, Q7 и Q9 независимо представляет собой С6-C10 арил, 5-10-членный гетероарил, С3-С8 циклоалифатическую группу или 3-12-членный гетероциклил; где указанные Q5, Q6, Q7 и Q9 являются независимо и необязательно замещенными 1-6 заместителями J;
Z представляет собой
где кольца А, В, С, D, Е, F, G, H, I, K, M, N, O, P, Q, R, S, Т, U, V, W и X, каждое независимо, представляют собой 5-6-членное, полностью ненасыщенное, частично ненасыщенное или моноциклическое ароматическое кольцо, необязательно содержащее 1-4 гетероатома, выбранных из атомов кислорода, азота или серы; 8-12-членное полностью ненасыщенное, частично ненасыщенное или ароматическое бициклическое кольцо, необязательно содержащее 1-6 гетероатомов, выбранных из атомов кислорода, азота или серы; или 10-14-членное полностью ненасыщенное, частично ненасыщенное или ароматическое трициклическое кольцо, необязательно содержащее 1-6 гетероатомов, выбранных из атомов кислорода, азота или серы;
L представляет собой -X Y, где Х представляет собой C1 алифатическую группу или -C(O)-, и Y представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или NH(C1-C6 алифатическая группа); L является необязательно замещенным 1-3 атомами галогенов;
Y, где Х представляет собой C1 алифатическую группу или -C(O)-, и Y представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или NH(C1-C6 алифатическая группа); L является необязательно замещенным 1-3 атомами галогенов;
L1 представляет собой -X1 Y1-, где Х1 представляет собой C1 алифатическую группу или -С(O)-, и Y1 представляет собой C1--C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C6 алифатическая группа); L1 является необязательно замещенным 1-3 атомами галогенов;
Y1-, где Х1 представляет собой C1 алифатическую группу или -С(O)-, и Y1 представляет собой C1--C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C6 алифатическая группа); L1 является необязательно замещенным 1-3 атомами галогенов;
L2 представляет собой -X2 Y2-, где Х2 представляет собой C1 алифатическую группу или -C(O)-, и Y2 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C6 алифатическая группа); L2 является необязательно замещенным 1-3 атомами галогенов;
Y2-, где Х2 представляет собой C1 алифатическую группу или -C(O)-, и Y2 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C6 алифатическая группа); L2 является необязательно замещенным 1-3 атомами галогенов;
каждый L3 и L5 независимо представляет собой C1-C12 алифатическую группу, в которой до трех метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C6 алифатическая группа); каждый L3 и L5 является независимо и необязательно замещенным 1-3 атомами галогенов;
L4 представляет собой -X4 Y4-, где Х4 представляет собой C1 алифатическую группу или -С(O)-, и Y4 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C6 алифатическая группа); L4 является необязательно замещенным 1-3 атомами галогенов;
Y4-, где Х4 представляет собой C1 алифатическую группу или -С(O)-, и Y4 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C6 алифатическая группа); L4 является необязательно замещенным 1-3 атомами галогенов;
L6 представляет C1-C15 алифатическую группу, в которой до шести метиленовых звеньев необязательно замещены на группы О, NH, N(C1-C6 алифатическая группа), S, -C(O)-, -S(O) или S(O)2; L6 является необязательно замещенным 1-3 атомами галогенов;
каждый L7 и L9 независимо представляет собой C1-C6 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C4 алифатическая группа); каждый L7 и L9 является независимо и необязательно замещенным 1-3 атомами галогенов;
L8 представляет собой -X8 Y8-, где Х8 представляет собой C1 алифатическую группу, и Y8 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C6 алифатическая группа); L8 является необязательно замещенным 1-3 атомами галогенов;
Y8-, где Х8 представляет собой C1 алифатическую группу, и Y8 представляет собой C1-C10 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -C(O)-, NH или N(C1-C6 алифатическая группа); L8 является необязательно замещенным 1-3 атомами галогенов;
L10 представляет собой C1-C6 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы О, NH, N(C1-C6 алифатическая группа), S или -C(O)-; L10 является необязательно замещенным 1-3 атомами галогенов;
L11 представляет собой C1-C6 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы О, NH, N(C1-C6 алифатическая группа), S или -C(O)-; L11 является необязательно замещенным 1-3 атомами галогенов;
L12 представляет собой C1-C6 алифатическую группу, в которой до двух метиленовых звеньев замещены на группы О, NH, N (C1-C6 алифатическая группа), S или -C(O)-; L11 является необязательно замещенным 1-3 атомами галогенов;
L13 представляет собой C1-C6 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы О, NH, N(C1-C6 алифатическая группа), S или -C(O)-; L11 является необязательно замещенным 1-3 атомами галогенов;
каждый J, JA, JB, JC, JD, JE, JF, JG, JH, JI, JK, JM, JN, JO, JP, JQ, JR, JS, JT, JU, JV, JW и JX независимо представляет собой атом галогена, -CN, -NO2, XJ, QJ или XJ-QJ;
XJ представляет собой C1-C10 алифатическую группу, в которой до 4 метиленовых звеньев необязательно замещены на группы -O-, -NH, N(C1-C6 алифатическая группа), -S-, -С(O)-, -C(=NOH)-, -S(O)-, -S(O)2-, P или P (O); XJ является необязательно замещенным 0-6 атомами галогенов;
QJ представляет собой 3-7-членное моноциклическое полностью ненасыщенное, частично ненасыщенное или ароматическое кольцо, необязательно содержащее 1-4 гетероатома, выбранных из атомов кислорода, азота или серы; или 8-12-членное полностью ненасыщенное, частично ненасыщенное или ароматическое кольцо, необязательно содержащее 1-6 гетероатомов, выбранных из атомов кислорода, азота или серы; где каждый QJ является необязательно замещенным 1-6 заместителями, выбранными из атомов галогенов, CN, NO2, C1-C6 алифатической группы, ОН, NH2, NH(C1-C6 алифатическая группа), N(C1-C6 алифатическая группа)2, фенила, 5-6-членного гетероарила, C3-С6 циклоалифатической группы или 3-8-членного гетероциклила, где указанные фенил, 5-6-членный гетероарил, C3-С6 циклоалифатическая группа или 3-8-членный гетероциклил являются необязательно замещенными галогеном, CN, NO2 или C1-6 алифатической группой, в которой до 3 метиленовых звеньев необязательно замещены на группы О, NH, S или CO;
при условии, что Z не является группой СН2СН2,
В некоторых вариантах осуществления настоящего изобретения С6-C10 арил из Q5, Q6, Q7 и Q9 представляет собой фенил или нафтил; 5-10-членный гетероарил представляет собой 5-6-членный моноциклический гетероарил, содержащий 1-4 гетероатома, выбранных из атомов кислорода, азота или серы; или 8-10 бициклический гетероарил, содержащий 1-4 гетероатома, выбранных из атомов кислорода, азота или серы; С3-С8 циклоалифатическая группа представляет собой моноциклическое С3-С8 циклоалкильное или циклоалкенильное кольцо; и 3-12-членный гетероциклил представляет собой 3-8-членный моноциклический гетероциклил, содержащий 1-3 гетероатома, выбранных из атомов кислорода, азота или серы; или 8-12-членный бициклический гетероциклил, содержащий 1-6 гетероатомов, выбранных из атомов кислорода, азота или серы.
Некоторые варианты осуществления настоящего изобретения включают в себя один или несколько из следующих параметров:
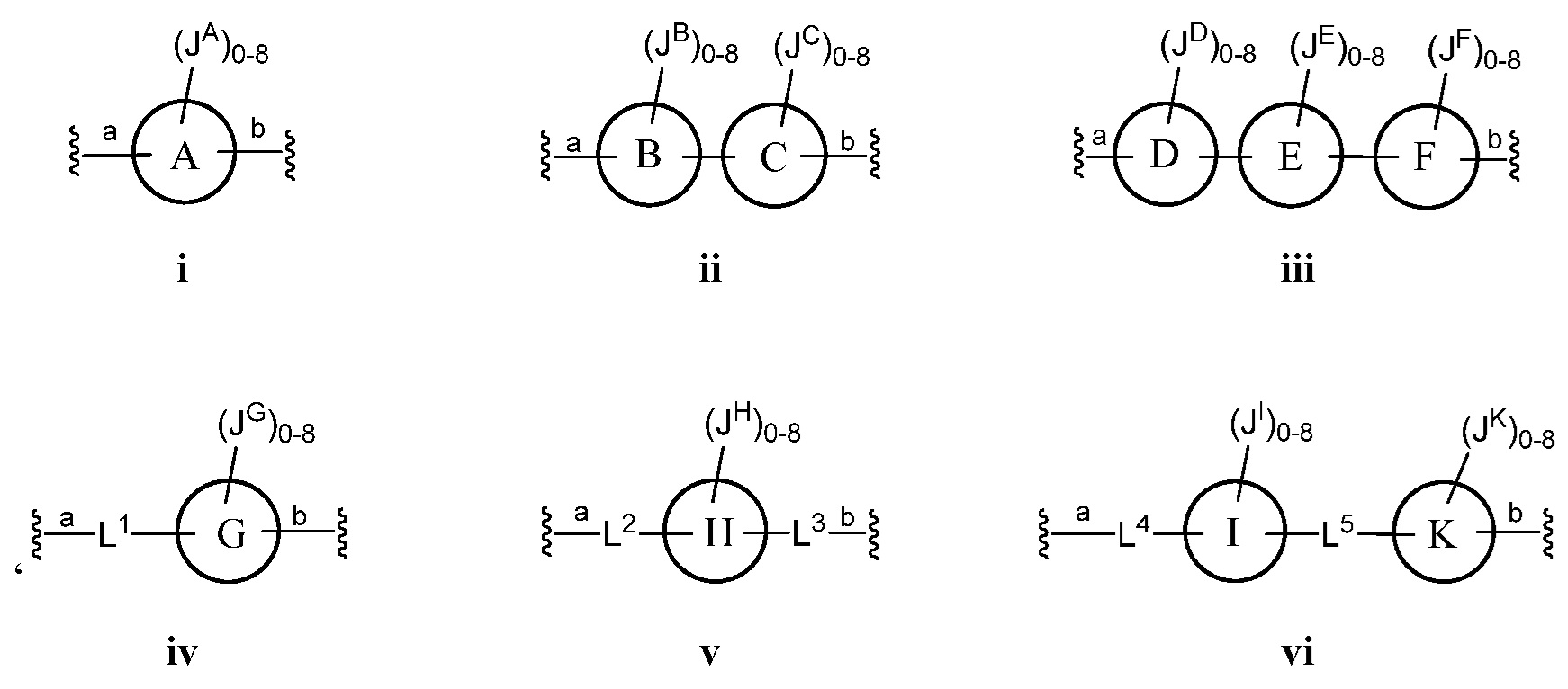
а) Z выбран из формулы i, ii, iii, iv, v, vi, vii, viii, ix, x, xi или xii;
b) каждое из колец А, В, С, D, Е, F, G, H, I, K, M, N, O, P, Q, R, S, Т, U, V, W и Х независимо представляет собой 5-6-членное полностью ненасыщенное, частично ненасыщенное или ароматическое моноциклическое кольцо, необязательно содержащее 1-4 гетероатома, выбранных из атомов кислорода, азота или серы; или 8-12-членное полностью ненасыщенное, частично ненасыщенное или ароматическое бициклическое кольцо, необязательно содержащее 1-6 гетероатомов, выбранных из атомов кислорода, азота или серы; и
с) XJ представляет собой C1-C10 алифатическую группу, в которой до 4 метиленовых звеньев необязательно замещены на группы -O-, -NH, N(C1-C6 алифатическая группа), -S-, -C(O)-, -C(=NOH)-, -S(O)-, -S(O)2-, Р или Р(О); XJ является необязательно замещенным 0-6 атомами галогенов.
В некоторых вариантах осуществления настоящего изобретения V1 представляет собой ОН. В других вариантах осуществления настоящего изобретения V представляет собой ОН.
В некоторых вариантах осуществления настоящего изобретения кольца А, В, С, D, Е, F, G, H, I, K, M, N, O, P, Q, R, S, T, U, V, W, X, Y и Z являются ароматическими.
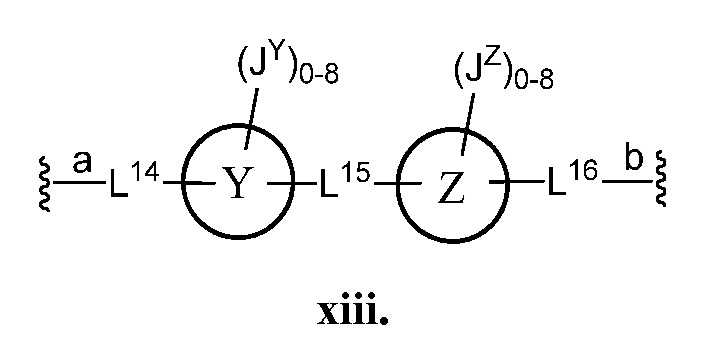
В другом варианте осуществления настоящего изобретения Z выбран из формулы ii, iii, v, vii или xiii. В некоторых вариантах осуществления настоящего изобретения Z выбран из формулы ii, iii или v.
В некоторых вариантах осуществления настоящего изобретения кольца А, В, С, D, Е, F, G, H, I, K, M, N, O, P, Q, R, S, T, U, V, W и Х являются ароматическими. В других вариантах осуществления настоящего изобретения каждое кольцо из A, B, C, D, E, F, G, H, I, K, M, N, O, P, Q, R, S, Т, U, V, W, X, Y и Z независимо представляет собой фенил, нафтил или 5-6-членный гетероарил, содержащий 1-4 гетероатома, выбранных из атомов кислорода, азота или серы. В других вариантах осуществления настоящего изобретения каждое кольцо из A, B, C, D, E, F, G, H, I, K, M, N, O, P, Q, R, S, Т, U, V, W и X независимо представляет собой фенил, нафтил или 5-6-членный гетероарил, содержащий 1-4 гетероатома, выбранных из атомов кислорода, азота или серы. В некоторых вариантах осуществления настоящего изобретения каждое кольцо из A, B, D, М, О, Т и U присоединено к маннозному кольцу, с которым оно связано, через атом углерода.
В некоторых вариантах осуществления настоящего изобретения каждый J, JA, JB, JC, JD, JE, JF, JG, JH, JI, JK, JM, JN, JO, JP, JQ, JR, JS, JT, JU, JV, Jw, JX, JY и JZ независимо представляет собой -NO2, -CN, галоген или C1-C10 алифатическую группу, в которой до трех метиленовых звеньев необязательно замещены на группы О, NH, N(C1-4 алкил), S, С(O), S(O) или S(O)2 и которая является необязательно замещенной 1-3 атомами галогенов или 1 группой CN. В других вариантах осуществления настоящего изобретения каждый J, JA, JB, JC, JD, JE, JF, JG, JH, JI, JK, JM, JN, JO, JP, JQ, JR, JS, JT, JU, JV, JW и JX независимо представляет собой -NO2, -CN, галоген или C1-C10 алифатическую группу, в которой до трех метиленовых звеньев необязательно замещены на группы О, NH, N(C1-С4 алкил), S, C(O), S(O) или S(O)2 и которая является необязательно замещенной 1-3 атомами галогенов.
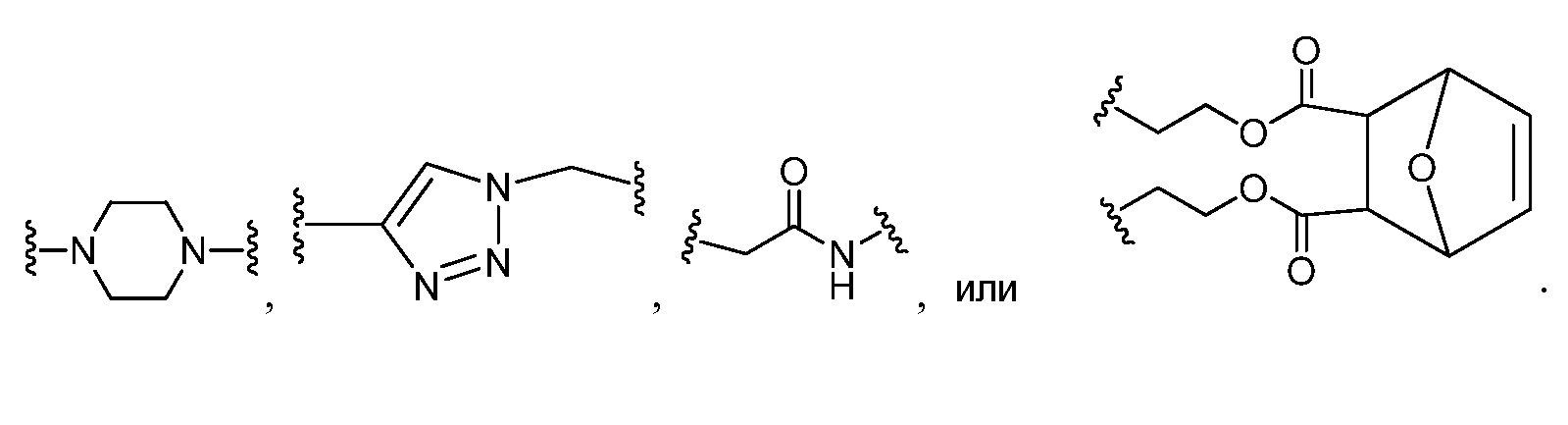
В одном аспекте настоящего изобретения Z представляет собой
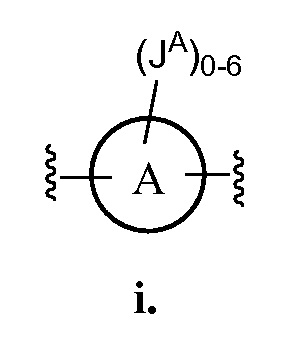
В некоторых вариантах осуществления настоящего изобретения кольцо А представляет собой триазолил, тиенил или фенил, и JA представляет собой CF3 или -О(C1-C6 алкил). В других вариантах осуществления настоящего изобретения кольцо A представляет собой фенил, и JA представляет CF3 или ОСН(СН3)2.
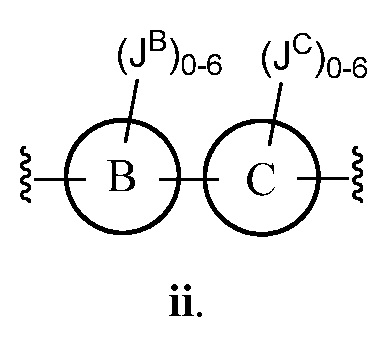
В соответствии с другим аспектом, Z представляет собой
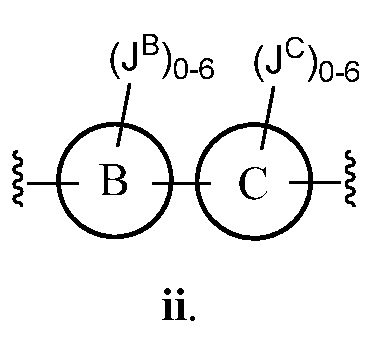
В некоторых вариантах осуществления настоящего изобретения кольцо B и кольцо C независимо друг от друга представляют собой триазолил или фенил. В других вариантах осуществления настоящего изобретения кольцо B и кольцо C представляют собой фенил. В некоторых вариантах осуществления настоящего изобретения JB и JC, каждый независимо, представляют собой галоген, C1-C6 алкил или О (C1-C6 алкил).
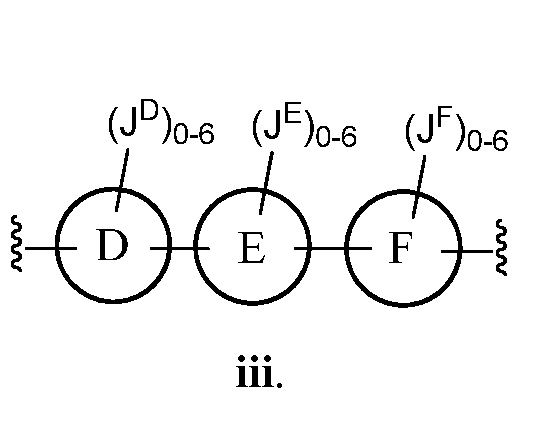
В соответствии с другим аспектом, Z представляет собой
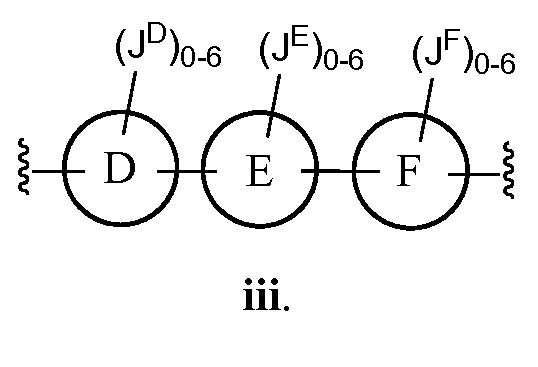
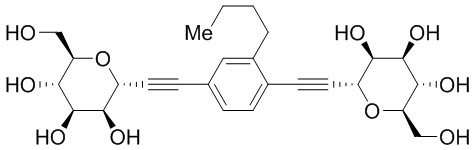
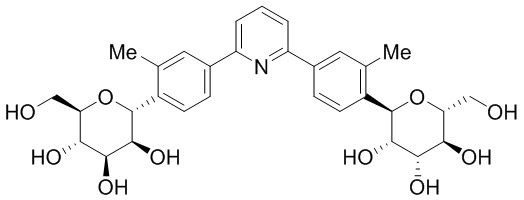
В некоторых вариантах осуществления настоящего изобретения кольцо D, кольцо E и кольцо F независимо друг от друга представляют собой триазолил или фенил. В других вариантах осуществления настоящего изобретения кольцо D и кольцо E представляют собой фенил, и кольцо Е представляет собой необязательно замещенную группу, выбранную из C3-6 циклоалкила, фенила, пиридинила или пиразинила. В некоторых вариантах осуществления настоящего изобретения кольцо Е представляет собой пиридинил. В других вариантах осуществления настоящего изобретения JD, JE и JF, каждый независимо, представляют собой C1-C6 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы О, NH, N(C1-C4 алкил) или С(O). В некоторых вариантах осуществления настоящего изобретения заместителями являются C1-C6 алкил, О(C1-C6 алкил), галоген или СН2С(О)ОСН3. В других вариантах осуществления настоящего изобретения заместителями являются СН3, ОСН3, фтор или СН2С(О)ОСН3.
В соответствии с другим аспектом, Z представляет собой
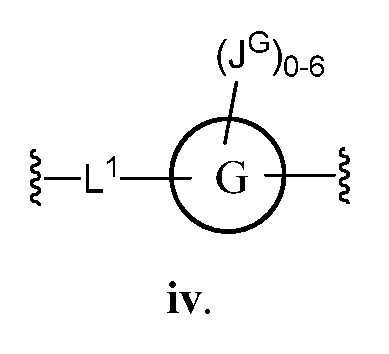
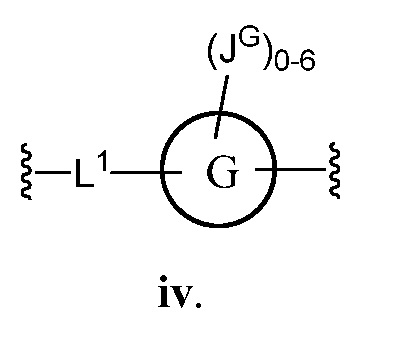
В некоторых вариантах осуществления настоящего изобретения L1 представляет C1-C6 алифатическую группу, и кольцо G представляет собой фенил. В других вариантах осуществления настоящего изобретения кольцо G представляет собой фенил или индолил; и JG представляет собой C1-C6 алкил, галоген или -О(C1-C6 алкил). В другом варианте осуществления настоящего изобретения L1 представляет собой О. В других вариантах осуществления настоящего изобретения L1 представляет собой -C≡C-.
В соответствии с еще одним аспектом, Z представляет собой
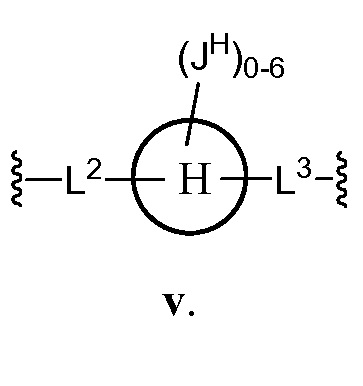
В некоторых вариантах осуществления настоящего изобретения
L2 представляет C1-C6 алифатическую группу или группу -(C1-C4 алифатическая группа)-C(O)NH-;
L3 представляет C1-C6 алифатическую группу или -C(O)NH-(C1-C4 алифатическую группу);
кольцо Н представляет собой фенил или нафтил; и
JH представляет собой галоген, CN, NO2, C1-C6 алифатическую группу, -OC1-C6 алифатическую группу или С(О)О(C1-C6 алифатическую группу).
В других вариантах осуществления настоящего изобретения
L2 представляет собой C1-C6 алифатическую группу или группу -(C1-4 алифатическая группа)-C(O)NH-;
L3 представляет собой C1-C6 алифатическую группу или -NHC(O)-(C1-C4 алифатическую группу);
кольцо Н представляет собой фенил или нафтил; и
JH представляет собой галоген, CN, NO2, C1-6 алифатическую группу, -OC1-6 алифатическую группу или С(O)O(C1-6 алифатическую группу), где указанный JH является необязательно замещенным 1-3 атомами галогенов.
В других вариантах осуществления настоящего изобретения JH представляет собой галоген, CN, NO2, фенил или C1-C10 алифатическую группу, в которой до 3 метиленовых звеньев необязательно замещены на группы О, NH, N(C1-4 алкил), S(O), SO или SO2; где JH является необязательно замещенным 1-3 группами, выбранными из CN, галогенов или фенила.
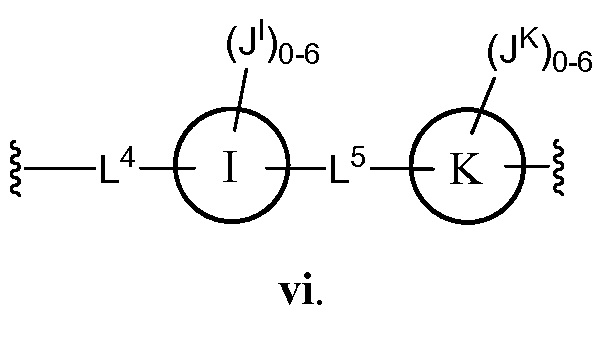
В соответствии с еще одним аспектом, Z представляет собой
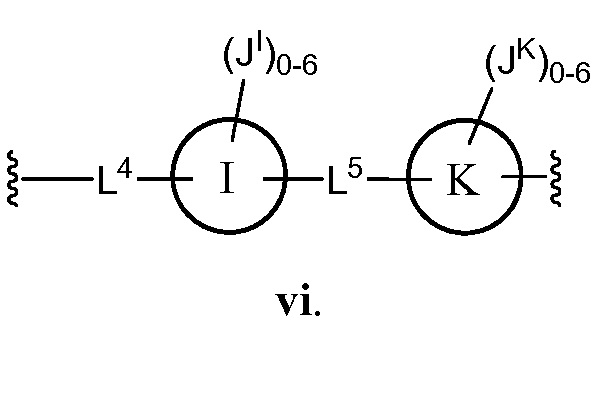
В некоторых вариантах осуществления настоящего изобретения L4 и L5 независимо друг от друга представляют C1-6 алифатическую группу;
кольцо I и кольцо K, каждое независимо, представляет собой фенил;
JI и JK каждый независимо представляет собой галоген, CN, NO2, C1-6 алифатическую группу, -OC1-6 алифатическую группу или группу С(O)O(C1-6 алифатическая группа).
В другом варианте осуществления настоящего изобретения L4 представляет собой -СН2СН=СН-, и L5 представляет собой -С≡С-.
В соответствии с еще одним аспектом, Z представляет собой
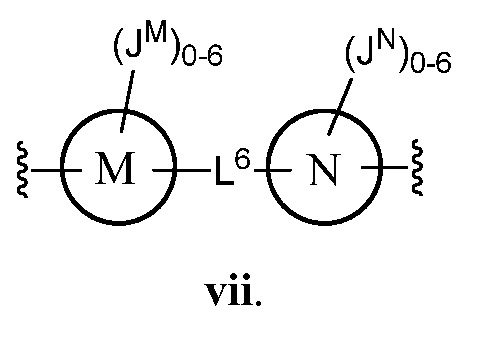
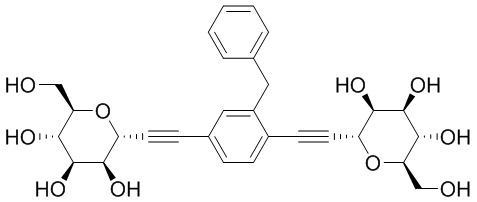
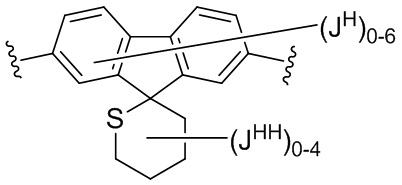
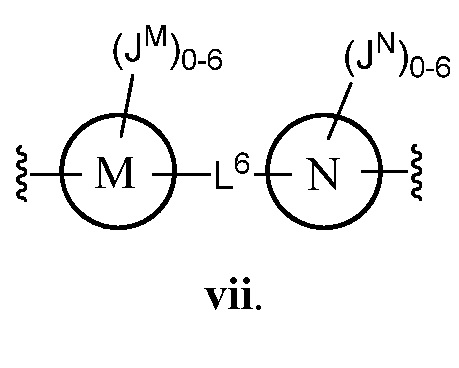
В некоторых вариантах осуществления настоящего изобретения L6 представляет C1-C15 алифатическую группу, в которой до 4 метиленовых звеньев необязательно замещены на группы -О- или C(O)NH. В других вариантах осуществления настоящего изобретения L6 представляет собой -C≡C-C≡C-, -C(O)NH-, -NHC(O)NH-, -(C1-C6 алкил)-, -С(O)NH-(-C1-C8 алкил)-NHC(O)-, -C(O)NH-(CH2CH2)-O-(CH2CH2)-O-(CH2CH2)-NHC(O)- или -CH2N(СН2≡СН)СН2-. В еще одном варианте осуществления настоящего изобретения М представляет собой фенил; N представляет собой фенил; и каждый JM и JN независимо представляет собой Н или C1-C6 алкил.
Еще один аспект предоставляет соединения, где Z представляет собой
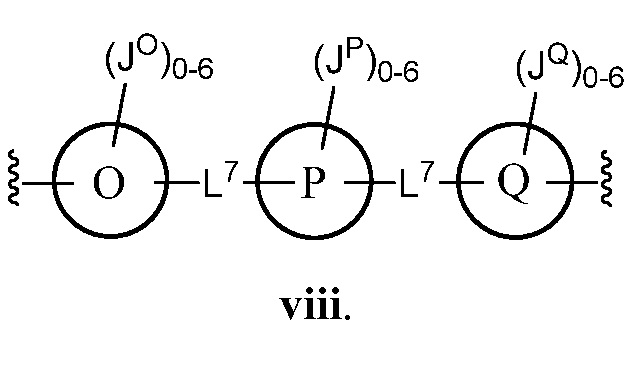
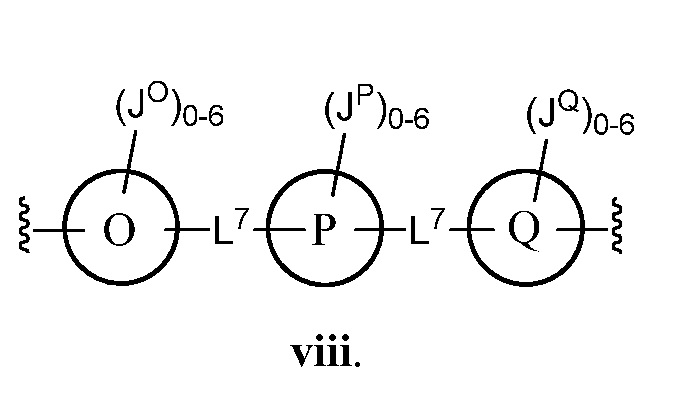
В некоторых вариантах осуществления настоящего изобретения кольцо О, кольцо Р и кольцо Q, каждое независимо, представляют собой фенил, триазолил или тиенил. В некоторых вариантах осуществления настоящего изобретения L7 представляет собой -C(O)NH- или -C1-4 алкил. В других вариантах осуществления настоящего изобретения кольцо О, кольцо Р и кольцо Q представляют собой фенил.
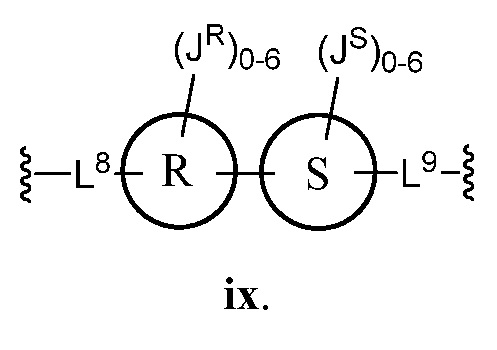
Еще один аспект предоставляет соединения, где Z представляет собой
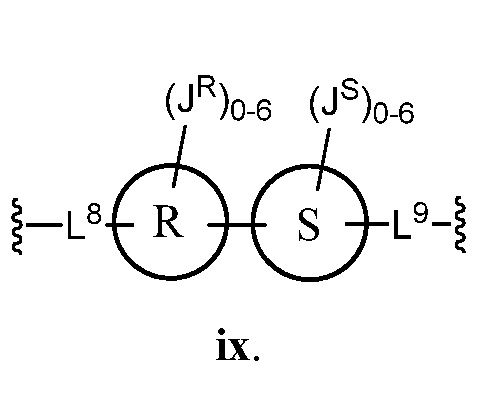
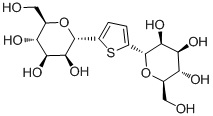
В некоторых вариантах осуществления настоящего изобретения кольцо R и кольцо S представляют собой фенил, и L8 представляет собой C1-C6 алкил. В других вариантах осуществления настоящего изобретения кольцо R и кольцо S представляют собой тиенил. В некоторых вариантах осуществления настоящего изобретения JR представляет собой C1-C6 алкил.
В соответствии с еще одним аспектом, Z представляет собой
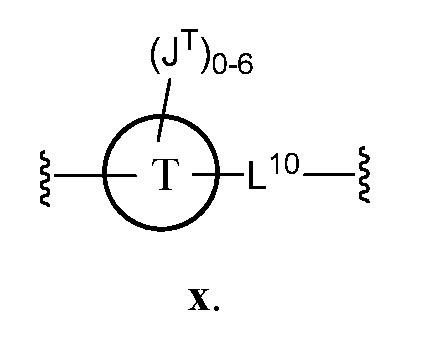
В некоторых вариантах осуществления настоящего изобретения кольцо Т представляет собой фенил или нафтил, и L10 представляет C1-C6 алифатическую группу, в которой до одного метиленового звена необязательно замещено на группу -O-. В некоторых вариантах осуществления настоящего изобретения L10 представляет собой -С≡С- или -СН2СН2-.
В соответствии с еще одним аспектом, Z представляет собой
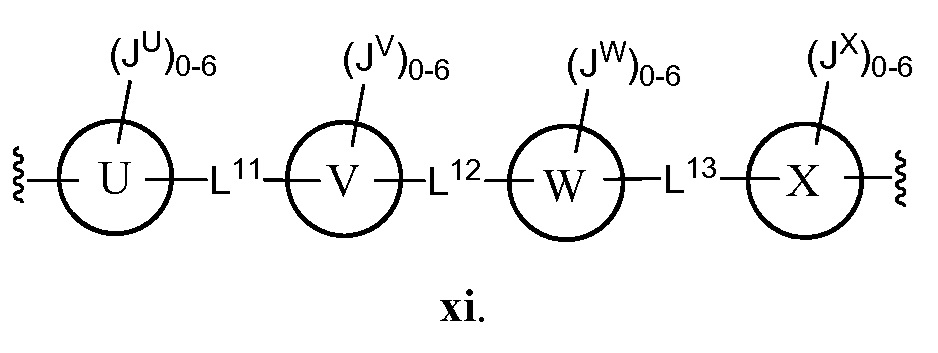
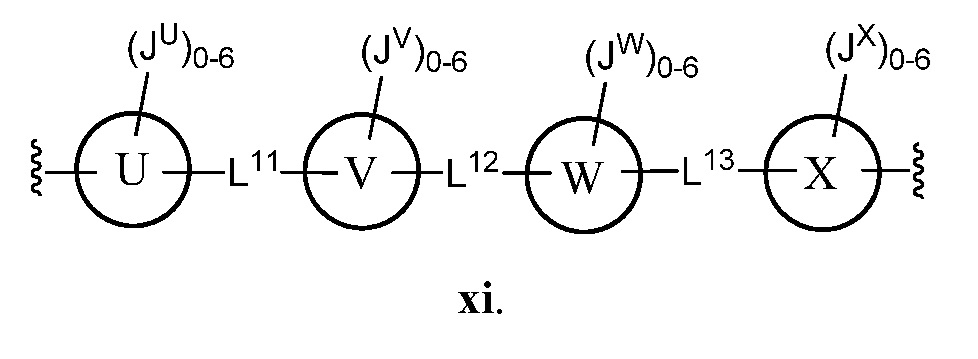
В некоторых вариантах осуществления настоящего изобретения L11, L12 и L13, каждый независимо, представляют собой -C(O)NH- или C1-C4 алкил, и кольца U, V, W и Х, каждый независимо, представляют собой фенил.
В соответствии с еще одним аспектом, Z представляет собой
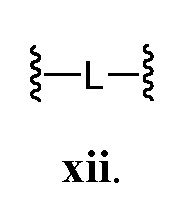
В некоторых вариантах осуществления настоящего изобретения L представляет собой C3-C6 алифатическую группу. В некоторых вариантах осуществления настоящего изобретения L представляет собой необязательно замещенную C1-C6 алифатическую группу. В других вариантах осуществления настоящего изобретения L представляет собой -С≡С-С≡С-.
В соответствии с еще одним аспектом, Z представляет собой
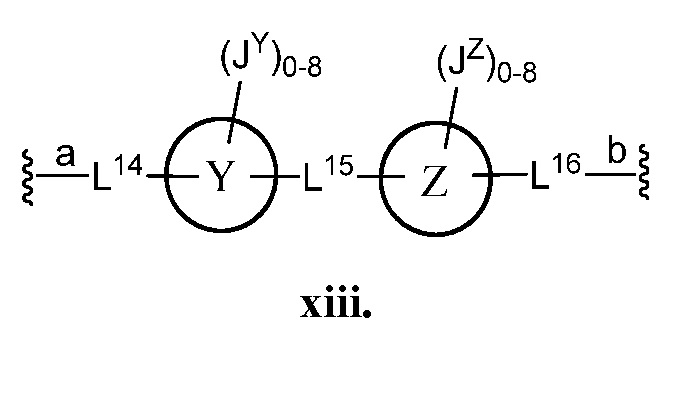
В некоторых вариантах осуществления настоящего изобретения кольцо Y и кольцо Z представляют собой фенил. В некоторых вариантах осуществления настоящего изобретения L14 и L16 представляют собой С≡С-. В некоторых вариантах осуществления настоящего изобретения L15 представляет собой C1-4 алифатическую группу. В некоторых вариантах осуществления настоящего изобретения L15 представляет собой -C(CH3)2-. В некоторых вариантах осуществления настоящего изобретения кольцо Y и кольцо Z представляют собой фенил; L14 и L16 представляют собой С≡С-; и L15 представляет собой -С(СН3)2-.
В соответствии с еще одним аспектом, L1, L2, L3, L6 и L10, каждый независимо, представляют собой C1-C4 алкенил или C1-C4 алкинил.
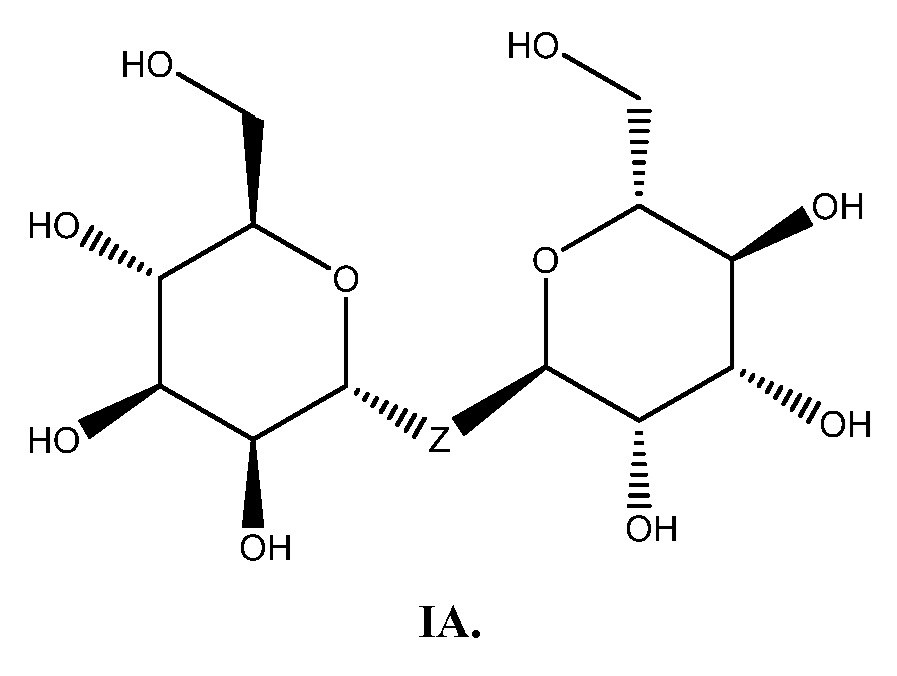
Еще один аспект предоставляет соединение формулы IA:
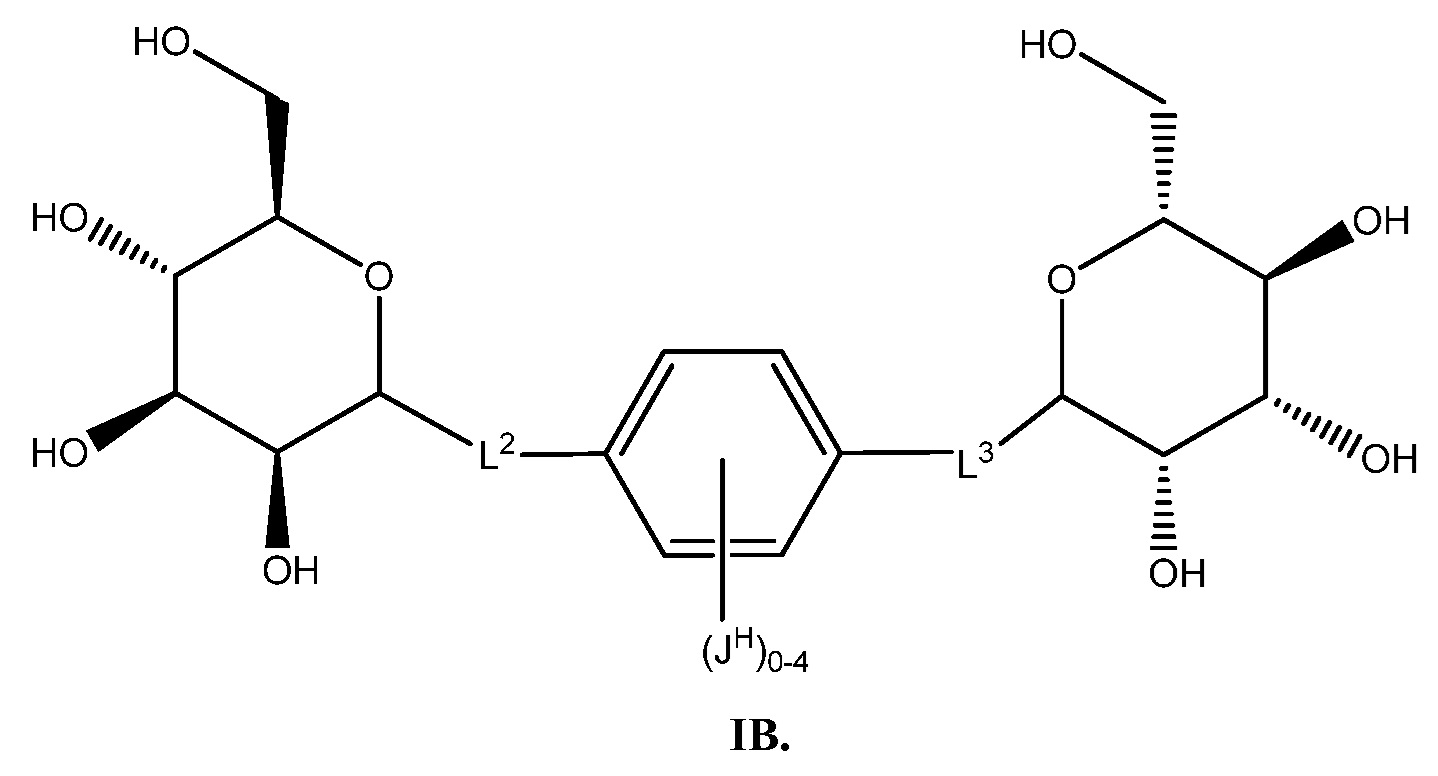
Еще один аспект предоставляет соединение формулы IB:

В некоторых вариантах осуществления настоящего изобретения L2 и L3 присоединены с маннозному кольцу через атом углерода. В некоторых вариантах осуществления настоящего изобретения L2 и L3 независимо друг от друга представляют собой C1-С6 алкенил или C1-C6 алкинил. В некоторых вариантах осуществления настоящего изобретения по меньшей мере один из L2 и L3 представляет собой -C≡C-. В других вариантах осуществления настоящего изобретения L2 и L3 оба представляют собой -С≡С-.
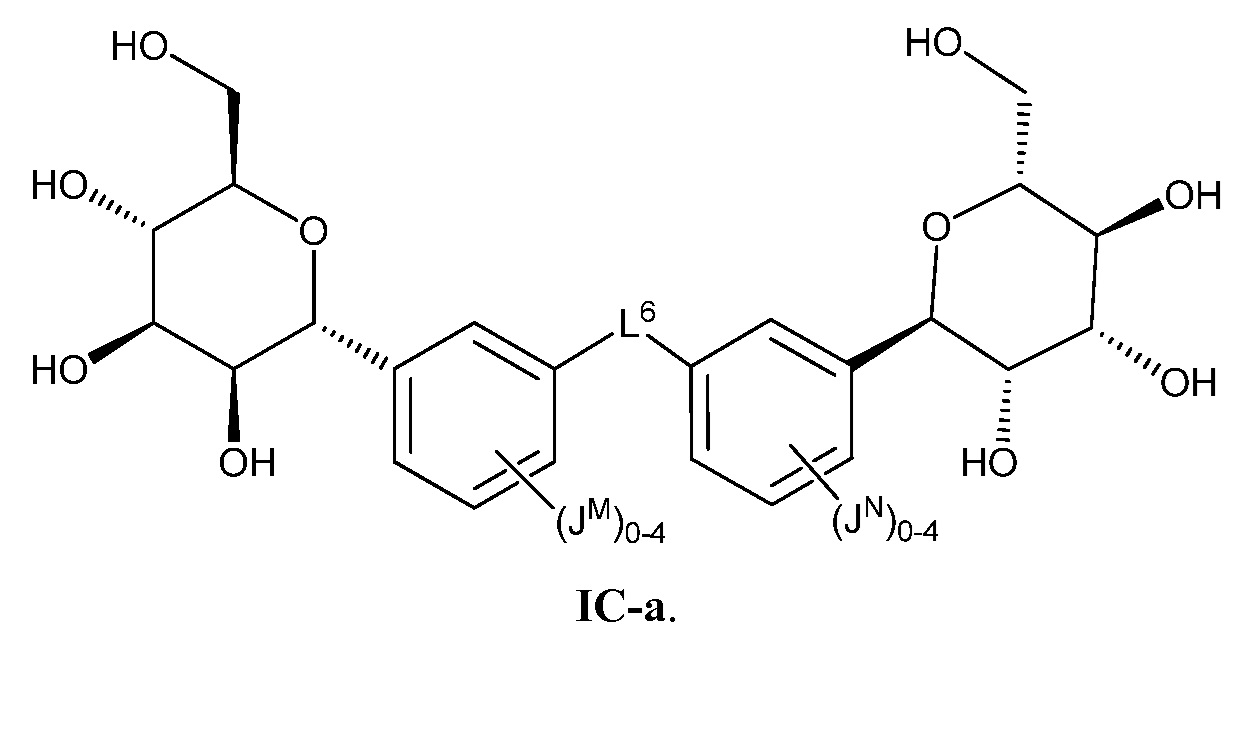
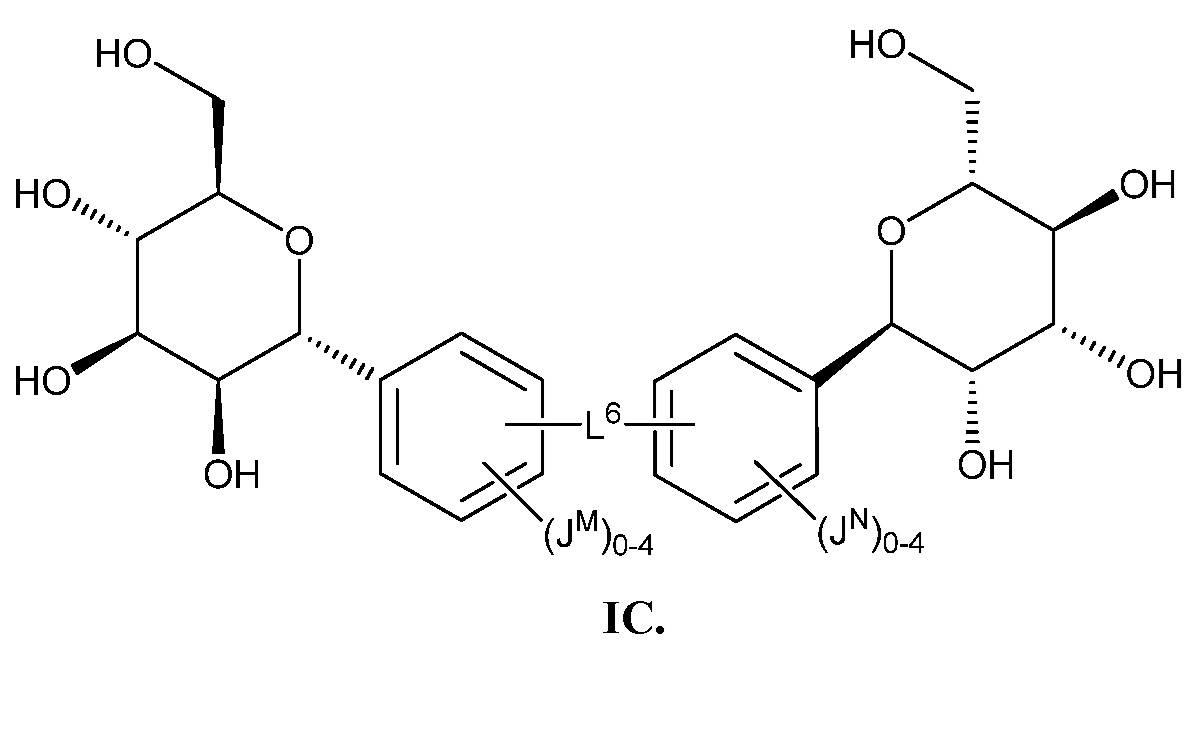
Еще один аспект предоставляет соединение формулы IC:
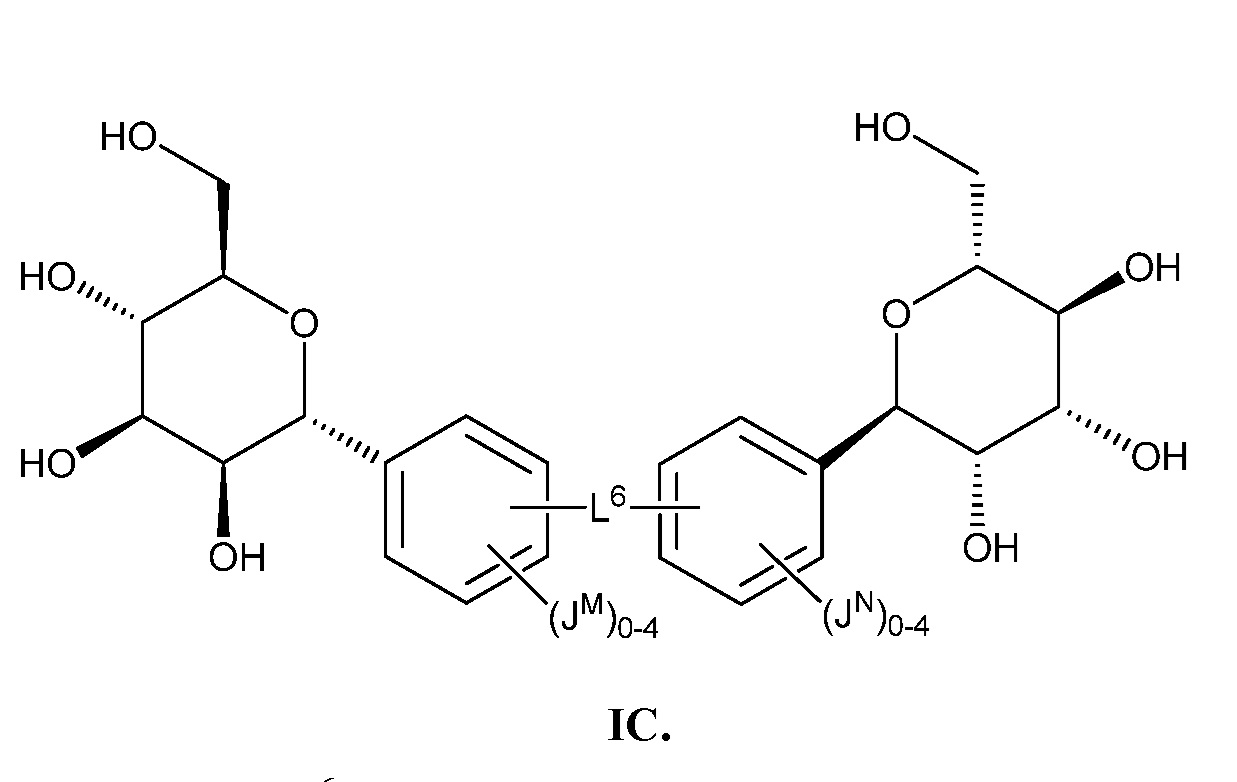
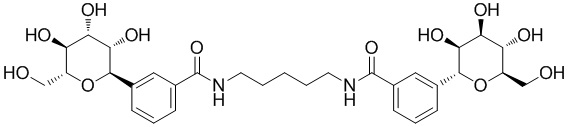
В некоторых вариантах осуществления настоящего изобретения L6 присоединен к фенильному(ым) кольцу(ам) в мета- или пара-положении. В других вариантах осуществления настоящего изобретения L6 присоединен к фенильному(ым) кольцу(ам) в пара-положении. В других вариантах осуществления настоящего изобретения L6 присоединен к фенильному(ым) кольцу(ам) в мета-положении, как показано в формуле IC-а:
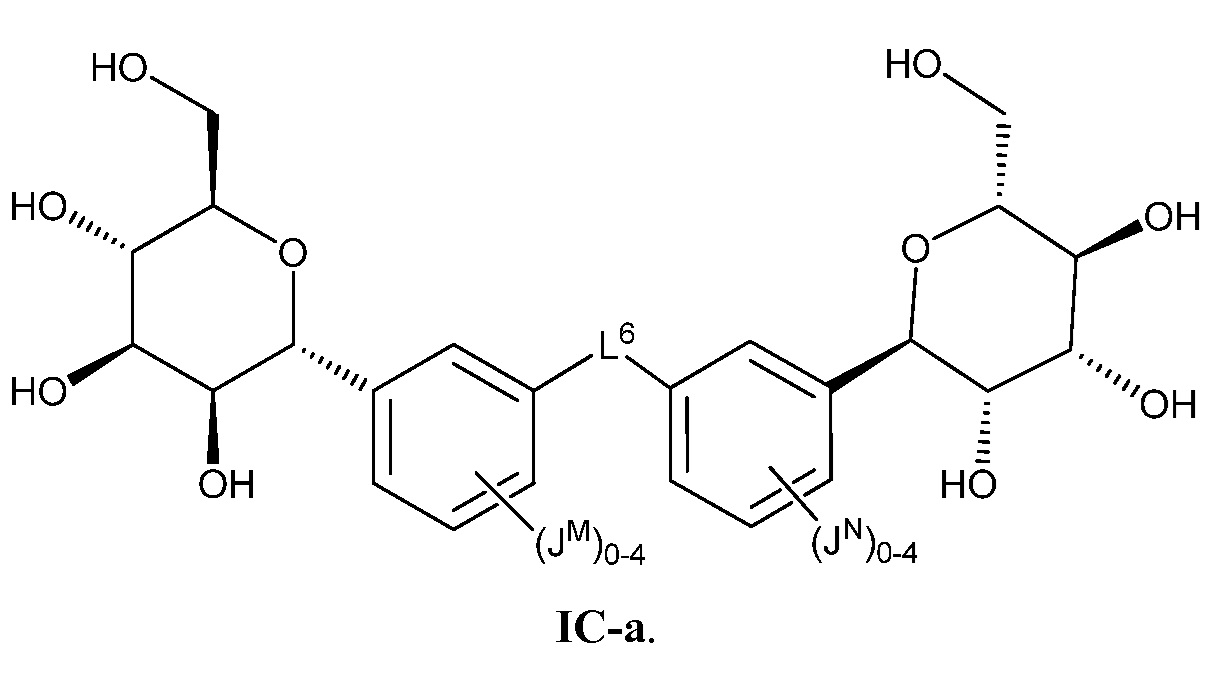
В некоторых вариантах осуществления настоящего изобретения L6 представляет собой -C≡C-C≡C-. В других вариантах осуществления L6 представляет C1-6 алифатическую группу, -O-(C1-4 алкил)-O-, -C(O)NH-, -NHC(O)NH-, -C(O)NH-(C1-10 алкил)-NHC(O)-, -(СН2СН2ОСН2СН2ОСН2СН2)-. В других вариантах осуществления настоящего изобретения L6 представляет собой -CH2- или -С(СН3)2-.
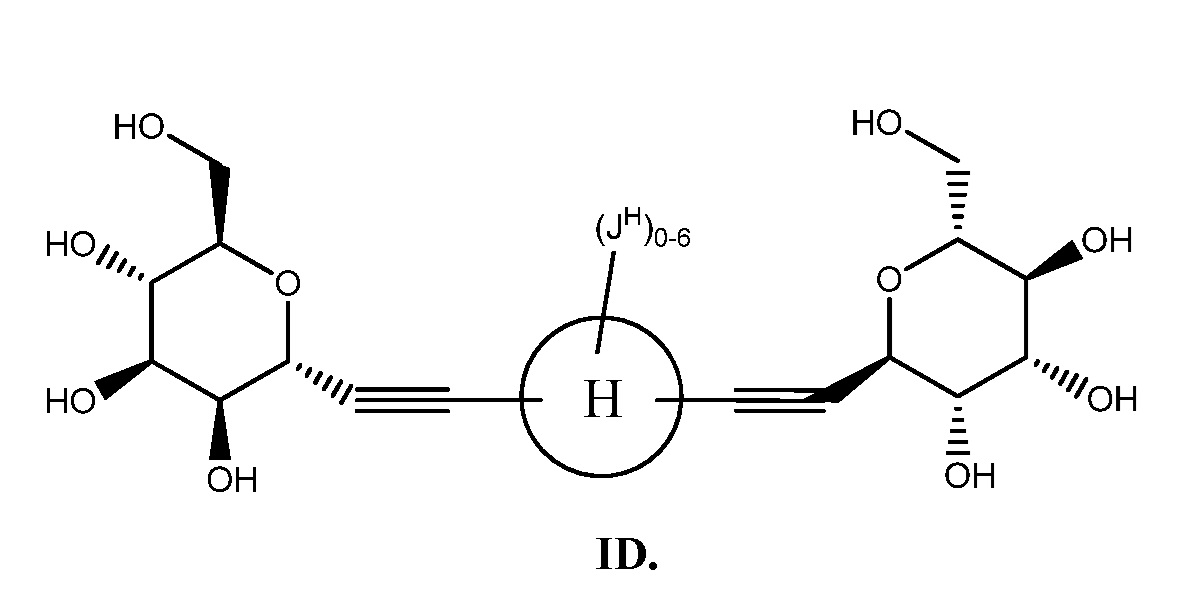
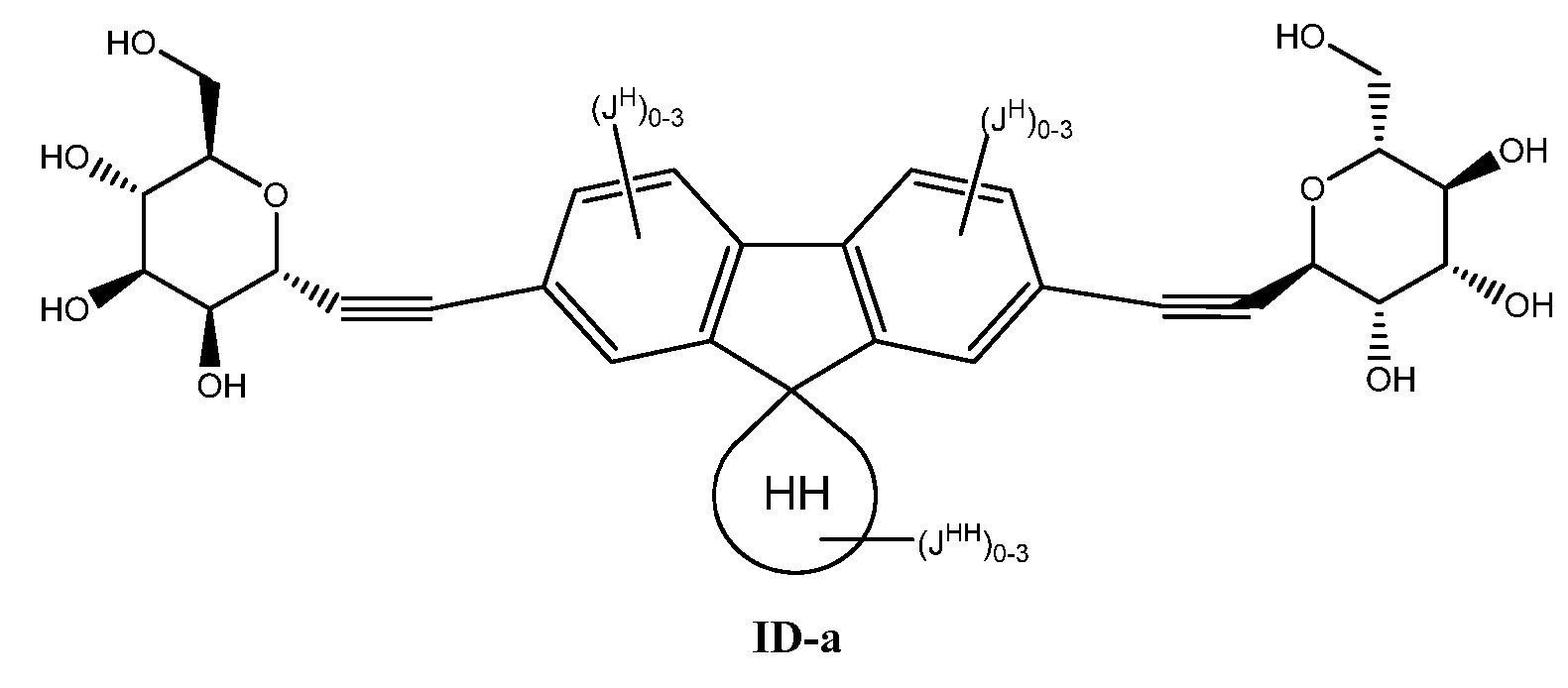
Еще один аспект предоставляет соединение формулы ID:
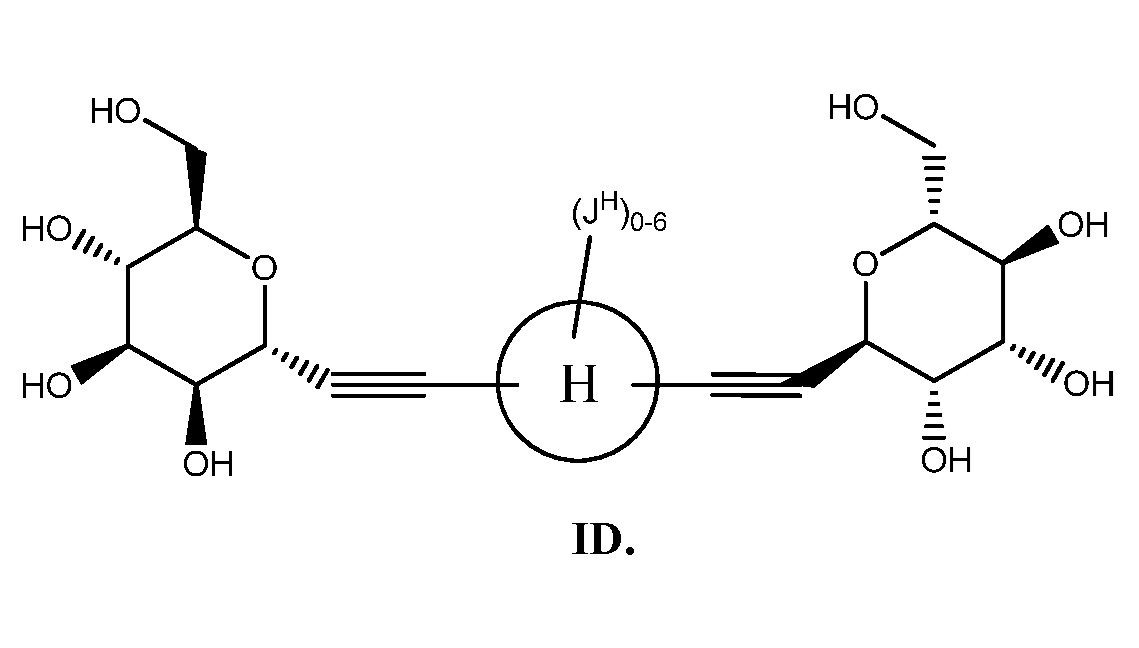
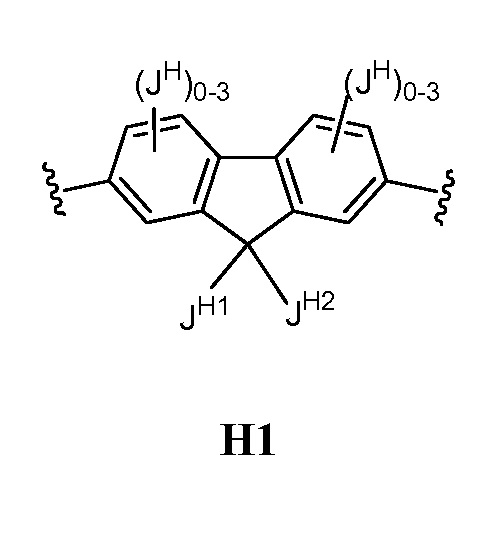
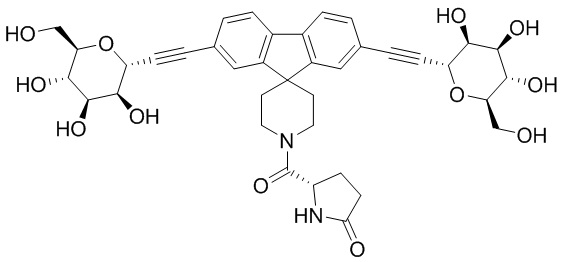
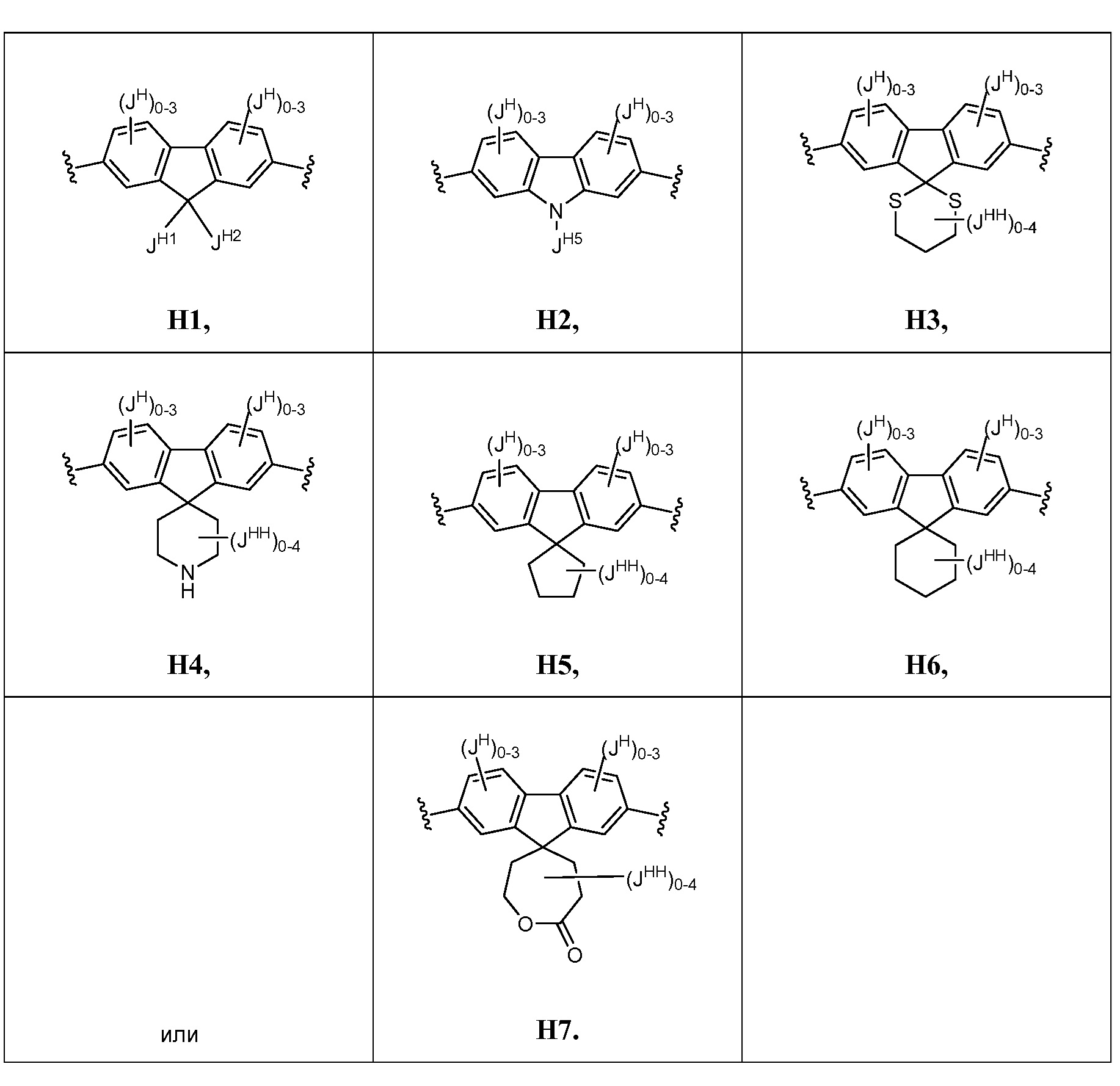
В некоторых вариантах осуществления настоящего изобретения кольцо Н представляет собой необязательно замещенное 5-6-членное моноциклическое ароматическое кольцо, необязательно содержащее 1-4 гетероатома, выбранных из атомов кислорода, азота или серы; или 8-12-членное бициклическое ароматическое кольцо, необязательно содержащее 1-6 гетероатомов, выбранных из атомов кислорода, азота или серы; или 10-14 трициклическое ароматическое кольцо, необязательно содержащее 1-6 гетероатомов, выбранных из атомов кислорода, азота или серы. Для ясности, бициклическое или трициклическое кольцо считается ароматическим кольцом, если оно содержит по меньшей мере одно ароматическое кольцо.
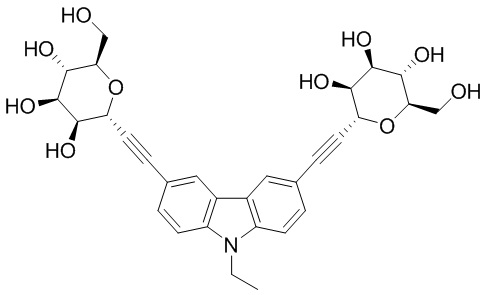
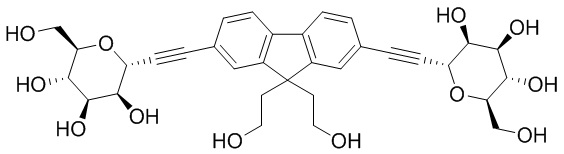
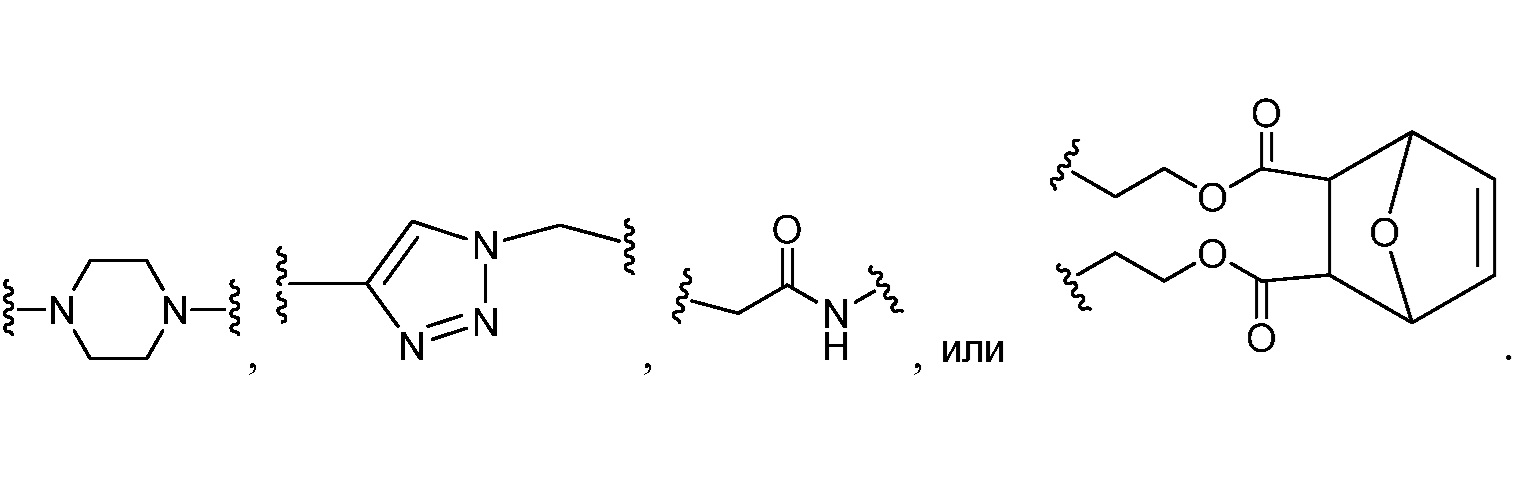
В других вариантах осуществления настоящего изобретения кольцо Н представляет собой необязательно замещенный фенил, нафтил, тиенил, изоксазолил, пиридинил, пиразинил, тиенил, тиофенил, хинолинил, хиназолинил, бензотиадиазолил или флуоренил. В других вариантах осуществления настоящего изобретения кольцо Н представляет собой необязательно замещенный фенил или нафтил.
В соответствии с еще одним вариантом осуществления настоящего изобретения кольцо Н вместе с JH и JHH выбрано из следующих групп:
В некоторых вариантах осуществления настоящего изобретения JH представляет собой галоген, оксо, CN, XJ, QJ или XJ-QJ; где
XJ представляет собой C1-C10 алифатическую группу, в которой до 4 метиленовых звеньев необязательно замещены на группы -O-, -NH, N(C1-C6 алифатическая группа), -S-, -С(O)-, -S(O)-, -S(O)2-;
QJ представляет собой фенил; и
JH является необязательно замещенным 0-3 атомами галогенов или 0-1 группой CN.
В некоторых вариантах осуществления настоящего изобретения кольцо Н представляет собой необязательно замещенный фенил или нафтил.
В других вариантах осуществления настоящего изобретения JH представляет собой галоген, CN, -C(CH3)2CN, C3-6 циклоалкил, фенил, -O-CH2-фенил или -C1-C6 алкил, где до одного метиленового звена необязательно замещено на группы -О-, -S-, -NH-, -N(C1-C6 алкил)- или -С(О)-. В других вариантах осуществления настоящего изобретения кольцо Н представляет собой фенил, и JH представляет собой галоген, CN, -C(CH3)2CN, C3-6 циклоалкил, фенил, СН2-фенил, -O-CH2-фенил или C1-6 алкил, где до одного метиленового звена необязательно замещено на группы -O-, -S-, -NH-, -N(C1-C6 алкил)- или -C(=O)-. В некоторых вариантах осуществления настоящего изобретения JH является замещенным 0-3 атомами галогенов или 0-1 группой CN.
В соответствии с еще одним вариантом осуществления настоящего изобретения кольцо Н представляет собой
 ,
,
где G представляет собой O, S, S(O), S(O)2, CF2, С(JH1)(JH2), -C(JH3)2-C(JH4)2- или N(JH5);
JH1 представляет собой Н, ОН или C1-C6 алкил, в котором до 2 метиленовых звеньев необязательно замещены на группы -O-, -NH-, -NH(C1-C6 алифатическая группа)-, -S-, -C(O)-, -S(O)- или -S(O)2-; JH1 является необязательно независимо замещенным 1-3 группами ОН;
JH2 представляет собой XJH, QJH или XJH-QJH; JH2 является необязательно замещенным 1-3 группами ОН;
XJH представляет собой C1-C6 алкил, в котором до 3 метиленовых звеньев необязательно замещены на группы -O-, -NH, N(C1-C6 алифатическая группа), -S-, -C(O)-, -S(O)- или -S(O)2-;
QJH представляет собой C3-6 циклоалкил, фенил или 5-7-членный моноциклический гетероциклил, содержащий 1-3 гетероатома, выбранных из атомов кислорода, азота или серы;
или JH1 и JH2 вместе с атомом углерода, к которому они присоединены, образуют С=N-OH, C=О или кольцо НН;
кольцо HH представляет собой 5-7-членное насыщенное моноциклическое кольцо, содержащее 0-2 гетероатома, выбранных из атомов кислорода, азота или серы; где указанное кольцо является необязательно замещенным 1-4 группами JHH;
JHH представляет собой галоген, CN, XJ, QJ или XJ-QJ;
JH5 представляет собой XJ, QJ или XJ-QJ;
XJ представляет собой C1-C10 алифатическую группу, в которой до 4 метиленовых звеньев необязательно замещены на группы -O-, -NH, N(C1-C6 алифатическая группа), -S-, -С(O)-, -S(O)- или -S(O)2-; XJ является необязательно замещенным 0-6 атомами галогенов или 0-1 группой CN;
QJ представляет собой 3-6-членное насыщенное, частично ненасыщенное или ароматическое моноциклическое кольцо, необязательно содержащее 1-4 гетероатома, выбранных из атомов кислорода, азота или серы; или 8-12-членное насыщенное, частично ненасыщенное или ароматическое бициклическое кольцо, необязательно содержащее 1-6 гетероатомов, выбранных из атомов кислорода, азота или серы; где каждый QJ является необязательно замещенным 1-6 группами, выбранными из атомов галогенов, оксо, CN, NO2 или C1-C6 алифатической группы, в которой до 3 метиленовых звеньев необязательно замещены на группы O, NR, S или CO;
каждый JH, JH3 и JH4 независимо представляет собой Н, галоген, CN или C1-C10 алифатическую группу, в которой до 3 метиленовых звеньев замещены на группы -O-, -NH, N(C1-C6 алифатическая группа), S, C(O)-, -S(O)- или SO2-; каждый JH, JH3 и JH4 является независимо и необязательно замещенным 0-2 группами, выбранными из атомов галогенов, ОН или C1-C4 алкила, или 1 группой CN; и
R представляет собой Н или C1-C4 алкил.
В некоторых вариантах осуществления настоящего изобретения
G представляет собой С(JH1)(JH2);
JH1 представляет собой ОН, F или -СН2СН2ОН;
JH2 представляет собой ОН, СН3, циклопропил, F, CH2CH3, -СН2СН2ОН, -СН2СН(ОН)СН2ОН или фенил, необязательно замещенный ОСН3;
или JH1 и JH2 вместе с атомом углерода, к которому они присоединены, образуют =N-OH или 6-членное насыщенное моноциклическое кольцо, содержащее 0-2 гетероатома, выбранных из атомов кислорода, азота или серы; где указанное кольцо является необязательно замещенным C1-C6 алкилом, ОН, NH2, -C(O)ОСН3, -С(O)OC(CH3)3, -C(O)С(СН3)2OH или -S(O)2СН3.
В некоторых вариантах осуществления настоящего изобретения кольцо НН выбрано из циклопентила, циклогексила, пиперидинила, пиперазинила, 1,3-дитианила или тетрагидропиранила. В некоторых вариантах осуществления настоящего изобретения XJH представляет собой C1-C6 алкил, и QJH представляет собой С3-6 циклоалифатическую группу, оксетанил, тетрагидропирролидинил, пиперидинил, пиперазинил или морфолинил.
В соответствии с еще одним вариантом осуществления настоящего изобретения, кольцо Н вместе с кольцом HH выбрано из следующих формул:
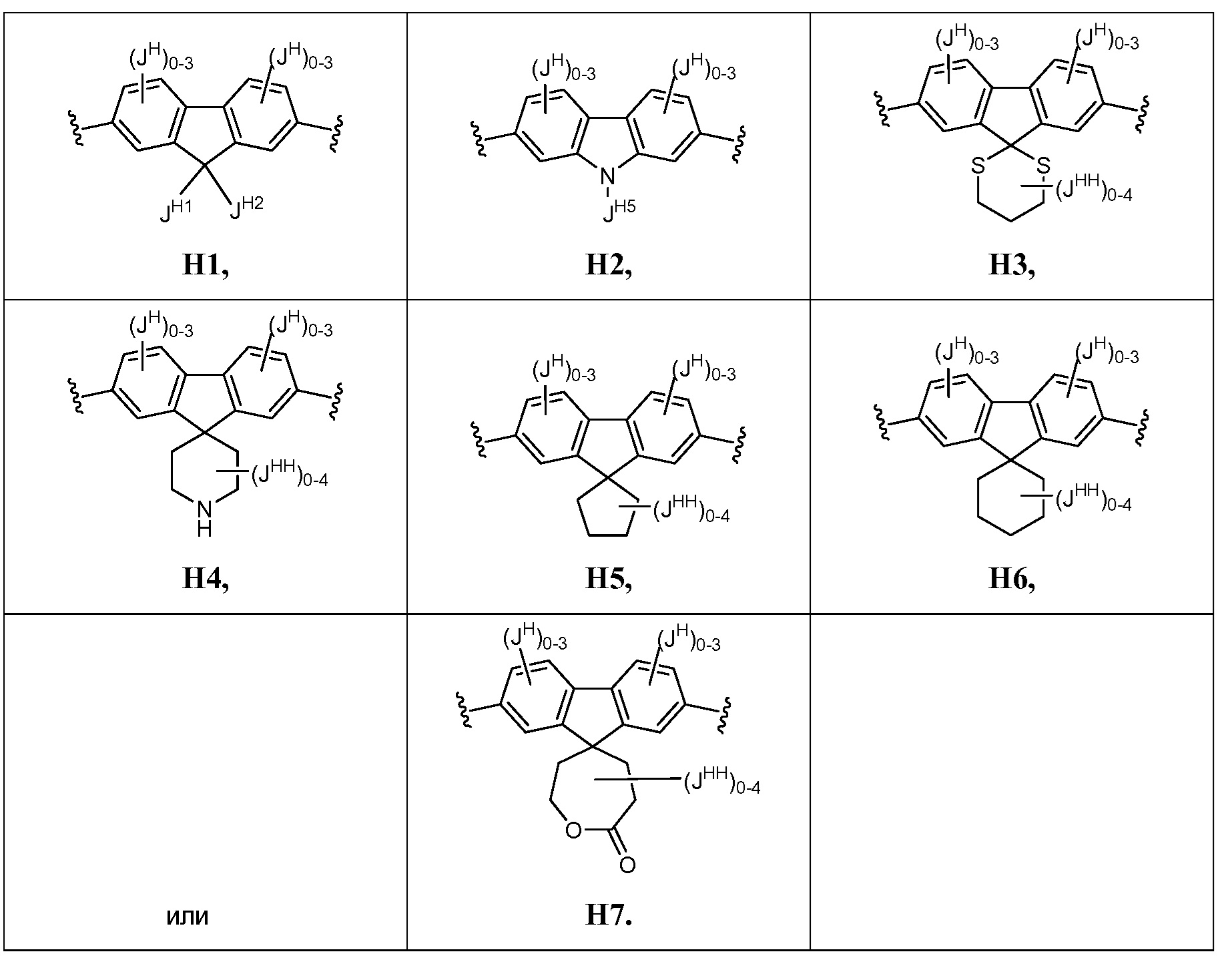
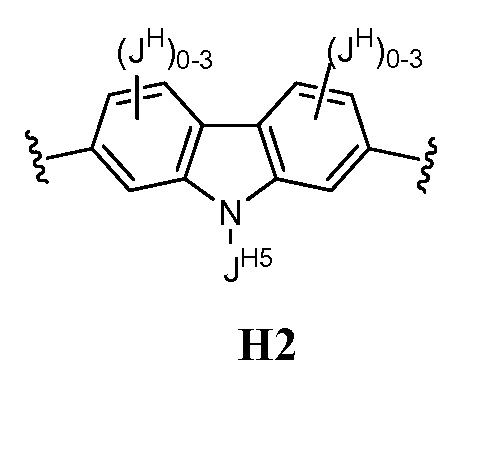
В соответствии с еще одним вариантом осуществления настоящего изобретения кольцо Н представляет собой Н2:
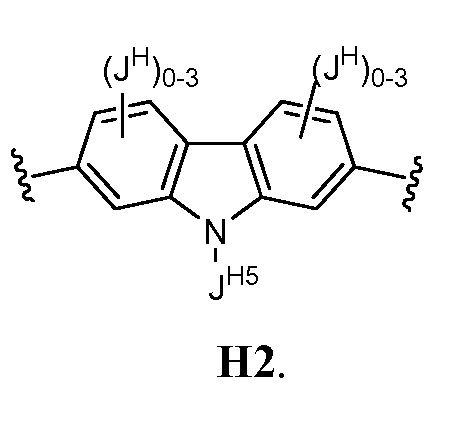
В некоторых вариантах осуществления настоящего изобретения
JH5 представляет собой XJ, QJ или XJ-QJ; где
XJ представляет собой C1-C10 алифатическую группу, в которой до 4 метиленовых звеньев необязательно замещены на группы -O-, -NH, N(C1-C6 алифатическая группа) или -S-; XJ является необязательно замещенным 1-2 атомами галогенов; и
QJ представляет собой моноциклическое 3-6-членное насыщенное кольцо, содержащее 1-2 гетероатома, выбранных из атомов кислорода, азота или серы; QJ является необязательно замещенным 1-4 группами, выбранными из атомов галогенов, CN, NO2, оксо или C1-C6 алифатической группы, в которой до 3 метиленовых звеньев необязательно замещены на группы O, NR, S или CO.
В некоторых вариантах осуществления настоящего изобретения JH5 представляет собой Н, фенил, СН2СН2ОН, CH2CH2OD3, СН2С(O)ОН, СН2С(O)ОСН2СН3, СН2С(O)N(СН3)2, СН2СН(ОН)СН2ОН, СН2СН(ОН)CH2N(СН3)2,
В соответствии с еще одним вариантом осуществления настоящего изобретения, кольцо Н представляет собой H1:
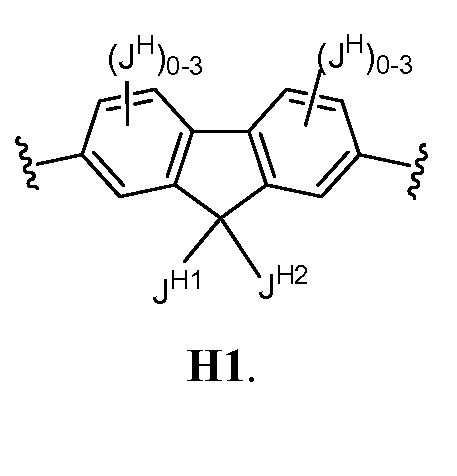
В некоторых вариантах осуществления настоящего изобретения
JH1 представляет собой Н, ОН, -(C1-4 алкил)ОН или -(C1-4 алкил)OC(O)(C1-4 алкил);
JH2 представляет собой XJH, QJH или XJH-QJH; где
XJH представляет собой C1-6 алкил, в котором до 3 метиленовых звеньев необязательно замещены на группы -O-, -NH, N(C1-C6 алифатическая группа) или -C(O)-;
QJH представляет собой C3-6 циклоалкил, фенил, необязательно замещенный группой -O(C1-4 алкил), или пиперазинил, необязательно замещенный C1-4 алкилом.
В других вариантах осуществления настоящего изобретения
JH1 представляет собой Н, ОН, СН2ОН, СН2СН2ОН или CH2OC(O)СН3;
JH2 представляет собой Н, СН2СН3, СН2СН2СН3, СН(СН3)2, СН2СН2СН(СН3)2, СН2ОН, СН2СН2ОН, СН2СН2С(O)ОН, СН2СН(ОН)СН2ОН, CH2OC(O)СН3 N(CH3)CH2CH2N(СН3)2, фенил, 3-метоксифенил, 4-метилпиперазинил или СН2-циклогексил; и
JH отсутствует (т.е. JH представляет собой Н или JH отсутствует).
В других вариантах осуществления настоящего изобретения XJH представляет собой Cl-6 алкил, и QJH представляет собой С3-6 циклоалифатическую группу, оксетанил, тетрагидропирролидинил, пиперидинил, пиперазинил или морфолинил.
Еще один вариант осуществления настоящего изобретения предоставляет соединение формулы ID-а:
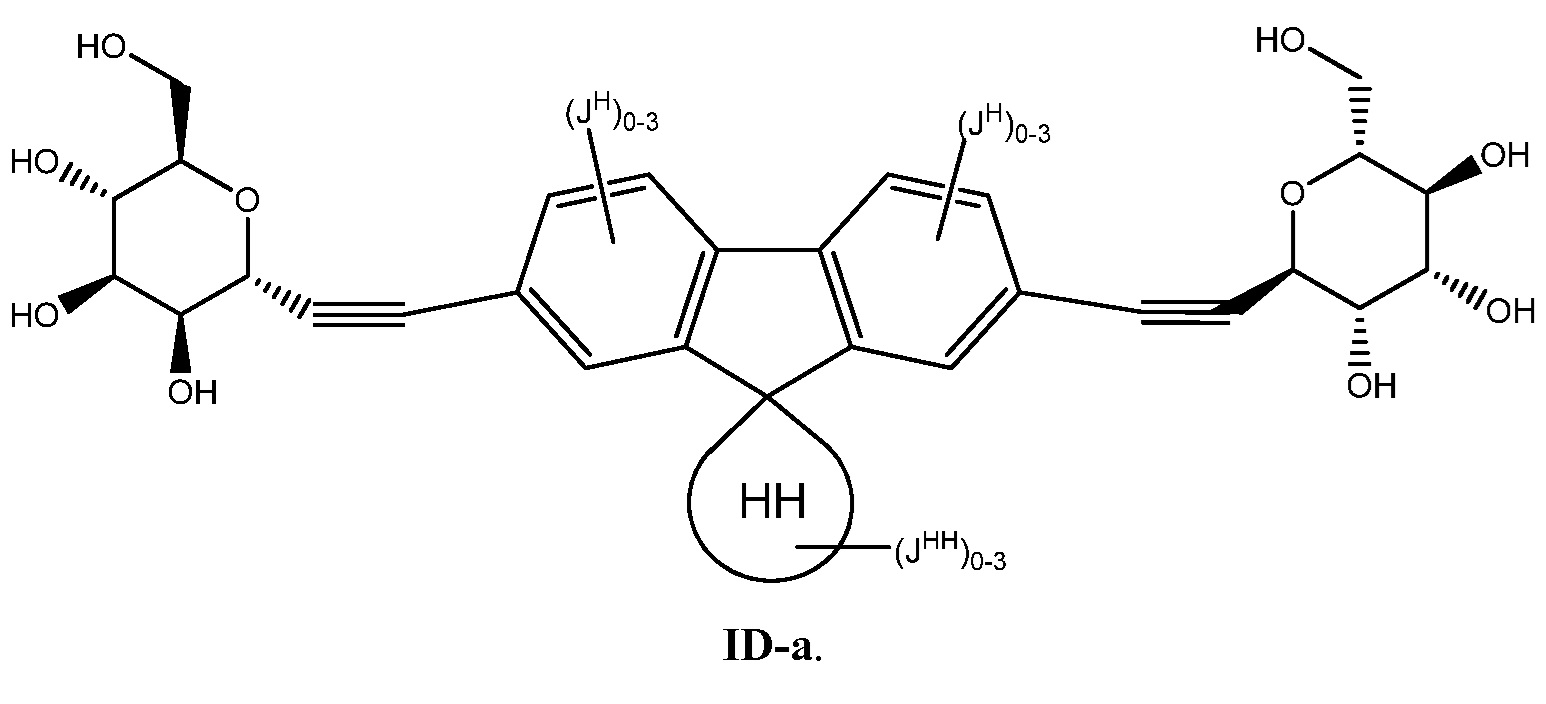
В некоторых вариантах осуществления настоящего изобретения
кольцо НН представляет собой 3-8-членное насыщенное моноциклическое кольцо, содержащее 0-2 гетероатома, выбранных из атомов кислорода, азота или серы;
JHH представляет собой XJ, QJ или XJ-QJ;
XJ представляет собой C1-C10 алифатическую группу, в которой до 4 метиленовых звеньев необязательно замещены на группы -O-, -NH, N(C1-C6 алифатическая группа), -S-, -С(O)-, -S(O)- или -S(O)2-; XJ является необязательно замещенным 0-6 атомами галогенов или 0-1 группой CN;
QJ представляет собой 3-7-членное моноциклическое насыщенное, частично ненасыщенное или ароматическое кольцо, необязательно содержащее 1-4 гетероатома, выбранных из атомов кислорода, азота или серы; где каждый QJ является необязательно замещенным 1-6 группами, выбранными из атомов галогенов, CN, NO2 или C1-C6 алифатической группы, в которой до трех метиленовых звеньев необязательно замещены на группы О, NH, NH(C1-C6 алифатическая группа), S, C(O), S(O) или S(O)2; и
JH представляет собой галоген, CN, NO2 или C1-C6 алифатическую группу, в которой до трех метиленовых звеньев необязательно замещены на группы О, NH, NH(C1-C6 алифатическая группа), S, C(O), S(O) или S(O)2.
В некоторых вариантах осуществления настоящего изобретения кольцо НН представляет собой циклопентил, циклогексил, тетрагидропиранил, 1,3-дитианил, пиперазинил, пиперидинил или оксепанил. В других вариантах осуществления настоящего изобретения кольцо НН представляет собой пиперидинил или тетрагидропиранил.
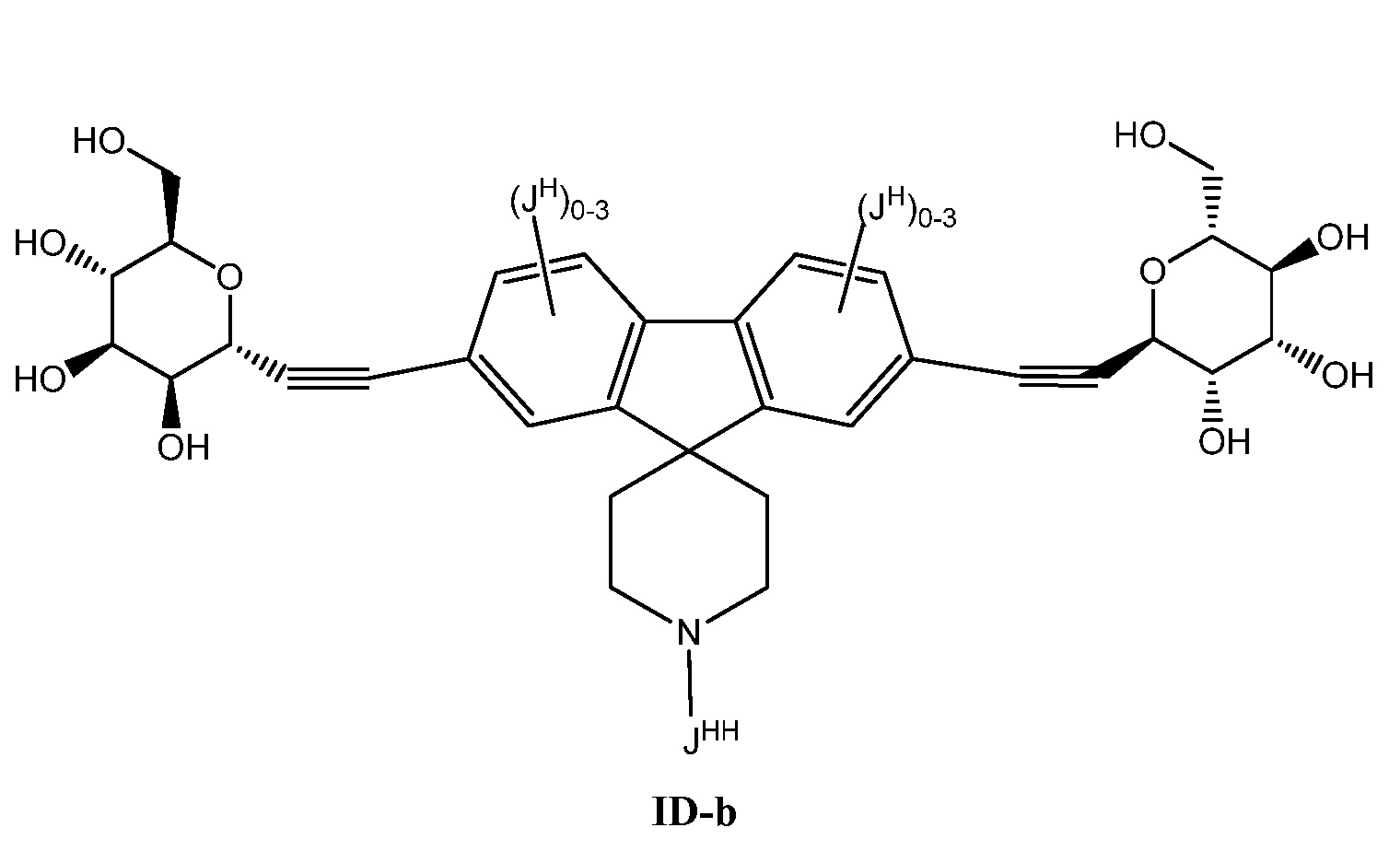
Еще один вариант осуществления настоящего изобретения предоставляет соединение формулы ID-b:
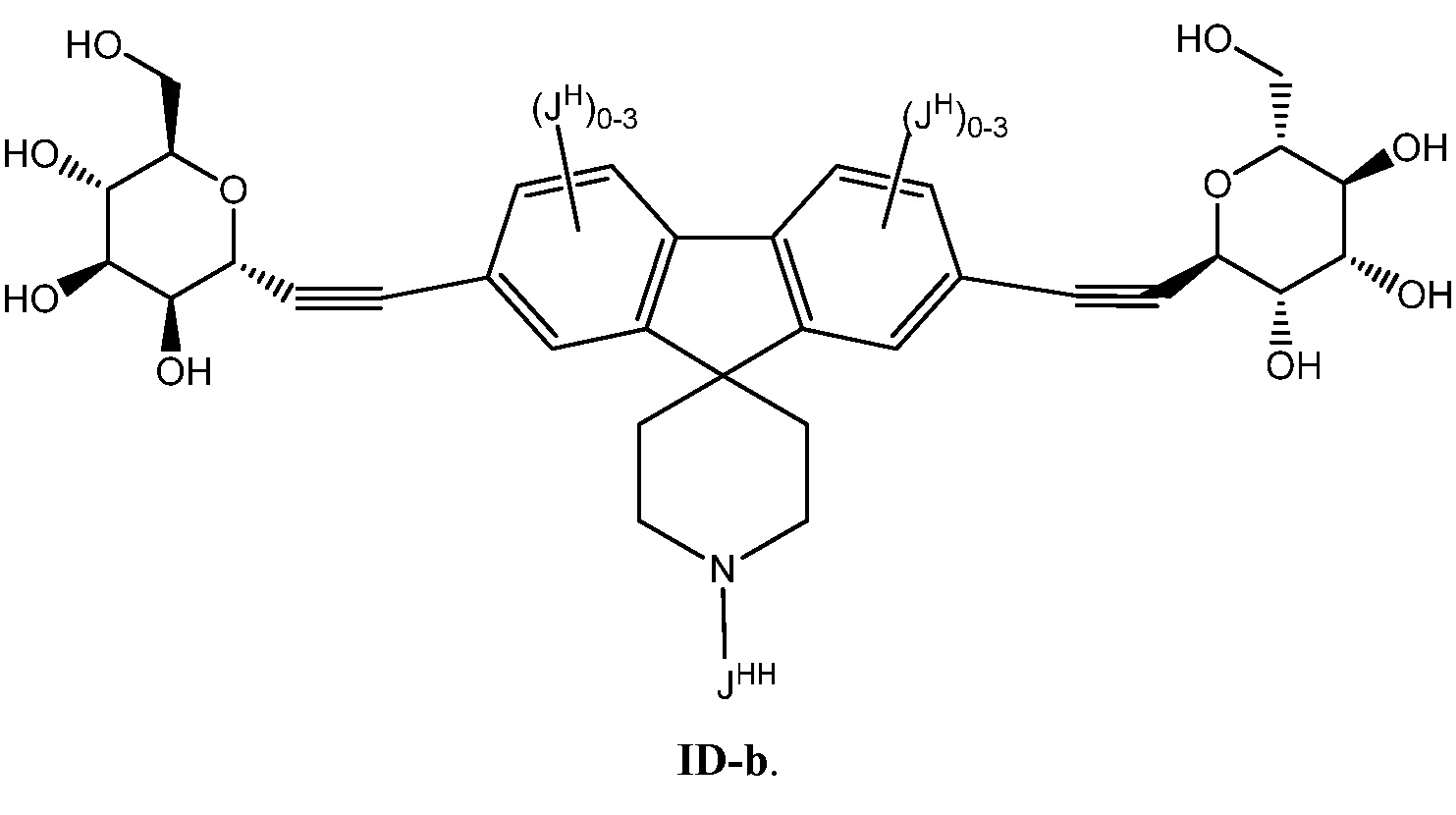
В некоторых вариантах осуществления настоящего изобретения
JHH представляет собой XJ, QJ или XJ-QJ;
XJ представляет собой C1-C4 алифатическую группу, в которой до двух метиленовых звеньев необязательно замещены на группы -O-, -NH, N(C1-C6 алифатическая группа), -S-, -C(O)-, -S(O)- или -S(O)2-;
QJ представляет собой 3-6-членное моноциклическое насыщенное, частично ненасыщенное или ароматическое кольцо, необязательно содержащее 1-4 гетероатома, выбранных из атомов кислорода, азота или серы; где каждый QJ является необязательно замещенным 1-3 группами, выбранными из атомов галогена, CN или C1-C6 алифатической группы, в которой до двух метиленовых звеньев необязательно замещены на группы О, NH, NH(C1-C6 алифатическая группа), S, C(O), S(O) или S(O)2; и
JH представляет собой галоген или C1-C4 алкил.
В некоторых вариантах осуществления настоящего изобретения JHH представляет собой Н, С(O)(C1-6 алкил), C(O)О(C1-6 алкил), S(O)2(C1-6 алкил), C(O)(С3-6 циклоалкил), С(O)(3-6-членный гетероциклил), С(O)(5-6-членный гетероарил), C(O)-(C1-4 алкил)-(5-6-членный гетероарил), C(O)-(C1-4 алкил)-(гетероциклил); где указанный гетероарил или гетероциклил содержит 1-3 гетероатома, выбранных из атомов кислорода, азота или серы; JHH является необязательно замещенным группами ОН, О(C1-6 алкил), оксо, C1-6 алкил, CN или галоген.
В других вариантах осуществления настоящего изобретения JHH представляет собой Н, С(O)СН3, С(O)OC(CH3)3, С(O)ОСН(СН3)2, C(O)ОСН2СН3, С(O)OC(ОН)(СН3)2, S(O)2СН3, С(O)СН(СН3)2, C(O)С(СН3)3, С(О)СН(СН3)ОСН3,
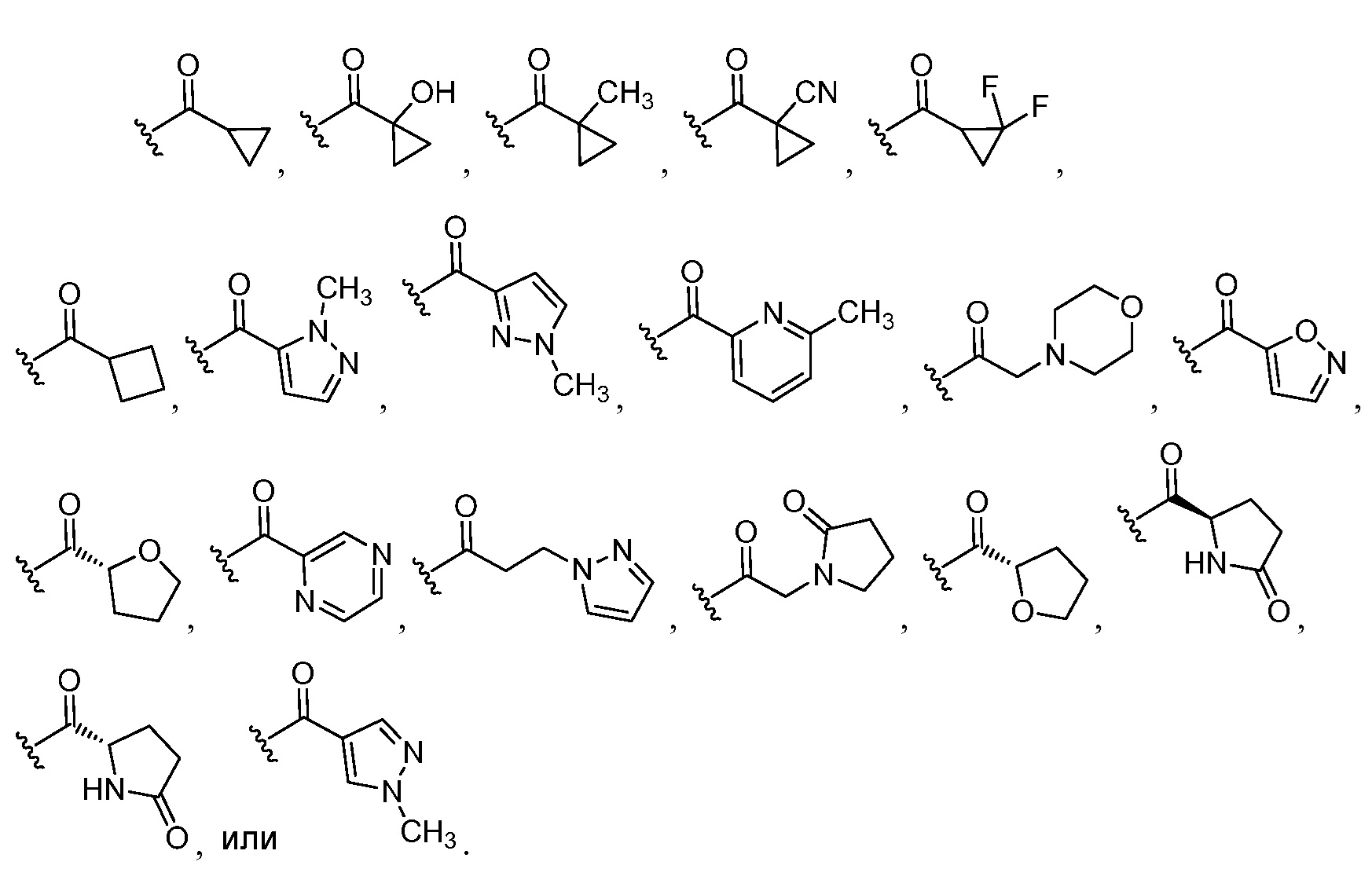
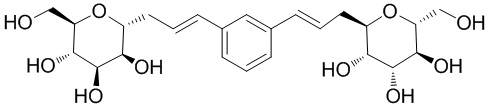
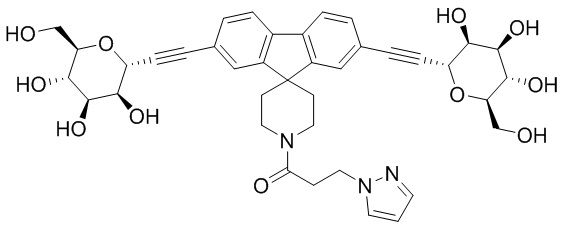
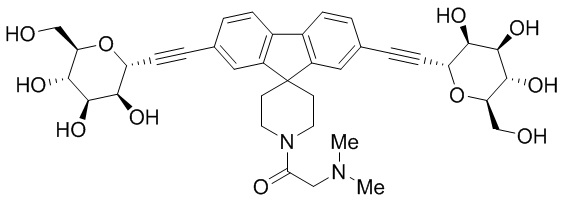
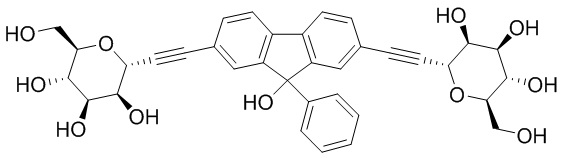
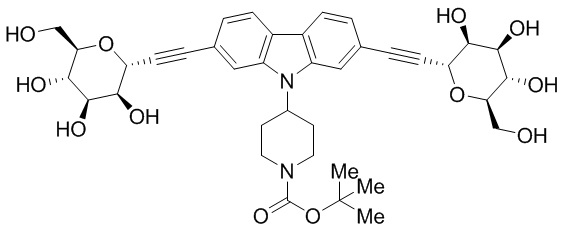
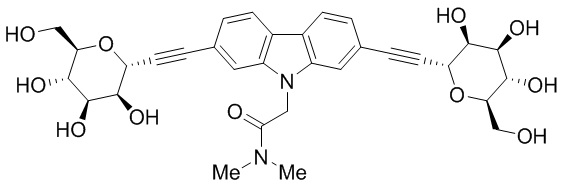
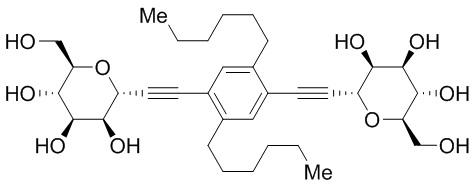
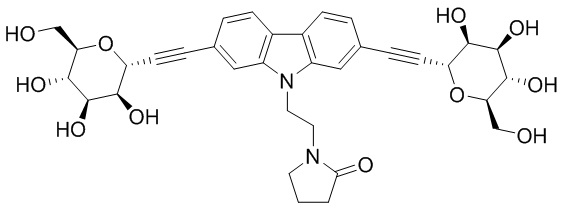
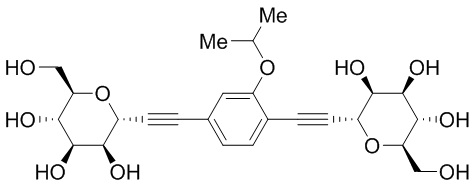
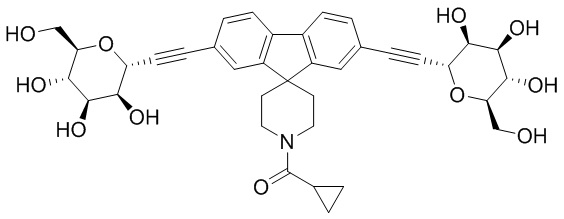
Еще один вариант осуществления изобретения предоставляет соединение, структурная формула которого выбрана из группы, включающей:
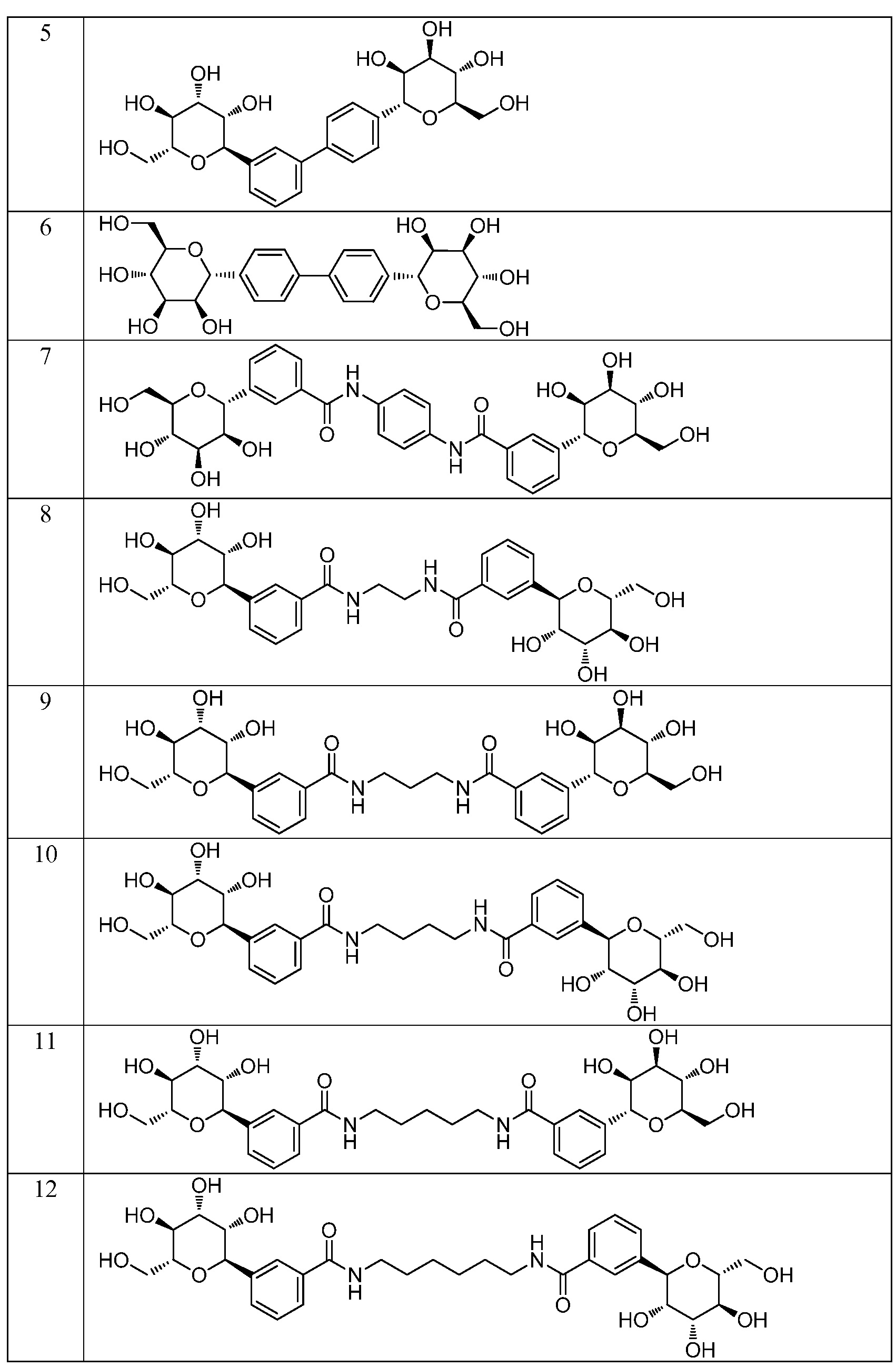
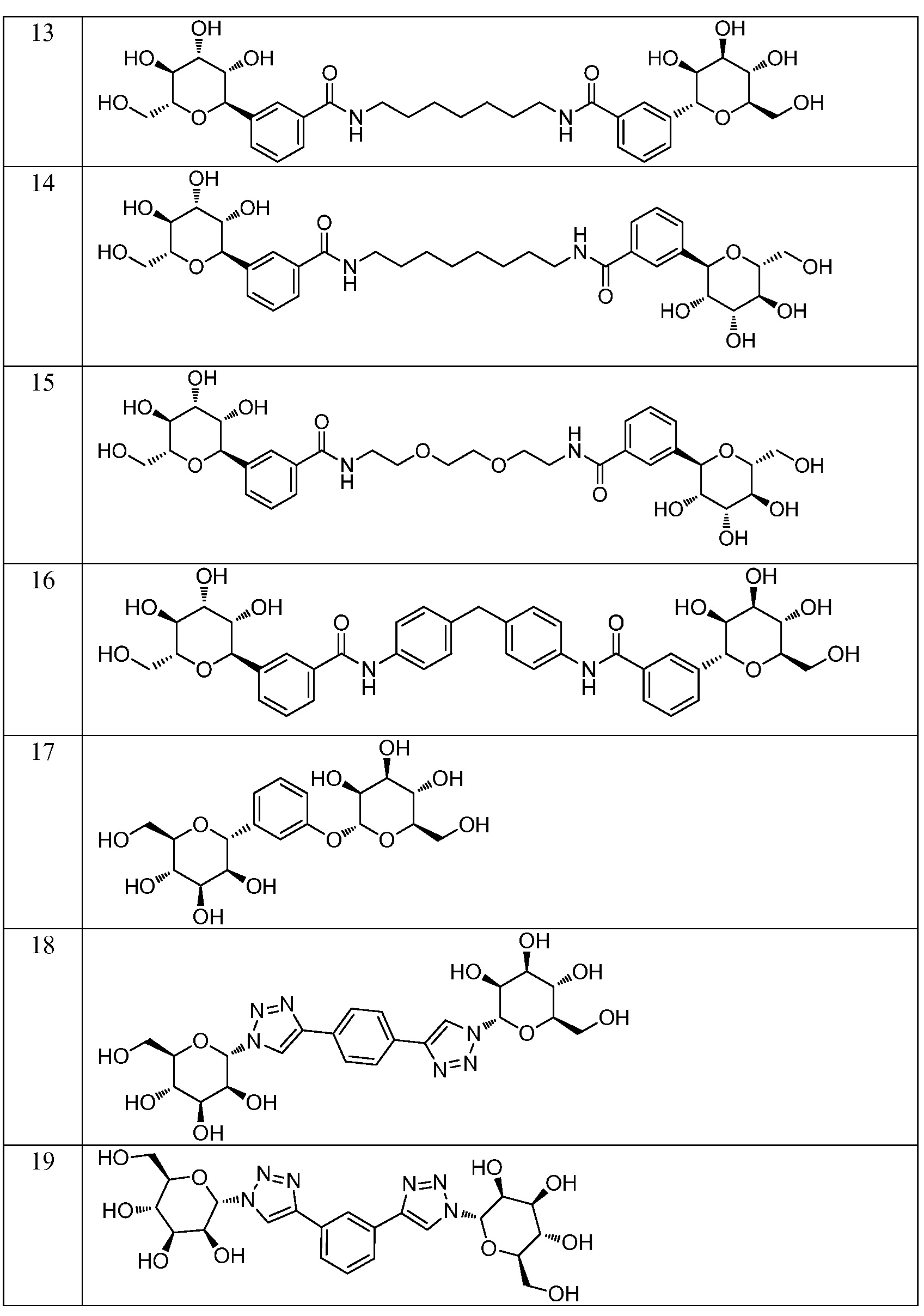
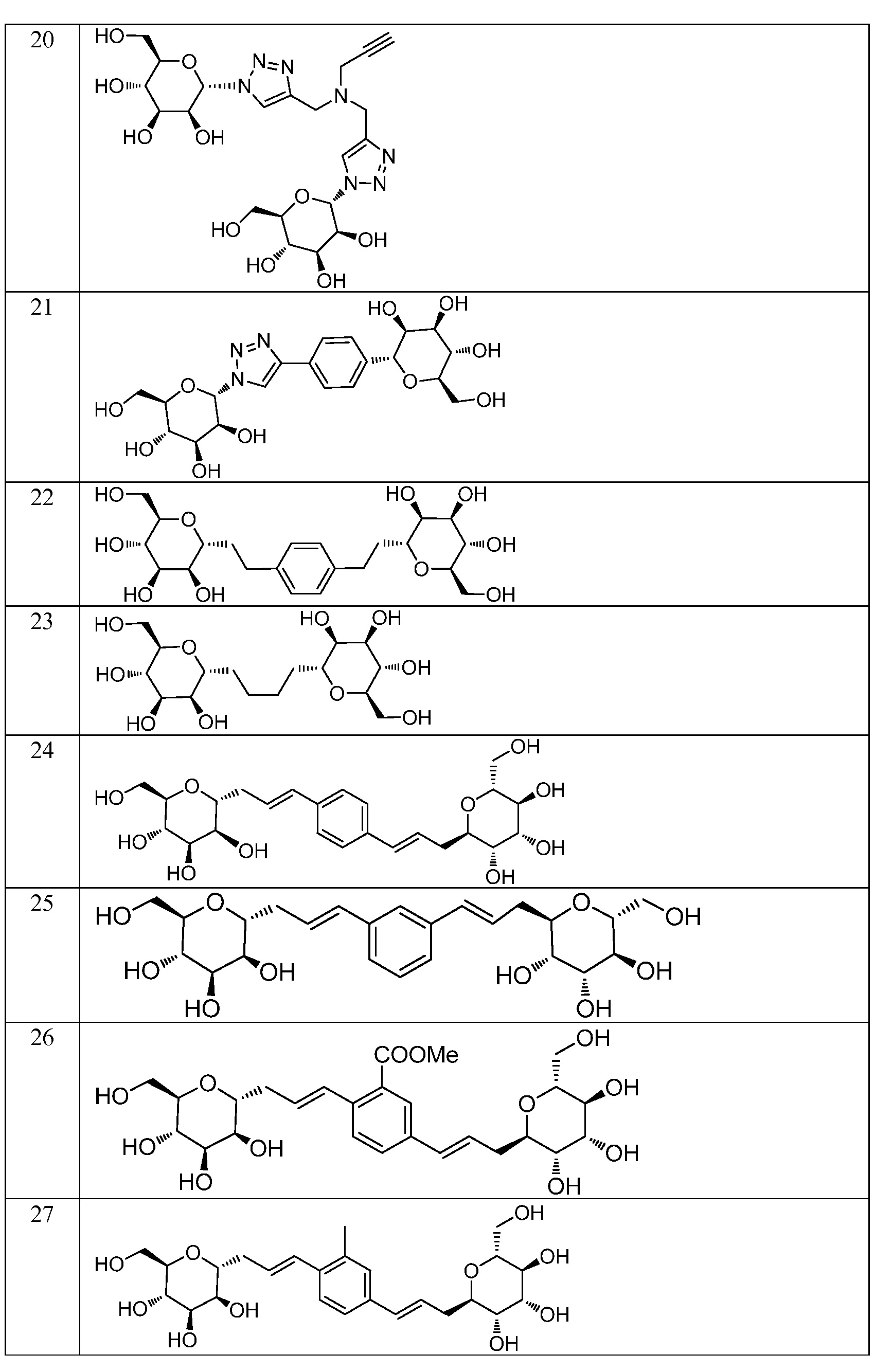
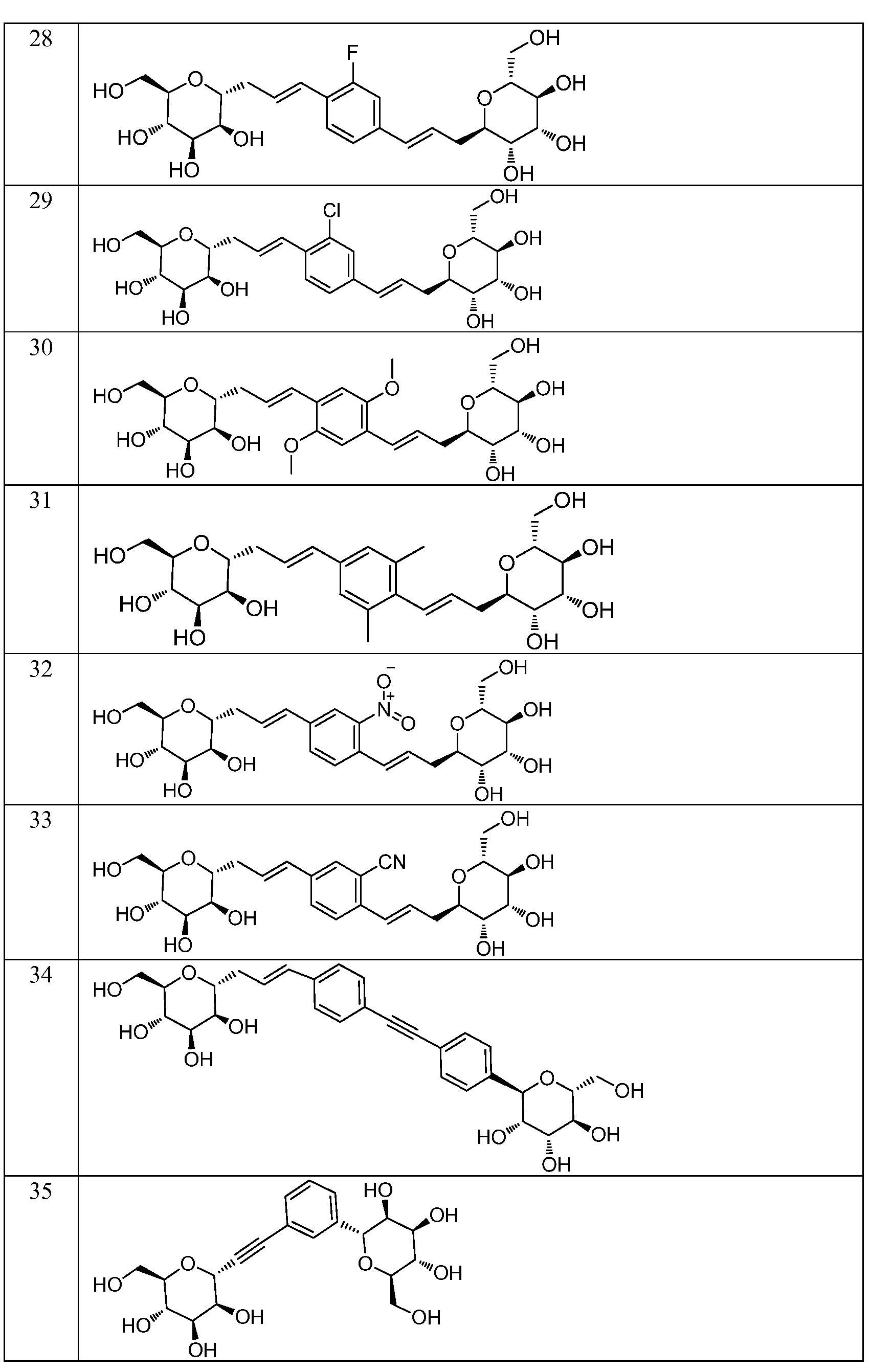
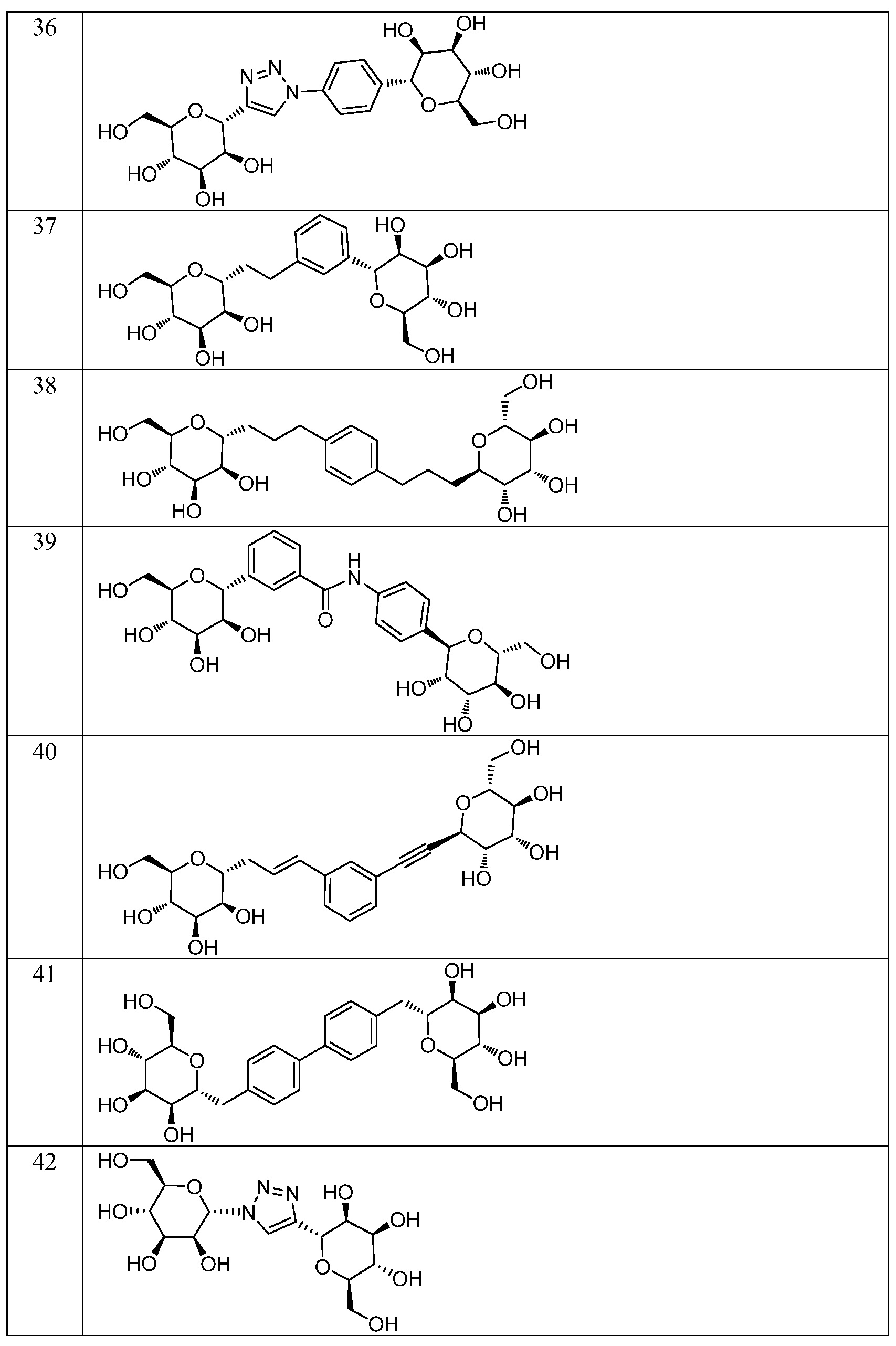
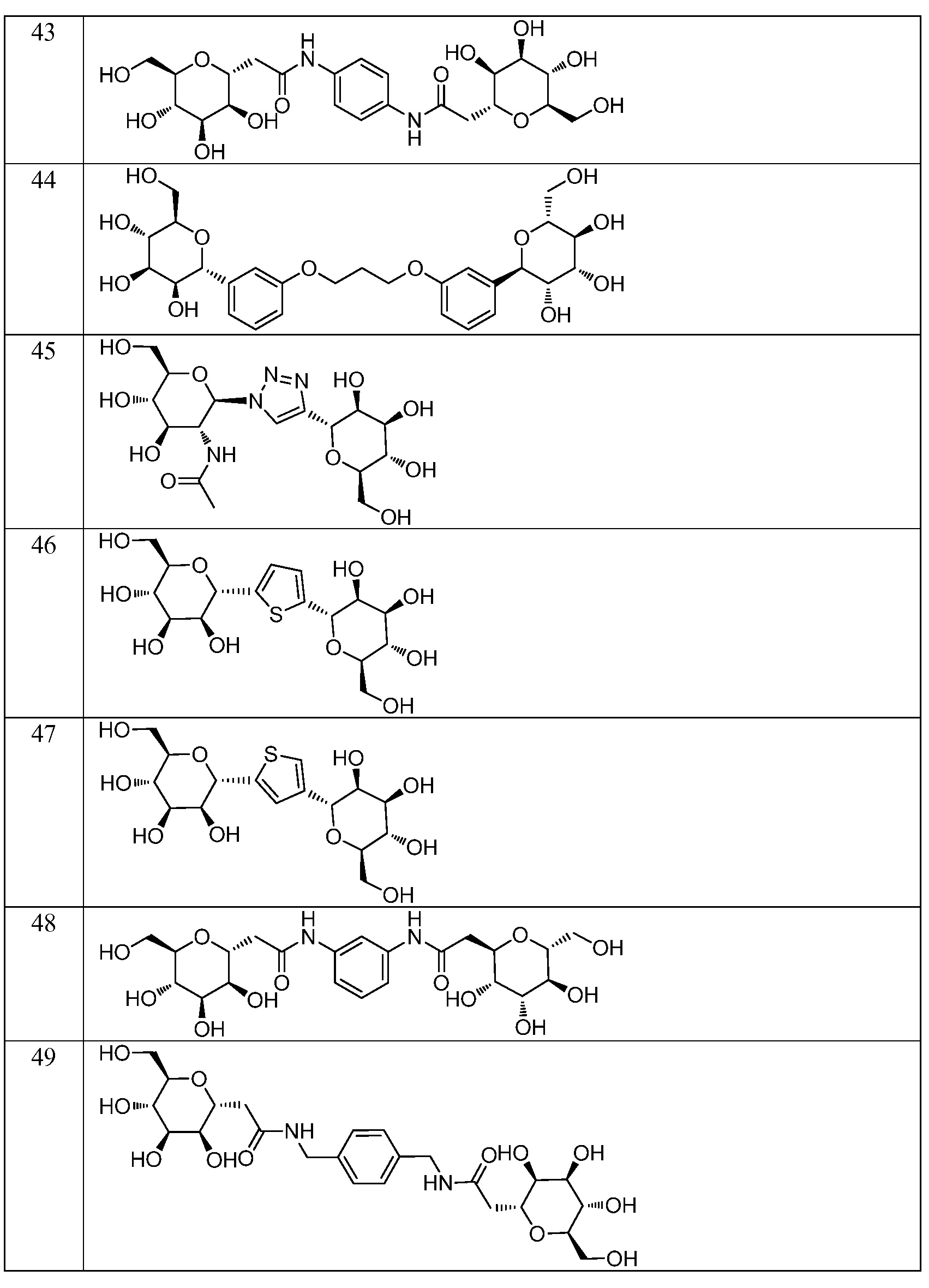
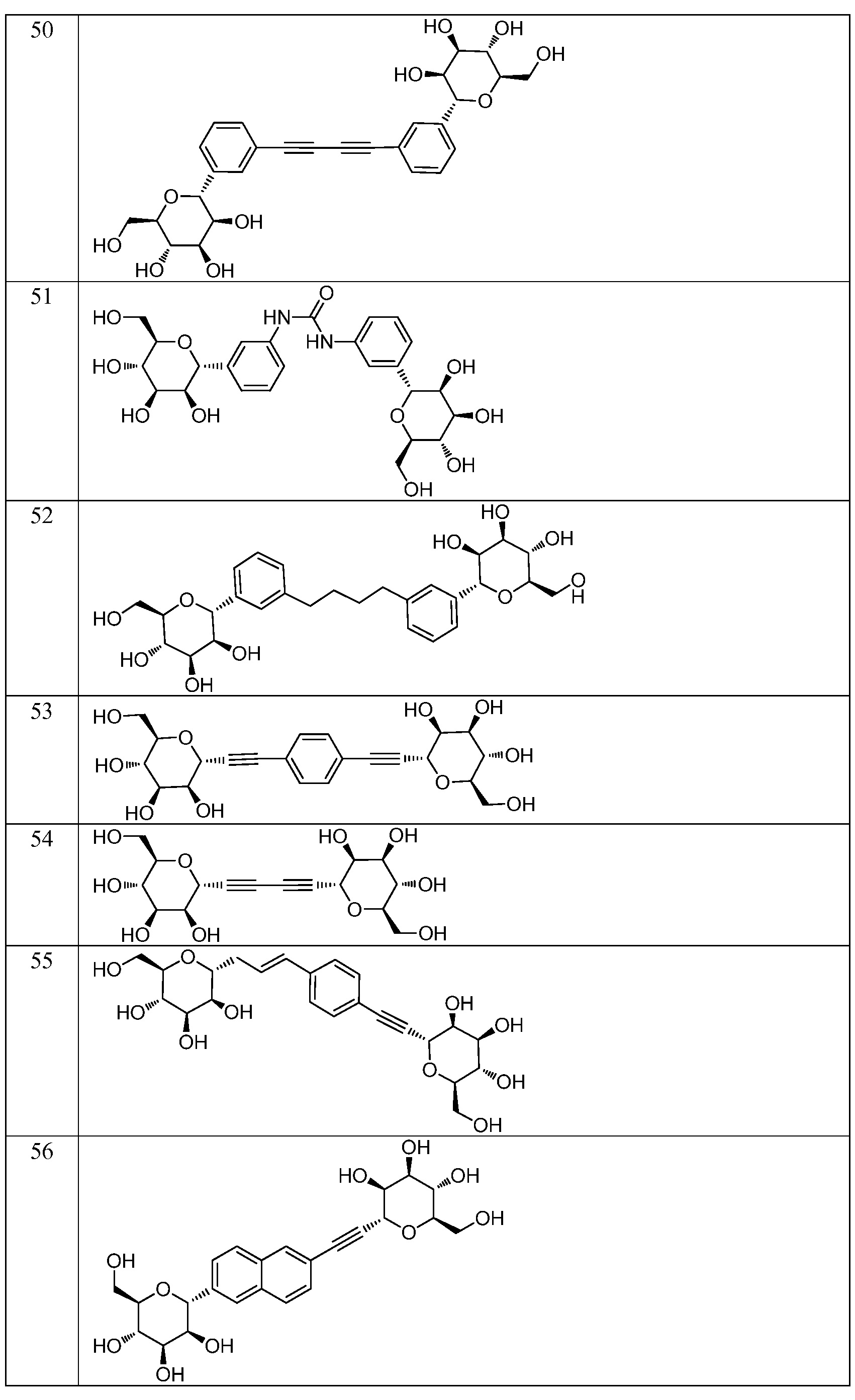
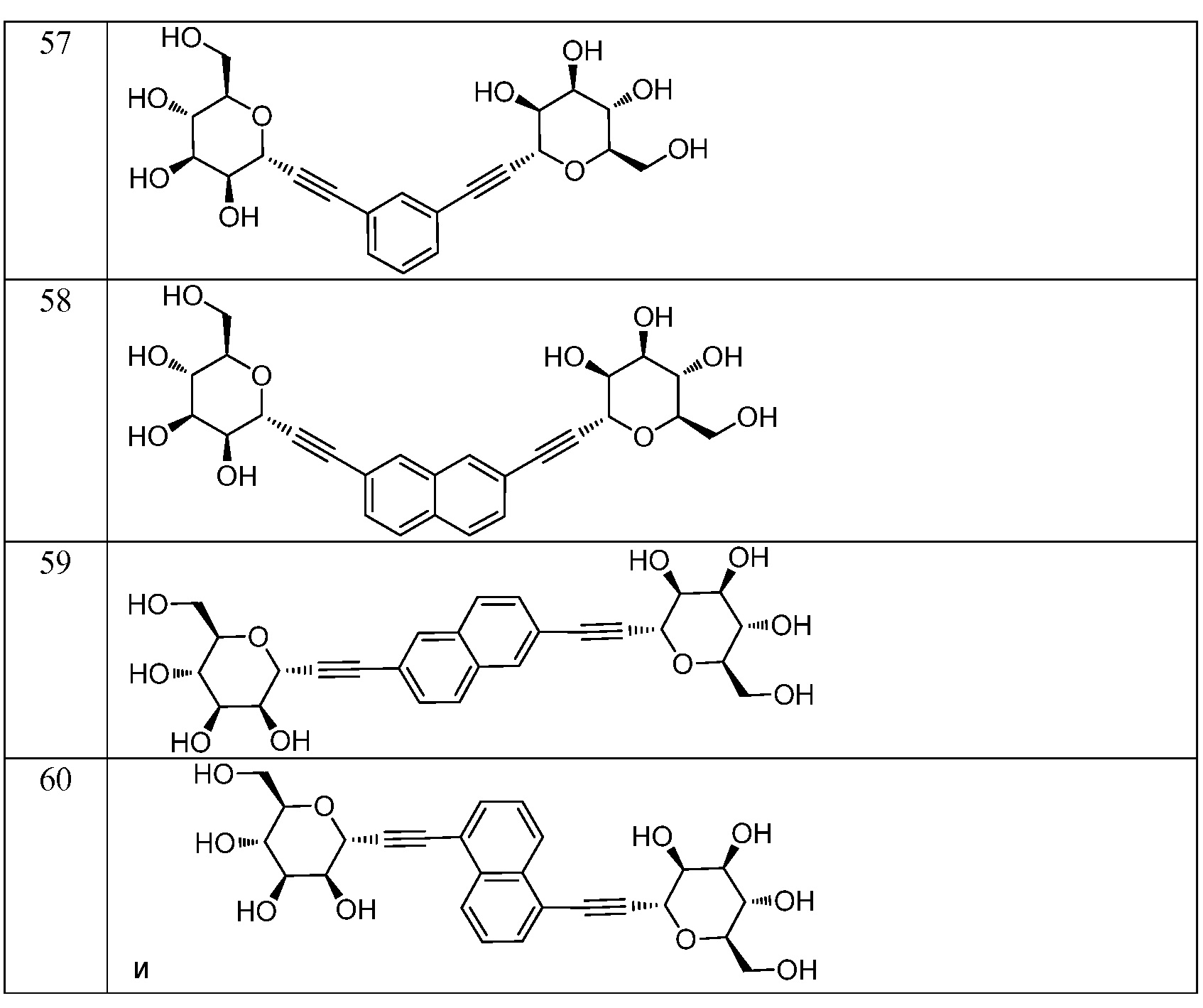
или их фармацевтически приемлемую соль.
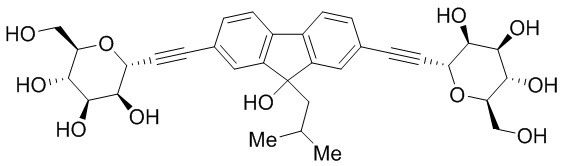
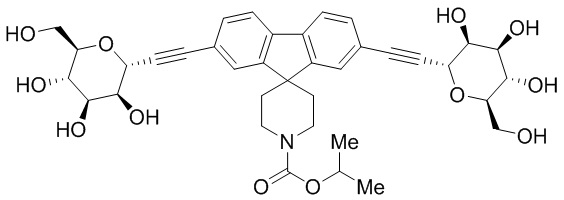
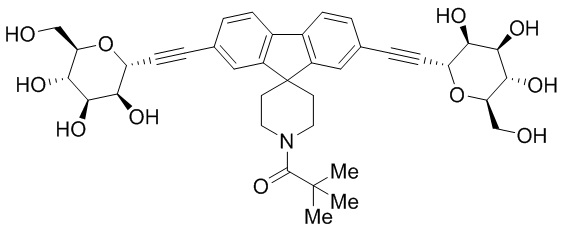
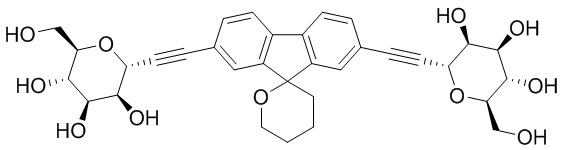
Еще один вариант осуществления настоящего изобретения предоставляет соединения структурной формулы, выбранной из группы, включающей
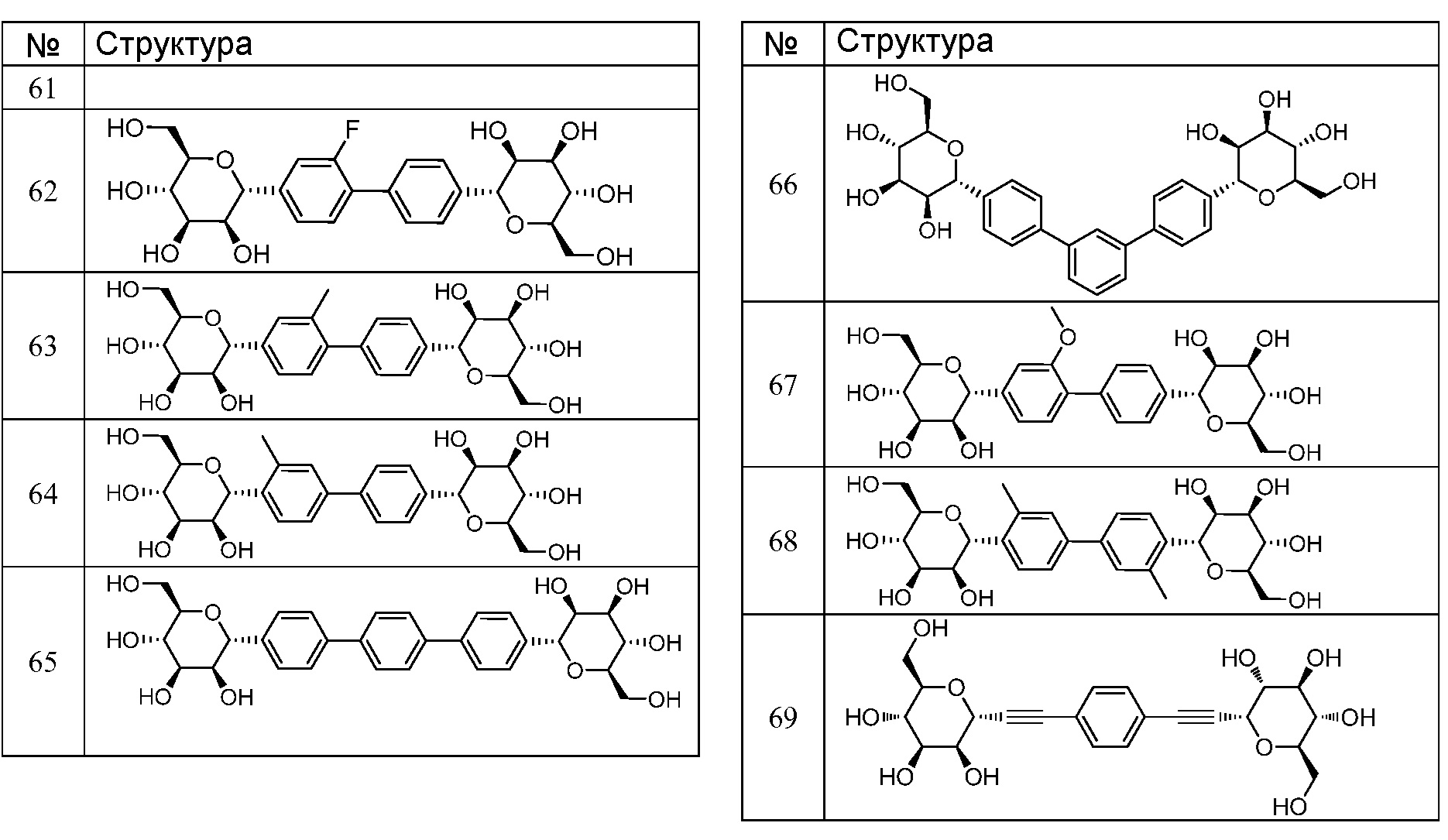
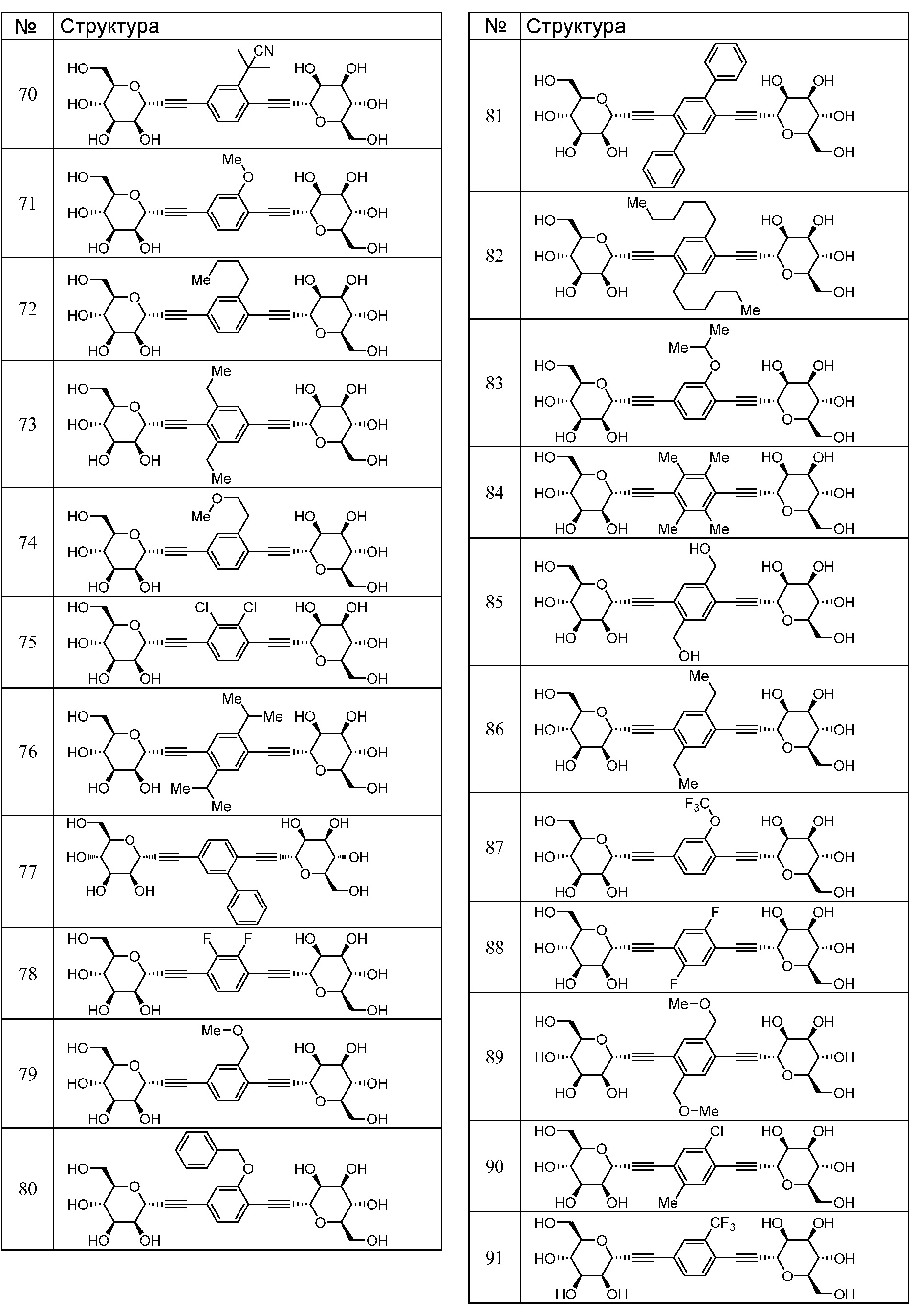
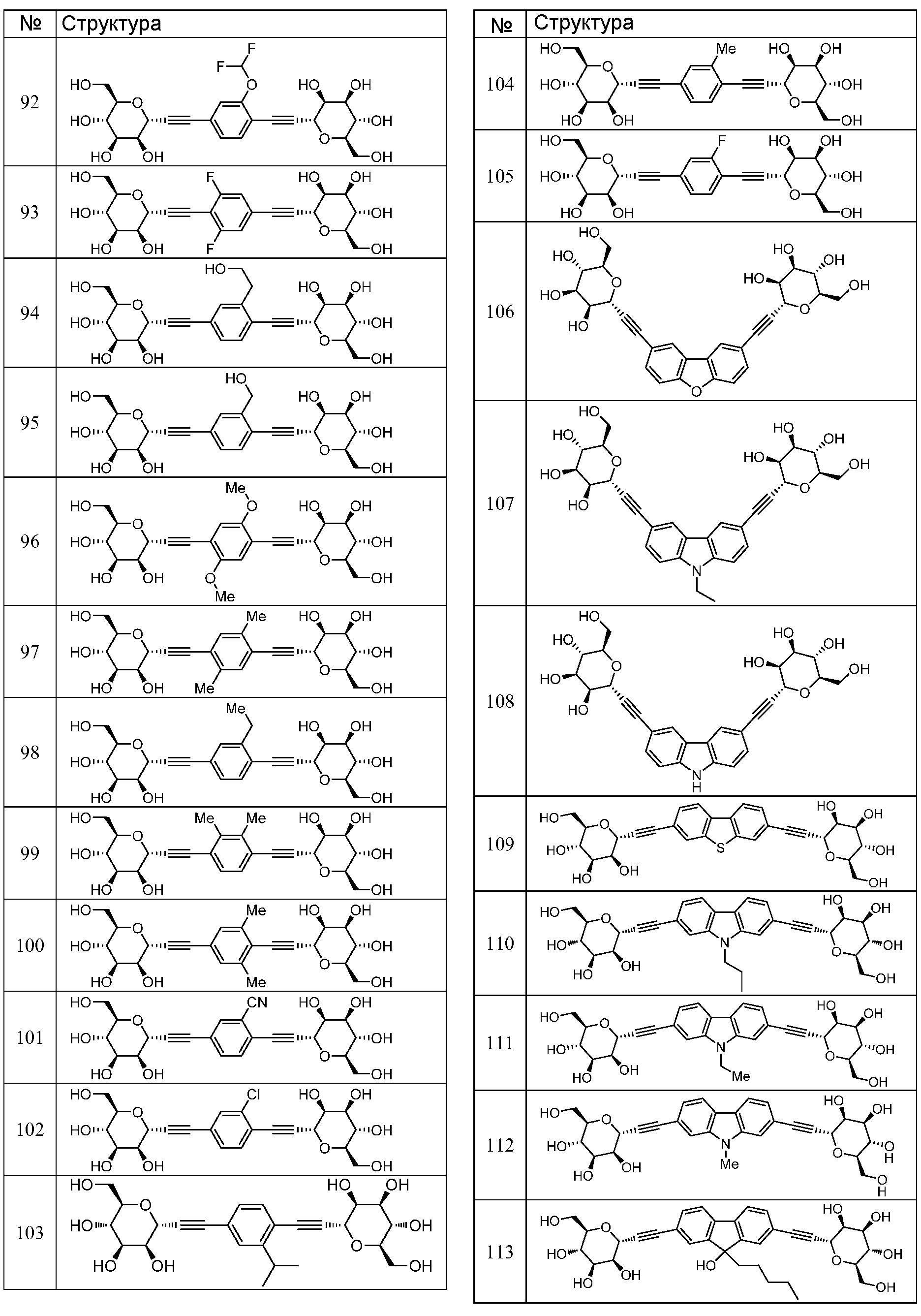
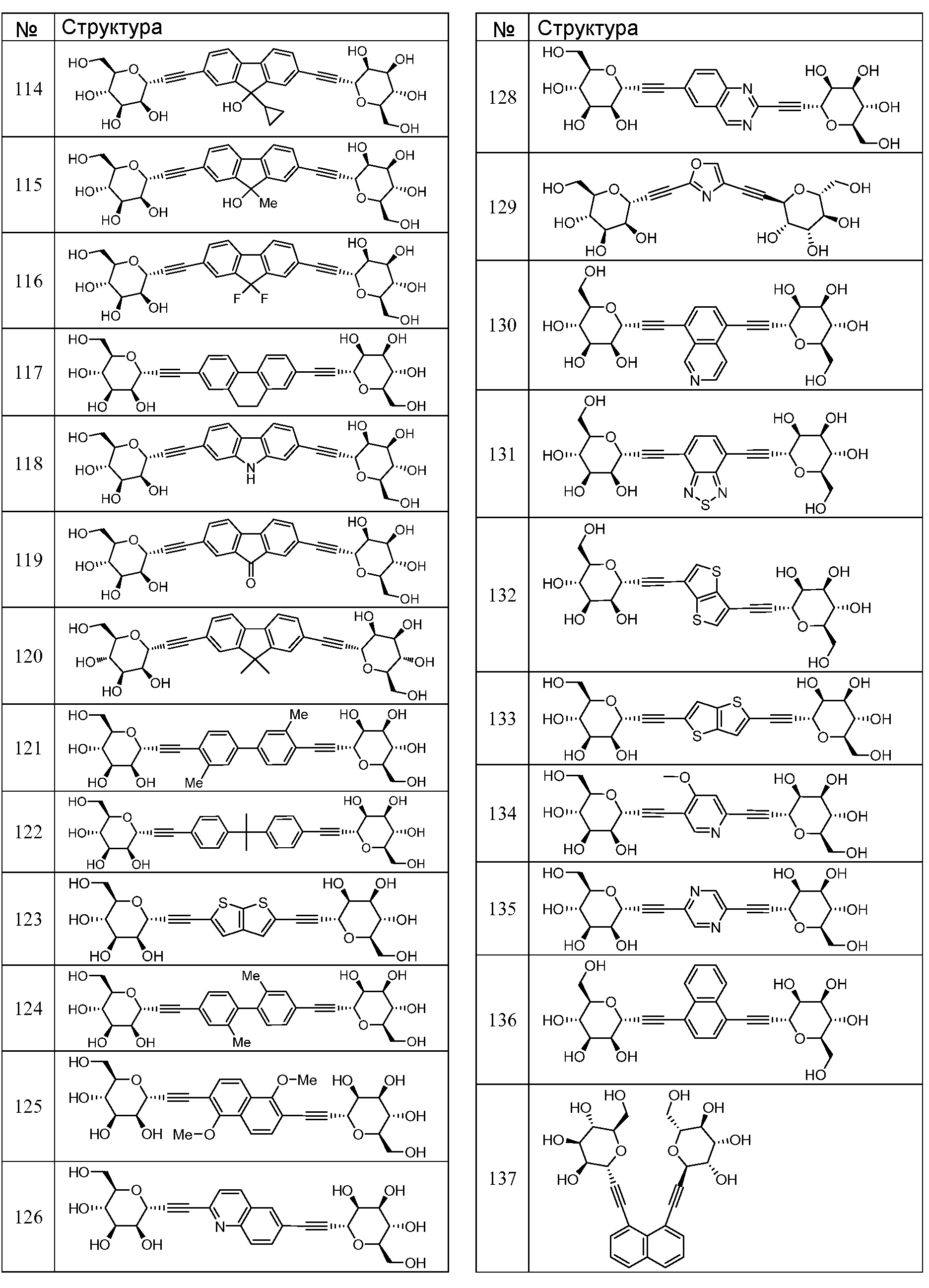
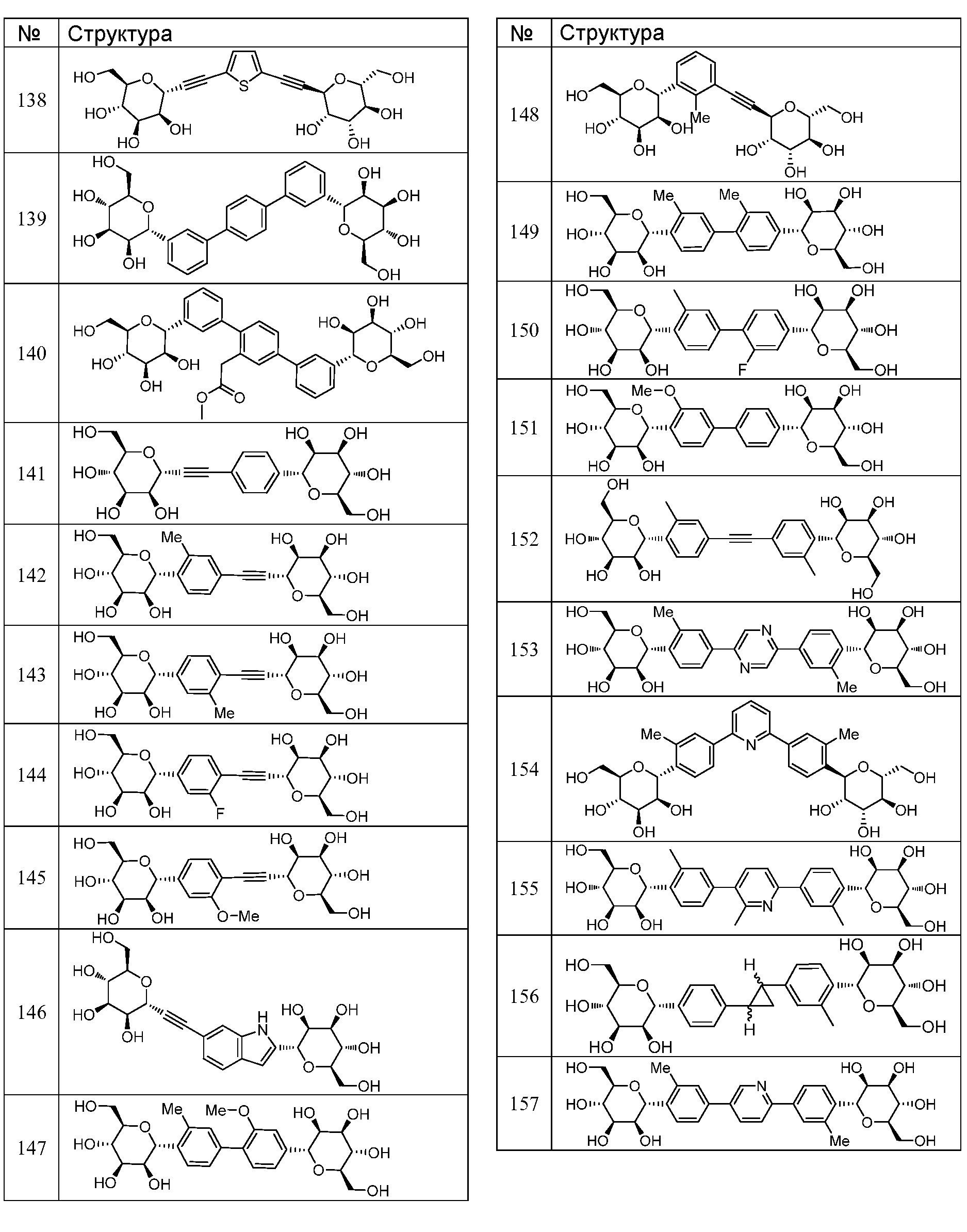
или их фармацевтически приемлемую соль.
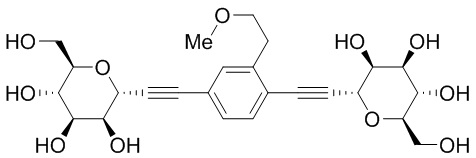
Еще один вариант осуществления изобретения предоставляет соединение, представленное структурной формулой, выбранной из группы, включающей:
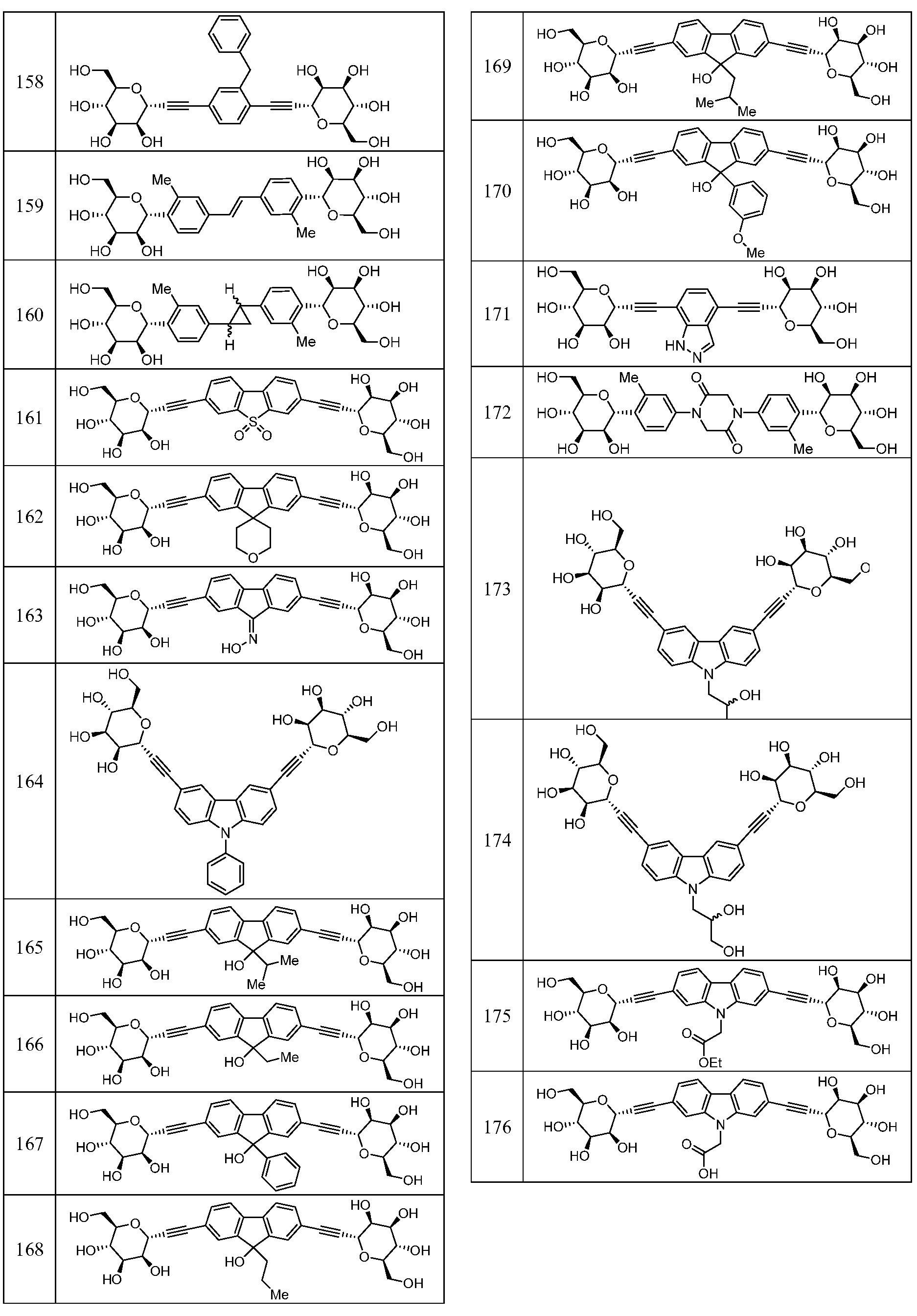
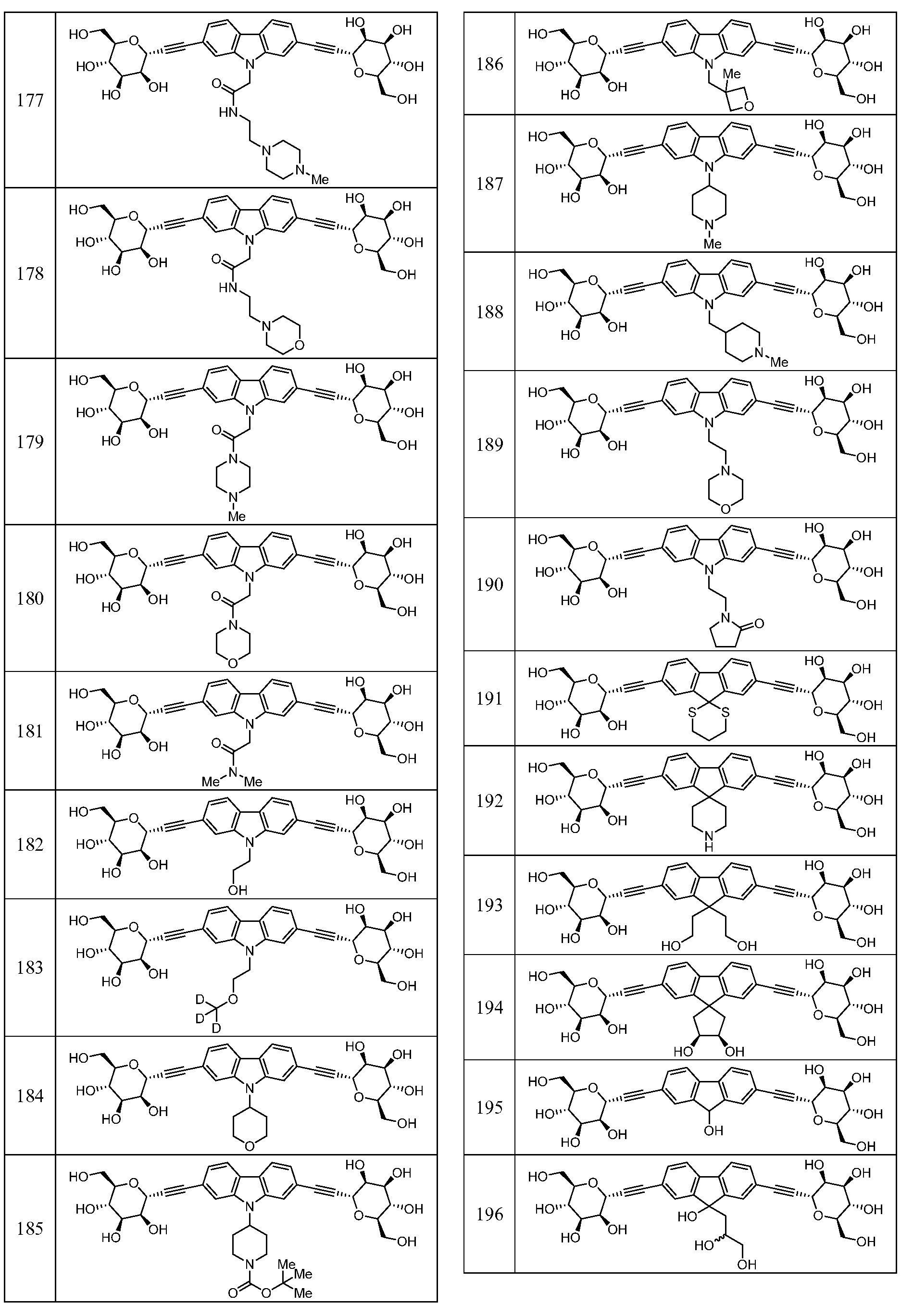
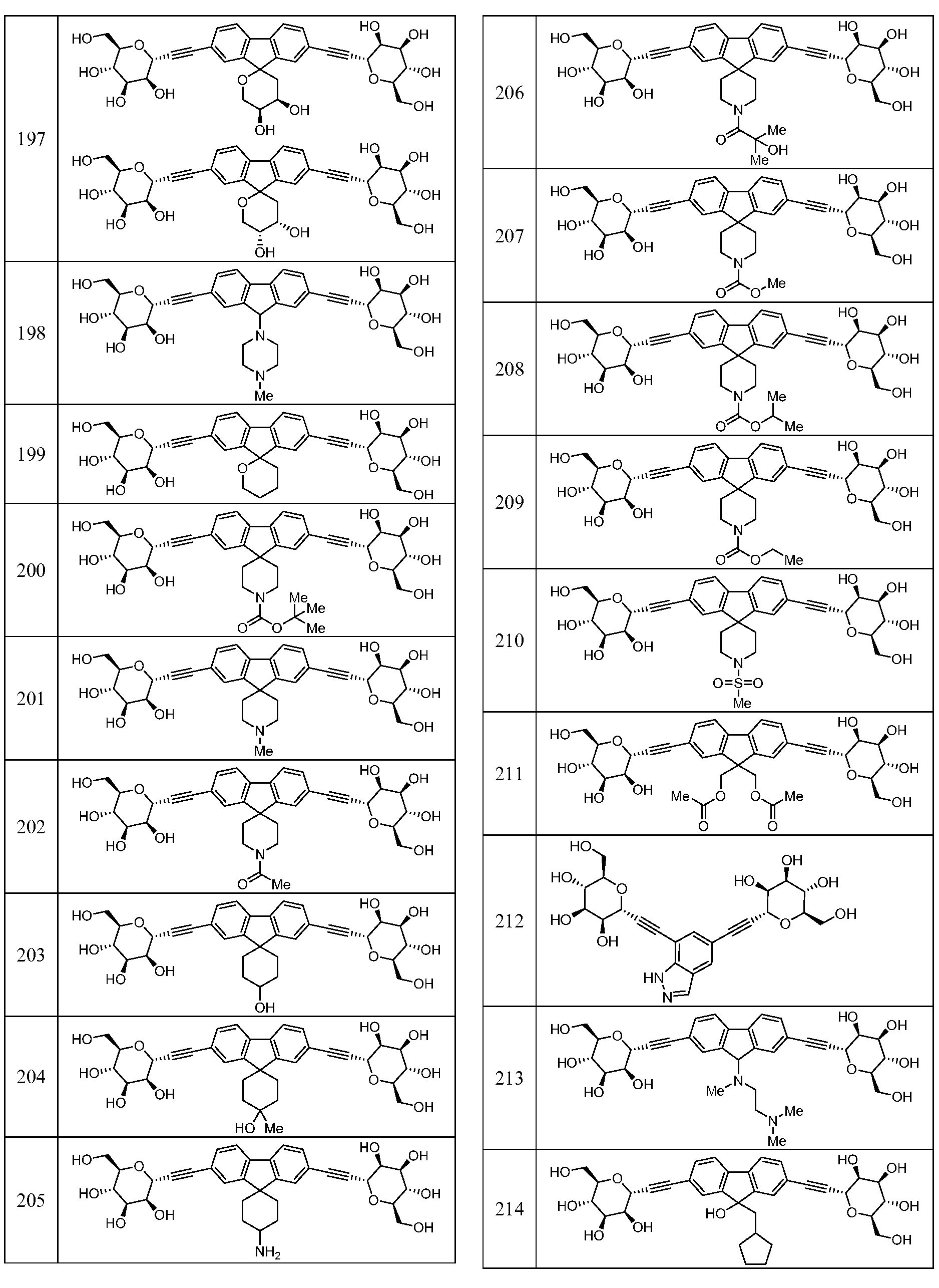
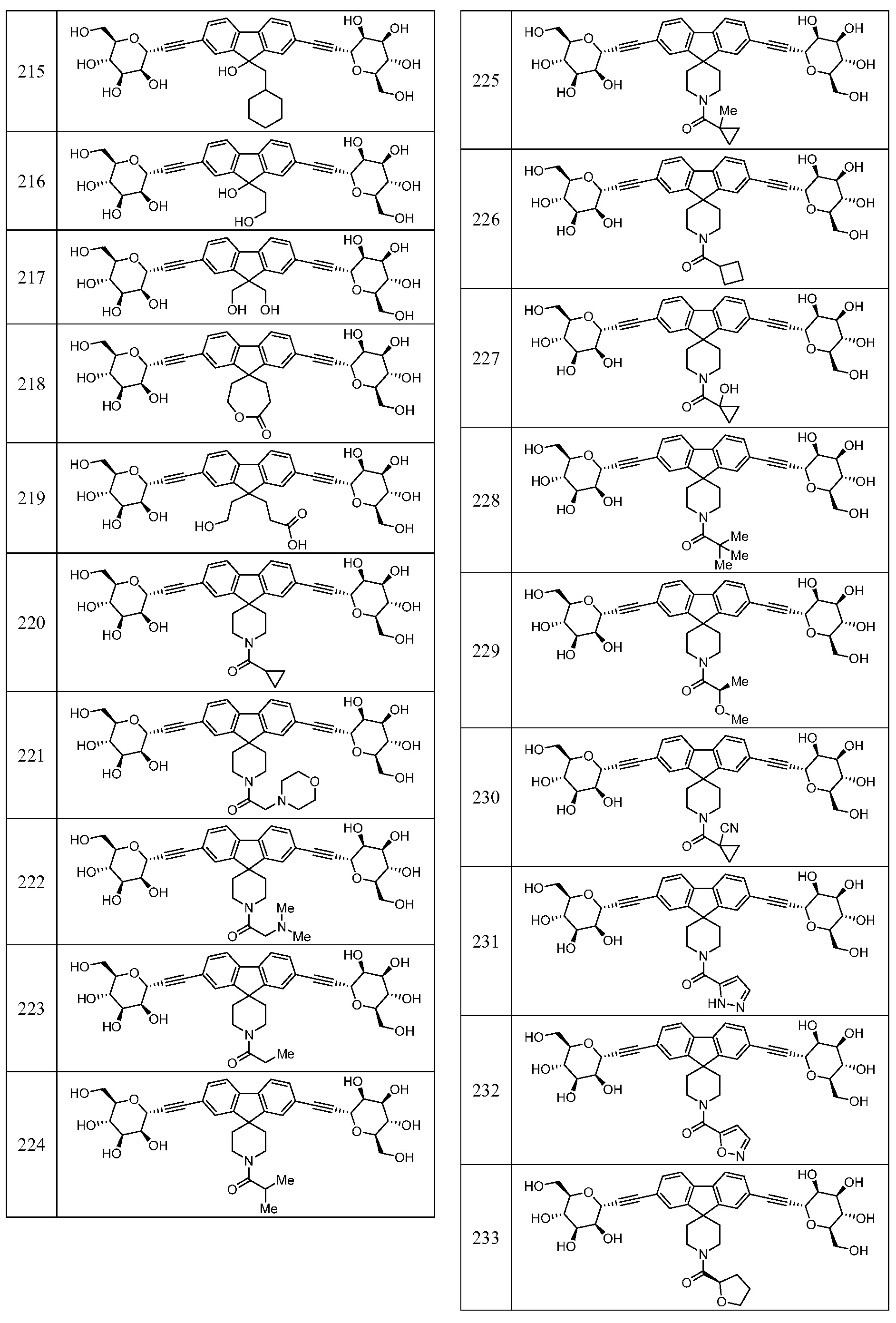
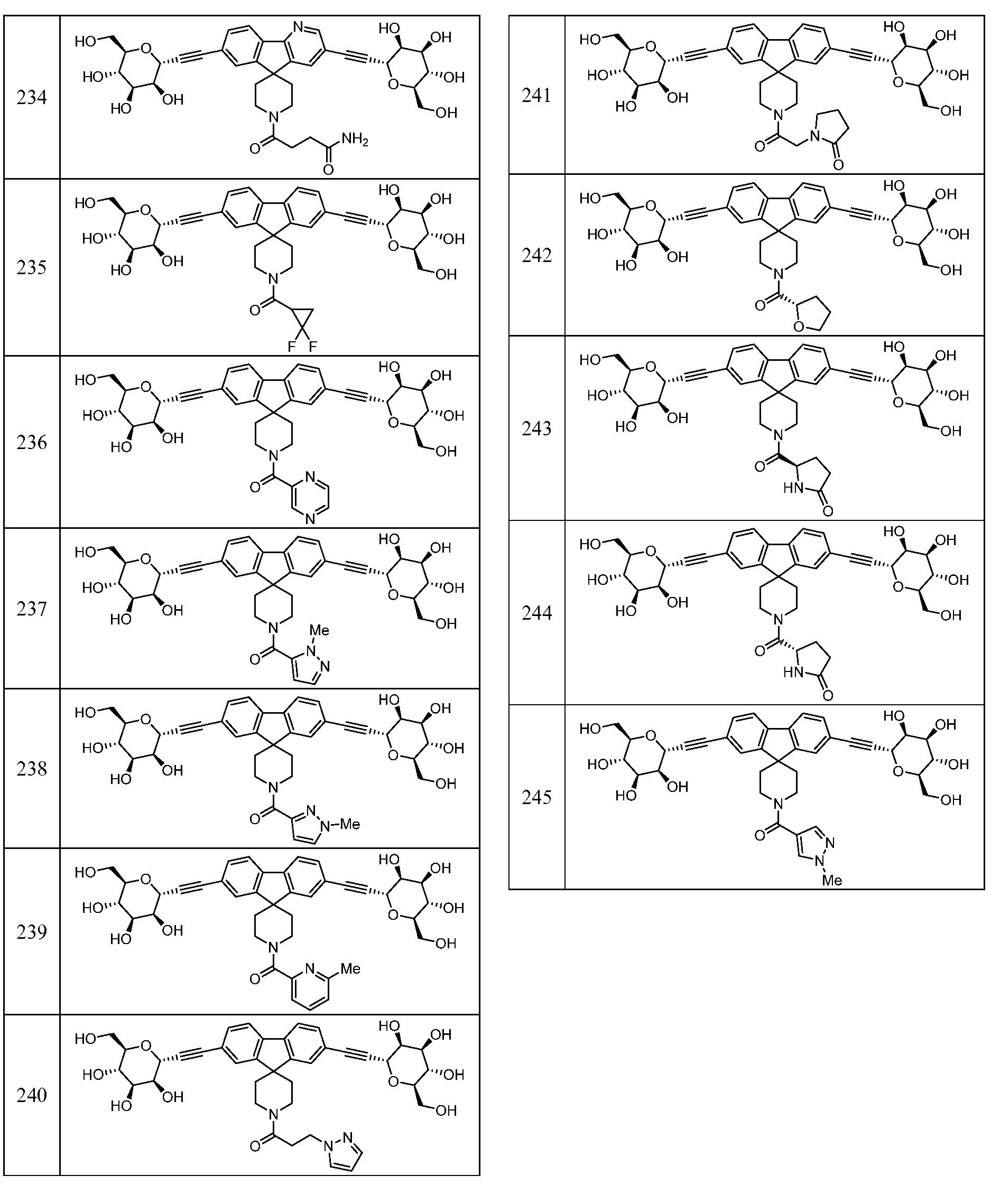
или его фармацевтически приемлемую соль.
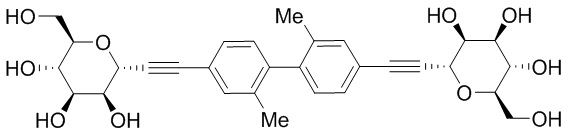
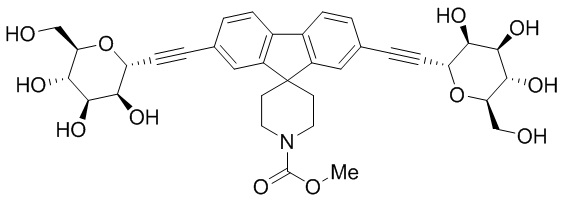
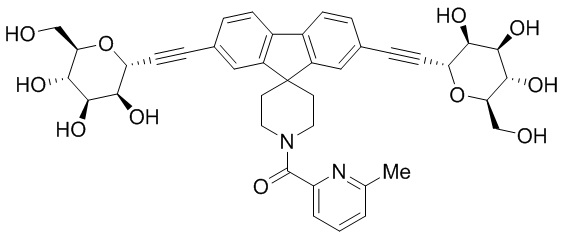
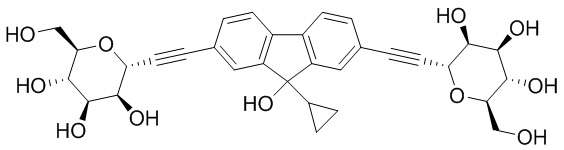
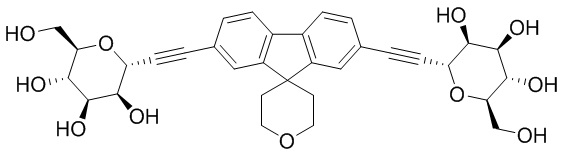
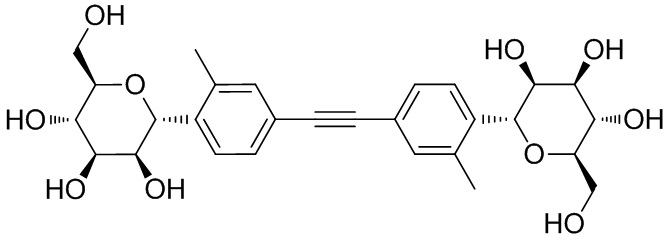
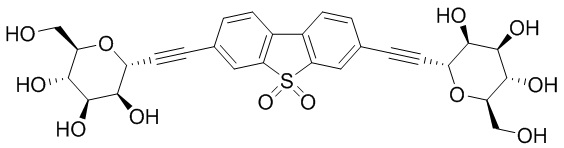
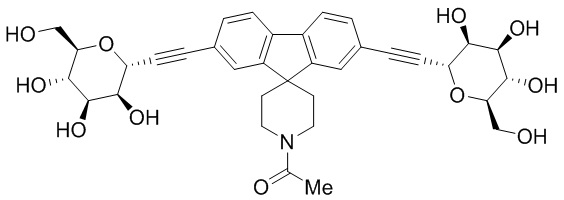
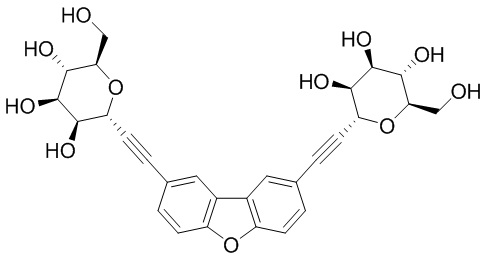
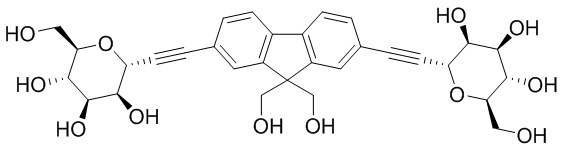
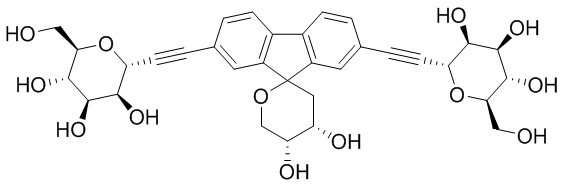
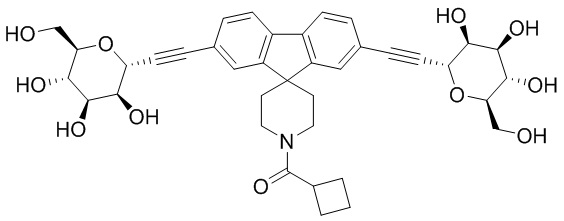
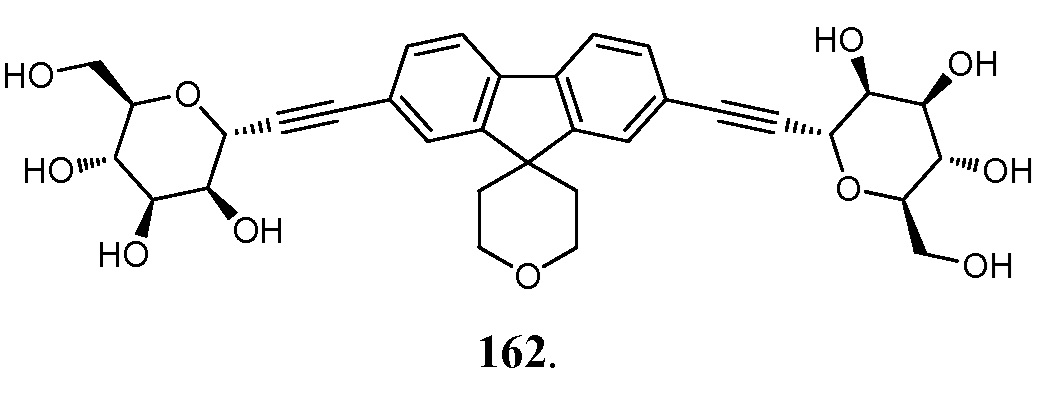
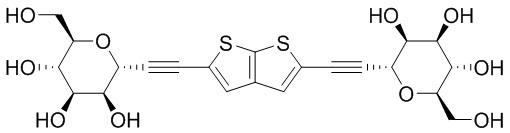
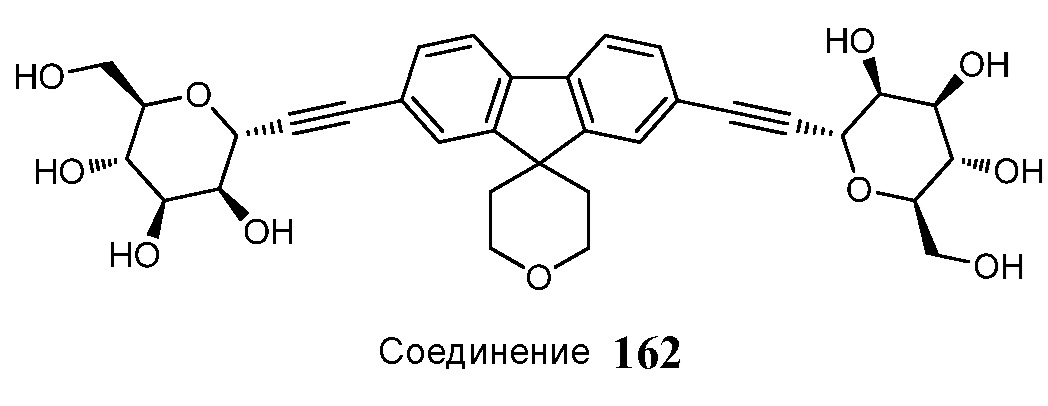
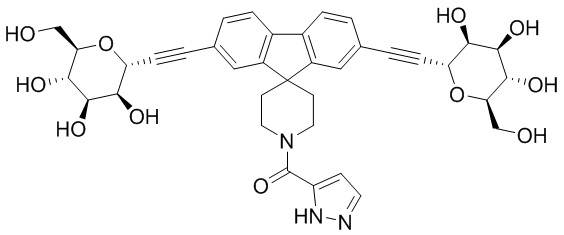
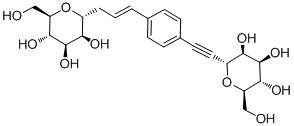
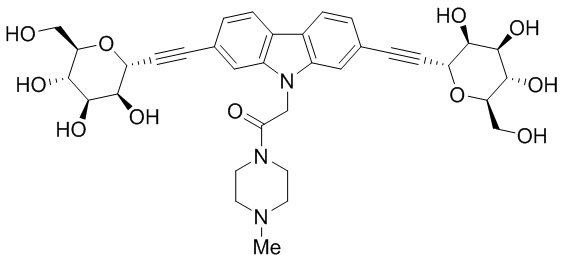
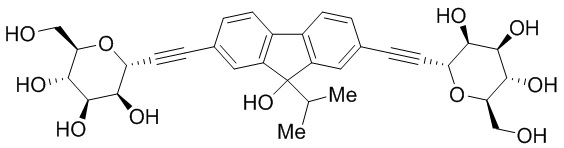
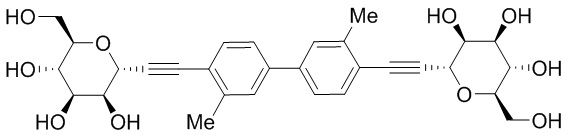
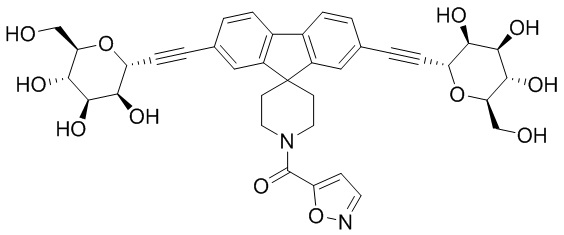
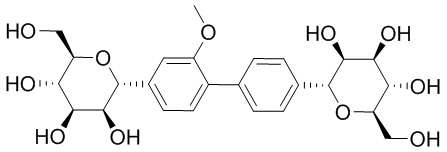
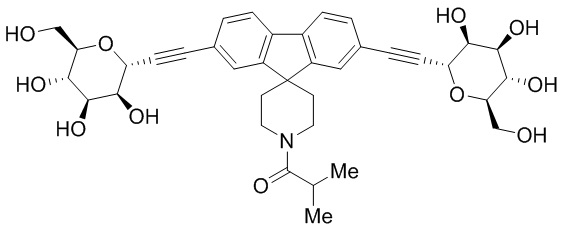
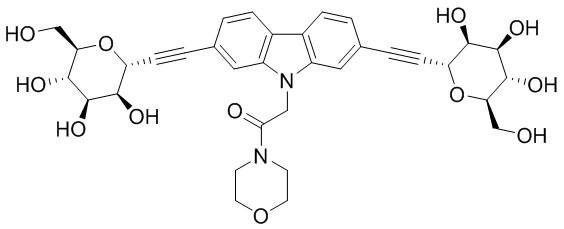
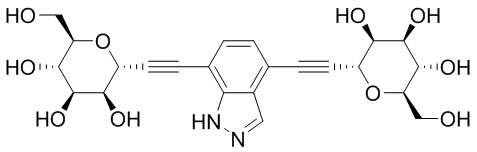
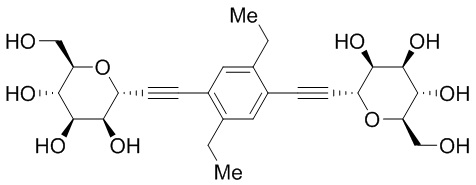
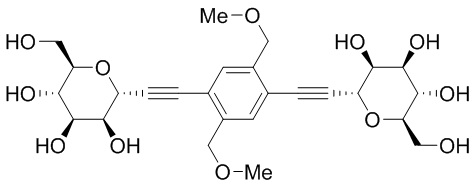
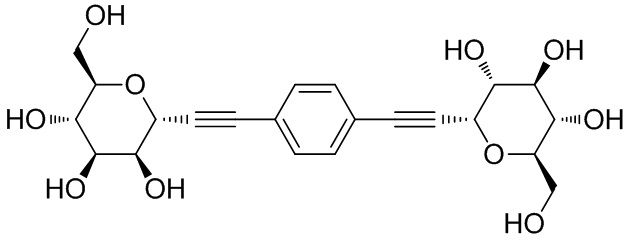
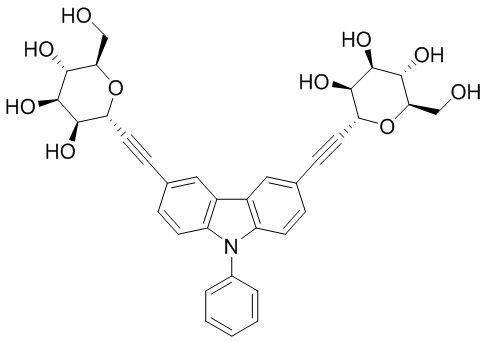
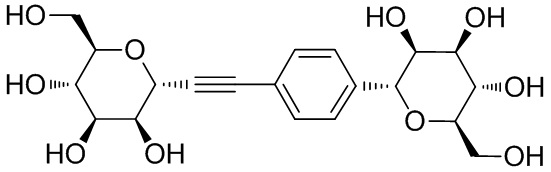
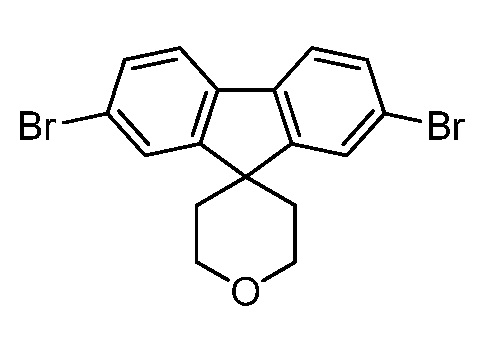
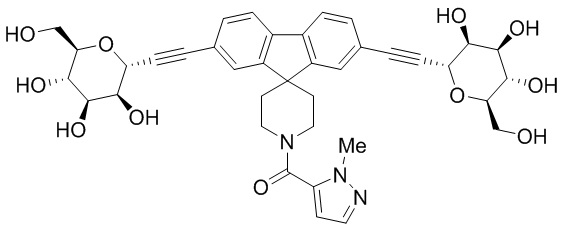
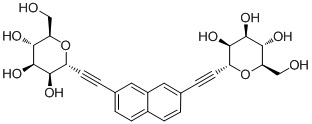
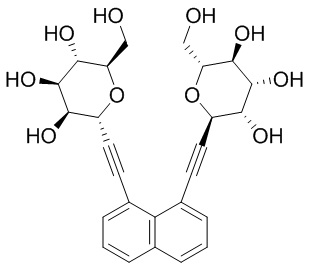
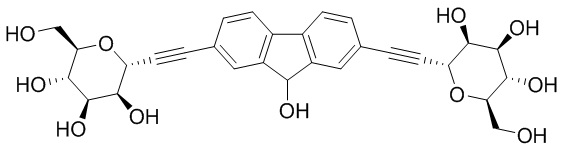
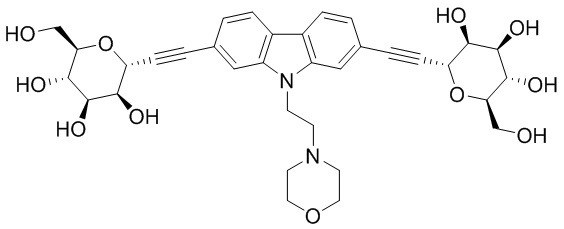
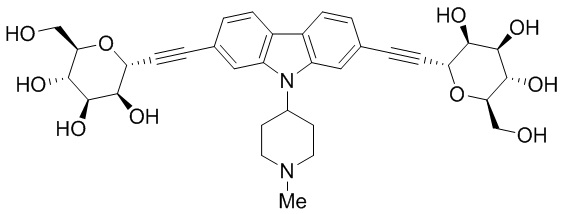
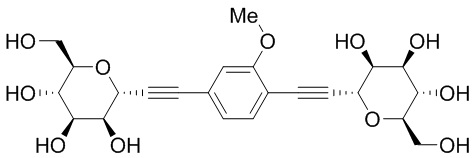
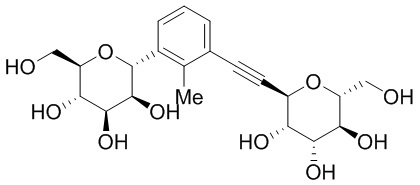
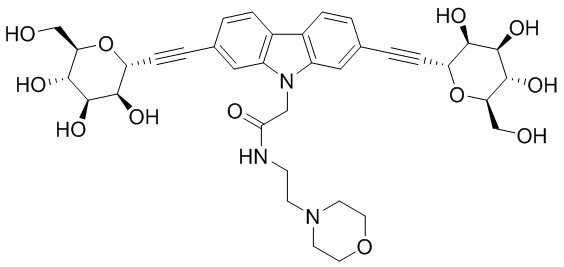
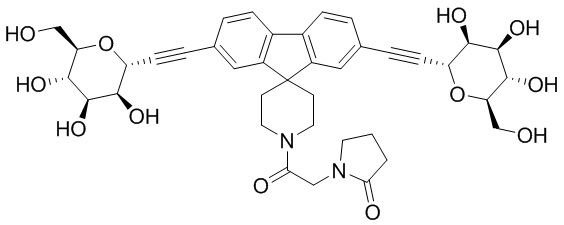
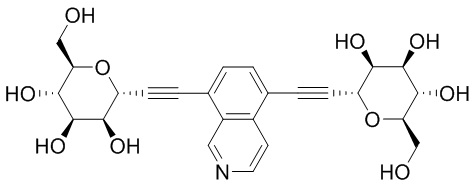
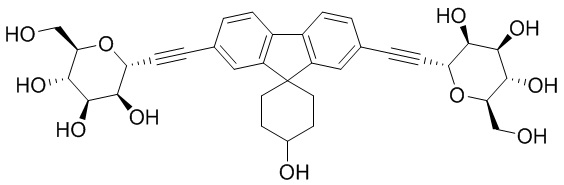
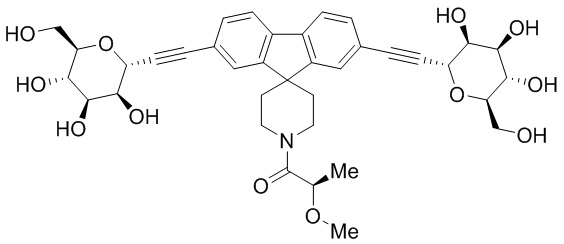
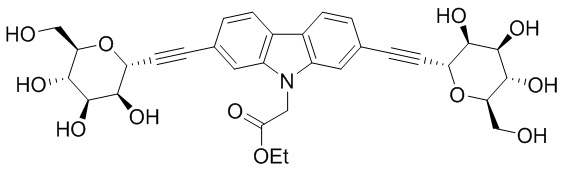
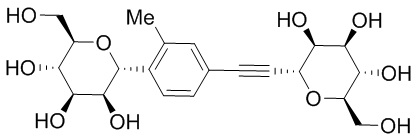
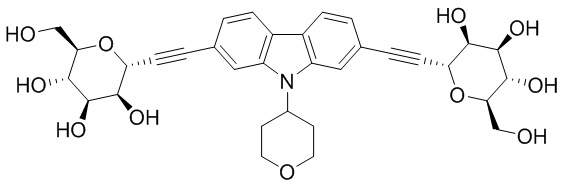
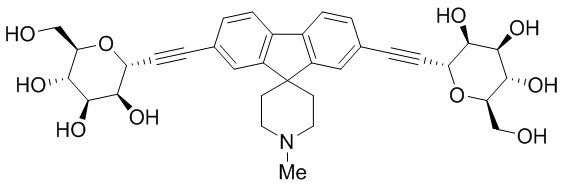
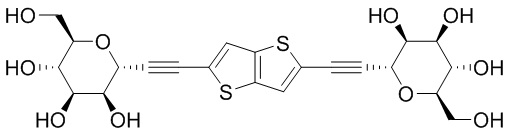
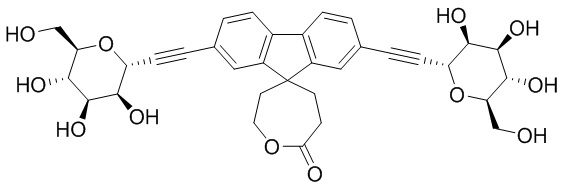
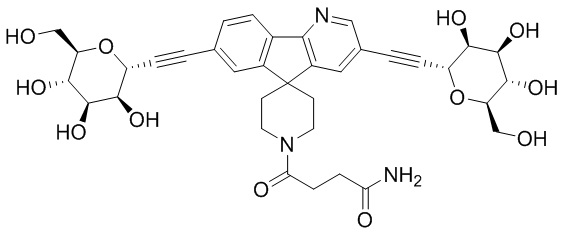
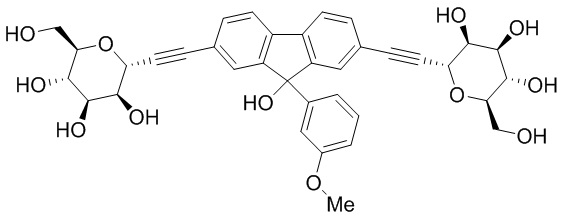
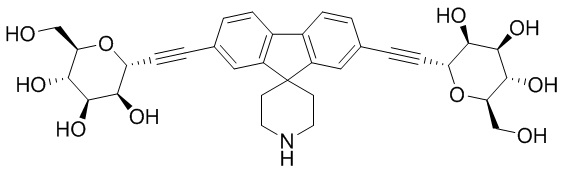
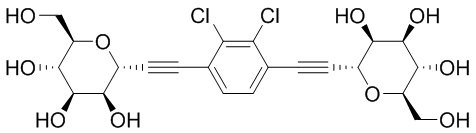
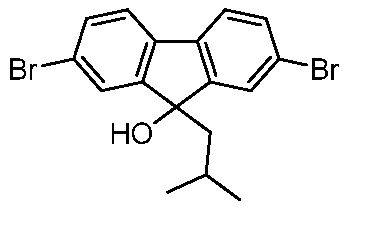
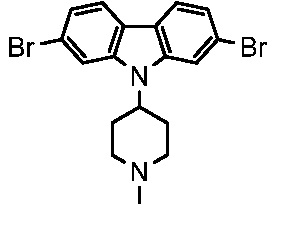
В некоторых вариантах соединения настоящего изобретения соединение представляет собой соединение 162:
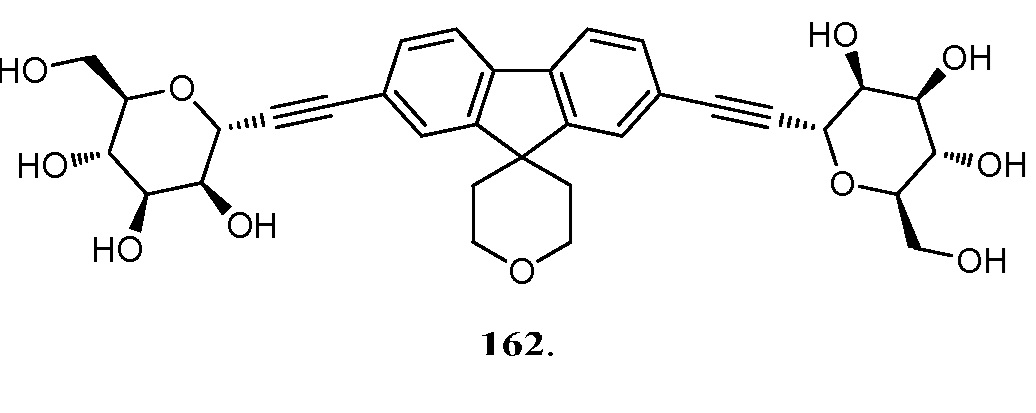
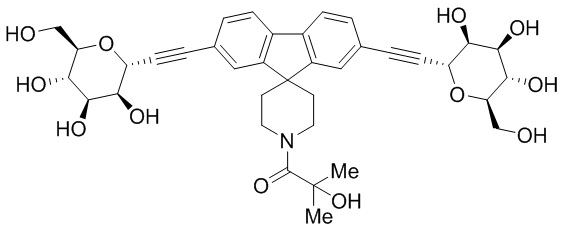
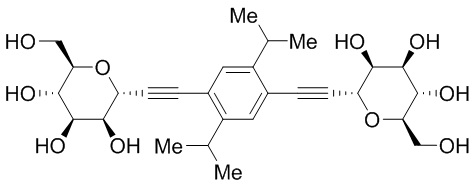
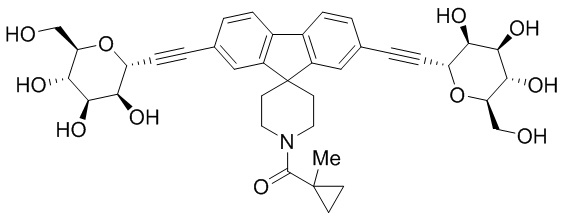
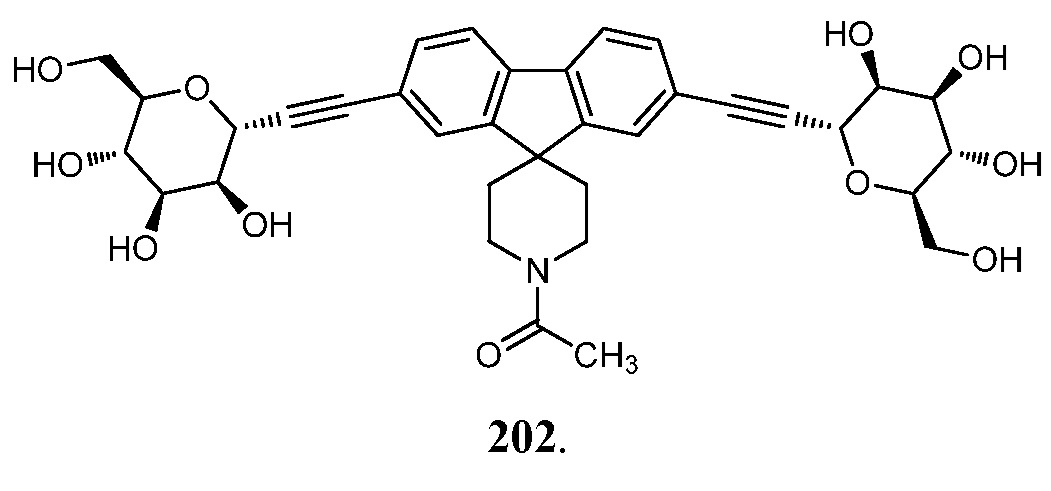
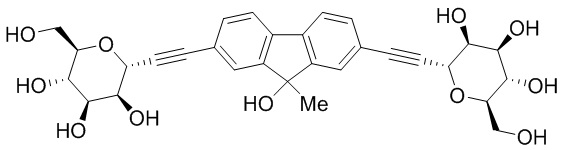
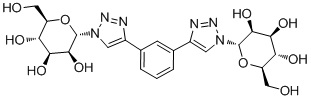
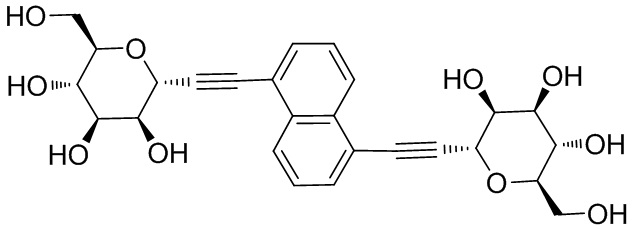
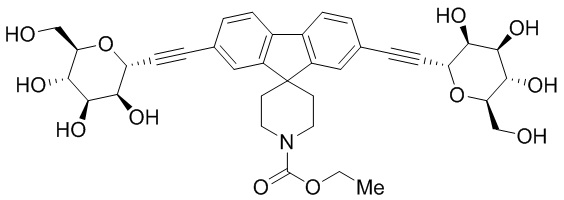
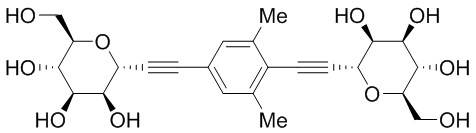
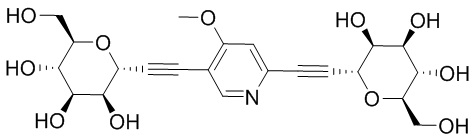
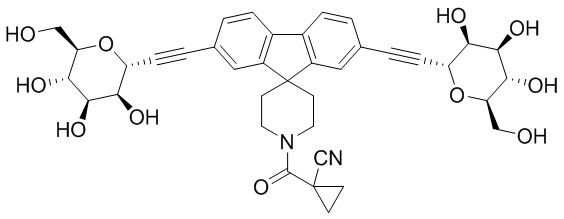
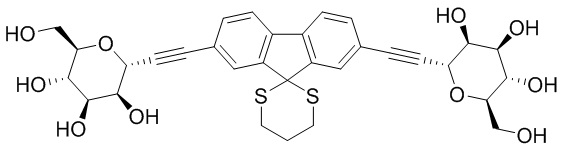
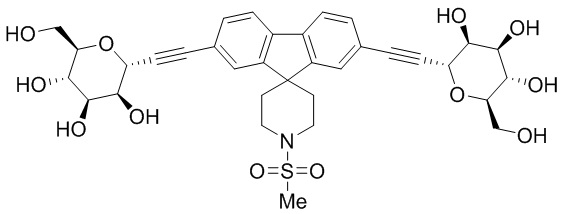
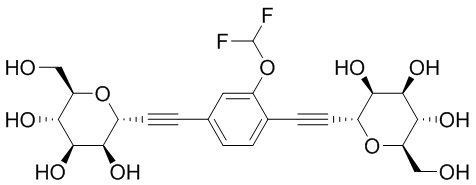
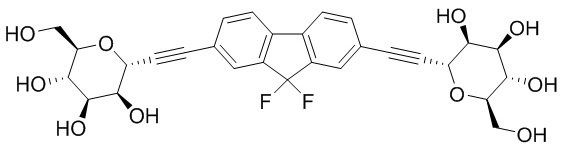
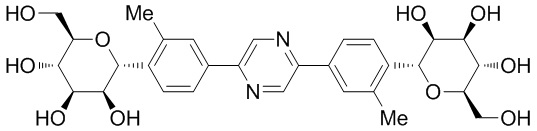
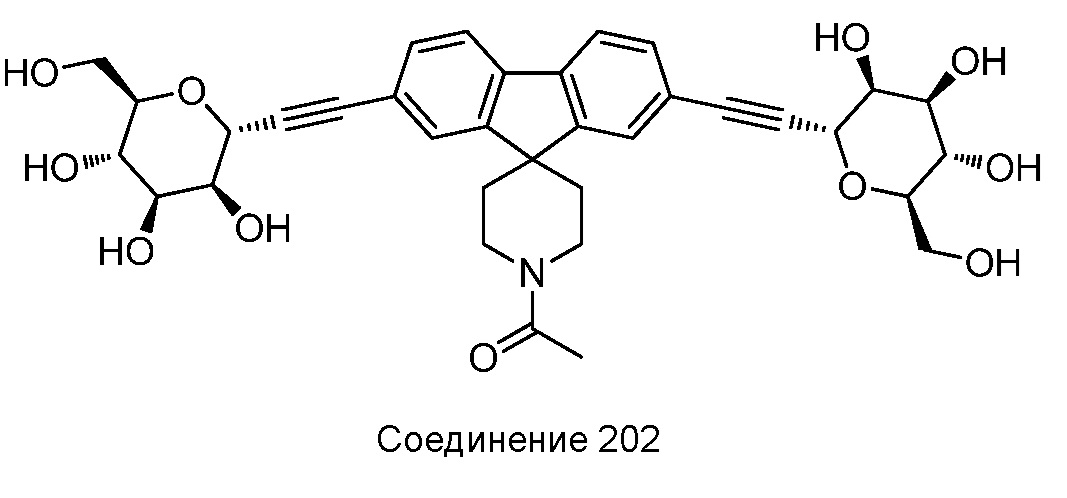
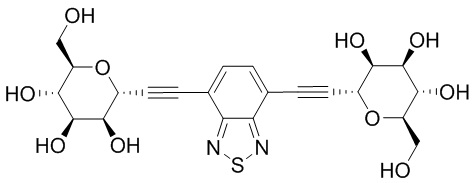
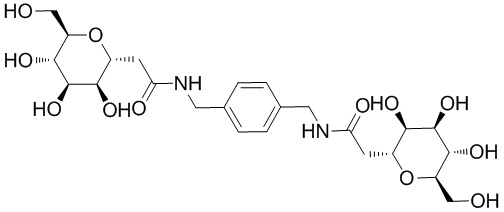
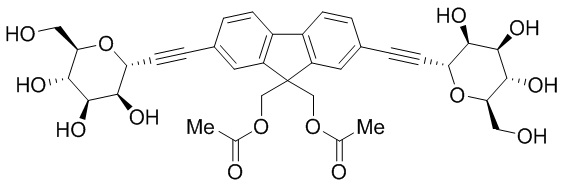
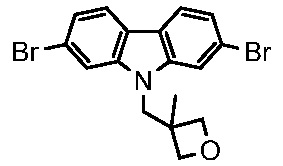
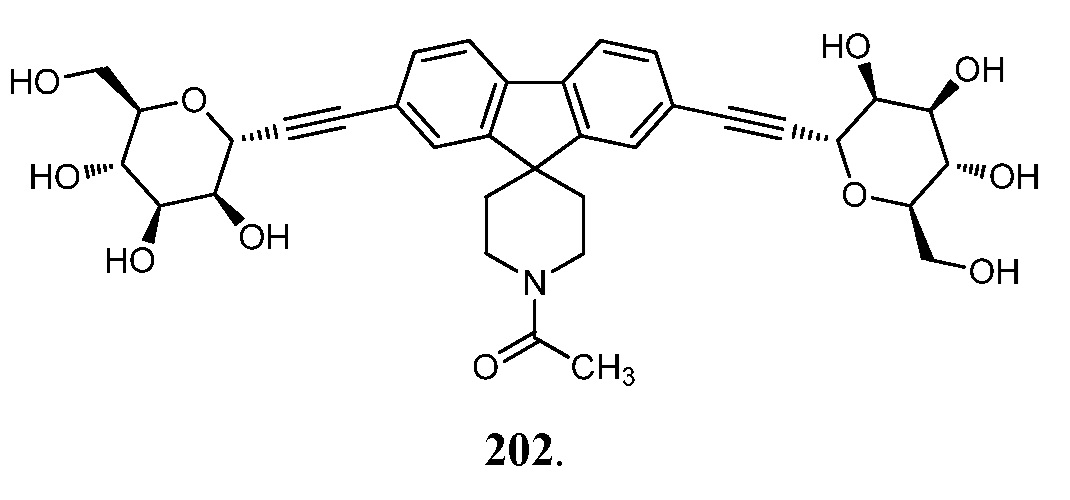
В других вариантах осуществления настоящего изобретения соединение представляет собой соединение 202:
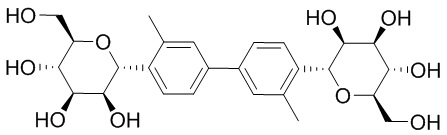
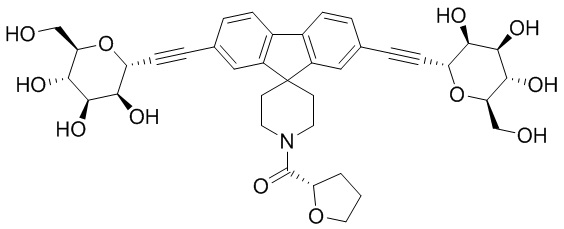
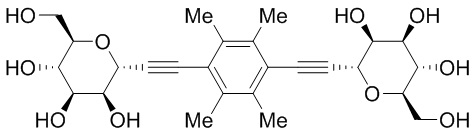
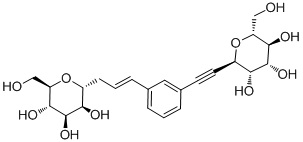
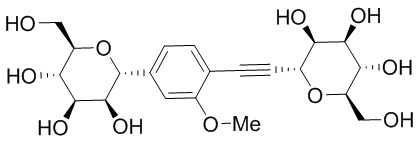
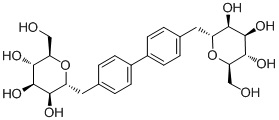
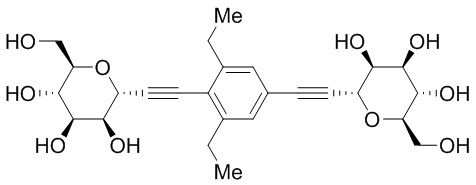
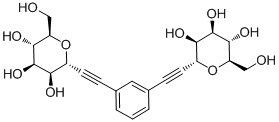
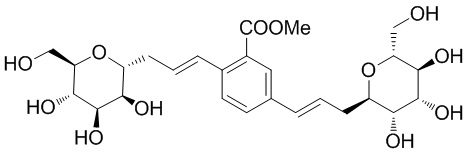
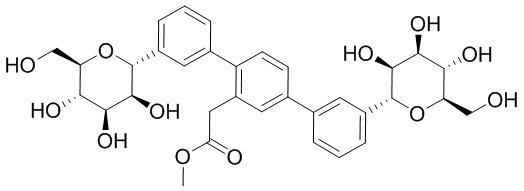
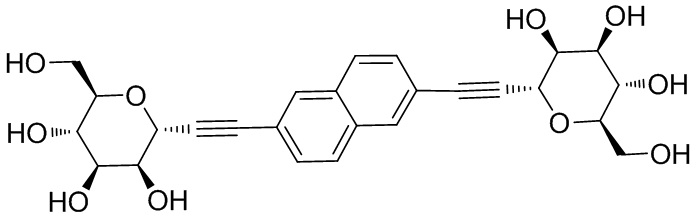
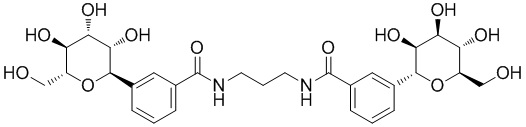
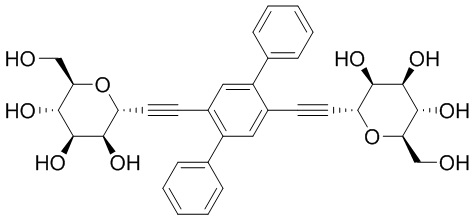
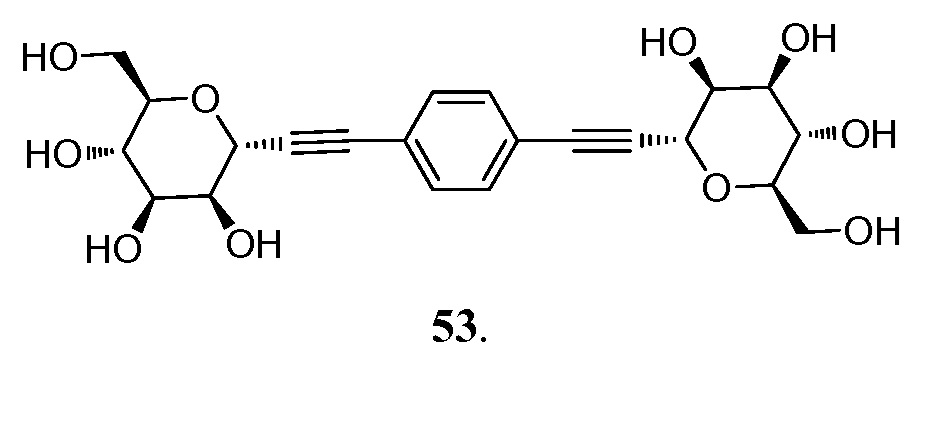
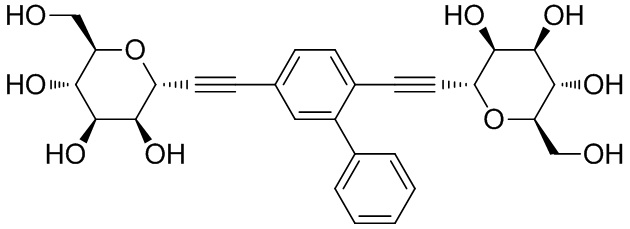
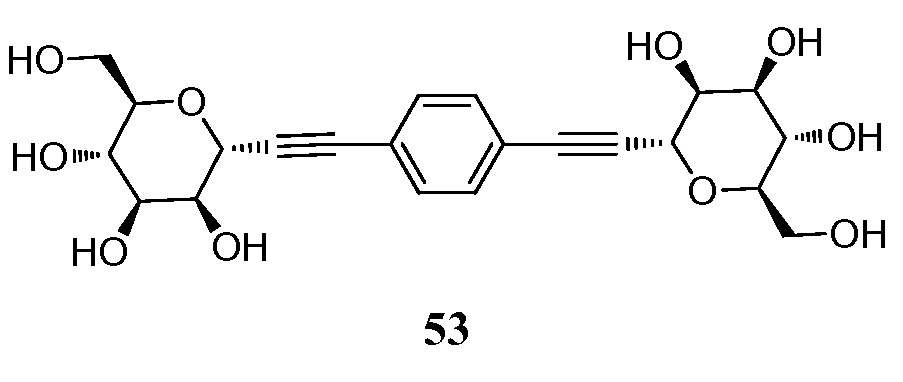
В других вариантах осуществления настоящего изобретения соединение представляет собой соединение 53:
Другой вариант осуществления настоящего изобретения предоставляет способ получения соединений по настоящему изобретению.
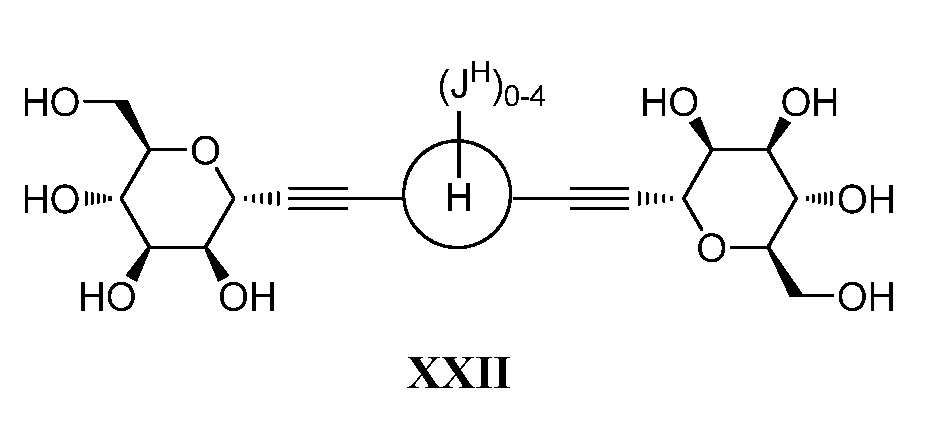
Один вариант осуществления настоящего изобретения предоставляет способ получения соединения формулы
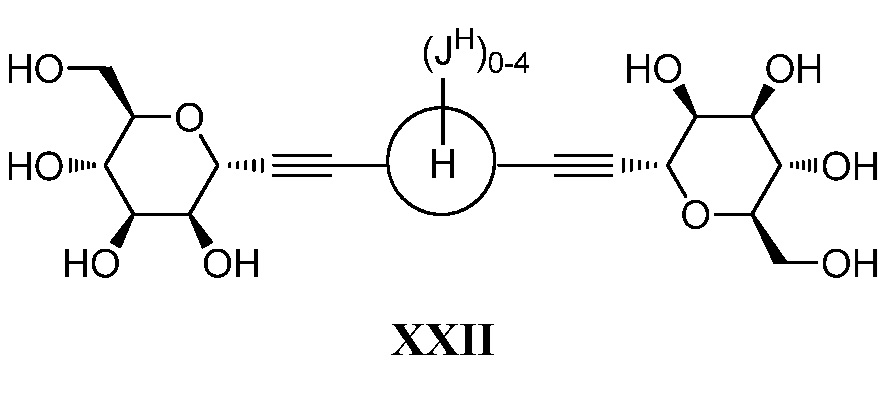 ,
,
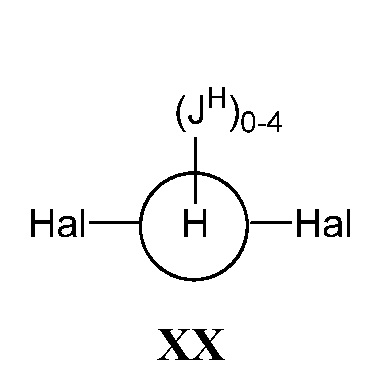
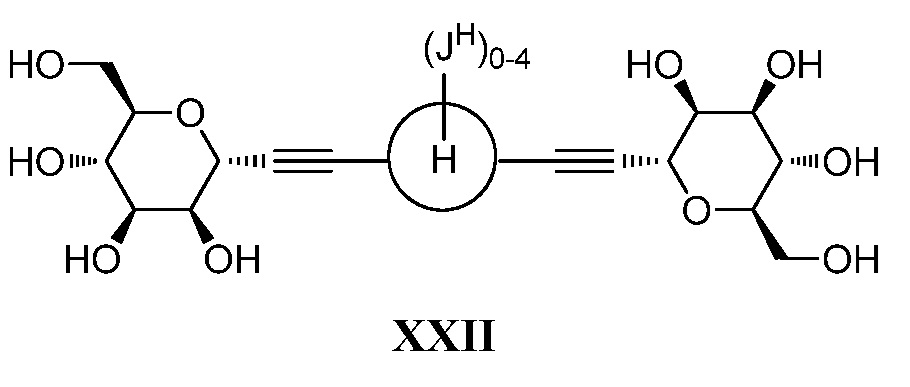
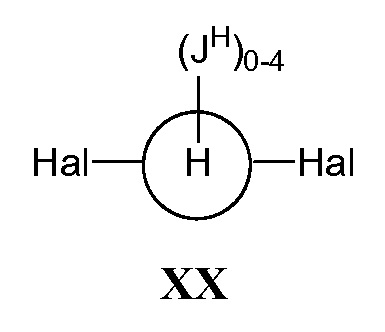
где кольцо Н и JH принимают значения, определенные в настоящем описании; включающий взаимодействие соединения формулы XX:
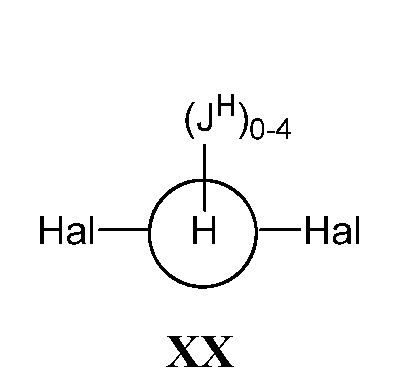 ,
,
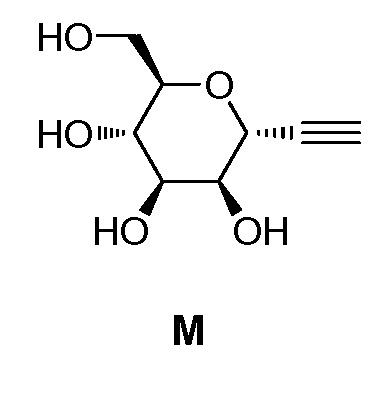
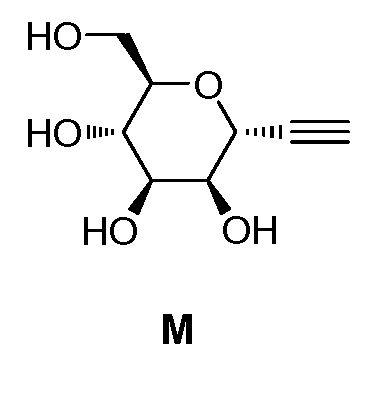
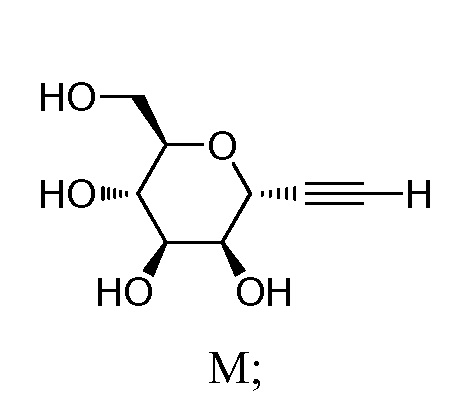
где Hal представляет собой галоген, такой как бром или йод; и JH принимает значения, определенные в настоящем описании; с промежуточным соединением М:
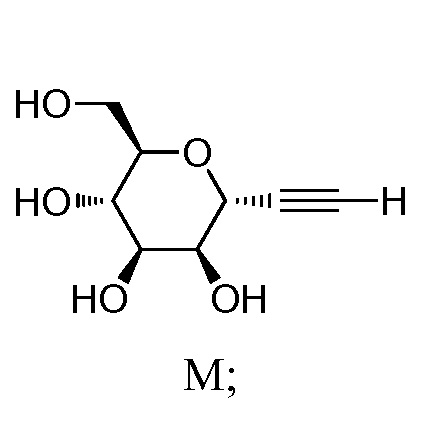 ,
,
в условиях реакции сочетания Соногаширы (Sonogashira) с получением соединения формулы XXII.
Другой вариант осуществления настоящего изобретения предоставляет способ получения соединения формулы
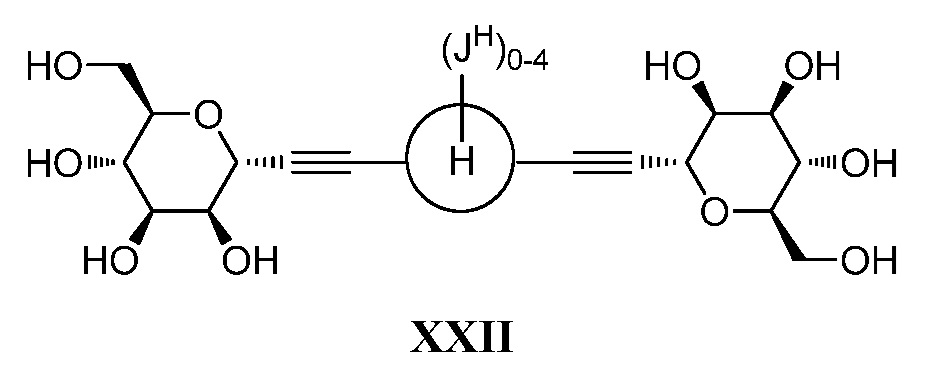 ,
,
где кольцо Н и JH принимают значения, определенные в настоящем описании; включающий
а) взаимодействие соединения формулы XX:
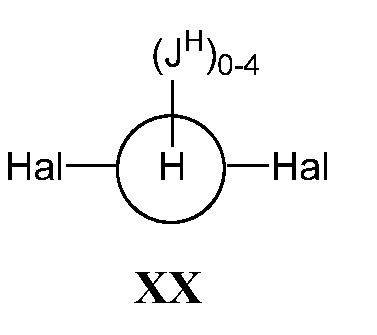 ,
,
где Hal представляет собой галоген, такой как бром или йод; и JH принимает значения, определенные в настоящем описании; с промежуточным соединением Р:
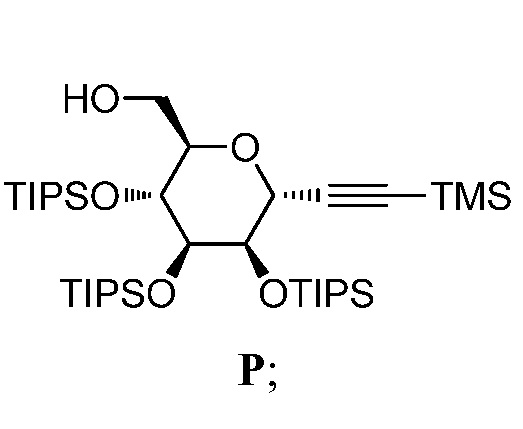
в условиях реакции сочетания Соногаширы;
b) удаление защитной группы из промежуточного соединения Р в кислотных условиях (например, ТФУК, ТГФ, H2O) или с помощью TBAF с получением соединения формулы XXII.
Еще один вариант осуществления настоящего изобретения предоставляет способ получения соединения формулы XXII, включающий
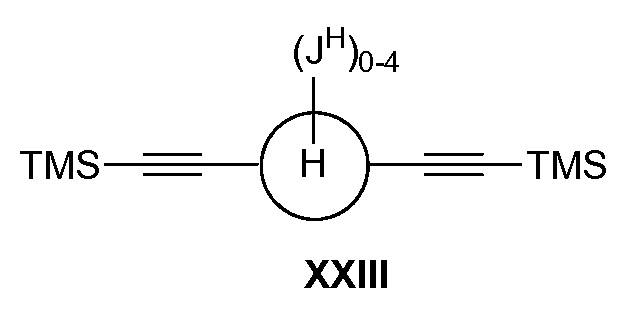
а) взаимодействие соединения формулы XXIII:
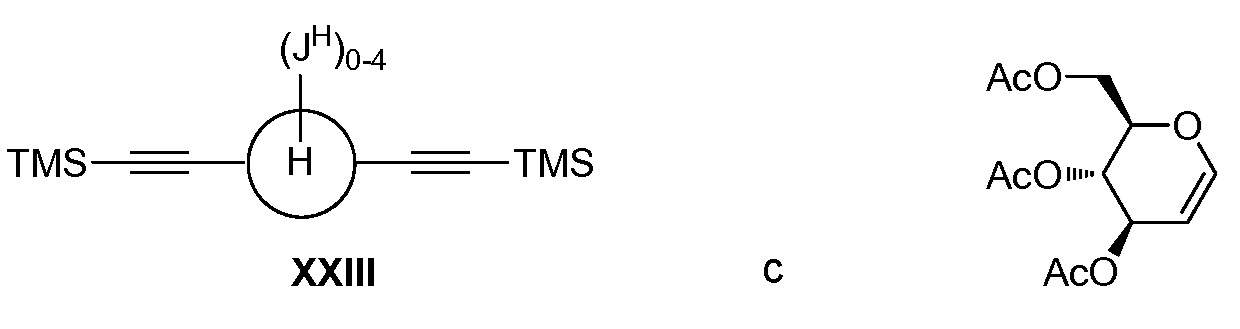
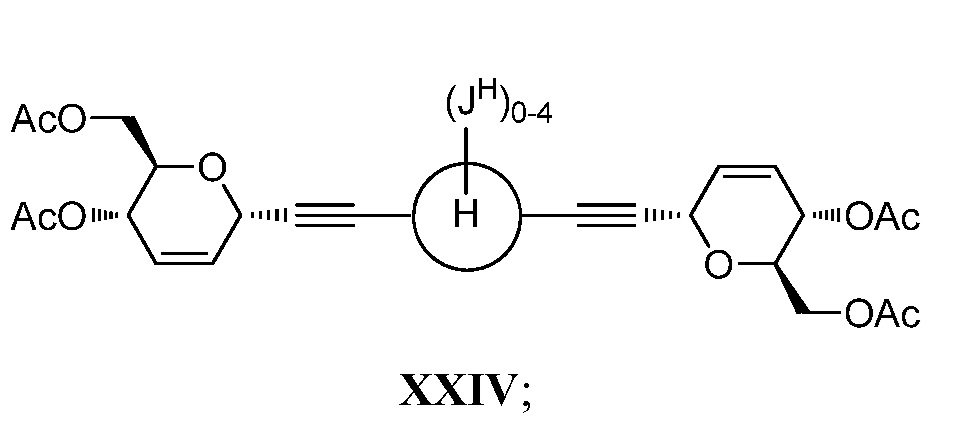
в условиях реакции двойного алкинилирования по типу Феррье, катализируемой кислотами Льюиса, с получением соединения формулы XXIV:
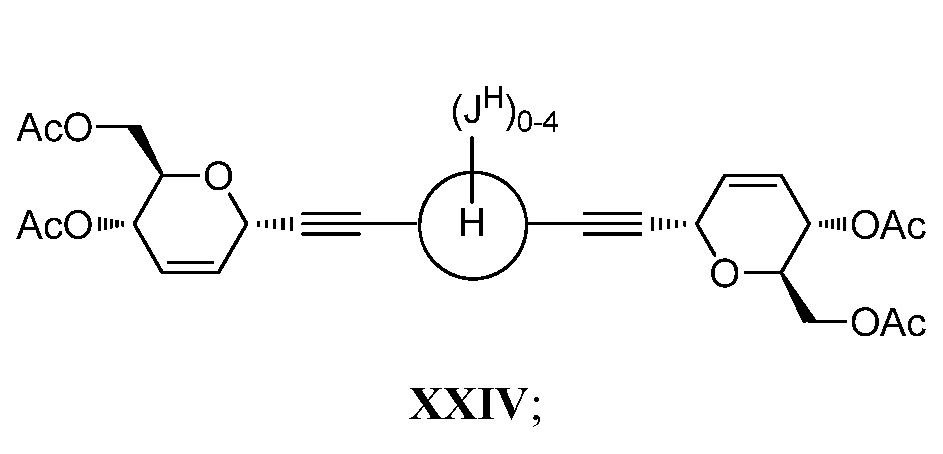
b) стереоспецифическое бис-дигидроксилирование соединения XXIV и последующее омыление с получением соединения формулы XXII.
В некоторых вариантах осуществления настоящего изобретения кольцо Н представляет собой незамещенный фенил, и Hal представляет собой йод.
Еще один вариант осуществления настоящего изобретения предоставляет способ получения соединения 202:
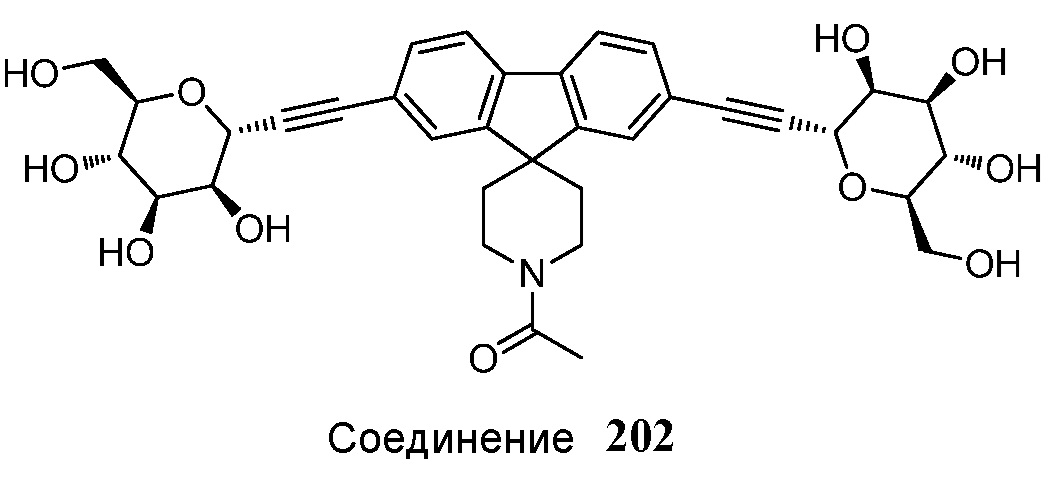 ,
,
включающий взаимодействие промежуточного соединения M:
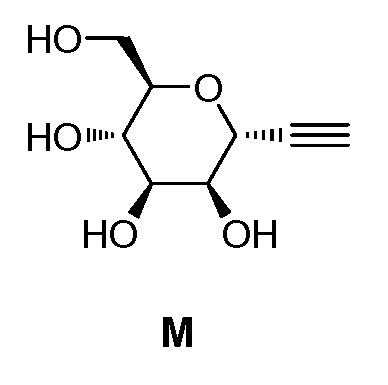 ,
,
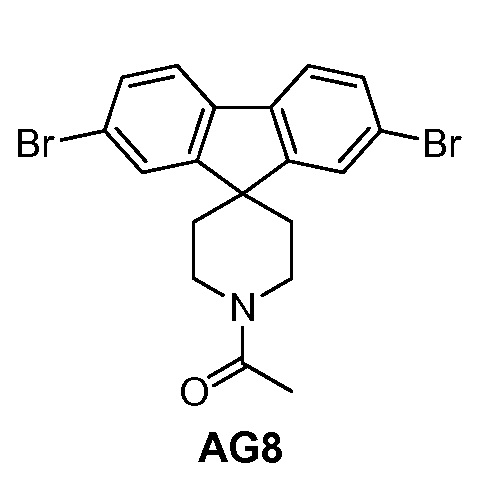
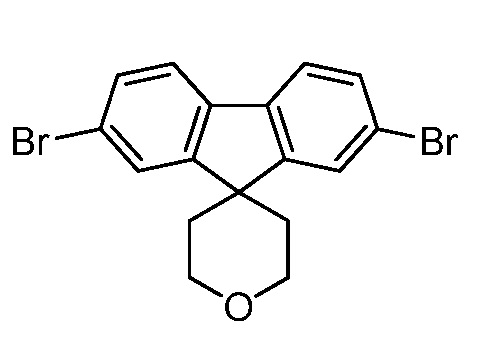
с промежуточным соединением AG8:
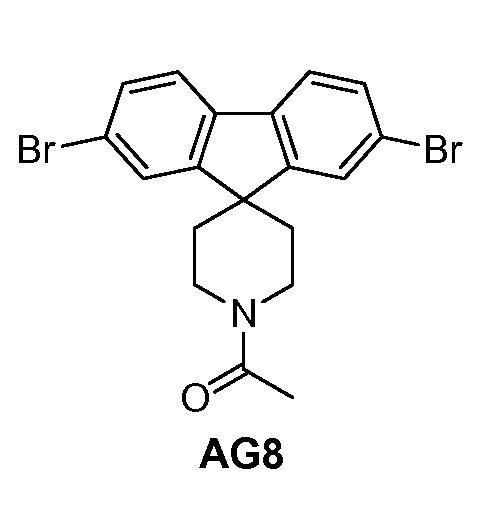 ,
,
в условиях реакции сочетания Соногаширы с получением соединения 202.
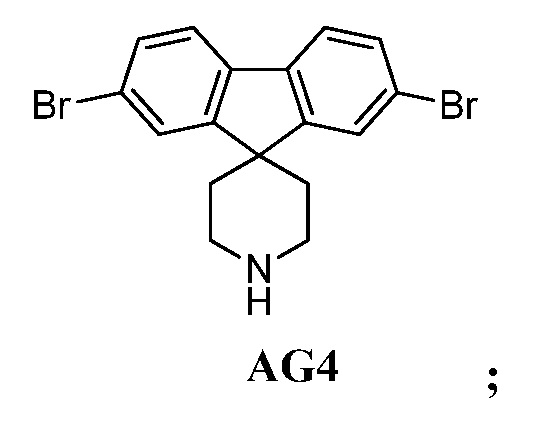
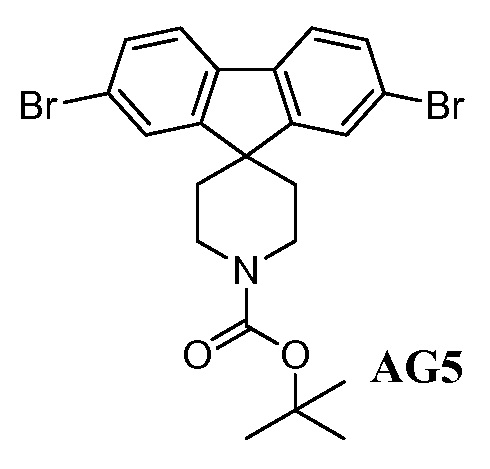
Еще один вариант осуществления настоящего изобретения предоставляет способ получения промежуточного соединения AG8, включающие следующие стадии:
а) взаимодействие
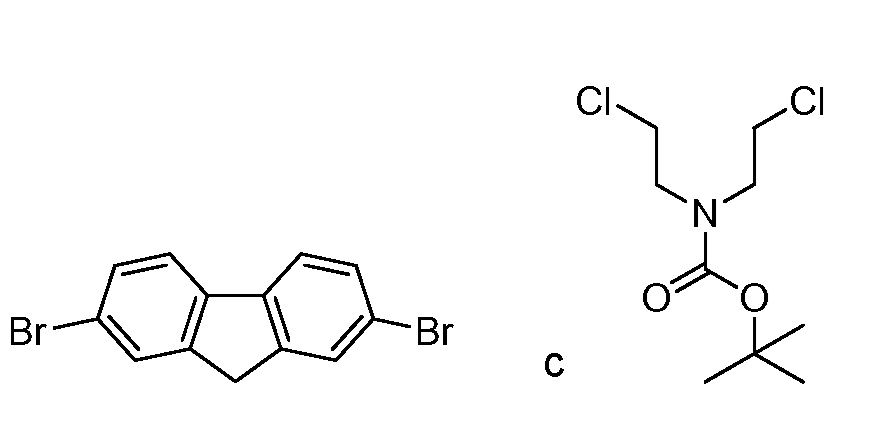
в присутствии подходящего основания, такого как NaH, и в подходящем растворителе, таком как ТГФ; с получением промежуточного соединения AG5:
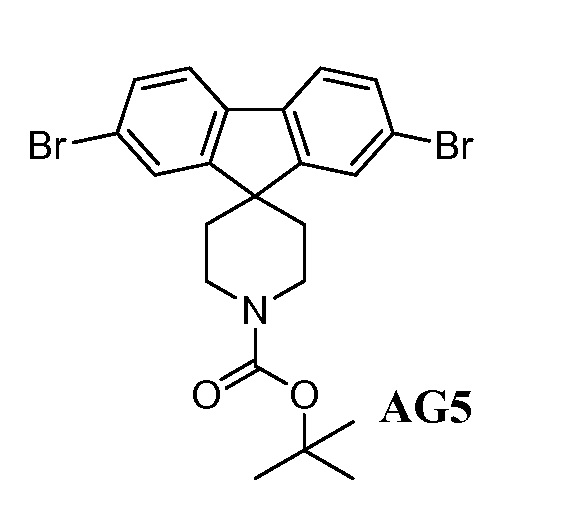 ;
;
b) взаимодействие промежуточного соединения AG5 в кислотных условиях, таких как HCl в диоксане, с получением промежуточного соединения AG:
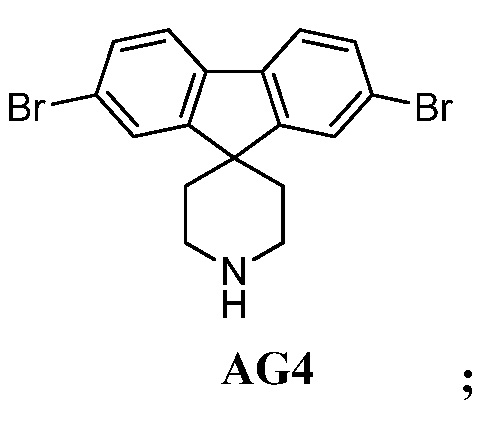
с) взаимодействие промежуточного соединения AG4 с ацетилхлоридом, подходящим основанием (например, триэтиламином) и подходящим растворителем (например, ДМФА) с получением промежуточного соединения AG8.
Еще один вариант осуществления настоящего изобретения предоставляет способ получения соединения 162
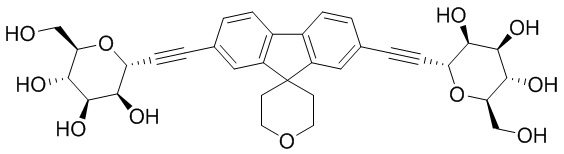
Соединение 162,
включающий взаимодействие промежуточного соединения M:
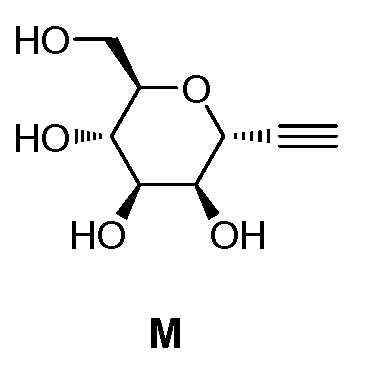
c
в условиях реакции сочетания Соногаширы с получением соединения 162.
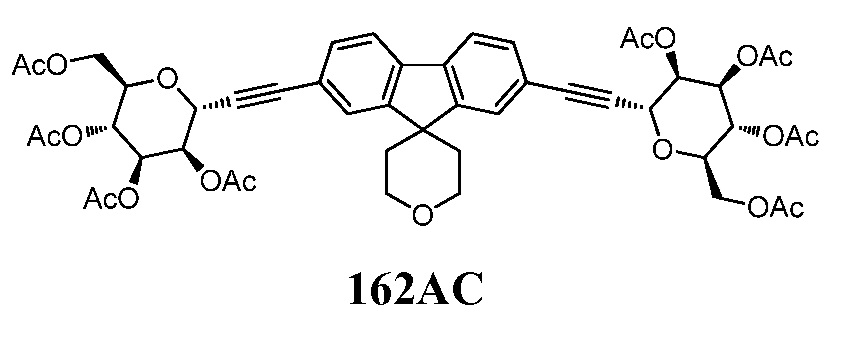
Еще один вариант осуществления настоящего изобретения предоставляет способ очистки сырого соединения 162, полученного в результате реакции сочетания Соногаширы, описанной выше, включающий одну или несколько из следующих стадий: ацетилирование соединения 162 в подходящих условиях реакции ацетилирования с получением соединения формулы 162АС:
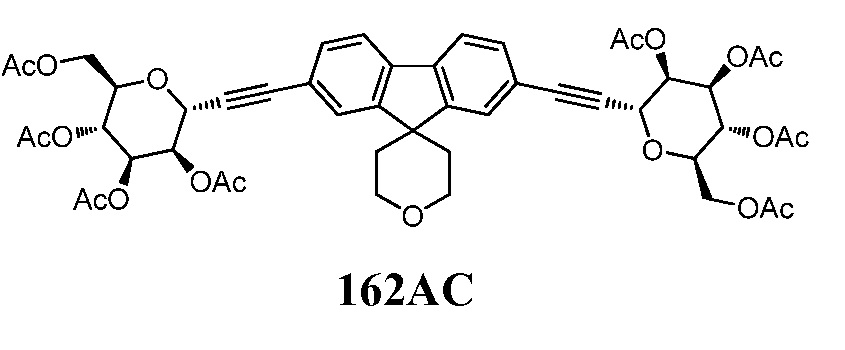 ,
,
включающее следующие стадии:
а) очистка соединения 162AC с помощью известных методов очистки; и
b) взаимодействие соединения 162AC в подходящих условиях удаления защиты с получением соединения 162. Примеры способов удаления защиты, включают, например, колоночную хроматографию.
Настоящее изобретение также предоставляет композицию, содержащую соединение, описанное в данном документе, и фармацевтически приемлемый носитель, адъювант или наполнитель.
Настоящее изобретение также предоставляет способ лечения или предотвращения бактериальной инфекции бактерий у субъекта, включающий введение субъекту эффективного количества соединения или композиции, описанной в данном документе.
В одном варианте осуществления указанного способа бактериальная инфекция представляет собой инфекцию мочевых путей или воспалительную болезнь кишечника.
Другой вариант осуществления настоящего изобретения предоставляет способ лечения или предотвращения бактериальной инфекции у субъекта, включающий введение субъекту эффективного количества соединения, описанного в данном документе, его фармацевтически приемлемой соли или композиции, содержащей указанное соединение. В некоторых вариантах осуществления настоящего изобретения бактериальная инфекция представляет собой инфекцию мочевых путей или воспалительную болезнь кишечника. В некоторых вариантах осуществления настоящего изобретения бактериальная инфекция представляет собой язвенный колит. В других вариантах осуществления настоящего изобретения бактериальная инфекция представляет собой болезнь Крона. В некоторых вариантах осуществления изобретения бактериальная инфекция является причиной болезни Крона или язвенного колита. В некоторых вариантах осуществления настоящего изобретения бактериальные инфекции вызваны штаммами AIEC (энтероадгезивная/инвазивная E. coli).
Еще один вариант осуществления изобретения предоставляет способ лечения или предотвращения воспалительной болезни кишечника у субъекта, включающий введение субъекту эффективного количества соединения, описанного в данном документе, его фармацевтически приемлемой соли или композиции, содержащей указанное соединение. В некоторых вариантах осуществления настоящего изобретения субъектом является пациент. В других вариантах осуществления настоящего изобретения субъектом является человек. В некоторых вариантах осуществления настоящего изобретения воспалительная болезнь кишечника представляет собой болезнь Крона. В других вариантах осуществления настоящего изобретения воспалительная болезнь кишечника представляет собой язвенный колит.
Другой вариант осуществления настоящего изобретения относится к способу ингибирования FimH в бактериях из штаммов бактерий E. coli, выделенных у пациентов с воспалительной болезнью кишечника, включающий контактирование бактерий с эффективным количеством соединения, описанного в данном изобретении, его фармацевтически приемлемой соли или композиции, содержащей указанное соединение. В некоторых вариантах осуществления настоящего изобретения бактериальный штамм представляет собой LF-82.
Еще один вариант осуществления настоящего изобретения предоставляет способ ингибирования FimH у субъекта, включающий введение субъекту эффективного количества соединения, описанного в данном изобретении, его фармацевтически приемлемой соли или композиции, содержащей указанное соединение.
Еще один вариант осуществления настоящего изобретения предоставляет способ ингибирования адгезии е.coli у субъекта, включающий введение субъекту эффективного количества соединения, описанного в данном изобретении, его фармацевтически приемлемой соли или композиции, содержащей указанное соединение. В некоторых вариантах осуществления настоящего изобретения ингибирование адгезии приводит к предотвращению приживаемости инфекции на подслизистой оболочке.
Еще один вариант осуществления настоящего изобретения предоставляет способ блокирования взаимодействия между пилий 1 типа и CEACAM6 у субъекта, включающий введение субъекту эффективного количества соединения, описанного в данном изобретении, его фармацевтически приемлемой соли или композиции, содержащей указанное соединение.
Как определено в данном описании, диапазон специфического числа атомов включает в себя любое целое число в данном диапазоне. Например, «группа, содержащая 1-4 атомов» может содержать 1, 2, 3 или 4 атома. Термин «стабильный», когда используется в данном описании, относится к соединениям, которые по существу не изменяются под воздействием условий, допустимых при их производстве, обнаружении, восстановлении, хранении, очистке и применении для одной или нескольких целей, раскрытых в настоящем изобретении. В некоторых вариантах осуществления настоящего изобретения стабильное соединение или химически возможное соединение представляет собой соединение, которое по существу не изменяется при хранении при температуре 40°С или менее в отсутствие влаги или других условиях возможного химического взаимодействия в течение по меньшей мере недели.
Термин «алифатический» или «алифатическая группа», когда используется в данном описании, означает прямую (т.е. неразветвленную) или разветвленную углеводородную цепь, которая является полностью насыщенной или которая содержит одно или несколько ненасыщенных звеньев, но не является ароматической.
Если не указано иное, алифатические группы содержат 1-20 алифатических атомов углерода. В некоторых вариантах осуществления настоящего изобретения алифатические группы содержат 1-10 алифатических атомов углерода. В других вариантах осуществления алифатические группы содержат 1-8 алифатических атомов углерода. В других вариантах осуществления настоящего изобретения алифатические группы содержат 1-6 алифатических атомов углерода, а в некоторых других вариантах осуществления изобретения алифатические группы содержат 1-4 алифатических атомов углерода. Алифатические группы могут представлять собой линейные или разветвленные, замещенные или незамещенные алкильные, алкенильные или алкинильные группы. Конкретные примеры включают, но без ограничения, метил, этил, изопропил, н-пропил, втор-бутил, винил, н-бутенил, этинил и трет-бутил. Алкильные группы могут также включать в себя дейтерированный атом водорода и такие группы, как CD3.
Термин «алкил», используемый в данном описании, означает насыщенный углеводород с прямой или разветвленной цепью. Термин «алкенил», используемый в данном описании, означает линейную или разветвленную углеводородную цепь, содержащую одну или несколько двойных связей. Термин «алкинил», используемый в данном описании, означает линейную или разветвленную углеводородную цепь, содержащую одну или несколько тройных связей. Термин «циклоалифатический» (или «карбоцикл», «карбоциклил» или «карбоциклический») относится к неароматическому моноциклическому кольцу, состоящему из атомов углерода, которое может быть насыщенным или содержать одно или несколько звеньев ненасыщенности, и содержащему от трех до четырнадцати атомов углерода в кольце. Термин включает полициклические конденсированные, спиро- или мостиковые карбоциклические кольцевые системы. Этот термин также включает полициклические кольцевые системы, в которых карбоциклическое кольцо может быть конденсировано с одним или несколькими неароматическими карбоциклическими или гетероциклическими кольцами или одним или несколькими ароматическими кольцами или их комбинациями, в которых радикал (свободная связь) или точка присоединения находится на карбоциклическом кольце. Конденсированные бициклические кольцевые системы включают в себя два кольца, где в обоих кольцах совместно используются два соседних атома кольца, мостиковые бициклические группы включают в себя два кольца, в которых совместно используются три или четыре соседних атома, принадлежащих обоим кольцам, в бициклических спирокольцевых системах в обоих кольцах совместно используется один атом, принадлежащий обоим кольцам. Примеры циклоалифатических групп включают, но без ограничения, циклоалкильные и циклоалкенильные группы. Конкретные примеры включают, но без ограничения, циклогексил, циклопропенил и циклобутил. Термин «гетероцикл» («гетероциклил», «гетероциклический»), когда используется в данном описании, относится к неароматическому моноциклическому кольцу, включающему в себя от трех до четырнадцати атомов, которое может быть насыщенным или содержать одно или несколько звеньев ненасыщенности и в котором один или несколько атомов углерода в кольце замещены на гетероатом, такой как атом N, S или O. Термин включает полициклические конденсированные, спиро или мостиковые гетероциклические кольцевые системы. Данный термин также включает полициклические кольцевые системы, в которых гетероциклическое кольцо может быть конденсировано с одним или несколькими неароматическими карбоциклическими или гетероциклическими кольцами или одним или несколькими ароматическими кольцами или их комбинациями, где радикал или точка присоединения находится на гетероциклическом кольце. Примеры гетероциклов включают, но без ограничения, пиперидинил, пиперазинил, пирролидинил, пиразолидинил, имидазолидинил, азепанил, диазепанил, триазепанил, азоканил, диазоканил, триазоканил, оксазолидинил, изоксазолидинил, тиазолидинил, изотиазолидинил, оксазоканил, оксазепанил, тиазепанил, тиазоканил, бензимидазолонил, тетрагидрофуранил, тетрагидрофуранил, тетрагидротиофенил, тетрагидротиофенил, морфолино, в том числе, например, 3-морфолино, 4-морфолино, 2-тиоморфолино, 3-тиоморфолино, 4-тиоморфолино, 1-пирролидинил, 2-пирролидинил, 3-пирролидинил, 1-тетрагидропиперазинил, 2-тетрагидропиперазинил, 3-тетрагидропиперазинил, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 1-пиразолинил, 3-пиразолинил, 4-пиразолинил, 5-пиразолинил, 1-пиперидинил, 2-пиперидинил, 3-пиперидинил, 4-пиперидинил, 2-тиазолидинил, 3-тиазолидинил, 4-тиазолидинил, 1-имидазолидинил, 2-имидазолидинил, 4-имидазолидинил, 5-имидазолидинил, индолинил, тетрагидрохинолинил, тетрагидроизохинолинил, тиенотиенил, тиенотиазолил, бензотиоланил, бензодитианил, 3-(1-алкил)бензимидазол-2-онил и 1,3-дигидроимидазол-2-онил.
Термин «гетероатом» означает один или несколько атомов кислорода, серы, азота, фосфора или кремния (включая любую окисленную форму атомов азота, серы, фосфора или кремния; кватернизованную форму любого основного атома азота или атома азота гетероциклического кольца, который может быть замещенным, например N (как в 3,4-дигидро-2Н-пирролил), ΝΗ (как в пирролидиниле) или NR+ (как в N-замещенном пирролидиниле)).
Термин «ненасыщенный», когда используется в данном описании, означает, что группа имеет одно или несколько ненасыщенных звеньев.
Термин «алкокси» или «тиоалкил», когда используется в данном описании, относится к алкильной группе, которая определена выше, присоединенной к молекуле через атом кислорода («алкокси», например -O-алкил) или атом серы («тиоалкил», например -S-алкил).
Термины «галогеналкил», «галогеналкенил», «галогеналифатический» и «галогеналкокси» означают алкил, алкенил или алкокси, в зависимости от обстоятельств, замещенный одним или несколькими атомами галогенов. Этот термин включает в себя перфторированные алкильные группы, такие как -CF3 и -CF2CF3.
Термины «галоген», «гало» означают F, Cl, Br или I.
Термин «арил», используемый отдельно или как часть большего фрагмента, например в терминах «аралкил», «аралкокси» или «арилоксиалкил», относится к карбоциклическим ароматическим циклическим системам. Термин «арил» может использоваться взаимозаменяемо с термином «арильное кольцо».
Карбоциклические ароматические кольцевые группы содержат в кольце только атомы углерода (обычно от шести до четырнадцати) и включают моноциклические ароматические кольца, такие как фенил, и конденсированные полициклические ароматические кольцевые системы, в которых два или более карбоциклических ароматических кольца конденсированы друг с другом. Примеры включают 1-нафтил, 2-нафтил, 1-антрацил и 2-антрацил. Данный термин также включен в термин «карбоциклическое ароматическое кольцо», когда он используется в настоящем описании, который относится к группе, в которой ароматическое кольцо конденсировано с одним или несколькими неароматическими кольцами (карбоциклическими или гетероциклическими), как, например, в инданиле, фталимидиле, нафтимидиле, фенантридиниле или тетрагидронафтиле, где свободная связь (радикал) или точка присоединения находится в ароматическом кольце.
Термины «гетероарил», «гетероароматический», «гетероарильное кольцо», «гетероарильная группа» и «гетероароматическая группа», используемые отдельно или как часть более крупного фрагмента, как, например, в термине «гетероаралкил» или «гетероарилалкокси», относятся к гетероароматическим кольцевым группам, содержащим от пяти до четырнадцати членов, включая моноциклические гетероароматические кольца и полициклические ароматические кольца, в которых моноциклическое ароматическое кольцо конденсировано с одним или несколькими другими ароматическими кольцами. Гетероарильные группы содержат в кольце один или несколько гетероатомов. Они также охватываются термином «гетероарил», когда он используется в настоящем описании, относящемуся к группе, в которой ароматическое кольцо конденсировано с одним или несколькими неароматическими кольцами (карбоциклическими или гетероциклическими) и свободная связь (радикал) или точка присоединения находится на ароматическом кольце. Термин «бициклическое 6,5-гетероароматическое кольцо», когда используется в данном описании, относится, например, к «шестичленному гетероароматическому кольцу, конденсированному со вторым пятичленным кольцом», где свободная связь (радикал) или точка присоединения находится на шестичленном кольце. Примеры гетероарильных групп включают пиридил, пиразинил, пиримидинил, пиридазинил, имидазолил, пирролил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил или тиадиазолил, включая, например, 2-фуранил, 3-фуранил, N-имидазолил, 2-имидазолил, 4-имидазолил, 5-имидазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-оксадиазолил, 5-оксадиазолил, 2-оксазолил, 4-оксазолил, 5-оксазолил, 3-пиразолил, 4-пиразолил, 1-пирролил, 2-пирролил, 3-пирролил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидинил, 4-пиримидинил, 5 -пиримидинил, 3-пиридазинил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-триазолил, 5-триазолил, тетразолил, 2-тиенил, 3-тиенил, карбазолил, бензимидазолил, бензотиенил, бензофуранил, индолил, бензотриазолил, бензотиазолил, бензоксазолил, бензимидазолил, изохинолинил, индолил, изоиндолил, акридинил, бензизоксазолил, изотиазолил, 1,2,3-оксадиазолил, 1,2,5-оксадиазолил, 1,2,4-оксадиазолил, 1,2,3-триазолил, 1,2,3-тиадиазолил, 1,3,4-тиадиазолил, 1,2,5-тиадиазолил, пуринил, пиразинил, 1,3,5-триазинил, хинолинил (например, 2-хинолинил, 3-хинолинил, 4-хинолинил) и изохинолинил (например, 1-изохинолинил, 3-изохинолинил или 4-изохинолинил).
Термины «защищающая группа» и «защитная группа», когда используются в данном описании, являются взаимозаменяемыми и означают группу, используемую для временного блокирования одной или нескольких желаемых функциональных групп в соединении с несколькими реакционно-способными сайтами. В некоторых вариантах осуществления настоящего изобретения защитная группа характеризуется одним или несколькими, предпочтительно всеми, перечисленными ниже признаками: а) добавляется избирательно на функциональную группу с хорошим выходом с получением защищенного субстрата, который b) является стабильным по отношению к реакциям, протекающим на одном или нескольких других реакционно-способных сайтах; и с) может селективно удаляться с хорошим выходом с помощью реагентов, которые не воздействуют на регенерируемую функциональную группу, с которой удаляется защитная группа. Специалисту данной области техники будет понятно, что в некоторых случаях реагенты не воздействуют на другие реакционно-способные группы в соединении. В других случаях реагенты могут также взаимодействовать с другими реакционно-способными группами в соединении. Примеры защитных групп подробно описаны в монографии Greene, T.W., Wuts, P. G in "Protective Groups in Organic Synthesis", Third Edition, John Wiley & Sons, New York: 1999 (и других изданиях данной монографии), все содержание которой включено в данное описании в виде ссылки. Термин «защитная группа атома азота», когда используется в данном описании, относится к реагенту (группе), который используется для временного блокирования одного или нескольких заданных реакционно-способных сайтов азота в соединении, содержащем несколько функциональных групп. Предпочтительные защитные группы атома азота также обладают характеристическими свойствами, указанными выше для защитных группу, и некоторые типичные примеры защитных групп атома азота также подробно описаны в главе 7 (Chapter 7) монографии Greene, T.W., Wuts, P. G in "Protective Groups in Organic Synthesis", Third Edition, John Wiley & Sons, New York: 1999, полное содержание которой включено в данное описание в виде ссылки.
В некоторых вариантах осуществления настоящего изобретения, где это указано, метиленовое звено алифатической цепи необязательно замещено на другой атом или группу. Примеры таких атомов или групп включают, но без ограничения, -NR-, -O-, -C(O)-, -C(=N-CN)-, -C(=NR)-, -C(=NOR)-, -S-, -S(O)- и -S(O)2-. Эти атомы или группы могут объединяться в более крупные группы. Примеры таких более крупных групп включают, но без ограничения, -OC(O)-, -С(O)CO-, -CO2-, -C(O)NR-, -C(=N-CN), -NRC(O)-, -NRC(O)О-, -S(O)2NR-, -NRSO2-, -NRC(O)NR-, -OC(O)NR- и -NRSO2NR-, где R принимает значения, определенные в данном описании.
Рассматриваются только те замены и комбинации групп, которые приводят к стабильной структуре. Дополнительные замены могут иметь место в пределах цепи и/или на обоих ее концах; т.е. в точке присоединения и/или также в конце. Два дополнительных замещения также могут располагаться рядом друг с другом в цепи, если это приводит к химически стабильному соединению. Необязательные замены могут также полностью заменить все атомы углерода в цепи. Например, в С3 алифатической группе может иметь место необязательное замещение группами -NR-, -C(O)- и -NR- с получением группы -NRC(O)NR-(карбамидный фрагмент).
За исключением особо оговоренных случаев, если замена происходит на концевом атоме, введенный заменой атом связан с H на конце. Например, если в группе -CH2CH2CH3 имеет место необязательная замена на группу -O-, полученная группа может представлять собой -OCH2CH3, -CH2OCH3 или -CH2CH2OH.
Следует представлять, что алифатические цепи могут включать в себя ненасыщенные связи, и поэтому атом, который заменяет «метиленовое» звено в алифатической группе, в действительности может заменять блок -CH=, =C= или ≡C-. Специалисту данной области техники будет понятно, что атом, заменяющий эти блоки, будет иметь соответствующий порядок связей для получения стабильной структуры. Например, когда метиленовое звено алифатической цепи необязательно замещено на группу -NR-, специалисту в данной области техники будет понятно, что если алифатическая группа представляла собой группу СН=СН-СН3, и должна быть замещена средняя метиленовая группа «CH», то заменяющей ее группой будет в действительности группа "N", а не "-NR-", для того чтобы получить группу CH=N-CH3.
Если не указано иное, то подразумевается, что структуры, представленные в описании, включают также все изомерные (например, энантиомерные, диастереомерные, геометрические, конформационные и вращательные) формы структуры. Например, в данное изобретение включены R и S конфигурации для каждого асимметричного центра, (Z) и (Е) изомеры двойной связи, и (Z) и (Е) конформационные изомеры. Специалисту данной области техники должно быть понятно, что заместитель может свободно вращаться вокруг любых вращающихся связей. Например, заместитель, изображенный как
 ,
,
также представляет собой
Таким образом, разделенные стереохимические изомеры, а также энантиомерные, диастереомерные, геометрические, конформационные и ротационные смеси соединений по настоящему изобретению, включены в объем настоящего изобретения.
Если не указано иное, все таутомерные формы соединений по изобретению входят в объем настоящего изобретения.
Кроме того, если не указано иное, структуры, показанные в данном описании, также включают соединения, которые различаются только присутствием одного или нескольких изотопно обогащенных атомов. Например, соединения с представленными в данном описании структурами, но с замещением водорода дейтерием или тритием или с замещением углерода на 13С- или 14С-обогащенный углерод, входят в объем настоящего изобретения. Такие соединения могут применяться, например, в качестве инструмента в анализе или в качестве зондов в биологических анализах. Эти соединения могут также использоваться при лечении бактериальных инфекций (см., например, соединение 183).
Как описано в данном изобретении, когда это указано, соединения по настоящему изобретению могут быть необязательно замещены одним или несколькими заместителями, например перечисленными в данном описании или типичными примерами конкретных классов, подклассов и видов. Следует иметь в виду, что фраза «необязательно замещенный» используется взаимозаменяемо с фразой «замещенный или незамещенный». Обычно термин «замещенный» с предшествующим ему термином «необязательно» или без него относится к замещению радикалов водорода в данной структуре радикалом конкретного заместителя. Если не указано иное, необязательно замещенная группа может содержать заместитель в каждом замещаемом положении группы, и когда более чем одно положение в любой данной структуре может быть замещено более чем одним заместителем, выбранным из указанной группы, заместители в каждом положении могут быть или одинаковыми или разными.
Рассматриваются только те варианты и комбинации заместителей, которые приводят к стабильной структуре. Такие варианты и комбинации будут очевидны для специалистов данной области техники и могут быть определены без излишнего эксперимента.
Термин «атом кольца» означает атом, такой как C, N, O или S, который находится в кольце ароматической группы, циклоалкильной группы или неароматического гетероциклическоого кольца.
«Замещаемый атом в кольце» в ароматической группе представляет собой атом углерода кольца или азота в кольце, которые связаны с атомом водорода. Водород может быть необязательно замещен на соответствующую группу заместителя. Таким образом, термин «замещаемый атом в кольце» не включает в себя атом азота или углерода в кольце, которые являются общими, когда два кольца являются конденсированными. Кроме того, термин «замещаемый атом в кольце» не включает в себя атом углерода или азота в кольце, когда структура показывает, что они уже соединены с фрагментом, который не является атомом водорода.
Следует представлять, что связь с заместителем, проведенная через несколько колец полициклической молекулы, указывает на то, что заместитель может быть связан с любым кольцом полициклической группы. Например, на фигуре, представленной ниже:
 ,
,
JH может быть заместителем на любом бензольном кольце в карбозолильном цикле, а также на 5-членном кольце в центре, например на атоме азота карбазолильного кольца. Поэтому, если JH представляет собой "СН3", любая из трех структур, приведенных ниже, будет подразумеваться в соответствии с приведенной выше формулой:
Арильная группа, которая определена в данном описании, может содержать одно или несколько замещаемых колец, которые могут быть соединены с подходящим заместителем. Примеры подходящих заместителей на способном к замещению атоме углерода кольца арильной группы включают R'. R' представляет собой -Ra, -Br, -Cl, -I, -F, -ORa, -SRa, -OCORa, -CORa, -CSRa, -CN, -NO2, -NCS, -SO3H, -N(RaRb), -COORa, -NRcNRcCORa, -NRcNRcCO2Ra, -CHO, -CON(RaRb), -О-С(O)N(RaRb), -CSN(RaRb), -NRcCORa, -NRcCOORa, -NRcCSRa, -NRcCON(RaRb), -NRcNRcC(O)N(RaRb), -NRcCSN(RaRb), -C(=NRc)-N(RaRb), -C(=S)N(RaRb), -NRd-С(=NRc)-N(RaRb), -NRcNRaRb, S(O)pNRaRb, -NRcSO2N(RaRb), -NRcS(O)pRa, -S(O)pRa, -OS(O)pNRaRb или -OS(O)pRa; где р равно 1 или 2.
Ra-Rd, каждый независимо, представляют собой -Н, алифатическую группу, ароматическую группу, неароматическую карбоциклическую или гетероциклическую группу, или -N(RaRb), взятые вместе, образуют неароматическую гетероциклическую группу. Алифатическая, ароматическая и неароматическая гетероциклическая группа, представленная Ra-Rd, и неароматическая гетероциклическая группа, представленная -N(RaRb), каждая необязательно и независимо, являются замещенными одной или несколькими группами, представленными R#. Предпочтительно, Ra-Rd являются незамещенными.
R# представляет собой галоген, R+, -OR+, -SR+, -NO2, -CN, -N(R+)2, -COR+, -COOR+, -NHCO2R+, -NHC(O)R+, -NHNHC(O)R+, -NHC(O)N(R+)2, -NHNHC(O)N(R+)2, -NHNHCO2R+, -C(O)N(R+)2, -OC(O)R+, -OC(O)N(R+)2, -S(O)2R+, -SO2N(R+)2, -S(O)R+, -NHSO2N(R+)2, -NHSO2R+, -C(=S)N(R+)2 или -С(=NH)-N(R+)2.
R+ представляет собой -Н, C1-C4-алкильную группу, моноциклическую арильную группу, неароматическую карбоциклическую или гетероциклическую группу, каждая из которых является необязательно замещенной алкилом, галогеналкилом, алкокси, галогеналкокси, галогеном, -CN, -NO2, амином, алкиламином или диалкиламином. Предпочтительно, R+ является незамещенным.
Алифатическая или неароматическая гетероциклическая или карбоциклическая группа, описанная в данном документе, может содержать один или несколько заместителей. Примерами подходящих заместителей для алифатической группы или атома углерода кольца неароматической гетероциклической группы являются группы R". R" включает заместители, перечисленные выше для R', и =О, =S, =NNHR**, =NN(R**)2,=NNHC(O)R**,=NNHCO2(алкил), =NNHSO2(алкил), =NR**, спироциклоалкильную группу или конденсированную циклоалкильную группу. Каждый R** независимо выбран из водорода, незамещенной алкильной группы или замещенной алкильной группы. Примеры заместителей в алкильной группе, представленной R**, включают амино, алкиламино, диалкиламино, аминокарбонил, галоген, алкил, алкиламинокарбонил, диалкиламинокарбонил, алкиламинокарбонилокси, диалкиламинокарбонилокси, алкокси, нитро, циано, карбокси, алкоксикарбонил, алкилкарбонил, гидроксильную группу, галогеналкокси или галогеналкил.
Когда гетероциклильная, гетероарильная или гетероаралкильная группа содержит атом азота, он может быть замещенным или незамещенным. Когда атом азота в ароматическом кольце гетероарильной группы содержит заместитель, атом азота может быть четвертичным азотом.
Предпочтительным положением замещения в неароматической азотсодержащей гетероциклической группе является атом азота. Подходящие заместители на атоме азота неароматической гетероциклической группы или гетероарильной группы включают -R^, -N(R^)2, C(O)R^, CO2R^, -C(O)С(O)R^, -SO2R^, SO2N(R^)2, C(=S)N(R^)2, C(=NH)-N(R^)2 и -NRSO2R^; где R^ представляет собой водород, алифатическую группу, замещенную алифатическую группу, арил, замещенный арил, гетероциклическое или карбоциклическое кольцо или замещенное гетероциклическое или карбоциклическое кольцо. Примеры заместителей на группе R^ включают алкил, галогеналкил, галогеналкокси, алкоксиалкил, сульфонил, алкилсульфонил, галоген, нитро, циано, гидроксильную группу, арил, карбоциклическое или гетероциклическое кольцо, оксо, амино, алкиламино, диалкиламино, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонилокси, алкокси, карбокси, алкоксикарбонил или алкилкарбонил. Предпочтительно, R^ является незамещенной.
Неароматические азотсодержащие гетероциклические кольца, которые замещены по атому азота кольца и присоединены к остальной части молекулы по атому углерода кольца, называют N-замещенными. Например, N-алкилпиперидинильная группа присоединена к остальной части молекулы в положении два, три или четыре пиперидинильного кольца и замещена по атому азота кольца алкильной группой. Неароматические азотсодержащие гетероциклические кольца, такие как пиразинил, которые являются замещенными по атому азота кольца и присоединены к остальной части молекулы по второму атома азота кольца, называют N'-замещенными N-гетероциклами. Например, N'-ацил-N-пиразинильная группа присоединена к остальной части молекулы через один атом кольца и замещена по второму атому азота кольца ацильной группой.
Необязательно замещенный аралкил, когда упоминается в данном изобретении, может быть замещенным как в алкильной, так и в арильной части. Если не указано иное, необязательно замещенный аралкил, когда упоминается в данном описании, является необязательно замещенным по арильной части.
Термины «связь» и «отсутствие» используются взаимосвязанно для указания того, что группа отсутствует.
Соединения по настоящему изобретению определены в настоящем изобретении их химическими структурами и/или химическими названиями. Когда соединение определено химической структурой и химическим названием, и химическая структура и химическое название не соответствуют друг другу, химическая структура является определяющей идентичность соединения.
Соединения по настоящему изобретению могут использоваться для лечения в свободной форме или, когда это уместно, в виде фармацевтически приемлемой соли.
Термин «фармацевтически приемлемая соль», когда используется в данном описании, относится к солям соединений, которые, в пределах погрешности медицинской оценки, пригодны для применения в контакте с тканями человека и низших животных без чрезмерных побочных эффектов, таких как токсичность, раздражение, аллергическая реакция и т.п., с соответствующим допустимым соотношением польза/риск.
Фармацевтически приемлемые соли хорошо известны в данной области техники. Например, фармацевтически приемлемые соли подробно описываются в публикации Berge S.M. J. Pharmaceutical Sciences, 1977, 66, 1-19, содержание которой включено в данное описание в качестве ссылки. Фармацевтически приемлемые соли соединений по настоящему изобретению включают соли, полученные из подходящих неорганических и органических кислот и оснований. Эти соли могут быть получены непосредственно во время конечного выделения и очистки соединений. Кислотно-аддитивные соли могут быть получены 1) взаимодействием очищенного соединения в форме свободного основания с подходящей органической или неорганической кислотой и 2) выделением полученной таким образом соли.
Примерами фармацевтически приемлемых нетоксичных кислотно-аддитивных солей являются соли аминогруппы, полученные с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, фосфорная кислота, серная кислота и хлорная кислота, с органическими кислотами, такими как уксусная кислота, щавелевая кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или с помощью других методов, применяемых в данной области, таких как ионный обмен. Другие фармацевтически приемлемые соли включают адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, гликолат, глюконат, гликолат, гемисульфат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидройодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, пальмоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, салицилат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат и т.п. соли.
Основно-аддитивные соли могут быть получены 1) взаимодействием очищенного соединения в его кислотной форме с подходящим органическим или неорганическим основанием и 2) выделением полученной соли. Соли, полученные из подходящих оснований, включают соли щелочных металлов (например, натрия, лития и калия), щелочноземельных металлов (например, магния и кальция), аммония и N+(C1-4 алкил)4 соли. Данное изобретение также предусматривает кватернизацию любых основных азотсодержащих групп соединений по настоящему изобретению. Продукты, растворимые в воде или масле или диспергируемые в воде или масле, могут быть получены с помощью такой кватернизации.
Дополнительные фармацевтически приемлемые соли включают, когда это уместно, нетоксичные аммониевый, четвертичный аммониевый и аминный катионы, полученные с использованием противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, низший алкилсульфонат и арилсульфонат. Другие кислоты и основания, хотя как сами по себе не являются фармацевтически приемлемыми, могут применяться для получения солей, подходящих в качестве промежуточных соединений при получении соединений по изобретению и их фармацевтически приемлемых кислотно- или основно-аддитивных солей.
Следует представлять, что данное изобретение включает смеси/комбинации различных фармацевтически приемлемых солей, а также смеси/комбинации соединений в свободной форме и их фармацевтически приемлемых солей.
В дополнение к соединениям по настоящему изобретению, его фармацевтически приемлемые производные или пролекарства соединений по данному изобретению также могут применяться в композициях для лечения или предотвращения расстройств, определенных в данном описании.
Термин «пролекарство», когда используется в настоящем описании и если не указано иное, означает производное соединения, которое может подвергаться гидролизу, окислению или иначе реагировать в биологических условиях (in vitro или in vivo) с получением соединения по настоящему изобретению. Пролекарства могут становиться активными в результате такого взаимодействии в биологических условиях или они могут обладать активностью в их непрореагировавших формах. Примеры пролекарств по настоящему изобретению включают, но без ограничения, аналоги или производные соединений по настоящему изобретению, которые содержат способные подвергаться биологическому гидролизу группы, такие как биологически гидролизуемые амиды, биологически гидролизуемые сложные эфиры, биологически гидролизуемые карбаматы, биологически гидролизуемые карбонаты, биологически гидролизуемые уреиды и биологически гидролизуемые фосфатные аналоги. Другие примеры пролекарств включают производные соединений по изобретению, которые содержат группы -NO, -NO2, -ONO или -ONO2. Обычно пролекарства могут быть получены хорошо известными способами, например описанными в монографии BURGER'S MEDICINAL CHEMISTRY AND DRUG DISCOVERY (1995) 172-178, 949-982 (Manfred E. Wolff ed., 5th ed).
Термин «фармацевтически приемлемое производное» означает продукт присоединения или производное, способное при введении пациенту, нуждающемуся в этом, прямо или косвенно обеспечить соединение по настоящему изобретению или его метаболит или остаток. Примеры фармацевтически приемлемых производных включают, но без ограничения, сложные эфиры и соли таких сложных эфиров.
Термин «фармацевтически приемлемое производное или пролекарство» включает в себя любой фармацевтически приемлемый сложный эфир соединения по настоящему изобретению, соль указанного сложного эфира или другое производное соединения по настоящему изобретению либо его соль, которое(ая) при введении реципиенту способно(а) обеспечить, прямо или косвенно, соединение по настоящему изобретению или его ингибиторно активный метаболит или остаток. Особенно предпочтительными производными или пролекарствами являются производные или пролекарства, которые повышают биологическую доступность соединений по настоящему изобретению при введении таких соединений пациенту (например, позволяя перорально вводимому соединению быстрее абсорбироваться в кровь) или которые улучшают доставку исходного соединения в биологический компартмент (например, мозг или лимфатическую систему) по сравнению с исходными веществами.
Фармацевтически приемлемые пролекарства соединений по настоящему изобретению включают, но без ограничения, сложные эфиры, аминокислотные сложные эфиры, фосфатные сложные эфиры, соли металлов и сложные эфиры сульфокислот.
Фраза «побочные эффекты», когда используется в данном документе, включает нежелательные и неблагоприятные эффекты терапевтического лечения (например, профилактического или терапевтического лекарственного средства). Побочные эффекты являются всегда нежелательными, но нежелательные эффекты не обязательно являются неблагоприятными. Неблагоприятное воздействие терапевтического лечения (например, профилактического или терапевтического лекарственного средства) может быть вредным, неприятным или опасным. Побочные эффекты включают, но без ограничения, лихорадку, озноб, вялость, желудочно-кишечную токсичность (в том числе язвы и эрозии желудка и кишечника), тошноту, рвоту, нейтотоксичности, нефротоксичности, почечные токсичности (в том числе такие состояния, как папиллярный некроз и хронический интерстициальный нефрит), печеночные токсичности (в том числе повышенные уровни ферментов печени в сыворотке), миелотоксичности (в том числе лейкопению, тромбоцитопению, миелосупрессию и анемию), сухость во рту, металлический привкус, переношенную беременность, слабость, сонливость, боль (в том числе мышечную боль, костную боль и головную боль), выпадение волос, астению, головокружение, экстрапирамидальные симптомы, акатизию, сердечно-сосудистые нарушения и сексуальную дисфункцию.
В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей соединение по настоящему изобретению и фармацевтически приемлемый носитель, разбавитель, адъювант или наполнитель. В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции, включающей в себя эффективное количество соединения по настоящему изобретению и фармацевтически приемлемый носитель, разбавитель, адъювант или наполнитель. Фармацевтически приемлемые носители включают, например, фармацевтические разбавители, наполнители или носители, подходящим образом выбранные с учетом предполагаемой формы введения и в соответствии с обычной фармацевтической практикой.
Фармацевтически приемлемый носитель может содержать инертные ингредиенты, которые не оказывают избыточного ингибирующего действия на биологическую активность соединений. Фармацевтически приемлемые носители должны быть биологически совместимыми, например, быть нетоксичными, облагать иммуногенной активностью, не проявлять воспалительного действия или других нежелательных реакций или побочных эффектов при введении субъекту. Могут применяться стандартные способы получения фармацевтических препаратов.
Термин «фармацевтически приемлемый носитель, адъювант или наполнитель», когда используется в данном описании, включает любые и все растворители, разбавители или другие жидкие наполнители, диспергирующие или суспендирующие вспомогательные добавки, поверхностно-активные агенты, добавки, регулирующие изотоничность, загустители или эмульгаторы, консерванты, твердые связующие вещества, смазывающие вещества и т.п., которые подходят к конкретной целевой лекарственной форме. В монографии Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980) раскрываются различные носители, используемые при составлении фармацевтически приемлемых композиций, и известные способы их получения. За исключением случаев, когда любая обычная среда-носитель несовместима с соединениями по изобретению, например, в результате какого-либо нежелательного биологического эффекта или иного неблагоприятного взаимодействия с любым(и) другим(и) компонентом(ами) фармацевтически приемлемой композиции, подразумевается, что применение носителя включено в объем настоящего изобретения.
Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают, но без ограничения, ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту или сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, гидрофосфат натрия, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, полиакрилаты, воски, блок-сополимеры полиэтилена и полиоксипропилена, ланолин, сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошкообразный трагакант; солод; желатин; тальк; наполнители, такие как масло какао и воски для суппозиториев; масла, такие как арахисовое масло, хлопковое масло; сафлоровое масло; кунжутное масло; оливковое масло; кукурузное масло и соевое масло; гликоли; например пропиленгликоль или полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные агенты, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический раствор соли; раствор Рингера; этиловый спирт и фосфатно-буферные растворы, а также другие нетоксичные совместимые смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также красители, добавки для высвобождения действующего вещества, добавки для получения покрытий, подсластители, ароматизаторы и отдушки, консерванты и антиоксиданты также могут присутствовать в композиции, что определяет составитель композиции.
Соединения по настоящему изобретению или их фармацевтически приемлемые соли могут быть приготовлены в виде фармацевтических композиций для введения субъекту, как определено в данном описании. Эти фармацевтические композиции, которые содержат количество соединений, эффективное для лечения или предотвращения бактериальной инфекции, такой как IBD, и фармацевтически приемлемый носитель, являются еще одним вариантом осуществления настоящего изобретения.
В одном варианте осуществления настоящее изобретение представляет собой способ лечения или предотвращения бактериальной инфекции, такой как IBD, у субъекта, нуждающегося в этом, включающий введение субъекту эффективного количества соединения или композиции по настоящему изобретению.
Термины «субъект», «пациент» и «млекопитающее», когда используются в данном описании, являются взаимозаменяемые. Термины «субъект» и «пациент» относится к животному (например, птице, такой как курица, перепелка или индейка, или млекопитающему), предпочтительно млекопитающему, включая не-примата (например, корову, свинью, лошадь, овцу, кролика, морскую свинку, крысу, кошку, собаку и мышь) и примата (например, обезьяну, шимпанзе и человека), более предпочтительно - к человеку. В одном варианте осуществления изобретения субъект является животным, отличным от человека, таким как сельскохозяйственное животное (например, лошадь, корова, свинья или овца) или домашнее животное (например, собака, кошка, морская свинка или кролик). В предпочтительном варианте осуществления настоящего изобретения субъектом является человек.
Термин «эффективное количество», когда используется в данном описании, относится к количеству, достаточному для достижения желаемой биологической реакции. В настоящем изобретении желаемая биологическая реакция представляет собой снижение или смягчение тяжести, продолжительности, развития или возникновения бактериальной инфекции, достижение регрессии бактериальной инфекции, предотвращение рецидива, развития, начала или прогрессирования симптома, связанного с бактериальной инфекцией, либо усиление или улучшение профилактического или терапевтического эффекта(ов) другого терапевтического лечения. Точное количество соединения, вводимого субъекту, будет зависеть от способа введения, типа и тяжести заболевания или состояния и от характеристик субъекта, таких как общее состояние здоровья, возраст, пол, масса тела и восприимчивость к лекарственным средствам. Оно также будет зависеть от степени, тяжести и вида бактериальной инфекции и от способа введения. Специалист данной области техники способен определить необходимые дозы в зависимости от этих и других факторов. При совместном введении с другими лекарственными средствами, например при совместном введении с лекарственным средством против бактериальной инфекции, «эффективное количество» второго лекарственного средства будет зависеть от типа используемого препарата. Подходящие дозировки известны для разрешенных к применению лекарственных средств и могут корректироваться специалистом данной области в зависимости от состояния субъекта, типа состояния(ий), подлежащего(их) лечению, и от применяемого количества соединения по изобретению. В случаях, когда количество прямо не указано, эффективное количество должно быть рассчитано.
Термины «лечить», «лечение» и «лечащий» относятся к снижению или облегчению прогрессирования, тяжести и/или длительности бактериальной инфекции или облегчению одного или нескольких симптомов (предпочтительно, одного или нескольких различимых признаков) бактериальной инфекции в результате введения одного или нескольких терапевтических лекарственных средств (например, одного или несколько терапевтических лекарственных средств, таких как соединения по настоящему изобретению). В конкретных вариантах осуществления изобретения термины «лечить», «лечение» и «лечащий» относятся к облегчению по меньшей мере одного физического параметра бактериальной инфекции, который может быть количественного определен. В других вариантах осуществления изобретения термины «лечить», «лечение» и «лечащий» относятся к ингибированию прогрессирования бактериальной инфекции физически, например стабилизацией различимого симптома, физиологически, например стабилизацией физического параметра, либо тем и другим образом. В других вариантах осуществления настоящего изобретения термины «лечить», «лечение» и «лечащий» относятся к снижению или стабилизации бактериальной инфекции.
Термины «предотвращать», «предотвращение» и «предотвращающий» относятся к снижению риска инфицирования или развития данной бактериальной инфекции либо к снижению или ингибированию рецидива или повторного появления бактериальной инфекции. В одном варианте осуществления настоящего изобретения соединение по настоящему изобретению вводят в качестве превентивной меры пациенту, предпочтительно человеку, с генетической предрасположенностью к любому из состояний, заболеваний или расстройств, описанных в данном изобретении.
Фармацевтически приемлемые композиции по настоящему изобретению могут вводиться людям и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, внутрибрюшинно, местно (в виде порошков, мазей или капель), трансбуккально, в виде перорального или назального спрея и т.п. в зависимости от тяжести инфекции, подлежащей лечению. Жидкие лекарственные формы для перорального введения включают, но без ограничения, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активных соединений жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное масла, масло зародышей пшеницы, оливковое, касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана и их смеси. Кроме инертных разбавителей, композиции для перорального введения могут также включать адъюванты, такие как смачивающие агенты, эмульгаторы и суспендирующие агенты, подсластители, вкусовые добавки и отдушки.
Препараты для инъекций, например стерильные водные или масляные суспензии для инъекций, могут быть получены известными способами с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих добавок. Стерильный препарат для инъекций также может представлять собой стерильный раствор для инъекций, суспензию или эмульсию в нетоксичном парентерально приемлемом разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. К приемлемым носителям и растворителям, которые могут применяться, относятся вода, раствор Рингера, USP и изотонический раствор хлорида натрия. Кроме того, обычно в качестве растворителя или суспендирующей среды применяются стерильные нелетучие масла. Для этого может использоваться любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, для получения препаратов для инъекций используются жирные кислоты, такие как олеиновая кислота.
Препараты для инъекций могут стерилизоваться, например фильтрованием через фильтр, удерживающий бактерии, или введением стерилизующих агентов в форме стерильных твердых композиций, которые могут растворяться или диспергироваться в стерильной воде или другой стерильной среде для инъекций непосредственно перед применением.
Зачастую для увеличения длительности действия соединения по настоящему изобретению желательно замедлить абсорбцию соединения из подкожной или внутримышечной инъекции. Это может достигаться применением жидкой суспензии кристаллического или аморфного материала с плохой растворимостью в воде. Скорость абсорбции соединения тогда зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. В качестве альтернативы, замедленная абсорбция парентерально вводимой формы соединения достигается посредством растворения или суспендирования соединения в масляном носителе. Депо-форму для инъекций получают путем получения микроинкапсулированных матриц соединения в биоразлагаемых полимерах, таких как полилактид-полигликолид. Скорость высвобождения соединения может контролироваться подбором соотношения соединения и полимера и применением специфического полимера. Примеры других биоразлагаемых полимеров включают сложные поли(ортоэфиры) и поли(ангидриды). Депо-препараты для инъекций также получают введением соединения в липосомы или микроэмульсии, которые совместимы с тканями организма.
Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые могут быть получены смешиванием соединений по настоящему изобретению с подходящими нераздражающими наполнителями или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при КТ, но жидкими при температуре тела и, следовательно, плавятся в прямой кишке или вагинальной полости с высвобождением активного соединения.
Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешано по меньшей мере с одним инертным фармацевтически приемлемым наполнителем или носителем, таким как цитрат натрия или дикальцийфосфат, и/или а) наполнителями или сухими экстендерами, такими как крахмалы, лактоза, сахароза, глюкоза, маннит и кремниевая кислота, b) связующими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и гуммиарабик, с) увлажнителями, такими как глицерин, d) дезинтегрирующими добавками, такими как агар-агар, карбонат кальция, картофельный крахмал или крахмал тапиоки, альгиновая кислота, некоторые силикаты и карбонат натрия, е) добавками, замедляющими растворение, такими как парафин, f) ускорителями абсорбции, такими как четвертичные аммониевые соединения, g) смачивающими агентами, такими как, например, цетиловый спирт и глицерилмоностеарат, h) абсорбентами, такими как каолин и бентонитовая глина, и i) смазывающими веществами, такими как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль лекарственная форма может также содержать буферные агенты.
Твердые композиции подобного типа могут также применяться в качестве наполнителей в желатиновых капсулах с мягким и твердым наполнением с использованием такие эксципиентов, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п. Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области производства фармацевтических препаратов. Они могут необязательно содержать опалесцирующие добавки и могут также представлять собой композицию, которая высвобождает активный(е) ингредиент(ы), исключительно или предпочтительно, в определенной части кишечного тракта необязательно замедленным образом. Примеры внедряемых композиций, которые могут применяться, включают полимерные вещества и воски. Твердые композиции аналогичного типа также могут применяться в качестве мягких и твердых наполнителей в желатиновых капсулах с использованием таких наполнителей, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п.
Активные соединения также могут быть представлены в микроинкапсулированной форме с одним или несколькими наполнителями, как отмечалось выше. Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия, покрытия, контролирующие высвобождение активного ингредиента, и другие покрытия, хорошо известные в области производства фармацевтических препаратов. В таких твердых лекарственных формах активное соединение может смешиваться по меньшей мере с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы могут также содержать, как это традиционно на практике, добавки, отличные от инертных разбавителей, например, смазывающие вещества для таблетирования и другие вспомогательные добавки для таблетирования, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль лекарственные формы могут также содержать буферные агенты. Они могут необязательно содержать опалесцирующие добавки и могут представлять собой композицию, которая высвобождает активный(е) ингредиент(ы), исключительно или предпочтительно, в определенной части кишечного тракта необязательно замедленным образом. Примеры внедряемых композиций, которые могут применяться, включают полимерные вещества и воски.
Лекарственные формы для местного или чрескожного введения соединения по настоящему изобретению включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингаляторы или пластыри. Активный компонент смешивается в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферными добавками, которые могут быть необходимы. Офтальмологические препараты, ушные капли, и глазные капли также рассматривают как входящие в объем настоящего изобретения. Кроме того, настоящее изобретение относится к применению чрескожных пластырей, которые имеют дополнительное преимущество в обеспечении контролируемой доставки соединения в организм. Такие лекарственные формы могут быть получены посредством растворения или диспергирования соединения в соответствующей среде. Для увеличения потока соединения, поступающего через кожу, могут также применяться усилители абсорбции. Скорость может регулироваться с помощью мембраны, регулирующей скорость проникновения, или диспергированием соединения в полимерной матрице или геле.
Композиции по настоящему изобретению могут вводиться перорально, парентерально, путем ингаляции, местно, ректально, назально, трансбуккально, вагинально или через имплантированный резервуар. Термин «парентеральный», когда используется в данном описании, включает, но без ограничения, методы подкожной, внутривенной, внутримышечной, интраартикулярной, внутрисуставной, интрастернальной, интратекальной, внутрипеченочной инъекции или инфузии, инъекции или инфузии в очаг поражения и внутричерепной инъекции или инфузии. Предпочтительно, композиции вводятся перорально, интраперитонеально или внутривенно.
Стерильные формы для инъекций композиций по настоящему изобретению могут представлять собой водную или масляную суспензию. Эти суспензии могут быть получены в соответствии со способами, известными в данной области, с использованием подходящих диспергирующих, смачивающих и суспендирующих агентов. Стерильный препарат для инъекций может также представлять собой стерильный раствор или суспензию для инъекций в нетоксичном парентерально приемлемом разбавителе или растворителе, например в виде раствора в 1,3-бутандиоле. Приемлемые носители и растворители, которые могут быть применяться, включают воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды обычно используются стерильные нелетучие масла. С этой целью может использоваться любое мягкое нелетучее масло, включая синтетические моно- или диглицериды. В препаратах для инъекций могут применяться жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, а также природные фармацевтически приемлемые маслами, например оливковое масло или касторовое масло, в особенности их полиоксиэтилированные производные. Эти масляные растворы или суспензии могут также содержать спиртовой разбавитель с длинной углеродной цепью или диспергатор, такой как карбоксиметилцеллюлоза, или аналогичные диспергирующие агенты, которые обычно используются в препаратах фармацевтически приемлемых лекарственных форм, включая эмульсии и суспензии. Для получения препаратов также могут быть применяться и другие, традиционно используемые поверхностно-активные вещества, такие как Tween, Span и другие эмульгаторы или добавки, повышающие биодоступность, которые обычно используются в производстве фармацевтически приемлемых твердых, жидких или других лекарственных форм.
Фармацевтические композиции по настоящему изобретению могут вводиться перорально в любой перорально приемлемой лекарственной форме, включая, но без ограничения, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального применения традиционно применяемые носители включают, но без ограничения, лактозу и кукурузный крахмал. Также добавляются смазывающие вещества, такие как стеарат магния. Разбавители, подходящие для препаратов перорального введения в форме капсулы, включают лактозу и высушенный кукурузный крахмал. Когда для перорального применения необходимы водные суспензии, активный ингредиент объединяется с эмульгирующим и суспендирующим агентами. При желании также могут добавляться некоторые подсластители, ароматизаторы или красители.
Альтернативно, фармацевтические композиции по данному изобретению могут вводиться в форме суппозиториев для ректального введения. Они могут быть получены смешиванием агента с подходящим нераздражающим эксципиентом, который является твердым при комнатной температуре, но жидким при ректальной температуре и, следовательно, будет плавиться в прямой кишке с высвобождением лекарственного средства. Такие материалы включают, но без ограничения, масло какао, пчелиный воск и полиэтиленгликоли.
Фармацевтические композиции по настоящему изобретению можно также вводить местно, особенно, когда цель лечения включает участки или органы, легкодоступные для местного применения, включая болезни глаз, кожи или нижней части кишечника. Подходящие композиции для местного применения легко получают для каждого из этих участков или органов. Местное применение для нижней части кишечника может осуществляться с помощью ректальных суппозиториев (см. выше) или подходящей композиции для клизмы. Местно также могут применяться чрескожные пластыри.
Фармацевтические композиции для местного применения могут быть представлены в форме подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или нескольких носителях. Носители для местного введения соединений по настоящему изобретению включают, но без ограничения, минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропилен, эмульгирующий воск и воду. Альтернативно, фармацевтические композиции могут быть представлены в виде подходящего лосьона или крема, содержащего активные компоненты, суспендированные или растворенные в одном или нескольких фармацевтически приемлемых носителях. Подходящие носители включают, но без ограничения, минеральное масло, сорбитанмоностеарат, полисорбат 60, цетиловый эфирный воск, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду.
Фармацевтические композиции для офтальмологического применения могут быть представлены в виде микронизированных суспензий в изотоническом стерильном растворе соли с определенным значением рН или, предпочтительно, в виде растворов в изотоническом стерильном растворе соли с определенным значением рН с добавлением или без добавления консерванта, такого как хлорид бензалкония. Альтернативно, фармацевтические композиции для офтальмологического применения могут быть представлены в виде мази, такой как вазелин.
Фармацевтические композиции по настоящему изобретению могут также вводиться в виде назального аэрозоля или ингаляцией. Такие композиции получают в соответствии со способами, хорошо известными в области получения фармацевтических препаратов, и могут быть получены в виде растворов в растворе соли с использованием бензилового спирта или других подходящих консервантов, усилителей абсорбции для повышения биологической доступности, фторуглеродов и/или других обычных солюбилизирующих или диспергирующих агентов. Режим дозировки с использованием соединений по настоящему изобретению может быть выбран в соответствии с различными факторами, включая расстройство, которое подлежит лечению, и тяжесть заболевания; активность конкретного используемого соединения; конкретную применяемую композицию; возраст, массу тела, общее состояние здоровья, пол и режим питания пациента; время введения, путь введения и скорость экскреции конкретного используемого соединения; почечную и печеночную функцию субъекта; применяемое конкретное соединение или его соль, продолжительность лечения; лекарственные средства, используемые в комбинации или совместно с конкретным используемым соединением, и т.п. факторы, хорошо известные в области медицины. Специалист в данной области может легко определить и назначить эффективное количество соединения по настоящему изобретению, необходимое для лечения, например, для предотвращения, ингибирования (полного или частичного) или остановки развития заболевания.
Дозировки соединений по настоящему изобретению могут находиться в интервале от примерно 0,01 до примерно 100 мг/кг массы тела/сутки, от примерно 0,01 до примерно 50 мг/кг массы тела/сутки, от примерно от 0,1 до примерно 50 мг/кг массы тела/сутки или от примерно 1 до примерно 25 мг/кг массы тела/сутки. Понятно, что общее суточное количество может вводиться в виде разовой дозы или может разделяться на несколько приемов, например два, три или четыре раза в сутки.
Соединения для применения в способе по настоящему изобретению могут быть представлены в виде лекарственной формы стандартной дозы. Термин «лекарственная форма стандартной дозы» относится к физически дискретным единицам, пригодным в качестве единичных доз для субъектов, проходящих лечение, где каждая дискретная единица содержит заданное количество активного вещества, рассчитанное на получение желаемого терапевтического эффекта, необязательно в сочетании с подходящим фармацевтическим носителем. Лекарственная форма стандартной дозы может быть представлена в виде одной суточной дозы или одной из нескольких суточных доз (например, приблизительно от 1 до 4 или более раз в день). Когда используется множество суточных доз, лекарственная форма стандартной дозы может быть одинаковой или разной для каждой дозы.
Эффективное количество может достигаться в способе или фармацевтической композиции по настоящему изобретению применением соединения по настоящему изобретению или его фармацевтически приемлемой соли отдельно или в сочетании с дополнительным подходящим терапевтическим лекарственным средством, например противораковым терапевтическим лекарственным средством. Когда применяется комбинированная терапия, эффективное количество может быть достигнуто с использованием первого количества соединения по настоящему изобретению или его фармацевтически приемлемой соли и второго количества дополнительного подходящего терапевтического лекарственного средства.
В одном варианте осуществления настоящего изобретения соединение по настоящему изобретению и дополнительное терапевтическое лекарственное средство вводят в эффективном количестве (т.е. в количестве, которое будет терапевтически эффективным при их отдельном введении). В другом варианте осуществления настоящего изобретения соединение по настоящему изобретению и дополнительное терапевтическое лекарственное средство вводят в количестве, которое само по себе не обеспечивает терапевтический эффект (субтерапевтические дозы). В еще одном варианте осуществления настоящего изобретения соединение по настоящему изобретению может вводиться в эффективном количестве, в то время как дополнительное терапевтическое лекарственное средство вводится в субтерапевтической дозе. В еще одном варианте осуществления изобретения соединение по настоящему изобретению может вводиться в субтерапевтической дозе, в то время как дополнительное терапевтическое лекарственное средство, например подходящее противораковое терапевтическое лекарственное средство, вводится в эффективном количестве.
Термины «в сочетании» или «совместное введение», когда используются в настоящем описании, могут применяться взаимозаменяемо для обозначения применения нескольких терапевтических лекарственных средств (например, одного или нескольких профилактических и/или терапевтических лекарственных средств). Использование указанных терминов не ограничивает порядок, в котором терапевтические лекарственные средства (например, профилактическое и/или терапевтическое лекарственные средства) вводятся субъекту. Совместное введение включает введение первого и второго количеств соединений совместного введения, по существу, одновременно, например, в единой фармацевтической композиции, например в капсуле или таблетке, с фиксированным соотношением первого и второго количеств, или в нескольких отдельных капсулах или таблетках для каждого. Кроме того, такое совместное введение включает также применение каждого соединения последовательно в любом порядке.
Когда совместное введение включает раздельное введение первого количества соединения по настоящему изобретению и второго количества дополнительного терапевтического лекарственного средства, соединения вводятся достаточно близко по времени для достижения желаемого терапевтического эффекта. Например, период времени между каждым введением, при котором может достигаться желаемое терапевтическое действие, может изменяться в интервале от нескольких минут до нескольких часов и может быть определен с учетом свойств каждого соединения, таких как эффективность, растворимость, биологическая доступность, период полувыведения из плазмы и кинетическая профиль. Например, соединение по настоящему изобретению и второе терапевтическое лекарственное средство могут вводиться в любом порядке с интервалом между введением одного и другого в пределах примерно 24 часов, с интервалом между введением одного и другого в пределах примерно 16 часов, с интервалом между введением одного и другого примерно 8 часов, с интервалом между введением одного и другого примерно 4 часов, с интервалом между введением одного и другого примерно 1 час или с интервалом между введением одного и другого 30 минут.
Более конкретно, первое терапевтическое средство (например, профилактическое или терапевтическое лекарственное средство, такое как соединение по изобретению) может вводиться субъекту перед (например, за 5 минут, за 15 минут, за 30 минут, за 45 минут, за 1 час, за 2 часа, за 4 часа, за 6 часов, за 12 часов, за 24 часа, за 48 часов, за 72 часа, за 96 часов, за 1 неделю, за 2 недели, за 3 недели, за 4 недели, за 5 недель, за 6 недель, за 8 недель, за 12 недель или раньше), одновременно или после (например, через 5 минут, через 15 минут, через 30 минут, через 45 минут, через 1 час, через 2 часа, через 4 часа, через 6 часов, через 12 часов, через 24 часа, через 48 часов, через 72 часа, через 96 часов, через 1 неделю, 2 недели, через 3 недели, через 4 недели, через 5 недель, через 6 недель, через 8 недель, или через 12 недель после) введения второго терапевтического средства (например, профилактического или терапевтического лекарственного средства, такого как противораковое лекарственное средство).
Понятно, что способ совместного введения первого количества соединения по настоящему изобретению и второго количества дополнительного терапевтического средства может привести к повышенному или синергическому терапевтическому эффекту, где комбинированное действие больше, чем аддитивное действие, которое должно быть получено при раздельном введении первого количества соединения по настоящему изобретению и второго количества дополнительного терапевтического средства.
Термин «синергический», когда используется в данном описании, относится к комбинации соединения по изобретению и другого терапевтического средства (например, профилактического или терапевтического лекарственного средства), которая является более эффективной, чем аддитивное действие терапевтических средств. Синергетическое действие комбинированной терапии (например, сочетание профилактических или терапевтических лекарственных средств) позволяет применять более низкие дозы одного или нескольких терапевтических лекарственных средств и/или менее частое введение указанных терапевтических средств субъекту. Возможность использовать более низкие дозы терапевтических средств (например, профилактического или терапевтического лекарственного средства) и/или вводить указанные терапевтические средства реже снижает токсичность, связанную с введением указанной терапии субъекту, без снижения эффективности указанного лечения в предотвращении, контроле или лечении расстройства. Кроме того, синергическое действие может привести к повышению эффективности лекарственных средств в предотвращении, контроле или лечении расстройства. Наконец, синергическое действие комбинированной терапии (например, сочетания профилактических или терапевтических лекарственных средств) может предотвращать или снижать неблагоприятные или нежелательные побочные эффекты, связанные с использованием какого-либо одного терапевтического лекарственного средства.
Наличие синергического действия может быть определено с использованием соответствующих методов оценки лекарственного взаимодействия. Подходящие способы включают в себя, например, уравнение сигмоидно-максимального действия (Holford, N.H.G. and Scheiner, L.B., Clin. Pharmacokinet. 6: 429-453 (1981)), уравнение аддитивности Лойе (Loewe) (Loewe, S. and Muischnek, Н., Arch. Exp. Pathol. Pharmacol. 114:313-326 (1926)) и уравнение среднего действия (Chou, T.C. and Talalay, P., Adv. Enzyme Regul. 22: 27-55 (1984)). Каждое уравнение, упомянутое выше, может применяться с экспериментальными данными для получения соответствующего графика с целью оценки действия комбинации лекарственных средств. Соответствующие графики, связанные с упомянутыми выше уравнениями, представляют собой кривую «концентрация-эффект», изоболограмму в виде кривой и кривую показателя комбинирования (combination index curve), соответственно.
Активность соединений в качестве ингибиторов бактериальной инфекции может испытываться in vitro или in vivo. Анализы in vitro включают в себя анализы, которые определяют ингибирование FimH активности, бактериальной адгезии и бактериального связывания. Альтернативные анализы in vitro количественно определяют способность ингибитора связываться с FimH, и эта способность может быть измерена либо с помощью радиоактивной метки ингибитора перед связыванием, выделением ингибиторного комплекса и определением количества связанной радиоактивной метки, либо с помощью конкурентного эксперимента, где новые ингибиторы инкубируются с FimH, связанным с известными радиолигандами. Подробные условия анализа активности соединения, используемые в настоящем изобретении, приведены в примерах ниже.
ПОДРОБНОЕ ОПИСАНИЕ ЭКСПЕРИМЕНТОВ
В приведенных ниже примерах используются следующие аббревиатуры:
|
|
Соединения по настоящему изобретению могут быть получены в соответствии с описанием с использованием стадий, в целом, известных специалистам данной области техники. Полученные соединения могут подвергаться анализу известными способами, в том числе, но без ограничения, ЖХ-МС (жидкостная хроматография- масс-спектрометрия), ВЭЖХ (высокоэффективная жидкостная хроматография) и ЯМР (ядерный магнитный резонанс). Следует понимать, что конкретные условия, показанные ниже, являются лишь примерами и не предназначены для ограничения объема условий, которые могут применяться для получения соединений по настоящему изобретению. Вместо этого настоящее изобретение также включает в себя условия, которые будут очевидны специалистам в данной области техники в свете данного описания для получения соединений по настоящему изобретению. Если не указано иное, все переменные в приведенных далее примерах принимают значения, определенные в данном описании.
Масс-спектрометрический анализ образцов проводится на масс-спектрометре Waters UPLC Acquity, работающем в единственном МС режиме с ионизацией электрораспылением. Образцы вводили в масс-спектрометр с помощью хроматографии. Подвижная фаза для масс-спектрометрического анализа включает 0,1% муравьиную кислоту и смесь CH3CN-вода. Условия элюирования колонки: элюирование с градиентом 5%-85% CH3CN-вода в течение 6 минут, колонка AcquityHSS T3 1,8 мкм 2,11 мм ID×5,0 мм. Скорость истечения: 1,0 мл/мин. Аббревиатура "Rt (мин)", когда используется в данном описании, относится к времени удержания в ЖХ-МС, выраженному в минутах и относящемуся к определенному соединению. Если не указано иное, метод ЖХ-МС, используемый для получения указанного времени удержания, представляет собой способ, описанный выше.
Очистку с помощью ВЭЖХ с обращенной фазой проводят в стандартных условиях с использованием колонки Phenomenex Gemini 21,2 мм ID×250 мм (5 мкм), колонки Gemini 21,2 мм ID×75 мм, (5 мкм), 110Ǻ, или, в большинстве случаев, колонки aWaters XSELECT CSH Prep Cl8 (5 мкм) ODB 19×100 мм. Элюирование проводят с использованием линейного градиента CH3CN-H2O (с использованием или без использования 0,01% ТФУК буфера или 0,1% HCOH) в качестве подвижной фазы. Система растворителя настраивается в соответствии с полярностью соединения, объемная скорость истечения 20 мл/мин. Соединения собираются с помощью УФ- или Waters3100 Mass детектора, ESI в положительном режиме. Фракции, содержащие целевое соединение, объединяют, концентрируют (роторный испаритель) для удаления избытка CH3CN, и полученный водный раствор лиофилизируют с получением целевого продукта, в большинстве случаев - в виде белой пены.
Общий способ синтеза
Соединения, описанные в настоящем изобретении, получают из основных промежуточных соединений с использованием двух ключевых реакций: реакции Сузуки и реакции сочетания Соногаширы.
Соединения формулы IV (Z=i) могут быть получены с помощью двух различных способов, как показано на схеме 1. В способе A стереоселективное С-гликозидирование перацетилированного гликаля с помощью арил/гетероарил-бис-бороновой кислоты I типа с использованием палладиевого катализатора приводит к селективному получению бис-α-глюкаля II типа (Maddaford et al. Org. Letters, 2001, 3(13), 2013). Стереоселективное бис-дигидроксилирование последнего (OsO4, NMO) приводит к получению арильных/гетероарильных бис-α-маннозидов III типа. Удаление ацетатной защитной группы омылением (MeONa/МеОН) приводит к получению целевого конечного продукта IV типа (Z=i). Альтернативно, в способе B стереоселективное C-гликозидирование является результатом двойного присоединения арил/гетероарильных реагентов цинка, полученных из дийодарила/гетероарила V типа по (3S,4S,5R,6R)-2-бром-6-((пивалоилокси)метил)тетрагидро-2Н-пиран-3,4,5-триил-трис(2,2-диметилпропаноату), как описано в публикации Knochel, Org. Letters, 2012, 14(6), 1480). В полученных полностью пивалатированных бисманнозидах VI удаляют защитные группы в кислотных условиях (АсОН, ТГФ, Н2О) с получением целевого продукта IV.
Схема 1: Способы А и В получения соединений формулы IV (Z=i)
Соединения формулы XI (Z=ii), XIV (Z=iii) и XIX (Z=vii) также могут быть получены с использованием способов А и В, как показано на схеме 2. Биарилы или бис-гетероарилы XI типа могут быть получены либо в соответствии со способом А, главным образом для несимметричных аналогов (B≠C) или, проще, в соответствии со способом В, ограничением которого является доступность исходного соединения V типа. В способе А промежуточные соединения IX типа получают, как описано ранее, с использованием бороновых кислот VII типа. В некоторых случаях бороновую кислоту VII заменяют соответствующим пинаколо-боронатом, полученным из соответствующего бензил-защищенного бром- или йодфенола. После реакции сочетания с глюкалем и дигидроксилирования бензил-защитную группу удаляют гидрогенолизом и превращают в трифлат для катализируемой палладием реакции перекрестного сочетания. Реакция сочетания Сузуки промежуточных соединений IX и X с последующим омылением приводит к получению целевых бис-маннозидов XI. Соединения XIV типа (Z=iii) могут быть получены аналогичным образом из пинаколбороната XII типа по Сузуки с бис- галогенированными промежуточными соединениями XIII типа. Этот подход осуществляется в двух стадиях (сочетания и удаления защиты) на симметричных соединениях (D=F) или последовательно для несимметричных (D≠F) аналогов. В способе B соединения XI, XIV и XIX типов получают, как описано выше, из промежуточных соединений XV, XVI и XVIII, соответственно, коммерчески доступных или полученных в соответствии со стратегиями кросс-сочетания.
Схема 2: Способы А и В получения соединений формулы ХХ (Z=ii), XIV (Z=iii) и XIX (Z=viii)
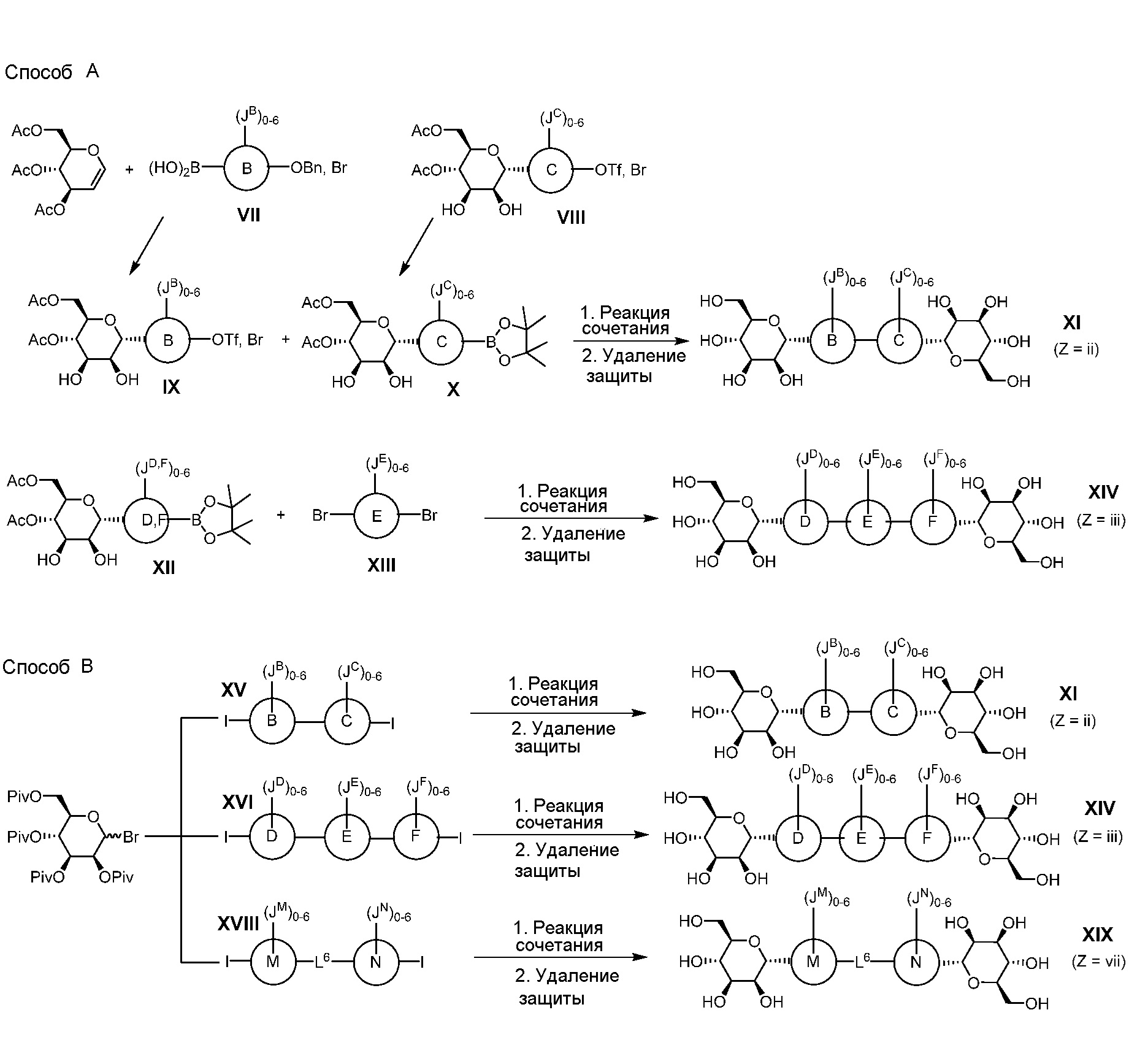
Соединения формулы XXII (Z=v), где L2 и L3 представляют собой алкин, могут быть получены тремя различными способами (С, D и Е), как показано на схеме 3. В способе С промежуточное соединение XXI получают в соответствии с реакцией сочетания Соногаширы между дибром- или дийодоарилом или гетероарилом ХХ типа и ((2R,3R,4R,5R,6R)-6-этинил-3,4,5-трис((триизопропилсилил)окси)тетрагидро-2H-пиран-2-ил)метанолом или TMS-защищенным аналогом (см. Helv. Chim. Acta. 2001, 84(8), 2355-2367). Удаление TIPS-защищающих групп из XVIII в кислотных условиях (ТФУК, ТГФ, Н2О) или с использованием TBAF приводит к получению целевого соединения XXII. Альтернативно, в способе D реакцию сочетания Соногаширы, описанную в способе C, проводят с использованием незащищенной этинилманнозы ((2R,3S,4R,5S,6R)-2-этинил-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триол; Helv. Chim. Acta. 2001, 84(8), 2355-2367). Наконец, в способе E двойное алкинилирование по типу Феррьера (Ferrier) между (2R,3S,4R)-2-(ацетоксиметил)-3,4-дигидро-2H-пиран-3,4-диилдиацетатом и бис-TMS-ацетиленарилом гетероарильного соединения XXIII с использованием в качестве катализатора кислот Льюиса может проводиться для получения целевого промежуточного соединения XXIV (Tetrahedron Letters 2002, 43, 5437-5440). Стереоспецифическое бис-дигидроксилирование промежуточного соединения XXIV с последующим омылением приводит к получению целевого конечного соединения XXII.
Схема 3: Способы С, D и Е получения соединений формулы III (Z=v)
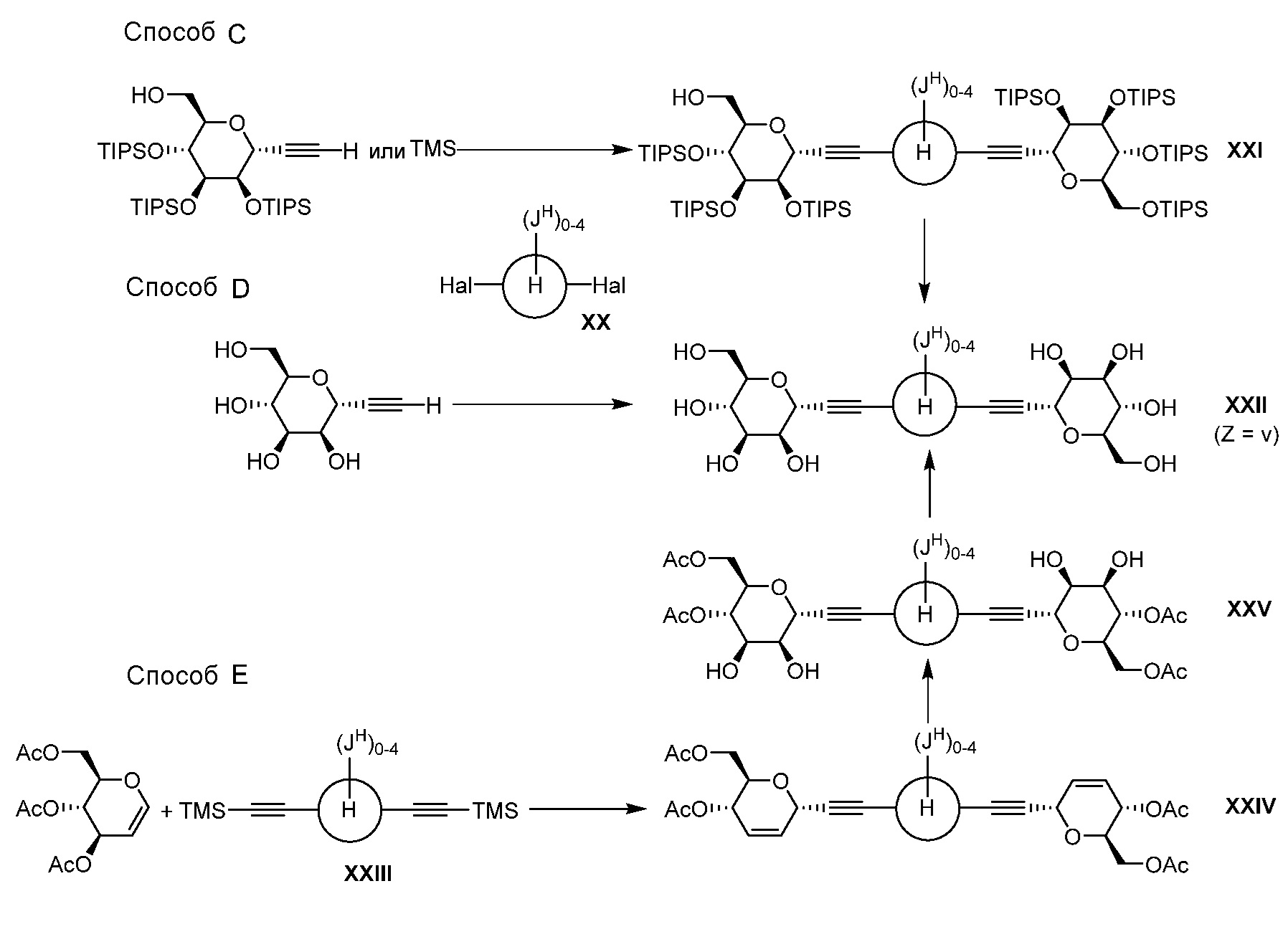
Бис-маннозиды XXVII типа, показывающие α-арильные и α-алкинильные линкеры с маннозой, получают с помощью описанных выше взаимодействий в соответствии со способом синтеза F, представленным на схеме 4. Реакция сочетания Соногаширы между галогенированными арилами или гетероарилами XXVI типа (полученными, как описано для IX) и (2R,3R,4R,5R,6R)-6-этинил-3,4,5-трис((триизопропилсилил)окси)тетрагидро-2Н-пиран-2-ил)метанолом или его TMS-защищенным аналогом может приводить, после последовательного удаления защитной группы ацетата и TIPS групп, если это необходимо, к получению целевых соединений XXVII типа.
Схема 4: Способ F получения соединений формулы XXIII (Z=iv)
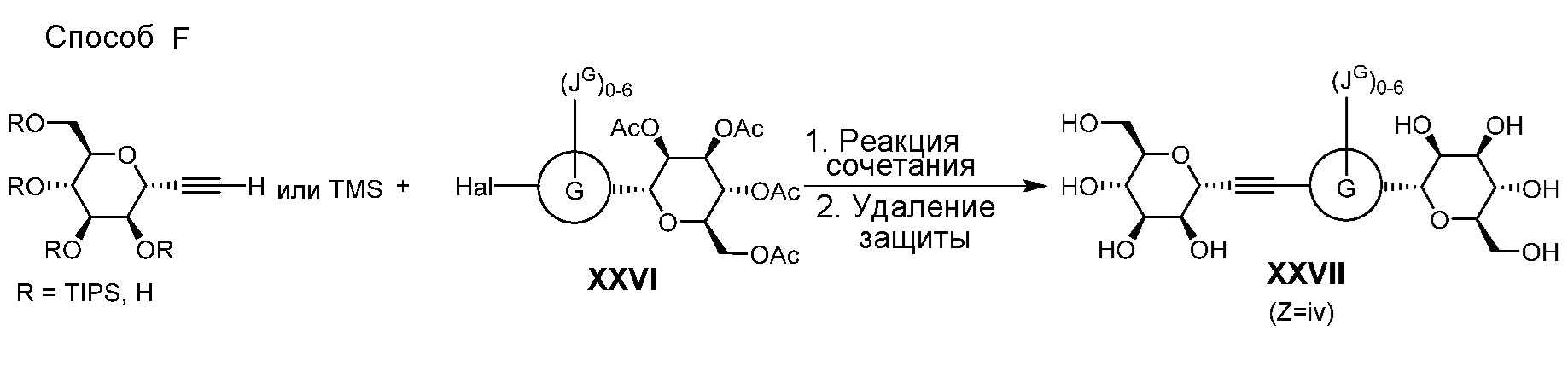
Ниже приведены основные промежуточные соединения, которые используются при получении соединений, описанных в данном изобретении:
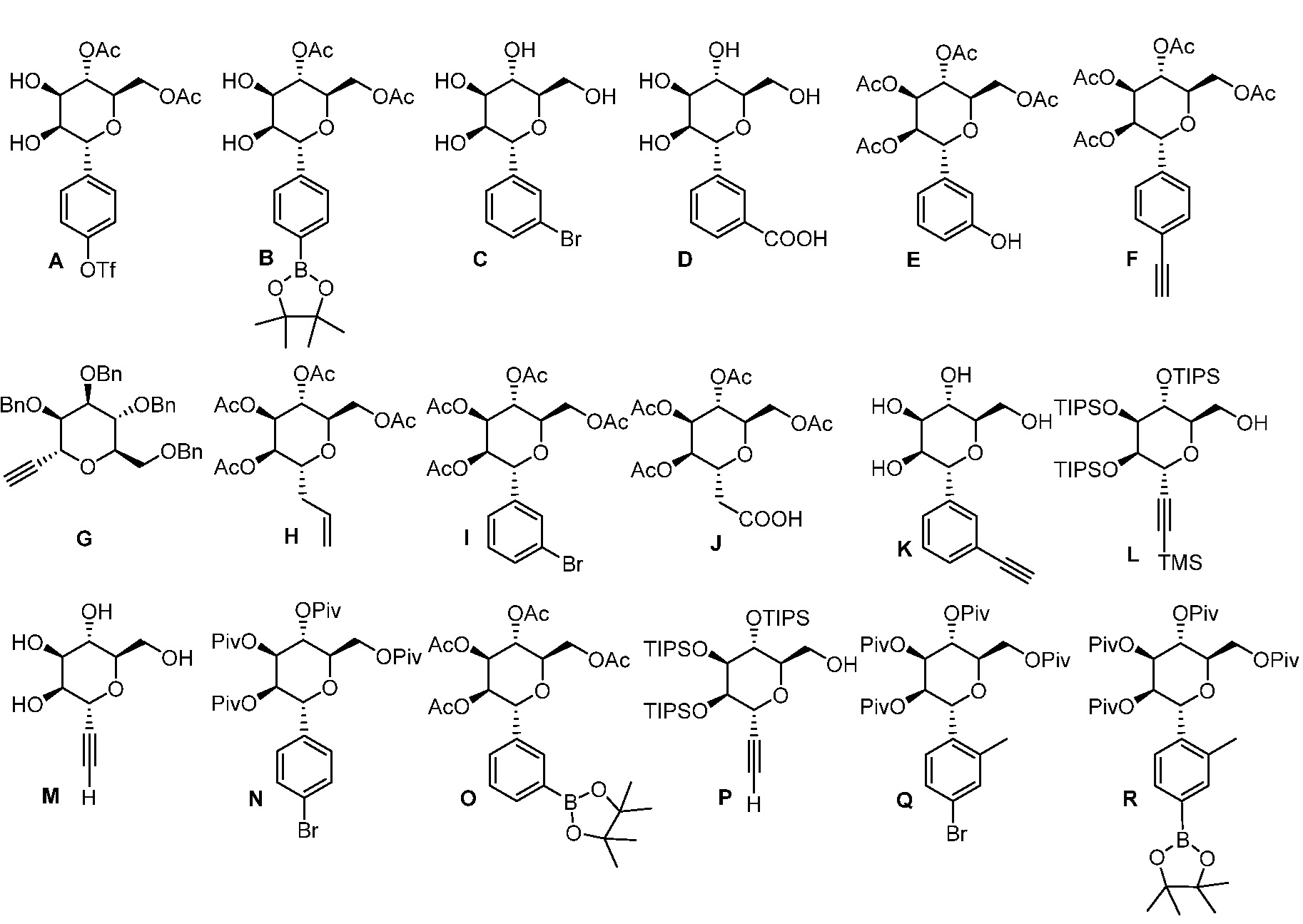
Получение промежуточного соединения А
[(2R,3S,4R,5S,6R)-3-Ацетокси-4,5-дигидрокси-6-[4-(трифторметилсульфонилокси)фенил]тетрагидропиран-2-ил]метилацетат
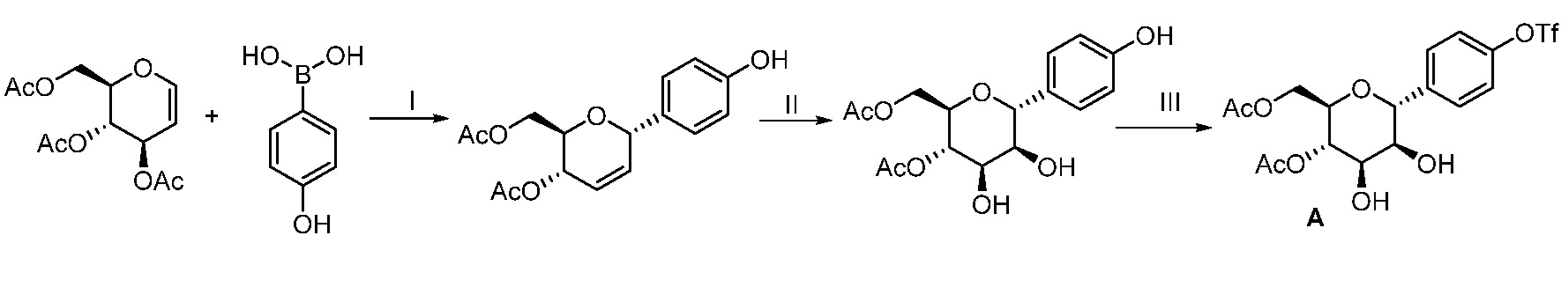
Стадия I: [(2R,3S,6S)-3-Ацетокси-6-(4-гидроксифенил)-3,6-дигидро-2Н-пиран-2-ил]метилацетат
Ацетонитрил (50,00 мл) добавляют к смеси [(2R,3S,4R)-3,4-диацетокси-3,4-дигидро-2Н-пиран-2-ил]метилацетата (9,869 г, 36,25 ммоль), (4-гидроксифенил)бороновой кислоты (5 г, 36,25 ммоль) и Pd(OAc)2 (1,221 г, 5,438 ммоль) и реакционную смесь перемешивают при КТ в течение ночи. После этого к смеси добавляют дополнительное количество (4-гидроксифенил)бороновой кислоты (1 г), реакционную смесь перемешивают в течение дополнительных 2 часов и затем фильтруют через целит. Фильтрат упаривают, и сырой продукт очищают на картридже Biotage™ SNAP (силикагель, 340 г; элюирование с градиентом: EtOAc в гексанах 5%-80%) с получением указанного в заголовке соединения (6,03 г).
Стадия II: [(2R,3S,4R,5S,6R)-3-Ацетокси-4,5-дигидрокси-6-(4-гидроксифенил)тетрагидропиран-2-ил]метилацетат
К суспензии [(2R,3S,6S)-3-ацетокси-6-(4-гидроксифенил)-3,6-дигидро-2Н-пиран-2-ил]метилацетата (6,03 г, 19,69 ммоль) в смеси ТГФ (36 мл)/вода (24 мл) добавляют метансульфонамид (2,810 г, 29,54 ммоль), OsO4 (6,007 г, 7,4 мл 2,5% масс./масс. в t-BuOH, 0,5907 ммоль) и NMO (4,613 г, 39,38 ммоль). Реакционную смесь перемешивают при КТ в течение ночи. Добавляют 1М раствор Na2S2O3 (40 мл) и полученную смесь экстрагируют EtOAc (3×40 мл). Объединенные органические экстракты промывают насыщенным раствором соли (15 мл) и сушат над Na2SO4. Смесь фильтруют, растворитель выпаривают, и сырой продукт очищают на картридже Biotage™ SNAP (силикагель, 220 г; элюирование с градиентом: МеОН в CH2Cl2 0%-20%) c получением указанного в заголовке соединения (6,05 г).
ЖХ-МС: m/z=329,3 (M+Na+).
Стадия III: Промежуточное соединение А
К раствору [(2R,3S,4R,5S,6R)-3-ацетокси-4,5-дигидрокси-6-(4-гидроксифенил)тетрагидропиран-2-ил]метилацетата (872 мг, 2,562 ммоль) в CH2Cl2 (22 мл) добавляют 1,1,1-трифтор-N-фенил-N-(трифторметилсульфонил)метансульфонамид (1,190 г, 3,331 ммоль), NEt3 (518,5 мг, 714 мкл, 5,124 ммоль) и реакционную смесь перемешивают при КТ в течение ночи. Растворитель выпаривают, и сырой продукт очищают на картридже Biotage™ SNAP (силикагель, 100 г; элюирование с градиентом: MeOH/CH2Cl2 0%-20%; более 15 объемов колонки (CV)) с получением указанного в заголовке продукта (1,06 г).
Получение промежуточного соединения B
([(2R,3S,4R,5S,6R)-3-Ацетокси-4,5-дигидрокси-6-[4-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)фенил]тетрагидропиран-2-ил]метилацетат)
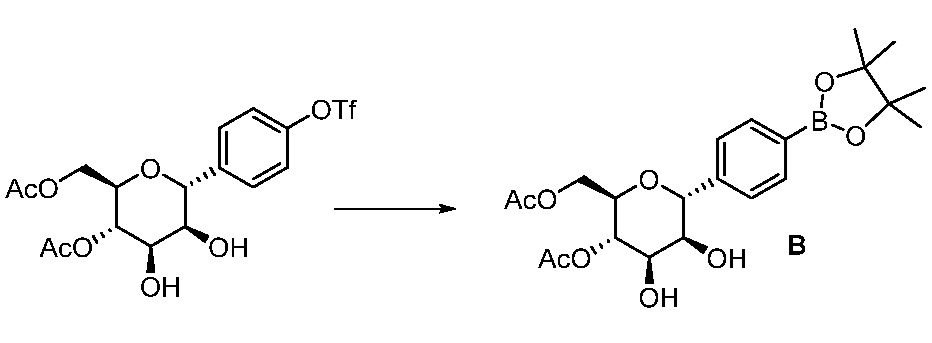
Смесь [(2R,3S,4R,5S,6R)-3-ацетокси-4,5-дигидрокси-6-[4-(трифторметилсульфонилокси)фенил]тетрагидропиран-2-ил]метилацетата (350 мг, 0,74 ммоль), 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолана (225,8 мг, 0,89 ммоль), PdCl2(dppf)·CH2Cl2 (45,18 мг, 0,074 ммоль) и ацетата калия (291 мг, 2,96 ммоль) в ДМФА (3,7 мл) дегазируют барботированием N2 (газообр.) в течение 5 мин. После этого реакционную смесь нагревают до 80°С и выдерживают при указанной температуре в течение 5 часов. Растворитель удаляют в высоком вакууме, сырой продукт растирают с EtOAc (10 мл) и смесь фильтруют. Фильтрат концентрируют и очищают на картридже Biotage™ SNAP (силикагель, 25 г; элюирование с градиентом: EtOAc в гексанах 40%-60%, объемная скорость истечения 24 мл/мин.; в течение 20 мин.) с получением указанного в заголовке соединения (168 мг, 0,3731 ммоль, 50,36%) в виде пены. 1H ЯМР (400 МГц, CD3OD) δ 7,75 (д, J=7,8 Гц, 2H), 7,45 (д, J=7,9 Гц, 2H), 4,96-4,90 (м, 1H), 4,72 (дд, J=12,1, 8,2 Гц, 1H), 4,20-4,02 (м, 2H), 3,93-3,76 (м, 2H), 3,49 (дд, J=14,4, 7,0 Гц, 1H), 2,07 (с, 3H), 2,05 (с, 3H), 1,35 (с, 12H).
ЖХ-МС: m/z=451,3 (М+Н+).
Получение промежуточного соединения C
((2R,3S,4R,5S,6R)-2-(3-Бромфенил)-6-(гидроксиметил)тетрагидро-2Н-пиран-3,4,5-триол)
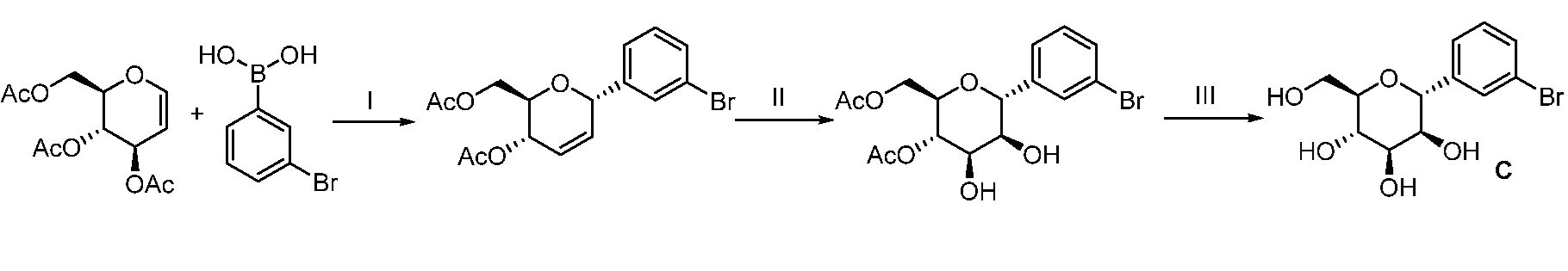
Стадия I: ((2R,3S,6S)-3-Ацетокси-6-(3-бромфенил)-3,6-дигидро-2Н-пиран-2-ил)метилацетат
Раствор [(2R,3S,4R)-3,4-диацетокси-3,4-дигидро-2Н-пиран-2-ил]метилацетата (3,00 г, 11,02 ммоль) и (3-бромфенил)бороновой кислоты (4,43 г, 22,04 ммоль) в CH3CN (22 мл) дегазируют барботированием газообразного азота в течение 3 минут. Добавляют ацетат палладия(II) (371 мг, 1,65 ммоль) и реакционную смесь перемешивают при КТ в течение 5 часов, после чего добавляют еще одну порцию ацетата палладия (II) (371 мг, 1,65 ммоль) и перемешивание продолжают в течение 18 часов. Растворитель выпаривают, и смесь разбавляют дихлорметаном (10 мл) и насыщенным водным раствором NaHCO3 (20 мл). Смесь фильтруют через картридж сепаратора фаз, фильтрат упаривают, и сырой продукт очищают на картридже Biotage™ SNAP (силикагель, 50 г; элюирование с градиентом: EtOAc/гексаны 5%-10%; объемная скорость истечения 40 мл/мин., в течение 30 мин.) с получением указанного в заголовке соединения (1,61 г, 4,36 ммоль, 40%) в виде масла. ЖХ-МС: m/z=391,1, 393,1 (M+Na+).
Стадия II: ((2R,3S,4R,5S,6R)-3-Ацетокси-6-(3-бромфенил)-4,5-дигидрокситетрагидро-2Н-пиран-2-ил)метилацетат
К раствору [(2R,3S,6S)-3-ацетокси-6-(3-бромфенил)-3,6-дигидро-2Н-пиран-2-ил]метилацетата (1,60 г, 4,33 ммоль) в воде (3 мл) и ТГФ (19 мл) добавляют метансульфонамид (618 мг, 6,50 ммоль), тетраоксид осмия (1,3 мл 2,5% масс./об. в t-BuOH, 0,130 ммоль) и N-метилморфолин-N-оксид (2,030 г, 17,33 ммоль) и реакционную смесь перемешивают при КТ в течение 2 дней. После этого добавляют еще одну порцию тетраоксида осмия (1,3 мл 2,5% масс./об. в t-BuOH, 0,130 ммоль), метансульфонамида (618 мг, 6,50 ммоль) и N-метилморфолин-N-оксида (2,030 г, 17,33 ммоль) и смесь перемешивают в течение дополнительных 24 часов. Растворитель выпаривают, сырую смесь разбавляют насыщенным раствором бисульфита натрия (50 мл) и экстрагируют EtOAc (3×15 мл). Объединенные органические экстракты сушат над Na2SO4, и растворитель выпаривают. Полученное гелеобразное вещество растворяют в минимальном количестве МеОН, разбавляют диэтиловым эфиром и помещают в холодильник на 2 часа. Осадок собирают фильтрацией, промывают диэтиловым эфиром и сушат в высоком вакууме, получая указанное в заголовке соединение (1,480 г, 85%) в виде твердого вещества. ЖХ-МС: m/z=425,1, 427,1 (M+Na+).
Стадия III: Промежуточное соединение С
((2R,3S,4R,5S,6R)-3-Ацетокси-6-(3-бромфенил)-4,5-дигидрокситетрагидро-2Н-пиран-2-ил)метилацетат (1,48 г) растворяют в МеОН (20 мл), к раствору добавляют раствор MeONa в MeOH (187 мкл, 25% масс./об., 0,87 ммоль) и реакционную смесь перемешивают при КТ в течение 4 часов. Реакционную смесь нейтрализуют добавлением смолы Amberlite IR120H до достижения нейтрального значения рН. Реакционную смесь фильтруют, фильтрат упаривают, и твердое вещество растирают с Et2O (2×10 мл) с получением указанного в заголовке соединения (1,08 г, 3,046 ммоль, 70,3%) в виде твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,68 (с, 1H), 7,45 (дд, J=10,6, 4,1 Гц, 2H), 7,29 (т, J=7,9 Гц, 1H), 4,91 (д, J=4,7 Гц, 1H), 4,29 (дд, J=4,6, 3,2 Гц, 1H), 3,95-3,71 (м, 3H), 3,61 (дд, J=7,4, 3,1 Гц, 1H), 3,55-3,47 (м, 1H). ЖХ-МС: m/z=341,1, 343,1 (M+Na+).
Получение промежуточного соединения D
3-((2R,3S,4R,5S,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил)бензойная кислота
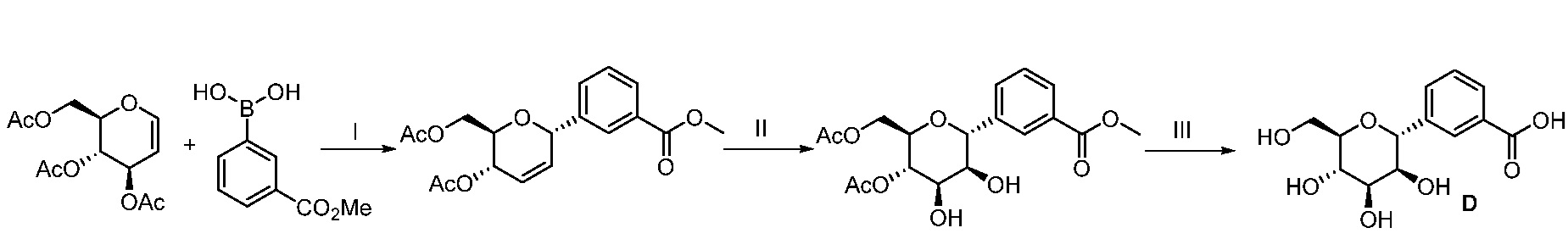
Стадия I: Метил-3-((2S,5S,6R)-5-ацетокси-6-(ацетоксиметил)-5,6-дигидро-2H-пиран-2-ил)бензоат
Метил-3-[(2R,3S,6S)-3-ацетокси-2-(ацетоксиметил)-3,6-дигидро-2H-пиран-6-ил]бензоат получают в соответствии с методикой, описанной в стадии I примера получения промежуточного соединения C, но с использованием (3-метоксикарбонилфенил)бороновой кислоты в качестве исходного вещества. ЖХ-МС: m/z=371,2 (M+Na+).
Стадия II: Метил-3-((2R,3S,4R,5S,6R)-5-ацетокси-6-(ацетоксиметил)-3,4-дигидрокситетрагидро-2Н-пиран-2-ил)бензоат
Метил-3-[(2R,3S,4R,5S,6R)-5-ацетокси-6-(ацетоксиметил)-3,4-дигидрокситетрагидропиран-2-ил]бензоат получают в соответствии с методикой, описанной в стадии II получения промежуточного соединения C. ЖХ-МС: m/z=383,3 (М+Н+).
Стадия III: Промежуточное соединение D
Смесь метил-3-[(2R,3S,4R,5S,6R)-5-ацетокси-6-(ацетоксиметил)-3,4-дигидрокситетрагидропиран-2-ил]бензоата (2,20 г, 5,75 ммоль) в МеОН (30 мл) обрабатывают раствором MeONa в MeOH (341 мкл, 25% масс./об., 1,58 ммоль), и реакционную смесь перемешивают при КТ в течение 18 часов. Летучие вещества выпаривают, смесь растворяют в МеОН (30 мл), добавляют водный раствор гидроксида натрия (5,1 мл 2М, 10,3 ммоль), и реакционную смесь перемешивают при КТ в течение 15 часов. Смесь нейтрализуют добавлением смолы Amberlite IR120H до достижения нейтрального значения рН. Реакционную смесь фильтруют, и фильтрат упаривают с получением указанного в заголовке соединения (1,57 г, 66%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,15 (с, 1H), 7,96 (д, J=7,7 Гц, 1H), 7,75 (д, J=7,7 Гц, 1H), 7,51 (т, J=7,8 Гц, 1H), 4,99 (д, J=4,4 Гц, 1H), 4,42-4,36 (м, 1H), 3,93-3,74 (м, 3H), 3,63 (дд, J=7,5, 3,1 Гц, 1H), 3,54-3,49 (м, 1H). ЖХ-МС: m/z=285,2 (М+Н+).
Получение промежуточного соединения Е
((2R,3R,4R,5R,6R)-2-(Ацетоксиметил)-6-(3-гидроксифенил)тетрагидро-2Н-пиран-3,4,5-триилтриацетат)
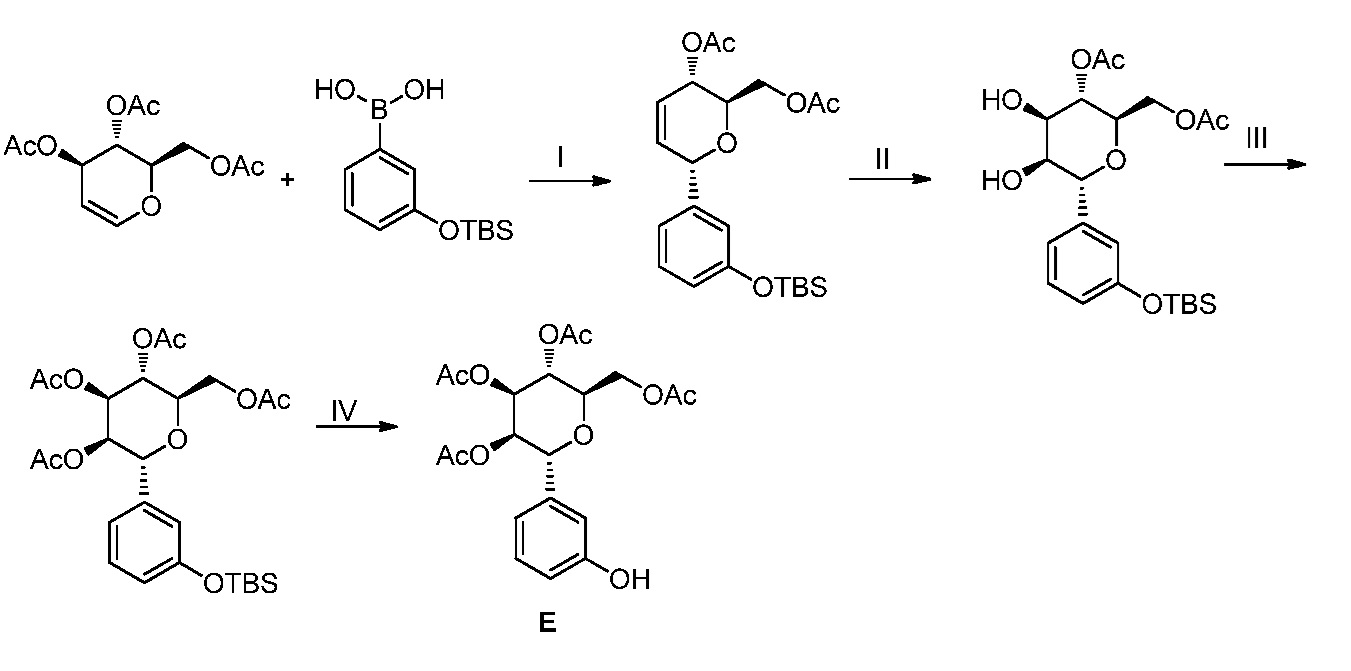
Стадия I: [(2R,3S,6S)-3-Ацетокси-6-[3-[трет-бутил(диметил)силил]оксифенил]-3,6-дигидро-2Н-пиран-2-ил]метилацетат
К раствору [(2R,3S,4R)-3,4-диацетокси-3,4-дигидро-2Н-пиран-2-ил]метилацетата (1,100 г, 4,040 ммоль) в 10 мл CH3CN добавляют [3-(трет-бутилдиметилсилил)оксифенил]бороновую кислоту (2,038 г, 8,080 ммоль) и Pd(OAc)2 (136,1 мг, 0,6060 ммоль). Смесь перемешивают при КТ в течение 5 часов, после чего к смеси добавляют еще одну порцию Pd(OAc)2 (136 мг, 0,606 ммоль) и [3-(трет-бутилдиметилсилил)оксифенил]бороновой кислоты (2,038 г, 8,080 ммоль). Смесь перемешивают при КТ в течение ночи. Смесь разбавляют 20 мл CH2Cl2 и фильтруют через слой целита. Фильтрат концентрируют, и остаток очищают на картридже Biotage™ SNAP (силикагель, 100 г, элюирование с градиентом: EtOAc/гексаны 0-20%, 20 CV) с получением указанного в заголовке соединения (805 мг, 47%) в виде масла, которое затвердевает на воздухе. 1H ЯМР (CDCl3, 400 МГц): 7,06 (м, 1H), 6,78 (м, 1H), 6,70 (м, 1H), 6,60 (м, 1H), 5,97 (м, 1H), 5,71 (м, 1H), 5,09 (м, 2H), 4,08 (м, 1H), 3,85 (м, 1H), 3,62 (м, 1H), 1,88 и 1,87 (2с, 6H), 0,78 (м, 9H), 0,00 (м, 6H).
Стадия II: [(2R,3S,4R,5S,6R)-3-Ацетокси-6-[3-[трет-бутил(диметил)силил]оксифенил]-4,5-дигидрокситетрагидропиран-2-ил]метилацетат
К раствору [(2R,3S,6S)-3-ацетокси-6-[3-[трет-бутил(диметил)силил]оксифенил]-3,6-дигидро-2Н-пиран-2-ил]метилацетата (2,500 г, 5,944 ммоль) в смеси вода (10 мл)/t-BuOH (10 мл) добавляют метансульфонамид (848,0 мг, 8,92 ммоль), 2,5% OsO4/BuOH (1,9 мл, 0,149 ммоль), NMO (1,393 г, 11,89 ммоль) и лутидин (689 мкл, 5,94 ммоль). Смесь перемешивают при КТ в течение ночи. Смесь гасят 15%-ным раствором бисульфита натрия (15 мл) и разбавляют EtOAc (40 мл). Водную фазу отделяют, промывают последовательно водой (20 мл) и насыщенным раствором соли (20 мл) и сушат над Na2SO4. После удаления растворителя при пониженном давлении остаток очищают на картридже Biotage™ SNAP (силикагель, 100 г, элюирование с градиентом: МеОН в CH2Cl2 0-6%, 20 CV), получая указанное в заголовке соединение (2,20 г, 81%) в виде масла. 1H ЯМР (CD3OD, 400 МГц): 7,06 (м, 1H), 6,78 (м, 1H), 6,70 (м, 1H), 6,58 (м, 1H), 4,85 (м, 1H), 4,64 (м, 1H), 4,46 (м, 1H), 3,96 (м, 1H), 3,85 (м, 1H), 3,62 (м, 2H), 1,86 и 1,83 (2с, 6H), 0,78 (м, 9H), 0,00 (м, 6H).
Стадия III: (2R,3R,4R,5R,6R)-2-(Ацетоксиметил)-6-(3-((трет-бутилдиметилсилил)окси)фенил)тетрагидро-2H-пиран-3,4,5-тритилтриацетат
К раствору [(2R,3S,4R,5S,6R)-3-ацетокси-6-[3-[трет-бутил(диметил)силил]оксифенил]-4,5-дигидрокситетрагидропиран-2-ил]метилацетата (1,00 г, 2,20 ммоль) в метиленхлориде (20 мл) при 0°C в атмосфере N2 добавляют 2,6-лутидин (872 мкл, 6,60 ммоль) с последующим добавлением DMAP (53,8 мг, 0,44 ммоль) и уксусного ангидрида (623 мкл, 6,60 ммоль). Полученный раствор желтого цвета перемешивают при 0°С в течение 1,5 часов. ТСХ (30% EtOAc/гексаны) показывает полное расходование исходного вещества. Реакционную смесь обрабатывают KHSO4 (15%, 2×6 мл), затем промывают насыщенным раствором соли, сушат и упаривают. Сырой продукт очищают на картридже Biotage™ SNAP (силикагель, 100 г; элюирование с градиентом: EtOAc/гексаны 0-5%, 3 объема колонки; 5-30%, 20 CV) с получением указанного в заголовке соединения (1,02 г) в виде прозрачной смолы.
Стадия IV: Промежуточное соединение Е
К раствору [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[3-[трет-бутил(диметил)силил]оксифенил]тетрагидропиран-2-ил]метилацетата (1,02 г, 1,799 ммоль) в ТГФ (10 мл) добавляют уксусную кислоту (162,0 мг, 153 мкл, 2,698 ммоль) и TBAF (5,4 мл, 1М, 5,397 ммоль). Смесь перемешивают при КТ в течение 30 минут. Затем разбавляют EtOAc (30 мл), промывают водой (20 мл) и насыщенным раствором соли (20 мл), сушат над сульфатом натрия и концентрируют. Сырой продукт очищают на колонке Biotage™ SNAP (силикагель, 25 г; элюирование с градиентом: EtOAc в гексанах, 5%, 5 CV; 5-30%, 25 CV; 30-40% 5 CV; 40-50%, 30 CV) с получением указанного в заголовке соединения (409 мг, 48,35%) в виде белой пены. 1H ЯМР (400 МГц, CD3OD) δ 7,23 (т, 1H), 6,92 (дд, 2H), 6,76 (дд, 1H), 5,86 (т, 1H), 5,24 (т, 1H), 5,10 (дд, 1H), 5,01 (д, 1H), 4,37 (дд, 1H), 4,13 (дд, 1H), 3,86-3,66 (м, 1H), 2,08 (д, 6H), 2,02 (д, 6H).
Получение промежуточного соединения F
((2R,3R,4R,5R,6R)-2-(Ацетоксиметил)-6-(4-этинилфенил)тетрагидро-2Н-пиран-3,4,5-триилтриацетат)
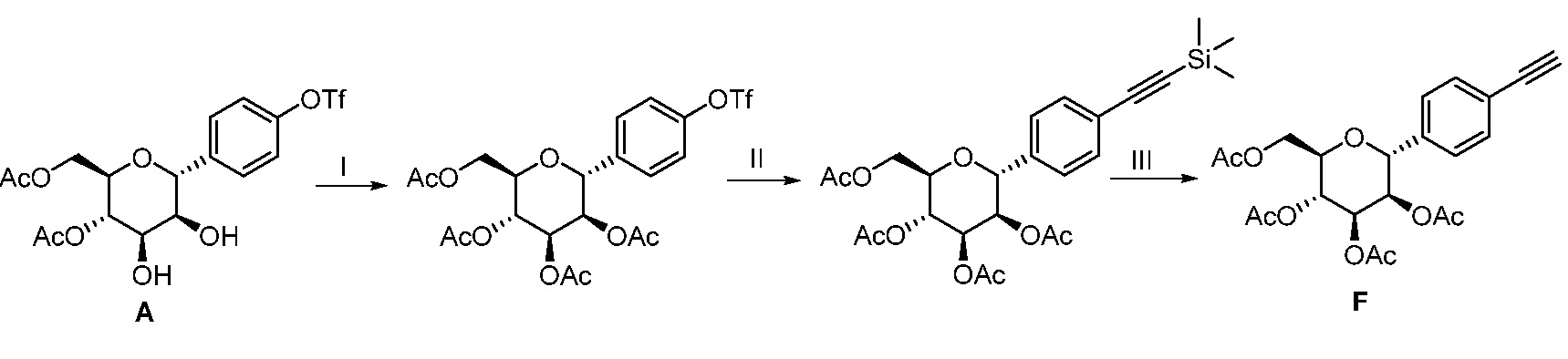
Стадия I: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[4-(трифторметилсульфонилокси)фенил]тетрагидропиран-2-ил]метилацетат
К раствору [(2R,3S,4R,5S,6R)-3-ацетокси-4,5-дигидрокси-6-[4-(трифторметилсульфонилокси)фенил]тетрагидропиран-2-ил]метилацетата (256 мг, 0,542 ммоль) в 2,6 мл CH2Cl2 последовательно добавляют пиридин (132 мкл, 1,63 ммоль), Ас2О (128 мкл, 1,36 ммоль) и DMAP (6,6 мг, 0,054 ммоль). Реакционную смесь перемешивают при КТ в течение 2 часов, разбавляют водой (1 мл), органический слой сушат над Na2SO4, фильтруют и упаривают досуха. Остаток очищают колоночной флэш-хроматографией на силикагеле (элюирование с градиентом: EtOAc в гексанах от 10 до 80%) с получением указанного в заголовке соединения (232 мг, 77%).
Стадия II: [(2R,3R,4R,5R,6R)-2-(Ацетоксиметил)-6-[4-((триметилсилил)этинил)фенил]тетрагидро-2Н-пиран-3,4,5-триилацетат
К смеси [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[4-(трифторметилсульфонилокси)фенил]тетрагидропиран-2-ил]метилацетата (1217 мг, 2,187 ммоль), Pd(dppf)Cl2-CH2Cl2 (178,6 мг, 0,2187 ммоль) и CuI (83,3 мг, 0,437 ммоль) в 12 мл ДМФА добавляют Et3N (1,5 мл, 11 ммоль) с последующим добавлением этинил(триметил)силана (1,54 мл, 10,9 ммоль). Реакционную смесь нагревают до 70°С в герметично закрытой пробирке и выдерживают при указанной температуре в течение 21 часов, затем охлаждают до КТ и разбавляют водой (40 мл). Реакционную смесь экстрагируют EtOAc (5×20 мл), объединенный органический слой промывают водой (3×10 мл), насыщенным раствором соли (10 мл), сушат над Na2SO4, фильтруют и упаривают досуха. Остаток очищают колоночной флэш-хроматографией на силикагеле (элюирование с градиентом: EtOAc в гексанах от 10 до 80%) с получением указанного в заголовке соединения (1,0596 г, 96%).
Стадия III: Промежуточное соединение F
К раствору [(2R,3R,4R,5R,6R)-2-(ацетоксиметил)-6-(4-((триметилсилил]этинил)фенил]тетрагидро-2Н-пиран-3,4,5-триилтриацетата (1,054 г, 2,089 ммоль) в 21 мл ТГФ последовательно добавляют АсОН (150,6 мг, 143 мкл, 2,507 ммоль) и раствор TBAF в ТГФ (2,298 мл, 1М, 2,298 ммоль) в атмосфере азота. Реакционную смесь перемешивают при КТ в течение 2 часов и упаривают досуха. Остаток очищают колоночной флэш-хроматографией на силикагеле (элюирование с градиентом: EtOAc в гексанах, от 10 до 80%) с получением указанного в заголовке соединения (892 мг, 99%).
Получение промежуточного соединения G
((2R,3R,4R,5R,6R)-3,4,5-Трибензилокси-2-(бензилоксиметил)-6-этинилтетрагидропиран)
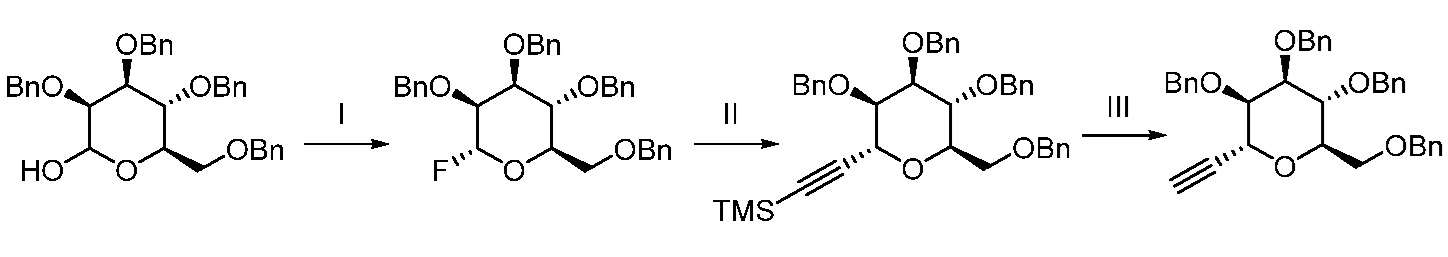
Стадия I: (2R,3R,4S,5S,6R)-3,4,5-Трибензилокси-2-(бензилоксиметил)-6-фтортетрагидропиран
К раствору (3S,4S,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ола (10,8 г, 19,98 ммоль) и тетрафторбората (диэтиламино)дифторсульфония (7,075 г, 29,97 ммоль) в 50 мл CH2Cl2 добавляют DBU (4,8 мл, 32,1 ммоль) при -15°С и полученную смесь перемешивают в течение 20 минут. Реакцию гасят насыщенным раствором бикарбоната натрия. Смесь экстрагируют CH2Cl2 (3×20 мл). Объединенные органические экстракты промывают последовательно водой и насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и упаривают досуха. Остаток очищают на картридже Biotage™ SNAP (силикагель, 100 г; элюирование с градиентом: EtOAc в гексанах 0-15%, 20 CV) с получением основной фракции, содержащей указанное в заголовке соединение (6,40 г). ЖХ-МС: m/z=565,4 (M+Na+).
Стадия II Триметил-[2-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]этинил]силан
К раствору (2R,3R,4S,5S,6R)-3,4,5-трибензилокси-2-(бензилоксиметил)-6-фтортетрагидропирана (1120 мг, 2,064 ммоль) и трифтор-(2-триметилсилилэтинил)боргидрида (ион калия(I)) (547,6 мг, 2,683 ммоль) в CH3CN (15 мл) добавляют BF3·OEt2 (351,6 мг, 306 мкл, 2,48 ммоль) при -10°С и смесь перемешивают в атмосфере азота в течение 20 минут при указанной температуре. Затем смесь разбавляют EtOAc (30 мл), гасят насыщенным раствором бикарбоната натрия, промывают последовательно водой и насыщенным раствором соли, сушат над сульфатом натрия и упаривают досуха. Остаток очищают на картридже Biotage™ SNAP (силикагель, 50 г; элюирование с градиентом: EtOAc в гексанах, 0-15% 20 CV) с получением указанного в заголовке продукта (1,06 г) в виде масла.
Стадия III: Промежуточное соединение G
К раствору триметил-[2-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]этинил]силана (550 мг, 1,0 ммоль) в ТГФ (10 мл) добавляют 1М раствор TBAF в ТГФ (1М раствор, 1,5 мл, 1,500 ммоль). Смесь перемешивают при КТ в течение 20 минут. Затем смесь разбавляют EtOAc (30 мл), последовательно промывают водой и насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и упаривают досуха. Остаток разделяют на картридже Biotage™ SNAP (силикагель, 25 г; элюирование с градиентом: EtOAc в гексанах, 0-15%, 20 CV) с получением (2R,3R,4R,5R,6R)-3,4,5-трибензилокси-2-(бензилоксиметил)-6-этинилтетрагидропирана (450 мг) в виде масла. 1H ЯМР (400 МГц, CDCl3) δ 7,44-7,20 (м, 18H), 7,19-7,11 (м, 2H), 4,87 (д, 1H), 4,81 (т, 1H), 4,74 (д, 1H), 4,58 (м, 6H), 4,09-3,91 (м, 3H), 3,85-3,68 (м, 3H), 2,49 (д, 1H).
Получение промежуточного соединения H
([(2R,3R,4R,5R,6R)-3-Триацетокси-6-аллилтетрагидропиран-2-ил]метилацетат)
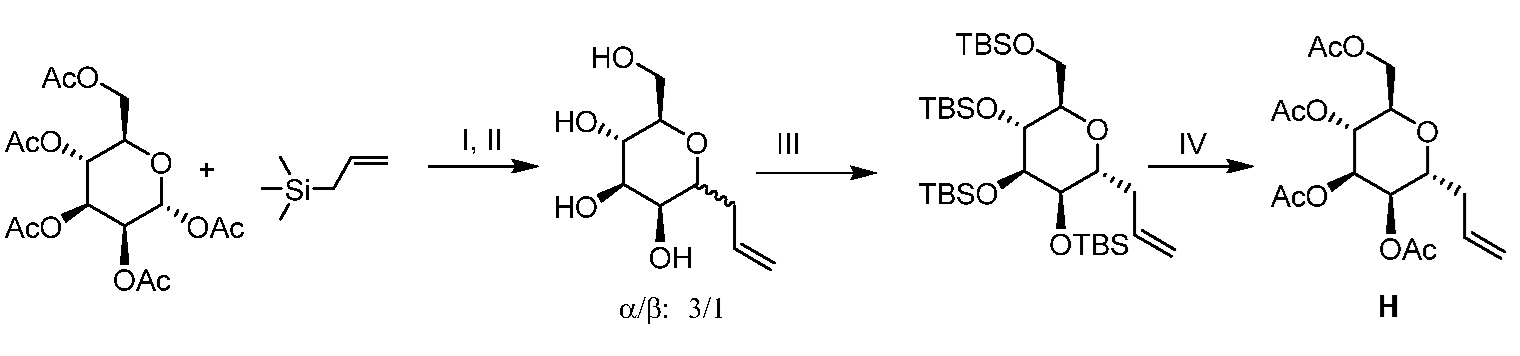
Стадия I: (2R,3R,4R,5R)-2-(Ацетоксиметил)-6-аллилтетрагидро-2Н-пиран-3,4,5-триилтриацетат
К раствору [(2R,3R,4S,5S,6R)-3,4,5,6-тетраацетокситетрагидропиран-2-ил]метилацетата (5 г, 12,81 ммоль) и аллилтриметилсилана (6,1 мл, 38,43 ммоль) в CH3CN (30 мл) при перемешивании добавляют BF3·EtO2 (эфир (1)) (8,12 мл, 64,05 ммоль) при 0°С. Смесь перемешивают при КТ в течение 2 дней, выливают в насыщенный раствор NaHCO3 и перемешивают до прекращения выделения пузырьков газа. После этого смесь экстрагируют CH2Cl2. Объединенные органические экстракты промывают последовательно водой и насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и упаривают досуха. Остаток очищают на картридже Biotage™ SNAP (силикагель, 100 г; элюирование с градиентом: EtOAc в гексанах, 0-50%, 20 CV) с получением указанного в заголовке продукта (2,2 г, 46%), который содержит α/β ~3:1. 1H ЯМР (400 МГц, CDCl3) δ 5,76 (ддт, 1H), 5,40-4,97 (м, 5H), 4,28 (ддд, 1H), 4,21-3,96 (м, 2H), 3,96-3,81 (м, 1H), 2,57-2,33 (м, 2H), 2,18-1,94 (м, 12H).
Стадия II: (3S,4R,5S,6R)-2-Аллил-6-(гидроксиметил)тетрагидро-2Н-пиран-3,4,5-триол
К раствору (2R,3R,4R,5R)-2-(ацетоксиметил)-6-аллилтетрагидро-2Н-пиран-3,4,5-триилтриацетата (3,9 г, 10,47 ммоль) в МеОН (22,5 мл) добавляют раствор MeONa в MeOH (25% мас./об., 241 мкл, 1,047 ммоль). Смесь перемешивают при КТ в течение ночи, нейтрализуют смолой Amberlite 120 (H). Смесь фильтруют, фильтрат упаривают досуха, остаток разделяют на картридже Biotage™ SNAP (силикагель, 50 г; элюирование с градиентом: МеОН в CH2Cl2, 0-20%, 24 CV) с получением указанного в заголовке продукта (1,9 г, 89%) 1H ЯМР (400 МГц, CD3OD) δ 5,95-5,69 (м, 1H), 5,08 (ддд, 2H), 3,94-3,81 (м, 1H), 3,81-3,54 (м, 5H), 3,50-3,37 (м, 1H), 2,53-2,40 (м, 1H), 2,34 (дкв.,1H).
Стадия III: [(2R,3R,4R,5R,6R)-2-Аллил-3,5-бис[[трет-бутил(диметил)силил]окси]-6-[[трет-бутил(диметил)силил]оксиметил]тетрагидропиран-4-ил]окси-трет-бутилдиметилсилан
К (3S,4R,5S,6R)-2-аллил-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триолу (1,9 г, 9,30 ммоль) в CH2Cl2 (90 мл) добавляют DIPEA (8,10 мл, 46,52 ммоль) с последующим добавлением TBДMCOTf (9,40 мл, 40,94 ммоль). Реакционную смесь перемешивают при КТ в течение ночи, затем разбавляют CH2Cl2, промывают насыщенным раствором CuSO4, H2O и насыщенным раствором соли. Органическую фазу сушат над Na2SO4, фильтруют и сушат. Сырой остаток очищают на картридже Biotage™ SNAP (силикагель, 100 г; элюирование с градиентом: EtOAc в гексанах, 0-2%, 24 CV) с получением указанного в заголовке соединения (4 г, 65%). 1H ЯМР(400 МГц, CDCl3) δ 5,89 (тт, 1H), 5,18-4,83 (м, 2H), 3,98-3,82 (м, 2H), 3,82-3,67 (м, 4H), 3,63 (т, 1H), 2,46 (дд, 1H), 2,00 (д, 1H), 1,10-0,66 (м, 36H), 0,28-0,28 (м, 24H).
Стадия IV: Промежуточное соединение Н
К раствору [(2R,3R,4R,5R,6R)-2-аллил-3,5-бис[[трет-бутил(диметил)силил]окси]-6-[[трет-бутил(диметил)силил]оксиметил]тетрагидропиран-4-ил]окси-трет-бутилдиметилсилана (4 г, 6,05 ммоль) в сухом ДМСО (35 мл) в атмосфере N2 добавляют раствор TBAF в ТГФ (1М, 26,6 мл, 26,62 ммоль) и полученную смесь перемешивают в течение 3 часов при 60°С. Реакционную смесь охлаждают до КТ, добавляют пиридин (5,38 мл, 66,54 ммоль), уксусный ангидрид (5,7 мл, 60,49 ммоль) и каталитическое количество диметиламинопиридина (36,4 мг, 0,30 ммоль) и перемешивание продолжают в течение 20 часов. Реакционную смесь медленно выливают в смесь лед/вода и экстрагируют этилацетатом. Органический слой тщательно промывают насыщенным раствором NaHCO3, H2O и насыщенным раствором соли. Органическую фазу сушат над Na2SO4, фильтруют и сушат с получением указанного в заголовке соединения (2,00 г, 89%). 1H ЯМР (400 МГц, CDCl3) δ 5,76 (ддт, 1H), 5,35-4,99 (м, 5H), 4,31 (дд, 1H), 4,20-3,94 (м, 2H), 3,94-3,71 (м, 1H), 2,60-2,48 (м, 1H), 2,47-2,29 (м, 1H), 2,23-1,91 (м, 12H).
Получение промежуточного соединения I
([(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-(3-бромфенил)тетрагидропиран-2-ил]метилацетат
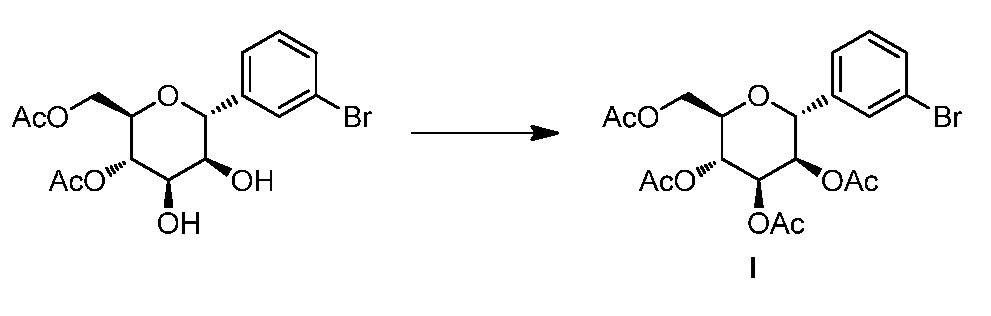
К раствору [(2R,3S,4R,5S,6R)-3-ацетокси-6-(3-бромфенил)-4,5-дигидрокситетрагидропиран-2-ил]метилацетата (604,8 мг, 1,5 ммоль) в ТГФ (10 мл) добавляют DIPEA (969,3 мг, 1,31 мл, 7,50 ммоль), DMAP (18,3 мг, 0,150 ммоль) и Ac2O (536,0 мг, 495 мкл, 5,25 ммоль) при 0°С. Смесь перемешивают при КТ в течение ночи. После этого смесь гасят насыщенным раствором бикарбоната натрия. Смесь экстрагируют CH2Cl2 (3×15 мл). Объединенные органические экстракты промывают последовательно водой и насыщенным раствором соли, сушат над сульфатом натрия, фильтруют и упаривают досуха. Остаток разделяют на картридже Biotage™ SNAP (силикагель, 25 г; элюирование с градиентом: EtOAc в гексанах, 0-30%, 20 CV) с получением указанного в заголовке соединения (650 мг, 1,334 ммоль, 88,9%). 1H ЯМР (400 МГц, CDCl3) δ 7,66 (с, 1H), 7,55-7,45 (м, 1H), 7,41 (дд, 1H), 7,29 (т, 1H), 5,87 (т, 1H), 5,28 (т, 1H), 5,10 (дд, 1H), 5,04 (д, 1H), 4,36 (дд, 1H), 4,14 (дд, 1H), 3,86-3,66 (м, 1H), 2,13 (2с, 6H), 2,05 (с, 3H), 2,02 (с, 3H).
Получение промежуточного соединения J
(2-[(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]уксусная кислота)
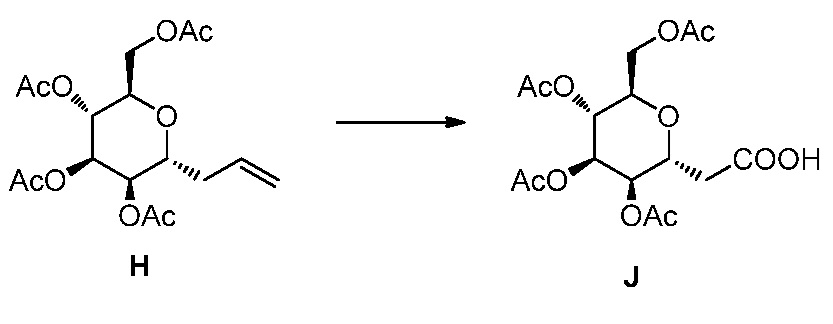
К раствору промежуточного соединения Н (220 мг, 0,590 ммоль) в смеси CH3CN (1,1 мл)/CCl4 (1,9 мл)/H2O (1,9 мл) добавляют NaIO4 (147,1 мкл, 2,66 ммоль) с последующим добавлением Cl3Ru (вода (1)) (53,27 мг, 0,234 ммоль). Реакционную смесь перемешивают при КТ в течение 4 часов, разбавляют водой и CH2Cl2, фильтруют через целит, промывают CH2Cl2. Водную фазу экстрагируют CH2Cl2 (×2). Объединенные органические фазы сушат над Na2SO4, фильтруют и концентрируют с получением указанного в заголовке соединения (110 мг, 74%), которое используют в следующей стадии без дополнительной очистки. ЖХ-МС: m/z=391,3 (М+Н+).
Получение промежуточного соединения K
((2R,3S,4R,5S,6R)-2-(3-Этинилфенил)-6-(гидроксиметил)тетрагидропиран-3,4,5-триол)
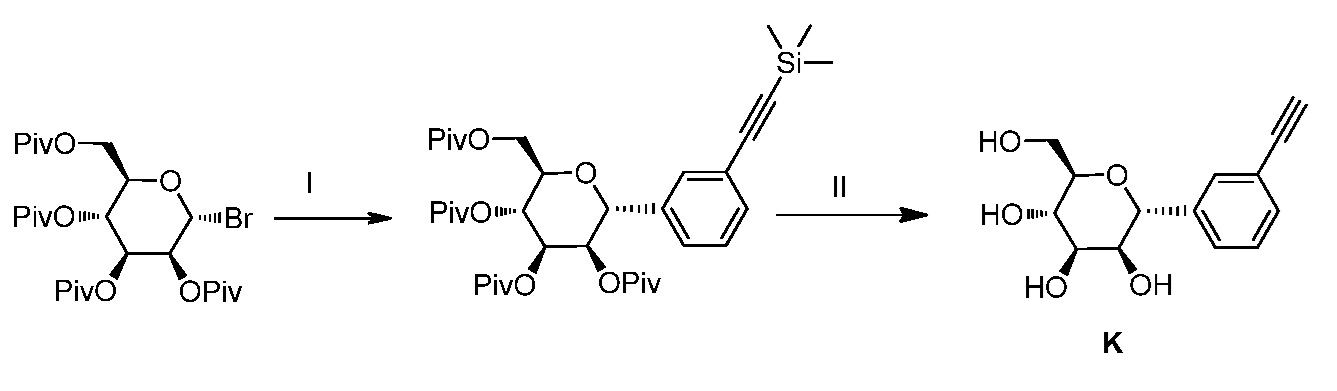
Стадия I: [(2R,3S,4R,5S,6R)-3,4,5-Трис(2,2-диметилпропаноилокси)-6-[3-(2-триметилсилилэтинил)фенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноат
Раствор n-Bu3MgLi (2,65 мл, 0,65 М, 1,725 ммоль) в смеси гексаны-гептан-дибутилэфир (8:20:3) добавляют к 2-(3-бромфенил)этинилтриметилсилану (1,248 г, 1,05 мл, 4,928 ммоль) в толуоле (2,4 мл) и дибутиловом эфире (1,4 мл) при 0°С и перемешивают в холодном помещении в течение 25 часов. К смеси по каплям добавляют раствор ZnBr2-LiBr в дибутиловом эфире (2,6 мл, 1,05 М, 2,711 ммоль), охлаждающую баню удаляют, смесь перемешивают при КТ в течение 1 часа. К смеси добавляют раствор [(2R,3R,4S,5S,6R)-6-бром-3,4,5-трис(2,2-диметилпропаноилокси)тетрагидропиран-2-ил]метил-2,2-диметилпропаноата (2,38 г, 4,107 ммоль) в толуоле (4,3 мл), смесь помещают на масляную баню, предварительно нагретую до 90°С, и выдерживают в указанных условиях в течение уик-энда. Реакционную смесь охлаждают до КТ, выливают в водный 1н раствор HCl (40 мл) и экстрагируют EtOAc (3×40 мл). Объединенные экстракты промывают насыщенным раствором соли, сушат (Na2SO4), концентрируют, очищают на картридже Biotage™ SNAP (силикагель, 100 г; элюирование с градиентом: EtOAc в гексанах, 0%-10% 12 CV; 10% 5 CV) с получением указанного в заголовке соединения (765 мг) в виде масла.
Стадия II: Промежуточное соединение K
К суспензии [(2R,3R,4R,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-[3-(2-триметилсилилэтинил)фенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноата (765 мг, 1,137 ммоль) в МеОН (15 мл) при перемешивании добавляют MeONa (0,5 М, 4,6 мл, 2,274 ммоль) и полученную смесь перемешивают при КТ в течение 24 часов. К полученному раствору добавляют Dowex 50WX4-400 до достижения рН значения 4-5, затем фильтруют и элюируют MeOH. Фильтрат концентрируют, остаток очищают на картридже Biotage™ SNAP (силикагель, 40 г; элюирование с градиентом: EtOAc-MeOH-H2O от 47,5:1,5:1 до 10:1,5:1) с получением указанного в заголовке соединения (170 мг, 55%) в виде твердого вещества бежевого цвета. ЖХ-МС: m/z=265,28 (М+Н+).
Получение промежуточного соединения L
[(2R,3R,4R,5R,6R)-3,4,5-Трис(триизопропилсилилокси)-6-(2-триметилсилилэтинил)тетрагидропиран-2-ил]метанол
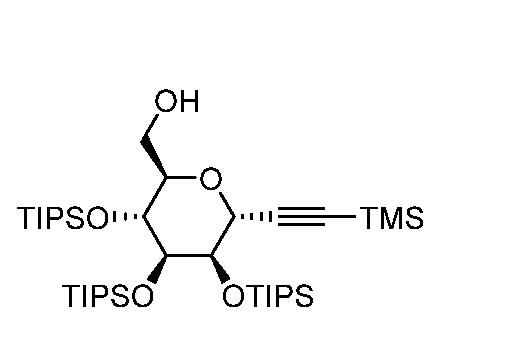
Промежуточное соединение L получают в соответствии с методикой, описанной в Jurgen Stichler-Bonaparte et al. Helv. Chim. Acta. 2001, 84(8), 2355-2367.
Получение промежуточного соединения М
(2R,3S,4R,5S,6R)-2-Этинил-6-(гидроксиметил)тетрагидропиран-3,4,5-триол
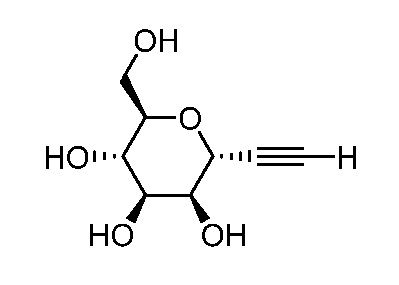
Промежуточное соединение М получают в соответствии с методикой, описанной в Jurgen Stichler-Bonaparte et al. Helv. Chim. Acta. 2001, 84(8), 2355-2367.
Получение промежуточного соединения N
[(2R,3R,4R,5R,6R)-6-(4-Бромфенил)-3,4,5-трис(2,2-диметилпропаноилокси)тетрагидропиран-2-ил]метил-2,2-диметилпропаноат
Раствор n-Bu3MgLi (2,20 мл, 0,66 М, 1,45 ммоль) в смеси гексан-гептан-дибутиловый эфир (8:20:3) добавляют к 1-бром-4-йодбензолу (1,172 г, 4,141 ммоль) в толуоле (2,0 мл) и дибутиловом эфире (1,2 мл) при 0°С. Смесь перемешивают при указанной температуре в течение 3,5 часов, затем по каплям добавляют раствор ZnBr2-LiBr в дибутиловом эфире (2,17 мл, 1,05 М, 2,28 ммоль). Охлаждающую баню удаляют и смесь перемешивают при КТ в течение 1 часа, после чего добавляют раствор [(2R,3R,4S,5S,6R)-6-бром-3,4,5-трис(2,2-диметилпропаноилокси)тетрагидропиран-2-ил]метил-2,2-диметилпропаноата (2,00 г, 3,45 ммоль) в толуоле (3,60 мл). Полученную смесь помещают на масляную баню, предварительно нагретую до 90°С, и выдерживают при указанной температуре в течение 4 часов (ТСХ показывает наличие большого количества исходного сырья), поэтому перемешивание продолжают при 100°С в течение 22 часов. Полученную смесь охлаждают до комнатной температуры, выливают в водный 1н раствор HCl (40 мл) и экстрагируют этилацетатом (3×25 мл). Объединенные органические экстракты промывают насыщенным раствором соли, сушат над Na2SO4, концентрируют, остаток очищают на картридже Biotage™ SNAP (силикагель, 100 г; элюирование с градиентом: EtOAc в гексанах, 0%-15%, 8 CV) с получением указанного в заголовке соединения (1,00 г, 44%) (см. Sebastien Lemaire et al. Org. Letts. 2012, 14, 1480-1483).
Получение промежуточного соединения O:
(2R,3R,4R,5R,6R)-2-(Ацетоксиметил)-6-(3-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)фенил)тетрагидро-2H-пиран-3,4,5-триилтриацетат
Промежуточное соединение I (6,640 г, 13,63 ммоль) растворяют в ДМФА (100 мл) и смесь дегазируют 3 раза, создавая вакуум и заполняя реактор N2. К раствору добавляют 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (5,191 г, 20,44 ммоль), KОАс (5,351 г, 54,52 ммоль) и Pd(dppf)·CH2Cl2 (1,113 г, 1,363 ммоль), смесь нагревают до 60°С и выдерживают при указанной температуре в течение 24 часов. Полученную смесь охлаждают до КТ и фильтруют через целит. Фракцию ДМФА промывают гексанами (3×100 мл) и разбавляют этилацетатом (300 мл). Органический слой промывают 100 мл водного раствора NH4Cl (20%), водой (2×100 мл), насыщенным раствором соли, сушат над Na2SO4 и затем упаривают досуха. Остаток очищают на картридже Biotage™ SNAP (силикагель, 340 г; элюирование с градиентом: EtOAc в гексанах, 7-60%) с получением указанного в заголовке соединения, загрязненного диоксабороланом. Остаток растирают в гептане при температуре 0°С, образующееся масло выделяют декантацией и, наконец, сушат в вакууме с получением указанного в заголовке соединения в виде бесцветного масла (7,512 г). ЖХ-МС: m/z=557,4 (M+Na+).
Получение промежуточного соединения P:
((2R,3R,4R,5R,6R)-6-Этинил-3,4,5-трис((триизопропилсилил)окси)тетрагидро-2Н-пиран-2-ил)метанола
К раствору промежуточного соединения L (1,02 г, 1,40 ммоль) в МеОН (10 мл) добавляют K2CO3 (386 мг, 2,80 ммоль). После перемешивания в течение 1 часа реакционную массу обрабатывают предварительно промытой смолой Dowex 50WX4-400, смесь фильтруют и промывают порциями МеОН. Объединенные фильтраты концентрируют с получением бесцветной смолы, которую очищают флэш-хроматографией на картридже Biotage™ SNAP (25 г; элюирование с градиентом: EtOAc в гексанах, 0-20%). Объединенные фракции концентрируют с получением указанного в заголовке соединения в виде бесцветного масла (878 мг, выход 96%).
Получение промежуточного соединения Q:
(2R,3R,4R,5R,6R)-2-(4-Бром-2-метилфенил)-6-((пивалоилокси)метил)тетрагидро-2Н-пиран-3,4,5-триил-трис(2,2-диметилпропаноат)
Промежуточное соединение Q получают в соответствии с методикой, описанной для получения промежуточного соединения N, но с использованием 4-бром-1-йод-2-метилбензола в качестве исходного вещества.
Получение промежуточного соединения R:
(2R,3R,4R,5R,6R)-2-(2-Метил-4-(4,4,5,5-тетраметил-1,3,2-диоксоборолан-2-ил)фенил)-6-((пивалоилокси)метил)тетрагидро-2H-пиран-3,4,5-триил-трис(2,2-диметилпропаноат)
Помежуточное соединение R получают в соответствии с методикой, описанной для получения промежуточного соединения O, но используя промежуточное соединение Q в качестве исходного вещества.
Ниже представлены основные промежуточные соединения, которые используют при получении соединений по настоящему изобретению:
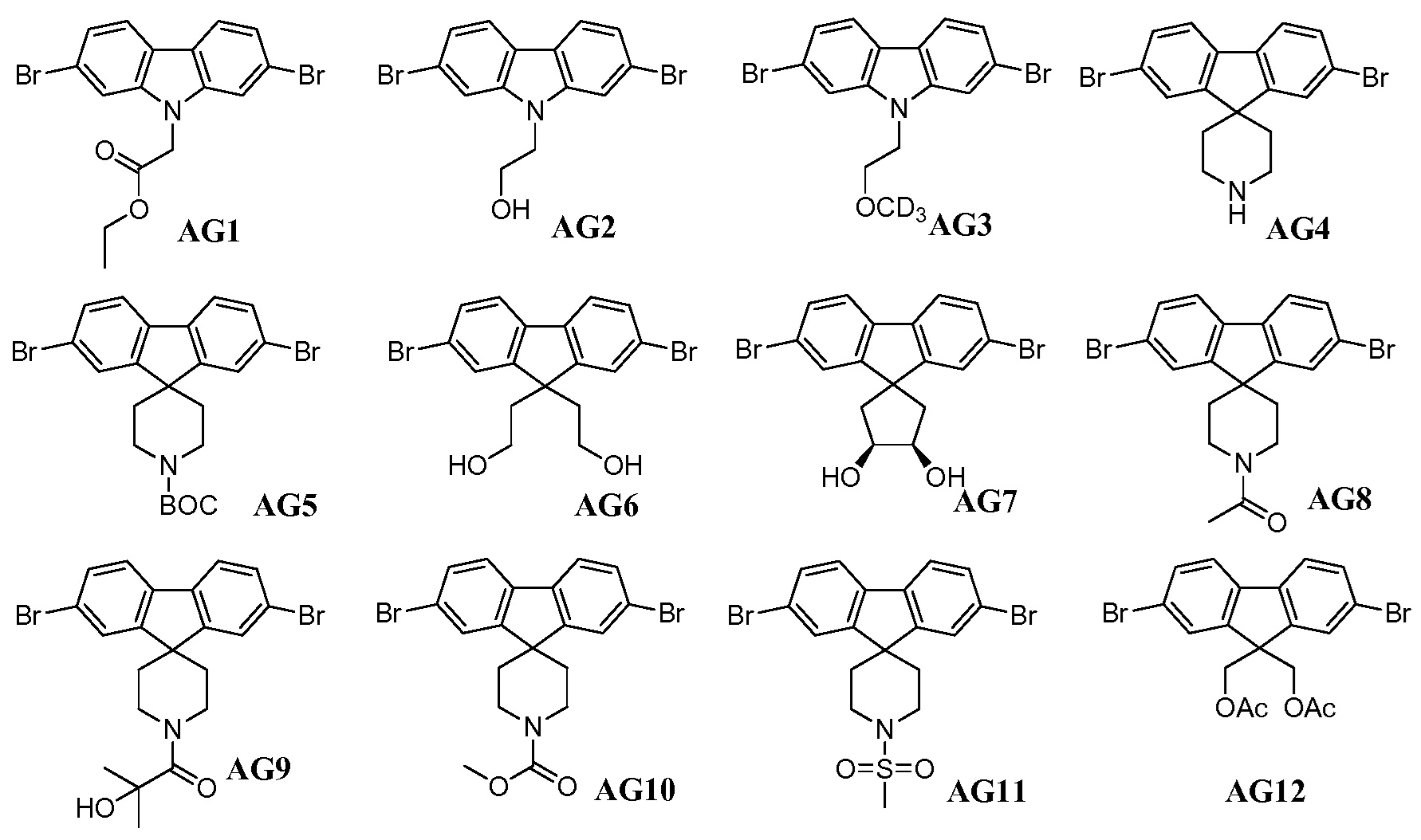
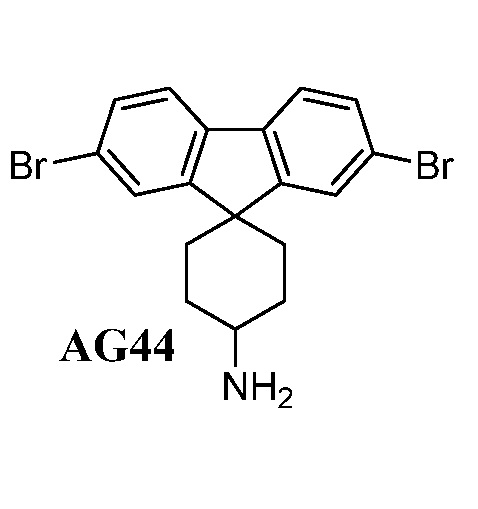
Получение промежуточного соединения AG1
Этил-2-(2,7-дибромкарбазол-9-ил)ацетат
К раствору 2,7-дибром-9Н-карбазола (3,00 г, 9,23 ммоль) в CH3CN (30 мл) добавляют этил-2-йодацетат (5,926 г, 3,274 мл, 27,69 ммоль) и Cs2CO3 (3,008 г, 9,231 ммоль). Реакционную смесь кипятят с обратным холодильником в течение 4 часов, охлаждают до КТ, разбавляют EtOAc (50 мл), фильтруют через воронку из спеченного стекла, твердые вещества промывают EtOAc (20 мл) и CH2Cl2 (20 мл). Фильтрат промывают водным раствором NH4Cl, насыщенным раствором соли, сушат над Na2SO4, фильтруют и упаривают с получением твердого продукта. Последний растворяют в CH2Cl2, добавляют гептан, CH2Cl2 медленно удаляют в вакууме, образующийся белый осадок собирают фильтрацией и промывают гептаном с получением указанного в заголовке соединения (1,75 г, 3,97 ммоль, 43%) в виде твердого вещества светло-желтого цвета. МС-ESI m/z: вычислено 410,16, 410,16; найдено 410,16 (М+1)+.
Получение промежуточного соединения AG2:
(2R,3S,4R,5S,6R)-2-Этинил-6-(гидроксиметил)метрагидропиран-3,4,5-триол
К смеси этил-2-(2,7-дибромкарбазол-9-ил)ацетата (500 мг, 1,216 ммоль) в ТГФ (3,0 мл) добавляют раствор борана в ТГФ (1,58 мл, 1М, 1,58 ммоль) при КТ. Реакционную смесь перемешивают при КТ в течение 5,5 часов (ЖХ-МС показывает 80% исходного вещества), реакционную смесь продолжают перемешивать в течение 88 часов. Реакцию осторожно гасят смесью ТГФ:вода (1:1,4 мл), подщелачивают твердым K2CO3, экстрагируют EtOAc (2×10 мл), объединенные экстракты промывают насыщенным раствором соли, сушат и концентрируют с получением указанного в заголовке соединения (440 мг, 88,19%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,87 (д, J=8,3 Гц, 2H), 7,60 (д, J=1,4 Гц, 2H), 7,34 (дд, J=8,3, 1,5 Гц, 2H), 4,37 (т, J=5,4 Гц, 2H), 4,09-4,01 (м, 2H). МС-ESI m/z: найдено 368,18 (М+1)+.
Получение промежуточного соединения AG3:
2,7-Дибром-9-[2-(тридейтериометокси)этил]карбазол
К охлажденной (0°С) суспензии 60%-го NaH в масле (51 мг, 1,27 ммоль) (предварительно промытой толуолом) в ДМФА (1 мл) при перемешивании добавляют раствор промежуточного соединения AG3 (260 мг, 0,634 ммоль) в ДМФА (1 мл). Реакционную смесь перемешивают при 0°C в течение 45 минут, обрабатывают тридейтерио(йод)метаном (118 мкл, 1,90 ммоль) и перемешивают в течение 20 минут. Охлаждающую баню удаляют, смесь перемешивают в течение 45 минут и гасят водным раствором NH4Cl. Образующийся осадок собирают фильтрацией, промывают водой и сушат в высоком вакууме с получением указанного в заголовке соединения (235 мг, 78%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,87 (д, J=8,3 Гц, 2H), 7,58 (д, J=1,5 Гц, 2H), 7,33 (дд, J=8,3, 1,6 Гц, 2H), 4,37 (т, J=5,7 Гц, 2H), 3,74 (т, J=5,7 Гц, 2H).
Получение промежуточного соединения AG4:
2,7-Дибромспиро[флуорен-9,4’-пиперидин]
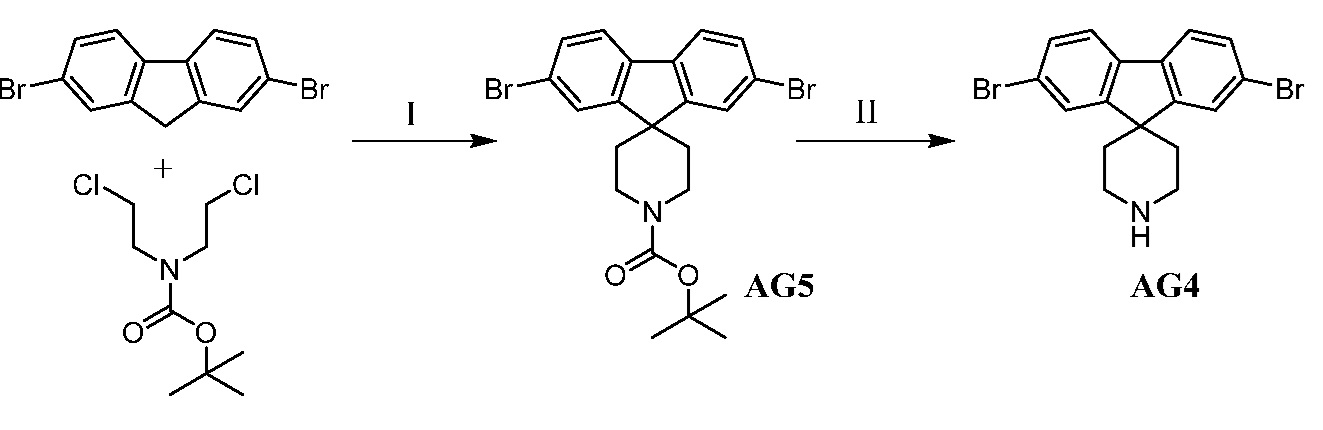
Стадия I: трет-Бутил-2,7-дибромспиро[флуорен-9,4'-пиперидин]-1’-карбоксилат. Промежуточное соединение AG5
К охлажденному (0°С) раствору 2,7-дибром-9Н-флуорена (7,500 г, 23,15 ммоль) в ТГФ (38 мл) при перемешивании небольшими порциями добавляют NaH в масле (3,7 г, 146,5 ммоль). Охлаждающую баню удаляют, смесь перемешивают при КТ в течение 30 минут (наблюдают энергичное выделение газообразного водорода) и затем смесь снова охлаждают до 0°С. После этого добавляют раствор трет-бутил-N,N-бис(2-хлорэтил)карбамата (4,00 г, 16,52 ммоль) в ТГФ (6,0 мл). Реакционную смесь медленно нагревают и кипятят с обратным холодильником при перемешивании в течение 4 часов (температура бани 75°С). Полученную реакционную смесь охлаждают до КТ, реакцию гасят, медленно выливая смесь на измельченный лед, и экстрагируют Et2O (2×100 мл). Объединенные органические экстракты промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, 340 г; элюирование с градиентом: EtOAc в гексанах, 0%-10%, 6 CV, 10%) с получением указанного в заголовке соединения (5,00 г, 61%) в виде твердого вещества оранжевого цвета. 1H ЯМР (400 МГц, CDCl3) δ 7,71 (д, J=1,7 Гц, 2H), 7,56 (д, J=8,1 Гц, 2H), 7,49 (дд, J=7,9, 1,5 Гц, 2H), 3,92-3,72 (м, 4H), 1,94-1,74 (м, 4H), 1,53 (с, 9H).
Стадия II: Промежуточное соединение AG4
К раствору HCl в диоксане (4М, 39,0 мл, 156 ммоль) добавляют промежуточное соединение AG5 (4,50 г, 9,12 ммоль) при КТ. Смесь перемешивают при КТ в течение 45 минут (продукт осаждается в течение 5 минут), разбавляют безводным Et2O (80 мл), охлаждают до ~4°С и фильтруют. Осадок на фильтре промывают Et2O (40 мл) и сушат с получением указанного в заголовке соединения (3,567 г, 84%) в виде твердого белого вещества. 1H ЯМР (400 МГц, ДМСО-D6) δ 8,95 (уш.с, 2H), 7,91 (д, J=1,5 Гц, 2H), 7,88 (д, J=8,2 Гц, 2H), 7,62 (дд, J=8,1, 1,6 Гц, 2H), 3,50-3,38 (м, 4H), 2,08-1,97 (м, 4H). МС-ESI m/z: вычислено 390,95712, найдено 394,19 (М+1)+.
Получение промежуточного соединения AG6
2-[2,7-Дибром-9-(2-гидроксиэтил)флуорен-9-ил]этанола
Стадия I: 2-[2,7-Дибром-9-(2-оксоэтил)флуорен-9-ил]ацетальдегид
К раствору 2',7'-дибромспиро[4,9'-циклопентен-флуорена] (500 мг, 1,33 ммоль) в CH2Cl2 (10 мл) при перемешивании добавляют МеОН (100 мкл, 2,47 ммоль) и охлаждают до -78°С. Через раствор барботируют смесь Ο3/Ο2 до тех пор, пока раствор не приобретет стойкое синее окрашивание (10 мин), а затем избыток озона удаляют продувкой газообразным азотом, пока раствор не станет прозрачным. Реакционную смесь гасят метилсульфидом (0,38 мл, 6,85 ммоль), перемешивают в течение 1 часа, охлаждающую баню удаляют, перемешивают смесь в течение 1 часа и затем концентрируют с получением указанного в заголовке соединения, которое используют в следующей стадии без дополнительной очистки.
Стадия II: Промежуточное соединение AG6
К охлажденному (0°С) раствору 2-[2,7-дибром-9-(2-оксоэтил)флуорен-9-ил]ацетальдегида, полученному на стадии I (0,66 ммоль), в смеси МеОН (2 мл) и ТГФ (2 мл) при перемешивании добавляют NaBH4 (100 мг, 2,64 ммоль) одной порцией, смесь перемешивают в течение 1,5 часов, затем гасят водой (5 мл) и водным 1н раствором HCl (5 мл). Смесь концентрируют и полученную водную фазу экстрагируют EtOAc (2×15 мл). Объединенные экстракты промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, 25 г; элюирование с градиентом: EtOAc в гексанах, 20%-75%) с получением указанного в заголовке соединения (230 мг, 84%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,67 (д, J=1,7 Гц, 2H), 7,65 (д, J=8,1 Гц, 2H), 7,50 (дд, J=8,1, 1,7 Гц, 2H), 2,84-2,75 (м, 4H), 2,36-2,27 (м, 4H).
Получение промежуточного соединения AG7
(1R,2S)-2',7'-Дибромспиро[циклопентан-4,9'-флуорен]-1,2-диол
В колбу объемом 100 мл загружают карбонат калия (880 мг, 6,367 ммоль), гексацианожелезо(3-)(йон калия (3)) (2,1 г, 6,378 ммоль), 1,4-бис[(S)-[(2R,4S,5R)-5-этилхинуклидин-2-ил]-(6-метокси-4-хинолил)метокси]фталазин (17 мг, 0,022 ммоль) [(DHQD)2PHAL] и дигидрат дикалия диоксидо-диоксо-осмия (2 мг, 0,005 ммоль), к смеси добавляют воду (5,0 мл) и трет-бутанол (4,0 мл), смесь перемешивают в течение 15 минут, добавляют метансульфонамид (304 мг, 3,196 ммоль) и смесь перемешивают в течение 15 минут. К смеси желтовато-оранжевого цвета добавляют теплый раствор 2',7'-дибромспиро[циклопентен-4,9'-флуорена] (200 мг, 0,5318 ммоль) в EtOAc (1,0 мл) и полученную смесь энергично перемешивают в течение 15 часов. Реакционную смесь гасят сульфитом натрия (1,4 г, 13,59 ммоль), перемешивают в течение 1 часа, фильтруют через целитный картридж, колбу промывают EtOAc (4×5 мл), объединенный фильтрат сушат (Na2SO4) и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, 25 г; элюирование с градиентом: EtOAc в гексанах, 10%-50%) с получением указанного в заголовке соединения (200 мг, 91,7%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,04 (д, J=1,8 Гц, 1H), 7,64-7,53 (м, 3H), 7,49-7,38 (м, 2H), 4,45 (т, J=4,5 Гц, 2H), 2,31-2,12 (м, 4H). МС-ESI m/z: вычислено 407,93607; найдено 408,06 (М+1)+.
Получение промежуточного соединения AG8
1-(2,7-Дибромспиро[флуорен-9,4'-пиперидин]-1'-ил)этанон
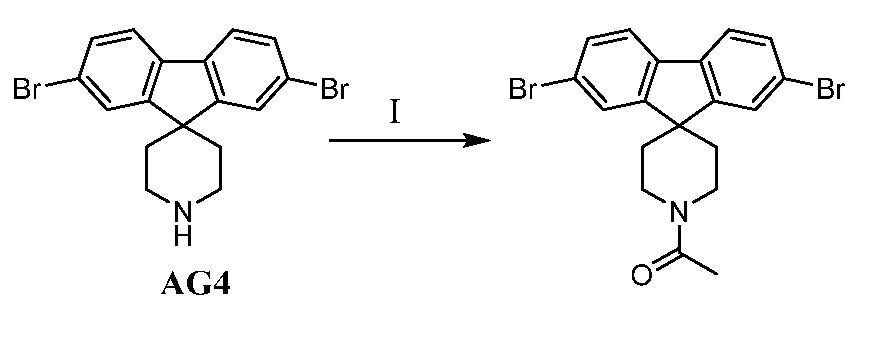
К смеси 2,7-дибромспиро[флуорен-9,4'-пиперидин] (соляная кислота (1)), AG4, (1000 мг, 2,142 ммоль) в ДМФА (10 мл) при перемешивании добавляют Et3N (900 мкл, 6,457 ммоль), в полученный прозрачный раствор по каплям добавляют ацетилхлорид (180 мкл, 2,532 ммоль) при КТ (экзотермическая реакция). Полученную реакционную смесь перемешивают в течение 1 часа, разбавляют водой (~20 мл)), перемешивают в течение 20 минут, выпавший осадок собирают фильтрацией, промывают водой (10 мл), гептаном (6 мл) и сушат в высоком вакууме, получая указанное в заголовке соединение (885 мг, 94,4%) в виде твердого белого вещества. 1H ЯМР (400 МГц, ДМСО-D6) δ 7,99 (уш.с, 2H), 7,84 (д, J=8,1 Гц, 2H), 7,57 (уш.д, J=8,1 Гц, 2H), 3,88-3,71 (м, 4H), 2,08 (с, 3H), 1,88-1,78 (м, 2H), 1,76-1,65 (м, 2H). МС-ESI m/z: вычислено 432,96768, найдено 434,2 (М+1)+.
Получение промежуточного соединения AG9
1-(2,7-Дибромспиро[флуорен-9,4'-пиперидин]-1'-ил)-2-гидрокси-2-метилпропан-1-он
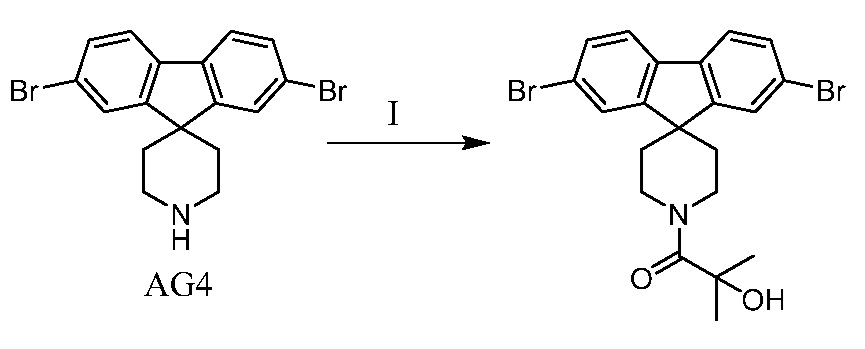
К смеси 2,7-дибромспиро[флуорен-9,4'-пиперидина] (соляная кислота (1)), AG4, (60 мг, 0,1397 ммоль) и HATU (64 мг, 0,1683 ммоль) в ДМФА (1 мл) при перемешивании последовательно добавляют 2-гидрокси-2-метилпропановую кислоту (17,5 мг, 0,168 ммоль) и Et3N (60 мкл, 0,4305 ммоль) при КТ, смесь перемешивают в течение 2 часов, разбавляют водой (~3 мл), полученный осадок собирают фильтрацией, промывают водой, гептаном (1 мл) и сушат в высоком вакууме, получая указанное в заголовке соединение (52 мг, 68,1%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,71 (уш.с, J=1,5 Гц, 2H), 7,58 (д, J=8,1 Гц, 2H), 7,52 (д, J=8,1 Гц, 2H), 4,37 (с, 1H), 4,12-4,01 (м, 4H), 1,94-1,84 (м, 4H), 1,60 (с, 6H).
Получение промежуточного соединения A10
Метил-2,7-дибромспиро[флуорен-9,4'-пиперидин]-1’-карбоксилат
К охлажденной (0°С) смеси 2,7-дибромспиро[флуорен-9,4'-пиперидина] (соляная кислота (1)), AG4, (60 мг, 0,1397 ммоль) и CH2Cl2 (1 мл) при перемешивании добавляют метилхлорформиат (16 мкл, 0,207 ммоль) с последующим добавлением Et3N (58 мкл, 0,419 ммоль) и полученную смесь перемешивают в течение 1,5 часов. Реакционную смесь гасят водным 1н раствором HCl (1,5 мл) и экстрагируют метиленхлоридом (3×2 мл). Объединенный фильтрат пропускают через фазоразделитель и концентрируют с получением указанного в заголовке соединения (59 мг, 88,74%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,71 (д, J=1,3 Гц, 2H), 7,57 (д, J=8,1 Гц, 2H), 7,50 (дд, J=8,1, 1,5 Гц, 2H), 3,87 (с, 4H), 3,78 (с, 3H), 1,84 (с, 4H).
Получение промежуточного соединения А11
2,7-Дибром-1'-метилсульфонилспиро[флуорен-9,4'-пиперидин]
К охлажденной (0°С) смеси 2,7-дибромспиро[флуорен-9,4'-пиперидина] (соляная кислота (1)), AG4, (60 мг, 0,1397 ммоль) и CH2Cl2 (1 мл) при перемешивании добавляют метансульфонилхлорид (16 мкл, 0,2096 ммоль) и затем Et3N (58 мкл, 0,4191 ммоль), полученную смесь перемешивают в течение 1,5 часов (ЖХ-МС показывает полную конверсию). Реакционную смесь гасят водным 1н раствором HCl (1,5 мл) и экстрагируют метиленхлоридом (3×2 мл). Объединенный фильтрат пропускают через фазоразделитель и концентрируют с получением указанного в заголовке соединения (62 мг, 0,1240 ммоль, 88,74%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,69 (д, J=1,5 Гц, 2H), 7,58 (д, J=8,1 Гц, 2H), 7,52 (дд, J=8,1, 1,6 Гц, 2H), 3,71-3,63 (м, 4H), 2,99 (с, 3H), 2,04-1,95 (м, 4H).
Получение промежуточного соединения AG12
[9-(Ацетоксиметил)-2,7-дибромфлуорен-9-ил]метилацетат
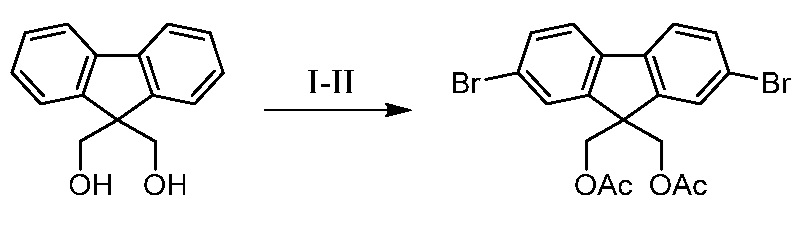
Стадия I: [2,7-Дибром-9-(гидроксиметил)флуорен-9-ил]метанол
К смеси [9-(гидроксиметил)флуорен-9-ил]метанола (1,584 г, 7 ммоль) и воды (5,5 мл) добавляют конц. H2SO4 (3 капли), смесь нагревают до 50°С и выдерживают при указанной температуре в течение 4,5 часов, затем охлаждают до КТ, гасят водным раствором тиосульфата натрия, разбавляют водой (30 мл), осадок собирают фильтрацией, промывают водой (15 мл) и сушат в высоком вакууме, получая указанное в заголовке соединение (2,5 г, 70,3%) в виде твердого белого вещества. Продукт, который содержит ~15% неизвестной примеси, используют в следующей стадии без дополнительной очистки. В ЖХ-МС основной пик появляется при 349 (М-2×Н2О)+.
Стадия II:
К смеси [2,7-дибром-9-(гидроксиметил)флуорен-9-ил]метанола (250 мг, 0,492 ммоль) в CH2Cl2 (5 мл) и пиридина (1 мл) при перемешивании добавляют 4-диметиламинопиридин (25 мг, 0,205 ммоль) и уксусный ангидрид (1 мл, 10,6 ммоль) при КТ, спустя 1,5 часа реакционную смесь гасят водным 1н раствором HCl (3 мл), затем перемешивают в течение 30 минут и экстрагируют метиленхлоридом (3×5 мл), объединенные экстракты промывают водным 1н раствором HCl (2×4 мл), пропускают через фазоразделитель, сушат (Na2SO4) и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, 50 г; элюирование с градиентом: EtOAc в гексанах, 10%-40%, 8 CV) с получением указанного в заголовке соединения (120 мг, 52,1% 1) в виде твердого белого вещества. ЖХ-МС показывает пик при 349 (М-2xOAc). 1H ЯМР (400 МГц, CDCl3) δ 7,71-7,67 (м, 2H), 7,58-7,55 (м, 4H), 4,29 (с, 4H), 2,10 (с, 6H).
Получение промежуточного соединения AG 13
2,7-Дибромспиро[флуорен-9,5'-оксепан]-2'-он
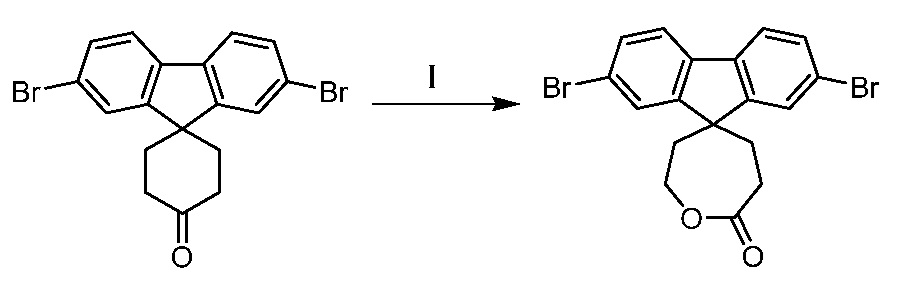
К раствору 2',7'-дибромспиро[циклогексан-4,9'-флуорен]-1-она (277 мг, 0,6821 ммоль) в CH2Cl2 (7 мл) добавляют m-СРВА (155 мг, 0,8982 ммоль). Реакционную смесь перемешивают при КТ в течение 18 часов, добавляют насыщенный водный раствор NaHCO3 и полученную смесь экстрагируют CH2Cl2. Органические фазы объединяют, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, элюирование с градиентом: EtOAc в гексанах, 0-20%, 20 CV) с получением указанного в заголовке соединения (205 мг, 71,2%) в виде твердого белого вещества.
Получение промежуточного соединения AG 14
2,7-дибром-1'-метилспиро[флуорен-9,4'-пиперидин]
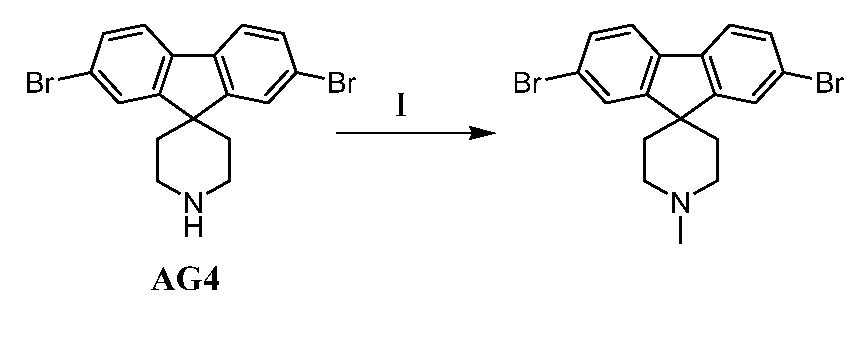
К смеси 2,7-дибромспиро[флуорен-9,4'-пиперидина] (соляная кислота (1)), AG4, (100 мг, 0,233 ммоль) и 1,2-дихлорэтана (2 мл) при перемешивании добавляют водный раствор формальдегида (38 мкл, 37% масс./об., 0,4683 ммоль) с последующим добавлением одной порцией триацетоксиборгидрида (ион натрия (1)) (148,0 мг, 0,698 ммоль) при КТ. Реакционную смесь перемешивают при КТ в течение 1 часа (ЖХ-МС показывает наличие чистого продукта). Реакционную смесь гасят 10% водным раствором NaOH до достижения значения рН 6-7, экстрагируют хлористым метиленом (4×5 мл), объединенные экстракты сушат (Na2SO4) и концентрируют с получением указанного в заголовке соединения (91 мг, 93,9%). 1H ЯМР (400 МГц, CDCl3) δ 7,79 (д, J=1,3 Гц, 2H), 7,54 (д, J=8,1 Гц, 2H), 7,48 (дд, J=8,1, 1,7 Гц, 2H), 2,91-2,79 (м, 4H), 2,54 (с, 3H), 2,02-1,89 (м, 4H). МС-ESI m/z: вычислено 404,97278, найдено 406,28 (М+1)+.
Получение промежуточного соединения AG15
2,7-Дибром-9-пропилкарбазол
К раствору 2,7-дибром-9Н-карбазола (150 мг, 0,462 ммоль) в MeCN (9 мл) добавляют 1-йодпропан (135 мкл, 1,38 ммоль) и CS2CO3 (752 мг, 2,31 ммоль). Реакционную смесь кипятят с обратным холодильником при перемешивании в течение 18 часов. Полученную смесь охлаждают до КТ, фильтруют и разбавляют этилацетатом. Органическую фазу промывают насыщенным водным раствором NH4Cl, сушат над MgSO4 и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, элюирование с градиентом: EtOAc/гексаны, 0-5%) с получением 2,7-дибром-9-пропилкарбазола (145 мг, 86%) в виде твердого белого вещества.
Промежуточные соединения AG16, AG24, AG25 получают в соответствии с методикой, описанной для получения промежуточного соединения AG15, с использованием подходящего алкилирующего реагента.
Промежуточное соединение AG 16:
2,7-Дибром-9-метилкарбазол
1H ЯМР (400 МГц, Хлороформ-d) δ 7,88 (д, J=8,3 Гц, 2H), 7,53 (д, J=1,6 Гц, 2H), 7,33 (дд, J=8,3, 1,7 Гц, 2H), 3,77 (с, 3H).
Промежуточное соединение AG24:
2-(2,7-Дибромкарбазол-9-ил)-1-морфолиноэтанон
1H ЯМР (400 МГц, Хлороформ-d) δ 7,88 (д, J=8,3 Гц, 2H), 7,40 (с, 2H), 7,35 (дд, J=8,3, 1,4 Гц, 2H), 4,96 (с, 2H), 3,77-3,49 (м, 8H).
Промежуточный AG25:
2-(2,7-Дибромкарбазол-9-ил)-N,N-диметилацетамид
1H ЯМР (400 МГц, Хлороформ-d) δ 7,88 (д, J=8,3 Гц, 2H), 7,41 (с, 2H), 7,34 (д, J=8,3 Гц, 2H), 4,96 (с, 2H), 3,17 (с, 3H), 3,02 (с, 3H).
Получение промежуточного соединения AG17
2,7-Дибром-9-пентилфлуорен-9-ол
Раствор 2,7-дибромфлуорен-9-она (200 мг, 0,592 ммоль) в ТГФ (2 мл) добавляют к раствору бромида н-пентилмагния в Et2O (355 мкл, 2,0 М, 0,710 ммоль) и разбавляют Et2O (4 мл) при 0°С. Реакционную смесь перемешивают 18 часов при КТ и гасят 1н раствором Na2CO3. Органическую фазу отделяют, промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель; элюирование с градиентом: EtOAc в гексанах, 0-8%) с получением 2,7-дибром-9-пентилфлуорен-9-ола (150 мг, 62%) в виде твердого белого вещества.
Промежуточные соединения AG18, А19, AG20, AG21, AG22 и AG23 получают в соответствии с методикой, описанной для промежуточного AG17, с использованием подходящего реактива Гриньяра.
|
|
Получение промежуточного соединения AG26
3-(2,7-Дибром-9-гидроксифлуорен-9-ил)пропан-1,2-диол
Стадия I: 9-Аллил-2,7-дибромфлуорен-9-ол
Указанное в заголовке соединение получают в соответствии с методикой, описанной для получения промежуточного соединения AG17, с использованием бромида аллилмагния. 1H ЯМР (400 МГц, Хлороформ-d) δ 7,64 (д, J=1,7 Гц, 2H), 7,51-7,40 (м, 4H), 5,62-5,48 (м, 1H), 5,05-4,95 (м, 2H), 2,77 (д, J=7,3 Гц, 2H), 2,18 (с, 1H).
Стадия II: Промежуточное соединение AG26
К раствору 9-аллил-2,7-дибромфлуорен-9-ола, полученного на стадии I (250 мг, 0,658 ммоль), в смеси ацетон/H2O (4:1, 6,6 мл) добавляют 4-метил-4-оксидоморфолин-4-ий (193 мг, 1,65 ммоль) и OsO4 (2,5% масс./об. в t-BuOH, 401 мкл, 0,03943 ммоль). Смесь перемешивают при КТ в течение 18 часов. Реакцию гасят добавлением насыщенного водного раствора NH4Cl. Смесь экстрагируют EtOAc. Органическую фазу промывают насыщенным водным раствором NH4Cl, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, элюирование с градиентом: EtOAc в гексанах, 30-100%, 20 CV) с получением указанного в заголовке соединения (174 мг, 64%) в виде твердого белого вещества. 1H ЯМР (400 МГц, Хлороформ-d) δ 7,82 (с, 1H), 7,67 (с, 1H), 7,54-7,40 (м, 4H), 4,26-4,13 (м, 1H), 3,76-3,67 (м, 1H), 3,66-3,55 (м, 1H), 3,52-3,37 (м, 2H), 2,49-2,37 (м, 1H), 1,86 (д, J=5,4 Гц, 2H), 1,59 (дд, J=8,1, 3,5 Гц, 1H).
Получение промежуточного соединения AG27
(3'S,4'R)-2,7-Дибромспиро[флуорен-9,6'-тетрагидропиран]-3',4'-диол и (3'R,4'S)-2,7-дибромспиро[флуорен-9,6'-тетрагидропиран]-3',4'-диол
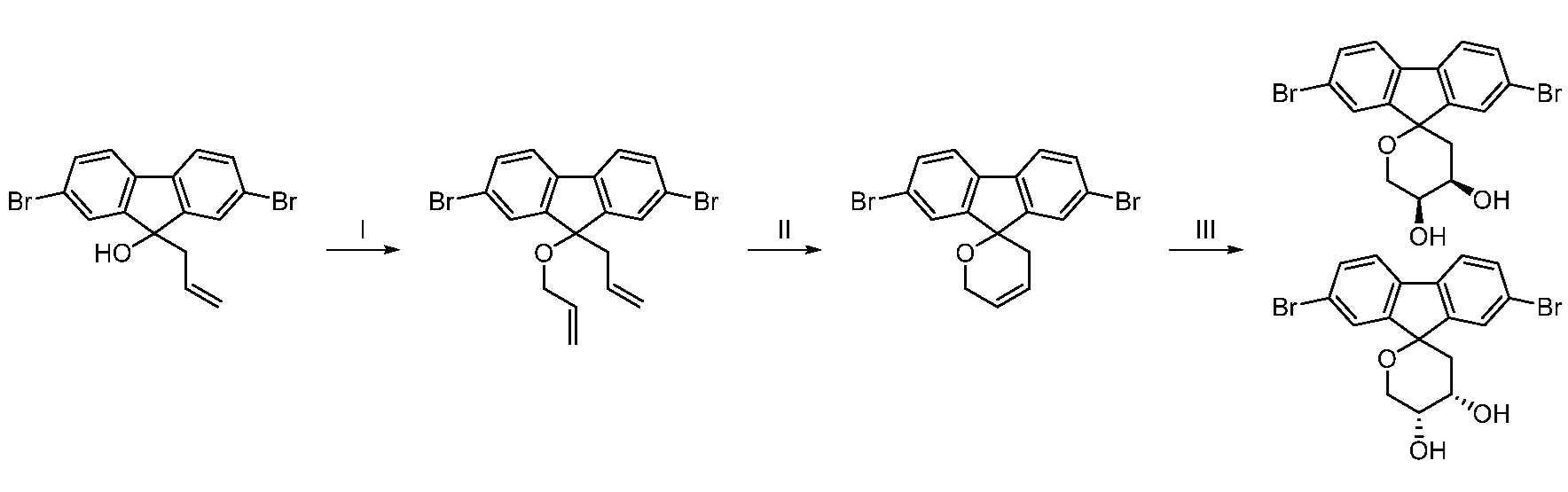
Стадия I: 9-Аллил-9-аллилокси-2,7-дибромфлуорен
К суспензии NaH (60%, суспензия в масле, 526 мг, 13,15 ммоль) в ДМФА (15 мл) при 0°С добавляют раствор 9-аллил-2,7-дибромфлуорен-9-ола, полученного в соответствии с методикой стадии I получения промежуточного соединения AG26 (1,00 г, 2,63 ммоль), в ДМФА (7,5 мл). Реакционную смесь нагревают до комнатной температуры в течение 1 часа, снова охлаждают до 0°C и добавляют аллилбромид (797 мкл, 9,210 ммоль). Реакционную смесь перемешивают при КТ в течение 18 часов. Полученную смесь разбавляют этилацетатом и гасят насыщенным водным раствором NH4Cl. Органическую фазу отделяют, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, элюирование с градиентом: EtOAc в гексанах, 0-8%, 20 CV) с получением указанного в заголовке соединения (1,04 г, 94%) в виде твердого вещества желтого цвета. 1H ЯМР (400 МГц, Хлороформ-d) δ 7,60 (д, J=1,7 Гц, 2H), 7,49 (дд, J=8,1, 1,8 Гц, 2H), 7,45 (д, J=8,0 Гц, 2H), 5,74 (ддт, J=17,1, 10,6, 5,4 Гц, 1H), 5,45 (ддт, J=17,4, 10,3, 7,2 Гц, 1H), 5,16 (дкв., J=17,2, 1,7 Гц, 1H), 5,05 (дкв., J=10,5, 1,4 Гц, 1H), 4,91-4,81 (м, 2H), 3,36 (дт, J=5,4, 1,5 Гц, 2H), 2,78 (д, J=7,2 Гц, 2H).
Стадия II: 2',7'-Дибромспиро[2,5-дигидропиран-6,9'-флуорен]
К раствору 9-аллил-9-аллилокси-2,7-дибромфлуорена, полученного на стадии I (1,04 г, 2,48 ммоль), в CH2Cl2 (200 мл) при КТ добавляют катализатор Граббса 2-го поколения (105 мг, 0,124 ммоль). Реакционную смесь перемешивают при КТ в течение 18 часов. Полученную смесь концентрируют, и остаток очищают на картридже Biotage™ SNAP (силикагель, элюирование с градиентом: EtOAc в гексанах, 0-8%, 20 CV) с получением указанного в заголовке соединения (853 мг, 88%) в виде твердого белого вещества. 1H ЯМР (400 МГц, Хлороформ-d) δ 7,68 (д, J=1,4 Гц, 2H), 7,53-7,44 (м, 4H), 6,18-6,02 (м, 1H), 4,54-4,41 (м, 2H), 2,53 (с, 2H).
Стадия III: Промежуточные соединения AG27
Указанные в заголовке соединения получают, используя в качестве исходного вещества 2',7'-дибромспиро[2,5-дигидропиран-6,9'-флуорен], полученный на стадии II (250 мг, 0,6376 ммоль), в соответствии с методикой, описанной для получения соединения 196 (стадия II), с получением целевой рацемической смеси диастереоизомеров в виде твердого белого вещества (201 мг, выход 74%). 1H ЯМР (400 МГц, Хлороформ-d) δ 7,83 (с, 1H), 7,68 (с, 1H), 7,57-7,41 (м, 4H), 4,54-4,43 (м, 1H), 4,20 (д, J=13,3 Гц, 1H), 4,13 (д, J=8,6 Гц, 2H), 2,46-2,33 (м, 2H), 2,27 (дд, J=7,1, 1,8 Гц, 1H), 2,00-1,91 (м, 1H).
Получение промежуточного соединения AG28
1-(2,7-Дибром-9Н-флуорен-9-ил)-4-метилпиперазин
К раствору 2,7-дибром-9Н-флуорен-9-ола (250 мг, 0,735 ммоль) в CH2Cl2 (3 мл) и ТГФ (1 мл) добавляют тионилхлорид (120 мкл, 1,65 ммоль). Смесь перемешивают при КТ в течение 1 часа. Полученную смесь упаривают досуха. К остатку добавляют MeCN (3 мл), затем 1-метилпиперазин (408 мкл, 3,67 ммоль), и смесь перемешивают при 82°С в течение 18 часов. Реакционную смесь гасят добавлением насыщенного водного раствора NH4Cl и разбавляют EtOAc. Органическую фазу отделяют, промывают насыщенным водным раствором NH4Cl, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, элюирование с градиентом: 30-100% этилацетат/гексаны+1% Et3N буфер, 20 CV) с получением указанного в заголовке соединения (200 мг, выход 64%) в виде твердого вещества желтого цвета. 1H ЯМР (400 МГц, Хлороформ-d) δ 7,75 (с, 2H), 7,47 (с, 4H), 4,77 (с, 1H), 2,64 (т, J=4,1 Гц, 4H), 2,40 (с, 4H), 2,26 (с, 3H).
Получение промежуточного соединения AG29
2,7-Дибромспиро[флуорен-9,2'-тетрагидропиран]
К раствору 2',7'-дибромспиро[2,5-дигидропиран-6,9'-флуорена], полученного в соответствии с методикой получения промежуточного продукта AG27 (стадия II) (200 мг, 0,510 ммоль), в EtOAc (7 мл) добавляют SiliaCat Pd0 (26 мг, 0,0013 ммоль). Через смесь в течение 5 минут барботируют Н2 и реакционную смесь перемешивают в атмосфере Н2 в течение 1 недели. Полученную смесь фильтруют и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, элюирование с градиентом: EtOAc в гексанах, 0-8%, 17 CV) с получением указанного в заголовке соединения (120 мг, 60%) в виде твердого вещества бледно-желтого цвета. 1H ЯМР (400 МГц, Хлороформ-d) δ 7,82 (д, J=1,6 Гц, 2H), 7,51-7,46 (м, 4H), 4,18-4,00 (м, 2H), 2,11-2,03 (м, 2H), 1,93 (дт, J=13,3, 6,4 Гц, 4H).
Получение промежуточного соединения AG30
N-(2,7-Дибром-9Н-флуорен-9-ил)-N,N,N’-триметилэтан-1,2-диамин
Указанное в заголовке соединение получают в соответствии с методикой, описанной для получения промежуточного соединения A28, но с использованием N1,N1,N2-триметилэтан-1,2-диамина в качестве исходного вещества. 1H ЯМР (400 МГц, Хлороформ-d) δ 7,73 (с, 2H), 7,48 (с, 4H), 4,87 (с, 1H), 2,74 (т, J=6,3 Гц, 2H), 2,59 (т, J=6,2 Гц, 2H), 2,37 (с, 6H), 2,26 (с, 3H).
Получение промежуточного соединения AG31
2,7-Дибром-9-(циклопентилметил)флуорен-9-ол
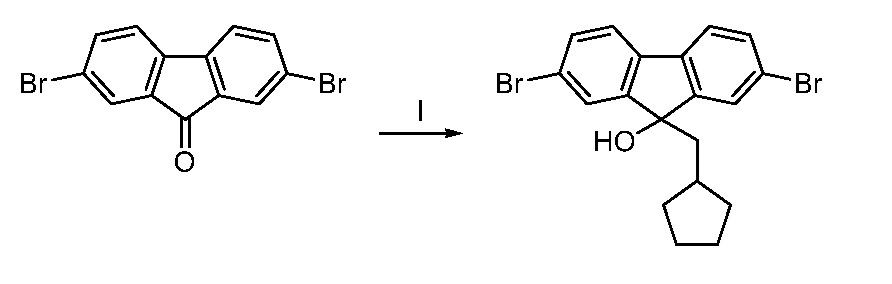
В герметично закрытую пробирку, промытую Et2O, в потоке N2 загружают йодметилциклопентан (145 мкл) в Et2O (1 мл) при КТ. Добавляют магний (27 мг, 1,111 ммоль) и йод (0,30 мг, 0,0012 ммоль) и смесь перемешивают при кипячении с обратным холодильником в течение 2 часов (или до расходования всего магния). Полученную смесь охлаждают до 0°С и добавляют раствор 2,7-дибромфлуорен-9-она (250 мг, 0,740 ммоль) в ТГФ (2 мл). Реакционную смесь перемешивают при КТ в течение 18 часов. Полученную смесь гасят насыщенным водным раствором NaHCO3, органическую фазу отделяют, промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, элюирование с градиентом: EtOAc в гексанах, 0-10%, 20 CV) с получением указанного в заголовке соединения (62 мг, 13%) в виде твердого вещества желтого цвета. 1H ЯМР (400 МГц, Хлороформ-d) δ 7,61 (д, J=1,8 Гц, 2H), 7,53-7,40 (м, 4H), 2,26 (д, J=5,9 Гц, 2H), 1,98 (с, 1H), 1,41 (с, 2H), 1,27-1,14 (м, 5H), 0,82 (с, 2H).
Получение промежуточного соединения AG32
2,7-Дибром-9-(циклогексилметил)флуорен-9-ол
Указанное в заголовке соединение получают в соответствии с методикой, описанной для получения промежуточного соединения AG32, но с использованием йодметилциклогексана в качестве исходного вещества. 1H ЯМР (400 МГц, Хлороформ-d) δ 7,61 (д, J=1,7 Гц, 2H), 7,48 (дд, J=8,0, 1,8 Гц, 2H), 7,43 (д, J=8,0 Гц, 2H), 2,07 (д, J=5,4 Гц, 2H), 1,94 (с, 1H), 1,46 (дд, J=9,0, 3,2 Гц, 3H), 1,22 (д, J=11,8 Гц, 2H), 1,05-0,69 (м, 6H).
Получение промежуточного соединения А33
2,7-Дибром-9-(2-гидроксиэтил)флуорен-9-ол
Через раствор 9-аллил-2,7-дибром-флуорен-9-ола, полученного в соответствии с методикой стадии I получения промежуточного соединения AG26 (1,00 г, 2,63 ммоль), в CH2Cl2 (13 мл) при -78°С барботируют О3 до приобретения раствором синей окраски. После этого через раствор в течение 10 минут барботируют азот для удаления избытка О3. Реакционную смесь оставляют нагреваться до 0°С, к смеси добавляют NaBH4 (597 мг, 15,8 ммоль), и смесь перемешивают в течение 1 часа. Реакционную смесь гасят добавлением насыщенного водного раствора NH4Cl. Органическую фазу отделяют, промывают насыщенным водным раствором NH4Cl, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, элюирование с градиентом: EtOAc в гексанах, 0-20%, 20 CV) с получением указанного в заголовке соединения (443 мг, 44%) в виде твердого белого вещества. 1H ЯМР (400 МГц, Хлороформ-d) δ 7,72 (дд, J=2,6, 1,5 Гц, 2H), 7,50 (ддд, J=8,1, 3,0, 1,6 Гц, 2H), 7,47-7,42 (м, 2H), 3,84 (д, J=3,9 Гц, 2H), 3,27 (с, 1H), 2,21 (тд, J=5,9, 3,0 Гц, 2H), 2,13 (тд, J=4,9, 2,4 Гц, 1H).
Получение промежуточного соединения AG34
2,7-Дибром-9-(тетрагидро-2Н-пиран-4-ил)-9Н-карбазол
К раствору 2,7-дибром-9Н-карбазола (250 мг, 0,77 ммоль) и тетрагидропиран-4-ола (146 мкл, 1,54 ммоль) в толуоле 2,5 мл добавляют 2-трибутилфосфоранилиденацетонитрил (1,54 мл, 1М, 1,54 ммоль). Реакционную смесь перемешивают при 110°С в течение 4 часов, охлаждают до КТ и распределяют между EtOAc и водой. Органический слой сушат над Na2SO4, фильтруют, концентрируют и очищают на картридже Biotage™ SNAP (силикагель, 24 г; элюирование с градиентом: EtOAc в гексанах, 0-50%) с получением указанного в заголовке соединения (95 мг, 30%). 1H ЯМР (400 МГц, Хлороформ-d) δ 7,89 (д, J=8,3 Гц, 2H), 7,70 (д, J=1,6 Гц, 2H), 7,34 (дд, J=8,3, 1,6 Гц, 2H), 4,58 (ддт, J=12,5, 8,8, 4,4 Гц, 1H), 4,24 (дд, J=11,7, 4,8 Гц, 2H), 3,64 (тд, J=12,1, 2,0 Гц, 2H), 2,69 (кв.д, J=12,5, 4,7 Гц, 2H), 1,84 (ддд, J=12,9, 4,3, 1,8 Гц, 2H).
Промежуточные соединения AG35-40 получают в соответствии с методикой, описанной в примере получения промежуточного соединения AG34.
|
|
|
Получение промежуточного соединения AG41:
2',7'-Дибромспиро[циклогексан-1,9'-флуорен]-4-он
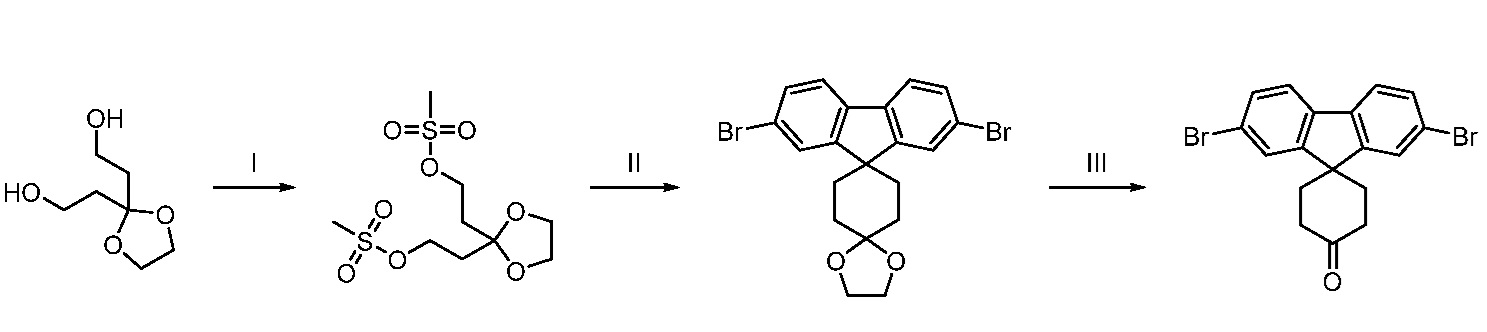
Стадия I: (1,3-Диоксолан-2,2-диил)бис(этан-2,1-диил)диметансульфонат
К охлажденному (0°С) раствору 2-[2-(2-гидроксиэтил)-1,3-диоксолан-2-ил]этанола (1000 мг, 6,200 ммоль) в CH2Cl2 (10,0 мл) по каплям в течение 10 минут добавляют Et3N (2,15 мл, 15,4 ммоль) и метансульфонилхлорид (1,00 мл, 12,9 ммоль). Реакционную смесь перемешивают в течение 45 минут при 0°С, после чего гасят водой (20 мл). Органическую фазу промывают насыщенным водным раствором NaHCO3, сушат над Na2SO4, фильтруют и концентрируют с получением указанного в заголовке соединения (1750 мг, 89%) в виде твердого белого вещества.
Стадия II: 2,7-Дибромдиспиро[флуорен-9,1'-циклогексан-4',2"-[1,3]диоксолан]
К охлажденному (0°C) раствору 2,7-дибром-9Н-флуорена (1,020 г, 3,100 ммоль) в ТГФ (7,0 мл) тремя порциями добавляют NaH (60%) в масле (814 мг, 20,4 ммоль). Реакционную смесь перемешивают при КТ в течение 30 минут, снова охлаждают до 0°С и добавляют раствор (1,3-диоксолан-2,2-диил)бис(этан-2,1-диил)диметансульфонат со стадии I (700 мг, 2,2 ммоль) в ТГФ (3,5 мл). Реакционную смесь перемешивают при 75°С в течение 4 часов, затем охлаждают до КТ, гасят водой со льдом и экстрагируют этилацетатом (3×10 мл). Объединенные экстракты промывают насыщенным раствором соли, сушат над Na2SO4 и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, 24 г; изократическое элюирование: 50% CH2Cl2/гексан) с получением указанного в заголовке соединения (750 мг, 76%). 1H ЯМР (400 МГц, Хлороформ-d) δ 7,75 (д, J=1,7 Гц, 2H), 7,54 (д, J=8,1 Гц, 2H), 7,47 (дд, J=8,1, 1,7 Гц, 2H), 4,11-4,05 (с, 4H), 2,06 (м, 4H), 1,98-1,90 (м, 4H).
Стадия III: Промежуточное соединение AG41
К раствору 2,7-дибромдиспиро[флуорен-9,1'-циклогексан-4',2'-[1,3]диоксолана] (1400 мг, 3,11 ммоль) в ТГФ (7,0 мл) добавляют HCl (5,2 мл, 3М, 15,6 ммоль). Реакционную смесь перемешивают при 45°С в течение 16 часов, охлаждают до КТ, разбавляют водой и экстрагируют этилацетатом. Органическую фазу отделяют, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, 24 г; элюирование с градиентом: гексаны/EtOAc, 0-50%, 15 CV) с получением указанного в заголовке соединения (923 мг, 73%). 1H ЯМР (400 МГц, Хлороформ-d) δ 7,68 (дд, J=1,7, 0,5 Гц, 2H), 7,60 (дд, J=8,1, 0,5 Гц, 2H), 7,53 (дд, J=8,1, 1,7 Гц, 2H), 2,80 (т, J=7,0 Гц, 4H), 2,18 (дд, J=7,4, 6,5 Гц, 4H).
Получение промежуточного соединения AG42
2',7'-Дибромспиро[циклогексан-1,9'-флуорен]-4-ол
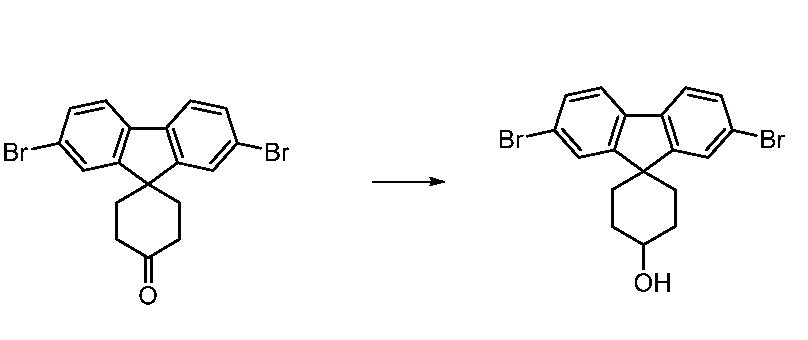
К охлажденному раствору (-40°С) промежуточного соединения AG41 (75 мг, 0,18 ммоль) в ТГФ (1,5 мл) добавляют NaBH4 (10,0 мг, 0,260 ммоль). Реакционную смесь перемешивают в течение 1 часа при -40°С и в течение 2 часов при КТ. Реакцию гасят водой, и смесь экстрагируют этилацетатом. Органическую фазу отделяют, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, 12 г; элюирование с градиентом: гексаны/EtOAc, 0-50%, 15 CV) с получением указанного в заголовке соединения (55 мг, 73%). 1H ЯМР (400 МГц, Хлороформ-d) δ 7,96-7,81 (м, 1H), 7,61-7,51 (м, 3H), 7,48 (ддд, J=12,1, 8,1, 1,7 Гц, 2H), 4,19-4,00 (м, 1H), 2,13 (дкв., J=13,9, 4,7 Гц, 2H), 2,01-1,88 (м, 2H), 1,83 (дт, J=9,9, 4,7 Гц, 4H).
Получение промежуточного соединения AG43
2',7'-Дибром-4-метилспиро[циклогексан-1,9'-флуорен]-4-ол
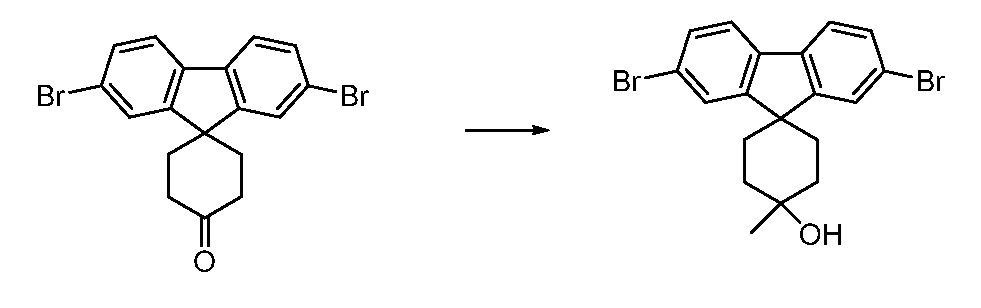
К охлажденному раствору (-40°С) промежуточного соединения AG41 (75 мг, 0,18 ммоль) в ТГФ (7,5 мл) добавляют метиллитий (140 мкл, 1,6М, 0,22 ммоль). Реакционную смесь перемешивают в течение 1 часа при -40°С и в течение 2 часов при КТ, затем гасят водой и экстрагируют EtOAc. Органическую фазу отделяют, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, 12 г; элюирование с градиентом: гексаны/EtOAc, 0-50%, 15 CV) с получением указанного в заголовке соединения (25 мг, 32%). 1H ЯМР (400 МГц, Хлороформ-d) δ 7,68 (дд, J=9,5, 1,8 Гц, 2H), 7,61-7,39 (м, 4H), 2,29-2,12 (м, 2H), 2,06-1,93 (м, 2H), 1,93-1,80 (м, 2H), 1,47 (с, 3H).
Получение промежуточного соединения AG44
2',7'-Дибромспиро[циклогексан-1,9'-флуорен]-4-амин
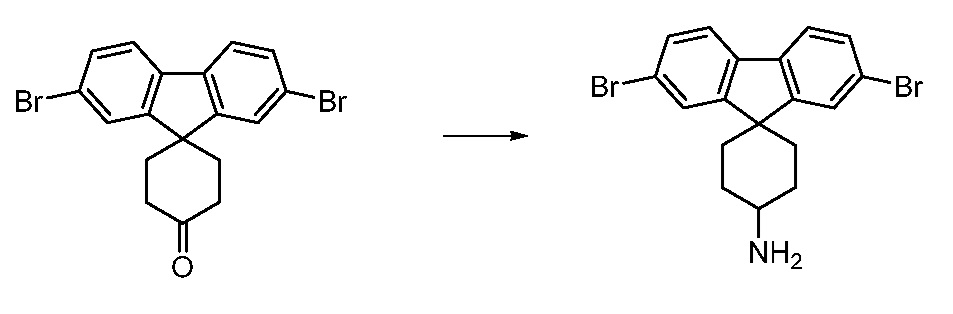
К раствору промежуточного соединения AG41 (200 мг, 0,490 ммоль) и ацетата аммония (380 мг, 4,90 ммоль) в МеОН (2,0 мл) добавляют NaBH3CN (22 мг, 0,34 ммоль). Реакционную смесь перемешивают при КТ в течение 16 часов, гасят 1н раствором NaOH (1 мл), экстрагируют CH2Cl2, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, 10 г; элюирование с градиентом: CH2Cl2/MeOH, 0-10%) с получением указанного в заголовке соединения (80 мг, 40%). 1H ЯМР (400 МГц, Хлороформ-d) δ 7,93 (д, J=1,7 Гц, 1H), 7,63-7,37 (м, 5H), 3,16-2,97 (м, 1H), 2,09-1,89 (м, 4H), 1,86-1,71 (м, 2H), 1,62 (д, J=13,4 Гц, 2H).
Пример 1: Получение соединения 1 (способ А)
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[4-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]тетрагидропиран-3,4,5-триол)
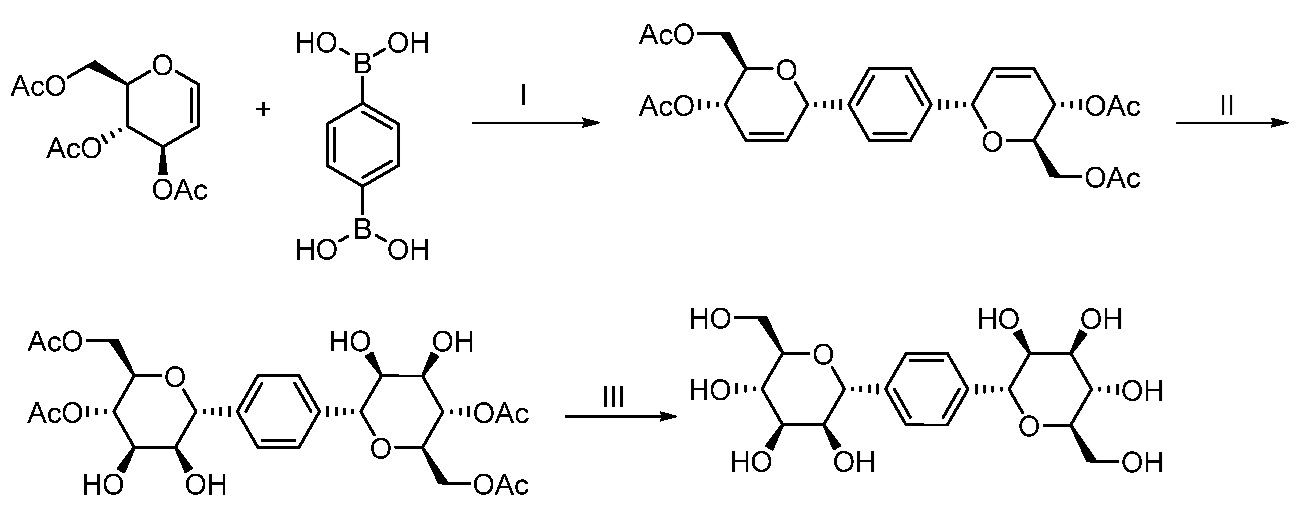
Стадия I: [(2R,3S,6S)-Ацетокси-6-[4-[(2R,3S,6S)-3-ацетокси-2-(ацетоксиметил)-3,6-дигидро-2Н-пиран-6-ил]фенил]-3,6-дигидро-2Н-пиран-2-ил]метилацетат
Раствор [(2R,3S,4R)-3,4-диацетокси-3,4-дигидро-2Н-пиран-2-ил]метилацетата (1,642 г, 6,033 ммоль) и (4-боронофенил)бороновой кислоты( 1,0 г, 6,03 ммоль) в CH3CN (30 мл) дегазируют барботированием N2 (газообр.) в течение 5 минут. Добавляют Pd(OAc)2 (338,6 мг, 1,50 ммоль) и реакционную смесь перемешивают при 40°С в течение 5 часов. Добавляют еще одну порцию Pd(OAc)2 (338,6 мг, 1,50 ммоль) и нагревание продолжают в течение дополнительных 15 часов. Растворитель выпаривают, смесь разбавляют EtOAc (25 мл) и фильтруют через целит. Фильтрат промывают насыщенным раствором NaHCO3 (2×25 мл), сушат над Na2SO4, и растворитель выпаривают. Сырой продукт очищают на картридже Biotage™ SNAP (силикагель, 50 г; элюирование с градиентом: EtOAc в гексанах, 10%-30%, объемная скорость истечения 40 мл/мин., в течение 35 мин.) с получением указанного в заголовке соединения (550 мг, 18,14%) в виде масла. ЖХ-МС: m/z=525,0 (M+Na).
Стадия II: [(2R,3S,4R,5S,6R)-3-Ацетокси-6-[4-[(2R,3S,4R,5S,6R)-5-ацетокси-6-(ацетоксиметил)-3,4-дигидрокситетрагидропиран-2-ил]фенил]-4,5-дигидроксиметрагидропиран-2-ил]метилацетат
К раствору [(2R,3S,6S)-3-ацетокси-6-[4-[(2R,3S,6S)-3-ацетокси-2-(ацетоксиметил)-3,6-дигидро-2H-пиран-6-ил]фенил]-3,6-дигидро-2Н-пиран-2-ил]метилацетата (550 мг, 1,095 ммоль) в смеси вода (1,6 мл)/ТГФ (9,4 мл) добавляют метансульфонамид (312,5 мг, 3,285 ммоль), OsO4 (1,1 мл, 2,5% масс./об. в t-BuOH, 0,1095 ммоль) и NMO (1,283 г, 10,95 ммоль), и реакционную смесь перемешивают при КТ в течение 5 дней. Растворитель выпаривают, сырую смесь разбавляют разбавленным раствором бисульфита натрия (50 мл) и через 15 минут экстрагируют EtOAc (3×25 мл). Объединенные органические экстракты сушат над Na2SO4, и растворитель выпаривают. Сырой продукт очищают на картридже Biotage™ SNAP (силикагель, 25 г; элюирование с градиентом: МеОН в CH2Cl2, 5%-10%, объемная скорость истечения 24 мл/мин., в течение 20 минут). Выделенный продукт растворяют в минимальном количестве MeOH и разбавляют Et2O для осаждения продукта. Осадок собирают фильтрацией и промывают диэтиловым эфиром с получением указанного в заголовке соединения (145 мг, 23,21%) в виде твердого белого вещества. ЖХ-МС: m/z=571,4 (М+Н+)
Стадия III: Соединение 1
[(2R,3S,4R,5S,6R)-3-Ацетокси-6-[4-[(2R,3S,4R,5S,6R)-5-ацетокси-6-(ацетоксиметил)-3,4-дигидрокситетрагидропиран-2-ил]фенил]-4,5-дигидрокситетрагидропиран-2-ил]метилацетат (145 мг, 0,2541 ммоль) растворяют в МеОН (3 мл), к раствору добавляют MeONa в MeOH (47 мкл, 25% масс./об., 0,22 ммоль) и полученную реакционную смесь перемешивают при КТ в течение 6 часов. Реакцию нейтрализуют добавлением смолы Amberlite IR120H до достижения нейтрального значения рН. Реакционную смесь фильтруют, и фильтрат упаривают с получением указанного в заголовке соединения (108 мг, 0,258 ммоль, 24%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,51 (с, 4H), 4,98 (д, J=3,4 Гц, 2H), 4,44 (т, J=3,3 Гц, 2H), 3,81 (т, J=8,4 Гц, 4H), 3,74 (т, J=8,1 Гц, 2H), 3,57 (дд, J=8,1, 3,1 Гц, 2H), 3,50-3,41 (м, 2H). ЖХ-МС: m/z=403,2 (М+Н+).
Пример 2. Получение соединений 2-4
Соединения 2-4 получают в соответствии со способом А с использованием соответствующих бис-бороновых кислот с использованием методики, описанной в примере 1.
|
|
Пример 3: Получение соединения 5 (способ А)
(2R,2’R,3S,3’S,4R,4’R,5S,5’S,6R,6’R)-6,6'-([1,1'-Бифенил]-3,4'-диил)бис(2-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триол)
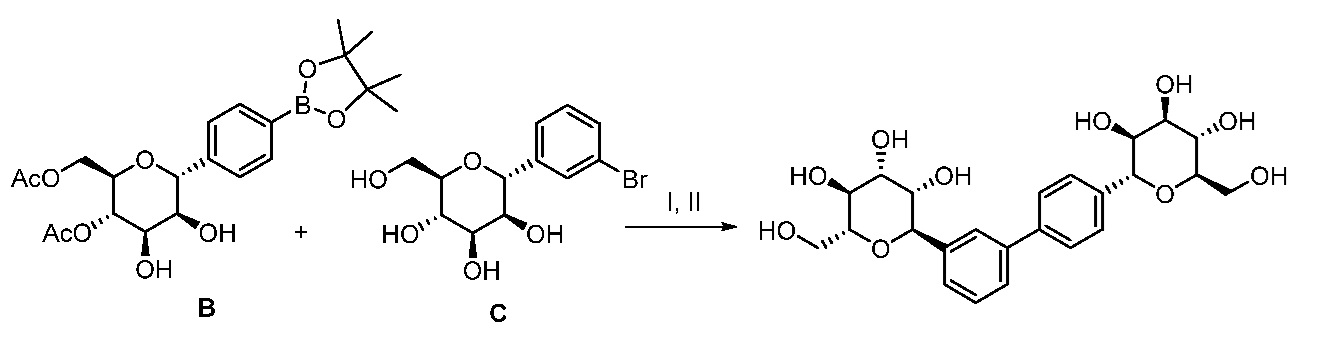
Стадия I: ((2R,3S,4R,5S,6R)-3-Ацетокси-4,5-дигидрокси-6-(3’-((2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил)-[1,1’-бифенил]-4-ил)тетрагидро-2Н-пиран-2-ил)метилацетат
Смесь промежуточного соединения B (30 мг, 0,066 ммоль), (2R,3S,4R,5S,6R)-2-(3-бромфенил)-6-(гидроксиметил)тетрагидро-2Н-пиран-3,4,5-триола (С, 30,71 мг, 0,087 ммоль), PdCl2(dppf)·CH2Cl2 (4,1 мг, 0,005 ммоль) и фосфата калия (35,7 мг, 0,167 ммоль) в дегазированном ДМФА нагревают в герметично закрытом реакторе объемом 4 мл до 90°С и выдерживают в указанных условиях в течение 4 часов. Смесь фильтруют через слой целита и очищают непосредственно ВЭЖХ с обращенной фазой (C18 Phenomenex Gemini AXIA, 5 мкм 110A, 21,2×75 мм; элюирование с градиентом: от 0% ACN/H2O+0,01% ТФУК до 50% ACN+0,01% ТФУК в течение 20 минут, затем до 100% ACN в течение 5 минут, 100% ACN в течение 5 минут; общее время работы: 30 минут) с получением указанного в заголовке соединения.
Стадия II: Соединение 5
((2R,3S,4R,5S,6R)-3-Ацетокси-4,5-дигидрокси-6-(3’-((2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил)-[1,1’-бифенил]-4-ил)тетрагидро-2Н-пиран-2-ил)метилацетат, полученный на стадии I, растворяют в МеОН (0,5 мл), к раствору добавляют раствор MeONa в MeOH (5 мкл, 25% масс./об., 0,023 ммоль) и перемешивают реакционную смесь при КТ в течение 15 часов. Реакцию нейтрализуют добавлением смолы Amberlite IR120 до достижения нейтрального значения рН. Реакционную смесь фильтруют, и фильтрат упаривают с получением указанного в заголовке соединения в виде твердого белого вещества (10,5 мг). 1H ЯМР (400 МГц, CD3OD) δ 7,78 (с, 1H), 7,66 (д, J=8,4 Гц, 2H), 7,55 (д, J=8,0 Гц, 3H), 7,44 (д, J=4,9 Гц, 2H), 5,02 (2d, J=3,5 Гц, 2H), 4,47 (дд, J=6,2, 3,1 Гц, 2H), 3,88-3,79 (м, 4H), 3,74 (тд, J=8,0, 2,8 Гц, 2H), 3,61 (тд, J=7,9, 3,1 Гц, 2H), 3,56-3,43 (м, 2H). ЖХ-МС: m/z=479,4 (М+Н+).
Пример 4. Получение соединения 6 (способ А)
(2R,2'R,3S,3'S,4R,4'R,5S,5'S,6R,6'R)-6,6'-([1,1'-Бифенил]-4,4'-диил)бис(2-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триол)
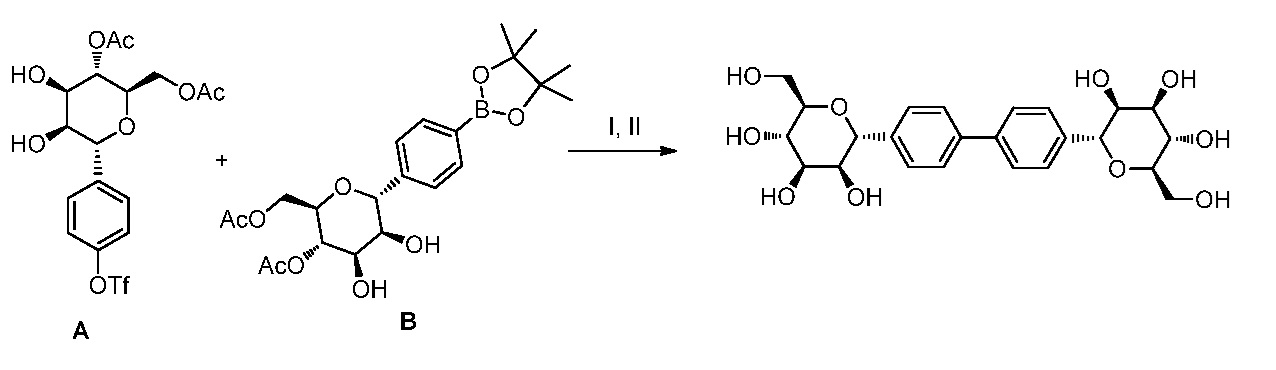
Указанное в заголовке соединение получают в соответствии с методикой, описанной в примере 3 для получения соединения 5, но с использованием промежуточного продукта А и промежуточного B в качестве исходных веществ. 1H ЯМР (400 МГц, CD3OD) δ 7,64 (т, J=10,1 Гц, 4H), 7,56 (д, J=8,2 Гц, 4H), 5,03 (д, J=3,3 Гц, 2H), 4,48 (т, J=3,3 Гц, 2H), 3,89-3,81 (м, 4H), 3,76 (т, J=8,1 Гц, 2H), 3,62 (дд, J=8,1, 3,0 Гц, 2H), 3,56-3,46 (м, 2H). ЖХ-МС: m/z=479,5 (М+Н+).
Альтернативный синтез соединения 6 (способ В)
(2R,2'R,3S,3'S,4R,4'R,5S,5'S,6R,6'R)-6,6'-([1,1'-Бифенил]-4,4'-диил)бис(2-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триол)
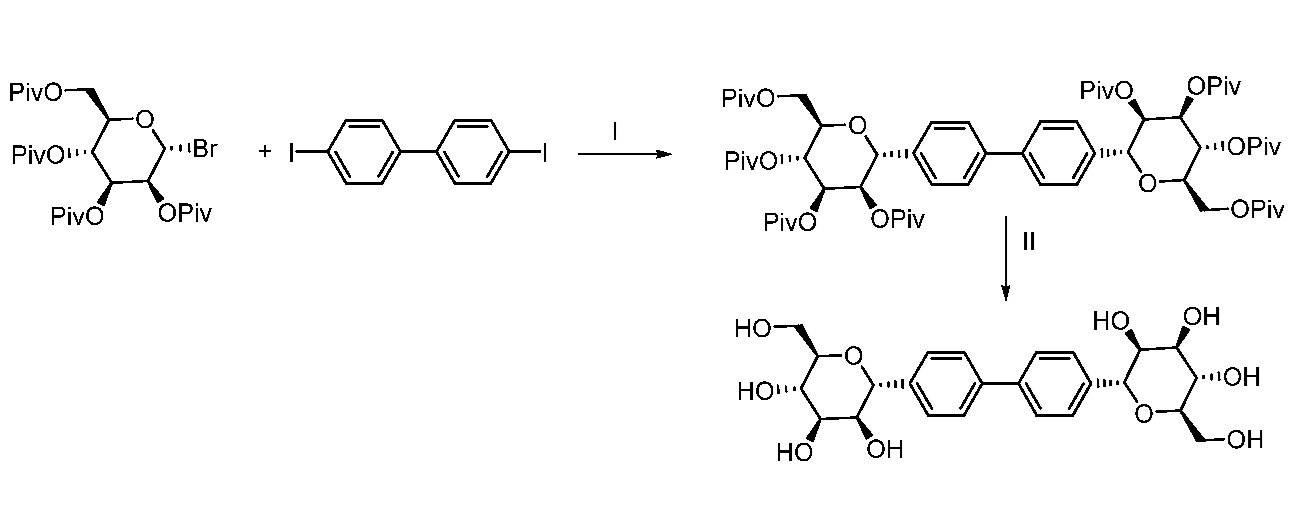
Стадия I: [(2R,3R,4R,5R,6R)-3,4,5-Трис(2,2-диметилпропаноилокси)-6-[4-[4-[(2R,3R,4R,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-(2,2-диметилпропаноилоксиметил)тетрагидропиран-2-ил]фенил]фенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноат
Раствор n-Bu3MgLi (2,195 мл, 0,66 М, 1,449 ммоль) в смеси гексан-гептан-дибутиловый эфир (8:20:3) добавляют к гетерогенной смеси 1-йод-4-(4-йодфенил)бензола (701 мг, 1,726 ммоль) в толуоле (4,0 мл) и дибутиловом эфире (2,4 мл) при 0°C, полученную смесь перемешивают при указанной температуре в течение 3,5 часов. К смеси по каплям добавляют раствор ZnBr2-LiBr в дибутиловом эфире (2,17 мл 1,05 М, 2,28 ммоль), охлаждающую баню удаляют, и перемешивают смесь при КТ в течение 1 часа. К смеси добавляют раствор [(2R,3R,4S,5S,6R)-6-бром-3,4,5-трис(2,2-диметилпропаноилокси)тетрагидропиран-2-ил]метил-2,2-диметилпропаноата (2 г, 3,451 ммоль, см. Sebastien Lemaire et. al. Org. Letts. 2012, 14, 1480-1483) в толуоле (3,6 мл), смесь помещают на масляную баню, предварительно нагретую до 100°С, и перемешивают в течение 30 часов. Реакционную смесь охлаждают до КТ и выливают в 1н водный раствор HCl (40 мл), экстрагируют этилацетатом (3×25 мл), объединенные экстракты промывают насыщенным раствором соли, сушат (Na2SO4) и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, 100 г; элюирование с градиентом: EtOAc в гексанах, 0%-15%, 8 CV) с получением указанного в заголовке соединения (400 мг, 0,347 ммоль, 20%) в виде твердого вещества светло-желтого цвета. 1H ЯМР (400 МГц, CDCl3) δ 7,67 (д, J=8,5 Гц, 4H), 7,63 (д, J=8,4 Гц, 4H), 6,07 (т, J=2,8 Гц, 2H), 5,54 (т, J=9,2 Гц, 2H), 5,19 (дд, J=9,4, 2,9 Гц, 2H), 5,13 (д, J=2,6 Гц, 2H), 4,32 (дд, J=12,2, 5,6 Гц, 2H), 4,19 (дд, J=12,2, 1,9 Гц, 2H), 3,87-3,79 (м, 2H), 1,28 (с, 36H), 1,19 (с, 18H), 1,15 (с, 18H).
Стадия II: Соединение 6
К суспензии [(2R,3R,4R,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-[4-[4-[(2R,3R,4R,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-(2,2-диметилпропаноилоксиметил)тетрагидропиран-2-ил]фенил]фенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноата (165 мг, 0,1433 ммоль) в МеОН (1,8 мл) добавляют раствор MeONa в MeOH (57,0 мкл, 0,5М, 0,287 ммоль), смесь перемешивают при КТ в течение 66 ч и гасят уксусной кислотой (50 мкл, 0,8792 ммоль). Реакционную смесь концентрируют и непосредственно загружают на 3 г C18 силикагельного картриджа с использованием ДМСО-CH2Cl2, сушат под вакуумом, очищают на картридже Biotage™ SNAP (С 18 силикагель, 25 г; элюирование с градиентом: CH3CN в воде, 0%- 50%, 12 CV) с получением указанного в заголовке соединения (30 мг, 0,0613 ммоль, 43%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,64 (д, J=8,4 Гц, 4H), 7,55 (д, J=8,2 Гц, 4H), 5,01 (д, J=3,5 Гц, 2H), 4,46 (т, J=3,3 Гц, 2H), 3,83 (д, J=4,7 Гц, 4H), 3,74 (т, J=8,1 Гц, 2H), 3,60 (дд, J=8,1, 3,1 Гц, 2H), 3,53-3,46 (м, 2H).
Пример 5. Получение соединения 7
(3-[(2R,3S,4R,5S,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]-N-[4-[[3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]бензоил]амино]фенил]бензамид)
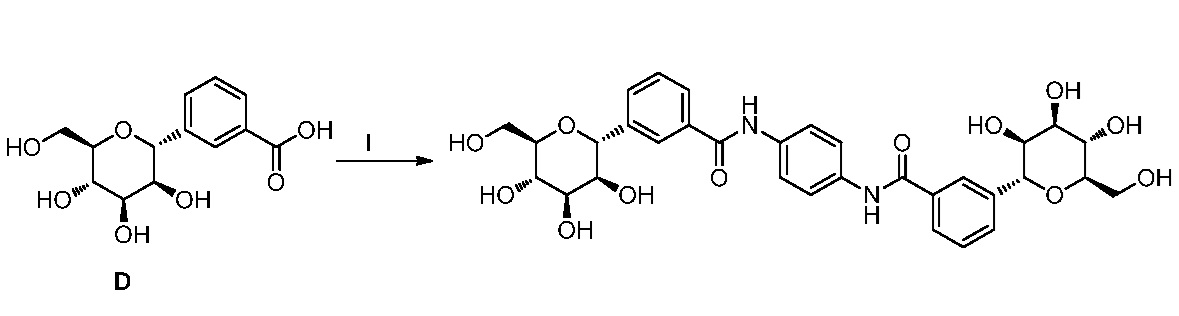
К раствору промежуточного соединения D (40 мг, 0,14 ммоль), бензол-1,4-диамина (7,6 мг, 0,07 ммоль) и HATU (69,20 мг, 0,18 ммоль) в ДМФА (350 мкл) добавляют триэтиламин (29 мкл, 0,21 ммоль), полученную реакционную смесь перемешивают при КТ в течение 18 часов. Смесь очищают с помощью ВЭЖХ с обращенной фазой (Phenomenex CI 8 Gemini AXIA Pack 5 мкм 110A 21,2×250 мм; элюирование с градиентом: 10 мин. 10% ACN/H2O+0,01% ТФУК, затем до 60% ACN+0,01% ТФУК в течение 20 мин, до 100% ACN в течение 5 мин, 100% ACN в течение 10 минут; общее время работы: 40 минут) с получением указанного в заголовке соединения (27,1 мг, 0,04 ммоль, 57,22%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,06 (с, 2H), 7,86 (д, J=7,8 Гц, 2H), 7,72 (д, J=7,0 Гц, 6H), 7,53 (т, J=7,8 Гц, 2H), 5,02 (д, J=4,4 Гц, 2H), 4,46-4,39 (м, 2H), 3,97-3,75 (м, 6H), 3,68 (дд, J=7,4, 3,0 Гц, 2H), 3,57 (тд, J=6,9, 3,0 Гц, 2H). ЖХ-МС: m/z=641,4 (М+Н+).
Пример 6. Получение соединений 8-16
Соединения 8-16 получают исходя из соответствующего диамина и промежуточного соединения D с использованием методики, описанной в примере 5.
|
|
Пример 7. Получение соединения 17
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[3-[(2R,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]оксифенил]тетрагидропиран-3,4,5-триол)
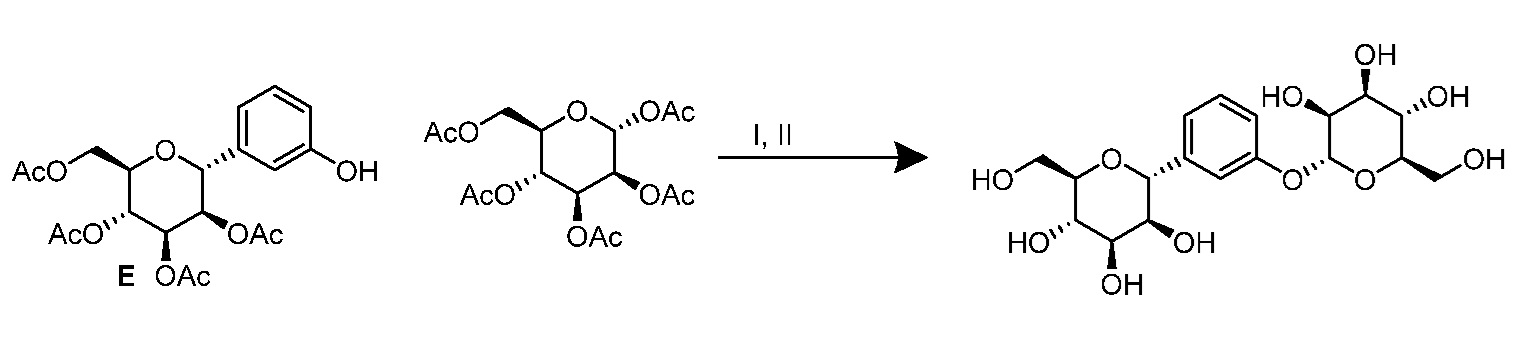
Стадия I: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[3-[(2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]оксифенил]тетрагидропиран-2-ил]метилацетат
К охлажденному (0°C) раствору (2R,3R,4R,5R,6R)-2-(ацетоксиметил)-6-(3-гидроксифенил)тетрагидро-2Н-пиран-3,4,5-триилтриацетата (100 мг, 0,2356 ммоль) и [(2R,3R,4S,5S,6R)-3,4,5,6-тетраацетокситетрагидропиран-2-ил]метилацетата (92 мг, 0,2356 ммоль) в CH2Cl2 (1,379 мл) при перешивании добавляют чистый BF3·OEt2 (100 мг, 0,7068 ммоль). Охлаждающую баню удаляют, смесь перемешивают при КТ в течение 15 минут, затем нагревают до 40°С и перемешивают при указанной температуре в течение 18 часов. Смесь охлаждают до КТ и выливают в водный раствор NaHCO3 (4 мл), полученную смесь перемешивают в течение 30 минут, водный раствор экстрагируют метиленхлоридом (2×4 мл). Объединенные экстракты сушат, концентрируют и очищают на картридже Biotage™ SNAP (силикагель, 25 г; элюирование с градиентом: EtOAc в гексанах, 30%-70%, 8 CV, 70%, CV 6) с получением указанного в заголовке соединения (130 мг, 0,1723 ммоль, 73,12%) в виде твердого не совсем белого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,41-7,33 (м, 1H), 7,23 (с, 1H), 7,19 (д, J=7,7 Гц, 1H), 7,10 (дд, J=8,2, 2,4 Гц, 1H), 5,92 (т, J=3,2 Гц, 1H), 5,59-5,52 (м, 2H), 5,45 (дд, J=3,5, 1,8 Гц, 1H), 5,39 (т, J=10,1 Гц, 1H), 5,32 (т, J=8,7 Гц, 1H), 5,13 (дд, J=8,9, 3,1 Гц, 1H), 5,07 (д, J=3,1 Гц, 1H), 4,43-4,35 (м, 1H), 4,34-4,26 (м, 1H), 4,21-4,04 (м, 3H), 3,88-3,75 (м, 1H), 2,21 (с, 3H), 2,165 (с, 3H), 2,153 (с, 3H), 2,064 (с, 3H), 2,06 (с, 3H), 2,049 (с, 3H), 2,04 (с, 3H), 2,037 (с, 3H).
Стадия II: Соединение 17
К раствору [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[3-[(2R,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]оксифенил]тетрагидропиран-2-ил]метилацетата (118 мг, 0,1564 ммоль) в МеОН (7 мл) при перемешивании добавляют MeONa (313 мкл, 0,5М, 0,1564 ммоль) и полученную реакционную смесь перемешивают при КТ в течение ночи. Добавляют ионообменную смолу Dowex 50 WX4-4 (Н+) [промытую несколько раз МеОН до получения бесцветной массы, высушенную] до достижения значения рН 5-6, смолу собирают фильтрацией и фильтрат концентрируют. Остаток растворяют в смеси CH3CN-вода, сушат вымораживанием с получением указанного в заголовке соединения (55 мг, 79%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,21 (т, J=8,0 Гц, 1H), 7,17 (с, 1H), 7,03 (д, J=7,2 Гц, 1H), 6,94 (дд, J=8,2, 2,4 Гц, 1H), 5,40 (д, J=1,7 Гц, 1H), 4,85 (д, J=3,3 Гц, 1H), 4,32 (т, J=3,3 Гц, 1H), 3,90 (дд, J=3,4, 1,8 Гц, 1H), 3,85-3,44 (м, 9H), 3,43-3,30 (м, 1H).
ЖХ-МС: m/z=491,2 (М+Н+).
Пример 8. Получение соединения 18
((2R,3S,4S,5S,6S)-2-(Гидроксиметил)-6-[4-[4-[1-[(2S,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]триазол-4-ил]фенил]триазол-1-ил]тетрагидропиран-3,4,5-триол)
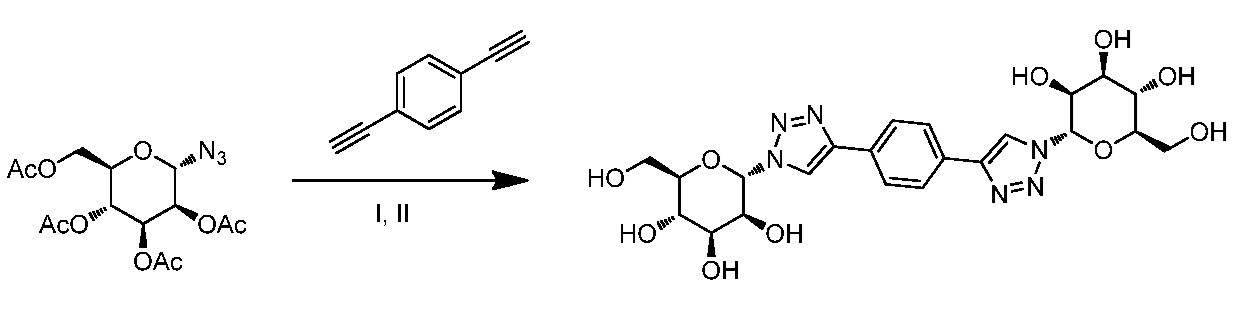
Стадия I: [(2R,3R,4S,5S,6S)-3,4,5-Триацетокси-6-[4-[4-[1-[(2S,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]триазол-4-ил]тетрагидропиран-2-ил]метилацетат
К раствору [(2R,3R,4S,5S,6S)-3,4,5-триацетокси-6-азидотетрагидропиран-2-ил]метилацетата (50 мг, 0,1339 ммоль) в ДМФА (5 мл) при перемешивании добавляют йодид меди (5,10 мг, 0,02678 ммоль) и DIPEA (25,95 мг, 35 мкл, 0,201 ммоль), полученную смесь продувают газообразным азотом. Реакционную смесь перемешивают при 80°С в течение 5 часов. Смесь охлаждают до КТ, выливают в воду, экстрагируют этилацетатом, объединенные экстракты промывают насыщенным раствором соли, сушат (Na2SO4) и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, 12 г; элюирование с градиентом: EtOAc в гексанах, 15%-80%) с получением указанного в заголовке соединения (20 мг, 34,2%) в виде твердого вещества светло-желтого цвета. ЖХ-МС: m/z=873,57 (М+Н+).
Стадия II: Соединение 18
К суспензии [(2R,3R,4S,5S,6S)-3,4,5-триацетокси-6-[4-[4-[1-[(2S,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]триазол-4-ил]тетрагидропиран-2-ил]метилацетата (20 мг, 0,02292 ммоль) в МеОН (1,000 мл) при перемешивании добавляют MeONa (45,84 мкл, 0,5 мкл, 0,02292 ммоль), суспензия становится прозрачной, и продукт выпадает из смеси в виде осадка. Реакционную смесь перемешивают при КТ в течение ночи, добавляют уксусную кислоту, смесь концентрируют, суспендируют в 0,5 мл MeOH, и продукт в виде твердого не совсем белого вещества собирают фильтрацией. Осадок промывают МеОН (0,5 мл) и сушат с получением указанного в заголовке соединения (10,5 мг, 79,4%) в виде твердого белого вещества. 1H ЯМР (400 МГц, ДМСО-D6) δ 8,66 (с, 2H), 7,95 (с, 4H), 6,04 (с, 2H), 5,32 (д, J=5,0 Гц, 2H), 5,08-4,96 (м, 4H), 4,58 (т, J=5,9 Гц, 2H), 3,95-3,86 (м, 2H), 3,75 (дд, J=10,9, 5,5 Гц, 2H), 3,65-3,56 (м, 2H), 3,55-3,36 (м, 6H). ЖХ-МС: m/z=537,42 (М+Н+).
Пример 9. Получение соединения 19
((2R,3S,4S,5S,6S)-2-(Гидроксиметил)-6-[4-[3-[1-[(2S,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]триазол-4-ил]фенил]триазол-1-ил]тетрагидропиран-3,4,5-триол)
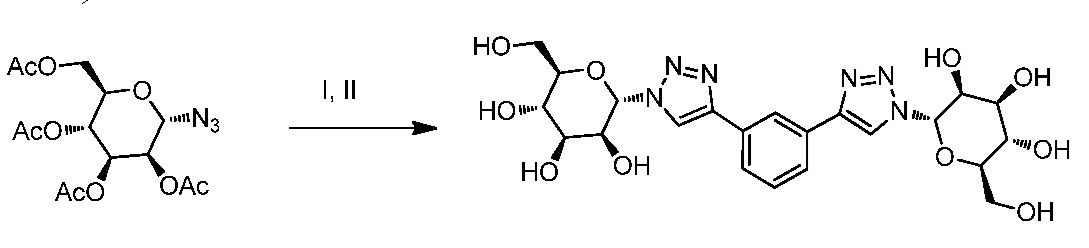
Стадия I: [(2R,3R,4S,5S,6S)-3,4,5-Триацетокси-6-[4-[3-[1-[(2S,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]триазол-4-ил]фенил]триазол-1-ил]тетрагидропиран-2-ил]метилацетат
К раствору [(2R,3R,4S,5S,6S)-4,5-диацетокси-2-(ацетоксиметил)-6-азидотетрагидропиран-3-ил]ацетата (96,6 мг, 0,259 ммоль) и 1,3-диэтинилбензола (11 мг, 0,087 ммоль) в EtOH (1,1 мл) и воде (275 мкл) при перемешивании последовательно добавляют CuSO4 (5,6 мг, 0,035 ммоль) и аскорбат натрия (12,3 мг, 0,07 ммоль) при КТ. Реакционную смесь перемешивают при КТ в течение уик-энда, затем разбавляют метиленхлоридом, фильтруют через фазоразделитель, водный раствор экстрагируют метиленхлоридом. Объединенные экстракты концентрируют, очищают на картридже Biotage™ SNAP (силикагель, 12 г; элюирование с градиентом: EtOAc в гексанах, 35%-75%, 15 CV, 75%, 9 CV) с получением указанного в заголовке соединения (69 мг, 90,7%) виде твердого белого вещества. 1H ЯМР (400 МГц, CDCl3) δ 8,34 (т, J=1,5 Гц, 1H), 8,07 (с, 2H), 7,89 (дд, J=7,8, 1,7 Гц, 2H), 7,55 (т, J=7,8 Гц, 1H), 6,10 (д, J=2,9 Гц, 2H), 6,06-6,02 (м, 2H), 5,97 (дд, J=8,8, 3,7 Гц, 2H), 5,40 (т, J=8,8 Гц, 2H), 4,42 (дд, J=12,5, 5,5 Гц, 2H), 4,13-4,05 (м, 2H), 3,99-3,92 (м, 2H), 2,20 (с, 6H), 2,11 (с, 6H), 2,09 (с, 6H), 2,08 (с, 6H).
Стадия II: Соединение 19
К раствору [(2R,3R,4S,5S,6S)-3,4,5-триацетокси-6-[4-[3-[1-[(2S,3S,4S,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]триазол-4-ил]фенил]триазол-1-ил]тетрагидропиран-2-ил]метилацетата (68 мг, 0,07791 ммоль) в МеОН (3,4 мл) при перемешивании добавляют MeONa (156 мкл, 0,5М, 0,078 ммоль) в МеОН. В течение часа начинает образовываться белый осадок. Реакционную смесь перемешивают при КТ в течение ночи. Белый осадок собирают фильтрацией, промывают сухим MeOH (2 мл) и сушат в вакууме с получением указанного в заголовке соединения в виде твердого белого вещества. 1H ЯМР (400 МГц, ДМСО-D6) δ 8,80 (с, 2H), 8,41 (с, 1H), 7,85 (дд, J=7,7, 1,6 Гц, 2H), 7,53 (т, J=7,8 Гц, 1H), 5,93 (д, J=4,5 Гц, 2H), 5,31 (д, J=5,4 Гц, 2H), 5,10 (д, J=5,2 Гц, 2H), 5,02 (д, J=5,4 Гц, 2H), 4,61 (т, J=5,8 Гц, 2H), 4,46 (дд, J=8,3, 4,8 Гц, 2H), 3,85 (дд, J=8,5, 6,5 Гц, 2H), 3,70-3,51 (м, 6H), 3,40 (тд, J=6,8, 3,0 Гц, 2H).
1H ЯМР (400 МГц, ДМСО-D6+D2O) δ 8,68 (с, 2H), 8,33 (с, 1H), 7,82 (дд, J=7,7, 1,5 Гц, 2H), 7,53 (т, J=7,8 Гц, 1H), 5,93 (д, J=4,1 Гц, 2H), 4,46 (т, J=3,7 Гц, 2H), 3,84 (дд, J=7,2, 3,3 Гц, 2H), 3,65-3,51 (м, 6H), 3,37-3,27 (м, 2H). ЖХ-МС: m/z=537,45 (М+Н+).
Пример 10. Получение соединения 20
((2R,2'R,3S,3'S,4S,4'S,5S,5'S,6S,6'S)-6,6'-(4,4'-((Проп-2-ин-1-илазандиил)бис(метилен))бис(1Н-1,2,3-триазол-4,1-диил))бис(2-(гидроксиметил)тетрагидро-2Н-пиран-3,4,5-триол)
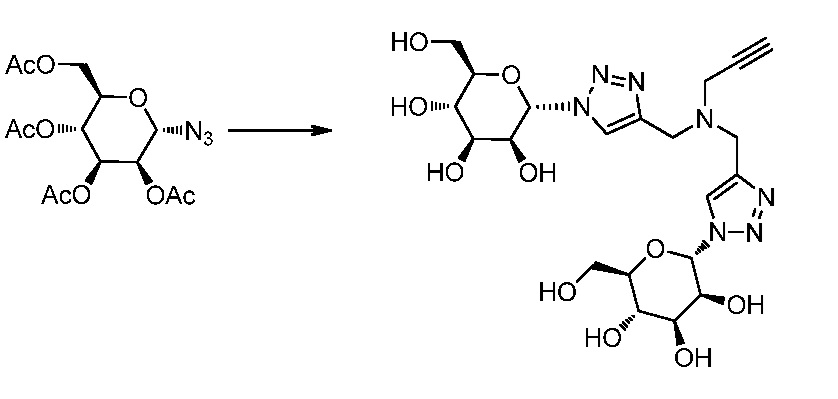
К раствору [(2R,3R,4S,5S,6S)-4,5-диацетокси-2-(ацетоксиметил)-6-азидотетрагидропиран-3-ил]ацетата (96,6 мг, 0,259 ммоль) и N,N-бис(проп-2-инил)проп-2-ин-1-амина (10,3 мг, 11 мкл, 0,0784 ммоль) в EtOH (966 мкл) и воде (242 мкл) последовательно добавляют CuSO4 (5,0 мг, 0,031 ммоль) и аскорбат натрия (11,1 мг, 0,0627 ммоль). Реакционную смесь перемешивают при КТ в течение 20 часов и затем упаривают досуха. Остаток очищают колоночной флэш-хроматографией (силикагель; элюирование с градиентом: МеОН в CH2Cl2, 2-20%) c получением 73 мг смеси целевого продукта, которую используют в следующей стадии без дополнительной очистки.
К раствору материала, полученного на предыдущей стадии, в МеОН (2 мл) добавляют MeONa (29 мкл, 0,5 М, 0,0146 ммоль) в МеОН. Реакционную смесь перемешивают при КТ в течение ночи, добавляют АсОН (1 мкл, 0,015 ммоль) и упаривают смесь досуха. Остаток очищают ВЭЖХ с обращенной фазой с получением 7 мг указанного в заголовке соединения. 1H ЯМР (400 МГц, CD3OD) δ 8,23 (с, 2H), 5,96 (с, 2H), 4,60 (с, 2H), 4,30 (с, 4H), 3,95 (дд, J=8,1, 3,2 Гц, 2H), 3,82 (с, 2H), 3,69 (м, 6H), 3,25 (м, 2H), 3,13 (с, 1H).
Пример 11. Получение соединения 21
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-(4-(1-((2S,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2H-пиран-2-ил)-1H-1,2,3-триазол-4-ил)фенил)тетрагидро-2H-пиран-3,4,5-триол)
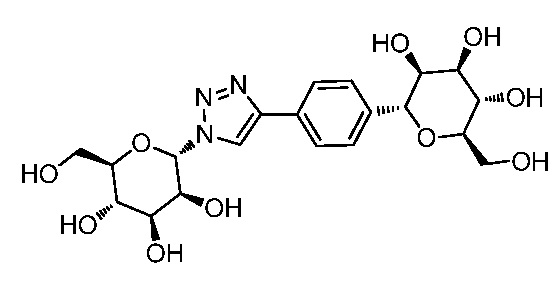
Указанное соединение получают из промежуточного соединения F и [(2R,3R,4S,5S,6S)-4,5-диацетокси-2-(ацетоксиметил)-6-азидотетрагидропиран-3-ил]ацетата в соответствии с методикой, описанной в примере 10. 1H ЯМР (400 МГц, ДМСО-D6) δ 8,66 (с, 1H), 7,80 (д, J=8,3 Гц, 2H), 7,44 (д, J=8,3 Гц, 2H), 5,88 (д, J=4,4 Гц, 1H), 4,68 (д, J=5,3 Гц, 1H), 4,41 (м, 1H), 4,03 (дд, J=5,3, 3,1 Гц, 1H), 3,81 (дд, J=6,7, 3,2 Гц, 1H), 3,66-3,46 (м, 6H), 3,46-3,28 (м, 3H). ЖХ-МС: m/z=470,36 (М+Н+).
Пример 12. Получение соединения 22 и соединения 23 (модифицированный способ D)
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[4-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этил]фенил]этил]тетрагидропиран-3,4,5-триол) и (2R,3S,4R,5S,6R)-2-(гидроксиметил)-6-[4-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]бутил]тетрагидропиран-3,4,5-триол)
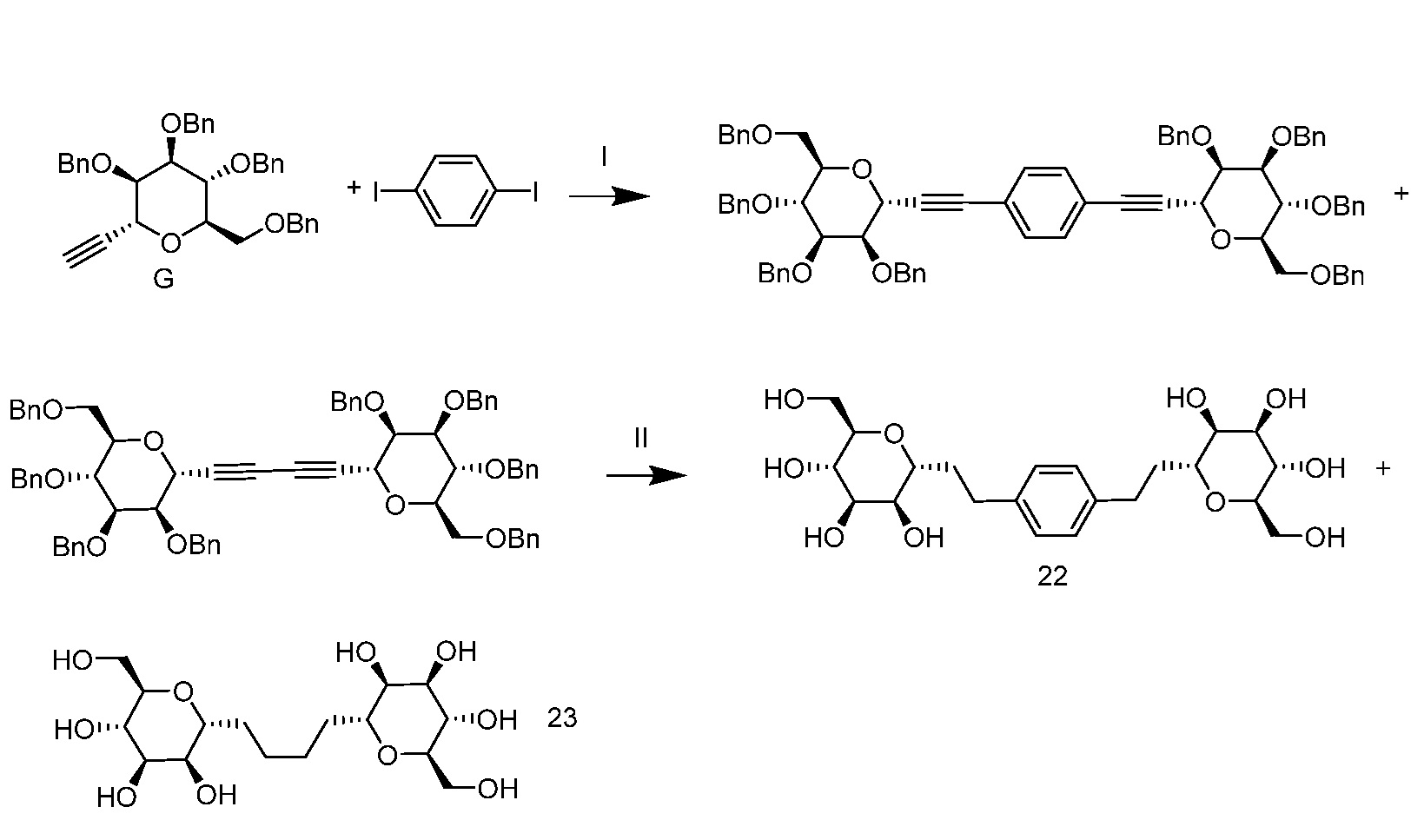
Стадия I:
К раствору промежуточного соединения G (104 мг, 0,1895 ммоль) в ТГФ (4 мл) добавляют 1,4-дийодбензол (27,8 мг, 0,0842 ммоль), PdCl2(dppf)-CH2Cl2 (3,5 мг, 0,0043 ммоль), CuI (3,2 мг, 0,0168 ммоль) и DIPEA (37 мкл, 0,2106 ммоль). Смесь перемешивают при 50°С в течение ночи в атмосфере азота. После удаления растворителя при пониженном давлении остаток разделяют на картридже Biotage™ SNAP (силикагель, 25 г; элюирование с градиентом: этилацетат в гексанах, 0-15%, 20 CV) с получением неразделимой смеси (2:1, 92 мг) (2R,3R,4R,5R,6R)-3,4,5-трибензилокси-2-(бензилоксиметил)-6-[2-[4-[2-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]этинил]фенил]этинил]тетрагидропирана и (2R,3R,4R,5R,6R)-3,4,5-трибензилокси-2-(бензилоксиметил)-6-[4-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]бута-1,3-диинил]тетрагидропирана, соответственно, которую используют в следующей стадии без дополнительной очистки.
ЖХ-МС: m/z=1193,9 (M+Na+). ЖХ-МС: m/z=1118,9 (M+Na+).
Стадия II: Соединение 22 и соединение 23
К раствору смеси (~2:1), полученной на стадии I (92 мг), в МеОН (5 мл) добавляют каталитическое количество 20% Pd(OH)2/C и каплю уксусной кислоты. Смесь гидрируют водородом из баллона и перемешивают при КТ в течение ночи. После фильтрации растворитель удаляют, и остаток очищают с помощью ВЭЖХ с обращенной фазой с получением соединения 22 (11 мг) и соединения 23 (9 мг), оба - в виде твердого белого вещества. Соединение 22: 1H ЯМР (400 МГц, CD3OD) δ 7,13 (с, 4H), 3,81 (м, 4H), 3,75-3,53 (м, 8H), 3,45 (м, 2H), 2,75 (м, 2H), 2,66-2,50 (м, 2H), 2,02 (м, 2H), 1,70 (м, 2H). ЖХ-МС: m/z=459,4 (М+Н+). Соединение 23: 1H ЯМР (400 МГц, CD3OD) δ 3,83 (д, 2H), 3,77 (м, 2H), 3,72-3,61 (м, 6H), 3,58 (м, 2H), 3,39 (м, 2H), 1,76 (м, 2H), 1,45 (м, 6H). ЖХ-МС: m/z=383,3 (M+H+).
Пример 13. Получение соединения 24
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[(E)-3-[4-[(E)-3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]проп-1-енил]фенил]аллил]тетрагидропиран-3,4,5-триол)
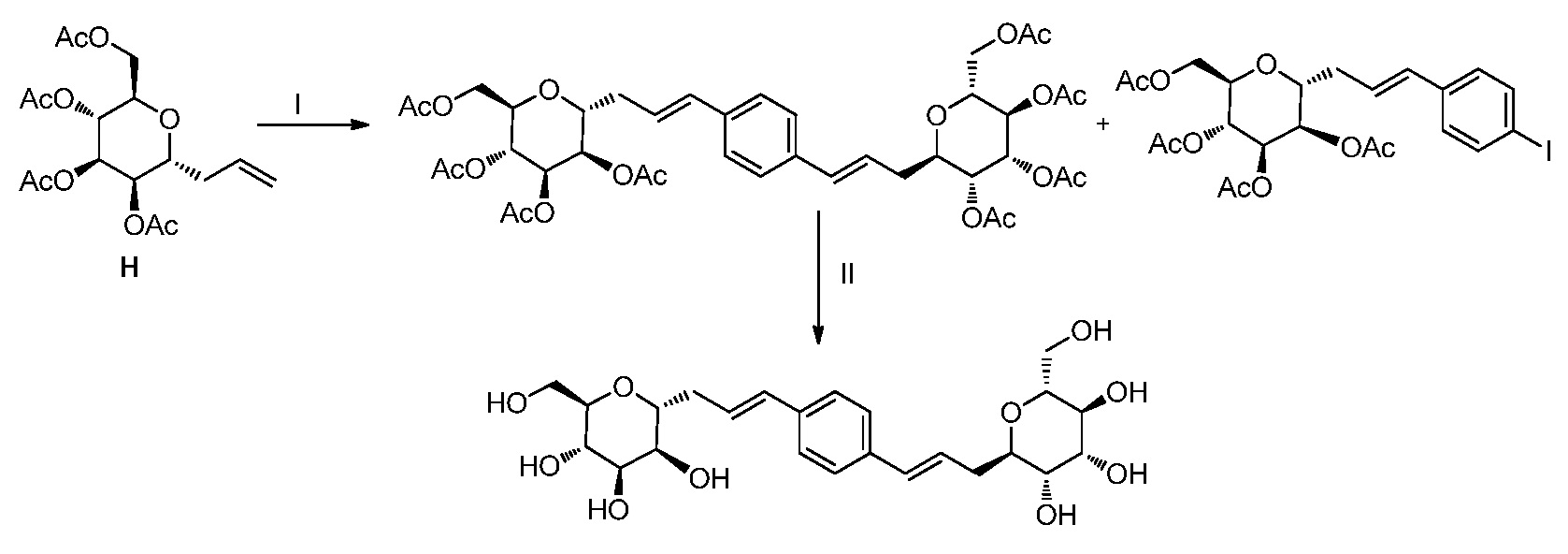
Стадия I: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[(Е)-3-[4-[(E)-3-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]проп-1-енил]фенил]аллил]тетрагидропиран-2-ил]метилацетат
К раствору промежуточного соединения H (112,9 мг, 0,303 ммоль) в ДМФА (1,5 мл) добавляют 1,4-дийодбензол (50 мг, 0,152 ммоль), ацетат палладия (3,4 мг, 0,0152 ммоль), бромид тетрабутиламмония (48,9 мг, 0,152 ммоль) и бикарбонат натрия (38,2 мг, 0,455 ммоль). Реакционную смесь нагревают до 85°С и выдерживают при указанной температуре в течение ночи в атмосфере N2, затем концентрируют и очищают на картридже Biotage™ SNAP (силикагель, 10 г; элюирование с градиентом: EtOAc в гексанах, 0-70%, 20 CV) с получением указанного в заголовке соединения (71 мг, выход 57%). ЖХ-МС: m/z=819,5 (М+Н+).
Кроме того, в качестве минорного соединения выделяют (2R,3R,4R,5R,6R)-2-(ацетоксиметил)-6-((Е)-3-(4-йодфенил)аллил)тетрагидро-2Н-пиран-3,4,5-триилтриацетат (33 мг, выход 20%). ЖХ-МС: m/z=575,3 (М+Н+).
Стадия II: Соединение 24
К раствору [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[(Е)-3-[4-[(E)-3-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]проп-1-енил]фенил]аллил]тетрагидропиран-2-ил]метилацетата (70 мг, 0,0855 ммоль) в МеОН (1,1 мл) при перемешивании добавляют 2 капли 25% масс./об. MeONa в MeOH. Реакционную смесь перемешивают при КТ в течение 3 часов. Смесь разбавляют МеОН и нейтрализуют смолой Amberlite 120 (H). Смолу удаляют фильтрацией, промывают MeOH, MeOH/H2O (2:1, об./об.), затем смесью диоксан/метанол (1:1, об./об.). Остаток бежевого цвета растирают с МеОН с получением 19 мг продукта, который снова очищают препаративной ВЭЖХ, получая (2R,3S,4R,5S,6R)-2-(гидроксиметил)-6-[(E)-3-[4-[(E)-3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]проп-1-енил]фенил]аллил]тетрагидропиран-3,4,5-триол (12,9 мг, выход 31%). 1H ЯМР (400 МГц, CD3OD) δ 7,21 (с, 4H), 6,38 (д, 2H), 6,28-6,10 (м, 2H), 3,88 (дд,2H), 3,76-3,59 (м, 8H), 3,55 (т, 2H), 3,43 (ддд, 2H), 2,62-2,46 (м, 2H), 2,48-2,30 (м, 2H). ЖХ-МС: m/z=483,4 (М+Н+).
Пример 14. Получение соединения 25
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[(E)-3-[3-[(E)-3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]проп-1-енил]фенил]аллил]тетрагидропиран-3,4,5-триол)
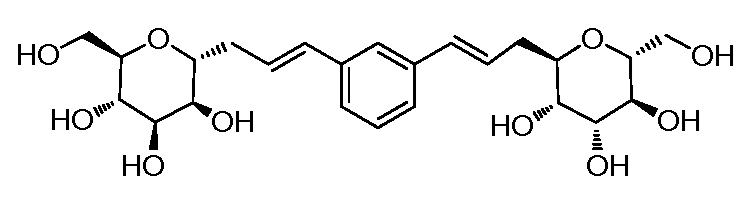
Соединение 25 получают в соответствии со способом получения соединения 24, описанным в примере 13, с использованием в качестве исходного соединения 1,3-дийодбензола вместо 1,4-дийодбензола. 1H ЯМР (400 МГц, CD3OD) δ 7,30 (с, 1H), 7,12 (д, 3H), 6,40 (д, 2H), 6,30-6,10 (м, 2H), 3,90 (с, 2H), 3,79-3,33 (м, 12H), 2,55 (д, 2H), 2,42 (дд, 2H).
ЖХ-МС: m/z=483,4 (М+Н+).
Пример 15. Получение соединений 26-33
Соединения 26-33 получают из промежуточного соединения H и подходящих производных 1,4-дийодбензола в соответствии с методикой, описанной в примере 14.
|
|
|
|
Пример 16. Получение соединения 34
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[(Е)-3-[4-[2-[4-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]этинил]фенил]аллил]тетрагидропиран-3,4,5-триол)
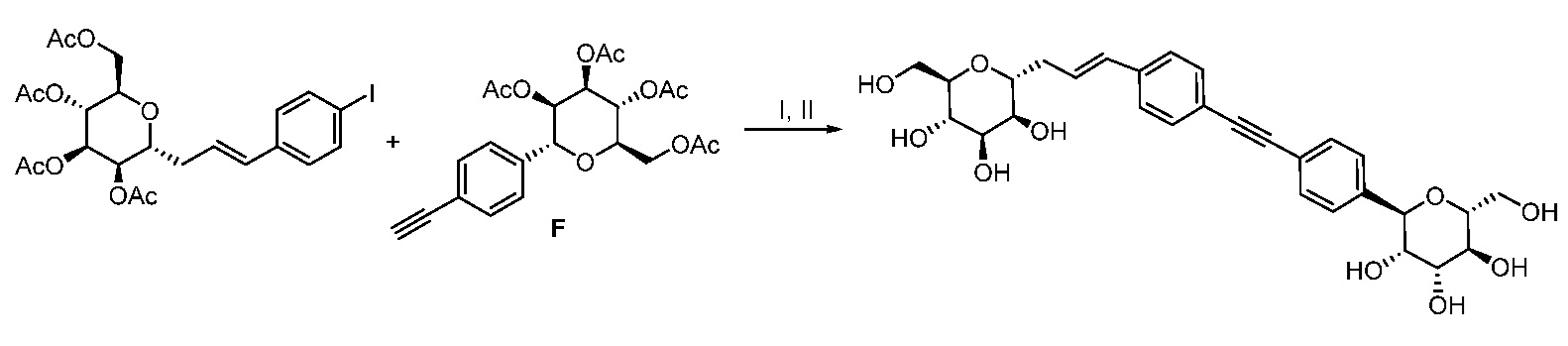
Стадия I: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[(Е)-3-[4-[2-[4-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]фенил]этинил]фенил]аллил]тетрагидропиран-2-ил]метилацетат
К смеси (2R,3R,4R,5R,6R)-2-(ацетоксиметил)-6-((Е)-3-(4-йодфенил)аллил)тетрагидро-2Н-пиран-3,4,5-триилтриацетата (33 мг, 0,057 ммоль), промежуточного соединения F (24,9 мг, 0,057 ммоль), Pd(dppf) (4,7 мг, 0,0057 ммоль), CuI (2,2 мг, 0,0115 ммоль) в ДМФА (660 мкл) добавляют NEt3 (24 мкл, 0,173 ммоль). Систему продувают азотом, смесь нагревают до 70°С и выдерживают при указанной температуре в течение ночи в атмосфере N2. Смесь разбавляют EtOAc и H2O, фильтруют через целит. Органическую фазу промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют, концентрируют и очищают на картридже Biotage™ SNAP (силикагель, 10 г; элюирование с градиентом: EtOAc в гексанах, 10-80%, 25 CV) c получением указанного в заголовке соединения (22 мг, 43,5%). ЖХ-МС: m/z=879,6 (М+Н+).
Стадия II: Соединение 34
К остатку, полученному на стадии I (22 мг, 0,025 ммоль), в МеОН (660 мкл) добавляют 2 капли раствора MeONa в MeOH (25% масс./об.). Реакционную смесь перемешивают при КТ в течение 2 часов, нейтрализуют смолой Amberlite 120(H). После фильтрации смолу промывают МеОН, и фильтрат упаривают досуха. Остаток очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (2,6 мг, 20%). 1H ЯМР (400 МГц, CD3OD) δ 7,49-7,37 (м, 4H), 7,32 (м, 4H), 6,43 (д, 1H), 6,36-6,21 (м, 1H), 5,39 (с, 2H), 4,30 (т, 1H), 3,90 (т, 1H), 3,82-3,31 (м, 10H), 2,57 (дд, 1H), 2,44 (дд, 1H). ЖХ-МС: m/z=543,4 (М+Н+).
Пример 17. Получение соединения 35 (способ F)
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]этинил]тетрагидропиран-3,4,5-триол)
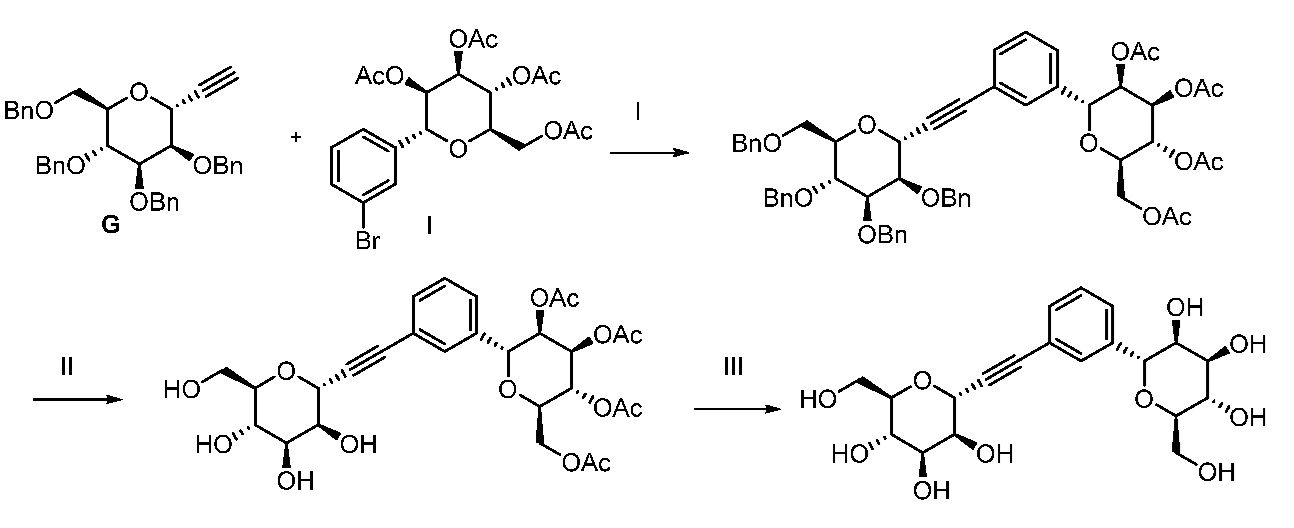
Стадия I: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[3-[2-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]этинил]фенил]тетрагидропиран-2-ил]метилацетат
К раствору промежуточного соединения G (160 мг, 0,2916 ммоль) в ДМФА (4 мл) добавляют промежуточное соединение I (113,7 мг, 0,2333 ммоль), PdCl2(dppf)-CH2Cl2 (9,5 мг, 0,0117 ммоль), CuI (8,9 мг, 0,0467 ммоль) и DIPEA (102 мкл, 0,5832 ммоль). Смесь перемешивают в атмосфере азота при 80°С. После удаления растворителя при пониженном давлении остаток разделяют на картридже Biotage™ SNAP (силикагель, 25 г; элюирование с градиентом: EtOAc в гексанах, 0-15%, 20 CV) с получением указанного в заголовке соединения (65 мг). ЖХ-МС: m/z=955,5 (М+Н+).
Стадия II: (2R,3R,4R,5R,6R)-2-(Ацетоксиметил)-6-(3-(((2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил)этинил)фенил)тетрагидро-2Н-пиран-3,4,5-триилтриацетат
К раствору [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[3-[2-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]этинил]фенил]тетрагидропиран-2-ил]метилацетата, полученного на стадии I, (20 мг, 0,0209 ммоль) в CH3CN (2 мл) добавляют TMSI (41,90 мг, 29,80 мкл, 0,2094 ммоль) в герметичной емкости. Смесь перемешивают при КТ в течение ночи. Смесь гасят каплями воды. После удаления растворителя при пониженном давлении остаток используют в следующей стадии без дополнительной очистки.
Стадия III: Соединение 35
К смеси со стадии II в МеОН (2 мл) добавляют каплю 25% MeONa в МеОН. Смесь перемешивают при КТ в течение 20 минут, затем нейтрализуют смолой Amberlite IR 120(H) и фильтруют. Фильтрат упаривают досуха, и остаток очищают с помощью препаративной ВЭЖХ с получением (2R,3S,4R,5S,6R)-2-(гидроксиметил)-6-[2-[3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]этинил]тетрагидропиран-3,4,5-триола (1,5 мг) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,51 (с, 1H), 7,45-7,35 (м, 1H), 7,28 (м, 2H), 4,82 (д, 1H), 4,76 (д, 1H), 4,24 (м, 1H), 3,91 (м, 1H), 3,84 (м, 1H), 3,80-3,75 (м, 2H), 3,74-3,69 (м, 2H), 3,67-3,60 (м, 2H), 3,58-3,46 (м, 2H), 3,41 (м,1H). ЖХ-МС: m/z=427,3 (М+Н+).
Пример 18. Получение соединения 36
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[4-[4-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]триазол-1-ил]фенил]тетрагидропиран-3,4,5-триол)
Стадия I: [(2R,3S,6S)-3-Ацетокси-6-[4-(трет-бутоксикарбониламино)фенил]-3,6-дигидро-2Н-пиран-2-ил]метилацетат
К раствору [(2R,3S,4R)-3,4-диацетокси-3,4-дигидро-2Н-пиран-2-ил]метилацетата (4 г, 14,69 ммоль) в CH3CN (35 мл) добавляют [4-(трет-бутоксикарбониламино)фенил]бороновую кислоту (6,965 г, 29,38 ммоль) и Pd(OAc)2 (494,6 мг, 2,203 ммоль). Смесь перемешивают при КТ в течение ночи и затем добавляют еще одну порцию [4-(трет-бутоксикарбониламино)фенил]бороновой кислоты (6,965 г, 29,38 ммоль) и Pd(OAc)2 (495 мг, 2,203 ммоль). Смесь перемешивают при КТ в течение ночи, затем разбавляют CH2Cl2 (35 мл) и фильтруют через слой целита. Фильтрат упаривают досуха при пониженном давлении, и остаток очищают на картридже Biotage™ SNAP (силикагель, 100 г; элиюрование с градиентом: EtOAc в гексанах 0-15%, 20 CV), с получением указанного в заголовке соединения (660 мг) в виде стекловидного твердого вещества.
Стадия II: ((2R,3S,6S)-3-Ацетокси-6-(4-аминофенил)-3,6-дигидро-2Н-пиран-2-ил)метилацетат
К раствору [(2R,3S,6S)-3-ацетокси-6-[4-(трет-бутоксикарбониламино)фенил]-3,6-дигидро-2Н-пиран-2-ил]метилацетата (303 мг, 0,7473 ммоль) в 1 мл CH2Cl2 добавляют ТФУК (1 мл, 12,98 ммоль). Смесь перемешивают при КТ в течение 20 минут. Растворитель удаляют при пониженном давлении, остаток растворяют в 10 мл CH2Cl2, промывают последовательно 10% раствором бикарбоната натрия (2 мл) и насыщенным раствором соли (5 мл), сушат над сульфатом натрия, фильтруют и упаривают досуха. Остаток используют в следующей стадии без дополнительной очистки. ЖХ-МС смеси показывает два продукта с одинаковой молекулярной массой. ЖХ-МС: m/z=306,4 (М+Н+).
Стадия III: [(2R,3S,6S)-3-Ацетокси-6-(4-азидофенил)-3,6-дигидро-2Н-пиран-2-ил]метилацетат
К раствору смеси со стадии II в 2 мл ACN добавляют t-BuONO (133 мкл, 1,121 ммоль) и TMSN3 (119 мкл, 0,8968 ммоль) при 0°С и затем перемешивают при КТ в течение часа. После удаления растворителя при пониженном давлении смесь очищают на картридже Biotage™ SNAP (силикагель, 25 г; элюрование с градиентом: EtOAc в гексанах 0-15%, 20 CV) с получением смеси (190 мг), содержащей указанное в заголовке соединение в виде масла, которое используют в следующей стадии без дополнительной очистки. ЖХ-МС: m/z=356,5 (M+Na+).
Стадия IV: ((2R,3S,6S)-3-Ацетокси-6-(4-(4-((2R,3R,4R,5R,6R)-3,4,5-трис(бензилокси)-6-((бензилокси)метил)тетрагидро-2Н-пиран-2-ил)-1Н-1,2,3-триазол-1-ил)фенил)-3,6-дигидро-2Н-пиран-2-ил)метилацетат
К раствору [(2R,3S,6S)-3-ацетокси-6-(4-азидофенил)-3,6-дигидро-2Н-пиран-2-ил]метилацетата (60 мг, 0,1811 ммоль) в ТГФ (5 мл) добавляют (2R,3R,4R,5R,6R)-3,4,5-трибензилокси-2-(бензилоксиметил)-6-этинилтетрагидропиран (99,4 мг, 0,1811 ммоль), CuI (6,9 мг, 0,0362 ммоль) и DIPEA (24 мг, 32 мкл, 0,1811 ммоль). Смесь перемешивают при 45°С в течение ночи в атмосфере азота. После удаления растворителя при пониженном давлении остаток разделяют на картридже Biotage™ SNAP (силикагель, 25 г; элиюрование с градиентом: EtOAc в гексанах, 0-45%, 20 CV) с получением смеси (142 мг), содержащей [(2R,3S,6S)-3-ацетокси-6-[4-[4-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил)триазол-1-ил)фенил)-3,6-дигидро-2Н-пиран-2-ил]метилацетат. ЖХ-МС: m/z=880,7 (М+Н+).
Стадия V: [(2R,3S,4R,5S,6R)-3-Ацетокси-4,5-дигидрокси-6-(4-(4-((2R,3R,4R,5R,6R)-3,4,5-трис(бензилокси)-6-((бензилокси)метил)тетрагидро-2Н-пиран-2-ил)-1Н-1,2,3-триазол-1-ил)фенил)тетрагидро-2Н-пиран-2-ил)метилацетат
К раствору [(2R,3S,6S)-3-ацетокси-6-[4-[4-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]триазол-1-ил)фенил)-3,6-дигидро-2Н-пиран-2-ил]метилацетата (160 мг, 0,1818 ммоль) в смеси вода (2 мл)/t-BuOH (4 мл) добавляют NMO (42,6 мг, 38 мкл, 0,3636 ммоль), 2,5% OsO4/t-BuOH (184,9 мг, 973 мкл, 0,0182 ммоль), метансульфонамид (25,9 мг, 0,2727 ммоль) и 2,6-лутидин (19,48 мг, 21 мкл, 0,1818 ммоль). Смесь перемешивают при КТ в течение 5 дней. После этого смесь разбавляют CH2Cl2 (10 мл), гасят 10% раствором бисульфита натрия (5 мл) и экстрагируют CH2Cl2 (3×10 мл). Объединенные органические экстракты сушат над сульфатом натрия, фильтруют и упаривают досуха. Остаток очищают на картридже Biotage™ SNAP (силикагель, 25 г; элиюрование с градиентом: МеОН в CH2Cl2, 0-5%, 20 CV) с получением смеси (150 мг) в виде масла ЖХ-МС: m/z=914,7 (М+Н+).
Стадия VI: соединение 36
К раствору смеси, полученной на стадии V, содержащей [(2R,3S,4R,5S,6R)-3-ацетокси-4,5-дигидрокси-6-[4-[4-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]триазол-1-ил]фенил]тетрагидропиран-2-ил]метилацетата (60 мг, 0,0657 ммоль), в МеОН (2 мл) добавляют одну каплю 25% MeONa/MeOH. Смесь перемешивают при КТ в течение 30 минут. Смесь нейтрализуют смолой Amberlite IR 120 (H), фильтруют и упаривают досуха. Остаток не очищают, но растворяют в МеОН (2 мл). Затем к раствору добавляют каталитическое количество 20% Pd(OH)2 и каплю уксусной кислоты. Смесь гидрируют водородом из баллона и перемешивают при КТ в течение ночи. После фильтрации растворитель удаляют при пониженном давлении, остаток очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (11 мг) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,47 (с, 1H), 7,78 (д, 2H), 7,62 (д, 2H), 5,10 (д, 1H), 4,91 (д, 1H), 4,45 (т, 1H), 4,28 (м, 1H), 3,91-3,58 (м, 7H), 3,55 (м, 1H), 3,47 (м, 1H), 3,41-3,33 (м, 1H). ЖХ-МС: m/z=470,4 (М+Н+).
Пример 19. Получение соединения 37
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]этил]тетрагидропиран-3,4,5-триол)
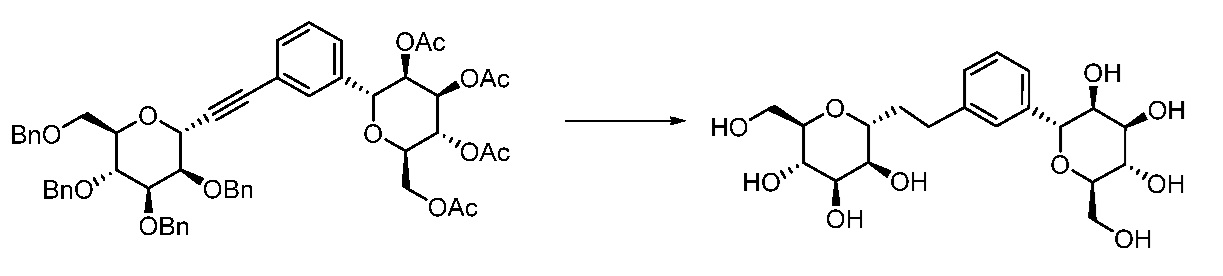
К раствору [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[3-[2-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]этинил]фенил]тетрагидропиран-2-ил]метилацетатацетата (пример 17, стади I) (32 мг, 0,0335 ммоль) в МеОН (2 мл) добавляют каплю 25% MeONa/MeOH. Смесь перемешивают при КТ в течение 30 минут. После этого смесь нейтрализуют смолой Amberlite IR 120 (H) и фильтруют. Фильтрат упаривают досуха, и остаток растворяют в МеОН (2 мл). Затем к раствору добавляют 20% Pd(OH)2/C и каплю уксусной кислоты. Смесь гидрируют с помощью водорода из баллона и перемешивают при КТ в течение ночи. После фильтрации смесь упаривают досуха, и остаток разделяют с помощью препаративной ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (11 мг) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,38 (с, 1H), 7,27 (д, 2H), 7,21-7,09 (м, 1H), 4,95 (д, 1H), 4,44 (т, 1H), 3,94-3,74 (м, 4H), 3,74-3,52 (м, 6H), 3,45 (м, 2H), 2,80 (м, 1H), 2,73-2,57 (м, 1H), 2,17-1,95 (м, 1H), 1,82-1,65 (м, 1H). ЖХ-МС: m/z=431,4 (М+Н+).
Пример 20. Получение соединения 38
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[3-[4-[3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]пропил]фенил]пропил]тетрагидропиран-3,4,5-триол
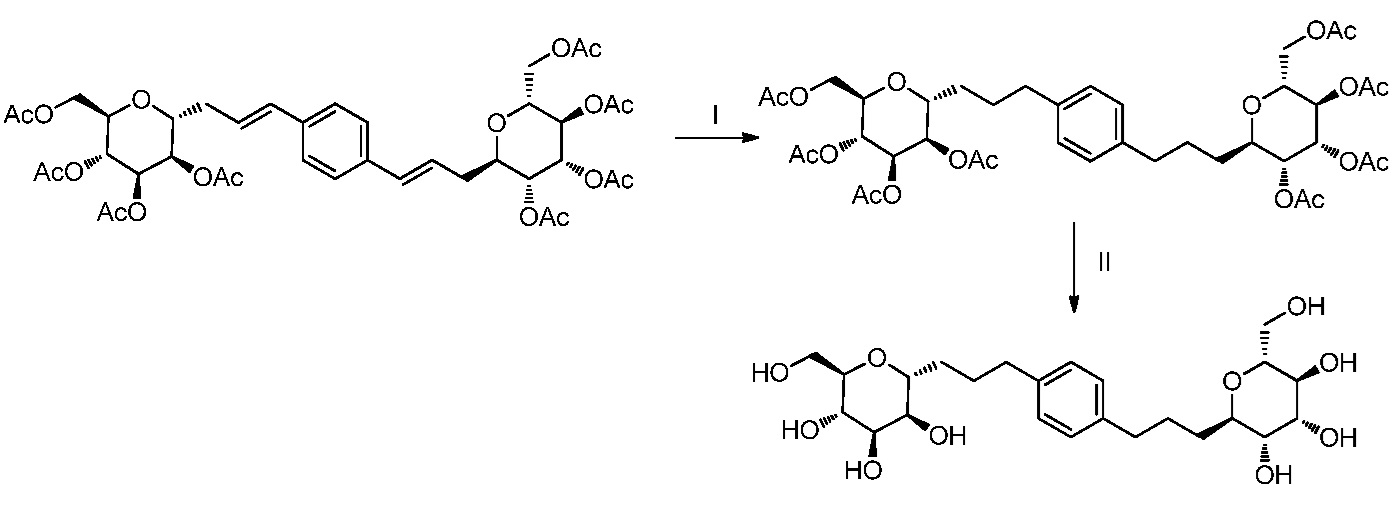
Стадия I: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[3-[4-[3-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]пропил]фенил]пропил]тетрагидропиран-2-ил]метилацетат
К [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[(Е)-3-[4-[(E)-3-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]проп-1-енил]фенил]аллил]тетрагидропиран-2-ил]метилацетату (пример 13, стадия I) (80 мг, 0,097 ммоль) в МеОН (2,4 мл) добавляют Pd(OH)2 (13,7 мг, 0,097 ммоль) и 1 каплю AcOH. Реакционную смесь гидрируют с помощью Н2 с давлением 1 атм. (101325 Па) в течение ночи. Реакционную смесь фильтруют через целит, промывают МеОН. Фильтрат концентрируют и очищают на картридже Biotage™ SNAP (силикагель, 10 г; элюирование с градиентом: EtOAc в гексанах, 15-100%) с получением указанного в заголовке соединения (36 мг, 44,8%). ЖХ-МС: m/z=823,7 (М+Н+).
Стадия II: Соединение 38
К раствору [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[3-[4-[3-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]пропил]фенил]пропил]тетрагидропиран-2-ил]метилацетата (36 мг, 0,097 ммоль) в МеОН (1,6 мл) добавляют каталитический MeONa (2 мкл, 25% масс./об., 0,0097 ммоль). Реакционную смесь перемешивают при КТ в течение 1 часа, затем нейтрализуют Amberlite IR120 (H). Смесь фильтруют, фильтрат концентрируют при пониженном давлении, и остаток очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (6,9 мг, 14%) 1H ЯМР (400 МГц, CD3OD) δ 7,00 (с, 4H), 3,80-3,72 (м, 2H), 3,67 (дд, 2H), 3,63-3,54 (м, 4H), 3,55-3,46 (м, 4H), 3,31-3,22 (м, 2H), 2,60-2,40 (м, 4H), 1,64 (ддд, 6H), 1,48-1,25 (м, 2H). ЖХ-МС: m/z=487,4 (М+Н+).
Пример 21. Получение соединения 39
(3-[(2R,3S,4R,5S,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]-N-[4-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]бензамид)
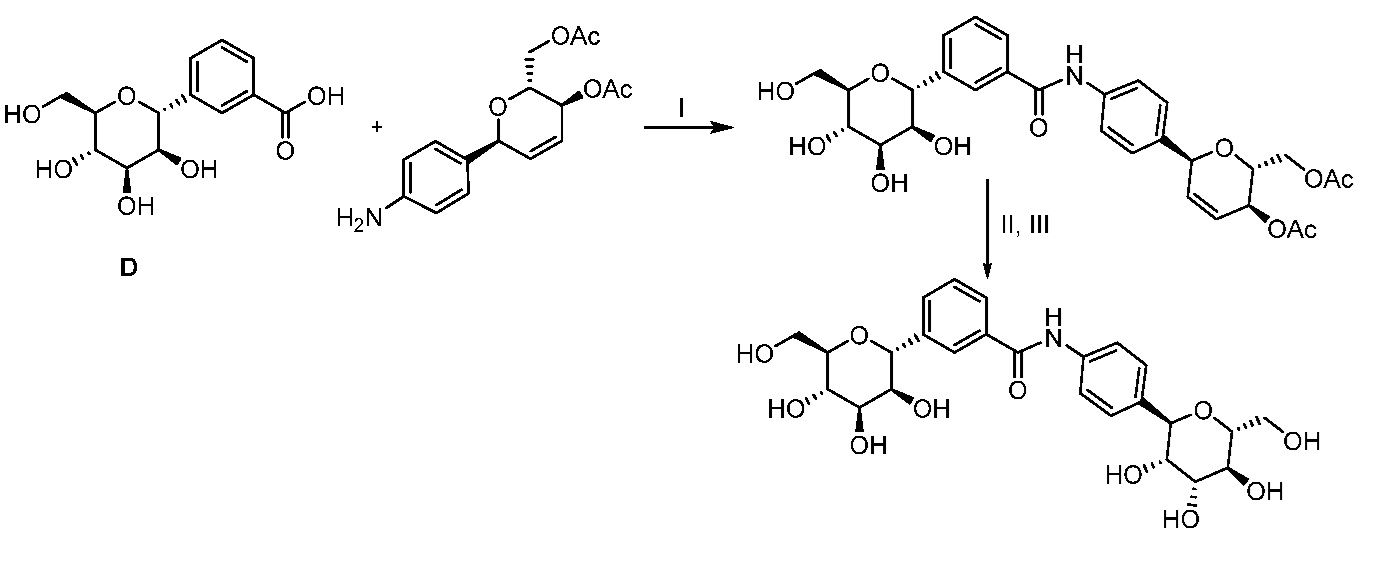
Стадия I: [(2R,3S,6R)-3-Ацетокси-6-[4-[[3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксимектил)тетрагидропиран-2-ил]бензоил]амино]фенил]-3,6-дигидро-2Н-пиран-2-ил]метилацетат
К смеси промежуточного соединения D (40,4 мг, 0,142 ммоль) и [(2R,3S,6S)-3-ацетокси-6-(4-аминофенил)-3,6-дигидро-2Н-пиран-2-ил]метилацетата (стадия II примера 18, 43,4 мг, 0,142 ммоль) в ДМФА (2,7 мл) добавляют 2,6-лутидин (49 мкл, 0,426 ммоль) с последующим добавлением HATU (59,4 мг, 0,156 ммоль) при 0°С. Реакционную смесь перемешивают при КТ в течение ночи, разбавляют EtOAc, промывают H2O и насыщенным раствором соли. Органическую фазу сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, 10 г; элюирование с градиентом: MeOH/CH2Cl2, 0-20%) с получением указанного в заголовке соединения (45 мг, 55% выход), которое используют в следующей стадии без дополнительной очистки, ЖХ-МС: m/z=572,4 (М+Н+).
Стадия II: [(2R,3S,4R,5S,6R)-3-Ацетокси-4,5-дигидрокси-6-[(4-[[3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]бензоил]амино]фенил]тетрагидропиран-2-ил]метилацетат
К раствору [(2R,3S,6R)-3-ацетокси-6-[4-[[3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксимектил)тетрагидропиран-2-ил]бензоил]амино]фенил]-3,6-дигидро-2Н-пиран-2-ил]метилацетата (45 мг, 0,0788 ммоль) в смеси вода (0,45 мл)/t-BuOH (0,45 мл) добавляют метансульфонамид (22,5 мг, 0,236 ммоль), 2,5% OsO4/t-BuOH (148,3, 0,012 ммоль), NMO (37 мг, 0,315 ммоль) и 2,6-лутидин (18 мкл, 0,157 ммоль). Смесь перемешивают при КТ в течение 2 дней, гасят 15%-ым раствором бисульфита натрия и разбавляют EtOAc. Водную фазу отделяют, органическую фазу промывают водой, насыщенным раствором соли и сушат над сульфатом натрия. Растворитель удаляют при пониженном давлении с получением указанного в заголовке соединения (29 мг, выход 36%). ЖХ-МС: m/z=606,4 (М+Н+).
Стадия III: Соединение 39
К раствору [(2R,3S,4R,5S,6R)-3-ацетокси-4,5-дигидрокси-6-[(4-[[3-(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]бензоил]амино]фенил]тетрагидропиран-2-ил]метилацетата (29 мг, 0,048 ммоль) в МеОН (0,45 мл) добавляют 2 капли раствора MeONa в МеОН (25% масс./об.). Реакционную смесь перемешивают при КТ в течение 1 часа, разбавляют МеОН, нейтрализуют смолой Amberlite 120 (H), фильтруют и сушат. Остаток очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (2,7 мг). 1H ЯМР (400 МГц, CD3OD) δ 7,96 (с, 1H), 7,77 (д, 1H), 7,64 (д, 2H), 7,58 (д, 1H), 7,49-7,31 (м, 3H), 4,9 (м, 2H), 4,36 (дд, 2H), 3,88-3,30 (м, 10H). ЖХ-МС: m/z=522,4 (М+Н+).
Пример 22. Получение соединения 40
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[(E)-3-[3-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]фенил]аллил]тетрагидропиран-3,4,5-триол)
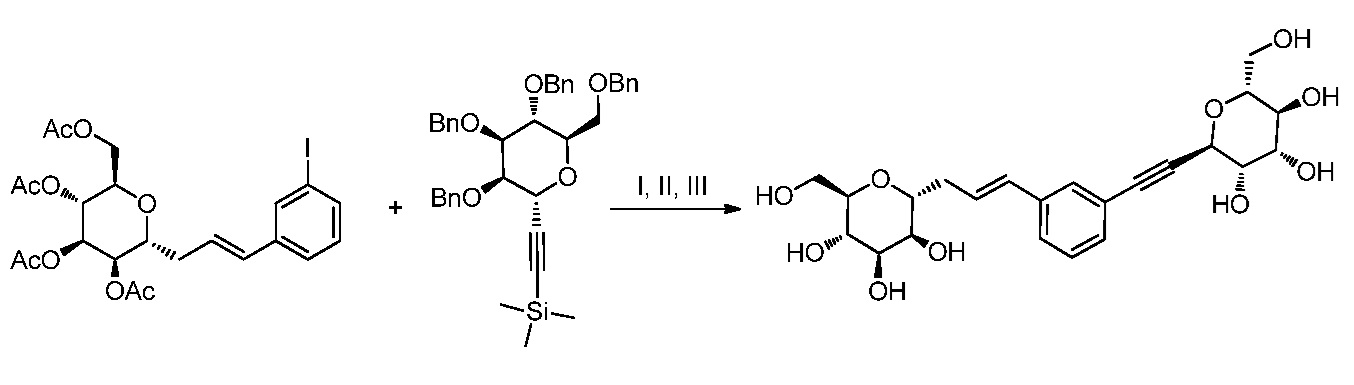
(2R,3R,4R,5R,6R)-2-(Ацетоксиметил)-6-((Е)-3-(3-йодфенил)аллил)тетрагидро-2H-пиран-3,4,5-триилтриацетат получают в соответствии с методикой, описанной в примере 13, используя 1,3-дийодбензол вместо 1,4-дийодбензола.
Стадия I: (2R,3R,4R,5R,6R)-2-(Ацетоксиметил)-6-((Е)-3-(3-(((2R,3R,4R,5R,6R)-3,4,5-трис(бензилокси)-6-((бензилокси)метил)тетрагидро-2Н-пиран-2-ил)этинил)фенил)аллил)тетрагидро-2Н-пиран-3,4,5-триилтриацетат
К смеси (2R,3R,4R,5R,6R)-2-(ацетоксиметил)-6-((Е)-3-(3-йодфенил)аллил)тетрагидро-2H-пиран-3,4,5-триилтриацетата (53 мг, 0,0923 ммоль), триметил-[2-[2-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]этинил]силана (стадия II примера получения промежуточного соединения G, 57,3 мг, 0,0923 ммоль), PdCl2(dppf)-CH2Cl2 (7,5 мг, 0,0092 ммоль) и CuI (3,5 мг 0,0185 ммоль) в ДМФА (1,1 мл) добавляют H2O(16,6 мкл, 0,923ммоль) и DBU (140,5 мг, 0,923 ммоль). Систему продувают азотом, смесь в атмосфере N2 нагревают до 70°С и выдерживают в указанных условиях в течение ночи. Реакционную смесь разбавляют этилацетатом и Н2О и фильтруют через целит. Органическую фазу промывают насыщенным раствором соли, сушат над Na2SO4, фильтруют, концентрируют и используют в следующей стадии без дополнительной очистки.
Стадия II: (2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[(E)-3-[3-[2-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]этинил]фенил]аллил]тетрагидропиран-3,4,5-триол
К остатку, полученному на стадии I (90 мг), в 2 мл МеОН добавляют 2 капли раствора MeONa в МеОН (25% масс./об.). Смесь выдерживают в течение 2 часа при КТ, после чего фильтрат нейтрализуют смолой Amberlite 120 (H), фильтруют и полученный фильтрат упаривают досуха. Остаток очищают на картридже Biotage™ SNAP (силикагель, 10 г; элюирование с градиентом: MeOH/CH2Cl2,0-20%, 20 CV) с получением указанного в заголовке соединения (44 мг, 59%). ЖХ-МС: m/z=827,6 (М+Н+).
Стадия III: Соединение 40
К раствору (2R,3S,4R,5S,6R)-2-(гидроксиметил)-6-[(E)-3-[3-[2-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]этинил]фенил]аллил]тетрагидропиран-3,4,5-триола (44 мг, 0,0532 ммоль) в CH3CN (1,3 мл) добавляют TMSI (68 мкл, 0,479 ммоль). Реакционную смесь перемешивают при КТ в течение ночи, гасят H2O (2 капли) и упаривают досуха. Остаток очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (4,2 мг, 15,7%). 1H ЯМР (400 МГц, CD3OD) δ 7,47 (с, 1H), 7,44-7,32 (м, 1H), 7,27 (дд, 2H), 6,48 (д, 1H), 6,42-6,24 (м, 1H), 4,84 (д,1H), 4,02-3,68 (м, 10H), 3,67-3,58 (м, 2H), 3,57-3,48 (м, 1H), 2,63 (дд, 1H), 2,49 (дд, 1H). ЖХ-МС: m/z=467,4 (М+Н+).
Пример 23. Получение соединения 41
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[[4-[4-[[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]метил]фенил]фенил]метил]тетрагидропиран-3,4,5-триол)
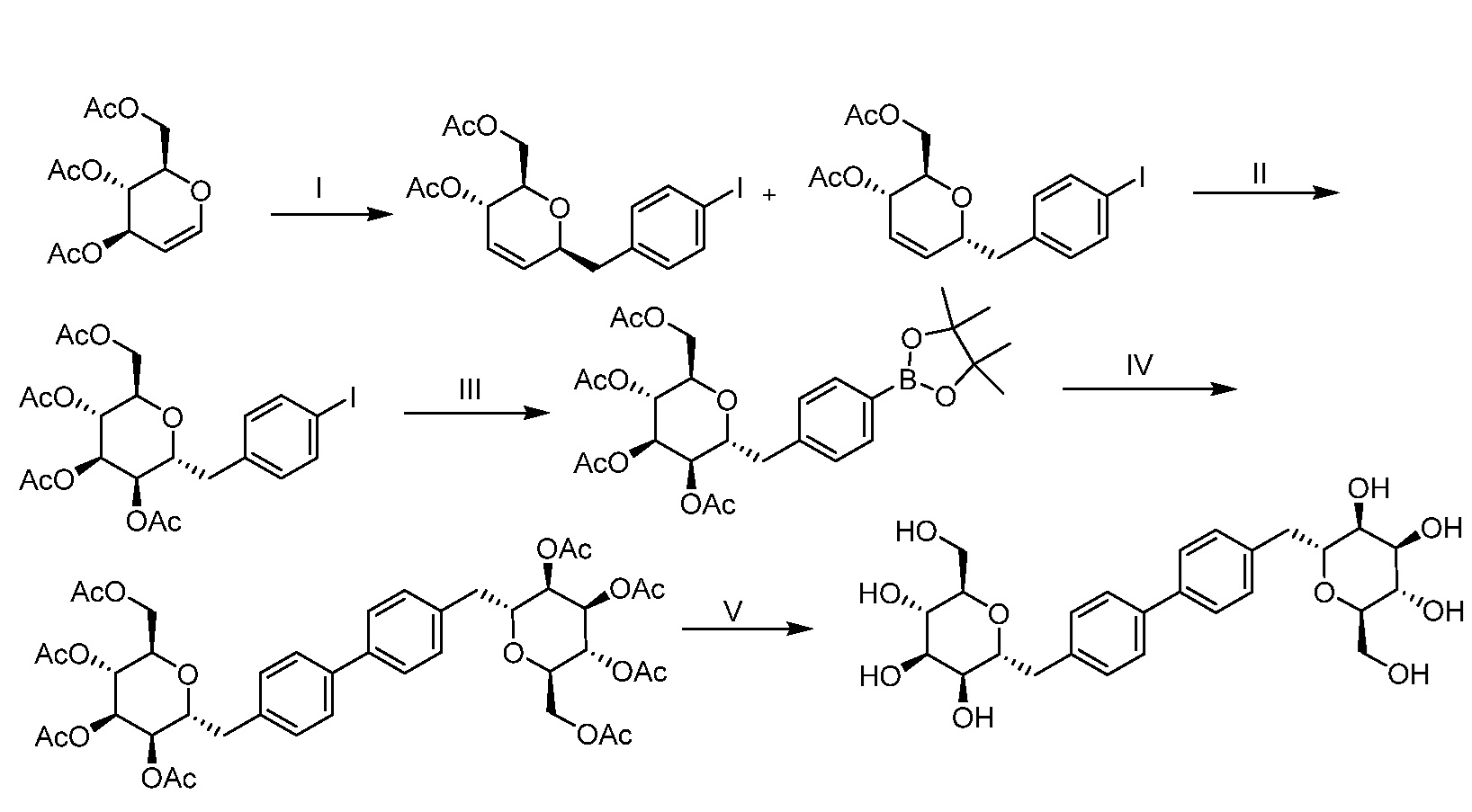
Стадия I: [(2R,3S,6S)-3-Ацетокси-6-[(4-йодфенил)метил]-3,6-дигидро-2Н-пиран-2-ил]метилацетат (β-изомер) и [(2R,3S,6R)-3-ацетокси-6-[(4-йодфенил)метил]-3,6-дигидро-2Н-пиран-2-ил]метилацетат (α-изомер)
К суспензии цинка Райка (Rieke) (4,80 мл, 10% масс./об., 7,35 ммоль) в ТГФ при 0°С по каплям в течение 20 минут добавляют раствор 1-(бромметил)-4-йодбензола (1,091 г, 3,674 ммоль) в ТГФ (2 мл). Реакционную смесь перемешивают при 0°С в течение 2 часов, после чего ТСХ показывает, что большая часть исходного вещества (бензилбромида) израсходована. Смесь нагревают до комнатной температуры, фильтруют в атмосфере азота через фритту в отдельную круглодонную колбу. ТГФ удаляют в токе азота при нагревании раствора на теплой водяной бане. Полученный темный остаток растворяют/суспендируют в CH2Cl2 (8 мл), охлаждают до -30°С, к полученной смеси добавляют [(2R,3S,4R)-3,4-диацетокси-3,4-дигидро-2Н-пиран-2-ил]метилацетат (500 мг, 1,837 ммоль) в виде твердого вещества с последующим добавлением BF3·OEt2 (1,433 г, 1,25 мл, 10,10 ммоль). Полученную реакционную смесь нагревают до 0°С и перемешивают при указанной температуре в течение 45 минут. ТСХ показывает, что весь исходный глюкаль израсходован. Смесь разбавляют CH2Cl2 и насыщенным раствором соли. Органическую фракцию выделяют на колоночном фазоразделителе, сушат (Na2SO4), фильтруют и концентрируют. Полученную сырую смесь очищают на картридже Biotage™ SNAP (силикагель, 50 г; элюирование с градиентом: EtOAc в гексанах, 10-20%). Вторую очистку смешанной фракции проводят с получением β-изомера (187 мг) и α-изомера (282 мг). ЖХ-МС: m/z=452,81 (M+Na+) для β-изомера. ЖХ-МС: m/z=452,77 (M+Na+) для α-изомера.
Стадия II: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[(4-йодфенил)метил]тетрагидропиран-2-ил]метилацетат
К раствору [(2R,3S,6R)-3-ацетокси-6-[(4-йодфенил)метил]-3,6-дигидро-2Н-пиран-2-ил]метилацетата (α-изомер, 282 мг, 0,616 ммоль) в трет-бутаноле (6 мл) и воде (2 мл) добавляют последовательно NMO (160 мг, 1,37 ммоль), метансульфонамид (90,0 мг, 0,946 ммоль), 2,6-диметилпиридин (75,0 мкл, 0,648 ммоль) и, наконец, OsO4 (300 мкл, 2,5% масс./об., 0,0295 ммоль). Реакционную смесь перемешивают при КТ в течение 24 часов, контролируя ход реакции с помощью ЖХ-МС. Реакционную смесь выливают в 10% раствор NaHSO3 и разбавляют EtOAc. Органический слой отделяют, промывают водой, насыщенным раствором соли, сушат над Na2CO3, фильтруют и концентрируют. Полученную сырую смесь очищают на картридже Biotage™SNAP (силикагель, 25 г; элюирование с градиентом: EtOAc в гексанах, 10-60%). Выделяют три фракции, из которых две последние фракции объединяют и подвергают перацетилированию в смеси пиридин/Ac2O в течение ночи при КТ. Смесь концентрируют, упаривают с толуолом дважды, и полученную сырую смесь очищают на картридже Biotage™ SNAP (силикагель, 10 г; элюирование с градиентом: EtOAc в гексанах, 10-50%) с получением указанного в заголовке соединения (204 мг, 63,1%), которое содержит 5% 2,3-альфа-диастереоизомера.
Стадия III: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]тетрагидропиран-2-ил]метилацетат
К раствору соединения, полученного на стадии II (112 мг, 0,204 ммоль), в ДМФА (3 мл) добавляют 4,4,5,5-тетраметил-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3,2-диоксаборолан (73 мг, 0,288 ммоль), ацетат калия (81 мг, 0,825 ммоль) и Pd(dppf)Cl2·CH2Cl2 (16 мг, 0,0196 ммоль). Полученную суспензию трижды дегазируют (вакуум, затем N2) и перемешивают при 70°С в течение 6 часов. Реакционную смесь выливают в насыщенный водный раствор NH4Cl и экстрагируют Et2O. Органическую фазу промывают водой (2х), насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Полученную сырую смесь очищают на картридже Biotage™ SNAP (силикагель, 10 г; элюирование с градиентом: EtOAc в гексанах, 10-40%) с получением указанного в заголовке соединения (83 мг, 72,6%).
Стадия IV: (2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[[4-[4-[[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]метил]фенил]фенил]метил]тетрагидропиран-2-ил]метилацетат
К раствору [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[(4-йодфенил)метил]тетрагидропиран-2-ил]метилацетата (91 мг, 0,166 ммоль) и [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[[(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]метил]тетрагидропиран-2-ил]метилацетата (83 мг, 0,148 ммоль) в диоксане (5 мл) добавляют K3PO4 (98 мг, 0,462 ммоль) и, наконец, Pd(dppf)Cl2·CH2Cl2 (10 мг). Реакционную смесь трижды дегазируют (вакуум, затем N2) и затем перемешивают при 80°С в течение 5 часов. Полученную смесь темно-коричневого цвета охлаждают до комнатной температуры, разбавляют 15 мл EtOAc и фильтруют через слой силикагеля. Силикагель промывают EtOAc (2×15 мл). Объединенные фракции концентрируют, и остаток очищают на колонке Biotage™ SNAP (силикагель, 10 г; элюирование с градиентом: EtOAc в гексанах, 10-80%) с получением указанного в заголовке соединения (26 мг).
Стадия V: Соединение 41
К раствору [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[[4-[4-[[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]метил]фенил]фенил]метил]тетрагидропиран-2-ил]метилацетата (26 мг, 0,031 ммоль) в МеОН (1 мл) добавляют раствор MeONa в МеОН (60 мкл, 0,5М, 0,030 ммоль). Реакционную смесь перемешивают при КТ в течение 12 часов. Реакционную смесь гасят уксусной кислотой (2,0 мкл, 0,035 ммоль), затем концентрируют и очищают с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (12 мг, 76,2%). 1H ЯМР (400 МГц, CD3OD) δ 7,54 (д, J=8,2 Гц, 4H), 7,34 (д, J=8,2 Гц, 4H), 4,16-4,07 (м, 2H), 3,87-3,76 (м, 6H), 3,76-3,61 (м, 6H), 3,07 (дд, J=14,0, 8,3 Гц, 2H), 2,94 (дд, J=14,0, 6,8 Гц, 2H). ЖХ-МС: m/z=507,46 (М+Н+).
Пример 24. Получение соединения 42
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[1-[(2S,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]триазол-4-ил]тетрагидропиран-3,4,5-триол)
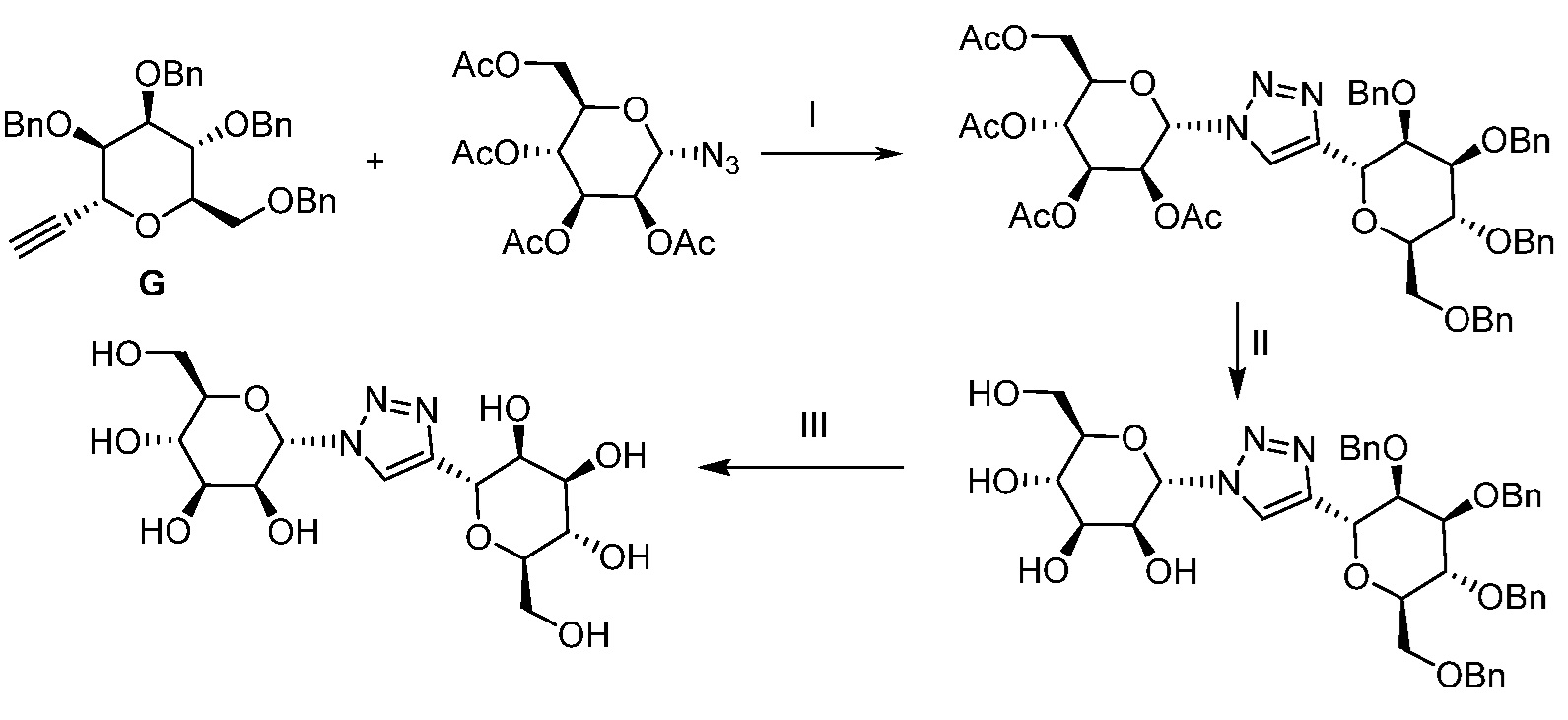
Стадия I: [(2R,3R,4S,5S,6R)-2-(Триацетокси)-6-[4-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]триазол-1-ил]тетрагидропиран-2-ил]метилацетат
К смеси промежуточного соединения G (76 мг, 0,1386 ммоль) и [(2R,3R,4S,5S,6S)-4,5-диацетокси-2-(ацетоксиметил)-6-азидотетрагидропиран-3-ил]ацетата (70 мг, 0,1875 ммоль) в этаноле (1 мл) и воде (250 мкл) одной порцией добавляют CuSO4 (11 мг, 0,0689 ммоль) и аскорбат натрия (22 мг, 0,1249 ммоль). Полученную реакционную смесь перемешивают в течение 30 минут, добавляют дополнительное количество этанола (1 мл), перемешивают смесь при КТ в течение 24 часов, разбавляют водой и экстрагируют метиленхлоридом. Объединенные экстракты сушат, концентрируют, очищают на картридже Biotage™ SNAP (силикагель, 12 г; элюирование с градиентом: EtOAc в гексанах, 15%-50%) с получением указанного в заголовке соединение (80 мг, 0,08677 ммоль, 59,84%) в виде твердого белого вещества. Rf=0,36 (50% EtOAc в гексанах). 1H ЯМР (400 МГц, CDCl3) δ 7,64 (с, 1H), 7,40 (дд, J=7,7, 1,5 Гц, 2H), 7,37-7,21 (м, 16H), 7,17-7,09 (м, 2H), 5,98 (дд, J=3,6, 2,7 Гц, 1H), 5,95-5,88 (м, 2H), 5,36 (т, J=9,1 Гц, 1H), 5,32 (д, J=2,8 Гц, 1H), 4,82 (д, J=11,0 Гц, 1H), 4,77 (с, 2H), 4,69-4,53 (м, 5H), 4,48 (д, J=11,0 Гц, 1H), 4,35 (дд, J=12,5, 5,3 Гц, 1H), 4,03 (дд, J=12,5, 2,5 Гц, 1H), 3,96 (т, J=8,7 Гц, 1H), 3,86-3,77 (м, 2H), 3,76-3,71 (м, 2H), 3,69-3,62 (м, 1H), 2,19 (с, 3H), 2,07 (с, 3H), 2,05 (с, 3H), 2,05 (с, 3H).
Стадия II: (2R,3S,4S,5S,6S)-2-(Гидроксиметил)-6-[4-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]триазол-1-ил]тетрагидропиран-3,4,5-триол
К раствору [(2R,3R,4S,5S,6S)-3,4,5-триацетокси-6-[4-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]триазол-1-ил]тетрагидропиран-2-ил]метилацетата (80 мг, 0,0868 ммоль) в MeOH (4 мл) при перемешивании добавляют раствор MeONa в MeOH (185 мкл, 0,5М, 0,0925 ммоль). Реакционную смесь перемешивают при КТ в течение ночи, нейтрализуют уксусной кислотой (10 мкл, 0,176 ммоль), 1/4 реакционной смеси (1 мл) концентрируют, сушат вымораживанием со смесью CH3CN-вода с получением указанного в заголовке соединения (16 мг, 0,0191 ммоль, 88,1%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,05 (с, 1H), 7,37-7,11 (м, 20H), 5,97 (д, J=2,7 Гц, 1H), 5,24 (д, J=4,1 Гц, 1H), 4,73-4,45 (м, 10H), 4,42 (дд, J=4,0, 2,5 Гц, 1H), 4,04 (дд, J=8,5, 3,5 Гц, 1H), 3,98-3,89 (м, 2H), 3,81-3,63 (м, 6H). ЖХ-МС: m/z=754,58 (М+Н+).
Стадия III: Соединение 42
К раствору (2R,3S,4S,5S,6S)-2-(гидроксиметил)-6-[4-[(2R,3R,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]триазол-1-ил]тетрагидропиран-3,4,5-триола в МеОН (3 мл) и уксусной кислоте (40 мкл, 0,703 ммоль) добавляют дигидроксипалладий (50 мг, 0,0712 ммоль), смесь перемешивают в атмосфере водорода при давлении 1 атм. (101325 Па) в течение 48 часов и фильтруют через целит. Фильтрат концентрируют и очищают препаративной ВЭЖХ (Phenomenex С18 8 Gemini AXIA 5 мкм 110A, 21,2×75 мм; от 0% ACN/H2O+0,01% ТФУК до 30% ACN+0,01% ТФУК в течение 40 минут, до 100% ACN в течение 1 минуты) с получением указанного в заголовке соединения (7,4 мг, 0,0169 ммоль, 26%) в виде твердого не совсем белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,18 (с, 1H), 6,03 (д, J=2,7 Гц, 1H), 5,14 (д, J=2,3 Гц, 1H), 4,72-4,67 (м, 1H), 4,48 (т, J=2,8 Гц, 1H), 4,06 (дд, J=8,5, 3,5 Гц, 1H), 3,86-3,65 (м, 7H), 3,45-3,33 (м, 2H).
Пример 25. Получение соединения 43
(2-[(2R,3S,4R,5S,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]-N-4-[[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]ацетил]амино]фенил]ацетамид)
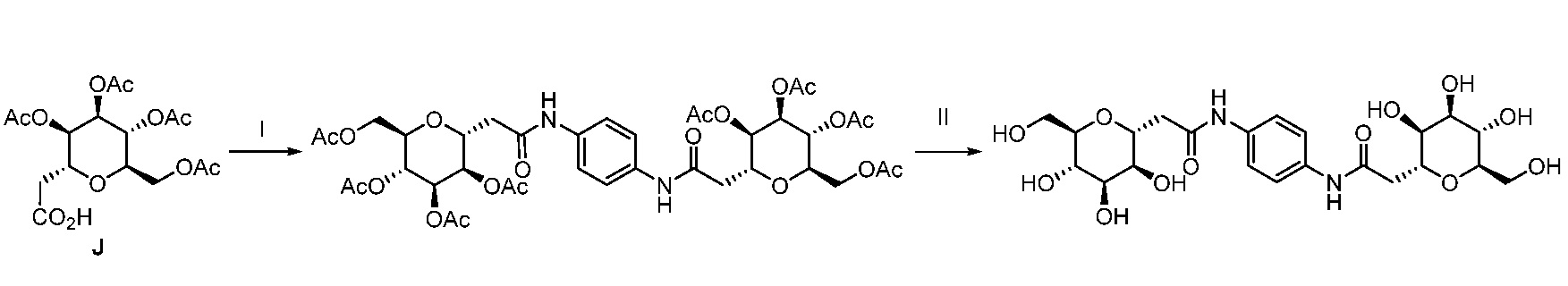
Стадия I: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[2-оксо-2-[4-[[2-[(2R,3R,4R,5R,6R)]-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]ацетил]амино]анилино]этил]тетрагидропиран-2-ил]метилацетат
К раствору промежуточного соединения J (128 мг, 0,328 ммоль) в 3,5 мл ДМФА в атмосфере азота последовательно добавляют бензол-1,4-диамин (14,2 мг, 0,131 ммоль), DIPEA (69 мкл, 0,394 ммоль) и HATU (125 мг, 0,328 ммоль). Реакционную смесь перемешивают при КТ в течение 20 часов и разбавляют водой (10 мл). Реакционную смесь экстрагируют EtOAc (5×10 мл), объединенный органический слой промывают водой (3×5 мл), насыщенным раствором соли (5 мл), сушат над Na2SO4, фильтруют и упаривают досуха. Остаток очищают колоночной флэш-хроматографией (силикагель; элюирование с градиентом: МеОН в CH2Cl2, 0-20%) с получением указанного в заголовке соединения (116,5 мг), которое используют в следующей стадии без дополнительной очистки.
Стадия II: Соединение 43
К раствору [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[2-оксо-2-[4-[[2-[(2R,3R,4R,5R,6R)]-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]ацетил]амино]анилино]этил]тетрагидропиран-2-ил]метилацетата (116,5 мг) в МеОН (2,3 мл) добавляют раствор MeONa в МеОН (68 мкл, 0,5М, 0,034 ммоль). Смесь перемешивают при КТ в течение 3 часов. Добавляют АсОН (2 мкл, 0,034 ммоль) и смесь упаривают досуха. Остаток очищают с помощью препаративной ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (34,3 мг, 43% для двух последних стадий). 1H ЯМР (400 МГц, ДМСО-D6) δ 9,76 (д, J=8,8 Гц, 2H), 7,43 (с, 4H), 4,77 (с, 2H), 4,64 (с, 2H), 4,54 (с, 2H), 4,29 (с, 2H), 4,09 (м, 2H), 3,50 (с, 8H), 3,43 (с, 2H), 3,36 (м, 2H), 2,51 (м, 4H).
Пример 26. Получение соединения 44
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[3-[3-[3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенокси]пропокси]фенил]тетрагидропиран-3,4,5-триол)
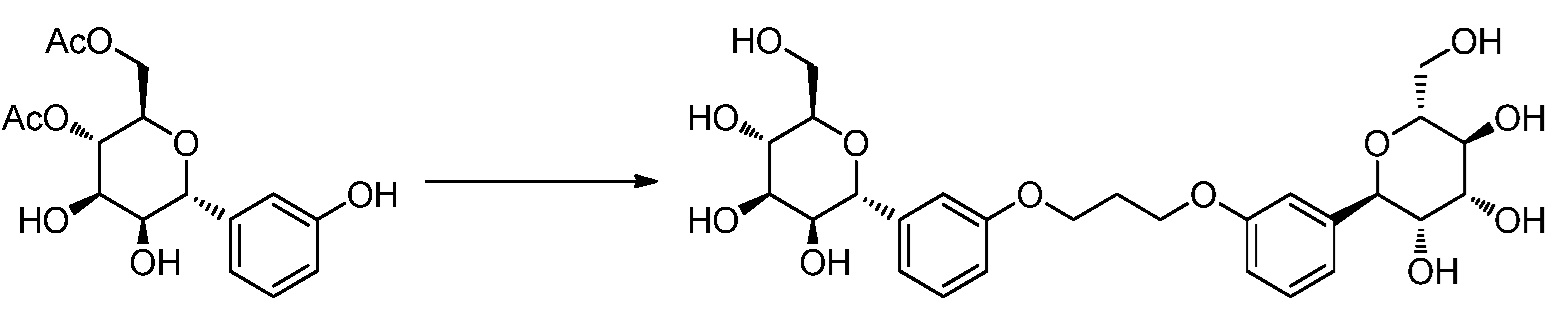
К раствору [(2R,3S,4R,5S,6R)-3-ацетокси-4,5-дигидрокси-6-(3-гидроксифенил)тетрагидропиран-2-ил]метилацетата (50 мг, 0,147 ммоль) в ДМФА (1 мл) добавляют Cs2CO3 (71,81 мг, 0,22 ммоль) с последующим добавлением 3-дийодпропана (10 мкл, 0,088 ммоль). Реакционную смесь выдерживают при 55°С в течение ночи, фильтруют и концентрируют. К полученному остатку в МеОН (1 мл) добавляют каталитическое количество раствора MeONa в МеОН (8 мкл, 25% масс./об., 0,037 ммоль). Реакционную смесь перемешивают при КТ в течение 1 часа и нейтрализуют Amberlite IR120 (H). Смесь фильтруют, фильтрат концентрируют при пониженном давлении, и остаток очищают с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (4,8 мг, 10,8%). 1H ЯМР (400 МГц, CD3OD) δ 7,17 (т, 2H), 7,01 (с, 2H), 6,92 (д, 2H), 6,76 (д, 2H), 4,84 (м, 2H), 4,32 (т, 2H), 4,09 (т, 4H), 3,82-3,66 (м, 4H), 3,61 (т, 2H), 3,48 (дд, 2H), 3,44-3,31 (м, 2H), 2,22-2,08 (м, 2H). ЖХ-МС: m/z=553,4 (М+Н+).
Пример 27. Получение соединения 45
(N-[(2R,3R,4R,5S,6R)-4,5-Дигидрокси-6-(гидроксиметил)-2-[4-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]триазол-1-ил]тетрагидропиран-3-ил]ацетамид)
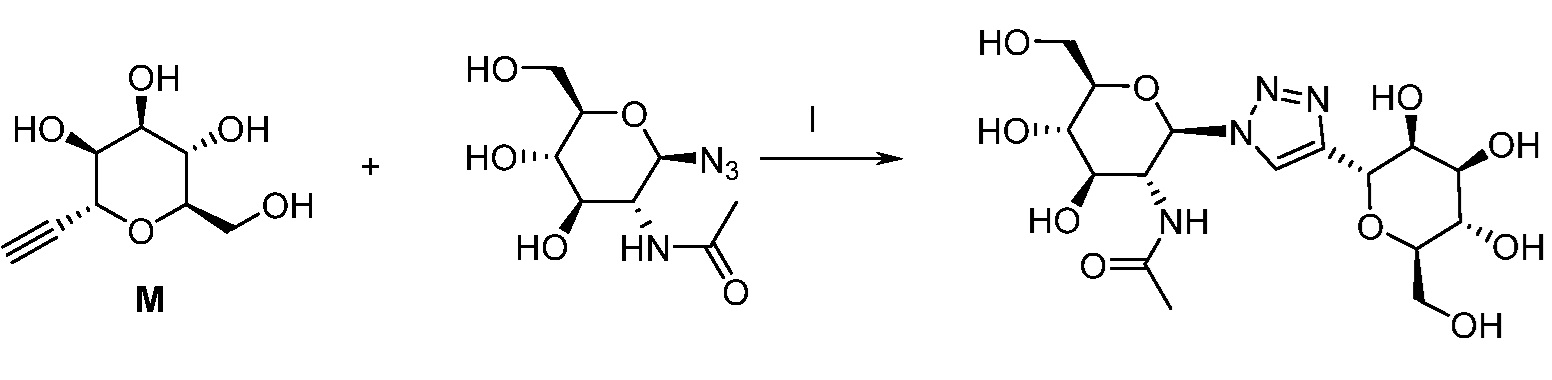
К раствору промежуточного соединения М (15 мг, 0,0797 ммоль) и N-((2R,3R,4R,5S,6R)-2-азидо-4,5-дигидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-3-ил)ацетамида (20 мг, 0,0812 ммоль) в этаноле (0,4 мл) и воде (0,1 мл) последовательно добавляют CuSO4 (6,0 мг, 0,0376 ммоль) и аскорбат натрия (15 мг, 0,0757 ммоль) при КТ. Реакционную смесь перемешивают при КТ в течение 24 часов, разбавляют водой и метанолом и фильтруют. Фильтрат концентрируют и очищают препаративной ВЭЖХ (Phenomenex C18 Gemini AXIA Pack 5 мкм 110 A, 21,2×250 мм; элюирование с градиентом: ACN+0,1% муравьиной кислоты 0%-40% в течение 40 минут, до 100% ACN в течение 5 минут, 100% ACN в течение 5 минут) с получением указанного в заголовке соединения (5 мг, 14%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,10 (с, 1H), 5,66 (д, J=9,8 Гц, 1H), 5,00 (д, J=2,1 Гц, 1H), 4,38-4,35 (м, 1H), 4,13 (т, J=10,0 Гц, 1H), 3,71-3,42 (м, 10H), 1,69 (с, 3H). ЖХ-МС: m/z=435,32 (М+Н+).
Пример 28. Получение соединения 46 и соединения 47 (способ B)
((2R,3S,4S,5S,6S)-2-(Гидроксиметил)-6-[5-[(2S,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]-2-тиенил]тетрагидропиран-3,4,5-триол) и ((2R,3S,4R,5S,6R)-2-(гидроксиметил)-6-[5-[(2S,3S,4S,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]-3-тиенил]тетрагидропиран-3,4,5-триол)
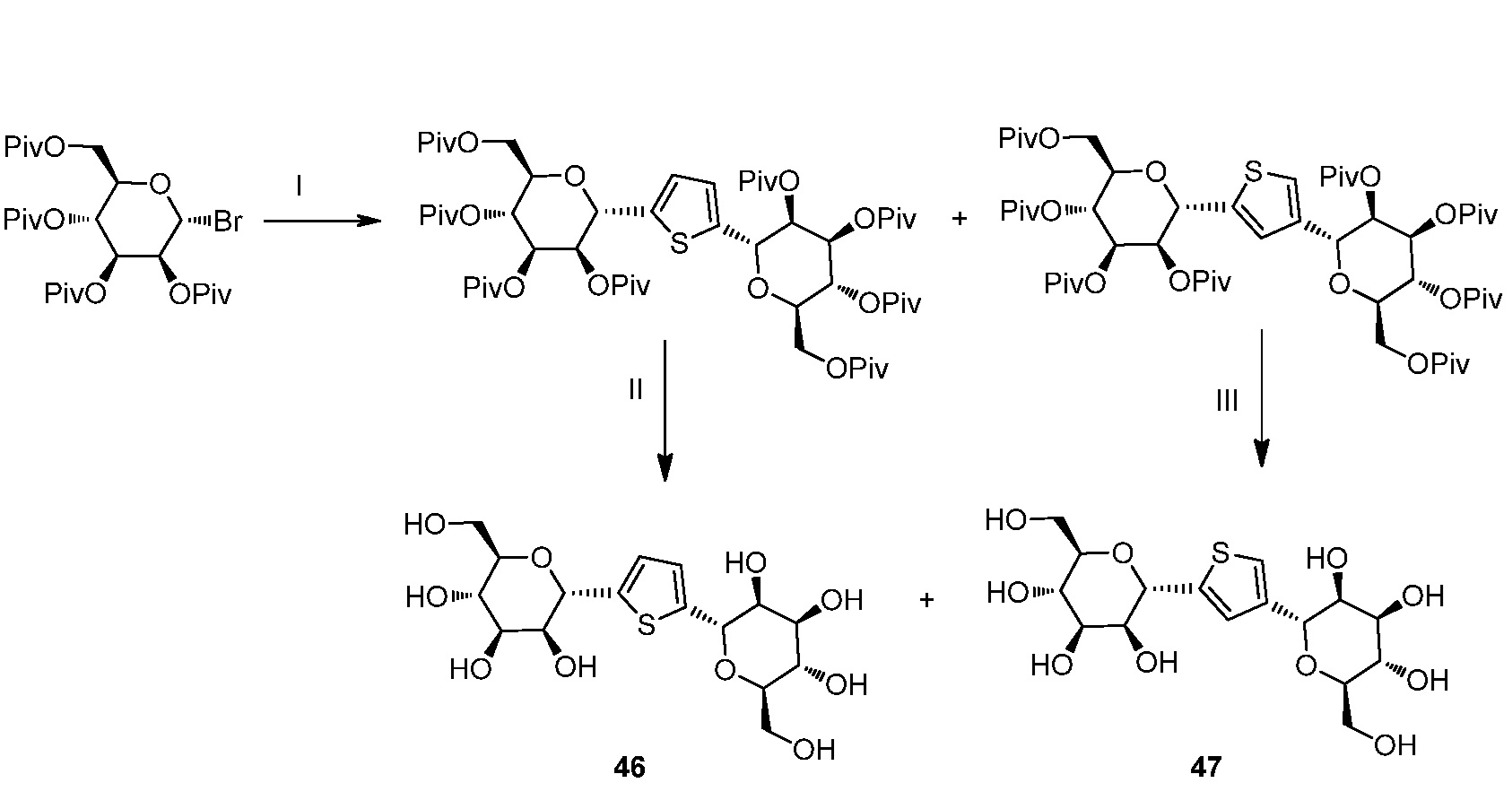
Стадия I: [(2R,3R,4R,5S,6S)-3,4,5-Трис(2,2-диметилпропаноилокси)-6-[5-[(2S,3S,4S,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-(2,2-диметилпропаноилоксиметил)тетрагидропиран-2-ил]-2-тиенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноат и [(2R,3R,4R,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-[5-[(2S,3S,4S,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-(2,2-диметилпропаноилоксиметил)тетрагидропиран-2-ил]-3-тиенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноат
Раствор n-Bu3MgLi (554 мкл, 0,65 М, 0,3600 ммоль) в смеси гексан-гептан-дибутилэфир (8:20:3) добавляют к 2,5-дийодтиофену (150 мг, 0,4465 ммоль) в толуоле (0,5 мл) при 0°С, полученную смесь перемешивают при указанной температуре в течение 3,5 часов (образуется густой осадок), к смеси по каплям добавляют раствор ZnBr2-LiBr в дибутиловом эфире (543 мкл, 1,05М, 0,57 ммоль), охлаждающую баню удаляют, и перемешивают смесь при КТ в течение 1 часа. Добавляют раствор [(2R,3R,4S,5S,6R)-6-бром-3,4,5-трис(2,2-диметилпропаноилокси)тетрагидропиран-2-ил]метил-2,2-диметилпропаноата (500 мг, 0,8628 ммоль) в толуоле (0,9 мл), смесь помещают на масляную баню, предварительно нагретую до 90°С, и выдерживают на бане в течение 4 часов. Смесь охлаждают до КТ, выливают в водный 1н раствор HCl (10 мл) и затем экстрагируют EtOAc (3×10 мл). Объединенные экстракты промывают насыщенным раствором соли, сушат (Na2SO4), концентрируют, очищают на картридже Biotage™ SNAP (силикагель, 50 г; элюирование с градиентом: EtOAc в гексанах, 5%-10% 8CV, 10% 5CV) с получением [(2R,3R,4S,5S,6S)-3,4,5-трис(2,2-диметилпропаноилокси)-6-[5-[(2S,3S,4S,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-(2,2-диметилпропаноилоксиметил)тетрагидропиран-2-ил]-2-тиенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноата (160 мг, 0,1480 ммоль, 33,1%) в виде твердого белого вещества. Rf=0,38 (15% EtOAc в гексанах). 1H ЯМР (400 МГц, CDCl3) δ 7,23 (с, 2H), 5,87 (т, J=2,6 Гц, 2H), 5,55 (т, J=9,6 Гц, 2H), 5,25 (дд, J=9,8, 3,0 Гц, 2H), 5,19 (д, J=2,2 Гц, 2H), 4,30 (дд, J=12,4, 4,7 Гц, 2H), 4,09 (дд, J=12,4, 1,9 Гц, 2H), 3,93 (ддд, J=9,3, 4,6, 1,8 Гц, 2H), 1,28 (с, 18H), 1,26 (с, 18H), 1,16 (с, 18H), 1,15 (с, 18H); и [(2R,3R,4R,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-[5-[(2S,3S,4S,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-(2,2-диметилпропаноилоксиметил)тетрагидропиран-2-ил]-3-тиенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноата (30 мг, 6,2%). Rf=0,37 (15% EtOAc в гексанах). 1H ЯМР (400 МГц, CDCl3) δ 7,48 (с, 1H), 7,26 (с, 1H), 5,90 (т, J=2,6 Гц, 1H), 5,80 (т, J=2,6 Гц, 1H), 5,65 (т, J=9,8 Гц, 1H), 5,56 (т, J=9,8 Гц, 1H), 5,23 (с, 1H), 5,21-5,14 (м, 2H), 5,04 (с, 1H), 4,36-4,26 (м, 2H), 4,24-4,07 (м, 3H), 3,88 (д, J=9,5 Гц, 1H), 1,29 (с, 9H), 1,29 (с, 9H), 1,27 (с, 9H), 1,27 (с, 9H), 1,15 (с, 9H), 1,14 (с, 9H), 1,13 (с, 9H), 1,12 (с, 9H).
Стадия II: Соединение 46
К суспензии [(2R,3R,4R,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-[5-[(2S,3S,4S,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-(2,2-диметилпропаноилоксиметил)тетрагидропиран-2-ил]-2- тиенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноата (92 мг, 0,0851 ммоль) в МеОН (2 мл) при перемешивании добавляют MeONa (340 мкл, 0,5М, 0,1702 ммоль). Смесь перемешивают при КТ в течение 48 часов, к полученной суспензии добавляют DOWEX 50WX4-400 до достижения значения рН 4-5, суспензия превращается в прозрачный раствор, раствор фильтруют, концентрируют, сушат вымораживанием с получением указанного в заголовке соединения (26,5 мг, 0,0616 ммоль, 72,5%) в виде ворсистого твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 6,94 (с, 2H), 5,12 (д, J=2,2 Гц, 2H), 4,31 (т, J=2,5 Гц, 2H), 3,83-3,64 (м, 8H), 3,56-3,47 (м, 2H).
Стадия III: Соединение 47
К суспензии [(2R,3R,4R,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-[5-[(2S,3S,4S,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-(2,2-диметилпропаноилоксиметил)тетрагидропиран-2-ил]-2-тиенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноата (33 мг, 0,0305 ммоль) в МеОН (600 мкл) добавляют MeONa (122 мкл, 0,5М, 0,06104 ммоль) и перемешивают полученную смесь при КТ в течение 48 часов. К полученному раствору добавляют DOWEX 50WX4-400 до достижения значения рН 4-5, смесь фильтруют, концентрируют и сушат вымораживанием с получением указанного в заголовке соединения (9,5 мг, 0,0221 ммоль, 72,4%) в виде ворсистого твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,29 (с, 1H), 7,11 (с, 1H), 5,13 (с, 1H), 4,93 (с, 1H), 4,36 (т, J=2,8 Гц, 1H), 4,32 (т, J=2,6 Гц, 1H), 3,86-3,34 (м, 10H).
Пример 29. Получение соединения 48
(2-[(2R,3S,4R,5S,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]-N-[3-[[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]ацетил]амино]фенил]ацетамид)
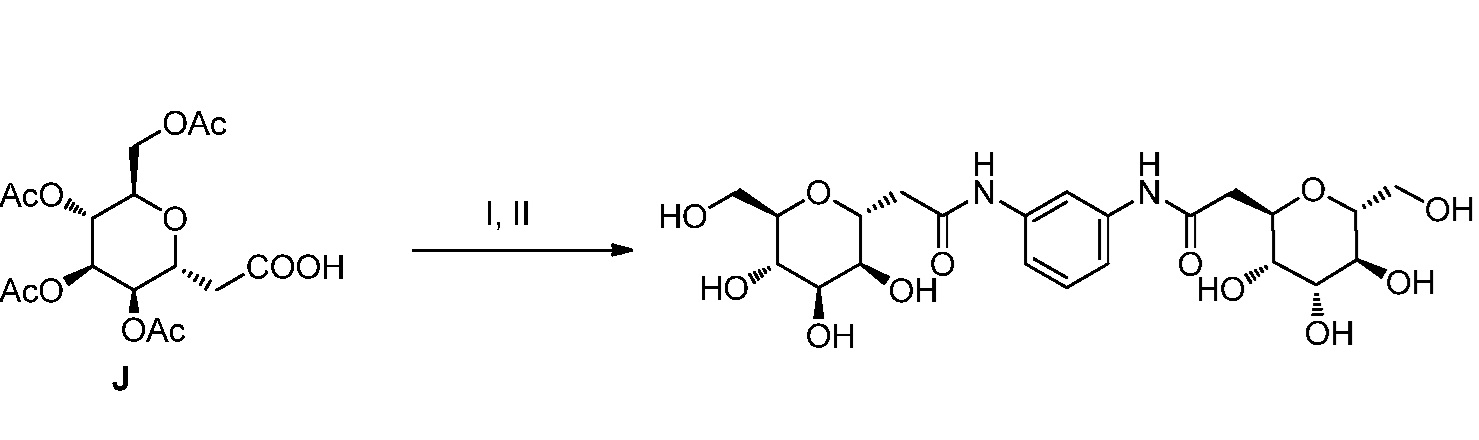
Стадия I: 2-[(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[2-оксо-2-[3-[[2-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]ацетил]амино]анилино]этил]тетрагидропиран-2-ил]метилацетат
К раствору промежуточного соединения J (70 мг, 0,179 ммоль) в ДМФА (1,4 мл) добавляют бензол-1,3-диамин (9,7 мг, 0,0896 ммоль), 2,6-лутидин (62 мкл, 0,538 ммоль) с последующим добавлением HATU (85,2 мг, 0,224 ммоль) при 0°С. Реакционную смесь перемешивают при КТ в течение 3 часов, разбавляют EtOAc, промывают H2O, насыщенным раствором соли. Органическую фазу сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, 10 г; элюирование с градиентом: EtOAc в гексанах, 0-15%, 25 CV) с получением указанного в заголовке соединения (58 мг, 75,8%) в виде бесцветного масла. ЖХ-МС: m/z=853,5 (М+Н+).
Стадия II: Соединение 48
К раствору [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[2-оксо-2-[3-[[2-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]ацетил]амино]анилино]этил]тетрагидропиран-2-ил]метилацетата (58 мг, 0,068 ммоль) в МеОН (1,4 мл) добавляют 2 капли раствора MeONa в MeOH (25% масс./об.). Смесь перемешивают в течение 1 часа, затем нейтрализуют Amberlite IR 120 (H). Смесь фильтруют, промывают метанолом, растворитель удаляют при пониженном давлении, и остаток очищают с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (11 мг, 23,3%). 1H ЯМР (400 МГц, CD3OD) δ 7,84 (д, 1H), 7,37-7,26 (м, 2H), 7,26-7,11 (м, 1H), 4,39-4,29 (м, 2H), 3,87 (дд, 2H), 3,79-3,64 (м, 8H), 3,64-3,55 (м, 2H), 2,71 (кв.д, 4H). ЖХ-МС: m/z=517,4 (М+Н+).
Пример 30. Получение соединения 49
(2-[(2R,3S,4R,5S,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]-N-[[4-[[[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]ацетил]амино]метил]фенил]метил]ацетамид)
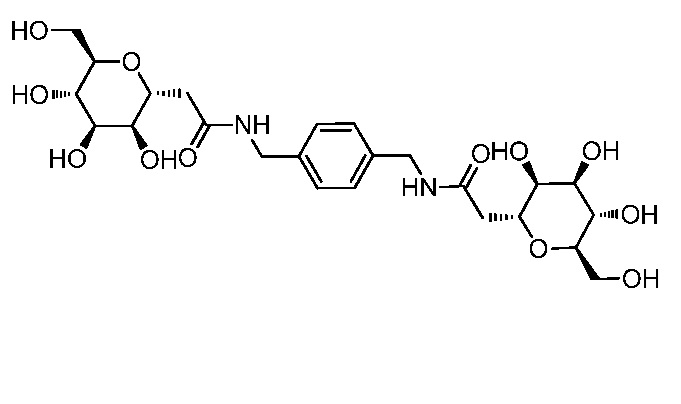
Соединение 49 получают в соответствии с методикой, описанной в примере 29, но с использованием промежуточного соединения J и [4-(аминометил)фенил]метанамина вместо бензол-1,3-диамина в качестве исходных реагентов. 1H ЯМР (400 МГц, CD3OD) δ 7,24 (с, 4H), 4,46-4,15 (м, 6H), 3,81 (дт,2H), 3,68 (ддд, 8H), 3,60-3,49 (м, 2H), 2,75-2,40 (м, 4H). ЖХ-МС: m/z=545,4 (М+Н+).
Пример 31. Получение соединения 50
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[3-[4-[3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]бута-1,3-дииил]фенил]тетрагидропиран-3,4,5-триол)
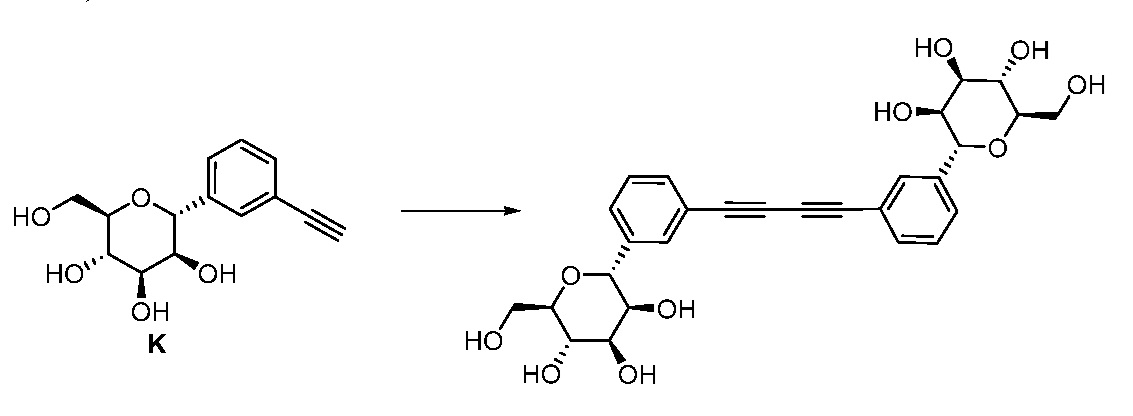
Раствор метил-4-йодбензоата (37 мг, 0,141 ммоль), CuI (4,8 мг, 0,025 ммоль) и Pd(dppf)Cl2-CH2Cl2 (19 мг, 0,0233 ммоль) в ДМФА (1,0 мл) дегазируют (вакуум/поток N2), к смеси добавляют триэтиламин (70,1 мг, 97 мкл, 0,6924 ммоль) и промежуточное соединение K (35 мг, 0,115 ммоль) в атмосфере азота, реакционную смесь перемешивают при КТ в течение ночи, затем загружают на C- 18 samplet, очищают на картридже Biotage™ SNAP (С-18 силикагель, 25 г; элюирование с градиентом: CH3CN-вода, 5%-50%) с получением указанного в заголовке соединения (3,0 мг). 1H ЯМР (400 МГц, CD3OD) δ 7,62 (с, 2H), 7,51 (д, J=7,4 Гц, 2H), 7,41 (д, J=7,7 Гц, 2H), 7,35 (т, J=7,7 Гц, 2H), 4,88 (д, J=4,5 Гц, 2H), 4,29 (дд, J=4,4, 3,2 Гц, 2H), 3,84 (дд, J=11,9, 6,9 Гц, 2H), 3,76 (дд, J=11,9, 3,1 Гц, 2H), 3,71 (т, J=7,2 Гц, 2H), 3,56 (дд, J=7,4, 3,1 Гц, 2H), 3,51-3,43 (м, 2H). ЖХ-МС: m/z=527,51 (М+Н+).
Пример 32. Получение соединения 51
(1,3-Бис(3-((2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил)фенил)мочевина)
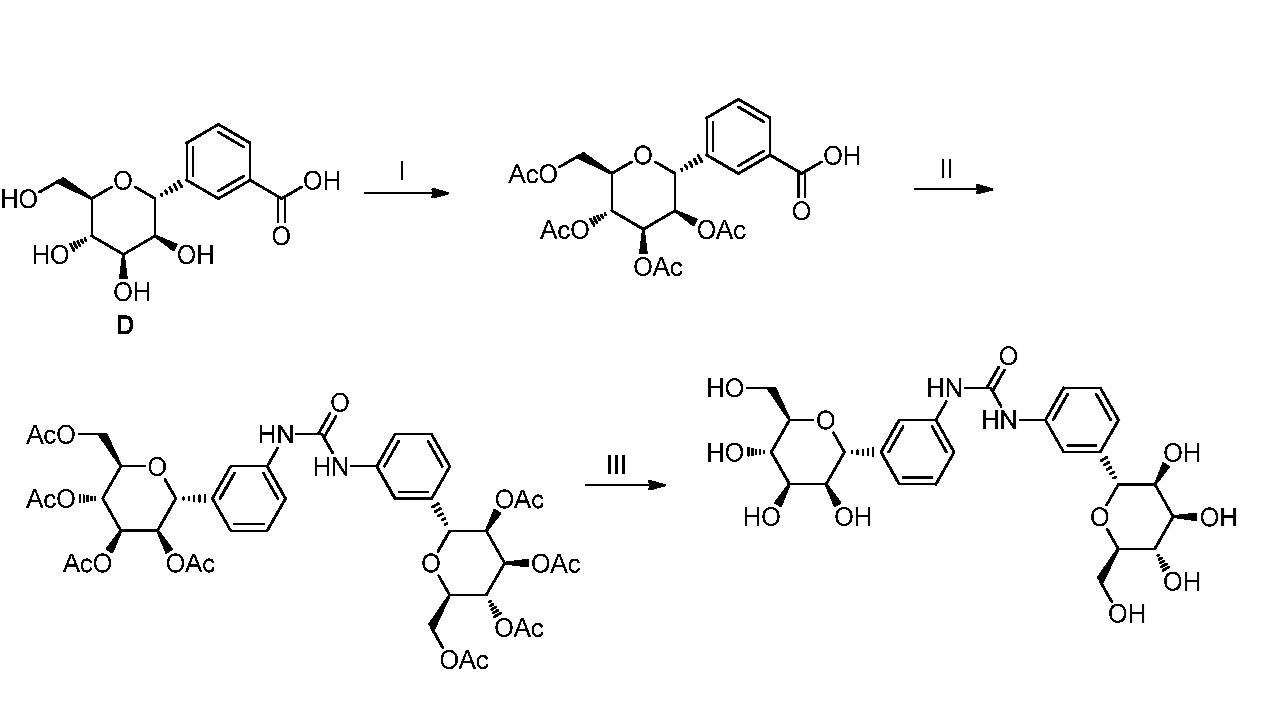
Стадия I: 3-((2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-(ацетоксиметил)тетрагидро-2Н-пиран-2-ил)бензойная кислота
К суспензии промежуточного соединения D (165 мг, 0,551 ммоль) в 1,6 мл CH2Cl2 последовательно добавляют пиридин (312 мкл, 3,86 ммоль), DMAP (6,7 мг, 0,055 ммоль) и Ас2О (312 мкл, 3,31 ммоль) в атмосфере азота. Реакционную смесь перемешивают при КТ в течение 20 часов, разбавляют 2М раствором HCl (0,5 мл). Органический слой сушат над Na2SO4, фильтруют и упаривают досуха. Остаток очищают колоночной флэш-хроматографией (силикагель; элюирование с градиентом: МеОН в CH2Cl2, 0-20%) с получением сырого продукта. Продукт растворяют в 5 мл CH2Cl2 и промывают 1М HCl (1 мл). Органический слой сушат над Na2SO4, фильтруют и упаривают досуха, получая указанное в заголовке соединение (242,2 мг, 97%).
Стадия II: (2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[3-[[3-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]фенил]карбамоиламино]фенил]тетрагидропиран-2-ил]метилацетат
К раствору 3-((2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидро-2Н-пиран-2-ил)бензойной кислоты (242 мг, 0,535 ммоль) в 7,3 мл трет-бутанола последовательно добавляют TEA (112 мкл, 0,802 ммоль) и дифенилфосфорилазид (162 мг, 0,588 ммоль) в атмосфере азота. Реакционную смесь кипятят с обратным холодильником в течение 4 часов, охлаждают до комнатной температуры и упаривают досуха. Остаток очищают колоночной флэш-хроматографией (силикагель; элюирование с градиентом: МеОН в CH2Cl2, 2-20% МеОН) с получением указанного в заголовке соединения (113 мг, 48%).
Стадия III: Соединение 51
К раствору [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[3-[[3-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]фенил]карбамоиламино]фенил]тетрагидропиран-2-ил]метилацетата в МеОН (2 мл) добавляют раствор MeONa в МеОН (64 мкл, 0,5М, 0,032 ммоль). Смесь перемешивают при КТ в течение ночи и фильтруют через картридж SCX-2 SPE (1 г). Фильтрат упаривают досуха, и остаток очищают с помощью препаративной ВЭЖХ с получением указанного в заголовке соединения (38 мг, 49%). 1H ЯМР (400 МГц, ДМСО-D6) δ 8,66 (с, 2H), 7,44 (с, 2H), 7,37 (д, J=8,1 Гц, 2H), 7,21 (т, J=7,9 Гц, 2H), 7,00 (д, J=7,7 Гц, 2H), 4,75 (м, 4H), 4,64 (м, 4H), 4,54 (т, J=5,8 Гц, 2H), 4,03 (м, 2H), 3,60 (м, 4H), 3,54 (м, 2H), 3,45-3,36 (м, 4H).
Пример 33. Получение соединения 52
((2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[3-[4-[3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]бутил]фенил]тетрагидропиран-3,4,5-триол)
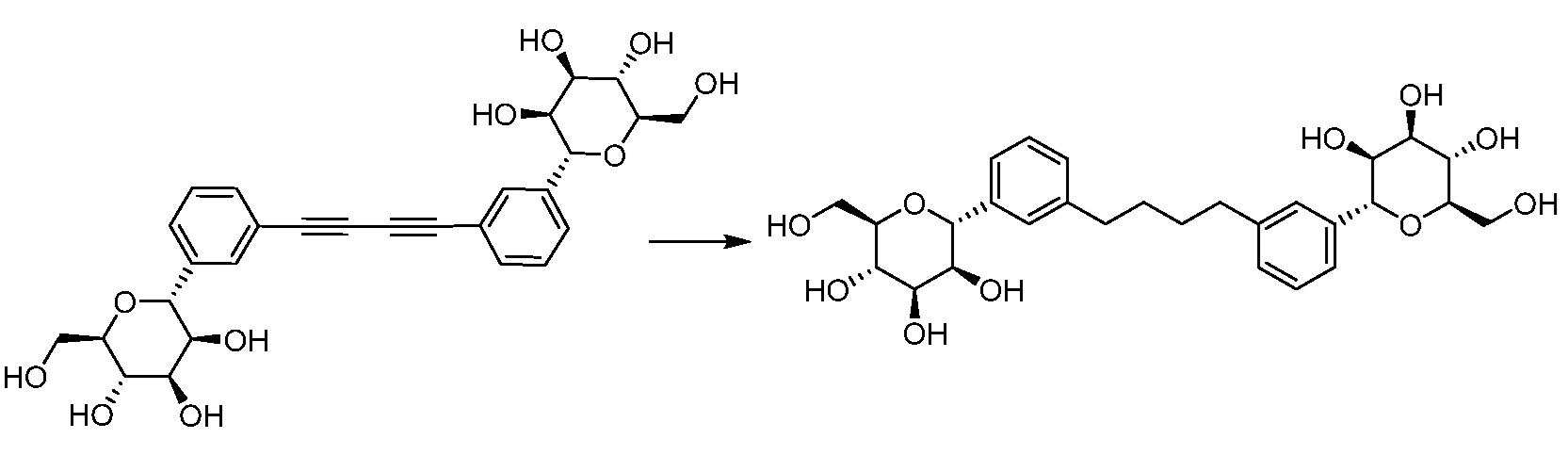
Смесь (2R,3S,4R,5S,6R)-2-(гидроксиметил)-6-[3-[4-[3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]бута-1,3-диинил]фенил]тетрагидропиран-3,4,5-триола (соединение 50, 5 мг, 0,009 ммоль) и 10% Pd на С (влажный, Degussa, 10 мг, 0,0094 ммоль) в МеОН (3 мл) гидрируют при 40 фунтах на кв. дюйм (2,76 ·105 Па) в течение 4 часов, катализатор удаляют фильтрацией, фильтрат концентрируют. Остаток растворяют в смеси вода-ацетонитрил и сушат вымораживанием с получением указанного в заголовке соединения (4,5 мг, 86%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,21 (с, 2H), 7,17 (д, J=4,9 Гц, 4H), 6,99 (т, J=3,7 Гц, 2H), 4,86 (д, J=3,3 Гц, 2H), 4,35 (т, J=3,3 Гц, 2H), 3,71 (д, J=4,6 Гц, 4H), 3,63 (т, J=8,2 Гц, 2H), 3,47 (дд, J=8,2, 3,1 Гц, 2H), 3,41-3,32 (м, 2H), 2,62-2,47 (м, 4H), 1,63-1,48 (м, 4H). ЖХ-МС: m/z=535,53 (М+Н+).
Пример 34. Получение соединения 53 (способ C)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[4-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]фенил]этинил]тетрагидропиран-3,4,5-триол
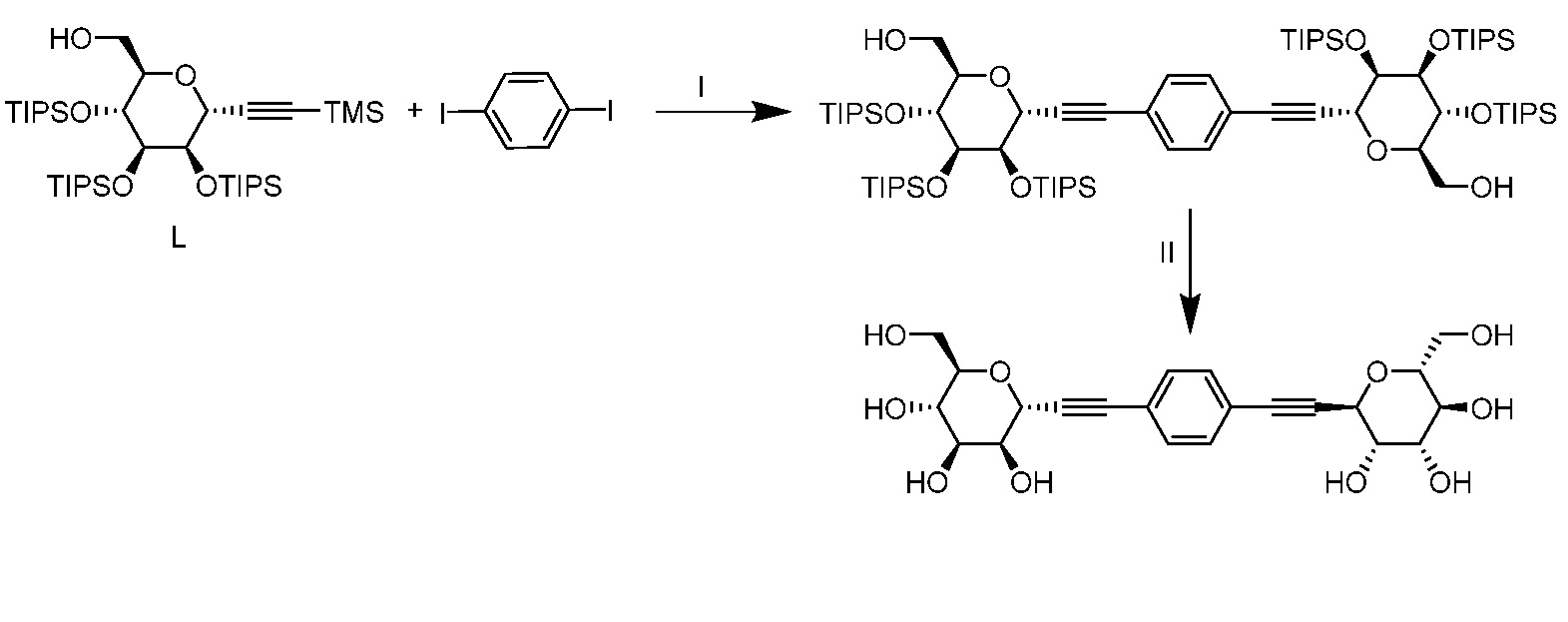
Стадия I: [(2R,3R,4R,5R,6R)-6-[2-[4-[2-[(2R,3R,4R,5R,6R)-6-(Гидроксиметил)-3,4,5-трис(триизопропилсилилокси)тетрагидропиран-2-ил]этинил]фенил]этинил]-3,4,5-трис(триизопропилсилилокси)тетрагидропиран-2-ил]метанол
К смеси дегазированного (вакуум-продувка азотом, 30 минут) раствора промежуточного соединени L (836 мг, 1,15 ммоль), 1,4-дийодбензола (180 мг, 0,545 ммоль), PdCl2(dppf)·CH2Cl2 (44,6 мг, 0,0546 ммоль) и CuI (10,4 мг, 0,0546 ммоль) в ДМФА (8 мл) в атмосфере азота добавляют DBU (653 мкл, 4,37 ммоль) и дегазированную воду (29,5 мг, 30 мкл, 1,64 ммоль). Реакционную смесь медленно нагревают до 50°С и выдерживают при указанной температуре в течение 4 часов, затем температуру повышают до 55°С и смесь выдерживают при указанной температуре в течение 16 часов. После этого добавляют дополнительное количество воды (10 мкл), нагрев продолжают в течение 6 часов, затем смесь охлаждают до КТ и оставляют на ночь. Реакционную смесь разбавляют водой (25 мл), экстрагируют EtOAc (3×25 мл), объединенные экстракты промывают насыщенным раствором соли, сушат (Na2SO4) и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, 100 г; элюирование с градиентом: EtOAc в гексанах, 0%-20%, 8 CV; 20%, 3 CV) с получением указанного в заголовке соединения (511 мг, 0,368 ммоль, 68%) в виде твердого не совсем белого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,37 (д, J=0,9 Гц, 4H), 4,90 (д, J=8,9 Гц, 2H), 4,44 (д, J=9,1 Гц, 2H), 4,20 (уш.с, 2H), 4,14-4,03 (м, 2H), 4,01-3,83 (м, 4H), 3,67-3,51 (м, 2H), 2,1-2,0 (м, 2H), 1,33-0,77 (м, 126H).
Стадия II: Соединение 53
Раствор [(2R,3R,4R,5R,6R)-6-[2-[4-[2-[(2R,3R,4R,5R,6R)-6-(гидроксиметил)-3,4,5-трис(триизопропилсилилокси)тетрагидропиран-2-ил]этинил]фенил]этинил]-3,4,5-трис(триизопропилсилилокси)тетрагидропиран-2-ил]метанола (471 мг, 0,339 ммоль) в ТГФ (16,0 мл), ТФУК (8,0 мл) и воде (8,0 мл) кипятят с обратным холодильником (температура бани 75°С) в течение 30 часов, затем концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, С18, 25 г; элюирование с градиентом: CH3CN в воде, 0%-50%, 10 CV) с получением указанного в заголовке соединения (146 мг, 0,311 ммоль, 88%) в виде твердого не совсем белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,43 (с, 4H), 4,85 (д, J=2,1 Гц, 2H), 3,98 (дд, J=3,1, 2,2 Гц, 2H), 3,92-3,83 (м, 4H), 3,81-3,68 (м, 4H), 3,61 (т, J=9,5 Гц, 2H).
Альтернативный синтез соединения 53 (способ C)
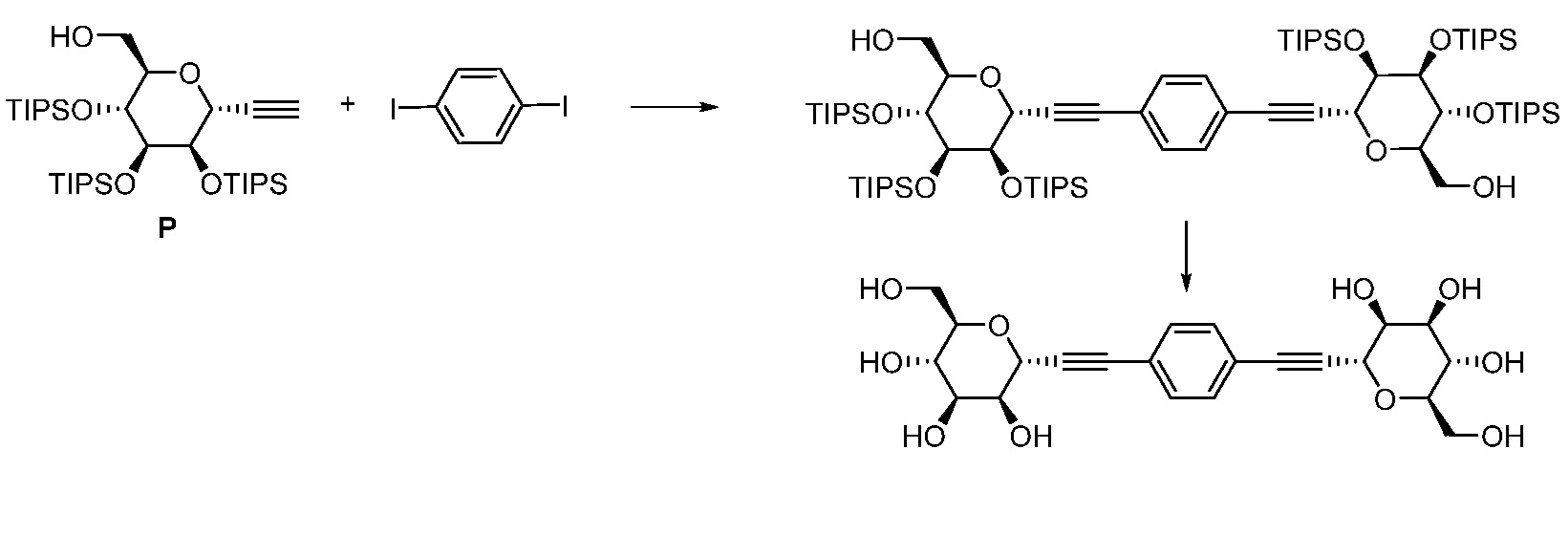
Стадия I: [(2R,3R,4R,5R,6R)-6-[2-[4-[2-[(2R,3R,4R,5R,6R)-6-(гидроксиметил)-3,4,5-трис(триизопропилсилилокси)тетрагидропиран-2-ил]этинил]фенил]этинил]-3,4,5-трис(триизопропилсилилокси)тетрагидропиран-2-ил]метанол
Промежуточное соединение Р (118 мг, 0,18 ммоль) и 1,4-дийодбензол (28 мг, 0,083 ммоль) загружают в емкость, растворяют в ДМФА (3 мл), дегазируют, затем добавляют CuI (7,8 мг, 0,041 ммоль) и Pd(dppf)Cl2-CH2Cl2 (8,4 мг, 0,010 ммоль), снова дегазируют, добавляют Et3N (57 мкл, 0,41 ммоль), после чего реакционную смесь закрывают и выдерживают при 40°С в течение 4 часов. Реакционную смесь разбавляют EtOAc (10 мл), промывают последовательно насыщенным раствором NH4Cl, H2O, насыщенным раствором соли (5 мл каждого), сушат над Na2SO4, фильтруют и концентрируют, затем очищают на картридже Biotage™ SNAP (силикагель, 10 г; элюирование с градиентом: EtOAc в гексанах от 0 до 20%). Чистые фракции объединяют и концентрируют, получая указанное в заголовке соединение (60 мг, 0,043 ммоль, выход 53%) в виде бесцветной пены.
Стадия II: Соединение 53
К раствору [(2R,3R,4R,5R,6R)-6-[2-[4-[2-[(2R,3R,4R,5R,6R)-6-(гидроксиметил)-3,4,5-трис(триизопропилсилилокси)тетрагидропиран-2-ил]этинил]фенил]этинил]-3,4,5-трис(триизопропилсилилокси)тетрагидропиран-2-ил]метанола (100 мг, 0,072 ммоль) в ТГФ (1 мл) добавляют раствор фторида тетрабутиламмония (575 мкл из 1 M, 0,58 ммоль) в ТГФ. Смесь перемешивают в течение 3,5 часов, затем концентрируют и очищают флэш-хроматографией с обращенной фазой на картридже Biotage™ SNAP (силикагель, С18, 12 г; элюирование с градиентом: MeCN в H2O, 0-50%). Объединенные фракции, содержащие целевое соединение, концентрируют, остаток снова растворяют в MeCN/H2O (20% MeCN) и сушат вымораживанием с получением указанного в заголовке соединения (52 мг) в виде твердого белого вещества.
Альтернативный синтез соединения 53 (способ D)
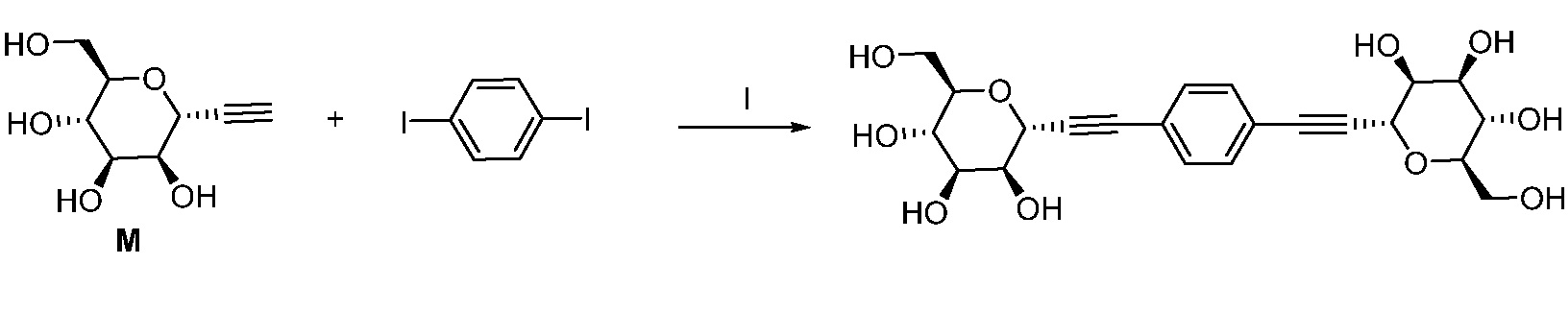
К раствору промежуточного соединения М (130 мг, 0,6908 ммоль) в ДМФА (4 мл) добавляют 1,4-дийодбензол (102,9 мг, 0,3119 ммоль), Pd(dppf)Cl2-CH2Cl2 (13,1 мг, 0,0160 ммоль), CuI (11,9 мг, 0,0625 ммоль) и DIPEA (163 мкл, 0,936 ммоль). Смесь перемешивают при 60°С в течение 5 часов в атмосфере азота. После удаления растворителя при пониженном давлении остаток очищают с помощью препаративной ВЭЖХ с получением указанного в заголовке соединения (52 мг, 0,115 ммоль, 37%) в виде твердого белого вещества. ЖХ-МС: m/z=451,5 (М+Н+).
Альтернативный синтез соединения 53 (способ E)
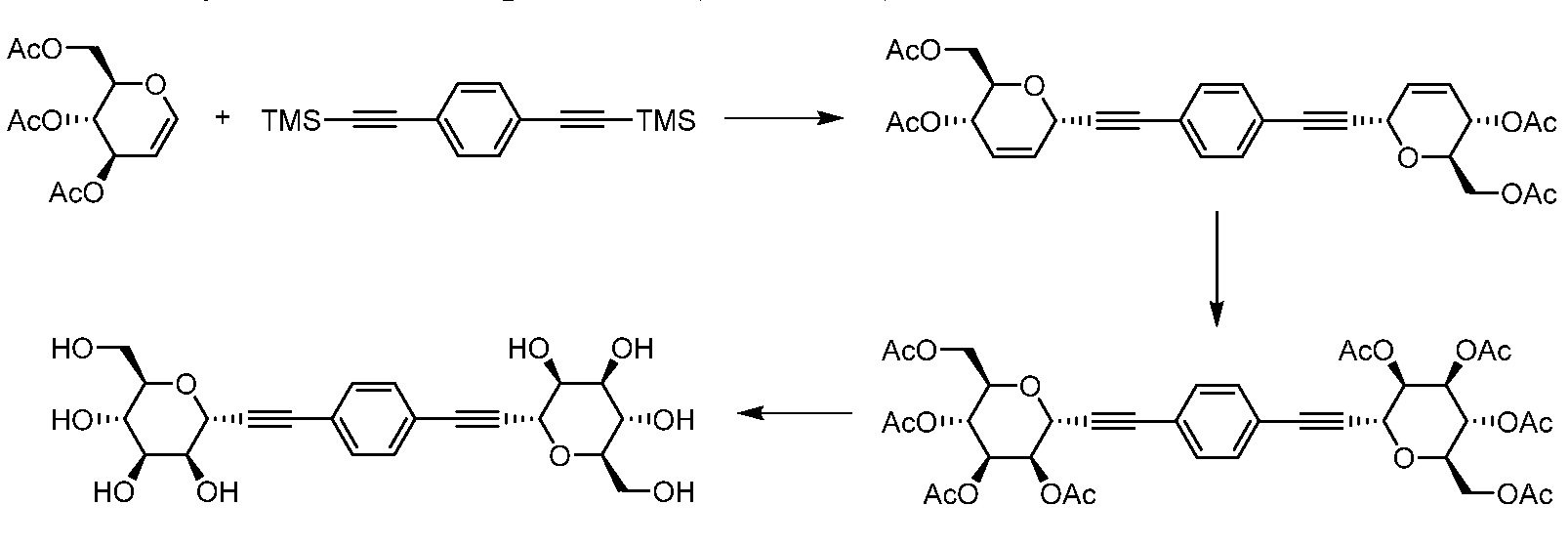
Стадия I: (2R,2’R,3S,3’S,6S,6’S)-(1,4-фениленбис(этин-2,1-диил))бис(2-(ацетоксиметил)-3,6-дигидро-2H-пиран-6,3-диил)диацетат
В 3-горлой круглодонной колбе объемом 1 л, снабженной магнитной мешалкой и термометром, растворяют триметил-[2-[4-(2-триметилсилилэтинил)фенил]этинил]силан (25,00 г, 92,42 ммоль) и трифлат индия (2,597 г, 4,621 ммоль) в CH2Cl2 (125 мл). Смесь перемешивают при КТ в течение 10 минут, затем по каплям, с помощью капельной воронки, в течение 2 часов добавляют [(2R,3S,4R)-3,4-диацетокси-3,4-дигидро-2Н-пиран-2-ил]метилацетат (100,7 г, 369,7 ммоль), растворенный в 100 мл CH2Cl2, поддерживая температуру реакционной смеси ниже 25°С. После добавления реакционную смесь перемешивают при КТ в течение дополнительных 18 часов. Реакцию гасят насыщенным водным раствором NaHCO3 (250 мл) и слои разделяют. Водный слой снова экстрагируют CH2Cl2 (150 мл), и объединенные органические слои промывают водой (250 мл), сушат над MgSO4 и фильтруют. К органической фазе добавляют силикагель (500 мл) и смесь упаривают досуха при пониженном давлении. Сырую смесь очищают на большом слое силикагеля (элюирование с градиентом: гексаны/EtOAc, 10-50%). Фракции, содержащие желаемый продукт, объединяют, концентрируют до 300 мл, затем добавляют гептан (500 мл) и МеОН (500 мл). Смесь концентрируют до образования твердого продукта, который собирают фильтрацией с получением 31,0 г (58%) указанного в заголовке соединения.
Стадия II: (2R,2’R,3S,3’S,4R,4’R,5S,5’S,6R,6’R)-(1,4-фениленбис(этин-2,1-диил))бис(2-(ацетоксиметил)-4,5-дигидрокситетрагидро-2H-пиран-6,3-диил)диацетат
В 3-горлую круглодонную колбу объемом 5 л, снабженную механической мешалкой, входным устройством для N2 и датчиком температуры, загружают K2CO3 (150,6 г, 1,090 моль), метансульфонамид (51,83 г, 544,9 ммоль), K3[Fe(CN)6] (358,9 г, 1,090 моль), 2-метилпропан-2-ол (1,000 л) и воду (1,250 л). Затем добавляют 1,4-бис[(S)-[(5S)-5-этилхинуклидин-2-ил]-(6-метокси-4-хинолил)метокси]фталазин (2,830 г, 3,633 ммоль) с последующим добавлением K2O4Os (334,6 мг, 0,9082 ммоль) и полученную смесь перемешивают при КТ в течение 15 минут. К смеси по каплям, через капельную воронку, в течение 10 минут добавляют [(2R,3S,6S)-3-ацетокси-6-[2-[4-[2-[(2R,3S,6S)-3-ацетокси-2-(ацетоксиметил)-3,6-дигидро-2Н-пиран-6-ил]этинил]фенил]этинил]-3,6-дигидро-2Н-пиран-2-ил]метилацетат со стадии I (50,00 г, 90,82 ммоль), растворенный в EtOAc (250 мл). Полученную реакционную смесь (коричнево-оранжевого цвета, достаточно однородную, без комочков) перемешивают (300 оборотов в минуту) при КТ в течение 18 часов. Добавляют дополнительное количество K2O4Os (335 мг, 0,908 ммоль) и реакционную смесь перемешивают в течение 24 часов. Последнюю процедуру повторяют дважды с общим количеством K2O4Os 1,340 г и времени реакции 96 часов. Реакционную смесь гасят Na2SO3 (233,9 г в 250 мл воды), перемешивают при КТ в течение 60 минут и фильтруют через слой целита. Органический слой отделяют и концентрируют с получением 76,74 г сырого соединения в виде смолы коричневого цвета.
Сырой продукт и DMAP (1,110 г, 9,082 ммоль) растворяют в пиридине (250,0 мл). Полученный раствор охлаждают в смеси лед/вода, и к раствору по каплям, в течение 10 минут, добавляют Ас2О (51,4 мл, 545 ммоль), поддерживая температуру ниже 10°С. После этого реакционную смесь перемешивают при КТ в течение 1,5 часов. После перемешивания при КТ в течение 1 часа добавляют 25 мл Ас2О и смесь перемешивают в течение дополнительных 4 часов. Полученную реакционную смесь разбавляют CH2Cl2 (250 мл) и водой (250 мл), перемешивают в течение 15 минут, затем добавляют 2н раствор HCl (2,25 л) и полученную смесь перемешивают в течение 5 минут с охлаждением на бане со смеси лед/вода для контроля экзотермической реакции. Водный раствор отделяют, снова экстрагируют CH2Cl2 (2×250 мл), объединенные органические экстракты еще раз промывают 2н раствором HCl (250 мл, с добавлением насыщенного раствора соли для лучшего разделения), сушат над Na2SO4 и концентрируют с получением 52,3 г сырого продукта в виде пенообразного твердого вещества коричневого цвета. Остаток суспендируют в этаноле (262 мл), перемешивают при кипячении с обратным холодильником до полного растворения, медленно охлаждают до КТ, затем до 0°С в течение 30 минут. Полученный осадок собирают фильтрацией, промывают охлажденным этанолом и сушат в вакуумной печи при 35°С в течение 48 часов с получением указанного в заголовке соединения (43,0 г, выход 77% в двух стадиях) в виде порошка бежевого цвета.
Стадия III: Соединение 53
В круглодонную колбу объемом 1 л загружают [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[2-[4-[2-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]этинил]фенил]этинил]тетрагидропиран-2-ил]метилацетат со стадии II (11,55 г, 14,68 ммоль), добавляют EtOH (347 мл) и смесь перемешивают при КТ в течение 5 минут. К смеси добавляют MeONa (327 мкл, 25% масс./масс., 1,47 ммоль), и реакционную смесь перемешивают при КТ в течение 4 дней. Реакция является незавершенной, поэтому добавляют МеОН (120 мл) и MeONa (981 мкл, 25% масс./масс., 4,41 ммоль). Конечную смесь перемешивают в течение 2 дней, полученный твердый продукт собирают фильтрацией и промывают EtOH. Маточные растворы нейтрализуют, пропуская через Dowex 50W4 колонку (27 г, предварительно промытую EtOH). Твердое вещество перемешивают в течение 15 минут в нейтрализованных маточных растворах. Затем суспензию упаривают досуха с получением 10 г твердого не совсем белого вещества. Продукт переносят в EtOH (165 мл) и полученную смесь перемешивают при 70°С в течение часа. Суспензию медленно охлаждают до КТ, затем охлаждают до 0°С и перемешивают при указанной температуре в течение 30 мин. После фильтрации и промывки дважды охлажденным EtOH (2×10 мл) и один раз гептаном (10 мл) получают (6,70 г) твердое не совсем белое вещество. Продукт сушат в вакуумной печи при 50°С в течение 2 дней с получением указанного в заголовке соединения в виде твердого не совсем белого вещества (6,37 г, 95%)
Пример 35. Получение соединения 54
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[4-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]бута-1,3-диинил]тетрагидропиран-3,4,5-триол
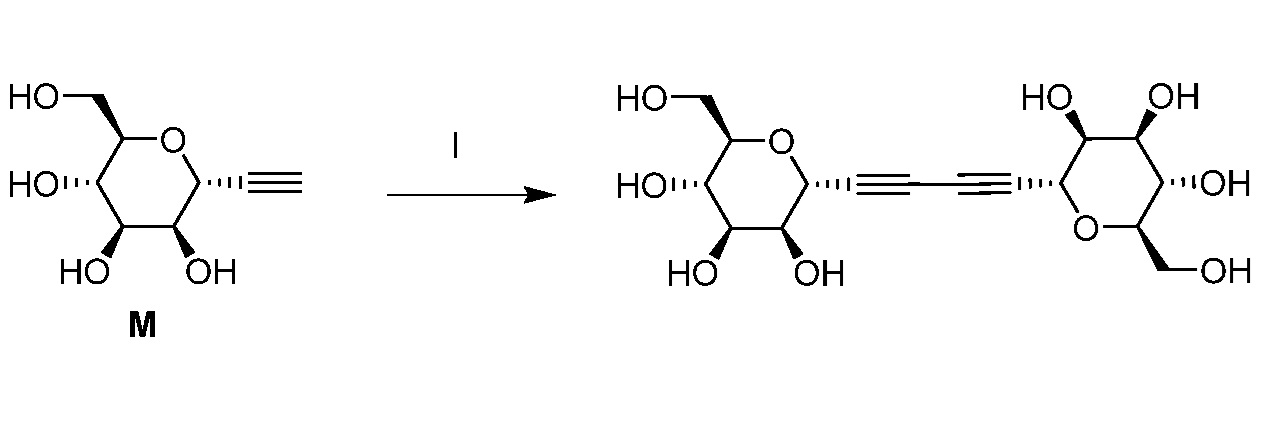
К раствору промежуточного соединения М (46 мг, 0,2444 ммоль) в ДМФА (3 мл) добавляют Pd(dppf)Cl2-CH2Cl2 (10 мг, 0,0123 ммоль), CuI (9,3 мг, 0,0488 ммоль) и DIPEA (85 мкл, 0,488 ммоль). Смесь перемешивают при 50°С в течение ночи в атмосфере азота. После удаления растворителя при пониженном давлении остаток очищают препаративной ВЭЖХ с получением указанного в заголовке соединения (6 мг, 0,0137 ммоль, 6%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 4,73 (д, 2H), 3,91-3,88 (м, 2H), 3,83 (м, 2H), 3,77-3,68 (м, 4H), 3,66-3,60 (м, 2H), 3,57 (м, 2H). ЖХ-МС: m/z=374,5 (М+Н+).
Пример 36. Получение соединения 55
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[(E)-3-[4-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]фенил]аллил]тетрагидропиран-3,4,5-триол
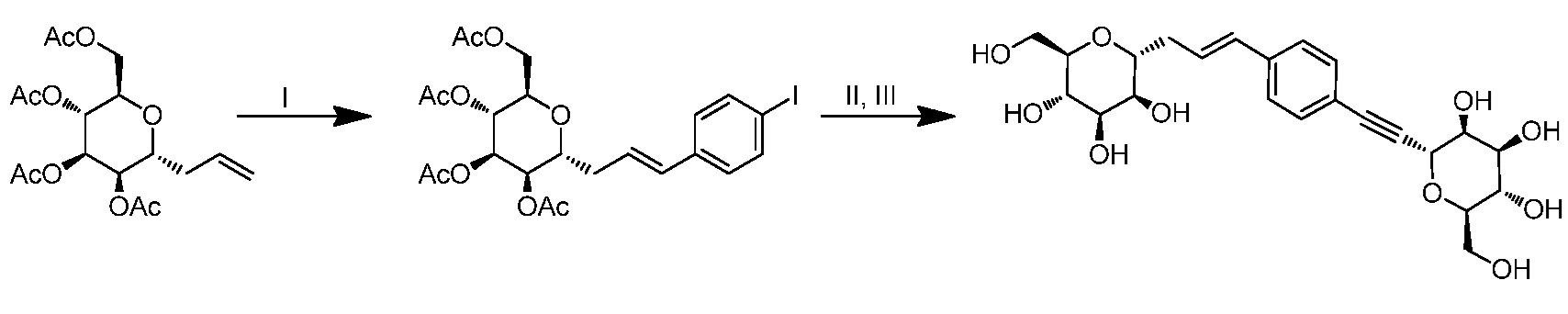
Стадия I: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[(Е)-3-(4-йодфенил)аллил]тетрагидропиран-2-ил]метилацетат
К раствору промежуточного соединения H (300 мг, 0,8057 ммоль) в ДМФА (8,0 мл) добавляют 1,4-дийодбензол (265,8 мг, 0,806 ммоль), ацетат палладия (18,09 мг, 0,081 ммоль), бромид тетрабутиламмония (259,7 мг, 0,81 ммоль) и бикарбонат натрия (203,0 мг, 2,42 ммоль). Реакционную смесь нагревают до 85°С в атмосфере N2 и выдерживают в указанных условиях в течение ночи. К реакционной смеси добавляют воду, смесь экстрагируют EtOAc (2х). Объединенные экстракты промывают смесью насыщенный раствор соли/вода (1:1 об./об., х2), сушат над MgSO4, фильтруют и концентрируют при пониженном давлении. Сырое масло темной окраски очищают на картридже Biotage™ SNAP (силикагель, 25 г; элюирование с градиентом: EtOAc в гексанах, 0-45%, 20 CV; 45%, 2 CV) с получением указанного в заголовке соединения (260 мг, 0,453 ммоль, 56%) в виде масла желтоватого цвета. 1H ЯМР (400 МГц, CD3OD) δ 7,64 (д, J=8,4 Гц, 2H), 7,18 (д, J=8,4 Гц, 2H), 6,50 (д, J=15,9 Гц, 1H), 6,32-6,22 (м, 1H), 5,35 (дд, J=8,7, 3,3 Гц, 1H), 5,24 (т, J=3,4 Гц, 1H), 5,15 (т, J=8,4 Гц, 1H), 4,40-4,31 (м, 1H), 4,15-4,00 (м, 5H), 2,78-2,53 (м, 2H), 2,10 (с, 4H), 2,07 (с, 3H), 2,01 (д, J =1,6 Гц, 5H), 1,90 (с, 3H), 1,24 (т, J=7,1 Гц, 2H). ЖХ-МС: m/z=575,35 (М+Н+)
Стадия II: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[(E)-3-[4-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]фенил]аллил]тетрагидропиран-2-ил]метилацетат
Раствор [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[(Е)-3-(4-йодфенил)аллил]тетрагидропиран-2-ил]метилацетата со стадии I (130 мг, 0,226 ммоль), CuI (9,4 мг, 0,049 ммоль) и Pd(dppf)Cl2-CH2Cl2 (37,3 мг, 0,046 ммоль) в ДМФА (4,2 мл) дегазируют (вакуум/поток N2). К полученной смеси добавляют триэтиламин (137,4 мг, 189,3 мкл, 1,358 ммоль) и промежуточное соединение М (42,6 мг, 0,226 ммоль) в атмосфере азота. Реакционную смесь перемешивают при КТ в течение ночи. Реакционную смесь гасят водой и экстрагируют EtOAc (2х). Объединенные органические экстракты промывают разбавленным раствором NH4Cl и смесью насыщенный раствор соли/вода (1:1 об./об., х2), сушат над MgSO4, фильтруют и концентрируют при пониженном давлении с получением указанного в заголовке соединения (143 мг), которое используют в следующей стадии без дополнительной очистки. ЖХ-МС: m/z=635,52 (М+Н+).
Стадия III: Соединение 55
К раствору [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[(E)-3-[4-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]фенил]аллил]тетрагидропиран-2-ил]метилацетата со стадии II (143 мг, 0,225 ммоль) в МеОН (2,9 мл) при перемешивании добавляют MeONa в MeOH (225 мкл, 0,5М, 0,113 ммоль). Реакционную смесь перемешивают при КТ в течение ночи. Реакционную смесь пропускают через ионообменную смолу Isolute SCX-2 (1 г, колонка) и промывают сухим MeOH. Объединенный фильтрат упаривают досуха, и остаток очищают препаративной ВЭЖХ, получая указанное в заголовке соединение (22,3 мг, 20%) в виде ворсистого твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,41 (с, 4H), 6,55 (д, J=15,9 Гц, 1H), 6,47-6,35 (м, 1H), 4,06-4,00 (м, 2H), 3,96 (дд, J=9,3, 3,3 Гц, 1H), 3,90 (дд, J=11,5, 2,1 Гц, 1H), 3,87-3,73 (м, 6H), 3,71-3,63 (м, 2H), 3,57 (ддд, J=9,0, 6,1, 3,2 Гц, 1H), 2,76-2,65 (м, 1H), 2,60-2,49 (м, 1H).
Пример 37. Получение соединения 56 (способ A)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[6-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]-2-нафтил]этинил]тетрагидропиран-3,4,5-триол
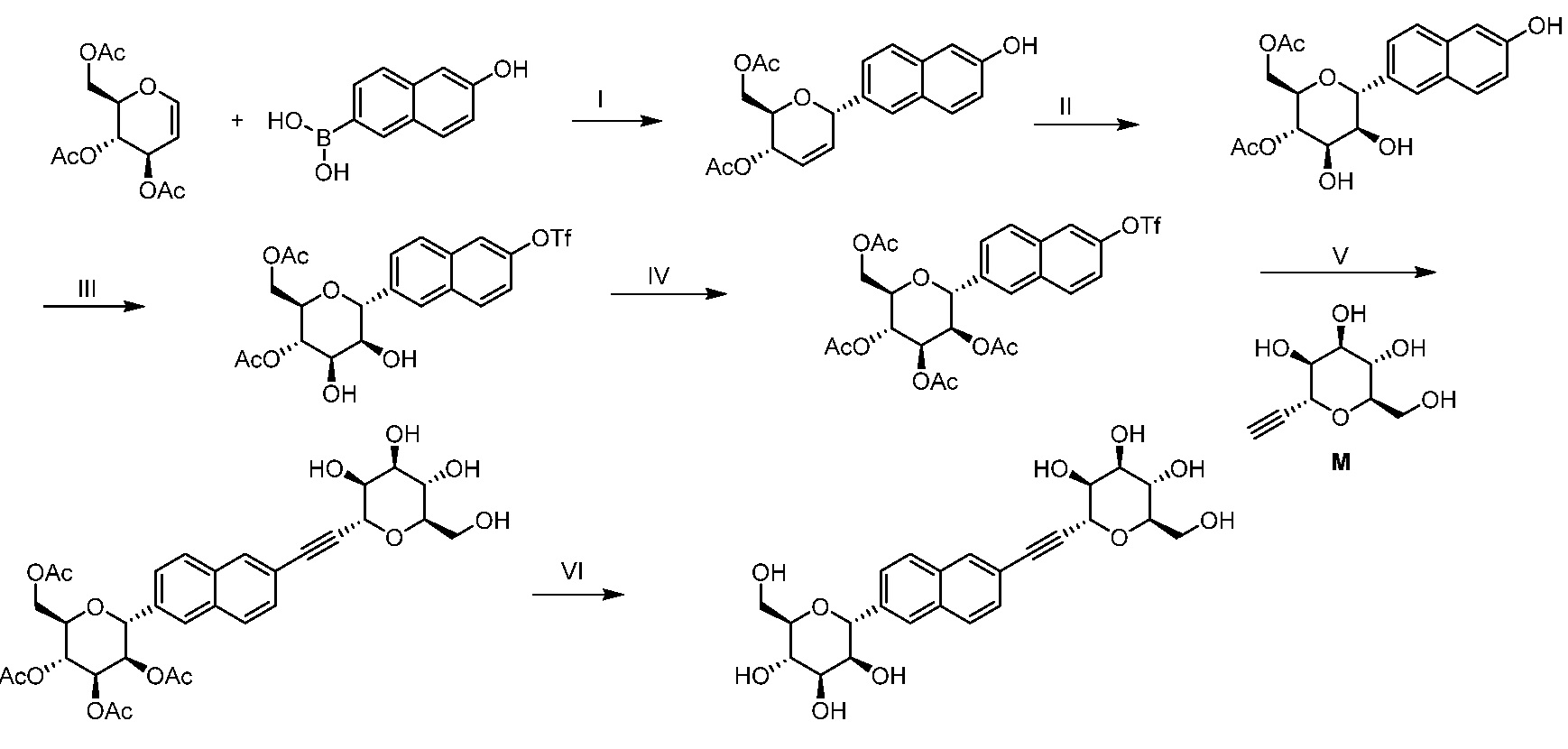
Стадия I: [(2R,3S,6S)-3-Ацетокси-6-(6-гидрокси-2-нафтил)-3,6-дигидро-2Н-пиран-2-ил]метилацетат
Ацетонитрил (10 мл) добавляют к смеси [(2R,3S,4R)-3,4-диацетокси-3,4-дигидро-2Н-пиран-2-ил]метилацетата (1,49 г, 5,47 ммоль), (6-гидрокси-2-нафтил)бороновой кислоты (1,0 г, 5,32 ммоль) и диацетоксипалладия (119 мг, 0,53 ммоль). Реакционную смесь перемешивают в течение ночи при КТ в атмосфере N2, затем фильтруют через картридж силикагеля (5 г) и промывают EtOAc. Объединенные фильтраты концентрируют и очищают на картридже Biotage™ SNAP (силикагель, 50 г; элюирование с градиентом: EtOAc в гексанах, 0-50%). Чистые фракции объединяют и концентрируют, получая указанное в заголовке соединение (935 мг, 2,62 ммоль, выход 49%) в виде пенообразного твердого не совсем белого вещества. 1H ЯМР (400 МГц, CDCl3) δ 7,80-7,72 (м, 2H), 7,70 (д, J=8,5 Гц, 1H), 7,51 (дд, J=8,5, 1,7 Гц, 1H), 7,18-7,08 (м, 2H), 6,28 (ддд, J=10,4, 3,1, 1,6 Гц, 1H), 6,13-6,00 (м, 1H), 5,49-5,42 (м, 1H), 5,36 (ддд, J=7,4, 4,1, 2,1 Гц, 1H), 4,28 (дд, J=12,0, 5,8 Гц, 1H), 4,09 (дд, J=12,0, 3,0 Гц, 1H), 3,86 (ддд, J=7,8, 5,8, 3,0 Гц, 1H), 2,10 (с, 3H), 2,08 (с, 3H). ЖХ-МС: m/z=357,34 (М+Н+).
Стадия II: [(2R,3S,4R,5S,6R)-3-Ацетокси-4,5-дигидрокси-6-(6-гидрокси-2-нафтил)тетрагидропиран-2-ил]метилацетат
К суспензии [(2R,3S,6S)-3-ацетокси-6-(6-гидрокси-2-нафтил)-3,6-дигидро-2Н-пиран-2-ил]метилацетата (930 мг, 2,61 ммоль) в смеси ТГФ (5,6 мл)/вода (3,7 мл) добавляют OsO4 (2,5% масс./масс., в трет-BuOH, 980 мкл, 0,078 ммоль) с последующим добавлением 4-метил-4-окисидоморфолин-4-ия (917 мг, 7,83 ммоль). Смесь перемешивают в течение 23 часов, к смеси добавляют еще одну порцию раствора OsO4 (300 мкл), полученную смесь перемешивают в течение дополнительных 18 часов, затем добавляют 1М водный раствор Na2S2O3 (6 мл), EtOAc (40 мл) и H2O (10 мл), органический слой отделяют, и водный слой экстрагируют EtOAc (2×20 мл). Объединенные органические экстракты промывают насыщенным раствором соли (20 мл), сушат над Na2SO4, фильтруют и концентрируют с получением сырого продукта в виде пенообразного твердого вещества темно-коричневого цвета, которое очищают на картридже Biotage™ SNAP (силикагель, 50 г; элюирование с градиентом: iPrOH в CH2Cl2, 0-10%). Объединенные чистые фракции концентрируют с получением указанного в заголовке соединения (281 мг, 0,72 ммоль, выход 27%) в виде твердого не совсем белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,77 (с, 1H), 7,73 (д, J=8,7 Гц, 1H), 7,67 (д, J=8,6 Гц, 1H), 7,48 (дд, J=8,6, 1,7 Гц, 1H), 7,12-7,04 (м, 2H), 5,10 (дд, J=6,3, 5,3 Гц, 1H), 5,03 (д, J=6,2 Гц, 1H), 4,74 (дд, J=12,1, 8,1 Гц, 1H), 4,31 (дд, J=6,2, 3,2 Гц, 1H), 4,12 (дд, J=12,1, 3,2 Гц, 1H), 3,95-3,84 (м, 2H), 2,09 (с, 3H), 2,06 (с, 3H). ЖХ-МС: m/z=413,34 (M+Na+).
Стадия III: [(2R,3S,4R,5S,6R)-3,4,5-Ацетокси-4,5-дигидрокси-6-[6-(трифторметилсульфонилокси)-2-нафтил]тетрагидропиран-2-ил]метилацетат
К суспензии [(2R,3S,4R,5S,6R)-3-ацетокси-4,5-дигидрокси-6-(6-гидрокси-2-нафтил)тетрагидропиран-2-ил]метилацетата (235 мг, 0,60 ммоль) в CH2Cl2 (6 мл) добавляют Et3N (168 мкл, 1,21 моль), 1,1,1-трифтор-N-фенил-N-(трифторметилсульфонил)метансульфонамид (266 мг, 0,7446 ммоль) и CH2Cl2 (4 мл). Смесь перемешивают в течение 4 дней, после чего концентрируют и очищают на картридже Biotage™ SNAP (силикагель, 25 г; элюирование с градиентом: MeOH в CH2Cl2, 0-10%). Фракции, содержащие продукт, объединяют, концентрируют, затем снова очищают на картридже Biotage™ SNAP (силикагель, 25 г; элюирование с градиентом: EtOAc в гексанах, 50-80%). Чистые фракции объединяют и концентрируют с получением указанного в заголовке соединения (214 мг, 0,41 ммоль, выход 68%) в виде воскообразного твердого вещества желтоватого цвета. 1H ЯМР (400 МГц, CD3OD) δ 8,06 (д, J=9,1 Гц, 1H), 8,02 (с, 1H), 8,00 (д, J=8,6 Гц, 1H), 7,91 (д, J=2,5 Гц, 1H), 7,74 (дд, J=8,6, 1,6 Гц, 1H), 7,47 (дд, J=9,0, 2,5 Гц, 1H), 5,15-5,00 (м, 2H), 4,24-4,07 (м, 2H), 4,02-3,97 (м, 1H), 3,95 (дд, J=5,4, 3,1 Гц, 1H), 2,12 (с, 3H), 2,03 (с, 3H). ЖХ-МС: m/z=545,36 (M+Na+).
Стадия IV: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[6-(трифторметилсульфонилокси)-2-нафтил]тетрагидропиран-2-ил]метилацетат
К раствору [(2R,3S,4R,5S,6R)-3-ацетокси-4,5-дигидрокси-6-[6-(трифторметилсульфонилокси)-2-нафтил]тетрагидропиран-2-ил]метилацетата (214 мг, 0,41 ммоль) в CH2Cl2 (2,2 мл) добавляют пиридин (100 мкл, 1,24 ммоль), DMAP (2,5 мг, 0,0208 ммоль) и Ас2О (97 мкл, 1,03 ммоль). Реакционную смесь перемешивают в течение 2 часов, затем разбавляют CH2Cl2 (5 мл), 1н водным раствором HCl (5 мл), и слои разделяют. Водный слой экстрагируют CH2Cl2 (2×5 мл). Объединенные органические экстракты концентрируют, снова растворяют в CH2Cl2, обрабатывают предварительно промытой Dowex 50WX4-400 смолой, фильтруют и промывают порциями CH2Cl2. Объединенные фильтраты концентрируют с получением указанного в заголовке соединения (232 мг, 0,38 ммоль, выход 93%) в виде твердого пенообразного не совсем белого вещества. 1H ЯМР (400 МГц, CDCl3) δ 8,05 (с, 1H), 7,99 (д, J=9,0 Гц, 1H), 7,95 (д, J=8,7 Гц, 1H), 7,77 (д, J=2,4 Гц, 1H), 7,72 (дд, J=8,5, 1,5 Гц, 1H), 7,43 (дд, J=9,0, 2,5 Гц, 1H), 6,10 (т, J=3,3 Гц, 1H), 5,37 (т, J=8,6 Гц, 1H), 5,27 (д, J=3,2 Гц, 1H), 5,22 (дд, J=8,9, 3,1 Гц, 1H), 4,44 (дд, J=12,2, 6,3 Гц, 1H), 4,15 (дд, J=12,1, 2,8 Гц, 1H), 3,83-3,69 (м, 1H), 2,17 (с, 3H), 2,14 (с, 3H), 2,10 (с, 3H), 2,02 (с, 3H). ЖХ-МС: m/z=607,41 (М+Н+).
Стадия V: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[6-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]-2-нафтил]тетрагидропиран-2-ил]метилацетат
К смеси [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[6-(трифторметилсульфонилокси)-2-нафтил]тетрагидропиран-2-ил]метилацетата со стадии IV (45 мг, 0,0742 ммоль), промежуточного соединения М (25 мг, 0,13 ммоль) и CuI (6,3 мг, 0,033 ммоль) в емкости для микроволновой обработки добавляют ДМФА (500 мкл) и Et3N (52 мкл, 0,37 ммоль). Реакционную смесь дегазируют (дом.-вакуум, N2, 3x), затем добавляют Pd(dppf)Cl2-CH2Cl2 (8 мг, 0,0098 ммоль), снова дегазируют, закрывают и перемешивают при 80°С в течение ночи. Реакционную смесь охлаждают до комнатной температуры, разбавляют EtOAc (2 мл) и H2O (1 мл), фильтруют через целит и промывают EtOAc (4×0,5 мл). Фильтрат разбавляют H2O, насыщенным раствором соли (1 мл) и EtOAc. Слои разделяют. Органический слой промывают H2O, насыщенным раствором соли, сушат над Na2SO4, фильтруют и концентрируют с получением сырого продукта, который очищают на картридже Biotage™ SNAP (силикагель, 10 г; элюирование с градиентом: МеОН в CH2Cl2, 0-20%). Чистые фракции объединяют и концентрируют, получая указанное в заголовке соединение (36 мг, 0,056 ммоль, выход 75%) в виде пенообразного твердого вещества бежевого цвета. 1H ЯМР (400 МГц, CD3OD) δ 8,05 (с, 1H), 8,00 (с, 1H), 7,94 (д, J=8,7 Гц, 1H), 7,90 (д, J=8,6 Гц, 1H), 7,66 (дд, J=8,7, 1,6 Гц, 1H), 7,56 (дд, J=8,5, 1,5 Гц, 1H), 6,03-5,97 (м, 1H), 5,32-5,25 (м, 2H), 5,22 (дд, J=8,3, 3,1 Гц, 1H), 4,92 (д, J=2,1 Гц, 1H), 4,50 (дд, J=12,1, 6,7 Гц, 1H), 4,18 (дд, J=12,2, 3,0 Гц, 1H), 4,06 (дд, J=3,2, 2,1 Гц, 1H), 3,99 (дд, J=9,3, 3,3 Гц, 1H), 3,94-3,81 (м, 3H), 3,76 (дд, J=11,7, 5,8 Гц, 1H), 3,67 (т, J=9,6 Гц, 1H), 2,12-2,07 (м, 9H), 2,04 (с, 3H). ЖХ-МС: m/z=645,43 (М+Н+).
Стадия VI: Соединение 56
К раствору [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[6-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]-2-нафтил]тетрагидропиран-2-ил]метилацетата (34 мг, 0,053 ммоль) в МеОН (1 мл) добавляют MeONa в MeOH (55 мкл, 0,5М, 0,028 ммоль). Реакционную смесь перемешивают в течение ночи, затем пропускают через предварительно промытый картридж SCX-2 (1 г) и промывают MeOH (3×1 мл). Объединенные фильтраты концентрируют с получением стекловидного твердого вещества, которое повторно растворяют в смеси MeCN/H2O (20% MeCN) и сушат вымораживанием с получением указанного в заголовке соединения (24 мг, 0,046 ммоль, выход 88%) в виде ворсистого твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,91 (с, 1H), 7,84 (с, 1H), 7,77 (т, J=8,0 Гц, 2H), 7,61 (дд, J=8,7, 1,4 Гц, 1H), 7,40 (дд, J=8,5, 1,5 Гц, 1H), 5,02 (д, J=3,9 Гц, 1H), 4,81 (д, J=2,1 Гц, 1H), 4,50-4,35 (м, 1H), 3,95 (дд, J=3,2, 2,2 Гц, 1H), 3,89 (дд, J=9,3, 3,3 Гц, 1H), 3,84-3,72 (м, 4H), 3,71-3,61 (м, 2H), 3,60-3,51 (м, 2H), 3,47-3,40 (м, 1H). ЖХ-МС: m/z=477,41 (М+Н+).
Пример 38. Получение соединения 57 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[3-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]фенил]этинил]тетрагидропиран-3,4,5-триол
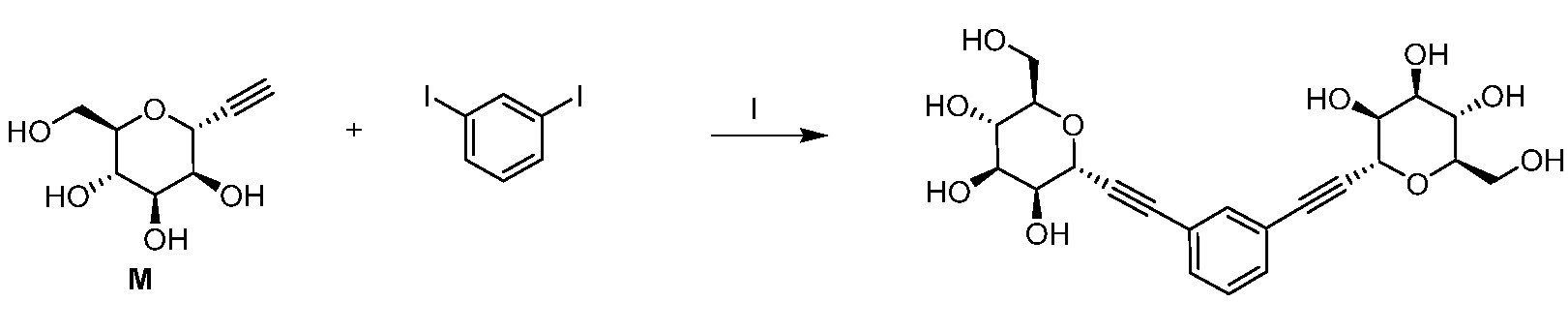
Промежуточное соединение М (108 мг, 0,57 ммоль) растворяют в ДМФА (2,7 мл), дегазируют, затем добавляют 1,3-дийодбензол (87 мг, 0,26 ммоль) с последующим добавлением CuI (21 мг, 0,11 ммоль) и Pd(dppf)Cl2-CH2Cl2 (22 мг, 0,027 ммоль), снова дегазируют, затем добавляют Et3N (180 мкл, 1,291 ммоль) и выдерживают реакционную смесь при 40°С в течение 6 часов. Реакционную смесь упаривают досуха, затем дважды очищают с помощью флэш-хроматографии с обращенной фазой на картридже Biotage™ SNAP С18 12+М (элюирование с градиентом: MeCN в H2O, 0-30%). Чистые фракции со второй очистки упаривают досуха с получением указанного в заголовке соединения (50 мг, 0,11 ммоль, выход 40%) в виде твердого вещества бледно-желтого цвета. 1H ЯМР (400 МГц, ДМСО-d6) δ 7,51-7,38 (м, 4H), 4,95 (д, J=4,4 Гц, 2H), 4,76 (д, J=6,1 Гц, 2H), 4,73-4,68 (м, 4H), 4,47 (т, J=6,0 Гц, 2H), 3,81-3,75 (м, 2H), 3,70-3,61 (м, 4H), 3,57-3,50 (м, 2H), 3,48-3,39 (м, 2H), 3,39-3,29 (м, 6H).
ЖХ-МС: m/z=451,49 (М+Н).
Пример 39. Получение соединения 58 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[7-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]-2-нафтил]этинил]тетрагидропиран-3,4,5-триол
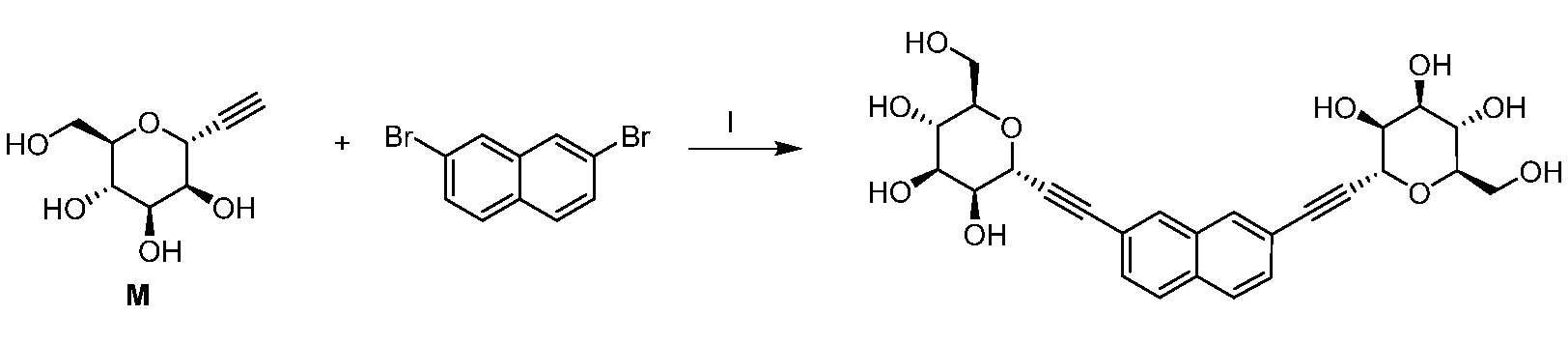
В емкость для микроволновой обработки загружают 2,7-дибромнафталин (36 мг, 0,13 ммоль), промежуточное соединение М (54 мг, 0,29 ммоль), PdCl2(dppf)·CH2Cl2 (9,2 мг, 0,011 ммоль) и CuI (14 мг, 0,074 ммоль). К смеси добавляют ДМФА (1 мл) и Et3N (88 мкл, 0,6295 ммоль), реакционную смесь дегазируют и нагревают в микроволновой печи в течение 10 мин при 120°С, затем упаривают досуха и дважды очищают с помощью флэш-хроматографии с обращенной фазой на картрридже Biotage™ SNAP (С18 12+М; элюирование с градиентом: MeCN в H2O, 10-90% для первой очистки, 10-60% для второй очистки). Фракции, полученные в результате второй очистки, упаривают досуха и очищают препаративной ВЭЖХ, получая указанное в заголовке соединение (11 мг, 0,020 ммоль, выход 16%) в виде твердого не совсем белого вещества. 1H ЯМР (400 МГц, ДМСО-D6) δ 8,11 (с, 2H), 7,96 (д, J=8,5 Гц, 2H), 7,54 (дд, J=8,5, 1,4 Гц, 2H), 5,01 (д, J=3,2 Гц, 2H), 4,84 (д, J=4,9 Гц, 2H), 4,80-4,71 (м, 4H), 4,53 (т, J=5,6 Гц, 2H), 3,85 (с, 2H), 3,71 (дд, J=18,8, 6,8 Гц, 4H), 3,65-3,55 (м, 2H), 3,52-3,20 (м, 4H).
1H ЯМР (400 МГц, ДМСО-D6+D2O) δ 8,09 (с, 2H), 7,95 (д, J=8,6 Гц, 2H), 7,53 (дд, J=8,5, 1,4 Гц, 2H), 4,77 (д, J=2,1 Гц, 2H), 3,86-3,81 (м, 2H), 3,73 (дд, J=9,2, 3,3 Гц, 2H), 3,69 (дд, J=11,7, 1,9 Гц, 2H), 3,64-3,56 (м, 2H), 3,56-3,43 (м, 2H), 3,39 (т, J=9,4 Гц, 2H). ЖХ-МС: m/z=501,65 (М+Н+).
Получение соединения 59 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[6-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]-2-нафтил]этинил]тетрагидропиран-3,4,5-триол
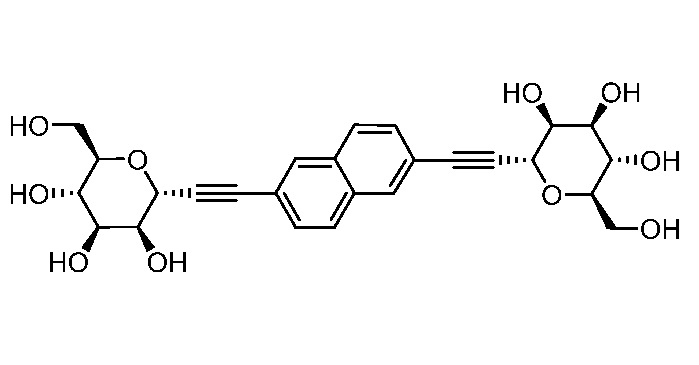
Указанное в заголовке соединение получают из 2,6-дибромнафталина в соответствии с методикой, описанной для получения соединения 58, но с тем отличием, что реакцию проводят при 90°С в течение 16 часов с получением указанного в заголовке соединения (30 мг, 0,057 ммоль, выход 42%) в виде твердого вещества бледно-желтого цвета. 1H ЯМР (400 МГц, CD3OD) δ 8,01 (с, 2H), 7,86 (д, J=8,6 Гц, 2H), 7,54 (дд, J=8,5, 1,4 Гц, 2H), 4,92 (д, J=2,1 Гц, 2H), 4,05 (дд, J=3,1, 2,2 Гц, 2H), 3,98 (дд, J=9,4, 3,3 Гц, 2H), 3,94-3,82 (м, 4H), 3,81-3,72 (м, 2H), 3,66 (т, J=9,5 Гц, 2H).
ЖХ-МС: m/z=501,40 (М+Н+).
Получение соединения 60 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[5-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]-1-нафтил]этинил]тетрагидропиран-3,4,5-триол
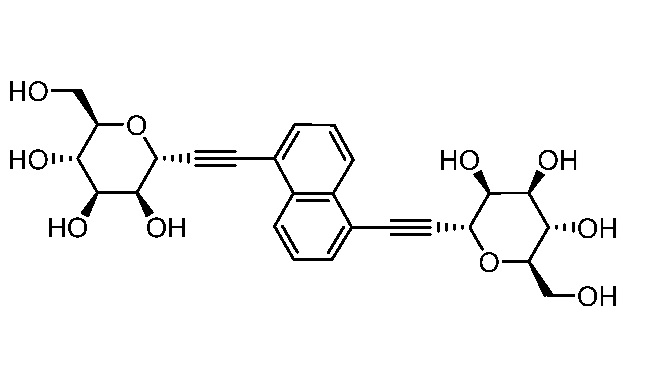
Указанное в заголовке соединение получают из 1,5-дибромнафталина в соответствии с методикой, описанной для получения соединения 58, но с тем отличием, что реакцию проводят при 90°С в течение 16 часов с получением указанного в заголовке соединения (27 мг, 0,05 ммоль, выход 24%) в виде не совсем белого твердого ворсистого/кристаллического вещества. 1H ЯМР (400 МГц, ДМСО-D6) δ 8,26 (д, J=8,5 Гц, 2H), 7,81 (д, J=6,5 Гц, 2H), 7,66 (дд, J=8,2, 7,3 Гц, 2H), 5,05 (д, J=4,4 Гц, 2H), 4,91 (д, J=2,1 Гц, 2H), 4,87 (д, J=5,9 Гц, 2H), 4,82 (д, J=5,8 Гц, 2H), 4,57 (т, J=6,0 Гц, 2H), 3,97-3,88 (м, 2H), 3,83-3,61 (м, 6H), 3,54-3,37 (м, 4H). ЖХ-МС: m/z=501,54 (М+Н+).
Получение соединений 62-68
Соединения 62-64, 67 и 68 получают с использованием способа А в соответствии с методикой, описанной для получения соединения 6, с использованием соответствующим образом функционализированных арилбромида, фенола или бороновой кислоты. Соединения 65 и 66 получают с использованием способа А в соответствии с методикой, описанной для получения соединения 139, с использованием соответствующим образом функционализированных галогенированных арилов.
|
|
|
Получение соединения 69 (модифицированный способ D)
(2R,3S,4R,5R,6R)-2-(Гидроксиметил)-6-[2-[4-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]фенил]этинил]тетрагидропиран-3,4,5-триол
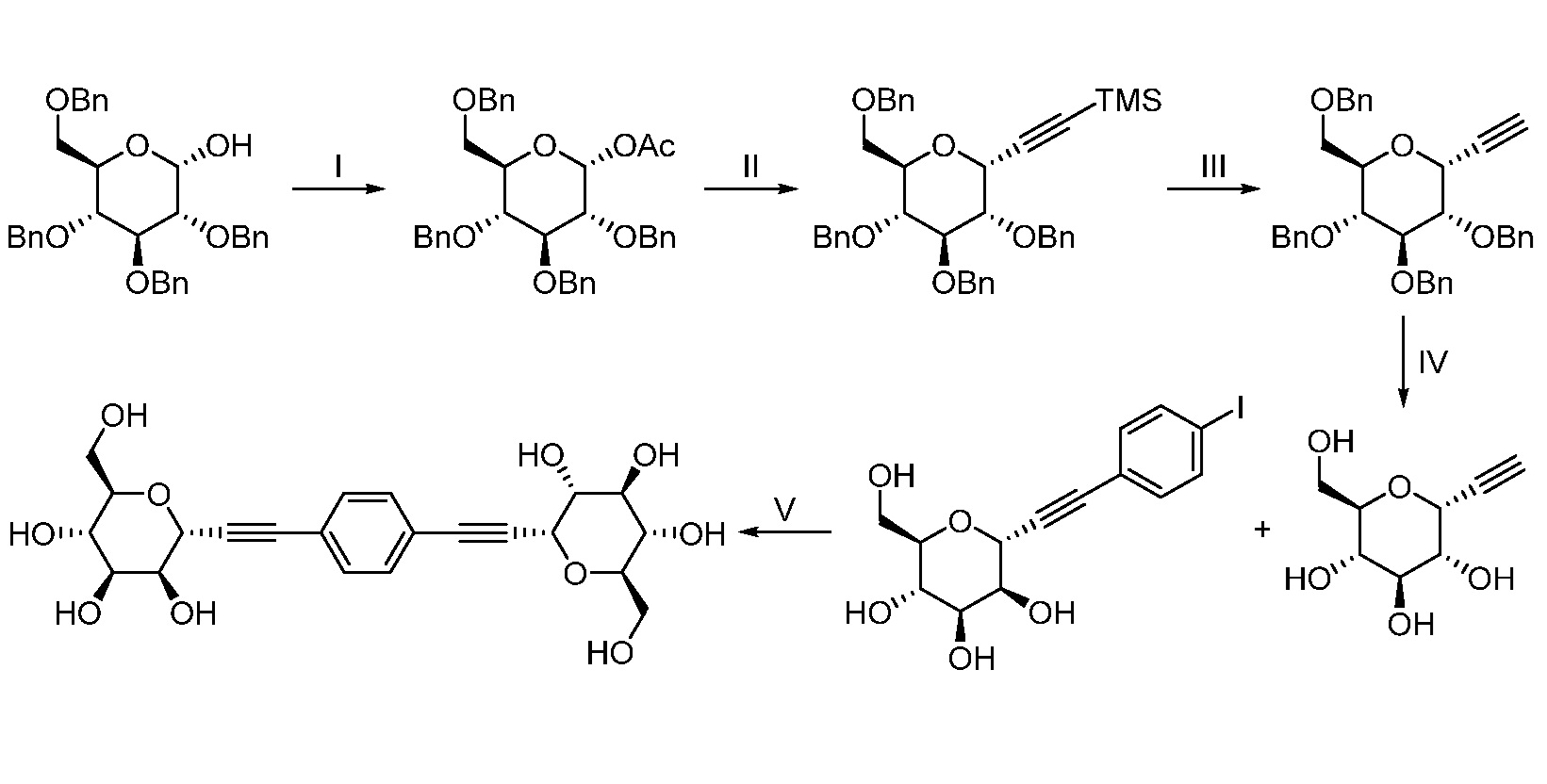
Стадия I: (2R,3R,4S,5R,6R)-3,4,5-Трис(бензилокси)-6-((бензилокси)метил)тетрагидро-2Н-пиран-2-илацетат
К раствору (2S,3R,4S,5R,6R)-3,4,5-трибензилокси-6-бензилоксиметил)тетрагидропиран-2-ола (5,920 г, 10,95 ммоль) в пиридине (21,90 мл) добавляют уксусный ангидрид (2,07 мл, 21,9 ммоль). Реакционную смесь перемешивают в течение 5 часов при КТ, затем концентрируют в вакууме. Сырую смесь разбавляют CH2Cl2 и полученный раствор промывают 1н раствором HCl и насыщенным раствором соли. Органическую фазу сушат над Na2SO4 и концентрируют с получением смеси α/β [(2R,3R,4S,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]ацетата в виде бесцветного масла.
Стадия II: Триметил-[2-[(2R,3S,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]этинил]силан
Смесь [(2R,3R,4S,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]ацетата (1000 мг, 1,716 ммоль), триметил-(2-трибутилстаннилэтинил)силана (1,329 г, 1,260 мл, 3,432 ммоль) и активированных молекулярных сит 4Ǻ (1 г) в CH2Cl2 (8,6 мл) перемешивают в течение 15 минут, затем по каплям при КТ добавляют TMSOTf (620 мкл, 3,43 ммоль). Реакционную смесь перемешивают в течение 1,5 часов и после этого добавляют Et3N (1,00 мл, 7,18 ммоль) и CH2Cl2 (8,6 мл). Полученную смесь фильтруют через целит (элюирование: 10% этилацетат/гексаны), фильтрат концентрируют, и остаток очищают на картридже Biotage™ SNAP (силикагель) с получением указанного в заголовке соединения (269 мг, 25%) в виде масла желтого цвета, загрязненного побочными оловосодержащими продуктами.
Стадия III: (2R,3R,4R,5S,6R)-3,4,5-Трибензилокси-2-(бензилоксиметил)-6-этинилтетрагидропиран
К раствору триметил-[2-[(2R,3S,4R,5R,6R)-3,4,5-трибензилокси-6-(бензилоксиметил)тетрагидропиран-2-ил]этинил]силана (269 мг, 0,433 ммоль) в МеОН (3,6 мл) и CH2Cl2 (722 мкл) при перемешивании добавляют NaOH (1,30 мл, 1М, 1,30 ммоль) и полученную смесь перемешивают в течение 1 часа при КТ. Реакцию гасят добавлением 1н раствора HCl и концентрируют для удаления летучих веществ. К остатку добавляют этилацетат, органическую фазу отделяют и сушат над MgSO4. Остаток растворяют в смеси 20% EtOAc/гексаны и очищают на слое силикагеля (элюирование: 20% EtOAc/гексаны). Фильтрат концентрируют с получением указанного в заголовке соединения (83,0 мг, 35%) в виде бесцветного масла, загрязненного побочными оловосодержащими продуктами с предыдущей стадии.
Стадия IV: (2R,3R,4R,5S,6R)-2-Этинил-6-(гидроксиметил)тетрагидропиран-3,4,5-триол
К раствору (2R,3R,4R,5S,6R)-3,4,5-трибензилокси-2-(бензилоксиметил)-6-этинилтетрагидропирана (76,0 мг, 0,139 ммоль) в EtSH (1,4 мл) добавляют BF3·OEt2 (479 мкл, 3,88 ммоль) и реакционную смесь перемешивают в течение 22 часов при КТ. Реакцию гасят добавлением MeOH и основной смолы для нейтрализации. Смесь фильтруют, и фильтрат концентрируют в вакууме с получением указанного в заголовке соединение (10 мг, 38%) в виде твердого белого вещества.
Получение (2R,3S,4R,5S,6R)-2-(гидроксиметил)-6-[2-(4-йодфенил)этинил]тетрагидропиран-3,4,5-триола
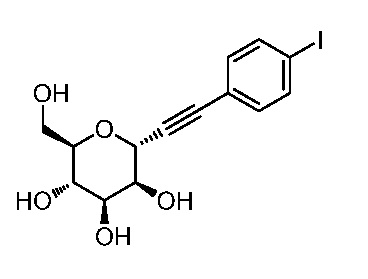
Указанное в заголовке соединение получают в соответствии с методикой, описанной для получения соединения 53, но с использованием 1 экв. 1,4-дийодбензола в стадии I: 1H ЯМР (400 МГц, CD3OD) δ 7,66-7,59 (м, 2H), 7,15-7,08 (м, 2H), 4,75 (д, J=2,1 Гц, 1H), 3,91-3,88 (м, 1H), 3,82-3,74 (м, 2H), 3,72-3,59 (м, 2H), 3,53 (т, J=9,4 Гц, 1H). ЖХ-МС: m/z=390,94 (М+Н+)
Стадия V: Соединение 69
Раствор (2R,3R,4R,5S,6R)-2-этинил-6-(гидроксиметил)тетрагидропиран-3,4,5-триола (10,0 мг, 0,053 ммоль), (2R,3S,4R,5S,6R)-2-(гидроксиметил)-6-[2-(4-йодфенил)этинил]тетрагидропиран-3,4,5-триола (20,7 мг, 0,0531 ммоль), PDCl2(dppf)·CH2Cl2 (8,7 мг, 0,01 ммоль 1) и CuI (2,3 мг, 0,012 ммоль) в ДМФА (511 мкл) дегазируют (N2) и к полученной смеси добавляют триэтиламин (44 мкл, 0,32 ммоль). Смесь перемешивают в герметично закрытой пробирке в атмосфере азота при КТ в течение 18 часов. Реакционную смесь фильтруют через 0,45-мкм фильтр и очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (5 мг, 20%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,45-7,37 (м, 4H), 4,87-4,83 (м, 2H), 3,95 (с, 1H), 3,90-3,71 (м, 5H), 3,71-3,56 (м, 4H), 3,56-3,49 (м, 1H), 3,28-3,22 (м, 1H). ЖХ-МС: m/z=451,46 (М+Н+).
Получение соединений с 70 по 76
Соединение 70 получают в соответствии с методикой, описанной для получения соединения 53.
Соединения 71-76 получают в соответствии с методикой, описанной для получения соединения 59.
|
|
|
Получение соединения 77 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[3-фенил-4-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]фенил]этинил]тетрагидропиран-3,4,5-триол
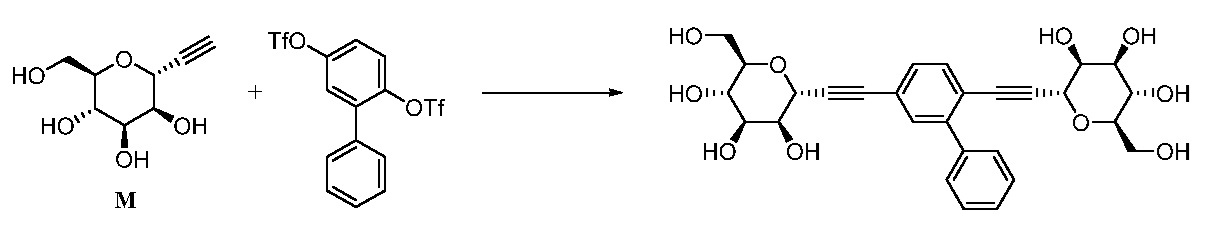
[3-Фенил-4-(трифторметилсульфонилокси)фенил]трифторметансульфонат (полученный в результате введения трифторметансульфогруппы в 2-фенилгидрохинон) (54 мг, 0,12 ммоль), CuI (9,0 мг, 0,048 ммоль) и Pd(dppf)Cl2-CH2Cl2 (9,0 мг, 0,012 ммоль) загружают в реакционную пробирку. Добавляют дегазированный раствор промежуточного соединения М (0,5 мл 0,53 М, 0,27 ммоль) в ДМФА с последующим добавлением DIEA (105 мкл, 0,60 ммоль). Пробирку герметизируют и встряхивают при 90°С в течение ночи с использованием реакционного блока. Реакционную смесь фильтруют, промывают ДМФА. Полученный фильтрат очищают с помощью ВЭЖХ с обращенной фазой, фракции, содержащие целевое соединение, объединяют и сушат вымораживанием с получением указанного в заголовке соединения (28 мг, выход 44%) в виде ворсистого твердого белого вещества.
1H ЯМР (400 МГц, CD3OD) δ 7,56 (д, J=8,0 Гц, 1H), 7,53-7,35 (м, 7H), 4,88 (д, J=2,1 Гц, 1H), 4,74 (д, J=2,0 Гц, 1H), 4,01 (дд, J=3,2, 2,1 Гц, 1H), 3,93 (дд, J=9,4, 3,3 Гц, 1H), 3,88 (дд, J=11,5, 2,1 Гц, 1H), 3,84-3,50 (м, 9H). МС-ESI m/z: вычислено 526,18, найдено 527,44 (М+1)+.
Получение соединений с 78 по 102
Соединения 78-84 и 86-89 получают в соответствии с методикой, описанной для получения соединения 59. Соединение 85 получают в соответствии с методикой, описанной для получения соединения 171. Соединения 100-102 получают в соответствии с методикой, описанной для получения соединения 103.
|
|
|
|
|
|
|
|
|
Получение соединения 103 (способ С)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[3-изопропил-4-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]фенил]этинил]тетрагидропиран-3,4,5-триол
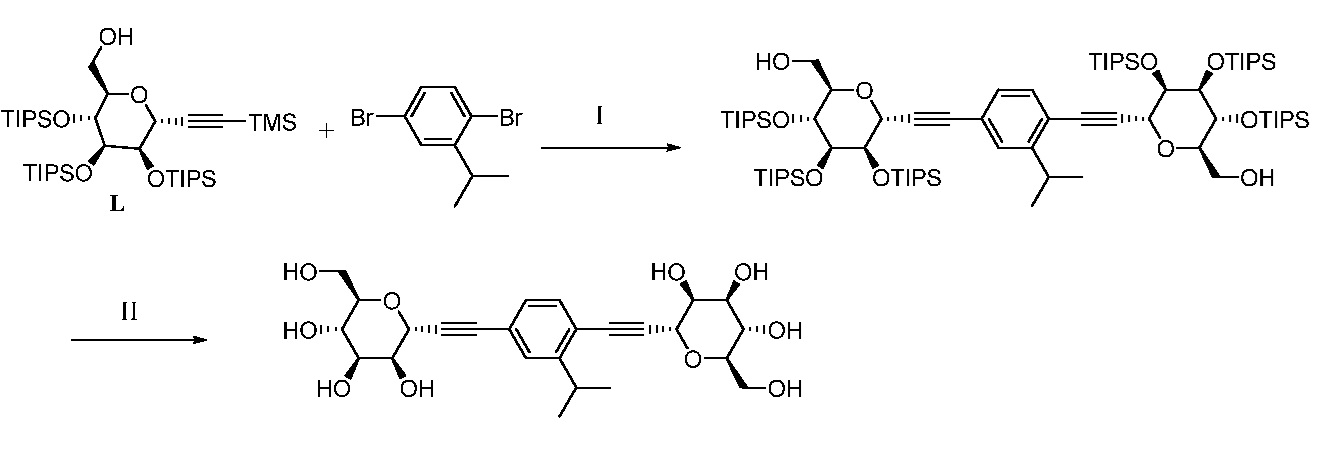
Стадия I: [(2R,3R,4R,5R,6R)-6-[2-[4-[2-[(2R,3R,4R,5R,6R)-6-Гидроксиметил)-3,4,5-трис(триизопропилсилилокси)тетрагидропиран-2-ил]этинил]-3-изопропилфенил]этинил]-3,4,5-трис(триизопропилсилилокси)тетрагидропиран-2-ил]
В стеклянную емкость загружают 1,4-дибром-2-изопропилбензол (60 мг, 0,22 ммоль), CuI (12 мг, 0,061 ммоль) и Pd(dppf)Cl2-CH2Cl2 (20 мг, 0,028 ммоль), емкость закрывают и дегазируют (вакуум-азот, 3 раза). Добавляют дегазированный раствор промежуточного соединения L (1,6 мл 0,26 М, 0,41 ммоль) в ДМФА и дегазированный ДМФА (0,9 мл) с последующим добавлением дегазированной смеси DBU и H2O (8:3 об./об., 250 мкл). Емкость переносят на предварительно нагретую масляную баню (90°С) и реакционную смесь преемешивают в течение ночи. Реакционную смесь охлаждают до КТ и распределяют между насыщенным раствором NH4Cl (5 мл) и EtOAc (10 мл). Слои разделяют, и водный слой снова экстрагируют этилацетатом (2×2 мл). Объединенные органические экстракты сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают флэш-хроматографией на картридже Biotage™ SNAP (силикагель, 25 г; элюирование с градиентом: EtOAc в гексанах, 0-20%) с получением указанного в заголовке соединения (90 мг, выход 29%) в виде смолы желтоватого цвета.
Стадия II: Соединение 103
Раствор [(2R,3R,4R,5R,6R)-6-[2-[4-[2-[(2R,3R,4R,5R,6R)-6-гидроксиметил)-3,4,5-трис(триизопропилсилилокси)тетрагидропиран-2-ил]этинил]-3-изопропилфенил]этинил]-3,4,5-трис(триизопропилсилилокси)тетрагидропиран-2-ил]метанола (90 мг, 0,066 ммоль), полученного на стадии I, в смеси ТГФ (810 мкл), ТФУК (405 мкл) и H2O (405 мкл) кипятят с обратным холодильником (80°С) в течение 48 часов и концентрируют. Остаток очищают флэш-хроматографией с обращенной фазой на картридже Biotage™ SNAP (силикагель, С18, 12 г; элюирование с градиентом: MeCN в H2O, 0-70%). Фракции концентрируют и сушат вымораживанием с получением указанного в заголовке соединения (13 мг, выход 40%) в виде ворсистого твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,41 (д, J=8,0 Гц, 1H), 7,39 (д, J=1,5 Гц, 1H), 7,26 (дд, J=7,9, 1,6 Гц, 1H), 4,92 (д, J=2,1 Гц, 1H), 4,88 (д, J=2,1 Гц, 1H), 4,04-3,98 (м, 2H), 3,95-3,88 (м, 3H), 3,86 (дд, J=3,3, 2,1 Гц, 1H), 3,84-3,71 (м, 4H), 3,69-3,58 (м, 2H), 3,41 (пент, J=6,9 Гц, 1H), 1,27 (д, J=6,9 Гц, 6H). МС-ESI m/z: вычислено 492,19955, найдено (М+1)+ 493,36.
Получение соединений со 104 по 109
Соединения 104 и 105 получают в соответствии с методикой, описанной для получения соединения 103.
Соединения 106, 108 и 109 получают в соответствии с методикой, описанной для получения соединения 59. Соединение 107 получают в соответствии с методикой, описанной для получения соединения 110.
|
|
|
Получение соединения 110 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[9-пропил-7-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]карбазол-2-ил]этинил]тетрагидропиран-3,4,5-триол
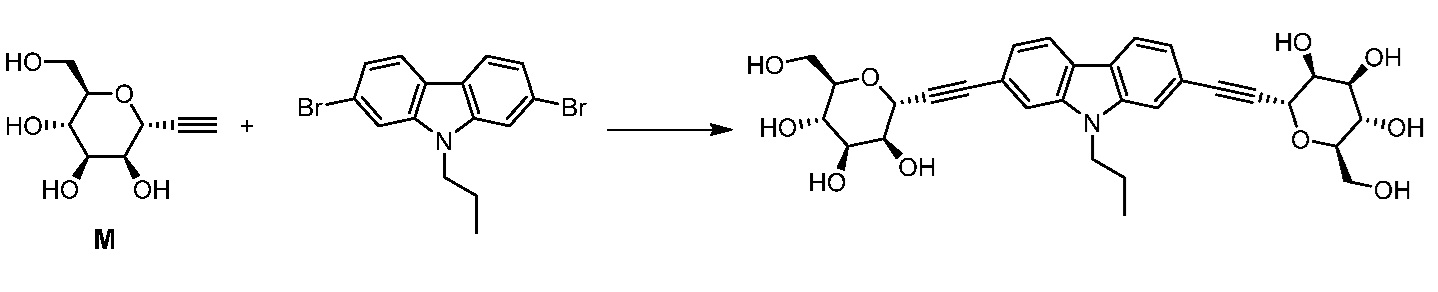
Смесь промежуточного соединения М (500 мкл, 0,53 М в ДМФА, 0,265 ммоль), AG15 (43 мг, 0,1171 ммоль), Pd(dppf)Cl2-CH2Cl2 (15 мг, 0,0184 ммоль) и CuI (15 мг, 0,079 ммоль) в ДМФА (200 мкл) дегазируют (N2). К полученной смеси добавляют N-этил-N-изопропилпропан-2-амин (180 мкл, 1,03 ммоль). Реакционную смесь перемешивают в герметично закрытой пробирке в атмосфере азота при 100°С в течение 18 часов. Реакционную смесь фильтруют через 0,45-мкм фильтр и концентрируют в вакууме. Остаток очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (7,9 мг, 10%) в виде твердого вещества серого цвета. 1H ЯМР (400 МГц, CD3OD) δ 8,05 (д, J=7,9 Гц, 2H), 7,63 (с, 2H), 7,29 (д, J=7,9 Гц, 2H), 4,90 (с, 2H), 4,33 (т, J=7,1 Гц, 2H), 4,04 (с, 2H), 4,03-3,96 (м, 2H), 3,88 (т, J=8,0 Гц, 4H), 3,75 (дд, J=12,1, 5,5 Гц, 2H), 3,65 (т, J=9,3 Гц, 2H), 1,87 (дд, J=14,5, 7,2 Гц, 2H), 0,93 (т, J=7,1 Гц, 3H). МС-ESI m/z: вычислено 581,61, найдено 582,44 (М+1)+.
Получение соединений 111 и 112
Соединения 111 и 112 получают в соответствии с методикой, описанной для получения соединения 110, с использованием соответствующих промежуточных соединений.
|
Получение соединения 113 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[9-гидрокси-9-пентил-7-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]флуорен-2-ил]этинил]тетрагидропиран-3,4,5-триол
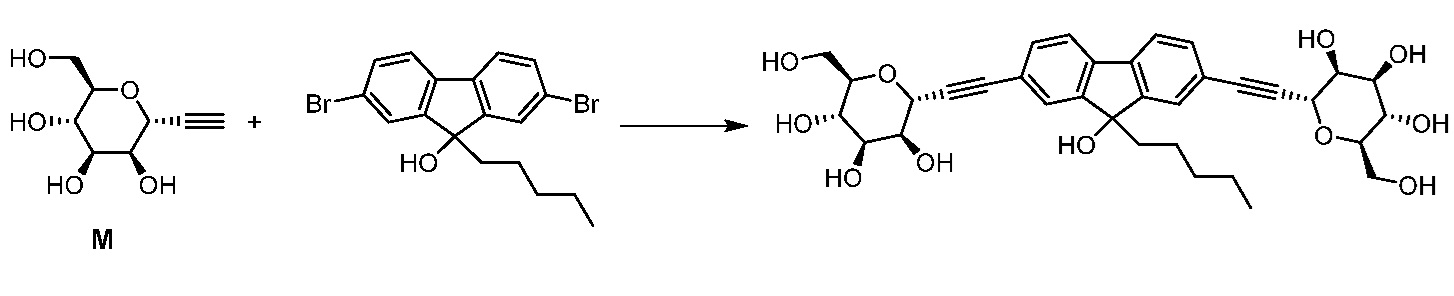
Стадия I: 2,7-Дибром-9-пентилфлуорен-9-ол
Раствор 2,7-дибромфлуорен-9-она (200 мг, 0,592 ммоль) в ТГФ (2 мл) добавляют к раствору н-пентилмагнийбромида (2,0M в Et2O, 355 мкл, 0,710 ммоль), разбавленного в Et2O (4 мл) при 0°С. Реакционную смесь перемешивают в течение 18 часов при КТ и гасят с помощью 1н раствора Na2CO3. Органическую фазу отделяют, промывают насыщенным раствором соли, сушат над MgSO4, фильтруют и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, элюирование с градиентом: EtOAc/гексаны, 0-8%) с получением 2,7-дибром-9-пентилфлуорен-9-ола (150 мг, 62%) в виде твердого белого вещества.
Стадия II: Соединение 113
Раствор промежуточного соединения М (500 мкл, 0,53М в ДМФА, 0,265 ммоль), 2,7-дибром-9-пентилфлуорен-9-ола (50,0 мг, 0,122 ммоль), Pd(dppf)Cl2-CH2Cl2 (15 мг, 0,018 ммоль) и CuI (15 мг, 0,07876 ммоль) в ДМФА (200 мкл) дегазируют (N2). К полученной смеси добавляют N-этил-N-изопропилпропан-2-амин (180 мкл, 1,03 ммоль). Полученную смесь перемешивают в герметично закрытой пробирке в атмосфере азота при 100°С в течение 18 часов. Реакционную смесь фильтруют через 0,45-мкм фильтр и концентрируют в вакууме. Остаток очищают с помощью ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение (9,4 мг, 11%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,68 (д, J=7,8 Гц, 2H), 7,55 (с, 2H), 7,47 (д, J=7,8 Гц, 2H), 4,80 (с, 2H), 4,01 (с, 2H), 3,98-3,92 (м, 2H), 3,91-3,80 (м, 4H), 3,73 (дд, J=11,3, 5,6 Гц, 2H), 3,63 (т, J=9,6 Гц, 2H), 2,15-2,07 (м, 2H), 1,16-1,07 (м, 4H), 0,79-0,64 (м, 5H). МС-ESI m/z: вычислено 624,68, найдено 625,47 (М+1)+.
Получение соединений со 114 по 119
Соединения 114 и 115 получают в соответствии с методикой, описанной для получения соединения 113, с использованием соответствующих промежуточных соединений. Соединения 116-119 получают в соответствии с методикой, описанной для получения соединения 59, с использованием коммерчески доступных исходных соединений.
|
|
|
Получение соединения 120 (способ D)
(2R,3S,4R,5S,6R)-2-[2-[9,9-Диметил-7-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]флуорен-2-ил]этинил]-6-(гидроксиметил)тетрагидропиран-3,4,5-триол
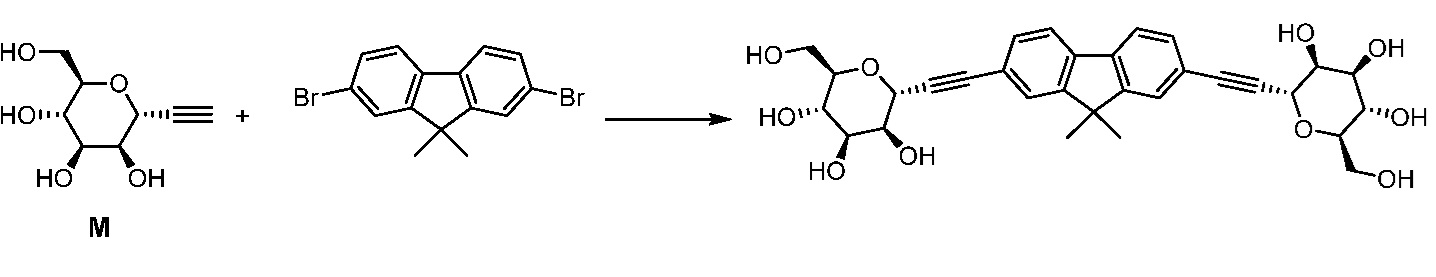
Раствор промежуточного соединения М (1,00 г, 5,31 ммоль), 2,7-дибром-9,9-диметил-флуорена (870 мг, 2,47 ммоль), Pd(dppf)Cl2-CH2Cl2 (141 мг, 0,1727 ммоль), CuI (141 мг, 0,7404 ммоль) дегазируют (N2) и к полученной смеси добавляют N-этил-N-изопропилпропан-2-амин (3,73 мл, 21,4 ммоль). Реакционную смесь перемешивают в герметично закрытой пробирке в атмосфере азота при 100°С в течение часа. Реакционную смесь выливают в круглодонную колбу, содержащую Ас2О (25,0 мл, 265 ммоль) и пиридин (25 мл, 309 ммоль), и полученную смесь перемешивают в течение 18 часов при КТ. После этого реакционную смесь концентрируют в вакууме, остаток растворяют в EtOAc (100 мл) и промывают раствором NH4Cl (3×125 мл). Органическую фазу сушат над MgSO4, фильтруют и концентрируют. Полученный остаток очищают на картридже Biotage™ SNAP (силикагель, 100 г; элюирование с градиентом: EtOAc в гексанах, 20-80%), получая указанное перацетилированное соединение 120 (1,36 г, 61%) в виде твердого пенообразного вещества бледно-желтого цвета. 1H ЯМР (400 МГц, CDCl3) δ 7,70 (д, J=7,9 Гц, 2H), 7,57 (с, 2H), 7,52 (дд, J=7,9, 1,3 Гц, 2H), 5,60 (дд, J=10,0, 3,4 Гц, 2H), 5,48 (дд, J=3,2, 2,1 Гц, 2H), 5,36 (т, J=10,0 Гц, 2H), 5,05 (д, J=2,0 Гц, 2H), 4,37 (дд, J=12,2, 4,8 Гц, 2H), 4,31 (ддд, J=10,0, 4,7, 2,0 Гц, 2H), 4,18 (дд, J=12,2, 2,0 Гц, 2H), 2,22 (с, 6H), 2,14 (с, 6H), 2,07 (с, 6H), 2,04 (с, 6H), 1,52 (с, 6H). МС-ESI m/z: вычислено 902,29974, найдено 903,73 (М+1)+.
К перацетилированному соединению 120, т.е. [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[2-[9,9-диметил-7-[2-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]этинил]флуорен-2-ил]этинил]тетрагидропиран-2-ил]метилацетату, (1,36 г, 1,506 ммоль), растворенному в МеОН (27 мл) (прозрачный раствор), добавляют MeONa в MeOH (3,00 мл, 0,5М, 1,50 ммоль). Спустя 1 час реакционную смесь обрабатывают предварительно промытой смолой Dowex 50WX4 (2,9 г), фильтруют и концентрируют. К остатку коричневого цвета добавляют 15 мл MeOH, суспензию обрабатывают ультразвуком, затем перемешивают при 40°С в атмосфере N2 в течение 1,5 часов. Смесь охлаждают до КТ, помещают на баню со льдом и фильтруют с получением указанного в заголовке соединения в виде твердого вещества светло-бежевого цвета (659 мг, 76% - из перацетилированного промежуточного соединения). 1H ЯМР (400 МГц, CD3OD) δ 7,74 (д, J=7,8 Гц, 2H), 7,57 (с, 2H), 7,43 (д, J=7,9 Гц, 2H), 4,87 (с, 2H), 4,02 (с, 2H), 3,96 (дд, J=9,2, 3,1 Гц, 2H), 3,90-3,81 (м, 4H), 3,74 (дд, J=11,2, 5,2 Гц, 2H), 3,64 (т, J=9,2 Гц, 2H), 1,46 (с, 6H). [1], 1Н-ЯМР (400 МГц, CD3OD) δ 7,74 (д, J=7,9 Гц, 2H), 7,57 (с, 2H), 7,44 (д, J=7,9 Гц, 2H), 4,92 (с, 2H), 4,03-4,00 (м, 2H), 3,96 (дд, J=9,4, 3,0 Гц, 2H), 3,91-3,81 (м, 4H), 3,74 (дд, J=11,2, 5,3 Гц, 2H), 3,63 (т, J=9,2 Гц, 2H), 1,46 (с, 6H). МС-ESI m/z: вычислено 566,60, найдено 567,42 (М+Н)+.
Получение соединений со 121 по 138
Соединения 121-138 получают в соответствии с методикой, описанной для получения соединения 59, с использованием коммерчески доступных исходных веществ.
|
|
|
|
|
|
|
Получение соединения 139 (способ А)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[3-[4-[3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]фенил]фенил]тетрагидропиран-3,4,5-триол
Стадия I: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[3-[4-[3-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]фенил]фенил]фенил]тетрагидропиран-2-ил]метилацетат
Смесь промежуточного соединения O (101 мг, 0,188 ммоль), 1-бром-4-йодбензола (86 мг, 0,304 ммоль), Siliacat DPP-Pd (72 мг, 0,018 ммоль), карбоната цезия (135 мг, 0,414 ммоль) в CH3CN (1,9 мл) в емкости для микроволновой обработки подвергают микроволновой обработке в течение 10 минут при 100°С. Полученную смесь разбавляют 4 мл EtOAc, фильтруют через целит и упаривают досуха. Остаток используют в следующей стадии без дополнительной очистки.
Стадия II: Соединение 139
В [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[3-[4-[3-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]фенил]фенил]фенил]тетрагидропиран-2-ил]метилацетате, полученном на стадии I, удаляют защитную группу, как описано выше, используя смесь МеОН/MeONa. 1H ЯМР (400 МГц, CD3OD) δ 7,83 (д, J=1,5 Гц, 2H), 7,73 (с, 4H), 7,59 (ддд, J=5,7, 3,8, 2,0 Гц, 2H), 7,46 (дд, J=4,2, 1,6 Гц, 4H), 5,04 (д, J=3,7 Гц, 2H), 4,49 (т, J=3,4 Гц, 2H), 3,85 (м, 4H), 3,75 (т, J=7,8 Гц, 2H), 3,64 (дд, J=7,9, 3,1 Гц, 2H), 3,55 (ддд, J=7,8, 5,6, 4,1 Гц, 2H).
Получение соединения 140 (способ А)
Метил-2-[2,5-бис[3-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]фенил]ацетат
Соединение 140 получают в соответствии с методикой, описанной для получения соединения 139, но с использованием метил-2-(2,5-дибромфенил) ацетата в качестве исходного вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,82 (с, 1H), 7,63-7,56 (м, 3H), 7,50 (д, J=7,7 Гц, 1H), 7,48-7,41 (м, 4H), 7,34-7,30 (м, 1H), 7,23 (д, J=7,5 Гц, 1H), 5,04 (д, J=3,7 Гц, 1H), 5,01 (д, J=3,6 Гц, 1H), 4,49 (т, J=3,5 Гц, 1H), 4,45 (т, J=3,4 Гц, 1H), 3,87-3,81 (м, 4H), 3,78-3,73 (м, 2H), 3,70 (с, 2H), 3,66-3,60 (м, 2H), 3,58 (с, 3H), 3,57-3,49 (м, 2H). МС-ESI: m/z (М+1)+ 627,4.
Получение соединения 141 (способ F)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[4-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]этинил]тетрагидропиран-3,4,5-триол
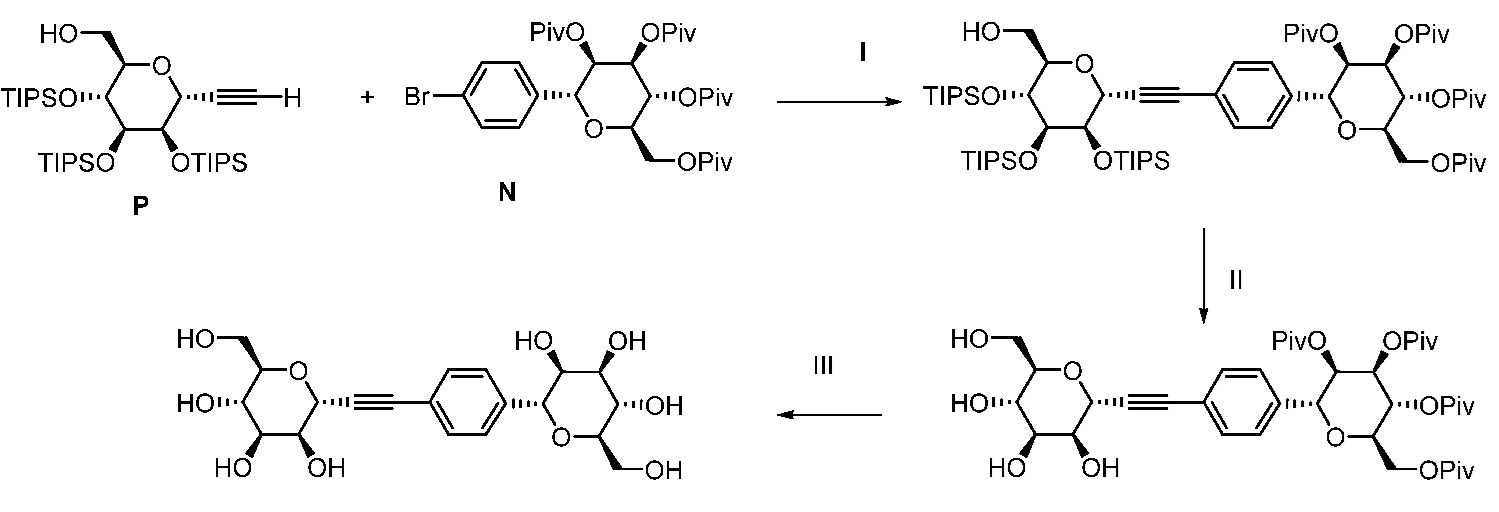
Стадия I: (2R,3R,4R,5R,6R)-2-(4-(((2R,3R,4R,5R,6R)-6-(Гидроксиметил)-3,4,5-трис((триизопропилсилил)окси)тетрагидро-2Н-пиран-3,4,5-триил-трис(2,2-диметилпропаноат)
В емкость загружают промежуточное соединение N (100 мг, 0,153 ммоль) и промежуточное соединение P (113 мг, 0,168 ммоль) в ДМФА (2,500 мл). Полученную смесь дегазируют. К смеси добавляют PdCl2(dppf)2-CH2Cl2 (15,8 мг, 0,0193 ммоль) и CuI (8,7 мг, 0,046 ммоль), полученную смесь снова дегазируют и затем добавляют Et3N (64 мкл, 0,46 ммоль). Емкость закрывают, и реакционную смесь перемешивают при 90°С в течение ночи. Смесь пропускают через целит, и остаточные растворители удаляют при пониженном давлении. Сырую смесь используют в следующей стадии без дополнительной очистки (201 мг, 0,163 ммоль).
Стадия II: (2R,3R,4R,5R,6R)-2-((Пивалоилокси)метил)-6-(4-(((2R,3R,4R,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил)этинил)фенил)тетрагидро-2Н-пирантриил-трис(2,2-диметилпропаноат)
К раствору (2R,3R,4R,5R,6R)-2-(4-(((2R,3R,4R,5R,6R)-6-(гидроксиметил)-3,4,5-трис((триизопропилсилил)окси)тетрагидро-2Н-пиран-2-ил)этинил)фенил)-6-((пивалоилокси)метил)тетрагидро-2Н-пиран-3,4,5-триил-трис(2,2-диметилпропаноата), полученного на стадии I, (187 мг, 0,152 ммоль) в ТГФ (2,1 мл) добавляют TBAF (607 мкл, 1 М, 0,607 ммоль). Полученную суспензию перемешивают в течение ночи при КТ. Смесь разбавляют ТГФ (1,5 мл) и обрабатывают Amberlyst Ca2+ (500 мг) и Amberlyst А-15 Н (500 мг) (предварительно промытыми H2O и ТГФ). Суспензию перемешивают в течение 1,5 часов, затем фильтруют и промывают порциями МеОН. Растворители удаляют и полученную сырую смесь используют в следующей стадии без дополнительной очистки.
Стадия III: Соединение 141
К сырой смеси (2R,3R,4R,5R,6R)-2-((пивалоилокси)метил)-6-(4-(((2R,3R,4R,5R,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидро-2Н-пиран-2-ил)этинил)фенил)тетрагидро-2Н-пирантриил-трис(2,2-диметилпропаноата), полученного на стадии II, и МеОН (2 мл) добавляют MeONa (607 мкл, 0,5М, 0,304 ммоль). Полученную смесь перемешивают при КТ в течение ночи. К смеси добавляют АсОН (17 мкл, 0,30 ммоль) и полученную смесь концентрируют в вакууме. Остаток очищают с помощью ВЭЖХ с обращенной фазой, получая указанное в заголовке соединение (7,6 мг). 1H ЯМР (400 МГц, CD3OD) δ 7,51-7,40 (м, 4H), 4,93 (д, J=4,0 Гц, 1H), 4,38-4,29 (м, 1H), 3,98 (дд, J=3,3, 2,1 Гц, 1H), 3,91 (дд, J=9,3, 3,3 Гц, 1H), 3,88-3,76 (м, 4H), 3,76-3,68 (м, J=5,6, 3,4 Гц, 2H), 3,62 (т, J=9,5 Гц, 1H), 3,56 (дд, J=7,7, 3,1 Гц, 1H), 3,47 (тд, J=6,9, 3,5 Гц, 1H). МС-ESI m/z: вычислено 426,41, найдено (М+1)+ 427,39.
Получение соединений 142-145 и 148
Соединения 142-145, 148 получают в соответствии с методикой, описанной для получения соединения 141.
|
|
|
Получение соединения 146 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]-1Н-индол-6-ил]этинил]тетрагидропиран-3,4,5-триол
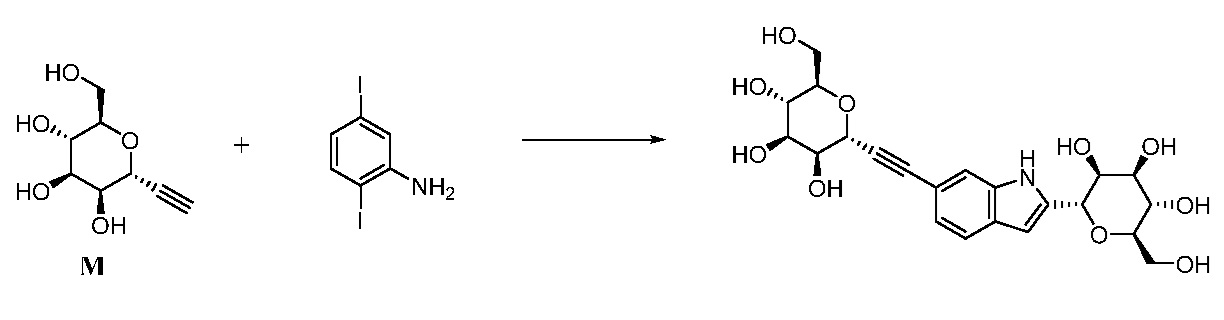
2,5-Дийоданилин (37 мг, 0,11 ммоль) и Pd(PPh3)4 (12 мг, 0,011 ммоль) загружают в стеклянную емкость, емкость закрывают, дегазируют (вакуум, затем N2, 3x), и к смеси добавляют раствор промежуточного соединения М (400 мкл, 0,53М раствор в ДМФА, 0,22 ммоль) с последующим добавлением DIPEA (300 мкл, 1,72 ммоль). Смесь дегазируют снова, затем переносят на предварительно нагретую масляную баню (60°С) и перемешивают в течение ночи. Полученную смесь фильтруют и очищают ВЭЖХ с обращенной фазой. Фракции, содержащие целевой продукт, объединяют и сушат вымораживанием с получением указанного в заголовке соединения (4,2 мг, выход 8%) в виде ворсистого твердого вещества бледно-желтого цвета. 1H ЯМР (400 МГц, CD3OD) δ 7,49-7,42 (м, 2H), 7,09 (дд, J=8,3, 1,3 Гц, 1H), 6,42 (т, J=0,9 Гц, 1H), 5,25-5,13 (м, 1H), 4,88 (д, J=2,0 Гц, 1H), 4,50 (дд, J=3,3, 2,2 Гц, 1H), 4,07-3,96 (м, 2H), 3,93-3,84 (м, 3H), 3,83-3,71 (м, 3H), 3,71-3,60 (м, 2H), 3,35-3,23 (м, 1H). МС-ESI m/z: вычислено 465,16348, найдено (М+1)+ 466,47.
Получение соединения 150 (способ А)
(2R,2'R,3S,3'S,4R,4'R,5S,5'S,6R,6'R)-6,6'-(2-Фтор-3'-метил-[1,1'-бифенил]-4,4'-диил)бис(2-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триол)
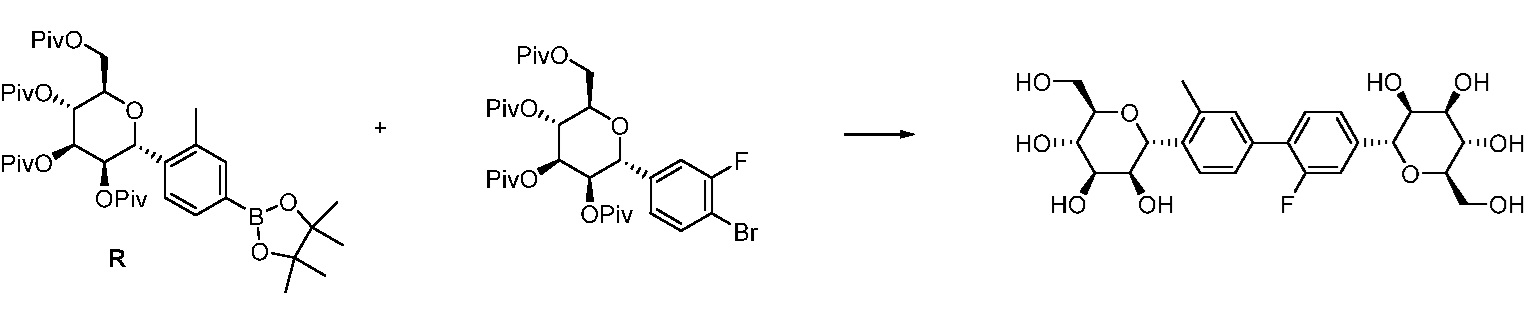
К раствору [(2R,3R,4R,5R,6R)-6-(4-бром-3-фторфенил)-3,4,5-трис(2,2-диметилпропаноилокси)тетрагидропиран-2-ил]метил-2,2-диметилпропаноата (90,2 мг, 0,134 ммоль, получен в соответствии с методикой, описанной для получения промежуточного соединения N, но с использованием 1-бром-2-фтор-4-йодбензола в качестве исходного соединения) и промежуточного соединения R (96,0 мг, 0,134 ммоль) в 2-метил-ТГФ (2,7 мл) последовательно добавляют 3-(2-дициклогексилфосфанилфенил)-2,4-диметоксибензолсульфоновую кислоту (натриевую соль) (13,8 мг, 0,0268 ммоль), Pd(OAc)2 (3,0 мг, 0,013 ммоль) (предварительно смешивают с 0,25 мл MeTHF), K2CO3 (335 2М, 0,669 ммоль) и полученную смесь перемешивают при 40°С в течение ночи. Реакционную смесь разбавляют этилацетатом (10 мл) и водой (5 мл), слои разделяют, водный слой снова экстрагируют 10 мл AcOEt. Объединенные органические слои сушат над Na2SO4 и упаривают досуха. Остаток растворяют в МеОН (2 мл) и MeONa (1,0 мл, 0,5М в МеОН, 0,5 ммоль) и перемешивают полученную смесь в течение ночи при КТ. К смеси добавляют АсОН (30,5 мкл, 0,536 ммоль), смесь упаривают досуха, и остаток очищают с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (12,4 мг, 18%). 1H ЯМР (400 МГц, CD3OD) δ 7,52 (д, J=8,0 Гц, 1H), 7,46 (т, J=8,1 Гц, 1H), 7,34 (м, 4H), 5,14 (д, J=6,5 Гц, 1H), 4,97 (д, J=4,1 Гц, 1H), 4,37 (дд, J=4,1, 3,1 Гц, 1H), 4,26 (дд, J=6,4, 3,3 Гц, 1H), 3,99 (м, 2H), 3,83 (м, 3H), 3,75 (м, 2H), 3,57 (м, 3H), 2,49 (с, 3H). МС-ESI m/z: вычислено 510,51, найдено (М+1)+ 511,42.
Получение соединений 147, 149 и 151
Соединения 147, 149 и 151 получают в соответствии с методикой, описанной для получения соединения 150.
|
|
Получение соединения 152 (модифицированный способ В)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-метил-4-[2-[3-метил-4-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]этинил]фенил]тетрагидропиран-3,4,5-триол
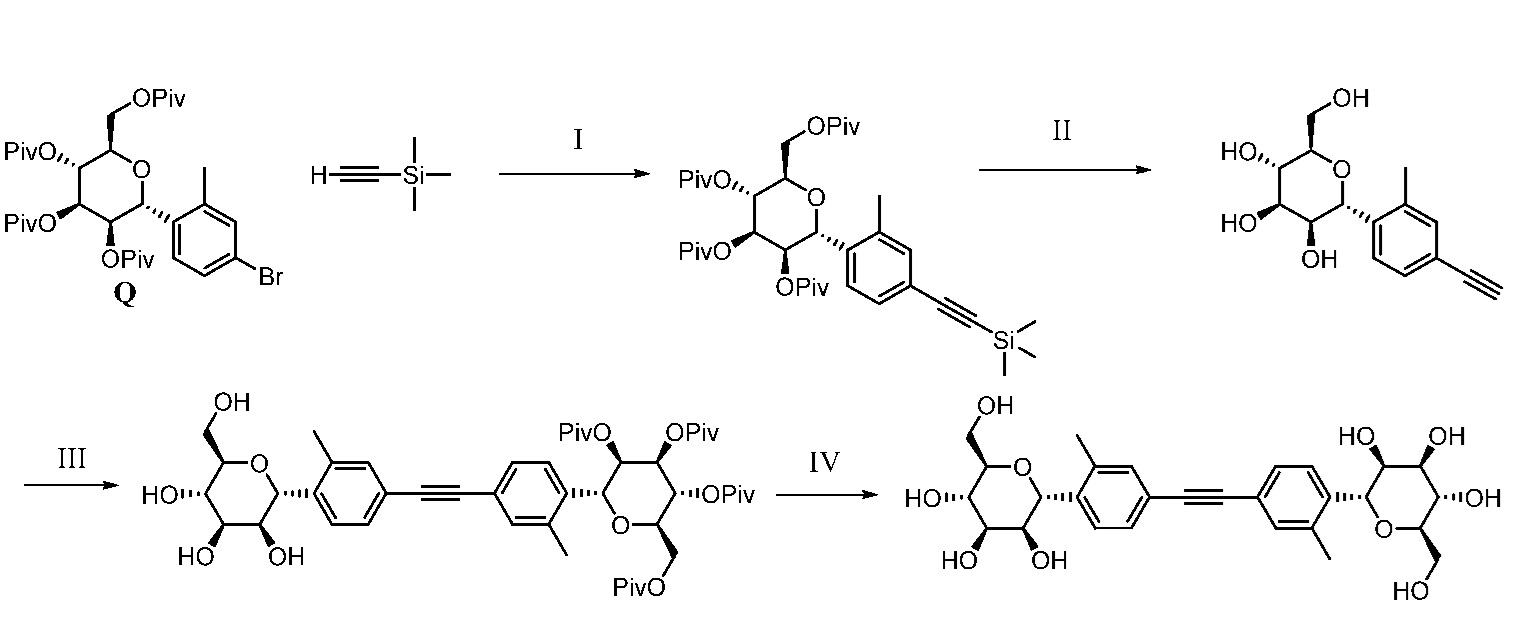
Стадия I: [(2R,3R,4R,5R,6R)-3,4,5-Трис(2,2-диметилпропаноилокси)-6-[2-метил-4-(2-триметилсилилэтинил)фенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноат
В стеклянную емкость загружают промежуточное соединение Q (259 мг, 0,389 ммоль), Pd(dppf)Cl2-CH2Cl2 (33 мг, 0,040 ммоль) и CuI (21 мг, 0,11 ммоль), емкость закрывают и продувают N2, затем добавляют ДМФА (2,6 мл), этинил(триметил)силан (275 мкл, 1,95 ммоль) и Et3N (270 мкл, 1,94 ммоль). Реакционную смесь переносят на предварительно нагретую (80°C) масляную баню и перемешивают на бане в течение ночи. Реакционную смесь охлаждают до КТ и разбавляют этилацетатом и насыщенным водным раствором NH4Cl (по 10 мл каждого). Органический слой отделяют, промывают насыщенным водным раствором NH4Cl (2×5 мл), насыщенным раствором соли (5 мл), сушат над Na2SO4 и пропускают через картридж диоксида кремния (2 г), элюируя EtOAc. Фильтрат концентрируют, затем очищают на картридже Biotage™ SNAP (силикагель, 10 г; элюирование с градиентом: EtOAc в гексанах, 0-20%). Целевые фракции объединяют и концентрируют с получением указанного в заголовке соединения (246 мг, выход 93%) в виде пены желтого цвета.
Стадия II: (2R,3S,4R,5S,6R)-2-(4-Этинил-2-метилфенил)-6-(гидроксиметил)тетрагидропиран-3,4,5-триол
К раствору [(2R,3R,4R,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-[2-метил-4-(2-триметилсилилэтинил)фенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноата, полученного на стадии I, (244 мг, 0,355 ммоль) в МеОН (2,5 мл) добавляют MeONa в MeOH (2,1 мл, 0,5М, 1,1 ммоль) и полученную смесь помещают на предварительно нагретую (60°С) масляную баню. Смесь перемешивают в течение 3 часов, затем охлаждают до КТ, обрабатывают предварительно промытой смолой Dowex 50WX4-400, фильтруют и промывают порциями МеОН. Объединенные фильтраты концентрируют и очищают с помощью флэш-хроматографии на картридже bond Elut (диоксид кремния, 5 г; элюирование с градиентом: MeOH в CH2Cl2, 0-20%). Объединенные фракции концентрируют с получением указанного в заголовке соединения (90 мг, выход 91%) в виде пенообразного твердого вещества желтого цвета.
Стадия III: (2R,3R,4R,5R,6R)-3,4,5-Трис(2,2-диметилпропаноилокси)-6-[2-метил-4-[2-[3-метил-4-[(2R,3S,4R,5S,6S)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]этинил]фенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноат
В стеклянную емкость загружают (2R,3S,4R,5S,6R)-2-(4-этинил-2-метилфенил)-6-(гидроксиметил)тетрагидропиран-3,4,5-триол (35,0 мг, 0,12 ммоль), промежуточное соединение Q (70,0 мг, 0,105 ммоль), CuI (10 мг, 0,053 ммоль) и Pd(dppf)Cl2-CH2Cl2 (10 мг, 0,014 ммоль), емкость закрывают, продувают N2, добавляют ДМФА (0,7 мл) и DIEA (55 мкл, 0,32 ммоль). Смесь дегазируют, помещают на предварительно нагретую масляную баню (90°С) и перемешивают в течение 1 часа, затем медленно охлаждают до комнатной температуры и оставляют на ночь. Реакционную смесь разбавляют этилацетатом и насыщенным раствором NH4Cl (по 10 мл каждого) и фильтруют. Слои разделяют, водный слой экстрагируют EtOAc (5 мл). Объединенные органические экстракты промывают насыщенным раствором NH4Cl (5 мл), насыщенным раствором соли (5 мл), сушат над Na2SO4, фильтруют и концентрируют. Сырой продукт очищают на картридже Biotage™ SNAP (диоксид кремния, 10 г; элюирование с градиентом: МеОН в CH2Cl2, 0-20%). Объединенные фракции концентрируют с получением указанного в заголовке соединения (28 мг, выход 31%) в виде твердого вещества розовато-коричневого цвета.
Стадия IV: Соединение 152
Удаление защиты из [(2R,3R,4R,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-[2-метил-4-[2-[3-метил-4-[(2R,3S,4R,5S,6S)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]этинил]фенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноата со стадии III (28 мг, 0,32 ммоль) проводят в соответствии с методикой, описанной в стадии II, с получением указанного в заголовке соединения (17 мг, выход 94%) в виде ворсистого твердого не совсем белого вещества (после повторного растворения сырого продукта в смеси H2O/MeCN (20% MeCN) и сушки вымораживанием). 1H ЯМР (400 МГц, CD3OD) δ 7,49 (д, J=8,6 Гц, 2H), 7,34 (д, J=7,2 Гц, 4H), 5,11 (д, J=7,0 Гц, 2H), 4,20 (дд, J=7,0, 3,3 Гц, 2H), 4,04 (дд, J=11,9, 7,4 Гц, 2H), 3,99 (дд, J=5,5, 3,3 Гц, 2H), 3,85 (дд, J=5,5, 4,3 Гц, 2H), 3,75 (дд, J=11,9, 3,8 Гц, 2H), 3,66-3,57 (м, 2H), 2,46 (с, 6H). МС-ESI m/z: вычислено 530,2152, найдено 531,55 (М+1)+.
Получение соединения 155 (способ А)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-метил-4-[2-метил-6-[3-метил-4-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]-3-пиридил]фенил]тетрагидропиран-3,4,5-триол
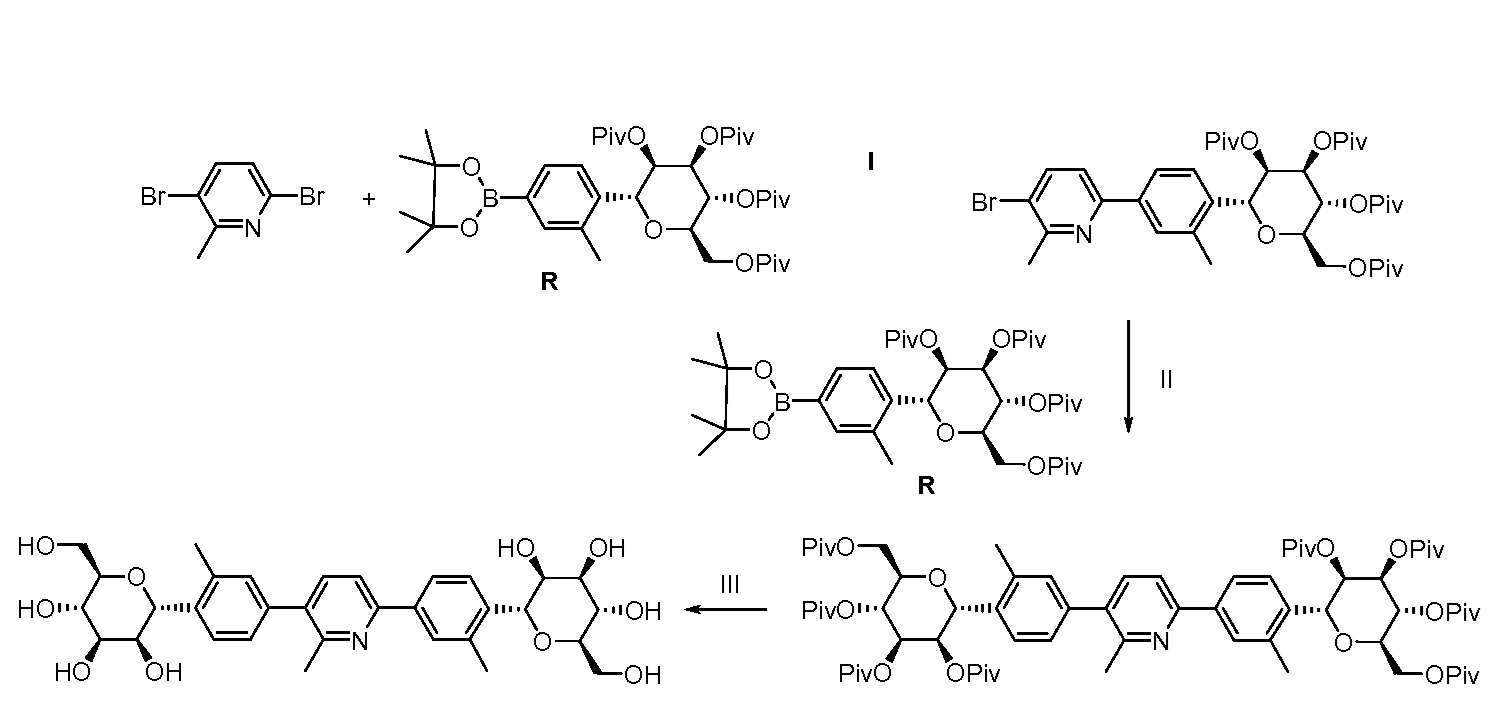
Стадия I: (2R,3R,4R,5R,6R)-2-(4-(5-Бром-6-метилпиридин-2-ил)-2-метилфенил)-6-((пивалоилокси)метил)тетрагидро-2Н-пиран-3,4,5-триил-трис(2,2-диметилпропаноат)
В емкость для микроволновой обработки объемом 5 мл загружают промежуточное соединение R (150 мг, 0,209 ммоль), 3,6-дибром-2-метилпиридин (43,8 мг, 0,174 ммоль), Siliacat DPP-Pd (70 мг, 0,017 ммоль) и Cs2CO3 (171 мг, 0,523 ммоль) в CH3CN (2,0 мл). Емкость загрывают в атмосфере азота и подвергают микроволновой обработке при 130°С в течение 30 минут в микроволновой печи. Реакционную смесь разбавляют EtOAc, наносят на картридж диоксида кремния (500 мг) и элюируют EtOAc. Полученную смесь концентрируют при пониженном давлении, остаток (159 мг) используют в следующей стадии без дополнительной очистки.
[(2R,3R,4R,5R,6R)-3,4,5-Трис(2,2-диметилпропаноилокси)-6-[2-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноат получают в соответствии с методикой, описанной для получения промежуточного соединения B и промежуточного соединения N.
Стадия II:
В емкость для микроволновой обработки объемом 5 мл загружают сырую смесь [(2R,3R,4R,5R,6R)-6-[4-(5-бром-6-метил-2-пиридил)-2-метилфенил]-3,4,5-трис(2,2-диметилпропаноилокси)тетрагидропиран-2-ил]метил-2,2-диметилпропаноата (130 мг, 0,1709 ммоль), промежуточное соединение R (123 мг, 0,171 ммоль), Siliacat DPP-Pd (68,4 мг, 0,0171 ммоль) и Cs2CO3 (167,0 мг, 0,513 ммоль) в CH3CN (2,7 мл). Емкость закрывают в атмосфере азота и подвергают микроволновой обработке при 130°С в течение 30 минут в микроволновой печи. Реакционную смесь разбавляют EtOAc, пропускают через картридж диоксида кремния (500 мг) и элюируют EtOAc. Остаточную смесь концентрируют при пониженном давлении с получением сырой смеси указанного в заголовке соединения, которую используют в следующей стадии без дополнительной очистки.
Стадия III: Соединение 155
Остаток растворяют в МеОН (1,30 мл). К раствору добавляют MeONa (46,2 мг, 0,855 ммоль) и полученную смесь перемешивают в течение 48 часов при КТ. К смеси добавляют АсОН (58 мкл, 1,03 ммоль) и растворители удаляют при пониженном давлении. Полученный остаток очищают с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (12,6 мг, 12%). 1H ЯМР (400 МГц, CD3OD) δ 7,83-7,72 (м, J=8,2 Гц, 2H), 7,66 (дд, J=18,0, 8,1 Гц, 2H), 7,58 (дд, J=7,9, 5,3 Гц, 2H), 7,26-7,18 (м, 2H), 5,16 (д, J=6,7 Гц, 2H), 4,27 (дд, J=6,6, 2,8 Гц, 2H), 4,07-3,92 (м, 4H), 3,89-3,81 (м, 2H), 3,76 (дт, J=11,9, 3,5 Гц, 2H), 3,65-3,53 (м, J=11,1, 8,0, 4,0 Гц, 2H), 2,54 (с, 3H), 2,52 (с, 3H), 2,51 (с, 3H). ЖХ-МС: m/z=598,59 (М+Н+).
Получение соединений 153, 154 и 157
Соединения 153, 154 и 157 получают в соответствии с методикой, описанной для получения соединения 155.
|
|
Получение соединения 156
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[4-[2-[3-метил-4-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]циклопропил]фенил]тетрагидропиран-3,4,5-триол
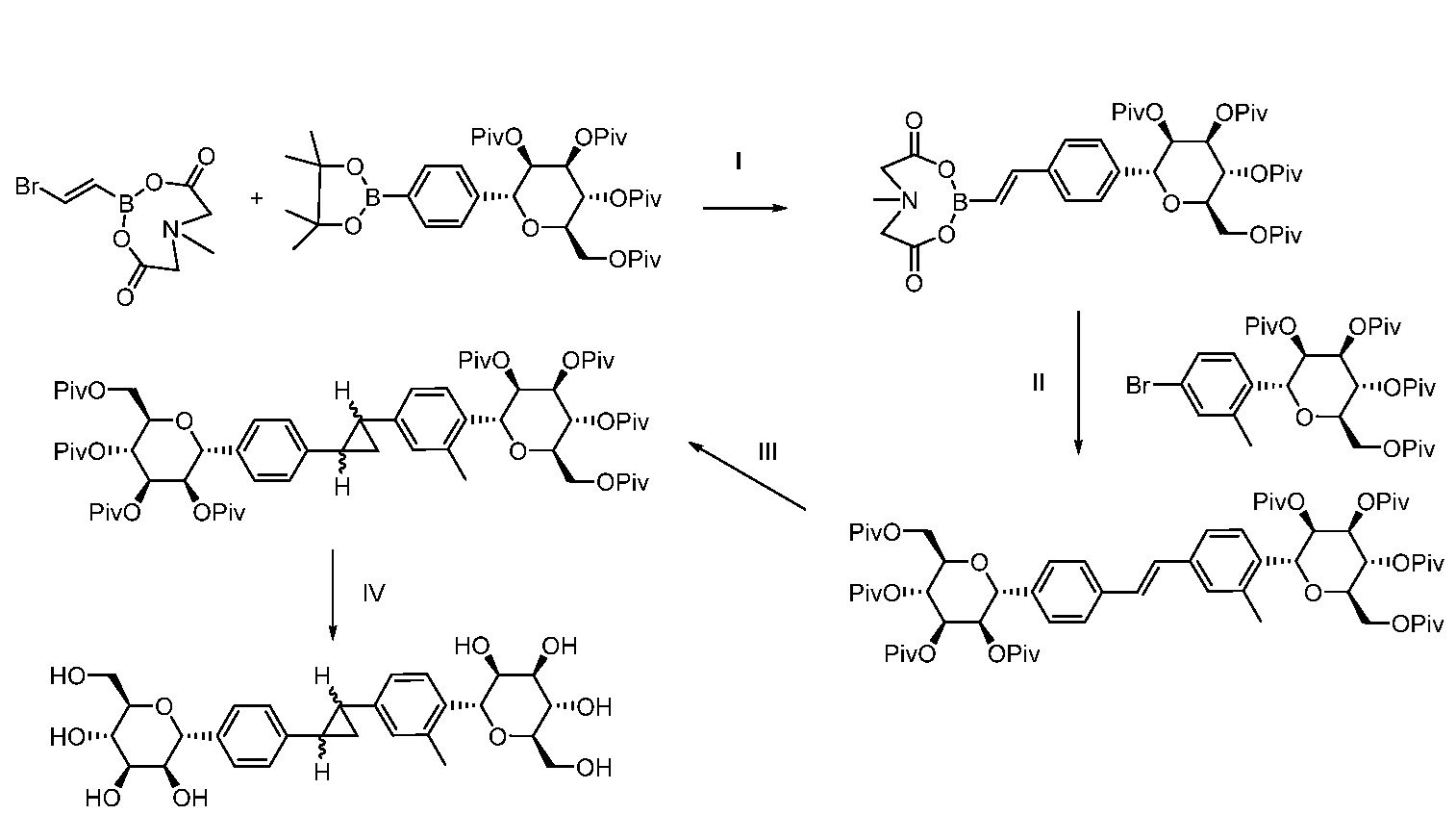
Стадия I: (2R,3R,4R,5R,6R)-2-(4-((E)-2-(6-метил-4,8-диоксо-1,3,6,2-диоксаборокан-2-ил)винил)фенил)-6-((пивалоилокси)метил)тетрагидро-2Н-пиран-3,4,5-триил-трис(2,2-диметилпропаноат)
В емкость, содержащую [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил]тетрагидропиран-2-ил]метилацетат (200 мг, 0,374 ммоль) и 2-[(Е)-2-бромвинил]-6-метил-1,3,6,2-диоксаборокан-4,8-дион (118 мг, 0,449 ммоль), в атмосфере азота добавляют C34H28Cl2FeP2Pd (27,4 мг, 0,0374 ммоль) и K3PO4 (238,4 мг, 1,123 ммоль). К смеси добавляют CH3CN (5,5 мл), емкость закрывают и оставляют перемешиваться при КТ в течение 3 дней. Смесь пропускают через слой силикагеля, растворители удаляют с получением сырой смеси указанного в заголовке соединения (104 мг, 0,1765 ммоль), которую используют в следующей стадии без дополнительной очистки.
Стадия II: (2R,3R,4R,5R,6R)-2-(4-((E)-3-Метил-4-((2R,3R,4R,5R,6R)-3,4,5-трис(пивалоилокси)-6-((пивалоилокси)метил)тетрагидро-2Н-пиран-2-ил)стирил)фенил)-6-((пивалоилокси)метил)тетрагидро-2Н-пиран-3,4,5-триил-трис(2,2-диметилпропаноат)
В емкость, содержащую (2R,3R,4R,5R,6R)-6-(4-бром-2-метилфенил)-3,4,5-трис(2,2-диметилпропаноилокси)тетрагидропиран-2-ил]метил-2,2-диметилпропаноат (119,0 мг, 0,1777 ммоль) и [(2R,3S,4R,5S,6R)-3,4,5-триацетокси-6-[4-[(E)-2-(6-метил-4,8-диоксо-1,3,5,2-диоксаборокан-2-ил)винил]фенил]тетрагидропиран-2-ил]метилацетат (104,7 мг, 0,1777 ммоль), в атмосфере азота добавляют C34H28Cl2FeP2Pd (130,0 мг, 0,1777 ммоль) и K3PO4 (113,2 мг, 0,5331 ммоль) в CH3CN (1,2 мл) и воде (251 мкл). Емкость герметично закрывают и оставляют перемешиваться при КТ в течение 24 часов. Смесь пропускают черед слой диоксида кремния, растворители (CH2Cl2 и EtOAc) удаляют, и остаток очищают с помощью EtOAc в гексанах (элюирование с градиентом: 0-80%) с получением указанного в заголовке соединения (46,5 мг, 26%).
Стадия III: [(2R,3S,4R,5S,6R)-3,4,5-Трис(2,2-диметилпропаноилокси)-6-[4-[(E)-2-[3-метил-4-[(2R,3S,4R,5S,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-(2,2-диметилпропаноилоксиметил)тетрагидропиран-2-ил]фенил]винил]фенил]тетрагидропиран-2-ил]метил-2,2-диметилпропан
К раствору [(2R,3R,4R,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-[2-метил-4-[(E)-2-[4-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]фенил]винил]фенил]тетрагидропиран-2-ил]метил-2,2-диметилпропаноата (46,0 мг, 0,0450 ммоль) и ацетата палладия (3,0 мг, 0,014 ммоль) в CH2Cl2 (1,2 мл) при 0°С по каплям добавляют раствор диазометана (9,0 мл, 0,5М, 4,5 ммоль), полученный раствор перемешивают до полной конверсии исходных веществ. ЖХ-МС показывает полное превращение исходных веществ в продукт. Полученную смесь фильтруют через целит, и фильтрат концентрируют при пониженном давлении с получением указанного в заголовке соединения в виде смеси, которую используют в следующей стадии без дополнительной очистки.
Стадия IV: Соединение 156
Остаток разбавляют МеОН (1,4 мл) и MeONa (540 мкл, 0,5М, 0,270 ммоль). Раствор перемешивают в течение 72 часов при КТ. Добавляют АсОН (13 мкл, 0,23 ммоль), летучие вещества удаляют при пониженном давлении, и остаток очищают с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (4,2 мг, 17%). 1H ЯМР (400 МГц, CD3OD) δ 7,34 (дд, J=18,6, 8,3 Гц, 3H), 7,14 (д, J=8,3 Гц, 2H), 7,01-6,86 (м, J=5,1 Гц, 2H), 5,06 (д, J=6,0 Гц, 1H), 4,94 (д, J=3,2 Гц, 1H), 4,42 (т, J=3,2 Гц, 1H), 4,24 (дд, J=5,8, 3,2 Гц, 1H), 4,01-3,86 (м, J=18,7, 9,0, 5,0 Гц, 2H), 3,79 (т, J=4,6 Гц, 3H), 3,77-3,67 (м, J=16,5, 5,9 Гц, 2H), 3,56 (дд, J=8,3, 3,1 Гц, 1H), 3,50-3,37 (м, 2H), 2,41 (с, 3H), 2,17-2,01 (м, J=14,5, 6,6 Гц, 2H), 1,52-1,29 (м, 2H). ЖХ-МС: m/z=533,52 (М+Н+).
Получение соединения 158 (способ D)
(2R,3S,4R,5S,6R)-2-[2-[3-Бензил-4-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]фенил]этинил]-6-(гидроксиметил)тетрагидропиран-3,4,5-триол
Соединение 158 получают в соответствии с методикой, описанной для получения соединения 59. 1H ЯМР (400 МГц, CD3OD) δ 7,46 (д, J=7,9 Гц, 1H), 7,36-7,24 (м, 4H), 7,22-7,14 (м, 3H), 4,94-4,87 (м, 1H), 4,85 (д, J=1,9 Гц, 1H), 4,14 (с, 2H), 4,00-3,97 (м, 1H), 3,97-3,94 (м, 1H), 3,92-3,68 (м, 8H), 3,65 (д, J=8,5 Гц, 1H), 3,60 (д, J=9,3 Гц, 1H). ЖХ-МС: m/z (М+Н)+= 541,5.
Получение соединения 159 (способ B)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-метил-4-[(E)-2-[3-метил-4-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]винил]фенил]тетрагидропиран-3,4,5-триол
Соединение 159 получают в соответствии с методикой, описанной для получения соединения 156. 1H ЯМР (400 МГц, CD3OD) δ 7,43 (д, J=8,0 Гц, 2H), 7,37 (д, J=10,8 Гц, 4H), 7,11 (с, 2H), 5,09 (д, J=6,2 Гц, 2H), 4,24 (дд, J=6,2, 3,2 Гц, 2H), 4,04-3,92 (м, J=11,9, 7,5 Гц, 4H), 3,82 (т, J=5,4 Гц, 2H), 3,74 (дд, J=11,9, 3,6 Гц, 2H), 3,58-3,50 (м, 2H), 2,46 (с, 6H).
Получение соединения 160 (способ B)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-метил-4-[2-[3-метил-4-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]циклопропил]фенил]тетрагидропиран-3,4,5-триол
Соединение 160 получают в соответствии с методикой, описанной для получения соединения 156. (400 МГц, CD3OD) δ 7,37-7,27 (м, J=8,6 Гц, 2H), 6,99-6,89 (м, J=4,7 Гц, 4H), 5,06 (д, J=5,9 Гц, 2H), 4,24 (дд, J=5,8, 3,3 Гц, 2H), 4,01-3,87 (м, J=18,7, 9,0, 5,1 Гц, 4H), 3,79 (т, J=5,8 Гц, 2H), 3,73 (дд, J=11,8, 3,6 Гц, 2H), 3,49-3,41 (м, 2H), 2,41 (с, 6H), 2,12-2,02 (м, J=7,3 Гц, 2H), 1,44-1,34 (м, 2H).
Получение соединения 162 (способ D)
(2R,2’R,3S,3’S,4R,4’R,5S,5’S,6R,6’R)-6,6'-((2',3',5',6'-Тетрагидроспиро[флуорен-9,4'-пиран]-2,7-диил)бис(этин-2,1-диил))бис(2-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триол)
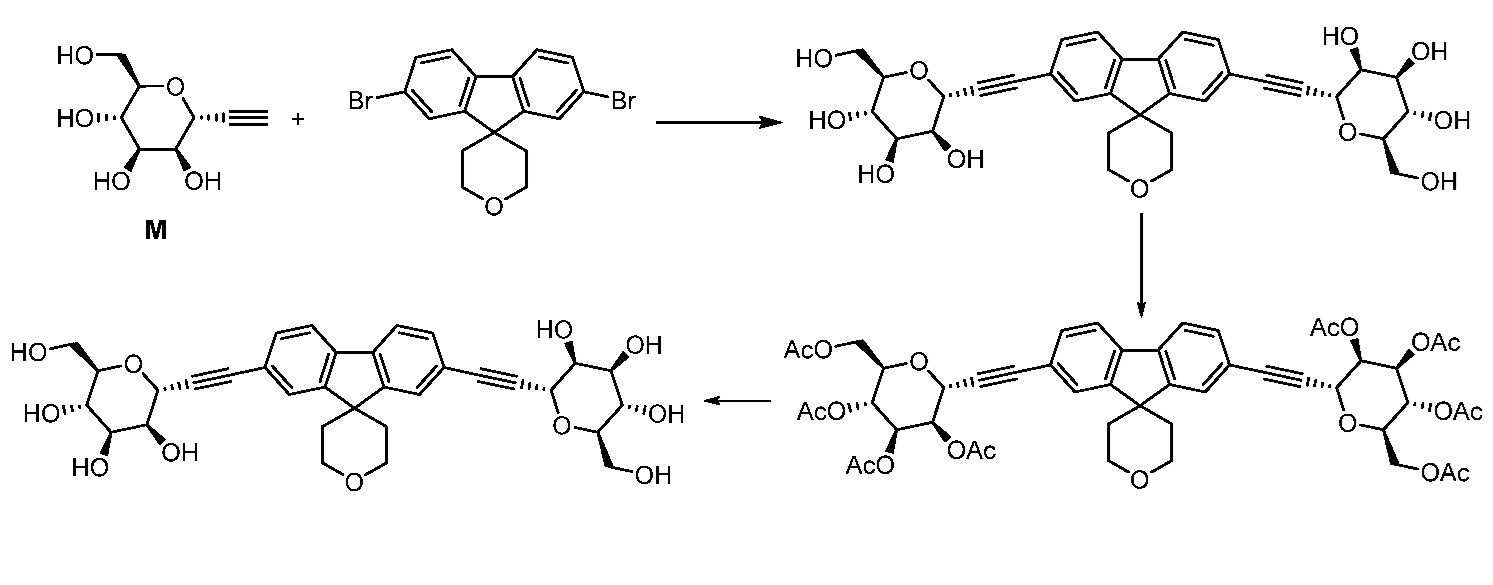
Стадия I: Сырое соединение 162
Смесь 2,7-дибромспиро[флуорен-9,4'-тетрагидропирана] (12,00 г, 30,45 ммоль) и промежуточного соединения M (16,02 г, 85,14 ммоль) в ДМФА (168,0 мл) дегазируют в течение 5 минут барботированием азота через реакционную смесь. К смеси добавляют Pd(dppf)Cl2-CH2Cl2 (1,680 г, 2,296 ммоль) и CuI (1,685 г, 8,849 ммоль), после чего через реакционную смесь еще раз барботируют азот в течение 5 минут. Добавляют диизопропилэтиламин (42,0 мл, 241 ммоль) и полученную смесь перемешивают в атмосфере азота при 100°С в течение 1 часа. Полученную реакционную смесь охлаждают до 35°С и по каплям добавляют воду (336,0 мл). Полученную смесь темно-красного цвета перемешивают в течение ночи при КТ, осадок собирают фильтрацией (ML1) и промывают 100 мл воды. Сырой продукт оранжевого цвета переносят в круглодонную колбу объемом 250 мл и растирают в 60 мл этанола в течение 30 минут. Полученное твердое вещество собирают фильтрацией и сушат в вакуумной печи в течение ночи при 45°С. Продукт, который является перацетилированным производным (стадия 2), очищают флэш-хроматографей для деацетилирования (стадия 3).
Стадия II: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[2-[7-[2-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]этинил]спиро[флуорен-9,4’-тетрагидропиран-2-ил]этинил]тетрагидропиран-2-ил]метилацетат
К сырому продукту в виде твердого вещества со стадии I (13,77 г) добавляют DMAP (276 мг, 2,26 ммоль) и пиридин (69 мл). Полученную смесь (суспензию коричневого цвета) охлаждают до 0°С на бане со смесью лед/вода и по каплям, в течение 10 минут, добавляют Ас2О (25,6 мл, 271 ммоль), поддерживая температуру ниже 20°C. Реакционную смесь перемешивают при КТ в течение 1 часа. Полученный раствор темно-коричневого цвета разбавляют CH2Cl2 (100 мл) и водой (75 мл), перемешивают в течение 15 мин, затем добавляют 2н раствор HCl (~475 мл) и смесь перемешивают в течение 5 минут, охлаждая на бане со смесью лед/вода для контроля выделения тепла. Водный раствор отделяют, органический слой снова экстрагируют CH2Cl2 (2×75 мл), объединенные органические экстракты еще раз промывают 2н раствором HCl (75 мл, с добавлением насыщенного раствора соли для способствования разделению), сушат над Na2SO4, фильтруют и концентрируют с получением 20,78 г стекловидного вещества оранжевого цвета. Твердое вещество растворяют в минимальном количестве CH2Cl2, адсорбируют на 75 мл силикагеля и очищают на картридже Biotage™ SNAP (силикагель, 340 г; элюирование с градиентом: 100% гексаны 1 CV; EtOAc/гексаны, 0-85%, 16 CV; 85% EtOAc/гексаны, 4 CV). Фракции, содержащие целевое соединение, объединяют и обрабатывают 4,5 г SiliaMet®Tiol в течение ночи при КТ для удаления следов палладия. Полученную смесь фильтруют и упаривают досуха с получением 16,87 г указанного в заголовке соединения.
Стадия III: Соединение 162
[(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[2-[7-[2-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]этинил]спиро[флуорен-9,4’-тетрагидропиран-2-ил]этинил]тетрагидропиран-2-ил]метилацетат, полученный на стадии II (15,37 г, 16,27 ммоль), растворяют в МеОН (344 мл) и к раствору добавляют MeONa (290 мкл, 25% масс./масс., 1,30 ммоль в МеОН). Конечное значение рН достигает 9. Реакционную смесь перемешивают при КТ в течение 18 часов. Полученную суспензию (твердое белое вещество) фильтруют, и твердый продукт промывают 8 объемами МеОН. Полученное твердое белое вещество сушат в вакуумной печи при 40°С в течение ночи с получением указанного в заголовке соединения в виде твердого вещества бежевого цвета (9,38 г, 15,03 ммоль), которое содержит 1,6% моноацетатной примеси. 1H ЯМР (400 МГц, ДМСО) δ 7,94 (д, J=7,9 Гц, 2H), 7,88 (д, J=1,4 Гц, 2H), 7,50 (дд, J=7,8, 1,3 Гц, 2H), 4,98 (д, J=4,3 Гц, 2H), 4,81 (д, J=5,9 Гц, 2H), 4,78-4,67 (м, 4H), 4,50 (т, J=6,0 Гц, 2H), 4,09 (кв., J=5,2 Гц, 0H), 4,00 (дд, J=7,1, 3,8 Гц, 4H), 3,89-3,80 (м, 2H), 3,80-3,65 (м, 4H), 3,60 (ддд, J=8,8, 6,3, 2,0 Гц, 2H), 3,48 (дт, J=12,0, 6,2 Гц, 2H), 3,40 (тд, J=9,3, 5,9 Гц, 2H), 3,16 (д, J=5,3 Гц, 0H), 2,03 (с, 0H), 1,81 (дд, J=7,3, 3,8 Гц, 4H). ЖХ-МС: m/z=609,57 (М+Н)+.
Получение соединений 161, 162 и 164
Соединения 161, 162 и 164 получают в соответствии с методикой, описанной для получения соединения 120, с использованием коммерчески доступных производных дибромфлуорена.
|
|
Получение соединений со 165 по 170
Соединения со 165 по 170 получают в соответствии с методикой, описанной для получения 113, с использованием подходящих промежуточных соединений.
|
|
|
Получение соединения 171 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[7-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]-1H-индазол-4-ил]этинил]тетрагидропиран-3,4,5-триол
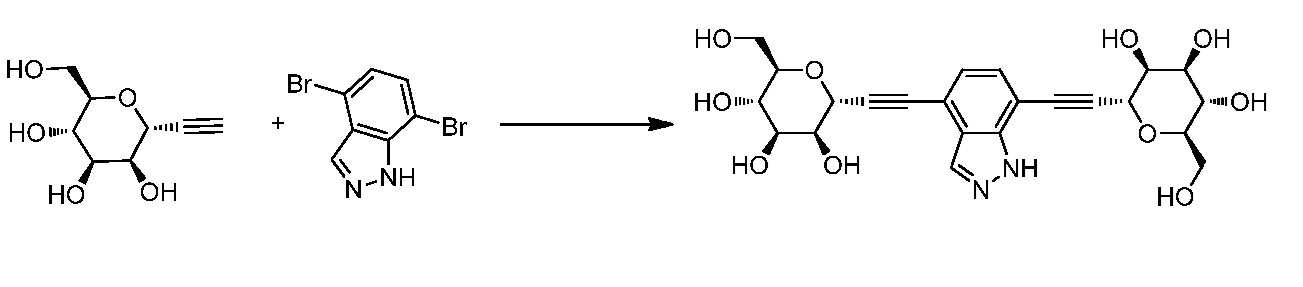
В реакционную пробирку загружают коммерчески доступный 4,7-дибром-1H-индазол (35,0 мг, 0,127 ммоль) и Pd(PPh3)4 (18,0 мг, 0,0156 ммоль), пробирку закрывают и дегазируют (вакуум, затем продувка азотом: два раза), затем добавляют промежуточное соединение M в виде раствора в ДМФА (500 мкл, 0,53 М, 0,265 ммоль) и DIPEA (500 мкл^). Реакционную смесь дегазируют снова, помещают на предварительно нагретую (80°C) масляную баню и перемешивают в течение 48 часов. После охлаждения до комнатной температуры реакционную смесь пропускают через Si-DMT картридж (200 мг), промывают порциями МеОН и очищают с помощью ВЭЖХ с обращенной фазой. Целевую фракцию сушат вымораживанием с получением указанного в заголовке соединения (12,6 мг, выход 20%) в виде ворсистого твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,21 (с, 1H), 7,50 (д, J=7,5 Гц, 1H), 7,28 (д, J=7,5 Гц, 1H), 5,02 (д, J=2,1 Гц, 1H), 5,00 (д, J=2,0 Гц, 1H), 4,16-4,08 (м, 2H), 4,04-3,83 (м, 6H), 3,82-3,72 (м, 2H), 3,71-3,59 (м, 2H). МС-ESI m/z: 491,44 (М+1)+.
Получение соединения 172:
1,4-бис[3-Метил-4-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]фенил]пиперазин-2,5-дион
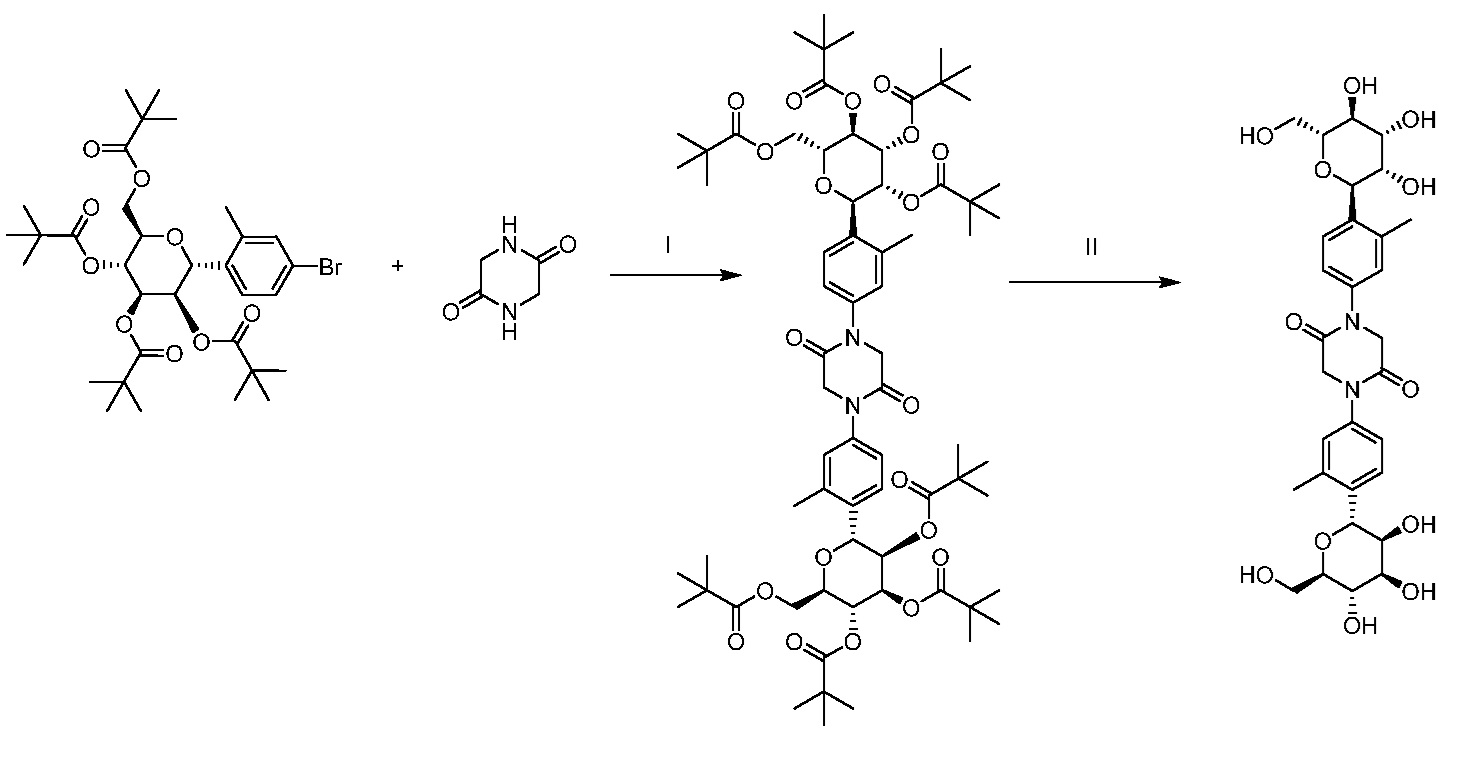
Стадия I: [(2R,3R,4R,5R,6R)-3,4,5-трис(2,2-Диметилпропаноилокси)-6-[2-метил-4-[4-[3-метил-4-[(2R,3R,4R,5R,6R)-3,4,5-трис(2,2-диметилпропаноилокси)-6-(2,2-диметилпропаноилоксиметил)тетрагидропиран-2-ил]фенил]-2,5-диоксопиперазин-1-ил]фенил]тетрагидропиран-2-ил]
В реакционную пробирку загружают промежуточное соединение Q (213 мг, 0,318 ммоль), пиперазин-2,5-дион (12,6 мг, 0,110 ммоль), CuI (7,8 мг, 0,0410 ммоль) и К2СО3 (50,0 мг, 0,362 ммоль), пробирку закрывают и дегазируют (вакуум, продувка азотом: 3 раза), затем добавляют дегазированный ДМФА (1 мл) с последующим добавлением N,N'-диметилэтан-1,2-диамина (8,0 мкл, 0,075 ммоль). Реакционную пробирку снова дегазируют, помещают на предварительно нагретую (110°C) масляную баню, и реакционную смесь перемешивают в течение ночи. Реакционную смесь охлаждают до КТ, разбавляют EtOAc (5 мл) и промывают последовательно насыщенным водным раствором NH4Cl (2×5 мл), H2O (2 мл), насыщенным раствором соли (2 мл), затем сушат над Na2SO4 и пропускают через картридж с диоксидом кремния (500 мг), используя EtOAc. Фильтрат концентрируют, затем очищают флэш-хроматографией на картридже Biotage™ SNAP (силикагель, 10 г; элюирование с градиентом: EtOAc в гексанах, 0-100%). Фракции объединяют и концентрируют с получением указанного в заголовке соединения (40 мг, выход 28%) в виде кристаллического твердого белого вещества.
Стадия II: Соединение 172
К раствору промежуточного соединения со стадии I (38,0 мг, 0,0294 ммоль), полученного как описано выше, в МеОН (1,4 мл) добавляют раствор MeONa в MeOH (90 мкл, 0,5М, 0,0450 ммоль). Реакционную смесь перемешивают при 60°С в течение 4 часов, затем пропускают через предварительно промытый (метанол) SCX-2 картридж (1 г), который промывают порциями MeOH (3х1 мл). Объединенные фильтраты концентрируют, снова растворяют в смеси H2O/MeCN (20% MeCN) и сушат вымораживанием с получением указанного в заголовке соединения (19 мг, выход 96%) в виде ворсистого твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,60 (д, J=9,1 Гц, 2H), 7,30-7,21 (м, 4H), 5,12 (д, J=7,0 Гц, 2H), 4,52 (с, 4H), 4,20 (дд, J=7,0, 3,2 Гц, 2H), 4,05 (дд, J=11,9, 7,4 Гц, 2H), 4,00 (дд, J=5,4, 3,3 Гц, 2H), 3,88-3,81 (м, 2H), 3,75 (дд, J=11,9, 3,8 Гц, 2H), 3,63 (дт, J=7,6, 3,9 Гц, 2H), 2,50 (с, 6H). МС-ESI m/z: 619,6 (М+1)+.
Получение соединений 173 и 174
Соединения 173 и 174 получают в соответствии с методикой, описанной для получения соединения 59, с использованием коммерчески доступных исходных везеств. Реакционные смеси перемешивают в течение 1 часа при 100°С.
|
|
Получение соединения 175 (способ D)
Этил-2-[2,7-бис[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]карбазол-9-ил]ацетат
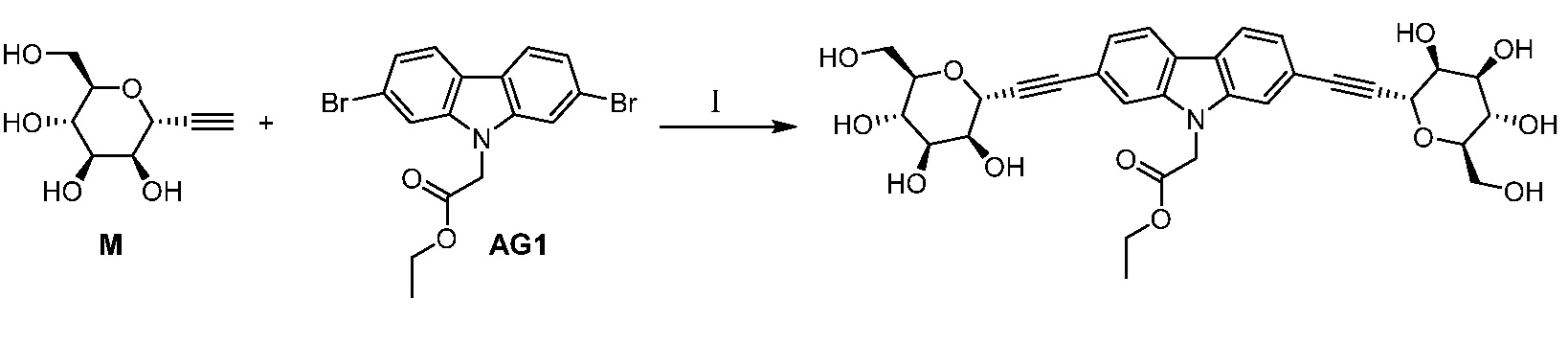
Стадия I: Соединение 175
К смеси промежуточного соединения AG1 (200 мг, 0,49 ммоль) и промежуточного соединения М (1,96 мл, 0,53М, 1,036 ммоль) добавляют Pd(dppf)Cl2-CH2Cl2 (26,2 мг, 0,032 ммоль), CuI (27,8 мг, 0,146 ммоль) в ДМФА (800,0 мкл), смесь дегазируют (вакуум/N2). К полученной смеси добавляют DIPEA (678 мкл, 3,89 ммоль), снова смесь дегазируют. Реакционную смесь нагревают до 100°С и выдерживают при указанной температуре в течение 2 часов 45 минут в атмосфере N2, затем концентрируют при высоком вакууме, остаток растворяют в ДМСО (1,5 мл), загружают на C18 Samplet. Остаток очищают на С-18 картридже (силикагель, 50 г) системы очистки Isolera™ (элюирование с градиентом: CH3CN в воде, 10%-45%, 12,5 CV) с получением после концентрирования указанного в заголовке соединения (140 мг, 42%) в виде твердого вещества светло-желтого цвета. 1H ЯМР (400 МГц, CD3OD) δ 8,06 (д, J=8,1 Гц, 2H), 7,57 (с, 2H), 7,32 (дд, J=8,1, 1,2 Гц, 2H), 5,20 (с, 2H), 4,89 (д, J=2,1 Гц, 2H), 4,20 (кв., J=7,1 Гц, 2H), 4,03 (дд, J=3,2, 2,2 Гц, 2H), 3,98 (дд, J=9,3, 3,3 Гц, 2H), 3,91-3,84 (м, 4H), 3,78-3,71 (м, 2H), 3,64 (т, J=9,5 Гц, 2H), 1,24 (т, J=7,1 Гц, 3H). МС-ESI m/z: вычислено 625,21594, найдено 626,56 (М+1)+.
Получение соединения 176 (Способ D)
2-[2,7-Бис[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]карбазол-9-ил]уксусная кислота
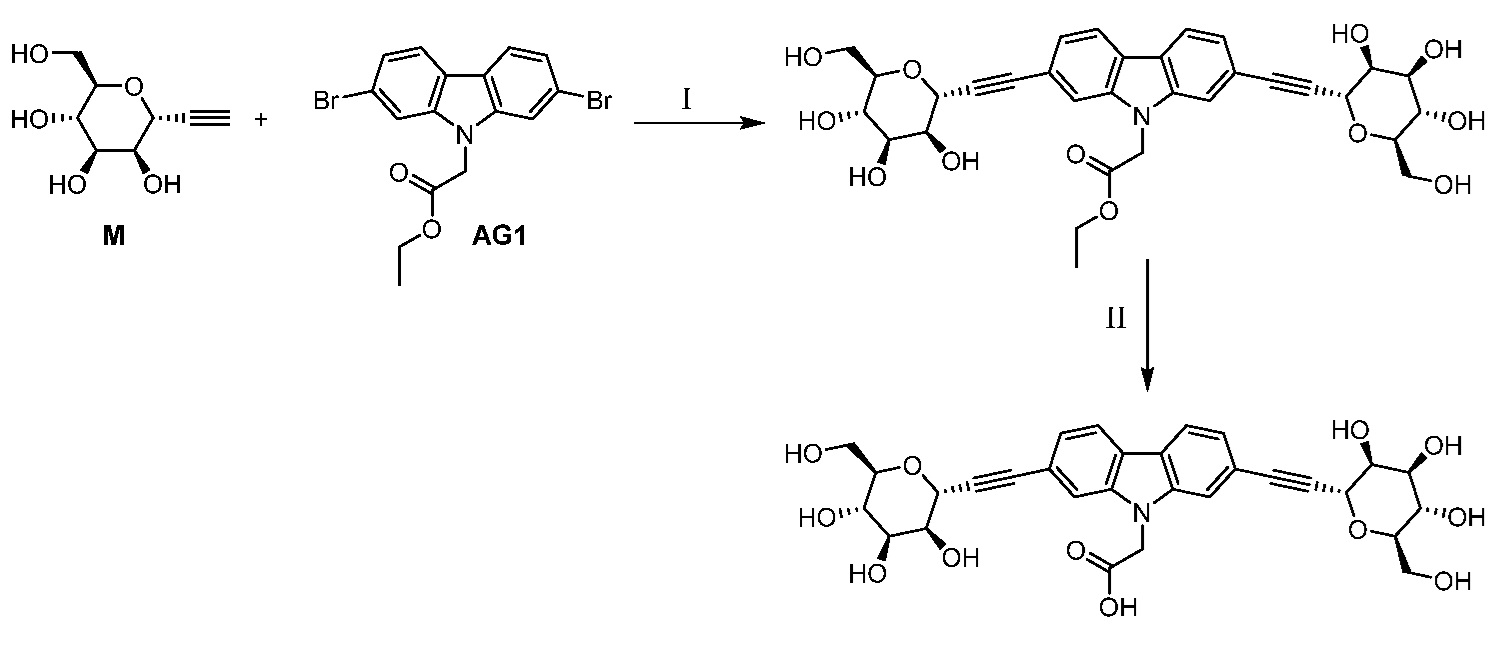
Стадия I: Соединение 176
К смеси этил-2-[2,7-бис[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]карбазол-9-ил]ацетата (соединение 175, 140 мг, 0,205 ммоль) в EtOH (2 мл) и H2O (1,5 мл) добавляют водный раствор NaOH (250 мкл, 10% масс./об., 0,6250 ммоль). Полученную смесь нагревают в герметично закрытой пробирке до 80°С и выдерживают в указанных условиях в течение 1 часа (ЖХ-МС показывает чистый продукт). Реакционную смесь гасят смолой DOWEX 50Wx4 (Н форма) до достижения рН значения 4-5, в результате образуется гель, гель разбавляют смесью вода-метанол (10 мл) до растворения геля, смесь фильтруют, концентрируют, остаток растворяют в воде и CH3CN, лиофилизуют с получением указанного в заголовке соединения (112 мг, 88,7%) в виде твердого вещества светло-желтого цвета. 1H ЯМР (400 МГц, CD3OD) δ 8,04 (д, J=8,1 Гц, 2H), 7,56 (с, 2H), 7,29 (д, J=8,1 Гц, 2H), 4,06-3,96 (м, 4H), 3,92-3,82 (м, 4H), 3,80-3,70 (м, 2H), 3,64 (т, J=9,3 Гц, 2H), 2,64 (с, 4H). (C1-H протоны находятся под пиком воды). МС-ESI m/z: вычислено 597,18463, найдено 598,59 (М+1)+.
Получение соединения 177 (способ D)
2-[2,7-бис[2-[(2R,3S,4R,5S,6R)-3,4,5-Тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]карбазол-9-ил]-N-[2-(4-метилпиперазин-1-ил)этил]ацетамид
К раствору 2-(4-метилпиперазин-1-ил)этанамина (7,7 мг, 0,054 ммоль) и Et3N (20 мкл) в ДМФА (0,3 мл) при перемешивании добавляют предварительно смешанный раствор соединения 176 и HATU (23 мг, 0,061 ммоль) в ДМФА (0,4 мл). Реакционную смесь перемешивают при КТ в течение 3 часов, полученную смесь очищают с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (16 мг, выход 40%). 1H ЯМР (400 МГц, CD3OD) δ 8,38 (уш.с, 1H), 8,11 (д, J=8,1 Гц, 2H), 7,63 (с, 2H), 7,36 (дд, J=8,1, 1,2 Гц, 2H), 5,04 (с, 2H), 4,90 (д, J=2,1 Гц, 2H), 4,03 (дд, J=3,2, 2,2 Гц, 2H), 3,96 (дд, J=9,3, 3,3 Гц, 2H), 3,91-3,81 (м, 4H), 3,73 (дд, J=11,3, 5,8 Гц, 2H), 3,63 (т, J=9,4 Гц, 2H), 2,64 (с, 3H), 2,46 (т, J=6,0 Гц, 2H), 1H ЯМР (400 МГц, ДМСО-D6) δ 8,17 (д, J=8,1 Гц, 2H), 8,08 (т, J=5,6 Гц, 1H), 7,64 (с, 2H), 7,30-7,25 (м, 2H), 5,06 (с, 2H), 4,76 (д, J=2,0 Гц, 2H), 3,83 (с, 2H), 3,77-3,65 (м, 4H), 3,63-3,55 (м, 2H), 3,46 (дд, J=11,7, 6,2 Гц, 2H), 3,39 (т, J=9,3 Гц, 2H), 3,16 (дд, J=12,1, 6,2 Гц, 2H), 2,40-2,16 (м, 10H), 2,11 (с, 3H). МС-ESI m/z: вычислено 722,3163, найдено 723,71 (М+1)+.
Получение соединений со 178 по 181
Соединения со 178 по 181 получают в соответствии с методикой, описанной для получения соединения 177, с использованием подходящих коммерчески доступных исходных веществ.
|
|
Получение соединения 182 (способ D)
(2R,3S,4R,5S,6R)-2-[2-[9-(2-Гидроксиэтил)-7-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]карбазол-2-ил]этинил]-6-(гидроксиметил)тетрагидропиран-3,4,5-триол
Смесь промежуточных соединения AG2 (60 мг, 0,15 ммоль) и М (588 мкл, 0,53М, 0,311 ммоль), Pd(dppf)Cl2-CH2Cl2 (7,9 мг, 0,01 ммоль), CuI (8,4 мг, 0,044 ммоль) в ДМФА (215 мкл) дегазируют (вакуум/N2). К полученной смеси добавляют DIPEA (204 мкл, 1,17 ммоль) и смесь снова дегазируют. Реакционную смесь нагревают до 100°С и выдерживают при указанной температуре в атмосфере N2 в течение 2 часов, затем пропускают через картридж поглотителя металлов (Si-DMT; Silicycle; SPE-R79030B-06P), который после этого промывают ДМФА (0,5 мл). Полученный фильтрат концентрируют в высоком вакууме, остаток растворяют в ДМСО и очищают с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (24 мг, 28%) в виде твердого вещества светло-желтого цвета. 1H ЯМР (400 МГц, CD3OD) δ 8,05 (д, J=8,1 Гц, 2H), 7,68 (с, 2H), 7,29 (д, J=8,1 Гц, 2H), 4,91-4,89 (м, 2H), 4,45 (т, J=5,4 Гц, 2H), 4,06-4,02 (м, 2H), 3,99 (дд, J=9,3, 3,3 Гц, 2H), 3,94-3,84 (м, 6H), 3,79-3,71 (м, 2H), 3,65 (т, J=9,4 Гц, 2H). МС-ESI m/z: вычислено 583,2054, найдено 584,54 (М+1)+.
Получение соединения 183 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[9-[2-(тридейтериометокси)этил]-7-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]карбазол-2-ил]этинил]тетрагидропиран-3,4,5-триол
Соединение 183 получают в соответствии с методикой, описанной для получения соединения 182, но с использованием промежуточных соединений AG3 (63 мг, 0,15 ммоль) и М (590,0 мкл, 0,53 М, 0,313 ммоль). Указанное в заголовке соединение выделяют в виде твердого белого вещества с помощью ВЭЖХ с обращенной фазой с последующей фильтрацией продукта, выпавшего в осадок из раствора (16,7 мг, 19%). 1H ЯМР (400 МГц, ДМСО-D6) δ 8,15 (д, J=8,1 Гц, 2H), 7,72 (с, 2H), 7,26 (д, J=8,1 Гц, 2H), 4,96 (д, J=4,3 Гц, 2H), 4,82 (д, J=5,7 Гц, 2H), 4,76 (с, 2H), 4,72 (д, J=5,9 Гц, 2H), 4,58 (с, 2H), 4,50 (т, J=5,9 Гц, 2H), 3,84 (с, 2H), 3,79-3,55 (м, 8H), 3,52-3,34 (м, 4H). МС-ESI m/z: вычислено 600,23987, найдено (М+1)+ 601,58.
Получение соединения 184 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[9-тетрагидропиран-4-ил-7-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]карбазол-2-ил]этинил]тетрагидропиран-3,4,5-триол
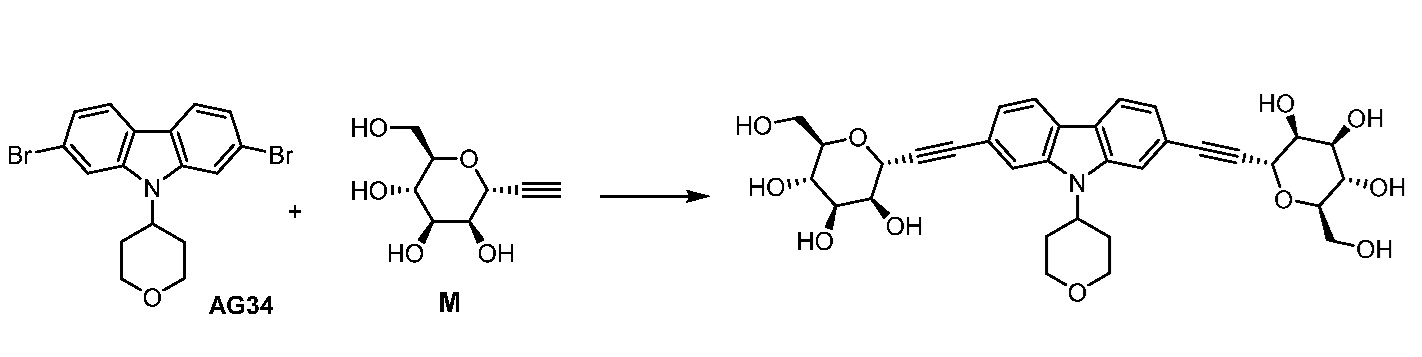
Раствор промежуточных соединений М (889 мкл, 0,53М в ДМФА, 0,47 ммоль) и AG34 (90 мг, 0,22 ммоль), Pd(dppf)Cl2-CH2Cl2 (13 мг, 0,016 ммоль), CuI (13 мг, 0,068 ммоль) дегазируют (вакуум/N2). К полученной смеси добавляют DIPEA (320 мкл, 1,84 ммоль). Реакционную смесь перемешивают в герметично закрытой пробирке в атмосфере N2 при 100°С в течение 2 часов. Реакционную смесь охлаждают, фильтруют через картридж SiliCycle SiliaPrep DMT (200 мг, 3 мл SPE) и концентрируют в вакууме. Остаток очищают с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (15 мг, 11%) в виде твердого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,06 (д, J=8,1 Гц, 2H), 7,79 (с, 2H), 7,30 (дд, J=8,0, 1,1 Гц, 2H), 4,91 (д, J=2,1 Гц, 2H), 4,22-4,10 (м, 2H), 4,05 (дд, J=3,2, 2,1 Гц, 2H), 3,99 (дд, J=9,3, 3,3 Гц, 2H), 3,93-3,82 (м, 4H), 3,81-3,60 (м, 7H), 2,68 (кв.д, J=12,6, 4,7 Гц, 2H), 1,83 (дд, J=11,8, 3,6 Гц, 2H). МС-ESI m/z: вычислено 623,65, 624,56 найдено (М+1)+.
Получение соединений со 185 по 190
Соединения со 185 по 190 получают в соответствии с методикой, описанной для получения промежуточного соединения 184, с использованием промежуточных соединений со AG35 по AG40.
|
|
|
Получение соединения 191 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[7'-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]спиро[1,3-дитиан-2,9'-флуорен]-2'-ил]этинил]тетрагидропиран-3,4,5-триол
Стадия I: 2',7'-Дибромспиро[1,3-дитиан-2,9'-флуорен]
К раствору 2,7-дибромфлуорен-9-она (1000 мг, 2,959 ммоль) в CH2Cl2 (9,863 мл) при КТ в атмосфере аргона добавляют пропан-1,3-дитиол (446 мкл, 4,44 ммоль) с последующим добавлением BF3·OEt2 (548 мкл, 4,44 ммоль). Полученную смесь перемешивают при КТ в течение 1 часа, затем нагревают до 60°С и выдерживают при указанной температуре в течение ночи. Реакционную смесь гасят, выливая в насыщенный водный Na2CO3, и экстрагируют EtOAc. Объединенные органические экстракты сушат над Na2SO4, фильтруют и концентрируют. В процессе концентрации образуется осадок, который собирают фильтрацией с получением указанного в заголовке соединения (0,937 г, 2,188 ммоль, 73,95%). ЖХ-МС: m/z=428,13 (М+Н+).
Стадия II: Соединение 191
К дегазированной смеси промежуточного соединения М (925 мкл, 0,53М, 0,490 ммоль), 2’,7’-дибромспиро[1,3-дитиан-2,9'-флуорена], полученного на стадии I, (100 мг, 0,2335 ммоль), Pd(dppf)Cl2-CH2Cl2 (19,07 мг, 0,02335 ммоль), CuI (13,34 мг, 0,07005 ммоль) в ДМФА (778,3 мкл) добавляют DIPEA (122 мкл, 0,701 ммоль). Смесь перемешивают в герметично закрытой пробирке в атмосфере азота при 90°С в течение ночи. Реакционную смесь фильтруют через целитный картридж и концентрируют в вакууме. Остаток очищают с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (37,2 мг, 25%). 1H ЯМР (400 МГц, CD3OD) δ 7,95 (с, 2H), 7,78 (д, J=7,9 Гц, 2H), 7,53 (дд, J=7,9 Гц, 2H), 4,90 (д, J=1,9 Гц, 3H), 4,04 (т, 2H), 3,96 (дд, J=9,4, 3,2 Гц, 2H), 3,90 (д, J=2,0 Гц, 1H), 3,89-3,80 (м, 3H), 3,74 (дд, J=11,4, 5,6 Гц, 2H), 3,63 (т, J=9,4 Гц, 2H), 2,38-2,28 (м, 2H). ЖХ-МС: m/z=643,51 (М+Н+).
Получение соединения 192 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[7-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]спиро[флуорен-9,4'-пиперидин]-2-ил]этинил]тетрагидропиран-3,4,5-триол
Соединение 192 получают в соответствии с методикой, описанной для получения соединения 182, но с использованием промежуточных соединений AG4 (45 мг, 0,08940 ммоль) и М (360 мкл, 0,53М, 0,1908 ммоль). Половину полученной сырой смеси растворяют в ДМСО (1 мл), очищают с помощью ВЭЖХ с обращенной фазой. К объединенным фракциям добавляют две капли аммонийного раствора (рН 6-7) с последующей лиофилизацией (дважды), получая указанное в заголовке соединение (11,8 мг, 43%) в виде твердого вещества светло-желтого цвета. 1H ЯМР (400 МГц, CD3OD) δ 7,85 (д, J=7,9 Гц, 2H), 7,82 (с, 2H), 7,55 (д, J=7,9 Гц, 2H), 4,89 (д, J=2,1 Гц, 2H), 4,05-3,98 (м, 2H), 3,93 (дд, J=9,3, 3,3 Гц, 2H), 3,89-3,79 (м, 4H), 3,74 (дд, J=11,4, 5,8 Гц, 2H), 3,67-3,57 (м, 6H), 2,11-2,03 (м, 4H). МС-ESI m/z: вычислено 607,24176, найдено 608,58 (М+1)+.
Получение соединения 193 (способ D)
(2R,3S,4R,5S,6R)-2-[2-[9,9-Бис(2-гидроксиэтил)-7-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]флуорен-2-ил]этинил]-6-(гидроксиметил)тетрагидропиран-3,4,5-триол
Соединение 193 получают в соответствии с методикой, описанной для получения соединения 182, но с использованием промежуточных соединений AG6 (40 мг, 0,097 ммоль) и М (390 мкл, 0,53М, 0,207 ммоль). Указанное в заголовке соединение (24 мг, 40%) получают после лиофилизации в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,75 (д, J=7,9 Гц, 2H), 7,60 (д, J=0,7 Гц, 2H), 7,47 (дд, J=7,9, 1,4 Гц, 2H), 4,88 (д, J=2,3 Гц, 2H), 4,02 (дд, J=3,2, 2,2 Гц, 2H), 3,95 (дд, J=9,3, 3,3 Гц, 2H), 3,91-3,80 (м, 4H), 3,74 (дд, J=11,4, 5,5 Гц, 2H), 3,63 (т, J=9,4 Гц, 2H), 2,82-2,70 (м, 4H), 2,39-2,29 (м, 4H). МС-ESI m/z: вычислено 626,2363, найдено 627,54 (М+1)+.
Получение соединения 194 (способ D)
(2R,3S,4R,5S,6R)-2-[2-[(3R,4S)-3,4-Дигидрокси-7’[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]спиро[циклопентан-1,9'-флуорен]2'-ил]этинил]-6-(гидроксиметил)тетрагидропиран-3,4,5-триол
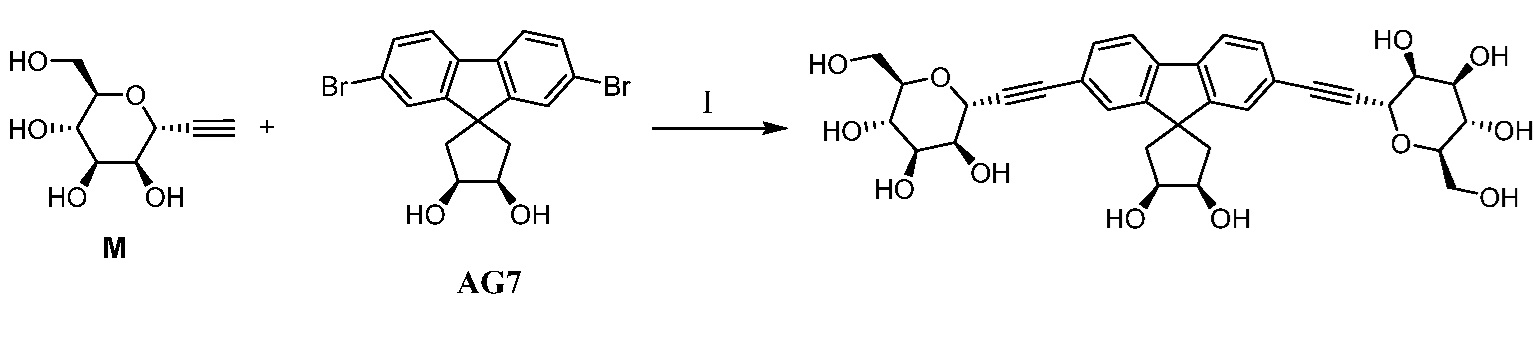
Соединение 194 получают в соответствии с методикой, описанной для получения соединения 182, но с использованием промежуточных соединений AG7 (41 мг, 0,01 ммоль) и М (400 0,53 М, 0,213 ммоль). Очистка с помощью ВЭЖХ с обращенной фазой с последующей лиофилизацией приводит к получению указанного в заголовке соединения (31 мг, 50%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,95 (с, 1H), 7,72-7,64 (м, 2H), 7,52 (с, 1H), 7,46-7,38 (м, 2H), 4,53-4,41 (м, 2H), 4,06-3,98 (м, 2H), 3,99-3,92 (м, 2H), 3,91-3,78 (м, 4H), 3,74 (дд, J=11,3, 5,3 Гц, 2H), 3,63 (т, J=9,4 Гц, 2H), 2,32-2,11 (м, 4H). (Два протона C-1 сахара перекрываются пиком растворителя). МС-ESI m/z: вычислено 624,2207, найдено 625,53 (М+1)+.
Получение соединений со 195 по 199
Соединения 195-199 получают в соответствии с методикой, описанной для получения соединения 182, но с использованием подходящих коммерчески доступных исходных веществ (для соединения 195) и промежуточных соединений AG27-AG29 (для соединений 196-199, соответственно).
|
|
|
Получение соединения 200 (способ D)
трет-Бутил-2,7-бис[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]спиро[флуорен-9,4'-пиперидин]-1'-карбоксилат
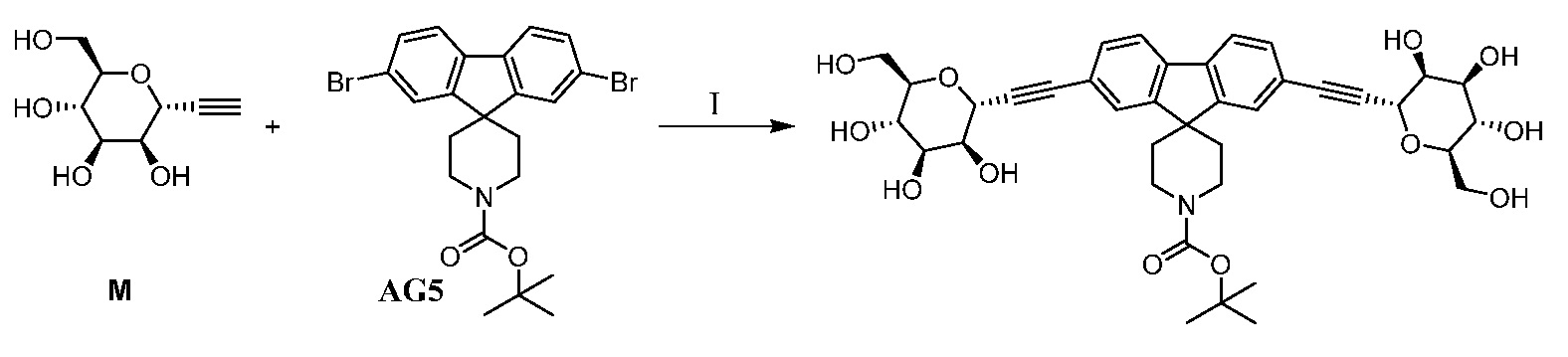
Соединение 200 получают в соответствии с методикой, описанной для получения соединения 182, но с использованием промежуточных соединений AG5 (42,0 мг, 0,0850 ммоль) и М (400 мкл, 0,53М, 0,2130 ммоль). Реакционную смесь герметично закрывают, нагревают до 100°С и выдерживают при указанной температуре в течение 2 часов в атмосфере N2. Очистка с помощью ВЭЖХ с обращенной фазой с последующей лиофилизацией приводит к получению указанного в заголовке соединения (11 мг, 18%) в виде твердого не совсем белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,83-7,75 (м, 4H), 7,49 (д, J=7,8 Гц, 2H), 4,02 (д, J=2,4 Гц, 2H), 3,95 (дд, J=9,4, 3,1 Гц, 2H), 3,92-3,79 (м, 8H), 3,73 (дд, J=11,4, 5,5 Гц, 2H), 3,63 (т, J=9,4 Гц, 2H), 1,83 (с, 4H), 1,52 (с, 9H). (Два протона C-1 сахара находятся под пиком растворителя). МС-ESI m/z: вычислено 707,2942, найдено 708,22 (М+1)+.
Получение соединения 201 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[1'-метил-7-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]спиро[флуорен-9,4'-пиперидин]-2-ил]этинил]тетрагидропиран-3,4,5-триол
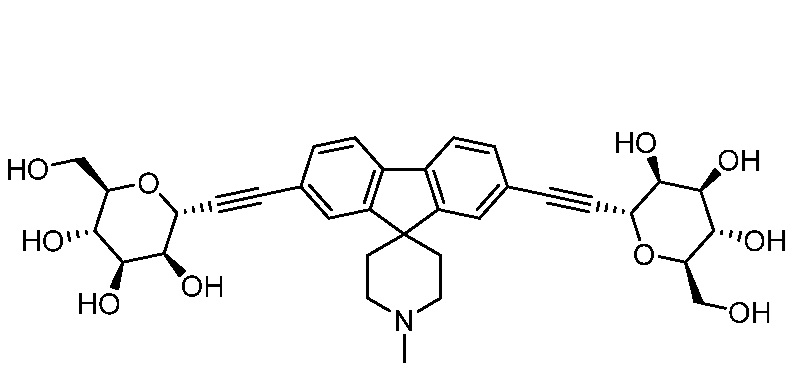
Соединение 201 получают в соответствии с методикой, описанной для получения соединения 182, но с использованием промежуточного соединения AG14. 1H ЯМР (400 МГц, CD3OD) δ 7,88-7,80 (м, 4H), 7,54 (д, J=7,9 Гц, 2H), 4,04-4,00 (м, 2H), 3,93 (дд, J=9,4, 3,2 Гц, 2H), 3,91-3,80 (м, 4H), 3,74 (дд, J=11,4, 5,7 Гц, 2H), 3,63 (т, J=9,4 Гц, 2H), 3,52-3,44 (м, 4H), 3,00 (с, 3H), 2,20-1,98 (м, 4H). (Два протона С-1 сахара находятся под пиком растворителя). МС-ESI: m/z (М+Н)+ 622,59.
Получение соединения 202 (способ D)
1-[2,7-Бис[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]спиро[флуорен-9,4'-пиперидин]-1’-ил]этанон
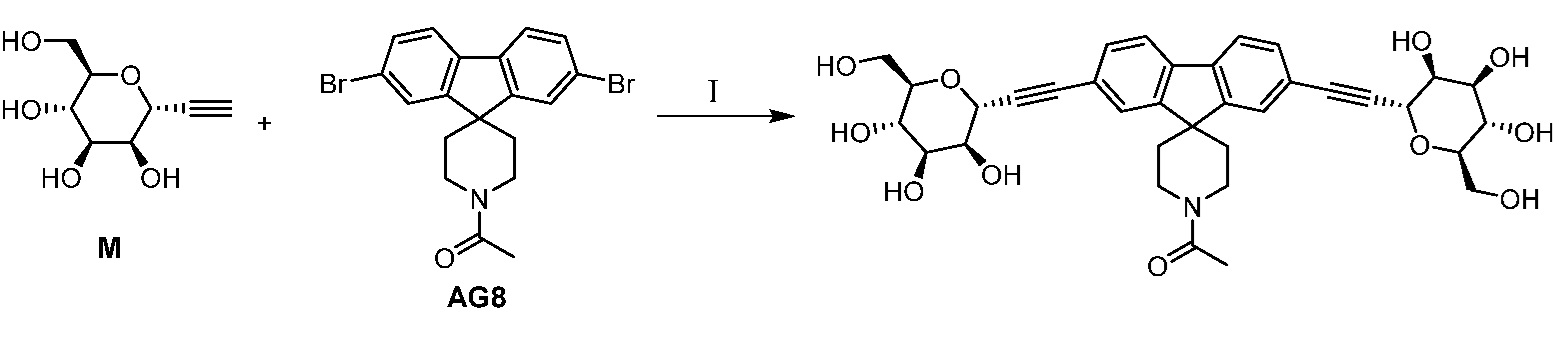
Смесь промежуточных соединений М (340 мкл, 0,53М, 0,1802 ммоль) и AG8, (35 мг, 0,080 ммоль), Pd(dppf)Cl2-CH2Cl2 (4,3 мг, 0,0053 ммоль) и CuI (4,6 мг, 0,024 ммоль) в ДМФА (140 мкл) дегазируют (вакуум/N2). К смеси добавляют DIPEA (112 мкл, 0,6430 ммоль) и снова дегазируют. Реакционную смесь нагревают до 100°С и выдерживают при указанной температуре в течение 2 часов, добавляют еще одну порцию промежуточного соединения М (152 мкл, 0,53М, 0,080 ммоль) и полученную смесь выдерживают при указанной температуре в атмосфере N2 в течение дополнительных 2,5 часов. Реакционную смесь охлаждают до КТ, фильтруют через картридж поглотителя металла (Si-DMT; Silicycle; SPE-R79030B-06P) и промывают ДМФА (1 мл). Фильтрат очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (42 мг, 80%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,82-7,78 (м, 4H), 7,50 (д, J=8,0 Гц, 2H), 4,05-3,98 (м, 4H), 3,98-3,91 (м, 4H), 3,91-3,79 (м, 4H), 3,73 (дд, J=11,4, 5,6 Гц, 2H), 3,63 (т, J=9,4 Гц, 2H), 2,25-2,19 (м, 3H), 1,98-1,89 (м, 2H), 1,88-1,80 (два протона C-1 сахара находятся под пиком растворителя). МС-ESI m/z: вычислено 649,2523, найдено 650,6 (М+1)+.
Альтернативное получение соединения 202
1-[2,7-Бис[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]спиро[флуорен-9,4'-пиперидин]-1’-ил]этанон
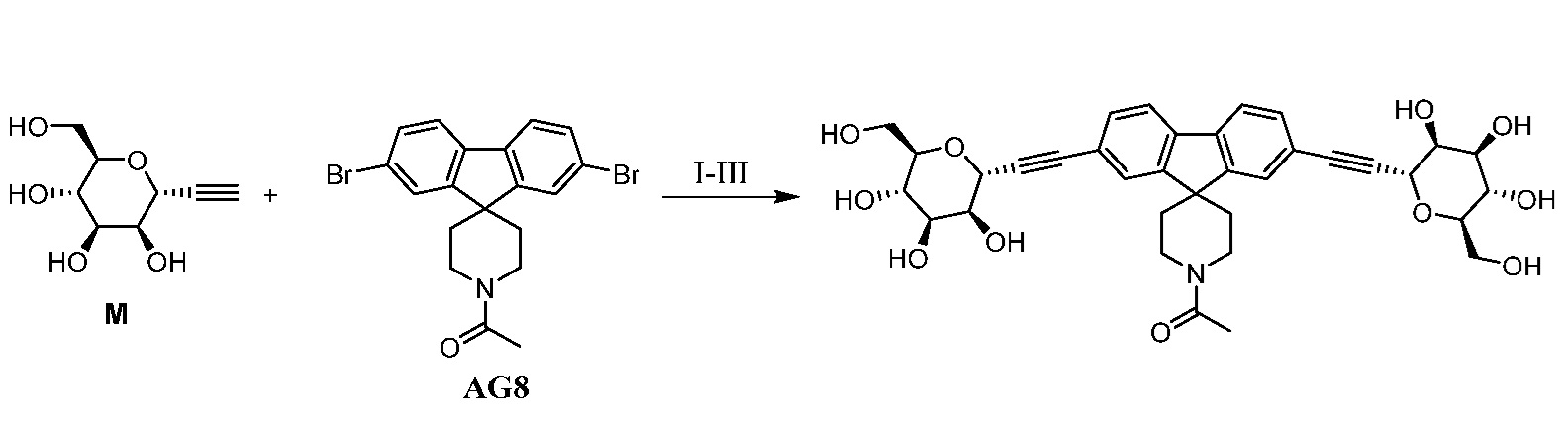
Стадия I: Сырое соединение 202
Смесь промежуточных соединений М (12,8 мл 0,468 М, 5,99 ммоль) и AG8, (875 мг, 1,999 ммоль), Pd(dppf)Cl2-CH2Cl2 (98 мг, 0,12 ммоль) и CuI (114 мг, 0,6 ммоль) в ДМФА (3,0 мл) дегазируют (вакуум/N2, дважды, в течение 5 минут каждый раз). К смеси добавляют DIPEA (2,80 мл, 16,1 ммоль) и смесь дегазируют два раза. Полученную реакционную смесь нагревают до 100°С и выдерживают при указанной температуре в течение 2 часов (ЖХ-МС через 1 час показывает полную конверсию AG8), охлаждают до КТ и концентрируют в вакууме при 40°С, получая указанное в заголовке соединение в виде масла темно-коричневого цвета.
Стадия II: [(2R,3R,4R,5R,6R)-3,4,5-Триацетокси-6-[2-[1’-ацетил-7-[2-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]этинил]спиро[флуорен-9,4’-пиперидин]-2-ил]этинил]тетрагидропиран-2-ил]метилацетат
К раствору сырого соединения 202, полученного на стадии I, в пиридине (9 мл) при КТ с перемешиванием последовательно добавляют DMAP (12 мг, 0,098 ммоль) и уксусный ангидрид (3,8 мл, 40,3 ммоль). Смесь перемешивают в течение 16 часов, разбавляют водой (40 мл), экстрагируют EtOAc (3×30 мл). Объединенные экстракты промывают 1н водным раствором HCl (3×20 мл), насыщенным раствором соли, пропускают через фазоразделитель и концентрируют. Остаток очищают на картридже Biotage™ SNAP (силикагель, 100 г; элюирование с градиентом: EtOAc в гексанах, 10%-20%, 8 CV; 100%) с получением указанного в заголовке соединения (1,690 г, 86%) в виде пены бежевого цвета. К раствору полученного продукта в EtOAc (10 мл) добавляют 300 мг SiliaMetS Thiol (Cat # R51030B от Silicycle) (1,42 ммоль/г) и смесь перемешивают при КТ в течение 3 часов, затем фильтруют, промывают EtOAc (15 мл) и концентрируют. Фильтрат обрабатывают еще раз SiliaMetS Thio с получением указанного в заголовке соединения (1,600 г).
Стадия III: Соединение 202
К раствору [(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-[2-[1'-ацетил-7-[2-[(2R,3R,4R,5R,6R)-3,4,5-триацетокси-6-(ацетоксиметил)тетрагидропиран-2-ил]этинил]спиро[флуорен-9,4'-пиперидин]-2-ил]этинил]тетрагидропиран-2-ил]метилацетата (1,600 г), полученного на стадии II, в МеОН (15 мл) при перемешивании добавляют MeONa в MeOH (400 из 0,5М, 0,200 ммоль). Смесь перемешивают при КТ в течение 7 часов и затем гасят АсОН (20 мкл, 0,36 ммоль). Смесь перемешивают в течение 15 минут, образовавшийся осадок собирают фильтрацией, промывают MeOH (10 мл) и сушат при вакуумной печи при 40°С в течение 40 часов с получением указанного в заголовке соединения (0,870 г, 65% общий выход со стадии I) в виде твердого не совсем белого вещества.
Получение соединения 203 до 205
Соединения 203, 204 и 205 получают в соответствии с методикой, описанной для получения соединения 182, но с использованием промежуточных соединений AG42, AG43 и AG44, соответственно.
|
|
Получение соединения 206 (способ D)
1-[2,7-Бис[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]спиро[флуорен-9,4'-пиперидин]-1'-ил]-2-гидрокси-2-метилпропан-1-он
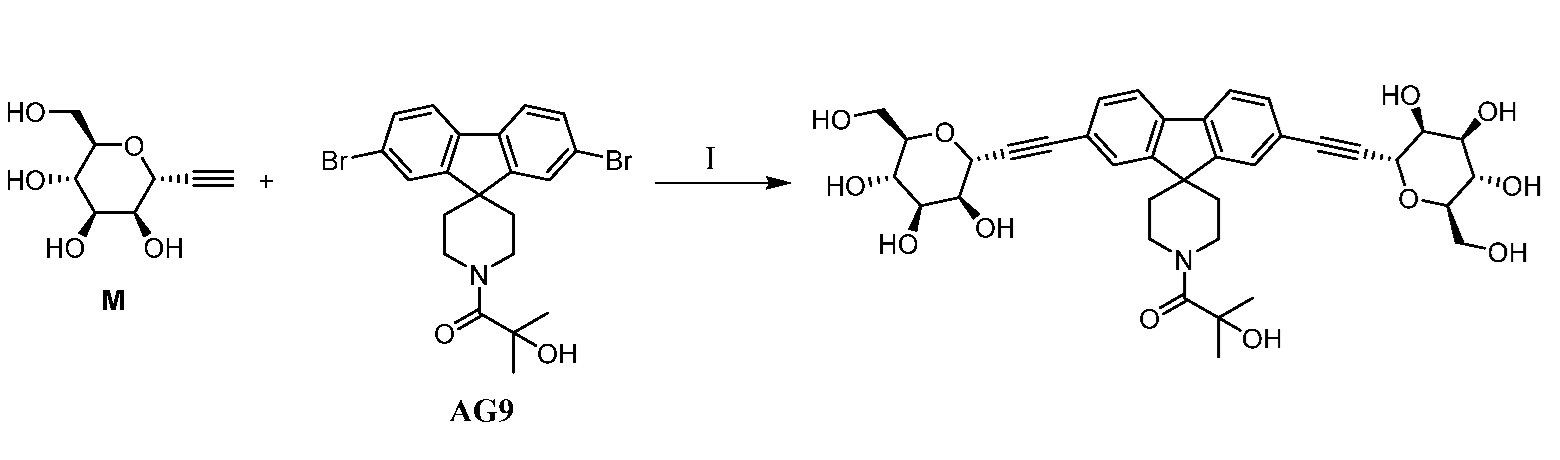
Соединение 206 получают в соответствии с методикой, описанной для получения соединения 182, но с использованием промежуточных соединений M (275 мкл, 0,53 М, 0,15 ммоль) и AG9 (34 мг, 0,0622 ммоль). Реакционную смесь нагревают до 100°С в атмосфере N2 и выдерживают в указанных условиях в течение 2 часов, после чего добавляют дополнительную порцию промежуточного соединения М (120 мкл, 0,53 м, 0,064 ммоль) для завершения реакции. Реакционную смесь перемешивают при 100°C в течение дополнительных 2 часов. После очистки с помощью ВЭЖХ с обращенной фазой получают указанное в заголовке соединение (11 мг, 23%). 1H ЯМР (400 МГц, CD3OD) δ 7,83-7,78 (м, 4H), 7,50 (дд, J=7,8, 1,3 Гц, 2H), 4,03-4,00 (м, 2H), 3,95 (дд, J=9,3, 3,3 Гц, 2H), 3,90-3,80 (м, 4H), 3,73 (дд, J=11,4, 5,6 Гц, 2H), 3,63 (т, J=9,4 Гц, 2H), 1,95-1,82 (м, 4H), 1,51 (с, 6H). Шесть протонов находятся под пиками растворителя. МС-ESI m/z: вычислено 693,2785, найдено 694,58 (М+1)+.
Получение соединения 207 (способ D)
Метил-2,7-бис[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]спиро[флуорен-9,4’-пиперидин-1’-карбоксилат
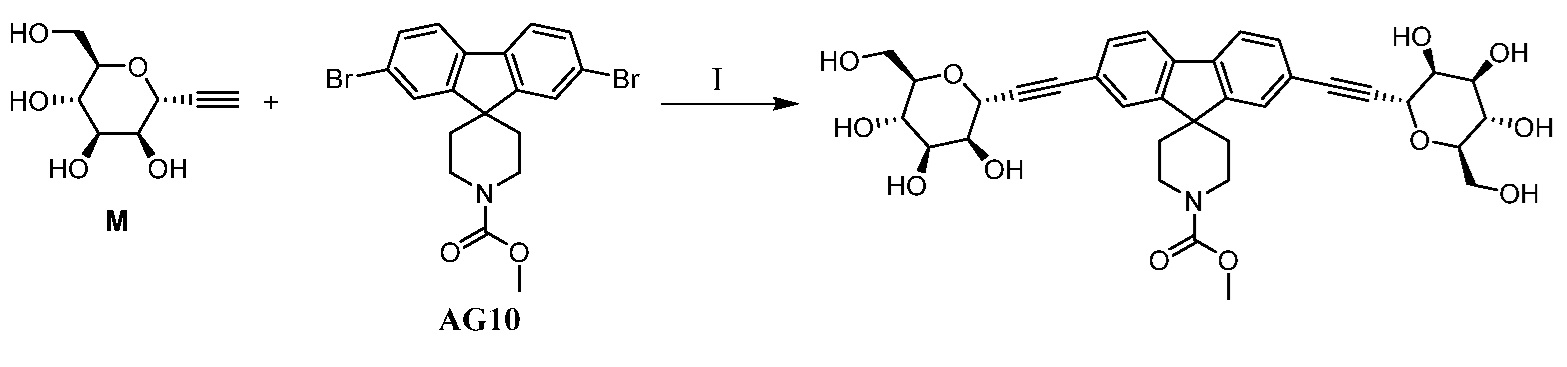
Соединение 207 получают в соответствии с методикой, описанной для получения соединения 182, но с использованием промежуточных соединений M (375 мкл. 0,53 М, 0,199 ммоль) и AG10 (40 мг, 0,08405 ммоль). Реакционную смесь нагревают в атмосфере N2 до 100°С и выдерживают в указанных условиях в течение 2 часов, и добавляют дополнительную порцию промежуточного М (160 мкл, 0,53М, 0,08480 ммоль) для завершения реакции. Реакционную смесь перемешивают при 100°C в течение дополнительных 2 часов. Смесь очищают с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (31 мг, 54%). 1H ЯМР (400 МГц, CD3OD) δ 7,82-7,77 (м, 4H), 7,49 (дд, J=7,9, 1,0 Гц, 2H), 4,03-4,00 (м, 2H), 3,95 (дд, J=9,4, 3,3 Гц, 2H), 3,93-3,80 (м, 8H), 3,76 (с, 3H), 3,73 (дд, J=11,4, 5,6 Гц, 2H), 3,63 (т, J=9,4 Гц, 2H), 1,89-1,79 (м, 4H). Два протона С-1 сахара находятся под пиком растворителя. МС-ESI m/z: вычислено 665,24725, найдено 666,57 (М+1)+.
Получение соединений 208 и 209
Соединения 208 и 209 получают в соответствии с методикой, описанной для получения соединения 207, но с использованием подходящих промежуточных соединений, полученных, как описано для промежуточного соединения AG10.
|
|
Получение соединения 210 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[1'-метилсульфонил-7-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]спиро[флуорен-9,4'-пиперидин]-2-ил]этинил]тетрагидропиран-3,4,5-триол
Соединение 210 получают в соответствии с методикой, описанной для получения соединения 182, но с использованием промежуточных продуктов M (350 мкл, 0,53 М, 0,186 ммоль) и AG11 (40 мг, 0,08 ммоль). Реакционную смесь перемешивают при 100°С в течение 2 часов в атмосфере N2, добавляют дополнительную порцию промежуточного соединения М (150 мкл, 0,53М, 0,08 ммоль) и перемешивают полученную смесь при 100°С в течение 2 часов. Смесь очищают с помощью ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (23 мг, 41%). 1H ЯМР (400 МГц, CD3OD) δ 7,85-7,77 (м, 4H), 7,51 (д, J=9,1 Гц, 2H), 4,02 (дд, J=3,2, 2,2 Гц, 2H), 3,95 (дд, J=9,3, 3,3 Гц, 2H), 3,90-3,81 (м, 4H), 3,76-3,66 (м, 6H), 3,63 (т, J=9,4 Гц, 2H), 3,06 (с, 3H), 2,03-1,95 (м, 4H). Два протона C-1 сахара перекрываются пиком растворителя. МС-ESI m/z: вычислено 685,2193, найдено 686,55 (М+1)+.
Получение соединения 211 (способ D)
[9-(Ацетоксиметил)-2,7-бис[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]флуорен-9-ил]метилацетат
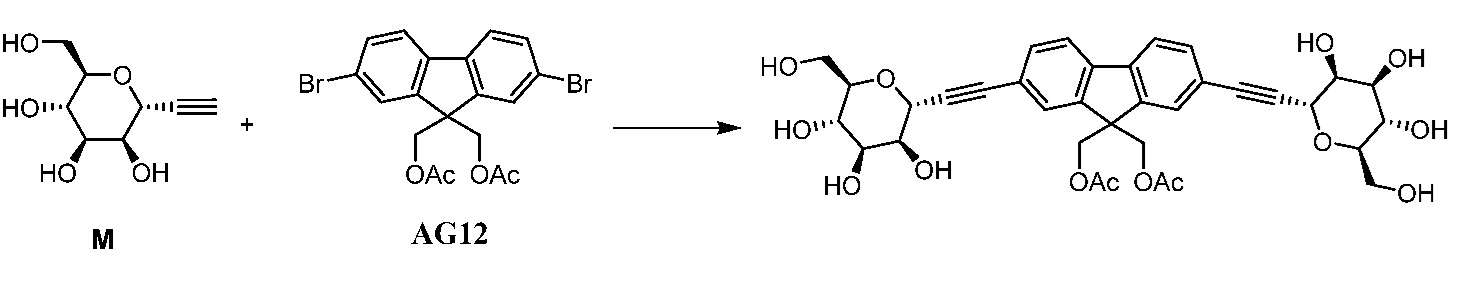
Соединение 211 получают в соответствии с методикой, описанной для получения соединения 182, но с использованием промежуточных продуктов M (1 мл 0,53 М, 0,53 ммоль) и AG12 (80 мг, 0,17 ммоль). Указанное в заголовке соединение (36 мг, 29%) получают после очистки с помощью ВЭЖХ с обращенной фазой. 1H ЯМР (400 МГц, CD3OD) δ 7,82 (д, J=7,9 Гц, 2H), 7,71 (с, 2H), 7,55 (д, J=7,9 Гц, 2H), 4,88 (д, J=2,1 Гц, 2H), 4,40 (с, 4H), 4,02 (дд, J=3,2, 2,2 Гц, 2H), 3,95 (дд, J=9,3, 3,3 Гц, 2H), 3,90-3,80 (м, 4H), 3,73 (дд, J=11,4, 5,5 Гц, 2H), 3,63 (т, J=9,4 Гц, 2H), 1,98 (с, 6H). МС-ESI m/z: вычислено 682,22614, найдено 683,22 (М+1)+.
Получение соединения 212 (способ D)
(2R,3S,4R,5S,6R)-2-(Гидроксиметил)-6-[2-[7-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]-1H-индазол-5-ил]этинил]тетрагидропиран-3,4,5-триол
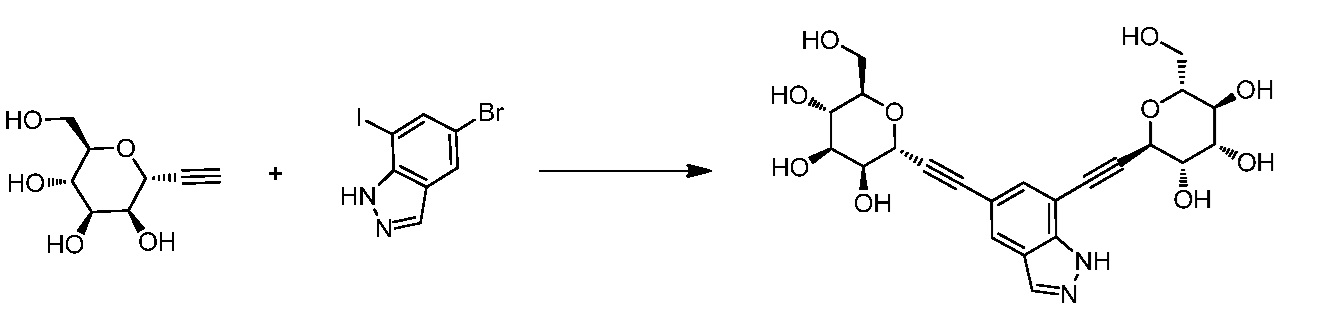
В реакционную пробирку загружают 5-бром-7-йод-1H-индазол (45,0 мг, 0,139 ммоль), полученный в соответствии с методикой, описанной в PCT Int. Appl, 2007117465, Pd(dppf)Cl2-CH2Cl2 (6,0 мг, 0,0082 ммоль) и CuI (6,0 мг, 0,032 ммоль), пробирку закрывают и дегазируют (вакуум, продувка азотом, 2x), после чего добавляют промежуточное соединение М (500 0,53 М, 0,265 ммоль) в виде раствора в ДМФА и DIPEA (400 мкл). Реакционную смесь в пробирке снова дегазируют, затем помещают на предварительно нагретую (80°C) масляную баню и перемешивают в течение ночи. После охлаждения до комнатной температуры реакционную смесь пропускают через Si-DMT картридж (200 мг), промывают порциями МеОН и очищают с помощью ВЭЖХ с обращенной фазой. Фракции объединяют и сушат вымораживанием с получением указанного в заголовке соединения (18,2 мг, выход 27%) в виде ворсистого твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 8,14 (с, 1H), 7,97 (д, J=1,3 Гц, 1H), 7,60 (д, J=1,2 Гц, 1H), 5,01 (д, J=2,1 Гц, 1H), 4,93-4,78 (м, 1H), 4,16-4,09 (м, 1H), 4,06-4,01 (м, 1H), 4,01-3,81 (м, 6H), 3,80-3,70 (м, 2H), 3,69-3,58 (м, 2H). МС-ESI m/z: 491,44 (М+1)+.
Получение соединений со 213 по 216
Соединения 213-216 получают в соответствии с методикой, описанной для получения соединения 182, но с использованием промежуточных соединений со AG30 по AG33, соответственно.
|
|
|
Получение соединения 217
(2R,3S,4R,5S,6R)-2-[2-[9,9-Бис(гидроксиметил)-7-[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]флуорен-2-ил]этинил]-6-(гидроксиметил)тетрагидропиран-3,4,5-триол
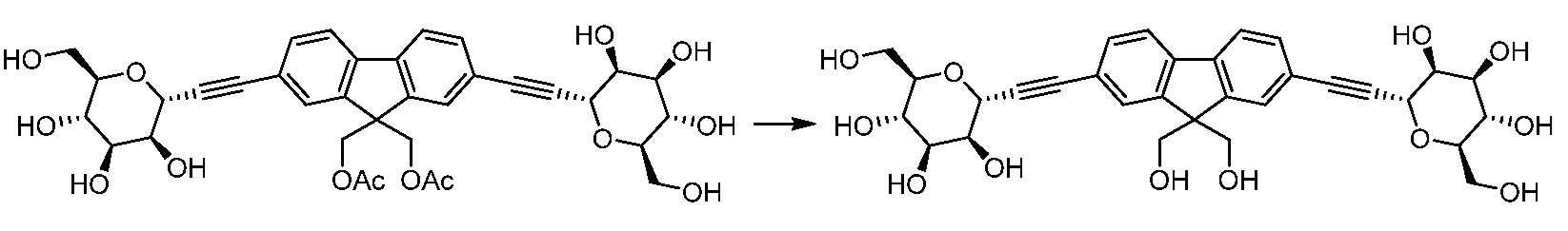
К раствору соединения 214 (23 мг, 0,03201 ммоль) в МеОН (1 мл) при перемешивании добавляют MeONa в MeOH (100 мкл, 0,5 м, 0,05 ммоль), реакционную смесь перемешивают при КТ в течение ночи, гасят смолой DOWEX 50Wx4 (Н форма) до достижения рН значения 4-5, затем фильтруют и концентрируют с получением указанного в заголовке соединения (15 мг, 68%) в виде твердого не совсем белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,77 (д, J=7,9 Гц, 2H), 7,72 (с, 2H), 7,49 (дд, J=7,9, 1,3 Гц, 2H), 4,03-3,99 (м, 2H), 3,95 (дд, J=9,3, 3,3 Гц, 2H), 3,90-3,80 (м, 8H), 3,73 (дд, J=11,3, 5,4 Гц, 2H), 3,63 (т, J=9,4 Гц, 2H), два протона C1-H сахара находятся под пиком растворителя. МС-ESI m/z: вычислено 598,205, найдено 599,53 (М+1)+.
Получение соединения 218 (способ D)
2,7-Бис[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]спиро[флуорен-9,5'-оксепан]-2'-он
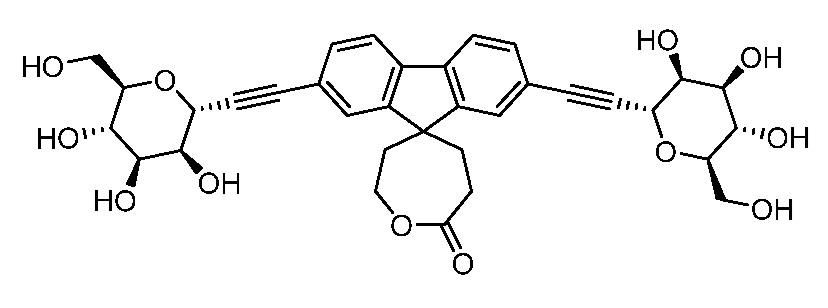
Соединение 218 получают в соответствии с методикой, описанной для получения соединения 182, но с использованием промежуточного соединения AG13. 1H ЯМР (400 МГц, CD3OD) δ 7,90 (с, 1H), 7,84-7,75 (м, 2H), 7,60-7,46 (м, 3H), 4,81-4,70 (м, 1H), 4,04-4,00 (м, 2H), 3,99-3,93 (м, 2H), 3,91-3,81 (м, 4H), 3,73 (дд, J=11,2, 5,4 Гц, 2H), 3,63 (т, J=9,4 Гц, 2H), 3,21-3,12 (м, 1H), 2,85-2,74 (м, 1H), 2,44-1,94 (м, 4H), 1,44-1,34 (м, 1H). Протоны C-1 сахара находятся под пиком растворителя. МС-ESI m/z: вычислено 637,27 (М+1)+.
Получение соединения 219
3-[9-(2-Гидроксиэтил)-2,7-бис[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]флуорен-9-ил]пропановая кислота
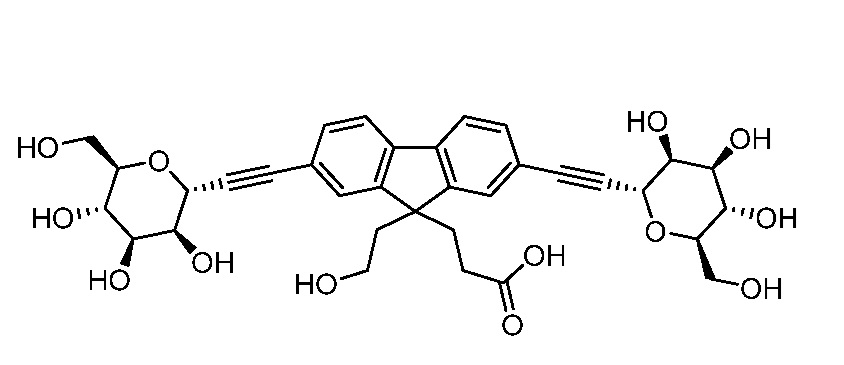
К суспензии соединения 218 (0,075 ммоль) в 1,4-диоксане (0,5 мл) добавляют водный раствор LiOH в воде (100 мкл, 1М, 0,100 ммоль). Полученную реакционную смесь перемешивают при КТ в течение 5 часов, гасят АсОН (20) мкл, очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (7 мг, 14%) в виде твердого белого вещества. 1H ЯМР (400 МГц, CD3OD) δ 7,77 (д, J=7,9 Гц, 2H), 7,58 (с, 2H), 7,49 (д, J=7,9 Гц, 2H), 4,04-4,00 (м, 2H), 3,96 (дд, J=9,3, 3,1 Гц, 2H), 3,91-3,81 (м, 4H), 3,73 (дд, J=11,3, 5,4 Гц, 2H), 3,63 (т, J=9,4 Гц, 2H), 2,84-2,73 (м, 2H), 2,46-2,29 (м, 4H), 1,48-1,34 (м, 2H). Протоны C-1 сахара перекрываются пиком растворителя. МС-ESI m/z: вычислено 655,21 (М+1)+.
Получение соединения 220 (способ D)
[2,7-Бис[2-[(2R,3S,4R,5S,6R)-3,4,5-тригидрокси-6-(гидроксиметил)тетрагидропиран-2-ил]этинил]спиро[флуорен-9,4'-пиперидин]-1'-ил]-циклопропилметанон
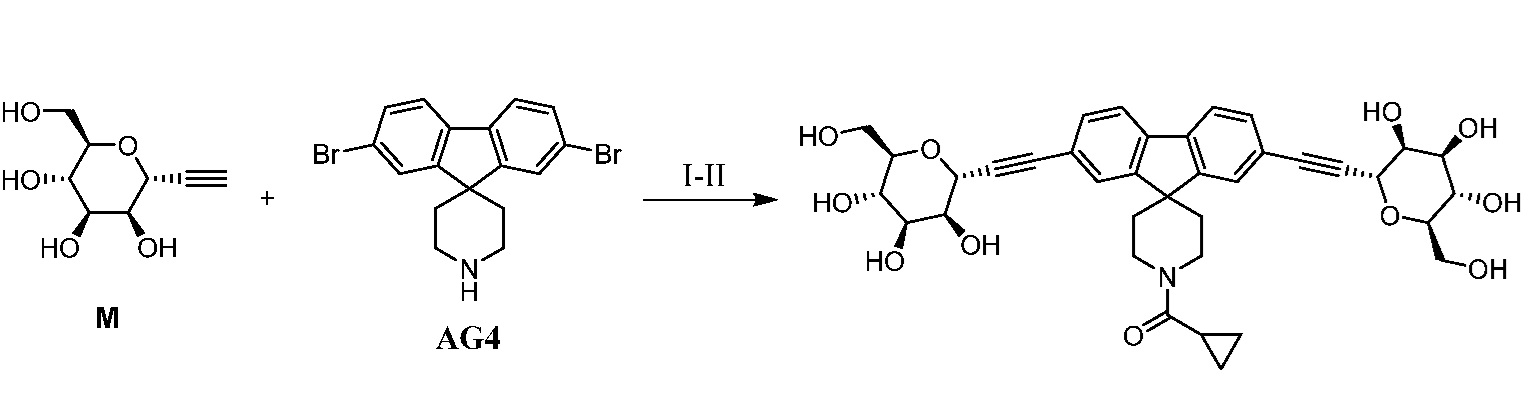
Стадия I: Сырое соединение 192
Смесь промежуточных соединений AG4, (84 мг, 0,186 ммоль) и М (1,1 мл, 0,53М, 0,583 ммоль), Pd(dppf)Cl2-CH2Cl2 (10,0 мг, 0,0123 ммоль) и CuI (11 мг, 0,058 ммоль) в ДМФА (320 мкл) дегазируют (вакуум/N2). К реакционной смеси добавляют DIPEA (260 мкл, 1,493 ммоль) и полученную смесь дегазируют. Реакционную смесь помещают на предварительно нагретую масляную баню при 100°С, перемешивают в течение 2 часов в атмосфере N2, охлаждают до КТ с получением указанного в заголовке соединения. Полученную сырую реакционную смесь используют в следующей стадии без дополнительной очистки.
Стадия II: Соединение 220
К 1/3 сырой реакционной смеси, полученной на стадии I, (0,062 ммоль, 0,55 мл) добавляют смесь HATU (25,5 мг, 0,067 ммоль) и циклопропанкарбоновой кислоты (5,8 мг, 0,067 ммоль) при КТ. Реакционную смесь перемешивают в течение 2 часов. Сырую реакционную смесь фильтруют через картридж акцептора металла (Si-DMT; Silicycle; SPE-R79030B-06P) и промывают 0,5 мл ДМФА. Фильтрат очищают ВЭЖХ с обращенной фазой с получением указанного в заголовке соединения (18 мг, 50%). 1H ЯМР (400 МГц, CD3OD) δ 7,83-7,77 (м, 4H), 7,50 (дд, J=8,0, 1,0 Гц, 2H), 4,88 (д, J=2,1 Гц, 2H), 4,24-4,15 (м, 2H), 4,06-3,99 (м, 4H), 3,95 (дд, J=9,3, 3,3 Гц, 2H), 3,90-3,80 (м, 4H), 3,73 (дд, J=11,4, 5,6 Гц, 2H), 3,63 (т, J=9,4 Гц, 2H), 2,14-2,04 (м, 1H), 1,99-1,90 (м, 2H), 1,89-1,80 (м, 2H), 1,00-0,94 (м, 2H), 0,90-0,82 (м, 2H). МС-ESI m/z: вычислено 675,26794, найдено 676,51 (М+1)+.
Получение соединений с 221 по 245
Соединения с 221 по 245 получают в соответствии с методикой, описанной для получения соединения 220, но с использованием подходящей коммерчески доступной карбоновой кислоты.
|
|
|
|
|
|
|
|
|
|
|
Дифференциальная сканирующая калориметрия соединения 162
Анализ методом дифференциальной сканирующей калориметрии кристаллической формы А соединения 162 А может проводиться с использованием ТА прибора DSC Q200 (Asset V012390). Образец (1,02 мг) взвешивают в герметичном алюминиевом тигле с предварительно пробитым отверстием и нагревают от комнатной температуры до температуры 350°С со скоростью 10°С/мин. Результат ДСК, представленный на фигуре А, показывает, что имеет место один эндотермический пик, наблюдаемый при 258°С (начальная температура 254°С, энтальпия 50,7 Дж/г).
Порошковая рентгеновская дифрактограмма (ПРД) соединения 162
ПРД может быть записана при КТ в режиме отражения с использованием системы Bruker D8 Discover (Asset Tag VO 12842), оснащенной закрытой рентгеновской трубкой, которая является источником рентгеновского излучения, и детектором Hi-Star area (Bruker AXS, Madison, WI). Генератор рентгеновского излучения работает при напряжении 40 кВ и токе 35 мА. Образец порошка помещают на Si подложку нулевого фона. Регистрируют две рамки со временем экспозиции каждой 120 секунд. Данные затем интегрируют в интервале 3°-41° 2-тета с величиной шага 0,02° и объединяют в одну непрерывную диаграмму. Фигура С представляет порошковую рентгеновскую дифрактограмму образца.
Характерные ПРД пики соединения 162:
|
Термоанализ соединения 202
Термогравиметрический анализ соединения 202 проводят для определения потери массы (в процентах) как функцию времени с использованием TA Instrument TGA Q500 (Asset V014840). Образец (1,29 мг) помещают в предварительно взвешенный алюминиевый тигель и нагревают от комнатной температуры до 350°С со скоростью 10°С/мин. Потеря веса примерно 2,2% наблюдалась при нагревании до 130°С с разложением, которое наблюдалось при >250°С. Результаты ТГА представлены на фигуре D.
ПРД соединения 202
ПРД соединения 202 записывают при КТ в режиме отражения с использованием системы Bruker D8 Discover (Asset Tag VO 12842), оснащенной закрытой рентгеновской трубкой, которая является источником рентгеновского излучения, и детектором Hi-Star area (Bruker AXS, Madison, WI). Генератор рентгеновского излучения работает при напряжении 40 кВ и токе 35 мА. Образец порошка помещают на Si подложку нулевого фона. Регистрируют две рамки со временем экспозиции каждой 120 секунд. Данные затем интегрируют для угла 2-тета в интервале 3°-41° с величиной шага 0,02° и объединяют в одну непрерывную диаграмму. Фигура D представляет порошковую рентгеновскую дифрактограмму образца.
Типичные пики ПРД соединения 202
|
Дифференциальная сканирующая калориметрия соединения 202
Анализ методом дифференциальной сканирующей калориметрии кристаллической формы А соединения 202 А может проводиться с использованием ТА прибора DSC Q2000 (Asset V012390). Образец (1,94 мг) взвешивают в герметичном алюминиевом тигле с предварительно пробитым отверстием и измерение проводят с амплитудой модуляции +/- 1°C/мин при скорости нагрева 3°С/мин до 300°С. Результат ДСК, представленный на фигуре E, показывает, что стеклование наблюдается при температуре около 143°С с последующим эндотермическим пиком плавления при 242°С (начальная температура 239,7°С, энтальпия 17,3 Дж/г).
Конкурентного связывания
Первые 177 аминокислот белка FimH экспрессируют в качествее слитого белка с тромбином в pET21b плазмиде в бактериях. Эта последовательность FimH белка содержит домен распознавания углеводов (carbohydrate recognition domain - CRD) и будет названа FimH-CRD. После бактериальной экспрессии белок FimH-CRD очищают до гомогенности и тромбиновую метку удаляют путем расщепления протеазой. Анализ конкурентного связывания с помощью флуоресцентной поляризации проводят с помощью 5 нм Alexa 647 маннозидного зонда и 60 нМ FimH-CRD. Образцы анализируют в 384-луночном микротитрационном планшете в конечном объеме 20 мкл. Конечный состав буфера для анализа: 50 мМ Tris-Cl, рН 7,0, 100 мМ NaCl, 1 мМ EDTA, 5 мМ β-меркаптоэтанола, 0,05% BSA и 2,5% ДМСО. Для FimH проводят два испытания, названные анализ 1 или анализ 2. Условия для обоих испытаний являются одинаковыми, за исключением того, что в анализе 1 тестируемые соединения разводят вручную с коэффициентом серийного разведения с 12-точечной зависимостью доза-эффект, в то время как в анализе 2 соединения разводят с помощью робототехнической системы также с коэффициентом серийного разведения (12 точечная зависимость доза-эффект) и первоначально подготавливают в двух экземплярах в круглодонных полипропиленовых 384-луночных микротитрационных планшетах. Микротитрационные планшены с соединениями замораживают и оттаивают перед применением. Первоначально Alexa 647 зонд и FimH-CRD добавляют в буфер для анализа, а затем добавляют 0,5 мкл тестируемого соединения (анализы 1 или 2) с конечной концентрацией в интервале от 0,4 нМ до 75 мкΜ конечная концентрация добавляются (12 точечное титрование с 3-кратным серийным разведением). Контрольные лунки для зонда Alexa 647 подготавливают таким же образом, но без добавления белка FimH-CRD. Затем планшеты инкубируют в течение 5 часов при КТ в темноте и в условиях повышенной влажности для предотвращения высыхания. Планшеты считывают с помощью многорежимного планшет-ридера SpectraMax Paradigm и подходящего флуоресцентного поляризационного картриджда обнаружения (Alexa-647).
Alexa 647 маннозидный зонд получают с использованием методики, аналогичной описанной для FAM маннозида (Han, Z. et al., 2010, J. Med. Chem., 53, 4779), которая представлена на приведенной ниже схеме.
В раствор (2S,3S,4S,5S,6R)-2-(4-аминобутокси)-6-(гидроксиметил)тетрагидропиран-3,4,5-триола (2,21 мг, 0,009 ммоль) и (2E-2-[(2E,4E)-5-[3,3-диметил-5-сульфонато-1-(3-сульфонатопропил)индол-1-им-2-ил]пента-2,4-диенилиден]-3-[6(2?5-диоксопирролидин-1-ил)окси-6-оксогексил]-3-метил-1-(3-сульфонатопропил)индолин-5-сульфоната)(ион калия (3)) (4,9 мг, 0,0044 ммоль) в ДМФА (44 мкл) голубого цвета с перемешиванием добавляют Et3N (5,4 мг, 7,0 мкл, 0,053 ммоль) при КТ. Раствор перемешивают при КТ в течение ночи, концентрируют, растворяют в воде и очищают на картридже С-18 системы Isolera (элюирование с градиентом: ацетонитрил в воде, от 0 до 40%, 10 CV) с последующей лиофилизацией с получением зонда Alexa 647 маннозида (3,3 мг, 34%) в виде твердого вещества синего цвета.
Значения Kd соединений определяются из кривых доза-ответ, используя двенадцать концентраций соединения в двух повторах. Кривые построены по точкам данных с использованием анализа флуоресцентного поляризационного конкурентного вытеснения, и значения Kd интерполируют из полученных кривых с использованием программного обеспечения GraphPad Prism, версия 50.4 (GraphPad Software Inc., Сан-Диего, CA, USA). В таблице 1 ниже представлены значения, полученные из анализа 1 и анализа 2.
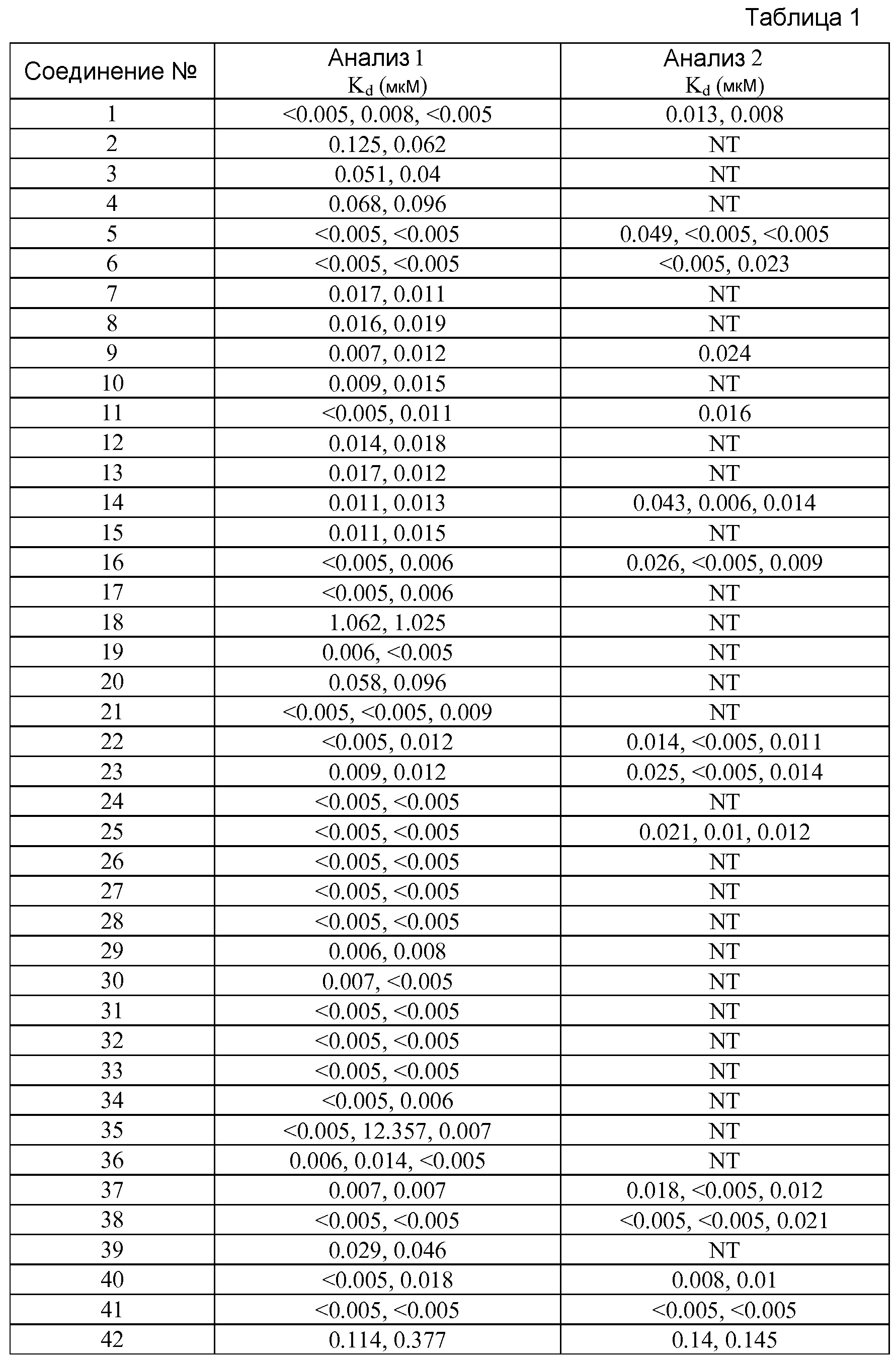
Анализ бактериального связывания
Целью анализа бактериального связывания (BBA) является определение ингибирующей активности селективных антагонистов FimH на бактериальном штамме LF82, связывающего гликопротеин BSA-(маннозы)3.
Ниже представлен перечень материалов, используемых для проведения BBA.
1. LB бульон: Поставщик: Gibco, # 10855
2. D-PBS: Поставщик: Wisent, # 311-425-Cl
3. LB агаровые пластины
4. 96-луночный черный микротитрационный планшет (высокое связывание): Поставщик: Costar, # 3925
5. Клейкая уплотнительная пленка TopSealTM-А; Поставщик PerkinElmer, #6005185
6. Таблетки карбонат-бикарбонатного буфера, рН 9,6; Поставщик: Medicago, # 09-8922-24
7. Вода, Поставщик: Gibco, # 15230-162
8. Бычий сывороточный альбумин (BSA): Поставщик: Sigma, #A7888
9. (Man)3BSA (α-3, α-6 Mannotriose-БСА, 1 мг), V-Labs, # NGP1336, lot № HGDX37-169-1
10. Tween 20: Поставщик: Sigma, #P9416
11. Bright-Glo Luciferase Assay System: Поставщик: Promega, #E2610
12. LF82/Luciferase штамм: инвазивная способность штамма Escherichia coli, выделенного из подвздошной слизистой оболочки пациента с болезнью Крона. Boudeau J., Glasser A.L., Masseret Е, Joly B., Darfeuille-Michaud, Infect. Immun. 1999, 67 (9), 4499-509
Растворы и буферы, используемые для проведения BBA:
1. 0,04 М карбонатно-бикарбонатный буфер (буфер покрытия)
2. 40 мкг/мл BSA-(MAN)3: Растворить 1 мг (MAN)3-BSA в 25 мл воды
3. 4000 мкг/мл BSA
4. 40 мкг/мл BSA
5. 1 мкг/мл BSA-(Man)3: 150 мкл BSA-(Man)3 40 мкг/мл + 5,85 мл 40 мкг/мл BSA
6. 0,5 мкг/мл BSA-(Man)3 в 0,02 М карбонат-бикарбонатном буфере
7. 20 мкг/мл BSA в 0,02М карбонатном-бикарбонатном буфере
8. блокирующий буфер (2% BSA/DPBS): 1 г BSA в 50 мл D-PBS
9. 2X связывающий буфер (0,2% BSA/D-PBS): 5 мл блокирующего буфера + 45 мл D-PBS
10. Промывочный буфер (D-PBS/0,01% Twee-20): 10 мкл, Tween 20 в 100 мл D-PBS
11. Субстрат IX Bright-Glo Luciferase: разбавленная (1:1) система Bright-Glo Luciferase и D-PBS
Экспериментальная методика проведения BBA описана ниже.
Ночная культура LF82/люциферазы: в две пробирки Falcon объемом 50 мл добавляют 20 мл LB + 20 мкл канамицина (50 мг/мл) и инокулируют петлей с культурой из глицеринового исходного штамма LF82/Luciferase. Инкубируют в течение ночи при 37°С без встряхивания.
Гликопротеиновое покрытие 96-луночных микротитрационных планшетов: Добавляют 100 мкл/лунка 0,5-2 мкг/мл BSA-(Man)3. В качестве контрольной среды используется 20 мкг/мл BSA. Уплотняющую пластину используют в качестве герметизирующей пленки и инкубируют в течение ночи при КТ. 96-Луночные микротитрационные планшеты промывают три раза 150 мкл/лунка D-PBS, добавляют 170 мкл/лункаΙ блокирующего раствора и инкубируют 45 мин (как минимум) при комнатной температуре.
Получение бактериальной суспензии: Культуры готовят в двух пробирках (40 мл) и разбавляют (1:1) в LB (900 мкл LB + 100 мкл культуры). Определяют оптическую плотность (OD) бактериальных культур. OD1 ~5×108 клеток/мл. Центрифугируют LF82 культуру в течение 20 минут при 3500 оборотах в минуту при комнатной температуре. Снова суспендируют бактериальный пеллет в D-PBS и снова центрифугируют в течение 20 минут при 3500 оборотах в минуту. Бактериальный пеллет еще раз суспендируют в D-PBS с концентрацией 2×109 бактерий/мл. Смесь разводят в соотношении 1/10 в D-PBS для получения конечной концентрации 2×108 бактерий/мл (=107 бактерий/50 мкл). Выполняют серийное разведение в соотношении 1/10 в LB каждой бактериальной суспензии, переносят 10 мкл разведений на LB агаровые планшеты (конечные разведения 10-7), инкубируют их в течение ночи при 37°С и подсчитывают CFU для определения фактической плотности бактерий в анализируемом образце.
Анализ бактериального связывания: В микротитрационные планшеты с соединением добавляют 147 мкл 2X буфера связывания (3 мкл соединения). После этого выполняют стадию блокирования (по меньшей мере, 45 минут), планшеты промывают D-PBS (три раза по 200 мкл/лунка). С помощью 100-мкл многоканальной ручной пипетки добавляют соединение (50 мкл/лунка), разведенное в 2X связывающем буфере. С помощью 100-мкл многоканальной ручной пипетки добавляют 50 мкл/лунка бактериальной суспензии. Медленно перемешивают в течение 1 минуты и инкубируют в течение 40-75 минут при комнатной температуре. Промывают 5 раз промывочным буфером (150 мкл/лунка) и затем один раз в D-PBS. Добавляют субстрат IX Bright-Glo Luciferase (100 мкл/лунка). Считывают люминесценцию с помощью планшет-ридера Analyst HT или Trilux 1450 Microbeta. В таблице 2 ниже представлены значения IC50 для соединений 1-245, полученные в анализе бактериального связывания.
|
|
|
|
|
|
|
|
Модель воспалительного заболевания кишечника (IBD) у мышей:
Модель трансгенных гуманизированных-CEACAM6 мышей может использоваться для тестирования соединений по настоящему изобретению (Carvalho F.A. et al. (2009) J. Exp. Med. Sep. 28; 206 (10):2179-89). Трансгенных гуманизированных-CEACAM6 мышей инфицируют, как описано в упомянутой выше публикации Carvalho et al. Зараженные мыши могут затем обрабатываться соединениями по настоящему изобретению.
В описании представлен ряд вариантов осуществления настоящего изобретения, однако очевидно, что наши основные примеры могут подвергаться изменениям для получения других вариантов осуществления, в которых используются соединения, способы и процессы по настоящему изобретению. Таким образом, следует представлять, что объем настоящего изобретения должен определяться прилагаемой формулой изобретения, а не конкретными вариантами осуществления, которые были представлены в данном описании с помощью примеров.