Результат интеллектуальной деятельности: Способ анализа соматических мутаций в генах GNAQ и GNA11 с использованием LNA-блокирующей мультиплексной ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом)
Вид РИД
Изобретение
Область техники, к которой относится изобретение
Изобретение относится к области генетики, молекулярной биологии и медицины и касается способа определения соматических мутаций в генах GNAQ и GNA11 с помощью технологии LNA-блокирующей мультиплексной ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом). Возникновение соматических мутаций в генах GNAQ и GNA11 является ранним событием в образовании увеальной меланомы, которая может развиваться из ранее существующего невуса. Выявление этих мутаций имеет значение для диагностических и прогностических целей. В настоящее время активно разрабатываются таргетные препараты, предназначенные для лечения пациентов с GNAQ/GNA11 мутациями.
Уровень техники
Известно большое количество способов определения соматических мутаций, в которых используются различные инструменты для анализа уникальной нуклеотидной последовательности ДНК человека. Условно среди них можно выделить шесть групп методов:
- Ферментативные методы:
анализ полиморфизма длин амплифицированных фрагментов (AFLP);
анализ полиморфизма длин рестрикционных фрагментов (RFLP);
расщепление клевазой (CFLP);
расщепление резольвазой (EMD); анализ, основанный на лигазной реакции (LDR, LCR);
ПЦР, обогащенная мутантной последовательностью;
PNA-блокирующая ПЦР в реальном времени (PNA-clamp PCR);
LNA-блокирующая ПЦР в реальном времени (LNA-clamp PCR);
ПЦР с прямой терминацией синтеза (DT-PCR);
аллель-специфическая ПЦР (AS-PCR, PCR-SSP);
SMart-амплификация;
PNA-LNA-блокирующая ПЦР в реальном времени (PNA- LNA-clamp PCR); сеьсвенирование по Сенгеру;
высокопроизводительное секвенирование (NGS);
цифровая капельная ПЦР (ddPCR).
- Химические методы:
химическое расщепление гетеродуплексов;
химическое лигирование.
- Методы, основанные на различной электрофоретической подвижности полиморфных участков ДНК:
анализ конформации одноцепочечных фрагментов (SSCP);
гетеродуплексный анализ (НА);
разделение продуктов амплификации посредством капиллярного электрофореза.
- Детекция на твердой фазе:
гибридизация на олигонуклеотидных матрицах;
элонгация иммобилизованных праймеров (минисеквенирование);
пиросеквенирование.
- Хроматографические методы:
высокоэффективная жидкостная хроматография (HPLC).
- Физические методы:
масс-спектрометрия;
резонансное тушение флуоресценции (FRET);
люминесценция, зависящая от локального окружения;
анализ кривых плавления высокого разрешения.
Наиболее распространенными из представленных методов являются:
1. Секвенирование по Сенгеру
GNAQ and GNA11 mutations occur in 9.5% of mucosal melanoma and are associated with poorprognosis / X. Sheng, Y. Kong, Y. Li, Q. Zhang, L. Si, C. Cui, Z. Chi, B. Tang, L. Mao, B. Lian, X. Wang, X. Yan, S. Li, J. Dai, J. Guo // Eur J Cancer. - 2016. - Vol. 65. - P. 156-163.
Mosaic Activating Mutations in GNA11 and GNAQ Are Associated with Phakomatosis Pigmentovascularis and Extensive Dermal Melanocytosis / A.C. Thomas, Z. Zeng, J.B. Riviere, R.  L. Al-Olabi, J. St-Onge, D.J. Atherton, H. Aubert, L. Bagazgoitia, S. Barbarot, E. Bourrat, C. Chiaverini, W.K. Chong, Y. Duffourd, M. Glover, L. Groesser, S. Hadj-Rabia, H. Hamm, R. Happle, I. Mushtaq, J.P. Lacour, R. Waelchli, M. Wobser, P. Vabres, E.E. Pattern, V.A. Kinsler // J Invest Dermatol. - 2016. - Vol. 136(4). - P. 770-778.
L. Al-Olabi, J. St-Onge, D.J. Atherton, H. Aubert, L. Bagazgoitia, S. Barbarot, E. Bourrat, C. Chiaverini, W.K. Chong, Y. Duffourd, M. Glover, L. Groesser, S. Hadj-Rabia, H. Hamm, R. Happle, I. Mushtaq, J.P. Lacour, R. Waelchli, M. Wobser, P. Vabres, E.E. Pattern, V.A. Kinsler // J Invest Dermatol. - 2016. - Vol. 136(4). - P. 770-778.
2. Высокопроизводительное секвенирование (next generation sequencing, NGS)
Targeted next generation sequencing reveals unique mutation profile of primary melanocyte tumors of the central nervous system / J. van de Nes, M. Gessi, A. Sucker, I. Moller, M. Stiller, S. Horn, S.L. Scholz, C. Pischler, N. Stadtler, B. Schilling, L. Zimmer, U. Hillen, R.A. Scolyer, M.E. Buckland, L. Lauriola, T. Pietsch, A. Waha, D. Schadendorf, R. Murali, K.G. Griewank // J Neurooncol. - 2016. - Vol. 127(3). - P. 435-444.
3. Анализ конформации одноцепочечных фрагментов ДНК (Single-strand conformation polymorphism analysis, SSCP)
Somatic mutation of GNAQ gene is rare in common solid cancers and leukemias / H.S. Eom, M.S. Kim, S.Y. Hur, N. Yoo, S. Lee // Acta Oncologica. - 2009 - Vol. 48. - P. 1082-1084.
GNA11 and N-RAS mutations: alternatives for МАРК pathway activating GNAQ mutations in primary melanocytic tumours of the central nervous system / M. Gessi, J. Hammes, L. Lauriola, E. Dorner, J. Kirfel, G. Kristiansen, A. zur Muehlen, D. Denkhaus, A. Waha, T. Pietsch // Neuropathol Appl Neurobiol. - 2013. - Vol. 39(4). - P. 417-425.
4. Капиллярный электрофорез
Routine multiplex mutational profiling of melanomas enables enrollment in genotype-driven therapeutic trials / C.M. Lovly, K.B. Dahlman, L.E. Fohn, Z. Su, D. Dias-Santagata, D.J. Hicks, D. Hucks, E. Berry, C. Terry, M. Duke, Y. Su, T. Sobolik-Delmaire, A. Richmond, M.C. Kelley, C.L. Vnencak-Jones, A.J. Iafrate, J. Sosman, W. Pao // PLoS One. - 2012. - Vol. 7(4). - e35309.
5. Цифровая капельная ПЦР (droplet digital PCR, ddPCR)
GNAQ and GNA11 mutations and downstream YAP activation in choroidal nevi / M.J.C. Vader, M.C. Madigan, M. Versluis, H.M. Suleiman, G. Gezgin, N.A. Gruis, J.J. Out-Luiting, W. Bergman, R.M. Verdijk, M.J. Jager, P.A. van der Velden // British Journal of Cancer. - 2017. - Vol. 117. - P. 884-887.
6. Анализ кривых плавления высокого разрешения
Mutation scanning of BRAF, NRAS, KIT, and GNAQ/GNA11 in oral mucosal melanoma: a study of 57 cases / J. Lyu, Y. Wu, C. Li, R. Wang, H. Song, G. Ren, W. Guo // J Oral Pathol Med. - 2016. - Vol. 45(4). - P. 295-301.
Метод 1 широко распространен и является достаточно информативным. Он предоставляет полную информацию о последовательности ДНК в исследуемом локусе и позволяет определять мутации de novo, однако не обладает достаточной чувствительностью при использования для анализа соматических мутаций (для данного метода образец должен содержать не менее 25% мутантной ДНК), отличается низкой производительностью и необходимостью в дорогостоящем оборудовании и реактивах. Для дальнейшей расшифровки хроматограмм необходима высокая квалификация персонала, что ограничивает использование данного метода.
Метод 2 является одним из самых передовых и высокопроизводительных подходов для анализа соматических мутаций. Он позволяет одновременно получать информацию о нуклеотидной последовательности большого количества генов, выявлять мутации de novo с высокой аналитической чувствительностью. К его недостаткам можно отнести чрезвычайно высокую стоимость реактивов и оборудования, большую трудоемкость в подготовке экспериментов и интерпретации результатов, что делает его малопригодным для рутинного лабораторного применения.
Метод 3 сложен в трактовке результатов, дает лишь косвенную информацию о нуклеотидной последовательности и не подлежит автоматизации.
Метод 4 дает косвенное представление об их нуклеотидной последовательности локуса. Для анализа требуется дорогостоящее оборудование и высококвалифицированный персонал, что снижает его удобство для рутинного использования в клинической практике.
Метод 5 обладает высокой аналитической чувствительностью, надежностью и точностью. Его недостатком является высокая стоимость реагентов и оборудования.
Метод 6 очень чувствителен к качеству исследуемых образцов ДНК, дает косвенную информацию о нуклеотидной последовательности исследуемого локуса, для точного определения мутации требуется последующее секвенирование. Он больше подходит для исследования терминальных мутаций и SNP, а не соматических мутаций.
Таким образом, в настоящий момент существует острая потребность в разработке способа диагностики значительного числа мутаций в генах GNAQ и GNA11, который бы выгодно отличался от известных решений простотой проведения анализа и низкой стоимостью.
В настоящее время существует всего несколько патентов на методы анализа мутаций в генах GNAQ и GNA11.
В патенте WO 2016106391 А1 приведены системы, наборы и методы количественного обнаружения однонуклеотидных полиморфизмов или мутаций в генах GNAQ и GNA11 для идентификации злокачественных новообразований. Метод основан на принципе PNA-LNA-блокирующей ПЦР в реальном времени (PNA, peptide nucleic acid; LNA, locked nucleic acid). Способы включают использование блокирующих зондов на основе PNA, которые связываются с последовательностью дикого типа целевого локуса и препятствуют его амплификации, и LNA-содержащие зонды, которые комплиментарны мутантной последовательности целевого аллеля и при связывании с ней флуоресцируют.Данный метод требуют постановки параллельных реакций для одновременного анализа генов GNAQ и GNA11.
Патент WO 2015116502 А1 описывает изобретение, относящееся к применению металлических наночастиц для раннего обнаружения увеальной меланомы. Наночастицы включают нуклеиновую кислоту, имеющую структуру штока и петли, которая сопоставляет металлический домен на флуорофоре для гашения флуорофора. При связывании с последовательностью варианта GNAQ структура штока и петли разрушается и флуорофор флуоресцирует. В конкретных вариантах осуществления металлический домен содержит золото. Данный метод не получил широкого распространения в рутинной лабораторной диагностике.
Поскольку все имеющиеся в настоящее время методы определения соматических мутаций в генах GNAQ и GNA11 обладают теми или иными недостатками, существует реальная потребность в создании простого, недорогого и специфичного метода для выявления соматических мутаций в данных генах, с целью дальнейшего внедрения в любую стандартную клиническую лабораторию.
Такой способ обеспечивается настоящим изобретением.
Раскрытие изобретения
Сущность изобретения заключается в обеспечении способа определения соматических мутаций в генах GNAQ и GNA11 в доброкачественных и злокачественных новообразованиях для диагностических и прогностических целей. Возникновение соматических мутаций в генах GNAQ и GNA11 является ранним событием в образовании увеальной меланомы. В настоящее время активно разрабатываются таргетные препараты, предназначенные для лечения пациентов с GNAQ/GNA11 мутациями. Предложенное изобретение может быть применимо в клинико-диагностических лабораториях учреждений онкологического профиля для диагностических целей и оценки прогноза развития заболевания.
Данный способ позволяет проводить детекцию точковых соматических мутаций Q209P (с. 626А>С), Q209L (с. 626А>Т), Q209R (c. 626A>G) гена GNAQ и Q209L (с. 626А>Т), Q209P (с. 626А>С) гена GNA11.
Основными признаками данного изобретения являются LNA-блокирующая мультиплексная «гнездовая» ПЦР и биочип, содержащий набор иммобилизованных дифференцирующих олигонуклеотидов.
Первым важным признаком изобретения являются праймеры для амплификации локусов исследуемых генов GNAQ и GNA11, набор которых используется для получения изучаемых флуоресцентно меченых фрагментов ДНК в требуемом количестве. Последовательности праймеров приведены в Перечне последовательностей 1 (SEQ ID NO: 1-6).
Вторым важным признаком изобретения являются LNA-олигонуклеотиды, которые узнают и специфически связываются с фрагментами ДНК «дикого типа», препятствуя их амплификации. За счет этого преимущественно амплифицируются ДНК-локусы, содержащие соматические мутации. Последовательности LNA-олигонуклеотидов приведены в Перечне последовательностей 2 (SEQ ID NO: 7-8).
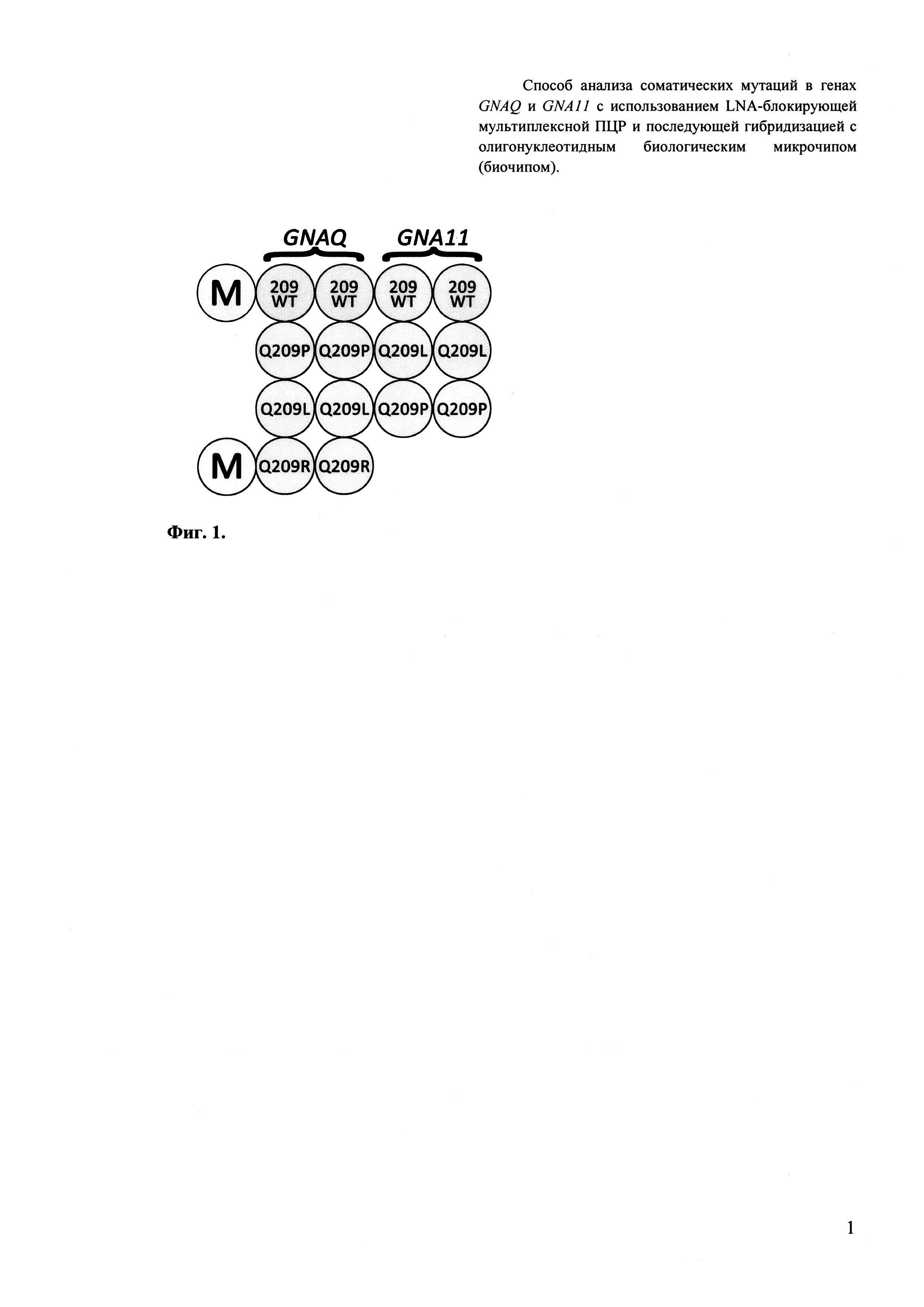
Третьим важным признаком изобретения является биочип, содержащий набор иммобилизованных дифференцирующих олигонуклеотидов, последовательности которых приведены в Перечне последовательностей 3 (SEQ ID NO: 9-15). Дифференцирующие олигонуклеотиды иммобилизуются в ячейках гидогелевого микрочипа, как описано в патенте [Композиция для иммобилизации биологических макромолекул в гидрогелях, способ приготовления композиции, биочип, способ проведения ПЦР на биочипе / А.Д. Мирзабеков, А.Ю. Рубина, С.В. Панъков, и др. // Патент RU 2206575 С2. - 2003] в концентрации 200 мкМ. Схема расположения ячеек биочипа для анализа соматических мутаций в генах GNAQ и GNA11 приведена на Фиг. 1.
Набор праймеров и LNA-олигонуклеотидов используется на стадии предварительной амплификации ДНК-локусов посредством проведения мультиплексной LNA-блокирующей «гнездовой» ПЦР для подготовки ДНК-мишени к гибридизации на биочипе. На первом этапе, благодаря использованию LNA-блокирующей мультиплексной ПЦР проходит преимущественная амплификация ДНК-локусов, содержащих соматические мутации в целевых последовательностях генов GNAQ и GNA11 (если образец содержит мутации). На втором этапе с амплифицированного фрагмента нарабатывается одноцепочечная ДНК с одновременным введением флуоресцентной метки. Далее проводится гибридизация флуоресцентно меченных фрагментов ДНК, полученных после проведения второго этапа ПЦР, с иммобилизованными в ячейках геля олигонуклеотидами, расположенными на пластиковой подложке. После проведения гибридизации и отмывки биочипа проводится анализ полученной флуоресцентной картины, на основании которого делается вывод о генотипе в исследуемом образце. Пример гибридизационной картины приведен на Фиг. 2.
Перечни последовательностей
Перечень последовательностей 1. Последовательности праймеров I и II этапа для проведения мультиплексной ПЦР с последующим анализом методом гибридизации на биочипе.
Перечень последовательностей 2. Нуклеотидные последовательности LNA-олигонуклеотидов. Условные обозначения: заглавные буквы - ДНК-нуклеотиды, строчные буквы - LNA-нуклеотиды
Перечень последовательностей 3. Последовательности олигонуклеотидных зондов, используемых для иммобилизации в ячейках биочипа.
Перечень фигур
Фигура 1. Схема биочипа для анализа соматических мутаций в генах GNAQ и GNA11: В угловых позициях слева нанесены ячейки (М), содержащие флуоресцентный краситель Су5, светящийся перманентно, для ориентировки и контроля интенсивности свечения.
Фигура 2. Гибридизационная картина, полученная с помощью биочипа для анализа соматических мутаций в генах GNAQ и GNA11 у испытуемого №ХХХ. Образец содержит мутацию Q209L в гене GNAQ.
Осуществление изобретения
Задача настоящего изобретения состоит в создании способа анализа, позволяющего выявлять соматические мутации в генах GNAQ и GNA11.
Для обеспечения оптимального состава и структуры ПЦР-праймеров, используемых в протоколе мультиплексной ПЦР, необходимы такие праймеры, которые не образуют между собой высокоэнергетических внутренних структур (шпильки и дуплексы), обеспечивают специфичную амплификацию необходимого количества продукта и при этом подобраны таким образом, чтобы их отжиг на мишени происходил при одинаковой температуре. Для обеспечения сбалансированной эффективной амплификации исследуемых образцов также должны быть оптимизированы такие параметры как концентрация MgCl2 и праймеров в ПЦР-смеси, соотношение прямых и обратных праймеров, количество циклов амплификации на обоих этапах, время элонгации, денатурации и отжига праймеров на каждом этапе. В результате проведенной работы подобраны праймеры 1 и 2 этапа, которые позволяют осуществлять эффективную наработку выбранных фрагментов генов GNAQ и GNA11.
Для обеспечения оптимального состава и структуры LNA-олигонуклеотидов, используемых в протоколе LNA-блокирующей мультиплексной ПЦР, необходимы такие LNA-олигонуклеотиды, которые не образуют между собой и с праймерами высокоэнергетических внутренних структур (шпильки и дуплексы), обеспечивают специфичное связывание с целевой последовательностью и при этом подобраны таким образом, чтобы при условиях ПЦР они образовывали с ДНК-мишенью стабильные совершенные дуплексы и не образовывали несовершенные дуплексы. В результате проведенной работы подобраны LNA-олигонуклеотиды, позволяющие осуществлять преимущественную наработку выбранных фрагментов генов GNAQ и GNA11, несущих соматические мутации.
Олигонуклеотиды для иммобилизации на биочипе подбираются таким образом, чтобы идентифицировать все выбранные для анализа соматические мутации в генах GNAQ и GNA11.
Олигонуклеотиды должны соответствовать следующим критериям: дискриминирующий зонд должен обладать высокой специфичностью к выбранному для анализа мутантному локусу, который представляет собой участок гена, амплифицированный с помощью ПЦР, с включенной флуоресцентной меткой; вариабельный нуклеотид должен находиться в серединной области зонда, поскольку такое положение позволяет добиться большей дискриминации между совершенными и несовершенными дуплексами; выбранные олигонуклеотиды не должны содержать высокостабильных вторичных структур, наличие которых может приводить к снижению эффективности гибридизации.
На биочипе для определения соматических мутаций в генах GNAQ и GNA11 иммобилизовано 7 высокоспецифичных дифференцирующих олигонуклеотидных зондов (Перечне последовательностей 3 (SEQ ID NO: 9-15)), структура которых обеспечивает связывание только с полностью комплементарными ДНК-мишенями, что обуславливает яркий флуоресцентный сигнал в соответствующих им ячейках биочипа и дает наиболее четкие картины распределения гибридизационных сигналов. Неспецифическое связывание сведено к минимуму, что практически исключает ложноположительное «срабатывание» ячеек.
Так как при амплификации целевых ДНК-локусов, используется LNA-блокирующая ПЦР, ячейки, содержащие зонды с последовательностью «дикого типа», может иметь крайне низкий уровень флуоресцентного сигнала.
Приведем последовательность анализа с использованием данного метода. Амплификация целевых последовательностей для последующей гибридизации на биочипе проводится посредством «гнездовой» мультиплексной LNA-блокирующей ПЦР в два этапа, при этом в качестве матрицы для проведения реакции используют образец ДНК. Амплификацию каждого образца ДНК проводят в одной пробирке.
ПЦР может быть проведена с использованием любого вида термостабильной полимеразы, не имеющей 5'>3'экзонуклеазной активности (например, SNPdetect полимеразы (Евроген)). Для построения новой цепи в буфер добавляется смесь дНТФ (дАТФ, дГТФ, дЦТФ, дТТФ) в принятых концентрациях, при этом вместо дТТФ может быть использован дУТФ. Для проведения ПЦР могут быть использованы готовые коммерчески доступные наборы, содержащие все необходимые компоненты за исключением праймеров LNA-олгигонуклеотидов.
На первом этапе проходит LNA-блокирующая амплификация ДНК-локусов генов GNAQ и GNA11 с преимущественной наработкой мутантных фрагментов (если образец содержит мутацию). Продукт первого этапа ПЦР используют в качестве матрицы на втором этапе, который проводят в реакционной смеси того же состава, но не добавляют LNA-олигонуклеотиды и добавляют избыток обратных праймеров для получения избытка флуоресцентно меченного одноцепочечного ПЦР-продукта, способного к гибридизации с аллель-специфичными ДНК-зондами на биочипе.
Праймеры, LNA-олигонуклеотиды и олигонуклеотидные зонды синтезируют с использованием различных химических подходов, таких как фосфодиэфирный метод, гидрофосфорильный метод и т.д., при этом наиболее распространенным в настоящее время является фосфоамидитный метод синтеза. Синтез праймеров осуществляют, используя автоматические ДНК/РНК синтезаторы, например производства фирмы «Applied Biosystems» (США).
При изготовлении биочипа могут быть использованы олигонуклеотиды, несущие по 5'- или 3'-концу активную группу, обеспечивающую иммобилизацию. Модификация олигонуклеотида для введения активной группы может быть осуществлена как в автоматическом режиме при синтезе с использованием широкого спектра коммерчески доступных модификаторов, так и постсинтетически в ручном режиме. Например, при синтезе олигонуклеотидных зондов с помощью 3'-Amino-Modifier С7 CPG 500 («Glen Research», США) на 3'-конец олигонуклеотидов вводится спейсер со свободной аминогруппой, используемый для последующей иммобилизации олигонуклеотида на биочипе.
Для проведения мультиплексной LNA-блокирующей «гнездовой» ПЦР используют праймеры SEQ ID NO: 1-6 и LNA-олигонуклеотиды SEQ ID NO: 7-8, приведенные в Перечнях последовательностей 1 и 2.
В мультиплексной реакции I этапа используют следующие праймеры и LNA-олигонуклеотиды: SEQ ID NO: 1, 2, 4, 5, 7, 8.
В мультиплексной реакции II этапа используют следующие праймеры: SEQ ID NO: 1, 3, 4, 6.
Далее проводится гибридизация флуоресцентно меченых ампликонов, полученных после проведения второго этапа ПЦР, с иммобилизованными в ячейках геля олигонуклеотидами. Олигонуклеотиды представляют собой участки целевых последовательностей генов GNAQ и GNA11 и являются комплементарными последовательности «дикого типа» или последовательности, содержащей мутацию.
Перед постановкой гибридизации ампликон денатурируют путем прогрева готовой гибридизационной смеси при 95°С в течение 5 мин. с последующим быстрым охлаждением на льду в течение 2 минут. Гибридизация может быть проведена в любом известном специалисту в данной области гибридизационном буфере, например в гуанидиновом или SSPE-буфере. Типичное время гибридизации составляет 12-14 ч. при 37°С. Анализ генотипа исследуемого образца проводится с учетом расположения олигонуклеотидных зондов на биочипе, схема которого позволяет определить какие соматические мутации присутствуют в образце.
Анализируемый фрагмент ДНК образует совершенные гибридизационные дуплексы только с полностью комплементарными ему олигонуклеотидами. Если последовательность анализируемой ДНК полностью комплементарна последовательности зонда, то образуется стабильный совершенный дуплекс (детектируется сигнал флуоресценции). В случае, если искомого фрагмента нет или в нем находится некомплементарное основание, то стабильного дуплекса не образуется (сигнал флуоресценции отсутствует). Дискриминацию совершенных и несовершенных дуплексов проводят после отмывки биочипа, сравнивая интенсивности сигналов флуоресценции соответствующих ячеек биочипа. Отмывка может быть проведена в любом известном в данной области техники буфере с добавлением соли (SSC, SSPE и т.п.) или в деионизованной воде, но за более короткое время [Molecular cloning: a laboratory manual / J.F. Sambrook, D.W. Russell // Cold Spring Harbor Laboratory Press. - 2001].
После отмывки биочипа проводится визуализация результатов гибридизации с помощью возбуждения флуоресценции прогибридизовавшегося меченного ПЦР-продукта. Регистрация картины гибридизации может быть произведена с помощью любой детектирующей системы, распознающей флуоресцентный сигнал (флуоресцентный микроскоп с ПЗС-камерой, лазерный сканер, портативный анализатор биочипов и т.п. коммерчески доступные флуоресцентные анализаторы, например, портативный анализатор биочипов, снабженный ПЗС-камерой и специальным программным обеспечением, производства ООО «БИОЧИП-ИМБ» (Москва, Россия).
Биочипы могут быть изготовлены посредством последовательного нанесения на поверхность стеклянной подложки матрицы из ячеек акриламидного геля, активации ячеек и ковалентной иммобилизации в ячейках модифицированных олигонуклеотидов, несущих активные группы [Analysis of SNPs and other genomic variations using gel-based chips / A. Kolchinsky, A. Mirzabekov // Hum Mutat. - 2002. - Vol. 19. - P. 343-360. Review]. В качестве подложки помимо стекла может быть использован другой материал, в том числе металл, гибкие мембраны и пластик [Применение немодифицированных полимерных материалов для изготовления подложки биочипов, биочип на их основе и способ его изготовления, способ иммобилизации гидрогелей на немодифщированных полимерных материалах / С. В. Панъков, Э.Я. Крейндлин, О.Г. Сомова, и др. // Патент RU 2309959. - 2007]. Бочипы также могут быть изготовлены любыми другими известными специалисту в данной области способами [Arrays of immobilized oligonucleotides--contributions to nucleic acids technology / H. Seliger, M. Hinz, E. Happ // Curr Pharm Biotechnol. - 2003. - Vol. 4. - P. 379-395].
Для изготовления биочипа в настоящем изобретении используется набор олигонуклеотидов SEQ ID NO: 9-15, приведенных в Перечне последовательностей 3. В качестве контроля прохождения гибридизации в настоящем изобретении используют образец контрольной ДНК. Расположение конкретных олигонуклеотидных зондов на биочипе может варьироваться и определяется только удобством интерпретации результатов гибридизации.
Далее приводятся примеры, которые показывают применение способа анализа соматических мутаций в генах GNAQ и GNA11. Следует понимать, что приводимые примеры служат исключительно для иллюстрации и не предназначены для ограничения объема притязаний, выраженных в формуле изобретения. На основании настоящего описания специалист в данной области сможет легко предложить свои варианты и модификации осуществления изобретения, не отходя от общей концепции настоящего изобретения и без привлечения собственной изобретательской деятельности, так что должно быть понятно, что такие варианты и модификации также будут входить в объем притязаний настоящего изобретения.
Пример 1. Амплификация фрагментов генов GNAQ и GNA11 методом «гнездовой» LNA-блокирующей ПЦР с целью получения флуоресцентно меченного ПЦР-продукта в необходимом количестве.
Из операционного материала, фиксированного в парафиновых блоках, образцы опухолевых тканей получали с помощью ручной микродиссекции под гистологическим контролем. Геномную ДНК выделяли с помощью набора QIAamp DNA FFPE Tissue Kit (Qiagen, Hilden, Германия).
Наработку локусов генов GNAQ и GNA11 проводили в мультиплексной реакции, которая содержала следующие праймеры и LNA-олигонуклеотиды - SEQ ID NO: 1, 2, 4, 5, 7, 8. ПЦР проводили на приборе Т100 («Bio-Rad», США). ПЦР-смесь первого этапа общим объемом 25 мкл включала в себя: 1× ПЦР-буфер (67 мМ Трис-HCl, рН 8.6, 166 мМ (NH4)2SO4, 0,01% Тритон Х-100), 1.5 мМ MgCl2, 0.2 мМ каждого из дНТФ («Силекс», Россия), 5 U SNPdetect-полимеразы («Евроген», Россия), по 0.2 мкМ праймеров, 0.04 мкМ LNA-олигонуклеотидов и 25 нг ДНК. Амплификацию проводили по следующей схеме: денатурация при 94°С (3 мин 30 с), далее 35 циклов: 94°С (30 с), 62°С (20 с), 72°С (10 с), затем элонгация при 72°С в течение 3 мин. Смесь второго этапа ПЦР отличалась составом и концентрацией праймеров. Она содержала по 0.2 мкМ прямых праймеров (SEQ ID NO: 1, 4), и по 2 мкМ обратных праймеров (SEQ ID NO: 3, 6) и не содержала LNA-олигонуклеотидов. Для флуоресцентного мечения ПЦР-продукта второго раунда смесь содержала 0.2 нМ флуоресцентно меченного дУТФ-Су5, который встраивался в цепь в процессе амплификации. В качестве матрицы в смесь добавляли 2 мкл продукта I этапа ПЦР и проводили амплификацию по следующей схеме: денатурация при 94°С (3 мин 30 с), далее 35 циклов: 94°С (30 с), 62°С (20 с), 72°С (10 с), затем элонгация при 72°С в течение 3 мин.
Пример 2. Олигонуклеотидный биочип для определения соматических мутаций в генах GNAQ и GNA11.
Олигонуклеотиды для иммобилизации на микрочипе синтезируют на автоматическом синтезаторе 394 DNA/RNA Synthesizer («Applied Biosystems», США) с использованием стандартной фосфоамидитной процедуры. 5' или 3'-конец олигонуклеотидов содержит спейсер со свободной аминогруппой, который вводят в состав олигонуклеотида при синтезе путем использования 3'-Amino-Modifier С7 CPG 500 («Glen Research)), США). Присоединение флуоресцентной метки к олигонуклеотидам по свободной аминогруппе осуществляют в соответствии с рекомендациями производителя. Олигонуклеотиды, меченные цианиновым красителем Су-3, очищают методом ВЭЖХ от олигонуклеотидов, не включивших флуоресцентный краситель, на колонке «Hypersil ODS» 5 мкм, 4,6×250 мм» («Sypelco Int», США).
Биочип изготовляют методом сополимеризации олигонуклеотида в акриламидном геле, как описано ранее [Применение немодифщированных полимерных материалов для изготовления подложки биочипов, биочип на их основе и способ его изготовления, способ иммобилизации гидрогелей на немодифщированных полимерных материалах / С.В. Панъков, Э.Я. Крейндлин, О.Г. Сомова, и др. // Патент RU 2309959. - 2007.], [Способ иммобилизации олигонуклеотидов, содержащих непредельные группы, в полимерных гидрогелях при формировании микрочипа / А.Д. Мирзабеков, А.Ю. Рубина, С.В. Панъков, и др. // Патент RU 2175972. - 2001.]. После изготовления биочипы проходят контроль качества нанесения, который включает в себя визуальный контроль физических размеров гелевых ячеек при помощи светового микроскопа в отраженном свете и контроль концентрации иммобилизованных олигонуклеотидов с помощью красителя Су-3 (ООО «БИОЧИП-ИМБ», Москва, Россия). Биочип содержит 7 иммобилизованных олигонуклеотидных зондов (SEQ ID NO: 9-15), список которых представлен также в Перечне последовательностей 3. Ячейки наносят согласно схеме на Фиг. 1. Пример 3. Гибридизация меченного продукта на биочипе
Реакционную смесь, полученную после проведения II этапа ПЦР, описанного в Примере 1, используют для гибридизации на биочипе. Гибридизационная смесь общим объемом 40 мкл содержала 10 мкл формамида ("Serva", США), 10 мкл 20×SSPE ("Promega", США) и 20 мкл амплификата. Готовую гибридизационную смесь перед гибридизацией денатурируют при 95°С в течение 5 мин., охлаждают во льду 2 мин. и наносят на биочип в гибридизационную камеру объемом 40 мкл (ООО «БИОЧИП-ИМБ», Москва, Россия). Гибридизацию проводят в течение 12-14 ч при температуре 37°С. После завершения инкубации гибридизационную камеру удаляют вместе с непрореагировавшей гибридизационной смесью и проводят отмывку в 1× SSPE буфере («Promega», США) при комнатной температуре в течение 15 мин.
Пример 4. Регистрация и интерпретация результатов гибридизации
Регистрацию гибридизационной картины производят с помощью портативного анализатора биочипов, снабженного ПЗС-камерой, производимого ООО «Биочип-ИМБ». Описание алгоритма автоматического анализа изображения с помощью программы Image Ware™ выходит за рамки настоящего изобретения.
Определим генотип по гибридизационной картине, представленной на Фиг. 2.
В ячейках биочипа, соответствующих 209 кодону гена GNAQ, интенсивный флуоресцентный сигнал, наблюдается только в паре ячеек, соответствующих соматической мутации Q209L. Ячейки биочипа, соответствующие «дикому типу» данного локуса, обладают низким уровнем флуоресценции. Для гена GNA11, флуоресцентный сигнал наблюдается только в паре ячеек, соответствующих последовательности «дикого типа». Следовательно, анализируемый образец содержит мутацию Q209L в гене GNAQ.