Результат интеллектуальной деятельности: СПОСОБ ВОССТАНОВЛЕНИЯ ПЛОТНОСТИ ИНТЕРФЕРОНОВЫХ РЕЦЕПТОРОВ ДЛЯ ПРОФИЛАКТИКИ ИЛИ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ПОНИЖЕННОЙ ПЛОТНОСТЬЮ ИНТЕРФЕРОНОВЫХ РЕЦЕПТОРОВ
Вид РИД
Изобретение
Область техники
Данное изобретение относится к медицине, в частности к применению глутарилгистамина или его фармацевтически приемлемой соли для восстановления и/или увеличения плотности интерфероновых рецепторов при профилактике или лечении заболеваний, связанных с пониженной плотностью интерфероновых рецепторов.
Уровень техники
Интерфероны первого типа, включающие интерферон α (IFNα) и интерферон β (IFNβ), являются важнейшими факторами врожденного иммунитета, определяющими защиту организма от вирусной инфекции и опухолевого роста. Эти цитокины несут свою сигнальную функцию, взаимодействуя с одним рецептором на поверхности клеток. Рецептор представляет собой гетеродимер, состоящий из двух цепей IFNAR1 и IFNAR2. Взаимодействие интерферонов с рецептором приводит к активации биохимических цепей, начинающихся активацией Janus-киназ Tyk2 и Jak1, которые обеспечивают фосфорилирование молекул-трансдукторов сигнала и активаторов транскрипции Stat1 и Stat2. Последние обеспечивают транскрипцию интерферон-стимулируемых генов, кодирующих белки эффекторы противовирусной защиты.
Сигналы интерферонов являются мощными стимулами, меняющими гомеостаз, функцию и деление разнообразных клеток организма, имеющих интерфероновые рецепторы. Неконтролируемое взаимодействие молекул интерферона с рецепторами может иметь токсическое, повреждающее действие, как на клетки иммунной системы, так и на весь организм. Например, нарушение регуляции интерфероновых сигналов приводит к развитию такой патологии, как системная красная волчанка. В связи с этим, интенсивность интерфероновых сигналов строго регулируется за счет разнообразных механизмов, но прежде всего, за счет модуляции/снижения плотности интерфероновых рецепторов на поверхности клеток (Coccia EM, Uze G, Pellegrini S (2006) Negative regulation of type I interferon signaling: facts and mechanisms. Cell Mol Biol (Noisy-le-grand) 52: 77-87). Этот физиологический механизм включает фосфорилирование, убиквитинирование, эндоцитоз и последующую деградацию субъединицы IFNAR1 рецептора в протеосомах клетки (Kumar KG, Krolewski JJ, Fuchs SY (2004) Phosphorylation and specific ubiquitin acceptor sites are required for ubiquitination and degradation of the IFNAR1 subunit of type I interferon receptor. J Biol Chem 279: 46614-46620).
Вирусы используют этот физиологический механизм в своих интересах, снижая интенсивность прохождения интерферонового сигнала, в том числе, за счет деградации интерфероновых рецепторов. Воздействие патогенов может включать целенаправленное подавление интерфероновых рецепторов вирусными белками. Например, вирус гепатита В понижает плотность интерфероновых рецепторов с помощью белка Х (Cho IR, Oh M, Koh SS, Malilas W, Srisuttee R, Jhun BH, Pellegrini S, Fuchs SY,
Chung YH. Hepatitis B virus X protein inhibits extracellular IFN-α-mediated signal transduction by downregulation of type I IFN receptor. Int J Mol Med. 2012 Apr;29(4):581-6. doi: 10.3892/ijmm.2012.879. Epub 2012 Jan 3). Другие вирусы, в число которых входят вирусы герпеса, достигают эффекта снижения плотности интерфероновых рецепторов через индукцию вирусами клеточного стресса (Liu J, HuangFu WC, Kumar KG et al. Virus-induced unfolded protein response attenuates antiviral defenses via phosphorylation-dependent degradation of the type I interferon receptor. Cell Host Microbe 2009; 5:72-83). Например, вирусы простого герпеса способны эффективно снижать плотность интерфероновых рецепторов за счет деградации их первой субъединицы - IFNAR1. (Qian J, Zheng H, Huangfu WC, Liu J, Carbone CJ, Leu NA, Baker DP, Fuchs SY. Pathogen recognition receptor signaling accelerates phosphorylation-dependent degradation of IFNAR1. PLoS Pathog. 2011 Jun;7(6):e1002065. doi: 10.1371/journal.ppat.1002065. Epub 2011 Jun 9). Известно, что семейство вирусов герпеса представлено восемью типами вирусов герпеса, вызывающих разные по тяжести процесса заболевания у людей. Характерной особенностью заболеваний является нахождение вирусов в организме человека в латентном состоянии.
Схожесть структуры генома различных герпесвирусов обусловливает наличие общих механизмов блокировки передачи интерфероновых сигналов.
Другим примером вирусной модуляции интерфероновых рецепторов при вирусной инфекции является нарушение баланса субъединиц интерферонового рецептора при папилломавирусном онкогенезе у женщин (Tirone NR, Peghini BC, Barcelos AC, Murta EF, Michelin MA. Local expression of interferon-alpha and interferon receptors in cervical intraepithelial neoplasia. Cancer Immunol Immunother. 2009 Dec;58(12):2003-10. doi:10.1007/s00262-009-0707-6. Epub 2009 Apr 18. PubMed PMID: 19381629.)
Таким образом, острые и хронические вирусные инфекции сопровождаются подавлением системы интерферона, в том числе за счет ускоренной деградации интерфероновых рецепторов (Qian J, Zheng H, Huangfu WC, Liu J, Carbone CJ, Leu NA, Baker DP, Fuchs SY. Pathogen recognition receptor signaling accelerates phosphorylation-dependent degradation of IFNAR1. PLoS Pathog. 2011 Jun;7(6):e1002065. doi: 10.1371/journal.ppat.1002065. Epub 2011 Jun 9; 2008 Jun 15;197(1):54-62.
Хронические интоксикации организма, например табакокурение, приводят к снижению плотности интерфероновых рецепторов в клетках респираторного тракта, что приводит к повышенной заболеваемости курильщиков вирусными заболеваниями и, возможно, риску развития рака легкого (Huang Fu WC, Liu J, Harty RN, Fuchs SY. Cigarette smoking products suppress anti-viral effects of Type I interferon via phosphorylation-dependent downregulation of its receptor. FEBS Lett. 2008 Sep 22;582(21-22):3206-10; Picaud S, Bardot B, De Maeyer E, Seif I. Enhanced tumor development in mice lacking a functional type I interferon receptor. J Interferon Cytokine Res. 2002 Apr;22(4):457-62).
В настоящее время лечение заболеваний, сопровождающихся подавление системы интерферона, проводится с помощью препаратов рекомбинантного (экзогенного) интерферона. При этом сниженная чувствительность пораженных клеток к экзогенному интерферону компенсируется высокими дозами препарата. Это приводит к токсическим эффектам интерферонотерапии, в частности, с развитием депрессивных синдромов (Patten SB. Psychiatric side effects of interferon treatment. Curr Drug Saf. 2006 May;1(2):143-50. Review. PubMed PMID: 18690925). В значительной мере, резистентность к терапии определяется снижением уровня экспрессии интерфероновых рецепторов. Например, при рассеянном склерозе наблюдается снижение уровня синтеза мРНК субъединицы интерферонового рецептора IFNAR1, что приводит к снижению эффективности терапии интерфероном β (Serana F, Sottini A, Ghidini C, Zanotti C, Capra R, Cordioli C, Caimi L, Imberti L. Modulation of IFNAR1 mRNA expression in multiple sclerosis patients. J Neuroimmunol. 2008 Jun 15;197(1):54-62.
Схожая ситуация наблюдается при интерферонотерапии хронических вирусных заболеваний. Клетки, зараженные вирусами, теряя определенное количество интерфероновых рецепторов, становятся нечувствительными к интерферонотерапии. Например, эффект терапии интерфероном-альфа при гепатите В часто непродолжителен, и заболевание переходит в стадию обострения, сопровождающегося ростом количества копий вирусного генома в крови пациентов. Это означает, что часть вирус-инфицированных клеток в организме не отвечала на терапию интерфероном. По этой же причине препараты интерферона не приводят к излечению организма от хронической инфекции, вызываемой разнообразными вирусами герпеса (Kroeker AL, Coombs KM. Systems biology unravels interferon responses to respiratory virus infections. World J Biol Chem. 2014 Feb 26;5(1):12-25. doi: 10.4331/wjbc.v5.i1.12. Review. PubMed PMID: 24600511; PubMed Central PMCID: PMC3942539); (Eron LJ, Toy C, Salsitz B, Scheer RR, Wood DL, Nadler PI. Therapy of genital herpes with topically applied interferon. Antimicrob Agents Chemother. 1987 Jul;31(7):1137-9. PubMed PMID: 3310870; PubMed Central PMCID: PMC174885).
Авторами изобретения неожиданно обнаружено, что эффективным способом лечения заболеваний, сопровождаемых снижением чувствительности клеток к интерферону, является терапия, направленная на увеличение плотности интерфероновых рецепторов на поверхности клеток. В этом случае, сенсибилизация клеток к сигналам эндогенного интерферона может приводить к терапевтическому эффекту без применения препаратов рекомбинантного интерферона, или способствовать снижению его терапевтических доз.
В настоящее время не существует средства, способного восстанавливать или увеличивать плотность интерфероновых рецепторов в случае их деградации при различных патологических состояниях. Авторы данного изобретения неожиданно обнаружили, что глутарилгистамин приводит к нарастанию синтеза матричных РНК интерфероновых рецепторов и увеличению плотности самих рецепторов на поверхности клеток. Таким образом, глутарилгистамин способен восстанавливать и/или увеличивать плотность интерфероновых рецепторов на поверхности клеток, что делает данное средство перспективным для профилактики или лечения ряда заболеваний. Средство может применяться как монотерапия вирусных заболеваний, при которой достигается эффект увеличения чувствительности клеток к низкому уровню эндогенного интерферона, за счет роста плотности интерфероновых рецепторов на поверхности клеток. Также, глутарилгистамин может применяться в составе комплексной терапии с препаратами интерферона, повышая ответ иммуносупрессированных клеток на экзогенный интерферон.
Раскрытие изобретения
Как показано авторами данного изобретения в экспериментах, глутарилгистамин может применяться для восстановления и/или увеличения плотности интерфероновых рецепторов при лечении и профилактике заболеваний, связанных с пониженной плотностью интерфероновых рецепторов. Такие заболевания представляют собой, в частности, гепатит В, герпес, папилломавирусную инфекцию и рассеянный склероз. При введении глутарилгистамина, за счет увеличения плотности интерфероновых рецепторов на поверхности клеток, обеспечивается усиление чувствительности клеток к действию эндогенного интерферона, что способствует преодолению вирус-индуцированной иммуносупрессии и обеспечивает лечебный эффект при вирусных инфекциях, таких как герпес 1-8 типов, гепатит В, папилломавирусная инфекция, а также при рассеянном склерозе. Кроме того, преодолевается резистентность к терапии интерфероном при вышеприведенных заболеваниях.
Установлено, что терапевтический эффект глутарилгистамина не сопровождается токсическими реакциями и другими побочными эффектами. Помимо этого, глутарилгистамин, являясь веществом низкомолекулярной природы, не может приводить к образованию нейтрализующих антител.
С учетом изложенного, настоящее изобретение относится к средству для восстановления и/или увеличения плотности интерфероновых рецепторов при профилактике и/или лечении заболеваний, связанных с пониженной плотностью интерфероновых рецепторов, представляющему собой глутарилгистамин, который соответствует следующей формуле
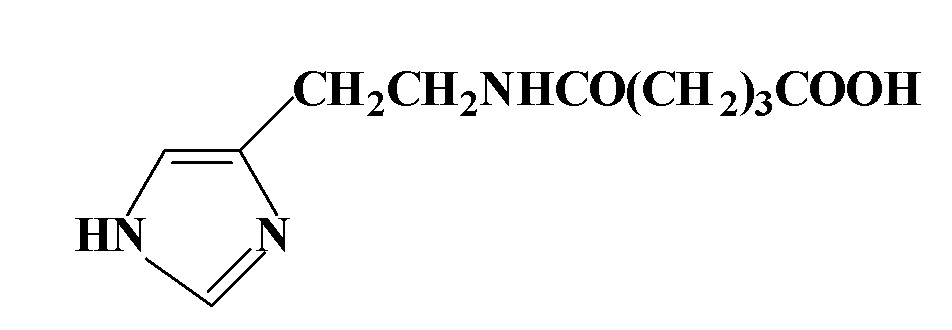
Изобретение также включает способ восстановления и/или увеличения плотности интерфероновых рецепторов при профилактике или лечении заболеваний, связанных с пониженной плотностью интерфероновых рецепторов, включающий введение эффективного количества глутарилгистамина или его фармацевтически приемлемой соли.
Профилактика указанных заболеваний включает профилактику их рецидива или обострения.
Далее, изобретение относится к фармацевтической композиции для восстановления и/или увеличения плотности интерфероновых рецепторов при профилактике или лечении заболеваний, связанных с пониженной плотностью интерфероновых рецепторов, содержащей эффективное количество глутарилгистамина или его фармацевтически приемлемой соли.
Кроме того, изобретение включает набор для восстановления и/или увеличения плотности интерфероновых рецепторов при профилактике или лечении заболеваний, связанных с пониженной плотностью интерфероновых рецепторов, включающий вышеприведенную композицию и инструкции по ее применению.
Далее, изобретение относится к применению глутарилгистамина или его фармацевтически приемлемой соли для восстановления и/или увеличения плотности интерфероновых рецепторов при профилактике или лечении заболеваний, связанных с пониженной плотностью интерфероновых рецепторов.
Дополнительно, изобретение включает применение глутарилгистамина или его фармацевтически приемлемой соли для производства фармацевтической композиции для восстановления и/или увеличения плотности интерфероновых рецепторов при профилактике или лечении заболеваний, связанных с пониженной плотностью интерфероновых рецепторов.
Предпочтительно, заболевания могут быть выбраны из группы, включающей гепатит В, герпес (в частности, вызванный вирусами герпеса 1, 2, 3, 4, 5, 6, 7 или 8 типов), папилломавирусную инфекцию и рассеянный склероз.
Вышеуказанные восстановление и/или увеличение плотности интерфероновых рецепторов обеспечивают компенсацию снижения уровня экспрессии интерфероновых рецепторов при длительной терапии интерферонами. Указанные восстановление и/или увеличение плотности интерфероновых рецепторов при могут обеспечивать преодоление резистентности к терапии интерферонами при заболеваниях, выбранных из группы, включающей гепатит В, герпес, папилломавирусную инфекцию и рассеянный склероз.
В конкретном варианте осуществления, профилактика или лечение осуществляются посредством повышения плотности интерфероновых рецепторов при рассеянном склерозе при терапии интерфероном β. Кроме того, изобретение включает профилактику иммуносупрессии при курении табака, связанной с деградацией интерфероновых рецепторов у курильщиков, при этом указанное лечение может быть направлено на преодоление резистентности к интерфероновой терапии у курильщиков. Интерфероновые рецепторы, в соответствии с изобретением, представляют собой рецепторы интерферона α (IFNα) и интерферона β (IFNβ).
Предпочтительно, глутарилгистамин вводится в твердой лекарственной форме.
Глутарилгистамин или его соли могут быть введены пациенту в дозах, составляющих от 0,1 до 100 мг/кг массы тела человека в день, предпочтительно в дозах от 0,1 до 30 мг/кг, более предпочтительно - в дозах от 0,3 до 10 мг/кг при приеме один или более раз в день. При этом разовая доза глутарилгистамина может составлять 100 мг. Длительность приема глутарилгистамина может составлять от 5 дней до 12 месяцев.
В качестве фармацевтически приемлемых солей глутарилгистамина в настоящем изобретении могут быть использованы его соли с щелочными и щелочноземельными металлами, предпочтительно натриевая, калиевая, литиевая соли.
Глутарилгистамин или его соли вводят в эффективном количестве, которое обеспечивает желаемый терапевтический результат.
При этом следует отметить, что конкретная доза для каждого конкретного пациента будет зависеть от многих факторов, таких как возраст, вес тела, пол, общее состояние здоровья и режим питания пациента, время и способ введения лекарственного средства, скорость его выведения из организма, а также тяжесть заболевания у данного индивида, подвергаемого лечению.
Фармацевтические композиции по настоящему изобретению содержат глутарилгистамин или его фармацевтически приемлемую соль в количестве, эффективном для достижения желаемого результата, и могут быть приготовлены в виде стандартных лекарственных форм (например, в твердой, полутвердой или жидкой формах), содержащих глутарилгистамин или его соль в качестве активного ингредиента в смеси с носителем или наполнителем, пригодным для внутримышечного, внутривенного, перорального, сублингвального, ингаляционного, интраназального, интраректального и трансдермального применения. Активный ингредиент может быть включен в композицию вместе с обычно используемыми нетоксичными фармацевтически приемлемыми носителями, пригодными для изготовления растворов, таблеток, пилюль, капсул, драже, суппозиториев, эмульсий, суспензий, мазей, гелей, пластырей и любых других лекарственных форм.
В качестве наполнителей могут быть использованы различные вещества, такие как сахариды, например глюкоза, лактоза или сахароза, маннит или сорбит, производные целлюлозы и/или фосфаты кальция, например, трикальций фосфат или кислый фосфат кальция; в качестве связующего компонента могут быть использованы такие, как крахмальная паста, например, кукурузный, пшеничный, рисовый, картофельный крахмал, желатин, трагакант, метилцеллюлоза, гидроксипропилметилцеллюлоза, натрий карбоксиметилцеллюлоза и/или поливинилпирролидон. При необходимости могут быть использованы разрыхляющие агенты, такие как вышеупомянутые крахмалы и карбоксиметилкрахмал, поперечно сшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, такая как альгинат натрия.
Могут быть использованы необязательные добавки, такие как агенты, регулирующие текучесть, и смазывающие агенты, такие как диоксид кремния, тальк, стеариновая кислота и ее соли, такие как стеарат магния или стеарат кальция, и/или пропиленгликоль.
В качестве добавок могут быть также использованы стабилизаторы, загустители, красители и отдушки.
В качестве мазевой основы могут быть использованы углеводородные мазевые основы, такие как вазелин белый и желтый (Vaselinum album, Vaselinum flavum), вазелиновое масло (Oleum Vaselini), мазь белая и жидкая (Unguentum album, Unguentum flavum), а в качестве добавок для придания более плотной консистенции - такие как твердый парафин и воск; абсорбтивные мазевые основы, такие как гидрофильный вазелин (Vaselinum hydrophylicum), ланолин (Lanolinum), кольдкрем (Unguentum leniens); мазевые основы, смываемые водой, такие как гидрофильная мазь (Unguentum hydrophylum); водорастворимые мазевые основы, такие как полиэтиленгликолевая мазь (Unguentum Glycolis Polyaethyleni), бентонитовые основы и другие.
В качестве основы для гелей могут быть использованы метилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, оксипропилцеллюлоза, полиэтиленгликоль или полиэтиленоксид, карбопол.
В качестве основы для суппозитория могут быть использованы основы, не растворимые в воде, такие как масло какао; основы, растворимые в воде или смешиваемые с водой, такие как желатино-глицериновые или полиэтиленоксидные; комбинированные основы - мыльно-глицериновые.
При приготовлении стандартной лекарственной формы количество активного ингредиента, используемого в комбинации с носителем, может варьироваться в зависимости от реципиента, подвергающегося лечению, от конкретного способа введения лекарственного средства.
Так, например, при использовании глутарилгистамина или его солей в виде растворов для инъекций, содержание активного агента в них составляет 0,1-5%. В качестве разбавителей могут быть использованы 0,9% раствор хлорида натрия, дистиллированная вода, раствор новокаина для инъекций, раствор Рингера, раствор глюкозы, специфические добавки для растворения. При введении в организм глутарилгистамина или его солей в виде таблеток и суппозиториев их количество составляет 10-300 мг на стандартную лекарственную форму.
Лекарственные формы настоящего изобретения получают по стандартным методикам, таким как, например, процессы смешивания, гранулирования, формирования драже, растворения и лиофилизации.
Следует отметить, что при длительном применении глутарилгистамина или его солей в терапевтических дозах и в дозах, на порядок превышающих терапевтические, не выявлено отрицательных побочных действий.
Краткое описание фигур
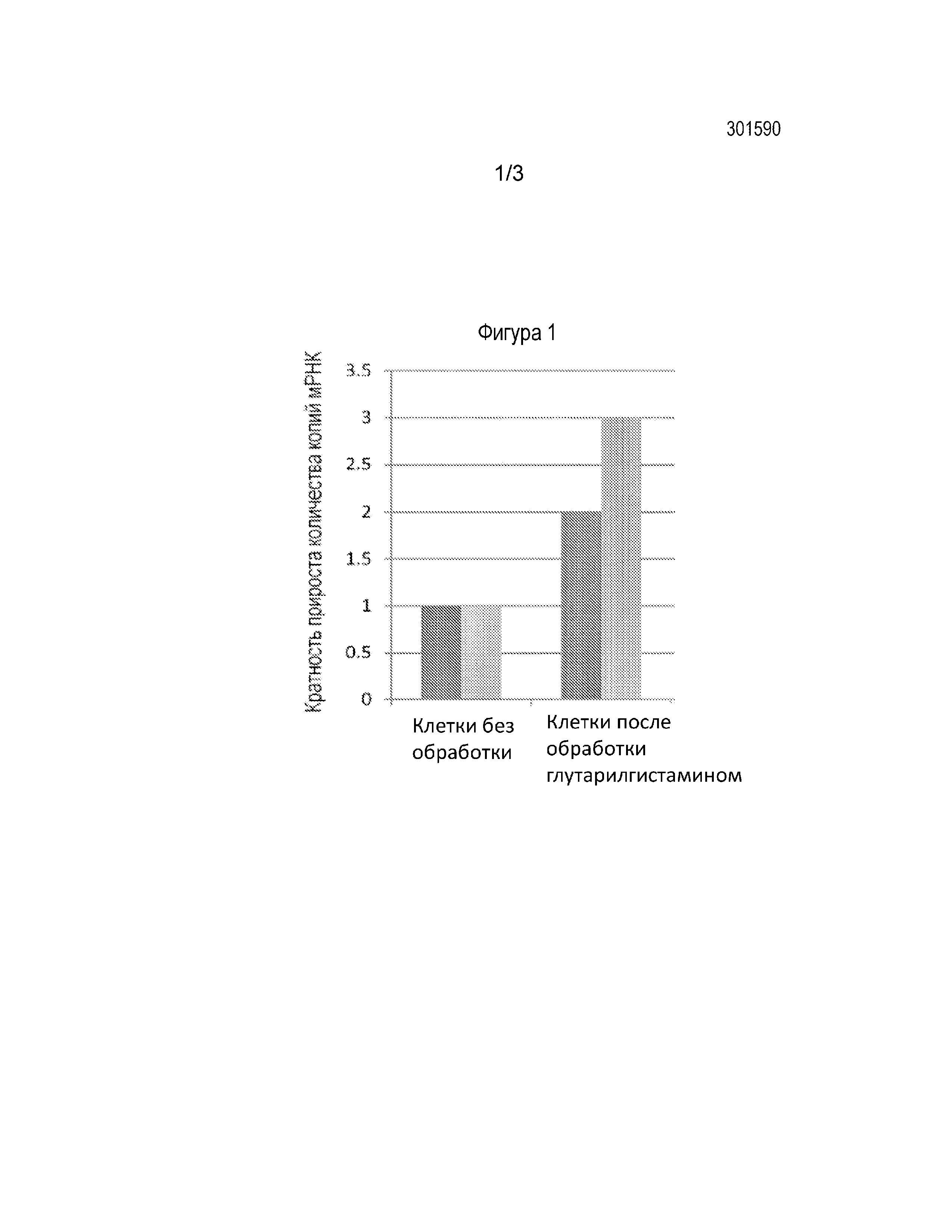
Фиг. 1 - диаграмма, иллюстрирующая повышение синтеза мРНК субъединиц интерфероновых рецепторов под воздействием глутарилгистамина в эпителиальных клетках А549.
Фиг. 2 - диаграмма, показывающая увеличение количества белка субъединиц интерфероновых рецепторов под воздействием глутарилгистамина на поверхности первичной культуры макрофагов человека.
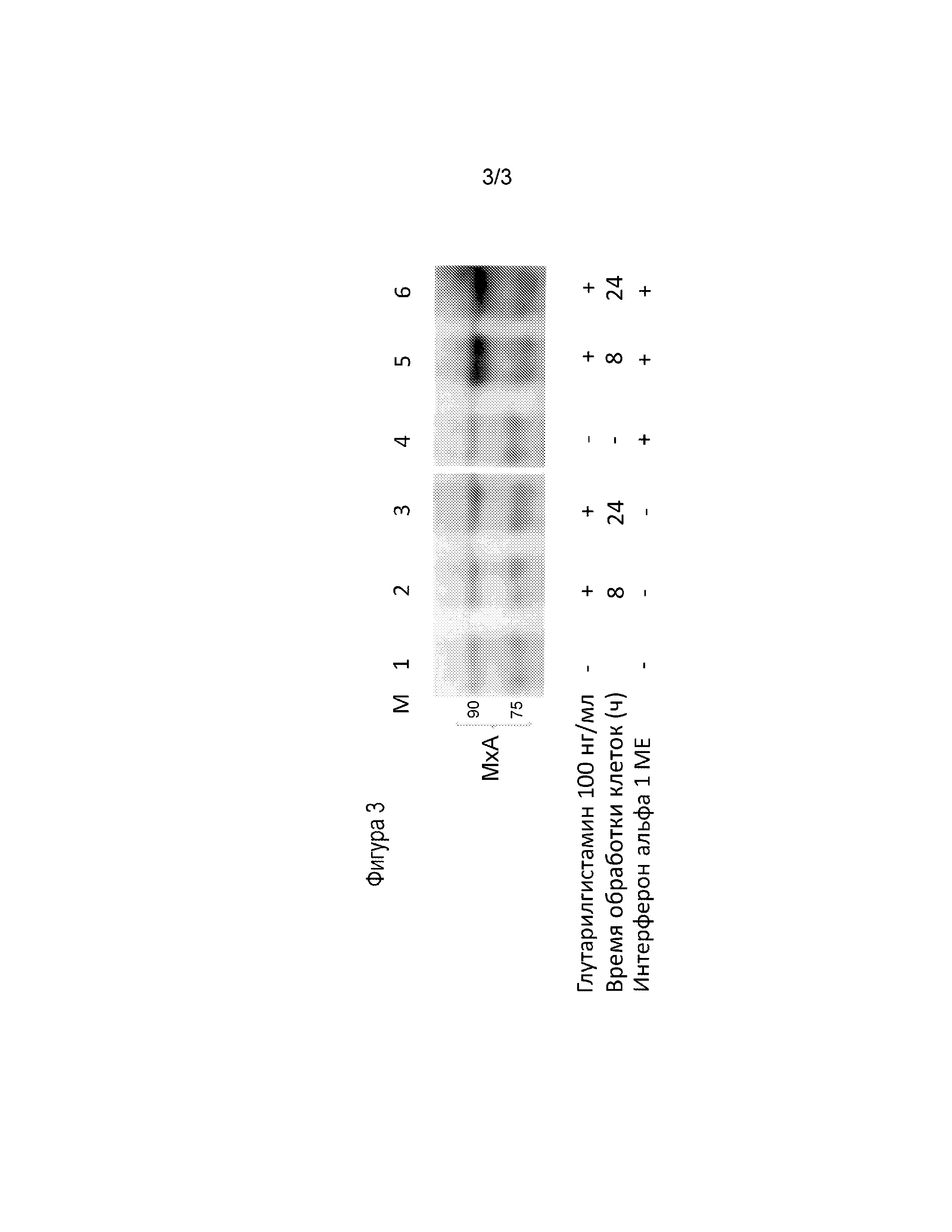
Фиг. 3 - фотография иммуноблота, демонстрирующая эффект сенсибилизации клеток к низким концентрациям интерферона при их обработке глутарилгистамином.
Осуществление изобретения
Далее приведено детальное описание экспериментальных примеров, подтверждающих эффективность глутарилгистамина для профилактики и лечения заболеваний в соответствии с данным изобретением, где приведенные примеры не предназначены для ограничения объема изобретения.
Пример 1
Уровень синтеза мРНК интерфероновых рецепторов под воздействием глутарилгистамина
Перевиваемая клеточная линия А-549 была подвергнута обработке глутарилгистамином в концентрации 100 нг/мл. Количественное определение копий матричной РНК интерфероновых рецепторов проводилось с помощью ПЦР реального времени через 16 часов после обработки. Изоляция РНК была проведена с помощью набора RNeasy Kit (Quiagen). Препарат РНК обрабатывался ДНКазой (RNase-free DNaseI (Ambion)). Обратная транскрипция проводилась с использованием Thermoscript RT-PCR System (Invitrogen). Количественная ПЦР проводилась с использованием праймеров: Ifnar1(forward) 5′ CACTGACTGTATATTGTGTGAAAGCCAGAG 3′, (reverse) 5′ CATCTATACTGGAAGAAGGTTTAAGTGATG 3′; Ifnar2 (forward) 5′ ATTTCCGGTCCATCTTATCAT 3′, (reverse) 5′ACTGAACAACGTTGTGTTCC 3′.
Результаты. Как видно из графика (фигура 1), обработка клеток глутарилгистамином приводила, по меньшей мере, к двукратному увеличению синтеза мРНК субъединицы IFNAR1 и трехкратному возрастанию количества мРНК субъединицы IFNAR2 рецептора к интерферону первого типа.
Пример 2
Влияние глутарилгистамина на плотность интерфероновых рецепторов на поверхности первичных человеческих макрофагов
10-дневная первичная культура человеческих макрофагов в 96 луночных панелях инкубировалась в течение 24 часов в присутствии глутарилгистамина в концентрациях: 0.1, 1.0, 10 или 100 нг/мл или без него. Затем клетки фиксировали раствором параформальдегида (без пермеабилизации), фиксированные клетки промывали фосфатным буферным раствором с детергентом (PBS-Tween), блокировали раствором бычьего сывороточного альбумина и инкубировали с антителами к субъединицам интерферонового рецептора IFNAR1 или IFNAR2. Визуализацию проводили путем окрашивания препарата вторичными антителами, мечеными пероксидазой хрена и добавлением субстрата. Оптическую плотность определяли с помощью ELISA спектрофотометра.
Как видно из примера (фигура 2), обработка макрофагов глутарилгистамином увеличивала плотность обеих цепей интерферонового рецептора на поверхности клеток, что отражается в заметном повышении уровня сигнала при окрашивании антителами, специфичными к IFNAR2 и IFNAR1.
Пример 3
Влияние глутарилгистамина на чувствительность клеток к интерферону
Увеличение плотности интерфероновых рецепторов на поверхности клеток должно приводить к повышению их чувствительности к слабым сигналам эндогенного интерферона в условиях подавления его сигналинга при вирусной инфекции. Для демонстрации эффекта сенсибилизации клеток к интерфероновым сигналам клетки А-549 обрабатывали глутарилгистамином в концентрации 100 нг/мл и инкубировали в течение 8 или 24 часов до проведения клеточного лизиса в присутствии или отсутствии 1 МЕ интерферона-альфа (IFNα: Roferon-A3®, Roche Molecular Biochemicals, Mannheim). Клеточные лизаты подвергали стандартной процедуре иммуноблота (вестерн блот), используя моноклональные антитела против МхА белка (sc-50509, Santa Cruz Biotechnology) для окрашивания мембраны методом хемилюминесценции, используя субстрат (chemiluminescent reagent Super Signal West Femto Chemiluminescent Substrate (Thermo Fisher Scientific). Белок МхА был выбран в качестве индикаторного продукта, свидетельствующего об экспрессии интерферон-стимулируемых генов (ISGs) при обработке клеток интерфероном.
Как видно из примера (фигура 3), в отсутствии обработки интерфероном, глутарилгистамин не вызывал накопления в клетках противовирусного белка МхА (дорожки 1,2,3). Интерферон, в низкой концентрации 1 МЕ также не индуцировал синтез МхА белка (дорожка 4). В то же время клетки, одновременно обработанные глутарилгистамином и интерфероном, демонстрировали увеличение синтеза МхА белка уже через 8 часов инкубации (дорожка 5), а также через 24 часа после начала обработки клеток (дорожка 6). Таким образом, обработка клеток глутарилгистамином приводила к усилению сигналинга интерферона и, как следствие, увеличению биосинтеза молекул эффекторов противовирусной защиты.
Пример 4
Терапевтическая эффективность глутарилгистамина на модели герпетического менингоэнцефалита мышей
Мышей заражали вирусами простого герпеса ВПГ-1/КЛ и ВПГ-2/ВН интрацеребрально в объеме 30 мкл, содержащем 10 LD50.
Изучение лечебного действия глутарилгистамина осуществляли путем перорального введения препарата зараженным животным 1 раз в день в объеме 200 мкл в дозе 30 мг/кг, через 24, 48, 72, 96 и 120 ч после инфицирования животных вирусом. Мышам контрольной группы вводили в тех же условиях плацебо (200 мкл физиологического раствора). За животными наблюдали в течение 14 суток после заражения, учитывая гибель мышей от герпетического менингоэнцефалита в группах леченых животных и в контроле. Активность препарата оценивали, сравнивая летальность животных, принимавших глутарилгистамин, с контрольной группой. Снижение летальности леченых животных по отношению к контролю выражали в процентах.
Показатели защиты от смертности и продолжительности жизни леченых, контрольных (инфицированных животных, не получавших глутарилгистамин) и интактных мышей (отрицательный контроль) представлены в таблице 1.
При лечении ВПГ-1/КЛ вирусной инфекции глутарилгистамином отмечалось достоверное (р=0,02) снижение летальности с 95% до 65% и увеличение средней продолжительности жизни с 4,8 до 8,1 суток. Аналогично, лечение мышей, инфицированных вирусом ВПГ-2/ВН глутарилгистамином приводило к статистически достоверному (р=0,008) снижению летальности вируса с 85% до 45% с увеличением средней продолжительности жизни с 6,1 до 10,2 сут. Для оценки достоверности применяли тест Log-rank Mantel-Cox. Таким образом, было показано, что глутарилгистамин обладает лечебной эффективностью при терапии герпетической инфекции у мышей.
|
Пример 5.
Изготовление лекарственных форм глутарилгистамина
Лекарственные формы глутарилгистамина для использования в соответствии с настоящим изобретением получают по стандартным методикам, таким как, например, процессы смешивания, гранулирования, формирование драже, растворение и лиофилизация.
Таблетированная форма
Таблетированную форму получают, используя приведенные ниже ингредиенты:
|
Компоненты смешивают и прессуют для образования таблеток весом 300 мг каждая.
Желатиновые капсулы
Глутарилгистамин или его соль - 90 мг,
Лактоза (сахар молочный), крахмал картофельный, кремния диоксид коллоидный (аэросил), магния стеарат - до получения массы содержимого капсулы 220 мг
Указанные выше ингредиенты смешивают, гранулируют, гранулы помещают в твердые желатиновые капсулы в количестве 220 мг.
Суппозитории
Пример состава суппозитория:
|
При необходимости возможно изготовление ректальных, вагинальных и уретральных суппозиториев с соответствующими наполнителями.
Раствор для инъекций
Пример состава раствора для инъекций:
|
В качестве растворителя при приготовлении раствора для инъекций могут быть использованы - 0,9% раствор натрия хлорида, дистиллированная вода, раствор новокаина. Форма выпуска - ампулы, флаконы, шприц-тюбики, «insert».