Результат интеллектуальной деятельности: Способ очистки лекарственного средства пролонгированного действия на основе рекомбинантного аналога интерферона бета 1b для лечения рассеянного склероза
Вид РИД
Изобретение
Изобретение относится к биотехнологии, в частности к способу получения гибридного белка, включающему конъюгацию рекомбинантного аналога интерферона бета 1b, который может быть использован для лечения рассеянного склероза.
Рассеянный склероз (PC) - наиболее распространенное демиелинизирующее заболевание, которое поражает в основном лиц трудоспособного возраста. В последние годы отмечается неуклонная тенденция к росту заболеваемости PC и омоложению контингента больных. Одной из главных характеристик PC является полиморфизм клинических проявлений, обусловленный особенностями течения и локализации демиелинизирующего процесса. Сочетание острой демиелинизации и патологических изменений аксонов лежит в основе прогрессирования неврологического дефицита и инвалидизации больных PC.
PC является заболеванием с высокозатратными схемами лечения и методиками социальной реабилитации больных.
Для терапии данного заболевания применяют иммуномодуляторы, изменяющие течение PC, снижающие остроту обострений, увеличивающие протяженность ремиссии и тем самым замедляющие прогрессию заболевания. Одним из первых таких препаратов является интерферон бета, и до сих пор он используются в качестве лекарственного средства первой линии.
Наибольшей активностью против рассеянного склероза в различных тестах in vitro обладает интерферон бета 1b.
В патенте RU 2614264 описана нуклеотидная последовательность, кодирующая рекомбинантный белок - аналог интерферона бета, которая оптимизирована для экспрессии в клетках Е. coli. Изобретение позволяет получить рекомбинантный белок - аналог интерферона бета с биологической активностью 1,8*109 Ед/мкмоль в системе A549/VSV. Однако данный рекомбинантный белок - аналог интерферона бета не обладает фармакокинетическими параметрами, превосходящими нативные не модифицированные препараты на основе интерферона бета.
Преимуществом предлагаемого изобретения является улучшенная фармакокинетика полученного гибридного белка по сравнению с нативным интерфероном бета 1b. Период полувыведения составляет 16 ч, что в 3-5 раза превышает значения для нативных препаратов.
Доступные в настоящее время технологии очистки рекомбинантных интерферонов бета, экспрессируемых в клетках СНО, состоят из 3-5 процедур очистки, включая первичную очистку методом аффинной хроматографии (US 4541952), метал-хелатную хроматографию (US 4257938), хроматографию на пористом стекле с контролируемым размером пор CGP (US 5244655 и др.) или хроматографию на Конкавалине A (US 4658017) с последующей катионообменной хроматографией или обращенно-фазовой хроматографией.
Использование для очистки металл-хелатной хроматографии может привести к загрязнению окружающей среды, так как в ней используют тяжелые металлы. Хроматография на пористом стекле или на Конкавалине А обладает низкой специфичностью. Более того, технологии очистки с помощью аффинной хроматографии включают промывание и элюцию с этиленгликолем с использованием моноклональных антител или смол, содержащих красители. Однако аффинная хроматография с использованием моноклональных антител требует отдельной стадии удаления негликозилированной формы интерферона бета, что делает массовое производство затруднительным, а используемый для промывания этиленгликоль является весьма токсичным для организма, что ограничивает применение этого способа очистки.
Целью изобретения является получение и очистка рекомбинантного аналога интерферона бета 1b, конъюгированного в районе сайта природного гликозилирования с олигосахаридом, представленного последовательностью SEQ ID NO 1, с повышенным выходом целевого продукта.
Получение гибридного белка, обладающего терапевтической активностью в отношении рассеянного склероза, включает в себя следующие этапы:
- получение рекомбинатного белка - аналога интерферона бета, соединенного с белком-стабилизатором;
- хроматографическая очистка рекомбинантного белка - аналога интерферона бета, соединенного с белком-стабилизатором, на металл-аффинном сорбенте;
- получение, очистка и анализ олигосахарида, содержащего на одну молекулу олигосахарида семь остатков сиаловых кислот;
- конъюгация олигосахарида с рекомбинантным белком - аналогом интерферона бета 1b, соединенным с белком-стабилизатором;
- хроматографическая очистка конъюгата рекомбинантного аналога интерферона бета 1b с олигосахаридом, которая проходит в один этап на ионообменном сорбенте.
Техническим результатом, достигаемым при реализации данного изобретения, является улучшенная фармакокинетика полученного гибридного белка по сравнению с нативным интерфероном бета 1b и повышение степени очистки рекомбинантного аналога, приводящее к однородности и практически к 100% хроматографической чистоте получаемого продукта.
Краткое описание чертежей
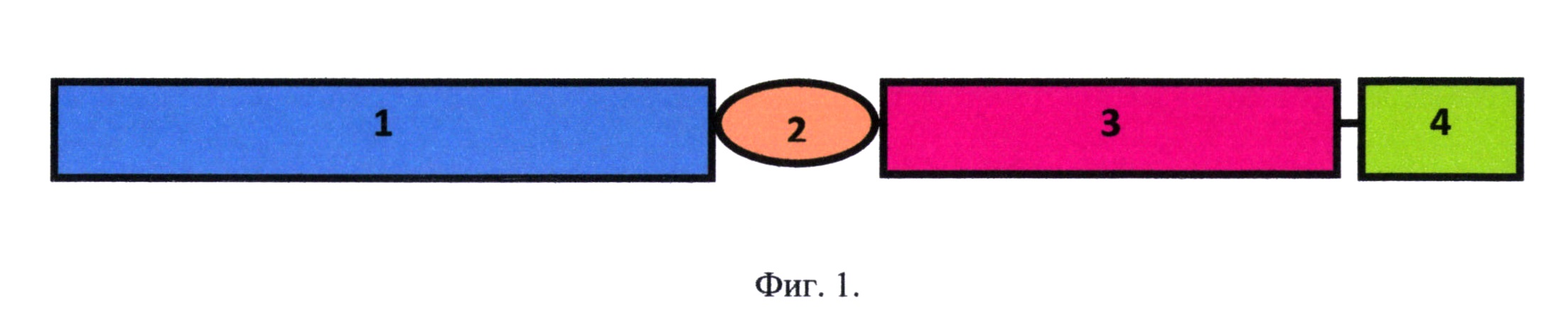
Фиг. 1. Схема рекомбинантного белка - аналога интерферона бета, соединенного с белком-стабилизатором: 1 - последовательность аналога интерферона бета человека; 2 - сайт расщепления ферментом энтерокиназой; 3 - последовательность белка из семейства шаперонов, стабилизирующего всю рекомбинантную конструкцию; 4 - полигистидиновая последовательность.
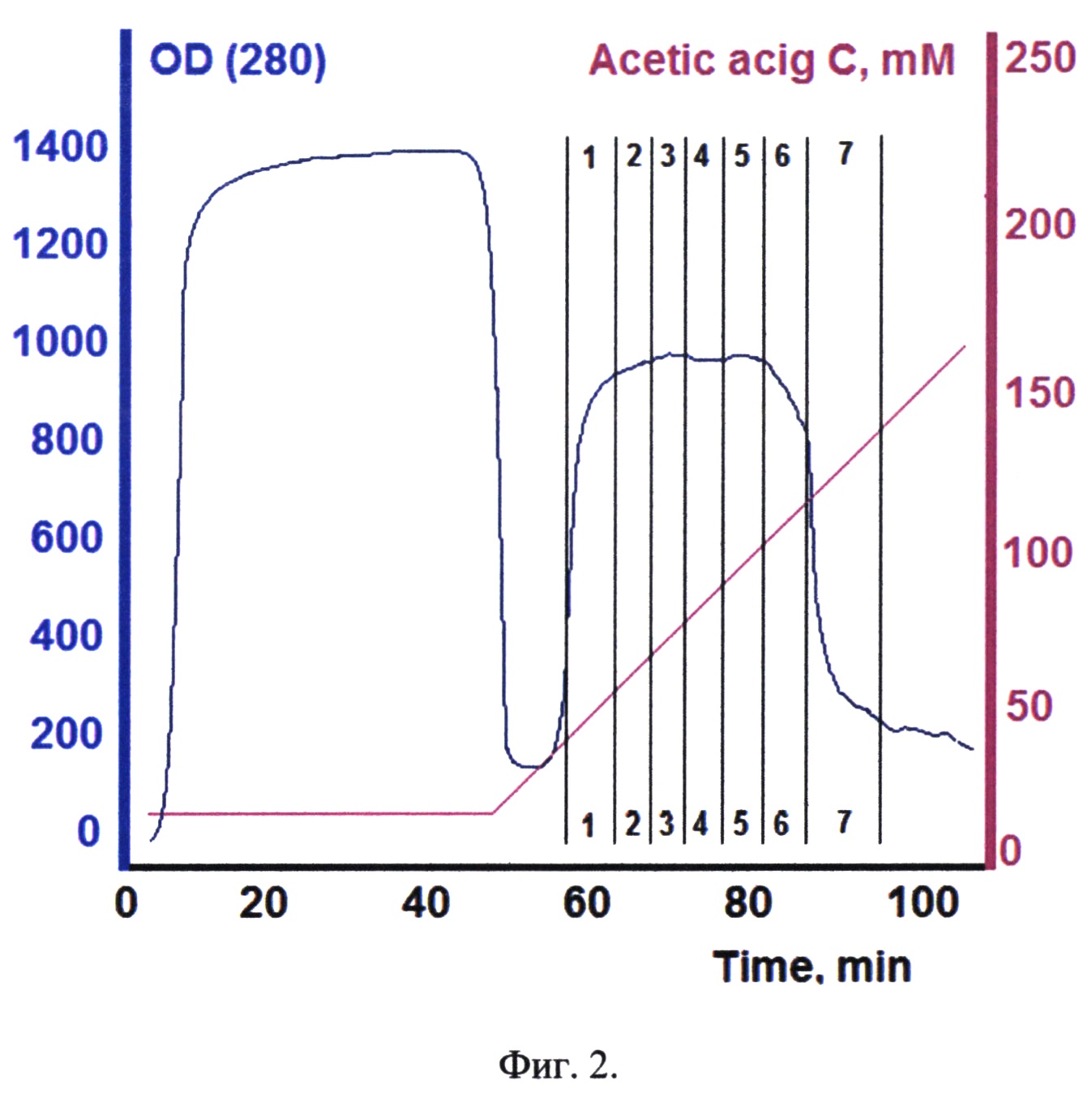
Фиг. 2. Хроматографический профиль элюции рекомбинантного белка - аналога интерферона бета, соединенного с белком-стабилизатором, с Ni-Sepharose.
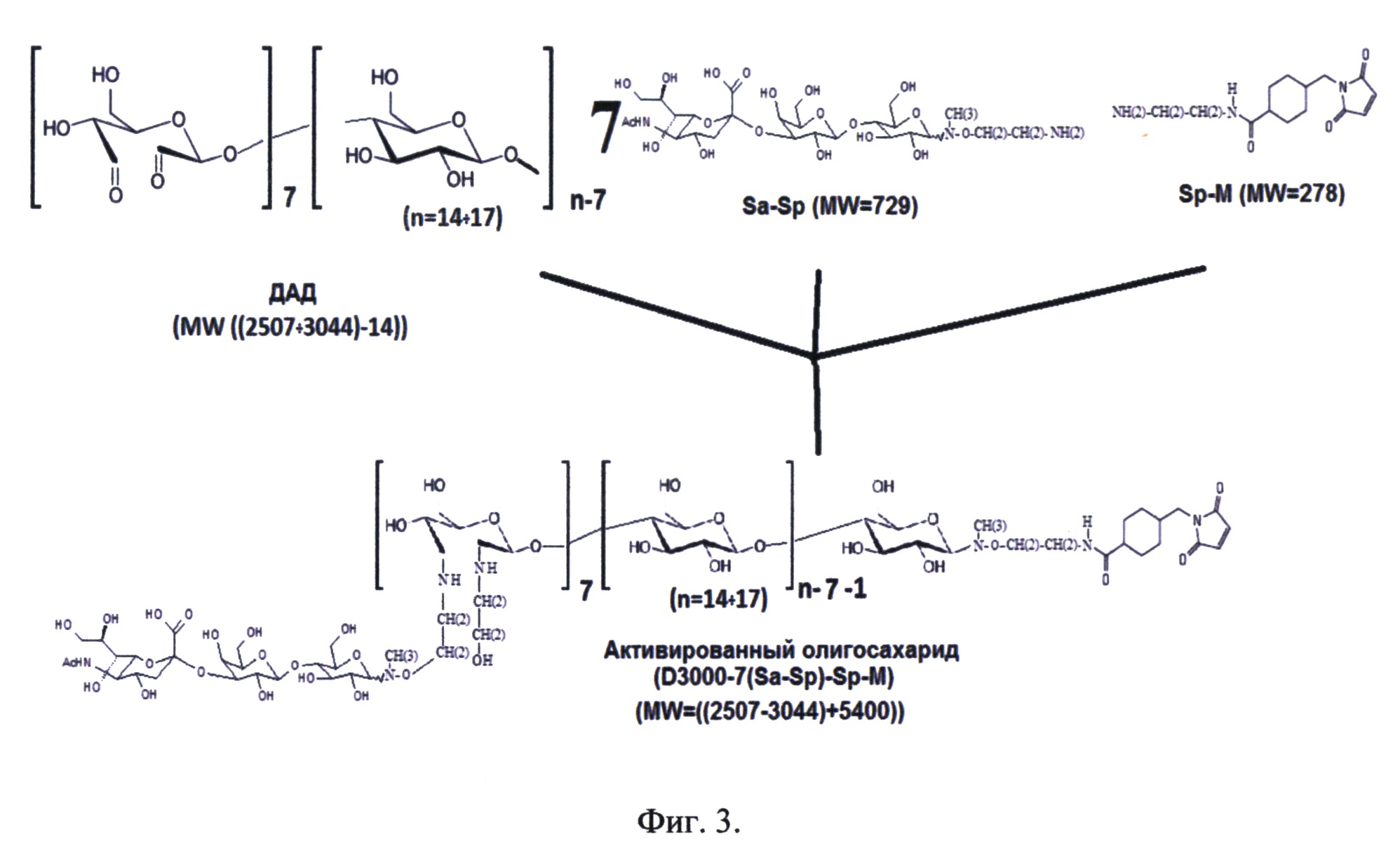
Фиг. 3. Схема синтеза активированного олигосахарида D3000-7(Sa-Sp)-Sp-M.
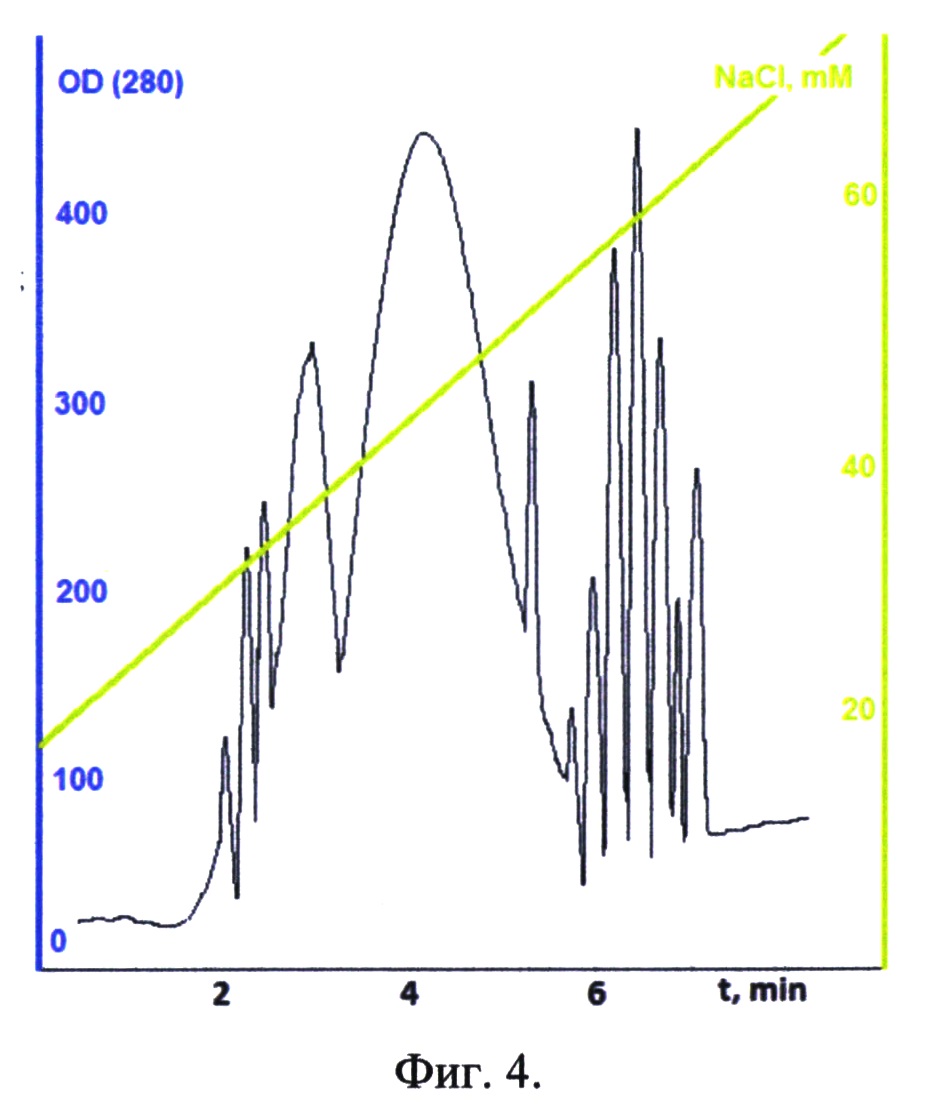
Фиг. 4. Хроматографический профиль элюции D3000-7(Sa-Sp)-Sp-M с препаративной колонки mono-Q.
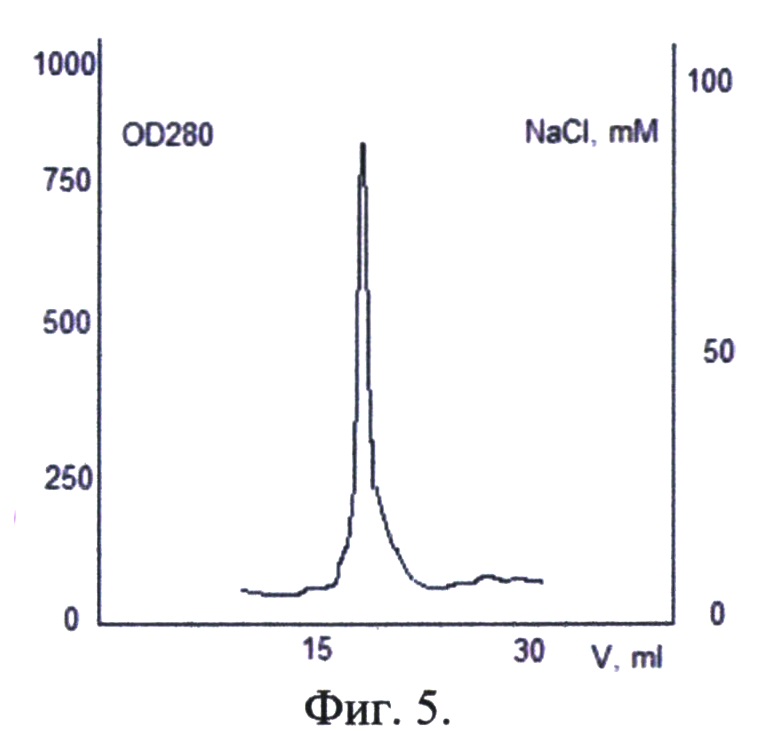
Фиг. 5. Хроматографический профиль элюции D3000-7(Sa-Sp)-Sp-M с аналитической колонки mono-Q.
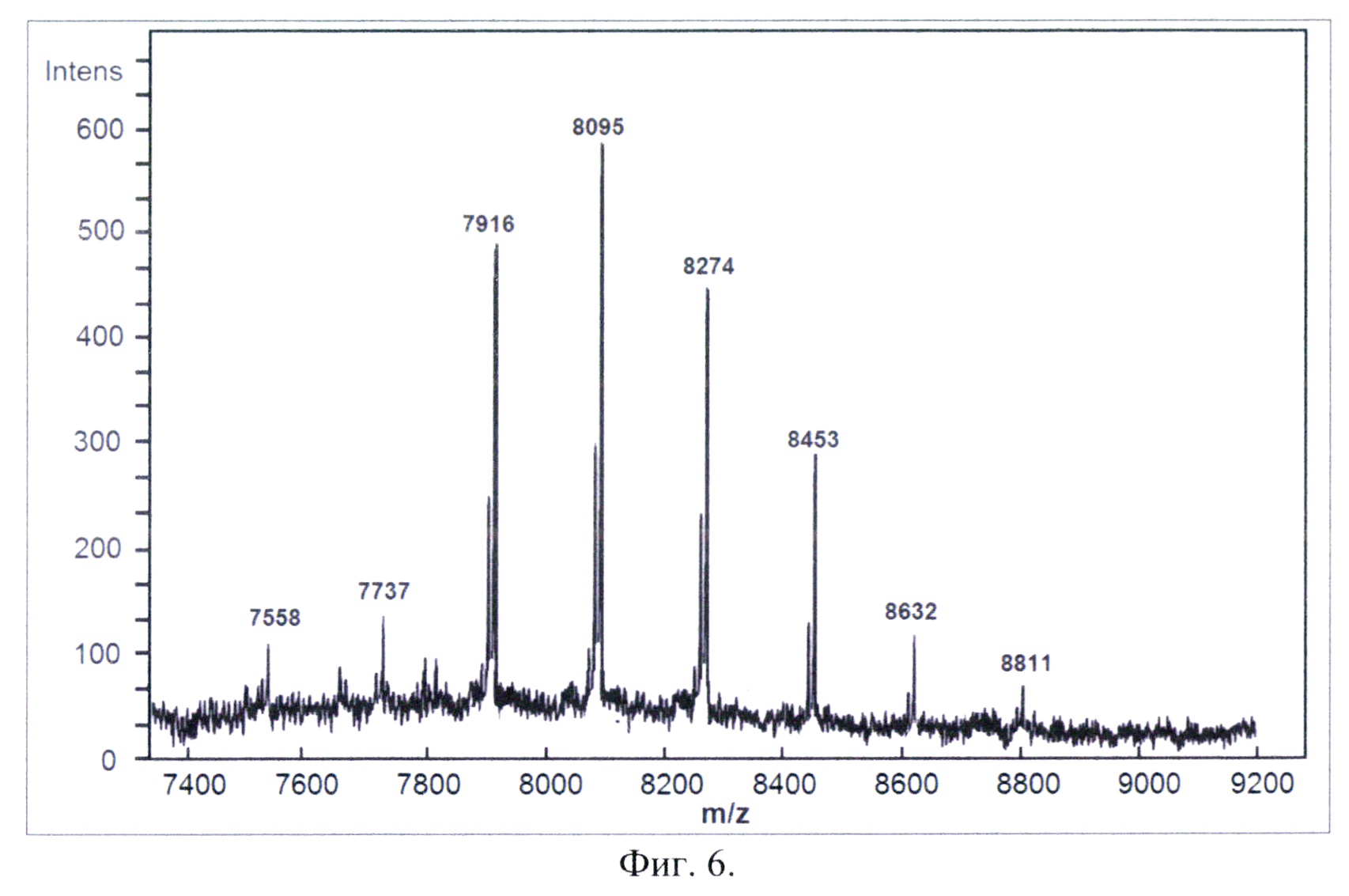
Фиг. 6. Масс-спектр MALD-TOF моноиона активированного олигосахарида. Матрица - 2,5-дигидроксибензойная кислота, лазер - 336 нм.
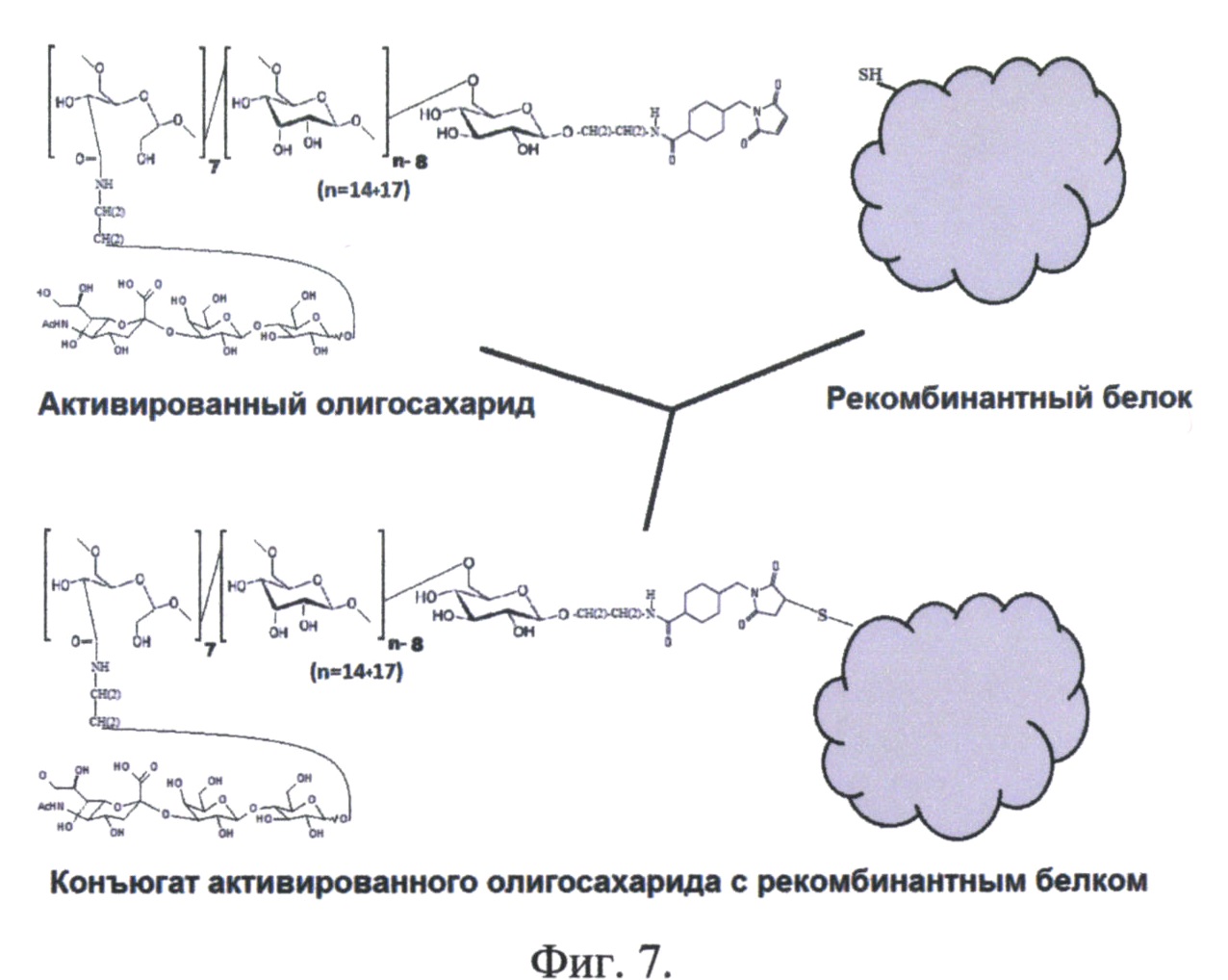
Фиг. 7. Химическая реакция конъюгации активированного олигосахарида и рекомбинантного белка.
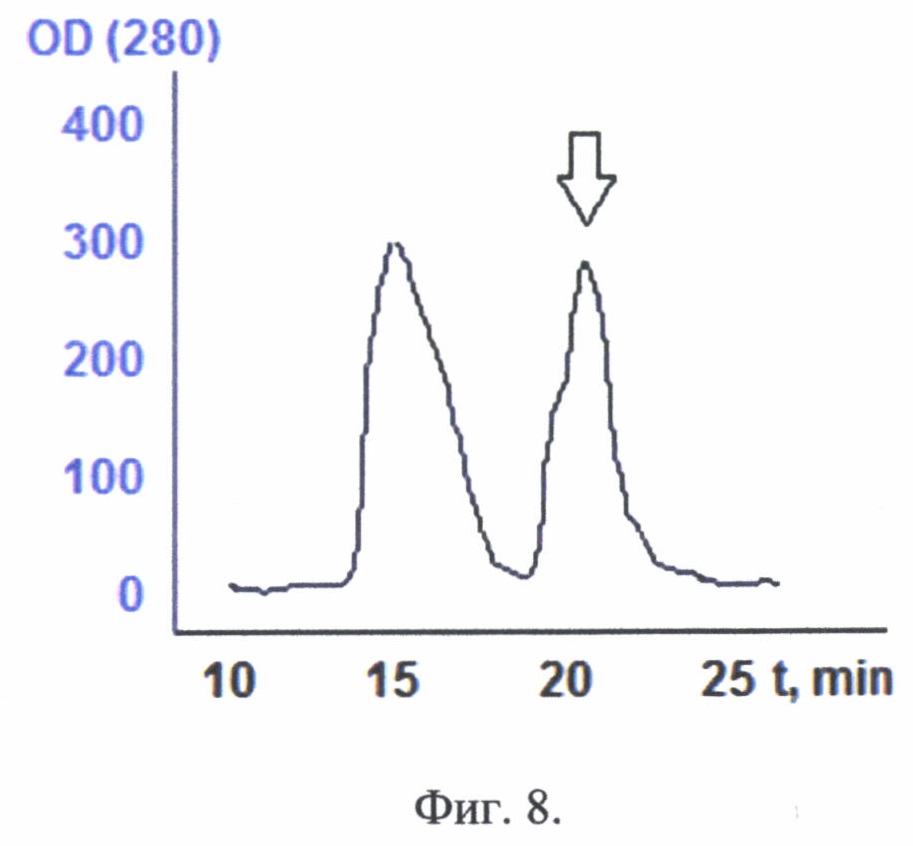
Фиг. 8. Хроматографический профиль гельфильтрации конъюгата через Sephacryl S400. Стрелкой отмечен выход конъюгата.
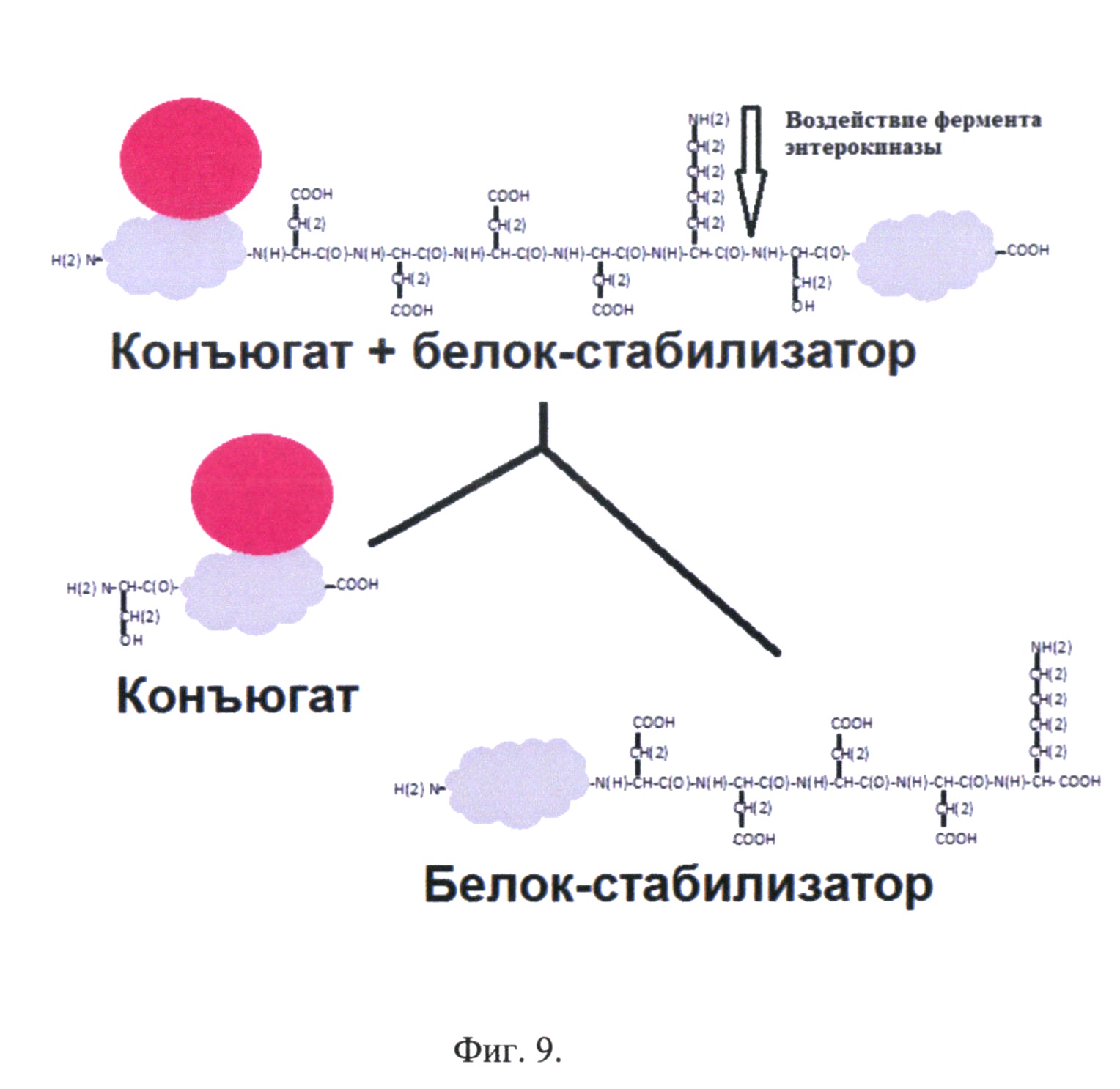
Фиг. 9. Гидролиз конъюгата рекомбинантного белка - аналога интерферона бета, соединенного с белком-стабилизатором с олигосахаридом ферментом энтерокиназой.
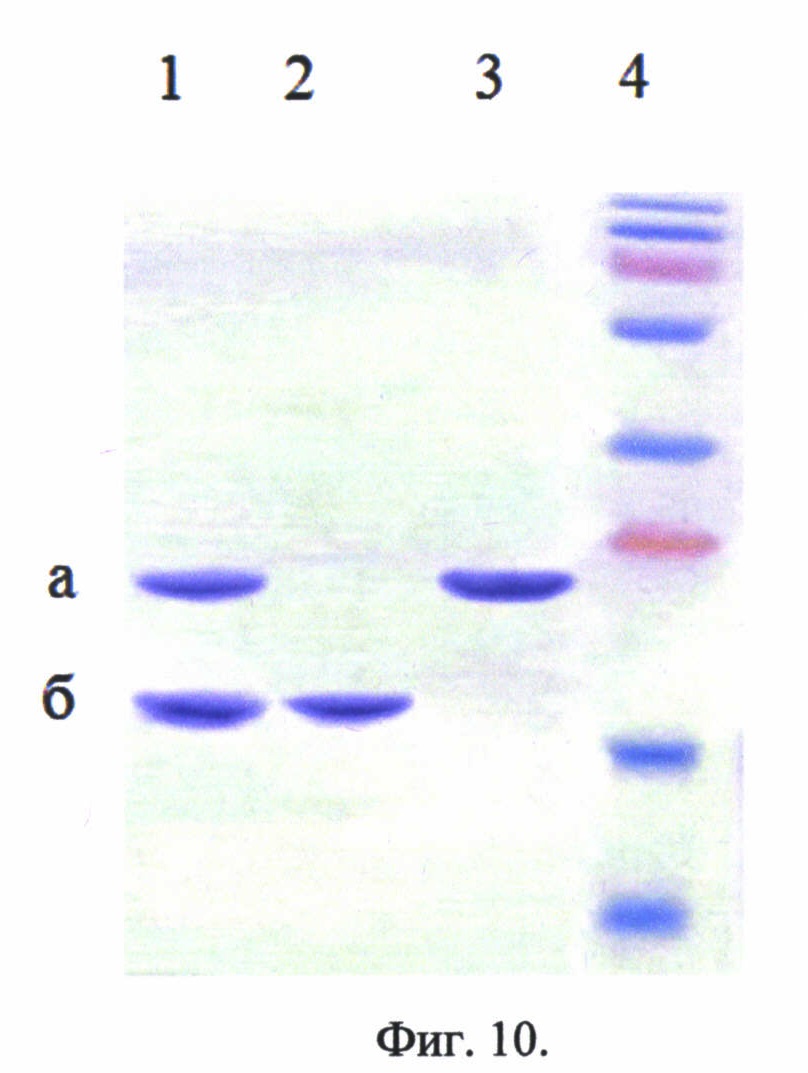
Фиг. 10. Электрофорез гидролизной смеси рекомбинантного белка - аналога интерферона бета, соединенного с белком-стабилизатором, и энтерокиназы в различные промежутки времени. Показана эффективность продолжительного гидролиза (60 минут). Трек 1 - реакционная смесь через полчаса после начала эксперимента (время Т=30 мин); трек 2 - реакционная смесь через час после начала эксперимента (время Т=60 мин); трек 3 - реакционная смесь в начале эксперимента (время Т=1 мин); трек 4 - стандарты молекулярных весов. Стрелками отмечены: положение в геле конъюгата, соединенного с белком-стабилизатором (а), чистого конъюгата (б).
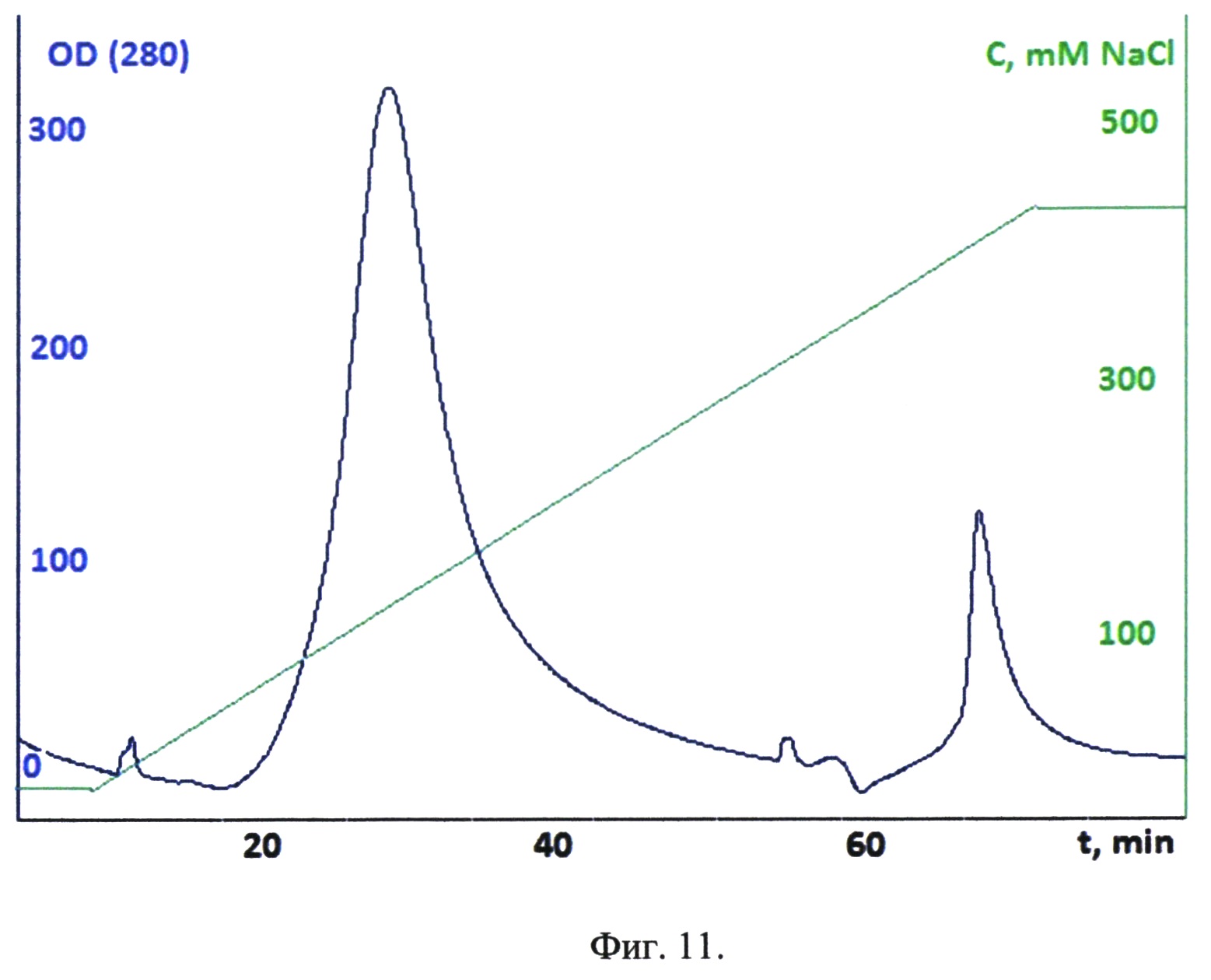
Фиг.11. Хроматографический профиль элюции рекомбинантного белка - аналога интерферона бета с SP-Sepharose.
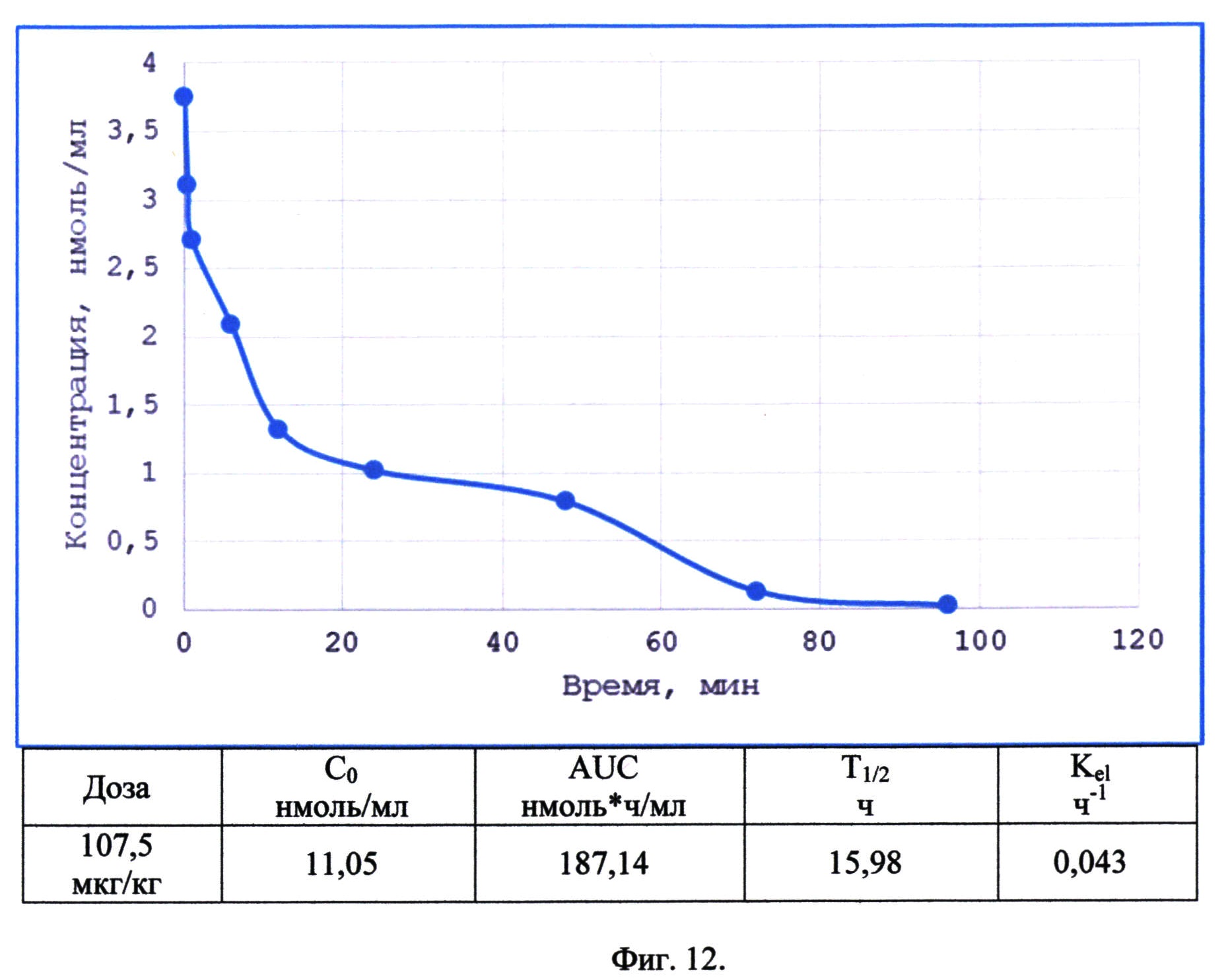
Фиг. 12. Динамика изменения концентрации рекомбинантного аналога интерферона бета 1b, конъюгированного с олигосахаридом, в сыворотке крыс после внутривенного введения в дозе 107,5 мкг/кг и параметры фармакокинетики.
Подробное описание изобретения
Пример 1. ПОЛУЧЕНИЕ РЕКОМБИНАТНОГО БЕЛКА - АНАЛОГА ИНТЕРФЕРОНА БЕТА
Для получения рекомбинантного белка, представленного последовательностью SEQ ID NO: 1, была создана генетическая конструкция по стандартной методике (Maniatis Т., Fritsch E.F., 1982) на основе коммерческой плазмиды рЕТ32а. Данной плазмидой трансфецировались клетки Е. coli штамма BL21(DE3). Полученной плазмидой рЕТ-32а/ИФН бета трансформируют компетентные бактериальные клетки штамма Е. coli BL21(DE3) для получения растворимой фракции белка. Штамм BL21(DE3) (Invitrogen) предназначен для экспрессии рекомбинантных белков. Обозначение DE3 означает, что штамм содержит лизоген фага λ DE3, который несет ген для Т7 РНК-полимеразы под контролем lacUV5-промотора. Для индукции экспрессии Т7 РНК-полимеразы необходим IPTG (изопропил-β-D-1-тиогалактопиранозид). Штамм Е. coli BL21(DE3)/рЕТ-32а/ИФН бета обеспечивает получение слитного белка тиоредоксин-интерферон бета. После трансфекции клетки пересевали в культуральную колбу с бульоном LB и канамицином 25 мкг/мл. Культура выращивалась на шейкере при 280 об/мин при температуре 37°С до достижения оптической плотности значения OD585=0,8E. Индукция экспрессии белка проводилась добавлением IPTG до концентрации 1 mM. Культура дополнительно культивировалась 4 часа, далее клетки осаждались центрифугированием при 5000g. Осадок клеток лизировали в 8 М мочевине и обрабатывали на ультразвуковом дезинтеграторе. Лизат клеток центрифугировали при 20000g 2 часа. Конструкция рЕТ-32а, несущая ген, кодирующая рекомбинантный белок ИФН-бета в клетках E. coli в виде слитного белка с белком-стабилизатором тиоредоксином, увеличивает уровень экспрессии и растворимость слитного белка.
На фиг. 1 представлена схема рекомбинантного белка - аналога интерферона бета, соединенного с белком-стабилизатором: 1 - последовательность аналога интерферона бета человека; 2 - сайт расщепления ферментом энтерокиназой; 3 - последовательность белка из семейства шаперонов, стабилизирующего всю рекомбинантную конструкцию; 4 - полигистидиновая последовательность.
Пример 2. ВЫДЕЛЕНИЕ И ОЧИСТКА РЕКОМБИНАНТНОГО БЕЛКА - АНАЛОГА ИНТЕРФЕРОНА БЕТА 1В, СОЕДИНЕННОГО С БЕЛКОМ-СТАБИЛИЗАТОРОМ
Хроматографическая очистка рекомбинантного белка - аналога интерферона бета, соединенного с белком-стабилизатором, проходит на металл-аффинном сорбенте. В качестве носителя использовалась Ni-Sepharose компании GE Helthcare. Данные колонки преднабиты, но их можно собирать в каскад за счет последовательного соединения. В хроматографической очистке рекомбинантного белка - аналога интерферона бета, соединенного с белком-стабилизатором, использовался каскад из пяти колонок HisPrep FF 16/10 (17-5256-01, GE Helthcare).
Весь объем лизата клеток прогонялся через каскад колонок с Ni-Sepharose, предварительно уравновешенных 10 mM уксусной кислотой. За счет полигистидиновой последовательности рекомбинантный белок сорбировался на носитель. Все иные компоненты клетки проходили через колонку. Наличие TRITON Х-100 в смеси позволяет избежать неспецифической сорбции ряда белков, имеющих отрицательный заряд, т.к. сорбент обладает и ионообменными свойствами.
Целевой белок элюируют линейным градиентом. Стартовый буфер: 10 mM уксусная кислота, финальный буфер: 200 mM уксусная кислота. Объем градиента 7500 мл. Элюат фракционировали. Наличие белка во фракции определяли электрофорезом в ПААГ. На фиг. 2 представлен хроматографический профиль элюции рекомбинантного белка - аналога интерферона бета, соединенного с белком-стабилизатором, с Ni-Sepharose. Цифрами 1-7 отмечены фракции, отобранные для анализа.
Пример 3. СИНТЕЗ, ОЧИСТКА И АНАЛИЗ АКТИВИРОВАННОГО ОЛИГОСАХАРИДА
Синтез активированного олигосахарида происходит в три стадии:
а) взаимодействие диальдегид декстрана (ДАД) с Neu5Ac-Lactose-N(CH)-CH(2)-CH(2)-NH(2) (Sa-Sp),
б) преобразование СООН-группы терминального остатка глюкозы декстранового кора в альдегидную группу СОН за счет обработки этаноламином,
в) введение малемидной группы в декстрановый кор олигосахарида за счет взаимодействия Малемид-СН(2)-СН(2)-NH(2) (Sp-M) с СОН-альдегидной группой терминального остатка глюкозы.
Реакция проходит посредством смешивания и инкубации растворов, содержащих ДАД, Neu5Ac-Lactose-N(CH)-CH(2)-CH(2)-NH(2) (Sa-Sp), Малемид-СН(2)-СН(2)-NH(2) (Sp-M) и этаноламин.
Растворы ДАД и Sa-Sp смешиваются и инкубируются при 24°С 2 часа, далее вносится раствор этаноламина, и смесь при той же температуре инкубируется при перемешивании 10 минут, затем вносится раствор Sp-M, и при перемешивании через 30 минут реакция синтеза активированного олигосахарида проходит до конца. Схема синтеза активированного олигосахарида D3000-7(Sa-Sp)-Sp-M представлена на фиг. 3.
В результате синтеза D3000-7(Sa-Sp)-Sp-M получается смесь олигосахаридов с различным количеством остатков сиаловых кислот на декстрановом коре. Для выделения продукта с нужной степенью замещения (семь сиаловых кислот) проводили ионообменную HPLC-хроматографию на колонке mono-Q. Элюировали линейным градиентом. Стартовый буфер: 5 mM NaCl, финальный буфер: 80 mM NaCl. Целевой продукт выходит в пределах концентраций NaCl от 38 mM до 50 mM. Для улучшения качества продукта «плечи» пика не отбирались. На фиг. 4 представлен хроматографический профиль элюции D3000-7(Sa-Sp)-Sp-M с препаративной колонки mono-Q.
Активированный олигосахарид D3000-7(Sa-Sp)-Sp-M анализировали методом HPLC-хроматографии на аналитической колонке mono-Q. D3000-7(Sa-Sp)-Sp-M разбавили в 10 раз 5 mM NaCl, нанесли на аналитическую колонку с mono-Q. Элюировали линейным градиентом. Стартовый буфер: 5 mM NaCl, финальный буфер: 100 mM NaCl. Целевой продукт вышел при концентрации NaCl 45 mM. На фиг. 5 представлен хроматографический профиль элюции D3000-7(Sa-Sp)-Sp-M с аналитической колонки mono-Q.
Пик симметричный, разделение на колонках данного типа происходит по величине заряда молекулы, что доказывает отсутствие в составе вещества молекул с иными зарядами, т.е. молекул с большим или меньшим количеством сиаловых групп.
Активированный олигосахарид D3000-7(Sa-Sp)-Sp-M анализировали методом масс-спектрометрии MALDI-TOF в режиме моноиона. Активированный олигосахарид в концентрации 0,1 мг/мл и объемом 5 мкл смешивали с матрицей и давали смеси высохнуть. Далее подвергали масс-спектрометрическому анализу и получали масс-спектр моноиона активированного олигосахарида.
На фиг. 6 представлен масс-спектр MALD-TOF моноиона активированного олигосахарида. Матрица - 2,5-дигидроксибензойная кислота, лазер - 336 нм. На масс-спектре видны четыре мажорных пика, а также четыре минорных. Минимальная масса мажорного пика 7916 Da, максимальная – 8453 Da. Минимальная масса минорного пика 7558 Da, максимальная – 8811 Da. От пика к пику масса изменяется на 179 Da, что соответствует массе молекулы глюкозы, лишенной протона (атома водорода). Наличие множества пиков связано с тем, что препарат Dextran3000 не является гомогенным препаратом и представляет собой смесь олигосахаридов.
Проанализировав полученные пики, можно подтвердить отсутствие дополнительных групп, несущих сиаловую кислоту (изменение массы на 729 Da (спейсер + Lactose-Neu5Ac), а также дополнительных малемидных групп (изменение массы на 232 Da) в составе активированного олигосахарида D3000-7(Sa-Sp)-Sp-M.
Пример 4. КОНЪЮГАЦИЯ ОЛИГОСАХАРИДА С РЕКОМБИНАНТНЫМ БЕЛКОМ - АНАЛОГОМ ИНТЕРФЕРОНА БЕТА 1В, СОЕДИНЕННЫМ С БЕЛКОМ-СТАБИЛИЗАТОРОМ
В процессе конъюгации происходит образование ковалентной связи между малеимидной группой активированного олигосахарида и -SH группой молекулы цистеина рекомбинантного аналога интерферона бета. Конъюгация проходит в присутствии 25 mM NaCl. На фиг. 7 представлена химическая реакция конъюгации активированного олигосахарида и рекомбинантного белка.
Активированный олигосахарид берется в избытке. Реакционная смесь инкубируется 8 часов, реакция проходит с выходом более 94%. Далее в реакционную смесь добавляется раствор дитиотриитола для восстановления иминов в молекуле активированного олигосахарида. После инкубации в течение 10 минут реакционную смесь наносили на гельфильтрационную колонку XK 50*100 (18-87-68 GE Healthcare) с Sephacryl S400 (17-0506-01 GE Helthcare), предварительно уравновешенную водой. На фиг. 8 представлен хроматографический профиль гельфильтрации конъюгата через Sephacryl S400. Стрелкой отмечен выход конъюгата.
Пример 5. РАСЩЕПЛЕНИЕ РЕКОМБИНАНТНОГО БЕЛКА - АНАЛОГА ИНТЕРФЕРОНА БЕТА 1В, СОЕДИНЕННОГО С БЕЛКОМ-СТАБИЛИЗАТОРОМ, И ВЫДЕЛЕНИЕ РЕКОМБИНАНТНОГО АНАЛОГА ИНТЕРФЕРОНА БЕТА 1В, КОНЪЮГИРОВАННОГО С ОЛИГОСАХАРИДОМ
Расщепление рекомбинантного белка - аналога интерферона бета 1b, соединенного с белком-стабилизатором, в составе конъюгата специфической протеазой и выделение рекомбинантного аналога интерферона бета 1b, конъюгированного с олигосахаридом.
Конъюгат активированного олигосахарида с рекомбинантным белком - аналогом интерферона бета 1b, соединенным с белком-стабилизатором, имеет в своем составе сайт расщепления ферментом энтерокиназой. Данный фермент позволяет расщепить белковый фрагмент «заподлицо». Т.е. после последовательности Asp-Asp-Asp-Asp-Lys фермент расщепляет белковую молекулу, что позволяет избежать появления дополнительных аминокислот в целевом белковом продукте, в нашем случае в молекуле рекомбинантного белка - аналога интерферона бета. На фиг. 9 представлен гидролиз конъюгата рекомбинантного белка - аналога интерферона бета, соединенного с белком-стабилизатором с олигосахаридом ферментом энтерокиназой.
Коммерческие наборы, содержащие фермент энтерокиназу, позволяют расщеплять одной единицей активности (1 unit) 20 микрограмм (μg) белка. Таким образом, количество расходуемого фермента энтерокиназа будет пропорционально молекулярной массе белковой молекулы. Т.к. снизить молекулярный вес рекомбинантного белка - аналога интерферона бета, соединенного с белком-стабилизатором, не представляется возможным, то длительное время гидролиза энтерокиназой за счет оборотистости фермента позволяет снизить его количество.
Был проведен предварительный эксперимент, показывающий эффективность гидролиза в зависимости от времени инкубации реакционной смеси. На фиг. 10 представлен электрофорез гидролизной смеси рекомбинантного белка - аналога интерферона бета, соединенного с белком-стабилизатором, и энтерокиназы в различные промежутки времени. Показана эффективность продолжительного гидролиза (60 минут). Трек 1 - реакционная смесь через полчаса после начала эксперимента (время Т=30 мин); трек 2 - реакционная смесь через час после начала эксперимента (время Т=60 мин); трек 3 - реакционная смесь в начале эксперимента (время Т=1 мин); трек 4 - стандарты молекулярных весов. Стрелками отмечены: положение в геле конъюгата, соединенного с белком-стабилизатором (а), чистого конъюгата (б).
Пример 6. ХРОМАТОГРАФИЧЕСКАЯ ОЧИСТКА РЕКОМБИНАНТНОГО АНАЛОГА ИНТЕРФЕРОНА БЕТА 1В, КОНЪЮГИРОВАННОГО С ОЛИГОСАХАРИДОМ
Хроматографическая очистка конъюгата рекомбинантного аналога интерферона бета 1b с олигосахаридом проходит в один этап на ионообменном сорбенте. В качестве носителя использовалась SP-Sepharose компании GE Helthcare. Для стандартизации процесса и его воспроизводимости использовались колонки типа HiTrap. В работе использовалась хроматографическая колонка HiPrep16/10 Q FF, емкости которой хватило на весь объем выделяемого белка.
Реакционная смесь после гидролиза и нагрева фильтруется через фильтр с порами 0,22 мкм от агрегатов денатурированных белков. Фильтрованная смесь наносится на колонку HiPrep16/10 Q FF, предварительно уравновешенную 25 mM NaCl.
Конъюгат элюировали линейным градиентом. Стартовый буфер: 25 mM NaCl, финальный буфер: 450 mM NaCl. Элюат фракционировали. Наличие конъюгата во фракции определяли электрофорезом в ПААГ. Хроматографический профиль элюции рекомбинантного белка - аналога интерферона бета с SP-Sepharose представлен на фиг. 11.
Пример 7. ИЗУЧЕНИЕ ФАРМАКОКИНЕТИКИ ПОЛУЧЕННОГО РЕКОМБИНАНТНОГО АНАЛОГА ИНТЕРФЕРОНА БЕТА 1В, КОНЪЮГИРОВАННОГО С ОЛИГОСАХАРИДОМ
Для исследования фармакокинетики полученный рекомбинантный аналог интерферона бета 1b, конъюгированного с олигосахаридом с одним 3Н замещенным атомом водорода, вводили внутривенно половозрелым крысам в дозе 107,5 мкг/кг с интервалами 2 мин, 30 мин, 60 мин, 4 ч, 12 ч, 24 ч, 36 ч, 96 ч. У крыс забирали 1 мл периферической крови и готовили не менее 300 мкл сыворотки. После пробоподготовки посредством добавления полуторакратного объема ацетонитрила количество 3Н замещенного препарата определяли при помощи сцинтилляционного детектора ядерных излучений.
На фиг. 12 показана динамика изменения концентрации рекомбинантного аналога интерферона бета 1b, конъюгированного с олигосахаридом, в сыворотке крыс после внутривенного введения в дозе 107,5 мкг/кг и параметры фармакокинетики. Максимальная концентрация компонентов рекомбинантного аналога интерферона бета 1b, конъюгированного с олигосахаридом, в крови выявлена сразу после введения препарата (через 2 мин), а через 96 часов после введения образец не детектировался в сыворотке крови. Период полувыведения для рекомбинантного аналога интерферона бета 1b, конъюгированного с олигосахаридом, составил около 16 ч, что в 3-5 раза превышает значения для нативных немодифицированных препаратов на основе интерферона бета (Jonasch Е., Haluska F.G. Interferon in Oncological Practice: Review of Interferon Biology, Clinical Applications, and Toxicities. The Oncologist February - 2001, Vol. 6, №1 - P. 34-55 doi: 10.1634/theoncologist.6-1-34).
Способ получения конъюгата рекомбинантного аналога интерферона бета 1b с полимером олигосахаридной природы, включающий получение рекомбинатного аналога интерферона бета 1b, оптимизированного для экспрессии в клетках Е. coli, представленного последовательностью SEQ ID NO: 1 и соединенного с белком-стабилизатором тиоредоксином через сайт расщепления энтерокиназой, хроматографическую очистку рекомбинантного аналога интерферона бета 1b, соединенного с белком-стабилизатором, на металл-аффинном сорбенте с применением Ni-Sepharose, конъюгацию рекомбинантного аналога интерферона бета 1b, соединенного с белком-стабилизатором, с полимером олигосахаридной природы D3000-7(Sa-Sp)-(Sp-M), в котором D3000 - диальдегид декстран, (Sa-Sp) - Neu5Ac-Lactose-N(CH)-CH(2)-CH(2)-NH(2), (Sp-M) - малеимид-CH(2)-NH(2), гидролиз рекомбинантного аналога интерферона бета 1b, соединенного с белком-стабилизатором, ферментом энтерокиназой, выделение конъюгата рекомбинантного аналога интерферона бета 1b с полимером олигосахаридной природы и очистку конъюгата рекомбинантного аналога интерферона бета 1b с полимером олигосахаридной природы на ионообменном сорбенте SP-Sepharose.