Результат интеллектуальной деятельности: СПОСОБ ОЧИСТКИ РЕКОМБИНАНТНОГО БЕЛКА ИНТЕРФЕРОНОПОДОБНОГО ФАКТОРА III ТИПА
Вид РИД
Изобретение
Изобретение относится к биотехнологии, а именно к технологии получения рекомбинантного белка интерфероноподобного фактора III типа (далее - ИПФ III), в частности к способу его очистки.
Известны способы очистки рекомбинантных интерферонов (далее - ИФН), основанные на выделении тел включения, их отмывки и рефолдинга целевого белка с последующими хроматографиями.
Известен способ получения рекомбинантного интерлейкина 29 (IL-29) в нерастворимой форме - в виде тел включения (патент US №7910313, 22.03.2011).
По сравнению с растворимой формой экспрессия белка в виде тел включения имеет ряд преимуществ: нерастворимые агрегаты белка не проявляют токсического действия, практически не атакуются протеазами, с высоким выходом выделяются центрифугированием. В то же время существуют проблемы низкого выхода активного, корректно сложенного белка после проведения рефолдинга и очистки IL-29, что определяется пространственной структурой последнего.
Известен способ очистки интерлейкина IL-29 и использованием детергента додецилсульфат натрия при его получении в нерастворимой форме (патент LIS №7485700, 03.02.2009). Однако при относительно низкой токсичности этого препарата использование додецилсульфата натрия в технологическом процессе сопряжено с целым рядом препятствий: это соединение вызывает значительную денатурацию целевого белка, его не удается удалить из раствора, что в свою очередь делает невозможной последующую ионообменную хроматографию, необходимую для дальнейшего процесса очистки IL-29.
Известен также способ очистки ИФН, позволяющий избежать указанных недостатков применением в качестве детергента γ-циклодекстрина, который не обладает денатурирующими свойствами, не образует ионных связей, является pH-независимым, может быть удален из раствора, делает возможной ионообменную хроматографию.
Наиболее близким, выбранным в качестве ближайшего аналога, к заявляемому является способ очистки интерлейкина IL-29 из тел включения с использованием аффинной хроматографии, катионно-обменной хроматографии и гельфильтрации (патент US №7968315, 28.06.2011).
Однако в этом способе не учитывается возможность использования обращенно-фазовой хроматографии для разделения изомеров с различной пространственной структурой и не охарактеризованы связанные с этим особенности его очистки.
Предлагаемое изобретение решает задачу оптимизации условий очистки ИПФ III на этапах отмывки и растворения тел включения, например, клеток E. coli BL(21)IPF3(7), продуцирующих рекомбинантный белок ИПФ III, в ходе технологического процесса рефолдинга целевого белка и очистки методами высокочувствительной белковой хроматографии (FPLC -Fast protein liquid chromatography) и высокоэффективной жидкостной хроматографии (HPLC-High performance liquid chromatography).
Заявляемый способ очистки рекомбинантного белка интерфероноподобного фактора III типа включает отмывку тел включения штамма-продуцента E. coli, происходящую в присутствии 2% водного раствора основного детергента γ-циклодекстрина, растворение тел включения в присутствии 2% водного раствора γ-циклодекстрина, 0,1 М сульфита калия и 0,01М тетратионата натрия, проведение металл-афинной хроматографии на Ni-Sepharose с элюцией линейным градиентом со стартовым буфером 2% γ-циклодекстрин, 6 М мочевина, 20 мМ Tris-HCl с pH 8.0, 10 мМ имидазол, и финальным буфером 2% γ-циклодекстрин, 6 М мочевина, 20 мМ Tris-HCl с pH 8.0, 400 мМ имидазол, с выходом целевого белка в диапазоне концентраций имидазола от 75 до 125 мМ, проведение диализа фракций, содержащих целевой белок против 6 М мочевины, 20 мМ Tris-HCl pH 8.0 и 2% γ-циклодекстрина, проведение анион-обменной хроматографии на Q-Sepharose с элюцией линейным градиентом, при этом стартовым буфером является 6 М мочевина, 20 мМ Tris-HCl с pH 8.0, 10 мМ NaCl, 2% γ-циклодекстрии, а финальным буфером является 6М мочевина, 20 мМ Tris-HCl с pH 8.0, 300 мМ NaCl, 2% γ-циклодекстрин, с выходом целевого белка в диапазоне концентраций NaCl от 115 до 125 мМ, проведение диализа фракций, содержащих целевой белок против 6М мочевины, 20 мМ Tris-HCl pH 8.0 и 2% γ-циклодекстрина, проведение катион-обменной хроматографии на SP- Sepharose с элюцией линейным градиентом со стартовым буфером 6М мочевина, 20 мМ Tris-HCl с pH 8.0, 10 мМ NaCl, 2% γ-циклодекстрин, и финальным буфером 6 М мочевина, 20 мМ Tris-HCl с pH 8.0, 300 мМ NaCl, 2% γ-циклодекстрин, с выходом целевого белка в диапазоне концентраций NaCl от 110 до 130 мМ, рефолдинга целевого белка при pH 10,5 добавлением смеси цистеамина и цистамина до конечных концентраций 1 мМ и 0,1 мМ, последующее проведение обращение - фазовой хроматографии на колонках Amberchrome Profile XT20 при pH 10,5 с элюцией линейным градиентом со стартовым буфером 10 мМ NaCl, 2% ацетонитрил, pH 10,5, и финальным буфером 10 мМ NaCl, 80% ацетонитрил, pH 10,5, с выходом целевого белка при концентрации ацетонитрила 54%, проведение диализа фракций, содержащих целевой белок против раствора 10 мМ NaCl, pH 10,5, проведение хроматографии на Amberchrome Profile HPR10 при pH 10,5 с элюцией линейным градиентом, при этом стартовым буфером является 10 мМ NaCl, 2% ацетонитрил, pH 10,5, а финальным буфером является 10 мМ NaCl, 80% ацетонитрил, pH 10,5, с выходом целевого белка при концентрации ацетонитрила 58%, проведение диализа фракций, содержащих целевой белок против раствора 100 мМ NaCl, добавление трифторуксусной кислоты до 0,1% и pH 1,0, проведение хроматографии на Kromasil 300-5C18 при pH 1,0 с элюцией линейным градиентом со стартовым буфером 0,1% трифторуксусная кислота, 2% ацетонитрил, и финальным буфером 0,1% трифторуксусная кислота, 80% ацетонитрил, с выходом целевого белка при концентрации ацетонитрила 35%.
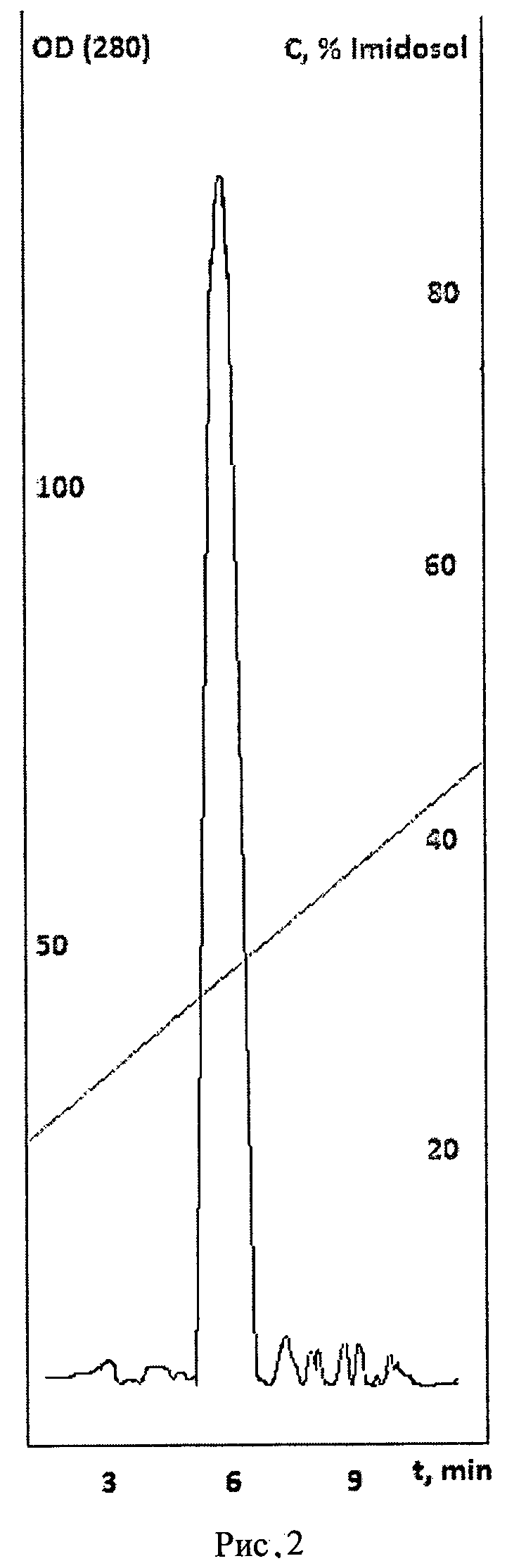
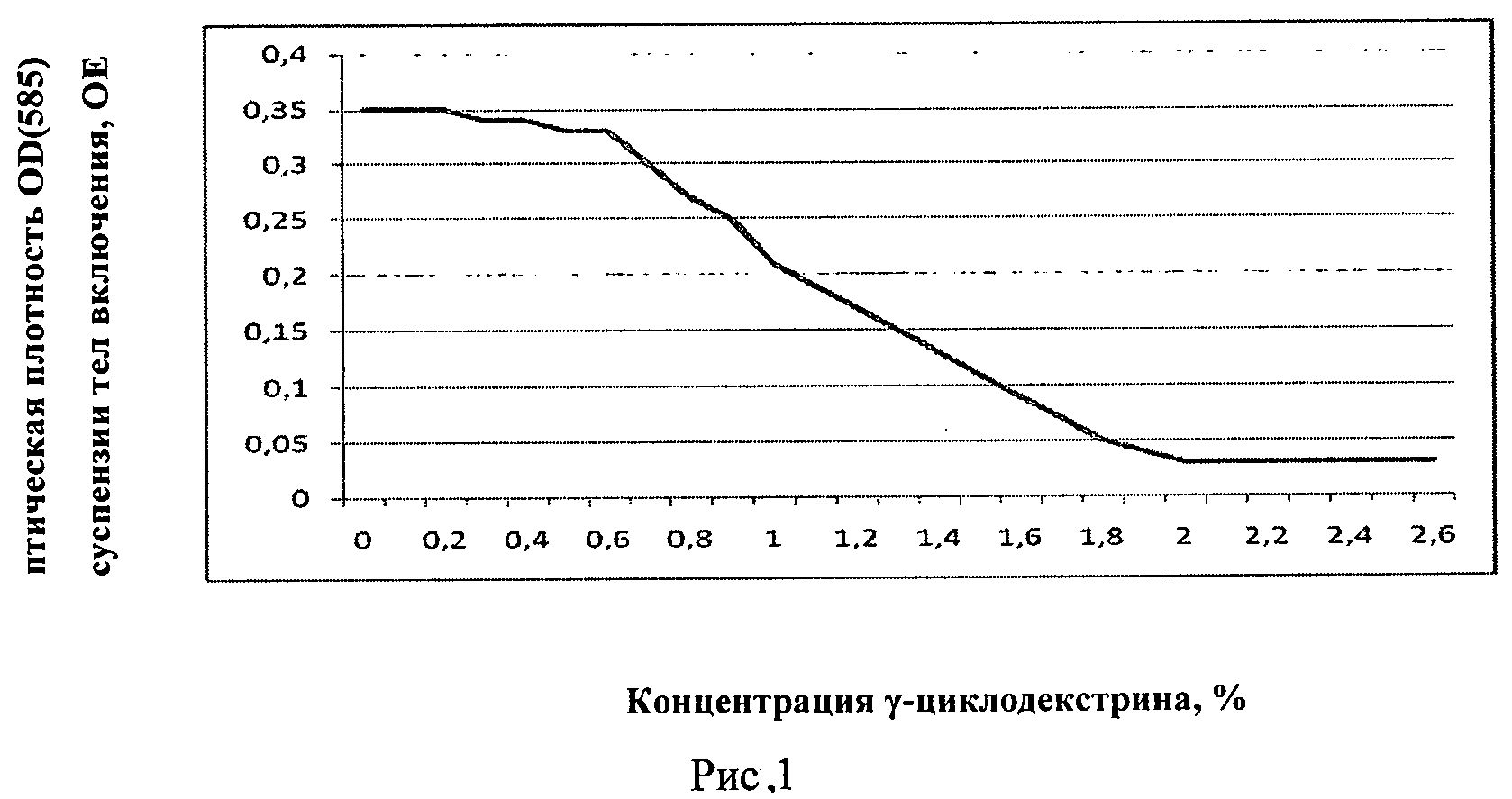
Заявляемое изобретение поясняется рисунками. На рисунке 1 представлено изменение оптической плотности OD (585) суспензии тел включения в 6М мочевине с 20 mM TrisHCl pH 8.0 в зависимости от повышения концентрации γ-циклодекстрина, на рисунке 2 - хроматографический профиль элюции рефолдированного рекомбинантного белка ИПФ III с аналитической колонки Kromasil 300-5C18, на рисунке 3 - электрофорез рефолдированного рекомбинантного белка ИПФ III после проведения всех этапов HPLC-хроматографической очистки, в котором трек 1 - стандарты молекулярных весов, трек 2 - рекомбинантный белок ИПФ III.
Заявляемый способ очистки рекомбинантного белка интерфероноподобного фактора III типа из тел включения Е. coli штамма-продуцента BL(21)IPF3(7) включает растворение и отмывку тел включения в растворе, содержащем 6 М мочевину, 20 мМ Tris HCl pH 8.0 и 2% γ-циклодекстрина с последующим удалением нерастворившегося материала центрифугированием, окисление целевого белка в растворе, содержащем 6 М мочевину, 20 мМ Tris HCl pH 8.0 и 2% γ-циклодекстрин с добавлением 0,1 М сульфита калия и 0,01 М тетратионата натрия, инкубацию 24 часа при температуре 20 C, разбавление смеси в пять раз, нанесение на колонку с Ni-Sepharose, уравновешенную раствором, содержащим 2% γ-циклодекстрин, 6 М мочевина, 20 мМ Tris-HCl pH 8,0, промывку раствором, содержащим 2% γ-циклодекстрин, 6 М мочевина, 20 мМ Tris-HCl pH 8,0, 0,005М NaCl, элюцию линейным градиентом со стартовым буфером 2% γ-циклодекстрин, 6 М мочевина, 20 мМ Tris-HCl с pH 8.0, 10 мМ имидазол, финальным буфером 2% γ-циклодекстрин, 6 М мочевина, 20 мМ Tris-HCl с pH 8.0, 400 мМ имидазол, с выходом целевого белка в диапазоне концентраций имидазола от 75 до 125 мМ, диализ фракций, содержащих целевой белок против 6 М мочевины, 20 мМ Tris-HCl pH 8.0 и 2% γ-циклодекстрина, нанесение на колонку с Q-Sepharose, предварительно уравновешенную 20 мМ Tris-HCl с pH 8.0, элюцию линейным градиентом со стартовым буфером 6 М мочевина, 20 мМ Tris-HCl с pH 8.0, 10 мМ NaCl, 2% γ-циклодекстрин, финальным буфером 6 М мочевина, 20 мМ Tris-HCl с pH 8.0, 300 мМ NaCl, 2% γ-циклодекстрин, с выходом целевого белка в диапазоне концентраций NaCl от 115 до 125 мМ, диализ фракций, содержащих целевой белок против 6 М мочевины, 20 мМ Tris-HCl pH 8.0 и 2% γ-циклодекстрина, нанесение на колонку с SP-Sepharose, предварительно уравновешенную 20 мМ Tris-HCl с pH 8.0, 2% γ-циклодекстрин, элюцию линейным градиентом со стартовым буфером 6 М мочевина, 20 мМ Tris-HCl с pH 8.0, 10 мМ NaCl, 2% γ-циклодекстрин, финальным буфером 6 М мочевина, 20 мМ Tris-HCl с pH 8.0, 300 мМ NaCl, 2% γ-циклодекстрин, с выходом целевого белка в диапазоне концентраций NaCl от 110 до 130 мМ, доведение pH белкового раствора 1М NaOH до pH 10,5, проведение рефолдинга добавлением смеси цистеамина и цистамина до конечных концентраций 1 мМ и 0,1 мМ соответственно, инкубация 24 часа при температуре 20°C, нанесение на колонку серии Amberchrome Profile XT 20, элюцию линейным градиентом со стартовым буфером 10 мМ NaCl, 2% ацетонитрил, pH 10,5, и финальным буфером 10 мМ NaCl, 80% ацетонитрил, pH 10,5, с выходом целевого белка при концентрации ацетонитрила 54%, диализ фракций, содержащих целевой белок против раствора 10 мМ NaCl, pH 10,5, нанесение на колонку серии Amberchrome Profile HPR 10, элюция линейным градиентом со стартовым буфером 10 мМ NaCl, 2% ацетонитрил, pH 10,5, и финальным буфером 10 мМ NaCl, 80% ацетонитрил, pH 10,5, с выходом целевого белка при концентрации ацетонитрила 58%, диализ фракций, содержащих целевой белок против раствора 100 мМ NaCl, добавление трифторуксусной кислоты до 0,1% с pH 1,0, нанесение на колонку серии Kromasil 300-5С18, элюцию линейным градиентом со стартовым буфером 0,1% трифторуксусная кислота, 2% ацетонитрил, и финальным буфером 0,1% трифторуксусная кислота, 80% ацетонитрил, с выходом целевого белка при концентрации ацетонитрила 35%.
При этом стартовый буфер: 10 мМ NaCl, 2% ацетонитрил, pH 10,5 доводили 1М NaOH, финальный буфер: 10 мМ NaCl, 80% ацетонитрил, pH 10,5 доводили 1М NaOH, содержащих целевой белок против раствора 10 мМ NaCl, pH 10,5 доводили 1М NaOH, нанесение на колонку серии Amberchrome Profile HPR 10, элюция линейным градиентом стартовый буфер: 10 мМ NaCl, 2% ацетонитрил, pH 10,5 доводили 1М NaOH, финальный буфер: 10 мМ NaCl, 80% ацетонитрил, pH 10,5 доводили 1 М NaOH.
Контроль выхода и активности рекомбинантного ИПФ III после очистки показал соответствие следующим критериям: выход 12%, мультимеры по гель-фильтрации <2%, родственные белки по обращенно-фазовой хроматографии <3%, родственные белки по электрофорезу в полиакриламидном геле в присутствии додецилсульфата натрия (ДСН-ПААГ) <5%, белки штамма-продуцента по иммуноферментному анализу (ИФА) <5 нг/мг, удельная активность ИПФ III соответствует стандартному препарату L-29 фирмы R&D на модели MDBK/VSV. Удельная активность стандартного препарата L-29 фирмы R&D на модели MDBK/VSV составляет ED50 0,2-1 млн units/mg (известно из сети Интернет http://www.rndsystems.com/Products/1598-IL.
Сочетанное использование обращенно-фазовой хроматографии на колонках с матрицей на основе полистирола/дивинилбензола, позволяющей осуществлять процесс очистки при pH 10,5 и обращенно-фазовой хроматографии на колонках с матрицей на основе сферического силикагеля, модифицированный C18-группами, позволяющей осуществлять процесс очистки при pH 1,0. Такое сочетание обращено-фазовой хроматографии при придельных значениях pH позволяет получить гомогенный препарат с фиксированной пространственной структурой.
Таким образом, предложенный способ очистки рекомбинантного белка ИПФ III (штамма-продуцента BL(21)IPF3(7)) предусматривает оптимизацию процессов отмывания тел включения, их растворения и рефолдинга целевого белка. Очистка рекомбинантного белка ИПФ III (штамма-продуцента BL(21)IPF3(7)) ведется с использованием в качестве основного детергента γ-циклодекстрина для отмывки и растворения тел включения E. coli. Далее проводят хроматографию на Ni-Sepharose, на Q-Sepharose и на SP-Sepharose с последующим рефолдингом белка ИПФ III. Далее проводят окисление с использованием смеси цистеамин/цистамин при pH 10,5, после чего проводят хроматографию на Amberchrome Profile XT20, хроматографию Amberchrome Profile HPR10 и хроматографию на Kromasil 300-5C18. Предложенный способ очистки позволяет обеспечить 12% выход целевого белка и получить рекомбинантный белок ИПФ III с удельной активностью, соответствующей стандартному препарату L-29 фирмы R&D на модели MDBK/VSV.
Заявляемое изобретение можно пояснить следующими примерами.
Пример 1. Трансформация штамма E. coli BL21(DE3) и получение тел включения
Компетентные клетки E. coli штамма BL21(DE3) размораживали на водяной бане, вносили 1,5 мкл раствора плазмиды, нагревали до 42C в течение 2 минут, затем, добавив 1 мл питательной среды LB, инкубировали 1 час при 37C. В результате трансформации получали штамм-продуцент Bl(21)IPF3(7). Трансформант, содержащий штамм-продуцент, переносили в 200 мл среды LB с добавление антибиотика канамицина в концентрации 25 мкг/мл и выращивали 4 часа на шейкере при 37C. Далее индуцировали раствором 0,5 мМ IPTG и инкубировали на шейкере еще 2 час при 37C. За это время клетки Е. coli нарабатывают рекомбинантный белок ИПФ III в телах включения. Клетки осаждали центрифугированием при 4000g в течение 10 минут и лизировали 200 мл раствора, содержащего лизин 2 мг/мл и ДНК-азу 1000 ED/мл в течение 30 минут при 37C. Далее смесь нагревали до 45C. Тела включения осаждали центрифугированием при 8000 g в течение 120 минут.
Пример 2. Трансформация штамма E. coli BLR(DE3) и получение тел включения
Компетентные клетки E. coli штамма BLR(DE3) размораживали на водяной бане, вносили 1,5 мкл раствора плазмиды, нагревали до 42C в течение 2 минут, затем, добавив 1 мл питательной среды ЕВ, инкубировали 1 час при 37C. Трансформант, содержащий штамм-продуцент, переносили в 200 мл среды ЕВ с добавление антибиотика канамицина в концентрации 25 мкг/мл и антибиотика тетрациклина 15 мкг/мл. Культуру наращивали 4 часа на шейкере при 37C. Далее индуцировали раствором 0,5 мМ IPTG и инкубировали на шейкере еще 2 час при 37C. За это время клетки Е. coli нарабатывают рекомбинантный белок ИПФ III в телах включения. Клетки осаждали центрифугированием при 4000 g в течение 10 минут и лизировали 200 мл раствора, содержащего лизин 2 мг/мл и ДНК-азу 1000 ED/мл в течение 30 минут при 37C. Далее смесь нагревали до 45C. Тела включения осаждали центрифугированием при 8000 g в течение 120 минут.
Пример 3. Трансформация штамма E. coli Origami 2 (DE3) и получение тел включения
Компетентные клетки E. coli штамма Origami 2 (DЕ3) размораживали на водяной бане, вносили 1,5 мкл раствора плазмиды, нагревали до 42C в течение 2 минут, затем, добавив 1 мл питательной среды LB, инкубировали 1 час при 37C. Трансформант, содержащий штамм-продуцент, переносили в 200 мл среды ЕВ с добавление антибиотиков канамицина в концентрации 25 мкг/мл, тетрациклина 15 мкг/мл и стрептомицина в концентрации 50 мкг/мл. Культуру наращивали 4 часа на шейкере при 37C. Далее индуцировали раствором 0,5 мМ IPTG и инкубировали на шейкере еще 2 час при 37C. За это время клетки Е. coli нарабатывают рекомбинантный белок ИПФ III в телах включения. Клетки осаждали центрифугированием при 4000 g в течение 10 минут и лизировали 200 мл раствора, содержащего лизин 2 мг/мл и ДНК-азу 1000 ED/мл в течение 30 минут при 37C. Далее смесь нагревали до 45C. Тела включения осаждали центрифугированием при 8000g в течение 120 минут.
Пример 4. Трансформация штамма E. coli Rosetta-gami 2(DE3) и получение тел включения
Компетентные клетки E. coli штамма Rosetta-gami 2(DE3) размораживали на водяной бане, вносили 1,5 мкл раствора плазмиды, нагревали до 42C в течение 2 минут, затем, добавив 1 мл питательной среды LB, инкубировали 1 час при 37C. Трансформант, содержащий штамм-продуцент, переносили в 200 мл среды LB с добавление антибиотиков канамицина в концентрации 25 мкг/мл, тетрациклина 15 мкг/мл, хлорамфеникола в концентрации 35 мкг/мл и стрептомицина в концентрации 50 мкг/мл. Культуру наращивали 4 часа на шейкере при 37C. Далее индуцировали раствором 0,5 мМ IPTG и инкубировали на шейкере еще 2 час при 37C. За это время клетки Е. coli нарабатывают рекомбинантный белок ИПФ III в телах включения. Клетки осаждали центрифугированием при 4000 g в течение 10 минут и лизировали 200 мл раствора, содержащего лизин 2 мг/мл и ДНК-азу 1000 ED/мл в течение 30 минут при 37C. Далее смесь нагревали до 45C. Тела включения осаждали центрифугированием при 8000 g в течение 120 минут.
Для осуществления предлагаемого изобретения были проведены следующие операции.
1. Растворение тел включения Е. coli BL(21)IPF3(7) с использованием γ-циклодекстрина
Тела включения ресуспензировали в 6М мочевине с 20 мМ Tris HCl pH 8.0, измеряли оптическую плотность данной суспензии на хроматографе при 585 нм, значение оптической плотности оказалось OD (585)=0,35OЕ. Суспензию тировали 20% раствором γ-циклодекстрина, измеряя оптическую плотность. В момент снижения оптической плотности в 10 раз, т.е. до значения OD (585)=0,03OE, концентрация γ-циклодекстрина была признана достаточной. Результаты отображены на рисунке 1. Оптимальной признана концентрация γ-циклодекстрина равная 2%.
2. Контроль эффективности способа очистки и рефолдинга рекомбинантного белка ИПФ III из тел включения E. coli BL(21)IPF3(7)
Раствор белка после очистки и рефолдинга диализовали против раствора 10 мМ NaCl и 0,1% трифторуксусной кислоты. Отбирали 150 мкл раствора и наносили на колонку Kromasil 300-5С18 4,6 мм ID × 150 мм. Проводили аналитическую хроматографию. Элюировали линейным градиентом. Стартовый буфер: 0,1% трифторуксусная кислота, 2% ацетонитрил, финальный буфер: 0,1% трифторуксусная кислота, 80% ацетонитрил. Белок выше при концентрации ацетонитрила 33%. Рефолдированный рекомбинантный белок ИПФ III диализовали против раствора 100 мМ NaCl. Чистоту белка так же определяли электрофорезом в ПААГ.
3. Хроматографическая очистка рекомбинантного белка ИПФ III на обращенно-фазовых сорбентах
Хроматографию проводили на колонке Amberchrome Profile XT20 22 мм ID × 250 мм. Реакционную смесь после рефодинга наносили на хроматографическую колонку. Элюировали линейным градиентом. Стартовый буфер: 10 мМ NaCl, 2% ацетонитрил, pH 10,5(доводили 1 М NaOH), финальный буфер: 10 мМ NaCl, 80% ацетонитрил, pH 10,5(доводили 1 М NaOH). Объем градиента 400 мл. Элюат фракционировали по показаниям хроматографа, собирая отдельные пики. Целевым является пик, сходящий при концентрации ацетонитрила 54%. Объем фракций, включивших в себя указанный пик, составил 92 мл. Фракции диализовали против раствора 10 мМ NaCl, pH 10,5 (доводили 1 М NaOH) и наносили на препаративную колонку Amberchrome Profile HPR10 22 мм ID × 250 мм. На колонке Amberchrome Profile HPR10 22 мм ID × 250 мм проводили хроматографию целевого пика, сошедшего с колонки Amberchrome Profile XT 20 22 мм ID × 250 мм. Элюировали линейным градиентом. Стартовый буфер: 10 мМ NaCl, 2% ацетонитрил, pH 10,5(доводили 1М NaOH), финальный буфер: 10 мМ NaCl, 80% ацетонитрил, pH 10,5(доводили 1 М NaOH). Объем градиента 400 мл. Целевым является пик, сходящий при концентрации ацетонитрила 58%. Объем фракций, включивших в себя указанный пик, составил 63 мл. Фракции диализовали против раствора 100 мМ NaCl, далее туда была добавляли трифторуксусную кислоту до 0,1%. Затем проба наносили на колонку Kromasil 300-5C18 21,2 мм ID × 250 мм. Элюировали линейным градиентом. Стартовый буфер: 0,1% трифторуксусная кислота, 2% ацетонитрил, финальный буфер: 0,1% трифторуксусная кислота, 80% ацетонитрил. Объем градиента 500 мл. Целевым является пик, сходящий при концентрации ацетонитрила 35%. Объем фракций, включивших в себя указанный пик, составил 59 мл.
4. Окисление и рефолдинг рекомбинантного белка ИПФ III.
В растворенные тела включения Е. coli BL(21)IPF3(7) в 6 М мочевине с 20 мМ Tris HCl pH 8.0 и 2% γ-циклодекстрином добавляли 0,1 М сульфита калия и 0.01М тетратионата натрия. Инкубировали 24 часа при температуре 20C°.
Раствор рекомбинантного белка ИПФ III в 6 М мочевине, 20 мМ Tris-HCl (pH 8.0), 300 мМ NaCl, 2% γ-циклодекстрине. Данный раствор доводим 1 М NaOH до pH 10,5 и добавляем смесь цистеамина/цистамина до конечной концентрации 1 мМ/0,1 мМ соответсвенно. Инкубируем 24 часа при температуре 20C°. Реакционную смесь наносим на колонку с обращеннофазовым сорбентом серии Amberchrome Profile XT 20.
5. Хроматографическая очистка рекомбинантного белка ИПФ III на Ni-Sepharose, Q-Sepharose и SP-Sepharose в присутствии 2% γ-циклодекстрина.
Раствор окисленных тел включения разбавляли в 5 раз 2% γ-циклодекстрином, 6 М мочевиной и 20 мМ Трис HCl pH 8,0. Центрифугировали в течении 120 минут при 17000 g. Супернатант наносили на колонку с Ni-Sepharose, предварительно уравновешенную раствором: 2% γ-циклодекстрин, 6 М мочевина, 20 мМ Tris-HCl pH 8,0. Промывали раствором: 2% γ-циклодекстрин, 6 М мочевина, 20 мМ Tris-HCl pH 8,0, 0,005М NaCl, для избавления от не связавшихся с сорбентом белками. Целевой белок элюировали линейным градиентом. Стартовый буфер: 2% γ-циклодекстрин, 6 М мочевина, 20 мМ Tris-HCl (pH 8.0), 10 мМ имидазол, финальный буфер: 2% γ-циклодекстрин, 6 М мочевина, 20 мМ Tris-HCl (pH 8.0), 400 мМ имидазол. Целевой белок выходит в диапазоне концентраций имидазола от 75 до 125 мМ. Фракции, содержащие целевой белок объединили и диализовали против 6 М мочевины, 20 мМ Tris-HCl pH 8.0 и 2% γ-циклодекстрина. На колонку с Q-Sepharose., предварительно уравновешенную 20 мМ Tris-HCl (pH 8.0) наносили полученный белковый раствор. Элюировали линейным градиентом. Стартовый буфер: 6 М мочевина, 20 мМ Tris-HCl (pH 8.0), 10 мМ NaCl, 2% γ-циклодекстрин, финальный буфер: 6 М мочевина, 20 мМ Tris-HCl (pH 8.0), 300 мМ NaCl, 2% γ-циклодекстрин. Целевой белок выходит в диапазоне концентраций NaCl от 115 до 125 мМ. Фракции, содержащие рекомбинантный белок ИПФ III объединили и диализовали против 6 М мочевины, 20 мМ Tris-HCl pH 8.0 и 2% γ-циклодекстрина.
На колонку с SP-Sepharose, предварительно уравновешенную 20 мМ Tris-HCl (pH 8.0), наносили полученный белковый раствор. Элюировали линейным градиентом. Стартовый буфер: 6 М мочевина, 20 мМ Tris-HCl (pH 8.0), 10 мМ NaCl, 2% γ-циклодекстрин, финальный буфер: 6 М мочевина, 20 мМ Tris-HCl (pH 8.0), 300 мМ NaCl, 2% γ-циклодекстрин. Целевой белок выходит в диапазоне концентраций NaCl от 110 до 130 мМ.
Способ очистки рекомбинантного белка интерфероноподобного фактора III типа, включающий отмывку тел включения штамма-продуцента E. coli, происходящую в присутствии 2% водного раствора основного детергента γ-циклодекстрина, растворение тел включения в присутствии 2% водного раствора γ-циклодекстрина, 0,1 М сульфита калия и 0,01 М тетратионата натрия, проведение металл-афинной хроматографии на Ni-Sepharose с элюцией линейным градиентом со стартовым буфером: 2% γ-циклодекстрин, 6 М мочевина, 20 мМ Tris-HCl с рН 8,0, 10 мМ имидазол, и финальным буфером: 2% γ-циклодекстрин, 6 М мочевина, 20 мМ Tris-HCl с рН 8,0, 400 мМ имидазол, с выходом целевого белка в диапазоне концентраций имидазола от 75 до 125 мМ, проведение диализа фракций, содержащих целевой белок, против 6 М мочевины, 20 мМ Tris-HCl рН 8,0 и 2% γ-циклодекстрина, проведение анионобменной хроматографии на Q-Sepharose с элюцией линейным градиентом, при этом стартовым буфером является 6 М мочевина, 20 мМ Tris-HCl с рН 8,0, 10 мМ NaCl, 2% γ-циклодекстрин, а финальным буфером является 6 М мочевина, 20 мМ Tris-HCl с рН 8,0, 300 мМ NaCl, 2% γ-циклодекстрин, с выходом целевого белка в диапазоне концентраций NaCl от 115 до 125 мМ, проведение диализа фракций, содержащих целевой белок, против 6 М мочевины, 20 мМ Tris-HCl рН 8,0 и 2% γ-циклодекстрина, проведение катионобменной хроматографии на SP-Sepharose с элюцией линейным градиентом со стартовым буфером: 6 М мочевина, 20 мМ Tris-HCl с рН 8,0, 10 мМ NaCl, 2% γ-циклодекстрин, и финальным буфером: 6 М мочевина, 20 мМ Tris-HCl с рН 8,0, 300 мМ NaCl, 2% γ-циклодекстрин, с выходом целевого белка в диапазоне концентраций NaCl от 110 до 130 мМ, рефолдинга целевого белка при рН 10,5 добавлением смеси цистеамина и цистамина до конечных концентраций 1 мМ и 0,1 мМ, последующее проведение обращенно-фазовой хроматографии на колонках Amberchrome Profile ХТ20 при рН 10,5 с элюцией линейным градиентом со стартовым буфером: 10 мМ NaCl, 2% ацетонитрил, рН 10,5, и финальным буфером: 10 мМ NaCl, 80% ацетонитрил, рН 10,5, с выходом целевого белка при концентрации ацетонитрила 54%, проведение диализа фракций, содержащих целевой белок, против раствора 10 мМ NaCl, рН 10,5, проведение хроматографии на Amberchrome Profile HPR10 при рН 10,5 с элюцией линейным градиентом, при этом стартовым буфером является 10 мМ NaCl, 2% ацетонитрил, рН 10,5, а финальным буфером является 10 мМ NaCl, 80% ацетонитрил, рН 10,5, с выходом целевого белка при концентрации ацетонитрила 58%, проведение диализа фракций, содержащих целевой белок, против раствора 100 мМ NaCl, добавление трифторуксусной кислоты до 0,1% и рН 1,0, проведение хроматографии на Kromasil 300-5С18 при рН 1,0 с элюцией линейным градиентом со стартовым буфером: 0,1% трифторуксусная кислота, 2% ацетонитрил, и финальным буфером: 0,1% трифторуксусная кислота, 80% ацетонитрил, с выходом целевого белка при концентрации ацетонитрила 35%.