Результат интеллектуальной деятельности: Способ очистки лекарственного средства пролонгированного действия на основе рекомбинантного аналога интерферона альфа-17 для лечения вирусного гепатита С
Вид РИД
Изобретение
Изобретение относится к области биотехнологии, а именно к способу очистки рекомбинантного белка аналога интерферона альфа-17, для получения фармацевтической субстанции для лечения вирусного гепатита С.
Интерфероны представляют собой противовирусные и иммуномодулирующие белки, являющиеся частью защиты от вирусов, бактерий и других чужеродных агентов.
Они взаимодействуют с клетками, связывая специфические рецепторы на их поверхности. Выделяют три субкласса интерферонов, обозначаемых как альфа, бета и гамма. В настоящее время интерферон альфа используется в лечении хронических гепатитов С и В. Противовирусное и иммуномодулирующее действие интерферонов альфа играет важную роль в элиминации HCV. В настоящее время одним из широко используемых интерферонов альфа для лечения вирусных гепатитов является ИФН альфа-17.
При экспрессии ИНФ в клетках Е. coli, возникает проблема дополнительной очистки препарата от нерастворимых агрегатов, называемых тельцами включения. Тельца включения, как правило, представляют собой неправильно уложенные и, вследствие этого, биологически неактивные белки. В ходе изучения уровня техник был найден ряд патентов: US 4765903, US 4511502, RU 2123010, US 4845032, ЕР 1310559 и ЕР 1990349, в которых предлагаются методы дополнительной очистки от телец включения путем очистки методом ВЭЖХ на различных колонках.
Ближайшим аналогом изобретения является патент US 4512922, в котором описывается способ очистки от телец включения и низкомолекулярных примесей путем диализа реакционной смеси после сульфитолиза против раствора слабого детергента. Описанный способ очистки ИФН альфа дает возможность после двухступенчатой очистки белка в нативных условиях в том числе получить гомогенный препарат из тел включения с удельной противовирусной активностью не менее 1,7 * 108 МЕ/мг, не содержащий примесных белков (не более 0,2 нг/мкг) с выходом 9 мг из 1 г биомассы.
Недостатками способа является его относительная невысокая производительность, неустойчивость продуцента в процессе ферментации, и как следствие, нестабильность выхода интерферона.
Задачей изобретения является повышение степени очистки рекомбинантного белка - аналога интерферона альфа-17, оптимизированного для экспрессии в клетках Е. coli, которая представлена последовательностью SEQ ID NO 1.
Для этого:
- Проведена одностадийная хроматографическая очистка рекомбинантного белка из лизата клеток на металло-аффинном сорбенте.
- Подобраны условия гидролиза рекомбинантного белка ферментом энтерокиназой-F в течение одного часа при 37°С и денатурации нагревом примесей при 64°С в течение 60 мин, позволяющих значительно обогатить целевой продукт.
- Проведена одноэтапная FPLC очистки рекомбинантного белка на ионообменном FPLC сорбенте.
- Проведена обратнофазовая HPLC хроматографическая очистка рекомбинантного белка с колонки Superdex 75.
Краткое описание чертежей.
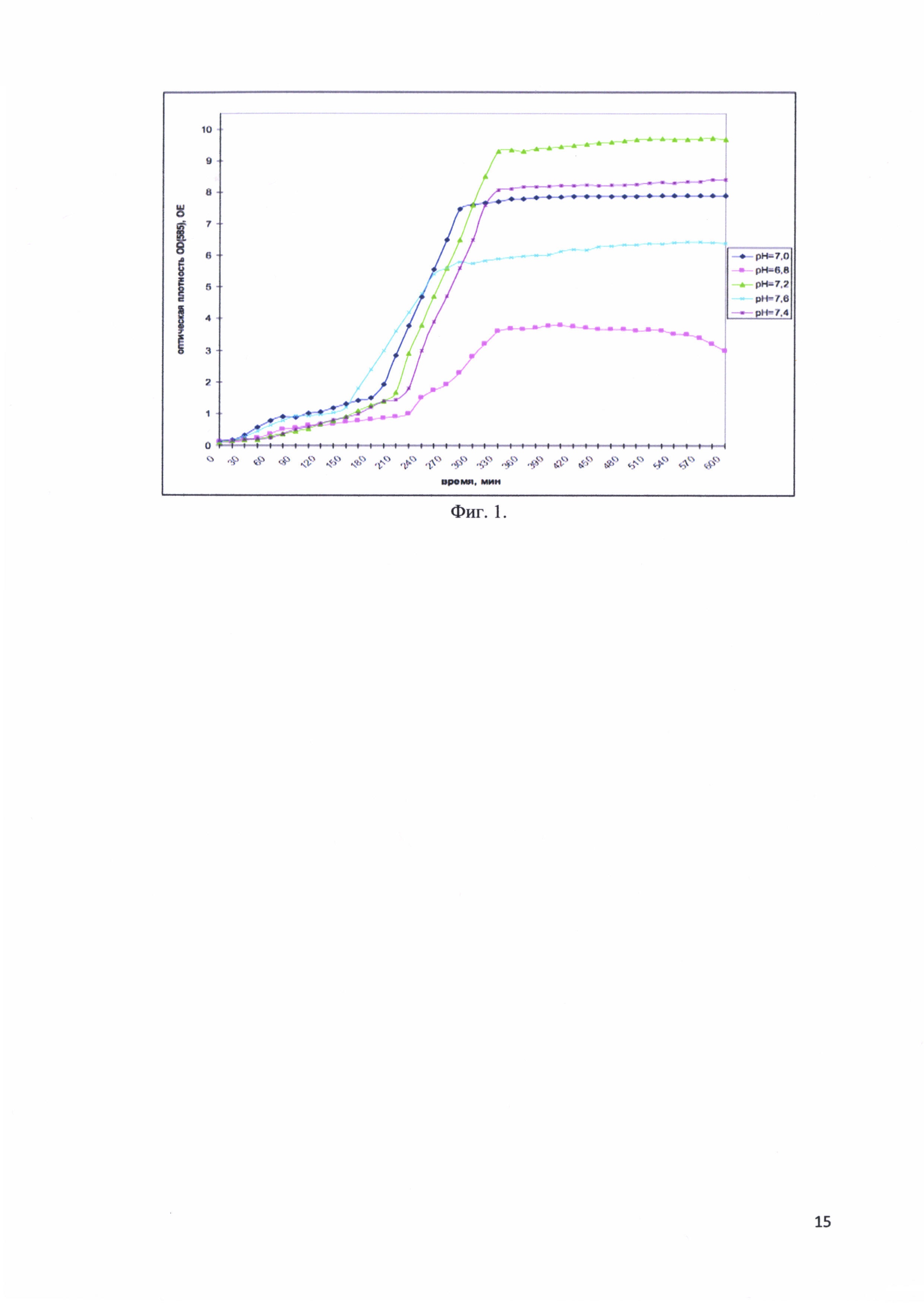
Фиг. 1. Изменение оптической плотности OD(585) культуральной среды во время ферментативной наработки рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором в зависимости от pH.
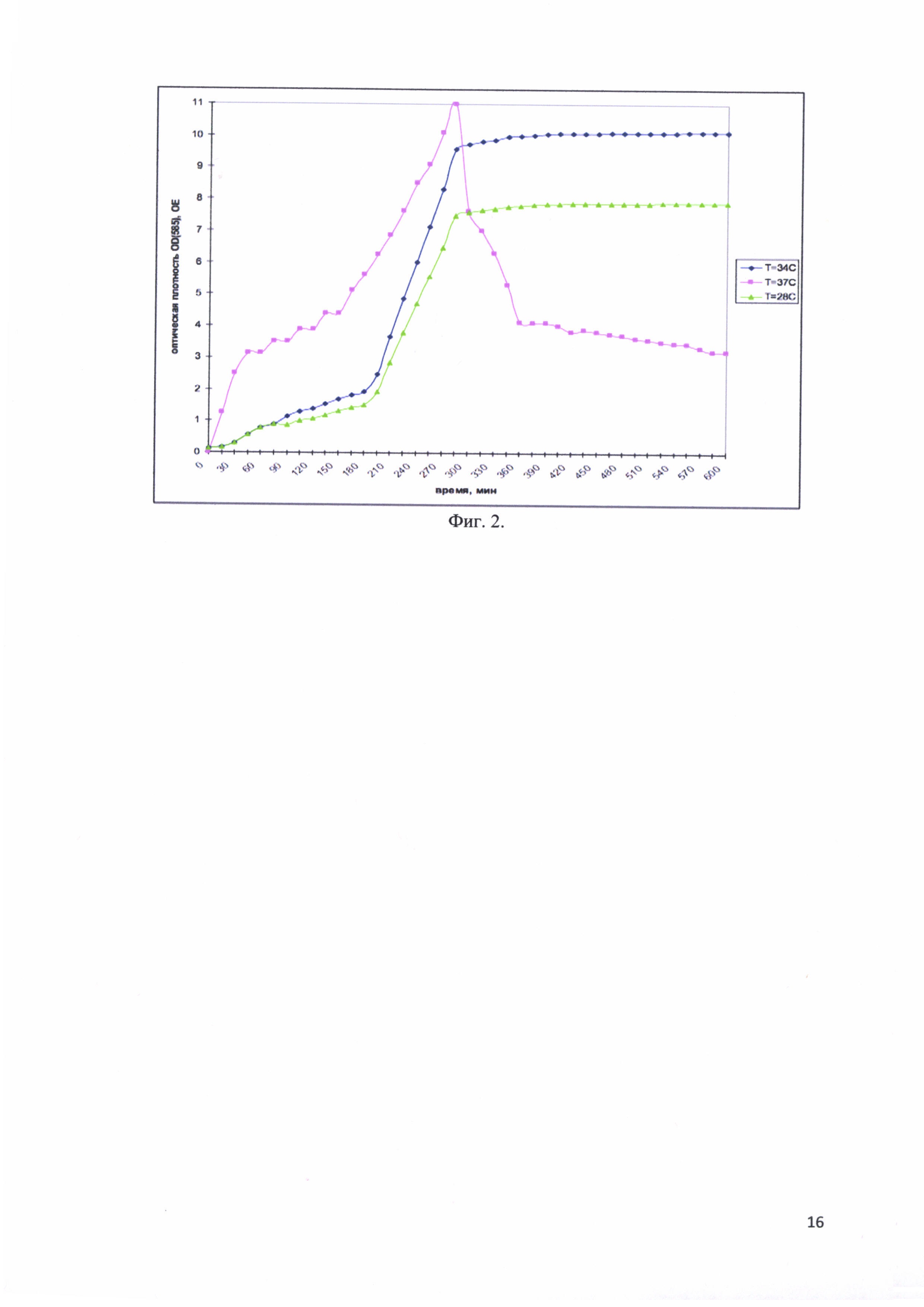
Фиг. 2. Изменение оптической плотности OD(585) культуральной среды во время ферментативной наработки рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором в зависимости от температуры Т°С.
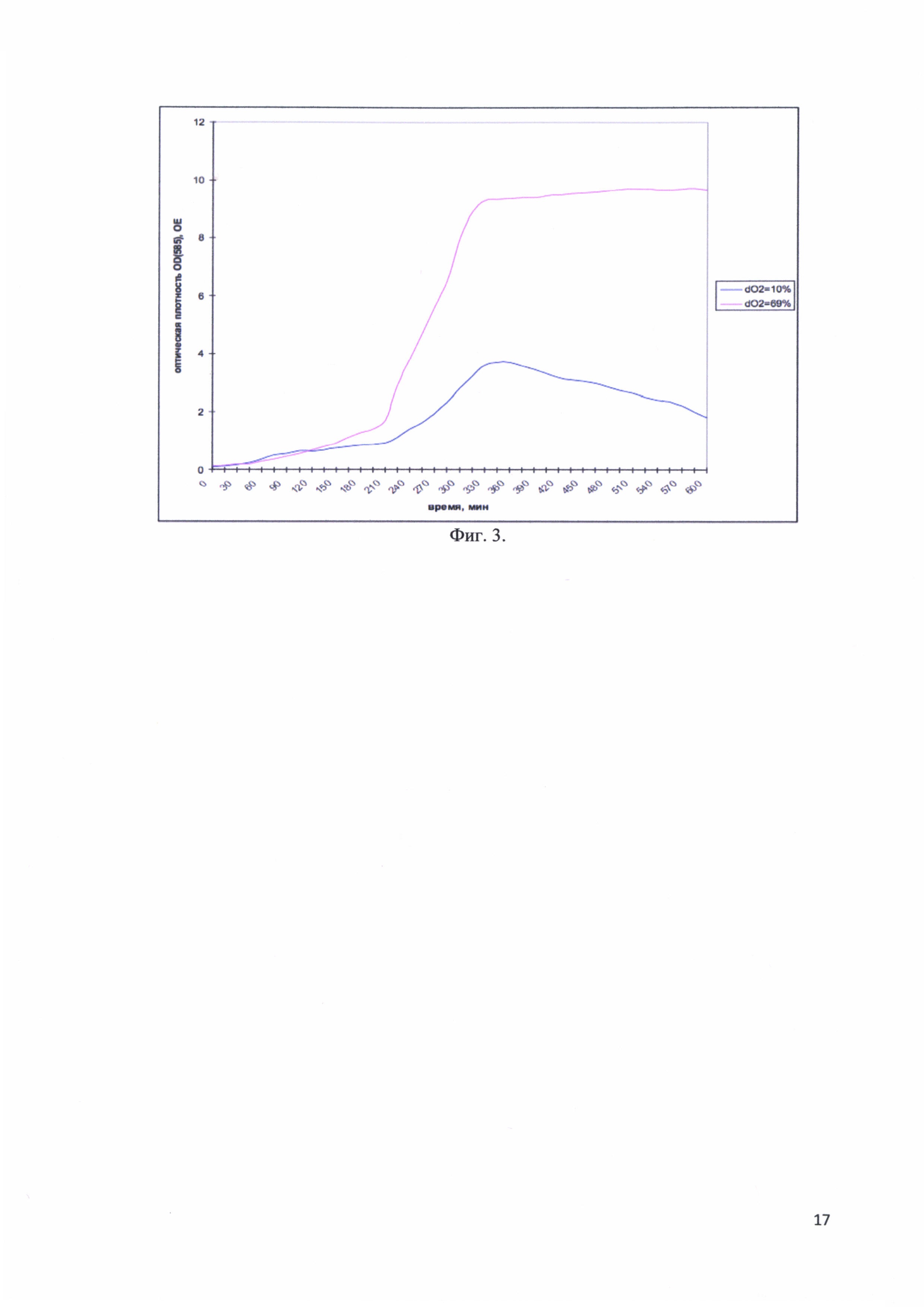
Фиг. 3. Изменение оптической плотности OD(585) культуральной среды во время ферментативной наработки рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором в зависимости от насыщаемости раствора кислородом.
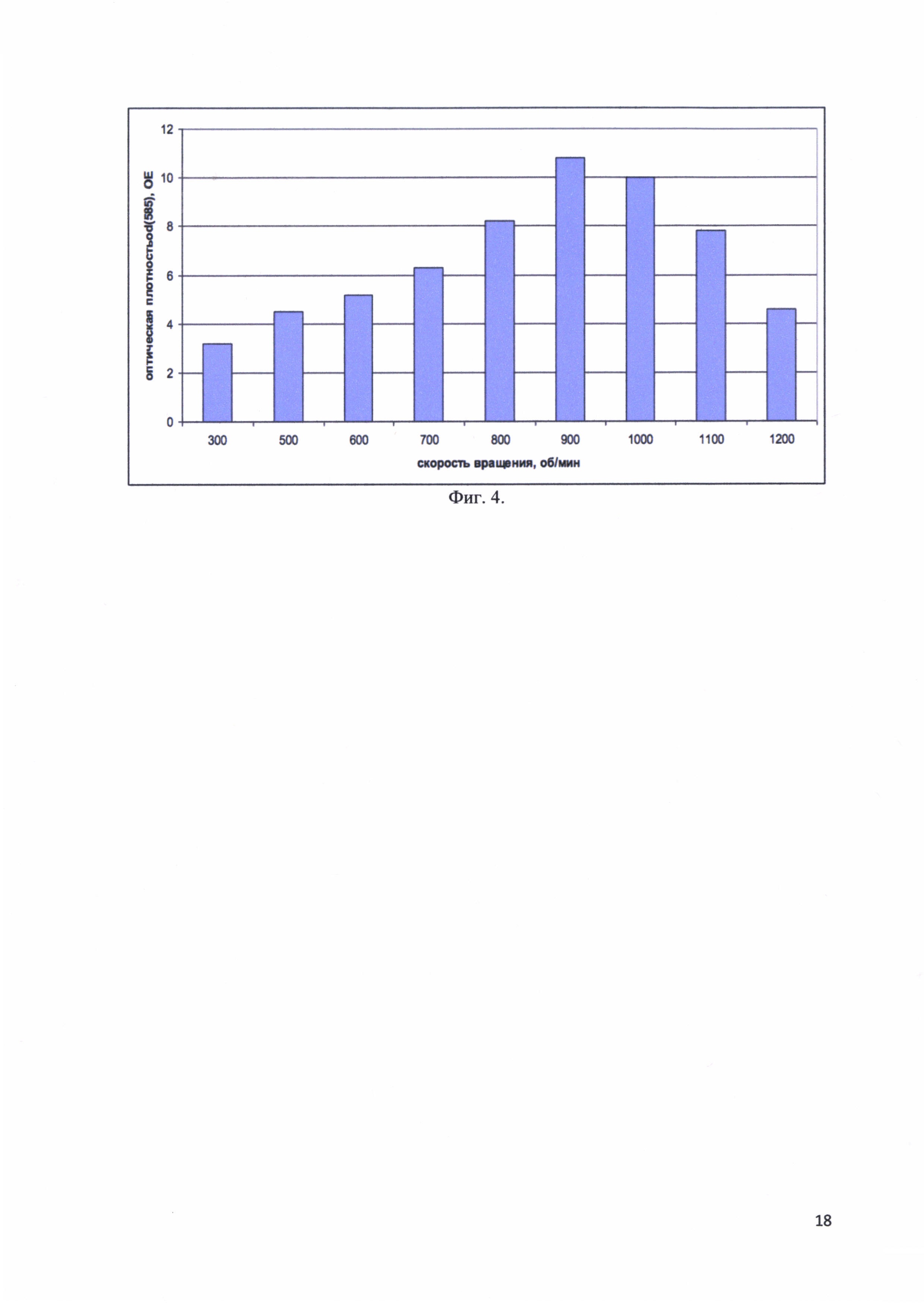
Фиг. 4. Максимальные значения оптической плотности OD(585) культуральной среды после 10 часовой ферментации в зависимости от скорости вращения шейкера.
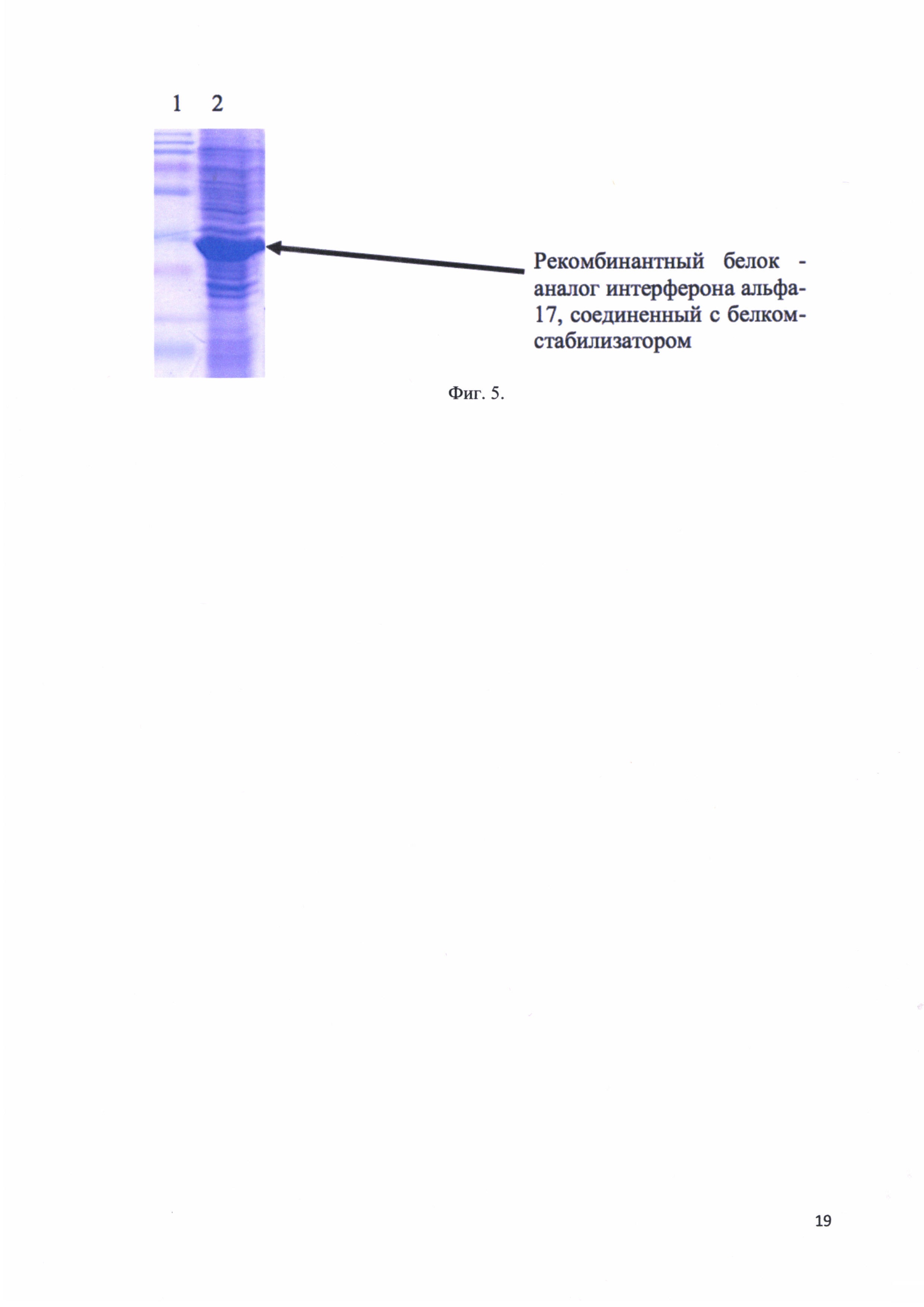
Фиг. 5. Электрофорез лизата клеток, экспрессировавших рекомбинантный белок -аналог интерферона альфа-17, соединенный с белком-стабилизатором: трек 1 - стандарты молекулярных весов; трек 2 - лизат клеток. Стрелкой отмечено положение рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором в геле.
Фиг. 6. Схема рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором. 1 - последовательность аналога интерферона альфа-17 человека; 2 - сайт расщепления ферментом энтерокиназой; 3 - последовательность белка из семейства шаперонов, стабилизирующего всю рекомбинантную конструкцию; 4 - полигистидиновая последовательность.
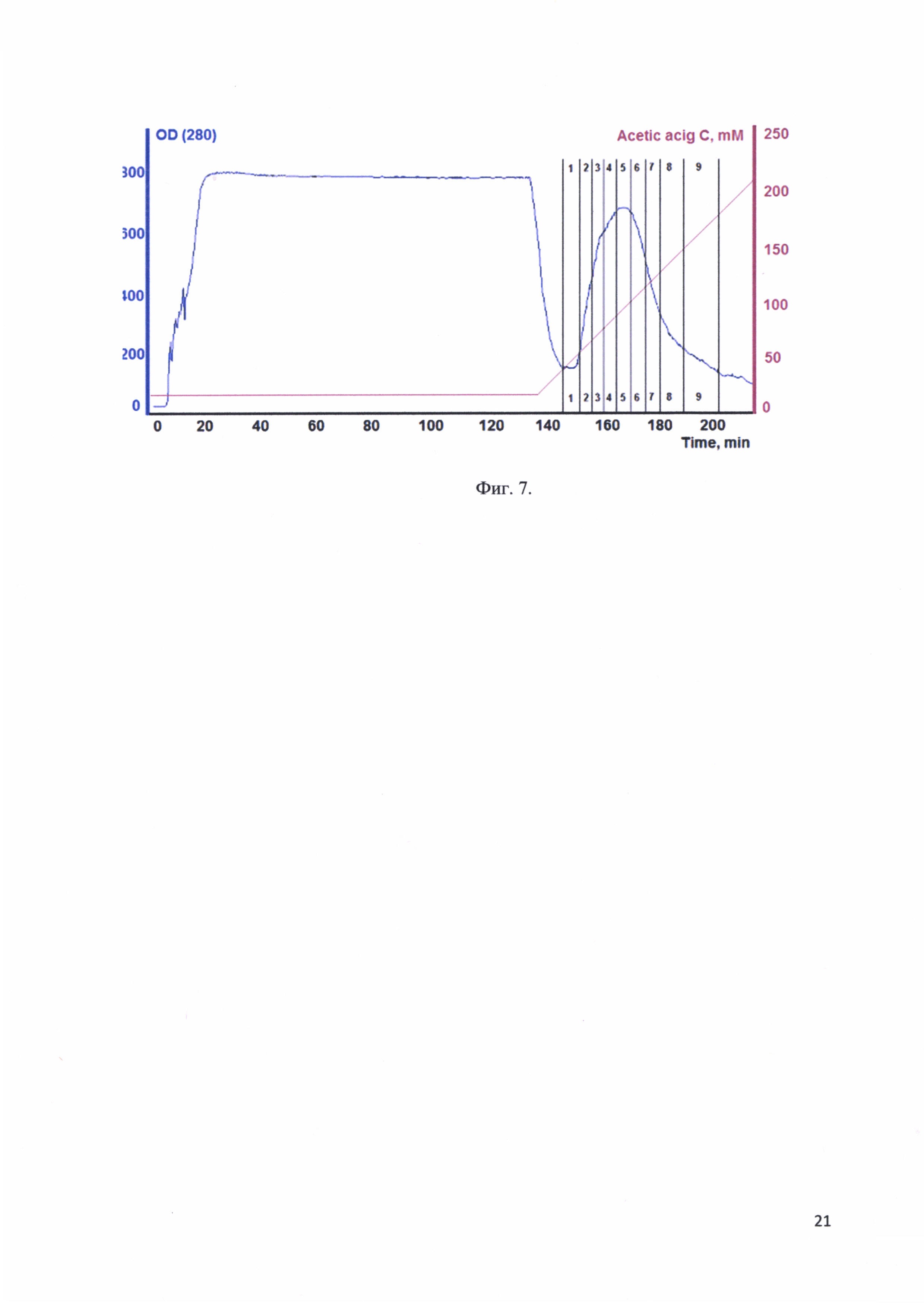
Фиг. 7. Хроматографический профиль элюции рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором с Ni-Sepharose; цифрами 1-9 отмечены фракции, отобранные для анализа.
Фиг. 8. Электрофорез фракций, содержащих рекомбинантный белок - аналог интерферона альфа-17, соединенный с белком-стабилизатором после хроматографии на Ni-Sepharose; трек 10 - стандарты молекулярных весов; треки 1-9 - фракции №1-9, содержащие целевой белок.
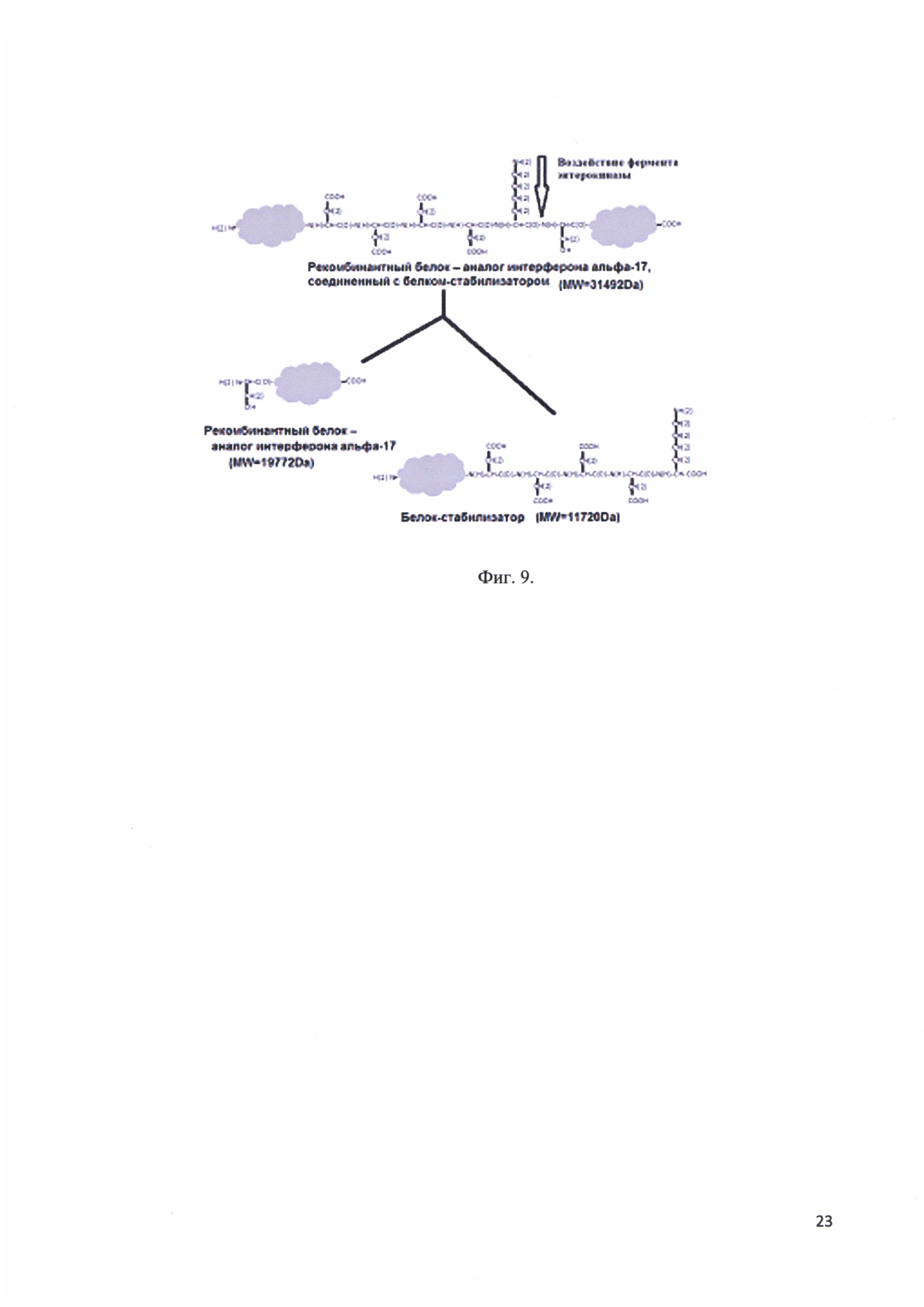
Фиг. 9. Гидролиз рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором ферментом энтерокиназой.
Фиг. 10. Электрофорез гидролизной смеси рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором и энтерокиназы в различные промежутки времени. Трек 1 - реакционная смесь в начале эксперимента (время Т=1 мин); трек 2 - реакционная смесь через полчаса после начала эксперимента (время Т=30 мин); трек 3 - реакционная смесь через час после начала эксперимента (время Т=60 мин); трек 4 - стандарты молекулярных весов. Стрелками отмечены: положение в геле рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором (а), чистого рекомбинантного белка - аналога интерферона альфа-17 (б) и чистого белка стабилизатора (в).
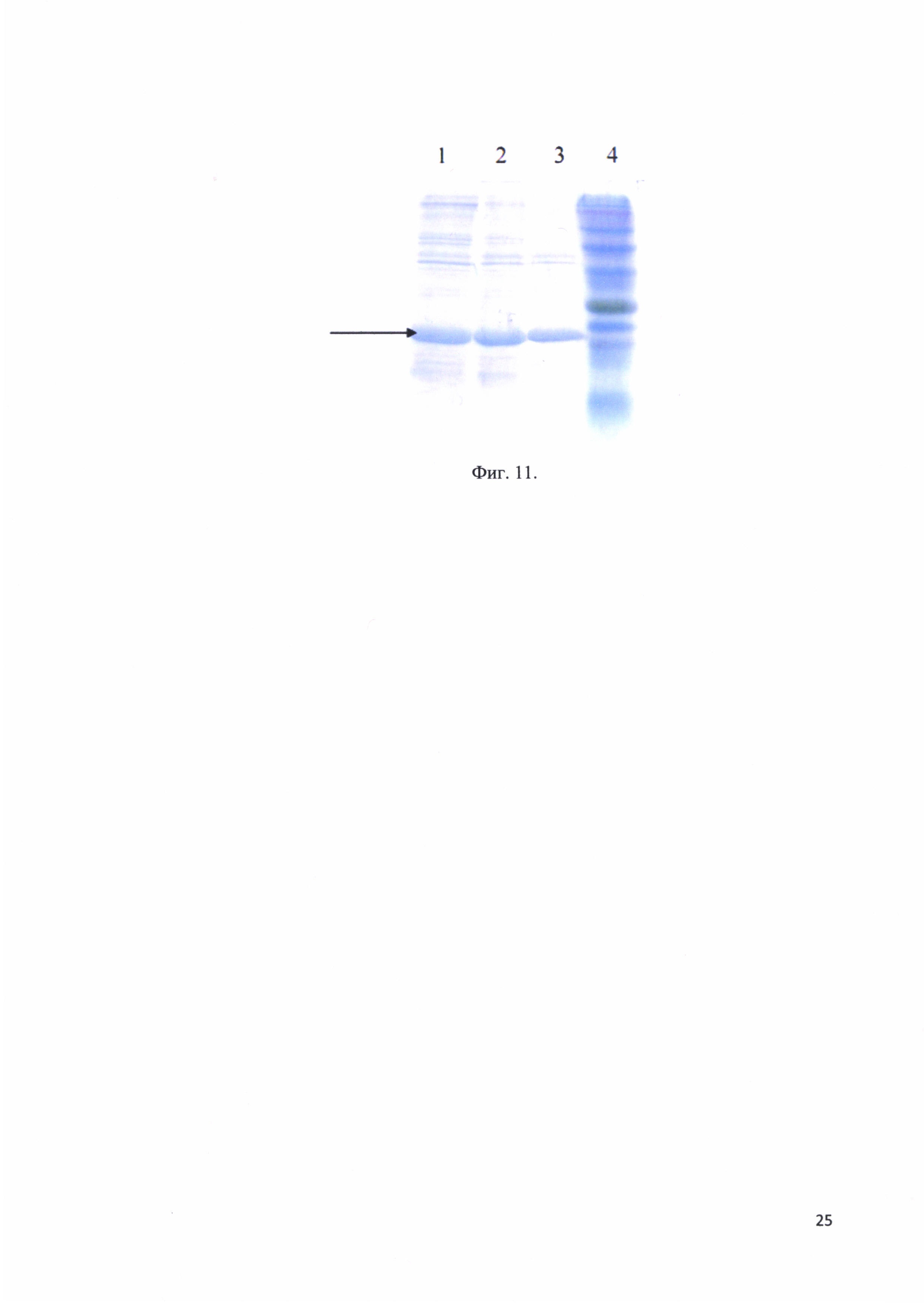
Фиг. 11. Электрофорез гидролизной смеси после нагрева; трек 1 - реакционная смесь без нагрева (37°С, 60 минут); трек 2 - реакционная смесь нагрев 52°С, 60 минут; трек 3 - реакционная смесь нагрев 64°С, 60 минут; трек 4 - стандарты молекулярных весов; стрелкой отмечено положение в геле рекомбинантного белка - аналога интерферона альфа-17.
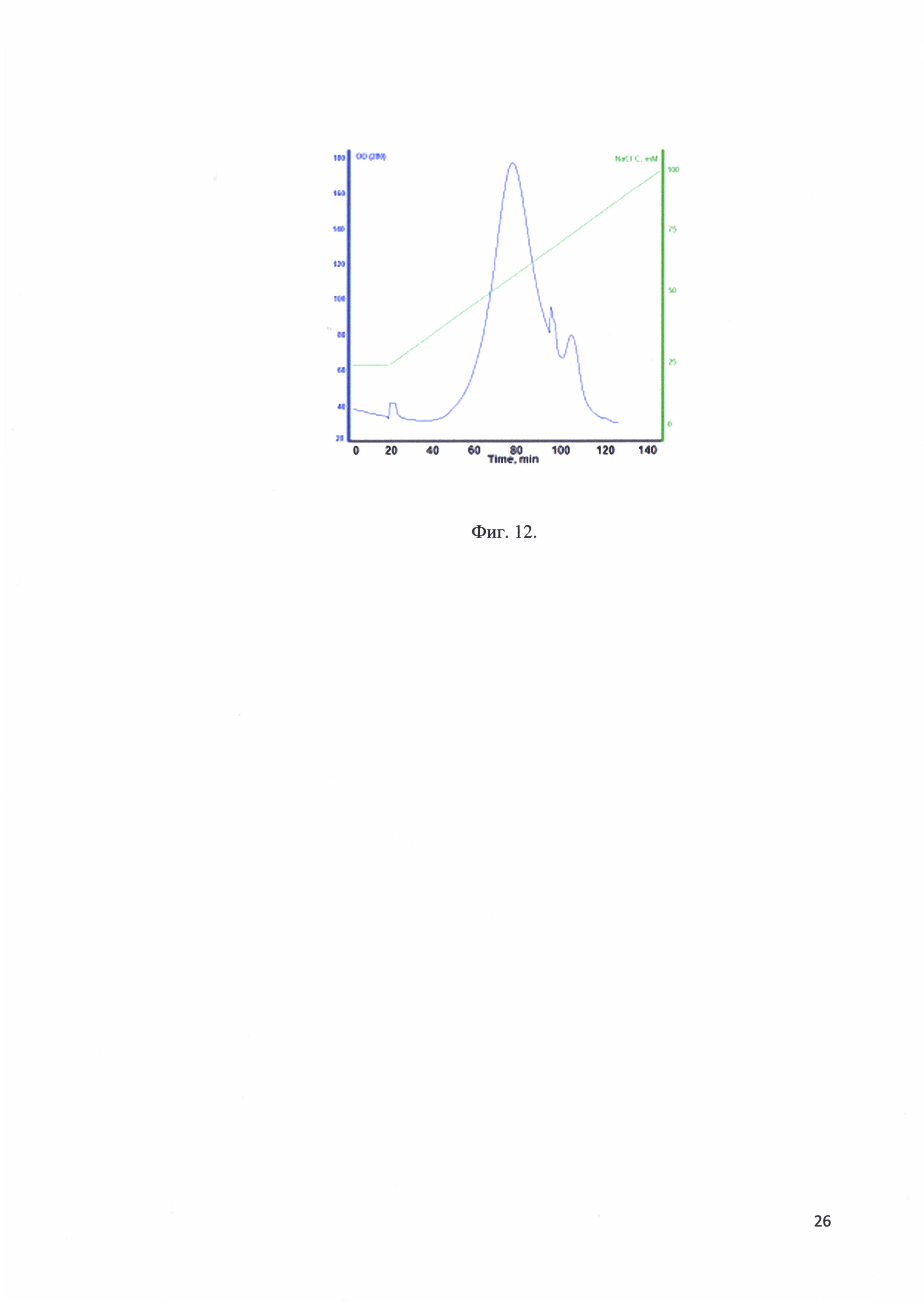
Фиг. 12. Хроматографический профиль элюции рекомбинантного белка - аналога интерферона альфа-17 с SP-Sepharose.
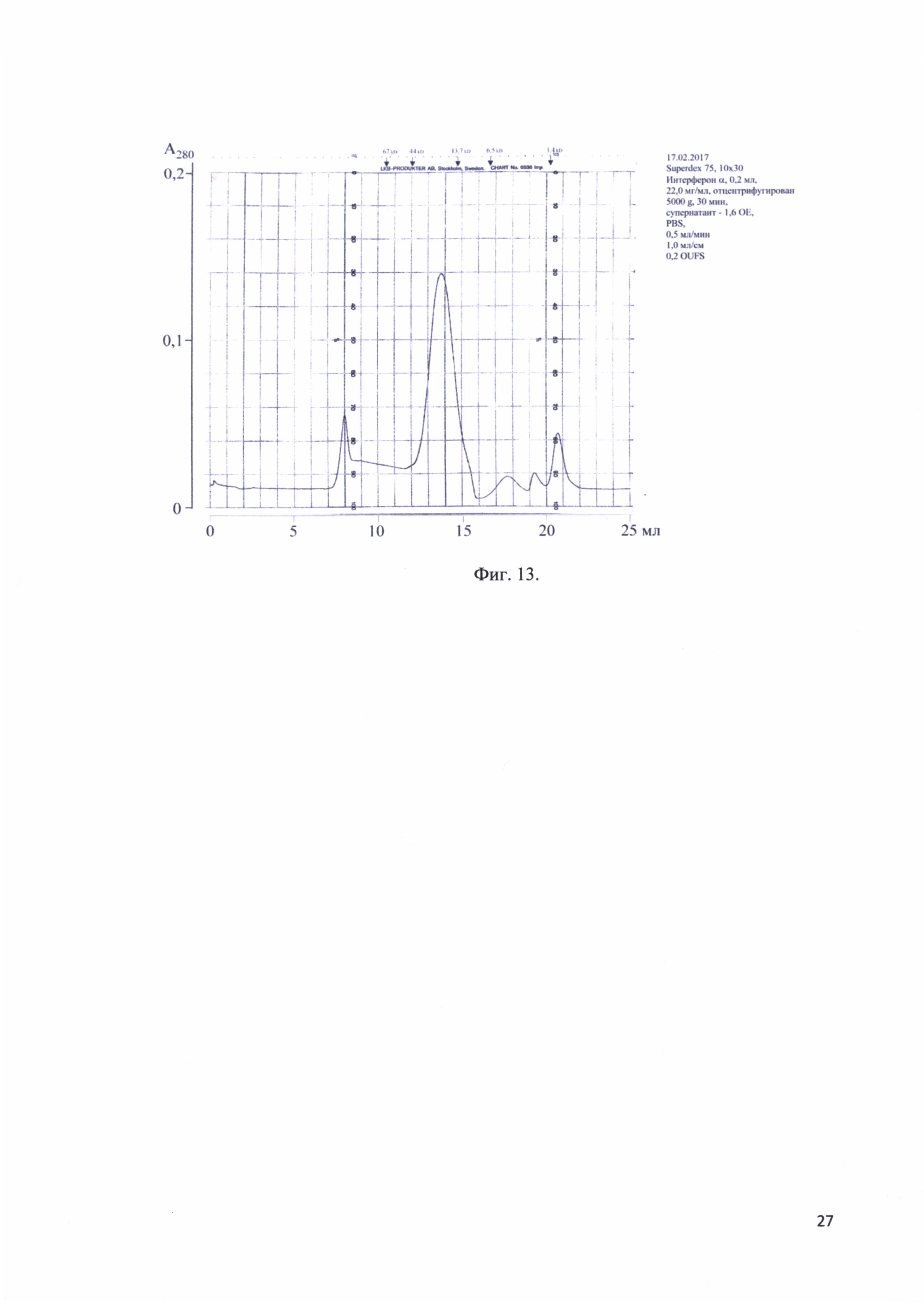
Фиг. 13. Хроматографический профиль элюции рекомбинантного белка - аналога интерферона альфа-17 человека с аналитической колонки Superdex 75.
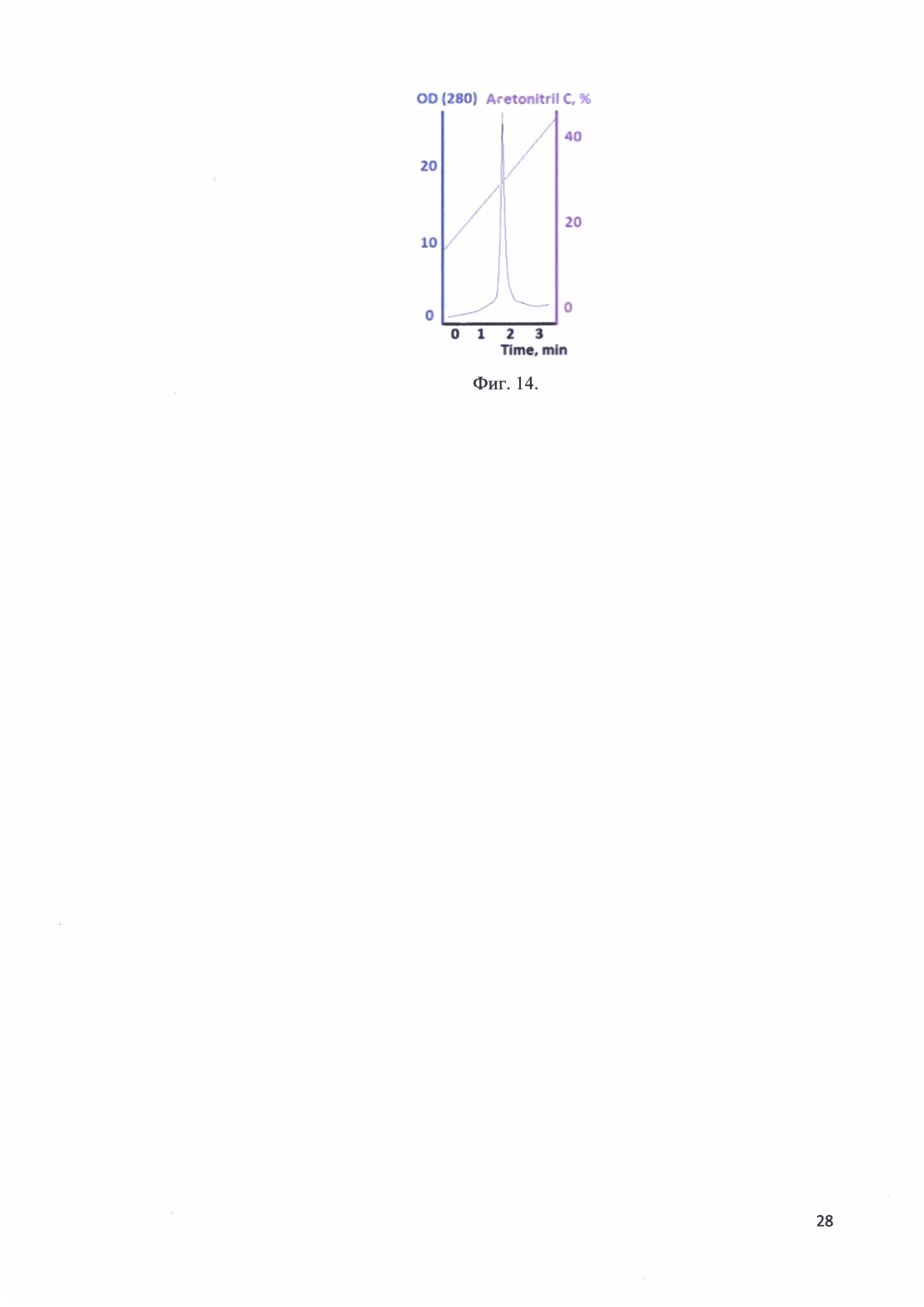
Фиг. 14. Хроматографический профиль элюции рекомбинантного белка - аналога интерферона альфа-17 с колонки Kromasil 300-5С18.
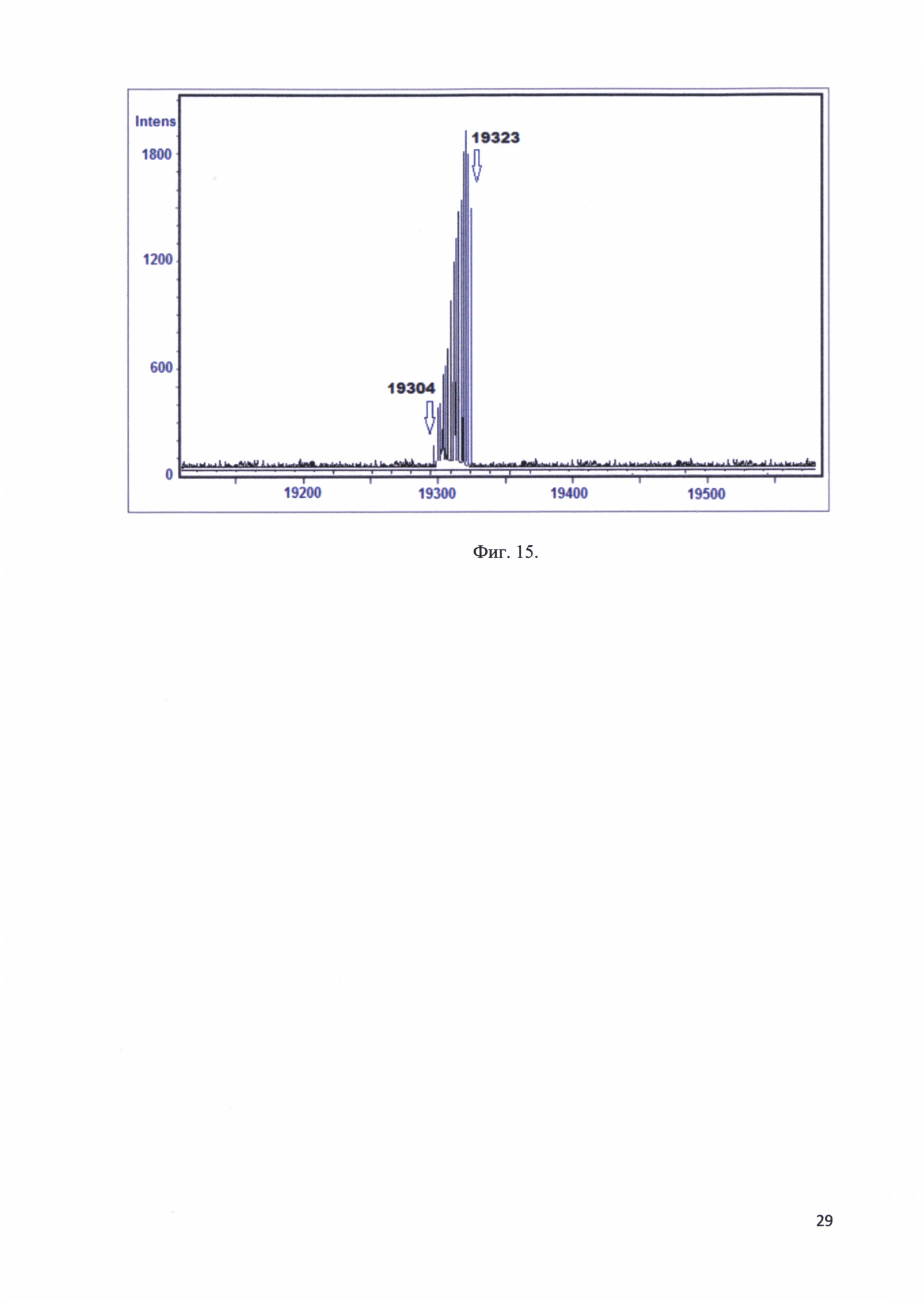
Фиг. 15. Масс-спектр MALD-TOF моноиона рекомбинантного белка - аналога интерферона альфа-17.
Техническим результатом заявленного изобретения является повышение эффективности очистки рекомбинантного белка - аналога интерферона альфа-17, представленного последовательностью SEQ ID NO 1, приводящей к однородности и практически к 100% хроматографической чистоте получаемого продукта, путем:
- получения конструкции ЕТ-32а, несущей ген, представленный последовательностью SEQ ID NO 2, для экспрессии в клетках Escherichia coli BL21(DE3), слитого рекомбинантного белка с белком стабилизатором тиоредоксином;
- подобранных условий гидролиза рекомбинантного белка ферментом энтерокиназой-F в течение одного часа при 37°С и денатурации нагревом примесей при 64°С в течение 60 мин, позволяющих значительно обогатить целевой продукт.
Подробное описание изобретения.
Пример 1. ПОДБОР УСЛОВИЙ НАРАБОТКИ В ФЕРМЕНТЕРЕ РЕКОМБИНАНТНОГО БЕЛКА - АНАЛОГА ИНТЕРФЕРОНА АЛЬФА-17, СОЕДИНЕННОГО С БЕЛКОМ-СТАБИЛИЗАТОРОМ
Был создан штамм-продуцент рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором - BL-32-A17, хранящийся при температуре -70°С. Данный штамм-продуцент использовался для наработки в ферментере, из расчета одна пробирка законсервированного штамма на одну ферментацию. Содержимое пробирки пересевали в среду LB объемом 2 л с канамицином 25 мкг/мл. Выращивали культуру при 300 об/мин при температуре 37°С ровно 10 часов. Затем содержимое реактора помещали в ферментер.
Ферментацию проводили в ферментере с рабочим объемом 15 литров (общий объем колбы 19 л) с культуральной средой LB и канамицином 25 мкг/мл. Основными параметрами, которые необходимо было откорректировать, являлись: кислотность культуральной среды (рН), температура (Т°С), растворенность кислорода в культуральной среде (dO2), количество оборотов шейкера. Оптимальными значениями признавались те, при которых достигалась максимальная оптическая плотность культуры клеток.
При выборе рН изучался диапазон от 6,8 до 7,5. Исследованы следующие величины рН: 6,8; 7,0; 7,2; 7,4 и 7,6. Оптимальным значением рН признано то, при котором достигалась максимальная оптическая плотность культуры клеток. Титрование проводилось растворами 0.1М NaOH и 0.1М HCl.
На фиг. 1 представлены изменения оптической плотности OD(585) культуральной среды во время ферментативной наработки рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором в зависимости от рН. Оптимальным оказалось значение рН, равное 7,2.
При выборе температуры было изучено три варианта: Т = 28°С, 34°С и 37°С. Оптимальной температурой признали ту, при которой достигалась максимальная оптическая плотность культуры клеток. Оптимальным значением оказалась температура Т=34°С. На фиг. 2 представлены изменения оптической плотности OD(585) культуральной среды во время ферментативной наработки рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором в зависимости от температуры Т°С. Видно, что при Т = 28°С, культура приостанавливает свой рост при значениях OD(585) = 8 ОЕ, при Т = 37°С культура набирает оптическую плотность до значений OD(585) = 11 ОЕ, но затем из-за повышенного метаболизма клетки лизируют. При Т = 34°С оптическая плотность изначально меньше, чем при Т = 37°С, однако лизиса не происходит и, в конечном итоге, получается больше биомассы.
Исследовалась зависимость оптической плотности культуры от насыщенности раствора кислородом в двух вариантах: dO2 = 69% и dO2 = 10%. На фиг. 3 представлены изменения оптической плотности OD(585) культуральной среды во время ферментативной наработки рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором в зависимости от насыщаемости раствора кислородом. Видно, что при dO2 = 10% культура клеток медленно набирает оптическую плотность, а затем начинается медленный лизис. При dO2 = 69% оптическая плотность растет достаточно быстро, выходит на «плато», лизиса нет. Таким образом оптимальным является насыщение культуры клеток кислородом и значение dO2 = 69%.
Измерялась максимальная оптическая плотность культуры клеток после окончания ферментации через 10 часов, при различных скоростях вращения шейкера. Ферментация проводилась при скоростях вращения 300, 500, 600, 700, 800, 900, 1000, 1100 и 1200 об/мин. На фиг. 4 представлены максимальные значения оптической плотности OD(585) культуральной среды после 10 часовой ферментации в зависимости от скорости вращения шейкера. Показано, что до 900 об/мин оптическая плотность растет пропорционально, но при дальнейшем увеличении оборотов начинает падать. Особенно резкое падение заметно при 1200 об/мин. Возможно, что здесь речь идет о физическом повреждении клеток лопастями шейкера.
Можно сделать заключение, что ферментация в 15 литровом ферментере оптимально проходит при рН = 7.2, Т = 34°С, насыщенности культуры кислородом dO2 = 69%, скорости вращения шейкера=900 об/мин и культура клеток достигает, как правило, величины оптической плотности OD(585) = 9,4 ОЕ.
Пример 2. НАРАБОТКА И ИНДУКЦИЯ РЕКОМБИНАНТНОГО БЕЛКА - АНАЛОГА ИНТЕРФЕРОНА АЛЬФА-17, СОЕДИНЕННОГО С БЕЛКОМ-СТАБИЛИЗАТОРОМ В ФЕРМЕНТЕРЕ
Ферментацию проводили в ферментере с рабочим объемом 15 литров (общий объем колбы 19 литров) с культуральной средой LB и канамицином 25 мкг/мл. Оптимальные параметрами являлись: кислотность культуральной среды (рН = 7,2), температура (Т°С = 34°С), растворенность кислорода в культуральной среде (dO2=69%), скорости вращения шейкера = 900 об/мин и культура клеток достигает, как правило, величины оптической плотности OD(585) = 9,40Е.
Наработка проводилась при 37°С, в течение 10 часов при 300 об/мин культура выращивалась.
После засева проводилась ферментация при 34°С, в течение 3 часов при 900 об/мин культура. Далее вносилось 400 мл среды LB стерилизованной фильтрацией через 0,22 мкм фильтр, содержащей 25 мкг/мл канамицина и 0,9 мг/мл IPTG. Происходила индукция экспрессии рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором. Далее ферментация продолжалась еще 7 часов.
Затем культура клеток подвергалась лизису. Для этого шейкер переводили на самые малые обороты (50 об/мин) и вносили лизирующий буфер. Буфер содержит ферменты лизоцим и ДНК-азу. Лизоцим разрушает полисахаридную оболочку клетки, ДНК-аза гидролизует ДНК, выходящую из лизированных клеток, снижая вязкость. Буфер так же содержит мягкий детергент TRITON Х-100 в концентрации 500 мкг/мл, который не позволяет активироваться бактериальным протеазам и повредить целевой продукт, при этом он участвует в деструкции билипидного слоя клеточной мембраны бактерии. Концентрация детергента такова, что не мешает сорбции рекомбинантного белка на металл-афинный сорбент.
После инкубации с лизирущим буфером культура клеток анализируется на наличие целевого белка методом SDS-электрофореза в ПААГ. Лизат клеток, содержащий целевой продукт, затем подвергался хроматографической очистки. На фиг. 5 представлен электрофорез лизата клеток, экспрессировавших рекомбинантный белок - аналог интерферона альфа-17, соединенный с белком-стабилизатором: трек 1 - стандарты молекулярных весов; трек 2 - лизат клеток. Стрелкой отмечено положение рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором в геле. Таким образом подтверждено наличие целевого белка в бактериальном лизате.
Пример 3. ВЫДЕЛЕНИЕ И ОЧИСТКА РЕКОМБИНАНТНОГО БЕЛКА -АНАЛОГА ИНТЕРФЕРОНА АЛЬФА-17, СОЕДИНЕННОГО С БЕЛКОМ-СТАБИЛИЗАТОРОМ
На фиг. 6 представлена схема рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором: 1 - последовательность аналога интерферона альфа-17 человека; 2 - сайт расщепления ферментом энтерокиназой; 3 - последовательность белка из семейства шаперонов, стабилизирующего всю рекомбинантную конструкцию; 4 - полигистидиновая последовательность.
Хроматографическая очистка рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором проходит на металл-аффинном сорбенте Ni-Sepharose. Лизата клеток прогонялся через колонки с Ni-Sepharose, предварительно уравновешенных 10 mM уксусной кислотой. За счет полигистидиновой последовательности рекомбинантный белок сорбировался на носитель. Все иные компоненты клетки проходили через колонку. Наличие TRITON Х-100 в смеси позволяет избежать неспецифической сорбции ряда белков, имеющих отрицательный заряд, т.к. сорбент обладает и ионообменными свойствами.
Целевой белок элюировали линейным градиентом. Стартовый буфер: 10 mM уксусная кислота, финальный буфер: 200 mM уксусная кислота. Объем градиента 7500 мл. Элюат фракционировали. Наличие белка во фракции определяли электрофорезом в ПААГ.
Хроматографический профиль элюции рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором с Ni-Sepharose представлен на фиг. 7. Цифрами 1-9 отмечены фракции, отобранные для анализа.
На фиг. 8 представлен электрофорез фракций, содержащих рекомбинантный белок - аналог интерферона альфа-17, соединенный с белком-стабилизатором после хроматографии на Ni-Sepharose. Трек 10 - стандарты молекулярных весов. Треки 1-9 - фракции №1-9, содержащие целевой белок. Стрелкой отмечено положение рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором в геле.
Таким образом из клеточного лизата выделен и хроматографически очищен рекомбинантный белок - аналог интерферона альфа-17, соединенный с белком-стабилизатором. Чистота рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором оценена электрофорезом в ПААГ.
Пример 4. РАСЩЕПЛЕНИЕ РЕКОМБИНАНТНОГО БЕЛКА - АНАЛОГА ИНТЕРФЕРОНА АЛЬФА-17, СОЕДИНЕННОГО С БЕЛКОМ-СТАБИЛИЗАТОРОМ СПЕЦИФИЧЕСКОЙ ПРОТЕАЗОЙ И ВЫДЕЛЕНИЕ РЕКОМБИНАНТНОГО АНАЛОГА ИНТЕРФЕРОНА АЛЬФА-17
Рекомбинантный белок - аналог интерферона альфа-17, соединенный с белком-стабилизатором имеет в своем составе сайт расщепления ферментом энтерокиназой. Данный фермент позволяет расщепить белковый фрагмент «заподлицо». Т.е. после последовательности Asp-Asp-Asp-Asp-Lys фермент расщепляет белковую молекулу, что позволяет избежать появления дополнительных аминокислот в целевом белковом продукте, в нашем случае в молекуле рекомбинантного белка - аналога интерферона альфа-17. Гидролиз рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором ферментом энтерокиназой представлен на фиг. 9.
Коммерческие наборы, содержащие фермент энтерокиназу, позволяют расщеплять одной единицей активности (1 unit) 20 микрограмм (μ.g) белка. Таким образом количество расходуемого фермента энтерокиназа будет пропорционально молекулярной массе белковой молекулы. Т.к. снизить молекулярный вес рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором, не представляется, то длительное время гидролиза энтерокиназой за счет оборотистости фермента позволяет снизить его количество. На фиг. 10 показаны результаты электрофореза гидролизной смеси рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором и энтерокиназы в различные промежутки времени. Трек 1 - реакционная смесь в начале эксперимента (время Т=1 мин); трек 2 - реакционная смесь через полчаса после начала эксперимента (время Т=30 мин); трек 3 - реакционная смесь через час после начала эксперимента (время Т=60 мин); трек 4 - стандарты молекулярных весов. Стрелками отмечены: положение в геле рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором (а), чистого рекомбинантного белка - аналога интерферона альфа-17 (б) и чистого белка стабилизатора (в). Показана эффективность продолжительного гидролиза (60 минут).
В качестве одного из этапов очистки для интерферонов использовали денатурацию нагревом. Были подобраны условия нагрева, при которых оптимальной оказалась инкубация реакционной смеси при 64°С. На фиг. 11 представлен электрофорез гидролизной смеси после нагрева: трек 1 - реакционная смесь без нагрева (37°С, 60 минут); трек 2 - реакционная смесь нагрев 52°С, 60 минут; трек 3 - реакционная смесь нагрев 64°С, 60 минут; трек 4 - стандарты молекулярных весов; стрелкой отмечено положение в геле рекомбинантного белка - аналога интерферона альфа-17.
Процедура гидролиза рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором ферментом энтерокиназой сводится к следующим манипуляциям:
- фракции, содержащие рекомбинантный белок - аналог интерферона альфа-17, соединенный с белком-стабилизатором после металл-афинной хроматографии смешивались с раствором, содержащим энтерокиназу;
- реакционная смесь инкубируется 60 минут при 37°С;
- реакционная смесь нагревается до 64°С и инкубируется 60 минут.
Пример 5. ХРОМАТОГРАФИЧЕСКАЯ ОЧИСТКА РЕКОМБИНАНТНОГО АНАЛОГА ИНТЕРФЕРОНА АЛЬФА-17 НА SP-SEPHAROSE
В качестве носителя использовалась SP-Sepharose. Реакционная смесь после гидролиза и нагрева фильтруется через фильтр с порами 0,22 мкм от агрегатов денатурированных белков. Фильтрованная смесь наносится на колонку HiPrepl6/10 Q FF, предварительно уравновешенную 25 mM NaCl. Целевой белок элюировали линейным градиентом. Стартовый буфер: 25 mM NaCl, финальный буфер: 100 mM NaCl. Элюат фракционировали. Наличие белка во фракции определяли электрофорезом в ПААГ. На фиг. 12 представлен хроматографический профиль элюции рекомбинантного белка - аналога интерферона альфа-17 с SP-Sepharose.
Пример 6. ОЦЕНКА РЕКОМБИНАНТНОГО БЕЛКА - АНАЛОГА ИНТЕРФЕРОНА АЛЬФА-17 МЕТОДАМИ ХРОМАТОГРАФИИ И МАСС-СПЕКТРОМЕТРИИ
Рекомбинантный аналог интерферона альфа-17 очищают с помощью гель-фильтрации (Sephadex G-25; элюирование 0,1% лауреата натрия и 10 MMTris-HCL). Данная процедура позволяет провести предварительную очистку белка от примесей. Фракции, соответствующие рекомбинантному аналогу интерферона альфа-17 лиофилизировали, после чего проводят дальнейшую очистку при помощи ВЭЖХ с использованием колонки С18 в линейном градиенте 50-65% ацетонитрила-0,1% ТФУ со скоростью 15 мл/мин. Размер пор должен соответствовать 300 или более ангстрем. Анализирование фракций после препаративной ВЭЖХ и центрифугирования образца при 5000g в течение 30 минут проводят на колонке Superdex 75 при скорости потока 0,5 мл/мин. При этом пик выходящий на 7-й минуте соответствует ЛС пролонгированного действия рекомбинантного аналога интерферона альфа-17. На фиг. 13 представлен хроматографический профиль элюции рекомбинантного белка - аналога интерферона альфа-17 человека с аналитической колонки Superdex 75.
Также чистоту рекомбинантного белка - аналога интерферона альфа-17 определяли методом HPLC - хроматографии, подлинность методом MALDI-TOF масс-спектрометрии.
Раствор, содержащий рекомбинантный белок - аналог интерферона альфа-17 диализовали против раствора 0,1% трифторуксусной кислоты. Отбирали 150 мкл раствора и наносили на колонку Kromasil 300-5С18 4,6ID150. Проводили аналитическую хроматографию. Элюировали линейным градиентом. Стартовый буфер: 0,1% трифторуксусная кислота, 2% ацетонитрил, финальный буфер: 0,1% трифторуксусная кислота, 80% ацетонитрил. Рекомбинантный белок - аналог интерферона альфа-17 сошел с колонки при концентрации ацетонитрила 33%. На фиг. 14 представлен хроматографический профиль элюции рекомбинантного белка -аналога интерферона альфа-17 с колонки Kromasil 300-5С18. Согласно хроматограмме чистота рекомбинантного белка более 99%.
Расчетная молекулярная масса рекомбинантного белка 19303 Da. Структуру рекомбинантного белка - аналога интерферона альфа-17 подтверждали масс-спектрами MALDI-TOF как моноиона, так и триптического гидролиза молекулы. Матрица - 2,5-дигидроксибензойная кислота. Длина волны лазера 336 нм.
Рекомбинантный белок - аналог интерферона альфа-17 в концентрации 0,15 мг/мл и объемом 5 мкл смешивали с матрицей и давали смеси высохнуть. Далее подвергали масс-спектрометрическому анализу и получали массу моноиона. На фиг. 15 представлен масс-спектр MALD-TOF моноиона рекомбинантного белка - аналога интерферона альфа-17.
На масс-спектре получен набор из нескольких пиков с массами от 19304 до 19323. Это связано с тем, что на каждые 1000 единиц молекулярного веса в белковых молекулах из-за накапливания изотоп С13 масса молекулы увеличивается на 1, таким образом вместо одной массы мы видим набор из нескольких масс.
Мажорный пик соответствует массе 19323, наблюдается «рост» пика соответствующего массе 19304, при этом пик 19303, который соответствует рекомбинантному белку - аналогу интерферона альфа-17 свободному от изотопов С13, мал, т.к. статистически на белковую молекулу массой более 10 kDa должна приходиться хотя бы одна молекула С13. Можно констатировать, что полученная масса для моноиона рекомбинантного белка - аналога интерферона альфа-17 соответствовала рассчитанной массе.
Способ очистки целевого рекомбинантного белка - аналога интерферона альфа-17, представленного последовательностью SEQ ID NO: 1, включающий получение растворимой фракции слитого рекомбинантного белка с белком стабилизатором тиоредоксином из штамма-продуцента Escherichia coli BL21(DE3), трансфицированного плазмидной ДНК рЕТ-32а, несущей ген, представленный последовательностью SEQ ID NO 2, хроматографическую очистку на металл-аффинном сорбенте с применением Ni-Sepharose, с последующим гидролизом слитого рекомбинантного белка ферментом энтерокиназой, инкубируя 1 час при 37°C, и денатурацией примесей при нагревании до 64°C в течение 60 мин, FPLC очистку на ионообменном сорбенте SP-Sepharose, обратнофазовую HPLC очистку целевого рекомбинантного белка на колонке Superdex 75.