Результат интеллектуальной деятельности: Способ получения рекомбинантного экзопротеина А Pseudomonas aeruginosa
Вид РИД
Изобретение
Изобретение относится к биотехнологии, а именно получению и производству иммунобиологических препаратов, технологий продукции и очистки рекомбинантных белков из штаммов микроорганизмов и касается разработки нового способа получения рекомбинантного экзопротеина A Pseudomonas aeruginosa (rEPA), обладающего высокой иммуногенностью и адъювантными свойствами, применимого в качестве белкового носителя для связывания с различными антигенами при создании конъюгированных вакцин.
Областью применения предлагаемого способа получения белка rEPA является биомедицина, разработка и создание иммуногенных композиций, в частности конъюгированных вакцин на основе белкового носителя rEPA, лабораторные биологические и медицинские исследования, использование иммуногенных конъюгатов для выработки антител против различных патогенов.
Рекомбинантный экзопротеин A Pseudomonas aeruginosa (rEPA) представляет собой атоксическую форму экзотоксина А, состоящий из 613 аминокислот. Экзотоксин А (ЕРА) наиболее токсичный фактор вирулентности P. aeruginosa. Он относится к семейству токсинов АДФ-рибозилтрансфераз и имеет молекулярную массу около 67 кДа. Экзотоксин А, как и дифтерийный токсин, ингибирует синтез белка вследствие своей АДФ-рибозилтрансферазной активности (Pollack М., Young L.S. // Clin. Invest. - 1979. - V. 63. - P. 276-286). EPA содержит три главных домена: домен Ia и Ib - 1-252 аминокислотные остатки (рецепторсвязывающий), домен II - 253-404 аминокислотные остатки (трансмембранный), домен III - 405-613 аминокислотные остатки (каталитический НАД-рибозил трансферазный). Именно домен III ингибирует белковый синтез путем инактивации эукариотического фактора элонгации 2 (Allured V.S., Collier R.J., Carroll S.F. et al. // Procl. Atl. Acad. Sci. USA. - 1986. - V. 83. - 1320-1324).
Для детоксикации экзопротеина А методами генетической инженерии был сконструирован рекомбинантный токсоид (rEPA), который отличается от токсина дикого типа по трем остаткам: Ala179-Thr (в рецепторсвязывающем домене), Leu 552-Val и делеции Glu 553 (в каталитическом домене) (Killeen K.P., Collier R.J. / Biochim. Biophys. Acta. - 1992. - V. 1138. - 162-166). Остаток глутаминовой кислоты в 553 положении был делетирован методом сайт-направленного мутагенеза (Lukac М., Pier G.B., Collier R.J. // Infect. Immun. - 1988. - V. 56, N. 12. - P. 3095-3098). Имеются также данные о том, что при химической модификации белка дикого типа в процессе конъюгации также происходит полная потеря токсичности (Cryz S.J. Jr., Sadoff J.С.,  E. // Microb. Pathog. - 1989. - V. 6, N. 1. - P. 75-80). Было установлено, что rEPA полностью иммунореактивен, тогда как его рибозилтрансферазная и цитотоксическая активности как минимум в 106 раз ниже, чем таковые у токсина дикого типа (Manafi A., Kohanteb J., Mehrabani D. et al. // BMC Microbiol. - 2009. - V. 9. - P. 23).
E. // Microb. Pathog. - 1989. - V. 6, N. 1. - P. 75-80). Было установлено, что rEPA полностью иммунореактивен, тогда как его рибозилтрансферазная и цитотоксическая активности как минимум в 106 раз ниже, чем таковые у токсина дикого типа (Manafi A., Kohanteb J., Mehrabani D. et al. // BMC Microbiol. - 2009. - V. 9. - P. 23).
На основе рекомбинантного экзотоксина A P. aeruginosa разрабатывают и тестируют на иммуногенность ряд препаратов. Против тифозной инфекции создана и проходит клинические испытания конъюгированная вакцина, содержащая очищенный полисахарид Vi Salmonella enterica serovar Typhi с белком-носителем rEPA (Lin F.Y.C., Но V.A., Khiem Н.В. et al. // N. Engl. J. Med. - 2001. - V. 344, N. 17. - P. 1263-1269; US 20100239601 A1; Anwar E.., Goldberg E., Fraser A. et al. // Cochrane Database Syst. Rev. - 2014). Одной из новых разрабатываемых вакцин с белком-носителем rEPA против брюшного тифа является конъюгат О-специфического полисахарида S. enterica ser. Typhi (Zhehui P., Chao P., Peng S. et al. // Yi Chuan. - 2015. - V. 37, N. 5. - P. 473-479). Белок-носитель rEPA стимулировал выработку высокого иммунного ответа на связанные с ним полисахариды О P. aeruginosa в доклинических исследованиях конъюгированных вакцин (Cryz Jr. S.J., Furer E., Sadoff J.C. et al. // Infect. Immun. - 1986. V. 52, N. 1. - P. 161-165; Abu-baker N.F., Masoud H.A., Jaber B.M. // Dirasat, Pure Sciences. - 2008. - V. 35, N. 2. - P. 110-122.). Он также используется в качестве носителя для вакцины против Staphylococcus aureus типа 5 и типа 8 (Fattom A., Schneerson R., Szu S.C. et al. // Infection and immunity. - 1990. - V. 58, N. 7. - P. 2367-2374; Shinefield H., Black S., Fattom A. et al. // N. Engl. J. Med. - 2002. - V. 346, N. 7. - P. 491-496). Белок rEPA применяют в вакцинах против шигелл (Cohen D., Ashkenazi S., Green M.S. et al. // Lancet. - 1997. V. 349, N. 9046. - P. 155-159), энтерогеморрагической E. coli (Szu S.C., Ahmed A. // Microbiol. Spectr. - 2014, V. 2, N. 6. - P. 1-7), возбудителя холеры (Wade Т.K., Saksena R., Shiloach J. et al. // FEMS Immunol. Med. Microbiol. - 2006. V. 48, N. 2. - P. 237-251) и даже при лечении никотиновой зависимости (US 20110217320 A1). Кроме того, rEPA способствовал повышению титра антител на поверхностные белки-антигены малярийного плазмодия Plasmodium falciparum при применении конъюгированной вакцины против малярии (Qian F., Wu Y., Muratova О. et al. // Vaccine. - 2007. - V. 25, N. 20. - P. 3923-3933; Qian F. // Zhongguo Ji Sheng Chong Xue Yu Ji Sheng Chong Bing Za Zhi. - 2012. - V. 30, N. 6. - P. 442-445).
Таким образом, широкое применение rEPA в качестве белкового носителя в разрабатываемых конъюгированных вакцинах обуславливает необходимость изобретения эффективного способа получения и очистки данного белка.
Известен способ получения rEPA в растворимой форме в клетках Pseudomonas fluorescens, включающий оптимизированную для экспрессии в клетках псевдомонад нуклеотидную последовательность белка, экспрессию с тегом для очистки (гексагистидин или глутатион-S-трансфераза или аналоги флуоресцентных белков YFP или GFP) и аффинную хроматографию (патент ЕР 2553102 А2). Однако данный способ не пригоден для продукции белка rEPA в клетках E. coli.
Известны изобретения, описывающее получение плазмид и штаммов-продуцентов Е. coli гибридных рекомбинантных белков, включающих аминокислотные последовательности белка F наружной мембраны и экзотоксина А P. aeruginosa (патент RU 2529359 С2) и вариант экзотоксина А с белком пилином типа IV (патент US 7314625 В2). Также известен способ, в котором конструировали плазмиду, содержащую нуклеотидную последовательность белка ЕРА, модифицированную для детоксификации, содержащую замену N-концевого сигнального пептида на сигнальный пептид DsbA Е. coli и две дополнительные гликозилированнные консенсусные последовательности, а также вставку на С конце тега гексагистидина для получения биоконъюгатов полисахаридов Staphylococcus aureus с rEPA (патент WO 2015082571 А1). Однако в указанных патентах продукцию и очистку белка rEPA отдельно, без конъюгатов, не проводили.
Известен способ создания самореплицирующегося вектора без гена антибиотикорезистентности с целью получения рекомбинантного белка, включающий генно-инженерную интеграцию экспрессионной конструкции, продуцирующей rEPA, в бактериальную клетку Е. coli с последующей геномной экспрессией, но не была описана процедура выделения белка (патент WO 2010007246 А1).
Известен по существу наиболее близкий к заявленному изобретению способ получения рекомбинантных вариантов экзотоксина А P. aeruginosa, но в нерастворимой фракции, с целью использования в качестве антигенов в иммунобиологических препаратах для диагностики, профилактики и лечения заболеваний, вызываемых синегнойной палочкой. Данный способ предполагает создание штаммов-продуцентов: синтезирующий экзотоксин А; домен I экзотоксина А; экспрессирующий вариант, состоящий из доменов I и II; вариант, состоящий из доменов I, II и части домена III. Для очистки рекомбинантных белков в работе указывается металл-хелатная хроматография в денатурирующих условиях с использованием Ni-сефарозы High Performance (GE Healthcare), с выходом препаратов от 38,8% до 71,4% и степенью очистки не менее 66% (Исаков М.А. / Автореф. дис. к.б.н. - Москва: НИИ вакцин и сывороток им. И.И. Мечникова, 2010 - 24 с.). Отличием данного способа от разработанного, является получение белка rEPA в нерастворимой форме, что существенно влияет на процедуру очистки белка.
Техническим результатом изобретения является создание эффективного способа получения рекомбинантного белка rEPA, позволяющего при экспрессии в клетках Е. coli повысить выход белка в растворимой форме и осуществить очистку солюбилизированного белка rEPA, пригодного для конъюгации с полисахаридами и другими антигенами в конъюгированных вакцинах.
Технический результат изобретения достигается за счет оптимизации последовательности ДНК, кодирующей рекомбинантный экзопротеин А P. aeruginosa, для достижения максимально эффективной трансляции белка в Е. coli.
Также технический результат изобретения достигается за счет конструирования векторной плазмиды, содержащей промоторную последовательность ДНК бактериофага Т7 и последовательности ДНК, кодирующие N-концевую область белкового продукта энхансера трансляции (аминокислотная последовательность MASMT), шесть аминокислотных остатков гистидинов для очистки белка металл-хелатной хроматографией, сайт расщепления протеазой SUMO и оптимизированную для трансляции в Е. coli последовательность ДНК, кодирующую рекомбинантный белок rEPA. Для жесткого блокирования фоновой продукции белка экспрессионные конструкции бактериофага Т7 содержат последовательность оператора.
Также технический результат достигается продукцией рекомбинантного белка rEPA слитого с пептидом SUMO в бактериях Е. coli штамма BL21 (DE3) при температуре 37°C, что обеспечивает накопление большого количества рекомбинантного белка в растворимой фракции.
Также технический результат изобретения достигается за счет высокоэффективной процедуры лизиса бактериальных клеток, предусматривающей обработку бактерий детергентом Triton Х-100 в концентрации 4%, что способствует сохранению белковой фракции в растворимом состоянии.
Также технический результат изобретения достигается благодаря схеме хроматографической очистки, включающей этапы металл-хелатной хроматографии на колонке Talon (Clontech, США), заряженной ионами Со2+, ионнообменной и гель-фильтрационной хроматографии с конечным переводом фермента в буфер со значением pH 7,5.
Отличием предлагаемого способа является получение rEPA на основе сконструированной синтетической последовательности ДНК, оптимизированной для продукции белка в Е. coli. Адаптация последовательности ДНК, кодирующей целевой белок, для продукции в Е. coli проводилась путем компьютерного анализа и включала замену кодонов нативного гена на кодоны, наиболее часто встречающиеся в белках с высоким уровнем продукции у организма-хозяина, анализ и совершенствование стабильности считываемой мРНК, удаление чрезмерной структурированности мРНК, удаление гомополимерных участков мРНК.
В предлагаемом техническом решении удаление N-концевого полипептида с восстановлением нативной последовательности белка rEPA обеспечивается за счет введенного в состав рекомбинантного белка сайта расщепления протеазой SUMO. Полипептид SUMO имеет аминокислотную последовательность DLDMEDNDIIEAHRE и служит для повышения растворимости белкового продукта. На N-конце рекомбинантного белка содержится короткая аминокислотная последовательность шести аминокислотных остатков гистидинов, не влияющая на свойства белка rEPA, но позволяющая удалить его из раствора адсорбцией на металл-хелатной смоле.
Предлагаемое техническое решение предусматривает проведение нескольких этапов хроматографической очистки, включая металл-хелатную хроматографию на сорбенте Talon (Clontech, США), заряженном ионами Со2+, а также анионообменную и гель-фильтрационную хроматографии, обеспечивающих получение белка высокой чистоты (до 98% по данным денситометрии) в конечном буферном растворе со значением pH 7,5, пригодном для анализа активности и хранения белка.
Существенным достоинством предлагаемого способа получения рекомбинантного экзопротеина P. aeruginosa rEPA является получение высокого выхода очищенного белка (0,25 г с литра бактериальной культуры) в растворимой форме при культивировании продуцента Е. coli при 37°C за счет его химеризации с полипептидом SUMO.
Изобретение осуществляют следующим образом.
Конструируют рекомбинантную плазмидную ДНК рЕТ_rEPA на основе коммерчески доступной плазмиды pET22b(+). Для этого конструируют последовательность ДНК, кодирующую рекомбинантный белок rEPA, оптимизированную для продукции белка в Е. coli, и синтезируют данную последовательность при помощи ПЦР с использованием перекрывающихся праймеров. На 5'-конец синтезированной последовательности при помощи ПЦР вводят фрагмент ДНК, кодирующий последовательность шести остатков гистидинов и полипептид SUMO и на 3'-конец последовательности при помощи ПЦР вводят стоп-кодон и сайт эндонуклеазы рестрикции XhoI. Полученный ПЦР-продукт расщепляют по сайтам эндонуклеаз рестрикции NdeI и XhoI и лигируют с расщепленной по соответствующим сайтам векторной плазмидной ДНК pET22b(+). Единичные клоны, содержащие плазмиду pET22b(+) со встроенной последовательностью ДНК получают электротрансформацией клеток штамма Е. coli DH12S.
Плазмидой рЕТ_rEPA трансформируют клетки штамма Е. coli BL21(DE3) и получают единичные колонии продуцента рекомбинантного экзопротеина А Е. coli BL-rEPA. На основании аналитической экспрессии выделяют клоны-суперпродуценты белка. Проводят препаративную экспрессию белка клонов-суперпродуцентов. Для этого бактериальные клоны выращивают в течение ночи в среде 2xYT, содержащей 50 мкг/мл ампициллина и 1% глюкозы, 10 мл ночной культуры помещают в 1 литр свежей среды, содержащей 0,1% глюкозы и 50 мкг/мл ампициллина, и наращивают культуру до достижения 0,8 единиц оптической плотности. Индуцируют синтез белка добавлением 1 мМ ИПТГ. Экспрессию белка проводят при 37°C в течение 4 часов. Бактериальную биомассу собирают центрифугированием и хранят при температуре -70°C.
Выделение белка rEPA из лизата культуры клеток проводят металл-хелатной хроматографией на колонке Talon (Clontech, США), заряженной кобальтом. Посадку белка на колонку осуществляют в буферном растворе, содержащем 20 мМ Трис-HCl, 200 мМ хлорида натрия, pH 8,0. Элюируют белок с колонки тем же буфером, содержащим 250 мМ имидазола. Протеолиз для отщепления пептида SUMO проводят в течение 2 часов при комнатной температуре в массовом соотношении SUMO-rEPA к протеазе как 1:1000 в присутствии 1 мМ ДТТ. Удаление отщепленного пептида проводят на колонке с ионнообменной смолой DEAE-Sepharose (GE Healthcare, Великобритания) в буфере, содержащем 20 мМ Трис-HCl, pH 8,0 и 20 мМ хлорида натрия. Элюцию с колонки проводят градиентом 0,5 М хлорида натрия в том же буфере. Доочищают полученный рекомбинантный белок гель-фильтрацией на колонке Superdex 200 (GE Healthcare, Великобритания). На каждом этапе контроль степени очистки проводят с применением электрофореза в ПААГ в денатурирующих условиях.
Выход рекомбинантного белка rEPA составляет 0,25 г с литра культуры.
Изобретение иллюстрируют следующие графические материалы:
Фиг. 1. Синтетическая последовательность ДНК, оптимизированная для эффективной продукции белка rEPA в клетках Е. coli. А - последовательность ДНК SUMO-rEPA, В - аминокислотная последовательность SUMO-rEPA. С - полная последовательность плазмиды рЕТ_rEPA.
Фиг. 2. Экспрессионная конструкция для продукции белка-партнера для конъюгации rEPA.
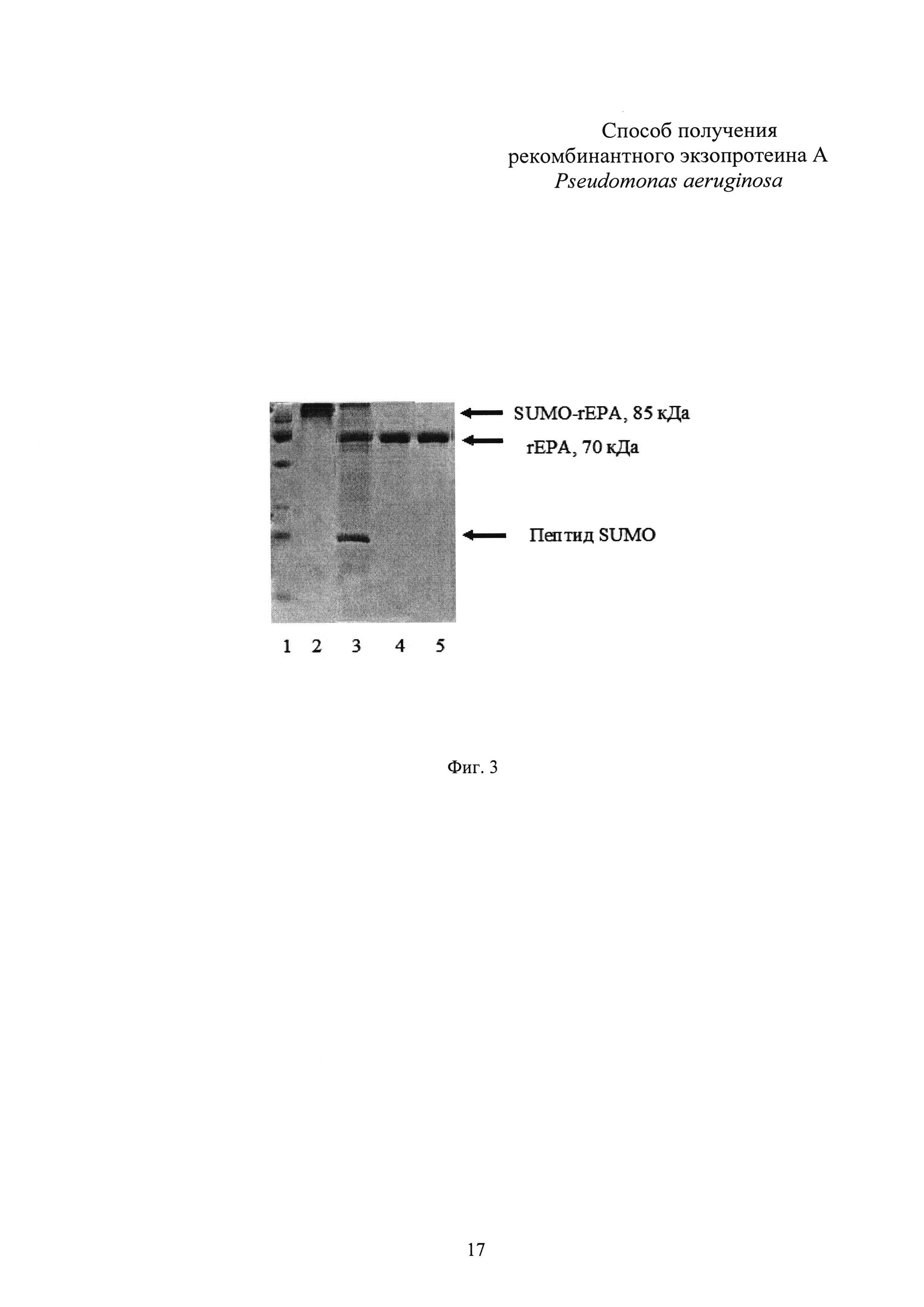
Фиг. 3. Результаты выделения и очистки рекомбинантного белка rEPA из бактериальной биомассы.
Дорожка 1 - маркер молекулярной массы SM0671 (Fermentas). Дорожка 2 - фьюжн-белок SUMO-rEPA, очищенный металл-хелатной хроматографией. Дорожка 3 - расщепление фьюжн-белка SUMO-rEPA протеазой SUMO. Дорожка 4 - белок rEPA, очищенный хроматографией на колонке DEAE-Sepharose. Дорожка 5 - белок rEPA после гель-фильтрационной хроматографии.
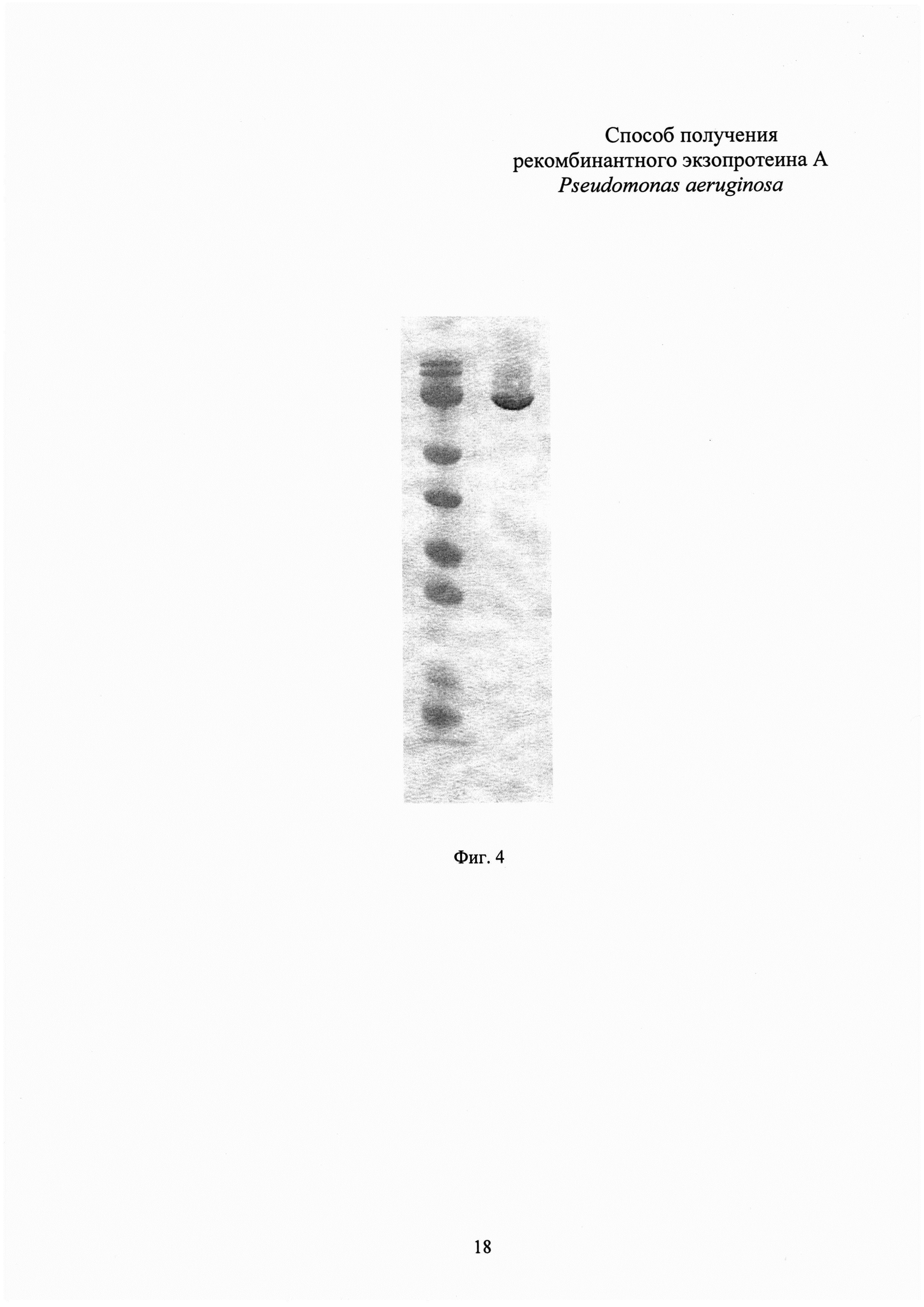
Фиг. 4. Результаты иммуноблоттинга рекомбинантного белка rEPA со специфичными к экзотоксину А P. aeruginosa антителами.
Дорожка 1 - маркер молекулярной массы SM0671 (Fermentas). Дорожка 2 - белок rEPA.
Для лучшего понимания сущности изобретения ниже следуют примеры его конкретного выполнения.
Пример 1. Создание экспрессионной конструкции для продукции рекомбинантного белка rEPA в Е. coli.
Конструируют рекомбинантную плазмидную ДНК рЕТ_rEPA на основе коммерчески доступной плазмиды pET22b(+) (Novagen, США). С помощью компьютерного анализа конструируют последовательность ДНК, кодирующую экзопротеин А P. aeruginosa - rEPA, оптимизированную для продукции белка в Е. coli и синтезируют данную последовательность при помощи ПЦР с перекрывающихся праймеров. На 5'-конец синтезированной последовательности с помощью ПЦР вводят фрагмент ДНК, кодирующий последовательность шести остатков гистидинов и сайт для протеазы SUMO, и на 3'-конец последовательности при помощи ПЦР вводят стоп-кодон и сайт эндонуклеазы рестрикции XhoI. Праймеры, используемые для ПЦР-амплификации, содержат сайты эндонуклеаз рестрикции NdeI и XhoI. Полученную ДНК расщепляют эндонуклеазами рестрикции NdeI и XhoI, и затем лигируют с расщепленной по соответствующим сайтам и очищенной элюцией из агарозного геля векторной плазмидной ДНК pET22b(+). Единичные клоны, содержащие плазмиду pET22b(+) со встроенным фрагментом шести остатков гистидинов, последовательности SUMO и rEPA получают электротрансформацией клеток штамма Е. coli DH12S (Thermo Fisher Scientific, США). Клоны, содержащие инсерт длиной около 2000 п.н., идентифицируют при помощи ПЦР с праймеров Т7 forward и Т7 reverse (Sigma-Aldrich, США). Выделяют плазмидную ДНК и верифицируют корректность встроенной последовательности методом капиллярного секвенирования.
Пример 2. Получение продуцентов и продукция rEPA в Е. coli.
Штамм-продуцент Е. coli BL-rEPA получают электротрансформацией компетентных клеток Е. coli BL21(DE3) плазмидой рЕТ_rEPA.
Проводят аналитическую экспрессию единичных клонов BL21 (DE3), несущих плазмиду рЕТ_rEPA. Для этого единичные колонии Е. coli BL-rEPA выращивают в течение ночи при 37°C в 5 мл среды 2xYT с добавлением 1% глюкозы и 50 мкг/мл ампициллина, засевают 100 мкл ночной культуры в 10 мл среды 2xYT, содержащей 0,1% глюкозы и 50 мкг/мл ампициллина и выращивают при 37°C в течение 3 часов. Экспрессию белка индуцируют добавлением ИПТГ до 1 мМ, экспрессию проводят 4 часа при температуре 37°C. Бактериальные клетки собирают центрифугированием при 3000 g в течение 10 минут, лизируют, затем анализируют уровень экспрессии белка rEPA электрофорезом в денатурирующих условиях в 12% полиакриламидном геле.
Для проведения электрофореза равные аликвоты клеток разных клонов центрифугируют при 3000 g 15 минут, и разделяют на растворимую и нерастворимую фракции белка. Для этого осажденные клетки растворяют в 200 мкл буфера 10 мМ Трис-HCl, pH 8,0, 100 мМ хлорид натрия. Клетки последовательно лизируют добавлением лизоцима (конечная концентрация 20 мкг/мл), Тритон Х-100 до 0,5%, 1 мМ MgCl2 и ДНКазы (конечная концентрация в растворе 10 мкг/мл), и центрифугируют при 18000 g в течение 15 мин. Супернатант, содержащий растворимую фракцию белка отбирают, аликвоту объемом 10 мкл смешивают с 5 мкл буфера для нанесения пробы в ПААГ (50 мМ Трис-HCl, pH 6,8, 2% SDS, 0,1% бромфенолового синего, 10% глицерола, 5% меркаптоэтанола), нагревают смесь в течение 5 минут при 100°C, и наносят на гель. После прохождения электрофореза гель окрашивают кумасси R-250 по стандартной методике Лэммли, и сканируют с помощью денситометра Typhoon FLA9500 (Healthcare, Великобритания). Клоны, обнаруживающие наибольший выход белка (образование на геле яркой полосы с молекулярной массой 85 кДа) отбирают для дальнейшей работы, их выращивают на богатой среде (2xYT) в течение ночи, добавляют глицерин до 15% и замораживают на -70°C для хранения.
Для препаративной экспрессии штаммы-суперпродуценты Е. coli BL-rEPA выращивают в течение ночи при 37°C с добавлением 1% глюкозы и 50 мкг/мл ампициллина на среде 2xYT, помещают 10 мл ночной культуры в 1000 мл среды 2xYT, содержащей 0,1% глюкозы и 50 мкг/мл ампициллина и выращивают при 37°C до достижения 0,8 единиц оптической плотности. Добавляют ИПТГ до 1 мМ, и проводят экспрессию в течение 4 часов при 37°C. Далее клетки собирают центрифугированием при 3000 g 10 минут и хранят в виде замороженных осадков при температуре -70°C до этапа выделения белка.
Пример 3. Выделение и очистка белка rEPA из бактериальной биомассы.
Все этапы выделения рекомбинантного белка rEPA проводят при температуре +4°C. 50 г биомассы суспендируют в 200 мл раствора, содержащего 20 мМ Трис-HCl, pH 8,0, 200 мМ хлорида натрия и ингибитор протеаз Complete (Roche Life Sciences, США), а затем проводят лизис бактериальных клеток. Для этого обрабатывают клеточную суспензию лизоцимом (20 мкг/мл) в течение 10 минут при температуре 4°C, затем добавляют к суспензии Triton Х-100 до концентрации 4%, выдерживают на холоде не менее 10 минут, после чего разрушают ДНК и РНК в образовавшейся смеси добавлением ДНКазы и РНКазы до концентрации 10 мкг/мл каждого фермента в присутствии 1 мМ MgCl2, выдерживают при комнатной температуре 15 минут. Полученный клеточный лизат центрифугируют в течение 20 минут при 18000 g.
Для подготовки колонки с металл-хелатным сорбентом, заряженным ионами кобальта, 2 мл металл-хелатной смолы Talon Superflow помещают в колонку Tricorn 5×100 (GE Healthcare, Великобритания) и промывают 20 объемами деионизированной воды, затем уравновешивают буфером 20 мМ Трис-HCl, pH 7,5, 200 мМ хлорида натрия. Осветленный лизат наносят на металл-хелатную смолу на скорости 1 мл/мин, промывают колонку буфером 20 мМ Трис-HCl, pH 7,5, 200 мМ хлорида натрия. Элюцию проводят буфером 20 мМ Трис-HCl, pH 7,5, 200 мМ хлорида натрия, содержащим 250 мМ имидазола.
Очищенный фьюжн белок SUMO-rEPA расщепляют протеазой SUMO. Протеазу добавляют к раствору белка в буфере 20 мМ Трис-HCl, pH 7,5, 200 мМ хлорида натрия с добавлением 1 мМ ДТТ. Массовое соотношение белка SUMO-rEPA к протеазе SUMO составляет 1:1000. Протеолиз проводят при комнатной температуре в течение 2 часов. Расщепление белка контролируют денатурирующим электрофорезом в 12% ПААГ (Фиг. 3, дорожка 3).
Рекомбинантный белок rEPA отделяют от отщепленного пептида SUMO и продуктов гидролиза ионообменной хроматографией. Стадию очистки проводят на колонке, упакованной 2 мл ионообменной смолы DEAE Sepharose (GE Healthcare, Великобритания). Сорбент промывают 20 объемами буфера Б: 20 мМ Трис-HCl, pH 7,5, 500 мМ хлорида натрия, затем уравновешивают буфером А: 20 мМ Трис-HCl, pH 7,5, 20 мМ хлорида натрия. Белковый элюат, полученный на стадии металл-хелатной хроматографической очистки, разводят 1:20 Буфером А и наносят на колонку на скорости 1 мл/мин. Колонку промывают 10 объемами Буфера А. Элюцию белка осуществляют градиентом Буфера Б от 0% до 100% в течение 40 минут при скорости потока 1 мл/мин. Фракции, содержащие белок rEPA, идентифицируют электрофорезом в 12% ПААГ (Фиг. 3, дорожка 4), концентрируют при помощи центрифужных концентраторов Amicon Ultra-15 (Millipore, США).
Сконцентрированный белок rEPA доочищают с применением эксклюзионной хроматографии на колонке Superdex 200 (GE Healthcare), уравновешенной фосфатно-солевым буфером (1,7 мМ KH2PO4, 5 мМ Na2HPO4 150 мМ NaCl, pH 7,4). Белковый элюат, полученный на предыдущей стадии, после концентрирования наносят на колонку в объеме 1 мл через петлю инжектора. После снятия всех фракций повторяют нанесение пробы до тех пор, пока не очистят весь объем элюата. В случае получения сложной хроматографической картины каждую фракцию собирают в отдельную пробирку. Фракции, содержащие очищенный рекомбинантный белок определяют денатурирующим электрофорезом в полиакриламидном геле (Фиг. 3, дорожка 5), объединяют, концентрируют и измеряют концентрацию белка. Окрашенный гель сканируют в денситометре и определяют сравнительную интенсивность окрашивания полос. Рекомбинантный экзопротеин rEPA хранят в аликвотах при температуре -70°C в присутствии 30% глицерина. Выход рекомбинантного белка rEPA составляет 0,25 г с литра культуры.
Пример 4. Анализ корректности рекомбинантного белка rEPA
Для подтверждения соответствия рекомбинантного белка rEPA нативному белку ЕРА используют метод иммуноблоттинга с поликлональными кроличьими антителами против экзотоксина А P. aeruginosa (Sigma, США). Очищенный белок rEPA в количестве 2 мкг вносят в лунку 12% ПААГ и подвергают электрофорезу в денатурирующих условиях. По окончании электрофореза ПААГ помещают в сэндвич для блоттинга для переноса белков из геля на PVDF мембрану Hybond-P (GE Healthcare, Великобритания). Перенос белков на мембрану проводят в буфере 50 мМ Трис-основание, 38 мМ глицина, 10% этилового спирта в течение часа при напряжении электрического поля 100 V с охлаждением раствора для переноса. По окончании переноса мембрану вынимают и погружают в обезжиренное молоко (МДЖ не более 0,5%) на 40 минут для блокировки свободных валентностей мембраны. Затем мембрану трижды отмывают фосфатно-солевым буфером (1,7 мМ KH2PO4, 5 мМ Na2HPO4, 150 мМ NaCl, pH 7,4). Погружают мембрану в раствор кроличьих поликлональных антител против экзотоксина А Р. aeruginosa (Sigma, США) с разведением антител в фосфатно-солевом буфере 1:20000 (в соответствии с инструкцией производителя). Инкубируют в течение 1 ч при 37°C на орбитальном шейкере (Elmi, Латвия) при 300 об./мин. Отмывают трижды в фосфатно-солевом буфере с добавлением 0,05% Твин-20. Отмытую мембрану помещают в раствор козьих антител к иммуноглобулинам класса G кролика, конъюгированным с пероксидазой хрена (Sigma, США), в фосфатно-солевом буфере в разведении 1:80000 (в соответствии с инструкцией производителя). Инкубируют мембрану в растворе конъюгата в течение 40 минут при 37°C с перемешиванием на орбитальном шейкере при 300 об./мин. Отмывают мембрану шестикратно фосфатно-солевым буфером с добавлением 0,05% Твин-20. Проявляют связавшиеся со специфическими антителами против экзотоксина А Р. aeruginosa молекулы конъюгата козьих антител с пероксидазой хрена, погружая мембрану в 1% раствор диаминобензидина, содержащий NiCl2, CoCl2 и 0,001% Н2О2. Выдерживают мембрану в проявляющем растворе до развития окраски (но не более 5 минут), не допуская фонового окрашивания мембраны. Для остановки реакции мембрану вынимают из окрашивающего раствора и погружают в деионизированную воду, после чего просушивают с помощью фильтровальной бумаги. Результаты иммуноблоттинга для рекомбинантного белка rEPA показаны на Фиг. 4.
Способ получения рекомбинантного экзопротеина А P. aeruginosa (rEPA), включающий получение экспрессионного плазмидного вектора pET-rEPA (SEQ NO: 3), содержащего промоторную последовательность ДНК бактериофага Т7 и последовательности ДНК, кодирующие N-концевую область белкового продукта энхансера трансляции (аминокислотная последовательность MASMT), шесть остатков гистидина, сайт расщепления протеазой SUMO и оптимизированную для трансляции в Е. coli последовательность (SEQ NO: 1), кодирующую рекомбинантный белок rEPA (SEQ NO: 2); продукцию рекомбинантного химерного белка-предшественника в гетерологичной системе экспрессии в электрокомпетентных клетках Е. coli BL21(DE3), трансформированных плазмидным вектором pET-rEPA с получением штамма Е. coli BL-rEPA, которая осуществляется при 37°С для обеспечения накопления максимального количества белка-предшественника в растворимой фракции; лизис бактериальной массы в присутствии 4% Triton Х-100 для сохранения белка-предшественника в растворимой форме; выделение белка предшественника с помощью металл-хелатной хроматографии на сорбенте Talon, заряженном ионами Со, с последующим отщеплением гексагистидина и пептида SUMO протеазой SUMO из состава полипептида; доочищение отщепленного рекомбинантного белка rEPA анионообменной хроматографией на сорбенте DEAE-Sepharose и гель-фильтрационной хроматографией на колонке, заполненной Superdex 200, с переводом в конечный буфер со значением рН 7.5, с получением рекомбинантного белка rEPA.