Результат интеллектуальной деятельности: СПОСОБ ВЫДЕЛЕНИЯ БАКТЕРИОЦИНОВ
Вид РИД
Изобретение
Изобретение относится к биохимии и биотехнологии, а именно к способу очистки бактериоцинов.
Бактериоцинами называются пептиды с молекулярной массой несколько килодальтон, секретируемые некоторыми грамположительными и грамотрицательными бактериями с последующим взаимодействием с мембранами реципиентных микробных клеток. Исследования ряда бактериоцинов показали их нетоксичность, нереактогенность и неаллергенность [Miller KW. Isolation and characterization of pediocin AcH chimeric protein mutants with altered bactericidal activity. Appl. Environ. Microbiology. 1998; 64; 1997-2005].
Бактериоцины могли бы найти широкое применение в медицине и ветеринарии (вместо антибиотиков), а также в пищевой промышленности (как консерванты). Однако этому препятствуют трудности получения очищенных бактериоцинов.
Известно использование только одного бактериоцина в промышленности - низина, секретируемого культурой Streptococcus lactis. В препарате всего лишь 2,5% низина [Mazzotta A.S., Crandall A.D., and Montville T.J. Nisin resistance in Clostridium botulinum spores and vegetative cells. Appl. Environ. Microbiol. 1997; 63: 2654-2659]. Применение же низина высокой чистоты экономически неэффективно.
В настоящее время высокоочищенные бактериоцины получают, в основном, для структурных исследований (например, для определения первичной структуры). Обычно используют осаждение сульфатом аммония, ионообменную хроматографию на катионо- и/или анионообменниках, гидрофобную хроматографию, высокоэффективную жидкостную хроматографию, гель-фильтрацию. Если применяют 1-2 способа очистки, то иногда может быть достигнут выход целевого продукта до 60-80% от общей активности в культуральной жидкости, однако чистота его, как правило, недостаточна для использования в медицинской промышленности [Carolissen-Mackay V, Arendse G, Hastings JW. Purification of bacteriocins of lactic acid bacteria: problems and pointers. Int. J. Food Microbiol. 1997; 34: 1-16].
Увеличение числа способов очистки ведет к резкому падению выхода, который может составлять проценты или даже десятые доли процента [Mortvedt CI, Nissen-Meyer JM, Sletten K, Nes IF. Purification and amino acid sequence of lactocin S, a bacteriocin produced by Lactobacillus sakei L45. Appl. Environ. Microbiol. 1991; 57: 1829-1834]. Даже после 3-4 x способов очистки чистота бактериоцинов зачастую недостаточна для определения первичной структуры и нужны еще один-два для достижения электрофоретической чистоты. Существенно также, что некоторые из них, например, гель-фильтрацию, трудно применить для крупномасштабного процесса.
Наиболее близким к предлагаемому является способ сорбции-десорбции бактериоцинов с поверхности клеток высушенных молочнокислых бактерий (авторы называют его «экстракцией») [Yang R, Johnson MC, Ray В. Novel method to extract large amounts of bacteriocins from lactic acid bacteria. Appl. Environ. Microbiol. 1992; 58: 3355-3359.]. Было показано, что в процессе ферментации при нейтральных значениях рН бактериоцины, продуцируемые четырьмя видами этих бактерий, сорбируются на клетках, а при рН 1,5-2,0 при перемешивании в течение 1 часа в присутствии 0,1 М NaCl, добавляемого для предотвращения слипания клеток, десорбируются с них. После удаления клеток супернатант диализуют и замораживают.
К недостаткам этого способа можно отнести сильное варьирование наиболее важных показателей: выхода и чистоты целевых продуктов. Выходы были от 44% до почти 100%, а число белковых пиков по данным электрофореза колебалось от одного до нескольких, что говорит о загрязнении целевого продукта балластными белками.. Кроме того, при масштабировании диализ будет усложнять выделение и очистку и может стать критической операцией. Авторы диализовали 1 л супернатанта, причем поры диализных мешков отсекали молекулы >1 кДа. Такой диализ должен идти весьма медленно и для объемов порядка 5 л будет совершенно неприемлемым.
Задачей изобретения является ускорение способа очистки бактериоцинов, увеличение выхода и чистоты целевых продуктов у продуцентов различных видов и родов полностью сохраняющих общую активность культуральной жидкости после осаждения сульфатом аммония и последующего диализа осадка и пригодного для крупномасштабного процесса.
Задача решается тем, что предлагаемый способ включает культивирование штамма-продуцента с последующим выделением и очисткой пептидной фракции. Вначале культуральную жидкость концентрируют на полых волокнах, отсекающих макромолекулы >15 кДа и к концентрату клеток добавляют сухой NaCl в конечной концентрации 0,5 М. Перемешивают на качалке в течение 20 мин, суспензию центрифугируют и отделяют супернатант. В супернатанте рН доводят до 3,0 четырехмолярным раствором HCl. Образующуюся суспензию центрифугируют, а осадку добавляют воду в объеме 0,1% от начального объема культуральной жидкости. Суспендируют осадок и добавляют такой же объем спирта, растворяющегося в воде в любом соотношении, выдерживают 30 мин при 0°С и центрифугируют, спирт из раствора удаляют выпариванием, добавляют воду до начального объема спиртового раствора, добавляют активированный уголь в количестве 0,5% w/v (v-объем воды), центрифугируют, удаляя адсорбированные на угле примеси. Водный раствор пропускают через мембрану, отсекающую макромолекулы >10 кДа. Все этапы центрифугирования проводят при 10000g, 15 мин. Элюат собирают и анализируют.
Отличительной особенностью предлагаемого способа является добавление спирта, (этанола, пропанола, изопропанола), к фрагментам клеток, на поверхности которых находится бактериоцин. Под действием спирта происходит снятие бактериоцина с поверхностных клеточных фрагментов и предложенный способ очистки можно назвать «гидрофобной хроматографией на поверхностных фрагментах клеток продуцента». В подавляющем большинстве работ считалось, что ведется очистка бактериоцинов, находящихся в растворимом состоянии и использовались способы, которые обычно применяются для очистки растворимых высокомолекулярных белков. Это приводило либо к низкому выходу, если использовались несколько способов для очистки, или к более высокому выходу, но низкой степени очистки, если использовались один-два способа.
Предлагаемый способ основан на общих свойствах бактериоцинов и общих свойствах поверхности клеток продуцентов различных видов и родов полностью сохраняющих общую активность культуральной жидкости после осаждения сульфатом аммония и последующего диализа осадка, поэтому пригоден для очистки не одного, а многих или даже всех бактериоцинов. Все бактериоцины являются низкомолекулярными пептидами (молекулярная масса - 2-7 кДа). Это - гидрофильно-гидрофобные термостабильные вещества. Гидрофильность (и хорошая растворимость в водном растворе) необходимы для доставки бактериоцина к реципиентной клетке, а гидрофобность необходима для связывания с мембранами. Общим свойством поверхности грамотрицательных и грамположительных клеток-продуцентов (пептидогликана и мембран) является их гидрофобность.
Предлагаемый способ очистки бактериоцинов осуществляют следующим образом:
- культуральную жидкость концентрируют на полых волокнах, отсекающих вещества с молекулярной массой более 15 кДа;
- к концентрату культуральной жидкости добавляют сухой NaCl с конечной концентрацией 0,5 М и перемешивают на качалке со скоростью 100 кач/мин в течение 20 мин;
- центрифугируют клетки, обработанные 0,5 М NaCl, отделяют их от супернатанта;
- доводят рН супернатанта 4 М HCl до значения 3,0 и получают суспензию клеточных фрагментов;
- центрифугируют полученную суспензию, удаляют надосадочную жидкость;
затем стадия: добавляют воду к осадку клеточных фрагментов в объеме 0.1% от начального объема культуральной жидкости, суспендируют фрагменты, добавляют изопропанол в объеме 0.1% от начального объема культуральной жидкости, выдерживают суспензию в течение 30 мин при 0°С, центрифугируют, отделяют осадок от раствора спирта;
- удаляют спирт из раствора на роторном испарителе при 60°С;
- добавляют воду до начального объема спиртового раствора и активированный уголь в количестве 0.5% w/v,
- выдерживают 15 мин, центрифугируют, удаляют активированный уголь с адсорбированными на нем примесями;
- пропускают водный раствор через мембрану, отсекающую макромолекулы >10 кДа.
Во всех случаях центрифугирование проводят при 10000g, 15 мин.
Активность бактериоцинов определяют в условных единицах "агарового теста". Для проведения этого теста индикаторный штамм наносят на чашку Петри с агаром, смешанным с питательной средой так, что за ночь при 37°С вырастает сплошной газон культуры. В качестве индикаторного штамма, чувствительного к действию бактериоцина, во всех примерах используют культуру Lister ea monocytogenes.
В агаре делают лунки диаметром 5 мм. Исследуемые образцы супернатанта, концентрата или элюата добавляют в эти лунки в объеме 10 мкл, титруют с двойным шагом, предварительно инкубируют 3 часа при комнатной температуре, а затем в течение ночи при 37°С. После окончания роста становятся видимыми зоны ингибирования. Величина разбавления, при котором образец далее не проявляет бактерицидной активности, представляет собой значение разбавления, после которого зоны ингибирования не просматриваются (конечное разбавление). За единицу активности принимают максимальное разведение пробы, при котором еще наблюдается лизис клеток индикаторного штамма, отнесенное к 1 мкл раствора или суспензии, в которых присутствуют бактериоцин.
Агаровый тест используется также для определения того, инактивируется ли вещество, вызывающее гибель клеток индикаторного штамма, в присутствии фермента, протеиназы К, т.е. является ли оно полипептидом. Для этого к супернатанту культуральной жидкости в объеме 1 мл и значении рН 7,0-7,2 добавляют раствор фермента с концентрацией 4-5 мг/мл в 0,05М фосфатном буфере, рН 7,0 и объеме 20 мкл. Инкубируют 1 час при 37°С. Отбирают 10 мкл и помещают в лунку с агаром, смешанным с питательной средой. Параллельно добавляют в лунку 10 мкл супернатанта без фермента, титруют оба образца с двойным шагом и сравнивают наличие или отсутствие зон ингибирования роста.
Примеры осуществления способа очистки бактериоцинов.
В качестве продуцентов бактериоцинов использовали следующие микроорганизмы из Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ-Оболенск»: Bacillus subtilis, регистрационный номер В-6799; Streptococcus raffinolactis, регистрационный номер S-4515; Streptococcus raffinolactis, регистрационный номер S-4516; Bacillus polymixis, регистрационный номер В-5831. В качестве тест-культуры использовали Listeria monocytogenes, регистрационный номер L-5949.
Пример 1.
Культуру Bacillus subtilis В-6799 выращивают в биореакторе с рабочим объемом 8,2 л на солевой среде следующего состава на 1 литр: K2HPO4 - 10,5 г; KH2PO4 - 4,5 г; (NH4)2SO4 - 1,0 г; цитрат Na·H2O - 0,5 г; MgSO4·7H2O (20 г/100 мл) - 1 мл/л; 20%-я глюкоза - 10 мл. Условия выращивания: рН 7,2, температура 37°С, скорость оборотов мешалки 200-250 об/мин, продувка воздухом: 6 л/мин, продолжительность ферментации 10 час до достижения стационарной фазы. Культуральную жидкость концентрируют в 8 раз на полых волокнах, отсекающих макромолекулы с молекулярной массой более 15 кДа. К концентрату добавляют сухой NaCl до конечной концентрации 0,5 М небольшими порциями при постоянном перемешивании на качалке со скоростью 100 кач/мин. Перемешивают в течение 20 мин. Затем центрифугируют при 10000g, 15 мин. Значение рН супернатанта доводят 4М HCl до 3,0, оставляют при 0°С на 30 мин для оседания клеточных фрагментов и центрифугируют 10000g, 15 мин. К осадку добавляют 6 мл воды и суспендируют осадок, добавляют 6 мл изопропанола, выдерживают 30 мин при 0°С, затем центрифугируют при 10000g, 15 мин. Изопропанол выпаривают на роторном испарителе при 60°С и добавляют воду до прежнего объема спиртовой суспензии. Добавляют активированный уголь в количестве 0,5% w/v. Центрифугируют 10000 g, 15 мин, удаляют уголь и адсорбированные на нем примеси. Водный раствор пропускают через мембрану, отсекающую макромолекулы >10 кДа. Выход составляет 94% от начальной общей активности в культуральной жидкости; получают электрофоретически чистый продукт. Результаты представлены в таблице 1.
|
Таким образом, как видно из результатов таблицы, предлагаемый способ позволяет получить бактериоцин с выходом более 90%.
Пример 2.
Культуру Streptococcus raffmolactis S-4515 выращивают в качалочных колбах при температуре 37°С, 200-250 кач/мин, время культивирования 12 ч, рН 7,0, объем раствора в колбе 250 мл. Состав питатательной среды (г/л): ферментативный гидролизат мяса - 10,0; ферментативный гидролизат казеина - 10,0; дрожжевой экстракт - 2,0; декстроза - 1,0; хлористый натрий - 5,0; бисульфит натрия - 0,1. Культуральную жидкость в объеме 1,5 л концентрируют в 10 раз на полых волокнах, отсекающих макромолекулы с молекулярной массой более 15 кДа и центрифугируют при 10000g, 15 мин. К полученному супернатанту добавляют сухой NaCl до конечной концентрации 0,5М при постоянном перемешивании на качалке со скоростью 100 кач/мин и перемешивают 20 мин. Центрифугируют при 10000g, 15 мин. Значение рН супернатанта доводят 4М HCl до 3, и оставляют при 0°С на 30 мин для оседания клеточных фрагментов. Суспензию центрифугируют при 10000g, 15 мин, надосадочную жидкость удаляют, а к осадку добавляют воду в объеме 1,5 мл., суспендируют осадок и добавляют 1,5 мл пропанола и выдерживают 30 мин при 0°С и центрифугируют при 10000g, 15 мин. Пропанол выпаривают на роторном испарителе при 60°С, добавляют воду до прежнего объема, затем добавляют активированный уголь (0,5% w/v) и центрифугируют при 10000g, 15 мин, удаляя адсорбированные примеси, водный раствор пропускают через мембрану, отсекающую макромолекулы >10 кДа. Выход бактериоцина: 95% от общей активности в начальной культуральной жидкости, получают электрофоретически чистый продукт.
Пример 3.
Культуру Streptococcus raffinolactis S-4516 выращивают в качалочных колбах при температуре 37°С, 200-250 кач/мин, время культивирования 12 ч, рН 7,0, объем раствора в колбе 250 мл. Состав питатательной среды (г/л): ферментативный гидролизат мяса - 10,0; ферментативный гидролизат казеина - 10,0; дрожжевой экстракт - 2,0; декстроза - 1,0; хлористый натрий - 5,0; бисульфит натрия - 0,1. Культуральную жидкость в объеме 1,5 л концентрируют в 10 раз на полых волокнах, отсекающих макромолекулы с молекулярной массой более 15 кДа. К концентрату добавляют сухой NaCl до конечной концентрации 0,5М, перемешивают 20 мин и центрифугируют при 10000g, 15 мин, получая супернатант. Значение рН супернатанта доводят 4М HCl до 3,0 и оставляют в холодильнике при 0°С на 30 мин для оседания клеточных фрагментов. Супернатант центрифугируют при 10000g, 15 мин, надосадочную жидкость удаляют, а к осадку добавляют воду 1,5 мл. Суспендируют в воде, добавляют 1,5 мл пропанола. Через 30 мин центрифугируют при 10000g, 15 мин. Удаляют спирт выпариванием, добавляют воду до прежнего объема. Затем добавляют активированный уголь в количестве 0,5% w/v и центрифугируют при 10000g, 15 мин, удаляют уголь и адсорбированные примеси. Водный раствор пропускают через мембрану, отсекающую макромолекулы >10 кДа.
Выход бактериоцина: 95% от общей активности в начальной культуральной жидкости, продукт электрофоретически чист.
Пример 4.
Культуру Bacillus polymixis B-5831 выращивают в качалочных колбах при температуре 37°С, 200-250 кач/мин, время культивирования 12 ч, рН 7,0, объем раствора в колбе 250 мл. Состав питатательной среды (г/л): мясной экстракт - 5,0; пептон - 4,0; дрожжевой экстракт - 5,0; декстроза - 1,0; хлористый натрий - 2,5; глюкоза - 8,0-10,0 мл;. Культуральную жидкость в объеме 1,5 л концентрируют в 10 раз на полых волокнах, отсекающих макромолекулы с молекулярной массой более 15 кДа. К концентрату добавляют сухой NaCl до конечной концентрации 0,5М при перемешивании на качалке в течение 20 мин, центрифугируют при 10000g, 15 мин, получая супернатант. Значение рН доводят 4М HCl до 3,0 и оставляют при 0°С на 30 мин для оседания клеточных фрагментов. Центрифугируют при 10000g, 15 мин, надосадочную жидкость удаляют, а к осадку добавляют 1,5 мл воды, суспендируют и добавляют 1,5 мл пропанола. Выдерживают 30 мин при 0°С, центрифугируют при 10000g, 15 мин. Пропанол выпаривают на роторном испарителе при 60°С, добавляют воду до прежнего объема спиртовой суспензии, затем добавляют активированный уголь в концентрации 0,5 w/v. Центрифугируют при 10000g, 15 мин, удаляют уголь и адсорбированные им примеси, а водный раствор пропускают через мембрану, отсекающую макромолекулы >10 кДа. Выход бактериоцина: 93% от общей активности в начальной культуральной жидкости, продукт электрофоретически чист.
Для определения молекулярной массы и чистоты целевого продукта используют метод SDS-PAG электрофореза в 16% полиакриламидном геле (стандартный протокол фирмы Bio-Rad) с набором белков-маркеров от 10 до 170 кДа (фирма Fermentas). 5 мкл раствора бактериоцина, разбавленного до концентрации ~0,5 мг/мл, смешивают с 5 мкл буфера для белкового SDS-PAG электрофореза и прогревают при 60°С. Движение белков происходит при силе тока в разделяющем геле 10 mA в течение 30 мин; в концентрирующем геле 14 mA - 60 мин. Гель фиксируют в растворе 10% уксусной кислоты и 20% изопропанола в течение часа, отмывают дистиллированной водой в течение 2 часов и окрашивают в растворе Кумасси G-250.
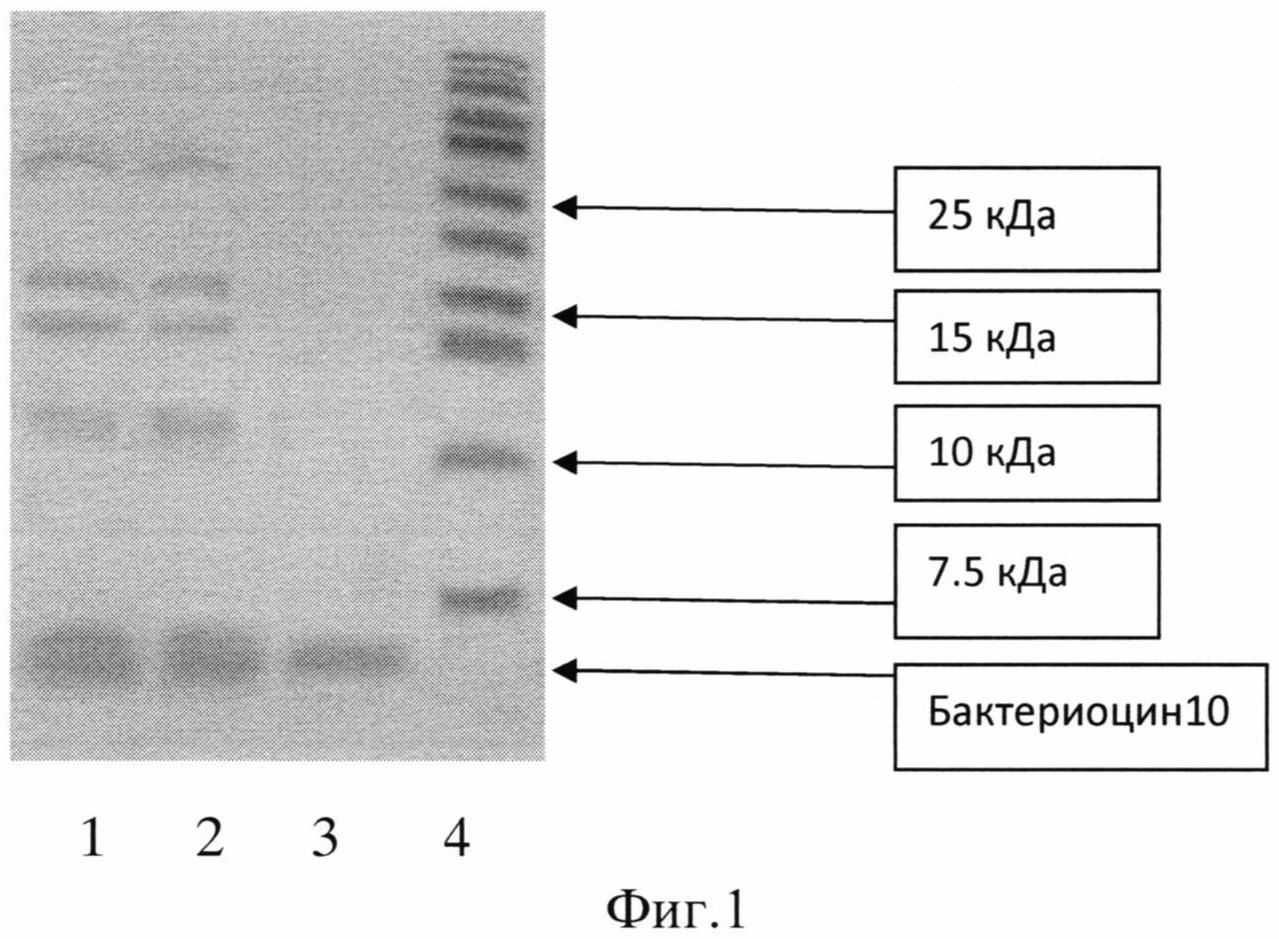
На фиг.1 приведена электрофореграмма очистки бактериоцина (пример 2).
1 - образец после действия пропанола на фрагменты
2 - образец на нитроцеллюлозной мембране
3 - бактериоцин, прошедший через мембрану, отсекающую белки >10 кДа
4 - белки-маркеры
Таким образом, предложенный способ очистки, путем удаления бактериоцина с поверхностных клеточных фрагментов под действием спирта можно назвать «гидрофобной хроматографией на поверхностных фрагментах клеток продуцента». Способ применим для крупномасштабного получения бактериоцинов, секретируемых продуцентами разных родов и видов, отсутствуют операции, требующие длительного времени (например, диализ), а результатом является электрофоретически чистый продукт с выходом более 90% от общей активности в культуральной жидкости.