Результат интеллектуальной деятельности: ДИПЕПТИДНОЕ ПРОЛЕКАРСТВО, ЕГО ПРИМЕНЕНИЕ И ЛЕКАРСТВЕННОЕ СРЕДСТВО
Вид РИД
Изобретение
Настоящее изобретение относится к пролекарствам, более конкретно к дипептидному пролекарству, его применению и лекарственному средству.
Пролекарства являются производными действующего вещества, которые перед высвобождением собственно действующего вещества претерпевают происходящее in vivo одноступенчатое или многоступенчатое биопревращение ферментативного и/или химического характера. Пролекарства, как правило, содержат химическую группировку, способствующую улучшению комплекса свойств лежащего в их основе действующего вещества [Р. Ettmayer и другие, J. Med. Chem., 47, 2393 (2004)]. При этом для обеспечения оптимального фармацевтического действия структуру указанной химической группировки и предусматриваемый механизм высвобождения действующего вещества из Пролекарства следует приводить в чрезвычайно точное соответствие с индивидуальным действующим веществом, показанием для его применения, местом его действия и способом применения. Многие лекарственные средства применяют в виде пролекарств, которые в отличие от лежащих в их основе действующих веществ характеризуются более высокой биодоступностью, что достигается, например, благодаря оптимизации физико-химических характеристик подобных пролекарств, в частности, повышению растворимости, а также улучшению способности к активному и пассивному поглощению или специфичному для тех или иных тканей распределению. Из обширного перечня касающейся пролекарств литературы особо следует упомянуть, например, Н. Bundgaard (издатель), Design of Prodrugs: Bioreversible derivatives for various functional groups and chemical entities, издательство Elsevier Science Publishers B.V., 1985.
Аденозин (пуриновый нуклеозид) присутствует в любых клетках и выделяется в свободном виде в качестве одного из многих физиологических и патофизиологических стимулирующих веществ. Аденозин образуется в качестве промежуточного продукта при деструкции аденозин-5’-монофосфата (AMP) и 8-аденозилгомоцистеина внутри клеток, однако, может высвобождаться из них и вследствие присоединения к специфическим рецепторам оказывать воздействие в качестве гормонального вещества или нейротрансмиттера. Посредством аденозин 1-рецепторов оказывают воздействие на эссенциальные функции, прежде всего, в возбудимых и/или действующих клетках различных тканей [смотри, например, K. A. Jacobson, Z.-G. Gao, Nat. Rev. Drug Discover., 5, 247-264 (2006)].
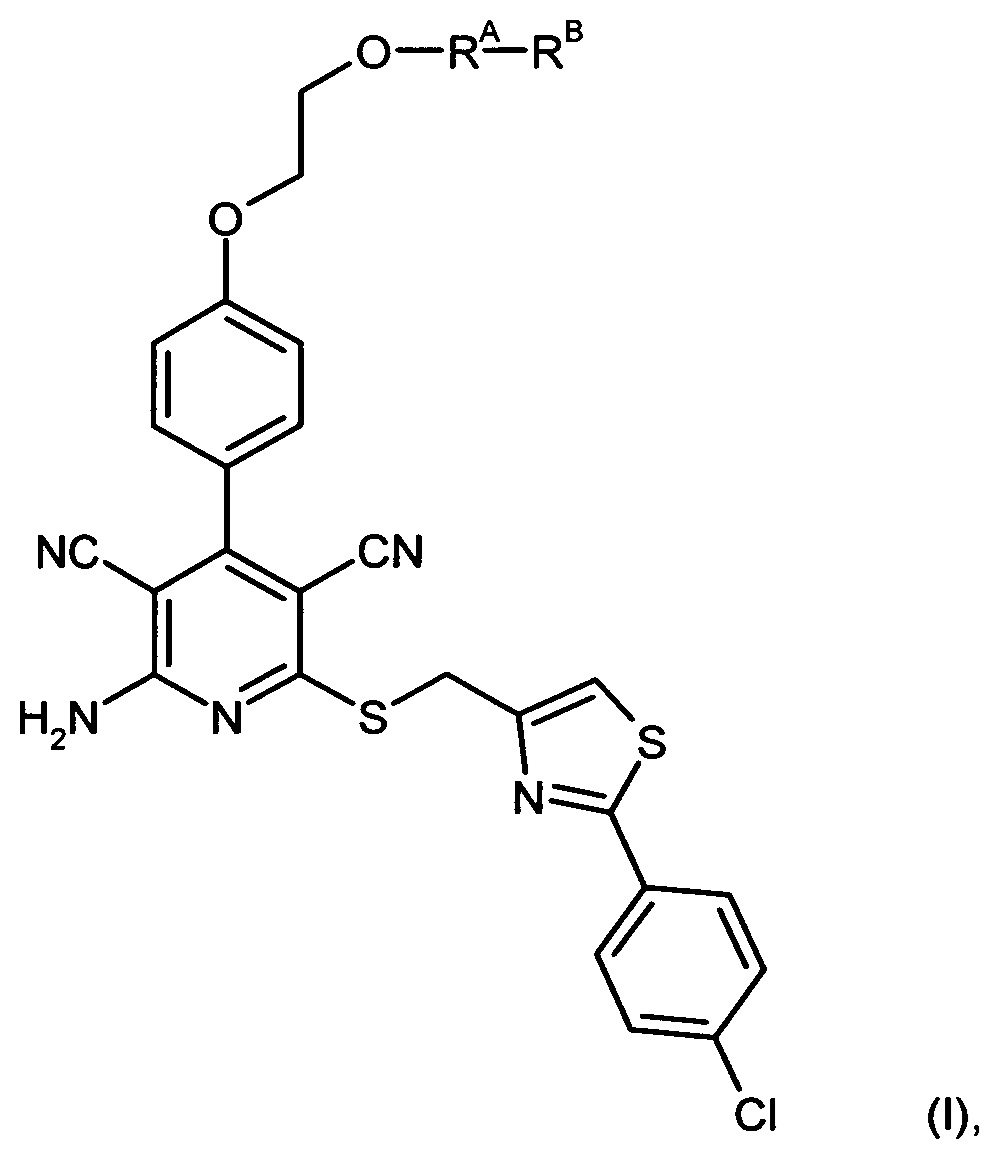
2-Амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}тио)-4-[4-(2-гидрокси-этокси)фенил]пиридин-3,5-дикарбонитрил [соединение формулы (А)] является эффективным при оральном применении агонистом рецептора аденозина 1, находящимся в настоящее время на стадии углубленного клинического исследования в качестве потенциального нового фармацевтического действующего вещества, предназначенного прежде всего для профилактики и лечения сердечно-сосудистых заболеваний [смотри WHO Drug Information, том 20, 2 (2006), а также получение и применение указанного соединения согласно примеру 6 международной заявки WO 03/053441].
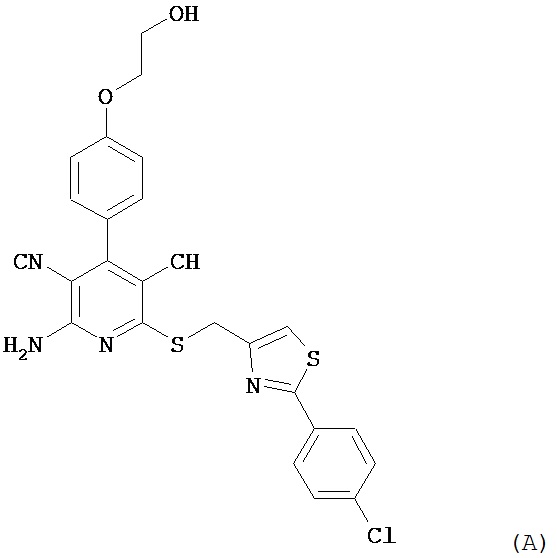
Однако соединение формулы (А) обладает низкой растворимостью в воде, физиологических средах и органических растворителях, а также ограниченной биодоступностью при оральном применении суспензий этого кристаллического вещества. Указанные обстоятельства, с одной стороны, обусловливают ограничение внутривенного применения соединения формулы (А) в качестве действующего вещества чрезвычайно низкими дозировками, поскольку приготовление инфузионных растворов на основе физиологических солевых растворов с использованием обычных гидротропных солюбилизаторов оказывается весьма затруднительным. С другой стороны, затруднительным является также изготовление соответствующих лекарственных препаратов в виде таблеток.
Исходя из вышеизложенного в основу настоящего изобретения была положена задача предложить производные или пролекарства соединения формулы (А), которые обладают повышенной растворимостью в указанных выше средах и/или улучшенной биодоступностью при оральном применении и вместе с тем после применения способны контролируемо высвобождаться в организме пациента. Повышенная пригодность соединения формулы (А) для внутривенного применения могла бы открыть другие сферы его терапевтического применения в качестве действующего вещества.
Обзор пролекарств, производных сложных эфиров карбоновых кислот, и возможные свойства этих соединений опубликованы, например, в К. Beaumont и другие в Curr. Drug Metab., 4, 461-485 (2003).
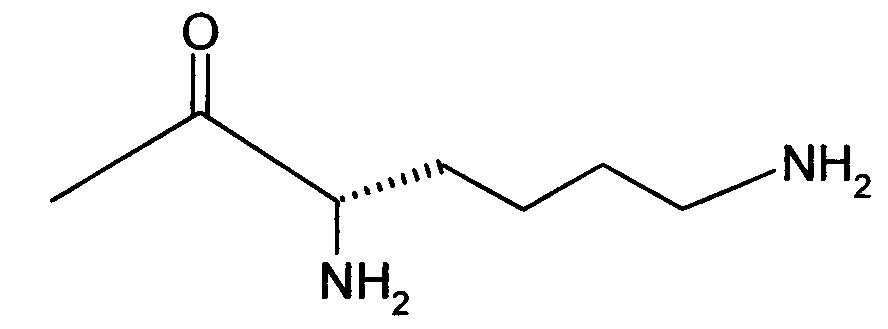
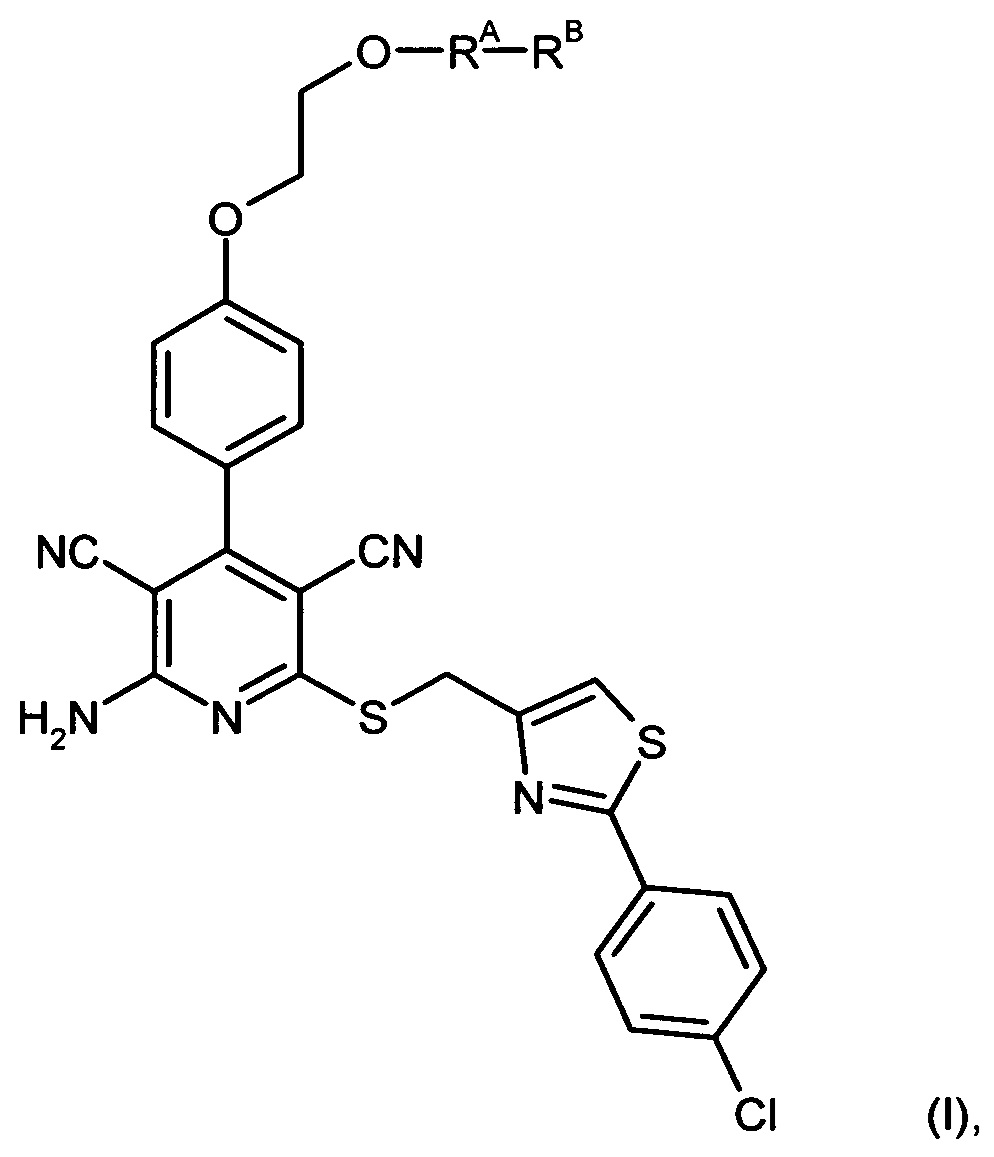
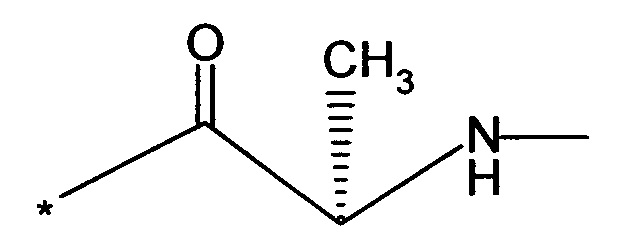
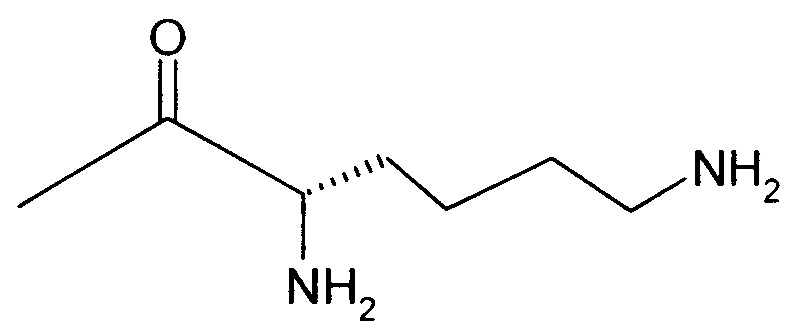
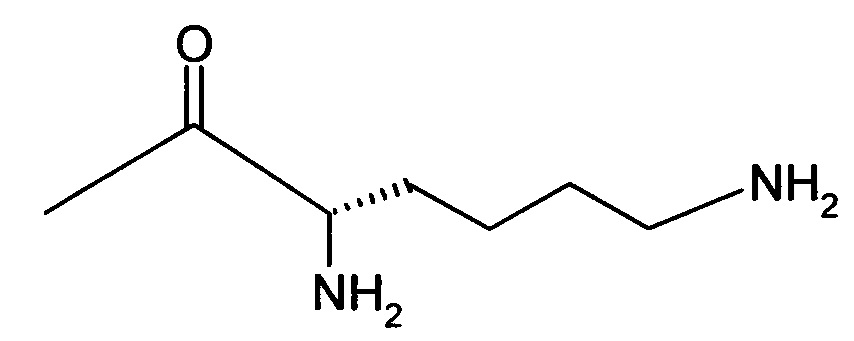
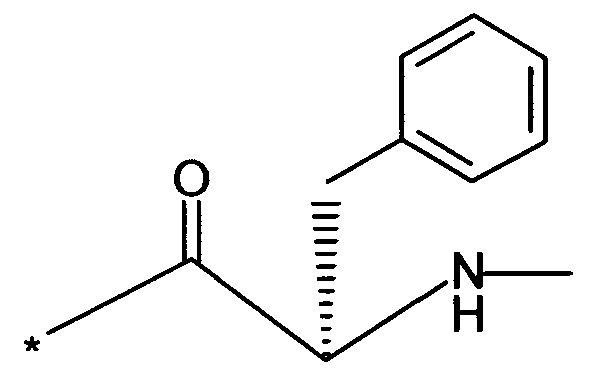
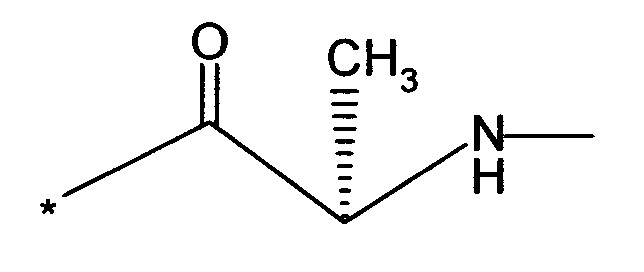
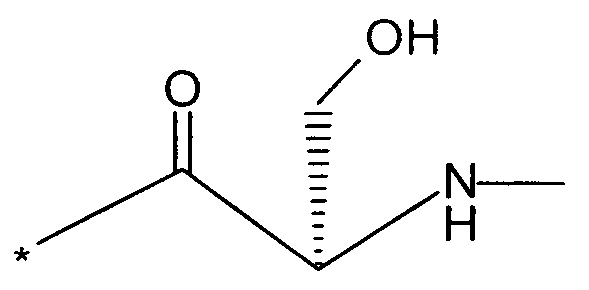
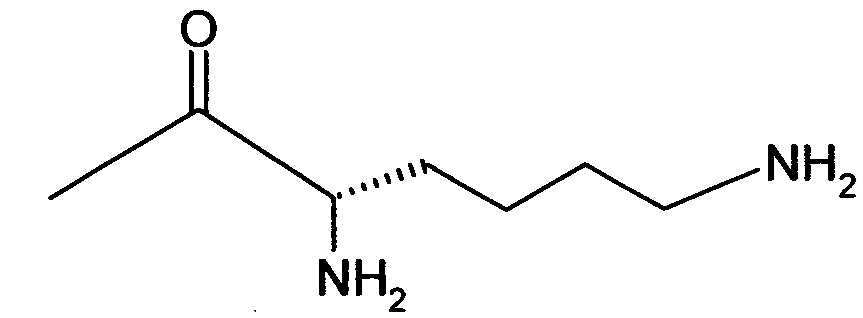
Вышеуказанная задача решается предлагаемым дипептидным пролекарством в виде дигидрохлорида общей формулы (I):
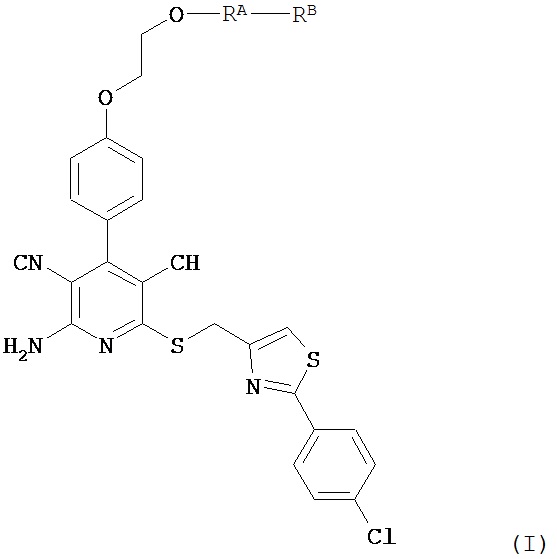
в которой
RA означает группу
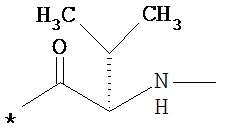 и
и
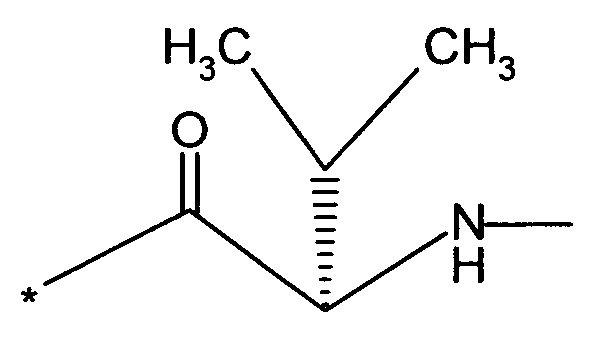
RB означает группу
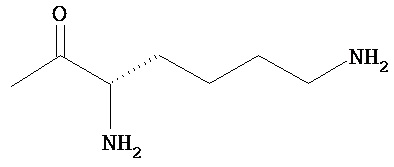
или
RA означает группу
 и
и
RB означает группу
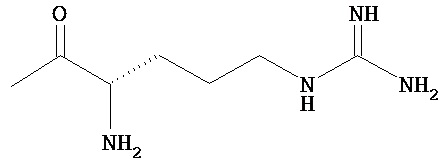
или
RA означает группу
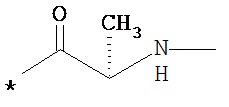 и
и
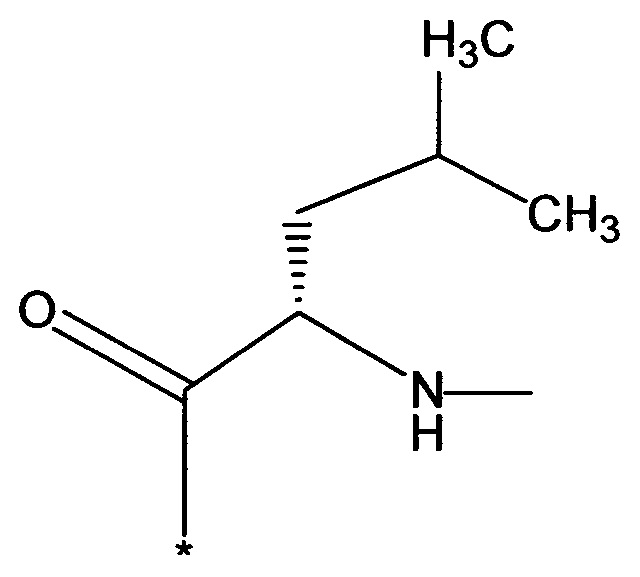
RB означает

или
RA означает группу
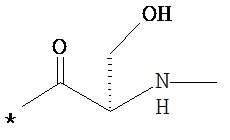 и
и
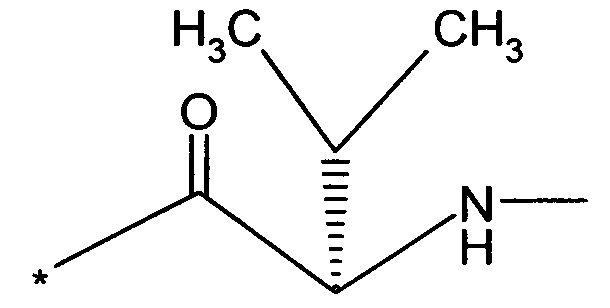
RB означает группу

или
RA означает группу
 и
и
RB означает группу

или
RA означает группу
 и
и
RB означает группу

или
RA означает группу
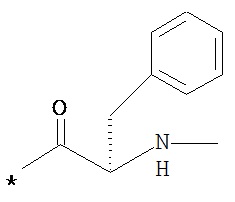 и
и
RB означает группу
 ,
,
а * означает место присоединения к атому кислорода.
Соединения согласно изобретению можно получать широко известными способами, например, способом, представленным на следующей схеме (расшифровка сокращений приведена ниже).
Схема
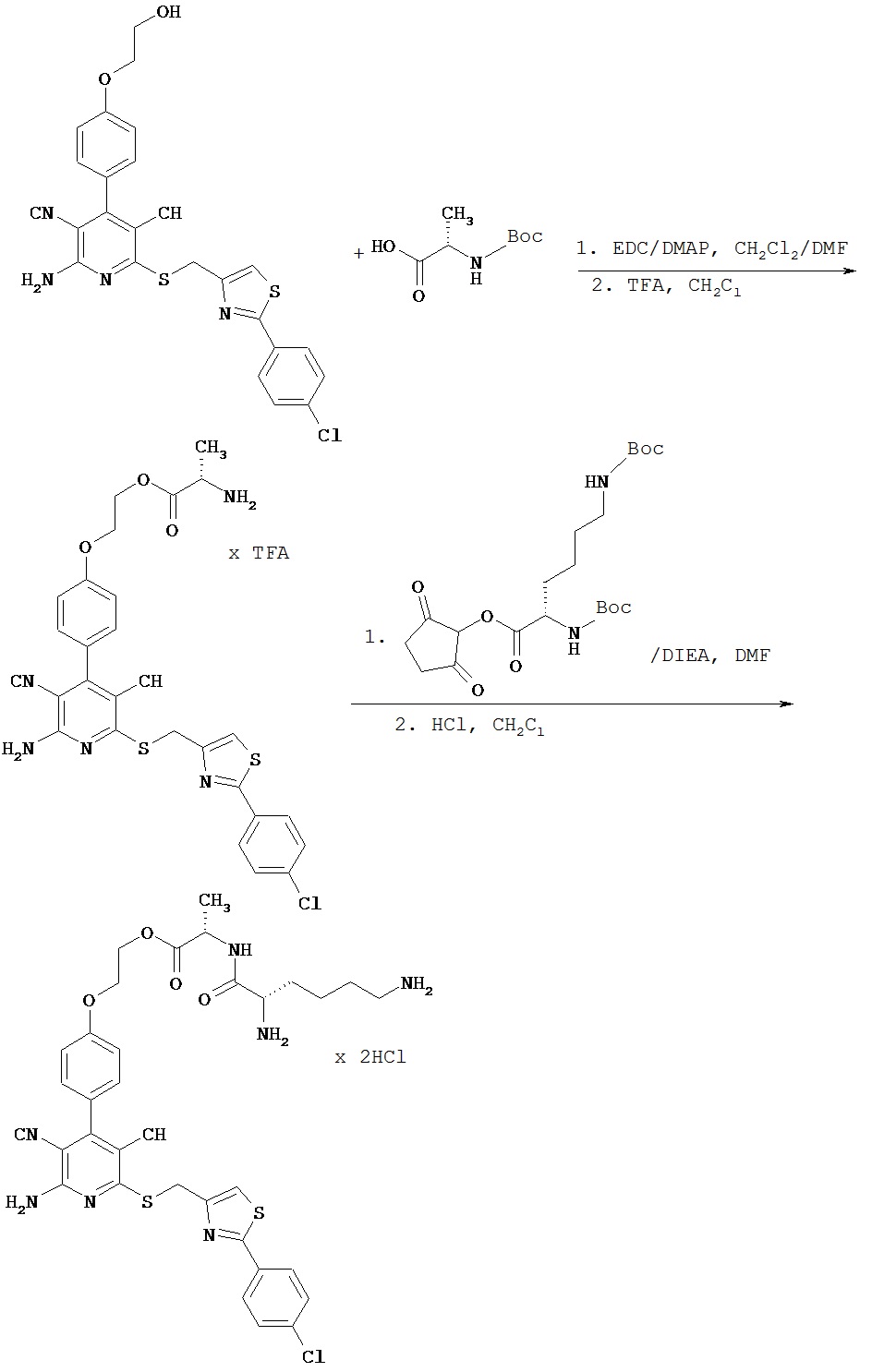
Соединения согласно изобретению являются оптимальными пролекарствами соединения формулы (А) в качестве действующего вещества. Они обладают высокой стабильностью, например, при различных значениях показателя рН и в то же время претерпевают эффективное превращение в соединение формулы (А) при физиологическом показателе рН и прежде всего in vivo. Помимо этого соединения согласно изобретению обладают высокой растворимостью в воде или других физиологически совместимых средах, что обусловливает их пригодность для терапевтического, прежде всего внутривенного применения. Кроме того, при их оральном применении наблюдается повышеннная биодоступность по сравнению с исходным соединением формулы (А).
Соединения согласно изобретению пригодны для лечения и/или профилактики сердечно-сосудистых заболеваний.
Поэтому дальнейшими объектами изобретения являются применение соединения формулы (I) для изготовления лекарственного средства, предназначенного для лечения и/или профилактики сердечно-сосудистых заболеваний, и лекарственное средство для лечения и/или профилактики сердечно-сосудистых заболеваний, содержащее соединение формулы (I), при необходимости, в комбинации с одним или несколькими инертными, нетоксичными, фармацевтически пригодными вспомогательными веществами.
В соответствии с настоящим изобретением под сердечно-сосудистыми заболеваниями подразумевают, например, гипертонию (повышенное кровяное давление), периферические и кардиальные сосудистые заболевания, ишемическую болезнь сердца, коронарные рестенозы, например, рестенозы после баллонной дилатации периферических кровеносных сосудов, инфаркт миокарда, острый коронарный синдром, острый коронарный синдром с подъемом сегмента ST, острый коронарный синдром без подъема сегмента ST, стабильную и нестабильную стенокардию, сердечную слабость, стенокардию Принцметала, персистирующую ишемическую дисфункцию («гибернацию миокарда»), преходящую постишемическую дисфункцию («оглушенный миокард»), сердечную недостаточность, тахикардию, предсердную тахикардию, аритмии, мерцания предсердий, мерцания желудочков, персистирующие мерцания предсердий, постоянные мерцания предсердий, мерцания предсердий с нормальной функцией левого желудочка, мерцания предсердий с ограничением функции левого желудочка, синдром преждевременного возбуждения желудочков, нарушения периферического кровообращения, повышенный уровень фибриногена и липопротеинов низкой плотности, а также повышенную концентрацию ингибитора 1 активатора плазминогена (PAI-1), прежде всего гипертонию, ишемическую болезнь сердца, острый коронарный синдром, стенокардию, сердечную недостаточность, инфаркт миокарда и мерцания предсердий.
Кроме того, соединения согласно изобретению пригодны также, прежде всего, для восстановления пораженной вследствие инфаркта области миокарда, а также для профилактики повторных инфарктов.
Наряду с этим они также пригодны для профилактики и/или лечения тромбоэмболических заболеваний, реперфузионных поражений после ишемии, микрососудистых и макрососудистых поражений (васкулита), артериальных и венозных тромбозов, отеков, ишемий, таких как инфаркт миокарда, кровоизлияния в мозг и транзиторных ишемических приступов, для защиты сердца при аортокоронарном шунтировании, первичной чрезкожной транслюминальной коронарной ангиопластике, чрезкожной транслюминальной коронарной ангиопластике после тромболиза, неотложной чрезкожной транслюминальной коронарной ангиопластике, трансплантации сердца и операций на открытом сердце, а также для защиты органов при операциях трансплантации и шунтирования, при обследованиях с использованием катетера и других операционных вмешательствах.
Другие показания для возможного применения соединений согласно изобретению относятся, например, к профилактике и/или лечению заболеваний урогенитальной сферы, например, таких как острая почечная недостаточность, гиперестезия мочевого пузыря, недержание мочи, эректильная дисфункция и женская сексуальная дисфункция, а также к профилактике и/или лечению воспалительных заболеваний, например, таких как воспалительные дерматозы и артриты, прежде всего ревматические артриты, заболеваний центральной нервной системы и нейродегенеративных нарушений (состояния после инсульта, болезни Альцгеймера, болезни Паркинсона, слабоумия, хореи Гентингтона, эпилепсии, депрессий, множественного склероза), болевых синдромов и мигреней, фиброза печени, онкологических заболеваний, тошноты и рвоты при лечении рака, а также к заживлению ран.
Другие показания для возможного применения соединений согласно изобретению относятся, например, к профилактике и/или лечению заболеваний дыхательных путей, например, таких как астма, хроническое обструктивное заболевание легких, хронический бронхит, эмфизема легких, бронхоэктазия, кистозный фиброз (муковисцидоз) и пульмональная гипертония, прежде всего пульмональная артериальная гипертония.
Соединения согласно изобретению можно использовать также для профилактики и/или лечения обменных заболеваний, например, таких как диабет, прежде всего сахарный диабет, диабет беременных, инсулинозависимый диабет и инсулинонезависимый диабет, диабетических осложнений, например, таких как ретинопатия, нефропатия и нейропатия, метаболических заболеваний, например, таких как метаболический синдром, гипергликемия, гиперинсулинемия, резистентность к инсулину, непереносимость глюкозы и ожирение (болезнь Деркума), а также артериосклероз и дислипидемии (гиперхолестеринемия, гипертриглицеридемия, повышенные концентрации триглицеридов в постпрандиальной плазме, гипоальфалипопротеинемия, комбинированные гиперлипидемии), прежде всего для профилактики и/или лечения диабета, метаболического синдрома и дислипидемии.
Соединения согласно изобретению можно использовать индивидуально или при необходимости в комбинации с другими действующими веществами.
Предпочтительно, используемыми другими действующими веществами являются, например, действующие вещества, изменяющие жировой обмен, антидиабетические средства, средства для снижения кровяного давления, средства, стимулирующие кровоток, и/или антитромботические средства, антиаритмические средства, антиоксиданты, антагонисты рецептора хемокина, ингибиторы р38-киназы, агонисты нейропептид-тирозина, агонисты орексина, средства, подавляющие аппетит, ингибиторы ацетилгидролазы фактора активации тромбоцитов, противовоспалительные средства (ингибиторы циклооксигеназы, антагонисты рецептора лейкотриена В4), а также анальгетические средства, например, такие как аспирин.
Соединения согласно изобретению могут быть скомбинированы с одним или несколькими из следующих действующих веществ:
- изменяющие жировой обмен действующие вещества, например, предпочтительно, выбранные из группы, включающей ингибиторы HMG-CoA-редуктазы, ингибиторы экспрессии HMG-CoA-редуктазы, ингибиторы синтеза сквалена, ингибиторы АСАТ, индукторы рецептора липопротеина низкой плотности, ингибиторы поглощения холестерина, полимерные поглотители желчной кислоты, ингибиторы реабсорбции желчной кислоты, ингибиторы МТР, ингибиторы липазы, активаторы липопротеин-липазы, фибраты, никотиновую кислоту, ингибиторы СЕТР, α-агонисты PPAR, γ-агонисты PPAR и/или δ-агонисты PPAR, модуляторы RXR, модуляторы FXR, модуляторы LXR, тироидные гормоны и/или тироидные имитаторы, ингибиторы АТР-цитрат-лиазы, антагонисты Lp(a), 1-антагонисты рецептора канабиноида, агонисты рецептора лептина, агонисты рецептора бомбезина, агонисты рецептора гистамина и антиоксиданты/акцепторы радикалов;
- антидиабетические средства, приведенные в Roten Liste 2004/II, глава 12, а также, например, предпочтительно, выбранные из группы, включающей сульфонилкарбамиды, бигуаниды, производные меглитинида, ингибиторы глюкозидазы, ингибиторы дипептидил-пептидазы IV (DPP-IV-ингибиторы), окса-диазолидиноны, тиазолидиндионы, агонисты GLP 1-рецептора, антагонисты глюкагона, сенсибилизаторы инсулина, агонисты ССК 1-рецептора, агонисты рецептора лептина, ингибиторы печеночных ферментов, участвующие в стимуляции гликонеогенеза и/или гликогенолиза, модуляторы усвоения глюкозы, а также средства для открытия калиевого канала, например, приведенные в международных заявках WO 97/26265 и WO 99/03861;
- снижающие кровяное давление действующие вещества, например, предпочтительно, выбранные из группы, включающей антагонисты кальция, антагонисты ангитензина АН, ингибиторы АСЕ, ингибиторы ренина, антагонисты бета-адреноцептора, антагонисты альфа-адреноцептора, диуретики, антагонисты альдостерона, антагонисты рецептора минералокортикоидного гормона, ингибиторы ЕСЕ, а также ингибиторы вазопептидазы;
- средства, обладающие противосвертывающим действием, например, предпочтительно, выбранные из группы, включающей ингибиторы агрегации тромбоцитов и антитромботические вещества;
- антиаритмические средства, прежде всего предназначенью для лечения суправентрикулярной аритмии и тахикардии;
- вещества для профилактики и лечения ишемических и реперфузионных нарушений;
- антагонисты рецептора вазопрессина;
- органические нитраты и доноры N0;
- соединения с позитивным инотропным действием;
- соединения, ингибирующие деструкцию циклического гуанозинмонофосфата (cGMP) и/или циклического аденозинмонофосфата (сАМР), например, такие как ингибиторы фосфодиэстеразы (PDE) 1, 2, 3, 4 и/или 5, прежде всего ингибиторы PDE 5, такие как сильденафил, варденафил и тадалафил, а также ингибиторы PDE 3, такие как миль-рининон;
- натрийуретические пептиды, например, такие как предсердные натрийуре-тические пептиды (ANP, анаритиды), натрийуретические пептиды В-типов или мозговые натрийуретические пептиды (BNP, незиритиды), натрийуретические пептиды С-типов (CNP), а также уродилатин;
- агонисты рецептора простациклина (IP-рецептора), например, такие как илопрост, берапрост и цикапрост;
- кальциевые сенсибилизаторы, например, предпочтительно, такие как левосимендан;
- калиевые биологически активные добавки;
- NO- и гемнезависимые активаторы гуанилатциклазы, прежде всего соединения, приведенные в международных заявках WO 01/19355, WO 01/19776, WO 01/19778, WO 01/19780, WO 02/070462 и WO 02/070510;
- NO - независимые, однако гемзависимые стимуляторы гуанилатциклазы, прежде всего соединения, приведенные в международных заявках WO 00/06568, WO 00/06569, WO 02/42301 и WO 03/095451;
- ингибиторы человеческой нейротрофильной эластазы (HNE), например, такие как сивелестат и DX-890 (релтран);
- соединения, ингибирующие каскады трансдукции сигналов, например, такие как ингибиторы тирозинкиназы, прежде всего сорафениб, иматиниб, гефитиниб и эрлотриниб;
- соединения, которые оказывают воздействие на энергетический метаболизм сердца, например, такие как этомоксир, дихлорацетат, ранолазин и триметазидин;
- анальгетические средства; и/или
- вещества для профилактики и лечения тошноты и рвоты.
Под изменяющими жировой обмен действующими веществами предпочтительно, подразумевают соединения, выбранные из группы, включающей ингибиторы HMG-СоА-редуктазы, ингибиторы синтеза сквалена, ингибиторы АСАТ, ингибиторы поглощения холестерина, ингибиторы МТР, ингибиторы липазы, тироидные гормоны и/или тироидные имитаторы, агонисты рецептора ниацина, ингибиторы СЕТР, α-агонисты PPAR, γ-агонисты PPAR и/или δ-агонисты PPAR, полимерные поглотители желчной кислоты, ингибиторы реабсорбции желчной кислоты антагонисты Lp(a), 1-антагонисты рецептора канабиноида, антиоксиданты/акцепторы радикалов, а также 1-антагонисты рецептора канабиноида.
В предпочтительном варианте осуществления изобретения соединения согласно изобретению применяют в комбинации с ингибитором HMG-CoA-редуктазы из класса статинов, например, предпочтительно, ловастатином, симвастатином, правастатином, флувастатином, аторвастатином, розувастатином, церивастатином или питавастатином.
В других вариантах осуществления изобретения соединения согласно изобретению применяют в комбинации с ингибитором синтеза сквалена, например, предпочтительно, таким как BMS-188494 или ТАК-475, с ингибитором АСАТ, например, предпочтительно, таким как авасимиб, мелинамид, пактимиб, эфлуцимиб или SMP-797, с ингибитором поглощения холестерина, например, предпочтительно, таким как эцетримиб, тиквесид или памаквесид, с ингибитором МТР, например, предпочтительно, таким как имплитапид, BMS-201038, R-103757 или JTT-130, c ингибитором липазы, например, предпочтительно, таким как орлистат, с тироидными гормонами и/или тироидными имитаторами, например, предпочтительно, такими как D-тироксин или 3,5,3’-трииодотиронин (Т3), с агонистом рецептора ниацина, например, предпочтительно, таким как никотиновая кислота, аципимокс, ацифран или радекол, с ингибитором СЕТР, например, предпочтительно, таким как торцетрапиб, JTT-705, BAY 60-5521, BAY 78-7499 или вакцина СЕТР (авант), с γ-агонистом PPAR, например, предпочтительно, таким как пиоглитазон или розиглитазон, с δ-агонистом PPAR, например, предпочтительно, таким как GW-501516 или BAY 68-5042, с полимерным поглотителем желчной кислоты, например, предпочтительно, таким как холестирамин, колестипол, колесольвам, холестагель или колестимид, с ингибитором реабсорбции желчной кислоты, например, предпочтительно, таким как ингибитор ASBT (соответственно IBAT), например, AZD-7806, S-8921, AK-105, BARI-1741, SC-435 или SC-635, c антиоксидантом/акцептором радикалов, например, предпочтительно, таким как пробукол, AGI-1067, ВО-653 или AEOL-10150, c 1-антагонистом рецептора канабиноида, например, предпочтительно, таким как римонабант или SR-147778.
Под антидиабетическими средствами предпочтительно, подразумевают инсулин и производные инсулина, а также орально применяемые гипогликемические действующие вещества. При этом под инсулином и производными инсулина подразумевают инсулины животного, человеческого или биотехнологического происхождения, а также их смеси. Под орально применяемыми гипогликемическими действующими веществами предпочтительно, подразумевают сульфонилкарбамиды, бигуаниды, производные меглитинида, ингибиторы глюкозидазы, ингибиторы DPP-IV и γ-агонисты PPAR.
Соединения согласно изобретению можно также применять в комбинации с инсулином, с сульфонилкарбамидом, например, предпочтительно, таким как толбутамид, глибен-кламид, глимепирид, глипизид или гликлазид, с бигуанидом, например, предпочтительно, таким как метформин, с производным меглитинида, например, предпочтительно, таким как репаглинид или натеглинид, с ингибитором глюкозидазы, например, предпочтительно, таким как миглитол или акарбоз, с ингибитором DPP-IV, например, предпочтительно, таким как ситаглиптин или вилдаглиптин, с γ-агонистом PPAR, например, из класса тиазолидиндионов, например, предпочтительно, таким как пиоглитазон или розиглитазон.
Соединения согласно изобретению можно также применять в комбинации с снижающими кровяное давление средствами, предпочтительно, с соединеними, выбранными из группы, включающей антагонисты кальция, антагонисты ангитензина AII, ингибиторы АСЕ, ингибиторы ренина, антагонисты бета-адреноцептора, антагонисты альфа-адреноцептора и диуретики.
Соединения согласно изобретению можно также применять в комбинации с диуретиком, например, предпочтительно, таким как фуросемид, буматанид, торсемид, бендрофлуметиазид, хлортиазид, гидрохлортиазид, гидрофлуметазид, метиклотиазид, политиазид, трихлорметиазид, хлорталидон, индапамид, метолазон, квинэтазон, ацетазоламид, дихлорфенамид, метазоламид, глицерин, изосорбид, маннитол, амилорид или триамтерен, с антагонистом рецептора альдостерона или минералокортикоида, например, предпочтительно, таким как спиронолактон или эплеренон, с антагонистом рецептора вазопрессина, например, предпочтительно, таким как кониваптан, толваптан, ликсиваптан или SR-121463, c донором органического нитрата или NO, например, предпочтительно, таким как нитропруссид натрия, нитроглицерин, изосорбидмононитрат, изосорбиддинитрат, молсидомин или SIN-1, или в комбинации с ингаляционным NO.
Соединения согласно изобретению можно также применять в комбинации с соединением, обладающим позитивным инотропным действием, например, предпочтительно, таким как сердечные гликозиды (дигоксин), а также бета-адренергические и дофаминергические агонисты, в частности, изопротенеренол, адреналин, норадреналин, допамин или добутамин, с антисимпатотоническими средствами, такими как резерпин, клонидин или альфа-метил-диоксифенилаланин, с агонистами калиевого канала, такими как миноксидил, диазоксид, дигидралазин или гидралазин, со средствами, которые обладают противосвертывающим действием, такими как, например, ингибиторы агрегирования тромбоцитов и антитромботические вещества.
Соединения согласно изобретению можно также применять в комбинации с антагонистом GPIIb/IIIa, например, предпочтительно, таким как тирофибан или абцикси-маб, с ингибитором фактора Ха, например, предпочтительно, таким как ривароксабан (BAY 59-7939), DU-176b, апиксабан, отамиксабан, фидексабан, разаксабан, фондапаринукс, идрапаринукс, PMD-3112, YM-150, KFA-1982, EMD-503982, МСМ-17, MLN-1021, DX 9065a, DPC 906, JTV 803, SSR-126512 или SSR-128428,c гепарином или низкомолекулярным производным гепарина, с антагонистами витамина K, например, предпочтительно, такими как коумарин, со снижающими аритмию средствами например из класса антиаритмических средств Ia (например, хинидин), класса антиаритмических средств Ic (например, флекаинид, пропафенон), класса антиаритмических средств II (например, метопролол, атенолол, соталол, окспренолол и другие ингибиторы бета-рецепторов), класса антиаритмических средств III (например, соталол, амиодарон) и класса антиаритмических средств IV (например, дигоксин, а также верапамил, дилтиазем и другие антагонисты кальция).
В соответствии с настоящим изобретением особенно предпочтительными являются комбинации, содержащие по меньшей мере одно из соединений формулы (I) и одно или несколько других действующих веществ, выбранных из группы, включающей ингибиторы HMG-CoA-редуктазы (статин), диуретики, антагонисты бета-адреноцептора, антагонисты альфа-адреноцептора, доноры органических нитратов и N0, антагонисты кальция, ингибиторы АСЕ, антагонисты ангитензина АН, антагонисты рецептора альдостерона и минералокортикоида, антагонисты рецептора вазопрессина, ингибиторы агрегации тромбоцитов, противосвертывающие вещества и антиаритмические средства, а также их применение для лечения и/или профилактики указанных выше заболеваний.
Соединения согласно изобретению обладают системным и/или местным действием. В соответствии с этим их можно применять, например, орально, парентерально, пульмонально, назально, сублингвально, лингвально, буккально, ректально, дермально, трансдермально, конъюнктивально, через слуховой проход или в виде имплантата, соответственно стента. Соединения согласно изобретению можно применять в формах, которые соответствуют указанным вариантам применения.
Для орального применения пригодны действующие в соответствии с уровнем техники формы применения, способные быстро и/или модифицированно высвобождать соединения согласно изобретению и содержащие соединения согласно изобретению в кристаллическом, аморфизованном и/или растворенном состоянии, например, такие как таблетки (таблетки без покрытия или снабженные, например, устойчивым к желудочному соку или медленно растворяющимся или нерастворимым покрытием, обеспечивающим контролируемое высвобождение предлагаемого в изобретении соединения), таблетки или пленки/лиофилизаты, быстро разрушающиеся в полости рта, пленки/облатки, капсулы (например, снабженные оболочкой из жесткого или мягкого желатина), драже, гранулы, пеллеты, порошки, эмульсии, суспензии, аэрозоли или растворы.
Парентеральное применение возможно в отсутствие резорбции (например, внутривенное, внутриартериальное, внутрисердечное, внутрипозвоночное или внутрипоясничное применение) или с резорбцией (например, внутримышечное, подкожное, внутрикожное, чрезкожное или внутрибрюшинное применение). Пригодными для парентерального применения формами, в частности, являются препараты для инъекций и вливаний в виде растворов, суспензий, эмульсий, лиофилизатов или стерильных порошков.
Для прочих вариантов применения пригодны, например, ингаляционные лекарственные формы (в частности, порошковые ингаляторы, аэрозольные распылители), нозальные капли, растворы или аэрозоли, таблетки для лингвального, сублингвального или буккального применения, пленки/облатки или капсулы, суппозитории, ушные или глазные препараты, вагинальные капсулы, водные суспензии (лосьоны, микстуры типа «болтушка»), липофильные суспензии, мази, кремы, трансдермальные терапевтические системы (например, пластыри), препараты в виде молочка, а также пасты, пены, присыпки, имплантаты или стенты.
Предпочтительным является оральное или парентеральное применение, прежде всего оральное применение.
Соединения согласно изобретению могут быть преобразованы в указанные выше формы применения. Соответствующие преобразования можно выполнять известными методами смешивания предлагаемых в изобретении соединений с инертными, нетоксичными, фармацевтически пригодными вспомогательными веществами. К пригодным вспомогательным веществам, в частности, относятся вещества-переносчики (например, микрокристаллическая целлюлоза, лактоза или маннитол), растворители (например, жидкие полиэтиленгликоли), эмульгаторы и диспергаторы или смачивающие агенты (например, додецилсульфат натрия или полиоксисорбитанолеат), связующие вещества (например, поливинилпирролидон), синтетические и природные полимеры (например, альбумин), стабилизаторы (в частности, антиоксиданты, например, такие как аскорбиновая кислота), красители (в частности, неорганические пигменты, например, такие как оксиды железа), а также вещества, предназначенные для корректирования вкуса и/или запаха.
В общем случае количество соединения формулы (I), необходимое для достижения желаемого эффекта, при парентеральном применении предпочтительно, находится в примерном интервале от 0,001 до 1 мг, преимущественно от 0,01 до 0,5 мг на килограмм массы тела. При оральном применении соответствующая дозировка составляет примерно от 0,01 до 100 мг/кг, предпочтительно, от 0,01 до 20 мг/кг и еще более предпочтительно, от 0,1 до 10 мг/кг массы тела.
Несмотря на это, при необходимости, может потребоваться корректировка указанных выше дозировок, которая определяется массой тела, вариантом применения препарата, индивидуальным отношением пациента к действующему веществу, типом препарата и моментом времени его применения (периодичностью). Так, например, в некоторых случаях могут оказаться достаточными дозировки, более низкие по сравнению с указанными выше минимальными предельными значениями, тогда как в других случаях могут потребоваться дозировки, превышающие указанные выше максимальные значения. В последнем случае рекомендуется распределять дозировку на несколько применяемых в течение суток доз.
Приведенные ниже примеры служат для пояснения настоящего изобретения. Примеры не ограничивают объема изобретения.
В отсутствие особых указаний процентные данные в нижеследующих опытах и примерах приведены в массовых процентах, части в массовых частях. Количественные соотношения между компонентами растворителей, степени разбавления и концентрации растворов жидких компонентов в жидкостях указаны в соответствующих объемных единицах.
А. Примеры
Сокращения и аббревиатуры
|
Методы ВЭЖХ и LC-MS
Метод 1 (аналитическая ВЭЖХ). Колонка XTerra WAT 186000478, 3,9 мм×150 мм; элюент А: 10 мл 70-процентной перхлорной кислоты в 2,5 л воды, элюент В: ацетонитрил; градиент: 0,0 мин 20% В→1 мин 20% В→4 мин 90% В→9 мин 90% В; комнатная температура; расход 1 мл/мин.
Метод 2 (LC-MS). Тип масс-спектрометра: Micromass ZQ; тип прибора ВЭЖХ: HP серии 1100; УФ-детектор DAD; колонка Phenomenex Gemini, 3 мкм, 30 мм×3,00 мм; элюент А: 1 л воды + 0,5 мл 50-процентной муравьиной кислоты, элюент В: 1 л ацетонитрила + 0,5 мл 50-процентной муравьиной кислоты; градиент: 0,0 мин 90% А→2,5 мин 30% А→3,0 мин 5% А→4,5 мин 5% А; расход 0,0 мин 1 мл/мин, 2,5 мин/3,0 мин/4,5 мин 2 мл/мин; температура печи 50°С; УФ-детектирование 210 нм.
Метод 3 (LC-MS). Тип масс-спектрометра: Micromass ZQ; тип прибора ВЭЖХ: Waters Alliance 2795; колонка Phenomenex Synergi, 2,5 мкм MAX-RP 100A Mercury, 20 мм×4 мм; элюент А: 1 л воды + 0,5 мл 50-процентной муравьиной кислоты, элюент В: 1 л ацетонитрила + 0,5 мл 50-процентной муравьиной кислоты; градиент: 0,0 мин 90% А→0,1 мин 90% А→3,0 мин 5% А→4,0 мин 5% А→4,01 мин 90% А; расход 2 мл/мин; температура печи 50°С; УФ-детектирование 210 нм.
Метод 4 (LC-MS). Прибор: Micromass Quattro LCZ с ВЭЖХ Agilent Serie 1100; колонка: Phenomenex Synergi, 2,5 мкм MAX-RP 100A Mercury, 20 мм×4 мм; элюент А: 1 л воды + 0,5 мл 50-процентной муравьиной кислоты, элюент В: 1 л ацетонитрила + 0,5 мл 50-процентной муравьиной кислоты; градиент: 0,0 мин 90% А→0,1 мин 90% А→3,0 мин 5% А→4,0 мин 5% А→4,1 мин 90% А; температура печи 50°С; УФ-детектирование 208-400 нм.
Метод 5 (LC-MS). Тип масс-спектрометра: Micromass Quattro Premier с Waters UPLC Acquity; колонка: Thermo Hypersil GOLD, 1,9 мкм, 50 мм×1 мм; элюент А: 1 л воды + 0,5 мл 50-процентной муравьиной кислоты, элюент В: 1 л ацетонитрила + 0,5 мл 50-процентной муравьиной кислоты; градиент: 0,0 мин 90% А→0,1 мин 90% А→1,5 мин 10% А→2,2 мин 10% А; температура печи 50°С; расход 0,33 мл/мин; УФ-детектирование 210 нм
Исходные соединения и промежуточные продукты
Пример 1А
2-{4-[2-Амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}тио)-3,5-дицианопиридин-4-ил]фенокси}этил-L-валинаттрифторацетат
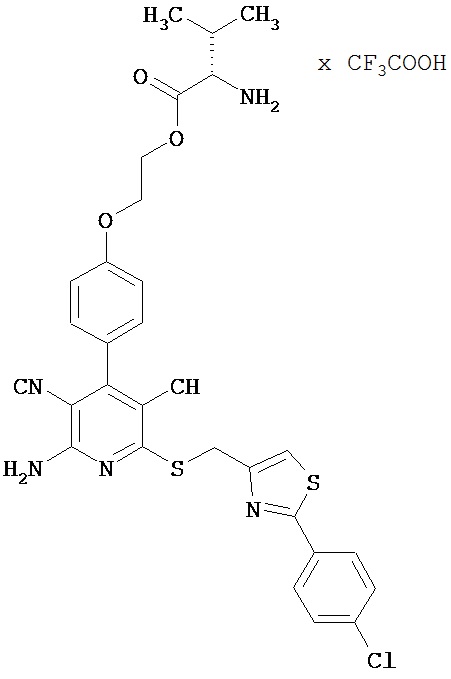
1 г (1,92 ммоль) 2-амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}тио)-4-[4-(2-гидроксиэтокси)фенил]пиридин-3,5-дикарбонитрила [согласно примеру 6 из международной заявки WO 03/053441], 0,460 г (2,11 ммоль) N-Boc-L-валина, 0,442 г (2,31 ммоль) 1-(3-диметиламинопропил)-3-этилкарбодиимид гидрохлорида, а также 0,023 г (0,19 ммоль) 4-диметиламино-пиридина совмещают в смеси 40 мл дихлорметана с 10 мл ДМФ и в течение ночи перемешивают при комнатной температуре. Образуется прозрачный раствор. Продукты реакции выливают в смесь полунасыщенного раствора хлорида аммония с дихлорметаном. Органическую фазу отделяют, последовательно промывают водой, насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и концентрируют. Остаток подвергают очистке флэш-хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана с этилацетатом (градиент 10:1→7:1→5:1). Соответствующие фракции объединяют, растворитель удаляют отгонкой в вакууме. В результате сушки остатка в высоком вакууме получают 0,85 г Boc-защищенного промежуточного продукта (выход от теоретического 62%).
Остаток вводят в смесь 5 мл дихлорметана с 5 мл безводной трифторуксусной кислоты, и полученный раствор в течение двух часов перемешивают при комнатной температуре. Затем его концентрируют до сухого остатка, который смешивают с этилацетатом. Образующийся осадок выделяют фильтрованием, промывают диэтиловым эфиром и сушат в высоком вакууме. Получают 935 мг целевого соединения в виде бесцветных кристаллов (количественный выход).
ВЭЖХ (метод 1): Rt=5,5 мин.
LC-MS (метод 2): Rt=2,06 мин; MS (ESIpos): m/z=619 (M+H)+
Пример 2А
2-{4-[2-Амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}тио)-3,5-дицианопиридин-4-ил]фенокси}этил-L-аланинат трифторацетат
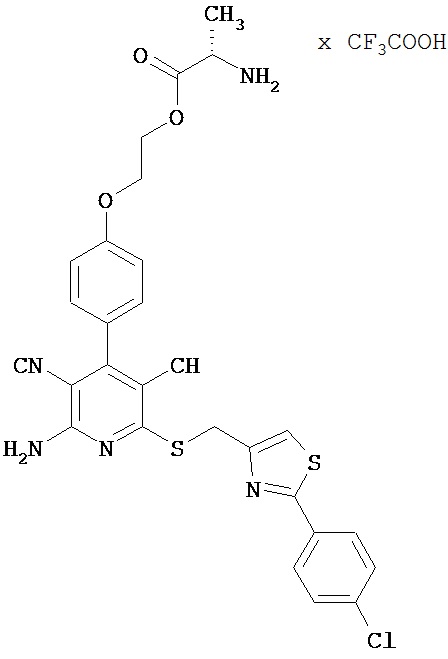
1,5 г (2,88 ммоль) 2-амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}-тио)-4-[4-(2-гидроксиэтокси)фенил]пиридин-3,5-дикарбонитрила, 1,64 г (8,66 ммоль) n-Boc-L-аланина, 0,719 г (3,75 ммоль) 1-(3-диметиламино-пропил)-3-этилкарбодиимид гидрохлорида, а также 0,176 г (1,44 ммоль) 4-диметиламинопиридина совмещают в смеси 25 мл дихлорметана с 25 мл ДМФ и в течение двух часов перемешивают при комнатной температуре. Реакционные продукты концентрируют в вакууме, остаток вводят в этилацетат. Смесь экстрагируют дважды 5-процентной лимонной кислоты и дважды раствором гидрокарбоната натрия. Органическую фазу концентрируют, остаток смешивают с 50 мл диэтилового эфира, а также с 50 мл пентана. Остаток отсасывают на вакуум-фильтре и промывают пентаном. В результате сушки остатка в высоком вакууме получают 1,23 г Boc-защищенного промежуточного продукта (выход от теоретического 62%).
Остаток вводят в смесь 18 мл дихлорметана с 2 мл безводной трифторуксусной кислоты, и раствор в течение часа обрабатывают при комнатной температуре в ультразвуковой ванне. Затем его концентрируют, и остаток смешивают с диэтиловым эфиром. Образующийся осадок выделяют фильтрованием, промывают диэтиловым эфиром и сушат в высоком вакууме. Получают 1200 мг целевого соединения в виде бесцветных кристаллов (выход от теоретического 96%).
ВЭЖХ (метод 1): Rt=5,3 мин.
LC-MS (метод 4): Rt=1,73 мин; MS (ESIpos): m/z=591 (M+H)+
Пример 3А
2-{4-[2-Амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}тио)-3,5-дицианопиридин-4-ил]фенокси}этил-O-трет-бутил-L-серинат
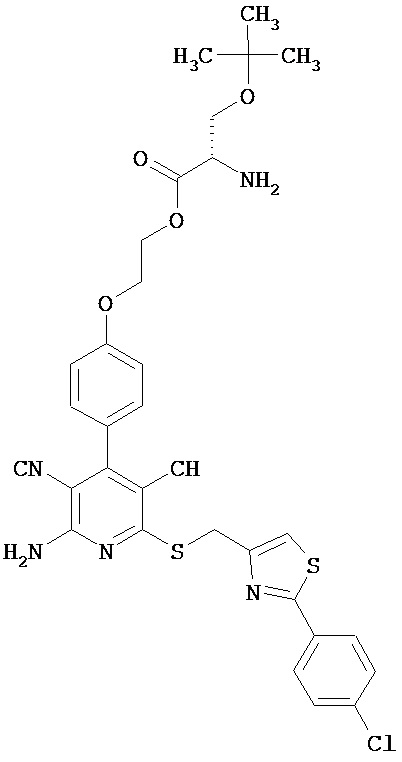
1 г (1,92 ммоль) 2-амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}тио)-4-[4-(2-гидроксиэтокси)фенил]пиридин-3,5-дикарбонитрила, 0,612 г (2,12 ммоль) N-(трет-бутоксикарбонил)-O-трет-бутил-L-серина, 0,442 г (2,31 ммоль) 1-(3-диметиламино-пропил)-3-этилкарбодиимид гидрохлорида, а также 0,024 г (0,192 ммоль) 4-диме-тиламинопиридина совмещают в смеси 40 мл дихлорметана с 10 мл ДМФ и в течение ночи перемешивают при комнатной температуре. Затем реакционные продукты выливают в смесь полунасыщенного раствора хлорида аммония с дихлорметаном. Органическую фазу отделяют, последовательно промывают водой, насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и концентрируют. Остаток вводят в дихлорметан и смешивают с диэтиловым эфиром. Образующийся осадок отсасывают на вакуум-фильтре и промывают диэтиловым эфиром. В результате сушки осадка в высоком вакууме получают 1,25 г защищенного промежуточного продукта (выход от теоретического 85%).
Остаток вводят в смесь 100 мл дихлорметана с 10 мл безводной трифторуксусной кислоты, и раствор в течение часа перемешивают при комнатной температуре. Затем реакционные продукты выливают в смесь полунасыщенного раствора гидрокарбоната натрия с дихлорметаном. Органическую фазу отделяют, сушат над сульфатом магния, фильтруют и концентрируют. В результате сушки остатка в высоком вакууме получают 1020 мг целевого соединения в виде бесцветного порошка (выход от теоретического 95%).
ВЭЖХ (метод 1): Rt=5,4 мин.
LC-MS (метод 3): Rt=1,65 мин; MS (ESIpos): m/z=663 (M+H)+
Пример 4А
2-{4-[2-Амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}сульфанил)-3,5-дицианопи-ридин-4-ил]фенокси}этил-L-лейцинаттрифторацетат
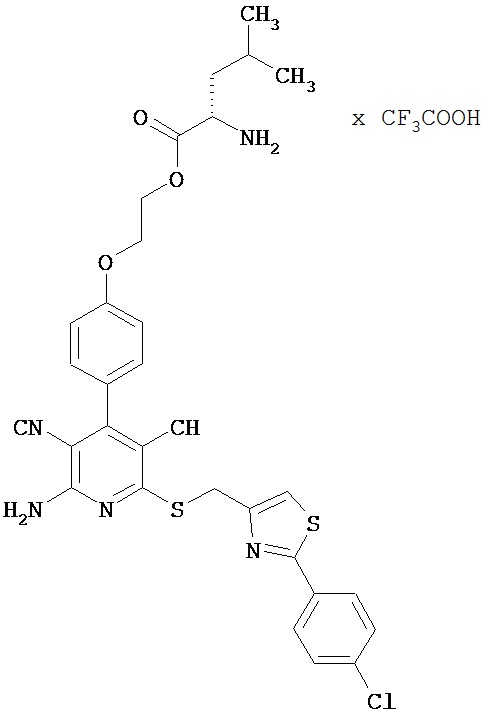
Целевое соединение получают аналогично примеру 1А из 2-амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}тио)-4-[4-(2-гидроксиэтокси)фенил]-пиридин-3,5-дикарбо-нитрила и Boc-L-лейцина.
ВЭЖХ (метод 1): Rt=5,5 мин.
LC-MS (метод 4): Rt=1,75 мин; MS (ESIpos): m/z=633 (M+H)+
Пример 5А
2-{4-[2-Амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}сульфанил)-3,5-дицианопи-ридин-4-ил]фенокси}этил-L-фенилаланинат трифторацетат
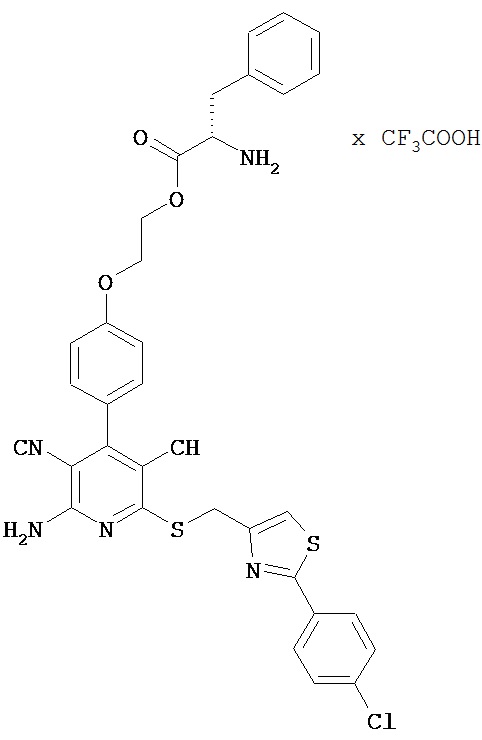
Целевое соединение получают аналогично примеру 2А из 2-амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}тио)-4-[4-(2-гидроксиэтокси)фенил]-пиридин-3,5-дикарбонитрила и Boc-L-фенилаланина.
ВЭЖХ (метод 1): Rt=5,1 мин.
LC-MS (метод 5): Rt=1,13 мин; MS (ESIpos): m/z=577 (M+H)+
Примеры осуществления изобретения
Пример 1
2-{4-[2-Амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}тио)-3,5-дицианопиридин-4-ил]фенокси}этил-1-лизил-L-валинатдигидрохлорид
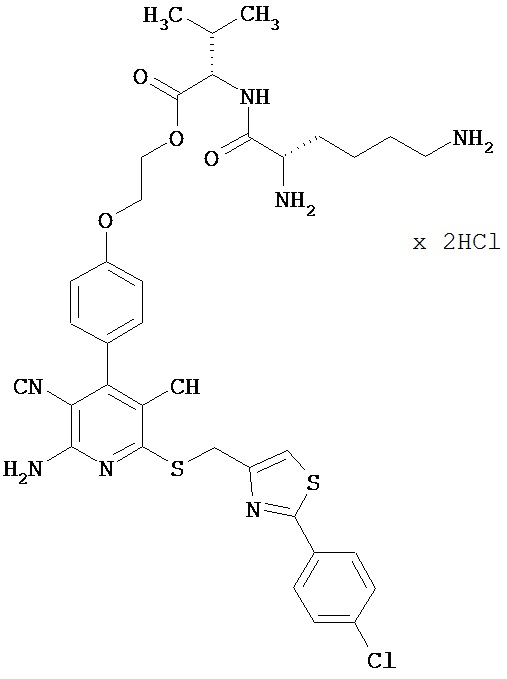
1,5 г (1,77 ммоль) соединения из примера 1А, 2,36 г (5,31 ммоль) 2,5-диоксо-пирролидин-1-ил-N2, N6-бис(трет-бутоксикарбонил)-L-лизината и 1,5 мл N,N-диизопропилэтиламина совмещают в 20 мл ДМФ и в течение ночи перемешивают при комнатной температуре. Затем растворитель удаляют отгонкой в вакууме, и остаток подвергают очистке флэш-хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана с этилацетатом (градиент 3:1→2:1). Соответствующие фракции объединяют, и растворитель удаляют отгонкой в вакууме. В результате сушки остатка в высоком вакууме получают 1,2 г защищенного промежуточного продукта (выход от теоретического 66%).
ВЭЖХ (метод 1): Rt=6,7 мин.
1,2 г (1,27 ммоль) полученного промежуточного продукта вводят в 3 мл дихлорметана и смешивают с 50 мл насыщенного раствора водородхлорида в дихлорметане. Реагенты в течение 30 минут перемешивают при комнатной температуре, при этом целевой продукт выпадает в осадок. Растворитель удаляют выпариванием, остаток смешивают с 70 мл диэтилового эфира. Смесь фильтруют, остаток на фильтре промывают диэтиловым эфиром и сушат в высоком вакууме. Получают 893 мг целевого соединения в виде бесцветных кристаллов (выход от теоретического 86%).
ВЭЖХ (метод 1): Rt=5,1 мин.
LC-MS (метод 4): Rt=1,47 мин; MS (ESIpos): m/z=747 (M+H)+.
1H-ЯМР (400 МГц, ДМСО-d6): 5=0,94 и 0,95 (2d, 6H), 1,4 (m, 2H), 1,55 (m, 2H), 1,75 (m, 2H), 2,14 (m, 1H), 2,7-2,8 (m, 2H), 3,95 (m, 1H), 4,3-4,5 (m, 2H), 4,65 (s, 2H), 7,12 (d, 2H), 7,51 (d, 2H), 7,58 (d, 2H), 7,95 (d, 2H), 7,97 (s, 1H), 8,0 (m, 2H), 8,3 (m, 2H), 8,8 (d, 1H).
Пример 2
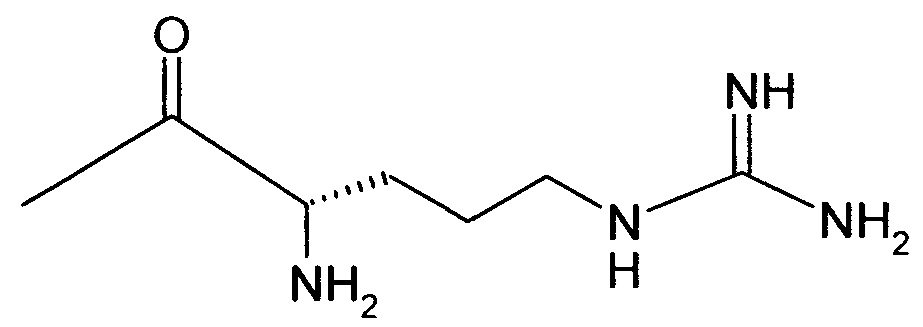
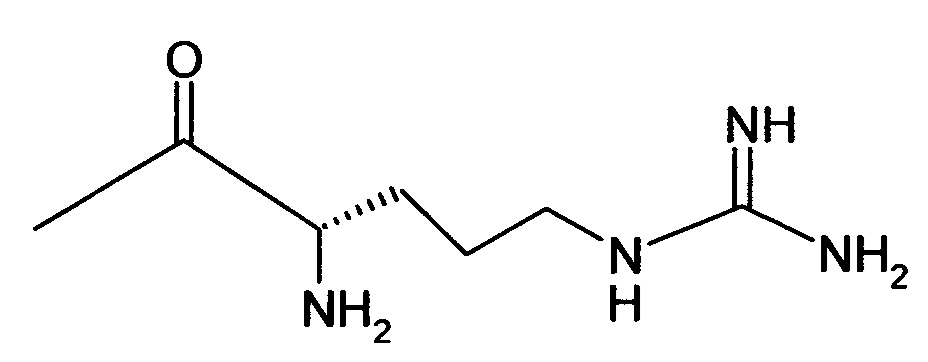
2-{4-[2-Амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}тио)-3,5-дицианопиридин-4-ил]фенокси}этил-L-аргинил-L-валинатдигидрохлорид
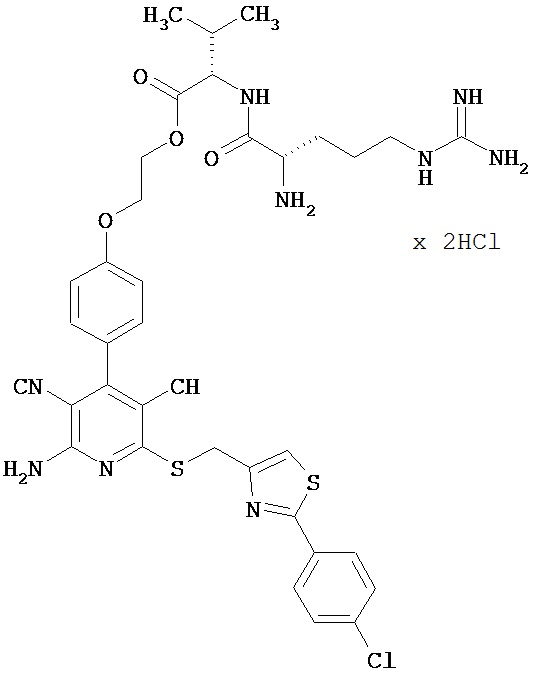
2,24 г (4,72 ммоль) N2,N5-бис(трет-бутоксикарбонил)-N5-{[(трет-бутокси-карбонил)амино](имино)метил}-L-орнитина, 0,96 г (7,08 ммоль) 1-гидрокси-1Н-бензотриазол гидрата и 1,09 г (5,66 ммоль) N-(3-диметиламинопропил)-N’-этилкарбодиимид гидрохлорида совмещают в 200 мл ДМФ. После 30-минутного перемешивания добавляют 2 г (2,36 ммоль) соединения из примера 1А, а также 1,65 мл N,N-диизопропилэтиламина, и компоненты в течение ночи перемешивают при комнатной температуре. Затем реакционную смесь концентрируют, остаток смешивают с водой. Смесь отсасывают на вакуум-фильтре, и остаток подвергают очистке флэш-хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана с этилацетатом (градиент 4:1→3:1). Соответствующие фракции объединяют, и растворитель удаляют отгонкой в вакууме. В результате сушки остатка в высоком вакууме получают 1,12 г защищенного промежуточного продукта (выход от теоретического 44%).
ВЭЖХ (метод 1): Rt=6,1 мин.
1,12 г (1,04 ммоль) промежуточного продукта вводят в 10 мл дихлорметана, смешивают с 10 мл безводной трифторуксусной кислоты и в течение ночи перемешивают при комнатной температуре. Затем реакционные продукты концентрируют, и остаток дважды промывают ТГФ. Смесь фильтруют, остаток на фильтре вводят в смесь 25 мл ТГФ с 5 мл метанола. При перемешивании добавляют 20 мл 2М раствора водородхло-рида в диэтиловом эфире. Образующийся после кратковременного дополнительного перемешивания осадок отсасывают на вакуум-фильтре и промывают диэтиловым эфиром. В результате сушки в высоком вакууме получают 920 мг целевого соединения в виде бесцветных кристаллов (выход от теоретического 99%).
ВЭЖХ (метод 1): Rt=5,1 мин.
LC-MS (метод 2): Rt=1,7 мин; MS (ESIpos): m/z=775 (M+H)+.
1H-ЯМР (400 МГц, ДМСО-d6): δ=0,95 и 0,97 (2d, 6Н), 1,6 (m, 2H), 1,75 (m, 2H), 2,14 (m, 1H), 3,25 (m, 2H), 4,05 (m, 1H), 4,25 (t, 1H), 4,3 (m, 2H), 4,4-4,5 (2m, 2H), 4,65 (s, 2H), 7,12 (d, 2H), 7,48 (d, 2H), 7,58 (d, 2H), 7,95 (m, 3H), 8,4 (m, 2H), 8,9 (d, 1H).
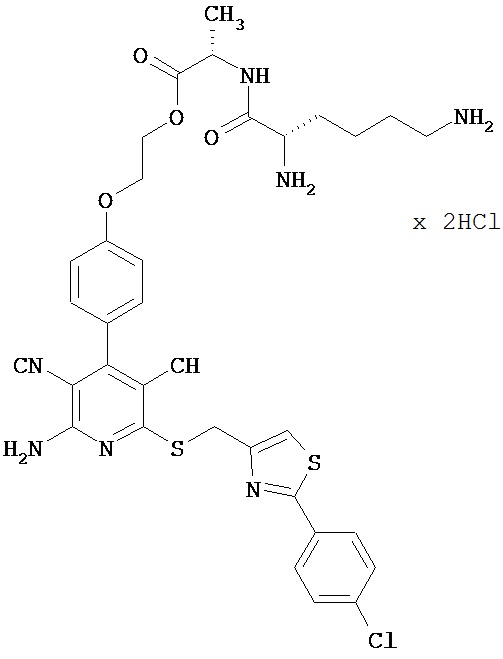
Пример 3
2-{4-[2-Амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}тио)-3,5-дицианопиридин-4-ил]фенокси}этил-L-лизил-L-аланинатдигидрохлорид
1,2 г (1,7 ммоль) соединения из примера 2А, 1,13 г (2,55 ммоль) 2,5-диоксопирролидин-1-ил-N2,N6-бис(трет-бутоксикарбонил)-L-лизината и 1,5 мл N,N-диизопропилэтил-амина совмещают в 40 мл ДМФ и в течение ночи перемешивают при комнатной температуре. Затем продукты реакции концентрируют, и остаток распределяют между этилацетатом и водой. Органическую фазу отделяют и последовательно экстрагируют дважды 5-процентной лимонной кислоты и дважды 5-процентным раствором гидрокарбоната натрия. Органическую фазу концентрируют, и остаток подвергают очистке флэш-хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана с этилацетатом (градиент 3:1→2:1). Соответствующие фракции объединяют, и растворитель удаляют отгонкой в вакууме. Остаток смешивают с 50 мл диэтилового эфира, а также с 50 мл пентана, и отсасывают на вакуум-фильтре. В результате сушки остатка в высоком вакууме получают 1,14 г защищенного промежуточного продукта (выход от теоретического 73%).
ВЭЖХ (метод 1): Rt=6,4 мин.
LC-MS (метод З): Rt=2,64 мин; MS (ESIpos): m/z=919 (M+H)+.
1,14 г (1,24 ммоль) промежуточного продукта вводят в 10 мл дихлорметана и смешивают с 60 мл насыщенного раствора водородхлорида в дихлорметане. Продукты реакции в течение ночи перемешивают при комнатной температуре, при этом целевое соединение выпадает в осадок. Растворитель концентрируют до одной трети от первоначального объема, и образовавшуюся суспензию смешивают с 200 мл диэтилового эфира. Смесь фильтруют, остаток на фильтре промывают диэтиловым эфиром и сушат в высоком вакууме. Получают 1,0 г целевого соединения в виде бесцветных кристаллов (количественный выход).
ВЭЖХ (метод 1): Rt=5,0 мин.
LC-MS (метод 2): Rt=1,67 мин; MS (ESIpos): m/z=719 (M+H)+.
1H-ЯМР (400 МГц, ДМСО-d6): δ=1,35 (d, 3Н), 1,4 (m, 2H), 1,6 (m, 2H), 1,75 (m, 2H), 2,75 (m, 2H), 3,8 (m, 1H), 4,25 (m, 2H), 4,3-4,5 (m, ЗН), 4,63 (s, 2H), 7,12 (d, 2H), 7,48 (d, 2H), 7,58 (d, 2H), 7,9-8,0 (m, 5H), 8,3 (m, 2H), 9,05 (d, 1H).
Пример 4
2-{4-[2-Амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}тио)-3,5-дицианопиридин-4-ил]фенокси}этил-L-лизил-L-серинатдигидрохлорид
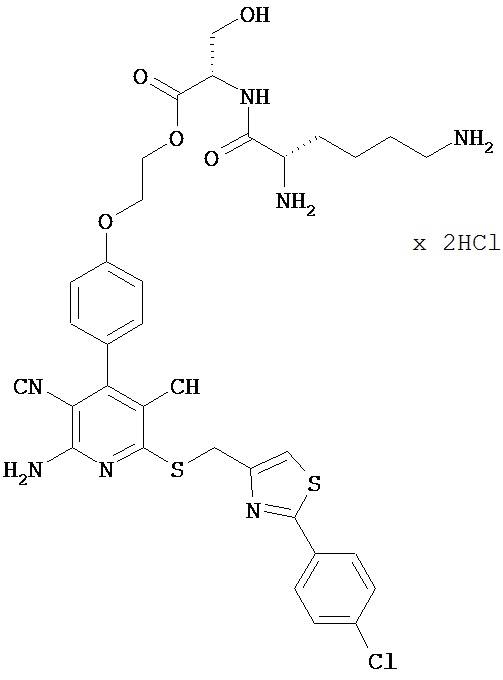
0,58 г (1,675 ммоль) N2,N6-бис(трет-бутоксикарбонил)-L-лизина, 0,28 г (1,83 ммоль) 1-гидрокси-1Н-бензотриазол гидрата и 0,35 г (1,83 ммоль) N-(3-диметиламинопропил)-N’-этилкарбодиимид гидрохлорида совмещают в 40 мл ДМФ и смешивают с 1,01 г (1,52 ммоль) соединения из примера ЗА. Реагенты в течение ночи перемешивают при комнатной температуре и выливают в смесь полунасыщенного раствора хлорида аммония с дихлорметаном. Органическую фазу отделяют, последовательно промывают водой, насыщенным раствором гидрокарбоната натрия и насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и концентрируют. Остаток подвергают очистке флэш-хроматографией на силикагеле, используя в качестве элюента сначала смесь дихлорметана с этилацетатом (градиент 3:1→2:1), а затем смесь дихлорметан/этил-ацетат/метанол (150:50:5). Соответствующие фракции объединяют и концентрируют. В результате сушки остатка в высоком вакууме получают 1,23 г защищенного промежуточного продукта (выход от теоретического 81%).
ВЭЖХ (метод 1): Rt=6,5 мин.
LC-MS (метод 4): Rt=2,99 мин; MS (ESIpos): m/z=991 (M+H)+.
1,216 г (1,48 ммоль) промежуточного продукта вводят в 6 мл дихлорметана, смешивают с 6 мл безводной трифторуксусной кислоты, и реагенты в течение ночи перемешивают при комнатной температуре. Реакционные продукты концентрируют, остаток вновь смешивают с дихлорметаном. Смесь фильтруют, и остаток на фильтре вводят в смесь 25 мл дихлорметана с 25 мл этилацетата. При перемешивании добавляют 20 мл 2М раствора водородхлорида в диэтиловом эфире. Образующийся после кратковременного дополнительного перемешивания осадок отсасывают на вакуум-фильтре, промывают диэтиловым эфиром и сушат в высоком вакууме. Остаток подвергают перекристаллизации из смеси 20 мл метанола с 20 мл этилацетата. Осадок вновь отсасывают на вакуум-фильтре, промывают этилацетатом и сушат в высоком вакууме. Получают 845 мг целевого соединения в виде бесцветных кристаллов (выход от теоретического 70%).
ВЭЖХ (метод 1): Rt=4,9 мин.
LC-MS (метод 2): Rt=1,62 мин; MS (ESIpos): m/z=735 (M+H)+.
Пример 5
2-{4-[2-Амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}сульфанил)-3,5-дицианопи-ридин-4-ил]фенокси}этил-L-лизил-L-лейцинатдигидрохлорид
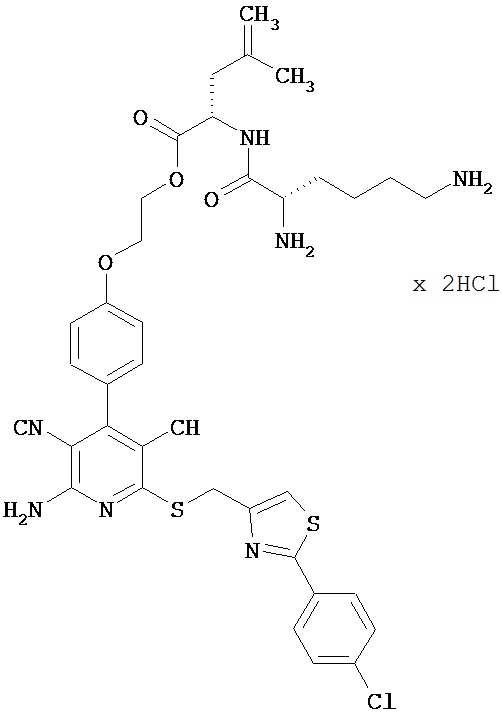
0,928 г (2,68 ммоль) N2,N6-бис(трет-бутоксикарбонил)-L-лизина, 0,362 г (2,68 ммоль) 1-гидрокси-1Н-бензотриазол гидрата и 0,411 г (2,144 ммоль) N-(3-диметиламино-пропил)-N’-этилкарбодиимид гидрохлорида совмещают в 200 мл ДМФ. Добавляют 1,335 г (1,787 ммоль) соединения из примера 4А, а также 935 мкл N,N-диизопропилэтиламина, и компоненты в течение ночи перемешивают при комнатной температуре. Затем реакционную смесь концентрируют в вакууме, остаток вводят в этилацетат и последовательно экстрагируют водой, 5-процентной лимонной кислотой и дважды 5-процентным раствором гидрокарбоната натрия. Органическую фазу концентрируют, и остаток подвергают очистке флэш-хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана с этилацетатом (градиент 3:1→2:1). Соответствующие фракции объединяют, растворитель удаляют отгонкой в вакууме. В результате сушки остатка в высоком вакууме получают 1,39 г защищенного промежуточного продукта (выход от теоретического 81%).
ВЭЖХ (метод 1): Rt=6,8 мин.
1,385 г (1,44 ммоль) полученного промежуточного продукта вводят в 20 мл дихлорметана и смешивают с 50 мл насыщенного раствора водородхлорида в дихлорметане.
Продукты реакции в течение часа перемешивают при комнатной температуре, при этом целевой продукт выпадает в осадок. Растворитель удаляют выпариванием, остаток смешивают с 70 мл пентана, кратковременно перемешивают и отсасывают на вакуум-фильтре. В результате сушки остатка в высоком вакууме получают 1,17 г целевого соединения (выход от теоретического 97%).
ВЭЖХ (метод 1): Rt=5,17 мин.
LC-MS (метод 2): Rt=1,76 мин; MS (ESIpos): m/z=761 (M+H)+.
Пример 6
2-{4-[2-Амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}сульфанил)-3,5-дицианопи-ридин-4-ил]фенокси}этил-L-аргинил-L-аланинатдигидрохлорид
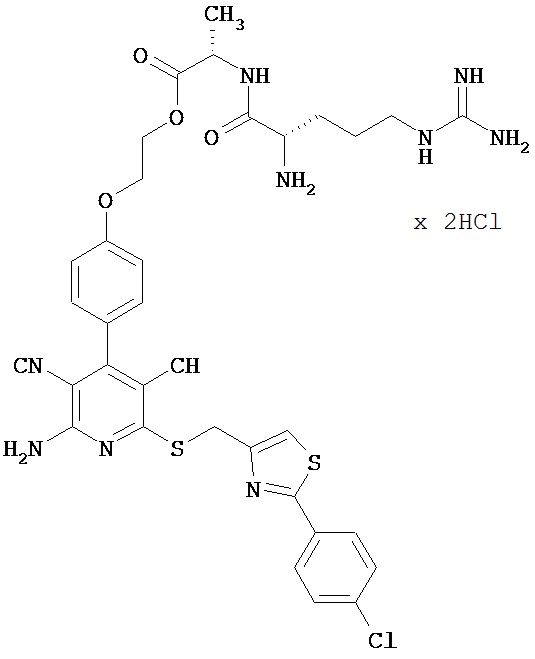
0,269 г (0,567 ммоль) N5-[N,N’-бис(трет-бутоксикарбонил)карбамидоил]-N2-(трет-бутоксикарбонил)-L-орнитина, 0,115 г (0,851 ммоль) 1-гидрокси-1Н-бензотриазол гидрата и 0,131 г (0,681 ммоль) N-(3-диметиламино-пропил)-N’-этилкарбодиимид гидрохлорида совмещают в 20 мл ДМФ. После 30-минутного перемешивания добавляют 0,2 г (0,284 ммоль) соединения из примера 2А, а также 200 мкл N,N-диизопропилэтиламина, и компоненты в течение ночи перемешивают при комнатной температуре. Затем смесь концентрируют в вакууме, остаток вводят в дихлорметан и последовательно экстрагируют 5-процентной лимонной кислоты, 5-процентным раствором гидрокарбоната натрия и водой. Органическую фазу концентрируют, и остаток подвергают очистке флэш-хроматографией на силикагеле, используя в качестве элюента смесь дихлорметана с этилацетатом (3:1). Соответствующие фракции объединяют, растворитель удаляют отгонкой в вакууме. В результате сушки остатка в высоком вакууме получают 0,179 г защищенного промежуточного продукта (выход от теоретического 60%).
ВЭЖХ (метод 1): Rt=5,8 мин.
0,178 г (0,17 ммоль) полученного промежуточного продукта вводят в 30 мл насыщенного раствора водородхлорида в дихлорметане и в течение ночи перемешивают при комнатной температуре. Продукты реакции концентрируют в вакууме до половины от первоначального объема, и образовавшийся осадок выделяют фильтрованием. Остаток на фильтре промывают диэтиловым эфиром и сушат в высоком вакууме. Получают 119 мг целевого соединения в виде бесцветных кристаллов (выход от теоретического 82%).
ВЭЖХ (метод 1): Rt=4,9 мин.
LC-MS (метод 2): Rt=1,58 мин; MS (ESIpos): m/z=747 (M+H)+.
1H-ЯМР (400 МГц, ДМСО-d6): δ=1,35 (d, 3Н), 1,55 (m, 2Н), 1,75 (m, 2H), 3,25 (m, 2H), 3,85 (m, 1H), 4,25 (m, 2H), 4,3-4,5 (m, ЗН), 4,65 (s, 2H), 7,12 (d, 2H), 7,48 (d, 2H), 7,58 (d, 2H), 7,75 (t, 1H), 7,93 (s, 1H), 7,94 (d, 2H), 8,3 (m, 3Н), 9,1 (d, 1H).
Пример 7
2-{4-[2-Амино-6-({[2-(4-хлорфенил)-1,3-тиазол-4-ил]метил}сульфанил)-3,5-дициано-пиридин-4-ил]фенокси}этил-L-лизил-L-фенилаланинатдигидрохлорид
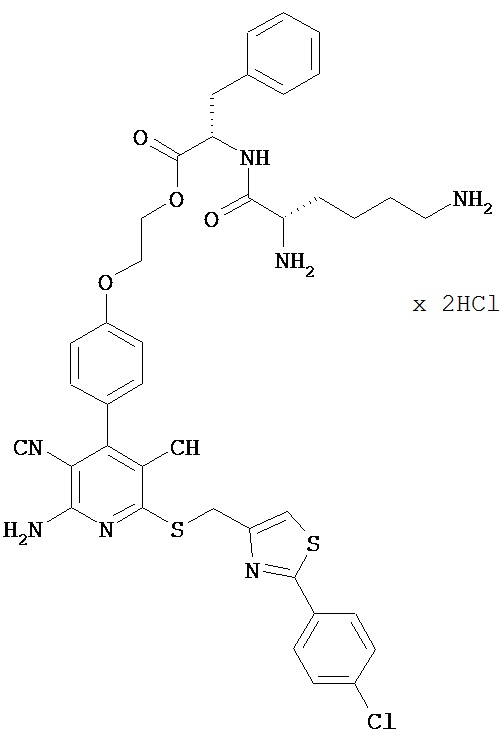
0,166 г (0,48 ммоль) N2,N6-бис-(трет-бутоксикарбонил)-L-лизина, 0,097 г (0,72 ммоль) 1-гидрокси-1Н-бензотриазол гидрата и 0,110 г (0,576 ммоль) N-(3-диметилами-нопропил)-N’-этилкарбодиимид гидрохлорида совмещают в 7 мл ДМФ и в течение 5 минут перемешивают при комнатной температуре. Затем добавляют 0,375 г (0,48 ммоль) соединения из примера 5А, а также 418 мкл N,N-диизопропилэтиламина, и компоненты в течение ночи перемешивают при комнатной температуре. Реакционные продукты концентрируют в вакууме, остаток вводят в 200 мл этилацетата, последовательно экстрагируют дважды 10-процентной лимонной кислоты и дважды 10-процентным раствором гидрокарбоната натрия и сушат над сульфатом магния. Органическую фазу концентрируют, остаток вводят в 10 мл этилацетата, и целевой продукт осаждают путем добавления диэтилового эфира. Осадок отсасывают на вакуум-фильтре и сушат в высоком вакууме. Получают 0,338 г защищенного промежуточного продукта (выход от теоретического 71%).
ВЭЖХ (метод 1): Rt=6,7 мин.
0,32 г (0,321 ммоль) полученного промежуточного продукта вводят в 100 мл дихлор-метана. Через полученный раствор при перемешивании пропускают газообразный водородхлорид, при этом лишенное защиты целевое соединение выпадает в осадок. Продукты реакции в течение последующего часа перемешивают при комнатной температуре, концентрируют в вакууме до половины от первоначального объема и медленно добавляют 10 мл абсолютного ТГФ. Смесь перемешивают в течение последующих 15 минут, образующийся осадок выделяют фильтрованием. Остаток на фильтре промывают диэтиловым эфиром и сушат в высоком вакууме. Получают 188 мг целевого соединения в виде бесцветных кристаллов (выход от теоретического 67%).
ВЭЖХ (метод 1): Rt=5,0 мин.
LC-MS (метод З): Rt=1,33 мин; MS (ESIpos): m/z=795 (M+H)+.
В. Определение растворимости, стабильности и способности к высвобождению
а) Определение растворимости
Испытуемое соединение суспендируют в 5-процентном водном растворе декстрозы. Полученную суспензию в течение 24 часов встряхивают при комнатной температуре. После 30-минутного ультрацентрифугирования с ускорением 224000g надосадочную жидкость разбавляют ДМСО и анализируют методом ВЭЖХ. Количественную оценку результатов анализа выполняют на основании двухточечной калибровочной кривой испытуемого соединения в ДМСО.
Анализ кислот методом ВЭЖХ
Прибор Agilent 1100 с детектором DAD (G1315A), четырехходовым насосом (G1311A), автоматической пипеткой (СТС HTS PAL), дегазатором (G1322A) и термостатом колонки (G1316A); колонка: Phenomenex Gemini C18, 5 мкм, 50 мм×2 мм; температура 40°С; элюент А: вода/фосфорная кислота с рН 2, элюент В: ацетонитрил; расход 0,7 мл/мин; градиент: 0-0,5 мин 85% А, 15% В; линейно 0,5-3 мин 10% А, 90% В; 3-3,5 мин 10% А, 90% В; линейно 3,5-4 мин 85% А, 15% В; 4-5 мин 85% А, 15% В.
Анализ оснований методом ВЭЖХ
Прибор Agilent 1100 с детектором DAD (G1315A), четырехходовым насосом (G1311A), автоматической пипеткой (СТС NTS PAL), дегазатором (G1322A) и термостатом колонки (G1316A); колонка: VDSoptilab Kromasil 100 С18, 3,5 мкм, 60 мм × 2,1 мм; температура 30°С; элюент А: вода + 5 мл перхлорной кислоты в литре, элюент В: ацетонитрил; расход: 0,75 мл/мин; градиент: 0-0,5 мин 98% А, 2% В; линейно 0,5-4,5 мин 10% А, 90% В; 4,5-6 мин 10% А, 90% В; линейно 6,5-6,7 мин 98% А, 2% В; 6,7-7,5 мин 98% А, 2% В.
В таблице 1 приведена растворимость соединений из репрезентативных примеров осуществления изобретения в 5-процентном водном растворе декстрозы
|
Деструкция соединений в указанном растворе отсутствует.
Растворимость лежащего в основе испытуемых соединений действующего вещества [соединения формулы (А)] в 5-процентном водном растворе декстрозы составляет менее 0,1 мг/литр.
b) Стабильность в буферных растворах при варьируемых значениях показателя рН
В пробирке для ВЭЖХ объемом 2 мл берут навеску испытуемого соединения (0,3 мг) и смешивают ее с 0,5 мл смеси ацетонитрил/ДМСО (9:1). С целью растворения испытуемого соединения пробирку примерно на 10 секунд помещают в ультразвуковую ванну.
Затем добавляют 0,5 мл соответствующего (буферного) раствора, и образец вновь подвергают ультразвуковой обработке.
Используемые буферные растворы
рН 2: 0,03 моль лимонной кислоты, 0,061 моль хлорида натрия и 0,0082 моль соляной кислоты; разбавление водой до 1 литра.
рН 4: 1 л пропущенной через ультратонкий фильтр воды с показателем рН 4,0, установленным посредством 1Н соляной кислоты.
рН 5: 0,096 моль лимонной кислоты и 0,2 моль гидроксида натрия; разбавление водой до 1 литра.
рН 6: 0,06 моль лимонной кислоты и 0,16 моль гидроксида натрия, разбавление водой до 1 литра.
рН 7,4: 90,0 г хлорида натрия, 13,61 г дигидрофосфата калия, 83,35 г 1Н раствора едкого натра, разбавление водой до 1 литра; указанный раствор дополнительно разбавляют пропущенной через ультратонкий фильтр водой в соотношении 1:10.
рН 8: 0,013 моль Borax и 0,021 моль соляной кислоты; разбавление водой до 1 литра.
В течение 24 часов при 25°С ежечасно выполняют ВЭЖХ-анализ образцов раствора объемом 5 мкл на содержание остающегося без изменений испытуемого соединения, соответственно образующегося исходного вещества формулы (А). Количественную оценку результатов анализа выполняют на основании выраженных в процентах площадей соответствующих пиков.
Метод ВЭЖХ
Прибор Agilent 1100 с детектором DAD (G1314A), бинарным насосом (G1312A), автоматической пипеткой (G1329A), печью (G1316A) и термостатом (G1330A); колонка Kromasil 100 С18, 125 мм × 4 мм, 5 мкм; температура колонки 30°С; элюент А: вода + 5 мл перхлорной кислоты в литре, элюент В: ацетонитрил; градиент: 0-2,0 мин 90% А, 10% В; 2,0-18,0 мин 64% А, 36% В; 18,0-20,0 мин 64% А, 36% В; 20,0-21,0 мин 10% А, 90% В; 21,0-23,0 мин 90% А, 10% В; 23,0-26,0 мин 90% А, 10% В; расход 2,0 мл/мин; УФ-детектирование 294 нм.
В таблице 2 приведено содержание испытуемых соединений, полученных в репрезентативных примерах осуществления изобретения, определенное в виде отношений площадей пиков (F) в соответствующие моменты времени (t) к их площадям в начальный момент времени.
|
В условиях данного испытания одновременно со снижением содержания испытуемого соединения констатируют рост содержания действующего вещества [соединения формулы (А)].
с) Стабильность в крысиной и человеческой плазме in vitro
В пробирке для ВЭЖХ объемом 2 мл берут навеску испытуемого соединения (1 мг) и смешивают ее с 1,5 мл ДМСО и 1 мл воды. С целью растворения испытуемого соединения пробирку примерно на 10 секунд помещают в ультразвуковую ванну. К 0,5 мл соответствующего раствора добавляют 0,5 мл крысиной, соответственно человеческой плазмы с температурой 37°С. Пробирку встряхивают и отбирают на анализ первый образец объемом около 10 мкл (момент времени to). В течение промежутка времени после начала инкубации, составляющего до 2 часов, отбирают от 4 до 6 предназначенных для количественной оценки дополнительных аликвотных образцов. Образцы во время испытания выдерживают при температуре 37°С. Определение характеристик и количественную оценку выполняют методом ВЭЖХ.
Метод ВЭЖХ
Прибор Agilent 1100 с детектором DAD (G1314A), бинарным насосом (G1312A), автоматической пипеткой (G1329A), печью (G1316A) и термостатом колонки (G1330A); колонка Kromasil 100 С18, 250 мм×4 мм, 5 мкм; температура колонки 30°С; элюент А: вода + 5 мл перхлорной кислоты в литре, элюент В: ацетонитрил; градиент; 0-8,0 мин 53% А, 47% В; 8,0-18,0 мин 53% А, 47% В; 18,0-20,0 мин 90% А, 10% В; 20,0-21,0 мин 90% А, 10% В; 21,0-22,5 мин 98% А, 2% В; 22,5-25,0 мин 98% А, 2% В; расход 2 мл/мин; УФ-детектирование 294 нм.
В таблице 3 приведены значения времени (t50%A), при которых после совместной инкубации полученных в репрезентативных примерах испытуемых соединений с крысиной плазмой образуется 50% от максимально возможного количества действующего вещества [соединения формулы (А)]. Количественную оценку выполняют по отношению площадей пиков в соответствующие моменты времени и в начальный момент инкубации.
|
d) Исследование фармакокинетики на крысах Wistar при внутривенной инъекции испытуемых соединений
В день применения испытуемых соединений в яремную вену наркотизированных посредством Isofluran® подопытных животных (мужских особей крыс Wistar с массой тела 200-250 г) имплантируют используемый при последующем отборе крови катетер.
В день эксперимента в хвостовую вену крысы стеклянным шприцем Hamilton® вводят определенную дозу испытуемого соединения в виде соответствующего раствора (длительность применения менее 10 секунд). В течение последующих 24 часов посредством катетера последовательно отбирают от 8 до 12 образцов крови. С целью выделения плазмы образцы центрифугируют в гепаринизованных трубочках. С целью осаждения белка определенный объем плазмы в соответствующий момент времени смешивают с ацетонитрилом. После центрифугирования, используя соответствующий метод LC/MS-MS, количественно определяют содержание испытуемого соединения и при необходимости известных продуктов его деструкции в надосадочной жидкости.
На основании измеренных концентраций в плазме вычисляют фармакокинетические характеристики испытуемого соединения, соответственно соединения формулы (А), высвобождающегося из испытуемого соединения в качестве действующего вещества, такие как AUC, Cmax, Т-Ч2 (период полувыделения) и CL (коэффициент очищения крови).
После внутривенного применения соединений из примеров 4, 5, 6 и 7 их не удавалось обнаружить в плазме уже при первом анализе крови. В течение всего периода испытания (24 часа) в плазме обнаруживали только действующее вещество формулы (А).
e) Исследование фармакокинетики на крысах Wistar при оральном применении испытуемых соединений
В день применения испытуемых соединений в яремную вену наркотизированных посредством Isofluran® подопытных животных (мужских особей крыс Wistar с массой тела 200-250 г) имплантируют используемый при последующем отборе крови катетер.
В день эксперимента в желудок животного через желудочный зонд вводят определенную дозу испытуемого соединения в виде соответствующего раствора. В течение последующих 24 часов посредством катетера последовательно отбирают от 8 до 12 образцов крови. С целью выделения плазмы образцы центрифугируют в гепаринизованных трубочках. С целью осаждения белка определенный объем плазмы в соответствующий момент времени смешивают с ацетонитрилом. После центрифугирования, используя соответствующий метод LC/MS-MS, количественно определяют содержание испытуемого соединения и при необходимости известных продуктов его деструкции в надосадочной жидкости.
На основании измеренных концентраций в плазме вычисляют фармакокинетические характеристики испытуемого соединения, соответственно соединения формулы (А), высвобождающегося из испытуемого соединения в качестве действующего вещества, такие как А и С, Cmax, T1/2 (период полувыделения) и CL (коэффициент очищения крови).
После орального применения соединений из примеров 4, 5 и 6 их не удавалось обнаружить в плазме уже при первом анализе крови. В течение всего периода испытания (24 часа) в плазме обнаруживали только действующее вещество формулы (А).
f) Влияние испытуемых соединений на частоту сердечных сокращений находящихся под наркозом крыс
Используют мужские особи крыс Wistar с массой тела более 250 г. В ночь перед экспериментом животным не дают корм, однако они имеют свободный доступ к питьевой воде. Животных препарируют и исследуют под наркозом, выполняемым посредством Trapanal® (100 мг/кг массы тела). Инъекцию и инфузию осуществляют через катетер в яремной вене, кровяное давление регистрируют посредством катетера в бедренной вене (трансдуцер фирмы Braun, Мелсунген). С целью компенсации потерь жидкости после препарирования выполняют длительное внутривенное вливание физиологического раствора поваренной соли. Испытуемое соединение или раствор плацебо применяют внутривенно по истечении времени уравновешивания (около 1 часа) в виде ударной дозы. Частоту сердечных сокращений и артериальное кровяное давление во время уравновешивания и по истечении по меньшей мере 30 минут после ударной инъекции записывают с помощью цифровой программы анализа.
В таблице 4 приведено снижение максимальной частоты сердечных сокращений в первые 30 минут после ударной внутривенной инъекции (100 мкг/кг) действующего вещества формулы (А), соответственно эквивалентной дозировки соединений из репрезентативных примеров осуществления изобретения.
|
С. Примеры изготовления фармацевтических препаратов
Предлагаемые в изобретении соединения могут быть преобразованы, например, в следующие фармацевтические препараты.
Таблетки
Состав
100 мг соединения согласно изобретению, 50 мг лактозы в виде моногидрата, 50 мг природного кукурузного крахмала, 10 мг поливинилпирролидона PVP 25 фирмы BASF (Людвигсхафен, Германия) и 2 мг стерата магния.
Масса таблетки 212 мг. Диаметр 8 мм, радиус кривизны 12 мм.
Изготовление
Смесь соединения согласно изобретению, лактозы и крахмала гранулируют, используя раствор поливинилпирролидона в воде концентрацией 5% масс. Гранулят после сушки смешивают в течение 5 минут со стератом магния. Полученную смесь подвергают прессованию на обычном таблеточном прессе (параметры таблеток указан выше). Нормированное усилие прессования составляет 15 кН.
Орально применяемая суспензия
Состав
1000 мг соединения согласно изобретению, 1000 мг этанола (96%), 400 мг ксантановой смолы Rhodigel® фирмы FMC (США, Пенсильвания) и 99 г воды.
Однократной дозе, содержащей 100 мг соединения согласно изобретению, соответствует 10 мл орально применяемой суспензии.
Изготовление
Смолу Rhodigel® суспендируют в этаноле и к полученной суспензии добавляют соединение согласно изобретению. При перемешивании добавляют воду. Компоненты перемешивают около 6 часов до завершения набухания смолы Rhodigel®.
Орально применяемый раствор
Состав
500 мг соединения согласно изобретению, 2,5 г полисорбата и 97 г полиэтиленгликоля 400. Однократной дозе, содержащей 100 мг соединения согласно изобретению, соответствует 20 мл орально применяемого раствора.
Изготовление
Соединение согласно изобретению при перемешивании суспендируют в смеси полиэтиленгликоля с полисорбатом. Перемешивание продолжают до полного растворения предлагаемого в изобретении соединения.
Раствор для внутривенных инъекций
Соединение согласно изобретению в концентрации ниже предела насыщения растворяют в физиологически совместимом растворителе (например, в изотоническом растворе хлорида натрия, 5-процентном растворе глюкозы и/или 30-процентном растворе полиэтиленгликоля 400, показатель рН которых устанавливают в диапазоне от 3 до 5). Раствор фильтруют при необходимости в стерильных условиях и/или расфасовывают в стерилизованные и освобожденные от пирогенных примесей сосуды для инъекций.