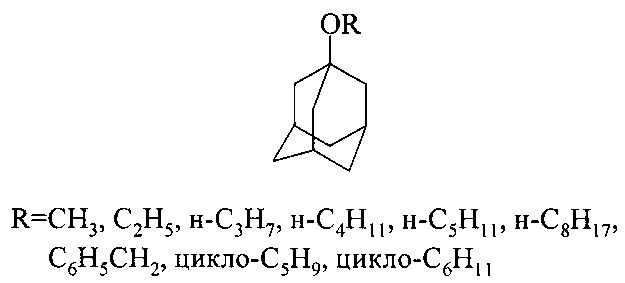Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ 1-АДАМАНТИЛАЛКИЛОВЫХ ЭФИРОВ
Вид РИД
Изобретение
Изобретение относится к области органического синтеза, в частности к способу получения 1-адамантилалкиловых эфиров.
1-Адамантилалкиловые эфиры формулы C10H16OR (1), где R=CH3(1a), C2H5(1b), н-C3H7(1с), н-C4H9(1d), н-C5H11(1e), H-C8H17(1f), C5H10(1g), C6H12(1b), C6H5CH2(1i), применяются в синтезе лекарственных препаратов и используются в качестве добавок смазочных масел и трансмиссионных жидкостей, повышающих окислительную стабильность и вязкость [1. Е.И.Багрий, Адамантаны М.: Наука, 1989, 264; 2. R.C. Fort // Adamantane: The Chemistry of Diamond Molecules. N.Y.: Dekker, 1976, 385].
Наиболее известным методом получения 1-адамантилалкиловых эфиров является фотолиз смеси галоидадамантанов со спиртами (Hg-лампа низкого давления, λ 254 нм, в атмосфере N2) [2. PJ. Kropp, G.S. Poindexter, N.J. Pienta, D.C. Hamilton // J.Am. Chem. Soc, 1976, 98(25), 8135-8144; 3. R.R Perkins, P.E. Pimcock // Tetrahedron Lett., 1975, 11, 943-946; 4. J.B. Miller, J.R. Salvador // J. Org. Chem. 2002, 67, 435-442; 5. P.J. Kropp, R.L. Adkins // J.Am. Chem. Soc, 1991, 113(7), 2709-2717].
Так, при фотолизе 1-иодадамантана (2) в метаноле в течение 24 часов (атмосфера азота) с выходом 90% образуется 1-метоксиадамантан (1а) при конверсии 1-иодадамантана (2) ~ 100%. При насыщении раствора кислородом выход эфира 1-метоксиадамантана (1а) снижается до 90%, так как наряду с последним образуется адамантанол-1 (3) (выход 10%).
Реакция 1-бромадамантана (4) с метанолом при облучении ртутной лампой проходит за более продолжительное время (48 ч), при этом снижается селективность реакции из-за восстановления (4) до адамантана (5).
1-Адамантил-трет-бутиловый эфир из 1-бромадамантана и t-BuOH был получен за более продолжительное время (144 ч) при облучении лампой 1000 W Hg/Xe [4. J.B. Miller, J.R. Salvador J. Org. Chem. 2002, 67, 435-442]
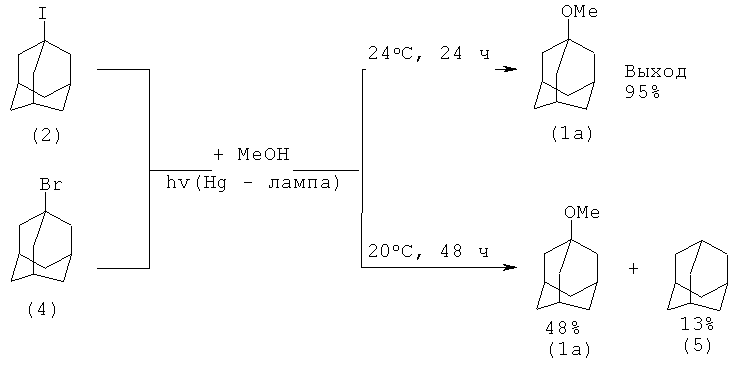
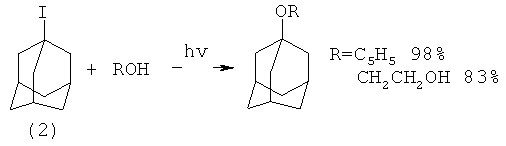
При использовании вместо метанола этанола или этиленгликоля были получены соответственно 1-этоксиадамантан (lb) (выход 98%) и 1-(2-гидроксиэтокси)адамантан (1j) (выход 83%)
Недостатки:
1. Значительная продолжительность реакции (20-48 часов).
2. Невозможность масштабирования реакции, так как фотохимические реакции проходят исключительно в прозрачном стеклянном и кварцевом оборудовании, объем которого строго лимитирован.
Реакция 1-бромадамантана (4) с метанолом в присутствии оксида серебра приводит к образованию 1-метоксиадамантана (1а) с выходом 91% за 15 часов [6. Р.Н.Owens, G.J.Gleicher, L.M.Smith // J. Am. Chem. Soc, 1968, 90(15), 4122-4126]

В работе [7. К. Tanemura, Т. Suzuki, Y. Nishida, К. Satsumabayashi, Т. Horaguchi // J. Chem. Soc, Perkin Trans.I, 2001, 3230-3231] для получения метиладамантилового эфира адамантан последовательно обработали окислителем 2,3-дихлор-5,6-дициано-пара-бензохиноном (DDQ) в трифторметансульфоновой кислоте при комнатной температуре, затем провели метанолиз
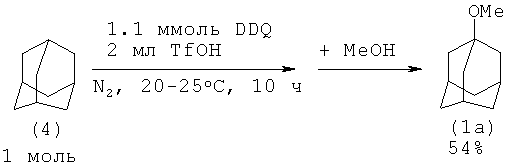
Недостатки:
1. Применение труднодоступных и дорогостоящих вспомогательных реагентов 2,3-дихлор-5,6-дициано-пара-бензохинона и трифторметансульфоновой кислоты в стехиометрическом количестве.
2. Образование большого количества отходов.
1-Метоксиадамантан (1а) и 1-этоксиадамантан (lb) были получены с умеренным выходом электролизом 1-адамантанкарбоновой кислоты (6) в присутствии метилата (этилата) натрия в среде метанола или этанола с добавками уксусной кислоты. Катодом служил платиновый электрод при силе токе 2А и напряжении 65 В
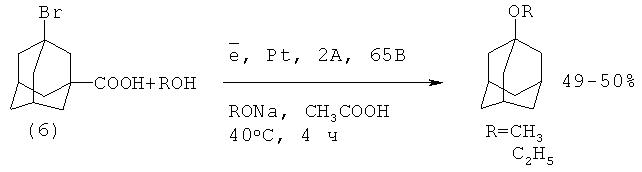
Из-за низкого выхода целевых продуктов, труднодоступности исходного реагента и малой производительности данный способ представляет лишь теоретический интерес [8. В.Ф.Баклан, С.С.Гуц // "Вести Киевск. политехн. института. Сер. хим.-технол", 1966, 2, 3-5].
1-Метоксиадамантан (1а) был получен окислением 1-иодадамантана (2) с помощью мета-хлорнадбензойной кислоты (7), взятой в трехкратном избытке, в среде метанола [9. R.I. Davidson, P.J. Kropp // J. Org. Chem, 1982, 10, 1904-1909]. Реакция проходит неселективно и приводит к образованию смеси 1-метоксиамантана (1а) (выход 84%) и адамантанола-1 (3) (выход 16%)
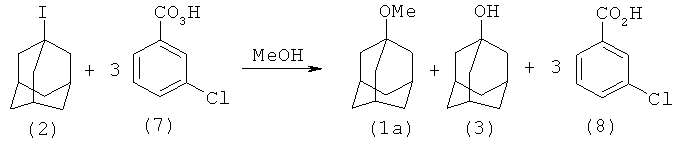
Недостатки:
1. Труднодоступность и дороговизна исходных реагентов - 1-иодадамантана (2) и надкислоты (7).
2. Большой расход окислителя (3 моля на 1 моль реагента).
3. Повышенная опасность процесса из-за использования высокореакционной надкислоты.
4. Образование большого количества агрессивных отходов (3 моля метахлорбензойной кислоты (8)).
5. Значительные трудности при выделении целевого продукта, связанные с нейтрализацией мета-хлорбензойной кислоты и удалением ее натриевой соли из реакционной массы.
Известен метод получения 1-метоксиадамантана (1а) из 1-хлорадамантана (9) и 1-йодадамантана (2) в присутствии избытка перхлората серебра, реакция протекает при комнатной температуре в метаноле
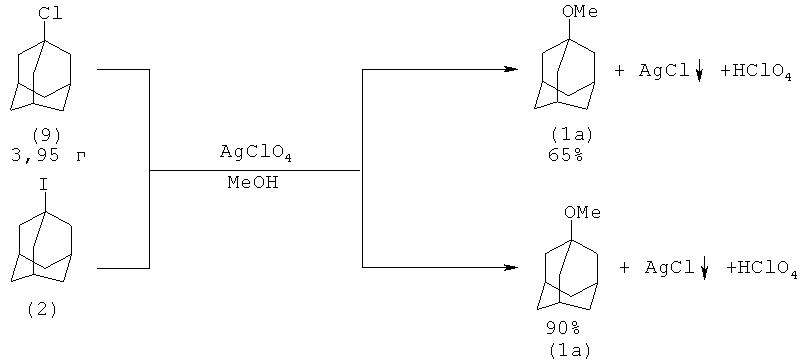
Реакция частично обратима, поэтому выпавший осадок необходимо срезу же отфильтровать. Избыток ионов хлора осаждают добавлением перхлората серебра в ацетоне [10. D.N.Kevill, К.С.Kolwysk, F.L.Weite // J. Am. Chem. Soc, 1970, 92(25), 7300-7306; 2. G. Poindexter, P.J. Kropp //J. Org. Chem. 1976, 41(7), 1215].
По указанной методике из 1-иодадамантана (2), 2-пропанола в присутствии AgC1О4 был получен 1-адамантилизопропиловый эфир (lk) с выходом 83%. Аналогичным способом был получен 1-адамантан-трет-бутиловый эфир (11) (80%).
Недостатки:
1. Большой расход катализатора дорогостоящего и взрывоопасного AgC1О4, который используется в эквимолярном количестве или избытке по отношению к 1-хлорадамантану (9).
2. Использование стехиометрических количеств AgClO4 влечет за собой целый ряд негативных последствий. Например, сильно усложняется процедура выделения и очистки целевого продукта.
3. Образуется значительное количество неорганических отходов (AgCl) и сточных вод, которые необходимо утилизировать, что требует больших трудо- и энергозатрат.
4. Процесс в целом является нетехнологичным и дорогим (большой расход катализатора, образование отходов, добавление дополнительной технологической стадии по осаждению катализатора, невозможность повторного использования дорогостоящего AgClO4 в связи с его превращением в нерастворимый в воде хлорид серебра.
5. Образование стехиометрического количества взрывоопасной кислоты НС1О4 (которая обладает высокой окислительной активностью), необходимость ее нейтрализации и образование отходов NaClO4.
В работе [11. У.М. Джемилев, Р.И. Хуснутдинов, Н.А. Щаднева, А.И. Маликов Пат. RU 2145593 (1998); 12. Р.И. Хуснутдинов, Н.А. Щаднева, А.И.Маликов, У.М. Джемилев // Нефтехимия. 2000, 40 (6), 458] защищен метод получения 1-адамантилалкиловых эфиров алкоголизом 1-хлорадамантана (9) с помощью спиртов под действием катализаторов комплексов палладия, таких как Pd(PPh3)4 и Pd(PPh3)2Cl2 при 160°C. В оптимальных условиях выходы 1-адамантилалкиловых эфиров достигают 90-98%. Такие выходы получены в присутствии Pd-содержащего катализатора, предварительно активированного при 200°C
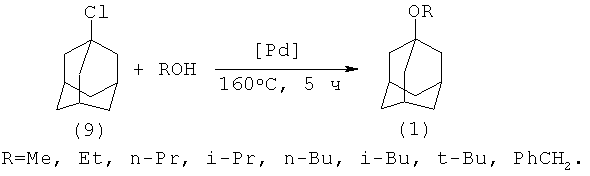
Недостатки:
1. Дороговизна катализаторов - трифенилфосфиновых комплексов палладия.
2. Необходимость предварительной активации катализатора при 200°C делает процесс двухстадийным, что повышает его трудоемкость.
Известен способ получения 1-этоксиадамантана (lb) реакцией 1-фторадамантана (10). В этом случае реакция проходит за 24 часа с выходом 97%
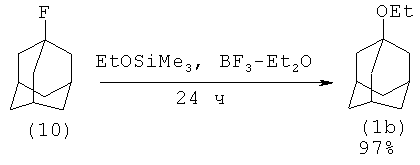
Недостатки:
1. Необходимость применения ядовитого эфирата трехфтористого бора.
2. Применение малодоступных 1-фторадамантана (10) и кремнийорганического реагента EtOSiMe3.
1-Адамантилбутиловый эфир (1d) был получен из 1-бромадамантана (4) и н-бутанола в присутствии Ag2(SO4)2 с выходом 88%. Процесс ведется при 70-90°C в течение 1,5-3 часов [13. Н. Xiao-chun, К. Li-chun. // Hecheng Huaxue, 2008, 16(4), 467-469, 471]:
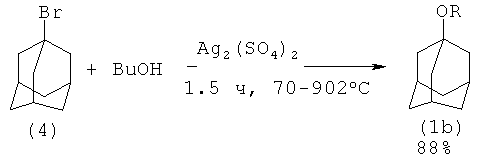
Недостатки:
1. Использование стехиометрических количеств дорогостоящего Ag2(SO4)2 влечет за собой усложнению процедуры выделения и очистки целевого продукта.
2. Образуется значительное количество неорганических отходов (AgBr) и сточных вод, которые необходимо утилизировать, что требует больших трудо- и энергозатрат.
3. Образование стехиометрического количества кислоты H2SO4, необходимость ее нейтрализации
В работе [14. E.L. Тае, С.Ventre, Z. Zhu, I. Likhotvorik, F. Ford, E. Tippmann, M.S. Platz // J. Phys. Chem. A., 2001, 105, 10146-10154] предложен способ получения 1-адамантилметилового эфира из AdOH-1 (3), NaH и CH3I с выходом 99%

Недостатки:
1. Пожароопасность процесса из-за применения сильного восстановителя - NaH.
2. Необходимость применения дорогостоящего метилйодида и абсолютированного растворителя - тетрагидрофурана.
3. Образование побочного продукта - йодида натрия в стехиометрическом количестве.
1-Адамантилбензиловый эфир синтезировали из адамантанола-1 и 2-бензилокси-1-метилпиридиний трифлата в присутствии MgO [15. K.W.Poon, G.Dubley // J. Org. Chem, 2006, 71(10), 3923-3927; 16. G. Dubley. Пат. US 7754909 (2010)]
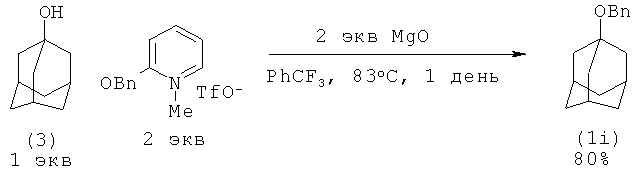
Недостатки:
1. Необходимость применения 2-кратного избытка 2-бензилокси-1-метилпиридиний трифлата (бензилирующий агент).
1-Адамантилалкиловые эфиры были получены из 1-адамантанола (9) с диалкоксиметаном в присутствии SAC-13 твердой суперкислоты (новый тип перфторсульфокислоты Nation) или в присутствии пара-толуолсульфокислоты или BF3-OEt2 в качестве побочного продукта при получении ацеталей [17. I. Ledneczki, A. Molnar // Synth. Commun., 2004, 34(20), 3683-3690]
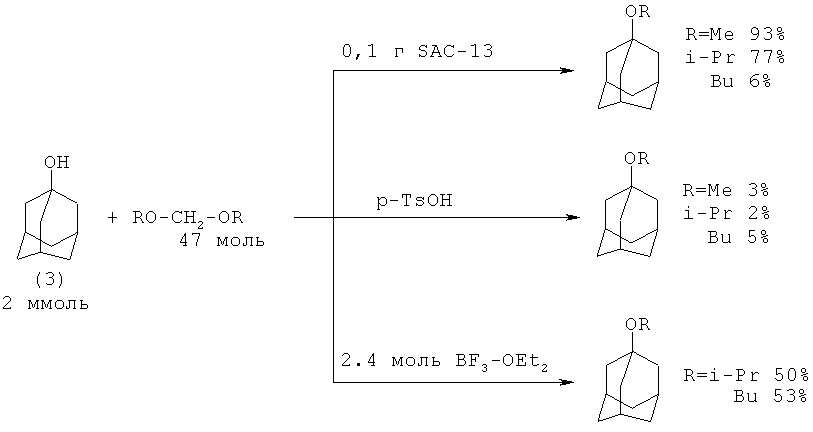
Недостатки:
1. Использование большого избытка труднодоступных диалкоксиметанов.
2. Применение дорогостоящей суперкислоты SAC-13, производимой компанией Du Pont (стоимость 10 г катализатора [31175-20-9] 85.70 €).
Наиболее близким к изобретению является способ получения 1-адамантилфениловых эфиров, описанный в [18]. 1-Адамантилфениловые эфиры были получены при взаимодействии 1-адамантанола (3) с фенолом и его производными в присутствии катализатора CuCl и дициклогексилкарбодиимида (водоотнимающий реагент) [18. U. Kraatz. // Chem. Ber. 1973, 106, 3095-3096]
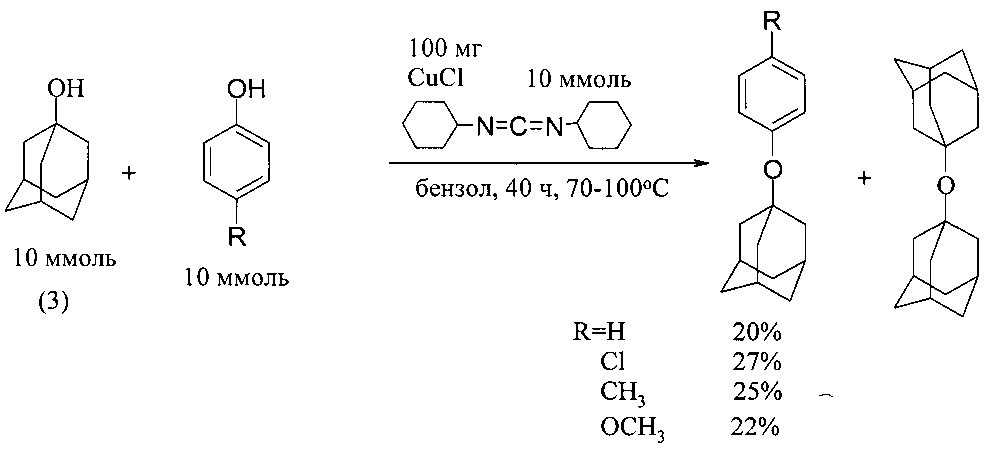
Прототип имеет следующие недостатки:
1. Необходимость использования водоотнимающего реагента - токсичного дициклогексилкарбодиимида в стехиометрическом количестве.
2. Образование большого количества отходов дициклогексилкарбодиимида.
3. Низкий выход эфиров.
Авторами предлагается следующий способ получения 1-адамантилалкиловых эфиров.
Сущность способа заключается в проведении реакции межмолекулярной дегидратации между 1-адамантанолом (3) и спиртами под действием катализатора Cu(асас)2 при 175-220°С в течение 4-10 ч при мольном соотношении [катализатор]:[адамантанол]:[спирт]=1-50:100:500-1600. При оптимальных условиях [катализатор]:[адамантанол]:[спирт]=10:100:1000, 220°С, 6 ч выход метилового эфира адамантана составил 95%, этилового 32%, н-пропилового 31%, н-бутилового 25%, н-пентилового 17%, н-октилового 16%, бензилового 58%, циклопентилового 39%, циклогексилового 21%.
Процесс проводится в микроавтоклаве и отличается высоким выходом метилового эфира. Непрореагировавший 1-адамантанол после выделения декантацией гексаном может быть возвращен в реакцию
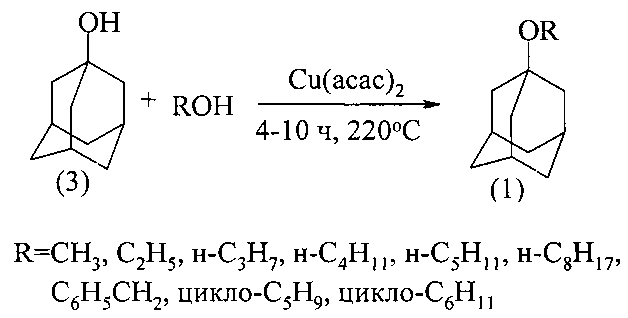
В случае этилового, н-пропилового и других спиртов реакция образования соответствующих эфиров проходит с ~100% селективностью при неполной конверсии 1-адамантанола (3), который легко отделяется от эфира и может быть возвращен в реакцию.
Существенные отличия предлагаемого способа от прототипа
Для получения адамантилалкиловых эфиров используют 1-адамантанол (3), доступные алифатические и циклоалифатические спирты и катализатор Cu(асас)2.
Предлагаемый способ поясняется примерами.
ПРИМЕР 1. Реакции проводили в стеклянной ампуле объемом 10 мл, помещенной в микроавтоклав из нержавеющей стали объемом 17 мл, при постоянном перемешивании и регулируемом нагреве.
В ампулу в токе аргона загружали 10 ммоль Cu(асас)2, 100 ммоль 1-адамантанола, 1000 ммоль спирта (метанол, этанол, н-пропанол, н-бутанол, н-пентанол, н-октанол, бензиловый спирт, циклопентанол, циклогексанол). Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 220°С в течение 6 ч при постоянном перемешивании. После окончания реакции автоклав охлаждали до комнатной температуры, ампулу вскрывали, реакционную массу фильтровали через бумажный фильтр. Растворитель отгоняли (низкокипящие гомо-эфиры отгоняли, высококипящие гомо-эфиры отгоняли под вакуумом). 1-Адамантилалкиловый эфир отделяли от непрореагировавшего адамантанола-1 декантацией в гексане.
Строение полученных соединений доказано методами ЯМР, масс-спектрометрии, а также сравнением с известными образцами и справочными данными.
1 - Адамантилметиловый эфир(1а). Выход 95%. Спектр ЯМР 13С (8, м.д.): 30.44 (С3,5,7), 36.33 (C4,6,10), 40.86 (С2,8,9), 47.55 (OCH3), 71.70 (С1). Спектр ЯМР 1H (CDCl3, δ, м.д.): 1.51 d (6Н, C2,8,9H2, J 11.2 Гц), 1.63 с (6Н, С4,6,10H2), 2.05 уш.с. (3Н, С3,5,7Н), 3.11 с (3H, OCH3) [14. E.L. Тае, С.Ventre, Z. Zhu, I. Likhotvorik, F. Ford, E. Tippmann, M.S. Platz // J. Phys. Chem. A., 2001, 105, 10146-10154; 12. Р.И.Хуснутдинов, H.A.Щаднева, А.И.Маликов, У.М.Джемилев // Нефтехимия. 2000, 40 (6), 458].
1-Адамантилэтиловый эфир(1b). Выход 32%. Спектр ЯМР 13С (δ, м.д.): 16.37 (CH3), 30.50 (C3,5,7), 36.52 (С4,6,10), 41.62 (C2,8,9), 54.88 (CH2CH3), 71.78 (С1). Спектр ЯМР 1H (CDCl3, S, м.д.): 1.15 т (3H, CH3, J 6.8 Гц), 1.61 с (6H, С4,6,10Н2), 1.61 d (6Н, С2,8,9Н2, J 6.8 Гц), 2.12 уш.с. (3H, С3,5,7H), 3.46 кв (2H, CH2CH3, J 7.2 Гц) [12. Р.И.Хуснутдинов, Н.А.Щаднева, А.И.Маликов, У.М.Джемилев // Нефтехимия. 2000,40 (6), 458].
1-Адамантилпропиловый эфир(1с). Выход 31%. Спектр ЯМР 13C (8, м.д.): 10.69 (CH3), 23.91 (СН2СН3), 30.67 (С3,5,7), 36.40 (С4,6,10), 41.63 (С2,8,9), 61.47 (CH2CH2), 71.64 (С1). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.09 т (3H, CH3, J 7.6 Гц), 1.76 с (6Н, C4,6,10H2), 1.58 d (6H, С2,8,9Н2, / 7.6 Гц), 2.15 уш.с. (3H, C3,5,7H), 3.62 т (2H, CH2CH2, J 6.8 Гц) [12. Р.И.Хуснутдинов, Н.А.Щаднева, А.И.Маликов, У.М.Джемилев // Нефтехимия. 2000, 40 (6), 458].
Масс-спектр, m/e (Ioтн, %): 194 [M]+(53), 136.20 (10.87), 135.20 (100.00), 110.15 (8.76), 107.15 (4.65), 95.10 (39.97), 94.10 (5.73), 93.10 (7.60), 79.10 (8.29), 67.05 (4.91), 55.05 (4.70).
1-Адамантилбутиловый эфир(1d). Выход 25%. Масс-спектр, m/e (Ioтн, %): 208 [M]+(36.37), 152 (12.72), 151 (76.36), 136 (10.91), 135 (100.00), 107 (7.27), 95 (81.82), 93 (14.55), 79 (16.36), 67 (7.27), 55 (6.36).
1-Адамантилпентиловый эфир(1е). Выход 17%. Масс-спектр, m/e (Ioтн, %): 222 [М]+(11.32), 165 (37.74), 136 (11.32), 135 (100.00), 107 (6.60), 95 (54.71), 93 (9.43), 79 (10.38), 67 (5.66), 55 (4.72).
1-Адамантилоктиловый эфир(1f). Выход 16%. Масс-спектр, m/e (Ioтн, %): 264.30 [М]+(1.79), 207.20 (16.54), 136.20 (10.87), 135.20 (100.00), 110.15 (8.76), 107.15 (4.65), 95.10 (39.97), 94.10 (5.73), 93.10 (7.60), 79.10 (8.29), 67.05 (4.91), 55.05 (4.70).
1-Адамантилбензиловый эфир(1g). Выход 58%. Масс-спектр, m/e (Ioтн, %): 242.20 [М]+(28.67), 185.10 (12.20), 136.20 (6.88), 135.20 (58.04), 107.15 (7.18), 93.10 (13.31), 92.10 (10.03), 91.10 (100.00), 79.10 (8.60), 67.05 (6.76), 65.00 (7.60).
1-Адамантилциклопентиловый эфир(1h). Выход 39%. Масс-спектр, m/e (Ioтн, %): 220.15 [M]+(8.05), 152.15 (5.18), 136.20 (10.79), 135.20 (100.00), 107.15 (6.21), 95.10 (9.74), 93.10 (10.71), 79.10 (10.58), 67.05 (4.77), 55.05 (2.90).
1-Адамантилциклогексиловый эфир(1i). Выход 21%. Масс-спектр, m/e (Ioтн, %): 234.20 [M]+(8.23), 152.15 (5.65), 136.20 (11.06), 135.20 (100.00), 107.15 (5.01), 95.10 (16.05), 93.10 (8.19), 79.10 (8.60), 67.05 (4.17), 55.05 (6.51).
Другие примеры, подтверждающие способ, приведены в таблице 1.
|