Результат интеллектуальной деятельности: ИММУНОБИОЛОГИЧЕСКОЕ СРЕДСТВО ДЛЯ ТЕРАПИИ РАКА МОЧЕВОГО ПУЗЫРЯ НА ОСНОВЕ БЦЖ И СПОСОБ ЕГО ИСПОЛЬЗОВАНИЯ
Вид РИД
Изобретение
Область техники
Изобретение относится к препаратам, созданным на основе вакцин для использования их в онкоурологии, и может быть использовано для терапии рака мочевого пузыря, а также для профилактики рецидивов рака мочевого пузыря после оперативного лечения.
Предшествующий уровень техники
В настоящее время рак мочевого пузыря (РМП) по данным Всемирной Организации Здравоохранения (ВОЗ) является одной из самых распространенных форм рака в мире. Частота встречаемости РМП среди опухолей различных локализаций составляет от 3 до 5%. Ежегодно в России рак мочевого пузыря диагностируется у 11-15 тысяч людей, при этом более 7 тысяч людей погибают.
Известно, что основным методом лечения РМП является трансуретальная резекция (ТУР) опухоли (в кн.: «Современная диагностика и хирургия рака мочевого пузыря» / Под ред. Когана М.И. и Перепечай В.А. - Изд-во РГМУ, г. Ростов-на-Дону, 2002 г. - С. 61-66), однако у большинства больных (более 60%) возникают рецидивы и РМП начинает прогрессировать заново, на большей глубине инвазии и с более агрессивным течением.
Одной из важнейших задач современной онкоурологии является поиск методов, которые бы позволили улучшить результаты оперативного лечения.
Известен способ лечения РМП, в котором авторы предлагают проводить послеоперационную иммунопрофилактику различными противоопухолевыми препаратами и химиопрепаратами после оперативного удаления опухоли (Матвеев Б.П., Фигурин К.М. и Карякин О.Б. "Рак мочевого пузыря", Москва, 2001 г.). Однако недостатком указанного метода является зависимость эффективности лечения от дозы иммуномодуляторов, а также высокая токсичность химиопрепаратов, которые действуют на стенку мочевого пузыря. Также к недостаткам метода можно отнести относительно низкую эффективность проникновения иммуномодуляторов и химиопрепаратов через слизистый слой мочевого пузыря.
Известно решение (патент РФ № RU 2290096), при котором предлагается способ введения химиопрепаратов с помощью микроирригаторов, которые вшивают в подслизистый слой мочевого пузыря пациентов после оперативного вмешательства. Данный способ позволяет уменьшить общую токсичность химиопрепаратов за счет локального введения, однако имеет недостаток, связанный с высокой травматичностью метода, поскольку требует дополнительного оперативного вмешательства для удаления микроирригаторов.
Известно решение согласно клиническим исследованиям компании Halozyme Therapeutics, Inc. № HZ2-08-01 (вторичный № NCT00782587), где заявлено использование гиалуронидазы совместно с химиопрепаратом митомицином С, которые вводятся в мочевой пузырь после трансуретальной резекции неинвазивной опухоли. В данном случае гиалуронидаза используется для повышения эффективности проникновения противоопухолевого антибиотика в клетки мочевого пузыря. Авторы отмечают снижение рецидивов, представленных только неинвазивными опухолями мочевого пузыря, в течение первого года с 50% (при обработке только митомицином С) до 30% (при совместной обработке митомицином С и гиалуронидазой).
Известно решение (патент US 8,273,721 В2), в котором предлагается способ использования препарата вальрубицина совместно с ферментами, разрушающими слизь (трипсин и гиалуронидаза). В указанном решении ферменты, разрушающие слизь мочевого пузыря, используются для повышения эффективности проникновения противоопухолевого препарата вальрубицина в клетки мочевого пузыря.
Известно также решение по патенту US 5194257, где заявлено использование бацилл Кальмета-Герена (БЦЖ), которые вводятся в мочевой пузырь после оперативного удаления опухоли. Данное решение основывается на том, что БЦЖ является мощным неспецифическим иммуностимулятором, вызывающим комплекс локальных иммунных реакций, в котором задействованы Т- и В-лимфоциты, макрофаги и целый ряд цитотоксичеких цитокинов, что обеспечивает ее противоопухолевую активность.
Данное техническое решение как наиболее близкое к заявляемому по составу действующего вещества и способу его использования выбрано авторами заявляемого изобретения за прототип.
К недостаткам прототипа можно отнести следующее:
1) Низкая эффективность проникновения БЦЖ в уротелий мочевого пузыря при внутрипузырном введении.
2) Относительно низкая иммуностимулирующая активность, требующая введения высоких доз БЦЖ, что приводит к увеличению токсичности.
Таким образом, в уровне техники существует острая потребность в разработке эффективного иммунобиологического средства для лечения рака мочевого пузыря вообще, а также после оперативного удаления опухолей, которое было бы лишено указанных недостатков.
Сущность изобретения
Задачей настоящего изобретения является создание иммунобиологического средства для терапии рака мочевого пузыря на основе БЦЖ, которое способно высокоэффективно проникать в уротелий мочевого пузыря через секрет слизистого слоя, в то же время иммунобиологическое средство должно обладать высокой иммуностимулирующей активностью.
Задача решается за счет создания нового иммунобиологического средства. Сущность созданного иммунобиологического средства для лечения рака мочевого пузыря на основе БЦЖ состоит в том, что оно дополнительно содержит фермент с обеспечением расщепления секрета слизистой оболочки мочевого пузыря и буфер, взятые в терапевтически эффективном соотношении. При этом в иммунобиологическом средстве в качестве фермента используют гиалуронидазу, или нейраминидазу, или гиалуронидазу и нейраминидазу. В иммунобиологическом средстве в дозе на одну инсталляцию в мочевой пузырь содержится:
БЦЖ - от 103 КОЕ/дозу до 1010 КОЕ/дозу;
Фермент, расщепляющий секрет слизистой оболочки мочевого пузыря, а именно:
гиалуронидазы от 1 до 100000 единиц/дозу;
нейраминидазы от 0,001 до 100 единиц/дозу;
или их смесь в любых соотношениях;
Буфер - остальное.
Способ использования иммунобиологического средства для лечения рака мочевого пузыря заключается во введении заявленного иммунобиологического средства в мочевой пузырь. При этом в мочевой пузырь вводится только иммунобиологическое средство. Или в мочевой пузырь предварительно вводится фермент, расщепляющий секрет слизистой оболочки мочевого пузыря, в заявленном для иммунобиологического средства количестве, а затем иммунобиологическое средство. Указанный способ используют у пациента, страдающего раком мочевого пузыря. При этом указанный способ используют для лечения пациента, страдающего раком мочевого пузыря, самостоятельно, без хирургического вмешательства, или после трансуретальной резекции рака мочевого пузыря. При введении фермента перед введением иммунобиологического средства в качестве фермента, расщепляющего секрет слизистой оболочки мочевого пузыря, используют гиалуронидазу, или нейраминидазу, или гиалуронидазу и нейраминидазу.
Раскрытие изобретения
Указанная выше задача настоящего изобретения решается за счет того, что создано иммунобиологическое средство для лечения рака мочевого пузыря на основе БЦЖ, при этом данное иммунобиологическое средство дополнительно включает фермент(ы), расщепляющий(ие) полисахариды секрета слизистого слоя мочевого пузыря. Также разработан комбинированный способ лечения мочевого пузыря, позволяющий решить указанную задачу.
В качестве ферментов используют гиалуронидазу, нейраминидазу или их композиции. При этом 1 терапевтическая доза препарата включает:
БЦЖ - от 103 КОЕ/дозу до 1010 КОЕ/дозу
Гиалуронидазу от 1 до 100000 условных единиц активности (УЕ)
Нейраминидазу от 0,001 до 100 Международных единиц активности (ME)
Буфер - остальное.
Заявленное иммунобиологическое средство используют в эффективном количестве для терапии рака мочевого пузыря.
Противоопухолевое действие БЦЖ связано с тем, что она обладает иммуностимулирующими свойствами. Известно, что в состав данных бактерий входят структуры, которые являются лигандами рецепторов врожденной иммунной системы (TLR4, TLR5 и др.). Взаимодействие компонентов БЦЖ с данными рецепторами приводит к активации различных транскрипционных факторов (например, транскрипционного фактора NF-kB), контролирующих экспрессию целого ряда провоспалительных молекул.
Так, было показано, что введение БЦЖ усиливает экспрессию адгезионных и костимуляторных молекул, включая внутриклеточные адгезионные молекулы ICAM-1, которые влияют на связывание Т-лимфоцитов и нейтрофилов с опухолевыми клетками. Также есть литературные данные, указывающие на то, что при введении данных бактерий увеличивается экспрессия HLAII, CD80, CD1b молекул, происходит индукция экспрессии ряда цитокинов, таких как интерлейкин-8 (ИЛ-8), интерлейкин-6 (ИЛ-6), фактор некроза опухолей альфа (TNFα), гранулоцитарно-макрофагальный фактор роста (GM-CSF).
Актуальной проблемой, ограничивающей использование БЦЖ-вакцины для лечения опухолевых образований в мочевом пузыре, является низкая эффективность их проникновения через секрет слизистой оболочки мочевого пузыря, состоящий из гликозамингликанов. Для более эффективной доставки различных веществ в клетки мочевого пузыря необходимо хотя бы частично разрушить секрет слизистой оболочки. Данная проблема решается в заявляемом иммунобиологическом средстве за счет включения в его состав ферментов или их композиций (гиалуронидаза, нейраминидаза), которые расщепляют секрет слизистой оболочки мочевого пузыря, тем самым способствуя прикреплению и проникновению БЦЖ в клетки мочевого пузыря. Так гиалуронидаза расщепляет кислые мукополисахариды (в т.ч. муцин, гиалуроновую кислоту, хондроитин-сульфат, дерматан-сульфат, которые входят в состав секрета слизистой оболочки мочевого пузыря). Нейраминидаза гидролизует сиаловые кислоты в олигосахаридах, гликопротеинах, гликолипидах, что также способствует проникновению БЦЖ через слизистый слой мочевого пузыря, богатый сиаловой кислотой.
Более того, известно, что при развитии рака любой этиологии опухолевые клетки имеют более выраженный гликокаликс по сравнению с нормальными клетками, что приводит к снижению эффективности распознавания таких клеток иммунной системой, а также снижению эффективности доставки различных препаратов внутрь этих клеток. Известно решение (патент US 6,977,169 В2), где предлагается использовать периодические введения раствора нейраминидазы для лечения широкого спектра новообразований, что способствует частичной деградации гликокаликса опуолевых клеток и повышению эффективности распознавания таких клеток иммунной системой.
Исследования, показывающие эффективность иммунобиологического средства, разработанного авторами, включают: оценку эффективности проникновения БЦЖ в клетки мочевого пузыря; оценку влияния схем введения иммунобиологического средства на эффективность проникновения БЦЖ в клетки мочевого пузыря; сравнительный анализ способности индуцировать иммунные реакции; оценку противоопухолевой активности и токсичности.
Краткое описание чертежей
На фиг. 1 представлена гистограмма, показывающая изменение титра КОЕ БЦЖ в клетках RT-4 при добавлении к ним иммунобиологического средства, содержащего различное количество ферментов, расщепляющих секрет слизистого слоя мочевого пузыря: гиалуронидазы и нейраминидазы.
Ось ординат - титр КОЕ БЦЖ.
Ось абсцисс - концентрация гиалуронидазы (УЕ/дозу).
Ось аппликат - концентрация нейраминидазы (МЕ/дозу).
На фиг. 2 представлена гистограмма, показывающая изменение концентрации цитокинов ИЛ-2, ИЛ-6, ИЛ-8, ИЛ-13, ФНОальфа, ИФНгамма в клетках RT-4 при добавлении иммунобиологического средства на основе вакцины БЦЖ.
Ось ординат - концентрация цитокинов, пг/мл.
Ось абсцисс: 1 - ИЛ-2, 2 - ИЛ-6, 3 - ИЛ-8, 4 - ИЛ-13, 5 - ФНО альфа, 6 - гамма интерферон.
 - Фосфатный буфер
- Фосфатный буфер
 - БЦЖ в количестве 108 КОЕ/дозу
- БЦЖ в количестве 108 КОЕ/дозу
 - БЦЖ в количестве 1011 КОЕ/дозу
- БЦЖ в количестве 1011 КОЕ/дозу
 - Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), при этом оно включает фермент гиалуронидазу в количестве 10000 УЕ/дозу
- Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), при этом оно включает фермент гиалуронидазу в количестве 10000 УЕ/дозу
 - Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), при этом оно включает фермент нейраминидазу в количестве 10 МЕ/дозу
- Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), при этом оно включает фермент нейраминидазу в количестве 10 МЕ/дозу
 - Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), при этом оно включает ферменты гиалуронидазу в количестве 10000 УЕ/дозу и нейраминидазу в количестве 10 МЕ/дозу
- Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), при этом оно включает ферменты гиалуронидазу в количестве 10000 УЕ/дозу и нейраминидазу в количестве 10 МЕ/дозу
На фиг. 3 представлена схема исследования противоопухолевой активности иммунобиологического средства на основе БЦЖ. По оси абсцисс указано время от начала эксперимента (дни),
А - введение клеток рака мочевого пузыря мышиМВ49,
В - введение стандартной вакцины БЦЖ,
С - введение иммунобиологического средства на основе БЦЖ, в качестве фермента используют гиалуронидазу,
D - введение иммунобиологического средства основе БЦЖ, в качестве фермента используют нейраминидазу,
Ε - введение иммунобиологического средства на основе БЦЖ, отличающейся тем, что в качестве фермента используют гиалуронидазу и нейраминидазу,
F - введение физиологического раствора.
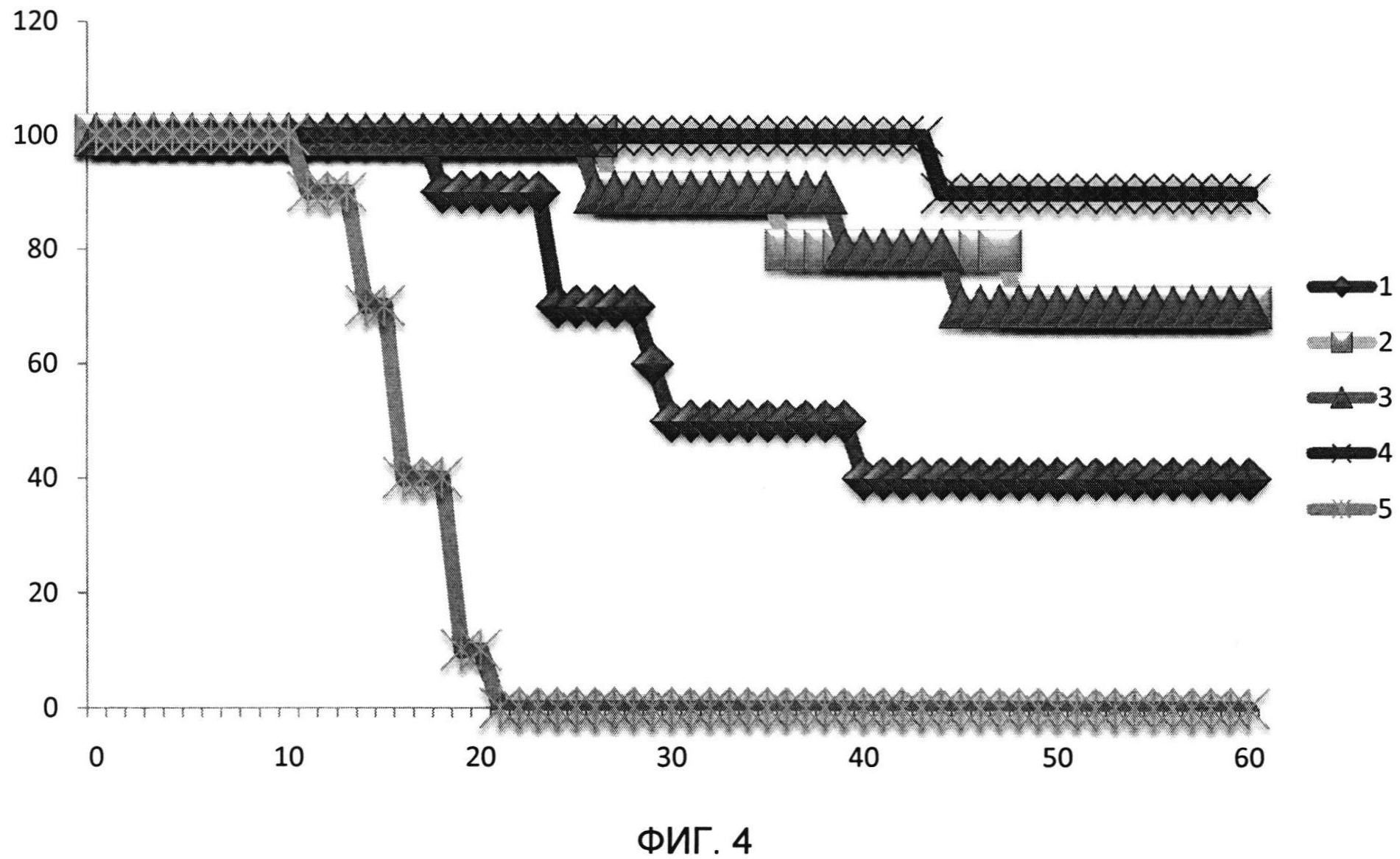
На фиг. 4 представлены результаты исследования противоопухолевой активности иммунобиологического средства.
По оси абсцисс указано время от начала эксперимента (дни), по оси ординат - выживаемость животных (%),
1 - БЦЖ в количестве 108 КОЕ/дозу,
2 - иммунобиологическое средство на основе БЦЖ, при этом в качестве фермента используют гиалуронидазу,
3 - иммунобиологическое средство на основе БЦЖ, при этом в качестве фермента используют нейраминидазу,
4 - иммунобиологическое средство на основе БЦЖ, при этом в качестве фермента используют гиалуронидазу и нейраминидазу,
5 - физиологический раствор.
На фиг. 5 представлена схема введения препаратов в исследовании влияния различных схем введения на эффективность проникновения БЦЖ в клетки мочевого пузыря.
По оси абсцисс указано время (минуты) введения препаратов,
А - введение стандартной вакцины БЦЖ,
В - введение иммунобиологического средства на основе вакцины БЦЖ, при этом она включает ферменты гиалуронидазу и нейраминидазу, С - введение смеси ферментов гиалуронидазы и нейраминидазы.
Примеры осуществления настоящего изобретения
Пример 1
Определение эффективных доз ферментов, расщепляющих секрет слизистой оболочки мочевого пузыря, в составе разрабатываемого иммунобиологического средства на основе БЦЖ.
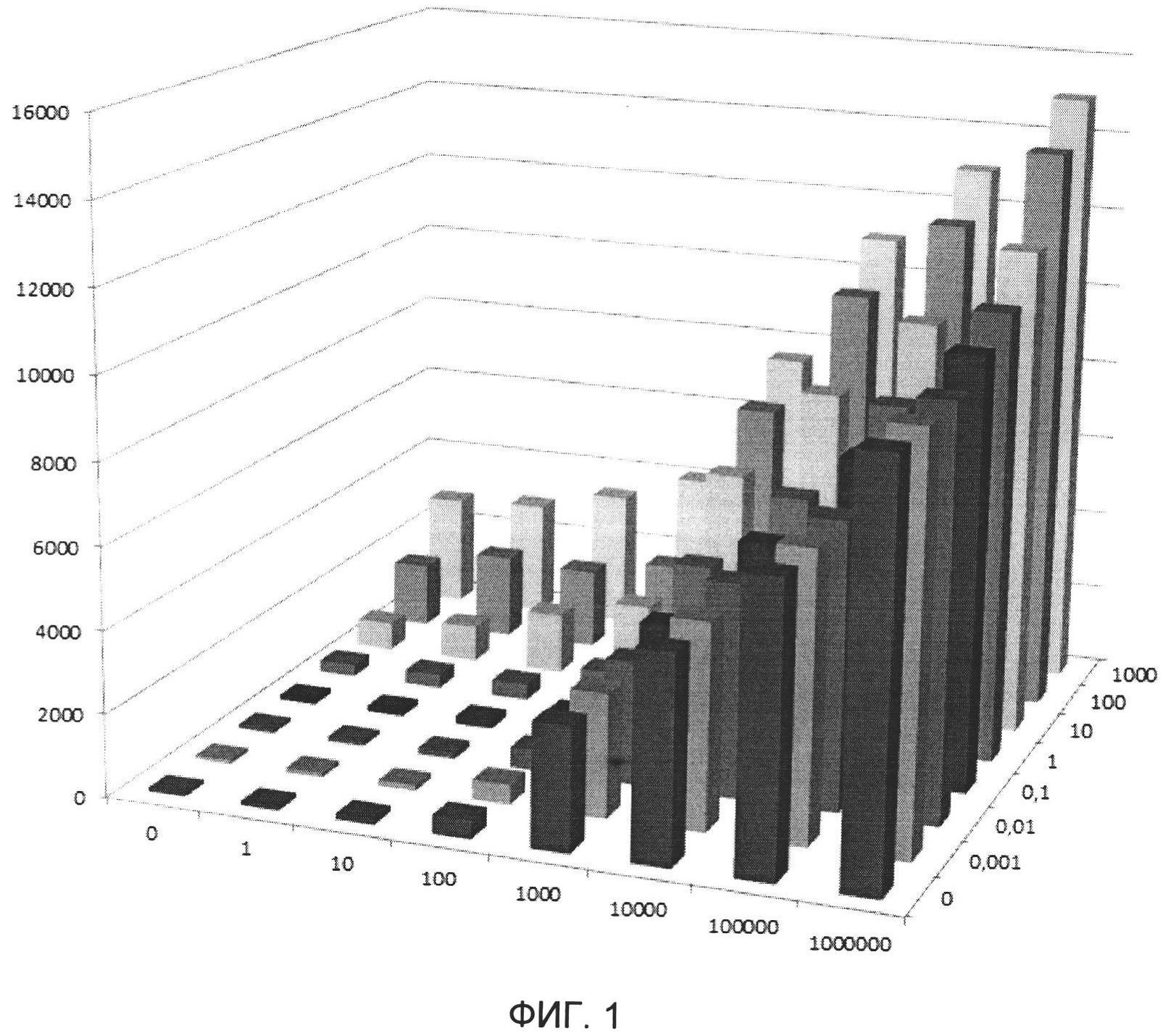
Поскольку одной из основных проблем использования БЦЖ-вакцины для лечения опухолевых новообразований в мочевом пузыре является низкая эффективность проникновения бактерий в подслизистый слой, целью данного эксперимента было определение доз ферментов, расщепляющих секрет слизистой оболочки мочевого пузыря, в составе разрабатываемого иммунобиологического средства (на основе БЦЖ) по способности БЦЖ проникать в обработанные ферментами опухолевые клетки мочевого пузыря в условиях in vitro. Для этого были использованы клетки рака мочевого пузыря человека RT-4, т.к. известно, что эти клетки обладают весьма выраженным гликокаликсом, сходным по своему составу и структуре с секретом слизистого слоя мочевого пузыря. Клетки культивировали на минимальной ростовой среде DMEM с 10% эмбриональной телячьей сывороткой и в присутствии необходимого количества заменимых и незаменимых аминокислот, при температуре 37°С и содержании CO2 5%. Далее клетки помещали на 48-луночный планшет в концентрации 4×104 клеток/лунку и инкубировали 16 часов (до конфлюентности 70-80%).
Далее был получен ряд иммунобиологических средств на основе вакцины БЦЖ (108 КОЕ/дозу), гиалуронидазы (в следующих концентрациях: 1 УЕ/дозу, 10 УЕ/дозу, 100 УЕ/дозу, 1000 УЕ/дозу, 10000 УЕ/дозу, 100000 УЕ/дозу, 1000000 УЕ/дозу) и нейраминидазы (в следующих концентрациях: 0,001 МЕ/дозу, 0,01 МЕ/дозу, 0,1 МЕ/дозу, 1 МЕ/дозу, 10 МЕ/дозу, 100 МЕ/дозу, 1000 МЕ/дозу). Под дозой понимается количество препарата, предназначенное для единовременного (за 1 инсталляцию) введения в мочевой пузырь. Объем препарата, рекомендованный для одной инсталляции в мочевой пузырь, составляет 50 мл (инструкции к препаратам «Иммурон-вак», «Уро-БЦЖ медак»). Поскольку иммунобиологическое средство содержит живые бактериальные клетки, для разведения может быть использован любой изотонический растворитель надлежащего фармацевтического качества. В данном случае нами использовался физиологический раствор.
После разведения иммунобиологического средства 20 мкл из каждого образца было добавлено в соответствующие лунки планшета. Через три часа после добавления иммунобиологического средства клетки промывали трижды ростовой средой, чтобы избавиться от неприкрепившихся бактерий, и заливали свежей ростовой средой. Далее клетки инкубировали 18 часов. Затем клетки снимали с планшета, гомогенизировали с помощью керамических бус, готовили разведения и высевали на плотные питательные среды Левенштейна-Иенсена для определения титра КОЕ БЦЖ.
В таблице 1 представлены результаты анализа титра КОЕ БЦЖ, полученные с помощью высевов гомогенатов клеток RT-4, обработанных различными иммунобиологическими средствами на основе БЦЖ, отличающимися концентрациями ферментов, расщепляющих секрет слизистой оболочки мочевого пузыря.
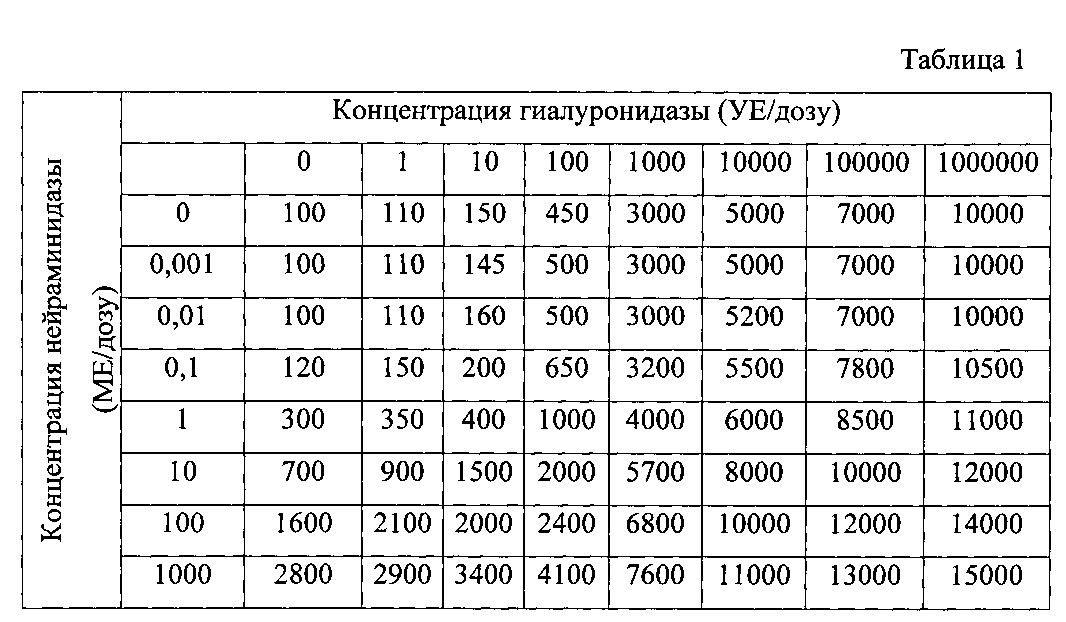
Для наглядности полученные данные представлены также в виде трехмерной гистограммы (см. фиг. 1), где ось ординат - титр КОЕ БЦЖ, ось абсцисс - концентрация гиалуронидазы (УЕ/дозу), ось аппликат - концентрация нейраминидазы (МЕ/дозу).
Как видно из представленных данных, эффективность проникновения БЦЖ в опухолевые клетки рака мочевого пузыря человека RT-4 значительно выше при использовании иммунобиологического средства на основе БЦЖ в диапазоне концентраций гиалуронидазы от 100 до 1000000 УЕ/дозу и нейраминидазы от 1 до 1000 МЕ/дозу, чем при использовании стандартной вакцины БЦЖ.
Пример 2
Определение эффективных доз БЦЖ в составе разрабатываемого иммунобиологического средства на основе БЦЖ.
Целью данного эксперимента являлось определение эффективных доз БЦЖ в составе разрабатываемого иммунобиологического средства. Для этого были использованы клетки рака мочевого пузыря человека RT-4, т.к. известно, что эти клетки обладают весьма выраженным гликокаликсом, сходным по своему составу и структуре с секретом слизистого слоя мочевого пузыря. Клетки культивировали на минимальной ростовой среде DMEM с 10% эмбриональной телячьей сывороткой и в присутствии необходимого количества заменимых и незаменимых аминокислот, при температуре 37°С и содержании СО2 5%. Далее клетки помещали на 48-луночный планшет в концентрации 4×104 клеток/лунку и инкубировали 16 часов (до конфлюентности 70-80%). Для исследования были выбраны дозы ферментов, расщепляющих секрет слизистой оболочки мочевого пузыря, которые лежат в середине исследованного в примере 1 рабочего диапазона концентраций: гиалуронидаза - 10000 УЕ/дозу, нейраминидаза - 10 УЕ/дозу.
Далее был получен ряд иммунобиологических средств на основе вакцины БЦЖ (в следующих концентрациях: 103 КОЕ/дозу, 104 КОЕ/дозу, 105 КОЕ/дозу, 106 КОЕ/дозу, 107 КОЕ/дозу, 108 КОЕ/дозу, 109 КОЕ/дозу, 1010 КОЕ/дозу, 1011 КОЕ/дозу), гиалуронидазы (10000 УЕ/дозу) и нейраминидазы (10 МЕ/дозу). В качестве контроля использовали вакцину БЦЖ в концентрациях: 103 КОЕ/дозу, 104 КОЕ/дозу, 105 КОЕ/дозу, 106 КОЕ/дозу, 107 КОЕ/дозу, 108 КОЕ/дозу, 109 КОЕ/дозу, 1010 КОЕ/дозу, 1011 КОЕ/дозу. Под дозой понимается количество препарата, предназначенное для единовременного (за 1 инсталляцию) введения в мочевой пузырь. Объем препарата, рекомендованный для одной инсталляции в мочевой пузырь, составляет 50 мл (инструкции к препаратам «Иммурон-вак», «Уро-БЦЖ медак»). Поскольку иммунобиологическое средство содержит живые бактериальные клетки, для разведения можно использовать любой изотонический растворитель надлежащего фармацевтического качества. В данном случае нами использовался физиологический раствор.
После разведения иммунобиологического средства и вакцины БЦЖ, 20 мкл из каждого образца было добавлено в соответствующие лунки планшета. Через три часа после добавления иммунобиологического средства клетки промывали трижды ростовой средой, чтобы избавиться от неприкрепившихся бактерий, и заливали свежей ростовой средой.
Далее клетки инкубировали 18 часов. Затем клетки снимали с планшета, гомогенизировали с помощью керамических бус, готовили разведения и высевали на плотные питательные среды Левенштейна-Иенсена для определения титра КОЕ БЦЖ.
В таблице 2 представлены результаты анализа титра КОЕ БЦЖ, полученные с помощью высевов гомогенатов клеток RT-4, обработанных различными иммунобиологическими средствами на основе БЦЖ, отличающимися концентрациями БЦЖ.
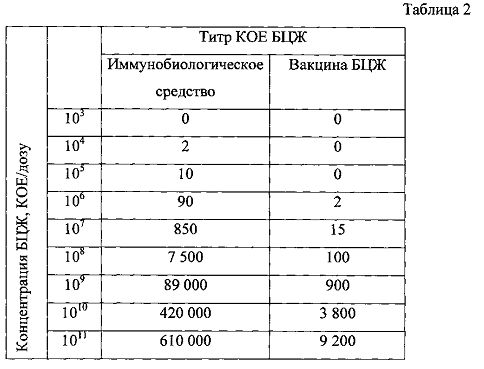
Как видно из представленных в таблице 2 данных, эффективность проникновения БЦЖ в опухолевые клетки рака мочевого пузыря человека RT-4 значительно выше при использовании иммунобиологического средства на основе БЦЖ в диапазоне концентраций БЦЖ от 104 до 1011 КОЕ/дозу, чем при использовании стандартной вакцины БЦЖ.
Пример 3
Оценка способности БЦЖ проникать в клетки мочевого пузыря в условиях in vivo.
Целью данного эксперимента являлось определение способности БЦЖ в составе иммунобиологического средства проникать в подслизистый слой мочевого пузыря, обработанного ферментами, расщепляющими секрет слизистого слоя мочевого пузыря, в условиях in vivo. Для этого были использованы мыши линии BALB/c, самки, весом 18-20 г. Для исследования были выбраны иммунобиологические средства на основе БЦЖ, содержащие ферменты, расщепляющие секрет слизистой оболочки мочевого пузыря, в дозах, которые лежат в середине исследованного в примере 1 рабочего диапазона концентраций: гиалуронидаза - 10000 УЕ/дозу, нейраминидаза - 10 УЕ/дозу; а также БЦЖ в дозе, которая находится в середине исследованного в примере 2 рабочего диапазона концентраций - 108 КОЕ/дозу. В качестве контроля использовалась стандартная вакцина БЦЖ в следующих концентрациях: 108 КОЕ/дозу, 109 КОЕ/дозу, 1010 КОЕ/дозу, 1011 КОЕ/дозу.
Все животные были катетеризованы по стандартной методике (С. Hung, K. Dodson, S. Hultgren, A murine model of urinary tract infection, Nature protocols, 4, 1230-1243, 2009). Далее все животные были разделены на семь групп, которым вводили
1) БЦЖ в количестве 108 КОЕ/дозу.
2) БЦЖ в количестве 109 КОЕ/дозу.
3) БЦЖ в количестве 1010 КОЕ/дозу.
4) БЦЖ в количестве 1011 КОЕ/дозу.
5) Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), при этом оно включает фермент гиалуронидазу в количестве 10000 УЕ/дозу.
6) Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), при этом оно включает фермент нейраминидазу в количестве 10 МЕ/дозу.
7) Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), при этом оно включает ферменты гиалуронидазу в количестве 10000 УЕ/дозу и нейраминидазу в количестве 10 МЕ/дозу.
Объем препарата, рекомендованный для одной инсталляции в мочевой пузырь, составляет 50 мл (инструкции к препаратам «Иммурон-вак», «Уро-БЦЖ медак»). Поскольку иммунобиологическое средство содержит живые бактериальные клетки, для разведения может быть использован любой изотонический растворитель надлежащего фармацевтического качества. В данном случае нами использовался физиологический раствор.
После разведения исследуемые образцы вводились мышам в мочевой пузырь в объеме 50 мкл с помощью катетера. Через 18 часов животные были усыплены.
Далее с помощью керамических бус были подготовлены гомогенаты мочевых пузырей. Для определения количества БЦЖ были приготовлены серии разведений гомогенатов мочевых пузырей и далее высеяны на скошенные среды Левенштейна-Йенсена. Косяки инкубировали при 37°С в течение 72 дней. Учет количества БЦЖ велся один раз в неделю.
В таблице 3 представлены результаты анализа титра КОЕ БЦЖ, полученные с помощью высевов гомогенатов мочевых пузырей мышей, обработанных различными иммунобиологическими средствами на основе БЦЖ.
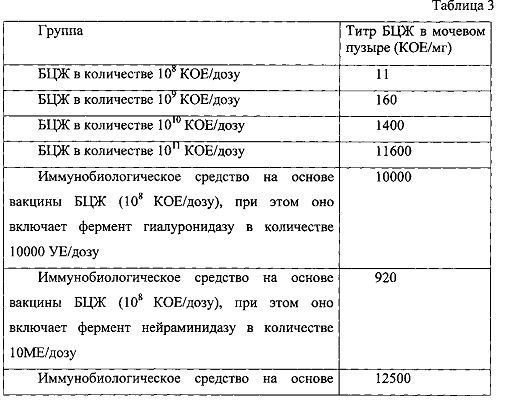

Как видно из результатов эксперимента, представленных в таблице 3, ферменты, разрушающие секрет слизистого слоя в мочевом пузыре, повышают эффективность проникновения БЦЖ, поскольку количество БЦЖ в гомогенатах мочевых пузырей мышей, получавших иммунобиологическое средство на основе БЦЖ и ферментов, расщепляющих секрет слизистой оболочки мочевого пузыря, превышает количество БЦЖ в гомогенатах мочевых пузырей мышей, получавших вакцину БЦЖ, от 81 до 1136 раз. Сравнимый эффект достигается при введении дозы стандартной вакцины БЦЖ, в 1000 раз превышающей дозу разработанного иммунобиологического средства на основе БЦЖ. При этом специалисту среднего уровня очевидно, что высокие концентрации вакцины БЦЖ (1011 КОЕ/дозу и более) являются токсичными.
Пример 4
Оценка иммуностимулирующих свойств иммунобиологического средства на основе вакцины БЦЖ.
Целью данного эксперимента являлось исследование иммуностимулирующих свойств разработанного иммунобиологического средства в сравнении со стандартной вакциной БЦЖ по способности индуцировать выброс цитокинов. Для этого была выбрана модель культуры клеток рака мочевого пузыря человека RT-4, обладающая выраженным гликокаликсом, сходным по своему строению с секретом слизистого слоя мочевого пузыря.
Для оценки уровня экспрессии цитокинов были выбраны тест-системы фирмы eBioscience (BMS822FF, BMS821FF) для мультиплексного анализа, которые позволяют одновременно измерять уровень экспрессии 19 цитокинов и хемокинов.
Клетки пассировались на 25 см2 культуральных матрасах. Клетки линии RT-4 культивировали на минимальной ростовой среде DMEM с 10% эмбриональной телячьей сывороткой и в присутствии необходимого количества заменимых и незаменимых аминокислот, при температуре 37°С и содержании СО2 5%. Для проведения анализа клетки были рассеяны на 96 луночный планшет в количестве 105 клеток на лунку. После рассева клеток планшет инкубировали при +37°С в присутствии 5% СО2 в течение 24 часов.
Через сутки к клеткам были добавлены исследуемые образцы, которые представляли собой
1) БЦЖ в количестве 108 КОЕ/дозу.
2) БЦЖ в количестве 1011 КОЕ/дозу.
3) Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), отличающееся тем, что она включает фермент гиалуронидазу в количестве 10000 УЕ/дозу.
4) Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), отличающееся тем, что она включает фермент нейраминидазу в количестве 10 МЕ/дозу.
5) Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), отличающееся тем, что она включает ферменты гиалуронидазу в количестве 10000 УЕ/дозу и нейраминидазу в количестве 10 МЕ/дозу.
Объем препарата, рекомендованный для одной инсталляции в мочевой пузырь, составляет 50 мл (инструкции к препаратам «Иммурон-вак», «Уро-БЦЖ медак»). Поскольку исследуемые образцы содержат живые бактериальные клетки, для разведения рекомендуется использовать любой изотонический растворитель надлежащего фармацевтического качества. В данном случае нами использовался физиологический раствор.
После разведения исследуемых образцов 10 мкл из каждого образца было добавлено в соответствующие лунки планшета.
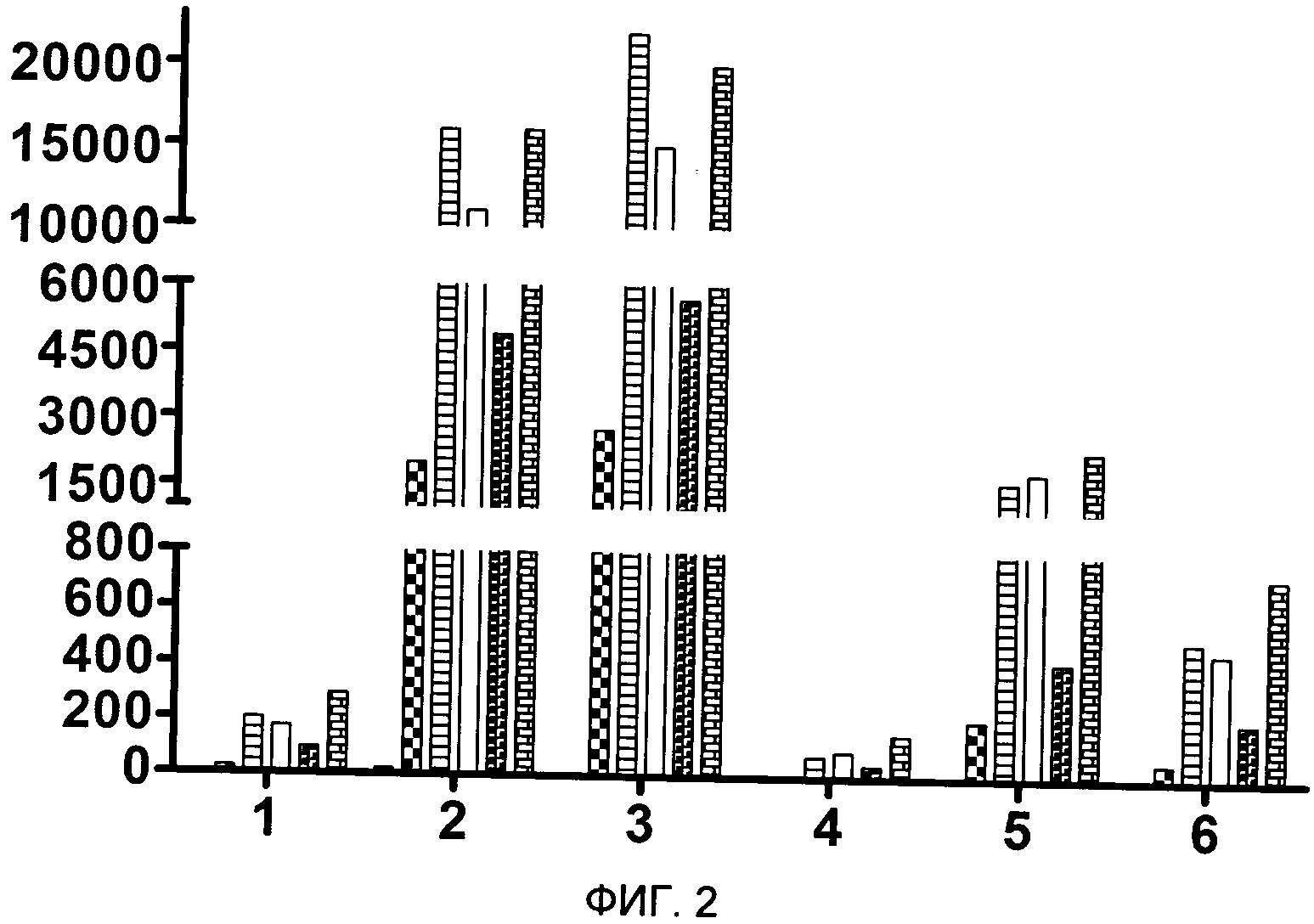
Далее клетки инкубировали 18 часов. Затем определяли уровень экспрессии цитокинов с помощью коммерческого набора. Полученные результаты представлены на фиг. 2, где
ось ординат - концентрация цитокинов, пг/мл
ось абсцисс: 1 - ИЛ-2, 2 - ИЛ-6, 3 - ИЛ-8, 4 - ИЛ-13, 5 - ФИО альфа, 6 - гамма интерферон.
 - Фосфатный буфер
- Фосфатный буфер
 - БЦЖ в количестве 108 КОЕ/дозу
- БЦЖ в количестве 108 КОЕ/дозу
 - БЦЖ в количестве 1011 КОЕ/дозу
- БЦЖ в количестве 1011 КОЕ/дозу
 - Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), отличающееся тем, что она включает фермент гиалуронидазу в количестве 10000 УЕ/дозу
- Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), отличающееся тем, что она включает фермент гиалуронидазу в количестве 10000 УЕ/дозу
 - Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), отличающееся тем, что она включает фермент нейраминидазу в количестве 10 МЕ/дозу
- Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), отличающееся тем, что она включает фермент нейраминидазу в количестве 10 МЕ/дозу
 - Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), отличающееся тем, что она включает ферменты гиалуронидазу в количестве 10000 УЕ/дозу и нейраминидазу в количестве 10 МЕ/дозу
- Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), отличающееся тем, что она включает ферменты гиалуронидазу в количестве 10000 УЕ/дозу и нейраминидазу в количестве 10 МЕ/дозу
Было показано, что разработанные иммунобиологические средства для терапии рака мочевого пузыря на основе БЦЖ по сравнению с прототипом (вакциной БЦЖ) вызывают более сильную индукцию ИЛ-2, ИЛ-6, ИЛ-8, ИЛ-13, ФИО альфа, ИФНгамма.
Сравнимый эффект достигается при введении дозы вакцины БЦЖ, в 1000 раз превышающей дозу разрабатываемого иммунобиологического средства на основе БЦЖ. При этом специалисту среднего уровня очевидно, что высокие концентрации вакцины БЦЖ (1011 КОЕ/дозу и более) являются токсичными.
Пример 5
Оценка токсичности иммунобиологического средства на основе вакцины БЦЖ.
Целью данного исследования являлось определение безопасности и потенциальных токсических эффектов иммунобиологического средства на основе вакцины БЦЖ.
Исследование токсичности проводили на клетках эмбриональной почки человека HEK293. Клетки пассировались на 25 см2 культуральных флаконах в ростовой среде DMEM с 10% эмбриональной сывороткой. Для проведения анализа клетки были рассеяны на 96 луночный планшет в количестве 105 клеток на лунку. После рассева клеток планшет инкубировали при +37°С и 5% СО2 в течение 24 часов. Далее к клеткам были добавлены иммунобиологические средства на основе БЦЖ с теми же концентрациями действующих веществ, как и в примере 1: БЦЖ (108 КОЕ/дозу), гиалуронидаза (в следующих концентрациях: 0 УЕ/дозу, 1 УЕ/дозу, 10 УЕ/дозу, 100 УЕ/дозу, 1000 УЕ/дозу, 10000 УЕ/дозу, 100000 УЕ/дозу, 1000000 УЕ/дозу) и нейраминидаза (в следующих концентрациях: 0 МЕ/дозу, 0,001 МЕ/дозу, 0,01 МЕ/дозу, 0,1 МЕ/дозу, 1 МЕ/дозу, 10 МЕ/дозу, 100 МЕ/дозу, 1000 МЕ/дозу); а также иммунобиологические средства на основе БЦЖ с теми же концентрациями действующих веществ, как и в примере 2: БЦЖ (в следующих концентрациях: 103 КОЕ/дозу, 104 КОЕ/дозу, 105 КОЕ/дозу, 106 КОЕ/дозу, 107 КОЕ/дозу, 108 КОЕ/дозу, 109 КОЕ/дозу, 1010 КОЕ/дозу, 1011 КОЕ/дозу), гиалуронидазы (10000 УЕ/дозу) и нейраминидазы (10 МЕ/дозу). В качестве контроля использовали вакцину БЦЖ в концентрациях: 103 КОЕ/дозу, 104 КОЕ/дозу, 105 КОЕ/дозу, 106 КОЕ/дозу, 107 КОЕ/дозу, 108 КОЕ/дозу, 109 КОЕ/дозу, 1010 КОЕ/дозу, 1011 КОЕ/дозу.
Под дозой понимается количество препарата, предназначенное для единовременного (за 1 инсталляцию) введения в мочевой пузырь. Объем препарата, рекомендованный для одной инсталляции в мочевой пузырь, составляет 50 мл. Поскольку исследуемые образцы содержат живые бактериальные клетки, для разведения рекомендуется использовать любой изотонический растворитель надлежащего фармацевтического качества. В данном случае был использован физиологический раствор.
После разведения исследуемых образцов 10 мкл из каждого образца было добавлено в соответствующие лунки планшета. Через сутки после добавления исследуемых образцов был произведен анализ количества живых клеток методом МТТ-теста. В среду к клеткам добавляли 1/10 объема концентрированного МТТ (10х МТТ, 5 мг/мл). Инкубировали три часа в CO2-инкубаторе при 37°С, затем отбирали всю среду, лизировали клетки в 100 мкл диметилсульфоксида (ДМСО) и измеряли оптическую плотность при 540 нм и 630 нм. Затем рассчитывали истинное значение оптической плотности (ODист) по формуле:
ODист=OD540нм-OD630нм,
где OD540нм - оптическая плотность, измеренная при длине волны 540 нм, а ОD630нм - оптическая плотность, измеренная при длине волны 630 нм.
Далее процент выживших клеток рассчитывали по формуле:
Количество выживших клеток (%) = (ODист.исслед./ODист.контр.)*100%,
где ОDист.исслед - истинная оптическая плотность клеток, обработанных иммунобиологическим средством, a ODист.контр - истинная оптическая плотность контрольных клеток.
Затем рассчитывали коэффициент токсичности образца Т:
Τ = (количество выживших контрольных клеток, %) - (количество выживших клеток в исследуемом образце, %).
При этом Т=0 означает, что препарат не токсичен и не влияет на выживаемость данной клеточной культуры, а Т=100% означает,что препарат токсичен и в лунке планшета нет живых клеток.
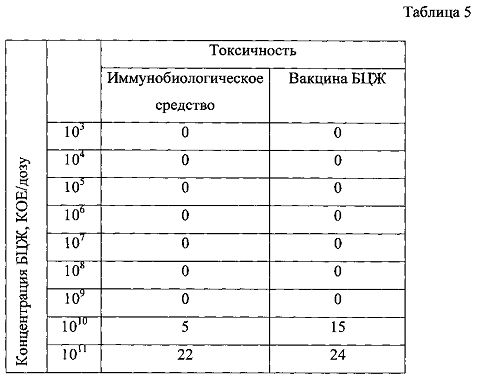
Результаты исследования токсичности иммунобиологических средств, отличающихся концентрациями ферментов, расщепляющих секрет слизистой оболочки мочевого пузыря, представлены в таблице 4. Результаты исследования токсичности иммунобиологических средств, отличающихся концентрациями БЦЖ, представлены в таблице 5.
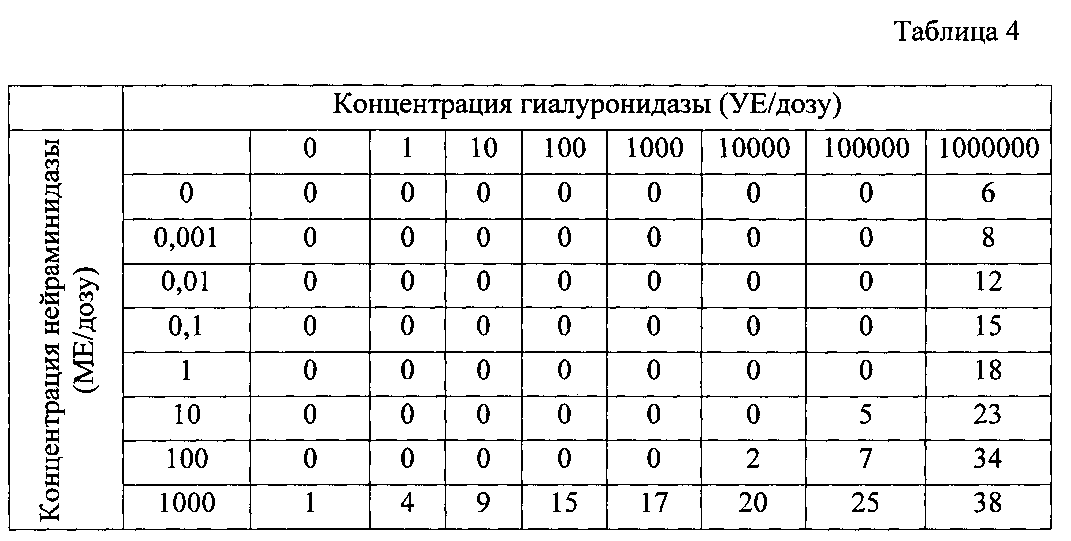
Как видно из результатов, представленных в таблице 4, Иммунобиологические средства на основе БЦЖ, содержащие гиалуронидазу в концентрации 1000000 УЕ/дозу и нейраминидазу в концентрации 100 МЕ/дозу, обладали наибольшей токсичностью. Другие иммунобиологические средства на основе БЦЖ, содержащие только гиалуронидазу (1-1000000 УЕ/дозу) или нейраминидазу (0,001-1000 МЕ/дозу), а также иммунобиологические средства, содержащие гиалуронидазу (1-100000 УЕ/дозу) и нейраминидазу (0,001-100 МЕ/дозу), либо не имели токсического эффекта, либо обладали незначительной токсичностью. Исходя из этого, можно сделать вывод о том, что данные концентрации ферментов могут быть использованы для создания иммунобиологического средства на основе БЦЖ.
Как видно из результатов, представленных в таблице 5, наибольшей токсичностью обладало иммунобиологическое средство, содержащее БЦЖ в количестве 1011 КОЕ/дозу. Другие иммунобиологические средства на основе БЦЖ, содержащие БЦЖ в количестве от 103 до 1010 КОЕ/дозу либо не обладали токсичностью, либо имели незначительный токсический эффект. Также следует заметить, что введение вакцины БЦЖ в дозах, превышающих рекомендованные (1010 КОЕ/дозу и более), приводит к увеличению токсичности, коррелирующей с увеличением дозы. Исходя из результатов, представленных в таблице 5, можно сделать вывод о том, что указанные концентрации БЦЖ (103 до 1010 КОЕ/дозу) могут быть использованы для создания иммунобиологического средства на основе БЦЖ.
Далее было проведено исследование токсичности иммунобиологического средства на основе БЦЖ, содержащей максимальные концентрации действующих веществ, которые по отдельности либо не обладают токсичностью, либо обладают минимальной токсичностью.
Исследование токсичности проводили на клетках эмбриональной почки человека HEK293. Клетки пассировались на 25 см2 культуральных флаконах в ростовой среде DMEM с 10% эмбриональной сывороткой. Для проведения анализа клетки были рассеяны на 96 луночный планшет в количестве 105 клеток на лунку. После рассева клеток планшет инкубировали при +37°С и 5% CO2 в течение 24 часов.
Далее был получен ряд иммунобиологических средств на основе вакцины БЦЖ, содержащих БЦЖ (в концентрациях: 109 КОЕ/дозу, 1010 КОЕ/дозу), гиалуронидазу (в концентрациях: 100000 УЕ/дозу, 1000000 УЕ/дозу) и нейраминидазу (в концентрациях: 100 МЕ/дозу, 1000 МЕ/дозу). Под дозой понимается количество препарата, предназначенное для единовременного (за 1 инсталляцию) введения в мочевой пузырь. Объем препарата, рекомендованный для одной инсталляции в мочевой пузырь, составляет 50 мл. Поскольку исследуемые образцы содержат живые бактериальные клетки, для разведения рекомендуется использовать любой изотонический растворитель надлежащего фармацевтического качества. В данном случае был использован физиологический раствор.
После разведения исследуемых образцов 10 мкл из каждого образца было добавлено в соответствующие лунки планшета. Через сутки после добавления исследуемых образцов был произведен анализ количества живых клеток методом МТТ-теста, описанного выше.
Результаты исследования токсичности иммунобиологического средства на основе БЦЖ, содержащей максимальные концентрации действующих веществ, которые по отдельности либо не обладают токсичностью, либо обладают минимальной токсичностью, представлены в таблице 6.
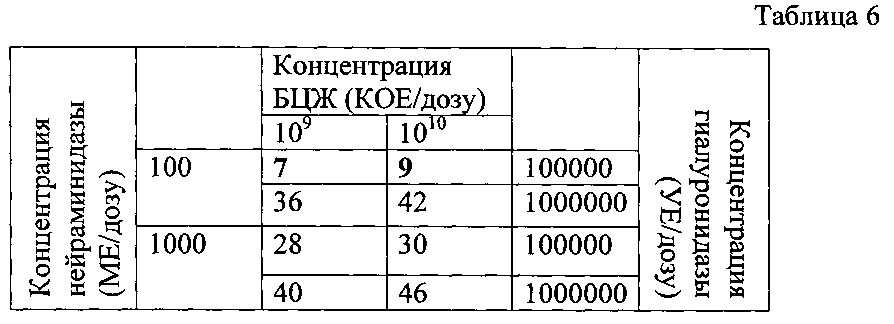
Как видно из результатов, представленных в таблице 6, наибольшей токсичностью обладало иммунобиологическое средство, содержащее гиалуронидазу в количестве 1000000 УЕ/дозу или нейраминидазу в количестве 1000 МЕ/дозу. Другие иммунобиологические средства на основе БЦЖ, содержащие БЦЖ в количестве от 109 до 1010 КОЕ/дозу, а также гиалуронидазу в количестве 100000 УЕ/дозу и нейраминидазу в количестве 100 МЕ/дозу обладали незначительной токсичностью.
Исходя из полученных результатов можно сделать вывод о том, что для создания иммунобиологического средства на основе БЦЖ могут быть использованы следующие концентрации действующих веществ:
БЦЖ - от 103 до 1010 КОЕ/дозу,
Гиалуронидаза - от 1 до 100000 УЕ/дозу,
Нейраминидаза - от 0,001 до 100 МЕ/дозу.
Пример 6.
Оценка противоопухолевой активности иммунобиологического средства на основе вакцины БЦЖ.
Целью данного эксперимента являлось изучение противоопухолевой эффективности иммунобиологического средства на основе БЦЖ. Исследование проводили на модели рака мочевого пузыря мышей на основе клеток МВ49 (рак мочевого пузыря мыши).
Схема эксперимента представлена на фиг. 3. По оси абсцисс указано время от начала эксперимента (дни), А - введение клеток рака мочевого пузыря мышь МВ49, В - введение стандартной вакцины БЦЖ, С - введение иммунобиологического средства на основе БЦЖ, отличающейся тем, что в качестве фермента используется гиалуронидаза, D - введение иммунобиологического средства на основе БЦЖ, отличающейся тем, что в качестве фермента используется нейраминидаза, Ε - введение иммунобиологического средства на основе БЦЖ, отличающейся тем, что в качестве фермента используется гиалуронидаза и нейраминидаза, F -введение физиологического раствора.
В эксперименте были использованы мыши линии C57BL/6, самки, весом 18-20 грамм и линия клеток рака мочевого пузыря мыши МВ49. Клетки пассировались на 75 см2 культуральных флаконах в ростовой среде DMEM с 10% эмбриональной сывороткой. В 0 день эксперимента клетки снимали с флаконов трипсином, затем после открепления ингибировали трипсин, промывали трижды в фосфатно-солевом буфере и готовили суспензии, содержащие 2×107 живых клеток/мл.
Затем животных катетеризовали по стандартной методике (С. Hung, K. Dodson, S. Hultgren, A murine model of urinary tract infection, Nature protocols, 4, 1230-1243, 2009). Всем животным вводили внутрипузырно раствор поли-L-лизина (50 мкл, концентрация 0,1 мг/мл). Через полчаса мочевые пузыри животных опустошали и вводили суспензию клеток МВ49 в объеме 50 мкл (106 клеток/мышь).
Для исследования были выбраны иммунобиологические средства на основе БЦЖ, содержащие ферменты, расщепляющие секрет слизистой оболочки мочевого пузыря, в дозах, которые лежат в середине исследованного в примере 1 рабочего диапазона концентраций: гиалуронидаза - 10000 УЕ/дозу, нейраминидаза - 10 УЕ/дозу; а также БЦЖ в дозе, которая находится в середине исследованного в примере 2 рабочего диапазона концентраций - 108 КОЕ/дозу. В качестве контроля использовали вакцину БЦЖ в количестве 108 КОЕ/дозу. Под дозой понимается количество препарата, предназначенное для единовременного (за 1 инстилляцию) введения в мочевой пузырь. Объем препарата, рекомендованный для одной инсталляции в мочевой пузырь, составляет 50 мл. Поскольку исследуемые образцы содержат живые бактериальные клетки, для разведения рекомендуется использовать любой изотонический растворитель надлежащего фармацевтического качества. В данном случае был использован физиологический раствор.
На пятый день от начала эксперимента все животные были разделены группы, которым вводили:
1) БЦЖ в количестве 108 КОЕ/дозу.
2) Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), отличающееся тем, что она включает фермент гиалуронидазу в количестве 10000 УЕ/дозу.
3) Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), отличающееся тем, что она включает фермент нейраминидазу в количестве 10 МЕ/дозу.
4) Иммунобиологическое средство на основе вакцины БЦЖ (108 КОЕ/дозу), отличающееся тем, что она включает ферменты гиалуронидазу в количестве 10000 УЕ/дозу и нейраминидазу в количестве 10 МЕ/дозу.
5) Физиологический раствор
Исследуемые образцы после разведения в физиологическом растворе вводили в мочевой пузырь мышей с помощью катетеров в терапевтической дозе в объеме 50 мкл на пятый, десятый и пятнадцатый день от начала эксперимента. Затем анализировали выживаемость мышей в течение 2 месяцев от начала эксперимента.
Результаты представлены на фиг. 4. По оси абсцисс указано время от начала эксперимента (дни), по оси ординат - выживаемость животных (%),
1 - БЦЖ в количестве 108 КОЕ/дозу,
2 - иммунобиологическое средство на основе БЦЖ, при этом в качестве фермента используется гиалуронидаза,
3 - иммунобиологическое средство на основе БЦЖ, при этом в качестве фермента используется нейраминидаза,
4 - иммунобиологическое средство на основе БЦЖ, при этом в качестве фермента используются гиалуронидаза и нейраминидаза, 5 - физиологический раствор.
Как видно из представленных данных, выживаемость мышей, получавших иммунобиологическое средство на основе БЦЖ, в два раза превышает выживаемость мышей, получавших вакцину БЦЖ. Таким образом, иммунобиологическое средство обладает выраженной противоопухолевой активностью, большей чем вакцина БЦЖ.
Пример 7
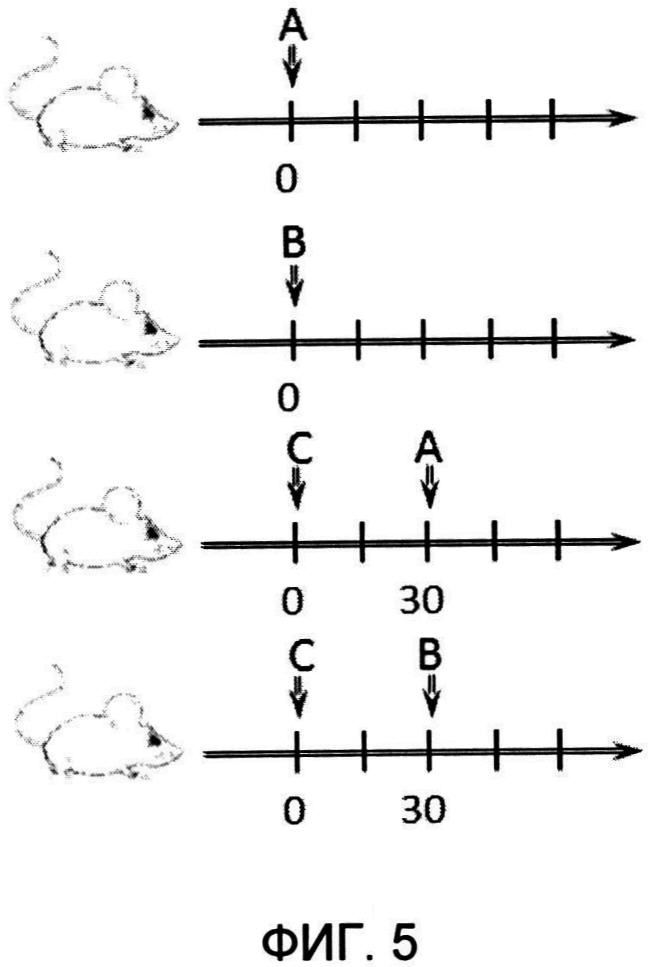
Оценка влияния схем введения иммунобиологического средства на эффективность проникновения БЦЖ в клетки мочевого пузыря в условиях in vivo.
Целью данного эксперимента являлось оценка влияния различных схем введения иммунобиологического средства на эффективность проникновения БЦЖ в клетки мочевого пузыря. В частности, была разработана схема, согласно которой сначала в мочевой пузырь вводят раствор ферментов на 30 минут, затем мочевой пузырь опустошают и вводят иммунобиологическое средство или вакцину БЦЖ.
Для этого были использованы мыши линии BALB/c, самки весом 18-20 г. Все животные были катетеризованы по стандартной методике (С. Hung, K. Dodson, S. Hultgren, A murine model of urinary tract infection, Nature protocols, 4, 1230-1243, 2009). Затем все животные были разделены на четыре группы, которым вводили иммунобиологическое средство и вакцину БЦЖ в разных схемах.
Схемы введения представлены на фиг. 5. По оси абсцисс указано время (минуты) введения препаратов,
А - введение стандартной вакцины БЦЖ,
В - введение иммунобиологического средства на основе вакцины БЦЖ, при этом она включает ферменты гиалуронидазу и нейраминидазу,
С - введение смеси ферментов гиалуронидазы и нейраминидазы.
Для исследования были выбраны иммунобиологические средства на основе БЦЖ, содержащие ферменты, расщепляющие секрет слизистой оболочки мочевого пузыря, в дозах, которые лежат в середине исследованного в примере 1 рабочего диапазона концентраций: гиалуронидаза - 10000 УЕ/дозу, нейраминидаза - 10 УЕ/дозу; а также БЦЖ в дозе, которая находится в середине исследованного в примере 2 рабочего диапазона концентраций - 108 КОЕ/дозу. Также для исследования были выбраны концентрации ферментов, расщепляющих секрет слизистой оболочки мочевого пузыря, в тех же дозах, что представлены в исследуемом иммунобиологическом средстве: гиалуронидаза - 10000 УЕ/дозу, нейраминидаза - 10 УЕ/дозу.
Далее для исследования была подготовлена смесь ферментов в указанных концентрациях.
Объем препарата, рекомендованный для одной инсталляции в мочевой пузырь, составляет 50 мл (инструкции к препаратам «Иммурон-вак», «Уро-БЦЖ медак»). Поскольку исследуемые образцы содержат живые бактериальные клетки, для разведения рекомендуется использовать любой изотонический растворитель надлежащего фармацевтического качества. В данном случае нами использовался физиологический раствор.
После разведения препараты вводились мышам в мочевой пузырь в объеме 50 мкл с помощью катетера согласно указанным схемам. Через 18 часов животные были усыплены.
Далее с помощью керамических бус были подготовлены гомогенаты мочевых пузырей. Для определения количества БЦЖ были приготовлены серии разведений гомогенатов мочевых пузырей и далее высеяны на скошенные среды Левенштейна-Йенсена. Косяки инкубировали при 37°С в течение 72 дней. Учет количества БЦЖ велся один раз в неделю.
В таблице 7 представлены результаты анализа титра КОЕ БЦЖ, полученные с помощью высевов гомогенатов мочевых пузырей мышей, обработанных иммунобиологическими средствами на основе БЦЖ при различных схемах введения.

Как видно из представленных результатов, введение ферментов, расщепляющих секрет слизистой оболочки мочевого пузыря, до введения иммунобиологического средства способствует увеличению проникновения БЦЖ в клетки мочевого пузыря.
Специалисту среднего уровня очевидно, что последовательное использование ферментов, расщепляющих секрет слизистой оболочки мочевого пузыря, и вакцины БЦЖ также приводит к увеличению проникновения БЦЖ в клетки мочевого пузыря, что также может быть использовано для увеличения иммуностимулирующих и противоопухолевых свойств вакцины БЦЖ при лечении рака мочевого пузыря.
Пример 8
Иммунобиологическое средство может быть представлено в виде лиофильно высушенного препарата, который включает БЦЖ, композицию ферментов, расщепляющих секрет слизистого слоя мочевого пузыря, и компоненты буфера.
Иммунобиологическое средство может быть представлено в виде лиофильно высушенных препаратов, находящихся в двух отдельных флаконах, которые растворяются и смешиваются непосредственно перед использованием. При этом в одном флаконе содержится лиофилизат БЦЖ и компоненты буфера, а в другом флаконе содержится лиофилизат композиции ферментов, расщепляющих секрет слизистой оболочки мочевого пузыря, и компоненты буфера.
Иммунобиологическое средство может быть представлено в виде лиофильно высушенных препаратов, находящихся в двух отдельных флаконах, которые растворяются непосредственно перед использованием и вводятся отдельно. При этом в одном флаконе содержится лиофилизат БЦЖ или лиофилизат БЦЖ, композиции ферментов, расщепляющих секрет слизистой оболочки мочевого пузыря, и компоненты буфера, а в другом флаконе содержится лиофилизат композиции ферментов, расщепляющих секрет слизистой оболочки мочевого пузыря, и компоненты буфера.
В качестве буферного раствора, в котором лиофильно высушен препарат, может выступать любой раствор, не токсичный для человека и содержащий все необходимые компоненты, обеспечивающие жизнеспособность БЦЖ и активность ферментов.
Пример 9
Способ использования иммунобиологического средства на основе БЦЖ для лечения рака мочевого пузыря.
Специалисту среднего уровня очевидно, что иммунобиологическое средство на основе БЦЖ, включающее фермент, расщепляющий секрет слизистой оболочки мочевого пузыря, может быть использовано в терапевтически ффективных количествах для лечения рака мочевого пузыря, в частности для лечения переходно-клеточного рака мочевого пузыря, плоскоклеточного рака мочевого пузыря и аденокарциномы мочевого пузыря.
Более того, специалисту среднего уровня очевидно, что заявленное иммунобиологическое средство может быть использовано как самостоятельное средство для лечения рака мочевого пузыря у пациента, так и в составе комплексного лечения, включающего этап трансуретальной резекции рака мочевого пузыря у пациента до введения иммунобиологического средства.
Специалисту среднего уровня очевидно, что иммунобиологическое средство может быть использовано для лечения рака мочевого пузыря как самостоятельно, когда ферменты, расщепляющие секрет слизистого слоя мочевого пузыря, вводятся одновременно с БЦЖ, так и в сочетании с дополнительным введением ферментов, расщепляющих секрет слизистой оболочки мочевого пузыря, которое осуществляется до введения иммунобиологического средства.
Приведенные примеры показывают, что задача, поставленная в данном изобретении, а именно создание иммунобиологического средства для терапии рака мочевого пузыря на основе БЦЖ, которое способно высокоэффективно проникать в уротелий мочевого пузыря через секрет слизистого слоя, в то же время иммунобиологическое средство должно обладать высокой иммуностимулирующей активностью, решена в данном изобретении.
Было показано, что разработанные иммунобиологические средства для терапии рака мочевого пузыря на основе БЦЖ по сравнению с прототипом (вакциной БЦЖ) вызывают более сильную индукцию ИЛ-2, ИЛ-6, ИЛ-8, ИЛ-13, ФНО альфа, ИФНгамма.
Приведенные примеры также подтвеждают промышленную применимость иммунобиологического средства для терапии рака мочевого пузыря на основе БЦЖ и показывают эффективность способа использования созданного иммунобиологического средства