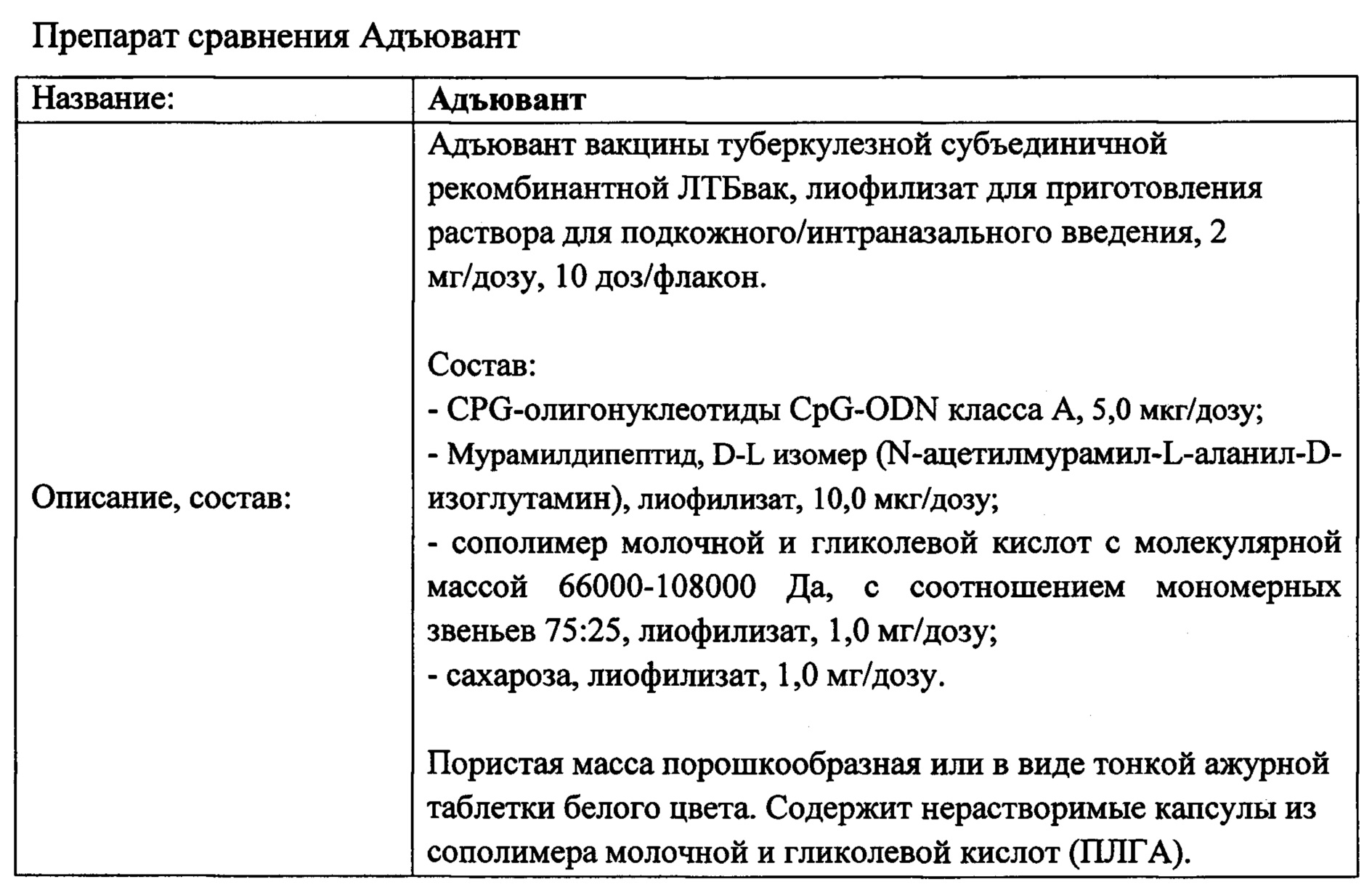
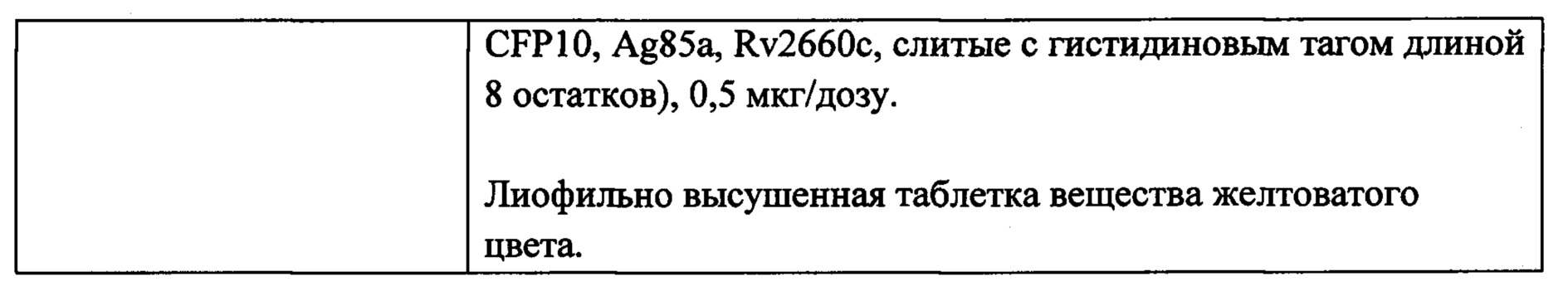
Результат интеллектуальной деятельности: ПОЛИАНТИГЕННАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ И ВСПОМОГАТЕЛЬНОГО ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА
Вид РИД
Изобретение
Изобретение относится к области медицины, а именно к иммунологии, и может быть использовано для получения вакцины, действующей на иммунодоминантные антигены М. tuberculosis, экспрессирующиеся на ранней стадии инфекции и латентной фазе инфекции для профилактики и вспомогательного лечения туберкулеза.
Туберкулез (ТБ) остается одной из самых опасных и распространенных инфекционных болезней. Это социально-значимое, передающееся контактным путем заболевание, вызываемое инфицированием микобактериями Mycobacterium tuberculosis (также М. bovis, М. Africanum). Всего, по оценкам эпидемилогов, за последние 200 лет от туберкулеза умерло более одного миллиарда человек [1]. Это больше, чем количество людей, скончавшихся в тот же период от оспы, малярии, чумы, гриппа, холеры и СПИДа вместе взятых. К концу XIX в. каждая пятая из смертей от любых причин была связана с туберкулезом [1]. На сегодняшний день по данным ВОЗ [2] в мире в среднем регистрируется около 9 млн. новых случаев и около 2 млн. смертей в год (в 2015 г. - 10,4 млн. новых случаев активного ТБ; 1,8 млн человек погибли от заболевания). Всего до 2 млрд человек во всем мире инфицированы возбудителем туберкулеза, и эксперты ВОЗ прогнозируют, что число новых инфицированных к 2020 году может увеличиться еще на 1 млрд [3].
Актуальной проблема туберкулеза является и в нашей стране. На протяжении последних шести лет заболеваемость туберкулезом снижается, однако, как на сегодняшний день, так и в перспективе туберкулез остается проблемой здравоохранения, требующей постоянного внимания, надзора и контроля [2].
Несмотря на наличие вакцины БЦЖ, и на то, что в настоящее время туберкулез является достаточно успешно излечимым заболеванием, он по-прежнему входит в тройку основных причин смерти от инфекционных заболеваний [4].
Другой стороной проблемы туберкулеза является увеличение заболеваемости его мультирезистентными формами. Известно, что в 2015 г. было зафиксировано около полумиллиона новых случаев туберкулеза с множественной лекарственной устойчивостью (МЛУ-туберкулеза) [4]. Основная проблема МЛУ-туберкулеза- очень высокая стоимость лечения (более $10000 за курс) при прогнозе выздоровления лишь в 50% случаев. Уже сейчас, по оценкам экспертов, около 50 млн. человек во всем мире являются латентно инфицированными МЛУ-туберкулезом [4]. Между тем вероятность перехода латентной формы в активную может быть более 10% в течении жизни [5]. В России особенно остро стоит проблема распространения МЛУ-туберкулеза. Так, в общей мировой заболеваемости МЛУ-туберкулезом совместный вклад Индии, Китая и России - 45% [4].
Уже сейчас очевидно, что глобальный контроль над туберкулезом может быть достигнут только за счет создания эффективных профилактических и терапевтических вакцин, развития диагностики и оптимизации схем терапии [6]. По оценкам специалистов, при сохранении существующих трендов исследований, снижение заболеваемости и смертности будет достигать лишь 1,5% от существующих [6]. Оптимизация уже существующих методов профилактики и лечения позволит снизить заболеваемость на 10% ежегодно к 2025 году, а разработка новых подходов - снизить заболеваемость до ожидаемого уровня в 90% [7].
В настоящее время бацилла Кальмета-Герена (БЦЖ) является самой широко используемой в мире вакциной и единственной противотуберкулезной вакциной, разрешенной для клинического применения. За почти столетний период своего существования этой вакциной было привито более чем 3 млрд человек, и сейчас по всему миру доля вакцинированных достигла 80% [8]. Но, несмотря на свое повсеместное использование, БЦЖ обеспечивает только минимальную защиту от ТБ и не способна бороться с уже имеющейся инфекцией.
Защитный эффект, обеспечиваемый БЦЖ, непродолжителен и длится всего несколько лет. БЦЖ не защищает от легочных форм ТБ в подростковом и взрослом возрасте, а именно эти случаи ТБ наиболее распространены в наше время [9]. Хотя БЦЖ считается безопасной, она представляет определенный риск для иммунодефицитных ВИЧ-инфицированных пациентов. Поэтому ВОЗ не рекомендует прививать БЦЖ ВИЧ-положительным новорожденным [10].
БЦЖ вызывает иммунный ответ, способный предотвратить развитие милиарного или менингеального туберкулеза, но не может предотвратить и ликвидировать туберкулезную инфекцию [11]. Эффективность БЦЖ варьирует в разных программах вакцинации в очень широких пределах: в одних она достигает 80%, в других стремится к нулю [12, 11]. Эффективность вакцины зависит от множества факторов, среди которых особенности штамма БЦЖ, генетические особенности иммунной системы индивида, его возраст, предварительное инфицирование М. tuberculosis, форма заболевания ТБ, а также предварительная сенсибилизация к БЦЖ иммунной системы сапрофитными видами Mycobacterium [9]. Очевидным недостатком БЦЖ является ее неспособность вызывать длительную защиту от ТБ: индивиды, вакцинированные вскоре после рождения, теряют защиту уже в юности и взрослом возрасте, а повторные введения БЦЖ больше не вызывают ожидаемого иммунного ответа [13].
К настоящему времени в мире существуют по крайней мере 11 различных штаммов БЦЖ, разосланных в разные лаборатории еще в начале XX века [14]. В то время еще не существовало стандартизованных процедур хранения, выращивания и пересева бактерий, и вплоть до 1960-х годов, пока не были разработаны методы лиофилизации материнских бактериальных линий, каждая лаборатория использовала свои методики. Это привело к накоплению в разных штаммах множества различных мутаций и к значительной генетической дивергенции штаммов [15, 14]. Генетические различия штаммов могут влиять на их эффективность в защите от инфекции, так как они несут различающиеся между собой поверхностные белки-антигены, вызывающие иммунный ответ [15]. Тем не менее, все имеющиеся штаммы БЦЖ остались невирулентными, и все они не имеют системы секреции ESX-1 (группы генов экспрессирующих факторы вирулентности типа VII, которые, по современным представлениям, определяют патогенность М. tuberculosis), компоненты которой (продукты генов ESAT6, CFP10 и др.) являются сильными антигенами М. tuberculosis.
Таким образом, в основном БЦЖ обеспечивает защиту только от внелегочных форм туберкулеза, и только в раннем детском возрасте. Сравнительно низкая эффективность БЦЖ вакцинации взрослого населения привела к активным поискам альтернативных решений для защиты против различных форм туберкулеза у взрослых. Попытки пролонгировать или восстановить действие БЦЖ с помощью ревакцинации ей же не привели к заметным успехам [13].
В связи с этим, в настоящее время десятки лабораторий по всему миру разрабатывают новые вакцины против ТБ, способные не только заменить БЦЖ для прививания новорожденных, но и позволяющие эффективно защищать от туберкулеза в подростковом и взрослом возрасте, препятствовать реактивации латентных форм туберкулеза и, в идеале, дающие возможность бороться с ТБ в латентной фазе, полностью уничтожая М. tuberculosis в организме.
Практически все эффективные вакцины против инфекционных патогенов, используемые в настоящее время, направлены на развитие гуморального иммунного ответа, то есть приводят к выработке специфических антител [16]. Так как М. tuberculosis является внутриклеточным патогеном и находится внутри макрофагов в особых вакуолях (фагосомах), несущих особые маркеры ранних фагосом, и не объединяющихся с лизосомами, то гуморального иммунного ответа для борьбы с М. tuberculosis недостаточно. Для уничтожения М. tuberculosis необходим клеточный иммунитет, обеспечиваемый иммунокомпетентными М. tuberculosis-специфическими Т-клетками, способными распознать и элиминировать инфицированные макрофаги без существенного вреда для хозяина. Клеточный иммунитет против М. tuberculosis обеспечивается прежде всего CD4+ Т-клетками типа Th1. Эти клетки вырабатывают IFN-γ, который вызывает усиление антимикобактериальной активности макрофагов. Хотя центральная роль CD4+ Т-клеток в иммунитете против М. tuberculosis не вызывает сомнений, в последнее время становится ясно, что одних CD4+ Т-клеток, вырабатывающих IFN-γ, недостаточно [17, 18]. Для успешной защиты от М. tuberculosis необходим одновременный скоординированный ответ CD4+ и CD8+ Т-клеток, вырабатывающих не только INF-γ, но и TNF-α, и еще более 10 типов интерлейкинов. Немаловажную роль в защите от М. tuberculosis играют и другие типы Т-клеток и клетки длительной иммунной памяти [19, 20]. Помимо внутриклеточной локализации, М. tuberculosis обладает еще рядом особенностей, усложняющим создание вакцины. Это, прежде всего, способность длительно персистировать в организме хозяина (вызывая латентную инфекцию, ЛТБ) и подавлять презентацию макрофагом своих антигенов Т-клеткам, необходимую для распознавания зараженных М. tuberculosis клеток и формирования иммунной памяти, а также способность управлять процессами апоптоза и некроза макрофагов, обеспечивающая М. tuberculosis благоприятные условия для расселения по тканям хозяина [21]. Поэтому при создании новых эффективных вакцин нужно стремиться активировать иммунную систему таким образом, чтобы она преодолела все способы защиты М. tuberculosis и смогла распознать и уничтожить инфицированные микобактериями клетки.
Как уже отмечалось, туберкулез у человека имеет четыре стадии развития: инфицирование, ЛТБ, реактивация инфекции и активная форма заболевания, в ходе которой происходит заражение других индивидов [22]. Белковые антигены, экспрессируемые М. tuberculosis, значительно различаются на разных стадиях заболевания [23], поэтому вакцина, эффективная на одной из стадий, может быть бесполезной на других. При первичном заражении М. tuberculosis иммунологически здорового индивида инфекция переходит в латентную форму, никак внешне себя не проявляя. Как показывает опыт, полная элиминация М. tuberculosis из организма происходит крайне редко, и, как правило, активность иммунной системы сводится к поддержанию М. tuberculosis в дормантном состоянии и препятствованию переходу заболевания из латентной фазы в активную. Поэтому, если иммунная система зараженных индивидов не ослабевает, М. tuberculosis в персистентном состоянии сохраняется у них всю жизнь. Индивид с ЛТБ не имеет внешних признаков болезни и не заражает окружающих, но он имеет Т-клетки памяти, специфичные для антигенов М. tuberculosis [16]. Таким образом, иммунная система человека, по-видимому, сама по себе неспособна полностью ликвидировать М. tuberculosis в организме, и пока неясно, сможем ли мы добиться этого в ближайшем будущем с помощью новых вакцин. Скорее всего, на разных стадиях ТБ и в различных случаях будут применяться разные вакцины, но идеальной была бы вакцина, способная уничтожать М. tuberculosis на всех стадиях развития болезни [24].
По своему назначению новые противотуберкулезные вакцины можно условно разделить на три типа - первичные, бустерные (вспомогательные, усиливающие) и терапевтические. Первичные вакцины разрабатываются для замены БЦЖ, тогда как для усиления ее эффекта после вакцинирования применяются бустерные вакцины. Терапевтические вакцины нацелены в основном на борьбу с активной формой ТБ у ВИЧ-инфицированных пациентов. Особое внимание привлекают вакцины, позволяющие подавлять М. tuberculosis в латентной фазе инфекции и способные в идеале полностью удалять М. tuberculosis из организма [26].
Практически все разрабатываемые в настоящее время вакцины могли бы применяться уже после заражения М. tuberculosis. По своему происхождению различают рекомбинантные вакцины на основе трансгенных штаммов БЦЖ, несущих некоторые отдельные антигены М. tuberculosis (это обычно живые невирулентные штаммы), или инактивированные клетки и полноклеточные экстракты некоторых штаммов М. tuberculosis или других видов Mycobacterium: М. smegmatis, М. vaccae, М. indicus. В некоторых случаях используются их генномодифицированные формы, имеющие антигены М. tuberculosis, способные усиливать иммунную память [27]. Кроме того, разрабатываются еще 2 типа вакцин, имеющие наибольшие на сей день перспективы: это субъединичные ДНК-вакцины и субъединичные белковые вакцины. Субъединичные ДНК-вакцины представляют собой генетическую конструкцию, включающую ген одного или нескольких антигенов М. tuberculosis под контролем эукариотического промотора. ДНК-вакцины доставляются в составе ДНК-вектора или вируса. Для этого используют неспособные к репликации у человека трансгенные формы аденовирусов и поксвирусов, несущие транскрибируемые в клетках человека гены, кодирующие антигены М. tuberculosis [18]. Субъединичные белковые вакцины являются искусственно созданными белковыми молекулами, включающими протективные антигены возбудителя инфекции, синтезируемыми в различных системах экспрессии.
К настоящему времени известно несколько сотен антигенов М. tuberculosis, перспективных для конструирования новых субъединичных вакцин [28]. Только антигенов, специфических для латентной стадии ТБ, выявлено более 60 [23]. Большинство субъединичных вакцин, тестируемых в настоящее время, содержат антигены М. tuberculosis Ag85a, Ag85b и ESAT-6. Первые два являются поверхностными белками М. tuberculosis и участвуют в формировании клеточной стенки бактерии. ESAT6 - это секреторный белок, необходимый для проявления вирулентности М. tuberculosis, отсутствующий у БЦЖ. ESAT-6 тесно взаимодействует с другим перспективным антигеном М. tuberculosis - CFP10, который является частью бактериальной системы секреции VII типа [29].
Рекомбинантные, аттенуированные и «классические» вакцины создаются в основном на основе живых невирулентных штаммов генно-модифицированных микобактерий разных видов, или их лизатов и цельноклеточных экстрактов. В таблице 1 представлен список вакцин, находящихся в настоящее время на разных стадиях клинических и доклинических исследований. Разработки новых вакцин против ТБ идут в основном в трех направлениях. Первое заключается в замене БЦЖ ее улучшенными рекомбинантными формами; второе и третье - в создании вакцин на основе либо генетически аттенуированных штаммов микобактерий, либо трансгенных штаммов сапрофитных видов микобактерий, несущих гены основных антигенных детерминант М. tuberculosis. Генетически улучшенные БЦЖ должны отличаться следующими характеристиками: они должны быть безопаснее, более иммуногенными, способными обеспечивать длительную остаточную защиту от туберкулеза, в особенности от крайне вирулентных клинических изолятов (таких как штаммы Beijing, MDR, XDR, TDR и др.). Один из способов улучшения БЦЖ - введение в ее геном иммунодоминантных антигенов М. tuberculosis, отсутствующих в геноме БЦЖ, таких как антигены, кодируемые RDl-локусом (ESAT-6, CFP10), или усилением продукции антигенов, уже имеющихся у БЦЖ (например, комплекс Ag85), но недостаточно активно экспрессирующихся. Другой путь улучшения БЦЖ заключается в ее генетических модификациях, которые бы активировали такие важные иммунные процессы, как кросс-презентация антигенов CD8+ Т-клеткам. Все эти «улучшения» БЦЖ могут быть скомбинированы в одном новом вакцинном штамме [30].
Второе направление в создании новых живых вакцин против ТБ заключается в генетической аттенуации М. tuberculosis. Эта стратегия включает в себя делецию некоторых важных метаболических генов, приводящих к появлению ауксотрофных мутантов, неспособных синтезировать некоторые соединения, необходимые для проявления «нормальной» вирулентности, или же делецию основных генов вирулентности (или их регуляторов). Для предотвращения возврата вирулентности нужно удалить из генома М. tuberculosis по крайней мере два независимых локуса, от которых зависит это свойство. Первые ауксотрофные штаммы М. tuberculosis были получены еще в середине 1990-х гг. [31]. Позднее были получены очень перспективные для испытаний в качестве вакцины штаммы М. tuberculosis, включая штамм ARDlApanCD, имеющий делеции в RD1 - основном генном кластере М. tuberculosis, ответственном за вирулентность, и в гене, участвующем в пути биосинтеза пантотената. Применение этого штамма вызывает эффективную защиту от ТБ у нормальных и иммунокомпромиссных мышей, и достаточно безопасно в использовании [32]. Другой перспективный в качестве вакцины аттенуированный штамм М. tuberculosis - APhoPAfadD26. Двухкомпонентная регуляторная система PhoP/PhoR на транскрипционном уровне регулирует экспрессию большого числа генов, включая основные гены вирулентности М. tuberculosis. Так, аттенуированный лабораторный штамм H37Ra содержит мутацию, инактивирующую ген phoP [33]. Ген fadD26, также инактивированный у штамма APhoPAfadD26, участвует в биосинтезе гликолипида PDIM, важного липидного компонента клеточной стенки М. tuberculosis [34].
Третье направление - это создание новых вакцин на основе других видов микобактерий. Это, прежде всего, умеренно вирулентные и авирулентные для человека виды М. vaccae, М. microti, М. smegmatis, а также сапрофитный вид М. indicuspranii. Инактивированные клетки М. vaccae [35] и М. indicuspranii, а также полноклеточный экстракт М. smegmatis [36] сейчас находятся на разных стадиях клинических испытаний в качестве терапевтических вакцин. На животных моделях показана эффективность рекомбинантного штамма М. microti, экспрессирующего антигены RD-1 локуса М. tuberculosis, для защиты от заражения туберкулезом [37]. Разрабатывается живая вакцина на основе рекомбинантного аттенуированного штамма М. smegmatis, из генома которого удален собственный локус esx-З [один из факторов вирулентности М. tuberculosis] и вместо него добавлен гомологичный локус esx-3 уже из М. tuberculosis. Такая замена не приводит к восстановлению вирулентности, но вызывает на мышиных моделях резкое увеличение числа Т-клеток памяти и генерирует сильный иммунный ответ на М. tuberculosis, приводящий в некоторых случаях к полной элиминации патогена [38].
Ассортимент успешно разрабатываемых (КИ этап 1 или выше) вакцин за последние 10 лет значительно расширился, но в основном за счет состава белковых антигенов. Обращает внимание количество продуктов, которые содержат одни и те же антигены, в основном гуморальные иммунодоминанты и одинаковые или схожие адъюванты из группы агонистов TLR (Toll-Like Receptors).
Использование вирусных векторов для рекомбинантных субъединичных ТБ-вакцин было первой попыткой найти замену БЦЖ или, по меньшей мере, повысить ее эффективность путем последующей буст-вакцинации. Первым разочарованием в испытаниях новых вакцин стали результаты клинических исследований (КИ) препарата MVA85A (№7 в таблице 1) разработки Оксфордского университета (на основе вируса осповакцины, штамм Анкара), которые не выявили достоверных различий в профилактической эффективности между этим кандидатом и контролем (только БЦЖ) у детей. Тем не менее, вакцину продолжают испытывать, но уже как терапевтическую, для взрослых.
Еще одна вирусная, адено-рекомбинантная (адено-5) ТБ-вакцина Ad5Ag85A (№2 в таблице 1) разработана в МакМастер университете (Канада) и вошла в КИ 1-й фазы, которые были терминированы в 2013 г. после приобретения всех прав на вакцину китайской компанией «КанСино». В настоящее время «КанСино» разрабатывает новый проект по Ad5Ag85A совместно с некоммерческой компанией «Аэрас» (США), финансирующей большинство современных разработок новых ТБ-вакцин.
Сходная адено-рекомбинантная (адено-35) ТБ-вакцина Ad35/Aeras 402 (№6 в таблице) (производства «Круцелл» и «Аэрас») показала в КИ фазы 1 безопасность и широкий иммунный ответ по типу ТМ, за исключением одного, но важного маркера - интерлейкина-17 (ИЛ-17). В настоящий момент проходят КИ фазы 2. Примечательно, что этот же антиген Ag85a, экспрессированный в другом вирусном векторе (Анкара) в составе MVA85A, индуцирует ИЛ-17. Основываясь на этих данных, «Аэрас» решила профинансировать еще один проект - использование Ad35/Aeras 402 и затем MVA85A как бустера.
Использование адъювантов - один из путей повышения иммуногенности и таким образом эффективности вакцин. Целый ряд кандидатов ТБ-вакцин использует для этих целей коммерчески производимое вещество на основе ДНК-олигонуклеотидов класса CpG - IC31® («Интерсел», Австрия), являющееся агонистом TLR9-рецепторов. Датский Институт Сыворотки (Statens Serum Institut) совместно с «Аэрас» испытывает различные сочетания рекомбинантных (в экспрессионной системе Е. coli) микобактериальных антигенов и этого адъюванта.
Первым кандидатом был Hybrid-1 (ESAT6/Ag85B+IC31), который в целом показал хорошие результаты в КИ, однако не выявил ожидаемого ответа на ключевой антиген ESAT-6 (№5 в таблице). Кроме того, в ходе исследований стало очевидно, что наличие ESAT-6 в вакцинном препарате ставит под сомнение результаты теста IGRA (interferon-gamma release assay), используемого в оценке эффективности.
Для преодоления этого недостатка ESAT-6 был заменен на функционально сходный антиген ТВ-10.4 в новой экспериментальной ТБ-вакцине Hybrid 4/Aeras-404 (или HyVac4/Aeras404), разработанной совместно с «Санофи Пастер», Канада (№3 в таблице). Одно КИ фазы 1 с этим кандидатом было терминировано без объяснения причин, но в настоящее время проходит еще одна попытка проведения КИ совмещенной фазы 1/2.
Последний на сегодняшний день кандидат из этой серии - Hybrid 56/Aeras-456 (или H56/IC31), в дополнение к первоначальному варианту (ESAT6/Ag85B + адъювант IC31) включает третий антиген (латентно-ассоциированный) Rv2660c (№4 в таблице). Результаты доклинических исследований (ДКИ) на низших приматах показали эффективность этого препарата как в предотвращении первичного инфицирования, так и в блокировке реактивации латентной инфекции. Клинические исследования фазы 1/2 проходят в настоящее время.
Другой адъювант, хотя также относящийся к агонистам TLR, использует в своей разработке «ГлаксоСмитКляйн» -AS02 (MPL™ + QS-21) (агонист TLR4), в сочетании с двумя микобактериальными антигенами Rv1196, Rv0125, являющимися выраженными иммунодоминантами (№8 в таблице). Кандидат М72 успешно завершил КИ фазы 1 и следом за MVA85A вступил в фазу IIb -исследование эффективности.
Аналогичный адъювант (агонист TLR4), но полученный синтетическим путем (GLA-SE) использован IDRI (Исследовательский институт инфекционных болезней, США) совместно с «Аэрас» сразу с четырьмя латентно-ассоциированными микобактериальными антигенами: Rv2608, Rv3619, Rv3620, Rv1913 (№2 в таблице) Кандидат ID-93 показал высокую эффективность в ДКИ, включая протективность против резистентных штаммов МТБ у низших приматов.
Наиболее релевантными по отношению к исследуемой теме, из числа выявленных патентных документов, являются следующие решения.
Изобретение по заявке US 2011/0020384 А1 касается использования разных антигенов ESAT-6, ESAT-6-Ag85B, ТВ10.4, CFP10, RD1-ORF5, RD1-ORF2, Rvl036, МРВ64, МРТ64, Ag85A, Ag85B (MPT59), MPB59, Ag85C, 19 kDa lipoprotein, MPT32 Mycobacterium tuberculosis для разработки поливалентной противотуберкулезной вакцины.
Изобретение US 7968105 В2 касается иммуногенной композиции или лекарственного средства, состоящих из одного антигена ESAT-6, Ag85A, Ag85B, ТВ 10.4 Mycobacterium tuberculosis; сочетания различных химерных (слитых) белков на основе этих антигенов; использование гибридных белков в разных сочетаниях с вакциной BCG.
Изобретение по заявке US 2011/0027349 В2 касается иммуногенной композиции, включающей один из антигенов Ag85A, Ag85B, МРТ-64, Pst-S1, Ара, GroES, GroEL, Dnak, CFP-10, Rv083 1c, Rv1324 Mycobacterium tuberculosis или их различных сочетания; использование полипептидов как компонентов для проведения вакцинации по схеме прайм-буст (prime-boost) в сочетании с вакциной BCG; использование различных адъювантов.
Изобретение, описанное в международной патентной публикации WO 2009/143413, касается иммуногенных композиций, содержащих слитые белки, в том числе белки комплекса mtb Mycobacterium tuberculosis, конъюгированные с полисахаридом, таким как декстран, причем заявленные композиции дают усиленный Т-клеточный ответ.
Изобретение по заявке US 2010/0015171 А1 касается иммуногенной композиции, включающей антигены семейства Ag85 и ТВ 10.4 Mycobacterium tuberculosis; различные сочетания этих антигенов; использование различных адъювантов (DDA, поликатионные пептиды, олигонуклеотиды, IC31® адъювант) для введения антигенов.
Изобретение RU 2520737 С1 относится к биохимии и биотехнологии и представляет собой рекомбинантную плазмиду pESAT6-DBD, состоящую из искусственного бактериального оперона химерного белка, включающего промоторную область раннего промотора бактериофага Т5, гена химерного белка, состоящего из последовательности белкового антигена ESAT-6 из Mycobacterium tuberculosis, слитого с последовательностью декстрансвязывающего домена (DBD) декстрансукразы Leuconostoc citreum КМ20 и терминатора транскрипции; бактериального оперона бета-лактамазы и бактериального участка инициации репликации типа ColE1. Изобретение также включает штамм Escherichia coli -продуцент химерного белка ESAT6-DBD, а также способ иммобилизации, концентрирования и очистки полученного белка на декстране. Кроме того, изобретение относится к самому рекомбинантному белку ESAT6-DBD и иммуногенной композиции, содержащей его, направленной на индукцию иммунитета против туберкулезной инфекции. Изобретение позволяет получать штамм-продуцент, обеспечивающий высокий уровень продукции устойчивых иммуногенных белков, которые могут быть получены, иммобилизованы и очищены в одну стадию, а также получать эффективные иммуногенные композиции против туберкулеза.
Изобретение RU 2539026 С1 относится к генной инженерии, биохимии, биотехнологии и иммунологии и представляет собой рекомбинантную плазмиду pESAT6-CFP10-DBD, рекомбинантный штамм Escherichia coli M15 [pREP4, pESAT6-CFP10-DBD], способ получения, иммобилизации, концентрирования и очистки рекомбинантного белка ESAT6-CFP10-DBD на декстране, рекомбинантный белок ESAT6-CFP10-DBD с молекулярной массой 26,4 кДа, иммуногенную композицию, содержащую белок ESAT6-CFP10-DBD, иммобилизованный на декстране, специфически активирующую Т-лимфоциты, синтезирующие ИФН-гамма при стимуляции антигенами микобактерий. Изобретение позволяет получить высокий уровень экспрессии белка, который эффективно индуцирует иммунный ответ на антиген микобактерий.
Ближайшим аналогом изобретения является вакцина рекомбинантная противотуберкулезная (RU 2665817 С1), содержащая первый антиген, представляющий собой очищенный рекомбинантный белок Ag85A микобактерий туберкулеза М. tuberculosis, второй антиген, представляющий собой гибридный рекомбинатный белок ESAT6-CFP10 микобактерий туберкулеза М. tuberculosis, включающий в себя очищенный микобактериальный белок ESAT-6, слитый с очищенным микобактериальным белком CFP10, и адъювант, включающий в себя первый водорастворимый высокомолекулярный полисахарид декстрана для иммобилизации белков Ag85A и ESAT6-CFP10 указанных антигенов, неметилированный CpG олигонуклеотид с фосфотиоатной связью, являющийся лигандом рецептора системы врожденного иммунитета TLR9, и второй водорастворимый высокомолекулярный полисахарид декстрана, отличный от первого водорастворимого высокомолекулярного полисахарида декстрана, для иммобилизации упомянутого CpG олигонуклеотида.
Вакцина ГамТБвак, находящаяся на II фазе клинических испытаний, позиционируется как профилактический препарат, ее предполагается использовать в качестве «препарата ревакцинации» («буст») для применения у БЦЖ-вакцинированных взрослых. Проведенные доклинические испытания и клиническое исследование I фазы вакцины ГамТБвак показали ее безопасность и иммунологический потенциал [39].
Поскольку, количество инфицированных людей-носителей латентной формы ТБ велико, одной из наиболее актуальных задач является разработка вакцины, способной не только обеспечивать защиту от активно форм заболевания, но также контролировать процесс реактивации микобактерий уже зараженных пациентов и, таким образом, поддерживать в организме хозяина дормантное состояние клеток патогена, и таким образом существенно ограничить естественный резервуар туберкулеза, а кроме того, способствовать сокращению сроков лечения при совместном использовании с антибиотикотерапией.
Поэтому задачей изобретения была разработка субъединичной вакцины (ЛТБвак), содержащей в составе рекомбинантные антигены МТБ, экспрессирующиеся на разных стадиях инфекции.
Помимо профилактической модели, она испытывается в качестве лечебной вакцины. Вакцина включает три антигена, экспрессирующиеся на ранней стадии инфекции (Ag85a, CFP10, ESAT6), и один антиген, экспрессирующиеся в латентной фазе инфекции (Rv2660c).
Данный выбор белков обусловлен необходимостью иммунопрофилактики туберкулеза, позволяющей контролировать все стадии инфекционного процесса.
В качестве основных антигенных компонентов в состав вакцины входят иммунодоминантные рекомбинантные белки ESAT-6 (Rv3875, Early secreted antigenic target 6 kDa protein) и CFP10 (Rv3874, Culture filtrate protein 10). Они представляют собой секретируемые антигены, обнаруженные в фильтрате ранней культуры микобактерий. Их включение обусловлено вызываемой ими сильной иммунной реакцией на всех стадиях инфицирования, и подтвержденной иммуногенностью при вакцинации в испытаниях на животных моделях и человеке.
Гены, кодирующие эти белки, располагаются в уникальных регионах геномов вирулентных штаммов М. tuberculosis, и не встречаются ни у одного из восьми применяемых вакцинных БЦЖ субштаммов. Они включены с состав системы секреции ESX-1 и, по всей видимости, частично обуславливают вирулентность микобактерий, позволяя патогену обходить иммунный ответ хозяина. Показано, что рекомбинантные антигены, попадая в организм, способны индуцировать синтез IFN-γ при туберкулезной инфекции, активировать специфический иммунный ответ организма при контакте с М. tuberculosis и формировать протективный иммунитет до непосредственного контакта с возбудителями туберкулеза - микобактериями.
Помимо этого, в состав вакцины включен антиген Ag85a (Rv3804c), играющий важную роль в формировании противотуберкулезного иммунитета. Этот белок способен стимулировать специфическую выработку IFN-γ при туберкулезной инфекции, содержит эпитопы для распознавания Т-клетками популяции CD4+ и CD8+. Кроме того, Ag85a индуцирует выработку специфических антител, которые обнаруживаются как в сыворотках больных с положительными туберкулиновыми пробами, так и с активной формой ТБ. Таким образом, антиген стимулирует формирование сбалансированного иммунного ответа, с преобладанием Th1-типа, что необходимо для развития протективного иммунитета.
Поскольку, разрабатываемая вакцина направлена, в том числе, на предотвращение реактивации латентных форм и возникновения вторичного туберкулеза, в антигенный состав ЛТБвак был включен рекомбинантный белок Rv2660c, относящийся к белкам DosR регулона М. tuberculosis. Известно, что дормантное состояние микобактерий характеризуется низким уровнем метаболической активности клеток, а также повышенной экспрессией белков, относящихся к DosR регулону. Именно гены DosR были идентифицированы как ключевые регуляторы перехода в дормантное состояние in vitro, и необходимы для поддержания этого состояния in vivo. Предполагается, что включение подобных антигенов в состав разрабатываемых вакцин способно повысить эффективность контроля реактивации микобактериальной инфекции и снижению бактериальной нагрузки.
Таким образом, вакцинный препарат сформулирован следующим образом.
Рекомбинантная противотуберкулезная вакцина содержит эффективное количество рекомбинантного белка ESAT6-CFP10-Ag85a-Rv2660c, который представляет собой слитые микобактериальные белки ESAT-6, CFP10, Ag85a, Rv2660c с гистидиновым тагом длиной 8 остатков и адъювант, представленный CPG-олигонуклеотидом и мурамилдипептидом, где рекомбинантный белок и адъювант иммобилизованны на частицах носителя из сополимера молочной и гликолевой кислот PLGA. Носитель PLGA представляет собой сополимер молочной и гликолевой кислот с молекулярной массой 66000-108000 Да, с соотношением мономерных звеньев 75:25. При этом средний размер частиц PLGA с иммобилизованным белком находится в пределах 100-200 нм. Адъювант в заявленной вакцине представляет собой комбинацию CPG-олигонуклеотида и мурамилдипептида, где мурамилдипептид представляет собой, D-L изомер, N-ацетилмурамил-L-аланил-D-изоглутамин, а CPG-олигонуклеотид представлен CpG-ODN класса А.
Выбор данной формуляции обусловлен тем, что каждый компонент выполняет определенную роль важную для формирования эффективного протективного иммунитета.
Технический результат от применения предлагаемой рекомбинантной противотуберкулезной вакцины заключается в том, что рекомбинантный антиген ESAT6-CFP10-Ag85a-Rv2660c в сочетании с адъювантом, представленным CPG-олигонуклеотидом и мурамилдипептидом, обладает повышенным иммуногенным действием, в первую очередь за счет увеличения массы антигена и его стерических размеров, что вызывает более активное поглощение таких белков распознающими клетками иммунной системы. Использование цельнослитого гибридного белка ESAT6-CFP10-Ag85a-Rv2660c обеспечивает однородный устойчивый высокий уровень клеточного и гуморального иммунного ответа. При этом обеспечивается синергический эффект эпитопов гибридного белка по сравнению с индивидуальными антигенами, входящими в его состав. Содержание в вакцине трех антигенов, экспрессирующихся на ранней стадии инфекции (Ag85a, CFP10, ESAT-6), и один антиген, экспрессирующийся в латентной фазе инфекции (Rv2660c) позволяет контролировать все стадии инфекционного процесса.
Краткое описание чертежей.
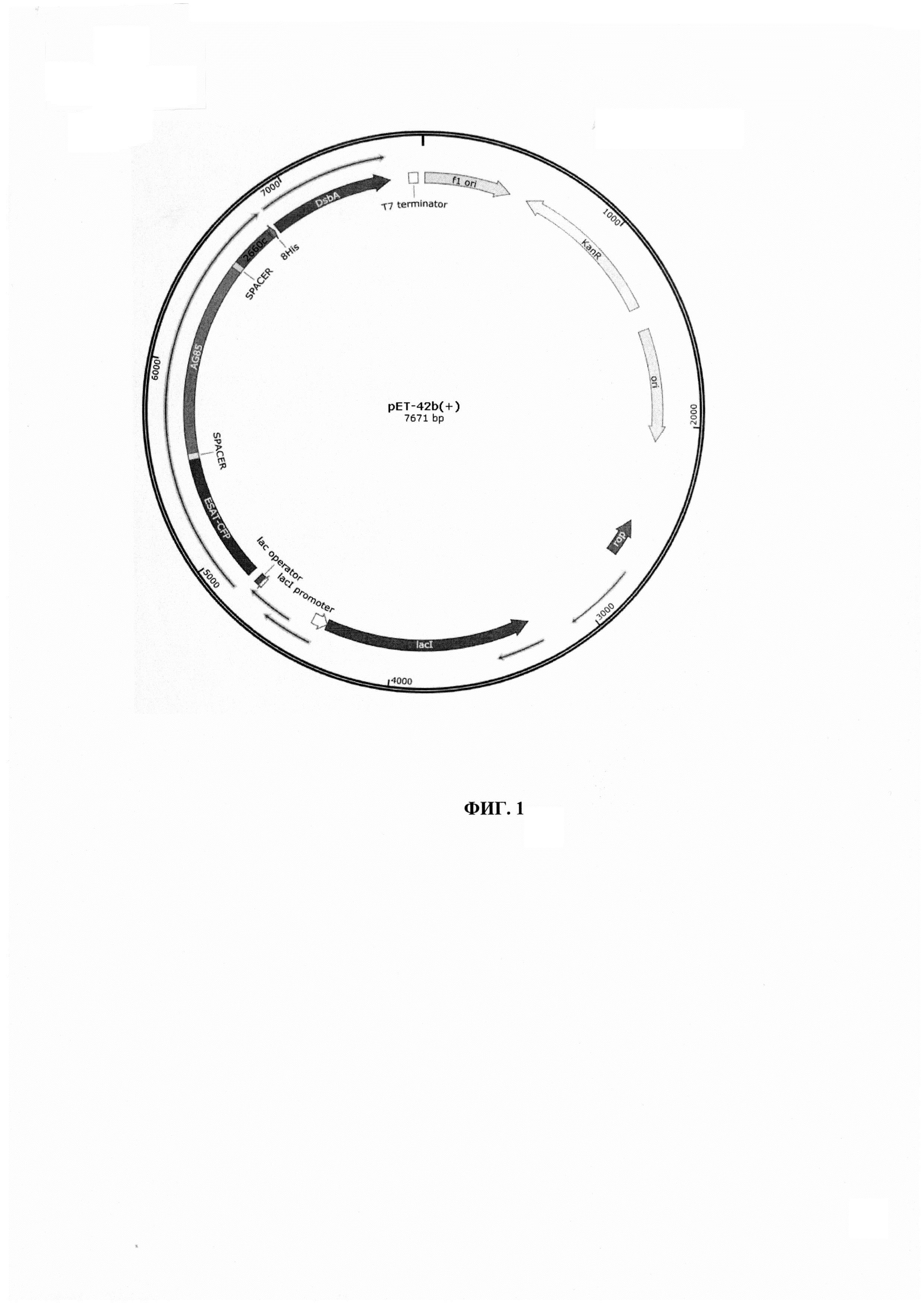
Фиг. 1 - Схематическое отображение расположения ключевых элементов экспрессионного вектора. Обозначения: lad, rop, ori, KanR, fi ori, T7, DsbA -служебные регионы плазмиды pET-42b(+); ESAT-CFP, AG85, 2660 с - кодирующие области целевых антигенов ESAT-6, CFP10, Ag85a, Rv2660c, соответственно; 8His - олигогистидиновый таг.
Фиг. 2 - Кривые роста Е. coli штамма Clear coli BL21(DE3) на различных питательных средах.
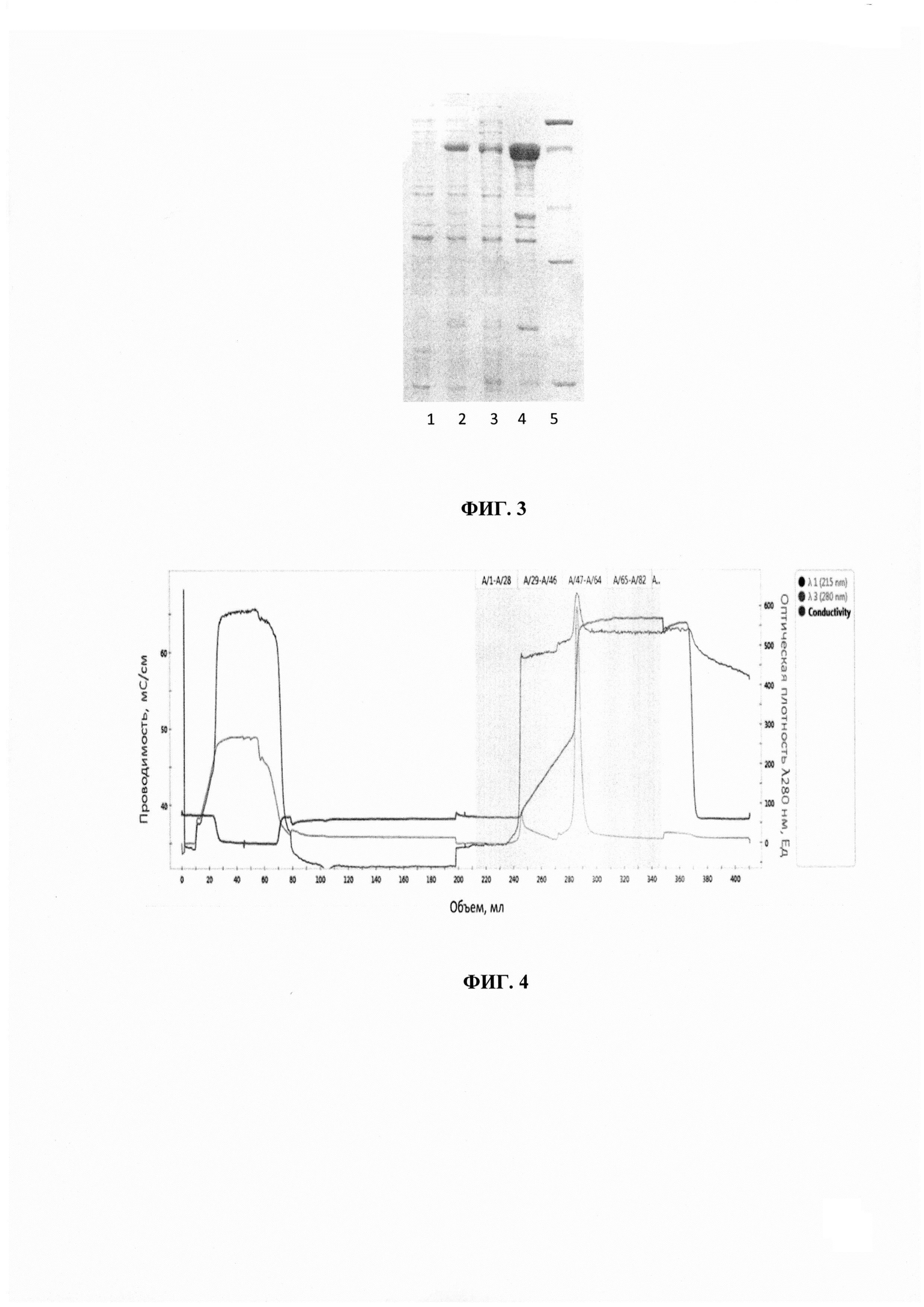
Фиг. 3 - Анализ экспрессии белков в клетках Е. coli (электрофорез в 12% ПААГ).
(1) ESAT6-CFP10-Ag85a-2660c (8His) (до индукции) (2) ESAT6-CFP10-Ag85a-2660 с (8His) (после индукции) (3) ESAT6-CFP10-Ag85a-2660c (8His) (лизатный супернатант) (4) ESAT6-CFP10-Ag85a-2660c (8His) (нерастворимый осадок) (5) Маркер молекулярных весов (14.4, 21.5, 31,45, 66.2, 97.4 кДа).
Фиг. 4 - Хроматограмма рекомбинантного гибридного белка ESAT6-CFP10-Ag85a-Rv2660c на колонке с сорбентом Ni Sepharose High Performance.
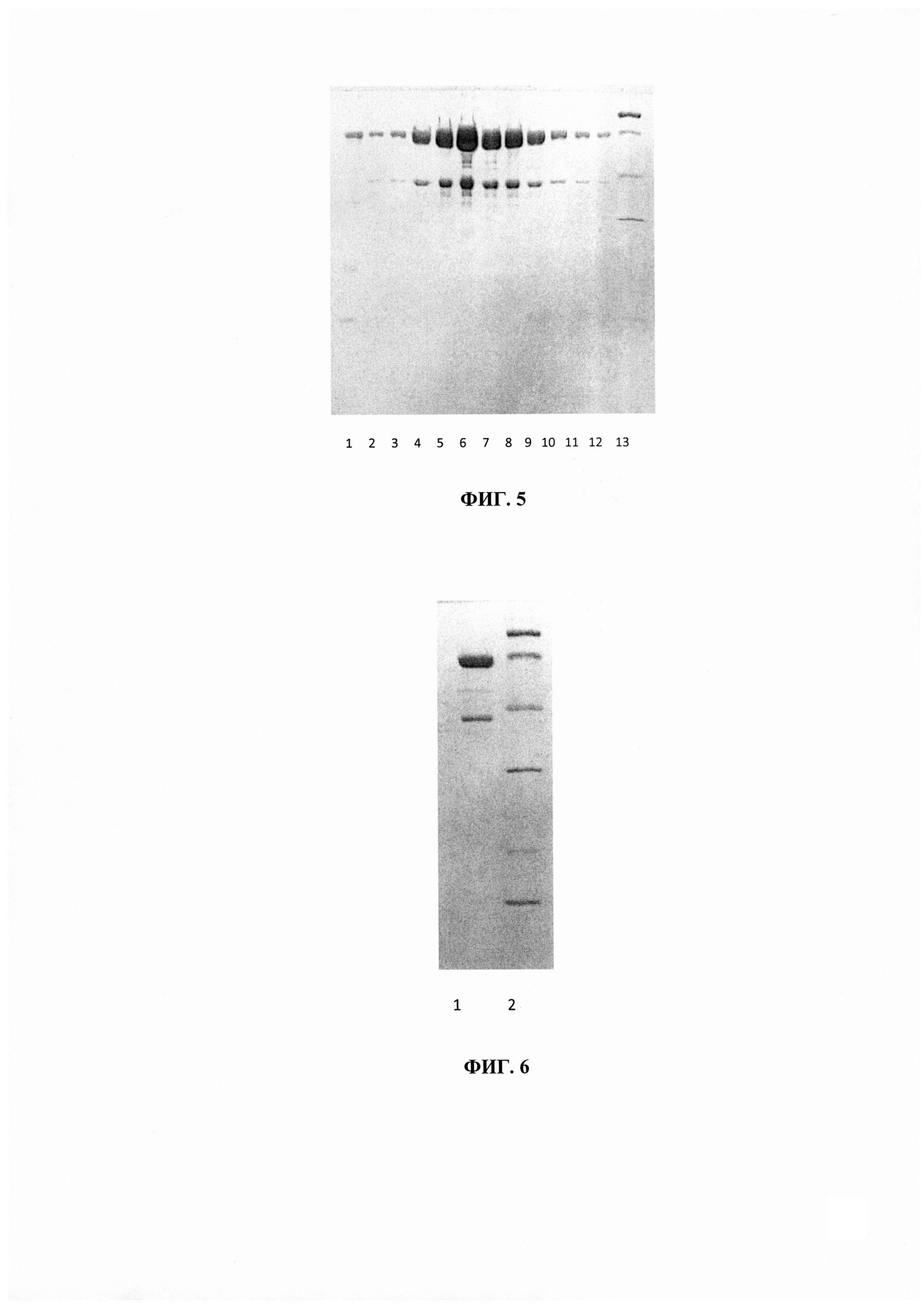
Фиг. 5 - Электрофоретическое разделение в ПААГ по Лэммли белковых фракций, полученных в процессе выделения и очистки рекомбинантного гибридного белка ESAT6-CFP10-Ag85a-Rv2660c. (1) белки супернатанта после лизиса биомассы, не связавшиеся с сорбентом Ni-NTA; (2-12) белок ESAT6-CFP10-Ag85a-Rv2660c (68,2 кДа), элюированный градиентом раствора имидазола 10 - 500 мМ, рН 8,8; (13) Маркер молекулярных весов (14.4, 21.5, 31,45,66.2, 97.4 кДа).
Фиг. 6 - Электрофоретическое разделение в ПААГ по Лэммли объединенного препарата гибридного белка после диализа. (1) белок ESAT6-CFP10-Ag85a-Rv2660c (68,2 кДа), после диализа против 20 мМ Трис рН 8.8, 5 мМ β-меркаптоэтанол; (2) Маркер молекулярных весов (14.4,21.5, 31, 45,66.2, 97.4 кДа).
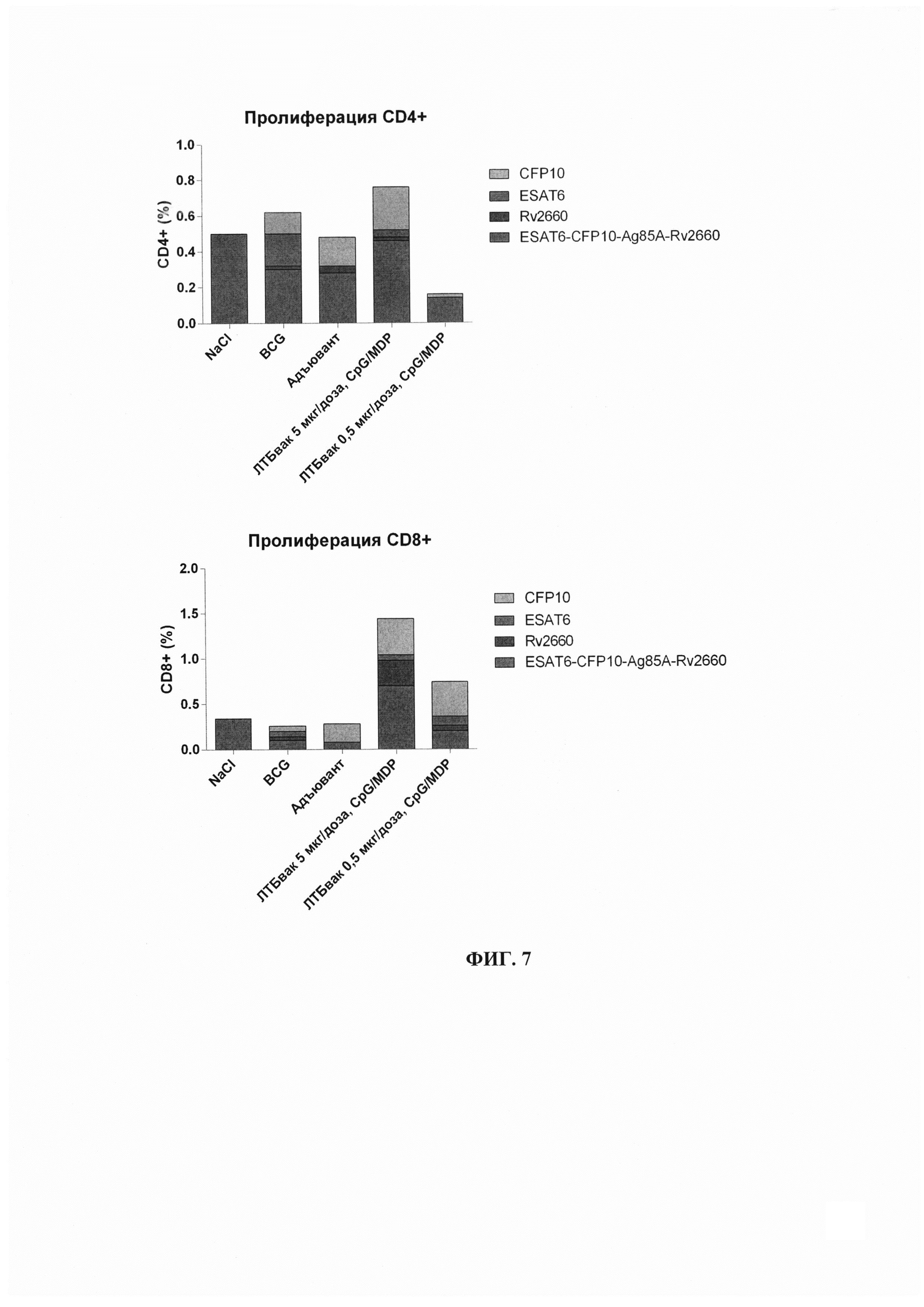
Фиг. 7 - Изучение пролиферации популяций Т-лимфоцитов CD4+, CD8+ у мышей при различных формуляциях вакцины. Показана доля пролиферирующих эффекторных (CD4+) и цитотоксических (CD8+) от всех Т-лимфоцитов в ответ на введение компонентов вакцинного антигена по отдельности и гибридного белка. Данные представлены в виде накопительных (суммирующих) диаграмм.
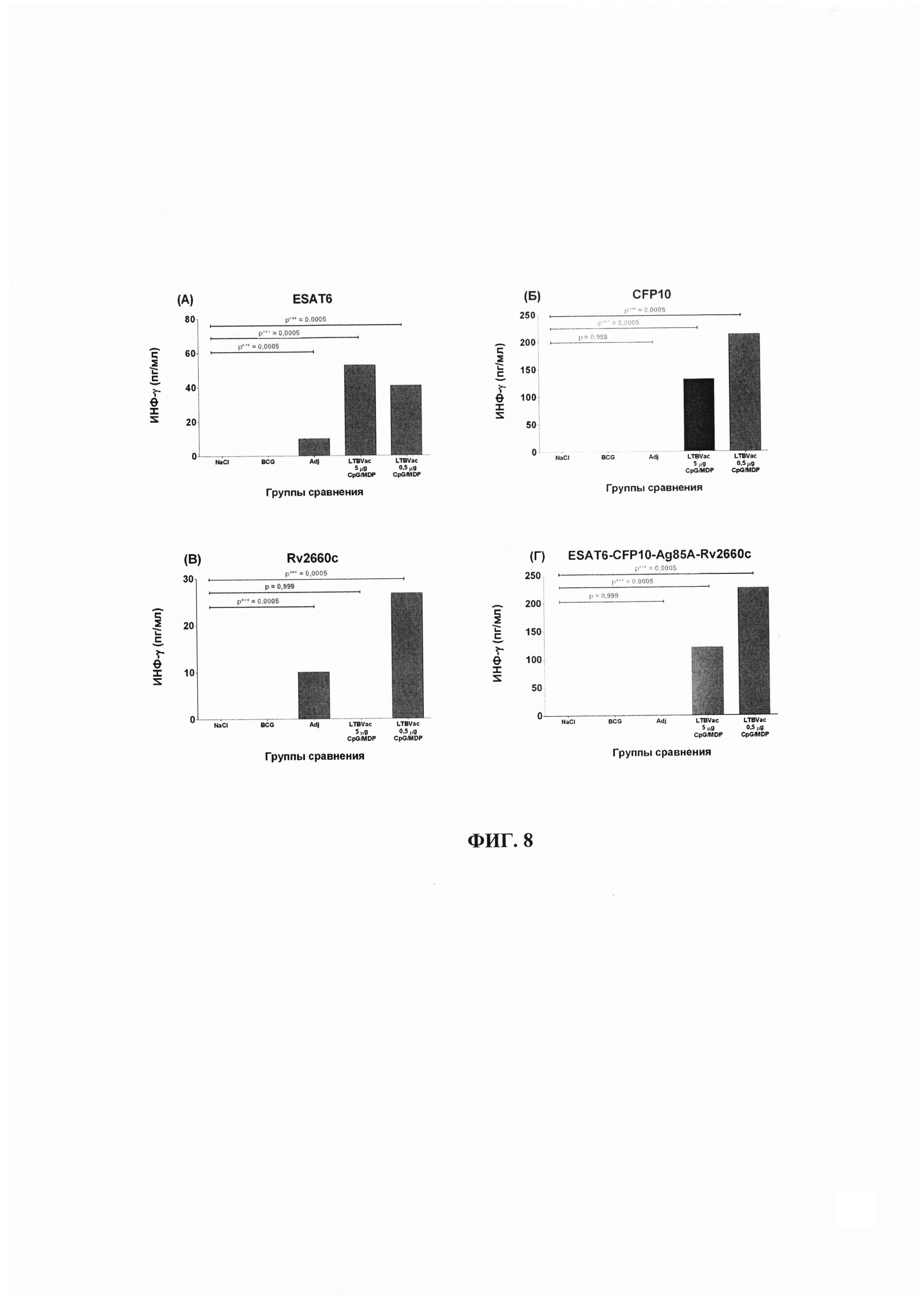
Фиг. 8 - Продукция ИНФ-γ спленоцитами мышей при стимуляции вакцинными антигенами. Обозначения: А-В - результаты IGRA-теста при стимуляции отдельными компонентами гибридного белка-антигена, Г - результаты IGRA-теста при стимуляции гибридным белком. Показаны средние значения по группам.
Фиг. 9 - Накопительный эффект при продукции ИНФ-γ спленоцитами при стимуляции всеми вакцинными антигенами.
Фиг. 10 - Уровни в сыворотке крови испытуемых животных антител класса G к пептидам, входящим в состав специфического антигена. Показан гуморальный иммунный ответ к каждому из пептидов (А-Г). Данные представлены в виде всех значений на фоне среднего значения+/- стандартной ошибки среднего (mean+/-SEM).
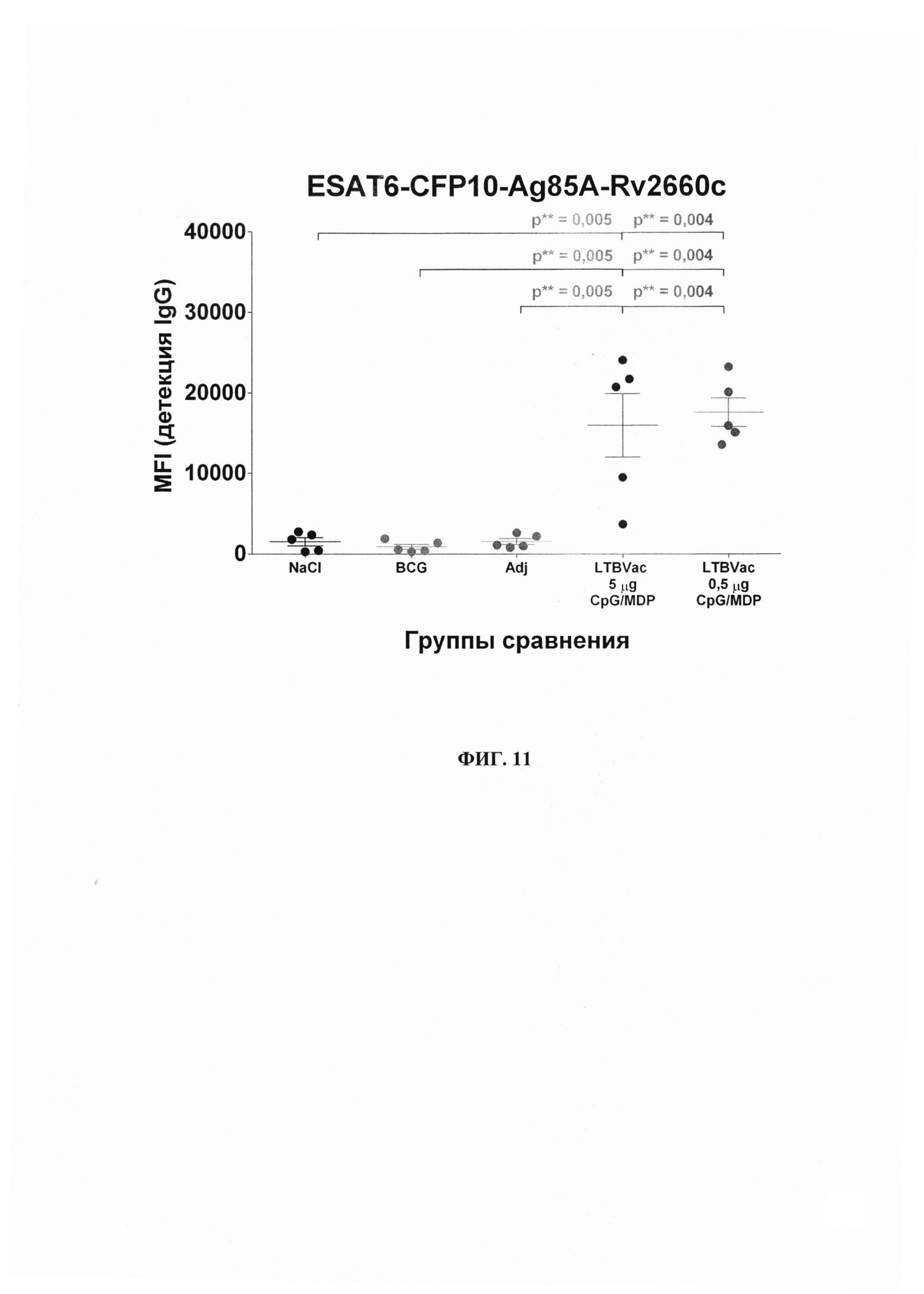
Фиг. 11 - Уровни в сыворотке крови испытуемых животных антител класса G к гибридному-белку вакцины ЛТБвак. Данные представлены в виде всех значений на фоне среднего значения +/- стандартной ошибки среднего (mean +/- SEM).
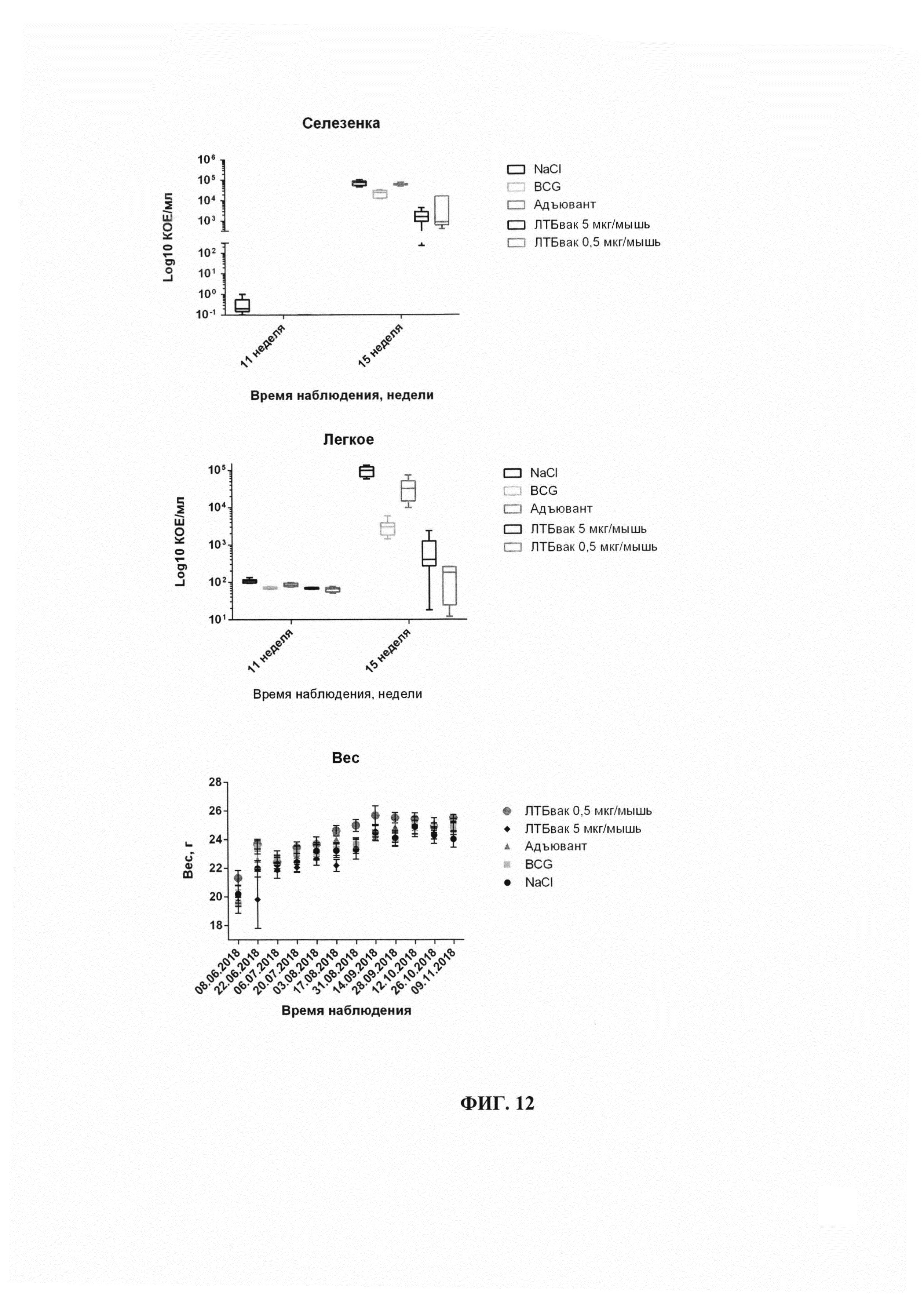
Фиг. 12 - Результаты высевов органов-мишеней (селезенка - верхняя панель, легкое - средняя панель, динамика изменения веса животных - нижняя панель) на присутствие в них М. tuberculosis.
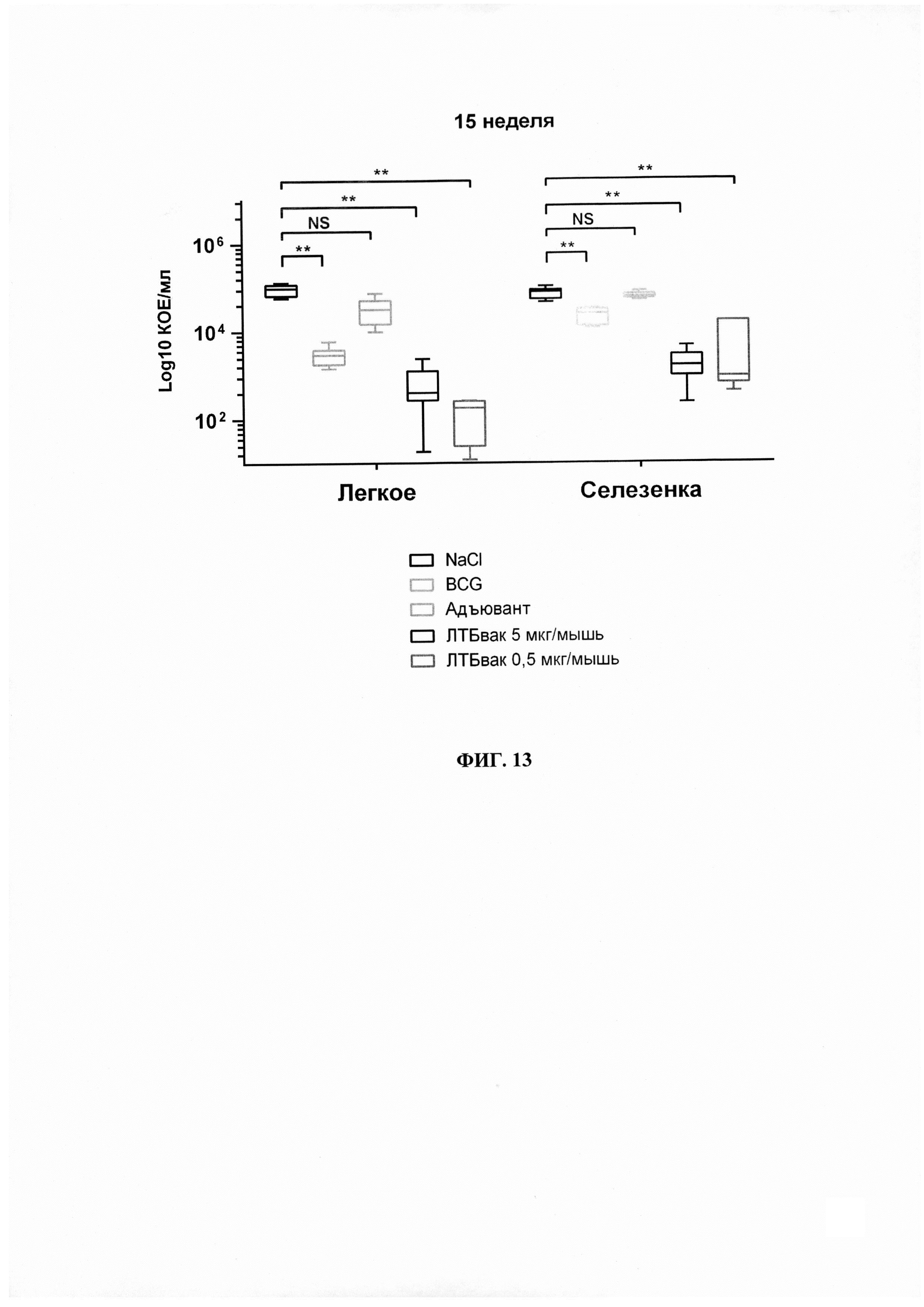
Фиг. 13 - Результаты высевов органов-мишеней (селезенка, легкое) на присутствие в них М. tuberculosis на 15 неделю у животных исследуемых групп. Данные представлены в виде диаграммы размаха с указанием медианы, нижнего и верхнего квартилей.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Разработана субъединичная полиантигенная генно-инженерная вакцина для профилактики и вспомогательного лечения туберкулеза (включая латентную форму) с рабочим названием «ЛТБвак», компонентами которого являются рекомбинантные белки микобактерий, экспрессирующиеся как на ранней (активной) - Ag85a, ESAT-6, CFP10, так и на латентной (Rv2660c) стадиях инфекции, объединенные ковалентными связями в общий («фьюжн») рекомбинантный белок ESAT6-CFP10- Ag85a-Rv2660c; носитель (поли(молочная-ко-гликолевая кислота), PLGA); и комплексный молекулярный адъювант, представленный CpG-олигонуклеотидами (CpGODN), являющимися лигандами различных типов рецепторов системы врожденного иммунитета (toll-like receptors -TLR9), а также мурамилпептид (MDP), являющийся неспецифическим лигандом рецепторов NOD2.
Процесс получения рекомбинантных секреторных микобактериальных белков, предназначенных для использования в качестве специфических стимуляторов иммунного ответа при применении как компонента субъединичной противотуберкулезной вакцины, состоит из следующих этапов:
- создание генетического вектора для экспрессии микобактериальных белков в слитой (фьюжн) форме;
- получение культуры-продуцента растворимого рекомбинантного микобактериального белка на основе клеток Е. coli штамма Clear coli BL21(DE3);
- масштабирование культуры-продуцента и получение клеточной биомассы в ферментере;
- получение субстанции рекомбинантных секреторных микобактериальных антигенов в виде фьюжн-белка состава ESAT6-CFP10-Ag85a-Rv2660c.
ПРИМЕР 1.
Получение рекомбинантного слитого белка Ag85a-ESAT6-CFP10-Rv2660c.
1.1. Создание генетического вектора для экспрессии генов, кодирующих микобактериальные белки
Общепризнанной проблемой рекомбинантных технологий производства белков является получение достаточно значительного количества растворимого и функционально полноценного продукта. Не смотря на то, что Escherichia coli остается самым распространенным организмом-продуцентом рекомбинантных антигенов, этому продуценту присуще отсутствие распространенных в других организмах, белков-помощников - внутриклеточных шаперонов. Следствием этого часто является неверное сворачивание полипептидной цепи с образованием нерастворимых агрегатов (телец включений), либо растворимых форм, лишенных функциональной активности.
Нерастворимость и отсутствие функциональной активности рекомбинантного продукта может также быть вызвано несоответствиями в использовании кодонов Е. coli и природным продуцентом.
Известно, что клонирование генов fbpA, esxA, esxB, rv2660 в составе экспрессионных векторов Е. coli приводит к продукции больших количеств белковых антигенов Ag85a, ESAT6-CFP10 и Rv2660c в составе телец включений.
Гены, кодирующие микобактериальные антигены, были синтезированы ЗАО «Евроген» (Россия). Для получения растворимых-нативных форм антигенов клонировали кодирующие их гены в составе вектора pET-42b(+) (Novagen of Merck Millipore, США). Был создан экспрессионный вектор, где в одной рамке считывания находились целевые микобактериальные антигены, соединенные спейсерами, и 8-His-tag, необходимый для аффинной хроматографической очистки получившегося белка (Фиг. 1).
Первичные последовательности полученных генетических конструкций и кодируемые ими полипептидные последовательности приведены в Приложении А.
1.2. Получение культур-продуцентов растворимых рекомбинантных микобактериальных белков на основе клеток Е. coli штамма Clear coli BL21(DE3).
Наработку рекомбинантных микобактериальных антигенов производили в специфической суспензионной прокариотической культуре Е. coli штамма Clear coli BL21(DE3). Данная культура клеток позволяет наращивать биомассы с низкой пирогенной активностью. Этот эффект объясняется геномными делениями (ΔgutQ ΔkdsD ΔlpxL ΔlpxM ΔpagP ΔlpxP ΔeptA) и одной компенсаторной мутацией (msbA148), блокирующими синтез нативных молекул липополисахаридов, являющихся основным фактором пирогенности.
Продуцент рекомбинантного микобактериального гибридного антигена получали методом химической трансформации созданной генетической конструкцией.
После получения колоний продуцентов рекомбинантного микобактериального антигена на твердых питательных средах исследовалась пригодность условий процесса для культивирования в конических колбах Эрленмейера при термостатировании и перемешивании.
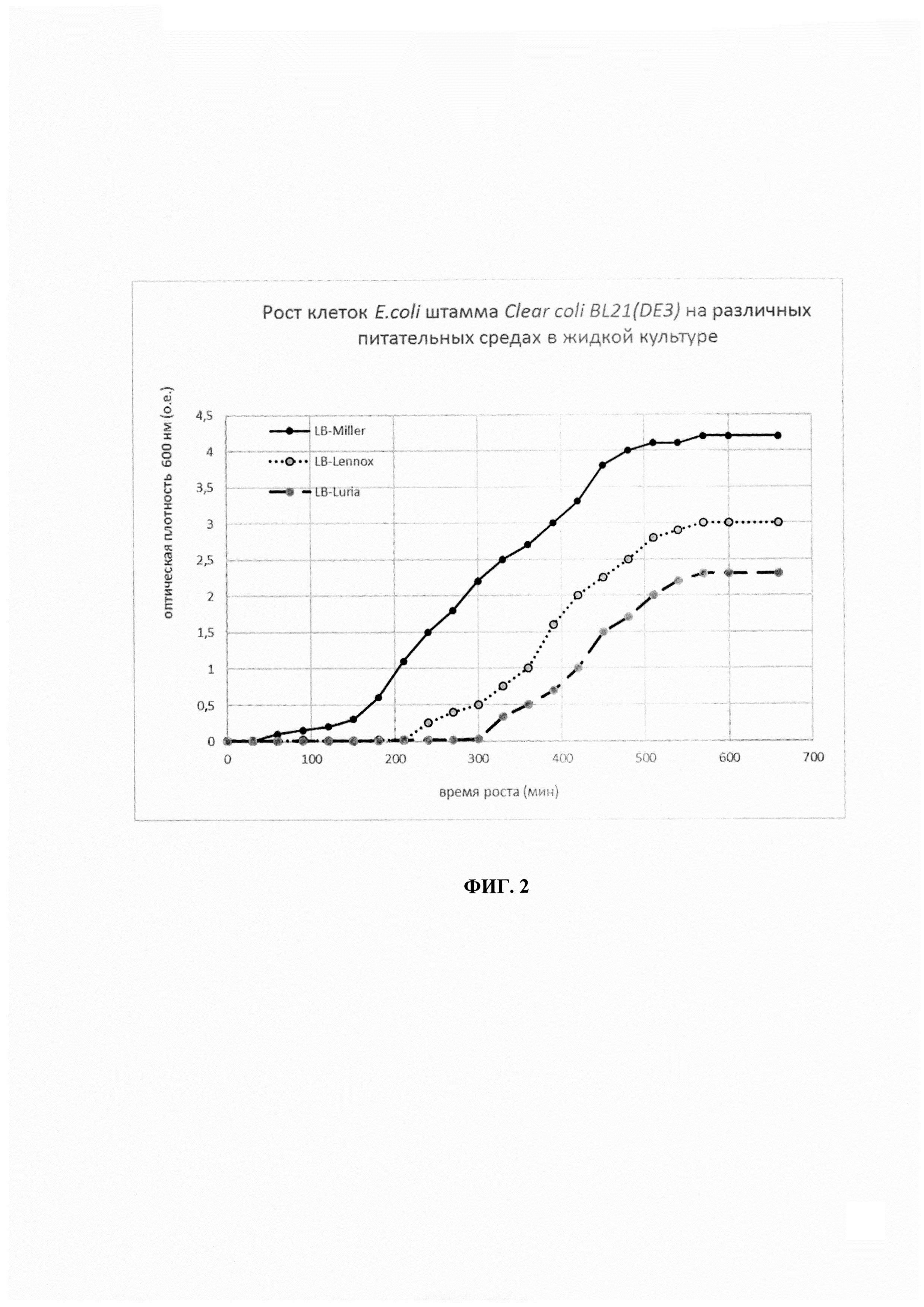
Были протестированы три самые популярные модификации питательной среды LB: LB-Miller, LB-Lennox, LB-Luria, в ходе эксперимента установили (Фиг. 2.), что оптимальной средой для роста продуцента будет питательная среда LB в исполнении Miller.
При выборе отношения объемов жидкой культуры к объему колбы учитывали два фактора - с одной стороны уменьшение объема культуры приводит к улучшению ее аэрации, с другой стороны снижает выход биомассы в граммах. В ходе эксперимента (таблица 2) было установлено, что оптимальное отношение объема жидкой культуры к объему колбы 1 к 5 при скорости перемешивания 250 об/мин.
При исследовании зависимости роста культуры Е. Coli штамма Clear coli BL21(DE3) от температуры окружающей среды было обнаружено, что культивирование при температуре ниже 29°С и выше 39°С значительно ухудшало динамику роста бактерий.
Принимая во внимание вышеописанное, оптимальными параметрами культивирования клеток-продуцентов, считали следующие:
- питательная среда LB-Miller;
- отношение объема жидкой культуры к объему колбы 1 к 5;
- температура культивирования 37°С;
- скорость перемешивания при инкубации - 250 об/мин.
Следующим этапом исследования явился подбор условий индукции экспрессии генов, кодирующих рекомбинантные антигены. Необходимо было установить действующую концентрацию индуктора, время его добавления, общую продолжительность индукции. Результаты подбора условий индукции генов рекомбинантных микобактериальных антигенов представлены в таблице 3.
Так же в ходе экспериментов было показано, что при культивировании культуры продуцентов при температуре 37°С и выше - небольшая часть продуцируемых рекомбинантных белков оказывалась в нерастворимой фракции клеточного лизата, тогда как понижение температуры до 30°С к появлению всех рекомбинантных белков в растворимой фракцию.
Кроме того, оказалось, что рекомбинантные белки достигают своей максимальной нативной концентрации в клетках в результате воздействия индуктором в период от 4х часов до 6 часов, после шести часов индукции рекомбинантные белки начинали накапливаться в форме нерастворимых агрегатов.
В результате экспериментов было показано, что наибольшая продукция рекомбинантных продуктов в клетках достигается при соблюдении следующих условий:
- добавление ИПТГ необходимо производить при оптической плотности
- культуры 0,5-0,75 о.е. (измерение при длине волны 600 нм);
- конечная концентрация ИПТГ в среде 0,4 мМ
- температура культивирования среды после добавления индуктора 30°С
- время культивирования после добавления индуктора не должно превышать 6 часов.
Подобранные условия роста и индукции культур-продуцентов позволили достичь продукции интеиновых химер антигенов в количествах порядка 10 мг/г биомассы клеток; получать биомассу клеток 2 г/л среды; при этом производимые химеры были растворимы и не попадали в состав телец включений.
1.3. Концентрирование клеток продуцента, их лизис и фракционирование белков по растворимости
Разработка методики выделения и очистки гибридного белка ESAT6-CFP10-Ag85A-Rv2660c из индуцированных клеток штаммов-продуцентов включала следующие стадии: осаждение клеток из культуральной среды центрифугированием, лизис и разрушение клеток посредством обработки ультразвуком и в лабораторном клеточном сепараторе, разделение дифференциальным центрифугированием белков легко растворимой фракции и нерастворимых белков, очистка рекомбинантных белков с помощью аффинной металл-хелатной хроматографии, стерилизующая фильтрация. Разработанная методика позволяет очищать рекомбинантные белки из биомассы штаммов-продуцентов с возможностью последующего масштабирования этого процесса до промышленных объемов.
Далее приведено подробное поэтапное описание всех стадий очистки рекомбинантного белка.
Концентрирование клеток производили посредством их сбора центрифугированием с последующим ресуспендированием в лизирующем буфере. Опытным путем было установлено, что центрифугирование суспензии клеток при 6000 g в течение 20 мин при температуре 4°С оптимально концентрирует исходный клеточный материал, сохраняя способность осадка к ресуспендированию.
После ресуспендирования клетки необходимо полностью разрушить и добиться полного высвобождения рекомбинантных белков в условиях промышленных объемов производства. Способ должен быть не только эффективным, но и технологичным.
Способ разрушения клеток, предлагаемый в лабораторном варианте очистки рекомбинантного гибридного белка ESAT6-CFP10-Ag85A-Rv2660c, заключается в обработке клеток лизирующим буфером с лизоцимом, разрушающим клеточную стенку Е. coli, и ультразвуком. Лизирующий буфер позволял поддерживать стабильную слабощелочную среду, поскольку при разрушении клеток в раствор выходит их содержимое, снижающее рН. Для лизиса продуцентов использовали лизирующий буфер следующего состава: 20 мМ Трис рН 8.8, 0,1% Тритон Х-100, 5 мМ ЭДТА, 200 мкМ ФМСФ (фенил-метил-сульфонил-флуорид). В зависимости от количества биомассы, исходя из соотношения 1 г клеток в 20 мл лизирующего буфера.
Нуклеиновые кислоты клеток, высвобождающиеся при лизисе, делают суспензию более вязкой, поэтому пробы обрабатывали ультразвуком на ультразвуковом дезинтеграторе в следующем режиме: 5 с. озвучивание - 5 с., пауза на протяжении 30 минут при амплитуде 40%. Этот способ лизиса может быть использован в дальнейшем при масштабировании процесса и промышленной очистке белков.
Суспензию клеток в лизирующем буфере пропускали через лабораторный клеточный сепаратор при давлении 1500 Psi, после чего центрифугировали лизат в течение 20 мин при 15000 g при температуре (9±1)°С. Полученный осадок после центрифугирования трижды промывали лизирующим буфером, каждый раз осадок телец включений разбивали ультразвуком и осаждали центрифугированием в течение 20 мин при 15000 g при температуре (9±1)°С. Полученный осадок растворяли в растворе следующего состава: 8 М Мочевина, 20 мМ Трис рН 8.8, 5 мМ β-меркаптоэтанол, 0,1% Тритон Х-100, 10 мМ Имидазол и пропускали под давлением через фильтрующую насадку с фильтром из ПВДФ и порами диаметром 0,22 мкм для стерилизации раствора (Фиг. 2).
1.4. Металл-хелатная аффинная хроматография
В аминокислотную последовательность полипептида гибридного белка ESAT6-CFP10-Ag85A-Rv2660c была включена последовательность 8His (аффинная к двухвалентным металлам), поэтому, для очистки гибридного белка возможно применение металл-хелатной аффинной хроматографии (МХАХ).
В металл-хелатной аффинной хроматографии используется свойство белковых доменов с определенными аминокислотными последовательностями связываться с ионами металлов, таких как Cu2+, Zn2+, Ni2+, Со2+, Fe2+. Специфическое связывание осуществляется за счет наличия на поверхности белка свободных электронодонорных групп. В условиях металл-хелатной хроматографии (нейтральные значения рН и высокие концентрации соли) в качестве потенциальных лигандов в белке могут выступать имидазольная группа гистидина (pK ~ 6,7), тиольная группа цистеина (pK ~ 8,5) и индольная группа триптофана (pK ~ 9,41). В определенных условиях в подобных взаимодействиях могут принимать участие С-концевые аминокислоты (pK ~ 7,7), а также остатки аспарагиновой и глутаминовой кислот (pK ~ 3,9). По прочности образуемых комплексов эти аминокислоты располагаются в ряду: His, Cys>Asp, Glu>> другие аминокислоты. Наличие остатков гистидина на поверхности белковой молекулы является необходимым и достаточным условием для ее сорбции на хелатирующем сорбенте: сорбция требует наличия как минимум двух близко расположенных остатков гистидина, которые могут быть сближены как в первичной, так и в третичной структуре белка.
Сорбенты для МХАХ заряжены ионами двухвалентных металлов, обычно Ni2+. Ионы двухвалентных металлов специфично связываются с белками, содержащими полигистидиновый таг (обычно 6His-таг), как растворимыми, так и изначально нерастворимыми, но растворенными в денатурирующих условиях. Успешная очистка с помощью металл-хелатной хроматографии дает высокий выход активного белка, возможен рефолдинг белка, иммобилизованного на аффинном сорбенте. Тем не менее, в связи с тем, что многие белки имеют в своей природной последовательности остатки гистидина и/или цистеина, они могут связываться с металл-хелатным сорбентом так же, как и белок, имеющий His-таг. В таких случаях часто необходимо подбирать условия сорбции белка, промывки и элюции для того, чтобы элюировать целевой белок как можно более чистым. В частности, увеличение концентрации имидазола при сорбции целевых белков позволяет уменьшить количество адсорбированных примесей. Поэтому при выделении рекомбинантного гибридного белка была использована буферная система имидазол-HCl с концентрацией имидазола 20 мМ, рН 8,0. Связывание белка на металл-хелатном сорбенте обычно происходит в интервале рН 5,5-8,5 (зависит от сорбента), но оно сильнее при щелочном рН, что обусловливает наш выбор рН. В буферные растворы для МХАХ добавляют NaCl до концентрации 0,15-0,5 М для того, чтобы увеличить ионную силу раствора белка и минимизировать неспецифические ионные взаимодействия с аффинной матрицей. Присутствие детергентов и денатурирующих агентов обычно не влияет на сорбцию белков.
Для удерживания иона металла на поверхности аффинного сорбента широко распространены следующие хелатирующие группы: иминодиацетат (IDA от англ. iminodiacetate), нитрилоуксусная кислота (NTA от англ. nitrilotriaceticacid), карбоксиметиласпартат (CM-Asp от англ. carboxymethylaspartate), трис(карбоксиметил)этилендиамин (TED от англ. Tris(carboxymethyl) ethylendiamin). Данные группы образуют различные по числу и качеству координационные связи с ионами двухвалентных металлов. Ионы имеют различные размеры, и от этого зависит возможность образования связей для каждой отдельной хелатирующей группы. Так, IDA образует две связи с ионом двухвалентного металла, NTA - 3, CM-Asp - 4, TED - 5. В нашей работе для металл-хелатной хроматографии использован Ni-содержащий сорбент WorkBeads 40 Ni с хелатирующей группой иминодиацетата (IDA).
Элюировать белок с металл-хелатного сорбента можно по-разному:
- имидазолом, гистидином или другими веществами, которые имеют сродство к хелатированным ионам металла.
- понизив рН (линейно или ступеньками). Большинство белков элюируются в интервале рН от 6 до 4.
- хелатирующими агентами, такими как этилендиаминтетрауксусная кислота (ЭДТА) и этиленгликольтетрауксусная кислота (ЭГТА). Эти вещества связывают ионы металла и вызывают тем самым элюцию белков. В этом случае разделения белков по сродству к ионам двухвалентных металлов не произойдет.
Первый способ элюции наиболее специфичен и поэтому предпочтительнее других.
Для очистки гибридного белка ESAT6-CFP10-Ag85A-Rv2660c подготавливалась хроматографическая колонка из расчета 1 мл хроматографического сорбента Ni Sepharose High Performance (GE, США) на каждые 20 мл клеточного лизата, сорбент упаковывался в цилиндрические колонки диаметром 1,5-5 см, объемом 35-100 мл под давлением 30 psi, после чего уравновешивается 15 объемами Буферного раствора состава: 8 М Мочевина, 20 мМ Трис рН 8.8, 5 мМ β-меркаптоэтанол, 0,2 мМ ФМСФ, 0,1% Тритон Х-100, на скорости 1-4 мл/мин.
Раствор осадка в буферном растворе с мочевиной, полученный на этапе лизиса клеток-продуцента наносили на предварительно уравновешенную колонку с Ni-Sepharose High Performance (GE, США) на скорости 1 мл/мин.
Колонку промывали 10-15 объемами колонки Буферным раствором состава: 8 М Мочевина, 20 мМ Трис рН 8.8, 5 мМ β-меркаптоэтанол, 0,2 мМ ФМСФ, 0,1% Тритон Х-100, на скорости 2- 4 мл/мин с ограничением давления 15 psi, контролируя при этом оптическую плотность (OD) 220 нм, 260 нм, 280 нм, 320 нм, промывку колонки завершали при снижении OD по вышеуказанным длинам волн к базовой линии. На стадии нагрузки на колонку рекомбинантный гибридный белок связывался с сорбентом (неподвижной фазой колонки), а не связавшиеся примеси вымывались с подвижной фазой. Наличие примесей обнаруживали по первому пику на хроматограмме (Фиг. 3).
После промывки колонки от неспецифически связавшихся примесей переводят хроматографию в неденатурирующие условия: запускают градиент в Буферный раствор состава: 20 мМ Трис рН 8.8, 5 мМ β-меркаптоэтанол, 0,1% Тритон Х-100, 10 мМ Имидазол, градиент составляет 15 объемов колонки на скорости потока 1 мл/ мин.
Элюцию проводят Буферным раствором состава: 20 мМ Трис рН 8.8, 5 мМ β-меркаптоэтанол, 0,1% Тритон Х-100, 500 мМ Имидазол, на скорости потока 1 мл/мин, собирали элюат и проводили последующий электрофоретический анализ белкового состава фракций элюата (Фиг. 4).
Фракции, содержащие гибридный белок рекомбинантных микобактериальных антигенов, объединяли и трижды диализовали против 500-кратного избытка раствора 20 мМ Трис рН 8.8, 5 мМ β-меркаптоэтанол тремя сериями по 4-12 часов для удаления имидазола и мочевины (Фиг. 5).
Выход белка ESAT6-CFP10-Ag85A-Rv2660c в процессе очистки по разработанной технологии составил 1,5 мг из 1 г биомассы клеток продуцента.
1.5. Стерилизующая фильтрация При стерилизации путем фильтрации происходит удаление любых частиц (включая микроорганизмы), размеры которых превышают пороговое значение пропускания фильтра. В результате конечный продукт не содержит жизнеспособных патогенных или других микроорганизмов. Фильтрация проводилась продавливанием через мембранный фильтр из полиэфирсульфона с диаметром пор 0,22 мкм (одноразовая стерильная система для стерилизующий фильтрации под вакуумом фирмы «Corning», США) в стерильном боксе. По измерению оптической плотности растворов белков при 280 нм была проведена оценка количественных потерь при фильтрации. Она составила 10-20%.
Полученный после диализа препарат фильтровали через фильтр ПВДФ с диаметром пор 0,22 мкм, оценивали концентрацию белковой составляющей, и гомогенность препарата, проводят исследование содержания эндотоксинов (LAL-тест) и разливают в герметично закрывающиеся полипропиленовые пробирки.
ПРИМЕР 2.
Упаковка антигенов и молекулярных адъювантов в наноразмерные частицы поли(молочной-ко-гликолевой) кислоты (PLGA)
Одним из наиболее часто используемых носителей для вакцин является биоразлагемый полимер PLGA, состоящий из сополимеризованных остатков молочной и гликолевой кислот. PLGA широко используют при создании материалов для имплантатов, протезов, хирургических инструментов. При попадании в организм частиц поли(лактид-со-гликолида) происходит гидролиз сополимера молочной и гликолевой кислот с образованием биологически совместимых и участвующих в обмене веществ молекул молочной и гликолевой кислот, которые, в конечном счете, выводятся из организма посредством цикла Кребса. Кроме химической структуры полимера при создании конкретной вакцины следует учитывать, что на взаимодействие наночастиц с иммунной системой влияют их физические параметры: размер, поверхностный заряд, гидрофобность/гидрофильность. В результате, меняя материал частиц и модифицируя их поверхность можно добиться необходимого влияния на иммунный ответ. Было показано, что микрочастицы с инкапсулированным поверхностным антигеном вируса гепатита В (HBsAg) диаметром 2-8 мкм садятся на поверхность макрофагов и вызывают длительную и сильную выработку антител. Кроме того, они стимулируют выработку интерлейкина-4 - цитокина, характерного для гуморального Th2-иммунного ответа - и синтез молекул МНС II. С другой стороны, наночастицы размером 100-600 нм эффективно поглощаются макрофагами и приводят к меньшей выработке антител, в то же время стимулируя синтез МНС I и характерного для клеточного Th1-ответа ИНФ-γ.
В этой связи для формуляции ГЛФ вакцины ЛТБвак именно PLGA был выбран в качестве носителя. Эксперименты по окончательной отработке технологического процесса получения микрочастиц PLGA с упакованными в них компонентами вакцины для профилактики туберкулеза включали проведение иммобилизации антигенных компонентов лекарственного средства в микрочастицах PLGA в трех разных вариантах смешения. Проверяли размер частиц PLGA, концентрацию антигена, инкорпорированного в наноразмерные частицы, измеряли количества агонистов паттерн-распознающих рецепторов в наноразмерных частицах.
Особенности разработанных технологических процессов описаны ниже.
Антигены и агонисты растворяли в фосфатном буферном растворе до конечных концентраций:
 белковой фармацевтической субстанции антигена 3,2 мг/мл;
белковой фармацевтической субстанции антигена 3,2 мг/мл;
 олигонуклеотид CpG 2 мг/мл;
олигонуклеотид CpG 2 мг/мл;
 МДП 2,5 мг/мл (водная фаза -W1)
МДП 2,5 мг/мл (водная фаза -W1)
После чего готовили 2% раствор PLGA (75:25) в этилацетате (масляная фаза - О) и готовили 10% раствор ПВС в воде mQ (водная фаза - W2). Для приготовления первичной эмульсии (W1/О) к раствору PLGA вносили 50 мкл (I формуляция), 500 мкл (II формуляция), или 1000 мкл (III формуляция) раствора антигена и агонистов. Затем эмульгировали с использованием ультразвуковой установки (Branson Sonifer) в течение 30 секунд. Для получения двойной эмульсии (W1/O/W2) к первичной эмульсии вносили раствор 10% поливинилового спирта. Затем повторно озвучивали с использованием ультразвуковой установки (Branson Sonifer) в течение 60 секунд. Полученную двойную эмульсию переносили в стерильные стаканы, закрывали фольгой и помещали на магнитную мешалку на ночь при комнатной температуре, при постоянном помешивании.
Для осаждения макрочастиц, полученную формуляцию центрифугировали при 2000 g, 30 мин, 4°С. Для избавления от ПВС надосадок 5 раз промывали водой, каждый раз частицы осаждали центрифугированием при 10000 об/мин, 4°С, в течение 60 минут.
Измерение размера частиц поли(молочной-ко-гликолевой) кислоты
Размер частиц определяли при помощи наносайзера Zetasizer Nano ZS (Malvern). Для прибора Zetasizer Nano ZS PLGA частицы разводили до концентрации 100 мкг/мл в воде milliQ. Затем 1 мл частиц перенести в кювету для измерения. Кювету помещали в прибор. Измерение и обсчет результатов производили с использование программного обеспечения Zetasizer Software (таблица 4).
Средний размер частиц PLGA с инкапсулированными антигенами составляет 126 нм и находится в пределах допустимых значений (100 нм - 200 нм), необходимых для доставки антигенов внутрь фагоцитов.
Измерение количества антигена, инкорпорированного в наноразмерные частицы
Концентрацию антигена на 1 мг наноразмерных частиц PLGA (таблица 5) определяли высокочувствительным и высокоспецифичным
иммунодиагностическим методом гетерогенного твердофазного
иммуноферментного анализа (ГФ XIII, ОФС.1.7.2.0033.15). Для построения калибровочной кривой были приготовлены стандартные растворы гибридного белка ESAT6-CFP10-Ag85A-Rv2660c в концентрациях от 0,19 мкг/мл до 50 мкг/мл. Проводили иммуноферментное определение содержания гибридного белка ESAT6-CFP10-Ag85A-Rv2660cB серии разведений стандартного образца. Все измерения проводились в трех технических повторностях. Измерение оптической плотности проводят с помощью планшетного спектрофотометра в двухволновом режиме: основной фильтр - 450 нм, референс-фильтр - в диапазоне 620-655 нм.
Измерение количества агонистов паттерн-распознающих рецепторов, инкорпорированных в наноразмерные частицы
Концентрация агонистов паттерн-распознающих рецепторов (ПРР), интернализованных в наноразмерные частицы определяли с' использованием репортерных клеточных линий HEK293-NOD2 и HEK293-TLR9, которые экспрессируют на своей поверхности индивидуальные ПРР - NOD2 и TLR9, соответственно. Данные клеточные линии несут ген NF-kB/AP-1 - зависимой щелочной фосфатазы (репортерный ген). Для количественного определения инкорпорированных агонистов строили калибровочную кривую, используя соответствующие агонисты (МДП или CpG, соответственно), в исходной концентрации от 1 мг/мл до 1 мкг/мл, а также готовятся разведения исследуемых образцов (после лизиса в 0,1н NaOH) от 1 мг/мл до 100 мкг/мл, с двукратным шагом. Образцы и контроли вносили по 10 мкл, в лунки 96 -луночного планшета с 24 часовой культурой клеток HEK293-NOD2 или HEK293-hTLR4-CD14. На следующий день после внесения образцов производили измерение уровня ферментативной активности репортерного гена щелочной фосфатазы колориметрическим методом, определяя скорость расщепления бесцветного субстрата нитрофенилфосфата динатриевой соли в окрашенный в желтый цвет -пара-нитрофенол. Для этого свежеприготовленный раствор субстрата в SEAP-буфере (0,5М NaHCO3, 0,5 мМ MgCl2, рН 9,8), разносили по 150 мкл в каждую лунку нового 96 луночного планшета. Затем из лунок планшета, в котором инкубировались клетки с исследуемыми образцами паттерн-распознающих рецепторов, отбирали по 50 мкл культуральной среды и переносили в лунки планшета с буфером для измерения SEAP. Сразу, после переноса среды со всех образцов, измерили оптической плотности раствора при длине волны 405 нм (OD1). Далее планшет инкубировали при +37°С в термостате, в течение 10-60 минут (время зависит от скорости окраски раствора). После чего, замеряли оптическую плотность (OD2). Уровень активности щелочной фосфатазы рассчитывали по формуле где ЕА - единицы активности щелочной фосфотазы, OD0 - оптическая плотность первого измерения, OD1 - оптическая плотность последнего измерения, Т0 - время первого измерения, Т1 - время последнего измерения.
Результат количества молекулярного адъюванта, включаемого в состав частиц PLGA, представлен в таблице 6.
ПРИМЕР 3.
Изучение специфической фармакологической активности in vivo вакцины ЛТБвак
Самкам и самцам мышей (гибриды F1 BALB/c х C57BL/6), предварительно иммунизированным живой вакциной БЦЖ в дозе 5×106 КОЕ/животное (на день 0 исследования), в разных дозах (5,0 и 0,5 мкг/дозу по содержанию вакцинного микобактериального антигена) вводился тестируемый препарат - вакцина ЛТБвак. Первая иммунизация была проведена подкожно на третьей неделе, объем введения - 0,2 мл/ животное (при сохранении количества вводимого препарата ЛТБвак 5 мкг и 0,5 мкг), вторая иммунизация - интраназально на пятой неделе исследования, объем введения - 0,02 мл/животное (аналогично с сохранением количества ЛТБвак 5 мкг и 0,5 мкг). Препаратом сравнения выступал Адъювант, входящий в состав вакцины, вводимый в эквивалентных объемах и дозах. В качестве контрольных препаратов был использован физраствор (0,9% раствор NaCl) и препарат вакцины БЦЖ.
При изучении специфической фармакологической активности in vivo и механизма действия вакцины ЛТБвак использовались следующие составы:
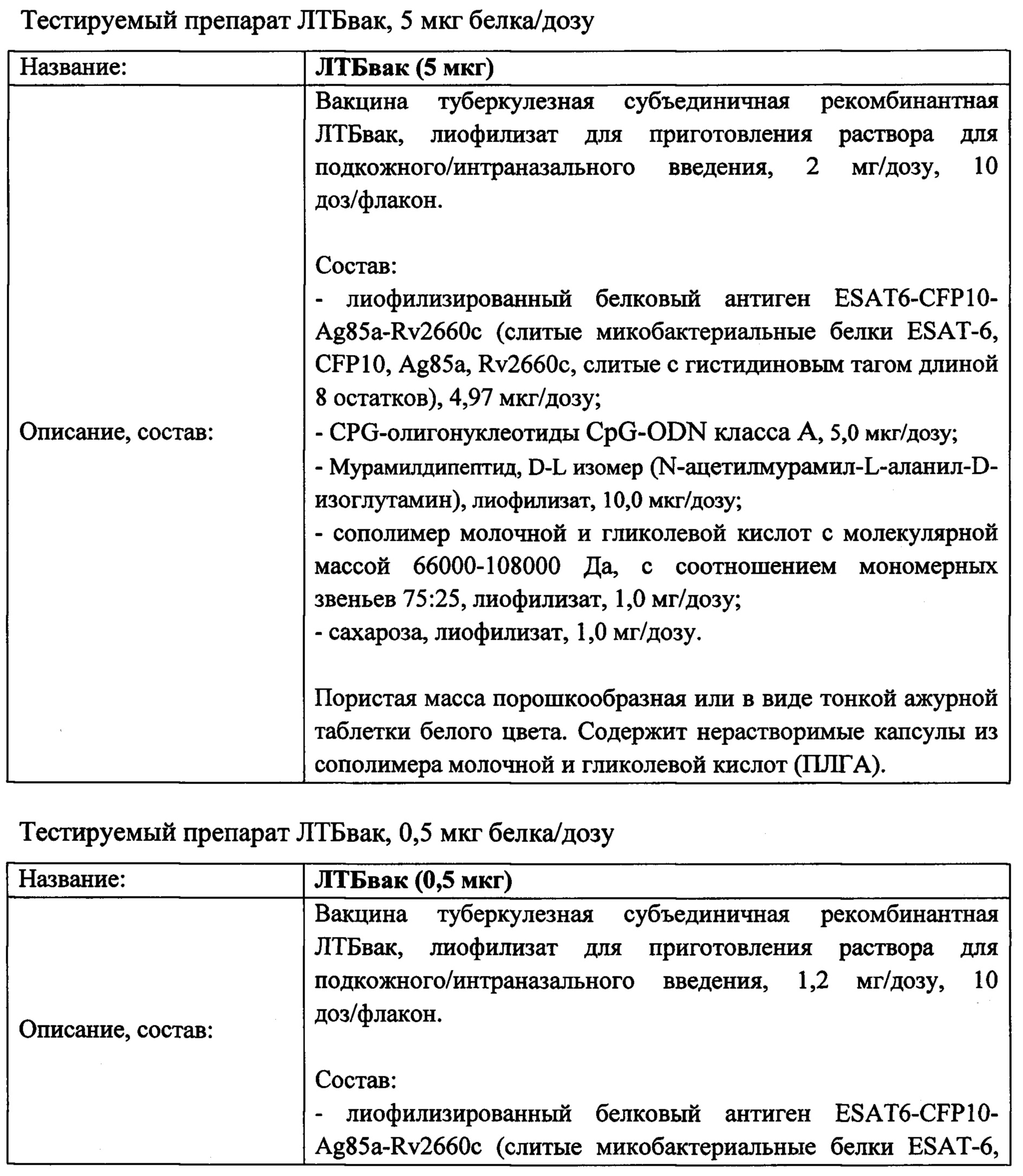



Во всех экспериментах, за исключением экспериментов по изучению специфической фармакологической активности лекарственного средства, все тестируемые препараты и препараты сравнения готовили непосредственно перед введением путем растворения в воде или физрастворе из расчета 0,5 мл растворителя на дозу введения. При этом препараты ЛТБвак (5 мкг), ЛТБвак (0,5 мкг), Адъювант растворяли в физрастворе, а препарат Антиген - в воде.
В экспериментах по изучению специфической фармакологической активности лекарственного средства препараты ЛТБвак (5 мкг) и ЛТБвак (0,5 мкг) растворяли в физрастворе в объемах, зависящих от способа иммунизации животных: 0,2 мл или 0,02 мл, с сохранением количества вводимого препарата.
ПРИМЕР 4.
Оценка активации клеточного иммунитета по уровню пролиферации Т-лимфоцитов иммунизированных мышей в ответ на стимуляцию специфическим вакцинным антигеном.
Исследовали содержание общих популяций иммунокомпетентных лимфоцитов и их основных субпопуляций при стимуляции микобактериальными антигенами, входящими в состав вакцины ЛТБвак.
Исследование пролиферирующих эффекторных (CD4+) и цитотоксических (CD8+) Т-клеток у мышей, получивших различные дозы вакцины, не показало достоверных отличий при сравнении с контрольными группами (группы 1-3) (Фиг. 7, таблица 7).
При исследовании отдельно популяции CD4+ наименее выраженным был эффект у группы 5 (ЛТБвак, содержание гибридного белка 0,5 мкг/дозу), где доля пролиферирующих CD4+ лимфоцитов составила 0,16% от общей популяции Т-лимфоцитов, в то время, как для остальных исследуемых групп это значение составило 0,50-0,76%. При этом, основной вклад в пролиферативную активность популяций во всех группах вносила стимуляция полноценным гибридным антигеном, и практически отсутствовало влияние индивидуальных антигенов ESAT-6, CFP10 и Rv2660c (Фиг. 7, верхняя часть, таблица 7).
Для популяции цитотоксических CD8+ Т-лимфоцитов эффект стимуляции вакцинными антигенами был более выраженным (но также статистически недостоверным в сравнениях с контрольными группами). Пролиферативная активность CD8+ Т-клеток наблюдалась в ответ на стимуляцию как гибридным белком, так и всеми вошедшими в исследование его компонентами во всех исследуемых группах. Особенно данный эффект выражен для исследуемых групп 4-5 (иммунизированных ЛТБвак в дозах, соответствующих 5 и 0,5 мкг белка, соответственно), где доля субпопуляции CD8+ достигала 1,5% от всех Т-лимфоцитов (Фиг. 7, нижняя часть, таблица 7).
Таким образом, на основе результатов, полученных методом оценки лимфопролиферации, можно заключить, что введение препарата ЛТБвак в дозе, эквивалентной 5 мкг вакцинного белка вызывает максимальный иммуногенный эффект.
ПРИМЕР 5.
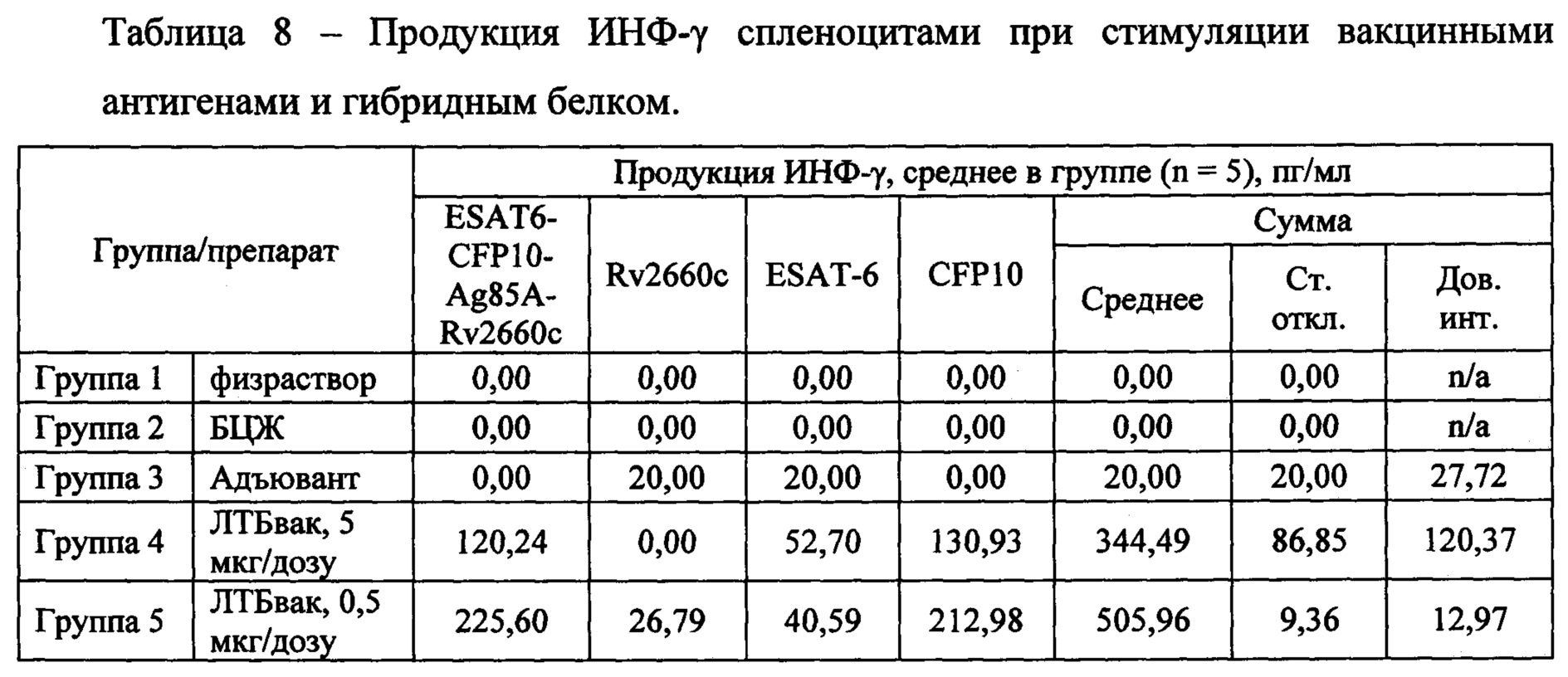
Оценка активации клеточного иммунитета по уровню продукции ИНФ-у лимфоцитами (спленоцитами) иммунизированных мышей в ответ на стимуляцию специфическим вакцинным антигеном.
Через 10 недель после начала исследования (по прошествии 5 недель после второго введения вакцины ЛТБвак, необходимых для формирования иммунитета), по 5 животных в каждой группе были подвергнуты эвтаназии с последующим забором биоматериала (кровь, спленоциты и т.д.) для определения иммуногенности. Была проведена оценка продукции ИНФ-у лимфоцитами (спленоцитами) иммунизированных мышей в ответ на стимуляцию вакцинным гибридным антигеном ESAT6-CFP10-Ag85a-Rv2660c, входящими в состав вакцины (и его отдельными компонентами) в тесте IGRA. Для этого, в полученных супернатантах методом ИФА было проведено исследование уровня ИНФ-γ с использованием коммерческого набора IFN gamma Mouse ELISA Kit (eBioscience, США).
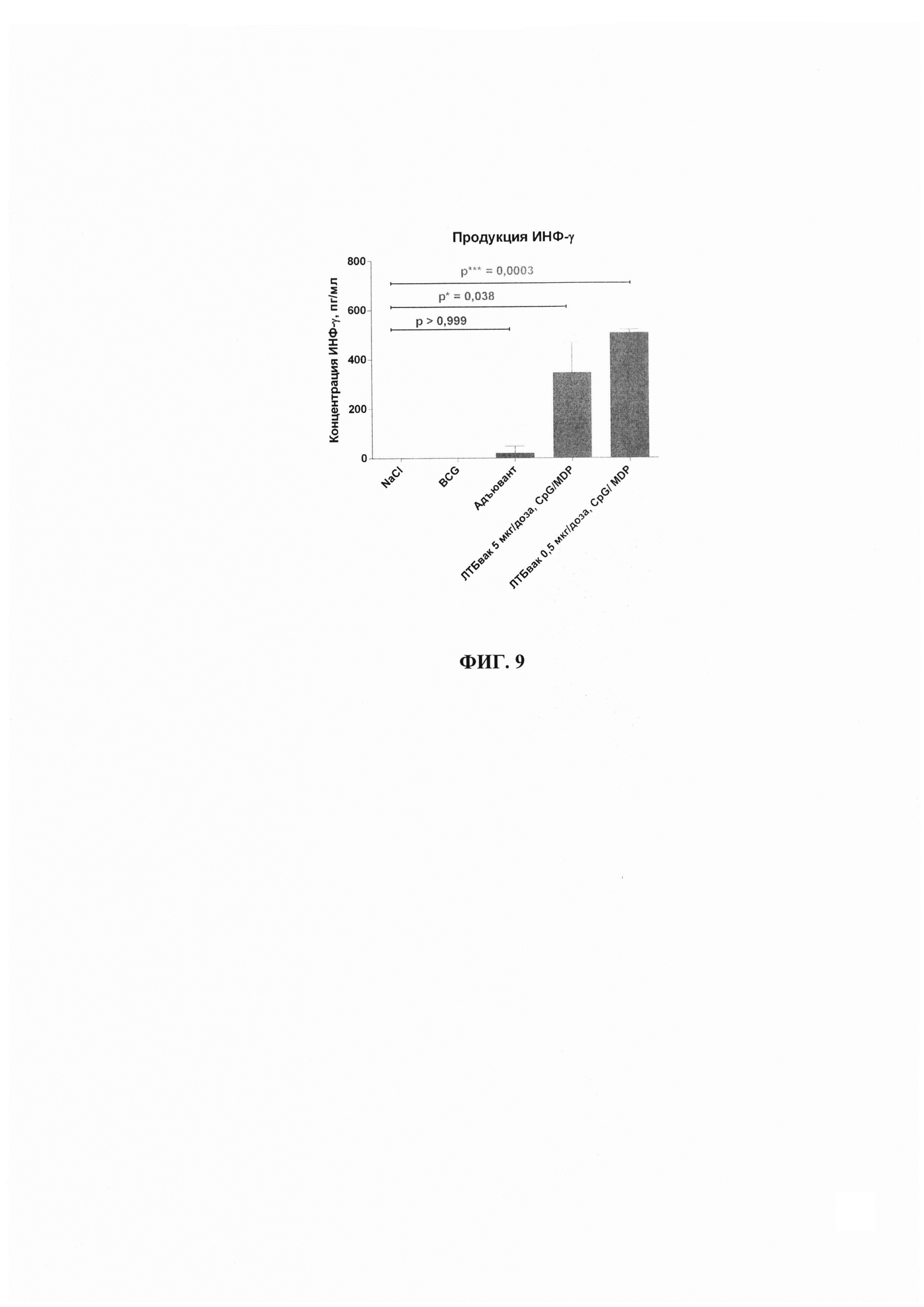
Для сравнения результатов в группах исследования по значениям показателей использованы методы непараметрической статистики, так как объемы групп попадают под определение малых выборок. Для оценки достоверности различий применялся однофакторный дисперсионный анализ (one-way ANOVA) и расчет критерия Краскелла-Уоллеса с поправкой Данна для множественных сравнений нескольких и множественных сравнений с контрольной группой (группы 1-3, получавшие физраствор, БЦЖ или Адъювант соответственно, таблица 8). Различия считали значимыми при р<0,05.
Полученные количественные данные представлены в виде среднего с указанием +/- стандартного отклонения. На фиг. 8, 9 уровень значимости различий представлен в виде символов: «*» - р<0,05; «***» - р<0,001 разного цвета. Зеленым показаны достоверные отличия, красным - отсутствие достоверных отличий между группами.
Активация неспецифическим митогеном - фитогемагглютинином показала, что все экспериментальные группы сохраняют митогенетический потенциал и отвечают на воздействие активным выбросом в супернатант ИНФ-γ. Было показано, что гибридный антиген, и отдельные компоненты, входящие в его состав, способны активировать выработку цитокина и вносят вклад в формирование клеточного иммунитета при иммунизации ЛТБвак (Фиг. 8). Видно, что все группы иммунизированных животных показывают достоверное повышение секреции ИНФ-γ. Однако, в зависимости от групп результаты стимуляции продукции интерферона различались.
Достоверное увеличение продукции ИНФ-γ спленоцитами в ответ на стимуляцию антигенами, относительно контрольных групп показано для практически всех исследуемых антигенов, входящих в состав тестируемых вакцинных препаратов, вне зависимости от получаемой дозы (Фиг. 8, 9, таблица 8). Исключение составляет стимуляция антигеном Rv2660c в группе 4.
При стимуляции спленоцитов мышей исследуемых групп гибридным белком, продемонстрирован существенный уровень продукции ИНФ-γ при полном отсутствии такового в двух контрольных группах (группы 1 и 2) и отсутствии или значительно сниженном уровне продукции в группе Адъюванта (группа 3) (Фиг. 8, Г). При этом, очевидно, что наибольший вклад в иммунный ответ вносят, по всей видимости, эпитопы белка CFP10 (Фиг. 8, Б), в то время как антигены ESAT6 и Rv2660c в меньшей степени влияют на формирование иммунного клеточного ответа при вакцинации (Фиг. 8, А, В). Для группы 4 (ЛТБвак 5 мкг/дозу, CpG + МДП) вклад в формирование клеточного иммунного ответа вносит также антиген ESAT6. Наибольшая концентрация ИНФ-γ отмечалась в группе 5 (ЛТБвак 0,5 мкг/дозу, CpG+МДП).
При этом, если оценивать суммарный уровень ответа на стимуляцию вакцинными антигенами спленоцитов, статистически значимых различий между исследуемыми группами 4 и 5, получавшими препарат ЛТБвак в разных дозировках, не наблюдается (Фиг. 9, таблица 8). Стоит обратить внимание, что группы 4 и 5 показывают достоверные отличия в активации секреции ИНФ-γ по сравнению с адъювантом (в группах, получавших препарат, средние значения секреции ИНФ-γ в 17-25 раз выше, чем в группе «Адъювант», не говоря уже о двух остальных контрольных группах, в которых специфическая секреция ИНФ-γ была нулевой (Фиг. 9, таблица 8). Это говорит о том, что антигены в составе вакцины вносят статистически достоверный вклад в иммуногенность вакцинной композиции.
Поскольку профиль клеточного ответа при стимуляции вакцинными антигенами (как гибридным белком, так и индивидуальными антигенами, входящими в его состав) очень близок у двух исследуемых групп (группы 4 и 5), обе формуляции могут быть использованы при дальнейшей разработке вакцины.
В совокупности приведенные данные показывают, что при иммунизации ЛТБвак происходит формирование клеточного ответа, в том числе за счет образования специфических субпопуляций CD4+ и CD8+, способных продуцировать значимый уровень ИНФ-γ - основного маркера протективного иммунитета против туберкулеза, установленного на сегодняшний день.
ПРИМЕР 6.
Оценка активации гуморального иммунного ответа по увеличению титра антител класса G, специфичных к компонентам разрабатываемой вакцины ЛТБвак
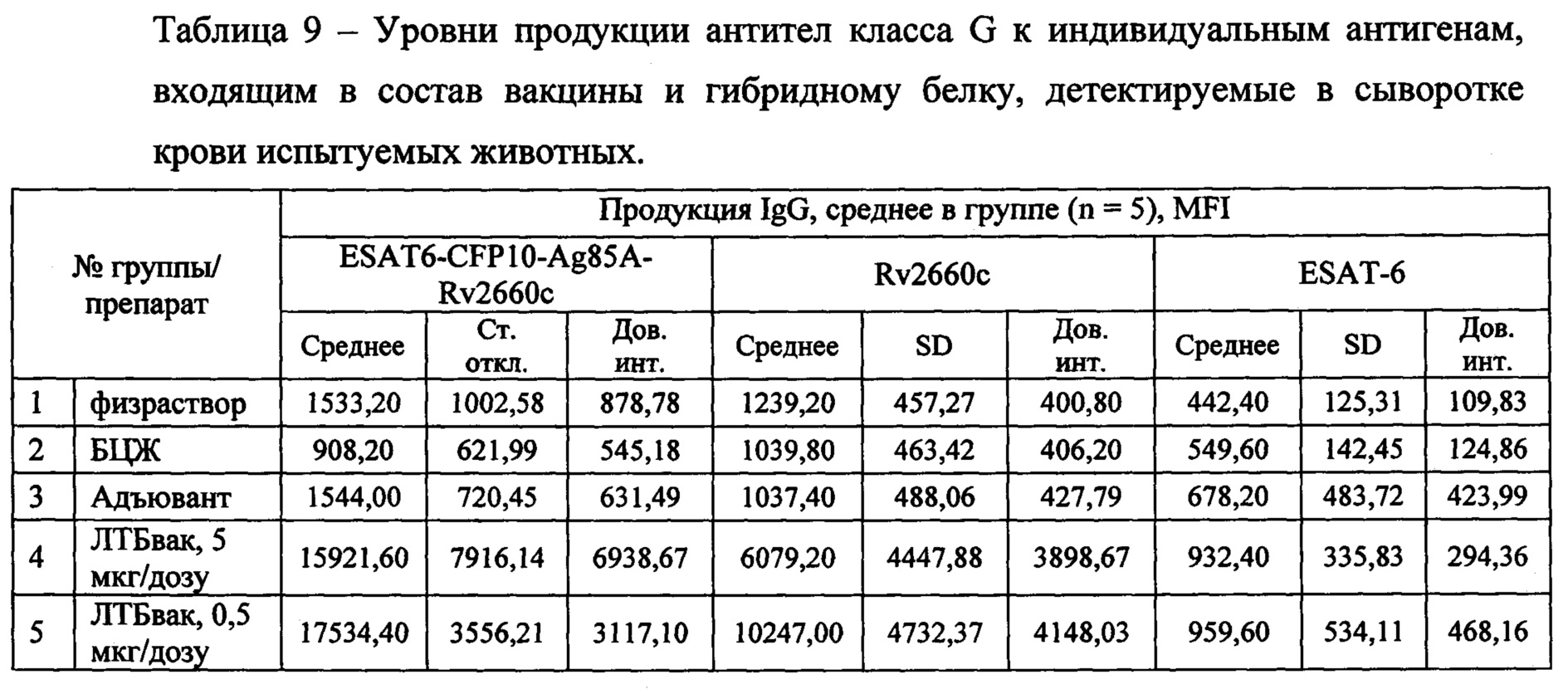
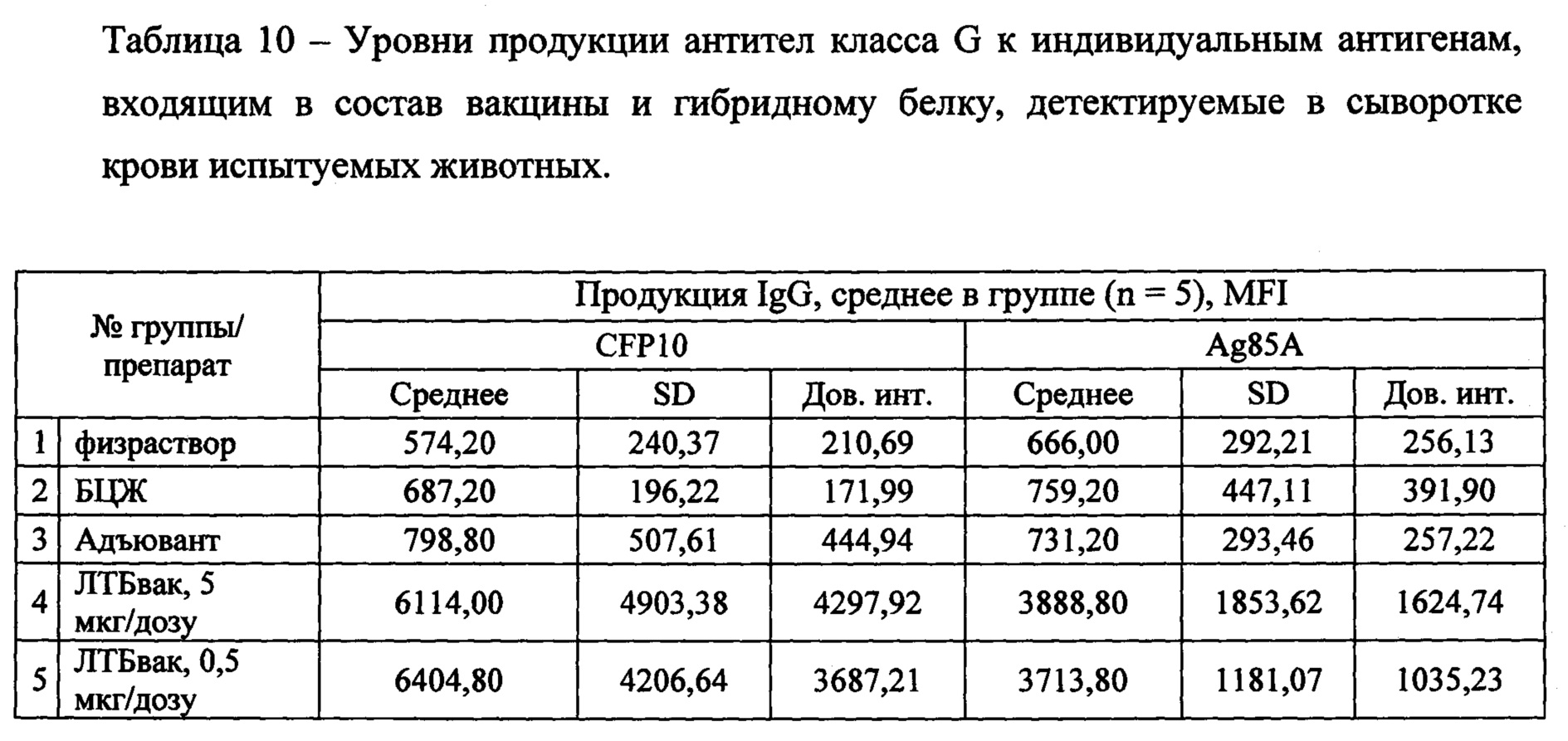
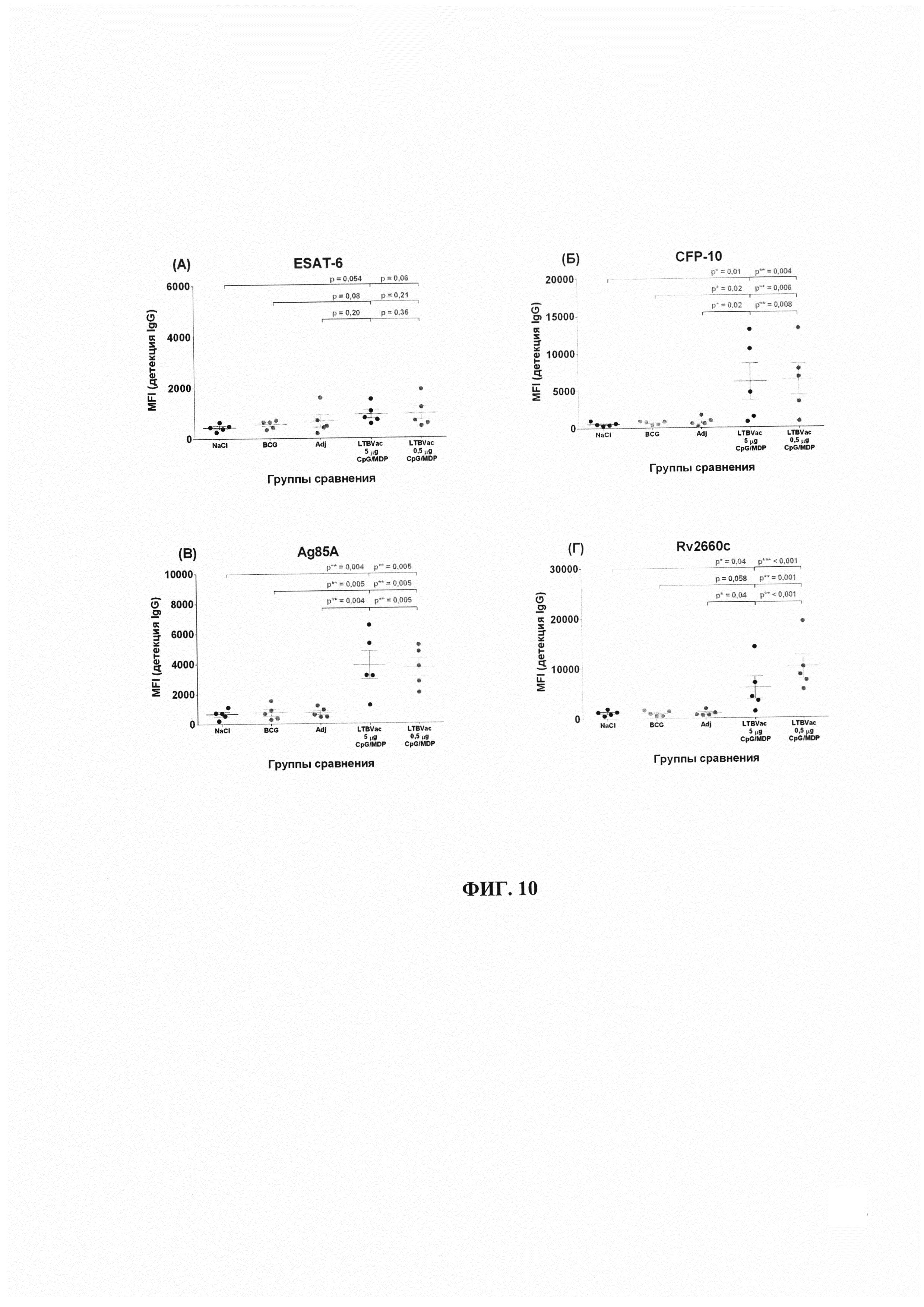
При изучении контрольных групп показано, что неспецифические антительные реакции в ответ на введение растворов и адъювантов, включенных в вакцину, отсутствуют (таблица 9, 10). Как видно на Фиг. 10, в сыворотках контрольных групп не происходит нарастания титра специфичных к гибридному антигену или его индивидуальным компонентам антител.
Изучение динамики накопления в сыворотке крови животных антител класса G к пептидам, входящим в состав антигенного гибридного белка, показало, что три из четырех пептидов с высокой степенью достоверности индуцируют выработку антител - CFP10, Ag85A, Rv2660c (Фиг. 10, таблица 9, 10). Пептид ESAT6 не оказывал никакого влияния на гуморальный иммунный ответ - достоверного повышения уровня антител относительно контрольных групп не было выявлено ни для одного из вариантов иммунизации животных (Фиг. 10A).
Остальные компоненты гибридного белка CFP10, Ag85A и Rv2660c по результатам исследования могут быть признаны равнозначно и положительно влияющими на выработку гуморального иммунного ответа (р<0,01). Этот вывод подтверждается достоверно высокими уровнями IgG во всех трех группах иммунизированных животных с некоторым допущением в отношении Rv2660c в группе 4 (5 мкг/мл CpG+МДП) (Фиг. 10Г). Однако обращает на себя внимание в целом характерная для серодиагностики туберкулеза определенная гетерогенность результатов, когда, например, для CFP10 значения IgG в сыворотках крови трех из 10 мышей не отличаются от значений в контрольных группах, а у остальных они расположились в достаточно широком диапазоне MFI (Фиг. 10Б).
Для гибридного белка ESAT6-CFP10-Ag85A-Rv2660 показано наличие достоверного гуморального ответа во всех исследуемых группах (Группы 4-5) по сравнению с контрольными группами (Группы 1-3) (Фиг. 11). Среднее значение MFI для исследуемых групп ЛТБвак 5 мкг и 0,5 мкг составляло около 16000 и 17500 единиц соответственно, что более чем в 10 раз превышает аналогичные значения во всех контрольных группах (таблица 9, 10). Стоит отметить, что для индивидуальных антигенов гуморальный ответ в целом был менее выражен, по сравнению с гибридным белком. При этом описанная выше для пептидных компонентов гибридного белка гетерогенность уровня гуморального ответа в данном случае значительно менее выражена - один случай на пятнадцать испытуемых животных. Для группы 5 (ЛТБвак 0,5 мкг/мл, CpG+МДП) значения можно описать как выраженные и компактно расположенные. Подобные отличия гетерогенности ответов могут быть связаны с частичным синергическим эффектом эпитопов гибридного белка по сравнению с индивидуальными антигенами, входящими в его состав. В данном случае эти результаты свидетельствуют в пользу применения в составе вакцины не индивидуальных антигенов, а цельнослитого гибридного белка, способного обеспечить однородный устойчивый высокий уровень иммунного ответа гуморального звена.
ПРИМЕР 7.
Оценка параметров протективности вакцины
Аэрозольное распыление М. tuberculosis проводили на 10 неделе эксперимента в количестве 50-100 КОЕ.
Поскольку защитное действия вакцины обуславливается подавлением размножения М. tuberculosis в органах-мишенях, на 11 и 15 неделях была произведена вторая и третья эвтаназии животных (по 6 животных в каждой группе). У животных отобраны органы-мишени (селезенка и легкие) для проведения бактериологических высевов и оценки присутствия в них М. tuberculosis. Результаты высевов на 11 неделю проводили для контроля инфицирования животных.
Было показано, что концентрация бактерий в легких на 11 неделю во всех группах одинакова, не отличается достоверно и составляет от 65 до 135 КОЕ/мл.
Высевы гомогенатов селезенок не показали присутствие бактерий, за исключением контрольной группы ОКО (Фиг. 12). Таким образом, можно утверждать, что инфицирование животных произошло во всех исследуемых группах, при этом его эффективность носила идентичный характер.
В высевах органов животных после третьей эвтаназии (15 неделя) бактерии обнаружены как в легких, так и в селезенке, при этом наблюдались достоверные отличия в концентрациях бактерий в экспериментальных группах: минимальное значение обсемененности обоих органов-мишеней наблюдалось в группах 4 и 5 (ЛТБвак 5 мкг/дозу, CpG+МДП и ЛТБвак 0,5 мкг/мл, CpG+МДП) и составило в среднем 729 и 15 КОЕ/мл для легкого и 1902,7, и 5958,3 КОЕ/мл для селезенки соответственно (Фиг. 13). Группа 3 (Адъювант ЛТБвак) не показала достоверных отличий от контрольной группы 1, что свидетельствует об эффективности именно формуляции вакцины, содержащей гибридный белок.
Таким образом, по результатам проведенных исследований показано, что при иммунизации вакциной ЛТБвак происходит достоверное снижение обсемененности органов-мишеней при инфицировании животных М. tuberculosis. Наблюдение за животными, гистологические и бактериологические исследования позволили оценить действие вакцины как протективное. При этом показано, что максимальное действие вакцины проявляется при концентрации белка 5 мкг/дозу (аналогично иммуногенному воздействию).
Выводы изучении специфической фармакологической активности in vivo По итогам проведенного доклинического исследования показано, что вакцина ЛТБвак обладает выраженной специфической фармакологической активностью в виде иммуногенного и протективного воздействия на организм экспериментальных животных при двукратном введении с промежутком 8 недель. При этом выраженный эффект достигается в дозировке, эквивалентной 5 мкг вакцинного белка на дозу.
При оценке клеточного иммунного ответа в IGRA-тесте (стимуляции спленоцитов мышей экспериментальных групп гибридным белком), продемонстрирован существенный уровень продукции ИНФ-γ в группах, получавших вакцину ЛТБвак в дозе 5 и 0,5 мкг, при полном отсутствии такового в двух контрольных группах, получавших БЦЖ или физраствор, и значительно сниженном уровне продукции в группе Адъюванта. Группы, получавшие вакцину, показывают достоверные отличия в секреции ИНФ-γ по сравнению со всеми тремя контрольными группами (в группах, получавших препарат, средние значения секреции ИНФ-γ в ответ на стимуляцию полным вакцинным белком ESAT6-CFP10-Ag85A-Rv2660c средние значения секреции составили 120,24 и 225,6 пг/мл ИНФ-γ для доз вакцины 5 и 0,5 мкг, что в 17-25 раз выше, чем в группе «Адъювант»; в двух остальных контрольных группах, получавших физраствор или БЦЖ, секреция ИНФ-γ была нулевой). При этом достоверной разницы в показателях между группами, получавшими тестируемый препарат ЛТБвак в разных дозах, выявлено не было.
Оценка клеточного иммунитета методом определения лимфопролиферации лимфоцитов после стимуляции вакцинными антигенами, не выявила достоверной разницы между группами, получавшими ЛТБвак и контрольные препараты. При этом наибольшие показатели лимфопролиферации отмечены в группе, получавшей ЛТБвак в дозе 5 мкг.
Оценка гуморального (антительного ответа) показала, что гибридный вакцинный белок ESAT6-CFP10-Ag85A-Rv2660 достоверно формирует гуморальный ответ во группах, получавших препарат ЛТБвак в обоих дозировках по сравнению с контрольными группами. Среднее полученное значение титров антител для исследуемых групп ЛТБвак 5 мкг и 0,5 мкг составило около 16000 и 17500 условных единиц соответственно, что более чем в 10 раз превышает аналогичные значения во всех контрольных группах.
Показано достоверное снижение бактериальной нагрузки на органы-мишени животных исследуемых групп (ЛТБвак в дозе 5 мкг и 0,5 мкг) относительно контрольных групп 1 и 3 (физраствор и Адъювант вакцины), что свидетельствует в пользу формирования протективного иммунитета у мывшей после иммунизации.
Подтверждена эффективность выбранного состава формуляции вакцины рекомбинантной субъединичной против туберкулеза ЛТБвак, а также схема введения вакцинного препарата. Показано, что при выбранном режиме иммунизации формуляция вакцины ЛТБвак с содержанием гибридного белка 5 мкг/дозу и адъюванта CpG+МДП, инкорпорированных в ПЛГА, является эффективной с точки зрения активации как клеточного (основного, с точки зрения формирования протективного иммунитета к туберкулезу, согласно современным представлениям), так и гуморального иммунитета у исследуемых животных.
Полученные данные свидетельствуют о способности исследуемого лекарственного средства - вакцины субъединичной рекомбинантной ЛТБвак к формированию специфического протективного иммунитета клеточного типа (Th1) к патогенным микроорганизмам М. tuberculosis. Использование высокоиммуногенных антигенов (рекомбинантных белков микобактерий, характерных для активной фазы течения болезни - ESAT6, CFP10, Ag85A, а также латентной фазы заболевания - Rv2660c), инкорпорированных в биодеградируемый нетоксичном полимер из поли(молочной-ко-гликолевой) кислоты (PLGA), совместно с высокоэффективным комплексным молекулярным адъювантом (представленным лигандами рецепторов системы врожденного иммунитета TLR9-CpG ODN и NOD2 - Мурамилдипептид, MDP), стимулирующим поляризацию иммунного ответа, приводит к стимуляции пролиферации CD4+ и CD8+ Т-клеток, увеличению синтеза IFN-γ, что свидетельствует об активации клеточного звена иммунитета и определяет устойчивость организма к М. tuberculosis.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1. Kaufmann, S. Н. Е., Weiner, J., von Reyn, С.F. Novel approaches to ТВ vaccine development. // International Journal of Infectious Disease. - 2016. - Vol. 56. - P. 263-267.
2. О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2016 году. Государственный доклад. - М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека, 2017. - 220 с.
3. Global tuberculosis control: WHO report 2010. World Health organization. Switzerland, Geneva. [Электронныйресурс]. - URL:http://who.int
4. WHO, Global Tuberculosis Report 2016 (21th edition). // France: World Health Organisation. - 2016. - 214 p.
5. Glaziou, P., Falzon, D., Floyd, K., Raviglione, M. Global epidemiology of tuberculosis. // Seminars in Respiratory and Critical Care Medicine. - 2013. - Vol. 34.-N. 1.-P. 3-16.
6. Abu-Raddad, L. J., Sabatelli, L., Achterberg, J. Т., Sugimoto, J. D., Longini, I. M. Jr., Dye, C, Halloran, M. E. Epidemiological benefits of more-effective tuberculosis vaccines, drugs, and diagnostics. // Proceedings of the National Academy of Sciences. - USA. - 2009. - V. 106. - P. 13980. -13985.
7. Helen, A., Fletcher, Lewis, Schrager. ТВ vaccine development and the End ТВ Strategy: importance and current status. // Transactions of The Royal Society of Tropical Medicine and Hygiene. - 2016. - V. 110. - Issue 4, 1. - P. 212-218.
8. Luca, S., Mihaescu, T. History of BCG vaccine // Medica. - 2013. - Vol. 8. - P. 53-58.
9. Colditz, G. A., Brewer, T. F., Berkey, C. S., Wilson, M. E., Burdick, E., Fineberg, H. V., Mosteller, F. Efficacy of BCG vaccine in the prevention of tuberculosis. Meta-analysis of the published literature. // JAMA. - 1994. - V. 271. - P. 698-702.
10. Hesseling, A. C, Marais, B. J., Gie, R. P., Schaaf, H. S, Fine, P. E., Godfrey-Faussett, P., Beyers, N. The risk of disseminated BacilleCalmette-Guerin (BCG) disease in HIV-infected children. // Vaccine. - 2007. - V. 25. - P. 14-18.
11. Mangtani, P., Abubakar, I., Ariti, C, Beynon, R., Pimpin, L., Fine, P. E., Rodrigues, L. C, Smith, P. G., Lipman, M., Whiting, P. F., Sterne, J. A. Protection by BCG vaccine against tuberculosis: a systematic review of randomized controlled trials. // Clinical infectious diseases: an official publication of the Infectious Diseases Society of America. - 2014. - Vol. 58. - N. 4. - P. 470-480.
12. Rowland, R., McShane, H. Tuberculosis vaccines in clinical trials. // Expert Review of Vaccines. - 2011. - Vol.10. - P. 645-658.
13. Rodrigues, L. C, Pereira, S. M., Cunha, S. S, Genser, В., Ichihara, M. Y., de Brito, S. C, Hijjar, M. A., Dourado, I., Cruz, A. A., Sant'Anna, C, Bierrenbach, A. L., Barreto, M. L. Effect of BCG revaccination on incidence of tuberculosis in school-aged children in Brazil: the BCG-REVAC cluster-randomised. // Lancet. - 2005. - Vol. 366. - N. 9493. - P. 1290-1295.
14. Ritz, N., Curtis, N. Mapping the global use of different BCG vaccine strains. // Tuberculosis. - 2009. - Vol.89. - P. 248-251.
15. Brosch, R., Gordon, S. V., Gamier, Т., Eiglmeier, K., Frigui, W., Valenti, P., Dos Santos, S., Duthoy, S., Lacroix, C, Garcia-Pelayo, C, Inwald, J. K., Golby, P., Garcia, J. N., Hewinson, R. G., Behr, M. A., Quail, M. A., Churcher, C, Barrell, B. G., Parkhill, J., Cole, S. T. Genome plasticity of BCG and impact on vaccine efficacy. // PNAS. USA. - 2007. - V. 104. - P. 5596-5601.
16. Andersen, P., Woodworm, J. S. Tuberculosis vaccines - rethinking the current paradigm. // Trends in Immunology. - 2014. - V. 35. - P. 387-395.
17. Kaufmann S. H. Tuberculosis vaccines: time to think about the next generation. // Seminars in Immunoljgy. - 2013. - V. 25. - P. 172-181.
18. Andersen, P., Kaufmann, S. H. Novel vaccination strategies against tuberculosis. // Cold Spring Harbor perspectives in medicine. - 2014. - V. 4. - P. a018523
19. Ottenhoff, Т. H. New pathways of protective and pathological host defense to mycobacteria. // Trends Microbiology. - 2012. - Vol.20. - P 419-428.
20. Розов, С.M., Попова, Н.А., Дейнеко, Е.В. Иммунитет против Mycobacteriumtuberculosis: стратегии защиты. // Успехи современной биологии. - 2016. - Т. 136. - С. 156-172.
21. Розов, С.М., Дейнеко, Е.В. Mycobacteriumtuberculosis: стратегии нападения и защиты. // Успехи современной биологии. - 2016. - Т. 136. - №1. - С. 25-40.
22. Ernst, J. D. The immunological life cycle of tuberculosis. // Nature Reviews Immunology. - 2012. - V. 12. - P. 581-591.
23. Serra-Vidal, M. M., Latorre, I., Franhen, K. L., Diaz, J., de Souza-Galvao, M. L., Casas, I., Maldonado, J., Mila, C, Solsona, J., Jimenez-Fuentes, M. A., Altet, N., Lacoma, A., Ruiz-Manzano, J., Ausina, V., Prat, C, Ottenhoff, Т. H., Dominguez, J. Immunogenicity of 60 novel latency-related antigens of Mycobacterium tuberculosis. // Frontiers in Microbiology. - 2014. - Vol.5. - P. 517-529.
24. Brennan, M. J., Thole, J. Tuberculosis vaccines: a strategic blueprint for the next decade. // Tuberculosis. - 2012. - V. 92. - Suppl. 1. - P. S6-S13.
25. Kaufmann, S. H. Future vaccination strategies against tuberculosis: thinking outside the box. // Immunity. - 2010. - V. 33. - P. 567-577.
26. Horwitz, M. A., Harth, G., Dillon, B. J., Maslesa-Galic, S. Recombinant bacillus Calmette-Guerin (BCG) vaccines expressing the Mycobacterium tuberculosis 30-kDa major secretory protein induce greater protective immunity against ТВ than conventional BCG vaccines in a highly susceptible animal model. // Proceedings of the National Academy of Sciences. USA. - 2000. - V. 97. - P. 13853-13858.
27. Ottenhoff, Т. H. M., Kaufmannm, S. H. E. Vaccines against tuberculosis: where are we and where do we need to go? // PLoS Pathogens. - 2012. - Vol. 8. - P. e1002607
28. Zvi, A., Ariel, N., Fulkerson, J, et al. Whole genome identification of Mycobacterium tuberculosis vaccine candidates by comprehensive data mining and bioinformatics analisis. // BMS Medical Genomics. - 2008. - Vol. 1. - Article 18.
29. Wang, С.C, Zhu, В., Fan, X., Gicquel, В., Zhang, Y. Systems approach to tuberculosis vaccine development. // Respirology. - 2013. - Vol.18. - N. 3. - P. 412-420.
30. Reece, S. Т., Kaufmann, S. H. Floating between the poles of pathology and protection: can we pin down the granuloma in tuberculosis? // Current Opinion in Microbiology. - 2012. - Vol. 15. - P. 63-70.
31. Guleria, I., Teitelbaum, R., McAdam, R. A., Kalpana, G., Jacobs, W.R. Jr., Bloom, B. R. Auxotrophic vaccines for tuberculosis. // Nature Medicine. - 1996. -V. 2. - P. 334-337.
32. Sambandamurthy, V. K., Derricks, C, Hsu, Т., Chen, В., Larsen, M. H., Jalapathy, К. V., Chen, M., Kim, J., Porcelli, S. A., Chan, J., Morris, S. L., Jacobs, W. R. Jr. Mycobacterium tuberculosis DeltaRDlDeltapanCD: a safe and limited replicating mutant strain that protects immunocompetent and immunocompromised mice against experimental tuberculosis. // Vaccine. - 2006. - Vol. 24. - P. 6309-6320.
33. Lee, J. S., Krause, R., Schreiber, J., Mollenkopf, H. J., Kowall, J., Stein, R., Jeon, B. Y., Kwak, J. Y., Song, M. K., Patron, J. P., Jorg, S., Roh, K., Cho, S. N., Kaufmann, S. H. Mutation in the transcriptional regulator PhoP contributes to aviralence of Mycobacterium tuberculosis H37Ra strain. // Cell Host Microbe. -2008. - V. 3. - P. 97-103.
34. Martin, C, Williams, A., Hernandez-Pando, R., Cardona, P. J., Gormley, E., Bordat, Y., Soto, C. Y., Clark, S. O., Hatch, G. J., Aguilar, D., Ausina, V., Gicquel, B. The live Mycobacterium tuberculosis phoPmutant strain is more attenuated than BCG and confers protective immunity against tuberculosis in mice and guinea pigs. // Vaccine. - 2006. - Vol. 24. - N. 17. - P. 3408-3419.
35. deBruyn, G., Garner, P. Mycobacterium vaccaeimmunotherapy for treating. // Cochrane Library. - 2010. - V. 1. - P. 1-17.
36. WHO, Tuberculosis vaccine candidates-2011. // Stop ТВ Partnership Working Group on new ТВ vaccines. // World Health Organization. - 2012. - 114 p.
37. Brodin, P., Majlessi, L., Brosch, R., Smith, D., Bancroft, G., Clark, S., Williams, A., Leclerc, C, Cole, S. T. Enhanced protection against tuberculosis by vaccination with recombinant Mycobacterium microtivaccine that induces T cell immunity against region of difference 1 antigens. // The Journal of Infectious Diseases. - 2004. - V. 190. - P. 115-122.
38. Sweeney, K. A., Dao,D. N, Goldberg, M. F., Hsu, Т., Venkataswamy, M. M., Henao-Tamayo, M., Ordway, D., Sellers, R. S., Jain, P., Chen, В., Chen, M., Kim, J., Lukose, R., Chan, J., Orme, I. M., Porcelli, S. A., Jacobs, W. R. Jr. A recombinant Mycobacterium smegmatisinduces potent bactericidal immunity against Mycobacterium tuberculosis. // Nature Medicine. - 2011. - Vol. 17. - P. -1268.
39. Клейменов, Д.А., Мазунина, E.П., Лунин, В.Г., Коптев, Е.Ю., Мануйлов, B.А., Гущин, В.А., Ткачук, А.П. Иммунологическая память, формируемая в ответ на вакцинацию противотуберкулезной рекомбинантной вакциной «ГамТБвак»: клинические исследования вакцины на здоровых добровольцах. // Вестник РГМУ. - 2017. - №5. - С.29-37.
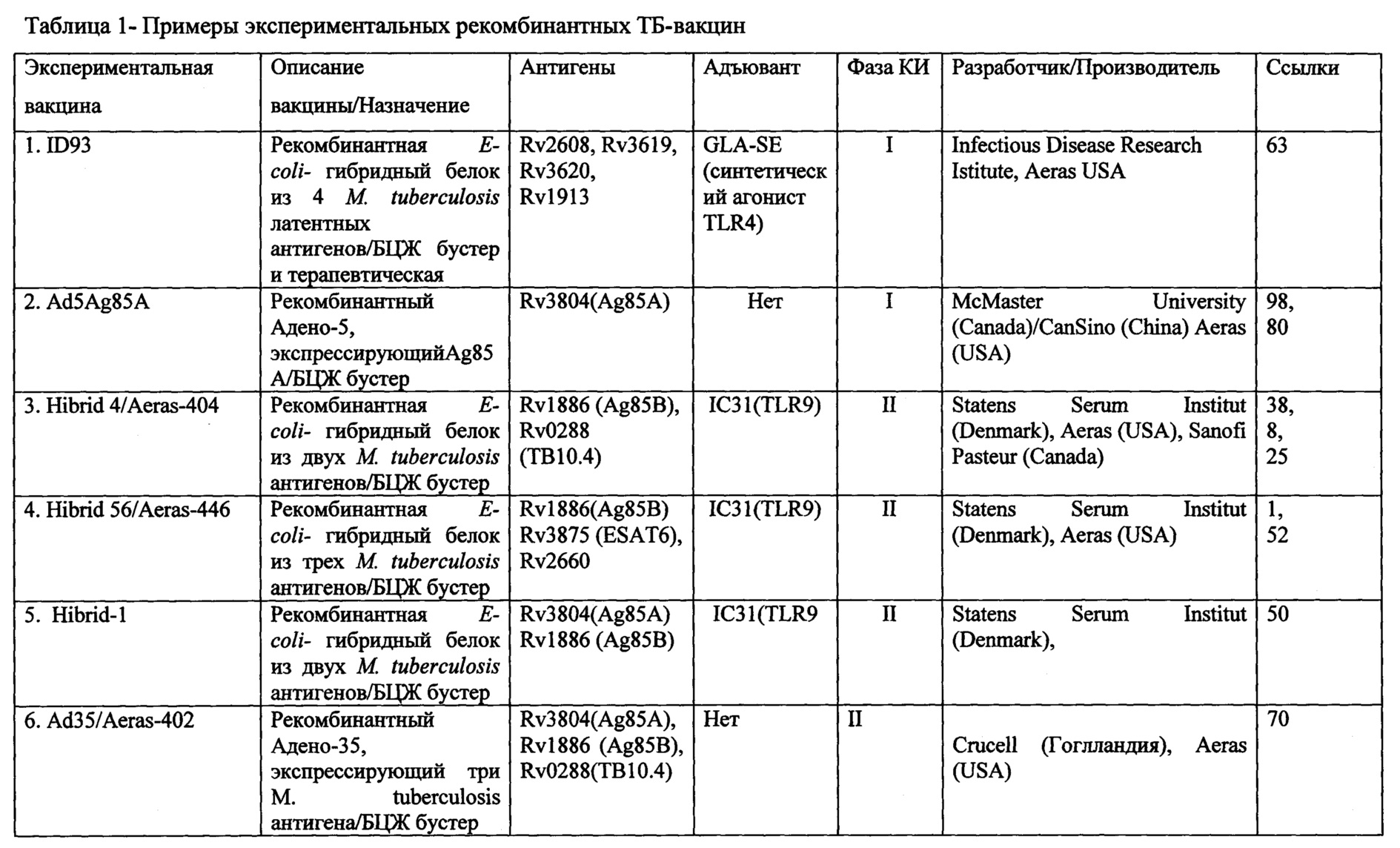
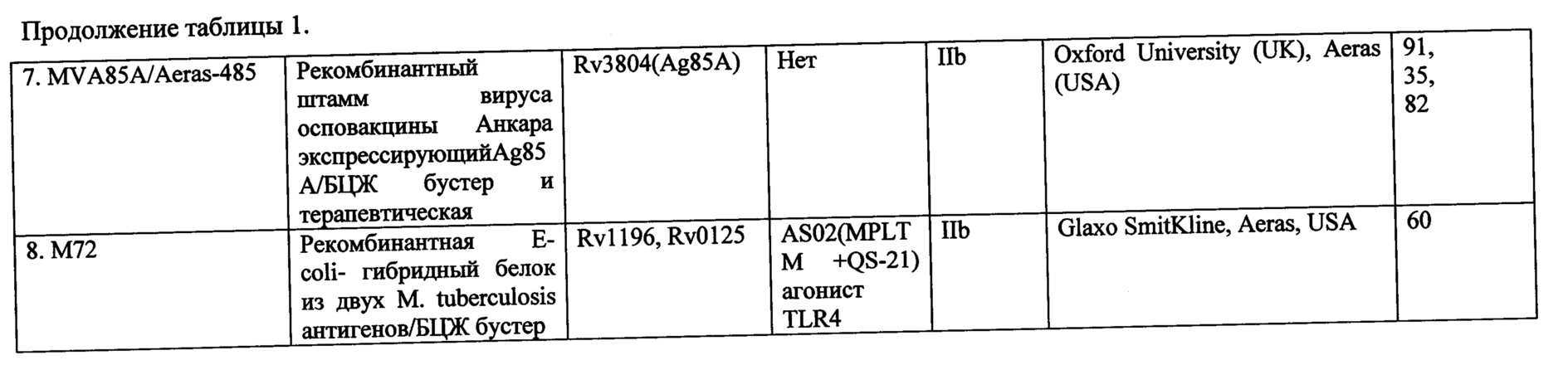
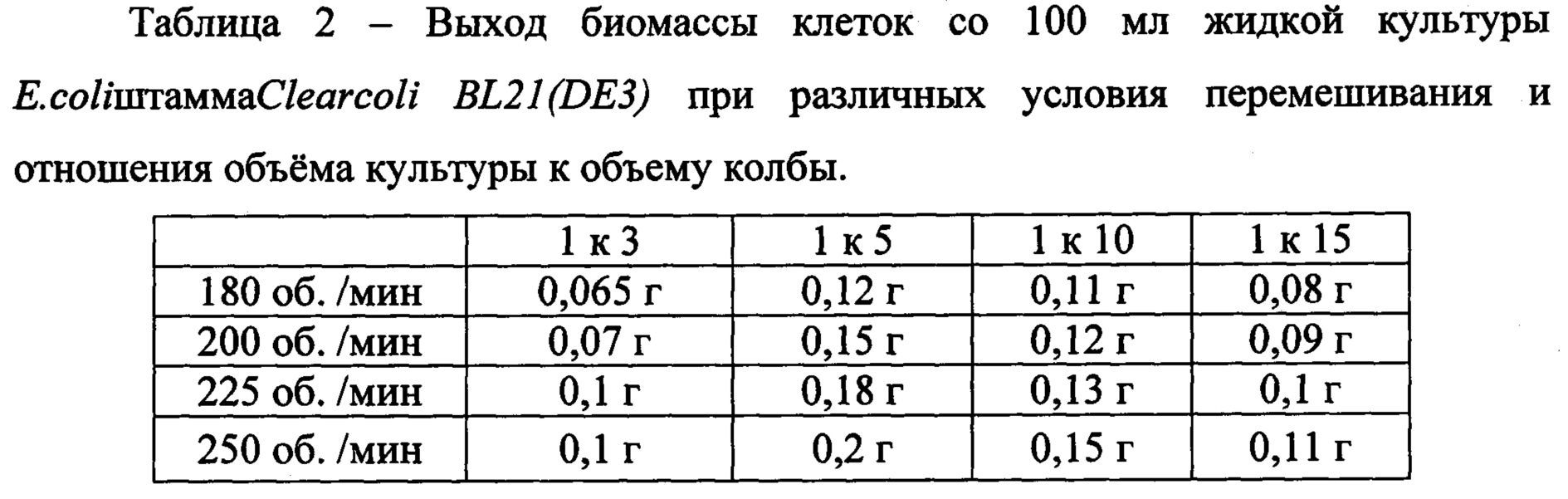
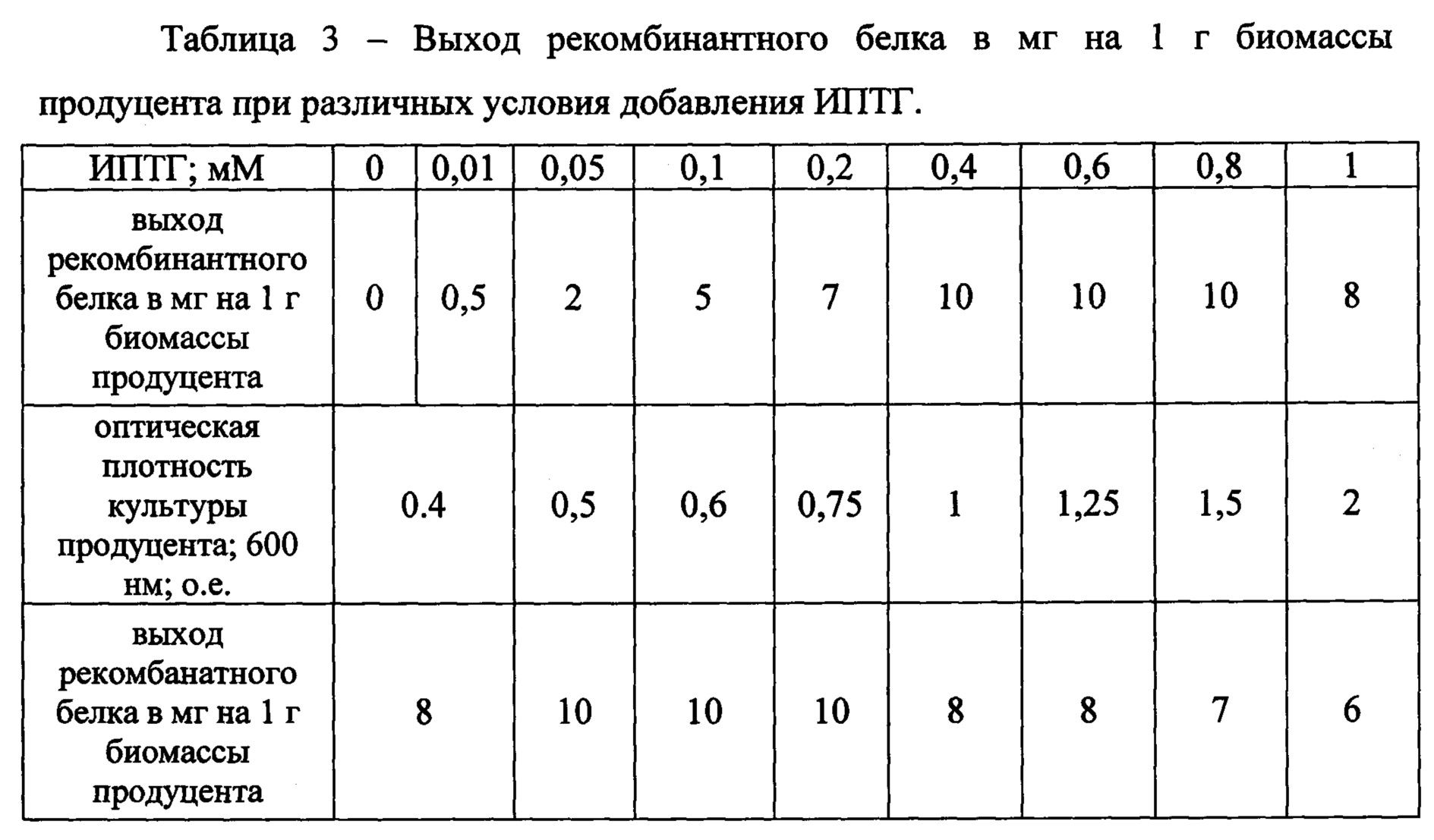

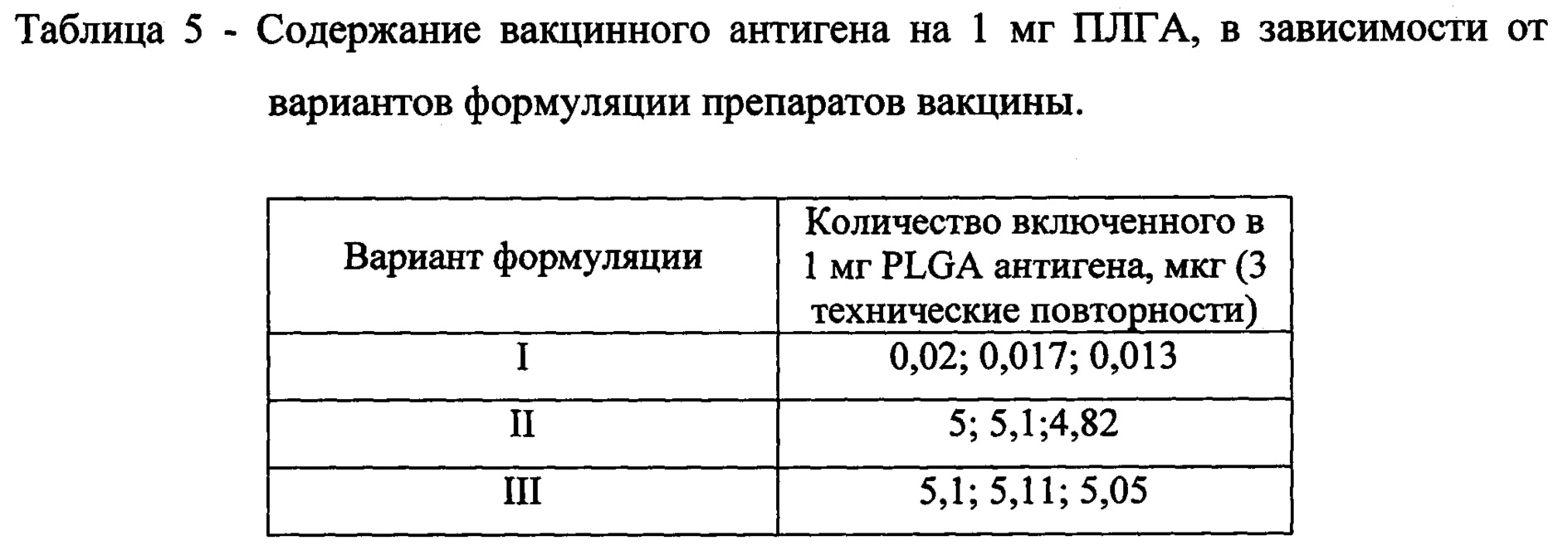

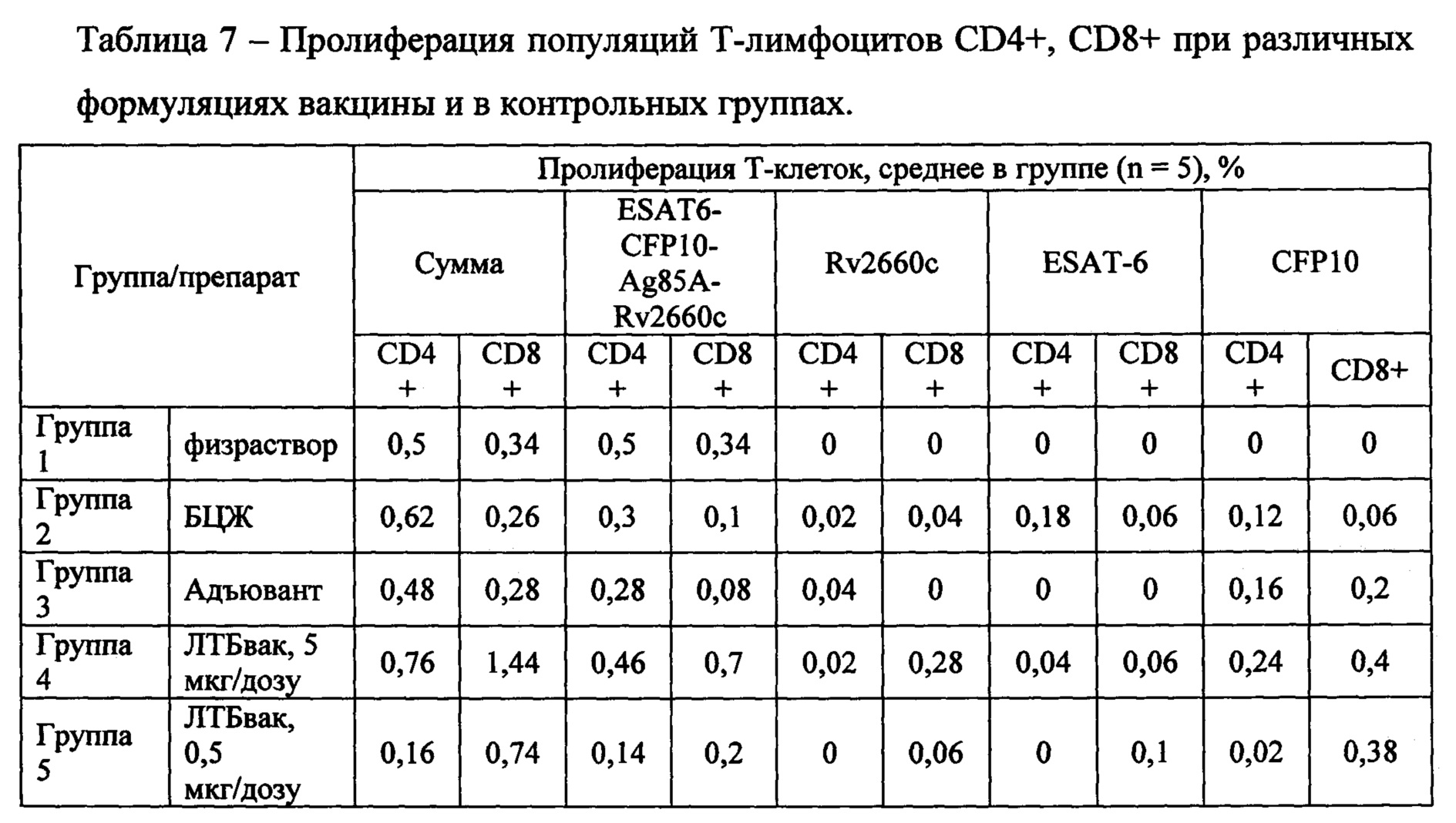
Примечание: Показано среднее долей пролиферирующих эффекторных (CD4+) и цитотоксических (CD8+) от всех Т-лимфоцитов в ответ на введение компонентов вакцинного антигена по отдельности и гибридного белка. Стандартное отклонение не приведено ввиду недостоверности отличий между группами.