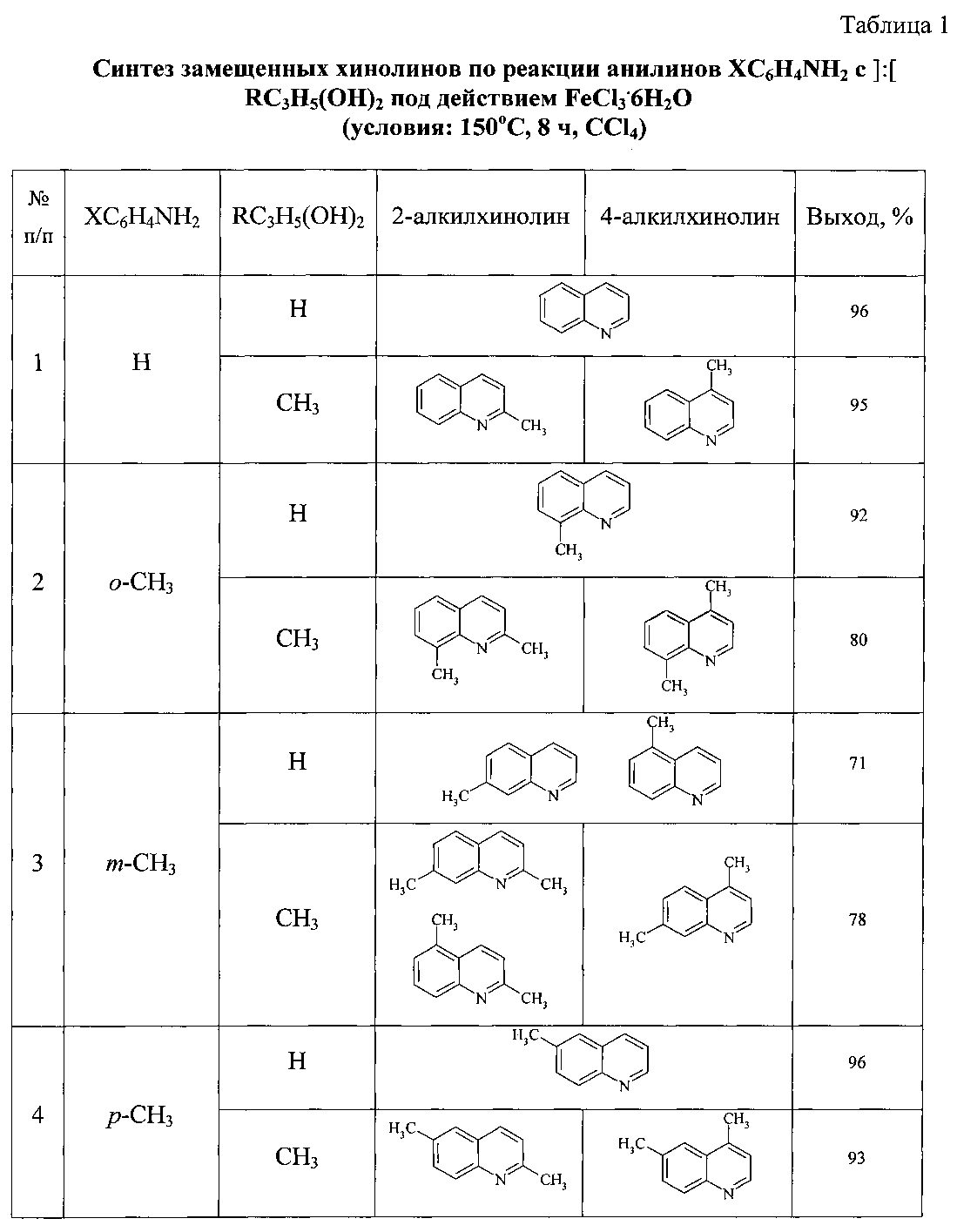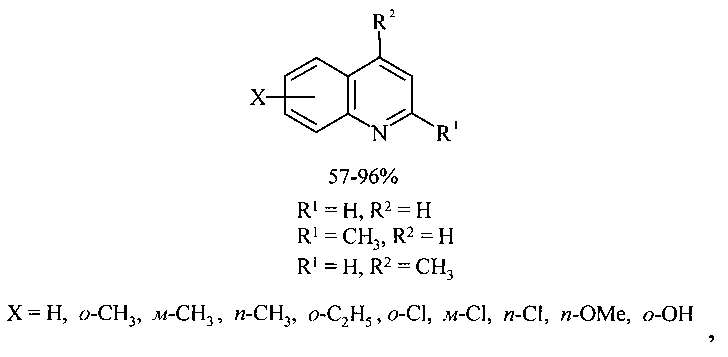Результат интеллектуальной деятельности: СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ ХИНОЛИНОВ ИЗ АНИЛИНА, 1,3-ДИОЛОВ И CCl4 ПОД ДЕЙСТВИЕМ ЖЕЛЕЗОСОДЕРЖАЩИХ КАТАЛИЗАТОРОВ
Вид РИД
Изобретение
Предлагаемое изобретение относится к области органической химии, в частности, к способу получения замещенных хинолинов.
Хинолин и его производные находят широкое применение в качестве синтонов при получении ингибиторов кислотной коррозии металлов, красителей и фармацевтических препаратов, проявляющих антималярийную, противосудорожную и антибактериальную активность [1. Larsen R.D., Corley E.G., King A.O., Carrol J.D., Davis P., Verhoeven T.R., Reider P.J., Labelle M., Gaunthier J.Y., Xiang Y.B., Zamboni R.J. // J. Org. Chem. 1996, 61, 3398-3405; 2. Chen Y.-L., Fang K.-C., Sheu J.-Y., Hsu S.-L., Tzeng C.-C. // J. Med. Chem. 2001, 44, 2374-2377; 3. Roma G., Braccio M.D., Grossi G., Mattioli F., Ghia M. // Eur. J. Med. Chem. 2000, 35, 1021-1035; 4. Dube D., Blouin M., Brideau C., Chan C.-C., Desmarais S., Ethier D., Falgueyret J.P., Friesen R.W., Girard M., Girard Y., Guay J., Riendeau D., Tgari P., Young R.N. // Bioorg. Med. Chem. Lett. 1988, 8, 1255-1260; 5. Maguire M.P., Sheets K.R., McVety K., Spada A.P., Zilberstein, A. // J. Med. Chem. 1994, 37, 2129-2137].
Известные методы синтеза замещенных хинолинов основаны на реакциях доступного анилина и его производных с различными органическими субстратами под действием металлокомплексных катализаторов.
Так, конденсация анилина с алифатическими альдегидами при 200°C под действием комплексов Ru и Rh приводит к замещенным хинолинам с выходами 60-80% [6. Джемилев У.М., Селимов Ф.А., Хуснутдинов Р.А., Фатыхов А.А., Халилов Л.М., Толстиков Г.А. // Известия Академии наук СССР 1991, 6, 1407-1413].
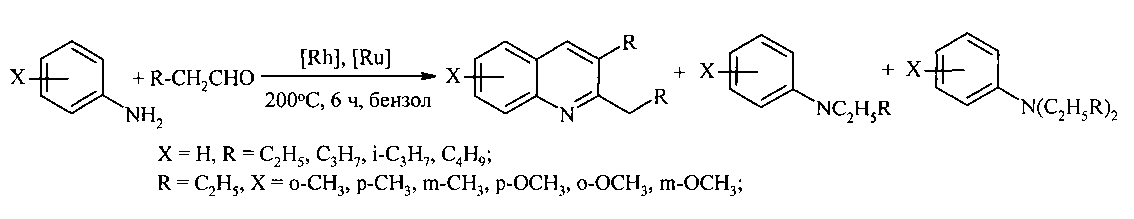
Недостатки метода:
1. Необходимость использования дорогостоящих рутениевых и родиевых катализаторов.
2. Реакция протекает неселективно, наряду с хинолинами образуются побочные продукты алкил- и диалкиланилины (20-40%).
3. Высокая температура - 200°C.
Эффективным катализатором синтеза хинолинов конденсацией анилинов с винилкетонами является фосфорномолибденовая кислота. Реакция в присутствии H7PMo12O42 проходит в среде толуола при 80°C в течение 50 мин. Выходы хинолинов составляют 87-97% [7. Chaskar A., Padalkar V., Phatangare К., Langi В., Shah С. // Synt. Commun., 40(15), 2336-2340; 2010].
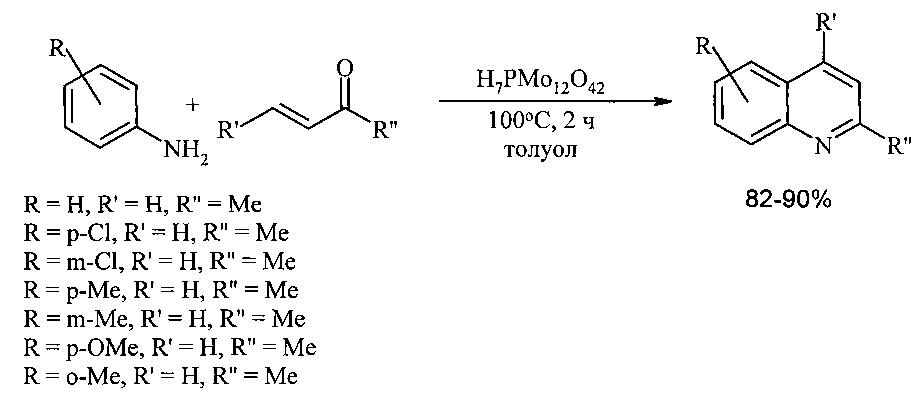
Недостатки метода:
1. Необходимость применения труднодоступных и дорогостоящих реагентов фосфорномолибденовой кислоты и алкилвинилкетонов.
Как известно из литературных данных, комплексы рутения обладают способностью к дегидрированию спиртов, превращая их в альдегиды. Это свойство рутениевых катализаторов успешно использовано в ряде работ для синтеза хинолинов с участием 1,3-диолов. В частности, система RuCl3·xH2O-PBu3-MgBr2·Et2O активно катализирует гетероциклизацию 1,3-диолов с анилинами [8. Monrad N.R., Madsen R. // Org. Biomol. Chem., 2011, 9(2), 610-615].
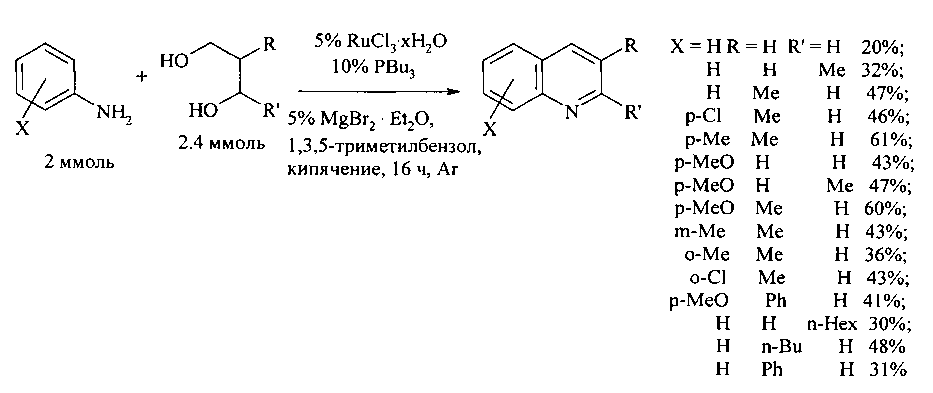
Недостатки метода:
1. Необходимость применения дорогостоящих рутениевых катализаторов.
2. Низкий выход целевого продукта (20-61%).
В работе [9. Tsuji Y., Nishimura Н., Huh К.Т., Watanabe Y. // J. Organometal. Chem. - 1985. - V. 286. - P. 44-46] циклоконденсацию анилина и его производных (4-RC6H4NH2, R=Н, Me, МеО) с 1,3-пропандиолом в присутствии соединений рутения, с образованием хинолинов проводили при 180°C в течение 5 ч в присутствии нитробензола, играющего роль акцептора водорода. В работе в качестве активирующих лигандов хлорида рутения в реакции анилинов с 1,3-диолами был испытан большой ассортимент фосфорорганических лигандов (PBu3, PEt3, РСу3, PEt2Ph, PEtPh2, PPh3, P(OPh)3, P(OBu)3, PPh2CH2PPh2, PPh2(CH2)2PPh2, PPh2(CH2)3PPh2, PPh2(CH2)4PPh2) и лучшие результаты получены при использовании каталитических систем RuCl3·nH2O - PBu3 и RuCl3·nH2O - PEt3 и проведении реакции при повышенной температуре кипячением в диглиме в течение 5 ч. Важно отметить, что при повышенной темпертуре использование акцептора водорода не требуется, ароматизация осуществляется путем дегидрирования под действием рутениевого катализатора
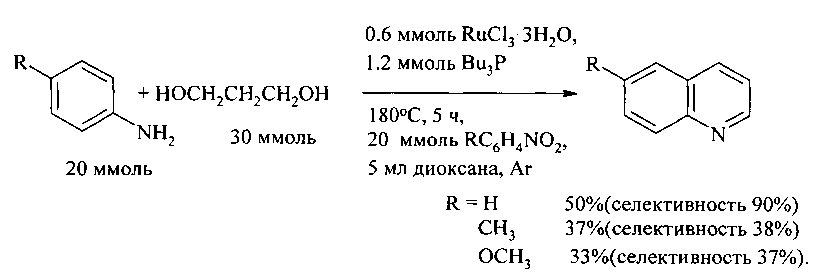
Прототип имеет следующие недостатки:
1. Необходимость применения дорогостоящих рутениевых катализаторов.
2. Низкий выход целевого продукта менее 50%.
3. Необходимость использования дополнительного реагента нитробензола в качестве акцептора водорода в стехиометрическом количестве.
Авторами предлагается новый способ получения замещенных хинолинов взаимодействием анилина с 1,3-диолами и CCl4 под действием железосодержащих катализаторов.
Задачей предлагаемого изобретения является удешевление себестоимости конечного продукта за счет использования доступного и дешевого катализатора - FeCl3·6H2O.
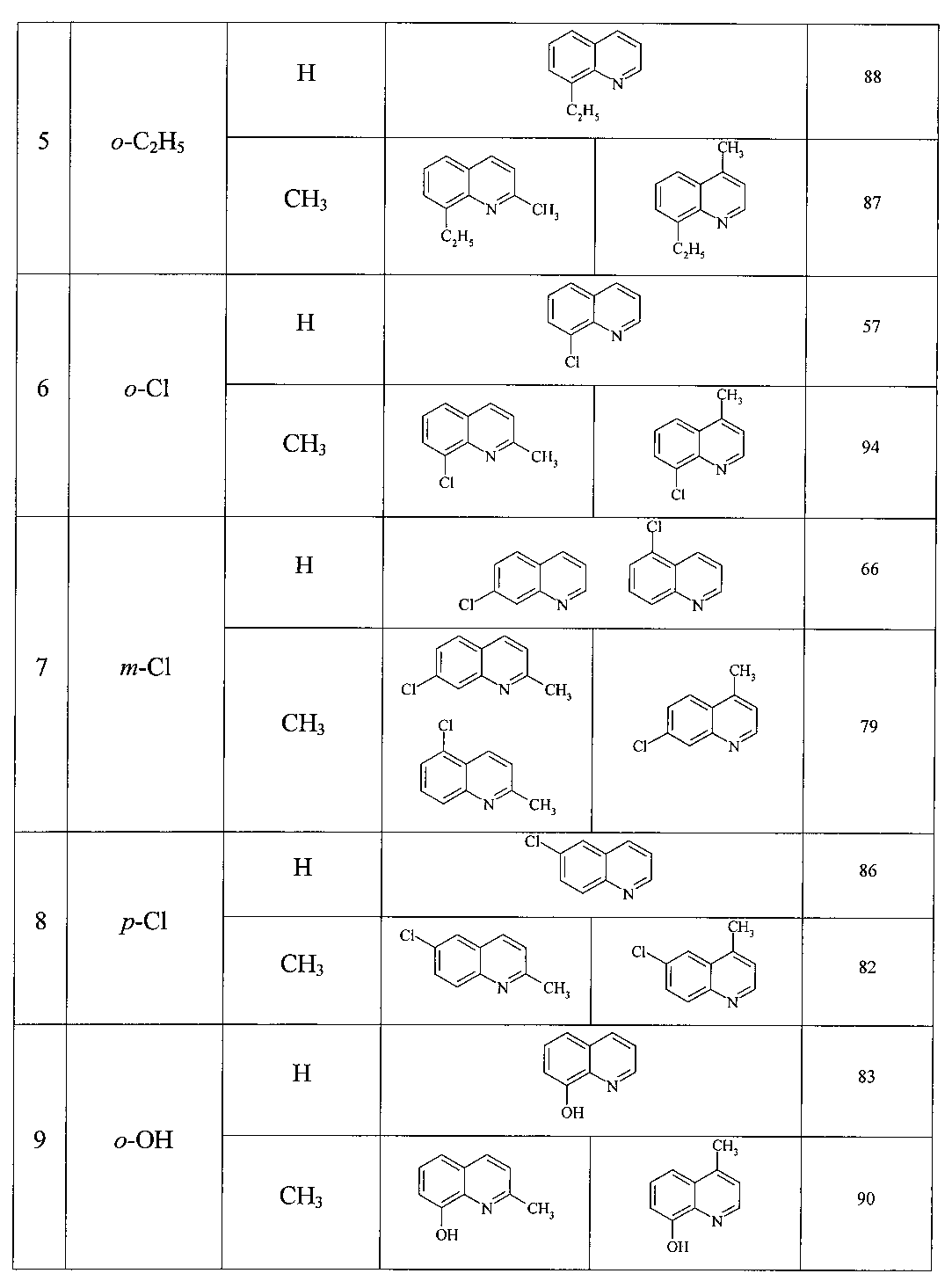
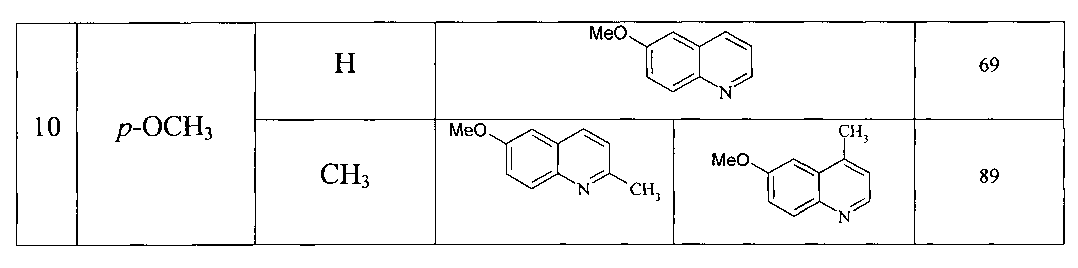
Сущность способа заключается во взаимодействии анилина и его производных общей формулы XC6H4NH2, где X=Н, о-СН3, м-СН3, п-СН3, о-С2Н5, о-Cl, м-Cl, п-Cl, п-ОМе, о-ОН с 1,3-диолами, а именно с 1,3-пропандиолом и 1,3-бутандиолом под действием следующих железосодержащих катализаторов: FeCl3·6H2O, FeCl3, FeCl2·4H2O, Fe(C5H5)2, Fe(acac)3, Fe(OAc)2 и Fe2(CO)9, лучшим из которых является FeCl3·6H2O в среде CCl4. Продуктами реакции являются замещенные хинолины, выходы которых составили 57-96%. Синтез проходит при 150°C в среде CCl4 в течение 8 ч при следующих мольных соотношениях катализатора и реагентов: [FeCl3·6H2O]:[XC6H4NH2]:[CCl4]:[диол]=1:100:200:400.
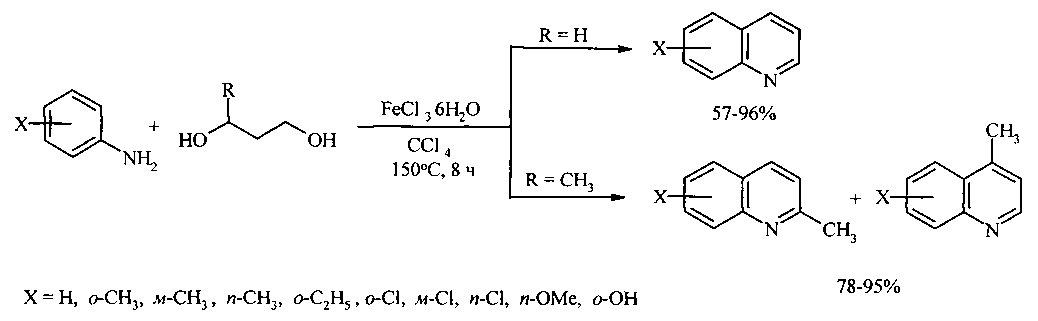
Преимущества предполагаемого метода.
1. Доступность и дешевизна исходных реагентов - замещенного анилина, CCl4, диолов и катализатора FeCl3·H2O - и удешевление себестоимости и упрощение технологии.
2. Высокая селективность реакции по хинолинам и отсутствие в реакционной массе побочных продуктов - N-алкиланилинов.
3. Отсутствие побочных продуктов облегчает выделение и очистку целевых замещенных хинолинов.
4. Высокий выход замещенных хинолинов (57-96%).
Предлагаемый способ поясняется примерами.
ПРИМЕР 1. Получение замещенных хинолинов
В ампулу в токе аргона загружали 6 мг (1 ммоль) FeCl3·H2O, 0.2 мл (100 ммоль) замещенного анилина, 0.42 мл (200 ммоль) CCl4 и 400 ммоль RC3H5(OH)2 (0,63 мл 1,3-пропандиола, 0,77 мл 1,3-бутандиола). Запаянную ампулу помещали в автоклав, автоклав герметично закрывали и нагревали при 150°C в течение 8 ч, затем автоклав охлаждали до ~20°C, ампулу вскрывали, реакционную массу нейтрализовали 10% водным раствором Na2CO3 (перемешивание на магнитной мешалке в течение 0.5-1 часа), органический слой экстрагировали хлористым метиленом и отфильтровывали. Растворители отгоняли, остаток перегоняли под вакуумом.
Строение полученных замещенных хинолинов доказано методами ЯМР, масс-спектрометрии, а также сравнением с известными образцами и литературными данными.
Хинолин [10. Boyd, Derek R. Can. J. Chem. 2002, 80, 589]. Выход 96%. T кип. 42-43°C/0.2 мм рт. ст. Спектр ЯМР13С(δ, м.д.):120.98(С3), 126.67(С6), 127.79(С5), 128.93(С4а), 129.02(С8), 129.39(С7), 140.01(С4), 148.20(С8а), 149.99 (С2). Спектр ЯМР1Н(CDCl3, δ, м.д.): 7.42 т (1H, С3Н, J 8 Гц), 7.54 т (1Н, С6Н, J 8 Гц), 7.71 т (1H, С7Н, J 8 Гц), 7.82 д (1Н, С5Н, J 8.4 Гц), 8.09 д (1Н, С4Н, J 7.6 Гц), 8.17 д (1Н, С8Н, J 8.4 Гц) 8.93 д (1H, С2Н, J 8 Гц). Масс-спектр, m/z (Iотн. (%)): 129.00 [М]+ (100), 130 (11), 118 (28), 102 (22), 76 (7), 51 (10).
8-Метилхинолин [11. Claret, P.A. Org. Magn. Reson. 1976, 8, 147; Derdau, V. Chem. Eur. J. 2009, 15, 10397]. Выход 92%. T кип. 47-48°C/0.3 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 18.11 (СН3), 120.77 (С3), 125.79 (С6), 126.22 (С5), 128.32 (С4а), 129.57 (С7), 137.02 (С8), 136.23 (С4), 147.41 (С8а), 149.22 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.83 с (3Н, СН3), 7.39 т (1Н, С3Н, J 8 Гц), 7.44 т (1Н, С6Н, J 8.4 Гц), 7.52 д (1Н, С7Н, J 8 Гц), 7.66 д (1Н, С5Н, J 8 Гц), 8.12 д (1Н, С4Н, J 8.8 Гц), 8.95 д (1Н, С2Н, J 8 Гц). Масс-спектр, m/z (Iотн. (%)): 143.00[М]+(100), 144 (11), 142 (43), 115 (14), 89 (6), 51 (4).
7-Метилхинолин [12. Su, J.A.; Org. Magn. Resonance 1977, 10, 122; Chakrabarty, M.R. J. Mol. Spect. 1969, 30, 348; (c) Osborne, A.G. Tetrahedron 1983, 39, 2831]. Выход 71% (7-метил-:5-метил-=2:1). T кип. 50-51°C/0.2 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 21.77 (СН3), 120.18 (С3), 126.31 (С4а), 127.42 (С5), 128.38 (С8), 128.71 (С6), 135.63 (С4), 139.53 (С7), 148.67 (С8а), 150.10 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.56 с (3Н, СН3), 7.32 т (1Н, С3Н, J 8 Гц), 7.41 д (1Н, С6Н, J 6.8 Гц), 7.68 д (1Н, С5Н, J 8 Гц), 7.89 с (1Н, С8Н), 8.06 д (1Н, С4Н, J 8 Гц), 8.88 д (1Н, С2Н, J 8 Гц). Масс-спектр, m/z (Iотн. (%)): 143.00 [М]+ (100), 144 (11), 142 (45), 115 (16), 89 (7), 51 (5). 5-Метилхинолин. Спектр ЯМР 13С (δ, м.д.): 22.34 (СН3), 120.10 (С3), 126.01 (С6), 127.38 (С8), 128.10 (С4а), 129.55 (С7), 132.76 (С4), 134.78 (С5), 147.64 (С8а), 149.78 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.68 с (3Н, СН3), 7.21 т (1Н, С3Н, J 8 Гц), 7.36 д (1Н, С6Н, J 7.6 Гц), 7.71 т (1Н, С7Н, J 8 Гц), 7.92 д (1Н, С8Н), 7.99 д (1Н, С4Н, J 8 Гц), 8.83 д (1H, С2Н, J 8 Гц).
6-Метилхинолин [13. Bhayana, В. Org. Lett. 2009, 11, 3954]. Выход 96%. Т кип. 73-74°C/0.5 мм рт. ст. Маслянистая желтая жидкость. Спектр ЯМР 13С (δ, м.д.): 21.42 (СН3), 121.01 (С3), 126.54 (С5), 128.33 (С4а), 128.98 (С8), 131.48 (С7), 135.20 (С4), 136.19 (С6), 147.07 (С8а), 149.40 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.52 с (3Н, СН3), 7.34 т (1Н, C3H, J 7.6 Гц), 7.55 д (1H, С7Н, J 8 Гц), 7.58 с (1Н, С5Н), 7.97 д (1Н, С8Н, J 8 Гц), 8.05 д (1Н, С4Н, J 8 Гц), 8.85 д (1H, С2Н, J 8 Гц). Масс-спектр, m/z (Iотн. (%)): 143.00 [М]+ (100), 144 (11), 142 (48), 115 (14), 89 (6), 71 (4), 51 (3).
8-Этилхинолин [14. Lu, В. J. Am. Chem. Soc. 2010, 132, 14070]. Выход 88%. Желтая жидкость. Т кип. 269°C. Спектр ЯМР 13С (δ, м.д.): 15.39 (СН3), 24.95 (СН2), 121.15 (С3), 126.16 (С6), 126.77 (С4а), 128.25 (С5), 128.71 (С7), 136.72 (С8), 143.24 (С4), 147.09 (С8а), 149.59 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.40 т (2Н, СН3, J 8 Гц), 3.32 к (2Н, СН2, J 7.6 Гц), 7.39 т (1Н, С3Н, J 6.8 Гц), 7.48 т (1Н, С6Н, J 8 Гц), 7.57 д (1Н, С5Н, J 8 Гц), 7.66 д (1Н, С7Н, J 8 Гц), 8.14 д (1Н, С4Н, J 7.6 Гц), 8.95 д (1Н, С2Н, J 8.8 Гц).
8-Хлорхинолин [15. Arjunan, V. J. Mol. Struct. 2011, 988, 91]. Выход 57%. T кип. 93-94°C/0.5 мм рт. ст. Желтая жидкость. Спектр ЯМР 13С (δ, м.д.): 121.78 (С3), 126.35 (С6), 127.09 (С5), 128.79 (С4а), 133.23 (С8), 129.43 (С7), 136.41 (С4), 144.20 (С8а), 150.79 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 7.44 т (1Н, С6Н, J 8 Гц), 7.45 т (1Н, С3Н, J 8 Гц), 7.73 д (1Н, С5Н, J 8 Гц), 7.81 д (1Н, С7Н, J 8.4 Гц), 8.13 д (1H, С4Н, J 8 Гц), 9.02 д (1Н, С2Н, J 7.6 Гц). Масс-спектр, m/z (Iотн. (%)): 163.00 [М]+ (100), 165 (33), 164 (12), 128 (26), 127(12), 101 (10), 75 (9).
7-Хлорхинолин [16. Joseph-Nathan, P. Magnetic Resonance in Chemistry 1990, 28, 299; Hirner, J.J. Tetrahedron Lett. 2009, 50, 4989]. Выход 66% (7-хлор-:5-хлор-=2:1). T кип. 70-71°C/0.2 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 121.65 (С3), 126.64 (С4а), 127.34 (С6), 128.13 (С8), 129.09 (С5), 135.49 (С7), 136.13 (С4), 148.56 (С8а), 151.08 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 7.23-7.30 м (1Н, С3Н), 7.35-7.55 м (1H, С6Н), 7.69 д (1Н, С5Н, J 8 Гц), 8.00 с (1H, С8Н), 8.13 д (1Н, С4Н, J 8 Гц), 8.99 д (1H, С2Н, J 8 Гц).
5-Хлорхинолин. Спектр ЯМР 13С (δ, м.д.): 122.05 (С3), 127.88 (С4а), 126.63 (С8), 127.29 (С6), 129.01 (С7), 135.49 (С5), 136.13 (С4), 149.07 (С8а), 151.14 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 7.23-7.30 м (1Н, С3Н), 7.35-7.55 м (1Н, С6Н), 7.76 д (1H, С7Н, J 8 Гц), 8.03 д (1H, С8Н, J 7.6 Гц), 8.10 д (1H, С4Н, J 8 Гц), 9.01 д (1Н, С2Н, J 8 Гц).
6-Хлорхинолин [17. Gaywood, А.Р. New J. Chem. 2010, 34, 236]. Выход 86%). Светло-желтая жидкость. Т кип. 126-127°C/10 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 121.79 (С3), 126.29 (С5), 128.77 (С4а), 130.21 (С7), 131.06 (С8), 132.15 (С6), 135.03 (С4), 146.42 (С8а), 150.53 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 7.40 т (1Н, С3Н, J 7.6 Гц), 7.63 д (1H, С7Н, J 8 Гц), 7.78 с (1H, С5Н), 8.03 д (1Н, С4Н, J 8 Гц), 8.05 д (1Н, С8Н, J 8.4 Гц), 8.90 д (1Н, С2Н, J 8 Гц). Масс-спектр, m/z (Iотн.. (%)): 163.00 [М]+ (100), 165 (31), 164 (13), 136 (8), 101 (9), 75 (8), 68 (5).
6-Метоксихинолин [18. Monrad, R.N.; Madsen, R. Org. Biomol. Chem. 2011, 9, 610]. Выход 69%. Светло-желтая жидкость. T кип. 91-92°C/0.4 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 55.40 (ОСН3), 105.09 (С5), 121.26 (С3), 122.23 (С7), 129.25 (С4а), 130.73 (С8), 134.73 (С4), 144.43 (С8а), 147.83 (С2), 157.63 (С6). Спектр ЯМР 1H (CDCl3, δ, м.д.): 3.87 с (3Н, ОСН3), 6.99 с (1Н, С5Н), 7.29 д (1Н, С7Н, J 7.6 Гц), 7.33 т (1H, С3Н, J 7.6 Гц), 7.95 д (1Н, С4Н, J 8 Гц), 7.98 д (1H, С8Н, J 8.4 Гц), 8.75 д (1Н, С2Н, J 7.6 Гц). Масс-спектр, m/z (Iотн. (%)): 159.00 [М]+ (100), 160 (12), 144 (11), 129 (14), 116 (67), 89 (17), 63 (9).
8-Гидроксихинолин [19. Fomichev, A.A. Khimiya Geterotsiklicheskikh Soedinenii 1977, 9, 1235]. Выход 79%. Белый кристаллический порошок. Т пл. 72-76°C. Спектр ЯМР 13С (δ, м.д.): 110.60 (С7), 118.03 (С5), 121.59 (С3), 127.65 (С6), 128.63 (С4а), 136.18 (С4), 138.29 (С8а), 148.09 (С2), 152.51 (С8). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 7.19 д (1Н, С7Н, J 8 Гц), 7.33 д (1H, С5Н, J 8.8 Гц), 7.43 т (1Н, С3Н, J 8 Гц), 7.46 т (1H, С6Н, J 7.2 Гц), 8.15 д (1Н, С4Н, J 8 Гц), 8.30 уш. с (1Н, ОН), 8.79 д (1H, С2Н, J 7.6 Гц). Масс-спектр, m/z (Iотн. (%)): 145.00 [М]+ (100), 146 (10), 117 (51), 90 (18), 89 (17), 63 (11), 59 (9).
2-Метилхинолин [20. Khusnutdinov, R.I.; Bayguzina, A.R.; Aminov, R.I.; Dzhemilev, U.M. Russ. J. Org. Chem. 2012, 48, 679]. Выход 95% (2-метил-:4-метил-=1:2). Маслянистая желтая жидкость. Т кип. 80-81°C/2 мм рт. ст. (Т кип. 248°C, 105-107°C/10 мм рт. ст. [268]. Спектр ЯМР 13С (δ, м.д.): 25.12 (СН3), 121.74 (С3), 125.45 (С6), 126.32 (С4а), 127.37 (С5), 128.80 (С8), 129.19 (С7), 135.84 (С4), 147.76 (С8а), 158.67 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.78 с (3Н, СН3), 7.22 д (1Н, С3Н, J 8 Гц), 7.68 т (1Н, С7Н, J А Гц), 7.46 т (1Н, С6Н, J6.4 Гц), 7.73 д (1Н, С5Н, J9.2 Гц), 7.91 д (1Н, С4Н, J9.2 Гц), 7.91 д (1H, С8Н, J 9.2 Гц). Масс-спектр, m/z (Iотн. (%)): 143.18 [М]+ (100), 128 (20), 115 (22), 101 (5), 89 (4), 75 (5), 51 (4).
4-Метилхинолин [21. De, Kavita J. Org. Chem. 2009, 74, 6260]. Спектр ЯМР 13C (δ, м.д.): 18.40 (CH3), 121.87 (С3), 123.85 (С5), 126.33 (С6), 127.99 (С4а), 128.95 (С7), 129.76 (С8), 144.50 (С4), 147.76 (С8а), 150.01 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.68 с (3Н, СН3), 7.18 д (1Н, С3Н, J8 Гц), 7.53 т (1Н, С6Н, J 7.6 Гц), 7.68 т (1H, С7Н, J 7.6 Гц), 7.95 д (1Н, С5Н, /9.2 Гц), 8.09 д (1Н, С8Н, J 8.4 Гц), 8.73 д (1Н, С2Н, J 8.4 Гц). Масс-спектр, m/z (Iотн. (%)): 143.18 [М]+ (100), 128 (34), 115 (19), 101 (8), 89 (5), 75 (4), 51(4).
2,8-Диметилхинолин [22. Sridharan, V. Tetrahedron 2006, 63, 673]. Выход 80% (2,8-диметил-:4,8-диметил-=1:2). Маслянистая желтая жидкость. Т кип. 65-66°C/0.3 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 21.56 (СН3), 25.67 (СН3), 121.63 (С3), 125.29 (С5), 126.98 (С6), 127.33 (С4а), 128.26 (С7), 136.50 (С8), 137.49 (С4), 144.67 (С8а), 157.85 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.) 2.65 с (3Н, СН3), 2.87 с (3Н, СН3), 6.98 д (1H, С5Н, J 8 Гц), 7.24 д (1Н, С3Н, J 8.4 Гц), 7.38 т (1Н, С6Н, J 8 Гц), 7.65 д (1H, С7Н, J 8 Гц), 7.89 д (1Н, С4Н, J 7.6 Гц). Масс-спектр, m/z (Iотн. (%)): 157.00 [М]+ (100), 156 (31), 143 (10), 115 (8), 71 (4), 65 (2), 52 (2).
4,8-Диметилхинолин. Спектр ЯМР 13С (δ, м.д.): 18.91 (СН3), 18.94 (СН3), 121.79 (С3), 125.55 (С6), 126.07 (С5), 129.42 (С7), 136.26 (С8), 139.45 (С4а), 148.84 (С4), 147.00 (С8а), 148.94 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.) 2.79 с (3Н, СН3), 2.89 с (3Н, СН3), 7.15-7.30 м (1Н, С3Н), 7.47 т (1Н, С6Н, J 7.2 Гц), 7.50-7.65 м (1Н, С7) 7.86 д (1H, С5Н, J 8.4 Гц), 8.84 д (1H, С2Н, J 7.6 Гц). Масс-спектр, m/z (Iотн. (%)): 157.00 [М]+ (100), 156 (31), 143 (10), 115 (8), 71 (4), 65 (2), 52 (2).
2,7-Диметилхинолин [23. Matsubara, Y. Angew. Chem., Int. Ed. 2011, 50, 7670]. Выход 78% (2,7-диметил-:2,5-диметил-:4,7-диметил-=2:1:3). Маслянистая желтая жидкость, Т кип. 53-54°C/0.25 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 21.78 (СН3), 25.29 (СН3), 121.00 (С3), 124.48 (С5), 127.03 (С4а), 127.78 (С8), 127.81 (С7), 135.65 (С6), 139.40 (С4), 148.26 (С8а), 158.71 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.) 2.40 с (3Н, СН3), 2.64 с (3Н, СН3), 7.00 д (1Н, С5Н, J 8 Гц), 7.03 д (1Н, С6Н, J 8 Гц), 7.47 д (1Н, С4Н, J 7.6 Гц), 7.78 д (1Н, С3Н, J 8.4 Гц), 7.79 с (1Н, С8Н). Масс-спектр, m/z (Iотн. (%)): 157.00 [М]+ (100), 156 (28), 142 (11), 115 (11), 89 (4), 65 (4), 51 (4).
4,7-Диметилхинолин [21. De, Kavita J. Org. Chem. 2009, 74, 6260]. Спектр ЯМР 13C (δ, м.д.): 18.61 (CH3), 21.72 (СН3), 121.13 (С3), 123.56 (С6), 126.34 (С5), 128.56 (С4а), 128.82 (С8), 139.3 (С7), 144.15 (С4), 148.10 (С8а), 150.04 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.) 2.54 с (3Н, СН3), 2.64 с (3Н, СН3), 7.14 д (1Н, С3Н, J 7.2 Гц), 7.38 д (1Н, С8Н, J 6.8 Гц), 7.85-7.95 м (1H, С5,6Н), 8.71 д (1Н, С2Н, J 8 Гц).
2,6-Диметилхинолин [24. Sridharan, V. Tetrahedron 2006, 63, 673]. Выход 93% (2,6-диметил-:4,6-диметил=1:1). Т кип. 75-76°C/0.4 мм рт.ст. Спектр ЯМР 13С (δ, м.д.): 21.36 (СН3), 25.13 (СН3), 121.78 (С3), 126.37 (С5), 126.42 (С4а), 128.35 (С8), 131.50 (С7), 135.19 (С6), 135.41 (С4), 146.76 (С8а), 157.84 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.54 с (3Н, СН3), 2.72 с (СН3), 7.21 д (1Н, С3Н, J 8 Гц), 7.59 д (1Н, С7Н, J 8.4 Гц), 7.73 с (1Н, С5Н), 7.95 д (1Н, С4Н, J 7.2 Гц), 7.93 д (1Н, С8Н, J 8.4 Гц). Масс-спектр, m/z (Iотн. (%)): 157.00 [М]+ (100), 156 (32), 142 (8), 115 (8), 89 (3), 77 (3), 65 (3).
4,6-Диметилхинолин [21. De, Kavita J. Org. Chem. 2009, 74, 6260]. Спектр ЯМР 13C (δ, м.д.): 18.61 (CH3), 21.80 (СН3), 121.81 (С3), 122.75 (С5), 128.20 (С4а), 129.60 (С8), 131.34 (С7), 136.02 (С4), 143.53 (С6), 146.46 (С8а), 149.21 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.59 с (3Н, СН3), 2.69 с (3Н, СН3), 7.16 д (1Н, С3Н, J 8 Гц), 7.52 д (1Н, С7Н, J 8.4 Гц), 7.72 с (1Н, С5Н), 7.99 д (1Н, С8Н, J 8.4 Гц), 8.69 д (1Н, С2Н, J 7.6 Гц). Масс-спектр, m/z (Iотн. (%)): 158.00 [М]+ (100).
2-Метил-8-этилхинолин. Выход 87% (2-метил-8-этил-:4-метил-8-этил-=1:2). Маслянистая желтая жидкость Т кип. 73-74°C/0.2 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 15.15 (СН2СН3), 24.34 (СН2СН3), 25.68 (СН3), 121.82 (С3), 125.43 (С5), 126.07 (С6), 126.24 (С4а), 128.34 (С7), 136.15 (С8), 142.38 (С4), 146.47 (С8а), 157.65 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.30-1.60 м (3Н, СН3), 2.78 с (3Н, СН3), 3.30-3.50 м (2Н, СН2), 7.43 т (1Н, С6Н, J 7.2 Гц), 7.56 д (1H, С7Н, J 6.8 Гц), 7.55-7.68 м (1Н, С5Н), 7.99 с (1Н, С4Н). Масс-спектр, m/z (Iотн. (%)): 170.10 [М]+ (100), 171 (83), 143 (63), 128 (16), 115 (36), 63 (40), 51 (50).
4-Метил-8-этилхинолин. Спектр ЯМР 13С (δ, м.д.): 15.22 (СН2СН3), 25.00 (СН2СН3), 18.97 (СН3), 121.79 (С3), 125.39 (С5), 126.03 (С6), 126.43 (С4а), 127.67 (С7), 136.22 (С8), 143.40 (С4), 144.36 (С8а), 148.91 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 1.30-1.60 м (3Н, СН3), 2.68 с (3Н, СН3), 3.30-3.50 м (2Н, СН2), 7.51 т (1Н, С6Н, J 7.6 Гц), 7.60 д (1Н, С7Н, J 7.6 Гц), 7.86 д (1Н, С5Н, J 8.4 Гц), 7.99 с (1Н, С4Н). Масс-спектр, m/z (Iотн. (%)): 170.10 [М]+ (100), 171 (83), 143 (63), 128 (16), 115 (36), 63 (40), 51 (50).
2-Метил-8-хлорхинолин. Выход 94% (2-метил-8-хлор-:4-метил-8-хлор-:=1:3). Т кип. 87-89°C/0.2 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 25.19 (СН3), 122.84 (С3), 125.45(С6), 126.32 (С4а), 127.37 (С5), 128.80 (С7), 130.13 (С8), 137.89 (С4), 148.56 (С8а), 161.87 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.84 с (3Н, СН3), 7.38-7.50 м (1Н, С3,6Н), 7.82 д (1H, С7Н, J 7.6 Гц), 8.00 д (1Н, С4Н, J 8.4 Гц), 8.03 д (1Н, С5Н, J 8 Гц). Масс-спектр, m/z (Iотн. (%)): 177. 1 [М]+.
4-Метил-8-хлорхинолин. Спектр ЯМР 13С (δ, м.д.): 18.98 (СН3), 121.68 (С3), 125.41 (С6), 126.41 (С4а), 127.71 (С7), 127.65 (С5), 142.30 (С8), 143.28 (С4), 144.53 (С8а), 148.84 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.68 с (3Н, СН3), 7.20-7.40 м (1Н, С3Н), 7.45-7.60 м (1Н, С6Н), 7.58 д (1Н, С7Н, J 7.6 Гц), 7.84 д (1Н, С5Н, J 8.4 Гц), 8.80 м (1Н, С2Н). Масс-спектр, m/z (Iотн. (%)): 177. 1 [М]+, 142 (14), 115 (15), 76 (7).
2-Метил-7-хлорхинолин. Выход 79% (2-метил-7-хлор:2-метил-5-хлор:4-метил-7-хлор=2:1:3). Маслянистая желтая жидкость, Т кип. 70-71°C/0.2 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 25.38 (СН3), 122.17 (С3), 124.89 (С6), 126.69 (С4а), 124.86 (С5), 127.85 (С8), 135.11 (С7), 135.84 (С4), 148.36 (С8а), 159.99 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.63 с (3Н, СН3), 7.12 д (1Н, С3Н, J 7.6 Гц), 7.25 д (1H, С6Н, J 7.6 Гц), 7.48 д (1Н, С5Н, J 9.2 Гц), 7.84 д (1Н, С4Н, J 8.4 Гц), 7.93 с (1H, С8Н). Масс-спектр, m/z (Iотн. (%)): 177 [М]+ (100), 179 (32), 178 (12), 142 (16), 115 (15), 76 (6).
2-Метил-5-хлорхинолин Спектр ЯМР 13С (δ, м.д.): 25.38 (СН3), 122.82 (С3), 124.96 (С6), 126.63 (С8), 126.69 (С4а), 130.08 (С7), 132.85 (С4), 134.88 (С5), 148.14 (С8а), 159.80 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.66 с (3Н, СН3), 7.11 д (1Н, С3Н, J 7.6 Гц), 7.24 д (1H, С6Н, J 7.6 Гц), 7.45 т (1H, С7Н, J 8.4 Гц), 7.84 д (1Н, С4Н, J 8 Гц), 8.20 д (1H, С8Н, J 7.6 Гц).
4-Метил-7-хлорхинолин. Спектр ЯМР 13С (δ, м.д.): 18.55 (СН3), 122.04 (С3), 125.23 (С6), 127.82 (С4а), 130.25 (С5), 127.16 (С8), 134.90 (С7), 144.40 (С4), 150.19 (С8а), 151.14 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.75 с (3Н, СН3), 7.10-7.20 м (1Н, С3Н), 7.30-7.55 м (1Н, С6Н), 7.70-8.00 м (1Н, С5Н), 8.07 с (1Н, С8Н), 8.60-8.78 м (1Н, С2Н). Масс-спектр, m/z (Iотн. (%)): 177 [М]+ (100), 179 (34), 178 (10), 143 (12), 115 (19), 76 (9).
2-Метил-6-хлорхинолин [25. Ramesh, С. Tetrahedron Lett. 2010, 51, 5234]. Выход 82% (2-Метил-6-хлор-:4-Метил-6-хлор-=1:2). Маслянистая желтая жидкость, Т кип. 70-71°C/0.2 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 25.30 (СН3), 122.89 (С3), 135.21 (С6), 128.99 (С4а), 126.41 (С5), 122.89 (С8), 130.16 (С7), 135.21 (С4), 145.55 (С8а), 159.01 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.69 с (3Н,СН3), 7.28 д (1Н, С3Н, J 7.6 Гц), 7.60 д (1Н, С7Н, J 7.6 Гц), 7.73 с (1Н, С5Н), 7.91 д (1Н, С8Н, J 8.4 Гц) 8.03 д (1H, С4Н, J 7.6 Гц). Масс-спектр, m/z (Iотн. (%)): 177 [М]+ (100), 179 (47), 142 (48), 116 (27), 99 (24), 51 (23).
4-Метил-6-хлорхинолин. Спектр ЯМР 13С (δ, м.д.): 18.57 (СН3), 122.85 (С3), 135.10 (С6), 127.05 (С4а), 126.11 (С5), 122.85 (С8), 130.26 (С7), 143.93 (С4), 145.86 (С8а), 150.07 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.69 с (3Н,СН3), 7.25 д (1Н, С3Н, J 7.6 Гц), 7.72 д (1Н, С7Н, J7.6 Гц), 7.72 с (1Н, С5Н), 8.10 д (1H, С8Н, J 8.4 Гц), 8.76 д (1H, С2Н, J 8 Гц). Масс-спектр, m/z (Iотн. (%)): 177 [М]+ (100), 179 (42), 142 (51), 116 (27), 99 (14), 51 (27).
2-Метил-6-метоксихинолин [26. Choi, H.Y. J. Org. Chem. 2005, 70, 1222]. Выход 89% (2-метил-6-метокси-:4-метил-6-метокси-=1:1). Маслянистая желтая жидкость, Т кип. 95-96°C/0.4 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 24.85 (СН3), 55.42 (ОСН3), 121.71 (С3), 122.01 (С6), 127.32 (С4а), 129.89 (С7), 134.78 (С4), 143.67 (С5), 155.49 (С8а), 157.45 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.69 с (3Н, СН3), 3.76 с (3Н, -ОСН3), 6.89 д (1Н, С3Н, J 8 Гц), 7.48 д (1Н, С7Н, J 7.6 Гц), 7.63 с (1Н, С5Н), 7.71 д (1Н, С4Н, J 8.4 Гц), 7.91 д (1Н, С8Н, J 9.2 Гц). Масс-спектр, m/z (Iотн. (%)): 173 [М]+ (100), 158 (38), 130 (80), 103 (23), 77 (23).
4-Метил-6-метоксихинолин Спектр ЯМР 13С (δ, м.д.): 18.80 (СН3), 55.53 (ОСН3), 101.9 (С5), 121.47 (С7), 122.15 (С3), 129.25 (С4а), 131.46 (С4), 142.73 (С8), 144.01 (С8а), 147.67 (С2), 157.60 (С6). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.63 с (3Н, СН3), 3.94 с (3Н, ОСН3), 7.15-7.18 м (2Н, С3,5Н), 7.35 д (1Н, С7Н, J 7.6 Гц), 8.00 д (1Н, С8Н, J 8.4 Гц), 8.61 д (1H, С2Н, J 8.8 Гц).
8-Гидрокси-2-метилхинолин [27. Chen, M.-Y. J. Chin. Chem. Soc. 2004, 51, 735]. Выход 90% (8-гидрокси-2-метил-:8-гидрокси-4-метил-=1:1).T кип. 64-65°C/0.2 мм рт. ст. Спектр ЯМР 13С (δ, м.д.): 24.82 (СН3), 110.32 (С7), 117.37 (С5), 122.57 (С3), 126.59 (С6), 127.98 (С4а), 136.04 (С4), 138.65 (С8а), 151.80 (С8), 156.77 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.72 с (3Н, СН3), 7.14 д (1Н, С7Н, J 7.6 Гц), 7.27 д (1H, С5Н, J 4.4 Гц), 7.29 д (1Н, С3Н, J 8.4 Гц), 7.38 т (1Н, С6Н, J 7.6 Гц), 8.02 д (1Н, С4Н, J 8 Гц). Масс-спектр, m/z (Iотн (%)): 159 [М]+ (100), 160 (12), 131 (53), 130 (24), 89 (4), 77 (7).
8-Гидрокси-4-метилхинолин. Спектр ЯМР 13С (δ, м.д.): 18.72 (СН3), 109.68 (С7), 114.87 (С5), 122.46 (С3), 127.2 (С4а), 128.41 (С6), 138.04 (С4), 145.00 (С8а), 147.30 (С8), 152.57 (С2). Спектр ЯМР 1Н (CDCl3, δ, м.д.): 2.68 с (3Н, СН3), 7.12-7.28 м (2Н, С3,5Н), 7.43-7.45 м (2Н, С6,7Н), 8.61 д (1Н, С2Н, J 8.4 Гц). Масс-спектр, m/z (Iотн (%)): 159 [М]+ (100), 160 (12), 131 (77).